Антидиабетические твердые фармацевтические композиции
Формула / Реферат
1. Антидиабетическая фармацевтическая композиция в твердой форме, подходящая для перорального введения субъекту, которая содержит соединение формулы (I)
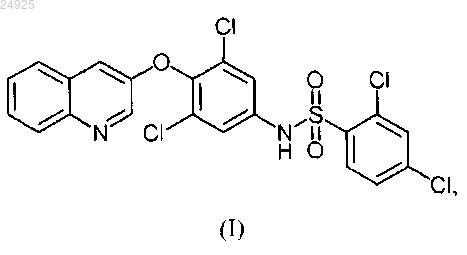
или его соль, в которой твердая фармацевтическая композиция после введения субъекту способна обеспечивать субъекту AUC0®¥ для соединения (I) по меньшей мере или приблизительно 150-5000 нг×ч/мл, причем композиция содержит:
(1) соединение формулы (I), предоставленное в форме бензолсульфонатной (безилатной) соли и составляющее от приблизительно 0,6 до 7,0% композиции;
(2) моногидрат лактозы, составляющий от приблизительно 25 до приблизительно 35% композиции;
(3) кросповидон, составляющий от приблизительно 4 до приблизительно 5% композиции;
(4) микрокристаллическую целлюлозу, составляющую от приблизительно 50 до приблизительно 60% композиции;
(5) повидон, составляющий от приблизительно 1 до приблизительно 3% композиции;
(6) стеарат магния, составляющий от приблизительно 0,25 до приблизительно 1,5% композиции, где все процентные доли представляют собой массовые процентные доли.
2. Твердая фармацевтическая композиция по п.1, дополнительно содержащая коллоидный диоксид кремния, составляющий от приблизительно 0 до приблизительно 0,7% композиции.
3. Твердая фармацевтическая композиция по любому из пп.1 или 2 в форме таблетки или порошка, включая порошок, помещенный в капсулу.
4. Твердая фармацевтическая композиция по любому из пп.1 или 2, предоставленная в виде стандартной лекарственной формы.
5. Антидиабетическая фармацевтическая композиция по любому из пп.1 или 2, в которой средний размер частиц соединения формулы (I) составляет от 1 до 150 мкм.
6. Фармацевтическая композиция по п.5, в которой средний размер частиц соединения формулы (I) составляет от 1 до 100 мкм.
7. Фармацевтическая композиция по п.5, в которой средний размер частиц соединения формулы (I) составляет от 1 до 50 мкм.
8. Фармацевтическая композиция по п.5, в которой средний размер частиц соединения формулы (I) составляет от 1 до 20 мкм.
9. Фармацевтическая композиция по п.5, в которой средний размер частиц соединения формулы (I) составляет от 1 до 10 мкм.
10. Твердая фармацевтическая композиция по любому из пп.5-9, в которой соединение формулы (I) присутствует в форме бензолсульфонатной соли и в которой бензолсульфонатная соль присутствует в количестве от приблизительно от 0,1 до приблизительно 10,0 мг.
11. Способ получения твердой фармацевтической композиции по п.1, который включает стадии (а) микронизации соединения формулы (I); и (b) получения влажного гранулята микронизированного соединения в комбинации с одним или более фармацевтически приемлемыми эксципиентами.
12. Способ получения твердой фармацевтической композиции по п.1, в котором указанную твердую фармацевтическую композицию получают влажным гранулированием.
13. Способ по п.12, включающий стадии:
(a) смешивания микронизированных частиц соединения формулы (I) с одним или более эксципиентами с получением порошкообразной смеси;
(b) добавления гранулирующего раствора к порошкообразной смеси, полученной на стадии (а), и смешивания раствора и порошкообразной смеси с получением влажных гранул;
(c) сушки влажных гранул, полученных на стадии (b), с получением сухих гранул;
(d) размалывания сухих гранул, полученных на стадии (с);
(e) смешивания размолотых сухих гранул, полученных на стадии (d), с одним или более эксципиентами, с получением смеси, представляющей конечный состав твердой фармацевтической композиции; и
(f) необязательно, прессования смеси, полученной на стадии (е), в стандартную лекарственную форму.
14. Способ получения продукта влажного гранулирования, подходящего в качестве предшественника для получения твердой фармацевтической антидиабетической композиции по п.1, включающий стадии:
(а) смешивания микронизированных частиц соединения формулы (I)
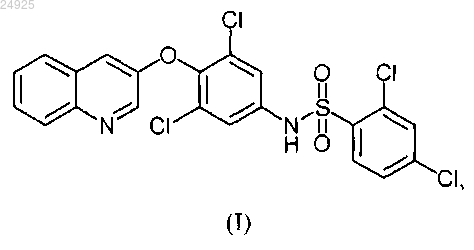
или его соли с одним или более эксципиентами, с получением их смеси;
(b) добавления гранулирующего раствора к смеси, полученной на стадии (а), и гранулирования раствора и смеси с получением влажных гранул.
15. Фармацевтическая композиция-предшественник, полученная с использованием способа влажного гранулирования по п.14, подходящая для использования для получения твердой стандартной лекарственной формы соединения формулы (I), причем указанная композиция-предшественник содержит:
(a) от приблизительно 0,5 до приблизительно 7,0% безилатной соли соединения формулы (I);
(b) от приблизительно 25 до 45% моногидрата лактозы;
(c) от приблизительно 25 до приблизительно 45% микрокристаллической целлюлозы;
(d) от приблизительно 2 до 4% повидона;
(e) от приблизительно 15 до приблизительно 24% воды,
в которой все процентные доли представляют собой массовые процентные доли.
16. Способ лечения PPARγ-опосредованного состояния или расстройства у человека, включающий введение субъекту терапевтически эффективного количества твердой фармацевтической композиции по п.1.
Текст
АНТИДИАБЕТИЧЕСКИЕ ТВЕРДЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ Изобретение относится к антидиабетической фармацевтической композиции в твердой форме,подходящей для перорального введения субъекту, которая содержит соединение формулы (I) или его соль, в которой твердая фармацевтическая композиция после введения субъекту способна обеспечивать субъекту AUC0 для соединения (I) по меньшей мере или приблизительно 150-5000 нгч/мл. Композиция содержит соединение формулы (I), предоставленное в форме бензолсульфонатной (безилатной) соли и составляющее от приблизительно 0,6 до 7,0% композиции; моногидрат лактозы, составляющий от приблизительно 25 до приблизительно 35% композиции; кросповидон, составляющий от приблизительно 4 до приблизительно 5% композиции; микрокристаллическую целлюлозу, составляющую от приблизительно 50 до приблизительно 60% композиции; повидон, составляющий от приблизительно 1 до приблизительно 3% композиции; стеарат магния, составляющий от приблизительно 0,25 до приблизительно 1,5% композиции, где все процентные доли представляют собой массовые процентные доли. Также описаны способы получения композиций и способы лечения PPAR-опосредованного состояния. Область техники Изобретение относится, главным образом, к твердым фармацевтическим композициям селективного модулятора -рецепторов, активируемых пролифераторами пероксисом ("PPAR"); к способам получения указанных композиций и способам их применения для лечения различных заболеваний и расстройств. Уровень техники-Рецептор, активируемый пролифераторами пероксисом ("PPAR"), является членом суперсемейства ядерных рецепторов активируемых лигандами факторов транскрипции и, как было показано, экспрессируется, главным образом, в адипозной ткани. Его экспрессия индуцируется на ранних стадиях дифференцировки нескольких клеточных линий преадипоцитов. В настоящее время дополнительные исследования показали, что PPAR играет центральную роль в адипогенном сигнальном каскаде. PPAR также регулирует ген ob/лептина, который участвует в регулировке энергетического гомеостаза и дифференцировке адипоцитов, что, как было показано, является главным этапом, нацеленным на лечение таких расстройств, как ожирение, диабет и дислипидемия. Что касается клинического значения PPAR, соединения, которые модулируют функцию PPAR,можно использовать для разработки новых терапевтических агентов. Мощные модуляторы PPAR были описаны, например, в международной патентной публикации WO 01/00579 и в патентах США 6200995 В 1, 6583157 В 2, 6653332 В 2 и 7041691 В 1. Один из указанных многообещающих модуляторов,идентифицируемых в настоящем документе как соединение 101 (или соединение формулы (I, находится в клинической разработке для лечения диабета 2 типа. Подходящая фармацевтическая композиция или лекарственная форма для указанной молекулы является существенной для ее применения в профилактике или лечении заболевания. Фармацевтические композиции, которые улучшают стабильность,увеличивают биодоступность и упрощают введение, были бы особенно подходящими. Лекарственные формы, способные облегчать введение комбинированных лекарственных средств, также являются желательными. Свободное основание и некоторые фармацевтически приемлемые соли соединения 101 описаны в международной патентной публикации WO 01/00579 и в патентах США 6583157 В 2 и 7041691 В 1. Патент США 7223761 В 2 утверждает, что соль соединения 101 с бензолсульфоновой кислотой (безилат) и ее полиморфы демонстрирует превосходную стабильность и гигроскопические свойства по сравнению с другими солями соединения 101. Несмотря на превосходную стабильность и гигроскопические свойства безилата соединения 101 безилат плохо растворяется в водных растворителях и в большинстве органических растворителей, что сильно ограничивает его эффективную концентрацию в фармацевтическом препарате и может приводить к пониженной биодоступности после введения. Предварительная патентная заявка США 61/102658 описывает фармацевтические препараты для перорального введения, включающие жидкие (на масляной основе) композиции безилата соединения 101 в капсуле. Несмотря на желаемую растворимость и биодоступность, которые наблюдаются у безилата соединения 101 в композиции на масляной основе, капсулы имеют склонность к протеканию или выпадению их содержимого в осадок с течением времени. Вытекание содержимого капсулы в течение времени может приводить к потере активного ингредиента капсулы и далее может приводить к контаминации содержимого капсулы. Выпадение содержимого капсулы в осадок в течение времени может приводить к потере биодоступности. Таким образом, существует потребность в фармацевтической композиции безилата и другой соли и полиморфных форм данного класса модуляторов PPAR, которая имеет подходящую биодоступность и стабильность при хранении и которая не склонна к протеканию жидкости из капсулы с течением времени. Этим и другим неудовлетворенным потребностям адресовано настоящее описание. Сущность изобретения Вариант осуществления настоящего изобретения (1). В первом варианте осуществления настоящее изобретение относится к антидиабетической фармацевтической композиции в твердой форме, подходящей для перорального введения субъекту, включая, без ограничения, человека, которая включает соединение формулы (I) или его соль, в которой твердая фармацевтическая композиция после введения субъекту способна обеспечивать AUC0 (площадь под кривой графика зависимости концентрации лекарственного средства от времени) для соединения (I) по меньшей мере или приблизительно 150-5000 нгч/мл. Соединение формулы (I) альтернативно упоминается в настоящем документе как соединение 101. В еще одном аспекте варианта осуществления настоящего изобретения (1) твердая фармацевтиче-1 024925 ская композиция после введения субъекту способна обеспечивать Tmax для соединения формулы (I) менее приблизительно 5,0 ч. В еще одном аспекте варианта осуществления настоящего изобретения (1) твердая фармацевтическая композиция после введения субъекту способна обеспечивать Tmax для соединения формулы (I) менее приблизительно 4,0 ч. В еще одном аспекте варианта осуществления настоящего изобретения (1) соединение формулы (I) присутствует в виде соли, выбранной из группы, состоящей из бензолсульфоната, гидрохлорида, гидробромида и п-толуолсульфоната. В еще одном аспекте варианта осуществления настоящего изобретения (1) соединение формулы (I) присутствует в виде бензолсульфоната (альтернативно, называемого безилатом), а твердая фармацевтическая композиция после введения субъекту способна обеспечивать субъекту AUC0 для соединения(I) по меньшей мере или приблизительно 150-5000 нгч/мл и Tmax для соединения формулы (I) менее приблизительно 4,0 ч. В еще одном аспекте варианта осуществления настоящего изобретения (1) твердая фармацевтическая композиция в любом из упомянутых аспектов включает по меньшей мере одно дополнительное антидиабетическое соединение, помимо соединения формулы (I). В еще одном аспекте варианта осуществления настоящего изобретения (1) твердая фармацевтическая композиция в любом из упомянутых аспектов находится в форме порошка или таблетки, включая порошок, помещенный в капсулу. В еще одном аспекте варианта осуществления настоящего изобретения (1) твердая фармацевтическая композиция в любом из упомянутых аспектов предоставляется в виде стандартной лекарственной формы. В еще одном аспекте варианта осуществления настоящего изобретения (1) твердую фармацевтическую композицию в любом из упомянутых аспектов получают способом, который включает стадии: (а) микронизации соединения формулы (I); и (b) осуществления влажного гранулирования микронизированного соединения. Один или более фармацевтически приемлемых эксципиентов (или их комбинации) можно включать в качестве интрагранулярного материала, т.е. включать перед осуществлением влажного гранулирования; и/или указанные наполнители можно добавлять в качестве экстрагранулярного материала к продукту влажного гранулирования, т.е. добавлять после того как продукт влажного гранулирования был высушен. Вариант осуществления настоящего изобретения (2). Изобретение дополнительно относится к антидиабетической фармацевтической композиции в твердой форме, подходящей для перорального введения субъекту, включая, без ограничения, человека, которая содержит соединение формулы (I) или его соль, в которой средний размер частиц соединения (1) составляет менее 150 мкм. В еще одном аспекте варианта осуществления (2) настоящего изобретения средний размер частиц составляет менее 100 мкм. В еще одном аспекте варианта осуществления (2) настоящего изобретения средний размер частиц составляет менее 50 мкм. В предпочтительном еще одном аспекте варианта осуществления (2) настоящего изобретения соединение формулы (I) получают в микронизированной форме, а средний размер частиц соединения составляет 20 мкм или менее. В особенно предпочтительном аспекте варианта осуществления (2) настоящего изобретения средний размер частиц составляет приблизительно от 1 до 10 мкм. В еще одном аспекте варианта осуществления (2) настоящего изобретения соединение формулы (I) представлено в виде соли, выбранной из группы, состоящей из бензолсульфонатной соли, гидрохлоридной соли, гидробромидной соли и п-толуолсульфонатной соли. В еще одном аспекте варианта осуществления (2) настоящего изобретения соединение формулы (I) представлено в виде бензолсульфонатной соли (альтернативно называемой безилатной солью). В еще одном аспекте варианта осуществления (2) настоящего изобретения соединение формулы (I) предоставлено в виде бензолсульфонатной соли и присутствует в фармацевтической композиции в количестве приблизительно от 0,1 до 10,0 мг. В еще одном аспекте варианта осуществления (2) настоящего изобретения твердая фармацевтическая композиция включает один или более фармацевтически приемлемых эксципиентов. В еще одном аспекте варианта осуществления (2) настоящего изобретения твердая фармацевтиче-2 024925 ская композиция включает один или более эксципиентов, выбранных из группы, состоящей из наполнителей, разбавителей, суперразрыхлителей, связующих агентов, агентов, обеспечивающих скольжение,смазывающих агентов и их комбинаций. В еще одном аспекте варианта осуществления (2) настоящего изобретения твердая фармацевтическая композиция включает один или более фармацевтически приемлемых эксципиентов, выбранных из группы, состоящей из моногидрата лактозы, микрокристаллической целлюлозы, кросповидона, повидона, коллоидного диоксида кремния, стеарата магния и их комбинаций. В еще одном аспекте варианта осуществления (2) настоящего изобретения твердую фармацевтическую композицию получают в виде стандартной лекарственной формы, которая после перорального введения субъекту-человеку обеспечивает субъекту AUC0 для соединения (I) по меньшей мере или приблизительно 150-5000 нгч/мл и Tmax для соединения формулы (I) 4,0 ч или менее. В еще одном аспекте варианта осуществления (2) настоящего изобретения композиция находится в форме сыпучего порошка, таблетки, таблетки в виде капсулы или порошка, помещенного в капсулу, и включает:(1) соединение формулы (I), представленное в форме безилатной соли и составляющее от приблизительно 0,6 до 7,0% композиции;(2) моногидрат лактозы, составляющий от приблизительно 25 до приблизительно 35% композиции;(3) кросповидон, составляющий от приблизительно 4 до приблизительно 5% композиции;(4) микрокристаллическую целлюлозу, составляющую от приблизительно 50 до приблизительно 60% композиции;(5) повидон, составляющий от приблизительно 1 до приблизительно 3% композиции;(6) необязательно, коллоидный диоксид кремния, составляющий вплоть до приблизительно 0,7% композиции; и(7) стеарат магния, составляющий от приблизительно 0,25 до приблизительно 1,5% композиции, в которой все процентные доли представляют собой массовые процентные доли. В еще одном аспекте варианта осуществления (2) настоящего изобретения твердая фармацевтическая композиция имеет такую скорость растворения, что 75% соединения формулы (I) растворяются в течение 45 мин, по результатам тестирования растворения с использованием аппарата USP типа 2 (лопастного) в водной среде, содержащей 0,5% SDS при рН 1,5 (с HCl), при скорости перемешивания 50 об/мин (900 мл при 37 С). В особенно предпочтительном аспекте варианта осуществления (2) настоящего изобретения твердую фармацевтическую композицию по любому из упомянутых аспектов указанного варианта осуществления получают способом, который включает стадии: (а) микронизации соединения формулы (I); и (b) осуществления влажного гранулирования соединения формулы (I) в комбинации с одним или более фармацевтически приемлемыми эксципиентами. Удивительным оказалось то, что влажное гранулирование, предпочтительно в сочетании с использованием микронизированного активного ингредиента, размолотого до среднего размера частиц менее 150 мкм, и более предпочтительно до размера от 1 до приблизительно 10 мкм, является способным обеспечивать однородную и стабильную фармацевтическую композицию, которая имеет отличную растворимость и биодоступность, сравнимую с капсулой с жидким наполнением на масляной основе, как описано в предварительной патентной заявке США 61/102658, в то же время избегая проблем, связанных с целостностью капсулы, часто связываемых с капсулами с жидким наполнением. Вариант осуществления настоящего изобретения (3). В третьем варианте своего осуществления настоящее изобретение относится к способу получения фармацевтической композиции в твердой форме,содержащей соединение формулы (I) или его соль, в которой твердую фармацевтическую композицию получают влажным гранулированием. В еще одном аспекте варианта осуществления (3) настоящего изобретения способ включает стадии:(a) просеивания и смешивания микронизированных частиц соединения формулы (I) с одним или более эксципиентами, с получением порошкообразной смеси;(b) добавления гранулирующего раствора к интрагранулярному материалу, полученному на стадии(c) сушки влажных гранул, полученных на стадии (b), с получением сухих гранул;(d) размалывания сухих гранул, полученных на стадии (с);(e) смешивания размолотых сухих гранул, полученных на стадии (d), с экстрагранулярным материалом, состоящим из одного или более эксципиентов, с получением смеси, представляющей конечный дозирующий состав твердой фармацевтической композиции; и(f) необязательно, прессования смеси, полученной на стадии (е), в стандартную лекарственную форму. В еще одном аспекте варианта осуществления (3) настоящего изобретения эксципиенты выбирают из группы, состоящей из разбавителей, наполнителей, суперразрыхлителей, связующих агентов, агентов,обеспечивающих скольжение, смазывающих агентов и их комбинаций. В еще одном аспекте варианта осуществления (3) настоящего изобретения эксципиенты выбирают из группы, состоящей из микрокристаллической целлюлозы, моногидрата лактозы, кросповидона, повидона, коллоидного диоксида кремния и стеарата магния; и способ включает стадии (е) и (f). В особенно предпочтительном аспекте варианта осуществления (3) настоящего изобретения способ включает дополнительную стадию (b)(i) добавления гранулирующего раствора к влажным гранулам,полученным на стадии (b), с получением влажных гранул, имеющих состав, отличный от состава гранул,полученных на стадии (b); в котором гранулирующий раствор, добавленный на стадии (b)(i), имеет тот же состав, что и гранулирующий раствор, добавленный на стадии (b), или отличается от него по составу. Указанный способ является предпочтительным способом гранулирования, поскольку неожиданно было установлено, что в результате он обеспечивает композиции, имеющие более высокую мощность, что будет показано в примерах. В еще одном аспекте варианта осуществления (3) настоящего изобретения, в котором применяется стадия (b) (i) предыдущего абзаца, способ по указанному варианту осуществления осуществляют таким образом, что гранулирующий раствор, добавленный на стадии (b), включает по меньшей мере приблизительно 15% и предпочтительно по меньшей мере приблизительно 20 мас.% повидона в гранулирующей воде, а гранулирующий раствор, добавленный на стадии (b)(i), представляет собой воду, по существу, не содержащую повидона, или воду, содержащую повидон, но в количестве, которое меньше количества,имеющегося в гранулирующем растворе стадии (b). Вариант осуществления настоящего изобретения (4). Четвертый вариант осуществления настоящего изобретения относится к фармацевтической композиции в твердой форме, подходящей для введения стандартной дозы субъекту, предпочтительно человеку, в порошкообразной, таблетированной или инкапсулированной форме, включая фармацевтическую композицию, полученную с использованием любой их методик влажного гранулирования, описанных для вариантов осуществления (3) настоящего изобретения. Вариант осуществления настоящего изобретения (5). В пятом варианте своего осуществления настоящее изобретение относится к способу получения продукта влажного гранулирования, подходящему в качестве предшественника для получения антидиабетической фармацевтической композиции в твердой форме; указанный способ влажного гранулирования включает стадии:(а) смешивания микронизированных частиц соединения формулы (I) или его соли с одним или более эксципиентами, с получением интрагранулярного материала;(b) добавления гранулирующего раствора к интрагранулярному материалу, полученному на стадии(а), и гранулирования раствора и интрагранулярного материала с получением влажных гранул. В еще одном аспекте способов варианта осуществления (4) настоящего изобретения или способов варианта осуществления (3) настоящего изобретения соединение формулы (I) находится в виде безилатной соли, а микронизированные частицы соединения формулы (I) имеют средний размер менее приблизительно 20 мкм и предпочтительно приблизительно или менее 20 мкм. В еще одном аспекте способов варианта осуществления (5) настоящего изобретения способ включает дополнительную стадию (b) (i), на которой добавляют гранулирующий раствор к влажным гранулам, полученным на стадии (b), с получением влажных гранул, отличающихся по составу от влажных гранул, полученных на стадии (b); в котором гранулирующий раствор, добавленный на стадии (b)(i),имеет тот же состав, что и гранулирующий раствор, добавленный на стадии (b), или отличается от него по составу. В еще одном аспекте варианта осуществления (5) настоящего изобретения, в котором применяется стадия (b) (i) предыдущего абзаца, способ по указанному варианту осуществления осуществляют таким образом, что гранулирующий раствор, добавленный на стадии (b), включает по меньшей мере приблизительно 15% и предпочтительно по меньшей мере приблизительно 20 мас.% повидона в гранулирующей воде, а гранулирующий раствор, добавленный на стадии (b) (i), представляет собой воду, по существу, не содержащую повидона, или воду, содержащую повидон, но в количестве, которое меньше его количества, имеющегося в гранулирующем растворе стадии (b). Вариант осуществления настоящего изобретения (6). Шестой вариант осуществления настоящего изобретения относится к фармацевтической композиции-предшественнику, полученной влажным гранулированием, осуществленным с использованием любого из аспектов способа, описанных в варианте осуществления (5), в котором предшественник является подходящим для использования для получения твердой лекарственной пероральной формы соединения формулы (I). В особенно предпочтительном аспекте варианта осуществления (6) настоящего изобретения предшественник, полученный с использованием влажного гранулирования, включает:(a) от приблизительно 0,5 до приблизительно 7,0% безилатной соли соединения формулы (I);(e) от приблизительно 15 до приблизительно 24% воды; в котором все процентные доли представляют собой массовые процентные доли. В еще одном аспекте варианта осуществления (6) настоящего изобретения соотношение интрагранулярной микрокристаллической целлюлозы и интрагранулярного моногидрата лактозы составляет от приблизительно 1,8:1 до приблизительно 0,67:1 и наиболее предпочтительно приблизительно 1,5:1. В еще одном аспекте варианта осуществления (6) настоящего изобретения вода (е), использованная для гранулирования, была удалена с получением высушенных гранул. В каждом из вариантов осуществления (1), (2), (4) и (6) композиция, содержащая соединение формулы (I), может дополнительно включать антидиабетическое соединение, в дополнение к соединению формулы (I). Если добавлено дополнительное антидиабетическое соединение к предшественнику варианта осуществления (6) в качестве его дополнительного активного компонента, количество эксципиента(-ов), использованного в композиции предшественника, можно подбирать известным способом таким образом, чтобы вместить дополнительный активный ингредиент. В каждом из вариантов осуществления (1), (2), (4) и (6) твердая фармацевтическая композиция, полученная в форме таблетки, содержащей от 0,5 до 10 мг соединения формулы (I), имеет такую скорость растворения, что 75% соединения формулы (I) растворяются в течение 45 мин, по результатам тестирования растворения с использованием аппарата USP типа 2 (лопастного) в водной среде (900 мл при 37 С), содержащей 0,5% SDS при рН 1,5 (с HCl), при скорости перемешивания 50 об/мин. Вариант осуществления настоящего изобретения (7). Седьмой вариант осуществления настоящего изобретения относится к способу лечения, профилактики или улучшения PPAR-опосредованного состояния или расстройства у субъекта; способ включает введение субъекту терапевтически эффективного количества твердой фармацевтической композиции, описанной в предыдущих вариантах осуществления настоящего изобретения. PPAR-опосредованное состояние или расстройство включает метаболические расстройства или воспалительные расстройства. Метаболические расстройства включают диабет, ожирение, гиперхолестеринемию, гиперлипидемию, дислипидемию, гипертриглицеридемию, гипергликемию,резистентность к инсулину и гиперинсулинемию. В предпочтительных аспектах варианта осуществления(7) настоящего изобретения подвергаемое лечению метаболическое расстройство представляет собой диабет 2 типа, а подвергаемые лечению воспалительные расстройства представляют собой ревматоидный артрит и атеросклероз. Заданное лечение предназначается для медицинских и ветеринарных целей. Описание фигур Фиг. 1. Данные по растворению для фармацевтических композиций по настоящему изобретению,включающих безилатную соль соединения 101, полученных посредством микронизации и влажного гранулирования. Фиг. 2. Сравнительная: данные по растворению для капсульных композиций безилатной соли соединения 101, полученных сухим смешиванием и горячим расплавом. Фиг. 3. Сравнительная: биодоступность (AUC) капсульных композиций безилатной соли соединения 101, полученных сухим смешиванием и горячим расплавом. Фиг. 4. Корреляция между биодоступностью (AUC) и растворением капсульных композиций безилатной соли соединения 101, полученных сухим смешиванием и горячим расплавом. Фиг. 5. Данные по биодоступности (AUC) для фармацевтических композиций по настоящему изобретению, включающих безилатную соль соединения 101, полученных посредством микронизации и влажного гранулирования. Фиг. 6. Относительная биодоступность (AUC) и Tmax композиций А и В безилатной соли соединения 101. Фиг. 7. Пример процесса получения таблетки безилатной соли соединения 101.(Заметьте, что данные по биодоступности, представленные на фиг. 3-6, были получены на обезьянах). Подробное описание Определения Термин "композиция", используемый в настоящем документе, относится к продукту, включающему перечисленные ингредиенты (и в описанных количествах, если это указано), а также к любому продукту, который получают, прямо или опосредованно, из комбинации перечисленных ингредиентов в описанных количествах. Под "фармацевтически приемлемым" подразумевается, что разбавитель, эксципиент или носитель должен быть совместимым с другими ингредиентами композиции и не наносит вреда его реципиенту. Нейтральные формы соединений могут быть получены контактированием соли с основанием или кислотой и выделением родительского соединения обычными способами. Родительская форма соединения отличается от различных солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях, но в других отношениях для целей настоящего изобретения соли являются эквивалентными родительской форме соединения. Термин "твердые формы" и родственные термины, используемые в настоящем документе, если не указано иное, относятся к кристаллическим формам и аморфным формам, включающим соединение 101 и его различные солевые формы. Термин "микронизированный", "микронизация" или "микронизирование" означает процесс уменьшения среднего диаметра частиц твердого материала. Термин "влажный гранулят" относится к продукту процесса влажного гранулирования, который обычно включает следующие последовательные стадии: (i) смешивание активного ингредиента по меньшей мере с одним эксципиентом, связующим агентом или разбавителем с получением порошкообразной смеси; (ii) добавление гранулирующего раствора, который может содержать один или более эксципиентов в растворителе, с получением, посредством высокоскоростного смешивания, влажного гранулята; (iii) сушка, размалыванием и/или смешивание влажного гранулята с дополнительными количествами по меньшей мере одного эксципиента с получением смеси; и (iv) необязательно, прессование высушенного гранулята или смеси, полученных на стадии (iii), в стандартную лекарственную форму, например таблетку. Эксципиенты, добавленные после влажного гранулирования, могут быть теми же эксципиентами того же или отличающегося качества/сорта, использованными перед или во время процесса влажного гранулирования. Предпочтительно, перед прессованием к массе смеси добавляют смазывающий агент. См., например, источник Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems,6-е изд., WilliamsWilkins, Baltimore MD (1995), стр. 194-204, содержание которого целиком включено в настоящий документ в качестве ссылки. Термин "кристаллический" и родственные термины, используемые в настоящем документе, когда используются для описания вещества, компонента или продукта, означают, что вещество, компонент или продукт является кристаллическим по результатам рентгеновского диффракционного анализа. См., например, источник Remington's Pharmaceutical Sciences, 18-e изд., Mack Publishing, Easton PA, стр. 173(1990); The United States Pharmacopeia, 23-е изд., стр. 1843-1844 (1995), содержание которого целиком включено в настоящий документ в качестве ссылки. Термин "кристаллические формы" и родственные термины, используемые в настоящем документе,относятся к различным кристаллическим модификациям данного вещества, включая, без ограничения,полиморфы, сольваты, гидраты, сокристаллы и другие молекулярные комплексы, а также соли, сольваты солей, гидраты солей, другие молекулярные комплексы солей и их полиморфы. Термин "фармацевтически приемлемые соли" означает соли активных соединений, которые получены с относительно нетоксичными кислотами. Кислотно-аддитивные соли можно получать контактированием нейтральной формы указанных соединений с достаточным количеством желаемой кислоты, неразбавленной или в подходящем инертном растворителе. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают соли, полученные с неорганическими кислотами, такими как хлористоводородная, бромистоводородная, азотная, угольная, моногидроугольная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, йодистоводородная или фосфористая кислоты и т.п., а также соли, полученные с относительно нетоксичными органическими кислотами, такими как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, субериновая, фумаровая, миндальная, фталевая, бензолсульфоновая, толуолсульфоновая, включая п-толуолсульфоновую, мтолуолсульфоновую и о-толуолсульфоновую, лимонная, винная, метансульфоновая и т.п. Также включены соли аминокислот, такие как аргинат и т.п., и соли органических кислот, таких как глюкуроновая или галактуроновая кислоты и т.п. (см., например, Berge et al., J. Pharm. Sci. 66:1-19 (1997. Используемый в настоящем документе в отношении соли или полиморфа термин "чистые", т.е., по существу, не содержащие других полиморфов, означает, что они содержат менее приблизительно 10% одного или более других полиморфов, предпочтительно менее приблизительно 5% одного или более других полиморфов, более предпочтительно менее приблизительно 3% одного или более других полиморфов, наиболее предпочтительно менее приблизительно 1% одного или более других полиморфов. Термин "аморфная форма", используемый в настоящем документе, относится к некристаллической форме вещества. Термины "полиморфы" и "полиморфные формы" и родственные термины, используемые в настоя-6 024925 щем документе, относятся к кристаллическим формам молекулы. Различные полиморфы могут иметь различные физические свойства, такие как, например, температура плавления, теплота плавления, растворимость, скорость растворения и/или колебательный спектр, как результат конфигурации или конформации молекул в кристаллической решетке. Различия в физических свойствах, которые демонстрируют полиморфы, влияют на фармацевтические параметры, такие как стабильность при хранении, прессуемость и плотность (важные для составления композиции и производства продукта), и скорость растворения (важный фактор для биодоступности). Полиморфные молекулы можно получать различными способами, известными специалистам. Указанные способы включают, без ограничения, кристаллизацию расплава, охлаждение расплава, перекристаллизация из растворителя, десольвацию, быстрое выпаривание, быстрое охлаждение, медленное охлаждение, диффузию пара и сублимацию. Методики изучения свойств полиморфов включают, без ограничения, дифференциальную сканирующую калориметрию (DSC), рентгеновскую порошковую дифрактометрию (XRPD), рентгеновскую дифрактометрию монокристаллов, колебательную спектроскопию, например, ИК-спектроскопию и рамановскую спектроскопию, ЯМР твердого тела, оптическую микроскопию нагретого тела, сканирующую электронную микроскопию (SEM), электронную кристаллографию и количественный анализ, анализ размеров частиц(PSA), анализ площади поверхности, исследования растворимости и исследования растворения. Термин "сольват", используемый в настоящем документе, относится к кристаллической форме вещества, которая содержит растворитель. Термин "гидрат" относится к сольвату, в котором растворителем является вода. Термин "десольватированный сольват", используемый в настоящем документе, относится к кристаллической форме вещества, которая может быть получена только удалением растворителя из сольвата. Термин "алкил", используемый в настоящем документе, относится к одновалентным насыщенным алифатическим гидрокарбильным группам, в особенности содержащим вплоть до приблизительно 11 атомов углерода, более предпочтительно к низшим алкилам, содержащим от 1 до 8 атомов углерода и еще более предпочтительно от 1 до 6 атомов углерода. Углеводородная цепь может быть как прямой, так и разветвленной. Примерами указанного термина могут служить такие группы как метил, этил, н-пропил,изопропил, н-бутил, изобутил, трет-бутил, н-гексил, н-октил, трет-октил и т.п. Термин "низший алкил" относится к алкильными группам, имеющим от 1 до 6 атомов углерода. Термин "алкил" также включает"циклоалкил", как определено ниже. Термин "гетероалкил", как в отдельности, так и в комбинации с другим термином, означает, если не указано иное, стабильную прямую или разветвленную цепь или циклический углеводородный радикал или их комбинации, состоящие из заявленного количества атомов углерода и из от одного до трех гетероатомов, выбранных из группы, состоящей из О, N, Si и S, и в котором атомы азота и серы могут быть необязательно окислены, а гетероатом азота может быть необязательно кватернизирован. Гетероатом(-ы) О, N и S могут быть помещены на любую внутреннюю позицию гетероалкильной группы. Гетероатом(-ы) Si может быть помещен на любую позицию гетероалкильной группы, включая позицию, на которой алкильная группа присоединена к оставшейся части молекулы. Примеры включают -СН 2-СН 2-О-СН 3,-CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-СН 3, -CH2-S-CH2-CH3, -CH2-CH2-S(О)-СН 3, -CH2-CH2-S(O)2-CH3,-CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3 и -СН=СН-N(CH3)-CH3. До двух гетероатомов могут располагаться последовательно, как, например, -CH2-NH-OCH3 и -CH2-O-Si(CH3)3. Термин "гетероалкил" также относится к радикалам, которые более подробно описаны ниже как "гетероалкилен" и "гетероциклоалкил"."Арил" относится к одновалентной ароматической углеводородной группе, полученной удалением одного атома водорода от одного атома углерода родительской ароматической кольцевой системы. Типичные арильные группы включают, без ограничения, группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, фторантена, флуорена, гексацена, гексафена, гексалена, as-индацена, s-индацена, индана, индена, нафталена, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена, рубицена, трифенилена, тринафталена и т.п. В частности, арильная группа включает от 6 до 14 атомов углерода. Термин "эксципиент" относится к неактивному ингредиенту фармацевтических композиций по настоящему изобретению. Он включает, без ограничения, растворители, увлажняющие агенты, разбавители, суперразрыхлители, связующие агенты, агенты, обеспечивающие скольжение и смазывающие агенты. Термины "лечить", "подвергаемый лечению" или "лечение", используемые в настоящем документе,относятся к уменьшению или улучшению прогрессирования, тяжести и/или продолжительности расстройства, или к устранению, уменьшению или улучшению симптомов расстройства, или к задержке рецидива или возникновения расстройства или его одного или более симптомов у субъекта, которые происходят вследствие введения одного или более соединений. Термин "терапевтически эффективное количество" относится к количеству рассматриваемой соли или полиморфа, которое будет вызывать биологический или лечебный ответ в ткани, системе, животном или человеке, которого добивается исследователь, ветеринар, врач или другой клиницист, или который является достаточным для предотвращения развития или до некоторой степени облегчения одного или более симптомов заболевания, по поводу которого проводится лечение. Термин "субъект", используемый в настоящем документе, включает животных, таких как млекопитающие, включая, без ограничения, приматов (например, людей), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей и т.п. В предпочтительном варианте осуществления настоящего изобретения субъектом является человек. Используемый в настоящем документе термин "диабет" относится к диабету 1 типа (ювенильному диабету), сахарному диабету 2 типа (инсулиннезависимому сахарному диабету или T2DM) и предиабету. Предиабет определяют как состояние, при котором анализ на глюкозу плазмы натощак и/или пероральный тест на толерантность к глюкозе дают повышенные результаты, но не трактуются как диабетические. Термин "ожирение", используемый в настоящем документе, представляет собой состояние, при котором имеет место избыток жира в организме. В некоторых вариантах осуществления настоящего изобретения ожирение определяют на основе индекса массы тела (BMI), который рассчитывается как вес тела, деленный на рост в метрах в квадрате, кг/м 2. В некоторых вариантах осуществления настоящего изобретения "субъект с ожирением" может являться в других отношениях здоровым субъектом с индексом массы тела (BMI), превышающим или равным 30 кг/м 2, или субъектом, имеющим по меньшей мере одну сопутствующую патологию, с BMI, превышающим или равным 27 кг/м 2. В некоторых вариантах осуществления настоящего изобретения "субъект с риском ожирения" может являться в других отношениях здоровым субъектом с BMI от 25 до менее 30 кг/м 2, или субъектом, имеющим по меньшей мере одну сопутствующую патологию, с BMI от 25 до менее 27 кг/м 2. Термин "метаболический синдром", используемый в настоящем документе, определен Adult Treatment Panel III (ATP III; National Institutes of Health: Third Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III), основные положения; Bethesda, Md., National Institutes of Health, National Heart, Lung andBlood Institute, 2001 (публикация NIH01-3670). Вкратце, метаболический синдром наблюдается, когда субъект отвечает трем или более из пяти критериев, относящихся к ожирению, гипертриглицеридемии,низкому содержанию холестерина ЛПВП, высокому кровяному давлению и высокому содержанию глюкозы натощак. Используемый в настоящем документе термин "PPAR-опосредованное состояние или расстройство" или "PPAR-опосредованное состояние или заболевание" относится к состоянию, расстройству или заболеванию, при котором модуляция PPAR приводит к облегчению основного состояния, расстройства или заболевания (например, модулятор PPAR вызывает некоторое улучшение состояния здоровья, по меньшей мере, у некоторых пациентов). Примеры PPAR-опосредованных состояний или расстройств включают, без ограничения, метаболические расстройства, например диабет, диабет 2 типа, ожирение,гипергликемию, резистентность к инсулину, гиперинсулинемию, гиперхолестеринемию, гипертензию,гиперлипопротеинемию, гиперлипидемию, гипертриглицеридемию и дислипидемию, и воспалительные состояния, например ревматоидный артрит и атеросклероз. Термин "селективный модулятор PPAR", используемый в настоящем документе, определяется как любое натуральное или синтетическое вещество, способное связываться с ядерным рецептором PPAR таким образом, что вещество активирует способность рецептора вызывать один или более желательных биологических эффектов, не активируя при этом также (или с значительно уменьшенной активацией) способности рецептора вызывать один или более нежелательных биологических эффектов. Например,селективные модуляторы PPAR, подходящие для введения пациенту с диабетом в комбинациях по настоящему изобретению, включают соединения, такие как соединение 101, которые естественным образом (или посредством своего строения, как в случае соединения 101) являются способными взаимодействовать с PPAR-связывающим карманом таким образом, что это вызывает те же или, по существу, те же сенсибилизирующие к инсулину эффекты, которые получают при использовании так называемых "полных агонистов" PPAR, таких как росиглитазон (Avandia) и пиоглитазон (Actos), но не вызывает или значительно смягчает известные вредные побочные эффекты, связанные с использованием указанных полных агонистов, включая, например, их тенденцию способствовать прибавке массы тела, задержке жидкости и перелому костей. Термин "селективный модулятор PPAR", таким образом, следует понимать, как исключающий вещества, такие как полные агонисты PPAR, которые, как обычно понимают специалисты в области техники, способны активировать по существу полный спектр эффектов PPAR, в то же время обладая малой способностью, если вообще обладая, дифференциально активировать только благоприятные эффекты рецептора, а не его вредные эффекты. Конкретным примером класса полных агонистов PPAR, исключенных из настоящего определения "селективного модулятора PPAR", является тиазолидиндионовый (TZD) класс полных агонистов PPAR. Одним из главных преимуществ селективного модулятора PPAR является то, что в отличие от полных или неселективных агонистов PPAR введение возрастающих доз селективного модулятора PPAR пациенту с диабетом может приводить к терапевтическим преимуществам по сравнению с выбранными пределами доз, при малом сопутствующем увеличении вредных побочных эффектов или вовсе без него. Указанное отличие между кривыми дозаответ для благоприятных эффектов по сравнению с вредными эффектами обеспечивает широкое тера-8 024925 певтическое окно для введения селективного модулятора PPAR пациенту с диабетом. Селективные модуляторы PPAR (также называемые SPPARM) обсуждаются в источниках "Higgins L.S., Montzoros CS,"The development of INT131 as a Selective PPAR Modulator: Approach to a Safer Insulin Sensitizer," PPARPharmacology and Experimental Therapeutics 2006 Vol 318, No 2 pages 863-871. Данные публикации целиком включены в настоящий документ в качестве ссылок. В той степени, в которой ссылки, процитированные в указанных публикациях, описывают селективные модуляторы PPAR, как определено в настоящем документе, указанные процитированные ссылки также включены в настоящий документ в качестве ссылок. Используемый в настоящем документе термин "примерно" или "приблизительно" означает приемлемую ошибку для конкретной величины, как определено специалистом в области техники, которая частично зависит от того, каким образом величина измерялась или определялась. В некоторых вариантах осуществления настоящего изобретения термин "примерно" или "приблизительно" означает пределы 1,2, 3 или 4 стандартных отклонений. В некоторых вариантах осуществления настоящего изобретения термин "примерно" или "приблизительно" означает 50, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0,005% данной величины или пределов. Термин "AUC", используемый в настоящем документе, относится к площади под кривой графика зависимости концентрации лекарственного средства в плазме от времени. Термин "Tmax", используемый в настоящем документе, относится к времени после введения лекарственного средства, когда достигается максимальная концентрация в плазме. Термин "интрагранулярный" относится к ингредиентам фармацевтической композиции по настоящему изобретению, которые объединены в процессе влажного гранулирования с использованием жидкого гранулирующего раствора для получения влажных гранул, которые содержат гранулированные ингредиенты. Термин "экстрагранулярный" относится к ингредиентам фармацевтической композиции по настоящему изобретению, которые объединены (например, смешаны в сухом виде) с продуктом влажного гранулирования, после того как последний продукт влажного гранулирования был превращен из влажных гранул в сухой порошок. Подробное описание композиций и способов Изобретение относится к твердым фармацевтическим композициям, которые являются пригодными для пероральной доставки селективных модуляторов PPAR, В которых композиции содержат соединение формулы (I) (также называемое в настоящем документе соединением 101) или его соль и по меньшей мере один фармацевтически приемлемый эксципиент, где композиция,после перорального введения субъекту, демонстрирует отличную биодоступность, предоставляющую возможность применения в получении стандартных лекарственных форм для перорального введения в твердой форме субъектам, которым требуется лечение PPAR-опосредованных состояний. Что касается методических аспектов, изобретение дополнительно относится к способам получения композиций, которые могут достигать желательной биодоступности и стабильности в пероральной стандартной лекарственной форме фармацевтической композиции, содержащей соединение формулы (I). Способы по настоящему изобретению включают микронизацию соединения формулы (I) до среднего размера частиц менее 150 мкм и предпочтительно приблизительно или менее 20 мкм с последующим осуществлением влажного гранулирования полученного микронизированного соединения в комбинации с одним или более фармацевтически приемлемыми эксципиентами. Указанные эксципиенты могут быть(а) включены в качестве интрагранулярных ингредиентов до или во время влажного гранулирования,становясь, таким образом, объектом процесса влажного гранулирования; и/или (b) добавлены в качестве экстрагранулярных эксципиентов (например, смешанных в сухом виде) к уже полученной и высушенной смеси, полученной влажным гранулированием. Еще одной особенностью изобретения является открытие того факта, что при использовании композиций соединения (I), полученных способами сухого смешивания и горячего расплава, не получают фармацевтических композиций, демонстрирующих коммерчески приемлемые комбинации свойств пероральной биодоступности, стабильности при хранении (деградация или утрата активности при форсиро-9 024925 ванных условиях хранения) и однородности продукта, которые успешно достигаются композициями и при использовании способов по настоящему изобретению. Кроме того, в то время как капсулы с жидким наполнением обычно предлагают сравнимые свойства биодоступности и растворимости, композиции,описанные в настоящем документе, облегчают проблемы, связанные с потенциальным протеканием или выпадением в осадок со временем для капсул с жидким наполнением на масляной основе. В соответствии с особенно предпочтительной практикой изобретения соединение формулы (I),представленное в форме безилатной соли, микронизируют перед влажным гранулированием с получением частиц соединения, имеющих средний размер от приблизительно 1 до 10 мкм. Безилатную соль соединения (I) берут в количествах, достаточных для того, чтобы составить от приблизительно 0,1 до 10 мг фармацевтической композиции и предпочтительно приблизительно от 0,5 до 5 мг в конечной дозированной твердой таблетке или порошкообразной форме, помещенной в капсулу. В предпочтительном способе композицию получают осуществлением влажного гранулирования микронизированной безилатной соли с одним или более фармацевтически приемлемыми эксципиентами, включенными в качестве интрагранулярных материалов. В особенно предпочтительной практике способа влажного гранулирования неожиданно было установлено, что превосходная активность (более 95%) для соединения (I) может быть достигнута в композиции, если влажное гранулирование осуществляют многостадийным способом,включающим сначала добавление связующего агента (например, повидона) и гранулирующей воды в более высокой концентрации связующего агента, чем это желательно в конечном итоге; с последующей дополнительной стадией гранулирования с использованием только воды или воды и меньшей концентрации связующего агента. При использовании предпочтительных способов получения по настоящему изобретению соединение формулы (I) демонстрирует такую скорость растворения, что по меньшей мере 75% соединения растворяются через 45 мин. После введения в виде стандартной лекарственной формы субъекту, которому требуется лечение PPAR-опосредованного состояния, фармацевтическая композиция способна обеспечивать субъекту AUC0 (площадь под кривой графика зависимости концентрации лекарственного средства в плазме от времени) для соединения (I) по меньшей мере или приблизительно 150-5000 нгч/мл, и Tmax, равное 4,0 ч или менее. Изобретение дополнительно относится к композиции-предшественнику, полученной влажным гранулированием, которую можно использовать в качестве промежуточного материала, подходящего для получения удобной однородной смеси соединения формулы (I) с другими лекарственными ингредиентами, такими как дополнительные антидиабетические агенты, перед окончательным получением композиции стандартной лекарственной формы, содержащей комбинацию. Предшественник можно получать объединением микронизированного соединения формулы (I) с одним или более дополнительными терапевтическими агентами перед осуществлением влажного гранулирования объединенных ингредиентов. Альтернативно,влажные гранулы можно первоначально получать с микронизированным соединением (I) в качестве единственного терапевтического агента, после чего, после получения материала влажного гранулирования,можно добавлять один или более дополнительных антидиабетических агентов к первоначальному продукту гранулирования, как до, так и после сушки продукта. Количество эксципиента(-ов) как в композициипредшественнике, так и в конечной твердой фармацевтической композиции, можно подбирать известным образом, чтобы уравновесить наличие дополнительных антидиабетических ингредиентов. Соединение 101. Селективный модулятор PPAR, наиболее подходящий для использования в фармацевтических композициях по настоящему изобретению, представляет собой селективный модулятор PPAR (бензолсульфонатную соль 2,4-дихлор-N-[3,5-дихлор-4-(хинолин-3-илокси)фенил]бензолсульфонамида) или соединение 101, имеющее общую формулу (I), или его фармацевтически приемлемую соль, гидрат или полиморф Указанный выше селективный модулятор PPAR соединения 101 описан, например, в международной патентной публикации WO 01/00579 (соответствующей патенту США 7041691), в патентах США 6200995, 6583157, 6653332, содержание которых целиком включено в настоящий документ в качестве ссылок. Соли соединения 101. Фармацевтические композиции по настоящему изобретению могут содержать фармацевтически приемлемые соли соединения 101. Указанные соли включают, без ограничения, HCl, HBr, тозилатную и безилатную соли соединения 101. В предпочтительных вариантах осуществления настоящего изобретения безилатные соли соедине- 10024925 ния 101 используют в способах и композициях. Предпочтительная безилатная соль соединение 101 представлена формулой (I) Каждую соль, упомянутую в настоящем документе, можно получить из препарата соединения 101,которое можно синтезировать или получить любым способом, известным специалистам. В некоторых вариантах осуществления настоящего изобретения соединение 101 получают способами, описанными в патентах США 6583157 В 2 и 72237 61 В 2, содержание которых полностью включено в настоящий документ в качестве ссылок. Полиморфы соединения 101. Также подходящими для композиций и способов являются полиморфы соединения 101. В некоторых вариантах осуществления настоящего изобретения полиморфами являются полиморфы безилатной соли соединения 101, описанные выше. В некоторых вариантах осуществления настоящего изобретения полиморфы могут представлять собой чистые полиморфы безилатной соли соединения 101. Например,полиморф может представлять собой чистый полиморф формы I или чистый полиморф формы II безилатной соли соединения 101. Полиморфы HCl, HBr, тозилатной и безилатной солей соединения 101 в значительной степени охарактеризованы и описаны в патенте США 7223761 В 2. Фармацевтические композиции и предшественники. Одним важным различием между представленными твердыми фармацевтическими композициями и существующими твердыми желатиновыми капсулами с жидким наполнением является то, что представленные композиции находятся, по существу, в твердой форме. Соответственно, они могут избегать проблем, связанных с капсулами с жидким наполнением, таких как протекание содержимого капсул. Представленные композиции демонстрируют сравнимую или улучшенную стабильность и/или активность по сравнению с известными препаратами с жидким наполнением. Предпочтительными солями и полиморфами соединения 101 для использования в фармацевтических композициях являются полиморфы формы I и формы II безилатной соли соединения 101. Наиболее предпочтительной солью соединения 101 является бензолсульфонат, также называемый безилатом. Фармацевтические композиции по настоящему изобретению предпочтительно включают от приблизительно 0,1 до приблизительно 10,0 мг бензолсульфонатной (безилатной) соли соединения формулы (I). Фармацевтически приемлемые эксципиенты выбирают из группы, состоящей из растворителей, увлажняющих агентов, разбавителей, наполнителей, суперразрыхлителей, связующих агентов, агентов,обеспечивающих скольжение, смазывающих агентов и их комбинаций. В особенно предпочтительных вариантах осуществления настоящего изобретения фармацевтически приемлемые эксципиенты выбирают из группы, состоящей из додецилсульфата натрия, моногидрата лактозы, микрокристаллической целлюлозы, кросповидона, повидона, коллоидного диоксида кремния,стеарата магния и их комбинаций. Следует понимать, что изобретение предусматривает использование других эксципиентов, которые служат преимущественно тем же целям и по существу таким же образом,как и те, которые описаны выше. В одном варианте осуществления настоящего изобретения фармацевтическая композиция включает бензолсульфонатную соль соединения формулы (I), повидон, интрагранулярный кросповидон, экстрагранулярный кросповидон, интрагранулярную микрокристаллическую целлюлозу, экстрагранулярную микрокристаллическую целлюлозу, моногидрат лактозы и гранулирующую воду. В особенно предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция находится в форме порошка, таблетки, таблетки в форме капсулы или капсулы и включает:(1) соединение формулы (I), представленное в форме безилатной соли и составляющее от приблизительно 0,6 до 7,0% композиции;(2) моногидрат лактозы, составляющий от приблизительно 25 до приблизительно 35% композиции;(3) кросповидон, составляющий от приблизительно 4 до приблизительно 5% композиции;(4) микрокристаллическую целлюлозу, составляющую от приблизительно 50 до приблизительно 60% композиции;(5) повидон, составляющий от приблизительно 1 до приблизительно 3% композиции;(6) необязательно, коллоидный диоксид кремния, составляющий вплоть до приблизительно 0,7% композиции;(7) стеарат магния, составляющий от приблизительно 0,25 до приблизительно 1,5% композиции, в которой все процентные доли представляют собой массовые процентные доли. В описанной выше предпочтительной композиции массовое соотношение интрагранулярной мик- 11024925 рокристаллической целлюлозы и моногидрата лактозы составляет от 1,8:1 до 0,67:1 и наиболее предпочтительно 1,5:1. В соответствии со способами по настоящему изобретению композицию-предшественник, подходящую для получения твердой фармацевтической композиции, получают микронизацией активного ингредиента (предпочтительно, безилатной соли соединения 101) и осуществлением влажного гранулирования, в которых соединение объединяют с фармацевтически приемлемыми эксципиентами с получением влажных гранул-предшественников. Особенно предпочтительная композиция-предшественник для влажного гранулирования включает:(a) от приблизительно 0,5 до приблизительно 7,0% безилатной соли соединения формулы (I);(b) предпочтительно составляет от приблизительно 0,67:1 до 1,8:1 и наиболее предпочтительно приблизительно 1,5:1. Количество воды, используемой для гранулирования для получения упомянутой выше композициипредшественника, наиболее предпочтительно составляет от 18 до 21% упомянутой выше композициипредшественника. Изобретение дополнительно относится к упомянутой выше композиции-предшественнику, после удаления воды, например сушкой, для формирования сухой порошкообразной композициипредшественника. В описанной выше композиции компонент (а) может быть заменен комбинацией,включающей соединение формулы (I) и один или более антидиабетических агентов. Альтернативно, дополнительные антидиабетические агенты могут быть объединены как экстрагранулярные материалы с высушенной грануляционной смесью, содержащей соединение (I) в качестве единственного антидиабетического агента. Конечная твердая фармацевтическая композиция, а также композиция-предшественник, полученная посредством влажного гранулирования, могут быть первоначально в форме сухого порошка, перед дополнительной обработкой. Конечную фармацевтическую композицию затем можно формировать в таблетку или в виде капсулы или таблетки в форме капсулы. Предшественник можно объединять с одним или более дополнительными экстрагранулярными эксципиентами для формирования твердой лекарственной формы фармацевтической композиции. Альтернативно, дополнительный антидиабетический агент может быть смешан в сухом виде с порошком, который составляет конечную высушенную твердую фармацевтическую композицию, содержащую соединение 101. Альтернативно, дополнительный антидиабетический агент может быть добавлен в сухую смесь в качестве отдельного слоя сформированной таблетки. Фармацевтические композиции, представленные в настоящем документе, могут дополнительно включать одну или более фармацевтически приемлемых добавок, таких как суспендирующий агент, корригент, подсластитель, диспергирующий агент, поверхностно-активный агент, краситель, солюбилизатор, увлажняющий агент, пластификатор, стабилизатор, усилитель проникновения, пеногаситель, антиоксидант, консервант или их смеси. Стандартные лекарственные формы. В некоторых вариантах осуществления настоящего изобретения фармацевтические композиции содержат соединение 101, включая солевые формы и полиморфы соединения 101, в стандартной лекарственной форме. В одном варианте осуществления настоящее изобретение относится к стандартной лекарственной форме, подходящей для перорального введения человеку, которая включает микронизированное соединение формулы (I) или его соль и по меньшей мере один фармацевтически приемлемый эксципиент, связующий агент или разбавитель, в которой указанное соединение имеет средний размер частиц от приблизительно 1 до приблизительно 10 мкм, в которой указанная лекарственная форма после введения человеку обеспечивает AUC0 для соединения (I) по меньшей мере или приблизительно 150-5000 нгч/мл, и Tmax менее приблизительно 5,0 ч, и в которой указанную лекарственную форму получают с использованием способа влажного гранулирования. В некоторых вариантах осуществления настоящего изобретения лекарственная форма после введения человеку обеспечивает Tmax (время после введения лекарственного средства, когда достигается максимум концентрации в плазме) менее приблизительно 4,0 ч. Фармацевтическую композицию, представленную в настоящем документе, можно составлять для введения субъекту посредством любых обычных способов, включая, без ограничения, пероральный, парентеральный (например, внутривенный, подкожный или внутримышечный), трансбуккальный, интраназальный, ректальный или чрескожный пути введения. Фармацевтическая композиция, представленная в настоящем документе, может находиться в форме, подходящей для перорального введения, например в форме порошков, таблеток, пилюль, капсул, облаток, пастилок и диспергируемых гранул. Фармацевтическая композиция, предназначенная для перорального введения, может содержать один или более агентов, выбранных из группы, состоящей из подсластителей, корригентов, красителей, консервантов, связующих агентов, разрыхлителей или инкапсулирующего материала, для получения фармацевтически элегантных и привлекательных препаратов. В предпочтительных вариантах осуществления настоящего изобретения стандартная лекарственная форма является подходящей для перорального введения человеку в форме таблетки, содержащей от 0,5 до 5 мг соединения 101. Капсулы и таблетки. В некоторых вариантах осуществления настоящего изобретения стандартная лекарственная форма фармацевтических композиций, представленных в настоящем документе, находится в форме наполненной порошком капсулы для перорального введения. Наполнение капсул содержимым можно осуществлять с использованием любой технологии наполнения капсул, известной специалистом. В некоторых вариантах осуществления настоящего изобретения стандартная лекарственная форма фармацевтических композиций, представленных в настоящем документе, находится в форме таблетки для перорального введения. Таблетки могут содержать твердый активный ингредиент в смеси с по меньшей мере одним фармацевтически приемлемым эксципиентом, который является подходящим для получения таблеток. Наполнитель может представлять собой, например, разрыхлитель, такой как суперразрыхлитель, связующий агент, разбавитель, агент, обеспечивающий скольжение, смазывающий агент, эмульгатор или любой другой наполнитель, известный специалистам. Предпочтительными таблетками являются те таблетки, которые обеспечивают хорошую эффективность, однородность содержимого, твердость, ломкость и растворение и которые вносят свой вклад в химическую и физическую стабильность фармацевтических композиций. Таблетки, описанные в настоящем документе, могут иметь такой размер, чтобы содержать желательное количество стандартной дозировки, обычно приблизительно до 1 г стандартной дозировки. Энтеросолюбильное покрытие. На капсулы, таблетки или другие стандартные лекарственные формы фармацевтических композиций, представленные в настоящем документе, также можно наносить энтеросолюбильное покрытие, в отдельности или в комбинации с другим покрытием. Энтеросолюбильное покрытие фармацевтических композиций, которые содержат лекарственные средства, хорошо известно в фармацевтической научной литературе. См., например, Remington's Pharmaceutical Sciences, 20-е изд., Mack Publishing, Easton PA(2000), содержание которого целиком включено в настоящий документ в качестве ссылки. Энтеросолюбильные материалы для использования в энтеросолюбильном покрытии предпочтительно предотвращают высвобождение лекарственного средства с энтеросолюбильным покрытием в желудочном соке и предотвращают воздействие кислотности содержимого желудка на лекарственное средство, когда лекарственная композиция с энтеросолюбильным покрытием находится в желудке. После выхода из желудка в тонкий кишечник энтеросолюбильное покрытие предпочтительно растворяется и высвобождает лекарственное средство в кишечные соки. Материалы, подходящие для использования в энтеросолюбильном покрытии, включают гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, этилцеллюлозу, сополимер акриловой кислоты и сложного эфира метакриловой кислоты или их смеси. Дополнительные материалы, подходящие для использования в энтеросолюбильном покрытии,включают фталаты, включая фталат гидроксипропилметилцеллюлозы, фталат гидроксиэтилцеллюлозы,фталат гидроксипропилцеллюлозы, фталат метилцеллюлозы, фталат этилцеллюлозы и фталат ацетат целлюлозы. В других вариантах фармацевтических композиций, представленных в настоящем документе, на капсулу, таблетку или другую стандартную лекарственную форму дополнительно может быть нанесено покрытие с контролируемым высвобождением, которое является совместимым с другими компонентами энтеросолюбильного покрытия. Покрытие с контролируемым высвобождением может включать гидрофобный материал с контролируемым высвобождением, выбранный их алкилцеллюлозы, акрилового полимера или их смесей. Способы получения. В предпочтительном варианте осуществления твердые фармацевтические композиции по настоящему изобретению получают с использованием процесса влажного гранулирования. В одном аспекте настоящее изобретение относится к способу получения фармацевтической компо- 13024925 зиции для перорального введения, включающей микронизированное соединение формулы (I) или его соль, в виде стандартной лекарственной формы, где указанный способ включает следующие стадии:(a) смешивание микронизированных частиц соединения формулы (I) с одним или более эксципиентами, с получением интрагранулярного материала;(b) добавление одного или более гранулирующих растворов к интрагранулярному материалу, полученному на стадии (а), и гранулирование раствора и интрагранулярного материала с получением влажных гранул;(c) сушка влажных гранул, полученных на стадии (b), с получением сухих гранул;(d) размалывание сухих гранул, полученных на стадии (с);(e) смешивание размолотых сухих гранул, полученных на стадии (d), с экстрагранулярным материалом, состоящим из одного или более эксципиентов, с получением смеси; и(f) необязательно, прессование смеси, полученной на стадии (е), в твердую лекарственную форму. В некоторых вариантах осуществления настоящего изобретения средний размер частиц микронизированного соединения 101 или его соли или полиморфа составляет менее 20 мкм. В некоторых вариантах осуществления настоящего изобретения средний размер частиц микронизированного соединения 101 или его соли или полиморфа составляет от приблизительно 1 до приблизительно 10 мкм, от приблизительно 1 до приблизительно 5 мкм или от приблизительно 1 до приблизительно 3 мкм. В некоторых вариантах осуществления настоящего изобретения средний размер частиц микронизированного соединения 101 или его соли или полиморфа составляет от приблизительно 1 до приблизительно 2 мкм. В некоторых аспектах настоящего изобретения эксципиенты, подходящие для представленных способов, выбирают из группы, состоящей из додецилсульфата натрия, моногидрата лактозы, микрокристаллической целлюлозы, кросповидона, повидона, коллоидного диоксида кремния, стеарата магния и их комбинаций. (Повидон также часто называют полиповидоном). Эксципиент может представлять собой, например, разрыхлитель, такой как суперразрыхлитель, разбавитель, наполнитель, агент, обеспечивающий скольжение, смазывающий агент, эмульгатор, такой как поверхностно-активный или увлажняющий агент. Или любой другой эксципиент, известный специалистам. В некоторых вариантах осуществления настоящего изобретения разрыхлитель представляет собой суперразрыхлитель. В некоторых вариантах осуществления настоящего изобретения разрыхлитель представляет собой поперечно сшитый поливинилпирролидон или поперечно сшитый поливинилполипирролидон. В некоторых вариантах осуществления настоящего изобретения разрыхлитель представляет собой кросповидон. В некоторых вариантах осуществления настоящего изобретения суперразрыхлитель представляет собой кросповидон. В некоторых вариантах осуществления настоящего изобретения агент, обеспечивающий скольжение, представляет собой коллоидный диоксид кремния. В некоторых вариантах осуществления настоящего изобретения смазывающий агент представляет собой стеарат магния. В некоторых вариантах осуществления настоящего изобретения эмульгатор представляет собой увлажняющий агент. В некоторых вариантах осуществления настоящего изобретения увлажняющий агент представляет собой додецилсульфат натрия. В некоторых вариантах осуществления настоящего изобретения связующий агент представляет собой поливинилпирролидон (также известный как повидон). В предпочтительном варианте осуществления настоящего изобретения способ включает дополнительную стадию (i) добавления гранулирующего раствора к влажным гранулам, полученным на стадии(b), с получением влажных гранул, имеющих состав, отличный от состава гранул, полученных на стадии(b); в котором гранулирующий раствор, добавленный на указанной дополнительной стадии, имеет тот же состав, что и гранулирующий раствор, добавленный на стадии (b), или отличается от него по составу. В особенно предпочтительном варианте осуществления настоящего изобретения гранулирующий раствор,добавленный на стадии (b), включает по меньшей мере приблизительно 20 мас.%, повидона в воде, а гранулирующий раствор, добавленный на указанной выше дополнительной стадии, включает повидон или другой связующий агент, или может представлять собой воду, по существу не содержащую повидона, или воду, по существу, не содержащую других веществ, помимо воды (т.е. очищенную воду). В предпочтительном варианте осуществления настоящего изобретения связующий агент включает приблизительно или более 20 мас.%, повидона в воде. Неожиданно было установлено, что таблетки, по- 14024925 лученные способом влажного гранулирования, в которых содержание связующего агента составляет приблизительно или более 20 мас.%, повидона в воде, имеют активность по меньшей мере приблизительно 95,0%, что превышает активность в таблетках, полученных с меньшими количествами повидона. Не связывая себя какой бы то ни было теорией, заявители предполагают, что достижение более высокой активности основывается на неожиданном открытии, которое заключается в том, что достаточно более высокая концентрация связующего агента (например, повидона) является существенной для достаточного увлажнения частиц активного фармацевтического ингредиента (API) в смеси и, таким образом, включения их в гранулят. Полагают, что, когда повидон (или другой связующий агент) не присутствует в достаточно высокой концентрации, частицы API неадекватно связываются во влажном грануляте и, таким образом, селективно утрачиваются в процессе сушки, что вносит свой вклад в потерю активности. Способ влажного гранулирования может иметь следующие преимущества по сравнению с другими способами получения фармацевтических композиций: увеличение однородности твердого активного ингредиента в фармацевтических композициях, получение высокопористых гранул твердого активного ингредиента, которые могут быстро распадаться в водном растворе, приводя к быстрому высвобождению твердого активного ингредиента из фармацевтических композиций. Указанные преимущества улучшают растворение фармацевтических композиций, что, как полагают, вносит свой вклад в улучшение биодоступности. Способы лечения. В еще одном аспекте в настоящем документе представлены способы лечения PPARопосредованных состояний или заболеваний посредством введения субъекту, имеющему указанное заболевание или состояние, терапевтически эффективного количества твердой фармацевтической композиции, включающей соль или полиморф соединения 101, представленного в настоящем документе. Субъект может представлять собой животное, такое как, например, млекопитающее, включая, без ограничения, приматов (например, людей), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей и т.п. В зависимости от биологического окружения (например, клеточного типа, патологического состояния хозяина и т.п.), указанные фармацевтические композиции могут активировать или блокировать действие PPAR. Путем активации рецептора PPAR фармацевтические композиции найдут свое применение в качестве терапевтических агентов, способных модулировать состояния, опосредованные рецептором PPAR, т.е. диабет 2 типа. Помимо этого, фармацевтические композиции могут быть пригодными для профилактики и лечения осложнений диабета (например, нейропатии, ретинопатии, гломерулосклероза и сердечнососудистых нарушений) и для профилактики или лечения гиперлипидемии. Также фармацевтические композиции могут быть пригодными для модулирования воспалительных состояний, которые, как недавно было установлено, контролируются PPAR. (См. Ricote et al., 1998, Nature 391:79-82,и Jiang et al., 1998, Nature 391:82-86). Примеры воспалительных состояний включают ревматоидный артрит и атеросклероз. Фармацевтические композиции, которые действуют посредством антагонизма по отношению к PPAR, могут быть пригодными для лечения ожирения, гипретензии, гиперлипидемии,гиперхолестеринемии, гиперлипопротеинемии и метаболических расстройств. Для терапевтического применения для лечения ожирения, диабета, воспалительных состояний или других состояний или расстройств, опосредованных PPAR, соли или полиморфы соединения 101 можно вводить в форме фармацевтических композиций, представленных в настоящем документе, в первоначальной дозе от приблизительно 0,001 до приблизительно 100 мг в день. Пределы суточных дозы от приблизительно 0,1 до приблизительно 10 мг являются предпочтительными. Пределы суточной дозы от приблизительно 0,5 до приблизительно 5 мг являются особенно предпочтительными. Дозы, однако, можно изменять в зависимости от потребностей пациента, тяжести состояния, которое лечат, и выбранного соединения. Необходимую дозу для конкретной ситуации определяет лечащий врач. Обычно лечение начинают с более низких доз, которые меньше оптимальной дозы соединения. После этого дозу постепенно и понемногу увеличивают до достижения оптимального эффекта при имеющихся обстоятельствах. Для удобства суммарную суточную дозу можно разделить и вводить частями в течение дня, если это желательно. Для лечения или профилактики состояний, которые требуют моделирования рецепторов PPAR,подходящий уровень дозы обычно будет составлять от приблизительно 0,001 до 100 мг соли или полиморфа соединения 101 в день, которую можно вводить в виде однократной или множества доз пероральной фармацевтической композиции, представленной в настоящем документе. Предпочтительно, уровень дозы будет составлять от приблизительно 0,01 до приблизительно 25 мг в день; более предпочтительно от приблизительно 0,1 до приблизительно 10 мг в день; и особенно предпочтительно от приблизительно 0,5 до приблизительно 5,0 мг в день. Подходящий уровень дозы может составлять от приблизительно 0,01 до 25 мг в день, от приблизительно 0,1 до 10 мг в день или от приблизительно 0,5 до 5 мг в день. В указанных пределах доза может составлять от 0,005 до 0,05, от 0,05 до 0,5 или от 0,5 до 5,0 мг в день. Фармацевтические композиции, представленные в настоящем документе,предпочтительно, предоставляют в форме пероральных капсул, содержащих от 0,1 до 20 мг соли или полиморфа соединения 101, в частности 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,4, 1,5, 1,6, 1,8, 2,0,2,2, 2,4, 2,5, 2,6, 2,8, 3,0, 3,2, 3,4, 3,5, 3,6, 3,8, 4,0, 4,2, 4,4, 4,5, 4,6, 4,8, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0 9,5, 10,0 или 20,0 мг соли или полиморфа соединения 101, для симптоматического подбора дозы конкретному пациенту для лечения. Фармацевтические композиции, представленные в настоящем документе, можно вводить по схеме от 1 до 4 раз в день, предпочтительно один или два раза в день. Следует понимать, однако, что конкретный уровень дозы и частота дозирования для любого конкретного пациента могут изменяться и будут зависеть от ряда факторов, включая, например, активность конкретного используемого полиморфа, метаболическую стабильность и продолжительность действия указанного полиморфа, возраст, массу тела, общее состояние здоровья, пол, диету, способ и время введения, скорость экскреции, комбинацию лекарственных средств и тяжесть состояния пациента. Фармацевтические композиции, представленные в настоящем документе, можно комбинировать с другими соединениями, обладающими сходными свойствами для лечения или профилактики метаболических расстройств и воспалительных состояний, их осложнений и связанных с ними патологических состояний (например, сердечно-сосудистого заболевания и гипертензии). Во многих случаях введение представленных фармацевтических композиций в сочетании с указанными альтернативными агентами усиливает эффективность указанных агентов. Соответственно, в некоторых случаях настоящие фармацевтические композиции, при комбинировании или введении, например, с антидиабетическими лекарственными средствами можно использовать в дозировках, которые меньше ожидаемых количеств при использовании по отдельности или меньше рассчитанных количеств для комбинированной терапии. Таким образом, настоящее изобретение относится к фармацевтической композиции для перорального введения, в твердой форме, содержащей: микронизированное соединение 101 или его соль или полиморф, в виде стандартной лекарственной формы, в которой средний размер частиц соединения 101 или его соли или полиморфа составляет менее 20 мкм, и альтернативный агент. В некоторых вариантах осуществления фармацевтические композиции, представленные в настоящем документе, можно использовать для лечения или профилактики ряда других показаний. Указанные показания включают, без ограничения, метаболические состояния, такие как диабет (включая диабет 1 и 2 типа), гипертензию, стенокардию, дислипидемию (включая гипертриглицеридемию, гиперлипопротеинемию и гиперхолестеринемию), подагру, нейропатию и другие почечные заболевания, вторичные по отношению к диабету, диабетическую нейропатию, другие заболевания, связанные с резистентностью к инсулину, синдром поликистозных яичников, индуцированную глюкокортикоидами резистентность к инсулину, ожирение, костные нарушения, состояния, специфичные для женщин (включая избыточное климактерическое маточное кровотечение), и акне; неврологические расстройства, такие как болезнь Альцгеймера, нейровоспаление, ишемический инсульт, закрытую черепно-мозговую травму и рассеянный склероз; пролиферативные расстройства, такие как атеросклероз, рестеноз, рак толстого кишечника,рак молочной железы, липосаркома, эпителиальные раки, уроэпителиальный рак и другие раки; и воспалительные или иммунные расстройства, такие как ревматоидный артрит, воспалительное заболевание кишечника, колит, болезнь Крона, макулярная дегенерация, другие воспалительные расстройства и другие иммунные расстройства. Логические обоснования, предполагающие пригодность фармацевтических композиций, представленных в настоящем документе, для лечения или профилактики при перечисленных показаниях, подробно обсуждаются в патенте США 7223761. В особенно предпочтительных вариантах осуществления фармацевтические композиции, представленные в настоящем документе, направлены на лечение или профилактику диабета типа 2 с использованием соли или полиморфа соединения 101, как в отдельности, так и в комбинации со вторым терапевтическим агентом, выбранным из антидиабетических агентов, таких как инсулин, сульфонилмочевины (например, меглинатид, толбутамид, хлорпропамид, ацетогексамид, толазамид, глибурид, глипизид и глимепирид), бигуаниды, например, метформин (Glucophage), ингибиторы -глюкозидазы (акарбоза), тиазолидиноновые соединения, например, розиглитазон (Avandia), троглитазон (Rezulin) и пиоглитазон (Actos). При использовании в комбинации лечащий врач может назначать комбинацию терапевтических агентов, или введение может быть последовательным. Примеры Реагенты и растворители, использованные ниже, можно получить из коммерческих источников, таких как Aldrich Chemical Co. (Milwaukee, Wis., США). 1 Н-ЯМР спектры записывались на ЯМРспектрометре Varian Gemini 400 МГц. Значимые пики табулировали в следующем порядке: количество протонов, множественность (с, синглет; д, дуплет; т, триплет; кв, квартет; м, мультиплет; шир.с, широкий синглет и константа(-ы) сопряжения в герцах (Гц). Масс-спектрометрию с ионизацией электроспрея(ESI) осуществляли на масс-спектрометре с ионизацией электроспрея Hewlett-Packard 1100 MSD, используя ВЭЖХ HP 1100 для доставки образцов. Результаты масс-спектрометрии представлены как отношение массы к заряду. Соединение растворяли в метаноле до 0,1 мг/мл и 1 мкл вливали с растворителем для доставки в масс-спектрометр, который сканировал от 100 до 1500 Да. Соединение можно было анализировать способом положительного ESI с использованием 1:1 ацетонитрила/воды с 1% уксусной кислотой в качестве растворителя для доставки. Соединение можно было анализировать способом отрицательного ESI, с использованием 2 мМ NH4OAc в ацетонитриле/воде в качестве растворителя для доставки. Пример 1. Композиции. Композиции влажного гранулирования. Данный пример иллюстрирует пять таблеточных композиций влажного гранулирования с использованием микронизированной безилатной соли соединения 101, которые были получены и изучены на предмет химической и физической стабильности, растворения и биодоступности (см. примеры 2 и 3, ниже). Указанные пять композиций (F6-F10) представлены в табл.1 А (иллюстрирующей предшественник влажного гранулирования по настоящему изобретению до удаления воды) и в табл.1 В (иллюстрирующей композицию сухой порошок/таблетка по настоящему изобретению). Таблица 1 А. Композиция безилатной соли соединения 101 для влажного гранулирования до удаления воды Все неактивные компоненты сорта USP-NF. Количества представлены для безилатной соли INT131 и эквивалентны 0,5, 3 и 5 мг на таблетку свободного основания INT131. 3 Удалена во время процесса производства.Ингредиенты, не присутствующие при влажном гранулировании, добавлены в качестве экстрагранулярных эсципиентов после сушки влажных гранул (см. табл. 1 В, ниже). 2 Таблица 1B. Конечные таблеточные композиции (сухие твердые) микронизированной безилатной соли соединения 101 Все неактивные компоненты сорта USP-NF. Количества представлены для безилатной соли INT131 и эквивалентны 0,5, 3 и 5 мг на таблетку свободного основания INT131. 3 Удалена во время процесса производства.Интрагранулярные материалы.Ингредиенты, добавленные в качестве экстрагранулярного материала после сушки композиции табл. 1 А. Все пять композиций (F6-F10) достигали первоначальной активности, близкой к целевой, без деградации; деградации не отмечалось в контрольных точках до 4 недель при 2-8 С, 25 С/60% ОВ или 4 0 С/75% ОВ. Ниже табл.2 для сравнения иллюстрирует две композиции для капсул, полученные сухим смешиванием, и три композиции для капсул, полученные горячим расплавом, с использованием безилатной соли соединения 101, которые были получены и изучены на предмет химической и физической стабильности,растворения и биодоступности (см. примеры 2 и 3, ниже). Указанные пять композиций (F1-F5) представлены в табл. 2. 2 Таблица 2. Сравнение: композиции безилатной соли соединения 101 для капсул,полученные сухим смешиванием и горячим расплавом 1,31% безилатной соли соединения 101 эквивалентны 1,00% свободного основания соединения 101. приблизительно мг на капсулу. Пять композиций, полученных горячим расплавом и сухим смешиванием (F1-F5), достигали первоначальной активности, близкой к целевой, без деградации; деградации не отмечалось в контрольных точках до 4 недель при 2-8 С, 25 С/60% ОВ или 40 С/75% ОВ. Однако сухие смеси и горячие расплавы не обеспечивали удовлетворительного растворения (см. пример 2, ниже). Пример 2. Тесты на растворение. Тесты на растворение таблеточных композиций влажного гранулирования. Тесты на растворение осуществляли на USP аппарате 2 типа с лопастями при 75 об/мин, 37 С, 900 мл (погруженное состояние), 2% SDS при рН 1,5 (с HCl). Фиг. 1 представляет результаты тестирования на растворение безилатной соли соединения 101 пяти композиций (F6-F10) примера 1. Сравнение: тесты на растворение композиций для капсул, полученных сухим смешиванием и горячим расплавом. Осуществляли тесты на растворение композиций соединения 101, полученных горячим расплавом и сухим смешиванием, (примечание: в данном сравнительном разделе в качестве контроля использовали капсулы с безилатной солью соединения 101 с жидким наполнением на масляной основе (см. предварительную патентную заявку США 61/102658. Результаты тестирования на растворение представлены на фиг. 2. Относительное растворение через 60 мин составляло: F0 (капсула с жидким наполнением на масляной основе в качестве компаратора), F3 (горячий расплав с Gelucire), F5 (горячий расплав с Solutol)F4 (горячий расплав с витамином Е TPGS)F1, F2 (сухие смеси с полоксамером и без него)сухой порошок 100% безилатной соли соединения 101. Сравнение композиций по настоящему изобретению с композициями для капсул, полученными сухим смешиванием и горячим расплавом. Сравнение данных на фиг. 1 и 2 демонстрирует значительно превосходящее растворение (фиг. 1) у композиций, полученных по настоящему изобретению. Данные дополнительно показывают, что твердые композиции по настоящему изобретению достигают более выраженного и более быстрого растворения по сравнению с капсулами с жидким наполнением, описанными во предварительной патентной заявке США 61/102658 (см. фиг. 2). Пример 3. Фармакокинетика. Таблеточные композиции влажного гранулирования. Фармакокинетику однократной дозы пяти таблеточных композиций влажного гранулирования (F6F10) и композиции для капсул на масляной основе, описанной выше (F0), оценивали натощак у обезьянcynomolgus, по 3-сторонней перекрестной схеме, при которой шесть обезьян получали каждая по три из шести композиций. Главным параметром сравнения была AUC. Результаты представлены на фиг. 5 и в табл. 3. Таблица 3. Относительная биодоступность (AUC) таблеточных композиций влажного гранулирования с микронизированной безилатной солью соединения 101 Фиг. 5 и табл. 3 показывают, что количество гранулирующей воды оказывает сильное воздействие на биодоступность. Образцы F6, F7 и F8 (имеющие содержание воды в предшественнике влажного гранулирования 18%) показали лучшую биодоступность в конечной композиции, чем у образцов F9 и F10(имеющих 24% воды в предшественнике влажного гранулирования). Помимо этого оказалось, что соотношение разбавителей (интрагранулярной микрокристаллической целлюлозы и моногидрата лактозы) влияли на индекс прессуемости и размер частиц сухого гранулята, и конечная смесь, прессованная в таблетку, с более высоким соотношением (1,5:1) по всем параметрам была предпочтительной. Сравнение: композиции для капсул, полученные сухим смешиванием и горячим расплавом. Фармакокинетику однократной дозы двух композиций для капсул, полученных сухим смешиванием (F1, F2), трех композиций для капсул, полученных горячим расплавом (F3-F5), и композиции для капсул с жидким наполнением на масляной основе, описанной выше (F0), оценивали натощак у обезьян cynomolgus, по 3-стронней перекрестной схеме, при которой шесть обезьян получали каждая по три из шести композиций. Главным параметром сравнения была AUC. Результаты представлены на фиг. 3. Фиг. 4 представляет in vitro - in vivo корреляцию (IVIVC) между биодоступностью у обезьяны и растворение через 60 мин. Корреляция r=0,917 предполагает, что улучшение растворения композиции может вносить свой вклад в улучшение биодоступности. Тесты на растворение осуществляли для всех композиций после хранения в течение 4 недель при 28 С, 25 С/60% ОВ или 40 С/75% ОВ. Композиции сухого смешивания 1 и 2 показали увеличение скорости растворения по мере хранения. Композиция 3 с Gelucire, которая первоначально показала самое быстрое растворение, продемонстрировала уменьшение скорости растворения при хранении. Причину изучили и предварительно обозначили как изменение кристаллической формы компонента Gelucire при хранении (т.е. отсутствие стабильности). Композицию с Gelucire изготовили партией 250 г с наполнением капсул 1 и 6 мг при условияхGMP. Производство включало стадию отверждения (содержание при 40 С в течение нескольких часов) для завершения изменения кристаллической формы. Неотвержденные капсулы отложили для сравнения. Отвержденные капсулы растворялись более быстро, чем неотвержденные капсулы одного и того же наполнения, что не согласуется с теорией изменения кристаллической формы. Сравнение композиций по настоящему изобретению с композициями для капсул, полученными сухим смешиванием и горячим расплавом. Композиции по настоящему изобретению показали гораздо более высокую биодоступность, чем композиции сухого смешивания. Несмотря на то что композиции горячего расплава для капсул имели приемлемую биодоступность, они обычно были физически нестабильными, что оказалось неожиданным и удивительным. Соответственно композиции по настоящему изобретению, как было установлено, значительно и неожиданным образом превосходили композиции, полученные сухим смешиванием и горячим расплавом. Пример 4. Отбор композиций и дальнейшее тестирование. Данный пример иллюстрирует оптимизацию отбора таблеточных композиций влажного гранулирования с безилатной солью соединения 101, которые подвергались дальнейшему тестированию. Композиция F8 (18% гранулирующей воды и соотношение разбавителей 1,5:1) показала самую высокую относительную биодоступность согласно табл.3, выше, a F10 (24% гранулирующей воды и соотношение разбавителей 0,67:1) показала самую низкую относительную биодоступность, согласно табл.3,выше. Четыре таблеточные композиции влажного гранулирования, содержащие 18 или 21% гранулирующей воды и имеющие соотношение разбавителей 1,5:1 или 1,2:1, получали с низкой (0,655 мг) и высокой (6,55 мг) концентрацией соединения (I); на основе химических и физических оценок, композиция А содержала 18% гранулирующей воды, соотношение разбавителей 1,5:1 и 0,65 или 6,55 мас.% безилатной соли соединения 101; а композиция В содержала 21% гранулирующей воды, соотношение разбавителей 1,2:1 и 0,65 или 6,55 мас.% безилатной соли соединения 101. Композиции А и В представлены в таблице 4. Таблица 4. Таблеточные композиции влажного гранулирования А и В микронизированной безилатной соли соединения 101 1,31 мг безилатной соли соединения 101 эквивалентны 1,0 0 мг свободного основания соединения 101. приблизительно мас.%, на таблетку. Таблица 5. Композиции "А" и "В" по настоящему изобретению Все неактивные компоненты сорта USP-NF. Количества представлены для безилатной соли INT131 и эквивалентны 0,5, 3 и 5 мг на таблетку свободного основания INT131. 3 Удалена во время процесса производства. Композиции А и В достигали первоначальной активности, близкой к целевой, без деградации. Помимо этого композиции А и В показали хорошие свойства таблетки, например хороший внешний вид,однородность содержимого, растворение, твердость и ломкость. Фармакокинетику однократной дозы пяти композиций А и В и композиции для капсул на масляной основе, описанной выше (F0), оценивали натощак у обезьян cynomolgus. Главными параметрами сравне 2 ния были AUC и Tmax. Результаты представлены на фиг. 6 и в табл. 6. Таблица 6. Относительная биодоступность (AUC) и Tmax композиций А и В безилатной соли соединения 101 1,31 мг безилатной соли соединения 101 эквивалентны 1,0 0 мг свободного основания соединения 101. приблизительно мас.%, на таблетку. Как можно видеть на фиг. 6 и в табл.6, композиции А и В показывают удивительно хорошую фармакокинетику и подтверждают использование указанных композиций для лечения по описанным показаниям. Пример 5. Способ получения таблеток. Данный пример иллюстрирует пример способа получения таблеток безилатной соли соединения 101. Микронизированные частицы безилатной соли соединения 101 просеивали и смешивали с кросповидоном, микрокристаллической целлюлозой (РН 101) и моногидратом лактозы на аппарате Quadro ComilU10 Mill с получением интрагранулярного материала. Интрагранулярный материал затем загружали в 25 л миксер/гранулятор с высокой скоростью сдвига Diosna P25 High Shear Mixer/Granulator, в который последовательно добавляли два гранулирующих раствора при перемешивании, с получением влажных гранул. Первый гранулирующий раствор (20 мас.%, повидона в гранулирующей воде) добавляли при перемешивании с получением влажных гранул. Второй гранулирующий раствор (гранулирующая вода без повидона) затем добавляли при перемешивании к влажным гранулам до тех пор, пока концентрация повидона во влажных гранулах не уменьшалась до эквивалента 13 мас.%, повидона в гранулирующей воде. Полученные влажные гранулы затем сушили в 20 л сушилке с использованием слоя воздуха (fluidair bed dryer), а затем высушенные гранулы размалывали с использованием измельчителя FitzMill M5A. Размолотые сухие гранулы смешивали с кросповидоном, микрокристаллической целлюлозой (РН 102),коллоидным диоксидом кремния и стеаратом магния в 8-кв. блендере PK-V с получением конечной смеси, которую прессовали в таблетки. Описанный выше способ получения проиллюстрирован на фиг. 7, с контролем качестве в ходе способа на стадиях сушки, смешивания и прессования. Пример 6. Оптимизация связующего агента и гранулирующего раствора. Данный пример показывает для предпочтительного варианта осуществления настоящего изобретения, что количество связующего агента в гранулирующем растворе может влиять на активность в конечной фармацевтической композиции по настоящему изобретению, а также иллюстрирует способ, при котором гранулирующие растворы предпочтительно используются по многостадийной схеме. Табл.7 показывает, что таблетки, полученные способом влажного гранулирования, в котором связующий агент составляет по меньшей мере приблизительно 15% повидона мас./мас, в воде, имеют активность по меньшей мере 95,0%, что выше таковой в таблетках, полученных с использованием более низкой концентрации повидона в гранулирующей воде. Другой потенциально важной разницей между способами по настоящему изобретению и обычным способом производства влажным гранулированием является то, что в обычном способе применяется только один раствор связующего агента, содержащий все количества связующего агента и гранулирующей воды. Таблица 7. Влияние способа добавления связующего агента на активность Соответственно, композиции по настоящему изобретению, полученные способом влажного гранулирования, в котором связующий агент включает по меньшей мере 20 мас.% повидона в воде, имеют активность по меньшей мере приблизительно 95,0%, что выше таковой в таблетках, полученных с использованием меньших количеств повидона. Все публикации и патентные заявки, процитированные в настоящем описании, включены в настоящий документ в качестве ссылок, как если бы каждая отдельная публикация или патентная заявка была конкретно и индивидуально указана как включенная в качестве ссылки. Хотя в подробном описании использовались примеры для иллюстрации и лучшего понимания, для специалиста будет очевидно, что определенные изменения и модификации можно проводить, не отступая от сущности или объема прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Антидиабетическая фармацевтическая композиция в твердой форме, подходящая для перорального введения субъекту, которая содержит соединение формулы (I) или его соль, в которой твердая фармацевтическая композиция после введения субъекту способна обеспечивать субъекту AUC0 для соединения (I) по меньшей мере или приблизительно 150-5000 нгч/мл, причем композиция содержит:(1) соединение формулы (I), предоставленное в форме бензолсульфонатной (безилатной) соли и составляющее от приблизительно 0,6 до 7,0% композиции;(2) моногидрат лактозы, составляющий от приблизительно 25 до приблизительно 35% композиции;(3) кросповидон, составляющий от приблизительно 4 до приблизительно 5% композиции;(4) микрокристаллическую целлюлозу, составляющую от приблизительно 50 до приблизительно 60% композиции;(5) повидон, составляющий от приблизительно 1 до приблизительно 3% композиции;(6) стеарат магния, составляющий от приблизительно 0,25 до приблизительно 1,5% композиции, где все процентные доли представляют собой массовые процентные доли. 2. Твердая фармацевтическая композиция по п.1, дополнительно содержащая коллоидный диоксид кремния, составляющий от приблизительно 0 до приблизительно 0,7% композиции. 3. Твердая фармацевтическая композиция по любому из пп.1 или 2 в форме таблетки или порошка,включая порошок, помещенный в капсулу. 4. Твердая фармацевтическая композиция по любому из пп.1 или 2, предоставленная в виде стандартной лекарственной формы. 5. Антидиабетическая фармацевтическая композиция по любому из пп.1 или 2, в которой средний размер частиц соединения формулы (I) составляет от 1 до 150 мкм. 6. Фармацевтическая композиция по п.5, в которой средний размер частиц соединения формулы (I) составляет от 1 до 100 мкм. 7. Фармацевтическая композиция по п.5, в которой средний размер частиц соединения формулы (I) составляет от 1 до 50 мкм. 8. Фармацевтическая композиция по п.5, в которой средний размер частиц соединения формулы (I) составляет от 1 до 20 мкм. 9. Фармацевтическая композиция по п.5, в которой средний размер частиц соединения формулы (I) составляет от 1 до 10 мкм. 10. Твердая фармацевтическая композиция по любому из пп.5-9, в которой соединение формулы (I) присутствует в форме бензолсульфонатной соли и в которой бензолсульфонатная соль присутствует в количестве от приблизительно от 0,1 до приблизительно 10,0 мг. 11. Способ получения твердой фармацевтической композиции по п.1, который включает стадии (а) микронизации соединения формулы (I); и (b) получения влажного гранулята микронизированного соединения в комбинации с одним или более фармацевтически приемлемыми эксципиентами. 12. Способ получения твердой фармацевтической композиции по п.1, в котором указанную твердую фармацевтическую композицию получают влажным гранулированием. 13. Способ по п.12, включающий стадии:(a) смешивания микронизированных частиц соединения формулы (I) с одним или более эксципиентами с получением порошкообразной смеси;(b) добавления гранулирующего раствора к порошкообразной смеси, полученной на стадии (а), и смешивания раствора и порошкообразной смеси с получением влажных гранул;(c) сушки влажных гранул, полученных на стадии (b), с получением сухих гранул;(d) размалывания сухих гранул, полученных на стадии (с);(e) смешивания размолотых сухих гранул, полученных на стадии (d), с одним или более эксципиентами, с получением смеси, представляющей конечный состав твердой фармацевтической композиции; и(f) необязательно, прессования смеси, полученной на стадии (е), в стандартную лекарственную форму. 14. Способ получения продукта влажного гранулирования, подходящего в качестве предшественника для получения твердой фармацевтической антидиабетической композиции по п.1, включающий стадии:(а) смешивания микронизированных частиц соединения формулы (I) или его соли с одним или более эксципиентами, с получением их смеси;(b) добавления гранулирующего раствора к смеси, полученной на стадии (а), и гранулирования раствора и смеси с получением влажных гранул. 15. Фармацевтическая композиция-предшественник, полученная с использованием способа влажного гранулирования по п.14, подходящая для использования для получения твердой стандартной лекарственной формы соединения формулы (I), причем указанная композиция-предшественник содержит:(a) от приблизительно 0,5 до приблизительно 7,0% безилатной соли соединения формулы (I);(e) от приблизительно 15 до приблизительно 24% воды,в которой все процентные доли представляют собой массовые процентные доли. 16. Способ лечения PPAR-опосредованного состояния или расстройства у человека, включающий введение субъекту терапевтически эффективного количества твердой фармацевтической композиции по п.1.
МПК / Метки
МПК: A61K 31/47, A61K 31/18, A61P 3/10, A61P 3/00, A61K 9/16, A61K 9/48, A61K 9/20
Метки: композиции, фармацевтические, твердые, антидиабетические
Код ссылки
<a href="https://eas.patents.su/28-24925-antidiabeticheskie-tverdye-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Антидиабетические твердые фармацевтические композиции</a>
Предыдущий патент: Фармацевтические композиции
Следующий патент: Схема приема cns 7056 (ремимазолама) для индуцирования седации
Случайный патент: Применение ингибиторов дипептидилпептидазы












