Гуманизированные антитела с противоопухолевой активностью
Номер патента: 24695
Опубликовано: 31.10.2016
Авторы: Поллард Мэттью, Кинцле Норберт Александер, Дойл Энтони Джерард, Дженнингз Филип Энтони, Кларк Адам Уилльям
Формула / Реферат
1. Антитело, которое связывается с клетками Colo205, где антитело содержит связывающий домен VH и связывающий домен VL, где указанный связывающий домен VH содержит последовательно первую каркасную область (FR1), первую CDR (CDR1), вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR (CDR3) и четвертую каркасную область (FR4), где
(i) последовательность FR1 представляет собой
X1VQLQESGPGLVKPSETLSLTCTVX2GYSX3X4 (SEQ ID NO: 95), где
X1 означает Q или Е,
Х2 означает S или Т,
Х3 означает I, L или V,
Х4 означает S или Т,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(ii) последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность, по меньшей мере на 80% идентичную указанной последовательности;
(iii) последовательность FR2 представляет собой WIRQX5PGKGLX6WX7G (SEQ ID NO: 97), где
Х5 означает S или Р,
Х6 означает Q или Е,
Х7 означает М или I,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(iv) последовательность CDR2 представляет собой HIHX8SGRPTYX9PSLX10S (SEQ ID NO: 98), где
Х8 означает F, Y или W,
Х9 означает N или D,
X10 означает K, L, H, F, R или S,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(v) последовательность FR3 представляет собой
RX11X12ISX13X14TAKNQFSLKLTSMTAADTAVYYCAR (SEQ ID NO: 99), где
Х11 означает V или I,
X12 означает Т или S,
Х13 означает R или K,
X14 означает Е или D,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности, при условии, что остаток в положении 6 должен быть R или K;
(vi) последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 100) или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(vii) последовательность FR4 представляет собой WGQGTLVTVSS (SEQ ID NO: 101) или последовательность, по меньшей мере на 90% идентичную указанной последовательности; и
где указанный связывающий домен VL содержит последовательно первую каркасную область (FR1), первую CDR (CDR1), вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR (CDR3) и четвертую каркасную область (FR4), где
(i) последовательность FR1 представляет собой
EX13VLTQSPGTLSLSX14GERATLSC (SEQ ID NO: 187), где
Х13 означает I или N,
X14 означает А или Р,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(ii) последовательность CDR1 означает SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(iii) последовательность FR2 представляет собой WYQQKPGQAPRLLIY (SEQ ID NO: 189) или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(iv) последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% идентичную указанной последовательности;
(v) последовательность FR3 представляет собой GIPDRFSGSGSGX15DFTLTISRVEPEDFAVYYC (SEQ ID NO: 191), где
X15 означает Т или N,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(vi) последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последовательность, по меньшей мере на 80% идентичную указанной последовательности;
(vii) последовательность FR4 представляет собой FGQGTKLEIKR (SEQ ID NO: 193) или последовательность, по меньшей мере на 90% идентичную указанной последовательности.
2. Антитело по п.1, в котором последовательность FR1 VH выбрана из группы, состоящей из

3. Антитело по п.1 или 2, в котором последовательность CDR1 VH представляет собой SGYSWH (SEQ ID NO: 96).
4. Антитело по любому из пп.1-3, в котором последовательность FR2 VH выбрана из группы, состоящей из
WIRQSPGKGLQWIG (SEQ ID NO: 127),
WIRQSPGKGLQWMG (SEQ ID NO: 128),
WIRQSPGKGLEWIG (SEQ ID NO: 129),
WIRQSPGKGLEWMG (SEQ ID NO: 130),
WIRQPPGKGLQWIG (SEQ ID NO: 131),
WIRQPPGKGLQWMG (SEQ ID NO: 132),
WIRQPPGKGLEWIG (SEQ ID NO: 133) и
WIRQPPGKGLEWMG (SEQ ID NO: 134).
5. Антитело по любому из пп.1-4, в котором последовательность CDR2 VH выбрана из группы, состоящей из
HIHFSGRPTYNPSLSS (SEQ ID NO: 135),
HIHFSGRPTYNPSLKS (SEQ ID NO: 136),
HIHFSGRPTYNPSLLS (SEQ ID NO: 137),
HIHFSGRPTYNPSLHS (SEQ ID NO: 138),
HIHFSGRPTYNPSLFS (SEQ ID NO: 139),
HIHFSGRPTYNPSLRS (SEQ ID NO: 140),
HIHWSGRPTYNPSLSS (SEQ ID NO: 141),
HIHWSGRPTYNPSLKS (SEQ ID NO: 142),
HIHWSGRPTYNPSLLS (SEQ ID NO: 143),
HIHWSGRPTYNPSLHS (SEQ ID NO: 144),
HIHWSGRPTYNPSLFS (SEQ ID NO: 145),
HIHWSGRPTYNPSLRS (SEQ ID NO: 146),
HIHYSGRPTYNPSLSS (SEQ ID NO: 147),
HIHYSGRPTYNPSLKS (SEQ ID NO: 148),
HIHYSGRPTYNPSLLS (SEQ ID NO: 149),
HIHYSGRPTYNPSLHS (SEQ ID NO: 150),
HIHYSGRPTYNPSLFS (SEQ ID NO: 151),
HIHYSGRPTYNPSLRS (SEQ ID NO: 152),
HIHFSGRPTYDPSLSS (SEQ ID NO: 153),
HIHFSGRPTYDPSLKS (SEQ ID NO: 154),
HIHFSGRPTYDPSLLS (SEQ ID NO: 155),
HIHFSGRPTYDPSLHS (SEQ ID NO: 156),
HIHFSGRPTYDPSLFS (SEQ ID NO: 157),
HIHFSGRPTYDPSLRS (SEQ ID NO: 158),
HIHWSGRPTYDPSLSS (SEQ ID NO: 159),
HIHWSGRPTYDPSLKS (SEQ ID NO: 160),
HIHWSGRPTYDPSLLS (SEQ ID NO: 161),
HIHWSGRPTYDPSLHS (SEQ ID NO: 162),
HIHWSGRPTYDPSLFS (SEQ ID NO: 163),
HIHWSGRPTYDPSLRS (SEQ ID NO: 164),
HIHYSGRPTYDPSLSS (SEQ ID NO: 165),
HIHYSGRPTYDPSLKS (SEQ ID NO: 166),
HIHYSGRPTYDPSLLS (SEQ ID NO: 167),
HIHYSGRPTYDPSLHS (SEQ ID NO: 168),
HIHYSGRPTYDPSLFS (SEQ ID NO: 169) и
HIHYSGRPTYDPSLRS (SEQ ID NO: 170).
6. Антитело по любому из пп.1-5, в котором последовательность FR3 VH выбрана из группы, состоящей из

7. Антитело по любому из пп.1-6, в котором последовательность CDR3 VH представляет собой KGKGSDDGLNY (SEQ ID NO:100).
8. Антитело по любому из пп.1-7, в котором последовательность FR4 VH представляет собой WGQGTLVTVSS (SEQ ID NO: 101).
9. Антитело по любому из пп.1-8, дополнительно содержащее константный домен VH.
10. Антитело по п.9, в котором константный домен имеет последовательность


11. Антитело по любому из пп.1-10, в котором последовательность FR1 VL выбрана из группы
EIVLTQSPGTLSLSPGERATLSC (SEQ ID NO: 195),
EIVLTQSPGTLSLSAGERATLSC (SEQ ID NO: 196),
ENVLTQSPGTLSLSPGERATLSC (SEQ ID NO: 197) и
ENVLTQSPGTLSLSAGERATLSC (SEQ ID NO: 198).
12. Антитело по любому из пп.1-11, в котором последовательность CDR1 VL представляет собой SASSSLSYIH (SEQ ID NO: 188).
13. Антитело по любому из пп.1-12, в котором последовательность FR2 VL представляет собой WYQQKPGQAPRLLIY (SEQ ID NO: 189).
14. Антитело по любому из пп.1-13, в котором последовательность CDR2 VL представляет собой DTSNLAS (SEQ ID NO: 190).
15. Антитело по любому из пп.1-14, в котором последовательность FR3 VL представляет собой GIPDRFSGSGSGTDFTLTISRVEPEDFAVYYC (SEQ ID NO: 199) или GIPDRFSGSGSGNDFTLTISRVE PEDFAVYYC (SEQ ID NO: 200).
16. Антитело по любому из пп.1-15, в котором последовательность CDR3 VL представляет собой FQGSEYPLT (SEQ ID NO: 192).
17. Антитело по любому из пп.1-16, в котором последовательность FR4 VL представляет собой FGQGTKLEIKR (SEQ ID NO: 193).
18. Антитело по любому из пп.1-17, дополнительно содержащее константный домен VL.
19. Антитело по п.18, в котором константный домен имеет последовательность

20. Антитело, которое связывается с клетками Colo205, где антитело содержит связывающий домен VH и связывающий домен VL, где указанный связывающий домен VH содержит последовательно первую каркасную область (FR1), первую CDR (CDR1), вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR (CDR3) и четвертую каркасную область (FR4), где
(i) последовательность FR1 представляет собой
EVQLQQWGAGLLKPSETLSLTCAVYGYSX18X19 (SEQ ID NO: 201), где
X18 означает I, L или V,
X19 означает S или Т,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(ii) последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность, по меньшей мере на 80% идентичную указанной последовательности;
(iii) последовательность FR2 представляет собой WIRQPPGKGLEWX20G (SEQ ID NO: 202), где
Х20 означает М или I,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(iv) последовательность CDR2 представляет собой HIHX21SGRPTYX22PSLX23S (SEQ ID NO: 98), где
X21 означает F, Y или W,
X22 означает N или D,
Х23 означает K, L, H, F, R или S,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(v) последовательность FR3 представляет собой
RX24X25ISX26DTSKNQFSLKLSSVTAADTAVYYCAR (SEQ ID NO: 203), где
Х24 означает V или I,
Х25 означает S или Т,
Х26 означает R или K,
или последовательность, по меньшей мере на 90% идентичную указанной последовательности, при условии, что остаток в положении 6 должен быть R или K;
(vi) последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 100) или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(vii) последовательность FR4 представляет собой WGQGTLVTVSS (SEQ ID NO: 101) или последовательность, по меньшей мере на 90% идентичную указанной последовательности; и
указанный связывающий домен VL содержит последовательно первую каркасную область (FR1), первую CDR (CDR1), вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR (CDR3) и четвертую каркасную область (FR4), где
(i) последовательность FR1 представляет собой EX23VLTQSPATLSLSPGERATLSC (SEQ ID NO: 211), где Х23 означает I или N, или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(ii) последовательность CDR1 представляет собой SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(iii) последовательность FR2 представляет собой WYQQKPGQAPRLLIY (SEQ ID NO: 189) или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(iv) последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% идентичную указанной последовательности;
(v) последовательность FR3 представляет собой GIPDRFSGSGSGX24DFTLTISRLEPEDFAVYYC (SEQ ID NO: 212), где X24 означает Т или N, или последовательность, по меньшей мере на 90% идентичную указанной последовательности;
(vi) последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последовательность, по меньшей мере на 80% идентичную указанной последовательности;
(vii) последовательность FR4 представляет собой FGGGTKVEIKR (SEQ ID NO: 193) или последовательность, по меньшей мере на 90% идентичную указанной последовательности.
21. Антитело по п.20, в котором последовательность FR1 VH выбрана из группы, состоящей из
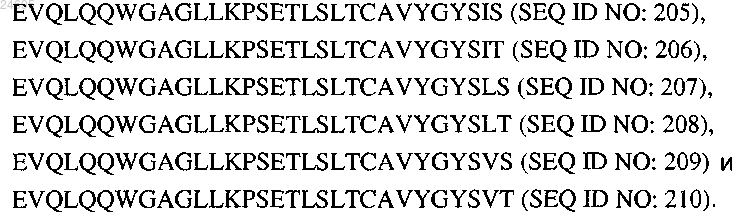
22. Антитело по п.20 или 21, в котором последовательность CDR1 VH представляет собой SGYSWH (SEQ ID NO: 96).
23. Антитело по любому из пп.20-22, в котором последовательность FR2 VH представляет собой WIRQPPGKGLEWIG (SEQ ID NO: 133) или WIRQPPGKGLEWMG (SEQ ID NO: 134).
24. Антитело по любому из пп.20-23, в котором последовательность CDR2 VH выбрана из группы, состоящей из


25. Антитело по любому из пп.20-24, в котором последовательность FR3 VH выбрана из группы, состоящей из
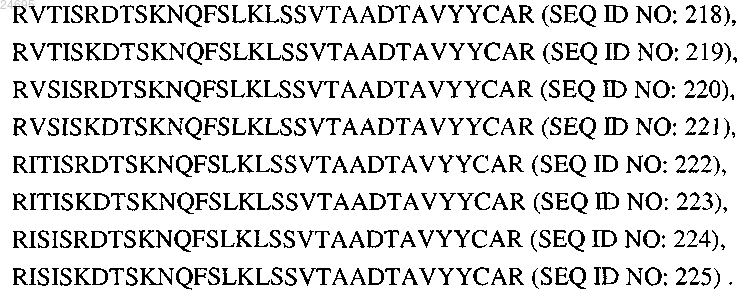
26. Антитело по любому из пп.20-25, в котором последовательность CDR3 VH представляет собой KGKGSDDGLNY (SEQ ID NO: 100).
27. Антитело по любому из пп.20-26, в котором последовательность FR4 VH представляет собой WGQGTLVTVSS (SEQ ID NO: 101).
28. Антитело по любому из пп.20-27, дополнительно содержащее константный домен VH.
29. Антитело по п.28, в котором константный домен имеет последовательность
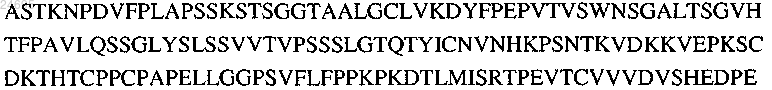

30. Антитело по любому из пп.20-29, в котором последовательность FR1 VL выбрана из группы, состоящей из EIVLTQSPATLSLSPGERATLSC (SEQ ID NO: 214) или ENVLTQSPATLSLSPGERATLSC (SEQ ID NO: 215).
31. Антитело по любому из пп.20-30, в котором последовательность CDR1 VL представляет собой SASSSLSYIH (SEQ ID NO: 88).
32. Антитело по любому из пп.20-31, в котором последовательность FR2 VL представляет собой WYQQKPGQAPRLLIY (SEQ ID NO: 189).
33. Антитело по любому из пп.20-32, в котором последовательность CDR2 VL представляет собой DTSNLAS (SEQ ID NO: 190).
34. Антитело по любому из пп.20-33, в котором последовательность FR3 VL представляет собой GIPDRFSGSGSGTDFTLTISRLEPEDFAVYYC (SEQ ID NO: 216) или GIPDRFSGSGSGNDFTLTI SRLEPEDFAVYYC (SEQ ID NO: 217).
35. Антитело по любому из пп.20-34, в котором последовательность CDR3 VL представляет собой FQGSEYPLT (SEQ ID NO: 192).
36. Антитело по любому из пп.20-35, в котором последовательность FR4 VL представляет собой FGGGTKVEIKR (SEQ ID NO: 193).
37. Антитело по любому из пп.20-36, дополнительно содержащее константный домен VL.
38. Антитело по п.37, в котором константный домен имеет последовательность

39. Антитело по п.1, в котором последовательность легких цепей представляет собой последовательность, указанную в SEQ ID NO: 7, и последовательность тяжелых цепей представляет собой последовательность, указанную в SEQ ID NO: 50.
40. Антитело по п.1, в котором последовательность легких цепей представляет собой последовательность, указанную в SEQ ID NO: 7, и последовательность тяжелых цепей представляет собой последовательность, указанную в SEQ ID NO: 94.
41. Антитело по любому из пп.1-40, в котором антитело имеет пониженный уровень фукозы.
42. Способ лечения злокачественной опухоли у субъекта, где злокачественная опухоль выбрана из группы, состоящей из опухолей прямой и ободочной кишки, яичника, поджелудочной железы, предстательной железы и легкого, причем способ включает введение субъекту терапевтически эффективного количества связывающего домена или антитела по любому из пп.1-41.
43. Способ выявления присутствия злокачественных клеток в образце, причем способ включает приведение образца клеток в контакт со связывающим доменом или антителом по любому из пп.1-41 и определение связывания связывающего домена или антитела с клетками.
Текст
Настоящее изобретение относится к гуманизированным антителам и их связывающим доменам с противоопухолевой активностью. В частности, гуманизированные антитела обладают специфичным связыванием и непосредственно вызывают гибель клеток опухолей ободочной кишки человека и проявляют высокую иммунно-опосредованную цитотоксическую активность против злокачественных клеток ободочной кишки человека in vitro в анализах зависимой от антител опосредованной клетками цитотоксичности (ADCC) и зависимой от комплемента цитотоксичности(71)(73) Заявитель и патентовладелец: СЕФАЛОН ОСТРЭЙЛИА ПТИ ЛТД. Дата подачи заявки Настоящая заявка связана и притязает на приоритет на основании заявки на выдачу патента Австралии 2009901129, поданной 16 марта 2009 г., заявки на выдачу патента США 61/160682, поданной 16 марта 2009 г., и заявки на выдачу патента США 61/258517, поданной 5 ноября 2009 г., полное содержание каждой из указанных заявок включено в настоящее описание в виде ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к гуманизированным антителам с высокой противоопухолевой активностью. В частности, гуманизированные антитела обладают специфичным связыванием и непосредственно вызывают гибель клеток опухолей ободочной кишки человека и проявляют высокую иммунно-опосредованную цитотоксическую активность против злокачественных клеток ободочной кишки человека в анализах зависимой от антител опосредованной клетками цитотоксичности (ADCC) и зависимой от комплемента цитотоксичности (CDC). Кроме того, настоящее изобретение относится к применению таких гуманизированных антител в терапии и диагностике. Уровень техники Углеводные структуры могут представлять собой специфичные для опухоли или ассоциированные с опухолями антигены и, таким образом, находятся в центре внимания многих методик иммунизации,направленных на генерирование антител. Однако генерирование специфичных противоуглеводных антител является сложной задачей, так как они могут не обладать специфичностью, аффинностью или относятся только к классу IgM (Christensen et al., 2009). Кроме того, сложной задачей является образование гуманизированных противоуглеводных антител, которые обладают способностью убивать злокачественные клетки, такой факт отражается в очень малом количестве отвечающих на такие антитела. Имеется только один пример противогликолипидного антитела, которое было успешно гуманизировано; антитело узнает ганглиозид GM2 и убивает опухолевые клетки человека in vitro и in vivo (патенты США 6423511 и 6872392). Хотя два других примера связывающих углеводы антител, которые были сконструированы для введения человеку, являются негуманизированными. Во-первых, противоуглеводное антитело RAV-12 является химерным IgG1 мыши-человека, которое эффективно in vitro и in vivo против клеток злокачественной опухоли ободочной кишки человека (Loo et al., 2007). Во-вторых, было показано, что противоуглеводное антитело НММС-1 эффективно in vitro против злокачественной опухоли яичника человека. НММС-1 является полностью человеческим антителом, образуемым у трансхромосомных мышей KM(Nozawa et al., 2004). В международной заявке на выдачу патентаWO 2005/108430 раскрыто мышиное моноклональное антитело против злокачественных опухолей, которое названо SC104. Описание указанной заявки включено в настоящее описание в виде ссылки. Точная природа антигена, с которым связывается SC104,не ясна, но в WO 2005/108430 указано, что антиген является сиалилтетраозилуглеводом. Также описано,что SC104 способно непосредственно индуцировать гибель клеток без необходимости в иммунных эффекторных клетках. Сущность изобретения В первом аспекте настоящее изобретение относится к связывающему домену VH антитела, при этом связывающий домен содержит последовательно первую каркасную область (FR1), первую CDR (CDR1),вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR(CDR3) и четвертую каркасную область (FR4), при этом последовательность FR1 представляет собой последовательностьX1 означает Q или Е,Х 2 означает S или Т,Х 3 означает I, L или V,Х 4 означает S или Т,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность,по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR2 представляет собой WIRQX5PGKGLX6WX7G (SEQ ID NO: 97), гдеX5 означает S или Р,Х 6 означает Q или Е,Х 7 означает М или I,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой HIHX8SGRPTYX9PSLX10S (SEQ ID NO: 98), где Х 8 означает F, Y или W,X9 означает N или D,-1 024695X10 означает K, L, H, F, R или S,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR3 представляет собойRX11X12ISX13X14TAKNQFSLKLTSMTAADTAVYYCAR (SEQ ID NO: 99), где Х 11 означает V или I,X12 означает Т или S,X13 означает R или K,X14 означает Е или D,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности, при условии, что остаток в положении 6 должен быть R или K; последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 100) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR4 представляет собой WGQGTLVTVSS (SEQ ID NO: 101) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. Во втором аспекте настоящее изобретение относится к связывающему домену VH антитела, при этом связывающий домен содержит каркасную последовательность и первую, вторую и третью CDR,расположенные в каркасной последовательности, при этом последовательность каркасных областей по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательностиTAVYYCARWGQGTLVTVSS (SEQ ID NO: 102); где Х 3 означает I, L или V,Х 13 означает R или K; и последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность CDR2 представляет собой HIHX8SGRPTYX9PSLX10S (SEQ ID NO: 98), где Х 8 означает F, Y или W,X9 означает N или D,X10 означает K, L, H, F, R или S,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; и последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 100) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. В третьем аспекте настоящее изобретение относится к связывающему домену VL антитела, при этом связывающий домен содержит последовательно первую каркасную область (FR1), первую CDR (CDR1),вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR(CDR3) и четвертую каркасную область (FR4), при этом последовательность FR1 представляет собой EX15VLTQSPGTLSLSX16GERATLSC (SEQ ID NO: 187), гдеX15 означает I или N,X16 означает А или Р,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR1 представляет собой SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR2 представляет собой WYQQKPGQAPRLLIY (SEQ ID NO: 189) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR3 представляет собой GIPDRFSGSGSGX17DFTLTISRVEPEDFAVYYC (SEQX17 означает Т или N,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпоч-2 024695 тительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR4 представляет собой FGQGTKLEIKR (SEQ ID NO: 193) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. В четвертом аспекте настоящее изобретение относится к связывающему домену VL антитела, при этом связывающий домен содержит каркасную последовательность и первую, вторую и третью CDR,расположенные в каркасной последовательности, при этом последовательность каркасных областей по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательностиGQGTKLEIKR (SEQ ID NO: 194); и последовательность CDR1 представляет собой SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; и последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности. В пятом аспекте настоящее изобретение относится к связывающему домену VH антитела, при этом связывающий домен содержит последовательно первую каркасную область (FR1), первую CDR (CDR1),вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR(CDR3) и четвертую каркасную область (FR4), при этом последовательность FR1 представляет собой EVQLQQWGAGLLKPSETLSLTCAVYGYSX18X19X18 означает I, L или V,X19 означает S или Т,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность,по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR2 представляет собой WIRQPPGKGLEWX20G (SEQ ID NO: 202), где Х 20 означает М или I,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой HIHX21SGRPTYX22PSLX23S (SEQ ID NO: 98), гдеX21 означает F, Y или W,X22 означает N или D,X23 означает K, L, H, F, R или S,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR3 представляет собой RX24X25ISX26DTSKNQFSLKLSSVTAADTAVYYCAR(SEQ ID NO: 203), где Х 24 означает V или I,Х 25 означает S или Т,Х 26 означает R или K,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности, при условии, что остаток в положении 6 должен быть R или K; последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 100) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR4 представляет собой WGQGTLVTVSS (SEQ ID NO: 101) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. В шестом аспекте настоящее изобретение относится к связывающему домену VH антитела, при этом связывающий домен содержит каркасную последовательность и первую, вторую и третью CDR, расположенные в каркасной последовательности, при этом последовательность каркасных областей по меньшей мере на 90%, предпочтительно по меньшей мере на 95%, идентична последовательностиDTAVYYCARWGQGTLVTVSS (SEQ ID NO: 204),где X18 означает I, L или V и X26 означает R или K; и последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность CDR2 представляет собой HIHX21SGRPTYX22PSLX23S (SEQ ID NO: 98), гдеX21 означает F, Y или W,X22 означает N или D,Х 23 означает K, L, H, F, R или S,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; и последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 10) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. В седьмом аспекте настоящее изобретение относится к связывающему домену VL антитела, при этом связывающий домен содержит последовательно первую каркасную область (FR1), первую CDR(CDR1), вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR (CDR3) и четвертую каркасную область (FR4), при этом последовательность FR1 представляет собой EX27VLTQSPATLSLSPGERATLSC (SEQ ID NO: 211),где Х 27 означает I или N,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR1 представляет собой SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR2 представляет собой WYQQKPGQAPRLLIY (SEQ ID NO: 189) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR3 представляет собой GIPDRFSGSGSGX28DFTLTISRLEPEDFAVYYC (SEQID NO: 212), где Х 28 означает Т или N,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR4 представляет собой FGGGTKVEIKR (SEQ ID NO: 193) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. В восьмом аспекте настоящее изобретение относится к связывающему домену VL антитела, при этом связывающий домен содержит каркасную последовательность и первую, вторую и третью CDR,расположенные в каркасной последовательности, при этом последовательность каркасных областей по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательности EIVLTQSPATLSLSPGERATLSCWYQQKPGQAPRLLIYGIPDRFSGSGSGTDFTLTISRLEPE DFAVYYCFGGGTKVEIKR (SEQ ID NO: 213),и последовательность CDR1 представляет собой SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; и последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последователь-4 024695 ность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности. Связывающие домены согласно настоящему изобретению в том случае, когда они представлены в виде части антитела, будут связывать линию клеток злокачественной опухоли ободочной кишки человека Colo205. Будет понятно, что антитело будет состоять из двух тяжелых цепей, каждая из которых содержит вариабельные и константные области, и двух легких цепей, каждая из которых содержит вариабельные и константные области. В том случае, когда заявленный связывающий домен представляет собой связывающий домен VH, антитело, которое связывает линию клеток злокачественной опухоли ободочной кишки человека Colo205, будет состоять из двух заявленных связывающих доменов VH, двух легких цепей SEQ ID NO: 7 и двух константных доменов тяжелой цепи SEQ ID NO: 92 или SEQ ID NO: 52. Подобным образом, когда заявленный связывающий домен представляет собой связывающий домен VL,антитело, которое связывает линию клеток злокачественной опухоли ободочной кишки человекаColo205, будет состоять из двух заявленных связывающих доменов VL, двух константных доменов VLSEQ ID NO: 93 и двух тяжелых цепей SEQ ID NO: 94 или SEQ ID NO: 50. Краткое описание чертежей Фиг. 1 - связывающие активности (панели слева) и активности, непосредственно вызывающие гибель (панели справа) мышиного SC104 (вариабельные домены, указанные в SEQ ID NO: 3/SEQ ID NO: 1) и химерного SC104 (SEQ ID NO: 4/SEQ ID NO: 2) антител и контроля изотипа IgG1 человека по отношению к позитивным по антигену SC104 (C170, Colo205) и негативным по антигену SC104 (НСТ-116) линиям клеток злокачественной опухоли ободочной кишки человека, которые показаны с использованием проточной цитометрии; идентификационные номера последовательностей относятся к номерам, указанным в списке последовательностей. Химерное SC104 и мышиное SC104 антитела проявляют сравнимое избирательное связывание и активность, непосредственно вызывающую гибель позитивных по антигену линий клеток злокачественной опухоли ободочной кишки человека. Оба антитела не связываются и не вызывают прямую гибель негативных по антигену линий клеток злокачественной опухоли ободочной кишки человека. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 2 - гуманизация SC104 на акцепторном каркасе человека 1U6A или 1QLR, включающая CDRH1 согласно определению Кабата дает нефункциональные варианты антитела, которые не связываются с позитивной по антигену SC104 линией клеток злокачественной опухоли ободочной кишки человека C170. Связывающие активности вариантов SC104, гуманизированных с использованием CDR-H1 согласно определению Кабата, привитой либо в акцептор человека 1U6A (SEQ ID NO: 7/SEQ ID NO: 9,панель А), либо 1QLR (SEQ ID NO: 8/SEQ ID NO: 10, панель В), оценивали с помощью проточной цитометрии, используя позитивную по антигену линию клеток С 170. Химерное антитело SC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного наряду с негативным контролем изотипа IgG1 человека. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 3 - гуманизация SC104 на акцепторном каркасе человека 1U6A или 1QLR, включающая CDRсогласно определению AbM, создает варианты антител, которые связываются с позитивной поH1 антигену SC104 линией клеток злокачественной опухоли ободочной кишки человека С 170. Активности связывания гуманизированных вариантов SC104, включающих CDR-H1 согласно определению AbM,привитую либо в акцептор человека 1U6A (SEQ ID NO: 7/SEQ ID NO: 11, панель А), либо в 1QLR (SEQID NO: 8/SEQ ID NO: 12, панель В), оценивали с помощью проточной цитометрии, используя позитивную по антигену линию клеток C170. Химерное антитело SC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного наряду с негативным контролем изотипа IgG1 человека. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 4 - анализ аминокислотной замены (замен) в легкой цепи и тяжелой цепи в отношении усиления связывающей активности 1U6 А-гуманизированного SC104. Влияние замен в каждой цепи анализировали в анализах активности связывания с позитивной по антигену линией клеток C170, используя проточную цитометрию. Химерное антитело SC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного наряду с негативным контролем изотипа IgG1 человека. Каждая точка представляет среднееSD для трех повторов образцов. А: прививки, содержащие CDR-H1 согласно определению Кабата; последовательность SEQ ID NO: 9 представляет собой незамещенную VH, последовательность SEQ ID NO: 15 содержит замены в VH:Q1E, Q46E, I48M, V67I, T68S, V71R и E72D, последовательность SEQ ID NO: 7 относится к VL, включающей в себя одну замену А 15 Р, тогда как последовательность SEQ ID NO: 16 относится к VL, содержащей три замены I2N, А 15 Р и T69N. В: прививки, содержащие CDR-H1 согласно определению AbM; последовательность SEQ ID NO: 11 относится к VH, не содержащей замен, последовательность SEQ ID NO: 13 содержит замены в VH: Q1E,Q46E, I48M, V67I, T68S, V71R и E72D, последовательность SEQ ID NO: 7 относится к VL, включающей в себя одну замену А 15 Р, и последовательность SEQ ID NO: 16 относится к VL, содержащей три замены:I2N, А 15 Р и T69N. Аминокислотная замена(ы) в тяжелой цепи усиливают биологическую активность 1U6A-гуманизированных вариантов антитела SC104 по отношению к позитивной по антигену линии клеток С 170. В сравнении аминокислотные замены в легкой цепи, по-видимому, менее важны для усиления связывающей активности гуманизированного SC104. Фиг. 5 - анализ шести отдельных замен VH, включенных в 1U6 А-гуманизированные антитела, содержащие CDR-H1 согласно определению AbM. Влияние замен анализировали в анализах активности связывания с позитивной по антигену линией клеток С 170, используя проточную цитометрию. Такие изменения представляли собой либо Q46E, либо I48M, либо V67I, либо T68S, либо V71R, либо E72D, и они описаны в SEQ ID NO: 19-24 соответственно. Замена R71 (SEQ ID NO: 23) была наиболее успешной в усилении эффективности связывания гуманизированного SC104. Химерное антитело SC104(SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного наряду с изотипом IgG1 человека в качестве негативного контроля. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 6 - VH-замена R71 усиливает активность связывания обоих вариантов антитела с CDR-H1 согласно определениям AbM- и Кабата с позитивной по антигену линией клеток C170,судя по определению с использованием проточной цитометрии. Химерное антитело SC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного, и изотип IgG1 человека использован в качестве негативного контроля. Каждая точка представляет среднее SD для трех повторов образцов. А: основанные на 1QLR варианты SC104 замена V71R; прививки CDR-H1 согласно определениюID NO: 9 (-R) и SEQ ID NO: 28 (+R). Фиг. 7 - влияние на активность связывания VH-замены G27Y в 1QLR-гуманизированных вариантахSC104 с CDR-H1 согласно определению Кабата. Такая замена не усиливает активность связывания 1QLR-гуманизированного SC104 (SEQ ID NO: 27 (+R) и SEQ ID NO: 29 (+R +Y) по сравнению с AbM-CDR-H1-содержащей последовательностью VH SEQ ID NO: 26) при исследовании в анализах связывания на основе проточной цитометрии с позитивной по антигену SC104 линией клеток С 170. Для сравнения показан 1QLR-гуманизированный вариант, включающий в себя CDR-H1 согласно определению Кабата без R71, SEQ ID NO: 10. Химерное антитело SC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного, и изотип IgG1 человека использован в качестве негативного контроля. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 8 - основанный на проточной цитометрии анализ связывания, показывающий влияние на связывающую активность после удаления предполагаемой сильной связывающей МНС класса II пептидной последовательности на границе каркас 2:CDR-H2 посредством замены F53 в CDR-H2 химерного SC104. Переход от F53 к другому ароматическому остатку, такому как W (SEQ ID NO: 30) или Y (SEQ ID NO: 31) оказывает ничтожное влияние на активность связывания, тогда как замена на предпочтительный остаток Р (SEQ ID NO: 32) сильно снижает активность связывания с позитивной по антигену SC104 линией клеток C170. Химерное антитело SC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного наряду с негативным контролем изотипа IgG1 человека. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 9 - гуманизированные варианты SC104 с более низкой предполагаемой иммуногенностью(1U6A VL/VH SEQ ID NO: 7/SEQ ID NO: 50; 1QLR VL/VH SEQ ID NO: 8/SEQ ID NO: 38) сравнимы с гуманизированными вариантами антитела с более высокой предполагаемой иммуногенностью (1U6AVL/VH SEQ ID NO: 7/SEQ ID NO: 25; 1QLR VL/VH SEQ ID NO: 8/SEQ ID NO: 26) в отношении специфичности и активности связывания с позитивной по антигену (C170, Colo205) или негативной по антигену(НСТ-116) линиями клеток злокачественной опухоли ободочной кишки человека, судя по определению с использованием проточной цитометрии. Химерное антитело SC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного наряду с негативным контролем изотипа IgG1 человека. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 10 - основанный на проточной цитометрии анализ связывания, показывающий, что остатки I(SEQ ID NO: 55) положении 29 в каркасе 1 1U6A вариабельной области тяжелой цепи придает более высокую активность связывания гуманизированных вариантов антитела SC104 с более низкой предполагаемой иммуногенностью с позитивной по антигену SC104 линией клеток злокачественной опухоли ободочной кишки человека C170. Химерное антитело SC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного наряду с негативным контролем изотипа IgG1 человека. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 11 - основанный на проточной цитометрии анализ связывания, показывающий, что положительно заряженные остатки R (SEQ ID NO: 50) но не отрицательно заряженный остаток D (SEQID NO: 75) или нейтральный остаток W (SEQ ID NO: 90) в положении 71 в каркасе 3 1U6A вариабельной области тяжелой цепи придает более высокую активность связывания гуманизированных вариантов антитела SC104 с более низкой предполагаемой иммуногенностью с позитивной по антигенуSC104 линией клеток злокачественной опухоли ободочной кишки человека C170. Химерное антителоSC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного наряду с негативным контролем изотипа IgG1 человека. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 12 - варианты антитела SC104, содержащие каркас 1U6A (VL/VH SEQ ID NO: 7/SEQ ID NO: 50 обладают более высокой активностью, непои SEQ ID NO: 7/SEQ ID NO: 25) средственно вызывающей гибель клеток, по сравнению с соответствующими вариантами SC104, полученными на основе 1QLR (VL/VH SEQ ID NO: 8/SEQ ID NO: 38 и SEQ ID NO: 8/SEQ ID NO: 26), судя по определению с помощью проточной цитометрии с использованием позитивной по антигену SC104 линии клеток злокачественной опухоли ободочной кишки человека C170. Химерное антитело SC104 (SEQ IDNO: 4/SEQ ID NO: 2) показано в качестве сравнительного наряду с негативным контролем изотипа IgG1 человека. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 13 - гуманизированные варианты антитела SC104, содержащие каркас 1U6A (VL/VH SEQ IDNO: 7/SEQ ID NO: 50 и SEQ ID NO: 7/SEQ ID NO: 25) обладают более высокой зависимой от антител опосредованной клетками цитотоксической активностью по сравнению с соответствующими полученными на основе 1QLR вариантами SC104 (VL/VH SEQ ID NO: 8/SEQ ID NO: 38 и SEQID NO: 8/SEQ ID NO: 26), как определено в анализах высвобождения LDH с использованием позитивной по антигену SC104 линии клеток злокачественной опухоли ободочной кишки человека C170. Химерное антитело SC104 (SEQ ID NO: 4/SEQ ID NO: 2) показано в качестве сравнительного, и изотип IgG1 человека использован в качестве негативного контроля. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 14 - варианты антитела SC104, содержащие каркас 1U6A (VL/VH SEQ ID NO: 7/SEQ ID NO: 50 и SEQ ID NO: 7/SEQ ID NO: 25) обладают более высокой зависимой от комплемента цитотоксичностью по сравнению с соответствующими полученными на основе 1QLR вариантами антитела SC104 (VL/VH SEQ ID NO: 8/SEQ ID NO: 38 и SEQ ID NO: 8/SEQ ID NO: 26), как определено в анализах жизнеспособности клеток с использованием позитивной по антигену SC104 линии клеток злокачественной опухоли ободочной кишки человека Colo205. Химерное антитело SC104 (SEQ ID NO: 4/SEQ IDNO: 2) показано в качестве сравнительного наряду с негативным контролем в виде изотипа IgG1 человека. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 15 - обработанное кифунензином гуманизированное антитело SC104 с более низкой предполагаемой иммуногенностью (SEQ ID NO: 7/SEQ ID NO: 50) обладает более высокой зависимой от антител опосредованной клетками цитотоксической активностью по сравнению с необработанным антикак определено в анализах высвобождения LDH с использованием позитивной по антигену теломSC104 линии клеток злокачественной опухоли ободочной кишки человека WiDr. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 16 - сконструированное способом Potelligent гуманизированное антитело SC104 с более низкой предполагаемой иммуногенностью (SEQ ID NO: 7/SEQ ID NO: 94) обладает более высокой зависимой от антител опосредованной клетками цитотоксической активностью по сравнению с необработанным антителом (SEQ ID NO: 7/SEQ ID NO: 50), как определено в анализах высвобождения LDH с использованием позитивной по антигену SC104 линии клеток злокачественной опухоли ободочной кишки человека Colo201. Каждая точка представляет среднее SD для трех повторов образцов. Фиг. 17 - обработка мышей, несущих ксенотрансплантат опухоли HT29, гуманизированным антителом SC104 с более низкой предполагаемой иммуногенностью(SEQ ID NO: 7/SEQ ID NO: 50) приводит к значимо пониженному росту по сравнению с контрольной обработкой наполнителем. Верхняя панель: среднее значение SEM объема опухоли в группах по 6-10 мышей. Звездочками указаны значимые различия между группами обработки, р 0,05, критерий Манна-Уитни. Нижняя панель: средние и индивидуальные массы опухолей в конце исследования. Р-значение на основе критерия Манна-Уитни. Фиг. 18 - обработка мышей, несущих ксенотрансплантат опухоли Colo201, сконструированным способом Potelligent гуманизированным антителом SC104 с более низкой предполагаемой иммуногенностью(SEQ ID NO: 7/SEQ ID NO: 94) приводит к значимо уменьшенному объему опухолей по сравнению с контрольной обработкой наполнителем. Среднее SEM в группах по 10 мышей. Звездочками указаны значимые различия между группами обработки, р 0,05, t-критерий. Подробное описание изобретения Настоящее изобретение относится к гуманизированным связывающим доменам против злокачественных опухолей. Такие связывающие домены основаны на мышином антителе SC104 (WO 2005/108430) и содержат модифицированные каркасные последовательности человека для увеличения связывающей активности и снижения предполагаемой иммуногенности. Как будет понятно специалистам в данной области, последовательности, разработанные и описанные в настоящей публикации, могут быть дополнительно модифицированы посредством созревания аффинности, чтобы повысить связывание и чтобы увеличить Fc-опосредованную эффекторную функцию. Связывающие домены, описанные в настоящей публикации, можно применять либо по отдельности, либо в сочетании для диагностики и/или лечения злокачественных опухолей человека, например рака прямой и ободочной кишки, поджелудочной желе-7 024695 зы, яичника и легкого. В первом аспекте настоящее изобретение относится к связывающему домену VH антитела, при этом связывающий домен содержит последовательно первую каркасную область (FR1), первую CDR (CDR1),вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR(CDR3) и четвертую каркасную область (FR4), при этом последовательность FR1 представляет собой X1VQLQESGPGLVKPSETLSLTCTVX2GYSX3X4 (SEQX1 означает Q или Е,X2 означает S или Т,Х 3 означает I, L или V,X4 означает S или Т,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность,по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR2 представляет собой WIRQX5PGKGLX6WX7G (SEQ ID NO: 97), гдеX5 означает S или Р,Х 6 означает Q или Е,X7 означает М или I,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой HIHX8SGRPTYX9PSLX10S (SEQ ID NO: 98), гдеX8 означает F, Y или W,X9 означает N или D,X10 означает K, L, H, F, R или S,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR3 представляет собой RX11X12ISX13X14TAKNQFSLKLTSMTAADTAVYX11 означает V или I,X12 означает Т или S,X13 означает R или K,X14 означает Е или D,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности при условии, что остаток в положении 6 должен быть R или K; последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 100) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR4 представляет собой WGQGTLVTVSS (SEQ ID NO: 101) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. Во втором аспекте настоящее изобретение относится к связывающему домену VH антитела, при этом связывающий домен содержит каркасную последовательность и первую, вторую и третью CDR,расположенные в каркасной последовательности, при этом последовательность каркасных областей по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательностиAADTAVYYCARWGQGTLVTVSS (SEQ ID NO: 102); где X3 означает I, L или V,X13 означает R или K; и последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность CDR2 представляет собой HIHX8SGRPTYX9PSLX10S (SEQ ID NO: 98), где Х 8 означает F, Y или W,X9 означает N или D,X10 означает K, L, H, F, R или S,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; и последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 100) или последова-8 024695 тельность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. Предпочтительными в случае FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4 являются следующие последовательности:CDR1 представляет собой последовательность SGYSWH (SEQ ID NO: 96);WGQGTLVTVSS (SEQ ID NO: 101). В третьем аспекте настоящее изобретение относится к связывающему домену VL антитела, при этом связывающий домен содержит последовательно первую каркасную область (FR1), первую CDR (CDR1),вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR(CDR3) и четвертую каркасную область (FR4), при этом последовательность FR1 представляет собой EX15VLTQSPGTLSLSX16GERATLSC (SEQ ID NO: 187), гдеX15 означает I или N,X16 означает А или Р,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR1 представляет собой SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR2 представляет собой WYQQKPGQAPRLLIY (SEQ ID NO: 189) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR3 представляет собой GIPDRFSGSGSGX17DFTLTISRVEPEDFAVYYC (SEQX17 означает Т или N,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпоч- 10024695 тительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR4 представляет собой FGQGTKLEIKR (SEQ ID NO: 193) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. В четвертом аспекте настоящее изобретение относится к связывающему домену VL антитела, при этом связывающий домен содержит каркасную последовательность и первую, вторую и третью CDR,расположенные в каркасной последовательности, при этом последовательность каркасных областей, по меньшей мере, на 90%, предпочтительно по меньшей мере на 95% идентична последовательностиCFGQGTKLEIKR (SEQ ID NO: 194); и последовательность CDR1 представляет собой SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; и последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности. Предпочтительными в случае FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4 являются следующие последовательности:FR4 представляет собой FGQGTKLEIKR (SEQ ID NO: 193). В пятом аспекте настоящее изобретение относится к связывающему домену VH антитела, при этом связывающий домен содержит последовательно первую каркасную область (FR1), первую CDR (CDR1),вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR(CDR3) и четвертую каркасную область (FR4), при этом последовательность FR1 представляет собой EVQLQQWGAGLLKPSETLSLTCAVYGYSX18X19X18 означает I, L или V,X19 означает S или Т,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность,по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR2 представляет собой WIRQPPGKGLEWX20G (SEQ ID NO: 202), где Х 20 означает М или I,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой HIHX21SGRPTYX22PSLX23S (SEQ ID NO: 98), гдеX21 означает F, Y или W,X22 означает N или D,X23 означает K, L, H, F, R или S,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR3 представляет собой RX24X25ISX26DTSKNQFSLKLSSVTAADTAVYYCARX24 означает V или I,Х 25 означает S или Т,Х 26 означает R или K,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности при условии, что остаток в положении 6 должен быть R или K; последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 100) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR4 представляет собой WGQGTLVTVSS (SEQ ID NO: 101) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. В шестом аспекте настоящее изобретение относится к связывающему домену VH антитела, при этом связывающий домен содержит каркасную последовательность и первую, вторую и третью CDR, расположенные в каркасной последовательности, при этом последовательность каркасных областей по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательностиADTAVYYCARWGQGTLVTVSS (SEQ ID NO: 204),где X18 означает I, L или V и X26 означает R или K; и последовательность CDR1 представляет собой SGYSWH (SEQ ID NO: 96) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность CDR2 представляет собой HIHX21SGRPTYX22PSLX23S (SEQ ID NO: 98), гдеX21 означает F, Y или W,Х 22 означает N или D,Х 23 означает K, L, H, F, R или S,или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; и последовательность CDR3 представляет собой KGKGSDDGLNY (SEQ ID NO: 100) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. Предпочтительными в случае FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4 являются следующие последовательности:FR4 представляет собой WGQGTLVTVSS (SEQ ID NO: 101). В седьмом аспекте настоящее изобретение относится к связывающему домену VL антитела, при этом связывающий домен содержит последовательно первую каркасную область (FR1), первую CDR(CDR1), вторую каркасную область (FR2), вторую CDR (CDR2), третью каркасную область (FR3), третью CDR (CDR3) и четвертую каркасную область (FR4), при этом последовательность FR1 представляет собой EX27VLTQSPATLSLSPGERATLSC (SEQ ID NO: 211),где Х 27 означает I или N,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR1 представляет собой SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR2 представляет собой WYQQKPGQAPRLLIY (SEQ ID NO: 189) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность FR3 представляет собой GIPDRFSGSGSGX28DFTLTISRLEPEDFAVYYC (SEQID NO: 212), где Х 28 означает Т или N,или последовательность, по меньшей мере на 90% или по меньшей мере на 95% сходную, предпочтительно по меньшей мере на 90% или по меньшей мере на 95% идентичную указанной последовательности; последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; последовательность FR4 представляет собой FGGGTKVEIKR (SEQ ID NO: 193) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности. В восьмом аспекте настоящее изобретение относится к связывающему домену VL антитела, при этом связывающий домен содержит каркасную последовательность и первую, вторую и третью CDR,расположенные в каркасной последовательности, при этом последовательность каркасных областей по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательностиFGGGTKVEIKR (SEQ ID NO: 213),и последовательность CDR1 представляет собой SASSSLSYIH (SEQ ID NO: 188) или последовательность, по меньшей мере на 90% сходную, предпочтительно по меньшей мере на 90% идентичную указанной последовательности; последовательность CDR2 представляет собой DTSNLAS (SEQ ID NO: 190) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности; и последовательность CDR3 представляет собой FQGSEYPLT (SEQ ID NO: 192) или последовательность, по меньшей мере на 80% сходную, предпочтительно по меньшей мере на 80% идентичную указанной последовательности. Предпочтительными в случае FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4 являются следующие последовательности:FR4 представляет собой FGGGTKVEIKR (SEQ ID NO: 193). В предпочтительных вариантах осуществления настоящего изобретения связывающие домены VH иVL антитела согласно настоящему изобретению дополнительно содержат константный домен. Константный домен может быть человеческим или доменом примата, отличного от человека, предпочтительно константной областью человека. В одном варианте последовательностью константного домена тяжелой цепи является последовательность и последовательностью константного домена легкой цепи является последовательность В следующем предпочтительном варианте осуществления настоящего изобретения предлагается антитело, содержащее VH согласно первому аспекту и VL согласно второму аспекту или VH согласно третьему аспекту и VL согласно четвертому аспекту. Связывающие домены и антитела согласно настоящему изобретению специфично связывают злокачественные клетки, которые экспрессируют антиген, связываемый SC104, в частности колоректальныую злокачественную опухоль и неколоректальные злокачественные опухоли, такие как злокачественная опухоль яичника, поджелудочной железы, предстательной железы и легкого. Согласно другому аспекту настоящее изобретение относится к способу лечения злокачественной опухоли у субъекта, при этом злокачественная опухоль выбрана из опухолей прямой и ободочной кишки, яичника, поджелудочной железы, предстательной железы и легкого, и при этом способ включает в себя введение субъекту терапевтически эффективного количества связывающего домена или антитела согласно настоящему изобретению. Настоящее изобретение также относится к способу выявления присутствия злокачественных клеток в образце, при этом способ включает в себя осуществление контакта образца клеток со связывающим доменом или антителом согласно настоящему изобретению и выявление связывания связывающего домена или антитела согласно настоящему изобретению с клетками. Как будет понятно, последовательности, разработанные и описанные в настоящем изобретении, могут быть модифицированы с применением способов, хорошо известных в данной области, чтобы повысить связывание, например, с использованием созревания аффинности, или чтобы понизить иммуногенность посредством удаления предполагаемых мотивов связывания МНС класса II. Терапевтическая применимость последовательностей, разработанных и описанных в настоящей публикации, может быть дополнительно увеличена в результате модулирования их функциональных свойств, таких как зависимая от антител опосредованная клетками цитотоксичность (ADCC), зависимая от комплемента цитотоксичность(CDC), время полужизни в сыворотке, биораспределение и связывание с Fc-рецепторами или сочетание любых из указанных свойств. Такое модулирование может быть осуществлено в результате белковой инженерии, гликоинженерии или химических способов. В зависимости от требуемого терапевтического применения может быть полезным либо повышение, либо снижение любой из указанных активностей. В данной области известны многочисленные способы созревания аффинности антител. Многие из них основаны на общей методике создания панелей или библиотек вариантов белков в результате мутагенеза с последующей селекцией и/или скринингом в отношении повышенной аффинности. Мутагенез часто осуществляют на уровне ДНК, например, используя склонную к ошибкам ПЦР (Thie, Voedisch etal. 2009), перетасовку генов (Kolkman and Stemmer 2001), применяя мутагенные химические средства или облучение, используя "мутаторные" штаммы со склонным к ошибкам аппаратом репликации (Greener,1996) или способы соматического гипермутирования, в которых используют природный механизм созревания аффинности (Peled, Kuang et al. 2008). Мутагенез также можно осуществлять на уровне РНК, например, используя Q-репликазу (Kopsidas, Roberts et al. 2006). Основанные на создании библиотек способы, позволяющие проводить скрининг в отношении улучшенных вариантов белков, могут быть основаны на различных методиках дисплея, такого как дисплей на основе фага, дрожжей, рибосомы, бактериальных клеток или клеток млекопитающих, и хорошо известны в данной области (Benhar, 2007). Созревание аффинности можно осуществить более прямыми/прогнозируемыми способами, например, с использованием сайт-направленного мутагенеза или синтеза генов, руководствуясь данными 3Dмоделирования белков (см., например, Queen, Schneider et al. 1989, или патент США 6180370, или патент США 5225539). Способы повышения ADCC описаны в следующих публикациях: Ferrara, Brunker et al. 2006; Li, Sethuraman et al. 2006; Stavenhagen, Gorlatov et al. 2007; Shields, Namenuk et al. 2001; Shinkawa, Nakamura etal. 2003 и WO 2008/006554. В предпочтительной форме антитела согласно настоящему изобретению имеют сниженный уровень фукозы. Способы увеличения CDC описаны в следующих публикациях: Idusogie, Wong et al. 2001; Dall'Acqua, Cook et al. 2006; Michaelsen, Aase et al. 1990; Brekke, Bremnes et al. 1993; Tan, Shopes et al. 1990; Norderhaug, Brekke et al. 1991. Публикации, описывающие способы увеличения ADCC и CDC, включают Natsume, In et al. 2008. Описание каждой из приведенных публикаций включено в настоящее описание посредством перекрестной ссылки. Ряд способов модулирования времени полужизни антитела в сыворотке и биораспределения основаны на модификации взаимодействия между антителом и неонатальным Fc-рецептором (FcRn), рецептором, играющим ключевую роль в защите IgG от катаболизма и поддержании высокой концентрации антител в сыворотке. В публикации Dall'Acqua с соавторами описаны замены в Fc-области IgG1, которые повышают аффинность связывания с FcRn, тем самым увеличивая время полужизни в сыворотке(Dall'Acqua, Woods et al. 2002), и дополнительно показана повышенная биодоступность и модулированиеADCC-активности с использованием тройной замены M252Y/S254T/T256E (Dall'Acqua, Kiener et al. 2006). Также см. патенты США 6277375, 6821505 и 7083784. Hinton с соавторами описали аминокислотные замены в константном домене в положениях 250 и 428, которые придают увеличенное время полужизни in vivo (Hinton, Johlfs et al. 2004). (Hinton, Xiong et al. 2006). Также см. патент США 7217797. Petkova с соавторами описали аминокислотные замены в константном домене в положениях 307, 380 и 434, которые придают увеличенное время полужизни in vivo (Petkova, Akilesh et al. 2006). Также см. публикацию Shields с соавторами (Shields, Namenuk et al. 2001) и WO 2000/42072. Другие при- 15024695 меры аминокислотных замен в константном домене, которые модулируют связывание с Fc-рецепторами и последующую функцию, опосредованную такими рецепторами, включая связывание FcRn и время полужизни в сыворотке, описаны в заявках на выдачу патента США 20090142340, 20090068175 и 20090092599. Известно, что гликаны, связанные с молекулами антител, влияют на взаимодействие антитела с Fcрецепторами и рецепторами гликанов и таким образом влияют на активность антител, включая время полужизни в сыворотке (Kaneko, Nimmerjahn et al. 2006; Jones, Papac et al. 2007; и Kanda, Yamada et al. 2007). Поэтому некоторые гликоформы, которые модулируют требуемые активности антитела, могут иметь терапевтические преимущества. Способы создания сконструированных гликоформ известны в данной области и включают без ограничения способы, описанные в патентах США 6602684,7326681, 7388081 и WO 2008/006554. Увеличение времени полужизни добавлением полиэтиленгликоля (ПЭГ) широко применяют для увеличения времени полужизни белков в сыворотке; обзор см., например, в публикации Fishburn(Fishburn 2008). Как будет понятно, можно осуществлять консервативные аминокислотные замены в последовательностях согласно настоящему изобретению. "Консервативная замена" означает замену аминокислотами, обладающими сходными свойствами. В используемом в настоящем описании смысле следующие группы аминокислот следует считать консервативными заменами: Н, R и K;F, Y и W. Можно будет увидеть, что в настоящем описании термины "на n% сходная" и "на n% идентичная" используют для описания ряда последовательностей. Как будет понятно, термин "на n% идентичная" означает, что при сравнении двух последовательностей на протяжении конкретной области такие две последовательности имеют определенное количество идентичных остатков в одном и том же положении. Термин "на % сходная" имеет подобное значение, но кроме определенного количества идентичных аминокислот в двух последовательностях также необходимо учесть наличие аминокислот, которые не идентичны, но представляют собой консервативные замены, которые определены. На протяжении описания следует понимать, что слово "содержат" или его варианты, такие как "содержит" или "содержащий", означает включение указанного элемента, целого числа или стадии или группы элементов, целых чисел или стадий, но не исключение любого другого элемента, целого числа или стадии или группы элементов, целых чисел или стадий. Все публикации, упоминаемые в настоящем описании, включены в виде ссылки. Любое обсуждение документов, актов, материалов, устройств, статей или тому подобного, которое включено в настоящее описание, приведено только в целях формирования контекста настоящего изобретения. Не следует считать, что любой или все такие материалы составляют часть основы известного уровня техники или представляли собой общедоступные известные данные в области, относящейся к настоящему изобретению, которые имелись в Австралии или в любом ином месте до даты приоритета каждого пункта формулы изобретения, приведенного в настоящей заявке. Для лучшего понимания природы настоящего изобретения далее будут описаны его предпочтительные формы посредством обращения к следующим примерам. Пример 1. Создание химерного антитела SC104. Вариабельную область тяжелой цепи (VH) SC104 мыши, SEQ ID NO: 1, форматировали in silico в остове IgG1 человека (домены CH1, шарнир, CH2 и СН 3 тяжелой цепи IgG1 человека, например, изNCBI с номером доступа ААН 72419 и его производные), получая химерную тяжелую цепь SC104, SEQID NO: 2. Подобным образом вариабельную область легкой цепи (VL) SC104, SEQ ID NO: 3, форматировали in silico в остове IgG1 человека (например, из NCBI с номером доступа Р 01834 и его производных) с образованием соответствующей химерной легкой цепи SC104, SEQ ID NO: 4. Форматирование и получение конструкций ДНК. Полученные аминокислотные последовательности тяжелой и легкой цепи обратно транслировали в последовательности ДНК. 5'-VH-специфичный сайт рестрикции AscI вводили выше по ходу транскрипции в нуклеотидную последовательность, кодирующую сигнальную полипептидную последовательность тяжелой цепи, SEQ ID NO: 5. Сайт рестрикции Tth111I вводили в полинуклеотидную последовательность, кодирующую аминокислоты 3'-VH-области TVSS. 5'-VL-специфичный сайт рестрикции BsiWI вводили выше нуклеотидной последовательности, кодирующей сигнальную полипептидную последовательность легкой цепи, SEQ ID NO: 6. Сайт рестрикции RsrII вводили на 3'-конце последовательности нуклеиновой кислоты, кодирующей аминокислоты RT, расположенные на С-конце VL-области. Затем такие последовательности оптимизировали для экспрессии в клетках СНО, используя методику GeneOptimizer (Gene Art, Germany). Затем вариабельные области синтезировали de novo путем сборки синтетических олигонуклеотидов(Gene Art, Germany). Добавленные сайты рестрикции использовали для клонирования вариабельных областей в векторах основанной на клетках яичника китайского хомячка глутаминсинтазной (GS) системы генной экспрессии (Lonza, UK), содержащих подходящие константные области IgG1. Полученные содержащие тяжелую цепь и содержащие легкую цепь векторы использовали для котрансфекции клеток СНО-K1SV с целью получения антител. Культура клеток и временная экспрессия конструкций антител. Клетки CHO-K1SV (Lonza, UK) культивировали при плотности 2105 - 4106 клеток/мл в химически определенной среде для роста клеток СНО Freestyle (Invitrogen) и в культуры добавляли Lглутамин (Invitrogen) до конечной концентрации 6 мМ. Клетки культивировали при 36,5 С, 10% СО 2 и 140 об./мин. За день до трансфекции высевали культуры объемом 100 мл по 5105 клеток/мл в вентилируемых колбах Эрленмейера объемом 500 мл (Corning). На следующий день готовили 4 мл OptiPROSFM (Invitrogen) в пробирке Corning объемом 15 мл и смешивали с 100 мкг каждой цепи антитела. Полученную смесь фильтровали через фильтрующую насадку на шприц 13 мм с диаметром пор 0,2 мкм(Invitrogen). Полученную смесь инкубировали в течение 10 мин при комнатной температуре, затем добавляли к клеткам CHO-K1SV, посеянным заранее. Через 7 дней надосадок собирали центрифугированием при 3000 g в течение 10 мин, затем фильтровали через 0,2 мкм-мембрану в стерильную емкость(фильтрующий элемент Corning). Очистка антител. Значение рН надосадков, собранных из трансфицированных клеток СНО, доводили до рН 7,4, затем наносили на колонку с белком A HiTrap (1 мл, GE Healthcare). Колонку промывали 30 мл 1X PBS (рН 7,4). Элюирование осуществляли, используя 0,1 М лимонную кислоту с рН 3. Элюированное антитело обессоливали, используя колонки для обессоливания Zeba (Pierce) в 1X PBS (рН 7,4). Концентрацию антител определяли по значению A280. Основанные на проточной цитометрии анализы связывания Жизнеспособные опухолевые клетки и контрольные клетки (2105, судя по исключению при окрашивании трипановым синим) инкубировали в трех повторах с мышиным SC104, химерным SC104 или гуманизированными вариантами и изотипом IgG1 человека (Sigma-Aldrich) в разных концентрациях в 100 мкл буфера (PBS плюс 1% FCS) в 96-луночных планшетах с V-образными лунками (Eppendorf) в течение 20 мин на льду в темноте. Клетки дважды промывали буфером перед инкубацией в течение 20 мин в 100 мкл буфера, содержащего антитело козы против IgG человека (Fc-специфичным, Sigma-Aldrich, конъюгированным с ФИТЦ) или антителом козы против IgG мыши (Fc-специфичным, Sigma-Aldrich, конъюгированным с ФИТЦ) для выявления химерных или мышиных антител соответственно. После промывки клетки ресуспендировали в буфере и анализировали в отношении связывания антител проточной цитометрией на приборе Cell Lab Quanta SC MPL (Beckman Coulter), используя EV, боковое светорассеяние и пропускание FL-1; во время регистрации клетки в 96-луночном планшете охлаждали лежащим снизу охлаждающим блоком (Eppendorf). Результаты выражали в виде средней интенсивности флуоресценции (MFI); значения наклона кривой вычисляли, используя анализ нелинейной регрессии с помощью компьютерной программы GraphPad Prism. Основанные на проточной цитометрии анализы прямой гибели. Жизнеспособные опухолевые клетки (2105, судя по исключению при окрашивании трипановым синим) инкубировали в трех повторах с мышиным SC104, химерным SC104 или гуманизированными вариантами и изотипом IgG1 человека (Sigma-Aldrich) в разных концентрациях в 80 мкл буфера (PBS плюс 1% FCS) в 96-луночных планшетах с V-образными лунками (Eppendorf) в течение 2,5-3 ч при комнатной температуре в темноте. В каждую лунку добавляли 0,15 г 7AAD (BD Biosciences) в 20 мкл буфера и клетки инкубировали еще в течение 20 мин и затем анализировали жизнеспособность клеток проточной цитометрией на приборе Cell Lab Quanta SC MPL (Beckman Coulter), используя EV, боковое светорассеяние и пропускание FL-3; во время регистрации клетки в 96-луночном планшете охлаждали лежащим снизу охлаждающим блоком (Eppendorf). Результаты выражали в виде процентного содержания 7AAD+-клеток; значения наклона кривой вычисляли, используя анализ нелинейной регрессии с помощью компьютерной программы GraphPad Prism. Химерное антитело SC104 проявляет эффективное и специфичное связывание и активность, непосредственно вызывающую гибель клеток опухоли ободочной кишки человека. Химерные и исходные мышиные антитела SC104 тестировали в отношении связывания с линиями клеток злокачественной опухоли ободочной кишки человека С 170 (ЕСАСС, номер доступа 97071507) иColo205 (ATCC номер доступа CCL-222); ранее с использованием проточно-цитометрических анализов было показано, что мышиное антитело SC104 прочно связывается с такими линиями клеток (Durrant,Harding et al. 2006). На фиг. 1 (панели слева) показано связывание антител SC104, но отсутствие связывания контрольного изотипа IgG1 человека с С 170 и Colo205 как в случае мышиного, так и в случае химерного антитела SC104, которые при этом проявляют сходную эффективность связывания во всем диа- 17024695 пазоне концентраций антител. Напротив, ни одно из антител не связывалось с линией клеток злокачественной опухоли ободочной кишки человека НСТ-116 (АТСС, номер доступа CCL-247), которая таким образом была определена как негативная по антигену SC104. Известно, что мышиное антитело SC104 индуцирует прямую гибель клеток опухоли ободочной кишки без необходимости участия иммунных эффекторных клеток или комплемента (Durrant, Harding etal. 2006). Действительно и мышиные, и химерные антитела SC104, но не контрольный изотип IgG1 человека, вызывали эффективную прямую гибель позитивных по антигену клеток С 170 и Colo205; напротив,антитела не вызывали превышающую фон гибель негативных по антигену клеток НСТ-116 (фиг. 1, панели справа). Другие эксперименты с разными негативными по антигену клетками опухоли прямой и ободочной кишки человека (НСТ 15, номер доступа АТСС CCL-225), неопухолевыми клетками человека (MRC5,АТСС, номер доступа CCL-171) или мононуклеарными клетками периферической крови здоровых людей доноров показали отсутствие связывания и отсутствие активностей, вызывающих непосредственную гибель, в случае мышиных и/или химерных антител SC104 (данные не показаны). Вместе взятые данные свидетельствуют, что химерное антитело SC104 имеет сходную эффективность и специфичность при сравнении с исходным мышиным антителом SC104. И поэтому химерное антитело SC104 использовали в качестве эталона при тестировании активности созданных затем гуманизированных вариантов антителаSC104. Пример 2. Гуманизация SC104. Отбор подходящих акцепторных каркасов человека с помощью 3D-моделирования. Конструировали независимые 3D-модели вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) SC104 мыши, используя базу данных кристаллических структур (см., например, банк данных о белках Research Collaboratory for Structural Bioinformatics (RCSB),http://www.rcsb.org/pdb/home/home.do; часть Всемирного банка белков, http://www.wwpdb.ore) и пакет компьютерных программ Discovery Studio v1.7 (Accelrys, USA). Коротко, осуществляли запрос в базе данных банка белков, используя средство поиска основного локального выравнивания (BLAST) и либо вариабельную область тяжелой цепи, либо вариабельную область легкой цепи мышиного SC104,чтобы идентифицировать антитела со сходной полипептидной последовательностью с сопровождающей информацией о структуре. Затем такие структуры использовали для построения моделей гомологии, основанных на гомологии аминокислотных последовательностей, общих для вариабельных областей мышиного SC104 и идентифицированных кристаллических структур. Используя такие модели мышиных VH и VL, независимо идентифицировали подходящие акцепторные каркасы VH и VL человека в банке данных о белках, которые имеют структурную гомологию каркаса с мышиным антителом. Чтобы гарантировать правильное спаривание тяжелых и легких цепей, в процессе гуманизации использовали акцепторные каркасы человека для VH и VL из одной и той же кристаллической структуры антитела. Акцепторные антитела человека с более высокой структурной гомологией каркасных областей тяжелых цепей мышичеловека были предпочтительнее по сравнению с акцепторными антителами человека с более высокой гомологией каркасов легких цепей мыши-человека. Такими антителами являются антитела с кодами доступа pdb 1U6A и 1QLR. Оценивали акцепторные каркасы человека, чтобы проверить, способны ли такие структуры соответствующим образом поддерживать CDR SC104. Форматирование конструкций гуманизированных антител. Сначала определяли области, определяющие комплементарность (CDR) мышиного SC104 согласно способу Кабата (см. (Kabat 1991, учитывая, что методики прививок CDR (см., например, (Queen,Schneider et al. 1989) или патент США 6180370 или патент США 5225539) основаны на такой классификации. При более поздних попытках гуманизации CDR1 тяжелой цепи (CDR-H1) определяли, используя номенклатуру AbM (см., например, (Diibel 2007) и ссылки, приведенные в указанной работе), табл. 1.CDR форматировали in silico в выбранные каркасы человека, используя пакет компьютерных программDNAStar (версия 8; Lasergene, USA). Области VH форматировали в тяжелую цепь IgG1 человека, содержащую домены CH1, шарнир, CH2 и СН 3 (например, из NCBI с номером доступа AAH72419 и ее производные). Одновременно форматировали VL-области, используя соответствующую константную область легкой цепи IgG1 человека (например, из NCBI с номером доступа Р 01834 и ее производные). Гуманизированные варианты SC104, содержащие определенную согласно Кабату CDR-H1, неожиданно дают нефункциональное антитело. Акцепторные каркасы человека 1U6A и 1QLR использовали для гуманизации SC104. CDR легкой цепи мышиного SC104 форматировали в каркасные области легких цепей 1U6A и 1QLR. Редко встречающийся остаток аланина в положении 15 в каркасной последовательности 1U6A удаляли, заменяя его пролином (А 15 Р) и получая последовательность SEQ ID NO: 7. Основанную на 1QLR гуманизированную легкую цепь SC104 форматировали, как описано выше, получая SEQ ID NO: 8. Соответствующие основанные на 1U6A тяжелые цепи SC104 форматировали, включая CDR-H1 согласно определению Кабата,SEQ ID NO: 9. Одновременно форматировали основанные на 1QLR тяжелые цепи SC104, включая CDRH1 согласно определению Кабата, SEQ ID NO: 10. Сочетания основанных на 1U6A легких и тяжелых цепей SEQ ID NO: 7 и SEQ ID NO: 9 коэкспрессировали в клетках СНО. Сочетания основанных на 1QLR легких и тяжелых цепей SEQ ID NO: 8 и SEQ ID NO: 10 также коэкспрессировали в клетках СНО. Полученные антитела очищали аффинной хроматографией на белке А и тестировали в отношении активности связывания живых клеток, используя проточную цитометрию. Неожиданно такие варианты гуманизированных антител, которые содержали CDR-H1 согласно определению Кабата, не могли связывать позитивные по антигену SC104 клетки (фиг. 2). Гуманизированные варианты SC104, содержащие CDR-H1 согласно определению AbM, неожиданно давали функциональное антитело. После неожиданной неудачи гуманизации с включением CDR-H1 согласно определению Кабата использовали номенклатуру CDR-H1 согласно определению AbM (табл. 1). Затем форматировали основанные на 1U6A и 1QLR тяжелые цепи SC104 так, чтобы они включали CDR-H1 согласно определениюAbM, SEQ ID NO: 11 и 12 соответственно. Сочетания основанных на 1U6A легких и тяжелых цепей SEQID NO: 7 и SEQ ID NO: 11 коэкспрессировали в клетках СНО. Сочетания основанных на 1QLR легких и тяжелых цепей SEQ ID NO: 8 и SEQ ID NO: 12 также коэкспрессировали в клетках СНО. Полученные антитела очищали аффинной хроматографией на белке А и тестировали в отношении активности связывания живых клеток, используя проточную цитометрию. Неожиданно такие гуманизированные варианты антитела, содержащие CDR-H1 согласно определению AbM, связывались с позитивными по антигенуSC104 клетками (фиг. 3). Повышение активности связывания гуманизированного SC104. На фиг. 3 показано, что гуманизированные антитела SC104 обладают субоптимальной связывающей активностью по сравнению с активностью, наблюдаемой в случае химерного SC104. Полученные данные свидетельствуют, что одна или несколько аминокислотных замен в каркасе важны для того, чтобы гуманизировать SC104 с небольшой потерей связывающей активности в результате этого. Чтобы решить указанную проблему, сравнивали полипептидные последовательности каркасов мышиного SC104 и 1U6A. Выделили различия в аминокислотах между каркасами и тщательно исследовали in silico, используя 3D-модели вариабельных областей мышиного SC104. Идентифицировали шесть аминокислот VH и три аминокислоты VL (включая замену А 15 Р, чтобы удалить редко встречающийся остаток аланина в данном положении, найденный в акцепторном каркасе 1U6A) для дальнейшего исследования in vitro,чтобы проверить их вклад в связывающую активность гуманизированных антител. Сходный анализ осуществляли, используя 1QLR-гуманизированное SC104, при этом было выделено четыре аминокислотыVH и две аминокислоты VL для тестирования in vitro. Все положения, выделенные для исследования invitro, в 1QLR-гуманизированном SC104 были идентичны положениям, уже идентифицированным в 1U6A-гуманизированном SC104. Затем попытки были сфокусированы на идентификации остатка (остатков), необходимых для повышения эффективности гуманизированного SC104, с использованием только акцептора 1U6A. Предполагаемая замена(ы), необходимая в гуманизированных каркасах VH, более важна для повышения активности связывания, чем замены, предполагаемые в гуманизированных VL. Гены, кодирующие варианты CDR-H1 согласно определениям AbM и Кабата основанных на 1U6A тяжелых цепей SC104, вновь синтезировали так, чтобы они содержали всего шесть замен аминокислотных остатков - Q46E, I48M, V67I, T68S, V71R, E72D (нумерация согласно Кабату). При этом получали последовательности SEQ ID NO: 13 (CDR-H1 AbM) и 15 (CBK-P1 по Кабату) соответственно. Две дополнительных аминокислотных замены - Q1E и S25T -, отмеченные как менее приоритетные, чем вышеупомянутые шесть замен, способами, описанными выше, также вводили в последовательность SEQ IDNO: 13, получая SEQ ID NO: 14, вариант CDR-H1 согласно определению AbM, содержащий всего восемь аминокислотных замен. Соответствующие последовательности тяжелых цепей с прививками согласноAbM и Кабату - SEQ ID NO: 11 и 9 соответственно использовали в качестве контролей, не содержащих замен. Основанную на 1U6A легкую цепь форматировали, включая три замены - I2N, А 15 Р, T69N (нумерация согласно Кабату), создавая последовательность SEQ ID NO: 16. Соответствующую последовательность легкой цепи SEQ ID NO: 7 использовали в качестве контроля с минимальными заменами. Сочетания тяжелых и легких цепей с заменами и без замен или с минимальными заменами коэкспрессировали и оценивали их активность в основанных на проточной цитометрии анализах связывания с клетками. В случае прививок, содержащих CDR-H1 согласно определению Кабата, оба гуманизированных варианта антитела SC104 SEQ ID NO: 7/SEQ ID NO: 15 и SEQ ID NO: 16/SEQ ID NO: 15 имели одну и ту же тяжелую цепь (SEQ ID NO: 15), содержащую вышеупомянутые шесть аминокислотных замен. Такие антитела проявляли сходную позитивную связывающую активность, независимо от спаривания либо с содержащими замены (SEQ ID NO: 16), либо с содержащими минимальные замены (SEQ ID NO:7) легкими цепями. Напротив, изменение тяжелой цепи на цепь, содержащую CDR-H1 согласно определению Кабата и не содержащую аминокислотных замен, такую как последовательность SEQ ID NO: 9, отменяло связывание независимо от того, использовали ли легкую цепь SEQ ID NO: 7 или SEQ ID NO: 16, фиг. 4 А. Подобным образом, легкие цепи, содержащие либо одну, либо все три замены (SEQ ID NO: 7 и 16 соответственно) заметно не влияли на эффективную связывающую активность гуманизированных вариантов(см., например, SEQ ID NO: 11 и 13, представляющие не содержащую замен и содержащую замены тяжелые цепи соответственно), фиг. 4 В. Сходную с показанной на фиг. 4 В тенденцию наблюдали, когда использовали переключение тяжелой цепи SEQ ID NO: 13 на тяжелую цепь SEQ ID NO: 14 и осуществляли идентичный основанный на проточной цитометрии анализ связывания с химерным SC104 (SEQ IDNO: 4/SEQ ID NO: 2), результаты не показаны. Полученные данные показали, что замены Q1E и S25T не являются ответственными за эффективную связывающую активность, проявляемую в последовательности SEQ ID NO: 13 и 14 тяжелой цепи по сравнению с их аналогом без замен, SEQ ID NO: 11. Далее замены Q1E и S25T больше не исследовали. Кроме того, полученные данные показывают важность одной или нескольких замен в тяжелой цепи 1U6A для создания гуманизированного варианта SC104 с повышенной активностью связывания. Замены в тяжелой цепи 1U6A-гуманизированного SC104 вводили в последовательность тяжелой цепи 1QLR с прививкой согласно определению Кабату (SEQ ID NO: 10) в положениях I48M, V67I, T68S и V71R, получая последовательность SEQ ID NO: 17. Подобным образом осуществляли замены в легкой цепи 1QLR-гуманизированного SC104, I2N и T69N, получая последовательность SEQ ID NO: 18. Активность антител, содержащих CDR-H1 согласно определению AbM (SEQ ID NO: 12), значимо не изменялась при экспрессии либо без содержащей замен (SEQ ID NO: 8), либо с содержащей замены (SEQ IDNO: 18) легкой цепью. Экспрессия варианта 1QLR-SC104 с CDR-H1 согласно определению Кабата, содержащей вышеупомянутые замены (SEQ ID NO: 17) с партнером 1QLR, не содержащим замены, SEQID NO: 8, давала гуманизированный вариант с низкой активностью связывания. Незначительная активность связывания, наблюдаемая в случае антитела, полученного при коэкспрессии последовательностиSEQ ID NO: 17 с содержащей полностью все замены легкой цепью SEQ ID NO: 18, свидетельствует, что замены в легкой цепи вредны для связывающей активности 1QLR-гуманизированного SC104. Данные о связывании таких вариантов антител наряду с данными, описанными ранее, суммированы в табл. 2. Присутствие R71 в каркасе VH важно для получения высоко активного гуманизированного SC104. Форматировали отдельные замены в каркасе вариабельной области тяжелой цепи 1U6A Q46E,I48M, V67I, T68S, V71R и E72D наряду с Q1E в последовательности SEQ ID NO: 11, получая последовательности SEQ ID NO: 19-24. Полученные тяжелые цепи коэкспрессировали с последовательностью SEQID NO: 7 легкой цепи, и полученные гуманизированные варианты SC104 сравнивали, используя основанные на проточной цитометрии анализы связывания. Гуманизированные варианты антитела SC104 с заменами Q46E, I48M, V67I, T68S и E72D проявляли сходную друг с другом активность связывания, но заметно более низкую активность по сравнению с химерным антителом SC104, фиг. 5. Напротив, гуманизированный вариант антитела SC104, несущий замену V71R (кодируемый последовательностью SEQID NO: 23), проявлял повышенную активность связывания, сходную с активностью химерного антителаSC104. Полученные данные показывают, что R71 в добавление к CDR-H1 согласно определению AbM важна для получения высокоэффективных гуманизированных форм SC104. Повторное форматированиеR71-содержащей тяжелой цепи так, чтобы она содержала замену E1Q, SEQ ID NO: 25, не изменяла высокие уровни активности связывания полученного антитела после коэкспрессии с легкой цепью SEQ IDR71 повышает активность связывания гуманизированных вариантов SC104, содержащих CDR-H1 как согласно определению AbM, так и согласно определению Кабата. Замену V71R, идентифицированную как необходимая для эффективной связывающей активностиSC104, гуманизированного с использованием акцептора 1U6A человека, вводили в основанные на 1QLR варианты SC104, содержащие CDR-H1 либо согласно определению AbM, либо согласно определению Кабата, которые подробно указаны в последовательностях SEQ ID NO: 26 и 27 соответственно. Для сравнения V71R также вводили в основанный на 1U6A вариант SC104, SEQ ID NO: 10, который содержит CDR-H1 согласно определению Кабата, с образованием последовательности SEQ ID NO: 28. Сочетания основанных на 1QLR легкой и тяжелой цепей SEQ ID NO: 8 и SEQ ID NO: 26 или SEQ ID NO: 27 коэкспрессировали в клетках СНО. Сочетание основанных на 1U6A легкой и тяжелой цепей SEQ ID NO: 7 и SEQ ID NO: 28 также коэкспрессировали в клетках СНО. Полученные антитела очищали аффинной хроматографией на белке А и тестировали в отношении активности связывания с живыми клетками, используя позитивную по антигену линию клеток С 170, с помощью проточной цитометрии. Замена V71R значимо повышает активность связывания с живыми клетками позитивной по антигену линии клеток С 170 основанного на 1QLR антитела SC104, содержащего CDR-H1 согласно определению AbM, и в меньшей степени соответствующего привитого антитела согласно определению Кабата, судя по измерению способом проточной цитометрии, фиг. 6 А. При сравнении показано, что замена V71R значимо повышает активность связывания с живыми клетками основанных на 1U6A вариантов SC104, содержащихCDR-H1 как согласно определению Кабата, так и согласно определению AbM, в случае позитивной по антигену линии клеток С 170, судя по измерению способом проточной цитометрии, фиг. 6B. Идентификация аминокислотных замен, которые повышают активность связывания гуманизированных вариантов SC104, в области, в которой отличаются CDR-H1 согласно определению AbM и определению Кабата CDR1 тяжелой цепи согласно определению AbM содержит пять дополнительных донор- 20024695 ных аминокислотных остатка на аминоконце CDR по сравнению с ее прививаемым аналогом согласно Кабату, табл. 1. Соответствующая повышенная эффективность вариантов SC104, содержащих CDR-H1 согласно определению AbM, по сравнению с их аналогами с прививками согласно Кабату, является неожиданной. В табл. 3 приведено сравнение таких пяти аминокислот из донорной (включенной в прививки CDR-H1 согласно AbM) и акцепторных последовательностей 1U6A и 1QLR. При сравнении донорной последовательности и последовательности 1U6A видно, что неконсервативное отличие G27Y наиболее вероятно ответственно за повышение эффективности гуманизированных вариантов, содержащих CDRH1 согласно определению AbM, по сравнению с химерой, так как T30S является консервативным изменением. Такую замену, G27Y, включали в вариант SC104 на основе 1QLR с прививкой согласно определению Кабата SEQ ID NO: 27 (+R) с получением последовательности SEQ ID NO: 29 (+R +Y). Такую тяжелую цепь вместе с основанной на 1QLR легкой цепью SEQ ID NO: 8 коэкспрессировали в клетках СНО и полученное антитело очищали как описано ранее. Для сравнения 1QLR-гуманизированное антитело, содержащее CDR-H1 согласно определению Кабата без R71 (SEQ ID NO: 10), и второй вариант,содержащий CDR-H1 согласно определению AbM с R71 (SEQ ID NO: 26), включали в сравнительный анализ активности связывания с живыми клетками позитивной по антигену клеточной линии C170 с использованием проточной цитометрии, фиг. 7. Неожиданно гуманизированный вариант антитела, полученный в результате сочетания легкой и тяжелой цепей SEQ ID NO: 8 и SEQ ID NO: 29, не обладал активностью связывания. Пример 3. Варианты SC104 с более низкой предполагаемой иммуногенностью. Проводили скрининг in silico аминокислотных последовательностей вариабельной области мышиного SC104 в отношении предполагаемых Т-клеточных эпитопов (Epibase, Algonomics, Belgium). Идентифицировали два предполагаемых пептида, связывающих молекулы главного комплекса гистосовместимости класса II (МНС класса II). Пептиды локализованы в тяжелой цепи на границах каркас (FR) 2:CDR-H2 и CDR-H2:FR3. Пептиды представляли особый интерес, поскольку расчеты показывают, что их удаление предполагает замену аминокислотных остатков CDR, которые могут изменять эффективность связывания антитела. Удаление предполагаемых пептидов, связывающих МНС класса II VH-области тяжелой цепи. Расчеты свидетельствуют, что эффективность пептида, связывающего МНС класса II, на границеFR2:CDR-H2 в мышиной VH-области может быть снижена заменой остатка фенилаланина в положении 4 последовательности CDR-H2 HIHFSGRPTYNPSLSS триптофаном (SEQ ID NO: 30), или тирозином (SEQID NO: 31), или предпочтительно пролином (SEQ ID NO: 32). Такие тяжелые цепи коэкспрессировали в клетках СНО с легкой цепью SEQ ID NO: 4 и полученные антитела очищали хроматографией на белке А,как описано ранее. Неожиданно сравнительные основанные на проточной цитометрии анализы связывания с использованием химерного SC104 показали, что замены F53W и F53Y оказывали очень незначительное влияние на высокую активность связывания, наблюдаемую в случае химерного SC104, тогда как замена F53P существенно снижала эффективность связывания полученного в результате антитела, фиг. 8. Дополнительные расчеты иммуногенности in silico (расчеты с использованием компьютерной программы ProPred, Singh, H. and Raghava, G.P.S.(2001) ProPred: Prediction of HLA-DR binding sites. Bioinformatics, 17(12), 1236-37.http://www.syfpeithi.de/Scripts/MHCServer.dll/EpitopePrediction .htm) свидетельствуют, что эффективность такого предполагаемого пептида, связывающего МНС класса II, снижается после прививкиCDR-H2 SC104 в акцепторный остов 1U6A или 1QLR человека. Рассчитано, что второй предполагаемый пептид, связывающий МНС класса II, присутствует на границе CDR-H2:FR3 как в последовательности мышиного, так и в последовательности гуманизированного антитела SC104. Варианты SC104 с более низкой предполагаемой иммуногенностью. На основе акцепторных каркасов были созданы основанные на 1U6A и 1QLR новые гуманизированные варианты SC104, из которых были удалены потенциальные последовательности, связывающие молекулы главного комплекса гистосовместимости класса II. Коротко, теоретически рассчитано, что гуманизированные вариабельные области легкой цепи имеют только толерантные (т.е. зародышевой линии) последовательности связывания МНС класса II, тогда как вариабельные области тяжелой цепи 1QLR и 1U6A, как было рассчитано, содержат одну и две сильно связывающие главный комплекс гистосовместимости класса II последовательности соответственно. Еще одна более слабо связывающая предполагаемая последовательность связывания МНС класса II также теоретически найдена непосредственно перед CDR-H1, определяемой способом Кабата. Разработана методика замены с целью удаления таких предполагаемых эпитопов, связывающих МНС класса II. Конструировали панель основанных на 1QLR вариантов вариабельной области тяжелой цепи SC104 с предполагаемой более низкой иммуногенностью, которые указаны в SEQ ID NO:33-SEQ ID NO: 38. Также конструировали панель основанных на 1U6A вариантов вариабельной области тяжелой цепиSC104 с предполагаемой более низкой иммуногенностью, которые подробно описаны в SEQ ID NO: 3950. Осуществляли коэкспрессию основанной на 1QLR легкой цепи SEQ ID NO: 8 с каждым из вариантовSEQ ID NO: 33-SEQ ID NO: 38 в клетках СНО и полученные антитела очищали, как подробно описано ранее. Подобным образом осуществляли коэкспрессию основанной на 1U6A легкой цепи SEQ ID NO: 7 с каждым из вариантов SEQ ID NO: 39-SEQ ID NO: 50 в клетках СНО и полученные в результате антитела очищали, как подробно описано ранее. Гуманизированные варианты антитела SC104 с более низкой предполагаемой иммуногенностью сравнивали в отношении активности связывания с клетками злокачественной опухоли ободочной кишки человека, которые экспрессируют антиген SC104 (C170, Colo205) с химерным SC104 в анализах связывания с живыми клетками на основе проточной цитометрии. В каждом случае наблюдали активность связывания, сравнимую с активностью химерного антитела. Связывание антитела SC104 также было специфичным для типа клеток, так как варианты SC104 с более низкой предполагаемой иммуногенностью не связывались с негативными по антигену SC104 клетками злокачественной опухоли ободочной кишки человека HCT116; примеры эффективного и специфичного связывания вариантов SC104 с более низкой предполагаемой иммуногенностью показаны на фиг. 9. Идентификация особенно важных остатков в вариабельной области тяжелой цепи, которые придают оптимальную активность связывания вариантам SC104 с более низкой предполагаемой иммуногенностью. Последовательность GY27SI29S, охватывающая положения аминокислот 26-30 в каркасной области непосредственно перед CDR-H1 согласно определению Кабата, придавала высокую активность связывания вариантам SC104 с более низкой предполагаемой иммуногенностью при введении в акцепторный каркас 1U6A или 1QLR (фиг. 9). Напротив, последовательность GY27SF29S неожиданно приводила к плохой связывающей активности при введении в конструкции, основанные на акцепторном каркасе 1QLR(фиг. 7), свидетельствуя о том, что Y27 является не единственным остатком, вовлеченным в обеспечение высокой активности связывания. Затем исследовали влияние разных аминокислотных остатков в положении 29 на связывающую активность, варьируя аминокислотный остаток, присутствующий в данном положении в 1U6A-гуманизированной тяжелой цепи SEQ ID NO: 50. Варианты тяжелой цепи коэкспрессировали в клетках СНО с легкой цепью SEQ ID NO: 7, очищали аффинной хроматографией на белке А и тестировали с использованием проточной цитометрии, как описано выше. Типичные результаты связывания показаны на фиг. 10, в то время как в табл. 4 суммированы данные об активности связывания в случае всех тестированных замен. Неожиданно обнаружено, что только остатки I (SEQ ID NO: 50), L(SEQ ID NO: 62) или V (SEQ ID NO: 70) в положении 29 обеспечивали оптимальную связывающую активность гуманизированных вариантов антитела SC104 с низкой предполагаемой иммуногенностью, тогда как большинство замен, включая I29F (SEQ ID NO: 58), приводило к плохой активности связывания с позитивными по антигену SC104 злокачественными клетками человека C170. Ранее было показано важное значение R71 в каркасе 3 вариабельной области тяжелой цепи для получения гуманизированного варианта, обладающего оптимально высокой связывающей активностью,фиг. 6. Чтобы дополнительно повысить связывающую активность основанных на 1U6A вариантов SC104 с более низкой предполагаемой иммуногенностью, заменяли остаток в положении 71, создавая панель вариантов тяжелой цепи. Затем такие варианты коэкспрессировали в клетках СНО с легкой цепью SEQID NO: 7, очищали аффинной хроматографией на белке А и тестировали с использованием проточной цитометрии, как описано ранее. Типичные результаты связывания показаны на фиг. 11. В табл. 5 суммированы активности связывания в случае всех тестированных замен. Неожиданно обнаружено, что только положительно заряженные остатки R и K (SEQ ID NO: 50 и 81 соответственно) в положении 71 придают гуманизированным вариантам антитела SC104 самую высокую активность связывания с позитивной по антигену SC104 линией клеток злокачественной опухоли ободочной кишки человека C170. Модификация мотива N-X-S в CDR-H2. Известно, что N-связанное гликозилирование вносит вклад в гетерогенность белковых продуктов и потенциально влияет на иммуногенность. Осуществляли анализ мышиных вариабельных областей в отношении потенциальных сайтов N-связанного гликозилирования (см., например, (Ye 2007) или компьютерный алгоритм прогнозирования NetNGlyc http://www.cbs/dtu/dk/services/NetNGlyc/, R. Gupta, E. Jungand S. Brunak). Используя указанный анализ, идентифицировали мотив N-X-S, NPS, в последовательности CDR-H2. Обычно мотив N-X-S является показателем присутствия предполагаемого сайта Nсвязанного гликозилирования, однако исключением из такого правила является случай, когда X означает остаток пролина, как в данном случае (см., например, Gavel and von Heijne 1990). Тем не менее, проводили анализ, чтобы посмотреть, допускает ли такой остаток N в CDR-H2 изменение в отношении сохранения связывающей активности. Последовательность NPS в химерной последовательности SC104 изменяли на DPS, получая последовательность SEQ ID NO: 51. Осуществляли коэкспрессию легкой цепи SEQ IDNO: 4 с тяжелой цепью SEQ ID NO: 51 в клетках СНО и последующую очистку полученного продукта(как описано ранее). Полученное антитело сравнивали в основанных на проточной цитометрии анализах связывания с позитивной по антигену SC104 линией клеток C170. Удаление мотива N-X-S заменой ND в CDR-H2 оказывала очень небольшое влияние на эффективность связывания полученного в результате антитела по сравнению с химерным SC104. Пример 4. Основанные на проточной цитометрии анализы прямой гибели. Жизнеспособные опухолевые клетки (2105, судя по исключению при окрашивании трипановым синим) анализировали, используя химерное SC104, гуманизированные варианты антитела SC104 или изотип IgG1 человека (Sigma-Aldrich), как описано в примере 1. Основанные на 1U6A гуманизированные варианты антитела SC104, состоящие из сочетаний легкой и тяжелой цепей SEQ ID NO: 7/SEQ IDNO: 25 и SEQ ID NO: 7/SEQ ID NO: 50, отбирали для дальнейших исследований дополнительно к основанным на 1QLR вариантам с сочетаниями SEQ ID NO: 8/SEQ ID NO: 26 и SEQ ID NO: 8/SEQ ID NO: 38. Новые гуманизированные варианты антитела SC104 с более низкой предполагаемой иммуногенностыо обладают высокой активностью, непосредственно вызывающей гибель клеток, направленной против клеток опухоли ободочной кишки человека. Гуманизированные варианты антитела SC104 с более низкой предполагаемой иммуногенностью проявляли высокую активность, непосредственно вызывающую гибель клеток злокачественной опухоли ободочной кишки человека без необходимости в иммунных эффекторных клетках. На фиг. 12 показан пример прямой гибели, вызванной такими гуманизированными вариантами антитела SC104, химерным антителом SC104 и контролем изотипа человека, в случае использования опухолевых клеток C170. Сходные результаты были получены при тестировании с использованием опухолевых клеток-мишенейColo205 (данные не показаны). Неожиданно показано, что полученные на основе 1U6A варианты антитела SC104 (SEQ ID NO: 7/SEQ ID NO: 25 и SEQ ID NO: 7/SEQ ID NO: 50) обладали более высокой активностью, непосредственно вызывающей гибель клеток, по сравнению с полученными на основе каркаса 1QLR вариантами антитела SC104 (SEQ ID NO: 8/SEQ ID NO: 28 и SEQ ID NO: 8/SEQ ID NO: 38). Такое различие в активности, непосредственно приводящей к гибели клеток, было неожиданным при наличии сходной связывающей активности таких вариантов антитела SC104 (фиг. 9). Пример 5. Анализ зависимой от антител опосредованной клетками цитотоксичности (ADCC). Эффекторные клетки (мононуклеарные клетки периферической крови) очищали из лейкоцитарной пленки, полученной от здоровых людей-доноров (Australian Red Cross Blood Services), используя Lymphoprep согласно протоколу производителя (Axis-Shield PoC AS). Жизнеспособные эффекторные клетки (5106/мл) инкубировали в течение ночи в RPMI 1640 (Gibco) плюс 10% FCS при 37 С и 10% СО 2. Опухолевые клетки-мишени и эффекторные клетки промывали в PBS, затем средой (RPMI1640 без фенолового красного, Gibco, плюс 0,5% FCS), ресуспендировали в среде и инкубировали с антителом в разных концентрациях (химерным SC104, гуманизированным SC104 или изотипом IgG1 человека, SigmaAldrich,I5154) в трех повторах в 96-луночных планшетах с U-образными лунками (Corning) в объеме для анализа 200 мкл, содержащем следующие конечные концентрации: клетки-мишени: 1105 клеток/мл; эффекторные клетки: 2,5106 клеток/мл; диапазон антител от 10 до 0,001 мкг/мл. В качестве контролей инкубировали только клетки-мишени в отсутствие (минимум мишени) или присутствии (максимум мишени) 1% тритона-Х (Sigma-Aldrich), и клетки-мишени и эффекторные клетки (фон) инкубировали в отсутствие антитела. Планшеты центрифугировали в течение 2 мин при 160g и инкубировали в увлажненной атмосфере, содержащей СО 2, при 37 С в течение 4 ч. Гибель клеток измеряли, используя анализ высвобождения лактатдегидрогеназы. Коротко, планшеты центрифугировали в течение 5 мин при 250g и 100 мкл надосадка клеток анализировали в отношении высвобождения лактатдегидрогеназы,используя набор для определения цитотоксичности (Roche) согласно инструкциям производителя. Чтобы минимизировать загрязнение примесью клеток, надосадок фильтровали, используя 96-луночный планшет с диаметром пор 0,2 мкм AcroPrep (Pall). Высвобождение LDH количественно оценивали, регистрируя оптическую плотность при 492 нм, и цитотоксичность в процентах вычисляли, используя следующую формулу: 100[образец - среднее (фон)]/среднее (максимум мишени - минимум мишени); значения ЕС 50 вычисляли, используя анализ нелинейной регрессии с помощью компьютерной программы GraphPad Prism. Анализ зависимой от комплемента цитотоксичности (CDC). Жизнеспособные опухолевые клетки-мишени инкубировали в среде (RPMI 1640 без фенолового красного, Gibco, плюс 5% FCS) с комплементом сыворотки человека (Sigma-Aldrich S1764) и различными концентрациями антитела (химерного SC104, гуманизированного SC104 или изотипа IgG1 человека, Sigma-Aldrich,I5154) в трех повторах в 96-лучноных планшетах с плоским дном (Corning) в объеме для анализа 150 мкл, содержащем следующие конечные концентрации: клетки-мишени: 13,3104 клеток/мл; комплемент: 15%; диапазон антител от 10 до 0,01 мкг/мл. Для контролей инкубировали только клетки-мишени в отсутствие (фон мишени) или присутствии (фон мишени и комплемента) комплемента и инкубировали только комплемент (фон комплемента) в среде. Планшеты центрифугировали в течение 2 мин при 160g и инкубировали в увлажненной атмосфере, содержащей СО 2, при 37 С в течение 2-3 ч. Гибель клеток измеряли, используя набор CellTiter 96 (Promega) согласно инструкциям производителя, включая дополнительный период инкубации 3-4 ч. Гибель клеток-мишеней количественно оценивали, регистрируя оптическую плотность при 492 нм, и цитотоксичность в процентах вычисляли, используя следующую формулу: 100[образец - среднее (фон мишени и комплемента)]/[среднее (фон комплемента) - среднее (фон мишени и комплемента)]; значения ЕС 50 вычисляли, используя анализ нелинейной регрессии с помощью компьютерной программы GraphPad Prism. Новые гуманизированные варианты антитела SC104 с более низкой предполагаемой иммуногенностыо обладают высокой цитотоксичностыо против клеток опухоли ободочной кишки человека. Цитотоксичность гуманизированных вариантов SC104 с более низкой предполагаемой иммуногенностью, направленную против клеток опухоли ободочной кишки человека, тестировали в анализе зависимой от антител опосредованной клетками цитотоксичности и в анализе зависимой от комплемента цитотоксичности. Гуманизированные варианты антитела SC104 и химерное антитело SC104, но не контрольный изотип человека, обладали высокой зависимой от антител опосредованной клетками цитотоксической активностью против опухолевых клеток C170 в случае использования мононуклеарных клеток периферической крови здоровых доноров (фиг. 13). Сходные результаты получали, используя мононуклеарные клетки периферической крови от других людей-доноров (данные не показаны). На фиг. 14 показано, что такая же панель гуманизированных вариантов антитела SC104 и химерное антитело SC104, но не контрольный изотип человека, обладали высокой зависимой от комплемента цитотоксической активностью против опухолевых клеток Colo205 в случае использования комплемента человека. Кроме того,все другие гуманизированные варианты антитела SC104 с более низкой предполагаемой иммуногенностью обладали высокой зависимой от антитела опосредованной клетками цитотоксичностью и зависимой от комплемента цитотоксической активностью против опухолевых клеток Colo205 (данные не показаны). В соответствии с данными о разной активности, вызывающей прямую гибель клеток, полученные на основе 1U6A варианты антитела SC104 проявляли более высокую зависимую от антител опосредованную клетками цитотоксичность и зависимую от комплемента цитотоксическую активность по сравнению с полученными на основе 1QLR вариантами антитела SC104. Такая иерархия в опосредованной иммунитетом цитотоксической активности была неожиданной с учетом сходной связывающей активности разных вариантов антитела SC104 (табл. 6). Пример 6. Протокол иммуногистохимии. Микроматрицу множества опухолевых тканей человека, содержащую образцы каждого типа опухоли от 10-12 разных доноров, подвергали скринингу в отношении связывания с биотинилированными гуманизированными вариантами антитела SC104, используя иммуногистохимию. Биотинилированный изотип IgG1 человека использовали для негативного контрольного окрашивания. Участки микроматрицы тканей подвергали обработке серией разных методик демаскировки антигена, включая модификацию температуры, давления и рН. Кроме того, осуществляли серию разведений первого антитела, чтобы получить наилучшее возможное отношение сигнала к шуму. Иммунореактивность антитела оценивали с помощью визуального наблюдения по четырехступенчатой шкале на основе интенсивности окрашивания и процентного содержания позитивных клеток. Гуманизированный вариант антитела SC104 связывается с различными типами злокачественных опухолей человека. Несколько разных типов злокачественных опухолей от разных пациентов анализировали в отношении связывания с гуманизированным антителом SC104, обладающим более низкой предполагаемой иммуногенностью (SEQ ID NO: 7/SEQ ID NO: 50). Гуманизированное антитело SC104, но не контрольный изотип человека, связывалось с тканями злокачественных опухолей ободочной кишки человека, проявляя специфичность в используемых условиях связывания (данные не показаны). В табл. 7 суммированы данные, показывающие, что позитивное окрашивание мембран обнаружено в злокачественной опухоли ободочной кишки (75%). Неожиданно обнаружено позитивное окрашивание в злокачественной опухоли поджелудочной железы (70%) и в более низкой степени в злокачественных опухолях яичника (25%) и злокачественных опухолях легкого (16,7%). Напротив, не обнаружено окрашивания в злокачественных опухолях почек в анализируемом образце ограниченного размера. Полученные результаты показывают,что гуманизированное антитело SC104 с низкой предполагаемой иммуногенностью применимо для диагностики опухолей в случае признаков злокачественных новообразований прямой и ободочной кишки,поджелудочной железы, яичника и легкого. Кроме того, можно предполагать, что гуманизированное антитело SC104 с низкой предполагаемой иммуногенностью применимо для терапевтического лечения злокачественной опухоли прямой и ободочной кишки, поджелудочной железы, яичника и легкого у человека. Такую противоопухолевую эффективность можно оценить in vivo в моделях ксенотрансплантатов опухолей у мышей. Пример 7. Усиление эффекторной функции антител SC104. Эффекторная функция антител может быть усилена благодаря повышению зависимой от антител опосредованной клетками цитотоксичности или зависимой от комплемента цитотоксичности или сочетания зависимой от антител опосредованной клетками цитотоксичности и зависимой от комплемента цитотоксичности. Усиление ADCC. Конструировали варианты антитела SC104 и химерное SC104 для получения повышенной зависимой от антител опосредованной клетками цитотоксической (ADCC) активности, используя стандартные модификации Fc-области антитела. Стандартные способы включают, например, белковую инженерию или гликоинженерию Fc-области антитела. В качестве примера белковой инженерии создавали мутации в последовательностях константных областей тяжелой цепи, как описано Lazar с соавторами, 2006 (Lazar, Dang et al. 2006). В частности, мутации S122D, S181A, I215E вводили в Fc-последовательность SEQ ID NO: 52 с образованием последовательности SEQ ID NO: 53. Несколько гуманизированных антител наряду с химерным антителом, обладающим усиленной Fc-областью SEQ ID NO: 52, тестировали в анализах ADCC после их экспрессии в клетках СНО и очистки хроматографией на белке А, как описано в примере 2. Функцию ADCC измеряли, как описано в примере 5. В качестве примера гликоинженерии клетки СНО, продуцирующие гуманизированные варианты антитела SC104 или химерное антитело SC104, инкубировали в течение 8-10 дней с кифунензином (0,25 мкг/мл) согласно способу Zhou с соавторами (Zhou, Shankara et al. 2008). Затем антитело очищали, как описано в примере 2, и функцию ADCC измеряли, как описано в примере 5. В другом примере гликоинженерии использован способ Potelligent, который описан Shinkawa Т. с соавторами, 2003 (J. Biol. Chem. 278: 3466-73). Вариабельные области легких и тяжелых цепей гуманизированных вариантов антитела экспрессировали в виде IgG1 в стандартном остове константной области. Последовательность константной области тяжелой цепи представляла собой последовательность изGenBank P01857.1 и последовательность константной области легкой цепи представляла собой последовательность из NCBI с номером доступа Р 01834. Функцию ADCC измеряли, как описано в примере 5. Варианты антитела SC104 с повышенной эффекторной функцией и химерное антитело SC104 обладают повышенной зависимой от антител опосредованной клетками цитотоксичностыо. В серии экспериментов применяли белковую инженерию или гликоинженерию для увеличения зависимой от антител опосредованной клетками цитотоксичности химерного антитела SC104 и вариантов антитела SC104 с низкой предполагаемой иммуногенностью. По сравнению с немодифицированными антителами, Fc-сконструированные (SEQ ID NO: 53) или обработанные кифунензином гуманизированные варианты антитела SC104 и химерное антитело SC104 проявляли повышенную зависимую от антител опосредованную клетками цитотоксичность против опухолевых клеток Colo205. На фиг. 15 показан пример заметно повышенной гибели злокачественных клеток ободочной кишки человека WiDr (ATCC,номер доступа CCL-218), вызываемой обработанным кифунензином гуманизированным антителомSC104 с более низкой предполагаемой иммуногенностью (SEQ ID NO: 7/SEQ ID NO: 50). На фиг. 16 показан пример заметно повышенной гибели злокачественных клеток ободочной кишки человека Colo201SC104 с более низкой предполагаемой иммуногенностью (SEQ ID NO: 7/SEQ ID NO: 94, последовательность константной области тяжелой цепи и последовательность константной области легкой цепи представляли собой последовательности GenBank P01857.1 и NCBI с номером доступа Р 01834 соответственно). Пример 8. Мышиная модель профилактики опухолевого ксенотрансплантата НТ 29. Самкам мышей BALB/c nude подкожно инокулировали 2106 клеток HT29 злокачественной опухоли ободочной кишки человека (АТСС, номер доступа НТВ-38). В тот же день, когда инокулировали опухолевые клетки (0 день), мышей рандомизированно распределяли на основе массы тела на две группы обработки (n=10 на группу). Каждую группу обрабатывали внутрибрюшинно либо контрольным наполнителем (PBS, 10 мл/кг), либо гуманизированным антителом SC104 (10 мг/кг). Контрольный наполнитель и гуманизированное антитело SC104 вводили дважды в неделю в течение четырех недель. Объем опухолей определяли три раза в неделю, используя следующую формулу: объем (мм 3) = длинадиаметр 2/6. В ходе исследования некоторых мышей приходилось отбраковывать вследствие чрезмерной потери массы тела, что привело к меньшему количеству мышей в группах обработки контрольным наполнителем (n=6) и антителом (n=9). После окончания исследования (27 день) и вскрытия опухоли вырезали из всех мышей, очищали от кожи и взвешивали. Мышиная модель терапии опухолевого ксенотрансплантата Colo201. Самкам бестимусных мышей nude подкожно инокулировали 5106 клеток злокачественной опухоли ободочной кишки человека Со 1 о 201 (АТСС, номер доступа CCL-224). После достижения определенного размера опухолей 110 мм 3 (0 день), мышей рандомизированно распределяли на две группы обработки(n=10 на группу). Каждую группу обрабатывали внутрибрюшинно либо контрольным наполнителем(PBS, 10 мл/кг) либо гуманизированным сконструированным способом Potelligent (как описано в примере 7) антителом SC104 (10 мг/кг). Контрольный наполнитель и гуманизированное сконструированное способом Potelligent антитело SC104 вводили дважды в неделю в течение 38 дней. Объем опухоли определяли два раза в неделю, используя следующую формулу: объем (мм 3)=1/2(a2b),где а означает наименьший диаметр, и b означает наибольший диаметр. Высокая противоопухолевая эффективность гуманизированного антитела SC104 с более низкой предполагаемой иммуногенностыо in vivo. Лечение мышей, несущих опухоли, гуманизированным антителом SC104 с более низкой предполагаемой иммуногенностью (SEQ ID NO: 7/SEQ ID NO: 50) приводило к значимо меньшим объему опухолей и массе опухолей по сравнению с обработкой контрольным наполнителем в модели профилактики опухолей HT29 (фиг. 17). Кроме того, в модели терапевтического лечения Colo201 гуманизированноеPotelligent-сконструированное антитело SC104 с более низкой предполагаемой иммуногенностью (SEQID NO: 7/SEQ ID NO: 94) проявляло значимую противоопухолевую активность (фиг. 18). Можно предполагать, что гуманизированные варианты антитела SC104 с низкой предполагаемой иммуногенностью применимы для лечения рака прямой и ободочной кишки у людей либо в виде монотерапии, либо в сочетании с другими терапевтическими противоопухолевыми средствами, например химиотерапевтическими средствами, малыми молекулами или биологическими препаратами. Таблица 1 Таблица 2 Несколько исходных вариантов гуманизированного антитела SC104 сохраняли активность связывания с позитивной по антигену SC104 линией клеток злокачественной опухоли ободочной кишки человека С 170 выраженную в виде связывания в процентах по сравнению со связыванием химерного SC104; при тестировании в других экспериментах получали сходные данные. Таблица 3 Сравнение последовательностей каркасной области непосредственно перед CDR-H1 согласно определению Кабата Таблица 4 Остатки I, L и V в положении 29 в сочетании с остатком Y в положении 27 в 1U6 А-каркасе 1 вариабельной области тяжелой цепи придают гуманизированным вариантам антитела SC104 с более низкой предполагаемой иммуногенностью наиболее высокую активность связывания с позитивной по антигенуSC104 линией клеток злокачественной опухоли ободочной кишки человека С 170. Выражено в виде средней активности в процентах по сравнению с химерным SC104, вычисленной на основе 2 экспериментов. Таблица 5 Положительно заряженные остатки R и K в положении 71 в 1U6A-каркасе 3 вариабельной области тяжелой цепи придают гуманизированным вариантам антитела SC104 с более низкой предполагаемой иммуногенностью наивысшую активность связывания с позитивной по антигену SC104 линией клеток злокачественной опухоли ободочной кишки человека С 170. Выражено в виде средней активности в процентах по сравнению с химерным SC104, вычисленной на основе 2-3 экспериментов.
МПК / Метки
МПК: A61K 39/395, A61P 35/00, C07K 16/30
Метки: противоопухолевой, гуманизированные, антитела, активностью
Код ссылки
<a href="https://eas.patents.su/30-24695-gumanizirovannye-antitela-s-protivoopuholevojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Гуманизированные антитела с противоопухолевой активностью</a>
Предыдущий патент: Способ получения самогерметизирующейся композиции
Следующий патент: Способ обработки волос
Случайный патент: Система подводной выработки электроэнергии












