Гуманизированные антитела, специфичные в отношении nogo-a, и их фармацевтические применения
Номер патента: 14291
Опубликовано: 29.10.2010
Авторы: Эллис Джонатан Генри, Принджха Рабиндер, Макадам Рут, Хэмблин Пол Эндрю, Льюис Алан Питер, Хуссэйн Фархана, Уилсон Пол
Формула / Реферат
1. Моноклональное антитело, его функциональный фрагмент или аналог, которые связываются с человеческим белком NOGO-A и нейтрализуют его активность, содержащие вариабельную область тяжелой цепи (VH-область) с аминокислотной последовательностью SEQ ID NO: 77, дополнительно содержащей аминокислотную замену в одном или более положениях, выбранных из группы, включающей 12, 20, 38, 40, 48, 67, 68, 70, 72, 74, 76, 79 и 91; где каждый замененный аминокислотный остаток заменен аминокислотным остатком в эквивалентном положении в SEQ ID NO: 7; причем замены сделаны в соответствии с табл. 3 описания.
2. Моноклональное антитело по п.1, содержащее замену в положении 79.
3. Моноклональное антитело по п.2, содержащее замену в положениях 48 и 68.
4. Моноклональное антитело по п.2 или 3, дополнительно содержащее замену в положениях 40 и/или 67.
5. Моноклональное антитело по п.4, дополнительно содержащее замену в положениях 38, и/или 72, и/или 70.
6. Моноклональное антитело по п.5, дополнительно содержащее замены в одном или более чем одном из положений 12, 20, 74, 76 или 91.
7. Моноклональное антитело по любому из пп.1-6, VH-область которого имеет последовательность SEQ ID NO: 11-18, 29-33 и 85-91.
8. Моноклональное антитело по п.7, VH-область которого имеет последовательность SEQ ID NO: 11, 12, 16, 18, 85, 86, 87 или 91.
9. Моноклональное антитело, его функциональный фрагмент или аналог по любому из пп.1-8, дополнительно содержащее вариабельную область легкой цепи (VL-область) с аминокислотной последовательностью SEQ ID NO: 20, где указанная аминокислотная последовательность SEQ ID NO: 20 может дополнительно содержать аминокислотную замену в одном или более положениях, выбранных из группы, включающей 4, 7, 11, 19, 42, 64 и 70; где каждый замененный аминокислотный остаток заменен аминокислотным остатком в эквивалентном положении в SEQ ID NO: 8; причем замены сделаны в соответствии с табл. 5 описания.
10. Моноклональное антитело по п.9, содержащее замену в положениях 11 и 19.
11. Моноклональное антитело по п.9, содержащее замену в положении 4.
12. Моноклональное антитело по п.10, дополнительно содержащее замену в положении 42.
13. Моноклональное антитело по п.10 или 12, дополнительно содержащее замену в положениях 7, 64 или 70.
14. Моноклональное антитело по п.9, VL-область которого имеет последовательность SEQ ID NO: 20.
15. Моноклональное антитело по п. 9, VL-область которого имеет последовательность SEQ ID NO: 23 и 25.
16. Моноклональное антитело, которое связывается с человеческим белком NOGO-A и нейтрализует его активность, содержащее VH- и VL-области, выбранные из следующего перечня:

![]()
или его функциональный фрагмент или аналог, который связывается с человеческим белком NOGO-A и нейтрализует его активность.
17. Моноклональное антитело по п.16, полученное в результате экспрессии одной из следующих полноразмерных цепей антитела в клетке млекопитающего:
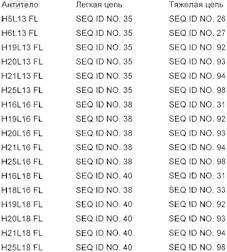
18. Фармацевтическая композиция, содержащая антитело против NOGO или его функциональный фрагмент по любому из пп.1-17 вместе с фармацевтически приемлемым разбавителем или носителем.
19. Способ лечения или профилактики инсульта и других неврологических заболеваний/расстройств у человека, включающий введение человеку, нуждающемуся в этом, эффективного количества антитела против NOGO-A, его функционального фрагмента или аналога по любому из пп.1-17.
20. Применение антитела против NOGO-A, его функционального фрагмента или аналога по любому из пп.1-17 в изготовлении лекарственного средства для лечения или профилактики инсульта и других неврологических заболеваний/расстройств.
21. Способ ингибирования нейродегенерации и/или стимулирования функционального восстановления у пациента-человека, страдающего инсультом или другим неврологическим заболеванием/расстройством или имеющего риск его развития, включающий введение указанному человеку, нуждающемуся в этом, эффективного количества антитела против NOGO-A, его функционального фрагмента или аналога по любому из пп.1-17.
22. Применение антитела против NOGO-A, его функционального фрагмента или аналога по любому из пп.1-17 в изготовлении лекарственного средства для ингибирования нейродегенерации и/или стимулирования функционального восстановления у пациента-человека, пораженного инсультом и другим неврологическим заболеванием/расстройством или имеющего риск его развития.
23. Способ лечения или профилактики инсульта или другого неврологического заболевания/расстройства у человека, включающий стадию парентерального введения указанному человеку терапевтически эффективного количества антитела против NOGO по любому из пп.1-17.
24. Способ по п.23, где антитело против NOGO вводят внутривенно.
25. Способ по любому из пп.19-23, где другое неврологическое заболевание/расстройство выбрано из группы, состоящей из травматического повреждения головного мозга, повреждения спинного мозга, болезни Альцгеймера, лобно-височных деменций (тауопатий), периферической невропатии, болезни Паркинсона, болезни Хантингтона и рассеянного склероза.
26. Способ стимулирования разрастания человеческих аксонов, включающий обеспечение контактирования человеческих аксонов с антителом против NOGO по пп.1-17.
27. Способ по п.26, который осуществляют in vitro.
28. Способ получения антитела против NOGO по любому из пп.1-17, включающий стадии:
(а) получения первого вектора, кодирующего тяжелую цепь антитела;
(б) получения второго вектора, кодирующего легкую цепь антитела;
(в) котрансфекции клетки-хозяина млекопитающего указанными первым и вторым векторами;
(г) культивирования клетки-хозяина, полученной на стадии (в), в культуральной среде (предпочтительно без сыворотки) в условиях, делающих возможной секрецию антитела из указанной клетки-хозяина в указанную культуральную среду;
(д) выделения секретированного антитела из культуральной среды.
29. Способ по п.28, где клетка-хозяин выбрана из группы, состоящей из NS0 Sp2/o, CHO, COS, фибробластной клетки, такой как 3T3, и предпочтительно представляет собой СНО.
Текст
Изобретение относится к антителам против NOGO, к фармацевтическим препаратам, содержащим их, и к применению таких антител в лечении и/или профилактике неврологических заболеваний/расстройств.(71)(73) Заявитель и патентовладелец: ГЛАКСО ГРУП ЛИМИТЕД (GB) 014291 Область изобретения Настоящее изобретение относится к иммуноглобулинам, в частности к антителам, которые связываются с NOGO и нейтрализуют его активность, к полинуклеотидам, кодирующим такие антитела, к фармацевтическим препаратам, содержащим указанные антитела, и к применению таких антител в лечении и/или профилактике неврологических заболеваний. Предшествующий уровень техники Инсульт представляет собой одну из основных причин смертности и инвалидности в западном мире. Кроме тканевого плазминогена (t-PA), который необходимо вводить в пределах 3 ч от начала компьютерного томографического (СТ) сканирования для исключения геморрагии, нет какой-либо другой одобренной к применению терапии для лечения инсульта. На настоящий момент большинство терапевтических агентов, предназначенных для лечения острого инсульта (то есть для нейрозащиты), главным образом, нацелено на рецепторы глутамата и их последующие сигнальные пути, которые вовлечены в острую гибель клеток. Однако на настоящий момент было показано, что эти стратегии не были успешными в клинических испытаниях и часто связаны с ограничивающими дозу побочными эффектами (HillHachinski, The Lancet, 352: (suppl III) 10-14 (1998. Поэтому имеется необходимость в новых подходах,направленных на ослабление клеточной гибели после прекращения тока крови. Нейрозащита представляет собой способность лечебного средства предотвращать или ослаблять потерю нейрональных клеток в ответ на процесс кровоизлияния или заболевания. Этого можно достичь путем нацеливания на нейроны непосредственно или опосредованно, предотвращая потерю глиальных клеток (в том числе олигодендроцитов). После начала инсульта у многих пациентов наблюдали некоторую степень спонтанного функционального восстановления, подтверждая, что мозг имеет способность (хотя и ограниченную) к репарации и/или перестройке после повреждения. Поэтому агенты, которые способны усиливать это восстановление, могут обеспечить вмешательство гораздо позже (потенциально через несколько дней) после начала церебральной ишемии. Агенты, которые способны обеспечивать немедленную нейрозащиту и усиливать функциональное восстановление, могут предоставить значительные преимущества перед имеющимися в настоящее время потенциальными нейрозащитными стратегиями. Механизмы, лежащие в основе функционального восстановления, в настоящее время неизвестны. Разрастание поврежденных или неповрежденных аксонов было предложено в качестве одного из возможных механизмов. Однако, хотя исследования in vivo показали, что лечение повреждения спинного мозга или инсульта нейротрофическими факторами приводит к усилению функционального восстановления и степени разрастания аксонов, это не является доказательством прямой взаимосвязи между степенью разрастания аксонов и степенью функционального восстановления (Jakeman, et al. 1998, Exp. Neurol. 154: 170-184, Kawamata et al. 1997, Proc Natl Acad. Sci. USA., 94:8179-8184, Ribotta, et al. 2000, J Neurosci. 20: 5144-5152). Более того, для разрастания аксонов требуются жизнеспособные нейроны. При таких заболеваниях, как инсульт, который ассоциирован с обширной гибелью клеток, усиление функционального восстановления, вызываемое данным агентом после инсульта, может таким образом происходить через механизмы, отличные от разрастания аксонов, такие как дифференцировка эндогенных стволовых клеток, активация избыточных путей, изменения в распределении рецепторов или возбудимости нейронов или глии (FawcettAsher, 1999, Brain Res. Bulletin, 49: 377-391, HornerGage, 2000, Nature 407 963970). Причиной ограниченной способности центральной нервной системы (ЦНС) к восстановлению после повреждения могут быть молекулы в пределах окружения ЦНС, которые оказывают ингибиторное действие на разрастание аксонов (отрастание нейритов), такие как миелиновый белок NOGO (Sato S. etMukhopadhyay G. et al. (1994) Neuron 13, 757-767; Torigoe K. and Lundborg G. (1997) Exp. Neurology 150,254-262; Schaferetal (1996) Neuron 16, 1107-1113; WO 9522344; WO 9701352; Prinjha R et al (2000) Nature 403, 383-384; Chen MS et al (2000) Nature 403, 434-439; GrandPre T. et al (2000) Nature 403, 439-444; US 005250414A; WO 200005364A1; WO 0031235). Были идентифицированы три формы человеческого NOGO: NOGO-A, имеющий 1192 аминокислотных остатка ( доступа в GenBank AJ251383), NOGO-B, сплайсированный вариант, который не имеет остатков от 186 до 1004 в предполагаемом внеклеточном домене ( доступа в GenBank AJ251384), и укороченный сплайсированный вариант NOGO-C, который тоже не имеет остатков от 186 до 1004, а также имеет меньший альтернативный аминоконцевой домен ( доступа в GenBank AJ251385) (Prinjhaet al. (2000) выше). Ингибирование ингибиторных белков ЦНС, таких как NOGO, может предоставить терапевтические средства для ослабления нейронального повреждения и стимулирования нейронального восстановления и роста, тем самым потенциально помогая восстановлению от нейронального повреждения, такого как повреждение, поддерживаемое при инсульте. Примеры таких ингибиторов NOGO могут включать в себя малые молекулы, пептиды и антитела. Антитела в типичных случаях содержат две тяжелые цепи, связанные вместе дисульфидными связями, и две легкие цепи. Каждый легкая цепь связана с соответствующей тяжелой цепью дисульфидными-1 014291 связями. Каждая тяжелая цепь имеет на одном конце вариабельный домен с последующим множеством константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце и константный домен на другом ее конце. Вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи. Константные домены в легких и тяжелых цепях не вовлечены непосредственно в связывание антитела с антигеном. Вариабельные домены каждой пары легких и тяжелых цепей формируют сайт связывания антигена. Вариабельные домены на легких и тяжелых цепях имеют одну и ту же общую структуру, и каждый домен содержит четыре каркасные области, последовательности которых являются относительно консервативными, связанные тремя определяющими комплементарность участками (CDR), часто называемыми гипервариабельными областями. Четыре каркасные области по большей части принимают конформацию бета-слоя, а CDR образуют петли, соединяющие и, в некоторых случаях, образующие часть этой структуры бета-слоя. CDR удерживаются в тесной близости посредством каркасных областей и, вместе с CDR из другого домена, участвуют в образовании сайта связывания антигена. CDR и каркасные области антител можно определять по Kabat et al. ("Sequences of proteins of immunological interest" US Dept. of Healthand Human Services, US Government Printing Office, 1987). Сообщали, что мышиное моноклональное антитело IN-1, которое было индуцировано против NI220/250, миелинового белка, который является сильнодействующим ингибитором роста нейритов (и затем было показано, что он является фрагментом NOGO-A), способствует регенерации аксонов (Caroni, Р.and Schwab, ME (1988) Neuron 1 85-96; Schnell, L. and Schwab, M.E. (1990) Nature 343 269-272; Bregman,BS et al. (1995) Nature 378 498-501 и Thallmair, M. et al. (1998) Nature Neuroscience 1 124-131). Также сообщали, что NOGO-A представляет собой мишень для IN-1 (Chen et al. (2000) Nature 403 434-439). Введение Fab-фрагмента IN-1 или гуманизированного IN-1 крысам, которые были подвергнуты рассечению спинного мозга, усиливает восстановление (Fiedler, M. et al. (2002) Protein Eng 15 931-941; Brosamle, С. etal. (2000) J. Neuroscience 20 8061-8068). Моноклональные антитела, которые связываются с NOGO, описаны в WO 04/052932 и WO 2005028508. В WO 04/052932 раскрыто мышиное антитело 11 С 7, которое связывается с некоторыми формами человеческого NOGO с высокой аффинностью. Желательно выделить и разработать дополнительные терапевтически полезные моноклональные антитела, которые связываются с человеческим NOGO и ингибируют его активность. Процесс нейродегенерации лежит в основе многих неврологических заболеваний/расстройств, в том числе, без ограничения ими, острых заболеваний, таких как инсульт (ишемический или геморрагический), травматическое повреждение головного мозга и повреждение спинного мозга, а также хронических заболеваний, в том числе болезни Альцгеймера, лобно-височных деменций (тауопатий), периферической невропатии, болезни Паркинсона, болезни Крейтцфельда-Якоба (CJD), шизофрении, бокового амиотрофического склероза(ALS), рассеянного склероза, болезни Хантингтона, рассеянного склероза и миозита с включенными тельцами. Следовательно, моноклональное антитело против NOGO может быть полезным в лечении этих заболеваний/расстройств. Такие антитела для лечения вышеуказанных заболеваний/расстройств предложены настоящим изобретением и подробно описаны ниже. В WO 2005/061544 раскрыты высокоаффинные моноклональные антитела, в том числе мышиное моноклональное антитело 2 А 10 и его гуманизированный вариант H1L11. Краткое изложение сущности изобретения В настоящем изобретении предложен ряд моноклональных антител, которые связываются с человеческим NOGO. В настоящей заявке даны ссылки на ряд номеров идентификации последовательностей(SEQ ID), которые суммированы в табл. 12, причем действительные последовательности приведены вслед за этой таблицей до конца этого документа. Мышиное антитело 2 А 10 связывается с человеческим NOGO с высокой аффинностью и связывается с формой NOGO, которая экспрессируется человеческими клеточными линиями, с высокой аффинностью. 2 А 10 было успешно гуманизировано ранее (H1L11, которое содержит вариабельную область Н 1 тяжелой цепи (SEQ ID NO. 77) и вариабельную область L11 легкой цепи (SEQ ID NO. 78. В настоящем изобретении предложены дополнительные гуманизированные моноклональные антитела, которые сохраняют большую часть аффинности или имеют аффинность, эквивалентную аффинности донорного антитела (2 А 10) к человеческому NOGO. В частности, антитела по настоящему изобретению имеют высокую степень связывания с человеческим NOGO как в рекомбинантной форме, экспрессируемой бактериальными клетками (такими как E.coli), так и в форме, которая экспрессируется линией клеток нейробластомы человека (например, линией клеток нейробластомы человека IMR32). С целью предоставления гуманизированных вариантов 2 А 10 авторы настоящего изобретения идентифицировали ряд ключевых аминокислотных остатков в каркасных последовательностях вариабельных областей 2 А 10, которые считаются важными в оптимальном сохранении аффинности связывания с человеческим NOGO. Вариабельная область (VH) тяжелой цепи 2 А 10 представлена в SEQ ID NO. 7; вариабельная область легкой цепи 2 А 10 (VL) представлена в SEQ ID NO. 8. Химерные тяжелые и легкие цепи,содержащие мышиные вариабельные области и человеческие константные области, представлены в SEQID NO. 9 и 10, соответственно (комбинация двух химерных цепей обозначена как HcLc). Специалист должен понимать, что SEQ ID NO. 9 и 10 представляют собой тяжелую цепь или легкие цепи до какоголибо процессинга (например, процессинга, опосредованного клеткой-хозяином) для удаления сигнальной последовательности. В типичных случаях процессированные формы цепей антитела начинаются в положении 20 (после удаления сигнальной последовательности) для SEQ ID NO. 9 и начинаются в положении 21 для SEQ ID NO. 10. В контексте настоящего изобретения все полноразмерные последовательности тяжелой и легкой цепи имеют включенную в них сигнальную последовательность (которая для всех других полноразмерных последовательностей, которые не представляют собой SEQ ID NO. 9 и 10,соответствует SEQ ID NO. 75). Специалисту должно быть понятно, что антитело, продуцируемое клеточной линией, которая трансфицирована геном, кодирующим любую из этих полноразмерных тяжелых и легких цепей, не должно содержать эту сигнальную последовательность. Табл. 1. CDR тяжелой цепи 2 А 10 представляют собой:immunological interest"; Fifth Edition; US Department of Health and Human Services; NIH publication No 913242). CDR предпочтительно являются такими, как определено по Kabat, но следуя принципам структуры и конформации белков, как определено Chothia и Lesk (Chothia et al., (1989) "Conformations of immunoglobulin hypervariable regions"; Nature 342, p. 877-883), надо понимать, что дополнительные остатки также можно считать частью участка связывания антигена, и они, таким образом, охватываются настоящим изобретением.VH- и VL-домены Н 1 и L11 были ранее описаны в WO 2005/061544 и представляют собой результат того, что CDR, упомянутые в табл. 1 и 2, были трансплантированы в человеческие вариабельные области с высокой гомологией с донорным антителом 2 А 10, причем каждый трансплантированный конструкт дополнительно содержит обратные мутации в положениях 93 и 94 по Kabat (для Н 1 VH) или 4, 45 и 46 (для L11 VL). Антитело 2 А 10 способно к связыванию с человеческим NOGO, а также связывается с NOGO мартышек и крыс, и, как полагают, новые гуманизированные антитела по настоящему изобретению будут сохранять это свойство. Например, моноклональное антитело, содержащее вариабельные области Н 20 иL16 (см. ниже подробно), связываются с NOGO мартышек, а также NOGO крыс, а также яванских макак и беличьей обезьяны. Последовательность фрагмента NOGO-A мартышек представлена в SEQ ID NO. 113. В настоящем изобретении предложены антитела, содержащие CDR из табл. 1 и 2. Также настоящее изобретение охватывает антитела, содержащие аналоги этих CDR. Вариабельная область тяжелой цепи (VH) По одному из аспектов настоящего изобретения антитела содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO. 77 (вариабельная область Н 1), дополнительно содержащую ряд замен в одном или более чем одном из положений 12, 20, 38, 40, 48, 67, 68, 70,72, 74, 76, 79 и 91; причем каждый замененный аминокислотный остаток заменен аминокислотным остатком в эквивалентном положении в SEQ ID NO. 7 (вариабельная область тяжелой цепи донорного антитела 2 А 10), и число замен составляет от 1 до 13. В других воплощениях число замен равно 1, или 2,или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12, или 13. В других воплощениях число замен составляет от 2 до 13, или от 3 до 13, или от 4 до 13, или от 5 до 13, или от 6 до 13, или от 7 до 13, или от 8 до 13, или от 9 до 13, или от 10 до 13, или от 11 до 13, или от 12 до 13. В других воплощениях число замен равно 1 или 2, или находится в диапазоне от 1 до 3 замен, или от 1 до 4, или от 1 до 5, или от 1 до 6, или от 1 до 7, или от 1 до 8, или от 1 до 9, или от 1 до 10, или от 1 до 11, или от 1 до 12 замен. В этом контексте описанные замены эквивалентны по своему значению "обратным мутациям", причем аминокислотные остатки человеческой каркасной области в конкретных положениях в пределах последовательности Н 1 мутированы к первоначальному виду до аминокислотных остатков в эквивалентном положении в пределах последовательности донорного антитела 2 А 10. Если конкретно не указано иначе, когда в этом документе упомянуто пронумерованное положение аминокислотного остатка, обнаруживаемого в пределах конкретной последовательности, например "по-3 014291 ложение 12", это означает, что специалист приписывает первой аминокислоте в данной последовательности положение "1" и ведет отсчет от положения один и идентифицирует аминокислоту, которая находится в желаемом положении, в этом примере - двенадцатый аминокислотный остаток в последовательности. Специалист должен заметить, что эта система нумерации не соответствует системе нумерации поKabat, которую часто используют для аминокислотных положений в последовательностях антител. В следующей таблице (табл. 3) показаны замены/обратные мутации по настоящему изобретению и даны их пронумерованные положения и номера по Kabat для этих пронумерованных положений. Таблица 3 В соответствии с табл. 3, в одном из воплощений моноклональные антитела по настоящему изобретению содержат замену/обратную мутацию в пронумерованном положении 79 с образованием антител"Класса А". Было обнаружено, что для оптимальной аффинности связывания пара аминокислотных остатков в положениях 48 и 68 должна представлять собой I и А соответственно (как они имеются в 2 А 10) или М иV соответственно (как они имеются в Н 1). Соответственно, опять же в соответствии с табл. 3, в еще одном воплощении, "Класс В", моноклональное антитело содержит замену в положениях 79, 48 и 68. В еще одном воплощении ("Класс С") моноклональные антитела "Класса А" или "Класса В" дополнительно содержат замену в положениях 40 и/или 67. В еще одном воплощении моноклональные антитела "Класса С" по настоящему изобретению дополнительно содержат замену в положениях 38, 72 или 70 с образованием антител "Класса D". В еще одном воплощении моноклональные антитела "Класса D" дополнительно содержат замены в одном или более чем одном из положений 12, 20, 74, 76 или 91 ("Класс Е"). Следующая таблица включает подробное описание 20 различных вариабельных областей тяжелой цепи (VH), которые могут образовывать часть антител по настоящему изобретению. Каждая из раскрытых VH основана на VH Н 1 (SEQ ID NO. 77), дополнительно содержащей замены, упомянутые в таблице(табл. 4), где остаток в Н 1 в соответствующем положении заменен остатком из 2 А 10 в этом положении (в таблице "-" означает, что в этом положении нет замен, так что остаток остается таким же, как в последовательности H1). Таблица 4-4 014291 Соответственно, предложено моноклональное антитело, содержащее вариабельную область тяжелой цепи, имеющую последовательность, представленную в любой из SEQ ID NO: 11-18 или 85-91; или его варианты, содержащие аналоги этих CDR. В еще одном воплощении предложено моноклональное антитело, содержащее тяжелую цепь, имеющую последовательность, представленную в любой из SEQID NO: 26-33 или 92-98; или его варианты, содержащие аналоги этих CDR. В конкретном воплощении антитело содержит VH-области, представленные в SEQ ID NO. 11, 12,16, 18, 85, 86, 87 или 91 или их варианты, содержащие аналоги этих CDR; или тяжелые цепи, представленные в SEQ ID NO. 26, 27, 31, 33, 92, 93, 94 или 98, или их варианты, содержащие аналоги этих CDR. Вариабельная область легкой цепи По одному из аспектов настоящего изобретения антитела содержат вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO. 20 (вариабельная область L13), возможно, дополнительно содержащую ряд замен в одном или более чем одном из положений 4, 7, 11, 19, 42, 64 и 70; причем каждый замененный аминокислотный остаток заменен аминокислотным остатком в эквивалентном положении в SEQ ID NO. 8 (вариабельная область легкой цепи донорного антитела 2 А 10), и число замен составляет от 0 до 7. В других воплощениях число замен равно 1, или 2, или 3, или 4, или 5, или 6, или 7. В других воплощениях число замен составляет от 2 до 7, или от 3 до 7, или от 4 до 7, или от 5 до 7, или от 6 до 7. В других воплощениях число замен равно 1 или 2 или находится в диапазоне от 1 до 3 замен, или от 1 до 4, или от 1 до 5, или от 1 до 6. В следующей таблице (табл. 5) показаны замены/обратные мутации по настоящему изобретению и даны их пронумерованные положения, а также номера по Kabat для этих пронумерованных положений. Таблица 5 В соответствии с табл. 5, в еще одном воплощении, "Класс X", моноклональные антитела по настоящему изобретению содержат VL-область, имеющую замену/обратную мутацию в положениях 11 и 19. В еще одном воплощении, "Класс Y", моноклональные антитела "Класса X" дополнительно содержат замену в положении 42. В дополнительном воплощении моноклональные антитела "Класса X" или"Класса Y" дополнительно содержат обратную мутацию в положениях 7, 64 или 70 с образованием"Класса Z". Опять же в соответствии с табл. 5, в еще одном воплощении моноклональные антитела по настоящему изобретению содержат VL-область, имеющую замену в положении 4 (соответствующую L11 (SEQID NO. 78. Следующая таблица (табл. 6) включает подробное описание семи различных вариабельных областей легкой цепи (VL), которые могут образовывать часть антител по настоящему изобретению или их вариантов, содержащих аналоги этих CDR. Каждая из раскрытых VL представляет собой, или основана на, VL L13 (SEQ ID NO. 20), которая, возможно, дополнительно содержит замены, упомянутые в таблице, где остаток L13 в соответствующем положении заменен остатком 2 А 10 в этом положении (в таблице"-" означает, что в этом положении нет замены и, таким образом, остаток остается таким же, как в последовательности L13). Таблица 6 Соответственно, предложено моноклональное антитело, содержащее вариабельную область легкой цепи, имеющую последовательность, представленную в любой из SEQ ID NO: 20-25; или его варианты,содержащие аналоги этих CDR. В еще одном воплощении предложено моноклональное антитело, содер-5 014291 жащее легкую цепь, имеющую последовательность, представленную в любой из SEQ ID NO: 35-40; или его варианты, содержащие аналоги этих CDR. Альтернативно, предложено моноклональное антитело, содержащее вариабельную область легкой цепи, имеющую последовательность, представленную в SEQ ID NO. 19, или легкую цепь, имеющую последовательность, представленную в SEQ ID NO. 34. В конкретном воплощении антитело содержит VL-области, представленные в SEQ ID NO. 20, 23 и 25, или их варианты, содержащие аналоги этих CDR, или легкие цепи, представленные в SEQ ID NO. 35,38 и 40, или их варианты, содержащие аналоги этих CDR. Конкретные комбинации вариабельных областей тяжелой и легкой цепи В настоящем изобретении предложены антитела или тому подобное, содержащие все возможные комбинации вариабельных областей тяжелых цепей и вариабельных областей легких цепей, которые раскрыты выше. Также предусмотрены в этих комбинациях и в комбинациях, перечисленных ниже, указанные конкретные последовательности или их варианты, содержащие аналоги встречающихся в природе. Антитела по настоящему изобретению содержат вариабельную область тяжелой цепи и вариабельную область легкой цепи. В одном из воплощений антитело содержит: (а) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO. 77 (вариабельная область Н 1), дополнительно содержащую ряд замен в одном или более чем одном из положений 12, 20, 38, 40, 48, 67, 68, 70, 72, 74, 76, 79 и 91; где каждый замененный аминокислотный остаток заменен аминокислотным остатком в эквивалентном положении в SEQ ID NO. 7 (вариабельная область тяжелой цепи донорного антитела 2 А 10), и число замен составляет от 1 до 13. В других воплощениях число замен равно 1, или 2, или 3, или 4, или 5, или 6,или 7, или 8, или 9, или 10, или 11, или 12, или 13; и(б) вариабельную область легкой цепи, выбранную из SEQ ID NO. 20-25 или 78. Конкретные воплощения представляют собой антитела, содержащие следующие комбинации вариабельных областей тяжелых и легких цепей: Другие воплощения представляют собой антитела, содержащие следующие комбинации вариабельных областей тяжелых и легких цепей: Дополнительные воплощения представляют собой антитела, содержащие следующие комбинации вариабельных областей тяжелых и легких цепей: В одном из воплощений антитело содержит следующие вариабельные области тяжелых и легких цепей: H6L13, H16L16, H20L13 или H20L16 или их варианты, содержащие аналоги встречающихся в природе CDR. В одном из воплощений антитело содержит H20L16 или его вариант, содержащий аналог встречающихся в природе CDR. Целые антитела Кроме того, в этом изобретении также предложено гуманизированное антитело, которое связывает и нейтрализует NOGO, предпочтительно человеческий NOGO, более предпочтительно человеческийNOGO-A. Более конкретно, предложено гуманизированное антитело, содержащее вариабельную область тяжелой цепи, как описано здесь, и вариабельную область легкой цепи, как описано здесь. Гуманизированные антитела по настоящему изобретению связываются с человеческим NOGO с аффинностью, сравнимой с аффинностью мышиного донорного антитела 2 А 10 или его химерного варианта (HcLc). В одном из воплощений связывание антитела по настоящему изобретению с NOGO имеет константу аффинности (KD, при измерении с использованием оборудования BiaCore) в пределах 10 кратной при сравнении с 2 А 10, и в еще одном воплощении константа аффинности находится в пределах трех- или двухкратной относительно таковой у 2 А 10, в еще одном воплощении константа аффинности-7 014291 отличается от таковой у 2 А 10 (или 2 А 10 HcLc). В еще одном воплощении константа аффинности находится в пределах трех- или двухкратной относительно таковой у 2 А 10, и скорость диссоциации (kd) находится в пределах 10-кратной, или трехкратной, или двухкратной относительно таковой у 2 А 10, в еще одном воплощении скорость диссоциации не отличается от таковой у 2 А 10 (или 2 А 10 HcLc). Метод измерения константы аффинности и скорости диссоциации антитела должен быть понятен специалисту,однако метод кинетического анализа BiaCore, данный в примере 5 этого документа, является иллюстрацией в этом отношении. Например, константа аффинности и скорость диссоциации 2 А 10 при измерении кинетическим анализом BiaCore обычно находятся в области 1 нМ и 1,8410-3 (kd 1/с) соответственно; в том же анализе антитела по одному из воплощений настоящего изобретения имеют константу аффинности менее чем 8-10 нМ и 1,8410-2. При таком же анализе химерное антитело 2 А 10, HcLc, имеет константу аффинности приблизительно от 1 до 2 нМ и от 210-3 до 410-3 (kd 1/с), соответственно. В типичных воплощениях антитела по этому изобретению представляют собой класс иммуноглобулинов (IgG), в более типичных случаях человеческих lgG1 или lgG4 с человеческой легкой цепью типа к(каппа). В дополнительном аспекте в этом изобретении предложена фармацевтическая композиция, содержащая антитело против NOGO по настоящему изобретению или его функциональный фрагмент вместе с фармацевтически приемлемым разбавителем или носителем. В дополнительном аспекте в настоящем изобретении предложен способ лечения или профилактики инсульта (в частности ишемического инсульта) и других неврологических заболеваний, в частности болезни Альцгеймера или рассеянного склероза, у человека, включающий введение указанному человеку,нуждающемуся в этом, эффективного количества антитела против NOGO по этому изобретению или его функциональных фрагментов. В другом аспекте в этом изобретении предложено применение антитела против NOGO по этому изобретению или его функционального фрагмента в изготовлении лекарства для лечения или профилактики инсульта (в частности ишемического инсульта) и других неврологических заболеваний, в частности болезни Альцгеймера или рассеянного склероза. В дополнительном аспекте в настоящем изобретении предложен способ ингибирования нейродегенерации и/или стимулирования функционального восстановления у пациента-человека, пораженного инсультом (в частности ишемическим инсультом) или другим неврологическим заболеванием, в частности болезнью Альцгеймера или рассеянным склерозом, или имеющего риск его развития, включающий введение указанному человеку, нуждающемуся в этом, эффективного количества антитела против NOGO по этому изобретению или его функционального фрагмента. В еще дополнительном аспекте в этом изобретении предложено применение антитела противNOGO по этому изобретению или его функционального фрагмента в изготовлении лекарства для ингибирования нейродегенерации и/или стимулирования функционального восстановления у пациентачеловека, пораженного инсультом (в частности ишемическим инсультом) или другим неврологическим заболеванием, в частности болезнью Альцгеймера или рассеянным склерозом, или имеющего риск его развития. В других аспектах настоящего изобретения предложено применение антител против NOGO по настоящему изобретению в способе лечения, или в изготовлении лекарства для лечения, травматического повреждения нерва, такого как повреждение спинного мозга или другое травматическое повреждение нервной системы. Другие аспекты и преимущества настоящего изобретения раскрыты дополнительно в подробном описании и в его предпочтительных воплощениях. В одном из воплощений полноразмерные антитела представляют собой антитела, содержащие легкие цепи согласно SEQ ID NO. 34-40 и тяжелые цепи согласно SEQ ID NO. 92-98 и, в частности, легкие цепи согласно SEQ ID NO. 35, 38 или 40 и тяжелые цепи согласно SEQ ID NO. 92, 93, 94 или 98. Специалистам должно быть очевидно, что все последовательности, данные для цепей полноразмерных антител в табл. 7 и 12 (и прилагаемые последовательности) представляют собой тяжелые цепи или легкие цепи до какого-либо процессинга (например процессинга, опосредованного клеткой-хозяином) для удаления сигнальной последовательности. В типичных случаях процессированные формы цепей антитела начинаются с положения 20 (после удаления сигнальной последовательности (остатки 1-19), которая соответствуетSEQ ID NO. 75). В настоящем изобретении предложены антитела, имеющие перечисленные полипептидные последовательности (после удаления первых 19 аминокислот сигнальной последовательности), а также предложены антитела в форме, в которой они продуцированы и выделены из клеток-хозяев, экспрессирующих полинуклеотиды, кодирующие тяжелую и легкую цепь.-8 014291 Таблица 7. Конкретные полноразмерные антитела включают: В одном из воплощений антитело представляет собой H6L13FL, H16L16 FL, H20L13 FL илиH20L16 FL. В одном из воплощений антитело представляет собой H20L16 FL или его вариант, содержащий аналог CDR. Альтернативно, вышеуказанные замены, представляющие собой обратные мутации по отношению к точному аминокислотному остатку, обнаруживаемому в эквивалентном положении в пределах последовательности донорного мышиного 2 А 10, могут быть любой заменой аминокислоты, которая представляет собой консервативную замену точного остатка, обнаруживаемого в эквивалентном положении в пределах последовательности донорного мышиного 2 А 10. Термин "консервативная замена" является понятным специалисту и включает в себя, например, замену аминокислоты другим аминокислотным остатком, имеющим такие же физические, химические или структурные свойства, такие как рН, заряд,гидрофобность, ароматичность и т.д. В одном из воплощений настоящего изобретения антитела не являются литическими в том смысле,что константная область не способна связываться с комплементом и/или опосредовать ADCC (антителозависимую клеточно-опосредованную цитотоксичность). Поэтому константные области полноразмерных антител основаны либо на константных доменах, которые естественным образом не являются литическими, таких как lgG4 человека, или содержат инактивирующие замены в положениях 235 и 237 в пределах константной области lgG1 человека (см. ЕР 0307434 для более подробного описания). Описание графических материалов Фиг. 1 А и Б - данные твердофазного иммуноферментного анализа (ELISA) для связывания супернатантов, содержащих моноклональное антитело, с рекомбинантным человеческим NOGO. Фиг. 2 А и Б - данные ELISA для связывания очищенного моноклонального антитела с рекомбинантным человеческим NOGO. Фиг. 3 А и Б - данные ELISA для связывания супернатантов, содержащих моноклональное антитело, с рекомбинантным человеческим NOGO. Фиг. 4 А и Б - данные ELISA для связывания супернатантов, содержащих моноклональное антитело, с рекомбинантным человеческим NOGO. Фиг. 5 А и Б - данные ELISA для связывания супернатантов, содержащих моноклональное антитело, с рекомбинантным человеческим NOGO. Фиг. 6 А-Е - данные активируемой флуоресценцией сортировки клеток (fluorescent-activated cellsorting, FACS) для связывания очищенного антитела с человеческим NOGO, экспрессированным клетками нейробластомы человека. Фиг. 7 - результаты конкурентного анализа ELISA. Фиг. 8 - данные ELISA для связывания моноклональных антител с рекомбинантным человеческимNOGO. Фиг. 9 - данные ELISA для связывания моноклональных антител с рекомбинантным человеческимNOGO. Фиг. 10 - данные ELISA для связывания моноклональных антител с рекомбинантным человеческим-9 014291 Фиг. 11 - данные ELISA для связывания моноклональных антител с рекомбинантным человеческимNOGO. Фиг. 12 А и Б - данные ELISA для связывания моноклональных антител с рекомбинантным человеческим NOGO. Фиг. 13 - данные FACS для связывания очищенного антитела с человеческим NOGO, экспрессированным клетками нейробластомы человека. Фиг. 14 А-В - данные FACS для связывания очищенного антитела с человеческим NOGO, экспрессированным клетками нейробластомы человека. Подробное описание изобретения Антитела по этому изобретению в типичных случаях имеют структуру природного антитела или его функционального фрагмента. Таким образом, антитело может содержать полноразмерное антитело,(Fab)2-фрагмент, Fab-фрагмент, димер легкой цепи или димер тяжелой цепи. Антитело может представлять собой IgG1, IgG2, IgG3 или IgG4; или IgM; IgA, IgE или IgD или их модифицированный вариант. Константная область тяжелой цепи антитела может быть выбрана соответственно. Константная область легкой цепи может представлять собой константную область каппа или лямбда. Более того, антитело может содержать модификации всех классов, например, димеры IgG, Fc-мутанты, которые более не связываются с Fc-рецепторами или не опосредуют связывание Clq. Антитело может также представлять собой химерное антитело типа, описанного в WO 86/01533, которое содержит участок связывания антигена и неиммуноглобулиновый участок. Участок связывания антигена представляет собой вариабельный домен легкой цепи или вариабельный домен тяжелой цепи антитела. В типичных случаях участок связывания антигена содержит вариабельные домены как легкой, так и тяжелой цепи. Неиммуноглобулиновый участок слит по его С-концу с участком связывания антигена. Неиммуноглобулиновый участок представляет собой в типичных случаях неиммуноглобулиновый белок и может представлять собой фермент,токсин или белок, имеющий известную специфичность связывания. Два участка этого типа в химерном антителе можно соединить расщепляемой линкерной последовательностью. Иммуноадгезины, имеющиеCDR, как они описаны выше, также предусмотрены в настоящем изобретении. Константная область выбрана в соответствии с требуемой функциональностью. Обычно IgG1 демонстрирует литическую способность через связывание с комплементом и/или опосредует ADCC (антителозависимую клеточно-опосредованную цитотоксичность). IgG4 является предпочтительным, если требуется нецитотоксическое блокирующее антитело. Однако IgG4-антитела могут демонстрировать нестабильность в продукции, и поэтому, может быть, более предпочтительно модифицировать обычно более стабильный IgG1. Предложенные модификации раскрыты в ЕР 0307434, предпочтительные модификации включают модификации в положениях 235 и 237. Таким образом, в данном изобретении предложена литическая и нелитическая форма антитела по изобретению. В одном из воплощений антитело по изобретению является полноразмерным (то есть, тетрамером,содержащим два тяжелые и две легкие цепи) нелитическим IgG1-антителом, имеющим VH- или VLпоследовательности, описанные выше. В еще одном воплощении авторами изобретения предложено полноразмерное нелитическое IgG1-антитело, имеющее VH согласно SEQ ID NO. 11, 12, 16, 18 или 85,86, 87 или 91; и VL согласно SEQ ID NO. 20, 23 или 25. В дополнительном аспекте в этом изобретении предложены полинуклеотиды, кодирующие раскрытые здесь тяжелые или легкие цепи или вариабельные области. Например, в этом изобретении предложены полинуклеотиды, кодирующие VH, имеющие последовательность, представленную в SEQ ID NO. 4552, 99-105, и VL-области, имеющие последовательность, представленную в SEQ ID NO. 53-59.NOGO-B, сплайсированный вариант, который не имеет остатков от 186 до 1004 в предполагаемом внеклеточном домене ( доступа в GenBank AJ251384), и укороченный сплайсированный вариант, NOGOC, который тоже не имеет остатков от 186 до 1004, а также имеет уменьшенный альтернативный аминоконцевой домен ( доступа в GenBank AJ251385) (Prinjha et al (2000) выше). Все ссылки на "NOGO" следует понимать здесь как включающие любую и все из вариантных форм NOGO, таких как NOGO-A, и описанные сплайсированные варианты, если не указана конкретная форма."Нейтрализующий" и его грамматические варианты относится к ингибированию, полному или частичному, функций NOGO, в том числе его связывания с нейронами и ингибирования роста нейритов. Термины Fv, Fc, Fd, Fab или F(ab)2 использованы в их стандартных значениях (см., например, Harlow et al., Antibodies. A Laboratory Manual, Cold Spring Harbor Laboratory (1988."Химерное антитело" относится к типу сконструированного антитела, который содержит существующую в природе вариабельную область (легких цепей и тяжелых цепей), происходящую из донорного антитела, в ассоциации с константными областями легких и тяжелых цепей, происходящими из акцепторного антитела."Гуманизированное антитело" относится к типу сконструированного антитела, имеющему его CDR,происходящие из донорного иммуноглобулина, не являющегося человеческим, причем остальные происходящие из иммуноглобулина части молекулы происходят из одного (или более чем одного) иммуногло- 10014291 булина(ов) человека. В дополнение, остатки каркасной области можно изменить с сохранением аффинности связывания (см., например, Queen et al., Proc. Natl Acad Sci USA, 86:10029-10032 (1989), Hodgson etal., Biotechnology, 9:421 (1991. Подходящее человеческое акцепторное антитело может быть выбрано из традиционных баз данных, например базы данных KABAT, базы данных Los Alamos и базы данныхSwiss Protein, по гомологии с нуклеотидными и аминокислотными последовательностями донорного антитела. Человеческое антитело, характеризующееся гомологией с каркасными областями донорного антитела (на основании аминокислот), может быть подходящим для предоставления константной области тяжелой цепи и/или вариабельной каркасной области тяжелой цепи для вставки донорных CDR. Подходящее акцепторное антитело, способное дать константные или вариабельные каркасные области легкой цепи, можно выбрать таким же образом. Следует отметить, что не требуется то, чтобы тяжелые и легкие цепи акцепторного антитела происходили из одного и того же акцепторного антитела. В предшествующем уровне техники описано несколько путей получения таких гуманизированных антител - см., например, ЕР-А-0239400 и ЕР-А-054951. Термин "донорное антитело" относится к антителу (моноклональному и/или рекомбинантному), которое предоставляет аминокислотные последовательности его вариабельных областей, CDR или других функциональных фрагментов или их аналогов первому иммуноглобулиновому партнеру, так чтобы получить измененную область, кодирующую иммуноглобулин, и получившееся измененное экспрессируемое антитело с антигенной специфичностью и нейтрализующей активностью, характерными для донорного антитела. Термин "акцепторное антитело" относится к антителу (моноклональному и/или рекомбинантному),которое является гетерологичным по отношению к донорному антителу и которое предоставляет все(или любую часть, но предпочтительно все) аминокислотные последовательности, кодирующие его каркасные области тяжелой и/или легкой цепи и/или его константные области тяжелой и/или легкой цепи,первому иммуноглобулиновому партнеру. Предпочтительно, акцепторное антитело является человеческим антителом."CDR" определены как аминокислотные последовательности определяющего комплементарность участка антитела, которые представляют собой гипервариабельные области тяжелых и легких цепей иммуноглобулинов. См., например, Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S.Department of Health and Human Services, National Institutes of Health (1987). В вариабельной части иммуноглобулина имеется три CDR тяжелой цепи и три CDR легкой цепи (или CDR-области). Таким образом,"CDR" при использовании здесь относится ко всем трем CDR тяжелой цепи или ко всем трем CDR легкой цепи (или как ко всем CDR тяжелой, так и ко всем CDR легкой цепи, как подходит). Структура и конформация белка антитела могут означать, что другие остатки считаются частью участка связывания антигена, и это должно быть понятно специалисту. См. например Chothia et al., (1989) Conformations ofCDR дают большинство контактирующих остатков для связывания антитела с антигеном или эпитопом. CDR, представляющие интерес в этом изобретении, происходят из вариабельных последовательностей тяжелой и легкой цепи донорного антитела и включают аналоги встречающихся в природе CDR,которые также имеют или сохраняют такую же специфичность связывания антигена и/или нейтрализующую способность, как и донорное антитело, из которого они происходят."Функциональный фрагмент" представляет собой частичную вариабельную последовательность тяжелой или легкой цепи (например, с минорными делециями на амино- или карбоксиконце вариабельной области иммуноглобулина), которая сохраняет такую же специфичность связывания антигена и такую же или подобную нейтрализующую способность, как и антитело, из которого происходит этот фрагмент."Аналог" представляет собой аминокислотную последовательность, модифицированную по меньшей мере по одной аминокислоте, причем указанная модификация может быть химической модификацией, или представлять собой замену, или перестройку нескольких аминокислот (а именно, не более чем 10), причем эта модификация позволяет аминокислотной последовательности сохранять биологические характеристики, например антигенную специфичность и высокую аффинность, немодифицированной последовательности. Настоящее изобретение также включает применение Fab-фрагментов или F(ab')2-фрагментов, происходящих из моноклональных антител (mAb) по настоящему изобретению, направленных противNOGO. Fab-фрагмент содержит полную легкую цепь и аминоконцевую часть тяжелой цепи; F(ab')2 фрагмент представляет собой фрагмент, образованный двумя Fab-фрагментами, связанными дисульфидными связями. Fab-фрагменты и F(ab')2-фрагменты можно получать общепринятыми способами, например расщеплением mAb подходящими протеолитическими ферментами, папаином и/или пепсином, или рекомбинантными способами. Fab- и F(ab')2-фрагменты сами по себе полезны в качестве терапевтических или профилактических средств, а также в качестве доноров последовательностей, включающих вариабельные области и CDR-последовательности, полезные в образовании рекомбинантных или гуманизированных антител, как описано здесь. В дополнительных аспектах этого изобретения авторами изобретения предложены диатела (бива- 11014291 лентные или биспецифичные), триатела, тетратела и другие мультивалентные разновидности белка scFV,имеющие один или более чем один CDR, как описано выше, которые связываются с NOGO и нейтрализуют его функцию. В еще одном дополнительном воплощении антитело по изобретению может иметь присоединенный к нему дополнительный агент. Например, технологию рекомбинантной ДНК можно использовать для получения сконструированного антитела по изобретению, в котором Fc-фрагмент или СН 2-CH3 домен молекулы полноразмерного антитела заменен ферментом или другой детектируемой молекулой (а именно полипептидной эффекторной или репортерной молекулой). Антитела по настоящему изобретению можно получать созданием традиционного экспрессионного вектора или рекомбинантной плазмиды путем введения этих кодирующих антитело последовательностей в клетку-хозяина, в функциональной ассоциации с общепринятыми регуляторными управляющими последовательностями, способными контролировать репликацию и экспрессию в клетке-хозяине и/или секрецию из нее. Регуляторные последовательности включают промоторные последовательности, напримерCMV-промотор, и сигнальные последовательности, которые могут происходить из других известных антител. Аналогичным образом, второй экспрессионный вектор можно получать как имеющий последовательность ДНК, которая кодирует комплементарную легкую или тяжелую цепь антитела. Предпочтительно, этот второй экспрессионный вектор является идентичным первому, за исключением того, что касается кодирующих последовательностей и маркеров для селекции, так чтобы обеспечить, насколько это возможно, чтобы каждая полипептидная цепь экспрессировалась функционально. Альтернативно,последовательности, кодирующие тяжелую и легкую цепь для измененного антитела, могут находиться на одном и том же векторе. Выбранную клетку-хозяин котрансфицируют общепринятыми методиками как первым, так и вторым вектором (или просто трансфицируют единственным вектором) для создания трансфицированной клетки-хозяина по изобретению, содержащей как рекомбинантные, так и синтетические легкие и тяжелые цепи. Трансфицированную клетку затем культивируют общепринятыми методиками с получением сконструированного антитела по изобретению. Антитело, которое включает ассоциацию обоих рекомбинантных тяжелой цепи и/или легкой цепи подвергают скринингу из культуры подходящим анализом,таким как твердофазный иммуноферментный анализ (ELISA) или радиоиммуноанализ (RIA). Такие же общепринятые методики можно использовать для конструирования других измененных антител и молекул. Подходящие векторы для стадий клонирования и субклонирования, используемые в способах и в создании композиций по этому изобретению, могут быть выбраны специалистом в данной области техники. Например, можно использовать общепринятые векторы серии pUC для клонирования. Один такой вектор, pUC19, имеется в продаже от таких поставщиков, как Amersham (Бекингэмшир, Англия) илиPharmacia (Уппсала, Швеция). Дополнительно, любой вектор, который способен легко реплицироваться,имеет множество сайтов клонирования и селектируемые гены (например, гены устойчивости к антибиотикам), и которым легко манипулировать, может быть использован для клонирования. Аналогичным образом, векторы, используемые для экспрессии антител, могут быть выбраны специалистом в данной области техники из любых общепринятых векторов. Эти векторы также содержат выбранные регуляторные последовательности (такие как промоторы CMV или RSV), которые управляют репликацией и экспрессией гетерологичных последовательностей ДНК в выбранных клетках-хозяевах. Эти векторы содержат вышеописанные последовательности ДНК, которые кодируют антитело или измененный участок иммуноглобулина. В дополнение, эти векторы могут включать в себя выбранные последовательности иммуноглобулина, модифицированные путем вставки желательных рестрикционных сайтов для упрощения манипуляции. Экспрессионные векторы могут также характеризоваться генами, подходящими для амплификации экспрессии гетерологичных последовательностей ДНК, например геном дигидрофолатредуктазы (DHFR) млекопитающего. Другие предпочтительные векторные последовательности включают в себя сигнальную последовательность полиА, такую как из гена бычьего гормона роста (BGH), и промоторную последовательность бета-глобина (betaglopro). Экспрессионные векторы, полезные здесь, можно синтезировать методиками, хорошо известными специалистам в данной области техники. Компоненты таких векторов, например репликоны, селекционные гены, энхансеры, промоторы,сигнальные последовательности и тому подобные, можно получать из коммерческих или природных источников или синтезировать известными способами для применения в управлении экспрессией и/или секрецией продукта рекомбинантной ДНК в выбранном хозяине. Также для этой цели могут быть выбраны другие подходящие экспрессионные векторы, многочисленные типы которых известны в данной области для экспрессии в млекопитающих, бактериях, насекомых, дрожжах и грибах. Настоящее изобретение также охватывает клеточную линию, трансфицированную рекомбинантной плазмидой, содержащей кодирующие последовательности антител или их измененных иммуноглобулиновых молекул. Клетки-хозяева, полезные для клонирования и других манипуляций с этими векторами для клонирования, также являются общепринятыми. Однако наиболее желательно использовать для репликации векторов для клонирования и других стадий в конструировании измененных антител по изобре- 12014291 тению клетки из различных штаммов Е. coli. Подходящими клетками-хозяевами или клеточными линиями для экспрессии антитела по изобретению предпочтительно являются клетки млекопитающего, такие как NSO, Sp2/0, CHO (например DG44),COS, фибробластная клетка (например 3 Т 3) и клетки миеломы и, более предпочтительно, клетка СНО или миеломы. Можно использовать человеческие клетки, таким образом делая возможной модификацию молекулы человеческими типами гликозилирования. Альтернативно, можно использовать другие эукариотические клеточные линии. Выбор подходящих клеток-хозяев млекопитающего и способы трансформации, культивирования, амплификации, скрининга и получения и очистки продукта известны в данной области техники. См., например, Sambrook et al., цитировано выше. Бактериальные клетки могут оказаться полезными в качестве клеток-хозяев, подходящих для экспрессии рекомбинантных Fab по настоящему изобретению (см., например, Pluckthun, A., Immunol. Rev.,130:151-188 (1992. Однако в виду того, что белки, экспрессируемые в бактериальных клетках, имеют тенденцию находиться не в складчатой форме, или в неправильной складчатой форме, или в негликозилированной форме, любой рекомбинантный Fab, продуцируемый в бактериальной клетке, следует подвергать скринингу на сохранение способности связывать антиген. Если молекула, экспрессированная бактериальной клеткой, продуцирована в правильной складчатой форме, эта бактериальная клетка должна быть желательным хозяином. Например, различные штаммы Е. coli, используемые для экспрессии,являются хорошо известными в качестве клеток-хозяев в области биотехнологии. Различные штаммы В.subtilis, Streptomyces, других бацилл и тому подобного также можно использовать в этом способе. Если желательно, доступными в качестве клеток-хозяев также являются штаммы дрожжевых клеток, известные специалистам в данной области техники, а также клетки насекомого, например Drosophila и Lepidoptera, и вирусные экспрессионные системы. См., например Miller et al., Genetic Engineering,8:277-298, Plenum Press (1986) и цитированные там ссылки. Общие способы, которыми можно конструировать векторы, способы трансфекции, требуемые для получения клеток-хозяев по изобретению, и способы культивирования, необходимые для получения антитела по изобретению из такой клетки-хозяина, все представляют собой общепринятые методики. В типичных случаях способ культивирования по настоящему изобретению представляет собой способ бессывороточного культивирования, обычно культивирование клеток в суспензии, свободной от сыворотки. Аналогично, когда они продуцированы, антитела по изобретению можно очищать из содержимого культуры клеток в соответствии со стандартными способами данной области, включающими в себя осаждение сульфатом аммония, аффинные колонки, колоночную хроматографию, гель-электрофорез и тому подобные. Такие методики находятся в пределах знаний специалиста в данной области техники и не ограничивают это изобретение. Например, получение измененных антител раскрыто в WO 99/58679 и WO 96/16990. В еще одном способе экспрессии антител можно использовать экспрессию в трансгенном животном, как описано в патенте США 4873316. Это относится к экспрессионной системе с использованием промотора казеина животного, который при трансгенном введении в млекопитающее делает возможным продукцию желаемого рекомбинантного белка в молоке самки. В дополнительном аспекте этого изобретения предложен способ получения антитела по изобретению, включающий стадию культивирования клетки-хозяина, трансформированной или трансфицированной вектором, кодирующим легкую и/или тяжелую цепь антитела по изобретению, и извлечение антитела, которое продуцировано таким образом. В соответствии с настоящим изобретением предложен способ получения антитела против NOGO по настоящему изобретению, которое специфично связывается с человеческим NOGO-A и нейтрализует его активность, включающий следующие стадии:(а) предоставление первого вектора, кодирующего тяжелую цепь антитела;(б) предоставление второго вектора, кодирующего легкую цепь антитела;(г) культивирование клетки-хозяина со стадии (в) в условиях, подходящих для секреции антитела из указанной клетки-хозяина в указанную культуральную среду;(д) извлечение секретированного антитела со стадии (г). Как только антитело экспрессировано желаемым способом, его затем проверяют на активность invitro, используя подходящий анализ. Для качественной и количественной оценки связывания антитела сNOGO используют общепринятые в настоящее время форматы анализа ELISA. Дополнительно, другие анализы in vitro также можно использовать для подтверждения нейтрализующей эффективности перед последующими клиническими исследованиями на человеке, осуществляемыми для оценки персистенции антитела в организме, невзирая на обычные механизмы выведения. Терапевтические агенты по этому изобретению можно вводить в качестве профилактического средства или после случая инсульта, при появлении клинических симптомов, или как это необходимо иным образом. Доза и длительность лечения связаны с относительной продолжительностью циркуляции молекул по настоящему изобретению в кровотоке человека, и они могут быть установлены специалистом в- 13014291 данной области техники в зависимости от состояния, которое лечат, и общего состояния здоровья пациента. Предусмотрено то, что повторные введения (например, один раз в неделю или один раз в две недели) в течение длительного периода времени (например, от четырех до шести месяцев) могут потребоваться для достижения максимальной терапевтической эффективности. Способом введения терапевтического агента по этому изобретению может быть любой подходящий путь, которым этот агент доставляется хозяину. Антагонисты и антитела, и фармацевтические композиции по изобретению особенно полезны для парентерального введения, то есть подкожного, интратекального, внутрибрюшинного, внутримышечного, внутривенного или интраназального, причем внутривенное введение является особенно предпочтительным. Терапевтические агенты по изобретению можно приготавливать в виде фармацевтических композиций, содержащих эффективное количество антагониста или антитела по изобретению в качестве активного ингредиента в фармацевтически приемлемом носителе. В профилактическом агенте по изобретению водная суспензия или раствор, содержащие сконструированное антитело, предпочтительно забуференные при физиологическом рН, в форме, готовой для инъекции, являются предпочтительными. Композиции для парентерального введения обычно содержат раствор антагониста или антитела по изобретению или их смеси, растворенные в фармацевтически приемлемом носителе, предпочтительно водном носителе. Можно использовать разнообразные водные носители, например 0,9% физраствор, 0,3% глицин и тому подобные. Эти растворы являются стерильными и обычно свободными от частиц. Эти растворы можно стерилизовать общепринятыми, хорошо известными методиками стерилизации (например, фильтрованием). Эти композиции могут содержать фармацевтически приемлемые вспомогательные вещества, как требуется для приближения к физиологическим условиям, такие как регулирующие рН и буферные агенты и т.д. Концентрация антагониста или антитела по изобретению в таком фармацевтическом препарате может широко варьировать, то есть от менее чем приблизительно 0,5%, обычно или по меньшей мере приблизительно 1% вплоть до 15 или 20% по массе, и должна быть выбрана, главным образом, на основании объемов жидкости, вязкости и т.д., в соответствии с конкретным выбранным способом введения. Таким образом, фармацевтическую композицию по изобретению для внутримышечной инъекции можно приготавливать так, чтобы она содержала 1 мл стерильной забуференной воды и от приблизительно 1 нг до приблизительно 100 мг, например от приблизительно 50 нг до приблизительно 30 мг или,более предпочтительно, от приблизительно 5 мг до приблизительно 25 мг антагониста или антитела по изобретению. Аналогичным образом, фармацевтическую композицию по изобретению для внутривенной инфузии можно приготавливать так, чтобы она содержала приблизительно 250 мл стерильного раствора Рингера и от приблизительно 1 до приблизительно 30 и, предпочтительно, от 5 мг до приблизительно 25 мг сконструированного антитела по этому изобретению. Реальные способы получения парентерально вводимых композиций хорошо известны или должны быть очевидны специалистам и раскрыты более подробно, например, в Remington's Pharmaceutical Science, 15th ed., Mack Publishing Company, Easton,Pennsylvania. В отношении приготовления препаратов внутривенно вводимого антитела по изобретению см. Lasmar U and Parkins D "The formulation of Biopharmaceutical products", Pharma. Sci.Tech.today, page 129-137, Vol. 3 (3rd April 2000), Wang, W. "Instability, stabilisation and formulation of liquid protein pharmaceuticals", Int. J. Pharm 185 (1999) 129-188, Stability of Protein Pharmaceuticals Part A and В ed Ahem T.J.,Manning M.C., New York, NY: Plenum Press (1992), Akers.M.J. "Excipient-Drug interactions in Parenteralprotein-structure-stabilizing effect during freeze-drying", J Pharm. Pharmacol, 54 (2002) 1033-1039, Johnson, R,"Mannitol-sucrose mixtures - versatile formulations for protein lyophilization", J. Pharm. Sci, 91 (2002) 914922. Ha E, Wang W, Wang Y.J. "Peroxide formation in polysorbate 80 and protein stability", J. Pharm Sci, 91,2252-2264 (2002), полное содержание которых включено в данное описание конкретной ссылкой для читателя. Предпочтительным является то, что терапевтический агент по изобретению в фармацевтическом препарате присутствует в стандартной лекарственной форме. Подходящую терапевтически эффективную дозу могут легко определить специалисты в данной области техники. Для эффективного лечения инсульта и других неврологических заболеваний у человека одну дозу антагониста или антитела по изобретению вплоть до 700 мг на 70 кг массы тела следует вводить парентерально, предпочтительно внутривенно или внутримышечно. Такие дозы можно, если необходимо, вводить повторно через подходящие интервалы времени, выбранные врачом, как целесообразно. Как раскрыто в примерах, авторам настоящего изобретения удалось продемонстрировать положительный эффект на функциональное восстановление в описанной там модели на крысах, когда антитела по изобретению вводили внутривенно. Антитела, описанные здесь, можно лиофилизировать для хранения и можно перед применением разводить в подходящем носителе. Показано, что эта методика эффективна с общепринятыми иммуноглобулинами, и что можно использовать известные в данной области методики лиофилизации и разведения. Антитела по изобретению можно также использовать в комбинации (а именно одновременно, по- 14014291 следовательно или раздельно) с нейротрофическим фактором, таким как фактор роста нервов (NGF), например нейротрофическим фактором из головного мозга (BDNF), с противовоспалительными агентами,такими как кортикостероиды, и/или с тканевым активатором плазминогена (tPA). Комбинации антитела к NOGO по изобретению и, например, tPA можно оценивать в модели окклюзии средней церебральной артерии (МСАО), описанной ниже в примерах. В другом аспекте в этом изобретении предложена фармацевтическая композиция, содержащая антитело против NOGO по настоящему изобретению или его функциональный фрагмент и фармацевтически приемлемый носитель для лечения или профилактики инсульта и других неврологических заболеваний. В еще дополнительном аспекте в этом изобретении предложена фармацевтическая композиция, содержащая антитело против NOGO по настоящему изобретению или его функциональный фрагмент и фармацевтически приемлемый носитель для ингибирования нейродегенерации и/или стимулирования функционального восстановления у пациента-человека, страдающего инсультом или другим неврологическим заболеванием или имеющего риск его развития. В данном изобретении дополнительно предложен способ лечения или профилактики инсульта (в частности ишемического инсульта) и других неврологических заболеваний/расстройств, в частности болезни Альцгеймера, у человека, включающий введение указанному человеку, нуждающемуся в этом,эффективного количества антитела против NOGO или его функционального фрагмента. Антитела по изобретению можно использовать в способах лечения для замедления или остановки прогрессии и/или начала болезни Альцгеймера, в дополнение к (или в качестве альтернативы) лечению имеющегося заболевания у пациента-человека. Дополнительно в этом изобретении предложено применение антитела против NOGO или его функционального фрагмента в изготовлении лекарства для лечения или профилактики инсульта и других неврологических заболеваний/расстройств, в частности болезни Альцгеймера. В данном изобретении также предложен способ ингибирования нейродегенерации и/или стимулирования функционального восстановления у пациента-человека, страдающего инсультом или другим неврологическим заболеванием/расстройством, в частности болезнью Альцгеймера, или имеющего риск его развития, включающий введение указанному человеку, нуждающемуся в этом, эффективного количества антитела против NOGO или его функционального фрагмента. В дополнение, в этом изобретении предложено применение антитела против NOGO или его функционального фрагмента в изготовлении лекарства для ингибирования нейродегенерации и/или для стимулирования функционального восстановления у пациента-человека, пораженного инсультом и другим неврологическим заболеванием/расстройством, в частности болезнью Альцгеймера, или имеющего риск его развития. В данном изобретении дополнительно предложен способ лечения или профилактики инсульта или другого неврологического заболевания/расстройства, в частности болезни Альцгеймера у человека,включающий стадию парентерального введения терапевтически эффективного количества антитела против NOGO. Предпочтительно, антитело против NOGO вводят внутривенно. Неврологические заболевания или расстройства при использовании здесь включают, без ограничения, травматическое повреждение головного мозга, повреждение спинного мозга, лобно-височные деменции (тауопатии), периферическую невропатию, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз и, в частности, болезнь Альцгеймера. В данном изобретении также предложен способ стимулирования разрастания аксонов, включающий стадию приведения в контакт человеческого аксона с антителом против NOGO. Этот способ можно осуществлять in vitro или in vivo, предпочтительно, этот способ осуществляют in vivo. Таким образом, в дополнительном аспекте предложено применение антитела против NOGO по изобретению во внутривенно вводимой форме, в изготовлении лекарства для лечения инсульта (в частности ишемического инсульта), повреждения головного мозга, повреждения спинного мозга, лобно-височных деменций (тауопатий), периферической нейропатии, болезни Паркинсона, болезни Хантингтона, рассеянного склероза и, в частности, болезни Альцгеймера у пациента-человека. Таким образом, в дополнительном аспекте предложен способ лечения инсульта (в частности ишемического инсульта), повреждения головного мозга, повреждения спинного мозга, лобно-височных деменций (тауопатий), периферической нейропатии, болезни Паркинсона, болезни Хантингтона, рассеянного склероза и, в частности, болезни Альцгеймера у пациента-человека, включающий внутривенное введение терапевтически эффективного количества антитела против NOGO по изобретению. В дополнительном аспекте настоящего изобретения предложен способ стимулирования аксонального разрастания нейронов в центральной нервной системе субъекта-человека (например пациента),включающий введение (например внутривенное введение) терапевтически эффективного количества антитела против NOGO (например антитела против NOGO, содержащего CDR, как изложено здесь). В дополнительном аспекте настоящего изобретения предложено применение антитела противNOGO (например антитела против NOGO, содержащего CDR, как изложено здесь) в изготовлении внутривенно вводимого лекарства для лечения инсульта (в частности ишемического инсульта), повреждения- 15014291 головного мозга, повреждения спинного мозга, лобно-височных деменций (тауопатий), периферической нейропатии, болезни Паркинсона, болезни Хантингтона, рассеянного склероза и, в частности, болезни Альцгеймера у пациента-человека. В дополнительном аспекте этого изобретения предложен способ регенерации аксональных отростков в нейронах центральной нервной системы у пациента-человека, пораженного инсультом (в частности ишемическим инсультом), повреждением головного мозга, повреждением спинного мозга, лобновисочными деменциями (тауопатиями), периферической нейропатией, болезнью Паркинсона, болезнью Хантингтона, рассеянным склерозом и, в частности, болезнью Альцгеймера, (или подверженного им),включающий стадию введения (например внутривенного) терапевтически эффективного количества антитела против NOGO по настоящему изобретению. В дополнительном аспекте этого изобретения предложено применение антитела против NOGO по настоящему изобретению в изготовлении внутривенно вводимой фармацевтической композиции для регенерации аксональных отростков в нейронах центральной нервной системы у пациента-человека, пораженного инсультом (в частности ишемическим инсультом), повреждением головного мозга, повреждением спинного мозга, лобно-височными деменциями (тауопатиями), периферической нейропатией, болезнью Паркинсона, болезнью Хантингтона, рассеянным склерозом и, в частности, болезнью Альцгеймера (или подверженного им). При использовании здесь термин "функциональное восстановление" относится к двигательному,и/или сенсорному, и/или поведенческому улучшению у субъекта после, например, ишемического эпизода или повреждения или начала клинических симптомов. Функциональное восстановление у людей можно оценивать приборами, предназначенными для измерения элементарных неврологических функций, таких как двигательная сила, ощущение и координация, умственных способностей, таких как память, речевая функция и способность следовать указаниям, и функциональных возможностей, таких как основные активности повседневной жизни или инструментальные активности. Восстановление элементарных неврологических функций можно измерять такими средствами, как шкала инсульта Национального института здоровья (NIH Stroke Scale, NIHSS), восстановление умственной способности можно измерять с помощью нейропсихологических тестов, таких как Boston Naming Test, Trail-making Tests иCalifornia Verbal Learning Test, и активности повседневной жизни можно измерять такими средствами,как шкала ADCS/ADL (Клинические исследования болезни Альцгеймера/повседневных активностей) или Бристольская шкала повседневных активностей (Bristol Activity of Daily Living Scale), причем все эти тесты и шкалы известны в данной области. Пример 1. Конструирование и экспрессия гуманизированного антитела против NOGO. Мышиные и гуманизированные VH- и VL-конструкты получали de novo путем создания перекрывающихся олигонуклеотидов, включающих рестрикционные сайты для клонирования в экспрессионные векторы Rld и Rln млекопитающих, а также человеческую сигнальную последовательность. Рестрикционные сайты Hind III и Spe I вводили для обрамления VH-домена, содержащего сигнальную последовательность САМРАТН-1 Н для клонирования в Rld, содержащем человеческую мутированную 1 константную область. Рестрикционные сайты Hind III и BsiWI вводили для обрамления VL-домена, содержащего сигнальную последовательность САМРАТН-1 Н для клонирования в Rln, содержащем человеческую константную область каппа. Сигнальная последовательность САМРАТН-1 Н: Параллельно генерировали химерную версию 11 С 7 (см. WO 04/052932). Последовательность вариабельного домена тяжелой цепи (происходит из SEQ ID 43 из WO 04/052932) и последовательность вариабельного домена легкой цепи (происходит из SEQ ID 44 из WO 04/052932) получали de novo путем создания перекрывающихся олигонуклеотидов. Рестрикционные сайты Hind III и Spel вводили для обрамления VH-домена для клонирования в Rld, содержащем человеческую мутированную 1-константную область. Рестрикционные сайты HindIII и BsiWI вводили для обрамления VL-домена для клонирования вRln, содержащем человеческую константную область каппа. Пример 2. Экспрессия антитела в клетках СНО. Плазмидами Rld и Rln, кодирующими тяжелую и легкую цепь, соответственно, осуществляли временную котрансфекцию клеток СНО и экспрессировали в малом масштабе или крупном масштабе с получением антитела. Альтернативно, теми же плазмидами котрансфицировали клетки СНО путем электропорации и выбирали стабильную поликлональную популяцию клеток, экспрессирующих подходящее антитело, с использованием среды без нуклеозидов. В некоторых случаях определяли антитело, содержащееся в супернатанте, в других случаях рекомбинантное антитело извлекали и очищали аффинной хроматографией на Сефарозе с протеином А. Пример 3. Гуманизированное антитело против NOGO связывается с NOGO. Комплекс глутатион-S-трансферазы (GST) с человеческим NOGO-A56 (SEQ ID: 76) при 1 мкг/мл в забуференном фосфатом физиологическом растворе (PBS) наносили на планшеты Nunc Immunosorp (100 мкл в лунке) при 4 С в течение ночи. Лунки промывали один раз забуференным трисом физиологиче- 16014291 ским раствором (TBS) + 0,05% Tween (TBST), затем инкубировали с 2% бычьим сывороточным альбумином (BSA) в TBST для блокирования сайтов неспецифичного связывания при комнатной температуре в течение 1 часа. Антитела разбавляли в TBST + 2% BSA до 10 мкг/мл и из него делали разведения 1/2. Антитела добавляли в лунки в двух параллелях и инкубировали при комнатной температуре в течение 1 ч. Лунки промывали три раза TBST, затем инкубировали с конъюгатом пероксидазы и антител против человеческих каппа (1:2000) в течение 1 ч. Лунки промывали три раза TBST и затем инкубировали с 100 мкл субстрата для пероксидазы, представляющего собой OPD (Sigma), на лунку в течение 10 мин. Цветную реакцию останавливали добавлением 25 мкл концентрированной H2SO4. Оптическую плотность при 490 нм измеряли с использованием планшет-ридера. Фоновые величины, считываемые с лунок без антитела, вычитали. Фиг. 1-5 иллюстрируют зависимое от дозы связывание гуманизированных антител в сравнении с химерой (обозначена как HcLc, представляет собой химеру 2 А 10 (содержащую VH (SEQ ID NO. 7) и VL(SEQ ID NO. 8) мышиного 2A10 и константные области человеческого IgG с человеческим NOGO-A56(см. более подробно в примере 6) в анализе ELISA. Ось Y показывает измеренную оптическую плотность(OD) при 490 нм, являющуюся количественным показателем антитела, иммобилизованного в лунках. ОсьX показывает концентрацию антитела (мкг/мл), использованного в лунке для каждой точки данных. Антитела, используемые на фиг. 1, 3, 4 и 5, получали временной трансфекцией в малом масштабе. Уровни человеческих IgG в супернатанте количественно определяли в ELISA (пример 4). Для фиг. 2 использованный материал представлял собой очищенное антитело (см. пример 2), генерированное либо поликлональной экспрессионной системой, либо временными трансфекциями в крупном масштабе. В этих случаях уровни IgG количественно определяли в ELISA и по оптической плотности. В другом эксперименте антитела (в форме супернатанта культуры клеток СНО) получали временными трансфекциями в малом масштабе (в трех параллелях) для следующих гуманизированных антител:H16L16, H17L16, H18L16, H16L18 и химерное антитело HcLc. Результаты этого эксперимента соответствуют данным, представленным на фиг. 1-5, за исключением H17L16, которое действовало менее хорошо,чем показано на фиг. 1 А и 2. Хотя это наблюдение не удается объяснить, следует отметить, что этим заключениям противоречит другой эксперимент с веществом супернатанта (см. фиг. 1 А) и эксперимент с использованием очищенного вещества H17L16 (фиг. 2), оба эти эксперимента свидетельствуют о том,что H17L16 показывает связывание, сравнимое с другими оптимизированными вариантами. Пример 4. Протокол количественного определения антитела Планшеты Nunc Immunosorp покрывали иммобилизованным антителом Н 19 (козы против IgG-цепей человека, Sigma 13382) при 2 мкг/мл в бикарбонатном буфере (Sigma C3041) и инкубировали в течение ночи при 4 С. Планшеты промывали дважды TBS, содержащим 0,05% Tween 20 (TBST), и блокировали 200 мкл TBST, содержащим 2% BSA(блокирующий буфер) в течение 1 ч при комнатной температуре. Планшеты промывали дважды TBST. Супернатанты тканевой культуры, содержащие антитело, титровали по планшету с 2-кратными шагами разведения в блокирующем буфере и инкубировали при комнатной температуре в течение 1 ч. Планшеты промывали три раза TBST. Конъюгат пероксидазы хрена (HRP) с антителом Н 23 (козы против каппацепи человека, Sigma A7164) разбавляли в соотношении 1:2000 в TBST и добавляли по 100 мкл в каждую лунку. Планшеты инкубировали при комнатной температуре в течение 1 ч. Планшеты промывали три раза TBST и проявляли с использованием 100 мкл субстрата Fast-OPD (Sigma P9187). Окраске давали развиваться 5-10 мин, после чего ELISA останавливали, используя 25 мкл 3 М H2SO4. Считывали с планшета поглощение при 490 нм и определяли концентрацию антитела по стандартной кривой. Пример 5. Протокол конкурентного ELISA на антитело GST-человеческий NOGO-A56 (SEQ ID: 76) при 0,1-1,0 мкг/мл в PBS наносили на планшеты Nunc Immunosorp (100 мкл/лунка) при 4 С в течение ночи или при 37 С в течение 1 ч. Лунки промывали три раза PBS, затем инкубировали с 1%-ным BSA вPBS (блокирующий буфер) при комнатной температуре в течение 2 ч для блокирования сайтов неспецифичного связывания. Параллельно готовили смесь антител 50:50. Мышиное антитело 2 А 10 добавляли до конечной концентрации либо 0,5, либо 1,0 мкг/мл в блокирующий буфер. Химерные антитела (мышиные вариабельные области, клонированные в мутированную константную область Fc человеческого IgG1) добавляли до конечной концентрации 0-25 мкг/мл в блокирующий буфер. Удаляли блокирующий буфер из планшетов и добавляли 100 мкл смеси антител 50:50 на 1 ч при комнатной температуре. Лунки промывали три раза PBS, затем инкубировали со 100 мкл конъюгата пероксидазы с антимышиными поликлональными иммуноглобулинами кролика (разбавлены 1:2000 в блокирующем буфере, DakoCytomationP0260) в течение 1 ч при комнатной температуре. Лунки промывали три раза PBS и затем инкубировали с 100 мкл субстрата OPD для пероксидазы (Sigma P9187) или субстрата ТМВ (Sigma Т 8665) на лунку в течение 10-30 мин. Цветную реакцию останавливали добавлением 25 мкл концентрированной H2SO4. Оптическую плотность при 490 нм (OPD) или 450 нм (ТМВ) измеряли с использованием планшетридера. В первом эксперименте (фиг. 7 А) планшеты покрывали конъюгатом GST-человеческий NOGO-A56 при 0,5 мкг/мл в PBS в течение ночи при 4 С и проявляли планшеты субстратом ТМВ. В этом эксперименте мышиное антитело 2 А 10 оценивали в комбинации с HcLc (химерная форма 2 А 10), 11 С 7, изотипическим контролем на химерное антитело и пустым контролем. Во втором эксперименте (фиг. 7 В) планшеты покрывали- 17014291 конъюгатом GST-человеческий NOGO-A56 при 0,5 мкг/мл в PBS при 37 С в течение 1 ч и планшеты проявляли субстратом, представляющим собой OPD. В этом эксперименте мышиное антитело 2 А 10 оценивали в комбинации с HcLc, 11C7, изотипическим контролем и очищенным антителом H16L18. Пример 6. Получение фрагмента NOGO-A (NOGO-A56, SEQ ID NO: 76). Последовательность кДНК, кодирующую аминокислоты 586-785(IPTG) до 0,5 мМ при 37 С в течение 3 ч. Клеточный осадок лизировали ультразвуком и слитый белок очищали с использованием Глутатион-сефарозы (Amersham Pharmacia) по инструкциям изготовителя. Очищенный белок элюировали, используя восстановленный глутатион, подвергали глубокому диализу против PBS и определяли количественно с использованием стандарта BSA и анализа белка BioRad на основе кумасси и затем хранили в аликвотах при -80 С. Пример 7. Анализ BiaCore гуманизированных моноклональных антител против NOGO. Кинетику связывания очищенных моноклональных антител (mAb) против NOGO с рекомбинантно экспрессированным человеческим NOGO-A (GST-человеческий NOGO-A56) анализировали с использованием биосенсора BiaCore3000. Чип hNOGO-A получали следующим образом. СпособhNOGO (GST-человеческий NOGO-A56) иммобилизовали на чипе СМ 5 взаимодействием, представляющим собой сочетание первичного амина, с использованием программы BiaCore Wizard, предназначенной для достижения целевых уровней иммобилизации. Поверхность сенсора СМ 5 активировали пропусканием раствора 50 мМ N-гидроксисукцинимида (NHS) и 200 мМ N-этил-N'-диметиламинопропилкарбонида (EDC). Затем пропускали над чипом и иммобилизовали hNOGO в натрий-ацетатном буфере, рН 5,0 или рН 4,5. После полной иммобилизации любые все еще активированные сложные эфиры блокировали введением 1 М гидрохлорида этаноламина, рН 8,5. Антитело mAb против NOGO разбавляли в HBS-EP (10 мМ HEPES, рН 7,4, 150 мМ NaCl, 3 мМ ЭДТА, и 0,005% поверхностно-активного вещества Р-20) и проводили исследования связывания в диапазоне определенных концентраций антитела. Все анализы проводили против пустой контрольной поверхности сенсора (которая была активирована и блокирована как описано выше, но не имела добавленного лиганда). Анализ связывания осуществляли с использованием программного обеспечения для кинетического анализа BlAevaluation, версия 4,1. Анализ BiaCore с другими антителами по изобретению следовал в сущности тому же протоколу, как описано здесь. Результаты - таблица 8. Среднее (+/- стандартное отклонение) четырех отдельных экспериментов. Результаты - таблица 9. Показанные результаты получены в одном эксперименте, за исключениемHcLc и H6Lc, где показанные величины представляют собой среднее (+/- стандартное отклонение) двух отдельных экспериментов. Результаты - таблица 10. Показанные результаты представляют собой один эксперимент. Пример 8. Анализ BiaCore гуманизированных моноклинальных антител против NOGO с использованием ранжирования по скорости диссоциации. Чип с hNOGO приготавливали как для кинетического анализа. Клеточные супернатанты брали непосредственно из временных трансфекций клеток СНО-K1. Пропускали их прямо над поверхностью сенсора и измеряли взаимодействие. Супернатант ложно-трансфицированных клеток использовали для двойного контроля с целью избавления от любых артефактов из-за среды культуры ткани. Все анализы проводили против пустой контрольной поверхности сенсора (которая была активирована и блокирована как описано выше, но не имела добавленного лиганда). Анализ связывания осуществляли с использованием программного обеспечения для кинетического анализа BIAevaluation, версия 4/1. Результаты - таблица 11. Показанные результаты представляют собой один эксперимент, за исключением H6L13, H16L16, H16L18, H1L11, HcLc и H18L16, где показанные величины представляют собой среднее (+/- стандартное отклонение) двух или трех отдельных экспериментов.- 19014291 Пример 9. FACS-анализ гуманизированных моноклональных антител против NOGO. Клетки нейробластомы человека IMR32 ресуспендировали в буфере для окраски в FACS, представляющем собой PBS + 4% инактивированную нагреванием фетальную телячью сыворотку (FCS), при плотности 106 клеток на мл. Переносили 100 мкл этой суспензии в лунки 96-луночного круглодонного микропланшета. Добавляли к каждой лунке 100 мкл Среды A "FixPerm" (Caltag Laboratories,GASO01S-100) и инкубировали планшет при комнатной температуре в течение 15 мин. Клетки осаждали и промывали дважды буфером для окраски в FACS. После промывки клетки ресуспендировали в 50 мкл раствора очищенных антител против NOGO или соответствующих по изотипу контрольных антител при концентрации 2 х конечной концентрации (0-200 мкг/мл в буфере для окраски в FACS). Добавляли 50 мкл Среды Б "FixPerm" (Caltag Laboratories GASO02S-100) и инкубировали планшет на льду в течение 1 ч. Клетки промывали дважды буфером для окраски в FACS перед тем, как ресуспендировать в 100 мкл раствора конъюгата РЕ с F(ab')2 козы против человеческих 1 (Sigma P-8047) при разведении 1/50 или 1/100. Клетки инкубировали 1 ч на льду. Клетки осаждали и промывали 3 раза буфером для окраски в FACS и ресуспендировали в 100 мкл того же буфера. Добавляли 100 мкл Среды Б "FixPerm" для фиксации клеток для экспериментов, показанных на фиг. 6 и 13. Добавляли 100 мкл CellFIX от Becton Dickinson для фиксации клеток для экспериментов, показанных на фиг. 14. Степень окрашивания определяли проточной цитометрией с использованием проточного цитометра Becton Dickinson FACScan. Использовали контроли, соответствующие по изотипу. Результаты показаны на фиг. 6 А-Е. В совокупности показанные данные иллюстрируют то, что антитело HcLc (из 2 А 10) дает сильный сигнал в этом FACS-анализе, что свидетельствует о сильном связывании с человеческой клеткой, экспрессирующей NOGO. Эти данные также показывают, что гуманизированные версии этой химеры могут сохранять это свойство. Антитело H20L16 постоянно превосходит 11 С 7 в этом анализе, в то время как химерное антитело 2 А 10 и его другие гуманизированные версии постоянно либо превосходят 11 С 7, либо являются сравнимыми с ним в этом анализе. Пример 10. Дополнительные гуманизированные моноклональные антитела против NOGO. Следуя методикам, описанным в примерах 1 и 2, получили множество дополнительных моноклональных антител. Связывающую активность этих антител анализировали с использованием BiaCore,ELISA и FACS. 10.1 BiaCore. Данные по дополнительным антителам против NOGO на основании способов, описанных в примере 7, показаны ниже в табл. 13, 14, 15 и 17 (очищенное вещество антитела) и в табл. 16 (вещество супернатанта). Результаты - таблица 13. Показанные результаты представляют собой один эксперимент. В этом эксперименте величина, полученная для H16L16, была нетипичной для величин, полученных в других экспериментах (в типичных случаях проявляющих KD (нм) около 1 (см. табл. 8 и 10. Результаты - таблица 14. Показанные результаты представляют собой один эксперимент.- 20014291 Результаты - таблица 15. Показанные результаты представляют собой один эксперимент. Результаты - таблица 16. Показанные результаты представляют собой один эксперимент. Данные представляют собой ранжирование по скорости диссоциации для вещества супернатанта от временной трансфекции в малом масштабе. Таблица 17. Результаты представляют собой 12 независимых определений. Показанные данные представляют собой среднее и стандартное отклонение для 12 определений. 10.2. ELISA. Дополнительные данные по антителам против NOGO на основании способов, описанных в примере 3, показаны на фиг. 8-11. В некоторых из этих экспериментов использовали различные концентрации наносимого антигена (0,1-1,0 мкг/мл). Результаты - фиг. 8. Антиген NOGO нанесен при 1,0 мкг/мл. Результаты - фиг. 9. Антиген NOGO 5+6 нанесен при 0,1 мкг/мл. Результаты - фиг. 10. Антиген NOGO нанесен при 0,5 мкг/мл. Результаты фиг. 11. Антиген NOGO нанесен при 1,0 мкг/мл. Результаты: фиг. 12 А и Б, антиген GST-человеческийNOGO A56 нанесен при 1,0 мкг/мл. Связывание в ELISA вещества супернатанта от временной трансфекции в малом масштабе. 10.3. Внутриклеточный FACS. Дополнительные данные по FACS на основании способов, описанных в примере 9, показаны на фиг. 13. Дополнительные данные показаны на фиг. 14 А-В. На фиг. 14 А представлены данные для един- 21014291 ственной точки данных для каждой пробы. На фиг. 14 А и 14 Б представлены средние от двух параллельных проб. Пример 11. Анализ BiaCore в обращенном формате для гуманизированных моноклональных антител против NOGO. Кинетику связывания очищенных моноклональных антител (mAb) против NOGO с рекомбинантно экспрессированным человеческим NOGO-A (GST-человеческий NOGO-A56) анализировали с использованием BiaCore T100. Чип приготавливали следующим образом. Способ Кинетический анализ BiaCore гуманизированных антител против NOGO осуществляли с использованием захвата антител-кандидатов Протеином А. Вкратце, Протеин А иммобилизовали на чипе СМ 5 путем взаимодействия, представляющего собой сочетание с первичным амином, используя стандартные способы сочетания, до плотностей около 3000-4000 резонансных единиц (RU) с использованием алгоритма иммобилизации, встроенного в программное обеспечение для оборудования. Затем пропускали гуманизированное антитело над поверхностью с Протеином А и проводили захват до уровней около 200400 RU, после периода стабилизации пропускали над поверхностью с иммобилизованным антителом человеческий NOGO 5+6 GST при определенных концентрациях и получали сенсограммы связывания. Кислотная регенерация (100 мМ H3PO4 или 10 мМ глицин при рН 1,5) приводила к полному удалению иммобилизованного антитела с поверхности с Протеином А и не снижала значительно связывающую способность поверхностей. Все кривые были против двойного контроля, представляющего собой введение буфера вместо человеческого NOGO 5+6 GST, и данные были аппроксимированы моделью связывания 1:1 с использованием параметров глобальной аппроксимации в аналитическом программном обеспечении BiaCore T100 v 1.1. Все эксперименты осуществляли на приборе Т 100. Таблица 18. Показанные результаты представляют собой среднее и стандартное отклонение для 5 или 6 независимых определений Обзор по последовательностям антител против NOGO (табл. 12)
МПК / Метки
МПК: C07K 16/18, A61P 19/10, C07K 16/22, C12N 15/63, A61P 25/28, A61K 39/395
Метки: антитела, специфичные, отношении, гуманизированные, nogo-a, фармацевтические, применения
Код ссылки
<a href="https://eas.patents.su/30-14291-gumanizirovannye-antitela-specifichnye-v-otnoshenii-nogo-a-i-ih-farmacevticheskie-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Гуманизированные антитела, специфичные в отношении nogo-a, и их фармацевтические применения</a>
Предыдущий патент: Способ получения пастообразующих (со)полимеров винилхлорида
Следующий патент: Лечебно-профилактическое средство, обладающее антибактериальным и спермицидным действием
Случайный патент: Фармацевтический состав, содержащий карбонат лантана (варианты)












