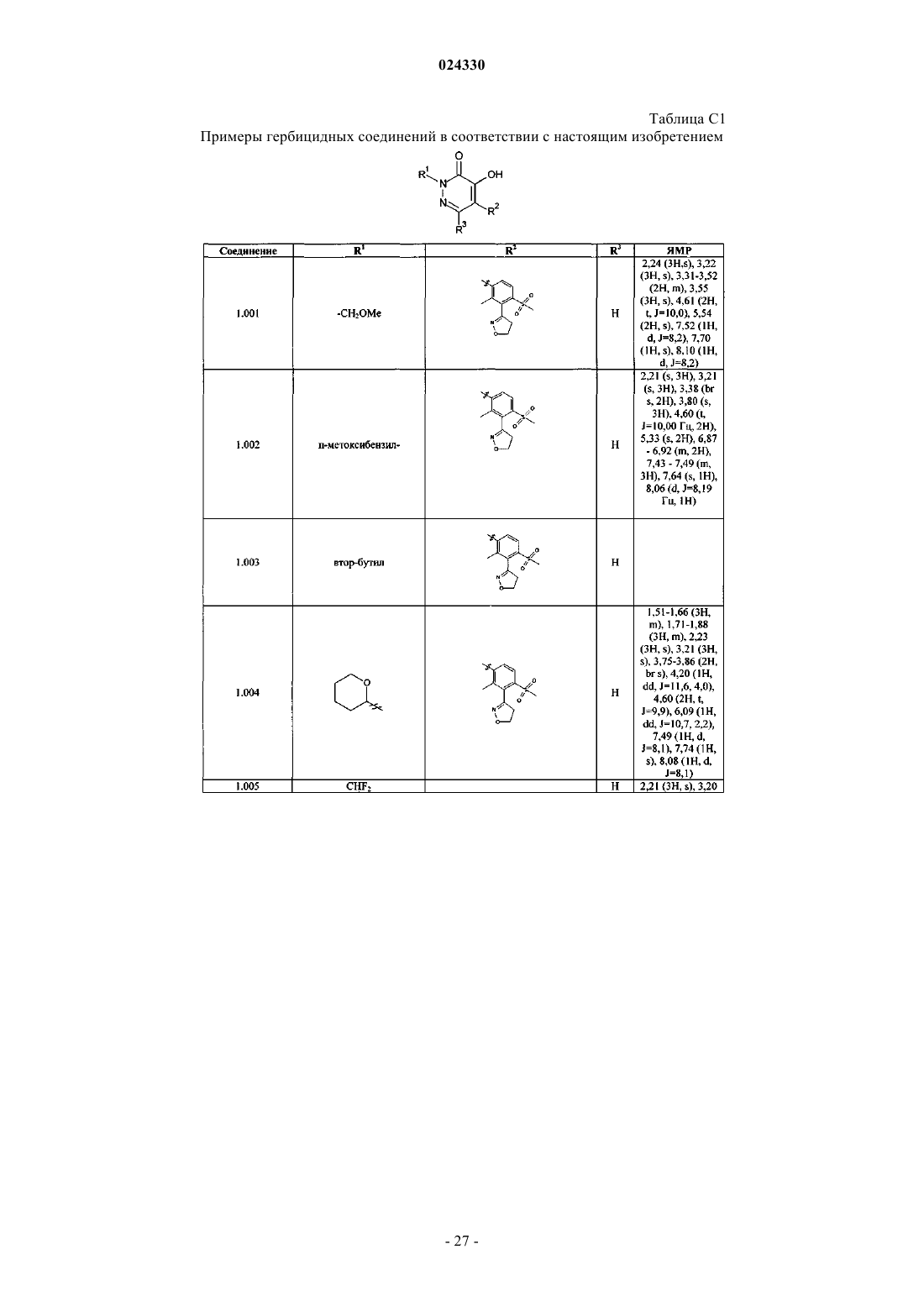
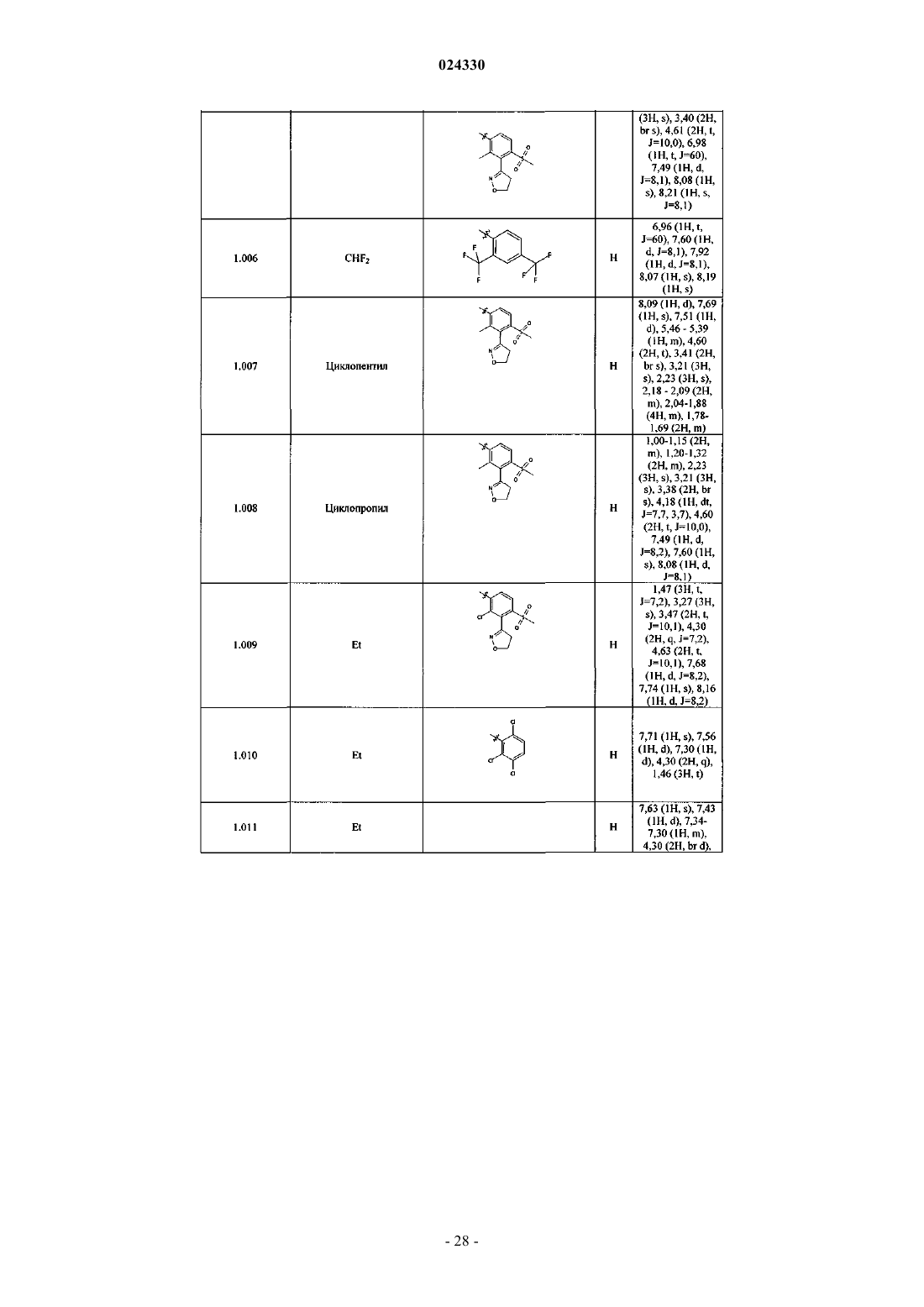
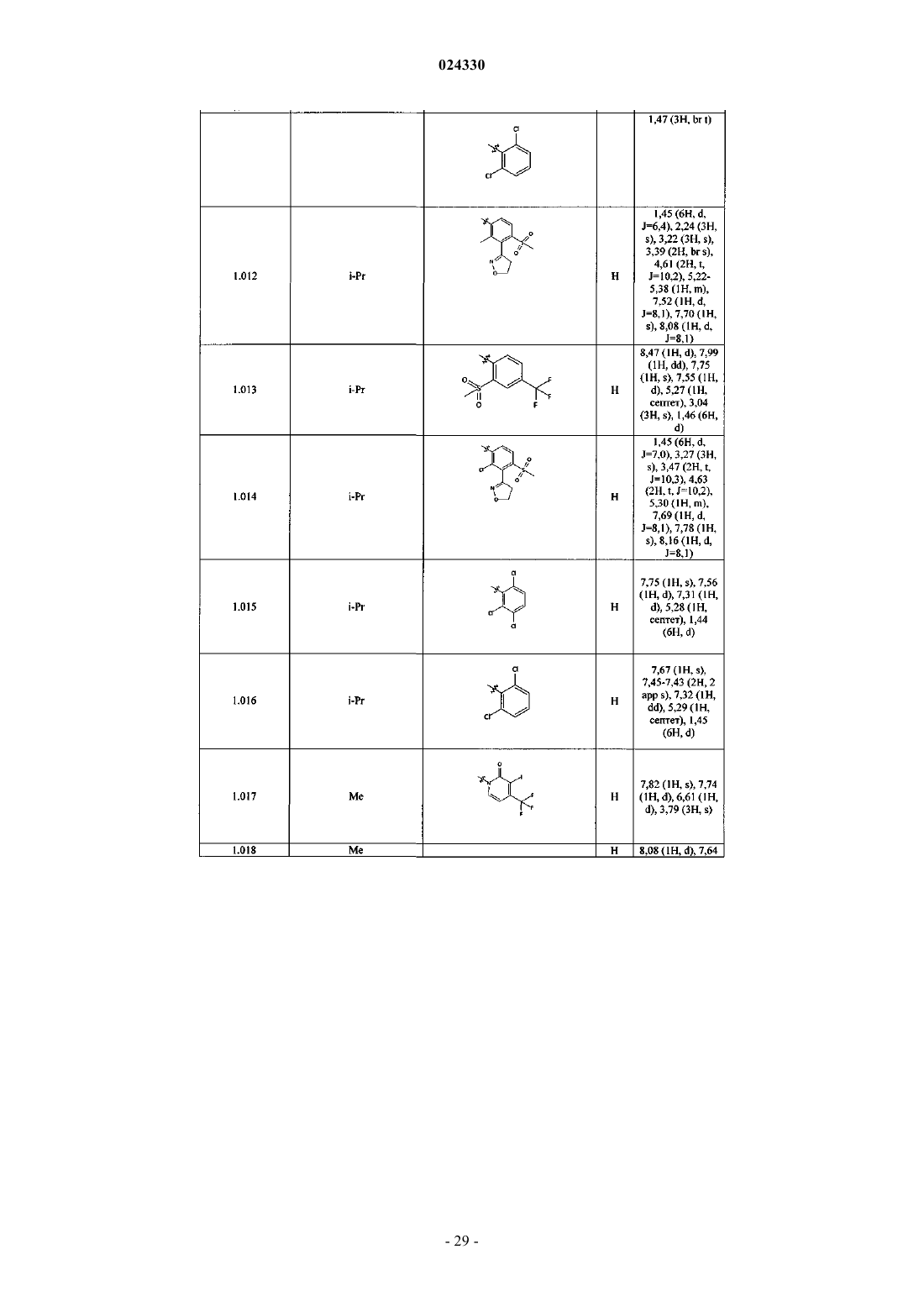
Гербицидные соединения
Номер патента: 24330
Опубликовано: 30.09.2016
Авторы: Эллиотт Алисон Клэр, Моррис Джеймс Алан, Линг Кеннет, Бхоноан Юнас, Голье Стивен, Митчелл Глинн, Винер Рассел Колин, Рсепа Паула Роча
Формула / Реферат
1. Соединение формулы (I)
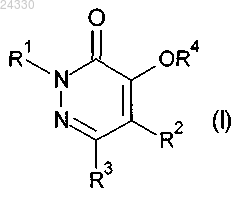
или его агрономически приемлемая соль,
где R1 выбран из группы, состоящей из водорода, C1-C6-алкила, C3-C6-циклоалкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-галогеналкила, C1-C6-алкокси-C1-C3-алкила, C3-C6-циклоалкил-C1-C3-алкила-, тетрагидропиранила- и бензила-, где бензил необязательно замещен одним или несколькими R11;
R2 выбран из группы, состоящей из (A1), (A2) и (A3):
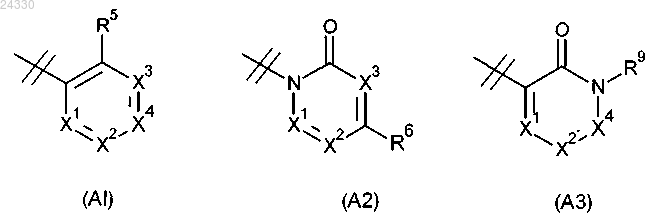
где X1 представляет собой N или CR7;
X2 представляет собой N или CR8;
X3 представляет собой N или CR9;
X4 представляет собой N или CR6;
R3 выбран из группы, состоящей из водорода, галогено, нитро, амино, циано, C1-C6-алкила, C1-C3-алкокси-, C3-C6-циклоалкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-галогеналкила, C1-C6-алкокси-C1-C3-алкила, C3-C6-циклоалкил-C1-C3-алкила, C1-C6-алкил-S(О)p-, C1-C6-алкил-S(О)р-C1-C3-алкила, C1-C6-галогеналкил-S(О)p-, C1-C3-алкиламино, C1-C3-диалкиламино и C1-C6-галогеналкил-S(О)р-C1-C3-алкила;
R4 выбран из группы, состоящей из водорода, C1-C6-алкилкарбонила-, арилкарбонила-, C1-C6-алкоксикарбонила-, C1-C6-алкил-S(О)p-, C1-C6-алкил-S(О)p-карбонила- и арил-S(О)р-, где указанные арильные группы необязательно могут быть замещены одним или несколькими R11;
R5 выбран из группы, состоящей из гидроксила, галогена, C1-C6-алкила, C1-C6-циклоалкила, C1-C6-галогеналкила, C2-C6-алкенила, C2-C6-галогеналкенила, C2-C6-алкинила, C1-C6-алкокси-, C2-C6-алкенилокси-, C3-C6-циклоалкил-C1-C3-алкила-, С1-С6-алкокси-C1-C3-алкила-, C1-C6-алкокси-C2-C6-алкокси-, C1-C6-алкокси-C2-C6-алкокси-C1-C3-алкила-, C1-C6-галогеналкокси-, C1-C6-галогеналкокси-C1-C3-алкила-, C1-C6-алкил-S(О)p-, C1-C6-галогеналкил-S(О)p-, арила, арил-S(О)р-, гетероциклила, гетероциклил-S(О)р-, арилокси-, арил-C2-C6-алкила-, арил-C1-C6-алкокси-, гетероциклилокси-, гетероциклил-C1-C3-алкокси-C1-C3-алкила-, гидроксикарбонила, гидроксикарбонил-C1-C3-алкокси-, C1-C3-алкоксикарбонила-, С1-С3-алкоксикарбонил-C1-C3-алкокси-, C1-C3-алкиламино-, C1-C3-диалкиламино-, C1-C3-алкиламино-S(О)p-, C1-C3-алкиламино-S(О)р-C1-C3-алкила-, C1-C3-диалкиламино-S(О)p-, C1-C3-диалкиламино-S(О)р-C1-C3-алкила-, C1-C3-алкиламинокарбонила-, C1-C3-алкиламинокарбонил-C1-C3-алкила-, C1-C3-диалкиламинокарбонила-, C1-C3-диалкиламинокарбонил-C1-C3-алкила-, C1-C3-алкилкарбониламино-, C1-C3-алкил-S(О)р-амино-, C1-C3-алкил-S(О)p-C1-C3-алкиламино-, C1-C3-алкил-S(О)р-амино-C1-C3-алкила-, циано и нитро, где указанные гетероциклилы представляют собой 5- или 6-членные гетероциклилы, содержащие от одного до трех гетероатомов, каждый из которых независимо выбран из группы, состоящей из кислорода, азота и серы, и где арильные или гетероциклильные компоненты необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогено, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси, C1-C6-алкил-S(О)p-, фенила, циано и нитро;
R6 и R9 независимо выбраны из группы, состоящей из водорода, гидроксила, галогена, C1-C6-алкила, C1-C6-циклоалкила, C1-C6-галогеналкила, C2-C6-алкенила, C2-C6-галогеналкенила, C2-C6-алкинила, C1-C6-алкокси-, C2-C6-алкенилокси-, C3-C6-циклоалкил-C1-C3-алкила-, C1-C6-алкокси-C1-C3-алкила-, C1-C6-алкокси-C2-C6-алкокси-, C1-C6-алкокси-C2-C6-алкокси-C1-C3-алкила-, C1-C6-галогеналкокси-, C1-C6-галогеналкокси-C1-C3-алкила-, C1-C6-алкил-S(О)p-, C1-C6-галогеналкил-S(О)p-, арила, арил-S(О)р-, гетероциклила, гетероциклил-S(О)р-, арилокси-, арил-C2-C6-алкила-, арил-C1-C6-алкокси-, гетероциклилокси-, гетероциклил-C1-C3-алкокси -C1-C3-алкила-, гидроксикарбонила, гидроксикарбонил-C1-C3-алкокси-, C1-C3-алкоксикарбонила-, C1-C3-алкоксикарбонил-C1-C3-алкокси-, C1-C3-алкиламино-, C1-C3-диалкиламино-, C1-C3-алкиламино-S(О)p-, C1-C3-алкиламино-S(О)p-C1-C3-алкила-, C1-C3-диалкиламино-S(О)p-, C1-C3-диалкиламино-S(О)p-C1-C3-алкила-, С1-С3-алкиламинокарбонила-, C1-C3-алкиламинокарбонил-C1-C3-алкила-, C1-C3-диалкиламинокарбонила-, C1-C3-диалкиламинокарбонил-C1-C3-алкила-, C1-C3-алкилкарбониламино-, C1-C3-алкил-S(О)р-амино-, C1-C3-алкил-S(О)p-C1-C3-алкиламино-, C1-C3-алкил-S(О)р-амино-C1-C3-алкила-, циано и нитро, где указанные гетероциклилы представляют собой 5- или 6-членные гетероциклилы, содержащие от одного до трех гетероатомов, каждый из которых независимо выбран из группы, состоящей из кислорода, азота и серы, и где арильные или гетероциклильные компоненты необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогено, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси, C1-C6-алкил-S(О)p-, фенила, циано и нитро;
R7 и R8 независимо выбраны из группы, состоящей из водорода, галогена, C1-C3-алкила-, C1-C3-алкокси-, C2-C3-алкенила-, C2-C3-алкинила-, C1-C3-галогеналкила- и C1-C3-галогеналкокси-;
R5 и R9 вместе могут образовывать насыщенное или ненасыщенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, при этом указанное гетероциклическое кольцо содержит один или несколько гетероатомов азота и/или кислорода, причем 5- или 6-членное кольцо необязательно является замещенным одним или несколькими R12; или
R6 и R9 вместе могут образовывать насыщенное или ненасыщенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, при этом указанное гетероциклическое кольцо содержит один или несколько гетероатомов, выбранных из группы, состоящей из азота, кислорода и S(O)2, причем 5- или 6-членное кольцо необязательно является замещенным одним или несколькими R12; или
R6 и R8 вместе могут образовывать насыщенное или ненасыщенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, при этом указанное гетероциклическое кольцо содержит один или несколько гетероатомов азота, причем 5- или 6-членное кольцо необязательно является замещенным одним или несколькими R13;
R11 выбран из группы, состоящей из галогено-, C1-C3-алкила, C1-C3-галогеналкила и C1-C6-алкокси;
R12 выбран из группы водорода, циано, галогено-, окси-, C1-C3-алкил-S(О)р-, C1-C3-алкила, C2-C3-алкенила, C2-C3-алкинила, C1-C3-алкокси и C1-C3-галогеналкила;
R13 выбран из группы водорода, циано, галогено-, C1-C3-алкил-S(О)р-, C1-C3-алкила, C2-C3-алкенила, C2-C3-алкинила, морфолинила- и C1-C3-галогеналкила;
р=0, 1 или 2;
где соединение формулы (I) не представляет собой 2-(1-бензил-5-гидрокси-6-оксо-1,6-дигидропиридазин-4-ил)бензойную кислоту.
2. Соединение по п.1, где R3 и/или R4 представляет собой водород.
3. Соединение по п.1 или 2, где R2 выбран из группы, состоящей из (А1a), (А1b), (А1c), (А1d), (А1e), (А1f), (А1g), (А1h), (А2a), (А2b), (А3а), (А3b) и (А3с):
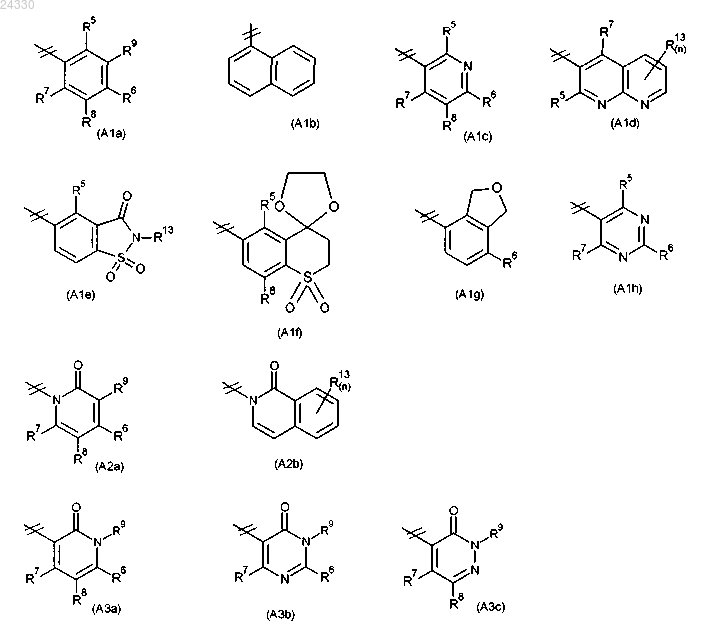
где R5, R6, R7, R8, R9 и R13 определены выше и n равняется 0, 1, 2 или 3.
4. Соединение по п.3, где R2 представляет собой (А1a).
5. Соединение по любому из предыдущих пунктов, где R5 выбран из группы, состоящей из гидроксила, галогено, C1-C6-алкила, C1-C6-циклоалкила, C1-C6-галогеналкила, C1-C6-алкокси, C1-C6-алкокси-C1-C3-алкила, C1-C6-алкокси-C2-C6-алкокси-C1-C3-алкила, C1-C6-галогеналкокси-C1-C3-алкила, C1-C6-алкил-S(О)p-, арила, арилокси, гетероциклил-C1-C3-алкокси-C1-C3-алкила, C1-C3-диалкиламино-, C1-C3-алкил-S(О)р-амино-C1-C3-диалкила, циано и нитро.
6. Соединение по п.5, где R5 выбран из группы, состоящей из хлора, фтора, метила, трифторметила, 2-фторэтила-, метоксиэтоксиметила-, трифторметоксиметила-, метил-S(O)р-, арила, изоксазолинила, морфолинила, метил-S(О)р-диметиламино-, циано и нитро, где арильные или гетероциклильные компоненты необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из хлора, метила или трифторметила.
7. Соединения по любому из предыдущих пунктов, где R6 выбран из группы, состоящей из водорода, галогена, C1-C6-алкила, C1-C6-галогеналкила, C1-C6-алкил-S(O)p-, C2-C6-алкенила и C2-C6-алкинила.
8. Соединение по любому из предыдущих пунктов, где R7 и R8 независимо выбраны из группы, состоящей из водорода, галогена и C1-C3-алкила-.
9. Соединение по любому из предыдущих пунктов, где R9 выбран из группы, состоящей из водорода, галогена, C1-C6-алкила, C1-C6-галогеналкила, C1-C6-алкил-S(O)p-, C2-C6-алкенила и C2-C6-алкинила.
10. Гербицидная композиция, содержащая гербицидное соединение по любому из предыдущих пунктов и приемлемое с точки зрения сельского хозяйства вспомогательное средство для составления.
11. Гербицидная композиция по п.10, дополнительно содержащая по меньшей мере один дополнительный пестицид.
12. Гербицидная композиция по п.11, где дополнительный пестицид представляет собой гербицид или антидот гербицида.
13. Способ борьбы с сорняками, включающий в месте их прорастания достаточного для контроля сорняков количества композиции по любому из пп.10-12.
14. Применение соединения формулы (I)
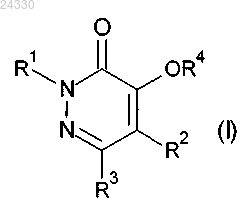
или его агрономически приемлемой соли,
где R1 выбран из группы, состоящей из водорода, C1-C6-алкила, C3-C6-циклоалкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-галогеналкила, C1-C6-алкокси-C1-C3-алкила, C3-C6-циклоалкил-C1-C3-алкила-, тетрагидропиранила- и бензила-, где бензил необязательно замещен одним или несколькими R11;
R2 выбран из группы, состоящей из (А1), (А2) и (А3):
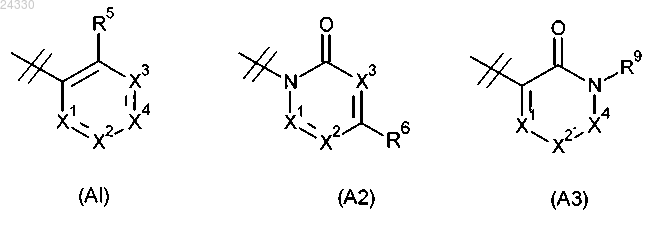
где X1 представляет собой N или CR7;
X2 представляет собой N или CR8;
X3 представляет собой N или CR9;
X4 представляет собой N или CR6;
R3 выбран из группы, состоящей из водорода, галогено, нитро, амино, циано, C1-C6-алкила, C1-C3-алкокси-, C3-C6-циклоалкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-галогеналкила, C1-C6-алкокси-C1-C3-алкила, C3-C6-циклоалкил-C1-C3-алкила, C1-C6-алкил-S(О)р-, C1-C6-алкил-S(О)р-C1-C3-алкила, C1-C6-галогеналкил-S(О)p-, C1-C3-алкиламино, C1-C3-диалкиламино и C1-C6-галогеналкил-S(О)p-C1-C3-алкила;
R4 выбран из группы, состоящей из водорода, C1-C6-алкилкарбонила-, арилкарбонила-, C1-C6-алкоксикарбонила-, C1-C6-алкил-S(О)p-, C1-C6-алкил-S(О)р-карбонила- и арил-S(О)р-, где указанные арильные группы необязательно могут быть замещены одним или несколькими R11;
R5 выбран из группы, состоящей из гидроксила, галогена, C1-C6-алкила, C1-C6-циклоалкила, C1-C6-галогеналкила, C2-C6-алкенила, C2-C6-галогеналкенила, C2-C6-алкинила, C1-C6-алкокси-, C2-C6-алкенилокси-, C3-C6-циклоалкил-C1-C3-алкила-, C1-C6-алкокси-C1-C3-алкила-, C1-C6-алкокси-C2-C6-алкокси-, C1-C6-алкокси-C2-C6-алкокси-C1-C3-алкила-, C1-C6-галогеналкокси-, C1-C6-галогеналкокси-С1-С3-алкила-, C1-C6-алкил-S(О)p-, C1-C6-галогеналкил-S(О)р-, арила, арил-S(О)р-, гетероциклила, гетероциклил-S(О)р-, арилокси-, арил-C2-C6-алкила-, арил-C1-C6-алкокси-, гетероциклилокси-, гетероциклил-C1-C3-алкокси-C1-C3-алкила-, гидроксикарбонила, гидроксикарбонил-C1-C3-алкокси-, C1-C3-алкоксикарбонила-, С1-С3-алкоксикарбонил-C1-C3-алкокси-, C1-C3-алкиламино-, C1-C3-диалкиламино-, C1-C3-алкиламино-S(О)p-, C1-C3-алкиламино-S(О)р-C1-C3-алкила-, C1-C3-диалкиламино-S(О)p-, C1-C3-диалкиламино-S(О)р-C1-C3-алкила-, C1-C3-алкиламинокарбонила-, C1-C3-алкиламинокарбонил-C1-C3-алкила-, C1-C3-диалкиламинокарбонила-, C1-C3-диалкиламинокарбонил-C1-C3-алкила-, C1-C3-алкилкарбониламино-, C1-C3-алкил-S(О)р-амино-, C1-C3-алкил-S(О)p-C1-C3-алкиламино-, C1-C3-алкил-S(О)р-амино-C1-C3-алкила-, циано и нитро, где указанные гетероциклилы представляют собой 5- или 6-членные гетероциклилы, содержащие от одного до трех гетероатомов, каждый из которых независимо выбран из группы, состоящей из кислорода, азота и серы, и где арильные или гетероциклильные компоненты необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогено, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси, C1-C6-алкил-S(О)p-, фенила, циано и нитро;
R6 и R9 независимо выбраны из группы, состоящей из водорода, гидроксила, галогена, C1-C6-алкила, C1-C6-циклоалкила, C1-C6-галогеналкила, C2-C6-алкенила, C2-C6-галогеналкенила, C2-C6-алкинила, C1-C6-алкокси-, C2-C6-алкенилокси-, C3-C6-циклоалкил-C1-C3-алкила-, C1-C6-алкокси-C1-C3-алкила-, C1-C6-алкокси-C2-C6-алкокси-, C1-C6-алкокси-C2-C6-алкокси-C1-C3-алкила-, C1-C6-галогеналкокси-, C1-C6-галогеналкокси-C1-C3-алкила-, C1-C6-алкил-S(O)p-, C1-C6-галогеналкил-S(О)p-, арила, арил-S(О)р-, гетероциклила, гетероциклил-S(О)р-, арилокси-, арил-C2-C6-алкила-, арил-C1-C6-алкокси-, гетероциклилокси-, гетероциклил-C1-C3-алкокси-C1-C3-алкила-, гидроксикарбонила, гидроксикарбонил-C1-C3-алкокси-, C1-C3-алкоксикарбонила-, C1-C3-алкоксикарбонил-C1-C3-алкокси-, C1-C3-алкиламино-, C1-C3-диалкиламино-, C1-C3-алкиламино-S(О)p-, C1-C3-алкиламино-S(О)p-C1-C3-алкила-, C1-C3-диалкиламино-S(О)p-, C1-C3-диалкиламино-S(О)p-C1-C3-алкила-, C1-C3-алкиламинокарбонила-, C1-C3-алкиламинокарбонил-C1-C3-алкила-, C1-C3-диалкиламинокарбонила-, C1-C3-диалкиламинокарбонил-C1-C3-алкила-, C1-C3-алкилкарбониламино-, C1-C3-алкил-S(О)р-амино-, C1-C3-алкил-S(О)p-C1-C3-алкиламино-, C1-C3-алкил-S(О)р-амино-C1-C3-алкила-, циано и нитро, где указанные гетероциклилы представляют собой 5- или 6-членные гетероциклилы, содержащие от одного до трех гетероатомов, каждый из которых независимо выбран из группы, состоящей из кислорода, азота и серы, и где арильные или гетероциклильные компоненты необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогено, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси, C1-C6-алкил-S(О)p-, фенила, циано и нитро;
R7 и R8 независимо выбраны из группы, состоящей из водорода, галогена, C1-C3-алкила-, C1-C3-алкокси-, C2-C3-алкенила-, C2-C3-алкинила-, C1-C3-галогеналкила- и C1-C3-галогеналкокси-;
R5 и R9 вместе могут образовывать насыщенное или ненасыщенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, при этом указанное гетероциклическое кольцо содержит один или несколько гетероатомов азота и/или кислорода, причем 5- или 6-членное кольцо необязательно является замещенным одним или несколькими R12; или
R6 и R9 вместе могут образовывать насыщенное или ненасыщенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, при этом указанное гетероциклическое кольцо содержит один или несколько гетероатомов, выбранных из группы, состоящей из азота, кислорода и S(O)2, причем 5- или 6-членное кольцо необязательно является замещенным одним или несколькими R12; или
R6 и R8 вместе могут образовывать насыщенное или ненасыщенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, при этом указанное гетероциклическое кольцо содержит один или несколько гетероатомов азота, причем 5- или 6-членное кольцо необязательно является замещенным одним или несколькими R13;
R11 выбран из группы, состоящей из галогено-, C1-C3-алкила, C1-C3 галогеналкила и C1-C6-алкокси;
R12 выбран из группы водорода, циано, галогено-, окси-, C1-C3-алкил-S(О)р-, C1-C3-алкила, C2-C3-алкенила, C2-C3-алкинила, C1-C3-алкокси и C1-C3-галогеналкила;
R13 выбран из группы водорода, циано, галогено-, C1-C3-алкил-S(О)р-, C1-C3-алкила, C2-C3-алкенила, C2-C3-алкинила, морфолинила- и C1-C3-галогеналкила;
р=0, 1 или 2,
в качестве гербицида.
Текст
Бхоноан Юнас, Эллиотт Алисон Клэр,Голье Стивен, Линг Кеннет, Митчелл Глинн, Моррис Джеймс Алан, Рсепа Паула Роча, Винер Рассел Колин (GB) или к его агрономически приемлемой соли, где R2 выбран из группы, состоящей из A1, A2 и A3:N или CR9; X4 представляет собой N или CR6; R1, R3, R4, R5, R6, R7, R8 и R9 определены в настоящем документе. Изобретение, кроме того, относится к гербицидным композициям, которые содержат соединение формулы (I), и к их применению для борьбы с сорняками, в частности, среди сельскохозяйственных культур полезных растений. Настоящее изобретение относится к новым производным пиридазинона, способам их получения,гербицидным композициям, которые содержат новые производные, и к их применению для борьбы с сорняками, в частности среди сельскохозяйственных культур полезных растений, или для подавления роста растений. Таким образом, в соответствии с настоящим изобретением представлено соединение формулы (I) или его агрономически приемлемая соль,где R1 выбран из группы, состоящей из водорода, C1-C6-алкила, C3-C6-циклоалкила, C2-C6-алкенила,C2-C6-алкинила, C1-C6-галогеналкила, C1-C6-алкокси-C1-C3-алкила, C3-C6-циклоалкил-C1-C3-алкила-, тетрагидропиранила- и бензила-, где бензил необязательно замещен одним или несколькими R11;R4 выбран из группы, состоящей из водорода, C1-C6-алкилкарбонила-, арилкарбонила-,C1-C6-алкоксикарбонила-, C1-C6-алкил-S(О)p-, C1-C6-алкил-S(О)р-карбонила- и арил-S(O)p-, где указанные арильные группы необязательно могут быть замещены одним или несколькими R11;R5 выбран из группы,состоящей из гидроксила,галогена,C1-C6-алкила,C1-C6-циклоалкила, C1-C6-галогеналкила, C2-C6-алкенила, C2-C6-галогеналкенила, C2-C6-алкинила,C1-C6-алкокси-, C2-C6-алкенилокси-, C3-C6-циклоалкил-C1-C3-алкила-, C1-C6-алкокси-C1-C3-алкила-,C1-C6-алкокси-C2-C6-алкокси-,С 1-С 6-алкокси-C2-C6-алкокси-C1-C3-алкила-,C1-C6-галогеналкокси-,C1-C6-галогеналкокси-C1-C3-алкила-, C1-C6-алкил-S(О)p-, C1-C6-галогеналкил-S(О)p-, арила, арил-S(О)р-,гетероциклила, гетероциклил-S(О)р-, арилокси-, арил-C2-C6-алкила-, арил-C1-C6-алкокси-, гетероциклилокси-, гетероциклил-C1-C3-алкокси-C1-C3-алкила-, гидроксикарбонила, гидроксикарбонил-C1-C3 алкокси-,C1-C3-алкоксикарбонила-,С 1-С 3-алкоксикарбонил-C1-C3-алкокси-,C1-C3-алкиламино-,C1-C3-диалкиламино-, C1-C3-алкиламино-S(О)p-, C1-C3-алкиламино-S(О)p-C1-C3-алкил-, C1-C3-диалкиламино-S(О)p-, C1-C3-диалкиламино-S(О)р-C1-C3-алкила-, C1-C3-алкиламинокарбонила-, C1-C3-алкиламинокарбонил-C1-C3-алкила-, C1-C3-диалкиламинокарбонила-, C1-C3-диалкиламинокарбонил-C1-C3-алкила-,C1-C3-алкилкарбониламино-,C1-C3-алкил-S(О)р-амино-,C1-C3-алкил-S(О)p-C1-C3-алкиламино-,C1-C3-алкил-S(О)р-амино-C1-C3-алкила-, циано и нитро, где указанные гетероциклилы представляют собой 5- или 6-членные гетероциклилы, содержащие от одного до трех гетероатомов, каждый из которых независимо выбран из группы, состоящей из кислорода, азота и серы, и где арильные или гетероциклильные компоненты необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-алкокси,C1-C3-галогеналкокси, C1-C6-алкил-S(О)p-, фенила, циано и нитро;R6 и R9 независимо выбраны из группы, состоящей из водорода, гидроксила, галогена,C1-C6-алкила, C1-C6-циклоалкила, C1-C6-галогеналкила, C2-C6-алкенила, C2-C6-галогеналкенила,C1-C6-алкокси-,C2-C6-алкенилокси-,C3-C6-циклоалкил-C1-C3-алкила-,C2-C6-алкинила,C1-C6-алкокси-C1-C3-алкила-, C1-C6-алкокси-C2-C6-алкокси-, C1-C6-алкокси-C2-C6-алкокси-C1-C3-алкила-,C1-C6-галогеналкокси-, C1-С 6-галогеналкокси-C1-C3-алкила-, C1-C6-алкил-S(О)p-, C1-C6-галогеналкилS(О)p-, арила, арил-S(O)р-, гетероциклила, гетероциклил-S(О)р-, арилокси-, арил-C2-C6-алкила-,арила-C1-C6-алкокси-, гетероциклилокси-, гетероциклил-C1-C3-алкокси-C1-C3-алкила-, гидроксикарбонила, гидроксикарбонил-C1-C3-алкокси-, C1-C3-алкоксикарбонила-, C1-C3-алкоксикарбонил-C1-C3-алкокси-,C1-C3-алкиламино-, C1-C3-диалкиламино-, C1-C3-алкиламино-S(О)p-, C1-C3-алкиламино-S(О)p-C1-C3-1 024330 алкила-, C1-C3-диалкиламино-S(О)p-, C1-C3-диалкиламино-S(О)p-C1-C3-алкила-, C1-C3-алкиламинокарбонила-, C1-C3-алкиламинокарбонил-C1-C3-алкила-, C1-C3-диалкиламинокарбонила-, C1-C3-диалкиламинокарбонил-C1-C3-алкила-, C1-C3-алкилкарбониламино-, C1-C3-алкил-S(О)р-амино-, C1-C3-алкилS(О)p-C1-C3-алкиламино-, C1-C3-алкил-S(О)р-амино-C1-C3-алкила-, циано и нитро, где указанные гетероциклилы представляют собой 5- или 6-членные гетероциклилы, содержащие от одного до трех гетероатомов, каждый из которых независимо выбран из группы, состоящей из кислорода, азота и серы, и где арильные или гетероциклильные компоненты необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-C3-алкила, C1-C3-галогеналкила,C1-C3-алкокси, C1-C3-галогеналкокси, C1-C6-алкил-S(O)p-, фенила, циано и нитро;R7 и R8 независимо выбраны из группы, состоящей из водорода, галогена, C1-C3-алкила-,C1-C3-алкокси-, C2-C3-алкенила-, C2-C3-алкинила-, C1-C3-галогеналкила- и C1-C3-галогеналкокси-;R5 и R9 вместе могут образовывать насыщенное или ненасыщенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, при этом указанное гетероциклическое кольцо содержит один или несколько гетероатомов азота и/или кислорода, причем 5- или 6-членное кольцо необязательно является замещенным одним или несколькими R12; илиR6 и R9 вместе могут образовывать насыщенное или ненасыщенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, при этом указанное гетероциклическое кольцо содержит один или несколько гетероатомов, выбранных из группы, состоящей из азота, кислорода и S(O)2, причем 5- или 6-членное кольцо необязательно является замещенным одним или несколькими R12; илиR6 и R8 вместе могут образовывать насыщенное или ненасыщенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо, при этом указанное гетероциклическое кольцо содержит один или несколько гетероатомов азота, причем 5- или 6-членное кольцо необязательно является замещенным одним или несколькими R13; иR12 выбран из группы водорода, циано, галогено-, окси-, C1-C3-алкил-S(О)р-, C1-C3-алкила,C2-C3-алкенила, C2-C3-алкинила, C1-C3-алкокси и C1-C3-галогеналкила;R13 выбран из группы водорода, циано, галогено-, C1-C3-алкил-S(О)р-, C1-C3-алкила, C2-C3-алкенила,C2-C3-алкинила, морфолинила- и C1-C3-галогеналкила; р=0, 1 или 2; и соединение формулы (I) не представляет собой 2-(1-бензил-5-гидрокси-6-оксо-1,6-дигидропиридазин 4-ил)бензойную кислоту. Алкильные группы с длиной цепи от 1 до 6 атомов углерода включают, например, метил (Me, СН 3),этил (Et, C2H5), н-пропил, изопропил (i-Pr), н-бутил (n-bu), изобутил (i-bu), втор-бутил и трет-бутил(t-бутил). Алкенильные группы с длиной цепи от 2 до 6 атомов углерода включают, например, -СН=СН 2 (винил) и -CH2-CH=CH2 (аллил). Алкинильные группы с длиной цепи от 2 до 6 атомов углерода включают, например, -С=СН (этинил) и -СН 2-С=СН (пропаргил). Циклоалкильные группы включают с-пропил (с-Pr), с-бутил (с-Bu), с-пентил и с-гексил. Галоген (галогено) охватывает фтор, хлор, бром или йод. То же самое, соответственно, применимо к галогену в контексте других определений, таких как галогеналкил или галогенфенил. Галогеналкильными группами с длиной цепи от 1 до 6 атомов углерода являются, например, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, 2,2,2-трифторметил,2-фторэтил, 2-хлорэтил, пентафторэтил, 1,1-дифтор-2,2,2-трихлорэтил, 2,2,3,3-тетрафторэтил и 2,2,2-трихлорэтил, гептафтор-н-пропил и перфтор-н-гексил. Галогеналкенильные радикалы включают алкенильные группы, замещенные один или несколько раз галогеном, при этом галогеном является фтор, хлор, бром или йод, в частности фтор или хлор, например 2,2-дифтор-1-метилвинил,3-фторпропенил,3-хлорпропенил,3-бромпропенил,2,3,3-трифторпропенил, 2,3,3-трихлорпропенил и 4,4,4-трифторбут-2-ен-1-ил. ПредпочтительныеC2-C6-алкенильные радикалы, замещенные один, два или три раза галогеном, характеризуются длиной цепи от 2 до 5 атомов углерода. Алкоксигруппы предпочтительно характеризуются длиной цепи от 1 до 6 атомов углерода. Алкокси представляет собой, например, метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси, вторбутокси, или трет-бутокси, или пентилокси, или изомер гексилокси, предпочтительно метокси и этокси. Алкилкарбонил предпочтительно представляет собой ацетил или пропионил. Алкоксикарбонил представляет собой, например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил,н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил или трет-бутоксикарбонил, предпочтительно метоксикарбонил, этоксикарбонил или трет-бутоксикарбонил. Также следует отметить, что два заместителя алкокси, присутствующих на одном и том же атоме углерода, могут быть соединены с образованием спирогруппы. Таким образом, метильные группы, присутствующие на двух заместителях метокси, могут быть соединены с образованием заместителя спиро-1,3-диоксолан, например. Такая возможность находится в объеме настоящего изобретения. Галогеналкокси представляет собой, например, фторметокси, дифторметокси, трифторметокси,2,2,2-трифторэтокси, 1,1,2,2-тетрафторэтокси, 2-фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси или 2,2,2-трихлорэтокси, предпочтительно дифторметокси, 2-хлорэтокси или трифторметокси. Группы алкилтио (алкил-S-) предпочтительно характеризуются длиной цепи от 1 до 6 атомов углерода. Алкилтио представляет собой, например, метилтио, этилтио, пропилтио, изопропилтио, нбутилтио, изобутилтио, втор-бутилтио или трет-бутилтио, предпочтительно метилтио или этилтио. Алкилсульфинил (алкил-SO-) представляет собой, например, метилсульфинил, этилсульфинил,пропилсульфинил, изопропилсульфинил, н-бутилсульфинил, изобутилсульфинил, втор-бутилсульфинил или трет-бутилсульфинил, предпочтительно метилсульфинил или этилсульфинил. Алкилсульфонил (алкил-S(О)2-) представляет собой, например, метилсульфонил, этилсульфонил,пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил или трет-бутилсульфонил, предпочтительно метилсульфонил или этилсульфонил. Алкиламино (алкил-NH-) представляет собой, например, метиламино, этиламино, н-пропиламино,изопропиламино или изомер бутиламино. Диалкиламино алкил)2-N-) представляет собой, например,диметиламино, метилэтиламино, диэтиламино, н-пропилметиламино, дибутиламино или диизопропиламино. Предпочтение отдают алкиламиногруппам с длиной цепи от 1 до 4 атомов углерода. Циклоалкиламино- или дициклоалкиламино- представляет собой, например, циклогексиламино или дициклопропиламино. Алкоксиалкильные группы предпочтительно имеют от 1 до 6 атомов углерода. Алкоксиалкил представляет собой, например, метоксиметил, метоксиэтил, этоксиметил, этоксиэтил, н-пропоксиметил,н-пропоксиэтил, изопропоксиметил или изопропоксиэтил. Алкилтиоалкильные группы (алкил-S-алкил) предпочтительно имеют от 1 до 6 атомов углерода. Алкилтиоалкил представляет собой, например, метилтиометил, метилтиоэтил, этилтиометил, этилтиоэтил, н-пропилтиометил, н-пропилтиоэтил, изопропилтиометил, изопропилтиоэтил, бутилтиометил, бутилтиоэтил или бутилтиобутил. Циклоалкильные группы предпочтительно имеют от 3 до 6 атомов углерода в кольце и могут быть замещены одной или несколькими метильными группами; они предпочтительно представляют собой незамещенный, например, циклопропил (с-Pr), циклобутил (с-Bu), циклопентил (с-пентил) или циклогексил (с-гексил). Арил включает бензил, фенил, в том числе фенил как часть заместителя, такого как фенокси, бензил, бензилокси, бензоил, фенилтио, фенилалкил, феноксиалкил или тозил, может быть в моно- или полизамещенной форме, в этом случае заместители могут быть, при необходимости, в орто-, мета- и/или пара-положении (положениях). Термин также предусматривает, например, нафталенил. Гетероциклил, например, включает морфолинил, тетрагидрофурил и гетероарил. Гетероарил, в том числе гетероарил как часть заместителя, такого как гетероарилокси, означает, например, 5-10 (предпочтительно 5- или 6-) членный гетероарил, содержащий один-три гетероатома, каждый из которых независимо выбран из группы, состоящей из кислорода, азота и серы. Термин "гетероарил", таким образом, предусматривает, например, бензофуранил, бензимидазолил, индолил, изобензофуранил, фуранил, тиофенил, тиазолил, оксазолил, изоксазолил, тиазолил, пиразолил, изотиазолил, пиридил, пиридазинил, пиразинил, пиримидинил, пиридонил, тиазолил, нафтиридинил и нафтиридинонил. Гетероарильный компонент необязательно может быть моно- или полизамещенным, как определено ранее. Предпочтительно R1 выбран из группы, состоящей из водорода, C1-C6-алкила, C2-C6-алкенила,C2-C6-алкинила, C3-C6-циклоалкила, C1-C6-галогеналкила, C1-C6-алкокси-C1-C3-алкила и C3-C6 циклоалкил-C1-C3-алкила. В более предпочтительном варианте осуществления R1 выбран из группы, состоящей из C1-C4-алкила, циклопропила, дифторметила, циклопропилметила-, винила и пропаргила, при этом метил является особенно предпочтительным. где R5, R6, R7, R8, R9 и R13 определены выше и n равняется 0, 1, 2 или 3. Более предпочтительно R2 выбран из группы, состоящей из фенила (например, A1a), 3-пиридила(например, A1c), N-пиридонила (например, А 2 а) и 3-связанного [1,8]нафтиридинила (например, A1d). Еще более предпочтительно R2 представляет собой фенил (например, A1a). Предпочтительно R3 выбран из группы, состоящей из водорода, галогена, циано, C1-C6-алкила,C2-C6-алкенила, C2-C6-алкинила, C1-C6-галогеналкила и C1-C6-алкил-S(О)p-. Более предпочтительно R3 выбран из группы, состоящей из водорода, галогена и C1-С 6-алкила, наиболее предпочтительным является водород или метил.R4 предпочтительно представляет собой водород.R3 и R4, оба, предпочтительно представляют собой водород.R5 предпочтительно выбран из группы, состоящей из гидроксила, галогена, C1-C6-алкила,C1-C6-циклоалкила,C1-C6-галогеналкила,C1-C6-алкенила,C1-C6-алкинила,C1-C6-алкокси,C1-C6-алкокси-C1-C3-алкила, C1-C6-алкокси-C2-C6-алкокси, C1-C6-алкокси-C2-C6-алкокси-C1-C3-алкила,C1-C6-галогеналкокси, C1-C6-галогеналкокси-C1-C3-алкила, C1-C6-алкил-S(О)p-, C1-C6-галогеналкил-S(О)p-,арила,арилокси,гетероциклила,гетероциклил-C1-C3-алкокси-C1-C3-алкила,C1-C3-алкиламино-,C1-C3-диалкиламино-, C1-C3-алкиламино-S(О)р-, C1-C3-алкиламино-S(О)p-C1-C3-алкила-, C1-C3-диалкиламино-S(О)р-, С 1-С 3-диалкиламино-S(О)р-C1-C3-алкила-, C1-C3-алкиламинокарбонила-, C1-C3-диалкиламинокарбонила-,C1-C3-диалкиламинокарбонил-C1-C3-алкила-,C1-C3-алкилкарбониламино-,C1-C3-алкил-S(О)р-амино-, циано и нитро, где указанные гетероциклилы представляют собой 5- или 6-членные гетероциклилы, содержащие от одного до трех гетероатомов, каждый из которых независимо выбран из группы, состоящей из кислорода, азота и серы, и где арильные или гетероциклильные компоненты необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси,циано и нитро. Термины "арил" и "гетероциклил" дополнительно определены выше. Однако в контексте R5 особенно предпочтительными являются фенил, бензил, изоксазолинил, пиримидинил, морфолинил, фурил и тиофенил. Более предпочтительно R5 выбран из группы, состоящей из хлора, фтора, метила, трифторметила,2-фторэтила-, метоксиэтоксиметила-, трифторметоксиметила-, метил-S(O)р-, арила, изоксазолинила,морфолинила, метил-S(О)р-диметиламино-, циано и нитро, где арильные или гетероциклильные компоненты необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из хлора, метила и трифторметила. Наиболее предпочтительно R5 выбран из группы,состоящей из метила, метил-S(О)2- и трифторметила.-4 024330 Предпочтительно R6 выбран из группы, состоящей из водорода, галогена, C1-C6-алкила,C1-C6-галогеналкила, C1-C6-алкил-S(О)p-, C1-C6-циклоалкила, C2-C6-алкенила, C2-C6-галогеналкенила,C2-C6-алкинила, C1-C6-алкокси-, C1-C6-галогеналкокси, С 2-С 6-алкенилокси-, C3-C6-циклоалкил-C1-C3 алкила-, C1-C6-алкокси-C1-C3-алкила-, C1-C6-алкокси-C2-C6-алкокси-, нитро и фенила, где фенил необязательно может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси, C1-C6-алкил-S(О)p-,фенила, циано и нитро. Более предпочтительно R6 выбран из группы, состоящей из водорода, галогена,C1-C6-алкила, C1-C6-галогеналкила, C1-C6-алкил-S(О)p-, C2-C6-алкенила и C2-C6-алкинила. Предпочтительно R7 выбран из группы, состоящей из водорода, галогена и C1-C3-алкила-. Предпочтительно R8 выбран из группы, состоящей из водорода, галогена и C1-C3-алкила-. Предпочтительно R9 выбран из группы, состоящей из водорода, галогена, C1-C6-алкила,C1-C6-галогеналкила, C1-C6-алкил-S(О)p-, C1-C6-циклоалкила, C2-C6-алкенила, C2-C6-галогеналкенила,C2-C6-алкинила, C1-C6-алкокси-, C1-C6-галогеналкокси, C2-C6-алкенилокси-, C3-C6-циклоалкил-C1-C3 алкила-, C1-C6-алкокси-C1-C3-алкила-, C1-C6-алкокси-C2-C6-алкокси-, нитро и фенила, где фенил необязательно может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси, C1-C6-алкил-S(О)p-,фенила, циано и нитро. Более предпочтительно R9 выбран из группы, состоящей из водорода, галогена,C1-C6-алкила, C1-C6-галогеналкила, C1-C6-алкил-S(О)p-, C2-C6-алкенила и C2-C6-алкинила. Соединения формулы (I) могут содержать асимметричные центры и могут быть представлены в виде единого энантиомера, пар энантиомеров в любой пропорции или, при наличии более одного асимметричного центра, содержать диастереоизомеры во всех возможных соотношениях. Как правило, один из энантиомеров обладает повышенной биологической активностью по сравнению с другими вариантами. Аналогично, в случае дизамещенных алкенов, они могут быть представлены в Е или Z форме или в виде их смесей в любой пропорции. Более того, соединения формулы (I) могут находиться в состоянии равновесия с альтернативными гидроксильными таутомерными формами. Следует понимать, что все таутомерные формы (отдельный таутомер или их смеси), рацемические смеси и отдельные изомеры охватываются объемом настоящего изобретения. Настоящее изобретение также включает агрономически приемлемые соли, которые соединения формулы (I) могут образовывать с аминами (например, аммиаком, диметиламином и триэтиламином),основаниями щелочного металла и щелочно-земельного металла или четвертичными аммониевыми основаниями. Среди гидроксидов, оксидов, алкоксидов и гидрокарбонатов щелочных металлов и щелочноземельных металлов, применяемых в качестве солеобразователей, особое внимание следует уделить гидроксидам, алкоксидам, оксидам и карбонатам лития, натрия, калия, магния и кальция, но особенно гидроксидам, алкоксидам, оксидам и карбонатам натрия, магния и кальция. Также можно применять соответствующую триметилсульфониевую соль. Соединения формулы (I) по настоящему изобретению можно сами по себе применять в качестве гербицидов, но обычно их составляют в гербицидные композиции с применением вспомогательных средств для составления, таких как носители, растворители и поверхностно-активные вещества (SFA). Таким образом, настоящее изобретение дополнительно предлагает гербицидную композицию, содержащую гербицидное соединение, описанное выше, и приемлемое с точки зрения сельского хозяйства вспомогательное средство для составления. Композиция может быть представлена в форме концентратов,которые разводят перед применением, хотя также могут быть получены готовые к применению композиции. Конечное разведение обычно производят при помощи воды, но вместо воды или в дополнение к воде, разведение можно производить при помощи, например, жидких удобрений, микроэлементов, биологических организмов, масел или растворителей. Гербицидные композиции, как правило, содержат от 0,1 до 99 вес.%, в частности от 0,1 до 95 вес.% соединений формулы (I) и от 1 до 99,9 вес.% вспомогательного средства для составления, которое предпочтительно включает от 0 до 25 вес.% поверхностно-активного вещества. Композиции можно выбрать из ряда типов составов, многие из которых известны из Manual onDevelopment and Use of FAO Specifications for Plant Protection Products, 5th Edition, 1999. Таковые включают порошки для распыления (DP), растворимые порошки (SP), растворимые в воде гранулы (SG), диспергируемые в воде гранулы (WG), смачиваемые порошки (WP), гранулы (GR) (с медленным или быстрым высвобождением), растворимые концентраты (SL), смешиваемые с маслом жидкости (OL), жидкости, применяемые в ультранизком объеме (UL), эмульгируемые концентраты (ЕС), диспергируемые концентраты (DC), эмульсии (как масло-в-воде (EW), так и вода-в-масле (ЕО, микроэмульсии (ME), суспензионные концентраты (SC), аэрозоли, капсулированные суспензии (CS) и составы для обработки семян. Выбранный тип состава в любом случае будет зависеть от конкретного предусматриваемого назначения, а также физических, химических и биологических свойств соединения формулы (I). Распыляемые порошки (DP) могут быть получены смешиванием соединения формулы (I) с одним или несколькими твердыми разбавителями (например, природными глинами, каолином, пирофиллитом,бентонитом, глиноземом, монтмориллонитом, кизельгуром, мелом, диатомовой землей, фосфатом каль-5 024330 ция, карбонатами кальция и магния, серой, известью, тонкодисперсными порошками, тальком и другими органическими и неорганическими твердыми носителями) и механическим измельчением смеси в мелкий порошок. Растворимые порошки (SP) могут быть получены смешиванием соединения формулы (I) с одной или несколькими растворимыми в воде неорганическими солями (такими как натрия бикарбонат, натрия карбонат или магния сульфат) или с одним или несколькими растворимыми в воде органическими твердыми веществами (такими как полисахарид) и необязательно с одним или несколькими смачивающими средствами, одним или несколькими диспергирующими средствами или смесью указанных средств для улучшения диспергируемости/растворимости в воде. Смесь затем измельчают в тонкодисперсный порошок. Подобные композиции можно также гранулировать для получения растворимых в воде гранул (SG). Растворимые порошки (WP) могут быть получены смешиванием соединения формулы (I) с одним или несколькими твердыми разбавителями или носителями, одним или несколькими смачивающими средствами и предпочтительно одним или несколькими диспергирующими средствами, а также необязательно с одним или несколькими суспендирующими средствами для облегчения дисперсии в жидкостях. Смесь затем измельчают в тонкодисперсный порошок. Подобные композиции можно также гранулировать для получения диспергируемых в воде гранул (WG). Гранулы (GR) могут быть образованы либо гранулированием смеси соединения формулы (I) и одного или нескольких порошковых твердых разбавителей или носителей, либо из предварительно образованных пустых гранул, абсорбирующих соединение формулы (I) (или его раствор в приемлемом средстве) в пористый материал гранулы (такой как пемза, аттапульгитовая глина, фуллерова земля, кизельгур,диатомовая земля или измельченные кукурузные початки), либо путем абсорбции соединения формулы(I) (или его раствора в приемлемом средстве) на материале твердого ядра (таком как песок, силикаты,минеральные карбонаты, сульфаты или фосфаты) и сушки, если необходимо. Средства, которые обычно используют для абсорбции или адсорбции, включают растворители (такие как алифатические и ароматические нефтяные растворители, спирты, эфиры, кетоны и сложные эфиры) и клейкие средства (такие как поливинилацетаты, поливиниловые спирты, декстрины, сахара и растительные масла). Одна или несколько других добавок может также содержаться в гранулах (например, эмульгирующее средство, смачивающее средство или диспергирующее средство). Диспергируемые концентраты (DC) могут быть получены растворением соединения формулы (I) в воде или органическом растворителе, таком как кетон, спирт или гликолевый эфир. Эти растворы могут содержать поверхностно-активное средство (например, для улучшения разбавления водой или предотвращения кристаллизации в резервуар опрыскивателя). Эмульгируемые концентраты (ЕС) или эмульсии масло-в-воде (EW) можно получить с помощью растворения соединения формулы (I) в органическом растворителе (необязательно содержащем одно или несколько смачивающих средств, одно или несколько эмульгирующих средств или смесь указанных средств). Подходящие органические растворители для применения в ЕС включают ароматические углеводороды (такие как алкилбензолы или алкилнафталины, например SOLVESSO 100, SOLVESSO 150 иSOLVESSO 200; SOLVESSO является зарегистрированной торговой маркой), кетоны (такие как циклогексанон или метилциклогексанон) и спирты (такие как бензиловый спирт, фурфуриловый спирт или бутанол), N-алкилпирролидоны (такие как N-метилпирролидон или N-октилпирролидон), диметиламиды жирных кислот (такие как C8-C10-диметиламид жирной кислоты) и хлорированные углеводороды. ЕС-продукт может спонтанно эмульгироваться при добавлении в воду с получением эмульсии с достаточной стабильностью для обеспечения применения распылением посредством подходящего оборудования. Получение EW включает получение соединения формулы (I) либо в виде жидкости (если оно не является жидкостью при комнатной температуре, его можно расплавить при умеренной температуре,обычно ниже 70 С), либо в растворе (путем растворения его в подходящем растворителе) и затем эмульгирование полученной жидкости или раствора в воде, содержащей одно или несколько SFA, при высоком сдвиговом усилии с получением эмульсии. Подходящие растворители для применения в EW включают растительные масла, хлорированные углеводороды (такие как хлорбензолы), ароматические растворители (такие как алкилбензолы или алкилнафталины) и другие подходящие органические растворители, которые имеют низкую растворимость в воде. Микроэмульсии (ME) можно получить смешиванием воды со смесью одного или нескольких растворителей с одним или несколькими SFA с получением самопроизвольно термодинамически стабильного изотропного жидкого состава. Соединения формулы (I) присутствуют изначально либо в воде, либо в смеси растворителя с SFA. Подходящие растворители для применения в ME включают такие, перечисленные в данном документе выше для применения в ЕС или в EW. ME может быть системой или маслов-воде, или вода-в-масле (какая система присутствует, можно определить измерением электрической проводимости) и может быть подходящей для смешивания растворимых в воде и растворимых в масле пестицидов в этом же составе. ME является подходящей для разведения в воде, или оставаясь в виде микроэмульсии, или образуя обычную эмульсию масло-в-воде. Суспензионные концентраты (SC) могут содержать водные или неводные суспензии мелко измельченных нерастворимых твердых частиц соединения формулы (I). SC могут быть получены шаровым или гранулярным размалыванием твердого соединения формулы (I) в приемлемой среде необязательно с одним или несколькими диспергирующими средствами с получением суспензии мелких частиц соединения. Одно или несколько смачивающих средств можно включить в композицию, а также можно включить суспендирующее средство для снижения скорости, с которой частицы оседают. В качестве альтернативы соединение формулы (I) может быть измельчено сухим и добавлено в воду, содержащую средства, описанные выше, с получением желаемого конечного продукта. Аэрозольные составы содержат соединение формулы (I) и приемлемый газ-вытеснитель (например,н-бутан). Соединение формулы (I) также можно растворить или диспергировать в подходящей среде (например, в воде или смешивающейся с водой жидкости, такой как н-пропанол) для обеспечения композиций для применения в не находящихся под давлением насосах для опрыскивания с ручным управлением. Капсульные суспензии (CS) могут быть получены подобно получению составов EW, но с дополнительным этапом полимеризации так, чтобы получалась водная дисперсия капелек масла, в которой каждая капелька масла инкапсулируется полимерной оболочкой и содержит соединение формулы (I) и необязательно его носитель или разбавитель. Полимерная оболочка может быть получена или реакцией межфазной поликонденсации, или процедурой коацервации. Композиции могут быть предусмотрены для контролированного высвобождения соединения формулы (I) и они могут применяться для обработки семян. Соединение формулы (I) также может быть составлено в биоразлагаемую полимерную матрицу для обеспечения медленного контролированного высвобождения соединения. Композиция может включать одну или несколько добавок для улучшения биологического действия композиции, например путем улучшения смачивания, удержания на поверхностях или распределения по поверхностям; устойчивости к смыванию дождем с обработанных поверхностей; или поглощения или подвижности соединения формулы (I). Такие добавки включают поверхностно-активные средства (SFA),добавки для опрыскивания на основе масел, например определенные минеральные масла или природные растительные масла (такие как соевое и рапсовое масло), и их смеси с другими биоусиливающими вспомогательными средствами (ингредиентами, которые могут содействовать или модифицировать действие соединения формулы (I. Смачивающие средства, диспергирующие средства и эмульгирующие средства могут быть SFA катионного, анионного, амфотерного или неионного типа. Подходящие SFA катионного типа включают четвертичные аммонийные соединения (например,цетилтриметиламмония бромид), имидазолины и соли аминов. Подходящие анионные SFA включают в себя соли щелочных металлов жирных кислот, соли алифатических сложных моноэфиров серной кислоты (например, лаурилсульфат натрия), соли сульфированных ароматических соединений (например, додецилбензолсульфонат натрия, додецилбензолсульфонат кальция, бутилнафталинсульфонат и смеси диизопропил- и триизопропил-нафталинсульфонатов натрия),эфирсульфаты, эфирсульфаты спирта (например, лаурет-3-сульфат натрия), эфиркарбоксилаты (например, лаурет-3-карбоксилат натрия), сложные фосфатэфиры (продукты реакции между одним или несколькими жирными спиртами и фосфорной кислотой (преимущественно сложные моноэфиры) или пентоксид фосфора (преимущественно сложные диэфиры), например, реакции между лауриловым спиртом и тетрафосфорной кислотой; эти продукты дополнительно могут быть этоксилированы), сульфосукцинаматы, парафин- или олефин-сульфонаты, таураты и лигносульфонаты. Подходящие SFA амфотерного типа включают бетаины, пропионаты и глицинаты. Подходящие SFA неионного типа включают продукты конденсации алкиленоксидов, таких как этиленоксид, пропиленоксид, бутиленоксид или их смеси, с жирными спиртами (такими как олеиловый спирт или цетиловый спирт) или с алкилфенолами (такими как октилфенол, нонилфенол или октилкрезол); неполные эфиры, полученные из длинноцепочечных жирных кислот или ангидридов гекситола; продукты конденсации указанных неполных эфиров с этиленоксидом; блок-полимеры (содержащие этиленоксид и пропиленоксид); алканоламиды; сложные эфиры (например, полиэтиленгликолевые сложные эфиры жирной кислоты); аминоксиды (например, лаурилдиметиламина оксид) и лецитины. Подходящие суспендирующие средства включают гидрофильные коллоиды (такие как полисахариды, поливинилпирролидон или карбоксиметилцеллюлоза натрия) и набухающие глины (такие как бентонит или аттапульгит). Композиция по настоящему изобретению может дополнительно содержать по меньшей мере один дополнительный пестицид. Например, соединения по настоящему изобретению также можно применять в сочетании с другими гербицидами или регуляторами роста растений. В предпочтительном варианте осуществления дополнительным пестицидом является гербицид и/или антидот гербицида. Примерами таких смесей (в которых I представляет соединение формулы (I являются I + ацетохлор, I + ацифлуорфен, I + ацифлуорфен-натрий, I + аклонифен, I + акролеин, I + алахлор, I + аллоксидим, I + аметрин, I + амикарбазон, I + амидосульфурон, I + аминопиралид, I + амитрол, I + анилофос, I + асулам, I + атразин, I+ симетрин, I + хлорат натрия, I + сулкотрион, I + сульфентразон, I + сульфометурон, I + сульфометуронметил, I + сульфосат, I + сульфосульфурон, I + серная кислота, I + тебутиурон, I + тефурилтрион, I + темботрион, I + тепралоксидим, I + тербацил, I + тербуметон, I + тербутилазин, I + тербутрин, I + тенилхлор,I + тиазопир, I + тифенсульфурон, I + тиенкарбазон, I + тифенсульфурон-метил, I + тиобенкарб, I + топрам, I + тралкоксидим, I + триаллат, I + триасульфурон, I + триазифлам, I + трибенурон, I + трибенуронметил, I + триклопир, I + триэтазин, I + трифлоксисульфурон, I + трифлоксисульфурон-натрий, I + трифлуралин, I + трифлусульфурон, I + трифлусульфурон-метил, I + тригидрокситриазин, I + тринексапакэтил, I + тритосульфурон, I + этиловый сложный эфир [3-[2-хлор-4-фтор-5-(1-метил-6-трифторметил-2,4 диоксо-1,2,3,4-тетрагидропиримидин-3-ил)фенокси]-2-пиридилокси]уксусной кислоты (CAS RN 35329231-6). Соединения по настоящему изобретению можно также комбинировать с гербицидными соединениями, раскрытыми в WO 06/024820 и/или WO 07/096576. Компоненты, смешиваемые с соединением формулы (I), могут также находиться в форме сложных эфиров или солей, которые упомянуты, например, в The Pesticide Manual, Fourteenth Edition, British Crop Соединение формулы (I) также можно применять в смесях с другими агрохимическими средствами,такими как фунгициды, нематициды или инсектициды, примеры которых приведены в The PesticideManual. Соотношение в смеси соединения формулы (I) и смешиваемого компонента предпочтительно составляет от 1:100 до 1000:1. Смеси преимущественно можно применять в упомянутых выше составах (в этом случае выражение"активный ингредиент" относится к соответствующей смеси соединения формулы (I) со смешиваемым компонентом). Соединения формулы (I) в соответствии с настоящим изобретением можно также применять в комбинации с одним или несколькими антидотами. Аналогично, смеси соединения формулы (I) в соответствии с настоящим изобретением с одним или несколькими дополнительными гербицидами также можно применять в комбинации с одним или несколькими антидотами. Антидотами могут быть AD 67 (MON 4660), беноксакор, клоквинтосет-мексил, ципросульфамид (CAS RN 221667-31-8), дихлормид, фенхлоразол-этил, фенклорим, флуксофеним, фурилазол и соответствующий R-изомер, изоксадифен-этил, мефенпир-диэтил, оксабетринил, N-изопропил-4-(2-метоксибензоилсульфамоил)бензамид (CAS RN 221668-344). Другие возможные варианты включают соединения-антидоты, раскрытые, например, в ЕР 0365484,например N-(2-метоксибензоил)-4-[(метиламинокарбонил)амино]бензолсульфонамид. Особенно предпочтительны смеси соединения формулы (I) с ципросульфамидом, изоксадифен-этилом, клоквинтосетмексилом и/или N-(2-метоксибензоил)-4-[(метиламинокарбонил)амино]бензолсульфонамидом. Антидоты соединения формулы (I) также могут находиться в форме сложных эфиров или солей, как упоминается, например, в The Pesticide Manual, 14th Edition (BCPC), 2006. Отсылка к клоквинтосетмексилу также относится к его литиевой, натриевой, калиевой, кальциевой, магниевой, алюминиевой,железной, аммониевой, четвертичной аммониевой, сульфоновой или фосфониевой соли, как раскрыто вWO 02/34048, а отсылка к фенхлоразол-этилу также относится к фенхлоразолу и т.д. Предпочтительно соотношение в смеси соединения формулы (I) и антидота составляет от 100:1 до 1:10, предпочтительно от 20:1 до 1:1. Смеси можно преимущественно применять в вышеупомянутых составах (в случае чего выражение"активный ингредиент" относится к соответствующей смеси соединения формулы (I) с антидотом). Настоящее изобретение, кроме того, дополнительно предлагает способ избирательной борьбы с сорняками в местоположении культурных растений и сорняков, при этом способ включает применение по отношению к местоположению достаточного для борьбы с сорняками количества композиции по настоящему изобретению. "Борьба" означает уничтожение, уменьшение или замедление роста или предупреждение или снижение прорастания. Обычно растениями, с которыми необходимо бороться, являются нежелательные растения (сорняки). "Местоположение" означает территорию, на которой растения произрастают или будут произрастать. Нормы внесения соединений формулы (I) могут варьировать в широких пределах и зависят от природы почвы, способа применения (до или после появления всходов; протравливание семян; применение по отношению к борозде для семян; применение беспахотной обработкой и т.д.), культурного растения,сорняка (сорняков), с которым(и) необходимо бороться, преобладающих климатических условий и других факторов, по которым регулируют способ применения, время применения и целевую культуру. Соединения формулы (I) по настоящему изобретению обычно вносят с нормой от 10 до 2000 г/га, предпочтительно от 50 до 1000 г/га. Применение обычно осуществляют путем распыления композиции, как правило, при помощи распылителя на базе трактора для больших территорий, но также можно применять другие способы, такие как опыление (для порошков), капельный полив или орошение. Пригодные растения, для которых можно применять композицию по настоящему изобретению,включают сельскохозяйственные культуры, такие как зерновые, например ячмень и пшеницу, хлопчатник, масличный рапс, подсолнечник, маис, рис, сою, сахарную свеклу, сахарный тростник и дерновой покров. Маис является особенно предпочтительным. Культурные растения могут также включать деревья, такие как фруктовые деревья, пальмовые деревья, кокосовые пальмы и другие орехи. Также включены вьющиеся растения, такие как виноград, плодовые кустарники, фруктовые растения и овощи. Сельскохозяйственные культуры следует понимать как также включающие такие сельскохозяйственные культуры, которым была придана толерантность к гербицидам или классам гербицидов (например, ALS-, GS-, EPSPS-, РРО-, ACC-аза- и HPPD-ингибиторы) при помощи традиционных способов селекции или при помощи генетической инженерии. Примером культуры, которая стала выносливой к имидазолинонам, например к имазамоксу, с помощью общепринятых способов селекции, является капуста полевая Clearfield (канола). Примеры сельскохозяйственных культур, которые оказались толерантными к гербицидам с применением способов генной инженерии, включают например, устойчивые к глифосату и глюфозинату сорта маиса, коммерчески доступные под торговыми названиями В предпочтительном варианте осуществления культурное растение наделяют толерантностью кHPPD-ингибиторам при помощи генетической инженерии. Способы придания культурным растениям толерантности к HPPD-ингибиторам известны, например, из WO 0246387. Таким образом, в еще более предпочтительном варианте осуществления культурное растение является трансгенным в отношении полинуклеотида, содержащего последовательность ДНК, которая кодирует устойчивый кHPPD-ингибитору HPPD-фермент, полученный из бактерии, более конкретно, из Pseudomonas fluorescens или Shewanella colwelliana, или из растения, более конкретно, полученный из однодольного растения или, еще более конкретно, из ячменя, маиса, пшеницы, риса, видов Brachiaria, Chenchrus, Lolium, Festuca,Setaria, Eleusine, Sorghum или Avena. Под сельскохозяйственными культурами также понимаются такие, которые оказались устойчивыми к вредным насекомым с применением способов генной инженерии, например маис Bt (устойчивый к мотыльку кукурузному), хлопчатник Bt (устойчивый к долгоносику хлопковому), а также картофель Bt (устойчивый к колорадскому жуку). Примерами маиса Bt являются гибриды Bt 176 маиса NK (SyngentaSeeds). Токсин Bt представляет собой белок, который образуется природно почвенной бактерией Bacillusthuringiensis. Примеры токсинов или трансгенных растений, способных синтезировать такие токсины,описаны в ЕР-А-451 878, ЕР-А-374753, WO 93/07278, WO 95/34656, WO 03/052073 и ЕР-А-427529. Примерами трансгенных растений, содержащих один или несколько генов, кодирующих устойчивость к инсектицидам и экспрессирующих один или несколько токсинов, являются KnockOut (маис), Yield GardProtexcta. Как растительные сельскохозяйственные культуры, так и их посевной материал могут быть устойчивыми к гербицидам и, в то же время, устойчивыми к поеданию насекомыми (трансгенные события "стекинга"). Например, семя может обладать способностью экспрессировать инсектицидный белокCry3, в то же время будучи толерантным к глифосату. Сельскохозяйственные культуры также следует понимать как культуры, которые получены традиционными способами селекции или генетической инженерии и обладают так называемыми привнесенными признаками (например, улучшенной стабильностью при хранении, более высокой питательной ценностью и улучшенным вкусом). Другие пригодные растения включают травы дернового покрова, например на гольф-площадках,лужайках, парках и обочинах дороги, или коммерчески выращиваемые для газона и декоративные растения, такие как цветы или кустарники. Композиции можно применять для борьбы с нежелательными растениями (собирательно "сорняками"). Сорняки, подлежащие борьбе, могут быть видами однодольных растений, например Agrostis,Alopecurus, Avena, Brachiaria, Bromus, Cenchrus, Cyperus, Digitaria, Echinochloa, Eleusine, Lolium, Monochoria, Rottboellia, Sagittaria, Scirpus, Setaria и Sorghum, так и видами двудольных растений, напримерAbutilon, Amaranthus, Ambrosia, Chenopodium, Chrysanthemum, Conyza, Galium, Ipomoea, Nasturtium, Sida,Sinapis, Solarium, Stellaria, Veronica, Viola и Xanthium. Сорняки также могут включать растения, которые можно считать культурными растениями, но которые вырастают за пределами посевной площади ("беглецы") или которые вырастают из семян, оставшихся от предыдущего посева другой сельскохозяйственной культуры ("растения-самосевы"). Такие растения-самосевы или беглецы могут быть толерантными к некоторым другим гербицидам. Соединения по настоящему изобретению можно получить с помощью приведенных далее способов. Соединения формул (1 а) могут быть получены из соединений формулы (I), как показано на схеме реакции 1. Схема реакции 1 Соединения формулы (Ia), в которой R4 представляет собой водород, могут быть получены из соединений формулы (I), в которых R4 представляет собой низший алкил, например метил, путем нагревания с морфолином (Nagashima, Hiromu et al. Heterocycles, 26(1), 1-4; 1987). Соединения формулы (I) могут быть получены из соединений формулы (2), как показано на схеме реакции 2. Соединения формулы (I), в которых R4 представляет собой низший алкил, например метил, и в которых R2 представляет собой арил или гетероарил, можно получить из соединений формулы (2) путем реакции с приемлемым металлом или металлоидным производным Y-M (например, бороновой кислотой или сложным эфиром, производным триалкилолова, производным цинка или реагентом Гриньяра) в присутствии приемлемого основания (например, неорганического основания, такого как фосфат калия или фторид цезия), источника металла (например, источника палладия, такого как Pd(OAc)2) и необязательно лиганда для металла (например, фосфинового лиганда) в приемлемом растворителе (например, в отдельном растворителе, таком как диметилформамид, или в системе смешанных растворителей, такой как смесь диметоксиэтан и вода или толуол и вода). Металлический катализатор и лиганды также можно добавлять в виде отдельного, предварительно образованного комплекса (например, комплекса палладий/фосфин, такого как бис-(трифенилфосфин)палладия дихлорид или дихлорметановый аддукт[1,1'-бис-(дифенилфосфино)ферроцен]палладия дихлорида). Соединения формулы (2) могут быть получены из соединений формулы (3), как показано на схеме реакции 3. Схема реакции 3 Соединения формулы (2), в которых R4 представляет собой низший алкил, например метил, могут быть получены из соединений формулы (3) путем реакции с приемлемым алкоксидом металла, например метоксидом натрия, в приемлемом растворителе, таком как диоксан. Соединения формулы (3) могут быть получены из соединений формулы (4), как показано на схеме реакции 4. Схема реакции 4 Соединения формулы (3) могут быть получены из соединения формулы (4) (4,5-дихлор-1 Нпиридазин-6-она-, коммерчески доступного) путем реакции с приемлемым алкилирующим средствомR1-X, где X представляет собой уходящую группу, такую как галид, например метилйодид, в присутствии приемлемого основания (например, неорганического основания, такого как карбонат калия) в приемлемом растворителе, таком как N,N-диметилформамид. В качестве альтернативы соединения формулы (1) могут быть получены из соединений формулы(5), как показано на схеме реакции 5. Схема реакции 5 Соединения формулы (1), в которых R4 представляет собой низший алкил, например метил, и в которых R2 представляет собой арил или гетероарил, могут быть получены из соединений формулы (5) путем реакции с приемлемым алкилирующим средством R2-X в присутствии приемлемого основания (например, неорганического основания, такого как фосфат калия или фторид цезия), источника металла (на- 11024330 пример, источника палладия, такого как Pd(OAc)2) и необязательно лиганда для металла (например, фосфинового лиганда) в приемлемом растворителе (например, в отдельном растворителе, таком как диметилформамид, или в системе смешанных растворителей, такой как смесь диметоксиэтан и вода или толуол и вода). Металлический катализатор и лиганды также можно добавлять в виде отдельного, предварительно образованного комплекса(например,комплекса палладий/фосфин,такого как бис-(трифенилфосфин)палладия дихлорид или дихлорметановый адцукт[1,1'-бис(дифенилфосфино)ферроцен]палладия дихлорида). Соединения формул (5) могут быть получены из соединений формулы (6), как показано на схеме реакции 6. Схема реакции 6 Соединения формулы (5), в которых R4 представляет собой низший алкил, например метил, могут быть получены из соединений формулы (6) путем реакции с приемлемой бороновой кислотой или сложным эфиром, например бис-(пинаколато)дибора, в присутствии приемлемого основания (например, неорганического основания, такого как фосфат калия или фторид цезия), источника металла (например,источника палладия, такого как Pd2(dba)3 или Pd(OAc)2) и необязательно лиганда для металла (например,фосфинового лиганда, такого как трициклогексилфосфин) в приемлемом растворителе (например, в отдельном растворителе, таком как диоксан, или в системе смешанных растворителей, такой как смесь диметоксиэтан и вода или толуол и вода). Металлический катализатор и лиганды также можно добавлять в виде отдельного, предварительно образованного комплекса (например, комплекса палладий/фосфин, такого как бис-(трифенилфосфин)палладия дихлорид или дихлорметановый аддукт[1,1'-бис-(дифенилфосфино)ферроцен]палладия дихлорида). Аналогичные реакции известны из уровня техники, например, из Tetrahedron, 57(49), 9813-9816; 2001. В качестве альтернативы соединения формулы (1 с), в которых R2 представляет собой азотсвязанный гетероцикл, например индол или пиридон, могут быть получены из соединений формулы (3) или (4), как показано на схеме реакции 7. Схема реакции 7 Соединения формулы (7) и (1b) могут быть получены из соединений формулы (3) и (4) соответственно путем реакции с азотсодержащим гетероциклом, таким как индол или пиридон, в присутствии приемлемого основания в приемлемом растворителе. Соединения формулы (1b), в которых R4 представляет собой низший алкил, например метил, могут быть получены из соединений формулы (7), как описано на схеме реакции 3, и соединения формулы (1 с) могут быть получены из соединений формулы (1b), как описано на схеме реакции 1. В качестве альтернативы, соединения формулы (1 с) могут быть получены непосредственно из соединений формулы (7) путем реакции с приемлемым гидроксидом металла, таким как гидроксид калия, в приемлемом растворителе, таком как водный метанол. Соединения формул (1) могут быть получены из соединений формулы (8), как показано на схеме реакции 8. Схема реакции 8 Соединения формулы (1), в которых R4 представляет собой низший алкил, например метил, могут быть получены из соединений формулы (8) путем реакции с приемлемым спиртом R1OH в приемлемом растворителе, таком как тетрагидрофуран, в присутствии приемлемой добавки, такой как трифенилфосфин, и азодикарбоксилата, такого как диэтилазодикарбоксилат (DEAD) или диизопропилазодикарбоксилат (DIAD). Соединения формул (8) могут быть получены из соединений формулы (1d), как показано на схеме реакции 9. Схема реакции 9 Соединения формулы (8) могут быть получены из соединений формулы (1d), в которых R1 представляет собой удаляемую защитную группу, такую как п-метоксибензил, путем реакции с приемлемым окислительным средством, таким как нитрат церия-аммония в приемлемом растворителе, таком как водный ацетонитрил. Соединения формулы (1d), в которых R1 представляет собой удаляемую защитную группу, такую как п-метоксибензил, могут быть получены из коммерчески доступного соединения (4) (4,5-дихлор-1 Нпиридазин-6-она) способом, аналогичным таковому в схемах 2-4. Соединения формул (3) могут быть получены из соединений (9), как показано на схеме реакции 10. Схема реакции 10 Соединения формулы (3), в которых R3 представляет собой, например, алкил, алкенил или алкинил,также могут быть получены из соединений (9), в которых X представляют собой приемлемую уходящую группу, такую как бромид, путем реакции с приемлемым металлом или металлоидным производным YM (например, бороновая кислота или сложный эфир, производное триалкилолова, производное цинка или реагент Гриньяра) в присутствии приемлемого основания (например, неорганической соли, такой как фосфат калия или фторид цезия), источника металла (например, источника палладия, такого какPd(OAc)2) и необязательно лиганда для металла (например, фосфинового лиганда) в приемлемом растворителе (например, в отдельном растворителе, таком как диоксан, или в системе смешанных растворителей, такой как смесь диметоксиэтан и вода или толуол и вода). Металлический катализатор и лиганды также можно добавлять в виде отдельного, предварительно образованного комплекса (например, комплекса палладий/фосфин, такого как бис-(трифенилфосфин)палладия дихлорид или дихлорметановый аддукт [1,1'-бис-(дифенилфосфино)ферроцен]палладия дихлорида). Соединения формулы (9) могут быть получены известными способами. Соединения формул (3) также могут быть получены как показано на схеме реакции 11. Соединения формулы (3), в которых R3 представляет собой водород, могут быть получены путем реакции 3,4-дихлор-2,5-фурандиона или 3,4-дибром-2,5-фурандиона с приемлемым образом защищенным гидразином в приемлемом растворителе, таком как водная хлористо-водородная кислота. Аналогичные реакции известны, например, из Angewandte Chemie (1965), 77(7), 282-90; SyntheticCommunications, (2006), 36(18), 2719-2726. Соединения формулы (I), в которых R2 представляет собой С-связанный пиридон, могут быть получены из соединений формулы 2, как показано в схеме 12. Схема реакции 12 Соединения формулы 1h, в которых R4 представляет собой низший алкил, например метил, могут быть получены из соединений формулы 2 путем реакции с приемлемым металлическим или металлоидным производным 2-метоксипиридина (например, бороновая кислота или сложный эфир, производное триалкилолова, производное цинка или реагент Гриньяра) в присутствии приемлемого основания (например, неорганического основания, такого как фосфат калия или фторид цезия), источника металла (например, источника палладия, такого как Pd(OAc)2) и необязательно лиганда для металла (например, фосфинового лиганда) в приемлемом растворителе (например, в отдельном растворителе, таком как диметилформамид, или в системе смешанных растворителей, такой как смесь диметоксиэтан и вода или толуол и вода). Металлический катализатор и лиганды также можно добавлять в виде отдельного, предварительно образованного комплекса (например, комплекса палладий/фосфин, такого как бис(трифенилфосфин)палладия дихлорид или дихлорметановый аддукт [1,1'-бис-(дифенилфосфино)ферроцен]палладия дихлорида). Соединения (1g) могут быть получены из соединений (1h) путем реакции с разбавленной водной кислотой, такой как хлористо-водородная кислота, необязательно с помощью нагревания или с помощью реакции в микроволнах, аналогично известным способам, таким как раскрытые в BioorganicMedicinalChemistry Letters, 18(9), 2967-2971; 2008. Соединения формулы (1f) могут быть получены из соединений формулы (1g) путем реакции с приемлемым арилйодидом в присутствии йодида меди, приемлемого основания, такого как трифосфат калия, в присутствии приемлемого катализатора, такого как тетрабутиламмония хлорид, в приемлемом растворителе, таком как N,N-диметилформамид, необязательно с помощью нагревания или с помощью реакции в микроволнах. Аналогичные реакции известны, например, из Tet. Lett. 45 (2004) 4257-4260. Соединения формулы (1 е) могут быть получены из соединения формулы (1g), как описано на схеме реакции 1. Соединения формулы (1 аа), в которых R4 представляет собой, например, алкилкарбонил, арилкарбонил, алкоксикарбонил, алкоксисульфонил или арилсульфонил, могут быть получены из соединений общей формулы (Ia), в которых R4 представляет собой водород, путем реакции с приемлемым галидом,таким как ацетилхлорид, метилхлорформиат, этилтиохлорформиат или п-толуолсульфонихлорид, в присутствии приемлемого основания, такого как триэтиламин или пиридин, в присутствии приемлемого растворителя, такого как дихлорметан или толуол. Схема реакции 14 Соединения формулы (1i), в которых R2 представляет собой замещенный пиримидин, или формулы(1l), в которых R2 представляет собой замещенный пиримидинон, могут быть получены согласно схеме реакций 14. Соединения формулы (11) могут быть получены из соединений формулы (10) путем реакции соответствующего реагента Гриньяра с хлоридом трибутилолова в присутствии приемлемого растворителя, такого как тетрагидрофуран, при этом реакционную смесь охлаждают при добавлении реагентов. Аналогичные реакции известны, например, из J. Org. Chem., 2011, 76, 6670-6677 (образование Гриньяра),WO 2010/59943 (р. 32) и Journal of Organometallic Chemistry, 1973, (63), 133-138. Соединения формулы (12) могут быть получены из соединений формулы (11) путем реакции с метил-(Z)-2-йод-3-метоксипроп-2-еноатом в присутствии приемлемого основания (например, неорганического основания, такого как фосфат калия или фторид цезия), источника металла (например, источника палладия, такого как палладий(0) тетракис-(трифенилфосфин и катализатора, такого как йодид меди,необязательно с нагреванием, согласно аналогичным способам, например, в Angew. Chem. Int. Ed., 2004,43,1132-1136. Соединения общей формулы (1k) могут быть получены из соединений общей формулы (12) путем реакции с приемлемым амидином в присутствии приемлемого алкоксида металла, например метоксида натрия, в приемлемом растворителе, таком как метанол, при этом реакционную смесь нагревают. Соединения общей формулы (1j) могут быть получены из соединений общей формулы (1k) путем реакции с приемлемым хлорирующим реагентом, таким как оксихлорид фосфора, необязательно в присутствии приемлемого растворителя, согласно процедурам, известным например, из Journal of OrganicChemistry, 76(10), 4149-4153; 2011. Соединения общих формул (1i) и (1l) могут быть получены из соединений общих формул (1j) и(1k), соответственно, как описано на схеме реакции 1. Примеры Ниже представлены примеры синтеза конкретных соединений в соответствии с настоящим изобретением. Пример 1. 5-[2-Хлор-3-(4,5-дигидроизоксазол-3-ил)-4-метилсульфонилфенил]-4-гидрокси-2-пропил пиридазин-3-он. Смесь 5-[2-хлор-3-(4,5-дигидроизоксазол-3-ил)-4-метилсульфонил фенил]-4-метокси-2-пропил пиридазин-3-она (692 мг, 1,62 ммоль) в морфолине (1,42 мл) нагревали до 100 С в течение 1 ч. Реакционную смесь охлаждали, затем добавляли дихлорметан (20 мл) и 2 М хлористо-водородной кислоты (20 мл) и смесь взбалтывали в течение 30 мин. Дихлорметановый слой отделяли, затем водный слой дважды экстрагировали дихлорметаном. Объединенные органические экстракты пропускали через картридж для фазового разделения, затем концентрировали в вакууме. Неочищенный продукт растворяли в этилацетате, затем осаждали гексаном, концентрировали в вакууме и измельчали ацетонитрилом с получением продукта в виде грязно-белого твердого вещества (224,6 мг). 5-[2-Хлор-3-(4,5-дигидроизоксазол-3-ил)-4-метилсульфонил-фенил]-4-метокси-2-пропилпиридазин-3-он. Смесь 5-хлор-4-метокси-2-пропил-пиридазин-3-она (811 мг, 4 ммоль), ацетата калия (589 мг,6 ммоль), бис-(пинаколато)дибора (1,52 г, 6 ммоль), трис-(дибензилиденацетон)дипалладия(0) (148 мг,0,16 ммоль) и трициклогексилфосфина (180 мг, 0.64 ммоль) в дегазированном диоксане (12 мл) нагревали при 150 С в течение 15 мин при микроволновом излучении. Смеси позволяли охладиться до комнатной температуры, затем фильтровали через целит с элюированием этилацетатом. Фильтрат выпаривали при пониженном давлении, затем использовали непосредственно на следующей стадии. Неочищенный боронатный сложный эфир растворяли в дегазированном диметоксиэтане (12 мл); к смеси добавляли 3-(3-бром-2-хлор-6-метилсульфонил-фенил)-4,5-дигидроизоксазол (2,71 г, 8 ммоль),фторид цезия (2,43 г, 16 ммоль) и дихлорметановый аддукт [1,1'-бис-(дифенилфосфин)ферроцен]палладия(II) дихлорида (260 мг, 0,32 ммоль). Полученную в результате смесь нагревали при 150 С в течение 20 мин при микроволновом излучении, затем позволяли остыть до комнатной температуры и фильтровали через целит с элюированием этилацетатом. Фильтрат концентрировали при пониженном давлении, затем очищали хроматографией на оксиде кремния, элюировали 0-100% этилацетатом в изогексане с получением продукта в виде коричневого масла (692 мг). 1 Н ЯМР 8,06 (1H, d, J=8,1 Гц), 7,59 (1H, s), 7,56 (1 Н, d, J=8,1 Гц), 4,63 (3 Н, t, J=10,2 Гц), 4,19 (3 Н, s),4,12 (2 Н, dd, J=7,3, 7,3 Гц), 3,47 (3 Н, t, J=10,2 Гц), 3,28 (3 Н, s), 1,90 (2 Н, m), 1,02 (3 Н, t, J=7,2 Гц). 5-Хлор-4-метокси-2-пропил-пиридазин-3-он. К взбалтываемому раствору 4,5-дихлор-2-пропил-пиридазин-3-она (7,31 г, 35,3 ммоль) в диоксане(150 мл) каплями добавляли раствор метоксида натрия в метаноле (25 вес.% в метаноле, 8,6 мл,38,8 ммоль) и смесь взбалтывали при комнатной температуре в течение 60 мин. Добавляли воду (150 мл) и смесь экстрагировали диэтиловым эфиром (3100 мл). Объединенные органические экстракты сушили,фильтровали и концентрировали в вакууме. Неочищенный продукт очищали посредством хроматографии на силикагеле с элюированием этилацетат/гексаны с получением титульного продукта в виде бесцветного масла (5,44 г). 4,5-Дихлор-2-пропил-пиридазин-3-он. К взбалтываемому раствору 4,5-дихлор-1 Н-пиридазин-6-она (8,25 г, 50 ммоль) вN,N-диметилформамиде (25 мл) при комнатной температуре добавляли карбонат калия (1,2 г, 60 ммоль) и 1-йодпропан (5,85 мл, 60 ммоль). Смесь взбалтывали при 70 С в течение 2 ч, затем добавляли воду(75 мл) и смесь экстрагировали дихлорметаном (3100 мл). Объединенные органические экстракты сушили, фильтровали и концентрировали в вакууме, затем разделяли между солевым раствором (200 мл) и диэтиловым эфиром (200 мл). Органический слой сушили, фильтровали и концентрировали в вакууме с получением коричневого масла. Неочищенный продукт очищали посредством хроматографии на силикагеле с элюированием этилацетат/гексаны с получением титульного продукта в виде бесцветного масла(7,31 г). 1 Н ЯМР 7,78 (1H, s), 4,20-4,11 (2 Н, m), 1,90-1,74 (2 Н, m), 0,96 (3 Н, t, J=7,2 Гц). Пример 2. 4-Гидрокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]пиридазин-3-он. Смесь 4-метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]пиридазин-3-она (48 мг,0,132 ммоль) в морфолине (2 мл) нагревали до 100 С в течение 3 ч. Затем реакционной смеси позволяли остыть до комнатной температуры и выпаривали при пониженном давлении. Полученный в результате остаток растворяли в этилацетате и промывали 2 М хлористо-водородной кислотой. Затем органический слой сушили над сульфатом натрия и выпаривали. Полученное в результате твердое вещество измельчали с дихлорметан/гексан с получением желаемого продукта в виде бледно-розового твердого вещества(90 мг, 0,27 ммоль) в уксусной кислоте (4 мл) добавляли пероксид водорода (50 вес.% в воде, 56 мг,0,82 ммоль) при комнатной температуре. Реакционную смесь медленно нагревали до 55 С и выдерживали при этой температуре в течение ночи. Реакционную смесь разбавляли дихлорметаном и медленно гасили насыщ. водн. гидрокарбонатом натрия и твердым гидрокарбонатом натрия до рН 6-7. Органический слой отделяли и водную фазу экстрагировали дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и выпаривали с получением желаемого продукта (78 мг) в виде бледно-желтого масла. Его использовали без дополнительной очистки. 1 Н ЯМР Н (CDCl3) 8,46 (1H, d), 7,98 (1 Н, dd), 7,60 (1H, s), 7,46 (1 Н, d), 4,14 (3 Н, s), 3,85 (3 Н, s), 3,02(4%, 21 мг, 0,023 ммоль) и трициклогексилфосфина (16%, 26 мг, 0,092 ммоль) в дегазированном диоксане (2,5 мл) нагревали при 150 С в течение 15 мин при микроволновом излучении. Смесь фильтровали через целит с промывкой этилацетатом и фильтрат выпаривали при пониженном давлении. Остаток растворяли в дегазированном 1,2-диметоксиэтане (2,5 мл) а затем добавляли 1-бром-2-метилсульфанил-4(трифторметил)бензол (233 мг, 0,86 ммоль), фторид цезия (348 мг, 2,29 ммоль) и[1,1'-бис-(дифенилфосфин)ферроцен]палладия(II) хлорид, дихлорметановый комплекс (8%, 38 мг,0,046 ммоль). Полученную в результате смесь нагревали при 160 С в течение 15 мин при микроволновом излучении. Реакционную смесь фильтровали через целит с промывкой этилацетатом. Фильтрат выпаривали при пониженном давлении и остаток очищали посредством хроматографии на оксиде кремния с элюированием 0-40% этилацетатом в гексанах с получением желаемого продукта (190 мг, содержащего некоторую примесь остаточного пинакола) в виде красного масла. Его использовали без дополнительной очистки. 1 Н ЯМР Н (CDCl3) 7,52 (1H, s), 7,50 (1H, br s), 7,47 (1H, br d), 7,26 (1H, br d), 4,05 (3H, s), 3,84 (3H,s), 2,49 (3H, s). 5-Хлор-4-метокси-2-метилпиридазин-3-он. К взбалтываемому раствору 4,5-дихлор-2-метилпиридазин-3-она (19,7 г, 110 ммоль) в 1,4-диоксане(550 мл) каплями добавляли метоксид натрия (28,5 г, 132 ммоль, 30,2 мл) и полученную в результате смесь взбалтывали при комнатной температуре в течение 1 ч. Реакционную смесь гасили водой(500 мл), затем экстрагировали диэтиловым эфиром (500 мл, затем 250 мл). Объединенные органические экстракты сушили, фильтровали и концентрировали в вакууме с получением 15,83 г белого твердого вещества. 1 Н ЯМР (CDCl3) Н 7,68 (1H, s), 4,28 (3 Н, s), 3,75 (3 Н, s). 4,5-Дихлор-2-метилпиридазин-3-он. К взбалтываемому раствору 4,5-дихлор-1 Н-пиридазин-6-она (25,0 г, 152 ммоль) вN,N-диметилформамиде (152 мл) добавляли карбонат калия (25,4 г, 182 ммоль) и йодметан (25,8 г,182 ммоль, 11,3 мл). Полученную в результате смесь взбалтывали при комнатной температуре в течение ночи. Затем реакционную смесь выливали в ледяную воду (300 мл) и смесь взбалтывали в течение 15 мин. Полученный в результате осадок собирали фильтрацией, затем растворяли в дихлорметане и пропускали через картридж для фазового разделения. Органические экстракты концентрировали в вакууме с получением 19,7 г бледно-коричневого твердого вещества. 1 Н ЯМР (400 МГц, хлороформ)ppm 3,83 (s, 3 Н) 7,77 (s, 1H). Пример 3. 4-Гидрокси-2-метил-5-[3-(м-толил)-2-оксо-4-(трифторметил)-1-пиридил]пиридазин-3-он. Смесь 4-хлор-2-метил-5-[3-(м-толил)-2-оксо-4-(трифторметил)-1-пиридил]пиридазин-3-она (74 мг,0,19 ммоль) в водном гидроксиде калия (0,5 М, 3 мл, 0,606 ммоль) и метаноле (2,5 мл) нагревали при 55 С в течение 90 мин. Добавляли морфолин (1 мл) и реакционную смесь нагревали при 90 С в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении. Затем осторожно добавляли 2 М хлористо-водородную кислоту к остатку с энергичным взбалтыванием в течение 5-10 мин. Полученный в результате кремообразный осадок фильтровали, промывали 2 М хлористо-водородной кислотой и водой,а затем сушили в вакуумной печи при 55 С в течение ночи с получением желаемого продукта (37 мг). 4-Хлор-2-метил-5-[3-(м-толил)-2-оксо-4-(трифторметил)-1-пиридил]пиридазин-3-он. Смесь 3-(м-толил)-4-(трифторметил)-1 Н-пиридин-2-она (68 мг, 0,269 ммоль), 4,5-дихлор-2 метилпиридазин-3-она (58 мг, 0,323 ммоль) и карбоната калия (112 мг, 0,807 ммоль) вN,N-диметилформамиде (1 мл) нагревали в микроволнах при 150 С в течение 25 мин. Затем реакционную смесь выливали в 2 М хлористо-водородную кислоту и экстрагировали этилацетатом. Органические экстракты объединяли, сушили над сульфатом натрия и выпаривали при пониженном давлении. Неочищенную смесь очищали посредством хроматографии на силикагеле с элюированием этилацетатом в гек- 17024330 санах с получением желаемого продукта в виде желтого масла (74 мг). 1 Н ЯМР H (CDCl3) 7,84 (1 Н, s), 7,34-7,22 (3 Н, m), 7,11 (2 Н, m), 6,63 (1 Н, d), 3,88 (3 Н, s), 2,38 (3 Н, s). 3-(м-Толил)-4-(трифторметил)-1 Н-пиридин-2-он. Смесь 2-хлор-3-(м-толил)-4-(трифторметил)пиридина (96 мг, 0,353 ммоль) и гидроксида натрия в диметилсульфоксиде (0,6 мл) и воды (0,6 мл) нагревали при 150 С при микроволновом излучении в течение 60 мин. Жидкую смесь отделяли от стекловидного остатка и подкисляли до рН 1 с помощью 2 М хлористо-водородной кислотой. Полученный в результате белый осадок фильтровали, промывали несколькими каплями воды и сушили в вакуумной печи при 55 С в течение ночи с получением продукта в виде белого твердого вещества (68 мг). 1 Н ЯМР (CD3OD) Н 7,62 (1H, d), 7,34-7,30 (1H, m), 7,25-7,23 (1 Н, m), 7,06 (1 Н, s), 7,02 (1H, d), 6,66(136 мг, 0,976 ммоль) в 1,2-диметоксиэтане (2,8 мл) нагревали при 150 С в течение 30 мин при микроволновом излучении. Реакционную смесь выливали в соляной раствор и экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия и выпаривали. Неочищенную смесь очищали посредством хроматографии на силикагеле с элюированием этилацетатом в гексанах с получением продукта в виде бесцветного масла (96 мг). 2-Хлор-3-йод-4-метилпиридин. н-Бутиллитий (1,6 М в гексанах, 13,3 мл, 21,3 ммоль) каплями добавляли к раствору диизопропиламина (33 мл, 23,3 ммоль) в тетрагидрофуране (7 мл) при -70 С (внутренняя температура) и полученную в результате смесь взбалтывали в течение 30 мин. Затем каплями добавляли 2-хлор-4-трифторметилпиридин (2,5 мл, 3,52 г, 19,4 ммоль) за 20 мин и смесь взбалтывали в течение 2 ч при -70 С. Затем ее быстро канюлировали в раствор йода (5,2 г, 20,4 ммоль) в тетрагидрофуране (3 мл),выдерживаемый при 0 С. Полученную в результате смесь взбалтывали в течение 10 мин, гасили водным метабисульфитом натрия и экстрагировали этилацетатом. Органический слой собирали, промывали соляным раствором, сушили над сульфатом магния и выпаривали. Неочищенную смесь очищали посредством хроматографии на оксиде кремния с элюированием этилацетатом в гексане с получением желаемого соединения (4,87 г, 82%) в виде бледно-желтого твердого вещества, загрязненного следами исходного материала. 1 Н ЯМР (CDCl3) H 8,50 (1H,d), 7,44 (1 Н, d). Пример 4. 2-Циклопентил-5-[3-(4,5-дигидроизокеазол-3-ил)-2-метил-4-метилсульфонил-фенил]-4 метоксипиридазин-3-он. К взбалтываемому раствору 4-[3-(4,5-дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-5 метокси-1H-пиридазин-6-она (126 мг, 0,35 ммоль), трифенилфосфина (184 мг, 0,70 ммоль) и циклопентанола (0,06 мл, 0,70 ммоль) в сухом THF (3,5 мл) в атмосфере азота каплями добавляли диизопропилазодикарбоксилат (0,14 мл, 0,7 ммоль). Полученную в результате смесь взбалтывали при комнатной температуре в течение 3 ч, затем концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии на оксиде кремния с элюированием изогексан/этилацетат с получением 2-циклопентил-5-[3-(4,5-дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-4 метоксипиридазин-3-она (94 мг). 1 Н ЯМР 8,06 (1 Н, d, J=8,1 Гц), 7,56 (1H, s), 7,43 (1H, d, J=8,1 Гц), 5,50-5,41 (1H, m), 4,61 (2 Н, t,J=9,9 Гц), 4,10 (3 Н, s), 3,41 (2 Н, br s), 3,22 (3 Н, s), 2,17-2,02 (2 Н, m), 2,04 (3 Н, s), 2,00-1,86 (4 Н, m), 1,741,67 (2 Н,m). 4-[3-(4,5-Дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-5-метокси-1 Н-пиридазин-6 он. К взбалтываемому раствору 5-[3-(4,5-дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-2[(4-гидроксифенил)метил]-4-метоксипиридазин-3-она(281 мг, 0,58 ммоль) в ацетонитриле(5 мл) и воды(1 мл) при комнатной температуре добавляли нитрат церия-аммония и смесь взбалтывали при комнатной температуре. Реакцию контролировали с помощью LCMS. Через 90 мин добавляли соляной раствор (25 мл) и этилацетат (25 мл). Слои разделяли и водном слой экстрагировали этилацетатом еще два раза. Объединенные органические экстракты промывали насыщ. водным бикарбонатом натрия (25 мл), затем сушили и концентрировали в вакууме. Неочищенный продукт измельчали с гексаном (20 мл) и фильтровали с получением 126 мг бледно-желтого твердого вещества. 1 Н ЯМР 8,08 (1H, d, J=8,1 Гц), 7,56 (1H, s), 7,44 (1H, d, J=8,1 Гц), 4,61 (2H, t, J=10,2 Гц), 4,19 (3H, s),3,43 (2H, br s), 3,22 (3H, s), 2,19 (3H, s). 5-[3-(4,5-Дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-2-[(4-гидроксифенил)метил]4-метокси-пиридазин-3-он. Смесь 5-хлор-4-метокси-2- [(4-метоксифенил)метил] пиридазин-3-она (281 мг, 1 ммоль), палладия ацетата (18 мг, 0,08 ммоль), 3-[2-метил-6-метилсульфонил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)фенил]-4,5-дигидроизоксазола(548 мг, 1,5 ммоль), водного трикалия фосфата (0,4 мл, 2 ммоль) иSPhos (66 мг, 0,16 ммоль) в дегазированном толуоле нагревали при 150 С в течение 30 мин при микроволновом излучении. Смеси позволяли охладиться до комнатной температуры, затем фильтровали через целит с элюированием этилацетатом. Фильтрат выпаривали при пониженном давлении, а затем очищали посредством колоночной хроматографии с получением желаемого продукта в виде розового масла(281 мг). 1 Н ЯМР 8,00 (1H, d), 7,49 (1H, s), 7,41 (2 Н, d), 7,35 (1 Н, d), 6,86 (2 Н, d), 5,36-5,14 (2 Н, br d), 4,54 (2 Н,t), 4,07 (3 Н, s), 3,77 (3 Н, s), 3,34 (2 Н, br s), 3,18 (3 Н, s), 2,11 (3 Н, s). 3-[2-Метил-6-метилсульфонил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4,5 дигидроизоксазол получали, как описано в примере 7 ниже. 5-Хлор-4-метокси-2-[(4-метоксифенил)метил]пиридазин-3-он. К взбалтываемому раствору 4,5-дихлор-2-[(4-метоксифенил)метил]пиридазин-3-она (5,70 г,20 ммоль) в сухом диоксане (50 мл) добавляли раствор метоксида натрия (30 вес.% раствор, в метаноле(5,4 М), 4,07 мл, 22 ммоль) при комнатной температуре. Полученную в результате смесь взбалтывали при комнатной температуре, контролировали с помощью LCMS, а затем выливали в воду(50 мл)/дихлорметан (50 мл). Органический слой отделяли, а водный слой экстрагировали дихлорметаном (250 мл). Объединенные органические экстракты сушили над сульфатом магния и выпаривали. Неочищенный продукт очищали посредством колоночной хроматографии на оксиде кремния с элюированием этилацетат/гексан с получением желаемого продукта 5-хлор-4-метокси-2-[(4 метоксифенил)метил]пиридазин-3-она в виде белого твердого вещества (4,53 г) вместе с изомерным соединением 4-хлор-5-метокси-2-[(4-метоксифенил)метил]пиридазин-3-оном (650 мг). Данные ЯМР: 5-хлор-4-метокси-2-[(4-метоксифенил)метил]пиридазин-3-он: 7,70 (1 Н, s), 7,39 (2 Н, d), 6,84 (2 Н, d),5,20 (2 Н, s), 4,24 (3 Н, s), 3,79 (3 Н, s); 4-хлор-5-метокси-2-[(4-метоксифенил)метил]пиридазин-3-он: 7,80 (1 Н, s), 7,40 (2 Н, d), 6,86 (2 Н, d),5,29 (2 Н, s), 4,02 (3 Н, s), 3,79 (3 Н, s). Получали 4,5-дихлор-2-[(4-метоксифенил)метил]пиридазин-3-он из 4,5-дихлор-1 Н-пиридазин-6-она процедурой, аналогичной описанной в примере 1 выше. Пример 5. 5-[6-Фтор-2-(трифторметил)-1,8-нафтиридин-3-ил]-4-гидрокси-2-метилпиридазин-3-он. 5-[6-Фтор-2-(трифторметил)-1,8-нафтиридин-3-ил]-4-метокси-2-метилпиридазин-3-он(70 мг,0,1976 ммоль) растворяли в ацетонитриле (5 мл) и добавляли йодид натрия (50 мг, 0,33 ммоль) в 20 мл пробирке для микроволнового реактора. Добавляли хлор(триметил)силан (0,043 мл, 0,34 ммоль), и желтая реакционная смесь немедленно становилась пурпурной. Смесь взбалтывали в емкости для микроволнового реактора при 100 С в течение 30 мин. LCMS демонстрировала только частичное превращение в желаемый продукт. Добавляли больше хлор(триметил)силана и йодида натрия и реакционную смесь повторно обрабатывали микроволнами при 100 С в течение 30 мин. LCMS демонстрировала увеличение желаемого продукта, но подтверждала, что исходный материал все еще оставался главным компонентом(60%). Смесь выливали в воду, подщелачивали 2 М гидроксидом натрия и экстрагировали дихлорметаном. Органические экстракты пропускали через картридж для фазового разделения и выпаривали с получением непрореагировавшего исходного материала. Основный водный слой подкисляли 2 М хлористоводородной кислотой и экстрагировали дихлорметаном. Органические экстракты пропускали через второй картридж для фазового разделения и выпаривали с получением желаемого продукта 5-[6-фтор-2-(трифторметил)-1,8-нафтиридин-3-ил]-4-гидрокси-2-метилпиридазин-3-она(21 мг,0,062 ммоль) в виде розового твердого вещества. 1[6-Фтор-2-(трифторметил)-1,8-нафтиридин-3-ил]-триметил-станнан (200 мг, 0,528 ммоль),5-хлор-4-метокси-2-метилпиридазин-3-он (105 мг, 0,60144 ммоль), 1,4-бис-(дифенилфосфинбутан)палладия дихлорид (33 мг), оксид меди(II) (45 мг, 0,566 ммоль) и N,N-диметилформамид (5 мл,64,4 ммоль) взбалтывали в емкости для микроволнового реактора при 140 С в течение 30 мин. LCMS демонстрировала хорошее превращение в желаемый продукт с небольшим количеством "гомоприсоединенного" побочного продукта, а также некоторые другие незначительные примеси. Реакционную смесь фильтровали через очень небольшую кремнеземную пробку. Фильтрат разделили между эфиром и водой. Органические экстракты отделяли, промывали, сушили над безводным сульфатом магния и выпаривали. Неочищенный продукт растворяли в дихлорметане и очищали посредством колоночной хроматографии с элюированием этилацетат/изогексан с получением 5-[6-фтор-2-(трифторметил)-1,8 нафтиридин-3-ил]-4-метокси-2-метилпиридазин-3-она (75 мг, 0,2117 ммоль) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, хлороформ)ppm (d, 1 Н, 9,20), (s, 1H, 8,20), (dd, 1H, 7,92), (s, 1H, 7,61), (s, 3H,4,14), (s, 3H, 3,88). 5-Хлор-4-метокси-2-метилпиридазин-3-он получали из 4,5-дихлор-1 Н-пиридазин-6-она, как описано в примере 2.(1,15 г, 3,40 ммоль) и катализатора бис-(трифенилфосфин)палладия(II) дихлорида (100 мг, 0,141 ммоль) в дегазированном 1,4-диоксане (6 мл, 70,3 ммоль) нагревали при 110 С в течение 60 мин при микроволновом излучении. LCMS демонстрировала хорошее превращение в желаемый продукт. Реакционную смесь адсорбировали на оксиде кремния и очищали посредством колоночной хроматографии с элюированием этилацетат/изогексан с получением [6-фтор-2-(трифторметил)-1,8-нафтиридин-3-ил]-триметил-станнана в виде бледно-оранжевого твердого вещества (300 мг, 0,7918 ммоль). 1 Н ЯМР (400 МГц, хлороформ)ppm (d, 1H, 9,10, (s, 1H, 8,48), (dd, 1H, 7,85), (s, 9H, 0,47). 6-Фтор-3-йод-2-(трифторметил)-1,8-нафтиридин можно получать из 6-фтор-2-(трифторметил)-1,8 нафтиридин-3-амина процедурами, известными, например, из J. Org. Chem. 1977, 42 (14), 2426-2431. Пример 6. 4-[3-(4,5-Дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-1,3-диметил-4 Н-пиридазин 5,6-дион. 4-[3-(4,5-Дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-1,3-диметил-4 Н-пиридазин 5,6-дион получали из 4,5-дихлор-2,6-диметилпиридазин-3-она последовательностью реакций, аналогичной таковой в примере 1. 4,5-Дихлор-2,6-диметилпиридазин-3-он. В 20-мл емкость для микроволнового реактора добавляли 6-бром-4,5-дихлор-2-метилпиридазин-3 он (1,00 г, 3,88 ммоль), [1,1'-бис-(дифенилфосфин)ферроцен]палладия(II) дихлорид дихлорметановый аддукт (0,032 г, 0,039 ммоль), карбонат цезия (2,02 г, 6,20 ммоль), триметилбороксин (0,787 г,6,20 ммоль, 0,876 мл) и 1,4-диоксан (9 мл) и нагревали в микроволнах при 100 С в течение 1 ч, а затем еще в течение 30 мин при 150 С. Реакционную смесь фильтровали через целит, добавляли оксид кремния и концентрировали в вакууме. Остаток очищали посредством хроматографии на оксиде кремния с элюированием 0-30% этилацетат/гексан с получением белого твердого вещества, содержащего соотношение 9:1 желаемого продукта 4,5-дихлор-2,6-диметилпиридазин-3-она вместе с побочным продуктом 5-хлор 2,4,6-триметилпиридазин-3-оном (всего 502 мг). Эту смесь использовали непосредственно в следующей стадии с образованием 5-хлор-4-метокси-2,6-диметилпиридазин-3-она, поскольку побочный продукт не реагирует. 1H ЯМР (CDCl3): 4,5-дихлор-2,6-диметилпиридазин-3-он:3,79 (s, 3 Н), 2,44 (s, 3 Н); 5-хлор-2,4,6-триметилпиридазин-3-он:3,73 (s, 3 Н), 2,38 (s, 3 Н), 2,29 (s, 3 Н). Пример 7. 2-Циклопропил-5-[3-(4,5-дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-4 гидроксипиридазин-3-он. Раствор 2-циклопропил-5-[3-(4,5-дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-4 метоксипиридазин-3-она (0,203 г, 0,5032 ммоль) в морфолине (0,4384 г, 5,032 ммоль, 0,440 мл) нагревали при 100 С в течение 1 ч. Реакционной смеси позволяли охладиться до комнатной температуры, затем разбавляли дихлорметаном (5 мл) и 2 М хлористо-водородной кислотой (5 мл). Затем смесь взбалтывали в течение 30 мин. Органический слой отделяли, а водный слой экстрагировали дихлорметаном (25 мл). Объединенные органические экстракты сушили и концентрировали в вакууме с получением розового твердого вещества. Неочищенное твердое вещество измельчали с ацетонитрилом (32-мл порции) и собирали путем фильтрации с получением 2-циклопропил-5-[3-(4,5-дигидроизоксазол-3-ил)-2-метил-4 метилсульфонил-фенил]-4-гидроксипиридазин-3-она в виде белого твердого вещества (0,0883 г). 1 Н ЯМР (400 МГц, хлороформ)ppm 1,05-1,12 (m, 2 Н), 1,22 - 1,29 (m, 2 Н), 2,23 (s, 3 Н), 3,21 (s, 3 Н),3,39 (br s, 2 Н), 4,19 (dt, J=7,65, 3,69 Гц, 1 Н), 4,60 (t, J=10,07 Гц, 2 Н), 7,49 (d, J=8,19 Гц, 1 Н), 7,60 (s, 1H),8,08 (d, J=8,19 Гц, 1 Н). 2-Циклопропил-5-[3-(4,5-дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-4 метоксипиридазин-3-он. Смесь 5-хлор-2-циклопропил-4-метоксипиридазин-3-она (0,20 г, 1 ммоль), 3-[2-метил-6 метилсульфонил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4,5-дигидроизоксазола (0,438 г,1,2 ммоль), палладия(II) ацетата (0,018 г, 0,08 ммоль), трикалия фосфата (1,026 г, 2 ммоль, 0,4 мл,5 моль/л) и SPhos (0,0670 г, 0,16 ммоль) в толуоле (3,46 г, 37,4 ммоль, 4,0 мл) нагревали при 150 С в течение 30 мин при микроволновом излучении. Реакционную смесь фильтровали через целит с элюирова- 20024330 нием этилацетатом. Фильтрат концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт загружали на оксид кремния и очищали посредством хроматографии с получением 2-циклопропил-5-[3-(4,5-дигидроизоксазол-3-ил)-2-метил-4-метилсульфонил-фенил]-4 метоксипиридазин-3-она в виде бесцветного масла (0,203 г, 0,503 ммоль). 1 Н ЯМР (400 МГц, хлороформ)ppm 1,03-1,11 (m, 2 Н), 1,19 (br. s, 2H), 2,18 (s, 3H), 3,22 (s, 3 Н), 3,40(br s, 2H), 4,14 (s, 4H), 4,60 (t, J=10,07 Гц, 3 Н), 7,41 (d, J=8,19 Гц, 1 Н), 7,48 (s, 1H), 8,06 (d, J=8,19 Гц, 1 Н). 3-[2-Метил-6-метилсульфонил-3-(4,4,5,5-тетраметил-1,3,2-диокеаборолан-2-ил)фенил]-4,5 дигидроизоксазол. Смесь 3-(3-бром-2-метил-6-метилсульфонил-фенил)-4,5-дигидроизоксазола (А, 3,182 г, 10 ммоль),бис-(пинаколато)дибора (3,8476 г, 15 ммоль), трис-(дибензилиденацетон)дипалладия(0) (0,092 г,0,1 ммоль), S-Phos (0,168 г, 0,4 ммоль) и ацетата калия (1,487 г, 15 ммоль) в 1,4-диоксане (15,51 г,176 ммоль, 15 мл) нагревали при 150 С в течение 30 мин при микроволновом излучении. Неочищенную смесь фильтровали через подушку целита с элюированием этилацетатом. Неочищенный продукт загружали на оксид кремния и очищали посредством хроматографии с получением 3-[2-метил-6 метилсульфонил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4,5-дигидроизоксазола в виде бледно-желтого твердого вещества (2,06 г, 5,64 ммоль). 1 Н ЯМР (400 МГц, хлороформ)ppm 1,37 (s, 13H), 2,52 (s, 3 Н), 3,16 (s, 4H), 3,33 (br. s., 2 Н), 4,57 (t,J=10,00 Гц, 2H), 7,94 (d, J=8,06 Гц, 1 Н), 7,99 (d, J=7,92 Гц, 1 Н). 3-(3-Бром-2-хлор-6-метилсульфонил-фенил)-4,5-дигидроизоксазол можно получать, как изложено,например, в патентном документе Германии 19820722. 5-Хлор-2-циклопропил-4-метоксипиридазин-3-он. К взбалтываемому раствору 4,5-дихлор-2-циклопропил-пиридазин-3-она (А, 0,599 г, 2,9214 ммоль,100 мас. %) в 1,4-диоксане (100 мл, 100 мас. %) каплями добавляли метоксид натрия (0,69443 г,3,2135 ммоль, 0,735 мл, 25 мас. %) и полученную в результате смесь взбалтывали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали в вакууме с получением неочищенного коричневого масла, затем загружали на оксид кремния, и очищали посредством хроматографии с получением 5-хлор-2-циклопропил-4-метоксипиридазин-3-она в виде белого твердого вещества (0,498 г). 1H ЯМР (400 МГц, хлороформ)ppm 0,96-1,14 (m, 4 Н), 3,95-4,07 (m, 1 Н), 4,28 (s, 3 Н), 7,64 (s, 1H). 4,5-Дихлор-2-циклопропил-пиридазин-3-он. Смесь трет-бутил-N-(трет-бутоксикарбониламино)-N-циклопропил-карбамата (0,68 г, 2,5 ммоль) и мукохлорной кислоты (0,43 г, 2,5 ммоль) в хлористо-водородной кислоте (4 моль/л) в воде (25 ммоль,6,3 мл) нагревали с обратным холодильником в течение 6 ч. Реакционной смеси позволяли охладиться до комнатной температуры, затем экстрагировали дихлорметаном (310 мл). Объединенные органические экстракты сушили и концентрировали в вакууме. Неочищенный продукт очищали посредством хроматографии с получением 4,5-дихлор-2-циклопропил-пиридазин-3-она в виде белого твердого веществаH ЯМР (400 МГц, хлороформ)ppm 1,02-1,17 (m, 4 Н), 4,09-4,16 (m, 1H), 7,72 (s, 1H). трет-Бутил-N-(трет-бутоксикарбониламино)-N-циклопропил-карбамат К взбалтываемой суспензии магния (1,34 г, 55 ммоль) и каталитического йода в тетрагидрофуране(5 мл) добавляли 5 мл из 45 мл раствора циклопропилбромида (4,0 мл) в тетрагидрофуране (50 мл). Смесь нагревали для инициации образования реактива Гриньяра, затем каплями добавляли оставшийся раствор циклопропилбромида за 30 мин с нагреванием (70 С). Раствор реактива Гриньяра нагревали с обратным холодильником в течение еще 30 мин, затем охлаждали до 0 С. К взбалтываемому раствору ди-трет-бутилазодикарбоксилата в THF (50 мл) при -78 С каплями через трубочку добавляли раствор циклопропилмагния бромида. Полученный в результате раствор взбалтывали при -78 С в течение 30 мин, затем гасили уксусной кислотой. Смеси позволяли нагреться до комнатной температуры, затем добавляли воду (150 мл) и смесь экстрагировали три раза диэтиловым эфиром. Объединенные органические экстракты сушили, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с элюированием этилацетат/гексан с получением продукта в виде белого твердого вещества (6,68 г). 1(0,1 г, 0,29 ммоль) в сухом дихлорметане (1 мл) при комнатной температуре добавляли пиридин (0,03 г,0,03 мл, 0,37 ммоль) и 4-(диметиламино)пиридин (0,35 мг, 0,0029 ммоль). Смесь взбалтывали в течение 2 мин и каплями добавляли ацетилхлорид (0,027 г, 0,025 мл, 0,345 ммоль). Полученную в результате суспензию взбалтывали при комнатной температуре в течение 2 ч, затем разбавляли дихлорметаном и последовательно промывали 2 М хлористо-водородной кислотой и насыщенным водным гидрокарбонатом натрия. Органический слой собирали, пропускали через картридж для фазового разделения и фильтрат выпаривали. Неочищенный остаток очищали флэш-хроматографией (10-55% этилацетат в гексанах,13 мин, затем 3 мин при 55%, 4 г оксида кремния GOLD) с получением [2-метил-5-[2-метилсульфонил-4(трифторметил)фенил]-3-оксопиридазин-4-ил]ацетата (0,095 г, 0,2434 ммоль, выход 84,78%) в виде белого твердого вещества. 4-Гидрокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]пиридазин-3-он получали, как описано в примере 2. Пример 9. Метил-[2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-3-оксопиридазин-4-ил]карбонат. К суспензии 4-гидрокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]пиридазин-3-она(0,1 г, 0,29 ммоль) в сухом толуоле (1,99 г, 2,3 мл, 21,5 ммоль) при комнатной температуре добавляли триэтиламин (0,032 г, 0,044 мл, 0,31 ммоль), а затем метилхлороформиат (0,03 г, 0,024 мл, 0,31 ммоль). Полученную в результате смесь взбалтывали в течение ночи. Добавили воду и смесь экстрагировали этилацетатом. Органические экстракты пропускали через картридж для фазового разделения и фильтрат концентрировали при пониженном давлении. Неочищенный остаток очищали флэш-хроматографией(0-50% этилацетат в гексанах, 12 мин, затем 3 мин при 50%, 4 г оксида кремния) с получением метил[2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-3-оксопиридазин-4-ил]карбоната (0,113 г,0,2781 ммоль, выход 96,87%) в виде белого твердого вещества. Получали 4-гидрокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]пиридазин-3-он, как описано в примере 2. Пример 10.(0,1 г, 0,29 ммоль) в сухом тетрагидрофуране (4,6 г, 5,17 мл, 63,7 ммоль) при комнатной температуре добавляли триэтиламин (0,059 г, 0,08 мл, 0,57 ммоль), а затем этилхлортиоформиат (0,047 г, 0,039 мл,0,36 ммоль). Полученную в результате суспензию взбалтывали при комнатной температуре в течение 90 мин, а затем разбавляли этилацетатом и промывали соляным раствором. Органическую слой собирали, пропускали через картридж для фазового разделения и фильтрат выпаривали. Фильтрат выпаривали и остаток очищали флэш-хроматографией (0-40% этилацетат в гексанах, 13 мин, затем 3 мин при 40%, 4 г оксида кремния) с получением[2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-3 оксопиридазин-4-ил]этилсульфанилформиата (0,126 г, 0,289 ммоль, выход 100%) в виде белого твердого вещества. 4-Гидрокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]пиридазин-3-он получали, как описано в примере 2. Пример 11.(0,1 г, 0,29 ммоль) в дихлорметане (1,14 г, 0,86 мл, 13,4 ммоль) при комнатной температуре добавляли раствор карбоната калия (0,06 г, 0,43 ммоль) в воде (0,86 г, 0,86 мл, 47,81 ммоль), а затем раствор 1-пропансульфонилхлорида (0,063 г, 0,05 мл, 0,43 ммоль) в дихлорметане (0,2 мл). Затем добавляли бензилтриметиламмония хлорид (0,0027 г, 0,0025 мл, 0,014 ммоль) и двухфазную смесь энергично взбалтывали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой/дихлорметаном и отделяли органическую фазу. Водный слой экстрагировали дихлорметаном. Объединенные органические экстракты промывали водной 2 М хлористо-водородной кислотой и соляным раствором, а затем пропускали через картридж для фазового разделения. Фильтрат выпаривали и остаток очищали посредством флэш-хроматографии (0-50% этилацетат в гексанах, 13 мин, 4 г оксида кремния) с получением [2-метил 5-[2-метилсульфонил-4-(трифторметил)фенил]-3-оксопиридазин-4-ил] пропан-1-сульфонат (0,1 г,0,22 ммоль, выход 76,7%) в виде белого твердого вещества. Получали 4-гидрокси-2-метил-5-[2 метилсульфонил-4-(трифторметил)фенил]пиридазин-3-он, как описано в примере 2. Пример 12.(0,1 г, 0,2871 ммоль) и пара-толуолсульфонилхлорида (0,061 г, 0,32 ммоль) в сухом ацетонитриле (4,51 г,5,7 мл, 110 ммоль) при комнатной температуре добавляли карбонат калия (0,071 г, 0,52 ммоль). Полученную в результате суспензию взбалтывали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой собирали, пропускали через картридж для фазового разделения и фильтрат выпаривали. Полученное в результате твердое вещество растворяли в минимальном количестве дихлорметана и каплями добавляли гексан с быстрым взбалтыванием до осаждения. Осадок собирали фильтрацией и сушили с отсасыванием для получения метилбензолсульфоната (0,10 г, 0,2 ммоль, выход 70,0%) в виде белого твердого вещества. Получали 4-гидрокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]пиридазин-3-он, как описано в примере 2. Пример 13. 4-Гидрокси-2-метил-5-[4-морфолино-2-(трифторметил)пиримидин-5-ил] пиридазин-3-он. 5-[4-Хлор-2-(трифторметил)пиримидин-5-ил]-4-метокси-2-метилпиридазин-3-он(240,0 мг,0,22 ммоль) растворяли в морфолине (2,5 мл, 28,6 ммоль). Реакционную смесь взбалтывали при 100 С в течение 45 мин. Реакционную смесь осторожно добавляли к 30,0 мл воды и взбалтывали в течение 10 мин. Водный слой экстрагировали дихлорметаном (220 м). Затем водный слой подкисляли водной хлористо-водородной кислотой (2,0 М), а затем промывали дихлорметаном, который собирали с использованием картриджа для фазового разделения. Растворитель концентрировали в вакууме и неочищенный продукт растирали с 5,0 мл ацетонитрила, затем обрабатывали ультразвуком и полученное в результате твердое вещество (40,0 мг) собирали фильтрацией. TLC демонстрировала некоторую примесь, поэтому растирали еще раз с использованием 5,0 мл метанола и полученный в результате осадок выделяли с получением 4-гидрокси-2-метил-5-[4-морфолино-2-(трифторметил)пиримидин-5-ил]пиридазин-3-она(25,0 мг, 0,07 ммоль, выход 31,2%) в виде белого твердого вещества. 5-[4-Хлор-2-(трифторметил)пиримидин-5-ил]-4-метокси-2-метилпиридазин-3-он. 4-Метокси-2-метил-5-[6-оксо-2-(трифторметил)-1 Н-пиримидин-5-ил]пиридазин-3-он (515,0 мг,1,7 ммоль) растворяли в оксихлориде фосфора(V) (5,0 мл, 53 ммоль). Смесь взбалтывали при 85 С в течение 90 мин. Затем реакцию останавливали и позволяли остыть до комнатной температуры, а затем концентрировали в вакууме. Неочищенный продукт каплями добавляли в ледяную воду и водный слой экстрагировали дихлорметаном. Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, затем очищали с использованием картриджа 24 г оксида кремния с элюированием изогексан:этилацетатом (100:0-60:40 в течение 12 мин, затем держали градиент в течение 6 мин). Фракции, содержащие продукт, концентрировали в вакууме с получением 5-[4-хлор-2-(трифторметил)пиримидин-5-ил]-4-метокси-2-метилпиридазин-3-она (240,0 мг, 0,22 ммоль,выход 13,18%) в виде прозрачного масла. 1H ЯМР (400 МГц, хлороформ)ppm 3,86 (3 Н, s), 4,29 (3 Н, s), 7,63 (1H, s), 8,76 (1H, s). 4-Метокси-2-метил-5-[6-оксо-2-(трифторметил)-1 Н-пиримидин-5-ил]пиридазин-3-он. 2,2,2-Трифторацетамидин (450 мг, 11,8 ммоль) суспендировали в метаноле (3,0 мл). Затем добавляли метил-(Е)-3-метокси-2-(5-метокси-1-метил-6-оксопиридазин-4-ил)проп-2-еноат (1,00 г, 3,93 ммоль), а потом метоксид натрия (1,35 мл, 5,90 ммоль). Смесь нагревали до 65 С в течение 2 ч. Еще добавляли 2,2,2-трифторацетамидин (450,0 мг, 11,8 ммоль) и метоксид натрия (1,35 мл, 5,90 ммоль) и смесь взбалтывали в течение еще 2 ч. Реакцию останавливали и обеспечивали остывание до комнатной температуры. Добавляли 2 М водной хлористо-водородной кислоты и смесь концентрировали в вакууме. Неочищенный продукт очищали посредством хроматографии на оксиде кремния с элюированием изогексан:этилацетатом, а затем дихлорметан:метанолом. Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением 4-метокси-2-метил-5-[6-оксо-2-(трифторметил)-1 Н-пиримидин-5 ил]пиридазин-3-она (520,0 мг, 1,72 ммоль, выход 43,7%) в виде бледно-желтого твердого вещества. 1 Н ЯМР (400 МГц, d3-метанол)ppm 3,80 (3 Н, s), 4,01 (3 Н, s), 7,94 (1 Н, s), 8,13 (1 Н, s). Метил-(Е)-3-метокси-2-(5-метокси-1-метил-6-оксопиридазин-4-ил)проп-2-еноат. 4-Метокси-2-метил-5-трибутилстаннил-пиридазин-3-он (2,9 г, 6,8 ммоль) и метил-(Z)-2-йод-3 метоксипроп-2-еноат (1,5 г, 6,2 ммоль) растворяли в N,N-диметилформамиде (15,0 мл, 193 ммоль). Добавляли фторид цезия (1,9 г, 2,0 экв., 12 ммоль) и смесь дегазировали азотом. Затем добавляли йодид меди (0,12 г, 0,62 ммоль) и палладия(0) тетракис(трифенилфосфин) (0,36 г, 0,31 ммоль) и смесь еще раз дегазировали азотом при помещении в предварительно нагретом до 55 С нагревательном блоке в течение 2 ч. Добавляли воду (50 мл) и дихлорметан (50 мл) и реакционную смесь энергично встряхивали. Добавляли 50,0 мл насыщенного водного гидрокарбоната натрия и смесь снова встряхивали. Дихлорметановый слой собирали и концентрировали в вакууме. Неочищенный продукт сушили загрузкой в картридж 120 г оксида кремния с элюированием дихлорметан: этилацетатом (100:0-40:60 в течение 20 мин,затем поддерживали градиент в течение еще 10 мин). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением 1,12 г коричневого масла, которое затвердевало при отстаивании. Неочищенный продукт далее очищали посредством колоночной хроматографии на оксиде кремния с элюированием изогексан:этилацетатом (60:40-30:70 в течение 8 мин, затем выдерживали градиент в течение 5 мин, затем переходили на 100% этилацетат). Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением продукта в виде бледно-желтого твердого вещества (882,0 мг, выход 56%). 1 Н ЯМР (400 МГц, хлороформ, (12wq161h2ppm 3,74 (3 Н, s), 3,77 (3 Н, s), 3,90 (3 Н, s), 4,11 (3 Н,s), 7,52 (1H, s), 7,56 (1H, s). 4-Метокси-2-метил-5-трибутилстаннил-пиридазин-3-он.(1,0 моль) в тетрагидрофуране (46 г, 45,7 ммоль, 46 мл, 1,0 моль/л) посредством капельной воронки (при поддерживании внутренней температуры ниже -30 С все время) и смесь взбалтывали при -40 С в течение 30 мин. Затем каплями добавляли три-н-бутилолова хлорид (23,2 г, 68,5 ммоль, 19,3 мл) в виде раствора в тетрагидрофуране (20 мл) и смеси позволяли нагреться до 0 С в течение 1 ч. Затем реакционную смесь гасили насыщенным водным раствором хлорида аммония (100 мл) и экстрагировали этилацетатом(3100 мл). Объединенные органические экстракты сушили, фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт загружали на оксиде кремния и очищали посредством хроматографии с получением 4-метокси-2-метил-5-трибутилстаннил-пиридазин-3-она в виде красноватого масла (5,21 г, 12,1 ммоль, выход 53,2%). 1 Н ЯМР (400 МГц, хлороформ)ppm 7,56 (1 Н, s), 4,14 (3 Н, s), 3,78 (3 Н, s), 1,44-1,62 (6 Н, m), 1,271,38 (6 Н, m), 1,00-1,21 (6 Н, m), 0,89 (9 Н, t, J=7,3 Гц). 5-Бром-4-метокси-2-метилпиридазин-3-он может быть получен аналогично схеме реакции 3. Пример 14. 3-Циклогексил-2-(3-фторфенил)-5-(5-гидрокси-1-метил-6-оксопиридазин-4-ил)пиримидин-4-он. 3-Циклогексил-2-(3-фторфенил)-5-(5-метокси-1-метил-6-оксопиридазин-4-ил)пиримидин-4-он(51,0 мг, 0,118 ммоль) растворяли в морфолине (2,0 мл, 23 ммоль). Реакционную смесь взбалтывали при 95 С в течение 2 ч. LC продемонстрировала отсутствие реакции, поэтому температуру повышали до 105 С и реакцию взбалтывали еще в течение 2 ч. На этот раз реакция подошла к завершению, поэтому смеси позволили остыть до комнатной температуры. Затем к реакционной смеси осторожно добавляли водную хлористо-водородную кислоту до подкисления смеси. Водный слой промывали дихлорметаном и органические слои объединяли и пропускали через картридж для фазового разделения. Растворитель концентрировали в вакууме и неочищенный продукт измельчали с 3,0 мл ацетонитрила, раствор обрабатывали в течение приблизительно 1 мин. Твердое вещество собирали фильтрацией с выходом продукта в виде бледно-розового твердого вещества (25,0 мг, выход 53,4%). 3-Циклогексил-2-(3-фторфенил)-5-(5-метокси-1-метил-6-оксопиридазин-4-ил)пиримидин-4-он. Этил-3-фторбензолкарбоксимидат гидрохлорид (135,0 мг, 0,6629 ммоль) суспендировали в метаноле (3,0 мл). Затем добавляли циклогексанамин (0,066 г, 0,6629 ммоль) и смесь взбалтывали в течение 2 ч в течение 18 ч. Реакционную смесь постепенно нагревали с обратным холодильником и взбалтывали еще 2 ч. Еще добавляли циклогексиламин (0,066 г, 0,6629 ммоль) и смесь взбалтывали с обратным холодильником в течение 2 ч. Реакцию останавливали и концентрировали в вакууме с получением масла. Неочищенный продукт повторно растворяли в метаноле (3,0 мл), затем добавляли метоксид натрия (0,12 г,0,57 ммоль), смесь взбалтывали в течение 5 мин перед добавлением метил-(Е)-3-метокси-2-(5-метокси-1 метил-6-оксопиридазин-4-ил)проп-2-еноата (145,0 мг, 0,57 ммоль) и смесь взбалтывали при 65 С в течение 3 ч. Реакционную смесь охлаждали и растворитель выпаривали в вакууме, затем неочищенный продукт поглощали диэтиловым эфиром. Органический слой промывали насыщенным гидрокарбонатом натрия, а водный слой промывали диэтиловым эфиром. Органические фазы объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, затем очищали посредством хроматографии на оксиде кремния с элюированием изогексан:этилацетатом с получением продукта (95 мг) в виде бледно-желтой смолы. Далее ее очищали посредством препаративной HPLC и концентрировали в вакууме с получением продукта в виде прозрачного масла (51,0 мг, выход 21,8%). 1 Н ЯМР (400 МГц, хлороформ)ppm 0,93-1,11 (2 Н, m), 1,14-1,30 (1H, m), 1,57 (1 Н, d, J=12,9 Гц),1,72 (2 Н, d, J=11,3 Гц), 1,81 (2 Н, d, J=13,4 Гц), 2,63-2,79 (2 Н, m), 3,81 (3 Н, s), 3,87-3,97 (1 Н, m), 4,21 (3 Н,s), 7,21-7,26 (1 Н, m), 7,27-7,30 (1H, m), 7,52 (1 Н, td, J=7,9, 5,6 Гц), 7,88 (1H, s), 8,07 (1H, s). Метил-(Е)-3-метокси-2-(5-метокси-1-метил-6-оксопиридазин-4-ил)проп-2-еноат получали, как описано в примере 13 выше. Пример 15. 4-Гидрокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-6-пропоксипиридазин-3-он. 4-Гидрокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-6-пропоксипиридазин-3-он можно получать из 4-метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-6 пропоксипиридазин-3-она способом, аналогичным описанному, например, в примере 1, стадия 1. 4-Метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-6-пропоксипиридазин-3-он. К смеси 4-метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-1 Н-пиридазин-3,6-диона(0,09 г, 0,24 ммоль) и карбоната калия (0,17 г, 1,19 ммоль) в N,N-диметилформамиде (1,4 г, 1,5 мл,19 ммоль) при комнатной температуре добавляли 1-йодпропан (0,045 г, 0,026 мл, 0,26 ммоль). Полученную в результате желтую смесь взбалтывали в течение 3 ч, а затем выливали в воду и экстрагировали этилацетатом. Органические экстракты промывали соляным раствором, фильтровали через картридж для фазового разделения и фильтрат выпаривали. Неочищенный остаток очищали флэш-хроматографией(0,099 г, 0,236 ммоль, выход 99%). 1 Н ЯМР (400 МГц, CDCl3):8,41 (1H, br d), 7,94 (1 Н, br dd), 7,39 (1H, d), 4,10 (3 Н, s), 4,04-4,00 (2 Н,m), 3,72 (3 Н, s), 2,99 (3 Н, s), 1,57-1,52 (2 Н, m), 0,76 (3 Н, t). 4-Метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-1H-пиридазин-3,6-дион. К раствору нитрита натрия (0,11 г, 1,6 ммоль) в концентрированной серной кислоте (3 мл) при 0 С каплями добавляли суспензию 6-амино-4-метокси-2-метил-5-[2-метилсульфонил-4(трифторметил)фенил]пиридазин-3-она (0,51 г, 1,352 ммоль) в ледяной уксусной кислоте (6,294 г, 6 мл,105 ммоль). Полученной в результате смеси позволяли нагреться до комнатной температуры и взбалтывали в течение 40 мин. Затем ее охлаждали до 0 С и каплями добавляли воду (9 мл). Полученную в результате суспензию взбалтывали в течение 60 мин при комнатной температуре, затем разбавляли водой(10 мл) и осадок собирали фильтрацией, промывали водой и сушили в вакуумной печи при 55 С в течение ночи с получением 4-метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-1 Нпиридазин-3,6-диона в виде грязно-белого твердого вещества (0,35 г, 0,92 ммоль, выход 68,25%). 1 Н ЯМР (400 МГц, MeOD):8,38 (1H, br d), 8,08 (1 Н, br dd), 7,62 (1H, d), 3,95 (3 Н, s), 3,67 (3 Н, s),3,14 (3 Н, s). 6-Амино-4-метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]пиридазин-3-он. К раствору 4-метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-6-нитропиридазин-3 она (0,8 г, 1,964 ммоль) в этаноле (19,7 г, 25 мл, 411 ммоль) при 80 С добавляли формиат аммония(2,502 г, 39,28 ммоль) и гидроксид палладия на угле (0,5517 г, 3,928 ммоль). Полученную в результате черную смесь выдерживали при 80 С в течение 1 ч (наблюдали NB сублимацию формиата аммония), а затем горячим фильтровали через небольшую подушку целита с промыванием горячим этанолом, этилацетатом и метанолом. Фильтрат выпаривали и полученный в результате остаток быстро взбалтывали с водой в течение 10 мин, а затем собирали фильтрацией и сушили в вакуумной печи при 55 С в течение 2 дней (выходных). Выход: 510 мг (69%, желтое твердое вещество). 1 Н ЯМР (400 МГц, MeOD):8,42 (1 Н, br s), 8,14 (1 Н, br d), 7,65 (1H, d), 3,94 (3H, s), 3,66 (3H, s),3,16 (3H,s). 4-Метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-6-нитропиридазин-3-он. К раствору 4-метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]пиридазин-3-она(1,81 г, 5,00 ммоль) в серной кислоте (14,7 г, 8 мл, 138 ммоль) при 0 С каплями добавляли азотную кислоту (1,26 г, 0,891 мл, 20,0 ммоль). Полученный в результате раствор взбалтывали при 0 С в течение 5 мин, затем обеспечивали нагревание до комнатной температуры в течение 15 мин, а потом нагревали до 50 С еще в течение 2,5 ч. Еще добавляли азотную кислоту (1,26 г, 0,891 мл, 20,0 ммоль) и нагревание продолжали еще 2 ч. LC-MS все еще демонстрировала присутствие исходного материала. Еще добавляли азотную кислоту (1,26 г, 0,891 мл, 20,0 ммоль) и нагревание продолжали еще 1 ч. Реакционной смеси позволяли остыть до комнатной температуры, а затем осторожно выливали в ледяную воду с быстрым взбалтыванием. Полученный в результате бледно-желтый осадок фильтровали, промывали ледяной водой, а затем сушили в вакуумной печи в течение ночи при 55 С. Выяснили, что неочищенный продукт содержал некоторую кислотную примесь. Оранжевое твердое вещество растворяли в дихлорметане и органическую фазу промывали водой (с добавлением нескольких капель водного гидроксида натрия - рН 14), а затем пропускали через картридж для фазового разделения. Фильтрат выпаривали при пониженном давлении с получением 4-метокси-2-метил-5-[2-метилсульфонил-4-(трифторметил)фенил]-6 нитропиридазин-3-она (0,8 г, 1,96 ммоль, выход 39,3%) в виде бледно-розового твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):8,38 (1H, br s), 7,98 (1 Н, dd), 7,41 (1 Н, d), 4,20 (3 Н, s), 3,92 (3 Н, s), 3,00(3 Н, s). Пример 16. 4-Гидрокси-2-метил-5-[1-метил-2-оксо-6-(трифторметил)-3-пиридил]пиридазин-3-он. 2-Метокси-6-(трифторметил)пиридин. К раствору 6-(трифторметил)пиридин-2-ола (10,0 г, 10,0 г, 61,3 ммоль) в дихлорметане (3 мл/ммоль,184 мл) добавляли карбонат серебра (22,8 г, 82,8 ммоль, 3,75 мл) и йодметан (87,0 г, 613 ммоль, 38,2 мл) и взбалтывали в темноте в течение 24 ч. Затем реакционную смесь фильтровали через целит и промывали дихлорметаном. Фильтрат концентрировали при 30 С при 250 мбар, добавляли оксид кремния и остаток очищали хроматографией с элюированием 0-10% этилацетатом в гексане. Фракции, содержащие продукт, объединяли с получением 2-метокси-6-(трифторметил)пиридина (6,49 г, 36,6 ммоль, 59,8% выход). 1 Н ЯМР (CDCl3):7,69 (t, J=8,1 Гц, 1H), 7,25 (d, J=7,5 Гц, 1H), 6,91 (d, J=8,6 Гц, 1H), 3,98 (s,3H).(1,2 мл/ммоль, 6,8 мл) при -78 С в азоте добавляли nBuLi (2,5 моль/л) в гексанах (4,7 г, 17 ммоль, 6,8 мл) в течение 5 мин и обеспечивали нагревание до комнатной температуры в течение 30 мин. Борной кислоты триизопропиловый сложный эфир (2,1 г, 11 ммоль, 2,6 мл) в диэтиловом эфире (1,2 мл/ммоль, 6,8 мл) охлаждали до -78 С и к этому раствору добавляли [2-метокси-6-(трифторметил)-3-пиридил]литий в течение 15 мин, а затем нагревали до комнатной температуры в течение 30 мин. Добавляли хлороводород(водный 25%) (10 мл, 10 ммоль) и реакционную смесь разбавляли водой и дважды экстрагировали дихлорметаном, пропускали через разделитель фаз и концентрировали в вакууме с получением желтого масла, которое затвердевало в течение ночи. Реакционную смесь адсорбировали оксидом кремния и очищали хроматографией на оксиде кремния с элюированием 0-25% этилацетат/гексан. Фракции, содержащие продукт, объединяли с получением [2-метокси-6-(трифторметил)-3-пиридил]бороновой кислоты в виде желтого твердого вещества (707 мг, 3,20 ммоль, выход 59%). 1 Н ЯМР (11vu941h1, CDCl3):8,29 (d, J=7,5 Гц, 1H), 7,34 (d, J=7,5 Гц, 1 Н), 5,92 (s, 2H), 4,10 (s, 3H). 4-Метокси-5-[2-метокси-6-(трифторметил)-3-пиридил]-2-метилпиридазин-3-он. К смеси 5-хлор-4-метокси-2-метилпиридазин-3-она (400 мг, 2,29 ммоль), полученной, как описано в примере 2, добавляли [2-метокси-6-(трифторметил)-3-пиридил]бороновую кислоту (0,71 г, 3,20 ммоль),sPhos (0,19 г, 0,46 ммоль), трис-(дибензилиденацетонил)-бис-палладий (0,11 г, 0,11 ммоль), фосфат калия(1,00 г, 4,58 ммоль, 0,39 мл) и реакционную смесь разбавляли трет-бутанолом (1,6 мл/ммоль, 2,88 г,38,5 ммоль, 3,67 мл). Реакционную смесь нагревали до 80 С в течение 50 мин. Реакционную смесь разбавляли соляным раствором и экстрагировали этилацетатом (3 х). Оранжевый раствор пропускали через разделитель фаз, добавляли оксид кремния и концентрировали в вакууме. Затем его очищали хроматографией с элюированием 0-50% этилацетатом в гексане. Фракции, содержащие продукт, объединяли с получением 4-метокси-5-[2-метокси-6-(трифторметил)-3-пиридил]-2-метилпиридазин-3-она (545 мг,0,54 г, 1,73 ммоль, выход 75,46%). 5-[2-Гидрокси-6-(трифторметил)-3-пиридил]-4-метокси-2-метилпиридазин-3-он. В 4 емкости для микроволнового реактора добавляли по 1 г 4-метокси-5-[2-метокси-6(трифторметил)-3-пиридил]-2-метилпиридазин-3-она (4,0 г, 13 ммоль), а затем 15 мл бромоводорода(48% водный раствор) (60 мл) и последовательно нагревали при 40 С в микроволнах в течение 45 мин. Реакционные смеси объединяли и добавляли этилацетат, затем соляной раствор, а потом экстрагировали этилацетатом (310 мл), объединенные органические экстракты пропускали через разделитель фаз и концентрировали в вакууме с получением белого твердого вещества. Затем его очищали хроматографией с элюированием 0-50% этилацетатом в гексане. Фракции, содержащие продукт, объединяли с получением 5-[2-гидрокси-6-(трифторметил)-3-пиридил]-4-метокси-2-метилпиридазин-3-она в виде розового твердого вещества (1,6 г, 5,3 ммоль, выход 42%). 1 Н ЯМР (11vz747h1, CDCl3):7,83 (s, 1H), 7,75 (d, J=7,6 Гц, 1H), 6,96 (d, J=7,4 Гц, 1 Н), 4,18 (s, 3H),3,82 (s, 3H). 4-Метокси-2-метил-5-[1-метил-2-оксо-6-(трифторметил)-3-пиридил]пиридазин-3-он. К раствору 5-[2-гидрокси-6-(трифторметил)-3-пиридил]-4-метокси-2-метилпиридазин-3-она(150 мг, 0,49797 ммоль) в 1,2-диметоксиэтане (12 мл/ммоль, 5,98 мл) добавляли дикалия карбонат (0,21 г,1,49 ммоль), а затем йодметан (0,64 г, 4,48 ммоль, 0,28 мл) и реакционную смесь нагревали с обратным холодильником (75 С) в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры и неорганические твердые вещества фильтровали и промывали этилацетатом и растворителем; добавляли оксид кремния, реакционную смесь концентрировали в вакууме и очищали хроматографией с элюированием 0-35-50% этилацетат/гексан. Фракции, содержащие продукт, объединяли с получением 4-метокси 2-метил-5-[1-метил-2-оксо-6-(трифторметил)-3-пиридил]пиридазин-3-она в виде белого твердого вещества (88 мг, 0,28 ммоль, выход 56,06%). 1 Н ЯМР (12wk938h1, CDCl3):7,82 (s, 1H), 7,55 (d, J=7,5 Гц, 1H), 6,78 (d, J=7,0 Гц, 1H), 4,16 (s, 3 Н),3,80 (s, 3 Н), 3,70 (d, J=1,1 Гц, 3 Н). 4-Гидрокси-2-метил-5-[1-метил-2-оксо-6-(трифторметил)-3-пиридил]пиридазин-3-он. Раствор 4-метокси-2-метил-5-[1-метил-2-оксо-6-(трифторметил)-3-пиридил]пиридазин-3-она (88 мг,0,2792 ммоль) в морфолине (1 мл, 11,4 ммоль) нагревали до 100 С в течение 1,5 ч. Реакционную смесь концентрировали в вакууме, разбавляли этилацетатом, промывали 1 М HCl 3 раза, концентрировали в вакууме и измельчали с ТВМЕ с получением 4-гидрокси-2-метил-5-[1-метил-2-оксо-6-(трифторметил)-3 пиридил]пиридазин-3-она в виде белого твердого вещества (48 мг, 0,16 ммоль, выход 57,08%). Таблица С 1 Примеры гербицидных соединений в соответствии с настоящим изобретением
МПК / Метки
МПК: C07D 413/14, C07D 401/14, C07D 495/10, C07D 409/14, C07D 237/16, C07D 417/04, C07D 401/04, C07D 405/04, C07D 471/04, C07D 405/14, A01N 43/58, C07D 405/12, C07D 413/10
Метки: гербицидные, соединения
Код ссылки
<a href="https://eas.patents.su/30-24330-gerbicidnye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Гербицидные соединения</a>
Предыдущий патент: Способ активации целлюлозы
Следующий патент: Применение соединений типа стробилуринов для борьбы с фитопатогенными грибами, устойчивыми к ингибиторам qo
Случайный патент: Способ рентгеновского контроля объекта исследования и установка для его реализации