Литический полипептид с пептидогликангидролазной активностью и его применение против инфекций, вызванных грамотрицательными бактериями
Номер патента: 24253
Опубликовано: 31.08.2016
Авторы: Брирс Ивс, Миллер Стефан, Валмах Маартен, Лавинь Роб
Формула / Реферат
1. Литический полипептид с пептидогликангидролазной активностью, содержащий аминокислотную последовательность SEQ ID NO: 1.
2. Полипептид по п.1, содержащий делецию, присоединение, инсерцию и/или замещение в аминокислотной последовательности SEQ ID NO: 1 и сохраняющий литическую активность полипептида.
3. Полипептид по п.1 или 2, содержащий дополнительно таг (метку), предпочтительно His6-таг.
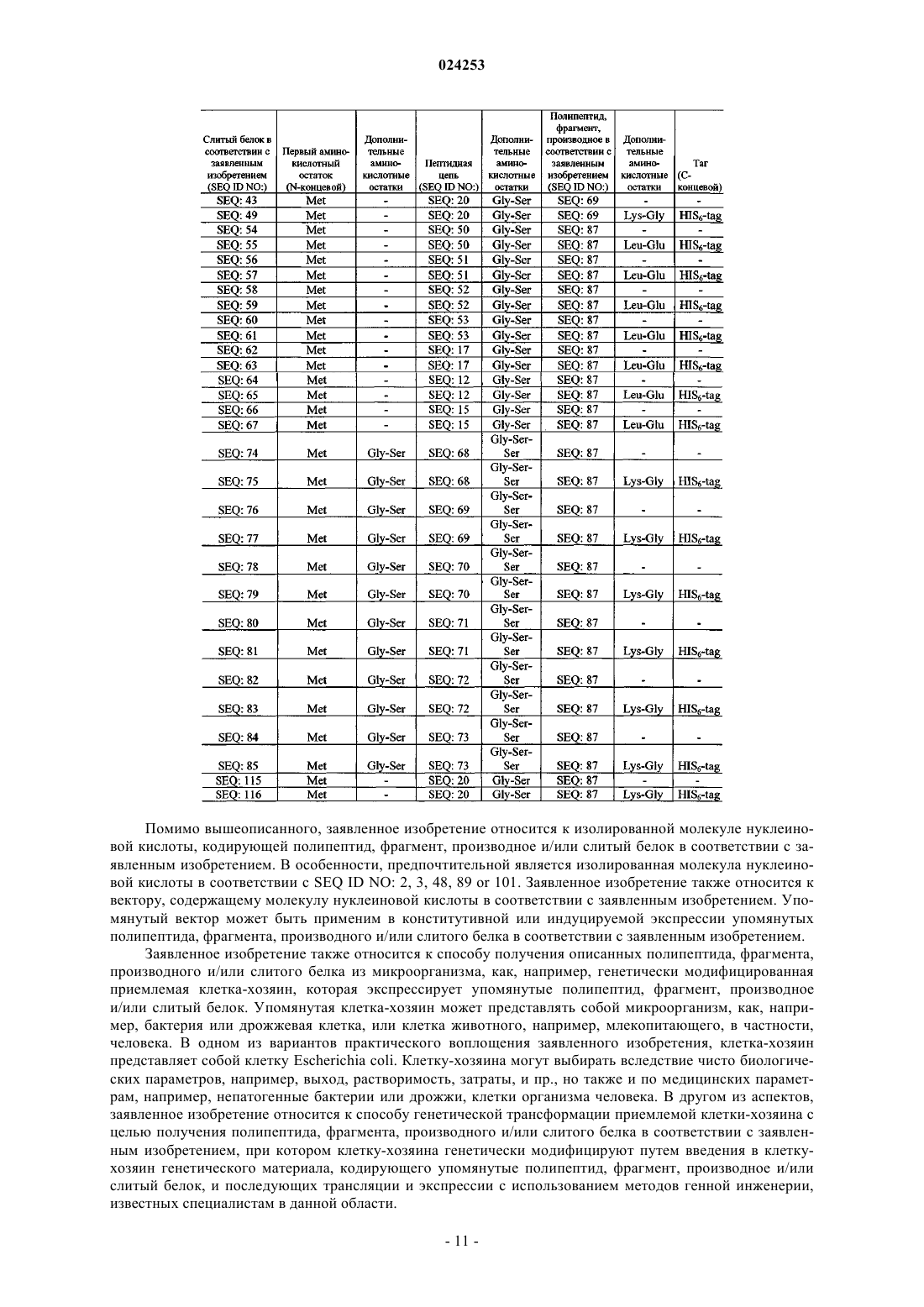
4. Полипептид по п.3, содержащий аминокислотную последовательность SEQ ID NO: 47.
5. Фрагмент полипептида по п.1, содержащий его каталитический домен и домен связывания с клеточной стенкой и сохраняющий литическую активность полипептида.
6. Фрагмент по п.5, содержащий аминокислотные последовательности SEQ ID NO: 4 и 5.
7. Фрагмент по п.6, содержащий делецию, присоединение, инсерцию и/или замещение в аминокислотной последовательности SEQ ID NO: 4 или 5 и сохраняющий литическую активность полипептида.
8. Фрагмент по любому из пп.5-7, содержащий дополнительно таг (метку), предпочтительно His6-таг.
9. Слитый белок, содержащий полипептид по любому из пп.1-4 или фрагмент по любому из пп.5-8 и слитую с указанным полипептидом или фрагментом на N- или С-конце пептидную цепь, представляющую собой катионный пептид, поликатионный пептид, амфипатичный пептид, sushi пептид, дефензин, гидрофобный пептид и/или антимикробный пептид.
10. Слитый белок по п.9, в котором пептидная цепь содержит от 5 до примерно 100 аминокислотных остатков, в частности от 5 до 50 аминокислотных остатков, в частности от 5 до 30 аминокислотных остатков.
11. Слитый белок по п.9 или 10, в котором катионная и/или поликатионная пептидная цепь содержит как минимум один аминокислотный остаток, принадлежащий группе, включающей остатки аргинина, гистидина и лизина, в частности, в котором пептидная цепь содержит как минимум 70% аминокислотных остатков, представляющих собой остатки аргинина, гистидина и/или лизина, в частности остатки аргинина и/или лизина.
12. Слитый белок по п.9, в котором амфипатичный пептид содержит как минимум один положительно заряженный аминокислотный остаток, принадлежащий группе, включающей остатки лизина, аргинина и гистидина, соединенный как минимум с одним гидрофобным аминокислотным остатком, принадлежащим группе, включающей остатки валина, изолейцина, лейцина, метионина, фенилаланина, триптофана, цистеина, аланина, тирозина, гистидина, треонина, серина, пролина и глицина, в частности, в котором амфипатичный пептид содержит примерно 70% аминокислотных остатков, представляющих собой остатки аргинина или лизина, и примерно 30% аминокислотных остатков, представляющих собой остатки валина, изолейцина, лейцина, метионина, фенилаланина, триптофана, цистеина, аланина, тирозина, гистидина, треонина, серина, пролина или глицина.
13. Слитый белок по п.9, в котором пептидная цепь содержит аминокислотную последовательность SEQ ID NO: 6-39.
14. Слитый белок по п.9, содержащий аминокислотную последовательность SEQ ID NO: 43 или 49.
15. Молекула нуклеиновой кислоты, кодирующая полипептид по любому из пп.1-4.
16. Молекула нуклеиновой кислоты, кодирующая фрагмент по любому из пп.5-8.
17. Молекула нуклеиновой кислоты, кодирующая слитый белок по любому из пп.9-14.
18. Вектор, содержащий молекулу нуклеиновой кислоты по любому из пп.15-17.
19. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты по любому из пп.15-17 либо вектор по п.18.
20. Применение полипептида по любому из пп.1-4 в качестве лекарственного препарата для человека или ветеринарного лекарственного препарата для лечения инфекций, вызванных грамотрицательными бактериями, либо в качестве ветеринарного диагностического средства для выявления инфекций, вызванных грамотрицательными бактериями, либо в качестве антимикробного агента в пищевой или косметической промышленности, либо в качестве дезинфектанта в мероприятиях по очистке окружающей среды.
21. Применение фрагмента по любому из пп.5-8 в качестве лекарственного препарата для человека или ветеринарного препарата для лечения инфекций, вызванных грамотрицательными бактериями, либо в качестве ветеринарного диагностического средства для выявления инфекций, вызванных грамотрицательными бактериями, либо в качестве антимикробного агента в пищевой или косметической промышленности, либо в качестве дезинфектанта в мероприятиях по очистке окружающей среды.
22. Применение слитого белка по любому из пп.9-14 в качестве лекарственного препарата для человека или ветеринарного препарата для лечения инфекций, вызванных грамотрицательными бактериями, либо в качестве ветеринарного диагностического средства для выявления инфекций, вызванных грамотрицательными бактериями, либо в качестве антимикробного агента в пищевой или косметической промышленности, либо в качестве дезинфектанта в мероприятиях по очистке окружающей среды.
23. Применение полипептида по любому из пп.1-4 в качестве лекарственного препарата для лечения или профилактики инфекций, вызванных грамотрицательными бактериями.
24. Применение фрагмента по любому из пп.5-8 в качестве лекарственного препарата для лечения или профилактики инфекций, вызванных грамотрицательными бактериями.
25. Применение слитого белка по любому из пп.9-14 в качестве лекарственного препарата для лечения или профилактики инфекций, вызванных грамотрицательными бактериями.
26. Применение полипептида по любому из пп.1-4 для устранения, уменьшения или предотвращения заражения грамотрицательными бактериями пищевых продуктов, загрязнения оборудования на предприятиях пищевой отрасли, различных поверхностей, контактирующих с пищевыми продуктами, изделий медицинского назначения, поверхностей в больницах и хирургических блоках.
27. Применение фрагмента по любому из пп.5-8 для устранения, уменьшения или предотвращения заражения грамотрицательными бактериями пищевых продуктов, загрязнения оборудования на предприятиях пищевой отрасли, различных поверхностей, контактирующих с пищевыми продуктами, изделий медицинского назначения, поверхностей в больницах и хирургических блоках.
28. Применение слитого белка по любому из пп.9-14 для устранения, уменьшения или предотвращения заражения грамотрицательными бактериями пищевых продуктов, загрязнения оборудования на предприятиях пищевой отрасли, различных поверхностей, контактирующих с пищевыми продуктами, изделий медицинского назначения, поверхностей в больницах и хирургических блоках.
29. Фармацевтическая композиция для лечения инфекций, вызванных грамотрицательными бактериями, содержащая полипептид по любому из пп.1-4.
30. Фармацевтическая композиция для лечения инфекций, вызванных грамотрицательными бактериями, содержащая фрагмент по любому из пп.5-8.
31. Фармацевтическая композиция для лечения инфекций, вызванных грамотрицательными бактериями, содержащая слитый белок по любому из пп.9-14.
Текст
ЛИТИЧЕСКИЙ ПОЛИПЕПТИД С ПЕПТИДОГЛИКАНГИДРОЛАЗНОЙ АКТИВНОСТЬЮ И ЕГО ПРИМЕНЕНИЕ ПРОТИВ ИНФЕКЦИЙ, ВЫЗВАННЫХ ГРАМОТРИЦАТЕЛЬНЫМИ БАКТЕРИЯМИ Заявленное изобретение относится к литическому полипептиду с пептидогликангидролазной активностью, содержащему аминокислотную последовательность SEQ ID NO: 1. Кроме того,заявленное изобретение относится к слитым белкам, содержащим упомянутый полипептид и дополнительную пептидную цепь, слитую с упомянутым полипептидом на N- или С-концах. Помимо этого, заявленное изобретение относится к молекулам нуклеиновой кислоты, кодирующим упомянутый полипептид или слитый белок, векторам, содержащим упомянутые молекулы нуклеиновой кислоты и клеткам-хозяин, содержащим либо упомянутые молекулы нуклеиновой кислоты, либо упомянутые векторы. Дополнительно, заявленное изобретение относится к применению упомянутого полипептида или слитого белка в качестве лекарственного препарата, в частности, для лечения или профилактики инфекций, вызванных грамотрицательными бактериями,средства диагностики, в косметической промышленности или дезинфектанта. Заявленное изобретение также относится к применению упомянутого полипептида или слитого белка для устранения, уменьшения или предотвращения заражения грамотрицательными бактериями пищевых продуктов, загрязнения оборудования на предприятиях пищевой отрасли, различных поверхностей, контактирующих с пищевыми продуктами, изделий медицинского назначения,поверхностей в больницах и хирургических блоках. Кроме того, заявленное изобретение относится к фармацевтической композиции, содержащей упомянутые полипептид или слитый белок. Заявленное изобретение относится к полипептиду с аминокислотной последовательностью в соответствии с SEQ ID NO: 1 и его фрагментам или производным. Заявленное изобретение также относится к слитым белкам, содержащим упомянутый полипептид и дополнительную удлиненную пептидную цепь,слитую с упомянутым полипептидом на N-конце или С-конце. Помимо этого заявленное изобретение относится к молекулам нуклеиновой кислоты, кодирующим упомянутые полипептид или слитый белок,векторам, включающим упомянутые молекулы нуклеиновой кислоты и клеткам-хозяинам, содержащим либо упомянутые молекулы нуклеиновой кислоты, либо упомянутые векторы. Дополнительно заявленное изобретение относится к применению упомянутых полипептида или слитого белка в качестве медикаментозного препарата, в частности, в лечении или профилактике инфекций, вызываемых грамотрицательными бактериями, в качестве средства диагностики или компонента косметического препарата. Заявленное изобретение также относится к применению упомянутых полипептида или слитого белка для обработки или профилактики заражения грамотрицательными бактериями пищевых продуктов, оборудования и помещений на предприятиях пищевой промышленности, поверхностей, контактирующих с пищевыми продуктами, медицинского оборудования, поверхностей в медицинских стационарах и хирургических блоках. Помимо этого, заявленное изобретение относится к фармацевтическим или косметическим композициям, содержащим упомянутые полипептид или слитый белок. Грамотрицательные бактерии обладают внешней мембраной, с отличительным признаком в виде характерного ассиметричного двойного слоя. Внешний мембранный двойной слой состоит из внутреннего одинарного слоя, включающего фосфолипиды (преимущественно, фосфатидил этаноламин), и внешнего одинарного слоя, который по преимуществу состоит из одного гликолипида, липополисахарида(ЛПС). В мире бактерий существует огромное множество структур ЛПС, и структура ЛПС может изменяться в ответ на превалирующие условия окружающей среды. Стабильность слоя ЛПС и взаимодействие между различными молекулами ЛПС главным образом происходят благодаря электростатическому взаимодействию бивалентных ионов (Mg2+, Са 2+) с анионными компонентами молекулы ЛПС (фосфатные группы в липиде А, а также внутреннее ядро и карбоксигруппы KDO). Помимо этого, компактное и упорядоченное расположение гидрофобной группы липида А, характеризуемое отсутствием ненасыщенных жирных кислот, образует жесткую структуру с высокой вязкостью. Это придает ей меньшую проницаемость, предотвращающую от проникновения липофильных молекул, а также дополнительную устойчивость внешней мембраны (ВМ). Известны различные типы агентов с бактерицидным или бактериостатическим действием, например, антибиотики, эндолизины, антимикробные пептиды и дефензины. Возрастающая микробная устойчивость в отношении антибиотиков, тем не менее, создает проблемы в лечении все большего числа инфекций, вызываемых бактериями, в частности, что касается инфекций, вызываемых грамотрицательными бактериями, как например, Pseudomonas aeruginosa и Enterobacteriaceae. Эндолизины представляют собой пептидогликангидролазы, кодированные бактериофагами (или бактериальными вирусами). Они синтезируются во время экспрессии "поздних" генов в литическом цикле мультипликации фагов и опосредуют высвобождение прогенных вирионов из инфицированных клеток путем разрушения бактериального пептидогликана. Они являются либо (1,4)-гликолазами (лизосимами), трансгликолазами, амидазами или эндопептидазами. Антимикробное применение эндолизинов было предложено еще в 1991 г. Gasson (GB2243611). Несмотря на то, что способность к уничтожению микробов, наблюдаемая у эндолизинов, известна в течение длительного времени, использование данных энзимов в качестве антимикробных веществ игнорировали по причине успешного и доминирующего применения антибиотиков. Только после обнаружения бактерий с множественной устойчивостью к антибиотикам, стали проявлять интерес к применению эндолизинов в качестве препаратов против патогенных микроорганизмов, вызывающих заболевания у человека. Возникла насущная потребность в разработке совершенно новых классов антибактериальных агентов, и эндолизины, используемые в качестве"энизибиотиков" - термин-гибрид ("энзимы" и "антибиотики") прекрасно выполняют данную функцию. В 2001, Fischetti и соавторы впервые продемонстрировали терапевтический потенциал эндолизина бактериофага С 1 в отношении стрептококков группы А (Nelson et al., 2001). С того времени множество публикаций подтвердили функцию эндолизинов в качестве приемлемого и дополнительного альтернативного средства для контроля бактериальных инфекций, вызываемых в частности грамположительными бактериями. Впоследствии была подтверждена эффективность в качестве энзибиотиков у различных эндолизинов, активных в отношении других грамположительных патогенов, как например Streptococcus pneumoniae (Loeffler и соавторы, 2001), Bacillus anthracis (Schuch и соавторы, 2002), S. agalactiae (Cheng и соавторы, 2005) и Staphylococcus aureus (Rashel и соавторы, 2007). В настоящее время самую насущную проблему в терапии с использованием эндолизинов представляет нечувствительность грамотрицательных бактерий к экзогенному действию эндолизинов, поскольку внешняя мембрана выполняет функцию щита, защищающего бактерии от проникновения эндолизинов из пептидогликанов. Данное свойство в настоящее время препятствует расширению перечня эффективных эндолизинов, применяемых в отношении важных грамотрицательных патогенов. Антимикробные пептиды (АМП) представляют широкий спектр малых, катионных, генкодированных пептидных антибиотиков, которые можно обнаружить в практически любом организме. Различные АМП обладают различными свойствами, многие пептиды в данном классе являются предметом интенсивных научных исследований не только как антибиотики, но также как образцы для создания пептидов, проникающих через клеточную стенку. Несмотря на наличие нескольких схожих свойств (например, катионность, амфипатичность и малый размер), существует огромное разнообразие последовательностей АМП, и в связи с этим предложили как минимум четыре структурные группы (альфаспиральные, бета-складчатые, растянутые и закольцованные) для систематизации всего разнообразия наблюдаемых АМП. Аналогичным образом, по мере появления новых антибиотиков было предложено несколько вариантов механизмов действия, и было доказано, что, например, основной мишенью многих из этих пептидов является клеточная мембрана, в то время, как основной мишенью для других пептидов является проникновение в цитоплазматическую мембрану и нарушение основных функций метаболизма. АМП могут приобретать концентрацию, достаточную для синергического действия, несмотря на отсутствие специфического связывания мишеней; например, путем образования поры в мембране, как, например, в случае многих АМП. Тем не менее, данное явление наблюдается только в модельных фосфолипидных бислоях, а в некоторых случаях концентрация АМП в мембране была настолько высока, что необходимо соотношение одной пептидной молекулы на шесть фосфолипидных молекул. Данные концентрации приближаются (и практически эквивалентны) к состоянию полной мембранной насыщаемости. Поскольку минимальная подавляющая концентрация (МПК) для АМП, как правило, находится в пределах низкого микромолярного диапазона, значимость определения данных значений и их роль в проведении опытов in vivo сопровождается совершенно объяснимым скептицизмом (Melo et al., Nature reviews,Microbiology, 2009, 245). Дефензины представляют собой большую группу малых, катионных, с повышенным содержанием цистеина и аргинина антимикробных пептидов, присутствующих как в позвоночной, так и межпозвоночной тканях. Дефензины подразделяют на пять групп, в соответствии с сеткой размещения цистеинов: растительные, межпозвоночные, -, -, и -дефензины. Последние три в большинстве случаев встречаются у млекопитающих, -дефензины представляют собой белки, встречающиеся в нейтрофилах и эпителии ЖКТ. -дефензины по преимуществу являются наиболее широко встречающимися и вырабатываются лейкоцитами и эпителиальными клетками различных видов. До настоящего времени, -дефензины редко обнаруживали, например, в лейкоцитах макак-резусов. Дефензины проявляют активность в отношении бактерий, грибков и многих вирусов с оболочкой и без. Тем не менее, для эффективного уничтожения бактерий необходимы по преимуществу высокие концентрации,например, в микромолярном диапазоне. Активность многих пептидов может снижаться в условиях, приближенных к условиям физиологической соли, бивалентных катионов и сыворотки. В зависимости от содержания гидрофобных аминокислотных остатков, дефензины также проявляют гемолитическую активность. Таким образом, присутствует необходимость в разработке новых антимикробных агентов, активных в отношении грамотрицательных бактерий. Нижеследующие фигуры иллюстрируют суть заявленного изобретения. Фиг. 1 представляет эндолизин OBPgpLYS в соответствии с заявленным изобретением. На фиг. 1 А представлена аминокислотная последовательность эндолизина OBPgpLYS (SEQ ID NO: 1) в соответствии с заявленным изобретением. На фиг. 1 Б представлена первичная структура OBPgpLYS, содержащая дополнительный His6-таг (-метку), с результатами функционального анализа с использованием BLASTp и Pfam (программированного амплитудно-частотного модулятора). Прогнозируемый N-концевой пептидогликан-связывающий домен (PBD, аминокислотные остатки 7-96) обозначен подчеркиванием, а Сконцевой каталитический домен (аминокислотные остатки 126 - 292) лизосом-подобного суперсемейства-курсивом. Полностью аминокислотная последовательность OBPgpLYS, содержащая дополнительныйHis6-таг на С-конце, представлена на фиг. 1 Б в SEQ ID NO: 47. Фиг. 2 представляет нуклеотидную последовательность (SEQ ID NO: 101) эндолизина фага ОВР. Фиг. 3 представляет нуклеотидную последовательность (SEQ ID NO: 3) эндолизина OBPgpLYS(SEQ ID NO: 1) в соответствии с заявленным изобретением. Фиг. 4 представляет изображение кумасси-помеченных SDS-PAGE (аббревиатура метода электрофореза в полиакриламидном геле) с результатами экспрессии и очистки немодифицированного эндолизина OBPgpLYS (SEQ ID NO: 47) и его модифицированного варианта эндолизина PKOBPgpLYS (SEQ IDNO: 49). Дорожка LMW относится к размерному маркеру (LMW лесенка). Следующие три дорожки относятся к протеиновым фракциям очищенного белка в элюирующем буфере (20 мМ NaH2PO4-NaOH рН 7,4; 0,5 М NaCl; 500 мМ имидазола) после Ni2+ аффинной хроматографии. Дорожка FT относится к поперечному потоку, а дорожка W - к побочным фракциям. На изображении очищенных протеиновых фракций видны единичные вторичные бэнды, что указывает на высокую чистоту рекомбинантных протеинов (90%). Фиг. 5, А-Е, представляет графическое изображение антибактериальной активности немодифицированного OBPgpLYS (SEQ ID NO: 47) и модифицированного PKOBPgpLYS (SEQ ID NO: 49) в различных сочетаниях в отношении некоторых экспоненциально растущих грамотрицательных бактерий после инкубации при комнатной температуре и без встряхивания. Каждый вид грамотрицательных бактерий подвергли инкубации в течение 30 мин с составом, содержащим 0,5 мМ ЭДТК, но без эндолизина, с составом, содержащим 1,315 мкМ немодифицированного OBPgpLYS, но без ЭДТК, с составом, содержащим 1,315 мкМ модифированного PKOBPgpLYS, но без ЭДТК, с составом, содержащим 1,315 мкМ немодифицированного OBPgpLYS и 0,5 мМ ЭДТК и с составом, содержащим 1,315 мкМ модифицированного PKOBPgpLYS и 0,5 мМ ЭДТК. На фиг. 5 А представлена антибактериальная активность в отношении клеток Escherichia coli WK 6, на фиг. 5 Б - антибактериальная активность в отношении клеток Salmonella typhimurium LT2 (SGSC2317), на фиг. 5 В - антибактериальная активность в отношении клетокPKOBPgpLYS. Планки погрешностей показывают стандартные отклонения средних значений. Фиг. 6 показывает графическое представление хозяинной специфичности немодифицированногоOBPgpLYS (SEQ ID NO: 47) и модифицированного PKOBPgpLYS (SEQ ID NO: 49). Каждый вид грамотрицательных бактерий инкубировали в течение 30 мин с композицией, содержащей в каждом случае 1,315 мкМ немодифицированного OBPgpLYS или модифицированного PKOBPgpLYS. На гистограмме представлены значения антибактериальной активности немодифицированного OBPgpLYS и модифицированного OBPgpLYS в отношении клеток Pseudomonas aeruginosa PAO1p (PAO1), Escherichia coli WK6(wk6), Burkholderia pseudomallei (Берк псевдо), Pseudomonas aeruginosa Br667 (Br667), Salmonella typhimurium LT2 (LT2) и Pseudomonas putida G1 (Ppu G1). Планки погрешностей показывают стандартные отклонения средних значений. Термин "белок" в том смысле, в котором он используется в описании заявленного изобретения, синонимично соотносится с термином "полипептид". Термин "белок" в том смысле, в котором он используется в описании заявленного изобретения, относится к линейному полимеру аминокислотных остатков,связанных пептидными связями в специфичной последовательности. Аминокислотные остатки белка могут быть модифицированы, например, ковалентными прикреплениями различных групп, как, например, углеводы и фосфаты. Прочие вещества могут быть более свободно ассоциированы с полипептидными цепочками, как, например, гемы или липиды, приводя к образованию конъюгированных белков,которые также обозначают термином "белок", в том смысле, в котором он используется в описании заявленного изобретения. Описаны различные варианты с включением полипептидных цепей, в частности,что касается присутствия альфа-спиральных и бета-складчатых структур. Термин "белок" в том смысле,в котором он используется в описании заявленного изобретения, относится к четырем классам белков, а именно альфа, бета, альфа/бета и альфа-плюс-бета. Термин "слитый белок", в том смысле, в котором он используется в описании заявленного изобретения, относится к продукту экспрессии, являющемуся результатом слияния двух последовательностей нуклеиновых кислот. Такой белок получают, например, в системах экспрессии рекомбинантных ДНК. Помимо этого, термин "слитый белою), в том смысле, в котором он используется в описании заявленного изобретения, относится к слиянию первой аминокислотной последовательности, как, например, эндолизин, со второй или последующими аминокислотными последовательностями. Вторая или последующие аминокислотные последовательности могут определять домен или прочие участки пептидной цепи. Предпочтительно, вторая или последующие аминокислотные последовательности представляют собой пептидную цепь, в частности, катионный пептид, поликатионный пептид, амфипатичный пептид, Sushi пептид, дефензин, гидрофобный пептид, или антимикробный пептид. Более предпочтительно, упомянутые вторая или последующие аминокислотные последовательности чужеродны и по преимуществу не гомологичны с любой областью первой аминокислотной последовательности. Помимо этого "пептидная цепь" в том значении, в котором она трактуется в заявленном изобретении, не относится к His6-тагам, Strep-тагам, Avi-тагам, Мус-тагам, Gst-тагам, JS-тагам, цистеин-тагам,FLAG-тагам или прочим тагам (меткам), известным из уровня техники, тиоредоксин- или мальтозасвязывающим белкам (МСБ). Термин "метка" или "таг", в отличие от термина "пептидная цепочка", используемый в описании заявленного изобретения, относится к пептиду, который применяется для облегчения экспресии и/или аффинной очистки полипептида, для иммобилизации полипептида на поверхности, или для применения в качестве маркера или меченой составляющей для обнаружения полипептида,например, при помощи связывания антител в различных форматах энзим связанного иммуносорбентного метода исследования (ELISA), если только функция построения метки, применяемая для любой из вышеперечисленных фасилитаций, не вызвана положительным зарядом упомянутого пептида. Тем не менее, His-метка может, в зависимости от соответствующего показателя рН, быть положительно заряженной, но используется в качестве средства аффинной очистки вследствие своей способности связываться с иммобилизированными бивалентными катионами, а не как пептидная цепочка, в соответствии с заявленным изобретением. Термин "пептидная цепь", в том смысле, в котором он используется в описании заявленного изобретения, относится к любому типу пептида, связанного с белком, например, с эндолизином. В частности, термин "пептидная цепь", в том смысле, в котором он используется в описании заявленного изобретения, относится к катионному пептиду, поликатионному пептиду, амфипатичному пептиду, Sushi пептиду, дефензину, гидрофобному пептиду, и/или антимикробному пептиду. Тем не менее,Термин "пептид", в том смысле, в котором он используется в описании заявленного изобретения,относится к малым полипептидам, состоящим из от примерно 2 до примерно 100 аминокислотных остатков, более предпочтительно, от примерно 4 до примерно 50 аминокислотных остатков, наиболее предпочтительно от примерно 5 до 30 аминокислотных остатков, причем аминогруппа одного аминокислотного остатка соединена пептидной связью с карбоксигруппой другого аминокислотного остатка. Пептид может обладать специфической функцией. Пептид может представлять собой природный пептид или пептид, сконструированный и полученный синтетическим путем. Пептид могут, к примеру, извлекать или получать путем удаления из нативного белка при помощи энзиматического (ферментативного) или химического расщепления, либо могут приготавливать с использованием методов традиционного синтеза пептидов (например, твердофазный синтез) или способов молекулярной биологии (see Sambrook, J. etal., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (1989. Примерами природных пептидов могут служить антимикробные пептиды, дефензины, Sushi пептиды. Примерами синтетически полученных пептидов являются поликатионные, амфипатичные или гидрофобные пептиды. Пептид в описании заявленного изобретения не обозначает His-таги (-метки), Strepтаги, белки, связывающие тиоредоксин или мальтозу (МВР) и им подобные, которые используют для очистки или локализации белков. Термин "эндолизин", в том смысле, в котором он используется в описании заявленного изобретения, относится к энзиму, применение которого приемлемо для гидролиза клеточных стенок бактерий."Эндолизины" состоят как минимум из одного "энзим-активного домена" (ЭАД), и обладают свойствами как минимум одного из нижеперечисленных компонентов: эндопептидаза, N-ацетил-мурамоил-L-аланинамидаза (амидаза), N-ацетил-мурамидаза, N-ацетил-глюкозаминидаза (лизосим) или трансгликолазы. Дополнительно, эндолизины могут включать также энзим-неактивные области, которые могут связываться с клеточной стенкой бактерии-хозяина, так называемые, домены связывания с клеточной стенкой. Эндолизин может состоять из двух или более доменов связывания с клеточной стенкой. Помимо этого,термин "эндолизин", в том смысле, в котором он используется в описании заявленного изобретения, относится к энзимам, содержащим как минимум один ЭАД, но ни одного домена связывания с клеточной стенкой. Как правило, домен связывания с клеточной стенкой обладает функцией связывания различных компонентов на поверхности бактерии. Предпочтительно, домен связывания с клеточной стенкой представляет собой пептидогликан-связывающий домен, который связывается с пептидогликан-структурой бактерии. Различные домены эндолизина могут связываться доменным линкером. Термин "доменный линкер", в том смысле, в котором он используется в описании заявленного изобретения, относится к аминокислотной последовательности, функционирующей в качестве связывающего звена единичные белковые домены друг с другом. Как правило, доменные линкеры не образуют или почти не образуют регулярную вторичную структуру, как, например, альфа-спиральные или бетаскладчатые структуры и могут занимать различные конформации с соответствующим структурным окружением ("контекстом"). Способы детекции доменного линкера и определения свойств линкерных последовательностей хорошо известны из уровня техники, например, из публикации Вае и соавторов, 2005,Bioinformatics, 21, 2264-2270 or GeorgeHeringa, 2003, Protein Engineering, 15, 871-879. Термин "дикий тип" или "дт", в том смысле, в котором он используется в описании заявленного изобретения, относится к аминокислотной последовательности эндолизина OBPgpLYS, представлен вSEQ ID NO: 86. Нуклеотидная последовательность, кодирующая эндолизин дикого типа OBPgpLYS,представлена в SEQ ID NO: 101. Термин "делеция", в том смысле, в котором он используется в описании заявленного изобретения,относится к делеции (удалению) 1, 2, 3, 4, 5 или более аминокислотных остатков из соответствующей стартовой последовательности. Термины "инсерция" или "аддиция", в том смысле, в котором они используются в описании заявленного изобретения, относятся к инсерции или адциции 1, 2, 3, 4, 5 или более аминокислотных остатков соответствующей стартовой последовательности. Термин "субституция", в том смысле, в котором он используется в описании заявленного изобретения, относится к замене аминокислотного остатка, расположенного на определенной позиции, на другой аминокислотный остаток. Термин "клеточная стенка", используемый в описании заявленного изобретения, относится ко всем компонентам, образующим внешнюю оболочку клетки грамотрицательной бактерии, обеспечивая, таким образом, ее целостность. В частности, термин "клеточная стенка" в том значении, в котором он используется в описании заявленного изобретения, относится к пептидогликану, внешней мембране грамотрицательной бактерии с липополисахаридом, клеточной мембране бактерии, а также к дополнительным слоям на пептидогликане, как, например, капсулы, внешние белковые слои или слаймы. Термин "ЭАД", в том смысле, в котором он используется в описании заявленного изобретения, относится к энзим-активному домену эндолизина. ЭАД ответственен за гидролиз бактериальных пептидогликанов. Этот домен обладает как минимум одной энзим-функцией эндолизина. ЭАД также может состоять из более чем одного энзим-активного модуля. Термин "ЭАД" используется в описании заявленно-4 024253 го изобретения синонимично с термином "каталитический домен". В описании заявленного изобретения, термин "катионный пептид" относится к пептиду с положительно заряженными аминокислотными остатками. Предпочтительно, катионный пептид имеет значение рКа (отрицательный десятичный логарифм константы диссоциации) равное 9,0 или выше. Как правило,по крайней мере, четыре аминокислотных остатка катионного пептида могут быть положительно заряженными, например, лизин или аргинин. Термин "положительно заряженные" относится к боковым цепочкам аминокислотных остатков, которые имеют чистый положительный заряд при физических условиях. Термин "катионный пептид", используемый в заявленном изобретении, также относится к поликатионным пептидам. Термин "поликатионный пептид", используемый в описании заявленного изобретения, относится к смоделированным и синтезированным пептидам, состоящих преимущественно из положительно заряженных аминокислотных остатков, в частности, остатков лизина и/или аргинина. Пептид состоит преимущественно из положительно заряженных аминокислотных остатков, причем как минимум примерно 20, 30, 40, 50, 60, 70, 75, 80, 85, 90, 95 или около 100% аминокислотных остатков представляют собой положительно заряженные аминокислотные остатки, в частности остатки лизина и/или аргинина. Те из аминокислотных остатков, которые не являются положительно заряженными, могут представлять собой нейтрально заряженные аминокислотные остатки и/или отрицательно заряженные аминокислотные остатки и/или гидрофобные аминокислотные остатки. Более предпочтительно, те из аминокислотных остатков, которые не являются положительно заряженными, могут представлять собой нейтрально заряженные аминокислотные остатки, в частности серии и/или глицин. Термин "антимикробные пептиды" (АМП), в том смысле, в котором он используется в описании заявленного изобретения, относится к любому пептиду с микробицидной и/или микробиостатической функциями. Так, например, термин "антимикробный пептид", в том смысле, в котором он используется в описании заявленного изобретения, относится, в частности, к любому пептиду с антимикробной, антигрибковой, антимикотической, антипаразитарной, антипротозойной, антивирусной, антиинфекционной,антиконтагиозной и/или бактерицидной, альгицидной, амебоцидной, микробицидной, бактерицидной,фунгицидной, паразитицидной, протозоицидной функцией. Термин "дефензин", в том смысле, в котором он используется в описании заявленного изобретения,относится к пептиду, встречающемуся в животном мире, предпочтительно, у млекопитающих, более предпочтительно, у человека, причем дефензин выполняет важную функцию в механизме внутренней защитной системы организма-хозяина, разрушая чужеродные вещества, как, например, инфекционные бактерии и/или инфекционные вирусы и/или грибки. Дефензин представляет собой микробицидный и/или туморицидный белок, пептид или полипептид типа "не-антитело". Примерами "дефензинов" могут являться "дефензины млекопитающих", альфа-дефензины, бета-дефензины, индолицин и магаинины. Термин "дефензины", в том смысле, в котором он используется в описании заявленного изобретения,относится как к изолированной форме из клеток животных, так и к синтетически получаемой форме, и также относится к вариантам, которые преимущественно сохраняют цитотоксические свойства своих родительских белков, но чьи последовательности изменили путем инсерции или делеции одного или более аминокислотных остатков. Термин "Sushi пептид", в том смысле, в котором он используется в описании заявленного изобретения, относится к белкам комплементарного контроля с короткими повторениями транскрипции. Sushi модуль Sushi пептидов функционирует как домен взаимодействия "белок-белок" в различных белках. Доказано, что пептиды, содержащие Sushi домен, показывают антимикробную активность. Термин "амфипатичный пептид", в том смысле, в котором он используется в описании заявленного изобретения, относится к пептидам, имеющим как гидрофильные, так и гидрофобные функциональные группы. Предпочтительно, в контексте описания заявленного изобретения, термин "амфипатичный пептид" относится к пептиду, имеющему определенное расположение гидрофильных и гидрофобных групп,например, амфипатичные пептиды могут являться альфа-спиральными, с превалирующими неполярными боковыми цепями вдоль одной стороны спирали и полярными остатками вдоль остальной части поверхности. Термин "гидрофобная группа", в том смысле, в котором он используется в описании заявленного изобретения, относится к химическим группам, как, например, аминокислотные боковые цепи, которые преимущественно водонерастворимы, но растворимы в масляной фазе, причем растворимость в масляной фазе выше, чем растворимость в воде или водной фазе. В воде, аминокислоты с гидрофобной боковой цепью, взаимодействуют друг с другом для получения неводной среды. Примерами аминокислотных остатков с гидрофобными боковыми цепями являются остатки валина, изолейцина, лейцина, метионина,фенилаланина, триптофана, цистеина, аланина, тирозина, гистидина, треонина, серина, пролина и глицина. Заявленное изобретение относится к новым антибактериальным агентам, активным в отношении грамотрицательных бактерий, в частности, к полипептиду, содержащему аминокислотную последовательность в соответствии с SEQ ID NO: 1 или ее фрагменты или производные. Полипептид, содержащий аминокислотную последовательность в соответствии с SEQ ID NO: 1 предпочтительно кодируют нук-5 024253SEQ ID NO: 4. С-концевой ЭАД представляет собой каталитический домен (аа 126-292), соотносящийся с каталитическим доменом лизосом-подобного суперсемейства и с аминокислотной последовательностью в соответствии с SEQ ID NO: 5. PGB и каталитический домен эндолизина OBPgpLYS соединены доменным линкером. Таким образом, предпочтительными фрагментами полипептида в соответствии с заявленным изобретением являются полипептиды, содержащие аминокислотную последовательность в соответствии сSEQ ID NO: 4 и/или в соответствии с SEQ ID NO: 5. Другой предпочтительный фрагмент полипептида в соответствии с заявленным изобретением содержит аминокислотную последовательность в соответствии с SEQ ID NO: 69. Фрагмент, содержащий аминокислотную последовательность в соответствии с SEQ IDNO: 69 отличается от полипептида с аминокислотной последовательностью в соответствии с SEQ ID NO: 1 тем, что стартовый остаток метионина был удален. Производные в соответствии с заявленным изобретением представляют собой полипептиды, содержащие аминокислотную последовательность в соответствии с SEQ ID NO: 1, 4, 5 и/или 69, но с дополнительными модификациями и/или альтерациями (изменениями). Такие изменения и/или модификации могут включать мутации, как, например, делеции, инсерции и аддиции, субституции или сочетания вышеупомянутых и/или химические изменения аминокислотных остатков, например, биотинилирование,ацетилирование, пегилирование, химические изменения амино-, SH- или карбоксигрупп. Упомянутые производные в соответствии с заявленным изобретением показывают литическую активность OBPgpLYS(SEQ ID NO: 1) и/или активность фрагментов в соответствии с заявленным изобретением. Упомянутая активность может находиться на уровне 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160,170, 180, 190 или примерно 200% от уровня активности OBPgpLYS и/или от уровня активности фрагментов в соответствии с заявленным изобретением. Активность можно измерить опытным путем при помощи методов, хорошо известных специалистам в данной области техники, как например, чашечный тест определения (гемолиза) или анализ в жидкой среде, которые описаны в публикациях (Briers et al, J. Biochem. Biophys Methods 70: 531-533, (2007. Предпочтительные производные в соответствии с заявленным изобретением представляют собой полипептиды, содержащие аминокислотную последовательность в соответствии с SEQ ID NO: 86 и 87. Упомянутые производные отличаются от полипептидов, содержащих аминокислотную последовательность в соответствии с SEQ ID NO: 1 и SEQ ID NO: 69, соответственно, тем, что остаток лейцина подвергли субституции на остаток гистидина в положениях 325 и 324, соответственно. Полипептид, содержащий аминокислотную последовательность в соответствии с SEQ ID NO: 86 предпочтительно кодируют нуклеотидной последовательностью в соответствии c SEQ ID NO:101. В предпочтительном варианте практического воплощения заявленного изобретения, полипептид,фрагмент и/или производное в соответствии с заявленным изобретением содержат дополнительно таг(метку), как, например, His6-таг, Strep-таг, Avi-таг, Мус-таг, Gst-таг, JS-таг, цистеин-таг, FLAG-таг или прочие таги, известные из уровня техники, на N-конце или на С-конце. В предпочтительном варианте практического воплощения заявленного изобретения, упомянутый таг связан с полипептидом, фрагментом и/или производным в соответствии с заявленным изобретением на С-конце. Упомянутый таг может быть связан с полипептидом, фрагментом и/или производным при помощи дополнительных аминокислотных остатков. Упомянутые дополнительные аминокислотные остатки могут состоять из как минимум 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дополнительных аминокислотных остатков. В предпочтительном варианте практического воплощения заявленного изобретения, таг связан с полипептидом, фрагментом и/или производным в соответствии с заявленным изобретением при помощи дополнительных аминокислотных остатков Leu-Glu or Lys-Gly. В предпочтительном варианте практического воплощения заявленное изобретение относится к полипептидам, содержащим аминокислотную последовательность в соответствии с SEQ ID NO: 47 or SEQSEQ ID NO: 1 и SEQ ID NO: 86, соответственно, при помощи дополнительных аминокислотных остатков лизина и глицина (Lys-Gly). Полипептид, содержащий аминокислотную последовательность в соответствии с SEQ ID NO: 47 предпочтительно кодируют нуклеотидной последовательностью в соответствии сSEQ ID NO: 48. Полипептид, содержащий аминокислотную последовательность в соответствии с SEQ IDNO: 88 предпочтительно кодируют нуклеотидной последовательностью в соответствии с SEQ ID NO: 89. Еще одним аспектом заявленного изобретения являются слитые белки, образованные из полипептида, фрагмента и/или производного в соответствии с заявленным изобретением и пептидная цепь, сли-6 024253 тая с полипептидом, фрагментом и/или производным в соответствии с заявленным изобретением на Nили С-концах. Пептидная цепь слитого белка в соответствии с заявленным изобретением предпочтительно связана ковалентной связью с полипептидом, фрагментом и/или производным в соответствии с заявленным изобретением. Предпочтительно, упомянутая пептидная цепь состоит из как минимум 5, более предпочтительно из как минимум 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29,30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59,60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89,90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или как минимум 100 аминокислотных остатков. Наиболее предпочтительной является пептидная цепь, содержащая от примерно 5 до примерно 100 аминокислотных остатков, от примерно 5 до примерно 50 или от примерно 5 до примерно 30 аминокислотных остатков. Более предпочтительной является пептидная цепь, содержащая от примерно 6 до примерно 42 аминокислотных остатков, от примерно 6 до примерно 39 аминокислотных остатков, от примерно 6 до примерно 38 аминокислотных остатков, от примерно 6 до примерно 31 аминокислотных остатков, от примерно 6 до примерно 25 аминокислотных остатков, от примерно 6 до примерно 24 аминокислотных остатков, от примерно 6 до примерно 22 аминокислотных остатков, от примерно 6 до примерно 21 аминокислотных остатков, от примерно 6 до примерно 20 аминокислотных остатков, от примерно 6 до примерно 19 аминокислотных остатков, от примерно 6 до примерно 16 аминокислотных остатков, от примерно 6 до примерно 14 аминокислотных остатков, от примерно 6 до примерно 12 аминокислотных остатков, от примерно 6 до примерно 10 аминокислотных остатков или от примерно 6 до примерно 9 аминокислотных остатков. Предпочтительно, пептидная цепь не содержит таг (метку), как, например, His-таг, Strep-таг,Avi-таг, Мус-таг, Gst-таг, JS-таг, цистеин-таг, FLAG-таг или прочих таги, известные из уровня техники и никаких тиоредоксин- или мальтоза-связывающих белков (МВР). Тем не менее, пептидная цепь может содержать дополнительно такой таг(и), функцией которых является очищение или локализация белков. Более предпочтительно, пептидная цепь обладает способностью направлять слитый белок через внешнюю мембрану грамотрицательной бактерии, но также обладает ничтожной или минимальной активностью при введении без слития с полипептидом, фрагментом и/или производным в соответствии с заявленным изобретением. Функция проведения слитого белка через внешнюю мембрану грамотрицательных бактерий обусловлена потенциалом внешней мембраны или ЛПС разрушающей активностью упомянутой пептидной цепи. Для определения, обладает ли пептидная цепь мембрано- или ЛПС разрушающей активностью, упомянутую цепь можно подвергнуть слиянию с полипептидом в соответствии с заявленным изобретением, как, например, описано в примерах в заявленном изобретении. Соответственно, фиксируемая антибактериальная активность слитого белка, состоящего из полипептида в соответствии с заявленным изобретением и пептидной цепи, можно сравнить с полипептидом в соответствии с заявленным изобретением без пептидной цепи, как также описано в примерах в соответствии с заявленным изобретением, и, к примеру, как показано на фиг. 5 А-Е и фиг. 6. Предпочтительно упомянутые испытания можно проводить на клетках Escherichia coli WK6 и/или Pseudomonas aeruginosa PAO1p, как описано в примерах к заявленному изобретению. В случае, если слитый белок показывает повышенную антибактериальную активность по сравнению с полипептидом в соответствии с заявленным изобретением без упомянутой пептидной цепи, в отношении как минимум одного из испытуемых грамотрицательных бактериальных штаммов, тогда упомянутая пептидная цепь имеет мембрану или обладает ЛПСразрушающей активностью. Предпочтительно, антибактериальная активность (в логарифмических юнитах (=log10N0/Ni полипептида в соответствии с заявленным изобретением повышается как минимум на примерно 5%, более предпочтительно как минимум примерно на 10%, за счет присутствия пептидной цепи, имеющей мембрану или обладающей ЛПС-разрушающей активностью. В одном из аспектов заявленного изобретения, слитая пептидная цепь представляет собой амфипатичный пептид, который содержит один или более положительно заряженных аминокислотных остатков лизина, аргинина и/или гистидина, в сочетании с одним или более гидрофобными аминокислотными остатками валина, изолейцина, лейцина, метионина, фенилаланина, триптофана, цистеина, аланина, тирозина, гистидина, треонина, серина, пролина и/или глицина. Боковые цепи аминокислотных остатков предпочтительно ориентированы с учетом того, что катионные и гидрофобные поверхности упорядочены в кластеры на противоположных сторонах пептида. Предпочтительно, более, чем примерно 30, 40, 50,60 или 70% аминокислотных остатков в упомянутом пептиде являются положительно заряженными аминокислотами. Предпочтительно, более, чем примерно 30, 40, 50, 60 или 70%, аминокислотных остатков в упомянутом пептиде являются гидрофобными аминокислотными остатками. Предпочтительно,амфипатичный пептид слит с N-концом и/или С-концом полипептида, фрагмента и/или производного в соответствии с заявленным изобретением, обладающими способностью разрушать клеточную стенку,повышая таким образом амфипатичность упомянутых белков. В предпочтительном варианте практического воплощения, как минимум примерно 30, 40, 50, 60 или 70% упомянутых аминокислотных остатков амфипатичного пептида являются остатками либо аргинина, либо лизина и/или как минимум 30, 40, 50, 60 или 70% упомянутых аминокислотных остатков амфипатичного пептида являются остатками гидрофобных аминокислот валина, изолейцина, лейцина, ме-7 024253 тионина, фенилаланина, триптофана, цистеина, аланина, тирозина, гистидина, треонина, серина, пролина и/или глицина. Предпочтительными амфипатичными пептидами являются Pleurocidin в соответствии с SEQ IDNO:6, Cecropin P1 в соответствии с SEQ ID NO:7, Buforin II в соответствии с SEQ ID NO:8, Buforin I в соответствии с SEQ ID NO:19 и Magainin в соответствии с SEQ ID NO:10. Более предпочтительными амфипатичными пептидами являются Cathelidicine, например, LL-37 в соответствии с SEQ ID NO:11. В другом аспекте заявленного изобретения слитая пептидная цепь представляет собой антимикробный пептид, который содержит номинальный положительный заряд и примерно 50% гидрофобных аминокислотных остатков. Антимикробные пептиды являются амфипатичными, с длиной примерно от 12 до примерно 50 аминокислотных остатков. Предпочтительные антимикробные пептиды приведены в нижеследующей таблице. Еще в одном аспекте заявленного изобретения слитая пептидная цепь представляет собой Sushi пептид, описанный в публикации Ding JL, Li Р, Но В Cell Mol Life Sci. 2008 Apr;65(7-8):1202-19. The Sushi peptides: structural characterization and mode of action against Gram-negative bacteria. Предпочтительные Sushi пептиды - это Sushi пептиды S1 и S3 и их производные; FASEB J. 2000Sep;14(12): 1801-13. В еще одном аспекте заявленного изобретения слитая пептидная цепь представляет собой дефензин, предпочтительно Cathelicidine, Cecropin P1, Cecropin А или Magainin II. В еще одном аспекте заявленного изобретения слитая пептидная цепь представляет собой гидрофобный пептид, предпочтительно содержащий аминокислотную последовательность Phe-Phe-Val-AlaPro (SEQ ID NO: 18). Специфические примеры предпочтительных пептидных цепей приведены в нижеследующей таблице. В одном из аспектов заявленного изобретения, слитая пептидная цепочка является катионным и/или поликатионным пептидом, который состоит из одного или более положительно заряженных аминокислотных остатков лизина, аргинина и/или гистидина, в частности, лизина и/или аргинина. Предпочтительно, более 20, 30, 40, 50, 60, 70, 75, 80, 85, 90, 95 или 99% аминокислотных остатков в упомянутой пептидной цепочке представляют собой положительно заряженные аминокислотные остатки, в частности остатки лизина и/или аргинина. Наиболее предпочтительными являются пептидные цепочки, состоящие из примерно 100% положительно заряженных аминокислотных остатков, в частности остатков аргинина и/или лизина, причем предпочтительно примерно от 60% до примерно 70% упомянутых положительно заряженных аминокислотных остатков представляют собой остатки лизина и примерно от 30% до примерно 40% упомянутых положительно заряженных аминокислотных остатков представляют собой остатки аргинина. Более предпочтительной является пептидная цепочка, состоящая из примерно 100% положительно заряженных аминокислотных остатков, в частности остатков аргинина и/или лизина, причем предпочтительно от примерно 64% до примерно 68% упомянутых положительно заряженных аминокислотных остатков представляют собой остатки лизина и примерно от 32% до примерно 36% упомянутых положительно заряженных аминокислотных остатков представляют собой остатки аргинина. Также предпочтительными являются пептидные цепочки, состоящие либо только из аргинина, либо только лизина. Наиболее предпочтительными являются катионные и/или поликатионные пептидные цепочки, состоящие как минимум из одного мотива в соответствии с SEQ ID NO: 19 (KRKKRK). В частности, катионные пептидные цепочки, состоящие из как минимум 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или 17 мотивов в соответствии с SEQ ID NO: 19 (KRKKRK) являются предпочтительными. Более предпочтительны - катионные пептидные цепочки, состоящие из как минимум KRK мотива (лизин-аргинин-лизин),предпочтительно из как минимум 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24,25, 26, 27, 28, 29, 30, 31, 32 или 33 KRK мотивов. В другом предпочтительном варианте практического воплощения заявленного изобретения, катионная пептидная цепочка состоит, помимо положительно заряженных аминокислотных остатков, в частности остатков лизина и/или аргинина, из нейтрально заряженных аминокислотных остатков, в частности из остатков глицина и/или серина. Предпочтительными являются катионные пептидные цепочки,состоящие из примерно от 70% до примерно 100%, или от примерно 80% до примерно 95%, или от примерно 85% до примерно 90% положительно заряженных аминокислотных остатков, в частности остатков лизина, аргинина и/или гистидина, более предпочтительно, остатков лизина и/или аргинина и примерно от 0% до примерно 30%, или примерно от 5% до примерно 20%, или примерно от 10% до примерно 20% нейтрально заряженных аминокислотных остатков, в частности остатков глицина и/или серина. Предпочтительными являются полипептидные цепочки, состоящие из примерно от 4% до примерно 8% остатков серина, из примерно от 33% до примерно 36% остатков аргинина и от примерно 56% до примерно 63% остатков лизина. Наиболее предпочтительными являются полипептидные цепочки, состоящие из как минимум одного мотива в соответствии с SEQ ID NO: 40 (KRXKR), причем X является любой другой аминокислотой, кроме лизина, аргинина и гистидина. Наиболее предпочтительными являются полипептидные цепочки, состоящие из как минимум одного мотива в соответствии с SEQ ID NO: 41 (KRSKR). Более предпочтительны - катионные цепочки, состоящие из как минимум 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12,13, 14, 15, 16, 17, 18, 19 или примерно 20 мотивов в соответствии с SEQ ID NO: 40 (KRXKR) или SEQ IDNO: 41 (KRSKR). Также предпочтительными являются полипептидные цепочки, состоящие из примерно от 9 до примерно 16% остатков глицина, от примерно 4 до примерно 11% остатков серина, от примерно 26 до примерно 32% остатков аргинина и примерно от 47 до примерно 55% остатков лизина. Наиболее предпочтительными являются полипептидные цепочки, состоящие из как минимум одного мотива в соответствии сSEQ ID NO: 42 (KRGSG). Более предпочтительными являются катионные цепочки, состоящие из как минимум примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или примерно 20 мотивов в соответствии с SEQ ID NO: 42 (KRGSG). В другом варианте предпочтительного воплощения заявленного изобретения катионная пептидная цепочка состоит, помимо положительно заряженных аминокислотных остатков, в частности остатков лизина и/или аргинина, из гидрофобных аминокислотных остатков, в частности остатков валина, изолейцина, лейцина, метионина, фенилаланина, триптофана, цистеина, аланина, тирозина, гистидина, треонина, серина, пролина и/или глицина, более предпочтительно из остатков аланина, валина, лейцина, изо-9 024253 лейцина, фенилаланина, и/или триптофана. Предпочтительными являются катионные пептидные цепочки, состоящие из примерно от 70% до примерно 100%, или примерно от 80% до примерно 95%, или от примерно 85% до примерно 90% положительно заряженных аминокислотных остатков, в частности остатков лизина и/или аргинина и от примерно 0% до примерно 30%, или от примерно 5% до примерно 20%, или от примерно 10% до примерно 20% гидрофобных аминокислотных остатков, остатков валина,изолейцина, лейцина, метионина, фенилаланина, триптофана, цистеина, аланина, тирозина, гистидина,треонина, серина, пролина и/или глицина. Наиболее предпочтительными являются пептидные цепочки, выбираемые из группы, состоящей из следующих последовательностей. Особенно предпочтительным является слитый белок, содержащий полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением, и пептидная цепь с аминокислотной последовательностью в соответствии с SEQ ID NO: 20. Более предпочтительны слитые белки с аминокислотной последовательностью в соответствии с SEQ ID NO: 43 и SEQ ID NO: 115. Также предпочтительны слитые белки с аминокислотной последовательностью в соответствии с SEQ ID NO: 49 иSEQ ID NO: 116. Слитые белки с аминокислотной последовательностью в соответствии с SEQ ID NO: 49 и SEQ ID NO: 116, соответственно, содержащие, по сравнению со слитыми белками с аминокислотной последовательностью в соответствии с SEQ ID NO: 43 и SEQ ID NO: 115, соответственно, дополнительный С-концевой His6-таг, связанный с С-концом слитого белка с аминокислотной последовательностью в соответствии с SEQ ID NO: 43 и SEQ ID NO: 115, соответственно, при помощи дополнительных аминокислотных остатков лизина и глицина (Lys-Gly). Слитые белки с аминокислотной последовательностью в соответствии с SEQ ID NO: 43 и SEQ ID NO: 115 и SEQ ID NO: 49 и SEQ ID NO: 116, соответственно,отличаются тем, что каждый из слитых белов с аминокислотной последовательностью в соответствии сNO: 115 и SEQ ID NO: 116 имеет субституцию остатка лейцина на остаток гистидина в позиции 336. Еще в одном из вариантов практического воплощения заявленного изобретения, пептидные цепи слитого белка в соответствии с заявленным изобретением содержат модификации и/или альтерации аминокислотных последовательностей. Такие альтерации и/или модификации могут содержать мутации, как,например, делеции, инсерции и аддиции, субституции или сочетания вышеперечисленных и/или химические изменения аминокислотных остатков, биотинилирование, ацетилирование, пегилирование, химические изменения амино-, SH- или карбоксильных групп. Вышеописанный слитый белок в соответствии с заявленным изобретением состоит из:(б) пептидной цепи, слитой с упомянутыми полипептидом, фрагментом, производным и/или слитым белком на N- или С-конце, и, факультативно(в) тага, например, His6-тагов, Strep-тагов, Avi-тагов, Мус-тагов, Gst-тагов, JS-тагов, cystein-тагов,FLAG-тагов или прочих тагов, известных из уровня техники, на N- или С-конце. В случае, если пептидная цепь слита с полипептидом, фрагментом и/или производным в соответствии с заявленным изобретением на С-конце, слитый белок содержит дополнительный таг, предпочтительно на N-конце. В наиболее предпочтительном варианте практического воплощения заявленного изобретения, пептидная цепь слита с полипептидом, фрагментом и/или производным в соответствии с заявленным изобретением на N-конце. В случае, если упомянутый слитый белок содержит дополнительный таг, данный таг предпочтительно расположен на С-конце. Два и три компонента слитого белка, соответственно, как описано выше, могут быть связаны друг с другом при помощи дополнительных аминокислотных остатков, например, вследствие клонирования. Кроме того, пептидная цепь может быть соединена со стартовым метиониновым остатком слитого белка при помощи дополнительных аминокислотных остатков. Упомянутые дополнительные аминокислотные остатки могут состоять, как минимум, из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дополнительных аминокислотных остатков. В предпочтительном варианте практического воплощения заявленного изобретения, пептидная цепь соединена с полипептидом, фрагментом и/или производным в соответствии с заявленным изобретением при помощи дополнительных аминокислотных остатков Gly-Ser или Gly-Gly-Ser. Дополнительные аминокислотные остатки, соединенные со стартовым метиониновым остатком и пептидной цепью предпочтительно представляют собой Gly-Ser. В случае, если слитый белок дополнительно содержит таг, полипептид, фрагмент и/или производное в соответствии с заявленным изобретением предпочтительно связаны с упомянутым тагом при помощи дополнительных аминокислотных остатков Leu-Glu или LysGly. Перечень наиболее предпочтительных слитых белков в соответствии с заявленным изобретением приведены в первом столбце нижеследующей таблицы, со стартовым остатком метионина на N-конце(второй столбец таблицы) и завершающим факультативным тагом на С-конце (последний столбец таблицы). Помимо вышеописанного, заявленное изобретение относится к изолированной молекуле нуклеиновой кислоты, кодирующей полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением. В особенности, предпочтительной является изолированная молекула нуклеиновой кислоты в соответствии с SEQ ID NO: 2, 3, 48, 89 or 101. Заявленное изобретение также относится к вектору, содержащему молекулу нуклеиновой кислоты в соответствии с заявленным изобретением. Упомянутый вектор может быть применим в конститутивной или индуцируемой экспрессии упомянутых полипептида, фрагмента, производного и/или слитого белка в соответствии с заявленным изобретением. Заявленное изобретение также относится к способу получения описанных полипептида, фрагмента,производного и/или слитого белка из микроорганизма, как, например, генетически модифицированная приемлемая клетка-хозяин, которая экспрессирует упомянутые полипептид, фрагмент, производное и/или слитый белок. Упомянутая клетка-хозяин может представлять собой микроорганизм, как, например, бактерия или дрожжевая клетка, или клетка животного, например, млекопитающего, в частности,человека. В одном из вариантов практического воплощения заявленного изобретения, клетка-хозяин представляет собой клетку Escherichia coli. Клетку-хозяина могут выбирать вследствие чисто биологических параметров, например, выход, растворимость, затраты, и пр., но также и по медицинских параметрам, например, непатогенные бактерии или дрожжи, клетки организма человека. В другом из аспектов,заявленное изобретение относится к способу генетической трансформации приемлемой клетки-хозяина с целью получения полипептида, фрагмента, производного и/или слитого белка в соответствии с заявленным изобретением, при котором клетку-хозяина генетически модифицируют путем введения в клеткухозяин генетического материала, кодирующего упомянутые полипептид, фрагмент, производное и/или слитый белок, и последующих трансляции и экспрессии с использованием методов генной инженерии,известных специалистам в данной области. Еще в одном из аспектов заявленное изобретение относится к композиции, предпочтительно, фармацевтической композиции, содержащей полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением и/или хозяин, трансформированный с использованием молекулы нуклеиновой кислоты или вектора, содержащего нуклеотидную последовательность, кодирующую полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением. В предпочтительном варианте практического воплощения заявленного изобретения композиция дополнительно содержит агенты, пермеабилизирующие внешнюю мембрану грамотрицательных бактерий, как, например, хелаты металлов, как-то ЭДТК, ТРИС, молочная кислота, лактоферрин, полимиксин,лимонная кислота и/или другие вещества, как описано в публикации Vaara (Agents that increase the permeability of the outer membrane. Vaara M. Microbiol. Rev. 1992 Sep; 56 (3):395-441). Предпочтительными также являются композиции, содержащие сочетания вышеупомянутых пермеабилизирующих агентов. Особенно предпочтительной является композиция, содержащая от примерно 10 мкМ до примерно 100 мМ ЭДТК, более предпочтительно от примерно 50 мкМ до примерно 10 мМ ЭДТК, более предпочтительно от примерно 0,5 мМ до примерно 10 мМ ЭДТК, более предпочтительно от примерно 0,5 мМ до примерно 2 мМ ЭДТК, более предпочтительно от примерно 0,5 мМ до 1 мМ ЭДТК. Также предпочтительной является композиция, содержащая от примерно 0,5 мМ до примерно 2 мМ ЭДТК, более предпочтительно от примерно 1 мМ ЭДТК и дополнительно от примерно 10 до примерно 100 мМ ТРИС. Заявленное изобретение также относится к полипептиду, фрагменту, производному и/или слитому белку в соответствии с заявленным изобретением и/или хозяину, трансформированному с использованием нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид,фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением для применения в качестве медикаментозного препарата. В другом аспекте заявленное изобретение относится к применению полипептида, фрагмента, производного и/или слитого белка в соответствии с заявленным изобретением и/или хозяину, трансформированному с использованием вектора, содержащего молекулу нуклеиновой кислоты, включающую нуклеотидную последовательность, кодирующую полипептид, фрагмент,производное и/или слитый белок в соответствии с заявленным изобретением для применения в производстве медикаментозного препарата для лечения и/или профилактики расстройств, заболеваний и прочих дисфункций, ассоциируемых с грамотрицательными бактериями. В частности, применение для лечения и/или профилактики расстройств, заболеваний и пр.дисфункций, которые могут быть вызваны грамотрицательными бактериями, бактериальными группами, семействами, родами или видами, содержащими штаммы, патогенные для человека или животных, а именно Enterobacteriaceae (Escherichia, в особенности Е. coli, Salmonella, Shigella, Citrobacter, Edwardsiella, Enterobacter, Hafnia, Klebsiella, в особенности К. pneumoniae, Morganella, Proteus, Providencia, Serratia, Yersinia), Pseudomonadaceae (Pseudomonas, в особенности P. aeruginosa, Burkholderia, Stenotrophomonas, Shewanella, Sphingomonas, Comamonas), Neisseria, Moraxella, Vibrio, Aeromonas, Brucella, Francisella, Bordetella, Legionella, Bartonella, Coxiella, Haemophilus, Pasteurella, Mannheimia, Actinobacillus, Gardnerella, Spirochaetaceae (Treponema и Borrelia), Leptospiraceae, Campylobacter, Helicobacter, Spirillum, Streptobacillus, Bacteroidaceae (Bacteroides, Fusobacterium, Prevotella, Porphyromonas), Acinetobacter, в особенности A. baumanii. В частности, для лечения и/или профилактики расстройств, заболеваний и прочих дисфункций, вызываемых Pseudomonas aeruginosa, Pseudomonas putida, Burkholderia pseudomallei, E. coli и/или Salmonella typhimurium. Заявленное изобретение также относится к медикаментозному препарату, содержащему полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением и/или хозяину, трансформированному с использованием нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением. Еще в одном из аспектов, заявленное изобретение относится к способу лечения заболеваний, расстройств или прочих дисфункций у пациентов в состоянии необходимости терапии и/или профилактики,причем способ предусматривает введение пациенту эффективной дозы полипептида, фрагмента, производного и/или слитого белка в соответствии с заявленным изобретением и/или эффективного количества хозяина, трансформированного с использованием нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую слитый белок в соответствии с заявленным изобретением или композицию в соответствии с заявленным изобретением. Пациент может являться человеком или животным. В частности упомянутый способ лечения могут применять для лечения и/или профилактики инфекций кожи, мягких тканей, респираторной системы, легких, пищеварительного тракта, глаз, ушей, зубов,носоглотки, рта, костной системы, влагалища, осложнений в виде раневых поверхностей при бактериемии и/или эндокардите, вызываемых грамотрицательными бактериями, в частности, вышеперечисленными грамотрицательными бактериями. Дозировка и путь введения, используемые в способе лечения (или профилактики) в соответствии с заявленным изобретением зависит от специфики заболевания/локализации инфекции. Путь введения,например, может быть пероральный, наружный, внутриносовой, парентеральный, внутривенный, ректальный или другие. Для введения полипептида, фрагмента, производного и/или слитого белка в соответствии с заяв- 12024253 ленным изобретением и/или эффективного количества хозяина, трансформированного с использованием нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением или композицию в соответствии с заявленным изобретением, в место локализации (или возможного распространения инфекции), применяют такую форму упаковки, которая защищает активные компоненты от воздействий внешних факторов, таких как протеазы, окисление, иммунный ответ и т.п., вплоть до достижения ими очага инфекции. Следовательно, лекарственная форма может представлять собой капсулу, драже, таблетку, порошок, суппозиторий, эмульсию, гель, лосьон, крем, мазь, инъекционный раствор, сироп, спрей,состав для ингаляций или любую другую приемлемую по медицинским показаниям упаковку. Предпочтительно, фармацевтическая композиция может содержать подобранные носители, стабилизаторы, красители, буферы или другие подходящие реагенты. Например, для местного нанесения лекарственная форма может представлять собой лосьон, крем, гель, мазь или пластырь, для назофарингального применения - физраствор для интраназального нанесения при помощи спрея. Предпочтительно полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением используют как компонент терапии или профилактики, в случае, если инфекция вызвана мультирезистентными бактериальными штаммами, в частности, штаммами, устойчивыми к одному или более из следующей группы антибиотиков: стрептомицин, тетрациклин, цефалотин, гентамицин, цефатоксин, цефалоспорин, цефтазидим или имипенем. Кроме этого, полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением применяют как компонент терапии путем введения в сочетании с традиционными антибактериальными препаратами, такими как антибиотики, лантибиотики, бактериоцины или эндолизины и т.п. Заявленное изобретение также относится к фармацевтическому препарату, содержащему одно или более отделений, причем как минимум одно отделение содержит один или более полипептида, фрагмента, производного и/или слитого белка в соответствии с заявленным изобретением и/или один или более хозяинов, трансформированных с использованием нуклеиновой кислоты с нуклеотидной последовательностью, кодирующей полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением, или композицию в соответствии с заявленным изобретением. В другом аспекте практической реализации заявленное изобретение относится к процессу приготовления фармацевтической композиции, причем данный процесс включает добавление путем смешивания одного или более полипептида, фрагмента, производного и/или слитого белка в соответствии с заявленным изобретением и/или один или более хозяев, трансформированных с использованием нуклеиновой кислоты с нуклеотидной последовательностью, кодирующей полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением, с фармацевтически приемлемым растворителем, эксципиентом или носителем. В более расширенном аспекте композиция в соответствии с заявленным изобретением представляет собой косметическую композицию. Некоторые виды бактерий могут вызывать раздражение на открытых участках тела пациента, например, на кожном покрове. Для предотвращения появления таких раздражений кожного покрова или вероятного патогенного влияния упомянутых бактериальных организмов,представляется возможным применение специальных косметических составов, которые содержат достаточное количество полипептида, фрагмента, производного и/или слитого белка в соответствии с заявленным изобретением для разрушения уже размножившихся или потенциально опасных очагов инфекции,вызванных грамотрицательными бактериями. В расширенном аспекте заявленное изобретение относится к применению полипептида, фрагмента,производного и/или слитого белка в соответствии с заявленным изобретением в качестве средства диагностики в здравоохранении, пищевой и природоохранной промышленности, в частности в качестве средства диагностики для диагностирования бактериальных инфекций, вызванных в частности грамотрицательными бактериями. Полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением можно применять в качестве инструмента направленного разрушения патогенных бактерий, в особенности грамотрицательных патогенных бактерий. Разрушению бактериальных стенок слитым белком в соответствии с заявленным изобретением можно способствовать путем добавления детергентов, как например Triton Х-100 или других добавок, которые ослабляют клеточную защиту бактерий, например, полимиксин В. Специально направленное разрушение клеток небходимо как начальный этап последующего направленного уничтожения бактерий с использованием НК-методов, как например,полимеразная цепная реакция (ПЦР), гибридизация нуклеиновой кислоты или амплификация, основанная на последовательности нуклеиновых кислот, иммунобиологических методов, например, IMS, иммунофлюоресценции или анализ ELISA, или методов, основанных на распознавании клеточного материала бактерий, как то энзим-анализы с использованием протеинов, чувствительных к определенным группам или видам бактерий (например, -галактоидаза для энтеробактерий, коагулаза для коагулаз-позитивных штаммов). В расширенном аспекте заявленное изобретение относится к использованию полипептида, фрагмента, производного и/или слитого белка в соответствии с заявленным изобретением, для устранения,уменьшения и/или профилактики заражения грамотрицательными бактериями пищевых продуктов, обо- 13024253 рудования на пищеперерабатывающих предприятиях, различных поверхностей, контактирующих с пищевыми продуктами, как, например, полки и места хранения пищевых продуктов, а также в любой другой области, где присутствует вероятность заражения пищевых продуктов, медицинского инструментария или прочих поверхностей в клиниках и хирургических блоках патогенными, потенциально болезнетворными и пр. нежелательными бактериями. В частности, полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением можно применять в профилактических целях в качестве обеззараживающего средства. Такое обеззараживающее средство можно использовать до или после хирургических вмешательств, или,например, во время гемодиализа. Кроме того, слитый белок в соответствии с заявленным изобретением можно применять как компонент терапии у недоношенных детей, пациентов с ослабленной иммунной реакцией, или пациентов с протезными устройствами. Данную терапию можно проводить как профилактику, так и в острый период. В этом же контексте внутрибольничные инфекции, в особенности вызванные резистентными к антибиотикам штаммами, как например, бактериями Pseudomonas aeruginosa(FQRP), Acinetobacter и энтеробактерии, как, например E.coli, Salmonella, Shigella, Citrobacter, Edwardsiella, Enterobacter, Hafnia, Klebsiella, Morganella, Proteus, Providencia, Serratia и Yersinia можно лечитькак профилактически, так и в стадии острого обострения - с использованием модифицированного варианта эндолизина в соответствии с заявленным изобретением. В связи с этим, полипептид, фрагмент, производное и/или слитый белок в соответствии с заявленным изобретением можно использовать в качестве дезинфицирующего средства, а также в сочетании с другими ингредиентами в составе дезинфицирующего раствора, как, например, детергенты, поверхностно-активные вещества, растворители, антибиотики,лантибиотики или бактериоцины. Следующие по тексту примеры носят иллюстративный характер и не являются ограничительными касательно сути заявленного изобретения. Если не указано иначе, в нижеследующих примерах использованы стандартные методики, принятые в молекулярной биологии, как, например, описано в изданииPress, Cold Spring Harbor, New York. Пример 1. Модифицированные варианты эндолизина Pseudomonas putida phage OBP.OBPgpLYS с аминокислотной последовательностью в соответствии с SEQ ID NO: 1 представляет собой модульный эндолизин из 332 аминокислотных остатков, полученных из Pseudomonas putida фагаSEQ ID NO: 1, дополнительный С-концевой His6-таг, связанный с С-концом при помощи дополнительных аминокислотных остатков лизина и глицина (Lys-Gly). Очищенную геномную ДНК фага ОВР использовали в качестве матрицы для амплификации открытой рамки считывания (ОРС, ORF) OBPgpLYS в стандартной полимеразной цепной реакции (ПЦР, PCR) с Pf и полимеразой (Fermentas, Ontario, Canada) при следующих параметрах ПЦР: Для этого использовали стандартный 5' праймер (5' ATGAAAAATAGCGAGAAGAAT 3' (SEQ IDNO: 44 и стандартный 3' праймер (5' AACTATTCCGAGTGCTTTCTTTGT 3' (SEQ ID NO: 45. Для удлинения 5' конца открытой рамки считывания, кодирующей OBPgpLYS с генным фрагментом, кодирующим поликатионный 9-мерный пептид Lys-Arg-Lys-Lys-Arg-Lys-Lys-Arg-Lys- (SEQ ID NO: 20) применили хвост ПЦР с удлиненным 5' праймером (с аналогичными упомянутой выше стандартной ПЦР параметрами) (5'ATGGGATCCAAACGCAAGAAACGTAAGAAACGCAAAAAAAATAGCGAGAAGAAT 3' (SEQ IDNO: 46 и стандартным 3' праймером в соответствии с SEQ ID NO: 45. Оригинальный немодифицированный OBPgpLYS ПЦР фрагмент и удлиненный фрагмент лигандировали в рЕХР 5 СТ/TOPO экспрессионном векторе (Invitrogen, Carlsbad, CA, USA), следуя протоколу ТА-клонирования компаниипроизводителя. Рекомбинантную экспрессию OBPgpLYS с аминокислотной последовательностью в соответствии сSEQ ID NO: 47 и PKOBPgpLYS с аминокислотной последовательностью в соответствии с SEQ ID NO: 49 осуществили в экспоненциально растущих клетках Е. coli BL21 (DE3) pLysS (Invitrogen) после индукции с 1 мМ IPTG (изопропилтиогалактозидом) при 37C в течение 4 ч. Оба белка подвергли очистке при помощи Ni2+ аффинной хроматографии (Akta FPLC, GE Healthcare) с использованием С-концевого 6xHisтага, кодированного рЕХР 5 СТ/TOPO экспрессионным вектором. Ni2+ аффинную хроматографию провели в 4 последующих этапа, все при комнатной температуре: 1. Эквилибрация Histrap HP 1 мл колонки (GE Healthcare) с 10 объемами колонки отмывочного буфера (60 мМ имидазола, 0,5 мМ NaCl и 20 мМ NaH2P04-NaOH при рН 7,4) при скорости потока 0,5 мл/мин. 2. Загрузка всего лизата (с требуемым объемом эндолизина) в Histrap HP 1 мл колонки при скорости потока 0,5 мл/мин. 3. Отмывка колонки с 15 объемами колонки отмывочного буфера при скорости потока 1 мл/мин. 4. Элюирование связанного эндолизина из колонки с 10 объемами колонки элюирующего буфера(500 мМ имидазола, 0,5 М NaCl и 20 мМ NaH2P04-NaOH при рН 7,4) при скорости потока 0,5 мл/мин. Общий выход обоих очищенных рекомбинантных протеинов на литр экспрессионной культурыE.coli приведен в табл. 1. Значения определили при помощи спектрофотометрического измерения протеиновой концентрации, а общий объем очищенного маточного раствора при длине волны 280 нм. Очищенные маточные растворы, состоящие из OBPgpLYS и PKOBPgpLYS, сооответственно, в элюирующем буфере (20 мМ NaH2P04NaOH рН 7,4; 0,5 М NaCl; 500 мМ имидазола) показали степень чистоты как минимум 90%, как определено визуально на SDS-PAGE (аббревиатура метода электрофореза в полиакриламидном геле) гелях. Таблица 1. Выход очищенного рекомбинантного OBPgpLYS эндолизина и его РК-модифщированного варианта PKOBPgpLYS на литр экспрессионной культуры Е. coli Для определения антиграмотрицательного спектра эндолизинов OBPgpLYS в соответствии с SEQID NO: 47 и PKOBPgpLYS в соответствии с SEQ ID NO: 49, испытали комбинацию 1,313 мкМ каждого эндолизина и 0,5 мМ ЭДТК на клинических мультирезистентных штаммах P. aeruginosa Br667, Pseudomons putida G1 (хозяин фага ОВР) и гамме прочих грамотрицательных патогенов (P. aeruginosa PAO1p, P.(см. Табл. 3). Экспоненциально растущие бактериальные клетки (OD600nm of 0,6) разбавленные в 100 раз до конечной плотности примерно 106 клеток/мл каждого штамма инкубировали в течение 30 мин при комнатной температуре без встряхивания, с немодифицированным эндолизином OBPgpLYS (SEQ IDNO: 47) и модифицированным эндолизином PKOBPgpLYS (SEQ ID NO: 49) каждый образец в комбинации без и вместе с 0,5 мМ ЭДТК. Для инкубации, оба эндолизина использовали в буфере (20 мМNaH2PO4-NaOH pH7,4; 0,5 М NaCl; 0,5 М имидазола), причем инкубацию провели при конечной концентрации эндолизина 1,313 мкМ. В качестве контроля, каждый штамм также подвергли инкубации в течение 30 мин с 0,5 мМ ЭДТК (в таком же, как и вышеупомянутый буфер), но без эндолизина. После инкубации, клеточные суспензии разбавили в три раза (соответственно 105-104-103 клеток/мл) и по 100 мкл каждого раствора поместили в чашку Петри на среду Лурия-Бертани. Остаточные колонии пересчитали после ночной инкубации при 37C. На основе подсчета количества клеток, рассчитали антибактериальную активность как относительную инактивацию в логарифмических юнитах (=log10N0/Ni, где N0= число необработанных клеток, a Ni = число обработанных клеток, оба показателя рассчитаны после инкубации) (Табл. 2). Все образцы реплицировали в 3 раза. Представлены средние значения девиаций +/-. Максимальное фиксируемое снижение (редукцию) наблюдали на уровне 10 клеток/мл при первоначальной плотности клеток. Таблица 2. Антибактериальная активность немодифицированного эндолизина (OBPgpLYS,) и его модифицированного варианта (PKOBPgpLYS) с и без ЭДТК-Na2 в отношении различных экспоненциальнорастущих грамотрщательных видов бактерий, в логарифмических юнитах При общей эффективности OBPgpLYS, результаты лечения с его применением варьируется у различных организмов, результаты, приведенные в Табл. 2, показывают добавочный эффект PKOBPgpLYS по сравнению с немодифицированным OBPgpLYS в отношении всех испытуемых бактериальных видов,как с, так и без 0,5 мМ ЭДТК. В отношении Pseudomonas и Burkholderia, наблюдается ярко выраженное синергическое действие с ЭДТК активности PKOBPgpLYS. Таблица 3. Перечень применяемых грамотрицательных штаммов Пример 2. Влияние различной концентрации ЭДТК на антибактериальную активность OBPgpLYS иPKOBPgpLYS. Для определения влияния ЭДТК на антибактериальную активность немодифицированного и модифицированного эндолизинов, антибактериальную активность немодифицированного OBPgpLYS эндолизина (SEQ ID NO: 47) и PKOBPgpLYS эндолизина (SEQ ID NO: 49) испытали на клетках Pseudomonasaeruginosa PAO1p (Pimay JP et al. J Clin Microbiol, 41(3):1192-1202 (2003 с использованием различных концентраций ЭДТК и эндолизинов. Экспоненциально растущие бактериальные клетки (OD600nm из 0,6) разбавили в 100 раз до достижения показателя конечной плотности примерно 106/мл и инкубировали в течение 30 мин при комнатной температуре без встряхивания вместе с немодифицированным эндолизином OBPgpLYS (SEQ ID NO: 47) и модифицированным эндолизином PKOBPgpLYS (SEQ ID NO: 49). Для инкубации, каждый тип эндолизина использовали в буфере (20 мМ NaH2PO4-NaOH pH7,4; 0,5 МNaCl; 0,5 М имидазола) при конечных концентрациях эндолизина 0,013 мкМ, 0,131 мкМ и 1,315 мкМ. При этом, использовали различные концентрации ЭДТК: 0 мМ, 0,05 мМ, 0,5 мМ и 10 мМ. В качестве контроля, инкубировали также один образец в течение 30 мин без эндолизина, вместо которого использовали добавочный буфер (20 мМ NaH2PO4-NaOH pH7.4; 0,5 М NaCl; 0.5 М имидазола). После инкубации, клеточные суспензии разбавили в три раза (соответственно, 105-104-103 клеток/мл) и по 100 мкл каждого раствора поместили в чашку Петри на среду Лурия-Бертани. Пересчитали остаточные колонии после ночной инкубации при 37C. На основе подсчета числа клеток, рассчитали антибактериальную активность как относительную инактивацию в логарифмических юнитах (=log10N0/Ni где N0= число необработанных клеток, a Ni= число обработанных клеток, расчеты проводились в обоих случаях после инкубации) (табл. 4). Все образцы реплицировали в три раза. Средние+/-стандартные девиации приведены. По результатам анализа, максимальное уменьшение (5.69 лог-юнитов) наблюдали при уровне детекции 10 клеток/мл и первоначальной клеточной плотности. "А" показывает разницу в показателях активности соответствующих образцов OBPgpLYS и PKOBPgpLYS. Таблица 4. Антибактериальный эффект немодифщированного эндолизина (OBPgpLYS) и его модифицированного варианта (PKOBPgpLYS) в комбинации с различными концентрациями ЭДТК-Na2 в отношении экспоненциально растущих клеток Pseudomonas aeruginosa PAO1p cells, в логарифмических юнитах Как следует из табл. 4, немодифицированный эндолизин OBPgpLYS уменьшает значительно число клеток с более, чем 2,5 лог-юнитов для 1,315 мкМ и с +/- 1 лог-юнит для 0,013 мкМ, по сравнению с отрицательным контролем. Модифицированный эндолизин PKOBPgpLYS показывает уменьшение в дополнительные 0,5 лог-юнитов в отношении экспоненциально растущих PAO1p клеток. Наблюдаемый антибактериальный эффект можно увеличить вплоть до редукции в 5,69 лог-юнитов (ниже уровня обнаружения) путем комбинирования PKOBPgpLYS с пермеабилизатором внешней мембраны ЭДТК-Na2 при концентрации 0,5 и 10 мМ ЭДТК. Различие в активности между немодифицированным OBPgpLYS и пируваткиназа(ПК)-модифицированным OBPgpLYS повышается при увеличении количества добавляемого эндолизина (начиная с 0,013 - 1,315 мкМ эндолизина). Пример 3. Клонирование, экспрессия и очистка производного OBPgpLYS, модифицированного с различными пептидными цепями на N-конце эндолизина. Производное OBPgpLYS в соответствии с SEQ ID NO:86 представляет собой модульный эндолизин, полученный из Pseudomonas putida фага ОВР с N-концевым пептидогликанным связыванием и Сконцевым каталитическим доменом. Производное OBPgpLYS кодируют молекулой нуклеиновой кислоты в соответствии с SEQ ID NO: 101. Очищенную плазмидную ДНК (см. ПРИМЕР 1) использовали для получения молекулы нуклеиновой кислоты в соответствии с SEQ ID NO: 101 с сайтом рестрикции BamHI (5'-GGA TCC-3') на 5'-конце молекулы нуклеиновой кислоты и Xho I (5'-СТС GAG-3') сайтом рестрикции на 3'- конце молекулы нуклеиновой кислоты. Нижеупомянутые пептидные цепи (табл. 5) использовали для получения слитых белков с производным эндолизина OBPgpLYS. Полученные слитые белки также представлены в Табл. 5. Таблица 5. Пептидные цепи и соответствующая последовательность нуклеиновой кислоты для получения специфичных слитых белков Молекулы нуклеиновой кислоты, кодирующие соответствующие пептидные цепи, получили синтетическим путем с сайтом рестрикции Nde I (5'-CAT ATG-3') на 5'-конце молекулы нуклеиновой кислоты и BamH I (5-GGA ТСС-3') сайтом рестрикции на 3'- конце молекулы нуклеиновой кислоты. Слитые белки получают путем соединения как минимум двух последовательностей нуклеиновых кислот с использованием стандартных методов клонирования, описанных, например, в публикации Sambrook et al. 2001, Molecular Cloning: A Laboratory Manual. Таким образом, молекулы нуклеиновой кислоты, кодирующие пептидные цепи, частично расщепили с соответствующими энзимами рестрикции Nde I и BamH I. После этого, расщепленные нуклеиновые кислоты, кодирующие пептидные цепи, лигандировали в рЕТ 21 b экспрессионном векторе (Novagen, Darmstadt, Germany), который также до этого подвергли расщеплению с соответствующими энзимами рестрикции Nde I и BamH I. После этого, молекулу нуклеиновой кислоты, кодирующую эндолизин OBPgpLYS, частично расщепили с энзимом рестрикции BamH I и Xho I, таким образом, чтобы было возможно лигандировать эндолизин в рЕТ 21b экспрессионном векторе (Novagen, Darmstadt, Germany). Таким образом, молекулу нуклеиновой кислоты, кодирующую пептидную цепь, лигандировали в соответствующем векторе на 5'-конце молекулы нуклеиновой кислоты, кодирующей производное эндолизина OBPgpLYS. Помимо этого, молекулу нуклеиновой кислоты, кодирующей эндолизин OBPgpLYS,лигандировали в соответствующей плазмиде, таким образом, чтобы молекула, кодирующая His6-таг, состоящий из шести гистидиновых остатков, ассоциировалась на 3'-конце молекулы нуклеиновой кислоты,кодирующей эндолизин. Последовательность слияний эндолизин-пептид контролировали при помощи секвенирования ДНК,а корректные клоны трансформировали в E.coli Т 7 Express lysY/Iq (DE3) (New England Biolabs, Frankfurt,Germany) для экспрессии белка. Рекомбинантную экспрессию слитых белков в соответствии с SEQ ID NO: 55, 57, 63, 65,67 осуществили в клетках Е. coli T7 Express lysY/Iq (New England Biolabs, Frankfurt, Germany). Клетки росли до достижения уровня значения оптической плотности OD600 0,5-0,8 мкм. Затем индуцировали экспрессию слитого белка с 0,5 мМ IPTG (изопропилтиогалактозидом) и осуществили экспрессию при 37C в течение 4 ч. Клетки собрали центрифугированием в течение 15 мин при 4000 г и дезинтегрировали путем разрушения ультразвуком на льду. Суммарный экстракт растворимой и нерастворимой фракций клеток E.coli сепарировали центрифугированием (Sorvall, SS34, 30 мин, 15000 оборотов в минуту). Все белки очистили при помощи Ni2+ аффинной хроматографии (Akta FPLC, GE Healthcare) с использованием Сконцевого 6xHis-тага, кодируемого вектором рЕТ 21b.Ni2+ аффинную хроматографию осуществили в 4 последовательных этапа, все при комнатной температуре: 1. Эквилибрация Histrap FF 5 мл колонки (GE Healthcare) с 10 объемами колонки отмывочного буфера (20 мМ имидазола, 1 М NaCl и 20 мМ Hepes (N-2-гидроксиэтилпиперазин-N-2-этансульфоновой кислоты) при рН 7,4) при скорости потока 3-5 мл/мин. 2. Загрузка всего лизата (с требуемым объемом слитого белка) в Histrap FF 5 ml колонки при скорости потока 3-5 мл/мин 3. Отмывка колонки с 10 объемами колонки отмывочного буфера для удаления несвязанного образца, с последующей повторной отмывкой с 10% элюирующего буфера (500 мМ имидазола, 0,5 М NaCl и 20 мМ Hepes при рН 7.4) при скорости потока 3-5 мл/мин/ 4. Элюирование связанных слитых белков из колонки с линейным градиентом 4 объемов колонки элюирующего буфера (500 мМ имидазола, 0,5 мМ NaCl и 20 мМ Hepes при рН 7,4) до 100% при скорости потока 3-5 мл/мин. Очищенные стоковые растворы слитых белков в элюирующем буфере (20 мМ Hepes рН 7,4; 0,5 МNaCl; 500 мМ имидазола) показали как минимум 60% степень чистоты, в соответствии с визуальным контролем на SDS-PAGE гелях (данные не приведены). Пример 4. Антимикробная активность производного эндолизина OBPgpLYS, модифицированного с использованием различных пептидных цепей на N-конце. Клетки Acinetobacter baumannii DSMZ 30007 и Pseudomonas aeruginosa PAO1p (Burn wound isolate,Queen Astrid Hospital, Brussels; Pirnay JP et al. (2003), http://www.ncbi.nlm.nih.gov/pubmed/ 12624051 ordinalpos=3itool=EntrezSystem2.PEntrez.Pubmed.PubmedResultsPanel.PubmedDefaultReportPanel. PubmedRVDo cSum J Clin Microbiol, 41(3):1192-1202) использовали в качестве тест-штаммов. Инкубированные в течение ночного времени суток культуры разбавили в 10 раз в свежей среде Лурия-Бертани и вырастили до OD600=0,6. Культуру осадили центрифугированием и разбавили в 10 раз в буфере разбавления (10 мМHEPES, 0,5 мМ ЭДТК; рН 7.4). Бактерии инкубировали при комнатной температуре с 10 мкг недиализированного слитого белка при конечной концентрации 100 мкг/мл в буфере (20 мМ NaH2P04-NaOH рН 7,4; 0,5 М NaCl; 0,5 М имидазола). По истечении 1 ч, в ФСБ построили серии разведения клеток и высеяли на среду Лурия-Бертани. Дополнительно, отрицательный контроль высеяли с использованием буфера (20 мМ NaH2P04-NaOH рН 7.4; 0.5 М NaCl; 0,5 М имидазола). Остаточные колонии пересчитали после ночной инкубации при 37C. На основе чисел клеток, рассчитали антибактериальную активность в логариф- 18024253 мических юнитах (=log10N0/Ni with N0 = число необработанных клеток и Ni = число обработанных клеток) (Табл. 5). Все образцы реплицировали как минимум в 4 раза. Таблица 6. Антимикробная активность производного OBPgpLYS, модифицированного с использованием различных пептидных цепей, в отношении грамотрицателъных бактерий Сокращения: +: 1 лог; : 2-3 лог; : 4 или более лог; не опр. - данный штамм не был тестирован с соответствующим слитым белком. Слитые белки в табл. 6 без тагов и линкеров также испытали при помощи вышеописанных методов определения активности. Результаты подтвердили антибактериальную активность в отношении бактериальных штаммов, перечисленных в табл. 6. Пример 5. N-концевое слияние антибактериального пептида с эндолизином Pseudomonas putida фага ОВР. Производное OBPgpLys, модульный эндолизин P. putida фага ОВР, подвергли N-концевому слиянию с тагами нативных антибактериальных пептидов (табл. 7) для изучения антибактериальной активности в отношении грамотрицательных бактерий. Таблица 7. Перечень антибактериальных пептидных тагов, слитых с производным OBPgpLYS Методология модификации тагов производного OBPgpLys За исключением тага пентапептидов все антибактериальные пептидные таги слили с открытой рамкой считывания (ОРС, ORF), которая кодирует производное OBPgpLYS, с использованием адаптированной версии Ligation Independent Cloning (LIC), как описано в Berrow et al. 2007. В данном случае уникальный Ecl136II рестрикционный сайт вставили впереди эндолизинового гена WT при помощи хвоста ПЦР со специфически смоделированным 5' праймером (5'-GGAATGGGGAGCTCCTCCAAAAATAGCGAGAAG-3'; SEQ ID NO:102) и стандартным производным OBPgpLys ревертивным праймером (5'AACTATTCCGTGTGCTTTCTTTGT-3'; SEQ ID NO:103) на очищенной геномной ДНК фага ОВР. Данный удлиненный фрагмент затем лигировали в эксперссионном векторе рЕХР 5 СТ/ТОРО (Invitrogen,Carlsbad, CA, USA), следуя протоколу ТА клонирования компании-производителя. Очищенную плазмиду разрезали один раз в Ecl136II рестрикционной кассете расщепления и гибридизированные пептиды(созданные гибридизацией праймерных пар, см. табл. 8) вставили в разрезанную плазмиду без необходимого этапа лигирования (LIC). Для N-концевого пентапептидного тагового слияния, хвост ПЦР с удлиненным 5' праймером, кодирующим данный пентапептид (5'-ATGGGATCCTTCTTCGTAGCATTCCGTGTGCTTTCTTTGT-3'; SEQ ID NO:103) стандартного производного OBPgpLys нанесли на фаг ОВР геномной ДНК. Корректность инсерции фрагментов в экспрессионном векторе контролировали секвенированием до момента введения в приемлемый экспрессионный штамм Escherichia coliBL21(DE3)pLysS. Таблица 8. Применяемые праймерные пары для гибридизации антибактериальных пептидных тагов для ОРС кодируемого производного OBPgpLys Масштабная рекомбинантная экспрессия слитых вариантов производного модифицированногоOBPgpLYS Стандартную экспрессию осуществили в Lysogeny Broth (LB) в экспоненциально растущих клетках(OD600 нм = 0,6), индуцированную с 1 мМ изопропил-бета-D-тиогалактопиранозидом. Параметры экспрессии, как, например, температуру, время и экспрессионный штамм, варьировали на основе специфичности белков с целью оптимизации уровня растворимой экспрессии модифицированных эндолизинов(см. табл. 9). Для очистки, клетки из экспрессионной культуры (500-600 мл) собрали центрифугированием (4500 оборотов в минуту, 30 мин, 4C) и ресуспендировали в 1/25 объема лизирующего буфера (10 мМ имидазола, 20 мМ NaH2PO4, 0.5 М NaCl, pH 7.4). данную суспензию заморозили/разморозили три раза до разрушения ультразвуком (8 30 s, амплитуда 40% на Vibra CellTM, Sonics, Dandurry, CT, USA) и профильтровали через мембранные фильтры Durapore 0,45 и 0,22 мкм (Millipore, Billerica, MA, USA). Очистку His-тагового слитого белка осуществили в один этап при помощи Ni2+ - аффинной хроматографии(HisTrap HP 1 мл колонки, GE Healthcare, Buckinghamshire, UK) согласно протоколу компаниипроизводителя. Ni2+ аффинную хроматографию провели в 4 последующих этапа, все при комнатной температуре: 1. Эквилибрация Histrap HP 1 мл колонки (GE Healthcare) с 10 объемами колонки отмывочного буфера (60 мМ имидазола, 0,5 мМ NaCl и 20 мМ NaH2PO4-NaOH при рН 7,4) при скорости потока 0,5 мл/мин. 2. Загрузка всего лизата (с требуемым объемом эндолизина) в Histrap HP 1 мл колонки при скорости потока 0,5 мл/мин. 3. Отмывка колонки с 15 объемами колонки отмывочного буфера при скорости потока 1 мл/мин. 4. Элюирование связанного эндолизина из колонки с 10 объемами колонки элюирующего буфера(500 мМ имидазола, 0,5 М NaCl и 20 мМ NaH2P04-NaOH при рН 7,4) при скорости потока 0,5 мл/мин. Отмывочный буфер содержал низкую концентрацию имидазола, варьируемую на основе специфичности белков с целью достижения высокой степени очистки белка (см. табл. 9). Общий выход очищенных рекомбинантных белков на литр экспрессионной культуры E.coli приведен в Табл. 3. Значения определили при помощи спектрофотометрического измерения белковой концентрации, а общий объем очищенного маточного раствора - при длине волны 280 нм. Очищенные маточные растворы показали степень чистоты как минимум 60% как определено визуально на SDS-PAGE (аббревиатура метода электрофореза в полиакриламидном геле) гелях. Таблица 9. Параметры экспрессии и полученный общий выход на литр экспрессионной культуры Nконцевых модифицированных эндолизинов. RP = Е. coli BL21(DE3)pLysS Codon min RP strain, RIL = E. Полученная in vitro антибактериальная активность и круг хозяев вариантов производного модифицированного OBPgpLys Экспоненциально растущие грамотрицательные бактериальные клетки (OD600nm = 0,6) разбавленные в 100 раз до конечной плотности примерно 106/мл, инкубировали в течение 30 мин при комнатной температуре без встряхивания, с различными вариантами производного модифицированного OBPgpLYS. После инкубации, клеточные суспензии разбавили в три раза (соответственно 105-104-103 клеток/мл) и по 100 мкл каждого раствора поместили в чашку Петри на среду Лурия-Бертани. Остаточные колонии пересчитали после ночной инкубации при 37C. На основе подсчета количества клеток, рассчитали антибактериальную активность как относительную инактивацию в логарифмических юнитах (= log10N0/Ni где N0= число необработанных клеток и Ni = число обработанных клеток, оба показателя рассчитаны после инкубации) (Табл. 10). Все образцы реплицировали в три раза. Средние +/- стандартные девиации приведены. Таблица 10. Полученная in vitro антибактериальная активность различных вариантов производного модифицированного OBPgpLYS в отношении круга экспоненциально растущих грамотрицательных бактериальных видов с 0.5 мМ ЭДТК. Первоначальная плотность составляет 106 клеток/мл и инкубация происходит в течение 30 мин без встряхивания при RT. Концентрация белка составляет 1500 нМ (нмоль),за исключением Artilysl-OBPgplys (800 нМ). Сокращения: +: примерно 0.5 лог; : 1-2 лог; :3-4 или более лог; не опр - штамм не был протестирован с соответствующим слитым белком.
МПК / Метки
МПК: C12N 9/52, A61K 38/46, C12N 9/36
Метки: вызванных, пептидогликангидролазной, против, литический, инфекций, применение, бактериями, активностью, грамотрицательными, полипептид
Код ссылки
<a href="https://eas.patents.su/30-24253-liticheskijj-polipeptid-s-peptidoglikangidrolaznojj-aktivnostyu-i-ego-primenenie-protiv-infekcijj-vyzvannyh-gramotricatelnymi-bakteriyami.html" rel="bookmark" title="База патентов Евразийского Союза">Литический полипептид с пептидогликангидролазной активностью и его применение против инфекций, вызванных грамотрицательными бактериями</a>
Предыдущий патент: Ингибиторы фосфоинозитид-3-киназ с цинксвязывающей группой
Следующий патент: Смесительный барабан для доменной печи
Случайный патент: Катализатор для получения этилена и пропилена из метанола и/или диметилового эфира, его получение и применение