Антагонисты рецептора витронектина.
Номер патента: 2419
Опубликовано: 25.04.2002
Авторы: Кинан Ричард Маккаллок, Каллахан Джеймс Фрэнсиз, Каузинс Расселл Донован, Миллер Вилльям Генри, Узинкас Ирен Нийоль, Квон Чет
Формула / Реферат
1. Соединение формулы (I)
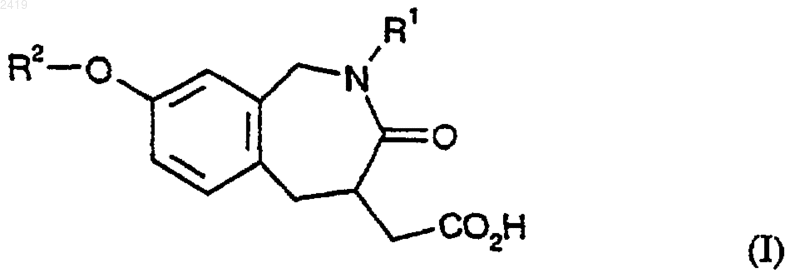
где R1 означает R7 или А-С0-4 алкил, А-С2-4 алкенил, А-С2-4 алкинил, А-С3-4 оксоалкенил, А-С3-4 оксоалкинил, A-C1-4 аминоалкил, А-С3-4 аминоалкенил, А-С3=4 аминоалкинил, необязательно замещенные любым приемлемым сочетанием одного или более R10 и R7;
А означает Н, С3-6 циклоалкил, Het или Аr;
R7 означает -COR8, -COCR'2R9, -C(S)R8, -S(O)mOR', -S(O)mNR'R", -PO(OR'), -PO(OR')2, -NO2 или тетразолил;
каждый R8 означает независимо -OR', -NR'R", -NR'SO2R', -NR'OR' или -OCR'2CO(O)R';
R9 означает -OR', -CN, -S(O)rR', -S(O)mNR'2, -C(O)R', C(O)NR'2 или -CO2R';
R10 означает Н, галоген, -OR11, -CN, -NR'R11, -NO2, -СF3, СF3S(O)r-, -CO2R', -CONR'2, A-C0-6 алкил-, A-C1-6 оксоалкил-, A-C2-6 алкенил-, А-С2-6 алкинил-, А-С0-6 алкилокси-, А-С0-6 алкиламино- или А-С0-6 алкил-S(О)r-;
R11 означает R', -C(O)R', -C(O)NR'2, -С(О)OR', -S(O)mR' или -S(O)mNR'2;
R2 означает

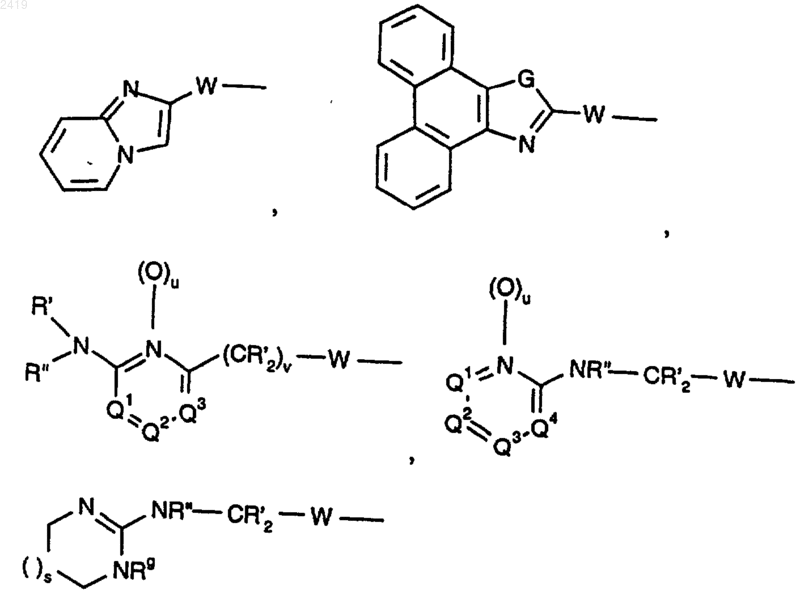
W означает -(CHRg)a-U-(СHRg)b-;
U отсутствует или означает СО, CRg2, C(=CRg2), S(O)k, O, NRg, CRgORg, CRg(ORk)CRg2, CRg2CRg(ORk), C(O)CRg2, CRg2C(O), CONRi, NRiCO, OC(O), C(O)O, C(S)O, OC(S), C(S)NRg, NRgC(S), S(O)2NRg, NRgS(O)2N=N, NRgNRg, NRgCRg2, CRg2NRg, CRg2O, OCRg2, C у C или CRg=CRg;
G означает NRe, S или О;
Rg означает Н, C1-6 алкил, Het-C0-6 алкил, С3-7 циклоалкил-С0-6 алкил или Аr-С0-6 алкил;
Rk означает Rg, -C(O)Rg или -С(O)ОRf;
Ri означает Н, C1-6 алкил, Het-C0-6 алкил, С3-7 циклоалкил-С0-6 алкил, Аr-С0-6 алкил или C1-6 алкил, замещенный одной-тремя группами, выбранными из галогена, CN, NRg2, ORg, SRg, CO2Rg и СОN(Rg)2;
Rf означает Н, C1-6 алкил или Аr-С0-6 алкил;
Re означает Н, C1-6 алкил, Аr-С0-6 алкил, Het-C0-6 алкил, С3-7 циклоалкил-С0-6 алкил или (CH2)kCO2Rg;
Rb и Rc выбирают независимо друг от друга из Н, C1-6 алкила, Аr-С0-6 алкила, Het-C0-6 алкила или С3-6 циклоалкил-С0-6 алкила, галогена, СF3, ORf, S(O)kRf, CORf, NO2, N(Rf)2, CO(NRf)2, CH2N(Rf)2, или Rb и Rc соединяются друг с другом с образованием пяти- или шестичленного ароматического или неароматического карбоциклического или гетероциклического кольца, необязательно замещенного заместителями в количестве до трех, выбранными из галогена, СF3, C1-4 алкила, ORf, S(O)kRf, CORf, CO2Rf, ОН, NO2, N(Rf)2, CO(NRf)2 и СH2N(Rf)2; или метилендиокси;
Q1, Q2, Q3 и Q4 означают независимо друг от друга N или C-Ry, при условии, что не более одного из Q1, Q2, Q3 и Q4 означает N;
R' означает Н, C1-6 алкил, Аr-С0-6 алкил или С3-6 циклоалкил-С0-6 алкил;
R" означает R', -C(O)R' или -C(O)OR';
R''' означает Н, C1-6 алкил, Аr-С0-6 алкил, Het-C0-6 алкил или С3-6 циклоалкил-С0-6 алкил, галоген, СF3, ORf, S(O)kRf, CORf, NO2, N(Rf)2, СО(NRf)2, СН2N(Rf)2;
Ry означает Н, галоген, -ORg, -SRg, -CN, -NRgRk, -NO2, -СF3, СF3S(O)r-, -CO2Rg, -CORg или -CONRg2 или C1-6 алкил, необязательно замещенный галогеном, -ORg, -SRg, -CN, -NRgR'', -NO2, -СF3, R'S(O)r-, -CO2Rg, -CORg или -CONRg2;
а означает 0, 1 или 2;
b означает 0, 1 или 2;
k означает 0, 1 или 2;
m означает 1 или 2;
r означает 0, 1 или 2;
s означает 0, 1 или 2;
u означает 0 или 1; и
v означает 0 или 1;
причем Het или гетероцикл означает необязательно замещенное пяти- или шестичленное моноциклическое кольцо или девяти- или десятичленное бициклическое кольцо, содержащие от одного до трех гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы;
или его фармацевтически приемлемая соль.
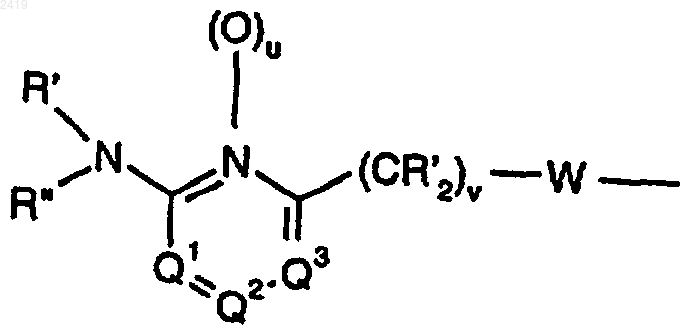
2. Соединение по п.1, в котором R2 означает
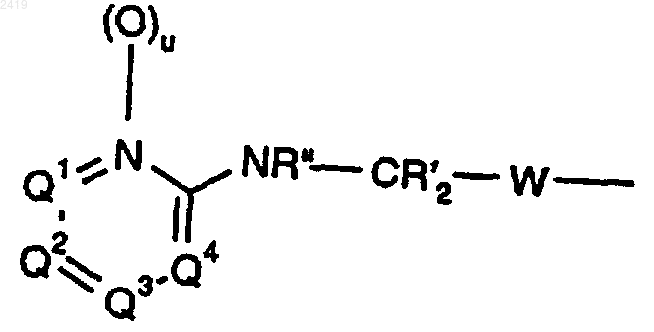
где Q1, Q2 и Q3 каждый означают CRy, Q4 означает CRy или N, u означает О, каждый R' означает Н, R'' означает Н, C1-6 алкил, -C(O)C1-6 алкил, C(O)OC1-6 алкил, -С(O)С0-6 алкил-Аr или С(O)ОС0-6 алкил-Аr, W означает -СН2-СН2- и Ry означает Н, галоген, -ORg, -SRg, -CN, -NRgRk, -NO2, -СF3, СF3(O)r-, -CO2Rg, -CORg, -CONRg2 или C1-6 алкил; или
где Q1, Q2 и Q3 каждый означают СН, u означает 0, каждый R' означает Н, R" означает Н или C1-4 алкил, v означает 0 и W означает -CH2-CH2-; или
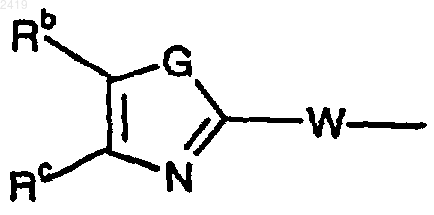
где G означает NН и Rb и Rc каждый означает Н и W означает -NRg-(CHRg)b-; или
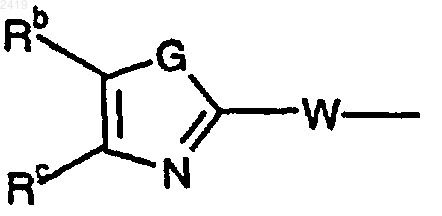
где G означает NH и Rb и Rc соединяются друг с другом с образованием пяти- или шестичленного ароматического или неароматического карбоциклического или гетероциклического кольца, необязательно замещенного заместителями в количестве до трех, выбранными из галогена, СF3, C1-4 алкила, ORf, S(O)kRf, CORf, CO2Rf, ОН, NO2, N(Rf)2, CO(NRf)2 и СН2N(Rf)2; или метилендиокси; и W означает -СН2-СН2-; или
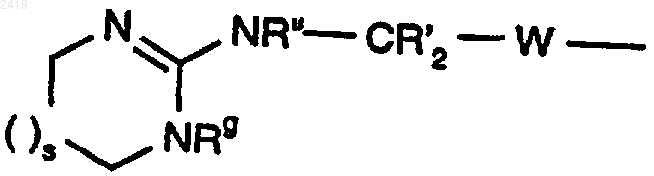
где каждый R' означает Н, R" означает Н или C1-4 алкил, Rg означает Н или C1-4 алкил, s означает 0, 1 или 2 и W означает -CH2-CH2-.
3. Соединение по п.1, в котором R1 означает Н, C1-6 алкил, Аr-С0-6 алкил, Het-C0-6 алкил, С3-6 циклоалкил-С0-6 алкил, -СН2СF3, -(CH2)1-2C(O)OR' или -(CH2)2OR', где R1 означает Н или C1-4 алкил.
4. Соединение по п.3, в котором R1 означает -СН2СF3.
5. Соединение, которое представляет собой
(+)-8-[3-(2-пиридиламино)-1-пропилокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[3-(4-амино-2-пиридиламино)-1-пропилокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[3-(4-метокси-2-пиридиламино)-1-пропилокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[3-(2-пиридиламино)-1-пропилокси]-2-метил-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[3-[2-(1,4,5,6-тетрагидропиримидинил)амино]-1-пропилокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[2-(2-бензимидазолил)этокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[2-[6-(метиламино)пиридин-2-ил)-1-этокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[2-(бензимидазол-2-ил)-1-этокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[3-(4-аминопиридин-2-иламино)-1-пропилокси]-2-метил-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-оксо-8-[3-(пиримидин-2-иламино)-1-пропилокси]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(R)-8-[3-(4-аминопиридин-2-иламино)-1-пропилокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-оксо-8-[3-[(1,4,5,6-тетрагидропиримидин-2-ил)амино]-1-пропилокси]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(S)-8-[3-(4-аминопиридин-2-иламино)-1-пропилокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-оксо-8-[3-[N-(пиpидин-2-ил)-N-(тpeт-бyтoкcикapбoнил)амино]-1-пропилокси]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[3-[N-(1-оксопиридин-2-ил)-N-(трет-бутоксикарбонил)амино]-1-пропилокси]-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-оксо-8-[3-[N-(пиридин-2-ил)-N-(трет-бутоксикарбонил)амино]-1-пропилокси]-2-(4-трифторметилбензил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(4-трифторметилбензил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-2-метил-3-оксо-8-[3-[N-(пиридин-2-ил)-N-(метил)амино]-1-пропилокси]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-2-бензил-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-2-(карбоксиметил)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-2-(4-аминобензил)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-оксо-8-[3-[N-(пиридин-2-ил)-N-(бензоил)амино]-1-пропилокси]-2-(4-трифторметилбензил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[3-(2-имидазолин-2-иламино)-1-пропилокси]-2-метил-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[2-(2-аминотиазол-4-ил)-1-этокси]-2-метил-3-оксо-2,3,4,5-тeтpaгидpo-1H-2-бeнзaзeпин-4-уксусную кислоту;
(+)-8-[3-(4,6-диметилпиридин-2-иламино)-1-пропилокси]-2-метил-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-8-[3-(4,5,6,7-тетрагидро-1Н-1,3-диазепин-2-иламино)-1-пропилокси]-2-метил-3-оксо-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-окco-8-[3-[N-(пиридин-2-ил)-N-(трет-бутилацетил)амино]-1-пропилокси]-2-(4-трифторметилбензил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-окco-8-[3-[N-(пиридин-2-ил)-N-изобутоксикарбониламино]-1-пропилокси]-2-(4-трифторметилбензил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(S)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(4-трифторметилбензил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-оксо-8-[3-(4-метилпиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(+)-3-оксо-8-[3-[N-(пиридин-2-ил)-N-(метил)амино]-1-пропилокси]-2-[4-(трифторметил)бензил]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(S)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(R)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(S)-8-[3-(4-метилпиридин-2-иламино)-1-пропилокси]-3-оксо-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(S)-3-оксо-8-[3-(1,4,5,6-тетрагидропиримид-2-иламино)-1-пропилокси]-2-[4-(трифторметил)бензил]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(S)-3-оксо-2-(2-фенилэтил)-8-[3-(пиридин-2-иламино)-1-пропилокси]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(S)-8-[2-[6-(метиламино)пиридин-2-ил]-1-этокси]-3-оксо-2-(2-фенилэтил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
(S)-8-[2-[6-(метиламино) пиридин-2-ил]-1-этокси]-3-оксо-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту; или
(S)-8-[2-[6-(метиламино)пиридин-2-ил]-1-этокси]-3-оксо-2-[4-(трифторметил)бензил]-2,3,4,5-тетрагидро-1Н-2-бензазепин-4-уксусную кислоту;
или их фармацевтически приемлемую соль.
6. Фармацевтическая композиция, которая включает соединение по любому одному из пп.1-5 и фармацевтически приемлемый носитель.
7. Способ получения соединения формулы (I) по п.1, отличающийся тем, что указанный способ включает взаимодействие соединения формулы (IV) с соединением формулы (V)

где R1 и R2 определены как в формуле (I), при этом осуществляется защита реакционноспособных функциональных групп, и L1 означает ОН или галоген;
с последующим удалением любой из защищающих групп и, необязательно, с образованием фармацевтически приемлемой соли.
8. Применение соединения по любому из пп.1-5 в качестве лекарственного средства.
9. Применение соединения формулы (I) по п.1 для изготовления лекарственного средства.
10. Применение соединения формулы (I) по п.1 для лечения остеопороза.
11. Применение соединения формулы (I) по п.1 для ингибирования ангиогенеза.
Текст
1 Настоящее изобретение относится к фармацевтически активным соединениям, которые ингибируют рецептор витронектина и используются для лечения воспаления, рака и сердечно-сосудистых заболеваний, таких как атеросклероз и рестеноз, а также заболеваний, при которых имеет место резорбция кости, таких как остеопороз. Интегрины представляют собой крупное семейство рецепторов клеточной адгезии, которые относятся к трансмембранным гликопротеинам, проявляющим свою активность на множестве клеток. Указанные рецепторы, необходимые для адгезии клеточных поверхностей,включают gpIIb/IIIa (рецептор фибриногена) иv3 (рецептор витронектина). Рецептор фибриногена gpIIb/IIIa экспрессируется на поверхности тромбоцитов и опосредует агрегацию тромбоцитов и образование кровоостанавливающего сгустка крови на месте кровоточащей раны(Philips, et al., Blood., 1988, 71, 831). Рецептор витронектина v3 экспрессируется на множестве клеток, включая эндотелиальные клетки,клетки гладких мышц, остеокласты и опухолевые клетки и обладает множеством функций. Рецептор v3, экспрессируемый на мембранах остеокластов, опосредует адгезию остеокластов к костному матриксу, что представляет собой ключевую стадию в процессе резорбции кости(Ross, et al., J. Biol. Chem., 1987, 262, 7703). Заболевание, характеризующееся избыточной резорбцией кости, называется остеопорозом. Рецептор v3, экспрессируемый на клетках гладких мышц аорты человека, опосредует их миграцию в неоинтиму, что представляет собой процесс, ведущий к рестенозу после чрескожной коронарной ангиопластики (Brown, et al.,Cardiovascular Res., 1994, 28, 1815). Кроме того,Брук с соавт. (Brooks, et al., Cell, 1994, 79, 1157) показали, что антагонист v3 способен вносить вклад в регрессию опухоли за счет индукции апоптоза ангиогенных сосудов крови. Таким образом, средства, которые блокируют рецептор витронектина, могут быть использованы при лечении заболеваний, таких как остеопороз, рестеноз и рак. В настоящее время известно, что рецептор витронектина представлен тремя различными интегринами, обозначаемыми как v1, v3 иv5 (Horton, et al., Int. J. Exp. Pathol., 1990, 71,741). v1 осуществляет связывание фибронектина и витронектина. v3 осуществляет связывание множества лигандов, включая фибрин,фибриноген, ламинин, тромбоспондин, витронектин, фактор фон Виллебранда, остеопонтин и костный сиалопротеин I. v5 осуществляет связывание витронектина. Было показано, что рецептор витронектина v5 принимает участие в клеточной адгезии различных типов клеток,включая эндотелиальные клетки микрососудов 2 того, была подтверждена его роль в ангиогенезе(Brooks, et al., Science, 1994, 264, 569). Этот интегрин экспрессирован на кровеносных сосудах в грануляционной раневой ткани человека, но не обнаружен в нормальной ткани кожи. Известно, что рецептор витронектина связывается с белками костного матрикса, который содержит трипептидный мотив Arg-Gly-AspRGD-содержащие пептиды и антитело к рецептору витронектина (23 С 6) ингибируют резорбцию дентина и рассеивание клеток остеокластами. Кроме того, Сато с соавт. (Sato, et al., J. Cell.RGD-последовательность, является потенциальным ингибитором резорбции кости в культуре ткани и ингибирует прикрепление остеокластов к костной ткани. В настоящее время обнаружено, что определенные соединения являются потенциальными ингибиторами рецепторов v3 и v5. В частности, было обнаружено, что такие соединения являются более мощными ингибиторами рецептора витронектина, чем рецептора фибриногена. Настоящее изобретение включает соединения формулы (I), определяемой ниже, которые обладают фармакологической активностью,направленной на ингибирование рецептора витронектина, и могут быть использованы для лечения воспаления, рака и сердечнососудистых заболеваний, таких как атеросклероз и рестеноз, а также заболеваний, в патологии которых существенную роль играет резорбция кости, таких как остеопороз. Настоящее изобретение также относится к фармацевтической композиции, включающей соединение формулы (I) и фармацевтический носитель. Настоящее изобретение также применяется в лечении заболеваний, в развитии которых участвует рецептор витронектина. В одном конкретном аспекте соединения согласно изобретению используются для лечения атеросклероза,рестеноза, воспаления, рака и заболеваний, связанных с резорбцией кости, таких как остеопороз. Настоящее изобретение относится к новым соединениям, которые являются более мощными ингибиторами рецептора витронектина, чем рецептора фибриногена. Новые соединения включают бензазепиновое ядро, при этом на ароматическом шестичленном кольце бензазепина содержится азотсодержащий заместитель,и на семичленном кольце бензазепина имеется алифатический заместитель, содержащий кислотную группировку. Считается, что бензазепиновая система колец предпочтительно взаимодействует с рецептором витронектина и ориентирует заместители на боковых цепях шести 3 и семичленных колец таким образом, что они могут предпочтительно взаимодействовать с рецептором. Предпочтительно, чтобы было примерно от двенадцати до примерно четырнадцати ковалентных связей на кратчайшем внутримолекулярном расстоянии между кислотной группировкой на алифатическом заместителе семичленного кольца бензазепина и азотом азотсодержащего заместителя в шестичленном ароматическом кольце бензазепина. Настоящее изобретение включает соединения формулы (I)R1 означает R7 или А-С 0-4 алкил, A-C2-4 алкенил, А-С 2-4 алкинил, А-С 3-4 оксоалкенил,А-С 3-4 оксоалкинил, A-C1-4 аминоалкил, А-С 3-4 аминоалкенил, А-С 3=4 аминоалкинил, необязательно замещенные любым приемлемым сочетанием одного или более R10 или R7; А означает Н, С 3-6 циклоалкил, Het или Аr;U отсутствует или означает СО, CRg2,C(=CRg2), S(O)k, O, NRg, CRgORg, CRg(ORk)CRg2,CRg2CRg(ORk), C(O)CRg2, CRg2C(O), CONRi,NRiCO, OC(O), C(O)O, C(S)O, OC(S), C(S)NRg,NRgC(S), S(O)2NRg, NRgS(O)2N=N, NRgNRg,NRgCRg2, CRg2NRg, CRg2O, OCRg2, CC илиRb и Rc выбирают независимо друг от друга из Н, C1-6 алкила, Аr-С 0-6 алкила, Het-C0-6 алкила или С 3-6 циклоалкил-С 0-6 алкила, галогена,СF3, ORf, S(O)kRf, CORf, NO2, N(Rf)2, СО(NRf)2,CH2N(Rf)2, или Rb и Rc соединяются с образованием пяти- или шестичленного ароматического или неароматического карбоциклического или гетероциклического кольца, необязательно замещенного заместителями в количестве до трех,выбранными из галогена, CF3, C1-4 алкила, ORf,S(O)kRf, CORf, CO2Rf, ОН, NO2, N(Rf)2, СО(NRf)2 и CH2N(Rf)2; или метилендиокси;Q1, Q2, Q3 и Q4 означают независимо друг от друга N или C-Ry, при условии, что не более одного из Q1, Q2, Q3 и Q4 означает N;v означает 0 или 1; или его фармацевтически приемлемую соль. В рамки настоящего изобретения также включаются фармацевтические аддитивные соли и комплексы соединений согласно изобретению. В тех случаях, когда соединения согласно изобретению имеют один или более хиральных 5 центров, если особо не оговорено, настоящее изобретение включает каждое такое отдельное нерацемическое соединение, которое может быть синтезировано и разрешено традиционными видами техники. В тех случаях, когда соединения имеют ненасыщенные углеродуглеродные двойные связи, как цис (Z)-, так и транс (Е)-изомеры входят в область настоящего изобретения. В тех случаях, когда соединения могут существовать в таутомерных формах, таких как кетоенольные таутомеры, такие как каждая такая таутомерная форма рассматривается в рамках настоящего изобретения, независимо от того, существует она в равновесной форме или закрыта в какой-то одной форме, при соответствующем замещении R'. Соединения формулы (I) ингибируют связывание витронектина и других RGDсодержащих пептидов с рецептором витронектина. Ингибирование рецептора витронектина на остеокластах приводит к снижению вызванной остеокластами резорбции костной ткани и полезно при лечении заболеваний, в которых патология связана с резорбцией кости, таких как остеопороз и остеоартрит. В другом аспекте настоящее изобретение относится к применению соединения, вызывающего повышение высвобождения остеокальцина, для стимулирования образования кости при лечении остеопороза. Усиленное образование кости представляет собой весомое достоинство в случае таких болезненных состояний,где имеется дефицит минерализованной костной массы или требуется моделирование кости, в случае, например, лечения переломов и предупреждения переломов кости. В случае заболеваний и метаболических расстройств, которые приводят к потере костной структуры, использование такого лечения также может быть полезно. Так, например, при введении соединения согласно изобретению можно добиться улучшения в случае таких заболеваний как гиперпаратиреоз, болезнь Пеже, гиперкальциемия при новообразованиях, остеолитические поражения,возникающие в случае метастазов в костной ткани, разрежение кости, связанное с иммобилизацией или недостатком половых гормонов,болезнь Бехчета, остеомаляция, гиперостоз и остеопетроз. Кроме того, поскольку соединения согласно изобретению ингибируют рецепторы витронектина на различных типах клеток, указанные соединения могут использоваться при лечении воспалительных заболеваний, таких как ревматоидный артрит и псориаз, а также сердечнососудистых заболеваний, таких как атеросклероз и рестеноз. Соединения формулы (I) согласно изобретению могут также использоваться при лечении или для профилактики других заболеваний, включающих, но не ограничиваю 002419 6 щихся ими, тромбоэмболические нарушения,астму, аллергию, респираторный дистресссиндром взрослых, реакцию "трансплантат против хозяина", реакцию отторжения трансплантата органа, септический шок, экзему, контактный дерматит, воспалительные заболевания кишечника и другие аутоиммунные заболевания. Соединения согласно изобретению могут также использоваться для лечения ран. Соединения согласно изобретению могут также применяться для лечения, в том числе и профилактики, ангиогенных заболеваний. Термин "ангиогенные заболевания" в контексте настоящего описания относится к состояниям,которые включают аномальную неоваскуляризацию. В тех случаях, когда возникновение новых кровеносных сосудов является причиной патологии или вносит вклад в развитие заболевания, ингибирование ангиогенеза будет снижать пагубный эффект заболевания. Примером такого заболевания-мишени является диабетическая ретинопатия. В том случае, когда для прогрессирования поражения ткани требуется развитие новых кровеносных сосудов, ингибирование ангиогенеза будет снижать поступление крови к ткани и, таким образом, сказываться на снижении тканевой массы в связи со снижением поступления крови. Такие примеры включают рост опухолей, когда необходима постоянная неоваскуляризация, для того, чтобы опухоль могла расти и обосноваться в виде твердых опухолевых метастазов. Таким образом, соединения согласно изобретению ингибируют ангиогенез опухолевой ткани, внося тем самым вклад в профилактику опухолевых метастазов и роста опухолей. Таким образом, в соответствии с методами настоящего изобретения, ингибирование ангиогенеза с применением соединений согласно изобретению может облегчать симптомы заболевания и в некоторых случаях может вылечивать заболевание. Другой терапевтической целью применения соединений согласно изобретению являются глазные заболевания, характеризующиеся наличием неоваскуляризации. Такие глазные заболевания включают неоваскулярные расстройства роговицы, такие как состояние при трансплантации роговицы, герпетический кератит, сифилитический кератит, птеригий и неоваскулярный паннус, связанный с использованием контактных линз. Другие заболевания глаз включают связанную с возрастом макулярную дегенерацию, предположительно глазной гистоплазмоз, возникающий при злоупотреблении линз, ретинопатия недоношенных и неоваскулярная глаукома. Настоящее изобретение открывает возможности для ингибирования роста опухоли,например, путем постадийного введения соединения формулы (I) или же введения этого соединения в физической комбинации с антине 7 опластическим агентом, таким как топотекан и цисплатина. В формуле (I) символы имеют следующие значения: где Q1, Q2 и Q3 каждый означают СН и u означает 0 и предпочтительно каждый R' означает Н,R" означает Н или C1-4 алкил, W означает -CH2CH2- и v означает 0. Альтернативно R2 означает где G означает NH и Rb и Rc соединяются с образованием пяти- или шестичленного ароматического или неароматического карбоциклического или гетероциклического кольца, необязательно замещенного заместителями в количестве до трех, выбранными из галогена, CF3, C1-4 алкила, ORf, S(O)kRf, CORf, CO2Rf, ОН, NO2,N(Rf)2, СО(NRf)2 и CH2N(Rf)2 или метилендиокси. Предпочтительно Rb и Rc соединяются с образованием шестичленного ароматического карбоциклического или гетероциклического кольца и W означает -СН 2-СН 2-. Альтернативно R2 означает-СН 2 СF3. Репрезентативными представителями новых соединений согласно изобретению являются следующие:(S)-8-[2-[6-(метиламино)пиридин-2-ил]-1 этокси]-3-оксо-2-[4-(трифторметил)бензил]2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-уксусная кислота; или их фармацевтически приемлемая соль. Предпочтительные соединения согласно изобретению включают(S)-8-[3-(4-метилпиридин-2-иламино)-1 пропилокси]-3-оксо-2-(2,2,2-трифторэтил)2,3,4,5-тетрагидро-1H-2-бензазепин-4-уксусную кислоту; или их фармацевтически приемлемую соль. В тех случаях, когда соединения согласно изобретению могут включать один или более хиральных центров, если не оговорено особо,настоящее изобретение включает каждое такое отдельное нерацемическое соединение, которое может быть синтезировано и разрешено с помощью традиционных технологий. В соответствии с настоящим изобретением предпочтительна (S)-конфигурация соединений формулы (I). 11 В тех случаях, когда соединения имеют ненасыщенные углерод-углеродные двойные связи, в рамки настоящего изобретения входят как цис (Z)-, так и транс (Е)-изомеры. Значение любого заместителя в любом случае не зависит от его собственного значения или от значений любых других заместителей в любом случае. В рамки настоящего изобретения также включены пролекарства на основе соединений согласно изобретению. К пролекарствам относят любые ковалентно связанные носители, которые высвобождают активное родительское лекарственное средство, по формуле (I) in vivo. Таким образом, в другом своем аспекте настоящее изобретение относится к новым пролекарствам формулы (II), которые являются также промежуточными агентами при изготовлении соединений формулы (I) где R1 означает R7 или А-С 0-4 алкил, А-С 2-4 алкенил, A-C2-4 алкинил, А-С 3-4 оксоалкенил,А-С 3-4 оксоалкинил, A-C1-4 аминоалкил, А-С 3-4 аминоалкенил, А-С 3-4 аминоалкинил, необязательно замещенные любым приемлемым сочетанием одного или более R10 или R7; А означает Н, С 3-6 циклоалкил, Het или Аr;W означает -(CHRg)a-U-(CHRg)b-; U отсутствует или означает СО, CRg2, C(=CRg2), S(O)k,O, NRg, CRgORg, CRg(ORk)CRg2, CRg2CRg(ORk),C(O)CRg2, CRg2C(O), CONRi, NRiCO, OC(O),C(O)O, C(S)O, OC(S), C(S)NRg, NRgC(S),S(O)2NRg, NRgS(O)2N=N, NRgNRg, NRgCRg2,CRg2NRg, CRg2O, OCRg2, CC или CRg=CRg;Rb и Rc выбирают независимо друг от друга из Н, C1-6 алкила, Аr-С 0-6 алкила, Het-C0-6 алкила или С 3-6 циклоалкил-С 0-6 алкила, галогена,СF3, ORf, S(O)kRf, CORf, NO2, N(Rf)2, CO(NRf)2,CH2N(Rf)2, или Rb и Rc соединяются друг с другом с образованием пяти- или шестичленного ароматического или неароматического карбоциклического или гетероциклического кольца,необязательно замещенного заместителями в количестве до трех, выбранными из галогена,СF3, C1-4 алкила, ORf, S(O)kRf, CORf, СО 2Rf, ОН,NO2, N(Rf)2, СО(NRf)2 и CH2N(Rf)2; или метилендиокси;Q1, Q2, Q3 и Q4 означают независимо друг от друга N или C-Ry, при условии, что не более одного из Q1, Q2, Q3 и Q4 означает N;v означает 0 или 1; или его фармацевтически приемлемой соли. Репрезентативными представителями новых пролекарств согласно изобретению являются следующие метил -3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2,3,4,5-тетрагидро-1 Н-2 бензазепин-4-ацетат; и этил-8-[3-(4-аминопиридин-2-иламино)-1-пропилокси]-3-оксо-2,3,4,5-тетрагидро 1 Н-2-бензазепин-4-ацетат; или их фармацевтически приемлемая соль. Помимо прочего, в настоящем изобретении получено новое промежуточное соединение формулы (III)R1 означает R7 или А-С 0-4 алкил, А-С 2-4 алкенил, А-С 2-4 алкинил, А-С 3-4 оксоалкенил,А-С 3-4 оксоалкинил, A-C1-4 аминоалкил, А-С 3-4 аминоалкенил, А-С 3-4 аминоалкинил, необязательно замещенные любым приемлемым сочетанием одного или более R10 и R7; А означает Н, С 3-6 циклоалкил, Het или Аr;U отсутствует или означает СО, CRg2,C(=CRg2), S(O)k, O, NRg, CRgORg, CRg(ORk)CRg2,CRg2CRg(ORk), C(O)CRg2, CRg2C(O), CONRi,NRiCO, OC(O), C(O)O, C(S)O, OC(S), C(S)NRg,NRgC(S), S(O)2NRg, NRgS(O)2N=N, NRgNRg,NRgCRg2, CRg2NRg, CRg2O, OCRg2, C=C илиQ1, Q2, Q3 и Q4 означают независимо друг от друга N или C-Ry, при условии, что не более одного из Q1, Q2, Q3 и Q4 означает N;r означает 0, 1 или 2; или его фармацевтически приемлемой соли. Для описания соединений согласно изобретению использованы сокращения и символы,обычно применяемые в химии пептидов. В основном аминокислотные сокращения соответствуют принятым в номенклатуре биохимических соединений сокращениям (IUPAC-IUB JointC1-4 алкил в контексте настоящего описания обозначает необязательно замещенную алкильную группу, содержащую от 1 до 4 атомов углерода и включает метил, этил, н-пропил,изопропил, н-бутил, изобутил и т-бутил. C1-6 алкил включает, кроме того, пентил, н-пентил,изопентил, неопентил и гексил и их простые алифатические изомеры. С 0-4 алкил и С 0-6 алкил указывает, кроме того, что алкильная группа может не присутствовать (т.е. имеется ковалентная связь). Любой C1-4 алкил или C1-6 алкил, С 2-6 алкенил, C2-6 алкинил или C1-6 оксоалкил могут быть необязательно замещены группой Rx, которая может находиться на любом атоме углерода, что приводит к созданию более стабильной структуры, и получение которой достижимо традиционной техникой синтеза. Подходящими группами для Rx являются C1-4 алкил, OR', SR', C1-4 алкилсульфонил, C1-4 алкилсульфоксил, -CN,N(R')2, CH2N(R')2, -NO2, -СF3, -CO2R', -CON(R')2,-COR', -NR'C(O)R', F, Cl, Br, I или СF3S(O)r-, гдеr обозначает 0, 1 или 2. Галоген означает F, Cl, Br и I. Аr, или арил, в контексте настоящего описания означает фенил или нафтил или фенил или нафтил, замещенные заместителями в количестве от одного до трех, такими как были определены выше для алкила, в особенности, С 1-4 алкилом, C1-4 алкокси, C1-4 алкилтио, CF3, NH2,ОН, F, Cl, Br или I.Het, или гетероцикл, указывает на наличие необязательно замещенного пяти- или шестичленного моноциклического кольца или девятиили десятичленного бициклического кольца,содержащего от одного до трех гетероатомов,выбранных из группы, состоящей из азота, кислорода и серы, которые отличаются стабильностью и могут быть получены традиционным химическим синтезом. Примерами гетероциклов 15 являются бензофурил, бензимидазол, бензопиран, бензотиофен, фуран, имидазол, индолин,морфолин, пиперидин, пиперазин, пиррол, пирролидин, тетрагидропиридин, пиридин, тиазол,тиофен, хинолин, изохинолин и тетра- и пергидрохинолин и изохинолин. В область настоящего изобретения входит также любая приемлемая комбинация заместителей на Het кольце в количестве до трех, таких как было указано для алкила, получение которых возможно химическим синтезом и которые являются стабильными. С 3-7 циклоалкил относится к необязательно замещенной карбоциклической системе, включающей от трех до семи атомов углерода, которые могут содержать до двух ненасыщенных углерод-углеродных связей. Типичными представителями С 3-7 циклоалкила являются циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил и циклогептил. В область настоящего изобретения входит также любая комбинация заместителей на циклоалкильном кольце в количестве до трех, таких как было указано для алкила, и получение которых возможно традиционным химическим синтезом, и которые являются стабильными. Если Rb и Rc соединяются друг с другом с образованием пяти- или шестичленного ароматического или неароматического карбоциклического или гетероциклического кольца, слитого с кольцом, к которому присоединены Rb и Rc, то образованное кольцо будет обычно пяти- или шестичленным гетероциклом, выбранным из перечисленных выше примеров для Het, или это может быть фенильное, циклогексильное или циклопентильное кольцо. Предпочтительно Rb иRc означают -D1=D2-D3=D4, где D1-D4 означает независимо СН, N или С-Rx, при условии, что не более чем два из D1-D4 означают N. Наиболее предпочтительно, когда Rb и Rc соединяются друг с другом с образованием группы -СН=СНСН=СН-. В настоящем описании определенные радикалы обозначены в сокращенном виде. t-Bu относится к третичному бутильному радикалу,Воc относится к т-бутилоксикарбонильному радикалу, Fmoc относится к флуоренилметоксикарбонильному радикалу, Ph относится к фенильному радикалу, Cbz относится к бензилоксикарбонильному радикалу, Вn относится к бензильному радикалу, Me относится к метилу, Et относится к этилу, Ас относится к ацетилу, Alk относится к C1-4 алкилу, Nph относится к 1- или 2-нафтилу и сНех относится к циклогексилу. Tet относится к 5-тетразолилу. Некоторые реагенты также даны в описании в сокращенном виде. ДЦК означает дициклогексилкарбодиимид, ДМАП означает диметиламинопиридин, ДИЭА означает диизопропилэтиламин, ЭДК означает 1-(3-диметиламинопропил)-3-этилкарбодиимид,гидрохлорид,HOBt означает 1-гидроксибензотриазол, ТГФNбромсукцинимид, Pd/C означает катализатор палладия на угле, ПФК означает полифосфорную кислоту, ДФФА означает дифенилфосфорилазид, ВОР означает бензотриазол-1-илокси 3-(диметиламино)фосфония гексафторфосфат,ФВ означает фтористо-водородную кислоту,ТЭА означает триэтиламин, ТФУ означает трифторуксусную кислоту, ПХХ означает пиридиния хлорхромат. Соединения формулы (I) в основном получают при взаимодействии соединения формулы где R1 и R2 определены в формуле (I), при этом осуществляется защита реакционноспособных функциональных групп, и L1 означает ОН или галоген; с последующим удалением любой из защищающих групп и необязательно с образованием фармацевтически приемлемой соли. При этом некоторые соединения формулы(I) получают при взаимодействии соединения формулы (IV) с соединением формулы (VI) где R1, R', R, W, Q1, Q2, Q3 и Q4 определены в формуле (I), при этом осуществляется защита реакционноспособных функциональных групп; с последующим удалением любой из защищающих групп и необязательно с образованием фармацевтически приемлемой соли. Предпочтительно в случае соединений формулы (VI) Q1, Q2, Q3 и Q4 означают СН, W означает -СН 2-СН 2-, R' означает Н и R означает Н, C1-4 алкил или -C(O)OC1-4 алкил. При этом реакцию между соединением формулы (IV) и соединением формулы (VI) проводят в присутствии диэтилазодикарбоксилата и трифенилфосфина в апротонном растворителе. Кроме того, некоторые соединения формулы (I) получают при взаимодействии соединения формулы (IV) с соединением формулы (VII) 17 где R1, R', R", W, Q1, Q2, Q3 и v определены в формуле (I), при этом осуществляется защита реакционноспособных функциональных групп; с последующим удалением любой из защищающих групп и необязательно с образованием фармацевтически приемлемой соли. Предпочтительно в случае соединений формулы (VII) Q1, Q2 и Q3 означают СН, W означает -CH2-CH2-, v означает О, R' означает Н иR означает Н или С 1-4 алкил. При этом реакцию между соединением формулы (IV) с соединением формулы (VII) проводят в присутствии диэтилазодикарбоксилата и трифенилфосфина в апротонном растворителе. Соединения формулы (I) получают с использованием общих методов, описанных на схемах I-VII. Схема I а) 2-[(3-гидрокси-1-пропил)амино]пиридин-N-оксид, ДЭАД, (Рh)3 Р, ДМФ; b) циклогексен, 10% Pd/C, 2-пропанол; с) 1,0N LiOH, ТГФ,H2O, затем проводится подкисление. Соединение I-1, получение которого проводят с использованием общей процедуры, описанной в работе Бондинелла с соавт. (Bondinell,et al. (WO 93/00095, взаимодействует с 2-[(3 гидрокси-1-пропил)амино]пиридин-N-оксидом по механизму реакции сопряжения Митсунобутипа (Organic Reactions 1992, 42, 335-656; Synthesis 1981, 1-28) с получением I-2. В ходе реакции в качестве промежуточного продукта образуется комплекс между диэтилазодикарбоксилатом и трифенилфосфином, при этом указанная реакция проводится в апротонном растворителе,например, в ТГФ, CH2Cl2 или ДМФ. ПиридинN-оксидная группировка в I-2 восстанавливается до соответствующего пиридина I-3 в условиях гидрогенизационного переноса с использованием платинового катализатора, предпочтительно металлической платины на активированном угле, в инертном растворителе, например, в метаноле, этаноле или 2-пропаноле. Для осуще 002419 18 ствления этого типа реакции в качестве реагентов переноса водорода обычно используют циклогексен, 1,4-циклогексадиен, муравьиную кислоту и соли муравьиной кислоты, такие как формиат калия или формиат аммония. Метиловый эфир I-3 гидролизуют с использованием водного основания, например, LiOH в водном ТГФ или NaOH в водном метаноле или этаноле,при этом промежуточную соль карбоксилата подкисляют с помощью подходящей кислоты,например, ТФУ или НСl, с получением карбоновой кислоты I-4. В альтернативном варианте промежуточный продукт в виде соли карбоксилата может быть выделен при желании, или соль карбоксилата свободной карбоновой кислоты может быть получена с помощью методов, хорошо известных в технике. Соединения формулы (I) могут быть также получены с помощью альтернативных методов,известных в технике. Так, например, эфирная связь в соединениях формулы (I) может быть образована при взаимодействии спиртовой группы соединения формулы 1-(Схема I) с соединением R2, содержащим замещаемую группу, такую как хлор, бром или иод. Могут быть также использованы другие эфирообразующие реакции, применение которых очевидно для специалистов в данной области. Схема IIa) 2-[N-(3-гидрокси-1-пропил)-N-(третбутоксикарбонил)амино]пиридин-N-оксид,ДЭАД, (Рh)3 Р, ДМФ; b) LiHMDS, 4 трифторметилбензилбромид, ДМФ; с) цикло 19 гексен, 10% Pd/C, 2-пропанол; d) 1,0N NaOH,MeOH; е) HCl/диоксан. Соединение II-1, полученное в соответствии со схемой I, взаимодействует с 2-[N-(3 гидрокси-1-пропил)-N-(трет-бутоксикарбонил) амино]пиридин-N-оксидом по механизму реакции сопряжения типа Митсунобу, которая описана подробно на схеме I. Полученный продукт,II-2, может быть алкилирован в положении 2(нумерация в бензазепине), в стандартных условиях алкилирования, известных каждому специалисту со средним уровнем знаний в данной области. Так, например, II-2 может быть обработан основанием, таким как гидрид натрия,LDA или гексаметилдисилазид лития, в соответствующем растворителе, обычно в ТГФ,ДМФ, ДМЭ или их смеси, для осуществления депротонирования N-H амида. Обработка полученных анионных видов соответствующим электрофилом, таким как галогенид алкила или бензила, приводит к N-алкилированию с получением продукта, например, II-3. N-оксид II-3 может быть восстановлен, как описано на схемеI, с получением II-4, который может быть далее омылен до II-5, как приведено на схеме I. Депротекцию II-5 с получением II-6 проводят в стандартных кислых условиях, в соответствии с описанием, приведенным Грином (Greene,"Protective Groups in Organic Synthesis" (опубликована Wiley-Interscience. Такие условия хорошо известны каждому специалисту со средним уровнем знаний в данной области. Альтернативно, превращение II-II-3 в II-6 может быть осуществлено за счет изменения последовательности, например, при проведении вначале снятия защитной Вос-группировки в II-3 с последующим восстановлением N-оксида и, наконец,при проведении омыления. Схема III 20 а) 2-[(3-гидрокси-1-пропил)амино]пиридин-N-оксид, ДЭАД, (Рh)3 Р, ДМФ; b) LiHMDS,СН 3I, ДМФ; с) циклогексен, 10% Pd/C, 2 пропанол; d) 1,0N NaOH, MeOH, затем проводится подкисление. Соединение III-2, полученное в соответствии со схемой I, может быть алкилировано одновременно в положении 2 (нумерация в бензазепине) и на атоме азота, присоединенном к пиридиновому кольцу, в стандартных условиях алкилирования, известных каждому специалисту со средним уровнем знаний в данной области. Так, например, III-2 может быть обработан,по меньшей мере, двумя молярными эквивалентами основания, такого как гидрид натрия, LDA или гексаметилдисилазид лития, в подходящем растворителе, обычно в ТГФ, ДМФ, ДМЭ или их смеси, для осуществления депротонирования. Обработка полученных анионных видов избытком соответствующего электрофила, такого как галогенид алкила или бензила, приводит к бис-алкилированию с получением продукта,например, III-3. Превращение III-3 в III-5 осуществляют с применением методов, показанных на схемах I и II. Схема IVHCl/диоксан; с) трет-бутилацетилхлорид, Et3N,CH2Cl2; d) 1,0N NaOH, МеОН, затем проводится подкисление. Соединение IV-2, полученное из IV-1, с помощью процедур, указанных на схемах I-III,может быть ацилировано в положении атома азота, присоединенного к пиридиновому кольцу, в стандартных условиях ацилирования, известных каждому специалисту в данной области. Так, например, взаимодействие IV-2 с ацилирующим агентом, например, с третбутилацетилхлоридом, в присутствии подходящего акцептора кислоты, обычно триэтиламина, 21 диизопропилэтиламина или пиридина, в подходящем растворителе, чаще всего CH2Cl2, приводит к получению IV-3. Известно множество других методик, применяемых для ацилирования амина, которые можно найти в стандартных руководствах (таких как "Compendium of Organic Synthetic Methods", vol. 1-VI (опубликована Wiley-Interscience. Омыление IV-3, как показано на схемах I-III, дает IV-4. Схема V а) 3-(4-нитробензилоксикарбониламино)-1 пропанол, ДЭАД, (Рh)3 Р, ДМФ, СН 2 Сl2; b) Н 2,Pd/C; EtOH; с) гидроиодид 2-метилтио-2 имидазолина,(i-Pr)2Net,диметилацетамид,100 С; d) 1,0N LiOH, ТГФ, Н 2O, затем проводится подкисление. Соединение V-1, полученное в соответствии со схемой I, взаимодействует с защищенным вариантом 3-амино-1-пропанола, таким как 3-(трет-бутоксикарбониламино)-1-пропанол, 3(бензилоксикарбониламино)-1-пропанол или 3(4-нитробензилоксикарбониламино)-1-пропанол, по механизму реакции сопряжения типа Митсунобу, которая описана подробно на схемеI. Полученный продукт V-2 подвергают депротекции с получением V-3. Как хорошо известно каждому специалисту со средним уровнем знаний в данной области, условия депротекции выбирают с учетом функциональной способности и природы защищающих групп, имеющихся на V-2. Так, например, п-нитро-Cbz-группу,имеющуюся на V-2, удаляют гидрогенолизом в присутствии палладиевого катализатора, обычно палладия на угле или Pd(OH)2 на угле, в соответствующем растворителе, обычно в метаноле, этаноле, этилацетате или их смеси. При желании, гидрогенолиз может быть проведен в присутствии кислоты, например, НСl, для получения соответствующей аммониевой соли V-2. Взаимодействие V-3 с гидроиодидом 2-метилтио-2-имидазолина в присутствии основания,например, диизопропилэтиламина в подходящем растворителе, таком как МеОН, EtOH,ДМФ или диметилацетамид, приводит к получению V-4. Сходные условия для осуществления родственной трансформации описаны в WO 22 95/32710. Омыление с получением V-5 осуществляют в соответствии с описанием, приведенным на схеме I. Схема VI а) 3-(трет-бутоксикарбониламино)-1 пропанол, ДЭАД, (Рh)3 Р, ДМФ, ТГФ; b) ТФУ,СН 2 Сl2; с) 2-бромпиримидин, NаНСО 3, EtOH,кипячение с обратным холодильником; d) H2,Pd/C, HCl, МеОН; е) К 2 СО 3, Н 2 О. Соединение VI-3, полученное из VI-1 с применением процедуры, обозначенной на схеме V, вступает в реакцию с 2-галогенпиримидином, обычно 2-хлорпиримидином или 2-бромпиримидином, в присутствии подходящего акцептора кислоты, обычно бикарбоната натрия, триэтиламина, диизопропилэтиламина,или пиридина, в подходящем растворителе, таком как этанол, ДМФ или диметилацетамид, что дает VI-4. Пиримидиновое кольцо VI-4 восстанавливают до соответствующего 1,4,5,6 тетрагидропиримидинового кольца, при использовании условий, которые, как было сообщено,облегчают такую трансформацию (см., например, WO 95/32710). Так, VI-4 гидрогенизируют в присутствии палладиевого катализатора,предпочтительно палладия на активированном угле, в подходящем растворителе, таком как метанол или этанол. Реакцию обычно проводят в кислых условиях; при этом предпочтительно добавление минеральной кислоты, такой как НСl. VI-5 получают после подщелачивания отфильтрованной реакционной смеси с помощью К 2 СО 3 и Н 2 О. Схема VIIBondinell, et al., PCT заявка WO 94/14776), вступает в реакцию с 4-(трифторметил)бензилбромидом в присутствии подходящего основания, чаще всего гидрида натрия или бис(триметилсилил)амида лития в апротонном растворителе, предпочтительно ДМФ, ТГФ или их смеси, что дает бис-алкилированный продуктVII-2. 4-(Трифторметил)бензиловый эфир VII-2 может быть легко удален гидрогенолизом, что дает фенол VII-3. Методы, применяемые для гидрогенолиза бензиловых эфиров, хорошо известны специалистам в соответствующей области, и они приведены в соответствующих руководствах (например, Greene "Protective Groups inOrganic Synthesis" (опубликована WileyInterscience. Фенол VII-3 используется затем для получения соединений формулы (I) с использованием методов, приведенных на предыдущих схемах. Реагенты связывания амидов в контексте настоящего описания обозначают реагенты, которые могут использоваться для образования пептидных связей. В типичных методах связывания используют карбодиимиды, активированные ангидриды и сложные эфиры и ацилгалогениды. Типичными для таких реакций являются ЭДК, ДЦК, ДФФА, ФФА, реагент ВОР, HOBt,N-гидроксисукцинимид, оксалилхлорид. Методы связывания для получения пептидных связей хорошо известны в технике. Основные методики пептидного синтеза, приведенные в работе Боданского с соавт. (Bodansky,et al., The practice of peptide synthesis, SpringerVerlag, Berlin, 1984, Ali et al. in J. Med. Chem.,29, 984 (1986) and J. Med. Chem., 30, 2291(1987, хорошо иллюстрируют имеющуюся технику и приведены в настоящем описании в качестве ссылки. В типичном случае амин или анилин связываются через свободные аминогруппы с субстратом, представляющим собой карбоновую кислоту, с использованием подходящего карбодиимидного связывающего реагента, такого какN,N'-дициклогексилкарбодиимид (ДЦК), необязательно в присутствии катализатора, такого как 1-гидроксибензотриазол (HOBt) и диметиламинопиридин (ДМАП). Пригодны также и другие методы, такие как образование активированных сложных эфиров, ангидридов или галогенидов кислоты на основе свободного карбоксила подходящим образом защищенного кислотного субстрата, и с проведением последующей реакции со свободным амином или подходящим образом защищенным амином, необязательно в присутствии основания. Например, защищенную Вос-аминокислоту или Cbz-амидинобензойную кислоту обрабатывают безводным растворителем, таким как метиленхлорид или тетрагидрофуран (ТГФ) в присутствии основания,такого как N-метилморфолин, ДМАП или три 002419 24 алкиламин, с изобутилхлорформиатом, с образованием "активированного ангидрида", который затем вступает в реакцию со свободным амином или второй защищенной аминокислотой или анилином. В работе Нестора с соавт. (Nestor, et al., J.Med. Chem., 1984, 27, 320) раскрываются интермедиаты, применимые для получения соединений формулы (I), в которой R2 представляет собой бензимидазол. Методы получения бензимидазольных соединений, применимых в качестве интермедиатов согласно изобретению, также известны в технике и могут быть найдены,например, в ЕР-А 0 381 033. Соли присоединения кислот соединений получают стандартным способом в подходящем растворителе из родительского соединения при наличии избытка кислоты, такой как соляная,бромисто-водородная,фтористо-водородная,серная, фосфорная, уксусная, трифторуксусная,малеиновая, янтарная или метансульфоновая. Некоторые из соединений образуют внутренние соли или цвиттерионы, которые могут быть также приемлемы. Катионные соли получают при обработке родительского соединения избытком щелочного реагента, такого как гидроксид, карбонат или алкоксид, содержащего соответствующий катион; или подходящим органическим амином. Конкретными примерами катионов, присутствующих в фармацевтически приемлемых солях, являются такие катионы, какLi+, Na+, K+, Са, Mg и NH4+. Настоящее изобретение также относится к фармацевтической композиции, которая включает соединение формулы (I) и фармацевтически приемлемый носитель. При этом соединения формулы (I) могут быть использованы при производстве лекарственного средства. Фармацевтические композиции соединений формулы(I), получаемые в соответствии с приведенным описанием, могут быть приготовлены в виде растворов или лиофилизированных порошков для парентерального введения. Порошки могут быть восстановлены при добавлении подходящего разбавителя или другого фармацевтически приемлемого носителя перед употреблением. Жидкая композиция может иметь вид забуференного изотонического водного раствора. Примеры подходящих разбавителей включают нормальный изотонический солевой раствор,стандартную водную 5% декстрозу или буферный раствор ацетата натрия или аммония. Такие композиции особенно приемлемы для парентерального введения, но могут также использоваться для перорального введения или при введении в ингалятор с отмеряемой дозой или использоваться для инсуффляции. Может быть также желательно добавить наполнители, такие как поливинилпирролидон, желатин, гидроксицеллюлоза, аравийская камедь, полиэтиленгликоль, маннит, хлорид натрия или цитрат натрия. 25 Альтернативно, указанные соединения могут быть инкапсулированы, таблетированы или приготовлены в виде эмульсий или сиропа для перорального введения. Могут быть добавлены фармацевтически приемлемые твердые или жидкие носители для усиления или стабилизации композиции или для облегчения приготовления композиций. Твердые носители включают крахмал, лактозу, дигидрат сульфата кальция,белую землю, стеарат магния или стеариновую кислоту, тальк, пектин, аравийскую камедь, агар или желатин. Жидкие носители включают сироп, арахисовое масло, оливковое масло, солевой раствор и воду. Носитель может также включать материал, способствующий пролонгированному высвобождению, такой как глицерилмоностеарат или глицерилдистеарат, один или в сочетании с воском. Количество твердого носителя варьирует, но предпочтительно составляет примерно от 20 мг приблизительно до 1 г на стандартную дозу. Фармацевтические препараты изготавливают с использованием традиционных фармацевтических методик, которые включают размалывание, смешивание,гранулирование и прессование, если необходимо для таблеточных форм; или размалывание,смешивание и наполнение в случае получения твердых желатиновых капсул. При использовании жидкого носителя препарат может иметь вид сиропа, эликсира, эмульсии или водной или неводной суспензии. Такая жидкая композиция может вводиться непосредственно перорально или может использоваться для введения в мягкую желатиновую капсулу. Для ректального введения соединения согласно изобретению могут быть также объединены с наполнителями, такими, как масло какао,глицерин, желатин или полиэтиленгликоль, и сформированы в виде суппозиториев. Приведенные в настоящем описании соединения являются антагонистами рецептора витронектина и могут использоваться для лечения заболеваний, в патологии которых имеет значение взаимодействие лиганда или клетки с рецептором витронектина. Так, например, указанные соединения могут применяться для лечения заболеваний, патологическую картину которых создает потеря костного матрикса. Так,соединения согласно изобретению могут использоваться для лечения остеопороза, гипертиреоидита, болезни Пеже, гиперкальциемии при злокачественных новообразованиях, остеолитических поражениях, возникающих при метастазах кости, разрежении кости, связанной с иммобилизацией или недостатком половых гормонов. Как полагают, соединения согласно изобретению могут также найти применение в качестве противоопухолевого, антиангиогенного, противовоспалительного и антиметастатического средства, а также могут использоваться для лечения атеросклероза и рестеноза. 26 Соединение вводится пациенту либо перорально, либо парентерально, и таким способом,чтобы концентрация лекарственного средства была достаточна для ингибирования резорбции костной ткани или снимала иные такие показания. Фармацевтическая композиция, содержащая соединение, вводится в пероральной дозе примерно от 0,1 до приблизительно 50 мг/кг,способом, соответствующим состоянию пациента. Предпочтительно пероральная доза составляет примерно от 0,5 до приблизительно 20 мг/кг. В случае лечения острых состояний предпочтительно парентеральное введение. При этом наиболее эффективна внутривенная инфузия пептида в 5% декстрозе в воде или в физиологическом растворе или аналогичная композиция, включающая подходящие наполнители,однако, инъекция внутримышечного болюса также применима. В типичном случае парентеральная доза составляет примерно от 0,01 до приблизительно 100 мг/кг и предпочтительно находится в интервале от 0,1 до 20 мг/кг. Соединение вводится от одного до четырех раз в день в количестве, достаточном для достижения общей дневной дозы примерно от 0,4 до приблизительно 400 мг/кг день. Точный уровень и способ введения соединений может быть легко определен любым специалистом в данной области при сравнении уровня данного средства в крови с концентрацией, необходимой для достижения терапевтического эффекта. Настоящее изобретение, кроме того, относится к способу лечения остеопороза или ингибирования резорбции кости, который включает введение, постадийное или в физической комбинации, соединения формулы (I) и других ингибиторов резорбции кости, таких как бифосфонаты (например, алендронат), средства, применяемые при гормонозамещающей терапии, антиэстрогены или кальцитонин. Кроме того, настоящее изобретение относится к методу лечения, использующему соединения согласно изобретению и анаболический агент, такой как морфогенный костный белок, ипрофлавон, используемый для предотвращения резорбции кости и/или для увеличения массы костной ткани. Настоящее изобретение относится также к способу ингибирования роста опухоли, включающему введение, постадийное или в виде физической комбинации, соединения формулы (I) и антинеопластического агента. Соединения из класса аналогов камптотецина, такие как топотекан, иринотекан и 9-аминокамптотецин, а также координационные комплексы платины,такие как цисплатина, ормаплатина и тетраплатина, относятся к хорошо известным группам антинеопластических средств. Соединения из класса аналогов камптотецина описаны в патентах США 5004758, 4604463, 4473692,4545880, 4342776, 4513138, 4399276 и в публикациях заявок на европейский патентand Nitta, et al., Proc. 14th Internat. Congr. Chemotherapy., 1985, Anticancer Section I, 28), полное раскрытие указанных документов приводится в настоящем описании в качестве ссылки. Координационный комплекс платины, цисплатина, доступен под названием "Платинол" от корпорации Bristol Myers-Squibb Corporation. Композиция цисплатины, обладающая полезными свойствами, описана в патентах США 5562925 и 4310515, полное раскрытие каждого из которых приведено в настоящем описании в качестве ссылки. При использовании метода, ингибирующего рост опухоли, который включает введение,постадийное или в физической комбинации,соединения формулы (I) и антинеопластического агента, координационное соединение платины, например, цисплатина, может вводиться с помощью медленной внутривенной инфузии. Предпочтительным носителем в этом случае является декстроза/солевой раствор, содержащий маннит. Режим дозирования координационного соединения платины может составлять от примерно 1 до примерно 500 мг на квадратный метр (мг/м 2) площади поверхности тела на курс лечения. Инфузии координационного соединения платины могут проводиться от одного до двух раз в неделю, а еженедельный курс лечения может быть повторен несколько раз. В использовании соединения из класса аналогов камптотецина для парентерального введения в курсе терапии обычно применяют примерно от 0,1 примерно до 300,0 мг/м 2 на площадь поверхности тела в день в течение примерно пяти последовательных дней. Наиболее предпочтительно, чтобы при использовании в курсе лечения топотекана доза составляла примерно от 1,0 до примерно 2,0 мг/м 2 на площадь поверхности тела в день в течение пяти последовательных дней. Предпочтительно повторение курса терапии, по меньшей мере, один раз с интервалом примерно от 7 до примерно 28 дней. Фармацевтическая композиция может быть приготовлена при включении как соединения формулы (I), так и антинеопластического средства в один и тот же контейнер, однако,предпочтительно фасовать их в разные контейнеры. В том случае, когда оба средства имеют вид раствора, они могут входить в систему инфузии/инъекции для одновременного введения или для использования в режиме тандема. Для удобства введения соединения формулы (I) и антинеопластического средства, в одно и то же или в разное время, готовят набор,включающий в одном контейнере, таком как бокс, картонная коробка или другой контейнер,отдельные флаконы, пакеты, ампулы или другие контейнеры, каждый из которых содержит эффективное количество соединений формулы (I) 28 для парентерального введения в соответствии с приведенным описанием, а также эффективное количество антинеопластического средства для парентерального введения, как описано выше. Такой набор может включать в себя, например,как фармацевтические средства в отдельных контейнерах или в одном и том же контейнере,необязательно в виде лиофилизированного материала, так и контейнеры, содержащие растворы для восстановления. Один из вариантов такого набора может включать в себя раствор для восстановления и лиофилизированный материал в двух камерах одного и того же контейнера, в котором можно создать условия для перемешивания перед употреблением. При использовании такого режима антинеопластический агент и соединение согласно изобретению могут быть расфасованы отдельно в виде двух контейнеров или лиофилизированы вместе и в виде порошка введены в один контейнер. Если оба средства имеют вид раствора, они могут входить в состав системы для инфузий/инъекций для одновременного введения или для введения в режиме тандема. Так, например,соединение формулы (I) может находиться в форме, пригодной для внутривенного введения,или в виде баллонов для инфузий, связанных в систему с помощью трубок, при наличии антинеопластического агента во втором баллоне для инфузий. При использовании такой системы пациент может получать начальную инъекцию в виде болюса или инфузию соединения формулы(I) с последующей инфузией антинеопластического агента. С целью определения концентрации соединения, которая необходима для создания нужного фармакологического эффекта, соединения могут тестироваться с использованием одного из нескольких биологических методов исследования. Ингибирование связывания витронектина Твердофазное связывание [3H]-SKF107260 с v3:v3 из плаценты человека или из тромбоцитов человека (0,1-0,3 мг/мл) в буфере Т (содержащем 5 мМ CaCl2 и 1% октилглюкозида) разбавляют буфером Т, содержащим 1 мМCaCl2, 1 мМ MnCl2, 1 мМ MgCl2 (буфер А) и 0,05% NаN3, и затем сразу вносят в полученную смесь на 96-гнездные пластинки для ИФТФА(Corning, New York, NY) по 0,1 мл на каждую ячейку. К каждой ячейке добавляют 0,1-0,2 мкгv3. Пластинки инкубируют в течение ночи при 4 С. Ячейки промывают один раз буфером А и инкубируют с 0,1 мл 3,5% бычьего сывороточного альбумина в том же буфере в течение 1 ч при комнатной температуре. После инкубации содержимое ячеек полностью отсасывают и промывают с помощью 0,2 мл буфера А. Соединение растворяют в 100% ДМСО с получением 2 мМ основного раствора, который разбавляют буфером для связывания (15 мМ 29 Трис-НСl (рН 7,4), 100 мМ NaCl, 1 мМ CaCl2, 1 мМ MnCl2, 1 мМ MgCl2) до конечной концентрации соединения 100 мкМ. Указанный раствор затем разбавляют до нужной концентрации соединения. К ячейкам в тройном повторе добавляют различные концентрации немеченных антагонистов (0,001-100 мкМ) и затем добавляют 5,0 нМ [ЗH]-SKF-107260 (65-86 Кюри/ммоль). Пластинки инкубируют в течение 1 ч при комнатной температуре. После инкубации содержимое ячеек полностью отсасывают и промывают один раз 0,2 мл охлажденного на льду буфера А. Рецепторы солюбилизируют с помощью 0,1 мл 1% ДСН, и количество связанного[3H]-SKF-107260 определяют при добавлении 3 мл Ready Safe методом счета в жидком сцинтилляторе в сцинтилляционном счетчике Beckman LS с 40% эффективностью. Неспецифическое связывание [3H]-SKF-107260 определяют в присутствии 2 мкМ SKF-107260, которое постоянно составляло менее 1% от общего уровня меченого лиганда. Значение ИК 50 (которое представляет собой концентрацию антагониста, ингибирующую на 50% связывание [3 Н]SKF-107260) определяют с помощью нелинейной программы наименьших квадратов, которая представляет собой модификацию программы LUN-DON-2. Значение Ki (константы диссоциации антагониста) вычисляют по уравнению: Кi=ИК 50/(1+L/Kd), где L и Кd представляют собой, соответственно, концентрацию и константу диссоциации [3 Н]-SKF-107260. Соединения согласно изобретению ингибируют связывание витронектина с SKF107260 в диапазоне концентраций примерно от 4,0 примерно до 0,0003 микромолей. Соединения согласно изобретению также исследовали in vitro и in vivo с целью определения их влияния на резорбцию кости с использованием имеющихся стандартных тестов для оценки ингибирования костеобразования, таких как тест на образование вдавления, раскрытый в ЕР 528587, который может быть проведен с использованием вместо остеокластов человека остеокластов крыс на модели овариэктомированных крыс, описанной Вронским с соавт.(Wronski, et al., Cells and Materials 1991, Sup.1,69-74). Тест на основе оценки миграции клеток гладких мышц сосудов Используют клетки гладких мышц аорты крысы или человека. Клеточную миграцию отслеживают в камере для культуры клеток Transwell с использованием поликарбонатной мембраны с размером пор 8 мкМ (Costar). Нижнюю часть поверхности покрывают витронектином. Клетки, которые были предварительно обработаны исследуемым соединением в различных концентрациях в течение 20 мин при 20 С, суспендируют в концентрации 2,5-5,0106 клеток/мл в среде DMEM, в которую добавлено 30 0,2% бычьего сывороточного альбумина. В качестве контроля используют только растворитель. 0,2 мл клеточной суспензии помещают в верхний отсек камеры. Нижний отсек содержит 0,6 мл среды DMEM с добавлением 0,2% бычьего сывороточного альбумина. Инкубацию проводят при 37 С в атмосфере 95% воздуха/5% СO2 в течение 24 ч. После окончания инкубации оставшиеся на верхней поверхности фильтра не мигрировавшие клетки удаляют осторожным соскабливанием. Затем фильтр фиксируют в метаноле и окрашивают 10% красителем Гимза. Миграцию определяют либо путем а) подсчета количества клеток, которые мигрировали на нижнюю поверхность фильтра, либо b) при экстракции окрашенных клеток 10% уксусной кислотой с последующим определением поглощения при 600 нМ. Модель с использованием крыс без щитовидной и паращитовидной желез Каждая экспериментальная группа включает 5-6 взрослых самцов крыс линии SpragueDawley (с весом тела 250-400 г). У всех крыс были удалены щитовидная и паращитовидная железы (фирмой-поставщиком Taconic Farms) за 7 дней до эксперимента. Все крысы получали замещающую дозу тироксина каждые 3 дня. В цельной крови был определен уровень ионизированного кальция сразу же после отбора крови из хвостовой вены в пробирки с гепарином. Крыс включали в экспериментальную группу,если уровень ионизированного кальция (измеренного на анализаторе Ciba-Corning model 634calcium pH analyzer) был 1,2 мМ/л. Каждой крысе был введен постоянный венозный и артериальный катетер для доставки исследуемого материала и для отбора образцов крови, соответственно. Затем крыс переводят на бескальциевую диету и деионизированную воду. Измеряют базовый уровень кальция, и каждой крысе вводят либо контрольный носитель, либо 1-34 пептид гормона паращитовидной железы человека (hPTH1-34 в дозе 1,25 мкг/кг/ч в физрастворе/0,1% бычьего сывороточного альбумина,Bachem, Ca) или смесь hPTH1-34 и исследуемого материала путем постоянной внутривенной инфузии через венозный катетер с использованием внешнего шприцевого насоса. Реакцию каждой крысы на изменение уровня кальция в крови измеряют с двухчасовыми интервалами в течение периода инфузии, составляющего 6-8 ч. Метод определения резорбции остеокластов человека и тест на наличие адгезии Был разработан метод определения резорбции по развитию вдавления и тест на наличие адгезии, которые затем были стандартизованы с использованием нормальных остеокластов человека, полученных из ткани остеокластомы. Метод 1 был разработан для измерения величины вдавления остеокластов с применением лазерной конфокальной микроскопии. Метод 2 был разработан как более совершенный скри 31 нинг, в ходе которого уровень коллагеновых фрагментов (высвобождающихся при резорбции), измеряют с помощью конкурентного метода ELISA. Метод определения 1 (с использованием лазерной конфокальной микроскопии) Аликвоты клеточных суспензий из остеокластомы человека вынимают из жидкого азота,где они хранились, быстро нагревают до 37 С и промывают один раз средой RPMI-1640 при центрифугировании (100 об./мин, 5 мин при 4 С). Среду отсасывают и замещают ее мышиным антителом к HLA-DR и затем разбавляют в соотношении 1:3 средой RPMI-1640. Суспензию инкубируют в течение 30 мин на льду и часто перемешивают. Клетки промывают два раза холодной средой RPMI-1640 с последующим центрифугированием (1000 об./мин, 5 мин при 4 С), и затем клетки переносят в стерильную 15 мл центрифужную пробирку. Количество моноядерных клеток подсчитывают в усовершенствованной камере для счета Нейбауэра. Вынимают из флакона достаточное количество хранящихся в нем магнитных шариков(5/моноядерную клетку), которые покрыты антителами козы против IgG мыши (Dynal, Great(которая смывает с них токсичный консервант азид). Среду удаляют, иммобилизуя шарики на магните, и замещают ее свежей средой. Шарики перемешивают с клетками и суспензию инкубируют в течение 30 мин на льду. Суспензию часто перемешивают. Клетки, покрытые шариками, иммобилизуют на магните и оставшиеся клетки (фракцию,обогащенную остеокластами) декантируют в стерильную 50 мл центрифужную пробирку. К клеткам, покрытым шариками, добавляют свежую среду для удаления захваченных остеокластов. Указанный процесс промывки повторяют 10 раз. Клетки, покрытые шариками,отбрасывают. Количество жизнеспособных остеокластов подсчитывают в счетной камере с использованием флуоресцеиндиацетата для мечения живых клеток. Для внесения образца в камеру используют крупнокалиберную одноразовую пластиковую пастеровскую пипетку. Остеокласты собирают центрифугированием и плотность их доводят до нужного уровня средой ЕМЕМ (количество остеокластов варьирует от опухоли к опухоли), в которую добавлено 10% околоплодной сыворотки теленка и 1,7 г/л бикарбоната натрия. Аликвоты клеточной суспензии по 3 мл (на тестирование 1 соединения) декантируют в 15 мл центрифужную пробирку. Клетки собирают центрифугированием. К каждой пробирке добавляют 3 мл соответствующего исследуемого соединения (раз 002419 32 бавленного до 50 мкМ средой ЕМЕМ). В эксперимент включаются также контроли на носитель, положительный контроль (мышиное моноклональное антитело к рецептору витронектина [87 МЕМ 1], разбавленной до 100 мкг/мл) и изотипный контроль (IgG2a, разбавленный до 100 мкг/мл). Образцы инкубируют при 37 С в течение 30 мин. Аликвоты по 0,5 мл клеток высевают на стерильные срезы дентина в 48-луночном планшете и инкубируют при 37 С в течение 2 ч. Каждую обработку проводят в четырехкратном повторе. Срезы промывают теплым PBS, меняя его 6 раз (10 мл/лунку в 6-луночном планшете) и затем помещают в свежую среду, содержащую обрабатываемое соединение или контрольные образцы. Образцы инкубируют при 37 С в течение 48 ч. Процедура, основанная на определении устойчивости кислой фосфатазы к тартрату(TRAP) (селективное окрашивание клеток остеокластной линии) Срезы костей, содержащие прикрепленные остеокласты, промывают фосфатно-буферным раствором и фиксируют в 3% глютеральдегиде(в 0,2 М какодилате натрия) в течение 5 мин. Затем их промывают в воде и инкубируют 4 мин в TRAP-буфере при 37 С (0,5 мг/мл нафтол AS-BI фосфата растворяют в Nдиметилформамиде и смешивают с 0,25 М цитратным буфером (рН 4,5), содержащим 10 мМ тартрата натрия). После промывки в холодной воде срезы погружают в холодный ацетатный буфер (0,1 М,рН 6,2), содержащий 1 мг/мл фаст ред гарнета и инкубируют при 4 С в течение 4 мин. Отсасывают избыток буфера, и срезы высушивают на воздухе с последующей промывкой в воде. Количество TRAP-положительных остеокластов (кирпично-красный/фиолетовый осадок) подсчитывают в освещенном поле микроскопа и затем удаляют с поверхности дентина озвучиванием. Объем вдавления определяют с использованием конфокального микроскопаELISA) Фракцию остеокластов человека обогащают и подготавливают к скринингу соединений,как описано на начальных девяти стадиях метода определения 1. Для ясности эти стадии ниже повторены. Аликвоты клеточных суспензий из остеокластомы человека вынимают из жидкого азота,где они хранились, быстро нагревают до 37 С и промывают один раз средой RPMI-1640 при центрифугировании (100 об./мин, 5 мин при 4 С). Среду отсасывают и замещают ее мышиным антителом к HLA-DR и затем разбавляют в 33 соотношении 1:3 средой RPMI-1640. Суспензию инкубируют в течение 30 мин на льду и часто перемешивают. Клетки промывают два раза холодной средой RPMI-1640 с последующим центрифугированием (1000 об./мин, 5 мин при 4 С), и затем клетки переносят в стерильную 15 мл центрифужную пробирку. Количество моноядерных клеток подсчитывают в усовершенствованной камере Нейбауэра. Вынимают из флакона достаточное количество хранящихся в нем магнитных шариков(5/моноядерную клетку), которые покрыты козьими антителами против IgG мыши (Dynal,Great Neck, NY) и помещают их в 5 мл свежей среды (которая смывает с них токсичный консервант азид). Среду удаляют, иммобилизуя шарики на магните, и замещают ее свежей средой. Шарики перемешивают с клетками, и суспензию инкубируют в течение 30 мин на льду. Суспензию часто перемешивают. Клетки, покрытые шариками, иммобилизуют на магните, и оставшиеся клетки (фракцию, обогащенную остеокластами) декантируют в стерильную 50 мл центрифужную пробирку. К клеткам, покрытым шариками, добавляют свежую среду для удаления захваченных остеокластов. Указанный процесс промывки повторяют 10 раз. Клетки, покрытые шариками,отбрасывают. Количество жизнеспособных остеокластов подсчитывают в счетной камере с использованием флуоресцеиндиацетата для мечения живых клеток. Для внесения образца в камеру используют крупнокалиберную одноразовую пластиковую пастеровскую пипетку. Остеокласты собирают центрифугированием, и плотность их доводят до нужного уровня средой ЕМЕМ (количество остеокластов варьирует от опухоли к опухоли), в которую добавлено 10% околоплодной сыворотки теленка и 1,7 г/л бикарбоната натрия. В отличие от метода определения 1, скрининг соединений проводят в 4 дозах для получения значений ИК 50, в соответствии с приведенным ниже описанием. Препараты остеокластов преинкубируют в течение 30 мин при 37 С с исследуемым соединением (4 дозы) или с контролями. Затем их высевают на кортикальные срезы бычьей кости в лунки 48-луночного планшета для культуры тканей и инкубируют еще в течение 2 ч при 37 С. Костные срезы промывают теплым забуференным фосфатом физраствором (PBS), проводя шесть раз его замену для удаления не прилипших клеток, и затем возвращают их в лунки 48-луночного планшета, содержащие свежие соединения или контроли. 34 Планшет для культуры ткани инкубируют затем в течение 48 ч при 37 С. Из каждой лунки отсасывают супернатанты в отдельные пробирки и проводят скрининг методом конкурентного ELISA, что позволяет обнаружить с-телопептид коллагена типа I, который высвобождается в ходе процесса резорбции. Для определения используют коммерчески доступный набор для ELISA (Osteometer, Дания), содержащий антитело кролика, которое специфически реагирует с последовательностью из 8 аминокислот (Glu-Lys-Ala-His-Asp-Gly-GlyArg), присутствующей на карбокси-конце телопептида a1-цепи коллагена типа I. Полученные результаты выражают в виде процента ингибирования резорбции в сравнении с контролем,содержащим носитель. Метод определения адгезии остеокластов человека Обогащенную фракцию остеокластов человека подготавливают для скрининга соединений, как описано выше на начальных девяти стадиях метода исследования 1. Для ясности указанные стадии повторены ниже. Аликвоты клеточных суспензий из остеокластомы человека вынимают из жидкого азота,где они хранились, быстро нагревают до 37 С и промывают один раз средой RPMI-1640 при центрифугировании (100 об./мин, 5 мин при 4 С). Среду отсасывают и замещают ее мышиным антителом к HLA-DR и затем разбавляют в соотношении 1:3 средой RPMI-1640. Суспензию инкубируют в течение 30 мин на льду и часто перемешивают. Клетки промывают два раза холодной средой RPMI-1640 с последующим центрифугированием (1000 об./мин, 5 мин при 4 С), и затем клетки переносят в стерильную 15 мл центрифужную пробирку. Количество моноядерных клеток подсчитывают в усовершенствованной камере Нейбауэра для счета клеток. Вынимают из флакона достаточное количество хранящихся в нем магнитных шариков(5/моноядерную клетку), которые покрыты козьими антителами против IgG мыши (Dynal,Great Neсk, NY) и помещают их в 5 мл свежей среды (которая смывает с них токсичный консервант азид). Среду удаляют, иммобилизуя шарики на магните, и замещают ее свежей средой. Шарики перемешивают с клетками, и суспензию инкубируют в течение 30 мин на льду. Суспензию часто перемешивают. Клетки, покрытые шариками, иммобилизуют на магните и оставшиеся клетки (фракцию,обогащенную остеокластами) декантируют в стерильную 50 мл центрифужную пробирку. К клеткам, покрытым шариками, добавляют свежую среду для удаления каких-либо захваченных остеокластов. Указанный процесс 35 промывки повторяют 10 раз. Клетки, покрытые шариками, отбрасывают. Количество жизнеспособных остеокластов подсчитывают в счетной камере с использованием флуоресцеиндиацетата для мечения живых клеток. Для внесения образца в камеру используют крупнокалиберную одноразовую пластиковую пастеровскую пипетку. Остеокласты собирают центрифугированием и плотность их доводят до нужного уровня средой ЕМЕМ (количество остеокластов варьирует от опухоли к опухоли), в которую добавлено 10% околоплодной сыворотки теленка и 1,7 г/л бикарбоната натрия. В отличие от метода определения 1, скрининг соединений проводят в 4 дозах для получения значений ИК 50, в соответствии с приведенным ниже описанием. Остеокласты, происходящие из остеокластомы, преинкубируют с соединением (4 дозы) или с контролями при 37 С в течение 30 мин. Затем клетки высевают на срезы, покрытые остепонтином (остеопонтин человека или крысы, 2,5 мкг/мл) инкубируют в течение 2 ч при 37 С. Не прилипшие клетки удаляют энергичным промыванием срезов в фосфатно-буферном растворе и оставшиеся на срезах клетки фиксируют в ацетоне. Остеокласты окрашивают для определения кислой фосфатазы, устойчивой к тартрату(TRAP), который представляет собой селективный маркер клеток указанного фенотипа (см. стадии 15-17), и количество их подсчитывают в световом микроскопе. Полученные результаты выражают в виде процента ингибирования адгезии в сравнении с контролем, содержащим носитель. Метод определения адгезии клеток Клетки и клеточные культуры Эмбриональные клетки почки человека(клетки НЕК 293) получают из АТСС (каталожный номер CRL 1573). Клетки выращивают на минимальной среде Эрла (ЕМЕМ), содержащей соли Эрла, 10% околоплодной сыворотки теленка, 1% глютамина и 1% пенициллинастрептомицина. Конструкции и трансфекцииEcoRI-EcoRV клонируемые сайты pCDN вектора (Aiyar et al., 1994), который содержит промотор CMV и селективный маркер G418, отслеживаемый по лигированию тупых концов. Для стабильной экспрессии 80106 НЕК 293 клеток подвергают электротрансформации с использованием конструкций v+3 (20 мкг ДНК каждой субъединицы) с использованием Gene Pulser 36 ростовую среду добавляют 450 мкг/мл генетицина (G418 Sulfate, GIBCO-BRL, Bethesda, MD). Клетки поддерживают на селективной среде до того момента, пока колонии достаточно вырастут для их исследования. Иммунохимический анализ трансфицированных клеток Для того, чтобы определить, экспрессируют ли НЕК 293 трансфектанты рецептор витронектина, клетки иммобилизуют на микроскопическом стекле при центрифугировании, фиксируют в ацетоне в течение 2 мин при комнатной температуре и высушивают на воздухе. Специфичная реакционная способность в отношении моноклонального антитела, специфичного для комплекса v3-23 С 6, была продемонстрирована с использованием стандартного метода непрямой иммунофлюоресценции. Определение адгезии клеток На 96-луночный микротитрационный планшет Corning для ELISA предварительно вносят на ночь при 4 С по 0,1 мл витронектина человека (0,2 мкг/мл в среде RPMI). Для эксперимента планшет промывают один раз средойRPMI и блокируют 3,5% БСА в среде RPMI в течение 1 ч при комнатной температуре. Трансфицированные клетки 293 ресуспендируют в среде RPMI, в которую добавлены 20 мМ Нереs,рН 7,4 и 0,1% БСА с плотностью 0,5106 клеток/мл. К каждому гнезду добавляют 0,1 мл клеточной суспензии и инкубируют в течение 1 ч при 37 С, в присутствии или в отсутствие различных антагонистов v3. После инкубации добавляют 0,025 мл 10% раствора формальдегида, рН 7,4, и клетки фиксируют при комнатной температуре в течение 10 мин. Планшет промывают 3 раза по 0,2 мл среды RPMI и прилипшие клетки окрашивают 0,1 мл 0,5% толуидинового синего в течение 20 мин при комнатной температуре. Избыток красителя удаляют обильным промыванием деионизированной водой. Толуидиновый синий, включенный в клетки, элюируют при добавлении 0,1 мл 50% этанола, содержащего 50 мМ НСl. Уровень клеточной адгезии определяют количественно по оптической плотности при 600 нм на счетчике микротитрационного планшета (Titertek Multiskan MC, Sterling,VA). Твердофазный метод определения связывания с v5 Рецептор витронектина v5 получают из плаценты человека и очищают. Препарат рецептора разбавляют 50 мМ Трис-HCl, рН 7,5, 100 мМ NaCl, 1 мМ CaCl2, 1 мМ MnCl2, 1 мМ MgCl2(буфер А) и сразу же добавляют к 96-луночному планшету для проведения ELISA по 0,1 мл на каждую лунку. К каждой лунке добавляют 0,10,2 мкг v3. Плато инкубируют в течение ночи при 4 С. Для эксперимента гнезда промывают один раз буфером А и инкубируют с 0,1 мл 3,5% бычьего сывороточного альбумина в том же 37 буфере в течение 1 ч при комнатной температуре. После инкубации содержимое лунок полностью отсасывают и дважды промывают с помощью 0,2 мл буфера А. В конкурентном анализе с использованием[3 Н]-SKF-107260 к лункам добавляют различные концентрации немеченных антагонистов(0,001-100 мкМ), и затем вносят 5,0 нМ [3 Н]SKF-107260. Планшеты инкубируют в течение 1 ч при комнатной температуре. После инкубации содержимое лунок полностью отсасывают и промывают один раз от ячейки к ячейке с использованием 0,2 мл охлажденного на льду буфера А на каждую ячейку. Рецепторы солюбилизируют добавлением 0,1 мл 1% ДСН, и количество связанного [3 Н]-SKF-107260 определяют при добавлении 3 мл Ready Safe методом счета в жидком сцинтилляторе в сцинтилляционном счетчике Beckman LS 6800 с 40% эффективностью. Неспецифическое связывание [3H]SKF-107260 определяют в присутствии 2 мкМ[3 Н]-SKF-107260, которое постоянно составляло менее 1% от общего уровня меченого лиганда. Значение ИК 50 (которое представляет собой концентрацию антагониста, ингибирующую на 50% связывание [3 Н]-SKF-107260 определяют с помощью нелинейной программы наименьших квадратов, представляющих собой модификацию программы LUNDON-2. Значение Ki (константы диссоциации антагониста) вычисляют по уравнению Ченга-Прусова Кi=ИК 50/(1+L/Kd), где L и Кd представляют собой, соответственно, концентрацию и константу диссоциации [3 Н]-SKF-107260. Ингибирование опосредованногоRGD связывания GPIIb-IIIа Очистка GPIIb-IIIа 10 Единиц старых промытых тромбоцитов человека (полученных от Красного Креста) лизируют при осторожном перемешивании в среде, содержащей 3% октилглюкозида, 20 мМ Трис-HCl, рН 7,4, 140 мМ NaCl, 2 мМ CaCl2 при 4 С в течение 2 ч. Лизат центрифугируют при 100000 г в течение 1 ч. Полученный супернатант наносят на 5 мл колонку с лентиллектинсефарозой 4 В (Е.Y. Labs), уравновешенной буфером, содержащим 20 мМ Трис-HCl, рН 7,4,100 мМ NaCl, 2 мм CaCl2, 1% октилглюкозида(буфер А). После 2 ч инкубации колонку промывают 50 мл холодного буфера A. GPIIb-IIIa,удержанный лектином, элюируют буфером А,содержащим 10% декстрозы. Все процедуры выполняют при 4 С. Полученный GPIIb-IIIa характеризуется чистотой 95%, как было показано при анализе гель-электрофорезом в SDSполиакриламиде. Включение GPIIb-IIIа в липосомы Смесь фосфатидилсерина (70%) и фосфатидилхолина (30%) (полярные липиды Аванти) высушивают на стенках стеклянной пробирки в потоке азота. Очищенный GPIIb-IIIa разбавляют до конечной концентрации 0,5 мг/мл и смеши 002419 38 вают с фосфолипидами в соотношении белок: фосфолипид, равным 1:3 (объем:объем). Смесь ресуспендируют и озвучивают в бане для озвучивания в течение 5 мин. Затем смесь диализуют в течение ночи с использованием диализных трубок, рассчитанных на молекулярный вес 12000-14000, против 1000-кратного избытка среды, содержащей 50 мМ Трис-HCl, рН 7,4,100 мМ NaCl, 2 мМ CaCl2 (с двумя сменами среды). Липосомы, содержащие GPIIb-IIIa, центрифугируют при 12000 г в течение 15 мин и ресуспендируют в диализном буфере с конечной концентрацией белка примерно 1 мг/мл. Липосомы хранят при -70 С до надобности. Конкурентное связывание с GPIIb-IIIа Связывание рецептора фибриногена(GPIIb-IIIa) исследуют с помощью метода непрямого конкурентного связывания с использованием [3H]-SKF-107260 в качестве лигандаRGD-типа. Тест на связывание проводят в 96 луночных микротитрационных планшетах (Millipore Corporation, Bedford, MA) с использованием 0,22 мкм гидрофильных дюрапоровых мембран. Гнезда предварительно покрывают 0,2 мл полилизина в концентрации 10 мкг/мл (SigmaChemical Co., St. Louis, МО) при комнатной температуре в течение 1 ч для блокирования неспецифического связывания. Затем к гнездам(в четырехкратном повторе) добавляют различные концентрации немеченных бензазепинов. В каждое гнездо вносят [3H]-SKF-107260 до конечной концентрации 4,5 мМ, и затем добавляют 1 мкг очищенных липосом, содержащих тромбоцитарный GPIIb-IIIa. Смеси инкубируют в течение 1 ч при комнатной температуре.GPIIb-IIIa, связанный с [3H]-SKF-107260, отделяют от несвязанного многократным фильтрованием через миллипоровые фильтры с последующей промывкой их ледяным буфером (2 раза по 0,2 мл). Оставшаяся на фильтрах связанная радиоактивность подсчитывается с использованием 1,5 мл Ready Solve (Beckman Instruments, Fullerton, CA) на счетчике Beckman(Модель LS6800) в сцинтилляционной жидкости с 40% эффективностью. Неспецифическое связывание определяют в присутствии 2 мкМ [3H]SKF-107260, которое постоянно составляло менее 0,14% от общей радиоактивности, добавленной к образцам. Все указанные данные представляют собой среднее арифметическое значение четырех повторных определений. Данные по конкурентному связыванию анализируют с использованием нелинейного метода наименьших квадратов. Этот метод позволяет получить значение MK50 антагонистов(значение концентрации антагониста, которая ингибирует специфическое связывание [3 Н]SKF-107260 на 50% в состоянии равновесия). ИК 50 сазана с равновесной константой диссоциации (Ki) антагониста уравнением ЧенгаПрусова: Ki=ИK50/(1+L/Kd), где L означает концентрацию [3H]-SKF-107260, использованную 39 в тесте на конкурентное связывание (4,5 нМ), и Кd означает константу диссоциации [3H]-SKF107260, которая составляет 4,5 нМ, как было показано при анализе по методу Scatchard. Предпочтительные соединения согласно изобретению имеют отношение аффинности к рецептору витронектина к аффинности к рецептору фибриногена более чем 10:1. Наиболее предпочтительные соединения имеют коэффициент активности более чем 100:1. Эффективность соединений формулы (I),самих по себе или в комбинации с антинеопластическим агентом, может быть определена с использованием нескольких моделей трансплантируемых опухолей мышей. Для выяснения деталей указанных моделей см. патенты США 5004758 и 5633016. Приведенные ниже примеры никоим образом не ограничивают область настоящего изобретения, а даны лишь для иллюстрации того,как можно получить и использовать соединения согласно изобретению. Многие варианты реализации изобретения будут вполне очевидны для специалистов в данной области. Примеры Общие замечания Спектры ядерного магнитного резонанса 1H (ЯМР) записывают при 250 или 400 МГц. Химические сдвиги обозначают в частях на миллион (d) в сторону слабого поля относительно внутреннего стандарта тетраметилсилана(ТМС). Для записи показаний ЯМР используют следующие обозначения: с. - синглет, д. - дублет, т. - триплет, к. - квартет, м. - мультиплет,дд. - дублет дублетов, дт. - дублет триплетов,оч. - очевидный, ш. - широкий. J указывает константу связывания в спектрах ЯМР, измеренную в герцах, CDCl3 - обозначает дейтерохлороформ, ДМСО-d6 - обозначает гексадейтеродиметилсульфоксид и CD3OD - обозначает тетрадейтерометанол. Спектр инфракрасных лучей (ИК) записывают методом трансмиссии, положение полосы обозначают в величинах, обратных длинам волн (см-1). Масс-спектры определяют с использованием электронапыления (ES) или методом ионизации с применением бомбардировок ускоренными атомами (FAB). Элементный анализ проводят с использованием собственной методики или по методу QuantitativeTechnologies Inc., Whitehouse, NJ. Точки плавления определяют с использованием прибора для определения точек плавления Thomas-Hoover и не корректируют. Все значения температур приведены в градусах Цельсия. Для тонкослойной хроматографии используют пластины с тонким слоем силикагеля Analtech GF и силикагеля E.Merck 60 F-254. Флэш-хроматографию и гравитационную хроматографию проводят с использованием силикагеля E. Merck Kieselgel 60 (230400 меш). Аналитическую и препаративную ВЭЖХ проводят с использованием хроматографов Rainin или Beckman. ODS (ОДС) относится 40 к хроматографическому носителю, представляющему собой октадецилсилиловое производное силикагеля. Apex-ODS, 5 мкм означает хроматографический носитель на основе октадецилсилилового производного силикагеля,имеющий номинальный размер частиц в 5 мкм,который производится компанией Jones Chromatography, Littleton, Colorado. YMC ODS-AQ представляет собой хроматографический носитель на основе ОДС (ODS), который относится к изделиям с торговой маркой YMC Co. Ltd.,Kyoto, Japan. PRP-1 обозначает полимерныйCelite представляет собой фильтрующее устройство, включающее диатомовый кремнезем,промытый кислотой, который относится к изделиям с торговой маркой Manville Corp., Denver,Colorado. Способ получения 1. Получение метил 8-гидрокси-3-оксо-2,3,4,5-тетрагидро-1 Н-2 бензазепин-4-ацетата.a) 4-Бром-3-бромметиланизол. Смесь 2-бром-5-метокситолуола (20 г, 0,10 моль), N-бромсукцинимида (19,6 г, 0,11 моль),перекиси бензоила (1 г, 4 ммоль) и метиленхлорида (200 мл) облучают в течение 18 ч прожектором для создания щадящих условий нагревания с обратным холодильником. Затем смесь охлаждают до -10 С в течение нескольких часов и раствор декантируют от осажденного сукцинимида. Раствор концентрируют и остаток кристаллизуют из хлороформа/гексана с получением целевого соединения (10,7 г, 70%) в виде бледно-желтых призматических кристаллов: 1 Н ЯМР (СDСl3)7,45 (д., J=8,9 Гц, 1 Н), 6,99 (д.,J=3 Гц, 1 Н), 6,74 (дц., J=8,9, 3 Гц, 1 Н), 4,55 (с.,2 Н), 3,80 (с., 3 Н).b) 3-бис(трет-бутоксикарбонил)аминометил-4-броманизол. Смесь 4-бром-3-бромметиланизола (24 г,86 ммоль) и ди-трет-бутилиминодикарбоксилата калия (24 г, 94 ммоль) в диметилформамиде (200 мл) перемешивают в атмосфере аргона при комнатной температуре в течение 18 ч. Затем реакционную смесь концентрируют под вакуумом и остаток распределяют между этилацетатом и водой. Органическую фазу промывают водой и насыщенным солевым раствором,высушивают (MgSO4) и концентрируют. Остаток повторно кристаллизуют из гексана с получением целевого соединения (15 г, 42%) в виде белого твердого вещества: 1H ЯМР (CDCl3)7,40 (д., J=8,6 Гц, 1 Н), 6,68 (м., 2 Н), 4,81 (с., 2 Н),3,74 (с., 3 Н), 1,44 (с., 18 Н).(150 мл). Через смесь пропускают аргон (несколько циклов наполнения аргоном/удаления) и затем нагревают ее до температуры кипения с обратным холодильником в атмосфере аргона в течение 1 ч. Затем реакционную смесь охлаждают до комнатной температуры (КТ) и вливают в охлажденный льдом этиловый эфир (500 мл). Полученный осадок удаляют фильтрованием, а фильтрат концентрируют. Остаток очищают хроматографией на силикагеле (10-20% этилацетат в гексане) с получением целевого соединения (11,8 г, 66%) в виде бледно-желтого масла: 1H ЯМР (СDСl3)7,94 (с., 1 Н), 7,15 (д., J=8,1 Гц, 1 Н), 6,77 (д., J=8,1 Гц, 1 Н), 6,76 (с., 1 Н), 4,73(трет-бутоксикарбонил)аминометил-4-метоксифенил]бутаноат. В колбу под давлением вводят метил -3 карбометокси-4-[2-бис(трет-бутоксикарбонил) аминометил-4-метоксифенил]-3-бутеноат (11,8 г), этилацетат (120 мл) и 10% палладий на угле(1 г), перемешивают в течение 18 ч под давлением водорода 45 фунт/кв.дюйм (255101 Па). Затем смесь фильтруют и фильтрат концентрируют с получением целевого соединения (12 г,100%) в виде бесцветного масла: 1H ЯМР(100 мл) и трифторуксусной кислоте (50 мл) перемешивают в атмосфере аргона при комнатной температуре в течение 4 ч. Затем раствор концентрируют под вакуумом с получением целевого соединения (10 г, 100%) в виде вязкого масла: MS (ES) m/e 296,2 (М+Н)+.f) Метил -8-метокси-3-оксо-2,3,4,5 тетрагидро-1 Н-2-бензазепин-4-ацетат. Раствор метил -3-карбометокси-4-[(2 аминометил)-4-метоксифенил]бутаноата (10 г,24 ммоль) и триэтиламина (17 мл, 120 ммоль) в толуоле (100 мл) нагревают при температуре кипения с обратным холодильником в течение 18 ч. Затем реакционную смесь концентрируют и остаток распределяют между этилацетатом и водой. Водный слой экстрагируют дважды этилацетатом и объединенные органические экстракты промывают насыщенным солевым раствором, высушивают (MgSO4) и концентрируют с получением целевого соединения (4,8 г, 002419g) Метил -8-гидрокси-3-оксо-2,3,4,5 тетрагидро-1 Н-2-бензазепин-4-ацетат. Безводный хлорид алюминия (7,6 г, 57 ммоль) добавляют порциями к перемешанному раствору метил -8-метокси-3-оксо-2,3,4,5 тетрагидро-1 Н-2-бензазепин-4-ацетата (3,0 г, 11 ммоль) и этантиола (4,2 мл, 57 ммоль) в метиленхлориде (100 мл) при 0 С в атмосфере аргона. Полученной смеси позволяют нагреться до комнатной температуры и перемешивают ее в течение ночи и затем концентрируют. Остаток растирают с ледяной водой и полученное после фильтрования твердое вещество высушивают,что дает целевое соединение (2,64 г, 91%) в виде желтовато-белого твердого вещества: MS (ES)(280 л) при комнатной температуре. Через 2,5 ч реакционную смесь концентрируют и остаток распределяют между Et2O (560 мл) и 1,0N NaOH(100 мл). Слои разделяют и органический слой высушивают (МgSO4) и концентрируют с получением желтого масла: ТСХ (5% МеОН/СНСl3)Rf - 0,32. Масло растворяют в СНСl3 (280 мл) и добавляют ди-трет-бутилдикарбонат (1,29 г, 56,29 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 45 мин и затем концентрируют. Хроматография на силикагеле (5% EtOAc/толуол) дает целевое соединение (16,81 г, 90%) в виде светло-желтого масла: ТСХ (5% EtOAc/толуол) Rf - 0,43; 1 Н ЯМР (400,CDCl3) смесь ротамеров;7,42 (д., J=8,7 Гц,1 Н), 6,65-6,80 (м., 2 Н), 4,40-4,55 (м., 2 Н), 3,77(75 мл) нагревают при температуре кипения с обратным холодильником в течение 45 мин,затем концентрируют на роторном испарителе. Остаток разбавляют Et2O (150 мл) и смесь фильтруют через целит (celite) с целью удаления нерастворимого материала. Фильтрат концентрируют и остаток вновь концентрируют из ксилолов. Хроматография на силикагеле (гради 43 ент: 20% EtOAc/гексаны, затем 1:1 EtOAc/ гексаны) позволяет удалить фосфиновые и основные материалы; все другие материалы со значением Rf - 0,40-0,70 собирают и концентрируют с получением мутного желтого масла: ТСХ (30% EtOAc/гексаны) Rf - 0,41 (основная масса продукта). Масло растворяют в МеОН (75 мл) и осторожно добавляют 10% Pd/C. Смесь встряхивают в атмосфере водорода (50 фунт/кв.дюйм(283446 в течение 2,5 ч и затем фильтруют через целит (celite) для удаления катализатора. Фильтрат концентрируют и остаток вновь помещают в условия реакции. Еще через 2,5 ч смесь фильтруют через целит (celite) для удаления катализатора и фильтрат концентрируют с получением светло-желтого масла. Его вновь концентрируют из СНСl3/гексанов, затем хроматографируют на силикагель (градиент: 20%EtOAc/гексаны, затем 1:1 EtOAc/гексаны) с получением целевого соединения (4,53 г, 74%) в виде светло-желтого масла: ТСХ (30%c) Метил -3-карбометокси-4-[2-(метиламино)метил-4-метоксифенил]бутаноат. ТФУ (55 мл) добавляют сразу в виде одной порции к раствору метил -3-карбометокси-4[2-[N-(трет-бутоксикарбонил)-N-метиламино] метил-4-метоксифенил]бутаноата (4,53 г, 11,06 ммоль) в безводном CH2Cl2 (55 мл) при 0 С и реакционную смесь нагревают до комнатной температуры. Через 1 ч реакционную смесь концентрируют и остаток повторно концентрируют из толуола (2100 мл) с получением целевого соединения (11,06 ммоль, количественно) в виде светло-желтого масла: MS (ES) m/e 310 (М+Н)+.(11,06 ммоль) и диизопропилэтиламина (5,8 мл,33,18 ммоль) в толуоле (110 мл) нагревают при температуре кипения с обратным холодильником в течение 25 ч, перемешивают при комнатной температуре в течение 4 дней и затем нагревают при температуре кипения с обратным холодильником еще в течение 24 ч. Концентрирование и последующая хроматография на силикагеле (5% МеОН в ЕtOАс/СНСl3, 1:1) дают целевое соединение (2,88 г, 94%) в виде светложелтого твердого вещества: ТСХ (5% МеОН в 1:1 EtOAc/CHCl3) Rf - 0,63; 1H ЯМР (250, СDСl3)7,02 (д., J=8,4 Гц, 1H), 6,78 (дд., J=8,4, 2,7 Гц,1H), 6,63 (д., J=2,7 Гц, 1H), 5,29 (д., J=16,3 Гц,1H), 3,50-3,90 (м., 2 Н), 3,79 (с., 3 Н), 3,71 (с., 3 Н), 002419(М+Н)+. е) Метил -8-гидрокси-2-метил-3-оксо 2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетат. Безводный хлорид алюминия (1,35 г, 10,15 ммоль) добавляют сразу в виде одной порции к раствору метил -8-метокси-2-метил-3-оксо 2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетата(562 мг, 2,03 ммоль) и этантиола (0,75 мл, 10,15 ммоль) в безводном СН 2 Сl2 (20 мл) при 0 С в атмосфере аргона. Смесь нагревают до комнатной температуры и перемешивают в течение 4,5 ч и затем снова охлаждают до 0 С. Добавляют ледяную H2O (20 мл) и смесь энергично перемешивают в течение 5 мин и затем экстрагируют СНСl3 (320 мл). Объединенные СНСl3 слои высушивают (МgSO4) и концентрируют с получением остатка. Водный слой фильтруют под разрежением с получением твердого осадка. Указанный осадок и остаток, полученный в СНСl3 слое, объединяют в МеОН/СНСl3 (1:1) и концентрируют этот раствор с получением желтовато-белого твердого вещества. Указанное вещество растирают с горячим МеОН и затем смесь охлаждают до комнатной температуры. Твердое вещество собирают фильтрованием под разрежением и промывают последовательно холодным МеОН и Et2O. Высушивание под глубоким вакуумом при 40 С дает целевое соединение (467,9 мг, 88%) в виде бесцветного твердого вещества: ТСХ (5% МеОН/СНСl3) Rf - 0,17; 1MS (ES) m/e 286 (М+Na)+, 264 (М+Н)+. Способ получения 3. Получение 2-[(3 гидрокси-1-пропил)амино]пиридин-N-оксида. а) 2-[(3-Гидрокси-1-пропил)амино]пиридин-N-оксид. Смесь 2-хлорпиридин-N-оксида (16,6 г, 0,1 моль), 3-амино-1-пропанола (15,3 мл, 0,2 моль),NaHCO3 (42 г, 0,5 моль) и трет-амилового спирта (100 мл) нагревают до температуры кипения с обратным холодильником. Через 21 ч реакционную смесь охлаждают, разбавляют CH2Cl2 (300 мл) и фильтруют под разрежением для удаления нерастворимого материала. Фильтрат концентрируют и повторно концентрируют из толуола с получением желтого масла. Хроматография на силикагеле (20% MeOH/CHCl3) приводит к получению целевого соединения (15,62 г, 93%) в виде желтого твердого вещества: ТСХ (20% 45 Способ получения 4. Получение 2-[(3 гидрокси-1-пропил)амино]-4-нитропиридин-Nоксида. а) 2-[(3-Гидрокси-1-пропил)амино]-4 нитропиридин-N-оксид. В соответствии с процедурой способа получения 3, за исключением того, что проводится замена 2-xлopпиpидин-N-oкcидa гидрохлорида на 2-хлор-4-нитропиридин-N-оксид (см. Jain,P.С.; Chatterjee, S.K.; Anand, N. Indian Journal ofChemistry 1966, 403), получают целевое соединение в виде оранжевого твердого вещества: MS(ES) m/e 214,2 (M+H)+. Способ получения 5. Получение 2-[(3 гидрокси-1-пропил)амино]-4-метоксипиридинN-оксида. а) 2-[(3-Гидрокси-1-пропил)амино]-4 метоксипиридин-N-оксид. Раствор 2-[(3-гидрокси-1-пропил)амино]-4 нитропиридин-N-оксида (0,275 г, 1 ммоль) и 0,5 М NaOMe в МеОН (16 мл, 8 ммоль) нагревают при температуре кипения с обратным холодильником в атмосфере аргона в течение 3 ч. Затем реакционную смесь охлаждают и добавляют ледяную АсОН (0,5 мл, 8 ммоль). Раствор концентрируют досуха и остаток растирают сCH2Cl2. Нерастворимый материал удаляют фильтрованием, и фильтрат концентрируют. Хроматография на силикагелеMeOH/CH2Cl2) дает целевое соединение (0,23 г,90%) в виде бесцветного масла: MS (ES) m/e 199,0 (М+Н)+. Способ получения 6. Получение -8 гидрокси-3-оксо-2-(2,2,2-трифторэтил)-2,3,4,5 тетрагидро-1 Н-2-бензазепин-4-ацетата.a) 3-[N-(трет-Бутоксикарбонил)-N-(2,2,2 трифторэтил)амино]метил-4-броманизол. 2,2,2-Трифторэтиламин (4,9 мл, 62,5 ммоль) быстро добавляют к раствору 4-бром-3 бромметиланизола (7,00 г, 25 ммоль) в безводном ДМСО (25 мл) при комнатной температуре. Реакционную смесь нагревают примерно до 3035 С. Через 2 ч реакционную смесь разбавляют охлажденным на льду 0,5N NaOH (100 мл) и проводят экстракцию с применением Et2O (3100 мл). Объединенные Et2O слои промывают последовательно H2O (225 мл) и насыщенным солевым раствором (25 мл), высушивают(MgSО 4) и концентрируют с получением светложелтого масла: ТСХ (толуол) Rf - 0,43. Масло растворяют в безводном CH2Cl2 (48 мл) в круглодонной колбе и добавляют ди-третбутилдикарбонат (10,48 г, 48,04 ммоль). Колбу,содержащую реакционный раствор, помещают в роторный испаритель и проводят испарение под вакуумом при 50 С в течение 16 ч. Полученный остаток разбавляют гексанами (100 мл) и в раствор вносят в качестве затравки небольшое количество чистого твердого вещества (полученного в предыдущем эксперименте при хроматографии на силикагеле с использованием в каче 002419 46 стве элюента 10% EtOAc/гексанов). Смесь выдерживают при комнатной температуре в течение нескольких часов и затем помещают в холодильник на ночь. Продукт собирают фильтрованием под разрежением и промывают гексанами. Высушивание под вакуумом дает целевое соединение (7,19 г, 75%) в виде бесцветного твердого вещества. Маточный раствор концентрируют и хроматографируют на силикагеле (10%EtOAc/гексаны) с получением дополнительного количества целевого соединения (1,42 г; всего 8,61 г, 90%); ТСХ (10% EtOAc/толуол) Rf - 0,48; Т.пл. 86-89 С; 1H ЯМР (250, CDCl3)7,44 (д.,J=9, 0 Гц, 1 Н), 6,64-6,82 (м., 2 Н), 4,52-4,70 (м.,2 Н), 3,61-4,00 (м., 2 Н), 3,77 (с., 3 Н), 1,22-1,68(9,17 г, 23,03 ммоль), диметилитаконата (4,73 г,29,94 ммоль), ацетата палладия (259 мг, 1,15 ммоль) три-о-толилфосфина (701 мг, 2,30 моль) и диизопропилэтиламина (8,0 мл, 46,06 ммоль) в пропионитриле (115 мл) дезоксигенерируют (3 цикла наполнения аргоном/удаления) и затем нагревают до температуры кипения с обратным холодильником в атмосфере аргона. Через 2 ч реакционную смесь концентрируют и повторно концентрируют из толуола. Хроматография на силикагеле (30% EtOAc/гексаны, образец вводят в CH2Cl2) удаляет фосфиновые и основные материалы; все другие материалы со значением Rf- 0,55-0,70 собирают и концентрируют с получением желтого масла. Указанное масло смывают с помощью 20% EtOAc/гексанов (200 мл) и полученную смесь выдерживают при комнатной температуре в течение 1 ч и затем в течение ночи в холодильнике. Смесь фильтруют с удалением желтого осадка и фильтрат концентрируют с получением 9,93 г (91%) желтого масла: ТСХ(30% EtOAc/гексаны) Rf - 0,55 (основная масса продукта). Масло растворяют в EtOAc (100 мл) и добавляют 10% Pd/C (44,4 г, 4,18 ммоль). Смесь перемешивают в атмосфере водорода (50 фунт/кв.дюйм (283446 Па в течение 3,5 ч и затем фильтруют ее через целит (celite ) для удаления катализатора. Фильтрат концентрируют и остаток хроматографируют на силикагеле(градиент: 20% EtOAc/гексаны) с получением целевого соединения (7,98 г, 73% для двух стадий) в виде бесцветного масла: ТСХ (20%c) Метил -3-карбометокси-4-[2-(2,2,2 трифторэтиламино)метил-4-метоксифенил] бутаноат. ТФУ (55 мл) добавляют сразу в виде одной порции к раствору метил -3-карбометокси-4[2-[N-(трет-бутоксикарбонил)-N-(2,2,2-трифторэтил)амино]метил-4-метоксифенил]бутаноата(7,98 г, 16,71 ммоль) в безводном CH2Cl2 (42 мл) при 0 С в атмосфере аргона, и затем реакционную смесь нагревают до комнатной температуры. Через 1,5 ч реакционную смесь концентрируют и остаток повторно концентрируют из ксилолов. Высушивание под высоким вакуумом при 40 С дает целевое соединение (8,70 г, количественно) в виде желтого твердого вещества:(9,5 мл, 50,13 ммоль) и ксилолов (170 мл) нагревают при температуре кипения с обратным холодильником. Через 63 ч реакционную смесь концентрируют и остаток хроматографируют на кремнеземе (2:1, EtOAc/гексаны, загрузка в(M+Na)+, 346 (М+Н)+. е) Метил -8-гидрокси-2-метил-3-оксо 2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетат. Раствор ВВr3 в CH2Cl2 (1,0 М, 60 мл, 60 ммоль) добавляют по каплям в течение 30 мин к раствору метил -8-метокси-3-оксо-2-(2,2,2 трифторэтил)-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетата (5,16 г, 14,94 ммоль) в безводномCH2Cl2 (60 мл) при температуре от -5 до -10 С в атмосфере аргона. После еще 1 ч выдерживания при температуре от -5 до -10 С реакционную смесь вновь тщательно охлаждают до -10 С и гасят реакцию добавлением по каплям МеОН(60 мл). Реакционную смесь перемешивают при температуре от -10 до 0 С в течение 1 ч и затем концентрируют на роторном испарителе. Остаток повторно концентрируют из МеОН (2 х) и затем из EtOAc, после чего фильтруют через прокладку силикагеля (элюент EtOAc). Концентрирование фильтрата дает желтое твердое вещество, которое растирают с горячими гексанами. Целевое соединение (4,74 г, 96%) получают в виде желтовато-белого твердого вещества: ТСХ (EtOAc/гексаны, 1:1) Rf - 0,40; 1H ЯМР(дд., J=17,0, 14 Гц, 1H), 2,49 (дд., J=16,7, 5,0 Гц,1H, частично погашен сигналом остатка растворителя); MS (ES) m/e 354 (M+Na)+. Способ получения 7. Разделение энантиомеров метил-8-гидрокси-3-оксо-2,3,4,5 тетрагидро-1 Н-2-бензазепин-4-ацетат разрешают на энантиомеры с помощью хиральной ВЭЖХ с использованием следующих условий: колонка Diacel Chiralpak AS (21,2250 мм),подвижная фаза - EtOH, скорость течения - 7 мл/мин, УФ обнаружение проводят при 254 нм,инъецируемое количество - 70 мг; tR для метил-8-метокси-3-оксо-2,3,4,5 тетрагидро-1 Н-2-бензазепин-4-ацетат разрешают на энантиомеры с помощью хиральной ВЭЖХ с использованием следующих условий: колонка Diacel Chiralpak AS (21,2250 мм),подвижная фаза - СН 3 СN, скорость течения - 15 мл/мин, УФ обнаружение проводят при 254 нм,инъецируемое количество - 500 мг; tR для метил(15,0 г, 0,057 моль) в СНСl3 (160 мл) добавляют по каплям в течение 30 мин к раствору трибромида бора (20,53 мл, 0,217 моль) в СНСl3 (160 мл) при -8 С в атмосфере аргона, поддерживая 49 температуру в диапазоне от -5 до 0 С. Реакционную смесь перемешивают при температуре примерно -8 С в течение 30 мин и затем добавляют МеОН (200 мл), вначале по каплям, поддерживая температуру примерно на уровне 0 С. Реакционную смесь концентрируют с получением вязкого масла, которое повторно концентрируют из МеОН (100 мл). Масло растворяют в Н 2 О/МеОН и небольшое количество образовавшегося темного твердого вещества удаляют фильтрованием. Фильтрат нейтрализуют (до рН 7) с помощью 50% гидроксида натрия, который осаждается в виде белого твердого вещества. рН суспензии доводят до значения 4,5 добавлением небольшого количества уксусной кислоты и собирают твердое вещество, которое высушивают под вакуумом с получением целевого соединения (9,7 г, 68%). Продукт анализируют на хиральную чистоту с применением ВЭЖХ: колонка Chiralpak AS (4,650 мм), подвижная фаза - 100% EtOH, скорость течения - 0,5 мл/мин, УФ обнаружение проводят при 215 нм,tR составляет 7,5 мин (S-энантиомер, 99%); и tR составляет 4,4 мин (R-энантиомер, 1%). Способ получения 10. Получение 2-[(3 гидрокси-1-пропил)амино]-4,6-диметилпиридин-N-оксида. а) 2-[(3-Гидрокси-1-пропил)амино]-4,6 диметилпиридин-N-оксид. В соответствии с процедурой способа получения 4, но с заменой 2-хлорпиридин-Nоксида гидрохлорида на 2-хлор-4,6-диметилпиридин-N-оксид (см. Brown, E.V.J. Amer.Chem. Soc. 1957, 79, 3565), получают целевое соединение в виде прозрачного масла: MS (ES)a) 2-(трет-Бутоксикарбониламино)-6 пиколин. К перемешанному раствору 2-амино-6 пиколина (4,33 г, 40 ммоль), Et3N (6,2 мл, 40 ммоль) и CH2Cl2 (50 мл) при 0 С добавляют дитрет-бутилдикарбонат (9,6 г, 44 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь концентрируют под вакуумом, разбавляют Н 2 О и экстрагируют CH2Cl2 (250 мл). Высушивание (MgSО 4) и концентрирование дают целевое соединение в виде бесцветного масла: MS (ES) m/e 209b) 2-[(трет-Бутоксикарбонил)метиламино]6-пиколин. К суспензии NaH (60% дисперсия в минеральном масле, 0,44 г, 11 ммоль) в ДМФ (20 мл) при 0 С добавляют раствор 2-(третбутоксикарбониламино)-6-пиколина (2,1 г, 10 ммоль) в ДМФ (30 мл). Реакционную смесь перемешивают при 0 С в течение 15 мин, и затем добавляют метилиодид (1,6 г, 11 ммоль). Реакционную смесь концентрируют под вакуумом, 002419 50 разбавляют Н 2 О и экстрагируют CH2Cl2 (350 мл). Высушивание (MgSО 4) и концентрирование дают целевое соединение в виде бесцветного масла: MS (ES) m/e 223 (М+Н)+.c) Этил-6-[(трет-бутоксикарбонил)метиламино]-2-пиридилацетат. Готовят LDA (18 ммоль) в ТГФ (30 мл),охлаждают до -78 С и добавляют 2-[(третбутоксикарбонил)метиламино]-6-пиколин (2 г, 9 ммоль), что приводит к образованию темнокрасного раствора. Через 15 мин добавляют диэтилкарбонат (18 мл, 15 ммоль). Раствор цвета красного бургундского вина перемешивают при-78 С в течение еще 15 мин и затем реакцию гасят добавлением насыщенного раствоpaNH4Cl. Смесь нагревают до комнатной температуры и экстрагируют EtOAc (330 мл). Объединенные органические слои промывают насыщенным солевым раствором, высушивают(MgSO4), фильтруют и концентрируют. Хроматография на силикагеле дает целевое соединение в виде бесцветного масла: MS (ES) m/e 294d) Этил-6-(метиламино)-2-пиридилацетат. Раствор этил-6-[(трет-бутоксикарбонил) метиламино]-2-пиридилацетата (0,6 г, 2 ммоль) и 4 М HCl/диоксана (5 мл, 20 ммоль) перемешивают при комнатной температуре в течение ночи и затем концентрируют. Повторная концентрация из толуола дает целевое соединение в виде белого твердого вещества: MS (ES) m/e 195LiАlH4 в ТГФ (1,0 М, 20 мл, 20,4 ммоль) добавляют по каплям раствор этил-2-(метиламино)-6 пиридилацетата (0,38 г, 2 ммоль) в ТГФ (10 мл). После завершения добавления реакционную смесь нагревают до 0 С и реакцию гасят добавлением 10% раствора NaOH. Твердые вещества удаляют фильтрованием и фильтрат концентрируют под вакуумом. Остаток растворяют в СН 2 Сl2 и раствор высушивают (MgSO4) и концентрируют. Повторная концентрация из толуола (3 х) дает целевое соединение в виде бесцветного масла: MS (ES) m/e 153 (M+H)+. Способ получения 12. Получение 3-[(третбутоксикарбонил)амино]-1-пропанола. а) 3-[(трет-Бутоксикарбонил)амино]-1 пропанол. Раствор ди-трет-бутилдикарбоната (10,91 г, 50 ммоль) в СН 2 Сl2 (50 мл) добавляют по каплям к раствору 3-амино-1-пропанола (11,5 мл,150 мл) в CHCl2 (250 мл) при 0 С. Мутный раствор нагревают до комнатной температуры и перемешивают в течение 1 ч и затем концентрируют на роторном испарителе. Остаток смывают H2O (100 мл) и экстрагируют с применениемEt2O (3100 мл). Высушивание (МgSO4) и концентрирование дают целевое соединение в виде бесцветного масла: 1H ЯМР (250 МГц, СDСl3) 51 4,80 (шc., 1H), 3,50-3,80 (м., 2 Н), 3,13-3,42 (м.,2 Н), 3,03 (шт., 1H), 1,55-1,80 (м., 2 Н), 1,45 (с.,9 Н); MS (ES) m/e 198 (М+Na)+. Способ получения 13. Получение 3-(4 нитробензилоксикарбониламино)-1-пропанола. а) 3-(4-Нитробензилоксикарбониламино)1-пропанол. К раствору 3-амино-1-пропанола (0,77 г,1,1 ммоль) и триэтиламина (2,85 мл, 7 ммоль) в ТГФ (5 мл), перемешанному в атмосфере аргона при комнатной температуре, добавляют суспензию 4-нитробензилхлорформиата (2 г, 1 ммоль) в ТГФ (20 мл). Полученную смесь перемешивают при комнатной температуре в течение недели и затем концентрируют. Остаток очищают хроматографией на силикагелеMeOH/CH2Cl2), что дает целевое соединениеa) 2-[N-(3-Гидрокси-1-пропил)-N-(третбутоксикарбонил)амино]пиридин-N-оксид. Раствор 2-[(3-гидрокси-1-пропил)амино] пиридин-N-оксида (8,0 г, 47,6 ммоль) в третВuОН (80 мл) обрабатывают ди-третбутилдикарбонатом (11,4 г, 55,3 ммоль). Через 18 ч раствор концентрируют и остаток растирают с гексаном. Полученное твердое вещество высушивают под вакуумом, что дает целевое соединение (12,5 г, 98%) в виде желтоватобелого твердого вещества: MS (ES) m/e 269,3-8-[3-[N-(1-оксопиридин-2-ил)-N-(третбутоксикарбонил)амино]-1-пропилокси]-3-оксо 2,3,4,5-тетрагидро-1H-2-бензазепин-4-ацетата. а) Метил -8-[3-[N-(1-оксопиридин-2 ил)-N-(трет-бутоксикарбонил)амино]-1-пропилокси]-3-оксо-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-уксусная кислота. В соответствии с процедурой примера 1(а),за исключением того, что проводят замену 2-[(3 гидрокси-1-пропил)амино]пиридин-N-оксида на 2-[N-(3-гидрокси-1-пропил)-N-(трет-бутоксикарбонил)амино]пиридин-N-оксид,получают целевое соединение в виде светло-оранжевой пены: MS (ES) m/e 500,4 (М+Н)+. Способ получения 16. Получение 2-[(3 гидрокси-1-пропил)амино]-4-метилпиридин-Nоксида. Смесь 2-хлор-4-метилпиридин-N-оксидаSoc. 1957, 79, 3565), 3-амино-1-пропанола (10,33 мл, 0,14 моль), NаНСО 3 (28 г, 0,34 моль) и третамилового спирта (70 мл) нагревают до температуры кипения с обратным холодильником. Через 16 ч реакционную смесь охлаждают, разбавляют CH2Cl2 (300 мл) и фильтруют под разрежением для удаления нерастворимого материала. Фильтрат концентрируют и повторно 52 концентрируют из толуола с получением желтого масла. Повторная кристаллизация изCH2Cl2/Et2O дает целевое соединение (10,87 г,88%) в виде желтого твердого вещества: ТСХ(S)-8-гидрокси-3-оксо-2-[4-(трифторметил) бензил]-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4 ацетата через алкилирование метил (S)-8 гидрокси-3-оксо-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетата.(0,31 г, 1,24 ммоль) и 4-(трифторметил) бензилбромида (0,89 г, 3,72 ммоль) в ДМФ (10 мл) добавляют NaH (60% суспензия в масле,0,11 г, 2,75 ммоль). После перемешивания при комнатной температуре в течение 4 ч весь ДМФ удаляют под вакуумом. Остаток распределяют между насыщенным NаНСО 3 и EtOAc. Водную фазу экстрагируют EtOAc и объединенные органические экстракты промывают насыщеннымNaCl, высушивают над Na2SO4 и концентрируют с получением прозрачного масла (0,90 г). Радиальная хроматография (5% ацетон/СН 2 Сl2,силикагель, пластинка 6 м) дает целевое соединение (0,53 г) в виде белой пены: MS (ES) m/e 566,1 (M+H)+.(S)-8-гидрокси-3-оксо-2-[4(трифторметил)бензил]-2,3,4,5-тетрагидро-1 Н-2 бензазепин-4-ацетат. В колбу для гидрогенизации Парра вносят метил(S)-3-оксо-8-[4-(трифторметил)бензилокси]-2-[4-(трифторметил)бензил]-2,3,4,5 тетрагидро-1 Н-2-бензазепин-4-ацетат (0,78 г,1,38 ммоль) и катализатор Перлмана (20 мг) в МеОН (20 мл). После гидрогенизации под давлением 50 фунт/кв.дюйм (283446 Па) в течение 24 ч из реакционного сосуда удаляют газ вентилированием, а катализатор удаляют фильтрованием. После удаления растворителя получают белую пену (0,60 г). Радиальная хроматография(5% ацетон/СН 2 Сl2, силикагель, пластинка 6 м) дают целевое соединение (0,42 г) в виде белой пены: 1H ЯМР (250 МГц, CDCl3)7,50 (д., J=8,5 Гц, 2 Н), 7,23 (д., J=8,5 Гц, 2 Н), 6,90 (д., J=7,5 Гц,1 Н), 6,67 (дд., J=7,5, 3,4 Гц, 1 Н), 6,39 (д., J=3,4 Гц, 1 Н), 5,05 (м., 2 Н), 4,35 (д., J=15,4 Гц, 1 Н),3,85 (м., 1H), 3,70 (с., 3 Н), 3,60 (м., 1H), 2,95 (м.,4 Н), 2,45 (дд., J=17,1, 5,1 Гц, 1H). Способ получения 18. Получение метил(S)-8-гидрокси-3-оксо-2-[4-(трифторметил)бен 53 зил]-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4 ацетата через энантиоселективный синтез.Nбромсукцинимид (97 г, 545 ммоль) и затем перекись бензоила (6 г, 25 ммоль). Реакционную смесь медленно нагревают до температуры кипения с обратным холодильником с помощью прожектора мощностью 150 Вт, при этом рефлектор помещают на расстоянии примерно 12 дюймов (0,3048 м) от реакционной колбы. Через 24 ч реакционную смесь концентрируют на роторном испарителе до половинного объема и выдерживают в течение 4 ч. Образованный белый осадок отфильтровывают и промывают небольшим количеством дихлорметана. Фильтрат концентрируют досуха и оставшийся твердый материал растирают с гексанами и фильтруют. Высушивание под вакуумом дает целевое соединение (100,25 г, 72%) в виде белых игольчатых кристаллов: GC tR=6,56 мин (метилсиликоновая колонка HP 530 мкм 20 м, скорость течения Не носителя - 20 мл/мин, исходная температура 100 С, исходное время - 1 мин, скорость изменения температуры 10 С/мин, конечная температура - 200 С конечное время - 1 мин); 1H ЯМР (400 МГц, CDCl3)7,44 (д., J=10 Гц, 1H),6,99 (д., J=3 Гц, 1H), 6,73 (дд., 1H), 4,55. (с., 2 Н),3,80 (с., 3 Н).b) 3-[N-(4-Трифторметилбензил)аминометил]-4-броманизол. К перемешанному раствору 4-бром-3 бромметиланизола (35 г, 125 ммоль) в безводном ДМСО (50 мл) и сухом ТГФ (50 мл) добавляют 4-трифторметилбензиламин (30 г, 171 ммоль) и затем триэтиламин (18 мл, 129 ммоль). После перемешивания в течение 18 ч при комнатной температуре реакционную смесь концентрируют, разбавляют 1N водным NaOH (250 мл) и экстрагируют с применением Et2O (2 250 мл). Объединенные органические слои промывают насыщенным солевым раствором, высушивают (Na2SO4) и концентрируют досуха. Полученный остаток очищают флэшхроматографией на силикагелеEtOAc/СНСl3), что дает целевое соединениеc) 3-[N-(трет-Бутоксикарбонил)-N-(4 трифторметилбензил)аминометил]-4-броманизол. К перемешанному раствору 3-[N-(4 трифторметилбензил)аминометил]-4-броманизола (34,17 г, 91 ммоль) в сухом ТГФ (100 мл) добавляют ди-трет-бутилдикарбонат (22 г, 101 ммоль). Реакционную смесь перемешивают в 54 атмосфере аргона в течение 18 ч (наблюдается энергичное выделение газа). Концентрирование и хроматография на силикагеле (5-10%EtOAc/гексан) дает целевое соединение (41,09 г,95%) в виде прозрачного масла: ТСХ (кремнезем, 25% EtOAc/гексан) Rf - 0,44; 1H ЯМР (400 МГц, CDCl3)7,57 (д., J=8,3 Гц, 2 Н), 7,40 (д.,J=8,3 Гц, 2 Н), 7,39-7,33 (м., 2 Н), 6,83 и 6,72 (2 с.,1 Н), 6,71 (дд., 1 Н), 4,54 и 4,50 (2 с., 2 Н), 4,43 (с.,2 Н), 3,75 (с., 3 Н), 1,47 (с., 9 Н).d) Метил 2-[N-(трет-бутоксикарбонил)-N(4-трифторметилбензил)аминометил]-4-метоксициннамат. Раствор 3-[N-(трет-бутоксикарбонил)-N-(4 трифторметилбензил)аминометил]-4-броманизола (37,08 г, 78 ммоль), метилакрилата (35 мл,390 ммоль), ацетата палладия (0,88 г, 3,9 ммоль), три-о-толилфосфина (2,38 г, 7,8 моль) и диизопропилэтиламина (31 мл, 178 ммоль) в ацетонитриле (200 мл) дезоксигенерируют (3 цикла заполнения аргоном/удаления) и затем нагревают до температуры кипения с обратным холодильником в атмосфере аргона (масляная баня установлена на отметке 80 С). Через 6 ч добавляют дополнительное количество ацетата палладия (0,88 г, 3,9 ммоль) и три-отолилфосфина (2,38 г, 7,8 моль) и реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение еще 18 ч. Реакционную смесь концентрируют досуха и остаток смывают Еt2O/петролейный эфир, 1:1(300 мл) и затем выдерживают в течение 4 ч. Окрашенный в серый цвет осадок отфильтровывают и промывают небольшим объемом Еt2O/петролейный эфир, 1:1 (100 мл). Оранжево-красный фильтрат концентрируют и очищают флэш-хроматографией на силикагеле (15% этилацетат/гексаны). Полученный остаток переносят в гексан и смесь выдерживают в течение нескольких часов, после чего фильтруют с удалением желтого осадка. Концентрирование фильтрата дает целевое соединение (34,52 г,92%) в вида густого желтого масла: ТСХ (кремнезем, 20% EtOAc/гексаны) Rf - 0,45; 1H ЯМР(400 МГц, CDCl3)7,80 (шс., 1H), 7,57 (д., J=8,1 Гц, 2 Н), 7,53 (д., J=8,6 Гц, 1 Н), 7,29 (шс., 2 Н),6,83 (дд., 1H), 6,72 (шс., 1H), 6,23 (д., J=15,7 Гц,1H), 4,58 и 4,53 (2 шс., 2 Н), 4,46 и 4,37 (2 шс.,2 Н), 3,80 (с., 3 Н), 3,77 (с., 3 Н), 1,49 (с., 9 Н). е) Метил 2-[N-(трет-бутоксикарбонил)-N(4-трифторметилбензил)аминометил]-4-метоксидигидроциннамат. К 10% Pd/C (5 г, 4,7 ммоль, смоченному в ДМФ) добавляют раствор метил 2-[N-(третбутоксикарбонил)-N-(4-трифторметилбензил) аминометил]-4-метоксициннамата (34,52 г, 72 ммоль) в метаноле (100 мл). Смесь перемешивают в атмосфере водорода (50 фунт/кв.дюйм(283446 Па в аппарате Парра в течение 7 ч и затем фильтруют через целитную прокладку 55 концентрируют с получением целевого соединения (34,15 г, 98%) в виде бесцветного масла: 1(34,15 г, 71 ммоль) в диоксане (150 мл) добавляют 1N водный NaOH (85 мл, 85 ммоль). Мутную реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Полученный гомогенный раствор нейтрализуют 1N водным НСl (85 мл, 85 ммоль) и экстрагируют этилацетатом (2250 мл). Объединенные органические слои промывают насыщенным солевым раствором (250 мл), высушивают (МgSO4) и концентрируют с получением целевого соединения (34,60 г, 100%) в виде густого прозрачного масла: ТСХ (95:4:1, СНСl3/МеОН/НОАс) Rf 0,49; 1H ЯМР (400 МГц, СDСl3)7,58 (д., J=8,1 Гц, 2 Н), 7,30 (шс., 2 Н), 7,09 (д., J=8,4 Гц, 1 Н),6,78 (дд., 1 Н), 6,65 (д., J=2,6 Гц, 1 Н), 4,47 (шс.,2 Н), 4,42 (шc., 2H), 3,76 (с., 3 Н), 2,81 (шс., 2H),2,53 (т., 2H), 1,47 (с., 9 Н).g) (R)-4-Бензил-2-оксазолидинонил 2-[N(трет-бутоксикарбонил)-N-(4-трифторметилбензил)аминометил]-4-метоксидигидроциннамид. К перемешанному раствору 2-[N-(третбутоксикарбонил)-N-(4-трифторметилбензил) аминометил]-4-метоксидигидрокоричной кислоты (34,60 г, 71 ммоль) и пиридина (6,9 мл, 85 ммоль) в сухом дихлорметане (200 мл) в атмосфере аргона добавляют с помощью шприца фторид циануровой кислоты (4,4 мл, 48 ммоль). Реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Полученную густую суспензию фильтруют через целитную прокладку (celite) и промывают небольшим объемом сухого дихлорметана (50 мл). Прозрачный фильтрат вливают в отделительную воронку и промывают ледяной водой (500 мл). Высушивание (МgSO4) и концентрированно дают неочищенный фторангидрид (34,70 г, 100%), который используют дальше без дополнительной очистки. К перемешанному раствору (R)-4-бензил 2-оксазолидинона (13,8 г, 78 ммоль) в сухом ТГФ (300 мл) в атмосфере аргона при -78 С добавляют с помощью шприца раствор n-BuLi в гексанах (2,5 М, 30 мл, 75 ммоль). Реакционную смесь перемешивают при -78 С в течение 15 мин и затем с помощью шприца добавляют раствор указанного выше фторангидрида (34,70 г,71 ммоль) в сухом ТГФ (200 мл). Реакционную смесь перемешивают в течение 1 ч при -78 С и 56 затем реакцию гасят добавлением насыщенногоNH4Cl и проводят экстракцию этилацетатом (2200 мл). Объединенные органические слои промывают насыщенным солевым раствором (400 мл), высушивают (MgSO4) и концентрируют досуха. Очистка флэш-хроматографией на силикагеле (20% этилацетат/гексаны) дает целевое соединение (40,34 г, 90%) в виде густого прозрачного масла: ТСХ (20% EtOAc/гексан) Rf 0,21; 1H ЯМР (400 МГц, СDСl3)7,58 (д., J=8,1 Гц, 2 Н), 7,33-7,26 (м., 5 Н), 7,16 (м., 3 Н), 6,77h) (R)-4-Бензил-2-оксазолидинонил 3-[2[N-(трет-бутоксикарбонил)-N-(4-трифторметилбензил)аминометил]-4-метоксифенил]-2(S)метоксикарбонилметилпропионамид. К перемешанному раствору (R)-4-бензил 2-оксазолидинонил-2-[N-(трет-бутоксикарбонил)-N-(4-трифторметилбензил)аминометил]-4 метоксидигидроциннамида (40,30 г, 64 ммоль) в сухом ТГФ (300 мл) при -78 С добавляют с помощью шприца раствор бис(триметилсилил) амида лития (70 мл, 1 М в ТГФ, 70 ммоль). По истечении 30 мин добавляют с помощью шприца метилбромацетат (30 мл, 317 ммоль). После выдерживания еще в течение 30 мин при -78 С реакционную смесь нагревают до -20 С и перемешивают еще в течение 6 ч. Реакцию гасят добавлением насыщенного NН 4 Сl (400 мл) и экстрагируют этилацетатом (2200 мл). Объединенные органические слои промывают насыщенным солевым раствором (300 мл), высушивают (MgSO4) и концентрируют досуха. Очистка флэш-хроматографией на силикагеле (20% этилацетат/гекcаны) дает целевое соединение(38,62 г, 86%) в виде белого твердого вещества: данные ВЭЖХ (Altex Ultrasphere -Si 5u, 20%EtOAc/гексан) указывают на то, что остается еще примерно 20% неалкилированного исходного материала. Данные ВЭЖХ неочищенной реакционной смеси указывают на 90% выход реакции; 1H ЯМР (400 МГц, СDСl3)7,57 (д.,J=8,1 Гц, 2 Н), 7,40-7,11 (м., 8 Н), 6,71 (дд., 1 Н),6,63 (д., J=2,7 Гц, 1 Н), 4,57-4,34 (м., 6 Н), 4,03(S)-8-метокси-3-оксо-2-(4 трифторметилбензил)-2,3,4,5-тетрагидро-1 Н-2 бензазепин-4-ацетат. К перемешанному раствору (R)-4-бензил 2-оксазолидинонил 3-[2-[N-(трет-бутоксикарбонил)-N-(4-трифторметилбензил)аминометил]-4 метоксифенил]-2(S)-метоксикарбонилметилпропионамида (38,0 г, 54 ммоль) в ТГФ (300 мл) и воде (100 мл) добавляют по каплям при температуре 0 С в течение 30 мин раствор 30% Н 2O2(62 мл). Мутный раствор перемешивают еще в течение 1 ч при 0 С. Полученный гомогенный раствор медленно обрабатывают раствором сульфита натрия (34,3 г, 272 ммоль) в воде (175 мл) при 0 С и затем подкисляют его охлажденным на льду раствором концентрированной НСl(35 мл) в воде (150 мл). Реакционную смесь экстрагируют этилацетатом (2200 мл) и объединенные органические слои промывают насыщенным солевым раствором (400 мл), высушивают (МgSO4) и концентрируют досуха. Полученный остаток обрабатывают 4,0 М НСl в диоксане (400 мл) при перемешивании в условиях комнатной температуры (наблюдается медленное выделение газа). По истечении 1 ч реакционную смесь концентрируют и повторно концентрируют из СНСl3/толуол, 1:1 (2 х), и затем остаток (37,65 г) переносят в сухой ДМФ (400 мл). К указанному раствору добавляют при перемешивании в атмосфере аргона при 0 С в колбе Дьюара триэтиламин (15,3 мл, 109 ммоль) и NaHCO3 (22,9 г, 273 ммоль) и затем дифенилфосфорилазид (13 мл, 60 ммоль). После перемешивания в течение 24 ч при 0 С реакционную смесь концентрируют досуха. Остаток переносят в этилацетат (400 мл) и промывают последовательно водой (300 мл) и насыщенным солевым раствором (300 мл). Высушивание(MgSO4),концентрирование и флэшхроматография на силикагеле (35% этилацетат/гексаны) дают целевое соединение (16,87 г,74%) в виде прозрачного густого масла: ТСХ(S)-8-гидрокси-3-оксо-2-(4 трифторметилбензил)-2,3,4,5-тетрагидро-1 Н-2 бензазепин-4-ацетат. Раствор трибромида бора в CH2Cl2 (1,0 М,160 мл, 160 ммоль) добавляют по каплям в течение 30 мин к раствору метил (S)-8-метокси-3 оксо-2-(4-трифторметилбензил)-2,3,4,5 тетрагидро-1 Н-2-бензазепин-4-ацетата (16,67 г,39,6 ммоль) в безводном CH2Cl2 (150 мл) при-20 С в атмосфере аргона. После дополнительного выдерживания в течение 1,5 ч при температуре от -15 до -20 С реакционную смесь вновь охлаждают до -20 С и реакцию гасят осторожным добавлением по каплям МеОН (160 мл). Реакционную смесь перемешивают в течение 1 ч при температуре от -10 до 0 С и затем концентрируют на роторном испарителе. Остаток повторно концентрируют из МеОН (2 х). Очистка флэш-хроматографией на силикагеле (50-100%(14,87 г, 92%) в виде белого твердого вещества:(дд., 1 Н, 2,98 (м., 1 Н), 2,90 (дд., 1 Н), 2,47 (дд.,1 Н). Способ получения 19. Разделение энантиомеров метил -8-метокси-3-оксо-2-(2,2,2 трифторэтил)-2,3,4,5-тетрагидро-2-бензазепин 4-ацетата с помощью ВЭЖХ. а) Метил (R)-(+)-8-метокси-3-оксо-2-(2,2,2 трифторэтил)-2,3,4,5-тетрагидро-2-бензазепин 4-ацетат и метил (S)-(-)-8-метокси-3-оксо-2(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-2 бензазепин-4-ацетат. Метил -8-метокси-3-оксо-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-2-бензазепин-4 ацетат разрешают на его энантиомеры с помощью хиральной ВЭЖХ с использованием следующих условий: колонка Diacel Chiralcel OJ(21,2250 мм), подвижная фаза - метанол, скорость течения - 15 мл/мин, УФ обнаружение проводят при 295 нм, инъецируемое количество- 400 мг; tR для метил (R)-(+)-8-метокси-3-оксо 2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-2-бензазепин-4-ацетата составляет 4,9 мин; tR для метил (S)-(-)-8-метокси-3-оксо-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-2-бенза-зепин-4 ацетата составляет 6,6 мин. Способ получения 20. Разделение энантиомеров метил -8-гидрокси-3-оксо-2-(2,2,2 трифторэтил)-2,3,4,5-тетрагидро-2-бензазепин 4-ацетата с помощью ВЭЖХ. а) Метил (R)-(+)-8-гидрокси-3-оксо-2(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-2-бензазепин-4-ацетат и метил (S)-(-)-8-гидрокси-3 оксо-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-2 бензазепин-4-ацетат. Метил-8-гидрокси-3-оксо-2-(2,2,2 трифторэтил)-2,3,4,5-тетрагидро-2-бензазепин 4-ацетат разрешают на его энантиомеры с помощью хиральной ВЭЖХ с использованием следующих условий: колонка Diacel ChiralcelOD (21,2250 мм), подвижная фаза - 20% этанол в гексане, скорость течения 10 мл/мин,УФ обнаружение проводят при 254 нм, инъецируемое количество 100 мг; tR для метил (R)-(+)8-гидрокси-3-оксо-2-(2,2,2-трифторэтил)-2,3,4,5 тетрагидро-2-бензазепин-4-ацетата составляет 14,4 мин; tR для метил (S)-(-)-8-гидрокси-3-оксо 2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-2 бензазепин-4-ацетата составляет 18,5 мин. Способ получения 21. Получение метилNбромсукцинимид (97 г, 545 ммоль) и затем перекись бензоила (6 г, 25 ммоль). Реакционную смесь осторожно нагревают до температуры кипения с обратным холодильником с помощью прожектора мощностью 150 Вт, в котором рефлектор помещен на расстоянии примерно 12 дюймов (0,3048 м) от колбы с реакционной смесью. Через 24 ч реакционную смесь концентрируют на роторном испарителе до половинного объема и выдерживают в течение 4 ч. Образовавшийся белый осадок отфильтровывают и промывают небольшим количеством дихлорметана. Фильтрат концентрируют досуха и оставшийся твердый материал растирают с гексанами и фильтруют. Высушивание под вакуумом дает целевое соединение (100,25 г, 72%) в виде белых игольчатых кристаллов: GC tR=6,56 мин(метилсиликоновая колонка HP 530 мкм 20 м,скорость течения Не носителя - 20 мл/мин, исходная температура - 100 С, исходное время - 1 мин, скорость изменения температуры 10 С/мин, конечная температура - 200 С, конечное время - 1 мин); 1H ЯМР (400 МГц,CDCl3)7,44 (д., J=10 Гц, 1 Н), 6,99 (д., J=3 Гц,1H), 6,73 (дд., 1 Н), 4,55 (с., 2 Н), 3,80 (с., 3 Н).b) 3-[N-(2,2,2-Трифторэтил)аминометил]-4 броманизол. К перемешанному раствору 4-бром-3 бромметиланизола (33,6 г, 120 ммоль) в безводном ДМСО (125 мл) быстро добавляют 2,2,2 трифторэтиламин (24 г, 242 ммоль) при комнатной температуре. Реакционную смесь нагревают примерно до 30-35 С. После перемешивания в течение 18 ч реакционную смесь разбавляют охлажденным на льду 1N NaOH (200 мл) и экстрагируют с помощью Et2O (2300 мл). Объединенные органические слои промывают насыщенным солевым раствором (300 мл), высушивают (MgSO4) и концентрируют с получением целевого соединения (41,35 г, 96%) в виде бледно-желтого масла: ТСХ (толуол) Rf - 0,32; 1H ЯМР (400 МГц, СDСl3)7,43 (д., J=9 Гц, 1 Н),6,97 (д., J=3 Гц, 1 Н), 6,71 (дд., 1 Н), 3,93 (шc.,2 Н), 3,80 (с., 3 Н), 3,18 (м., 2 Н), 1,86 (шс., 1 Н).c) 3-[N-(трет-Бутоксикарбонил)-N-(2,2,2 трифторэтил)аминометил]-4-броманизол. К 3-[N-(2,2,2-трифторэтил)аминометил]-4 броманизолу (41,35 г, 137 ммоль) добавляют дитрет-бутилдикарбонат (36 г, 165 ммоль, ожиженный при нагревании в горячей водяной бане). Реакционную смесь промывают в указанном порядке небольшим количеством дихлорметана (20 мл) и перемешивают в атмосфере аргона на масляной бане, установленной на 50 С в течение 18 ч (наблюдается медленное 60 выделение газа). Остаток, полученный после концентрирования на роторном испарителе под вакуумом разбавляют гексанами (100 мл) и в раствор вносят в качестве затравки небольшое количество чистого твердого продукта (полученного в результате предыдущей реакции после хроматографии на силикагеле с использованием 10% EtOAc/гексанов в качестве элюента). Смесь выдерживают при комнатной температуре в течение нескольких часов и затем помещают на ночь в холодильник. Продукт собирают фильтрованием под разрежением и промывают гексанами. Высушивание под вакуумом дает целевое соединение (48,54 г, 88%) в виде бесцветного твердого вещества: ТСХ (10%(48,19 г, 121 ммоль), метилакрилата (55 мл, 605 ммоль), ацетата палладия (1,36 г, 6,1 ммоль),три-о-толилфосфина (3,69 г, 12 моль) и диизопропилэтиламина (49 мл, 278 ммоль) в ацетонитриле (200 мл) дезоксигенируют (3 цикла заполнения аргоном/удаления) и затем нагревают до температуры кипения с обратным холодильником в атмосфере аргона на масляной бане,установленной на отметке 80 С. Через 6 ч вносят дополнительное количество ацетата палладия (1,36 г, 6,1 ммоль) и три-о-толилфосфина(3,69 г, 12 ммоль) и реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение еще 18 ч. Реакционную смесь концентрируют досуха, и остаток переносят в Еt2O/петролейный эфир, 1:1 (300 мл) и выдерживают в течение 4 ч. Окрашенный в серый цвет осадок отфильтровывают и промывают небольшим объемом Et2O/петролейный эфир, 1:1 (100 мл). Оранжево-красный фильтрат концентрируют и очищают флэшхроматографией на силикагеле (15% этилацетат/гексаны). Полученный осадок переносят в гексан и смесь выдерживают в течение 2 ч, после чего фильтруют с удалением желтого осадка. Концентрирование фильтрата дает целевое соединение (45,85 г, 94%) в виде желтого масла: ТСХ (20% EtOAc/гексан) Rf - 0,50; 1 Н ЯМР (400 МГц, CDCl3)7,84 (д., J=16 Гц, 1H), 7,57 (д.,J=9 Гц, 1 Н), 6,86 (дд., 1H), 6,74 и 6,72 (2 с., 1H),6,26 (д., J=16 Гц, 1H), 4,74 и 4,70 (2 с., 2 Н), 3,83
МПК / Метки
МПК: A61P 9/10, A61K 31/55, C07D 223/16
Метки: витронектина, антагонисты, рецептора
Код ссылки
<a href="https://eas.patents.su/30-2419-antagonisty-receptora-vitronektina.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты рецептора витронектина.</a>
Предыдущий патент: Производные гетароилциклогександиона с гербицидным действием
Следующий патент: Способ сбора биологически ценного зерна жарылкасына и устройства для его осуществления
Случайный патент: Кристаллическая форма эплеренона


































