Фармацевтическая дозированная форма, включающая производное глюкопиранозилдифенилметана, и применения для улучшения гликемического контроля у пациентов
Номер патента: 24072
Опубликовано: 31.08.2016
Авторы: Шултц Леон, Ван Зерень, Ладизински Надя С., Айзенрайх Вольфрам, Ли Данпин, Барта Альберт, Мача Срерадж
Формула / Реферат
1. Фармацевтическая дозированная форма, включающая фармацевтическую композицию, обладающую ингибирующей активностью в отношении SGLT-2, содержащую соединение формулы (I.9)
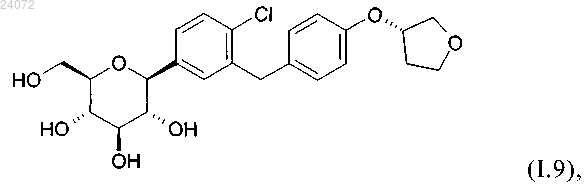
где распределение частиц по размерам соединения формулы (I.9) в указанной композиции составляет 1≤Х90<200 мкм, и где содержание указанного соединения формулы (I.9) составляет от 0,5 до 25% в расчете на массу указанной композиции, и где количество соединения формулы (I.9) составляет 10 или 25 мг.
2. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по п.1, где распределение частиц по размерам соединения формулы (I.9) в указанной композиции составляет 5≤Х90<150 мкм.
3. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по п.1, где распределение частиц по размерам соединения формулы (1.9) в указанной композиции составляет Х90≤150 мкм, 5≤Х50≤50 мкм и Х10≥0,5 мкм.
4. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.1-3, где содержание указанного соединения формулы (I.9) составляет от 1,0 до 20% в расчете на массу указанной композиции.
5. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по п.4, где содержание указанного соединения формулы (I.9) составляет от 2,0 до 15% в расчете на массу указанной композиции.
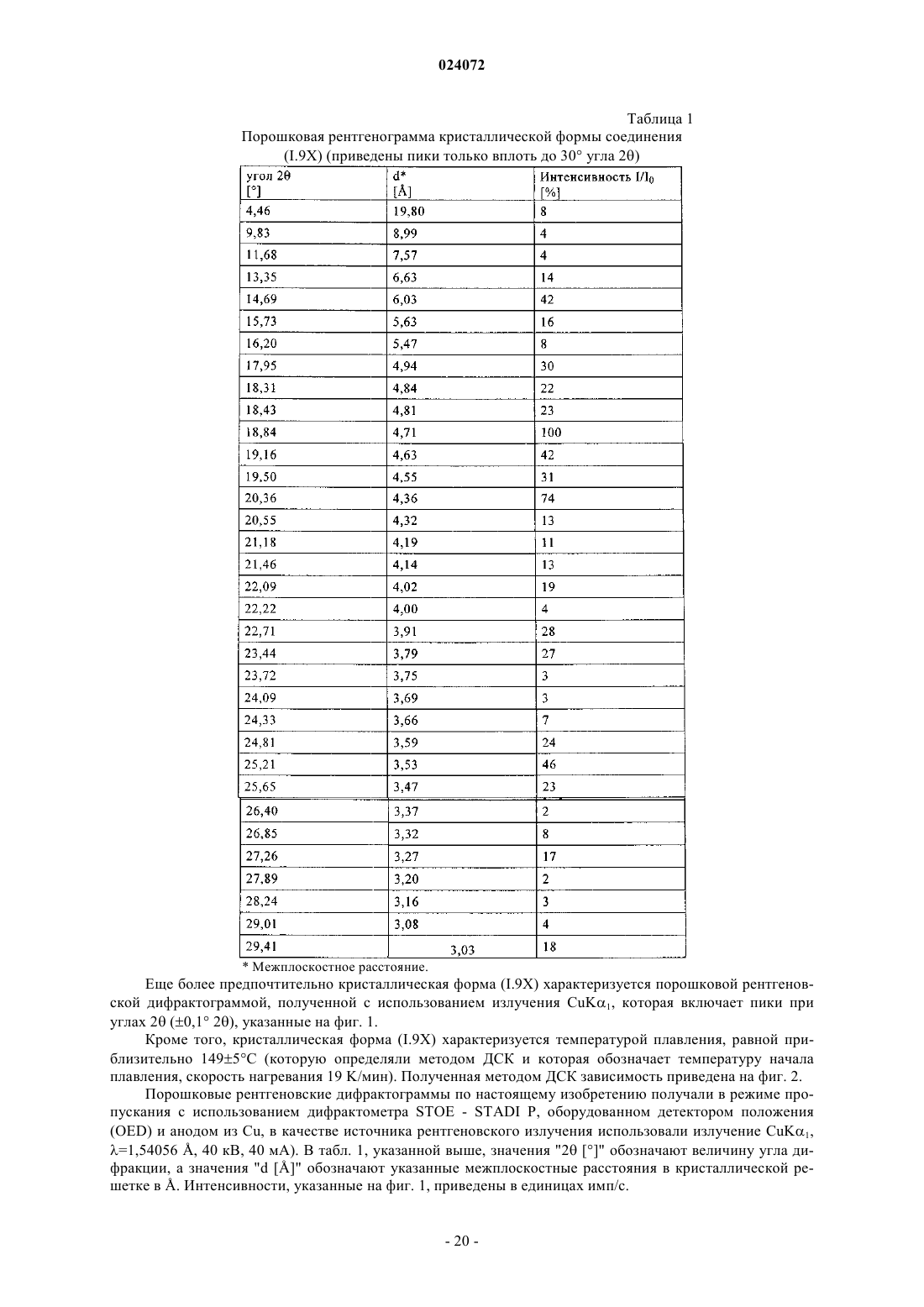
6. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.1-5, содержащую кристаллическую форму (I.9X) указанного соединения формулы (I.9), где указанная кристаллическая форма (I.9X) характеризуется порошковой рентгеновской дифрактограммой (излучение CuKα1), которая включает пики угла 2θ при 18,84, 20,36 и 25,21° (±0,1° 2θ).
7. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.1-6, содержащую дезинтегрирующий агент и связующий агент, причем массовое соотношение указанного дезинтегрирующего агента и указанного связующего агента составляет от 1,5:3,5 до 1:1.
8. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по п.7, в которой по крайней мере 99 мас.% частиц указанного связующего агента характеризуются диаметром 250 мкм или менее.
9. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.1-8, которая получена влажной грануляцией с высоким сдвигом, причем указанная композиция дополнительно включает разбавитель, где указанный разбавитель в количестве 5-20 мас.% добавлен к указанной композиции в качестве сухой добавки после указанной стадии влажной грануляции.
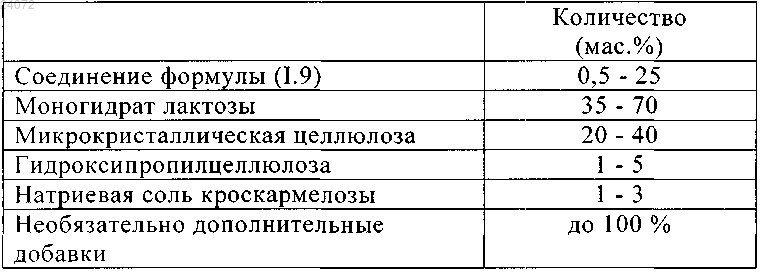
10. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.1-6 и 9, содержащую
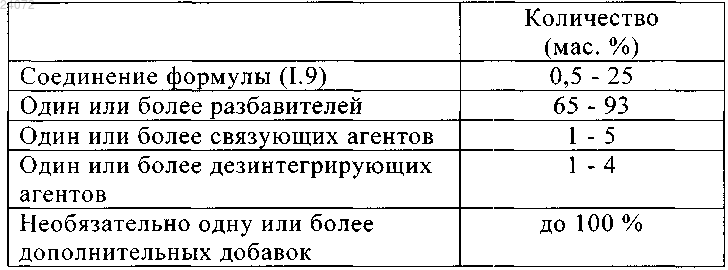
11. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по п.10, где разбавителем является моногидрат лактозы и/или микрокристаллическая целлюлоза.
12. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.7, 8 или 10, где связующим агентом является гидроксипропилцеллюлоза и/или микрокристаллическая целлюлоза.
13. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по п.10, где дезинтегрирующим агентом является натриевая соль кроскармеллозы.
14. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.1-13, которая дополнительно содержит одно или более смазывающих веществ.
15. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по п.14, где смазывающим веществом является стеарат магния.
16. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.1-15, которая дополнительно содержит одно или более скользящих веществ.
17. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по п.16, где скользящим веществом является коллоидный диоксид кремния или тальк.
18. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.1-17, которая дополнительно содержит одно или более пленочных покрытий.
19. Фармацевтическая дозированная форма, включающая фармацевтическую композицию по любому из пп.1-18, содержащую
20. Фармацевтическая дозированная форма по любому из пп.1-19, которая представляет собой таблетку.
21. Применение фармацевтической дозированной формы по любому из пп.1-20 для приготовления лекарственного средства для лечения метаболического нарушения, выбранного из группы, состоящей из сахарного диабета типа 1, сахарного диабета типа 2, нарушенной толерантности к глюкозе (IGT), нарушенного уровня глюкозы в крови натощак (IFG), гипергликемии, гипергликемии после приема пищи, избыточной массы тела, ожирения и метаболического синдрома.
Текст
ФАРМАЦЕВТИЧЕСКАЯ ДОЗИРОВАННАЯ ФОРМА, ВКЛЮЧАЮЩАЯ ПРОИЗВОДНОЕ ГЛЮКОПИРАНОЗИЛДИФЕНИЛМЕТАНА, И ПРИМЕНЕНИЯ ДЛЯ УЛУЧШЕНИЯ ГЛИКЕМИЧЕСКОГО КОНТРОЛЯ У ПАЦИЕНТОВ В изобретении описана фармацевтическая дозированная форма, включающая фармацевтическую композицию, обладающую ингибирующей активностью в отношении SGLT-2, содержащую соединение формулы (I.9) где распределение частиц по размерам соединения формулы (I.9) в указанной композиции составляет 1 Х 90200 мкм, содержание указанного соединения формулы (I.9) составляет от 0,5 до 25% в расчете на массу указанной композиции и количество соединения формулы (I.9) составляет 10 или 25 мг, и применения для лечения метаболических нарушений.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Область, к которой относится изобретение В настоящем изобретении предлагаются фармацевтические композиции, содержащие в качестве активного фармацевтического ингредиента ингибитор SGLT-2. Кроме того, в настоящем изобретении предлагается фармацевтическая дозированная форма, включающая указанную фармацевтическую композицию. Кроме того, в настоящем изобретении предлагается способ получения указанной фармацевтической дозированной формы. Кроме того, в настоящем изобретении предлагается использование указанной фармацевтической композиции и фармацевтической дозированной формы для лечения и/или профилактики отдельных заболеваний или патологических состояний, особенно одного или более состояний,выбранных из группы, включающей наряду с прочими сахарный диабет типа 1, сахарный диабет типа 2,нарушенную толерантность к глюкозе, нарушенный уровень глюкозы в крови натощак и гипергликемию. Кроме того, в настоящем изобретении предлагаются способы лечения и/или профилактики таких заболеваний и патологических состояний, которые заключаются во введении фармацевтической композиции или фармацевтической дозированной формы по настоящему изобретению пациенту, нуждающемуся в лечении. Предпосылки создания настоящего изобретения Диабет типа 2 становится все более распространенным заболеванием, которое из-за высокой частоты осложнений приводит к значительному сокращению средней продолжительности жизни. В связи со связанными с диабетом микрососудистыми осложнениями диабет типа 2 является в настоящее время самой распространенной причиной развития потери зрения у взрослых, почечной недостаточности и ампутаций конечностей в промышленно развитых странах. К тому же заболевание диабетом типа 2 повышает в 2-5 раз риск сердечно-сосудистых заболеваний. После продолжительного периода развития заболевания большинство пациентов с диабетом типа 2 становятся невосприимчивыми к пероральным курсам лечения, а также инсулинозависимыми, с необходимостью ежедневных инъекций и измерений уровня глюкозы несколько раз в день. В ходе Британских перспективных исследований по лечению сахарного диабета (UKPDS) было установлено, что интенсивное лечение метформином, сульфонилмочевинами или инсулином приводит только к ограниченному улучшению гликемического контроля (различие уровней HbA1c составляет 0,9%). Кроме того, даже у пациентов из группы интенсивного лечения гликемический контроль со временем значительно ухудшался, что объясняется ухудшением функции -клеток. Важно отметить, что при интенсивном лечении не наблюдается существенное снижение микрососудистых осложнений, т.е. сердечно-сосудистых явлений. В связи с этим множество пациентов, страдающих от сахарного диабета типа 2, практически не поддаются лечению, частично в связи с ограничениями продолжительной эффективности, с переносимостью и сложностями при введении доз, которыми характеризуются современные антигипегликемические курсы лечения. Пероральные лекарственные средства, обычно используемые для лечения (например, такие как средства первой или второй линии и/или средства для моно- или комбинированной терапии (первичной или дополнительной терапии, включают, но не ограничиваясь только ими, метформин, сульфонилмочевины, тиазолидиндионы, глиниды и ингибиторы -глюкозидазы. Множество случаев неэффективного лечения является основной причиной высокого уровня развития долгосрочных осложнений, ассоциированных с гипергликемией, или хронических заболеваний(включая микро- и макрососудистые заболевания, например, такие как диабетическая нефропатия, ретинопатия или невропатия или сердечно-сосудистые осложнения) у пациентов, страдающих от диабета типа 2. В связи с этим в медицине существует нереализованная потребность в способах, лекарственных средствах и фармацевтических композициях с достаточно высокой эффективностью в отношении гликемического контроля, в отношении модифицирующих заболевание свойств и снижения заболеваемости и смертности в связи с сердечно-сосудистыми заболеваниями, и в тоже время характеризующиеся улучшенным профилем безопасности. Ингибиторы SGLT2 представляют собой новый класс агентов, которые в настоящее время используют при разработке способов лечения или улучшения гликемического контроля у пациентов с диабетом типа 2. Глюкопиранозилзамещенные производные бензола в качестве ингибиторов SGLT2 описаны в публикациях предшествующего уровня техники, например в заявках WO 01/27128, WO 03/099836,WO 2005/092877, WO 2006/034489, WO 2006/064033, WO 2006/117359, WO 2006/117360,WO 2007/025943, WO 2007/028814, WO 2007/031548, WO 2007/093610, WO 2007/128749,WO 2008/049923, WO 2008/055870, WO 2008/055940. Глюкопиранозилзамещенные производные бензола предлагаются в качестве индукторов выведения сахара с мочой и в качестве лекарственных средств,предназначенных для лечения диабета. Почечная фильтрация и обратный захват глюкозы вносят вклад, наряду с другими механизмами, в поддержание постоянной концентрации глюкозы в плазме и, таким образом, могут служить в качестве антидиабетической мишени. Обратный захват профильтрованной через эпителиальные клетки почек глюкозы происходит с участием натрий-зависимых белков-переносчиков глюкозы (SGLT2), локализо-1 024072 ванных в мембране щеточной каймы канальцев по градиенту натрия. Существует по крайней мере 3 изоформы SGLT, которые отличаются типом экспрессии, а также физико-химическими свойствами. SGLT2 экспрессируется исключительно в почках, в то время как SGLT1 экспрессируется и в других тканях, таких как кишечник, ободочная кишка, скелетные и сердечные мышцы. Установлено, что SGLT3 является рецептором глюкозы в интерстициальных клетках кишечника и не проявляет транспортную функцию. Предполагается, что другие родственные, но еще не охарактеризованные гены могут вносить дополнительный вклад в обратный захват глюкозы. При нормогликемии глюкоза полностью повторно абсорбируется в почках с участием SGLT2, причем емкость почек по обратному захвату глюкозы насыщается при концентрации глюкозы более 10 мМ, что приводит к глюкозурии ("сахарный диабет"). Такую предельную концентрацию можно уменьшить за счет ингибирования SGLT2. В экспериментах по испытанию игибитора SGLT, флоризина, было установлено, что при ингибировании SGLT частично подавляется обратный захват глюкозы из клубочкового фильтрата в кровь, что приводит к снижению концентрации глюкозы в крови и глюкозурии. Цель настоящего изобретения Цель настоящего изобретения заключается в разработке фармацевтической композиции, включающей ингибитор SGLT-2, которая характеризуется отсутствием или снижением способности к слипанию в процессе получения указанной композиции. Другая цель настоящего изобретения заключается в разработке фармацевтической композиции,включающей ингибитор SGLT-2, характеризующейся низким пленкообразованием в процессе получения композиции или отсутствием пленкообразования. Еще одна цель настоящего изобретения заключается в разработке фармацевтической дозированной формы, включающей ингибитор SGLT-2, характеризующейся коротким временем распадаемости, удовлетворительной растворимостью и/или высокой биодоступностью ингибитора SGLT-2 у пациентов. Другая цель настоящего изобретения заключается в разработке фармацевтической композиции,включающей ингибитор SGLT2, характеризующейся высокой однородностью и/или получение которой эффективно с точки зрения временных затрат и стоимости производства лекарственных форм. Еще одна цель настоящего изобретения заключается в разработке фармацевтической композиции и фармацевтической дозированной формы, каждая из которых включает ингибитор SGLT2, и способа профилактики, замедления прогрессирования, приостановки или лечения метаболического нарушения, прежде всего сахарного диабета типа 2. Другая цель настоящего изобретения заключается в разработке фармацевтической композиции и фармацевтической дозированной формы, каждая из которых включает ингибитор SGLT2, и способа улучшения гликемического контроля у пациентов, которые в этом нуждаются, прежде всего у пациентов с сахарным диабетом типа 2. Другаяцель настоящего изобретения заключается в разработке фармацевтической композиции и фармацевтической дозированной формы, каждая из которых включает ингибитор SGLT2, и способа улучшения гликемического контроля у пациентов с недостаточным гликемическим контролем. Другая цель настоящего изобретения заключается в разработке фармацевтической композиции и фармацевтической дозированной формы, каждая из которых включает ингибитор SGLT2, и способа профилактики, замедления или приостановки прогрессирования нарушенной толерантности к глюкозе (IGT),нарушенного уровня глюкозы в крови натощак (IFG), резистентности к инсулину и/или метаболического синдрома при сахарном диабете типа 2. Еще одна цель настоящего изобретения заключается в разработке фармацевтической композиции и фармацевтической дозированной формы, каждая из которых включает ингибитор SGLT2, и способа профилактики, замедления прогрессирования, приостановки или лечения состояния или нарушения, выбранных из группы, включающей осложнения, опосредованные сахарным диабетом. Другая цель настоящего изобретения заключается в разработке фармацевтической композиции и фармацевтической дозированной формы, каждая из которых включает ингибитор SGLT2, и способа снижения массы тела или предотвращения увеличения массы тела у пациентов, нуждающихся в этом. Еще одна цель настоящего изобретения заключается в разработке фармацевтической композиции и фармацевтической дозированной формы, каждая из которых включает ингибитор SGLT2, характеризующихся высокой эффективностью при лечении метаболических нарушений, особенно таких как сахарный диабет, нарушенную толерантность к глюкозе (IGT), нарушенный уровень глюкозы в крови натощак (IFG), и/или гипергликемия, характеризующихся достаточно или чрезвычайно высокими фармакологическими и/или фармакокинетическими и/или физико-химическими свойствами. Другая цель настоящего изобретения заключается в разработке способа получения фармацевтической дозированной формы по настоящему изобретению, получение которой эффективно с точки зрения временных затрат и стоимости производства лекарственных форм. Другие цели настоящего изобретения представляются очевидными для специалистов в данной области медицины на основании описания и примеров настоящего изобретения. Краткое изложение сущности изобретения В одном объекте настоящего изобретения предлагается фармацевтическая композиция, включающая в качестве активного фармацевтического ингредиента ингибитор SGLT-2 и один или более эксципиентов, прежде всего один или более разбавителей, и/или один или более дезинтегрирующих агентов. В еще одном объекте указанная фармацевтическая композиция дополнительно включает один или более связующих агентов. В одном объекте фармацевтическими композициями по настоящему изобретению являются твердые фармацевтические композиции, например твердая фармацевтическая композиция для перорального введения. В одном варианте настоящего изобретения содержание активного ингредиента составляет 25% или менее в расчете на массу фармацевтической композиции. Содержание указанного активного ингредиента предпочтительно составляет от 0,5 до 25% в расчете на массу фармацевтической композиции. Более предпочтительно содержание активного ингредиента составляет от 1,0 до 20% в расчете на массу фармацевтической композиции. Еще более предпочтительно содержание активного ингредиента составляет от 2,0 до 15% в расчете на массу фармацевтической композиции. В настоящем изобретении было установлено, что фармацевтическая композиция, включающая в качестве активного фармацевтического ингредиента ингибитор SGLT-2 с распределением частиц по размерам Х 90200 мкм, прежде всего с распределением частиц по размерам в диапазоне 1 Х 90200 мкм,характеризуется благоприятным профилем растворения и/или достаточно высокой биодоступностью,высокой степенью однородности и получение которой эффективно с точки зрения временных затрат и стоимости производства лекарственных форм. В связи с этим в другом объекте настоящего изобретения предлагается фармацевтическая композиция, включающая в качестве активного фармацевтического ингредиента ингибитор SGLT-2 и один или более эксципиентов, причем указанный активный ингредиент характеризуется распределением частиц по размерам Х 90200 мкм, прежде всего объемным распределением частиц по размерам в диапазоне 1 мкмХ 90200 мкм, по данным метода лазерной дифракции. В одном варианте соотношение дезинтегрирующих агентов и связующих агентов в композиции по настоящему изобретению составляет от 1,5:3,5 до 1:1. В другом варианте дезинтегрирующим агентом в указанной фармацевтической композиции является натриевая соль кроскармеллозы. В одном варианте связующим агентом в указанной фармацевтической композиции является гидроксипропилцеллюлоза. В еще одном варианте разбавителем в указанной фармацевтической композиции является моногидрат лактозы или микрокристаллическая целлюлоза. В другом варианте указанная фармацевтическая композиция включает моногидрат лактозы и микрокристаллическую целлюлозу. В еще одном варианте фармацевтическая композиция дополнительно включает скользящее вещество, например коллоидный диоксид кремния или тальк. В другом варианте указанная фармацевтическая композиция дополнительно включает смазывающее вещество. В одном варианте связующим агентом по настоящему изобретению является связующий агент,представляющий собой тонкодисперсные частицы. В другом варианте по крайней мере 99 мас.% частиц связующего агента характеризуются размером частиц 250 мкм или менее. В одном варианте по крайней мере 99,5 мас.% частиц связующего агента характеризуются размером частиц 250 мкм или менее. В еще одном варианте 99,9 мас.% частиц связующего агента проходят через сито с размером ячеек 60 меш, т.е. характеризуются размером частиц 250 мкм или менее. В другом варианте настоящего изобретения предлагается фармацевтическая дозированная форма,например таблетка, которая включает фармацевтическую композицию по настоящему изобретению. В одном варианте указанная дозированная форма, например таблетка, включает: В другом варианте настоящего изобретения указанная дозированная форма, например таблетка,включает: В одном варианте указанная дозированная форма, например таблетка, в расчете на 1 мг дозированной формы включает: В другом варианте настоящего изобретения указанная дозированная форма, например таблетка, в расчете на 1 мг дозированной формы включает: В одном варианте указанная фармацевтическая дозированная форма, например таблетка, дополнительно включает смазывающее вещество, например стеарат магния, например в количестве 0,25-2%. В другом варианте указанная фармацевтическая дозированная форма, например таблетка, дополнительно включает скользящее вещество, например коллоидный диоксид кремния, например в количестве 0,25-2%. На дозированную форму, например таблетку по настоящему изобретению, можно наносить пленочное покрытие. Обычно содержание пленочного покрытия составляет 2-5% в расчете на общую массу композиции и включает предпочтительно пленкообразующий агент, пластификатор, скользящее вещество и, необязательно, один или более пигментов. Типичная композиция для нанесения пленочного покрытия может включать гидроксипропилметилцеллюлозу (ГПМЦ), полиэтиленгликоль (ПЭГ), тальк, диоксид титана и, необязательно, оксид железа, например оксид железа красный и/или желтый. В другом объекте настоящего изобретения предлагается способ получения фармацевтической композиции методом влажной грануляции, который включает следующие стадии: 1) предварительное смешивание активного ингредиента и основной порции эксципиентов, включая связующий агент, в смесителе, при этом получают предварительную смесь;(2) грануляция предварительной смеси, полученной на стадии (1), при добавлении жидкости для грануляции, предпочтительно очищенной воды;(3) высушивание гранул, полученных на стадии (2), в сушилке с псевдоожиженным слоем или сушильном шкафу;(4) необязательно, сухое просеивание высушенных гранул, полученных на стадии (3),(5) смешивание высушенных гранул, полученных на стадии (4), с остальной порцией эксципиентов,включая скользящее вещество и смазывающее вещество, в смесителе, при этом получают конечную смесь;(6) таблетирование конечной смеси, полученной на стадии (5), при ее прессовании в пригодном прессе для таблетирования, при этом получают ядра таблеток;(7) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (6), при нанесении функционально неактивного покрытия. В другом объекте настоящего изобретения предлагается способ получения фармацевтической композиции вышеуказанным способом. В еще одном объекте настоящего изобретения предлагается способ получения фармацевтической композиции методом прямого прессования, который включает следующие стадии:(1) предварительное смешивание активного ингредиента и основной порции эксципиентов в смесителе, при этом получают предварительную смесь;(2) необязательно, сухое просеивание предварительной смеси через сито для отделения слипшихся частиц и повышения однородности смеси;(3) необязательно, смешивание предварительной смеси, полученной на стадии (1) или (2), с остальными эксципиентами в смесителе при перемешивании;(4) таблетирование конечной смеси, полученной на стадии (3), при ее прессовании в пригодном прессе для таблетирования, при этом получают ядра таблеток;(5) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (4), при нанесении функционально неактивного покрытия. В другом объекте настоящего изобретения предлагается фармацевтическая композиция, которую получают вышеописанным способом. В еще одном объекте настоящего изобретения предлагается способ получения фармацевтической композиции методом сухой грануляции, который включает следующие стадии:(1) смешивание активного ингредиента со всеми эксципиентами или их порцией в смесителе;(2) уплотнение смеси, полученной на стадии (1), в пригодном ротационном уплотнителе;(3) измельчение лент, полученных на стадии (2), при этом получают гранулы, предпочтительно гранулы небольшого размера, с использованием пригодных стадий измельчения или просеивания;(4) необязательно, смешивание гранул, полученных на стадии (3), с остальными эксципиентами в смесителе, при этом получают конечную смесь;(5) таблетирование гранул, полученных на стадии (3), или конечной смеси, полученной на стадии(4), при ее прессовании в пригодном прессе для таблетирования, при этом получают ядра таблеток;(6) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (5), при нанесении функционально неактивного покрытия. В другом объекте настоящего изобретения предлагается фармацевтическая композиция, которую получают вышеописанным способом. В одном варианте фармацевтическую композицию по настоящему изобретению получают влажной грануляцией с высоким сдвигом. Предпочтительно, ингибитор SGLT2 выбран из группы, включающей глюкопиранозилзамещенные производные бензола формулы (I)R3 обозначает (R)-тетрагидрофуран-3-илоксигруппу или (S)-тетрагидрофуран-3-илоксигруппу,или пролекарство одного из вышеупомянутых ингибиторов SGLT2. Предпочтительные заместители указанных выше замещенных глюкопиранозилпроизводных бензола формулы (I) имеют следующие значения:R1 предпочтительно обозначает хлор или цианогруппу, прежде всего хлор;R3 предпочтительно обозначает (R)-тетрагидрофуран-3-илоксигруппу или (S)-тетрагидрофуран-3 илоксигруппу. Глюкопиранозилзамещенные производные бензола формулы (I) предпочтительно выбирают из группы, включающей соединения (I.8)-(I.11), представленные ниже в таблице. Более предпочтительные глюкопиранозилзамещенные производные бензола формулы (I) выбирают из группы, включающей соединения (I.8), (I.9) и (I.11). Еще более предпочтительно глюкопиранозилзамещенные производные бензола формулы (I) выбирают из группы, включающей соединения (I.8) и (I.9) или кристаллическую форму (I.9X) соединения(I.9). Указанные фармацевтические композиции по настоящему изобретению характеризуются высокой однородностью, и их производство является эффективным с точки зрения временных затрат и стоимости производства лекарственных форм, таких как таблетки и капсулы. Кроме того, в одном варианте указанные лекарственные формы предлагаются прежде всего в форме таблеток. В одном объекте предлагается фармацевтическая дозированная форма, включающая фармацевтическую композицию по настоящему изобретению. В еще одном объекте лекарственные формы по настоящему изобретению представляют собой твердые лекарственные формы, например твердую фармацевтическую дозированную форму для перорального введения. В другом объекте предлагается способ получения фармацевтической дозированной формы по настоящему изобретению, включающий один или более способов грануляции, в котором активный фармацевтический ингредиент гранулируют в смеси с одним или более эксципиентов. В другом объекте фармацевтическая композиция или фармацевтическая дозированная форма по настоящему изобретению характеризуются фармакокинетическим профилем после введения субъекту,прежде всего после введения человеку, как например, описано в данном контексте. Было установлено, что фармацевтическую композицию, включающую ингибитор SGLT2, как описано в данном контексте, можно эффективно использовать для профилактики, замедления прогрессирования, приостановки или лечения метаболического нарушения, прежде всего для улучшения гликемического контроля у пациентов. Данный факт открывает новые терапевтические возможности для лечения и профилактики сахарного диабета типа 2, избыточной массы тела, ожирения, осложнений при сахарном диабете и сопутствующих патологических состояний. Следовательно, в одном объекте настоящего изобретения предлагается способ профилактики, замедления, приостановки прогрессирования или лечения метаболического нарушения, выбранного из группы, включающей сахарный диабет типа 1, сахарный диабет типа 2, нарушенную толерантность к глюкозе (IGT), нарушенный уровень глюкозы в крови натощак (IFG), гипергликемию, гипергликемию после приема пищи, избыточную массу тела, ожирение и метаболический синдром у пациента, нуждающегося в таком лечении. Указанный способ заключается в том, что фармацевтическую композицию или фармацевтическую дозированную форму по настоящему изобретению вводят пациенту, как описано в данном контексте. В другом объекте настоящего изобретения предлагается способ улучшения гликемического контроля и/или снижения уровня глюкозы в крови натощак, уровня глюкозы в плазме после приема пищи и/или гликозилированного гемоглобина HbA1c у пациентов, нуждающихся в таком лечении, и указанный способ заключается в том, что фармацевтическую композицию или фармацевтическую дозированную форму по настоящему изобретению вводят пациенту, как описано в данном контексте. Фармацевтическая композиция по настоящему изобретению может также оказывать ценное модифицирующее действие на заболевания или состояния, связанные с нарушенной толерантности к глюкозе,нарушенным уровнем глюкозы в крови натощак (IFG), резистентностью к инсулину и/или метаболическим синдромом. В другом объекте настоящего изобретения предлагается способ профилактики, замедления, приостановки или обращения прогрессирования нарушенной толерантности к глюкозе, нарушенного уровня глюкозы в крови натощак, резистентности к инсулину и/или метаболического синдрома при сахарном диабете типа 2 у пациентов, нуждающихся в таком лечении, и указанный способ заключается в том, что фармацевтическую композицию или фармацевтическую дозированную форму по настоящему изобретению вводят пациенту, как описано в данном контексте. Поскольку применение фармацевтической композиции по настоящему изобретению приводит к улучшению гликемического контроля у пациентов, нуждающихся в таком лечении, то ее также можно использовать для лечения состояний и/или нарушений, связанных с увеличением уровня глюкозы в крови. В другом объекте настоящего изобретения предлагается способ профилактики, замедления прогрессирования, приостановки или лечения состояний и нарушений, выбранных из группы, включающей осложнения при сахарном диабете, например, катаракта и микро- и макрососудистые заболевания, такие как нефропатия, ретинопатия, невропатия, ишемия тканей, диабетическая стопа, артериосклероз, инфаркт миокарда, острый коронарный синдром, нестабильная стенокардия, стабильная стенокардия, инсульт, окклюзионное заболевание периферической артерии, кардиомиопатия, сердечная недостаточность, нарушения сердечного ритма и сосудистый рестеноз, у пациентов, нуждающихся в таком лечении,и указанный способ заключается в том, что пациенту вводят фармацевтическую композицию или фармацевтическую дозированную форму по настоящему изобретению. Прежде всего, можно лечить, замедлять прогрессирование или предотвращать развитие одного или более проявлений диабетической нефропатии, такого как гиперперфузия, протеинурия и альбуминурия. Термин "ишемия тканей" прежде всего обозначает диабетическую макроангиопатию, диабетическую микроангиопатию, нарушенное ранозаживление и диабетическую язву. В настоящем описании термины "микро- и макрососудистые заболевания" и "микро- и макрососудистые осложнения" используются взаимозаменяемо. В результате введения фармацевтической композиции по настоящему изобретению, ингибирующей активность SGLT2, избыточное количество глюкозы не превращается в нерастворимую форму запасания, такую как жиры, а выводится с мочой пациента. Поэтому в результате не наблюдается увеличение массы тела или происходит даже снижение массы тела. В еще одном объекте настоящего изобретения предлагается способ снижения массы тела или профилактики увеличения массы тела или ускорения снижения массы тела у пациентов, нуждающихся в таком лечении, который заключается в том, что фармацевтическую композицию или фармацевтическую дозированную форму по настоящему изобретению вводят пациенту, как описано в данном контексте. Фармакологическое действие ингибитора SGLT2 в составе фармацевтической композиции по настоящему изобретению не зависит от инсулина. Таким образом, можно улучшить гликемический контроль без дополнительной нагрузки на бета-клетки поджелудочной железы. После введения фармацевтической композиции по настоящему изобретению наблюдается замедление или предотвращение дегенерации бета-клеток и снижения функциональности бета-клеток, такой как, например, апоптоз или некроз. Более того, можно улучшить или восстановить функциональность бета-клеток поджелудочной железы, а также увеличить их размер и число. Было установлено, что при лечении фармакологической композицией по настоящему изобретению можно нормализовать нарушенные гипергликемией статус дифференциации и гиперплазию бета-клеток поджелудочной железы. В другом объекте настоящего изобретения предлагается способ профилактики, замедления прогрессирования, приостановки или лечения дегенерации бета-клеток поджелудочной железы и/или снижения функции бета-клеток поджелудочной железы и/или для улучшения и/или восстановления функции бета-клеток поджелудочной железы и/или функциональности секреции инсулина поджелудочной железой у пациентов, нуждающихся в таком лечении, и указанный способ заключается в том, что фармацевтическую композицию или фармацевтическую дозированную форму вводят пациенту, как описано в данном контексте. В результате введения комбинации или фармацевтической композиции по настоящему изобретению можно снизить или подавить аномальное накопление жира в печени. Таким образом, в другом объ-7 024072 екте настоящего изобретения предлагается способ профилактики, замедления, приостановки прогрессирования или лечения заболеваний или состояний, связанных с аномальным накоплением жира в печени у пациентов, нуждающихся в таком лечении, и указанный способ заключается в том, что ингибиторSGLT2, как описано в данном контексте, вводят пациенту. Заболевания или нарушения, связанные с аномальным накоплением жира в печени, прежде всего, выбраны из группы, включающей неспецифический жировой гепатоз, неалкогольный гепатоз печени, неалкогольный стеатогепатит, индуцированный гипералиментацией жировой гепатоз, диабетический жировой гепатоз, алкогольный жировой гепатоз или токсический жировой гепатоз. В связи с этим в еше одном объекте настоящего изобретения предлагается способ поддержания и/или улучшения чувствительности к инсулину и/или лечения или профилактики гиперинсулинемии и/или резистентности к инсулину у пациентов, нуждающихся в таком лечении, и указанный способ заключается в том, что фармацевтическую композицию или фармацевтическую дозированную форму вводят пациенту, как описано в данном контексте. В другом объекте настоящего изобретения предлагается применение фармацевтической композиции или фармацевтической дозированной формы, описанных в данном контексте, для получения лекарственного средства, предназначенного для профилактики, замедления и приостановки прогрессирования или лечения метаболического нарушения, выбранного из группы, включающей сахарный диабет типа 1, сахарный диабет типа 2, нарушенную толерантность к глюкозе, нарушенный уровень глюкозы в крови натощак, гипергликемию, гипергликемию после приема пищи, избыточную массу тела, ожирение и метаболический синдром; или улучшения гликемического контроля и/или для снижения уровня глюкозы в плазме натощак, уровня глюкозы в плазме после приема пищи и/или гликозилированного гемоглобина HbA1c; или профилактики, замедления, приостановки прогрессирования или обращения прогрессирования нарушенную толерантность к глюкозе, нарушенный уровень глюкозы в крови натощак, резистентности к инсулину и/или метаболического синдрома при сахарном диабете типа 2; или профилактики, замедления, приостановки прогрессирования или лечения состояния или нарушения,выбранного из группы, включающей осложнения при сахарном диабете, такие как, например, катаракта и микро- и макрососудистые заболевания, такие как нефропатия, ретинопатия, невропатия, ишемия тканей, диабетическая стопа, артериосклероз, инфаркт миокарда, острый коронарный синдром, нестабильная стенокардия, стабильная стенокардия, инсульт, окклюзионное заболевание периферической артерии,кардиомиопатия, сердечная недостаточность, нарушение ритма сердца и сосудистый рестеноз; или снижения массы тела или профилактики повышения массы тела; или ускорения снижения массы тела; или профилактики, замедления, приостановки прогрессирования; или лечения дегенерации бета-клеток поджелудочной железы и/или снижения функции бета-клеток поджелудочной железы и/или для улучшения и/или восстановления функции бета-клеток поджелудочной железы и/или восстановления функциональности секреции инсулина из поджелудочной железы; или профилактики, замедления, приостановки прогрессирования или лечения заболеваний или состояний, связанных с аномальным накоплением жира в печени; или поддержания и/или улучшения чувствительности к инсулину и/или лечения или профилактики гиперинсулинемии и/или резистентности к инсулину,у пациентов, нуждающихся в таком лечении, и указанный способ заключается в том, что ингибиторSGLT2 вводят способом, как описано в данном контексте. В еще одном объекте настоящего изобретения предлагается применение фармацевтической композиции или фармацевтической дозированной формы по настоящему изобретению для получения лекарственного средства, предназначенного для лечения и профилактики, как описано в данном контексте. Таким образом, в настоящем изобретении предлагаются следующие фармацевтические композиции. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак наблюдаются следующие результаты: а) в дозе 2,5 мг: 1) Cmax от 40,3 до 96,3 нмоль/л и 2) AUC от 283 до 677 нмольч/л; и/или б) в дозе 5,0 мг: 1) Cmax от 123 до 230 нмоль/л и 2) AUC от 1,000 до 1,310 нмольч/л; и/или в) в дозе 10,0 мг: 1) Cmax от 143 до 796 нмоль/л и 2) AUC от 1,170 до 3,190 нмольч/л; и/или г) в дозе 25,0 мг: 1) Cmax от 334 до 1,030 нмоль/л и 2) AUC от 2,660 до 7,640 нмольч/л; и/или д) в дозе 50,0 мг: 1) Cmax от 722 до 2,020 нмоль/л и 2) AUC от 6,450 до 14,100 нмольч/л. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак наблюдаются следующие результаты: а) в дозе 2,5 мг: 1) геометрическое среднее значение Cmax в диапазоне от 52,9 до 66,6 нмоль/л,2) геометрическое среднее значение AUC в диапазоне от 394 до 468 нмольч/л; и/или б) в дозе 10,0 мг: 1) геометрическое среднее значение Cmax в диапазоне от 221 до 372 нмоль/л,2) геометрическое среднее значение AUC в диапазоне от 1,690 до 2,660 нмольч/л; и/или в) в дозе 25,0 мг: 1) геометрическое среднее значение Cmax в диапазоне от 490 до 709 нмоль/л,2) геометрическое среднее значение AUC в диапазоне от 3,750 до 6,130 нмольч/л; и/или г) в дозе 50,0 мг: 1) геометрическое среднее значение Cmax в диапазоне от 1,080 до 1,140 нмоль/л,2) геометрическое среднее значение AUC в диапазоне от 8,310 до 8,460 нмольч/л. Фармацевтическая композиция, включающая соединение формулы (I.9), при введении которой человеку натощак наблюдаются следующие результаты: а) в однократной дозе 2,5 мг: 1) Cmax в диапазоне от 42,8 до 81,2 нмоль/л,2) AUC0-inf в диапазоне от 326 до 631 нмольч/л; и/или б) в однократной дозе 5,0 мг: 1) Cmax в диапазоне от 123 до 230 нмоль/л,2) AUC0-inf в диапазоне от 1,000 до 1,310 нмольч/л; и/или в) в однократной дозе 10,0 мг: 1) Cmax в диапазоне от 143 до 796 нмоль/л,2) AUC0-inf в диапазоне от 1,170 до 3,190 нмольч/л; и/или г) в однократной дозе 25,0 мг: 1) Cmax в диапазоне от 334 до 1,030 нмоль/л,2) AUC0-inf в диапазоне от 2,660 до 7,170 нмольч/л; и/или д) в однократной дозе 50,0 мг: 1) Cmax в диапазоне от 722 до 2,020 нмоль/л,2) AUC0-inf в диапазоне от 6,450 до 14,100 нмольч/л. Фармацевтическая композиция, включающая соединение формулы (I.9), при введении которой человеку натощак наблюдаются следующие результаты: а) в однократной дозе 2,5 мг: 1) геометрическое среднее значение Cmax в диапазоне от 52,9 до 61,3 нмоль/л,2) геометрическое среднее значение AUC0-inf в диапазоне от 394 до 468 нмольч/л; и/или б) в однократной дозе 10,0 мг: 1) геометрическое среднее значение Cmax в диапазоне от 221 до 372 нмоль/л,2) геометрическое среднее значение AUC0-inf в диапазоне от 1,690 до 2,660 нмольч/л; и/или в) в однократной дозе 25,0 мг: 1) геометрическое среднее значение Cmax в диапазоне от 490 до 709 нмоль/л,2) геометрическое среднее значение AUC0-inf в диапазоне от 3,750 до 6,130 нмольч/л; и/или г) в однократной дозе 50,0 мг: 1) геометрическое среднее значение Cmax в диапазоне от 1,080 до 1,140 нмоль/л,2) геометрическое среднее значение AUC0-inf в диапазоне от 8,310 до 8,460 нмольч/л. Фармацевтическая композиция, включающая соединение формулы (I.9), при введении которой человеку натощак наблюдаются следующие результаты: а) в многократных дозах 2,5 мг: 1) Cmax,ss в диапазоне от 40,3 до 96,3 нмоль/л,2) AUC,ss в диапазоне от 283 до 677 нмольч/л; и/или б) в многократных дозах 10,0 мг: 1) Cmax,ss в диапазоне от 166 до 479 нмоль/л,2) AUC,ss в диапазоне от 1,350 до 2,600 нмольч/л; и/или в) в многократных дозах 25,0 мг: 1) Cmax,ss в диапазоне от 443 до 907 нмоль/л,2) AUC,ss в диапазоне от 2,790 до 7,640 нмольч/л. Фармацевтическая композиция, включающая соединение формулы (I.9), при введении которой человеку натощак наблюдаются следующие результаты: а) в многократных дозах 10,0 мг: 1) геометрическое среднее значение Cmax,ss в диапазоне от 252 до 272 нмоль/л,2) геометрическое среднее значение AUC,ss в диапазоне от 1,850 до 2,000 нмольч/л; и/или б) в многократных дозах 25,0 мг: 1) геометрическое среднее значение Cmax,ss в диапазоне от 622 до 676 нмоль/л,2) геометрическое среднее значение AUC,ss в диапазоне от 4,640 до 4,890 нмольч/л. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак наблюдаются следующие нормированные по дозе результаты:AUC0-inf, norm в диапазоне от 106 до 306 нмольч/л/мг. В одном варианте при введении указанной фармацевтической композиции наблюдаются указанные нормированные по дозе Cmax, norm и AUC0-inf, norm в дозах указанного соединения формулы (I.9) в диапазоне от 2,5 до 50 мг. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак наблюдаются следующие результаты: нормированные по дозе Cmax, norm в диапазоне от 13 до 80 нмоль/л/мг иAUC0-inf, norm от 106 до 306 нмольч/л/мг в дозах указанного соединения формулы (I.9) в диапазоне от 5 до 25 мг. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак наблюдаются следующие результаты: нормированное по дозе геометрическое среднее значение Cmax, norm в диапазоне от 20 до 37 нмоль/л/мг и нормированное по дозе геометрическое среднее значение AUC0-inf, norm в диапазоне от 150 до 266 нмольч/л/мг. В одном варианте при введении фармацевтической композиции наблюдаются указанные нормированные значения Cmax,norm и AUC0-inf,norm в дозах указанного соединения формулы (I.9) в диапазоне от 2,5 до 50 мг и выше. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак наблюдаются следующие результаты: нормированное по дозе геометрическое среднее значение Cmax, norm в диапазоне от 20 до 37 нмоль/л/мг и нормированное по дозе геометрическое среднее значение AUC0-inf, norm в диапазоне от 150 до 266 нмольч/л/мг в дозах указанного соединения формулы (I.9) в диапазоне от 5 до 25 мг. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак наблюдаются следующие результаты: нормированное по дозе значение Cmax, norm в диапазоне от 13 до 80 нмоль/л/мг и нормированное по дозе значение AUC0-inf, norm в диапазоне от 106 до 287 нмольч/л/мг. В одном варианте при введении указанной фармацевтической композиции наблюдаются указанные нормированные по дозе значения Cmax, norm и AUC0-inf, norm в дозах указанного соединения формулы (I.9) в диапазоне от 2,5 до 50 мг при введении человеку натощак в однократной дозе. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак в однократной дозе наблюдаются следующие результаты: нормированное по дозе значение Cmax, norm в диапазоне от 13 до 80 нмоль/л/мг и нормированное по дозе значение AUC0-inf, norm в диапазоне от 106 до 287 нмольч/л/мг в дозах указанного соединения формулы (I.9) в диапазоне от 5 до 25 мг. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак в однократной дозе наблюдаются следующие результаты: нормированное по дозе геометрическое среднее значение Cmax, norm в диапазоне от 20 до 37 нмоль/л/мг и нормированное по дозе геометрическое среднее значение AUC0-inf,norm в диапазоне от 150 до 266 нмольч/л/мг. В одном варианте при введении указанной фармацевтической композиции наблюдаются указанные нормированные по дозе геометрические средние значения Cmax, norm и AUC0-inf, norm в дозах указанного соединения формулы (I.9) в диапазоне от 2,5 до 50 мг при введении человеку натощак в однократной дозе. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак в однократной дозе наблюдаются следующие результаты: нормированное по дозе геометрическое среднее значение Cmax, norm в диапазоне от 20 до 37 нмоль/л/мг и нормированное по дозе геометрическое среднее значение AUC0-inf, norm в диапазоне от 150 до 266 нмольч/л/мг в дозах указанного соединения формулы (I.9) в диапазоне от 5 до 25 мг. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак в однократной дозе наблюдаются следующие результаты: нормированное по дозе значение Cmax,ss, norm в диапазоне от 16 до 48 нмоль/л/мг и нормированное по дозе AUC,ss, norm в диапазоне от 112 до 306 нмольч/л/мг. В одном варианте при введении указанной фармацевтической композиции наблюдаются указанные нормированные по дозе значения Cmax,ss, norm и AUC,ss,norm в дозах указанного соединения формулы (I.9) в диапазоне от 5 до 25 мг при введении человеку натощак в многократных дозах. Фармацевтическая композиция, включающая соединение формулы (I.9) при введении которой человеку натощак в многократных дозах наблюдаются следующие результаты: нормированное по дозе геометрическое среднее значение Cmax,ss, norm в диапазоне от 25 до 27 нмоль/л/мг и нормированное по дозе геометрическое среднее значение AUC,ss, norm в диапазоне от 184 до 200 нмольч/л/мг. В одном варианте при введении указанной фармацевтической композиции наблюдаются указанные нормированные по дозе геометрические средние значения Cmax,ss, norm и AUC,ss, norm в дозах указанного соединения формулы (I.9) в диапазоне от 2,5 до 25 мг при введении человеку натощак в многократных дозах. Фармацевтическая композиция, как указано выше, распределение частиц которой по размерам составляет Х 90200 мкм. Фармацевтическая композиция, как указано выше, в которой содержание указанного соединения формулы (I.9) составляет 25% или менее в расчете на массу указанной композиции. Фармацевтическая композиция, включающая соединение формулы (I.9) распределение частиц которой по размерам составляет Х 90200 мкм, причем содержание указанного соединения формулы (I.9) составляет 25% или менее в расчете на массу указанной композиции. Фармацевтическая композиция, как указано выше, которая включает кристаллическую форму (I.9X) указанного соединения формулы (I.9). Фармацевтическая композиция, как указано выше, распределение частиц которой по размерам составляет Х 90150 мкм, Х 90100 мкм или Х 9090 мкм. Фармацевтическая композиция, как указано выше, в которой содержание указанного соединения формулы (I.9) составляет 20% или менее в расчете на массу указанной композиции или 15% или менее в расчете на массу указанной композиции. Фармацевтическая композиция, как указано выше, распределение частиц которой по размерам составляет Х 90100 мкм, причем содержание указанного соединения формулы (I.9) составляет 20% или менее в расчете на массу указанной композиции. Фармацевтическая композиция, как указано выше, распределение частиц которой по размерам составляет Х 9090 мкм, причем содержание указанного соединения формулы (I.9) составляет 15% или менее в расчете на массу указанной композиции. Фармацевтическая композиция, как указано выше, содержащая дезинтегрирующий агент и связующий агент, и массовое соотношение указанного дезинтегрирующего агента и указанного связующего агента составляет от 1,5:3,5 до 1:1. Фармацевтическая композиция, как указано выше, в которой по крайней мере 99 мас.% частиц указанного связующего агента характеризуются диаметром 250 мкм или менее. Фармацевтическая композиция, как указано выше, в которой указанным связующим агентом является гидроксипропилцеллюлоза. Фармацевтическая композиция, как указано выше, которую получают влажной грануляцией с высоким сдвигом, причем указанная композиция дополнительно включает разбавитель, где 5-20 мас.% указанного сухого разбавителя добавляют в композицию после стадии указанной влажной грануляции. Фармацевтическая композиция, как указано выше, в которой указанным разбавителем является микрокристаллическая целлюлоза. Фармацевтическая композиция, как указано выше, причем влажная грануляция с высоким сдвигом включает следующие стадии:(1) предварительное смешивание соединения формулы (I.9) и основной порции эксципиентов,включая связующий агент, в смесителе, при этом получают предварительную смесь;(2) грануляция предварительной смеси, полученной на стадии (1), при добавлении жидкости для грануляции, предпочтительно воды;(3) высушивание гранул, полученных на стадии (2), в сушилке с псевдоожиженным слоем или сушильном шкафу;(4) необязательно, сухое просеивание высушенных гранул, полученных на стадии (3);(5) смешивание сухих гранул, полученных на стадии (4), с остальными эксципиентами, такими как скользящее вещество и смазывающее вещество, в смесителе, при этом получают конечную смесь;(6) таблетирование конечной смеси, полученной на стадии (5), прессованием в пригодном прессе для таблетирования, при этом получают ядра таблеток;(7) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (6). Фармацевтическая композиция, как указано выше, следующего состава: Фармацевтическая композиция, как указано выше, которая дополнительно включает одно или более смазывающих веществ. Фармацевтическая композиция, как указано выше, в которой смазывающим веществом является стеарат магния. Фармацевтическая композиция, как указано выше, которая дополнительно включает одно или более скользящих веществ. Фармацевтическая композиция, как указано выше, в которой скользящим веществом является коллоидный диоксид кремния. Фармацевтическая композиция, как указано выше, которая дополнительно включает одно или более пленочных покрытий. Фармацевтическая композиция, как указано выше, в которой указанное пленочное покрытие наносят в количестве 1-5% и которая включает гипромеллозу, полиэтиленгликоль, тальк, диоксид титана,оксиды железа и, необязательно, дополнительно включает красители. Фармацевтическая дозированная форма, включающая любую из фармацевтических композиций,описанных выше. Например, фармацевтическая дозированная форма представляет собой таблетку. Способ лечения заболевания(ний), как описано в данном контексте, включающий введение пациенту любой из фармацевтических композиций или лекарственных форм, описанных в данном контексте. Способ влажной грануляции для получения фармацевтической дозированной формы, включающей соединение формулы (I.9) и один или более эксципиентов, причем указанный способ включает следующие стадии:(1) предварительное смешивание указанного соединения формулы (I.9) и основной порции эксципиентов, включая связующий агент, в смесителе, при этом получают предварительную смесь;(2) грануляция предварительной смеси, полученной на стадии (1), при добавлении жидкости для грануляции, предпочтительно воды;(3) высушивание гранул, полученных на стадии (2), в сушилке с псевдоожиженным слоем или сушильном шкафу;(4) необязательно, просеивание через сито высушенных гранул, полученных на стадии (3);(5) смешивание сухих гранул, полученных на стадии (4), с остальными эксципиентами в смесителе,при этом получают конечную смесь;(6) таблетирование конечной смеси, полученной на стадии (5), прессованием в пригодном прессе для таблетирования, при этом получают ядра таблеток;(7) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (6). В одном варианте по крайней мере 99 мас.% частиц указанного связующего агента характеризуются диаметром 250 мкм или менее. В одном варианте эксципиенты, применяемые на стадии (1), также включают разбавитель, причем 80-95 мас.% разбавителя предварительно смешивают с соединением формулы(I.9) на стадии (1) и разбавитель в количестве 5-20 мас.% добавляют в указанную композицию в качестве сухой добавки на стадии (5). Фармацевтическая композиция, которую получают способом, описанным выше. Процесс прямого прессования для получения фармацевтической композиции, включающей соединение формулы (I.9) и один или более эксципиентов, где указанный способ включает следующие стадии:(1) Предварительное смешивание соединения формулы (I.9) и основной порции эксципиентов в смесителе, при этом получают предварительную смесь;(2) необязательно, сухое просеивание предварительной смеси через сито для отделения слипшихся частиц и повышения однородности смеси;(3) смешивание предварительной смеси, полученной на стадии (1) или (2), в смесителе, необязательно, с добавлением остальных эксципиентов в смесь при перемешивании;(4) таблетирование конечной смеси, полученной на стадии (3), прессованием в пригодном прессе для таблетирования, при этом получают ядра таблеток;(5) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (4). Фармацевтическая композиция, которую получают способом, описанным выше. Способ сухой грануляции для получения фармацевтической композиции, включающей соединение формулы (I.9), и один или более эксципиентов, причем указанный способ включает следующие стадии:(1) Смешивание указанного соединения формулы (I.9) со всеми эксципиентами или порцией эксципиентов в смесителе;(2) уплотнение смеси, полученной на стадии (1), в пригодном ротационном уплотнителе;(3) измельчение лент, полученных на стадии (2), с использованием пригодных стадий измельчения или просеивания, при этом получают гранулы;(4) необязательно, смешивание гранул, полученных на стадии (3), с остальными эксципиентами в смесителе, при этом получают конечную смесь;(5) таблетирование гранул, полученных на стадии (3), или конечной смеси, полученной на стадии(4), прессованием в пригодном прессе для таблетирования, при этом получают ядра таблеток;(6) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (3). Фармацевтическая композиция, которую получают способом, описанным выше. Определения. Термин "активный ингредиент" фармацевтической композиции по настоящему изобретению обозначает ингибитор SGLT2 по настоящему изобретению. В данном контексте иногда вместо термина "активный ингредиент" используется также термин "активное соединение". Термин "индекс массы тела" или "ИМТ" человека обозначает массу в килограммах, деленную на рост в метрах в квадрате, и в единицах измерения ИМТ кг/м 2. Термин "избыточная масса тела" обозначает состояние, при котором ИМТ у пациента составляет более 25 кг/м 2, но менее 30 кг/м 2. Термины "избыточная масса" и "предожирение" используются взаимозаменяемо. Термин "ожирение" обозначает состояние, в котором ИМТ у пациента равен 30 кг/м 2 или более. Согласно определению ВОЗ термин ожирение классифицируют следующим образом: термин "ожирение первого класса" обозначает состояние, в котором ИМТ равен 30 кг/м 2 или более, но менее 35 кг/м 2, термин "ожирение второго класса" обозначает состояние, в котором ИМТ равен 35 кг/м 2 или более, но менее 40 кг/м 2, термин "ожирение третьего класса" обозначает состояние, в котором ИМТ равен 40 кг/м 2 или более. Термин "висцеральное ожирение" обозначает состояние, в котором соотношение окружности талии и окружности бедер равно 1,0 или более у мужчин и 0,8 или более у женщин. Такой показатель обозначает риск развития резистентности к инсулину и предиабета. Термин "центральное ожирение" обычно обозначает состояние, в котором окружность талии составляет 40 дюймов или 102 см у мужчин и 35 дюймов или 94 см у женщин. В японской этнической группе или у японских пациентов центральное ожирение обозначает окружность талии 85 см у мужчин и 90 см у женщин (см., например, данные комитета по исследованию метаболического синдрома в Японии). Термин "эугликемия" обозначает состояние, в котором у пациента концентрация глюкозы в крови натощак находится в пределах нормального диапазона, более 70 мг/дл (3,89 ммоль/л) и менее 110 мг/дл(6,11 ммоль/л). Термин "натощак" является обычным медицинским значением. Термин "гипергликемия" обозначает состояние, при котором у пациента концентрация глюкозы в крови натощак составляет значение выше предела нормального диапазона, более 110 мг/дл(6,11 ммоль/л). Термин "натощак" является обычным медицинским термином. Термин "гипогликемия" обозначает состояние, при котором у пациента концентрация глюкозы в крови натощак составляет значение ниже предела нормального диапазона от 60 до 115 мг/дл (от 3,3 до 6,3 ммоль/л). Термин "гипергликемия после приема пищи" обозначает состояние, при котором у пациента концентрация глюкозы в крови или сыворотке через 2 ч после приема пищи составляет более 200 мг/дл(11,11 ммоль/л). Термин "нарушенный уровень глюкозы натощак (IFG)" обозначает состояние, при котором у пациента концентрация глюкозы в крови натощак или концентрация глюкозы в сыворотке натощак находится в диапазоне от 100 до 125 мг/дл (т.е. от 5,6 до 6,9 ммоль/л), прежде всего более 110 мг/дл и менее 126 мг/дл (7,00 ммоль/л). "Нормальный уровень глюкозы натощак" в крови у пациента обозначает концентрацию глюкозы натощак менее 100 мг/дл, т.е. менее 5,6 ммоль/л. Термин "нарушенная толерантность к глюкозе (IGT)" обозначает состояние, при котором концентрация глюкозы в крови или сыворотке у пациента через 2 ч после приема пищи составляет более 140 мг/дл (7,78 ммоль/л) и менее 200 мг/дл (11,11 ммоль/л). Аномальную толерантность к глюкозе, т.е. концентрацию глюкозы в крови или сыворотке через 2 ч после приема пищи, измеряют по уровню сахара в крови в мг глюкозы на 1 дл плазмы через 2 ч после приема 75 г глюкозы натощак. "Нормальная толерантность к глюкозе" у пациента соответствует концентрации глюкозы в крови или сыворотке через 2 ч после приема пищи менее 140 мг/дл (7,78 ммоль/л). Термин "гиперинсулинемия" обозначет состояние, при котором у пациента с резистентностью к инсулину, при наличии эугликемии или при ее отсутствии, концентрация инсулина натощак или после приема пищи в сыворотке или плазме составляет более высокое значение по сравнению с нормальными худыми пациентами без резистентности к инсулину, у которых соотношение окружности талии и окружности бедер составляет 1,0 (для мужчин) или 0,8 (для женщин). Термины "сенисибилизация к инсулину", "улучшение резистентности к инсулину" или "снижение резистентности к инсулину" являются синонимами и используются взаимозаменяемо. Термин "резистентность к инсулину" обозначает состояние, при котором требуется избыточное количество инсулина в кровотоке по сравнению с нормальной ответной реакцией на поступление глюкозы,чтобы поддержать эугликемическое состояние (Ford E.S. et al., JAMA, 287, 356-359 (2002. Способ определения резистентности к инсулину включает эугликемический-гиперинсулинемический клэмп-метод. Соотношение инсулина и глюкозы определяют методом совместной инфузии инсулина и глюкозы. Резистентность к инсулину определяют по абсорбции глюкозы, составляющей величину ниже 25-ного процентиля в основной исследуемой популяции (методика ВОЗ). Достаточно менее трудоемкими по сравнению с клэмп-методом являются методы так называемых минимальных моделей, в которых в ходе внутривенного глюкозотолерантного теста концентрацию глюкозы и инсулина в крови измеряют через определенные интервалы времени и полученные данные используют для расчета индекса резистентности к инсулину. Такой метод не позволяет различить резистентность к инсулину клеток печени или периферических тканей. Кроме того, резистентность к инсулину, ответную реакцию пациента с резистентностью к инсулину на лечение, чувствительность к инсулину и гиперинсулинемию можно оценивать по показателю "гомеостатической модели оценки резистентности к инсулину (ГМО-РИ)", который является достоверным показателем резистентности к инсулину (Katsuki А. et al., Diabetes Care, 24: 362-365 (2001. Методы определения индекса ГМО-РИ для оценки чувствительности к инсулину описаны в статье (Matthews et al.,Diabetologia, 28, 412-419 (1985, соотношения интактного проинсулина и инсулина и эугликемический клэмп-метод описаны в статье (Forst et al., Diabetes, 52(Suppl.1): A459 (2003. Кроме того, можно контролировать уровень адипонектина в плазме, как косвенный показатель чувствительности к инсулину. Значение резистентности к инсулину методом ГМО-РИ рассчитывают по формуле (Galvin P. et al., DiabetMed., 9:921-928(1992: ГМО-РИ=[концентрация инсулина в сыворотке натощак (мкЕ/мл)][концентрация глюкозы в плазме натощак (ммоль/л)/22,5]. Как правило, в ежедневной клинической практике для оценки резистентности к инсулину используют другие параметры. Предпочтительно, например, используют концентрацию триглицеридов у пациентов, поскольку повышенный уровень триглицеридов строго коррелирует с наличием резистентности к инсулину. У пациентов, предрасположенных к развитию IFG или НГТ или диабета типа 2, установлен диагноз эугликемии с гиперинсулинемией и у них по определению развивается резистентность к инсулину. Типичные пациенты с резистентностью к инсулину обычно характеризуются избыточной массой тела и ожирением. Если установлена резистентность к инсулину, то она прежде всего является серьезным признаком наличия предиабета. Таким образом, для того чтобы поддержать гомеостаз глюкозы, пациенту необходимо в 2-3 раза больше инсулина, по сравнению со здоровым человеком, при этом клинические симптомы не наблюдаются. Для исследования функциональности бета-клеток поджелудочной железы используют методы, аналогичные описанным выше для определения чувствительности к инсулину, гиперинсулинемии или резистентности к инсулину: улучшение функциональности бета-клеток можно, например, оценивать по индексу ГМО-РИ для функциональности бета-клеток (Matthews et al., Diabetologia, 28, 412-419, (1985, соотношению интактного проинсулина и инсулина (Forst et al., Diabetes, 52(Suppl.1): A459 (2003, секреции инсулина/С-пептида после перорального глюкозотолерантного теста и теста на толерантность к пище или с использованием гипергликемического клэмп-теста и/или минимального моделирования после многократного отбора крови в ходе внутривенного глюкозотолерантного теста (Stumvoll et al., Eur. J.Clin. Invest, 31, 380-381 (2001. Термин "предиабет" обозначает состояние, при котором пациент предрасположен к развитию диабета типа 2. Предиабет предполагает определение нарушенной толерантности к глюкозе для включения пациентов с уровнем глюкозы в крови натощак выше нормального диапазона 100 мг/дл (J.В. Meigs etal., Diabetes, 52, 1475-1484 (2003 и гиперинсулинемией натощак (повышенная концентрация инсулина в плазме). Научные и медицинские основы для определения предиабета, как серьезной угрозы здоровью,изложены в совместном заключении Американской ассоциации по диабету и Национального института диабета, заболеваний желудочно-кишечного тракта и почек ("The Prevention or Delay of Type 2 Diabetes",Diabetes Care, 25, 742-749 (2002. У пациентов с резистентностью к инсулину наблюдаются два или более следующих симптомов: 1) избыточная масса тела или ожирение, 2) высокое кровяное давление, 3) гиперлипидемия, 4) один или более симптомов 1-й степени в зависимости от диагноза IFG или НГТ или диабета типа 2. Резистентность к инсулину у таких пациентов можно подтвердить по индексу ГМО-РИ. Согласно настоящему изобретению резистентность к инсулину определяют по клиническому состоянию, при котором у пациента индекс ГМО-РИ составляет 4,0 или индекс ГМО-РИ выше верхнего предела нормального диапазона, который определяют по данным лабораторного анализа уровней глюкозы и инсулина. Термин "диабет типа 2" обозначает состояние, при котором у пациента концентрация глюкозы в крови натощак или концентрация глюкозы в плазме натощак составляет более 125 мл/дл (6,94 ммоль/л). Уровень глюкозы в крови определяют стандартным методом лабораторного анализа. Если проводят глюкозотолерантный тест, уровень сахара в крови больного диабетом превышает 200 мг глюкозы на 1 дл(11,1 ммоль/л) в плазме через 2 ч после приема 75 г глюкозы на пустой желудок. При проведении глюкозотолерантного теста 75 г глюкозы пациент принимает перорально после голодания в течение 10-12 ч и уровень глюкозы регистрируют непосредственно перед приемом глюкозы и через 1 и 2 ч после ее приема. У здорового человека уровень сахара в крови перед приемом глюкозы составляет от 60 до 110 мг на 1 дл плазмы, менее 200 мг/дл через 1 ч после приема глюкозы и менее 140 мг/дл через 2 ч после приема глюкозы. Если через 2 ч значение составляет от 140 до 200 мг, то у пациента наблюдается аномальная толерантность к глюкозе. Термин "поздняя стадия сахарного диабета типа 2" включает пациентов, не поддающихся вторичному курсу лечения, которым показана инсулинотерапия и у которых наблюдается прогрессирование микро- и макрососудистых осложнений, например диабетическая нефропатия или ишемическая болезнь сердца. Термин "HbA1c" представляет собой продукт неферментативного гликозилирования цепи гемоглобина В, известный специалистам в данной области. При мониторинге в ходе лечения сахарного диабета уровень HbA1c является чрезвычайно важным. Поскольку его продуцирование в значительной степени зависит от уровня сахара в крови и периода жизни эритроцитов, уровень HbA1c в качестве "памяти уровня сахара в крови" отражает средний уровень сахара в крови в течение 4-6 недель. Пациенты с сахарным диабетом, у которых уровень HbA1c постоянно поддерживается в ходе интенсивного лечения диабета (т.е. 6,5% от общего гемоглобина в образце), в значительной степени защищены от диабетической микроангиопатии. Например, метформин сам по себе обеспечивает среднее улучшение уровняHbA1c у пациента с диабетом на 1,0-1,5%. Такое снижение уровня HbA1c является недостаточным для всех пациентов с диабетом, чтобы достичь требуемого уровня HbA1c 6,5% и предпочтительно 6%. Термин "недостаточный гликемический контроль", использованный в данном контексте, обозначает состояние, при котором у пациента уровень HbA1c составляет более 6,5%, предпочтительно более 7,0%,более предпочтительно более 7,5%, прежде всего более 8%."Метаболический синдром", так называемый "синдром X" (если используется в контексте метаболического нарушения), и так называемый "дисметаболический синдром" представляет собой комплекс синдромов с основным показателем резистентности к инсулину (Laaksonen D.E. et al., Am. J. Epidemiol. 156, 1070-1077 (2002. Согласно инструкциям ATP III/NCEP (Основные положения третьего отчета Национальной образовательной программы по холестерину (NCEP) панель экспертов по детекции, анализу и лечению высокого уровня холестерина в крови у взрослых (Панель лечения взрослых III), Journal of theAmerican Medical Association 285, 2486-2497 (2001 диагностика метаболического синдрома основана на трех или более следующих факторов риска: 1) центральное ожирение, если окружность талии 40 дюймов или 102 см у мужчин и 35 дюймов или 94 см у женщин, или в японской этнической группе или у японских пациентов окружность талии 85 см у мужчин и 90 см у женщин; 2) триглицериды 150 мг/дл; 3) холестерин-ЛПВП 40 мг/дл у мужчин; 4) кровяное давление 130/85 мм рт. ст. (СКД 130 или ДКД 85); 5) уровень глюкозы в крови натощак 110 мг/дл. Рекомендации NCEP были утверждены в 2002 г (Laaksonen D.E. et al., Am. J. Epidemiol. 156, 10701077 (2002. Уровни триглицеридов и холестерина-ЛПВП в крови можно также определить стандартными методами лабораторных анализов и описаны, например, в справочнике Thomas L. (ред.) "Labor undDiagnose", TH-Books Verlagsgesellschaft mbH, Frankfurt/Main, 2000. Широко известный термин "гипертензия" обозначает состояние, при котором систолическое кровяное давление (СКД) превышает 140 мм рт. ст. и диастолическое кровяное давление (ДКД) превышает 90 мм рт. ст. Если у пациента установлен диагноз диабет, в последнее время рекомендуется, снижать систолическое кровяное давление до менее 130 мм рт. ст. и диастолическое кровяное давление до менее 80 мм рт. ст. Термин "ингибитор SGLT2", использованный в данном контексте, обозначает соединения, прежде всего глюкопиранозилпроизводные, т.е. соединения, содержащие глюкопиранозильный фрагмент, которые ингибируют натрийзависимый белок-переносчик глюкозы 2 (SGLT2), прежде всего SGLT2 человека(hSGLT2). Предпочтительно соединения, ингибирующие hSGLT2, характеризуются значением IC50 менее 1000 нМ, более предпочтительно менее 100 нМ, наиболее предпочтительно менее 50 нМ. Ингибирующую активность соединений в отношении hSGLT2 можно оценить методами, описанными в литературе, прежде всего описанными в заявках WO 2005/092877 или WO 2007/093610 (с. 23-24), которые включены в полном объеме в настоящее описание. Термин "ингибитор SGLT2" включает также любые их фармацевтически приемлемые соли, гидраты и сольваты, включая соответствующие кристаллические формы. Термин "лечение" включает медикаментозное лечение пациентов, у которых наблюдается прогрессирование указанного состояния, прежде всего в явной форме. Медикаментозное лечение представляет собой симптоматическое лечение для снижения интенсивности симптомов специфического состояния или этиотропное лечение для обращения или частичного обращения симптомов состояния или для приостановки или замедления прогрессирования заболевания. Таким образом, композиции и способы по настоящему изобретению можно использовать, например, для медикаментозного лечения в течение определенного периода времени, а также для продолжительного курса лечения. Термины "профилактическое лечение", "профилактика" являются взаимозаменяемыми и включают лечение пациентов группы риска развития вышеупомянутых состояний с целью снижения упомянутого риска. Термин "таблетка" обозначает таблетки без покрытия и таблетки с одним или более покрытиями. Кроме того, термин "таблетка" включает одно-, двух-, трех- или многослойные таблетки, а также таблетки с прессованным покрытием, при этом каждый из указанных типов таблеток не содержит или содержит одно или более покрытий. Термин "таблетка" включает также мини-таблетки, плавящиеся, жевательные, шипучие и пероральные распадающиеся таблетки. Термин "фармакопея" включает стандартные фармакопеи, такие как фармакопея США, "USP 31-NF 26, второе дополненное издание" (United States Pharmacopeial Convention) или "европейская фармакопея 6.3" (European Directorate for the Quality of Medicines and Health Care, 2000-2009). Краткое описание фигур На фиг. 1 представлена порошкообразная рентгеновская дифрактограмма кристаллической формы(I.9X) соединения (I.9). На фиг. 2 представлены результаты термического анализа и определения температуры плавления кристаллической формы (I.9X) соединения (I.9), полученные методом ДСК. На фиг. 3 представлены результаты введения соединения по настоящему изобретению крысам линии ZDF. Подробное описание настоящего изобретения Объекты настоящего изобретения, прежде всего фармацевтические композиции, способы и применения, относятся к ингибиторам SGLT2, как описано в данном контексте. Предпочтительно ингибитор SGLT2 выбран из глюкопиранозилзамещенных производных бензола формулы (I)R3 обозначает (R)-тетрагидрофуран-3-илоксигруппу или (S)-тетрагидрофуран-3-илоксигруппу,или пролекарство одного из вышеупомянутых ингибиторов SGLT2. Соединения формулы (I) и способы их получения описаны, например, в следующих заявках:WO 2005/092877, WO 2006/117360, WO 2006/117359, WO 2006/120208, WO 2006/064033,WO 2007/031548, WO 2007/093610, WO 2008/020011, WO 2008/055870. Вышеупомянутые глюкопиранозилзамещенные производные бензола формулы (I) содержат следующие предпочтительные заместители:R1 предпочтительно обозначает хлор или цианогруппу, прежде всего хлор;R3 предпочтительно обозначает (R)-тетрагидрофуран-3-илоксигруппу или (S)-тетрагидрофуран-3 илоксигруппу. Глюкопиранозилзамещенные производные бензола формулы (I) предпочтительно выбирают из группы, включающей соединения (I.8)-(I.11): Более предпочтительные глюкопиранозилзамещенные производные бензола формулы (I) выбирают из группы, включающей соединения (I.8), (I.9) и (I.11). Еще более предпочтительные глюкопиранозилзамещенные производные бензола формулы (I) выбирают из группы, включающей соединения (I.8) и (I.9). Согласно настоящему изобретению определения вышеперечисленных глюкопиранозилзамещенных производных бензола формулы (I) также включают их гидраты, сольваты и полиморфные формы, а также пролекарства. Кристаллическая форма предпочтительного соединения (I.8) описана в заявкеWO 2006/117360, которая включена в полном объеме в описание настоящего изобретения. Кристаллическая форма предпочтительного соединения (I.9) описана в заявке WO 2006/117359, которая включена в полном объеме в описание настоящего изобретения. Кристаллическая форма предпочтительного соединения (I.11), описана в заявке WO 2008/049923, которая включена в полном объеме в описание настоящего изобретения. Указанные кристаллические формы характеризуются достаточно высоким профилем растворения,что обеспечивает достаточно высокую биодоступность ингибитора SGLT2. Кроме того, кристаллические формы соединений характеризуются физико-химической стабильностью, что обеспечивает достаточно высокую стабильность фармацевтической композиции при хранении. Для исключения любых неопределенностей цитированные документы, в которых описаны указанные выше ингибиторы SGLT2, в полном объеме включены в настоящее описание в качестве ссылки. Предпочтительная кристаллическая форма (I.9X) соединения (I.9) характеризуется порошковой рентгеновской дифрактограммой (излучение CuK), которая включает пики угла 2 при 18,84, 20,36 и 25,21 (0,1 2). Предпочтительно указанная порошкообразная рентгеновская дифрактограмма (излучение CuK1) включает пики угла 2 при 14,69, 18,84, 19,16, 19,50, 20,36 и 25,21 (0,1 2). Предпочтительно указанная порошкообразная рентгеновская дифрактограмма (излучение CuK1) включает пики угла 2 при 14,69, 17,95, 18,43, 18,84, 19,16, 19,50, 20,36, 22,71, 23,44, 24,81, 25,21 и 25,65(0,1 угла 2). Более конкретно, кристаллическая форма (I.9X) характеризуется порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuK1, которая включает пики угла 2 (0,1 2), указанные в табл. 1. Наиболее характерны пики с относительной интенсивностью I/I0 выше 20. Таблица 1 Порошковая рентгенограмма кристаллической формы соединения(I.9X) (приведены пики только вплоть до 30 угла 2) Еще более предпочтительно кристаллическая форма (I.9X) характеризуется порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuK1, которая включает пики при углах 2 (0,1 2), указанные на фиг. 1. Кроме того, кристаллическая форма (I.9X) характеризуется температурой плавления, равной приблизительно 1495 С (которую определяли методом ДСК и которая обозначает температуру начала плавления, скорость нагревания 19 K/мин). Полученная методом ДСК зависимость приведена на фиг. 2. Порошковые рентгеновские дифрактограммы по настоящему изобретению получали в режиме пропускания с использованием дифрактометра STOE - STADI Р, оборудованном детектором положения(OED) и анодом из Cu, в качестве источника рентгеновского излучения использовали излучение CuK1,=1,54056 , 40 кВ, 40 мА). В табл. 1, указанной выше, значения "2 []" обозначают величину угла дифракции, а значения "d []" обозначают указанные межплоскостные расстояния в кристаллической решетке в . Интенсивности, указанные на фиг. 1, приведены в единицах имп/с. С учетом экспериментальной ошибки указанные выше значения углов 2 следует считать точными с отклонением 0,1 2, прежде всего 0,05 2. Следует отметить, что для определения соответствия образца соединения (I.9) кристаллической форме по изобретению, значение угла 2, наблюдаемые на дифрактограмме образца, должно совпадать с характеристическим значением, указанным выше, при этом значение может отличаться от характеристического значения на величину не более 0,1 2, прежде всего не более 0,05 2. Температуру плавления определяли методом ДСК (дифференциальная сканирующая калориметрия) на установке DSC 821 (фирмы Mettler Toledo). В одном варианте фармацевтическая композиция или фармацевтическая дозированная форма по настоящему изобретению содержит соединение (I.9), при этом по крайней мере 50 мас.% соединения(I.9) присутствует в виде кристаллической формы (I.9X), описанной в данном контексте. Предпочтительно в указанной композиции или стандартной лекарственной форме по крайней мере 80 мас.%, более предпочтительно по крайней мере 90 мас.% соединения (I.9) присутствует в виде кристаллической формы (I.9X), описанной в данном контексте. На профиль растворения фармацевтической композиции и фармацевтической дозированной формы по изобретению, содержащих активные фармацевтические ингредиенты, наряду с прочими факторами оказывают влияние размер частиц и распределение частиц по размеру соответствующего активного фармацевтического ингредиента. Активные фармацевтические ингредиенты, входящие в состав фармацевтической композиции и фармацевтической дозированной формы по изобретению, предпочтительно характеризуются следующим объемным распределением частиц по размеру: по крайней мере 90% соответствующих частиц активного фармацевтического ингредиента характеризуются размером менее 200 мкм, т.е. Х 90200 мкм. Прежде всего, было установлено, что размер частиц глюкопиранозилзамещенного производного бензола формулы (I), прежде всего соединения (I.9) или его кристаллической формы (I.9X), оказывает влияние на технологичность композиции. Прежде всего, было установлено, что на технологичность композиции оказывают влияние частицы малого размера, прежде всего чрезвычайно малого размера (например, так называемые "тонкодисперсные" частицы, т.е. частицы, размер которых составляет менее 63 мкм) за счет их слипания или образования пленки во время процесса таблетирования. С другой стороны, частицы слишком большого размера оказывают отрицательное действие на профиль растворения фармацевтической композиции и фармацевтической дозированной формы, и таким образом снижают их биодоступность. Ниже описаны предпочтительные диапазоны распределения частиц по размерам. Следовательно, в одном объекте настоящего изобретения предлагаются фармацевтическая композиция и фармацевтическая дозированная форма по настоящему изобретению, содержащие глюкопиранозилзамещенное производное бензола формулы (I), прежде всего соединение (I.9), предпочтительно в виде кристаллической формы (I.9X), предпочтительно характеризуется следующим объемным распределением частиц по размеру: по крайней мере 90% соответствующего активного фармацевтического ингредиента характеризуются размером частиц менее 200 мкм, т.е. Х 90200 мкм, предпочтительно Х 90150 мкм, более предпочтительно Х 90100 мкм, еще более предпочтительно Х 9090 мкм. Кроме того, указанная композиция характеризуются следующим распределением частиц по размеру: предпочтительно Х 901 мкм, более предпочтительно Х 905 мкм, еще более предпочтительно Х 9010 мкм. Таким образом, указанные композиции характеризуются следующим распределением частиц по размеру: 1 Х 90200 мкм, предпочтительно 1 Х 90150 мкм, более предпочтительно 5 Х 90150 мкм, еще более предпочтительно 5 Х 90100 мкм, наиболее предпочтительно 10 Х 90100 мкм. В предпочтительном варианте Х 9075 мкм. В другом предпочтительном варианте 20 Х 9050 мкм. В еще одном предпочтительном варианте 10 Х 90 75 мкм. В другом предпочтительном варианте 60 Х 90150 мкм. Кроме того, фармацевтическая композиция и фармацевтическая дозированная форма по настоящему изобретению, содержащие глюкопиранозилзамещенное производное бензола формулы (I), прежде всего соединение (I.9), предпочтительно в виде кристаллической формы (I9.X), предпочтительно характеризуются следующим объемным распределением частиц по размеру: предпочтительно Х 5090 мкм,более предпочтительно Х 5075 мкм, еще более предпочтительно Х 5050 мкм, наиболее предпочтительно Х 5040 мкм. С другой стороны, указанные композиции характеризуются следующим распределением частиц по размеру: предпочтительно Х 501 мкм, более предпочтительно Х 505 мкм, еще более предпочтительно Х 508 мкм. Таким образом, указанные композиции характеризуются следующим распределением частиц по размеру: предпочтительно 1 Х 5090 мкм, прежде всего 1 Х 5075 мкм, более предпочтительно 5 Х 5075 мкм, еще более предпочтительно 5 Х 5050 мкм. В предпочтительном варианте 8 Х 5040 мкм. Кроме того, фармацевтическая композиция и фармацевтическая дозированная форма по настоящему изобретению, содержащие глюкопиранозилзамещенное производное бензола формулы (I), прежде всего соединение (I.9), предпочтительно в виде кристаллической формы (I9.X), предпочтительно характеризуются следующим объемным распределением частиц по размеру: предпочтительно X100,1 мкм,- 21024072 более предпочтительно X100,5 мкм, еще более предпочтительно X101 мкм, прежде всего X102 мкм. Кроме того, в предпочтительном варианте X1010 мкм, более предпочтительно Х 105 мкм. Таким образом, в предпочтительном варианте 0,5 мкмХ 1010 мкм, предпочтительно 1 мкмX105 мкм. Таким образом, фармацевтическая композиция и фармацевтическая дозированная форма по настоящему изобретению предпочтительно характеризуются распределением частиц по размеру, указанным выше (Х 90, Х 50 и/или Х 10), или одним из вариантов, описанных ниже. Значение Х 90 соответствует величине 90% на диаграмме объемного распределения, полученной с использованием лазерного дифрактометра. Другими словами согласно настоящему изобретению значение Х 90 обозначает, что в образце присутствует 90% частиц (распределение по объему), диаметр которых меньше указанного значения. Аналогичным образом, значение Х 50 соответствует величине 50%(средний размер 50% частиц) на диаграмме объемного распределения, полученной с использованием лазерного дифрактометра. Другими словами, согласно настоящему изобретению значение Х 50 обозначает, что в образце присутствует 50% частиц (распределение по объему), диаметр которых меньше указанного значения. Аналогичным образом значение Х 10 соответствует величине 10% на диаграмме распределения по объему, полученной с использованием лазерного дифрактометра. Другими словами, согласно настоящему изобретению значение X10 обозначает, что в образце присутствует 10% частиц (распределение по объему), диаметр которых меньше указанного значения. Предпочтительно все значения Х 90, Х 50, X10 (распределение по объему), описанные в данном контексте, получены методом дифракции лазерного излучения, прежде всего методом малоуглового лазерного светорассеяния, т.е. методом на основе дифракции Фраунгофера. Предпочтительный способ анализа описан в экспериментальной части данного описания. Метод дифракции лазерного излучения позволяет определить среднеобъемный размер частицы, который эквивалентен среднемассовому размеру частицы, если плотность не изменяется. Распределение частиц по размерам, полученное с использованием одного метода, можно сравнить с распределением частиц, полученным другим методом, например, другим стандартным методом, известным в данной области техники. В другом варианте распределение частиц по размерам в фармацевтической композиции или лекарственной форме можно определить методом микроскопии, прежде всего методом электронной микроскопии или методом сканирующей электронной микроскопии. Ниже приводится подробное описание пригодных эксципиентов и носителей, входящих в состав фармацевтической композиции по изобретению. Фармацевтическая композиция по изобретению обычно включает один или более разбавителей,один или более дезинтегрирующих агентов, и, необязательно, один или более связующих агентов. Некоторые эксципиенты могут выполнять две или более функции одновременно, например, могут использоваться в качестве наполнителя и связующего агента. Пригодными разбавителями (другое название - наполнители) по настоящему изобретению являются, например, лактоза, прежде всего моногидрат лактозы, целлюлоза и ее производные, такие как порошкообразная целлюлоза, микрокристаллическая или силилированная микрокристаллическая целлюлоза,ацетат целлюлозы, крахмал и его производные, такие как предварительно желатинизированный крахмал,кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, стерильная кукуруза, хлорид натрия, карбонат кальция, фосфат кальция, прежде всего двузамещенный фосфат кальция,сульфат кальция, дикальций или трикальций фосфат, карбонат магния, оксид магния, сахара и их производные, такие как сахарная пудра, фруктоза, сахароза, декстраты, декстрин, комплекс D-сорбита и сульфобутилового эфира -циклодекстрина, декстроза, полидекстроза, трегалоза, мальтоза, мальтит, маннит,мальтодекстрин, сорбит, инулин, ксилит, эритрит, изомальт, каолин и лактит. Предпочтительными разбавителями являются моногидрат лактозы и микрокристаллическая целлюлоза. Пригодными дезиюегирующими агентами по настоящему изобретению, например, являются порошкообразная целлюлоза, кросповидон, натриевая соль кроскармеллозы, докузат натрия, гидроксипропилцеллюлоза с низкой степенью замещения, алюмосиликат магния, микрокристаллическая целлюлоза,полакрилин калия, натриевая соль гликолята крахмала, крахмал, прежде всего предварительно желатинированный крахмал и кукурузный крахмал. Предпочтительным дезинтегрирующим агентом является натриевая соль кроскармеллозы Согласно настоящему изобретению можно использовать любые стандартные связующие агенты,используемые в фармацевтических композициях. В качестве связующих агентов можно использовать,например, природные или частично или полностью синтетические полимеры, выбранные из аравийской камеди, агара, альгиновой кислоты, карбомеров, натриевой соли кармеллозы, каррагинана, фталатацетата целлюлозы, препаратов рожкового дерева, хитозана, сахарной пудры, коповидона, повидона,хлопкового масла, декстрата, декстрина, декстрозы, полидекстрозы, мальтодекстрина, мальтозы, целлюлозы и ее производных, таких как микрокристаллическая целлюлоза, метилцеллюлоза, этилцеллюлоза,гидроксиэтилцеллюлоза, гидроксиэтилметилцеллюлоза, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, гипромеллоза (метиловый эфир гидроксипропилцеллюлозы), крахмала и его производных, таких как предварительно желатинированный крахмал, гидроксипропилкрахмал, кукурузный крахмал, желатина, глицерилбегената, трагакантовой камеди, гуаровой камеди, гидрированных растительных масел, инулина, полоксамера, поликарбофилов, полиэтиленоксида, поливинилпирролидона, сополимеровN-винилпирролидона и винилацетата, полиметакрилатов, полиэтиленгликолей, альгинатов, таких как альгинат натрия, желатина, сахарозы, подсолнечного масла, зеина, а также их производных и смесей. Предпочтительными связующими агентами являются микрокристаллическая целлюлоза и гидроксипропилцеллюлоза. В одном объекте количество частиц малого размера снижают путем использования тонкодисперсного связующего агента для получения фармацевтической композиции или фармацевтической дозированной формы. Соответственно в одном варианте для получения композиции по настоящему изобретению используют связующий агент в виде тонкодисперсных частиц. В настоящем изобретении предлагается способ получения фармацевтической композиции, включающей глюкопиранозилзамещенные производные бензола формулы (I), прежде всего соединение (I.9) или его кристаллическую форму (I.9X), и тонкодисперсный связующий агент. В одном варианте по крайней мере 99 мас.% частиц связующего агента характеризуются размером 250 мкм или менее. В другом варианте по крайней мере 99,5% частиц связующего агента характеризуются размером 250 мкм или менее. Например, связующим агентом в композиции по настоящему изобретению является гидроксипропилцеллюлоза Klucel EXF. Другим примером связующего агента с частицами малого размера является Коповидон Kollidon VA 64 fine. В одном объекте настоящего изобретения используют гидроксипропилцеллюлозу низкой вязкости. Гидроксипропилцеллюлоза различных марок с различной молекулярной массой выпускается различными фирмами, например, 80000, 95000, 140000, 370000, 850000 и 1150000. Гидроксипропилцеллюлоза с низкой молекулярной массой характеризуется низкой вязкостью, гидроксипропилцеллюлоза с высокой молекулярной массой соответственно характеризуется высокой вязкостью. Для получения фармацевтической композиции или фармацевтической дозированной формы по настоящему изобретению предпочтительной является гидроксипропилцеллюлоза с низкой вязкостью. Соответственно в одном варианте для получения фармацевтической композиции или фармацевтической дозированной формы по настоящему изобретению используют марки гидроксипропилцеллюлозы с молекулярной массой не более 370000. В другом варианте для получения фармацевтической композиции или фармацевтической дозированной формы по настоящему изобретению используют марки гидроксипропилцеллюлозы с молекулярной массой не более 140000. В другом варианте для получения фармацевтической композиции или фармацевтической дозированной формы по настоящему изобретению используют марки гидроксипропилцеллюлозы с молекулярной массой 80000 или 95000. Фармацевтическая композиция по настоящему изобретению может также включать один или более смазывающих веществ. Пригодными смазывающими веществами по настоящему изобретению являются стеариновая кислота, а также ее соли, включая тальк, стеарат натрия, стеарат кальция, стеарат цинка,стеарат магния, стеарилфумарат натрия, глицерилмоностеарат, прежде всего стеарат магния, полиэтиленгликоли, прежде всего полиэтиленгликоль с молекулярной массой в диапазоне от приблизительно 4400 до приблизительно 9000, гидрированное касторовое масло, жирная кислота, например, фумаровая кислота, а также соли жирных кислот, прежде всего соли кальция, магния, натрия или калия, например,бегенат кальция, стеарат кальция, стеарилфумарат натрия или стеарат магния (например, продукт HyQual, фирмы Mallinckrodt), глицериды, такие как глицерилбегенат (продукт Compritol 888), продуктыDynasan 118 или Boeson VP. Фармацевтическая композиция по настоящему изобретению может также включать одно или более скользящих соединений. Пригодными скользящими соединениями по настоящему изобретению являются диоксид кремния, прежде всего коллоидный диоксид кремния (например, продукты Аэросил стеарат цинка, стеарат магния, силикат магния, силикат кальция, трисиликат магния и тальк. Предпочтительными скользящими соединениями являются коллоидный диоксид кремния и тальк. В другом варианте фармацевтическая композиция по изобретению включает ингредиенты, указанные ниже в таблице. В одном объекте настоящего изобретения в качестве активного ингредиента предлагается соединение формулы (I), например, соединение формулы (I.9) или его кристаллическая форма (I.9X). В другом варианте изобретения фармацевтическая композиция включает ингредиенты, указанные ниже в таблице. В одном объекте изобретения в качестве активного ингредиента предлагается соединение формулы(I), например, соединение формулы (I.9) или его кристаллическая форма (I.9X). В другом варианте фармацевтическая композиция по изобретению включает ингредиенты, указанные ниже в таблице. В другом объекте изобретения в качестве активного ингредиента используют соединение формулы(I), например, формулы (I.9) или его кристаллическую форму (I.9X). В другом варианте фармацевтическая композиция по изобретению включает ингредиенты, указанные ниже в таблице. В одном объекте изобретения в качестве активного ингредиента предлагается соединение формулы(I), например, соединение формулы (I.9) или его кристаллическая форма (I.9X). В другом варианте фармацевтическая композиция по изобретению включает ингредиенты, указанные ниже в таблице. В одном объекте изобретения в качестве активного ингредиента предлагается соединение формулы(I), например, соединение формулы (I.9) или его кристаллическая форма (I.9X). В другом варианте фармацевтическая композиция по изобретению включает ингредиенты, указанные ниже в таблице. В одном объекте изобретения в качестве активного ингредиента предлагается соединение формулы(I), например, соединение формулы (I.9) или его кристаллическая форма (I.9X). В другом варианте фармацевтическая композиция по изобретению включает ингредиенты, указанные ниже в таблице. В одном объекте изобретения в качестве активного ингредиента предлагается соединение формулы(I), например, соединение формулы (I.9) или его кристаллическая форма (I.9X). В другом варианте фармацевтическая композиция по изобретению включает ингредиенты, указанные ниже в таблице. В одном объекте изобретения в качестве активного ингредиента предлагается соединение формулы(I), например, соединение формулы (I.9) или его кристаллическая форма (I.9X). В другом варианте фармацевтическая композиция по изобретению включает ингредиенты, указанные ниже в таблице. В другом объекте изобретения в качестве активного ингредиента предлагается соединение формулы (I), например, соединение формулы (I.9) или его кристаллическая форма (I.9X). В одном варианте массовое соотношение указанного дезинтегрирующего агента и указанного связующего агента в фармацевтической композиции по изобретению составляет от 1,5:3,5 до 1:1. В другом объекте изобретения было установлено, что количество активного ингредиента, а именно глюкопиранозилзамещенного производного бензола формулы (I), прежде всего соединения (I.9) или его кристаллической формы (I.9X), влияет на технологичность получения фармацевтической композиции или фармацевтической дозированной формы, прежде всего высокое содержание активного ингредиента влияет на технологичность композиции по причине слипания или образования пленки во время процесса таблетирования. Соответственно в одном варианте содержание активного ингредиента составляет 25% или менее в расчете на массу фармацевтической композиции. В другом варианте содержание активного ингредиента составляет 20% или менее, предпочтительно 15% или менее в расчете на массу фармацевтической композиции. Содержание активного ингредиента предпочтительно составляет от 0,5 до 25% в расчете на массу фармацевтической композиции. Более предпочтительно содержание активного ингредиента составляет от 1,0 до 20% в расчете на массу фармацевтической композиции. Еще более предпочтительно содержание активного ингредиента составляет от 2,0 до 15% в расчете на массу фармацевтической композиции. Ниже описаны предпочтительные диапазоны количества глюкопиранозилзамещенного производного бензола в лекарственной форме по настоящему изобретению. Такие диапазоны обозначают количества, которые вводят раз в сутки взрослому пациенту, например, с массой тела приблизительно 70 кг и которые соответственно разделяют на дозы для введения 2, 3, 4 или более раз в сутки с учетом другого способа введения и возраста пациента. Диапазоны доз и количеств рассчитывают для активного ингредиента. Предпочтительно количество глюкопиранозилзамещенного производного бензола, прежде всего соединения (I.9) или его кристаллической формы (I.9X), находится в диапазоне от 0,5 до 100 мг, предпочтительно от 0,5 до 50 мг, более предпочтительно от 1 до 25 мг, еще более предпочтительно от 5 до 25 мг. Предпочтительные дозы глюкопиранозилзамещенного производного бензола составляют, например, 1, 2, 2,5, 5, 7,5, 10, 12,5, 15, 20, 25 и 50 мг. Фармацевтическую композицию по настоящему изобретению можно перерабатывать в таблетки,капсулы или таблетки с пленочным покрытием. В одном варианте таблетка, содержащая фармацевтическую композицию по настоящему изобретению, включает смазывающее вещество, такое как стеарат магния. Указанное смазывающее вещество присутствует в указанной таблетке в концентрации 0,25-2%. В одном варианте таблетка, содержащая фармацевтическую композицию по настоящему изобретению, включает скользящее вещество, такое как коллоидный диоксид кремния. Указанное скользящее вещество содержится в указанной таблетке в концентрации 0,25-2%. На таблетку по настоящему изобретению можно наносить пленочное покрытие. Обычно содержание пленочного покрытия составляет 2-5% в расчете на общую массу композиции, и предпочтительно пленочное покрытие содержит пленкообразующий агент, пластификатор, агент против склеивания и,необязательно, один или более пигментов. Типичная композиция покрытия может включать гидроксипропилметилцеллюлозу (ГПМЦ), ПЭГ, тальк, диоксид титана и, необязательно, оксид железа, включая краситель красного и/или желтого цвета на основе оксида железа. Например, пленочное покрытие по настоящему изобретению включает 50% гипромеллозы, 5% макрогола, 24,75% оксида титана, 20% талька и 0,25% оксида железа желтого (Opadry желтый 02 В 38190). В одном объекте пленочное покрытие по настоящему изобретению включает ингредиенты, указанные в таблице ниже: В одном варианте предлагается фармацевтическая дозированная форма по изобретению со следующим профилем растворения: по крайней мере 75 мас.%, по крайней мере 80 мас.%, предпочтительно по крайней мере 90 мас.% фармацевтически активного ингредиента растворяется через 45 мин. В другом варианте по крайней мере 75 мас.%, по крайней мере 80 мас.%, предпочтительно по крайней мере 90 мас.% фармацевтически активного ингредиента растворяется через 30 мин. В еще одном варианте по крайней мере 65 мас.%, по крайней мере 75 мас.%, по крайней мере 80 мас.%, предпочтительно по крайней мере 90 мас.% фармацевтически активного ингредиента растворяется через 15 мин. Растворимость определяют стандартным способом, например, описанным в сборниках стандартов различных фармакопей, например, в фармакопее США (USP31-NF26 S2, глава 711 (растворимость. В одном варианте фармацевтическая дозированная форма по настоящему изобретению распадается в течение 40 мин, в другом варианте в течение 30 мин, предпочтительно в течение 20 мин, более предпочтительно в течение 15 мин. Распадаемость определяют стандартным способом, например, описанным в сборниках стандартов различных фармакопей, например, в фармакопее США (USP31-NF26 S2, глава 701 (распадаемость. В другом варианте фармацевтическая дозированная форма по настоящему изобретению характеризуется высокой степенью однородности состава, предпочтительно в диапазоне от 85 до 115 мас.%, более предпочтительно от 90 до 110 мас.%, еще более предпочтительно от 95 до 105 мас.% в расчете на массу фармацевтического ингредиента. Однородность состава можно оценить стандартным способом, например, как описано в различных фармакопеях, например, с использованием 10 произвольно выбранных лекарственных форм. Фармацевтическую дозированную форму, такую как таблетка, капсула или таблетка с пленочным покрытием, можно получать стандартными способами, известными специалисту в данной области техники. Пригодные способы получения таблетки включают прессование порошкообразной фармацевтической композиции, т.е. прямое прессование указанной композиции или прессование фармацевтической композиции в форме гранул, и с использованием при необходимости дополнительных эксципиентов. Гранулы фармацевтической композиции по настоящему изобретению можно получать способами,известными специалисту в данной области техники. Предпочтительные способы грануляции активных ингредиентов в смеси с различными эксципиентами включают влажную грануляцию, например, влажную грануляцию в грануляторе с высоким сдвигом и влажную грануляцию в псевдоожиженном слое, сухую грануляцию (так называемое ротационное уплотнение). При влажной грануляции в качестве жидкости для грануляции можно использовать растворитель в отдельности или растворы одного или более связующих агентов в одном растворителе или смеси растворителей. Пригодные связующие агенты описаны в данном контексте. Примеры указанных агентов включают гипромеллозу, гидроксипропилцеллюлозу, повидон и коповидон. Пригодными растворителями являются, например, очищенная вода, этанол, метанол, изопропанол, ацетон, прежде всего очищенная вода,включая их смеси. Растворитель представляет собой летучее соединение, которое отсутствует в конечном продукте. Один или более активных ингредиентов и другие эксципиенты, прежде всего один или более разбавителей, а также один или более дезинтегрирующих агентов, обычно за исключением смазывающего вещества, предварительно смешивают и гранулируют в жидкости для грануляции, например, в грануляторе с высоким сдвигом. После стадии влажной грануляции обычно следует одна или более стадий сушки и просеивания. При этом для сушки продукта можно использовать, например, сушильный шкаф или сушилку с псевдоожиженным слоем. Высушенные гранулы просеивают через сито с требуемым размером ячеек. После необязательного добавления других эксципиентов, прежде всего дезинтегрирующего агента, связующего агента, наполнителя и/или скользящего вещества, за исключением смазывающего вещества, смесь перемешивают в пригодном смесителе, например, в гравитационном смесителе, затем добавляют одно или более смазывающих веществ, например, стеарат магния, и полученную смесь перемешивают. Типичный способ влажной грануляции для получения фармацевтической композиции по настоящему изобретению включает следующие стадии:(1) предварительное смешивание активного ингредиента и основной порции эксципиентов, включая связующий агент, в смесителе, при этом получают предварительную смесь;(2) грануляция предварительной смеси, полученной на стадии (1), при добавлении жидкости для грануляции, прежде всего очищенной воды;(3) высушивание гранул, полученных на стадии (2), в сушилке с псевдоожиженным слоем или сушильном шкафу;(4) необязательно, сухое просеивание высушенных гранул, полученных на стадии (3);(5) смешивание сухих гранул, полученных на стадии (4), с остальными эксципиентами, такими как наполнитель (или разбавитель), связующий агент, дезинтегрирующий агент и/или скользящее вещество,в смесителе, при этом получают основную смесь;(6) смешивание основной смеси, полученной на стадии (5), со смазывающим веществом в смесителе, при этом получают конечную смесь;(7) таблетирование конечной смеси, полученной на стадии (6), при ее прессовании в пригодном прессе для таблетирования, при этом получают ядра таблеток;(8) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (7), при нанесении функционально неактивного покрытия. Было установлено, что добавление порции разбавителя после стадии влажной грануляции, например, в качестве сухой добавки, снижает вероятность слипания и/или образования пленки в процессе получения фармацевтической композиции или фармацевтической дозированной формы. Добавление дополнительного количества разбавителей после стадии влажной грануляции также способствует повыше- 27024072 нию физической стабильности фармацевтической дозированной формы (твердости таблетки). Соответственно в одном варианте в процессе влажной грануляции по настоящему изобретению разбавитель добавляют после проведения влажной грануляции, например, в качестве сухой добавки, такой как, например,компонент, используемый на стадии (5), описанной выше. В одном варианте количество разбавителя,который добавляют после стадии влажной грануляции в качестве сухой добавки, такой как, например,компонент, используемый на стадии (5), описанной выше, составляет от 1 до 20% в расчете на массу таблетки (без пленочного покрытия), предпочтительно от 2,5 до 10% в расчете на массу таблетки (без пленочного покрытия). В качестве разбавителя используют, например, микрокристаллическую целлюлозу. Разбавитель можно добавлять на стадиях (1) и (5), как описано выше в данном контексте. В одном объекте фармацевтическую композицию по настоящему изобретению получают влажной грануляцией с высоким сдвигом. В настоящем изобретении также предлагается фармацевтическая композиция, которую получают способом, описанным выше. Типичный способ прямого прессования по настоящему изобретению для получения фармацевтической композиции включает следующие стадии:(1) предварительное смешивание активного ингредиента и основной порции эксципиентов в смесителе, при этом получают предварительную смесь;(2) необязательно, сухое просеивание предварительной смеси через сито для удаления слипшихся частиц и повышения однородности;(3) смешивание предварительной смеси, полученной на стадии (1) или (2), в смесителе, необязательно с добавлением остальных эксципиентов в смесь, при перемешивании;(4) таблетирование конечной смеси, полученной на стадии (3), при ее прессовании в пригодном прессе для таблетирования, при этом получают ядра таблеток;(5) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (4), при нанесении функционально неактивного покрытия. В настоящем изобретении также предлагается фармацевтическая композиция, которую получают способом, описанным выше. Типичный способ сухой грануляции по настоящему изобретению для получения фармацевтической композиции включает следующие стадии:(1) смешивание активного ингредиента со всеми эксципиентами или порцией эксципиентов в смесителе;(2) уплотнение смеси, полученной на стадии (1), в пригодном ротационном уплотнителе;(3) измельчение лент, полученных на стадии (2), при этом получают гранулы, предпочтительно гранулы небольшого размера, с использованием пригодных стадий измельчения или просеивания;(4) необязательно, смешивание гранул, полученных на стадии (3), с остальными эксципиентами в смесителе, при этом получают конечную смесь;(5) таблетирование гранул, полученных на стадии (3), или конечной смеси, полученной на стадии(4), при ее прессовании в пригодном прессе для таблетирования, при этом получают ядра таблеток;(6) необязательно, нанесение пленочного покрытия на ядра таблеток, полученные на стадии (5), при нанесении функционально неактивного покрытия. В одном варианте размер гранул по настоящему изобретению находится в диапазоне от 25 до 800 мкм, например от 40 до 500 мкм. Размер гранул можно определять с использованием ситового анализа, например ультразвукового сита. В другом варианте по крайней мере 80%, по крайней мере 90% или по крайней мере 95 мас.% полученных гранул находятся в указанном диапазоне размеров. В одном варианте фармацевтическая композиция или фармацевтическая дозированная форма по настоящему изобретению характеризуется специфическим фармакокинетическим профилем после введения субъекту, прежде всего человеку, как, например, описано ниже в данном контексте. Соответственно в другом варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в дозе 2,5 мг наблюдаются следующие результаты: Cmax от 40,3 до 96,3 нмоль/л и AUC от 283 до 677 нмольч/л. В одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в дозе 2,5 наблюдаются следующие результаты: геометрическое среднее значение Cmax от 52,9 до 66,6 нмоль/л и геометрическое среднее значение AUC от 394 до 468 нмольч/л. В еще одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в дозе 5,0 мг наблюдаются следующие результаты: Cmax от 123 до 230 нмоль/л иAUC0-inf от 1,000 до 1,310 нмольч/л. В другом варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в дозе 10,0 мг наблюдаются следующие результаты: Cmax от 143 до 796 нмоль/л и AUC от 1,170 до 3,190 нмольч/л. В одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в дозе 10,0 мг наблюдаются следующие результаты: геометрическое среднее значение Cmax от 221 до 372 нмоль/л и геометрическое среднее значение AUC от 1,690 до 2,660 нмольч/л. В еще одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в дозе 25,0 мг наблюдаются следующие результаты: Cmax от 334 до 1,030 нмоль/л иAUC от 2,660 до 7,640 нмольч/л. В другом варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в дозе 25,0 мг наблюдаются следующие результаты: геометрическое среднее значение Cmax от 490 до 709 нмоль/л и геометрическое среднее значение AUC от 3,750 до 6,130 нмольч/л. В одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в дозе 50,0 мг наблюдаются следующие результаты: Cmax от 722 до 2,020 нмоль/л и AUC от 6,450 до 14,100 нмольч/л. В еще одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в дозе 50,0 мг наблюдаются следующие результаты: геометрическое среднее значениеCmax от 1,080 до 1,140 нмоль/л и геометрическое среднее значение AUC0-inf от 8,310 до 8,460 нмольч/л. В одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак наблюдаются следующие результаты: а) в дозе 2,5 мг: 1) Cmax от 40,3 до 96,3 нмоль/л,2) AUC от 283 до 677 нмольч/л; и/или б) в дозе 5,0 мг: 1) Cmax от 123 до 230 нмоль/л,2) AUC от 1,000 до 1,310 нмольч/л; и/или в) в дозе 10,0 мг: 1) Cmax от 143 до 796 нмоль/л,2) AUC от 1,170 до 3,190 нмольч/л; и/или г) в дозе 25,0 мг: 1) Cmax от 334 до 1,030 нмоль/л,2) AUC от 2,660 до 7,640 нмольч/л; и/или д) в дозе 50,0 мг: 1) Cmax от 722 до 2,020 нмоль/л,2) AUC от 6,450 до 14,100 нмольч/л. В еще одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак наблюдаются следующие результаты: а) в дозе 2,5 мг: 1) геометрическое среднее значение Cmax в диапазоне от 52,9 до 66,6 нмоль/л,2) геометрическое среднее значение AUC в диапазоне от 394 до 468 нмольч/л; и/или б) в дозе 10,0 мг: 1) геометрическое среднее значение Cmax в диапазоне от 221 до 372 нмоль/л,2) геометрическое среднее значение AUCf в диапазоне от 1,690 до 2,660 нмольч/л; и/или в) в дозе 25,0 мг: 1) геометрическое среднее значение Cmax в диапазоне от 490 до 709 нмоль/л,2) геометрическое среднее значение AUC в диапазоне от 3,750 до 6,130 нмольч/л; и/или г) в дозе 50,0 мг: 1) геометрическое среднее значение Cmax в диапазоне от 1,080 до 1,140 нмоль/л,2) геометрическое среднее значение AUC в диапазоне от 8,310 до 8,460 нмольч/л. В другом варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в однократной дозе 2,5 мг наблюдаются следующие результаты: Cmax от 42,8 до 81,2 нмоль/л и AUC0-inf от 326 до 631 нмольч/л. В одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в однократной дозе 2,5 мг наблюдаются следующие результаты: геометрическое среднее значение Cmax от 52,9 до 61,3 нмоль/л и геометрическое среднее значение AUC0-inf от 394 до 468 нмольч/л. В одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в однократной дозе 5,0 мг наблюдаются следующие результаты: Cmax от 123 до 230 нмоль/л и AUC0-inf от 1,000 до 1,310 нмольч/л. В одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в однократной дозе 10,0 мг наблюдаются следующие результаты: Cmax от 143 до 796 нмоль/л и AUC0-inf от 1,170 до 3,190 нмольч/л. В одном варианте при введении фармацевтической композиции по настоящему изобретению человеку натощак в однократной дозе 10,0 мг наблюдаются следующие результаты: геометрическое среднее значение Cmax от 221 до 372 нмоль/л и геометрическое среднее значение AUC0-inf от 1,690 до
МПК / Метки
МПК: A61K 9/00, A61K 9/20, A61K 9/16, A61P 3/10, A61K 31/7004, A61P 3/04, A61K 31/431, A61P 3/06
Метки: фармацевтическая, глюкопиранозилдифенилметана, улучшения, применения, пациентов, включающая, форма, производное, контроля, гликемического, дозированная
Код ссылки
<a href="https://eas.patents.su/30-24072-farmacevticheskaya-dozirovannaya-forma-vklyuchayushhaya-proizvodnoe-glyukopiranozildifenilmetana-i-primeneniya-dlya-uluchsheniya-glikemicheskogo-kontrolya-u-pacientov.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая дозированная форма, включающая производное глюкопиранозилдифенилметана, и применения для улучшения гликемического контроля у пациентов</a>
Предыдущий патент: Способы получения, фармацевтические композиции и способы применения твердой формы v вещества xlf-iii-43
Следующий патент: Способ и устройство для нанесения покрытий
Случайный патент: Новые липидные смеси для синтетических сурфактантов