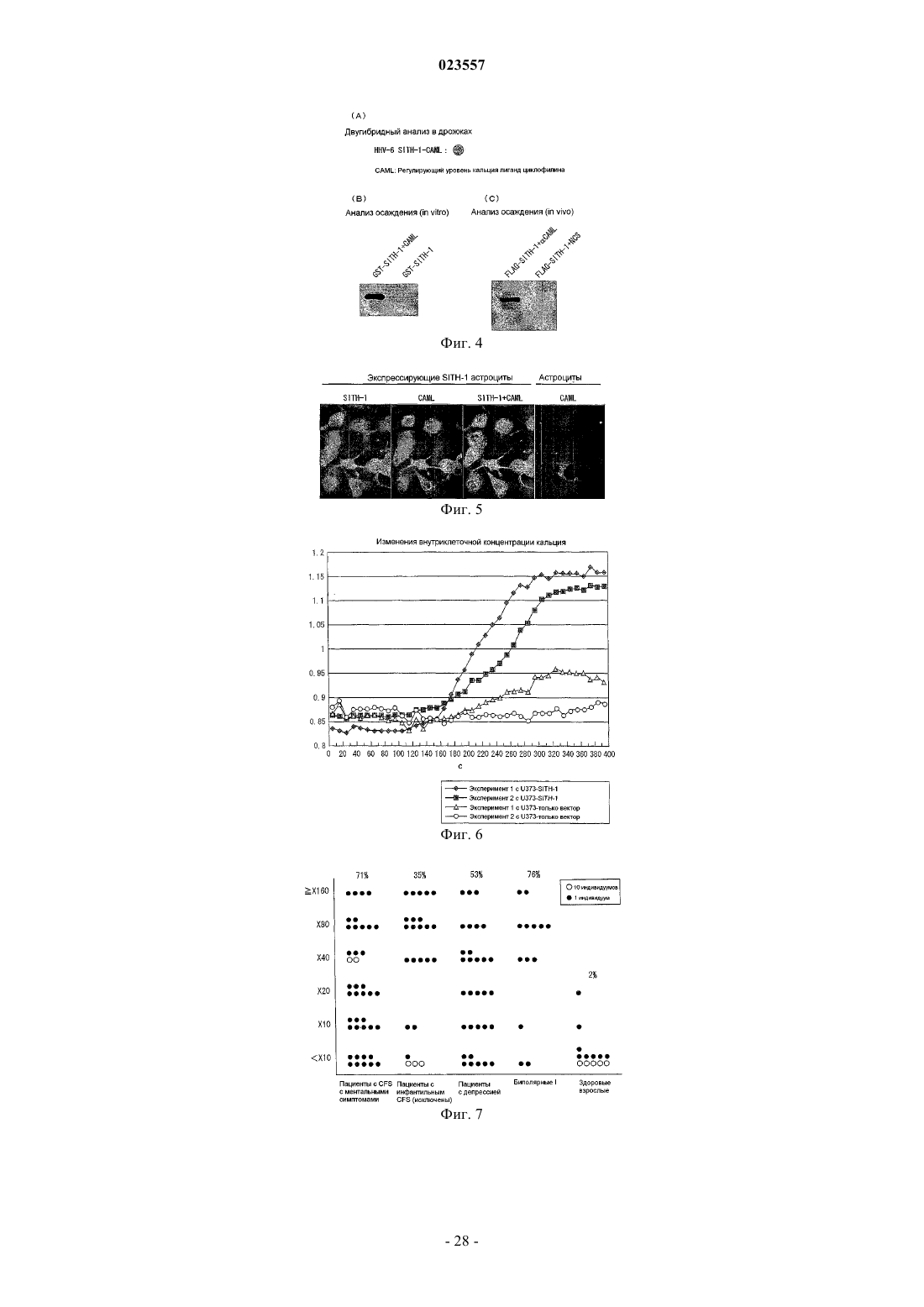
Белок, вовлеченный в латентную инфекцию герпесвирусом, и его применение для диагностики ментальных нарушений у животных
Формула / Реферат
1. Полинуклеотид, выбранный из группы, включающей:
(а) полинуклеотид, кодирующий белок, обладающий активностью увеличения внутриклеточной концентрации кальция и имеющий аминокислотную последовательность SEQ ID NO: 1;
(b) полинуклеотид, содержащий открытую рамку считывания, имеющий последовательность SEQ ID NO: 2, кодирующий белок, обладающий активностью увеличения внутриклеточной концентрации кальция; и
(с) полинуклеотид, кодирующий белок, который обладает активностью увеличения внутриклеточной концентрации кальция, причем указанный полинуклеотид гибридизуется в строгих условиях гибридизации с нуклеотидной последовательностью, комплементарной SEQ ID NO: 2.
2. Белок, обладающий активностью увеличения внутриклеточной концентрации кальция, выбранный из группы, включающей:
(а) белок, обладающий аминокислотной последовательностью SEQ ID NO: 1; и
(b) белок, кодируемый полинуклеотидом по п.1.
3. Антитело против белка, обладающего активностью увеличения внутриклеточной концентрации кальция, которое получено с использованием в качестве антигена белка по п.2 или его несущего антигенный эпитоп пептида.
4. Рекомбинантный экспрессирующий вектор, содержащий полинуклеотид по п.1.
5. Трансформированная клетка, предназначенная для экспрессии белка по п.2, где клетка включает полинуклеотид по п.1 или рекомбинантный экспрессирующий вектор по п.4.
6. Средство для детекции полинуклеотида, кодирующего белок, обладающий активностью увеличения внутриклеточной концентрации кальция, для диагностики ментального нарушения, содержащее зонд, имеющий в длину 12-50 оснований последовательности полинуклеотида по п.1 или комплементарную к ней последовательность.
7. Средство детекции антитела по п.3 для диагностики ментального нарушения, содержащее белок по п.2 или его антигенный эпитоп.
8. Способ диагностики ментального нарушения у субъекта-человека, включающий стадии:
(i) определения уровня антитела по п.3 в биологической пробе, отобранной у субъекта-человека; и
(ii) определения того, что субъект-человек обладает ментальным нарушением в том случае, когда на стадии (i) выявляется, что уровень указанного антитела выше порогового значения, измеренного в биологической пробе, полученной от здорового человека.
9. Способ диагностики ментального нарушения у животного, не являющегося человеком, включающий определение наличия у животного, не являющегося человеком, антитела по п.3, причем при обнаружении у животного, не являющегося человеком, антитела по п.3 диагностируют ментальное нарушение.
10. Набор для осуществления диагностического способа по п.8 или 9, содержащий по меньшей мере два компонента, выбранных из:
(i) белка по п.2;
(ii) антигенного эпитопа белка (i) и
(iii) средства для детекции, на котором иммобилизован белок (i) или антигенный эпитоп (ii).
11. Способ выбора животной модели, не являющейся человеком, для определения ментального нарушения, включающий стадии:
(i) диагностики, имеет или нет субъект-животное, не являющееся человеком, антитела по п.3; и
(ii) определения, что указанное субъект-животное является применимым в качестве модели ментального нарушения в случае, когда на стадии (i) выявляют указанные антитела.
12. Трансгенное модельное животное, не являющееся человеком, предназначенное для использования в качестве животной модели ментального нарушения, содержащее полинуклеотид по п.1.
13. Способ скрининга вещества-кандидата на психотропное средство, включающий в себя стадии:
(i) введения в животную модель по п.12 рассматриваемого вещества;
(ii) определения того, является или нет рассматриваемое вещество веществом-кандидатом на психотропное средство на основании того, что уровень антитела по п.3 в указанной животной модели снижается по сравнению с уровнем указанного антитела в указанной животной модели, не являющейся человеком, которой не вводится рассматриваемое вещество.
14. Применение полинуклеотида по п.1 для получения животной модели, не являющейся человеком, имеющей ментальное нарушение.
15. Применение по п.14, где ментальное нарушение представляет собой ментальное нарушение, вызванное болезнью Крона.
16. Применение белка по п.2 или его несущего антигенный эпитоп пептида для диагностики ментального нарушения у субъекта.
17. Применение модельного животного, не являющееся человеком, по п.12 для скрининга вещества-кандидата на психотропное средство.
18. Применение белка по п.2 или его антигенного эпитопа для производства средства для диагностики ментального нарушения у субъекта.
19. Способ диагностики ментального нарушения, вызванного болезнью Крона, включающий следующие стадии:
(i) определение уровня антитела по п.3 в биологической пробе, выделенной у субъекта-человека; и
(ii) определение, что субъект-человек имеет ментальное нарушение, вызванное болезнью Крона, в том случае, когда на стадии (i) определяется, что уровень указанного антитела выше порогового значения, измеренного в биологической пробе, полученной от здорового индивидуума.
Текст
БЕЛОК, ВОВЛЕЧЕННЫЙ В ЛАТЕНТНУЮ ИНФЕКЦИЮ ГЕРПЕСВИРУСОМ, И ЕГО ПРИМЕНЕНИЕ ДЛЯ ДИАГНОСТИКИ МЕНТАЛЬНЫХ НАРУШЕНИЙ У ЖИВОТНЫХ Изобретение относится к белку, вовлеченному в латентную инфекцию герпесвирусом, и его применению. В частности, настоящее изобретение относится к полинуклеотиду, кодирующему белок, обладающий активностью увеличения внутриклеточной концентрации кальция и имеющий аминокислотную последовательность SEQ ID NO: 1, рекомбинантному экспрессирующему вектору и трансформированной клетке, содержащим указанный полинуклеотид, и средству для детекции указанного полинуклеотида. Кроме того, изобретение относится к белку, обладающему активностью увеличения внутриклеточной концентрации кальция и имеющему аминокислотную последовательность SEQ ID NO: 1, и антителу против указанного белка. Изобретение также относится к средству и способу диагностики ментального нарушения у животных, включая человека, в частности ментального нарушения, вызванного болезнью Крона, а также к набору для(71)(73) Заявитель и патентовладелец: ДЖАПАН ТОБАККО ИНК.; ВАЙРУС ИКАГАКУ КЕНКЮСО ИНК. (JP) осуществления указанного способа и трансгенному модельному животному, предназначенному для использования в качестве животной модели ментального нарушения. Область техники Настоящее изобретение относится к белку, вовлеченному в латентную инфекцию герпесвирусом, и его применению. В частности, настоящее изобретение относится к новому белку, который специфически экспрессируется во время латентной инфекции герпесвирусом, гену, кодирующему указанный белок, и их применению. Уровень техники Вирусы семейства Herpesviridae, каждый из которых обладает общим размером приблизительно 150-200 нм, являются такими, что коровый белок окружен многоцепочечной ДНК с молекулярными массами 80-150106 Да. Эта многоцепочечная ДНК заключена в икосаэдрический капсид, имеющий диаметр приблизительно 100 нм и составленный из 162 капсомеров, с образованием нуклеокапсида, окруженного оболочкой. Герпесвирусы обнаружены почти у всех млекопитающих и земноводных. В частности, вирусы семейства Herpesviridae, обладающие специфичностью к человеку как к хозяину, названы герпесвирусами человека (HHV). HHV классифицированы на подсемейства Alphaherpesvirinae (например, вирус простого герпеса и вирус герпеса Варицелла-Зостер), Betaherpesvirinae (например, цитомегаловирус) иGammaherpesvirinae (например, вирус ЕВ). Эти герпесвирусы характеризуются наличием стадии латентной инфекции. "Латентная инфекция" относится к такой стадии инфекции, когда вирус, инфицировавший клетку-хозяина, не продуцирует инспекционные вирионы внутри клетки-хозяина, но продолжает выживать. Даже в этой фазе латентной инфекции гены и продукты генов вируса, помогающие существовать генам вируса, остаются внутри клетки-хозяина. Известно, что герпесвирусы с латентной инфекцией возобновляют продукцию вирионов и вирусную репликацию в больших количествах вследствие определенных причин со стороны хозяина(например, старение и соматические осложнения (включая утомление. Это состояние называют "реактивацией". Кратко, герпесвирусы обладают следующим уникальным свойством: герпесвирусы продолжают инфицировать хозяина латентно, пока у хозяина нет ничего аномального; однако как только у хозяина возникает соматическое нарушение, и вирусы детектируют, что хозяин подвергается опасности, вирусы реактивируются для поиска другого, здорового хозяина. Для изучения биологии таких вирусов семейства Herpesviridae понимание их латентной инфекции и реактивации является необходимым. Однако, среди множества герпесвирусов только вирус ЕВ, принадлежащих к семейству Gammaherpesvirinae, изучали с получением множества результатов относительно латентной инфекции, и многое остается неясным относительно других вирусов. В частности, относительно факторов, которые могут являться вовлеченными в латентную инфекцию Betaherpesvirinae, не получено информации, отличной от результатов, ранее полученных авторами настоящего изобретения. Например, в непатентном документе 1 описана латентная инфекция HHV-6 в макрофагах в периферической крови, где макрофаги являлись дифференцированными до относительно высокой степени, и идентифицированы участки организма хозяина, в которых хозяин являлся латентно инфицированным HHV-6. В непатентном документе 2 описана очень частая инвазия HHV-6 в мозг при первичной инфекции, что вызывает персистентную инфекцию и латентную инфекцию. В непатентном документе 3 описаны гены (гены латентной инфекции), которые экспрессируются во время латентной инфекции HHV-6, и выдвинуто предположение, что эти гены играют роль в регуляции латентной инфекции и реактивации вируса. В непатентном документе 4 показано, что в состояние латентной инфекции HHV-6 вовлечена промежуточная стадия, которая является сравнительно стабильной и позволяет активную экспрессию генов,что приводит к тому, что ген латентной инфекции и белок (белок гена латентной инфекции), кодируемый этим геном, экспрессируются избыточно. Более того, в непатентном документе 5 показано, что у пациентов с синдромом хронической усталости в сыворотке присутствуют антитела против белков генов латентной инфекции, которые экпрессированы на повышенном уровне на промежуточной стадии. Непатентный документ 1. Краткое изложение сущности изобретения Однако, не идентифицировано какого-либо гена латентной инфекции или белка гена латентной инфекции, специфически вовлеченного в заболевания. Кроме того, его функции и связь с патогенетическим механизмом синдрома хронической усталости остаются неизвестными. Кроме того, существует возможность, что HHV-6 является вовлеченным в другие заболевания в дополнение к синдрому хронической усталости. Таким образом, остается сильная необходимость в прояснении связи между инфекцией HHV-6 и заболеваниями, а также в развитии способов, способствующих разработке (i) объективного диагностического способа для заболеваний и (ii) модели на животных. Настоящее изобретение сделано, принимая во внимание вышеупомянутые проблемы, и целью настоящего изобретения является идентификация фактора, вовлеченного в латентную инфекцию HHV-6, и обеспечение его применения. Чтобы преодолеть вышеупомянутые проблемы, авторы настоящего изобретения провели тщательное исследование. В результате, у авторов настоящего изобретения возникла следующая уникальная идея: в свете характерной природы HHV-6, т.е. латентной инфекции и реактивации, идентификация фактора, вовлеченного в латентную инфекцию и реактивацию, приведет к открытиям относительно связи между инфекцией HHV-6 и ментальными нарушениями. На основании этой идеи авторы настоящего изобретения множество раз проводили сложные эксперименты на современном уровне. В результате авторы настоящего изобретения идентифицировали: новый ген, экспрессирующийся на промежуточной стадии, на которой ген, специфический для латентной инфекции HHV-6, экспрессируется активно; и новый белок (малый белок, кодируемый промежуточным транскриптом HHV-6-1; SITH-1), кодируемый новым геном. Кроме того, авторы настоящего изобретения провели функциональный анализ нового гена и белка SITH-1, кодируемого новым геном, так что сделаны новые обнаружения: (i) белок SITH-1 обладает способностью увеличивать внутриклеточную концентрацию кальция; и (ii) антитела против белкаSITH-1 в значительном количестве детектируют у пациентов с аффективными расстройствами, но его почти невозможно детектировать у здоровых индивидуумов. Таким образом, настоящее изобретение осуществлено. Настоящее изобретение выполнено на основании вышеупомянутых новых открытий и включает в себя следующие изобретения:(а) полинуклеотид, кодирующий белок, обладающий активностью увеличения внутриклеточной концентрации кальция и имеющий аминокислотную последовательность SEQ ID NO: 1;(b) полинуклеотид, содержащий открытую рамку считывания, имеющий последовательность SEQID NO: 2, кодирующий белок, обладающий активностью увеличения внутриклеточной концентрации кальция; и(с) полинуклеотид, кодирующий белок, который обладает активностью увеличения внутриклеточной концентрации кальция, причем указанный полинуклеотид гибридизуется в строгих условиях гибридизации с нуклеотидной последовательностью, комплементарной SEQ ID NO: 2.(2) Белок, обладающий активностью увеличения внутриклеточной концентрации кальция, выбранный из группы, включающей:(а) белок, обладающий аминокислотной последовательностью SEQ ID NO: 1; и(3) Антитело против белка, обладающего активностью увеличения внутриклеточной концентрации кальция, которое получено с использованием в качестве антигена белка, как указано в (2), или его несущего антигенный эпитоп пептида.(5) Трансформированная клетка, предназначенная для экспрессии белка, как указано в (2), где клетка включает полинуклеотид, как указано в (1), или рекомбинантный экспрессирующий вектор, как указано в (4).(6) Средство для детекции полинуклеотида, кодирующего белок, обладающий активностью увеличения внутриклеточной концентрации кальция, для диагностики ментального нарушения, содержащее зонд, имеющий в длину 12-50 оснований последовательности полинуклеотида, как указано в (1), или комплементарную к ней последовательность.(7) Средство детекции антитела, как указано в (3), для диагностики ментального нарушения, содержащее белок, как указано в (2), или его антигенный эпитоп.(8) Способ диагностики ментального нарушения у субъекта-человека, включающий стадии:(ii) определения того, что субъект-человек обладает ментальным нарушением в том случае, когда на стадии (i) выявляется, что уровень указанного антитела выше порогового значения, измеренного в биологической пробе, полученной от здорового человека.(9) Способ диагностики ментального нарушения у животного, не являющегося человеком, включающий определение наличия у животного, не являющегося человеком, антитела, как указано в (3), при-2 023557 чем при обнаружении у животного, не являющегося человеком, антитела, как указано в (3), диагностируют ментальное нарушение.(10) Набор для осуществления диагностического способа, как указано в (8) или (9), содержащий по меньшей мере два компонента, выбранных из:(ii) антигенного эпитопа белка (i) и(iii) средства для детекции, на котором иммобилизован белок (i) или антигенный эпитоп (ii).(11) Способ выбора животной модели, не являющейся человеком, для определения ментального нарушения, включающий стадии:(i) диагностики, имеет или нет субъект-животное, не являющееся человеком, антитела, как указано в (3); и(ii) определения, что указанное субъект-животное является применимым в качестве модели ментального нарушения в случае, когда на стадии (i) выявляют указанные антитела.(12) Трансгенное модельное животное, не являющееся человеком, предназначенное для использования в качестве животной модели ментального нарушения, содержащее полинуклеотид, как указано в(ii) определения того, является или нет рассматриваемое вещество веществом-кандидатом на психотропное средство, на основании того, что уровень антитела, как указано в (3), в указанной животной модели снижается по сравнению с уровнем указанного антитела в указанной животной модели, не являющейся человеком, которой не вводится рассматриваемое вещество.(14) Применение полинуклеотида, как указано в (1), для получения животной модели, не являющейся человеком, имеющей ментальное нарушение.(15) Применение, как указано в (14), где ментальное нарушение представляет собой ментальное нарушение, вызванное болезнью Крона.(16) Применение белка , как указано в (2), или его несущего антигенный зпитоп пептида для диагностики ментального нарушения у субъекта.(18) Применение белка, как указано в (2), или его антигенного эпитопа для производства средства для диагностики ментального нарушения у субъекта.(19) Способ диагностики ментального нарушения, вызванного болезнью Крона, включающий следующие стадии:(ii) определения, что субъект-человек имеет ментальное нарушение, вызванное болезнью Крона, в том случае, когда на стадии (i) определяется, что уровень указанного антитела выше порогового значения, измеренного в биологической пробе, полученной от здорового индивидуума. Ген или белок по настоящему изобретению специфически экспрессируется во время латентной инфекции герпесвирусом и обладает способностью регулировать латентную инфекцию и реактивацию герпесвируса. Кроме того,как описано позже, показано, что антитело против белка по настоящему изобретению в значительном количестве обнаруживают у пациентов с ментальными нарушениями. Таким образом, определение присутствия или отсутствия антитела позволяет объективную диагностику ментальных нарушений. Более того, ген или белок по настоящему изобретению можно применять для диагностики различных заболеваний, так же как для диагностики заболеваний, описанных в настоящем документе. Более того, ген или белок по настоящему изобретению доступны также для применения, например, в способах скрининга лекарственных средств, способах получения моделей на животных и различных видах наборов. Для более полного понимания сущности и преимуществ изобретения следует сделать ссылку на следующее подробное описание, во взаимосвязи с сопутствующими чертежами. Краткое описание чертежей Фиг. 1 представляет собой схему, показывающую схематическую структуру специфического для латентной инфекции гена и положения аналитических праймеров. Фиг. 2 представляет собой чертеж, показывающий результаты амплификации, проведенной способом ПЦР по отношению к продуктам гена HHV-6. Фиг. 3 представляет собой чертеж, показывающий результаты анализа, проведенного способомRACE по отношению к мРНК нового специфического для латентной инфекции гена. Фиг. 4 представляет собой схему, показывающую результаты эксперимента, в котором белок хозяина, связывающийся с белком SITH-1, идентифицировали анализом в дрожжевой двугибридной системе. Фиг. 5 представляет собой чертеж, показывающий, что белок SITH-1 увеличивает количествоCAML в линии астроцитоподобных глиальных клеток. Фиг. 6 представляет собой график, показывающий, как SITH-1 увеличивает концентрацию кальция в глиальных клетках. Фиг. 7 представляет собой график, показывающий титры антител против SITH-1 у пациентов с ментальными нарушениями. Фиг. 8 представляет собой график, показывающий результат исследования эффекта SITH-1 в тесте подвешивания за хвост. Фиг. 9 представляет собой график, показывающий результат исследования эффекта SITH-1 в тесте принудительного плавания. Фиг. 10 представляет собой график, показывающий результат исследования эффекта SITH-1 в отношении реакции вздрагивания (преимпульсное ингибирование). Фиг. 11 представляет собой график, показывающий результат эксперимента, в котором SITH-1 экспрессировали в глиальных клетках мыши с использованием аденовирусного вектора и через три недели у животных измеряли моторную активность по активности на беличьем колесе. Фиг. 12 представляет собой график, показывающий результат эксперимента, в котором SITH-1 экспрессировали в глиальных клетках мыши с использованием лентивирусного вектора и через восемь недель у животных измеряли моторную активность по активности на беличьем колесе. Фиг. 13 представляет собой график, показывающий результаты диагностики различных заболеваний, осложненных депрессией, с использованием SITH-1 в качестве маркера. Описание вариантов осуществления Ниже описан один вариант осуществления настоящего изобретения. Однако, настоящее изобретение не является ограниченным этим. Сначала, чтобы помочь пониманию настоящего изобретения, кратко описано, как авторы настоящего изобретения выполнили настоящее изобретение. Авторы настоящего изобретения выдвинули предположение, что инфекция HHV-6 среди различных видов герпесвирусов человека, наиболее вероятно, является причиной ментальных нарушений, в частности, сопровождающихся аффективными нарушениями. Причины включают в себя: (i) среди симптомов синдрома хронической усталости (CFS), для которых до настоящего времени HHV-6 признавали одной из причин, распознавали симптомы депрессии и другие,часто обнаруживаемые при ментальных нарушениях; (ii) HHV-6 вызывает латентную инфекцию в мозге; и (iii) антитело, узнающее идентифицированный к настоящему времени белок гена, специфического для латентной инфекции HHV-6, так же как антитело, узнающее неизвестный белок, который экспрессируется в клетках, латентно инфицированных HHV-6, но для которого еще не идентифицировали гена или который еще не идентифицировал сам по себе, детектировали с высокой частотой в сыворотке пациентов сCFS. Кроме тоге, в свете того факта, что первичные участки в мозге при латентной инфекции HHV-6 включают в себя лобную долю и область гиппокампа, каждая из которых управляет мыслями и эмоциями, так же как того факта, что вирусов, вызывающих латентную инфекцию в мозге, совсем немного,включая HHV-6, авторы настоящего изобретения выдвинули предположение о связи между HHV-6 и ментальными нарушениями. Более того, известно, что HHV-6 вызывает латентную инфекцию в глиальных клетках (например, астроцитах), что играет важную роль в метаболизме внутри мозга веществ (например, серотонина), связанных с депрессией. Также в отношении этого авторы настоящего изобретения пришли к уникальной идее, что HHV-6 может являться связанным с ментальными нарушениями, такими как аффективные нарушения. Таким образом, авторы настоящего изобретения выдвинули предположение, что пациенты с CFS могут включать в себя немало случаев с присутствием симптомов из-за латентной инфекции мозга HHV6. В частности, авторы настоящего изобретения выдвинули предположение о связи между HHV-6 и аффективными нарушениями, такими как депрессия и маниакально-депрессивное заболевание. Аффективные нарушения представляют собой симптомы, обнаруженные при ментальных нарушениях, такие как депрессия и маниакально-дегрессивное заболевание, и два наиболее типичных примера представляют собой депрессию, при которой присутствуют только симптомы депрессии, и маниакальнодепрессивное заболевание, при котором эпизоды мании чередуются с эпизодами депрессии. В то время как предполагали различные возможные причины, включая стресс, генетические аберрации и инфекции,еще не установлено отдельных факторов. В настоящее время частота возникновения аффективных нарушений увеличена, и это становится большой социальной проблемой. Таким образом, является желательным распознавать этиологию и патологию каждого аффективного нарушения и развивать способы их диагностики и лечения настолько быстро, насколько возможно. Особого упоминания в настоящем документе заслуживает та проблема, что доступна только качественная диагностика аффективных нарушений, и она связана с трудностями в достижении объективности. Кроме того, еще не развито адекватных моделей на животных, вносящих вклад в изучение аффективных нарушений и развитие способов их лечения. Это затрудняет классификацию этиологии и развитие способов лечения. По этой причине авторы настоящего изобретения считали, что является необходимым прояснять связь между (i) инфекцией HHV-6 и (ii) аффективными нарушениями и ментальными нарушениями, и развивать способ, вносящий вклад в постановку объективного диагноза и модели на животных для аффективных нарушений и ментальный нарушений. Нет необходимости упоминать, что эти предположения являются уникальными, к которым авторы настоящего изобретения пришли в результате тщательного исследования, выполненного в данной области исследования в течение длительного времени, и к ним не может легко прийти средний специалист в данной области. Далее подробно описаны белок, ген и прочее по настоящему изобретению по порядку.(1) Белок и ген по настоящему изобретению.(1-1) Структура. Настоящее изобретение относится к фактору, вовлеченному в латентную инфекцию герпесвирусом. Более подробно, настоящее изобретение относится (i) к белку, специфически экспрессирующемуся во время латентной инфекции герпесвирусом, и (ii) к гену, кодирующему белок. Фраза, гласящая "специфически экспрессирующийся во время латентной инфекции герпесвирусом", означает, что ген, полученный из герпесвируса, или продукт этого гена специфически экспрессируется в инфицированном вирусом хозяине в то время, как хозяин является латентно инфицированным (но не продуктивно инфицированным) герпесвирусом. Белок и ген могут представлять собой, например, (а) белок, обладающий аминокислотной последовательностью, показанной на SEQ ID NO: 1, и ген, кодирующий белок. Как описано позже в примере, белок, обладающий аминокислотной последовательностью, показанной на SEQ ID NO: 1, выделили и идентифицировали как белок, специфически экспрессирующийся во время латентной инфекции герпесвирусом-6 человека (HHV-6). Этот белок в дальнейшем в этом документе обозначают "малый белок, кодируемый промежуточным транскриптом HHV-6-1 (белок SITH-1)". Белок SITH-1 представляет собой белок, обладающий молекулярной массой приблизительно 17,5 кДа,аминокислотной последовательностью, показанной на SEQ ID NO: 1, и 159 аминокислотами. Белок SITH-1 кодирует ген SITH-1. Как показано на SEQ ID NO: 3, кДНК гена SITH-1 обладает размером 1795 пар оснований (приблизительно 1,79 т.п.о.). Кроме того, последовательность нуклеотидов от 954 до 956 представляет собой стартовый кодон (Kozak ATG), в то время как последовательность нуклеотидов от 1431 до 1433 представляет собой стоп-кодон (ТАА). Таким образом, ген SITH-1 обладает открытой рамкой считывания (ORF), обладающей последовательностью нуклеотидов от 954 до 1430 из нуклеотидной последовательности, показанной на SEQ ID NO: 3, с ORF, обладающей размером 477 пар оснований (приблизительно 0,48 т.п.о.). Нуклеотидная последовательность, представляющая областьORF из кДНК SITH-1, показана на SEQ ID NO: 2. Следует отметить, что нуклеотидная последовательность, показанная на SEQ ID NO: 2, включает три основания стоп-кодона. Белок по настоящему изобретению может представлять собой, например, (b) белок, обладающий аминокислотной последовательностью с заменой, делецией, вставкой и/или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной на SEQ ID NO: 1, где белок специфически экспрессируется во время латентной инфекции герпесвирусом. Ген по настоящему изобретению может представлять собой, например, ген, кодирующий этот белок. Фраза "с заменой, делецией, вставкой и/или добавлением одной или нескольких аминокислот" означает замену, делецию, вставку и/или добавление ряда аминокислот (например, предпочтительно 10 или менее, более предпочтительно 7 или менее, более предпочтительно 5 или менее), которые можно осуществлять известным способом получения мутантных пептидов, таким как сайт-направленный мутагенез. Таким образом, белок (b) можно описать как являющийся мутантным белком из белка (а). Следует отметить, что "мутант" в настоящем документе в первую очередь относится к мутанту, полученному искусственным введением мутаций посредством известного способа получения мутантного белка, или может представлять собой мутант, полученный выделением и очисткой существующего в природе сходного мутантного белка. Альтернативно, ген по настоящему изобретению может представлять собой, например, ген, кодирующий (с) белок, который гибридизуется в строгих условиях гибридизации с ДНК, обладающей нуклеотидной последовательностью, комплементарной ДНК, обладающей нуклеотидной последовательностью, показанной на SEQ ID NO: 2, где белок специфически экспрессируется во время латентной инфекции герпесвирусом. Фраза "гибридизуется в строгих условиях гибридизации" означает, что гибридизация происходит только в случае, когда представляющие интерес нуклеотидные последовательности обладают по меньшей мере 90% идентичности, предпочтительно по меньшей мере 95% идентичности, наиболее предпочтительно, по меньшей мере 97% идентичности. В качестве конкретного примера "строгих условий гибридизации" возможны следующие условия: фильтр для гибридизации инкубируют в течение ночи при 42C в растворе для гибридизации (включая 50% формамид, 5SSC (150 мМ NaCl, 15 мМ цитрат тринатрия), 50 мМ фосфат натрия (рН 7,6), 5 раствор Денхардта, 10% декстрансульфат и 20 мкг/мл денатурированной, фрагментированной ДНК спермы лосося) с последующей промывкой в 0,1SSC при приблизительно 65C. Кроме того, гибридизацию можно проводить общеизвестным способом, например, со-5 023557Spring Harbor Laboratory (1989)", и без ограничения каким-либо одним конкретным способом. В общем,при повышении температуры и понижении концентрации соли уровень строгости увеличивается (т.е. больше трудностей для гибридизации). Следует отметить, что термин "ген" в настоящем документе используют взаимозаменяемо с "полинуклеотид", "нуклеиновая кислота" или "молекула нуклеиновой кислоты". "Полинуклеотид" относится к полимеру из нуклеотидов. Таким образом, термин "ген" в настоящем документе включает в себя не только двухцепочечные ДЧК, но также одноцепочечные ДНК (например, смысловую цель и антисмысловую цепь, составляющие двухцепочечную ДНК) и РНК (например, мРНК). Антисмысловую цепь можно использовать в качестве зонда или антисмыслового лекарственного средства. Термин "ДНК" включает в себя, например, (i) кДНК, полученную клонированием, способом химического синтеза или их сочетанием, и (ii) геномную ДНК. То есть "ДНК" может представлять собой "геномную" ДНК, включающую некодирующую последовательность (например, интрон), где геномная ДНК представляет собой форму,содержащуюся в геномах животных. Альтернативно, "ДНК" может представлять собой кДНК, полученную из мРНК с использованием обратной транскриптазы или полимеразы, т.е. "транскрипционную" ДНК, не включающую некодирующей последовательности (например, интрона). Кроме того, ген по настоящему изобретению может представлять собой ген, обладающий не только последовательностью,кодирующей аминокислоты, описанные по отношению к вышеупомянутым (а) или (b), но также последовательностью нетранслируемой области (UTR) и/или последовательность вектора (включая последовательность экспрессирующего вектора). Кроме того, мРНК или кДНК может содержать на конце и/или внутри ее транслируемой области желательный полинуклеотид, такой как регуляторная последовательность или последовательность полиадениловой кислоты. Более того, в случае, когда белок по настоящему изобретению может кодировать множество аллелей, термин "нуклеиновая кислота" включает все аллели, их транскрипты и кДНК. Следует отметить, что термин "нуклеиновая кислота" в настоящем документе включает в себя полинуклеотид, включая желательные обычные нуклеотиды и/или модифицированные нуклеотиды, примеры которых включают в себя кДНК, мРНК, тотальную РНК и мРНК. Термин"модифицированные нуклеотиды" включает в себя сложные фосфатные эфиры, например инозина, ацетилцитидина, метилцитидина, метиладенозина и метилгуанозина; и нуклеотиды, которые можно получить действием ультрафиолетовых лучей или химических веществ. Термин "нуклеотидная последовательность" используют взаимозаменяемо с "последовательностью нуклеиновой кислоты" и представляют как последовательность дезоксирибонуклеотидов (каждый сокращенно обозначенный как A, G, С или Т). Кроме того, полинуклеотид или "нуклеотидная последовательность" полинуклеотида предназначена для обозначения (i) последовательности дезоксирибонуклеотидов для молекулы или полинуклеотида ДНК и (ii) последовательности рибонуклеотидов (A, G, C и U)(каждый тимидин (Т), который является дезоксинуклеотидом, в дезоксинуклеотидной последовательности, указанной в настоящем документе, заменен на уридин (U), который является рибонуклеотидом) для молекулы или полинуклеотида РНК. Например, молекула РНК, обладающая последовательностью, показанной на SEQ ID NO: 2 или 4,которая представлена сокращенными наименованиями дезоксирибонуклеотидов, предназначена для обозначения молекулы РНК, обладающей последовательностью, в которой дезоксинуклеотиды A, G и С,показанные на SEQ ID NO: 2 или 4, заменены соответствующими им рибонуклеотидами A, G и С, а дезоксинуклеотид Т, показанный на SEQ ID NO: 2 или 4, заменен рибонуклеотидом U. Кроме того, полинуклеотид, обладающий нуклеотидной последовательностью, показанной на SEQ ID NO: 2 или 4, или фрагмент полинуклеотида предназначен для обозначения полинуклеотида, обладающего последовательностью, представленной дезоксинуклеотидами A, G, С и/или Т, показанными в SEQ ID NO: 2 или 4, или фрагмента полинуклеотида. Фрагмент (частичную последовательность) гена по настоящему изобретению можно использовать в качестве праймера для полимеразной цепной реакции (ПЦР) или в качестве зонда для гибридизации. Фрагмент (полинуклеотид) является пригодным для специфической ПЦР амплификации гомолога или ортолога гена по настоящему изобретению, а также является пригодным в качестве зонда для гибридизации, который специфически гибридизуется с гомологом или ортологом гена по настоящему изобретению. То есть в предпочтительном варианте осуществления фрагмент гена по настоящему изобретению является применимым для диагностики (i) в качестве праймера для амплификации последовательностимишени, проводимой посредством полимеразной цепной реакции (ПЦР), или (ii) в качестве зонда согласно общепринятому способу гибридизации ДНК. Кроме того, другие примеры применения фрагмента гена по настоящему изобретению включают в себя: гибридизацию in situ (например, FISH) по отношению к препаратам митотических хромосом, посредством этой гибридизации in situ показывают точный участок на хромосоме (описано в Verma et al.,Human Chromosomes: a Manual of Basic Techniques, Pergamon Press, New York (1988; и анализ нозернблоттингом для детекции мРНК по настоящему изобретению, экспрессированной в конкретной ткани. Ген по настоящему изобретению включает в себя в качестве неограничивающих примеров собственно полинуклеотид, кодирующий аминокислотную последовательность зрелого белка; кодирующую последовательность зрелого белка и дополнительную к ней последовательность (например, последовательность, кодирующую лидерную последовательность) (например, последовательность пребелка, последовательность пробелка или последовательность препробелка); интрон, некодирующую 5'последовательность и некодирующую 3'-последовательность (например, транскрипция нетранслируемой области, действующей в транскрипции и процессинге мРНК (включая сигнал сплайсинга и полиаденилирования); и дополнительную кодирующую последовательность, кодирующую другие аминокислоты,обеспечивающие дополнительную функциональность. Таким образом, для примера последовательность, кодирующую белок, можно сливать с маркерной последовательностью (например, последовательностью, кодирующей пептид, облегчающий очистку слитого белка). В предпочтительном варианте осуществления настоящего изобретения маркерная аминокислотная последовательность может представлять собой гекса-гистидиновый пептид, такой как метка,представленная в векторе pQE (Qiagen, Inc.). Как описано в "Gentz et al., Proc. Natl. Acad. Sci. USA 86: 821-824 (1989)", гекса-гистидиновый пептид является применимым для очистки слитого белка простым способом. Альтернативно, можно использовать публично и/или коммерчески доступную маркерную аминокислотную последовательность множества видов. Например, как описано в "Wilson et al., Cell 37: 767 (1984)", метка "НА" представляет собой другой пептид, применимый для очистки, где НА соответствует эпитопу, полученному из белка гемагглютинина гриппа (НА). Кроме того, альтернативно, слитый белок, полученный слиянием Fc с N-концом или С-концом белка по настоящему изобретению, может являться применимым для очистки. Кроме того, настоящее изобретение относится к мутанту гена по настоящему изобретению. Мутант может существовать в природе, как существует природный аллельный мутант. "Аллельный мутант" предназначен для обозначения одной из некоторых чередующихся форм гена, занимающих предопределенный генный локус на хромосоме организма. Кроме того, не встречающийся в природе мутант можно получить с использованием, например, способа мутагенеза, известного в данной области. Примеры такого мутанта включают в себя мутант, полученный заменой, делецией или добавлением одного или нескольких нуклеотидов, как описано выше. Может происходить замена, делеция или добавление одного или нескольких нуклеотидов. Мутант может содержать мутацию, возникшую в кодирующей области,некодирующей области или и в той, и в другой. Мутация в кодирующей области может вызывать консервативную или неконсервативную замену, делецию или добавление аминокислоты. В дополнение к зрелому белку примеры предпочтительного белка по настоящему изобретению включают в себя внеклеточный домен, трансмембранный домен, внутриклеточный домен и белок, в котором отсутствует весь или часть трансмембранного домена, но присутствуют внеклеточный и внутриклеточный домены. Термин "белок" в настоящем документе используют взаимозаменяемо с "полипептид" или "пептид". Кроме того, настоящее изобретение относится к полипептиду с заменой, добавлением и/или делецией одной или нескольких аминокислот из белка, кодируемого нуклеотидной последовательностью, показанной на SEQ ID NO: 2. Консервативная или неконсервативная замена, делеция и/или добавление аминокислоты(аминокислот) является/являются предпочтительной, и их молчащая замена, добавление и/или делеция является/являются особенно предпочтительной. Это не изменяет характеристик и активности белка по настоящему изобретению или части белка. В отношении этого вопроса особенно предпочтительной является консервативная замена. Кроме того, белок по настоящему изобретению может представлять собой не только белок, выделенный из природных источников, но также химически синтезированный или полученный рекомбинацией белок. То есть белок по настоящему изобретению можно выделить и очистить, например, из клеток или тканей. Альтернативно, белок по настоящему изобретению можно экспрессировать внутри клеток посредством кодирования его геном, перенесенным в клетку-хозяина. Кроме того, белок по настоящему изобретению может содержать дополнительный полипептид. Настоящее изобретение относится к полипептиду, обладающему аминокислотной последовательностью несущей эпитоп части белка, описанного в настоящем документе. Для полипептида, обладающего аминокислотной последовательностью несущей эпитоп части белка по настоящему изобретению, необходимо только содержать часть полипептида, где часть включает в себя по меньшей мере 6, 7, 8, 9 или 10 аминокислот. Кроме того, такой полипептид может также представлять собой несущую эпитоп часть полипептида, обладающую длиной (необязательно, установленной), равной или более короткой, чем длина полной аминокислотной последовательности (i) белка, кодируемого нуклеотидной последовательностью, показанной на SEQ ID NO: 2 или 4 или (ii) белка, обладающего аминокислотной последовательностью, показанной на SEQ ID NO: 1. Иными словами, настоящее изобретение относится к несущему эпитоп пептиду из белка по настоящему изобретению. Как описано в описанном позже примере, белок по настоящему изобретению является иммукогенным. Таким образом, является возможным идентифицировать в белке по настоящему изобретению часть-эпитоп, индуцирующую ответ антитела, согласно способу, известному в данной области. Например, в Geysen H.M. et al., Proc. Natl. Acad. Sci. USA 81: 3998-4002 (1984) описан способ быстрого одновременного синтеза на твердых подложках сотен пептидов, обладающих достаточной чистотой для реакции в твердофазном иммуноферментном анализе. Взаимодействие синтезированных пептидов с антителами затем легко детектируют без удаления их с подло-7 023557 жек. По этому способу пептид, несущий иммуногенный зпитоп желаемого белка, специалист в данной области может идентифицировать общепринятым образом. Например, иммунологически важный эпитоп белка оболочки вируса ящура локализован Geysen et al. с разрешением в семь аминокислот посредством синтеза перекрывающегося набора всех 208 возможных гексапептидов, покрывающих полную 213 аминокислотную последовательность белка. Затем синтезировали полный набор пептидов с заменами, в которых все 20 аминокислот меняли по очереди в каждом положении внутри эпитопа и определяли конкретные аминокислоты, придающие специфичность для реакции с антителом. Таким образом, пептидный аналог несущего эпитоп пептида по настоящему изобретению можно получить общепринятым образом по этому способу. В патенте США 4708781 Geysen (1987) более подробно описывает этот способ, посредством которого идентифицируют пептид, несущий иммуногенный эпитоп желаемого белка."Иммуногенный эпитоп" определяют как часть белка, индуцирующую ответ антитела, в случае, когда целый белок является иммуногеном. Считают, что иммуногенные эпитопы ограничены двумя или более областями молекулы. С другой стороны, участок белковой молекулы, с которым может связываться антитело, определяют как "антигенный эпитоп". Как правило, в белке число иммуногенных эпитопов меньше, чем число антигенных эпитопов. Например, см. Geysen H.M. et al., Proc. Natl. Acad. Sci. USA 81: 3998-4002 (1984). Пептид, несущий антигенный эпитоп по настоящему изобретению, является применимым для индукции антител, включая моноклональное антитело, специфически связывающее белок по настоящему изобретению. Таким образом, большинство гибридов, полученных слиянием клеток селезенки, взятых от донора, иммунизированного пептидом, несущим антигенный эпитоп, секретируют антитела, как правило,узнающие природные белки. Антитела, индуцированные пептидом, несущим антигенный эпитоп, являются применимыми для детекции мимикрирующих белков, и антитела против различных пептидов можно использовать для прослеживания судьбы различных областей предшественника белка, которые подвергаются посттрансляционному процессингу. Пептид и антитело против пептида можно использовать во множестве количественных или качественных анализов для мимикрирующих белков (например, в конкурентных анализах), поскольку показано, что в анализах иммунопреципитации даже короткие пептиды (например, приблизительно 9 аминокислот) могут связываться и замещать более длинные пептиды. Например, см. Wilson I.A. et al., Cell 37: 767-778 (1984) 777. Антитело против белка по настоящему изобретению является также применимым для очистки мимикрирующих белков (например, адсорбционной хроматографией с использованием способа, известного в данной области). Пептид, несущий антигенный эпитоп по настоящему изобретению, сконструированный согласно вышеуказанному руководству, предпочтительно включает в себя последовательность из по меньшей мере семи, более предпочтительно из по меньшей мере девяти, наиболее предпочтительно от приблизительно 15 до приблизительно 30 аминокислот, включенных в аминокислотную последовательность белка по настоящему изобретению. Однако пептид или полипептид, содержащий более крупную часть аминокислотной последовательности белка по настоящему изобретению, содержащей от приблизительно 30 до приблизительно 50 аминокислот, или любую длину вплоть до полной аминокислотной последовательности белка по настоящему изобретению и включая ее, также предусмотрен как несущий эпитоп пептид по настоящему изобретению и также является применимым для индукции антител, узнающих мимикрирующий белок. Предпочтительно аминокислотную последовательность несущего эпитоп пептида выбирают так, что она может обеспечивать значительную растворимость в водном растворителе (т.е. выбранная последовательность содержит относительно гидрофильные остатки, и высокогидрофобной последовательности предпочтительно избегают); и последовательность, содержащая остаток пролина, является особенно предпочтительной. Несущий эпитоп пептид по настоящему изобретению можно получать желательными, общепринятыми способами получения рекомбинантного белка с использованием гена по настоящему изобретению. Например, короткую несущую эпитоп аминокислотную последовательность можно сливать с более крупным полипептидом, который действует как носитель во время продукции и очистки рекомбинанта и иммунизации для получения антитела против белка. Несущий эпитоп пептид можно также синтезировать с использованием известного способа химического синтеза. Кроме того, настоящее изобретение может относиться к белку, подлежащему экспрессии, где в белок включен подходящий секреторный сигнал, для секреции транслированного белка во внутреннюю часть просвета эндоплазматического ретикулума, во внутреннюю часть периплазматического пространства или во внеклеточное окружение. Секреторный сигнал может являться эндогенным по отношению к полипептиду, или может представлять собой гетерогенный сигнал. Таким образом, белок по настоящему изобретению можно экспрессировать в модифицированной форме, такой как слитый белок, и он может содержать не только секреторный сигнал, но также дополнительную гетерогенную функциональную область. Например, дополнительную аминокислоту, в частности область электрически заряженных аминокислот, можно добавлять к N-концу белка для улучшения стабильности и долговечности в клетках-хозяевах во время очистки или последующих манипуляций и хранения. Кроме того, часть пептида можно добавлять к белку для облегчения очистки. Такую область можно удалять перед окончательным выделением белка. В частности, добавление части пептида к белку с целью вызвать секрецию или экскрецию, улучшить стабильность и облегчить очистку, хорошо известны в данной области и представляют собой общепринятые способы. Предпочтительно слитый белок содержит гетерогенную область, полученную из иммуноглобулина,где гетерогенная область является применимой, чтобы сделать белок растворимым. Например, в EP A 0464533 ,эквивалентной канадской патентной заявке 20458691, описаны слитые белки, содержащие различные части константных областей молекул иммуноглобулинов вместе с другим белком человека или его частью. Во многих случаях применение Fc-области слитого белка является значительно преимущественным для применения в терапии и диагностике, таким образом, приводя, например, к улучшенным фармакокинетическим свойствам (EP A 0232262). С другой стороны, для некоторых применений является желательным делетировать Fc-фрагмент после того, как слитый белок экспрессирован, детектирован и очищен описанным преимущественным способом. Это представляет собой случай, где доказано, что Fcфрагмент является помехой для применения в терапии и диагностике (например, в случае, где слитый белок предназначен для применения в качестве антигена для иммунизации). Например, при скрининге лекарственных средств белки человека, такие как hIL-5, сливали с Fc-фрагментами для применения в анализе высокопроизводительного скрининга для идентификации антагониста hIL-5. См. D. Bennett et al.,Journal of Molecular Recognition Vol. 8: 52-58 (1995), и K. Johanson et al., The Journal of Biological Chemistry Vol. 270,16, pages 9459-9471 (1995).(1-2) Функции. Далее подэобно описаны функции белка по настоящему изобретению, принимая вышеописанный белок SITH-1 в качестве примера. Как показано в описанном позже примере, ген SITH-1 экспрессирован все время в цитоплазме клеток, латентно инфицированных HHV-6, но не в продуктивно инфицированных клетках. Ген, кодирующий белок SITH-1, закодирован в ДНК, формирующей комплементарную цепь для обнаруженного ранее специфического для латентной инфекции HHV-6 гена (H6LT), и экспрессия гена усиливается на промежуточной стадии латентной инфекции HHV-6. По этим фактам считают, что белок SITH-1 представляет собой белок, специфически экспрессирующийся во время латентной инфекции HHV-6. Кроме того, обнаружили, что белок SITH-1 явно отличается от идентифицированных до настоящего времени белков, вовлеченных в латентную инфекциюHHV-6. Кроме того, авторы настоящего изобретения провели функциональный анализ белка SITH-1 и обнаружили следующий факт: белок SITH-1 связывается с CAML (регулирующим уровень кальция лигандом циклофилина, инвентарныйU18242), который представляет собой белок хозяина, так что увеличивает концентрацию кальция в глиальных клетках, таких как астроциты. CAML представляет собой белок, в большом количестве встречающийся в мозге и лимфоцитах в живом организме хозяина, и известно, что он увеличивает концентрацию кальция в клетках. Кроме того, считают, что увеличение внутриклеточной концентрации кальция из-за экспрессии белка SITH-1 индуцирует активацию общей передачи сигналов в латентно инфицированной клетке, таким образом, внося вклад в эффективную реактивацию HHV-6. Под термином "глиальные клетки", как применяют в настоящем документе, понимают все виды глиальных клеток, включая зрелые формы и формы предшественников глиальных клеток в центральной нервной системе, например астроциты, олигнодендроциты, микроглию и эпендимные клетки. Другие типы, которые можно предусматривать, представляют собой сателлитные клетки, шванновские клетки и терминальные глиоциты в периферической нервной системе. Известно, что HHV-6 вызывает латентную инфекцию глиальных клеток (например, астроцитов) в мозге. Считают, что концентрация кальция в глиальных клетках (например, астроцитах) повышается,если HHV-6, находясь на стадии латентной инфекции или на промежуточной стадии, которая представляет собой стадию латентной инфекции, характеризующуюся высокой активностью, вызывает экспрессию SITH-1. В результате обнаружений, недавно сделанных в области психиатрии, считают, что увеличение внутриклеточной концентрации кальция в клетках мозга тесно связаны с аффективными нарушениями и другими ментальными нарушениями. Фактически как показано в примере, оказалось, что экспрессия белка SITH-1 в глиальных клетках мыши (например, астроцитах) индуцирует симптомы, сходные с симптомами аффективных нарушений,которые представляют собой ментальные нарушения, и увеличивает чувствительность. Это убедительно позволяет предполагать возможность того, что HHV-6, латентно инфицирующий глиальные клетки (например, астроциты), может запускать ментальное нарушение посредством белка SITH-1. Более того, HHV-6 может инфицировать не только астроциты, но и другие типы глиальных клеток,такие как микроглия. Таким образом, ментальные нарушения, такие как депрессия и маниакальнодепрессивное заболевание, могут быть вызваны другими типами глиальных клеток в дополнение к астроцитам. Вышеупомянутые обнаружения позволяют предполагать, что белок по настоящему изобретению обладает способностью сохранять активность связывания CAML, который представляет собой белок хозяина, и увеличения внутриклеточной концентрации кальция. Обнаружено также, что ментальное нарушение можно индуцировать, вызывая экспрессию белка по настоящему изобретению в глиальных клетках (например, астроцитах), где, по-видимому, происходит наиболее сильная экспрессия этого белка. Таким образом, считают, что белок по настоящему изобретению обладает способностью вызывать ментальное нарушение у хозяина при экспрессии во время латентной инфекции герпесвирусом или на ранней стадии его реактивации.(1-3) Способы получения гена и белка. Способы получения (или продукции) гена и белка по настоящему изобретению не являются ограниченными конкретно. Ниже описаны типичные примеры способов. Способ получения белка. Как описано выше, способ получения белка по настоящему изобретению (или способ продукции белка) не является ограниченным конкретно. Примеры способа включают в себя способ простой очистки из биологических образцов (например, клеток, тканей или отдельного организма), содержащих белок по настоящему изобретению. Способ очистки также не является ограниченным конкретно, и его можно осуществлять таким образом, что раствор экстракта экстрагируют из клеток или тканей известным способом, и затем раствор экстракта очищают известным способом (например, способом с использованием колонки). Например, белок по настоящему изобретению можно очищать и выделять проведением высокоэффективной жидкостной хроматографии (HPLC) для фракции неочищенного белка, выделенной из клеток или тканей. Кроме того, другие примеры способа получения белка по настоящему изобретению включают в себя способ с использованием, например, способа генной рекомбинации. В этом случае, например, можно принять способ: ген по настоящему изобретению вставляют, например, в вектор, вектор затем переносят в клетку-хозяина известным способом, так что он способен экспрессироваться в ней, и белок, полученный трансляцией внутри клетки, очищают. Конкретные способы переноса гена (трансформации), экспрессии гена и т.п. описаны ниже. Следует отметить, что для переноса чужеродного гена в хозяина, как выше, вектора и хозяина можно выбирать в зависимости от их назначения, поскольку существуют различные виды хозяев и экспрессирующих векторов, содержащих промотор, функционирующий в хозяине для экспрессии чужеродного гена. Способ очистки продуцированного белка отличается в зависимости от используемого хозяина и/или характеристик белка. Однако, например, использование метки позволяет выделять целевой белок относительно простым способом. Способ получения мутантного белка также не является ограниченным каким-либо конкретным способом. Можно использовать известный способ получения мутантного белка, например сайтнаправленный метагенез (Hashimoto-Gotoh, Gene 152, 271-275 (1995), и другие), способ получения мутантного белка введением точечной мутации в нуклеотидную последовательность способом ПЦР или способом получения мутантной линии вставкой транспозона. С использованием любого из этих способов можно получать мутантный белок, осуществляя в нуклеотидной последовательности кДНК, кодирующей белок (а), мутацию замены, делеции, вставки и/или добавления одного или нескольких нуклеотидов. Кроме того, мутантный белок можно получать с использованием коммерчески доступного набора. Способ получения белка по настоящему изобретению не ограничен указанными выше способами. Альтернативно, можно использовать, например, химический синтез с использованием, например, коммерчески доступного синтезатора пептидов. Кроме того, альтернативно, например, бесклеточный раствор для синтеза белка можно использовать для синтеза пептида по настоящему изобретению по гену по настоящему изобретению. Способ получения гена. Как описано выше, способ получения гена по настоящему изобретению (или способ продукции гена) также не является ограниченным конкретно и может представлять собой, например, способ с использованием дифференциального скрининга (вычитательное клонирование). Этот способ можно осуществлять таким образом, чтобы согласно известному способу проводить несколько повторов прямой гибридизации в пробирке, чтобы сконцентрировать кДНК-мишень (ген по настоящему изобретению). Каждую стадию дифференциального скрининга можно проводить в общепринятых условиях. В отношении клона, полученного в результате этого, можно получать карту с помощью рестрикционного фермента, и можно определять нуклеотидную последовательность (секвенировать), для более подробного анализа клона. Этот анализ позволяет легко подтверждать, получен или нет фрагмент ДНК, содержащий последовательность гена по настоящему изобретению. Альтернативно, способ получения гена по настоящему изобретению может представлять собой способ выделения и клонирования согласно известному способу фрагмента ДНК, содержащего ген по настоящему изобретению. Например, можно получать зонд, специфически гибридизующийся с частью последовательности кДНК, и проводить скрининг геномной библиотеки ДНК или библиотеки кДНК. Зонд может обладать любой последовательностью и/или длиной, пока он специфически гибридизуется по меньшей мере с частью последовательности кДНК или комплементарной ей последовательности. Кроме того, альтернативно, способ получения гена по настоящему изобретению может представлять собой способ с использованием способов амплификации, таких как ПЦР. Например, праймеры получают соответственно на основе 5'- и 3'-концов последовательности кДНК (или комплементарной ей последовательности) гена по настоящему изобретению, и праймеры используют, например, для проведения ПЦР с геномной ДНК (или кДНК) в качестве матрицы, так что амплифицируют область ДНК между праймерами. Таким способом фрагменты ДНК, включая ген по настоящему изобретению, можно получать в массовом количестве. Кроме того, альтернативно, полинуклеотид, обладающий этой последовательностью, можно синтезировать известным химическим синтезом на основании информации о последовательности гена.(2) Антитело по настоящему изобретению. Антитело по настоящему изобретению получают в форме поликлонального или моноклонального антитела известным способом с использованием в качестве антигена белка по настоящему изобретению(например, белка (а) или (b или его частичного пептида. Примеры известного способа включают в себя способы, описанные в документах, таких как: Harlow et al., "Antibodies: A laboratory manual (Cold SpringAntibody Hybridomas and ELISA)", Kodansha (1991. Полученное таким образом антитело можно использовать для детекции и анализа белка по настоящему изобретению. Например, несущий эпитоп пептид по настоящему изобретению, описанный выше в (1-1), используют для индукции антитела способом, известным в данной области. Например, см.: Chow, M. et al., Proc.Natl. Acad. Sci. USA 82: 910-914; и Bittle, F. J. et al., J. Gen. Virol. 66: 2347-2354 (1985). Как правило, животных можно иммунизировать свободным пептидом; однако титр антитела против белка можно увеличивать бустер-иммунизацией посредством соединения пептида с высокомолекулярным носителем (например, гемоцианином морского блюдечка (KLH) или анатоксином столбняка). Например, пептид, содержащий цистеин, можно соединять с носителем с использованием линкера, такого как ммалеимидобензоил-N-гидроксисукцинимидный эфир (MBS), в то время как другие пептиды можно соединять с носителями с помощью более распространенных линкеров, таких как глутаральдегид. Животных, таких как кролики, крысы и мыши, иммунизируют свободным или связанным с носителем пептидом, например посредством внутрибрюшинной и/или внутрикожной инъекции приблизительно 100 мкг эмульсии, содержащей пептид или белок-носитель и адъювант Фрейнда. Может потребоваться несколько инъекций для бустер-иммунизации, например, с 2-недельными интервалами, например, для получения антитела против белка с применимым титром, который можно детектировать в анализе ELISA с использованием свободного пептида, адсорбированного на твердой поверхности. Титр антитела против белка в сыворотке от иммунизированного животного можно увеличивать отбором антитела против белка, например, связыванием с пептидом на твердой подложке способом, известным в данной области, и растворением отобранного антитела. Термин "антитело" в настоящем документе обозначает иммуноглобулины (IgA, IgD, IgE, IgG, IgM и их Fab-фрагменты, F(ab')2-фрагменты и Fc-фрагменты), которые включают в себя в качестве неограничивающих примеров поликлональные антитела, моноклональные антитела, одноцепочечные антитела, антиидиотипические антитела и гуманизированные антитела. Термин "антитело, узнающее белок по настоящему изобретению" в настоящем документе предназначен, чтобы включать в себя полные молекулы и фрагменты антител (например, Fab- и F(ab')2 фрагменты), способные специфически связывать описанный выше белок по настоящему изобретению.Fab- и F(ab')2-фрагменты, в каждом из которых отсутствует Fc-фрагмент, входящий в интактное антитело, подвергаются более быстрому клиренсу из кровотока и вряд ли могут обладать тканеспецифическим связыванием, как интактное антитело (Wahl et al., J. Nucl. Med. 24: 316-325 (1983. По этой причине эти фрагменты являются предпочтительными. Кроме того, другое антитело, способное узнавать белок по настоящему изобретению, можно получать двухступенчатым способом посредством использования антиидиотипического антитела. В этом способе используют преимущество того факта, что антитело само по себе является антигеном; таким образом, этим способом можно получать антитело, связывающееся со вторым антителом. По этому способу антитело, специфическое для белка по настоящему изобретению, используют для иммунизации животных (предпочтительно, мышей). Затем клетки селезенки животных используют для получения клеток гибридомы, которые затем подвергают скринингу для идентификации клона, продуцирующего антитело,аффинность которого для связывания с антителом, специфическим для белка по настоящему изобретению, можно блокировать белковым антигеном по настоящему изобретению. Такое антитело может представлять собой антиидиотипическое антитело против антитела, специфического для белка по настоящему изобретению, и его можно использовать для иммунизации животных для индукции образования дополнительных антител, специфических для белка по настоящему изобретению. Понятно, что Fab-фрагмент, F(ab')2-фрагмент и другие фрагменты антитела по настоящему изобретению можно использовать в способах, описанных в настоящем документе. Эти фрагменты получают расщеплением протеолизом с использованием фермента, типичные примеры которого включают в себя папаин (образующий Fab-фрагмент) или пепсин (образующий F(ab')2-фрагмент). Альтернативно, связывающий белок фрагмент по настоящему изобретению можно получать применением способа рекомбинантной ДНК или посредством синтетической химии. Для детекции увеличенного уровня белка по настоящему изобретению с использованием получения изображения in vivo с целью диагностики у людей может являться предпочтительным использовать "гуманизированное" химерное моноклональное антитело. Такое антитело можно получать с использованием генетической конструкции, полученной из клеток гибридомы, образующей вышеупомянутое моноклональное антитело. Способы получения химерных антител известны в данной области знаний. Их общие описания см. в: Morrison, Science 229: 1202 (1985); Oi et al., BioTechniques 4: 214 (1986); Cabilly et al. Патент США 4816567; Taniguchi et al., EP 171496; Morrison et al., EP 173494; Neuberger et al., WO 8601533; Robinson et al., WO 8702671; Boulianne et al., Nature 312: 643 (1984) и Neuberger et al., Nature 314: 268 (1985).(3) Рекомбинантный экспрессирующий вектор по настоящему изобретению. Рекомбинантный экспрессирующий вектор по настоящему изобретению содержит ген по настоящему изобретению, кодирующий белок (а) или (b). Рекомбинантный экспрессирующий вектор может представлять собой, например, рекомбинантный экспрессирующий вектор, в который вставлена кДНК. Рекомбинантный экспрессирующий вектор можно получать с использованием, например, плазмиды, фага или космиды (не ограничиваясь ими). Кроме того, в способе получения рекомбинантного экспрессирующего вектора можно применять известный метод. Вектор не является ограниченным каким-либо специфическим видом и может являться любым, пока его можно экспрессировать в клетке-хозяине (хозяине). То есть экспрессирующий вектор можно получать следующим образом: чтобы ген надежно экспрессировался, последовательность промотора выбирают, как необходимо в соответствии с типом клетки-хозяина; и выбранную таким образом последовательность промотора и ген по настоящему изобретению вставляют, например, в плазмиду различных видов. Примеры экспрессирующего вектора включают в себя фаговые векторы; плазмидные векторы; вирусные векторы; ретровирусные векторы; хромосомные векторы; эписомные векторы; и полученные из вирусов векторы (например, векторы, полученные из бактериальных плазмид, бактериофагов, эписомы дрожжей, хромосомные элементы дрожжей, вирусы (например, бакуловирусы, паповавирусы, вирусы осповакцины, аденовирусы, авипоксвирусы, вирусы инфекционного бульварного паралича, герпесвирусы, лентивирусы и ретровирусы) и их сочетания, например, космиды и фагмиды). Как правило, введение плазмидного вектора осуществляют в взвесях, таких как взвеси фосфата кальция, или в комплексе с заряженными липидами. В случае, когда вектор представляет собой вирус,вектор можно упаковывать in vitro с использованием подходящей линии упаковывающих клеток, и затем ими можно трансдуцировать клетку-хозяина. Ретровирусный вектор может являться реплицирующимся или дефектным по репликации. В последнем случае размножение вируса, как правило, происходит только в комплементирующей клетке-хозяине. Кроме того, предпочтительными являются векторы, каждый из которых включает в себя цисдействующую регуляторную область для гена-мишени. Пригодный трансдействующий фактор может предоставлять хозяин, комплементирующий вектор, или сам вектор во время введения вектора хозяину. В предпочтительном в этом отношении варианте осуществления предпочтительными являются векторы,каждый из которых обеспечивает специфическую экспрессию, которая может являться индуцибельной и/или специфической для типа клеток. Особенно предпочтительными среди этих векторов являются векторы, индуцибельные посредством внешних факторов, которыми легко манипулировать, такие как температура и питательные добавки. Примеры предпочтительного вектора для бактерий для использования включают в себя: pQE70,pQE60 и pQE-9 (доступные из Qiagen); вектор pBS, вектор Phagescript, вектор Bluescript, pNH8A,pNH16a, pNH18A, pNH46A (доступные из Stratagene); и ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5(доступные из Phrmacia). Кроме того, примеры предпочтительного вектора для эукариот включают в себя pWLNEO, pSV2CAT, pOG44, pXT1 и pSG (доступные из Stratagene); и pSVK3, pBPV, pMSG и pSVL(доступные из Phrmacia). Различные виды маркеров можно использовать для подтверждения, перенесен или нет ген по настоящему изобретению в клетку-хозяина, и для подтверждения, надежно или нет ген экспрессируется в клетке-хозяине. То есть, экспрессирующий вектор предпочтительно содержит по меньшей мере один селективный маркер. Примеры такого селективного маркера включают в себя редуктазу дигидрофолиевой кислоты или устойчивость к неомицину для культуры эукариотических клеток; и гены устойчивости,такие как ген устойчивости к тетрациклину и ген устойчивости к ампициллину, для культуры Е. coll и других бактерий. В другом примере используют в качестве маркера ген, делетированный в клеткехозяине, и в клетку-хозяина вводят в качестве экспрессирующего вектора плазмиду или т.п., содержащую маркер и ген по настоящему изобретению. По экспрессии маркерного гена можно подтвердить, что ген по настоящему изобретению перенесен. Альтернативно, белок по настоящему изобретению можно экспрессировать в качестве слитого белка. Например, с помощью зеленого флуоресцентного белка(GFP), полученного из Aequorea victoria, применяемого в качестве маркера, белок по настоящему изобретению можно экспрессировать в форме слитого с GFP белка. Кроме того, ген по настоящему изобретению можно связывать с вектором, содержащим селективный маркер для размножения клетки-хозяина. Кроме того, является предпочтительным, чтобы вставка ДНК являлась функционально связанной с подходящим промотором (например, промотором фага APL, промотором lac Е. coli, промотором trp,- 12023557 промотором tac, ранним промотором и поздним промотором SV40 и промотором ретровируса LTR). В качестве другого подходящего промотора можно использовать любой известный специалистам в данной области. По настоящему изобретению известные промоторы бактерий, которые предпочтительно используют, включают в себя промоторы Е. coli lacI, LacZ, Т 3, Т 7, gpt, PR, PL и trp. Подходящие промоторы эукариот включают в себя немедленный ранний промотор CMV, промотор тимидинкиназы HSV, ранний промотор SV40 и поздний промотор SV40, промотор LTR ретровируса (например, промотор вируса саркомы Рауса (RSV, и промотор металлотионеин (например, промотор металлотионеина I мыши). Является предпочтительным, чтобы рекомбинантный экспрессирующий вектор дополнительно содержал участки старта транскрипции и терминации транскрипции и область транскрипции, содержащую участок связывания рибосомы для трансляции. Зрелый транскрипт, экспрессируемый посредством векторной конструкции, содержит кодирующую область, содержащую (i) старт транскрипции AUG на старте подлежащего трансляции полипептида и (ii) стоп-кодон, надлежащим образом расположенный на конце полипептида. Транскрипцию ДНК у высших эукариот можно усиливать вставкой последовательности энхансера в вектор. Энхансер представляет ссбой цис-действующий элемент ДНК (как правило, приблизительно от 10 до 300 п.о.), действующий для усиления транскрипционной активности промотора предопределенного типа клетки-хозяина. Примеры энхансера включают в себя энхансер SV40 (расположенный от 100 до 270 п.о. на поздней стороне от точки начала репликации); энхансер раннего промотора цитомегаловируса; энхансер полиомы на поздней стороне от точки начала репликации и энхансер аденовируса. Вышеупомянутые клетки-хозяева не являются ограниченными какой-либо одной конкретной, и можно подходящим образом использовать общеизвестные клетки различных видов. Типичные примеры подходящего хозяина включают в себя клетки бактерий (например, клетки Е. coli, клетки Streptomyces и клетки Salmonella typhimurium); клетки грибов (например, клетки дрожжей); клетки насекомых (например, клетки Drosophila S2 и клетки Spodoptera Sf9); клетки животных (например, клетки СНО, клеткиCOS и клетки меланомы Bowes); и клетки растений. Более конкретные примеры этого включают в себя не только клетки млекопитающих, такие как клетки человека и клетки мыши, а также клетки, полученные из Bombys mori, насекомых, таких как Drosophila melamogaster, бактерий, таких как Е. coli (Escherichia coli), дрожжей (Saccharomyces cerevisiae и Schizosaccharomyces pombe), и Caenorhabditis elegans,и клетки-ооциты Xenopus laevis. Однако, настоящее изобретение не является ограниченным этим. Культуральная среда и условия, подходящие для каждой из вышеупомянутых клеток-хозяев, могут представлять собой те, которые известны в данной области. Способ введения экспрессирующего вектора в клетку-хозяина, т.е. способ трансформации, также не является ограниченным каким-либо конкретным, и можно подходящим образом использовать общеизвестный способ, например электропорацию, способ с фосфатом кальция, липосомами, DEAE-декстраном,микроинъекцию, опосредованную катионными липидами трансфекцию, электропорацию, трансдукцию или инфекцию. Эти способы описаны во многих общепринятых лабораторных руководствах, напримерDavis et al., Basic Methods In Molecular Biology (1986). Следует отметить, что настоящее изобретение может также относиться к (i) рекомбинантному экспрессирующему вектору, содержащему полинуклеотид, кодирующий частичный фрагмент белка по настоящему изобретению, и (ii) к трансформанту (клетке-хозяину), генетически модифицированному посредством рекомбинантного экспрессирующего вектора, каждый из которых предназначен для рекомбинантной продукции частичного фрагмента (фрагмента) белка по настоящему изобретению. Кроме того, настоящее изобретение может включать в себя также изобретение, относящееся к продукции белка по настоящему изобретению или его фрагмента посредством вышеупомянутых рекомбинантных способов. То есть настоящее изобретение может также относиться к способу продукции белка по настоящему изобретению и его фрагмента посредством применения рекомбинантного способа. Рекомбинантный белок, полученный этим способом, можно собирать и очищать из продукта культивирования рекомбинантных клеток посредством известного способа, например преципитации сульфатом аммония или преципитации этанолом, кислой экстракции, анионо- или катионообменной хроматографии,хроматографии на фосфоцеллюлозе, хроматографии гидрофобного взаимодействия, аффинной хроматографии, хроматографии на гидроксиапатите или лектиновой хроматографии. Наиболее предпочтительной, применяемой для очистки, является высокоэффективная жидкостная хроматография ("HPLC").(4) Трансформант по настоящему изобретению. Трансформант по настоящему изобретению представляет собой трансформант, в который перенесен ген по настоящему изобретению, т.е. трансформант, в который перенесен рекомбинантный экспрессирующий вектор, описанный в (3) выше. Выражение "ген перенесен" в настоящем документе означает,что ген перенесен в клетку-мишень (клетку-хозяина) подходящим для экспрессии образом посредством известного способа генной инженерии (способа генетической манипуляции). Кроме того, "трансформант" обозначает не только клетку, ткань и орган, но также отдельный организм. Способ получения (продукции) трансформанта по настоящему изобретению может представлять собой, например, способ трансформации вышеупомянутым рекомбинантным экспрессирующим векто- 13023557 ром. Организм, подлежащий трансформации, также не является ограниченным каким-либо конкретным организмом, его примеры включают в себя различные виды микроорганизмов и животных (например,трансгенную мышь), проиллюстрированных в вышеупомянутых описаниях по отношению к клеткехозяину. Кроме того, растение также может являться субъектом, подлежащим трансформации с помощью выбранного промотора и/или а вектора.(5) Средство для детекции генов по настоящему изобретению. В средстве для детекции генов по настоящему изобретению применяют в качестве зонда по меньшей мере часть нуклеотидной последовательности гена по настоящему изобретению или комплементарной ей последовательности. Средство для детекции генов можно использовать, например, для детекции и/или измерения характера экспрессии гена по настоящему изобретению в различных условиях. Средство для детекции генов по настоящему изобретению может, например, представлять собой чип ДНК, содержащий субстрат (подложку), на которой иммобилизован зонд, специфически гибридизующийся с геном по настоящему изобретению. "Чип ДНК" в настоящем документе в первую очередь относится к синтетическому чипу ДНК, в котором используют в качестве зонда синтезированный олигонуклеотид. Не только это, термин "чип ДНК" в настоящем документе включает в себя также микромассив ДНК по типу присоединения, в котором используют в качестве зонда кДНК, такую как продукт ПЦР. Последовательность, применяемую в качестве зонда, можно определять общеизвестным способом для определения характерной последовательности по последовательности кДНК. Конкретно, например,способ может представлять собой способ серийного анализа экспрессии генов (SAGE) (Science 276:1268,1997; Cell 88:243, 1997; Science 270:484, 1995; Nature 389:300, 1997; патент США 5695937). Следует отметить, что чип ДНК можно изготавливать известным способом. Например, чтобы использовать синтезированный олигонуклеотид в качестве олигонуклеотида, способ фотолитографии и способ твердофазного синтеза ДНК можно использовать в сочетании, так что олигонуклеотид получают посредством синтеза на субстрате. С другой стороны, чтобы использовать кДНК в качестве олигонуклеотида, кДНК можно присоединять к субстрату с помощью аппарата для составления массива. Кроме того, так же как в общепринятых чипах ДНК, точность детекции гена можно дополнительно улучшить предоставлением полностью совпадающего зонда (олигонуклеотида) вместе с несовпадающим зондом, который отличается от полностью совпадающего зонда заменой одного основания. Кроме того,для параллельной детекции различных генов чип ДНК можно сконфигурировать так, что множество видов олигонуклеотидов иммобилизуют на одном субстрате. Далее более подробно описано средство для детекции генов по настоящему изобретению. Субстрат. От материала субстрата для применения в средстве для детекции генов по настоящему изобретению требуется только то, чтобы он представлял собой материал, на котором можно стабильно иммобилизовать олигонуклеотид. Материал включает в себя в качестве неограничивающих примеров синтетические смолы (например, поликарбонат и пластмассу) и стекло. Форма субстрата также не является ограниченной какой-либо конкретной формой. Например, предпочтительно можно использовать субстрат в форме планшета или субстрат в форме пленки. Олигонуклеотид, подлежащий иммобилизации на поверхности субстрата. От олигонуклеотида, подлежащего иммобилизации на поверхности субстрата из средства для детекции генов по настоящему изобретению, требуется только то, чтобы он представлял собой олигонуклеотид, основанный по меньшей мере на части нуклеотидной последовательности гена по настоящему изобретению. По установлению гибридизации между олигонуклеотидом и нуклеиновой кислотой, полученной из образца, можно детектировать ген, содержащийся в образце. Следует отметить, что олигонуклеотид, основанный по меньшей мере на части нуклеотидной последовательности гена по настоящему изобретению, далее в настоящем документе в некоторых случаях обозначают как "связывающий олигонуклеотид". Связывающий олигонуклеотид можно конструировать на основании нуклеотидной последовательности гена по настоящему изобретению. Таким образом, связывающий олигонуклеотид может представлять собой саму нуклеотидную последовательность или может включать в себя мутацию, пока это позволяет установление специфической гибридизации между связывающим олигонуклеотидом и нуклеиновой кислотой, полученной из образца, подлежащего детекции. Положение мутации не является конкретно ограниченным. Длина (число оснований) связывающего олигонуклеотида не является конкретно ограниченной. Однако, если длина является слишком короткой, детекция гибридизации становится сложной; если длина является слишком длинной, возможна неспецифическая гибридизация. Авторы настоящего изобретения продолжали исследовать оптимизацию длины связывающего олигонуклеотида и определили длину 12-50 оснований как стандартную длину. Стандартная длина составляет предпочтительно 12-40 оснований,более предпочтительно 12-30 оснований, более предпочтительно 13-22 оснований. Однако, настоящее изобретение не является ограниченным этим. Длина в основаниях в первую очередь зависит от характеристик последовательности (содержания конкретного основания, повторения конкретного основания). Кроме того, авторы настоящего изобретения подтвердили, что даже короткоцепочечный связывающий олигонуклеотид способен к специфической гибридизации при условии, что короткоцепочечный связывающий олигонуклеотид обладает точным связыванием. В случае, когда связывающий олигонуклеотид обладает одной из структуры шпильки, структуры петли и других третичных структур, каждая из которых препятствует гибридизации с нуклеиновой кислотой, полученной из образца, замена одного или нескольких нуклеотидов, составляющих связывающий олигонуклеотид, инозином или нуклеиновой кислотой(кислотами), не спаривающимися с какимлибо нуклеотидом(нуклеотидами), может устранять третичную структуру. Способ синтеза связывающего олигонуклеотида не является ограниченным каким-либо конкретным способом. Например, можно использовать известный способ (например, способ, описанный в Maniatis T.et al., Molecular Cloning A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press (1989. В общем, связывающий олигонуклеотид можно синтезировать химически с использованием коммерчески доступного ДНК-синтезатора. В средстве для детекции генов по настоящему изобретению является предпочтительным, чтобы так называемый контрольный связывающий олигонуклеотид, так же как олигонуклеотид, основанный по меньшей мере на части нуклеотидной последовательности гена по настоящему изобретению, являлись иммобилизованными на поверхности субстрата. Контрольный связывающий олигонуклеотид включает в себя связывающий олигонуклеотид для положительного контроля и связывающий олигонуклеотид для отрицательного контроля. Связывающий олигонуклеотид для положительного контроля используют для проверки, успешно или нет прошла реакция амплификации на описанной ниже стадии получения зонда. Связывающий олигонуклеотид для отрицательного контроля используют для проверки неспецифической гибридизации, т.е. ложноположительного сигнала гибридизации. Настоящее изобретение относится также к средству для детекции генов, в котором эти связывающий олигонуклеотид для положительного контроля и связывающий олигонуклеотид для положительного контроля иммобилизованы на поверхности субстрата. Связывающий олигонуклеотид для положительного контроля может представлять собой любой олигонуклеотид при условии, что он сконструирован на основе нуклеотидной последовательности, входящей в зонд, полученный из образца, подлежащего детекции. Кроме того, чтобы множество образцов,подлежащих детекции, детектировать одновременно с использованием одного средства для детекции генов, связывающие олигонуклеотиды для положительного контроля можно сконструировать соответственно для образцов, подлежащих детекции, или связывающий олигонуклеотид для положительного контроля можно сконструировать на основе нуклеотидной последовательности, общей для зондов, полученных из множества образцов, подлежащих детекции. В случае, если не существует нуклеотидной последовательности, общей для зондов, полученных из всех образцов, подлежащих детекции, связывающий олигонуклеотид для положительного контроля можно сконструировать для каждой из некоторых групп. Альтернативно, искусственную последовательность можно сконструировать так, чтобы она обладала последовательностью, отличающейся от последовательности рассматриваемой бактерии, но обладала общей последовательностью праймера, и часть искусственной последовательности можно использовать в качестве связывающего олигонуклеотида для положительного контроля. С помощью такой искусственной последовательности, используемой в качестве матрицы, можно получить зонд (такой зонд в настоящем документе назван "контрольный зонд"), и полученный зонд добавляют к зонду, полученному из образца. Таким образом, можно тестировать специфичность гибридизации. Более подробно зонд обсуждают ниже. Является предпочтительным связывающий олигонуклеотид для отрицательного контроля конструировать так, чтобы он обладал нуклеотидной последовательностью связывающего олигонуклеотида для положительного контроля с искусственной заменой одного или нескольких оснований, но менее чем 20% от всех оснований последовательности. Число замененных оснований определяют, принимая во внимание условия гибридизации, так что связывающий олигонуклеотид для отрицательного контроля не гибридизуется с зондом, полученным из образца, подлежащего детекции. Образец, подлежащий детекции, не является ограниченным каким-либо конкретным образцом. Кроме того, необходимо только, чтобы количество видов связывающих олигонуклеотидов, подлежащих иммобилизации на одном субстрате, составляло один или более, и не существует верхнего предела для этого. Также является наиболее предпочтительным конструировать средство для детекции генов по настоящему изобретению так называемого типа микромассива, в котором множество частичных фрагментов (обладающих различными нуклеотидными последовательностями) гена по настоящему изобретению иммобилизуют на одном субстрате в качестве связывающих олигонуклеотидов. Иммобилизация олигонуклеотида (связывающего олигонуклеотида). Способ иммобилизации олигонуклеотида на поверхности субстрата не является ограниченным каким-либо конкретным способом, но его можно выбрать из известных способов, по необходимости. Например, доступны средства, применяемые для общих способов гибридизации, например физическая адсорбция, электрическое связывание или молекулярное ковалентное связывание. Для средства для детекции генов по настоящему изобретению является предпочтительным использование субстрата, обладающего карбодиимидной группой или изоцианатной группой на поверхности (патент США 5908746,- 15023557Tokukaihei,8-23975) для иммобилизации. Если количество олигонуклеотида, наносимого пятнами на субстрат, слишком мало, детекция может являться сложной, поскольку может происходить недостаточно сильная реакция между олигонуклеотидом и зондом. Кроме того, нанесение пятнами с высокой плотностью приводит к техническим проблемам и высокой стоимости, а также требует дорогостоящего высокоточного средства для детекции(например, сканера) для детекции сигнала гибридизации с использованием, например, флуоресцентной метки из зонда или хемилюминесценции. Таким образом, является предпочтительным иммобилизовать на поверхности субстрата олигонуклеотид в пределах размера от 10 до 1000 мкм в диаметре. Способ нанесения пятен олигонуклеотида на субстрат не является ограниченным каким-либо конкретным способом. Например, нанесение пятнами можно осуществлять нанесением пятен раствора олигонуклеотида на субстрат с использованием аппарата для нанесения пятен. Таким образом, раствор олигонуклеотида можно, как правило, наносить, по существу, кругами.(6) Средство для детекции с использованием белка по настоящему изобретению или его частичного фрагмента. В средстве для детекции по настоящему изобретению используют в качестве зонда по меньшей мере часть аминокислотной последовательности белка по настоящему изобретению. Иными словами, средство для детекции по настоящему изобретению представляет собой средство для детекции с иммобилизованным на нем белком по настоящему изобретению или его частичным фрагментом (фрагментом). Средство для детекции можно использовать для детекции и/или измерения в различных условиях вещества (например, полипептида, нуклеиновой кислоты или антитела), взаимодействующего с белком по настоящему изобретению. Средство для детекции по настоящему изобретению может представлять собой, например, средство, включающее субстрат (подложку) с иммобилизованным на нем зондом, где зонд специфически связывается с антителом, узнающим белок по настоящему изобретению. В случае аминокислотной последовательности, используемой в качестве зонда, является предпочтительным использовать участок белка по настоящему изобретению, где участок специфически взаимодействует с антителом по настоящему изобретению, т.е. несущий эпитоп пептид белка по настоящему изобретению. От материала субстрата для применения в средстве для детекции по настоящему изобретению требуется только то, чтобы он представлял собой материал, на котором можно стабильно иммобилизовать олигопептид. Материал включает в себя в качестве неограничивающих примеров синтетические смолы(например, поликарбонат и пластмассу) и стекло. Форма субстрата также не является ограниченной какой-либо конкретной формой. Например, предпочтительно можно использовать субстрат в форме планшета или субстрат в форме пленки. Кроме того, способ иммобилизации олигопептида на субстрате может представлять собой общеизвестный способ и не является ограниченным каким-либо конкретным способом. Например, иммобилизацию можно осуществлять посредством способа, в котором олигопептид связан с нерастворимым носителем посредством способа ковалентного связывания или способа адсорбции; способ иммобилизации захватыванием, в котором олигопептид окружают высокомолекулярными веществами; или способ, в котором олигопептид иммобилизуют на подложке с использованием сшивающего средства или т.п. Следует отметить, что подходящий способ иммобилизации можно выбирать с учетом (i) совместимости между субстратом для иммобилизации олигопептидом (ii) цели использования иммобилизованного вещества.(7) Полезность гена, белка и прочего по настоящему изобретению. Как описано выше, ген и белок по настоящему изобретению экспрессируются специфически во время латентной инфекции герпесвирусом. Считают, что этот белок обладает способностью индуцировать ментальное нарушение у хозяина при экспрессии в глиальных клетках (например, астроцитах) в мозге. Кроме того, интересно, что обнаружено, что ген и белок по настоящему изобретению относятся к пациентам с ментальными нарушениями. Более подробно, как показано в описанном позже примере, антитело против SITH-1 детектировали приблизительно у 50% пациентов, страдающих аффективными нарушениями или другими ментальными нарушениями, в то время как антитело против SITH-1 почти не поддавалось детекции у здоровых индивидуумов (частота детекции антитела против SITH-1 у здоровых индивидуумов составляла менее приблизительно 2%). Таким образом, авторы настоящего изобретения самостоятельно открыли, что антитело, специфическое для белка по настоящему изобретению, обнаружено в значительном количестве только у пациентов с аффективными нарушениями и другими ментальными нарушениями, но едва поддается детекции у здоровых индивидуумов. Следует отметить, что "ментальное нарушение", как применяют в настоящем документе, предназначено для обозначения состояния, при котором возникают значительные ограничения в повседневной жизни или социальной жизни из-за нарушений ментальных функций, таких как сознание, интеллект, память, эмоции, мышление и поведение. "Аффективное нарушение" предназначено,чтобы обозначать такое состояние, когда из-за постоянных изменений настроения или эмоциональных изменений испытывают аномальные чувства депрессии или подъема с нарушениями в функциях повседневной жизни или в функциях социальной жизни. Конкретные причины для вышеупомянутого состояния, когда "антитело, специфическое для белка по настоящему изобретению обнаруживают в значительном количестве только у пациентов с аффективными нарушениями и другими ментальными нарушениями, но оно едва поддается детекции у здоровых" в настоящее время подвергаются интенсивному изучению для их понимания. Белок по настоящему изобретению обладает таким свойством, что он активно продуцируется на промежуточной стадии, когда латентная инфекция индуцируется по направлению к реактивации. Считают, что в ответ на стресс индуцируется реактивация герпесвирусов (например, HHV-6), в результате чего продуцируется белок по настоящему изобретению. Считают, что у индивидуумов, обладающих антителами против белка го настоящему изобретению, насчитывающих приблизительно 50% из пациентов с ментальными нарушениями, экспрессия этого белка избыточна из-за стресса или какого-либо генетического фактора в течение длительного периода в глиальных клетках (например, астроцитах) в мозге, когда глиальные клетки являются латентно инфицированными HHV-6. В результате, увеличение концентрации кальция в глиальных клетках (например, астроцитах) продолжается в течение длительного периода, и метаболизм серотонина и другие важные функции глиальных клеток (например, астроцитов) нарушены, в результате чего может проявляться ментальное нарушение. Пациенты с синдромом хронической усталости (CFS) с присутствием ментальных нарушений являются носителями антитела против белка по настоящему изобретению с высокой частотой. Причиной для этого может являться то, что пациенты с CFS часто являются латентно инфицированными HHV-6 в более высоком количестве, чем здоровые индивидуумы, таким образом, обладая большей вероятностью для продукции белка по настоящему изобретению (белок SITH1). Тот факт, что пациенты с CFS являются латентно инфицированными HHV-6 в более высоком количестве, чем здоровые, поддерживают также результаты реакции между опубликованным ранее продуктом специфического для латентной инфекции гена и антителом у пациентов с CFS (см. непатентный документ 5). Таким образом, хотя детальный механизм того феномена, что антитело против белка по настоящему изобретению обнаружено у пациентов с ментальными нарушениями, до сих пор не ясен, использование этого феномена обеспечивает способ определения и диагностический способ, вносящие вклад в объективную диагностику ментальных нарушений. Кроме того, настоящее изобретение также относится к набору для определения, набору для диагностики, способу получения модели на животных и способу скрининга лекарственного средства. Ниже подробно описан каждый из этих способов.(7-1) Способ определения по настоящему изобретению. От способа определения по настоящему изобретению требуется только то, чтобы он представлял собой способ определения, существует или нет у субъекта антитело, узнающее белок по настоящему изобретению (т.е. белок (а) или (b. Следует отметить, что термин "субъект" обозначает человека или млекопитающее, отличное от человека. Анализ антитела возможен посредством детекции, например посредством реакции связывания белка, узнаваемого антителом, или частичного фрагмента белка. Таким образом, в этом способе определения белок, узнаваемый антителом, или частичный фрагмент белка предпочтительно используют для определения присутствия антитела иммунологическим способом (т.е. с использованием реакции антигенантитело). Следует отметить, что "частичный фрагмент" предпочтительно содержит, по меньшей мере,несущий эпитоп пептид. В качестве примера этого способа определения нерастворимый носитель, на котором иммобилизован белок в соответствии с настоящим изобретением или его частичный фрагмент, приводят в контакт с биологическим образцом, взятым от субъекта, промывают и затем детектируют антитела, специфически связанные с белком или его частичным фрагментом на нерастворимом носителе. Антитела, специфически связанные с белком или его частичным фрагментом на нерастворимом носителе, представляют собой, например, антитела, полученные от субъекта. Таким образом, такие антитела можно легко детектировать с использованием вторичного антитела, т.е. антитела, специфического для антител субъекта. В этом случае краситель, фермент или радиоактивную или флуоресцентную метку можно включать во вторичное антитело для усиления и, таким образом, дополнительного облегчения предусмотренной детекции. Таким образом, анализы антител для применения в рассматриваемом способе определения включают в себя способы анализа с использованием общепринятых иммуногистологических способов, таких как способ с флуоресцентным антителом, дот-блок-анализ, способ вестерн-блоттинга, способы твердофазного иммуноферментного анализа (включая способ ELISA и сэндвич-ELISA), способ радиоиммунного анализа (RIA) и способ анализа иммунодиффузии. В этих анализах используют такие молекулы как авидин и биотин для целей молекулярной иммобилизации и детекции, и способы получения этих реагентов и способы их использования могут представлять собой способы, известные специалисту в данной области. Следует отметить, что результатом рассматриваемого способа определения является иммуногистологическое окрашивание срезов тканей для патологического тестирования. Следует также отметить, что рассматриваемый способ определения предпочтительно осуществляют с использованием биологического образца, выделенного из субъекта. Термин "биологический образец,выделенный" может относиться к любому образцу, содержащему клетки, ткани или их дезорганизован- 17023557 ные части, как взято от субъекта. Например, "выделенный биологический образец" может представлять собой любой из образцов периферической крови, слюны, мочи, кала и клеток и не является ограниченным каким-либо конкретным образцом. Из них особенно предпочтительным образцом является периферическая кровь, взятая от субъекта, принимая во внимание тот факт, что герпесвирусы латентно инфицируют макрофаги в периферической крови. В этом случае субъект получает преимущества от низкой степени инвазии. Количество антител, присутствующих в биологическом образце (образце), можно легко вычислить,проводя сравнения с количеством антител, присутствующих в стандартном препарате (например, в стандартном образце, взятом от здорового индивидуума, или в образце, взятом от типичного пациента с ментальным нарушением), с использованием, например, компьютерного алгоритма линейной регрессии. В то время как различные способы анализа доступны для детекции антител, пример ELISA описан в Iacobelli et al., Breast Cancer Research and Treatment 11: 19-30 (1988). Подходящие ферментные метки можно проиллюстрировать метками, полученными из класса оксидаз, катализирующих образование пероксида водорода посредством реакции с субстратом. Оксидаза глюкозы является особенно предпочтительной, поскольку обладает удовлетворительной стабильностью,и ее субстрат (глюкоза) является легкодоступным. Активность оксидазной метки можно оценивать измерением концентрации пероксида водорода, образованного посредством реакции меченного ферментом антитела/субстрата. В дополнение к ферментам другие пригодные метки включают в себя радиоактивные изотопы (например, иод (125I и 125I), углерод (14 С), серу (35S), тритий (3 Н), индий (112In) и технеций(99mTc), так же как флуоресцентные метки (например, флуоресцеин и родамин) и биотин. Уровень антител (против белка по настоящему изобретению), присутствующих в биологических образцах, полученных от субъекта, можно также детектировать in vivo способами, отличными от вышеописанного способа иммуноанализа, например посредством анализа получения изображения. Кратко,принимая во внимание тот факт, что антитело против белка в соответствии с настоящим изобретением также представляет собой белок, антитело, специфически узнающее это антитело, можно использовать для детекции in vivo посредством анализа изображения по уровню антител (против белка по настоящему изобретению), присутствующих в биологических образцах, полученных от субъекта. Метки или маркеры антитела для анализа получения изображения антител включают в себя те, которые можно детектировать получением рентгеновских изображений, ЯМР или ЭПР. Для получения рентгеновских изображений подходящие метки включают в себя радиоактивные изотопы, такие как барий или цезий, которые излучают поддающееся детекции радиоактивное излучение, но которые явно безопасны для тестируемого образца. Подходящие маркеры для ЯМР и ЭПР включают в себя маркеры,которые можно использовать для мечения питательных веществ для культивирования связанной гибридомы для получения соответствующего антитела, таким образом, метку включают в продуцируемое антитело; примером такой метки является дейтерий, обладающий поддающимся детекции характерным спином. Антитело или его фрагмент, которое является специфическим для антитела против белка по настоящему изобретению и которое является меченным подходящей поддающейся детекции анализом получения изображения частью, такой как радиоактивный изотоп (например, 131I, 111In или 99mTc), непроницаемый для радиоактивности субстрат или вещество, которое можно детектировать ядерным магнитным резонансом, вводят (например, парентерально, подкожно или внутривенно) млекопитающему, подлежащему тестированию по нарушению. В данной области знаний известно, что количество части для анализа получения изображения, необходимое для получения диагностического изображения, определяют по размеру подлежащего тестированию образца и по системе анализа изображения, подлежащей использованию. В случае, когда эта часть представляет собой часть радиоактивного изотопа, количество радиоактивности, подлежащей инъекции в человеческий образец, как правило, лежит в диапазоне от приблизительно 5 до приблизительно 20 мКи 99mTc. Затем меченое антитело или его фрагмент накапливается предпочтительно в том участке клетки, который содержит антитело против белка по настоящему изобретению. Следует отметить, что анализ получения изображения опухолей in vivo описан в S. W. Burchiel etThe Radiochemical Detection of Cancer, Burchiel S.W. and Rhodes B.A. eds., Masson Publishing Inc. (1982. Ниже перечислены конкретные примеры метки, доступной по настоящему изобретению. Примеры подходящих ферментных меток включают в себя малатдегидрогеназу, нуклеазу Staphylococcus, алкогольдегидрогеназу дрожжей, -глицерин-фосфатдегидрогеназа, триозофосфатизомеразу, пероксидазу,щелочную фосфатазу, аспарагиназу, оксидазу глюкозы, -галактозидазу, рибонуклеазу, уреазу, каталазу,глюкоза-6-фосфатдегидрогеназу, глюкоамилазу и ацетилхолинзстеразу. Примеры подходящих меток с радиоактивными изотопами включают в себя 3 Н, 111In, 125In, 131In, 32P,35 14S, C, 51CR, 57To, 58 Со, 59Fe, 75Se, 152Eu, 90Y, 67Cu, 217Ci, 211At, 212Pb, 47Sc и 109Pd. Индий 111 (111In) является предпочтительным изотопом в случае, когда применяют получение изображения in vivo, поскольку этим избегают проблемы дегалогенирования моноклонального антитела, меченного 125I или 131I, где дегалогенирование осуществляется в печени. Кроме того, этот радиоактивный изотоп обладает благоприят- 18023557 ной для получения изображения энергией высвечивания гамма-квантов (Perkins et al., Eur. J. Nucl. Med. 10: 296-301 (1985); Carasquillo et al., J. Nucl. Med. 28: 281-287 (1987. Например, показано, что индий 111(111In), присоединенный к моноклональному антителу с использованием 1-(Р-бензилизотиоцианат)DPTA, обладает небольшим поглощением в неопухолевых тканях, в частности печени, и, таким образом,усиливает специфичность локализации опухоли (Esteban et al., J. Nucl. Med. 28: 861-870 (1987. Примеры подходящих меток с нерадиоактивными изотопами включают в себя 157Gd, 55Mn, 162Dy,52Tr и 56Fe. Примеры подходящих флуоресцентных меток включают в себя метку 152Eu, флуоресцеиновую метку, изотиоцианатную метку, родаминовую метку, фикоэритриновую метку, фикоцианиновую метку, аллофикоцианиновую метку, о-фталальдегидную метку и флуорескаминовую метку. Примеры подходящих маркерных токсинов включают в себя дифтерийный токсин, рицин и холерный токсин. Примеры хемилюминесцентных меток включают в себя люминаловую метку, изолюминаловую метку, метку ароматического сложного эфира акридиния, имидазоловую метку, метку соли акридиния,метку оксалатного сложного эфира, люцифериновую метку, люциферазную метку и эквориновую метку. Примеры контрастных средств для ядерного магнитного резонанса включают в себя ядра атомов тяжелых металлов, таких как Gd, Mn и Fe. Репрезентативные способы для связывания вышеупомянутых меток с антителами представлены вKennedy et al. (Clin. Chim. Acta 70: 1-31 (1976 и Schurs et al. (Clin. Chim. Acta 81: 1-40 (1977. Способы присоединения, описанные в последнем, включают в себя способ с глутаральдегидом, способ с периодатом, способ с дималеинимидом и способ с м-малеинимидбензил-N-гидрокси-сукцинимидным сложным эфиром. Все эти способы приведены в настоящем документе в качестве ссылок.(7-2) Диагностический способ. От диагностического способа определения по настоящему изобретению требуется только то, чтобы в нем использовали вышеупомянутый способ определения. Конкретная конфигурация, условия и прочее диагностического способа не являются конкретно ограниченными. Например, с использованием в качестве маркера антитела по настоящему изобретению, существующего у субъекта-человека или субъектаживотного, является возможным определить, что субъект-человек или субъект-животное поражен ментальным нарушением. Кроме того, диагностику можно осуществлять с использованием в качестве показателя количественного значения для антитела по настоящему изобретению следующим образом: Пороговое значение устанавливают соответствующим образом в соответствии с количественным значением(нормальным значением), измеренным у здорового индивидуума, или с количественным значением (значением для нарушения), измеренным у типичного пациента с ментальными нарушениями; если значение,измеренное у субъекта, выше или ниже порогового значения, определяют, что субъект с большой вероятностью поражен ментальным нарушением. При развитии ментального нарушения количество антитела увеличено. Ввиду этого по настоящему изобретению, например, количественное значение (нормальное значение), измеренное у здорового индивидуума, устанавливают в качестве порогового значения; если значение, измеренное у субъекта-человека, ниже порогового значения, можно определить, что субъектчеловек с высокой вероятностью поражен ментальным нарушением. Следует отметить, что термин "субъект-человек" в настоящем документе обозначает человека, а термин "субъект-животное" обозначает животное, отличное от человека. Примеры субъекта-животного включают в себя мышей, крыс и обезьян. Не только эти, любое животное, отличное от человека, может являться "субъектом-животным". Таким образом, этот диагностический способ предоставляет возможность простого и точного определения, (i) обладает или нет субъект ментальным нарушением, или (ii) обладает или нет субъект вероятностью поражения ментальным нарушением. Кроме того, диагностический способ для субъектаживотного может являться достаточно полезным, например, для скрининга лекарственного средства для разработки лекарственных средств против ментальных нарушений и субъектов-животных для тестирования эффективности лекарственного средства.(7-3) Набор для определения, набор для диагностики. Набор для определения и набор для диагностики по настоящему изобретению требуется только разработать так, чтобы позволять осуществление способа определения, описанного выше в (7-1), или диагностического способа, описанного выше в (7-2). Конкретные конфигурации, материалы, инструменты и прочее из этого не являются конкретно ограниченными. Для специфичности, для иммунологической детекции антитела по настоящему изобретению каждый из набора для определения и набора для диагностики предпочтительно содержит любое из: (i) белка по настоящему изобретению; (ii) частичного фрагмента (предпочтительно содержащего несущий эпитоп пептид) белка (i) и (iii) средства для детекции, на котором иммобилизован белок (i) или частичный фрагмент (ii). Набор, обладающий вышеуказанной конфигурацией, является достаточно полезным, поскольку такой набор обеспечивает возможность легко и надежно осуществлять способ определения или диагностический способ по настоящему изобретению. Кроме того, в дополнение к вышеуказанной конфигурации каждый из набора для определения и на- 19023557 бора для диагностики может содержать элемент для осуществления каждой стадии способа определения или диагностического способа. Примеры такого элемента включают в себя инструменты для забора образца от субъекта (например, шприц (инъектор) для сбора периферической крови) и элемент, необходимый для осуществления способа определения и/или диагностического способа, такой как лабораторные инструменты и различные реагенты (например, реагенты, применяемые для иммунологической реакции,такой как ELISA). Кроме того, каждый из набора для определения и набора для диагностики может содержать вычислительное устройство (например, компьютер) или программное обеспечение, каждое из которых является необходимым для проведения определения более просто и точно.(7-4) Способы получения, определения, скрининга и оценки модели на животных. Диагностический способ по настоящему изобретению является применимым в способе получения модели на животных (отличных от человека) ментального нарушения; в способе определения полезности модели на животных и в способе определения полезности лекарственного средства посредством скрининга лекарственного средства с использованием модели на животных. Конкретно, как описано в примере, модельные животные для ментального нарушения можно получать введением белка SITH-1 в мозг животного с использованием, например, вектора. Кроме того, полезность модели ментального нарушения на животных можно определять следующим образом: подобным образом, как в способе определения и диагностическом способе, определяют, развивается или нет у субъекта-животного ментальное нарушение в зависимости от присутствия или отсутствия антитела по настоящему изобретению; если у субъекта-животного развилось ментальное нарушение, можно определить, что субъект-животное является применимым в качестве модели ментального нарушения на животных. Является более предпочтительным, чтобы в каждом из вышеуказанных различных способов, кроме того, использовали в качестве средства оценки диагностический способ с использованием, например,известного до настоящего времени нарушения поведения и/или реакции вздрагивания животного. Конкретно, для диагностики в тестах на животных можно использовать любое из следующего: (i) тест нарушения поведения, например тест подвешивания за хвост или тест принудительного плавания; и (ii) известный тест функционирования мозга, например реакцию вздрагивания."Субъект-животное" в настоящем документе может представлять собой любое животное, отличное от человека, особенно предпочтительные примеры животных включают в себя мышей, крыс, морских свинок, собак, кроликов, обезьян и шимпанзе. Определение (диагностика) ментальных нарушений для животных, отличных от человека, являлось более сложным. В отношении этого способ по настоящему изобретению является достаточно полезным. Кроме того, вещество-кандидат на психотропное средство или антипсихотическое средство (средство для лечения или улучшения ментального нарушения) можно вводить в такой модели на животных, и после этого тест на нарушение поведения и детекцию антитела по настоящему изобретению можно проводить таким способом, как описано выше. Затем, если ментальное нарушение является вылеченным или улучшенным, можно определить, что вещество-кандидат обладает эффектом против ментального нарушения. Таким образом, применение диагностического способа по настоящему изобретению позволяет легко и надежно проводить скрининг веществ-кандидатов на психотропное средство. "Вещество-кандидат на психотропное средство" в настоящем документе может представлять собой любое вещество, желательное для лица, проводящего тест. Следует отметить, что главным в способе определения, диагностическом способе или т.п. по настоящему изобретению является предоставление объективного способа определения для определения,поражен или нет субъект ментальным нарушением, посредством детекции антитела против белка, который специфически экспрессируется во время латентной инфекции герпесвирусом, и главное не лежит в каждой манипуляции, конкретно описанной в настоящем документе. Таким образом, следует отметить,что способы определения и диагностические способы с использованием манипуляций, отличных от описанных выше, также входят в объем настоящего изобретения. Кроме того, считают, что инфекция герпесвирусами связана с заболеваниями, сопровождающимися иммунодефицитом, такими как CFS, которые описаны также в примере (например, аутоиммунные заболевания, такие как болезнь Крона); кожные заболевания, которые также считают связанными с HHV-6(например, индуцируемый лекарственным средством синдром гиперчувствительности); и энцефалит, и энцефалопатия, индуцируемые HHV-6. Таким образом, можно считать, что способ определения и диагностический способ по настоящему изобретению также позволяют объективные диагностику и оценку этих заболеваний. То есть белок, ген и прочее по настоящему изобретению можно использовать в качестве маркера заболевания для различных заболеваний, в которые может быть вовлечен HHV-6. Кроме того, настоящее изобретение относится также к модели на животных, полученной переносом вышеописанного гена по настоящему изобретению, продукта этого гена (например, белка, кодируемого геном) или рекомбинантного экспрессирующего вектора, несущего ген. Поскольку ген по настоящему изобретению вовлечен в ментальное нарушение как описано выше, в модели на животных, полученной переносом гена, продукта этого гена (например, белка, кодируемого геном) или рекомбинантного экспрессирующего вектора, несущего ген, проявляется симптом ментального нарушения. Примеры симптома ментального нарушения включают в себя подобные маниакально-депрессивным симптомам, подоб- 20023557 ные маниакальным симптомам, подобные депрессивным симптомам и в зависимости от способа тестирования подобные симптомам шизофрении. Субъект-животное не является ограниченным каким-либо конкретным животным, при условии, что оно является доступным в качестве тестируемого животного. Особенно предпочтительное животное представляет собой млекопитающее, например мышь, крысу или обезьяну. Более того, способ переноса гена, продукта гена и рекомбинантного экспрессирующего вектора может представлять собой общеизвестный способ и не является ограниченным каким-либо конкретным способом. Например, способ вызова экспрессии белка по настоящему изобретению в мозге может представлять собой способ с использованием аденовирусного вектора или способ с использованием ретровирусного вектора (см. описанный ниже пример) и, разумеется, может представлять собой любой из способов с использованием векторов, которые не являются аденовирусным вектором или ретровирусным вектором. Альтернативно, можно использовать перенос гена с использованием системного трансгана (например, получение трансгенной мыши). Кроме того, альтернативно, можно использовать способ прямой инокуляции в мозг белка по настоящему изобретению. Животную модель ментального нарушения можно подходящим образом использовать, например,для исследования в способах лечения ментальных нарушений, изучения эффектов лекарственных средств, определения эффектов лекарственных средств и оценки способов лечения (например, термотерапии), которые не являются способами лечения с использованием лекарственных средств, и, таким образом, она является достаточно полезной. Кроме того, модельных животных можно использовать для исследования фактора, связанного с фактором развития ментального нарушения. Модельных животных можно также использовать для исследования для предотвращения развития ментальных нарушений, например посредством исследования,насколько сильно утомление и стресс вовлечены в индукцию ментального нарушения. Ниже показаны примеры для более подробного описания вариантов осуществления настоящего изобретения. Разумеется, настоящее изобретение не является ограниченным примерами ниже, и детали могут принимать различные формы. Кроме того, настоящее изобретение не является ограниченным описанием вышеуказанных вариантов осуществления, но специалист в данной области может изменять его в пределах объема формулы изобретения. Вариант осуществления, основанный на соответствующей комбинации технических средств, описанных в других вариантах осуществления, входит в технический объем настоящего изобретения. Примеры 1. Идентификация продукта гена (мРНК), кодирующего специфический для латентной инфекции белок SITH-1. Матричную РНК (мРНК) выделяли из макрофагов, описанных в непатентном документе 1, которые являлись латентно инфицированными HHV-6, и реакцию обратной транскрипции проводили с использованием случайно синтезированных праймеров, IE4RB в качестве праймера для обратной транскрипции смысловых транскриптов, и IE2FB в качестве праймера для обратной транскрипции антисмысловых транскриптов. Затем полученные обратные транскрипты (кДНК) амплифицировали способом ПЦР с использованием праймеров IE4RB и IE2FB, и продукты далее амплифицировали способом двойной гнездовой ПЦР с использованием внутренних праймеров IE4RA и IE2FA. На фиг. 1 показано (i) соответствие между смысловым транскриптом (H6LT) известной мРНК во время продуктивной инфекции и новым специфическим для латентной инфекции геном, и (ii) открытая рамка считывания специфического для латентной инфекции белка SITH-1. Подробности информации о последовательности SITH-1 и нового специфического для латентной инфекции гена см. в списке последовательностей. В результате амплификации получили продукт 925 п.о., который отличался как от (i) продукта 351 п.о., амплифицированного с мРНК, экспрессированной в клетках МТ-4, продуктивно инфицированныхHHV-6, так и от (ii) продукта 351 п.о., амплифицированного с продукта специфического для латентной инфекции гена (ассоциированный с латентной инфекцией HHV-6 транскрипт: H6LT), описанного в непатентном документе 3, который поддается детекции во время латентной инфекции макрофагов (МФ)HHV-6. Этот продукт отличался также от продукта 1241 п.о., амплифицированного с ДНК HHV-6, тем что он амплифицировался исключительно с продукта обратной транскрипции антисмысловых транскриптов в клетках, латентно инфицированных HHV-6. Из этого показали, что продукт является неизвестным до настоящего времени продуктом нового специфического для латентной инфекции гена (см. фиг. 2). На фиг. 2 "R" обозначает случайно синтезированный праймер, "S" обозначает смысловой транскрипт и "анти-S" обозначает антисмысловой транскрипт. Для определения структуры мРНК этого нового специфического для латентной инфекции гена осуществляли способ быстрой амплификации 5'-концов кДНК (RACE) и способ 3'-RACE, в результате чего определили не только 5'- и 3'-концы, но также всю нуклеотидную последовательность (см. фиг. 3). 2. Функциональный анализ нового белка SITH-1 для специфического для латентной инфекции гена. Для исследоаания функции белка SITH-1 идентифицировали белок хозяина, с которым белок SITH1 может связываться внутри клеток. Это осуществляли скринингом библиотеки кДНК эмбрионального мозга человека посредством двугибридного анализа в дрожжах с использованием белка SITH-1 в качестве "наживки" (bait). Результат показан на фиг. 4. На фиг. 4 (А) показаны клоны дрожжей, в которых галактозидаза сильно экспрессировалась из-за связывания между SITH-1 и CAML; на (В) показана подтвержденная вестерн-блоттингом и окрашиванием антителами против CAML схема того, что в анализе осаждения in vitro CAML, экспрессированный в Е. coli, можно копреципитировать со слитым белкомGST-SITH-1, который также экспрессируют в Е. coli, и на (С) показана подтвержденная вестернблоттингом и окрашиванием антителами против FLAG схема, того, что после того как SITH-1 с меткойFLAG и CAML перенесли в клетки 293 Т с использованием экспрессирующего вектора, SITH-1 можно копреципитировать с антителами против CAML. Как показано на фиг. 4, обнаружили, что белок SITH-1 сильно связывается с регулирующим уровень кальция лигандом циклофилина (CAML).CAML представляет собой белок, который, как сообщается, демонстрирует сильную экспрессию в лимфоцитах и в мозге, и известно, что CAML обладает способностью увеличивать внутриклеточную концентрацию кальция. Таким образом, чтобы увидеть, может ли белок SITH-1 опосредованно черезCAML увеличивать внутриклеточную концентрацию кальция, линию астроцитоподобных глиальных клеток (U373), в которых экспрессировался SITH-1, и необработанные клетки U373 окрашивали способом с флуоресцентным антителом с использованием антител против SITH-1 и антител против CAML. Как выяснилось, когда белок SITH-1 экспрессировался в линии астроцитоподобных глиальных клеток(U373), было обнаружено больше CAML, чем в необработанных клетках U373 (фиг. 5). Уровень экспрессии CAML в клетках U373 являлся не очень высоким, когда клетки U373 являлись необработанными,однако было обнаружено, что больше CAML наблюдалось при экспрессии SITH-1 в клетках U373. В другом эксперименте получали два образца: один образец получали переносом SITH-1 в линию астроцитоподобных глиальных клеток (U373) посредством ретровирусного вектора, а другой образец получали введением в U373 только вектора. Каждый образец стимулировали с помощью тапсигаргина(TG), и внутриклеточную концентрацию кальция измеряли с использованием Fura2. В результате, действительным измерением внутриклеточной концентрации кальция показали, что вследствие стимуляции с помощью тапсигаргина (TG), внутриклеточная концентрация кальция в экспрессирующей SITH-1 линии астроцитоподобных глиальных клеток являлась значительно более высокой, чем в клетках, в которые переносили только вектор (фиг. 6). По этим результатам обнаружили, что белок SITH-1 обладает способностью увеличивать внутриклеточную концентрацию кальция в линии астроцитоподобных глиальных клеток при его экспрессии во время латентной инфекции HHV-6 для увеличения внутриклеточного количества CAML. 3. Связь между SITH-1 и аффективными нарушениями. На следующей стадии авторы настоящего изобретения исследовали связь между SITH-1 и ментальными нарушениями. Результаты показаны на фиг. 7. В отличие от белка специфического для латентной инфекции гена, опубликованного, например, в непатентном документе 5, связь между антителом противSITH-1 и пациентами с синдромом хронической усталости являлась низкой, однако частота носителей антитела являлась высокой среди пациентов с синдромом хронической усталости, сопровождающимся ментальными нарушениями. Во многих случаях у пациентов с синдромом хронической усталости (CFS),сопровождающимся психиатрическими симптомами, в первую очередь проявляются депрессивные симптомы, в то время как у пациентов с инфантильным CFS в основном проявляется аномальное возбуждение. На фиг. 7 "биполярные I" относится к пациентам с тяжелыми симптомами маниакальнодепрессивного заболевания. Здоровые взрослые почти не являются носителями антитела против SITH-1. Для измерения титра антитела экспрессирующие SITH-1 клетки 293 Т использовали в качестве антигенов,и применяли способ с флуоресцентным антителом. 4. Создание модельных мышей для ментального нарушения посредством экспрессии SITH-1.SITH-1 с промотором глиального фибриллярного кислого белка (GFAP), присоединенного на 5'конце от его открытой рамки считывания, инъецировали в мозг новорожденных мышей с использованием аденовирусного вектора или ретровирусного вектора. GFAP представляет собой белок, специфически экспрессирующийся в глиальных клетках, таких как астроциты. Через приблизительно четыре или пять недель после инъекции наблюдали поведение каждой мыши, чтобы подтвердить, что модельные мыши с ментальными нарушениями получены переносом SITH-1. Тест подвешивания за хвост и тест принудительного плавания проводили для оценки ментальных нарушений; эти тесты являются общепринятыми для наблюдения пациентов с депрессией или маниакально-депрессивным заболеванием. Конкретно, мышей, которым переносили SITH-1 с использованием аденовирусного вектора, подвергали тесту подвешивания за хвост. Как выяснилось, мыши, которым переносили SITH-1, обладали заметно более коротким временем неподвижности, что указывает на то, что эти мыши находились в маниакальном состоянии (фиг. 8). Затем мышей, которым переносили SITH-1 с использованием ретровирусного вектора, подвергали тесту принудительного плавания. Как выяснилось,мыши, которым переносили SITH-1 с использованием ретровирусного вектора с высоким титром, обладали более долгим временем неподвижности, чем контрольные мыши, которым переносили ген зеленого флуоресцентного белка (EGFP), что указывает на го, что мыши, которым переносили SITH-1 с высоким титром, находились в состоянии депрессии. В отличие от этого мыши, которым переносили SITH-1 с использованием ретровирусного вектора с низким титром, обладали более коротким временем неподвижности, что указывает на то, что мыши, которым переносили SITH-1 с низким титром, находились в маниакальном состоянии (фиг. 9). Таким образом, маниакальное состояние наблюдали в тесте подвешивания за хвост, в то время как и маниакальное состояние, и депрессивное состояние наблюдали в тесте принудительного плавания. Кроме того, тот факт, что либо маниакальное состояние, либо депрессивное состояние наблюдали в зависимости от титра ретровирусного вектора, используемого для введенияSITH-1, не только показывает, что представляющая интерес модель может одинаково служить моделями депрессии и маниакально-депрессивного заболевания, но также позволяет предполагать, что уровень экспрессии SITH-1 влияет на симптомы ментальных нарушений. Авторы настоящего изобретения измерили также преимпульсное ингибирование, чтобы проверить какую-либо аномалию в реакции вздрагивания, где эту аномалию можно обнаружить у пациентов с маниакально-депрессивным заболеванием и шизофренией. Конкретно, у мышей, которым переносилиSITH-1 с использованием аденовирусного вектора, оценивали реакцию вздрагивания измерением преимпульсного ингибирования. Результат показан на фиг. 10; как выяснилось, мыши с перенесенным SITH-1 обладали заметно более низким преимпульсным ингибированием, что указывает на то, что мыши становились сверхчувствительными к стимулам. Таким образом, значительную аномалию наблюдали также в реакции вздрагивания, что указывает на то, что SITH-1 сильно влияет на функцию мозга, связанную с ментальными нарушениями. 5. Создание модельных мышей для ментального нарушения 2 посредством экспрессии SITH-1 Затем открытую рамку считывания SITH-1 присоединяли на 3'-конце от промотора GFAP и экспрессировали в глиальных клетках мышей с использованием аденовирусного вектора; через три недели у мышей измеряли моторную активность в отношении активности на беличьем колесе. Результат показан на фиг. 11. Как показано на фиг. 11, по сравнению с контрольными мышами, у которых экспрессировали EGFP(усиленный зеленый флуоресцентный белок), экспрессирующие SITH-1 мыши обладали усиленной моторной активностью, и для экспрессирующих SITH-1 мышей показали тенденцию находиться в маниакальном состоянии. 6. Создание модельных мышей для ментального нарушения 3 посредством экспрессии SITH-1. Затем открытую рамку считывания SITH-1 присоединяли на 3'-конце от промотора GFAP и экспрессировали в глиальных клетках мышей с использованием лентивирусного вектора; через восемь недель у мышей измеряли моторную активность в отношении активности на беличьем колесе. Результат показан на фиг. 12. Как показано на фиг. 12, по сравнению с контрольными мышами, у которых экспрессировали EGFP(усиленный зеленый флуоресцентный белок), экспрессирующие SITH-1 мыши обладали подавленной моторной активностью, и для экспрессирующих SITH-1 мышей показали тенденцию находиться в депрессивном состоянии. Как можно видеть из фиг. 11 и 12, обнаружили, что один и тот же SITH-1 вызывает два противоположных феномена, маниакальное состояние и депрессивное состояние. Причины могут быть следующими: 1) SITH-1, который несет аденовирусный вектор, экспрессируется в большем количестве, чем когдаSITH-1 несет лентивирусный вектор; 2) с другой стороны, лентивирусный вектор позволяет экспрессиюSITH-1 в течение более длительного периода, так что наблюдали эффект продолжительной экспрессииSITH-1. Этот факт, т.е. то, что модельных мышей и для маниакального состояния, и для депрессивного состояния можно сконструировать, экспрессируя SITH-1, можно описать как получение результата в хорошем соответствии с клиническими обнаружениями, что антитела против SITH-1 детектируют как у пациентов с маниакально-депрессивным заболеванием, так и у пациентов с депрессией. 7. Диагностика с использованием SITH-1 в качестве маркера. Проводили исследование, чтобы увидеть, может ли диагноз, основанный на SITH-1, являться также применимым при диагностике других заболеваний, осложненных депрессией. Результаты показаны на фиг. 13. Диагноз, основанный на антителе против SITH-1, является достаточно специфическим для аффективных нарушений, таких как депрессия, маниакально-депрессивное заболевание и синдром хрониче- 23023557 ской усталости. Однако, как показано на фиг. 13, для того же самого диагноза показали исключительно высокую положительную частоту среди пациентов с болезнью Крона. Не получили положительных ответов для пациентов с язвенным колитом, являющимся сходным с болезнью Крона. Однако известно, что болезнь Крона наиболее часто осложняется "депрессивными симптомами", и положительные по антителам протиЕ SITH-1 индивидуумы, показанные на фиг. 13, представляют собой случаи болезни Крона, достаточно тяжелые для осложнения депрессивными симптомами. Рассматриваемый пример показывает, что даже в таких серьезных случаях, когда у пациентов с болезнью Крона, которая представляет собой хроническое заболевание, классифицируемое как аутоиммунное заболевание,также проявляются депрессивные симптомы, депрессию можно диагностировать с использованиемSITH-1 в качестве маркера. Иными словами, тестирование с помощью антитела против SITH-1 можно рассматривать как являющееся "также применимым при диагностике депрессии, вызванной другими, не психиатрическими заболеваниями". Промышленная применимость Как описано выше, каждый из гена и белка по настоящему изобретению является фактором, вовлеченным в латентную инфекцию герпесвирусом. С использованием гена и/или белка в качестве маркера является возможным объективно определить, является или нет субъект пораженным ментальным нарушением. Таким образом, настоящее изобретение не только предоставляет преимущество в области академической науки и в области фундаментальных исследований, но также имеет значение для клинической медицины. Список последовательностей(а) полинуклеотид, кодирующий белок, обладающий активностью увеличения внутриклеточной концентрации кальция и имеющий аминокислотную последовательность SEQ ID NO: 1;(b) полинуклеотид, содержащий открытую рамку считывания, имеющий последовательность SEQID NO: 2, кодирующий белок, обладающий активностью увеличения внутриклеточной концентрации кальция; и(с) полинуклеотид, кодирующий белок, который обладает активностью увеличения внутриклеточной концентрации кальция, причем указанный полинуклеотид гибридизуется в строгих условиях гибридизации с нуклеотидной последовательностью, комплементарной SEQ ID NO: 2. 2. Белок, обладающий активностью увеличения внутриклеточной концентрации кальция, выбранный из группы, включающей:(а) белок, обладающий аминокислотной последовательностью SEQ ID NO: 1; и(b) белок, кодируемый полинуклеотидом по п.1. 3. Антитело против белка, обладающего активностью увеличения внутриклеточной концентрации кальция, которое получено с использованием в качестве антигена белка по п.2 или его несущего антигенный эпитоп пептида. 4. Рекомбинантный экспрессирующий вектор, содержащий полинуклеотид по п.1. 5. Трансформированная клетка, предназначенная для экспрессии белка по п.2, где клетка включает полинуклеотид по п.1 или рекомбинантный экспрессирующий вектор по п.4. 6. Средство для детекции полинуклеотида, кодирующего белок, обладающий активностью увеличения внутриклеточной концентрации кальция, для диагностики ментального нарушения, содержащее зонд, имеющий в длину 12-50 оснований последовательности полинуклеотида по п.1 или комплементарную к ней последовательность. 7. Средство детекции антитела по п.3 для диагностики ментального нарушения, содержащее белок по п.2 или его антигенный эпитоп. 8. Способ диагностики ментального нарушения у субъекта-человека, включающий стадии:(i) определения уровня антитела по п.3 в биологической пробе, отобранной у субъекта-человека; и(ii) определения того, что субъект-человек обладает ментальным нарушением в том случае, когда на стадии (i) выявляется, что уровень указанного антитела выше порогового значения, измеренного в биологической пробе, полученной от здорового человека. 9. Способ диагностики ментального нарушения у животного, не являющегося человеком, включающий определение наличия у животного, не являющегося человеком, антитела по п.3, причем при обнаружении у животного, не являющегося человеком, антитела по п.3 диагностируют ментальное нарушение. 10. Набор для осуществления диагностического способа по п.8 или 9, содержащий по меньшей мере два компонента, выбранных из:(ii) антигенного эпитопа белка (i) и(iii) средства для детекции, на котором иммобилизован белок (i) или антигенный эпитоп (ii). 11. Способ выбора животной модели, не являющейся человеком, для определения ментального нарушения, включающий стадии:(i) диагностики, имеет или нет субъект-животное, не являющееся человеком, антитела по п.3; и(ii) определения, что указанное субъект-животное является применимым в качестве модели ментального нарушения в случае, когда на стадии (i) выявляют указанные антитела. 12. Трансгенное модельное животное, не являющееся человеком, предназначенное для использования в качестве животной модели ментального нарушения, содержащее полинуклеотид по п.1. 13. Способ скрининга вещества-кандидата на психотропное средство, включающий в себя стадии:(i) введения в животную модель по п.12 рассматриваемого вещества;(ii) определения того, является или нет рассматриваемое вещество веществом-кандидатом на психотропное средство на основании того, что уровень антитела по п.3 в указанной животной модели снижается по сравнению с уровнем указанного антитела в указанной животной модели, не являющейся человеком, которой не вводится рассматриваемое вещество. 14. Применение полинуклеотида по п.1 для получения животной модели, не являющейся человеком, имеющей ментальное нарушение. 15. Применение по п.14, где ментальное нарушение представляет собой ментальное нарушение, вызванное болезнью Крона. 16. Применение белка по п.2 или его несущего антигенный эпитоп пептида для диагностики ментального нарушения у субъекта. 17. Применение модельного животного, не являющееся человеком, по п.12 для скрининга веществакандидата на психотропное средство. 18. Применение белка по п.2 или его антигенного эпитопа для производства средства для диагностики ментального нарушения у субъекта. 19. Способ диагностики ментального нарушения, вызванного болезнью Крона, включающий следующие стадии:(i) определение уровня антитела по п.3 в биологической пробе, выделенной у субъекта-человека; и(ii) определение, что субъект-человек имеет ментальное нарушение, вызванное болезнью Крона, в том случае, когда на стадии (i) определяется, что уровень указанного антитела выше порогового значения, измеренного в биологической пробе, полученной от здорового индивидуума.
МПК / Метки
МПК: A01K 67/027, G01N 33/53, C12N 15/09, C12N 1/19, C07K 14/03, C12N 1/21, G01N 33/15, G01N 33/50, C12N 1/15, C07K 16/08, G01N 33/569, C12M 1/00, C12N 5/10
Метки: нарушений, инфекцию, ментальных, герпесвирусом, животных, белок, применение, латентную, диагностики, вовлеченный
Код ссылки
<a href="https://eas.patents.su/30-23557-belok-vovlechennyjj-v-latentnuyu-infekciyu-gerpesvirusom-i-ego-primenenie-dlya-diagnostiki-mentalnyh-narushenijj-u-zhivotnyh.html" rel="bookmark" title="База патентов Евразийского Союза">Белок, вовлеченный в латентную инфекцию герпесвирусом, и его применение для диагностики ментальных нарушений у животных</a>
Предыдущий патент: 1,2-дизамещенные-4-аминоимидазохинолины
Следующий патент: Термостабильный полипептид с активностью β-целлобиогидролазы и его применение для производства сахаров из лигноцеллюлозного материала
Случайный патент: Приспособление и способ для идентификации и лечения вагинальных заболеваний