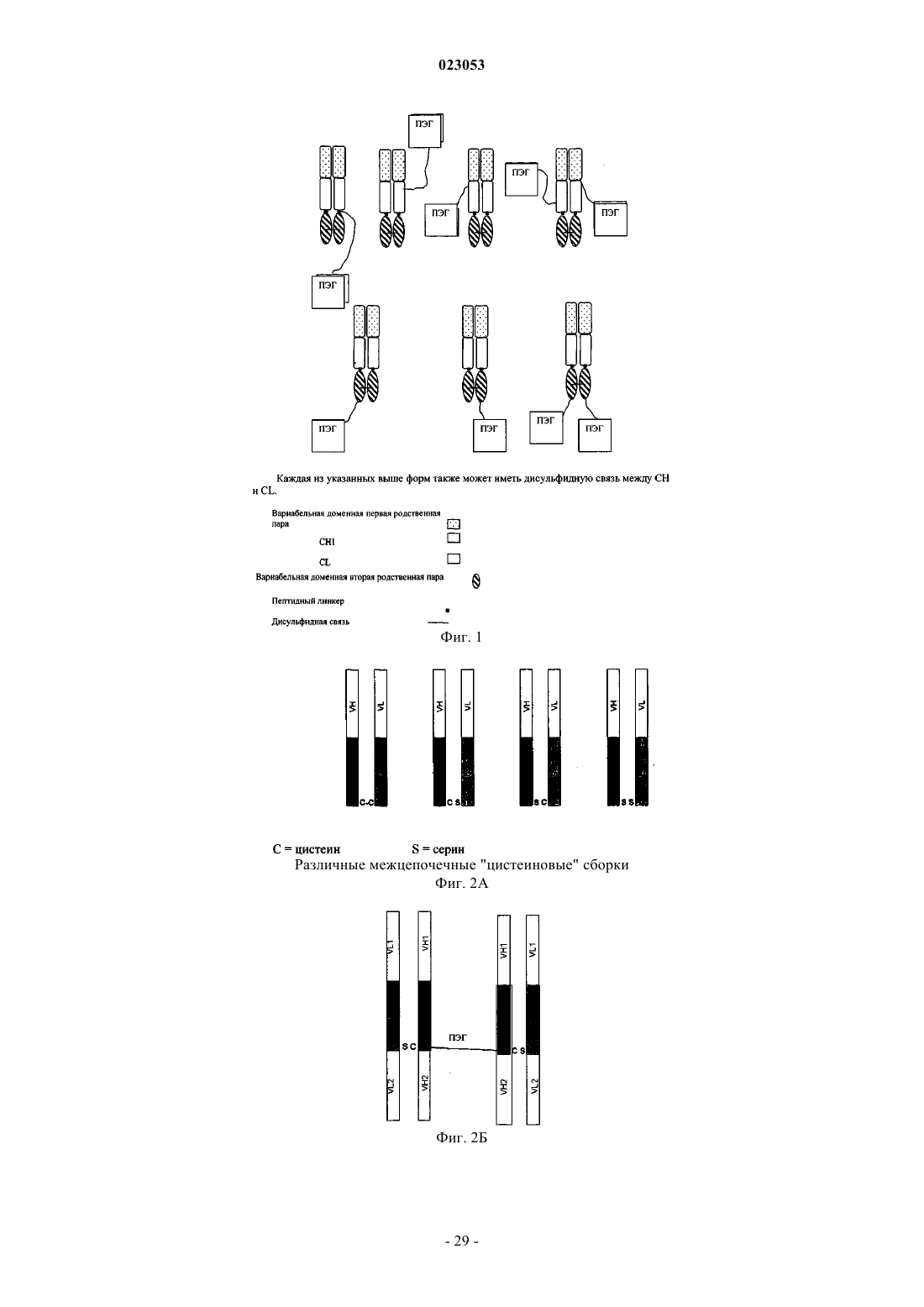
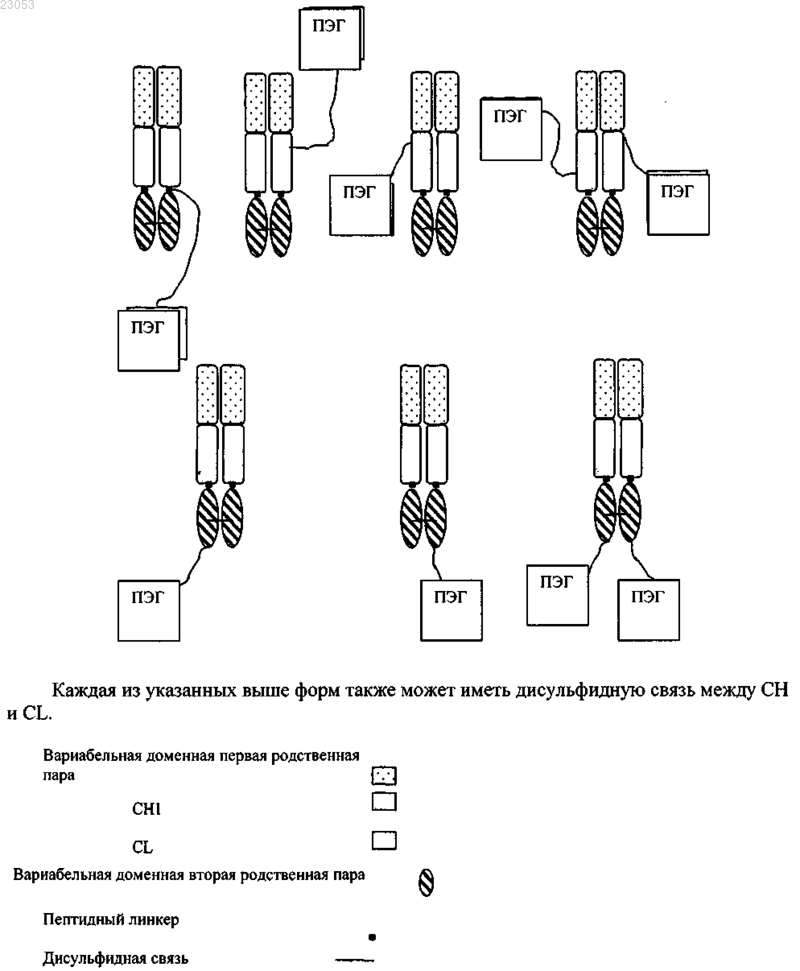
Поливалентные антитела
Номер патента: 23053
Опубликовано: 29.04.2016
Авторы: Хейвуд Сэм Филип, Хамфрис Дейвид Пол, Лосон Аластэр Дейвид Гриффитс
Формула / Реферат
1. Рекомбинантный гибридный белок, включающий
тяжелую цепь,состоящую из последовательно с N-конца вариабельного домена номинально VH1, области CH1 и дополнительного вариабельного домена номинально VH2,
легкую цепь, состоящую из последовательно с N-конца вариабельного домена номинально VL1, домена CL и вариабельного домена номинально VL2,
причем указанные тяжелую и легкую цепи выравнивают для обеспечения первого сайта связывания, сформированного первой вариабельной доменной парой VH1 и VL1, и второго сайта связывания, сформированного второй вариабельной доменной парой VH2 и VL2,
при этом имеется дисульфидная связь внутри второй вариабельной доменной пары VH2 и VL2, и указанный гибридный белок конъюгирован с одной или двумя молекулами ПЭГ.
2. Рекомбинантный гибридный белок по п.1, в котором имеется дисульфидная связь внутри первой вариабельной доменной пары VH1 и VL1.
3. Рекомбинантный гибридный белок по одному из пп.1, 2, в котором аминокислота в VH2 непосредственно связана с аминокислотой в CH1 пептидной связью.
4. Рекомбинантный гибридный белок по п.1, в котором VH2 связан с CH1 опосредованно с помощью линкера.
5. Рекомбинантный гибридный белок по одному из пп.1-4, в котором аминокислота в VL2 непосредственно связана с аминокислотой в CL пептидной связью.
6. Рекомбинантный гибридный белок по одному из пп.1-4, в котором VL2 связан с CL опосредованно с помощью линкера.
7. Рекомбинантный гибридный белок по п.4 или 6, в котором линкер имеет последовательность, представленную в SEQ ID NO:226.
8. Рекомбинантный гибридный белок по одному из пп.1-7, в котором рекомбинантный гибридный белок ПЭГелирован через растворимый доступный цистеин.
9. Рекомбинантный гибридный белок по одному из пп.1-7, причем рекомбинантный гибридный белок ПЭГелирован через межцепочечный цистеин в СН1 и/или CL.
10. Рекомбинантный гибридный белок по одному из пп.1-7, который ПЭГелирован по сконструированному цистеину в легкой цепи, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 5, 7, 9, 10, 12, 14, 15, 16, 17, 18, 20, 22, 24, 26, 27, 28, 30, 31, 34, 39, 41, 42, 43, 55, 56, 57, 60, 61, 63, 67, 68, 69, 70, 72, 74, 76, 77, 79, 81, 107, 108, 109, 110, 114, 121, 122, 123, 126, 127, 128, 129, 143, 144, 145, 147, 149, 151, 152, 153, 156, 157, 158, 159, 160, 161, 167, 168, 169, 170, 171, 190, 195, 197, 199, 200, 202, 203, 205, 206, 210, 211, 212 и 213, пронумерованных по системе нумерации Kabat, такой, например, как рекомбинантный гибридный белок, который ПЭГелирован по сконструированному цистеину в легкой цепи, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 77, 107, 109, 143, 145, 149 и 210, пронумерованных по системе нумерации Kabat.
11. Рекомбинантный гибридный белок по одному из пп.1-10, который ПЭГелирован по сконструированному цистеину в тяжелой цепи, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 3, 7, 8, 9, 10, 13, 15, 16, 17, 21, 26, 40, 43, 57, 58, 61, 62, 64, 65, 66, 68, 70, 72, 82а, 82b, 82с, 84, 85, 86, 96, 97, 98, 99, 105, 112, 113, 114, 115, 116, 117, 120, 127, 128, 129, 130, 133, 134, 135, 136, 156, 163, 164, 165, 167, 168, 169, 176, 177, 179, 180, 182, 183, 195, 196, 197, 199, 200, 203, 205, 213, 215, 216, 218, 220, 222 и 232, пронумерованных по системе нумерации Kabat, такой, например, как рекомбинантный гибридный белок, который ПЭГелирован по сконструированному цистеину в тяжелой цепи, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 82b, 116, 163, 182 и 216, пронумерованных по системе нумерации Kabat.
12. Рекомбинантный гибридный белок по любому из пп.1-11, в котором молекулы ПЭГ имеют молекулярную массу в диапазоне от 5000 до 80000 Да.
13. Рекомбинантный гибридный белок по одному из пп.1-12, в котором домен VH1 в тяжелой цепи является вариабельным доменом из тяжелой цепи или вариабельным доменом из легкой цепи, домен VH2 в тяжелой цепи является вариабельным доменом из тяжелой цепи или вариабельным доменом из легкой цепи; и VL1 в легкой цепи является вариабельным доменом из легкой цепи или тяжелой цепи, и домен VL2 в легкой цепи является вариабельным доменом из легкой цепи или тяжелой цепи.
14. Рекомбинантный гибридный белок по одному из пп.1-13, в котором домен VH2 является вариабельным доменом из тяжелой цепи и домен VL2 является вариабельным доменом из легкой цепи.
15. Рекомбинантный гибридный белок по одному из пп.1-14, в котором вторая вариабельная доменная пара связана дисульфидной связью между двумя остатками цистеина, одним в домене VH2 и одним в домене VL2, причем положение двух остатков цистеина выбрано из группы, состоящей из положений VH37 и VL95, VH44 и VL100, VH44 и VL105, VH45 и VL87, VH100 и VL50, VH100b и VL49, VH98 и VL46, VH101 и VL46, VH105 и VL43 и VH106 и VL57, так, например в котором цистеин домена VH2 находится в положении 44 и цистеин домена VL2 находится в положении 100.
16. Рекомбинантный гибридный белок по одному из пп.1-15, в котором каждая из двух вариабельных доменных пар является родственной парой.
17. Рекомбинантный гибридный белок по одному из пп.1-16, в котором две вариабельные доменные пары, каждая из которых комплементарна паре VH/VL, совместно связывают антиген.
18. Рекомбинантный гибридный белок по одному из пп.1-17, в котором домены СН1 и CL производны от IgG1.
19. Рекомбинантный гибридный белок по одному из пп.1-18, являющийся димеризованным, где димеризация выбрана из:
а) димеризация непосредственно через дисульфидную связь и
б) димеризация через химический линкер, например через линкер ПЭГ или через пептидный линкер.
20. Рекомбинантный гибридный белок по п.19, который димеризуется через растворимые доступные цистеины.
21. Рекомбинантный гибридный белок по одному из пп.1-20, являющийся биспецифичным или моноспецифичным.
Текст
Хамфрис Дейвид Пол, Хейвуд Сэм Филип,Лосон Аластэр Дейвид Гриффитс (GB)CHEMISTRY, ACS, WASHINGTON, DC, US, vol. 16, no. 1, В изобретении описан гибридный белок поливалентного антитела, включающий тяжелую цепь,содержащую последовательно с N-конца вариабельный домен номинально VH1, область CH1 и дополнительный вариабельный домен номинально VH2, легкую цепь, включающую последовательно с N-конца вариабельный домен номинально VL1, домен CL и вариабельный домен номинально VL2, причем указанные тяжелую и легкую цепи выравнивают для обеспечения первого сайта связывания, сформированного первой вариабельной доменной парой VH1 и VL1, и второго сайта связывания, сформированного второй вариабельной доменной парой VH2 и VL2,причем имеется дисульфидная связь внутри вариабельной доменной пары, формирующей сайт связывания, и указанный гибридный белок конъюгирован с полимером ПЭГ. 023053 Изобретение относится к антителам с двумя сайтами связывания антигена, в которых, например,стерическое препятствие вокруг каждого сайта минимизировано таким образом, что на сродство к антигену-мишени или антигенам-мишеням формат не оказывает вредного воздействия. Поливалентные антитела известны. Однако даже несмотря на то, что основная концепция была разработана несколько лет назад, имелись практические препятствия, связанные с применением данной технологии, и поэтому она не получила широкого применения в разработке способов получения фармацевтических биологических продуктов. Неприродные/ненативные форматы антител могут быть сложны для экспрессии, и может быть существенно повышена цена продуктов до неприемлемого уровня. Такие форматы могут повысить иммуногенность или понизить стабильность in vivo по сравнению со стандартным антителом или фрагментом и/или могут проявлять нежелательную фармакокинетику. В частности проблемы, связанные с получением гомогенных продуктов, касались неприродных форматов. Например, если имеется одна перестановка в комбинировании мономерных компонентов, в результате могут сформироваться смеси. Таким образом, могут потребоваться тщательно разработанные способы очистки для выделения требуемых/целевых продуктов с удовлетворительными уровнями очистки. Исследования велись в разных направлениях, например, используя короткие линкеры при получении биспецифических антител, при этом добиваясь соответствующей димеризации. Однако установлено,что ориентация вариабельных доменов может влиять на экспрессию формата и формирование сайтов активного связывания. Один из подходов к осуществлению сборки в требуемом положении или ориентации называется методом "выступ-во-впадину", по которому крупная "впадина" интродуцируется в домен VH, например,в некоторых антителах, заменяя валин 137 на крупный остаток фенилаланин и замещая лейцин 45 на триптофан. Комплементарная впадина может быть интродуцирована, например, в домен VL, в некоторых антителах, за счет мутации фенилаланина 98, а именно его замещения на метионин, и триптофана 87 на аланин. Однако сниженное антигенсвязывающее действие наблюдают для некоторых конструкций. В настоящем изобретении положение CL в легкой цепи и CH1 в тяжелой цепи обеспечивает правильную ориентацию цепей. Таким образом, предусматривают рекомбинантный гибридный белок, включающий тяжелую цепь,включающую последовательно с N-конца вариабельный домен номинально VH1, область CH1 и дополнительный вариабельный домен номинально VH2, легкую цепь, включающую последовательно с N-конца вариабельный домен номинально VL1, домен CL и вариабельный домен номинально VL2, причем указанные тяжелую и легкую цепи выравнивают для обеспечения первого сайта связывания, сформированного первой вариабельной доменной парой VH1 и VL1, и второго сайта связывания, сформированного второй вариабельной доменной парой VH2 и VL2, причем имеется дисульфидная связь внутри вариабельной доменной пары, формирующей сайт связывания, например, между VH1 и VL1 и/или VH2 и VL2, и указанный гибридный белок конъюгирован с полимером ПЭГ. Рекомбинантный гибридный белок, предусмотренный в настоящем изобретении, также преимущественно обладает периодом полураспада, сходным с периодом полураспада целого антитела, и, следовательно, предположительно применим для лечения. Краткое описание фигур Фиг. 1 показывает различные форматы гибридных антител по настоящему описанию; фиг. 2 А - различные форматы известных фрагментов антител; фиг. 2 Б - одну возможную сборку для димерного формата по настоящему изобретению; фиг. 3 - аминокислотную последовательность легкой цепи для антитела 4D5; фиг. 4 - аминокислотную последовательность тяжелой цепи для антитела 4D5; фиг. 5 - конструкцию A26Fab-(3G4S)-dsFv645 с положениями мутаций Cys на поверхности, отмеченными жирным шрифтом; фиг. 6 - невосстановленный гель ПЭГелированных мутантов A26Fab-(3G4S)-dsFv645, S182 и S163. Тяжелая цепь, применяемая в настоящем изобретении, является цепью, которая включает доменCH1. Обычно тяжелая цепь не включает фрагмент Fc, т.е. фрагмент CH2 и/или CH3. В одном из вариантов осуществления настоящего изобретения тяжелая цепь включает только один домен CH1.VH1 и VH2, применяемые в настоящем изобретении, предназначены для ссылки на то обстоятельство, что вариабельные области локализованы в тяжелой цепи антитела по настоящему изобретению. Это само по себе не свидетельствует о происхождении вариабельной области как таковой.VL1 и VL2, применяемые в настоящем изобретении, предназначены для ссылки на то обстоятельство, что вариабельные области локализованы в легкой цепи антитела по настоящему изобретению. Это само по себе не свидетельствует о происхождении вариабельной области как таковой. Легкая цепь, применяемая в настоящем изобретении, включает домен CL. В одном из вариантов-1 023053 осуществления настоящего изобретения легкая цепь включает только один домен CL. Сборка по настоящему изобретению CL в качестве фрагмента константной области в легкой цепи и домена CH1 в качестве фрагмента константной области в тяжелой цепи предположительно минимизирует несоответствующую димеризацию. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему описанию включает шарнир, например, в качестве линкера, к вариабельному домену. Шарнир может быть присоединен к С-концу домена CH1 в соответствующем положении, установленном в антителе полной длины, и может формировать связь между CH1 и VH2. В таком варианте осуществления настоящего изобретения линкер также может быть предусмотрен в легкой цепи таким образом, что VL2 соответствующим образом помещен в пару с VH2 в тяжелой цепи. Линкер, применяемый в легкой цепи, может быть идентичным, сходным или полностью отличным от шарнирного линкера, применяемого в тяжелой цепи. В другом варианте осуществления настоящего изобретения легкая цепь включает шарнир, например, присоединенный к С-концу домена CL, и связывающий домен CL с VL2. В этом варианте осуществления настоящего изобретения линкер может потребоваться в тяжелой цепи для того, чтобы обеспечить соответствующим доменам VL2 и VH2 соответствующее спаривание для формирования активного сайта. Линкер в тяжелой цепи может быть идентичным, сходным или полностью отличным от линкера, применяемого в легкой цепи. Примеры соответствующих шарниров приведены ниже. Вариабельные домены предусмотрены в каждой цепи таким образом, что они заранее формируют определенные пары с соответствующим/должным связыванием с антигеном-мишенью. В одном из вариантов осуществления настоящего изобретения вариабельная доменная пара обладает сродством в отношении антигена-мишени, составляющим 100 нм или менее, например 50 нм или менее, в особенности 1 нм или менее. Соответствующие вариабельные доменные пары могут быть идентифицированы с помощью какихлибо возможных средств, например, включая выработку антител у хозяев, с последующим скринингом В-клеток. Другие соответствующие пары могут быть идентифицированы с помощью фагового дисплея. Методы фагового дисплея известны в данной области и включают методы, описанные Brinkman и др., J. Immunol. Methods, 182, 1995, сс. 41-50; Ames и др., J. Immunol. Methods, 184, 1995, сс. 177-186; Kettleborough и др. Eur. J. Immunol., 24, 1994, сс. 952-958; Persic и др., Gene, 187, 1997, сс. 9-18; Burton и др.,Advances in Immunology, 57, 1994, сс. 191-280; WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619;WO 93/11236; WO 95/15982; WO 95/20401; US 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743; 5969108. Трансгенные мыши или другие организмы, включая других млекопитающих, могут применяться для выработки гуманизированных антител. В одном из вариантов осуществления настоящего изобретения вариабельной доменной парой (или каждой вариабельной доменной парой) является родственная пара. Понятие родственной пары, применяемое в настоящем изобретении, относится к природной паре вариабельных доменов, т.е. выделенных из одного антитела или из клеток, экспрессирующих антитело. В одном из примеров родственной парой является комплементарная пара VH/VL, которая связывает антиген совместно, т.е. они составляют комплементарную пару VH/VL. Обычно родственной парой может быть пара VH/VL, производная от того же антитела. В одном из примеров родственной парой является пара вариабельных доменов, выделенных в качестве пары из "библиотеки пар", например библиотеки фагового дисплея Fab. В одном примере пара VH/VL является моноспецифической. Названия первого и второго сайтов связывания приводятся условно (относительно друг друга) и номинальные метки приводят для сайтов связывания для того, чтобы отличать один от другого. Если один сайт связывания обозначен "первым", другой считается "вторым". Первая и вторая родственные пары также метятся относительно друг друга, чтобы номинально различать эти пары. Пара, которая в настоящем изобретении обозначается "первой парой", не определяется по положению в молекуле. Вариабельные домены могут быть оптимизированы и/или гуманизированы. Оптимизированные/гуманизированные вариабельные домены, происходящие от родственной пары, по-прежнему могут рассматриваться в качестве родственной пары после оптимизации/гуманизирования. В контексте настоящего изобретения CL обозначает часть константной области в легкой цепи, которая может быть природной константной областью легкой цепи. Каждый вариабельный домен может прямо соединяться через линкер с константным доменом в значимой цепи. В контексте настоящего изобретения понятие "непосредственно связанный с" относится к непрерывной аминокислотной последовательности, которая не прерывается, т.е. связана непосредственно через пептидную связь, например, непосредственно с последовательностью вариабельного домена, или,наоборот, фрагмент константной области не соединяется через линкер. Инсерция "неприродного пептид-2 023053 ного линкера" в аминокислотную последовательность разрывает последовательность, и таким образом последовательность, содержащая "неприродный пептидный линкер", не рассматривается в качестве гибридизированной со значимыми частями непосредственно, что соответствует настоящему описанию. Добавление природного пептидного линкера также может рассматриваться в качестве прерывания аминокислотной последовательности, она не может считаться частью последовательности одного или нескольких значимых компонентов, например, вариабельного домена или фрагмента константной области (например, домена CL или домена CH1).VH1 обычно может быть соединен непосредственно с CH1.VL1 обычно может быть соединен непосредственно с CL. В одном из вариантов осуществления настоящего изобретения VH1 CH1 и VL1 CL вместе формируют Fab или Fab'. В одном из вариантов осуществления настоящего изобретения аминокислота в VH2 (например, с егоN-конца) непосредственно связана с аминокислотой в CH1 пептидной связью (например, с С-конца CH1 ). В одном из вариантов осуществления настоящего изобретения аминокислота в VH2 (например, с егоN-конца) опосредованно связана с CH1 линкером (например, с С-конца фрагмента CH1). В одном из вариантов осуществления настоящего изобретения аминокислота в домене VL2 (например, с его N-конца) непосредственно связана с аминокислотой в CL пептидной связью (например, с Сконца CL). В одном из вариантов осуществления настоящего изобретения аминокислота в домене VL2 (например, с его N-конца) опосредованно связана с CL линкером (например, с С-конца CL). В одном из вариантов осуществления настоящего изобретения домен VH1 в тяжелой цепи является вариабельным доменом из тяжелой цепи. Т.е. этот домен происходит от тяжелой цепи природного антитела или его значимого фрагмента или происходит от другого источника, например фагового дисплея, и обладает свойствами вариабельного домена, производного от тяжелой цепи. В одном из вариантов осуществления настоящего изобретения домен VH1 в тяжелой цепи является вариабельным доменом из легкой цепи. Т.е. этот домен происходит от легкой цепи природного антитела или его значимого фрагмента или происходит от другого источника, например, фагового дисплея, и обладает свойствами вариабельного домена, производного от легкой цепи. В одном из вариантов осуществления настоящего изобретения VH2 в тяжелой цепи является вариабельным доменом из тяжелой цепи. В одном из вариантов осуществления настоящего изобретения VH2 в тяжелой цепи является вариабельным доменом из легкой цепи. В одном из вариантов осуществления настоящего изобретения VL1 в легкой цепи является вариабельным доменом из тяжелой цепи. В одном из вариантов осуществления настоящего изобретения VL1 в легкой цепи является вариабельным доменом из легкой цепи. В одном из вариантов осуществления настоящего изобретения VL2 в легкой цепи является вариабельным доменом из тяжелой цепи. В одном из вариантов осуществления настоящего изобретения VL2 в легкой цепи является вариабельным доменом из легкой цепи. В одном из вариантов осуществления настоящего изобретения VH1 является вариабельным доменом из легкой цепи, и VH2 является вариабельным доменом из легкой цепи. В одном из вариантов осуществления настоящего изобретения VH1 является вариабельным доменом из тяжелой цепи, и VH2 является вариабельным доменом из тяжелой цепи. В одном из вариантов осуществления настоящего изобретения VH1 является вариабельным доменом из легкой цепи, и VH2 является вариабельным доменом из тяжелой цепи. В одном из вариантов осуществления настоящего изобретения VH1 является вариабельным доменом из тяжелой цепи, и VH2 является вариабельным доменом из легкой цепи. В одном из вариантов осуществления настоящего изобретения VL1 является вариабельным доменом из легкой цепи, и VL2 является вариабельным доменом из легкой цепи. В одном из вариантов осуществления настоящего изобретения VL1 является вариабельным доменом из тяжелой цепи, и VL2 является вариабельным доменом из тяжелой цепи. В одном из вариантов осуществления настоящего изобретения VL1 является вариабельным доменом из легкой цепи, и VL2 является вариабельным доменом из тяжелой цепи. В одном из вариантов осуществления настоящего изобретения VL1 является вариабельным доменом из тяжелой цепи, и VL2 является вариабельным доменом из легкой цепи. В одном из вариантов осуществления настоящего изобретения первая вариабельная доменная пара связывает тот же эпитоп, что и вторая вариабельная доменная пара. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему изобретению активно связывает антиген-мишень. В одном из вариантов осуществления настоящего изобретения первая вариабельная доменная пара связывает тот же антиген, что и вторая вариабельная доменная пара, например, первая вариабельная до-3 023053 менная пара и вторая вариабельная доменная пара связывают разные эпитопы на одном антигене. Таким образом, в одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему описанию является моноспецифическим. Понятие моноспецифичности в настоящем изобретении относится к тому обстоятельству, что все сайты связывания связывают один и тот же антигенмишень. В одном из объектов настоящего изобретения все сайты связывания связывают один и тот же эпитоп (эпитопы) указанного антигена. В другом варианте осуществления настоящего изобретения по меньшей мере два сайта связывания связывают разные эпитопы на антигене-мишени. В одном из вариантов осуществления настоящего изобретения первая вариабельная доменная пара связывает другой/отличный антиген относительно второй вариабельной доменной пары. Таким образом, в одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему описанию является биспецифическим, например два сайта связывания специфически связывают разные или отличающиеся антигена. В контексте настоящего изобретения понятие "специфического связывания" относится к антителам,обладающим высоким сродством в отношении антигена-мишени (т.е. антигенов, в отношении которых антитела специфичны), которые связывают антигены, в отношении которых они неспецифичны на низком уровне или с намного меньшим сродством (или совсем не связывают). Методы измерения сродства известны специалистам в данной области, и к ним относится, например, метод BIAcore. В одном из вариантов осуществления настоящего изобретения вариабельные домены по меньшей мере одной вариабельной доменной пары, например родственной пары, связаны дисульфидной связью. В одном из вариантов осуществления настоящего изобретения имеется дисульфидная связь между вариабельными доменами, которые формируют первый сайт связывания, например, в первой родственной паре. В одном из вариантов осуществления настоящего изобретения имеется дисульфидная связь между вариабельными доменами, которые формируют второй сайт связывания, например, во второй родственной паре. В одном из вариантов осуществления настоящего изобретения имеется дисульфидная связь междуVL1 и VH1, например, при отсутствии дисульфидной связи между VL2 и VH2. В одном из вариантов осуществления настоящего изобретения имеется дисульфидная связь междуVL2 и VH2, например, при отсутствии дисульфидной связи между VL2 и VL2. В одном из вариантов осуществления настоящего изобретения имеется дисульфидная связь между вариабельными доменами, которые формируют первый сайт связывания, и дополнительно имеется дисульфидная связь между вариабельными доменами, которые формируют второй сайт связывания. В одном из вариантов осуществления настоящего изобретения дисульфидная связь находится между (если не указано иначе, в приведенном ниже перечне применяют нумерацию по Kabat). При любых обстоятельствах ссылки на нумерацию по Kabat соответствуют нумерации, описанной Kabat и др. в кн.:VH106 + VL57 см., например, Young и др., FEBS Letters 377, 1995, сс. 135-139. Перечисленные выше аминокислотные пары находятся в положении, благоприятном для замещения цистеинами таким образом, что могут быть сформированы дисульфидные связи. Цистеины могут быть сконструированы в этих положениях известными методами. Таким образом, в одном из вариантов осуществления настоящего изобретения вариабельная доменная пара (VH/VL) по настоящему изобретению может быть связана дисульфидной связью между двумя остатками цистеина, одним в VH и одним в VL, причем положение пары остатков цистеина выбрано из группы, состоящей из VH37 и VL95, VH44 и VL100, VH44 и VL105, VH45 и VL87, VH100 и VL50,VH100b и VL49, VH98 и VL46, VH101 и VL46, VH105 и VL43 и VH106 и VL57. В одном из вариантов осуществления настоящего изобретения вариабельная доменная пара(VH/VL) по настоящему изобретению может быть связана дисульфидной связью между двумя остатками цистеина, одним в VH и одним в VL, которые находятся вне областей CDR, причем положение пары остатков цистеина выбрано из группы, состоящей из VH37 и VL95, VH44 и VL100, VH44 и VL105, VH45 иVL87, VH100 и VL50, VH98 и VL46, VH105 и VL43 и VH106 и VL57. В одном из вариантов осуществления настоящего изобретения вариабельная доменная пара(VH/VL) по настоящему изобретению может быть связана дисульфидной связью между двумя остатками цистеина, одним в VH и одним в VL, которые находятся вне областей CDR, причем положение пары остатков цистеина выбрано из группы, состоящей из VH37 и VL95, VH44 и VL105, VH45 и VL87, VH100 иVL50, VH98 и VL46, VH105 и VL43 и VH106 и VL57. В одном из вариантов осуществления настоящего изобретения вариабельная доменная пара(VH/VL) по настоящему изобретению может быть связана дисульфидной связью между двумя остатками цистеина, причем остаток цистеина в VH находится в положении 44 и остаток цистеина в VL находится в положении 100. Обычно пары цистеина сконструированы в таких положениях в VH и VL, что в одном из вариантов осуществления настоящего изобретения вариабельная доменная пара (VH/VL) по настоящему изобретению может быть связана дисульфидной связью между двумя сконструированными остатками цистеина,одним в VH и одним в VL, причем положение пары сконструированных остатков цистеина выбрано из группы, состоящей из положений VH37 и VL95, VH44 и VL100, VH44 и VL105, VH45 и VL87, VH100 иVL50, VH100b и VL49, VH98 и VL46, VH101 и VL46, VH105 и VL43 и VH106 и VL57. В одном из вариантов осуществления настоящего изобретения вариабельная доменная пара(VH/VL) по настоящему изобретению может быть связана дисульфидной связью между двумя сконструированными остатками цистеина, одним в VH и одним в VL, которые находятся вне областей CDR,причем положение пары сконструированных остатков цистеина выбрано из группы, состоящей из положений VH37 и VL95, VH44 и VL100, VH44 и VL105, VH45 и VL87, VH100 и VL50, VH98 и VL46, VH105 и VL43 и VH106 и VL57. В одном из вариантов осуществления настоящего изобретения вариабельная доменная пара(VH/VL) связана дисульфидной связью между двумя сконструированными остатками цистеина, одним вVH и одним в VL, которые находятся вне областей CDR, причем положение пары сконструированных остатков цистеина выбрано из группы, состоящей из VH37 и VL95, VH44 и VL105, VH45 и VL87, VH100 и VL50, VH98 и VL46, VH105 и VL43 и VH106 и VL57. В одном из вариантов осуществления настоящего изобретения вариабельная доменная пара(VH/VL) связана дисульфидной связью между двумя сконструированными остатками цистеина, причем сконструированный остаток цистеина в VH находится в положении 44 и сконструированный остаток цистеина в VL находится в положении 100. В одном из вариантов осуществления настоящего изобретения VH1 гибридизирован непосредственно с CH1 , a VL1 гибридизирован непосредственно с CL, и имеется дисульфидная связь между VH2 и VL2. В одном из вариантов осуществления настоящего изобретения одна или несколько дисульфидных связей между вариабельными областями одного или нескольких сайтов связывания обладают стабилизирующим эффектом и, например, поддерживают экспрессию и/или минимизируют нежелательную димеризацию. В одном из вариантов осуществления настоящего изобретения имеется дисульфидная связь между вариабельными доменами в первой родственной паре и/или между вариабельными доменами во второй родственной паре и дисульфидная связь между фрагментами константной области, например, фрагментами CH1 и CL. Какой-либо из форматов, предусмотренных в настоящем изобретении, может быть предусмотрен с дисульфидной связью между константными доменами или без нее. Домен CL является производным от каппа- или лямбда-цепи. В одном из вариантов осуществления настоящего изобретения CL является cKappa. В одном из вариантов осуществления настоящего изобретения "природная" дисульфидная связь находится между CH1 и CL. Природным положением "межцепочечного цистеина", формирующего связь,является положение 214 в сКарра и cLambda человека (нумерация по Kabat, 4-е издание, 1987). Точное положение цистеина, формирующего связь, или "межцепочечного цистеина", в CH1 зависит от определенного фактически применяемого домена. Таким образом, например, в гамма-1 человека природное положение межцепочечного цистеина, формирующего дисульфидную связь, находится в положении 233 (нумерация по Kabat, 4-е издание, 1987). Известно положение формирующего связь цистеина для других изотипов человека, например, гамма 2, 3, 4, IgM и IgD, например 127. Различные межцепочечные дисульфидные связи и их утрата представлены на фиг. 2 А. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему описанию имеет дисульфидную связь в положении, эквивалентном соответствующему природному положению CH1 и CL. В одном из вариантов осуществления настоящего изобретения константная область, включающаяCH1 или CL, имеет дисульфидную связь, которая занимает неприродное положение. Она может быть-5 023053 сконструирована в молекуле путем интродукции цистеина (цистеинов) в аминокислотную цепь в нужных положениях. Такая неприродная дисульфидная связь является дополнительной связью или связью, заменяющей природную дисульфидную связь, имеющуюся между CH1 и CL. В одном из вариантов осуществления настоящего изобретения отсутствует природная дисульфидная связь между CH1 и CL. В одном из вариантов осуществления настоящего изобретения полностью отсутствуют межцепочечные дисульфидные связи между CH1 и CL. В одном из вариантов осуществления настоящего изобретения каждый фрагмент константной области гибридизирован по меньшей мере с одним вариабельным доменом. В одном из вариантов осуществления настоящего изобретения каждый фрагмент константной области также связан через пептид, например искусственный/неприродный линкер, например, через последовательность в табл. 1 и/или 2, с вариабельным доменом, например с доменом, который не является родственной парой для гибридизируемого с ним вариабельного домена. В одном из вариантов осуществления настоящего изобретения фрагмент константной области, например в тяжелой цепи, включает домен CH1. В одном из вариантов осуществления настоящего изобретения фрагмент константной области состоит из домена CH1 . Домен CH1 может быть производным от IgA, IgD, IgE, IgG (например, IgG1, IgG2, IgG3, IgG4) илиIgM доменов человека и их изотипов. В одном из вариантов осуществления настоящего изобретения легкая цепь включает домен CL. В одном из вариантов осуществления настоящего изобретения константная область в легкой цепи состоит из домена CL. В одном из вариантов осуществления настоящего изобретения с N-конца тяжелая цепь собрана следующим образом: вариабельный домен VH1 (часть первой родственной пары), CH1, вариабельный доменVH2 (часть второй родственной пары). При такой сборке CH1 может, например, гибридизироваться с вариабельным доменом VL1 из первой родственной пары и связываться через пептид с вариабельным доменом второй родственной пары. В одном из вариантов осуществления настоящего изобретения с N-конца легкая цепь собрана следующим образом: VL1 (часть первой родственной пары), CL, VL2 (часть второй родственной пары), например, домен CL может быть гибридизирован с VL1 первой родственной пары и связан через пептид сVL2 второй родственной пары. Примеры соответствующих пептидных линкеров приведены ниже, например, в табл. 1. Таблица 1. Гибкие линкерные последовательности-6 023053 К примерам жестких линкеров для применения в гибридных белках по настоящему описанию относятся пептидные последовательности GAPAPAAPAPA (SEQ ID NO:42), РРРР (SEQ ID NO:43) и РРР. В одном из вариантов осуществления настоящего изобретения пептидный линкер включает альбуминсвязывающий пептид. Примеры альбуминсвязывающих пептидов представлены в WO 2007/106120 и включают Таблица 2 В одном из вариантов осуществления настоящего изобретения линкер обладает эффекторной функцией. В одном из вариантов осуществления настоящего изобретения гибридные белки по настоящему описанию димеризованы для создания молекулы, обозначаемой в настоящем изобретении "(Fab'Fv)2". Димеризация, например, может быть через формирование дисульфидной связи между двумя растворимыми доступными "целевыми" цистеинами на каждом из двух гибридных белков по настоящему описанию (т.е. Fab-dsFv), или за счет химического перекрестного связывания "целевых" цистеинов, лизинов,частей молекул сахаров или неприродных аминокислот на каждой из двух молекул Fab-Fv. Если требуется формирование меж-Fab-Fv дисульфидной связи (формирование межцепочечной связи), только один линкер в составе Fab-Fv содержит цистеин или цистеины. Т.е. если линкер между CL и VL2 содержит один или несколько цистеинов, линкер между CH1 и VH2 обычно может быть лишен цистеинов. Если линкер между CH1 и VH2 содержит один или несколько цистеинов, то линкер между CL и VL2 обычно может быть лишен цистеинов. Линкеры могут содержать от 1 до 8 цистеинов и могут состоять из какой-либо пептидной последовательности, содержащей 1-8 цистеинов. Соответствующие пептидные последовательности показаны в табл. 1-3, а также при необходимости могут конструироваться последовательности, содержащие от 1 до 8 цистеинов. Шарниры могут применяться в качестве линкеров для индукции димеризации, поскольку они обладают природной гибкостью и их вторичная структура достаточна для того, чтобы индуцировать эффективную и стабильную дисульфидную связь. В частности могут применяться природные шарниры или модифицированные шарниры какого-либо класса или изотипа, если они содержат от 1 до 8 остатков цистеина. Если природная или модифицированная последовательность шарнирного линкера между CL и VL2 действительно содержит один или несколько цистеинов, линкер между CH1 и VH2 обычно может быть лишен цистеинов. Если шарнирный линкер между CH1 и VH2 действительно содержит один или несколько цистеинов,линкер между CL и VL2 обычно лишен цистеинов. В другом варианте меж-Fab-Fv димеризация может быть индуцирована конструированием "целевых" остатков на какой-либо растворимой или доступной на поверхности области VL1, VH1, cKappa,cLambda, CH1 , VL2 или VH2. Сходным образом "целевые" остатки могут быть сконструированы с Сконца полипептидов или легкой цепи, или тяжелой цепи, например, после VL2 после VH2. Эти целевые остатки предпочтительно могут быть остатками цистеина сразу после последних остатков VL2 или VH2 или в линкере, шарнире или спейсерной области полипептида. Если "целевые" остатки связаны химическим перекрестным линкером, длина, состав, действие или гетерофункциональность могут варьировать для точной настройки доступности антигена, функциональной авидности, периода полураспада в сыворотке, свойств очистки или свойств для хранения и переработки. Химический перекрестный линкер частично может состоять из полиэтиленгликоля или может содержать дополнительные реакционноспособные группы для добавления третьей специфичности или действующего агента. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему изобретению димеризуют, используя полимер, например ПЭГ, таким образом, что одна цепь в первом гибридном белке конъюгирована с полипептидом, например, антителом или фрагментом, для формирования гетеродимера. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему-7 023053 изобретению димеризуют, используя полимер, со вторым гибридным белком по настоящему описанию для формирования гетеродимера или гомодимера. Фиг. 2 Б показывает пример формата связанного с помощью ПЭГ димера, включающего два белка по настоящему описанию. Линкер ПЭГ связывает CH1 в одном гибридном белке и CH1 во втором гибридном белке. Однако шарнирная область может быть инкорпорирована с соответствующими свойствами для конъюгации с линкерной молекулой ПЭГ. В другом варианте домен CL может быть применен для конъюгации с ПЭГ. Положение дисульфидной связи между одной или несколькими вариабельными доменами парами может быть в каких-либо положениях, описанных в настоящем изобретении. Также может быть предусмотрен формат, содержащий или не содержащий дисульфидную связь между константными областями, примеры которых более подробно рассмотрены выше. Шарниры могут быть природными шарнирами или модифицированными шарнирами. Могут применяться модифицированные шарниры, например, представленные в табл. 3. Ряд модифицированных шарнирных областей уже был описан, например, в патентах US 5677425,US 6642356, WO 9915549, WO 2005003170, WO 2005003169, WO 2005003170, WO 9825971 и WO 2005003171, а также в тех, которые приводятся в настоящем изобретении в виде ссылок. Примерами шарниров также являются те шарниры, которые представлены в табл. 3. Таблица 3. Последовательности шарнирных линкеровX означает какую-либо аминокислоту, например XX может означать АА. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему описанию не содержит шарнира. В настоящем изобретении высказывают предположение, что путем обеспечения вариабельных доменов в качестве родственных пар в итоговых конструкциях оптимизируют и поддерживают антигенсвязывающие свойства сайта связывания, сформированного родственной парой. Полагают, что дисульфидные мостики в родственных парах полезны, поскольку способствуют стабилизации формата. Было признано, что одно или несколько аминокислотных замещений, добавлений и/или делеций может быть произведено в вариабельных доменах антител, предусмотренных в настоящем изобретении,без существенного изменения способности антитела связывать целевой антиген и без изменения его нейтрализующего действия. Действие каких-либо аминокислотных замещений, добавлений и/или делеций может быть легко проверено специалистом в данной области, например, путем использования анализовin vitro, например, анализа BIAcore. В одном из вариантов осуществления настоящего изобретения отсутствует межцепочечная дисульфидная связь между легкой цепью и тяжелой цепью, и один или два цистеина, которые не могут нормально формировать связь (межцепочечных цистеинов), конъюгированы с полимером. Один межцепочечный цистеин может быть избирательно конъюгирован методами генной инженерии для замещения соответствующего межцепочечного цистеина другой аминокислотой, например серином. Оба межцепочечных цистеина могут быть конъюгированы с полимером за счет применения соответствующих сильно восстанавливающих агентов. Различные сборки межцепочечных цистеинов или их утрата показаны на фиг. 2 А. Домен каппа или лямбда может быть модифицирован химической конъюгацией с соответствующим- 10023053 полимером. В одном из вариантов осуществления настоящего изобретения сКарра человека в гибридном белке по настоящему изобретению включает с С-конца последовательность, выбранную изSCNRGES (SEQ ID NO:195). Один или несколько цистеинов на С-конце cKappa, например, непосредственно описанных выше,могут применяться для конъюгации с полимером ПЭГ. Соответствующие положения в cKappa для конъюгации включают: 1. верхний домен cKappa, который примерно равно отстоит от VL1 и VL2 в гибридном белке по настоящему описанию, например Glu143, Gln199 и/или Val110 (линейный, нумерация по Kabat; 2. средний домен cKappa, который удален от всех мобильных и гибких мотивов, которые могут потребоваться для эффективного связывания антигена, например Lys145 и/или Gln147, (линейный, нумерация по Kabat); и/или 3. нижний домен cKappa, например Lys190, Asn210, Arg211 и/или Glu213 (линейный, нумерация поKabat). Эти аминокислоты при необходимости могут быть замещены, например, цистеином, используя известные методы. В одном из вариантов осуществления настоящего изобретения гибридный белок включает последовательность,например, в cKappa, в частности в положении 108-214 (нумерация по Kabat) в аминокислотной последовательности. В одном из вариантов осуществления настоящего изобретения CH1 человека в гибридном белке настоящего изобретения включает с С-конца последовательность, выбранную изKCS. В одном из вариантов осуществления настоящего изобретения гибридный белок включает последовательность Аминокислота S120, выделенная жирным шрифтом, не является частью генетического/экзонного определения домена CH1 , но рассматривается в виде части структурного "локтя". Подчеркнутая последовательность является не частью генетического/экзонного определения домена CH1, а частью расположенного выше шарнира, например, в CH1, в частности в положении 121-218(нумерация по Kabat) в аминокислотной последовательности. К соответствующим положениям в CH1 для конъюгации относятся: 1. верхний домен CH1, который примерно равно отстоит от VH1 и VH2 В гибридных белках по настоящему описанию, например Asn211 (216) и/или Thr123 (Asn 216 и/или Thr 116 по нумерации Kabat); 2. средний домен CH1, который удален от всех мобильных и гибких мотивов, которые могут потребоваться для эффективного связывания антигена, например Ser163 и/или Ser127 (Ser163 и/или Ser120 по нумерации Kabat); и/или 3. нижний домен CH1, например Lys136, Ser137 и/или Ser222 (Lys129, Ser130, Ser232 по нумерацииKabat). Аминокислоты могут быть замещены согласно необходимости, например, цистеином, используя известные методы. В одном из вариантов осуществления настоящего изобретения соответствующим образом сконструированным цистеином по настоящему изобретению является природный остаток в данном положении аминокислоты, который замещен остатком цистеина. Внедрение сконструированных цистеинов может осуществляться каким-либо известным в данной области методом. К таким методам относятся, но ими перечень не ограничивается, ПЦР протяженный перекрывающийся мутагенез, сайт-направленный мутагенез или кассетный мутагенез (см. общую информацию в кн.: Sambrook и др. "Molecular Cloning, A Laboratory Manual", 1989, изд-во Cold Spring Harbour Laboratory Press, Cold Spring Harbour, Нью-Йорк; в кн.: Ausbel и др. "Current Protocols in MolecularBiology", 1993, изд-во Greene PublishingWiley-Interscience, Нью-Йорк). Наборы для сайт- 11023053 направленного мутагенеза коммерчески доступны, например набор для сайт-направленного мутагенезаQuikChange (фирма Stratagen, La Jolla, Калифорния). Кассетный мутагенез может проводиться на основе работы Wells и др., Gene, 34, 1985, сс. 315-323. В другом варианте мутанты могут быть получены полным генным синтезом путем отжига, лигирования и ПЦР амплификации, а также клонирования перекрывающихся олигонуклеотидов. В одном из вариантов осуществления настоящего изобретения гибридный белок не содержит цистеинов в областях СН 1 и/или CL для конъюгации с полимером. В одном из вариантов осуществления настоящего изобретения область VH1 гибридизирована с областью СН 1 и аминокислотная последовательность, соединяющая их, в настоящем изобретении называется "локтем". В одном из вариантов осуществления настоящего изобретения указанный локоть содержит один или несколько, например один, конъюгированный с ним полимер ПЭГ, например конъюгированный в положении, равноудаленном между VH1 и VH2, например конъюгированный с остатками(Ser115 по классификации Kabat). Предусмотрена дисульфидная связь, например, путем инжиниринга цистеина или цистеинов в соответствующих положениях в молекуле для обеспечения субстрата для конъюгации с ней полимера ПЭГ. В одном из вариантов осуществления настоящего изобретения область VL1 гибридизирована с областью CL, и аминокислотная последовательность, соединяющая их, в настоящем изобретении называется "локтем". В одном из вариантов осуществления настоящего изобретения указанный локоть содержит один или несколько, например один, конъюгированный с ним полимер ПЭГ, например конъюгированный в положении, равноудаленном между VL1 и VL2, например конъюгированный с остатками Lys107,Arg108 и/или Thr109 (линейный, нумерация по Kabat). Выше обсуждалось, что цистеины могут быть предусмотрены при необходимости для конъюгации. В одном из вариантов осуществления настоящего изобретения ПЭГ конъюгируют с остатком, который пространственно близок областям, предрасположенным к агрегированию. Преимущественно ПЭГелирование, близкое к таким областям, может существенно маскировать целевую область от межмолекулярных взаимодействий в концентрациях в растворе, приемлемых для терапевтических доз. В легкой цепи конъюгация может быть, например, по положениям Thr109 или Gln199 (линейный, нумерация поKabat), или около них, например, для отрицания ValAla-AlaLys пятна, и/или Lys149 или Asn152 (линейный, нумерация по Kabat), например, для отрицания единичного Leu пятна. В тяжелой цепи конъюгация может быть, например, по положениям Gln178 (Gln 179 по классификации Kabat), или Ser180 (Ser182 по классификации Kabat), или Gly181 (Gly 183 по классификации Kabat), или около них рассматриваютValLys-Tyr пятно. В одном из вариантов осуществления настоящего изобретения молекула ПЭГ присоединена к доступной для растворителя реакционноспособной и/или представленной на поверхности/доступной аминокислоте, например, к цистеину. Представленный на поверхности цистеин (свободный цистеин) в контексте настоящего изобретения означает цистеин, который при нахождении гибридного белка в конформации "природной" укладки доступен для конъюгации с ним эффекторной молекулы, например, молекулы ПЭГ. Представленный на поверхности цистеин является цистеином, обнаруженным в гидрофильной части антитела или его фрагмента. Примеры конструирования свободных цистеинов данного типа также предусмотрены в US 7521541. К соответствующим аминокислотам в легкой цепи антитела 4D5 (последовательность показана на фиг. 3), которые могут быть заменены на цистеин, относятся серин (S): 7, 9, 10, 12, 14, 26, 56, 60, 63, 67, 76, 77, 114, 121, 127, 156, 159, 168, 171, 202, 203,треонин (Т): 5, 20, 22, 31, 69, 72, 74, 129, 197, 206,глицин (G): 16, 41, 57, 68, 128, 143, 157, 200, 212,аспартат (D): 17, 28, 70, 122, 151, 167, 170,аргинин (R): 18, 24, 61, 211,глутамин (Q): 27, 79, 147, 160, 195, 199,аспарагин (N): 30, 152, 158, 210,аланин (А): 34, 153,лизин (K): 39, 42, 126, 145, 149, 169,глутамат (Е): 55, 81, 123, 161, 213. Указанные выше номера представляют первичную последовательность антител, нумерованных согласно показанному в файле банка данных белков по кристаллической структуре, 1FVE. Эти номера также соответствуют нумерации по Kabat. Настоящее изобретение также относится к замещению соответствующих аминокислот (используя нумерацию Kabat) в других антителах или фрагментах, включенных в гибридные белки по настоящему изобретению. Соответственно в одном из вариантов осуществления настоящего изобретения легкая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений S7, S9, S10, S12, S14, S26, S56, S60, S63,- 12023053S67, S76, S77, S114, S121, S127, S156, S159, S168, S171, S202, S203, Т 5, Т 20, Т 22, Т 31, Т 69, Т 72, Т 74,Т 129, Т 197, Т 206, G16, G41, G57, G68, G128, G143, G157, G200, G212, D17, D28, D70, D122, D151, D167,D170, R18, R24, R61, R211, Q27, Q79, Q147, Q160, Q195, Q199, N30, N152, N158, N210, А 34, А 153, K39,K42, K126, K145, K149, K169, Е 55, Е 81, Е 123, Е 161 и Е 213. В одном из вариантов осуществления настоящего изобретения легкая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений S7, S9, S10, S12, S14, S26, S56, S60, S63, S67, S76, S77,S114, S121, S127, S156, S159, S168, S171, S202, S203, Т 5, Т 20, Т 22, Т 31, Т 69, Т 72, Т 74, Т 109, Т 129, Т 197,Т 206, G16, G41, G57, G68, G128, G143, G157, G200, G212, D17, D28, D70, D122, D151, D167, D170, R18,R24, R61, R108, R211, Q27, Q79, Q147, Q160, Q195, Q199, N30, N152, N158, N210, А 34, А 153, K39, K42,K107, K126, K145, K149, K169, K190, Е 55, Е 81, Е 123, Е 143, Е 161 и Е 213. К другим соответствующим остаткам, описанным в литературе, относятся остатки, описанные вWO 2006/034488 и WO 2008/038024. Соответственно в одном из вариантов осуществления настоящего изобретения цистеин сконструирован в легкой цепи гибридного белка, напримерS203 замещен на С. Приведенная выше нумерация соотносится с последовательностью легкой цепи, показанной на фиг. 3, но настоящее описание также распространяется на соответствующие положения по нумерации Kabat в других легких цепях. В одном из вариантов осуществления настоящего изобретения цистеин сконструирован в легкой цепи гибридного белка, напримерS203 замещен на С. В одном из вариантов осуществления настоящего изобретения легкая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений S7, S9, S10, S12, S14, S26, S56, S60, S63, S67, S76, S77,S114, S121, S127, S156, S159, S168, S171, S202, S203, Т 5, Т 20, Т 22, Т 31, Т 69, Т 72, Т 74, Т 109, Т 129, Т 197,Т 206, V15, V110, V205, G16, G41, G57, G68, G128, G143, G157, G200, G212, D17, D28, D70, D122, D151,D167, D170, R18, R24, R61, R108, R211, Q27, Q79, Q147, Q160, Q195, Q199, N30, N152, N158, N210, А 34,А 43, А 144, А 153, K39, K42, K107, K126, K145, K149, K169, K190, Е 55, Е 81, Е 123, Е 143, Е 161 и Е 213. В одном из вариантов осуществления настоящего изобретения легкая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений S7, S9, S10, S12, S14, S26, S56, S60, S63, S67, S76, S77,S159, Т 5, Т 20, Т 22, Т 31, Т 69, Т 72, Т 74, Т 109, Т 129, Т 197, Т 206, G16, G41, G57, G68, G128, G143, G157,G200, G212, D17, D28, D70, D122, D151, D167, D170, R18, R24, R61, R108, R211, Q27, Q79, Q147, Q160,Q195, Q199, N30, N152, N210, А 34, K39, K42, K107, K126, K145, K149, K169, K190, Е 55, Е 81, Е 123, Е 143,Е 161 и Е 213. В одном из вариантов осуществления настоящего изобретения цистеин конструируют в константной области легкой цепи гибридного белка, CL, например Т 109 замещен на С,Е 143 замещен на С,K145 замещен на С,K149 замещен на С и/илиN210 замещен на С. В одном из вариантов осуществления настоящего изобретения цистеин конструируют в вариабельной области легкой цепи гибридного белка, напримерK107 в SEQ ID NI:44 замещен на С. В одном из вариантов осуществления настоящего изобретения легкая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений S77, K107, Т 109, Е 143, K145, K149 и N210. Все остатки, установленные выше в настоящем изобретении, производны от IgG1, но настоящее описание также распространяется на соответствующие положения по нумерации Kabat в других легких цепях от антител других классов и изотипов. Таким образом, в одном из вариантов осуществления настоящего изобретения легкая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 5, 7, 9, 10, 12, 14, 15, 16, 17, 18, 20, 22, 24,26, 27, 28, 30, 31, 34, 39, 41, 42, 43, 55, 56, 57, 60, 61, 63, 67, 68, 69, 70, 72, 74, 76, 77, 79, 81, 107, 108, 109,110, 114, 121, 122, 123, 126, 127, 128, 129, 143, 144, 145, 147, 149, 151, 152, 153, 156, 157, 158, 159, 160,161, 167, 168, 169, 170, 171, 190, 195, 197, 199, 200, 202, 203, 205, 206, 210, 211, 212 и 213, пронумерованных по системе нумерации Kabat. В одном из вариантов осуществления настоящего изобретения легкая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 5, 7, 9, 10, 12, 14, 16, 17, 18, 20, 22, 24, 26, 27, 28, 30, 31,34, 39, 41, 42, 55, 56, 57, 60, 61, 63, 67, 68, 69, 70, 72, 74, 76, 77, 79, 81, 107, 108, 109, 122, 123, 126, 128,129, 143, 145, 147, 149, 151, 152, 157, 159, 160, 161, 167, 169, 170, 190, 195, 197, 199, 200, 206, 210, 211,212 и 213, пронумерованных по системе нумерации Kabat. Таким образом, в одном из вариантов осуществления настоящего изобретения легкая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 77, 107, 109, 143, 145, 149 и 210, пронумерованных по системе нумерации Kabat. Соответствующие аминокислоты в тяжелой цепи антитела 4D5 (последовательности, показанной на фиг. 4), которые могут быть замещены цистеином, включают серин (S): 7, 17, 21, 63, 71, 86, 119, 120, 122, 127, 134, 135, 137, 139, 160, 163, 168, 179, 180, 193, 194,195, 210, 222 треонин (Т): 58, 69, 123, 138, 167, 198, 200,глицин (G): 8, 9, 10, 15, 16, 26, 66, 100, 101, 103, 140, 141, 164, 169, 181, 197,аспартат (D): 62, 73, 102, 215,аргинин (R): 59, 67, 87,глутамин (Q): 3, 13, 112, 155, 199, 219,аспарагин (N): 84, 211,аланин (А): 88, 121, 165,лизин (K): 43, 65, 124, 136, 208, 213, 217,глутамат (Е): 89. Указанные выше номера представляют первичную последовательность антител, нумерованных согласно показанному в файле банка данных белков по кристаллической структуре, 1FVE. Настоящее описание также распространяется на замещение соответствующих аминокислот (используя нумерацию поKabat) в других антителах или фрагментах, включенных в гибридные белки по настоящему изобретению. Нумерация положений эквивалентной последовательности по Kabat в тяжелой цепи следующая: серин (S): 7, 17, 21, 62, 70, 82b, 112, 113, 115, 120, 127, 128, 130, 134, 156, 163,168, 180, 182, 195, 196,197, 215, 232,треонин (Т): 57, 68, 116, 133, 167, 200, 205,глицин (G): 8, 9, 10, 15, 16, 26, 65, 96, 97, 99, 135, 136, 164, 169, 183, 199,аспартат (D): 61, 72, 98, 220,аргинин (R): 58, 66, 86,глутамин (Q): 3, 13, 105, 203,аспарагин (N): 82 а, 216,аланин(А): 84, 114, 165,лизин (K): 43, 64, 117, 129, 213, 218, 222,глютамат (Е): 85. Таким образом, в одном из вариантов осуществления настоящего изобретения тяжелая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений S7, S17, S21, S62, S70, S82b, S112,S113, S115, S120, S127, S128, S130, S134, S156, S163, S168, S180, S182, S195, S196, S197, S215, S232, Т 57,Т 68, Т 116, Т 133, Т 167, Т 200, Т 205, G8, G9, G10, G15, G16, G26, G65, G96, G97, G99, G135, G136, G164,G169, G183, G199, D61, D72, D98, D220, R58, R66, R86, Q3, Q13, Q105, Q203, N82a, N216, А 84, А 114,А 165, K43, K64, K117, K129, K213, K218, K222 и Е 85. В одном из вариантов осуществления настоящего изобретения тяжелая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цис- 14023053 теина выбрано из группы, состоящей из положений S7, S17, S21, S62, S70, S82b, S112, S113, S115, S120,S127, S128, S130, S134, S156, S163, S168, S180, S182, S195, S196, S197, S215, S232, T57, T68, T116, T133,T167, T200, T205, G8, G9, G10, G15, G16, G26, G65, G96, G97, G99, G135, G136, G164, G169, G183, G199,D61, D72, D98, D220, R58, R66, R86, Q3, Q13, Q105, Q179, Q203, N82a, N216, A84, A114, A165, K43, K64,K117, K129, K213, K218, K222 и Е 85. Другие соответствующие остатки описаны в литературе, в том числе в WO 2006/034488 и WO 2008/038024. Таким образом, в одном из вариантов осуществления настоящего изобретения цистеин сконструирован в тяжелой цепи гибридного белка, например А 40 замещен на С,L86 замещен на С,А 88 замещен на С,S119 замещен на С,S120 замещен на С,А 121 замещен на С,S122 замещен на С,А 175 замещен на С,V176 замещен на С, и/илиS179 замещен на С. Приведенная выше нумерация соотносится с последовательностью тяжелой цепи, показанной на фиг. 4, но настоящее описание также распространяется на соответствующие положения по Kabat в других тяжелых цепях. Эквивалентные положения по классификации Kabat следующие: А 40 замещен на С,L82c замещен на С,А 84 замещен на С,S112 замещен на С,S113 замещен на С,А 114 замещен на С,S115 замещен на С,А 176 замещен на С,V177 замещен на С, и/илиS180 замещен на С. Таким образом, в одном из вариантов осуществления настоящего изобретения тяжелая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений S7, S17, S21, S62, S70, S82b, S112,S113, S115, S120, S127, S128, S130, S134, S156, S163, S168, S180, S182, S195, S196, S197, S215, S232, Т 57,Т 68, Т 116, Т 133, Т 167, Т 200, Т 205, G8, G9, G10, G15, G16, G26, G65, G96, G97, G99, G135, G136, G164,G169, G183, G199, D61, D72, D98, D220, R58, R66, R86, Q3, Q13, Q105, Q179, Q203, N82a, N216, A40,A84, A114, A165, A176, V177, L82c, K43, K64, K117, K129, K213, K218,K222 и Е 85. В одном из вариантов осуществления настоящего изобретения тяжелая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений S7, S17, S21, S62, S70, S82b, S120, S127, S128, S130,S134, S156, S163, S168, S182, S195, S196, S197, S215, S232, Т 57, Т 68, Т 116, Т 133, Т 167, Т 200, Т 205, G8,G9, G10, G15, G16, G26, G65, G96, G97, G99, G135, G136, G164, G169, G183, G199, D61, D72, D98, D220,R58, R66, R86, Q3, Q13, Q105, Q179, Q203, N82a, N216, А 165, K43, K64, K117, K129, K213, K218, K222 и Е 85. В одном из вариантов осуществления настоящего изобретения цистеин сконструирован в константной области тяжелой цепи гибридного белка СН 1, например Т 116 замещен на С,S163 замещен на С,S182 замещен на С, и/илиN216 замещен на С. В одном из вариантов осуществления настоящего изобретения цистеин сконструирован в вариабельном домене тяжелой цепи гибридного белка, VH, напримерS82b в SEQ ID NO:227 замещен на С. В одном из вариантов осуществления настоящего изобретения тяжелая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений S82b, T116, S163, S182 и N216. Все остатки, указанные выше в настоящем изобретении, производны от IgG1, но сущность настоящего изобретения также распространяются на соответствующие положения по нумерации Kabat в других тяжелых цепях от антител других классов и изотипов. Таким образом, в одном из вариантов осуществления настоящего изобретения тяжелая цепь белка- 15023053 гибридного антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 3, 7, 8, 9, 10, 13, 15, 16, 17, 21, 26, 40,43, 57, 58, 61, 62, 64, 65, 66, 68, 70, 72, 82 а, 82b, 82 с, 84, 85, 86, 96, 97, 98, 99, 105, 112, 113, 114, 115, 116,117, 120, 127, 128, 129, 130, 133, 134, 135, 136, 156, 163, 164, 165, 167, 168, 169, 176, 177, 179, 180, 182,183, 195, 196, 197, 199, 200, 203, 205, 213, 215, 216, 218, 220, 222 и 232, пронумерованных по системе нумерации Kabat. В одном из вариантов осуществления настоящего изобретения тяжелая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 3, 7, 8, 9, 10, 13, 15, 16, 17, 21, 26, 43, 57, 58, 61, 62,64, 65, 66, 68, 70, 72, 82 а, 82b, 85, 86, 96, 97, 98, 99, 105, 116, 117, 120, 127, 128, 129, 130, 133, 134, 135,136, 156, 163, 164, 165, 167, 168, 169, 179, 182, 183, 195, 196, 197, 199, 200, 203, 205, 213, 215, 216, 218,220, 222 и 232, пронумерованных по системе нумерации Kabat. В одном из вариантов осуществления настоящего изобретения тяжелая цепь гибридного белка антитела включает сконструированный цистеин, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 82b, 116, 163, 182 и 216, пронумерованных по системе нумерации Kabat. В одном из вариантов осуществления настоящего изобретения рекомбинантный гибридный белок по настоящему изобретению ПЭГелирован через сконструированный цистеин в тяжелой цепи в положении 163 и/или 182. В одном из вариантов осуществления настоящего изобретения гибридный белок включает свободный цистеин, к которому присоединена молекула ПЭГ или к которой молекула ПЭГ может быть присоединена. В одном из вариантов осуществления настоящего изобретения гибридный белок или его часть включает одну или несколько последовательностей, выбранных изHTFPCVLQSSGLYS (SEQ ID NO:201). В одном из вариантов осуществления настоящего изобретения предусмотрен со сконструированным цистеином гибридный белок, который включает свободный цистеин и необязательно включает последовательность, выбранную из одной или нескольких из следующих последовательностей: В одном из вариантов осуществления настоящего изобретения предусмотрена легкая цепь, включающая последовательность В одном из вариантов осуществления настоящего изобретения предусматривают тяжелую цепь,включающую последовательность В одном из вариантов осуществления настоящего изобретения полимер ПЭГ конъюгирован по положению в нижнем вариабельном домене легкой цепи, например, VL1 и/или VL2, соответствующим образом удаленных от областей CDR, и расположенных около/в смежном положении с областью локтя, но не кодируемых в ней, например Ser12, Ser14, Gln79 или Glu81, например, таким образом, что связывание молекулы никоим образом не ухудшается, а также не оказывает на него вредного воздействия. Нумерация этих остатков в легкой цепи та же и приведена по нумерации Kabat. В одном из вариантов осуществления настоящего изобретения полимер ПЭГ конъюгирован по положению в нижнем вариабельном домене тяжелой цепи, например VH1 и/или VH2, соответствующим образом удаленных от областей CDR и расположенных около/в смежном положении с областью локтя,но не кодируемых в ней, например Gln13 (Gln13 по нумерации Kabat) или Glu89 (Glu85 по нумерацииKabat), таким образом, что связывание молекулы никоим образом не ухудшается, а также не оказывает на него вредного воздействия. В одном из вариантов осуществления настоящего изобретения тяжелая цепь включает последовательность SEQ ID NO:225 и/или 227. В одном из вариантов осуществления настоящего изобретения легкая цепь включает последовательность SEQ ID NO:228 и/или 44. Во всех вариантах осуществления настоящего изобретения конъюгация полимера ПЭГ с объектом не ослабляет связывания/сродства гибридного белка по настоящему изобретению, а также не оказывает на него вредного воздействия. К соответствующим примерам относятся полиалкиленовый полимер, например, поли(этиленгликоль) или особенно метоксиполи(этиленгликоль) или его производное, и особенно с молекулярной массой в диапазоне примерно от 15 до примерно 40 кДа. К другим соответствующим полимерам относятся, например, крахмалы, сложные гликоформы, например, N-GlucNac и другие, например исследуемые полимеры, в том числе те, которые основаны на аминокислотах, например поли-GGGGS,полиглутамате и полиаспартате (Schlapschy и др., 2007; Jultani и др., 1997; Zunino и др., 1982); которые основаны на углеводах, например окисленном декстране, карбометильном декстране, крахмале и полисиаловой кислоте (Fagnani и др., 1990; Baudys и др., 1998; Gregoriadis и др., 2000); и полностью синтетических полимерах, например поли(N-винилпирролидоне), поли(N-акрилоилморфолине), полиоксиэтилированном глицерине, гидроксипропилметакрилатамиде, полиметакрилате, дендримерах типа "bow tie" и ПЭГ (Kaneda и др., 2004; Caliceti и др., 1999; Soucek и др., 2002). Размер полимера может варьировать в соответствие с необходимостью, но обычно его средняя молекулярная масса может составлять от 500 до 80 кДа, например от 5 до 50 кДа, например от 20 до 40 кДа. Размер полимера может быть, в частности, выбран на основе предполагаемого применения продукта,например, исходя из способности откладываться в определенных тканях, например опухолях, или исходя из способности к более длительному периоду полураспада в кровяном русле (см. обзор Chapman, Advanced Drug Delivery Reviews, 54, 2002, cc. 531-545). Таким образом, например, если продукт должен покинуть кровяное русло и проникнуть в ткани, например, для применения в лечении опухоли, может быть полезным применение низкомолекулярного полимера, например, с молекулярной массой около 5 кДа.- 17023053 Для тех случаев применения, когда продукт сохраняется в кровяном русле, может быть полезным применение высокомолекулярного полимера, например, с молекулярной массой в диапазоне от 20 до 40 кДа. Молекулы ПЭГ могут быть присоединены через какую-либо доступную аминокислотную цепь или концевую аминокислотную функциональную группу, расположенную во фрагменте антитела, например какую-либо свободную амино, имино, тиольную, гидроксильную или карбоксильную группу. Такие аминокислоты могут естественным образом содержаться во фрагменте антитела или могут быть сконструированы во фрагменте, используя методы рекомбинации ДНК (см., например, US 5219996, US 5667425, WO 98/25971). В одном из примеров молекулой антитела по настоящему изобретению является модифицированный фрагмент Fab, в котором модификацией является добавление к С-концу его тяжелой цепи одной или нескольких аминокислот для осуществления присоединения эффекторной молекулы. Соответствующим образом присоединенные аминокислоты формируют модифицированную шарнирную область, содержащую один или несколько остатков цистеина, к которым эффекторная молекула может быть присоединена. Множественные сайты могут применяться для присоединения двух или нескольких молекул ПЭГ. В одном из вариантов осуществления настоящего изобретения фрагмент Fab или Fab' ПЭГелированы одной или двумя молекулами ПЭГ. В одном из вариантов осуществления настоящего изобретения молекула ПЭГ связана с цистеином 171 в легкой цепи, например см. патент WO 2008/038024, включенный в настоящее изобретение в виде ссылки. В одном из вариантов осуществления настоящего изобретения фрагмент Fab или Fab' ПЭГелированы через растворимый или доступный на поверхности цистеин. Соответствующим образом молекулы ПЭГ ковалентно связаны через тиольную группу по меньшей мере одного остатка цистеина, расположенного в гибридном белке. Каждая молекула полимера, присоединенная к гибридному белку, может быть ковалентно связана с атомом серы остатка цистеина, расположенного в белке. Ковалентная связь обычно является дисульфидной связью или, в частности, связью серы-углерода. Если тиольную группу применяют в качестве точки присоединения соответствующим образом активированных молекул ПЭГ, могут применяться, например, тиольные селективные производные, например малеимиды и производные цистеина. Активированная молекула ПЭГ может применяться в качестве исходного материала для получения молекул, содержащих гибридный с полимером белок,согласно описанному выше. Активированная молекула ПЭГ может быть каким-либо полимером, содержащим тиольную реакционноспособную группу, например -галогенкарбоновую кислоту или сложный эфир, например иодоацетамид, имид, например малеимид, винилсульфон или дисульфид. Такие исходные материалы могут быть приобретены на коммерческой основе (например, от фирмы Nektar, США; фирмы Nippon Oils and Fats (NOF), Япония; фирмы Dr Reddy, Великобритания; фирмы JenKem, Китай; фирмы Pan Asia Bio, Китай; фирмы SunBio, Южная Korea; фирмы Biovectra, США) или могут быть получены из коммерчески доступных исходных материалов, используя обычные химические методы. Определенные молекулы ПЭГ включают 20K метокси-ПЭГ-амин и 20K метокси-ПЭГ-N-гидрокси сукцимидный сложный эфир (например, от фирмы Nippon Oils and Fats (NOF), Япония; фирмы Dr Reddy, Великобритания; фирмы JenKem, Китай; фирмы Pan Asia Bio, Китай; фирмы SunBio, Южная Korea; фирмы RappPolymere, Германия). Эффекторные молекулы, например молекулы ПЭГ, могут быть присоединены к гибридным белкам с помощью разных методов, в том числе через альдегидные сахара или чаще через какую-либо доступную аминокислотную цепь или концевую аминокислотную функциональную группу, расположенную во фрагменте антитела, например какую-либо свободную амино, имино, тиольную, гидроксильную или карбоксильную группу. Сайт присоединения эффекторных молекул может быть или случайной, или сайт-специфичной. Случайное присоединение часто происходит через аминокислоты, например лизин, и в результате образуются эффекторные молекулы, например молекулы ПЭГ, присоединяемые к ряду сайтов через фрагмент антитела в зависимости от положений лизинов. Хотя в некоторых случаях это было успешно,точное расположение и число эффекторных молекул, например присоединенных молекул ПЭГ, не поддается контролю, что может привести к потере активности, например, если присоединено слишком мало молекул и/или утрачено сродство, если, например, они взаимодействуют с сайтом связывания антигена(Chapman, Advanced Drug Delivery Reviews, 54, 2002, cc. 531-545). В результате контролируемое сайтспецифическое присоединение эффекторных молекул, например, молекул ПЭГ, обычно является методом выбора. Сайт-специфичное присоединение эффекторных молекул, например, молекул ПЭГ, наиболее часто достигается по остаткам цистеина, поскольку такие остатки относительно редки во фрагментах антитела. Шарниры антител являются обычно применяемыми областями для сайт-специфичного присоединения,поскольку содержат остатки цистеина и отдалены от других областей гибридного белка, предположительно участвующих в связывании антигена. Соответствующие шарниры или содержатся во фрагменте естественным образом, или могут быть созданы, используя методы рекомбинации ДНК (см., напримерogy, 17, 1999, cc. 780-783). В другом варианте или дополнительно сайт-специфичные цистеины также могут быть сконструированы во фрагменте антитела, например, для создания представленного на поверхности цистеина (цистеинов) для присоединения эффекторных молекул (US 5219996). В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему изобретению включает шарнир в качестве линкера между CL и VL2 спейсером, по длине примерно соответствующим длине шарнира. Описаны методы, в которых нативные и сконструированные цистеины применяют для сайтспецифичного присоединения эффекторных молекул, например, молекул ПЭГ (см. WO 2005003169, WO 2005003170 и WO 2005003171). Во всех этих фрагментах нативная межцепочечная дисульфидная связь между константными областями тяжелой и легкой цепи (СН 1 и CL) отсутствует или из-за того, что межцепочечные цистеины применяют в качестве сайта присоединения эффекторных молекул, или в связи с тем, что межцепочечные цистеины замещены другой аминокислотой, чтобы избежать присоединения эффекторной молекулы к таким цистеинам. Такие фрагменты также могут включать сконструированные цистеины для применения в качестве сайтов присоединения эффекторных молекул. В одном из примеров такие сконструированные цистеины представляют пару сконструированных цистеинов, которые формируют дисульфидную связь между константными областями тяжелой и легкой цепи исходного материала фрагмента антитела; указанная дисульфидная связь утрачена, однако однократно эффекторные молекулы присоединяются к таким цистеинам. В одном из вариантов осуществления настоящего изобретения предусмотрены конъюгаты молекул ПЭГ и гибридного белка, в которых тяжелые и легкие цепи фрагментов антител связаны сконструированной межцепочечной дисульфидной связью, которая не является нативной межцепочечной дисульфидной связью. Такая сконструированная межцепочечная дисульфидная связь сохраняется при присоединении эффекторной молекулы, даже при использовании сильных восстанавливающих агентов. Также предусмотрены сайты на границе раздела легкой цепи:тяжелой цепи, где пары цистеинов могут быть успешно сконструированы для внедрения дисульфидной связи, которая достаточно погружена, при этом в значительной степени недоступна для восстанавливающих агентов и эффекторных молекул, примеры"погруженных дисульфидов" представлены в WO 2007010231. Особое преимущество таких фрагментов заключается в том, что дисульфидная связь между сконструированными межцепочечными цистеинами остается интактной при присоединении эффекторной молекулы. Таким образом, в одном из вариантов осуществления настоящего изобретения согласно настоящему изобретению предусматривают гибридный белок, к которому присоединяется одна или несколько эффекторных молекул, отличающийся тем, что нативная межцепочечная дисульфидная связь между константными областями тяжелой цепи (СН 1) и легкой цепи (CL) отсутствует и константные области тяжелой цепи (СН 1) и легкой цепи (CL) связаны межцепочечной дисульфидной связью между парой сконструированных цистеинов, одним в константной области легкой цепи (CL) и другим в константной области тяжелой цепи (СН 1). В одном из вариантов осуществления настоящего изобретения ПЭГ конъюгирован с доступным на поверхности цистеином. Понятие "нативная межцепочечная дисульфидная связь" в контексте настоящего изобретения относится к межцепочечной дисульфидной связи, которая имеется между цистеинами в константных областях тяжелой и легкой цепи, кодируемых в гене природного антитела зародышевой линии. В частности нативные межцепочечные цистеины являются цистеином в константной области легкой цепи (CL) и цистеином в первой константной области тяжелой цепи (СН 1), которые связаны друг с другом дисульфидом в природных антителах. Примеры таких цистеинов обычно могут быть обнаружены в положении 214 легкой цепи и в положении 233 тяжелой цепи IgG1 человека, в положении 127 тяжелой цепи IgM, IgE,IgG2, IgG3, IgG4 человека и в положении 128 тяжелой цепи IgD и IgA2B человека, установленных по нумерации, описанной Kabat и др. в кн.: "Sequences of Proteins of Immunological Interest", 1987, Министерства здравоохранения и социальных услуг США, Национальный институт здравоохранения, США. Следует отметить, что точное положение этих цистеинов может варьировать относительно положения в природных антителах, если проведена какая-либо модификация, например, делеция, инсерция и/или замена во фрагменте антитела. Таким образом, в одном или нескольких вариантах осуществления настоящего изобретения отсутствует нативная межцепочечная дисульфидная связь. Нативная межцепочечная дисульфидная связь может отсутствовать, поскольку присоединена одна или несколько эффекторных молекул. В другом варианте осуществления настоящего изобретения нативная межцепочечная дисульфидная связь отсутствует во фрагментах антитела по настоящему изобретению, поскольку межцепочечные цистеины замещены другой аминокислотой, например серином. Во фрагментах антител по настоящему изобретению константные области тяжелой и легкой цепи связаны межцепочечной дисульфидной связью между сконструированными цистеинами в легкой и/или тяжелой цепи. Гибридные белки по настоящему изобретению соответствующим образом обладают связывающим- 19023053 сродством, особенно выражаемым в пикомолях. Сродство можно измерить, используя какие-либо соответствующие методы, известные в данной области, включая BIAcore. В одном из вариантов осуществления настоящего изобретения молекула антитела по настоящему изобретению обладает связывающим сродством, составляющим примерно 100 пМ или меньше. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему изобретению обладает связывающим сродством, составляющим примерно 50 пМ или меньше. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему изобретению обладает связывающим сродством, составляющим примерно 40 пМ или меньше. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему изобретению обладает связывающим сродством, составляющим примерно 30 пМ или меньше. В одном из вариантов осуществления настоящего изобретения гибридный белок по настоящему изобретению полностью является белком человека или гуманизированным белком и обладает связывающим сродством примерно 100 пМ или меньше. При необходимости гибридный белок по настоящему изобретению может быть конъюгирован с одной или несколькими дополнительными эффекторными молекулами. Следует отметить, что эффекторная молекула может включать одну эффекторную молекулу, или две, или несколько таких молекул, связанных таким образом, что они формируют одну часть молекулы, которая может быть присоединена к антителам по настоящему изобретению. Если необходимо получить фрагмент антитела, связанный с эффекторной молекулой, он может быть получен стандартными химическими методами или методами рекомбинации ДНК, причем фрагмент антитела связан или непосредственно, или через соединяющий агент с эффекторной молекулой. Методы конъюгации таких эффекторных молекул с антителами известны в данной области (см. Hellstrom и др. в кн.: "Controlled Drug Delivery", 1987, 2-е изд., под ред. Robinson и др., сс. 623-653; Thorpe и др., Immunol. Rev., 62, 1982, сс. 119-158, Dubowchik и др., Pharmacology и Therapeutics, 83, 1999, сс. 67-123). К определенным химическим методам относятся, например, те, которые описаны в WO 93/06231, WO 92/22583, WO 89/00195, WO 89/01476 и WO 03031581. В другом варианте,если эффекторной молекулой является белок или полипептид, связь может быть осуществлена, используя методы рекомбинантной ДНК, например, описанные в WO 86/01533 и ЕР 0392745. В контексте настоящего изобретения к понятию "эффекторая молекула" относятся, например, антинеопластические агенты, лекарственные средства, токсины, биологически активные белки, например ферменты, другие антитела или фрагменты антител, синтетические или природные полимеры, нуклеиновые кислоты и их фрагменты, например, ДНК, РНК и их фрагменты, радионуклиды, особенно радиоактивный иод, радиоизотопы, хелатированные металлы, наночастицы и репортерные группы, например флуоресцентные соединения или соединения, которые могут быть выявлены методами ЯМР или спектроскопией электронного спинового резонанса. К примерам эффекторных молекул могут относиться цитотоксины или цитотоксические агенты,включая какие-либо агенты, которые губительны (т.е. убивают) для клеток. Примерами являются комбрестатины, доластатины, эпотилоны, стауроспорин, мейтансиноиды, спонгистатины, ризоксин, галихондрины, роридины, гемиастероины, таксол, цитохалазин В, грамицидин D, этидий бромид, эметин,митомицин, этопозид, тенопозид, винкристин, винбластин, колхитин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин, а также их аналоги или гомологи. К эффекторным молекулам также могут относиться, но ими перечень не ограничивается, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацилдекарбазин),алкилирующие агенты (например, мехлоретамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромоманнит, стрептозотоцин, митомицин С и цисдихлордиамин платина (II) (cis-dichlorodiamine platinum (II) - DDP) цисплатин), антрациклины (например,даунорубицин (ранее называвшийся дауномицином) и доксирубицин), антибиотики (например, дактиномицин (ранее называвшийся актиномицином), блеомицин, митрамицин, антрамицин (anthramycin АМС), калихиамицины или доукармицины) и антимитотические агенты (например, винкристин и винбластин). К другим эффекторным молекулам могут относиться хелатированные радионуклиды, например 111In и 90Y, Lu177, висмут 213, калифорнии 252, иридии 192 и вольфрам 188/рений 188; или лекарственные средства, например, но ими перечень не ограничивается, алкилфосфохолины, ингибиторы топоизомеразы I,таксоиды и сурамин. К другим эффекторным молекулам относятся белки, пептиды и ферменты. К соответствующим ферментам относятся, но ими не ограничиваются, протеолитические ферменты, гидролазы, лиазы, изомеразы, трансферазы. К соответствующим белкам, полипептидам и пептидам относятся, но ими не ограничиваются, иммуноглобулины, токсины, например, абрин, рицин А, экзотоксин псевдомонад или дифтерийный токсин, белки, например инсулин, фактор некроза опухоли, -интерферон, -интерферон, фактор роста нервов, тромбоцитарный фактор роста или тканевый активатор плазминогена, антитромботический агент или антиангиогенный агент, например ангиостатин или эндостатин, или модификатор биологического ответа, например лимфокин, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), гранулоцитарныймакрофагальный колониестимулирующий фактор (granulocyte macrophage colony stimulating factor - GM- 20023053CSF), гранулоцитарный колониестимулирующий фактор (granulocyte colony stimulating factor-G-CSF),фактор роста нервов (nerve growth factor -NGF) или другие факторы роста, и иммуноглобулины. К другим эффекторным молекулам могут относиться выявляемые вещества, применимые, например, в диагностике. К примерам выявляемых веществ относятся различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы, биолюминесцентные материалы, радиоактивные нуклиды, металлы с позитронной эмиссией (для применения в позитрон-эмиссионной томографии) и ионы нерадиоактивных парамагнитных металлов. См. в целом US 4741900 по ионам металлов, которые могут быть конъюгированы с антителами для применения в диагностике. К соответствующим ферментам относятся пероксидаза хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинэстераза; к соответствующим простетическим группам относятся стрептавидин, авидин и биотин; к соответствующим флуоресцентным материалам относятся умбеллиферон, флуоресцеин, флуоресцеин изотиоцианат, родамин, дихлортриазиниламин флуоресцеина, дансил хлорид и фикоэритрин; соответствующим люминесцентным материалом является люминол; к соответствующим биолюминесцентным материалам относятся люцифераза, люциферин и экворин; и к соответствующим радионуклидам относятся 125I, 131I, 111In и 99 Тс. В другом примере эффекторная молекула может повысить период полураспада антитела in vivo и/или снизить иммуногенность антитела и/или повысить доставку антитела через эпителиальный барьер в иммунную систему. К примерам соответствующих эффекторных молекул этого типа относятся полимеры, альбумин, альбуминсвязывающие белки или альбуминсвязывающие соединения, например, описанные в WO 05/117984. Если эффекторной молекулой может быть полимер, он может быть синтетическим или природным полимером, например, полимером полиалкиленом, полиалкениленом или полиоксиалкиленом с необязательно замещенной прямой или разветвленной цепью или разветвленным или неразветвленным полисахаридом, например, гомо- или гетерополисахаридом. К специфическим заместителям, которые могут содержаться в указанных выше синтетических полимерах, относятся одна или несколько гидрокси-, метил- или метоксигрупп. К специфическим примерам синтетических полимеров относятся необязательно замещенные прямые или разветвленные цепи из поли(пропиленгликоля), поливинилового спирта) или их производных,особенно необязательно замещенного поли(этиленгликоля), например, метоксиполи(этиленгликоля) или его производных. К специфическим природным полимерам относятся лактоза, амилоза, декстран, гликоген или их производные. Понятие "производные" в контексте настоящего изобретения относится к реакционноспособным производным, например тиол-селективным реакционноспособным группам, например малеимидам и др. Реакционноспособная группа может быть связана прямо или через сегмент линкера с полимером. Следует подчеркнуть, что остаток такой группы в некоторых случаях может формировать часть продукта в качестве связывающей группы между гибридным белком и полимером. Настоящее изобретение также предусматривает выделенную ДНК, кодирующую антитело, описанное в настоящем изобретении, или фрагмент его тяжелой или легкой цепи. В другом объекте настоящего изобретения предусматривают вектор, включающий указанную ДНК. Основные методы, с помощью которых эти векторы могут быть сконструированы, методы трансфекции и методы культивирования известны специалистам в данной области. В этом отношении с информацией можно ознакомиться в кн.: "Current Protocols in Molecular Biology", 1999, под ред. F.M. Ausubel, изд-во Wiley Interscience, Нью-Йорк, и в руководстве Маниатиса издательства Cold Spring HarborPublishing. В другом объекте настоящего изобретения предусматривают клетку-хозяина, включающую указанный вектор и/или ДНК. Какая-либо соответствующая система клетки-хозяина/вектора может применяться для экспрессии последовательностей ДНК, кодирующих молекулу гибридного белка по настоящему изобретению. Могут применяться бактериальные, например Е.coli, и другие микробные системы, или также могут применяться эукариотические системы клеток-хозяев, например млекопитающих. К соответствующим клеткам-хозяевам млекопитающих относятся клетки СНО, клетки миеломы или гибридомы. Настоящее изобретение также предусматривает способ получения молекул гибридного белка по настоящему изобретению, включающий культивирование клетки-хозяина, содержащей вектор (и/или ДНК) по настоящему изобретению в условиях, пригодных для проведения экспрессии белка с ДНК, кодирующей молекулу антитела по настоящему изобретению, и выделение молекулы антитела. Для получения продуктов, включающих и тяжелые, и легкие цепи, линия клеток может быть трансфецирована двумя векторами: первым вектором, кодирующим полипептид легкой цепи, и вторым вектором, кодирующим полипептид тяжелой цепи. В другом варианте может применяться один вектор,включающий последовательности, кодирующие полипептиды легкой цепи и тяжелой цепи. Молекулы гибридных белков по настоящему описанию экспрессируются клетками-хозяевами на хороших уровнях. Таким образом, свойства молекул гибридных белков оптимизированы и способствуют- 21023053 коммерческой переработке. Молекулы гибридных белков по настоящему описанию применимы для лечения и/или профилактики патологического состояния. Таким образом, настоящее изобретение также предусматривает молекулы гибридных белков для применения в лечении, для введения их терапевтически эффективных количеств. В одном из вариантов осуществления настоящего изобретения молекулы гибридных белков вводят в виде фармацевтического состава, включающего фармацевтически приемлемый эксципиент. Таким образом, настоящее изобретение также предусматривает фармацевтическую или диагностическую композицию, включающую молекулы гибридного белка по настоящему изобретению в комбинации с одним или несколькими из фармацевтически приемлемых эксципиентов, растворителей или носителей. Таким образом, предусматривают применение молекул гибридных белков по настоящему изобретению для получения лекарственного средства. Композиция обычно может поставляться в качестве части стерильной фармацевтической композиции, которая может в норме включать фрмацевтически приемлемый носитель. Фармацевтическая композиция по настоящему изобретению может дополнительно включать фармацевтически приемлемый адъювант. Настоящее изобретение также предусматривает способ получения фармацевтической или диагностической композиции, включающей добавление и перемешивание молекул гибридного белка по настоящему изобретению вместе с одним или несколькими фармацевтически приемлемыми эксципиентами, разбавителями или носителями. Молекула гибридного белка может быть единственным действующим ингредиентом в фармацевтической или диагностической композиции или может дополняться другими действующими ингредиентами, включая другие ингредиенты антител, например, анти-TNF, анти-IL-1, анти-Т-клетки, анти-IFN или анти-ЛПС антитела, или ингредиентами, не относящимися к антителам, например ксантинами. К другим действующим ингредиентам относятся антитела, способные индуцировать устойчивость, например анти-CD3 или анти-CD4 антитела. В другом варианте осуществления настоящего изобретения молекулу гибридного белка или композицию по настоящему изобретению применяют в комбинации с другим агентом фармацевтического действия, например кортикостероидом (например, флутиказоном пропионатом) и/или бета-2-агонистом (например, сальбутамолом, салметеролом или формотеролом) или ингибиторами роста и пролиферации клеток (например, с рапамицином, циклофосфамидом, метотрексатом) или в другом варианте ингибитором CD28 и /или CD40. В одном из вариантов осуществления настоящего изобретения ингибитор является низкомолекулярное соединение. В другом варианте осуществления настоящего изобретения ингибитором является антитело, специфичное в отношении мишени. Фармацевтические композиции соответствующим образом включают терапевтически эффективное количество антитела по настоящему изобретению. В контексте настоящего изобретения понятие "терапевтически эффективное количество" относится к количеству терапевтического агента, необходимому для лечения, облегчения или предупреждения целевого заболевания или состояния, или для проявления выявляемого терапевтического или профилактического эффекта. Для какого-либо антитела терапевтически эффективное количество может быть установлено первоначально или в культуре клеток, или на животных моделях, обычно на грызунах, кроликах, собаках, свиньях или приматах. Животные модели также можно использовать для определения диапазона соответствующей концентрации и способа введения. Такая информация затем может применяться для определения доз и способов для введения людям. Тщательно установленное терапевтически эффективное количество для человека зависит от тяжести заболевания, общего состояния здоровья субъекта, возраста, массы тела и пола субъекта, питания,времени и частоты введения, комбинации (комбинаций) лекарственных средств, реакционной чувствительности и устойчивости/ответа на лечение. Это количество может быть определено путем обычного эксперимента и определяется практикующими врачами. Обычно терапевтически эффективное количество может составлять от 0,01 до 50 мг/кг, например от 0,1 до 20 мг/кг. Фармацевтические композиции могут быть представлены в отдельных дозированных формах, содержащих предварительно установленное количество действующего агента по настоящему изобретению на дозу. Композиции могут вводиться пациенту отдельно или в комбинации (например, одновременно, последовательно или раздельно) с другими агентами, лекарственными средствами или гормонами. Доза, в которой молекулу гибридного белка по настоящему изобретению вводят в зависимости от природы состояния, подвергаемого лечению, степени имеющегося воспаления и от того, применяют ли молекулу антитела профилактически или для лечения имеющегося состояния. Частота дозирования может зависеть от периода полураспада молекулы антитела и длительности ее действия. Если у молекулы антитела период полураспада короткий (например, от 2 до 10 ч), может потребоваться введение одной или нескольких доз в сутки. В другом варианте, если молекула антитела имеет длительный период полураспада (например, от 2 до 15 суток), может потребоваться введение дозы раз в сутки, раз в неделю или даже один раз каждые 1 или 2 месяца. Фармацевтически приемлемый носитель сам не должен индуцировать выработку антител, вредных для индивидуума, получающего композицию и не должен быть токсичным. Соответствующие носители- 22023053 могут быть крупными, медленно метаболизируемыми макромолекулами, например белками, полипептидами, липосомами, полисахаридами, полимолочными кислотами, полигликолиевыми кислотами, полимерными аминокислотами, аминокислотными сополимерами и инактивированными вирусными частицами. Могут применяться фармацевтически приемлемые соли, например соли минеральных кислот, например гидрохлориды, гидробромиды, фосфаты и сульфаты или соли органических кислот, например ацетаты, пропионаты, малонаты и бензоаты. Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, например воду, физраствор, глицерин и этанол. Дополнительно, вспомогательные вещества, например агенты увлажнения, или эмульгаторы, или рН буферные вещества могут содержаться в таких композициях. Такие носители позволяют перерабатывать фармацевтические композиции в таблетки, пилюли, драже, капсулы, жидкости, гели, сиропы, гидросмеси и суспензии для проглатывания пациентом. К соответствующим формам для введения относятся формы, пригодные для парентерального введения, например, путем инъекции или инфузии, например болюсной инъекцией или непрерывной инфузией. Если продукт предназначен для инъекции или инфузии, он может быть в форме суспензии, раствора или эмульсии в масле или водном растворителе, и он может содержать агенты для переработки, например суспендирующие, консервирующие, стабилизирующие и/или диспергирующие агенты. В другом варианте молекула антитела может быть в сухой форме, предназначенной для восстановления перед применением с соответствующей стерильной жидкостью. Будучи переработанными, композиции по настоящему изобретению могут быть непосредственно введены субъекту. Субъектами, подвергаемыми лечению, могут быть животные. Однако в одном или нескольких вариантах осуществления настоящего изобретения композиции адаптированы для введения людям. Соответствующим образом в составах по настоящему описанию рН итогового состава отличается от величины изоэлектрической точки антитела или фрагмента, например, если величина рН состава равна 7, тогда величина pI от 8-9 или выше может быть соответствующей величиной. Хотя нет теоретического обоснования, предполагают, что это может в конечном счете обеспечить итоговый состав с улучшенной стабильностью, например антитело или фрагмент остается в растворе. Фармацевтические композиции по настоящему изобретению могут вводиться каким-либо из способов, включая, но ими не ограничиваясь, пероральный, внутривенный, внутримышечный, внутриартериальный, интрамедуллярный, подоболочечный, внутрижелудочковый, чрезкожный (например, см. WO 98/20734), подкожный, внутрибрюшинный, интраназальный, энтеральный, местный, подъязычный, внутривлагалищный или ректальный способ введения. Обычно терапевтические композиции могут быть получены в виде инъекционных средств, или в виде жидких растворов, или в виде суспензий. Также могут быть приготовлены твердые формы для растворения или приготовления суспензии в жидком растворителе перед инъекцией. Непосредственная доставка композиций обычно может осуществляться инъекцией, введенной подкожно, внутрибрюшинно, внутривенно или внутримышечно, или вводится в межклеточное пространство тканей. Композиции также могут вводиться в рану. Дозирование при лечении может быть по схеме однократного дозирования или по схеме многократного дозирования. Следует учесть, что действующим ингредиентом в композиции может быть молекула гибридного белка. В этом случае она может быть разрушена в желудочно-кишечном тракте. Таким образом, если композицию вводят через желудочно-кишечный тракт, в ней должны быть агенты, которые защищают антитело от разрушения, но высвобождают антитело, когда оно всасывается из желудочно-кишечного тракта. В кн.: "Remington's Pharmaceutical Sciences", 1991, изд-во Mack Publishing Company, Нью-Джерси,можно ознакомиться с подробным анализом фармацевтически приемлемых носителей. В одном из вариантов осуществления настоящего изобретения состав предусмотрен в качестве состава для местного введения, в том числе для ингаляции. Соответствующие препараты для ингаляции включают порошки для ингаляции, дозируемые аэрозоли, содержащие газы-вытеснители, или растворы для ингаляции, не содержащие газов-вытеснителей. Порошки для ингаляции по настоящему изобретению, содержащие действующее вещество, могут состоять исключительно из указанных выше действующих веществ с физиологически приемлемым эксципиентом. Порошки для ингаляции могут включать моносахариды, например, глюкозу или арабинозу), дисахариды (например, лактозу, сахарозу, мальтозу), олиго- и полисахариды (например, декстраны), полиспирты (например, сорбит, манит, ксилит), соли (например, натрий хлорид, кальций карбонат) или их смеси. Моно- или дисахариды применяют соответствующим образом, лактозу или глюкозу, особенно, но не исключительно, применяют в форме их гидратов. Частицы для отложения в легких должны иметь размер менее 10 мкм, например 1-9 мкм, например от 0,1 до 5 мкм, в частности от 1 до 5 мкм. Размер частиц действующего ингредиента (например, антитела или фрагмента) имеет особо важное значение.- 23023053 Газы-вытеснители, которые могут применяться для получения аэрозолей для ингаляции, известны в данной области. Соответствующие газы-вытеснители выбирают из углеводородов, например, n-пропана,n-бутана или изобутана, и галогенсодержащих углеводородов, например хлорированных и/или фторированных производных метана, этана, пропана, бутана, циклопропана или циклобутана. Указанные выше газы-вытеснители могут применяться отдельно или в виде их смесей. Особенно применимыми газами-вытеснителями являются галогенированные алканные производные, выбранные из TG11, TG12, TG134 а и TG227. Из указанных выше галогенированных углеводородов,TG134a (1,1,1,2-тетрафторэтана) и TG227 (1,1,1,2,3,3,3-гептафторпропана) и их смеси особенно применимы. Аэрозоли, содержащие газы-вытеснители для ингаляции, также могут содержать другие ингредиенты, например сопутствующие растворители, стабилизаторы, поверхностно-активные агенты (сурфактанты), антиоксиданты, смазывающие агенты и средства для коррекции рН. Все эти ингредиенты известны в данной области. Аэрозоли, содержащие газы-вытеснители для ингаляции по настоящему изобретению, могут содержать до 5 мас.% действующего вещества. Аэрозоли по настоящему изобретению содержат, например,0,002-5, 0,01-3, 0,015-2, 0,1-2 , 0,5-2 или 0,5-1 мас.% действующего ингредиента. В другом варианте местное введение в легкие также может быть введением состава жидкого раствора или суспензии, например, с помощью устройства, например небулайзера, например, соединенного с компрессором небулайзера (например, небулайзера Pari LC-Jet Plus(R), соединенного с компрессоромPari Master(R) фирмы Pari Respiratory Equipment, Inc., Ричмонд, Вирджиния). Молекулы гибридного белка по настоящему изобретению могут доставляться диспергированными в растворителе, например, в форме раствора или суспензии. Белок может быть суспендирован в соответствующем физиологическом растворе, например в физрастворе или другом фармакологически приемлемом растворителе или буферном растворе. Известные в данной области буферные растворы могут содержать от 0,05 до 0,15 мг динатриевого эдитата, от 8,0 до 9,0 мг NaCl, от 0,15 до 0,25 мг полисорбата, от 0,25 до 0,30 мг безводной лимонной кислоты и от 0,45 до 0,55 мг натрия цитрата в 1 мл воды таким образом, чтобы достичь величины рН примерно от 4,0 до 5,0. Суспензия может содержать, например, лиофилизированное антитело. Составы терапевтических суспензий или растворов также могут содержать один или несколько эксципиентов. Эксципиенты хорошо известны в данной области и к ним относятся буферы (например, цитратный буфер, ацетатный буфер и бикарбонатный буфер), аминокислоты, мочевина, спирты, аскорбиновая кислота, фосфолипиды, белки (например, сывороточный альбумин), EDTA, натрий хлорид, липосомы, маннит, сорбит и глицерин. Растворы или суспензии могут быть включены в липосомы или биоразрушаемые микросферы. Состав обычно получают практически в стерильной форме, используя стерильный процесс производства. Такой процесс может включать получение и стерилизацию путем фильтрации буферного растворителя/раствора, применяемого для состава, асептическая суспензия антитела в стерильном буферном растворе растворителя и помещение состава в стерильные резервуары методами, известными специалистам в данной области. Состав для распыления по настоящему описанию может быть применим, например, в качестве отдельных единиц дозирования (например, в пластиковых запечатанных контейнерах или ампулах), упакованных в пакеты из фольги. Каждая ампула содержит единичную дозу в объеме, например, в 2 мл, растворителя/буферного раствора. Предусматривают, чтобы молекула гибридного белка по настоящему изобретению была приспособлена для доставки путем распыления. Материалы, включенные в настоящее описание, дополнительно поясняют сущность настоящего изобретения. В тех случаях, когда это технически осуществимо, варианты осуществления настоящего изобретения могут комбинироваться. Варианты осуществления настоящего изобретения описаны в качестве вариантов, включающих определенные свойства/элементы. Сущность настоящего изобретения также распространяется на отдельные варианты осуществления настоящего изобретения, в значительной степени состоящие из указанных свойств/элементов или включающие их. Настоящее изобретение дополнительно описывают с помощью иллюстраций, приводимых только в приведенных ниже примерах, которые относятся к прилагаемым фигурам. Фиг. 1 показывает различные форматы гибридных белков по настоящему описанию; фиг. 2 А - различные известные форматы фрагментов антител; фиг. 2 Б - одну возможную сборку для димерного формата, соответствующую настоящему изобретению; фиг. 3 - аминокислотную последовательность легкой цепи антитела 4D5; фиг. 4 - аминокислотную последовательность тяжелой цепи антитела 4D5; фиг. 5 - конструкцию A26Fab-(3G4S)-dsFv645 с положениями мутаций поверхностных цистеинов(Cys), показанных жирным шрифтом; фиг. 6 - гель без восстановления ПЭГелированных мутантов A26Fab-(3G4S)-dsFv645, S182 и S163. ПримерыFab-dsFv. Гибриды антител в формате Fab-dsFv получают согласно описанию, представленному в WO 2010/035012. Конструкция Fab-dsFv включает вариабельные области из антитела ОХ-40, обозначаемые"А 26", которые описаны в WO 2010/096418 и представлены на фиг. 5 (SEQ ID NOS: 225 и 228), и последовательностей вариабельной области антитела против сывороточного альбумина человека, обозначаемого "645" согласно описанному в WO 2010/035012 и представленному на фиг. 5 SEQ ID NO: 227 и 44. Форматом является A26Fab-ds645Fv. Определенные остатки в Fab-dsFv A26-645 выбирают для интродукции остатков цистеина в качестве точек ПЭГелирования. Выбранные мутации имеются и в тяжелой, и в легкой цепи, а также и в Fab, и вFv. Были предприняты усилия по удалению остатков из областей CDR и каких-либо других структурно важных мотивов для ограничения воздействия на выработку белка, его укладку, сродство и стабильность. Выбранные остатки показаны на фиг. 5 и в табл. 4. На фиг. 5 специфические остатки пронумерованы и выделены жирным шрифтом. Таблица 4 Мутации 5 и 13 произведены в качестве контролей, в которых один из двух остатков цистеина, который участвует в межцепочечной дисульфидной связи, в результате мутации заменен на серин, а другой остаток оставлен в качестве сайта для ПЭГелирования. Мутагенез гибридной конструкции Fab-dsFv. Сайт-направленный мутагенез по каждому положению в табл. 4, пронумерованному по системе нумерации Kabat, в Fab-dsFv A26-645 проводят следующим образом: вектор, кодирующий Fab-dsFv A26645, подвергают сайт-направленному мутагенезу, используя стандартный метод "перекрывающейся ПЦР". Вкратце, два мутагенных олигонуклеотида применяют наряду с двумя фланкирующими олигонуклеотидами для выработки двух мутантных продуктов ПЦР в двух разных реакциях ПЦР. Небольшой объем (обычно примерно 1 мкл) сырца продукта перекрывающейся ПЦР из каждой реакции применяют в качестве матрицы в 3-й сборке ПЦР, используя те же два фланкирующих олигонуклеотида. В результате получают последовательность мутантной ДНК полной длины, которую клонируют рестрикцией/лигированием в плазмиде экспрессии перед контролем путем секвенирования ДНК. Конструкция гибридных плазмид Fab-dsFv для экспрессии в клетках млекопитающих. Каждый мутант тяжелой цепи Fab-dsFv клонируют в векторе экспрессии млекопитающих под контролем промотора HCMV-MIE и полиА последовательности SV40E. Их спаривают со схожим вектором,содержащим соответствующую Fab-dsFv легкую цепь для экспрессии в клетках млекопитающих (см. ниже). Экспрессия в клетках млекопитающих Fab-dsFv. Клетки HEK293 трансфецируют плазмидами тяжелой и легкой цепей, используя реагент для трансфекции 293fectin фирмы Invitrogen по инструкциям производителя. Вкратце, 2 мкг плазмиды тяжелой цепи + 2 мкг плазмиды легкой цепи инкубируют с 10 мкл 293fectin + 340 мкл среды Optimem в течение 20 мин при комнатной температуре. Затем смесь добавляют к 510 клеткам HEK293 в суспензии и инкубируют в течение 4 суток при перемешивании при 37 С. Очистка с белком G. Суспензии после экспрессии в клетках млекопитающих осветляют центрифугированием и супернатанты концентрируют до 2 мл, используя концентраторы для отсечения центрифугированием соединений с молекулярной массой 10 кДа. Сконцентрированные супернатанты центрифугируют в режиме 16000 g в течение 10 мин для удаления какого-либо осадка и затем 1,8 мл загружают в колонки HiTrapProtein-G объемом 1 мл (фирма GE Healthcare) со скоростью 1 мл/мин. Колонки промывают 20 мМ фосфатом, 40 мМ NaCl pH 7,4 и связанный материал элюируют с помощью 0,1 М глицина/HCl рН 2,7. Пик элюции (2,5 мл) собирают и величину рН доводят до рН 7 с помощью 100 мкл 2 М Tris/HCl рН 8,5.- 25023053 Элюаты с установленной величиной рН диализируют в фосфатно-солевом буфере (ФСБ), используя концентраторы для отсечения центрифугированием соединений с молекулярной массой 10 кДа, и концентрируют до 500 мкл. Все конструкции Fab-dsFv, за исключением Thr109Cys и Asn216Cys, экспрессируются довольно хорошо. Последовательности ДНК обоих слабо экспрессирующих мутантов были проверены, поскольку с этими последовательностями не было осложнений до тех пор, пока у обоих мутантов не показано очень низкой продуктивности, ни Thr109Cys в легкой цепи, ни Asn211Cys в тяжелой цепи, в дальнейшем не исследуют. Анализ Biacore. Связывающее сродство и кинетические параметры по взаимодействиям конструкций Fab-dsFv определяют методом поверхностного плазмонного резонанса (surface plasmon resonance - SPR) на прибореBiacore 3000, используя сенсорные чипы СМ 5 и подвижный буфер HBS-EP (10 мМ HEPES (рН 7,4), 150 мМ NaCl, 3 мМ EDTA, 0,05 об.% поверхностно активного вещества Р 20). Образцы Fab-dsFv захватываются поверхностью сенсорного чипа, используя или козий фрагмент Fab, специфичный в отношенииF(ab')2 человека (фирма Jackson ImmunoResearch, 109-006-097), или самостоятельно полученное моноклональное антитело против СН 1 человека. Ковалентная иммобилизация захваченного антитела достигается стандартными химическими методами присоединения амина. Каждый цикл исследования состоит, во-первых, из захвата конструкции Fab-dsFv, применяя инъекцию длительностью 1 мин, перед фазой ассоциации, состоящей из инъекции антигена длительностью 3 мин, после чего диссоциацию подвергают мониторингу в течение 20 мин. После каждого цикла захваченную поверхность регенерируют с помощью 21 мин инъекций 40 мМ HCl, затем в течение 30 с 5 мМNaOH. Применяют следующие скорости тока: 10 мкл/мин для захвата, 30 мкл/мин для фаз ассоциации и диссоциации и 10 мкл/мин для регенерации. Для кинетических исследований титруют антиген, пустую проточную кювету используют для вычитания контроля, а инъекции только буфера учитывают для вычитания шума инструмента и сдвига. Кинетические параметры определяют путем одновременной общей наладки получаемых сенсограмм по стандартной модели связывания 1:1, используя программное обеспечение Biacore 3000 Evaluation software. Таблица 5. Сродство мутантов А 26-645 в отношении HSA и Ох 40 Восстановление и ПЭГелирование конструкции Fab-dsFv-Cys. Очищенную белком G конструкцию Fab-dsFv, содержащую интродуцированные сайты ПЭГелирования по цистеину по положению S182C или S163C в CH1 в 0,1 М фосфате, 2 мМ EDTA, рН 6, восстанавливают путем добавления 100 мМ -меркаптоэтиламина (МЕА) в 0,1 М фосфате, 2 мМ EDTA, рН 6, до- 26023053 конечной концентрации 1 мМ. Реакции восстановления инкубируют в течение 1 ч при температуре окружающей среды до начала фракционирования с помощью SE-HPLC на колонке Sephacryl-200 10/30 в изократическом градиенте 0,1 М фосфата, 2 мМ EDTA рН 6. Фракцию объемом 500 мкл, содержащую основное количество мономера Fab-dsFv, выявляют и делят на две части. К одной части добавляют 5 мкл 150 мг/мл SUNBRIGHT ME-200MA ПЭГ (фирма NOF) в 0,1 М фосфате, 2 мМ EDTA рН 6, молекулярной массой 20 кДа, малеимид активный ПЭГ. К другой части добавляют 5 мкл 100 мМ N-этилмалеимида(NЭM) в 0,1 М фосфате, 2 мМ EDTA рН 6. Все образцы инкубируют в течение ночи при температуре окружающей среды. Образцы анализируют в невосстанавливающем геле 4-20% акрилимид Tris/глицин. Гель окрашивают серебром, используя набор Owl Silver Stain по инструкциям производителя. См. фиг. 6. Фиг. 6.B = S182C CH1 +NЭM Дорожка В на фиг. 6 показывает, что восстановление не разрушает внутренние или внешние дисульфидные связи в Fab-dsFv. После фореза имеется только одна полоса в том же положении, что и точно связанная дисульфидом конструкция Fab-dsFv при сравнении со стандартом, который не претерпевает восстановления и NЭM кэппирования (данные не представлены). На дорожках А и Б имеется по две полосы, из которых нижняя соответствует точно связанной дисульфидом конструкции Fab-dsFv, а нижняя является ПЭГелированной точно связанной дисульфидом конструкцией Fab-dsFv. Сдвиг в геле означает добавление молекулы ПЭГ массой 20 кДа. При применении малеимидной химии эти данные показывают сайт-специфическое ПЭГелирование Fab-dsFv по внедренному сайту ПЭГелирования по цистеину в положениях S182C и S163C на СН 1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантный гибридный белок, включающий тяжелую цепь,состоящую из последовательно с N-конца вариабельного домена номинально VH1,области CH1 и дополнительного вариабельного домена номинально VH2,легкую цепь, состоящую из последовательно с N-конца вариабельного домена номинально VL1, домена CL и вариабельного домена номинально VL2,причем указанные тяжелую и легкую цепи выравнивают для обеспечения первого сайта связывания, сформированного первой вариабельной доменной парой VH1 и VL1, и второго сайта связывания,сформированного второй вариабельной доменной парой VH2 и VL2,при этом имеется дисульфидная связь внутри второй вариабельной доменной пары VH2 и VL2, и указанный гибридный белок конъюгирован с одной или двумя молекулами ПЭГ. 2. Рекомбинантный гибридный белок по п.1, в котором имеется дисульфидная связь внутри первой вариабельной доменной пары VH1 и VL1. 3. Рекомбинантный гибридный белок по одному из пп.1, 2, в котором аминокислота в VH2 непосредственно связана с аминокислотой в CH1 пептидной связью. 4. Рекомбинантный гибридный белок по п.1, в котором VH2 связан с CH1 опосредованно с помощью линкера. 5. Рекомбинантный гибридный белок по одному из пп.1-4, в котором аминокислота в VL2 непосредственно связана с аминокислотой в CL пептидной связью. 6. Рекомбинантный гибридный белок по одному из пп.1-4, в котором VL2 связан с CL опосредованно с помощью линкера. 7. Рекомбинантный гибридный белок по п.4 или 6, в котором линкер имеет последовательность,представленную в SEQ ID NO:226. 8. Рекомбинантный гибридный белок по одному из пп.1-7, в котором рекомбинантный гибридный белок ПЭГелирован через растворимый доступный цистеин. 9. Рекомбинантный гибридный белок по одному из пп.1-7, причем рекомбинантный гибридный белок ПЭГелирован через межцепочечный цистеин в СН 1 и/или CL. 10. Рекомбинантный гибридный белок по одному из пп.1-7, который ПЭГелирован по сконструированному цистеину в легкой цепи, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 5, 7, 9, 10, 12, 14, 15, 16, 17, 18, 20, 22, 24, 26, 27, 28, 30, 31, 34, 39,41, 42, 43, 55, 56, 57, 60, 61, 63, 67, 68, 69, 70, 72, 74, 76, 77, 79, 81, 107, 108, 109, 110, 114, 121, 122, 123,126, 127, 128, 129, 143, 144, 145, 147, 149, 151, 152, 153, 156, 157, 158, 159, 160, 161, 167, 168, 169, 170,171, 190, 195, 197, 199, 200, 202, 203, 205, 206, 210, 211, 212 и 213, пронумерованных по системе нумерации Kabat, такой, например, как рекомбинантный гибридный белок, который ПЭГелирован по сконструированному цистеину в легкой цепи, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 77, 107, 109, 143, 145, 149 и 210, пронумерованных по системе нумерации Kabat. 11. Рекомбинантный гибридный белок по одному из пп.1-10, который ПЭГелирован по сконструи- 27023053 рованному цистеину в тяжелой цепи, причем положение указанного сконструированного цистеина выбрано из группы, состоящей из положений 3, 7, 8, 9, 10, 13, 15, 16, 17, 21, 26, 40, 43, 57, 58, 61, 62, 64, 65,66, 68, 70, 72, 82 а, 82b, 82 с, 84, 85, 86, 96, 97, 98, 99, 105, 112, 113, 114, 115, 116, 117, 120, 127, 128, 129,130, 133, 134, 135, 136, 156, 163, 164, 165, 167, 168, 169, 176, 177, 179, 180, 182, 183, 195, 196, 197, 199,200, 203, 205, 213, 215, 216, 218, 220, 222 и 232, пронумерованных по системе нумерации Kabat, такой,например, как рекомбинантный гибридный белок, который ПЭГелирован по сконструированному цистеину в тяжелой цепи, причем положение указанного сконструированного цистеина выбрано из группы,состоящей из положений 82b, 116, 163, 182 и 216, пронумерованных по системе нумерации Kabat. 12. Рекомбинантный гибридный белок по любому из пп.1-11, в котором молекулы ПЭГ имеют молекулярную массу в диапазоне от 5000 до 80000 Да. 13. Рекомбинантный гибридный белок по одному из пп.1-12, в котором домен VH1 в тяжелой цепи является вариабельным доменом из тяжелой цепи или вариабельным доменом из легкой цепи, домен VH2 в тяжелой цепи является вариабельным доменом из тяжелой цепи или вариабельным доменом из легкой цепи; и VL1 в легкой цепи является вариабельным доменом из легкой цепи или тяжелой цепи, и доменVL2 в легкой цепи является вариабельным доменом из легкой цепи или тяжелой цепи. 14. Рекомбинантный гибридный белок по одному из пп.1-13, в котором домен VH2 является вариабельным доменом из тяжелой цепи и домен VL2 является вариабельным доменом из легкой цепи. 15. Рекомбинантный гибридный белок по одному из пп.1-14, в котором вторая вариабельная доменная пара связана дисульфидной связью между двумя остатками цистеина, одним в домене VH2 и одним в домене VL2, причем положение двух остатков цистеина выбрано из группы, состоящей из положенийVL46, VH101 и VL46, VH105 и VL43 и VH106 и VL57, так, например, в котором цистеин домена VH2 находится в положении 44 и цистеин домена VL2 находится в положении 100. 16. Рекомбинантный гибридный белок по одному из пп.1-15, в котором каждая из двух вариабельных доменных пар является родственной парой. 17. Рекомбинантный гибридный белок по одному из пп.1-16, в котором две вариабельные доменные пары, каждая из которых комплементарна паре VH/VL, совместно связывают антиген. 18. Рекомбинантный гибридный белок по одному из пп.1-17, в котором домены СН 1 и CL производны от IgG1. 19. Рекомбинантный гибридный белок по одному из пп.1-18, являющийся димеризованным, где димеризация выбрана из: а) димеризация непосредственно через дисульфидную связь и б) димеризация через химический линкер, например через линкер ПЭГ или через пептидный линкер. 20. Рекомбинантный гибридный белок по п.19, который димеризуется через растворимые доступные цистеины. 21. Рекомбинантный гибридный белок по одному из пп.1-20, являющийся биспецифичным или моноспецифичным.
МПК / Метки
МПК: C07K 16/00, C07K 19/00
Метки: антитела, поливалентные
Код ссылки
<a href="https://eas.patents.su/30-23053-polivalentnye-antitela.html" rel="bookmark" title="База патентов Евразийского Союза">Поливалентные антитела</a>
Предыдущий патент: Стальное волокно для армирования бетона или строительного раствора
Следующий патент: Рекомбинантные антигены pcb
Случайный патент: Зажим топливного инжектора и способ его формирования