Твердая форма {3-[5-(4-хлорфенил)-1н-пирролo[2,3-b]пиридин-3-карбонил]-2,4-дифторфенил}амида пропан-1-сульфоновой кислоты и ее применение
Номер патента: 22924
Опубликовано: 31.03.2016
Авторы: Ийер Раман Махадеван, Виршем Франк, Вюттенбах Николь, Го Зенайда, Маир Ханс-Юрген, Ибрахим Прабха Н., Десай Дипен, Лаупер Штефан, Вайсор Гари Конард, Шах Навнит Харговиндас, Диодон Ральф, Пудевэлл Йоханнес, Сандху Харприт К.
Формула / Реферат
1. Твердая дисперсия, содержащая соединение I
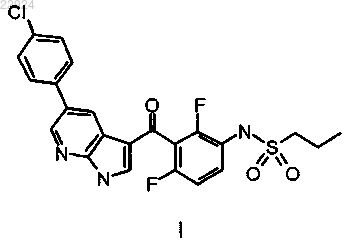
молекулярно диспергированное в полимерной матрице, образованной ионным полимером, представляющим собой ацетат-сукцинат гидроксипропилметилцеллюлозы (HPMC-AS), причем соединение I присутствует в аморфной форме.
2. Твердая дисперсия по п.1, отличающаяся тем, что указанный ионный полимер находится в твердом состоянии.
3. Твердая дисперсия по п.1 или 2, отличающаяся тем, что соотношение массового содержания соединения I в твердой дисперсии к массовому содержанию ионного полимера составляет от 1:9 до 1:1, предпочтительно от 2:8 до 4:6, в частности 3:7.
4. Фармацевтическая композиция для модулирования киназ, содержащая твердую дисперсию по любому из пп.1-3 и фармацевтически приемлемый носитель.
5. Лекарственная форма, содержащая твердую дисперсию по любому из пп.1-3 или композицию по п.4, суспендированную в водной среде.
6. Лекарственная форма по п.5, дополнительно содержащая коллоидный диоксид кремния, предпочтительно в количестве, составляющем по меньшей мере 0,5% от массы указанной композиции.
7. Лекарственная форма по п.6, отличающаяся тем, что указанная водная среда содержит 2 мас.% гидроксипропилцеллюлозы.
8. Способ получения твердой дисперсии по любому из пп.1-3, включающий микроосаждение соединения I и ацетата-сукцината гидроксипропилметилцеллюлозы (HPMC-AS), при этом соединение I и HPMC-AS образуют молекулярную дисперсию соединения I в указанном HPMC-AS.
9. Способ по п.8, отличающийся тем, что соединение I и указанный ацетат-сукцинат гидроксипропилметилцеллюлозы растворяют в органическом растворителе с получением раствора, причем указанный растворитель предпочтительно выбран из диметилформамида, диметилацетамида, диметилсульфоксида и N-метилпирролидона.
10. Способ по п.9, отличающийся тем, что полученный раствор добавляют в воду, тем самым обеспечивая одновременное осаждение соединения I и ацетата-сукцината гидроксипропилметилцеллюлозы с получением твердого молекулярного комплекса, содержащего соединение I, заключенное в матрицу, образованную ацетатом-сукцинатом гидроксипропилметилцеллюлозы, и твердый молекулярный комплекс промывают водой для удаления органического растворителя.
11. Способ по п.9, отличающийся тем, что полученный раствор добавляют в водную соляную кислоту (HCl), тем самым обеспечивая одновременное осаждение соединения I и ацетата-сукцината гидроксипропилметилцеллюлозы с получением твердого молекулярного комплекса, содержащего соединение I, заключенное в матрицу, образованную ацетатом-сукцинатом гидроксипропилметилцеллюлозы, и твердый молекулярный комплекс промывают водой для удаления органического растворителя.
12. Способ по п.8, включающий следующие этапы:
(a) растворение соединения I и HPMC-AS в одном и том же органическом растворителе с получением единой органической фазы;
(b) непрерывное добавление органической фазы, полученной на этапе (а), в водную фазу, которая присутствует в смесительной камере, снабженной узлом смешения с большим усилием сдвига и двумя дополнительными отверстиями, которые соединяют смесительную камеру с замкнутым контуром, при этом водную фазу подвергают циркуляции с пропусканием через указанную смесительную камеру;
(c) осаждение смеси, состоящей из аморфной формы соединения I и HPMC-AS, из водной фазы, полученной на этапе (b), в ходе работы смесителя с большим усилием сдвига и пропускание указанной водной фазы через смесительную камеру в замкнутом контуре с образованием осадка водной суспензии;
(d) обеспечение непрерывной циркуляции водной суспензии через смесительную камеру в процессе работы узла смешения с большим усилием сдвига и после того, как органический раствор, полученный на этапе (а), полностью добавлен в водную фазу, до тех пор, пока не будет достигнут заданный размер частиц и/или распределение частиц по размеру;
(e) выделение твердой фазы из суспензии;
(f) промывание выделенной твердой фазы водой;
(g) деагломерация и сушка твердой фазы.
13. Способ по п.12, отличающийся тем, что
органическая фаза на этапе (а) представляет собой 35%-ный раствор соединения I и HPMC-AS в диметилацетамиде, при этом отношение соединения I к HPMC-AS составляет от 30 до 70% (мас./мас.); и
непрерывное добавление на этапе (b) обеспечивают с помощью инжекторной форсунки, расположенной под углом от 40 до 50° к продольной оси смесителя с большим усилием сдвига и находящейся на расстоянии от 1 до 10 мм от ротора смесителя с большим усилием сдвига, который работает с окружной скоростью от 15 до 25 м/с.
Текст
Десай Дипен (US), Диодон Ральф (DE), Го Зенайда, Ибрахим Прабха Н., Ийер Раман Махадеван (US), Маир Ханс-Юрген (DE),Сандху Харприт К., Шах Навнит Харговиндас, Вайсор Гари Конард (US),Вюттенбах Николь, Лаупер Штефан,Пудевэлл Йоханнес, Виршем Франк (CH) Область техники В настоящем изобретении предложены композиции, которые содержат соединения, такие как биологически активные соединения, и способы получения таких композиций. Уровень техники В публикации заявки РСТ WO 2007/002325 предложен 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты (см., например, с. 80 и соответствующую формулу на с. 82). Краткое описание изобретения Согласно настоящему изобретению предложены композиции, которые содержат соединение I или относятся к соединению I. "Соединение I в настоящем описании означает 3-[5-(4-хлорфенил)-1 Нпирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты (указанное соединение также называют в соответствии с номенклатурой "3-[5-(4-хлорфенил)-1 Н-пирроло[2,3b]пиридин-3-карбонил-2,4-дифторфенил]амидомпропан-1-сульфоновой кислоты"), соли указанного соединения (включая фармацевтически приемлемые соли), конъюгаты указанного соединения, производные указанного соединения, формы указанного соединения и пролекарства указанного соединения. Структура 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламида пропан 1-сульфоновой кислоты представлена ниже. 3-[5-(4-Хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1 сульфоновой кислоты В настоящем описании термин "твердая дисперсия" означает любую твердую композицию, содержащую по меньшей мере два компонента. В некоторых вариантах реализации твердая дисперсия, описанная в данном документе, содержит активный ингредиент (например, соединение 1), предпочтительно диспергированный по меньшей мере в одном другом компоненте, например полимере. В некоторых вариантах реализации твердая дисперсия, описанная в данном документе, представляет собой фармацевтическую дисперсию, которая включает по меньшей мере один фармацевтически или биологически активный ингредиент (например, соединение 1). В некоторых вариантах реализации твердая дисперсия включает соединение I, молекулярно диспергированное (т.е. образующее дисперсию на молекулярном уровне) в полимере. Предпочтительно твердая дисперсия представляет собой однофазную систему. Особенно предпочтительно твердая дисперсия согласно настоящему изобретению представляет собой микроосажденный рыхлый порошок (МВР), содержащий соединение I. Термин "молекулярно диспергированный" в настоящем описании относится к неупорядоченному распределению соединения (например, соединения I) в полимере. В некоторых вариантах реализации указанное соединение присутствует в полимере в конечном раздробленном состоянии. См., например,M.G. Vachon et al., J. Microencapsulation, 14:281-301 (1997) и Vandelli et al., J. Microencapsulation, 10:55-65(1993). В некоторых вариантах реализации соединение (например, соединение I) может быть диспергировано в матрице, образованной полимером в твердом состоянии, таким образом, что указанное соединение иммобилизовано в аморфной форме. Образуется ли молекулярная дисперсия данного соединения в полимере, можно проверить множеством способов, например по тому, характеризуется ли полученный твердый молекулярный комплекс единой температурой перехода в стеклообразное состояние. Термин "твердый молекулярный комплекс" в настоящем описании означает твердую дисперсию,которая содержит соединение I, молекулярно диспергированное в полимерной матрице. Термин "иммобилизовать", используемый в настоящем описании в отношении иммобилизации активного соединения в полимерной матрице, означает, что молекулы соединения взаимодействуют с молекулами полимера таким образом, что молекулы указанного соединения удерживаются упомянутой выше матрицей, и предотвращается зарождение в них центров кристаллизации вследствие отсутствия подвижности. В некоторых вариантах реализации указанный полимер может предотвращать образование межмолекулярных водородных связей или слабых дисперсионных сил между двумя или несколькими лекарственными молекулами соединения I. См., например, Matsumoro и Zografi, PharmaceuticalResearch, vol. 16, No. 11, p. 1722-1728, 1999. Соответственно, в первом аспекте предложена твердая дисперсия, которая содержит соединение I и полимер. Также предложен твердый молекулярный комплекс, который содержит соединение I и полимер. Полимер может представлять собой неионный полимер или ионный полимер. В некоторых вариантах реализации полимер выбирают из группы, состоящей из ацетата сукцината гидроксипропилметилцеллюлозы, гидроксипропилметилцеллюлозы, сополимеров метакриловой кислоты и т.п., а также из смесей двух или нескольких из перечисленных полимеров. В некоторых вариантах реализации отноше-1 022924 ние количества по массе соединения I в твердой дисперсии или твердом молекулярном комплексе к количеству по массе ионного полимера в указанном комплексе составляет от приблизительно 1:9 до приблизительно 5:5. В предпочтительном варианте реализации настоящего изобретения отношение количества по массе соединения I в твердой дисперсии или твердом молекулярном комплексе к количеству по массе ионного полимера в указанном комплексе составляет от приблизительно 2:8 до приблизительно 4:6. В различных вариантах реализации отношение соединения I к полимеру в твердой дисперсии не равно 1:1; например отношение может составлять приблизительно 2:8, или приблизительно 3:7, или приблизительно 4:6. В предпочтительном варианте реализации отношение количества по массе соединения I в твердой дисперсии или твердом молекулярном комплексе к количеству по массе ионного полимера в указанном комплексе составляет приблизительно 3:7. В некоторых предпочтительных вариантах реализации соединение I может присутствовать в твердой дисперсии в количестве от приблизительно 0,1 до приблизительно 80% от от массы твердой дисперсии; или в количестве от приблизительно 10 до приблизительно 70% от массы твердой дисперсии; или в количестве от приблизительно 20 до приблизительно 60% от массы твердой дисперсии; или в количестве от приблизительно 20 до приблизительно 40% от массы твердой дисперсии; или в количестве приблизительно 30% от массы твердой дисперсии. В некоторых вариантах реализации указанный полимер может присутствовать в твердой дисперсии в количестве не менее чем приблизительно 20% от массы твердой дисперсии; или в количестве от приблизительно 20 до приблизительно 95% от массы твердой дисперсии; или в количестве от приблизительно 20 до приблизительно 70% от массы твердой дисперсии. В некоторых предпочтительных вариантах реализации соединение I стабильно в твердой дисперсии(или твердом молекулярном комплексе) в течение по меньшей мере 2 месяцев при 25 С; или в течение по меньшей мере 6 месяцев при 25 С; или в течение по меньшей мере 12 месяцев при 25 С; или в течение по меньшей мере 15 месяцев при 25 С; или в течение по меньшей мере 18 месяцев при 25 С; или в течение по меньшей мере 24 месяцев при 25 С; или в течение по меньшей мере 2 месяцев при 40 С и относительной влажности 75%; или в течение по меньшей мере 4 месяцев при 40 С и относительной влажности 75%; или в течение по меньшей мере 5 месяцев при 40 С и относительной влажности 75%; или в течение по меньшей мере 6 месяцев при 40 С и относительной влажности 75%. В некоторых предпочтительных вариантах реализации соединение I иммобилизовано таким образом, что оно находится преимущественно в аморфной форме в твердой дисперсии или твердом молекулярном комплексе в течение по меньшей мере трех недель хранения при 40 С и относительной влажности 75%; или в течение по меньшей мере одного месяца хранения при 40 С и относительной влажности 75%; или в течение по меньшей мере двух месяцев хранения при 40 С и относительной влажности 75%; или в течение по меньшей мере трех месяцев хранения при 40 С и относительной влажности 75%; или в течение по меньшей мере четырех месяцев хранения при 40 С и относительной влажности 75%; или в течение по меньшей мере пяти месяцев хранения при 40 С и относительной влажности 75%; или в течение по меньшей мере шести месяцев хранения при 40 С и относительной влажности 75%. В некоторых вариантах реализации соединение I присутствует в комплексе в виде тозилатной соли или мезилатной соли. Указанный комплекс может дополнительно включать фармацевтически приемлемый носитель. В настоящем описании термин "преимущественно в аморфной форме" означает, что больше чем 50%; или больше чем 55%; или больше чем 60%; или больше чем 65%; или больше чем 70%; или больше чем 75%; или больше чем 80%; или больше чем 85%; или больше чем 90%; или больше чем 95% соединения присутствует в композиции в аморфной форме. В настоящем описании термин "приблизительно", используемый в контексте количественных измерений, означает указанное количество 10%. Например, "приблизительно 2:8" будет означать 1,8-2,2:7,28,8. В настоящем описании в контексте фармацевтически или биологически активного соединения (например, соединения I) термин "стабильный" относится к способности указанного соединения сохранять свою активность или сохранять некоторые физические или химические свойства при некоторых заданных условиях. В некоторых вариантах реализации активное соединение "стабильно", если активность по окончании заданного периода составляет по меньшей мере 50%; или по меньшей мере 60%; или по меньшей мере 70%; или по меньшей мере 75%; или по меньшей мере 80%; или по меньшей мере 85%; или по меньшей мере 90%; или по меньшей мере 95%; или по меньшей мере 98% от активности указанного соединения в начале заданного периода. В некоторых вариантах реализации соединение в аморфной форме стабильно, если по меньшей мере 50%; или по меньшей мере 60%; или по меньшей мере 70%; или по меньшей мере 75%; или по меньшей мере 80%; или по меньшей мере 85%; или по меньшей мере 90%; или по меньшей мере 95%; или по меньшей мере 98% указанного соединения остается в аморфной форме по окончании заданного периода. В дополнительных вариантах реализации аморфное соединение стабильно, если оно не образует каких-либо детектируемых кристаллических пиков в профилях порошкового рентгеноструктурного анализа (XRD) в течение указанного периода. Термин "сополимеры метакриловой кислоты" в настоящем описании включает сополимеры метакриловой кислоты, сополимеры метакриловой кислоты и метакрилата, сополимеры метакриловой кислоты и этилакрилата, сополимеры аммонийметакрилата, сополимеры аминоалкилметакрилатов и т.п. сополимеры. В некоторых вариантах реализации "сополимер метакриловой кислоты" может представлять собойEUDRAGIT L 100 и EUDRAGIT L 12,5 (также называемый или соответствующий терминам: "сополимер метакриловой кислоты типа А"; "сополимер метакриловой кислоты и метилметакрилата (1:1)";EUDRAGIT S 12,5 (также называемый или соответствующий терминам: "сополимер метакриловой кислоты типа В"; "сополимер метакриловой кислоты и метилметакрилата (1:2)"; "сополимер метакриловой кислоты S"; "DMF 1242" или "PR-MF 6918"); EUDRAGIT L 100-55 (также называемый или соответствующий терминам: "сополимер метакриловой кислоты типа С"; "сополимер метакриловой кислоты и этилакрилата (1:1) типа А"; "обезвоженный сополимер метакриловой кислоты LD" или "DMF 2584");EUDRAGIT L 30 D-55 (также называемый или соответствующий терминам: "дисперсия сополимера метакриловой кислоты"; "30-процентная дисперсия сополимера метакриловой кислоты и этилакрилата(также называемый DMF 13941 или DMF 2006-176); EUDRAGIT RL 100 (также называемый или соответствующий терминам: "сополимер аммонийметакрилата типа А"; "сополимер аммонийметакрилатаPO (также называемый или соответствующий терминам: "сополимер аммонийметакрилата типа А"; "сополимер аммонийметакрилата (типа А)"; "сополимер аминоалкилметакрилата RS"; "DMF 1242");EUDRAGIT RL 12,5 (также называемый или соответствующий терминам: "сополимер аммонийметакрилата типа А"; "сополимер аммонийметакрилата (типа A)"; "DMF 1242" или "PR-MF 6918");EUDRAGIT L 100-55 (также называемый или соответствующий терминам: "сополимер метакриловой кислоты типа С"; "сополимер метакриловой кислоты и этилакрилата (1:1) типа А"; "обезвоженный сополимер метакриловой кислоты LD"; "DMF 2584"); EUDRAGIT L 30 D-55 (также называемый или соответствующий терминам: "дисперсия сополимера метакриловой кислоты", NF "30-процентная дисперсия сополимера метакриловой кислоты и этилакрилата (1:1)"; "сополимер метакриловой кислоты LD"; "DMF 2584" или "PR-MF 8216"); EUDRAGIT FS 30 D (также называемый или соответствующий терминам:"DMF 13941" или "DMF 2006-176"); EUDRAGIT RL 100 (также называемый или соответствующий терминам: "сополимер аммонийметакрилата типа А"; "сополимер аммонийметакрилата (типа А)"; "сополимер аминоалкилметакрилата RS"; "DMF 1242" или "PR-MF 6918"); EUDRAGIT RL PO (также называемый или соответствующий терминам: "сополимер аммонийметакрилата типа А"; "сополимер аммонийметакрилата (типа А)"; "сополимер аминоалкилметакрилата RS" или "DMF 1242"); EUDRAGIT RL 12,5 (также называемый или соответствующий терминам: "сополимер аммонийметакрилата типа А";(также называемый или соответствующий терминам: "дисперсия сополимера аммонийметакрилата типа А"; "сополимер аммонийметакрилата (типа А)" или "DMF 1242"); EUDRAGIT RS 100 (также называемый или соответствующий терминам: "сополимер аммонийметакрилата типа В"; NF "сополимер аммонийметакрилата (типа В)"; "сополимер аминоалкилметакрилата RS"; "DMF 1242" или "PR-MF 6918");EUDRAGIT RS PO (также называемый или соответствующий терминам: "сополимер аммонийметакрилата типа В"; "сополимер аммонийметакрилата (типа В)"; "сополимер аминоалкилметакрилата RS" или"DMF 1242"); EUDRAGIT RS 12,5 (также называемый или соответствующий терминам: "сополимер аммонийметакрилата типа В"; NF полимер, соответствующий терминам: "сополимер аммонийметакрилата (типа В)"; "DMF 1242" или "PR-MF 6918"); EUDRAGIT RS 30 D (также называемый или соответствующий терминам: "дисперсия сополимера аммонийметакрилата типа В"; NF полимер, соответствующий терминам: "сополимер аммонийметакрилата (типа В)" или "DMF 1242"); EUDRAGIT E 100 (также называемый или соответствующий терминам: "сополимер аминометакрилата"; NF "основный сополимер бутилированного метакрилата"; "сополимер аминоалкилметакрилата Е"; "DMF 1242" или "PR-MF 6918");EUDRAGIT Е РО (также называемый или соответствующий терминам: "основный сополимер бутилированного метакрилата"; "сополимер аминоалкилметакрилата Е"; "сополимер аминометакрилата"; "DMF 1242"); EUDRAGIT E 12,5 (также называемый или соответствующий терминам: "ссополимер аминометакрилата"; "основный сополимер бутилированного метакрилата"; "DMF 1242" или "PR-MF 6918");EUDRAGIT NE 30 D (также называемый или соответствующий терминам: "дисперсия сополимера этилакрилата и метилметакрилата"; "30-процентная дисперсия полиакрилата"; ("30% дисперсия поли(этилакрилат-метилметакрилата)"); "дисперсия сополимера этилакрилата и метилметакрилата"; "DMF 2822" или "PR-MF 6918"); EUDRAGIT NE 40 D (также называемый или соответствующий терминам:DMF 2822); EUDRAGIT NM 30 D (также называемый "30-процентная дисперсия полиакрилата"; "30% дисперсия (поли(этилакрилата-метилметакрилата" или "DMF 2822"; PLASTOID В (также называемый или соответствующий термину: "DMF 12102") или т.п. Во втором аспекте предложены способы получения твердых дисперсий или твердых молекулярных комплексов, описанных в данном документе. Указанный способ может включать применение соединенияI в форме тозилатной или мезилатной соли. Предполагается, что все атомы в соединении, описанном в данном документе, включают любой их изотоп, если явно не указано иначе. Должно быть очевидно, что для любого данного атома изотопы могут присутствовать, по существу, в соотношениях согласно их распространенности в природе, или количество одного или нескольких определенных атомов можно увеличить по отношению к одному или нескольким изотопам, применяя синтетические способы, известные специалисту в данной области. Таким образом, водород включает, например, 1H, 2H, 3H; углерод включает, например, 11C, 12C, 13C, 14C; кислород включает, например, 16 О, 17 О, 18 О; азот включает, например, 13N, 14N, 15N; сера включает, например,32Cl, 38Cl, 39Cl и т.п. В настоящем описании термин "твердая форма" относится к твердому препарату (т.е. препарату,который не является ни газом, ни жидкостью) фармацевтически активного соединения, который подходит для введения предполагаемому животному для терапевтических целей. Указанная твердая форма включает любой комплекс, такой как соль, сокристалл или аморфный комплекс, а также любую полиморфную форму указанного соединения. Твердая форма может быть, по существу, кристаллической, полукристаллической или, по существу, аморфной. Твердую форму можно вводить непосредственно или использовать для получения подходящей композиции, обладающей улучшенными фармацевтическими свойствами. Например, твердую форму можно применять в виде лекарственной формы, содержащей по меньшей мере один фармацевтически приемлемый носитель или вспомогательное вещество. В настоящем описании в объем термина "по существу кристаллический" материал входит материал,у которого степень кристалличности больше чем приблизительно 90%; и в объем термина "кристаллический" материал входит материал, у которого степень кристалличности больше чем приблизительно 98%. В настоящем описании в объем термина "по существу аморфный" материал входит материал, у которого степень кристаллизации не больше чем приблизительно 10%; и в объем термина "аморфный" материал входит материал, у которого степень кристалличности не больше чем приблизительно 2%. В настоящем описании в объем термина "полукристаллический" материал входит материал, у которого степень кристалличности больше чем 10%, но не больше чем 90%; предпочтительно в объем термина "полукристаллический" материал входит материал, у которого степень кристалличности больше чем 20%, но не больше чем 80%. В одном аспекте настоящего изобретения можно получить смесь твердых форм указанного соединения, например, смесь аморфной и кристаллической твердых форм, например,чтобы получить "полукристаллическую" твердую форму. Такую "полукристаллическую" твердую форму можно получить с помощью способов, известных в данной области, например путем смешивания аморфной твердой формы с кристаллической твердой формой в желательном соотношении. В некоторых случаях соединение, смешанное с кислотой или основанием, образует аморфный комплекс; полукристаллическое твердое вещество можно получить, используя некоторое количество соединения в стехиометрическом избытке указанного соединения и кислоту или основание в аморфном комплексе, получая,тем самым, некоторое количество аморфного комплекса на основании его стехиометрии, в котором избыток соединения находится в кристаллической форме. Величину избытка соединения, используемого для получения указанного комплекса, можно изменять для получения желательного соотношения аморфного комплекса и кристаллического соединения в полученной смеси твердых форм. Например,если стехиометрия аморфного комплекса кислоты или основания и соединения составляет 1:1, получение указанного комплекса с молярным соотношением соединения к кислоте или основанию 2:1 позволит получить твердую форму с 50% аморфного комплекса и 50% кристаллического соединения. Такая смесь твердых форм может быть полезна в качестве лекарственного продукта, например, благодаря наличию аморфного компонента, обладающего улучшенными биофармацевтическими свойствами, наряду с указанным кристаллическим компонентом. Аморфный компонент будет обладать более высокой биодоступностью, тогда как кристаллический компонент будет обладать более низкой биодоступностью. Такая смесь может обеспечить одновременно быстрое и продолжительное воздействие активного соединения. В настоящем описании термин "комплекс" относится к комбинации фармацевтически активного соединения и дополнительных молекул, которые образуют или позволяют получить новые химические соединения в твердой форме. В некоторых случаях указанный комплекс может представлять собой соль,т.е. когда дополнительная молекула несет противоион кислоты/основания для кислотной/основной группы указанного соединения, в результате чего возникает взаимодействие кислота: основание, которое приводит к образованию обычной соли. Помимо того, что такие солевые формы обычно, по существу,кристаллические, они также могут представлять собой частично кристаллические, по существу, аморфные или аморфные формы. В некоторых случаях, дополнительная молекула в комбинации с фармацевтически активным соединением образует несолевой сокристалл, т.е. соединение и молекула не взаимодействуют обычным способом взаимодействия кислота: основание, но все же образуют, по существу, кристаллическую структуру. Сокристаллы также можно получить из соли указанного соединения и дополнительной молекулы. В некоторых случаях комплекс представляет собой, по существу, аморфный комплекс, который может включать солеобразные взаимодействия кислота: основание, которые не приводят к образованию обычных солевых кристаллов, но вместо этого образуют, по существу, аморфное твердое вещество, т.е. твердое вещество, на порошковой рентгенограмме которого отсутствуют острые пики (на-4 022924 пример, проявляется аморфное гало). В настоящем описании термин "стехиометрия" относится к молярному соотношению двух или более взаимодействующих веществ, которые объединяются с образованием комплекса, например к молярному соотношению кислоты или основания и соединения, которые образуют аморфный комплекс. Например, смесь 1:1 кислоты или основания с соединением (т.е. 1 моль кислоты или основания на моль соединения) позволяет получить аморфную твердую форму со стехиометрией 1:1. В настоящем описании термин "композиция" относится к фармацевтическому средству, подходящему для введения предполагаемому животному для терапевтических целей, которое содержит по меньшей мере одно фармацевтически активное соединение, включая любую его твердую форму. Указанная композиция может содержать по меньшей мере один дополнительный фармацевтически приемлемый компонент для получения улучшенной лекарственной формы указанного соединения, такой как подходящий носитель или вспомогательное вещество. Термин "фармацевтически приемлемый" указывает на то, что указанный материал не проявляет свойств, которые могли послужить причиной избежания осторожным врачом-терапевтом введения указанного материала пациенту, принимая во внимание конкретное заболевание или патологические состояния, которые необходимо лечить, и соответствующий путь введения. Например, главным образом необходимо, чтобы такой материал был, по существу, стерильным, например, для инъецируемых лекарственных средств. В контексте настоящего изобретения термин "терапевтически эффективный" или "эффективное количество" указывает на то, что материалы или количество материала эффективно для предупреждения,частичного снятия или снижения выраженности одного или нескольких симптомов заболевания или патологического состояния и/или для продления выживаемости субъекта, которого лечат. В некоторых вариантах реализации "терапевтически эффективное количество" соединения I относится к таким дозировкам и/или введению в течение таких периодов времени, которые необходимы для ингибирования b-Raf человека, содержащего мутацию V600E. Более того, терапевтически эффективное количество может представлять собой такое количество, при котором общее терапевтически полезное действие превосходит токсичные или нежелательные побочные действия. Терапевтически эффективное количество соединения I может изменяться в зависимости от стадии заболевания, возраста и веса субъекта, которого лечат. Таким образом, схемы приема лекарственного средства обычно изменяют в зависимости от потребностей субъекта в каждом конкретном случае, что находится в рамках компетенции в данной области. В некоторых вариантах реализации подходящая ежедневная доза для введения соединения I взрослому человеку может составлять от приблизительно 100 до приблизительно 3200 мг или от приблизительно 250 до приблизительно 2000 мг, хотя верхний предел можно превышать, когда это необходимо. Ежедневную дозу соединения I можно вводить в виде разовой дозы, в виде дробных доз или для парентерального введения ее можно вводить в виде подкожных инъекций. В контексте настоящего изобретения термины "синергически эффективный" или "синергическое действие" указывают на то, что два или более соединения, которые являются терапевтически эффективными, обеспечивают улучшенное терапевтическое действие, когда применяются в комбинации, по сравнению с их совокупным действием, которое будет ожидаться на основании действия каждого соединения отдельно. В настоящем описании термин "модулирование" или "модулировать" относится к эффекту изменения биологической активности, особенно биологической активности, связанной с конкретной биомолекулой, такой как протеинкиназа. Например, агонист или антагонист конкретной биомолекулы модулирует активность этой биомолекулы, например фермента, путем повышения (например, агонист, активатор) или снижения (например, антагонист, ингибитор) активности указанной биомолекулы, такой как фермент. Такую активность обычно выражают в терминах ингибиторной концентрации (IC50) или среднеэффективной концентрации (ЕС 50) соединения для ингибитора или активатора соответственно по отношению, например, к ферменту. Дополнительные аспекты и варианты реализации должны быть очевидны из следующего подробного описания и из формулы изобретения. Краткое описание чертежей Фиг. 1 представляет собой схематическое изображение типичной схемы получения твердой дисперсии (МВР) согласно этапам а)-d), в частности согласно примеру 22 настоящего изобретения. Фиг. 2 представляет собой подробное схематическое изображение узла смешения с большим усилием сдвига 6) на фиг. 1). На фиг. 3 А и 3 В приведено сравнение рентгенограмм, полученных для двух партий твердых дисперсий (МВР), содержащих HPMC-AS и соединение I, полученных путем осаждения в смесителе с большим усилием сдвига согласно способу, описанному в примере 22 (см. фиг. 3 А), и путем обычного распылительного осаждения (см. фиг. 3 В). Подробное описание изобретения 3-[5-(4-Хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид сульфоновой кислоты, представляет собой соединение следующей структуры (соединение I): пропан-1 В некоторых вариантах реализации соединение I представляет собой ингибитор киназы b-Raf. Нормально функционирующая b-Raf представляет собой киназу, которая участвует в передаче сигналов от мембраны в ядро клетки и активна только когда необходимо передавать такие сигналы. Мутантная b-Raf,тем не менее, постоянно активна и, таким образом, играет роль в развитии опухоли. Мутантная b-Raf,содержащая мутацию V600E, приводит к различным опухолям, например, колоректальному раку, меланоме и раку щитовидной железы. 3-[5-(4-Хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил]-2,4 дифторфениламид пропан-1-сульфоновой кислоты специфично нацелен на мутантную b-Raf, содержащую мутацию V600E. Соответственно, такой ингибитор применяют для ингибирования опухолей, особенно солидных опухолей, таких как меланома. Как указано ранее, формулировка "соединение I" в настоящем описании относится к 3-[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил]-2,4 дифторфениламиду пропан-1-сульфоновой кислоты, а также к любой соли, конъюгату, производному или пролекарству указанного соединения. Соединения, которые имеют низкую растворимость в воде (например, некоторые соединения в кристаллической форме), имеют низкую скорость растворения и в результате могут обладать низкой биодоступностью. Низкая биодоступность соединений может оказаться проблемой для терапевтического введения пациенту, часто вследствие невозможности прогнозировать дозы/терапевтические эффекты,что обусловлено неравномерным всасыванием соединения у пациента. Например, прием пищи может оказывать влияние на способность организма пациента всасывать такие соединения, обладающие низкой биодоступностью, таким образом, потенциально требуются схемы приема, учитывающие влияние приема пищи. Кроме того, при введении дозы может потребоваться большой предел безопасности для указанной дозы, вследствие непредсказуемого действия дозы. Также вследствие низкой биодоступности для достижения желательного терапевтического эффекта может потребоваться большая доза соединения, что потенциально может привести к нежелательным побочным действиям. Аморфные формы соединения I имеют улучшенную растворимость в воде по сравнению с кристаллической формой, но они нестабильны, так как проявляют склонность к кристаллизации. Таким образом,необходимо получить такой состав соединения I, чтобы оно смогло стабильно существовать, преимущественно в аморфной форме. Таким образом, в некоторых аспектах и вариантах реализации, раскрытых и описанных в данном документе, предложены методики, способы и композиции для улучшения растворимости и/или биодоступности соединения I. В некоторых вариантах реализации предложены композиции и способы, включающие соединение I в композиции, форме или лекарственной форме, в которой оно обладает улучшенной растворимостью в воде и/или биодоступностью по сравнению с соединением I в кристаллической форме или соединением I в преимущественно кристаллической форме. В некоторых вариантах реализации предложены композиции, содержащие соединение I в аморфной форме указанного соединения. Указанная аморфная форма соединения I может обладать улучшенной растворимостью в воде по сравнению с соединением I в кристаллической форме. В некоторых вариантах реализации можно получить лекарственные формы соединения I, в которых соединение I стабильно существует в аморфной форме, например, путем иммобилизации соединения в матрице, образованной полимером. См., например, патент США 6350786. Твердые дисперсии и твердые молекулярные комплексы соединения I и полимера. В некоторых аспектах и вариантах реализации предложены твердые дисперсии и твердые молекулярные комплексы, которые содержат соединение I. Например, соединение I можно диспергировать в матрице, образованной полимером, в твердом состоянии, таким образом, что оно иммобилизуется в аморфной форме. В некоторых вариантах реализации указанный полимер может предотвращать образование внутримолекулярных водородных связей или слабых дисперсионных сил между двумя или более молекулами лекарственного соединения I. См., например, Matsumoro и Zografi, Pharmaceutical Research,vol. 16, No. 11, p. 1722-1728, 1999. В некоторых вариантах реализации твердая дисперсия обеспечивает большую площадь поверхности, таким образом, дополнительно обеспечивая улучшенное растворение и биодоступность соединения I. В некоторых вариантах реализации твердая дисперсия или твердый молекулярный комплекс содержит терапевтически эффективное количество соединения I. В некоторых вариантах реализации настоящего изобретения соединение I присутствует в твердой дисперсии в количестве от приблизительно 1 до приблизительно 50 мас.%; или от приблизительно 10 до приблизительно 40 мас.%; или от приблизительно 20 до приблизительно 35 мас.%; или от приблизительно 25 до приблизительно 30 мас.%. В сходных вариантах реализации полимер присутствует в твердой дисперсии в количестве от приблизительно 0 до приблизительно 50 мас.%; или от приблизительно 5 до приблизительно 60 мас.%; или от 10 до приблизительно 70 мас.%. В некоторых вариантах реализации полимер присутствует в твердой дисперсии в количестве большем чем приблизительно 10 мас.%; или большем чем приблизительно 20 мас.%; или большем чем приблизительно 30 мас.%; или большем чем приблизительно 40 мас.%; или большем чем приблизительно 50 мас.%. В одном предпочтительном варианте реализации указанная твердая дисперсия состоит из приблизительно 30 мас.% соединения I и приблизительно 70 мас.% полимера. Твердая дисперсия может содержать соединение I, диспергированное в неионном полимере. Этого можно добиться с помощью различных средств, включая (А) плавление полимера и растворение соединения в полимере, а затем охлаждение полученной смеси и (В) растворение как интересующего соединения, так и полимера в органическом растворителе и выпаривание растворителя, например, в роторном испарителе. Полученная в результате этого твердая дисперсия может содержать соединение, диспергированное в полимере в аморфной форме. Твердую дисперсию можно получить путем диспергирования соединения I в ионном полимере. Получение такой твердой дисперсии может привести к повышенной стабильности соединения I. Этого можно добиться с помощью различных средств, включая способы, описанные выше для получения дисперсии в неионном полимере. Так как ионные полимеры имеют зависимую от рН растворимость в водных системах, полученная с ними твердая дисперсия соединения I и полимера может оказаться стабильной при низком рН в желудке и может высвобождать соединение I при более высоком рН в кишечнике,который является местом всасывания. В предпочтительных вариантах реализации соединение I в таких твердых дисперсиях с ионным полимером, таким образом, может быть менее подвержено отделению от полимера и может быть иммобилизовано полимером в аморфной форме. При реализации настоящего изобретения можно применять любой ионный полимер. Примеры таких ионных полимеров включают ацетатсукцинат гидроксипропилметилцеллюлозы (HPMC-AS), фталат гидроксипропилметилцеллюлозы(НРМСР) и сополимеры метакриловой кислоты. Так как одна цель составления формулы соединения I в комплексе с ионным полимером состояла в иммобилизации соединения I таким образом, чтобы оно находилось преимущественно в аморфной форме, полимер, который способен иммобилизовать соединениеI таким образом, что он находится преимущественно в аморфной форме в течение продолжительного периода времени, является предпочтительным. Обнаружили, что полимеры, такие как HPMC-AS иEUDRAGIT L 100-55 (сополимер метакриловой кислоты), способны иммобилизовать соединение I таким образом, что оно находится преимущественно в аморфной форме в течение по меньшей мере четырех недель хранения при 40 С и относительной влажности 75%. По этой причине HPMC-AS иEUDRAGIT L 100-55 представляют собой предпочтительные полимеры для применения в некоторых вариантах реализации настоящего изобретения.HPMC-AS (HPMC-AS или AQOAT, который доступен, например, в Shin-Etsu) представляет собой особенно предпочтительный полимер для применения при реализации некоторых вариантов реализации настоящего изобретения. Он доступен при следующих степенях чистоты: AS-LF, AS-MF, AS-HF, AS-LG,AS-MG и AS-HG. HPMC-AS представляет собой анионный, относительно нерастворимый в воде, высокомолекулярный полимер с рН-зависимой растворимостью в воде, при этом растворение происходит при рН 5,2 и выше. Растворение можно регулировать в диапазоне рН от 5,2 до 6,5, в зависимости от используемых степеней чистоты HPMC-AS. HPMC-AS может быть относительно устойчивым к распаду в кислой среде желудка и при нормальных температурах хранения. В то же время, так как HPMC-AS растворяется при рН 5,2 и выше, он растворяется в основной среде кишечника, таким образом обеспечивая улучшение всасывания соединения I и дополнительно обеспечивая повышение биодоступности соединения I. Соответственно, в некоторых вариантах реализации настоящего изобретения соединение I находится в твердой дисперсии по меньшей мере с одним полимером, выбранным из HPMC-AS с различными степенями чистоты, описанного выше. Тем не менее, предполагается, что смесь двух или болееHPMC-AS с различными степенями чистоты также можно применять в соответствии с настоящим изобретением. В одном варианте реализации настоящего изобретения отношение количества по массе соединенияI в твердом комплексе к количеству по массе ионного полимера в указанном комплексе составляет от приблизительно 1:9 до приблизительно 1:1. В предпочтительном варианте реализации настоящего изобретения отношение количества по массе соединения I в твердом комплексе к количеству по массе ионного полимера в указанном комплексе составляет от приблизительно 2:8 до приблизительно 4:6. В предпочтительном варианте реализации настоящего изобретения отношение количества по массе соединенияI в твердом комплексе к количеству по массе ионного полимера в указанном комплексе составляет приблизительно 3:7. В одном варианте реализации настоящего изобретения соединение I иммобилизовано таким образом, что оно находится преимущественно в аморфной форме в комплексе в течение до трех недель хранения при 40 С и относительной влажности 75%. В предпочтительном варианте реализации соединение I иммобилизовано таким образом, что оно находится преимущественно в аморфной форме в комплексе в течение до одного месяца хранения при 40 С и относительной влажности 75%. В другом предпочтительном варианте реализации соединение I иммобилизовано таким образом, что оно находится преимущественно в аморфной форме в комплексе в течение до двух месяцев хранения при 40 С и относительной влажности 75%. В другом предпочтительном варианте реализации соединение I иммобилизовано таким образом, что оно находится преимущественно в аморфной форме в комплексе в течение до трех месяцев хранения при 40 С и относительной влажности 75%. В некоторых вариантах реализации HPMC-AS присутствует в твердой дисперсии в количестве от приблизительно 1 до приблизительно 50 мас.%; или от приблизительно 5 до приблизительно 60 мас.%; или от 10 до приблизительно 70 мас.%. В некоторых вариантах реализации HPMC-AS присутствует в твердой дисперсии в количестве большем чем приблизительно 10 мас.%; или большем чем приблизительно 20 мас.%; или большем чем приблизительно 30 мас.%; или большем чем приблизительно 40 мас.%; или большем чем приблизительно 50 мас.%. Настоящее изобретение также относятся к композициям, содержащим твердую дисперсию или твердый молекулярный комплекс, описанный в данном документе. Указанная композиция, кроме твердой дисперсии или твердого молекулярного комплекса, также может включать терапевтически инертные неорганические или органические носители (например, фармацевтически приемлемые носители или вспомогательные вещества). Фармацевтическая композиция также может содержать дополнительные агенты, такие как консервирующие агенты, солюбилизирующие агенты, стабилизирующие агенты, смачивающие агенты, эмульгирующие агенты, подслащивающие агенты, подкрашивающие агенты, ароматизирующие агенты, соли для изменения осмотического давления, буферы, агенты для покрытия и антиоксиданты. Композиция также может содержать дополнительные терапевтически активные соединения или более чем один комплекс терапевтически активного соединения/полимера (например, твердую дисперсию или твердый молекулярный комплекс). В некоторых вариантах реализации указанная композиция содержит твердую дисперсию или твердый молекулярный комплекс, суспендированный в водной среде, включающий гидроксипропилцеллюлозу (НРС). В особенно предпочтительном варианте реализации указанная среда содержит приблизительно 2 мас.% НРС. В предпочтительном варианте реализации композиция содержит коллоидный диоксид кремния. В некоторых вариантах реализации добавление коллоидного диоксида кремния может дополнительно улучшить стабильность твердой дисперсии или твердого молекулярного комплекса. В особенно предпочтительном варианте реализации указанная композиция содержит по меньшей мере приблизительно 0,5 мас.% коллоидного диоксида кремния. В некоторых вариантах реализации предложенные композиции содержат соединение I (например, в твердой дисперсии или твердом молекулярном комплексе) и кросповидон (или полипласдон XL; разрыхляющий агент для лекарственной формы), стеарат магния (смазывающий агент, который можно применять в процессах таблетирования и капсулирования) и/или кроскармеллозу натрия (AcDiSol; разрыхляющий агент). В особенно предпочтительном варианте реализации указанная композиция включает твердую дисперсию или твердый молекулярный комплекс, суспендированный в водном носителе, содержащем до 2 мас.% НРС и по меньшей мере приблизительно 0,5 мас.% коллоидного диоксида кремния. Способ получения твердого молекулярного комплекса соединения I и ионного полимера. Также предложены способы получения твердых молекулярных комплексов, описанных в данном документе, и композиций, включающих твердые молекулярные комплексы. В указанном способе для соединения I можно провести микроосаждение с полимером, описанным в данном документе (например,HPMC-AS). Микроосаждения можно добиться с помощью любых средств, известных в данной области,например с помощью распылительной сушки или лиофилизации; контролируемого растворителем осаждения; контролируемого уровнем рН осаждения; экструзии горячего расплава и технологии с применением сверхкритических жидкостей. Каждый из данных способов подробно описан ниже. Как только твердую дисперсию осадили из раствора с помощью различных способов, ее можно извлечь из раствора с помощью методик, известных специалистам в данной области, например путем фильтрования, центрифугирования, промывки и т.д. Извлеченный твердый молекулярный комплекс затем можно высушить (например, на воздухе, в печи или под вакуумом), и полученное в результате этого твердое вещество можно перемолоть, растереть или тонко измельчить в мелкодисперсный порошок с помощью средств, известных в данной области. Порошкованную форму твердой дисперсии затем можно диспергировать в носителе с получением фармацевтической композиции. В предпочтительном варианте реализации к указанной композиции добавляют по меньшей мере приблизительно 0,5% (мас./мас.) коллоидного диоксида кремния.a) Процесс распылительной сушки или лиофилизации. Соединение I и полимер (например, HPMC-AS) можно растворить в обычном растворителе, имеющем низкую точку кипения, например, в этаноле, метаноле, ацетоне и т.д. С помощью распылительной сушки или лиофилизации растворитель выпаривают путем мгновенного испарения при температуре,близкой к точке кипения растворителя, или под глубоким вакуумом (низкое давление насыщенного па-8 022924 ра), оставляя соединение I осажденным в матрице, образованной полимером. В некоторых вариантах реализации соединение I представляет собой мезилатную или тозилатную солевую форму и, следовательно, предпочтительно обладает улучшенной растворимостью.b) Контролируемое растворителем осаждение. Соединение I и полимер (например, HPMC-AS) можно растворить в обычном растворителе, например диметилацетамиде, диметилформамиде, диметилсульфоксиде (ДМСО), N-метилпирролидоне (NMP),и т.д. Раствор соединения I/полимера добавляют в холодную воду (от 0 до 7 С, предпочтительно от 2 до 5 С), доводят рН до подходящего уровня (например, во многих вариантах реализации подходящий рН представляет собой рН, равный 3 или менее). Это вызывает осаждение соединения I в матрице, образованной полимером (например, HPMC-AS). Микропреципитат можно промыть несколько раз в водной среде до тех пор, пока остаточный уровень растворителя не упадет ниже приемлемого предела для данного растворителя. "Приемлемый предел" для каждого растворителя определяют в соответствии с рекомендациями Международной конференции по гармонизации технических требований (ICH). В предпочтительном варианте реализации получают раствор, содержащий соединение I, органический растворитель (такой как диметилформамид, диметилацетамид (ДМА), диметилсульфоксид (ДМСО),N-метилпирролидон (NMP) и т.п.) и ионный полимер. Органический растворитель предпочтительно представляет собой ДМА при температуре от 20 до 25 С. Указанный раствор можно получить путем предварительного растворения соединения I в органическом растворителе. Затем добавляют полимер при перемешивании. Полученную смесь затем нагревают до температуры между приблизительно 50 и приблизительно 110 С, предпочтительно до приблизительно 70 С. Также получают второй раствор, который представляет собой 0,01 н. HCl. В настоящем описании его называют "водной фазой". Водная фаза имеет температуру между приблизительно 0 и приблизительно 60 С, предпочтительно между 5 и 15 С. Водную фазу затем подвергают циркуляции через смесительную камеру смесителя с большим усилием сдвига, при этом органическую фазу вводят дозами в камеру в процессе работы камеры. Дозирование можно осуществить, например, с помощью шестеренчатого насоса, шлангового насоса или шприцевого насоса. В предпочтительном варианте реализации дозирование осуществляют, применяя шестеренчатый насос, при этом распылитель форсунки направлен в смесительную камеру. Смесительная камера предпочтительно содержит ротор и статор. У каждого ротора и статора может быть, например, либо один, либо два ряда зубцов. В предпочтительном варианте реализации у каждого ротора и статора есть один ряд зубцов. Окружную скорость ротора предпочтительно устанавливают между приблизительно 15 и приблизительно 25 м/с. В процессе смешивания соединение I и полимер осаждают, получая суспензию частиц комплекса соединения I и полимера в водной органической среде. Полученную суспензию затем можно много раз пропустить через диспергирущий блок, чтобы отрегулировать размер частиц указанного соединения. Суспензию затем можно центрифугировать и несколько раз промыть в водной фазе, чтобы удалить органический растворитель, а затем промыть еще раз чистой водой. Полученный продукт затем можно просеять и высушить с получением твердого комплекса согласно настоящему изобретению. В процессе сушки температура полученного комплекса должна быть предпочтительно ниже 40 С, чтобы избежать перекристаллизации соединения I. В некоторых конкретных вариантах реализации описанный выше способ включает следующие этапы:(a) растворение соединения I и HPMC-AS в одном и том же органическом растворителе с получением единой органической фазы;(b) непрерывное добавление органической фазы, полученной на этапе (а), в водную фазу, которая присутствует в смесительной камере, снабженной узлом смешения с большим усилием сдвига и двумя дополнительными отверстиями, которые соединяют указанную смесительную камеру с замкнутым контуром, при этом указанную водную фазу подвергают циркуляции с пропусканием через смесительную камеру;(c) осаждение смеси, состоящей из аморфной формы соединения I и HPMC-AS, из водной фазы,указанной на этапе (b), в процессе работы узла смешения с большим усилием сдвига, и пропускание указанной водной фазы через смесительную камеру в замкнутом контуре с образованием водной суспензии осадка;(d) обеспечение непрерывной циркуляции водной суспензии через смесительную камеру в процессе работы узла смешения с большим усилием сдвига и после того как органический раствор, полученный на этапе (а), полностью добавлен в водную фазу, до тех пор, пока не будет достигнут определенный размер частиц и/или распределение частиц по размеру;(e) выделение твердой фазы из суспензии;(f) промывка выделенной твердой фазы водой; В более конкретных вариантах реализации способы согласно настоящему изобретению включают этапы, на которых органическая фаза на этапе (а) выше представляет собой 35% раствор соединения I и HPMC-AS в диметилацетамиде (ДМА), при этом отношение соединения I к HPMC-AS составляет от 30 до 70%(мас./мас.); и непрерывное добавление на этапе (b) обеспечивают с помощью инжекторной форсунки, расположенной под углом между 40 и 50 к продольной оси узла смешения с большим усилием сдвига и находится на расстоянии от приблизительно 1 до приблизительно 10 мм от ротора указанного узла смешения с большим усилием сдвига, который работает с окружной скоростью от приблизительно 15 до приблизительно 25 м/с. В еще более конкретных вариантах реализации настоящие способы включают этап, на котором непрерывное добавление на этапе (b) выше достигается с помощью распылительной форсунки, расположенной под углом приблизительно 45 к продольной оси узла смешения с большим усилием сдвига и находится на расстоянии от приблизительно 2 до приблизительно 4 мм от ротора указанного узла смешения с большим усилием сдвига, который работает с окружной скоростью, составляющей приблизительно 25 м/с. В других конкретных вариантах реализации способы согласно настоящему изобретению включают этап, на котором сушка на этапе (g) выше достигается с помощью сушки в кипящем слое. В дополнительном варианте реализации предложены твердые дисперсии, полученные с помощью приведенного выше способа. Высушенный осадок, полученный с помощью приведенного выше способа, можно дополнительно переработать в любой тип твердых фармацевтических препаратов или лекарственных форм, которые известны специалисту в данной области. Особенно предпочтительны пероральные лекарственные формы, такие как таблетки, капсулы, пилюли, порошки, суспензии и т.п. формы. Следовательно, полученные таким образом фармацевтические препараты образуют дополнительные варианты реализации, приведенные в данном документе. Термин "органический растворитель", упомянутый на этапе (а) выше, означает любой органический растворитель, в котором смешиваются и соединение I, и HPMC-AS. Предпочтительные органические растворители представляют собой N-метилпирролидон (NMP), диметилформамид (DMF), диметилсульфоксид (ДМСО), диметилацетамид (ДМА) и т.п. растворители, при этом ДМА является наиболее предпочтительным. Общее количество соединения I и HPMC-AS в органической фазе может лежать в диапазоне приблизительно от 15 до 40 мас.%, предпочтительно приблизительно от 25 до 40%, наиболее предпочтительно может составлять приблизительно 35 мас.%. Массовое соотношение соединенияI/HPMC-AS в органическом растворителе составляет приблизительно 30:70 мас.% соответственно. Предпочтительно температуру органического растворителя доводят до 50-110 С, предпочтительно до 6090 С, наиболее предпочтительно приблизительно до 70 С перед его добавлением в смесительную камеру, что упомянуто на этапе (b). Смесь соединения I и HPMC-AS в органическом растворителе также обозначают в данном документе как "органическая фаза" или "фаза ДМА"."Водная фаза", упомянутая на этапе (b), предпочтительно состоит из кислой воды (рН 7, предпочтительно менее чем 3), наиболее предпочтительно из 0,01 н. соляной кислоты (HCl). Водную фазу держат при температуре между приблизительно 0 и приблизительно 60 С, предпочтительно между приблизительно 0 и 20 С, более предпочтительно между приблизительно 5 и приблизительно 15 С, наиболее предпочтительно при температуре приблизительно 5 С. Водная фаза выкачивается из донного клапана резервуара, в котором она содержится 1) на фиг. 1), благодаря потоку, создаваемому узлом смешения с большим усилием сдвига или с помощью вспомогательного насоса, предпочтительно коловратного насоса, затем проходит через узел смешения с большим усилием сдвига обратно в резервуар. Предпочтительно выходное отверстие замкнутого контура расположено ниже уровня жидкости, поддерживаемого в резервуаре, чтобы предотвратить пенообразование. Добавление органической фазы в смесительную камеру, упомянутую на этапе (b) выше, достигается с помощью инжекторной форсунки, которая непосредственно направлена в водную фазу. Можно применять любую обычную форсунку, известную специалисту в данной области. Предпочтительные инжекторные форсунки имеют центральную или ацентрическую геометрию и имеют диаметр, равный приблизительно от 1 до 10 мм. Ацентрическая (не центрированная) геометрия и диаметр, составляющий 5 мм, являются особенно предпочтительными. Распылительная форсунка может быть направлена на ротор смесителя с большим усилием сдвига под угломмежду 0 и 90, предпочтительно между 40 и 50,наиболее предпочтительно под углом 45 (фиг. 2). Во время проведения процесса согласно настоящему изобретению расстояние между положением инжекторной форсунки и наконечником ротора смесителя с большим усилием сдвига составляет приблизительно от 1 до 10 мм, предпочтительно приблизительно от 2 до 4 мм и наиболее предпочтительно приблизительно 2,6 мм. Добавление органической фазы предпочтительно осуществляют со скоростью подачи, составляющей от приблизительно 60/1 до приблизительно 300/1 (отношение водной фазы к органической фазе в процессе осаждения), предпочтительно от приблизительно 70/1 до приблизительно 120/1 и наиболее предпочтительно приблизительно при 100/1. Конеч- 10022924 ное соотношение водной фазы и органической фазы после осаждения составляет от приблизительно 5/112/1, предпочтительно 7/1-10/1 и наиболее предпочтительно составляет 8,5/1. В то время как органическую фазу добавляют (вспрыскивают) в водную фазу в смесительной камере, узел смешения с большим усилием сдвига находится в рабочем состоянии. Можно применять любой обычный узел смешения с большим усилием сдвига (блок ротор/статор), известный специалисту в данной области. В предпочтительной геометрии ротора согласно настоящему изобретению используется блок ротор/статор с одним звездчатым рядом зубцов или двумя звездчатыми рядами зубцов или их комбинация. Окружная скорость ротора составляет от приблизительно 15 до приблизительно 25 м/с, предпочтительно 25 м/с. После добавления всей органической фазы в водную фазу полученную суспензию, а именно осадок, состоящий из аморфного соединения I и HPMC-AS в водной фазе, подвергают дополнительной циркуляции в замкнутом цикле, включающем узел смешения с большим усилием сдвига. За пределами узла смешения с большим усилием сдвига циркуляция должна осуществляться с помощью вспомогательного насоса, предпочтительно коловратного насоса Суспензию пропускают через узел смешения с большим усилием сдвига несколько раз, до момента получения необходимого размера частиц и/или необходимого распределения размеров частиц. Обычно суспензию пропускают через узел смешения с большим усилием сдвига приблизительно от 1 до 60 раз, наиболее предпочтительно 6 раз. Размер частиц и/или распределение размеров частиц можно определить с помощью стандартных способов, хорошо известных специалисту в данной области, таких как, например, динамическое рассеяние света. Предпочтительный размер частиц согласно настоящему изобретению составляет D50=80-230 мкм,предпочтительно D50=80-160 мкм. Выделение твердой дисперсии (МБР) согласно этапу (е), описанному выше, можно осуществить с помощью обычных способов фильтрования или с помощью центрифуг. Перед выделением температуру суспензии предпочтительно подводят приблизительно до 5-10 С. Далее, выделенную твердую дисперсию промывают подкисленной кислотой; предпочтительно 0,01 н. HCl, а затем дополнительно промывают чистой водой, чтобы преимущественно удалить органический растворитель (этап (f. Выделенная(влажная) твердая дисперсия (МВР) обычно содержит от 60 до 70% воды (мас./мас.), и ее предпочтительно высушивают перед какой-либо дополнительной обработкой. Сушку можно осуществить, применяя любые стандартные способы, известные специалисту в данной области, например используя сушильный шкаф при температурах между 30 и 50 С, предпочтительно приблизительно при 40 С и при пониженном давлении, предпочтительно ниже 20 мбар. Несколько методов сушки можно объединить или использовать последовательно, при этом применение сушки в кипящем слое является особенно предпочтительным в качестве конечного этапа сушки согласно настоящему изобретению. Конкретный способ получения (HPMC-AS-соединение I) МВР согласно этапам а)-g) выше описан в примере 22, который представляет собой дополнительный предпочтительный вариант реализации настоящего изобретения. Стабильность твердой дисперсии (МВР), полученной с помощью способа согласно примеру 22, сравнивали со стабильностью МВР, полученной с помощью обычного распылительного осаждения. Формулировка "обычное распылительное осаждение" означает, что органическую фазу распыляли на водную фазу через форсунку, которая помещена снаружи от водной фазы, над ее поверхностью, как и в случае многих обычных способов распылительного осаждения. Все дальнейшие параметры процесса одинаковы для обоих способов. Стабильность, т.е. ингибирование перекристаллизации соединения I, определяют с помощью рентгеноструктурного анализа, применяя обычную схему широкоугольного рассеяния рентгеновских лучей, так как она хорошо известна квалифицированному специалисту. Получение образца было идентичным для обеих МВР. Образцы обрабатывали в климатической камере(50 С и влажность 90% (ОВ в течение от нескольких часов до нескольких дней (0, 14, 41 ч и 4, 6,13 дней) перед рентгеноструктурным анализом. Результаты представлены на фиг. 3 А для МВР, полученной согласно примеру 22, и на фиг. 3 В для МВР, полученной с помощью обычного способа. В начале кривых рентгенограммы для обеих МВР видно широкое гало в широкоугольном участке, при этом отсутствуют остроконечные сигналы, что свидетельствует о том, что оба материала находятся в аморфном состоянии. Через несколько дней остроконечные сигналы появляются на рентгенограммах, снятых для МВР, полученной с помощью обычного способа (см. фиг. 3 В), но не на рентгенограммах, снятых для МВР, полученной с помощью способа, описанного в данном документе (см. фиг. 3 А). Таким образом, результаты, представленные на фиг. 3 А и 3 В, демонстрируют, что осажденная распылением МВР менее устойчива к перекристаллизации, чем МВР, осажденная при больших усилиях сдвига, о чем свидетельствует раннее появление остроконечных сигналов на дифрактограммах (см. фиг. 3 В), которые возникают за счет образования кристаллической формы соединения I. Нижняя линия на каждой фигуре представляет собой исходный образец, следующие линии снизу вверх соответствуют 14, 41, 96 ч, 6, 13 дней хранения в климатической камере (при 50 С и относительной влажности 90%). Новые способы, приведенные в данном документе, предпочтительно можно осуществить, применяя схему, показанную на сопроводительной фиг. 1. Схему, по существу показанную на фиг. 1, можно применять для получения согласно следующей методике. Так, на фиг. 1 изображены два резервуара (сосуда) со средствами контроля температуры: один для обеспечения контролируемой температуры водной фазы (1), другой для обеспечения контролируе- 11022924 мой температуры органической фазы (2). Оба сосуда дополнительно оборудованы автоматическими мешалками (3). Водную фазу прокручивают в замкнутом контуре (4), применяя насос (5), при этом пропуская через узел смешения с большим усилием сдвига (6). Органическую фазу добавляют в водную фазу внутри узла смешения с большим усилием сдвига с помощью подающего насоса (7) и через инжекторные форсунки, которые более подробно показаны на фиг. 2. На фиг. 2 показано, что форсунка (8) расположена в водной фазе внутри узла смешения с большим усилием сдвига. Форсунка может быть расположена под различными угламипо отношению к ротору(9) узла смешения с большим усилием сдвига и на определенных расстояниях (d) от наконечника ротора Твердую дисперсию, в частности МВР, которую можно получить согласно предложенным способам, можно применять в большом разнообразии форм для введения лекарственных средств, таких как соединение I, включая лекарственные средства, которые плохо растворимы в воде, и, в частности, в пероральных лекарственных формах. Типичные лекарственные формы включают порошки или гранулы,которые можно принимать перорально либо в сухом виде, либо после восстановления влагосодержания путем добавления воды с получением пасты, кашицы, суспензии или раствора; таблетки, капсулы или пилюли. Различные добавки вещества можно смешивать, перемалывать или гранулировать с твердой дисперсией, описанной в данном документе, с получением материала, подходящего для описанных выше лекарственных форм. Потенциально предпочтительные вспомогательные вещества, как правило, относятся к следующим классам: другие материалы матриц или разбавители, поверхностно-активные агенты,агенты, образующие комплексы с лекарственным средством, или солюбилизаторы, наполнители, разрыхляющие агенты, связующие агенты, смазывающие агенты и модификаторы рН (например, кислоты,основания или буферы). Примеры других матричных материалов, наполнителей или разбавителей включают лактозу, маннит, ксилит, микрокристаллическую целлюлозу, дифосфат кальция и крахмал. Примеры поверхностно-активных агентов включают лаурилсульфат натрия и полисорбат 80. Примеры агентов,образующих комплексы с лекарственным средством, или солюбилизаторов включают полиэтиленгликоли, кофеин, ксантен, гентизиновую кислоту и циклодекстрины. Примеры разрыхляющих агентов включают крахмалгликолят натрия, альгинат натрия, карбоксиметилцеллюлозу натрия, метилцеллюлозу и кроскармеллозу натрия. Примеры связующих агентов включают метилцеллюлозу, микрокристаллическую целлюлозу, крахмал и камеди, такие как гуаровая камедь и трагакант. Примеры смазывающих агентов включают стеарат магния и стеарат кальция. Примеры модификаторов рН включают кислоты,такие как лимонная, уксусная, аскорбиновая, молочная, аспарагиновая, янтарная, фосфорная кислоты и т.п.; основания, такие как ацетат натрия, ацетат калия, оксид кальция, оксид магния, тринатрийфосфат,гидроксид натрия, гидроксид кальция, гидроксид алюминия и т.п., и буферы, как правило, включающие смеси кислот и солей указанных кислот. По меньшей мере одной целью включения таких модификаторов рН является контролирование скорости растворения лекарственного средства, матричного полимера или обоих, тем самым позволяя осуществлять контроль локальной концентрации лекарственного средства в процессе растворения. Добавки можно включить в твердую аморфную дисперсию в процессе или после ее образования. В дополнение к перечисленным выше добавкам или вспомогательным веществам, для целей настоящего изобретения может потенциально подходить применение любых обычных материалов и процедур для составления формулы и получения пероральных лекарственных форм с применением композиций, описанных в данном документе, известных специалисту в данной области. Следовательно, дополнительный вариант реализации включает фармацевтическое средство, содержащее твердую дисперсию, полученную с помощью способа, описанного в данном документе, в частности, полученную согласно этапам а)-g), упомянутым выше, и, в частности, полученную в соответствии с процессом, описанным в примере 22. В еще одном варианте реализации предложена твердая дисперсия, полученная в соответствии с настоящим процессом, для применения в качестве лекарственного средства, в частности твердая дисперсия,содержащая HPMC-AS и соединение I, в частности твердая дисперсия, полученная согласно этапам а)-g) выше или согласно примеру 22. В еще одном варианте реализации предусмотрено применение твердой дисперсии, которую можно получить с помощью настоящих этапов а)-g) или с помощью способа из примера 22, для получения лекарственных средств для лечения рака, в частности солидных опухолей и, в частности, злокачественных(метастатических) меланом. В еще одном варианте реализации предложена твердая дисперсия, полученная согласно этапам а)-g), приведенным выше, или с помощью способа из примера 22, для применения в качестве лекарственного средства для лечения рака, в частности солидных опухолей и злокачественных (метастатических) меланом.c) Контролируемое рН осаждение. Указанный процесс включает осаждение соединения I в ионном полимере (например, HPMC-AS). В этом процессе соединение I и полимер растворяют при высоком рН и осаждают путем снижения рН раствора, или наоборот. В предпочтительном варианте реализации полимер представляет собой HPMC-AS, который нерастворим при низких рН. Соединение I и HPMC-AS растворяют в органическом растворителе, таком как диметилформамид, диметилацетамид (ДМА), диметилсульфоксид (ДМСО), N-метилпирролидон (NMP) и т.п. растворители. рН раствора затем снижают, например, путем добавления кислоты. Добавление кислоты включает смешивание раствора соединения I и полимера и кислоты, например путем добавления кислоты в раствор соединения I и полимера, добавление раствора соединения I и полимера к кислоте или одновременное их смешивание. При пониженном рН как соединение I, так и HPMC-AS одновременно осаждаются, тем самым обеспечивая получение твердого молекулярного комплекса, включающего соединение I, заключенное в матрицу, образованную HPMC-AS. Полученный в результате твердый молекулярный комплекс затем можно промыть водой, чтобы удалить органический растворитель.d) Процесс экструзии горячего расплава. В некоторых вариантах реализации микроосаждение соединения I в полимере (таком какHPMC-AS) может быть достигнуто с помощью процесса экструзии горячего расплава. Соединение I и полимер смешивают, а затем непрерывно подают в экструдер с контролем температуры, тем самым обеспечивая молекулярное диспергирование соединения I в расплавленном полимере. Полученный в результате этого экструдат охлаждают до комнатной температуры и перемалывают в тонкодисперсный порошок. е) Процесс со сверхкритической жидкостью. В этом процессе соединение I и полимер (такой как HPMC-AS) растворяют в сверхкритической жидкости, такой как жидкий азот или жидкий диоксид углерода. Сверхкритическую жидкость затем удаляют путем выпаривания, оставляя соединение I микроосажденным в матрице, образованной полимером. Согласно другому способу соединение I и полимер (такой как HPMC-AS) растворяют в подходящем растворителе. Микроосажденный порошок затем можно получить путем распыления полученного раствора в сверхкритическую жидкость, которая действует как антирастворитель. Полученный в результате этого твердый молекулярный комплекс, полученный с помощью любого способа, можно дополнительно обработать, чтобы обеспечить подходящую биодоступность. Твердый молекулярный комплекс можно обработать путем вальцевания, например комплекс и другие порошки можно смешать и вальцевать с получением ленты или листа, который затем перемалывают, смешивают с другими вспомогательными веществами и инкапсулируют с необходимой силой в состоящие из двух половин оболочки твердых желатиновых капсул. Определение того, находится ли соединение I в аморфной форме. Определить, было ли соединение I успешно иммобилизовано в аморфной форме, можно с помощью различных средств, включая порошковый рентгеноструктурный анализ. Кроме того, можно измерить температуру перехода комплекса в стеклообразное состояние, применяя модулированную дифференциальную сканирующую калориметрию (DSC), и этот метод также может предоставить сведения, является ли дисперсия многофазной или однофазной. Однофазность указывает на такую иммобилизацию. Мезилатная соль соединения I. Предложена мезилатная солевая форма 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламида пропан-1-сульфоновой кислоты. В одном варианте реализации предусмотрена мезилатная солевая форма 3-[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил]-2,4 дифторфениламида пропан-1-сульфоновой кислоты. В одном варианте реализации указанная мезилатная солевая форма является, по существу, кристаллической. В одном варианте реализации мезилатная солевая форма является частично аморфной. В одном варианте реализации мезилатная солевая форма является, по существу, аморфной. В одном варианте реализации мезилатную соль используют в процессе получения микроосажденного рыхлого порошка, чтобы получить соль в аморфной форме. В одном варианте реализации мезилатную соль получают in situ в процессе получения микроосажденного рыхлого порошка, чтобы получить соль в аморфной форме. В одном варианте реализации предложена композиция, содержащая мезилатную соль. Тозилатная соль соединения I. Предложена тозилатная соль 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4 дифторфениламида пропан-1-сульфоновой кислоты. В одном варианте реализации указанная тозилатная солевая форма является, по существу, кристаллической. В одном варианте реализации тозилатная солевая форма является частично аморфной. В одном варианте реализации тозилатная солевая форма является, по существу, аморфной. В одном варианте реализации тозилатную соль используют в процессе получения микроосажденного рыхлого порошка, чтобы получить соль в аморфной форме. В одном варианте реализации тозилатную соль получают in situ в процессе получения микроосажденного рыхлого порошка, чтобы получить соль в аморфной форме. В одном варианте реализации предложена композиция, содержащая тозилатную соль. Киназные мишени и показания. Протеинкиназы играют ключевые роли в передаче биохимических сигналов в различных биологических путях. Было описано более 500 киназ и выявлено, что определенные киназы вовлечены в широкий диапазон заболеваний или патологических состояний (т.е. показаний), включая, например, без огра- 13022924 ничения, рак, сердечно-сосудистое заболевание, воспалительное заболевание, неврологическое заболевание и другие заболевания. По этой причине киназы представляют собой важные мишени для низкомолекулярного терапевтического воздействия. Описание конкретных целевых протеинкиназ, рассматриваемых в настоящем изобретении, приведено далее.ARAF). Зрелый белок содержит RBD (т.е. Ras-связывающий домен) и домен "цинковые пальцы", активируемый форболовым эфиром/диацилглицерином, и участвует в передаче митогенных сигналов от мембраны клетки в ядро. Ингибиторы A-Raf могут подходить для лечения неврологических заболеваний,таких как мультиинфарктная деменция, черепно-мозговая травма, повреждение спинного мозга, болезнь Альцгеймера (AD), болезнь Паркинсона; неопластических заболеваний, включая, но не ограничиваясь перечисленными, меланому, глиому, саркому, карциному (например, колоректальную, карциному легкого, груди, поджелудочной железы, щитовидной железы, почек, яичника), лимфому (например, гистиоцитарную лимфому), нейрофиброматоз, миелодиспластический синдром, лейкемию, ангиогенез опухоли; боль невропатического или воспалительного происхождения, включая острую боль, хроническую боль,связанную с раком боль и мигрень; и заболевания, связанные с мышечной регенерацией или дегенерацией, включая, но не ограничиваясь перечисленными, сосудистый рестеноз, саркопению, мышечные дистрофии (включая, но не ограничиваясь перечисленными, дистрофию Дюшена, Беккера, Эмери-Дрейфуса,конечностно-поясную дистрофию, плече-лопаточно-лицевую миопатию, миотоническую дистрофию,окулофарингеальную, дистальную и врожденные мышечные дистрофии), заболевания двигательного нейрона (включая, но не ограничиваясь перечисленными, боковой амиотрофический склероз, младенческую прогрессивную спинальную мышечную атрофию, промежуточную спинальную мышечную атрофию, ювенильную спинальную мышечную атрофию, спинально-бульбарную мышечную атрофию и спинальную мышечную атрофию взрослых), воспалительные миопатии (включая, но не ограничиваясь перечисленными, дерматомиозит, полимиозит и миозит с тельцами включений), заболевания нервномышечных соединений (включая, но не ограничиваясь перечисленными, миастению, синдром ИтонаЛамберта и врожденный миастенический синдром), миопатии вследствие эндокринных нарушений(включая, но не ограничиваясь перечисленными, гипертиреоидную миопатию и гипотиреоидную миопатию), заболевания периферических нервов (включая, но не ограничиваясь перечисленными, болезнь Шарко-Мари-Тута, болезнь Дежерина-Сотта и атаксию Фридрейха), другие миопатии (включая, но не ограничиваясь перечисленными, врожденную миотонию, врожденную парамиотонию, заболевание с поражением сердцевины мышечных волокон, немалиновую миопатию, миотубулярную миопатию и периодический паралич), и метаболические заболевания мышц (включая, но не ограничиваясь перечисленными, дефицит фосфорилазы, дефицит кислой мальтазы, дефицит фосфофруктокиназы, дефицит гидролазы точек ветвления, митохондриальную миопатию, дефицит карнитина, дефицит карнитинпальмитоилтрансферазы, дефицит фосфоглицераткиназы, дефицит фосфоглицератмутазы, дефицит лактатдегидрогеназы и дефицит миоаденилатдезаминазы).B-Raf: Целевая киназа B-Raf (т.е. гомолог В 1 вирусного онкогена v-raf саркомы мыши) представляет собой 84,4 кДа серин/треонинкиназу, кодируемую хромосомой 7q34 (обозначение: BRAF). Зрелый белок содержит домены RBD (т.е. Ras-связывающий домен), С 1 (т.е. консервативную область 1 протеинкиназы С) и STK (т.е. серин/треонинкиназный домен). Целевая киназа B-Raf участвует в передаче митогенных сигналов от мембраны клетки в ядро и может играть роль в постсинаптических ответах гиппокампальных нейронов. Таким образом, гены семейства RAF кодируют киназы, которые регулируются Ras и опосредуют клеточные ответы на ростовые сигналы. Действительно, киназа B-Raf представляет собой ключевой участок киназного сигнального каскада RAS-Raf-MEK-ERK/MAP, который играет основную роль в регуляции роста, деления и пролиферации клеток и при конститутивной активации вызывает образование опухолей. Среди нескольких изоформ Raf-киназы Raf-киназа типа В, или B-Raf, является наиболее сильным активатором последующего сигнального МАР-киназного каскада. Ген B-Raf часто оказывается мутированным во множестве опухолей человека, особенно при злокачественной меланоме и карциноме толстой кишки. Наиболее часто встречающаяся мутация представляет собой миссенс-трансверсию тимина (Т) на аденин (А) в 1796 нуклеотиде (Т 1796 А; аминокислотная замена в белке B-Raf: Val600 на Glu600), она наблюдается в 80% злокачественных меланомных опухолей. Функциональный анализ показал, что эта трансверсия представляет собой единственную обнаруженную мутацию, которая вызывает конститутивную активацию киназной активности B-Raf, независимо от активации RAS, превращая B-Raf в доминантный трансформирующий белок. Основываясь на конкретных случаях, выяснили, что опухоли человека развивают устойчивость к ингибиторам киназ благодаря мутированию конкретной аминокислоты в каталитическом домене, как "привратника". (Balak, et al.,Clin. Cancer Res. 2006, 12:6494-501). Таким образом, предполагают, что замена Thr-529 в BRAF на Ile является механизмом устойчивости к ингибиторам BRAF и ее можно представить как замену в кодоне 529 с ACC на ATC. обнаружили две гетерозиготные мутации KRAS у трех индивидуумов и восемь мутаций BRAF у 16 индивидуумов, это позволило предположить, что такое нарушение регуляции каскада RAS-RAF-ERK представляет собой общую молекулярную основу для трех указанных расстройств (Niihori et al., Nat Genet. 2006, 38(3):294-6). с-Raf-1: Целевая киназа с-Raf-1 (т.е. гомолог 1 вирусного онкогена v-raf саркомы мыши) представляет собой 73 кДа STK, кодируемую хромосомой 3 р 25 (обозначение: RAF1). с-Raf-1 может быть направлена в митохондрии белком BCL2 (т.е. онкоген В-клеточной лейкемии 2), который представляет собой регулятор апоптотической гибели клеток. Активная с-Raf-1 улучшает BCL2-опосредованную устойчивость к апоптозу и фосфорилирует BAD (т.е. BCL2-связывающий белок). с-Raf-1 вовлечена в возникновение карцином, включая колоректальную карциному, карциному яичника, легкого и почечноклеточную карциному. с-Raf-1 также является важным медиатором ангиогенеза опухоли (Hood, J.D. etal., 2002, Science, 296, 2404). Ингибиторы с-Raf-1 также могут быть полезны для лечения острой миелоидной лейкемии и миелодиспластических синдромов (Crump, Curr Pharm Des, 2002, 8(25):2243-8). Активаторы Raf-1 могут быть полезны в качестве лекарства от нейроэндокринных опухолей, таких как медуллярный рак щитовидной железы, карциноидная опухоль, мелкоклеточный рак легкого и феохромоцитома (Kunnimalaiyaan et al., Anticancer Drugs, 2006, 17(2):139-42). Ингибиторы A-Raf, B-Raf и/или с-Raf могут подходить для лечения A-Raf-опосредованного,B-Raf-опосредованного или c-Raf-1-опосредованного заболевания или патологического состояния, выбранного из группы, состоящей из неврологических заболеваний, включая, но не ограничиваясь перечисленными, мультиинфарктную деменцию, черепно-мозговую травму, повреждение спинного мозга,болезнь Альцгеймера (AD), болезнь Паркинсона, пароксизм и эпилепсию; неопластических заболеваний,включая, но не ограничиваясь перечисленными, меланому, глиому, саркому, карциному (например, желудочно-кишечного тракта, печени, желчных протоков (холангиокарциному), колоректальную карциному, карциному легкого, груди, поджелудочной железы, щитовидной железы, почек, яичника, предстательной железы), лимфому (например, гистиоцитарную лимфому), нейрофиброматоз, острую миелоидную лейкемию, миелодиспластический синдром, лейкемию, ангиогенез опухоли, нейроэндокринные опухоли, такие как медуллярный рак щитовидной железы, карциноидная опухоль, мелкоклеточный рак легкого, саркома Калоши и феохромоцитома; боли невропатического или воспалительного происхождения, включая, но не ограничиваясь перечисленными, острую боль, хроническую боль, связанную с раком боль и мигрень; сердечнососудистых заболеваний, включая, но не ограничиваясь перечисленными, сердечную недостаточность, ишемический инсульт, гипертрофию сердца, тромбоз (например, синдромы тромботической микроангиопатии), атеросклероз и реперфузионное повреждение; воспаления и/или пролиферации, включая, но не ограничиваясь перечисленными, псориаз, экзему, артрит и аутоиммунные заболевания и патологические состояния, остеоартрит, эндометриоз, рубцевание, сосудистый рестеноз,фиброзные расстройства, ревматоидный артрит, воспалительное заболевание кишечника (IBD); иммунодефицитных заболеваний, включая, но не ограничиваясь перечисленными, отторжение трансплантированного органа, реакцию "трансплантант против хозяина" и саркому Калоши, связанную с ВИЧ; кистозных болезней почек или болезней предстательной железы, включая, но не ограничиваясь перечисленными, диабетическую нефропатию, поликистозную болезнь почек, нефросклероз, гломерулонефрит, гиперплазию предстательной железы, поликистозную болезнь печени, туберозный склероз, болезнь ГиппеляЛиндау, медуллярную кистозную болезнь почек, нефронофтиз и кистозный фиброз; метаболических расстройств, включая, но не ограничиваясь перечисленными, ожирение; инфекции, включая, но не ограничиваясь перечисленными, инфицирование Helicobacter pylori, вирусами гепатита и гриппа, лихорадку,ВИЧ и сепсис; заболеваний легких, включая, но не ограничиваясь перечисленными, хроническую обструктивную болезнь легких (COPD) и синдром острой дыхательной недостаточности (ARDS); наследственных болезней роста, включая, но не ограничиваясь перечисленными, синдром Нунан, синдром Костелло (скелетно-кожно-лицевой синдром), синдром LEOPARD, сердечно-кожно-лицевой синдром (CFC) и синдром нервного гребня; нарушений, вызывающих сердечно-сосудистые, скелетные, кишечные, кожные, волосяные и эндокринные заболевания; и заболеваний, связанных с мышечной регенерацией или дегенерацией, включая, но не ограничиваясь перечисленными, саркопению, мышечные дистрофии(включая, но не ограничиваясь перечисленными, миодистрофию Дюшена, Беккера, Эмери-Дрейфуса,конечностно-поясную дистрофию, плече-лопаточно-лицевую миопатию, миотоническую дистрофию,окулофарингеальную, дистальную и врожденный мышечные дистрофии), заболевания двигательного нейрона (включая, но не ограничиваясь перечисленными, боковой амиотрофический склероз, младенческую прогрессивную спинальную мышечную атрофию, промежуточную спинальную мышечную атрофию, ювенильную спинальную мышечную атрофию, спинально-бульбарную мышечную атрофию и спинальную мышечную атрофию взрослых), воспалительные миопатии (включая, но не ограничиваясь перечисленными, дерматомиозит, полимиозит и миозит с тельцами включений), заболевания нервномышечных соединений (включая, но не ограничиваясь перечисленными, миастению, синдром ИтонаЛамберта и врожденный миастенический синдром), миопатии вследствие эндокринных нарушений(включая, но не ограничиваясь перечисленными, гипертиреоидную миопатию и гипотиреоидную миопатию), заболевания периферических нервов (включая, но не ограничиваясь перечисленными, болезнь Шарко-Мари-Тута, болезнь Дежерина-Сотта и атаксию Фридрейха), другие миопатии (включая, но не ограничиваясь перечисленными, врожденную миотонию, врожденную парамиотонию, заболевание с поражением сердцевины мышечных волокон, немалиновую миопатию, миотубулярную миопатию и периодический паралич) и метаболические заболевания мышц (включая, но не ограничиваясь перечисленными, дефицит фосфорилазы, дефицит кислой мальтазы, дефицит фосфофруктокиназы, дефицит гидролазы точек ветвления, митохондриальную миопатию, дефицит карнитина, дефицит карнитинпальмитоилтрансферазы, дефицит фосфоглицераткиназы, дефицит фосфоглицератмутазы, дефицит лактатдегидрогеназы и дефицит миоаденилатдезаминазы). Альтернативные формы или производные соединения. 3-[5-(4-Хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил-2,4-дифторфенил]амидпропан-1 сульфоновой кислоты, рассмотренный в данном документе, описан на основании конкретного соединения. Кроме того, соединение I может существовать во множестве различных форм или производных, все из которых входят в объем настоящего изобретения. Альтернативные формы или производные включают, например, (а) пролекарства и активные метаболиты, (b) таутомеры, (с) фармацевтически приемлемые соли и (d) твердые формы, включая различные кристаллические формы, полиморфные или аморфные твердые вещества, включая гидраты и сольваты указанного соединения, и другие формы. Пролекарства и метаболиты. Пролекарства представляют собой соединения или фармацевтически приемлемые соли указанных соединений, которые при метаболизме в физиологических условиях или при превращении путем сольволиза, позволяют получить необходимое активное соединение. Пролекарства включают, без ограничения,эфиры, амиды, карбаматы, карбонаты, уреиды, сольваты или гидраты активного соединения. Обычно пролекарство неактивно или менее активно, чем активное соединение, но может обеспечивать одно или несколько преимуществ при обращении, введении и/или в метаболических свойствах. Пролекарства могут включать варианты, в которых -NH-группа указанного соединения была подвергнута ацилированию,как, например, в положении 1 пирроло[2,3-b]пиридинового кольца или по азоту сульфонамидной группы соединения I или фармацевтически приемлемой соли указанного соединения, при этом расщепление ацильной группы дает свободную -NH-группу активного лекарственного средства. Некоторые пролекарства активируют ферментативно с получением активного соединения или можно подвергнуть соединение дополнительной химической реакции с получением активного соединения. Пролекарства можно превратить из пролекарственной формы в активную форму за один этап или через одну или несколько промежуточных форм, которые сами по себе могут быть активны или неактивны. В The Practice of Medicinal Chemistry, главы 31-32 (изд. Wermuth, Academic Press, Сан-Диего, Калифорния, 2001) описано, что пролекарства можно, по существу, разделить на две неисключающие категории: пролекарства-биопредшественники и пролекарства-носители. Как правило, пролекарствабиопредшественники представляют собой соединения, которые неактивны или обладают низкой активностью по сравнению с соответствующим активным лекарственным соединением, которые содержат одну или несколько защитных групп и превращаются в активную форму посредством метаболизма или сольволиза. Как активная лекарственная форма, так и любые высвобожденные продукты метаболизма должны иметь приемлемо низкую токсичность. Обычно образование активного лекарственного соединения включает метаболический процесс или реакцию одного из следующих типов. Окислительные реакции: Примерами окислительных реакций могут служить, без ограничения, такие реакции, как окисление спирта, карбонила и кислотных функциональных групп, гидроксилирование алифатических атомов углерода, гидроксилирование алициклических атомов углерода, окисление ароматических атомов углерода, окисление двойных связей углерод-углерод, окисление азотсодержащих функциональных групп, окисление кремния, фосфора, мышьяка и серы, окислительноеN-дезалкилирование, окислительное О- и S-дезалкилирование, окислительное дезаминирование, а также другие окислительные реакции. Восстановительные реакции: Примерами восстановительных реакций могут служить, без ограничения, такие реакции, как восстановление карбонильных функциональных групп, восстановление спиртовых функциональных групп и углерод-углеродных двойных связей, восстановление азотсодержащих функциональных групп и другие восстановительные реакции. Реакции без изменения окислительного состояния: Примерами реакций без изменения окислительного состояния могут служить, без ограничения, такие реакции, как гидролиз простых и сложных эфиров, гидролитическое расщепление углерод-азотных ординарных связей, гидролитическое расщепление неароматических гетероциклов, гидрирование и дегидрирование множества связей, образование новых ковалентных связей в результате реакций дегидрирования, гидролитическое дегалогенирование, удаление молекулы галогеноводорода и другие подобные реакции. Пролекарства-носители представляют собой лекарственные соединения, которые содержат транспортный фрагмент, например, который улучшает поглощение и/или локализованную доставку в место(а) действия. Для такого пролекарства-носителя желательно, чтобы связь между лекарственным фрагментом и транспортным фрагментом представляла собой ковалентную связь, чтобы пролекарство было неактивным или менее активным, чем само лекарственное соединение, чтобы пролекарство и любой высвобож- 16022924 денный транспортный фрагмент были приемлемо нетоксичными. Для пролекарств, в которых транспортный фрагмент должен повышать всасывание, высвобождение транспортного фрагмента, как правило, должно быть быстрым. В других случаях, желательно использовать фрагмент, который обеспечивает медленное высвобождение, например, некоторые полимеры или другие фрагменты, такие как циклодекстрины. (См., например, Cheng et al., патент США, номер публикации 20040077595, заявка 10/656,838, включенный в данную заявку посредством ссылки.) Такие пролекарства-носители часто предпочтительны для вводимых перорально лекарственных средств. В некоторых случаях транспортный фрагмент обеспечивает нацеленную доставку лекарственного средства, например лекарственное средство можно конъюгировать с антителом или фрагментом антитела Пролекарства-носители, например,можно применять для улучшения одного или нескольких из следующих свойств: повышения липофильности, повышения продолжительности фармакологического действия, повышения сайт-специфичности,снижения токсичности и нежелательных реакций и/или улучшения лекарственной формы лекарственного средства (например, ее стабильности, растворимости в воде, для снижения ее нежелательных органолептических или физиохимических свойств). Например, липофильность можно повысить путем этерификации гидроксильных групп липофильными карбоновыми кислотами, или групп карбоновых кислот спиртами, например алифатическими спиртами. Wermuth, см. выше. Метаболиты, например активные метаболиты, перекрываются с пролекарствами, описанными выше, например с пролекарствами-биопредшественниками. Таким образом, такие метаболиты представляют собой фармакологически активные соединения или соединения, которые дополнительно метаболизируются до фармакологически активных соединений, которые представляют собой производные, возникшие в результате метаболических процессов в организме субъекта. Среди них, активные метаболиты представляют собой такие фармакологически активные производные соединения. Для пролекарств соединение пролекарства, как правило, неактивно или обладает более низкой активностью, чем метаболизированный продукт. Для активных метаболитов исходное соединение может либо представлять собой активное соединение, либо может быть неактивным пролекарством. Например, в некоторых соединениях, одна или несколько алкоксильных групп могут метаболизироваться до гидроксильных групп, при этом сохраняя фармакологическую активность, и/или карбоксильные группы могут подвергнуться этерификации, например глюкуронидироваться. В некоторых случаях может образовываться более чем один метаболит, при этом промежуточный метаболит(ы) дополнительно метаболизируется с получением активного метаболита. Например, в некоторых случаях производное соединения, полученное в результате метаболического глюкуронидирования, может быть неактивным или может обладать низкой активностью и может дополнительно метаболизироваться с получением активного метаболита. Метаболиты соединения можно идентифицировать, применяя обычные способы, известные в данной области, и определять их активности, применяя такие тесты, как описаны в данном документе. См.,например, Bertolini et al., 1997, J. Med. Chem., 40:2011-2016; Shan et al., 1997, J. Pharm. Sci. 86(7):756-757;Bagshawe, 1995, Drug Dev. Res., 34:220-230; Wermuth, выше. Таутомеры. Должно быть очевидно, что некоторые соединения могут обладать таутомерией. В таких случаях в формулах, приведенных в настоящем описании, явно представлена лишь одна из возможных таутомерных форм. Следовательно, должно быть очевидно, что предполагается, что соединение I, приведенное в настоящем описании, представляет собой любую таутомерную форму изображенного соединения и не должно быть ограничено только конкретной таутомерной формой, представленной на изображении указанного соединения. Фармацевтически приемлемые соли. Если не указано иначе, описание соединения I в данном документе включает фармацевтически приемлемые соли указанного соединения. Таким образом, соединение I может находиться в виде фармацевтически приемлемых солей или может входить в состав лекарственной формы в виде фармацевтически приемлемых солей. Предполагаемые фармацевтически приемлемые солевые формы включают, без ограничения, моно-, бис-, трис-, тетракис- и т.п. формы. Фармацевтически приемлемые соли являются нетоксичными в количествах и концентрациях, в которых их вводят. Получение таких солей может облегчить фармакологическое применение благодаря изменению физических свойств соединения без препятствования его физиологическому действию. Подходящие изменения физических свойств включают снижение температуры плавления, чтобы облегчить введение через слизистую, и повышение растворимости, чтобы облегчить введение более высоких концентраций лекарственного средства соединение I обладает достаточно кислой и достаточно основной функциональной группой и, соответственно, может реагировать с любым из множества неорганических или органических оснований и неорганических и органических кислот с получением фармацевтически приемлемой соли. Фармацевтически приемлемые соли включают соли присоединения кислоты, такие как включающие хлорид, бромид, йодид, гидрохлорид, ацетат, дихлорацетат, фенилацетат, акрилат, аскорбат, аспартат, бензоат, 2-феноксибензоат, 2-ацетоксибензоат, динитробензоат, гидроксибензоат, метоксибензоат,метилбензоат, бикарбонат, бутин-1,4-диоат, гексин-1,6-диоат, капроат, каприлат, хлорбензоат, циннамат,цитрат, деканоат, формиат, фумарат, гликолят, глюконат, глюкарат, глюкуронат, глюкозо-6-фосфат, глу- 17022924 тамат, гептаноат, гексаноат, изетионат, изобутират, гамма-гидроксибутират, фенилбутират, лактат, малат, малеат, гидроксималеат, метилмалеат, малонат, манделат, никотинат, нитрат, изоникотинат, октаноат, олеат, оксалат, памоат, фосфат, моногидрофосфат, дигидрофосфат, ортофосфат, метафосфат, пирофосфат, 2-фосфоглицерат, 3-фосфоглицерат, фталат, пропионат, фенилпропионат, пропиолат, пируват,хинат, салицилат, 4-аминосалицилат, себацат, стеарат, суберат, сукцинат, сульфат, пиросульфат, бисульфат, сульфит, бисульфит, сульфамат, сульфонат, бензолсульфонат (т.е. безилат), этансульфонат (т.е. эзилат), этан-1,2-дисульфонат, 2-гидроксиэтансульфонат (т.е. изетионат), метансульфонат (т.е. мезилат),нафталин-1-сульфонат, нафталин-2-сульфонат (т.е. нафтилат), пропансульфонат, п-толуолсульфонат (т.е. тозилат), ксиленсульфонаты, циклогексилсульфамат, тартрат и трифторацетат. Данные фармацевтически приемлемые соли присоединения кислоты можно получить, применяя соответствующую подходящую кислоту. Если присутствуют кислые функциональные группы, такие как в карбоновой кислоте или феноле,фармацевтически приемлемые соли также включают соли присоединения основания, такие как включающие бензатин, хлорпрокаин, холин, этаноламин, диэтаноламин, триэтаноламин, трет-бутилшин, дициклогексиламин, этилендиамин, N,N'-дибензилэтилендиамин, меглюмин, гидроксиэтилпирролидин,пиперидин, морфолин, пиперазин, прокаин, алюминий, кальций, медь, железо, литий, магний, марганец,калий, натрий, цинк, аммиак и моно-, ди- или триалкиламины (например, диэтиламин), или соли, полученные из аминокислот, таких как L-гистидин, L-глицин, L-лизин и L-аргинин. Например, см. Remington's Pharmaceutical Sciences, 19-e изд., Mack Publishing Co., Истон, Пенсильвания, том 2, с. 1457, 1995. Данные фармацевтически приемлемые соли присоединения основания можно получить, применяя подходящее основание. Фармацевтически приемлемые соли можно получить с помощью стандартных способов. Например,форму свободного основания соединения можно растворить в подходящем растворителе, таком как водный или водно-спиртовой раствор, включающий подходящую кислоту, а затем выделить путем выпаривания раствора. В другом примере соль можно получить путем приведения во взаимодействие свободного основания и кислоты в органическом растворителе. Если указанное конкретное соединение представляет собой кислоту, желательную фармацевтически приемлемую соль можно получить с помощью любого подходящего способа, например путем обработки свободной кислоты подходящим неорганическим или органическим основанием. Другие формы соединения. В случае агентов, которые представляют собой твердые вещества, для специалистов в данной области должно быть очевидно, что указанные соединения и соли могут существовать в различных кристаллических или полиморфных формах, или могут входить в состав лекарственных форм в виде сокристаллов, или могут находиться в аморфной форме, или могут представлять собой любую комбинацию перечисленного (например, могут быть частично кристаллическими, частично аморфными или смесью полиморфов), все из которых предполагаются входящими в объем настоящего изобретения и приведенной формулы изобретения. Если соли образуются при добавлении кислоты/основания, т.е. свободное основание или свободная кислота интересующего соединения вступает в кислотную/основную реакцию с соответствующим присоединением основания или присоединением кислоты, соответственно, что приводит к ионообменному взаимодействию, сокристаллы представляют собой новые химические соединения, которые образуются из нейтральных соединений, с получением соединения и дополнительной молекулы в одной и той же кристаллической структуре. В некоторых случаях соединение I образует комплекс с кислотой или основанием, включая соли присоединения основания, такие как соли аммония, диэтиламина, этаноламина, этилендиамина,диэтаноламина, трет-бутиламина, пиперазина, меглюмина; соли присоединения кислоты, такие как ацетат, ацетилсалицилат, безилат, камзилат, цитрат, формиат, фумарат, глутарат, гидрохлорат, малеат, мезилат, нитрат, оксалат, фосфат, сукцинат, сульфат, тартрат, тиоционат и тозилат; и аминокислоты, такие как аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан,тирозин или валин. При объединении соединения I с кислотой или основанием предпочтительно образуется аморфный комплекс, чем кристаллический материал, такой как обычная соль или сокристалл. В некоторых случаях образованию аморфной формы указанного комплекса способствует дополнительная обработка, такая как сушка распылением, механохимические способы, такие как вальцевание, или обработка микроволновым излучением исходного соединения, смешанного с кислотой или основанием. Такие аморфные комплексы обеспечивают несколько преимуществ. Например, снижение температуры плавления по отношению к свободному основанию облегчает дальнейшую обработку, например экструзию, горячего расплава, чтобы дополнительно улучшить биофармацевтические свойства соединения. Также указанный аморфный комплекс легко крошится, что обеспечивает улучшенное сжатие для помещения твердого вещества в форму капсулы или таблетки. Дополнительно, предполагается, что соединение I или его соли, описанные в данном документе,также включают гидратированные или сольватированные, а также негидратированные или несольватированные формы идентифицированного материала. Например, соединение I или его соли включают как гидратированные, так и негидратированные формы. Другие примеры сольватов включают структуры в комбинации с подходящим растворителем, таким как изопропанол, этанол, метанол, ДМСО, этилацетат,уксусная кислота или этаноламин. Лекарственные формы и введение. Соединение I или любая его форма, описанная в данном документе (включая твердые молекулярные комплексы), как правило, будет применяться для терапии людей. Тем не менее, соединение I и его композиции также можно применять для лечения похожих или идентичных симптомов у других животных и можно вводить различными путями, включая инъекцию (т.е. парентерально, включая внутривенную, интраперитонеальную, подкожную и внутримышечную инъекцию), пероральный, трансдермальный, трансмукозальный, ректальный пути или ингаляцию. Такие лекарственные формы должны позволить соединению достигнуть целевых клеток. Другие факторы хорошо известны в данной области и включают такие факторы, как токсичность, и лекарственные формы, которые задерживают проявление действия соединения или композиции. Методики и лекарственные формы обычно можно найти вRemington: The Science and Practice of Pharmacy, 21-е изд., Lippincott, Williams и Wilkins, Филадельфия,Пенсильвания, 2005 (включен в данное описание посредством ссылки). В некоторых вариантах реализации композиции (включая твердые комплексы, описанные в данном документе) содержат фармацевтически приемлемые носители или вспомогательные вещества, такие как наполнители, связующие агенты, разрыхляющие агенты, глиданты, смазывающие агенты, комплексообразующие агенты, солюбилизаторы и поверхностно-активные вещества, которые можно выбрать, чтобы способствовать введению соединения определенным путем. Примеры носителей включают карбонат кальция, фосфат кальция, различные сахара, такие как лактоза, глюкоза или сахароза, разновидности крахмала, производные целлюлозы, желатин, липиды, липосомы, наночастицы и т.п. Носители также включают физиологически совместимые жидкости в качестве растворителей или для получения суспензий, включая, например, стерильные водные растворы для инъекции (WFI), солевой раствор, раствор декстрозы, раствор Ханка, раствор Рингера, растительные масла, минеральные масла, животные масла,полиэтиленгликоли, жидкий парафин и т.п. Вспомогательные вещества также могут включать, например,коллоидный диоксид кремния, силикагель, тальк, силикат магния, силикат кальция, алюмосиликат натрия, трисиликат магния, порошкованную целлюлозу, макрокристаллическую целлюлозу, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу натрия с поперечными межмолекулярными связями, бензоат натрия, карбонат кальция, карбонат магния, стеариновую кислоту, стеарат алюминия, стеарат кальция,стеарат магния, стеарат цинка, стеарилфумарат натрия, силоид, Stearowet С, оксид магния, крахмал,крахмалгликолят натрия, глицерилмоностеарат, глицерилдибегенат, глицерилпальмитостеарат, гидрогенезированное растительное масло, гидрогенезированное хлопковое масло, касторовое масло, минеральное масло, полиэтиленгликоль (например, PEG 4000-8000), полиоксиэтиленгликоль, полоксамеры, повидон, кросповидон, кроскармеллозу натрия, альгиновую кислоту, казеин, сополимер метакриловой кислоты и дивинилбензола, докузат натрия, циклодекстрины (например, 2-гидроксипропил-дельтациклодекстрин),полисорбаты(d-альфатокоферилполиэтиленгликоль 1000 сукцинат), лаурилсульфат магния, лаурилсульфат натрия, эфиры полготиленгликоля, диэфиры жирных кислот и полиэтиленгликолей или сложный эфир жирной кислоты полиоксиалкиленсорбитана (например, сложный эфир полиоксиэтиленсорбитана, Tween), сложные эфиры жирных кислот полиоксиэтиленсорбитана, сложный эфир жирной кислоты сорбитана, например,сложный эфир жирной кислоты сорбитана, полученный из жирной кислоты, такой как олеиновая, стеариновая или пальмитиновая кислота, маннит, ксилит, сорбит, мальтозу, лактозу, моногидрат лактозы или лактозу, высушенную распылением, сахарозу, фруктозу, фосфат кальция, двухосновный фосфат кальция,трехосновный фосфат кальция, сульфат кальция, декстраты, декстран, декстрин, декстрозу, ацетат целлюлозы, мальтодекстрин, симетикон, полидекстрозам, хитозан, желатин, НРМС (гидроксипропилметилцеллюлозы), НРС (гидроксипропилцеллюлозу), гидроксиэтилцеллюлозу, гипромеллозу и т.п. В одном варианте реализации настоящего изобретения предложена лекарственная форма, которая включает упомянутый выше твердый комплекс, суспендированный в водном носителе. Указанная лекарственная форма может дополнительно включать коллоидный диоксид кремния, который, как было выявлено, стабилизирует суспензию. Диоксид кремния предпочтительно присутствует в количестве, составляющем по меньшей мере 0,5% от массы лекарственной формы. Водный носитель предпочтительно содержит приблизительно 2 мас.% гидроксипропилцеллюлозы. В некоторых вариантах реализации можно использовать пероральное введение. Фармацевтические препараты для перорального применения могут входить в состав обычных пероральных лекарственных форм, таких как капсулы, таблетки и жидкие препараты, такие как сиропы, эликсиры и концентрированные капли. Соединение I можно комбинировать с твердыми вспомогательными веществами, возможно перемалывать полученную смесь и обрабатывать смесь гранул после добавления подходящих вспомогательных средств, при необходимости, с получением, например, таблеток, таблеток, покрытых оболочкой,твердых капсул, мягких капсул, растворов (например, водных, спиртовых или маслянистых растворов) и т.п. Подходящие вспомогательные вещества, в частности, представляют собой наполнители, такие как сахара, включая лактозу, глюкозу, сахарозу, маннит или сорбит; препараты целлюлозы, например куку- 19022924 рузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовую камедь, метилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу натрия (CMC) и/или поливинилпирролидон (ПВП: повидон); маслянистые вспомогательные вещества, включая растительные и животные масла, такие как подсолнечное масло, оливковое масло или рыбий жир. Лекарственные формы для перорального введения также могут включать разрыхляющие агенты, такие как поливинилпирролидон с поперечными межмолекулярными связями, агар или альгиновая кислота, или ее соль, такая как альгинат натрия; смазывающий агент, такой как тальк или стеарат магния; пластификатор, такой как глицерин или сорбит; подсластитель, такой как сахароза, фруктоза, лактоза или аспартам; природный или синтетический ароматизатор, такой как мята перечная, винтергриновое масло или ароматизатор "вишня"; или красящие вещества или пигменты, которые можно применять для идентификации или описания различных доз или комбинаций. Также предложены сердцевины драже с подходящими покрытиями. Для этой цели можно применять концентрированные сахарные растворы, которые возможно могут включать, например, гуммиарабик, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль и/или диоксид титана, лакирующие растворы и подходящие органические растворители или смеси растворителей. Фармацевтические препараты, которые можно применять перорально, включают плотно закрытые капсулы (pish-fit), сделанные из желатина ("gelcaps"), а также мягкие, запечатанные капсулы, сделанные из желатина, и пластификатор, такой как глицерин или сорбит. Капсулы pish-fit могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующими агентами,такими как крахмалы, и/или смазывающими агентами, такими как тальк или стеарат магния, и, возможно, стабилизаторами. В мягких капсулах активное соединение можно растворить или суспендировать в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. В некоторых вариантах реализации инъекцию (парентеральное введение) можно осуществлять, например, внутримышечно, внутривенно, интраперитонеально и/или подкожно. Соединение I и композиции, содержащие указанное соединение, для инъекции могут входить в состав лекарственной формы в виде стерильных жидких растворов, предпочтительно с физиологически совместимыми буферами или растворами, такими как солевой раствор, раствор Ханка или раствор Рингера. Также можно получить дисперсии в неводных растворах, таких как глицерин, пропиленгликоль, этанол, жидкие полиэтиленгликоли, триацетин и растительные масла. Растворы также могут включать консервант, такой как метилпарабен, пропилпарабен, хлорбутанол, фенол, сорбиновая кислота, тимеросал и т.п. Кроме того, соединение I или композиции, содержащие указанное соединение, могут входить в состав твердой лекарственной формы, включая, например, лиофилизированные формы, и их можно вновь растворять или суспендировать перед применением. В некоторых вариантах реализации можно осуществлять трансмукозальное, топическое или трансдермальное введение. В лекарственных формах соединения I для такого введения используют проникающие вещества, подходящие для преодоления необходимого препятствия. Такие проникающие вещества, в целом, известны в данной области и включают, например, для трансмукозального введения соли желчных кислот и производные фусидовой кислоты. Кроме того, можно применять детергенты, способствующие проницаемости. Трансмукозальное введение, например, может осуществляться посредством назальных спреев или суппозиториев (ректальных или вагинальных). Композиции соединения I для топического введения могут быть приготовлены в виде масел, кремов, лосьонов, мазей и т.п., в зависимости от выбора подходящих носителей, известных в данной области. Подходящие носители включают растительные или минеральные масла, белый вазелин (белый мягкий парафин), жиры или масла с разветвленными цепями, животные жиры и высокомолекулярный спирт (больше чем С 12). В некоторых вариантах реализации носители выбирают таким образом, чтобы активный ингредиент был растворимым. Также можно включать эмульгаторы, стабилизаторы, увлажнители и антиоксиданты, а также, при необходимости, агенты, придающие цвет или аромат. Кремы для топического применения предпочтительно получают из смеси минерального масла, самоэмульгирующегося пчелиного воска и воды, с которой смешивают активный ингредиент, растворенный в небольшом количестве растворителя (например, масла). Дополнительно, введение с помощью трансдермальных средств может включать трансдермальный пластырь или перевязочный материал, такой как бинт, пропитанный активным ингредиентом и возможно одним или несколькими носителями или разбавителями, известными в данной области. Для введения посредством трансдермальной системы доставки, введение дозы будет скорее непрерывным, чем прерывистым на всем протяжении приема лекарственного средства. В некоторых вариантах реализации соединение I или композиции, содержащие указанное соединение, вводят в виде ингаляций. Соединение I или композиции, содержащие указанное соединение, могут входить в состав лекарственной формы в виде сухих порошков или подходящего раствора, суспензии или аэрозоля. Порошки и растворы могут включать подходящие вспомогательные вещества, известные в данной области. Например, порошки могут включать подходящую порошковую основу, такую как лактоза или крахмал, а растворы могут включать пропиленгликоль, стерильную воду, этанол, хлорид натрия и другие вспомогательные вещества, такие как кислота, соль щелочных металлов и буферная соль. Такие растворы или суспензии можно вводить путем ингаляции с помощью распылителя, насоса, пульверизатора или небулайзера и т.п. средств. Соединение I или композиции, содержащие указанное соединение,- 20022924 также можно применять в комбинации с другими лекарствами, вводимыми посредством ингаляций, например, кортикостероидами, такими как флутиказонпропионат, беклометазондипропионат, триамцинолонацетонид, будезонид и мометазонфуроат; бета-агонистами, такими как альбутерол, салметерол и формотерол; антихолинэргическими агентами, такими как ипратропийбромид или тиотропий; сосудорасширяющими средствами, такими как трепростинал и илопрост; ферментами, такими как ДНКаза; терапевтическими белками; иммуноглобулиновыми антителами; олигонуклеотидом, таким как одно- или двунитевая ДНК или РНК, миРНК; антибиотиками, такими как тобрамицин; антагонистами мускаринового рецептора; антагонистами лейкотриенов; антагонистами цитокинов; ингибиторами протеаз;кромолином натрия; недокрилом натрия и кромогликатом натрия. Количества соединения I или композиций, содержащих указанное соединение, которое нужно вводить, можно определить с помощью стандартных методик, учитывая такие факторы, как активность соединения (in vitro, например, IC50 соединения по отношению к мишени или активность in vivo в моделях эффективности у животных), фармакокинетические результаты в моделях на животных (например, биологическое время полужизни или биодоступность), возраст, размер и вес субъекта и конкретное расстройство у данного субъекта. Важность данных и других факторов хорошо известна средним специалистам в данной области. Как правило, доза будет составлять приблизительно от 0,01 до 50 мг/кг, также приблизительно от 0,1 до 20 мг/кг массы субъекта, которого лечат. Можно использовать многократные дозы. Соединение I или композиции, содержащие указанное соединение, также можно применять в комбинации с другими методами лечения того же заболевания. Такое комбинированное применение включает введение соединения I и одного или нескольких других лекарств в различные моменты времени или совместное введение соединения I и одного или нескольких других лекарств. В некоторых вариантах реализации можно изменять дозировку соединения I или другого лекарства, применяемых в комбинации,например уменьшать вводимое количество по сравнению с применением отдельно соединения или лекарства, с помощью способов, хорошо известных средним специалистам в данной области. Должно быть очевидно, что комбинированное применение включает применение с другими видами терапии, лекарственными средствами, медицинскими процедурами и т.д., при этом другую терапию или процедуру можно осуществлять в разные моменты времени (например, в течение короткого промежутка времени, например в течение нескольких часов (например, 1, 2, 3, 4-24 ч), или в течение более длительного времени (например, 1-2 дней, 2-4 дней, 4-7 дней, 1-4 недель, отличные от введения соединения I или композиций, содержащих указанное соединение, или в то же время, что и соединение I или композиции, содержащие указанное соединение. Комбинированное применение также включает применение с терапией или медицинской процедурой, которые осуществляют один раз или редко, такой как хирургическое вмешательство, наряду с введением соединения I или композиций, содержащих указанное соединение, в течение короткого промежутка времени или более длительного промежутка времени до или после другой терапии или процедуры. В некоторых вариантах реализации настоящее изобретение обеспечивает доставку соединения I или композиций, содержащих указанное соединение, и одного или нескольких других лекарственных средств с помощью различных путей введения или с помощью одного и того же пути введения. Комбинированное применение для любого пути введения включает доставку соединения I или композиций, содержащих указанное соединение, и одного или нескольких других лекарственных средств с помощью одного и того же пути введения вместе в любой лекарственной форме,включая лекарственные формы, в которых два указанных соединения соединены химической связью таким образом, что они сохраняют свою терапевтическую активность при введении. В одном аспекте другое лекарственное средство можно вводить совместно с соединением I или композициями, содержащими указанное соединение. Комбинированное применение путем совместного введения включает введение совместных лекарственных форм или лекарственных форм соединенных химической связью соединений или введение двух или более соединений в раздельных лекарственных формах в течение короткого промежутка времени друг от друга (например, в течение 1, 2, 3 и до 24 ч), вводимых тем же путем или различными путями. Совместное введение отдельных лекарственных форм включает совместное введение путем доставки с помощью одного устройства, например одного ингалятора, одного шприца и т.д., или введение с помощью отдельных устройств в течение короткого промежутка времени друг от друга. Совместные лекарственные формы соединения I и одного или нескольких дополнительных лекарственных средств, доставляемые одним и тем же путем, включают совместное получение указанных материалов таким образом, что их можно вводить с помощью одного устройства, включая отдельные соединения, объединенные в одной лекарственной форме, или соединения, которые были модифицированы таким образом, что они соединяются химической связью, при этом сохраняя свою биологическую активность. Такие соединенные химической связью соединения могут иметь связь, которая, по существу, сохраняется in vivo, или связь, которая может разрушаться in vivo, отделяя друг от друга два активных компонента. Примеры Примеры, относящиеся к настоящему изобретению, описаны ниже. В большинстве случаев можно применять альтернативные способы. Предполагается, что примеры являются иллюстрирующими, но не ограничивают и не сужают объем настоящего изобретения. Пример 1. В данном примере описано получение твердого молекулярного комплекса, содержащего соединение I и HPMC-AS. 3-[5-(4-Хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1 сульфоновой кислоты и HPMC-AS в соотношении 3:7 (30% соединения и 70% полимера) растворяли в диметилацетамиде (ДМА). Полученный в результате этого раствор затем добавляли при перемешивании в очень холодную разбавленную соляную кислоту, в результате чего происходило совместное осаждение 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламида пропан-1 сульфоновой кислоты и HPMC-AS в виде твердого молекулярного комплекса, в котором 3-[5-(4 хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты обладал размерами в диапазоне наночастиц. Отношение ДМА к кислоте составляло от 1:5 до 1:10. Копреципитат затем промывали водой, чтобы удалить ДМА, фильтровали, сушили до достижения влагосодержания 2% и пропускали через сито 30 меш перед оценкой. Полученный в результате этого твердый молекулярный комплекс содержал 30 мас.% 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламида пропан-1-сульфоновой кислоты и 70 мас.% HPMC-AS. Свойства полученного твердого молекулярного комплекса описаны далее. Примеры 2-7. Твердые молекулярные комплексы, содержащие соединение I и HPMC-AS, получали, применяя способы, аналогичные применяемым в примере 1 для получения твердых молекулярных комплексов, но отличающиеся тем, что отношение количества по массе 3-[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин 3-карбонил]-2,4-дифторфениламида пропан-1-сульфоновой кислоты в указанном твердом молекулярном комплексе к количеству по массе ионного полимера в указанном комплексе составляло 3:7, 5:5, 5:5,4:6, 4:6 и 2:8 соответственно. Аморфную природу твердых молекулярных комплексов, полученных в примерах 1-7, оценивали с помощью порошковой рентгеновской дифракции (XRD). Образцы помещали в открытые условия путем помещения образца в колбу в климатической камере без крышки, без герметизации и без колпака, при 40 С и относительной влажности 75% (ОВ) и изучали свойства твердых молекулярных комплексов после такого воздействия. Периоды воздействия показаны в табл. 1. По окончании периода воздействия образец порошка отбирали из колбы и помещали в камеру для порошковой рентгеновской дифракции (XRD) и получали дифракционную картину. Образцы считали стабильными, если на профиле порошковой XRD не было кристаллических пиков. Полученные и подвергнутые хранению образцы также оценивали с помощью микроскопии в поляризованном свете. Падение поляризованного света приводит к явлению двоякого лучепреломления, если в образце присутствуют кристаллы. Для аморфного образца такой тест может показывать присутствие кристаллического материала, что указывает на то, что аморфный материал нестабилен. Таблица 1 Оценка твердых молекулярных комплексов лекарственное средство-НРМС-AS в различных соотношениях Пример 8. В данном примере описано получение твердого молекулярного комплекса, содержащего 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1 сульфоновой кислоты и EUDRAGIT L 100. EUDRAGIT L 100 представляет собой другой анионный полимер, эфир полиметилметакрилата с метакриловой кислотой в качестве функциональной группы, и он растворяется при рН 6,0 и выше. 3-[5-(4-Хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1 сульфоновой кислоты и EUDRAGIT L 100 в соотношении 3:7 (30% соединения и 70% полимера) растворяли в диметилацетамиде (ДМА). Полученный в результате раствор затем добавляли при перемешивании в очень холодную разбавленную соляную кислоту, в результате чего происходило совместное осаждение 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан 1-сульфоновой кислоты и EUDRAGIT L 100 в виде твердого молекулярного комплекса, в котором указанное лекарственное средство обладало размерами в диапазоне наночастиц. Копреципитат затем промывали водой, чтобы удалить ДМА, фильтровали, сушили и перемалывали в тонкодисперсный порошок. Отношение ДМА к кислоте составляло от 1:5 до 1:10. Копреципитат затем промывали водой, чтобы удалить ДМА, фильтровали, сушили до достижения влагосодержания 2% и пропускали через сито 30 меш перед оценкой. Полученный в результате этого твердый молекулярный комплекс содержал 30 мас.% 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламида пропан-1-сульфоновой кислоты и 70 мас.% EUDRAGIT L 100. Аморфную природу образцов твердого молекулярного комплекса оценивали сразу после получения с помощью порошковой XRD. Образцы подвергали хранению в ОТКРЫТЫХ условиях при 40 С/ОВ 75% в течение различных периодов времени, аналогично хранению, описанному в примерах 1-7. По окончании периода воздействия образец порошка отбирали из колбы, помещали в камеру для порошковой рентгеновской дифракции (XRD) и получали дифракционную картину. Образцы считали стабильными, если на профиле порошковой XRD не было кристаллических пиков. Полученные и подвергнутые хранению образцы также оценивали с помощью микроскопии в поляризованном свете. Падение поляризованного света приводит к явлению двоякого лучепреломления, если в образце присутствуют кристаллы. Для аморфного образца, такой тест может показывать присутствие кристаллического материала, что указывает на то, что аморфный материал нестабилен. Результаты для данного примера показаны в табл. 2. Пример 9. Данный пример осуществляли с теми же этапами, что и в примере 8, за исключением того, что 3[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты и EUDRAGIT L 100 растворяли в диметилацетамиде (ДМА) в соотношении 4:6 (40% соединения и 60% полимера) вместо 3:7, как в примере 8. Результаты для данного примера показаны в табл. 2. Пример 10. Твердые молекулярные комплексы, содержащие 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты и EUDRAGIT L 100-55 в соотношениях 4:6 и 5:5 соответственно, получали, применяя процесс микроосаждения, аналогично описанному в примере 1. EUDRAGIT L 100-55 похож на L 100, за исключением того, что он растворяется при рН 5,5 и выше и, следовательно, больше походит на HPMC-AS по своему профилю растворимости при различных рН. Полученные и подвергнутые хранению образцы оценивали с помощью порошковой XRD. Результаты для данного примера показаны в табл. 2. Пример 11. В данном примере описано получение твердого молекулярного комплекса, содержащего 3-[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты и фталат гидроксипропилметилцеллюлозы (НРМСР), другой анионный полимер, используемый для достижения растворимости в кишечнике. НРМСР представляет собой целлюлозный полимер,в котором некоторые из гидроксильных групп замещены на сложные эфиры фталевых кислот (27-35%). Он начинает растворяться при рН 5,5 и выше. Твердые молекулярные комплексы, содержащие 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты и НРМСР в соотношении 1:1, получали, применяя такой же способ, как и использованный в примере 1. Полученные и подвергнутые хранению образцы оценивали с помощью XRD. Результаты для данного примера показаны в табл. 2. Таблица 2 Оценка твердых молекулярных комплексов лекарственное средство-полимер в различных соотношениях На основании примеров 1-11 при соотношении 3-[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламида пропан-1-сульфоновой кислоты и полимера, равном 4:6, наблюдалась наиболее высокая концентрация лекарственного средства (40%), стабильного при хранении с HPMC-AS в качестве полимера. Следовательно, данное соотношение выбрали для сравнения с другими полимерами в отдельном исследовании. Комплексы из примеров 12-16 получали с помощью процесса микроосаждения, аналогичного таковому в примере 1. Аморфную природу высушенных образцов порошка оценивали сразу после получения с помощью порошковой XRD. Образцы дополнительно подвергали хранению в ОТКРЫТЫХ условиях при 40 С/ОВ 75% в течение различных периодов времени, аналогично хранению, описанному в примерах 1-7. Результаты представлены в табл. 3. Пример 12. Твердые молекулярные комплексы, содержащие 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты и HPMC-AS в соотношении 4:6, оказались аморфными при оценке сразу после получения (табл. 3), и их подвергли хранению в течение 4 недель при 40 С/ОВ 75%. Оценили XRD для твердых молекулярных комплексов. Пример 13. Твердые молекулярные комплексы, содержащие 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты и НРМСР в соотношении 4:6, оказались аморфными при оценке сразу после получения (табл. 3), и их подвергли хранению в течение 4 недель при 40 С/ОВ 75%. Пример 14. Твердые молекулярные комплексы, содержащие 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты и EUDRAGIT L 100-55 в соотношении 4:6, оказались аморфными при оценке сразу после получения (табл. 3), и их подвергли хранению в течение 4 недель при 40 С/ОВ 75%. Пример 15. Твердые молекулярные комплексы, содержащие 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты и поливинилацетатфталат (PVAP) в соотношении 4:6, оказались кристаллическими при оценке сразу после получения и поэтому не были подвергнуты дополнительному тестированию. PVAP представляет собой анионный кишечнорастворимый полимер, полученный в виде эфира фталевой кислоты поливинилацетата и содержащий 5562% фталильных групп. Он обладает низкой Тс, составляющей 42,5 С, что делает его неподходящим в качестве стабилизирующей полимерной матрицы. Он растворяется при рН 5. Пример 16. Твердые молекулярные комплексы, содержащие 3-[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты и ацетатфталат целлюлозы (САР) в соотношении 4:6, оказались кристаллическими при оценке сразу после получения и поэтому не были подвергнуты дополнительному тестированию. Профили порошковой XRD для Примеров 12-16 в начальной стадии при оценке сразу после получения показаны в табл. 3. Таблица 3 Оценка твердых молекулярных комплексов лекарственное средство-полимер при фиксированном соотношении 4:6 Через 1 неделю на порошковой XRD образца, полученного в примере 13, обнаружили малый пик,что указывало на переход в кристаллическую форму. Этот пик стал более четко выраженным после 2 недель хранения. Пример 17. Для образцов, полученных в примерах 12 и 14, не обнаружили каких-либо кристаллических пиков в профилях порошковой XRD до окончания 4 недель хранения. Чтобы дополнительно различить образцы из примеров 12 и 14, указанные образцы подвергали тесту на растворение путем помещения некоторого количества твердого молекулярного комплекса, эквивалентного 80 мг 3-[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламида пропан-1-сульфоновой кислоты, в 900 мл фосфатно-буферной среды, рН 6,8, содержащей 0,09% поверхностно-активного вещества НТАВ, в устройство для растворения USP Paddle при скорости 75 об/мин. В одной из серий экспериментов получили отсев через сито гранул из примеров 12 и 14 путем отделения фракции гранул на сите размером 25/40 меш и проводили тест на растворение. Твердые молекулярные комплексы с HPMC-AS лучше растворились, в процентном отношении, по сравнению с твердыми молекулярными комплексами с EUDRAGIT L 100-55, при этом твердые молекулярные комплексы сHPMC-AS оказались приблизительно на 85% растворенными через 200 мин, а твердые молекулярные комплексы с EUDRAGIT L 100-55 оказались приблизительно на 40% растворенными через 200 мин. В другом эксперименте образцы твердого молекулярного комплекса из примеров 12 и 14 предварительно смачивали в среде, содержащей гидроксипропилцеллюлозу (Klucel), для улучшенного диспергирования и подвергали тесту на растворение. Твердые молекулярные комплексы с HPMC-AS лучше растворились, в процентном отношении, по сравнению с твердыми молекулярными комплексами сEUDRAGIT L 100-55, при этом твердые молекулярные комплексы с HPMC-AS оказались приблизительно на 60-65% растворенными через 200 мин, а твердые молекулярные комплексы сEUDRAGIT L 100-55 оказались приблизительно на 20-25% растворенными через 200 мин. На основании результатов данных экспериментов было показано, что HPMC-AS представляет собой превосходный полимер для стабилизации лекарственного средства при хранении при стрессовых условиях, а также обеспечивает высвобождение лекарственного средства и сохранение перенасыщения аморфного лекарственного средства в процессе растворения без превращения в кристаллическую форму на всем протяжении тестирования. EUDRAGIT L 100-55 не повышает высвобождение лекарственного средства по сравнению с HPMC-AS и, следовательно, не ожидают, что он сможет обеспечить воздействие и биодоступность, которые обеспечивает HPMC-AS. По истечении 3 ч почти 90% лекарственного средства было высвобождено из образца согласно примеру 12 (HPMC-AS), тогда как из образца согласно примеру 14 (EUDRAGIT L-100-55) высвобожденным оказалось приблизительно 50% лекарственного средства Таким образом, твердый молекулярный комплекс 3-[5-(4-хлорфенил)-1H-пирроло[2,3b]пиридин-3-карбонил]-2,4-дифторфениламида пропан-1-сульфоновой кислоты и HPMC-AS, полученный с помощью процесса микроосаждения, следовательно, не только стабилизирует аморфное соединение для эксплуатации и хранения, но также обеспечивает быстрое высвобождение лекарственного средства, что приводит к превосходному растворению и, следовательно, биодоступности. Пример 18. Данный пример демонстрирует стабилизацию твердых молекулярных комплексов в водных системах. Твердый молекулярный комплекс лекарственного средства-HPMC-AS суспендировали в водной среде, содержащей 2% гидроксипропилцеллюлозы (Klucel LF). После добавления 0,5% (мас./мас.) коллоидного диоксида кремния обнаружили, что полученная в результате этого суспензия была стабильна в течение до 8 ч при стандартных условиях и в течение до 24 ч в условиях охлаждения. Пример 19. 3-[5-(4-хлорфенил)-1 Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1 сульфоновой кислоты может существовать с полиморфных формах, например в виде полиморфных форм 1 или 2, при этом такие полиморфные формы можно выделить в виде, по существу, чистых полиморфов. Желательную полиморфную форму можно получить, например используя подходящие условия кристаллизации. Например, форму 1 получали путем перекристаллизации из смеси ацетон/абсолютный этанол(например, от 1:1 до 5:1, предпочтительно 2:1 по объему), что подробно описано в данном документе. Форму 2 можно получить, например, непосредственно путем кристаллизации из смеси диметилацетамид/метанол или при различных условиях перекристаллизации, например, можно получить путем перекристаллизации из смеси метил-трет-бутиловый эфир/тетрагидрофуран, этилацетат, ацетон или получить путем нагревания/плавления и повторного затвердевания любой твердой формы, такой как полиморфная форма 1, или смеси твердых форм. По существу, чистые изолированные полиморфные формы описывали с помощью порошковой рентгеновской дифракции (XRPD), дифференциальной сканирующей калориметрии (DSC) и инфракрасной спектроскопии (см. пример 20). Чтобы продемонстрировать получение полиморфной формы 1, 3-[5-(4-хлорфенил)-1 Нпирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфениламид пропан-1-сульфоновой кислоты (7,8 кг) обрабатывали смесью ацетон абсолютный этанол (1:4 по объему, 19 кг) в реакторе и взбалтывали при 205 С в течение по меньшей мере 6 ч. Содержимое фильтровали и промывали твердые вещества смесью ацетон:абсолютный этанол (1:4 по объему). Твердые вещества обрабатывали тетрагидрофураном(26,6 кг) и полученную суспензию грели при 605 С в течение по меньшей мере 30 мин и взбалтывали. Смесь охлаждали до 555 С и добавляли метил-трет-бутиловый эфир (92,3 кг). Полученную в результате этого суспензию охлаждали до 205 С в течение по меньшей мере 1 ч. Содержимое фильтровали и промывали твердые вещества метил-трет-бутиловым эфиром и сушили. Твердое вещество обрабатывали смесью ацетон: абсолютный этанол (2:1 по объему) в реакторе. Содержимое взбалтывали и суспензию грели при 60 С до получения раствора. Полученный раствор фильтровали через большой фильтр тонкой очистки, чтобы удалить все остаточное твердое вещество после этапа обработки метил-трет-бутиловым эфиром. Полученный фильтрат концентрировали под вакуумом, перемешивали при 205 С в течение по меньшей мере 30 мин и фильтровали. Твердые вещества промывали предварительно охлажденным (от 0 до -5 С) этанолом и сушили при 45 С, а затем сушили при 75 С под вакуумом до достижения постоянного веса с получением чистой полиморфной формы 1 3-[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3 карбонил]-2,4-дифторфениламида пропан-1-сульфоновой кислоты. Форму 1 также получали путем обработки образца 120 мл смеси ацетон:этанол (1:1 по объему) при кипении с обратным холодильником,затем фильтровали в горячем виде и удаляли растворитель из фильтрата под вакуумом с получением твердого осадка. Пример 20. В данном примере описано получение твердой дисперсии (МВР) аморфного соединения I вHPMC-AS. Получение фазы в ДМА. Концентрация соединения I и HPMC-AS в органическом растворителе составляла 35% (мас./мас.),тогда как отношение количества соединения I к HPMC-AS составляло 30:70. Температуру раствора подводили до 70 С. В 250 мл реакторе, представляющем собой стеклянную колбу с двойными стенками, растворяли 21 г соединения I в 130 г диметилацетамида (ДМА) при 20-25 С. В раствор добавляли при перемешивании 48,9 г HPMC-AS. Полученную смесь нагревали до 70 С. Получали прозрачный раствор. Получение водной фазы. В 2-литровом реакторе с двойными стенками, таком как показан на фиг. 1, 1210 г 0,01 н. HCl доводили до температуры 5 С. Из донного клапана реактора водую фазу прокручивали с помощью узла смешения с большим усилием сдвига или с помощью вспомогательного насоса, предпочтительно коловратного насоса, а затем после узла смешения с большим усилием сдвига возвращали в верхнюю часть реак- 26022924 тора. Вход для возвращения в реактор находился ниже уровня жидкости, чтобы предотвратить пенообразование (см. фиг. 1). Осаждение. Смеситель с большим усилием сдвига (HSM). Окружную скорость ротора в смесителе с большими сдвиговыми усилиями устанавливали на 25 м/с. Применяли комбинацию ротор/статор с одним рядом зубцов как у ротора, так и у статора. Подача раствора ДМА. Раствор ДМА, температуру которого довели до 70 С, подавали с помощью шестеренчатого насоса через распылительную форсунку, которая была направлена в смесительную камеру смесителя с большим усилием сдвига, в циркулирующую водную фазу. Скорость подачи раствора ДМА. Раствор ДМА подавали в водную фазу до достижения в смесительной камере смесителя с большим усилием сдвига соотношения HCl/ДМА, равного 100/1. Дополнительное диспергирование в HSM (после осаждения), выделение и промывка. После добавления раствора ДМА полученную суспензию МВР диспергировали в течение дополнительного времени в соответствии с эквивалентами партии, пропущенными через смеситель с большим усилием сдвига. Данное время соответствовало 6-кратному рассчитанному времени возвращения партии в реактор. Полученную суспензию, температуру которой поддерживали при 5-10 С, отделяли от твердого МВР. Это осуществляли с помощью вакуумного фильтра. Выделенный МВР промывали 0,01 н. HCl(15 кг 0,01 н. HCl/кг МВР), а затем промывали водой (5 кг воды/кг МВР), чтобы удалить ДМА. Выделенный (влажный) МВР содержал от 60 до 70% воды. Деагломерация и сушка. Перед сушкой (влажный) МВР деагломерировали с помощью ситовой мельницы. (Влажный) МВР сушили в сушильном шкафу. В процессе сушки МВР температуру продукта поддерживали ниже 40 С,чтобы избежать перекристаллизации API. Давление внутри сушильного шкафа было ниже 20 мбар. Содержание воды в МВР после сушки было ниже 2%, и он оказался аморфным на паттерне XRPD. Пример 21. В данном примере описано получение с помощью распылительной сушки твердого молекулярного комплекса, содержащего соединение I и HPMC-AS. Получали комплекс соединения I с полимером, таким как HPMC-AS, возможно включающий поверхностно-активное вещество (например, ионное поверхностно-активное вещество, такое как 1,4-бис-(2-этилгексокси)-1,4-диоксобутан-2-сульфонат натрия (докузат натрия) или неионное поверхностно-активное вещество, такое как полисорбат 80). Обычно подходящую систему растворителей, как,например, смесь тетрагидрофуран:ацетон 20:80 (мас./мас.), доводили до температуры 30 С и добавляли соединение I до уровня 2-10% твердого вещества 4-6 частями при перемешивании. Добавляли HPMC-AS при подходящем соотношении, например 70:30 мас./мас. HPMC-AS:соединение I. В качестве альтернативы добавляли HPMC-AS и поверхностно-активное вещество, например, в соотношении 65:5:30HPMC-AS поверхностно-активное вещество:соединение I. Температуру поднимали до 35-40 С и систему возможно фильтровали, чтобы обеспечить удаление малейшего количества нерастворенных твердых веществ. Раствор затем подвергали распылительной сушке с получением сферических частиц с распределением по размерам 1-20 мкм. Дополнительная обработка могла включать сушку материала в кипящем слое или в центробежной сушилке, и полученный в результате этого материал можно уплотнить, например, путем вальцевания. В качестве примера соединение I и HPMC-AS в соотношении 30:70 (мас./мас.) растворяли до содержания твердых веществ 5,4% в смеси 20:80 (мас./мас.) тетрагидрофурана и ацетона. Полученный в результате этого раствор затем подвергали распылительной сушке с получением твердой дисперсии, аморфного порошка. Раствор подвергали распылительной сушке, применяя подходящую распылительную сушилку, например распылительную сушилку GEA-Niro SDMicro для меньших партий(например, 1 кг твердого вещества). Например, для партии весом 10 г 35,0 г тетрагидрофурана смешивали с 140,0 г ацетона в стеклянном стакане и добавляли 3,0 г соединения I при перемешивании в течение 10 мин до растворения; затем добавляли 7,0 г HPMC-AS-L (степени чистоты NF Shin-Etsu) и перемешивали. По мере того как твердые вещества растворялись, раствор фильтровали через фильтровальную бумагу перед распылительной сушкой. Раствор подвергали распылительной сушке в распылительной сушилке GEA-Niro SDMicro с температурой на входе/выходе 85 и 55 С соответственно, при давлении распыленного пара 0,5 бар. Подвергнутый распылительной сушке материал собирали в циклонный уловитель в количестве 5,78 г или с выходом 58%. Также получали партию 1,6 кг, при этом раствор получали аналогично, но вместо фильтрации раствор перемешивали в течение ночи при комнатной температуре, чтобы обеспечить растворение всего твердого вещества. Экран 200 меш присоединяли к концу питающего шланга, чтобы удалить все нерастворенные частицы, и раствор подвергали распылительной сушке, применяя распылительную сушилкуMobile Manor. Температура на входе/выходе составляла 100 и 55 С соответственно, при давлении распыленного пара 1,0 бар, при скорости потока газа 90 кг/ч. Материал сушили распылением в течение двух дней и материал, собранный после первого дня, подвергали вакуумной сушке при 45 С, чтобы удалить остаточный уровень растворителей. Оценивали насыпную плотность собранного материала (0,23 г/мл),размер частиц (8 мкм, с нормальным распределением и стандартным отклонением 3 мкм), остаточный уровень растворителя (через 89 ч вакуумной сушки, в большой партии остаточный уровень растворителей составлял 0,001% ацетона и 0,017% тетрагидрофурана), осуществляли микроскопические исследования в поляризованном свете, DSC (на термограмме DSC для маленькой партии был виден эндотермический пик приблизительно при 243 С, тогда как на термограмме для большой партии, по существу, не наблюдали пика) и XRPD (который показал аморфность материала). Все патенты и другие ссылочные материалы, цитированные в настоящем описании, указывают на уровень квалификации специалистов в области, к которой относится настоящее изобретение, и полностью включены в данное описание посредством ссылки, включая все таблицы и фигуры, до той же степени, как если бы каждый ссылочный материал был отдельно полностью включен посредством ссылки. Для специалиста в данной области должно быть очевидно, что настоящее изобретение достаточно адаптировано для восприятия упомянутых, а также присущих ему аспектов и преимуществ. Способы,варианты и композиции, описанные в данном документе, которые в настоящий момент представляют предпочтительные варианты реализации, являются примерами и не предполагается, что они ограничивают объем настоящего изобретения. Изменения в указанных способах, вариантах и композиция, а также другие применения будут очевидны для специалиста в данной области, и они также включены в сущность настоящего изобретения и определяются объемом формулы изобретения. Для специалиста в данной области должно быть очевидно, что можно ввести различные замены и модификации изобретения, описанного в данном документе, не отклоняясь от объема и сущности настоящего изобретения. Например, можно внести изменения в условия кристаллизации или сокристаллизации для Ret и белков-имитаторов Ret и/или можно использовать различные последовательности киназного домена. Таким образом, такие дополнительные варианты реализации входят в объем настоящего изобретения и следующей формулы изобретения. Настоящее изобретение, наглядно описанное в данном документе, можно подходящим образом осуществить в отсутствие какого-либо элемента или элементов, ограничения или ограничений, которые конкретно не описаны в данном документе. Таким образом, например, в каждом примере в настоящем описании любые термины из "включающий", "состоящий по существу из" и "состоящий из" могут быть заменены на любой из других двух терминов. Таким образом, для варианта реализации настоящего изобретения, в котором используется один из указанных терминов, настоящее изобретение также включает другой вариант реализации, отличающийся тем, что один из данных терминов заменен на другой из данных терминов. В каждом варианте реализации указанные термины имеют известное значение. Таким образом, например, в один вариант реализации может входить способ, "включающий" ряд этапов, в другой вариант реализации будет входить способ, "по существу состоящий из" тех же этапов, и в третий вариант реализации будет входить способ "состоящий из" тех же этапов. Использованные термины и выражения используются как описывающие, но не ограничивающие термины, и не предполагается, что использование таких терминов и выражений исключает какие-либо эквиваленты показанных и описанных свойств, или части свойств, но должно быть очевидно, что возможны различные модификации, и данные модификации входят в заявленный объем настоящего изобретения. Таким образом, должно быть очевидно, что хотя настоящее изобретение конкретно описано с помощью предпочтительных вариантов реализации и возможных свойств, специалист в данной области может обратиться к модификациям и вариантам понятий, описанных в данном документе, и что такие модификации и варианты предполагаются входящими в объем настоящего изобретения, определенного прилагаемой формулой изобретения. Кроме того, если признаки или аспекты настоящего изобретения описаны в терминах групп Маркуша или другой группировки альтернатив, для специалистов в данной области должно быть очевидно,что настоящее изобретениетакже, вследствие этого, описано в терминах любого отдельного члена или подгруппы членов группы Маркуша или другой группы. Также, если не указано иначе, когда для вариантов реализации предложены различные численные значения, дополнительные варианты реализации описывают, используя любые два различных значения в качестве предельных значений диапазона. Такие диапазоны также входят в объем описанного изобретения. Таким образом, дополнительные варианты реализации входят в объем настоящего изобретения и в следующую формулу изобретения. молекулярно диспергированное в полимерной матрице, образованной ионным полимером, представляющим собой ацетат-сукцинат гидроксипропилметилцеллюлозы (HPMC-AS), причем соединение I присутствует в аморфной форме. 2. Твердая дисперсия по п.1, отличающаяся тем, что указанный ионный полимер находится в твердом состоянии. 3. Твердая дисперсия по п.1 или 2, отличающаяся тем, что соотношение массового содержания соединения I в твердой дисперсии к массовому содержанию ионного полимера составляет от 1:9 до 1:1,предпочтительно от 2:8 до 4:6, в частности 3:7. 4. Фармацевтическая композиция для модулирования киназ, содержащая твердую дисперсию по любому из пп.1-3 и фармацевтически приемлемый носитель. 5. Лекарственная форма, содержащая твердую дисперсию по любому из пп.1-3 или композицию по п.4, суспендированную в водной среде. 6. Лекарственная форма по п.5, дополнительно содержащая коллоидный диоксид кремния, предпочтительно в количестве, составляющем по меньшей мере 0,5% от массы указанной композиции. 7. Лекарственная форма по п.6, отличающаяся тем, что указанная водная среда содержит 2 мас.% гидроксипропилцеллюлозы. 8. Способ получения твердой дисперсии по любому из пп.1-3, включающий микроосаждение соединения I и ацетата-сукцината гидроксипропилметилцеллюлозы (HPMC-AS), при этом соединение I иHPMC-AS образуют молекулярную дисперсию соединения I в указанном HPMC-AS. 9. Способ по п.8, отличающийся тем, что соединение I и указанный ацетат-сукцинат гидроксипропилметилцеллюлозы растворяют в органическом растворителе с получением раствора, причем указанный растворитель предпочтительно выбран из диметилформамида, диметилацетамида, диметилсульфоксида и N-метилпирролидона. 10. Способ по п.9, отличающийся тем, что полученный раствор добавляют в воду, тем самым обеспечивая одновременное осаждение соединения I и ацетата-сукцината гидроксипропилметилцеллюлозы с получением твердого молекулярного комплекса, содержащего соединение I, заключенное в матрицу,образованную ацетатом-сукцинатом гидроксипропилметилцеллюлозы, и твердый молекулярный комплекс промывают водой для удаления органического растворителя. 11. Способ по п.9, отличающийся тем, что полученный раствор добавляют в водную соляную кислоту (HCl), тем самым обеспечивая одновременное осаждение соединения I и ацетата-сукцината гидроксипропилметилцеллюлозы с получением твердого молекулярного комплекса, содержащего соединениеI, заключенное в матрицу, образованную ацетатом-сукцинатом гидроксипропилметилцеллюлозы, и твердый молекулярный комплекс промывают водой для удаления органического растворителя. 12. Способ по п.8, включающий следующие этапы:(a) растворение соединения I и HPMC-AS в одном и том же органическом растворителе с получением единой органической фазы;(b) непрерывное добавление органической фазы, полученной на этапе (а), в водную фазу, которая присутствует в смесительной камере, снабженной узлом смешения с большим усилием сдвига и двумя дополнительными отверстиями, которые соединяют смесительную камеру с замкнутым контуром, при этом водную фазу подвергают циркуляции с пропусканием через указанную смесительную камеру;(c) осаждение смеси, состоящей из аморфной формы соединения I и HPMC-AS, из водной фазы, полученной на этапе (b), в ходе работы смесителя с большим усилием сдвига и пропускание указанной водной фазы через смесительную камеру в замкнутом контуре с образованием осадка водной суспензии;(d) обеспечение непрерывной циркуляции водной суспензии через смесительную камеру в процессе работы узла смешения с большим усилием сдвига и после того, как органический раствор, полученный на этапе (а), полностью добавлен в водную фазу, до тех пор, пока не будет достигнут заданный размер частиц и/или распределение частиц по размеру;(e) выделение твердой фазы из суспензии;(f) промывание выделенной твердой фазы водой;
МПК / Метки
МПК: C07D 471/04, A61K 31/437, A61P 35/00
Метки: пропан-1-сульфоновой, форма, твердая, 3-[5-(4-хлорфенил)-1н-пирролo[2,3-b]пиридин-3-карбонил]-2,4-дифторфенил}амида, применение, кислоты
Код ссылки
<a href="https://eas.patents.su/30-22924-tverdaya-forma-3-5-4-hlorfenil-1n-pirrolo23-bpiridin-3-karbonil-24-diftorfenilamida-propan-1-sulfonovojj-kisloty-i-ee-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Твердая форма {3-[5-(4-хлорфенил)-1н-пирролo[2,3-b]пиридин-3-карбонил]-2,4-дифторфенил}амида пропан-1-сульфоновой кислоты и ее применение</a>












