Антитела к csf-1r
Формула / Реферат
1. Антитело или его фрагмент, которые специфически связываются с вариантом CSF-1R человека (SEQ ID NO: 15), содержащие
CDRH1, имеющий последовательность SYGMH (SEQ ID NO: 1),
CDRH2, имеющий последовательность VIWYDGSNKYYADSVKG (SEQ ID NO: 2),
CDRH3, имеющий последовательность DYEVDYGMDV (SEQ ID NO: 3),
CDRL1, имеющий последовательность RASQGISNALA (SEQ ID NO: 4),
CDRL2, имеющий последовательность DASSLES (SEQ ID NO: 5), и
CDRL3, имеющий последовательность QQFNSYPWT (SEQ ID NO: 6).
2. Антитело или его фрагмент по п.1, содержащее
VL, имеющую последовательность аминокислот:
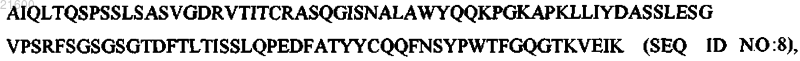
VH, имеющую последовательность аминокислот:
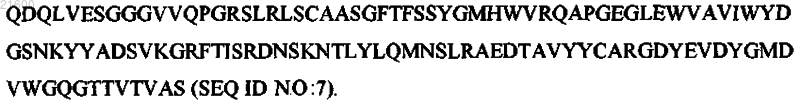
3. Антитело или его фрагмент по любому из пп.1 или 2, содержащие тяжелую цепь, имеющую последовательность аминокислот SEQ ID NO: 9, и легкую цепь, имеющую последовательность аминокислот SEQ ID NO: 10.
4. Антитело или его фрагмент по любому из пп.1-3, содержащие две тяжелые цепи, каждая из которых имеет последовательность аминокислот SEQ ID NO: 9, и две легкие цепи, каждая из которых имеет последовательность аминокислот SEQ ID NO: 10.
5. Фармацевтическая композиция для лечения лейкоза, карциномы эндометрия, карциномы молочной железы и карциномы предстательной железы, содержащая антитело или его фрагмент по любому из пп.1-4 в сочетании с фармацевтически приемлемой основой, растворителем или наполнителем.
6. Фармацевтическая композиция по п.5, также содержащая дополнительный фармацевтический агент, выбранный из доцетаксела, паклитаксела, герцептина® или доксорубицина.
7. Применение антитела или его фрагмента по любому из пп.1-4 для изготовления лекарственного средства для лечения рака, выбранного из лейкоза, карциномы эндометрия, карциномы молочной железы и карциномы предстательной железы.
8. Применение антитела или его функционального фрагмента по любому из пп.1-4 в качестве лекарственного препарата для лечения рака, выбранного из лейкоза, карциномы эндометрия, карциномы молочной железы и карциномы предстательной железы.
9. Способ лечения рака, выбранного из лейкоза, карциномы эндометрия, карциномы молочной железы и карциномы предстательной железы, включающий введение антитела или его функционального фрагмента по любому из пп.1-4, где указанное антитело или его фрагмент вводят перед, во время, по существу, одновременно или после начала терапии другим противораковым средством.
10. Способ по п.9, где указанное противораковое средство выбирают из группы, состоящей из антиангиогенного агента, химиотерапевтического агента и антинеопластического агента.
11. Способ по п.10, где указанный антинеопластический агент выбирают из группы, состоящей из доцетаксела, паклитаксела, герцептина® и доксорубицина.
12. Способ определения, является ли субъект, страдающий раком, кандидатом на противораковую терапию с применением анти-CSF-1R антител, где указанное антитело представляет собой антитело по любому из пп.1-4, при этом указанный способ включает определение уровня CSF-1 или IL-34 или их обоих, ex vivo или in vitro в пробе пациента, причем указанную пробу выбирают из группы, состоящей из крови, сыворотки, плазмы, клеток опухоли и циркулирующих клеток опухоли, при этом повышение уровня CSF-1 или IL-34 или их обоих по сравнению с уровнем CSF-1 или IL-34 или их обоих у лиц, не страдающих раком, указывает на то, что указанный субъект является кандидатом на противораковую терапию с применением анти-CSF-1R антител.
Текст
Согласно изобретению предложено антитело, которое связывает CSF-1R человека с высокой аффинностью. Антитела согласно изобретению обладают значительными преимуществами по сравнению с антителами, известными в данной области техники, благодаря своей многофункциональности: ингибированию передачи сигнала от CSF-1R, интернализации и стимулированию разрушения CSF-1R, а также стимулированию антителозависимой клеточной цитотоксичности в клетках, включая опухоли, макрофаги и моноциты. Также была продемонстрирована их эффективность в лечении лейкемии, рака молочной железы, эндометрия и предстательной железы по отдельности или в сочетании с доцетакселем, паклитакселем,герцептином или доксорубицином. Заявка на данное изобретение испрашивает приоритет в соответствии с предварительной заявкой на патент США 61/319896, поданной 1 апреля 2010 г. Настоящее изобретение относится к областям иммунологии и лечения рака. Более конкретно, настоящее изобретение относится к антителам человека, которые связываются с рецептором колониестимулирующего фактора-1 (CSF-1R). Рецептор колониестимулирующего фактора-1 (CSF-1R), также называемый CSFR или CD-115 (вариант CSF-1R человека; SEQ ID NO: 15) (CSF-1R человека; SEQ ID NO: 16; номер доступа в системеUniprot P07333), кодируемый геном c-fms, представляет собой тирозинкиназный рецептор, селективно экспрессируемый на линиях макрофагов и гранулоцитов у здоровых людей и на клетках раковых опухолей. Известны два лиганда: колониестимулирующий фактор-1 (CSF-1) (CSF-1 человека; SEQ ID NO: 17; номер доступа в системе Uniprot P09603), также именуемый М-CSF, и IL-34 (интерлейкин-34) (IL-34 человека; SEQ ID NO: 18; номер доступа в системе Uniprot Q6ZMJ4), которые связываются с внеклеточным доменом CSF-1R. При связывании с CSF-1 или IL-34 CSF-1R димеризуется, что приводит к трансфосфорилированию рецептора, а также фосфорилированию и активации молекул, расположенных ниже в сигнальном пути, таких как MAPK (митоген-активируемая протеинкиназа) и Akt. ФосфорилированиеCSF-1R приводит к (1) пролиферации и дифференцировке макрофагов из гематопоэтических стволовых клеток-предшественников и (2) выживанию и миграции макрофагов в разные органы и ткани организма,в частности в строму опухоли. Также CSF-1R может экспрессироваться на поверхности клеток опухоли. Антитела к CSF-1R мыши не обладают перекрестной реактивностью в организме человека и, следовательно, были бы неэффективны в качестве средств для лечения рака у людей. Антитела человека к CSF-1R описаны в публикации WO 2009/026303 (Brasel, et al.). Такие антитела не вызывают антителозависимой клеточной цитотоксичности (АЗЦТ) в отношении клеток, связываемых указанными антителами. АЗЦТ возникает, когда указанное антитело связывается с клеткой, экспрессирующей антиген (клетка-мишень), в ходе чего Fc-область указанного антитела становится доступна для связывания с рецептором Fc на клетках - естественных киллерах, моноцитах, нейтрофилах и дендритных клетках (клетки-эффекторы). Антитела, раскрытые у Brasel, не способны сблизить клетку-мишень и клетку-эффектор, чтобы инициировалось уничтожение клетки-мишени. Антитела к указанному лиганду не обладают перекрестной реактивностью. Следовательно, антитела к CSF-1 не ингибируют связывания IL-34 с CSF-1R, а антитела к IL-34 не ингибируют связыванияCSF-1 с CSF-1R. Связывание лиганда с рецептором может оказывать определенное действие на рост раковой опухоли. Кроме того, антитела к указанному лиганду не интернализуются, не вызывают разрушения CSF-1R и не стимулируют АЗЦТ в отношении клеток. Существует потребность во многофункциональных антителах, которые блокировали бы связывание указанных лигандов с CSF-1R, а также обусловливали АЗЦТ активность в отношении клеток, с которыми связались эти антитела. Антитела согласно настоящему изобретению имеют преимущество перед известными антителами,поскольку они обладают различными функциями. Антитела согласно настоящему изобретению блокируют связывание CSF-1 и IL-34 с рецептором, благодаря чему препятствуют димеризации рецептора и последующему фосфорилированию внутриклеточных остатков тирозина - функции, которые исключительно важны для предотвращения роста опухоли, индуцированного макрофагами. Антитела согласно настоящему изобретению интернализуются и вызывают разрушение CSF-1R. Важно, что, помимо блокирования связывания лиганда, антитела согласно настоящему изобретению усиливают активность АЗЦТ,стимулируя уничтожение клеток опухоли и ассоциированных с опухолью макрофагов и моноцитов. Антитела согласно настоящему изобретению также одновременно воздействуют на активность макрофагов - активность, которая играет ключевую роль в прогрессировании опухоли. Благодаря разнообразным терапевтическим функциям, которыми обладают антитела согласно настоящему изобретению, они имеют значительное преимущество перед антителами, известными в данной области техники. Сущность изобретения Одним аспектом настоящего изобретения является антитело или его фрагмент, которые специфически связываются с вариантом CSF-1R человека (SEQ ID NO: 15), содержащиеCDRL3, имеющий последовательность QQFNSYPWT (SEQ ID NO: 6). Другим аспектом настоящего изобретения является антитело или его фрагмент, которые специфически связываются с вариантом CSF-1R человека (SEQ ID NO: 16), содержащееCDRL3, имеющий последовательность QQFNSYPWT (SEQ ID NO: 6). Одним из аспектов настоящего изобретения является антитело или его фрагмент, которые специфически связываются с вариантом CSF-1R человека (SEQ ID NO: 15), содержащиеCDRL3, имеющий последовательность QQFNSYPWT (SEQ ID NO: 6). Антитела согласно настоящему изобретению также могут содержать замены аминокислот в одном из указанных CDR. Согласно другому аспекту вышеуказанные CDR не содержат замен аминокислот в последовательностях одной из CDR. Другим аспектом настоящего изобретения является антитело или его фрагмент, которые связываются с вариантом CSF-1R человека и содержат VH, имеющую последовательность аминокислот: Другим аспектом настоящего изобретения является антитело или его фрагмент, которые связываются с вариантом CSF-1R человека и содержат легкую цепь, имеющую последовательность аминокислотSEQ ID NO: 10, и тяжелую цепь, содержащую последовательность аминокислот SEQ ID NO: 9. Согласно еще одному аспекту настоящего изобретения указанное антитело содержит две легкие цепи, каждая из которых имеет последовательность аминокислот SEQ ID NO: 10, и две тяжелые цепи, каждая из которых имеет последовательность аминокислот SEQ ID NO: 9.CSF-1R-связывающие фрагменты таких антител являются частью настоящего изобретения. Также согласно настоящему изобретению предложены изолированные ДНК и полинуклеотиды/полинуклеиновые кислоты, кодирующие антитела или их фрагменты, описанные выше, векторы экспрессии, содержащие указанные полинуклеотиды, и клетки-хозяева, содержащие указанные полинуклеотиды. Также согласно настоящему изобретению предложены способы очистки указанных антител или их фрагментов. Также согласно настоящему изобретению предложены композиции, содержащие указанные антитела или их фрагменты, полинуклеотиды, векторы или клетки-хозяева согласно настоящему изобретению, одни или с фармацевтически приемлемой основой, растворителем или наполнителем. Согласно настоящему изобретению предложены фармацевтические композиции, содержащие указанные антитела или их фрагменты согласно настоящему изобретению вместе с фармацевтически приемлемой основой,растворителем или наполнителем. Кроме того, настоящее изобретение относится к способам подавления роста клеток опухоли и к способам лечения лейкемии, карцином молочной железы и предстательной железы, у млекопитающих,путем введения эффективного количества антитела. Другой аспект настоящего изобретения относится к способам подавления роста клеток опухоли и к способам лечения лейкемии, карцином эндометрия, молочной железы и предстательной железы у млекопитающих путем введения эффективного количества антитела. Еще один аспект настоящего изобретения относится к способам подавления роста клеток опухоли, и к способам лечения лейкемии, карцином эндометрия, молочной железы и предстательной железы, а также рака яичников, прямой и ободочной кишки, печеночно-клеточного рака, рака почек, множественной миеломы и лимфомы Ходжкина. Антитела согласно настоящему изобретению можно применять для лечения новообразований, включая солидные опухоли, и для лечения карцином молочной железы и предстательной железы. Согласно другому аспекту настоящего изобретения указанные антитела можно применять для лечения новообразований, включая солидные опухоли, и для лечения карцином эндометрия, молочной железы и предстательной железы. Согласно другому аспекту настоящего изобретения указанные антитела можно применять для лечения новообразований, включая солидные опухоли,и для лечения карцином эндометрия, а также карциномы яичников, прямой и ободочной кишки, печеночно-клеточной карциномы и карциномы почек,Одним из аспектов настоящего изобретения является антитело или его фрагмент для применения при терапии, или для применения в лечении, или для применения в качестве лекарственного средства. Согласно еще одному аспекту описанные выше антитела или их фрагменты применяют в лечении рака. Настоящее изобретение можно применять в лечении типов рака, которые включают лейкемию, рак молочной железы и рак предстательной железы, но не ограничиваются ими. Согласно одному аспекту настоящее изобретение можно применять в лечении типов рака, которые включают лейкемию, рак молоч-2 021600 ной железы, рак эндометрия и рак предстательной железы, но не ограничиваются ими. Согласно другому аспекту настоящее изобретение можно применять в лечении типов рака, которые включают лейкемию,рак молочной железы, рак эндометрия, рак предстательной железы, рак яичника, рак прямой и ободочной кишки, печеночно-клеточный рак, рак почек, множественную миелому и лимфому Ходжкина, но не ограничиваются ими. Также настоящее изобретение включает антитело или его фрагмент согласно настоящему изобретению для применения в лечении рака, включая обеспечение или введение эффективного количества другого противоракового средства, причем указанное противораковое средство включает антиангиогенный агент, химиотерапевтический агент или антинеопластический агент, но не ограничиваясь ими. Также антинеопластические агенты включают доцетаксел, паклитаксел, герцептин и доксорубицин, но не ограничиваются ими. Указанный противораковый агент вводят пациенту в дополнение к антителу или его фрагменту, раскрываемым в настоящем изобретении. Указанное антитело или его фрагмент вводят перед, во время, в существенной степени одновременно или после начала терапии другим противораковым препаратом или другим антинеопластическим агентом. Также согласно настоящему изобретению предложено применение антитела согласно настоящему изобретению в изготовлении лекарственного препарата для лечения рака. Согласно одному аспекту указанный рак - это лейкемия, рак молочной железы, рак эндометрия или рак предстательной железы. Согласно другому аспекту настоящего изобретения указанный рак - это лейкемия, рак молочной железы,рак эндометрия, рак предстательной железы, рак яичника, рак прямой и ободочной кишки, печеночноклеточный рак, рак почек, множественная миелома или лимфома Ходжкина. Применение указанного антитела включает обеспечение или введение эффективного количества другого противоракового препарата, причем указанный противораковый агент включает антиангиогенный агент, химиотерапевтический агент или антинеопластический агент, но не ограничиваясь ими. Также антинеопластические агенты включают доцетаксел, паклитаксел, герцептин и доксорубицин, но не ограничиваются ими. Указанный противораковый агент вводят пациенту в дополнение к антителу или его фрагменту согласно настоящему изобретению. Указанное антитело или его фрагмент вводят перед, во время, по существу, одновременно или после начала терапии другим противораковым средством или другим антинеопластическим агентом. Также согласно настоящему изобретению предложен способ лечения рака у млекопитающего,включающий введение указанному млекопитающему, нуждающемуся в нем, эффективного количества антитела или его фрагмента согласно настоящему изобретению. Указанный рак выбран из группы, состоящей из лейкемии, рака молочной железы, рака эндометрия и рака предстательной железы. Согласно другому аспекту указанный рак выбирают из группы, состоящей из лейкемии, рака молочной железы,рака эндометрия, рака предстательной железы, рака яичника, рака прямой и ободочной кишки, печеночно-клеточноо рака, рака почек, множественной миеломы и лимфомы Ходжкина. Кроме того, указанный способ может включать введение другого противоракового препарата указанному млекопитающему. Указанный противораковый агент выбирают из группы, включающей антиангиогенный агент, химиотерапевтический агент или антинеопластический агент. Также антинеопластические агенты включают доцетаксел, паклитаксел, герцептин и доксорубицин. Также согласно настоящему изобретению предложены способы применения антител в лечении млекопитающего, нуждающегося в таком лечении, например, для подавления ангиогенеза или метастазов в костях или для подавления роста опухоли или пролиферативного роста, или для лечения воспалительных заболеваний. Также согласно настоящему изобретению предложены антитела для лечения млекопитающего, нуждающегося в лечении, например, для подавления ангиогенеза или метастазов в костях или для угнетения опухоли или пролиферативного роста, или воспалительных заболеваний. Также настоящее изобретение относится к продукту или фармацевтической композиции, содержащим антитело или его фрагмент согласно настоящему изобретению. Кроме того, указанный продукт или фармацевтическая композиция может включать дополнительный фармацевтический агент, антибластомный агент или средство, включая доцетаксел, паклитаксел, герцептин и доксорубицин, но не ограничиваясь ими, в сочетании с раскрываемым в настоящем описании антителом одновременно, раздельно или последовательно в ходе терапии. Согласно настоящему изобретению предложено применение уровня CSF-1 в пробах крови, сыворотки, плазмы, клеток опухоли или циркулирующих клеток опухоли в качестве индикатора успешности лечения антителами к CSF-1R согласно настоящему изобретению, или его фрагментами, у пациентов,если указанная раковая опухоль экспрессирует на поверхности ассоциированных с опухолью макрофаговCSF-1R. Также согласно настоящему изобретению предложен способ лечения рака у пациента, включающий следующие этапы:(1) измерение уровня CSF-1 в пробе, взятой у пациента, причем пробу выбирают из группы, состоящей из крови, сыворотки, плазмы, опухолевых клеток и циркулирующих опухолевых клеток; и(2) введение пациенту антитела или фрагмента антитела согласно настоящему изобретению, если уровень CSF-1 выше, чем уровень CSF-1, определяемый у контрольной популяции. Согласно настоящему изобретению предложено применение уровня IL-34 в пробах крови, сыворотки, плазмы, клеток опухоли или циркулирующих клеток опухоли в качестве индикатора успешности лечения антителами к CSF-1R согласно настоящему изобретению, или его фрагментами, у пациентов. Также согласно настоящему изобретению предложен способ лечения рака у пациента, включающий следующие этапы:(1) измерение уровня IL-34 в пробе, взятой у пациента, причем пробу выбирают из группы, состоящей из крови, сыворотки, плазмы, опухолевых клеток и циркулирующих опухолевых клеток; и(2) введение пациенту антитела или фрагмента антитела согласно настоящему изобретению, если уровень IL-34 выше, чем уровень IL-34, определяемый у контрольной популяции. Одним из аспектов настоящего изобретения является способ определения, является ли субъект,страдающий раком, кандидатом на противораковую терапию с применением анти-CSF-1R антител, причем указанное антитело - это антитело согласно настоящему изобретению, и при этом способ включает:(1) определение уровня CSF-1 ex vivo или in vitro в пробе пациента, причем указанную пробу выбирают из группы, состоящей из крови, сыворотки, плазмы, опухолевых клеток и циркулирующих опухолевых клеток; и(2) повышение уровня CSF-1 по сравнению с уровнем CSF-1 у лиц, не страдающих раком, которое указывает на то, что указанный субъект является кандидатом на противораковую терапию с применением анти-CSF-1R антител. Другим аспектом настоящего изобретения является способ определения, является ли субъект, страдающий раком, кандидатом на противораковую терапию с применением анти-CSF-1R антител, причем указанное антитело - это антитело согласно настоящему изобретению, и при этом способ включает:(1) определение уровня IL-34 ex vivo или in vitro в пробе пациента, причем указанную пробу выбирают из группы, состоящей из крови, сыворотки, плазмы, опухолевых клеток и циркулирующих опухолевых клеток; и(2) повышение уровня IL-34 по сравнению с уровнем IL-34 у лиц, не страдающих раком, которое указывает на то, что указанный субъект является кандидатом на противораковую терапию с применением анти-CSF-1R антител. Также согласно настоящему изобретению предложены антитела, специфично связывающиеся сCSF-1R. Указанные антитела обладают по меньшей мере одним свойством, выбранным из следующей группы:(с) уменьшение уровня фосфорилирования CSF-1R;(g) индукция АЗЦТ. Предпочтительный вариант реализации настоящего изобретения обладает свойствами (а)-(g). Одним из аспектов настоящего изобретения является антитело или его фрагмент, которые специфически связываются с вариантом CSF-1R человека (SEQ ID NO: 15) или с CSF-1R человека(SEQ ID NO: 16) и ингибируют передачу сигнала через CSF-1R, интернализуются и вызывают разрушение CSF-1R, а также стимулируют антителозависимую клеточно-опосредованную цитотоксичность(АЗЦТ) в отношении целого ряда клеток, включая клетки опухоли, макрофаги и моноциты. Последовательности SEQ ID NO: 15 и SEQ ID NO: 16 различаются по одной аминокислоте в положении 54, находящемся за пределами области связывания. В настоящем описании термин "антитело" включает молекулы иммуноглобулинов, содержащие четыре полипептидных цепи, две тяжелых (Н) и две легкие цепи (L), связанные друг с другом дисульфидными связями. Индивидуальные цепи могут скручиваться в домены сходного размера (110-125 аминокислот) и структуры, но с разными функциями. Указанная легкая цепь может содержать вариабельную область (обозначаемую в настоящем описании VL) и/или один константную область (обозначаемую в настоящем описании CL). Легкие цепи антитела человека (иммуноглобулинов) представляют собой либо каппалегкие цепи, либо лямбдалегкие цепи. Термин "экспрессия VL" в настоящем описании включает вариабельные области как из легких цепей каппа-типа (V), так и из легких цепей лямбда-типа (V). Указанная тяжелая цепь может также содержать вариабельную область (обозначаемую в настоящем описании VH) и/или, в зависимости от класса или изотипа антитела, три или четыре константных домена (CH1, CH2, СН 3 и СН 4) (вместе обозначаемые в настоящем описании как СН). У людей указанные изотипы включают IgA, IgD, IgE, IgG иIgM, причем IgA и IgG также подразделяют на подклассы или подтипы (IgA1-2 и IgG1-4). Настоящее изобретение включает антитела любого из вышеперечисленных классов или подклассов. Для антител согласно настоящему изобретению предпочтительным изотипом является IgG1 человека. В каждом VL или VH находятся три участка, называемые гипервариабельными или определяющими комплементарность участками (CDR), которые поддерживаются менее вариабельными областями,называемыми каркасными (сокращенно в настоящем описании обозначаются FR). Согласно правилу Kabat аминокислоты относят к конкретной области или домену CDR (Kabat, et al., Ann. NY Acad. Sci. 190:382-93 (1971); Kabat, et al., Sequences of Proteins of Immunological Interest, Fifth Edition, U.S.Department of Health and Human Services, NIH Publication No. 91-3242 (1991).). Каждая VH и VL состоит из трех CDR и четырех FR, которые расположены от N-конца к С-концу в следующем порядке:FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. Часть антитела, состоящая из областей VL и VH, обозначают Fv(вариабельный фрагмент), и она образует собой антигенсвязывающий сайт. Одноцепочечный Fv (scFv) представляет собой фрагмент антитела, содержащий область VL и область VH в одной полипептидной цепи, причем N-конец одной области и С-конец другой области соединены гибким линкером."Изолированное антитело" - это антитело, которое (1) было частично, в существенной степени или полностью очищено из смеси компонентов; (2) было идентифицировано и выделено и/или восстановлено из какого-либо компонента его естественного окружения; (3) является моноклональным; (4) не содержит других белков из того же вида; (5) экспрессируется клеткой другого вида или (6) не существует в природе. Термин "компоненты" в контексте настоящего описания не включает антитело согласно настоящему изобретению. Загрязняющие компоненты его (антитела) естественного окружения - это материалы, которые могут мешать при диагностическом или терапевтическом применении указанного антитела, и они могут включать ферменты, гормоны и другие белковоподобные или небелково-подобные растворимые вещества. Примеры изолированных антител включают антитело, которое было афинно очищено, антитело, которое было получено посредством гибридомы или другой линии клеток in vitro, и антитело человека, полученной из трансгенных мышей. В настоящем описании термин "моноклональное антитело" относится к антителу, полученному из популяции в существенной степени однородных антител, например из индивидуальных антител, составляющих одну популяцию, которые в существенной степени идентичны за исключением возможных возникающих в природе мутаций или минорных посттрансляционных вариантов, которые могут присутствовать. Моноклональные антитела высокоспецифичны и направлены к одному антигенному сайту (также называемому детерминантой или эпитопом). Кроме того, в отличие от препаратов традиционного (поликлонального) антитела, которые обычно включают разные антитела, направленные против разных детерминант, каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение "моноклональное" указывает на свойство антитела, полученного в существенной степени из однородной популяции антител, но ни в какой мере не требует, чтобы указанное антитело было получено каким-либо конкретным способом. В настоящем описании термин "антитело человека" включает антитела, содержащие вариабельные и константные области, соответствующие последовательности иммуноглобулина человека эмбрионального типа (как описано у Kabat et al., supra). Антитела человека согласно настоящему изобретению могут включать остатки аминокислот, не кодируемые последовательностями иммуноглобулина человека эмбрионального типа (например, мутации, полученные путем случайного или сайт-специфичного мутагенеза in vitro или за счет соматических мутаций), например в CDR. В антителе человека может содержаться замена по меньшей мере в одном положении на определенный остаток аминокислоты, например, остаток аминокислоты, повышающий активность, который не кодируется последовательностью иммуноглобулина человека эмбрионального типа. Однако в настоящем описании термин "антитело человека" не включает антитела, в которых последовательности CDR, полученные из эмбриона или от другого вида млекопитающих, таких как мышь, было привито в каркасные последовательности. Не предполагается,что способы получения "антител человека", применяемых в настоящем описании, включают антитела,полученные от людей. Фраза "рекомбинантное антитело человека" включает антитела человека, которые готовят, экспрессируют, создают или выделяют посредством рекомбинантных способов, такие как антитела, экспрессируемые при помощи рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина, антитела, выделенные из библиотеки рекомбинантных, гибридных антител человека, антитела, выделенные у животного, которое трансгенно по генам иммуноглобулина человека, или антитела, которые готовят,экспрессируют, создают или выделяют любыми другими способами, включающими сплайсинг последовательностей генов иммуноглобулинов человека с получением других последовательностей ДНК. Такие рекомбинантные антитела человека содержат вариабельные и константные области, полученные из последовательностей иммуноглобулина человека эмбрионального типа Fc (фрагмент, кристаллизуемая область) - это обозначение части или фрагмента антитела, которая содержит парные константные области тяжелых цепей. Например, в антителе IgG Fc состоит из доменов тяжелых цепей СН 2 и СН 3. Fc антителаIgA или IgM также содержит домен СН 4. Fc ассоциирован со связыванием рецептора к Fc, активацией антителозависимой клеточной цитотоксичности (АЗЦТ) и/или клеточной цитотоксичности (ЦТ). Для таких антител, как IgA и IgM, которые представляют собой комплексы или множественные IgGподобные белки, образование комплекса требует константных доменов Fc. Таким образом, антитела согласно настоящему изобретению включают изолированные антитела,антитела человека, гуманизированные антитела, рекомбинантные антитела человека, моноклональные антитела, фрагменты расщепления, специфические их части и варианты, включая миметики антител или части антител, которые имитируют структуру и/или функцию антитела, или специфический его фрагмент или часть, но не ограничиваются ими; каждое из которых содержит по меньшей мере один CDR. Функциональные фрагменты включают антигенсвязывающие фрагменты, которые связывают антигенCSF-1R. Например, фрагменты антител, способные связываться с CSF-1R, или их часть, и которые попадают в область настоящего изобретения, включают двухвалентные фрагменты, такие как (Fab')2 с интактными межцепьевыми дисульфидными связями, одновалентные фрагменты, такие как Fab (фрагмент,антигенсвязывающий), которые относятся к фрагментам антител, содержащим домены VL-CL иVH-CH1, и не сохраняют шарнирной области тяжелой цепи (например, посредством расщепления папаином), Fabs, которые сохраняют шарнирную область тяжелой цепи, Facb (например, полученные посредством расщепления папаином), F(ab')2, Fab', которые не имеют дисульфидных связей, pFc' (например,полученные посредством расщепления пепсином или плазмином), Fd (например, полученные посредством расщепления пепсином, частичного восстановления или повторной агрегации) и Fv или scFv (например, полученные посредством методов молекулярной биологии). Фрагменты антител также должны включать, например, антитела с удаленными доменами, линейные антитела, одноцепочечные антитела,scFv, антитела с одним доменом, поливалентные одноцепочечные антитела, мультиспецифичные антитела, образованные из фрагментов антител, включая диатела, триатела и подобные, которые специфично связываются с антигенами. Шарнирная область разделяет части Fab и Fc в антителе, обеспечивая подвижность Fab относительно друг друга и относительно Fc, также включающего множество дисульфидных связей для ковалентного связывания с двумя тяжелыми цепями. Были разработаны такие формы антител, которые сохраняют специфичность связывания, но обладают другими характеристиками, которые могут быть желательны, включая, например, двойную специфичность, поливалентность (более двух связывающих сайтов) и компактный размер (например, только связывающие домены). Антитела согласно настоящему изобретению специфичны по отношению кCSF-1R. Термин "специфичность антитела" относится к селективному распознаванию антителом какоголибо конкретного эпитопа на антигене. Например, антитела согласно настоящему изобретению могут быть моноспецифичным или биспецифичным. Биспецифичные антитела (BsAb) - это антитела, которые обладают двумя разными антигенсвязывающими видами специфичности или сайтами. Когда антитело имеет более одной специфичности, распознаваемые эпитопы могут быть ассоциированы с одним антигеном или с более чем одним антигеном. Таким образом, согласно настоящему изобретению предложены биспецифичные антитела, которые связываются с двумя разными антигенами, причем по меньшей мере одна специфичность - это специфичность к CSF-1R. Как было указано выше, такие антитела включают любые их фрагменты. Специфичность настоящих антител или их фрагментов в отношении CSF-1R можно определить на основании аффинности или авидности. Аффинность, выражаемая константой равновесия для диссоциации антигена с антителом (KD), характеризует силу связывания между антигенной детерминантой и связывающим сайтом антитела. Антитела или их фрагменты согласно настоящему изобретению связываются с эпитопом CSF-1R,расположенным на сегментах внеклеточного домена (здесь и далее обозначается просто как "домены" или "ECD"). В настоящем описании термин "эпитоп" относится к дискретным трехмерным сайтам на антигене, которые распознаются антителами согласно настоящему изобретению. Эпитопы - это иммунологически активные области в сложном антигене, области, которые на самом деле связываются с рецептором В-клеток и которые на самом деле связываются образующимися в результате молекулами антител,вырабатываемых В-клетками. В целом антигены содержат по меньшей мере один эпитоп и обычно более одного эпитопа. Эпитопы белковых антигенов могут быть линейными или нелинейными. Линейные эпитопы - это эпитопы, содержащие смежные остатки аминокислот в последовательности аминокислот белка. Линейным эпитопам может требоваться, а может и не требоваться конформационное скручивание,чтобы они приобрели нативную трехмерную структуру и могли вызывать иммунный ответ, при котором образуются антитела со специфическим связыванием указанного антигена. Нелинейные эпитопы состоят из несмежных остатков аминокислот. Так, нелинейным эпитопам всегда требуется некоторая степень скручивания белка, чтобы сблизить необходимые остатки аминокислот для образования нативной трехмерной структуры и способности вызывать иммунный ответ, при котором образуются антитела со специфическим связыванием указанного антигена. Антитела согласно настоящему изобретению также включают антитела, у которых характеристики связывания улучшены посредством прямой мутации, методом "созревания аффинности", фагового дисплея или перетасовки цепей. Аффинность и специфичность можно модифицировать или повысить путем мутирования остатков CDR и/или FW и скрининга с отбором антигенсвязывающих сайтов, обладающих желаемыми характеристиками (например, см. Yang et al., J. Mol. Biol., 254:392-403(1995. МутированиеCDR осуществляют разными способами. Один из способов - это случайный выбор отдельных остатков,-6 021600 или сочетания остатков, при котором в популяции в остальном идентичных антигенсвязывающих сайтов подгруппы из двух-двадцати аминокислот находились в конкретных положениях. В качестве альтернативы можно осуществлять мутации по широкому диапазону остатков путем ПЦР с внесением ошибок(например, см. Hawkins et al., J. Mol. Biol., 226:889-96 (1992. В другом примере, можно воспроизводить в штаммах-мутаторах Е. coli векторы фагового дисплея, содержащие гены вариабельных областей тяжелых и легких цепей (например, см. Low et al., J. Mol. Biol., 250:359-68 (1996. Указанные способы мутагенеза иллюстрируют тот факт, что специалистам в данной области известно множество способов. Удобным способом получения вариантов-заместителей является "созревание аффинности" с применением фагового дисплея. Вкратце, несколько сайтов области CDR подвергают мутированию в целях генерирования всех возможных замен аминокислот в каждом сайте. Варианты антител, сгенерированные таким образом, отображают в одновалентной форме на частицах нитевидных фагов в виде гибридов с продуктом гена IIIM13, упакованного в каждую частицу. Несомые фагом варианты затем отбирают либо по биологической активности (например, аффинность связывания (KD, специфичность, ЕС 50 - концентрация, которая приводит к 50% максимального эффекта), как раскрывается в настоящем описании. Чтобы определить кандидаты на модификацию среди сайтов участков CDR, можно проводят мутагенез со сканированием по аланину для идентификации остатков в области CDR, вносящих значительный вклад в связывание антигена. В качестве альтернативы или в дополнение можно проводить случайный мутагенез на одной или более последовательностях CDR в одном или более положениях либо пока CDR функционально связана с вариабельной областью, либо пока CDR не зависит от последовательности другой вариабельной области, и затем измененную CDR возвращают в вариабельную область при помощи технологии рекомбинантных ДНК. После генерации и экспрессии таких вариантов антител указанный набор вариантов подвергают скринингу, как описано в настоящем описании, и при помощи одного или более проб тестов отобрать антитела с лучшими свойствами для дальнейшей разработки. Помимо антител, конкретно описанных в настоящем описании, можно с легкостью разработать и производить другие "по существу, гомологичные" модифицированные антитела при помощи разных технологий рекомбинантных ДНК, хорошо известных специалистам в данной области техники. Например,каркасные участки могут варьировать в диапазоне от нативных последовательностей на уровне первичной структуры до нескольких замен аминокислот, концевых и промежуточных вставок и делеций и т.п. Кроме того, в качестве основы для гуманизированных иммуноглобулинов согласно настоящему изобретению можно применять разные каркасные области человека по отдельности или в сочетании. В целом модификации генов можно легко получить при помощи разных хорошо известных способов, таких как сайт-направленный мутагенез. Настоящее изобретение включает последовательности нуклеиновых кислот, которые кодируют тяжелую цепь анти-CSF-1R антитела, содержащую любую одну из областей VH или ее часть, или любой одну из CDR VH, включая любые их варианты, которые раскрыты в настоящем описании. Также настоящее изобретение включает молекулы нуклеиновых кислот, которые кодируют легкую цепь анти-CSF-1R антитела, содержащую любую одну из областей VL или ее часть, или любой один из CDRVL, включая любые их варианты, которые раскрыты в настоящем описании. Также настоящее изобретение включает молекулы нуклеиновых кислот антитела 1, SEQ ID NO: 13 и 14 для тяжелой и легкой цепей соответственно. Антитела согласно настоящему изобретению включают антитела, содержащие те же участки CDR, что и в антителе 1, и/или ту же вариабельную область легкой цепи или вариабельную область тяжелой цепи, что и в антителе 1. Антитела согласно настоящему изобретению можно получить способами, известными в технике. Указанные способы включают иммунологический способ, описанный у Kohler and Milstein, Nature,256:495-497 (1975); Laboratory Techniques in Biochemistry and Molecular Biology, Volume 13 (Burdon et al.Characterization of Rodent and Human Hybridomas (Campbell ed., 1984); а также способом рекомбинантных ДНК, описанным у Huse et al., Science, 246:1275-1281 (1989). Также указанные антитела можно получить из библиотек, содержащих сочетания областей VH и VL в форме scFv или Fab. Области VH и VL могут кодироваться нуклеотидами, которые являются синтетическими, частично синтетическими или полученными из природных источников. Настоящее изобретение можно осуществить при помощи библиотек фагового дисплея, которые содержат фрагменты антител человека. Другие источники антител человека включают трансгенных мышей, модифицированных для экспрессии генов иммуноглобулинов человека. Согласно одному варианту реализации для получения антител применяют экспрессию нуклеиновой кислоты, кодирующей антитело согласно настоящему изобретению, в организме трансгенного животного, которому ввели существенную часть генома, продуцирующего антитело человека, и которое дефектно по выработке эндогенных антител. Трансгенные животные включают мышей, коз и кроликов, но не ограничиваются ими. Еще один вариант реализации настоящего изобретения включает экспрессию кодирующего антитело гена, например, в молочных железах животного для секреции полипептида в ходе лактации. Распространенный способ получения "гуманизированных" антител - это прививка последовательностей CDR из МАТ (полученных путем иммунизации грызуна-хозяина) в остов Ig человека и трансфек-7 021600 ция указанных химерных генов в клетки яичника китайского хомячка (СНО), которые, в свою очередь,будут вырабатывать функциональное антитело, секретируемое клетками СНО. Ясно, что остатки аминокислот, являющиеся основными детерминантами связывания однодоменных антитела, могут входить в состав CDR, определенных по Kabat или Chothia, но могут также включать и другие остатки, например остатки, которые могут быть в другом случае были бы заглублены в границе VH-VL гетеродимера VH-VL. Белок, применяемый для идентификации CSF-1R-связывающих антител согласно настоящему изобретению, предпочтительно представляет собой CSF-1R и более предпочтительно - внеклеточный доменCSF-1R. Внеклеточный домен CSF-1R может не содержать другой молекулы или может быть конъюгирован с другой молекулой. Антитела согласно настоящему изобретению могут быть соединены с дополнительными остатками аминокислот. Такие остатки аминокислот могут быть пептидной меткой, возможно, облегчающей выделение части FC Ig для оптимизации димеризации. Также рассматриваются другие остатки аминокислот для хоминга антител в специфических органах или тканях. Фрагменты антител можно получить путем расщепления целого антитела или путем экспрессии ДНК, которая кодирует указанный фрагмент. Фрагменты антител можно приготовить при помощи способов, описанных у Lamoyi et al., J. Immunol. Methods. 56:235-243 (1983) и у Parham, J. Immunol. 131:2895-2902 (1983). Такие фрагменты могут содержать один или более фрагментов F(ab')2. Также такие фрагменты могут содержать одноцепочечные фрагменты вариабельных областей антител, т.е. scFv, диатела или другие фрагменты антител. Способы получения таких функциональных эквивалентов раскрыты в публикации заявки на Европейский патентЕР 239400 (Winter); публикации в соответствии с РСТWO 89/09622 (Hann, et al.); публикации заявки на Европейский патентЕР 338745 (Owens, et al.) и публикации заявки на Европейский патент 332424 (Beldler, et al.). В данном описании термин "антитела" согласно настоящему изобретению включает любые их фрагменты, независимо от того, есть в отношении этого особое указание. Предпочтительными клетками-хозяевами для трансформации векторов и экспрессии антител согласно настоящему изобретению являются клетки млекопитающих, например клетки NS0 (несекретирующие (0) клетки миеломы мыши), 293, SP20 и СНО, а также другие линии клеток лимфоидного происхождения, такие как клетки лимфомы, миеломы или гибридомы. В качестве альтернативы можно применять клетки других эукариот, таких как дрожжи. Антитела согласно настоящему изобретению можно выделить или очистить любыми способами,известными в данной области техники, включая осаждение сульфатом аммония или сульфатом натрия,после которого проводят диализ с физиологическим раствором, ионообменную хроматографию, аффинную или иммуноаффинную хроматографию, а также гель-фильтрацию или зональный электрофорез. Предпочтительным способом очистки антител согласно настоящему изобретению является аффинная хроматография с белком А. ДНК, кодирующую антитела человека, можно получить из рекомбинантной ДНК, кодирующей константные области человека и вариабельные области, отличные от CDR, полученных в существенной степени или исключительно из соответствующих областей антител человека, и ДНК, кодирующей CDR,полученной из антител человека. Подходящие источники ДНК, кодирующей фрагменты антител, включают любые клетки, такие как гибридомы и клетки селезенки, которые экспрессируют полноразмерное антитело. Указанные фрагменты можно применять сами по себе в качестве эквивалентов антител или их можно рекомбинировать в эквиваленты, как описано выше. Рекомбинацию ДНК и другие методики, описываемые в настоящем описании, можно реализовывать при помощи известных способов. Другим источником ДНК является библиотека отображения фагов, которая известна в технике. Кроме того, согласно настоящему изобретению предложены векторы экспрессии, содержащие последовательности описанных выше полинуклеотидов, функционально связанные с регуляторной последовательностью, такой как последовательность экспрессии, последовательность промотора и/или энхансера. Были разработаны различные векторы экспрессии для эффективного синтеза полипептидов антител в прокариотических системах, таких как бактерии, и эукариотических системах, включая системы на основе культуры клеток дрожжей и млекопитающих, но не ограничиваясь ими. Векторы согласно настоящему изобретению могут содержать сегменты последовательностей хромосомной, внехромосомной и синтетической ДНК. Можно применять любые подходящие векторы экспрессии. Например, клонирующие векторы прокариот включают плазмиды из Е.coli, такие как colE1, pCR1, pBR322, pMB9, pUC, pKSM и RP4. Также векторы прокариот включают производные фагов, такие как М 13 и другие нитевидные одноцепочечные ДНК-фаги. Примером вектора, применяемого у дрожжей, может служить плазмида 2. Подходящие векторы для экспрессии в клетках млекопитающих включают хорошо известные производные SV-40, CMV(цитомегаловируса), аденовируса, полученные из ретровируса последовательности ДНК, и бифункциональные векторы, полученные путем комбинирования функциональных векторов млекопитающих, таких как векторы, описанные выше, и функциональных плазмид и ДНК фагов. В технике известны и другиеScahill et al., Proc. Nat'l Acad. Sci. USA 80:4654-59 (1983); Urlaub and Chasin, Proc. Nat'l Acad. Sci. USA,77:4216-20) (1980). Векторы экспрессии, которые можно применять в рамках настоящего изобретения, содержат по меньшей мере одну последовательность для регуляции экспрессии, которая функционально связана с последовательностью или фрагментом ДНК, которые требуется экспрессировать. Указанную регуляторную последовательность вводят в вектор в целях регулирования экспрессии клонированной последовательности ДНК. Примеры применимых последовательностей, регулирующих экспрессию, включаютlac-систему, trp-систему, tac-систему, trc-систему, области главного оператора и промотора фага лямбда,регуляторную область белка козы fd, промоторы генов гликолиза у дрожжей, например, промотор 3-фосфоиназы, промоторы кислой фосфатазы дрожжей, например, Pho5, промоторы факторов спаривания альфа у дрожжей и промоторы, полученные из полиомы, аденовируса, ретровируса и вируса обезьян,например ранние и поздние промоторы или SV40, и другие последовательности с установленными свойствами регуляции экспрессии генов прокариотических или эукариотических клеток и их вирусов, или их сочетания. В тех случаях, когда желательно экспрессировать генный конструкт в дрожжах, подходящим геном селекции для применения в дрожжах является ген trpl, присутствующий в плазмиде дрожжей YRp7. Генtrp1 обеспечивает наличие селектируемого маркера для мутантного штамма дрожжей, утратившего способность к росту на триптофане, например 44076 в АТСС (Американской коллекции типовых культур). Наличие повреждения trp1 в геноме клеток-хозяев дрожжей в дальнейшем обусловливает эффективное окружение для выявления трансформации на основании роста в отсутствии триптофана. Аналогично, штаммы дрожжей, дефицитные по Leu2 (ATCC 20 622 или 38 626), дополняют известными плазмидами, содержащими ген Leu2. Также согласно настоящему изобретению предложены рекомбинантные клетки-хозяева, содержащие рекомбинантные векторы, которые описывались выше. Антитела согласно настоящему изобретению можно экспрессировать в линиях клеток, отличных от гибридом. Для трансформации подходящих клеток-хозяев млекопитающих можно применять нуклеиновые кислоты, которые содержат последовательность, кодирующую полипептид согласно настоящему изобретению. Наиболее предпочтительные линии клеток выбирают на основании высокого уровня экспрессии, конститутивной экспрессии рассматриваемого белка и минимального загрязнения белками клетки-хозяина. Линии клеток млекопитающих, подходящие в качестве хозяев для экспрессии, хорошо известны в технике и включают многие бессмертные линии клеток, такие как клетки COS-7, клетки яичника китайского хомячка (СНО), клетки почек новорожденного хомячка (ВНК) и многие другие линии лимфоидного происхождения, такие как клетки лимфомы, миеломы или гибридомы, но не ограничиваясь ими. Дополнительные подходящие клетки эукариот включают дрожжи и другие грибы. Применимые клетки-хозяева прокариот включают, например,Е.coli, такие как Е.coli SG-936, Е.coli НВ 101, Е.coli W3110, Е.coli X1776, Е.coli X2282, Е.coli DHI и Е.coliMRCl, Pseudomonas, Bacillus, такие как Bacillus subtilis и Streptomyces. Указанные рекомбинантные клетки-хозяева можно применять для получения антитела или его фрагмента посредством культивирования клеток в условиях, допускающих экспрессию указанного антитела или его фрагмента, и очистки указанного антитела или его фрагмента от клетки-хозяина или среды,окружающей клетку-хозяина. Направленную доставку экспрессируемого антитела или его фрагмента для секреции из рекомбинантных клеток-хозяев можно стимулировать посредством введения последовательности, кодирующей сигнальный или секреторный лидерный пептид, на 5'-конце кодирующего антитело гена. Такие элементы, соответствующие секреторному лидерному пептиду, можно получить из последовательностей прокариот либо эукариот. Соответственно, применяют подходящие секреторные лидерные пептиды, которые представляют собой аминокислоты, присоединенные к N-концу полипептида для направленного выхода указанного полипептида из цитозоля клетки-хозяина и его секреции в среду. Трансформированные клетки-хозяева культивируют с использованием способов, известных в технике, в жидкой среде, содержащей усваиваемые источники углерода (углеводы, такие как глюкоза или лактоза), азота (аминокислоты, пептиды, белки или продукты их расщепления, такие как пептоны, соли аммония или подобные) и неорганических солей (сульфаты, фосфаты и/или карбонаты натрия, калия,магния и кальция). Также указанная среда содержит, например, способствующие росту вещества, такие как микроэлементы, например железо, цинк, марганец и подобные. Также согласно настоящему изобретению предложен способ лечения опухолевого роста у млекопитающих, основанный на введении указанному млекопитающему эффективного количества антитела. Патологические состояния, которые можно лечить согласно настоящему изобретению, сопряжены с наличием клеток, экспрессирующих CSF-1R. Хотя настоящие способы не предполагают связи с каким-либо конкретным механизмом, они обеспечивают средство против раковых клеток, например включая состояния, при которых рост новообразований, метастазирование в кости, отторжение трансплантата органов или иммунные нарушения, например аутоиммунные заболевания, стимулируются через CSF-1R. Термины "лечение" или "лечить" в контексте настоящего изобретения относятся к терапевтическому лечению, включая угнетение, замедление, ослабление или обращение прогрессирования основного заболевания или нежелательного физиологического изменения, ассоциированного с заболеванием или нарушением, облегчение клинических симптомов патологического состояния или предупреждение симптомов указанного состояния. Полезные или желаемые клинические результаты включают облегчение клинических симптомов патологического состояния или предупреждение появления клинических симптомов указанного состояния, снижение выраженности заболевания или нарушения, стабилизацию заболевания или нарушения (т.е. когда указанное заболевание или нарушение не усугубляется), отсрочивание или замедление прогрессирования заболевания или нарушения, облегчение или смягчение заболевания или нарушения и ремиссию (частичную либо полную) заболевания или нарушения, выявляемые или невыявляемые. Также термин "лечение" может обозначать продление выживания по сравнению с ожидаемым выживанием при отсутствии лечения. Субъекты, нуждающиеся в лечении, включают субъектов,которые уже страдают указанным заболеванием. Согласно одному варианту реализации настоящее изобретение можно применять в качестве лекарственного препарата. Способы согласно настоящему изобретению основаны на введении терапевтически эффективного количества антитела согласно настоящему изобретению млекопитающему или пациенту, нуждающемуся в нем. Кроме того, фармацевтические композиции согласно настоящему изобретению могут включать терапевтически эффективное количество анти-CSF-1R антитела согласно настоящему изобретению. Термин "терапевтически эффективное количество" относится к количеству, позволяющему достичь желаемого терапевтического результата при необходимых дозировках и периодах времени. Терапевтически эффективное количество антитела может варьировать в зависимости от таких факторов, как стадия заболевания, возраст, пол и масса субъекта и способность указанного антитела или его части вызывать желаемую реакцию у указанного субъекта. К другим факторам можно отнести путь введения, органмишень, физиологическое состояние пациента, является ли пациент человеком или животным, другие вводимые препараты, и является ли данное воздействие профилактическим или лечебным. Хотя антитела человека согласно настоящему изобретению особенно полезны при введении их человеку, их также можно вводить и другим млекопитающим. В настоящем описании термин "млекопитающее" должен включать людей, лабораторных животных, домашних животных и сельскохозяйственных животных, но не ограничивается ими. Терапевтически эффективное количество также подразумевает такое количество,при котором любые токсическое или вредное действие указанного антитела или части антитела менее значимо, чем терапевтически полезные эффекты. Для обеспечения оптимального желаемого эффекта (например, терапевтического или профилактического эффекта) можно корректировать режим введения средства. Для оптимизации безопасности и эффективности можно титровать дозировки лекарственного средства при помощи стандартных способов,известных специалистам в данной области техники. Режимы введения средства обычно варьируют в диапазоне от однократной дозы в форме болюса или непрерывной инфузии до многократного введения в течение дня (например, каждые 4-6 ч) или зависят от назначения лечащего врача и состояния пациента. Примерный, не накладывающий ограничений, диапазон терапевтически эффективных количеств антитела согласно настоящему изобретению составляет 0,1-50 мг/кг, более предпочтительно 3-35 мг/кг и более предпочтительно 5-20 мг/кг. Дозировки и частоту введения определяет лечащий врач пациента, и они могут включать дозы от менее 1 до более 100 мг/кг раз в день, три раза в неделю, раз в неделю, раз в две недели или реже. Однако следует иметь в виду, что настоящее изобретение не ограничивается какойлибо конкретной дозой. Анти-CSF-1R антитела можно вводить в сочетании с одним или более другими противораковыми средствами, включая антиангиогенный агент, химиотерапевтический агент или антинеопластический агент, но не ограничиваясь ими. Можно применять любое подходящее средство лечения рака, такое как химиотерапевтический агент, облучение, антитело или их сочетание. Противораковые средства включают антинеопластические агенты, антитела, адъюванты и пролекарства. Антинеопластические агенты, которые в настоящее время известны в технике или в настоящее время проходят оценку, можно подразделить на несколько классов, включая, например, ингибиторы митоза, алкилирующие агенты, антиметаболиты, интеркалирующие антибиотики, ингибиторы факторов роста, ингибиторы клеточного цикла, ферменты, ингибиторы топоизомеразы, препараты против приживления, модификаторы биологического отклика, антигормоны и препараты против ангиогенеза. Примеры алкилирующих агентов включают цисплатин, циклофсофамид, мелфалан и дакарбазин, но не ограничиваются ими. Примеры антиметаболитов включают доксорубицин, даунорубицин, паклитаксел, гемцитабин, ALIMTA и ингибиторы топоизомеразы - иринотекан (СРТ-11), аминокамптотецин, камптотецин,DX-8951f, топотекан (топоизомераза I), этопозид (VP-16) и тенипозид (VM-26) (топоизомераза II), но не ограничиваются ими. Когда анитинеопластичесим средством лечения является облучение, источник излучения может быть либо внешним (наружная дистанционная лучевая терапия - EBRT), либо внутренним (близкофокусная лучевая терапия - ВТ) по отношению к пациенту, которого лечат. Доза вводимого антибластомного препарата зависит от разных факторов, включая, например, тип препарата, тип и тяжесть опухоли, которую лечат, и путь введения указанного препарата. Однако следует подчеркнуть, что настоящее изобретение не ограничивается какой-либо конкретной дозой. Согласно одному аспекту предпочтительным антинеопластическим агентом согласно настоящему изобретению является доцетаксел. Согласно другому аспекту настоящего изобретения предпочтительными антинеопластическими агентами являются паклитаксел, герцептин и доксорубицин. Анти-CSF-IR антитела согласно настоящему изобретению можно вводить с антителами, которые нейтрализуют другие рецепторы, участвующие в росте опухоли или ангиогенезе. Согласно одному варианту реализации настоящего изобретения анти-CSF-1R антитело применяют в сочетании с антагонистом рецептора, который специфически связывается с рецептором Her2. Другим примером такого рецептора является VEGFR (рецептор фактора роста эндотелия сосудов). Анти-CSF-IR антитело можно применять в сочетании с антагонистом VEGFR. Анти-CSF-IR антитело также можно вводить в сочетании с одним или более подходящих адъювантов, например, таких как цитокины (например, IL-10, IL-4 и IL-13) или другие иммунные стимуляторы, такие как хемокины, опухолеспецифические антигены и пептиды, но не ограничиваясь ими. Согласно настоящему изобретению можно применять любой подходящий способ или путь введения для введения анти-CSF-1R антител, и по выбору, для совместного введения антинеопластических препаратов и/или антагонистов других рецепторов. При комбинированной терапии согласно настоящему изобретению анти-CSF-1R антитело можно вводить до, во время, по существу, одновременно или после начала терапии другим средством, включая доцетаксел, паклитаксел, герцептин или доксорубицин, а также их сочетание, но не ограничиваясь ими. Режимы введения антинеопластических препаратов согласно настоящему изобретению включают любой режим, который считают оптимальным для лечения новообразования у пациента. Разные злокачественные опухоли могут требовать применения специфических направленных против опухоли антител и специфических антибластомных агентов, что определяется индивидуально для каждого пациента. Пути введения включают, например, пероральное, внутривенное,внутрибрюшинное, подкожное или внутримышечное введение. Доза вводимого антагониста зависит от разных факторов, включая, например, тип антагониста, тип и тяжесть опухоли, которую лечат, и путь введения указанных антагонистов. Однако следует подчеркнуть, что настоящее изобретение не ограничивается каким-либо конкретным способом или путем введения. Для применения у млекопитающего в целях профилактики или лечения анти-CSF-1R антитела согласно настоящему изобретению предпочтительно преобразовывать в фармацевтическую композицию. Такие фармацевтические композиции и способы их получения тождественны хорошо известным в данной области техники. Например, см. Remenigton: The Science and Practice of Pharmacy (Gennaro A., et al.,eds., 19th ed., Mack Publishing Co., 1995). Согласно другому аспекту настоящего изобретения данные антитела можно вводить совместно, в химической или биосинтетической связи с противораковыми агентами, антинеопластическими агентами,препаратами против ангиогенеза, или препаратами, дающими различимый сигнал. Противоопухолевые агенты, связанные с антителом, включают любые агенты, которые разрушают или повреждают новообразованные сосуды или опухоль, или макрофаги, с которыми связалось указанное антитело, или окружение клетки, с которым связалось указанное антитело. Настоящее изобретение может включать анти-CSF-1R антитело в виде конъюгата, включая иммуноконъюгат, который специфически связывается с рецептором и доставляет токсин посредством интернализации комплекса лиганд-токсин, но не ограничиваясь им. Указанный конъюгат антитело-препарат может непосредственно конъюгировать посредством линкера, пептидного или непептидного. Например, противоопухолевый препарат или препарат против макрофагов являются токсичными препаратами, такими как антинеопластические агенты или радиоизотоп. Подходящие антинеопластические агенты, включая химиотерапевтические агенты, известны специалистам в данной области техники и обсуждаются далее. Также в настоящем изобретении рассматриваются анти-CSF-1R антитела, связанные с целевыми компонентами или компонентами-репортерами,включая только в качестве примера антинеопластические агенты, другие антитела или репортеры, такие как радиоизотопы, в диагностической системе, в которой препарат, дающий различимый сигнал, конъюгирован с указанным антителом. Согласно настоящему изобретению способ подавления ангиогенеза включает введение композиции,содержащей антитело или фрагмент антитела согласно настоящему изобретению, млекопитающему в течение времени и в количестве, которые эффективны для подавления ангиогенеза. Аналогично, указанные антитела и фрагменты антител можно применять при реализации способов подавления метастазирования опухоли у млекопитающего путем введения композиции, содержащей антитело или фрагмент антитела согласно настоящему изобретению, в течение времени и в количестве, которые эффективны в отношении подавления метастазирования опухоли. Согласно настоящему изобретению способ подавления инфильтрации макрофагов в строму опухоли включает введение композиции, содержащей антитело или фрагмент антитела согласно настоящему изобретению, млекопитающему в течение времени и в количестве, которые эффективны в отношении подавления эффектов макрофагов на рост опухоли. Аналогично, указанные антитела и фрагменты антител можно применять при реализации способов сокращения эрозий костной ткани и метастазирования опухоли у млекопитающего путем введения композиции, содержащей антитело или фрагмент антитела согласно настоящему изобретению, в течение времени и в количестве, которые эффективны в отношении подавления эрозии костной ткани. Согласно настоящему изобретению предложено применение лиганда CSF-1R (CSF-1 или IL-34) в качестве биологического маркера в крови, сыворотке, плазме, клетках опухоли или циркулирующих клетках опухоли пациентов, страдающих раком, которые реагируют на лечение, когда в указанной опухоли ассоциированные с ней макрофаги экспрессирует на своей поверхности CSF-1R. Также согласно настоящему изобретению предложен способ прогнозирования успешности лечения пациента антителом или фрагментом антитела согласно настоящему изобретению на основании измерения уровня CSF-1R в пробе, где указанную пробу выбирают из группы, включающей сыворотку, плазму, клетки опухоли или циркулирующие клетки опухоли. Еще одним аспектом настоящего изобретения является способ лечения рака у пациента, включающий следующие этапы:(1) измерение уровня CSF-1 в пробах, отобранных у пациента, где указанную пробу выбирают из группы, включающей сыворотку, плазму, клетки опухоли или циркулирующие клетки опухоли; и(2) введение указанному пациенту антитела или его фрагмента согласно настоящему изобретению,если уровень CSF-1 выше, чем уровень CSF-1, определяемый у контрольной популяции. Также в настоящем изобретении предусмотрен способ прогнозирования успешности лечения пациента антителом или фрагментом антитела согласно настоящему изобретению на основании измерения уровня IL-34 в пробе, где указанную пробу выбирают из группы, включающей сыворотку, плазму, клетки опухоли или циркулирующие клетки опухоли. Еще одним аспектом настоящего изобретения является способ лечения рака у пациента, включающий следующие этапы:(1) измерение уровня IL-34 в пробах, отобранных у пациента, где указанную пробу выбирают из группы, включающей сыворотку, плазму, клетки опухоли или циркулирующие клетки опухоли; и(2) введение указанному пациенту антитела или его фрагмента согласно настоящему изобретению,если уровень IL-34 выше, чем уровень IL-34, определяемый у контрольной популяции. Также согласно настоящему изобретению предложен способ определения, является ли субъект,страдающий раком, кандидатом на противораковую терапию с применением анти-CSF-1R антител, где указанное антитело - это антитело согласно настоящему изобретению, способ, включающий:(1) определение уровня CSF-1 ex vivo или in vitro в пробе пациента, где указанную пробу выбирают из группы, состоящей из крови, сыворотки, плазмы, опухолевых клеток и циркулирующих опухолевых клеток; и(2) повышение уровня CSF-1 по сравнению с уровнем CSF-1 у лиц, не страдающих раком, которое указывает на то, что указанный субъект является кандидатом на противораковую терапию с применением анти-CSF-1R антител. Также согласно настоящему изобретению предложен способ определения, является ли субъект,страдающий раком, кандидатом на противораковую терапию с применением анти-CSF-1R антител, где указанное антитело - это антитело согласно настоящему изобретению, включающий:(1) определение уровня IL-34 ex vivo или in vitro в пробе пациента, где указанную пробу выбирают из группы, состоящей из крови, сыворотки, плазмы, опухолевых клеток и циркулирующих опухолевых клеток; и(2) повышение уровня IL-34 по сравнению с уровнем IL-34 у лиц, не страдающих раком, которое указывает на то, что указанный субъект является кандидатом на противораковую терапию с применением анти-CSF-1R антител. Также согласно настоящему изобретению предложен способ определения, является ли субъект,страдающий раком, кандидатом на противораковую терапию с применением анти-CSF-1R антител, где указанное антитело - это антитело согласно настоящему изобретению, включающий:(1) определение уровня CSF-1 или IL-34, или их обоих ex vivo или in vitro в пробе пациента, где указанную пробу выбирают из группы, состоящей из крови, сыворотки, плазмы, опухолевых клеток и циркулирующих опухолевых клеток; и(2) повышение уровня CSF-1 или IL-34, или их обоих по сравнению с уровнем CSF-1 или IL-34, или их обоих у лиц, не страдающих раком, которое указывает на то, что указанный субъект является кандидатом на противораковую терапию с применением анти-CSF-1R антител. Уровень CSF-1 или IL-34 могут быть измерен разными способами, включая коммерческие наборы("RD Systems" для CSF-1 и "USCN Life Sciences, Inc." для IL-34). Согласно одной такой методике стандарты или пробы CSF-1 или IL-34 добавляют в планшет с предварительно нанесенными антителами кCSF-1 или IL-34 человека, что делает возможным связывание CSF-1 или IL-34 с указанными антителами. После отмывки не связавшихся CSF-1 или IL-34 и других белков добавляют вторичное антитело, которое распознает анти-CSF-l или анти-IL-34 антитело соответственно. Указанное вторичное антитело соединено с пероксидазой хрена, которая создает синеватое окрашивание при добавлении субстрата в указанные лунки. Интенсивность окраски зависит от количества CSF-1 или IL-34, находящихся в планшете. Поскольку CSF-1 или IL-34 существуют в организме здорового человека, базальный уровень CSF-1 или IL-34 необходимо определять у контрольной популяции. Такая контрольная популяция может включать группу субъектов, у которых не диагностировано онкологическое заболевание или признаки инфекции. Соответственно, в контрольной популяции определяют диапазон уровней CSF-1 или IL-34, который является нормальным или базальным для здоровых субъектов. Например, уровень CSF-1 в сыворотке пациентов с раком молочной железы или раком ободочной и прямой кишки выше на 68 или 77% соответственно, чем в сыворотке контрольных групп (Lawicki et al., Clin. Chim. Acta, 317:112-116 (2006);Mroczho et al., Clin. Chim. Acta, 380:208-212 (2007. Согласно одному аспекту настоящего изобретения уровень лиганда CSF-1R в пробах пациентов, страдающих раком, должен быть по меньшей мере на 50% выше, чем в пробах контрольной популяции. Диапазон уровней CSF-1 и/или IL-34 в контрольной популяции следует сравнивать с уровнем CSF-1 и/или IL-34, выявляемым в пробе или пробах пациентов, чтобы определить, выше ли уровень CSF-1 и/или IL-34 у пациента, чем базальный диапазон для контрольной популяции. Согласно одному аспекту антитела согласно настоящему изобретению применяют в лечении рака, в случае когда раковые клетки секретируют лиганд. Согласно другому аспекту антитела согласно настоящему изобретению следует применять в лечении рака, в случае когда раковые клетки секретируютCSF-1. Согласно еще одному аспекту антитела согласно настоящему изобретению следует применять для лечения рака, где раковые клетки секретируют IL-34. Также настоящее изобретение включает наборы для подавления роста опухоли и/или ангиогенеза,включающие терапевтически эффективное количество анти-CSF-1R антитела человека. Указанные наборы также могут включать указанное антитело или его фрагмент и дополнительный агент, включая дополнительные противораковые препараты, антинеопластические агенты или средства, включая доцетаксел, паклитаксел, герцептин или доксорубицин, но не ограничиваясь ими. В качестве альтернативы или дополнительно указанные наборы могут содержать любые подходящие антагонисты, например, рецепторов другого фактора роста, участвующих в онкогенезе или ангиогенезе, которые обсуждаются далее. Наборы согласно настоящему изобретению также могут включать адъювант. Соответственно, антитела к настоящему рецептору можно применять in vivo и in vitro для осуществления способов исследования, диагностики профилактики или лечения, которые хорошо известны в технике. Специалист в данной области техники может вносить видоизменения в принципы изобретения,раскрываемого здесь, и предполагается, что такие модификации должны включаться в область настоящего изобретения. Следует понимать и предполагается, что специалист в данной области техники может вносить изменения в принципы изобретения, раскрываемого здесь, и предполагается, что такие модификации также включены в область настоящего изобретения. Примеры Следующие примеры дополнительно иллюстрируют настоящее изобретение, но их не следует воспринимать в качестве ограничения объема настоящего изобретения и не предполагается, что они какимлибо образом ограничивают широкий объем настоящего изобретения. Подробное описание обычных методов, таких как методы конструирования векторов и плазмид, встраивания генов, кодирующих полипептиды, в такие векторы и плазмиды, введения плазмид в клетки-хозяева, а также способы экспрессии генов и продуктов генов и ее определения, можно найти в многочисленных публикациях, включая(1989) и Coligan, J. et al. Current Protocols in Immunology, WileySons, Incorporated (2007). Экспрессия и очистка анти-CSF-1R антител человека. Для каждого антитела встраивают соответствующую последовательность нуклеотидов для тяжелой цепи, например SEQ ID NO: 13 для антитела 1, в соответствующую экспрессионную плазмиду, например в pGSHC, и встраивают соответствующую последовательность нуклеотидов для легкой цепи, напримерSEQ ID NO: 14 для антитела 1, в соответствующую экспрессионную плазмиду, такую как pGSLC, с использованием соответствующего метода, такого как ПЦР-клонирование. Для получения стабильной линии клеток осуществляют совместную трансфекцию линии клеток-хозяев, таких как клетки NS0 или СНО, линеаризованными плазмидами для тяжелой и легкой цепей посредством электропорации и культивируют их в соответствующей среде, такой как модифицированная по способу Дульбекко среда Игла без глутамина с добавлением диализированной эмбриональной телячьей сыворотки и глутаминсинтетазы. Проводят скрининг клонов на экспрессию антител при помощи твердофазного иммуноферментного анализа (ELISA) и отбирают максимальных продуцентов для дальнейшего культивирования в роллерных колбах. Антитела очищают соответствующим методом, таким как аффинная хроматография с белком А. В табл. 1 приведены последовательности аминокислот и SEQ ID NO: для разных CDR антитела 1 согласно настоящему изобретению. Все последовательности CDR определены по правилам Kabat. В табл. 2 представлены SEQ ID NO для разных последовательностей, относящихся к настоящему изобретению. Последовательности нуклеиновых кислот, которые кодируют последовательности аминокислот,раскрываемые далее, также включены в объем настоящего изобретения. Таблица 1 Последовательность аминокислот антитела 1 CDR вариабельных областей тяжелых и легких цепей Таблица 2 Номера в перечне последовательностей для последовательностей аминокислот антитела 1 Анализ связывания методом твердофазного иммуноферментного анализа (ELISA). Для анализа связывания CSF-1R планшет на 96 лунок покрывают растворимым рекомбинантным гибридным белком CSF-1R человека-Fc ("RD Systems") (1 мкг/мл 100 мкл), закрывают планшет пленкой и инкубируют его в течение ночи при 4 С. Далее промывают указанные лунки 3 раза с применением ФСБ (фосфатно-солевого буфера), содержащего 0,2% Твин-20 (ФСБ/Т), затем блокируют лунки в течение 1 ч при комнатной температуре (20-25 С) (КТ) ФСБ, содержащим 3% бычьего сывороточного альбумина (БСА). Удаляют аспирацией смесь ФСБ-БСА и промывают планшеты трижды ФСБ/Т. Делают серийные разведения антитела 1 или контрольного IgG (начиная с 3 мкг/мл и разводят в 3 раза) и добавляют по 100 мкл в лунку, оставив их на 1 ч при КТ. Трижды промывают лунки ФСБ/Т. После промывки инкубируют планшет с 100 мкл конъюгата антитела к F(ab')2-фрагменту человека с пероксидазой хрена("Jackson ImmunoResearch") в ФСБ (разведение 1:5000) при КТ в течение 1 ч. Пять раз промывают планшеты ФСБ/Т и затем инкубируют со 100 мкл препарата субстрата пероксидазы ТМВ и раствора пероксидазы В (KPL) в соотношении 1:1 в течение 15 мин при КТ. Останавливают колориметрическую реакцию путем добавления 100 мкл 0,1 М H2SO4. Считывают данные при помощи ридера для микропланшетов на длине волны 450 нм. Анализируют данные о поглощении при помощи программы "GraphPad" и рассчитывают ED50. ED50 или половина максимально эффективной дозы - это доза, которая обеспечивает 50% максимального связывания.ED50 для связывания антитела 1 с CSF-1R человека составляет 8,710-11 М, т.е. 0,09 нМ. Антитело 1 проявляет сильное связывание с CSF-1R. Анализ блокирования методом твердофазного иммуноферментного анализа (ELISA).ELISA для демонстрации того, что антитела блокируют взаимодействие CSF-1/CSF-1R. Титрационный микропланшет на 96 лунок покрывают CSF-1R (0,5 мкг/мл 100 мкл) ("RDSystems") и инкубируют его в течение ночи при 4 С. Далее трижды промывают указанные лунки ФСБ/Т,затем блокируют 100 мкл 3% БСА/ФСБ в течение 1 ч при КТ. Повторно промывают 3 раза ФСБ/Т. Разводят растворимый гибридный белок rh-CSF-1R человека-Fc ("RD Systems") до конечной концентрации 0,250 мкг/мл в ФСБ. Одновременно разводят антитело 1 в ФСБ до конечной концентрации 200 нМ. Делают серийные разведения антитела в соотношении 1:3 от исходной концентрации 200 нМ до 310-12 М. Объединяют 100 мкл rh-CSF-1R-Fc со 100 мкл каждого из разведений антитела 1 и инкубируют в течение 30 мин при КТ. Далее инкубируют 100 мкл смеси антитела 1: CSF-1R-Fc в течение 1 ч при КТ в лунках,покрытых CSF-1. После инкубации в течение 1 ч при КТ промывают лунки 3 раза ФСБ/Т и добавляют разведение 1:5000 анти-hIgG-Fc-антитела, конъюгированного с HRP, в планшеты и инкубируют их в течение 1 ч при КТ. Пять раз промывают планшеты ФСБ/Т и затем инкубируют со 100 мкл препарата субстрата пероксидазы ТМВ и раствора пероксидазы В (KPL) в соотношении 1:1 в течение 15 мин при КТ. Останавливают колориметрическую реакцию путем добавления 100 мкл 0,1 М H2SO4. Регистрируют данные на ридере для микропланшетов на длине волны 450 нм. Анализируют данные о поглощении при помощи программы "GraphPad Prism" и рассчитывают IC50. IC50 или половина максимально ингибирующей концентрации - это концентрация, которая обеспечивает 50% максимального ингибирования связывания лиганда с рецептором.IC50 для связывания антитела 1 с CSF-1R человека составляет 8,110-10 М, т.е. 0,81 нМ. Антитело 1 ингибирует связывание CSF-1 с CSF-1R и тем самым предотвращает активацию CSF-1R лигандом CSF-1.ELISA для демонстрации того, что антитела блокируют взаимодействие IL-34/CSF-1R. Титрационный микропланшет на 96 лунок покрывают IL-34 (0,5 мкг/мл 100 мкл) ("RD Systems") и инкубируют его в течение ночи при 4 С. Далее трижды промывают указанные лунки ФСБ/Т, затем блокируют 100 мкл 3% БСА/ФСБ в течение 1 ч при КТ. Повторно промывают 3 раза ФСБ/Т. Разводят растворимый гибридный белок rh-CSF-1R человека-Fc ("RD Systems") до конечной концентрации 0,250 мкг/мл в ФСБ. Одновременно разводят антитело 1 в ФСБ до конечной концентрации 200 нМ. Делают серийные разведения антитела 1 в соотношении 1:3 от исходной концентрации 200 нМ до 310-12 М. Объединяют 100 мкл rh-CSF-1R-Fc со 100 мкл каждого из разведений антитела 1 и инкубируют в течение 30 мин при КТ. Далее инкубируют 100 мкл смеси антитела 1:CSF-1R-Fc в течение 1 ч при КТ в лунках, покрытых IL-34. После инкубации в течение 1 ч при КТ промывают лунки 3 раза ФСБ/Т и добавляют разведение 1:5000 анти-hIgG-Fc-антитела, конъюгированного с HRP, в планшеты, и инкубируют их в течение 1 ч при КТ. Пять раз промывают планшеты ФСБ/Т и затем инкубируют со 100 мкл препарата субстрата пероксидазы ТМВ и раствора пероксидазы В (KPL) в соотношении 1:1 в течение 15 мин при КТ. Останавливают колориметрическую реакцию путем добавления 100 мкл 0,1 М H2SO4. Регистрируют данные на ридере для микропланшетов на длине волны 450 нм. Анализируют данные о поглощении при помощи программы "GraphPad Prism" и рассчитывают IC50. IC50 или половина максимально ингибирующей концентрации - это концентрация, которая приводит к 50% максимального ингибирования связывания лиганда с рецептором.IC50 для связывания антитела 1 с CSF-1R человека составляет 7,0-10 М, т.е. 0,71 нМ. Антитело 1 ингибирует связывание IL-34 с CSF-1R и тем самым предотвращает активацию CSF-1R лигандом IL-34. Анализ кинетики связывания при помощи поверхностного плазмонного резонанса/анализаBiacore. Кинетику связывания антитела 1 с CSF-1R-Fc измеряют при 25 С на биосенсоре Biacore 2000 SPR("GE Healthcare"). Иммобилизуют растворимый гибридный белок CSF-1R-Fc (в концентрации 10 мкг/мл и рН 5) в диапазоне от 395 до 1200 единиц ответа на чипе СМ 5 с применением стандартного протокола присоединения аминов. Во время измерений аффинности связывания в качестве подвижного буфера используют HBS-EP (0,01 Н HEPES (рН 7,4), 0,15 мМ NaCl и 3 мМ EDTA, 0,05% (объемные проценты) поверхностно-активного вещества Р 20). Проводят анализ взаимодействия с введением антител в растворе в концентрациях от 1,5 до 100 нМ на подготовленную поверхность сенсорного чипа СМ 15. Антитела вводят в течение 3 мин для связывания и оставляют диссоциировать в течение 15 мин. Проводят регенерацию иммобилизованного белка путем введения 20 мМ соляной кислоты со скоростью 10 мкл/мин. Для определения Ka (kon) и Kd (koff) образования комплекса используют программу "BIAevaluation", версия 4.1, и одновременно проводят общую аппроксимацию данных в соответствии с моделью Ленгмюра 1:1. Рассчитывают константу равновесия для связывания (KA) как отношение 1/KD, измеряемое в молях(1/М). Рассчитывают константу равновесия для диссоциации (KD) как отношение Kd/Ka, измеряемое в молях (М). Средние значения для Ka, Kd и KD для нескольких анализов Biacore для связывания антитела 1 сCSF-1R в обобщенном виде представлены в табл. 3. Таблица 3 Кинетика связывания антитела с рекомбинантным CSF-1R человека Антитело 1 демонстрирует высокую аффинность связывания с CSF-1R. Фосфорилирование CSF-1R, определяемое методом вестерн-блоттинга. Клетки NIH3T3, стабильно трансфицированные CSF-1R, высевают в планшет на 12 лунок с плотностью 5105 клеток/лунку в лунке объемом 1 мл, заполненной модифицированной по способу Дульбекко средой Игла (DMEM), содержащей 10% эмбриональной телячьей сыворотки (ЭТС) и 1 мг/мл генетицина; инкубируют планшет в течение 5 ч. Дважды промывают монослои ФСБ и культивируют в течение ночи в 0,9 мл/лунку DMEM с 1% ЭТС. Делают серийные разведения антитела 1 в DMEM (начиная с 1 мкг/мл и разводя в 3 раза) и добавляют по 100 мкл на лунку; инкубируют в течение 2 ч при 37 С. Стимулируют клетки с применением 100 нг/мл лиганда CSF-1 или IL-34 в течение 10 мин, а затем кладут на лед и промывают ледяным ФСБ. Клетки лизируют в 100 мкл 50 мМ HEPES (рН 7,5 150 мМ NaCl, 0,5% Тритона Х 100, 1 мМ Na3VO4, 10 мМ NaPPi, 50 мМ NaF) и с добавлением таблетки ингибиторов протеаз ("Roche") на льду в течение 10 мин. Очищают лизат от лизированных клеток путем центрифугирования при 4 С. Загружают 20 мкл лизата на денатурирующий гель для проведения электрофореза и проводят блоттинг на нитроцеллюлозной мембране. Определяют фосфорилированный по тирозину CSF-1R на блоте с применением антифосфо-CSF-1R антитела в концентрации 1 мкг/мл ("Cell Signaling"). Определить передачу сигнала с CSF-1R путем анализа блоттинга антителами либо антифосфо-MAPK (разведение 1:500), либо антифосфо-Akt (1:1000) ("Cell Signaling"). Чтобы гарантировать одинаковую загрузку на дорожки, анализируют блот с использованием анти-CSF-1R антител (1 мкг/мл; "RD Systems") или антител к актину(1:2000; "Sigma"). Инкубируют все первичные антитела на качалке в течение 1 ч при КТ; после чего добавляют соответствующее вторичное антитело, конъюгированное с пероксидазой хрена, и инкубируют также при встряхивании в течение 1 ч при КТ. Визуализируют полосы при помощи хемилюминесцентно- 15021600 го реагента ("GE Healthcare"). Клетки NIH-3T3, стабильно трансфицированные CSF-1R, демонстрируют быстрое фосфорилирование CSF-1R при их стимуляции либо CSF-1, либо IL-34. Присутствие антитела-1 приводит к ингибированию фосфорилирования CSF-1R, даже когда уровень антител составляет 1 мМ, что указывает на то, что связывание антитела 1 с CSF-1R препятствует активации указанного рецептора как CSF-1, так и IL-34. Ингибирование фосфорилирования CSF-1R также приводит к снижению фосфорилирования сигнальных молекул, применяемых в сигнальном пути CSF-1 или IL-34. И для Akt, и для MAPK, которые в сигнальном пути стоят после CSF-1R, уровень фосфорилирования снижается, когда клетки инкубируют со 100-1 нМ антитела 1. Следовательно, антитело 1 препятствует активации CSF-1R и активации каскада киназ, который включается вслед за стимуляцией CSF-1R. Различий в уровне белка для актина и CSF-1R между дорожками не было, что подтверждается одинаковым сигналом хемилюминесценции на каждой дорожке, выявляемым, когда блоты тестировали с антителами к указанным молекулам. Следовательно,ингибирование фосфорилирования CSF-1R возникает не вследствие технических трудностей, связанных с неравномерной загрузкой белковых проб, а является истинным отражением снижающегося сигнала. Анализ интернализации и разрушения. Антитело 1 вызывает интернализацию рецептора CSF-1R. Клетки NIH-3T3-CSF-1R высевают на предметные стекла, заключенные в камеру, на 8 лунок("Nunc") и инкубируют при 37 С до тех пор, пока клетки не покроют 50% площади поверхности лунок. Перед началом эксперимента охлаждают предметные стекла до 4 С в суспензионной смеси воды и льда. Инкубируют клетки с 5 мкг/мл антитела 1 и сразу же переносятся в температуру 37 С, где выдерживают от 15 мин до 4 ч, чтобы произошла интернализация. В качестве контроля проводят инкубацию отдельного набора предметных стекол в суспензионной смеси воды и льда в течение 15 мин-4 ч с 5 мкг/мл антитела 1. Инкубация при 4 С препятствует интернализации рецептора CSF-1, следовательно, любой сигнал в указанных клетках будет артефактом. После инкубации дважды промывают клетки ФСБ, после чего фиксируют клетки при помощи ледяного 1% параформальдегида в течение 15 мин. После трехкратной промывки холодным ФСБ пермеабилизируют клетки в ФСБ, содержащем 0,5% сапонина и 1% БСА, в течение 5 мин, затем повторно промывают в ФСБ, содержащем 1% БСА. В течение 1 ч проводят мечение антителом козы Су 3 против IgG человека (разведение 1:5000), которое будет служить флуоресцентной меткой антитела 1. Проводят окончательную трехкратную промывку с применением ФСБ, после чего помещают в среду GelMount ("Biomeda") и накрывают полученные препараты покровными стеклами. Антитело 1 с флуоресцентной меткой можно наблюдать визуально под микроскопом, чтобы определить клеточную локализацию в разных условиях, описанных выше. При микроскопическом исследовании антитело 1 в препаратах при 4 С перед началом эксперимента видно на периферии клетки. Перевод клеток в температуру 37 С создает возможность быстрой интернализации комплекса антитело 1/CSF-1R, которую обычно можно увидеть через 15 мин. После инкубации с антителом 1 в течение 1 или 2 ч все комплексы антитело 1/CSF-1R переходят в перинуклеарную область, и лишь очень маленькая часть видна на плазматической мембране, что указывает на то, что связывание антитела 1 с CSF-1R вызывает быструю интернализацию рецептора и его удержание внутри клетки. Клетки, инкубируемые в течение 2 ч при 4 С, демонстрируют только периферическое окрашивание клетки, и интернализации антитела 1 не происходит. Таким образом, интернализация антитела/CSF1R является АТФ-зависимым процессом, который происходит в течение 15 мин после добавления антитела к клеткам. Антитело 1 вызывает разрушение рецептора CSF-1R. Клетки NIH-3T3-CSF-1R высевают с плотностью 5105 клеток/лунку в планшеты на 12 лунок в 1 мл среды DMEM, содержащей 10% ЭТС м 1 мг/мл геницитина. После инкубации клеток в течение 5 ч при 37 С в планшет добавляют либо 100 нг/мл CSF-1, либо 15 мкг/мл антитела 1. Известно, что CSF-1 вызывает интернализацию и разрушение CSF-1R, следовательно, он может выступать в качестве положительного контроля в данном эксперименте. Перед сбором клеток оставляют их на 1 и 5 ч, чтобы CSF-1 в течение указанного времени оставался в клетках. Для других лунок перед сбором клеток инкубируют их в течение 24 и 48 ч с антителом 1. Отбирают среду, лизируют клетки и наносят осветленные лизаты на гели (как описано выше). Анализируют перенесенные белки с анти-CSF-1R антителами с целью определения количества рецепторов для каждых условий. Анализируют те же блоты с антителами к актину для нормировки уровня белка. Осуществляют количественное определение уровня CSF-1R и актина при помощи программы "Multi-Gauge", измерив плотность полос на вестерн-блоте. Относительный суммарный уровень белка CSF-1R получают путем деления общей плотности полосы CSF-1R на соответствующую плотность полосы актина. Инкубация клеток NIH-3T3-CSF-1R с CSF-1 приводит к разрушению CSF-1R при обработке в течение 1 ч, а уровень CSF-1R снижается вдвое через 5 ч. Разрушение CSF-1R при инкубации клеток с антителом 1 не было таким же выраженным; антитело 1 снижает уровень CSF-1R на одну четверть. Через 48 ч уровень разрушения остается таким же, что указывает на то, что скорость разрушения остается постоянной. Следовательно, связывание антитела 1 с CSF-1R приводит к разрушению указанного рецепто- 16021600 ра в клетках. Антителозависимая клеточная цитотоксичность (АЗЦТ), вызываемая антителом 1. Помимо ингибирования связывания CSF-1 с CSF-1R и индукции интернализации и разрушенияCSF-1R, антитело 1 также ингибирует CSF-1R, запуская реакцию АЗЦТ. Клетки лейкемии человека NKM-1 засевают с плотностью 2105 клеток/лунку в 25 мкл среды RPMI,содержащей 10% ЭТС со сверхнизким уровнем IgG и 3 нг/мл IL-2 человека, в планшет на 96 лунок. Делают серийные разведения 1 мкг/мл антитела 1 в соотношении 1:3 на основе IgG1 или IgG2 и добавляют в планшет в количестве 25 мкл/лунку. После инкубации в течение 15 мин высевают по 25 мкл клеток NK человека ("Lonza") с плотностью 2106 клеток/лунку и инкубируют их еще в течение 4 ч при 37 С. Добавляют 10 мкл лизирующего буфера из набора "aCella-TOX" ("Cell Technology") и оставляют при КТ на 15 мин. Добавляют 125 мкл ЭТС с низким уровнем IgG и центрифугируют планшеты в течение 1 мин при 750g. В планшеты Optiplate ("Perkin Elmer") добавляют 50 мкл раствора для разведения при ферментном анализе из набора "aCella-TOX" и аккуратно переносят 50 мкл надосадочной жидкости из культуры клеток на планшеты Optiplate. Готовят реагент для ферментного анализа и реагент для детекции в соответствии с инструкцией к набору, добавляют в планшеты Optiplate 100 мкл реагента для ферментного анализа, после чего сразу же добавляют 50 мкл реагента для детекции. Считывают показатели с планшетов на люминометре через 20 мин после добавления указанных реагентов. Активность АЗЦТ увеличивается при повышении дозы антитела 1, причем, когда концентрация антитела 1 достигает 1 мкг/мл, погибает 9% клеток NKM-1. В отличие от этого, когда антитело 1 клонируют в остов IgG2, изменения активности АЗЦТ при увеличении количества антитела 1 не происходит. Следовательно, антитело 1 - молекула IgG1 - вызывает АЗЦТ в отношении клеток, с которыми оно связывается. Картирование эпитопов. В более ранних публикациях было определено, что CSF-1 связывается с первыми тремя доменамиIg CSF-1R (Wang et al., Mol. Cell. Biol. 13:5348 (1993. Антитело 1 связывается с CSF-1R и ингибирует связывание CSF-1 с CSF-1R человека, таким образом, оно должно связываться с первыми тремя доменами Ig CSF-1R или рядом с ними. Чтобы определить эпитопы, с которыми связывается антитело 1 в молекуле CSF-1R, первые три домена Ig мыши и человека заменяют (см. табл. 4). Антитело 1 не распознаетCSF-1R мыши, следовательно, если домен Ig мыши ввести в критическую связывающую область CSF-1R человека, связывания указанных антител не произойдет. Встраивают модификации первых трех доменов Ig в остов CSF-1R человека, содержащего оставшиеся два наиболее С-концевых домена Ig во внеклеточном домене. Гибридизуют указанные конструкции с частью Fc молекулы IgG для облегчения выработки белка и повышения стабильности указанных молекул. Таблица 4 Определенные домены(м, ч, ч), домены Ig человека 4 и 5, соединенные с меткой Fc. Химеры 2-7 следующие: м, м, ч (химера 2),м, м, м (химера 3), ч, м, ч (химера 4), ч, м, м (химера 5), ч, ч, м (химера 6) и м, ч, м (химера 7), соединенные с последними двумя доменами Ig CSF-1R человека, а затем с меткой Fc. Связывание антитела 1 с химерными белками CSF-1R определяют методом ELISA и Biacore, как было описано выше. Вкратце, покрывают планшеты 100 мкл белками человека, мыши или химерными белками (1-7) в концентрации 200 нг/мл и оставляют на ночь. После промывки и блокирования планшетов добавляют антитело 1 в нескольких повторах в концентрации 100 нМ. Добавляют вторичное антитело против Fab человека, конъюгированное с пероксидазой хрена, в концентрации 1:10000 для определения связывания антитела 1 с молекулами CSF-1R. Как и ожидалось, в анализе связывания методом ELISA антитело 1 связывается с CSF-1R человека,но не мыши. Антитело 1 слабо связывается с химерами, содержащими первый или второй домен Ig человека, но не с химерами, содержащими первый или второй домен Ig мыши. Антитело 1 сильно связывается с химерами, содержащими и первый, и второй домен Ig CSF-1R человека. Все прочие конструкции не связываются с антителом 1. Следовательно, антитело 1 связывается с доменами Ig один или два, но для сильного связывания антитела с CSF-1R человека требуются оба домена, когда оценку проводят в ходе анализа связывания. Данные анализа Biacore соответствуют данным ELISA. Любые химерные конструкции, которые не содержат второго домена Ig человека, не связываются с антителом 1, даже когда уровень указанного антитела составляет 1 мкМ, что указывает на то, что для связывания с антителом 1 тре- 17021600 буется второй домен Ig. Связывание с антителом 1 также усиливалось, когда первый домен Ig также был от молекулы человека. Следовательно, антитело 1 первично связывается со вторым доменом IgCSF-1R, но образует некоторые полезные контакты с первым доменом Ig. Анализ дифференцировки и пролиферации. Дифференцировка макрофагов под действием CSF-1. Моноциты ("Lonza") высевают с плотностью 4105 клеток/мл в каждую камеру предметного стекла на 8 лунок, в 900 мкл среды Онкологического института Розуэлла Парка (RPMI) 1640, содержащей 10% ЭТС и 100 нг/мл hCSF-1. Делают серийные разведения антитела 1 в RPMI (начиная с 1 мкг/мл и разводя в 3 раза) и добавляют по 100 мкл в каждую лунку. Инкубируют при 37 С, заменяя среду каждые 3 дня,до тех пор, пока моноциты (на основании визуальной оценки) не прикрепятся к планшетам и не удлинятся, что характерно для дифференцировки в макрофаги. Моноциты, обработанные антителом 1 в концентрации 2 нМ или выше в присутствии CSF-1, не дифференцировались в макрофаги, сохраняя округлую форму, характерную для моноцитов. Индукцию лигандом CSF-1 дифференцировки моноцитов в макрофаги можно подавить антителом 1 с IC50 0,25 нМ. Кроме того, многие моноциты погибают во время обработки, не имея способности к выживанию без постоянной стимуляции CSF-1. Дифференцировка макрофагов под действием CSF-1. Моноциты ("Lonza") высевают с плотностью 4105 клеток/мл в каждую камеру предметного стекла на 8 лунок, в 900 мкл среды Онкологического института Розуэлла Парка (RPMI) 1640, содержащей 10% ЭТС и 100 нг/мл hIL-34. Делают серийные разведения антитела 1 в RPMI (начиная с 1 мкг/мл и разводя в 3 раза) и добавляют по 100 мкл в каждую лунку. Инкубируют при 37 С, заменяя среду каждые 3 дня, до тех пор, пока моноциты (на основании визуальной оценки) не прикрепятся к планшетам и не удлинятся,что характерно для дифференцировки в макрофаги. Моноциты, обработанные антителом 1 в концентрации 2 нМ или выше, в присутствии IL-34 не дифференцировались в макрофаги, сохраняя округлую форму, характерную для моноцитов. Индукцию лигандом IL-34 дифференцировки моноцитов в макрофаги можно подавить антителом 1 с IC50 0,3 нМ. Кроме того, многие моноциты погибают во время обработки, не имея способности к выживанию без постоянной стимуляции CSF-1. Пролиферация моноцитов под действием CSF-1. Высевают моноциты ("Lonza") с плотностью 3000 клеток/лунку в планшет на 96 лунок в присутствии среды RPMI 1640, содержащей 10% ЭТС и 100 нг/мл CSF-1. На следующий день заменяют среду и добавляют антитело 1, последовательно разведенное с 20 до 0,01 нМ (разведения 1:3). Через три дня заменяют среду свежей средой, содержащей 10% ЭТС и 100 нг/мл CSF-1, а также антитело, и дают клеткам расти еще 5 дней. При добавлении 100 мкл люминесцентного буфера CellTiter Glo и субстрата("Promega") проводят встряхивание клеток в течение 10 мин и осуществляют считывание люминесценцию в качестве показателя жизнеспособности.IC50 для ингибирования роста моноцитов антителом 1 составляет 1,410-10 М, т.е. 0,1 нМ. IC50 для индукции роста моноцитов CSF-1 в присутствии антитела 1 показывает, что антитело 1 угнетает пролиферацию моноцитов в культуре. Пролиферация моноцитов под действием IL-34. Высевают моноциты ("Lonza") с плотностью 3000 клеток/лунку в планшет на 96 лунок в присутствии среды RPMI 1640, содержащей 10% ЭТС и 100 нг/мл IL-34. На следующий день заменяют среду и добавляют антитело 1, последовательно разведенное с 20 до 0,01 нМ (разведения 1:3). Через три дня заменяют среду свежей средой, содержащей 10% ЭТС и 100 нг/мл IL-34, а также антитело, и оставляют клетки расти еще 5 дней. При добавлении 100 мкл люминесцентного буфера CellTiter Glo и субстрата("Promega") осуществляют встряхивание клеток в течение 10 мин и регистрируют люминесценцию в качестве показателя жизнеспособности.IC50 для ингибирования роста моноцитов антителом 10,5 нМ. IC50 для индукции роста моноцитов лигандом IL-34 в присутствии антитела 1 показывает, что антитело 1 подавляет пролиферацию моноцитов в культуре. Пролиферация линий клеток опухоли под действием CSF-1. Высевают клетки лейкемии NKM-1 с плотностью 1104 клеток/мл в планшет на 96 лунок в 100 мкл среды RPMI 1640, содержащей 1% ЭТС, и оставляют на одну ночь. Добавляют 20 нг/мл CSF-1 к клеткам в среде RPMI 1640, содержащей 1% ЭТС и 20-0,01 нМ последовательно разведенного антитела 1 (разведения 1:3). Инкубируют еще 3 дня при 37 С. Добавив 100 мкл люминесцентного буфера CellTiter Glo и субстрата ("Promega") осуществляют встряхивание клеток в течение 10 мин и регистрируют люминесценцию (в качестве показателя жизнеспособности).IC50 для ингибирования роста клеток NKM-1 антителом 1 составляет 7,610-11 М, т.е. 0,7 нМ. Это показывает, что антитело 1 угнетает пролиферацию клеток NKM-1 в культуре. Модели опухолей in vivo, в которых CSF-1R экспрессируется на поверхности опухоли. Более длительное выживание мышей с клетками лейкемии человека NKM-1 при лечении антителом 1. Облучают мышей Nu/nu сублетальными дозами 200 рад/мышь за 24 ч перед внутривенным введением 2,5106 клеток лейкемии NKM-1. Еще через 24 ч случайным образом делят мышей на 4 группы для получения 60 мг/кг IgG человека, 60, 20 или 5 мг/кг антитела 1 два раза в неделю. Ежедневно следят за выживанием указанных мышей. Определяют значение Р по логарифмическому ранговому критерию Кокса-Мантеля. Таблица 5 Увеличение выживаемости мышей, зараженных клетками лейкемии NKM-1, при их лечении антителом 1 Объем опухоли рассчитывают по формуле Объем = [(Pi/6)lw2],где Pi=3,14;l - длина. Процент от контроля или %Т/С = 100 (объем при лечении)/(объем в контроле). Различия признавали статистически значимыми, если значение р было меньше либо равно 0,05. Антитело 1 повышает выживаемость мышей, зараженных клетками лейкемии NKM-1, как показывают данные в табл. 5. Модели опухолей in vivo, в которых CSF-1R экспрессируется на поверхности ассоциированных с опухолью макрофагов. Анти-CSF-1R антитело 1 представляет собой полностью человеческое антитело, которое распознает свойственную человеку форму CSF-1R, но не форму указанного рецептора, свойственную мыши. Следовательно, для проведения исследования по подтверждению концепции in vivo, в котором CSF-1R экспрессируется на поверхности макрофага, требуется антимышиное антитело. Указанные исследования должны ответить на вопрос о роли макрофагов мыши в росте опухолей человека в моделях ксенотрансплантата у мышей. Антимышиные антитела могут влиять на макрофаги мышей, но не на опухоль, что позволило бы оценить эффект стромальных макрофагов на рост опухоли. Следующие эксперименты проводили с антителом 2 - антимышиным антителом крысы против CSF-1R. Эффективность антимышиного mAb против CSF-1R в модели ксенотрансплантата AN3CA карциномы эндометрия человека. Следует подкожно ввести мышам Nu/nu (самкам, возраст 7-8 недель) 5106 клеток AN3 СА/мышь, в левый бок. Когда опухоль достигнет приблизительного размера 200 мм 3, разделить мышей случайным образом на группы по 12 мышей/группу лечения. Готовят антитело 2 и IgG крысы в физиологическом растворе в концентрации 6 мг/мл и вводят мышам подкожно три раза в неделю в дозе 40 мг/кг. На 15-й день регистрируют объем и рассчитывают % Т/С. Анализируют объем опухоли при помощи RM ANOVA (дисперсионного анализа). Т/С% для группы лечения, получавшей антитело 2, составил 66% по сравнению с контрольной группой, получавшей IgG крысы. Указанные результаты демонстрируют значимое подавление роста опухоли (р=0,045) у животных, получавших антитело 2. Эффективность антимышиного mAb против CSF-1R в модели ксенотрансплантата НСС 1954 карциномы молочной железы человека. Мышам Nu/nu (самкам, возраст 7-8 недель; "Charles River Laboratories") подкожно вводят 1107 клеток НСС 1954/мышь. Когда опухоли достигнут приблизительного размера 300 мм 3, мышей рандомизируют в зависимости от размера опухоли на группы по 12 мышей в каждую группу лечения. ГотовятIgG и антитело 2 крысы в физиологическом растворе в концентрации 6 мг/мл и вводят мышам подкожно три раза в неделю. IgG крысы вводят животным в количестве 40 мг/кг, а антитело 2 вводят животным в количестве 40 или 10 мг/кг в каждой инъекции. Регистрируют размеры опухоли два раза в неделю; через 37 дней после первой инъекции рассчитывают Т/С%. Анализируют объем опухоли при помощи RM Как показано в табл. 6, Т/С% в группе лечения, получавшей 10 мг/кг через 37 дней, составил 77%, а в группе лечения, получавшей 40 мг/кг, составил 56%, по сравнению с объемом опухоли в контрольной группе, получавшей физиологический раствор. Полученные результаты указывают на значимое подавление роста опухоли (р=0,0014) у животных, получавших 40 мг/кг антитела 2. Противоопухолевое действие mAb против CSF-1R мыши в модели ксенотрансплантата DU145 рака предстательной железы человека. Подкожно вводят мышам Nu/nu (самцы, возраст 7-8 недель) 15106 клеток DU145/мышь, в левый бок. Когда опухоль достигнет приблизительного размера 250 мм, мышей разделяют случайным образом на группы по 12 мышей/группу лечения. Приготавливают антитело 2 и IgG крысы в физиологическом растворе в концентрации 6 мг/мл и вводят мышам подкожно три раза в неделю в дозе 40 и 10 мг/кг. На 21-й день регистрируют объем и рассчитывают % Т/С для групп, получавших 10 и 40 мг/кг. Анализируют объем опухоли при помощи RMANOVA. Как показано в табл. 6, Т/С% для групп лечения, получавших антитело 2 в дозах 10 и 40 мг/кг, составил 50 и 43 соответственно, по сравнению с контрольной группой, получавшей IgG крысы. Указанные результаты демонстрируют значимое подавление роста опухоли (р 0,0001 для обеих концентраций) у животных, получавших антитело 2. Таблица 6 Подавление роста опухоли из ксенотрансплантата опухоли человека антителом 2 Уменьшение инфильтрации макрофагов в опухоли молочной железы НСС 1954 и предстательной железы DU145 при лечении mAb к CSF-1R мыши. Удаляют опухоль у животного, использовавшегося в исследованиях на животных с опухолями НСС 1954 (молочная железа) и DU145 (предстательная железа), описанных выше. Разрезают опухоль вдоль длинной оси и помещают в 10% формалин на одну ночь при 4 С и встряхивании. Через 24 ч 2 раза промывают в ФСБ в течение 20 мин, затем добавляют растворы с прогрессивно возрастающей концентрацией этанола, пока в опухоли концентрация этанола не достигнет 100%. Заменяют этанол ксилолом посредством нескольких инкубации в 100% ксилоле и запечатывают опухоль в парафин. Делают срезы парафинового блока толщиной 4 мкм и кладут их на предметные стекла. Освобождают от парафина и регидратируют ткань посредством последовательных инкубаций в ксилоле, после чего увеличивают концентрацию воды в этаноле. Нагревают препараты опухоли в буфере для демаскировки ("Dako") в течение 3 мин в микроволновой печи, после чего блокируют эндогенные пероксидазы 3% Н 2 О 2 в течение 10 мин при КТ. Блокируют неспецифическое связывание белков посредством белкового блока ("Dako") в течение 10 мин, после чего добавляют специфичное антитело крысы к макрофагам мыши F4/80 (2 мкг/мл"Serotec"), конъюгированное с биотином, и инкубируют в течение ночи при 4 С. Инкубируют в преоксидазе хрена-стрептавидине (разведение 1:1000 "Jackson ImmunoResearch") в течение 45 мин при КТ, затем промывают 3 раза. Проводят реакцию в диаминобензидине ("Dako") в соответствии с инструкцией к набору, останавливая реакцию посредством двукратной промывки в воде. Осуществляют быстрое контрастирующее окрашивание гематоксилином Майера (10 мин; "Dako"), после чего промывают водой, погружают в кислоту+спирт, вторично промывают водой и стимулируют развитие синей окраски при помощи водного раствора аммиака. Дегидатируют, осветляют и накрывают покровным стеклом, применяя перманентную заливочную среду. Анализируют по 5 изображений от трех животных на каждую группу лечения. Определяют количество/площадь макрофагов для каждой группы лечения при помощи программы "ImagePro". Таблица 7 Инфильтрация макрофагов в опухоли при лечении антимышиным mAb против CSF-1R - антителом 2 Как показано в табл. 7, количество макрофагов уменьшается в опухолях обеих моделей, особенно по периферии. Таким образом, лечение антителом 2 приводит к снижению инфильтрации макрофагов в опухоли, что указывает на то, что антимышиное антитело против CSF-1R обусловливает сокращение популяции макрофагов в указанных опухолях. Значимость макрофагов и уровня CSF-1 для прогрессирования опухоли. Введение антитела 1 может оказывать положительное действие на подавление роста опухолей, а также на лечение многих типов рака, помимо рака молочной и предстательной железы. Некоторые типы опухолей, такие как рак почек, экспрессируют CSF-1R на поверхности своих клеток, и лечение антителом 1 может непосредственно подавлять рост указанных опухолей (Soares, et al., Modern Pathol. 22:744752 (2009. Борьба с другими типами опухолей, такими как лимфома Ходжкина и множественная миелома, которые включают большую популяцию ассоциированных с опухолью макрофагов, могла бы быть улучшена путем лечения антителом 1, при котором антитело 1 могло бы уничтожать макрофаги, которые индуцируют рост опухоли (Steidl, et al. New Engl. J. Med. 362:875-885 (2010); Zheng, et al., Blood 114:3625-3628 (2009. Кроме того, к анти-CSF-1 или CSF-1R лечению чувствительны опухоли, которые секретируют CSF-1, такие как рак прямой и ободочной кишки (Aharinejad, et al., Cancer Res. 62:5317-5324(2002, и при них может быть полезно проводить лечение антителом 1. Кроме того, кандидатами на лечение антителом 1 могут быть рак яичника, печеночно-клеточная карцинома и почечно-клеточная карцинома, при которых высокий уровень экспрессии CSF-1 коррелирует с плохим прогнозом (Toy, et al.,Gyn. Oncol. 80:194-200 (2001); Zhang, et al., Gyn. Oncol. 107:526-531 (2007); Zhu, et al., J. Clin. Oncol. 26:2707-2716 (2008); Gerharz, et al., Urol. 58:821-827 (2001. Рост опухолей, не экспрессирующих CSF-1R, но характеризующихся ассоциированными с опухолью макрофагами, подавляется анти-CSF-1R антителами, только если они секретируют CSF-1. Высевают линии клеток опухолей НСС 1954 (молочная железа), DU145 (предстательная железа) и Рс 3 (предстательная железа) в концентрации 5105 клеток/мл и культивируют в течение 48 ч в среде для роста, содержащей 1% ЭТС. Отбирают, осветляют и анализируют указанную среду при помощи набора"RD Quantikine Human M-CSF Assay" ("RD Systems"). Определяют уровень CSF-1 в момент времени 0 и 48 ч, выразить в пг/мл. В момент времени 0, как и ожидалось, в среде не выявляется CSF-1. Однако за 48 ч клетки НСС 1954 секретировали 3613 пг/мл CSF-1, а клетки DU145 выработали 4019 пг/мл. Напротив, среда клеток Рс 3 содержала только 39 пг/мл CSF-1. Линию клеток рака предстательной железы выращивают в мышах, чтобы проверить, коррелирует ли отсутствие экспрессии CSF-1 с устойчивостью к анти-CSF-1R лечению. Подкожно водят клетки предстательной железы Рс 3 в количестве 5106 бестимусным мышам (самцы, возраст 7-8 недель) и позволяют опухоли вырасти до размера 300 мм 3, после чего делят мышей на группы лечения по 12 животных в каждой группе. Вводят животным 40 мг/кг JgG крысы, 40 мг/кг антитела 2 или 10 мг/кг антитела 2 три раза в неделю, пока опухоли в контроле не достигнут размера 2000 мм 3. На 18-й день измеряют объем опухоли и рассчитывают Т/С% для каждой группы лечения как отношение объема опухоли к объему опухоли в контрольной группе, получавшей IgG крысы. Анализируют объем опухоли при помощи RM ANOVA. Таблица 8 Корреляция CSF-1 и устойчивости к анти-CSF-1R препаратам Различий в росте опухоли между контрольными группами, получавшими IgG крысы, и группами,получавшими антитело 2, нет, что указывает на то, что повышенный уровень CSF-1 может быть биологическим маркером для лечения анти-CSF-1R антителами. Секреция CSF-1 коррелирует с чувствительностью к анти-CSF-1R препаратам, когда CSF-1R экспрессируется на поверхности ассоциированных с опухолью макрофагов. Бестимусным мышам подкожно вводят клетки, как описано в табл. 9 и 10 далее, и дают опухоли вырасти до размера 300 мм 3, после чего делят мышей на группы лечения, по 12 животных в каждой группе. Вводят животным препарат в соответствии с данными в табл. 9 и 10 три раза в неделю, пока опухоли в контроле не достигнут размера 2000 мм 3. Измеряют объем опухоли и рассчитывают Т/С% для каждой группы лечения как отношение относительного объема опухоли к объему опухоли в контрольной группе, получавшей IgG крысы. Аанализируют объем опухоли при помощи RM ANOVA. Таблица 9 Чувствительность в моделях опухолей, секретирующих CSF-1 Все секретирующие CSF-1 опухоли (табл. 9) реагируют на анти-CSF-1R лечение антителом 2, а опухоли, которые не секретируют CSF-1 (табл. 10), не реагируют или очень плохо реагируют на антиCSF-1R лечение антителом 2. Секреция CSF-1 коррелирует с чувствительностью к анти-CSF-1R лечению в тех моделях опухолей, в которых CSF-1R экспрессируется на поверхности ассоциированных с опухолью макрофагов. Соответственно, повышенный уровень CSF-1 может служить потенциальным индикатором чувствительности или биологическим маркером того, что CSF-1R экспрессируется на поверхности ассоциированных с опухолью макрофагов.CSF-1R также экспрессируется на поверхности клеток опухоли. Секреция CSF-1 не коррелирует с чувствительностью к анти-CSF-1R препаратам в случае экспрессии CSF-1R на поверхности клеток опухоли. Уровень IL-34 в пробах ткани опухоли и сыворотки пациентов. Помимо CSF-1, с CSF-1R может связываться и IL-34, вызывая фосфорилирование указанного рецептора и активацию стоящих ниже сигнальных молекул, что приводит к дифференцировке и выживанию макрофагов. CSF-1 и IL-34 связываются с доменами IgG во внеклеточной области CSF-1R (Lin, etal., Science, 320:807-11 (2008, и оба эти лиганда можно ингибировать путем связывания CSF-1R с антителом 1 (IC50=0,81 нМ и IC50=0,71 нМ для ингибирования связывания CSF-1 и IL-34 с антителом 1 соответственно, как было описано выше). Обработка клеток NIH-3T3, стабильно трансфицированныхIL-34 (как было описано выше). Кроме того, индукцию лигандом IL-34 дифференцировки моноцитов в макрофаги и пролиферации макрофагов можно ингибировать антителом 1 с IC50=0,3 и 0,5 нМ соответственно (как было описано выше), что сопоставимо с результатами, полученными для CSF-1. Следовательно, активность IL-34 и ее ингибирование антителом 1 аналогичны тем, которые отмечаются дляCSF-1. Уровень IL-34 повышен в клетках многих опухолей, включая линии клеток опухолей молочной железы, предстательной железы и эндометрия. Кроме того, определенные субпопуляции пациентов с раком предстательной и молочной железы имеют высокий уровень белка IL-34 в своей сыворотке. Соответственно, поскольку функции IL-34 практически идентичны функциям CSF-1, а секреция CSF-1 коррелирует с чувствительностью к анти-CSF-1R препаратам, повышенный уровень IL-34 также может служить индикатором чувствительности или биологическим маркером. Комбинированные исследования опухолей молочной железы. Вводят подкожно мышам Nu/nu (самки, возраст 7-8 недель) клетки молочной железы НСС-1954 в количестве 1107/мышь и дают опухоли достигнуть размеров 300 мм 3 перед началом лечения. Случайным образом делят мышей на группы по 12 животных и осуществляют следующее лечение. Таблица 11 Комбинированные исследования опухолей молочной железы Измеряют объем опухоли и рассчитывают Т/С% для каждой группы лечения как отношение относительного объема опухоли к объему опухоли в контрольной группе. Анализируют объем опухоли при помощи RM ANOVA. Во всех исследованиях, представленных в табл. 11, антитело 2, герцептин, доксорубицин и паклитаксел подавляли рост опухоли при монотерапии указанными препаратами. Однако сочетание антитела 2 с препаратом, обеспечивающим направленную доставку к опухоли, обеспечивает аддитивное действие,что указывает на то, что сочетание анти-CSF-1R антитела с химиотерапией или другими препаратами,воздействующими на опухоль, будет более эффективным, чем указанные препараты по отдельности. Комбинированные исследования опухолей предстательной железы. Водят подкожно мышам Nu/nu (самцы, возраст 7-8 недель) клетки предстательной железы DU145 в количестве 1,5107/мышь и дают опухоли достигнуть размеров 300 мм 3 перед началом лечения. Случайным образом делят мышей на группы по 10 животных и осуществляют следующее лечение. Таблица 12 Комбинированные исследования опухолей предстательной железы Измеряют объем опухоли и рассчитывают Т/С% для каждой группы лечения как отношение относительного объема опухоли к объему опухоли в контрольной группе. Анализируют объем опухоли при помощи RM ANOVA. Сочетание антитела 2 с доцетакселем оказывает аддитивное действие, что указывает на то, что сочетание химиотерапевтических препаратов при раке предстательной железы может быть более эффективным, чем химиотерапевтические препараты по отдельности. Дополнительные последовательности
МПК / Метки
МПК: C07K 16/28, C07K 16/32, A61K 39/395, A61P 35/02, A61P 35/00
Код ссылки
<a href="https://eas.patents.su/30-21600-antitela-k-csf-1r.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела к csf-1r</a>
Предыдущий патент: Устройство для объединения, распределения и передачи мощности для системы генерирования мощности с использованием водных потоков
Следующий патент: Натриево-известковый стеклокерамический материал
Случайный патент: Модифицированные растворимые слитые конструкции рецептора fgf и fc с улучшенной биологической активностью и их применение












