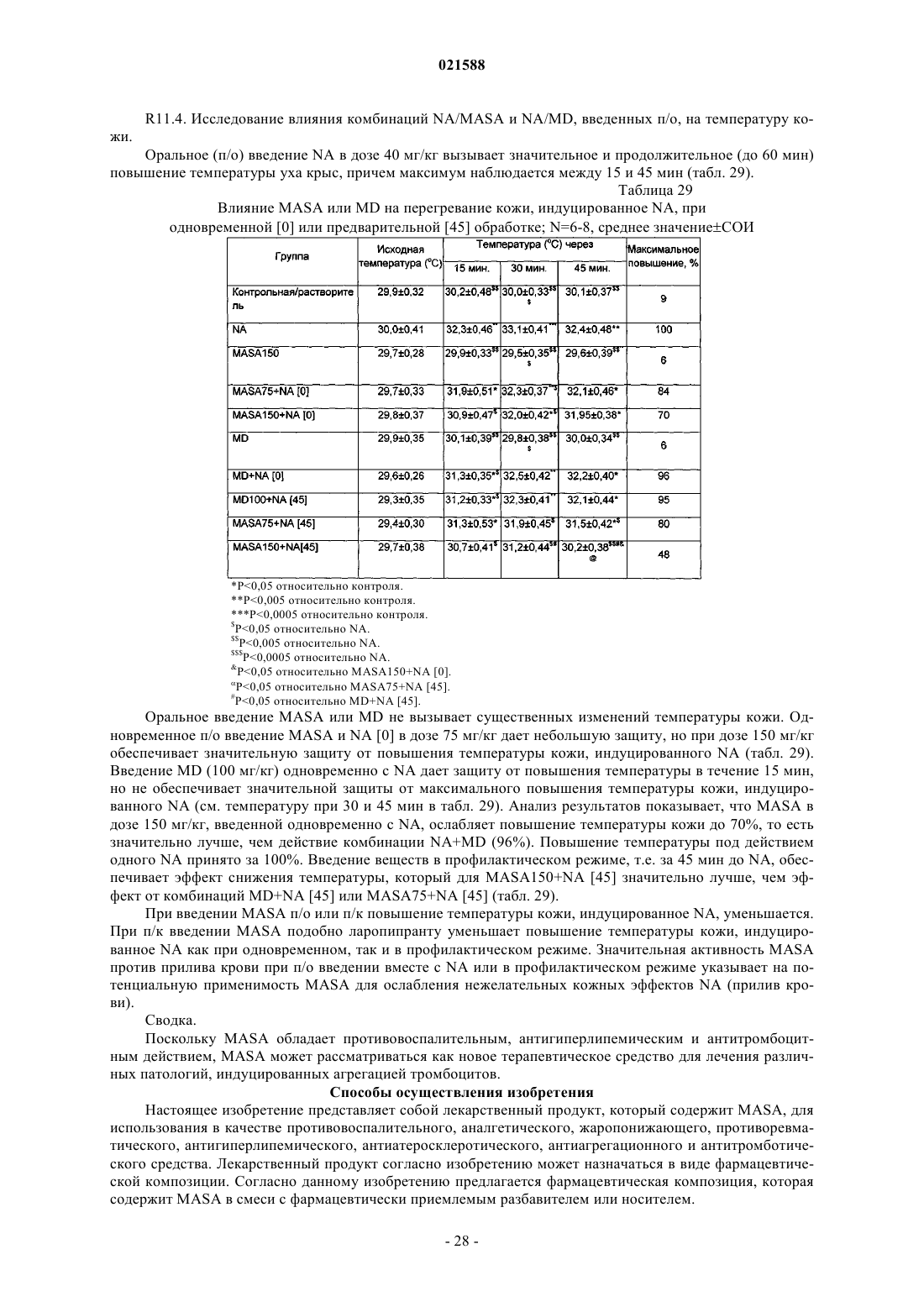
Бетаиновые соли ацетилсалициловой кислоты
Номер патента: 21588
Опубликовано: 30.07.2015
Авторы: Лебедев Антон, Калвиньш Иварс, Веверис Марис, Бирман Анатолий, Миснов Анатолий
Формула / Реферат
1. Аддитивная соль 4-триметиламмонийбутаноата и ацетилсалициловой кислоты, отличающаяся тем, что в рентгенограмме имеются пики при углах 2θ: 5.10, 13.58, 13.83, 15.02, 15.17, 17.89, 19.33, 19.87, 21.85, 22.05, 23.32, 23.56, 23.92, 24.75, 25.55, 25.80, 27.05, 27.91, 30.25±0,2°.
2. Аддитивная соль L-карнитина и ацетилсалициловой кислоты, отличающаяся тем, что в рентгенограмме имеются пики при углах 2θ: 5.09, 12.62, 13.48, 13.84, 15.04, 17.82, 19.15, 19.77, 21.84, 22.56, 23.33, 23.92, 24.40, 25.17, 25.43, 26.14, 27.24, 29.50, 30.36±0,2°.
3. Аддитивная соль 3-(триметиламмонийамино)пропаноата (мелдоний) и ацетилсалициловой кислоты, отличающаяся тем, что в рентгенограмме имеются пики при углах 2θ: 5.19, 13.22, 13.82, 14.20, 14.95, 15.36, 15.93, 18.11, 18.97, 19.74, 21.02, 22.15, 23.15, 23.65, 24.31, 25.28, 26.18, 26.58, 27.73, 28.36±0,2°.
4. Применение аддитивной соли 3-(триметиламмонийамино)пропаноата (мелдоний) и ацетилсалициловой кислоты по п.3 в качестве лекарственного средства для предупреждения и/или лечения воспаления, боли, лихорадки, ревматических состояний, гиперлипидемических состояний, атеросклеротических состояний, инфаркта миокарда, инсульта, тромбоза и тромбоэмболии.
5. Фармацевтическая композиция для предупреждения и/или лечения воспаления, боли, лихорадки, ревматических состояний, гиперлипидемических состояний, атеросклеротических состояний, патологий, индуцированных агрегацией тромбоцитов или образованием тромбов, содержащая аддитивную соль мелдония и ацетилсалициловой кислоты по п.3 и фармацевтически приемлемый носитель.
6. Композиция по п.5, где патология, индуцированная агрегацией тромбоцитов, включает ишемические явления, выбранные из инфаркта миокарда, инсульта, или тромбоз и тромбоэмболию.
7. Способ предупреждения и/или лечения воспаления, боли, лихорадки, ревматических состояний, гиперлипидемических состояний, атеросклеротических состояний, патологий, индуцированных агрегацией тромбоцитов или образованием тромбов, который включает введение страдающему пациенту терапевтически эффективного количества аддитивной соли мелдония и ацетилсалициловой кислоты по п.3 или фармацевтической композиции по п.5.
8. Применение аддитивной соли мелдония и ацетисалициловой кислоты по п.3 для предупреждения и/или лечения воспаления, боли, лихорадки, ревматических состояний, гиперлипидемических состояний, атеросклеротических состояний, патологий, индуцированных агрегацией тромбоцитов или образованием тромбов.
9. Применение по п.8, где патология, индуцированная агрегацией тромбоцитов, включает ишемические явления, выбранные из инфаркта миокарда, инсульта, или тромбоз и тромбоэмболию.
10. Применение фармацевтической композиции по п.5 для предупреждения и/или лечения воспаления, боли, лихорадки, ревматических состояний, гиперлипидемических состояний, атеросклеротических состояний, патологий, индуцированных агрегацией тромбоцитов или образованием тромбов.
11. Применение по п.10, где патология, индуцированная агрегацией тромбоцитов, включает ишемические явления, выбранные из инфаркта миокарда, инсульта, или тромбоз и тромбоэмболию.
12. Комбинированный лекарственный продукт для предупреждения и/или лечения патологии, индуцированной агрегацией тромбоцитов, представляющей собой инсульт, содержащий эффективное количество аддитивной соли мелдония и ацетилсалициловой кислоты по п.3 и эффективное количество дипиридамола.
13. Комбинированный лекарственный продукт для предупреждения и/или лечения патологии, индуцированной агрегацией тромбоцитов, содержащий эффективное количество аддитивной соли мелдония и ацетилсалициловой кислоты по п.3 и эффективное количество клопидогрела.
14. Применение комбинированного лекарственного продукта по п.13 для предупреждения и/или лечения патологии, индуцированной агрегацией тромбоцитов, при котором патология, индуцированная агрегацией тромбоцитов, включает ишемические явления, выбранные из инфаркта миокарда, инсульта, или тромбоз и тромбоэмболию, или острый коронарный синдром, внезапную сердечную смерть и осложнения после коронарной пластической операции на сосудах или аортокоронарного шунтирования.
15. Комбинированный лекарственный продукт для предупреждения и/или лечения патологии, индуцированной агрегацией тромбоцитов, содержащий эффективное количество аддитивной соли мелдония и ацетилсалициловой кислоты по п.3 и эффективное количество никотиновой кислоты или ее фармацевтически приемлемой соли.
16. Применение комбинированного лекарственного продукта по п.5 для предупреждения и/или лечения патологии, индуцированной агрегацией тромбоцитов.
17. Применение по п.16, в котором патология, индуцированная агрегацией тромбоцитов, включает ишемические явления, выбранные из инфаркта миокарда, инсульта, или тромбоз и тромбоэмболию.
18. Применение комбинированного лекарственного продукта по п.15 для предупреждения и/или лечения заболевания, выбранного из группы, состоящей из дислипидемии, гиперлипидемии и атеросклероза.
19. Комбинированный лекарственный продукт для предупреждения и/или лечения заболевания, выбранного из группы дислипидемии, гиперлипидемии и атеросклероза, содержащий эффективное количество аддитивной соли мелдония и ацетилсалициловой кислоты по п.3 и статина, выбранного из группы аторвастатина, церивастатина, флувастатина, ловастатина, мевастатина, питавастатина, правастатина, розувастатина и симвастатина.
20. Применение комбинированного лекарственного продукта по п.19 для предупреждения и/или лечения заболевания, выбранного из группы дислипидемии, гиперлипидемии и атеросклероза.
Текст
БЕТАИНОВЫЕ СОЛИ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ В изобретении представлены бетаиновые соли ацетилсалициловой кислоты, а именно аддитивная соль 4-триметиламмонийбутаноата и ацетилсалициловой кислоты,аддитивная соль L-карнитина и ацетилсалициловой кислоты, аддитивная соль 3(триметиламмонийамино)пропаноата (мелдоний) и ацетилсалициловой кислоты. Применение аддитивной соли 3-(триметиламмонийамино)пропаноата (мелдоний) и ацетилсалициловой кислоты в качестве антитромбоцитарного средства для лечения различных патологий,индуцированных агрегацией тромбоцитов, противовоспалительного и антигиперлипидемического средства. Область изобретения Настоящее изобретение в основном относится к солям ацетилсалициловой кислоты и в особенности к новым и полезным водорастворимым солям ацетилсалициловой кислоты и к способу их получения. Ацетилсалициловая кислота представляет собой широко употребляемый лекарственный препарат,главным образом известный своими аналгетическими свойствами. Область применения ацетилсалициловой кислоты существенно ограничивается ее малой растворимостью в воде (приблизительно 0,3%). Кроме Li, Na, Mg и кальциевых солей, раскрыт ряд солей с основными аминокислотами (US 4625888). Каждой из указанных солей присущи определенные достоинства и недостатки, поэтому предпочтительно иметь в распоряжении новые соли ацетилсалициловой кислоты с потенциально более выгодными характеристиками. Поскольку сами соединения типа бетаина, входящие в класс новых солей ацетилсалициловой кислоты, обладают различной фармакологической активностью, указанные новые соли ацетилсалициловой кислоты могут иметь полезные свойства в дополнение к свойствам ацетилсалициловой кислоты или бетаинов, в том числе новую фармакологическую активность. Краткое описание изобретения Целью настоящего изобретения является получение нового типа солей ацетилсалициловой кислоты с определенными соединениями типа бетаина. Неожиданно и непредсказуемо было обнаружено, что сами соли ацетилсалициловой кислоты с определенными бетаинами являются гигроскопическими веществами, которые образуют стабильные, водорастворимые кристаллические соли. Следовательно, целью настоящего изобретения является получение солей ацетилсалициловой кислоты, которые имеют высокую растворимость в воде и в то же время обладают исключительной стабильностью и большим сроком хранения. Кроме этого целью настоящего изобретения является разработка способа получения указанной соли. Другой целью настоящего изобретения является получение мелдониевой соли ацетилсалициловой кислоты (ацетилсалицилат 3-(триметиламмонийамино)пропаноата) для применения в качестве лекарственного средства. Целью настоящего изобретения является также получение лекарственного продукта, а именно ацетилсалицилат 3-(триметиламмонийамино)пропаноата (ацетилсалицилат мелдония), обладающего противовоспалительными, аналгетическими, жаропонижающими, противоревматическими, антигиперлипемическими, антиатеросклеротическими, антиагрегационными и антитромботическими свойствами. Также целью настоящего изобретения является способ лечения субъекта, который нуждается в противовоспалительной, аналгетической, жаропонижающей, противоревматической, антигиперлипемической, антиатеросклеротической, антиагрегационной и антитромботической терапии. Дополнительной целью изобретения является получение фармацевтической композиции, содержащей ацетилсалицилат мелдония(MASA) для указанной выше цели. Кроме этого, другие цели изобретения станут очевидными в дальнейшем для специалиста в этой области техники. Описание предпочтительных вариантов изобретения Далее следуют примеры различных солей и способов настоящего изобретения и их характеристики. Пример 1. Ацетилсалицилат 4-триметиламмонийбутаноат. Дигидрат гамма-бутиробетаина (1,81 г, 10 ммоль) и ацетилсалициловую кислоту (1,80 г, 10 ммоль) растворяют в этаноле (20 мл). Раствор концентрируют в вакууме приблизительно при 40C до состояния сиропа, который кристаллизуется при охлаждении. Кристаллическую массу растирают с ацетоном (50 мл), фильтруют, промывают ацетоном и сушат в вакууме при комнатной температуре. Выход бесцветных кристаллов с температурой плавления 120-122C составляет 3,04 г (93,5%). Полученное вещество растворимо в воде и стабильно в условиях окружающей среды. Спектр 1 Н ЯМР (D2O, стандарт - ТМС) : 1,93-2,12 (2 Н, м, СН 2 СН 2 СН 2); 2,33 (3H, с, COCH3); 2,40(2 Н, т, J=7,0 Гц, СН 2 СОО-); 3,09 (9 Н, с, CH3N); 3,14-3,37 (2 Н, м, CH2N); 7,16 (1H, дд, J=1,1 и 8,1 Гц, Н-3); 7,38 (1H, ддд, J=1,1, 7,6 и 7,6 Гц, Н-5); 7,56 (1 Н, ддд, J=1,8, 7,6 и 8,1 Гц, Н-4); 7,79 м.д. (1 Н, дд, J=1,8 и 7,6 Гц, Н-6). C16H23NO6: Вычислено, %: С 59,07; Н 7,13; N 4,30, Найдено, %: С 59,17; Н 7,10; N 4,13. Новая соль охарактеризована методом порошковой рентгенограммы (излучение Cu K), в которой имеются пики при углах 2: 5,10, 13,58, 13,83, 15,02, 15,17, 17,89, 19,33, 19,87, 21,85, 22,05, 23,32, 23,56,23,92, 24,75, 25,55, 25,80, 27,05, 27,91, 30,250,2. Структура указанной новой соли подтверждена методом рентгеноструктурного анализа монокристалла (см. ниже). Кристаллы являются моноклинными, при температуре эксперимента Т=-85C параметры ячейки имеют значения: а=13,1154(6) A, b=7,5092(3) А,с=17,6451 (9) А, =104,728(2), объем ячейки V=1693,5(1) A3, пространственная группа Р 21/а. Ниже указан фрагмент кристаллической структуры ацетилсалицилата 4-триметиламмонийбутаноатаL-Карнитин (1,61 г, 10 ммоль) и ацетилсалициловую кислоту (1,80 г, 10 ммоль) растворяют в этаноле (20 мл). Раствор концентрируют в вакууме приблизительно при 40C до состояния сиропа, который кристаллизуется при охлаждении. Кристаллическую массу растирают с ацетоном (50 мл), фильтруют,промывают ацетоном и сушат в вакууме при комнатной температуре. Выход бесцветных кристаллов с температурой плавления 90-94C составляет 3,17 г (93%). Вещество растворимо в воде и стабильно в условиях окружающей среды. Спектр 1 Н ЯМР (D2O, ТМС) : 2,32 (3H, с, COCH3); 2,53 (2 Н, d, J=6,6 Гц,СН 2 СОО-; 3,18 (9 Н, с, CH3N); 3,38-3,45 (2 Н, м, CH2N); 4,59 (1 Н, квинт., J=6,1 Гц, СНОН); 7,15 (1 Н, дд,J=1,1 и 8,1 Гц, Н-3); 7,37 (1 Н, ддд, J=1,1, 7,6 и 7,6 Гц, Н-5); 7,56 (1 Н, ддд, J=1,8, 7,8 и 7,8 Гц, Н-4); 7,79 м.д. (1 Н, дд, J=1,8 и 7,8 Гц, Н-6). C16H23NO7. Вычислено, %: С 56,30; Н 6,79; N 4,10, Найдено, %: С 55,67; Н 6,85; N 4,12. Новая соль охарактеризована методом порошковой рентгенограммы (излучение Cu K), в которой имеются пики при углах 2: 5,09, 12,62, 13,48, 13,84, 15,04, 17,82, 19,15, 19,77, 21,84, 22,56, 23,33, 23,92,24,40, 25,17, 25,43, 26,14, 27,14, 29,50, 30,360,2. Структура указанной новой соли подтверждена методом рентгеноструктурного анализа монокристалла (см. ниже). Кристаллы являются моноклинными, при температуре эксперимента Т=-85C параметры ячейки имеют значения: а=13,1342(6) A, b=7,6396(3) А,с=17,737(1) А, =104,535(2), объем ячейки V=1722,8(2) A3, пространственная группа Р 21/а. Ниже указан фрагмент кристаллической структуры ацетилсалицилата L-карнитина Пример 3. Ацетилсалицилат 3-(триметиламмонийамино)пропаноата (ацетилсалицилат мелдония). Растворяют дигидрат 3-(триметиламмонийамино)пропаноата (INN - Мелдоний) (3,64 г, 20 ммоль) и ацетилсалициловую кислоту (3,60 г, 20 ммоль) в горячем пропаноле-2 (30 мл) и нагревают при 50-55C в течение 20 мин. Прекращают нагревание и раствор перемешивают при комнатной температуре в течение 3 ч. Суспензию перемешивают дополнительно при 0C еще 3 ч, отфильтровывают осадок и промывают его холодным пропанолом-2 (2 раза по 15 мл). Указанную соль подвергают перекристаллизации из пропанола-2. Получают бесцветные кристаллы с температурой плавления 104-106C. Выход 4,12 г (63%). Спектр 1 Н ЯМР (D2O, ТМС) : 2,34 (3H, с, COCH3); 2,51 (2 Н, т, J=6,4 Гц, СН 2 СОО-; 3,16 (2 Н, т, J=6,4 Гц,CH2N); 3,33 (9 Н, с, CH3N); 7,17 (1H, дд, J=1,1 и 7,8 Гц, Н-3); 7,39 (1H, ддд, J=1,1, 7,6 и 7,6 Гц, Н-5); 7,58(1 Н, ддд, J=1,7, 7,6 и 7,8 Гц, Н-4); 7,81 м.д. (1H, дд, J=1,7 и 7,6 Гц, Н-6). C15H22N2O6. Вычислено, %: С 55,11; Н 6,79; N 8,58. Найдено, %: С 55,15; Н 6,79; N 8,53. Новая соль охарактеризована методом порошковой рентгенограммы (излучение Cu K), в которой имеются пики при углах 2: 5,19, 13,12, 13,82, 14,10, 14,95, 15,36, 15,93, 18,11, 18,97, 19,74, 21,02, 22,15,23,15, 23,65, 24,31, 25,18, 26,18, 26,58, 27,73, 28,360,2. Структура указанной новой соли подтверждена методом рентгеноструктурного анализа монокристалла (см. ниже). Кристаллы являются моноклинными, при температуре эксперимента Т=-85C параметры ячейки имеют значения: а=19,3399(8) A, b=7,1400(3) А, с=35,137(2) А, =90,758(2), объем ячейки Ниже указан фрагмент кристаллической структуры ацетилсалицилата 3-(триметиламмонийамино)пропаноата Фармакологические свойства ацетилсалицилата 3-(триметиламмонийамино)пропаноата (ацетилсалицилат мелдония). Предусматривается, что новое вещество, раскрытое в указанном изобретении, может принимать различные полиморфные кристаллические формы и сольваты, предпочтительно гидраты, которые обладают подобными биологическими свойствами и поэтому включены в это изобретение в качестве вариантов описанного вещества. Первоначально авторы установили, что ацетилсалицилат мелдония замедляет и существенно снижает расширение кожных кровеносных сосудов, вызванное никотиновой кислотой. Дальнейшие эксперименты продемонстрировали неожиданное улучшение фармакологической активности ацетилсалицилата мелдония. Использованные сокращения. Для краткости в описании будут использоваться следующие сокращения:NA (фирма Acros Chemicals), MD (Grindex), ASA (Acros Chemicals), LA (MK 0524, Cayman Chemicals), гидросульфат клопидогрела для испытаний in vitro (Molean Corporation), CL для испытаний in vivo в виде Plavix (Sanofi-Aventis), DI (Sigma-Aldrich). История вопроса. Ацетилсалициловая кислота представляет собой наиболее широкоупотребляемый лекарственный препарат, хорошо известный своими противовоспалительными, аналгетическими, жаропонижающими и противоревматическими свойствами. В малых суточных дозах ASA также применяется в качестве антитромбоцитарного средства для пациентов с риском сердечно-сосудистого заболевания (Eidelman R.S. и др., Arch. Intern. Med., 2003; 163: 2006-2010). Тромбоциты играют главнейшую роль в развитии атеросклероза и неизбежного образования тромба в ходе ишемической болезни сердца. Антитромбоцитарные средства становятся первостепенными для предупреждения и терапии различных заболеваний, в том числе сердечно-сосудистых, цереброваскулярных и периферических артериальных систем (MeadowsT.A. и др., Circ. Res., 2007; 100(9): 1261-75). Несмотря на многолетнюю известность в качестве антитромбоцитарного агента, теперь ASA приобретает большее признание в кардиологии благодаря своим противовоспалительным свойствам (RidkerP.M. и др., N. Engl. J. Med., 1997; 336:973-979). Следовательно, клинические измерения таких воспалительных маркеров, как С-реактивный белок (CRP), частично могут отражать показатели атеросклероза(Buckley D.I. и др., Ann. Intern. Med., 2009; 151:483-495). Современные данные указывают, что уменьшение содержания CRP предупреждает явления CHD(Ridker P.M. и др., Lancet, 2009; 373:1175-82). Ross предположил, что атеросклероз является воспали-3 021588 тельным заболеванием (Ross R., N. Engl. J. Med., 1999; 340:115-126). Ацетилсалициловая кислота может не только влиять на воспалительный аспект атеросклероза, но также может давать непосредственный вклад, стимулируя понижение содержания липидов (Kourounakis A.P. и др., Experimental and MolecularPathology, 2002, 73:135-138). Ниацин (NA) представляет собой эффективный агент, изменяющий содержание липидов, который предупреждает атеросклероз и ослабляет сердечно-сосудистые явления. NA оказывает разнообразные эффекты на липопротеин и противодействует тромбозу артерии, улучшая эндотелиальную функцию,ослабляет воспаление, повышает стабильность тромбоцитов и снижает вероятность тромбоза (RosensonNA почти полностью предупреждает внутрисосудистое свертывание крови, вызванное тромбопластином и питуитрином, что демонстрирует тромболитический эффект ниацина (Baluda V.P., Кардиология, 1974; 14(11): 105-7 (рус.). Противотромболитические свойства NA описаны несколькими авторами(Shestakov V.A., Пробл. Гематол. Перелив. Крови, 1977; 22(8):29-35, Chekalina S.I., Sov. Med. 1982(5): 105-8). Никотиновая кислота снижает риск свертывания крови (Chesney С.М. и др., Am. Heart J., 2000; 140:631-36). Ниацин ингибирует агрегацию тромбоцитов (Lakin K.M., Фармакол. Токсикология, 1980; 43(5):5815). Вне организма NA влияет на активность тромбоцитов, умеренно ингибируя агрегирование и стимулируя значительное выделение простагландина с главным образом интактной экспрессией главного рецептора тромбоцитов. Влияние NA является уникальным, отличаясь от известного эффекта антитромбоцитарных средств, и позволяет предположить возможность терапевтических комбинаций (SerebruanyNA является эффективным агентом, изменяющим содержание липидов, что предупреждает появление атеросклероза и ослабляет сердечно-сосудистые явления (Drexel H., European Heart Journal Supplements, 2006; Vol. 8, Suppl. F: F23-F29, Savel'ev A.A., Shershevskii M.G., Клин. Мед. (рус.), 1996; 74:48-52). Доступны три рецептуры NA (с непосредственным выделением, с продленным выделением и длительного действия). Непосредственно выделяющийся NA ассоциирован с неблагоприятным приливом крови и повышением содержания глюкозы в крови. NA длительного действия ассоциирован с пониженным приливом крови, но также с риском гепатотоксических эффектов. Продленное выделение сопряжено с меньшим приливом крови и низким гепатотоксическим риском (McKenney J., Arch. Intern. Med.,2004; 164(7):697-705). Клиническое применение NA ограничивается кожным приливом крови. Продленное выделение никотиновой кислоты может способствовать регулированию явлений прилива крови (Guyton J.R. и др., J.Clin. Lipidol., 2009; 3: 101-108). Для регулирования прилива крови были предложены ASA и другие нестероидные противовоспалительные препараты (NSAID) с другими фармацевтическими композициями,чтобы обеспечить улучшение использования NSAID до дозировки NA (WO9632942, WO9906052,WO2009142731). Недавно был предложен специфический антагонист для простагландина D2 (Parhofer K.G., VascularHealth и Risk Management, 2009;5:901-908) рецепторный подтип 1, ларопипрант, в качестве средства для снижения прилива крови, вызванного NA (Lai E. и др., Clin. Pharm. Ther., 2007; 81:849-857, DavidsonM.H., Am. J. Cardiol., 2008; 101 [suppl]:14B-19B). Хотя добавление ларопипранта будет снижать частоту прилива крови, LA не может полностью исключить указанный побочный эффект. Ларопипрант не изменяет действие никотиновой кислоты на липиды или другие побочные эффекты никотиновой кислоты. Следовательно, комбинация никотиновой кислоты с ларопипрантом может обеспечить использование более высоких доз никотиновой кислоты и поэтому раскрывается полный потенциал лекарственного препарата (Parhofer K.G., Vascular Health andRisk Management, 2009; 5:901-908, Olsson A.G., Expert Opinion on Pharmacotherapy, 2010; 11(10): 77751726). Мелдоний представляет собой лекарственный препарат с определенным полезным воздействием на сердце и сосуды. Некоторая желательная активность MD была обнаружена на животных моделях атеросклероза (Veveris M., Smilsaraja В., Baltic J. Lab. Anim. Sci., 2000; 10,194-199, Veveris M. и др., Baltic J.(2):24-7) и наблюдалась в клиниках (Karpov R.S. и др., Тер. Арх., 1991; 63(4):90-3). Кроме того, было отмечено, что MD ингибирует агрегацию тромбоцитов (Tsirkin V.I., Рос. Кардиол. ж., 2002; 1: 45-52). При двухнедельном терапевтическом применении перорального введения MD кроликам и собакам, после экспериментального артериального тромбоза обнаружен тромболитический эффект (Logunova L. и др.,Экспер. клин, фармакотер., 1991; 19:91-98 (рус.). Данные о профилактическом эффекте MD для ограничения или предупреждения тромбоза не известны. Пример 4. Определение острой токсичности MASA. Острую токсичность MASA определяют на крысах Wistar и мышах ICR при пероральном введении. Методика. Используют самцов мышей IRC с массой тела 20-22 г и крыс Wistar, имеющих массу 200-230 г. Для определения острой токсичности каждую дозу дают 6 животным, при этом каждую следующую дозуCurrent Sci. 2007; 93:917-920 с модификацией для определения доверительного интервала дозы (Turner R. В книге "Методы тестирования в фармакологии" Screening Methods in Pharmacology, Acad. Press, NewLD50=наименьшая летальная доза для всех животных группы - (ab)/N,N - количество животных в каждой группе,а - разность доз,b - средняя смертность (летальность в двух соседних группах/2).MASA растворяют немедленно в 0,2% агар-агаре и вводят перорально в желудок через катетер. Объем введенной таким образом жидкости не превышал 0,5 мл для мышей и 2 мл для крыс. Животных наблюдают в течение 10 суток после введения дозы. Результаты. Результаты относительно острой токсичности MASA для мышей представлены в табл. 1 и 2. Таблица 1 Острая токсичность MASA для мышей (перорально п/о)LD50=3000 - (5000/6)=2167. Коэффициент f при Р=0,05 для указанного эксперимента равен 1,32, следовательно, доверительный интервал для LD50 составляет 1642-2860 (мг/кг). После введения MASA токсическое действие проявляется в течение первых часов, причем часть животных умирают в течение первых 2 суток. Симптомы токсичности у выживших животных постепенно ослабевают и спустя 5-8 суток эти животные не отличаются от контрольных особей такого же возраста. Таким образом, найдено, что значение LD50 для MASA (на мышах п/о) составляет 2167 (1642-2860) мг/кг. Результаты. Результаты острой токсичности MASA для крыс п/о представлены в табл. 2 и 3. Таблица 2 Острая токсичность MASA для крыс (п/о)LD50=3000 - (4500/6)=2250. Коэффициент f при Р=0,05 для указанного коэффициента равен 1,308, следовательно, доверительный интервал для LD50 составляет 1720-2944 (мг/кг). Введение п/о дозы 1500 мг/кг MASA крысам вызывает кратковременное нарушение особенностей питания и движения, но животные выживают. Токсические симптомы начинают исчезать на третьи сутки после введения. Таким образом, найдено, что значение LD50 для MASA (на крысах п/о) составляет 2250(1720-2944) мг/кг. Сводка. Исследование острой токсичности продемонстрировало, что MASA представляет собой вещество с низкой токсичностью (LD502000 мг/кг для мышей и крыс, п/о). Острая токсичность для ASA по данным фирм Boehringer Ingelheim Pharmaceuticalc, Inc., Acros Chemicals и Sigma-Aldrich составляет 250 мг/кг для мышей и 200 мг/кг для крыс п/о, хотя фирма Bayer AG приводит значение LD50 для крыс п/о более 1100 мг/кг и, таким образом, MASA является менее токсичным, чем ASA. Таблица 3 Острая токсичность MASA для мышей и крыс; N=6 Пример 5. Исследование аналгетической жаропонижающей и противовоспалительной активностиMASA в сравнительных экспериментах с ASA и MD. При исследовании аналгетического, противовоспалительного и жаропонижающего действия MASA использовались общепринятые методы для оценки NSAID. В экспериментах использовали белых лабораторных мышей Mongrel и крыс Wistar. Животных содержали в группах по 7, 8 особей в соответствую-5 021588 щих клетках, в камерах искусственного климата при 221C, относительной влажности 605% и 12/12-часовых циклах чередования света и темноты, при свободном доступе к пище и воде. Были сформированы следующие группы для сравнения эффектов MASA с ASA и MD при оральном приеме: Водные растворы испытуемых веществ были приготовлены немедленно. В каждой экспериментальной серии имелась контрольная группа животных, которые получали п/о идентичный объем воды. Статистика. Данные обрабатывали с использованием программы Microsoft Excel 2007 и результаты выражали как "среднее значениестандартная ошибка измерения" (СОИ). Средние результаты для различных групп сопоставляли с использованием однофакторного дисперсионного анализа (ANOVA) с повторным сопоставлением (тест Tukey's). Вероятность Р 0,05 считалась значимой. 5.1. Исследование аналгетической активности. 5.1.1. Оценка аналгетической активности с помощью теста корчей, вызванных введением мыши уксусной кислоты. Методика. Восприятие боли оценивали методом химического раздражения - теста корчей от введения уксусной кислоты (Charaborty А. и др., Indian J. of Pharmacology, 2004; 36(3):148-150). Животные получали внутрибрюшинно (в/б) 0,25 мл 0,75% водного раствора уксусной кислоты. После инъекции животных размещали отдельно в специальных боксах и наблюдали в течение 10 мин. Регистрировали количество абдоминальных сокращений. Аналгетическая активность проявлялась путем уменьшения количества абдоминальных сокращений в течение 10 мин. Испытуемые вещества вводили за 30 мин до раздражающего вещества. Уровень обезболивания выражали как аналгетический коэффициент, рассчитываемый следующим образом:Ct - количество сокращений в испытуемой группе. Полученные результаты приведены в табл. 4. Таблица 4 Аналгетическое действие испытуемых веществ в тестовой модели корчей; Для MASA наблюдается положительный эффект в зависимости от дозы. Наилучшие результаты продемонстрированы в группах ASA50 и MASA300 (Р 0,0005), тогда как MD не обладает активностью. Аналгетический коэффициент для группы MASA300 составляет 7,3 (только у 5 животных из 8 наблюдалась болевая реакция). 5.1.2. Оценка аналгетической активности в тесте горячей пластинки с мышами. Методика. Тест горячей пластинки был проведен с 52 мышами, имеющими массу 17-26 г, как описано в литературе (Belyakov V.A., Solov'ev I.K. Наркотические аналгетики, Нижний Новгород, 2001 (рус Тест горячей пластинки использован для отбора аналгетиков центрального действия (Osterberg А. и др., J. Phar-6 021588macol. Exper. Ther., 1958; 122:59). Водные растворы испытуемых веществ вводились п/о за 30 или 60 мин до испытания. Регистрировали время до облизывания лап. Показателем аналгетической активности является запаздывание отклика на термическое раздражение. Результаты представлены в табл. 5. Таблица 5 Время отклика в тесте горячей пластинки с мышами;MD проявляется значительный аналгетический эффект через 30 и 60 мин. ASA значительно повышает порог болевой чувствительности только через 60 мин, что указывает на более медленное возникновение эффекта (табл. 5). Пример 6. Сравнительная оценка жаропонижающей активности испытуемых веществ. 6.1. Оценка предупреждающей жаропонижающей активности у крыс путем инъекции пирогенала. Методика. Эксперименты проводились на 48 крысах Wistar с массой тела 165-182 г путем внутримышечной инъекции пирогенала (Гос. учреждение НИИЭМ им. Н.Ф. Гамалеи, Москва, РФ) в дозах по 100 мкг(Shwarz G.Y., Syubaev R.D., Ведомости Научного центра экспертизы и государственного контроля лекарственных средств, МЗ РФ 2000; 1:44-50 (рус.). Испытуемые вещества вводили п/о за 1 ч до инъекции пирогенала. Ректальную температуру измеряли с помощью электрического термометра TERMO до инъекции пирогенала (базовый уровень) и в течение 3 ч после инъекции. Жаропонижающую активность оценивают по уменьшению гипертермической реакции через 2 ч после инъекции пирогенала, что хорошо коррелирует с опубликованными данными (10) о пике реакции (табл. 6). Комнатную температуру поддерживают равной 20-21C. Как видно из приведенных данных, температура тела животных в контрольной группе постепенно повышается, достигает максимума через 2 ч и остается нормальной еще в течение 1 ч. Таблица 6 Изменения ректальной температуры крыс в контрольной группе под действием пирогенала; N=8; среднее значениеСОИ Испытуемые вещества незначительно влияют на нормальную температуру тела животных, но значительно снижают перегревание организма, вызванное пирогеналом (табл. 7). Таблица 7 Влияние испытуемых веществ на перегревание организма, вызванное внутримышечной (в/м) инъекцией пирогенала; N=8; среднее значениеСОИ В модели перегревания организма увеличение температуры тела, вызванное инъекцией пирогенала,полностью предупреждается в группах ASA50 и MASA300 (табл. 7). В группах MD100, MASA75 и MASA150 жаропонижающее действие проявляется слабее. 6.2. Оценка предупредительного жаропонижающего действия на крысах путем инъекции пирогенала (лечебный режим). Методика. Жаропонижающее действие испытуемых веществ в терапевтическом (лечебном) режиме исследовали на 48 крысах с массой тела 182-205 г, у которых перегревание было вызвано путем инъекции дозы пирогенала 100 мкг (Shwarz G.Y., Syubaev R.D., Ведомости НЦЭГК лекарственных средств М 3 РФ, 2000; 1:44-50 (рус.). Испытуемые вещества давали п/о через 2 ч после инъекции пирогенала непосредственно после регистрации повышенной температуры тела. Ректальную температуру измеряли электрическим термометром TERMO до в/м инъекции пирогенала (температура базового уровня), на пике перегревания организма (контроль пирогенала) и через 30 мин после обработки испытуемым веществом, т.е. через 2,5 ч после инъекции пирогенала. Комнатную температуру поддерживали равной 20-22C. Результаты представлены в табл. 9. Таблица 9 Влияние испытуемых веществ на перегревание, вызванное внутримышечной инъекцией (лечебный режим); N=8, среднее значениеСОИ Пирогенал вызывает значительное и аналогичное повышение температуры у всех животных, использованных в эксперименте (сравните контроль пирогенала относительно базового уровня, табл. 9). За исключением MD, обработка испытуемыми веществами вызывает снижение температуры тела относительно базового уровня и контроля пирогенала. В группах MASA300 и ASA50 наблюдалась сравнительно высокая гипотермия, причем снижение температуры тела было значительным относительно контрольной и MD100 групп. Необходимо отметить, что в группе MASA300, в отличие от группы ASA50,снижение температуры тела также было значительным относительно контроля пирогенала. Это демонстрирует значительное и быстрое жаропонижающее действие MASA, что могло бы быть полезным в клинике. Пример 7. Сравнительная оценка противовоспалительной активности испытуемых веществ. 7.1. Исследование на модели острого воспалительного отека. Методика. Эксперименты были проведены с использованием теста карагенана (Winter С. и др., Proc.Soc. Exptl.Sigma) в физиологическом растворе (0,1 мл) вводили крысам в заднюю лапу. Испытуемые вещества вводили п/о (через катетер в желудок крысы) через 30 мин после инъекции карагенана. Объем лапы измеряли с помощью онкометра на базовом уровне и через 4 ч после инъекции карагенана. Процент предупреждения (ингибирования) отека рассчитывали по формуле Р(%)=(1-Vo/Vc)100,где Р - предупреждение (ингибирование) отека, %;Vo - разность между объемом лапы на базовом уровне и в условиях эксперимента;Vc - аналогичная разность в контрольной группе. Результаты представлены в табл. 10. Таблица 10 Антиэкссудативная активность испытуемых веществ в модели карагенанового воспаления; N=7, среднее значениеСОИ В модели острого воспалительного отека объем пораженной конечности в контрольной группе увеличивается приблизительно в 1,6 раза. Наиболее выраженное влияние на воспалительный процесс отмечено в группе MASAI50, где коэффициент предупреждения составляет 93% относительно контрольной группы. В группе MASA300 наблюдалась немного меньшая активность - отек уменьшился на 91%. Уменьшение отека также наблюдалось в группах MD 100 и ASA50. 7.2. Исследование противовоспалительной активности испытуемых веществ против карагенанового отека в профилактическом режиме. Методика. Карагенановый отек исследовали широко известным методом (Okunevich I.V., Ryzhenkov V.E., Патол. Физиол. Экспер. Тер., 2002(2):24-7 (рус.) на 42 крысах с массой тела 178-220 г. Испытуемые вещества вводились п/о в течение 5 дней. На 6 день непосредственно после введения испытуемых веществ крысы получали инъекцию 0,1 мл 1% раствора карагенана в заднюю лапу. Объем лапы измеряли на базовом уровне и через 4 ч после инъекции карагенана. Коэффициент предупреждения рассчитывали, как указано в предыдущем параграфе. Профилактическое введение испытуемых веществ в течение 6 дней приводит к уменьшению отека по сравнению с необработанными животными (табл. 11). Таблица 11 Предупреждающее антиэкссудативное действие испытуемых веществ против карагенанового отека; N=7, среднее значениеСОИ В группах MASA150 и MASA300 отмечена значительная предупреждающая активность (94%) более высокая, чем активность в группах MD100 (34%) и ASA50 (70%) для указанной воспалительной модели (табл. 11). Для оценки интенсивности воспалительного процесса определяли содержание CRP с использованием стандартного метода на анализаторе "INTEGRA 400+" в конце эксперимента (5 ч после инъекции карагенана). Результаты определения содержания CRP в крови представлены в табл. 12. Таблица 12 Содержание CRP в крови крыс для карагенановой модели воспаления крыс; N=7, среднее значениеСОИ Как следует из приведенных данных, карагенан вызывает увеличение содержания CRP в крови крыс. В группе ASA100 увеличение содержания CRP снижается на 50% (табл. 12). Неожиданно в группеMASA150 увеличение содержания CRC выражено существенно слабее (только 33% от контроля). Это подтверждает вывод, что MASA может оказывать положительный эффект на воспалительный процесс в клинике. Пример 8. Исследование противоревматической активности MASA по сравнению с ASA и MD. Клинические данные показывают, что пациенты с ревматоидным артритом (RA) имеют предрасположенность к атеросклерозу и сердечно-сосудистым заболеваниям (Nasonov E.L., Вестн. Росс. Акад. Наук., 2003, (7):6-10). У пациентов с продолжительным RA чаще наблюдается атеросклероз, чем у пациентов такого же возраста с более поздним началом заболевания. Системное воспаление может усиливать опасность сердечно-сосудистого заболевания, связанного с возрастом (Del Rincon I. и др., Atherosclerosis,2007; 196(2):354-360). Ревматоидный артрит занимает ведущее положение среди ревматоидных состояний. Наиболее подходящей экспериментальной животной моделью для ревматоидного артрита человека является модель адъювантного артрита, вызванного инъекцией адъюванта Фрейнда в заднюю лапу крысы. Указанная модель широко применяется при скрининге антиартритических средств (Wei Jia и др., Journal of Ethnopharmacology, 2003(89):139-141; Sutharson Lingadurai и др., African Journal of traditional, complementary и alternative medicines, 2007, 4(4):411-416). Методика. Эксперименты этого изобретения были спланированы с целью тестирования влияния MASA на развитие стимулятора артрита по сравнению с MD и ASA. Эксперименты были проведены с крысамиWistar, имеющими исходную массу 153-185 г. Крыс выдерживали в камерах искусственного климата при 221C, относительной влажности 605% и 12/12-часовых циклах чередования света и темноты. В каждой стандартной клетке размещали по 7 крыс, имеющих неограниченный доступ к питьевой воде и гранулированному стандартному корму. Все эксперименты проводились в соответствии с Директивой Совета ЕЭС от 24 ноября 1986 г. (86/609/ЕЕС), относящейся к содержанию экспериментальных животных. Были приняты все меры, чтобы свести к минимуму страдания животных и снизить количество использованных животных. Была использована модифицированная стандартная методика возбуждения и оценки развития хронического стимулятора артрита (Bellavite P., Ortolani R., Conforti A., Immunology and Homeopaty. 3. Experimental Studies on Animal Models, Advance Access Publication, 2.05, 2006, 171-186). Крысам вводили инъекцию раствора полного адъюванта Фрейнда: 0,1 мл в заднюю лапу и 0,05 мл внутрибрюшинно. Растворы испытуемых веществ готовили немедленно. Использовали водные растворы: ASA 0,1 и 1%, MD 1% и MASA 0,25, 1 и 2% растворы. Испытуемые растворы вводились животным п/о с помощью катетера в желудок. Были сформированы следующие группы животных (N=7). Животные контрольной группы и животные групп AdA вместо испытуемых веществ получали п/о воду по той же схеме, как в испытуемых группах. Статистика. Данные обрабатывали с использованием программы Microsoft Excel 2007 и результаты выражали как "среднее значениеСОИ". Средние результаты для различных групп сопоставляли с использованием однофакторного дисперсионного анализа (ANOVA) с повторным сопоставлением (тест Tukey's). Вероятность Р 0,05 считалась значимой. Результаты. Динамику клинических проявлений артрита исследовали на 14 и 28 дни. Действие испытуемых веществ оценивают с использованием следующих критериев: 1) оценка локальных проявлений артрита - объем лапы и контур голеностопного сустава; 2) оценка анализа крови (WBC),3) оценка биохимических тестов (CRP),4) оценка иммунологических показателей (содержание CIC). Отек, то есть увеличение объема задней лапы, измеряют онкометром. Предупреждение (ингибирование отека) в процентах рассчитывают по формуле Р(%)=(Vc-Vt)Nc100,где Vc - объем лапы в контрольной группе;Vt - объем лапы в тестовой группе; Р - предупреждение, % (ингибирование отека). Гематологические показатели определяют стандартными методами с помощью гематологического анализатора "PENTRA 120", CRP определяют на приборе "INTEGRA 400+". Содержание CIC в сыворотке крови определяют спектрометрически с использованием этиленгликоля. После инъекции адъюванта Фрейнда у всех животных испытуемых групп развивалось хроническое воспаление, крысы были утомленными, агрессивными при манипулировании, взъерошенными. Однако особенности питания во всех группах не отличались от контрольных групп. Увеличение массы тела во всех группах практически не отличалось от контрольной группы. В табл. 13 и 14 приведены данные локальных проявлений артрита: объем лапы (характеризует отек мягких тканей) и контур/объем голеностопного сустава (характеризует органические повреждения тканей сустава артритического типа) на 14 и 28 дни. Таблица 13 Действие испытуемых веществ на объем лапы (мл) на 14 и 28 дни после инъекции адъюванта Фрейнда; N=7; среднее значениеСОИ Как видно из данных табл. 13, на 14 день у всех животных испытуемых групп развивается выраженный отек мягких тканей. Обработка в течение 14 суток сравнительно мало влияет на развитие отека. Однако у животных в группах MASA100 и MASA200 имеется существенно менее выраженный отек, чем у животных в группе ASA10. На 14 день MD и ASA10 не предупреждают развитие отека, но дают даже больший объем отеков по сравнению с группой AdA (отрицательная защита -7%). На 28 день любые дозы MASA и ASA100 значительно предупреждают развитие отека (соответствующий процент защиты: 41,45, 24 и 32%). Необходимо отметить, что MASA100 обеспечивает значительно лучшую защиту, чемASA10, ASA100 и MD. Таблица 14 Влияние испытуемых веществ на изменения голеностопного сустава крыс на 14 и на 28 дни после инъекции адъюванта Фрейнда; N=7; среднее значениеСОИ Анализы данных голеностопного сустава (табл. 14) показывают, что на 14 день только MASA200 обеспечивает существенную защиту от развития артритического повреждения. На 28 день существенную защиту дают MASA25, MASA100 и ASA100. В указанном экспериментальном ряду сравнительно лучшую защиту обеспечивает MASA100. Авторы установили, что на 28 день уровень отека (табл. 13) и артритических изменений голеностопного сустава (табл. 14) уменьшаются. MASA100 обладает значительно большей эффективностью, чем ASA или MD. Оценка WBC указывает увеличение (лейкоцитоз) под действием адъюванта Фрейнда (табл. 15). Лейкоцитоз является характерным признаком воспалительного процесса. Таблица 15 Изменения WBC в крови крыс под действием испытуемых веществ на 14 и на 28 дни после инъекции адъюванта Фрейнда; N=7; среднее значениеСОИ Использование испытуемых веществ вызывает уменьшение WBC по сравнению с группой AdA, что указывает на противовоспалительную активность. Хотя отсутствует статистически значимое различие между действием испытуемых веществ на увеличение содержания лейкоцитов, на 14 день сравнительно более высокую активность проявляет MASA 100, однако на 28 день наиболее активна MASA200 (табл. 15). Для оценки развития воспалительного процесса определяли содержание CRP на 14 и на 28 дни. Известно, что содержание CRP увеличивается в ходе воспалительного процесса. Таблица 16 Изменения содержания CRP в крови крыс под действием испытуемых веществ на 14 и 28 дни после инъекции адъюванта Фрейнда; N=7; среднее значениеСОИ Как следует из данных в табл. 16, на 14 день во всех испытуемых группах наблюдается увеличение содержания CRP, что указывает на воспалительный процесс. В серии экспериментов согласно изобретению только для MASA200 наблюдается значительная защита от увеличения CRP на 14 день. Необходимо отметить, что MASA200 на 14 день оказывает значительно лучшее действие, чем MASA100. На 28 день существенно лучшая защита наблюдается в группах MASA25 и MASA100 по сравнению с группойASA10 (табл. 16). Содержание CIC определяют с помощью стандартного спектрофотометрического метода (Baranovskii P.V., Rudyk В.I., Лабораторное дело, 1982; 12:35-39 (рус.). Иммунологические коэффи- 13021588 циенты были исследованы в динамике на 14 и на 28 дни. Изменения содержания CIC представлены в табл. 17. Таблица 17 Количество CIC (в единицах) на 14 и на 28 дни после инъекции адъюванта Фрейнда; N=7; среднее значениеСОИ На 14 и на 28 дни содержание CIC в испытуемых группах было выше, чем в контрольной группе. Содержание CIC на 14 день было ниже, чем в AdA группе, только в группах ASA10 и MASA25. На 28 день уровень CIC в группах, получающих испытуемые вещества, был близок к контрольному уровню, за исключением группы ASA100. В ходе эксперимента увеличение содержания CIC на 14 день наблюдалось в группах ASA100, MASA100 и MASA200. На 28 день содержание CIC в группах MASA100 и MASA200 нормализовалось. Увеличение содержания CIC в сыворотке крови может наблюдаться при различных патологических состояниях иммунитета. Значительное увеличение CIC наблюдается при воспалительных процессах, в том числе в соматических состояниях, причем содержание CIC указывает на интенсивность патологического процесса (Bier О. и др., Fundamentals of Immunology, New York, Heidelberg, Berlin,p. 442). Продолжительная обработка различными дозами MASA снижает содержание CIC до нормы. При достаточно активном иммунитете основная часть CIC удаляется клетками Купфера, причем уменьшение содержания CIC воспринимается как положительный эффект. Тот факт, что при использовании MASA в группах MASA100 и MASA200 наблюдается нормализующий эффект для содержания CIC на 28 день,указывает, что продолжительное использование MASA в различных дозах клинически может быть более перспективным при лечении артрита, чем повышенные дозы ASA. Пример 9. Исследование антигиперлипидемических характеристик. Атеросклероз представляет собой многофакторный процесс (Berliner J.A. и др., Circulation, 1995; 91:2488-2495), причем клиническое воздействие возрастает наряду с ростом симптомов коронарного заболевания сердца. Существенную роль в процессе атеросклероза играет воспаление и реакция организма на воспаление (Ross R, Am. Heart J., 1999; 138; S419-S420). Клинические наблюдения показывают, что противовоспалительная терапия ослабляет проявления атеросклероза (Stoller D.K. и др., J. Surg. Res.,1993; 54:7-11). Экспериментальные данные подтверждают существенную корреляцию противовоспалительной активности с гиполипидемической активностью, по меньшей мере, среди ингибиторов COX-I(Kourounakis A.P. и др., Exper. Mol. Pathol., 2002; 73:135-138). В изобретении гиполипидемическая активность ASA и MASA сопоставляется при эквивалентных дозах. 9.1. Сравнительное действие испытуемых веществ на содержание липидов у крыс для модели острой гиперлипидемии. Методика. Использовали самцов крыс Wistar с массой тела 250-270 г. Животных в группах по 6-8 особей выдерживали в камерах искусственного климата при 221C, относительной влажности 605% и 12/12 часовых циклах чередования света и темноты при свободном доступе к воде и пище. Состояние острой экспериментальной гиперлипидемии/гиперхолестеринемии индуцировали введением Triton WR1339(TR), как описано в работе Kourounakis А.Р. и др., Exper. Mol. Pathol., 2002; 73:135-138). Крыс после ночного голодания обрабатывали в/б дозами 250 мг/кг TR, растворенными в изотоническом физиологическом растворе. Раствор испытуемого вещества или воду вводили п/о контрольной и TR группам животных за 1 ч до и через 20 ч после введения TR, как описано ниже. Кровь для биохимического анализа отбирали на следующий день (через 24 ч после инъекции TR) путем пункции сердца под эфирным наркозом. Сыворотку отделяли путем центрифугирования и анализировали на общее содержание холестерина, HDL, LDL и TG с использованием стандартных наборов. Были проведены три серии экспериментов. Статистика. Данные обрабатывали с использованием программы Microsoft Excel и результаты выражали как"среднее значениестандартная ошибка среднего". Средние результаты для различных групп сопоставляли с использованием однофакторного анализа ANOVA и критерия Стьюдента. Вероятность Р 0,05 считалась значимой. Серия I. Сопоставление ASA, MD и MASA. Результаты. У крыс, которые получали TR, развивалась выраженная гиперхолестеринемия и гиперлипидемия,причем общее содержание холестерина, LDL и TG значительно отличалось от содержания в контрольной группе (общий С увеличился в 6-7 раз, TG более чем в 30 раз (табл. 18. Терапия ASA, особенно в дозе 90 мг/кг, ограничивает увеличение общего С, LDL и TG, но незначительно изменяет содержание HDL. В экспериментальной серии авторов MD незначительно защищает от изменений содержания липидов, вызванного Тритоном (TR). Обработка MASA в зависимости от дозы обеспечивает защиту от индуцированной TR гиперлипидемии/гиперхолестеринемии. MASA в дозе 75 мг/кг не отличается от ASA45, но в дозе 150 мг/кг MASA гораздо более эффективен, чем ASA45 и MD150, для защиты от действия TR. MASA300 значительно лучше, чем ASA45 и ASA90 снижает содержание общего С, LDL и TG. Это указывает, что MASA может быть полезным для предупреждения и/или лечения состояний гиперхолестеринемии и гиперлипидемии и с учетом противовоспалительной активности MASA может быть полезным для предупреждения и/или лечения атеросклероза и других состояний, вызванных нарушениями метаболизма липидов и воспалением. Таблица 18 Сравнительное действие MD, ASA и MASA на содержание липидов в модели крысиной гиперлипидемии; n=6-8; среднее значениеСОИ Результаты. В экспериментальной серии авторов изобретения NA обеспечивает значительную защиту от изменений содержания липидов (С, LDL и TG), индуцированных TR (табл. 19). Комбинация ASA и NA незначительно изменяет действие NA на содержание липидов. Неожиданно, что комбинация MASA и NA существенно усиливает действие NA50 и превосходит защитное действие MASA на увеличение содержания TG под действием TR (табл. 19). Комбинированное применение MASA и NA также является существенно более эффективным, чем нормализующее действие ASA45+NA50 на содержание LDL и TG. Таблица 19 Раздельное и комбинированное действие MD, ASA и MASA на содержание липидов у крыс в модели гиперлипидемии; n=6-8; среднее значениеСОИ Результаты. В экспериментальной серии авторов SI в дозе 5 мг/кг обеспечивает значительную защиту от изменений содержания липидов (С, LDL и TG), индуцированных TR (табл. 20). Комбинация SI с испытуемыми веществами увеличивает нормализующее действие на содержание липидов. MASA в комбинации с SI значительно более эффективен, чем MD+SI, для предотвращения увеличения содержания LDL и TG под действием TR (табл. 20). В документе WO2006099244 предложена комбинация MD со статином без каких-либо данных. Для комбинированного использования статинов и ASA требуется специальная фармацевтическая композиция, поскольку эти вещества фармакологически и химически несовместимы (патентUS 6235311), поэтому синергетический эффект невозможен. Таблица 20 Раздельное и комбинированное действие MD, MASA и SI на содержание липидов у крыс в модели гиперлипидемии; n=6-8; среднее значениеСОИ Сводка. Результаты указывают на потенциал MASA для предупреждения и/или лечения гиперхолестеринемии и гиперлипидемии. С учетом противовоспалительной активности MASA может быть более эффективным, чем ASA или MD для предупреждения и/или лечения атеросклероза и других состояний, развивающихся под действием воспаления. Комбинированное использование MASA и NA эффективнее усиливает положительное действие отдельных веществ на экспериментальное увеличение содержания липидов, чем ASA плюс NA. В комбинации с SI MASA не только более эффективен, чем индивидуальныйSI, но также обладает гораздо большей эффективностью, чем MD+SI при противодействии увеличению содержания LDL и TG под действием TR. 9.2. Раздельное и комбинированное влияние NA и MASA на содержание липидов у крыс в модели гиперлипидемии. Методики. Использовали самцов крыс Wistar с 250-270 г. Животных выдерживали в камерах искусственного климата при 221C, относительной влажности 605% и 12/12-часовых циклах чередования света и темноты при свободном доступе к воде и пище. Начальная масса животных составляла 220-240 г. Состояие хронической (субхронической) экспериментальной гиперлипидемии/гиперхолестеринемии индуцировали введением TR с использованием метода, описанного Levine и Saltzman (Levine S., Saltzman A., J.Pharmacol. Toxicol. Meth., 2007; 55:224-226). Животные получали 250 мг/кг раствора TR через хвостовую вену, три раза в неделю, в течение 3 недель. Растворы испытуемых веществ или воды для контрольной иTR групп вводили п/о один раз в день, за 1 ч до инъекции раствора TR или отбирали пробу крови по следующей схеме: Кровь для биохимических анализов отбирали через 1, 2 и 3 недели (на следующий день после инъекции TR) путем пункции сердца под эфирным наркозом. Сыворотку отделяли путем центрифугирования и анализировали, определяя содержание общего С, HDL, LDL и TG с помощью стандартных наборов. Статистика. Данные обрабатывали с использованием программы Microsoft Excel, и результаты выражали как"среднее значениестандартная ошибка среднего". Средние результаты для различных групп сопоставляли с использованием однофакторного анализа ANOVA и критерия Стьюдента. Вероятность Р 0,05 считалась значимой. Результаты. При повторных инъекциях TR развивается выраженная и стабильная гиперхолестеринемия и гиперлипидемия, характеризующиеся значительным увеличением содержания общего С, LDL и TG по сравнению с контрольной группой (общий С увеличивается в 6-7 раз, TG - в 30 раз и более, см. табл. 21). Терапия NA, особенно значительно в первую неделю, ограничивает увеличение общего С, LDL и TG, но содержание HDL значительно увеличивается только через 2 и 3 недели. MASA почти так же, как NA сни- 17021588 жает содержание общего С и LDL и увеличивает содержание HDL, но слабее, чем NA предупреждает увеличение TG, вызванное инъекцией TR (табл. 21). Неожиданно, что комбинированное использованиеNA+MASA через 3 недели значительно лучше, чем индивидуальные NA или MASA, снижает содержание общего С, LDL и TG и увеличивает содержание HDL. Таким образом, можно ожидать, что комбинация NA+MASA будет полезной для предупреждения и/или лечения гиперхолестеринемии и гиперлипидемии. Таблица 21 Раздельное и комбинированное действие NA и MASA на содержание липидов у крыс в модели гиперлипидемии; n=9-14; среднее значениеСОИ Комбинированное использование MASA и NA является значительно более эффективным, чем индивидуальное действие веществ. Пример 10. Влияние испытуемых веществ на агрегацию тромбоцитов и образование тромбов. 10.1. Агрегация тромбоцитов.ASA является одним из широко употребляемых профилактических антитромбоцитарных средств(Miner J. и др., Тех. Heart Inst. J., 2007; 34(2):179-186). ASA в сочетании с NA используется как противовоспалительное средство (патент US 3312593) и антитромбоцитарное средство (WO9632942). Известны многие другие агенты и комбинации ASA. Широко известно, что MD нормализует сосудистый тонус,ингибирует агрегацию тромбоцитов и окисление жирных кислот и оптимизирует потребление кислорода во время ишемии миокарда (Tsirkin V.I., Рос. Кардиол. Ж., 2002; 1:45-52). Кроме того, NA немного ингибирует агрегацию тромбоцитов (Lakin K.M. и др., Фармакол. Токсикол., 1980, 43(5):581-5 (рус.). Традиционное антитромбоцитарное средство - клопидогрел используется индивидуально (патенты US 4529596, US 4847265, US 5576328) или в комбинации со статином (WO9804259) или с ASA(WO9729753). Кроме того, ASA может компоноваться с антитромбоцитарным средством - дипиридамолом (Halkes Р.Н. и др., Lancet, 2006, 367(9523):1665-73). Клинический опыт указывает на повышенную гибкость в применении комбинаций различных средств. Методика. Агрегацию тромбоцитов исследовали с использованием импедансного измерителя агрегации цельной крови на приборе Multiplate (Многофункциональный Анализатор Тромбоцитов, фирма DynabyteMedical, Германия) (Toth О. и др., Thromb. Haemost, 2006; 96:781-788, Velik-Salchner С. и др., Anesth. Analg., 2008; 107:1798-1806). Пробы крови для экспериментов in vitro собирали от здорового донора В.(возраст 37 лет), который не принимал ASA или какие-либо другие антитромбоцитные средства, в пластиковые пробирки, покрытые антикоагулянтом - гирудин (Dynabyte Medical, Germany) и использовали для измерений между 30 мин и 4 ч после сбора крови. В экспериментах ex vivo кровь собирали в пластиковые пробирки, покрытые гирудином (Dynabyte Medical, Germany), от наркотизованных крыс, который получили предварительную трехсуточную п/о обработку испытуемыми веществами. Измерения проводили согласно модифицированному протоколу фирмы Dynabyte Medical. Подогревают изотонический раствор хлорида натрия (0,3 мл, или физиологический раствор с исследуемым веществом в окончательной концентрации 10-4 ммоль/мл каждого вещества) до 37C и добавляют из пипетки в испытуемые клетки и вводят пробу 0,3 мл цельной крови, содержащей антикоагулянт - гирудин. Измерения начинают через 5 мин после инкубации и перемешивания при 37C, путем добавления раствора соответствующего агониста (получены от фирмы Dynabyte Medical, Germany): 1) аденозиндифосфат (ADP) - ADP-тест. ADP стимулирует активацию тромбоцитов под действиемADP рецепторов (P2Y12 и другие); 2) арахидоновая кислота (АА) - ASPI-тест: активация под действием АА - субстрат циклооксигеназы образует тромбоксан А 2 (ТХА 2), который является сильным агонистом тромбоцитов; 3) тест ADP HS (простагландин E1 в комбинации с ADP). Добавка эндогенного ингибитора PGE1 делает тест ADP HS более чувствительным к действию клопидогрела и родственных лекарственных препаратов по сравнению с тестом ADP. Кривые агрегирования регистрировали в течение 6 мин и анализировали с использованием программного обеспечения Dynabyte Medical. Были рассчитаны следующие параметры агрегации тромбоцитов: 1) Amax, максимальное значение агрегации тромбоцитов, выраженное в условных единицах (AU) агрегирования; 2) AUC, общая площадь под кривой агрегирования (AUмин). На величину площади влияет общая высота кривой агрегирования, а также наклон кривой, причем AUC наилучшим образом выражает суммарную активность тромбоцитов. Статистика. Результаты выражают как "среднее значениеСОИ". Для оценки значимости отклонений используют однофакторный анализ ANOVA. Если недействительная гипотеза отклонена, то после этого используют критерий Student-Newman-Keuls. Результаты. Как видно из данных табл. 22, MASA в концентрации 10-4 моль обеспечивает значительную защиту от ADP и особенно предотвращает агрегацию тромбоцитов, индуцированную действием АА иADP+PGE1 (значительно снижаются AUC и Amax, табл. 22). NA (в группе 10-4 ммоль/мл) также уменьшает агрегирование, вызванное действием ADP (смотрите Amax в табл. 22). Комбинированное действие обоих веществ обеспечивает более высокое и выраженное снижение агрегации тромбоцитов, вызванное действием ADP или ADP+PGEJ, что проявляется в величинах AUC и Amax (табл. 22). Таблица 22 Влияние MD, NA и их комбинации на агрегацию тромбоцитов,индуцированную ADP, АА и PGE1+ADP; N=5-8; среднее значениеСОИMASA значительно лучше, чем ASA или MD, предотвращает агрегирование тромбоцитов, индуцированное действием АА (табл. 22). Комбинация MASA+NA проявляет значительно более высокую ак- 20021588 тивность против агрегирования, индуцированного действием АА, причем превосходит активность каждого отдельного вещества, а также активность ASA+NA и MD+NA (табл. 22). Были проведены параллельные эксперименты с дипиридамолом (DI) и комбинацией DI с ASA илиXII, 1-3). Дипиридамол плюс аспирин обладают более высокой эффективностью после церебральной ишемии артериального происхождения, чем один аспирин (Halkes P.H. и др. Lancet, 2006, 367(9523): 1665-73). Таблица 23 Влияние испытуемых веществ отдельно и в комбинации на агрегацию тромбоцитов, индуцированную ADP или АА; N=5-8; среднее значениеСОИ В этой серии наиболее высокую активность проявляют MASA+DI, причем она значительно выше,чем активность ASA+DI (табл. 23). 10.2. Тромбоз. Терапевтическое использование MD в течение двух недель при пероральном назначении кроликам и собакам после экспериментального артериального тромбоза продемонстрировало тромболитический эффект (Logunova L. и др., Эксперим. клин. Фармакотер., 1991; 19:91-98 (рус.). Данные о профилактическом действии MD на ограничение или предупреждение тромбоза не известны. Благодаря разнообразным механизмам NA снижает вероятность тромбоза (Rosenson R.S. и др., Atherosclerosis, 1998; 140:27180). Методика. Авторы изобретения выбрали экспериментальную модель тромбоза на основе артериального тромбоза крыс, индуцированного действием FeCl3 (Kurz K. и др., Thromb. Res., 1990, 60:269-280, Wang X., XuL., Thromb. Res., 2005, 115:95-100). Повреждение ткани, инициированное химическим окислением при опосредствованном действии железа, склоняет поврежденную область к прилипанию и агрегированию тромбоцитов с последующей активацией коагуляции и осаждения фибрина. В экспериментах использовали самцов крыс Wistar с массой тела 350-420 г. Животных выдерживали в группах по 7, 8 особей в соответствующих клетках, в камере искусственного климата при 221C, относительной влажности 605% и 12/12-часовых циклах чередования света и темноты, при свободном доступе к корму и воде. Все эксперименты проводились в соответствии с Директивой Совета ЕЭС от 24 ноября 1986 г. (86/609/ЕЕС), относящейся к содержанию экспериментальных животных. Были приняты все меры, чтобы свести к минимуму страдания животных и снизить количество использованных животных. Крыс статистически разделяли на различные экспериментальные группы, в каждой из которых содержалось не менее семи животных. Носитель или испытуемое соединение MD (25 мг/кг), NA (25 мг/кг), MASA (10 мг/кг), ASA (5 мг/кг) и комбинации MD+NA (25+25 мг/кг), MASA+NA (10+25 мг/кг) и ASA+NA (5+25 мг/кг) были введены через рот за 2 ч до инициирования тромбоза. Были проведены параллельные эксперименты с целью сопоставления действия отдельных доз испытуемых веществ (заданных за 2 ч до инициирования тромбоза) и повторных доз (один раз в день, трое суток). Группы из 7, 8 животных получали следующие вещества:ASA+CL (5+5 мг/кг). Крыс анестезировали с помощью пентобарбитала натрия (50 мг/кг, в/б и 10 мг/кг/ч) и в течение эксперимента держали на терморегулируемом столе для поддержания температуры тела,равной 37C. Одну из каротидных артерий подвергали разрезанию на шее, отделяли от примыкающей ткани, блуждающего нерва и помещали датчик потока (электромагнитный измеритель кровотока MFV 1200, Nicon Kohden, Japan) на обнаженном сегменте обычной каротидной артерии, чтобы регистрировать кровоток. Через 15 мин периода стабилизации индуцировали тромбоз путем местного наложения (в контакте с адвентициальной поверхностью сосуда) двух кусков (21 мм) фильтровальной бумаги Whatman,пропитанной 15% раствором FeCl3. Время тромбоза каротидной артерии регистрировали как время, необходимое для полного прекращения кровотока и записывали как время до закупорки (ТТО). Если кровоток не прекращался в течение 90 мин в группе активной обработки, записывали значение ТТО 90 мин. Кроме того, в ходе экспериментального тромбоза измеряли время кровотечения из хвостовой вены крыс. На хвосте делали поперечный надрез скальпелем (на расстоянии 5 мм от конца) и хвост погружали непосредственно в теплый (37C) изотонический физиологический раствор до момента прекращения кровотечения. Прекращение кровотечения определяли как время полной остановки кровотечения без возобновления кровотечения в течение следующих 30 с. После экспериментального тромбоза животных под наркозом, которые получали испытуемые вещества в течение 3 суток, использовали в тесте агрегации тромбоцитов ex vivo. Вскрывали брюшную полость и собирали кровь из нижней полой вены в пластиковые пробирки, покрытые гирудином (Dynabyte Medical, Germany). Для измерений использовали пробы крови, отобранные между 30 мин и 4 ч. Указанные измерения проводили в соответствии с модифицированным протоколом фирмы Dynabyte Medical (см. выше в разделе "Агрегация тромбоцитов"). Статистика. Данные обрабатывали с использованием программы Microsoft Excel 2007 и результаты выражали как "среднее значениеСОИ". Различия между экспериментальными группами сопоставляли с использованием однофакторного дисперсионного анализа (ANOVA) с повторным сопоставлением (тест Tukey's). Вероятность Р 0,05 считалась значимой. Результаты. Среднее время для индуцированного FeCl3 тромбоза артерии и получающаяся остановка артериального кровотока в контрольной группе составляет 24,4 мин (табл. 24). Таблица 24 Влияние испытуемых веществ на индуцированный FeCl3 тромбоз каротидной артерии; N=7-8; среднее значениеСОИ Профилактическая обработка веществом MASA обеспечивает значительное продление времени ТТО (Р 0,005 относительно контроля), но в отличие от ASA была существенно менее эффективной в тесте кровотечения (от 136 до 155%). MASA+NA (10+25 мг/кг) вызывает сравнительно более длительную задержку тромбоза, превосходящую эффект от MD+NA или ASA+NA (табл. 24). Необходимо отметить, что при использовании ASA и ASA+NA увеличение ТТО, наряду с временем кровотечения, хотя увеличение ТТО при использовании MASA или MASA+NA значительно выше, чем рост времени кровотечения (табл. 24). В параллельных экспериментах с обычной контрольной группой было исследовано влияние на тромбоз для ASA, MASA и CL и их комбинаций. Испытуемые вещества вводили в виде отдельной дозы(2 ч до испытания) или давали 1 раз в день в течение 3 суток. ASA или CL, введенные за 2 ч до испытания тромбоза, значительно продлевали ТТО относительно контрольной группы, которая получала воду(табл. 25). Таблица 25 Влияние отдельной дозы испытуемых веществ на ТТО и время кровотечения в индуцированном FeCl3 экспериментальном тромбозе каротидной артерии; N=7-8; среднее значениеСОИ Отдельная доза MASA обеспечивает более значительное увеличение ТТО, чем CL. MASA, введенный вместе с CL, значительно увеличивает ТТО, но только незначительно изменяет время кровотечения(табл. 25). Следует отметить, что комбинация MASA+CL вызывает значительное увеличение ТТО по сравнению с эффектом для отдельных веществ и действием комбинации ASA+CL. Повторная обработка испытуемыми веществами вызывает дополнительное увеличение ТТО и времени кровотечения (табл. 26). Таблица 26 Влияние повторной обработки испытуемыми веществами на ТТО и время кровотечения в индуцированном FeCl3 экспериментальном тромбозе каротидной артерии; N=7-8; среднее значениеСОИ Повторная обработка веществами MASA или CL оказывает значительно более высокое влияние на ТТО, чем ASA (соответственно 191 и 194% против 162%), но MASA, в отличие от CL или ASA, не увеличивает время кровотечения (табл. 26). Повторная обработка комбинациями MASA+CL или ASA+CL дает значительное и вполне аналогичное увеличение ТТО, но MASA+CL сравнительно слабее влияет на время кровотечения хвоста, чем ASA+CL (241% относительно 319%) (табл. 26). Эксперименты ex vivo. После экспериментального тромбоза отбирают кровь животных и определяют параметры агрегирования. Обработка веществом MASA в дозе 10 мг/кг в течение трех дней вызывает значительное уменьшение агрегации тромбоцитов по всем испытанным индукторам агрегирования (табл. 27). Таблица 27 Влияние MASA, ASA, CL и их комбинаций на агрегацию тромбоцитов Обработка веществом CL в дозе 5 мг/кг/д в течение 3 дней вызывает значительную защиту против агрегирования, индуцированного ADP и PGE1+ADP, но не защищает от агрегирования, индуцированного АА. ASA обеспечивает значительную защиту от агрегирования, возбужденного АА, но не дает эффекта против ADP (табл. 27). Комбинация MASA и CL (10+5 мг/кг/д 3) обеспечивает сравнительно лучший эффект предупреждения агрегирования, вызванного различными индукторами, значительно лучше, чем эффект, обеспечиваемый ASA+CL в испытаниях с ADP и PGE1+ADP (табл. 27). Сводка.MASA значительно лучше, чем MD или ASA при аналогичных молярных концентрациях предотвращает агрегацию тромбоцитов, индуцированную АА. Защитный эффект MASA+NA значительно превосходит эффект для MD, NA и ASA, а также для комбинации ASA+NA против всех индукторов агрегирования, а также эффект для MD+NA против агрегирования, индуцированного АА. Учитывая положительный эффект для MASA и комбинации MASA+NA против агрегации тромбоцитов и продление времени ТТО in vivo, MASA или комбинация MASA+NA может найти применение для уменьшения агрегации тромбоцитов и риска тромбоза у пациентов с выраженным атеросклерозом,потенциальным инфарктом миокарда и инсультом, а также с нарушениями периферийного кровообра- 24021588 щения. Тот факт, что MASA и комбинация MASA+NA не пролонгируют время кровотечения хвоста,указывает на возможное применение этой комбинации для пациентов с увеличенным риском кровотечения в период до и после операции. Комбинация MASA+DI значительно лучше, чем ASA+DI защищает от агрегирования, индуцированного ADP и АА.MASA+CL. В экспериментальном тромбозе отдельная доза MASA+CL обеспечивает лучшую защиту от индуцированного FeCl3 тромбоза, чем ASA+CL. MASA+CL сравнительно слабее, чем ASA+CL пролонгируют время кровотечения хвоста. В эксперименте ex vivo MASA+CL обеспечивает значительно более выраженную защиту против агрегации тромбоцитов, чем CL, ASA или MASA. MASA+CL лучше,чем ASA+CL предотвращает агрегацию тромбоцитов, индуцированную ADP и PGE1+ADP. Эти факты указывают, что MASA+CL может найти применение в клинике для непосредственной защиты против увеличения риска агрегации тромбоцитов надвигающегося или текущего тромбоза. Пример 11. Сравнительное исследование комбинированного применения MASA/NA, MD/NA иLA/NA для уменьшения прилива крови, индуцированного NA. Никотиновая кислота (ниацин, NA) эффективно снижает уровень сывороточного холестерина, LDL и триглицеридов при увеличении HDL. Однако ограничивающим неблагоприятным эффектом у пациентов, получающих никотиновую кислоту непосредственно или в виде длительного выделения, является быстрое развитие значительного кожного тепла и расширения сосудов, называемое "приливом", что приводит к болезненному прекращению (Gupta E.K., Ito M.K., Heart Dis., 2002; 4:124-137). В качестве одного из наиболее активных и перспективных средств для снижения прилива крови под действием NA был предложен Ларопипрант (MK-0524) (LA) (Cheng K. и др., PNAS, 2006; 103:6682-6687). 11.1. Сопротивление расширению кожных сосудов, вызванному действием никотиновой кислоты. Модель. Самцов крыс Wistar анестезировали с помощью пентобарбитала натрия (50 мг/кг, в/б) и держали под наркозом, вводя дополнительные дозы (10 мг/кг) каждый 1 ч. Кровяное давление измеряли в левой каротидной артерии, электрокардиограмму (ECG) записывали с помощью стандартного проводника II. Кровоток в правой ушной артерии определяли с помощью лаазерного допплеровского измерителя расхода (OXYFLOW 2000, USA). Кровоток, ECG и артериальное давление регистрировали с помощью системы AD Instruments PowerLab и данные хранили в компьютере для последующей обработки. После регистрации базового уровня в течение 10 мин испытуемые вещества вводили подкожно (п/к) в область загривка и продолжали регистрацию в течение 30 мин. Данные среднего кровотока для каждого животного вычисляли, принимая во внимание среднее давление крови, и сопоставляли с начальным и контрольным значением. Результаты вычисляли для 5-8 отдельных экспериментов и выражали в процентах как максимальное изменение кровотока относительно базовой линии (Carballo-Jane E. и др., J. Pharmacol. Toxicol.Methods, 2007; 56(3):308-316). Статистика. Результаты для каждой группы выражали как среднее значение СОИ. Статистический анализ внутри групп осуществляли с помощью критерия Стьюдента. Разности между каждой экспериментальной группой сопоставляли с использованием однофакторного дисперсионного анализа с повторными сравнениями (теста Tukey's). Вероятность Р 0,05 считалась значимой. Результаты. Никотиновая кислота (NA) в дозе 15 мг/кг вызывает значительное увеличение кровотока в ушной артерии для этой животной модели (табл. 28). MASA, подобно контролю (буферный раствор 0,9% NaCl),вызывает незначительное варьирование кровотока. NA вместе с MASA вызывает заторможенный (медленно возрастающий) и статистически значительно менее выраженное абсолютное увеличение кровотока по сравнению с одним NA (табл. 28). Потенциал MASA для противодействия расширению периферических сосудов, вызванному действием NA, может иметь положительный результат в клинике для уменьшения кожных эффектов (прилив крови) от никотиновой кислоты, что будет дополнительно подробно исследовано, как описано ниже. Таблица 28 Влияние экспериментальных веществ на расширение кожных сосудов; N=5-8; среднее значениеСОИ Заключение. Авторы неожиданно обнаружили, что MASA значительно снижает расширение периферических сосудов, вызванное действием NA. Целью настоящего экспериментального исследования было сопоставление действия MASA, MD иLA на прилив крови (изменение температуры кожи), вызванный действием NA. Методика. Использовали самцов крыс Wistar (280-330 г). Животных содержали в группах по 6 особей в камерах искусственного климата при 221C, относительной влажности 605% и 12/12-часовых циклах чередования света и темноты, при свободном доступе к питьевой воде и пище (R3 - LactaMHH AB, Sweden). Для регистрации изменений температуры кожи интактных крыс использовали бесконтактный метод регистрации температуры (Papaliodis D. и др., Br. J. Pharmacol., 2008; 153:1382-1387). Измерения температуры проводили с использованием портативного инфракрасного термометра (Model Proscan 510, TFADostman). Животных приучали к манипулированию и к инфракрасному датчику в течение 3 суток до исследования. Показания температуры на тыльной стороне каждого уха регистрировали без обезболивания в начале и в ходе эксперимента. Температуру уха замеряли каждые 5 мин в течение периода 60 мин. Между измерениями животных возвращали в клетки. Вещества NA, MD и MASA растворяли в физиологическом растворе с коррекцией рН непосредственно перед использованием. LA (MK 0524, Cayman Chemicals) сначала растворяли в диметилсульфоксиде и затем свежий раствор разбавляли 0,9% раствором NaCl в каждый день эксперимента. Пропорция в комбинации NA и LA основана на Сводке характеристик продукта для таблеток модифицированного выделения Tredaptive 1000 мг/20 мг (никотиновая кислота/ларопипрант). Статистика. Для каждого момента времени усредняли данные шести измерений температуры уха (по три для каждого уха). Данные обрабатывали с использованием программы Microsoft Excel и результаты выражали как "среднее значениестандартная ошибка среднего". Средние результаты для различных групп сопоставляли с использованием однофакторного анализа ANOVA и критерия Стьюдента. Вероятность Р 0,05 считалась значимой. 11.2. Испытание влияния времени и растворителя на температуру кожи. 11.3. Исследование влияния отдельных испытуемых веществ на температуру кожи при одновременном [0] введении и за 30 мин [30] до п/к введения. Контролировали влияние действия индивидуальных LA, MD или MASA на температуру кожи. Каждое исследуемое вещество вводили п/к, одновременно с NA, как LA+NA [0], или за 30 мин до NA, как 11.4. Исследование влияния комбинаций MASA/NA и MD/NA на температуру кожи при одновременном введении [0] или за 45 мин [45] до п/о введения.R11.2. Испытание влияния времени и растворителя на температуру кожи. На базовом уровне средняя температура уха, регистрируемая с 10 до 14 ч, составляет 28,4-30,6C. Исследование времени отклика на введение NA (15 мг/кг, п/к) показывает максимальное увеличение температуры на 10 мин, равное 2,320,37C от базового уровня и 2,570,43C по сравнению с группой растворителя (Р 0,005) (см. ниже). Установлено, что влияние LA/растворитель на температуру уха существенно отличается от влияния NA, MASA и MD/растворитель только в первые 5 мин после инъекции,поэтому при расчете температуры на 10 мин использовалась только одна контрольная группа. Влияние NA, растворитель/NA и растворитель/LA на температуру уха крысR11.3. Исследование влияния отдельных испытуемых веществ на температуру кожи при одновременном [0] введении или за 30 мин [30] до п/к введения. Подкожная инъекция MASA, MD или LA не вызывает значительных изменений температуры уха крыс (табл. 29). Отсутствует отличие температуры между группами MD+NA [0], когда MD добавляется вместе с NA, и MD+NA [30], когда MD вводится за 30 мин до NA. Таблица 29 Влияние MASA, LA и MD на повышение температуры кожи,вызванное действием NA; N=6, среднее значениеСОИ Одновременно введение NA и MASA (группа NA+MASA [0]; время упреждения=0) вызывает уменьшение прилива крови от NA, которое подобно уменьшению, вызванному одновременным назначением NA и LA или NA и MD. Повышение температуры, вызванное действием NA, снижается соответственно от 100% (эффект от NA) до 62, 67 и 69% (табл. 27). В экспериментах изобретения введениеMASA+NA и LA+NA (когда они вводятся п/к за 30 мин до NA) вызывает значительное и подобное защитное действие от повышения температуры кожи, индуцированного NA (табл. 28).R11.4. Исследование влияния комбинаций NA/MASA и NA/MD, введенных п/о, на температуру кожи. Оральное (п/о) введение NA в дозе 40 мг/кг вызывает значительное и продолжительное (до 60 мин) повышение температуры уха крыс, причем максимум наблюдается между 15 и 45 мин (табл. 29). Таблица 29 Влияние MASA или MD на перегревание кожи, индуцированное NA, при одновременной [0] или предварительной [45] обработке; N=6-8, среднее значениеСОИ Оральное введение MASA или MD не вызывает существенных изменений температуры кожи. Одновременное п/о введение MASA и NA [0] в дозе 75 мг/кг дает небольшую защиту, но при дозе 150 мг/кг обеспечивает значительную защиту от повышения температуры кожи, индуцированного NA (табл. 29). Введение MD (100 мг/кг) одновременно с NA дает защиту от повышения температуры в течение 15 мин,но не обеспечивает значительной защиты от максимального повышения температуры кожи, индуцированного NA (см. температуру при 30 и 45 мин в табл. 29). Анализ результатов показывает, что MASA в дозе 150 мг/кг, введенной одновременно с NA, ослабляет повышение температуры кожи до 70%, то есть значительно лучше, чем действие комбинации NA+MD (96%). Повышение температуры под действием одного NA принято за 100%. Введение веществ в профилактическом режиме, т.е. за 45 мин до NA, обеспечивает эффект снижения температуры, который для MASA150+NA [45] значительно лучше, чем эффект от комбинаций MD+NA [45] или MASA75+NA [45] (табл. 29). При введении MASA п/о или п/к повышение температуры кожи, индуцированное NA, уменьшается. При п/к введении MASA подобно ларопипранту уменьшает повышение температуры кожи, индуцированное NA как при одновременном, так и в профилактическом режиме. Значительная активность MASA против прилива крови при п/о введении вместе с NA или в профилактическом режиме указывает на потенциальную применимость MASA для ослабления нежелательных кожных эффектов NA (прилив крови). Сводка. Поскольку MASA обладает противовоспалительным, антигиперлипемическим и антитромбоцитным действием, MASA может рассматриваться как новое терапевтическое средство для лечения различных патологий, индуцированных агрегацией тромбоцитов. Способы осуществления изобретения Настоящее изобретение представляет собой лекарственный продукт, который содержит MASA, для использования в качестве противовоспалительного, аналгетического, жаропонижающего, противоревматического, антигиперлипемического, антиатеросклеротического, антиагрегационного и антитромботического средства. Лекарственный продукт согласно изобретению может назначаться в виде фармацевтической композиции. Согласно данному изобретению предлагается фармацевтическая композиция, которая содержит MASA в смеси с фармацевтически приемлемым разбавителем или носителем. Поскольку противовоспалительное, аналгетическое, жаропонижающее, противоревматическое, антигиперлипемическое, антиатеросклеротическое, антиагрегационное и антитромботическое использование лекарственного продукта предполагает продолжительное действие, в наиболее предпочтительном варианте осуществления изобретения предусматривается форма, подходящая для орального применения,например, в виде таблеток или капсул. Другим объектом данного изобретения является применение лекарственного продукта, который описан выше, или фармацевтической композиции, которая описана выше, для производства лекарственного препарата для лечения воспаления, боли, лихорадки, ревматических состояний, гиперлипидемических состояний, атеросклеротических состояний, агрегации тромбоцитов или образования тромбов. Еще одним объектом изобретения является комбинация лекарственных продуктов, содержащихMASA и другого вещества, выбранного из группы NA, статины, CL и DI. Эти продукты могут быть основаны на фармацевтических композициях, разработанных для самого MASA. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Аддитивная соль 4-триметиламмонийбутаноата и ацетилсалициловой кислоты, отличающаяся тем, что в рентгенограмме имеются пики при углах 2: 5.10, 13.58, 13.83, 15.02, 15.17, 17.89, 19.33, 19.87,21.85, 22.05, 23.32, 23.56, 23.92, 24.75, 25.55, 25.80, 27.05, 27.91, 30.250,2. 2. Аддитивная соль L-карнитина и ацетилсалициловой кислоты, отличающаяся тем, что в рентгенограмме имеются пики при углах 2: 5.09, 12.62, 13.48, 13.84, 15.04, 17.82, 19.15, 19.77, 21.84, 22.56, 23.33,23.92, 24.40, 25.17, 25.43, 26.14, 27.24, 29.50, 30.360,2. 3. Аддитивная соль 3-(триметиламмонийамино)пропаноата (мелдоний) и ацетилсалициловой кислоты, отличающаяся тем, что в рентгенограмме имеются пики при углах 2: 5.19, 13.22, 13.82, 14.20,14.95, 15.36, 15.93, 18.11, 18.97, 19.74, 21.02, 22.15, 23.15, 23.65, 24.31, 25.28, 26.18, 26.58, 27.73,28.360,2. 4. Применение аддитивной соли 3-(триметиламмонийамино)пропаноата (мелдоний) и ацетилсалициловой кислоты по п.3 в качестве лекарственного средства для предупреждения и/или лечения воспаления, боли, лихорадки, ревматических состояний, гиперлипидемических состояний, атеросклеротических состояний, инфаркта миокарда, инсульта, тромбоза и тромбоэмболии. 5. Фармацевтическая композиция для предупреждения и/или лечения воспаления, боли, лихорадки,ревматических состояний, гиперлипидемических состояний, атеросклеротических состояний, патологий,индуцированных агрегацией тромбоцитов или образованием тромбов, содержащая аддитивную соль мелдония и ацетилсалициловой кислоты по п.3 и фармацевтически приемлемый носитель. 6. Композиция по п.5, где патология, индуцированная агрегацией тромбоцитов, включает ишемические явления, выбранные из инфаркта миокарда, инсульта, или тромбоз и тромбоэмболию. 7. Способ предупреждения и/или лечения воспаления, боли, лихорадки, ревматических состояний,гиперлипидемических состояний, атеросклеротических состояний, патологий, индуцированных агрегацией тромбоцитов или образованием тромбов, который включает введение страдающему пациенту терапевтически эффективного количества аддитивной соли мелдония и ацетилсалициловой кислоты по п.3 или фармацевтической композиции по п.5. 8. Применение аддитивной соли мелдония и ацетисалициловой кислоты по п.3 для предупреждения и/или лечения воспаления, боли, лихорадки, ревматических состояний, гиперлипидемических состояний,атеросклеротических состояний, патологий, индуцированных агрегацией тромбоцитов или образованием тромбов. 9. Применение по п.8, где патология, индуцированная агрегацией тромбоцитов, включает ишемические явления, выбранные из инфаркта миокарда, инсульта, или тромбоз и тромбоэмболию. 10. Применение фармацевтической композиции по п.5 для предупреждения и/или лечения воспаления, боли, лихорадки, ревматических состояний, гиперлипидемических состояний, атеросклеротических состояний, патологий, индуцированных агрегацией тромбоцитов или образованием тромбов. 11. Применение по п.10, где патология, индуцированная агрегацией тромбоцитов, включает ишемические явления, выбранные из инфаркта миокарда, инсульта, или тромбоз и тромбоэмболию. 12. Комбинированный лекарственный продукт для предупреждения и/или лечения патологии, индуцированной агрегацией тромбоцитов, представляющей собой инсульт, содержащий эффективное количество аддитивной соли мелдония и ацетилсалициловой кислоты по п.3 и эффективное количество дипиридамола. 13. Комбинированный лекарственный продукт для предупреждения и/или лечения патологии, индуцированной агрегацией тромбоцитов, содержащий эффективное количество аддитивной соли мелдония и ацетилсалициловой кислоты по п.3 и эффективное количество клопидогрела. 14. Применение комбинированного лекарственного продукта по п.13 для предупреждения и/или лечения патологии, индуцированной агрегацией тромбоцитов, при котором патология, индуцированная агрегацией тромбоцитов, включает ишемические явления, выбранные из инфаркта миокарда, инсульта,или тромбоз и тромбоэмболию, или острый коронарный синдром, внезапную сердечную смерть и ос- 29
МПК / Метки
МПК: A61K 31/616, A61P 9/08, C07C 229/22, A61K 31/205, C07C 243/40, C07C 69/157, C07C 229/12, A61P 7/02, A61P 29/00
Метки: ацетилсалициловой, кислоты, соли, бетаиновые
Код ссылки
<a href="https://eas.patents.su/30-21588-betainovye-soli-acetilsalicilovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Бетаиновые соли ацетилсалициловой кислоты</a>
Предыдущий патент: Соединения галогеналкилгетероарилбензамида
Следующий патент: Устройство для перераспределения светового потока
Случайный патент: Защитный колпачок шприца