Способ получения метансульфонатных солей ралфинамида или их r-энантиомеров
Формула / Реферат
1. Способ получения и/или очистки соли соединения (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида, ралфинамида (Ia)
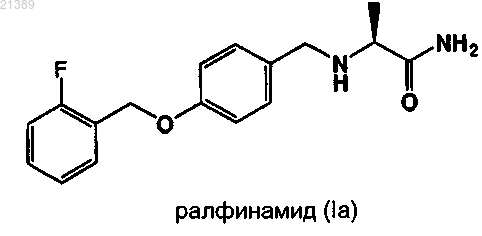
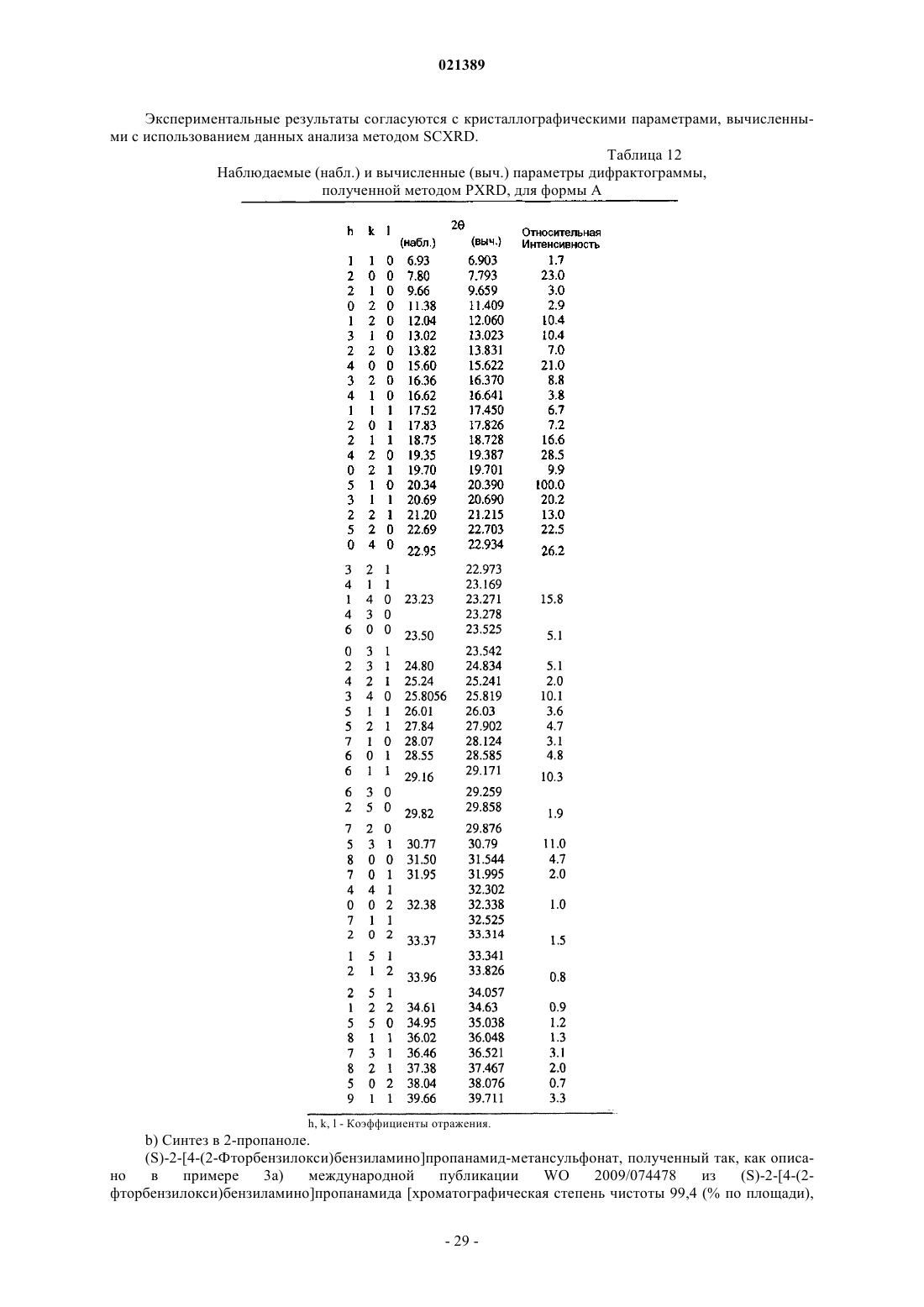
или соответственного R-энантиомера (I'а) и метансульфокислоты в форме кристаллической безводной полиморфной модификации, идентифицируемой как форма А, характеризующейся порошковой рентгеновской дифрактограммой (PXRD), имеющей, по существу, характеристические пики в области значений угла 2θ: 6,93; 7,80; 9,66; 11,38; 12,04; 13,02; 13,82; 15,60; 16,36; 16,62; 17,52; 17,83; 18,75; 19,35; 19,70; 20,34; 20,69; 21,20; 22,69; 22,95; 23,23; 23,50; 24,80; 25,24; 25,8056; 26,01; 27,84; 28,07; 28,55; 29,16; 29,82; 30,77; 31,50; 31,95; 32,38; 33,37; 33,96; 34,61; 34,95; 36,02; 36,46; 37,38; 38,04; 39,66, где содержание каждой из примесей, имеющих генотоксический эффект, которые состоят из одного или более (С1-С5)алкилметансульфоната(ов), составляет менее 0,05 м.д., и каждого из остаточных растворителей, известных как их потенциальные вещества-предшественники, которые состоят из одного или более (C1-C5)алканола(ов) или сложного(ых) эфира(ов) алканола(ов) с низшей(ими) алкановой(ыми) кислотой(ами), составляет менее 6 м.д., отличающийся тем, что:
(i) соль получают или очищают кристаллизацией из раствора в растворителе, выбранном из:
a) воды,
b) смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода,
с) ацетона, алифатического кетона с 4-5 атомами углерода или их смеси; или
(ii) твердую соль, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники, суспендируют с растворителем, выбранным из:
(a) воды,
(b) смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода,
(c) ацетона, алифатического кетона с 4-5 атомами углерода или их смеси; или
(iii) твердую соль, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники, подвергают воздействию потока воздуха, имеющего относительную влажность выше 65% при температуре от 5 до 30°С для удаления вышеупомянутых примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники;
(iv) в том случае, когда образующаяся в результате кристаллическая форма полученной таким образом соли представляет собой кристаллическую полугидратную псевдополиморфную модификацию, идентифицируемую как форма Н, характеризующуюся порошковой рентгеновской дифрактограммой, имеющей характеристические пики в области значений угла 2θ: 4,09; 7,09; 10,06; 11,64; 12,34; 16,38; 17,00; 17,47; 19,26; 20,11; 20,63; 21,34; 21,97; 23,35; 23,86; 24,12; 25,29; 27,15; 27,61; 28,02; 28,74; 29,62; 30,02; 30,51; 31,29; 31,81; 32,89; 33,35; 33,93; 35,10; 35,39; 35,62; 36,22; 38,91; 39,50; или смесь этой модификации с кристаллической безводной полиморфной модификацией формы А;
(v) упомянутую полугидратную псевдополиморфную модификацию формы Н или вышеупомянутую смесь модификаций полностью превращают в кристаллическую безводную полиморфную модификацию формы А путем удаления кристаллизационной воды при нагревании.
2. Способ по п.1, отличающийся тем, что:
(i) соль получают или очищают кристаллизацией из раствора в растворителе, выбранном из:
a) воды,
b) смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода; или
(ii) твердую соль, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники, суспендируют с растворителем, выбранным из:
(a) воды,
(b) смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода; или
(iii) твердую соль, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники, подвергают воздействию потока воздуха, имеющего относительную влажность выше 65% при температуре от 5 до 30°С для удаления вышеупомянутых примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники;
(iv) в том случае, когда образующаяся в результате кристаллическая форма полученной таким образом соли представляет собой кристаллическую полугидратную псевдополиморфную модификацию, идентифицируемую как форма Н, характеризующуюся порошковой рентгеновской дифрактограммой, имеющей, по существу, характеристические пики в области значений угла 2θ: 4,09; 7,09; 10,06; 11,64; 12,34; 16,38; 17,00; 17,47; 19,26; 20,11; 20,63; 21,34; 21,97; 23,35; 23,86; 24,12; 25,29; 27,15; 27,61; 28,02; 28,74; 29,62; 30,02; 30,51; 31,29; 31,81; 32,89; 33,35; 33,93; 35,10; 35,39; 35,62; 36,22; 38,91; 39,50; или смесь вышеупомянутой кристаллической полугидратной псевдополиморфной модификации формы Н с кристаллической безводной полиморфной модификацией формы А;
(v) упомянутую полугидратную псевдополиморфную модификацию формы Н или вышеупомянутую смесь модификаций полностью превращают в кристаллическую безводную полиморфную модификацию формы А путем удаления кристаллизационной воды при нагревании.
3. Способ по любому из пп.1 и 2, где (C1-C5)алкилметансульфонат(ы) выбирают из метилметансульфоната, этилметансульфоната и изопропилметансульфоната.
4. Способ по любому из пп.1-3, где (C1-C5)алканол(ы) выбирают из метанола, этанола и изопропанола.
5. Способ по любому из пп.1-4, где сложный(ые) эфир(ы) с низшей(ими) алкановой(ыми) кислотой(ами) представляет(ют) собой ацетат(ы).
6. Способ по любому из пп.2 (стадии (i) (а)) и 3-5, где метансульфонатную соль ралфинамида или его R-энантиомера получают в кристаллической полугидратной псевдополиморфной модификации формы Н путем кристаллизации соответствующей соли из воды или путем проведения реакции соответствующего свободного основания с метансульфокислотой в воде с последующей кристаллизацией и упомянутую соль формы Н, которую получают, полностью превращают в кристаллическую безводную полиморфную модификацию формы А путем удаления кристаллизационной воды при нагревании.
7. Способ по любому из пп.2 (стадии (i) (b)) и 3-5, где метансульфонатную соль ралфинамида или его R-энантиомера получают либо в кристаллической полугидратной псевдополиморфной модификации формы Н, либо в форме смеси этой модификации с кристаллической безводной полиморфной модификацией формы А путем кристаллизации соответствующей соли из смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода или путем проведения реакции соответствующего свободного основания с метансульфокислотой в смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода, и упомянутую кристаллическую полугидратную псевдополиморфную модификацию формы Н или вышеупомянутую смесь модификаций полностью превращают в кристаллическую безводную полиморфную модификацию формы А путем удаления кристаллизационной воды при нагревании.
8. Способ по любому из пп.6 и 7, где кристаллизацию проводят в присутствии зародышевых кристаллов формы Н.
9. Способ по любому из пп.2 (стадии (ii)) и 3-5, где порцию твердой соли, кристаллической безводной полиморфной модификации формы А метансульфоната ралфинамида или его R-энантиомера, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники, суспендируют с растворителем, выбранным из (а) воды и (b) смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода, где полученный продукт состоит из кристаллической полугидратной псевдополиморфной модификации формы Н или из смеси этой модификации с кристаллической безводной полиморфной модификацией формы А, и вышеупомянутую кристаллическую полугидратную псевдополиморфную модификацию формы Н или смесь модификаций полностью превращают в кристаллическую безводную полиморфную модификацию формы А путем удаления кристаллизационной воды при нагревании.
10. Способ по любому из пп.2 (стадии (iii)) и 3-5, где порцию твердой соли, метансульфонатной соли ралфинамида или его R-энантиомера, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники, подвергают воздействию потока воздуха, имеющего относительную влажность выше 65% при температуре от 5 до 30°С для удаления вышеупомянутых примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники, где полученный продукт состоит из кристаллической полугидратной псевдополиморфной модификации формы Н или из смеси этой модификации с кристаллической безводной полиморфной модификацией формы А, и вышеупомянутую кристаллическую полугидратную псевдополиморфную модификацию формы Н или смесь модификаций полностью превращают в кристаллическую безводную полиморфную модификацию формы А путем удаления кристаллизационной воды при нагревании.
11. Способ по любому из пп.1 (стадии (i) (а)) и 3-5, где метансульфонатную соль ралфинамида или его R-энантиомера получают в кристаллической безводной полиморфной модификации формы А путем медленного концентрирования выпариванием при комнатной температуре раствора соответствующей соли в воде.
12. Способ по любому из пп.1 (стадии (i) (с)) и 3-5, где метансульфонатную соль ралфинамида или его R-энантиомера получают в кристаллической безводной полиморфной модификации формы А путем кристаллизации соответствующей соли из ацетона, алифатического кетона с 4-5 атомами углерода или из их смеси или путем проведения реакции соответствующего свободного основания с метансульфокислотой в ацетоне, в алифатическом кетоне с 4-5 атомами углерода или в их смеси.
13. Способ по любому из пп.1 (стадии (ii) (с)) и 3-5, где порцию твердой соли, кристаллической безводной формы А метансульфоната ралфинамида или его R-энантиомера, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники, суспендируют с растворителем, выбранным из ацетона, алифатического кетона с 4-5 атомами углерода или из их смеси.
14. Способ по п.8, где метансульфонатную соль ралфинамида или его R-энантиомера очищают кристаллизацией, которая включает нагревание смеси воды и соли в соотношении от 3:1 до 10:1 (мас./мас.) вплоть до 65°С, добавление к раствору зародышевых кристаллов полугидратной псевдополиморфной модификации формы Н, поддерживание смеси при температуре 55-65°С в течение вплоть до 1 ч и затем постепенное охлаждение смеси до 5-15°С в течение 2-6 ч с получением осадка кристаллической полугидратной псевдополиморфной модификации формы Н.
15. Способ по п.8, где метансульфонатную соль ралфинамида или его R-энантиомера получают путем проведения реакции, которая включает добавление к суспензии или эмульсии соответствующего свободного основания воды в количестве воды, достаточном для образования конечной смеси воды и соли в соотношении от 3:1 до 10:1 (мас./мас.), приблизительно при 70-90°С, количества метансульфокислоты, соответствующего 50-70% стехиометрически требуемого количества, с образованием раствора и впоследствии добавление стехиометрически комплементарного количества метансульфокислоты или количества с небольшим избытком или количества с небольшим недостатком до 3 мол.% при поддержании температуры на уровне приблизительно 60-70°С, добавление к раствору зародышевых кристаллов полугидратной псевдополиморфной модификации формы Н при 55-65°С, затем постепенное понижение температуры до приблизительно 5-15°С с выполнением кристаллизации кристаллической полугидратной псевдополиморфной модификации формы Н соли.
16. Способ по п.8, где метансульфонатную соль ралфинамида или его R-энантиомера получают путем проведения реакции, которая включает добавление при комнатной температуре свободного основания ралфинамида или его R-энантиомера к водному раствору, содержащему эквимолярное количество, или количества с небольшим избытком, или количества с небольшим недостатком до 3 мол.% метансульфокислоты, где соотношение между водой и кислотой является достаточным для образования конечной смеси воды и соли в соотношении от 3:1 до 10:1 (мас./мас.), нагревание смеси до 65-70°С, добавление к полученному раствору зародышевых кристаллов полугидратной псевдополиморфной модификации формы Н при 60-65°С, затем постепенное охлаждение смеси до 5-15°С с обеспечением соли в кристаллической полугидратной псевдополиморфной модификации формы Н.
17. Способ по п.7, где растворитель, применяемый для кристаллизации или получения метансульфонатной соли, выбирают из смеси воды с ацетоном в соотношении от 5:95 до 30:70 (мас./мас.) и из смеси воды с метилэтилкетоном в соотношении от 5:95 до 25:75 (мас./мас.).
18. Способ по п.12, где кристаллическую безводную полиморфную модификацию формы А метансульфоната ралфинамида или его R-энантиомера получают путем проведения реакции, которая включает медленное добавление метансульфокислоты к раствору, полученному растворением соответствующего свободного основания в ацетоне, алифатическом кетоне с 4-5 атомами углерода или в их смеси в соотношении от 1:3 до 1:10 (мас./мас.) при 50-80°С.
19. Способ по п.9, который включает перемешивание порции твердой соли, кристаллической безводной полиморфной модификации формы А метансульфоната ралфинамида или его R-энантиомера при температуре, варьирующейся от 10 до 40°С, с растворителем, выбранным из (а) воды и (b) смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода, в количестве, которое является достаточным для образования суспензии твердых кристаллов в упомянутом растворителе, но не способно растворить их в заметной степени при рабочей температуре в течение периода времени в зависимости от применяемого количества воды и от выбранной рабочей температуры.
20. Способ по п.13, который включает перемешивание порции твердой соли, кристаллической безводной полиморфной модификации формы А метансульфоната ралфинамида или его R-энантиомера при комнатной температуре в течение 24 ч с количеством растворителя, выбранного из ацетона, алифатического кетона с 4-5 атомами углерода или их смеси, которое является достаточным для образования суспензии твердых кристаллов в упомянутом растворителе, но не способно растворить их в заметной степени при рабочей температуре в течение периода времени в зависимости от количества растворителя и от выбранной рабочей температуры, посредством чего получают метансульфонатную соль в форме кристаллической безводной полиморфной модификации формы А.
21. Способ по любому из пп.1-10, 14-17 и 19, который включает удаление кристаллизационной воды из кристаллической полугидратной псевдополиморфной модификации формы Н метансульфонатной соли ралфинамида или его R-энантиомера путем нагревания упомянутой соли при 95-120°С при пониженном давлении до достижения постоянной массы с превращением упомянутой соли кристаллической полугидратной псевдополиморфной модификации формы Н в соль кристаллической безводной полиморфной модификации формы А.
22. Способ по п.21, где соль нагревают при 98-102°С.
23. Способ по п.21, где рабочее пониженное давление составляет 20 мм рт. ст.
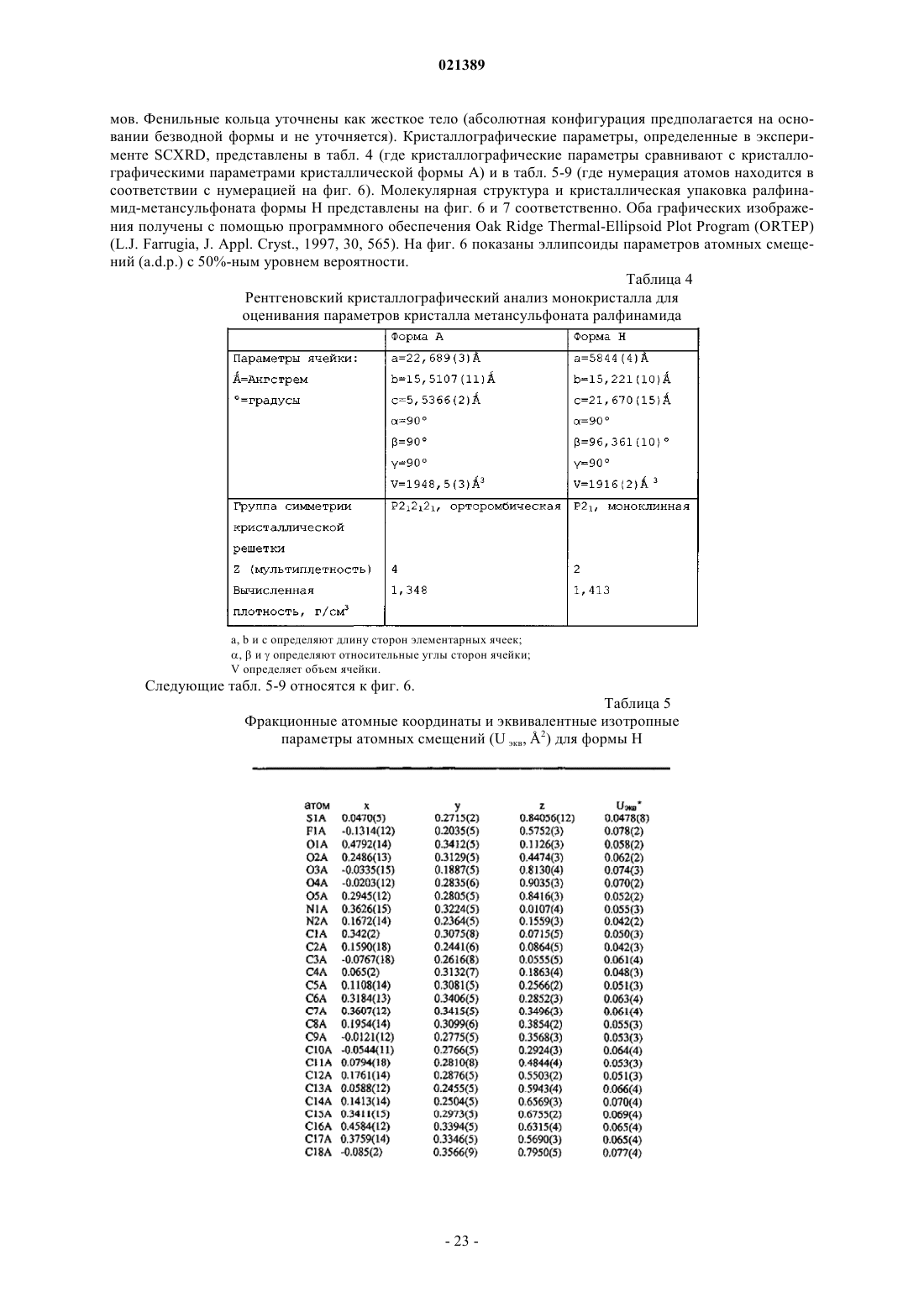
24. Кристаллическая полугидратная псевдополиморфная модификация формы Н метансульфонатной соли ралфинамида или его R-энантиомера, характеризующаяся рентгеновской порошковой дифрактограммой (PXRD), имеющей, по существу, характеристические пики в области значений угла 2θ: 4,09; 7,09; 10,06; 11,64; 12,34; 16,38; 17,00; 17,47; 19,26; 20,11; 20,63; 21,34; 21,97; 23,35; 23,86; 24,12; 25,29; 27,15; 27,61; 28,02; 28,74; 29,62; 30,02; 30,51; 31,29; 31,81; 32,89; 33,35; 33,93; 35,10; 35,39; 35,62; 36,22; 38,91; 39,50.
25. Кристаллическая полугидратная псевдополиморфная модификация формы Н метансульфонатной соли ралфинамида или его R-энантиомера по п.24, дополнительно отличающаяся тем, что она проявляет в основном следующие характеристики:
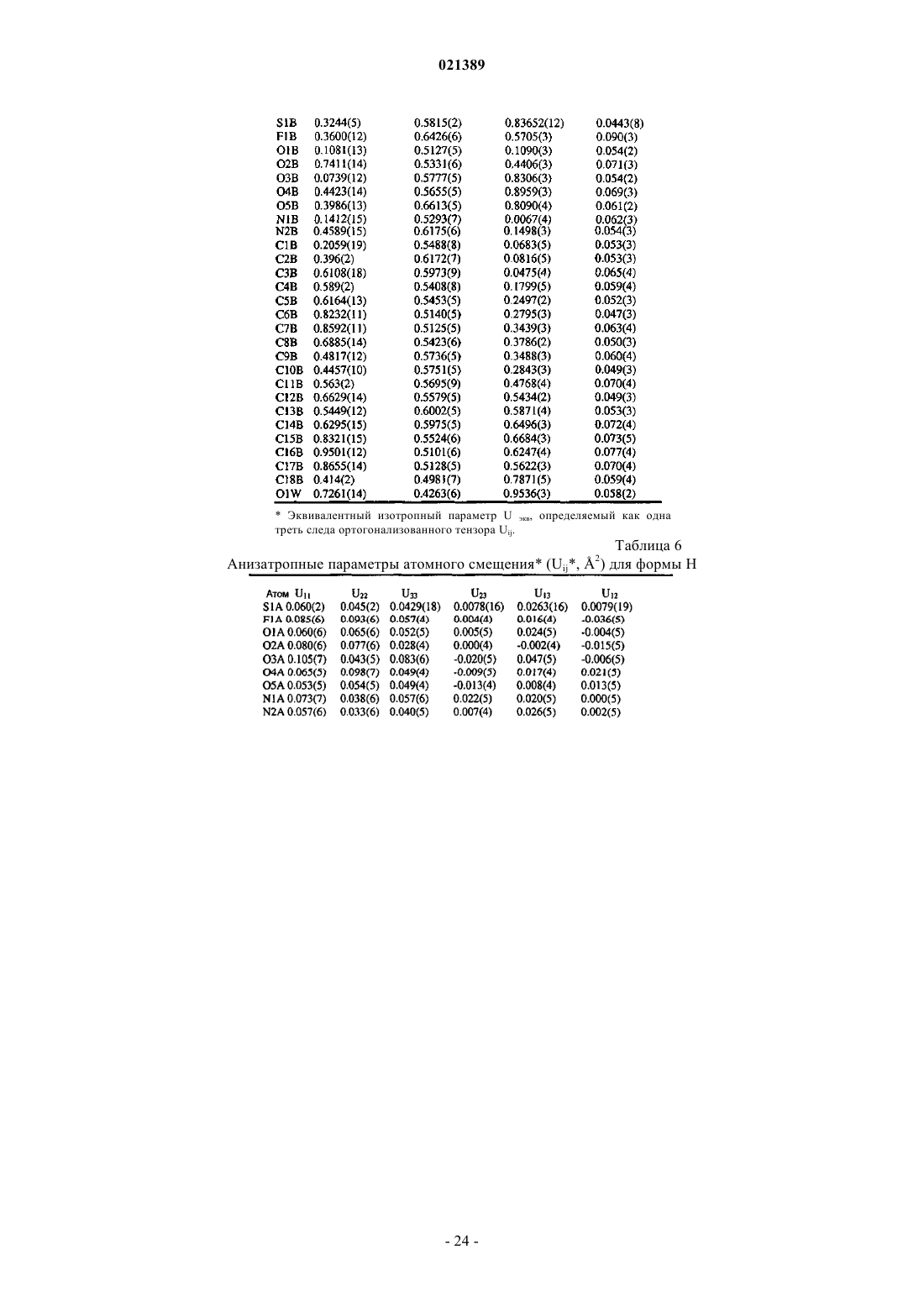
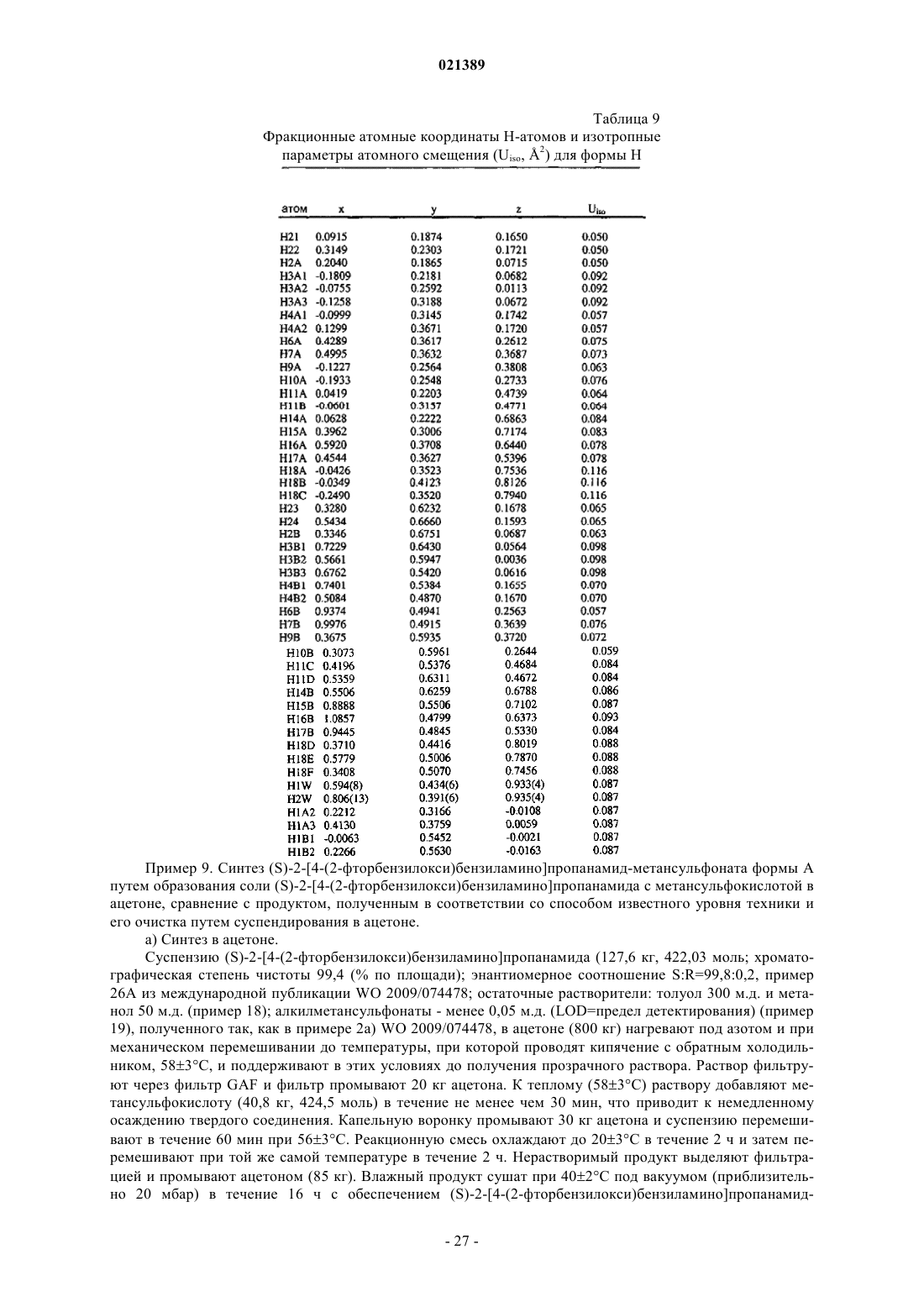
(а) следующие параметры кристаллов, полученные методом рентгеноструктурного анализа кристаллов:

где a, b и с определяют длину сторон элементарных ячеек;
α, β и γ определяют относительные углы между сторонами ячейки;
V определяет объем ячейки;
(b) анализ по методу Карла Фишера показывает содержание воды 2,2 мас.%, что соответствует присутствию 1 моль воды на 2 моль метансульфоната ралфинамида или его R-энантиомера;
(c) кривая TGA показывает потерю массы на 2,14% при 95°С, которая соответствует присутствию 1 моль воды на 2 моль метансульфоната ралфинамида или его R-энантиомера;
(d) кривая DSC показывает эндотермические пики: первый пик при 95,1±2°С и второй пик при 241,3±0,3°С;
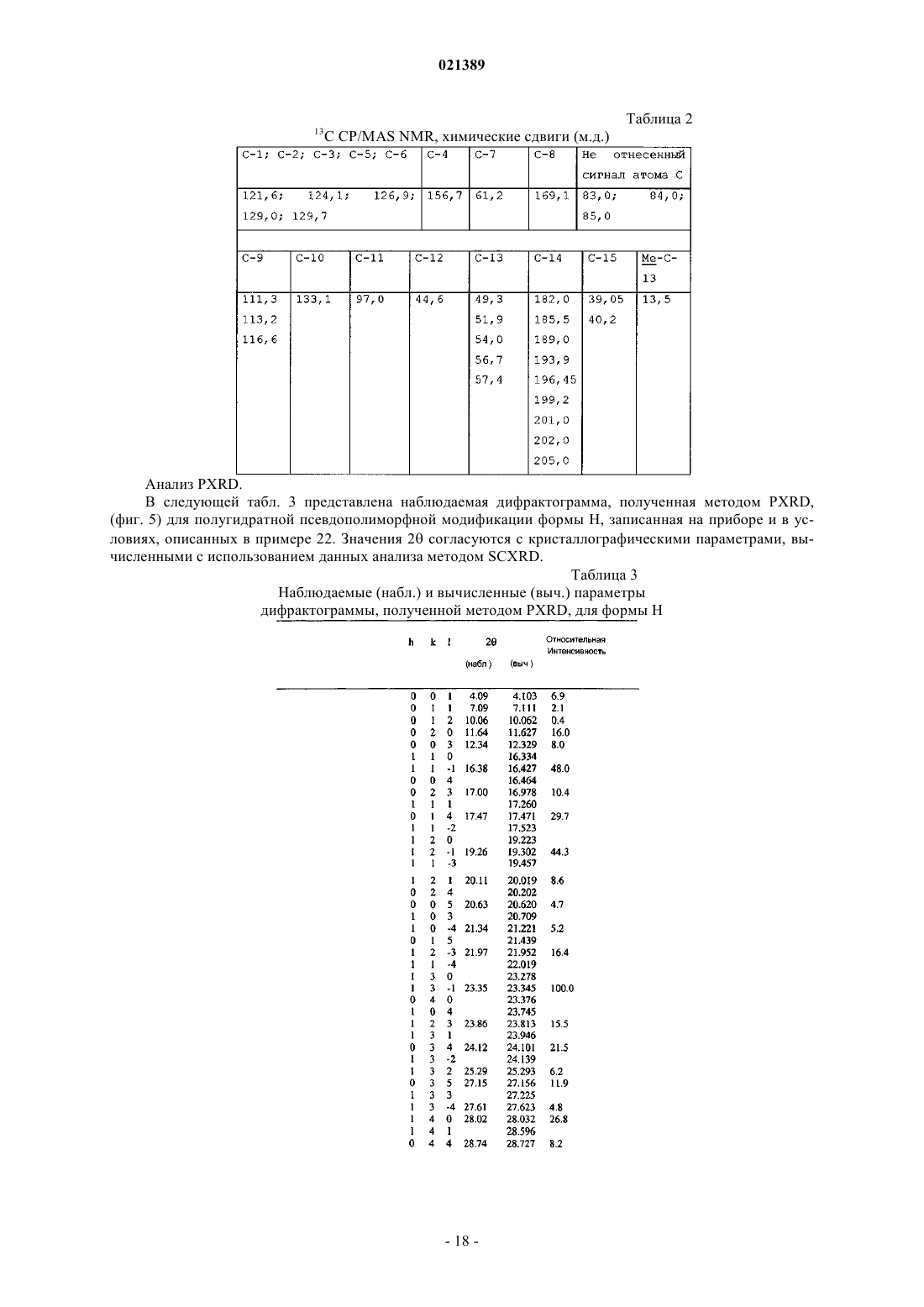
(e) спектр 13С ЯМР, полученный в твердом теле с использованием кросс-поляризации и вращения образца под магическим углом (13C-CP/MAS NMR), показывает следующие химические сдвиги (м.д.): 13,5; 39,05; 40,02; 44,6; 49,3; 51,9; 54,0; 56,7; 57,4; 61,2; 83,0; 84,0; 85,0; 97,0; 111,3; 113,2; 116,6; 121,6; 124,1; 126,9; 129,0; 129,7; 133,1; 156,7; 169,1; 182,0; 185,5; 189,0; 193,9; 196,45; 199,2; 201,0; 202,0; 205,0.
26. Применение кристаллической полугидратной псевдополиморфной модификации формы Н метансульфонатной соли ралфинамида или его R-энантиомера по любому из пп.24 и 25 в качестве лекарственного препарата.
27. Фармацевтический состав, содержащий в качестве активного ингредиента соединение по любому из пп.24 и 25.
28. Фармацевтический состав по п.27, который представляет собой состав с модифицированным высвобождением.
29. Фармацевтический состав по п.28, который представляет собой таблетку или таблетку с нанесенным покрытием.
30. Фармацевтический состав по п.27, который содержит в качестве активного ингредиента метансульфонат ралфинамида или его R-энантиомер в кристаллической полугидратной псевдополиморфной модификации формы Н в количестве, соответствующем 40, 80, 160 и 320 мг свободного основания соответственно.
31. Применение кристаллической полугидратной псевдополиморфной модификации формы Н метансульфоната ралфинамида или его R-энантиомера по любому из пп.24 и 25 в качестве промежуточного соединения для получения кристаллической безводной полиморфной модификации формы А метансульфоната ралфинамида или его R-энантиомера, где содержание каждой из примесей, имеющих генотоксический эффект, которые состоят из одного или более (С1-С5)алкилметансульфоната(ов), составляет менее 0,05 м.д. и содержание каждого из остаточных растворителей, известных как их потенциальные вещества-предшественники, которые состоят из одного или более (C1-C5)алканола(ов) или сложного эфира(ов) алканола(ов) с низшей(ими) алкановой(ыми) кислотой(ами), составляет менее 6 м.д.
Текст
СПОСОБ ПОЛУЧЕНИЯ МЕТАНСУЛЬФОНАТНЫХ СОЛЕЙ РАЛФИНАМИДА ИЛИ ИХ Изобретение относится к новому способу получения и/или очистки соли соединения (S)-2-[4(2-фторбензилокси)бензиламино]пропанамида, то есть ралфинамида, или соответственного Rэнантиомера, и метансульфокислоты с высокими выходами и очень высокими энантиомерной и химической степенями чистоты в форме кристаллической безводной полиморфной модификации,идентифицируемой как форма А, где упомянутая соль является в значительной мере свободной от примесей, имеющих генотоксический эффект, таких как (С 1-С 5)алканилметансульфонаты, и от остаточных растворителей, известных как их потенциальные вещества-предшественники,таких как (С 1-С 5)алканолы или сложные эфиры алканолов и низших алкановых кислот. Способ предусматривает (i) получение и/или кристаллизацию соли из воды, ацетона, алифатического кетона с 4-5 атомами углерода или из их смеси с водой, или (ii) суспендирование твердой соли (а) с водой, (b) со смесью воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода, (с) с ацетоном, алифатическим кетоном с 4-5 атомами углерода или с их смесью, или(iii) воздействие на твердую соль потока воздуха, имеющего высокую степень относительной влажности, и в том случае, когда полученный продукт состоит полностью или частично из кристаллов с кристаллической полугидратной псевдополиморфной модификацией формы Н,превращение упомянутого продукта в кристаллы безводной формы А путем проведения процесса удаления воды. Кристаллическая полугидратная псевдополиморфная модификация формы Н метансульфоната ралфинамида или его R-энантиомера является полезным промежуточным соединением для получения кристаллической безводной полиморфной модификации формы А,свободной от вышеупомянутых примесей, имеющих генотоксический эффект, и/или от остаточных растворителей, известных как их вещества-предшественники, и показывает физико-химический профиль, предоставляющий значительные преимущества в разработке и создании твердых лекарственных форм, в частности, с составами модифицированного высвобождения. Настоящее изобретение относится к новому способу получения и/или очистки солей метансульфоновой кислоты и (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида, то есть ралфинамида (Ia) либо или соответственного R-энантиомера (I'a). Способ по данному изобретению позволяет получать вышеупомянутые соли с высокими выходами и с очень высокой энантиомерной и химической чистотой,что требуется для производства промышленного масштаба, где упомянутые соли являются в значительной мере свободными от примесей, имеющих генотоксические эффекты, и от остаточных растворителей,известных как их потенциальные вещества-предшественники. Известный уровень техники Несколько солей ралфинамида раскрыты в уровне техники (WO 90/14334; P. Pevarello et al., J. Med.Chem., 1998, 41:579). Метансульфонатные соли ралфинамида и его R-энантиомера являются особенно полезными для применения в получении лекарственных препаратов для лечения некоторых расстройств,включая болезнь Паркинсона, припадок/судороги, боль (в том числе смешанную и комбинированную боль), мигрень, биполярные аффективные расстройства, депрессии, сердечно-сосудистые, воспалительные, урогенитальные, метаболические, желудочно-кишечные, когнитивные и психиатрические расстройства (WO 90/14334, WO 99/35125, WO 03/020273, WO 2004/089353, WO 2005/102300, WO 2004/062655,WO 2005/018627, WO 2005/070405, WO 2006/027052, WO 2007/144153, WO 2009/080470 и WO 2009/109334; Stummann T.C. et al., Eur. J. Pharmacol., 2005, 510:197-208; Shi-Hong Zhang et al., Pain, 2008,139:293-305; Yamane H. et al., Exp. Neurol., 2007, 208(1):63-72). Получения в промышленном масштабе метансульфонатной соли ралфинамида и соответственногоR-энантиомера с высокой степенью чистоты были описаны в международных публикациях WO 2007/147491 и WO 2009/074478. Как правило, получение солей ралфинамида и его R-энантиомера включает образование соли соответствующих оснований с помощью подходящей фармацевтически приемлемой кислоты на последней стадии способа. В частности, соли с органическими кислотами для фармацевтического применения, как правило,синтезируют добавлением стехиометрического количества предпочтительной кислоты к раствору соответствующего основания в органическом растворителе. В соответствии с получениями и кристаллизациями метансульфонатных солей ралфинамида и егоR-энантиомера, описанными в известном уровне техники, в качестве растворителя применяют изопропанол или этилацетат. Конкретно, как международная публикация WO 2007/147491, так и международная публикация WO 2009/074478 раскрывают кристаллизацию метансульфонатной соли ралфинамида из изопропанола (2 пропанола). Получение и кристаллизацию из этилацетата метансульфонатной соли 3-фторсодержащего аналога ралфинамида (то есть сафинамида) раскрыто как в международной публикации WO 2007/147491, так и в международной публикации WO 2009/074478. Этот последний документ раскрывает также получение и кристаллизацию метансульфонатной соли R-энантиомера ралфинамида из изопропанола или этилацетата(см. также WO 2006/027052). Как международная публикация WO 2007/147491 (пример 13, табл. 15), так и международная публикация WO 2009/074478 (пример 21, табл. 6) описывают кристаллизацию сафинамид-метансульфоната из смеси ацетона/воды. Выходы, представленные в обоих случаях (18-20%), являются намного более низкими в сравнении с выходами, получающимися в результате применения изопропанола или этилацетата (как правило, выше 90%), что, следовательно, не позволяет предположить какое-либо применение упомянутой смеси растворителей в процессах получения и очистки его 2-фторсодержащего аналога в промышленном масштабе. Кроме того, ни международная публикация WO 2007/147491, ни международная публикация WO 2009/074478 не дает представления о полиморфизме и об остаточном содержании генотоксических примесей или растворителей, известных как потенциальные вещества-предшественники метансульфонатного продукта сафинамида, полученного с использованием смеси ацетона/воды в качестве растворителя для кристаллизации. До настоящего времени метансульфонаты ралфинамида и его R-энантиомера, полученные способами известного уровня техники, были проанализированы с тем, чтобы определить хроматографическую степень чистоты, энантиомерную степень чистоты и содержание соответствующих бис-бензилированных побочных продуктов, (S)- или (R)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида, в качестве примеси (WO 2007/147491 и WO 2009/074478), обладающей ингибирующими эффектами в от-1 021389 ношении ферментов цитохрома р 450 и свойствами блокирования ген-специфических калиевых каналов сердца. В вышеупомянутых документах известного уровня техники не представлено никакой информации, характеризующей эти соли в форме, соответствующей твердому состоянию, кроме температуры плавления. Предпосылки создания изобретения Как правило, соли активных фармацевтических ингредиентов (API), содержащих аминогруппу, которые являются коммерчески доступными или находятся в стадии исследования активности лекарственных средств, за исключением четвертичных аммониевых солей, обычно получают путем контактирования соответствующего амина с органической или неорганической кислотой и кристаллизуют из растворителей; см., например, получение следующих метансульфонатных солей (мезилатов): амидефринмезилата (RN 1421-68-7), бетагистин-мезилата, бромокриптин-мономезилата (25614-03-3), дефероксамин-мезилата, дигидроэргокристин-мезилата, дигидроэрготамин-мезилата, доксазин-мезилата, пефлоксацин-мономезилат-дигидрата (RN 70458-95-6), нелфинавир-мезилата (RN 159989-65-8), перголидмезилата (RN 66104-23-2), фентоламин-мезилата и саквинавир-мономезилата (RN 149845-06-7), и получение других солей активных фармацевтических ингредиентов (API), таких как индинавир-сульфат (RN 157810-81-6), омоконазол-нитрат (RN 83621-06-1), хинин-сульфат (RN 549-56-4), рацефемингидрофумарат (RN 1590-35-8), рамосетрон-гидрохлорид (RN 132907-72-3) и ропивакаин-гидрохлорид(RN 98717-15-8). Кристаллизация солей имеет целью повышение степени чистоты соли путем удаления примесей,которые могут быть классифицированы (Duane A. Pierson et al., Organic Process Research andDevelopment, 2009, 13 (2):285-291), с учетом снижения потенциала риска следующим образом: класс 1 - примеси, которые известны как генотоксические и канцерогенные; класс 2 - примеси, известные как генотоксические; класс 3 - вызывающая подозрение структура, неродственная API и имеющая неизвестный генотоксический потенциал; класс 4 - вызывающая подозрение структура, родственная API; класс 5 - не вызывающая подозрение структура. Растворители, используемые на последней стадии способа изготовления активного фармацевтического ингредиента (API), в частности, для получения желательной соли API, ее кристаллизации и для любого другого вида очистки API должны быть выбраны с учетом свойств как растворителей, так и субстратов. Используемые растворители должны быть инертными. Под инертными растворителями, как правило, понимают растворители, которые не реагируют с солями API, с API и/или с сольобразующей(им) кислотой или основанием. Хотя кристаллизация из растворителя представляет собой важное средство для удаления примесей из соли API, в том случае, когда используют неподходящий растворитель, кристаллизованная соль может быть загрязнена новыми примесями. Европейское агентство по оценке лекарственных средств (ЕМЕА) классифицировало органические растворители, обычно применяемые в процессах изготовления API, по трем категориям с учетом их токсикологических свойств (ЕМЕА: Notice for Guidance on Impurities: Residual Solvents, CPMP/ICH/283/95,Март 1998). Растворители 3 класса согласно ЕМЕА (ацетон, 2-пропанол, этилацетат и т.д.) являются предпочтительными растворителями для получения и очистки солей основных API с кислотами при условии, что они не реагируют с активным основным субстратом, кислотой и/или с солью. На самом деле некоторые предупредительные меры должны быть предприняты в том случае, когда основный API и/или кислота содержит(ат) химические группы, которые могут реагировать с растворителем. В качестве общего правила использование алкиловых сложных эфиров в качестве растворителей следует избегать в том случае, когда API представляет собой первичный или вторичный амин, поскольку аминогруппа является реакционноспособной в отношении карбоксиалкильного фрагмента и образует амиды. Это может привести к частичной потере API и к вырабатыванию структурно родственных API примесей (March's Advanced Organic Chemistry, Reactions, Mechanism, and Structure 6th Edition, Michael B.Smith and Jerry March, John WileySons, Inc. Hoboken, New Jersey, 2007, 1434-1436). Кроме того, алкиловые сложные эфиры, такие как этилацетат, могут реагировать с алкил- и арилсульфокислотами, используемыми для получения соли свободного основания активного вещества, с образованием алкилового сложного эфира, например этилового сложного эфира, предпочтительной сульфокислоты. С API, содержащими первичную(ые) и/или вторичную(ые) аминогруппу(ы), применение кетонов в качестве растворителей, как правило, не рекомендуется, поскольку они могут вступать в реакцию конденсации с первичными аминами (образование оснований Schiff) и с вторичными аминами (образование енаминов), с вырабатыванием структурно родственных API примесей (March's Advanced Organic Chemistry, Reactions, Mechanism, and Structure 6th Edition, Michael B. Smith and Jerry March, John WileySons,Inc. Hoboken, New Jersey, 2007, 1281-1284). В дополнение к этому кетоны в присутствии одновременно и сильных кислот, и оснований способ-2 021389 ствуют образованию примесей вследствие протекания реакции самоконденсации. Использование алканолов в качестве растворителей следует избегать, поскольку первичные, вторичные и третичные спирты могут реагировать с предпочтительной кислотой с образованием соответствующего алкилового сложного эфира, который может проявлять алкилирующую способность и, как следствие, может иметь генотоксические эффекты (L. Miller et al., Regulatory Toxicology and Pharmacology, 44 (2006), 198-211). Эффект становится более очевидным в том случае, когда предпочтительная кислота является сильной кислотой и ее используют в количестве, которое превышает стехиометрическое количество, и/или когда к кислоте добавляют основание. Мезилатные сложные эфиры низших (С 1-С 5)алканолов, в частности (C1-С 3)алканолов, являются реакционноспособными веществами прямого действия, которые показали, что их алкилирующее действие в отношении ДНК может индуцировать мутагенный, канцерогенный и тератогенный эффекты. Вследствие их способности индуцировать генетические мутации и/или хромосомные перестройки в последние годы стал актуальным контроль генотоксических и канцерогенных примесей в фармацевтических веществах. Недавно были опубликованы разработанные Регуляторными Органами нормы, определяющие пределы для проведения испытаний и контроля потенциальных генотоксических примесей (GTI). Например,комитет Европейского агентства по оценке лекарственных средств (ЕМЕА) в отношении лекарственных препаратов для применения человеком (СНМР) определил порог токсикологической угрозы (ТТС), в соответствии с которым полагают, что прием/введение внутрь 1,5 мкг/день генотоксической примеси имеет допустимый риск. Из этого значения порога допустимый уровень в активном фармацевтическом ингредиенте (API) может быть вычислен в расчете на предполагаемую суточную дозу активного ингредиента[концентрационный предел (м.д. (ppm=ТТС [мкг/день]/доза (г/день)]. Для лекарственного средства, принимаемого в дозе 100 мг/день, это приравнивается к концентрационному пределу 15 м.д. для каждой потенциальной генотоксической примеси. Это составляет значительно более низкие уровни, чем обычно применяемый порог идентификации примесей согласно ICH(Международная конференция по гармонизации технических требований к регистрации фармацевтических продуктов) (Согласованное трехстороннее руководство Международной конференции по гармонизации, "Impurities in new drug substances" Q3A(R2), 25 October 2006), что создает для ученого-аналитика сложнейшую задачу разработки чувствительных аналитических методов мониторирования и количественного определения GTI. Опасения, которые появляются касательно возможного образования сложных эфиров сульфокислот и низших алкилов во время получения сульфонатных солей (Elder D.P. et al., J. Pharmacy and Pharmacology, 2009, 61:269-278) активного фармацевтического ингредиента (API) путем добавления алкил- или арилсульфокислоты (например, метансульфокислоты и т.д.) к свободному основанию, растворенному в растворителе на основе низшего алканола, привели Органы государственного регулирования к решению требовать от заявителей Регистрационное удостоверение, подтверждающее, что лекарственное средство имеет содержание алкил- и арилсульфонатов, которое не превышает пределы, указанные Органами по регулированию лекарственных средств (Lutz Muller et al., Regulatory Toxicology and Pharmacology, 2006,44:198-211). Таким образом, становится обязательным проверка того, что образование сложного эфира алкил- или арилсульфокислот не происходит во время получения соли API и гарантирование того, что промышленно выпускаемые алкил- или арилсульфокислоты, в частности метансульфокислота, используемые в качестве кислотных исходных веществ, не загрязнены соответствующими сложными эфирами низших алкилов. Нормы согласно ЕМЕА для генотоксических примесей устанавливают пределы по метил-, этил-, изопропилметансульфонатам (MMS, EMS, IMS), безилатам и тозилатам(EMEA/CHMP/CVMP/QWP/66297/2008 от 24 января 2008 г. и EMEA/CHMP/QWP/251334/2006). В вышеуказанном контексте органы по регулированию лекарственных средств (FDA, ЕМЕА) продолжают запрашивать разработку способов получения активных веществ с более высокой степенью чистоты и с самым низким воздействием на окружающую среду. Испытание активных фармацевтических ингредиентов (API) на генотоксические примеси заключает в себе ряд сложностей, обычных для следового анализа. Наиболее существенные аналитические трудности связаны с тремя основными проблемами: первая проблема касается структурного различия у генотоксических примесей и основного соединения, в связи с чем необходимы различные аналитические подходы; вторая проблема связана с соответственной реакционной способностью или с нестабильностью, в соответствии с чем требуются особые методы работы; третья проблема привносится матрицей образца, где "матрица" означает все компоненты, кроме анализируемого вещества, то есть растворимость образца и/или хроматографические интерференции, обусловленные основными компонентами. Даже если для наиболее распространенных генотоксических примесей аналитические методы описаны в соответствующей литературе, необходимо, чтобы каждая новая матрица образца была исследована для оптимизации аналитической селективности и чувствительности. Первым этапом разработки аналитического метода для количественного определения генотоксических примесей является выбор аналитического метода: этот подбор основан на химической структуре анализируемого вещества и на пределах, которые должны быть определены. Обычно используемые методы представляют собой газовую хроматографию для летучих генотоксических примесей и высокоэффективную жидкостную хроматографию (HPLC) для нелетучих генотоксических примесей. Применение масс-детектора в селективном ионном мониторинге (SIM) рассматривается как наиболее универсальный,чувствительный и селективный метод для следового анализа, за исключением доступного прибора, в особенности источника ионизации, и экспертный анализ специалистов-аналитиков вскрывает критические проблемы. Также могут быть использованы пламенно-ионизационный детектор (FID), детектор электронного захвата (ECD) и детектор ультрафиолетового излучения, если разделение пика анализируемых веществ от пика API является достаточным; однако эти методы являются менее чувствительными. Для очень реакционноспособных и нестабильных соединений может быть рассмотрен подход дериватизации: однако этот подход не может быть использован, если дериватизирующий реагент может вступать в реакцию с API сам по себе. В этом случае должны быть оптимизированы дезактивация/обезвреживание или удаление матрицы или прямой анализ. Наконец, следует рассмотреть вопросы валидации. Методы, использованные для контроля генотоксических примесей, могут быть основаны на испытаниях на предельное содержание примесей в лекарственных препаратах или на количественных испытаниях. В первом случае анализируемое вещество в испытуемом образце сравнивают с раствором стандарта, содержащим его в известной концентрации, и оценивание основано на определении того, является ли реакция анализируемого вещества слабее или сильнее реакции стандарта, во втором случае концентрацию анализируемого вещества определяют в численном выражении. Расширение границ валидации зависит от метода оценивания, который выбран,причем требования валидации в случае количественного метода являются более жесткими, чем требования валидации в случае метода с определением предельного содержания примесей в лекарственном препарате: с помощью подхода испытания на предельное содержание примесей в лекарственном препарате должны быть показаны специфичность, как оценка без помех, и чувствительность, как демонстрация того, что предел детектирования (LOD) является ниже требуемого предела, тогда как с помощью количественного подхода также необходимо показать линейность и предел количественного определения(LOQ), прецизионность, достоверность и надежность. В соответствии с вышеупомянутыми нормами Q3A (R2) от 25 октября 2006 г. примеси, содержащиеся в количестве 0,10% или более в новых лекарственных веществах (API), которые должны быть введены в суточной дозе, значение которой ниже 2 г/день, должны быть идентифицированы (то есть их структурное охарактеризовывание должно быть получено); кроме того, примеси, содержащиеся в количестве 0, 15% или более, должны быть качественно определены (то есть должны быть получены биологические данные, устанавливающие безопасность на заданном уровне примесей). Для того чтобы снизить риски, обусловленные использованием растворителей на стадии синтезаAPI, усилия были направлены на проведение реакций в отсутствие органических растворителей. Тем не менее, часто преимущество жидкофазных реакций без растворителя снижено в результате того факта,что использование органических растворителей может требоваться на конечных стадиях очистки (KoichiTanaba, Solvent-free Organic Synthesis, 2009, Wiley-VCH). С другой стороны, несмотря на то что использование органических растворителей в получении или в кристаллизации солей API в твердом состоянии является вполне обычным в фармацевтической практике, оно может нести в себе экологические проблемы, такие как риск опасности возникновения пожара и взрыва, и токсичность в отношении рабочих, в дополнение к проблемам, которые могут являться результатом загрязнения готового лекарственного препарата остаточными растворителями. Остаточные количества растворителя(ей) в активном ингредиенте и/или в готовом лекарственном препарате могут быть снижены только с помощью продления периода сушки или с помощью продленного нагревания соли API в твердом состоянии и/или готовой лекарственной формы, что приводит к невыгодному снижению производительности всего процесса изготовления. По сути дела, в том случае, когда органические растворители применяют для получения и/или кристаллизации солей API, таких как ралфинамид-метансульфонат или его R-энантиомер, эти соли являются загрязненными остаточным количеством органических растворителей. В случае получения или кристаллизации упомянутых метансульфонатных солей либо из низших алканолов, либо из алкиловых сложных эфиров, образование сложных эфиров низших алкилов и метансульфокислоты может происходить в конечном продукте, и упомянутые примеси могут присутствовать в качестве генотоксических загрязняющих веществ. Кроме того, в том случае, когда остаточный растворитель представляет собой либо низший алканол, либо алкиловый сложный эфир, может быть получен сложный эфир низшего алкила и метансульфокислоты. Описание изобретения Никакого конкретного раскрытия или информации, касающейся твердой формы ралфинамидметансульфоната и его R-энантиомера, в отношении содержания остаточных растворителей и генотоксических примесей и охарактеризовывания кристаллической структуры (Polymorphism in PharmaceuticalSolids - edited by Harry G. Britain 1999 - Marcel Dekker, Inc. NY), не представлено в известном уровне техники. Образцы твердого безводного ралфинамид-метансульфоната и соответственного R-энантиомера,приготовленные в соответствии с описанием известного уровня техники, с использованием изопропанола или этилацетата в качестве растворителя (WO 2007/147491, WO 2006/027052 и WO 2009/074478), были подвергнуты анализу для того, чтобы определить уровень остаточных растворителей и генотоксических загрязняющих веществ и кристаллические свойства. Теперь кристаллическая структура ралфинамид-метансульфонатной соли определена. На фиг. 1 представлена порошковая рентгеновская дифрактограмма (PXRD) для ралфинамид-метансульфонатной соли, полученной в соответствии со способами,описанными в WO 2007/147491 и в WO 2009/074478 и рассмотренными более подробно в дальнейшем в этом документе, которая показывает, что упомянутая соль всегда состоит из одинаковых безводных полиморфных модификаций, в дальнейшем в этом документе идентифицируемых как форма А. Аналогичные результаты были получены с R-энантиомером ралфинамид-метансульфоната, полученного в соответствии со способом, описанным в WO 2006/027052 и в WO 2009/074478. Аналитические испытания,выполненные на метансульфонатной соли как ралфинамида, так и его R-энантиомера, полученной согласно вышеупомянутым способам известного уровня техники, показывают, что эти соли загрязнены некоторым количеством остаточных растворителей и следовыми количествами генотоксических алкилметансульфонатов (см. примеры 18 и 19). Количество остаточных растворителей (изопропанола или этилацетата) и генотоксических загрязняющих веществ, таких как метилметансульфонат (MMS), этилметансульфонат (EMS) и изопропилметансульфонат (IMS), как было обнаружено, является меньшим, чем пределы, предписанные Органами по Регулированию лекарственных средств (например, Нормы ЕМЕА по Предельному содержанию генотоксических примесей, EMEA/CHMP/QWP/251334/2006; ЕМЕА "Note forGuidance on Impurities: Residual Solvents" CPMP/ICH/283/95). Несмотря на вышеупомянутое, стоит отметить, что увеличение в масштабе известных способов для промышленного получения может привести к увеличению количества генотоксических примесей в связи с различными экспериментальными условиями для реакции, выделения и сушки соли. Кроме того, уровень генотоксических примесей может варьироваться во времени в зависимости от количества остаточного растворителя и локально свободной метансульфокислоты. Кроме того, потенциальное присутствие этих генотоксических примесей обязывает производителей соли проверять в различных фазах процесса получения и хранения продуктов количества таких примесей. Это представляет собой очень дорогой и трудоемкий контроль ввиду ряда анализов, запрашиваемых также по причине усовершенствования способов. Ввиду вышеупомянутой и еще повышающейся жесткости рекомендаций, вырабатываемых Органами по Регулированию лекарственных средств, основной интерес представляет обеспечение нового способа получения ралфинамид-метансульфоната и соответственного R-энантиомера, который позволяет дополнительно улучшить как токсикологический профиль, так и экономические аспекты получения этих лекарственных средств, посредством чего получают метансульфонатные соли ралфинамида (Ia) и соответственного R-энантиомера (I'a) в твердой форме, которая является в значительной мере свободной от примесей, имеющих генотоксические эффекты и остаточные растворители, такие как низшие алканолы и низшие алкилацетаты, известные как их потенциальные вещества-предшественники. В соответствии с этим изобретением предоставлен новый способ, который позволяет осуществлять крупномасштабное получение и/или очистку метансульфонатной соли ралфинамида (Ia) или соответственного R-энантиомера (I'а) с высокими выходами, которая является в значительной мере свободной от примесей, имеющих генотоксический эффект, таких как MMS, EMS и IMS, и от остаточных растворителей, известных в качестве их потенциальных веществ-предшественников ввиду их реакционной способности по отношению к метансульфокислоте с образованием соответственных сложных эфиров. Способ по этому изобретению, включающий образование соли и/или очистку, при применении к порциям ралфинамида и его R-энантиомера, которые получены в соответствии со способами, описанными в WO 2007/147491 и WO 2009/074478, позволяет получать метансульфонатную соль вышеназванных веществ, которые, кроме наличия ожидаемой высокой степени чистоты в части бис-бензилированных побочных продуктов, взаимодействующих с цитохромами системы Р 450 (CYP 450), являются в значительной мере свободными от примесей, имеющих генотоксический эффект, и от остаточных растворителей, известных в качестве их потенциальных веществ-предшественников. Это изобретение относится к новому способу получения и/или очистки соли соединения (S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида, то есть ралфинамида (Ia) или соответственного R-энантиомера (I'a) и метансульфокислоты, с высокими выходами и с очень высокой энантиомерной и химической степенью чистоты в форме кристаллической безводной полиморфной модификации, идентифицируемой как форма А, характеризующейся порошковой рентгеновской дифрактограммой (PXRD), имеющей, по существу, характеристические пики в области значений угла 2: 6,93; 7,80; 9,66; 11,38; 12,04; 13,02; 13,82; 15,60; 16,36; 16,62; 17,52; 17,83; 18,75; 19,35; 19,70; 20,34; 20,69; 21,20; 22,69; 22,95; 23,23; 23,50; 24,80; 25,24; 25,8056; 26,01; 27,84; 28,07; 28,55; 29,16; 29,82; 30,77; 31,50; 31,95; 32,38; 33,37; 33,96; 34,61; 34,95; 36,02; 36,46; 37,38; 38,04; 39,66; где упомянутая соль является в значительной мере свободной от примесей, имеющих генотоксический эффект, и от остаточных растворителей, известных как их потенциальные веществапредшественники, отличающемуся тем, что:(i) соль получают или очищают кристаллизацией из раствора в растворителе, выбранном из:a) воды,b) смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода,c) ацетона, алифатического кетона с 4-5 атомами углерода или их смеси; или(ii) твердую соль, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники,суспендируют с растворителем, выбранным из:(a) воды,(b) смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода,(c) ацетона, алифатического кетона с 4-5 атомами углерода или их смеси; или(iii) твердую соль, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники,подвергают воздействию потока воздуха, имеющего высокую степень относительной влажности при температуре и в течение периода времени, достаточных для удаления вышеупомянутых примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники;(iv) в том случае, когда получающаяся в результате кристаллическая форма полученной таким образом соли представляет собой кристаллическую полугидратную псевдополиморфную модификацию,идентифицируемую как форма Н, характеризующуюся порошковой рентгеновской дифрактограммой(PXRD), имеющей, по существу, характеристические пики в области значений угла 2: 4,09; 7,09; 10,06; 11,64; 12,34; 16,38; 17,00; 17,47; 19,26; 20,11; 20,63; 21,34; 21,97; 23,35; 23,86; 24,12; 25,29; 27,15; 27,61; 28,02; 28,74; 29,62; 30,02; 30,51; 31,29; 31,81; 32,89; 33,35; 33,93; 35,10; 35,39; 35,62; 36,22; 38,91; 39,50; или смесь этой модификации с кристаллической безводной полиморфной модификацией формы А;(v) упомянутую полугидратную псевдополиморфную модификацию формы Н или вышеупомянутую смесь модификаций полностью превращают в кристаллическую безводную полиморфную модификацию формы А путем удаления кристаллизационной воды при нагревании. В соответствии с предпочтительным вариантом осуществления этого изобретения способ крупномасштабного получения и/или очистки метансульфонатной соли ралфинамида или его R-энантиомера с очень высокими выходами и с очень высокой энантиомерной и химической степенью чистоты в форме кристаллической безводной полиморфной модификации, идентифицируемой как форма А, где упомянутая соль является в значительной мере свободной от примесей, имеющих генотоксический эффект, и от остаточных растворителей, известных как их потенциальные вещества-предшественники, отличается тем, что:(i) соль получают или очищают кристаллизацией из раствора в растворителе, выбранном из:(ii) твердую соль, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники,суспендируют с растворителем, выбранным из:(iii) твердую соль, содержащую нежелательное количество примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники,-6 021389 подвергают воздействию потока воздуха, имеющего высокую степень относительной влажности при температуре и в течение периода времени, достаточных для удаления вышеупомянутых примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных как их потенциальные вещества-предшественники;(iv) где получающаяся в результате кристаллическая форма полученной таким образом соли представляет собой кристаллическую полугидратную псевдополиморфную модификацию, идентифицируемую как форма Н, характеризующуюся порошковой рентгеновской дифрактограммой, имеющей, по существу, характеристические пики в области угла 2: 4,09; 7,09; 10,06; 11,64; 12,34; 16,38; 17,00; 17,47; 19,26; 20,11; 20,63; 21,34; 21,97; 23,35; 23,86; 24,12; 25,29; 27,15; 27,61; 28,02; 28,74; 29,62; 30,02; 30,51; 31,29; 31,81; 32,89; 33,35; 33,93; 35,10; 35,39; 35,62; 36,22; 38,91; 39,50; или смесь этой модификации с кристаллической безводной полиморфной модификацией формы А;(v) упомянутую полугидратную псевдополиморфную модификацию формы Н или вышеупомянутую смесь модификаций полностью превращают в кристаллическую безводную полиморфную модификацию формы А путем удаления кристаллизационной воды при нагревании. В этом описании и в пунктах формулы выражение "примеси, имеющие генотоксический эффект" означает (С 1-С 5)алкилметансульфонаты, предпочтительно метилметансульфонат (MMS), этилметансульфонат (EMS) и изопропилметансульфонат (IMS). Один или более (C1-C5)алкилметансульфонатов могут присутствовать в качестве примесей в метансульфонатной соли активного вещества. Выражение "остаточные растворители, известные как их потенциальные веществапредшественники" определяет (C1-С 5)алканолы или их сложные эфиры с низшей алкановой кислотой,предпочтительно с метанолом, этанолом и изопропанолом, или их ацетаты. Один или более(С 1-С 5)алканолов могут присутствовать в качестве остаточных растворителей в активной метансульфонатной соли активного вещества. Выражение "в значительной мере свободные от примесей, имеющих генотоксический эффект" в этом описании и в пунктах формулы означает, что количество каждого из (С 1-С 5)алкилметансульфоната,предпочтительно каждого из MMS, EMS и IMS, определяемое с помощью аналитического метода, описанного в этом документе, составляет менее чем 0,05 м.д. (ppm) (LOD=предел детектирования) относительно метансульфонатной соли активного вещества. Аналогично, выражение "в значительной мере свободные от остаточных растворителей, известных как их потенциальные вещества-предшественники" (то есть вещества-предшественники генотоксических примесей) означает, что количество каждого из остаточных растворителей, (С 1-С 5)алканолов, в частности (C1-С 3)алканолов, таких как метанол, этанол и изопропанол, и/или их сложных эфиров с низшими алкановыми кислотами (например, этилацетат), составляет менее чем 6 м.д. (LOD=предел детектирования) относительно метансульфонатной соли активного вещества, которое определяют в соответствии с аналитическим методом, описанным в этом документе. Выражение "получают или очищают кристаллизацией из раствора в растворителе" означает, что соль получают в виде кристаллического твердого продукта из раствора в выбранном растворителе, где солеобразующие реагенты или соль сама по себе прежде были полностью растворены. Выражения "суспендируют с растворителем", "методика суспендирования" означают, что твердую соль суспендируют в выбранном растворителе в форме гетерогенной смеси и подвергают перемешиванию либо встряхиванию или другой эквивалентной обработке. Получение или кристаллизация соли (i). а) Использование воды. Неожиданно было обнаружено, что безводный метансульфонат ралфинамида или его R-энантиомера в кристаллической форме А, имеющей характеристики, определенные выше, может быть получен непосредственно кристаллизацией из воды в том случае, когда водный раствор метансульфоната ралфинамида или его R-энантиомера медленно концентрируют упариванием при комнатной температуре. В этих условиях кристаллы растут в форме бесцветных иголок. Анализ методом порошковой рентгеновской дифракции (PXRD), который дает рентгенограмму, полностью совместимую с фиг. 1, подтверждает, что полученные кристаллы имеют структуру формы А. Термогравиметрический анализ(TGA), проведенный на выращенных кристаллах, не показывает потери массы. Рентгеноструктурный анализ (SCXRD), который позволяет выполнять прямое экспериментальное определение всех кристаллографических параметров с определением кристаллического состояния соединения (то есть размеров элементарной ячейки, группы симметрии кристаллической решетки и положения всех атомов относительно исходного расположения атомов в элементарной ячейке), был проведен на кристалле, выбранном из порции выращенных кристаллов. Определенные элементарная ячейка, группа симметрии кристаллической решетки и вычисленная плотность кристалла представлены в табл. 1. Рентгеноструктурный анализ подтверждает, что кристаллическая структура соли состоит из упаковки протонированных фрагментов ралфинамида (протонирование происходит на атоме азота аминогруппы) и метансульфонатных анионов без других молекул. Фиг. 2 показывает молекулярную структуру, подтверждающую абсолютную конфигурацию S-ралфинамидного фрагмента. Фиг. 3 показывает кристаллическую упаковку, которая в основном определяется водородными связями с участием атомов водорода аминных и амидных групп и атомов кислорода сульфонатной группы. Каждый ралфинамидный фрагмент связан с четырьмя различными сульфонатными группами, с двумя с помощью аминной группы и с двумя с помощью амидной группы соответственно, тогда как атомы кислорода каждой сульфонатной группы связаны с четырьмя ралфинамидными фрагментами, в двух случаях через аминную группу и в других двух случаях через амидную группу. Таким образом, анионы и катионы интеркалированы вдоль оси b с образованием цепей, в которых ралфинамидные фрагменты приобретают расположение "елочкой". Тогда цепи дополнительно связаны вдоль оси с с образованием молекулярных плоскостей, перпендикулярных направлению а. Смежные плоскости являются обращенными для максимального увеличения эффективности упаковки, определяемой вандерваальсовыми взаимодействиями. Терминальное ароматическое кольцо ралфирнамидного фрагмента, как было обнаружено, разупорядочено по двум возможным ориентациям (наклоненных друг к другу приблизительно на 39) с различным уровнем вероятности (65 и 35% соответственно). Для каждой ориентации атом фтора разупорядочен с таким же уровнем вероятности (50%) по двум положениям, соответствующим вращению на 180 вокруг связи С 11-С 12 всего кольца. Поскольку результаты анализа SCXRD ограничены одним кристаллом, помещенным в пучок рентгеновских лучей, что заключает в себе название метода, их преобразование в порошковую рентгеновскую дифрактограмму обеспечивает путь сравнения их с результатами, полученными на большой группе кристаллов (например, порции, из которой был выбран кристалл). Такое преобразование стало возможным с помощью различных компьютерных программ с использованием кристаллографических параметров, определяемых по стандартной методике в эксперименте SCXRD. Это было выполнено с помощью программного обеспеченияPOWDER CELL (W. Kraus and G. Nolze, J. Appl. Cryst. (1996) 29:301), и результаты в графическом виде представлены на фиг. 4 в сравнении с экспериментальной дифрактограммой, записанной для обычного образца с формой А (порошок). Полное совмещение вычисленных и экспериментальных положений пиков ясно указывает на то, что результаты анализа SCXRD отражают форму А. Анализ Карла Фишера (KF) кристаллов формы А, полученных так, как описано выше, показывает 0,1%-ное (мас./мас.) содержание воды, что согласуется с отсутствием потери массы, полученным посредством TGA (фиг. 11), и соответственно с безводной природой кристаллов. Дифференциальная сканирующая калориметрия (DSC) (фиг. 11) показывает одну эндотерму при 243,10,2 С (Н=132,14,5 Дж/г). Кристаллы характеризуют с помощью спектров ядерно-магнитного резонанса в твердом теле, полученных с использованием кросс-поляризации и вращения образца под магическим углом (CP/MAS NMR)(M.R.M. Palermo de Aguiar, A.L. Gemal and R. Aguiar da Silva San Gil. Quimica nova, 22(4) (1999. Анизотропии локальных полей протонов уширяют спектры 1 Н CP/MAS NMR для этой формы А таким образом, что спектральные линии не могут быть разрешены и не могут стать определяющими. В противоположность тому, спектр 13 С CP/MAS NMR хорошо разрешен в алифатической части, где узкие сигналы резонансов наблюдаются для МеС-13 (16,6 м.д. (ppm, С-15 (39,0 м.д.), С-12 (50,8 м.д.),С-13 (57,0 м.д.) и С-7 (63,5 м.д.), хотя сигналы ароматических углеродов являются едва уширенными с шириной линии вплоть до 800 Гц. Кроме того, резонансы четвертичных углеродов ароматических колец С-11, С-4 и С-8 обнаружены на 158,1, 158,2 и 170,0 м.д. соответственно и амидный углерод показывает три широких сигнала на 193,0, 197,0 и 203,0 м.д. Кристаллическая структура ралфинамид-метансульфоната, полученного путем медленного концентрирования упариванием водного раствора соли, была обычным способом идентифицирована как полиморфная модификация формы А. Данные PXRD для метансульфонатной соли R-энантиомера ралфинамида, полученной в соответствии с аналогичной методикой, описанной выше, согласуются с результатами PXRD для полиморфной модификации формы А ралфинамид-метансульфоната. Анализ PXRD, проведенный на образцах метансульфоната ралфинамида и соответственного Rэнантиомера, полученных в соответствии со способами известного уровня техники (WO 2006/027052,WO 2007/147491 и WO 2009/074478), подтверждает, что эти образцы проявляют аналогичные характеристические параметры, что и метансульфонатные соли, полученные согласно методике, описанной выше,и, следовательно, им может быть присвоена структура полиморфной модификации формы А. В соответствии с дополнительным аспектом этого изобретения было обнаружено, что новая кристаллическая псевдополиморфная модификация, идентифицируемая как полугидратная форма Н, метансульфоната ралфинамида, а также соответственного R-энантиомера может быть получена в большом количестве кристаллизацией соли из воды в присутствии зародышевых кристаллов формы Н или реакцией соответствующего свободного основания с метансульфокислотой в воде ("образование соли") с последующей кристаллизацией соли, из среды солеобразования, промотируемой с помощью добавления зародышевых кристаллов формы Н. Полугидратная псевдополиморфная модификация формы Н, которая не содержит остаточные растворители низшие алканолы, а также генотоксические примеси низшие алкилсульфонаты, является полезной сама по себе ввиду ее обычных фармацевтических свойств и по той причине, что она может быть количественно превращена путем удаления воды при нагревании в соответствующую форму А, которая,в свою очередь, является свободной от растворителей и генотоксических примесей. Превращение полугидратной псевдополиморфной модификации формы Н в безводную полиморфную модификацию формы А с удалением кристаллизационной воды может быть проведено путем нагревания при 95-120 С, предпочтительно при 98-102 С, при пониженном давлении до достижения постоянной массы. В качестве примера при проведении процесса при давлении 20 мм рт. ст. и при температуре 110 С превращение кристаллов формы Н в кристаллы формы А является завершенным через приблизительно 4 ч. Кристаллы формы Н также могут быть использованы в качестве зародыша кристаллизации в инициировании образования кристаллов формы Н из насыщенных водных растворов метансульфонатной соли ралфинамида или его R-энантиомера. Методики образования и кристаллизации в воде могут быть осуществлены в соответствии с обычными способами, известными эксперту-специалисту в данной области, где воду используют в качестве растворителя в получении или в кристаллизации солей основных активных фармацевтических ингредиентов (API) с фармакологически приемлемыми кислотами. Ввиду амидной природы ралфинамида и его R-энантиомера применяемое для предосторожности условие представляет собой то, что водный раствор, содержащий соль, не подвергают воздействию при температуре выше 70 С в течение длительного времени (например, более 2 ч в случае раствора, где соотношение мас./мас. между водой и солью варьируется от 3:1 до 10:1) во избежание гидролиза амидной функциональной группы. Применение кристаллизационной технологии с применением воды в качестве единственного растворителя при очистке вышеупомянутых метансульфонатных солей предоставляет высокие выходы полугидратных кристаллов формы Н, свободных от генотоксических примесей и остаточных растворителей, известных в качестве их потенциальных веществ-предшественников. В соответствии с предпочтительным способом выполнения методики кристаллизации смесь воды и метансульфоната (S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида или его R-энантиомера (соотношении мас./мас. от 3:1 до 10:1) нагревают вплоть до 65 С при механическом перемешивании и под азотом. Раствор фильтруют. Зародышевые кристаллы формы Н добавляют к раствору и поддерживают при перемешивании при температуре 55-65 С в течение вплоть до 1 ч. Смесь охлаждают при перемешивании до 5-15 С постепенно за 2-6 ч, фильтруют, промывают охлажденной очищенной водой, что дает влажный продукт, который сушат при 20-40 С с обеспечением указанного в заглавии продукта, с 70-90%-ным выходом, имеющего более высокую хроматографическую степень чистоты, относительно степени чистоты исходной соли. Остаточные растворители: менее 6 м.д. (LOD=Предел Детектирования). Алкилметансульфонаты включают каждый из MMS, EMS и IMS в количестве менее 0,05 м.д. (LOD). В соответствии с предпочтительным способом осуществления процесса, определяемого выше как "образование соли", получение формы Н метансульфоната ралфинамида или его R-энантиомера осуществляют с использованием воды в качестве единственного растворителя, в котором свободное основание и метансульфокислоту подвергают контактированию в значительной мере в эквимолярной пропорции. В соответствии с более предпочтительным способом метансульфокислоту добавляют к суспензии или эмульсии свободного основания в воде. Как правило, первоначально добавляют 50-70% стехиометрического количества кислоты. Неожиданно в этих условиях получают раствор несмотря на то, что свободное основание почти нерастворимо в воде. Остальную порцию метансульфокислоты для восполнения стехиометрического количества, требуемого для солеобразования, или с небольшим избытком или с небольшим недостающим количеством (в обоих случаях вплоть до 3 мол.%), впоследствии добавляют к полученному раствору. Свободное основание ралфинамида и его R-энантиомера являются практически не растворимыми в воде и при 100 С (например, в том случае, когда суспензию ралфинамида в количестве воды, достаточном для образования конечной смеси воды и соли в соотношении мас./мас. от 3:1 до 10:1, нагревают при 80-95 С, отделяется маслянистая фаза). Таким образом, будет невозможно применять до добавления кислоты какой-либо способ очистки, предполагающий обработку раствора свободного основания активным углем или инертным порошком с последующей фильтрацией для удаления небольших частиц и/или примесей. Однако в соответствии со способом этого изобретения было неожиданно обнаружено, что добавление метансульфокислоты в количестве, значительно меньшем, чем стехиометрическое количество, к нагретой суспензии свободного основания ралфинамида или его R-энантиомера в воде производит полное его переведение в раствор, имеющий высокую стабильность, которая позволяет проводить очистку полученного раствора с помощью фильтрации или контактирования с твердой абсорбирующей средой. Дополняющее количество кислоты может быть добавлено вскоре после этой обработки раствора, предпочтительно после понижения температуры смеси ниже 70 С. Затем зародышевые кристаллы формы Н, приготовленные, например, по суспензионной технологии(см. пример 3), добавляют к раствору для того, чтобы контролировать начало кристаллизации и способ-9 021389 ствовать осаждению полугидратной псевдополиморфной модификации формы Н и предотвращению кристаллизации безводной полиморфной модификации формы А. После того как зародышевые кристаллы были добавлены к раствору соли, температуру дополнительно понижают контролируемым заранее заданным способом. В соответствии с более конкретным репрезентативным примером полугидратную псевдополиморфную модификацию формы Н метансульфоната ралфинамида или его R-энантиомера приготавливают путем добавления метансульфокислоты в количестве приблизительно 50-70% относительно требуемого стехиометрического количества к суспензии основания ралфинамида при приблизительно 70-90 С. Раствор, полученный таким образом, обрабатывают активным углем и фильтруют. Затем добавляют дополнительное количество (30-50%) метансульфокислоты при поддержании температуры на уровне приблизительно 60-70 С. Добавление зародышевых кристаллов полугидратной псевдомодификации формы Н к раствору, поддерживаемому при 50-65 С, вызывает начало кристаллизации, которую осуществляют путем постепенного понижения температуры до приблизительно 5-15 С с выполнением кристаллизации кристаллической полугидратной псевдополиморфной модификации формы Н соли. Твердое вещество собирают фильтрацией, сушат при приблизительно 40-50 С с предоставлением твердого порошка, содержащего 2,2 мас.% воды, что определяют с помощью анализа K.F. и что соответствует 1 моль воды на 2 моль метансульфоната ралфинамида (или его R-энантиомера). Дополнительный предпочтительный альтернативный способ (способ обратного добавления) состоит в добавлении ралфинамида или его R-энантиомера к водному раствору, содержащему эквимолярное(или с небольшим избытком или с небольшим недостающим количеством вплоть до 3 мол.%) количество метансульфокислоты в количестве очищенной воды, достаточном для образования смеси воды и соли в соотношении мас./мас. от 3:1 до 10:1, при комнатной температуре с последующим нагреванием полученной таким образом гетерогенной смеси вплоть до 65-70 С с предоставлением раствора. Зародышевые кристаллы формы Н, приготовленные так же, как в примере 3, добавляют к полученному таким образом раствору и поддерживают при перемешивании при 60-65 С. Смесь охлаждают при перемешивании до 515 С постепенно за 3-6 ч и затем кристаллический продукт фильтруют, промывают охлажденной очищенной водой, что дает влажный продукт, который сушат при 40-50 С при давлении окружающей среды с предоставлением метансульфоната ралфинамида формы Н с 80-90%-ным выходом. Содержание остаточных растворителей: менее 6 м.д. (LOD). Содержание алкилметансульфонатов: MMS, EMS и IMS, составляет менее 0,05 м.д. (LOD) (см. пример 19). Анализ методом порошковой рентгеновской дифракции (PXRD) (фиг. 5), проведенный на кристаллах полугидратной псевдополиморфной модификации формы Н, полученных посредством суспензионной технологии кристаллизации или кристаллообразования, показывает аналогичную дифрактограмму,подтверждающую то, что они имеют аналогичную кристаллическую структуру. Структура одного кристалла формы Н, полученного кристаллизацией из насыщенного водного раствора метансульфоната ралфинамида после добавления нескольких зародышевых кристаллов формы Н,была исследована методом рентгеноструктурного анализа (SCXRD). Размер элементарной ячейки, группа симметрии кристаллической решетки и вычисленные параметры плотности кристалла представлены в табл. 2 в сравнении с соответствующими параметрами формы А (см. пример 7). Анализ методом SCXRD подтверждает то, что структура кристалла формы Н содержит кристаллизационную воду в соотношении 1:2 с метансульфонатом ралфинамида и не содержит никакой другой примеси или остаточного растворителя. Молекулярная структура, включающая молекулу воды и две симметрически независимые молекулярные единицы как для фрагментов протонированного ралфинамида (протонирование происходит на атоме азота аминогруппы), так и для метансульфонатных фрагментов,показана на фиг. 6. Структура подтверждает абсолютную конфигурацию S ралфинамидного фрагмента. Кристаллическая структура состоит из упаковки, включающей фрагменты протонированного ралфинамида, метансульфонатные анионы и воду в соотношении 2:2:1. Кристаллическая упаковка (фиг. 7) в основном определяется тетраэдральной системой водородных связей, включающей молекулу воды, связанную с двумя ралфинамидными фрагментами и двумя метансульфонатными группами. В такой системе каждая молекула воды действует как двойной донор (по отношению к двум кислородным атомам анионов) и двойной акцептор (по отношению к двум водородным атомам амидных групп молекул ралфинамида). Каждый ралфинамидный фрагмент связан с тремя различными сульфонатными группами, с двумя посредством аминогруппы и с одной посредством амидной группы соответственно и с молекулой воды(посредством амидной группы). Вместе с тем атомы кислорода каждой сульфонатной группы связаны с тремя ралфинамидными фрагментами, в двух случаях через аминогруппу и в другом - через амидную группу, и с молекулой воды. Такая сложная система водородных связей приводит к образованию 2Dмолекулярных листовых структур, параллельных плоскости ab, в которой ралфинамидные фрагменты,наблюдаемые вдоль оси а, принимают встречно-гребенчатое расположение по типу двойной гребенки. Фиг. 7 показывает решающую роль воды в обуславливании высокой эффективности упаковки полугидратной псевдополиморфной модификации формы Н, где подразумевается отсутствие разупорядоченности и значительное увеличение плотности кристалла (4%) по отношению к безводной форме А. Сравнение экспериментально полученной методом PXRD дифрактограммы, обычной для формы Н, с дифракто- 10021389 граммой, рассчитанной с помощью программного обеспечения POWDER CELL на основе кристаллографических параметров, определенных в эксперименте с использованием метода SCXRD, показано на фиг. 8. Полное совмещение вычисленных и экспериментально полученных положений пиков ясно указывает на то, что результаты анализа методом SCXRD отражают форму Н. Полученные таким образом кристаллы дополнительно характеризуют с помощью DSC, TGA 1NMR в CD3CN, и с помощью 1 Н и 13 С ядерно-магнитного резонанса с использованием кросс-поляризации и вращения образца под магическим углом (CP-MAS NMR) (см. пример 10). Термогравиметрический анализ (TGA) (фиг. 12) показывает потерю массы на 2,14% при 95 С, полностью согласующуюся с наличием одной молекулы воды на две молекулы метансульфоната ралфинамида. Потеря воды находится в соответствии с анализом K.F. Дифференциально-сканирующая калориметрия (DSC) (фиг. 12) показывает два эндотермических пика: продукт показывает первую эндотерму при 95,12,0 С (Н=91,43,3 Дж/г) и вторую эндотерму при 241,30,3 С (Н=116,75,1 Дж/г) (см. пример 20). Кристаллы характеризуют с помощью спектров ядерно-магнитного резонанса в твердом теле, полученных с использованием кросс-поляризации и вращения образца под магическим углом (CP/MAS NMR)(см. фиг. 10). 1 Н CP/MAS NMR-спектр для формы Н не позволяет определить ширину линии сигналов, однако на уровне 1,76 м.д. имеется острая резонансная линия, которая может быть отнесена к воде. 13 С CP/MASNMR-спектр показывает в алифатической области несколько острых сигналов между 13,5 и 61,2 м.д.; кроме того, резонансные линии, относящиеся к ароматическим углеродам, в диапазоне от 111,3 до 133,1 м.д. показывают хорошую степень разрешения (ширина линии приблизительно 200-250 Гц). Спектр показывает сигналы ароматических четвертичных углеродов на уровне 156,8 и 166,05 м.д. и ряд резонансных линий, отнесенных к атому углерода амидной группы, между 182,0 и 207,0 м.д. 13 С CP/MAS NMR-спектры для формы А и Н в основном отличаются числом линий и химическими сдвигами для большинства углеродных атомов. В алифатической области (10-70 м.д.) спектр формы А показывает меньшее число резонансных линий со сходной амплитудой, тогда как форма Н обнаруживает острые резонансные линии с различной структурой: С-15 расщеплена на две линии (39,05 и 40,2 м.д.), С 12 имеет сдвиг в высокие поля (44,6 м.д.) относительно формы А (50,8 м.д.), в зависимости от их различной ориентации относительно внешнего магнитного поля. На самом деле анизотропия химического экранирования обусловливает частотные сдвиги в зависимости от ориентации. Кроме того, в ароматической области форма А показывает для протонированных ароматических углеродов меньшее число резонансных линий, но с четырехкратной шириной линии (вплоть до 800 Гц) по отношению к форме Н, которая имеет острые резонансные линии (ширина линии приблизительно 200-250 Гц). Также сигналы атома углерода амидной группы формы Н увеличены как по числу, так и по остроте. Сравнение данных для формы А и для формы Н метансульфоната ралфинамида показывает, что они имеют две различные кристаллические структуры, где форма Н, как оказывается, является более упорядоченной по отношению к форме А. Для проверки того, может ли быть получена полугидратная псевдополиморфная кристаллическая модификация формы Н, представленная метансульфонатом ралфинамида и его R-энантиомера, также для солей с другими кислотами, нежели метансульфокислота, была приготовлена соль ралфинамида с соляной кислотой с использованием воды в качестве растворителя. Гидрохлоридная соль ралфинамида, полученная добавлением соляной кислоты к суспензии свободного основания ралфинамида в воде, выделением соли посредством фильтрации и сушкой при комнатной температуре до достижения постоянной массы (пример 13), не показывает какого-либо наличия воды в кристаллической структуре. Этот результат подтвержден как с помощью анализа методом K.F., так и с помощью анализов методом DSC и методом TGA. Дифрактограммы, полученные с помощью методаPXRD, для влажного и сухого образца являются идентичными (фиг. 14). Гидрохлоридная соль, которая никогда не была раскрыта в известном уровне техники, отличается от метансульфонатной соли, поскольку никакая гидратированная форма не образуется также в условиях, которые благоприятствуют образованию полугидратной формы метансульфонатной соли.b) Применение смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода. Кристаллы полугидратной псевдополиморфной модификации формы Н могут быть получены также путем (кристалло)образования или очистки кристаллизацией метансульфоната ралфинамида или его Rэнантиомера из смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода. Этот способ в особенности подходит для очистки препаратов метансульфонатной соли ралфинамида или его Rэнантиомера, содержащих нежелательное количество генотоксических примесей, таких как низшие алкилметансульфонаты, и/или остаточных растворителей, известных как их потенциальные веществапредшественники, таких как (C1-C5)алканолы, в частности (C1-C3)алканолы. Полезная смесь воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода может заключать в себе смесь двух или более упомянутых растворителей в любой пропорции, хотя система из двух растворителей является пред- 11021389 почтительной. Соотношение воды с кетонным растворителем может варьироваться в пределах широкого диапазона в соответствии с взаимной растворимостью при рабочей температуре. Здесь преимущественно заимствованы аналогичные, принимаемые для предосторожности условия, которые применяют при использовании воды, что описано выше в параграфе (а). Например, преимущественно применяют смеси вода/ацетон от 5:95 до 30:70 (мас./мас.), вода/метилэтилкетон от 5:95 (мас./мас.) до 25:75 (мас./мас.). В процессе кристаллизации рабочую температуру обычно определяют посредством точки кипения смеси. Вышеупомянутые смеси воды с ацетоном или с (C4-С 5)алифатическим кетоном могут быть применены также в качестве растворителей для образования солей посредством реакции свободного основания ралфинамида или его R-энантиомера с метансульфокислотой в соответствии с методикой, описанной выше для применения воды в качестве растворителя. Кристаллическая форма, образующаяся в результате применения водных смесей в качестве растворителя для получения или очистки метансульфонатной соли, может представлять собой либо форму Н,либо форму А, либо смесь этих форм, в зависимости от соотношения компонентов смеси растворителей и от условий, применяемых во время процесса (кристалло)образования, или кристаллизации. В любом случае, когда получают кристаллы формы Н или смесь кристаллов формы Н и формы А (которые являются в значительной мере свободными от вышеопределенных примесей, имеющих генотоксический эффект, и от остаточных растворителей, которые являются их потенциальными веществамипредшественниками), упомянутая смесь может быть полностью превращена в безводную кристаллическую форму А путем проведения процесса удаления воды, описанного выше. с) Применение ацетона или алифатического кетона с 4-5 атомами углерода. В качестве дополнительного аспекта этого изобретения было обнаружено, что путем использования кетонных растворителей, таких как ацетон, алифатический кетон с 4-5 атомами углерода или их смесь, в получении (образовании) или очистке кристаллизацией метансульфонатных солей ралфинамида или егоR-энантиомера полученные соли являются в значительной мере свободными не только от генотоксических примесей и остаточных растворителей, известных в качестве их веществ-предшественников, но также и от примесей, получающихся в результате взаимодействия активного вещества с кетонным растворителем. Эти результаты являются неожиданными, ведь общеизвестна реакционная способность алифатических кетонов по отношению к веществам, которые, подобно ралфинамиду, содержат вторичную аминогруппу. В том случае, когда используют ацетон, алифатический кетон с 4-5 атомами углерода или их смесь в качестве растворителя и медленно добавляют метансульфокислоту к раствору, полученному растворением свободного основания в растворителе (предпочтительно в соотношении от 1:3 до 1:10 (мас./мас. при 50-80 С (в зависимости от растворителя), из смеси отделяются бесцветные кристаллы. После охлаждения, фильтрации смеси и сушки кристаллов получают соль с высоким выходом. В качестве примера кристаллы метансульфоната ралфинамида, полученного 50-100-килограммовой пробной порцией в ацетоне, после сушки показывают содержание остаточного ацетона в диапазоне от 800 до 1500 м.д., тогда как низшие алканолы (метанол, этанол и изопропанол), а также сложные низшие алкилэфиры (этилацетат), как выявлено, отсутствуют (ниже LOD (предела детектирования, даже в том случае, когда такой растворитель, низший алканол, был использован на предыдущих стадиях процесса. Кроме того, анализ методом GC/MS (газовая хроматография/масс-спектрометрия) указывает на то, что низшие алкилметансульфонаты (ROSO2CH3, где R=CH3, C2H5, C3H7 и т.д.) присутствуют в количестве,которое ниже LOD (см. пример 19). Соли в твердом состоянии, полученные в соответствии с этой методикой, характеризуют с помощью методов PXRD, DSC и TGA и 1H и 13 С CP-MAS NMR с получением подтверждения того, что полученная форма представляет собой безводную форму А. Кроме того, сравнительный анализ методамиPXRD и DSC показывает, что соли ралфинамида с метансульфокислотой при образовании в ацетоне в(С 4-С 5)алифатическом кетоне или в их смеси имеют аналогичную безводную кристаллическую форму(форму А) солей, получаемых посредством способов известного уровня техники. Те же самые растворители, упомянутые ранее в этом документе, могут быть использованы для очистки порций метансульфоната ралфинамида или его R-энантиомера кристаллизацией в том случае, когда эти соли содержат нежелательные количества вышеупомянутых генотоксических примесей и/или остаточных растворителей, которые являются их потенциальными веществами-предшественниками. Суспендирование твердой соли (ii). В соответствии с обычной методикой суспендирования (ii) порцию кристаллической безводной полиморфной модификации формы А метансульфоната ралфинамида или его R-энантиомера в твердой форме, содержащей нежелательное количество вышеопределяемых примесей, имеющих генотоксический эффект, и/или остаточных растворителей, известных в качестве их потенциальных веществпредшественников, перемешивают при температуре, варьирующейся от 10 до 40 С, с количеством воды или смеси воды и ацетона или алифатического кетона с 4-5 атомами углерода, которое является доста- 12021389 точным для образования суспензии твердых кристаллов в упомянутом растворителе, но которое не может растворить их в заметной (поддающейся оценке) степени при рабочей температуре, в течение периода времени, которое зависит от количества применяемой воды и от выбранной рабочей температуры и,как правило, находится в диапазоне от 4 до 48 ч. В конце процесса перемешивания суспензию кристаллов оставляют отстояться при комнатной температуре и твердое вещество отфильтровывают и сушат при комнатной температуре в вакууме, что дает порцию кристаллов полугидратной псевдополиморфной модификации формы Н, что подтверждено с помощью анализа методом PXRD (фиг. 5). Соотношение воды к кетонному растворителю может варьироваться в пределах широкого диапазона в соответствии со взаимной растворимостью при рабочей температуре точно так же, как описано выше для процессов (кристалло)образования и кристаллизации. Аналогичная методика суспендирования может быть применена для очистки твердой метансульфонатной соли ралфинамида или его R-энантиомера с использованием ацетона, (С 4-С 5)алифатического кетона или их смеси вместо воды или смеси воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода. Условия в общем и целом совпадают с условиями, описанными выше. Очищенная соль имеет кристаллическую безводную полиморфную модификацию формы А. Воздействие потока воздуха, имеющего высокую степень относительной влажности (iii). В качестве альтернативной методики суспендирования с водой для превращения кристаллов безводной формы А, содержащих нежелательные количества генотоксических примесей и/или остаточных растворителей, известных как их потенциальные вещества-предшественники, в соответствующую полугидратную псевдополиморфную модификацию формы Н, в значительной мере свободную от генотоксических примесей и/или остаточных растворителей, известных как их потенциальные веществапредшественники, может быть использована способность кристаллов безводной формы А захватывать воду из воздуха, имеющего высокую степень относительной влажности. Например, полное превращение кристаллов формы А в кристаллы соответствующей полугидратной псевдополиморфной модификации формы Н может быть достигнуто путем выдерживания порции кристаллов формы А метансульфоната ралфинамида или его R-энантиомера в потоке воздуха, имеющего относительную влажность выше, чем 65% при температуре от 5 до 30 С в течение периода времени, который может варьироваться от дней до недель и месяцев, в зависимости от степени относительной влажности и температуры. Если кристаллы, получающиеся из суспензии или в результате воздействия на твердые соли влажного потока воздуха, что описано выше, состоят из смеси кристаллов формы А и формы Н, упомянутая смесь может быть полностью превращена в порцию кристаллов формы А путем выполнения удаления воды так же, как описано выше. С учетом вышеприведенного описания один аспект этого изобретения заключается в обеспечении нового способа получения или очистки метансульфонатной соли ралфинамида или его R-энантиомера. Способ предусматривает (i) образование и/или кристаллизацию из воды, ацетона, алифатического кетона с 4-5 атомами углерода или из их смесей с водой, (ii) суспендирование с (а) водой, (b) со смесью воды с ацетоном или с алифатическим кетоном с 4-5 атомами углерода, (с) с ацетоном, с алифатическим кетоном с 4-5 атомами углерода или с их смесью или (iii) воздействие потока воздуха, имеющего высокую степень относительной влажности, и в том случае, когда полученный продукт состоит в целом или частично из кристаллов полугидратной псевдополиморфной модификации формы Н, превращение упомянутого продукта в кристаллы безводной формы А путем удаления воды из него, где упомянутый способ отличается тем, что соль получают в форме, которая в значительной мере свободна от примесей, имеющих генотоксический эффект, и/или от остаточных растворителей, известных как их потенциальные вещества-предшественники. В соответствии с дополнительным аспектом этого изобретения применение воды в качестве единственного реакционного растворителя позволяет осуществить предпочтительный способ изготовления метансульфонатной соли ралфинамида или его R-энантиомера из соответствующего свободного основания и метансульфокислоты, поскольку он предоставляет соли ралфинамида или его R-энантиомера с метансульфокислотой с высокой химической и энантиомерной степенью чистоты, в значительной мере свободные от генотоксических примесей и от остаточных растворителей, известных как их потенциальные вещества-предшественники. Согласно более предпочтительному аспекту этого изобретения новый способ включает первую стадию, посредством которой соль получают в форме полугидратной псевдополиморфной модификации (форма Н), и вторую стадию, посредством которой удаляют воду из полугидрата с превращением в кристаллическую полиморфную модификацию А. Полиморфная модификация А представляет собой кристаллическую форму метансульфонатной соли ралфинамида или его R-энантиомера, полученную в соответствии со способами, описанными в известном уровне техники, которая была подходящим образом использована для всех фармакологических и клинических применений, приведенных в международной публикации WO 2009/109334. Новая полугидратная псевдополиморфная модификация формы Н метансульфоната ралфинамида и его R-энантиомера является полезным интермедиатом для получения кристаллической полиморфной модификации А, в значительной мере свободной от генотоксических примесей и от остаточных растворителей, известных как их потенциальные вещества-предшественники. Такое использование полугид- 13021389 ратной псевдополиморфной модификации Н, полученной с применением воды в качестве растворителя,является особенно преимущественным с экономической и с фармацевтической точки зрения для крупномасштабных производств полиморфной модификации А для клинических применений. Преимущества нового способа, основанного на применении воды в качестве растворителя, касаются степени чистоты, безопасности и снижения издержек себестоимости. В сущности, никакие побочные продукты и генотоксические примеси не образуются в ходе реакции свободного основания ралфинамида или R-энантиомера с метансульфокислотой в воде. Благодаря отсутствию органических растворителей, твердая форма метансульфонатной соли ралфинамида или егоR-энантиомера не является загрязненной упомянутыми примесями. Главные потенциальные проблемы безопасности, которые, как правило, связаны с применением органических растворителей ввиду их воспламеняемости и взрывчатости при контактировании паров с воздухом, устранены с помощью применения воды в качестве растворителя для получения и/или очистки метансульфонатной соли в соответствии со способом этого изобретения. Стоит отметить, что органические растворители, которые не проявляют вышеупомянутые свойства, например, такие как галогенированные растворители, нежелательны ввиду их токсичности. Снижение издержек себестоимости очевидно, поскольку очищенная вода является менее дорогостоящим растворителем. Аналитических проблем становится меньше по причине отсутствия алкилметансульфонатных примесей. Стоимость выполнения анализа снижается, так как нет необходимости отмерять дозы генотоксических примесей на уровне миллионных долей, поскольку они не образуются, если процесс проводят в воде. Дополнительные преимущества связаны с тем фактом, что даже если на стадиях синтеза, предшествующих образованию соли, в качестве растворителей используют низшие алканолы, применение воды в качестве растворителя в образовании соли и/или в очистке позволяет полностью исключить любой существующий или потенциальный риск загрязнения конечного продукта примесями из низших алкилметансульфонатов. Фармацевтические характеристики действующего вещества и лекарственных продуктов на основе метансульфоната ралфинамида (и его R-энантиомера) формы Н. Признано, что различные полиморфные формы твердого вещества могут отличаться друг от друга в отношении многих физико-химических свойств, таких как растворимость и растворение, кажущаяся и истинная плотности, форма кристалла, характеристика компактирования, текучие свойства и стабильность твердого состояния (Florence А.Т. et al. Physicochemical Principles of Pharmacy, 1994, The MacMillanPress London). Физико-химический профиль полугидратной псевдополиморфной модификации (форма Н) метансульфоната ралфинамида в сравнении с физико-химическим профилем безводного соединения (форма А) показывает значительные преимущества в разработке и создании твердых лекарственных форм. Они обобщены следующим образом: более высокая стабильность во влажных или мокрых условиях,прессуемость и свойство достижения монолитности при таблетировании,меньшая внутричастичная пористость,более медленная скорость растворения. Адсорбция воды формой А ралфинамида при воздействии влажных или мокрых условий ясно указывает на то, что следует избегать или строго ограничивать применение влажных технологий, таких как мокрое гранулирование и нанесение пленочных покрытий на водной основе или простое воздействие высокой влажности, если в готовом лекарственном продукте должно быть сохранено безводное лекарственное вещество. Применение гидратированного лекарственного вещества позволяет устранить проблемы, связанные с абсорбцией воды и перекристаллизацией. Конкретно, гидратная форма Н позволяет использовать мокрое гранулирование, которое представляет собой надежный технологический процесс,имеющий преимущества, заключающиеся (i) в придании текучести/сыпучести составу, (ii) в снижении проблем упругого деформирования, (iii) в улучшении смачиваемости в том случае, когда поверхность таблетки покрывают гидрофильными полимерами, и (iv) в снижении потенциального разъединения связывания лекарственного средства с эксципиентами (Dilip M. Parikh (ed.), Handbook of PharmaceuticalGranulation Technology, Mercel Dekker, New York, 1997). Вода, присутствующая в гидратированном соединении, также полезна для технологических операций при изготовлении конечной лекарственной формы, такой как таблетки. Внедрение молекул воды изменяет свободную поверхностную энергию и определяет заполнение внутричастичных пустот, уменьшая пористость частиц. В результате увеличения силы сжатия во время таблетирования значительная теплота трения выделяется в точках контактирования, и присутствие воды действует как агент, облегчающий достижение монолитности таблетки в точках контактирования частиц. Итоговый эффект проявляется в более легком процессе прессования. Нанесение пленочного покрытия включает в себя нанесение полимерной пленки на поверхность таблетки с ничтожно малым увеличением размера таблетки. Нанесение покрытия на таблетки может быть разработано с тем, чтобы сделать легче проглатывание лекарственной формы, а также с тем, чтобы корригировать неприятный вкус и запах действующего вещества. Поскольку контроль административных органов по регулированию лекарственных средств в отношении здоровья, безопасности и защиты окружающей среды возрос, применение водных растворов становится обязательным. В ходе исходных стадий процесса нанесения пленочного покрытия на водной основе водные капельки сталкиваются с непокрытой поверхностью и одновременно с тем проникают в таблетки. Вода, проникающая внутрь таблетки, не взаимодействует с активным веществом, так как полугидратная форма представляет собой вполне определенную псевдополиморфную форму (James W. McGinity (ed.) - Aqueous Polymeric Coatingfor Pharmaceutical Dosage Forms - Mercel Dekker, New York, 1997). Кроме того, готовый продукт, содержащий полугидратное лекарственное средство, упакованное в блистерные упаковки или в бутылочки и сохраняемое в теплых и влажных условиях, не изменяет содержание воды за весь период срока годности. Другим важным фактором является то, что, когда частицы подвергают воздействию интенсивного трения, такому как процессы измельчения или смешения, присутствие воды в частицах снижает вероятность любого усложняющего электростатического эффекта посредством обеспечения проводящего пути для диссипации заряда. Итоговое преимущество полугидратной псевдополиморфной модификации формы Н метансульфоната ралфинамида (и его R-энантиомера) представляет собой более легкое создание перорального твердого состава. Собственная скорость растворения является характерной для каждого твердого соединения в данном растворителе в неизменных гидродинамических условиях. Знание этого значения помогает в прогнозировании того факта, будет ли абсорбция ограничена скоростью растворения. Измерение собственной скорости растворения (IDR) для метансульфоната ралфинамида формы А и Н проводят в соответствии с Общей Главой Фармакопеи США 1087. Результаты измерения IDR показаны ниже: Дано то, что IDR для полугидратной формы Н ниже, чем IDR для формы А, эта характеристика является полезной для разработки модифицированной системы доставки лекарственного средства, такой как пролонгированное или продленное высвобождение лекарственного средства (Michael J. Rathbone,Jonathan Hadgraft and Michael S. Roberts (ed.), Modified Release Drug Delivery Technology, Mercel Dekker,New York, 2003). Как правило, основные подходы к составу с замедленным высвобождением составляют:(a) нерастворимая, медленно размывающаяся или набухающая матрица (Robert S. Langer and Donald(b) состоящая из множества частиц лекарственная форма с нанесенным полимерным покрытием(Ghebre-Sellassie I. (ed.), Multiparticulate Oral Dose Delivery, Mercel Dekker, New York, 1994). Монолитные матрицы широко применяются благодаря простоте и удобству их изготовления с использованием обычного технологического оборудования. Матричные системы состоят из растворенного или диспергированного лекарственного средства в пределах набухающей или размывающейся полимерной матрицы. Высвобождение лекарственного средства из этих систем определяется проникновением воды в матрицу и последующими диффузией лекарственного средства в окружающую среду, размыванием матрицы или комбинацией того и другого. Для получения контролирующей скорость матричной системы используют гидрофильные камеди, которые образуют при гидратации вязкий ретардирующий высвобождение гелеобразный слой. Лекарственные формы, состоящие из множества частиц, с нанесенным полимерным покрытием, такие как пеллеты и гранулы, предоставляют ряд потенциальных преимуществ по сравнению с монолитными препаратами по их дисперсионным характеристикам, временам транзита по желудочно-кишечному тракту и сниженному потенциалу раздражения желудка. Для получения пеллетов либо шариков или мини-таблеток используют процессы экструзии-сферонизации, наслоения или минитаблетирования (Ghebre-Sellassie I. (ed.), Pharmaceutical Pelletization Technology, Mercel Dekker, New York, 1989). Их затем покрывают нерастворимыми пленками, которые действуют как мембрана, которая делает возможным протекание инфузии желудочно-кишечных жидкостей и обратную диффузию растворенного лекарственного средства. Полимеры, как правило, используемые для образования контролирующей высвобождение пленки, представляют собой целлюлозные и акриловые производные, такие как этилцеллюлозные и акриловые смолы. Кроме того, эти системы с контролируемой доставкой могут быть улучшены, если продукт, полученный на последней стадии кристаллизации (размер частиц, немикронизированный), используют непосредственно для дополнительного замедления скорости растворения лекарственного средства. Скорость растворения и размер частиц составляют два параметра, которые очень полезны в разработке и оптимизации пролонгирования высвобождения лекарственного средства. На основе вышеупомянутых соображений можно сделать вывод о преимуществах формы Н метансульфоната ралфинамида (и его R-энантиомера) относительно формы А для изготовления лекарственных форм с модифицированным высвобождением. Описание чертежей На фиг. 1 представлена характеристическая рентгеновская порошковая дифрактограмма (PXRD) табл. 12 - формы А метансульфоната ралфинамида; горизонтальная ось (2) в градусах; вертикальная ось: интенсивность (в импульсах в секунду (cps. На фиг. 2 показана симметрическая независимая молекулярная структура формы А, полученная с помощью рентгеноструктурного анализа (атомные координаты основаны на данных табл. 13-17). Для наглядности показана только одна возможная конформация терминального ароматического кольца (разупорядоченного по двум возможным ориентациям) и атома фтора (разупорядоченного по двум положениям для каждой ориентации ароматического кольца). На фиг. 3 показана молекулярная упаковка формы А, в проекции на плоскость ab структуры (размер элементарной ячейки и симметрия основаны на данных табл. 4, и атомные координаты основаны на данных табл. 13-17). Для наглядности показана только одна возможная конформация терминального ароматического кольца (разупорядоченного по двум возможным ориентациям) и атома фтора (разупорядоченного по двум положениям для каждой ориентации ароматического кольца). Светлые линии указывают на систему водородных связей. На фиг. 4 представлен график вычисленной относительно экспериментальной порошковой рентгеновской дифрактограммы (PXRD) для формы А; горизонтальная ось (2) в градусах; вертикальная ось: интенсивность (единицы поглощения (a.u.; верхний график - вычисленная порошковая дифрактограмма; нижний график - экспериментальная порошковая дифрактограмма. На фиг. 5 представлена характеристическая рентгеновская порошковая дифрактограмма (PXRD) для формы Н метансульфоната ралфинамида; горизонтальная ось (2) в градусах; вертикальная ось: интенсивность (в импульсах в секунду (cps. На фиг. 6 показана симметрически независимая молекулярная структура формы Н метансульфоната ралфинамида, полученная с помощью рентгеноструктурного анализа (атомные координаты основаны на данных табл. 5-9). На фиг. 7 показана молекулярная упаковка формы Н, в проекции на плоскость bc структуры (размер элементарной ячейки и симметрия основаны на данных табл. 4, и атомные координаты основаны на данных табл. 5-9). Светлые линии указывают на систему водородных связей. На фиг. 8 представлен график вычисленной относительно экспериментальной рентгеновской порошковой дифрактограммы (PXRD) для формы Н; горизонтальная ось (2) в градусах; вертикальная ось: интенсивность (единицы поглощения (a.u Верхний график - вычисленная порошковая дифрактограмма; нижний график - экспериментальная порошковая дифрактограмма. На фиг. 9 представлен спектр ядерно-магнитного резонанса, полученный с использованием 13 СCP/MAS NMR для формы А метансульфоната ралфинамида; горизонтальная ось: химический сдвиг, м.д.; вертикальная ось: относительная интенсивность. На фиг. 10 представлен спектр 13 С CP/MAS NMR для формы Н метансульфоната ралфинамида; горизонтальная ось: химический сдвиг, м.д.; вертикальная ось: относительная интенсивность. На фиг. 11 представлена кривая, полученная посредством дифференциально-сканирующей калориметрии (DSC) (нижняя кривая), и кривая, полученная посредством термогравиметрического анализа(TGA) (верхняя кривая), для формы А метансульфоната ралфинамида. На фиг. 12 представлена DSC-кривая (нижняя кривая) и TGA-кривая (верхняя кривая) для формы Н метансульфоната ралфинамида. На фиг. 13 представлена DSC-кривая (нижняя кривая) и TGA-кривая (верхняя кривая) для формы А метансульфоната ралфинамида, полученной из формы Н посредством потери воды. На фиг. 14 (сравнительный пример) представлена характеристическая рентгеновская порошковая дифрактограмма (PXRD) для безводной формы гидрохлорида ралфинамида; горизонтальная ось (2) в градусах; вертикальная ось: интенсивность (единицы поглощения (а.u Верхняя кривая: сухой порошок; нижняя кривая: влажный порошок. Примеры Пример 1. Синтез формы Н (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната посредством образования соли (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида с метансульфокислотой в воде (прямое и обратное добавление). 1a) Прямое добавление. Смесь очищенной воды (300 мл) и (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (60,0 г,0,198 моль; хроматографическая степень чистоты 99,4 (% по площади), пример 25 А международной публикации WO 2009/074478; энантиомерное соотношение S:R=99,8:0,2, пример 26 А из WO 2009/074478; остаточные растворители: толуол 300 м.д. и метанол 50 м.д. (пример 18); алкилметансульфонаты: MMS,EMS и IMS, менее 0,05 м.д. (LOD=предел детектирования) (пример 19), полученного так, как в примере 2 а) международной публикации WO 2009/074478, нагревают вплоть до 70 С при механическом перемешивании и под азотом. К перемешанной смеси при 70 С за 15 мин добавляют метансульфокислоту (14,4 г, 9,7 мл, 0,149 моль). Раствор, полученный таким образом, фильтруют и охлаждают медленно до 65 С. К раствору, поддерживаемому при температуре 65 С, добавляют метансульфокислоту (5,3 г, 0,055 моль) при перемешивании. Зародышевые кристаллы, приготовленные так, как в примере 3 а), добавляют при перемешивании к раствору, поддерживаемому при 55-60 С. Смесь постепенно охлаждают за 3 ч при перемешивании до 5 С и затем суспендированный кристаллический продукт выделяют фильтрацией, промывают охлажденной очищенной водой (30 мл), что дает влажный продукт (83,2 г), который сушат при 50 С при давлении окружающей среды с предоставлением 68,9 г (0,169 моль, выход 85,5%) продукта, указанного в заглавии. Хроматографическая степень чистоты: 99,9 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 А международной публикации WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: толуол и метанол - менее 6 м.д. (LOD) (пример 18). Алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19).DSC: первая эндотерма при 95,12,0 С (Н=91,43,3 Дж/г) и вторая эндотерма при 241,30,3 СTGA: эндотерма при приблизительно 95 С, сопровождаемая потерей массы 2,14% (пример 20 и фиг. 12). ЯМР высокого разрешения (пример 21): спектр 1 Н ЯМР в CD3CN для метансульфоната (S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида, формы Н, таким образом полученного, полностью согласуется с заданной структурой, и он идентичен спектру формы А. ЯМР-данные для всех протонов приведены в следующей табл. 1.CP/MAS NMR в твердом теле (пример 21): спектр ядерно-магнитного резонанса в твердом теле, полученный с использованием кросс-поляризации и вращения образца под магическим углом для метансульфоната (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида, формы Н, показывает широкий сигнал между 2,00 и 7,50 м.д. и острый сигнал при 1,76 м.д. 13 Спектр С(S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида, формы Н показывает следующие резонансные линии с химическими сдвигами в м.д., описанными здесь ниже в табл. 2. Полный спектр представлен на фиг. 10. Анализ PXRD. В следующей табл. 3 представлена наблюдаемая дифрактограмма, полученная методом PXRD,(фиг. 5) для полугидратной псевдополиморфной модификации формы Н, записанная на приборе и в условиях, описанных в примере 22. Значения 2 согласуются с кристаллографическими параметрами, вычисленными с использованием данных анализа методом SCXRD. Таблица 3 Наблюдаемые (набл.) и вычисленные (выч.) параметры дифрактограммы, полученной методом PXRD, для формы Н(S)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид (60,0 г, 0,199 моль; хроматографическая степень чистоты 99,4 (% по площади), пример 25 А международной публикации WO 2009/074478; хроматографическое энантиомерное соотношение S:R=99,8:0,2, пример 26 А из WO 2009/074478; остаточные растворители: толуол 300 м.д. и метанол 50 м.д. (пример 18); алкилметансульфонаты: MMS, EMS и IMS,менее 0,05 м.д. (LOD=предел детектирования) (пример 19), полученный так, как в примере 2 а) международной публикации WO 2009/074478, добавляют порциями за 15 мин к перемешанному раствору метансульфокислоты (0,198 моль) в воде (400 мл) с обеспечением гетерогенной смеси, состоящей из соли и водного раствора. Смесь нагревают вплоть до 65 С при механическом перемешивании и под азотом с получением раствора. Зародышевые кристаллы, приготовленные так, как в примере 3 а), добавляют к раствору при 60-65 С. Смесь постепенно охлаждают при перемешивании до 5 С за 3 ч и затем нерастворимый кристаллический продукт собирают фильтрацией, промывают охлажденной очищенной водой(30 мл), что дает влажный продукт (80,2 г), который сушат при 50 С при давлении окружающей среды с предоставлением 65 г (0,160 моль, выход 80,2%) продукта, указанного в заглавии. Хроматографическая степень чистоты: 99,9 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 А международной публикации WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: толуол и метанол - менее 6 м.д. (LOD) (пример 18). Алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19).DSC: первая эндотерма при 95,12,0 С (Н=91,43,3 Дж/г) и вторая эндотерма при 241,30,3 СTGA: эндотерма при приблизительно 95 С, сопровождаемая потерей массы 2,14% (пример 20 и фиг. 12). Пример 2. Синтез формы Н (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната посредством образования соли (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида с метансульфокислотой в воде. Смесь очищенной воды (300 мл) и (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (60,0 г,0,198 моль; хроматографическая степень чистоты 99,4 (% по площади), пример 25 А международной публикации WO 2009/074478; энантиомерное соотношение R:S=99,6:0,4, пример 26 В WO 2009/074478; остаточные растворители: толуол 300 м.д. и метанол 50 м.д. (пример 18); алкилметансульфонаты: MMS, EMS и IMS, менее 0,05 м.д. (LOD=предел детектирования) (пример 19), полученного так, как в примере 5 а) международной публикации WO 2009/074478, нагревают вплоть до 100 С при механическом перемешивании и под азотом с получением смеси, состоящей из двух жидких фаз. Смесь охлаждают до 90 С. К перемешанной смеси за 15 мин добавляют метансульфокислоту (14,4 г, 9,7 мл, 0,149 моль). Температура смеси поднимается до 93 С и затем раствор, полученный таким образом, фильтруют и охлаждают медленно до 65 С. К раствору, поддерживаемому при температуре 65 С,добавляют метансульфокислоту (5,3 г, 0,055 моль) при перемешивании. Зародышевые кристаллы, приготовленные так, как в примере 3b), добавляют к раствору, поддерживаемому при перемешивании при 55-60 С. Кристаллизационную смесь постепенно охлаждают за 3 ч при перемешивании до 5 С и затем кристаллический продукт выделяют фильтрацией, промывают охлажденной очищенной водой (30 мл), что дает влажный продукт (84 г), который сушат при 50 С при давлении окружающей среды с предоставлением 68,0 г (0,167 моль, выход 84,3%) продукта, указанного в заглавии. Хроматографическая степень чистоты: 99,8 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 В международной публикации WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: толуол и метанол - менее 6 м.д. (LOD) (пример 18). Алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19). Данные DSC и TGA (пример 20), спектры 1H-ЯМР в CD3CN, анализ методами 13 С CP/MAS NMR(пример 21) и PXRD (пример 22) полностью совпадают с соответствующими данными DSC и TGA, спектрами 1 Н-ЯМР в CD3CN, анализом методами 13 С CP/MAS NMR и PXRD для (S)-энантиомера формы Н,представленными в примере 1 а). Пример 3. Зародышевые кристаллы формы Н (S)- и (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната как результат суспендирования формы A (S)- и (R)-2-[4-(2 фторбензилокси)бензиламино]пропанамид-метансульфоната в воде соответственно. а) Смесь очищенной воды (2,5 л) и (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамидметансульфоната (125 г, 0,314 моль; хроматографическая степень чистоты 99,4 (% по площади), пример 25 А международной публикации WO 2009/074478; энантиомерное соотношение S:R=99,8:0,2, пример 26 А WO 2009/074478; остаточные растворители: 2-пропанол 1300 м.д. (пример 18); алкилметансульфонаты: MMS и EMS - ниже 0,05 м.д. (LOD) и IMS - 0,14 м.д. (пример 19), полученного так, как в примере 3 а) международной публикации WO 2009/074478, перемешивают при комнатной температуре в течение 24 ч. Нерастворимое вещество выделяют фильтрацией и сушат при комнатной температуре с предоставлением (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната формы Н (63,9 г, выход 50%). Хроматографическая степень чистоты: 99,8 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 А международной публикации WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: 2-пропанол - менее 6 м.д. (LOD) (пример 18). Алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19). Данные DSC и TGA (пример 20), спектры 1 Н-ЯМР в CD3CN, 13C CP/MAS NMR (пример 21) и анализ методом PXRD (пример 22) полностью совпадают с соответствующими данными DSC и TGA, спектрами 1 Н-ЯМР в CD3CN, 13C CP/MAS NMR и анализом методом PXRD для формы Н (S)-2-[4-(2 фторбензилокси)бензиламино]пропанамид-метансульфоната, представленными в примере 1 а).b) (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфонат формы Н (65 г, выход 51%) получают в соответствии с аналогичной методикой, описанной выше, начиная из (R)-2-[4-(2 фторбензилокси)бензиламино]пропанамид-метансульфоната формы А (хроматографическая степень чистоты 99,4 (% по площади); энантиомерное соотношение R:S=99,8:0,2, пример 26 В WO 2009/074478; остаточные растворители: 2-пропанол 1300 м.д. (пример 18); алкилметансульфонаты: MMS и EMS - ниже 0,05 м.д. (LOD) и IMS - 0,14 м.д. (пример 19), полученного так, как в примере 5b) международной публикации WO 2009/074478. Полученную соль формы Н характеризуют следующим образом. Хроматографическая степень чистоты: 100,0 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 В международной публикации WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: 2-пропанол - менее 6 м.д. (LOD) (пример 18). Алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19). Данные DSC и TGA (пример 20), спектры ЯМР в CD3CN, 13C CP/MAS NMR (пример 21) и анализ методом PXRD (пример 22) полностью совпадают с соответствующими данными DSC и TGA, спектрами ЯМР в CD3CN, 13C CP/MAS NMR и анализом методом PXRD для формы Н (R)-энантиомера, представленными в примере 2. Пример 4. Получение (S)- и (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната формы Н: обратное добавление.a) (S)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид (60,0 г, 0,198 моль; хроматографическая степень чистоты 99,4 (% по площади); энантиомерное соотношение S:R=99,8:0,2, пример 26 А из WO 2009/074478; остаточные растворители: толуол 300 м.д. и метанол 50 м.д. (пример 18); алкилметансульфонаты: менее 0,05 м.д. (LOD=предел детектирования) (пример 19), полученный так, как в примере 2 а) международной публикации WO 2009/074478, добавляют при перемешивании при 10 С за 5 мин к раствору метансульфокислоты (19,3 г, 0,201 моль) в очищенной воде (400 мл). Полученную гетерогенную смесь, которая состоит из соли и водного раствора, перемешивают при комнатной температуре в течение 24 ч. Нерастворимое вещество отфильтровывают, промывают водой (40 мл) и сушат при комнатной температуре с предоставлением (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната формы Н с выходом 90%. Хроматографическая степень чистоты: 99,8 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 А международной публикации WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: толуол и метанол - менее 6 м.д. (LOD) (пример 18). Алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19). Данные DSC и TGA (пример 20), спектры ЯМР в CD3CN, анализ методами 13 С CP/MAS NMR (пример 21) и PXRD (пример 22) полностью совпадают с соответствующими данными DSC и TGA, спектрами ЯМР в CD3CN, анализом методами 13 С CP/MAS NMR и PXRD для формы Н (S)-энантиомера, которые представлены в примере 1.b) (R)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид-метансульфонат формы Н (выход 91%) получают в соответствии с аналогичной методикой, описанной выше, начиная из (R)-2-[4-(2 фторбензилокси)бензиламино]пропанамида (60,0 г, 0,198 моль; хроматографическая степень чистоты 99,4 (% по площади); хроматографическое энантиомерное соотношение R:S=99,8:0,2, пример 26 В WO 2009/074478; остаточные растворители: толуол 320 м.д. и метанол 40 м.д. (пример 18); алкилметансульфонаты: менее 0,05 м.д. (LOD, полученного так, как в примере 2 а) международной публикации WO 2009/074478. Полученную соль формы Н характеризуют следующим образом. Хроматографическая степень чистоты: 99,8 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 В международной публикации WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: толуол и метанол - менее 6 м.д. (LOD) (пример 18). Алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19). Данные DSC и TGA (пример 20), спектры ЯМР в CD3CN, анализ методами 13 С CP/MAS NMR (пример 21) и PXRD (пример 22) полностью совпадают с соответствующими данными DSC и TGA, спектрами ЯМР в CD3CN, анализом методами 13 С CP/MAS NMR и PXRD для формы Н (R)-энантиомера, представленными в примере 2. Пример 5. Получение (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната формы Н путем кристаллизации из воды. Смесь очищенной воды (500 мл) и (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамидметансульфоната (78,9 г, 0,198 моль; хроматографическая степень чистоты 99,4 (% по площади); хроматографическое энантиомерное соотношение S:R=99,8:0,2; остаточные растворители: 2-пропанол 1300 м.д.) (пример 18); содержание алкилметансульфонатов: MMS и EMS - менее 0,05 м.д. (LOD) и IMS - 0,14 м.д. (пример 19), приготовленного так, как в примере 3 а) WO 2009/074478, нагревают вплоть до 65 С при механическом перемешивании и под азотом и затем фильтруют. Зародышевые кристаллы, приготовленные так, как в примере 3 а), добавляют к раствору и поддерживают при перемешивании при 55-60 С. Смесь постепенно охлаждают при перемешивании до 5 С за 3 ч и затем кристаллический продукт отфильтровывают, промывают охлажденной очищенной водой(30 мл), что дает влажный продукт, который сушат при 40 С при давлении окружающей среды с предоставлением продукта (64,8 г, 0,159 моль; выход 80,6%), указанного в заглавии. Хроматографическая степень чистоты: 99,9 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 А WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: 2-пропанол - менее 6 м.д. (LOD) (пример 18). Алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19). Данные DSC и TGA (пример 20), спектры ЯМР в CD3CN, анализ методами 13 С CP/MAS NMR (пример 21) и PXRD (пример 22) полностью совпадают с соответствующими данными DSC и TGA, спектрами ЯМР в CD3CN, анализом методами 13 С CP/MAS NMR и PXRD для формы Н (S)-энантиомера, представленными в примере 1 а). Пример 6. Получение (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната формы Н путем кристаллизации из смеси ацетон/вода с соотношением 95:5 (мас./мас.).(S)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид-метансульфонат формы А (1,5 г; хроматографическая степень чистоты 99,4 (% по площади); хроматографическое энантиомерное соотношениеS:R=99,8:0,2; остаточные растворители: 2-пропанол 1300 м.д., пример 18; содержание алкилметансульфонатов: MMS и EMS - менее 0,05 м.д. (LOD) и IMS - 0,14 м.д. (пример 19), приготовленный так, как в примере 3 а) WO 2009/074478, и смесь ацетон/вода с соотношением 95:5 (мас./мас.) (20 мл) помещают в 50-миллилитровую круглодонную колбу, оснащенную обратным холодильником. Суспензию нагревают до температуры, которая приблизительно на 5 С ниже температуры кипения растворителя, и поддерживают при перемешивании с помощью магнитной мешалки при этой температуре в течение 12 ч. Затем суспензии дают остыть самопроизвольно до комнатной температуры и фильтруют с предоставлением после сушки в вакууме при комнатной температуре (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфонат формы Н с выходом 87%. Хроматографическая степень чистоты: 99,9 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 А WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: 2-пропанол - менее 6 м.д. (LOD) и ацетон 200 м.д. (пример 18). Алкилметансульфонаты (MMS, EMS и IMS): менее 0,05 м.д. (LOD) (пример 19). Данные DSC и TGA (пример 20), спектры ЯМР в CD3CN, анализ методами 13 С CP/MAS NMR (пример 21) и PXRD (пример 22) полностью совпадают с соответствующими данными DSC и TGA, спектрами ЯМР в CD3CN, анализом методами 13 С CP/MAS NMR и PXRD для формы Н (S)-энантиомера, полученной в примере 1 а). Пример 7. Образование (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната формы Н из (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната формы А посредством поглощения воды из влажного воздуха.(S)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид-метансульфонат формы А (3 г; хроматографическая степень чистоты 99,8 (% по площади), пример 25 А WO 2009/074478; хроматографическое энантиомерное соотношение S:R=99,5:0,5, пример 26 А WO 2009/074478; остаточные растворители: ацетон 1023 м.д. (пример 18); алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19), полученный так, как в примере 9 а), выдержанный в потоке воздуха с относительной влажностью 97% при 25 С в течение двух месяцев, полностью превращают в форму Н. Хроматографическая степень чистоты: 99,9 (% по площади) (пример 25 А международной публикации WO 2009/074478). Хроматографическая энантиомерная степень чистоты: 100% (пример 26 А WO 2009/074478). Анализ K.F.: содержание воды 2,3 мас.% (пример 17). Остаточные растворители: ацетон - 100 м.д. (пример 18). Алкилметансульфонаты: MMS, EMS и IMS - менее 0,05 м.д. (LOD) (пример 19). Данные DSC и TGA (пример 20), спектры ЯМР в CD3CN, анализ методами 13 С CP/MAS NMR (пример 21) и PXRD (пример 22) полностью совпадают с соответствующими данными DSC и TGA, спектрами ЯМР в CD3CN, анализом методами 13 С CP/MAS NMR и PXRD для формы Н (S)-энантиомера, которые представлены в примере 1 а). Пример 8. Получение монокристалла (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамидметансульфоната формы Н кристаллизацией (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамидметансульфоната формы А из воды. К насыщенному раствору (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната(6 г) в воде (100 мл), поддерживаемому при комнатной температуре, добавляют зародышеобразующие кристаллы (1-2 мг, пример 3 а. Сразу после добавления зародышеобразующих кристаллов зародышеобразование (образование центров кристаллизации) происходит вполне быстро. Выбирают очень небольшой игольчатый кристалл(0,630,020,02 мм), прикрепляют на стекловолокно и используют в дифракционном эксперименте. Данные собирают с использованием излучения Мо K (=0,71069 ) на дифрактометре Bruker APEX II, оснащенном графитовым монохроматором и очень чувствительным двумерным детектором CCD (Bruker(2008). APEX-II (Version 2008.1-0), SAINT (Version 7.51A) и SADABS (Version 2007/4), Bruker AXS Inc.,Madison, Wisconsin, USA). Структуру разрешают с помощью программного обеспечения SIR97 (Altomare, A., Burla, M.C., Camalli, M., Cascarano G., Giacovazzo, С., Guagliardi, A., Moliterni, A.G.G., PolidoriSHELX97L (Sheldrick G.M., Acta Cryst., А 2008, 64, 112-122). Атомы водорода локализованы с помощью карт разностного синтеза Фурье и затем уточнены в фиксированных положениях, за исключением атомов водорода молекулы воды, для которой применяется только ограничение по длине связи. Уточнение проводят с использованием анизотропных параметров атомных смещений для всех неводородных ато- 22021389 мов. Фенильные кольца уточнены как жесткое тело (абсолютная конфигурация предполагается на основании безводной формы и не уточняется). Кристаллографические параметры, определенные в эксперименте SCXRD, представлены в табл. 4 (где кристаллографические параметры сравнивают с кристаллографическими параметрами кристаллической формы А) и в табл. 5-9 (где нумерация атомов находится в соответствии с нумерацией на фиг. 6). Молекулярная структура и кристаллическая упаковка ралфинамид-метансульфоната формы Н представлены на фиг. 6 и 7 соответственно. Оба графических изображения получены с помощью программного обеспечения Oak Ridge Thermal-Ellipsoid Plot Program (ORTEP)(L.J. Farrugia, J. Appl. Cryst., 1997, 30, 565). На фиг. 6 показаны эллипсоиды параметров атомных смещений (a.d.p.) с 50%-ным уровнем вероятности. Таблица 4 Рентгеновский кристаллографический анализ монокристалла для оценивания параметров кристалла метансульфоната ралфинамидаa, b и с определяют длину сторон элементарных ячеек;,иопределяют относительные углы сторон ячейки; Следующие табл. 5-9 относятся к фиг. 6. Таблица 5 Фракционные атомные координаты и эквивалентные изотропные параметры атомных смещений (U экв, 2) для формы Н Эквивалентный изотропный параметр U треть следа ортогонализованного тензора Uij. Таблица 6 Анизатропные параметры атомного смещения (Uij, 2) для формы Н Экспонента для анизотропных параметров атомного смещения принимает форму Получается в результате уточнения согласно модели жесткого тела для ароматических колец. Получается в результате уточнения согласно модели жесткого тела для ароматических колец Таблица 9 Фракционные атомные координаты Н-атомов и изотропные параметры атомного смещения (Uiso, 2) для формы Н Пример 9. Синтез (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид-метансульфоната формы А путем образования соли (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида с метансульфокислотой в ацетоне, сравнение с продуктом, полученным в соответствии со способом известного уровня техники и его очистка путем суспендирования в ацетоне. а) Синтез в ацетоне. Суспензию (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (127,6 кг, 422,03 моль; хроматографическая степень чистоты 99,4 (% по площади); энантиомерное соотношение S:R=99,8:0,2, пример 26 А из международной публикации WO 2009/074478; остаточные растворители: толуол 300 м.д. и метанол 50 м.д. (пример 18); алкилметансульфонаты - менее 0,05 м.д. (LOD=предел детектирования) (пример 19), полученного так, как в примере 2 а) WO 2009/074478, в ацетоне (800 кг) нагревают под азотом и при механическом перемешивании до температуры, при которой проводят кипячение с обратным холодильником, 583 С, и поддерживают в этих условиях до получения прозрачного раствора. Раствор фильтруют через фильтр GAF и фильтр промывают 20 кг ацетона. К теплому (583 С) раствору добавляют метансульфокислоту (40,8 кг, 424,5 моль) в течение не менее чем 30 мин, что приводит к немедленному осаждению твердого соединения. Капельную воронку промывают 30 кг ацетона и суспензию перемешивают в течение 60 мин при 563 С. Реакционную смесь охлаждают до 203 С в течение 2 ч и затем перемешивают при той же самой температуре в течение 2 ч. Нерастворимый продукт выделяют фильтрацией и промывают ацетоном (85 кг). Влажный продукт сушат при 402 С под вакуумом (приблизительно 20 мбар) в течение 16 ч с обеспечением (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид- 27021389DSC: эндотермический пик плавления при 243,10,2 С (Н=132,14,5 Дж/г) (пример 20).TGA: продукт не теряет массу вплоть до 240 С. Потеря массы выше этой температуры происходит в результате разложения вещества (пример 20). ЯМР высокого разрешения (пример 21): спектр 1 Н ЯМР в CD3CN для метансульфоната (S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида формы А полностью согласуется с заданной структурой и,как обнаружено, идентичен спектру структуры формы Н (пример 1 а). В следующей табл. 10 приведены ЯМР-данные для всех протонов.CP/MAS NMR в твердом теле (пример 21). Спектр CP/MAS NMR в твердом теле для метансульфоната (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида формы А показывает два широких сигнала, первый - между 1,00 и 1,50 м.д. и второй сигнал - между 2,00 и 6,00 м.д. Спектр 13 С CP/MAS NMR для метансульфоната (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида формы А показывает резонансные линии с химическими сдвигами (м.д.), описанными здесь ниже в табл. 11. Полный спектр представлен на фиг. 9. Таблица 11 13 С CP/MAS NMR, химические сдвиги (м.д.) Анализ PXRD. В следующей табл. 12 представлена наблюдаемая дифрактограмма, полученная методом PXRD, для безводной полиморфной модификации формы А (порошок), записанная на приборе и в условиях, описанных в примере 22. Экспериментальные результаты согласуются с кристаллографическими параметрами, вычисленными с использованием данных анализа методом SCXRD. Таблица 12 Наблюдаемые (набл.) и вычисленные (выч.) параметры дифрактограммы,полученной методом PXRD, для формы А
МПК / Метки
МПК: C07C 237/06, A61K 31/165, C07C 309/04, C07C 231/24
Метки: способ, получения, метансульфонатных, солей, r-энантиомеров, ралфинамида
Код ссылки
<a href="https://eas.patents.su/30-21389-sposob-polucheniya-metansulfonatnyh-solejj-ralfinamida-ili-ih-r-enantiomerov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения метансульфонатных солей ралфинамида или их r-энантиомеров</a>
Предыдущий патент: Аппликатор, предназначенный для прикрепления к клапанному соединению бутылки, оснащенной адаптером пистолета-аппликатора
Следующий патент: Состав для обработки призабойных зон и защиты нефтепромыслового оборудования от сероводородной и углекислотной коррозии
Случайный патент: Способ получения &alpha, &beta - ненасыщенной алкеноатной смолы