Способ получения соединений, применимых в качестве ингибиторов натрийзависимого переносчика глюкозы (нзпг)
Номер патента: 21373
Опубликовано: 30.06.2015
Авторы: Йада Мицухиро, Йосинага Масахико, Телеха Кристофер, Хацуда Масанори, Филлье Вальтер Фердинанд Мария, Брукс Руди Лоран Мария, Нисте Патрик Хуберт Й.
Формула / Реферат
1. Способ получения соединений формулы (I)
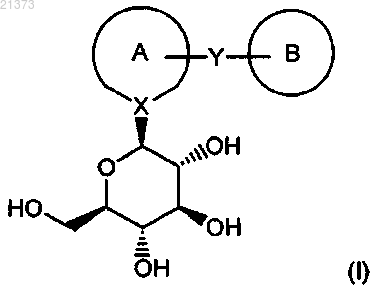
где кольцо А представляет собой
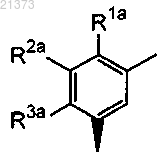
где R1a представляет собой атом галогена, С1-6алкил или С1-6алкокси;
R2a и R3a являются водородом;
кольцо В представляет собой
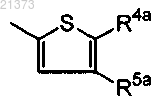
где R4a представляет собой фенильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из атома галогена, цианогруппы, С1-6алкила, галоген-С1-6алкила, C1-6алкокси, галоген-С1-6алкокси, моно- или ди-C1-6алкиламиногруппы, карбамоильной группы и моно- или ди-С1-6алкилкарбамоильной группы; или 5- или 6-членную гетероциклическую группу, содержащую 1 или 2 гетероатома, независимо выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем указанная гетероциклическая группа необязательно замещена атомом галогена, цианогруппой, С1-6алкилом, C1-6алкокси, карбамоильной группой и моно- или ди-С1-6алкилкарбамоильной группой;
R5a является водородом;
X представляет собой атом углерода;
Y представляет собой группу -(СН2)-;
при условии, что в кольце А X участвует в образовании ненасыщенной связи;
или их фармацевтически приемлемых солей или их сольватов; включающий
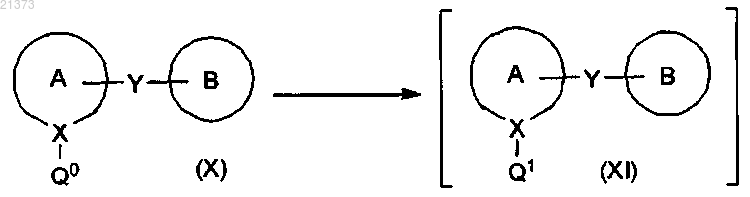
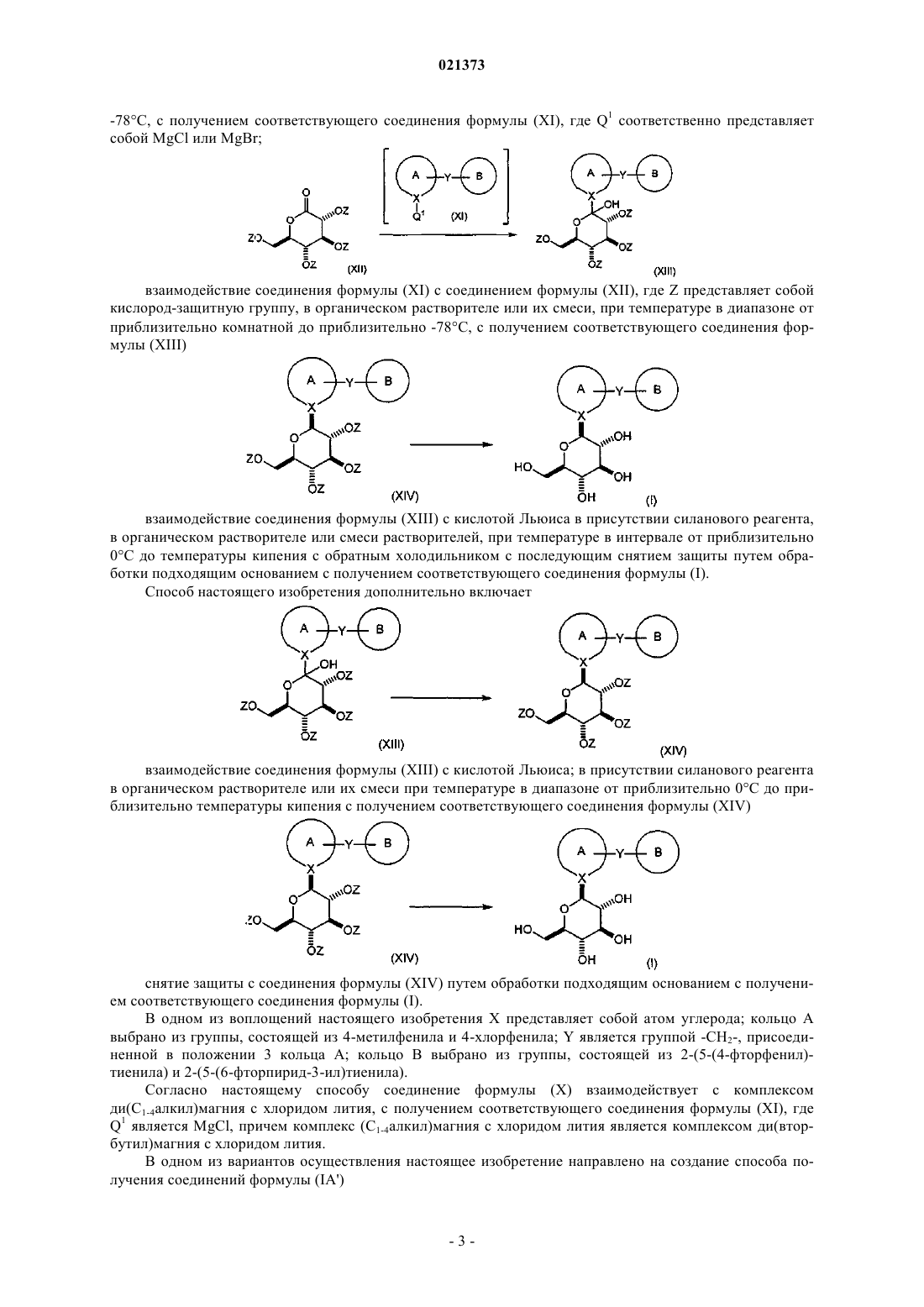
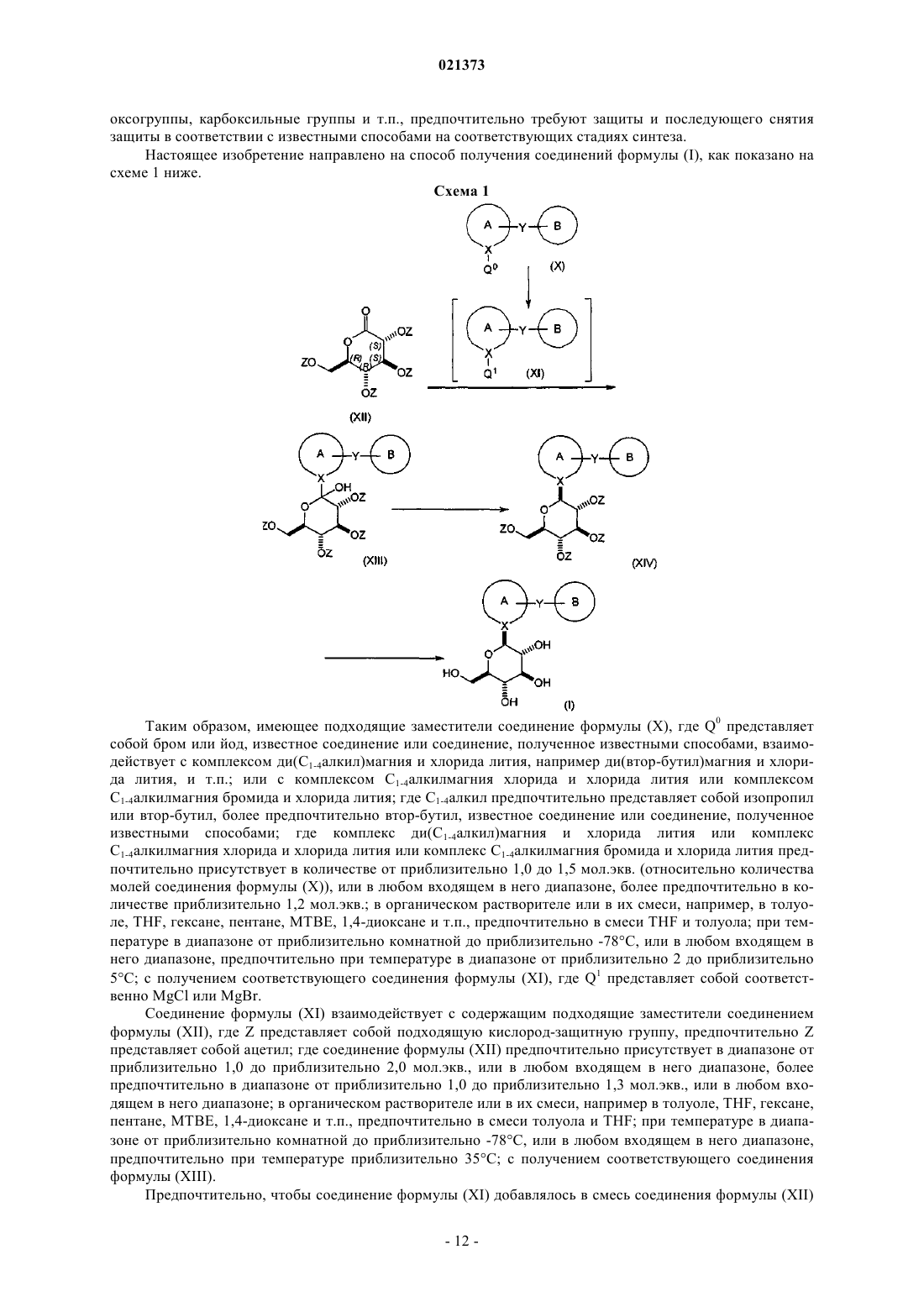
взаимодействие соединения формулы (X), где Q0 представляет собой бром или йод, с комплексом ди(С1-4алкил)магния с хлоридом лития или с комплексом С1-4алкилмагния хлорида с хлоридом лития или с комплексом С1-4алкилмагния бромида с хлоридом лития; в органическом растворителе или смеси органических растворителей; при температуре в диапазоне от приблизительно комнатной до приблизительно -78°С; с получением соответствующего соединения формулы (XI), где Q1 соответственно представляет собой MgCl или MgBr;
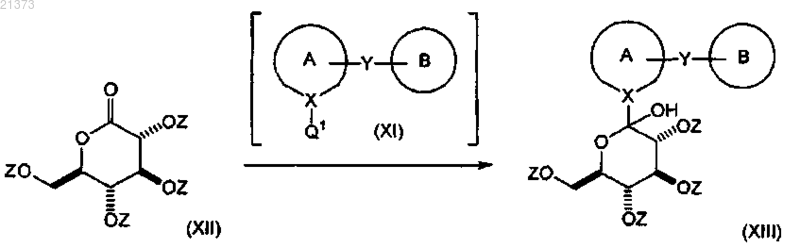
взаимодействие соединения формулы (XI) с соединением формулы (XII), где Z представляет собой кислород-защитную группу, выбранную из группы, состоящей из ацетила или пивалоила; в органическом растворителе или их смеси; при температуре в диапазоне от приблизительно комнатной до приблизительно -78°С; с получением соответствующего соединения формулы (XIII);
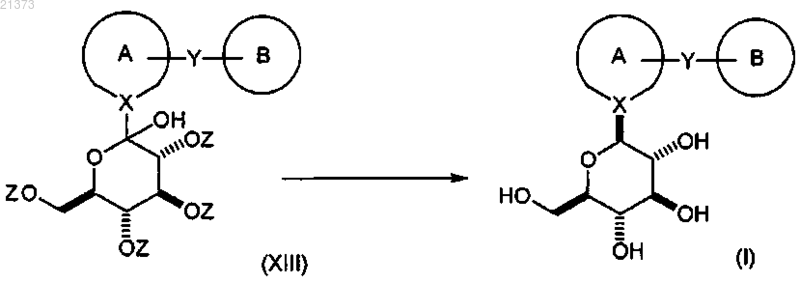
взаимодействие соединения формулы (XIII) с кислотой Льюиса в присутствии силанового реагента; в органическом растворителе или смеси растворителей; при температуре в интервале от приблизительно 0°С до температуры кипения с обратным холодильником с последующим снятием защиты путем обработки подходящим основанием с получением соответствующего соединения формулы (I).
2. Способ по п.1, согласно которому
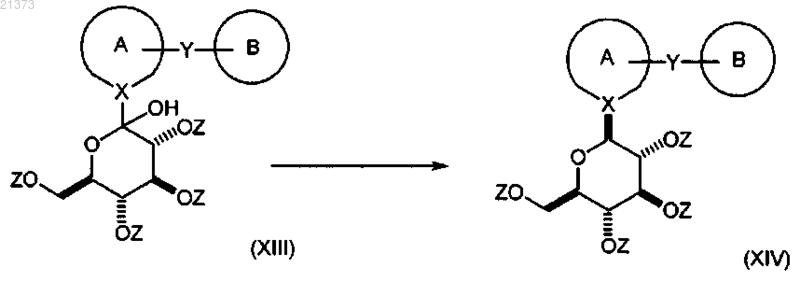
соединение формулы (XIII) взаимодействует с кислотой Льюиса; в присутствии силанового реагента; в органическом растворителе или их смеси; при температуре в диапазоне от приблизительно 0°С до приблизительно температуры кипения; с образованием соответствующего соединения формулы (XIV);
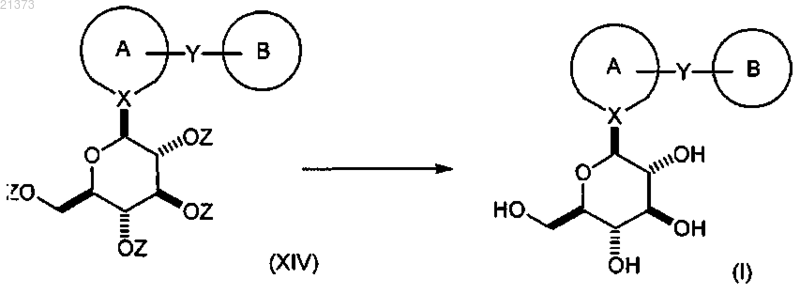
с последующим снятием защиты с соединения формулы (XIV) путем обработки подходящим основанием с получением соответствующего соединения формулы (I).
3. Способ по п.1, в котором
X представляет собой атом углерода;
кольцо А выбрано из группы, состоящей из 4-метилфенила и 4-хлорфенила;
Y является группой -СН2-, присоединенной в положении 3 кольца А;
кольцо В выбрано из группы, состоящей из 2-(5-(4-фторфенил)тиенила) и 2-(5-(6-фторпирид-3-ил)тиенила).
4. Способ по п.1, в котором соединение формулы (X) взаимодействует с комплексом ди(С1-4алкил)магния с хлоридом лития, с получением соответствующего соединения формулы (XI), где Q1 является MgCl.
5. Способ по п.4, в котором комплекс (С1-4алкил)магния с хлоридом лития является комплексом ди(втор-бутил)магния с хлоридом лития.
6. Способ получения соединения формулы (I-S)
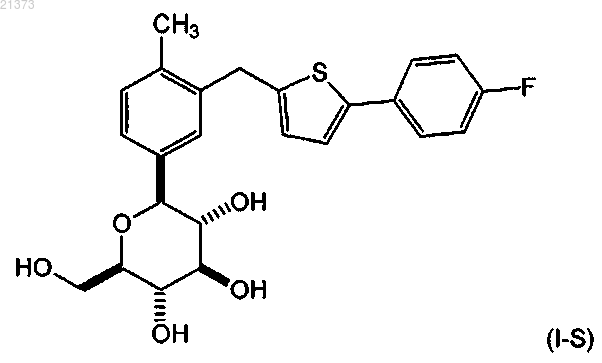
или его сольвата, включающий
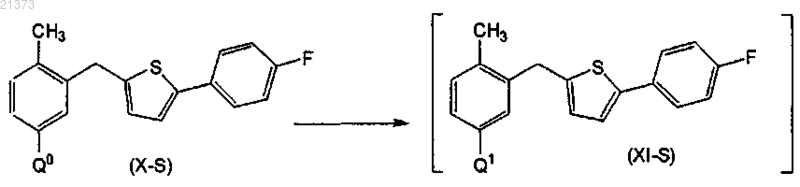
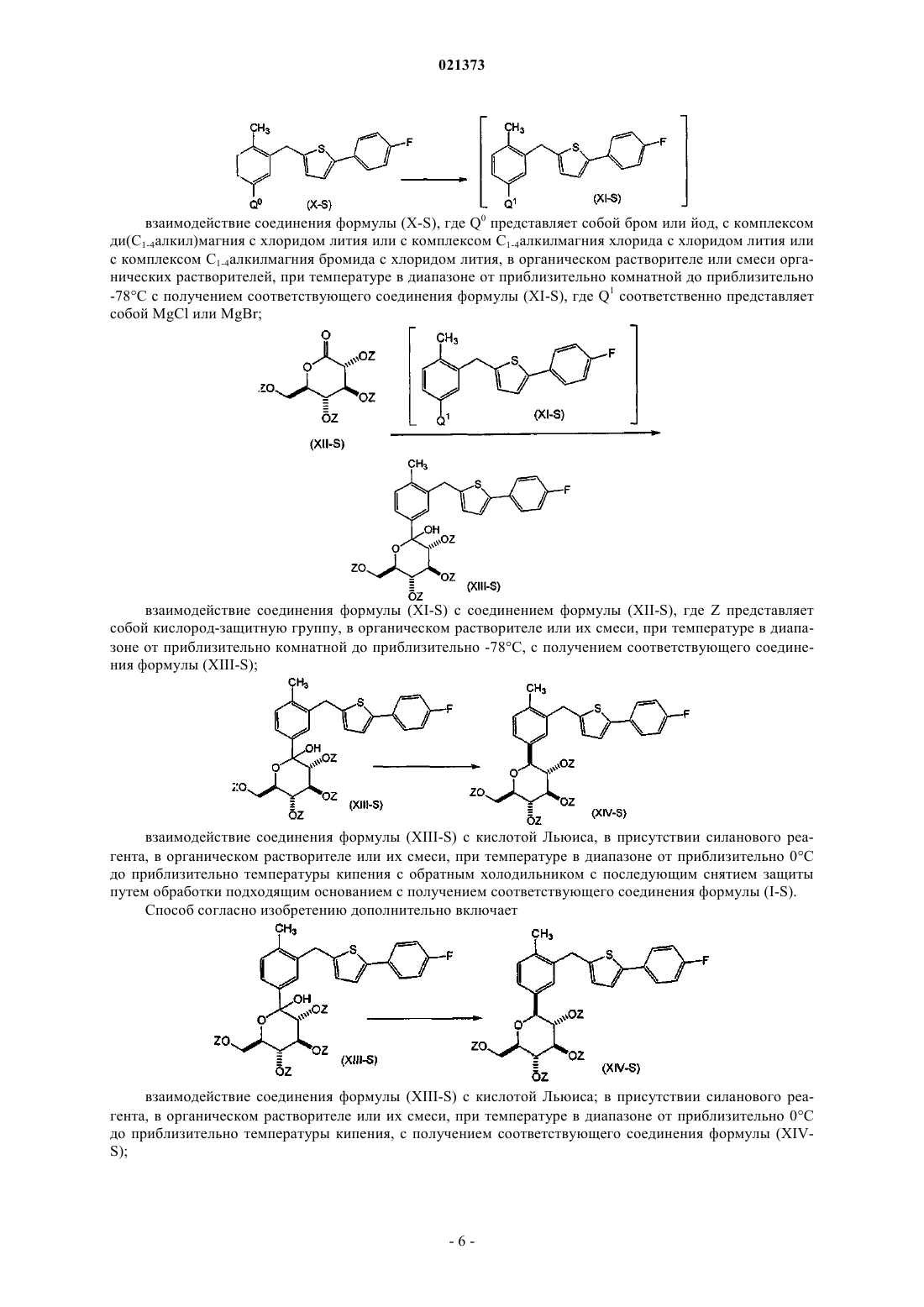
взаимодействие соединения формулы (X-S), где Q0 представляет собой бром или йод, с комплексом ди(С1-4алкил)магния с хлоридом лития, или с комплексом С1-4алкилмагния хлорида с хлоридом лития, или с комплексом С1-4алкилмагния бромида с хлоридом лития; в органическом растворителе или смеси органических растворителей; при температуре в диапазоне от приблизительно комнатной до приблизительно -78°С; с получением соответствующего соединения формулы (XI-S), где Q1 соответственно представляет собой MgCl или MgBr;
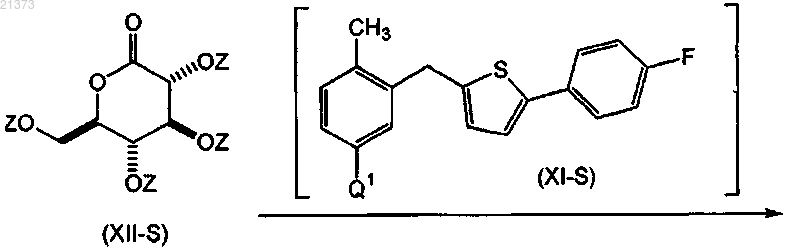
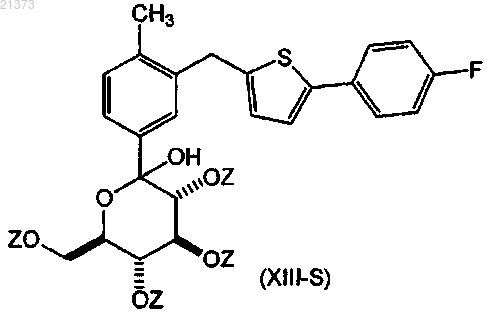
взаимодействие соединения формулы (XI-S) с соединением формулы (XII-S), где Z представляет собой кислород-защитную группу, выбранную из группы, состоящей из ацетила или пивалоила; в органическом растворителе или их смеси; при температуре в диапазоне от приблизительно комнатной до приблизительно -78°С; с получением соответствующего соединения формулы (XIII-S);
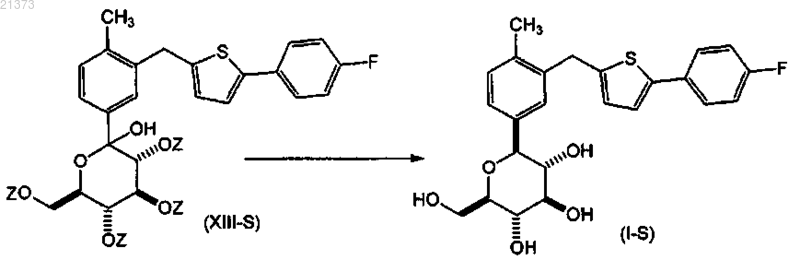
взаимодействие соединения формулы (XIII-S) с кислотой Льюиса в присутствии силанового реагента; в органическом растворителе или смеси растворителей; при температуре в интервале от приблизительно 0°С до температуры кипения с обратным холодильником с последующим снятием защиты путем обработки подходящим основанием с получением соответствующего соединения формулы (I-S).
7. Способ по п.6, согласно которому

соединение формулы (XIII-S) взаимодействует с кислотой Льюиса; в присутствии силанового реагента; в органическом растворителе или их смеси; при температуре в диапазоне от приблизительно 0°С до приблизительно температуры кипения; с образованием соответствующего соединения формулы (XIV-S);
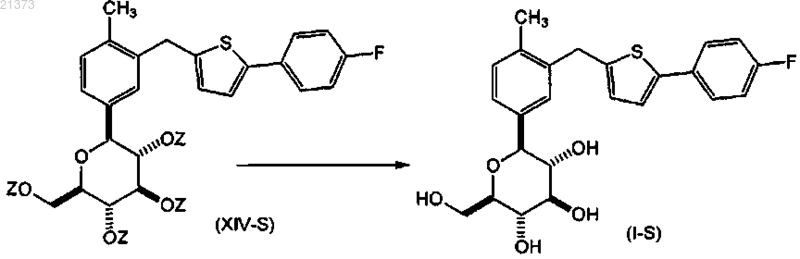
с последующим снятием защитных групп с соединения формулы (XIV-S) путем обработки подходящим основанием с получением соответствующего соединения формулы (I-S).
8. Способ по п.6, в котором комплекс ди(С1-4алкил)магния с хлоридом лития или комплекс С1-4алкилмагний хлорида с хлоридом лития или комплекс С1-4алкилмагний бромида с хлоридом лития присутствует в количестве от приблизительно 1,0 до приблизительно 1,5 мол.экв.
9. Способ по п.6, в котором соединение формулы (X-S) взаимодействует с комплексом ди(С1-4алкил)магния с хлоридом лития с получением соответствующего соединения формулы (XI-S), где Q1 представляет собой MgCl.
10. Способ по п.9, в котором комплекс ди(С1-4алкил)магния с хлоридом лития является комплексом ди(втор-бутил)магния с хлоридом лития.
11. Способ по п.9 или 10, в котором комплекс ди(втор-бутил)магния с хлоридом лития присутствует в количестве от приблизительно 1,0 до приблизительно 1,5 мол.экв.
12. Способ по п.6, в котором Z представляет собой ацетил.
13. Способ по п.6, в котором соединение формулы (XII-S) присутствует в количестве от приблизительно 1,0 до приблизительно 2,0 мол.экв.
14. Способ по п.6, в котором соединение формулы (XI-S) взаимодействует с соединением формулы (XII-S), причем соединение формулы (XI-S) добавляют к раствору соединения формулы (XII-S) в органическом растворителе или смеси растворителей.
15. Способ по п.7, в котором кислота Льюиса выбрана из группы, состоящей из BF3×OEt2, BF3×THF, хлорида алюминия, хлорида цинка и хлорида железа; и где силановый реагент выбран из группы, состоящей из триэтилсилана, триизопропилсилана и тетраметилдисилоксана.
16. Способ по п.15, в котором кислота Льюиса является хлоридом алюминия, при этом хлорид алюминия присутствует в количестве от приблизительно 0,5 до приблизительно 2,5 мол.экв.
17. Способ по п.15, в котором силановый реагент является тетраметилдисилоксаном, при этом тетраметилдисилоксан присутствует в количестве от приблизительно 1,0 до приблизительно 2,5 мол.экв.
18. Способ по п.15, в котором кислота Льюиса является хлоридом алюминия, при этом силановый реагент является тетраметилдисилоксаном, а мольное соотношение хлорида алюминия и тетраметилдисилоксана составляет приблизительно 1:1,25.
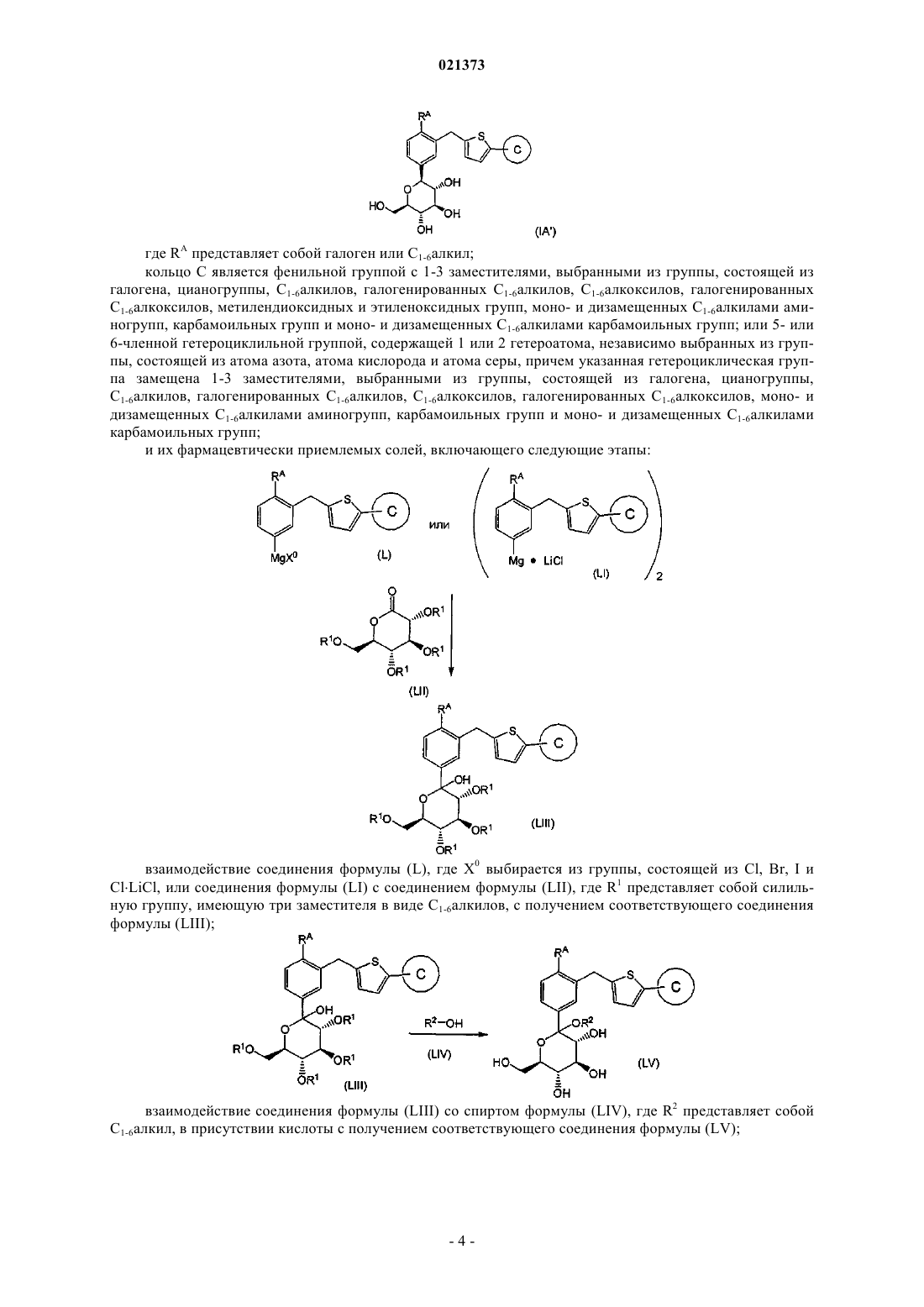
19. Способ получения соединения формулы (IA')

где RA является галогеном или С1-6алкилом;
кольцо С является фенильной группой с 1-3 заместителями, выбранными из группы, состоящей из галогена, цианогруппы, С1-6алкилов, галогенированных С1-6алкилов, С1-6алкоксилов, галогенированных С1-6алкоксилов, метилендиоксидных и этиленоксидных групп, моно- и дизамещенных С1-6алкилами аминогрупп, карбамоильных групп и моно- и дизамещенных C1-6алкилами карбамоильных групп; или 5- или 6-членной гетероциклильной группой, содержащей 1 или 2 гетероатома, независимо выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем указанная гетероциклическая группа замещена 1-3 заместителями, выбранными из группы, состоящей из галогена, цианогруппы, C1-6алкилов, галогенированных С1-6алкилов, С1-6алкоксилов, галогенированных С1-6алкоксилов, моно- и дизамещенных С1-6алкилами аминогрупп, карбамоильных групп и моно- и дизамещенных C1-6алкилами карбамоильных групп;
или его фармацевтически приемлемой соли, включающий следующие стадии:
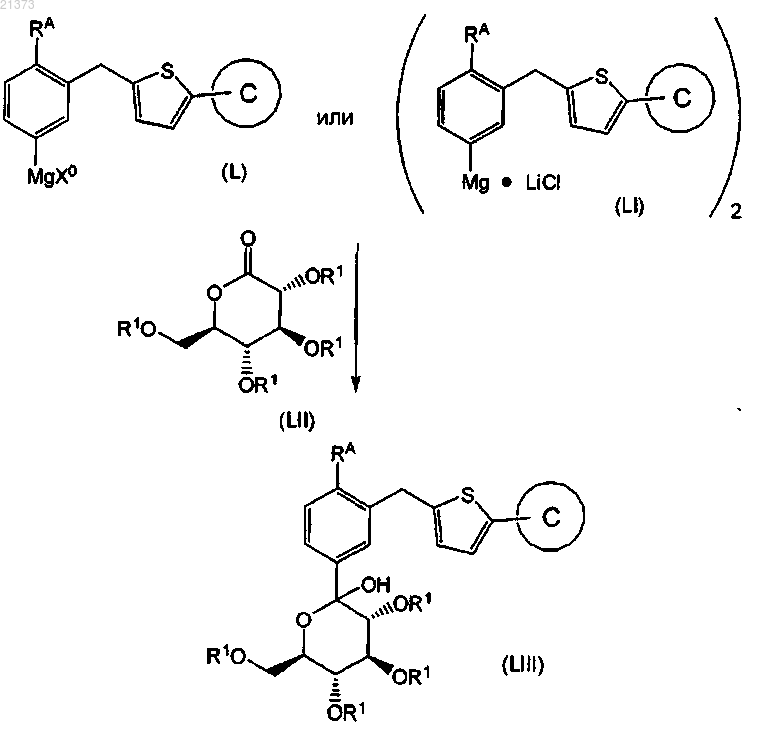
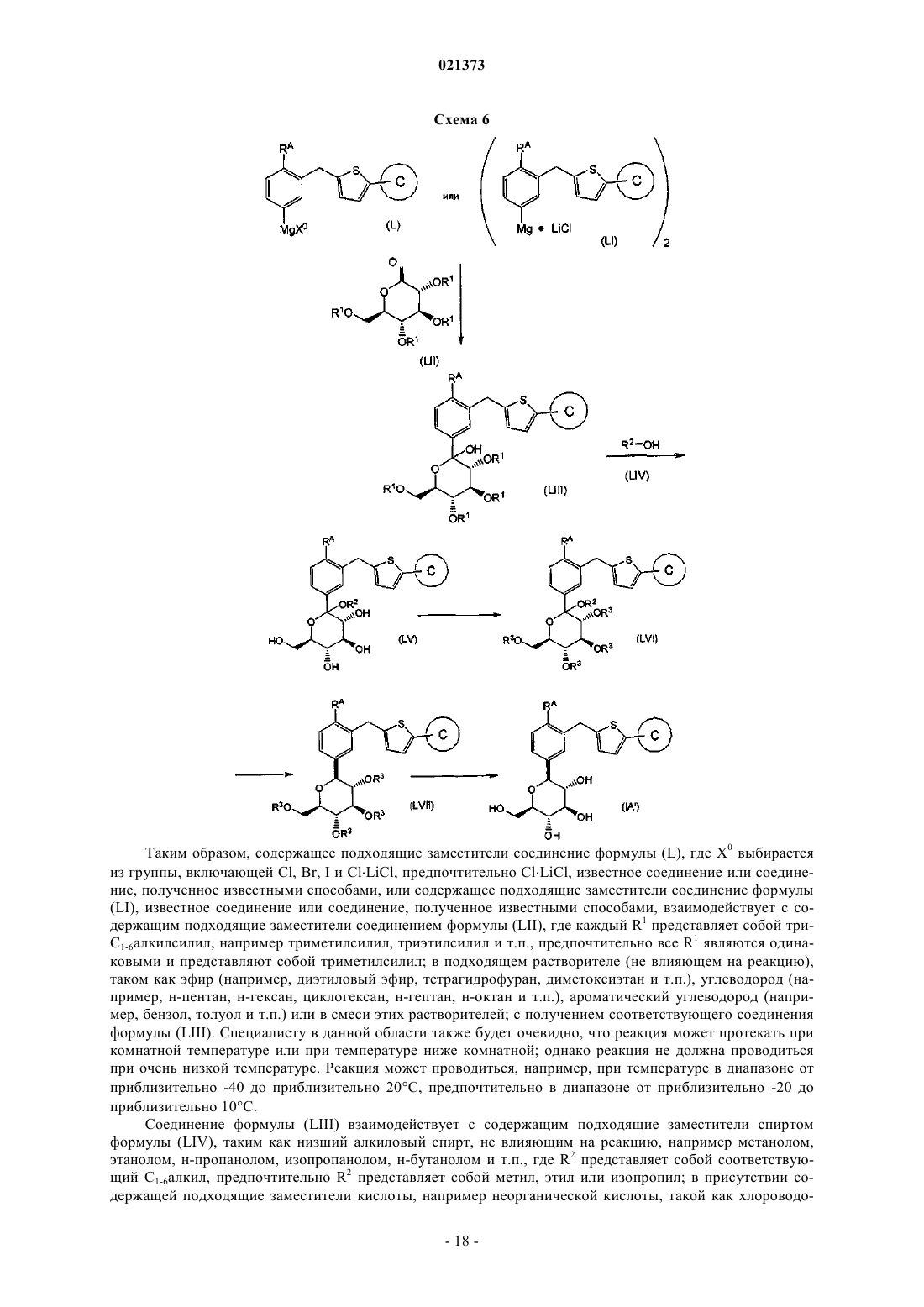
взаимодействие соединения формулы (L), где Х0 выбран из группы, состоящей из Cl, Br, I и Cl×LiCl, или соединения формулы (LI) с соединением формулы (LII), где R1 является силильной группой, имеющей три заместителя в виде С1-6алкилов, с образованием соответствующего соединения формулы (LIII);
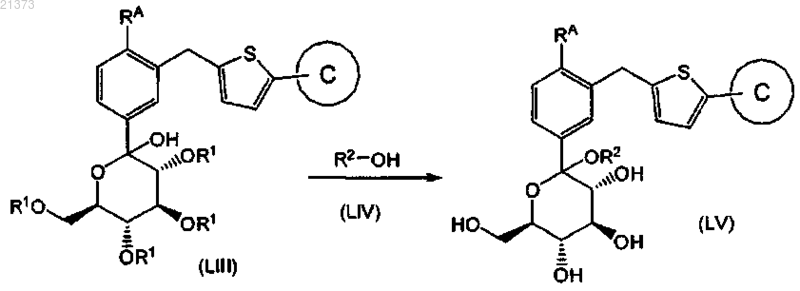
взаимодействие соединения формулы (LIII) со спиртом формулы (LIV), где R2 является С1-6алкилом, в присутствии кислоты, с образованием соответствующего соединения формулы (LV);

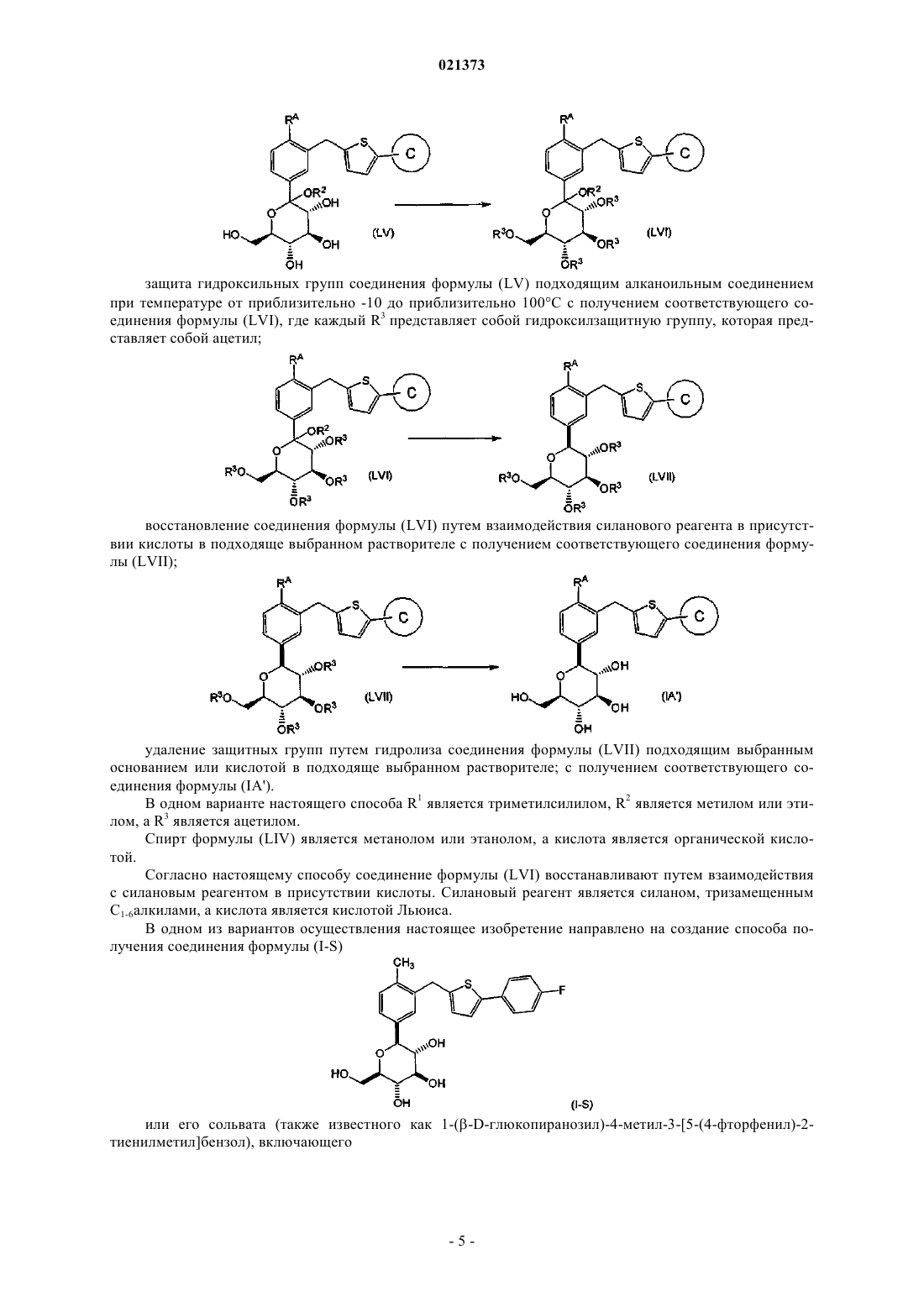
защита гидроксильных групп соединения формулы (LV) подходящим алканоильным соединением при температуре в диапазоне от приблизительно -10 до приблизительно 100°С с образованием соответствующего соединения формулы (LVI), где каждый R3 является защитной группой кислорода, которая представляет собой ацетил;
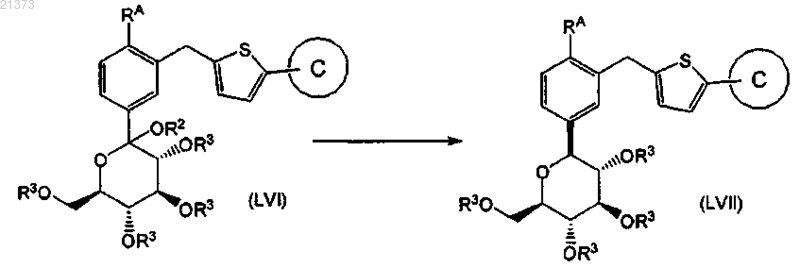
восстановление соединения формулы (LVI) путем взаимодействия силанового реагента в присутствии кислоты в подходяще выбранном растворителе с получением соответствующего соединения формулы (LVII);
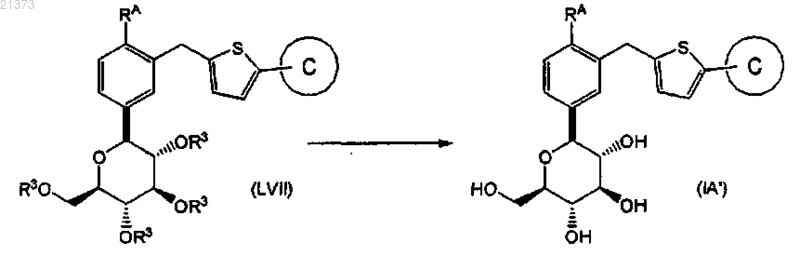
удаление защитных групп кислорода соединения формулы (LVII) путем взаимодействия с подходяще выбранным основанием или кислотой в подходяще выбранном растворителе с получением соответствующего соединения формулы (IA').
20. Способ по п.19, в котором R1 является триметилсилилом, R2 является метилом или этилом, a R3 является ацетилом.
21. Способ по п.19, в котором спирт формулы (LIV) является метанолом или этанолом, а кислота является органической кислотой.
22. Способ по п.19, в котором соединение формулы (LVI) восстанавливают путем взаимодействия с силановым реагентом в присутствии кислоты.
23. Способ по п.19, в котором силановый реагент является силаном, тризамещенным С1-6алкилами, а кислота является кислотой Льюиса.
Текст
СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ, ПРИМЕНИМЫХ В КАЧЕСТВЕ ИНГИБИТОРОВ НАТРИЙЗАВИСИМОГО ПЕРЕНОСЧИКА ГЛЮКОЗЫ (НЗПГ) Изобретение направлено на новый способ получения соединений, оказывающих ингибирующее действие на натрийзависимых переносчиков глюкозы (НЗПГ), присутствующих в кишечнике или почках Филлье Вальтер Фердинанд Мария,Брукс Руди Лоран Мария, Нисте Патрик Хуберт Й. (BE), Хацуда Масанори, Йосинага Масахико, Йада Мицухиро (JP), Телеха Кристофер(BE); МИЦУБИСИ ТАНАБЕ ФАРМА КОРПОРЕЙШН (JP) Перекрестные ссылки на смежные изобретения Заявка на настоящий патент истребует приоритет, заявленный в предварительной заявке на патент США 61/106231, поданной 17 октября 2008 г., и в предварительной заявке на патент США 61/106260, поданной 17 октября 2008 г., обе из которых полностью включены в настоящий документ путем ссылки. Область применения изобретения Настоящее изобретение направлено на новый способ получения соединений, оказывающих ингибирующее действие на натрийзависимых переносчиков глюкозы (НЗПГ), присутствующих в кишечнике или почках. Предпосылки создания изобретения Диетотерапия и лечебная физкультура играют важную роль в лечении сахарного диабета. Если данные виды терапии не позволяют в достаточной мере контролировать состояние пациента, для лечения диабета дополнительно применяется инсулин или вводимый перорально противодиабетический препарат. В настоящее время в качестве противодиабетических препаратов применяются бигуанидные соединения, соединения сульфонил-мочевины, вещества, снижающие резистентность к инсулину, и ингибиторы -глюкозидазы. Однако данные противодиабетические препараты имеют ряд побочных эффектов. Например, бигуанидные соединения вызывают лактоцидоз, соединения сульфонил-мочевины вызывают значительную гипогликемию, препараты, снижающие резистентность к инсулину, приводят к отекам и сердечной недостаточности, а ингибиторы -глюкозидазы вызывают вздутие живота и диарею. Учитывая данные обстоятельства, желательно разработать новые препараты для лечения сахарного диабета, не имеющие таких побочных эффектов. Недавно были получены данные о том, что с началом и прогрессивным развитием сахарного диабета связана гипергликемия (так называемая теория глюкозной токсичности). А именно, хроническая гипергликемия приводит к снижению секреции инсулина, далее, к снижению чувствительности к инсулину и, в итоге, к увеличению концентрации глюкозы в крови, так что сахарный диабет усугубляется [Unger,R.H., et al., Hyperglycemia as an inducer as well as a consequence of impaired islet cell function and insulinal., Glucose Toxicity, Diabetes Care, 1990, vol. 13, no. 6, p. 610-630]. Следовательно, при лечении гипергликемии указанный цикл усугубления заболевания прерывается, что делает возможным профилактику или лечение сахарного диабета. Одним из возможных способов лечения гипергликемии является экскретирование избыточной глюкозы непосредственно в мочу с нормализацией концентрации глюкозы в крови. Например, при ингибировании натрийзависимого переносчика глюкозы, присутствующего в проксимальных извитых почечных канальцах, блокируется обратное поглощение глюкозы в почках, что способствует экскретированию глюкозы в мочу и снижению уровня глюкозы в крови. Доказано, что в моделях развития диабета у животных постоянное подкожное введение флоризина, обладающего ингибиторной активностью в отношении НЗПГ, приводит к нормализации гипергликемии, и глюкоза в крови животного может поддерживаться на нормальном уровне в течение длительного времени, что приводит к улучшению секреции инсулина и резистентности к инсулину Кроме того, при длительном лечении диабета на экспериментальных моделях у животных при помощи ингибиторов НЗПГ у животных улучшается секреторный инсулиновый ответ, а также чувствительность к инсулину, в отсутствие неблагоприятного воздействия на почки и баланс электролитов в крови, в результате чего предотвращается возникновение и развитие диабетической нефропатии На основании приведенных выше данных можно предполагать, что ингибиторы НЗПГ могут улучшать секрецию инсулина и резистентность к инсулину, снижая уровень глюкозы в крови, и таким образом предотвращать возникновение и прогрессирование сахарного диабета и его осложнений.Nomura, S., et al. в заявке на патент США 2005/0233988, опубликованной 20 октября 2005 г., описывают ингибиторы НЗПГ и способы их получения. Краткое описание изобретения Настоящее изобретение направлено на создание способа получения соединений формулы (I) где кольцо А и кольцо В являются одними из следующих: кольцо А представляет собой где R1a представляет собой атом галогена, С 1-6 алкил или C1-6 алкокси; где R4a представляет собой фенильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из атома галогена, цианогруппы, С 1-6 алкила, галоген-С 1-6 алкила, C1-6 алкокси,галоген-С 1-6 алкокси, моно- или ди-C1-6 алкиламиногруппы, карбамоильной группы и моно- или ди-С 1-6 алкилкарбамоильной группы; или 5- или 6-членную гетероциклическую группу, содержащую 1 или 2 гетероатома, независимо выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем указанная гетероциклическая группа необязательно замещена атомом галогена, цианогруппой, С 1-6 алкилом, С 1-6 алкокси, карбамоильной группой и моно- или ди-С 1-6 алкилкарбамоильной группой;X представляет собой атом углерода;Y представляет собой группу -(СН 2)n-; где n равно 1 или 2; при условии, что в кольце А X участвует в образовании ненасыщенной связи; или их фармацевтически приемлемых солей или их сольватов; включающего взаимодействие соединения формулы (X), где Q0 представляет собой бром или йод, с комплексом ди(С 1-4 алкил)магния с хлоридом лития или с комплексом С 1-4 алкилмагния хлорида с хлоридом лития или с комплексом С 1-4 алкилмагния бромида с хлоридом лития, в органическом растворителе или смеси органических растворителей, при температуре в диапазоне от приблизительно комнатной до приблизительно-78 С, с получением соответствующего соединения формулы (XI), где Q1 соответственно представляет собой MgCl или MgBr; взаимодействие соединения формулы (XI) с соединением формулы (XII), где Z представляет собой кислород-защитную группу, в органическом растворителе или их смеси, при температуре в диапазоне от приблизительно комнатной до приблизительно -78 С, с получением соответствующего соединения формулы (XIII) взаимодействие соединения формулы (XIII) с кислотой Льюиса в присутствии силанового реагента,в органическом растворителе или смеси растворителей, при температуре в интервале от приблизительно 0 С до температуры кипения с обратным холодильником с последующим снятием защиты путем обработки подходящим основанием с получением соответствующего соединения формулы (I). Способ настоящего изобретения дополнительно включает взаимодействие соединения формулы (XIII) с кислотой Льюиса; в присутствии силанового реагента в органическом растворителе или их смеси при температуре в диапазоне от приблизительно 0 С до приблизительно температуры кипения с получением соответствующего соединения формулы (XIV) снятие защиты с соединения формулы (XIV) путем обработки подходящим основанием с получением соответствующего соединения формулы (I). В одном из воплощений настоящего изобретения X представляет собой атом углерода; кольцо А выбрано из группы, состоящей из 4-метилфенила и 4-хлорфенила; Y является группой -СН 2-, присоединенной в положении 3 кольца А; кольцо В выбрано из группы, состоящей из 2-(5-(4-фторфенил)тиенила) и 2-(5-(6-фторпирид-3-ил)тиенила). Согласно настоящему способу соединение формулы (X) взаимодействует с комплексом ди(С 1-4 алкил)магния с хлоридом лития, с получением соответствующего соединения формулы (XI), гдеQ1 является MgCl, причем комплекс (С 1-4 алкил)магния с хлоридом лития является комплексом ди(вторбутил)магния с хлоридом лития. В одном из вариантов осуществления настоящее изобретение направлено на создание способа получения соединений формулы (IA') где RA представляет собой галоген или С 1-6 алкил; кольцо С является фенильной группой с 1-3 заместителями, выбранными из группы, состоящей из галогена, цианогруппы, C1-6 алкилов, галогенированных С 1-6 алкилов, С 1-6 алкоксилов, галогенированных С 1-6 алкоксилов, метилендиоксидных и этиленоксидных групп, моно- и дизамещенных С 1-6 алкилами аминогрупп, карбамоильных групп и моно- и дизамещенных С 1-6 алкилами карбамоильных групп; или 5- или 6-членной гетероциклильной группой, содержащей 1 или 2 гетероатома, независимо выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем указанная гетероциклическая группа замещена 1-3 заместителями, выбранными из группы, состоящей из галогена, цианогруппы,С 1-6 алкилов, галогенированных С 1-6 алкилов, С 1-6 алкоксилов, галогенированных С 1-6 алкоксилов, моно- и дизамещенных С 1-6 алкилами аминогрупп, карбамоильных групп и моно- и дизамещенных С 1-6 алкилами карбамоильных групп; и их фармацевтически приемлемых солей, включающего следующие этапы: взаимодействие соединения формулы (L), где Х 0 выбирается из группы, состоящей из Cl, Br, I иClLiCl, или соединения формулы (LI) с соединением формулы (LII), где R1 представляет собой силильную группу, имеющую три заместителя в виде С 1-6 алкилов, с получением соответствующего соединения формулы (LIII); взаимодействие соединения формулы (LIII) со спиртом формулы (LIV), где R2 представляет собой С 1-6 алкил, в присутствии кислоты с получением соответствующего соединения формулы (LV); защита гидроксильных групп соединения формулы (LV) подходящим алканоильным соединением при температуре от приблизительно -10 до приблизительно 100 С с получением соответствующего соединения формулы (LVI), где каждый R3 представляет собой гидроксилзащитную группу, которая представляет собой ацетил; восстановление соединения формулы (LVI) путем взаимодействия силанового реагента в присутствии кислоты в подходяще выбранном растворителе с получением соответствующего соединения формулы (LVII); удаление защитных групп путем гидролиза соединения формулы (LVII) подходящим выбранным основанием или кислотой в подходяще выбранном растворителе; с получением соответствующего соединения формулы (IA'). В одном варианте настоящего способа R1 является триметилсилилом, R2 является метилом или этилом, a R3 является ацетилом. Спирт формулы (LIV) является метанолом или этанолом, а кислота является органической кислотой. Согласно настоящему способу соединение формулы (LVI) восстанавливают путем взаимодействия с силановым реагентом в присутствии кислоты. Силановый реагент является силаном, тризамещенным С 1-6 алкилами, а кислота является кислотой Льюиса. В одном из вариантов осуществления настоящее изобретение направлено на создание способа получения соединения формулы (I-S) или его сольвата (также известного как 1-(-D-глюкопиранозил)-4-метил-3-[5-(4-фторфенил)-2 тиенилметил]бензол), включающего взаимодействие соединения формулы (X-S), где Q0 представляет собой бром или йод, с комплексом ди(С 1-4 алкил)магния с хлоридом лития или с комплексом С 1-4 алкилмагния хлорида с хлоридом лития или с комплексом С 1-4 алкилмагния бромида с хлоридом лития, в органическом растворителе или смеси органических растворителей, при температуре в диапазоне от приблизительно комнатной до приблизительно-78 С с получением соответствующего соединения формулы (XI-S), где Q1 соответственно представляет собой MgCl или MgBr; взаимодействие соединения формулы (XI-S) с соединением формулы (XII-S), где Z представляет собой кислород-защитную группу, в органическом растворителе или их смеси, при температуре в диапазоне от приблизительно комнатной до приблизительно -78 С, с получением соответствующего соединения формулы (XIII-S); взаимодействие соединения формулы (XIII-S) с кислотой Льюиса, в присутствии силанового реагента, в органическом растворителе или их смеси, при температуре в диапазоне от приблизительно 0 С до приблизительно температуры кипения с обратным холодильником с последующим снятием защиты путем обработки подходящим основанием с получением соответствующего соединения формулы (I-S). Способ согласно изобретению дополнительно включает взаимодействие соединения формулы (XIII-S) с кислотой Льюиса; в присутствии силанового реагента, в органическом растворителе или их смеси, при температуре в диапазоне от приблизительно 0 С до приблизительно температуры кипения, с получением соответствующего соединения формулы (XIVS); снятие защитных групп с соединения формулы (XIV-S) путем обработки подходящим основанием с образованием соответствующего соединения формулы (I-S). В настоящем способе комплекс ди(С 1-4 алкил)магния с хлоридом лития или комплекс С 1-4 алкилмагний хлорида с хлоридом лития или комплекс С 1-4 алкилмагний бромида с хлоридом лития присутствует в количестве от приблизительно 1,0 до приблизительно 1,5 мол.экв. В одном из вариантов изобретения соединение формулы (X-S) взаимодействует с комплексом ди(С 1-4 алкил)магния с хлоридом лития, с получением соответствующего соединения формулы (XI-S), где Q1 представляет собой MgCl,причем комплекс ди(С 1-4 алкил)магния с хлоридом лития является комплексом ди(втор-бутил)магния с хлоридом лития. Согласно настоящему способу комплекс ди(втор-бутил)магния с хлоридом лития присутствует в количестве от приблизительно 1,0 до приблизительно 1,5 мол.экв. В одном из вариантов изобретения Z представляет собой ацетил. Соединение формулы (XII-S) присутствует в количестве от приблизительно 1,0 до приблизительно 2,0 мол.экв. В настоящем способе соединение формулы (XI-S) взаимодействует с соединением формулы (XII-S), причем соединение формулы (XI-S) добавляют к раствору соединения формулы (XII-S) в органическом растворителе или смеси растворителей. Кислота Льюиса выбрана из группы, состоящей из BF3OEt2, BF3THF, хлорида алюминия, хлорида цинка и хлорида железа; и где силановый реагент выбран из группы, состоящей из триэтилсилана, триизопропилсилана и тетраметилдисилоксана. Предпочтительно кислота Льюиса является хлоридом алюминия, при этом хлорид алюминия присутствует в количестве от приблизительно 0,5 до приблизительно 2,5 мол.экв. В одном из вариантов способа силановый реагент является тетраметилдисилоксаном, при этом тетраметилдисилоксан присутствует в количестве от приблизительно 1,0 до приблизительно 2,5 мол.экв. Предпочтительно кислота Льюиса является хлоридом алюминия, при этом силановый реагент является тетраметилдисилоксаном, а мольное соотношение хлорида алюминия и тетраметилдисилоксана составляет приблизительно 1:1,25. Настоящее изобретение позволяет получать соединения, предназначенные для получения фармацевтических препаратов, состоящих из фармацевтически приемлемого носителя и продукта, полученного в соответствии с любым из способов, описанных в настоящем документе, например, путем смешивания продукта, полученного в соответствии с любым из способов, описанных в настоящем документе, и фармацевтически приемлемого носителя. Соединения, получаемые способами настоящего изобретения, могут использоваться в способах лечения заболеваний, опосредованных НЗПГ (включая лечение или задержку развития или возникновения сахарного диабета, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии,медленного заживления ран, резистентности к инсулину, гипергликемии, гиперинсулинемии, повышенного уровня жирных кислот в крови, повышенного уровня глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, синдрома X, осложнений диабета, атеросклероза или повышенного давления), заключающиеся во введении пациенту терапевтически эффективного количества любого из соединений или фармацевтических препаратов, перечисленных выше. Также они могут быть пригодны для лечения сахарного диабета 1 и 2 типов, заключающегося во введении пациенту терапевтически эффективного количества любого из соединений или фармацевтических препаратов, перечисленных выше, отдельно или в сочетании по меньшей мере с одним из противодиабетических препаратов, препаратов для лечения осложнений диабета, препаратов для лечения ожирения, противогипертонических препаратов, противотромбоцитарных препаратов, противоатеросклеротических препаратов и (или) гиполипидемических препаратов. Подробное описание изобретения Настоящее изобретение направлено на создание способа получения соединений формулы (I) и их фармацевтически приемлемых солей или сольватов, как более подробно описано в настоящем документе. Соединения формулы (I) проявляют ингибиторную активность в отношении натрийзависимого переносчика глюкозы, присутствующего в кишечнике и почках млекопитающих, и могут применяться при лечении сахарного диабета или осложнений диабета, таких как диабетическая ретинопатия,диабетическая нейропатия, диабетическая нефропатия, ожирение и медленное заживление ран. В одном из вариантов осуществления настоящее изобретение относится к способу получения соединения формулы (I-S), подробно описанному в настоящем документе. Настоящее изобретение также относится к способу получения соединений формулы (IA') где RA и кольцо С соответствуют описанию, приведенному в настоящем документе; и их фармацевтически приемлемых солей. Известно, что соединения формулы (IA') обладают ингибиторной активностью в отношении натрийзависимых переносчиков глюкозы и демонстрируют отличный эффект в отношении снижения уровня глюкозы в крови. Следовательно, соединения формулы (IA') могут использоваться для лечения или профилактики сахарного диабета, осложнений диабета (например,диабетической ретинопатии, диабетической нейропатии и диабетической нефропатии) и сопутствующих заболеваний, например ожирения. Термин "галоген" означает хлор, бром, фтор и йод. При рассмотрении заместителей, входящих в соединение формулы (I), термин "атом галогена" или "галоген" означает хлор, бром и фтор, при этом хлор и фтор являются предпочтительными заместителями. Термин "алкильная группа" означает линейную или разветвленную одновалентную насыщенную углеводородную цепь, содержащую от 1 до 6 атомов углерода. Предпочтительно термин "алкильная группа" означает линейную или разветвленную углеродную цепь, содержащую от 1 до 4 атомов углерода. Наиболее предпочтительно термин "алкильная группа" означает линейную углеродную цепь, содержащую один или два атома углерода. К примерам "алкилов" относятся метил, этил пропил, изопропил,бутил, трет-бутил, изобутил, пентил, гексил и их различные изомеры с разветвленной цепью. В одном из вариантов осуществления настоящего изобретения в соединениях формулы (IA') термин"гетероциклил" означает одновалентную группу ненасыщенного углеводородного кольца, содержащую 1-4 гетероатома, независимо выбираемых из атома азота, атома кислорода и атома серы, и предпочтительным является 5-6-членное насыщенное или ненасыщенное углеводородное кольцо, содержащее 1-4 гетероатомов, независимо выбираемых из атома азота, атома кислорода и атома серы. К примерам "гетероциклила" относятся пиридил, пиримидил, пиразинил, фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, 4,5-дигидрооксазолил, тиазолил, изотиазолил, тиадиазолил, триазолил и тетразолил. К предпочтительным "гетероциклилам" относятся пиридил, пиримидил, пиразинил, фурил,тиенил, пирролил, имидазолил, оксазолил и тиазолил. Термин "алканоильная группа" означает формильную группу, а также группы, образующиеся при связывании "алкильной группы" с карбонильной группой. К примерам "С 1-6 алкоксигрупп" относятся метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, трет-бутоксигруппа, изобутоксигруппа, пентилоксигруппа, гексилоксигруппа и их разные разветвленные изомеры. Также термины "галоген-C1-6 алкильная группа", "галоген-C1-6 алкоксигруппа" означаютC1-6 алкильную группу, C1-6 алкоксигруппу (далее называемые "алкильной и прочими группами"), с введенными одним и несколькими заместителями - атомами галогена соответственно. Предпочтительными являются алкильная и прочие группы с введенными в качестве заместителей от 1 до 7 атомами галогена,более предпочтительными - алкильная и прочие группы с введенными в качестве заместителей от 1 до 5 атомами. К фармацевтически приемлемым солям соединения формулы I относятся, например, соль с щелочным металлом, таким как литий, натрий, калий и т.п.; соль с щелочно-земельным металлом, таким как кальций, магний и т.п.; соль с цинком или алюминием; соль с органическим основанием, таким как аммиак, холин, диэтаноламин, лизин, этилендиамин, трет-бутиламин, трет-октиламин, трис(гидроксиметил)аминометан, N-метилглюкозамин, триэтаноламин и дегидроабиэтиламин; соль с неорганической кислотой, такой как соляная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или соль с органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая ки-8 021373 слота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота,винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота и т.п.; или соль с аминокислотой, такой как аспарагиновая кислота, глутаминовая кислота и т.п. В другом предпочтительном варианте осуществления настоящего изобретения группа Y находится в положении 3 кольца А, если считать положение группы X первым положением; кольцо А представляет собой бензольное кольцо с необязательными заместителями, которыми могут быть атомы галогена,С 1-6 алкильная группа, С 1-6 алкоксильная группа. Следующие сокращения использованы в спецификации, в частности в схемах и примерах: Если не указано иначе, используемый в настоящем документе термин "изолированная форма" означает, что указанное соединение присутствует в форме, которая отделена от любой твердой смеси с другим соединением (соединениями), системы раствора или биологической среды. В одном варианте осуществления настоящее изобретение относится к способу получения соединения формулы (I), при этом соединение формулы (I) получается в изолированной форме. В другом варианте осуществления настоящее изобретение относится к способу получения соединения формул (IA'), при этом соединение формулы(IA') получается в изолированной форме. В другом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (I-S), при этом соединение формулы (I-S) получается в изолированной форме. Если не указано иначе, используемый в настоящем документе термин "преимущественно чистый" означает, что молярная процентная доля примесей в изолированном соединении составляет менее приблизительно 5 мол.%, предпочтительно менее приблизительно 2 мол.%, более предпочтительно менее приблизительно 0,5 мол.%, наиболее предпочтительно менее приблизительно 0,1 мол.%. В одном из вариантов осуществления настоящее изобретение относится к способу получения соединения формулы (I), при этом соединение формулы (I) является "преимущественно чистым". В другом варианте осуществления настоящее изобретение относится к способу получения соединения формулы(IA'), при этом соединение формулы (IA') является преимущественно чистым. В другом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (I-S), при этом соединение формулы (I-S) является преимущественно чистым. Если не указано иначе, используемый в настоящем документе термин "преимущественно свободный от соответствующих солевых форм" применительно к описанию соединения формулы (I) означает, что мольная доля соответствующих солевых форм в изолированной основной форме соединения формулы (I) составляет менее приблизительно 5 мол.%, предпочтительно менее приблизительно 2 мол.%, более предпочтительно менее приблизительно 0,5 мол.%, наиболее предпочтительно менее приблизительно 0,1 мол.%. В одном из вариантов осуществления настоящее изобретение относится к способу получения соединения формулы (I), при этом соединение формулы (I) является преимущественно свободным от соответствующих солевых форм. В другом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (IA'), при этом соединение формулы (IA') является преимущественно свободным от соответствующих солевых форм. В другом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (I-S), при этом соединение формулы (I-S) является преимущественно свободным от соответствующих солевых форм. Специалистам в данной области будет очевидно, что при отсутствии специальных указаний реакционные стадии получения требуемого продукта проводят в соответствующих условиях, следуя известным методикам. Специалистам в данной области также будет очевидно, что в техническом описании и в формуле изобретения, представленной в настоящем документе, в случае если реагент или класс/тип реагента (например, основание, растворитель и т.д.) указан для более чем одной стадии способа, конкретные реагенты выбираются для каждой стадии независимо и могут быть одинаковыми или могут отличаться друг от друга. Например, если органическое или неорганическое основание указывается в качестве реагента для двух стадий способа, выбранное для первой стадии органическое или неорганическое основание может быть таким же либо может отличаться от органического или неорганического основания, используемого во второй реакции. Специалисту также будет очевидно, что, если реакционная стадия в рамках настоящего изобретения может быть проведена в нескольких растворителях или системах растворителей, указанная реакционная стадия также может быть проведена в смесях соответствующих растворителей или систем растворителей. Примеры соответствующих целям настоящего изобретения растворителей, оснований, температур и иных условий проведения реакции и используемых компонентов даются в подробных описаниях ниже. Специалистам в данной области будет очевидно, что перечень указанных примеров не предполагает и не должен рассматриваться как ограничивающий настоящее изобретение, излагаемое далее в формуле изобретения. Для большей краткости описания некоторые количественные выражения в настоящем документе приводятся в виде диапазона от приблизительного количества X до приблизительного количества Y. Предполагается, что указанный диапазон не ограничивается указанной верхней и нижней границей, но включает весь диапазон от приблизительного количества X до приблизительного количества Y, а также все меньшие диапазоны, входящие в него. Для более точного описания некоторые из используемых в настоящем документе количественных выражений не описываются термином "приблизительно". Необходимо понимать, что независимо от того,используется ли явно термин "приблизительно" или нет, каждое приведенное в настоящем документе количество предполагает действительное численное значение, а также разумное приближение к такому числовому значению, основанное на имеющихся у специалиста знаниях, включая приближение, учитывающее экспериментальные условия и (или) измерения, имеющие отношение к такому числовому значению. Если не указано иначе, используемый в настоящем изобретении термин "защитная группа для азота" означает группу, которая может быть присоединена к атому азота для защиты указанного атома азота от участия в реакции и которая может быть затем легко снята после выполнения реакции. Соответствующие защитные группы азота включают, помимо прочего, карбаматы - группы с формулой -C(O)O-R,где R представляет собой, например, метил, этил, трет-бутил, бензил, фенилэтил, СН 2=СН-СН 2- и другие аналогичные группы; амиды - группы сформулой -C(O)-R', где R' представляет собой, например, метил,фенил, трифторметил и другие аналогичные группы; производные N-сульфонила - группы с формулой-SO2-R", где R" представляет собой, например, толил, фенил, трифторметил, 2,2,5,7,8-пентаметилхроман 6-ил-, 2,3,6-триметил-4-метоксибензол и другие аналогичные группы. Другие допустимые группы, защищающие азот, могут быть указаны в работах, подобных T.W. GreeneP.G.M. Wuts, Protective Groupsin Organic Synthesis, John WileySons, 1991. Если не указано иначе, используемый в настоящем документе термин "кислород-защитная группа" означает группу, которая может быть присоединена к атому кислорода для защиты указанного атома от участия в реакции и которая может быть снята после осуществления указанной реакции. К подходящим кислород-защитным группам относятся, помимо прочего, ацетил, бензоил, трет-бутил-диметилсилил,триметилсилил (TMS), MOM, THP и т.п. Прочие примеры подходящих групп, защищающих кислородную группу, могут быть указаны в работах, подобных T.W. GreeneP.G.M. Wuts, Protective Groups inOrganic Synthesis, John WileySons, 1991. В тех случаях, когда способы получения соединений в соответствии с настоящим изобретением приводят к образованию смеси стереоизомеров, такие изомеры могут быть изолированы с помощью известных способов, например препаративной хроматографией. Соединения могут быть получены в рацемической форме, либо отдельные энантиомеры могут быть получены в результате энантиоспецифического синтеза либо с помощью разделения. Соединения могут, например, быть разделены на составляющие энантиомеры с помощью стандартных способов, таких как формирование диастереометрических пар путем образования солей с оптически активными кислотами, например, (-)-ди-пара-толуоил-Dвинно-каменная кислота и (или) (+)-ди-пара-толуоил-L-винно-каменная кислота, с последующей фракционной кристаллизацией и восстановлением свободного основания. Соединения также могут быть разделены путем образования диастереометрических эфиров или амидов с последующим хроматографическим разделением и удалением хирального партнера. В альтернативном варианте соединения могут быть разделены при помощи хиральной колонки для HPLC. В рамках способов получения соединений, составляющих предмет настоящего изобретения, может возникнуть необходимость в защите чувствительных или реакционных групп любой из рассматриваемых молекул. Для этих целей могут использоваться стандартные защитные группы, например, описанные в работах Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; и T.W. GreeneP.G.M. Wuts, Protective Groups in Organic Synthesis, John WileySons, 1991. Защитные группы могут быть сняты на какой-либо последующей стадии с применением известных в данной области способов. Специалистам в данной области будет очевидно, что в любом из способов, описанных в настоящем документе, реакционноспособные заместители в соединении формулы (I), такие как гидроксигруппы,- 11021373 оксогруппы, карбоксильные группы и т.п., предпочтительно требуют защиты и последующего снятия защиты в соответствии с известными способами на соответствующих стадиях синтеза. Настоящее изобретение направлено на способ получения соединений формулы (I), как показано на схеме 1 ниже. Схема 1 Таким образом, имеющее подходящие заместители соединение формулы (X), где Q0 представляет собой бром или йод, известное соединение или соединение, полученное известными способами, взаимодействует с комплексом ди(С 1-4 алкил)магния и хлорида лития, например ди(втор-бутил)магния и хлорида лития, и т.п.; или с комплексом С 1-4 алкилмагния хлорида и хлорида лития или комплексом С 1-4 алкилмагния бромида и хлорида лития; где С 1-4 алкил предпочтительно представляет собой изопропил или втор-бутил, более предпочтительно втор-бутил, известное соединение или соединение, полученное известными способами; где комплекс ди(С 1-4 алкил)магния и хлорида лития или комплекс С 1-4 алкилмагния хлорида и хлорида лития или комплекс С 1-4 алкилмагния бромида и хлорида лития предпочтительно присутствует в количестве от приблизительно 1,0 до 1,5 мол.экв. (относительно количества молей соединения формулы (X, или в любом входящем в него диапазоне, более предпочтительно в количестве приблизительно 1,2 мол.экв.; в органическом растворителе или в их смеси, например, в толуоле, THF, гексане, пентане, МТВЕ, 1,4-диоксане и т.п., предпочтительно в смеси THF и толуола; при температуре в диапазоне от приблизительно комнатной до приблизительно -78 С, или в любом входящем в него диапазоне, предпочтительно при температуре в диапазоне от приблизительно 2 до приблизительно 5 С; с получением соответствующего соединения формулы (XI), где Q1 представляет собой соответственно MgCl или MgBr. Соединение формулы (XI) взаимодействует с содержащим подходящие заместители соединением формулы (XII), где Z представляет собой подходящую кислород-защитную группу, предпочтительно Z представляет собой ацетил; где соединение формулы (XII) предпочтительно присутствует в диапазоне от приблизительно 1,0 до приблизительно 2,0 мол.экв., или в любом входящем в него диапазоне, более предпочтительно в диапазоне от приблизительно 1,0 до приблизительно 1,3 мол.экв., или в любом входящем в него диапазоне; в органическом растворителе или в их смеси, например в толуоле, THF, гексане,пентане, МТВЕ, 1,4-диоксане и т.п., предпочтительно в смеси толуола и THF; при температуре в диапазоне от приблизительно комнатной до приблизительно -78 С, или в любом входящем в него диапазоне,предпочтительно при температуре приблизительно 35 С; с получением соответствующего соединения формулы (XIII). Предпочтительно, чтобы соединение формулы (XI) добавлялось в смесь соединения формулы (XII) в органическом растворителе или их смеси с получением соответствующего соединения формулы (XIII). Соединение формулы (XIII) взаимодействует с подходящей кислотой Льюиса, например BF3OEt2,BF3THF, хлоридом алюминия, хлоридом цинка, хлоридом железа и т.п., предпочтительно BF3THF или хлоридом алюминия, более предпочтительно хлоридом алюминия; где кислота Льюиса предпочтительно присутствует в количестве от приблизительно 0,5 до приблизительно 10,0 мол.экв., или в любом входящем в него диапазоне, более предпочтительно в диапазоне от приблизительно 0,5 до приблизительно 2,5 мол.экв., или в любом входящем в него диапазоне, наиболее предпочтительно приблизительно 0,8 мол.экв.; в присутствии подходящего силанового реагента, например триизопропилсилана, триэтилсилана, тетраметилдиизосилоксана и т.п., предпочтительно триэтилсилана или тетраметилдиизосилоксана,более предпочтительно тетраметилдиизосилоксана; где силановый реагент предпочтительно присутствует в диапазоне от приблизительно 1,0 до приблизительно 10,0 мол.экв., или в любом входящем в него диапазоне, более предпочтительно в диапазоне от приблизительно 1,0 до приблизительно 6,0 мол.экв.,или в любом входящем в него диапазоне, наиболее предпочтительно приблизительно 1,0 мол.экв.; где в одном из вариантов осуществления настоящего изобретения отношение содержания хлорида алюминия к тетраметилдисилоксану составляет приблизительно 1:1,25; в органическом растворителе, таком какDCM, DCE, ацетонитрил, толуол и т.п., или в смеси указанных органических растворителей, предпочтительно в ацетонитриле; предпочтительно при температуре в диапазоне от приблизительно 0 С до приблизительно температуры кипения, или в любом входящем в него диапазоне, более предпочтительно при температуре приблизительно 45 С; с получением соответствующего соединения формулы (XIV). Соединение формулы (XIV) предпочтительно суспендируется или растворяется в растворителе, более предпочтительно суспендируется; затем фильтруется, предпочтительно фильтруется при повышенной температуре, для удаления примесей и (или) побочных продуктов. Из соединения формулы (XIV) убираются защитные группы с использованием известных способов. Например, соединение формулы (XIV) взаимодействует с подходящим основанием, таким как LiOH,NaOH, NaOCH3 и т.п., предпочтительно NaOCH3; где количество основания предпочтительно находится в диапазоне от приблизительно 0,1 до приблизительно 2,0 мол.экв., или в любом входящем в него диапазоне, более предпочтительно находится в диапазоне от приблизительно 0,5 до приблизительно 1,5 мол.экв., или в любом входящем в него диапазоне, наиболее предпочтительно приблизительно 1,0 мол.экв.; в органическом растворителе или их смеси, например метаноле, этаноле, THF и т.п., предпочтительно в метаноле; предпочтительно при комнатной температуре; с получением соответствующего соединения формулы (I). Специалисту в данной области также будет очевидно, что, в зависимости от конкретной защитной группы Z, на этапе снятия защиты могут использоваться другие реагенты, включая, помимо прочего,Pd/C, Pd(OH)2, PdCl2, Pd(OAc)2/Et3SiH и RaNi. Такие реагенты могут применяться с использованием различных систем растворителей и (или) дополнительных сочетаний кислот и оснований, известных любому специалисту в данной области. Соединение формулы (I) предпочтительно выделяется и (или) перекристаллизовывается в соответствии с известными способами. В одном из вариантов осуществления настоящее изобретение относится к способу получения соединения формулы (I-S), как показано на схеме 2 ниже. Таким образом, имеющее подходящие заместители соединение формулы (X-S), где Q0 представляет собой бром или йод, известное соединение или соединение, полученное известными способами, взаимодействует с комплексом ди(С 1-4 алкил)магния и хлорида лития, например, ди(втор-бутил)магния и хлорида лития и т.п.; или с комплексом С 1-4 алкилмагния хлорида и хлорида лития, или комплексом С 1-4 алкилмагния бромида и хлорида лития; где С 1-4 алкил предпочтительно представляет собой изопропил или втор-бутил, более предпочтительно втор-бутил, известное соединение или соединение, полученное известными способами; где комплекс ди(С 1-4 алкил)магния и хлорида лития или комплекс С 1-4 алкилмагния хлорида и хлорида лития или комплекс С 1-4 алкилмагния бромида и хлорида лития предпочтительно присутствует в диапазоне от приблизительно 1,0 до 1,5 мол.экв. (относительно количества молей соединения формулы (X-S, или в любом входящем в него диапазоне, более предпочтительно в количестве приблизительно 1,2 мол.экв.; в органическом растворителе или в их смеси, например в толуоле, THF, гексане, пентане, МТВЕ, 1,4-диоксане и т.п., предпочтительно в смеси THF и толуола; при температуре в диапазоне от приблизительно комнатной до приблизительно -78 С, или в любом входящем в него диапазоне, предпочтительно при температуре в диапазоне от приблизительно 2 до приблизительно 5 С; с получением соответствующего соединения формулы (XI-S), где Q1 представляет собой соответственно MgCl или MgBr. Соединение формулы (XI-S) взаимодействует с содержащим подходящие заместители соединением формулы (XII-S), где Z представляет собой подходящую кислород-защитную группу, предпочтительно Z представляет собой ацетил; где соединение формулы (XII-S) предпочтительно присутствует в диапазоне от приблизительно 1,0 до приблизительно 2,0 мол.экв., или в любом входящем в него диапазоне, более предпочтительно находится в диапазоне от приблизительно 1,0 до приблизительно 1,3 мол.экв., или в любом входящем в него диапазоне; в органическом растворителе или в их смеси, например в толуоле, THF, гексане, пентане, МТВЕ,1,4-диоксане и т.п., предпочтительно в смеси толуола и THF; при температуре в диапазоне от приблизительно комнатной до приблизительно -78 С, или в любом входящем в него диапазоне, предпочтительно при температуре приблизительно 35 С; с получением соответствующего соединения формулы (XIII-S). Предпочтительно, чтобы соединение формулы (XI-S) добавлялось в смесь соединения формулы(XII-S) в органическом растворителе или их смеси с получением соответствующего соединения формулыBF3THF или хлоридом алюминия, более предпочтительно хлоридом алюминия; где кислота Льюиса предпочтительно присутствует в диапазоне от приблизительно 0,5 до приблизительно 10,0 мол.экв., или в любом входящем в него диапазоне, более предпочтительно в диапазоне от приблизительно 0,5 до приблизительно 2,5 мол.экв., наиболее предпочтительно приблизительно 0,8 мол.экв.; в присутствии подходящего силанового реагента, например iPr3SiH, триэтилсилана, тетраметилдиизосилоксана и т.п., предпочтительно триэтилсилана или тетраметилдиизосилоксана, более предпочтительно тетраметилдиизосилоксана; где силановый реагент предпочтительно присутствует в диапазоне от приблизительно 1,0 до приблизительно 10,0 мол.экв., или в любом входящем в него диапазоне, более предпочтительно в диапазоне от приблизительно 1,0 до приблизительно 6,0 мол.экв., или в любом входящем в него диапазоне, наиболее предпочтительно приблизительно 1,0 молярного эквивалента; где, в одном из вариантов осуществления настоящего изобретения, отношение содержания хлорида алюминия к тетраметилдисилоксану составляет приблизительно 1:1,25; в органическом растворителе, таком как DCM, DCE, ацетонитрил, толуол и т.п., или в смеси указанных органических растворителей, предпочтительно в ацетонитриле; предпочтительно при температуре в диапазоне от приблизительно 0 С до приблизительно температуры кипения, или в любом входящем в него диапазоне, более предпочтительно при приблизительно 45 С; с получением соответствующего соединения формулы (XIV-S). Соединение формулы (XIV-S) предпочтительно суспендируется или растворяется в растворителе,более предпочтительно суспендируется; затем фильтруется, предпочтительно фильтруется при повышенной температуре, для удаления примесей и (или) побочных продуктов. Из соединения формулы (XIV-S) удаляются защитные группы с использованием известных способов. Например, соединение формулы (XIV-S) взаимодействует с подходящим основанием, таким какLiOH, NaOH, NaOH3 и т.п., предпочтительно NaOCH3; где количество основания предпочтительно находится в диапазоне от приблизительно 0,1 до приблизительно 2,0 мол.экв., или в любом входящем в него диапазоне, более предпочтительно в диапазоне от приблизительно 0,5 до приблизительно 1,5 мол.экв.,или в любом входящем в него диапазоне, наиболее предпочтительно приблизительно 1,0 мол.экв.; в органическом растворителе или их смеси, например метаноле, этаноле, THF и т.п., предпочтительно в метаноле; предпочтительно при комнатной температуре; с получением соответствующего соединения формулы (I-S). Специалисту в данной сфере также будет очевидно, что, в зависимости от конкретной защитной группы Z, на этапе снятия защиты могут использоваться другие реагенты, включая, помимо прочего,Pd/C, Pd(OH)2, PdCl2, Pd(OAc)2/Et3SiH и RaNi. Такие реагенты могут применяться с использованием различных систем растворителей и (или) дополнительных сочетаний кислот и оснований, известных любому специалисту в данной области. Соединение формулы (I-S) предпочтительно выделяется и (или) перекристаллизовывается в соответствии с известными способами. Соединение формулы (X-S) может быть получено, как показано на схеме 4 ниже. Таким образом, соединение формулы (XV-S), также известное как 2-бромтиофен, известное соединение или соединение, полученное известными способами, взаимодействует с соединением формулы(XVII-S), где Q3 представляет собой -В(ОН)2, известное соединение или соединение, полученное известными способами, в условиях реакции Судзуки, с получением соответствующего соединения формулы(XVIII-S), также известного как 2-(4-фторфенил)тиофен. Более конкретно, соединение формулы (XV-S) взаимодействует с соединением формулы (XVII-S), где Q3 представляет собой -В(ОН)2; где соединение формулы (XVII-S) предпочтительно присутствует в диапазоне от приблизительно 0,5 до приблизительно 2,0 мол.экв., более предпочтительно в диапазоне от приблизительно 0,9 до приблизительно 1,1 мол.экв.; в присутствии содержащего подходящие заместители палладиевого катализатора, такого как Pd(PPh3)4,Pd(OAc)2, PdCl2(PPh3)2 и т.п.; в присутствии подходящего основания, такого как Na2CO3, K3PO4 и т.п.; в подходящем органическом растворителе, таком как DME и т.п.; предпочтительно при температуре в диапазоне от приблизительно 60 до приблизительно 85 С; с получением соответствующего соединения формулы (XVIII-S). В альтернативном варианте соединение формулы (XVI-S), где Q2 представляет собой бром, хлор,йод и т.п., предпочтительно бром; взаимодействует с подходящим магниевым реагентом, таким как Mg,изопропил-MgCl, изопропил-MgClLiCl, втор-бутил-MgClLi, ди(втор-бутил)Mg, три-(н-бутил)MgLi и т.п.; в подходящем органическом растворителе, таком как THF, 2-метил-THF, дибутиловый эфир, диэтиловый эфир и т.п.; с получением соответствующего производного Гриньяра, соединения формулы (XVIIS), где Q3 представляет собой соответствующую группу Гриньяра, более конкретно - соответствующийMgBr, MgCl, Mgl или соответствующий аддукт LiCl (MgBrLiCl, MgClLiCl, MgILiCl). Соединение формулы (XVII-S) взаимодействует с соединением формулы (XV-S), также известным как 2-бромтиофен, известным соединением или соединением, полученным известными способами, где соединение формулы (XVII-S) предпочтительно присутствует в диапазоне от приблизительно 0,5 до приблизительно 2,0 мол.экв., более предпочтительно в диапазоне от приблизительно 0,9 до приблизительно 1,2 мол.экв.; в присутствии подходящего катализатора на основе Ni или Pd, такого как NiCl2(dppe),NiCl2(dppp), NiCl2(dppf), Ni(OAc)2/dppe, Pd(OAc)2/dppp и т.п.; в подходящем органическом растворителе,таком как 2-метил-THF, THF, дибутиловый эфир, диэтиловый эфир и т.п.; предпочтительно при температуре в диапазоне от приблизительно 0 до приблизительно 60 С; с получением соответствующего соединения формулы (XVIII-S), также известного как 2-(4-фторфенил)тиофен. Предпочтительно, чтобы соединение формулы (XVIII-S) не выделялось. Соединение формулы (XVII-S), где Q3 представляет собой MgBr, MgCl, MgI или соответствующий аддукт LiCl (более конкретно MgBrLiCl, MgClLiCl или MgILiCl), взаимодействует с соединением формулы (XV-S), также известным как 2-бромтиофен; где соединение формулы (XVII-S) присутствует в количестве от приблизительно 0,8 до приблизительно 3,0 мол.экв., предпочтительно в диапазоне от приблизительно 1,0 до приблизительно 2,0 мол.экв., более предпочтительно в диапазоне от приблизительно 1,05 до приблизительно 1,2 мол.экв.; в присутствии подходящего катализатора на основе Pd или Ni, такого какNi(COD)2; где Pd(OAc)2 предпочтительно присутствует в диапазоне от приблизительно 0,0001 мол.% до приблизительно 10 мол.% (от количества соединения формулы (XV-S, более предпочтительно в диапазоне от приблизительно 0,001 до приблизительно 1 мол.%, более предпочтительно в диапазоне от приблизительно 0,01 до приблизительно 0,1 мол.%; при необходимости в присутствии подходящего лиганда,такого как триметилфосфин, трифенилфосфин, трициклогексилфосфин, три(о-толил)фосфин, 2(дициклогексилфосфино)-2',4',6'-триизопропил-1,1'-бифенил(XPhos), 2-(дициклогексилфосфино)-2'-(N,Nдиметиламино)бифенил,2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил,2 дициклогексилфосфино-2',6'-диметокси-1,1'-бифенил,бутилди-1-адамантилфосфин,2-(ди-третбутилфосфино)бифенил,2-(дициклогексилфосфино)бифенил,(R)-(-)-1-[(S)-2(дифенилфосфино)ферроценил]этилдициклогексилфосфин, 1,2-бис-(дифенилфосфино)бензол (дибензол),2,2'-бис-(дифенилфосфино)-1,1'-бинафтил (BINAP), бис-(2-дифенилфосфинофенил)эфир (DPEphos), 4,5 бис-(дифенилфосфино)-9,9-диметилксантен (Xantphos), dppb, dppe, dppf, dppp или трет-Bu3PHBF4, предпочтительно dppf, dppp, трет-Bu3PHBF4, Xantphos, трициклогексилфосфин или XPhos, более предпочтительно dppp или Xphos; где лиганд предпочтительно присутствует в диапазоне от приблизительно 0,0001 мол.% до приблизительно 10 мол.% (от количества соединения формулы (XV-S, более предпочтительно в диапазоне от приблизительно 0,001 мол.% до приблизительно 1 мол.%, более предпочтительно в диапазоне от приблизительно 0,01 мол.% до приблизительно 0,1 мол.%; в подходящем растворителе, таком как THF, диметоксиэтан, диэтиловый эфир, диизопропиловый эфир, циклопентилметиловый эфир,трет-бутилметиловый эфир, диоксан, ксилен и толуол; при пониженной, комнатной или повышенной температуре, предпочтительно при температуре в диапазоне от приблизительно -20 до приблизительно 150 С, более предпочтительно при температуре в диапазоне от приблизительно 30 до приблизительно 80 С, более предпочтительно при температуре в диапазоне от приблизительно 40 до приблизительно 60 С; с получением соответствующего соединения формулы (XVIII-S). Предпочтительно, чтобы соединение формулы (XVII-S) добавлялось медленно, например, со скоростью, при которой TOF ниже 12000, предпочтительно ниже 2000, к смеси соединения формулы (XV-S),катализатора и лиганда в подходящем растворителе. Соединение формулы (XVIII-S) взаимодействует с соединением формулы (XIX-S), где Q0 представляет собой бром или йод, предпочтительно йод, известное соединение или соединение, полученное известными способами, где соединение формулы (XVIII-S) предпочтительно присутствует в диапазоне от приблизительно 0,5 до приблизительно 2,0 мол.экв., более предпочтительно в диапазоне от приблизительно 0,9 до приблизительно 1,1 мол.экв.; в подходящем растворителе, таком как дихлорметан, хлороформ и т.п.; с получением соответствующего соединения формулы (XX-S). Предпочтительно, чтобы соединение формулы (XX-S) не выделялось. Соединение формулы (XX-S) взаимодействует с подходящим восстанавливающим агентом, таким как Et3SiH, тетраметилдисилоксан, NaBH4 и т.п.; в присутствии кислоты Льюиса, такой как BF3Et2O,BF3THF, AlCl3, ZnCl2, FeCl3 и т.п.; в подходящем растворителе, таком как дихлорметан, хлороформ, ацетонитрил и т.п. или их смеси; с получением соответствующего соединения формулы (X-S). Настоящее изобретение также относится к способу получения соединений формулы (IA'), изображенному на схеме 6 ниже. Таким образом, содержащее подходящие заместители соединение формулы (L), где Х 0 выбирается из группы, включающей Cl, Br, I и ClLiCl, предпочтительно ClLiCl, известное соединение или соединение, полученное известными способами, или содержащее подходящие заместители соединение формулы(LI), известное соединение или соединение, полученное известными способами, взаимодействует с содержащим подходящие заместители соединением формулы (LII), где каждый R1 представляет собой триС 1-6 алкилсилил, например триметилсилил, триэтилсилил и т.п., предпочтительно все R1 являются одинаковыми и представляют собой триметилсилил; в подходящем растворителе (не влияющем на реакцию),таком как эфир (например, диэтиловый эфир, тетрагидрофуран, диметоксиэтан и т.п.), углеводород (например, н-пентан, н-гексан, циклогексан, н-гептан, н-октан и т.п.), ароматический углеводород (например, бензол, толуол и т.п.) или в смеси этих растворителей; с получением соответствующего соединения формулы (LIII). Специалисту в данной области также будет очевидно, что реакция может протекать при комнатной температуре или при температуре ниже комнатной; однако реакция не должна проводиться при очень низкой температуре. Реакция может проводиться, например, при температуре в диапазоне от приблизительно -40 до приблизительно 20 С, предпочтительно в диапазоне от приблизительно -20 до приблизительно 10 С. Соединение формулы (LIII) взаимодействует с содержащим подходящие заместители спиртом формулы (LIV), таким как низший алкиловый спирт, не влияющим на реакцию, например метанолом,этанолом, н-пропанолом, изопропанолом, н-бутанолом и т.п., где R2 представляет собой соответствующий С 1-6 алкил, предпочтительно R2 представляет собой метил, этил или изопропил; в присутствии содержащей подходящие заместители кислоты, например неорганической кислоты, такой как хлороводо- 18021373 родная кислота, азотная кислота, серная кислота и т.п., или органической кислоты, такой как паратолуолсульфоновая кислота, метансульфоновая кислота и трифторуксусная кислота и т.п.; в чистом виде или в подходящем растворителе (не влияющем на реакцию), таком как углеводород (например, н-пентан,н-гексан, циклогексан, н-гептан и т.п.), ароматический углеводород (например, бензол, толуол и т.п.),простой эфир (например, диэтиловый эфир, тетрагидрофуран и т.п.), галогенированный углеводород(например, дихлорметан, тетрахлоруглерод и т.п.), сложный эфир (например, этилацетат, метилацетат и т.п.), кетон (например, ацетон, 2-бутанон и т.п.), ацетонитрил, или в смеси таких растворителей; с получением соответствующего соединения формулы (LV). Специалисту в данной области также будет очевидно, что реакцию можно проводить при пониженной, комнатной или повышенной температуре. Предпочтительно реакция может осуществляться при температуре в диапазоне от приблизительно -20 до приблизительно 40 С, предпочтительно в диапазоне от приблизительно -20 до приблизительно 10 С. В одном из вариантов осуществления настоящего изобретения спирт с формулой (LIV) представляет собой метанол или этанол, а кислота представляет собой органическую кислоту, например, паратолуолсульфоновую кислоту или трифторуксусную кислоту. В другом варианте осуществления настоящего изобретения спирт с формулой (LIV) используется в качестве растворителя, и реакция, таким образом, осуществляется без примесей. Соединение формулы (LV) защищают известными способами, с получением соответствующего соединения формулы (LVI), где каждый R3 представляет собой подходящую кислород-защитную группу,предпочтительно, чтобы все R3 были одинаковыми и представляли собой ацетил. Защиту можно обеспечить традиционными способами, хорошо известными специалистам в данной области. Общее описание защитных групп и их применения приводится в публикации Т.W. Greene et al., Protecting Groups in Organic Synthesis, John WileySons, New York, 1999. Реакцию по обеспечению защиты можно проводить при пониженной, комнатной или повышенной температуре. Предпочтительно реакция проводится при температуре в диапазоне от приблизительно -10 до приблизительно 100 С, более предпочтительно в диапазоне от приблизительно 5 до приблизительно 35 С. Предпочтительно кислород-защитную группу выбирают из групп, традиционно используемых в качестве кислород-защитных групп. К подходящим примерам кислород-защитных групп относятся алканоил (например, ацетил и т.п.). Соединение формулы (LVI) восстанавливается в соответствии с известными способами, в чистом виде или в подходящем растворителе; с получением соответствующего соединения формулы (LVII). Специалисту в данной области также будет очевидно, что реакцию можно осуществлять при пониженной, комнатной или повышенной температуре. Предпочтительно восстановление производится при температуре в диапазоне от приблизительно -40 до приблизительно 40 С, более предпочтительно в диапазоне от приблизительно 0 до приблизительно 25 С; с получением соответствующего соединения формулы(LVII). Например, соединение формулы (LVI) можно восстановить в результате реакции с подходящим силановым реагентом, например, низшие триалкилсиланы (такие как триэтилсилан, триизопропилсилан и т.п.) или полиалкилсиланы (такие как поли(метилгидросилоксан) и т.п.); в присутствии содержащей подходящие заместители кислоты, такой как подходящая кислота Льюиса (например, комплекс трифторида бора с диэтиловым эфиром, хлорид алюминия, тетрахлорид титана и т.п.), или подходящие органические кислоты (такие как трифторуксусная кислота, трифторметансульфоновая кислота, метансульфоновая кислота и т.п.); в подходящем растворителе, таком как ацетонитрил, дихлорметан, смесь ацетонитрила и дихлорметана и т.п. В альтернативном варианте соединение формулы (LVI) может быть восстановлено в результате реакции с содержащим подходящие заместители борановым реагентом, например подходящим комплексом борана (таким как борантетрагидрофуран, пиридинборан, борандиметилсульфид, третбутиламинборан, боранморфолин и т.п.), или подходящим борогидридом (например, борогидрид натрия, триацетоксиборогидрид натрия и т.п.); в присутствии подходящей кислоты, например подходящей кислоты Льюиса (такой как комплекс трифторида бора с диэтиловым эфиром, хлорид алюминия, тетрахлорид титана и т.п.), или подходящих органических кислот (например, трифторуксусной кислоты,трифторметансульфоновой кислоты, метансульфоновой кислоты и т.п.); в чистом виде или в подходящем растворителе, таком как диэтиловый эфир, тетрагидрофуран и т.п. В альтернативном варианте соединение формулы (LVI) может восстанавливаться в условиях каталитической реакции восстановления с использованием подходящего палладиевого катализатора, такого как палладированный уголь, гидроксид палладия и т.п.; в водородной атмосфере или в присутствии подходящего восстанавливающего реагента (такого как формиат аммония, муравьиная кислота и т.п.); в подходящем растворителе, таком как карбоновая кислота (например, уксусная кислота и т.п.), спирт (например, метанол, этанол и т.п.) или сложный эфир (например, этилацетат и т.п.). Предпочтительно соединение формулы (LVI) восстанавливают в результате реакции с подходящим силановым реагентом, более предпочтительно триэтилсиланом; в присутствии подходящей кислоты, бо- 19021373 лее предпочтительно кислоты Льюиса, более предпочтительно эфирата трифторида бора; в подходящем растворителе, более предпочтительно в ацетонитриле. Снятие защиты с соединения формулы (LVII) осуществляется в соответствии с известными способами с образованием соответствующего соединения формулы (IA'). Более конкретно, соединение формулы (LVII) вводится в реакцию для удаления кислород-защитных групп путем восстановления, гидролиза,обработки кислотой или фторидом. Специалисту в данной области будет очевидно, что реакцию для снятия защиты можно проводить при пониженной, комнатной или повышенной температуре. Предпочтительно реакция снятия защиты проводится при температуре в диапазоне от приблизительно -20 до приблизительно 150 С, более предпочтительно в диапазоне от приблизительно 20 до приблизительно 50 С. В одном из примеров с соединения формулы (LVII) защита снимается в результате реакции с подходящим основанием, таким как гидроксиды щелочных металлов (например, гидроксид натрия, гидроксид калия, гидроксид лития и т.п.) или алкоксиды щелочных металлов (например, метоксид натрия,этоксид натрия и т.п.); в подходящем растворителе, таком как простой эфир (например, тетрагидрофуран, диоксан и т.п.), спирт (например, метанол, этанол и т.п.), вода или смесь этих растворителей. В другом примере с соединения формулы (LVII) защита снимается в результате реакции с подходящей кислотой, такой как хлороводородная кислота, пара-толуолсульфоновая кислота, метансульфоновая кислота, трифторуксусная кислота и т.п.; в подходящем растворителе, таком как спирт, например,метанол, этанол и т.п. В другом примере с соединения формулы (LVII) защита снимается в результате реакции с подходящим фтористым реагентом, таким как фтороводород, фтороводород-пиридин, фторид тетрабутиламмония и т.п.; в подходящем растворителе, таком как уксусная кислота, спирт, (например, метанол или этанол), ацетонитрил или простой эфир, такой как тетрагидрофуран. В одном из вариантов осуществления настоящего изобретения каждая из защитных групп R3 в соединении формулы (LVI) представляет собой бензил. Если в соединении формулы (LVI) все защитные группы представляют собой бензил, соединение формулы (LVI) восстанавливают путем (а) каталитического восстановления с использованием подходящего металлического катализатора (такого как палладированный уголь, гидроксид палладия, оксид платины, родиевый уголь и т.п.) в водородной атмосфере в подходящем растворителе (таком как уксусная кислота, метанол, этанол, этилацетат и т.п.); (b) взаимодействия с подходящим деалкилирующим реагентом, таким как трибромид бора, трихлорид бора, комплекс трихлорид борадиметилсульфид или йодтриметилсилан в подходящем растворителе (таком как ацетонитрил, дихлорметан и т.п.); или путем (3) взаимодействия с подходящим низшим алкилтиолом,например, этантиолом, в присутствии подходящей кислоты Льюиса (такой как комплекс трифторида бора с диэтиловым эфиром и т.п.) в подходящем растворителе (таком как дихлорметан и т.п.). В одном из вариантов осуществления настоящего изобретения R1 представляет собой триметилсилил, R2 представляет собой метил, этил или изопропил, a R3 представляет собой ацетил. Соединения формулы (L) являются известными соединениями либо соединениями, полученными известными способами. В одном из примеров соединения формулы (L) могут быть получены, как изображено на схеме 7. Схема 7 Таким образом, содержащее подходящие заместители соединение формулы (LX), где Ха представляет собой бром или йод, известное соединение или соединение, полученное известными способами,взаимодействует с подходящим галогенидом алкилмагния, например хлоридом алкилмагния, хлоридом метилмагния, хлоридом изопропилмагния, хлоридом втор-бутилмагния и т.п.; бромидом алкилмагния,например бромидом метилмагния, бромидом изопропилмагния, бромидом втор-бутилмагния и т.п.; или йодидом алкилмагния, например йодидом метилмагния, йодидом изопропилмагния, йодидом вторбутилмагния и т.п.; или с подходящим реагентом хлорид алкилмагния/хлорид лития, например, хлорид изопропилмагния/хлорид лития, хлорид втор-бутилмагния/хлорид лития и т.п.; где для получения соединений формулы (L), в которых Х 0 представляет собой ClLiCl, используется хлорид изопропилмагния/хлорид лития; где хлорид изопропилмагния/хлорид лития предпочтительно присутствует в диапазоне от приблизительно 0,95 до приблизительно 1,6 мол.экв., более предпочтительно в диапазоне от приблизительно 1,05 до приблизительно 1,10 мол.экв.; в подходящем растворителе (не мешающем реакции),например подходящем простом эфире, таком как тетрагидрофуран, диэтиловый эфир и т.п., с получением соответствующего соединения формулы (L). Специалисту в данной области будет очевидно, что соединение формулы (LX) может реагировать с получением соответствующего соединения формулы (L) при пониженной, комнатной или повышенной температуре. Предпочтительно реакция проводится при температуре в диапазоне от приблизительно -20 до приблизительно 40 С, более предпочтительно в диапазоне от приблизительно -10 до приблизительно 10 С. Соединения формулы (LI) являются известными соединениями либо соединениями, полученными известными способами. В одном из примеров соединения формулы (LI) могут быть получены, как изображено на схеме 8. Схема 8 Таким образом, содержащее подходящие заместители соединение формулы (LX), где Ха представляет собой бром или йод, известное соединение или соединение, полученное известными способами,взаимодействует с подходящим выбранным реагентом диалкилмагния/лития хлорид, таким как хлорид ди(изопропил)магния/хлорид лития, хлорид ди(втор-бутил)магния/хлорид лития и т.п., в подходящем растворителе. Специалисту в данной области будет очевидно, что соединения формулы (L) и соединения формулы (LI), полученные, как описано выше, могут использоваться без дополнительной очистки. Соединения формулы (LX) являются известными соединениями либо соединениями, полученными известными способами. В одном из примеров соединения формулы (LX) могут быть получены, как изображено на схеме 9. Схема 9 Таким образом, содержащее подходящие заместители соединение формулы (LXI), известное соединение или соединение, полученное известными способами, взаимодействует с содержащим подходящие заместители соединением формулы (LXII), известным соединением или соединением, полученным известными способами, в условиях реакции ацилирования, с получением соответствующего соединения формулы (LXIII). В одном из вариантов осуществления соединение формулы (LXI) взаимодействует с подходящим галогенирующим реагентом, таким как тионил хлорид, оксалил хлорид и т.п.; дополнительно в присутствии каталитически активного количества подходящего активатора (такого как диметилформамид и т.п.); в чистом виде или в подходящем растворителе, таком как подходящий галогенированный углеводород,например дихлорметан, хлорбензол, тетрахлоруглерод и т.п.; при пониженной, комнатной или повышенной температуре, например при температуре в диапазоне от приблизительно 0 до приблизительно 50 С; с последующим взаимодействием с соединением формулы (LXIII). В другом варианте осуществления соединение формулы (LXI) взаимодействует с содержащим подходящие заместители соединением формулы (LXII); в присутствии подходящей кислоты Льюиса, такой как AlCl3, TiCl4, FeCl3 и т.п., в соответствии с известными способами проведения реакции ацилирования Фриделя-Крафтса; в подходящем растворителе, таком как углеводород (например, н-пентан, н-гексан,циклогексан, н-гептан и т.п.), простой эфир (например, диэтиловый эфир, тетрагидрофуран и т.п.), галогенированный углеводород (например, дихлорметан, тетрахлоруглерод и т.п.), сложный эфир (например,этилацетат, метилацетат и т.п.) или в смеси этих растворителей; при пониженной, комнатной или повышенной температуре, предпочтительно при температуре от приблизительно 0 до приблизительно 50 С. Соединение формулы (LXIII) восстанавливается путем взаимодействия с подходящим восстанавливающим реагентом, в соответствии с известными способами, с получением соответствующего соединения формулы (LXa). Соединение формулы (LXIII) можно восстановить в результате реакции с подходящим силановым реагентом, например низшие триалкилсиланы (такие как триэтилсилан, триизопропилсилан и т.п.) или полиалкилсиланы (такие как поли(метилгидросилоксан) и т.п.), в присутствии содержащей подходящие заместители кислоты, такой как подходящая кислота Льюиса (например, комплекс трифторида бора с диэтиловым эфиром, хлорид алюминия, тетрахлорид титана и т.п.), или подходящих органических ки- 21021373 слот (таких как трифторуксусная кислота, трифторметансульфоновая кислота, метансульфоновая кислота и т.п.); в подходящем растворителе, таком как ацетонитрил, дихлорметан, смесь ацетонитрила и дихлорметана и т.п. В альтернативном варианте соединение формулы (LXIII) может быть восстановлено в результате реакции с содержащим подходящие заместители борановым реагентом, например, подходящим комплексом борана (таким как борантетрагидрофуран, пиридинборан, борандиметилсульфид, третбутиламинборан, боранморфолин и т.п.), или подходящим борогидридом (например, борогидрид натрия, триацетоксиборогидрид натрия и т.п.), в присутствии подходящей кислоты, например подходящей кислоты Льюиса (такой как комплекс трифторида бора с диэтиловым эфиром, хлорид алюминия, тетрахлорид титана и т.п.) или подходящих органических кислот (например, трифторуксусной кислоты, трифторметансульфоновой кислоты, метансульфоновой кислоты и т.п.), в чистом виде или в подходящем растворителе, таком как диэтиловый эфир, тетрагидрофуран и т.п. В альтернативном варианте соединение формулы (LXIII) может восстанавливаться в условиях каталитической реакции восстановления, с использованием подходящего палладиевого катализатора, такого как палладированный уголь, гидроксид палладия и т.п., в водородной атмосфере или в присутствии подходящего восстанавливающего реагента (такого как формиат аммония, муравьиная кислота и т.п.); в подходящем растворителе, таком как карбоновая кислота (например, уксусная кислота и т.п.), спирт (например, метанол, этанол и т.п.) или сложный эфир (например, этилацетат и т.п.). Соединение формулы (LXa) дополнительно, при необходимости, может быть введено в реакцию с подходящим йодирующим реагентом, таким как йодид щелочного металла, например йодид натрия, йодид калия и т.п., в присутствии каталитического количества йодида меди(I), в подходящем растворителе,таком как галогенированный углеводород, например дихлорметан, хлорбензол, тетрахлоруглерод и т.п.,при комнатной температуре или при повышенной температуре, например при температуре в диапазоне от приблизительно 50 до приблизительно 150 С, с получением соответствующего соединения формулыAn Aromatic Finkelstein Reaction, J. Am. Chem. Soc. (2002), 124(50), p. 14844-14845). Соединения формулы (LXII) являются известными соединениями либо соединениями, полученными известными способами. В одном из примеров соединения формулы (LXII) могут быть получены, как изображено на схеме 10. Схема 10 Таким образом, 2-бромтиофен, известное соединение, взаимодействует с содержащим подходящие заместители соединением формулы (LXIV), известным соединением или соединением, полученным известными способами, в присутствии подходящего палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0), палладия(II) ацетат, бис-(ацетонитрил)дихлорпалладий(II), дихлор-бис(трифенилфосфин)палладий(II), [1,1'-бис-(дифенилфосфино)ферроцен]дихлорпалладий(II) в комплексе с дихлорметаном, трис-(дибензилиденацетон)дипалладий(0) - хлороформный аддукт, палладия(II) хлорид и т.п., в присутствии подходящего основания, такого как карбонат щелочного металла (например, карбонат калия, карбонат натрия, бикарбонат натрия и т.п.), фосфат щелочного металла (например, трехосновный фосфат калия, фосфат натрия, гидрофосфат натрия и т.п.), органического основания (например, N,Nдиизопропилэтиламина и т.п.) или фторида щелочного металла (например, фторида цезия, фторида калия и т.п.), дополнительно в присутствии подходящего лиганда, такого как трициклогексилфосфин, три(отолил)фосфин и т.п., дополнительно в присутствии подходящей добавки, например, йодида меди(I) и т.п., в подходящем растворителе, таком как ароматический углеводород (например, бензол, толуол и т.п.), простой эфир (например, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан и т.п.), амид (например,диметилформамид, диметилацетамид, 1,3-диметил-2-имидазолидинон, н-метилпирролидон и т.п.), спирт(например, метанол, этиловый спирт, 2-пропанол и т.п.), вода, или в смеси этих растворителей, при комнатной или повышенной температуре, например, при температуре в диапазоне от приблизительно 25 до приблизительно 150 С, предпочтительно в диапазоне от приблизительно 80 до приблизительно 150 С, с получением соответствующего соединения формулы (LXII). Специалисту в данной области будет очевидно, что дополнительные исходные соединения и (или) реагенты доступны в продаже или могут быть получены в соответствии с традиционными способами,хорошо известными специалистам. Следующие примеры предлагаются в целях обеспечения понимания сути настоящего изобретения и не предназначены для того (и не должны быть истолкованы таким образом), чтобы ограничивать настоящее изобретение, описанное далее в пунктах его формулы. В приведенных ниже примерах некоторые продукты синтеза указаны как выделенные в виде остатка. Специалистам будет очевидно, что термин "остаток" не ограничивает физическое состояние, в кото- 22021373 ром продукт был получен, и может включать, например, твердый продукт, масло, пену, смолу, сироп и аналогичные состояния. Если не указано иначе, идентичность и (или) чистота продуктов, полученных в примерах 1-6, определялась методом HPLC. Пример 1. 3(R),4(S),5(R)-триацетокси-6-3-[5-(4-фторфенил)тиофен-2-илметил]-4-метилфенил-6 гидрокситетрагидропиран-2(R)-илметилацетат Стадия А. Получение группы Гриньяра. 2-(4-Фторфенил)-5-(5-йод-2-метилбензил)тиофен (122,48 г, 0,3 моль) перемешивали при комнатной температуре в толуоле (0,75 л/моль), затем охлаждали до -10 С. Затем к образовавшейся смеси через капельную воронку под потоком аргона приблизительно в течение 45 мин при температуре от -5 до -7 С добавляли втор-бутил MgClLiCl (приблизительно 15% в THF; 269,70 г, 0,36 моль) и образовавшийся темно-зеленый раствор перемешивали в течение 1 ч при температуре от -5 до 0 С. Стадия Б. 3(R),4(S),5(R)-Триацетокси-6-оксотетрагидропиран-2(R)-илметилацетат (приблизительно 50% в толуоле, 0,39 моль) разбавляли THF (0,25 л/моль) и образовавшуюся смесь охлаждали до -35 С. После этого к смеси под потоком аргона с помощью шприца/капельной воронки приблизительно в течение 1 ч при температуре не выше -35 С добавляли раствор, полученный на стадии А выше. Через 15 мин перемешивания при -35 С приблизительно в течение 5 мин добавляли смесь уксусной кислоты (23 мл) и воды (225 мл). Затем давали образовавшейся смеси нагреться до 25 С. Разделяли слои образовавшейся двухфазной смеси. Верхний (органический) слой промыли дважды водой (100 мл). Концентрировали органический слой и выделяли остаток отгонкой растворителя. Затем к остатку добавляли ацетонитрил (420 мл) и образовавшуюся смесь промывали метилциклогексаном (300 мл). Образованная смесь содержала два быстроразделяющихся органических слоя. Содержащий титульное соединение ацетонитрильный раствор затем без дальнейшей очистки или выделения титульного соединения использовали в следующей стадии. Пример 2. 3(R),4(R),5(S)-триацетокси-6(S)-3-[5-(4-фторфенил)тиофен-2-илметил]-4-метилфенилтетрагидропиран-2(R)-илметилацетат Триэтилсилан (87,2 г, 0,75 моль) добавляли к ацетонитрильному раствору, содержащему 3(R),4(S),5(R)-триацетокси-6-3-[5-(4-фторфенил)тиофен-2-илметил]-4-метилфенил-6 гидрокситетрагидропиран-2(R)-илметилацетат (полученный в приведенном выше примере 1, 0,30 моль),образованный коричневатый раствор охлаждали до 2 С. После этого приблизительно в течение 30 мин добавляли с помощью шприца эфират трехфтористого бора (46,84 г, 0,33 моль), образованную смесь перемешивали в водно-ледяной бане в течение 1 ч. Затем к смеси через капельную воронку приблизительно в течение 20 мин добавляли 10% по весу водного раствора Na2CO3 (330 мл). Образовавшуюся смесь нагревали до полного растворения, происходящего приблизительно при 45 С. Разделяли слои образовавшейся трехслойной смеси. Средний (органический) слой перемешивали в течение 16 ч, за это время он охладился до комнатной температуры, и началась кристаллизация. Затем образовавшуюся смесь охлаждали на ледяной бане до 2 С и перемешивали дополнительно в течение 4 ч. Осадок отфильтровывали, промывали двумя порциями (75 мл и 30 мл) метанола. Титульное соединение получили сушкой при 50 С в вакууме образовавшегося беловатого осадка. Пример 3. 3(R),4(S),5(R)-триацетокси-6-3-[5-(4-фторфенил)тиофен-2-илметил]-4-метилфенил-6 гидрокситетрагидропиран-2(R)-илметилацетат. Стадия А. Получение группы Гриньяра. 2-(4-Фторфенил)-5-(5-йод-2-метилбензил)тиофен (204,14 г, 0,5 моль) суспендировали при комнатной температуре в толуоле (0,3 л/моль), образовавшуюся смесь охлаждали до 2 С. Через капельную воронку в течение 1 ч добавляли при 2-5 С втор-бутил MgClLiCl (приблизительно 15% в THF; мольное отношение составило 1,2:1 чистого лабораторного реагента). Затем образовавшийся темно-коричневый раствор в течение 2 ч перемешивали при 2 С. Стадия Б. 3(R),4(S),5(R)-Триацетокси-6-оксотетрагидропиран-2(R)-илметилацетат (приблизительно 50%-ый раствор в толуоле, 0,65 моль) разбавляли THF (0,2 л/моль), образовавшуюся смесь охлаждали до -40 С. Затем к смеси шприцом в течение 1/2 ч при температуре от -35 до -40 С добавляли смесь, полученную на стадии А выше. После чего образовавшуюся смесь охлаждали до -40 С и перемешивали в течение 30 мин. Затем в течение 10 мин при -40 С добавляли смесь HCl (59,8 мл) в воде (100 мл). Образовавшуюся смесь нагревали в течение 15 мин до 20 С и затем снова разбавляли водой (150 мл). Разделяли слои образовавшейся двухфазной смеси. К органическому слою добавляли толуол (100 мл). Затем органический слой промывали водой (250 мл), слои разделяли и органический слой концентрировали в роторном испарителе при минимальном давлении 5 кПа (50 миллибар) и 70 С. Остаток представлял собой титульное соединение, которое использовали на следующей стадии синтеза без дальнейшей очистки. Образец полученного соединения растворяли в дейтерированном хлороформе и регистрировали спектры 1 Н и 13 С ЯМР. Для регистрации одномерных спектров использовали ЯМР-спектрометр BrukerAVANCE 400 МГц с ПО TOPSPIN 2.0 и датчиком высокого разрешения с диаметром 5 мм Bruker BBO 400 МГц с Z-градиентом. фторфенил)тиофен-2-илметил]-4-метилфенил-6-гидрокситетрагидропиран-2(R)-илметилацетат (0,455 моль, получен в приведенном выше примере 3), добавляли триэтилсилан (132,27 г, 1,14 моль), образовавшийся раствор перемешивали при 22 С. Через капельную воронку приблизительно в течение 3 мин добавляли комплекс трехфтористого бора и THF (76,39 г, 0,55 моль), при этом образовалась гомогенная темно-коричневая смесь. Смесь нагрели до 40 С, энергично перемешали при 40 С в течение 2,5 ч, затем охлаждали до 20 С. К образовавшейся смеси в течение 15 мин добавляли метанол (910 мл) и перемешивали смесь при 20 С в течение 0,5 ч. К образовавшейся смеси добавляли водный раствор гидроксида аммония (31,8 мл) (при 20 С, до рН 7,2) и затем смесь перемешивали в течение 16 ч при 20 С. Образовавшийся осадок фильтровали, промывали метанолом (3114 мл), после чего сушкой в вакууме при 60 С выделяли титульное соединение в твердом виде. Образец полученного соединения растворяли в дейтерированном DMSO и регистрировали спектры 1 Н и 13 С ЯМР. Для регистрации одномерных спектров 1 Н и 13 С ЯМР использовали ЯМР-спектрометрBruker AVANCE-400 МГц с ПО TOPSPIN 2.0 и датчиком высокого разрешения с диаметром 5 мм Bruker В трехгорлую круглодонную колбу добавляли метанол (244,80 мл, 3 л/моль, чистый лабораторный реагент), метилат натрия (15,31 мл, 81,60 ммоль) и 3(R),4(R),5(S)-триацетокси-6(S)-3-[5-(4 фторфенил)тиофен-2-илметил]-4-метилфенилтетрагидропиран-2(R)-илметилацетат (полученный, например, в приведенном выше примере 4; 49,99 г, 81,60 ммоль) и образовавшуюся густую гомогенную смесь перемешивали в течение 1 ч при 20-25 С. После этого образовавшуюся смесь нагревали до температуры кипения, отгоняли приблизительно 82 мл растворителя, а затем охлаждали в течение 30 мин до 2 С. К смеси добавляли уксусную кислоту (4,68 мл, 81,60 ммоль). Затем при охлаждении приблизительно в течение 15 мин добавляли 114 мл воды и нагревали образовавшуюся смесь до 22 С. К образовавшейся смеси для затравки добавляли 300 мг предварительно полученного продукта, затем перемешивали смесь в течение 19 ч при 22 С. В течение 2,5 ч добавляли еще 49 мл воды (до соотношения метанол:вода=50:50), образовавшуюся смесь охлаждали в течение 15 мин до 0 С, затем перемешивали в течение 2 ч при 0 С. Образовавшуюся суспензию фильтровали, твердый осадок промывали смесью метанол:вода (соотношение 50:50, общий объем 20 мл), затем сушкой под вакуумом в течение 18 ч при 50 С выделяли в твердом виде титульное соединение. В трехгорлую круглодонную колбу добавляли 2(S)-3-[5-(4-фторфенил)тиофен-2-илметил]-4 метилфенил-6(R)-гидроксиметилтетрагидропиран-3(R),4(R),5(S)-триол (25,0 г, 55,15 ммоль), изопропилацетат (также называемый 1-метилэтилацетат, 110 мл) и воду (1,25 мл, 69,39 ммоль), образовавшуюся смесь нагревали до 65 С. Затем к образовавшейся смеси добавляли активированный уголь (1 NORIT ASUPRA, 0,5 г) и перемешивали смесь в течение 15 мин при 60-65 С. Затем активированный уголь отфильтровывали и промывали изопропилацетатом (15 мл). Фильтрат охлаждали до 50 С, добавляли для затравки полученный ранее продукт (0,25 г) и перемешивали смесь в течение 4 ч при 50 С. Затем образовавшуюся смесь охлаждали до 0 С в течение 12 ч и перемешивали в течение 2 ч при 0 С. Образовавшуюся суспензию отфильтровывали, осадок промывали изопропилацетатом и затем сушкой при 50 С под вакуумом выделяли титульное соединение в твердом виде. Образец полученного соединения растворяли в дейтерированном DMSO и регистрировали спектр 1 Н и 13 С ЯМР. Использовали ЯМР-спектрометр Bruker AVANCE-400 МГц с ПО XWIN-NMR 3.5.6 и датчиком высокого разрешения с диаметром 5 мм Bruker CPDUL 1H/2H-13C Z-GRD. В потоке азота ацетонитрил (112,50 мл, 88,12 г) охлаждали до 2 С. Добавляли одной порцией хлорид алюминия (13,33 г) и перемешивали образовавшуюся смесь в течение 15 мин, охладив ее до 15 С. При 15 С добавляли одной порцией СН 3)2SiH)2O (22,13 мл, 16379 г) и образовавшуюся смесь перемешивали в течение 15 мин. Затем к смеси при 15 С приблизительно за 3 ч добавляли 3(R),4(S),5(R)триацетокси-6-3-[5-(4-фторфенил)тиофен-2-илметил]-4-метилфенил-6-гидрокситетрагидропиран-2(R)илметилацетат (1,0 экв. 146,46 мл (145,26 г, 54,10% по весу в ацетонитриле. После этого образовавшуюся смесь перемешивали в течение 15 мин при 15 С, затем нагревали в течение приблизительно 30 мин до 45 С. К образовавшейся смеси приблизительно в течение 15 мин добавляли 4-метил-2-пентанон(32,92 мл, 26,29 г), затем давали смеси нагреться до 50 С и перемешивали при 50 С в течение 1 ч. Затем добавляли через капельную воронку водный NH4Cl и образовавшуюся смесь приблизительно в течение 15 мин нагревали до 65 С и перемешивали при этой же температуре в течение 15 мин. Отделяли водный слой от органического и удерживаемого им бесцветного промежуточного слоя. Органический слой промывали при 65 С раствором хлористого аммония (3,21 г) в воде (20,00 мл) и разделяли образовавшиеся три слоя. Органический слой нагревали приблизительно в течение 15 мин до 65 С, охлаждали в течение 15 мин до 55 С, затем для затравки добавляли 3(R),4(R),5(S)-триацетокси-6(S)-3-[5-(4 фторфенил)тиофен-2-илметил]-4-метилфенилтетрагидропиран-2(R)-илметилацетат (1/15 г). Образовавшуюся смесь перемешивали в течение 6 ч при 55 С, охлаждали приблизительно в течение 15 ч до 1 С,затем в течение 5 ч перемешивали при 1 С. Образовавшийся осадок отфильтровывали, промывали метанолом (2 Х, 46,88 мл), затем сушкой в вакууме при 60 С выделяли титульное соединение в твердом виде. Пример 8. 2-(4-Фторфенил)-5-(5-йод-2-метилбензил)тиофен Следующие реакции проводили в аргоновой атмосфере. Стадия А. 4-Фтор-фенилмагнийбромид. К магнию (19,44 г, 0,8 моль) добавляли 2-Me-THF (80 мл, 0,1 л/моль) и образовавшуюся смесь медленно перемешивали. 1-Бром-4-фтор-бензол (142,8 г, 0,816 моль) растворяли в 2-Me-THF (200 мл, 0,25 л/моль) и 25 мл этого раствора добавляли к взвеси магния. Образовавшуюся смесь нагревали приблизительно до 43 С, оставшийся раствор 1-бром-4-фторбензола добавляли приблизительно в течение 40 мин,нагревая смесь при температуре кипения с обратным холодильником. Капельную воронку, используемую для добавления 1-бром-4-фторбензола, промывали 2-метил-THF (40 мл), промывной растворитель добавляли в смесь. Образовавшуюся смесь перемешивали в течение 1 ч при 90 С, затем охлаждали до 20 С и выделяли коричнево-зеленый раствор, содержащий 4-фтор-фенилмагнийбромид. Стадия В. 2-(4-Фторфенил)тиофен. 2-Бромтиофен (130,4 г, 0,8 моль) растворяли в 2-Me-THF (240 мл, 0,3 л/моль) и образовавшуюся смесь охлаждали до 2 С. Добавляли NiCl2(dppe) (2,11 г, 4,0 ммоль), затем в течение приблизительно 40 мин при 30 С добавляли раствор 4-фтор-фенилмагнийбромида, полученного на стадии А выше, в результате чего образовывался темно-красный раствор. Затем раствор в течение 1,5 ч перемешивали при 22 С. После этого добавляли раствор уксусной кислоты (91,7 мл, 1,6 моль) в воде (240 мл, 0,3 л/моль) и образовавшуюся смесь энергично перемешивали в течение 15 мин. Разделяли образовавшиеся слои, органический слой промывали водой (80 мл, 0,1 л/моль), затем путем концентрации раствора в вакууме при 75 С выделяли 2-(4-фторфенил)тиофен в виде коричневого масла. Стадия С. 2-(4-Фторфенил)-5-(5-йод-2-метилбензил)тиофен. К 91,7 г 5-йод-2-метилбензойной кислоты (91,7 г, 0,35 моль) добавляли DCM (350 мл, 1 л/моль), образовавшуюся гетерогенную смесь перемешивали при 22 С. Затем к образовавшейся смеси через капельную воронку добавляли тионилхлорид (42,5 г, 0,35 моль). Образовавшуюся смесь медленно нагревали с обратным холодильником до температуры кипения (в течение этого времени смесь превращается в бесцветный раствор и наблюдается газовыделение), затем смесь перемешивали в течение 1 ч и охлаждали до 2 С. К образовавшейся смеси добавляли гранулы хлористого алюминия (56,0 г, 0,42 моль), затем в течение 15 мин перемешивали смесь при 2 С. После этого раствор 2-(4-фторфенил)тиофена (0,35 моль,89,7% по весу) в DCM (0,5 л/моль) добавляли через капельную воронку в течение 10 мин и давали смеси при добавлении нагреться до 20 С. Образовавшуюся смесь перемешивали в течение 2 ч при 20 С, затем охлаждали до 2 С. Добавляли дополнительное количество гранул хлористого алюминия (107,3 г, 0,805 моль) и образовавшуюся смесь перемешивали в течение 15 мин. В течение 20 мин при температуре 20 С ацетонитрил (210 мл, 0,6 л/моль) добавляли через капельную воронку. Затем в течение 5 мин через капельную воронку добавляли тетраметилдисилоксан (131,6 г, 0,98 моль). Образовавшуюся смесь медленно нагревали с обратным холодильником до температуры кипения (42 С), кипятили в течение 3 ч и давали охладиться до 22 С, затем перемешивали в течение 16 ч. В течение 30 мин при температуре 35 С добавляли воду (420 мл, 1,2 л/моль), образовавшуюся смесь энергично перемешивали в течение 15 мин. Образовавшиеся слои разделили, органический слой промывали водой (70 мл, 0,2 л/моль), затем концентрацией в вакууме при 50 С титульное соединение выделяли в виде остатка. Остаток (62,0 г, теоретически 0,1 моль) суспендировали в смеси этилацетата (40 мл) и 2-пропанола(50 мл). К образовавшейся смеси добавляли активированный уголь (1,2 г), нагревали смесь с обратным холодильником до температуры кипения и выдерживали при этой температуре в течение 15 мин. Образовавшуюся смесь, не давая ей остыть, фильтровали через фильтрующую среду, фильтр промывали этилацетатом (10 мл), объединяли фильтрат и промывной растворитель и охлаждали смесь в течение 16 ч до 2 С, после чего наблюдали самопроизвольную кристаллизацию. Осадок фильтровали, промывали 2 пропанолом (50 мл) и путем сушки в вакууме при 60 С выделяли титульное соединение - 2-(4 фторфенил)-5-(5-йод-2-метилбензил)тиофен - в твердом виде. Пример 9. 5-(5-(5-Бром-2-хлорбензил)тиофен-2-ил)-2-фторпиридин Стадия А. (6-Фторпиридин-3-ил)магнийбромид. 5-Бром-2-фторпиридин (8,8 г, 50 ммоль) растворяли в азотной атмосфере в сухом THF (50 мл). Затем к образовавшейся смеси приблизительно в течение 30 мин при комнатной температуре добавляли втор-бутил MgClLiCl (15% в THF, 1,5 экв.), образовавшуюся смесь перемешивали в течение 2 ч при комнатной температуре. Стадия В. 2-Фтор-5-(тиофен-2-ил)пиридин. В отдельный реакционный сосуд в азотной атмосфере добавляли NiCl2(dppp) (0,02 экв., 0,60 г) иTHF (50 мл). Добавляли 2-бромтиофен (8,1 г, 4,81 мл, 50 ммоль, 1 экв.), образовавшийся раствор перемешивали в течение 2 мин. Затем к образовавшейся смеси приблизительно в течение 30 мин при 0 С добавляли смесь, полученную на стадии А выше, и давали смеси нагреться до комнатной температуры при перемешивании. После этого к образовавшейся смеси добавляли диэтиловый эфир, охлаждали смесь до 0 С и обрабатывали HCl (1 н.). Образовавшуюся смесь трижды экстрагировали диэтиловым эфиром, отделенный органический слой сушили над MgSO4, затем фильтровали и упаривали фильтрат, выделив 2 фтор-5-(тиофен-2-ил)пиридин в жидком виде. Стадия С. (5-Бром-2-хлорфенил)(5-(6-фторпиридин-3-ил)тиофен-2-ил)метанон. В азотной атмосфере к смеси DCM (30 мл) и 1 капли DMF добавляли 5-бром-2-хлорбензойную кислоту (5,26 г, 22,3 ммоль). Затем к образовавшейся смеси добавляли оксалилхлорид (4,26 г, 2,93 мл, 33,5 ммоль, 1,5 экв.) и перемешивали смесь в течение 2 ч. Образовавшуюся смесь упаривали до остатка, к которому добавляли DCM (30 мл), а затем смесь снова упаривали. Операцию добавления DCM повторяли дважды. К образовавшемуся остатку добавляли по каплям раствор AlCl3 (3,6 г, 1,2 экв.) в DCM (40 мл) и образовавшуюся смесь перемешивали в течение 2 ч при комнатной температуре. Затем прекращали реакцию добавлением воды, образовавшиеся слои разделяли, а водный слой экстрагировали DCM. Объединенные органические фракции промывали K2CO3, затем сушили MgSO4, фильтровали и упариванием выделяли остаток - (5-бром-2-хлорфенил)(5-(6-фторпиридин-3-ил)тиофен-2-ил)метанон. Стадия D. 5-(5-(5-Бром-2-хлорбензил)тиофен-2-ил)-2-фторпиридин. В азотной атмосфере растворяли в DCM (12,5 мл) (5-бром-2-хлорфенил)(5-(6-фторпиридин-3 ил)тиофен-2-ил)метанон (1,96 г, 4,9 ммоль). Затем к образовавшейся смеси добавляли ацетонитрил (12,5 мл) и Et3SiH (2,29 мл, 14,3 ммоль, 2,9 экв.), при этом образовывалась желтая суспензия. Суспензию охлаждали до 0 С, затем добавляли по каплям BF3OEt2 (13,8 ммоль, 1,75 мл, 2,8 экв.). Образовавшуюся смесь оставляли на ночь, в течение этого времени смесь нагревалась до комнатной температуры. Добавляли насыщенный раствор Na2CO3 (6 мл), образовавшуюся смесь экстрагировали хлороформом, разделяли образовавшиеся фазы, органический слой сушили MgSO4 и упариванием выделяли остаток, который растворяли в этилацетате и затем обрабатывали метанолом, что вызвало выпадение осадка. Путем фильтрования осадка выделили титульное соединение - 5-(5-(5-бром-2-хлорбензил)тиофен-2-ил)-2 фторпиридин - в твердом виде. Пример 10. 2-(4-Фторфенил)тиофен си). Образовавшуюся смесь охлаждали до комнатной температуры и перемешивали в течение ночи. Твердый осадок отделяли и отбрасывали. Жидкую фазу промывали водой (2500 мл). Объединенные водные слои экстрагировали диэтиловым эфиром (2500 мл), сушили над NaCl и концентрировали. Однократной перегонкой выделяли титульное соединение в виде белого твердого осадка. Пример 11. К раствору 2-(5-йод-2-метилбензил)-5-(4-фторфенил)тиофена (40,0 г) в безводном THF (200 мл) добавляли раствор i-пропилмагний хлорида/i-пропиллитий хлорида в THF (14,5% по весу, 76,4 г), добавление производили по каплям в потоке N2 при температуре от 0 до 5 С. Смесь перемешивали в течение 1 ч при той же температуре, затем при температуре от 0 до 5 С добавляли ее по каплям к раствору 2,3,4,6 тетракис-О-(триметилсилил)-D-глюкопирано-1,5-лактона (54,9 г; см. патент США 6515117) в безводном THF (80 мл). Реакционную смесь перемешивали в течение 2 ч, затем прекращали реакцию добавлением раствора метансульфоновой кислоты (11,3 г) в метаноле (400 мл) при охлаждении. До завершения добавления смесь перемешивали при охлаждении в течение 2 ч, затем нагревали до комнатной температуры и перемешивали еще в течение 4 ч. Прекращали реакцию, вылив смесь при охлаждении в растворNaHCO3 (4,12 г) в Н 2 О (400 мл). Давали смеси нагреться до комнатной температуры, затем к смеси добавляли н-гептан. После разделения фаз водную фазу экстрагировали этилацетатом и толуолом. Объединенные органические слои промывали 5% водным раствором NaHCO3, сушили безводным MgSO4, фильтрованием выделяли раствор метил 1-С-(3-[5-(4-фторфенил)-2-тиенил]метил-4-метилфенил)-Dглюкопиранозида в этилацетате и толуоле (выход согласно HPLC 80%; колонка Symmetry C18 4,6 мм 150 мм; подвижная фаза: фаза А, 0,1% TFA в H2O; фаза В, 0,1% TFA в CH3CN). К перемешиваемому раствору метил 1-С-(3-[5-(4-фторфенил)-2-тиенил]метил-4-метилфенил)-Dглюкопиранозида (масса нетто 10,54 г) в толуоле и этилацетате при комнатной температуре добавлялиN-метилморфолин (11,9 г) и 4-диметиламинопиридин (217 мг). Раствор охлаждали до 0 С и добавляли по каплям при температуре ниже 15 С уксусный ангидрид (52,7 мл). Давали реакционной смеси нагреться до комнатной температуры и перемешивали в течение 15 ч. Прекращали реакцию добавкой 28%-го водного раствора NH3 (приблизительно 31,6 мл), поддерживая рН в диапазоне 6-7. К смеси добавляли воду и разделяли слои. Органический слой промывали водой и рассолом, сушили безводным MgSO4 и фильтровали. Концентрацией фильтрата в вакууме получили метил 2,3,4,6-тетра-О-ацетил-1-С-(3-[5-(4 фторфенил)-2-тиенил]метил-4-метилфенил)-D-глюкопиранозид (17,59 г) в виде желтого масла.
МПК / Метки
МПК: C07D 333/12, C07C 1/00, C07D 309/10, C07H 7/04, C07H 13/04, C07D 409/10
Метки: ингибиторов, соединений, глюкозы, получения, способ, применимых, переносчика, качестве, нзпг, натрийзависимого
Код ссылки
<a href="https://eas.patents.su/30-21373-sposob-polucheniya-soedinenijj-primenimyh-v-kachestve-ingibitorov-natrijjzavisimogo-perenoschika-glyukozy-nzpg.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения соединений, применимых в качестве ингибиторов натрийзависимого переносчика глюкозы (нзпг)</a>
Предыдущий патент: Гибкий трубчатый элемент (варианты) и способ получения гибкого трубчатого элемента
Следующий патент: Внутренняя облицовка холодильника и способ ее изготовления
Случайный патент: Терапевтическое средство при дислипидемии