Новые антигены gp41
Формула / Реферат
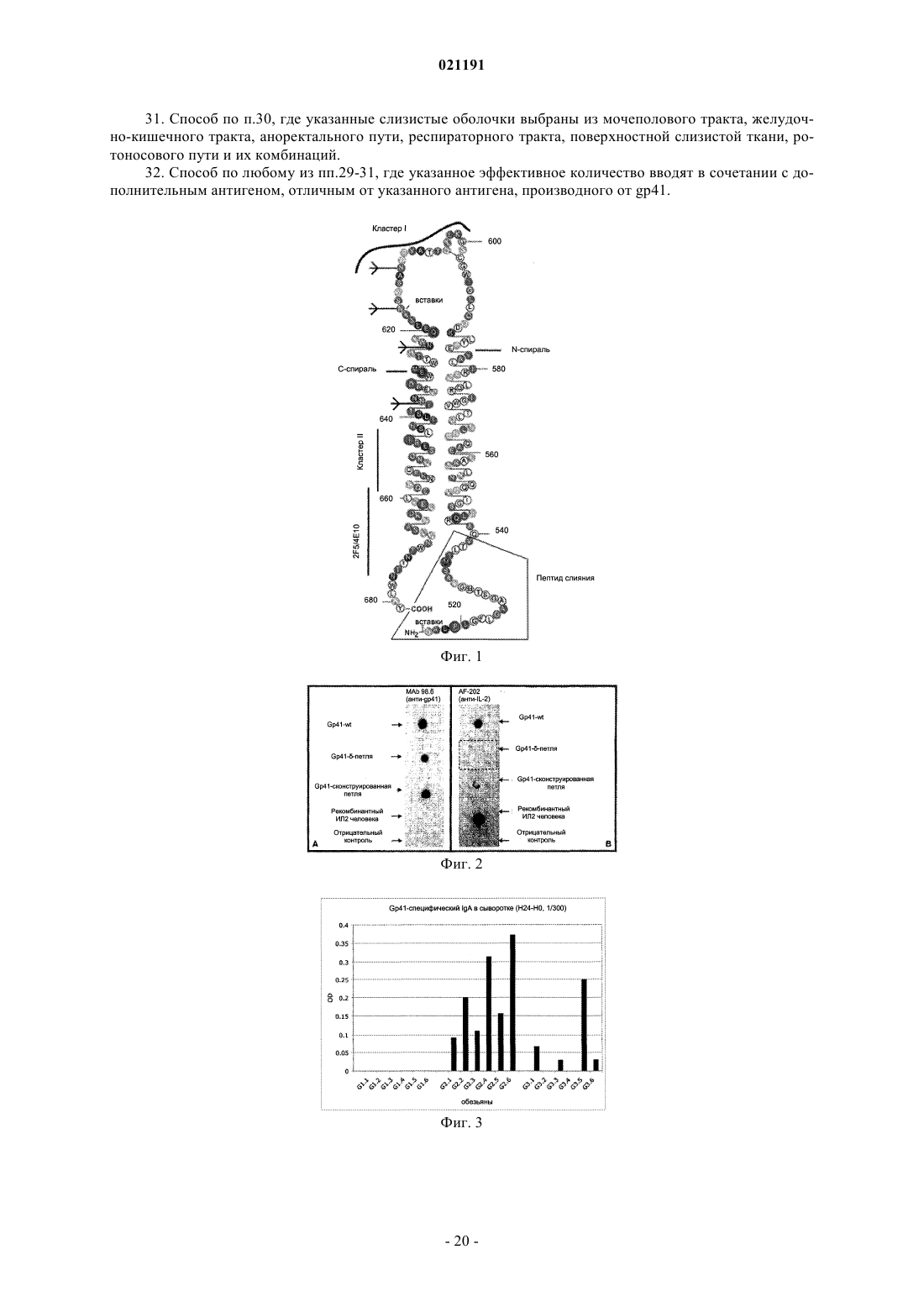
1. Модифицированный полипептид, содержащий три смежных сегмента N, L и С, представленный формулой N-L-C и содержащий N-спиральный участок gp41 (N), С-спиральный участок gp41 (С) и соединительную петлю, содержащую синтетический линкер (L) между N- и С-спиралями, где линкер заменяет аминокислоты 593-617 gp41, где порядок нумерации соответствует прототипу - изоляту штамма ВИЧ-1 НхВ2 клада В и где указанный полипептид содержит кальвеолин-1-нейтрализующий эпитоп и эпитоп 98.6 D, но не содержит эпитопов 2F5 и 4Е10, не является пептидом слияния и обладает минимальной перекрестной иммунногенной реактивностью с ИЛ-2.
2. Полипептид по п.1, дополнительно содержащий S-фрагмент, представленный формулой N-L-C-S, в которой S представляет собой спейсерный фрагмент.
3. Полипептид по п.1 или 2, в котором сегмент N представляет собой аминокислоты 540-592 gp41, где порядок нумерации соответствует прототипу - изоляту НхВ2 ВИЧ-1.
4. Полипептид по любому из пп.1-3, где N представлен на SEQ ID NO: 13 или SEQ ID NO: 14.
5. Полипептид по любому из пп.1-4, где сегмент С представляет собой аминокислоты 618-664 gp41, где порядок нумерации соответствует прототипу - изоляту НхВ2.
6. Полипептид по п.5, где С представлен на SEQ ID NO: 15.
7. Полипептид по п.1, где L представлен на SEQ ID NO: 16.
8. Полипептид по п.2, где S представлен на SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12.
9. Полипептид по п.1, представленный на SEQ ID NO: 17 или 18.
10. Полипептид по п.2, представленный на SEQ ID NO: 19 или SEQ ID NO: 20.
11. Водная композиция, содержащая полипептид по любому из пп.1-10, где указанный полипептид образует тример в водной среде.
12. Водная композиция по п.11, где указанный тример является стабильным.
13. Конъюгат, содержащий полипептид по любому из пп.1-10 и 16, конъюгированный с виросомой.
14. Полинуклеотид, кодирующий полипептид по любому из пп.1-10.
15. Полинуклеотид по п.14, представленный на SEQ ID NO: 21 или SEQ ID NO: 28.
16. Полипептид, кодируемый полинуклеотидом по любому из пп.14, 15.
17. Тример, содержащий три полипептида по любому из пп.1-10 и 16.
18. Экспрессионный вектор, содержащий, по меньшей мере, промотор транскрипции, полинуклеотид по п.14 или 15 и терминатор транскрипции.
19. Клетка-хозяин, содержащая экспрессионный вектор по п.18.
20. Антигенная или иммуногенная композиция, содержащая полипептид по любому из пп.1-10 или 16, или конъюгат по п.13, или тример по п.17.
21. Фармацевтический препарат, содержащий полипептид по любому из пп.1-10 или 16, или конъюгат по п.13, или тример по п.17.
22. Фармацевтический препарат по п.21, содержащий дополнительный антиген, отличный от полипептида по пп.1-16.
23. Фармацевтический препарат по п.22, в котором указанный дополнительный антиген представлен в виде конъюгата.
24. Фармацевтический препарат по п.23, в котором указанный дополнительный антиген конъюгирован с виросомой.
25. Фармацевтический препарат по любому из пп.21-24, где указанный дополнительный антиген представлен на SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6.
26. Применение фармацевтического препарата по любому из пп.21-25 в иммунотерапии.
27. Применение по меньшей мере одного полипептида по любому из пп.1-10 или 16, тримера по п.17 или конъюгата по п.13 для изготовления лекарственного средства, предназначенного для индукции адаптивного иммунного ответа и/или врожденного иммунного ответа, направленного против белка gp41 вируса иммунодефицита человека.
28. Применение одного полипептида по любому из пп.1-10 или 16, тримера по п.17, экспрессионного вектора по п.18 или конъюгата по п.13 и дополнительного антигена, представленного на SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6, в виде конъюгата, где указанный конъюгат более предпочтительно является виросомой, для изготовления лекарственного средства, предназначенного для индукции адаптивного иммунного ответа и/или врожденного иммунного ответа, направленного против белка gp41 вируса иммунодефицита человека.
29. Способ лечения и/или профилактики ВИЧ-инфекции, включающий, по меньшей мере, стадию введения индивидууму, нуждающемуся в этом, эффективного количества полипептида по любому из пп.1-10 или 16, тримера по п.17 или конъюгата по п.13.
30. Способ по п.29, где указанное эффективное количество вводят системно путем инъекции и/или местно через слизистые оболочки.
31. Способ по п.30, где указанные слизистые оболочки выбраны из мочеполового тракта, желудочно-кишечного тракта, аноректального пути, респираторного тракта, поверхностной слизистой ткани, ротоносового пути и их комбинаций.
32. Способ по любому из пп.29-31, где указанное эффективное количество вводят в сочетании с дополнительным антигеном, отличным от указанного антигена, производного от gp41.
Текст
Изобретение относится к модифицированному полипептиду, содержащему три смежных сегментаN, L и С, представленному формулой N-L-С и содержащему N-спиральный участок gp41 (N),С-спиральный участок gр 41(С) и соединительную петлю, содержащую синтетический линкер (L) между N- и С-спиралями, где линкер заменяет аминокислоты 593-617 gр 41, где порядок нумерации соответствует прототипу - изоляту штамма ВИЧ-1 НхВ 2 клада В и где указанный полипептид содержит кальвеолин-1-нейтрализующий эпитоп и эпитоп 98.6 D, но не содержит эпитопов 2F5 и 4 Е 10, не является пептидом слияния и обладает минимальной перекрестной иммунногенной реактивностью с интерлейкином-2 человека (ИЛ-2). Предшествующий уровень техники Настоящее изобретение относится к растворимой и стабилизированной в водной среде форме гликопротеина оболочки ВИЧ-1 gp41, пригодной для индукции иммунного ответа против вируса иммунодефицита человека типа 1 (ВИЧ-1), фармацевтическим композициям, содержащим указанный gp41, способу лечения, направленному против вируса иммунодефицита человека и/или заболеваний или расстройств, ассоциированных с ВИЧ. ВИЧ-1 кодирует предшественник гликопротеина оболочки массой 160 кДа (gp160), который протеолитически расщепляется на внешний (gp120) и трансмембранный (gp41) гликопротеины. В зрелой гликопротеидной оболочке гликопротеин gp120 находится в форме, ассоциированной с эктодоменом gp41 посредством нековалентного взаимодействия. Нативные гликопротеины оболочки ВИЧ-1 существуют преимущественно в виде тримеров на поверхности вирусной мембраны, состоящих из трех gp120 и трех gp41 субъединиц, и заякорены в мембране вируса или инфицированной клетки посредством трансмембранного участка gp41. Показано, что связывание gp120 с рецептором CD4 вызывает конформационные изменения, способствующие последующему взаимодействию с одним из ряда хемокиновых рецепторов (CXCR4, CCR5,). Эти связывания запускают конформационные изменения в gp41. В частности, исследования при помощи рентгенокристаллографии и ядерного магнитного резонанса показывают, что гликопротеин оболочки вируса gp41 существует по меньшей мере в трех конформациях: нативной конформации (шип),префузогенной метастабильной конформации, которая переходит в термостабильную фузогенную конформацию ("три шпильки") вследствие инициирующего события, такого как связывание частицы вируса ВИЧ-1 с мембраной клетки-мишени. Так, связывание gp120 с клеточными корецепторами вызывает переход gp41 из префузогеннной формы в фузогенную. Линейная организация gp41 включает пептид слияния, эктодомен (N-концевую суперспираль, дисульфид-связанный участок петли и С-концевой -спиральный отрезок) и трансмембранный домен. В фузогенном шестиспиральном пучке gp41 три N-концевых спирали формируют трехмерную суперспираль и три С-концевых спирали упакованы в обратном направлении в три гидрофобные бороздки на поверхности суперспирали. Такая спирально-шпилечная структура соответствует конформации gp41 с фузогенной активностью. Поскольку трансмембранный якорь и пептид слияния эктодомена gp41 погружены соответственно в мембраны вируса и клетки-мишени, образование фузогенной шпилечной структуры приводит к колокализации двух мембран и, таким образом, позволяет преодолевать энергетический барьер слияния мембран. Гликопротеины оболочки ВИЧ-1 представляют собой единственную реалистичную мишень для индуцированного вакциной ответа нейтрализующих антител, поскольку они способствуют слиянию вирусной мембраны посредством рецептор-опосредованных конформационных изменений и экспрессируются на поверхности как вирионов, так и инфицированных клеток. Изначально в качестве основных кандидатов для вакцины рассматривались мономерный gp120 ВИЧ-1 и его производные. Однако gp120 ВИЧ-1 является высоковариабельным и, как было неоднократно показано, иммуногенно неэффективным при индукции нейтрализующих антител против клинических изолятов ВИЧ-1. Некоторые из антител, индуцированных мономерами gp120, эффективно связывают собранные тримеры поверхностных гликопротеинов ВИЧ-1. Напротив, gp41 представляет собой чрезвычайно иммунногенный гликопротеин, индуцирующий образование антител практически у всех ВИЧ-инфицированных индивидуумов. Эктодомен gp41 представляет собой наиболее консервативный участок поверхностного мембранного белка ВИЧ-1, который в остальных областях проявляет существенное генетическое разнообразие даже среди близкородственных изолятов. Кроме того, gp41 играет критическую роль в поддержании структуры и инфекционности вирионов ВИЧ-1. Антитела, направленные против структур шестиспирального пучка (фузогенная форма) и прешпильки (префузогенная форма), препятствуют слиянию при определенных условиях. Антитела, имеющие доступ к конформациям пре-шпильки и шестиспирального пучка gp41, будут способны ингибировать опосредованное gp41 слияние. Кроме того, шестиспиральный пучок представляет собой чрезвычайно стабильную структуру. Эти наблюдения позволяют рассматривать gp41 в модифицированной или немодифицированной форме в качестве приемлемой мишени для разработки лекарственных средств и вакцин. В US 6455265 показано, что некоторые производные gp41 могут быть особенно эффективными для получения вакцин для предотвращения патогенных эффектов, связанных с ретровирусной ВИЧинфекцией, при условии, что соответствующие полипептиды имеют эпитопы, обладающие модифицированной антигенностью, так чтобы получать отличный иммунный ответ по отношению к вирусной оболочке и некоторым собственным белкам. Более конкретно, обнаружено, что консервативные и иммуннодоминантные участки ретровирусной оболочки могут быть ответственны за вредный аутоиммунный процесс, особенно в случае ретровирус-1 021191 ной оболочки gp41. Было установлено, что определенные иммуннодоминантные участки gp41 демонстрируют трехмерные структурные аналогии и/или перекрестную реактивность с определенными участками некоторых белков иммунной системы человека и, в частности, с интерлейкином 2 (ИЛ-2). Таким образом, в US 6455265 были предложены модифицированные полипептиды, полученные посредством модифицирования антигенности интересующего эпитопа белка оболочки, для получения различного иммунного ответа по отношению к белку вирусной оболочки и к этим белкам иммунной системы человека, в частности ИЛ-2. В WO 2005/01033 раскрыты такие модифицированные полипептиды по меньшей мере с одним антигенным участком нативного белка ВИЧ gp41. Обычно синтетический gp41 может быть получен в трансфецированном бакуловирусе или клетках млекопитающего, но в меньшем количестве, чем в Е. coli. Кроме того, гликозилирование в бакуловирусе или клетках млекопитающего отличается от гликозилирования в клетках человека и не является необходимым условием иммуногенности белка. Фактически gp41 является сильно иммунногенным без гликозилирования. Однако полноразмерный или укороченный рекомбинантный эктодомен gp41 ВИЧ-1, продуцируемый в Е. coli, обычно образует нерастворимые осадки (агрегаты тримерной формы gp41) в водной среде при нейтральном рН. Все еще существует необходимость получения высоких уровней белков gp41, которые могут быть лишены иммуннодоминантного участка, запускающего антитела без нейтрализующей активности, но сохраняют при этом участки gp41, важные для направления иммунного ответа на соответствующие эпитопы, в целом сохраняющие иммунногенную активность. Однако все еще остается потребность в вакцине, позволяющей индуцировать универсальный иммунный ответ против ВИЧ-инфекции и, в частности, инфекции ВИЧ-1. Также существует необходимость создания вакцин к вирусам, не относящимся к кладу В, например к штаммам клада С. Также существует необходимость создания вакцины с широким спектром ингибирования, дающей возможность перекрестно-кладного ингибирования. Существует потребность в вакцине, позволяющей индуцировать врожденный, и/или гуморальный,и/или клеточный иммунный ответ против инфекции ВИЧ-1. Существует потребность в вакцине, позволяющей индуцировать иммунный ответ против инфекции ВИЧ на уровне слизистых оболочек и в крови. Существует потребность в вакцине, позволяющей индуцировать IgA, и/или антитела слизистой,и/или системные IgA- и/или IgG-антитела, способные препятствовать проникновению ВИЧ через слизистую и ранней клеточной инфекции под слизистой. Существует потребность в вакцине, приемлемой для ингибирования или снижения проникновения ВИЧ через слизистые ткани, например вагинальные слизистые ткани, посредством различных механизмов, таких как трансцитоз и АЗКЦ (антителозависимая клеточная цитотоксичность). Целью изобретения является удовлетворение всех вышеуказанных потребностей. Краткое описание изобретения Более конкретно, настоящее изобретение относится к стабилизированным водорастворимым формам белка gp41. Авторы настоящего изобретения неожиданно обнаружили, что возможно значительно снизить любую иммуннодоминантную перекрестную реакцию с некоторыми белками иммунной системы человека,гидрофобность петли, за счет повышения растворимости и стабильности производных gp41, что дает тримерную растворимую форму gp41 без изменения его иммунногенной реактивности. Кроме того, согласно предпочтительному, но не единственному, воплощению указанные полипептиды легко очищают и прикрепляют к носителю, приемлемому для индукции иммунного ответа против вируса иммунодефицита человека, например виросоме. Подробное описание изобретения Одной из основных целей настоящего изобретения является разработка других модифицированных полипептидов, обладающих улучшенной стабильностью, в мономерной или олигомерной форме, при сохранении их растворимости в водной среде, в частности, когда они прикреплены или связаны с вышеуказанной виросомной частицей. Другой целью настоящего изобретения является разработка других модифицированных пептидов,которые, будучи конъюгированы с виросомоподобной частицей, мимикрируют ориентацию и/или презентирование белка gp41 на нативной вирусной мембране ВИЧ и/или на любой мембране клетки, инфицированной ВИЧ. Другой целью настоящего изобретения является разработка других модифицированных пептидов,обладающих эффективными антигенными, возможно иммунногенными свойствами, которые делают их возможными кандидатами для профилактического лечения, направленного против ВИЧ. Соответственно одним объектом настоящего изобретения является любое антигенное и/или иммунногенное соединение или композиция, содержащие эти другие модифицированные пептиды. Другой целью настоящего изобретения является разработка других модифицированных полипепти-2 021191 дов, эффективно индуцирующих системный IgG (кровь) и возможный комплементарный IgA слизистой,направленных на соответствующие консервативные участки белка gp41, в частности против вариантов ВИЧ различных кладов, например против кладов В и С ВИЧ-1 и различных подтипов среди них. Другой целью настоящего изобретения является разработка других модифицированных пептидов,эффективно индуцирующих протективные антитела и генерирующих в небольшом количестве, или не генерирующих вообще, ненейтрализующие антитела против ВИЧ, или обладающих лучшим или оптимально направленным гуморальным ответом против консервативных участков gp41. Другой целью настоящего изобретения является разработка других модифицированных пептидов,способных блокировать транслокацию вируса через слизистый барьер и/или ингибировать клеточную инфекцию, таким образом предотвращая инфекцию ВИЧ-1. Другая цель настоящего изобретения предусматривает полипептиды, подобные gp41, которые можно подвергать липидизации, т.е. напрямую или не напрямую комбинировать своим С-терминальным концом с приемлемым липидом, в количестве, совместимом с индустриализацией/продукцией любого виросомного конъюгата указанного пептида. Другая цель настоящего изобретения предусматривает полипептиды, подобные gp41, способные быть связанными, т.е. прикрепленными с внешней стороны к виросомо-подобной частице, в количестве,совместимом с индустриализацией/продукцией любого конъюгата указанного пептида. В рамках одного аспекта изобретения предложен модифицированный полипептид, содержащий три смежных сегмента N, L и С, представленный формулой N-L-C и содержащий N-спиральный участок(L) между N- и С-спиралями, где линкер заменяет аминокислоты 593-617 gp41, где порядок нумерации соответствует прототипу - изоляту штамма ВИЧ-1 НхВ 2 клада В и где указанный пептид содержит кальвеолин-1-нейтрализующий эпитоп и эпитоп 98.6 D, но не содержит эпитопов 2F5 и 4 Е 10, не является пептидом слияния и обладает минимальной перекрестной иммунногенной реактивностью с интерлейкином-2 (ИЛ-2). Полипептид по изобретению далее в данном документе взаимозаменяемо называется "антиген,производный от gp41", или "gp41 по изобретению", или "rgp41". Полипептид по настоящему изобретению фактически сохраняет нативную конформацию в результате взаимодействия между N- и С-спиралями и обладает гидрофобностью, обеспечивающей растворимую и стабильную тримерную форму указанного модифицированного полипептида без значительного изменения его иммунногенной реактивности. В контексте настоящего изобретения эпитоп 2F5 соответствует специфическому участку gp41, распознаваемому антителом 2F5 человека, обладающим широкой нейтрализующей активностью в отношении различных первичных изолятов ВИЧ-1 (Trkola A. et al., 1995, J. Virol., 69, р. 6609-6617, см. фиг. 1). Это моноклональное антитело распознает коровый эпитоп из шести аминокислот в пределах относительно консервативной линейной последовательности из 16 аминокислот (NEQELLELDKWASLWN, SEQ IDNO: 7) в эктодомене gp41 около трансмембранного участка молекулы (Parker et al., 2001, J. Virol., 75, р. 10906-10911). Моноклональное антитело человека 4 Е 10 является специфичным для трансмембранного проксимального участка gp41, расположенного в непосредственной близости от карбокситерминального конца по отношению к эпитопу 2F5, и также обладает широкой нейтрализующей активностью (Zwick et al.,2001, J. Virol., 75, p. 10892-10905, см. фиг. 1). Эпитоп 98.6 D расположен в участке gp41 кластера II и распознается моноклональным антителом человека 98.6 D, как описано в Gorny M.K. et al., 1989, Proc. Natl. Acad. Sci., 86, p. 1624-1628 и Xu J.-Y. etID NO: 8) в gp41 (Benferhat et al., 2009, Mol. Immunol. 46(4), p. 705-712). Пептид слияния соответствует аминотерминальному участку gp41, который доступен после образования суперспиральной формы. Этот участок встраивается в мембрану клетки-мишени, что приводит к слиянию вирусной и клеточной мембран; он соответствует участку 512-539 внеклеточной части gp41 (Quintana et al., 2005, JCI; см. фиг. 1). Полипептид согласно настоящему изобретению делает возможным образование тримеров, сохраняет антигенность нативного gp41 и проявляет минимальную перекрестную реактивность с ИЛ-2. Такая перекрестная реактивность может быть определена способами, хорошо известными специалистам в области техники, такими как gp41-ИСФА и gp41-дот-блот. Пример такого определения приведен ниже (см. пример 3, фиг. 2). Согласно настоящему изобретению выражение "сохраняет антигенность нативного gp41" или "без изменения его иммунногенной активности" означает, что полипептид по изобретению обладает практически таким же уровнем антигенной и/или иммунногенной активности, как дикий тип gp41. Участки N и С, составляющие полипептид по изобретению, могут быть получены из любого белкаgp41 ВИЧ, включая штаммы ВИЧ-1 и ВИЧ-2, в том числе лабораторные штаммы и первичные изоляты. Предпочтительно эти участки получают из штамма ВИЧ-1 и, в частности, из штамма НхВ 2 ВИЧ-1, как представлено на SEQ ID NO: 1. Нуклеотидные и пептидные последовательности большого числа белков gp41 известны и доступны,например, в Интернете на сайте http://www.hiv.lanl.gov/, а также в соответствующем кратком руководствеJ., Wolinsky S. and Korber B., Eds., опубликованном в Theoretical Biology and Biophysics Group, Los Alamos National Laboratory, NM, LA-UR 06-0680). Любая последовательность, приведенная выше и/или в формуле изобретения, в которую внесены одна или более консервативных мутаций (незначительно модифицирующих иммуногенность) также включена в вышеуказанное определение. Аминокислоты пронумерованы путем ссылки на последовательность белка gp41, представленного на фиг. 1 (аминокислотная последовательность которого представлена на SEQ ID NO: 1). В более предпочтительном воплощении полипептид по изобретению представляет собой последовательность, представленную на SEQ ID NO: 17 или SEQ ID NO: 18. В еще одном аспекте изобретения полипептид также содержит по меньшей мере один спейсерный пептидный участок S. В еще одном аспекте полипептид по изобретению представлен SEQ ID NO: 19 илиSEQ ID NO: 20 и соответственно назван M0 или М 1. Указанная спейсерная последовательность пригодна для обеспечения лучшей коньюгации, например, связи полипептида с носителем, например, виросомой, путем создания реактивных аминокислот, за счет которых указанная привитая сополимеризация происходит более успешно. В частности, это может позволить дополнительно отдалять аминокислоту(ы), на которой происходит указанная привитая сополимеризация, от мембраны виросомы. Композиция указанного спейсерного участка, например аминокислотная последовательность, также может быть разработана таким образом, чтобы облегчить способ получения полипептида по изобретению. В конкретном воплощении изобретения указанный спейсерный участок может содержать остатки гистидина, которые могут участвовать в этапе очистки целого полипептида (см. пример 1 ниже). Указанный спейсерный пептид содержит, по меньшей мере, аминокислотную последовательность,представленную на SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12, в С-терминальной части полипептида по изобретению. Указанная спейсерная последовательность также может вносить вклад в иммуногенность полипептида по изобретению. В предпочтительных воплощениях N сегмент представлен аминокислотами 540-592 gp41, порядок нумерации согласно прототипу-изоляту НхВ 2 ВИЧ-1, и/или С участок представлен аминокислотами 618664 gp41, порядок нумерации согласно прототипу-изоляту НхВ 2 ВИЧ-1. Согласно предпочтительному воплощению N участок представляет собой последовательность, приведенную на SEQ ID NO: 13 или SEQ ID NO: 14 и/или С участок представляет собой последовательность,приведенную на SEQ ID NO: 15. В еще одном аспекте изобретения указанный фрагмент L представляет собой последовательность,приведенную на SEQ ID NO: 16. Полипептиды по изобретению доступны в форме тримеров. В другом аспекте настоящего изобретения предложена водная композиция, содержащая полипептид по изобретению, где указанный полипептид формирует стабильные тримеры в водной среде. Настоящее изобретение, в частности, как определено в прилагаемой формуле изобретения, включает полипептиды, эквивалентные ранее определенным или описанным, в частности их аналоги, как определено в данном документе ниже при помощи ссылки на другие дополнительные антигены, пригодные для осуществления настоящего изобретения. Как его употребляют в настоящем изобретении, выражение "его аналог" в отношении gp41 производного антигена относится к пептиду, обладающему значительной (по меньшей мере 85%, в частности по меньшей мере 90% и в частности по меньшей мере 95%) идентичностью или гомологией аминокислотной последовательности (т.е. аминокислотный остаток замещен аминокислотным остатком того же семейства, например, одинаковой полярности или заряда) с аминокислотной последовательностью указанного gp41-производного антигена и который обладает сходными или сохраненными биологическими свойствами, в частности, в отношении антиген-связывающей части иммунноглобина, направленными против белка gp41. Согласно вышеописанным характеристикам полипептид по настоящему изобретению образует при растворении растворимые тримеры. По существу, в еще одном аспекте согласно изобретению предложена водная композиция, содержащая полипептид по изобретению, где указанный полипептид образует тример в водной среде. Указанный тример является стабильным в указанной водной композиции. Олигомерное, например тримерное, состояние полипептида по изобретению может быть определено способами, хорошо известными специалистам в области техники, такими как гель-фильтрация, например FPLC, с разделением между 3000 и 600000 Да. Стабильность тримеров, образованных пептидом по изобретению, может быть определена способами, хорошо известными в области техники, такими как несколько циклов замораживания и оттаивания водной композиции, содержащей полипептид по изобретению. Полипептиды по изобретению получают посредством обычных или стандартных способов химического синтеза или генетической инженерии, хорошо известных специалистам в области техники. Согласно одному варианту полипептиды получают посредством химического синтеза: они могут быть синтезированы в виде отдельной последовательности или в виде нескольких субпоследовательностей, которые затем связывают друг с другом. Химический синтез может быть осуществлен в твердой фазе или в растворе, эти два способа синтеза хорошо известны специалистам в области техники. Эти способы, в частности, описаны Atherton и Shepard в "Solid phase peptide synthesis" (IRL press Oxford,1989) и Houbenweyl в "Methoden der organischen Chemie" (Methods inorganic chemistry), опубликованной в Е. Wunsch, Vol. 15-1 и 11, Stuttgart, 1974, и также в последующих статьях, включенных в данный документ посредством ссылки: Р.Е. Dawson et al. (Sience 1994; 266(5186), р. 776-779); G.G. Kochendoerfer et al.(1999; 3(6), p. 665-671); P.E. Dawson et al. (2000, 69, Annu. Rev. Biochem., p. 923-960). Согласно другому варианту полипептиды по изобретению получают при помощи способов генетической инженерии, хорошо известных специалистам в области техники. Если указанные полипептиды по изобретению получают посредством генетической инженерии, они могут содержать на NH2 терминальном конце дополнительный остаток метионина, соответствующий трансляции первого стартового кодона. Более подробно эти способы описаны в Molecular Cloning: молекулярное руководство Maniatis et al.,Cold Spring Harbor, 1989. Обычно применяют способ ПЦР для получения последовательности ДНК, кодирующей полипептиды по изобретению, в форме, которая может быть встроена в экспрессионный вектор. Затем экспрессионный вектор, содержащий интересующую последовательность, применяют для трансформации клетки-хозяина, которая позволяет экспрессировать интересующую последовательность. После этого полученные полипептиды изолируют из культуральной среды при помощи стандартных способов хроматографии, хорошо известных специалистам в области техники. На этапе очистки предпочтительно применяют высокоэффективную жидкостную хроматогафию (ВЭЖХ). Обычно клетки собирают посредством центрифугирования в конце культивирования и помещают в нейтральный буфер для того, чтобы разрушить с помощью любого приемлемого средства. После этого клеточный лизат центрифугируют с целью отделения растворимого материала от нерастворимого. SDS-PAGE анализ супернатанта и осадка после центрифугирования выявляет, является ли полипептид растворимым, или нет. Если пептид нерастворим, то повышения растворимости достигают при помощи буфера, содержащего мочевину, гуанидин или любой другой растворитель. Центрифугирование на этом этапе дает возможность удалить остатки органических веществ и другие нерастворимые продукты, которые будут препятствовать хроматографии. Следующий этап заключается в нанесении растворенных молекул на колонку для аффинной хроматографии, которая может быть металло-хелатного типа, если количество гистидиновых остатков такое же, как в линкерном участке L, который может быть интегрирован в интересующий полипептид. Система, дающая возможность аффинной очистки, может быть различной по своей природе, например иммунноафинная, аффинная к цибакрону синему и т.д. На данном этапе полипептид демонстрирует степень очистки, близкую к или большую 80%, в частности по меньшей мере 90%, как может быть определено посредством колориметрии при SDS-PAGE электрофорезе с последующим выдерживанием в Кумасси голубом. Денситометрическое измерение полос дает возможность вычислить степень очистки. Степень очистки также может быть измерена посредством обратно-фазовой ВЭЖХ, посредством измерения области различных пиков. Может быть добавлен дополнительный этап хроматографии с целью дальнейшей очистки полипептида, например, посредством описанной гель-фильтрации или обратно-фазовой хроматографии. В еще одном воплощении изобретение описывает полинуклеотид, кодирующий полипептиды, определенные выше. Полинуклеотиды согласно настоящему изобретению включают как одноцепочечные, так и двуцепочечные молекулы ДНК/РНК. В еще одном аспекте настоящего изобретения полинуклеотид, кодирующий rgp41 по настоящему изобретению, имеет последовательность SEQ ID NO: 21 или SEQ ID NO: 28. Дополнительные последовательности ДНК, кодирующие модифицированные полипептиды, попадающие в объем настоящего изобретения, могут быть легко получены специалистами в области техники на основании генетического кода и полипептидных последовательностей, приведенных в настоящем описании. С другой стороны, любому специалисту в области техники очевидно, что среди молекул полипептидов, кодируемых молекулами полинуклеотидов по настоящему изобретению, в частности полинуклеотидными последовательностями, приведенными в настоящем описании, возможны вариации последовательности с учетом вырожденности генетического кода. Все эти вариации включены определением(ями) изобретения и прилагаемой формулой изобретения,если эти вариации не изменяют значительно структуру/конформацию, и/или функцию(ии), и/или свойства получаемого полипептида по отношению к таковым, описанным ранее отдельно и/или ниже в данном документе. Согласно одному воплощению изобретения полинуклеотидную последовательность по изобретению напрямую химически синтезируют (Young L. and Dong Q., 2004, Nucleic Acids Res., Apr 15; 32(7),Hoover D.M. and Lubkowski J., 2002, Nucleic Acids Res., 30, Villalobos A., et al., 2006. BMC Bioinformatics,Jun 6; 7:285). Полинуклеотидные последовательности по изобретению, полученные таким образом, могут быть встроены известным способом в любой подходящий вектор, дающий возможность экспрессировать указанный полипептид, если необходимо, в модифицированной форме, в подходящих клеточных системах. Полинуклеотидные последовательности, полученные таким образом, могут быть введены в хозяйскую клетку для трансформации хозяина и обеспечения экспрессии (например, транскрипции и трансляции) введенной последовательности. Векторы включают плазмиды, фаги и т.д. Предпочтительно применяют вектора, в которых последовательность ДНК, кодирующая полипептид по изобретению, находится под контролем сильного промотора, который может быть индуцибельным или неиндуцибельным. В качестве примера промотора, который может быть применен, упоминают промотор РНК полимеразы Т 7. Экспрессионные векторы могут включать селекционный маркер, такой как гены устойчивости к ампицилину, тетрациклину или другим антибиотикам для применения людьми. С другой стороны, трансформированные клетки могут быть отобраны с помощью маркера ауксотрофности или способа селекции любого типа, не основанного на антибиотиках (комплементация жизненно необходимого гена, предварительно нокаутированного, в геноме хозяина). Примеры экспрессионных векторов, которые могут применяться, включают плазмиды рЕТ 21b,рЕТ 30 (Novagen), векторы дрожжей, бактерий, вирусов, таких как бакуловирусы и поксвирусы. Для обеспечения экспрессии и очистки полипептида по изобретению последний может быть экспрессирован в модифицированной форме, такой как гибридный белок, и может включать не только секреционные сигналы, но также дополнительные гетерологичные функциональные участки. Например, для улучшения его стабильности и сохранности полипептида в хозяйской клетке на N-конце может быть добавлен участок дополнительных аминокислот, в том числе заряженных аминокислот. Целью изобретения также является экспрессионный вектор, содержащий полинуклеотид, как описано выше. Указанный вектор может быть применен для трансформации организма хозяина, где указанный организм хозяина представляет собой другую цель настоящего изобретения. Согласно изобретению также предложена хозяйская клетка, трансформированная при помощи указанного вектора. Может быть использована любая хозяйская клетка, обычно применяемая в сочетании с экспрессионными векторами, описанными ранее, например Е. coli, BL21 (DE3), BLR (DE3), origami 2(DE3), Bacillus или другие грам-положительные хозяева, такие как Lactococcus lactis, дрожжи, бакуловирус и эукариотические клетки, такие как СНО (клетки яичника китайского хомячка) или Vera. Предпочтительные клеточные экспрессионные системы включают Е. coli, такую как BL21 (DE3). В другом аспекте настоящего изобретения предложен конъюгат, содержащий полипептид по настоящему изобретению. В еще одном аспекте полипептид по изобретению конъюгирован с виросомоподобной везикулой. Виросомоподобная везикула. Виросомоподобная везикула, приемлемая для настоящего изобретения, содержит, по меньшей мере,виросомальные липиды и предпочтительно проявляет свойства мембран слияния. Согласно одному воплощению виросомоподобная везикула по изобретению может содержать моноламеллярный липидный бислой. Согласно еще одному воплощению виросомоподобная везикула по изобретению может быть биили мультиламеллярной везикулой. Согласно еще одному воплощению виросомоподобная везикула может иметь диаметр, как правило,в пределах от 50 до 600 нм и, в частности, диаметр от 100 до 300 нм и, в частности, от 300 до 400 нм. Виросомоподобные везикулы по изобретению могут быть сферическими однослойными везикулами со средним диаметром приблизительно 150 нм. Виросомоподобные везикулы содержат инкорпорированные в липидный бислой белки вирусной мембраны, имеющие или не имеющие свойства слияния, или их фрагменты. Выражение "белки слияния или их фрагменты" относится к белкам или их фрагментам, способным индуцировать и/или обеспечивать реакцию слияния между мембраной виросомоподобной везикулы и биологической мембраной клетки-мишени. Например, белки слияния могут представлять собой мембранные гликопротеины вируса гриппа, такие как гемагглютинин (ГА). Согласно одному воплощению могут использовать по меньшей мере два различных белка слияния или их фрагменты, которые могут проявлять различные характеристики слияния. Согласно другому воплощению различные характеристики слияния могут представлять собой, например, различную чувствительность к температуре, к концентрации ионов, к кислотности, к типу клеточной или тканевой специфичности. Согласно одному воплощению виросомоподобная везикула может содержать белки слияния, опо-6 021191 средующие слияние при двух различных температурах. Согласно другому воплощению для построения виросомоподобной везикулы из различных штаммов вирусов может быть использован гемаглютинин(ГА). Например, молекулы ГА из вирионов Х-31 и PR8/34 могут быть способными катализировать две различные реакции слияния при разных температурах. Белки слияния с различными характеристиками слияния могут быть получены из различных штаммов вируса гриппа или белки слияния могут быть получены из различных вирусов, таких как белок EI вируса везикулярного стоматита (ВВС), поверхностный белковый комплекс вируса леса Семлики (ВЛС) или белок F вируса Сендай. Антиген, соединенный с мембраной виросомоподобной везикулы, может быть деградирован при помощи эндосомы и может быть презентирован иммунной системе посредством рецепторов МНС классаII. Антиген, содержащийся внутри полости виросомы, может быть доставлен в цитозоль антигенпрезентирующей клетки посредством слияния мембран и деградирован в цитозоле, после чего он может быть презентирован как антиген молекулами МНС класса I. Также может происходить перекрестная презентация антигенов, доставляемых виросомами. Таким образом, виросомоподобная везикула может быть способной индуцировать гуморальный и/или клеточный иммунный ответ. В частности, виросомоподобная везикула может индуцировать продукцию IgA-антител, таких как секреторный IgA, а также IgG или IgM. Протоколы приготовления хорошо известны специалистам в области техники. Приемлемые протоколы приготовления виросом описаны, например, в WO 2004/045582 или ЕР 0538437, ЕР 1633395, ЕР 1594466, включенных в данный документ посредством ссылки. Согласно одному воплощению виросомоподобные везикулы по изобретению могут быть получены либо из виросомных везикул как таковых, либо из везикул, образующихся в результате слияния виросомной везикулы с липосомной везикулой. Приготовление виросомных везикул может быть осуществлено посредством любого способа, известного специалистам в области техники, такого как описанный в Stegmann et al., EMBO J., 6, 1987, no. 9, 2651-9 или de Jonge et al., Biochim. Biophys. Acta, 1758, 2006, 527-539, включенных в данный документ посредством ссылки. Виросомные везикулы могут быть восстановлены, например, из липидов оригинальной вирусной мембраны или гликопротеинов вирусной мембраны после растворения, например интактного вируса гриппа, при помощи моно-N-додецилового эфира октаэтиленгликоля (OEG), осаждения нуклеокапсида (вирусные гликопротеины и липиды остаются в супернатанте) и удаления детергента из супернатанта при помощи гидрофобной смолы (Bio-Beads SM2) (Stegmann Т., et al., EMBO J., 6, 1987,2651-9). Виросомы также могут быть восстановлены из оригинальных вирусных мембран посредством растворения вирусных мембран при помощи короткоцепочечного фосфолипида, осаждения нуклеокапсида(только гликопротеины вирусных мембран и липиды остаются в супернатанте) и удаления короткоцепочечного липида из супернатанта посредством диализа. После растворения вируса при помощи детергента или короткоцепочечного фосфолипида и удаления нуклеокапсида, как описано ранее, в супернатант перед удалением детергента или короткоцепочного липида могут быть добавлены антигены или адъюванты, растворимые в детергенте или короткоцепочечном фосфолипиде, что приводит к инкорпорированию антигена или адъюванта в формируемую таким образом виросому. Аналогично, в супернатант могут быть добавлены липиды, растворимые в детергенте или короткоцепочечном фосфолипиде, для включения в вирусную мембрану. Приготовление виросомных везикул, содержащих белки слияния из различных вирусов, может быть осуществлено посредством смешивания супернатантов, содержащих растворенные вирусные мембраны, как описано ранее, или посредством добавления очищенных белков слияния в такой супернатант до указанного удаления детергента или короткоцепочечного липида. Согласно одному воплощению виросомоподобная везикула по изобретению может быть получена в результате слияния виросомной везикулы с липосомной везикулой. Таким образом, согласно одному воплощению виросомоподобная везикула по изобретению может содержать виросомальные и липосомальные липиды. Согласно одному воплощению виросомоподобная везикула по изобретению может содержать липидный бислой, включающий липиды, выбранные из катионных липидов, синтетических липидов, гликолипидов, фосфолипидов, глицерофосфолипидов, гликосфинголипидов, подобных галактозилцерамиду, сфинголипиды, холестерол и их производные. Фосфолипиды могут включать, в частности, фосфатидилхолин, сфингомиелин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилглицерол, фосфатидную кислоту, кардиолипин и фосфатидилинозитол с различным жирно-кислотным составом. Катионные липиды могут быть выбраны из DOTMA (N-(1-(2,3-диолеилакси)пропил)-N,N,Nтриметил аммоний хлорид), DOTAP (N-(1-(2,3-диолеоилокси)пропил)-N,N,N-триметиламмоний хлорид,DODAC (N,N-диолеил-N,N-диметиламмоний хлорид), DDAB (дидодецилдиметиламмоний бромид) и стеариламина или других алифатических аминов и др. Липиды, применяемые в изобретении, могут быть представлены в виде небольших однослойных липосом в смеси с DOPE (диолеоилфосфатидил-этаноламин), который широко применяют в качестве вспомогательного липида, способствующего разрушению эндосомальной мембраны. Согласно другому воплощению для улучшения устойчивости и/или изоляции везикул также может быть применен коэмульгирующий агент. Например, указанный коэмульгирующий агент может быть приготовлен из холестерола и производных, таких как, например, заряженный холестероловый эфир или нейтральный холестеринсульфат; производных со стероловой основой, например производные из растений, такие как фитостеролы (ситостерол, сигмастерол), церамиды и их смеси. Виросомы или их содержимое могут подвергать гидролизу и физической деградации при хранении. Согласно одному воплощению виросомы могут быть сохранены для длительного хранения посредством лиофилизации и восстановлены перед применением при помощи водного раствора. Лиопротектанты,такие как инулин, могут быть добавлены непосредственно перед лиофилизацией, чтобы обеспечить сохранность целостности виросомы в течение лиофилизации и при восстановлении (Wilschut J. et al., J.Liposome Res. 17, 2007, 173-182). Предпочтительно применяют лиофильную сушку (Amorij J.P. et al.,Vaccine 17, 2007, 8707-17). Виросомоподобная везикула по изобретению может дополнительно содержать группировку таргетинга, нацеливающую указанную везикулу на специфичную клетку или ткань. Согласно одному воплощению виросомоподобная везикула по изобретению дополнительно может содержать группировку таргетинга, нацеливающую указанную везикулу на специфичную клетку или ткань. Приемлемая группировка таргетинга может быть выбрана из рецептора клеточной поверхности,хемокина, цитокина, фактора роста, антитела или фрагмента антитела, пептидной последовательности со специфичностью или удельным зарядом, комплементарным молекуле адгезии, такой как интегрин. Группировка таргетинга может быть инкорпорирована в или прикреплена к липидному бислою указанной везикулы посредством любых способов, известных специалистам в области техники. Согласно одному воплощению антиген, локализованный на внешней поверхности виросомоподобной везикулы по изобретению, может быть ковалентно связан с липидом указанной виросомоподобной везикулы или включен в липидный бислой указанной виросомоподобной везикулы посредством трансмембранного пептидного домена. Согласно одному воплощению антиген может содержаться внутри виросомы. Модификации антигена по изобретению и способы перекрестного связывания указанного модифицированного антигена с внешней поверхностью виросомоподобной везикулы могут представлять собой таковые, описанные в WO 2004/078099. Согласно одному воплощению антиген может быть ковалентно присоединен к внешней поверхности виросомоподобной везикулы посредством перекрестного связывания с липидом или фосфолипидом. Согласно другому воплощению антиген может быть присоединен к внешней поверхности виросомоподобной везикулы посредством перекрестного связывания с карбогидратом. Согласно одному воплощению ковалентносвязанный антиген может содержать по меньшей мере один С-терминально расположенный перекрестно-связывающий остаток. Например, перекрестно-связывающий остаток может быть выбран из цистеина (Cys) или лизина(Lys). Согласно другому воплощению ковалентносвязанный антиген может дополнительно содержать по меньшей мере один спейсерный остаток между указанными С-терминально расположенными перекрестно-связывающими остатками и соответствующим С-концом антигена. Приемлемый спейсерный остаток может быть выбран, например, из остатков Gly (глицина), Ala(аланина), Ser (серина), Asp (аспартата), Lys (лизина), Gln (глутамина), His (гистидина), Ile (изолейцина) и Leu (лейцина). Спейсерные остатки с 2 по 12, в частности с 3 по 10 и в особенности с 4 по 8, могут быть связаны для образования спейсерных последовательностей. Приемлемые спейсерные последовательности могут быть выбраны, например, из Gly-Gly или Lys-Gly. Поперечное связывание антигена с поверхностью виросомоподобной везикулы может быть осуществлено при помощи амфифильных производных ПЭГ, фосфатидилэтаноламина (ФЭ), фосфатидилхолина (ФХ), фосфатидилсерина, холестерола или их смеси, легко включаемых в липидный бислой. Поперечное связывание антигена с липидом виросомоподобной везикулы по изобретению может быть осуществлено посредством любого способа, известного специалистам в области техники. Поперечное связывание может быть проведено в липидном растворе и липид-пептидном конъюгате, который может быть впоследствии включен в виросомоподобную везикулу. Согласно воплощению изобретения антиген может быть связан с липидом везикулы по изобретению, например, посредством бифункционального сукцинатного линкера, в частности Nгидроксисукцинимидного эфира-(гамма)малеимидобутирилокси-сукцинимид-эфира. Антигены, липидсвязанные антигены, фосфолипиды и адъюванты могут быть добавлены к супернатанту, образующемуся после растворения вируса при помощи детергента или короткоцепочечного фосфолипида и удаления нуклеокапсида, как описано выше. Затем могут быть сформированы виросомы,как описано ранее, посредством удаления детергента, например, при помощи Bio-Beads SM-2 (Biorad),-8 021191Amberlyte ХМ, или короткоцепочечный фосфолипид могут удалять посредством диализа. Неожиданно оказалось, что ни один конъюгат, полученный, как описано выше, не оказывает существенного влияния ни на структуру/конформацию, ни на свойства, ни на функцию(и) полипептида по изобретению, в частности на его способность к тримеризации. Неожиданно оказалось, при растворении в водной среде указанные конъюгаты и, следовательно,указанные полипептиды остаются в растворенном состоянии и являются стабильными. Таким образом,водные композиции, содержащие указанные конъюгаты, подлежащие растворению в водной среде, непосредственно включены в настоящее изобретение. Согласно другим его аспектам настоящее изобретение относится к фармацевтическому препарату,обычно содержащему любой полипептид gp41 по изобретению, какую-либо его химическую/физическую форму и/или какие-либо фармацевтические адъюванты или эксципиенты. В еще одном воплощении фармацевтический препарат в качестве активного вещества содержит, по меньшей мере, полипептид по изобретению, или конъюгат, как описано выше, или экспрессионный вектор, позволяющий осуществлять экспрессию полипептида по изобретению. Такие фармацевтические препараты по возможности содержат водную композицию по изобретению. Для фармацевтических целей по изобретению может быть применен ряд водных сред, например вода, буферная вода, 0,4% солевой раствор, 0,3% глицин, гиалуроновая кислота и др. Фармацевтический препарат может быть стерилизован посредством обычных хорошо известных способов стерилизации или посредством стерильного фильтрования. Фармацевтические препараты по изобретению могут быть упакованы для применения как есть, или в лиофилизированной форме, при этом лиофилизированный препарат перед введением комбинируют со стерильным раствором. Фармацевтический препарат по изобретению, при необходимости, может содержать фармацевтически приемлемые вспомогательные вещества для обеспечения физиологических условий, такие как агенты для подведения рН и буферные агенты, агенты, регулирующие тоничность, увлажняющие агенты и др., например ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитанмонолаурат, триэтаноламинолеат и др. Фармацевтический препарат по изобретению может содержать полипептид, или его тример, или его конъюгат, или дополнительный антиген, являющийся производным gp41, в количестве, эффективном для лечения пациента, нуждающегося в этом. Указанный дополнительный антиген gp41 отличен от полипептида по изобретению. В более конкретном воплощении указанный дополнительный антиген существует в виде конъюгата и более конкретно связан с виросомой. Эффективное количество представляет собой такое количество полипептида или конъюгата по изобретению, которое отдельно или вместе с дополнительными дозами может стимулировать желаемый ответ. Эффективное количество зависит от различных факторов, таких как путь введения, однократное или многократное введение, и индивидуальных параметров пациента, таких как возраст, физическое состояние, размер, масса и стадия заболевания. Эти факторы хорошо известны специалистам в области техники и могут быть рассмотрены в ходе стандартного исследования. Таким образом, согласно одному воплощению препарат может содержать полипептиды, или их тримеры, или их конъюгаты по изобретению сами по себе или в сочетании по меньшей мере с одним адъювантом, как описано ранее. Указанный антиген является отличным от такового или таковых rgp41 по изобретению. Указанный антиген также отличен от такового или таковых, в частности ГА, содержащегося в указанных виросомах. Дополнительный антиген представляет собой, например, любую часть белка gp41, а также белокgp41, отличный от участков 540-592 и 618-664, где порядок нумерации основан на прототипе - изоляте клада В ВИЧ-1 НхВ 2 в его целостности, и их аналоги. Указанный дополнительный антиген может происходить из ВИЧ-1 любого клада, в предпочтительном воплощении указанный дополнительный антиген происходит из gp41 клада В или клада С. Согласно одному воплощению антиген, производный от gp41, приемлемый в качестве дополнительного антигена для изобретения, лишен свойства слияния по отношению к клеточной мембране клетки-мишени. Согласно одному воплощению указанный антиген, производный от gp41, ковалентно связан с внешней поверхностью виросомоподобной везикулы, как описано ранее для конъюгатов по настоящему изобретению, содержащих виросомы и виросомоподобные частицы. Согласно одному воплощению указанный антиген, производный от gp41, представляет собой пептид, называемый Р 1. Пептид Р 1 соответствует аминокислотной последовательности, присутствующей в эктодомене поверхностного белка gp41 ВИЧ, локализованного на поверхности вирусных частиц до взаимодействия вируса с клетками-мишенями. Например, в штамме НхВ 2 ВИЧ-1 эта последовательность состоит из аминокислот с 649 по 683, где порядок нумерации основан на прототипе - изоляте штамма из клада В НхВ 2 ВИЧ-1. В предпочтительном воплощении указанный пептид Р 1 описан полностью или частично посредством последовательности, выбранной из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 6 или их аналога, как описано в WO 2007/099446, содержание которого включено в данный документ посредством ссылки. В качестве примера антигена Р 1, приемлемого для изобретения, может быть приведена пептидная последовательность Р 1, дополнительно содержащая трехаминокислотный спейсер L-G-C или L-S-C в Стерминальном положении, как, например, описанная на SEQ ID NO: 4 или SEQ ID NO: 5. В конкретном воплощении фармацевтический препарат по настоящему изобретению применяют при иммунотерапии, в частности профилактической иммунотерапии. Фармацевтический препарат по изобретению содержит полипептид или конъюгат по изобретению в количестве, эффективном для лечения нуждающегося в этом пациента. В дальнейшем воплощении фармацевтический препарат, как определено ранее, может применяться при иммунотерапии, в частности профилактической иммунотерапии. Согласно другому воплощению фармацевтический препарат по изобретению может содержать дополнительный антиген, отличный от указанного полипептида или указанного конъюгата по изобретению, в качестве комбинированного препарата для единовременного, отдельного или последовательного применения при иммунотерапии. Согласно другим его аспектам настоящее изобретение также относится к применению по меньшей мере одного полипептида gp41, конъюгата или экспрессионного вектора в соответствии с настоящим изобретением, для производства лекарственного средства, предназначенного для индукции адаптивного иммунного ответа и/или врожденного иммунного ответа, направленного против белка gp41 вируса иммунодефицита человека (ВИЧ). В предпочтительном воплощении применяемый полипептид gp41 представлен на SEQ ID NO: 19 или SEQ ID NO: 20 в связанной с виросомой форме. В еще одном воплощении изобретения описано применение одного полипептида, тримера, экспрессионного вектора или конъюгата по изобретению и дополнительного антигена в виде конъюгата, где указанный конъюгат наиболее предпочтительно является виросомой, для изготовления лекарственного средства, предназначенного для индукции адаптивного иммунного ответа и/или врожденного иммунного ответа, направленного против белка gp41 вируса иммунодефицита человека, где указанный дополнительный антиген наиболее предпочтительно представлен на SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4,SEQ ID NO: 5 или SEQ ID NO: 6. Такие фармацевтические препараты обычно могут содержать фармацевтически приемлемые концентрации солей, буферных агентов, антиоксидантов, консервантов, совместимых носителей, адъювантов, как описано ниже, и дополнительно другие терапевтические агенты. Адъюванты. Согласно одному воплощению иммуностимулирующий эффект полипептида или конъюгата по изобретению по возможности повышают посредством ассоциации этих полипептида и конъюгата по меньшей мере с одним адъювантом. Согласно одному воплощению иммуностимулирующий эффект виросомоподобных везикул по изобретению может быть дополнительно повышен за счет ассоциации этих виросомоподобных везикул по меньшей мере с одним адъювантом. Указанный адъювант может быть инкапсулирован внутри, и/или инкорпорирован в липидный бислой, и/или свободно комбинирован с указанной везикулой. Согласно одному воплощению виросомоподобная везикула может дополнительно содержать по меньшей мере один адъювант, усиливающий и/или опосредующий иммунный ответ, выбранный из врожденного иммунного ответа и/или адаптивного иммунного ответа. Применяемые адъюванты могут усиливать иммунный ответ посредством активирования антигенпрезентирующих клеток (АПК), макрофагов и/или стимуляции специфических типов лимфоцитов. Адъювант, который может быть использоваться в настоящем изобретении, может представлять собой любой лиганд, приемлемый для активации рецептора, распознающего патоген (PRR), экспрессируемого в или на дендритных клетках (ДК), Т-клетках, В-клетках или других антигенпрезентирующих клетках. Для цели изобретения могут быть пригодны лиганды, активирующие путь рецептора нуклеотидсвязывающего олигомеризационного домена (NOD). Адъюванты, приемлемые для этих лигандов, могут представлять собой мурамил-дипептидные производные. Лиганды, активирующие Toll-подобные рецепторы (TLR), также могут использоваться для цели изобретения. Эти рецепторы являются членами семейства PRR и широко экспрессируются на различных врожденных иммунных клетках, включая ДК, макрофаги, тучные клетки и нейтрофилы. В качестве примера лигандов, активирующих TLR, могут быть указаны для TLR4 - монофосфорил липид А, 3-О-деацитилированный монофосфорил липид А, ЛПС из E. coli, таксол, RSV белок слияния и хозяйские белки теплового шока 60 и 70, для TLR2 - липопептиды, такие как N-пальметоил-S2,3(биспальметоилокси)-пропил-цистеинил-серил-(лизил)3-лизин, пептидогликан Staphylococcus aureus,липопротеины М. tuberculosis, зимозан Sacharomyces cerevisiae и высокоочищенный ЛПС P. gingivalis,для TLR3 - дцРНК, для TLR5 - флагеллин, для TLR7 - синтетические соединения, такие как имидазохинолины, и для TLR9 - определенные типы CpG-богатой ДНК. Другие полезные для изобретения адъюванты могут быть эпитопами Т-хелперов. Т-хелперный эпитоп представляет собой пептид, обычно получаемый из экзогенных белков, кото- 10021191 рые прошли протеолитическую деградацию и процессинг по эндоцитарному пути антигенпрезентирующих клеток (АПК). В таких клетках главный комплекс гистосовместимости класса II (МНС II) ассоциирован с этими пептидами в эндосомах. Этот комплекс, транспортируемый к поверхности АПК, может взаимодействовать со специфичным Т-клеточным рецептором Т-лимфоцитов CD4, что приводит к их активации. В соответствии с типом хелперного эпитопа Т-клеточный ответ может быть типа Тх 1 и/или Тх 2, как известно в области техники. В качестве примера эпитопа Т-хелпер-ориентированного ответа можно упомянуть один пан-DRхелперный Т-клеточный эпитоп (PADRE). Этот эпитоп сконструирован так, что он связывает наиболее распространенные молекулы HLA-DR с высокой аффинностью и действует как сильный иммуноген. Показано, что эпитоп PADRE HTL увеличивает эффективность вакцин, разработанных для стимуляции клеточного иммунного ответа (Alexander J. et al., Immunol. Res. 18, 1998, 79-92). Согласно одному воплощению адъювант, который может быть использован с виросомоподобными везикулами согласно настоящему изобретению, может быть выбран из солей алюминия, фосфатных гелей алюминия, микобактерий, таких как BCG, M. vaccae или Corynebacterium parvum, пептидов, гемоцианина лимфы улитки, интерлейкина-2 (ИЛ-2), ИЛ-12, GM-CSF (колониестимулирующего фактора гранулоцитов-макрофагов), лигандов хемокинового семейства, таких как RANTES (хемокин, экспрессируемый и секретируемый нормальными Т-клетками при активации), липопротеина грам-бактерий, компонента клеточной стенки дрожжей, двуцепочечной РНК, липополисахарида грам-бактерий, флагеллина,богатой U одноцепочечной вирусной РНК, CpG-содержащей ДНК, супрессора цитокинового сигналинга малой интерферирующей РНК 6f (SOCS siRNA), меллитин-производных пептидов, пан-DR-эпитопа(PADRE) и их смеси. Такие препараты обычно могут содержать фармацевтически приемлемые концентрации солей, буферных агентов, антиоксидантов, консервантов, совместимых носителей, адъювантов, таких как описанные ранее, и, возможно, другие терапевтические агенты. В одном воплощении полипептид или конъюгат по изобретению может применяться для изготовления фармацевтического препарата, подлежащего введению в виде вакцины. Может быть использован любой стандартный протокол иммунизации из области техники. Как таковая, антигенная и иммунногенная композиция по изобретению содержит полипептид, конъюгат или тример по изобретению. Фармацевтические препараты по изобретению, содержащие композицию, могут быть введены системно посредством инъекции, или местно через слизистые оболочки, или с помощью комбинации обоих путей. Инъекционный путь может представлять собой, например, интраперитонеальный, интрадермальный, подкожный, внутривенный или внутримышечный пути. Может быть использован любой путь введения через слизистые оболочки, такой как введение через мочеполовой путь, аноректальный путь, респираторный путь, через поверхностную слизистую ткань,ротоносовой путь и их сочетания. В одном воплощении фармацевтический препарат по изобретению представлен в виде лекарственных форм для перорального применения, таких как таблетки, капсулы (где все вышеуказанное включает препараты с повременным высвобождением и замедленным высвобождением), пилюли, порошки, гранулы, эликсиры, настойки, растворы, суспензии, сиропы и эмульсии. Все эти формы хорошо известны специалистам в области фармацевтики. Согласно одному воплощению целью изобретения является индукция системного IgA- и IgGиммунного ответа человека и/или IgA- и IgG-иммунного ответа на слизистых оболочках против вируса ВИЧ при помощи полипептида по изобретению или его конъюгата. IgA на слизистых оболочках может быть результатом смешивания между системным IgA- и секреторным IgA-ответом. Согласно другому воплощению целью изобретения является ингибирование или уменьшение трансцитоза ВИЧ, в частности, на уровне слизистых оболочек, таких как мочеполовой тракт, желудочно-кишечный тракт, аноректальный путь, респираторный тракт, поверхностная слизистая ткань, ротоносовой путь и их сочетания. В контексте настоящего изобретения выражение "адаптивный иммунный ответ" относится к иммунному ответу, зависящему от активации компонента иммунной системы, подразумевая специфичность и память по отношению к антигену или патогену. Такой ответ может быть высокоспецифичным по отношению к антигену или патогену и является более эффективным при вторичном и последующем контакте с антигеном или патогеном. Такой адаптивный иммунный ответ может зависеть от активации лимфоцитов, таких как Т-клетки или В-клетки. В контексте изобретения выражение "врожденный иммунный ответ" относится к ответу, зависящему от неспецифических систем распознавания и не изменяющемуся при последующем контакте с антигеном или патогеном. Такая система может зависеть от иммунных клеток, таких как, например, моноциты, макрофаги или натуральные киллеры (НК) или Т-клеточные натуральные киллеры (НКТ). Согласно одному воплощению полипептиды или конъюгаты по изобретению могут применяться при приготовлении лекарственного средства, предназначенного для индукции адаптивного иммунного ответа и/или врожденного иммунного ответа, направленного против белка gp41 вируса иммунодефицита человека. Согласно другим его аспектам настоящее изобретение также относится к способу лечения и/или профилактики ВИЧ-инфекции, включающему, по меньшей мере, этап введения индивидууму, нуждающемуся в этом, эффективного количества полипептида gp41 по настоящему изобретению, его тримера или конъюгата, или водной композиции, как определено ранее, в соответствии с настоящим изобретением. Согласно одному воплощению способа лечения и/или профилактики ВИЧ-инфекции полипептид или конъюгат в соответствии с изобретением вводят посредством инъекции и/или местно через слизистые оболочки или сочетанием этих путей, как указано ранее. Указанные слизистые оболочки выбраны из мочеполового тракта, желудочно-кишечного тракта,аноректального пути, респираторного тракта, поверхностной слизистой ткани, ротоносового пути и их сочетаний. В более конкретном аспекте в рамках способа по изобретению полипептид вводят в сочетании с дополнительным антигеном, отличным от указанного антигена-производного gp41, как описано выше. Сам по себе предпочтительный способ включает, по меньшей мере, этап введения, по меньшей мере, первого антигена-производного gp41, представленного на SEQ ID NO: 19 или SEQ ID NO: 20, или его аналога, и второго gp41-производного антигена, представленного на SEQ ID NO: 4 или SEQ ID NO: 5, или его аналога. Согласно другому аспекту настоящее изобретение также относится к набору для индукции иммунного ответа против белка gp41 вируса иммунодефицита человека, содержащему, по меньшей мере, первый антиген-производное gp41 в виде конъюгата, где указанный конъюгат наиболее предпочтительно является виросомоподобной везикулой по изобретению, и по меньшей мере второго антигенапроизводного gp41 в виде конъюгата, где указанный конъюгат является наиболее предпочтительно виросомоподобной везикулой по изобретению, где указанные первый и второй антигены-производные gp41 отличны друг от друга. Согласно предпочтительному воплощению первый антиген-производное gp41 представляет собой пептид, представленный на SEQ ID NO: 19 или SEQ ID NO: 20, или его аналог, второй gp41-производный антиген представляет собой пептид, представленный на SEQ ID NO: 4 или SEQID NO: 5, или его аналог. Настоящее изобретение далее будет объясняться при помощи следующих примеров, представленных в иллюстративных целях и не подлежащих интерпретации как ограничение объема настоящего изобретения. Краткое описание чертежей Фиг. 1 - диаграмма структуры поверхностного гликопротеина gp41 ВИЧ-1, штамма НхВ 2 клада В,на которой представлены хорошо известные идентифицированные эпитопы, кластеры и участки. Незаштрихованные круги соответствуют инвариантным аминокислотам, светло-серые круги соответствуют высококонсервативным аминокислотам, круги серого цвета средней интенсивности соответствуют средневариабельным аминокислотам, темные круги соответствуют инвариантным аминокислотам и аминокислоты, которые значительно более вариабельны в одном кладе, чем в другом, изображены как круги с жирным контуром. Часть участка MPER, содержащая эпитопы для 2F5 и 4 Е 10 нейтрализующих антител широкого спектра действия и присутствующая в пептиде Р 1 по настоящему изобретению, показана внизу слева; эта часть отсутствует у полипептида gp41 по изобретению. Аминокислоты из кластера 1 замещены линкером в структурах белка gp41 по изобретению. Фиг. 2 - перекрестная реактивность дикого типа gp41 и производных с моноклональными антителами против gp41, MAb 98.6 (слева) и анти-ИЛ-2 антитело, AF-202 (справа). Фиг. 3 показывает IgA в образцах сыворотки макак, иммунизированных при помощи gp41-виросом и Р 1-виросом посредством внутримышечной инъекции (обезьяны G2.1-2.6), по сравнению с сывороткой макак, иммунизированных виросомами посредством сочетания внутримышечной и интраназальной инъекции (G3.1-3.6). Группа 1 (G1.1-1.6, плацебо) представляет собой контрольную группу; этих животных иммунизировали внутримышечно обычными виросомами вируса гриппа, лишенного антигенов ВИЧ. Данные для сывороток снимали на 24 неделе и OD преимунных фонов (неделя 0) вычитали из OD недели 24 (н 24-н 0). Примерное разведение 1:300. Фиг. 4 - IgG измеряли в образцах сыворотки макак, имуннизированных виросомами gp41 в сочетании с виросомами Р 1 посредством внутримышечной инъекции (обезьяны G2.1-2.6), сравнивая с сывороткой макак, иммунизированных виросомами посредством сочетания внутримышечной и интраназальной инъекции (G3.1-3.6). Группа 1 (обезьяны G1.1-1.6) представляет собой контрольную (плацебо) группу, иммунизированную внутримышечно виросомами вируса гриппа. Данные для сывороток снимали на 24 неделе и OD преимунных фонов (неделя 0) вычитали из OD недели 24 (н 24-н 0). Примерное разведение 1:900. Фиг. 5 - виремия в течение и после интравагинальных иммунизации SHIVSF162P3 клада В. Стрелки обозначают 13 вагинальных иммунизации 20-30 TCID50, начинающихся один месяц спустя после четырех вакцинаций, дни после начальной иммунизации обозначены наклонными номерами. Вирусная нагрузка в плазме обозначена линиями для отдельных животных; предел чувствительности 2,5103 копий на мл посредством прямой линии. Линии с символами представляют отдельных животных. Группы как на фиг. 3 и 4. Фиг. 6 - ингибирование трансцитоза ВИЧ-1 через эпителиальные клетки за счет цервиковагинальных выделений (CVS). Панель А: штамм ВИЧ-1 93BR029 (клад В). Панель В: штамм ВИЧ-1 92BR025 (клад С). Сплошные столбики: CVS, примененные в разведении 1:6, открытые столбики - 1:10. В отсутствие специфических IgA-антител против gp41 способность к трансцитозу ВИЧ-1 эффективна более чем на 100%, в то время как в присутствии специфических анти-gp41 IgA-антител, трансцитоз может быть снижен более чем на 40%, когда разведение CVS составляет 1:6. Фиг. 7 - ингибирование трансцитоза через эпителиальные клетки посредством секреции CVS с или без элиминации IgA. Сплошные столбики: с элиминацией, заштрихованные столбики - без элиминации. При IgA-антителах слизистой, содержащихся в CVS, наблюдается ингибирование трансцитоза ВИЧ-1. При элиминации IgA из CVS ингибирование трансцитоза прекращается. Фиг. 8 - панель А: виремия после иммунизации невакцинированных обезьян вирусом клада С при помощи штамма SHIV1157ipd3N4. Панель В: виремия у обезьян, вакцинированных при помощи виросомgp41-производных антигенов из клада В (группа 3 по примеру 6) и иммунизированных SHIV клада С при помощи штамма SHIV1157ipd3N4. Восемнадцать обезьян после четвертой вакцинации, животные, получили стимуляцию, и после пяти недель они были иммунизированы интравагинально 10 раз с 10-20TCID50. Вирусная нагрузка в плазме обозначена для отдельных животных линиями, примечание - предел чувствительности составляет 103 копий на 1 мл. Примеры Пример 1. Построение М 0 и М 1 полипептида по изобретению (rgp41), кодируемого SEQ ID NO: 28 и SEQ ID NO: 21, посредством молекулярной биологии. а) Первый этап: построение gp41 петли (SEQ ID NO: 27).gp41- петлю получали посредством ПЦР. Разработка праймеров. Олигонуклеотидный праймер gp41-Nde (SEQ ID NO: 22) и олингонуклеотидный праймер gp41Bam1 (SEQ ID NO: 23) применяли для амплификации N-спирали и встройки гидрофильного линкера. Данные олигонуклеотидные праймеры разработаны соответственно для введения сайтов рестрикции для ферментов NdeI и BamHI. Олигонуклеотидный праймер gp41-Bam1 также разработан для встройки олигопептидного линкера SGGRGGS (SEQ ID NO: 16) с целью замещения удаленной части петли. Олигонуклеотидный праймер gp41-Bam2 (SEQ ID NO: 24) и олигонуклеотидный праймер gp41XhoI (SEQ ID NO: 25) применяли для амплификации С-спирали gp41 посредством ПЦР. Данные олигонуклеотидные праймеры разработаны для введения сайтов рестрикции для ферментов BamHI и XhoI соответственно. Условия ПЦР.gp41 петлевой полинуклеотид амплифицировали с матрицы gp41 (SEQ ID NO: 26) посредством ПЦР при помощи вышеописанных олигонуклеотидных праймеров. Плазмиду использовали в количестве 0,5 мкг/мкл, праймеры использовали в количестве 10 мкМ каждый и dNTP использовали в количестве 10 мМ каждый. Амплификацию проводили при помощи ДНК полимеразы DyNazyme от Finnzymes. Амплификацию начинали с этапа денатурации - 5 мин при 94 С, с последующими 30 циклами, каждый из которых содержал этап 1 мин при 94 С (этап денатурации), 1 мин при 60 С (гибридизация) и этап 1 мин при 72 С (элонгация), и амплификацию заканчивали последним этапом - 10 мин при 72 С. Очищенные ПЦР продукты подвергали рестрикции с помощью NdeI (Ozyme, R0111S) и XhoI (Ozyme, R0146S) для встройки в рЕТ 21b. Вектор pET21b (Novagen) подвергали рестрикции с помощью NdeI и XhoI и продукты ПЦР экстрагировали и очищали. Лигирование проводили при помощи Quick ligation kit (New England Biolabs) согласно предписанию производителя для получения рЕТ 21b-gp4 петли. рЕТ 21b-gp41 петлевые продукты трансформировали в DH5-альфа (Invitrogen).b) Второй этап: построение М 0gp41 Спетли клада В (SEQ ID NO: 28), кодирующей М 0 полипептид (rgp41 по изобретению). Две ПЦР проводили на матрице gp41 петли (SEQ ID NO: 27) для получения структуры гена М 0gp41 СкладВ при помощи полимеразы Phusion (Finnzymes). Первую реакцию проводили с применением праймеров: GP41B-C-D1 (SEQ ID NO: 29) и GP41B-C-R2 (SEQ ID NO: 30). Вторую реакцию проводили с применением праймеров: GP41B-C-D1 (SEQ ID NO: 29) и GP41B-CR1 (SEQ ID NO: 31). Положительные продукты ПЦР подвергали рестрикции при помощи ферментов рестрикции NdeI(Ozyme, R0111S) и XhoI (Ozyme, R0146S) для введения Gp41 СкладВ кодирующего гена в рЕТ 30b(VWR, 69910-3). Вектор рЕТ 30b подвергали рестрикции при помощи ферментов рестрикции NdeI и XhoI(при помощи набора для экстракции от Macherey-Nagel, 740 609 250). Лигирование этих двух фрагментов выполняли при помощи Quick ligation kit (New Englands Biolabs Inc, M2200S). 1 мкл лигазной смеси использовали для трансформации Е. coli DH5-альфа (Invitrogen, 12297-016). Трансформанты изолировали на чашках с LB агаром, содержащим 30 мкг/мл канамицина. Изолированные колонии инокулировали в 4 мл LB среды, дополненной 30 мкг/мл канамицина. Культуры растили в течение ночи при 37 С при 180 об/мин. Экстракцию ДНК из соответствующих осадков выполняли согласно протоколу, приведенному вNucleospin Plasmid extraction kit от Macherey-Nagel, Ref. 740588-250. Они были проанализированы посредством рестрикции при помощи рестрикционных ферментов, и вставки секвенировали при помощи праймеров T7prom (SEQ ID NO: 32) и T7term (SEQ ID NO: 33). Полная нуклеотидная последовательность М 0gp41 петли-С клада В была определена и представлена на SEQ ID NO: 28. с) Третий этап: построение М 1gp41 Спетли клада В (SEQ ID NO: 21), кодирующей полипептид М 1 (rgp41 по изобретению). М 1gp41 Спетлю клада В конструировали при помощи ПЦР. Были выполнены две ПЦР на матрице gp41 петли-Склада В (SEQ ID NO: 28) для получения М 1gp41 Спетли клады В при помощи полимеразы Phusion (Finnzymes). Первую реакцию проводили при помощи праймеров GP41B-C-D1 (SEQID NO: 29) и GP41C3-R1 (SEQ ID NO: 34). Перед второй ПЦР реакцией очистку проводили при помощи Nucleospin extraction kit (MachereyNagel, 740609250) при помощи следующих праймеров: GP41B-C-D1 (SE ID NO: 29) и GP41-C3-R2 (SEQID NO: 35). Положительные продукты ПЦР подвергали рестрикции при помощи ферментов рестрикцииNdeI (Ozyme, R0111S) и XhoI (Ozyme, R0146S) для введения кодирующего гена М 1gp41 петли-С клада В в рЕТ 30b (VWR, 69910-3). Вектор рЕТ 30b рестрицировали при помощи рестрикционных ферментовNdeI и XhoI (Ozyme). Фрагменты ДНК, соответствующие гену М 1gp41 петли-С клада В и рЕТ 30b, экстрагировали и очищали (при помощи набора для экстракции от Macherey-Nagel, 740 609 250). Лигирование этих двух фрагментов выполняли при помощи Quick ligation kit (New Englands Biolabs Inc, M2200S). 1 мкл лигазной смеси применяли для трансформации Е. coli DH5-альфа (Invitrogen, 12297-016). Трансформанты изолировали на чашках с LB агаром, содержащим 30 мкг/мл канамицина. Изолированные колонии инокулировали в 4 мл LB среды, дополненной 30 мкг/мл канамицина. Культуры растили в течение ночи при 37 С при 180 об/мин. Экстракцию ДНК из соответствующих осадков выполняли согласно протоколу, приведенному в Nucleospin Plasmid extraction kit от Macherey-Nagel, Ref. 740588-250. Они были проанализированы посредством рестрикции при помощи рестрикционных ферментов и вставки были секвенированы при помощи праймеров T7prom (SEQ ID NO: 32) и T7term (SEQ ID NO: 33). Полная нуклеотидная последовательность М 1gp41 петли-Склада В была идентифицирована и она представлена на SEQ ID NO: 21. Пример 2. Воспроизведение модифицированного полипептида в Е. coli.a) Трансформация. Плазмиду рЕТ 30b-М 0gp41 петля-С клада В или pET30b-M1gp41 петля-С клада В трансформировали в экспрессионный штамм Е. coli BLR (DE3). Экспрессию М 1gp41 петли-С и М 0gp41 петли-С клада В запускали посредством промотора Т 7.b) Экспрессионные тесты: шесть культур Е. coli штамма BLR (DE3), содержащих плазмиду рЕТ 30bМ 0gp41 петля-С клады В или pET30b-M1gp41 петля-С клады В выращивали при 37 С в бульоне Луриа с 30 мкг/мл канамицина до оптической плотности при 600 нм, достигшей 0,6 (спектрофотометр JascoV-530). Модифицированный полипептид индуцировали при помощи 1 мМ IPTG (изопропил-В-Dтиогалактозида) и продолжали культивирование в течение последующих 2 ч при 37 С. Экспрессию белков проверяли посредством разделения на SDS-4-12% PAGE. с) Продукция. 1) Культивирование: 1 л культуры BL21 (DE3)/рЕТ 30b-М 1gp41 петля-С клада В или(DE3)/рЕТ 30b-М 0gp41 петля-С клада В выращивали в бульоне Луриа при 37 С до оптической плотности при 600 нм, достигавшей значения 6,0. Экспрессию gp41-сконструированной петли индуцировали посредством 1 мМ IPTG и культивирование продолжали последующие 2 ч при 37 С. Культуру центрифугировали (Centrifuge Beckman Coulter Avanti J20XP с ротором JLA 8-1000, 4000g, 30 мин, 4 С) и осадок хранили при -80 С. 2) Экстракция М 0 или М 1 rgp41 модифицированных полипептидов. Осадок ресуспендировали в буфере для обработки ультразвуком (40 мл Трис-HCl 50 мМ рН 8, NaCl 300 мМ). Бактерии разрушали посредством 15 мин обработки ультразвуком во льду/этаноле (дезинтегратор UP200S амплитуда 80%, коэффициент 0,5). Затем суспензию центрифугировали при 40000g в течение 30 мин при 4 С для отделения растворимых белков (супернатант) от нерастворимых белков (осадок)d) Очистка М 1 rgp41 модифицированного полипептида. 1) Аффинная хроматография. Первый этап очистки М 1 (кодируемого М 1gp41 петля-С клада В, SEQ ID NO: 21) выполняли посредством аффинной хроматографии на Ni Sepharose 6 Fast Flow среде, упакованной в колонку ХК 16/20 (GE Healthcare) с объемом колонки 1 мл среды на 1 л культуры в камерах. Специфический спейсерный пептид S позволил использовать этап аффинной хроматографии как этап поглощения для восстановления растворимой фракции М 0 или М 1. Это было важно из-за низкой продуктивности белка. Колонки уравновешивали буфером (Na-фосфат 50 мМ, рН 7,5, NaCl 300 мМ, -меркаптоэтанол, 5 мМ). Очищенные образцы полипептида М 1 в буфере (Na-фосфат 50 мМ, рН 7,5, NaCl 300 мМ,-меркаптоэтанол, 5 мМ, 2 мМ MgCl2, леупептин и пепстатин 0,1 мМ) наносили на колонку при 2 мл/мин. Затем колонку промывали уравновешивающим буфером и осуществляли этапы элюирования с 25, 50 и 150 мМ имидазола. М 1 gp41 элюировали при помощи буфера (Na-фосфат 50 мМ, рН 7,5, NaCl 300 мМ, -меркаптоэтанол, 5 мМ, имидазол 300 мМ) при 4 мл/мин. При конечной концентрации 0,05% добавляли Tween 20 на смешанную фракцию аффинной хроматографии и проводили диализ в течение ночи при 4 С под действием медленного магнитного перемешивания против буфера: Na-фосфат 50 мМ,рН 7,5, NaCl 300 мМ, ТСЕР 1 мМ, Tween 20 0,05%. Затем образцы концентрировали в три раза посредством центрифугирования на Amicon 10 кДа concentration unit (Millipore). 2) Эксклюзионная хроматография. Второй этап очистки М 1 выполняли посредством эксклюзионной хроматографии при помощи Superde 200 Prep grade среды, упакованной в колонку ХК 26/60 (GE Healthcare) с объемом колонки 320 мл. Колонку уравновешивали при помощи буфера (Na-фосфат 50 мМ, рН 7,5, NaCl 300 мМ, ТСЕР 1 мМ,Tween 20 0,05%). М 1 в буфере (Na-фосфат 50 мМ, рН 7,5, NaCl 300 мМ, ТСЕР 1 мМ, Tween 20 0,05%) наносили на колонку при 1,5 мл/мин и элюировали при помощи уравновешивающего буфера при 2,5 мл/мин. Согласно калибровочной кривой белок элюировался в виде растворимых тримеров. Таким образом, присутствие спейсера, содержащего цистеиновый остаток в С-терминальной части М 1 или М 0, не изменяло конформационного состояния белка. Пример 3. Перекрестная реактивность. Четыре белка были йотированы на нитроцеллюлозную мембрану: wt gp41-HA (нативный gp41, слитый с НА-тагом (GenBank AF348176) в Трис 50 мМ рН 8, NaCl 200 мМ, Triton Х-100 0,1%, 0,1 мг/мл;gp41 петля (SEQ ID NO: 38), отличающийся от нативного фрагмента gp41 на фиг. 1 в основном за счет замещения 25 остатков в кластере I линкером SEQ ID NO: 16, в Трис 50 мМ рН 8, NaCl 200 мМ, глицерол 5%, 0,2 мг/мл; gp41-сконструированная петля (SEQ ID NO: 37), отличающийся от нативного фрагментаgp41 фиг. 1 в основном за счет замещения 12 остатков в кластере I линкером SEQ ID NO: 16) в Трис 50 мМ рН 8, NaCl 200 мМ рН 8, имидазол 200 мМ, глицерол 5%, 0,2 мг/мл; рекомбинантный ИЛ-2 человека в Трис 50 мМ рН 8, NaCl 200 мМ, 0,1 мг/мл и негативный контроль (бычий сывороточный альбумин)(фиг. 2). Мембрану инкубировали при 37 С и затем помещали в 20 мл PBS, Tween 0,3%, 5% молоко еще на 1 ч при перемешивании. Антитела 98.6 D (анти-gp41 моноклональное антитело человека от NIBSC, Великобритания) и AF-202 (античеловеческий-ИЛ-2-антитело от RD Systems) добавляли при конечной концентрации 0,05 или 0,5 мкг/мл соответственно, в 20 мл PBS/Tween 20 0,3-5% молоко в течение 1 ч при перемешивании. Соответствующую концентрацию связанного с пероксидазой антитела к IgG добавляли в 20 мл PBS Tween 0,3%-молоко 5% с перемешиванием в течение 1 ч и блот отмывали три раза в течение 15 мин каждый в PBS Tween 0,3%. После этого были выявлены две пероксидазные активности при помощи коммерческого набора, усиливающего хемилюминесценцию (Amersham) и пленки Kodak, подвергнутой воздействию блота, как известно в области техники. Как показано на фиг. 2, нативный gp41 хорошо распознается античеловеческим-ИЛ-2 антителом,при этом замещение 25 остатков в кластере I прекращало распознавание этого белка человеческим антиИЛ-2 антителом, замещение 12 остатков в кластере I частично уничтожало реактивность человеческого анти-ИЛ-2 антитела, рекомбинантный человеческий ИЛ-2, как и ожидалось, хорошо распознавался с помощью AF-202 анти-ИЛ-2 антитела. Однако замещение 12 или 25 аминокислот при помощи линкера не влияло на распознавание посредством анти-gp41 моноклонального антитела 98.6. Пример 4. Анализ растворимости полипептида rgp41. Культуры Е. coli, экспрессирующие gp41 по изобретению, центрифугировали при 4000g при 4 С в течение 15 мин. Осадки суспендировали в объеме лизисного буфера (фосфат 50 мМ рН 7,5, NaCl 300 мМ,MgCl2 2 мМ, -меркаптоэтанол 5 мМ, бензоназа 1 мкМ, пепстатин 1 мкМ, леупептин 1 мкМ) до достижения ОП при 600 нм, равной 10. Раствор инкубировали при 4 С в течение 30 мин. Лизис клеток выполняли посредством трех циклов замораживания/оттаивания. Растворимые и нерастворимые белки отделяли путем 30 мин центрифугирования при 21000g при 4 С. 10 мкл белка анализировали для определения уровня экспрессии и растворимости посредством SDS-PAGE 4-12% электрофореза с последующим выдерживанием в Кумасси голубом. Было обнаружено присутствие rgp41 в супернатанте. Таким образом,белок является растворимым. Пример 5. Приготовление виросомоподобных везикул, презентирующих полипептид qp41, продуцируемый в Е. coli на внешней поверхности (rgp41-виросомы) и приготовление виросом, презентирующих синтетический пептид на внешней поверхности (Р 1-виросомы). Виросомоподобные везикулы в основном готовили, как описано в WO 2007/099387. Вкратце, вирус гриппа А/Сингапур/6/86 выращивали в яйцах с эмбрионом и инактивировали при помощи пропиолактона, как известно в области техники. Вирус растворяли в 100 мМ монододециловом эфире октаэтиленгликоля (OEG) в фосфатном забуференном солевом растворе (PBS) и вирусный нуклеокапсид удаляли посредством ультрацентрифугирования. Растворенные мембраны, содержащие 4 мг гемаглютинина, смешивали с 32 мг яичного фосфатидилхолина (ФХ) и 8 мг фосфатидилэтаноламина (ФЭ), растворенного в 2 мл PBS, содержащего 100 мМ OEG. Фосфолипиды и раствор, содержащий гемаглютинин,смешивали, как описано выше, и обрабатывали ультразвуком в течение 1 мин. Данный раствор центрифугировали в течение 1 ч при 100000g и препарат вирусной мембраны/липидную смесь стерилизовали посредством фильтрации. Полипептид по изобретению, содержащий спейсер и цистеиновый остаток в С-терминальном положении (SEQ ID NO: 19), конъюгировали при помощи малеимидо-сукцинимидного линкера на N-конце с региоизомером фосфатидилэтаноламина (ФЭ), как указано далее. Фосфатидилэтаноламин (ФЭ) растворяли в метаноле и добавляли 0,1% (об./об.) триэтиламина. Затем раствор смешивали с гетеробифункциональным кросс-линкером N(гамма)-малеимидобутирилоксисукцинимид-эфиром (GMBS), (Pierce Chemical Company, Rockford, IL) (соотношение PE:GMBS=5:1),предварительно растворенном в диметилсульфоксиде (DMSO) (20 мкл). После инкубации в течение 30 мин при комнатной температуре растворители выпаривали в течение 1 ч под действием вакуума в центрифуге SpeedVac. GMBS-PE затем растворяли в 1 мл PBS, содержащем 100 мМ октаэтиленгликоля(OEG) (Fluka Chemicals, Switzerland) (PBS-OEG), и добавляли полипептид по изобретению, содержащий участок S с остатком цистеина в С-терминальном положении (SEQ ID NO: 19) (соотношение РЕCMBS:полипептид=5:1). На этом этапе малеимид фосфатидилэтаноламин-GMBS реагирует с сульфгидрилом свободного С-терминального цистеина полипептида gp41. После инкубации в течение 30 мин добавляли дополнительный свободный цистеин для нейтрализации всех остатков свободного GMBS (соотношение цистеин:GMBS=10:1). Полипептид, конъюгированный с липидом, добавляли к препарату содержащей гемагглютинин вирусной мембраны/липидной смеси, как описано выше, в соотношении 1 мг rgp41 на 1 мг гемагглютинина, и формировали rgp41-виросомы посредством удаления детергента на SM-2 BioBeads (BioRad, Glattbrugg, Switzerland). Аналогично, связанный с липидом синтетический пептид Р 1, аминокислотная последовательность которого соответствует SEQ ID NO: 5 (SQTQQGKNEQELLELDKWASLWNWFDITNWLWYIKLSC карбоксиметил(1,3-дипальмитиол-глицеро-2-фосфатидилэтаноламино-ОН синтезировали в виде соли ТФУ с SQTQQGKNEQELLELDKWASLWNWFDITNWLWYIKLS-гидроксилцистеином посредством твердофазной Fmoc химии, как известно в области техники, и связывали с фосфатидилэтаноламином через его С-терминальный гидроксилцистеин при помощи бромацетилфосфатидилэтаноламина. После очистки при помощи препаративной ВЭЖХ и ионного обмена с получением его ацетатной соли пептид лиофилизировали, в растворенном в PBS-OEG состоянии смешивали с препаратом вирусной мембраны/липидной смесью, в соотношении 5 мг Р 1 на вирусный гемагглютинин, и формировали Р 1 виросомы посредством удаления детергента. Пример 6. Иммунизация макак при помощи вакцинной композиции, содержащей rpg41 виросомоподобные везикулы по изобретению и Р 1-виросомы по изобретению. Иммунизацию макак при помощи вакцинной композиции, содержащей виросомоподобные везикулы с полипептидом rgp41, как описано выше, а также виросомоподобные везикулы с gp41-производным антигенным пептидом Р 1, локализованным на внешней поверхности, выполняли, как описано далее. Использовали три группы по пять самок макак средним возрастом приблизительно 5 лет. За четыре недели до первого введения вакцины все макаки получили внутримышечные инъекции инактивированного -пропиолактоном вируса гриппа А Сингапур 6/86 (100 мкл, 0,01 мг/мл). Затем проводили вакцинации макак при помощи виросомоподобных везикул в водном растворе (40 мкг Р 1-виросомы и 40 мкгrgp41-виросомы, 100 мкл) на сроке 0, 7, 15 и 24 недели. Группа 1 (обезьяны G1.1-G1.6) получила виросомы вируса гриппа без антигенов gp41 (плацебо). Группа 2 (G2.1-G2.6) получила четыре внутримышечные вакцинации как Р 1-виросомами, так и gp41-виросомами при каждой вакцинации, и группа 3 (G3.13.6) - две внутримышечные вакцинации (неделя 0 и 7) с двумя последующими интраназальными вакцинациями (неделя 15 и 24), введенными в виде спрея, каждый раз при помощи как Р 1-виросом, так и gp41 виросом. Одно животное в группе 3 (3.2) погибло по причинам, не относящимся к вакцинации. Образцы сыворотки брали при каждом моменте времени вакцинации. Уровень общих IgA- и IgG-антител в сыворотке определяли согласно следующему протоколу ELISA. Пептид Р 1 (SEQ ID NO: 5) 100 нг/100 мкл/лунка или rgp41 по изобретению (SEQ ID NO: 19, 100 нг/100 мкл/лунка) в бикарбонатном буфере (50 мМ, рН 9,6) использовали для нанесения на планшетыELISA (Nunc), ночь, 4 С. Планшеты пропитывали БСА 2%, PBS-Tween 0,1% в течение 1 ч при 37 С, затем промывали при помощи буфера PBS-Tween 0,1%. Сыворотки, разведенные 1/300 для IgA и 1/200 дляIgG при помощи PBS-Tween 0,1%, инкубировали ночь при 4 С. Затем планшеты промывали буферомPBS-Tween 0,1%. Для определения IgG макак использовали козьи антитела к IgG макаки, конъюгированные с биотином (Rockland) (1/15000) с последующей инкубацией со стрептавидин-HPR (Immunotech),разбавленным в соотношении 1/50000. Для определения IgA макак применяли козьи антитела против IgA макак, конъюгированные с био- 16021191 тином (Rockland) 1/15000) с последующей инкубацией со стрептавидин-HPR (Immunotech), разбавленным в соотношении 1/50000. Моноклональное антитело 2F5-IgA применяли в качестве положительного контроля вслед за инкубацией с биотин меченным козьим Fab'2 против IgA человека (0,14 мкг/мл конечная) (Caltag H 14015) и выявляли при помощи стрептавидин-HPR (1/50000). 2F5-IgG моноклональное антитело применяли в качестве положительного контроля вслед за инкубацией с биотинилированным козьим Fab'2 против IgG человека (0,1 мкг/мл конечная) (Rockland 609106123) и выявляли при помощи стрептавидин-HPR(1/50000). Антитела инкубировали в течение 1 ч при 37 С. Колориметрическую реакцию запускали, добавляя субстрат ТМВ, и останавливали посредством добавления 1 М Н 2 РО 4. Оптическую плотность (ОП) считывали при 450 нм. Результаты проиллюстрированы на фиг. 3 (gp41-специфичный IgA в сыворотке) и фиг. 4 (gp41 специфичный IgG в сыворотке). Результаты показывают, что самки макак, вакцинированные внутримышечно, имеют высокие уровни специфичных IgA- и IgG-анти-gp41 антител в сыворотке. В заключение, в сыворотке иммунизированных самок макак наблюдалось присутствие IgA-, а также IgG-антител. Результаты показали, что иммунный ответ при помощи IgA может быть получен за счет вакцины по изобретению. Для исследования того, будет ли вакцинация индуцировать слизистый иммунитет, получали цервико-вагинальные образцы из всех животных, вакцинированных согласно примеру 6 на 24 неделе, посредством введения 3 мл PBS, содержащего антибиотики и ингибиторы протеаз. Образцы центрифугировали для удаления осадка, разделяли на аликвоты, немедленно быстро замораживали и хранили при -80 С. Р 1 антитела слизистых оболочек определяли посредством ELISA, как описано выше, в то время как антиgp41 клады В антитела определяли согласно Tudor et al., 2009, Mucosal. Immunol., 2, 412-426. Результаты выражали в виде количества животных, имеющих концентрацию антител в два раза большую стандартного отклонения, и по сравнению с результатами определений сывороточных антител, выраженных аналогично (табл. 1). Сыворотка обезьяны 3.2 была исключена из анализа. Таблица 1 Кроме того, наблюдали, что IgA- и IgG-антитела также были индуцированы в генитальном тракте, в то время как IgA определяли в кишечном отделе даже после вакцинации посредством внутримышечной инъекции в отсутствии слизистого адъюванта. Пример 7. Защита против гетерологичной иммунизации вакцинированных макак. Обезьян по примеру 6 иммунизировали живым вирусом следующим образом: через четыре недели после последней вакцинации животных иммунизировали интравагинально 13 раз, каждые 4-7 дней, при помощи низких доз (20-30 TCID50) SHIVSF162P3, как показано на фиг. 5. Этот химерный вирус иммунодефицита обезьяна/клад В человека имеет патогенный SIVmac239 в качестве основы, содержащий гены env(gp120+gp41), tat, rev и vpu из HIV-1SF162P3. Этот вирус распознает рецептор CCR5 по сравнению с Х 4 тропным штаммом НхВ 2, применяемым для получения gp41-структуры по изобретению и пептида Р 1 по изобретению. Таким образом, иммунизацию осуществляли при помощи гетерологичного вируса. Вирус был предоставлен NIAID (National Institute of Allergy and Infectious diseases - Национальный институт аллергии и инфекционных болезней), NIH (National Institutes of Health - Национальный институт здоровья) Вифезда, США, в 2 мл PBS. Как показано на фиг. 5, все невакцинированные обезьяны (группа 1, плацебо) быстро оказывались инфицированными вирусом с вирусными нагрузками в плазме, наблюдающимися в течение двух недель,составлявшими приблизительно 106-107 копий на 1 мл, как и предполагалось (Hessel A.J. et al., Nat. Med. 15, 951-959). 50% обезьян в группе 2 (внутримышечная вакцинация) были защищены. Все животные в группе 3 (внутримышечная/интраназальная) были защищены; одно животное ( 3.3) имело отсроченную или низкую виремию, составляющую 800 копий/мл в течение приблизительно недели и соответственно было отрицательным; для подтверждения этого были проведены повторные исследования на образцах с низким порогом чувствительности (фиг. 5). Одно животное в группе 3 погибло по причинам, не относящимся к иммунизации. Эти данные показали, что вакцинация защищает животных от гетерологичной иммунизации, хотя группа 3 имела низкие уровни системных нейтрализующих антител. Пример 8. Ингибирование трансцитоза и перекрестно-кладной защиты. Для исследования того, будет ли вакцинация индуцировать иммунитет слизистых оболочек, цервико-вагинальные образцы, полученные согласно примеру 6, анализировали посредством исследования ингибирования трансцитоза ВИЧ-1, выполненного, как описано ранее (Bomsel et al., 1997, Nat. Med. 3: 42-47). Трансцитоз ВИЧ-1 через эпителиальные клетки и нейтрализацию трансцитоза посредством антител исследовали на линии кишечных клеток НТ 29, выращенных в виде плотного поляризованного монослоя в течение 7 дней на проницаемой фильтрационной подложке (размер пор 0,45 мкм), образующей границу между двумя независимыми камерами, выше таковой, омывающей апикальную (люминальную) поверхность эпителиального монослоя и ниже таковой, омывающей базолатеральную поверхность. Перед трансцитозными экспериментами эпителиальные клетки промывали и затем инкубировали в RPMI 1640, глутамине, 10% FCS. Образцы цервико-вагинального выделяемого (CVS) (разведение 1/12 и 1/6) из группы 1 (плацебо) или группы 3 (W24; вм+ин, см. пример 7 выше) предварительно инкубировали с ВИЧ-1-инфицированными клетками (1106 ВИЧ-1 93BR029 вирус (ВИЧ-1 клады В) или с 92BR025 вирусом (ВИЧ-1 клады С) + PBMCs (7 день после инфекции активированным PBMCs от здоровых индивидуумов, инфицированных или JRCFS или первичными вирусами) в течение 20 мин при комнатной температуре. Таким образом, предварительно инкубированные ВИЧ 1-инфицированные клетки добавляли в апикальную камеру. Контакт между ВИЧ-1-инфицированными клетками и эпителиальным клеточным монослоем приводил к быстрому образованию ВИЧ-1-вирионов с последующей интернализацией частицы ВИЧ и трансцитозом с апикальной на базолатеральную сторону эпителиального клеточного монослоя. После 2 ч определяли ингибирование трансцитоза посредством CVS при помощи детекции р 24 в базолатеральной среде посредством коммерческого ELICA (Coulter, Villepinte, France). В течение 2 ч контакта инфицированных клеток с эпителиальными клетками барьерная функция эпителиального монослоя оставалась неизменной, предотвращая проникновение ВИЧ-1-инфицированных клеток в монослой или транслокацию ВИЧ-1-инфицированных клеток в базолатеральную камеру (1). Результаты трансцитоза ВИЧ-1 приведены на фиг. 6. Очевидно, что трансцитоз вируса клада В ингибировался за счет CVS вакцинированных животных. Однако неожиданно оказалось, что вакцинация также индуцировала ингибиторную активность против вируса клада С, как показано по снижению трансцитоза соответствующего контроля ВИЧ-1 (перекрестно-кладная защита), что подтверждает присутствие общего конформационного эпитопа, хотя аминокислотная последовательность у используемых вирусов отличается. Пример 9. Трансцитоз ингибируется посредством секреторного IgA в CVS вакцинированных животных. Образцы цервико-вагинальных выделений, собранные от животных, как описано в примере 8, были очищены от IgA посредством инкубации с биотинилированным антителом против IgA макаки, как раскрыто далее. Биотинилированный античеловеческий IgA (Caltag, France) связывали со стрептавидинагарозой (Pierde, France) в массовом соотношении 1:3, и нагруженные гранулы отмывали для удаления несвязанного биотинилированного анти-IgA. 30 мкл гранул вращали в течение ночи при 4 С с CVS (разведение 1:6) и центрифугировали в течение 10 мин при 1000g. Полученный супернатант собирали и анализировали с последующей инкубацией со стрептавидин-агарозными гранулами (Pierde, France) и центрифугировали для удаления гранул. Эти IgA-очищенные образцы затем проверяли в трансцитозном тесте при помощи вируса 93BR029 клада В, как описано в примере 8, и сравнивали с образцами без очистки от IgA. Как показано на фиг. 7, не было ингибирования или было небольшое ингибирование трансцитоза ВИЧ-1 после очистки от IgA, что ясно демонстрировало роль IgA слизистых оболочек, а не сывороточного IgA, в защите против инфекции. Пример 10. Перекрестно-кладная защита in vivo. Поскольку в испытаниях in vitro наблюдалось ингибирование перекрестно-кладного трансцитоза, то было решено иммунизировать обезьян из группы 3, пример 6 (интраназальная и внутримышечная вакцинация при помощи виросом, основанных на кладе В) вирусом клада С. Спустя один год после их последней вакцинации при помощи виросом, обезьяны все еще оставались серонегативными. Они были ревакцинированы один раз посредством внутримышечной инъекции, как описано в примере 6, и через пять недель после вакцинации они были иммунизированы 10 раз, с интервалом 4-7 дней, при помощи 10-20TCID50 SHIV1157ipd3N4 (клад С, тропизм R5, любезно предоставлен д-ром Рут Рупрехт, Институт рака Даны Фарбер, США). В каждый момент времени вакцинации брали образцы крови для определения виремии. Образцы крови брали каждые 4-7 дней в течение 60 дней с этого времени (фиг. 8). Как показано на фиг. 8, в первые 40 дней после инъекции невакцинированные животные были инфицированы. В невакцинированной контрольной группе 5/6 обезьян были инфицированы на 11 день (фиг. 9) и на 60 день все животные были инфицированы. В вакцинированной группе 2/5 обезьян оставались неинфицированными в течение 120-дневного периода исследования, в то время как для тех, которые были инфицированы, данный процесс был значительно замедлен по отношению к контрольной группе. Эти неожиданные данные представляют собой точное доказательство существования перекрестнокладной защиты in vivo. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Модифицированный полипептид, содержащий три смежных сегмента N, L и С, представленный формулой N-L-C и содержащий N-спиральный участок gp41 (N), С-спиральный участок gp41 (С) и соединительную петлю, содержащую синтетический линкер (L) между N- и С-спиралями, где линкер заменяет аминокислоты 593-617 gp41, где порядок нумерации соответствует прототипу - изоляту штамма ВИЧ-1 НхВ 2 клада В и где указанный полипептид содержит кальвеолин-1-нейтрализующий эпитоп и эпитоп 98.6 D, но не содержит эпитопов 2F5 и 4 Е 10, не является пептидом слияния и обладает минимальной перекрестной иммунногенной реактивностью с ИЛ-2. 2. Полипептид по п.1, дополнительно содержащий S-фрагмент, представленный формулой N-L-C-S,в которой S представляет собой спейсерный фрагмент. 3. Полипептид по п.1 или 2, в котором сегмент N представляет собой аминокислоты 540-592 gp41,где порядок нумерации соответствует прототипу - изоляту НхВ 2 ВИЧ-1. 4. Полипептид по любому из пп.1-3, где N представлен на SEQ ID NO: 13 или SEQ ID NO: 14. 5. Полипептид по любому из пп.1-4, где сегмент С представляет собой аминокислоты 618-664 gp41,где порядок нумерации соответствует прототипу - изоляту НхВ 2. 6. Полипептид по п.5, где С представлен на SEQ ID NO: 15. 7. Полипептид по п.1, где L представлен на SEQ ID NO: 16. 8. Полипептид по п.2, где S представлен на SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQID NO: 12. 9. Полипептид по п.1, представленный на SEQ ID NO: 17 или 18. 10. Полипептид по п.2, представленный на SEQ ID NO: 19 или SEQ ID NO: 20. 11. Водная композиция, содержащая полипептид по любому из пп.1-10, где указанный полипептид образует тример в водной среде. 12. Водная композиция по п.11, где указанный тример является стабильным. 13. Конъюгат, содержащий полипептид по любому из пп.1-10 и 16, конъюгированный с виросомой. 14. Полинуклеотид, кодирующий полипептид по любому из пп.1-10. 15. Полинуклеотид по п.14, представленный на SEQ ID NO: 21 или SEQ ID NO: 28. 16. Полипептид, кодируемый полинуклеотидом по любому из пп.14, 15. 17. Тример, содержащий три полипептида по любому из пп.1-10 и 16. 18. Экспрессионный вектор, содержащий, по меньшей мере, промотор транскрипции, полинуклеотид по п.14 или 15 и терминатор транскрипции. 19. Клетка-хозяин, содержащая экспрессионный вектор по п.18. 20. Антигенная или иммуногенная композиция, содержащая полипептид по любому из пп.1-10 или 16, или конъюгат по п.13, или тример по п.17. 21. Фармацевтический препарат, содержащий полипептид по любому из пп.1-10 или 16, или конъюгат по п.13, или тример по п.17. 22. Фармацевтический препарат по п.21, содержащий дополнительный антиген, отличный от полипептида по пп.1-16. 23. Фармацевтический препарат по п.22, в котором указанный дополнительный антиген представлен в виде конъюгата. 24. Фармацевтический препарат по п.23, в котором указанный дополнительный антиген конъюгирован с виросомой. 25. Фармацевтический препарат по любому из пп.21-24, где указанный дополнительный антиген представлен на SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6. 26. Применение фармацевтического препарата по любому из пп.21-25 в иммунотерапии. 27. Применение по меньшей мере одного полипептида по любому из пп.1-10 или 16, тримера по п.17 или конъюгата по п.13 для изготовления лекарственного средства, предназначенного для индукции адаптивного иммунного ответа и/или врожденного иммунного ответа, направленного против белка gp41 вируса иммунодефицита человека. 28. Применение одного полипептида по любому из пп.1-10 или 16, тримера по п.17, экспрессионного вектора по п.18 или конъюгата по п.13 и дополнительного антигена, представленного на SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6, в виде конъюгата, где указанный конъюгат более предпочтительно является виросомой, для изготовления лекарственного средства, предназначенного для индукции адаптивного иммунного ответа и/или врожденного иммунного ответа, направленного против белка gp41 вируса иммунодефицита человека. 29. Способ лечения и/или профилактики ВИЧ-инфекции, включающий, по меньшей мере, стадию введения индивидууму, нуждающемуся в этом, эффективного количества полипептида по любому из пп.1-10 или 16, тримера по п.17 или конъюгата по п.13. 30. Способ по п.29, где указанное эффективное количество вводят системно путем инъекции и/или местно через слизистые оболочки. 31. Способ по п.30, где указанные слизистые оболочки выбраны из мочеполового тракта, желудочно-кишечного тракта, аноректального пути, респираторного тракта, поверхностной слизистой ткани, ротоносового пути и их комбинаций. 32. Способ по любому из пп.29-31, где указанное эффективное количество вводят в сочетании с дополнительным антигеном, отличным от указанного антигена, производного от gp41.
МПК / Метки
МПК: C07K 14/16, A61K 39/21
Код ссылки
<a href="https://eas.patents.su/30-21191-novye-antigeny-gp41.html" rel="bookmark" title="База патентов Евразийского Союза">Новые антигены gp41</a>
Предыдущий патент: Способ ферментации низкомолекулярного сахара в продукт
Следующий патент: Система регулирования объекта с рециклом
Случайный патент: Способ лечения обычной простуды, аллергического ринита и инфекций дыхательных путей