Генетические маркеры, ассоциированные с ответом на интерферон-альфа
Номер патента: 20795
Опубликовано: 30.01.2015
Авторы: Шианна Кевин, Саймон Джейсон С., Гэ Дунлян, Урбан Томас, Фелле Жак, Бертелсен Артур, Макхатчисон Джон Г., Мерголо Николас Дж., Рэлстон Роберт Орвилл II, Голдстейн Дэвид Б., Цю Пин, Томпсон Александер Дж.
Формула / Реферат
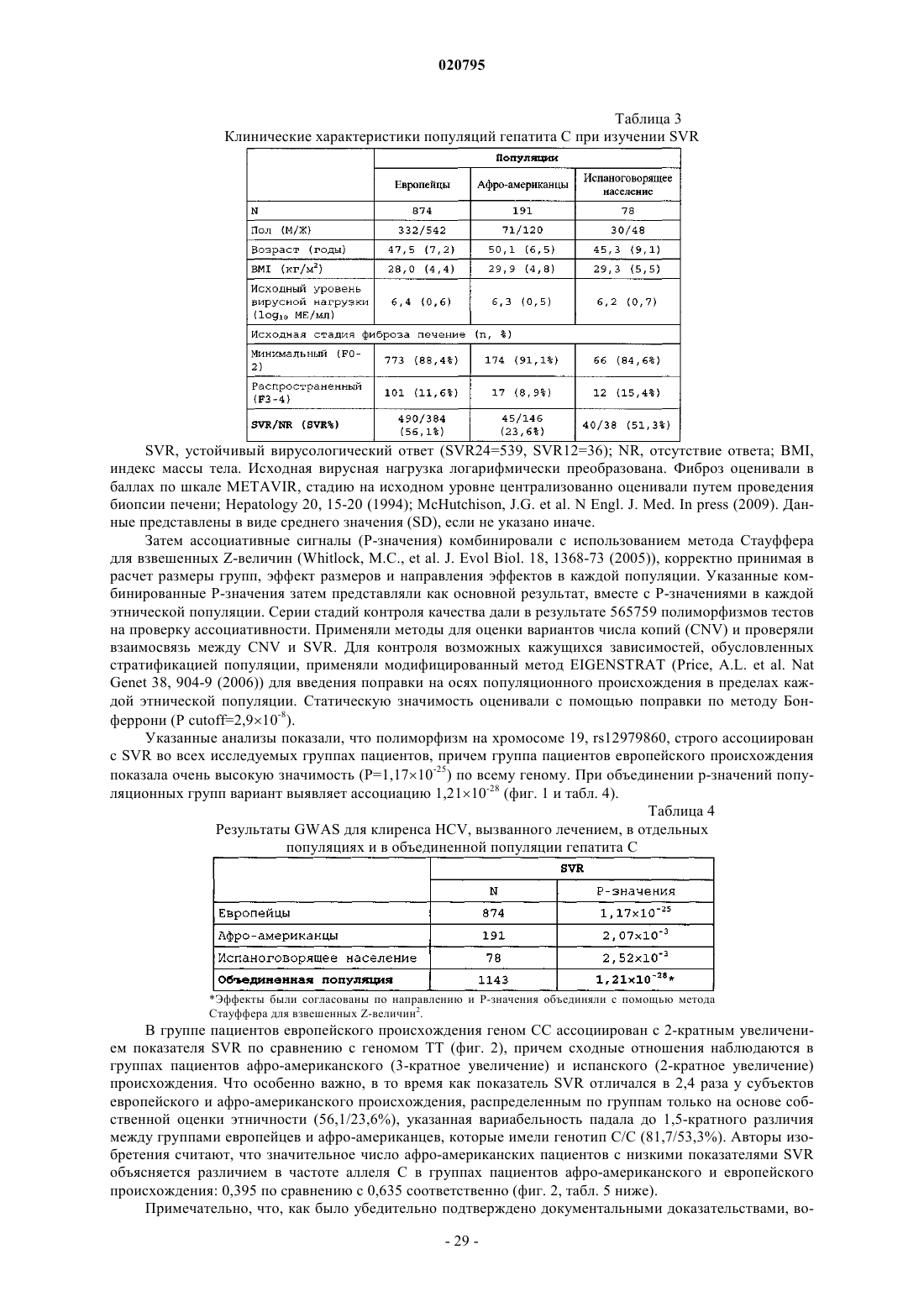
1. Способ тестирования индивида-человека с хронической инфекцией, вызванной вирусом гепатита С генотипа 1 (HCV), на наличие или отсутствие по меньшей мере одного маркера ответа на IFN-α, где способ включает получение образца нуклеиновой кислоты от указанного индивида и проведение анализа образца нуклеиновой кислоты для определения генотипа индивида в полиморфном сайте (PS), согласно таблице, представленной ниже
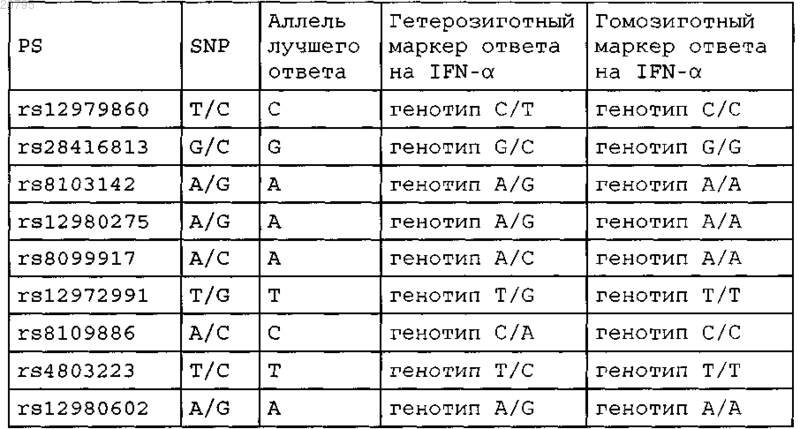
где если индивид является гетерозиготным или гомозиготным по аллелю лучшего ответа указанного в таблице PS, то маркер ответа на IFN-α присутствует, и если индивид является гомозиготным по другому аллелю указанного PS, то маркер ответа на IFN-α отсутствует.
2. Способ по п.1, где маркер ответа IFN-α является гомозиготным по А в rs8103142, гомозиготным по G в rs28416813 или гомозиготным по С в rs12979860.
3. Набор для тестирования индивида-человека, страдающего хронической инфекцией, вызванной HCV генотипа 1, на наличие или отсутствие маркера ответа на IFN-α, который содержит набор олигонуклеотидов, разработанных для генотипирования по меньшей мере одного полиморфного сайта (PS), выбранного из группы полиморфных сайтов в табл. 1.
4. Набор по п.3, где полиморфный сайт представляет собой rs12979860, rs8103142 или rs28416813.
5. Способ выбора терапии для лечения индивида-человека, страдающего хронической инфекцией, вызванной HCV генотипа 1, включающий определение генотипа индивида в полиморфном сайте (PS), выбранном из полиморфных сайтов табл. 1, и выбор терапии на основе результатов стадии определения,
где если индивид является гетерозиготным или гомозиготным по аллелю лучшего ответа в выбранном PS, то выбранная терапия включает начальное лечение или продолженное лечение IFN-a, и
где если индивид является гомозиготным по другому аллелю в выбранном PS, то выбранная терапия включает введение индивиду IFN-α в комбинации по меньшей мере с одним терапевтическим агентом, который не является IFN-α, или выбранная терапия исключает терапию на основе IFN-α.
6. Способ по п.5, где IFN-α представляет собой пегилированный белок IFN-α-2а или слитый белок альбумин-IFN-α-2a.
7. Способ по п.6, где IFN-α представляет собой пегилированный IFN-α-2b или слитый белок альбумин-IFN-α-2b.
8. Способ лечения индивида-человека с хронической инфекцией HCV генотипа 1, который включает
определение генотипа индивида по меньшей мере в одном полиморфном сайте (PS) табл. 1 и
назначение схемы лечения на основе полученного генотипа,
где если генотип является гомозиготным по аллелю лучшего ответа, то схема лечения включает введение индивиду IFN-α в комбинации с рибавирином, и
где если генотип индивида является гетерозиготным или гомозиготным по другому аллелю, то схема лечения включает введение индивиду IFN-α в комбинации с рибавирином и по меньшей мере одним противовирусным агентом, который не является IFN-α, или схема лечения исключает терапию на основе IFN-α.
9. Способ по п.10, где IFN-α представляет собой пегилированный белок IFN-α-2а или слитый белок альбумин-IFN-α-2а.
10. Способ по п.9, где IFN-α представляет собой пегилированный IFN-α-2b или слитый белок альбумин-IFN-α-2b.
11. Способ по любому из пп.8-10, где по меньшей мере один противовирусный агент представляет собой боцепревир или телапревир.
12. Способ по любому из пп.8-11, где полиморфный сайт представляет собой rs8103142 и где если генотип индивида является гетерозиготным или гомозиготным по аллелю G, то схема лечения включает введение индивиду IFN-α в комбинации с рибавирином и по меньшей мере одним терапевтическим агентом, который не является IFN-α.
13. Способ по любому из пп.8-12, где индивид не получал ранее лечение IFN-α.
14. Способ скрининга для отбора индивидов для начального лечения или продолженного лечения IFN-α из группы индивидов-людей с диагностированной хронической инфекцией, вызванной HCV генотипа 1, включающий тестирование каждого члена группы заболевания на наличие по меньшей мере одного маркера ответа на IFN-α и отбор для лечения по меньшей мере одного индивида, тестированного положительно на маркер ответа на IFN-α, где положительный результат теста на маркер ответа на IFN-α соответствует гетерозиготному генотипу или гомозиготному генотипу по аллелю лучшего ответа по меньшей мере для одного полиморфного сайта (PS), выбранного из полиморфных сайтов табл. 1.
15. Способ по п.14, где IFN-α представляет собой пегилированный IFN-α-2а или пегилированный IFN-α-2b.
Текст
Бертелсен Артур, Фелле Жак,Гэ Дунлян, Голдстейн Дэвид Б.,Макхатчисон Джон Г., Мерголо Николас Дж., Цю Пин, Рэлстон Роберт Орвилл II, Шианна Кевин, Саймон Джейсон С., Томпсон Александер Дж.,Урбан Томас (US) Медведев В.Н. (RU) Изобретение предоставляет генетические маркеры, расположенные на хромосоме 19 человека,которые ассоциированы с положительным ответом на интерферон-альфа (IFN-). Указанные маркеры ответа на IFN- являются полезными, помимо прочего, для выявления пациентов,на которых, по всей вероятности, окажет благоприятное действие лечение фармацевтическими композициями и лекарственными продуктами IFN-, в способах лечения пациентов, имеющих заболевание, поддающееся лечению IFN-, и в способах выбора наиболее подходящей терапии для таких пациентов.(71)(73) Заявитель и патентовладелец: МЕРК ШАРП ЭНД ДОМЭ КОРП. Область техники, к которой относится изобретение Настоящее изобретение относится к генетическим маркерам, расположенным на хромосоме 19 человека, которые являются прогностическими для положительного ответа на терапию IFN-. Уровень техники изобретения Идентификация какой-либо публикации в данном разделе или в любом разделе настоящей заявки не является подтверждением того, что такая публикация представляет собой известный уровень техники настоящего изобретения. Семейство белков интерферона-альфа (IFN-) типа I проявляет клинически важные противовирусные антипролиферативные и иммуномодуляторные активности, и различные белки IFN- были одобрены для лечения ряда заболеваний, включая гепатит и злокачественные опухоли. Ввиду короткого времени полужизни в плазме крови исходно одобренных белков IFN- были разработаны длительно действующие версии: в частности, пег-IFN2 а, поставляемый на рынок Hoffman-La Roche (Nutley, NJ) под коммерческим названием PEGASYS; пег-IFN2b, поставляемый на рынок Schering-Plough (Kenilworth, NJ) под коммерческим названием PegIntron и Albuferon, слитый белок человеческого сывороточного альбумина и IFN2b, который находится на поздней стадии клинической разработки компанииHuman Genome Sciences. Белки IFN- воздействуют на ряд клеточных функций, включая репликацию ДНК и синтез РНК и белков в нормальных и патологических клетках. Таким образом, цитотоксические эффекты терапииIFN- не ограничиваются опухолевыми или зараженными вирусом клетками, но также проявляются в нормальных здоровых клетках в такой же мере. В результате во время терапии IFN- возникают нежелательные, но обычно обратимые побочные эффекты, особенно если для достижения терапевтического эффекта необходимы высокие дозы. Например, введение белков IFN- может привести к снижению количества эритроцитов, лейкоцитов и тромбоцитов, и высокие дозы часто вызывают гриппоподобные симптомы (например, лихорадка, утомляемость, головные боли и озноб), желудочно-кишечные нарушения (например, анорексия, тошнота и диарея), изменения настроения и изменение ферментов печени. Такие побочные эффекты могут иметь особо важное значение из-за продолжительного времени лечения, обычно необходимого при терапии на основе IFN-. Например, рекомендуемая продолжительность комбинированной терапии пег-IFN-/рибавирином при инфекции вирусом гепатита С (HCV) составляет от 24 до 48 недель в зависимости от генотипа HCV и исходного уровня вирусной нагрузки. Продолжительность лечения при определенных онкологических показаниях может быть даже более длительной, чем подтверждено в недавно завершенном клиническом испытании пег-IFN2b в качестве адъювантной терапии при резецированной меланоме III стадии, в котором пациенты получали 6 мкг/кг пег-IFN2b подкожно в течение 8 недель (индуктивная фаза) с последующими 3 мкг/кг в неделю подкожно при планируемой продолжительности лечения 5 лет (фаза стабилизации) (Eggermont A.M.M. et al.,Lancet 372:117-126 [2008]). Помимо возможности проблематичных побочных эффектов, терапевтический эффект леченияIFN- может значительно варьировать среди пациентов с определенным заболеванием. Например, комбинированная терапия пег-IFN2b/рибавирином при HCV дает значение устойчивого вирусологического ответа (SVR) приблизительно от 20 до 93% в различных группах пациентов, определяемых генотипомHCV и исходным уровнем вирусной нагрузки. Также пациенты с HCV африканского происхождения имеют значительно более низкие показатели устойчивого вирусологического ответа (SVR), чем пациенты европейского происхождения; см., например, публикации McCone, J. et al., Hepatology 48 (4):430 А-43IA, Abstr. No. 268 (59th Ann. Mtg. Am. Assoc. Study Liver Dis., AASLD, San Francisco, CA, USA, Oct. 31Nov. 4, 2008); Reid, A.E., Curr. Hepatitis Rep., Vol. 7, No. 3, p. 120-126 (2008); Jacobson, I.M. et al. Hepatology, 46 (4): 971-981 (2007). Также Eggermont et al., выше, сообщали о более благоприятных исходах заболевания у пациентов с ранней III стадией меланомы, чем у пациентов с более поздней стадией заболевания, в частности, о снижении совокупного риска рецидива приблизительно на 18-25%. Таким образом, с учетом побочного эффекта, вариабельного ответа и профилей чувствительности,наблюдаемых при терапии IFN-, существует потребность в способе определения пациентов, на которых терапия IFN- наиболее вероятно будет оказывать благоприятное действие. Настоящее изобретение направлено на удовлетворение данной потребности. Сущность изобретения Настоящее изобретение основано на открытии, что несколько однонуклеотидных полиморфизмов(SNP) хромосомной области человека 19q13.13 прочно ассоциированы с ответом на лечение пег-IFN/рибавирином у пациентов, хронически инфицированных HCV генотипа 1. Один из SNP представляет собой полиморфизм С/Т, идентифицируемый как rs12979860 в базе данных SNP NCBI. Полиморфизм rs12979860 расположен на 3 т.п.н. выше гена интерлейкина 28 В (IL-28B),который кодирует интерферон-лямбда 3 (IFN-3). Наличие аллеля С ассоциировано с лучшим ответом на лечение, причем генотип С/С ассоциирован с повышением вероятности устойчивого вирусологического ответа (SVR) в 2, в 3 и в 2 раза, по сравнению с генотипом Т/Т у пациентов с HCV европейского, афри-1 020795 канского и испанского происхождения соответственно. Кроме того, поскольку генотип С/С представлен со значительно более высокой частотой в популяции европейского происхождения, чем в популяции африканского происхождения, полиморфизм rs12979860 объясняет важный компонент межпопуляционного различия при ответе пациентов с HCV на комбинированную терапию пегилированным IFN/рибавирином. Частота аллеля С rs12979860 существенно снижена в когорте пациентов, хронически инфицированных HCV, по сравнению с произвольно выбранной популяционной группой с неизвестным статусом гепатита С, что позволяет предположить, что аллель С также ассоциирован с более высокой вероятностью спонтанного клиренса гепатита С генотипа 1. Авторы изобретения здесь также определили связи между rs12979860 и другими SNP на 19q13.13,которые сами ассоциированы с SVR. Два из указанных SNP находятся в гене IL-28 В: rs28416813, полиморфизм G/C, расположенный на 37 оснований выше стартового кодона ATG, и rs8103142, полиморфизмA/G, расположенный в кодирующей последовательности, который приводит в результате к явлению аминокислотного полиморфизма Lys или Arg в положении 70 аминокислотной последовательностиIFN-3, представленной на фиг. 4 (SEQ ID NO: 10). Аллель А полиморфизма rs8103142 кодирует Lys в положении 70 IFN-3, тогда как полиморфизм G дает в результате Arg в положении 70. На основе недавно опубликованной кристаллической структуры IFN-3 (Gad, Н.Н. et al., JBC 2009, размещенной он-лайн 20 мая 2009 г. как Manuscript M109.002923), авторы изобретения предполагают здесь, что вариацияArg/Lys находится в петле АВ области, которая вероятно участвует в связывании IFN-3 с IFN-R1.SNP в гене IL28B представляют особый интерес в качестве кандидатных полиморфизмов, выражающих причинную обусловленность, в качестве кандидатных каузальных полиморфизмов, поскольку экспрессия IFN-3 вызывается инфицированием HCV и другими вирусами, и IFN-3 проявляет антивирусную активность in vivo (Sheppard, P. et al., Nature Immunol. 4(l):63-68 (2003); Kotenko, S.V., et al., Nature Immunology 4(1):p. 69-77 (2003); Ank, N., et al., J. InterferonCytokine Res. 26:373-379 (2006. В частности, ассоциация аллеля Arg70 с более слабым ответом на IFN- позволяет предположить, что наличие данного аллеля негативно влияет на способность субъекта производить важные компоненты иммунного ответа на HCV, которые участвуют в обеспечении SVR при терапии на основе IFN-. Это может происходить в результате сниженной функции изоформы Arg70 по сравнению с изоформой Lys70 в результате воздействия изоформы Arg70 на функцию изоформы Lys70 или из-за комбинации обоих эффектов. Принимая во внимание тот факт, что сниженные уровни изоформы Arg70 в сыворотке крови являются наиболее правдоподобным объяснением фенотипа с более слабым ответом, авторы изобретения обнаружили, что человеческая клеточная линия, сконструированная для экспрессии myc-меченной версии изоформы Lys70 или изоформы Arg70, секретирует в значительно больших количествах изоформуSNP, ассоциированные с ответом на терапию IFN-, описаны в табл. 1 ниже, в которой перечислены полиморфные сайты (PS), где располагается SNP, идентифицируемый с помощью обозначения базы данных SNP NCBI, альтернативные аллели, которые обнаружены в PS, аллель, который ассоциирован с лучшим ответом на терапию IFN-, и гетерозиготные и гомозиготные генотипы, содержащие указанный аллель, которые обозначаются здесь как маркеры ответа на IFN-. Таблица 1 Маркеры ответа на IFN Авторы изобретения предполагают здесь, что тестирование субъектов на наличие одного или более маркеров ответа на IFN- табл. 1 будет полезным для ряда фармакогинетических продуктов и методов,которые включают определение пациентов, которые наиболее вероятно ответят на терапию IFN- при заболевании, поддающемся лечению IFN-, для определения субъектов, хронически инфицированныхHCV, которым может быть полезно дополнение комбинированной терапии IFN-/рибавирином, терапией, которая увеличивает уровни изоформы Lys70 IFN-3, снижает уровни изоформы Arg70 IFN-3 или оказывает оба эффекта, и для помощи врачам в принятии решения, назначать ли противовирусную терапию пациенту с острой инфекцией HCV. Таким образом, в одном варианте осуществления изобретение предоставляет фармацевтическуюIFN-, и положительный результат теста по меньшей мере на один маркер ответа на IFN-. В другом варианте осуществления изобретение предоставляет применение IFN- в получении лекарственного препарата для лечения субъекта, имеющего заболевание, поддающееся лечению IFN-, и положительный результат теста по меньшей мере на один маркер ответа на IFN-. В еще одном варианте осуществления изобретение предоставляет фармацевтический продукт, который содержит фармацевтическую композицию IFN- и инструкцию-вкладыш, которая включает фармакогенетическое показание, при котором рекомендуется фармацевтическая композиция. Фармакогенетическое показание включает два компонента: заболевание, поддающееся лечению IFN- в фармацевтической композиции, и пациенты, которые имеют заболевание и которые генетически характеризуются наличием по меньшей мере одного маркера ответа на IFN-. Изобретение также предоставляет способ тестирования субъекта на наличие или отсутствие по меньшей мере одного маркера ответа на IFN-, способ включает получение образца нуклеиновой кислоты субъекта и анализ образца для определения генотипа субъекта по меньшей мере в одном из полиморфных сайтов в табл. 1. В другом варианте осуществления изобретение предоставляет способ тестирования субъекта на наличие или отсутствие маркера ответа на IFN- в PS rs8103142, способ включает получение биологического образца субъекта и анализ биологического образца на наличие IFN-3 с Lys в положении аминокислоты 70 или на наличие IFN-3 с Arg в положении аминокислоты 70. В некоторых вариантах осуществления стадия анализа включает взаимодействие биологического образца с моноклональным антителом, которое способно различать IFN-3 с Lys в положении аминокислоты 70 и IFN-3 с Arg в положении аминокислоты 70. В некоторых вариантах осуществления способ тестирования субъектов на наличие или отсутствие маркера ответа на IFN- дополнительно включает создание отчета по результатам исследования, в котором указан генотип субъекта в анализируемом полиморфном сайте, и при желании предоставление отчета по результатам исследования субъекту или врачу, который лечит субъекта, по поводу заболевания,поддающегося лечению IFN-. В еще одном аспекте изобретение предоставляет набор для обнаружения маркера ответа на IFN- в образце нуклеиновой кислоты. Набор включает комплект из одного или более олигонуклеотидов, сконструированных для идентификации каждого из аллелей в полиморфном сайте маркера ответа IFN-. В некоторых вариантах осуществления образец нуклеиновой кислоты является образцом, полученным у пациента, имеющего заболевание, поддающееся лечению IFN-. В одном варианте осуществления заболевание является хронической HCV-инфекцией, субъект ранее перенес трансплантацию печени и образец нуклеиновой кислоты является образцом биопсии трансплантированной печени. В другом варианте осуществления образец нуклеиновой кислоты является образцом донорской печени, которую тестируют для трансплантации пациенту с хронической HCV-инфекцией. В еще одном варианте осуществления изобретение предоставляет способ выбора терапии для лечения субъекта, имеющего заболевание, поддающееся лечению IFN-, включающий определение, имеет ли субъект по меньшей мере один маркер ответа на IFN-, и выбор терапии, исходя из результатов стадии тестирования, при котором, если субъект имеет маркер ответа на IFN-, выбираемая терапия включает начальное лечение или продолженное лечение IFN-, и, если субъект не имеет маркера ответа на IFN-,выбранная терапия либо включает введение IFN- в комбинации по меньшей мере с одним другим терапевтическим агентом, который не является IFN-, либо исключает лечение на основе IFN-. Изобретение также предоставляет метод скрининга для отбора субъектов для начального лечения или продолженного лечения IFN- из группы субъектов, имеющих заболевание, поддающееся лечениюIFN-. Указанный метод скрининга включает тестирование каждого члена группы заболевания на наличие по меньшей мере одного маркера ответа на IFN- и отбор для лечения по меньшей мере одного субъекта, положительно тестируемого на маркер ответа на IFN-. В каждом из приведенных выше вариантов осуществления маркер ответа IFN- представляет собой любой из маркеров ответа на IFN- в гетерозиготном и гомозиготном состоянии, представленных в табл. 1. В предпочтительных вариантах осуществления маркер ответа на IFN- представляет собой один из маркеров ответа в гомозиготном состоянии. В одном предпочтительном варианте осуществления маркер ответа на IFN- представляет собой генотип А/А в PS rs8103142 или генотип G/G в rs28416813. В других вариантах осуществления прогноз ответа на IFN- основан на наличии маркера ответа на IFN- по меньшей мере для двух PS из табл. 1. В еще одном варианте осуществления изобретение предоставляет способ прогнозирования, ответит ли пациент с хронической HCV-инфекцией на комбинированную терапию, включающую IFN2 и рибавирин. Способ включает получение образца нуклеиновой кислоты субъекта, оценку образца нуклеиновой кислоты на наличие по меньшей мере одного маркера ответа на IFN- в гомозиготном состоянии из табл. 1 и проведение прогноза на основе результатов стадии оценки. Если результаты теста на наличие маркера ответа на IFN- в гомозиготном состоянии положительны, прогнозируется, что субъект, вероятно, достигнет SVR, и если результаты теста на наличие маркера ответа на IFN- в гомозиготном состоянии отрицательны (например, субъект имеет генотип С/Т или генотип Т/Т в полиморфном сайтеrs12979860), прогнозируется, что субъект, вероятно, не достигнет SVR. В одном варианте осуществления пациент ранее перенес трансплантацию печени и образец нуклеиновой кислоты является образцом биопсии трансплантируемой печени. В еще одном варианте осуществления изобретение предоставляет способ лечения субъекта с хронической HCV-инфекцией. Способ включает определение генотипа субъекта по меньшей мере для одного из полиморфных сайтов табл. 1 и назначение схемы лечения, исходя из полученного генотипа. Если генотип представляет собой генотип маркеров ответа на IFN- в гомозиготном состоянии, то схема лечения включает введение субъекту IFN- в комбинации с рибавирином. В некоторых вариантах осуществления схема лечения субъекта с маркером ответа на IFN- в гомозиготном состоянии включает введение субъекту терапевтически эффективных количеств пегилированного IFN-, рибавирина и по меньшей мере одного другого антивирусного агента. В некоторых вариантах осуществления другой противовирусный агент является ингибитором протеазы HCV или ингибитором полимеразы HCV. Если полученный генотип не является маркером ответа на IFN- в гомозиготном состоянии (т.е. является гетерозиготным или гомозиготным по аллелю слабого ответа), то в некоторых вариантах осуществления назначаемая схема лечения включает один или более противовирусных агентов, которые не являются IFN-, и в некоторых предпочтительных вариантах осуществления такие противовирусные агенты выбирают из ингибиторов протеазы HCV, ингибиторов полимеразы HCV и лекарственных средств, которые увеличивают уровни изоформы IFN-3 Lys70, снижают уровни изоформы IFN-3 Arg70 или делают и то, и другое. В еще одном варианте осуществления изобретение предоставляет фармацевтический продукт, содержащий фармацевтическую композицию IFN-3 Lys70 и инструкцию-вкладыш, в которой указано, что фармацевтическая композиция рекомендуется для лечения субъекта, инфицированного HCV, и имеющего положительный результат теста на наличие аллеля G в rs8103142. Фармацевтическая композиция IFN3 Lys70 включает полипептид IFN-3 Lys70 или вектор экспрессии, который кодирует полипептид IFN3 Lys70. В предпочтительных вариантах осуществления в инструкции-вкладыше дополнительно указано, что фармацевтическая композиция IFN-3 Lys70 предназначена для применения в комбинации с терапией на основе IFN-. В еще одном варианте осуществления изобретение предоставляет фармацевтическую композицию,которая специфически нейтрализует активность IFN-3 Arg70, но не IFN-3 Lys70. В некоторых вариантах осуществления фармацевтическая композиция включает моноклональное антитело, которое специфически связывается и нейтрализует полипептид, содержащий аминокислоты 23-196 фиг. 4 (SEQ ID NO: 10), в котором аргинин замещен лизином в положении аминокислоты 70, но не связывается с полипептидом, содержащим аминокислоты 23-196 SEQ ID NO: 10, в котором лизин представлен в положении аминокислоты 70. В других вариантах осуществления нейтрализующая фармацевтическая композиция включает молекулу, которая ингибирует экспрессию IFN-3 Arg70, но не IFN-3 Lys70. В некоторых вариантах осуществления молекула является антисмысловой РНК, si-РНК или рибозимом. В некоторых вариантах осуществления любой из приведенных выше композиций и способов, в которых заболевание, поддающееся лечению IFN-, является хронической HCV-инфекцией, хроническаяHCV-инфекция представляет собой инфекцию с исходным высоким уровнем вирусной нагрузки, с генотипом HCV, выбранным из группы, состоящей из генотипа 1 (G1 HCV), генотипа 3 (G3 HCV) или генотипа 4 (G4 HCV). Во всех упомянутых выше вариантах осуществления IFN- предпочтительно представляет собой пегилированный IFN2a или пегилированный IFN2b и в особенно предпочтительных вариантах осуществления IFN- представляет собой PEGASYS (пег-IFN2 а) или PegIntron (пег-IFN2b). Во всех упомянутых выше вариантах осуществления пациент с заболеванием, поддающимся лечению IFN-, не отвечал соответствующим образом на предшествующую терапию IFN-. Во всех упомянутых выше вариантах осуществления положительный результат теста на маркер ответа на IFN- может быть использован в комбинации с наличием одного или более других предикторов положительного ответа на терапию IFN- для выявления пациентов, которые, вероятно, ответят на начальную или продолженную терапию IFN-. В еще одном варианте осуществления изобретение предоставляет способ оценки вероятности того,что пациент, имеющий хроническую инфекцию HCV генотипа 1, достигнет устойчивого вирусологического ответа с использованием комбинированной терапии пегилированным IFN2 и рибавирином. Способ включает получение набора генетических и клинических предикторов ответа пациента, ввод полученных предикторов в компьютер, в котором запускают модель логистической регрессии на основании введенных предикторов для расчета оценки вероятности, и передача оценки вероятности пациенту или врачу пациента, где пациент идентифицирует себя как афро-американец или европеец, где ряд генетических и клинических предикторов ответа состоит из генотипа пациента в полиморфном сайте rs12979860,исходного уровня HCV-вирусной нагрузки пациента, определения пациентом своей этнической принадлежности и оценки исходного уровня фиброза у пациента по шкале METAVIR и где логистическая регрессионная модель представляет собой где Р - вероятность достижения SVR;V - исходный уровень вирусной нагрузки: больше или равен 600000 МЕ/мл=0, меньше 600000 МЕ/мл=1; Е - этническая принадлежность: африканское происхождение=0, европейское происхождение=1;F - исходный уровень фиброза: METAVIR F3-4=0, F0-2=1. В еще одном варианте осуществления изобретение предоставляет способ лечения субъекта, у которого диагностирована острая инфекция HCV. Способ включает получение генотипа субъекта для PSrs12979860 и принятие решения о лечении на основе полученного генотипа. Если генотип является гомозиготным по Т, то лечебным решением является начать пациенту антивирусную терапию. Если генотип является гетерозиготным по С или гомозиготным по С, то лечебным решением является отложить антивирусную терапию до тех пор, пока у субъекта не будет диагностирована хроническая HCV-инфекция. Краткое описание чертежей Фиг. 1 иллюстрирует результаты тестов тенденции изменения генотипа одного маркера в отношении важных детерминант устойчивого вирусологического ответа (SVR) в объединенной группе пациентов европейского, афро-американского и испанского происхождения, хронически инфицированных HCV генотипа 1 и получавших лечение комбинированной терапией пег-IFN2/рибавирином. На верхнем и среднем графиках представлены значения р всех генотипированных SNP (ось Y), полученные в результате анализа всего генома и хромосомы 19 соответственно, и красные вертикальные линии указывают SNP,которые показывают статистически значимую связь с SVR по всему геному, красная стрелка указываетSNP rs12979860. На нижнем графике показано положение известных генов на хромосоме 19, обозначенных вертикальными полосками, при этом некоторые гены указаны по названию и положение гена IL-28B указано голубой стрелкой. Дополнительные детали представлены в примерах. Фиг. 2 иллюстрирует связь между генотипом полиморфного сайта rs12979860 (Т/Т, Т/С или С/С)(ось Y) и процентом пациентов каждого генотипа, которые достигли SVR (ось X и круговая диаграмма) в различных группах пациентов, хронически инфицированных HCV генотипа 1 и получавших лечение комбинированной терапией пег-IFN-/рибавирином. Дополнительные детали представлены в примерах. Фиг. 3 иллюстрирует показатель устойчивого вирусологического ответа (SVR) и частоту аллеля Сrs12979860 в различных этнических группах, при этом показатели SVR пациентов европейского, испанского и афро-американского происхождения взяты из двух клинических исследований, описанных здесь в примерах, и показатель SVR пациентов восточно-азиатского происхождения взят из публикации Liu,C.H. et al., Pegylated interferon-alfa-2a plus ribavirin for treatment-naive Asian patients with hepatitis С virusgenotype 1 infection: a multicenter, randomized controlled trial. Clin Infect Dis Al, 1260-9 (2008). Дополнительные детали представлены в примерах. Фиг. 4 иллюстрирует референсную аминокислотную последовательность человеческого предшественника 28 В (IFN-3): референсная последовательность из 196 аминокислот, NCBI NP742151.2,GI:28144901 (SEQ ID NO: 10), причем предсказанный сигнальный пептид подчеркнут и локализация положений вариантных аминокислот, описанных в базе данных SNP NCBI по состоянию на 15 июня 2009 г., указана выделенными буквами в референсной последовательности, и обозначение вариантного аллеля указано выделенной буквой под положением вариантной аминокислоты. Фиг. 5 иллюстрирует сниженную секрецию изформы IFN-3 Arg70 по сравнению с изоформой IFN3 Lys70, когда они экспрессированы в виде myc-меченных конструкций в клетках Т 293, причем на фиг. 5 А изображен окрашенный Кумасси голубым гель общего белка, представленного в супернатанте через 48 ч после трансфекции указанной экспрессионной конструкции, и на фиг. 5 В представлен вестернблоттинг сдвоенного геля, исследованного с помощью антитела анти-myc.I. Определения. С целью облегчения понимания изобретения ниже приводятся следующие технические и научные термины. За исключением случаев, особо указанных в другом месте в настоящем документе, все другие технические и научные термины, применяемые здесь, используются в значении, обычно понимаемом специалистом в области, к которой принадлежит изобретение, если термины применяют в контексте,сходном с используемым здесь контекстом. В данном контексте, включая прилагаемую формулу изобретения, определения в единственном числе включают соответствующие их упоминания во множественном числе, если из контекста не следует ясно иное."Приблизительно", когда используется для определения количественно задаваемого параметра, например дозы терапевтического агента, рассматриваемого здесь, или продолжительности времени лечения, означает, что параметр может изменяться на 10% больше или меньше от указанного числового значения для данного параметра. Например, доза приблизительно 1,5 мкг/кг PegIntron (пег-IFN2b), используемая при лечении пациентов с HCV, может изменяться от 1,30 до 1,65 мкг/кг."Аллель" представляет собой определенную форму гена или другого генетического локуса, отличающуюся от других форм своей специфической нуклеотидной последовательностью, термин "аллель" также включает один из альтернативных полиморфизмов (например, SNP), обнаруживаемых в полиморфном сайте."Благоприятный результат" означает желаемый клинический результат лечения IFN-, включая без ограничения: уменьшение одного или более симптомов заболевания, снижение степени заболевания (например, снижение вирусной нагрузки), стабильное (т.е. неухудшающееся) состояние заболевания, замедление прогрессирования заболевания, улучшение или временное облегчение состояния заболевания,продление выживаемости (по сравнению с ожидаемой выживаемостью при отсутствии лечения), безрецидивная выживаемость, ремиссия (частичная или полная) и выздоровление (т.е. устранение заболевания). Термин "состоит, по существу, из" и варианты, такие как "состоят, по существу, из" или "состоящий, по существу, из", которые используют в описании и в формуле изобретения, показывают включение любых перечисленных элементов или группы элементов и необязательное включение других элементов, сходной или другой природы, чем перечисленные элементы, которые не изменяют фактически начальных или новых свойств указанного режима дозирования, способа или композиции."Субъект", или "животное", или "пациент", или "млекопитающее" обозначает любого субъекта, в особенности субъекта-млекопитающего, которому нужны или могут быть полезны любая из заявленных композиций и способов. В предпочтительных вариантах осуществления субъект является человеком. В более предпочтительных вариантах осуществления субъект является взрослым человеком, т.е. по меньшей мере в возрасте 18 лет."Ответ на IFN-" означает желаемый клинический результат лечения IFN-, включая, но без ограничения: уменьшение одного или более симптомов заболевания, снижение степени заболевания (например, снижение вирусной нагрузки), стабильное (т.е. не ухудшающееся) состояние заболевания, замедление прогрессирования заболевания, улучшение или временное облегчение состояния заболевания, продление выживаемости (по сравнению с ожидаемой выживаемостью при отсутствии лечения), безрецидивная выживаемость, ремиссия (частичная или полная) и выздоровление (т.е. устранение заболевания)."Не леченный ранее IFN-" означает, что субъект или пациент, которого лечат или проверяют согласно любому из вариантов осуществления, описанных здесь, не получал раньше лечения каким-либоIFN-, включая какой-либо экспериментальный или утвержденный фармацевтический продукт IFN-.SEQ ID NO: 10 (непрерывно расположенные аминокислоты на фиг. 4), и включает встречающиеся в природе аллельные варианты SEQ ID NO: 10, в которых референсная аминокислота в одном или более вариантных положений, показанных на фиг. 4, заменена вариантной аминокислотой. Полипептид IFN-3IFN-3 Arg70 является изоформой IFN-3, имеющей аргинин в положении аминокислоты 70 фиг. 4. В контексте терапевтических композиций и способов, описанных здесь, термин "полипептид IFN-3Lys70" включает производные, в которых главная аминокислотная цепь ковалентно соединена с другими молекулами для обеспечения одного или более желаемых свойств, таких как увеличенное время полужизни in vivo или сниженная иммуногенность. Неограничивающие примеры производных полипептидаIFN-3 Lys70, применимых в настоящем изобретении, включают гликозилированные производные, пегилированные производные, гибридные белки полипептида IFN-3 Lys70 и неинтерфероновый белок,такой как человеческий сывороточный альбумин или IgG. В контексте терапевтических композиций и способов, описанных здесь, термин "полипептид IFN-3 Lys70" также включает цистеиновые мутанты, в которых один или более из семи остатков цистеина SEQ ID NO: 10 замещен другой аминокислотой, чтобы облегчить рекомбинантное получение композиции IFN-3 Lys70, содержащего пример одной ди-6 020795 сульфидной связи, как описано в патенте США 7517961. Предпочтительные цистеиновые мутанты включают замену второго или третьего остатков Cys SEQ ID NO: 10 серином, аланином, треонином, валином или аспарагином."Фармацевтическая композиция IFN-3 Lys70" обозначает фармацевтически приемлемый носитель,разбавитель или среду для лекарственного средства и либо (1) полипептид IFN-3 Lys70, либо (2) вектор экспрессии, который содержит нуклеотидную последовательность, которая кодирует полипептид IFN-3Lys70, функционально связанную с промоторной последовательностью, которая способна запустить экспрессию полипептида IFN-3 Lys70 по меньшей мере в одной ткани человека. В предпочтительных вариантах осуществления ткань человека является печеночной тканью."Выделенный" обычно используется, чтобы отразить состояние очистки биологической молекулы,такой как РНК, ДНК, олигонуклеотид или белок, и в таком контексте обозначает молекулу, по существу,не содержащую других биологических молекул, таких как нуклеиновые кислоты, белки, липиды, углеводы или другие вещества, такие как продукты распада клеток и среды роста. Как правило, термин "выделенный" не предназначен для обозначения полного отсутствия других биологических молекул или веществ или отсутствия воды, буферов или солей, если только они не представлены в количествах, которые, по существу, не мешают способам настоящего изобретения."Локус" относится к положению на хромосоме или молекуле ДНК, соответствующему гену, физическому признаку, такому как полиморфный сайт, или положению, связанному с фенотипическим признаком."Нуклеотидная пара" представляет собой набор из двух нуклеотидов (которые могут быть одинаковыми или различными), обнаруживаемых в полиморфном сайте на двух копиях хромосомы субъекта."Олигонуклеотид" относится к нуклеиновой кислоте, которая обычно имеет в длину от 5 до 100 непрерывных оснований и наиболее часто 10-50, 10-40, 10-30, 10-25, 10-20, 15-50, 15-40, 15-30, 15-25, 1520, 20-50, 20-40, 20-30 или 20-25 непрерывных оснований в длину. Последовательность олигонуклеотида может быть разработана для специфической гибридизации с любой из аллельных форм локуса; такие олигонуклеотиды обозначаются как аллель-специфические зонды. Если локус представляет собой PS,содержащий SNP, комплементарный аллель для такого SNP может находиться в любом положении в аллель-специфическом зонде. Другие олигонуклеотиды, применяемые в применении на практике изобретения, специфически гибридизуются с областью-мишенью рядом с PS, своим 3'-концом, расположенным на расстоянии приблизительно от одного и не более 10 нуклеотидов от PS, предпочтительно приблизительно 5 нуклеотидов. Такие олигонуклеотиды, гибридизующиеся рядом с PS, используются в методах удлинения праймера, опосредованного полимеразой, и обозначаются здесь как "олигонуклеотиды удлинения праймеров". В предпочтительном варианте осуществления 3'-конец олигонуклеотида удлинения праймера представляет собой дезоксинуклеотид, комплементарный нуклеотиду, непосредственно прилегающему к PS."Парентеральное введение" означает внутривенную, подкожную или внутримышечную инъекцию."обычно считаются безопасными" - например, которые физиологически переносимы и обычно не вызывают аллергической или подобной нежелательной реакции, такой как желудочное расстройство и т.п.,при введении человеку. В другом варианте осуществления указанный термин относится к молекулярным субстанциям и композициям, одобренным регуляторным органом федерального или государственного правительства или перечисленных в фармакопее США, или в другой общепризнанной фармакопее для применения у животных и, в частности, у человека."Полиморфный сайт" или "PS" относится к положению в генетическом локусе или в гене, в котором обнаруживается полиморфизм, например однонуклеотидный полиморфизм (SNP), полиморфизм длин рестрикционных фрагментов (RFLP), варьирующее число тандемных повторов (VNTR), динуклеотидный повтор, тринуклеотидный повтор, тетрануклеотидный повтор, простой повтор последовательности, перемещающийся встроенный элемент, такой как Alu, и делеция или вставка одного или более нуклеотидов). В интересующей популяции обычно PS предшествуют и за ними следуют высококонсервативные последовательности, и, таким образом, положение PS обычно обнаруживают относительно консенсусной последовательности нуклеиновой кислоты, состоящей из тридцати-шестидесяти нуклеотидов, предворяющих и завершающих PS, которая в случае SNP обычно обозначается как "контекстная последовательность SNP". Положение PS также может быть определено по его локализации в конценсусной или референсной последовательности относительно инициирующего кодона (ATG) трансляции белка. Специалист в данной области понимает, что локализация конкретного PS может оказаться не точно в том же самом положении, как в референсной или контекстной последовательности, у каждого субъекта интересующей популяции из-за присутствия у субъекта одной или более вставок или делеций, по сравнению с конценсусной или референсной последовательностью. Кроме того, для специалиста в данной области является обычной процедурой создание надежных, специфичных и точных тестов для обнаружения альтернативных аллелей в полиморфном сайте у любого данного субъекта, если специалисту в данной области известны альтернативные аллели в PS, которые нужно обнаружить, и контекстная или референсная последовательность либо обе указанные последовательности, в которых присутствует PS. Таким образом, специалисту в данной области будет понятно, что определение локализации любого PS, описанного здесь, на основе конкретного положения в референсной или в контекстной последовательности (или с учетом кодона инициации в такой последовательности) имеется лишь для удобства, и что любое специфически пронумерованное положение нуклеотида в настоящем смысле включает любое положение нуклеотида того же самого PS, который фактически располагается в том же самом локусе у субъекта, которого проверяют на наличие или отсутствие генетического маркера изобретения с применением какоголибо из методов генотипирования, описанных здесь, или других методов генотипирования, хорошо известных в данной области."Лечить" или "лечение" означает введение терапевтического агента, такого как композиция, содержащая любой из белков IFN-, описанных здесь, внутрь или наружно субъекту, который нуждается в терапевтическом агенте. Субъекты, нуждающиеся в агенте, включают субъектов, которые уже имеют или характеризуются высоким риском развития состояния или нарушения, поддающегося лечению агентом, а также субъекты, которые уже имеют или характеризуются высоким риском развития одного или более неблагоприятных эффектов лечения первым терапевтическим агентом, которые могут быть ослаблены вторым терапевтическим агентом. Обычно терапевтический агент вводят в терапевтически эффективном количестве, которое подразумевает оптимальное количество, чтобы произвести один или более благоприятных результатов. Терапевтически эффективное количество определенного агента может изменяться в соответствии с факторами, такими как состояние болезни, возраст и вес пациента, которого лечат, и восприимчивость пациента, например способность отвечать на терапевтический агент. Был ли достигнут благоприятный результат или клинический результат, может быть оценено с помощью какоголибо клинического измерения, обычно используемого врачами или другими медицинскими сотрудниками, чтобы определить наличие, тяжесть или состояние прогрессирования заданного заболевания, симптома или побочного эффекта. Как правило, терапевтически эффективное количество агента будет приводить в результате к улучшению соответствующего клинического измерения (измерений) по сравнению с исходным состоянием или по сравнению с ожидаемым состоянием при отсутствии лечения по меньшей мере на 5%, обычно по меньшей мере на 10%, более часто по меньшей мере на 20%, наиболее часто по меньшей мере на 30%, предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 50%, наиболее предпочтительно по меньшей мере на 60%, в идеальном случае по меньшей мере на 70%, в более идеальном по меньшей мере на 80% и в наиболее идеальном случае по меньшей мере на 90%. В то время как вариант осуществления настоящего изобретения (например, способ лечения или готовое изделие) может не достигать желаемого клинического благоприятного воздействия или результата у каждого пациента, он должен обеспечивать его у статистически значимого числа пациентов, которое определяют с помощью любого статистического критерия, известного в данной области, например tкритерий Стьюдента, 2-критерий, U-критерий Манна-Уитни, критерий Крускала-Уоллиса (Н-критерий),критерий Джонкхиера-Терпстра и критерий Уилкоксона."Вирусная нагрузка" в контексте лечения хронической HCV-инфекции означает количество РНКHCV в сыворотке крови пациента (также обозначаемое в данной области и здесь как РНК HCV в сыворотке крови и вирусная нагрузка HCV). Вирусную нагрузку определяют предпочтительно с помощью количественного анализа ПЦР-РВ, например, такого как анализ, описанный здесь в разделе "Примеры",или с помощью любого другого анализа, в котором используется другой, но общепринятый в данной области метод, который обеспечивает аналогичный или сходный результат. Более предпочтительно анализ ПЦР-РВ, применяемый для измерения вирусной нагрузки HCV субъекта, имеет нижний предел обнаружения (LLQ) приблизительно 29 международных единиц/мл (IU/мл) или меньше. Количественное определение вирусной нагрузки HCV пациента на исходном уровне и в разные моменты времени во время применения антивирусной терапии используется, чтобы определить, имеет ли пациент высокий исходный уровень вирусной нагрузки, указанный в данном документе, и установить фенотип вирусологического ответа пациента, включая любой из фенотипов вирусологического ответа, описанных здесь."Исходный уровень вирусной нагрузки" обозначает уровень РНК HCV в сыворотке крови до начала терапии одним или более противовирусными агентами. "Высокий исходный уровень вирусной нагрузки" обозначает количество РНК HCV, согласно которому, как обычно понимают в данной области, пациента классифицируют как испытывающего сложности в лечении хронической вирусной инфекции HCV. Два значения исходного уровня вирусной нагрузки, которые использовали для классификации пациентов как тяжелых для лечения, в контексте непрямой терапии пег-IFN-/рибавирином, составляют 600000 и 800000 МЕ/мл. В последнее время вирусная нагрузка, применяемая для классификации пациентов как сложных для лечения, составляет 400000 МЕ/мл."Неопределяемый уровень РНК HCV" обозначает, что РНК HCV не определялся при использовании теста ПЦР-РВ с нижним пределом обнаружения (LLD) приблизительно 10 МЕ/мл или меньше или с применением любого другого теста, в котором применяется другая методика, но который является общепринятым в данной области и обеспечивает эквивалентную или сходную чувствительность."Вирусологический ответ" в контексте лечения хронической HCV-инфекции означает снижение уровня РНК HCV в сыворотке крови после начала антивирусной терапии. В некоторых вариантах осуществления антивирусная терапия включает IFN-. В других вариантах осуществления терапия включает IFN- и один или более дополнительных противовирусных агентов. Комбинированная терапия, которая включает IFN-, часто обозначается в данной области как терапия на основе IFN-. В других вариантах осуществления вирусологический ответ, который измеряют, является ответом на антивирусную терапию, которая не включает IFN-. Предпочтительные фенотипы вирусологического ответа представляют собой быстрый вирусологический ответ (RVR), ранний вирусологический ответ (EVR), вирусологический ответ на лечение (ETR), устойчивый вирусологический ответ(SVR), медленный ответ, нулевой ответ, отсутствие ответа (NR) и рецидив. Определения и моменты времени для оценки указанных фенотипов ответа описаны ниже. В некоторых вариантах осуществления лечение HCV включает вводный период непрямой антивирусной терапии, такой как комбинированная терапия пег-IFN-/рибавирином, с последующей "прямой антивирусной терапией", которая используется здесь, что означает, что терапия включает введение по меньшей мере одного прямого противовирусного агента, такого как ингибитор протеазы HCV, необязательно в комбинации с одним или более непрямыми противовирусными агентами, такими как пегилированный интерферон и рибавирин. В таких многофазных схемах лечения моменты времени вирусологического ответа, описанные ниже, не включают вводный период лечения; скорее, они относятся к продолжительности лечения с прямой антивирусной терапией."Быстрый вирусологический ответ" или "RVR" в контексте непрямой антивирусной комбинированной терапии, например, включающей пегилированный IFN- и рибавирин, означает неопределяемый уровень РНК HCV в сыворотке крови в конце четырех недель лечения."Ранний вирусологический ответ" или "EVR" означает уменьшение РНК HCV в сыворотке крови,больше или равное 2 log в конце 12 недель антивирусной терапии, при этом "полный EVR" означает неопределяемый уровень РНК HCV в сыворотке крови в конце 12 недель антивирусной терапии."Ответ на лечение" или "ETR" означает неопределяемый уровень РНК HCV в сыворотке крови по окончании антивирусной терапии и предпочтительно по окончании любой из схем лечения, описанных здесь или при окончании любой схемы лечения, рекомендованной в инструкции-вкладыше, одобренной регуляторными органами. Неограничивающими примерами моментов времени ETR являются 12, 16, 24,36 и 48 недель."Устойчивый вирусологический ответ" или "SVR" обозначает неопределяемый уровень РНК HCV в сыворотке крови при завершении антивирусной терапии и максимум через 24 недели после окончания антивирусной терапии. В некоторых вариантах осуществления SVR измеряют через 12 недель после окончания антивирусной терапии. SVR также описывается в публикации Dr. Steven L. Flamm в the Journal of the American Medical Association, Vol. 289, No. 18, p. 2413-2417 (2003)."Медленный ответ" в контексте комбинированной терапии пегилированным IFN-/рибавирином означает сниженный больше или равный 2 log, но еще определяемый уровень РНК HCV в сыворотке крови в конце 12 недели антивирусной терапии и неопределяемый уровень РНК HCV в сыворотке крови в конце 24 недели антивирусной терапии."Нулевой ответ" означает уменьшение меньше 1 log уровня РНК HCV в сыворотке крови и/или уменьшение меньше 2 log уровня РНК HCV в сыворотке крови после 4 недель и после 12 недель антивирусной терапии соответственно."Отсутствие ответа" или "NR" означает наличие определяемого уровня РНК HCV на протяжении как минимум 12 недель антивирусной терапии. Фенотип, соответствующий отсутствию ответа, обычно устанавливают, если уровень РНК HCV в сыворотке крови определяется в конце 4 недели и в конце 12 недели антивирусной терапии."Рецидив" обозначает наличие обнаруживаемого уровня РНК HCV в любое время после ответа на лечение (ETR), включая, но без ограничения в 12 или в 24 недели после ETR.II. Применение маркеров ответа на IFN- изобретения. Фенотипический эффект маркеров ответа, описываемых здесь, обеспечивает использование указанных маркеров в ряде коммерческих применений, включая, но без ограничения, клинические испытания исследуемых или ранее одобренных лекарственных средств IFN- у пациентов, выбранных на основе наличия или отсутствия одного или более указанных маркеров, фармацевтические композиции и фармацевтические продукты, содержащие IFN- для лечения пациентов, которые имеют по меньшей мере один из указанных маркеров ответа, диагностические методы и фармакогенетические методы лечения,которые включают индивидуализацию лекарственной терапии пациента, исходя из того, имеет ли пациент один или более указанных маркеров. Полезность любого из коммерческих применений, заявленных здесь, не требует, чтобы взаимосвязь между наличием генетического маркера изобретения и появлением желаемого ответа на IFN- наблюдалась у 100% субъектов, которые получают IFN-; также не требует, чтобы диагностический способ или набор имел определенную степень специфичности или чувствительности в определении наличия или отсутствия маркера ответа у каждого субъекта, также не требует, чтобы диагностический способ, заяв-9 020795 ленный здесь, являлся 100% точным при прогнозировании для каждого субъекта, будет ли он иметь благоприятный ответ на IFN-. Таким образом, авторы изобретения подразумевают здесь, что термины "определить", "определение" и "прогнозирование" не следует интерпретировать, как требующие окончательного или определенного результата; напротив, указанные термины следует истолковывать как обозначающие, что заявленный способ обеспечивает точный результат для большинства субъектов или что результат или прогноз для любого данного субъекта более вероятно является правильным, чем неправильным. Предпочтительно точность результата, предусмотренная диагностическим способом изобретения,представляет собой точность, которую специалист в данной области или регуляторный орган рассматривал бы как подходящую для конкретного применения, в котором используется метод. Аналогичным образом, полезность заявленных фармацевтических продуктов и способов лечения не требует, чтобы они вызывали заявленный или желаемый эффект у каждого субъекта; все, что требуется, это чтобы врач при вынесении своего профессионального суждения в соответствии со всеми применяемыми нормами определял, что шанс достижения заявленного эффекта лечения данного субъекта согласно заявленному способу или с помощью заявленного фармацевтического продукта является достаточно высоким, чтобы обосновать назначение лечения или фармацевтического продукта. А. Тестирование на маркеры ответа на IFN- изобретения. Наличие или отсутствие маркера ответа на IFN- может быть обнаружено посредством любого из ряда методов генотипирования, обычно применяемых в данной области. Как правило, в таких методах генотипирования используются один или более олигонуклеотидов, которые комплементарны области,содержащей или расположенной рядом с PS, представляющим интерес. Последовательность олигонуклеотида, применяемого для генотипирования определенного PS, представляющего интерес, обычно разрабатывают на основе контекстной последовательности PS. Локализация у конкретного субъекта любого из полиморфных сайтов, указанных в табл. 1, представляет собой положение, соответствующее локализации PS, представляющего интерес, в референсной кодирующей или геномной последовательности ДНК окружающей PS, представляющий интерес, или в одной из контекстных последовательностей, описанных в табл. 2 ниже, или в их комплементарных последовательностях. Более длинные контекстные последовательности, используемые при конструировании олигонуклеотидов для генотипа PS табл. 1, представляют собой контекстные последовательности,зарегистрированные в базе данных SNP NCBI по состоянию на 19 мая 2009 г. Референсные кодирующие и аминокислотные последовательности IFN-3 представляют собой последовательности, представленные в GenBank с номером доступа AY129149 (Version Y129149.1, GI:25527104) в базе данных нуклеотидных последовательностей NCBI по состоянию на 19 мая 2009 г. Таблица 2 Контекстные последовательности для SNP, ассоциированных с ответом на IFN 1 Как понятно специалисту в данной области, образцы нуклеиновой кислоты, содержащие определенный PS, могут представлять собой комплементарные двухцепочечные молекулы, и таким образом ссылка на определенный сайт на смысловой цепи также относится к соответствующему сайту на комплементарной антисмысловой цепи. Аналогичным образом, ссылка на определенный генотип, полученный для PS на обеих копиях одной цепи хромосомы, является равнозначной по отношению к комплементарному генотипу, полученному для того же самого PS на обеих копиях другой цепи. Таким образом,генотип А/А для PS rs8103142 на кодирующей цепи гена IL28B эквивалентен генотипу Т/Т указанногоPS некодирующей цепи. Контекстные последовательности, перечисленные здесь, а также их комплементарные последовательности, могут быть использованы для построения зондов и праймеров для генотипирования полиморфных сайтов табл. 1 в образце нуклеиновой кислоты, полученном от субъекта-человека, представляющего интерес, с применением любого из множества методов, хорошо известных в данной области,который позволяет определить, является ли субъект гетерозиготным или гомозиготным по аллелю лучшего ответа, установленному в табл. 1. Молекулы нуклеиновой кислоты, используемые в таких методах,обычно включают РНК, геномную ДНК или кДНК, полученную из РНК. Как правило, методы генотипирования включают анализ образца нуклеиновой кислоты, выделенной из биологического образца, полученного у субъекта, для определения природы нуклеотида или нуклеотидной пары, представленных в одном или более полиморфных сайтов, представляющих интерес. Образцы нуклеиновой кислоты могут быть получены практически из любого биологического образца. Например, подходящие образцы включают сыворотку цельной крови, семенную жидкость, слюну, слезы,каловые массы, мочу, пот, буккальный материал, кожу и волосы. Соматические клетки являются предпочтительными, поскольку они позволяют провести определение природы обоих аллелей, представленных в PS, представляющем интерес. Образцы нуклеиновой кислоты могут быть получены для анализа с применением метода, известного специалистам в данной области. Предпочтительно такие методы дают в результате выделение геномной ДНК, достаточно чистой для определения генотипа желаемого полиморфного сайта (сайтов) молекулы нуклеиновой кислоты. Для увеличения чувствительности и специфичности указанного определения часто желательно амплифицировать из образца нуклеиновой кислоты область-мишень, содержащую PS,который нужно генотипировать. Методы выделения и амплификации нуклеиновой кислоты можно найти, например, в публикации Sambrook, et al., Molecular Cloning: A Laboratory Manual (Cold Spring HarborLaboratory, New York) (2001). Любой метод амплификации, известный специалисту в данной области, может быть использован в осуществлении настоящего изобретения, включая, но без ограничения, методы полимеразной цепной реакции (ПЦР). Реакция ПЦР может быть проведена с использованием материалов и методов, известных специалистам в данной области (см. в целом PCR Technology: Princzals and Applications for DNA Amplification (ed. H.A. Erlich, Freeman Press, NY, N. Y., 1992); PCR Protocols: A Guide to Methods and ApplicationsEckert et al., PCR Methods and Applications 1: 17 (1991); PCR (eds. McPherson et al., IRL Press, Oxford) и патент США 4683202. Другие подходящие методы амплификации включают лигазную цепную реакцию (LCR) (см. Wu and Wallace, Genomics 4: 560 (1989) и Landegren et al., Science 241:1077 (1988, амплификацию посредством транскрипции (Kwoh et al., Proc. Natl. Acad. Sci. USA 86: 1173 (1989, самоподдерживающуюся репликацию последовательностей (Guatelli et al., Proc. Nat. Acad. Sci. USA, 87: 1874(1990; изотермические методы (Walker et al., Proc. Natl. Acad. Sci. USA 89:392-6 (1992 и амплификацию, основанную на последовательности нуклеиновых кислот (NASBA). Амплифицированную область-мишень анализируют, чтобы определить природу по меньшей мере одного из аллелей, представленных в PS в области-мишени. Если оба аллеля локуса представлены в амплифицированной мишени, специалисту в данной области будет понятно, что только один аллель будет определяться в PS у субъектов, которые являются гомозиготными в указанном PS, тогда как два различных аллеля будут обнаруживаться, если субъект является гетерозиготным по указанному PS. Аллель можно идентифицировать непосредственно, путем положительной идентификации или с помощью логического заключения путем отрицательной идентификации. Например, если известно, чтоSNP соответствует гуанину или цитозину в референсной популяции, PS можно определить путем положительной идентификации как гуанин или цитозин, если субъект является гомозиготным по указанному участку, или как и гуанин, и цитозин, если субъект является гетерозиготным по указанному участку. Альтернативно, PS можно определить путем отрицательной идентификации, как не являющийся гуанином (то есть цитозин/цитозин) и не являющийся цитозином (то есть гуанин/гуанин). Идентификация аллеля или пары аллелей (например, двух нуклеотидов в случае SNP) в PS в образце нуклеиновой кислоты, полученном у субъекта, может быть выполнена с использованием любой методики, известной специалистам в данной области. Предпочтительные методики позволяют быстрый, точный анализ множества PS с минимальной обработкой проб. Некоторые примеры подходящих методик включают, но без ограничения, прямое секвенирование ДНК амплифицированной области-мишени, капиллярный электрофорез, гибридизацию аллель-специфических зондов, анализ одноцепочечного конформационного полиморфизма, электрофорез в градиенте денатурирующего геля, гель-электрофорез с градиентом температуры, обнаружение несоответствий в последовательностях; олигонуклеотидные мик- 11020795HuSNP Mapping Assay, reagent kit and user manual, Affymetrix Part No. 90094 (Affymetrix, Santa Clara, CA). В предпочтительных вариантах осуществления природу аллеля (аллелей) в PS определяют с применением метода удлинения праймера с применением полимеразы. Такие методы описаны в патентной и научной литературе и включают метод анализа генетической информации или удлинение на твердой фазе "Genetic Bit Analysis" (WO92/15712) и анализ генетической информации с помощью лигазы/полимеразы (патент США 5679524). Связанные методы раскрыты в международных патентахWO91/02087, WO90/09455, WO95/17676 и в патентах США 5302509 и 5945283. Удлиненные праймеры, содержащие участок, комплементарный полиморфизму, можно обнаружить с помощью массспектрометрии, как описано в патенте США 5605798. В другом методе удлинения праймера используется аллель-специфическая ПЦР (Ruano, G. et al.,Nucl. Acids Res. 17:8392 (1989); Ruano, G. et al., Nucl. Acids Res. 19:6877-82 (1991); WO93/22456; Turki etal., J. Gun. Invest. 95:1635-41 (1995. Кроме того, множественные PS можно исследовать путем одновременного амплифицирования множества областей нуклеиновой кислоты с применением наборов аллельспецифических праймеров, как описано в международном патенте WO89/10414. Еще в одном методе удлинения праймера для определения и анализа полиморфизмов используется удлинение на одно основание (SBE) флуоресцентно-меченого праймера, объединенное с резонансным переносом энергии флуоресценции (FRET) между меткой добавляемого основания и меткой праймера. Как правило, в методе, таком как метод, описанный Chen et al., Proc. Nat. Acad. Sci. 94:10756-61 (1997),используется локус-специфический олигонуклеотидный праймер, меченный на 5'-конце 5 карбоксифлуоресцеином (FAM). Указанный меченый праймер сконструирован так, что 3'-конец непосредственно прилегает к полиморфному сайту, представляющему интерес. Меченый праймер гибридизуется с локусом, и удлинение на одно основание меченого праймера осуществляется флуоресцентномеченными дидезоксирибонуклеотидами (ddNTP) с терминацией последовательности в присутствии красителя, причем дезоксирибонуклеотиды не представлены. Увеличение флуоресценции добавленногоddNTP в ответ на возбуждение при длине волны меченого праймера используется, чтобы сделать заключение о природе добавленного нуклеотида. Предпочтительным тестом для генотипирования является TaqMan SNP Genotyping Assay от Applied Biosystems или тест, характеризующийся приблизительно такой же надежностью, точностью и специфичностью. Во всех упомянутых выше методах точность и специфичность теста, разработанного для определения природы аллеля (аллелей) в каком-либо PS, обычно подтверждают путем выполнения теста на образцах ДНК, в которых природа аллеля (аллелей) в указанном PS известна. Предпочтительно образец,представляющий каждый возможный аллель, включают в процесс валидации. Для диплоидных локусов,таких как локусы на аутосомной и на Х-хромосомах, проверочные образцы, как правило, включают образец, который является гомозиготным по главному аллелю PS, образец, который является гомозиготным по минорному аллелю PS, и образец, который является гетерозиготным в указанном PS. Указанные проверочные образцы, как правило, также включают в качестве контролей при выполнении теста с опытным образцом (т.е. образец, в котором природа аллеля (аллелей) PS неизвестна). Специфичность теста также можно подтвердить путем сравнения результата теста опытного образца с результатом, полученным для того же самого образца с помощью другого типа теста, например с помощью определения последовательности амплифицированной области-мишени, которая, как считают, содержит PS, представляющий интерес, сравнения установленной последовательности с контекстными последовательностями, общеизвестными в данной области, такими как контекстные последовательности, предоставленные в описании. Длина контекстной последовательности, необходимая для доказательства, что проверяется правильное положение в геноме, будет меняться с учетом уникальности последовательности в областимишени (например, может быть одно или более высокогомологичных последовательностей, расположенных в других областях генома). Специалист в данной области может без труда определить соответствующую длину контекстной последовательности для любого PS, используя известные приемы, такие как сравнение с помощью программы BLAST контекстной последовательности с последовательностями из общедоступных баз данных. Для амплифицированных областей-мишеней, которые обеспечивают первый уровень специфичности, рассмотрение контекстной последовательности приблизительно из 30-60 оснований на каждой стороне PS в известных образцах, как правило, является достаточным, чтобы гарантировать специфичность выполнения теста для PS, представляющего интерес. Иногда валидированный тест может не дать однозначного результата для опытного образца. Обычно это результат образца, содержащего ДНК несоответствующей чистоты или качества, и неоднозначный результат обычно получают при повторной очистке или повторном выделении образца ДНК или при тестировании образца с помощью другого типа анализа. Кроме того, при выполнении любого из описанных здесь методов, которые требуют определения наличия или отсутствия определенного маркера ответа на IFN-, такое определение может быть выполнено путем получения справочной информации из хранилища данных, которое содержит достаточную информацию о наборе генов пациента, чтобы определить, имеет ли пациент маркер, представляющий интерес. Предпочтительно хранилище данных регистрирует какой маркер(ы) ответа на IFN- присутствует и отсутствует у субъекта. Хранилище данных должно содержать личные истории болезни, карту клинических данных, файл (например, не структурированный ASCII файл), доступный компьютеру или другому электронному или неэлектронному носителю, на котором может сохраняться соответствующая информация или генетические данные. Используемая здесь карта клинических данных является портативным запоминающим устройством, таким как магнитная карта, смарт-карта, которая имеет встроенное устройство обработки данных, и которое продается производителем, таким как Siemens of Munich Germany, или карта флэш-памяти. Если хранилище данных является хранилищем данных с доступными файлами для компьютера; такие файлы могут быть расположены на различных носителях, включая сервер, клиент, жесткий диск, CD, DVD, персональный цифровой органайзер, такой как Palm Pilot, магнитная лента, zip-дисковод, компьютерное встроенное ПЗУ (постоянное запоминающее устройство) либо Интернет или всемирная паутина. Другие носители для хранения файлов, доступных компьютеру, будут очевидны специалисту в данной области. Изобретение также предполагает, что тестирование на маркер ответа на IFN- может ограничиваться определением, имеет ли субъект аллель, например нуклеотид, в другом локусе, который имеет высокую степень неравновесного сцепления (LD) с аллелем лучшего ответа для любого из SNP, перечисленных в табл. 1. Два определенных аллеля в различных локусах на одной хромосоме считаются находящимися в LD, если присутствие одного из аллелей в одном локусе предполагает присутствие другого аллеля в другом локусе. Такие варианты, обозначенные здесь как сцепленные варианты или заместительные варианты (proxy variants), могут представлять собой любой тип варианта (например, SNP, вставка или делеция), который имеет высокую степень LD с аллелем лучшего ответа, представляющим интерес. Сцепленные варианты легко идентифицируют путем определения степени неравновесного сцепления (LD) между аллелем лучшего ответа любого из SNP табл. 1 и кандидатным сцепленным аллелем в полиморфном сайте, расположенным в хромосомной области 19q13.13 или в другом месте на хромосоме 19. Кандидатный сцепленный вариант может быть аллелем полиморфизма, который известен в настоящее время. Другие кандидатные сцепленные варианты могут быть легко идентифицированы специалистом в данной области с применением любой методики, хорошо известной в данной области, для нахождения полиморфизмов. Степень LD между аллелем лучшего ответа из табл. 1 и кандидатным сцепленным вариантом может быть определена с помощью любого показателя LD, известного в данной области. Показатели LD в области генома легко определяют опытным путем в соответствующим образом выбранных образцах с использованием различных методик, известных в данной области для определения существует ли между двумя аллелями (например, между нуклеотидами в различных PS) неравновесное сцепление (см., например, GENETIC DATA ANALYSIS II, Weir, Sineuer Associates, Inc. Publishers, Sunderland, MA 1996). Специалист в данной области может без труда выбрать, какой метод определения LD будет подходить наилучшим образом для популяционной группы определенного размера и для области генома. Одним из наиболее часто используемых показателей неравновесного сцепления является r2, который рассчитывают с помощью формулы, описанной Devlin et al. (Genomics, 29(2):311-22 (1995. Значение r2 является показателем того, насколько хорошо аллель X в первом локусе предсказывает появление аллеля Y во втором локусе на той же самой хромосоме. Показатель достигает значения 1,0, только если предсказание является совершенным (например, X, если, и только если, Y). Предпочтительно локус сцепленного варианта находится в области генома, состоящей приблизительно из 100 тысяч пар нуклеотидов, более предпочтительно приблизительно 10 т.п.н., которая перекрывает любой из PS табл. 1. Другие сцепленные варианты представляют собой варианты, у которых LD с аллелем лучшего ответа имеет значение r2, которое измеряют в соответствующей референсной популяции, по меньшей мере 0,75, более предпочтительно по меньшей мере 0,80, еще более предпочтительно по меньшей мере 0,85 или по меньшей мере 0,90, еще более предпочтительно по меньшей мере 0,95 и наиболее предпочтительно 1,0. Референсная популяция, используемая для такого измерения r2, может быть генеральной популяцией, популяцией, использующей IFN-, популяцией с диагносцированным определенным состоянием, для которого показана эффективность IFN- (такое как хроническая HCVинфекция), или популяция, члены которой идентифицируют свою принадлежность к одной этнической группе, например европеец, афро-американец, испаноговорящий, латиноамериканец, коренной американец и т.п., или может быть любой комбинацией из указанных категорий. Предпочтительно референсная популяция отражает генетическое разнообразие популяции пациентов, которых лечат IFN-. В некоторых вариантах осуществления врач определяет, имеет ли пациент маркер ответа на IFN-,описанный здесь, назначая диагностический тест, который предназначен для определения, имеет ли пациент по меньшей мере один аллель лучшего ответа в одном или более полиморфных сайтов табл. 1. Предпочтительно тест определяет природу обоих аллелей, т.е. генотип, в указанном PS. В некоторых вариантах осуществления лаборатория тестирования будет получать образец нуклеиновой кислоты из биологического образца (такого как образец крови или буккальный мазок), полученного у пациента. В некоторых вариантах осуществления образец крови у пациента берет врач либо медицинский сотрудник или лаборант диагностической лаборатории. В некоторых вариантах осуществления пациенту предоставляется набор для приготовления буккального мазка с внутренней стороны щеки, который затем пациент отдает медицинскому сотруднику или отправляет непосредственно в диагностическую лабораторию. В некоторых вариантах осуществления в лаборатории тестирования неизвестны идентификационные данные субъекта, чей образец тестируется; т.е. образец, принимаемый лабораторией, делают анонимным каким-либо образом перед отправкой в лабораторию. Например, образец может быть идентифицирован просто с помощью номера или какого-либо другого кода ("ID образца") и результаты диагностического метода могут быть сообщены стороне, назначившей тест, с использованием ID образца. В предпочтительных вариантах осуществления связь между идентификационной информацией субъекта и образцом субъекта известна только субъекту или врачу субъекта. В некоторых вариантах осуществления после того, как получены результаты теста, лаборатория тестирования составляет отчет по результатам исследования, в котором указано наличие или отсутствие аллеля лучшего ответа в генотипированном полиморфном сайте, и предпочтительно указано является ли пациент гетерозиготным или монозиготным по аллелю наилучшего ответа. В некоторых вариантах осуществления отчет по результатам исследования является письменным документом, подготовленным лабораторией тестирования и отправленным пациенту или врачу пациента в виде печатного документа или с помощью электронной почты. В других вариантах осуществления отчет по результатам исследования создается с помощью компьютерной программы и демонстрируется на видеомониторе в кабинете врача. Отчет по результатам исследования также может включать в себя устное сообщение результатов теста непосредственно пациенту либо врачу пациента или сотруднику с разрешенным допуском в кабинете врача. Аналогичным образом, отчет по результатам исследования может содержать запись о результатах теста, которую врач описал в файле пациента. В одном предпочтительном варианте осуществления, если пациент является гомозиготным по аллелю лучшего ответа, то в отчете по результатам исследования дополнительно указано, что пациент тестирован положительно на генетический маркер, ассоциированный с возможным ответом на лечение IFN-,тогда как, если субъект является гетерозиготным по аллелю лучшего ответа или является гомозиготным по другому аллелю, то в отчете по результатам исследования дополнительно указано, что пациент отрицательно тестирован на генетический маркер, ассоциированный с возможным ответом на лечение IFN-. В некоторых вариантах осуществления результат теста будет включать оценку вероятности достижения благоприятного ответа на IFN-, которую получают в результате выполнения модели, которая взвешивает различные параметры пациента (например, возраст, пол, вес, раса, результаты тестов на другие фармакогинетические маркеры для IFN-) и характеристики заболевания (например, тяжесть заболевания),которые связаны с ответом на IFN- в популяции с соответствующим заболеванием. Вес, придаваемый каждому параметру, основан на его вкладе по сравнению с другими параметрами в объяснение межсубъектной вариабельности ответа на IFN- в популяции с рассматриваемым заболеванием. Доктор может использовать указанную оценку вероятности ответа как показатель в выборе терапии или схемы лечения для пациента. Например, при хронической HCV-инфекции параметры пациента, ассоциированные с достижением SVR, включают расу и параметры заболевания включают генотип HCV, исходный уровень вирусной нагрузки и степень фиброза. Как правило, субъект может быть проверен на наличие маркера ответа на IFN- до начала терапииIFN-, но предусматривается, что такое тестирование может быть проведено в любое время после введения субъекту первой дозы IFN-. Например, лечащий врач может быть обеспокоен тем, что пациент не отвечает соответствующим образом на лечение и хочет назначить тест субъекту, чтобы определить обосновано ли продолжение лечения IFN-. В некоторых вариантах осуществления врач может определить,следует или нет субъекту проводить тест на маркеры ответа на IFN-. Например, врач может оценивать,назначать ли пациенту фармацевтический продукт, который показан для пациентов, положительно тестированных на маркер ответа на IFN-. В вариантах осуществления, где пациент имеет обнаруживаемый уровень РНК HCV в сыворотке крови и перенес трансплантацию печени, врач может принять решение о проведении биопсии трансплантированной печени для проверки маркера ответа на IFN-, чтобы облегчить принятие лечебных решений в отношении пациента. При принятии решения, как использовать результаты теста на маркер ответа на IFN- в лечении какого-либо отдельного пациента, врач также может принимать во внимание другие соответствующие условия, такие как заболевание или состояние, которое лечат, возраст, вес, пол, наследственность и расу пациента, включая ввод комбинации указанных факторов и результатов теста на генетический маркер в модель, которая помогает врачу провести выбор терапии и/или схемы лечения для указанной терапии. Определение наличия или отсутствия любого из маркеров ответа табл. 1 может быть осуществлено с применением набора, который специально разработан для данной цели. В одном варианте осуществления набор изобретения содержит ряд олигонуклеотидов, предназначенных для идентификации каждого из аллелей в PS по меньшей мере одного маркера табл. 1, в предпочтительных вариантах осуществленияPS представляет собой rs12980275, rs28416813 или rs8103142. В другом варианте осуществления разрабатывается ряд олигонуклеотидов для идентификации аллелей в любой комбинации двух или более PS табл. 1. В предпочтительном варианте осуществления комбинация PS включает по меньшей мере PSrs28416813 и PS rs8103142. В другом предпочтительном варианте осуществления комбинация PS включает каждый из полиморфных сайтов табл. 1. В некоторых вариантах осуществления олигонуклеотиды в наборе являются либо аллельспецифичными зондами, либо аллель-специфичными праймерами. В других вариантах осуществления набор содержит олигонуклеотиды для удлинения праймера. В других вариантах осуществления набор олигонуклеотидов представляет собой комбинацию аллель-специфичных зондов, аллель-специфичных праймеров и олигонуклеотиды для удлинения праймера. Набор может содержать олигонуклеотиды,предназначенные для обнаружения наличия других генетических маркеров, ассоциированных с ответом на IFN-. Олигонуклеотиды в наборах изобретения должны быть способны специфически гибридизоваться с целевой областью полинуклеотида. Используемая здесь "специфическая гибридизация" означает, что олигонуклеотид образует антипараллельную двухцепочечную структуру с областью-мишенью в определенных условиях гибридизации и в то же время не способен образовать такую структуру с областями, не являющимися мишенями, при их инкубации с полинуклеотидом в тех же самых условиях гибридизации. В некоторых вариантах осуществления область-мишень содержит PS, представляющий интерес, тогда как в других вариантах осуществления область-мишень расположена на расстоянии 1-10 нуклеотидов рядом с PS. Состав и длина каждого олигонуклеотида в наборе будет зависеть от природы геномной области,содержащей PS, а также от типа теста, который нужно выполнить с помощью олигонуклеотида, и они могут быть легко определены специалистом в данной области. Например, полинуклеотид, который используют в тесте, может составлять продукт амплификации,и таким образом требуемая специфичность олигонуклеотида существует в отношении гибридизации с областью-мишенью в продукте амплификации, скорее чем в геномной ДНК или кДНК, выделенной у субъекта. В качестве другого примера, если набор предназначен для генотипирования двух или более полиморфных сайтов одновременно, температуры плавления олигонуклеотидов для каждого PS в наборе обычно будут находиться в узком диапазоне, предпочтительно меньше 5 и более предпочтительно меньше 2 С. В некоторых вариантах осуществления каждый олигонуклеотид в наборе совершенно комплементарен своей области-мишени. Олигонуклеотид называется "совершенно" или "полностью" комплементарным другой молекуле нуклеиновой кислоты, если каждый нуклеотид одной из молекул комплементарен нуклеотиду в соответствующем положении другой молекулы. В то время как совершенно комплементарные олигонуклеотиды предпочтительны для обнаружения полиморфизмов, предусматриваются отклонения от полной комплементарности, если такие отклонения не препятствуют специфической гибридизации молекулы с областью-мишенью, как определено выше. Например, олигонуклеотидный праймер может иметь некомплементарный фрагмент на 5'-конце, при этом оставшаяся часть праймера полностью комплементарна области-мишени. Альтернативно, некомплементарные нуклеотиды могут быть расположены вразброс в зонде или праймере при условии, что полученный зонд или праймер попрежнему способен специфически гибридизоваться с областью-мишенью. В некоторых предпочтительных вариантах осуществления каждый олигонуклеотид в наборе специфически гибридизуется со своей областью-мишенью в жестких условиях гибридизации. Жесткие условия гибридизации зависят от последовательности и варьируют в зависимости от обстоятельств. В целом жесткие условия выбирают так, что температура приблизительно на 5 С ниже, чем температурная точка плавления (т.пл.) для конкретной последовательности при определенной ионной силе и значении рН. Т.пл. представляет собой температуру (при определенной ионной силе, рН и концентрации нуклеиновой кислоты), при которой 50% зондов, комплементарных последовательности-мишени, гибридизуются с последовательностью-мишенью в равновесном состоянии. Поскольку последовательности-мишени обычно представлены в избытке, при т.пл. 50% зондов находятся в равновесном состоянии. Как правило, жесткие условия включают концентрацию соли по меньшей мере приблизительно 0,01-1,0 М концентрации ионов натрия (или других солей) при значении рН 7,0-8,3 и температура составляет по меньшей мере приблизительно 25 С для коротких олигонуклеотидых зондов (например, 1050 нуклеотидов). Жесткие условия также могут быть получены при добавлении дестабилизирующих агентов, таких как формамид. Например, условия 5SSPE (750 мМ NaCl, 50мМ фосфат натрия, 5 мМ ЭДТА, рН 7,4) и температура 25-30 С предназначены для гибридизации аллель-специфических зондов. Дополнительные жесткие условия могут быть найдены в руководстве Molecular Cloning: A LaboratoryNUCLEIC ACID HYBRIDIZATION, A PRACTICAL APPROACH, Haymes et al., IRL Press, Washington,D.C., 1985. Один неограничивающий пример жестких условий гибридизации включает гибридизацию в 4 буфере хлорид натрия/цитрат натрия (SSC) приблизительно при 65-70 С (или, альтернативно, гибридизацию в 4SSC плюс 50% формамид приблизительно при 42-50 С) с последующей одной или более промывками в 1SSC приблизительно при 65-70 С. Неограничивающий пример высокожестких условий гибридизации включает гибридизацию в 1SSC приблизительно при 65-70 С (или, альтернативно, гибридизацию в 1SSC плюс 50% формамид приблизительно при 42-50 С) с последующей одной или более промывками в 0,3SSC приблизительно при 65-70 С. Неограничивающий пример условий гибридизации пониженной жесткости включает гибридизацию в 4SSC приблизительно при 50-60 С (или, альтернативно, гибридизацию в 6SSC плюс 50% формамид приблизительно при 40-45 С) с последующей одной или более промывками в 2SSC приблизительно при 50-60 С. Подразумевается, что жесткие условия в пределах от средних значений до указанных выше значений, например, при 65-70 С или при 42-50 С также включены в настоящее изобретение. Буфер SSPE (1SSPE представляет собой 0,15 М NaCl, 10 мМNaH2PO4 и 1,25 мМ ЭДТА, рН 7,4) может быть заменен на буфер SSC (1SSC представляет собой 0,15 МNaCl и 15 мМ цитрат натрия) в гибридизационном и промывочном буферах; промывки производят в течение 15 мин, каждая после того, как гибридизация завершена. Температура гибридизации для гибридов с предполагаемой длиной меньше 50 пар оснований должна быть на 5-10 С ниже, чем температура плавления (т.пл.) гибрида, где т.пл. определяют согласно следующим уравнениям. Для гибридов длиной меньше 18 пар оснований т.пл. (С)=2( оснований А+Т)+4( оснований G+C). Для гибридов длиной от 18 до 49 пар оснований т.пл.(С)=81,5+16,6(log10[Na+])+0,41(%G+C)-(600/N), где N представляет собой число оснований в гибриде и[Na+] представляет собой концентрацию ионов натрия в гибридизационном буфере ([Na+] для 1SSC=0,165 M). Олигонуклеотиды в наборах изобретения могут состоять из рибонуклеотидов, дезоксирибонуклеотидов, ациклических нуклеотидных производных и других функционально эквивалентных производных в любом состоянии фосфорилирования. Альтернативно, олигонуклеотиды могут иметь основную цепь,не содержащую фосфатов, которая может быть составлена из звеньев, таких как карбоксиметил, ацетамидат, карбамат, полиамид (пептидная нуклеиновая кислота (PNA и т.п. (Varma, в MOLECULAR BIOLOGY AND BIOTECHNOLOGY, A COMPREHENSIVE DESK REFERENCE, Meyers, ed., p. 6, 17-20,VCH Publishers, Inc., 1995). Олигонуклеотиды могут быть получены с помощью химического синтеза с использованием любой подходящей методики, известной в данной области, или могут быть получены из биологического образца, например, путем ограниченного расщепления. Олигонуклеотиды могут содержать детектируемую метку в соответствии с любым способом, известным в данной области, включая применение радиометок, флуоресцентных меток, ферментных меток, белков, гаптенов, антител, маркирующих последовательностей и т.п. Олигонуклеотиды в наборе могут быть произведены и представлены на рынке в виде аналит-специфических реагентов (ASR) или могут быть составными компонентами одобренного диагностического устройства. В некоторых вариантах осуществления набор олигонуклеотидов в наборе содержит различные метки, чтобы обеспечить одновременное определение идентичности аллелей в двух или более полиморфных сайтах. Олигонуклеотиды также могут составлять требуемый ряд олигонуклеотидов, иммобилизованных на твердой поверхности, такой как микрочип, кремниевые гранулы (например, технология BeadArray отIllumina, San Diego, CA) или стеклянная пластина (см., например, WO98/20020 и WO98/20019). Наборы,содержащие такие иммобилизованные олигонуклеотиды, могут быть предназначены для выполнения ряда тестов для определения полиморфизма, включая, но без ограничения, тесты на основе метода гибридизации зондов и удлинения праймера с применением полимеразы. Наборы изобретения также могут содержать другие реагенты, такие как гибридизационный буфер(например, если олигонуклеотиды используют в качестве аллель-специфичных зондов) или дидеоксинуклеотидные трифосфаты (ddNTP; например, если аллели в полиморфных сайтах определяют с помощью удлинения праймера). Наборы, предназначенные для применения в тестах генотипирования с применением полимеразы, также могут содержать полимеразу и реакционный буфер, оптимизированный для выполнения теста с применением полимеразы. Наборы изобретения также могут содержать реагенты для определения, произошла ли специфическая гибридизация или произошло ли специфическое удлинение праймера, опосредуемое полимеразой. Такие реагенты для обнаружения могут включать биотин-меченные или флуоресцентно-меченные олигонуклеотиды или ddNTP и/или меченное ферментом антитело и один или более субстратов, которые производят детектируемый сигнал, когда на них воздействует фермент. Специалисту в данной области понятно, что набор олигонуклеотидов и реагенты для выполнения теста предоставляются в отдельных емкостях, помещенных при необходимости в контейнер набора, чтобы сохранить биологическую или химическую активность и обеспечить надлежащее использование при проведении теста. В других вариантах осуществления проверяли качество каждого из олигонуклеотидов и всех других реагентов в наборе для оптимального выполнения теста, предназначенного для определения генотипа одного или более PS табл. 1. В некоторых вариантах осуществления набор содержит инструкцию о порядке работы, в которой описано, как использовать расшифрованный генотип, чтобы определить в тестируемом образце нуклеиновой кислоты наличие или отсутствие маркера ответа. В некоторых предпочтительных вариантах осуществления набор олигонуклеотидов в наборе представляет собой алелль-специфические олигонуклеотиды. Используемый здесь термин "алелльспецифический олигонуклеотид" (ASO) обозначает олигонуклеотид, который способен в достаточно жестких условиях специфически гибридизоваться с одним аллелем PS в области-мишени, содержащей PS, и в то же время не гибридизоваться с той же областью, содержащей другой аллель. Специалисту в данной области понятно, что специфичность связывания аллеля будет зависеть от ряда легко оптимизируемых условий жесткости, включая концентрацию соли и формамида, а также от температуры на стадии гибридизации и на стадии промывки. Примеры условий гибридизации и промывки, обычно применяемых для ASO-зондов и праймеров,можно найти в публикации Kogan et al., "Genetic Prediction of Hemophilia A" in PCR PROTOCOLS, AUSA 87:6296-300 (1990). Как правило, ASO будет полностью комплементарен одному аллелю и в то же время будет иметь ошибочное спаривание пары оснований с другим аллелем. В ASO-зондах ошибочное спаривание пары оснований происходит предпочтительно в центральном положении олигонуклеотидного зонда при его выравнивании с полиморфным сайтом в области-мишени (например, приблизительно 7-е или 8-е положение в 15mer, 8-е или 9-е положение в 16mer и 10-е или 11-е положение в 20mer). Ошибочное спаривание пары оснований в ASO-праймерах находится в 3'-концевом нуклеотиде или предпочтительно в 3'предпоследнем нуклеотиде. ASO-зонды и ASO-праймеры, гибридизующиеся с кодирующей или с некодирующей цепью, предусматриваются изобретением. В некоторых вариантах осуществления набор содержит пару аллель-специфических олигонуклеотидов для каждого PS, который исследуют, причем один член пары специфичен для одного аллеля (например, аллель лучшего ответа) и другой член является специфичным для другого аллеля. В таких вариантах осуществления олигонуклеотиды в паре могут быть разной длины или могут содержать различные детектируемые метки, чтобы позволить пользователю набора определить генотип в исследуемом PS. В других предпочтительных вариантах осуществления олигонуклеотиды в наборе являются олигонуклеотидами удлинения праймера. Для остановки реакции удлинения, опосредуемого полимеразой,выбирают смеси любых указанных олигонуклеотидов, чтобы прекратить удлинение олигонуклеотида в интересующем PS, или выбирают одно основание соответственно в зависимости от противоположных нуклеотидов, представленных в PS. В одном варианте осуществления набор содержит пару аллель-специфических олигонуклеотидных зондов для генотипирования по меньшей мере одного из полиморфных сайтов табл. 1. В одном варианте осуществления один ASO-зонд в паре содержит нуклеотидную последовательность по меньшей мере из 15 нуклеотидов, которая идентична или полностью комплементарна аллелю лучшего ответа в контекстной последовательности, представленной в табл. 2, и другой ASO-зонд в паре содержит нуклеотидную последовательность по меньшей мере из 15 нуклеотидов, которая идентична или полностью комплементарна другому аллелю в контекстной последовательности, представленному в табл. 2. В одном предпочтительном варианте осуществления набор содержит такие ASO-зонды для генотипирования по меньшей мере одного PS, выбранного из группы, состоящей из rs8103142 и rs8103142. В другом предпочтительном варианте осуществления набор содержит такие ASO-зонды для генотипирования обоих PS. В другом варианте осуществления набор содержит такие ASO-зонды для генотипирования каждого PS табл. 1. В. Фармацевтические композиции, фармацевтические продукты и схемы лечения. Субъект, которого тестируют или лечат с помощью любого из способов и продуктов, описанных здесь, является субъектом-человеком, нуждающимся в лечении IFN-. В некоторых вариантах осуществления у субъекта диагносцирован или проявляется симптом, заболевание, поддающееся лечению IFN-. В других вариантах осуществления лекарственное средство IFN-, которое используют, одобрено для применения в лечении показания, которое было диагносцировано у субъекта. В других вариантах осуществления лекарственное средство IFN-, которое используют, не одобрено для лечения диагносцированного заболевания или выявленного симптома (симптомов), но лечащий врач считает, что лекарственное средство может быть полезно в лечении субъекта.IFN-, используемый в фармацевтических композициях, фармацевтических продуктах и способах настоящего изобретения, может быть любым из многих подтипов белков IFN-, экспрессируемых у человека и многих других видов (Pestka, S. et al., Immunol. Reviews 202:8-32 (2004); Diaz, M.O., et al., J. In- 17020795terferon Cytokine Res 16: 179-180 (1996. В предпочтительных вариантах осуществления белок IFNявляется белком, полученным рекомбинантным способом, который состоит или по существу состоит из зрелой аминокислотной последовательности одного из следующих подтипов IFN- человека: IFN-1,IFN-2, IFN-4, IFN-5, IFN-6, IFN-7, IFN-8, IFN-10, IFN-13, IFN-14, IFN-16, IFN-17, IFN21 (Bekisz, J. et al., Growth Factors 22(4):243-351 (2004, а также аллельных вариантов любого из указанных подтипов, например IFN-2a, IFN-2b и IFN-2c. Подтипы IFN- человека характеризуются 7599% идентичности аминокислотной последовательности и зрелой аминокислотой из 166 а.к., за исключением IFN-2, который состоит из 165 а.к. в результате делеции в положении 44 (Bekisz, J., et al., выше). Другие рекомбинантные белки IFN-, предусмотренные для применения в настоящем изобретении,включают любой консенсусный белок IFN-, в котором аминокислотная последовательность создана путем отбора для каждого положения аминокислоты, которая чаще всего встречается в таком положении в различных нативных подтипах IFN-. Особенно предпочтительные композиции IFN- для применения в фармацевтических продуктах и способах настоящего изобретения представляют собой продукты IFN2, одобренные государственным регуляторным органом, включая любые из перечисленных: Roferon-A (IFN- 2 А, рекомбинантный),поставляемый Hoffmann La-Roche, Nutley NJ), и его пегилированные версии, такие как PEGASYS (пегIFN2 а), поставляемый Hoffmann La-Roche, Nutley NJ); INTRON А (IFN2b, рекомбинантный), поставляемый Schering Corporation, Kenilworth, NJ) и его пегилированные версии, такие как PegIntronAmgen, Thousand Oaks, CA и в настоящее время поставляемый Three Rivers Pharmaceuticals, Warrendale,PA. Другие интерфероны, предусмотренные для применения в настоящем изобретении, включают гибриды IFN- и неинтерферонового белка, такие как Albuferon (альб-IFN2b), который разрабатываетсяHuman Genome Sciences, Rockville, MD и Norvartis, Basel, Switzerland; Locteron, проходящая клиническое испытание композиция с контролируемым высвобождением IFN- (Biolex/OctoPlus); и Belerofon, вариант природного -IFN с заменой одной аминокислоты, разработанный Nautilus Biotech. Любая из названных выше композиций IFN- также может продаваться под различными торговыми названиями, такими как VIRAFERONPEG, пег-IFN2b, который представляет собой такую же композицию, как и PegIntron, пег-IFN2b.PEGASYS пег-IFN2 а получают путем ковалентного связывания одного разветвленного PEGполимера с молекулярным весом 40 кДа с помощью амидной связи с боковой цепью лизина молекулыIFN2b; см., например, Dhalluin, С. et al., Bioconjugate Chem. 16:504-517 (2005) и патент США 7201897. Конечный продукт представляет собой смесь шести основных монопегилированных позиционных изомеров (Dhalluin, С., выше, Foser, S. et al., J. Prot. Exp. Purif. 30: 78-87 [2003]). PEGASYS (пегIFN2 а) и его биоаналоги также обозначаются здесь как bPEG40K-IFN2 а.PegIntron (пег-IFN2b) получают при ковалентном взаимодействии рекомбинантного IFN2b с сукцинимидилкарбонатом PEG со средним молекулярным весом 12000 Да (SC-PEG12k) в 100 мМ фосфате натрия, рН 6,5 (см., например, Grace, M. et al., J. Interferon Cytokine Res. 21:1103-1115 (2001); Wang,Y.S. et al., Adv. Drug Delivery Rev. 54:547-570 (2000) и патент США 5951974). Конечный продукт представляет собой смесь главным образом монопегилированных видов, в которых PEG12k присоединен к различным остаткам IFN2b с помощью уретановой связи, причем основной позиционный изомер имеет уретановую связь в положении гистидин 34 (см., например, Wang, Y.S. et al. выше и патент США 5951974). PegIntron (пег-IFN2b) и его биоаналоги также обозначены здесь как PEG12k-IFN2b. Другие продукты IFN-, предусмотренные для применения в изобретении, которые были одобрены ранее или представлены в настоящее время на рынке, включают Berofor -2 (рекомбинантный IFN-2 С, Boehringer Ingelheim Pharmaceutical, Inc., Ridgefield, CT; IFNn1, очищенная смесь природных-IFN, известная как Surniferon (Sumitomo, Japan) или как Wellferon IFNn1 (INS), Glaxo-WellcomeLtd., London, Great Britain; консенсусный IFN-, такой как интерфероны, описанные в патентах США 4897471 и 4695623 (особенно примеры 7, 8 или 9); ALFERON N Injection [IFNn3 (полученный из лейкоцитов человека)], смесь многочисленных видов природных -IFN, предоставляемая HemispherxBiopharma, Inc., Philadelphia, PA. Другие конъюгаты IFNполимер, применяемые в настоящем изобретении, описаны в патенте США 4766106, патенте США 4917888, европейской патентной заявке 0236987, европейских патентных заявках 0510356, 0593868 и 0809996 и в международной публикации WO95/13090. Также для применения в настоящем изобретении предусмотрена любая фармацевтическая композиция пегилированного IFN- 2 а или 2b, которая одобрена регуляторным органом на основе по меньшей мере в части идентичности преклинических и/или клинических данных, ранее представленных регуляторному органу в связи с утверждением любого из описанных выше представленных на рынке продуктов пегилированного IFN-, т.е. PEGASYS (пег-IFN2 а) и PegIntron (пег-IFN2b). Такие позднее одобренные продукты могут быть описаны регуляторным органом в терминах, таких как генерический,- 18020795 биоэквивалентный, биоаналог или заменяющий в отношении ранее одобренного продукта, указанные термины могут быть определены или не определены в явной форме регуляторным органом. Фармацевтические композиции пегилированных IFN-, предназначенные для парентерального введения, могут быть включены в состав с подходящим буфером, например Tris-HCl, ацетатным или фосфатным, таким как буфер двухосновный фосфат натрия/одноосновный фосфат натрия, и фармацевтически приемлемыми средами для лекарственного средства (например, сахароза, трегалоза), носителями(например, человеческий сывороточный альбумин), токсическими агентами (например, NaCl), консервантами (например, тимеросал, крезол или бензиловый спирт) и сурфактантами (например, твин или полисорбаты) в стерильной воде для инъекций; см., например, патент США 6180096 и международную патентную заявку WO2006/020720. Такие композиции могут быть сохранены в виде лиофилизированных порошков при охлаждении до 2-8 С и могут быть восстановлены стерилизованной водой перед применением. Такие восстановленные водные растворы обычно стабильны при хранении и использовании в течение 24 ч после восстановления; см., например, патенты США 4492537, 5762923 и 5766582. Композиции леофилизированного пегилированного интерферона могут быть предоставлены в шприце-ручке,которая включает в себя стеклянный картридж, содержащий разбавитель (т.е. стерилизованную воду) в одном отделении и порошок лиофилизированного пегилированного IFN- в специальном отделении. Примеры водных композиций пегилированного интерферона описаны в патенте США 5762923. Такие композиции могут храниться в предварительно заполненных, многодозовых шприцах, таких как шприцы, применяемые для доставки лекарственных средств, таких как инсулин. Типичные соответствующие шприцы включают системы, содержащие предварительно заполненный пузырек, прикрепленный к ручке-шприцу, такому как NOVOLET Novo Pen, доступному в Novo Nordisk, а также предварительно заполненные ручки-шприцы, которые позволяют пользователю легко ввести инъекцию самому себе. Настоящее изобретение также предполагает применение любого из упомянутых выше IFN- в комбинации с агонистом Toll-подобного рецептора (TLR), который, как предполагают, индуцирует ответ на интерферон. Например, агонисты TLR3, TLR7 и TLR9 проходят оценку для применения в лечении HCV. Заболевания и состояния, которые могут лечить по настоящему изобретению, обычно являются такими, которые поддаются лечению IFN-, т.е. IFN- обеспечивает клинически измеримый благоприятный результат в группе пациентов заболевания, например уменьшение вирусной нагрузки у HCVинфицированных пациентов. Типичные заболевания и состояния, поддающиеся лечению IFN-, включают, но без ограничения, заболевания, вызываемые клеточной пролиферацией, в особенности вирусные инфекции и злокачественные опухоли. Предпочтительно заболевание представляет собой заболевание,для которого IFN- одобрен регуляторным органом, таким как Управление по контролю качества пищевых продуктов и лекарственных средств США. Вирусные инфекции включают гепатит А, гепатит В, гепатит С, гепатит D, другой гепатит не-А/неВ, вирус герпеса, вирус Эпштейн-Барра (EBV), цитомегаловирус (CMV), простой герпес, вирус герпеса человека тип 6, папилломавирусы, поксвирус, пикорнавирус, аденовирус, риновирус, человеческий Тлимфотропный вирус типа 1 и 2, человеческий ротавирус, вирус бешенства, ретровирусы, включая вирус иммунодефицита человека (ВИЧ), энцефалит и респираторные вирусные инфекции. В предпочтительных вариантах осуществления вирусная инфекция представляет собой HCV или HBV. В особенно предпочтительном варианте осуществления вирусная инфекция представляет собой хроническую HCV-инфекцию. В предпочтительных вариантах осуществления маркеры ответа на IFN- настоящего изобретения применяются совместно с любой схемой лечения монотерапии IFN- или комбинированной терапии,одобренной регуляторным органом при показании хронический HBV или хронический HCV, и в особенно предпочтительных вариантах осуществления совместно с любой из схем дозирования и лечения хронического гепатита С, описанных в листке-вкладыше для продуктов Roferon-A (IFN- 2 А, рекомбинантный), PEGASYS (пег-IFN2 а), INTRON А (IFN2b, рекомбинантный) и PegIntron (пег-IFN-2b). Одобренные схемы комбинированной терапии при хронической HCV-инфекции обычно включают рибавирин, нуклеозидный аналог в дополнение к белку IFN-. Для продукта PegIntron (пег-IFN2b) такие одобренные комбинированные схемы рекомендуют терапию в течение 24 недель для пациентов,хронически инфицированных HCV генотипа 2 или 3, и до 48 недель для пациентов, хронически инфицированных HCV генотипа 1, причем 24-недельная терапия одобрена в Европе для подгруппы пациентов с генотипом 1 инфекции и пациентов с низкой вирусной нагрузкой (меньше 600000), которые являютсяHCV РНК-отрицательными на четвертой неделе лечения и остаются HCV РНК-отрицательными на 24-й неделе лечения. В других вариантах осуществления маркеры ответа на IFN- используются совместно с тестированием вирусологического ответа для определения соответствующей продолжительности лечения комбинированной терапией IFN-/рибавирином пациентов, инфицированных HCV генотипа 1. Пациенты, положительно тестированные на маркер ответа на IFN- в гомозиготном состоянии и которые имеют неопределяемый уровень РНК HCV на 4 и на 12 неделях лечения, могут быть кандидатами для лечения продолжительностью 12-36 недель, например 12, 18, 24, 30 или 36 недель. В некоторых предпочтительных вариантах осуществления выбираемая продолжительность лечения составляет 24 недели для не получавшего ранее лечения пациента, хронически инфицированного HCV генотипа 1 с высоким исходным уровнем вирусной нагрузки, который положительно тестирован на маркер ответа на IFN- в гомозиготном состоянии и имеет неопределяемый уровень РНК HCV в каждую из недель лечения 4 и 12. В особенно предпочтительных вариантах осуществления IFN- представляет собой пегилированный IFN2 а или -2b или слитый белок альбумин-IFN2 а или -2b. Комбинированные схемы на основе IFN-, включающие нуклеозидный аналог, другой, чем рибавирин, также рассматриваются для лечения HCV-инфекции у субъектов, положительно тестированных на маркер ответа на IFN-. Примеры таких нуклеозидных аналогов включают производные рибавирина,такие как тарибавирин (также известный как вирамидин и ICN 3142), который разрабатывается ValeantPharmaceuticals International (Aliso Viejo, CA), и соединения, описанные в патентах США 6403564 и 6924270. Маркеры ответа на IFN- настоящего изобретения также могут быть использованы для отбора пациентов, хронически инфицированных HCV, которые, по-видимому, получат наибольшую пользу от лечения терапией на основе IFN- (с рибавирином или без него) в комбинации с одним или более дополнительными противовирусными агентами. Неограничивающие примеры противовирусных агентов, применяемых в таких схемах комбинированного лечения, включают ингибитор протеазы HCV, ингибитор протеазы NS3, ингибитор полимеразы HCV, ингибитор HCV NS5A, ингибитор IRES, ингибитор NS4B, ингибитор хеликазы HCV, ингибитор входа, ингибитор продукции вирионов HCV и другие интерфероны. В одном варианте осуществления противовирусный агент представляет собой ингибитор протеазыHCV. Ингибиторы протеазы HCV, используемые в таких комбинированных схемах лечения, описаны в опубликованных международных патентных заявкахWO2009/038663, WO2007/092616 иWO2002/18369 и в опубликованной патентной заявке США 2007/0042968. Другие ингибиторы протеазы HCV, используемые в способах и комбинированных терапиях настоящего изобретения, включают боцепревир (SCH503034) и SCH900518 (Schering-Plough); телапревирIngelheim). Дополнительные примеры ингибиторов протеазы HCV, используемых в способах и комбинированных терапиях настоящего изобретения, включают ингибиторы, раскрытые в публикациях Landro et al.,Biochemistry, 36 (31):9340-9348 (1997); Ingallinella et al., Biochemistry, 37(25): 8906-8914 (1998); LlinasBrunet et al., Bioorg Med Chem Lett, 8(13): 1713-1718 (1998); Martin et al., Biochemistry, 37(33):11459-11468(1998); Dimasi et al., J Virol, 71 (10): 7461-7469 (1997); Martin et al., Protein Eng, 10(5):607-614 (1997); Elzouki et al., J Hepat, 27(l):42-48 (1997); BioWorld Today, 9(217):4 (10 ноября 1998 г.); в патентных публикациях СШАUS2005/0249702 и US2007/0274951; и в международных патентахWO98/14181,WO98/17679, WO98/17679, WO98/22496, WO99/07734 и WO05/087731. Другие примеры ингибиторов протеазы HCV, используемые в настоящих композициях и способах,включают, но не ограничиваются следующими соединениями: В другом варианте осуществления противовирусный агент представляет собой ингибитор протеазыNS3. Ингибиторы сериновой протеазы NS3, используемые в настоящих способах и комбинированных терапиях настоящего изобретения, включают без ограничения ингибиторы, раскрытые в патентах США 7494988, 7485625, 7449447, 7442695, 7425576, 7342041, 7253160, 7244721, 7205330, 7192957,7186747, 7173057, 7169760, 7012066, 6914122, 6911428, 6894072, 6846802, 6838475, 6800434, 6767991,5017380, 4933443, 4812561 и 4634697; в патентных публикациях СШАUS20020068702,US20020160962, US20050119168, US20050176648, US20050209164, US20050249702 и US20070042968 и в международных патентных публикацияхWO03/006490, WO03/087092, WO04/092161 иWO08/124148. В еще одном варианте осуществления противовирусный агент представляет собой ингибитор полимеразы HCV. Ингибиторы полимеразы HCV, используемые в способах и в комбинированных терапиях настоящего изобретения, включают, но не ограничиваются: VP-19744 (Wyeth/ViroPharma), PS1-7851WO09/032125. В другом варианте осуществления противовирусный агент является ингибитором NS5A HCV. Неограничивающие примеры ингибиторов NS5A HCV, применимые в способах и комбинированных терапиях настоящего изобретения, представляют собой AZD2836 (А-831) и AZD7295 (А-689) (Arrow Therapeutics) и BMS-790052 (Bristol-Myers Squibb). В одном варианте осуществления противовирусный агент является ингибитором NS4B, таким как гидрохлорид клемизола и другие соли клемизола. В одном варианте осуществления противовирусный агент является ингибитором репликазы HCV,включая ингибиторы, раскрытые в патентной публикации СШАUS20090081636. В другом варианте осуществления противовирусный агент является ингибитором хеликазы HCV,таким как триоксален. В другом варианте осуществления противовирусный агент представляет собой ингибитор входаHCV, включая, но без ограничения, ITX5061 и ITX4520 (iTherx, PRO 206 (Progenies) и селгосивир (MX3253), MIGENIX. В другом варианте осуществления противовирусный агент является соединением РНК-i, например ТТ-033 (Tacere Therapeutics, Inc., San Jose, CA). В еще одном варианте осуществления противовирусный агент представляет собой другой интерферон типа 1 (например, IFN- или IFN-), интерферон типа II (например, IFN-) или интерферон типа III(например, Il-28 или Il-29). Примеры интерферонов типа III, предусмотренных для применения в способах и комбинированных терапиях настоящего изобретения, включают, но не ограничиваются, PEG-IFN- (ZymoGenetics/BrisolMyers Squibb). Примеры других дополнительных противовирусных агентов, предусмотренных для применения в способах и комбинированных терапиях настоящего изобретения, включают, но не ограничиваются,ТТ 033 (Benitec/Tacere Bio/Pfizer), Sirna-034 (Sirna Therapeutics), GNI-104 (GENimmune), IDX-102 (Idenix),Levovirin (ICN Pharmaceuticals, Costa Mesa, California); Humax (Genmab), ITX-2155 (Ithrex/Novartis),PRO 206 (Progenies), HepaCide-I (NanoVirocides), MX3235 (Migemx), SCV-07 (SciClone Pharma),KPE02003002 (Kemin Pharma), Lenocta (VioQuest Pharmaceuticals), IET - Interferon Enhancing Therapy(CAN-FITE). Изобретение также предполагает лечение пациентов с HCV, которые являются гетерозиготными или гомозиготными по аллелю G rs8103142, терапевтическим агентом, который увеличивает уровни изоформы Lys70 IFN-3, снижает уровни изоформы Arg70 IFN-3 или оказывает оба эффекта. Иллюстративные примеры терапевтических агентов, которые могли бы увеличить уровень изоформы Lys70 IFN-3, включают полипептид IFN-3 Lys70 и вектор экспрессии, который кодирует полипептид IFN-3 Lys70. Полипептид IFN-3 Lys70 может быть получен с помощью методик, хорошо известных в данной области техники; см., например, Dellgren, С. et al., Genes and Immunity 10:125-131 (2009) и патент США 7517961. Предпочтительно вектор экспрессии представляет собой вектор, который воздействует на экспрессию кодируемого полипептида IFN-3 Lys70 в гепатоцитах печени человека. Такая таргентная генотерапия печени с использованием аденоассоциированных вирусных векторов была описана; см., например, публикацию Hasbrouck, N.C. et al., Gene Therapy 15:870-875 (2008) и материалы, использованные при экспертизе заявки, Nancy Smyth Templeton, Gene and Cell Therapy: Therapeutic Mecha- 22020795therapy: methods and protocols, опубликовано Humana Press (2001). Агенты, которые могли бы снизить уровень изоформы Arg70 IFN-3, включают антисмысловые РНК, малые интерферирующие РНК (si-РНК) и рибозимы. Специалист в данной области может легко разработать и проверить такие агенты с применением методик, известных в данной области; см., например, Stanley Т. Crooke, Antisense drug technology: principles, strategies, and applications, 2nd Edition: 2, опубликовано CRC Press (2007) Kevin J. Scanlon, Therapeutic applications of ribozymes, опубликовано HumanaPress (1998). Другой агент, который мог бы снизить уровень изоформы Arg70 IFN-3, представляет собой моноклональное антитело, которое связывается и нейтрализует изоформу Arg70, но не изоформу Lys70. Выделение таких антител должно быть легко осуществимым, поскольку положение аминокислоты 70, как считают, представлено на внешней поверхности IFN-3. Аллель С rs12979860 также ассоциирован с более высокой вероятностью естественного клиренсаHCV у пациентов с острым гепатитом С, который относится к первым 6 месяцам после заражения HCV. Во время острой фазы симптомы не развиваются у 60-70% инфицированных людей. Однако некоторые пациенты имеют симптомы острой инфекции гепатита С, которые включают сниженный аппетит, утомляемость, боли в животе, желтуху, зуд и гриппоподобные симптомы, что приводит к раннему выявлению заболевания. У других пациентов выявляют острый гепатит С в результате проверки на HCV-инфекцию после известного воздействия источника инфекции, такого как травма от иглы. Вирус гепатита С обычно обнаруживается в крови с помощью ПЦР в течение от одной до трех недель после инфицирования, и антитела к вирусу обычно обнаруживаются в течение от 3 до 15 недель. Поскольку у 50% пациентов происходит спонтанная элиминация вируса во время острой фазы, врачи обычно крайне неохотно и вынужденно подвергают пациента, у которого обнаружен острый гепатит,расходам и побочным эффектам антивирусной терапии, прежде чем у пациента не разовьется хроническая HCV-инфекция, т.е. инфекция позднее более 6 месяцев. Определение генотипа пациента в PSrs12979860 может быть другим фактором, который следует учитывать врачу, принимая решение, начинать ли антивирусную терапию или отложить терапию на шесть месяцев после выявления острой HCVинфекции. Если генотип пациента является гетерозиготным или гомозиготным по С, врач может принять решение отложить терапию на шесть месяцев. Если генотип пациента является гомозиготным по Т, врач может полагать, что ранняя противовирусная терапия оправдана, поскольку спонтанная элиминация вируса у пациента является маловероятной. Дозы и схемы дозирования других агентов, используемых в комбинированных терапиях настоящего изобретения для лечения HCV-инфекции, могут быть определены лечащим врачом с учетом одобренных доз и схемы дозирования, указанных в листке-вкладыше; и возраста, пола и общего состояния здоровья пациента. Агенты, вводимые в комбинированной терапии HCV, могут быть введены одновременно(т.е. в одной и той же композиции или в отдельных композициях один сразу после другого) или последовательно. Это особенно удобно, если компоненты комбинации предоставляются в различных схемах дозирования, например один компонент вводят один раз в день и другой компонент вводят каждые 6 ч, или если предпочтительные фармацевтические композиции являются различными, например одна представляет собой таблетку и другая представляет собой капсулу. Набор, содержащий отдельные лекарственные формы, соответственно является предпочтительным. Если IFN- представляет собой PEG12k-IFN2b, такой как PegIntron (пег-IFN2b) или его биоаналог, предпочтительная схема лечения хронической HCV-инфекции включает 1,5 мкг/кг PEG12kIFN2b один раз в неделю в комбинации с дневными дозами 800-1400 мг рибавирина. Доза рибавирина учитывает вес пациента: 800 мг/день для пациентов весом 40-65 кг, 1000 мг/день для пациентов весом больше 65 и до 85 кг, 1200 мг/день для пациентов весом больше 85 и до 105 кг и 1400 мг/день для пациентов весом больше 105 кг. В некоторых вариантах осуществления рекомендованная недельная дозаPEG12k-IFN2b составляет 0,5, 0,75 или 1,0 мкг/кг, и дневная доза рибавирина составляет 600-1400 мг рибавирина, исходя из веса пациента. Если IFN- представляет собой bPEG40K-IFN2 а, такой как PEGASYS (пег-IFN2 а) или его биоаналог, предпочтительная схема лечения хронической HCV-инфекции включает 180 мкг/неделюbPEG40K-IFN2 а в комбинации с дневной дозой рибавирина 1000 мг для пациентов весом меньше 75 кг и 1200 мг для пациентов весом больше или равным 75 кг. В некоторых вариантах осуществления рекомендованная недельная доза bPEG40K-IFN2 а является по меньшей мере на 25% меньше 180 мкг. В некоторых предпочтительных вариантах осуществления схема комбинированного лечения, применяемая для лечения пациентов, хронически инфицированных HCV генотипа 1 с высокой вирусной нагрузкой и положительно тестируемых по меньшей мере на один маркер ответа на IFN-, включает вводный период лечения от приблизительно 2 до 17 недель, во время которого IFN-, такой как PEG12kIFN2b и bPEG40K-IFN2 а, вводят в комбинации с рибавирином, за которым следует второй период лечения от приблизительно 12 до приблизительно 28 недель, во время которого вводят трехкомпонентную комбинацию IFN-, рибавирина и ингибитора протеазы, такого как боцепревир или телапревир. Та- 23020795 кие двухфазные схемы лечения описаны в публикации международной патентной заявкиWO2009/038663. В особенно предпочтительных вариантах осуществления вводный период составляет приблизительно 4 недели и второй период лечения составляет приблизительно 24 недели. Злокачественные опухоли, поддающиеся лечению IFN-, включают меланому, хронический миелолейкоз (CML), почечно-клеточный рак (RCC), волосатоклеточный лейкоз, саркому Капоши, множественную миелому, базально-клеточную карциному, злокачественную меланому, поверхностный рак мочевого пузыря (SBC), рак яичников, фолликулярную лимфому, неходжкинскую лимфому, кожную Тклеточную лимфому, кондилому остроконечную, грибовидный микоз, карциноидный синдром, колоректальный рак, папилломатоз гортани и старческий кератоз. Предпочтительные злокачественные новообразования и соответственно схемы дозирования описаны в схемах для хронического гепатита С, указанных в маркировке и в инструкции-вкладыше продуктов Roferon-A (IFN- 2 А, рекомбинантный) и INTRON А (IFN2b, рекомбинантный). В предпочтительных вариантах осуществления маркеры ответа на IFN- настоящего изобретения применяются совместно с пегилированным IFN- для лечения пациентов с меланомой, хроническим миелолейкозом (CML) или почечно-клеточным раком (RCC), включая, например, схемы лечения, описанные в патентах США 6923966 (меланома), 6605273 (RCC) и 6362162 (CML); Bukowski R., et al., Cancer 95 (2):389-396 (2002); Bukowski R., et al., J. Clin Oncol. 20(18):3841-348 (2002); Garcia-Manero, G. et al.,Cancer 97 (12):2010-2016 (2003); Garcia-Manero, G. et al., Cancer 98(3): 437-457 (2003); Michallet, M. et al.,Leukemia 18:309-315 (2004); Motzer, R.J. et al., J. Clin Oncol. 19(5): 1312-1319 (2001); Motzer, RJ. et al.,Ann. Oncol. 13:1799-1805 (2002); Lipton, J.H., et al., Blood 100:782a Abstract 3091 (2002); Hochhaus, A., et(2003). В одном предпочтительном варианте осуществления маркеры ответа на IFN- изобретения используются для выявления пациентов с меланомой высокой степени риска, которые являются подходящими кандидатами для терапии IFN-, особенно пациенты на стадии IIB (повреждения 4 мм, но без вовлечения лимфоузлов) и на стадии III (повреждения 4 мм и с вовлечением лимфоузлов) первичной кожной меланомы. Предпочтительно терапия IFN- используется в качестве адъювантной терапии после того,как пациенты были прооперированы по поводу меланомы стадии IIB или стадии III. В более предпочтительных вариантах осуществления IFN-, используемый в качестве адъювантной терапии, представляет собой пегилированный IFN-. Пациенты с меланомой, которых лечат согласно улучшенным способам настоящего изобретения, включают пациентов с впервые выявленным заболеванием, у которых не обнаруживали заболевания после операции, но которые имеют высокий риск системного рецидива заболевания. Термин "пациенты высокого риска", который используется здесь, обозначает пациентов с меланомой, у которых толщина повреждений по Бреслоу 4 мм, а также пациентов с любой толщиной повреждений по Бреслоу с первичным или рекуррентным вовлечением лимфоузлов. Лечение пегилированным IFN- по настоящему изобретению будет продолжаться до пяти лет, если только нет клинических данных о прогрессировании заболевания, неприемлемой токсичности или пожеланий пациентов прекратить терапию. Если пегилированный IFN-, применяемый для лечения пациента с меланомой высокого риска,представляет собой PEG12k-IFN2b, такой как PegIntron (пег-IFN2b) или его биоаналог, предпочтительная схема лечения включает введение пациенту начальной дозы 3,0-9,0 мкг на 1 кг один раз в неделю (QW), предпочтительно в пределах от 4,5 до 6,5 мкг на 1 кг QW, более предпочтительно в пределах 5,5-6,5 мкг на 1 кг QW и наиболее предпочтительно приблизительно 6,0 мкг на 1 кг QW. В некоторых предпочтительных вариантах осуществления пациент с меланомой высокого риска первоначально получал лечение 6,0 мкг на 1 кг PEG12k-IFN2b QW в течение восьми недель и затем 3,0 мкг на 1 кг или меньше PEG12k-IFN2b QW в течение периода времени продолжительностью пять лет минус восемь недель начального лечения. Если пациент получает дозу меньше 3,0 мкг на 1 кг, например, для поддержания переносимости пациентом лечения дозу предпочтительно уменьшают на 1 мкг на 1 кг во время каждого уменьшения, например от 3,0 до 2,0 до 1,0. Если пегилированный IFN-, применяемый для лечения пациента с меланомой высокого риска,представляет собой bPEG40K-IFN2 а, такой как PEGASYS (пег-IFN2 а) или его биоаналог, схема лечения включает введение пациенту дозы приблизительно от 50 до 500 мкг QW, предпочтительно приблизительно от 200 до 250 мкг QW. При введении комбинированной терапии, которую выбирают для лечения пациента на основе наличия или отсутствия маркера ответа на IFN- у пациента, терапевтические агенты в комбинации или фармацевтической композиции либо в композициях, содержащих терапевтические агенты, могут быть введены в любом порядке, например последовательно, параллельно, совместно, одновременно и т.д. Количества различных терапевтических агентов такой комбинированной терапии могут представлять собой различные количества (различные размеры дозировки) или одинаковые количества (одинаковые размеры дозировки). В некоторых вариантах осуществления агенты в комбинации вводят в дозах, обычно приме- 24020795 няемых, когда такие агенты используют в виде монотерапии для лечения заболевания или состояния пациента, тогда как в других вариантах осуществления агенты вводят в дозах более низких, чем дозы,обычно применяемые, когда такие агенты используют в виде монотерапии для лечения заболевания или состояния. В некоторых вариантах осуществления терапевтические агенты, используемые в комбинированной терапии, представлены в той же самой фармацевтической композиции, которая может быть применима для перорального введения, внутривенного введения, подкожного введения или парентерального введения. Авторы изобретения также предполагают, что маркеры ответа на IFN-, описанные здесь, могли бы быть использованы при обращении за разрешением регуляторного органа для реализации на рынке нового фармацевтического продукта IFN- с фармакогенетическим показанием, т.е. показанием, которое включает компонент заболевания и компонент маркера ответа IFN-. Компонент заболевания представляет собой заболевание, поддающееся лечению IFN-, и компонент генетического маркера представляет собой пациента, который положительно тестирован по меньшей мере на один из маркеров ответа на IFN, описанных здесь. Аналогичным образом, авторы изобретения предполагают здесь, что указанные маркеры ответа на IFN- являются полезными при обращении за разрешением регуляторного органа в отношении таких фармакогенетических показаний для одобренных в настоящее время лекарственных средств IFN-, которые врачи назначают с неохотой при определенных заболеваниях, исходя из отношения получаемой пользы/риска препарата для лечения таких заболеваний в общей популяции. Обращение за разрешением регуляторного органа в отношении фармакогенетического показания обычно предусматривает измерение числа случаев желательного ответа на лекарственный препарат в двух отдельных группах пациентов, получавших лечение лекарством. Каждый субъект в одной из групп имеет заболевание и генетические профили, по которым пациента относят к предлагаемому фармакогенетическому показанию. Субъекты в другой группе могут быть выбраны случайным образом независимо от того имеют ли они компонент генетического маркера предлагаемого фармакогенетического показания. С другой стороны, субъектов распределяют в другую группу таким способом, который дает в результате "контрольную" группу, в которой процент субъектов, которые соответствуют и не соответствуют компоненту генетического маркера, аналогичен наблюдаемому в общей популяции или в популяции пациентов с компонентом заболевания предлагаемого фармакогенетического показания. Фармацевтический продукт, для которого получают разрешение, может быть введен двум группам в проспективном клиническом исследовании. Альтернативно, может быть произведен ретроспективный фармакогенетический анализ пациентов, получавших лечение лекарственным средством в прошлом. Фармацевтический продукт, для которого ведут поиск фармакогенетического показания, может оцениваться с другими терапевтически активными агентами, например другое лекарственное средство с эффективностью для лечения заболевания или состояния в предлагаемом фармакогенетическом показании, или агент, который предназначен для уменьшения числа случаев нежелательного эффекта, вызываемого лекарственным средством. В некоторых вариантах осуществления фармакогенетическое показание, для которого получают разрешение регуляторного органа, может включать другие маркеры (генетические маркеры или биомаркеры) или предикторы ответа на лекарственное средство. Например, быстрый вирусологический ответ HCV (RVR) на комбинированную терапию пегилированным IFN- и рибавирином является хорошим предиктором достижения SVR. Фармакогинетическое исследование может быть разработано после консультации с представителями регуляторного органа или государственной организации, утверждение которой необходимо перед продвижением на рынке фармакогенетического фармацевтического продукта в определенной стране. Предпочтительно регуляторный орган уполномочен правительством крупной промышленноразвитой страны, такой как Австралия, Канада, Китай, страна - член Европейского союза, Япония и т.п. Наиболее предпочтительно регуляторный орган уполномочен правительством Соединенных Штатов и тип заявки, которая подается для утверждения, будет зависеть от юридических требований, установленных в последней принятой версии Закона о пищевых продуктах, лекарственных препаратах и косметических средствах, которые применимы к фармацевтическому продукту и также могут включать другие соображения, такие как стоимость составления обязательной отчетности и маркетинговая стратегия для фармацевтического продукта. Например, если фармацевтическая композиция в фармацевтическом продукте была ранее утверждена для компонента заболевания, предлагаемого фармакогенетического показания, то заявка может представлять собой бумажную NDA, дополнительную NDA или сокращеннуюNDA, но может потребоваться, чтобы заявка являлась полной NDA, если фармацевтическая композиция не была утверждена ранее; причем указанные термины имеют значения, применимые к ним специалистами в фармацевтической области или как определено в законе "О ценовой конкуренции на рынке лекарственных средств и восстановлении срока действия патента" от 1984 г. Один ожидаемый результат фармакогенетического клинического испытания с использованием маркеров ответа на IFN- изобретения представляет собой одобренный для представления на рынке фармацевтический продукт, который включает (1) фармацевтическую композицию IFN- и (2) инструкцию- 25020795 вкладыш, которая включает фармакогенетическое показание, для которого рекомендована фармацевтическая композиция. Инструкция-вкладыш обычно находится в листке-вкладыше, также часто называемом листок-вкладыш в упаковке или этикетка для лекарственного средства. Как обсуждалось выше, фармакогенетическое показание имеет два компонента: компонент заболевания и компонент маркера ответа на IFN-. Таким образом, инструкция-вкладыш описывала бы генетически определяемые группы пациентов, в которых была показана эффективность лекарственного препарата в отношении одного или более заболеваний, симптомов или медицинских состояний. В некоторых вариантах осуществления в инструкции-вкладыше будет рассматриваться, как идентифицировать субъектов, которые составляют генетически определяемую группу. Например, в некоторых вариантах осуществления в инструкции-вкладыше определено, что лекарственный препарат показан субъектам, положительно тестированным на один или более маркеров ответа на IFN-, описанных здесь. С другой стороны,в инструкции-вкладыше может говориться, что лекарственное средство противопоказано субъектам, отрицательно тестированным на один или более из всех указанных маркеров ответа IFN-. В некоторых предпочтительных вариантах осуществления инструкция-вкладыш включает название по меньшей мере одного утвержденного диагностического теста, который используют для обнаружения наличия или отсутствия предусмотренного компонента генетического маркера фармакогенетического показания. Как описано выше, фармакогенетическое показание для фармакогенетического фармацевтического продукта изобретения может включать дополнительные маркеры или предикторы ответа на фармацевтическую композицию IFN- и/или требование использовать лекарственное средство в комбинации с одним или более других терапевтически активных агентов. Инструкция-вкладыш может содержать информацию о рекомендованных дозах и схемах лечения. В некоторых вариантах осуществления фармакогенетический фармацевтический продукт предоставляется в виде композиции или в упаковке, которая имеет характерный внешний вид, который производитель ввел для идентификации фармацевтического продукта в качестве фармакогенетического продукта, чтобы помочь фармацевтам и врачам отличить указанный продукт от других продаваемых продуктов, содержащих такой же или похожий активный ингредиент IFN-, который, однако, не имеет фармакогенетического показания. Использование оформления фармацевтических композиций и упаковки фармацевтического продукта как части создания характерного бренда фармацевтических продуктов хорошо известно в данной области и включает форму и цвет таблеток или капсул, а также символы или логотипы, проштампованные на них или на упаковочном материале фармацевтического продукта. В предпочтительных фармакогинетических фармацевтических продуктах изобретения фармацевтическая композиция включает пегилированный IFN2 а, пегилированный IFN2b или альб-IFN2b. Более предпочтительно фармацевтическая композиция включает bPEG40K-IFN2 а или PEG12k-IFN-2b. Предпочтительное фармакогенетическое показание для фармацевтических продуктов изобретения включает применение фармацевтической композиции для лечения пациентов хронически инфицированных HCV генотипа 1 и которые имеют положительный результат теста по меньшей мере на один из маркеров ответа на IFN- в гомозиготном состоянии, описанных здесь. В некоторых предпочтительных вариантах осуществления пациенты имеют высокую исходную вирусную нагрузку HCV, как определено выше. В более предпочтительных вариантах осуществления в инструкции-вкладыше указано, что фармацевтическая композиция IFN- показана в комбинации по меньшей мере с одним другим противовирусным агентом для лечения пациентов, хронически инфицированных HCV генотипа 1 с высоким исходным уровнем вирусной нагрузки. Противовирусный агент может представлять собой рибавирин, ингибитор протеазы HCV и ингибитор полимеразы HCV или другой агент, который специфически ингибирует репликацию HCV. В инструкции-вкладыше может быть рекомендовано применение фармацевтической композиции IFN- в комбинации с любой комбинацией из двух или более указанных противовирусных агентов. Кроме того, инструкция-вкладыш может включать рекомендованную схему лечения, причем предпочтительными схемами лечения являются любые из схем, описанных выше для фармацевтических композиций PEG12k-IFN2b и bPEG40K-IFN2 а. Любая или все аналитические и математические операции, предусмотренные при осуществлении способов, описанных здесь, или при использовании наборов и продуктов, описанных здесь, могут быть выполнены с помощью компьютера. Например, компьютер может выполнять компьютерную программу,которая определяет наличие или отсутствие маркера ответа на IFN- у субъекта на основе данных о генотипе, введенных сотрудником лаборатории тестирования или лечащим врачом, кроме того, тот же самый компьютер или другой компьютер может выводить прогнозируемый ответ на терапию IFN- на основе определения маркера ответа. В некоторых вариантах осуществления компьютер выполняет компьютерную программу, которая производит оценку вероятности ответа пациента, исходя из различных параметров пациента и заболевания, связанных с ответом на IFN-, включая наличие или отсутствие маркера ответа на IFN-. Данные, относящиеся к наличию или отсутствию маркеров ответа на IFN- у субъекта, могут быть сохранены в виде части реляционной базы данных (например, базы данных Oracle или набора простых файлов ASCII), содержащей другие клинические и/или генетические данные субъекта. Указанные данные могут храниться на жестком диске компьютера или могут храниться, например, наCD-ROM или на одном или более устройств хранения, доступных компьютеру. Например, данные могут храниться в одной или более базах данных, соединенных с компьютером посредством сети. Примеры Следующие примеры предоставляются для более понятного описания настоящего изобретения и не должны интерпретироваться как ограничивающие объем изобретения. Пример 1. Количественный метод ПЦР-РВ. Тест на РНК HCV. А. Принцип. Обнаружение HCV-PHK определяется выделением общей РНК из биологического образца и выполнением полимеразной цепной реакции с обратной транскриптазой (ПЦР-РВ). Используемая ПЦР-РВ является автоматизированным методом, который позволяет количественное определение в реальном масштабе времени заданных молекул нуклеиновой кислоты. В указанном методе используется активность обратной транскриптазы, 5'-экзонуклеазная и ДНК-полимеразная активности ДНК-полимеразыrTth. ДНК-полимераза rTth производит копии ДНК вирусной РНК (активность обратной транскриптазы) и затем приступает к изготовлению копии ДНК (полимеразная активность). В то время как происходит амплификация, 5'-экзонуклеазная активность ДНК-полимеразы rTth расщепляет сайт-специфический зонд. Указанное действие высвобождает флуоресцентный сигнал, позволяющий количественное определение вводимых копий РНК. Генотип HCV определяют секвенированием ПЦР-амплифицированного фрагмента ДНК 5'нетранслируемой области генома HCV. Затем проводят выравнивание последовательности с опубликованными последовательностями генотипов HCV, чтобы прийти к определению.B. Выделение РНК из образца. Общую РНК выделяют с помощью автоматизированного высокопроизводительного устройстваLiquid Handler и с использованием набора для экстракции РНК QIAamp 96 Viral PNA от QIAGEN (Germantown, MD). Указанный метод обеспечивает получение РНК высокого качества, применимой в ПЦРРВ.C. Количественная ПЦР-РВ для HCV. Одностадийную ПЦР-РВ осуществляют с применением ДНК-полимеразы rTth. Прямое обнаружение продукта ПЦР-РВ достигается путем мониторинга увеличения флуоресценции меченого красителем зонда. Во время ПЦР, если присутствует представляющая интерес мишень, зонд специфически гибридизуется с мишенью. 5'-экзонуклеазная активность ДНК-полимеразы rTth расщепляет зонд с высвобождением флуоресценции. Указанный процесс происходит в каждом цикле во время ПЦР и не препятствует экспоненциальному накоплению продукта. Увеличение флуоресценции (пропорциональное количеству накопленного продукта ПЦР) обнаруживается, только если последовательность-мишень комплементарна зонду и амплифицируется во время ПЦР. Благодаря указанным требованиям, неспецифическая амплификация не обнаруживается. Система может измерить продукты ПЦР после каждого цикла амплификации. Начальное число копий матрицы-мишени определяют путем анализа изменения сигнала флуоресценции (.Rn) от цикла к циклу в виде результата амплификации матрицы во время ПЦР. Требуется несколько циклов, чтобы достичь детектируемого сигнала флуоресценции (представляемого как Ct, пороговый цикл), большего, чем сигнал, соответствующий начальному числу копий. Приложение для определения последовательностей определяет начальные количества копий, которые неизвестны, с помощью интерполяции на стандартную кривую, построенную на основании стандартных растворов с известным начальным количеством копий.D. Контроль качества/гарантия качества. К каждой пробе добавляют внутренний РНК-контроль для проверки эффективности выделения РНК и ПЦР-РВ. Различные разведения предварительно откалиброванного контроля HCV РНК запускают в каждом тесте для построения стандартной кривой. В качестве положительных контролей в каждом тесте запускают образец из набора HCV Proficiency Panel Members. Нормальную человеческую сыворотку и воду запускают в качестве отрицательного контроля при выделении РНК и ПЦР-РВ. Определения ПЦР-РВ HCV-PHK, выполненные с использованием указанного выше теста, проверяли в сравнении с международными стандартами ВОЗ для РНК вируса гепатита C и с тест-системой HCVPanel от Aero Metrix. Нижний предел количественного определения для данного теста составляет 29 международных единиц/мл (МЕ/мл). Все результаты HCV-PHK представлены здесь в МЕ/мл. Пример 2. Идентификация однонуклеотидного полиморфизма (SNP), ассоциированного с ответомHCV на лечение комбинированной терапией пег-IFN2/рибавирин. Чтобы определить вклад генетических факторов в ответ на терапию, авторы изобретения провели полногеномное ассоциативное исследование на геномных образцах, полученных из двух проспективных клинических исследований. Более 1500 субъектов приняли участие в исследовании IDEAL, дизайн которого описан в публикации McHutchinson et al., J. Viral Hepatol, Vol. 15, No. 7, July 2008, p. 475-481. С целью увеличения числа афро-американцев в полногеномном ассоциативном анализе, также были включены 67 человек из другого проспективного исследования, в котором изучали лечение афро-американцев(2004. Вкратце, в исследовании IDEAL ранее нелеченные пациенты, хронически инфицированные HCV генотипа 1, были рандомизированы (1:1:1) для получения одной из следующих 48-недельных схем лечения: пег-IFN2b (PEG2b) по 1,5 мкг/кг/неделю плюс рибавирин (RBV); PEG2b по 1,0 мкг/кг/неделю плюс RBV; или пег-IFN2 а (PEG2a) по 180 мкг/неделю+RBV. В схемах PEG2b пациенты весом 40-65 кг получали 800 мг/день RBV; пациенты весом больше 65 и до 85 кг получали 1000 мг/день RBV; пациенты весом больше 85 и до 105 кг получали 1200 мг/день RBV и пациенты весом больше 105 кг получали 1400 мг/день RBV. В схемах PEG2a пациенты весом меньше 75 кг получали 1000 мг/день RBV, тогда как пациенты весом больше или равном 75 кг получали 1200 мг/день RBV. Статус РНК HCV определяли на исходном уровне в 12 и 24 недели лечения, в конце 48 недель лечения и на 24 неделе после лечения. Субъекты с недостаточным вирусологическим ответом в 12 или 24 недели досрочно выбывали из исследования ввиду отсутствия эффекта терапии. Результаты исследования IDEAL продемонстрировали, по существу, эквивалентную эффективность схем PEG2b (1,5 мкг/кг/неделя) плюс RBV и PEG2a со значительно более низким ответом в хорошо подобранной группе афро-американцев по сравнению с группой европейцев. Все пациенты, включенные в полногеномный анализ, являлись ранее нелеченными и хронически инфицированными HCV генотипа 1. Пациенты получали лечение в течение 48 недель (субъекты с недостаточным вирусологическим ответом в 12 или 24 недели досрочно выбывали из исследования по протоколу ввиду отсутствия эффекта терапии) и 24 недели продолженного наблюдения. Геномные образцы 1630 субъектов генотипировали с применением набора Human610-quad BeadChip от Illumina (SanDiego, CA), который содержит приблизительно 600000 меченых SNP, полученных на основании данных фазы II НарМар (HumanHap 610 quad V 1.0). Результаты генотипирования анализировали в отношении детерминант ответа на терапию (клиренс вируса или SVR) в качестве основной конечной точки. Ответ на терапию и отсутствие ответа (NR) устанавливали согласно стандартным определениям (Ghany, M.G. etGuidelines; Diagnosis, Management, and Treatment of Hepatitis C: An Update (2009. Устойчивый вирусологический ответ определяли, как недетектируемый сывороточный уровень РНК HCV, с применением чувствительного теста ПЦР-РВ через 24 недели после прекращения лечения (или недетектируемые вирусные уровни в 12 недель продолженного наблюдения, если дальнейшее продолженное наблюдение было невозможно). Отсутствие ответа определяли либо как невозможность достичь, по меньшей мере, уменьшения на 2-log10 уровня РНК HCV в сыворотке в 12 недель лечения, либо как детектируемый уровень РНК HCV в сыворотке крови в конце периода продолженного наблюдения. Все пациенты, которые достигали SVR, были включены в анализ в качестве респондентов. Чтобы убедиться, что оценивали только нереспондентов с соответствующим воздействием лекарственного средства (истинные биологические нереспонденты), только пациенты, получившие минимум 12 недель терапии и с соблюдением режима терапии более 80% для PegIFN и RBV, были включены в анализы ассоциации. Проводили серии процедур контроля качества, чтобы гарантировать качество данных. Всего 1143 пациента с гепатитом C и с достаточными данными ответа на лечение отвечали указанным критериям и затем были включены в анализы ассоциации (табл. 3). Первичные тесты ассоциации SVR включали тесты определения тенденции изменения генотипа одного маркера, выполненные в трех независимых этнических популяциях (европейцы, N=874; афроамериканцы, N=191, и испаноговорящие, N=78), с применением логистических регрессионных моделей,реализованных в программном обеспечении PLINK (Purcell, S. et al. Am J. Hum Genet. 81 (2007 с коррекциями для числа клинических ковариантов, включая исходную (до лечения) сывороточную вирусную нагрузку HCV и тяжесть фиброза. Таблица 3 Клинические характеристики популяций гепатита С при изучении SVRSVR, устойчивый вирусологический ответ (SVR24=539, SVR12=36); NR, отсутствие ответа; BMI,индекс массы тела. Исходная вирусная нагрузка логарифмически преобразована. Фиброз оценивали в баллах по шкале METAVIR, стадию на исходном уровне централизованно оценивали путем проведения биопсии печени; Hepatology 20, 15-20 (1994); McHutchison, J.G. et al. N Engl. J. Med. In press (2009). Данные представлены в виде среднего значения (SD), если не указано иначе. Затем ассоциативные сигналы (Р-значения) комбинировали с использованием метода Стауффера для взвешенных Z-величин (Whitlock, M.C., et al. J. Evol Biol. 18, 1368-73 (2005, корректно принимая в расчет размеры групп, эффект размеров и направления эффектов в каждой популяции. Указанные комбинированные Р-значения затем представляли как основной результат, вместе с Р-значениями в каждой этнической популяции. Серии стадий контроля качества дали в результате 565759 полиморфизмов тестов на проверку ассоциативности. Применяли методы для оценки вариантов числа копий (CNV) и проверяли взаимосвязь между CNV и SVR. Для контроля возможных кажущихся зависимостей, обусловленных стратификацией популяции, применяли модифицированный метод EIGENSTRAT (Price, A.L. et al. NatGenet 38, 904-9 (2006 для введения поправки на осях популяционного происхождения в пределах каждой этнической популяции. Статическую значимость оценивали с помощью поправки по методу Бонферрони (Р cutoff=2,910-8). Указанные анализы показали, что полиморфизм на хромосоме 19, rs12979860, строго ассоциирован с SVR во всех исследуемых группах пациентов, причем группа пациентов европейского происхождения показала очень высокую значимость (Р=1,1710-25) по всему геному. При объединении р-значений популяционных групп вариант выявляет ассоциацию 1,2110-28 (фиг. 1 и табл. 4). Таблица 4 Результаты GWAS для клиренса HCV, вызванного лечением, в отдельных популяциях и в объединенной популяции гепатита С Эффекты были согласованы по направлению и Р-значения объединяли с помощью метода Стауффера для взвешенных Z-величин 2. В группе пациентов европейского происхождения геном СС ассоциирован с 2-кратным увеличением показателя SVR по сравнению с геномом ТТ (фиг. 2), причем сходные отношения наблюдаются в группах пациентов афро-американского (3-кратное увеличение) и испанского (2-кратное увеличение) происхождения. Что особенно важно, в то время как показатель SVR отличался в 2,4 раза у субъектов европейского и афро-американского происхождения, распределенным по группам только на основе собственной оценки этничности (56,1/23,6%), указанная вариабельность падала до 1,5-кратного различия между группами европейцев и афро-американцев, которые имели генотип С/С (81,7/53,3%). Авторы изобретения считают, что значительное число афро-американских пациентов с низкими показателями SVR объясняется различием в частоте аллеля С в группах пациентов афро-американского и европейского происхождения: 0,395 по сравнению с 0,635 соответственно (фиг. 2, табл. 5 ниже). Примечательно, что, как было убедительно подтверждено документальными доказательствами, во- 29
МПК / Метки
МПК: C12Q 1/68
Метки: интерферон-альфа, генетические, ассоциированные, ответом, маркеры
Код ссылки
<a href="https://eas.patents.su/30-20795-geneticheskie-markery-associirovannye-s-otvetom-na-interferon-alfa.html" rel="bookmark" title="База патентов Евразийского Союза">Генетические маркеры, ассоциированные с ответом на интерферон-альфа</a>
Предыдущий патент: Ингибиторы 11β-гидроксистероидной дегидрогеназы типа 1
Следующий патент: Устройство внутрискважинное для герметизации скважины
Случайный патент: Шлем