Инсектицидные соединения
Номер патента: 20755
Опубликовано: 30.01.2015
Авторы: Ренольд Петер, Кассайре Жером Ив, Пабба Ягадиш, Эль-Касеми Мирием, Питтерна Томас
Формула / Реферат
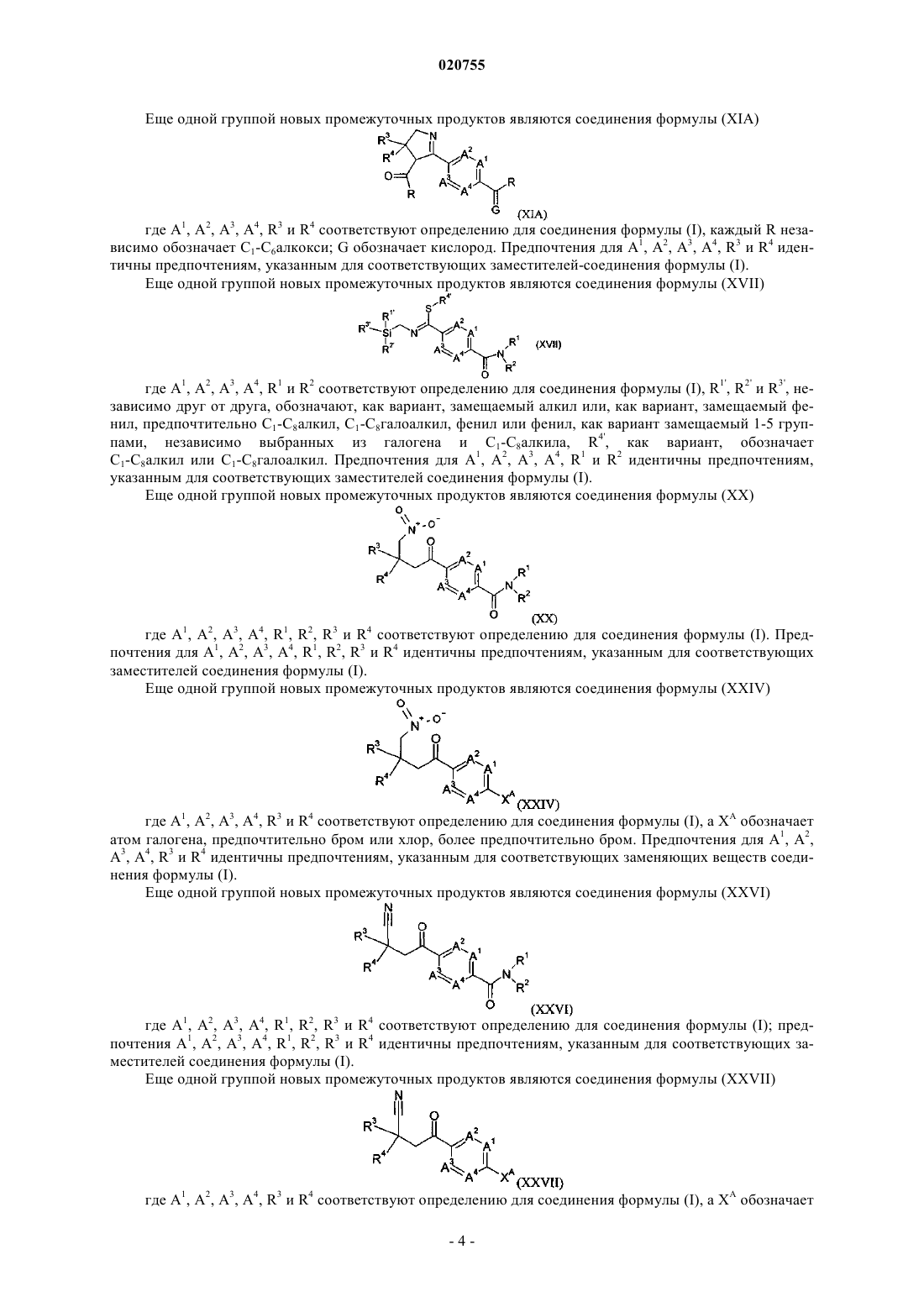
1. Соединение формулы (I)
где А1, А2, А3 и А4, независимо друг от друга, обозначают С-Н или C-R5;
G обозначает кислород;
R1 обозначает водород;
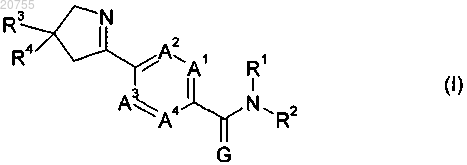
R2 обозначает группу формулы (II)
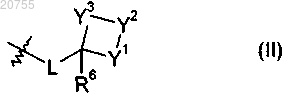
где L обозначает одинарную связь или С1-С6алкилен и
Y1, Y2 и Y3, независимо друг от друга, обозначают CR8R9, C=N-OR10, S, SO или SO2 при условии, что по крайней мере один из Y1, Y2 или Y3 не является CR8R9 или C=N-OR10;
R3 обозначает С1-С8галоалкил;
R4 обозначает арил, замещенный 1-5 R7, или гетероарил, замещенный 1-5 R7;
каждый R5, независимо от других, обозначает галоген, С1-С8алкил, С1-С8галоалкил или С1-С8алкенил, или два R5 на смежных атомах углерода совместно образуют мост -СН=СН-СН=СН-;
R6 обозначает водород или С1-С8алкил;
каждый R7, независимо от других, обозначает галоген, циано, С1-С8алкил, C1-С8галоалкил или С1-С8алкокси-;
каждый R8 и R9, независимо от других, обозначает водород, галоген, С1-С8алкил или С1-С8галоалкил;
каждый R10, независимо от других, обозначает водород, С1-С8алкил, С1-С8галоалкил, арил-С1-С4алкилен- или арил-С1-С4алкилен-, где фрагмент арила заменен 1-3 R12;
каждый R12, независимо от других, обозначает галоген, циано, нитро, С1-С8алкил, C1-С8галоалкил, С1-С8алкокси-, С1-С8галоалкокси- или С1-С8алкоксикарбонил-;
или его соль,
и где арил обозначает фенил и гетероарил обозначает пиридил.
2. Соединение по п.1, где А1 обозначает C-R5, А2 обозначает С-Н, А3 обозначает С-Н и А4 обозначает С-Н.
3. Соединение по п.1 или 2, где R2 обозначает группу формулы (IIc)
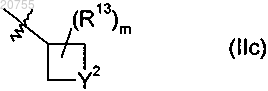
где R13 обозначает С1-С8алкил;
m обозначает 0, 1, 2, 3, 4 или 5 и
Y2 обозначает S, SO или SO2.
4. Соединение по п.1 или 2, где R2 обозначает тиетан-3-ил-, 1-оксотиетан-3-ил-, 1,1-диоксотиетан-3-ил- или 3-метилтиетан-3-ил-.
5. Соединение по любому из пп.1-4, где R3 обозначает хлордифторметил или трифторметил.
6. Соединение по п.1,
где А1, А2, А3 и А4, независимо друг от друга, обозначают С-Н или C-R5;
G обозначает кислород;
R1 обозначает водород;
R2 обозначает группу формулы (IIb)
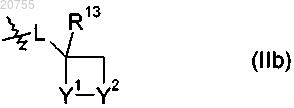
где L обозначает одинарную связь, метилен, этилен или пропилен;
один из Y1 и Y2 обозначает S, SO или SO2, а другой обозначает СН2;
R3 обозначает хлордифторметил или трифторметил;
R4 обозначает 3,5-дибромфенил-, 3,5-дихлорфенил-, 3,5-бис-(трифторметил)фенил-, 3,4-дихлорфенил-, 3,4,5-трихлорфенил- или 3-трифторметилфенил-;
каждый R5 независимо обозначает бром, хлор, фтор, метил, трифторметил или винил или два R5 на смежных атомах углерода совместно образуют мост -СН=СН-СН=СН-;
каждый R10 независимо обозначает метил или водород;
R13 обозначает водород или С1-С8алкил.
7. Соединение по п.1,
где А1, А2, А3 и А4, независимо друг от друга, обозначают С-Н или C-R5;
G обозначает кислород;
R1 обозначает водород;
R2 обозначает группу формулы (IIc)

где m обозначает 0, 1, 2, 3, 4 или 5 и
Y2 обозначает S, SO или SO2;
R3 обозначает хлордифторметил или трифторметил;
R4 обозначает 3,5-дибромфенил-, 3,5-дихлорфенил-, 3,5-бис-(трифторметил)фенил-, 3,4-дихлорфенил-, 3,4,5-трихлорфенил- или 3-трифторметилфенил-;
каждый R5 независимо обозначает бром, хлор, фтор, метил, трифторметил или винил или два R5 на смежных атомах углерода совместно образуют мост -СН=СН-СН-СН-;
каждый R10 независимо обозначает метил или водород;
R13 обозначает метил.
8. Соединение по п.1,
где А1 обозначает C-R5, А2 обозначает С-Н, А3 обозначает С-Н, А4 обозначает С-Н;
G обозначает кислород;
R1 обозначает водород;
R2 обозначает тиетан-3-ил-, 1-оксотиетан-3-ил-, 1,1-диоксотиетан-3-ил- или 3-метилтиетан-3-ил-;
R3 обозначает трифторметил;
R4 обозначает фенил, замещенный 1-3 R7;
каждый R5 независимо обозначает бром, хлор, фтор, метил, трифторметил или винил или два R5 на смежных атомах углерода совместно образуют мост -СН=СН-СН=СН-;
каждый R7 независимо обозначает бром, хлор, фтор, циано, метил, трифторметил, метокси или трифторметокси.
9. Соединение по п.1 формулы (Ia), которое представляет собой соединение А1, A3 или А4
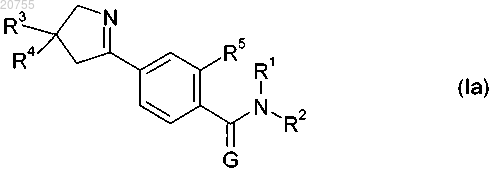
где G обозначает кислород, R3 обозначает трифторметил, R4 обозначает 3,5-дихлорфенил-, R5 обозначает метил, R1 обозначает Н и R2 имеет значения, указанные в таблице ниже

10. Соединение формулы (IA)
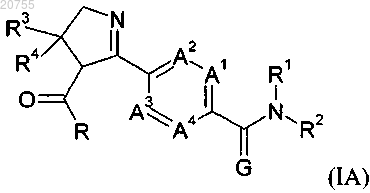
где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I) согласно любому из пп.1-9;
G обозначает кислород и
R обозначает С1-С6алкокси,
или соединение формулы (VA)
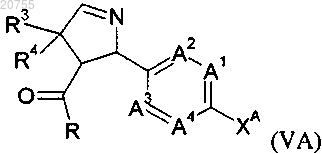
где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I) согласно любому из пп.1-9;
R обозначает С1-С6алкокси и
XA обозначает атом галогена,
или соединение формулы (XIA)
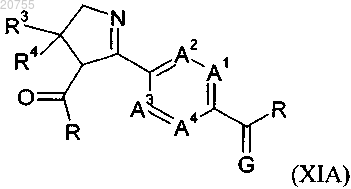
где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I) согласно любому из пп.1-9;
каждый R независимо обозначает С1-С6алкокси;
G обозначает кислород.
11. Соединение формулы (XVII)
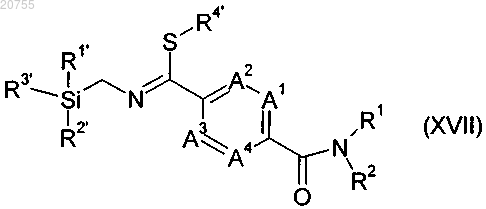
где А1, А2, A3, A4, R1 и R2 соответствуют определению для соединения формулы (I) согласно любому из пп.1-9;
каждый R1', R2' и R3', независимо от других, обозначает С1-С8алкил, С1-С8галоалкил, фенил или фенил, необязательно замещаемый 1-5 группами, независимо выбранными из галогена и С1-С8алкила; и
R4 обозначает С1-С8алкил или С1-С8галоалкил.
12. Соединение формулы (XX)
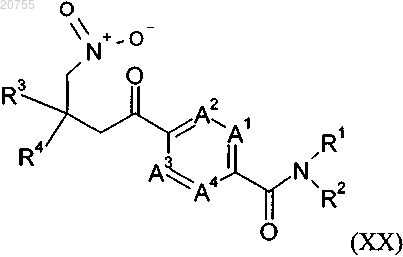
где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I) согласно любому из пп.1-9,
или соединение формулы (XXIV)
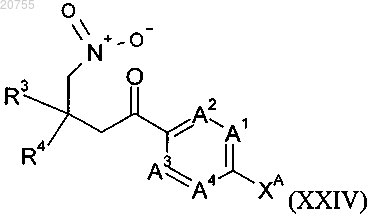
где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I) согласно любому из пп.1-9 и
ХА обозначает атом галогена.
13. Соединение формулы (XXVI)
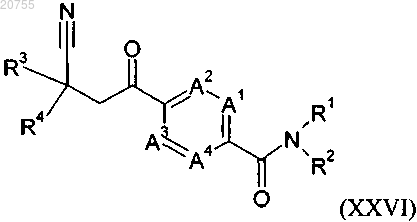
где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I) согласно любому из пп.1-9, или
соединение формулы (XXVII)
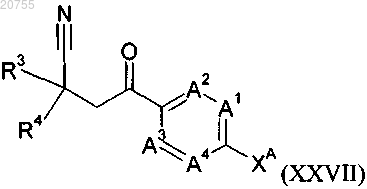
где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I) согласно любому из пп.1-9 и
ХА обозначает атом галогена.
14. Способ борьбы с насекомыми, акаридами, нематодами или моллюсками, состоящий в обработке вредителя, очага скопления вредителей или растения, чувствительного к нападению вредителя, достаточным для уничтожения насекомых, акарид, нематод или моллюсков количеством соединения формулы (I), определенного в любом из пп.1-9.
15. Инсектицидная, акарицидная, нематоцидная или моллюскоцидная композиция, содержащая достаточное для уничтожения насекомых, акарид, нематод или моллюсков количество соединения формулы (I), определенного в любом из пп.1-9, совместимый с ней носитель или разбавитель и необязательно содержащая дополнительный пестицид.
Текст
Предметом изобретения являются соединения формулы (I) где A1, A2, A3, A4, G, R1, R2, R3 и R4 соответствуют определению согласно п.1 патентной формулы или обозначают его соль. Кроме того, предметом изобретения являются промежуточные продукты для получения соединений формулы (I), инсектицидные, акарицидные, нематоцидные и моллюскоцидные композиции, в состав которых входят соединения формулы (I), а также методы использования соединений формулы (I) для борьбы с вредителями - насекомыми, акаридами,нематодами и моллюсками. Предметом изобретения являются некоторые производные дигидропиррола с четырехчленным кольцом в качестве конечной группы, процессы и промежуточные продукты для получения этих производных, инсектицидные, акарицидные, нематоцидные и моллюскоцидные композиции, в состав которых входят эти производные, а также методы использования этих производных для борьбы с вредителями насекомыми, акаридами, нематодами и моллюсками. Некоторые производные дигидропиррола с инсектицидными свойствами описаны, например, в JP 2007/091708 и JP 2008/133273. Авторами настоящей разработки было выявлено, что производные дигидропиррола с четырехчленным кольцом обладают инсектицидными свойствами. Таким образом, настоящее изобретение предлагает соединение формулы (I) где А 1, А 2, А 3 и А 4, независимо друг от друга, обозначают С-Н или C-R5;R2 обозначает группу формулы (II) где L обозначает одинарную связь или С 1-С 6 алкилен иY1, Y2 и Y3, независимо друг от друга, обозначают CR8R9, C=N-OR10, S, SO или SO2 при условии,что по крайней мере один из Y1, Y2 или Y3 не является CR8R9 или C=N-OR10;C1-С 8 алкенил или два R5 на смежных атомах углерода совместно образуют мост -СН=СН-СН=СН-;R6 обозначает водород или С 1-С 8 алкил; каждый R7, независимо от других, обозначает галоген, циано, С 1-С 8 алкил, C1-С 8 галоалкил или С 1-С 8 алкокси-; каждый R8 и R9, независимо от других, обозначает водород, галоген, С 1-С 8 алкил или С 1-С 8 галоалкил; каждый R10, независимо от других, обозначает водород, С 1-С 8 алкил, С 1-С 8 галоалкил, арил-C1 С 4 алкилен- или арил-С 1-С 4 алкилен-, где фрагмент арила заменен 1-3 R12; каждый R12, независимо от других, обозначает галоген, циано, нитро, С 1-С 8 алкил, C1-С 8 галоалкил,С 1-С 8 алкокси-, С 1-С 8 галоалкокси- или С 1-С 8 алкоксикарбонил-,или его соль,и где арил обозначает фенил и гетероарил обозначает пиридил. Соединения формулы (I) могут существовать в виде различных геометрических или оптических изомеров или таутомерных форм. Это изобретение охватывает все такие изомеры и таутомеры, а также их смеси во всех пропорциях и изотопные формы, такие как дейтерированные соединения. Соединения, описываемые в данном изобретении, могут содержать один или несколько асимметричных атомов углерода, например, в -CR3R4- группе и могут существовать как энантиомеры (или как пары диастероизомеров) или как смесь таковых. Алкиловые группы (самостоятельно или как часть большей группы, например алкокси-, алкилтио-,алкилсульфинил-, алкилкарбонил- или алкоксикарбонил-) могут представлять собой прямую или разветвленную цепь и являться следующими соединениями: метил, этил, пропил, проп-2-ил, бутил, бут-2 ил, 2-метил-проп-1-ил или 2-метил-проп-2-ил. Если не указано иное, алкиловые группы являются предпочтительно алкиловыми группами C1-C6, более предпочтительно C1-C4, наиболее предпочтительноC1-C3. Алкиленовые группы могут представлять собой прямую или разветвленную цепь и быть, например,-СН 2-, -СН 2-СН 2-, -СН(СН 3)-, -СН 2-СН 2-СН 2-, -СН(СН 3)-СН 2- или -СН(СН 2 СН 3)-. Если не указано иное,алкиленовые группы являются предпочтительно алкиленовыми группами C1-C3, более предпочтительноC1-C2, наиболее предпочтительно С 1. Алкениловые группы могут представлять собой прямую или разветвленную цепь и могут, по обстоятельствам, иметь конфигурацию (Е)- или (Z)-. Примерами являются винил и аллил. Если не указано иное, алкениловые группы являются предпочтительно алкениловыми группами С 2-C6, более предпочтительно С 2-С 4, наиболее предпочтительно С 2-С 3. Алкиниловые группы могут представлять собой прямые или разветвленные цепи. Примерами являются этинил и пропаргил. Если не указано иное, алкиниловые группы являются предпочтительно ал-1 020755 киниловыми группами С 2-С 6, более предпочтительно С 2-С 4, наиболее предпочтительно С 2-C3. Под галогеном следует понимать фтор, хлор, бром или йод. Галогеналкильные группы (самостоятельно или в составе больших групп, таких как галоакокси-,галоалкилтио-, галоалкилсульфинил-, галоалкилсульфонил-, галоалкилкарбонил- или галоалкоксикарбонил-) являются алкильными группами, которые замещаются одним или несколькими, одинаковыми или различными атомами галогена. Примерами таких групп могут быть дифторметил, трифторметил, хлордифторметил или 2,2,2-трифторэтил. Галоалкениловые группы - это алкениловые группы, которые замещаются одним или несколькими,одинаковыми или различными атомами галогена. Примерами данных групп могут быть 2,2-дифторвинил или 1,2-дихлор-2-фторвинил. Галоалкиниловые группы - это алкиниловые группы, которые замещаются одним или несколькими,одинаковыми или различными атомами галогена, например 1-хлор-проп-2-инил. Циклоалкильные группы могут быть моноциклическими или бициклическими; примерами являются циклопропил, циклобутил, циклогексил и бицикло[2.2.1]гептан-2-ил. Если не указано иное, циклоалькильные группы являются предпочтительно группами C3-C8, более предпочтительно C3-C6. Арильные группы являются ароматическим циклическим системами в моно-, би- и трициклической форме. Примерами таких колец являются фенил, нафтил, антраценил, инденил и фенантренил. Предпочтительными арильными группами являются фенил и нафтил, при этом фенил является наиболее предпочтительной группой. При наличии замещаемых фрагментов арила, если не указано иное, фрагмент арила предпочтительно замещается 1-4 заместителями, наиболее предпочтительно 1-3 заместителями. Гетероарильные группы представляют собой ароматическую циклическую систему, содержащую не менее одного гетероатома и состоящую либо из единого кольца, либо из двух или более сочлененных колец. Предпочтительно, чтобы единые кольца содержали до трех гетероатомов, а бициклические системы содержали до четырех гетероатомов, которые предпочтительно должны выбираться из азота, кислорода и серы. Примеры моноциклических групп включают пиридил, пиридазинил, пиримидинил, пиразинил, пирролил, пиразолил, имидазолил, триазолил, фуранил, тиофенил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил и тиадиазолил. Примеры бициклических групп включают квинолинил,циннолинил, хиноксалинил, индолил, индазолил, бензимидазолил, бензотиофенил и бензотиазолил. Моноциклические гетероарильные группы являются предпочтительными, при этом пиридил является наиболее предпочтительным. При наличии замещаемых фрагментов гетероарила, если не указано иное,фрагмент гетероарила предпочтительно замещается 1-4 заместителями, наиболее предпочтительно 1-3 заместителями. Гетероциклические группы определяются как содержащие гетероариальные группы и, кроме того,их ненасыщенные или частично ненасыщенные аналоги. Примеры моноциклических групп включают тиетанил, пирролидинил, тетрагидрофуранил, [1,3]диоксоланил, пиперидинил, пиперазинил,[1,4]диоксанил и морфолинил или их окисленные версии, например 1-оксотиетанил и 1,1 диоксотиетанил. Примеры бициклических групп включают 2,3-дигидро-бензофуранил, бензо[1,3]диоксоланил и 2,3-дигидро-бензо[1,4]диоксинил. Если не указано иное, при замене фрагмента гетероциклила фрагмент гетероциклила предпочтительно замещается 1-4 заместителями, наиболее предпочтительно 1-3 заместителями. Предпочтительные значения A1, A2, A3, A4, G, R1, R2, R3, R4, L, Y1, Y2, Y3, R5, R6, R7, R8, R9, R10, R11,12R , R13 и m в любой их комбинации должны соответствовать указанным ниже. В одной предпочитаемой группе соединений А 1 является C-R5, А 2 является С-Н, А 3 является С-Н, а 4 А является С-Н. Предпочтительно, чтобы R2 обозначал группу формулы (IIc)Y2 является S, SO или SO2. Наиболее предпочтительно, чтобы R2 являлся тиетан-3-илом-, 1-оксотиетан-3-илом-, 1,1 диоксотиетан-3-илом- или 3-метилтиетан-3-илом-. Предпочтительно, чтобы R3 являлся хлордифторметилом или трифторометилом, наиболее предпочтителен трифторметил. Группой предпочитаемых соединений являются соединения, в которых А 1, А 2, А 3 и А 4, независимо друг от друга, являются С-Н или C-R5, А 1 предпочтительно является C5 2R2 обозначает группу формулы (IIb)R3 является хлордифторметилом или трифторметилом;R4 обозначает 3,5-дибромфенил-, 3,5-дихлорфенил-, 3,5-бис-(трифторметил)фенил-, 3,4 дихлорфенил-, 3,4,5-трихлорфенил- или 3-трифторметилфенил-; каждый R5 независимо обозначает бром, хлор, фтор, метил, трифторметил или винил или два R5 на смежных атомах углерода совместно образуют мост -СН=СН-СН=СН-; каждый R10 независимо обозначает метил или водород;R13 обозначает водород или С 1-С 8 алкил. Еще одной группой предпочитаемых соединений являются соединения, в которых А 1, А 2, А 3 и А 4, независимо друг от друга, являются С-Н или C-R5, А 1 предпочтительно является C5 2R2 обозначает группу формулы (IIc)R3 является хлордифторметилом или трифторметилом;R4 обозначает 3,5-дибромфенил-, 3,5-дихлорфенил-, 3,5-бис-(трифторметил)фенил-, 3,4 дихлорфенил-, 3,4,5-трихлорфенил- или 3-трифторметилфенил-; каждый R5 независимо обозначает бром, хлор, фтор, метил, трифторметил или винил или два R5 на смежных атомах углерода совместно образуют мост -СН=СН-СН=СН-; каждый R10 независимо обозначает метил или водород;R13 обозначает метил. В предпочтительном варианте осуществления предлагается соединение формулы (Ia) где G, R1, R2, R3, R4 и R5 соответствуют определению для соединения формулы (I) или представляют собой его соль. Предпочтительные значения G, L, R1, R2, R3, R4, Y1, Y2, Y3, R5, R6, R7, R8, R9, R10, R11,R12, R13 и m должны соответствовать определению для соединения формулы (I). Некоторые промежуточные продукты являются новшествами и составляют еще один аспект изобретения. Одной из групп новых промежуточных продуктов являются соединения формулы (IA) где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает С 1-С 6 алкокси. Предпочтения для А 1, А 2, А 3, А 4, R1, R2, R3 и R4 идентичны предпочтениям, указанным для соответствующих заместителей соединения формулы (I). Еще одной группой новых промежуточных продуктов являются соединения формулы (VA) где А 1, А 2, А 3, A4, R3 и R4 соответствуют определению для соединения формулы (I), R обозначает С 1-С 6 алкокси, а ХА обозначает атом галогена, предпочтительно бром или хлор, более предпочтительно бром. Предпочтения для A1, A2, A3, A4, R3 и R4 идентичны предпочтениям, указанным для соответствующих заместителей соединения формулы (I). Еще одной группой новых промежуточных продуктов являются соединения формулы (XIA) где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), каждый R независимо обозначает С 1-С 6 алкокси; G обозначает кислород. Предпочтения для А 1, А 2, А 3, А 4, R3 и R4 идентичны предпочтениям, указанным для соответствующих заместителей-соединения формулы (I). Еще одной группой новых промежуточных продуктов являются соединения формулы (XVII) где А 1, А 2, А 3, A4, R1 и R2 соответствуют определению для соединения формулы (I), R1', R2' и R3', независимо друг от друга, обозначают, как вариант, замещаемый алкил или, как вариант, замещаемый фенил, предпочтительно С 1-С 8 алкил, C1-С 8 галоалкил, фенил или фенил, как вариант замещаемый 1-5 группами, независимо выбранных из галогена и С 1-С 8 алкила, R4', как вариант, обозначает С 1-С 8 алкил или С 1-С 8 галоалкил. Предпочтения для A1, A2, A3, A4, R1 и R2 идентичны предпочтениям,указанным для соответствующих заместителей соединения формулы (I). Еще одной группой новых промежуточных продуктов являются соединения формулы (XX) где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I). Предпочтения для A1, A2, A3, A4, R1, R2, R3 и R4 идентичны предпочтениям, указанным для соответствующих заместителей соединения формулы (I). Еще одной группой новых промежуточных продуктов являются соединения формулы (XXIV) где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), a ХА обозначает атом галогена, предпочтительно бром или хлор, более предпочтительно бром. Предпочтения для A1, A2,A3, A4, R3 и R4 идентичны предпочтениям, указанным для соответствующих заменяющих веществ соединения формулы (I). Еще одной группой новых промежуточных продуктов являются соединения формулы (XXVI) где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I); предпочтения A1, A2, A3, A4, R1, R2, R3 и R4 идентичны предпочтениям, указанным для соответствующих заместителей соединения формулы (I). Еще одной группой новых промежуточных продуктов являются соединения формулы (XXVII) где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), a ХА обозначает-4 020755 атом галогена, предпочтительно бром или хлор, более предпочтительно бром. Предпочтения для A1, A2,A3, A4, R3 и R4 идентичны предпочтениям, указанным для соответствующих заменяющих веществ соединения формулы (I). Соединения, являющиеся предметом данного изобретения, могут быть получены различными методами, например методами, указанными на схеме 1. Схема 1 1. Амин формулы (IX), где А 1, А 2, А 3 и А 4 соответствуют определению для соединения формулы (I),а Х обозначает замещаемую группу, например атом галогена, такого как атом брома, получают путем реакции бензонитрила формулы (X), где А 1, А 2, А 3 и А 4 соответствуют определению для соединения формулы (I), а ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, с восстанавливающим веществом, например гидридом металла, таким как алюмогидрид лития, в растворителе, например апротонном растворителе, таком как диэтиловый эфир. Реакция проводится предпочтительно в защищенной среде, например в аргоновой атмосфере. Реакция проводится предпочтительно при температуре от -20 до 100 С, более предпочтительно от 0 до 80 С, особенно при 40 С. Бензонитрилы формулы (X) доступны в продаже или могут быть получены с использованием методов, известных специалистам. 2. Формамид формулы (VIII), где А 1, А 2, А 3 и А 4 соответствуют определению для соединения формулы (I), а ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, получают путем реакции амина формулы (IX), как описано в п.1, с формилирующим реагентом, таким как этилформиат, в растворителе, например в избытке формилирующего реагента, в присутствии основания,например органического основания, такого как триэтиламин. Реакция проводится предпочтительно при температуре от -20 до 100 С, более предпочтительно от 20 до 90 С, в частности при температуре обратного потока растворителя. 3. Изоциановое соединение формулы (VII), где А 1, А 2, А 3 и А 4 соответствуют определению для соединения формулы (I), а ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, получают путем реакции формамида формулы (VIII), как указано в п.2, с дегидратирующим агентом, например хлорирующим агентом, таким как оксилхлорид фосфора, в растворителе, например апротонном растворителе, таком как дихлорметан. Реакция проводится предпочтительно при температуре от-20 до 50 С, более предпочтительно от 0 до 50 С, в частности при комнатной температуре. 4. Соединение формулы (V), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), а ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, получают путем реакции изоцианового соединения формулы (VII), как указано в п.3, с виниловым соединением формулы (VI), где R3 и R4 соответствуют определению для соединения формулы (I), в присутствии катализатора, такого как оксид меди(I), в растворителе, например ароматическом растворителе, таком как толуол. Реакция проводится предпочтительно при температуре от -20 до 200 С, более предпочтительно от 50 до 150 С, в частности при 110 С. Виниловые соединения формулы (VI) описаны в специальной литературе (например, ЕР 1731512) или могут быть получены с использованием методов, известА ных специалистам. 5. Карбоновый эфир формулы (IV), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает С 1-С 8 алкокси, получают путем реакции соединения формулы (V), как описано в п.4, с монооксидом углерода и спирта формулы R-H, где R обозначает С 1-С 8 алкокси, например этанол, в присутствии катализатора, такого как бис(трифенилфосфин)палладий(II) дихлорид (Pd(PPh3)2Cl2) или продукт присоединения дихлорид 1,1'-бис(дифенилфосфино)ферроцен палладия(II) дихлорметан Pd(dppf)Cl2), в присутствии основания, такого как пиридин, триэтиламин, 4-(диметиламино)пиридин (DMAP), диизопропилэтиламин (основание Хунига) или ацетат натрия, и, как вариант, в присутствии растворителя, например полярного растворителя, такого как диметилформамид. Реакция проводится предпочтительно при температуре от -20 до 200 С, более предпочтительно от 50 до 150 С, особенно при 85 С. Реакция проводится предпочтительно при давлении от 1 до 200 бар, более предпочтительно от 2 до 10 бар, особенно при давлении 6 бар. 6. Карбоновая кислота формулы (III), где А 1, А 2, А 3, А 4, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает ОН, может быть получена из карбонового эфира формулы (IV), как описано в п.5, в стандартных условиях, например обработкой гидроокисью щелочного металла, такой как гидроксид натрия или гидроксид калия, в растворителе, таком как этанол или тетрагидрофуран, в присутствии воды. Альтернативным способом является обработка эфира кислотой,такой как трифторуксусная кислота, в растворителе, таком как дихлорметан, с последующим добавлением воды. Реакция проводится предпочтительно при температуре от -20 до 100 С, более предпочтительно от 20 до 80 С, особенно при 50 С. 7. Галогенангидрид формулы (III'), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает Br, Cl или F, получают из карбоновой кислоты формулы (III), как описано в п.5, в стандартных условиях, таких как обработка тионилхлоридом или оксалилхлоридом, в растворителе, таком как дихлорметан. Реакция проводится предпочтительно при температуре от -20 до 100 С, более предпочтительно от 0 до 50 С, особенно при комнатной температуре. 8. Соединение формулы (I), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, получают путем реакции карбоновой кислоты формулы(III) или галогенангидрида формулы (III'), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, с амином формулы HNR1R2, где R1 и R2 соответствуют определению для соединения формулы (I). Когда используется карбоновая кислота, такие реакции обычно проводятся в присутствии связующего реагента, такого как N,N'-дициклогексилкарбодиимид (DCC),1-этил-3-(3-диэтиламинопропил)карбодиимид гидрохлорид(бис-(2-оксо-3 оксазолидинил)фосфиновый хлорид (ВОР-Cl), в присутствии основания, а также, как вариант, в присутствии нуклеофильного катализатора. Такие реакции проводятся предпочтительно при температуре от -20 до 200 С, более предпочтительно от 50 до 150 С, особенно при 100 С. Когда используется галогенангидрид, такие реакции обычно проводятся в присутствии основания и, как вариант, в присутствии нуклеофильного катализатора. Если используется галогенангидрид, реакцию можно также проводить в двухфазной системе, содержащей органический растворитель, предпочтительно этилацетат, и водный растворитель, предпочтительно раствор гидрокарбоната натрия. Такие реакции проводятся предпочтительно при температуре от -20 до 50 С, более предпочтительно от 0 до 50 С, особенно при комнатной температуре. Применимые нуклеофильные катализаторы включают гидроксибензотриазол (НОВТ). Применимые растворители включают диметилацетамид, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, этилацетат и толуол. Амины формулы (II) описаны в специальной литературе (например, WO 2007/080131) либо могут быть получены с помощью известных специалисту методов. 9. Соединение формулы (I), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает серу, получают реакцией соединения формулы (III), где A1, A2, A3,A4, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород или соединение формулы (III'), где R обозначает Br, Cl или F, либо соединение формулы (XI), где R обозначает С 1-С 8 алкокси (см. схему 2), с тионирующим реагентом, таким как реагент Лоуссона, или пентасульфидом фосфора до реакции с амином формулы HNR1R2, как описано в п.8. Схема 1a-6 020755 9 а. В качестве альтернативы соединение формулы (V), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I) и XA обозначает замещаемую группу, например атом галогена,такого как атом брома, получают путем обработки соединения формулы (VA), где А 1, А 2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I) и ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, a R обозначает C1-С 6 алкокси, в гидролитических условиях с последующим декарбоксилированием промежуточной кислоты. Таким условиями являются, например, обработка гидроксидом щелочного металла, таким как гидроксид натрия или гидроксид калия, в растворителе, таком как этанол или тетрагидрофуран, в присутствии воды. Альтернативным способом является обработка эфира кислотой, такой как трифторуксусная кислота, в растворителе, таком как дихлорметан с последующим добавлением воды. Реакция производится предпочтительно при температуре от -20 до 100 С, более предпочтительно от 20 до 80 С, особенно при 50 С. 9b. Соединение формулы (VA), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I) и ХА обозначает замещаемую группу, например атом галогена, такого как атом брома,получают путем реакции изоцианового соединения формулы (VII), как указано в п.3, с виниловым соединением формулы (VIA), где R3 и R4 соответствуют определению для соединения формулы (I), a R обозначает C1-С 6 алкокси, в присутствии катализатора, такого как оксид меди (I), в растворителе, например ароматическом растворителе, таком как толуол. Реакция проводится предпочтительно при температуре от -20 до 200 С, более предпочтительно от 50 до 150 С, особенно при 110 С. Виниловые соединения формулы (VIA) описаны в специальной литературе (например, J. Org. Chem. (2003), 68(15), 59255929) или могут быть получены с использованием методов, известных специалистам. Схема 2 10. Соединение формулы (XIV), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R обозначает С 1-С 6 алкокси, R1', R2' и R3' представляют, как вариант, замещаемый алкил или,как вариант, замещаемый фенил, a G обозначает кислород, получают реакцией карбоновой кислоты формулы (XV), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I) и R обозначает С 1-С 6 алкокси, с амином (XVI), где R1', R2' и R3' представляют, как вариант, замещаемый алкил или, как вариант, замещаемый фенил. Такие реакции обычно проводятся в присутствии связующего реагента,такого как N,N'-дициклогексилкарбодиимид (DCC), 1-этил-3-(3-диэтиламинопропил)карбодиимид гидрохлорид (EDC) или бис-(2-оксо-3-оксазолидинил)фосфиновый хлорид (BOP-Cl), в присутствии основания, а также, как вариант, в присутствии нуклеофильного катализатора. Такие реакции проводятся предпочтительно при температуре от -20 до 200 С, более предпочтительно от 50 до 150 С, особенно при температуре 100 С. Применимые нуклеофильные катализаторы включают гидроксибензотриазол (НОВТ). Применимые растворители включают диметилацетамид, тетрагидрофуран, диоксан, 1,2-диметоксиэтан,этилацетат и толуол. Амины формулы (VI) и карбоновые кислоты формулы (XV) описаны в специальной литературе или могут быть получены с помощью известных специалисту методов. 11. Соединение формулы (XIII), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R обозначает С 1-С 6 алкокси, R1', R2' и R3' представляют, как вариант, замещаемый алкил или,как вариант, замещаемый фенил, a G обозначает кислород, получают реакцией соединения формулы(XIV), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R обозначает С 1-С 6 алкокси, R1', R2' и R3' представляют, как вариант, замещаемый алкил или замещаемый фенил, a G обозначает кислород, с тионирующим реагентом, таким как реагент Лоуссона, или пентасульфидом фосфора, в растворителе, например ароматическом растворителе, таком как толуол. Реакция проводится предпочтительно при температуре от -20 до 200 С, более предпочтительно от 50 до 150 С, в частности при 110 С. 12. Соединение формулы (XII), где А 1, А 2, А 3, А 4 соответствуют определению для соединения фор-7 020755 мулы (I), R обозначает С 1-С 6 алкокси, R1', R2' и R3' представляют, как вариант, замещаемый алкил или, как вариант, замещаемый фенил, R4' представляет, как вариант, замещаемый алкил, a G обозначает кислород,получают реакцией соединения формулы (XIII), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R представляет С 1-С 6 алкокси, R1', R2' и R3' представляют, как вариант, замещаемый алкил или замещаемый фенил, a G обозначает кислород, с алкилирующим веществом R4'-X, где X обозначает замещаемую группу, например атом галогена, такой как атом йода, и основание, такое как карбонат натрия или карбонат калия, в растворителе, таком как ацетонитрил. Реакция проводится предпочтительно при температуре от -20 до 100 С, более предпочтительно от 0 до 50 С, особенно при комнатной температуре. 13. Соединение формулы (XI), где А 1, А 2, А 3, А 4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает С 1-С 6 алкокси, получают реакцией соединения формулы (XII), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R обозначает С 1-С 6 алкокси, R1', R2' и R3' представляют, как вариант, замещаемый алкил или, как вариант, замещаемый фенил, R4' представляет, как вариант, замещаемый алкил, a G представляет кислород, с виниловым соединением формулы (VI), где R3 и R4 соответствуют определению для соединения формулы (I), в присутствии фтористого реагента, такого как фторид калия или фторид тетрабутиламмония, в растворителе, например THF. Реакция проводится предпочтительно при температуре от -20 до 500 С, более предпочтительно от 0 до 100 С, особенно при комнатной температуре. Виниловые соединения формулы (VI) описаны в специальной литературе (например, ЕР 1731512) либо могут быть получены с помощью известных специалисту методов. 14. Соединение формулы (I), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, получают путем реакции карбоновой кислоты формулы(III) или галогенангидрида формулы (III'), где А 1, А 2, А 3, A4, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает Br, Cl или F (которые можно получить из соединения формулы (XI), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает С 1-С 6 алкокси), с амином формулы HNR1R2, где R1 иR2 соответствуют определению для соединения формулы (I) при условиях, описанных в п.8. Схема 2 а 14 а. В качестве альтернативы соединение формулы (III), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, получают обработкой соединения формулы (XIA), где А 1, А 2, А 3, А 4, R3 и R4 соответствуют определению для соединения формулы (I) и R обозначает С 1-С 6 алкокси, в гидролитических условиях с последующим декарбоксилированием. Таким условиями являются, например, обработка гидроксидом щелочного металла, таким как гидроксид натрия или гидроксид калия, в растворителе, таком как этанол или тетрагидрофуран, в присутствии воды. Альтернативным способом является обработка эфира кислотой, такой как трифторуксусная кислота, в растворителе, таком как дихлорметан, с последующим добавлением воды. Реакция производится предпочтительно при температуре от -20 до 100 С, более предпочтительно от 20 до 80 С, особенно при 50 С. 14b. Соединение формулы (XIA), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I) и R обозначает С 1-С 6 алкокси, получают реакцией соединения формулы (XII), где А 1,А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R обозначает С 1-С 6 алкокси, R1', R2' иR3' представляют, как вариант, замещаемый алкил или, как вариант, замещаемый фенил, R4' представляет,как вариант, замещаемый алкил, a G обозначает кислород, с виниловым соединением формулы (VIA),где R3 и R4 соответствуют определению для соединения формулы (I) и R обозначает С 1-С 6 алкокси, в присутствии фтористого реагента, такого как фторид калия или фторид тетрабутиламмония, например THF. Реакция проводится предпочтительно при температуре от -20 до 500 С, более предпочтительно от 0 до 100 С, особенно при комнатной температуре. Виниловые соединения формулы (VIA) описаны в специальной литературе (например, J. Org. Chem. (2003), 68(15), 5925-5929) либо могут быть получены с помощью известных специалисту методов. 15. Карбоновые кислоты формулы (XVIII), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R1', R2' и R3' представляют, как вариант, замещаемый алкил или, как вариант, замещаемый фенил, R4' представляет, как вариант, замещаемый алкил, a G обозначает кислород, могут быть получены из эфиров формулы (XII), где R обозначает С 1-С 6 алкокси. Специалистам известно, что существует много методов гидролиза таких эфиров в зависимости от характеристик группы алкокси. Одним из широко используемых методов для достижения такого преобразования является обработка гидроксидом щелочного металла, таким как гидроксид натрия или гидроксид лития, в растворителе, таком как этанол или тетрагидрофуран, в присутствии воды. Другим способом является обработка эфира кислотой,такой как трифторуксусная кислота, в растворителе, таком как дихлорметан, с последующим добавлением воды. Реакция проводится при температуре от 0 до 150 С, более предпочтительно от 15 до 100 С,особенно при 50 С. 16. Соединение формулы (XVII), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R1', R2' и R3' представляют, как вариант, замещаемый алкил или, как вариант, замещаемый фенил, R4' обозначает, как вариант, замещаемый алкил, a G обозначает кислород, получается при реакции кислот формулы (XVIII), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R1',R2' и R3' представляют, как вариант, замещаемый алкил или замещаемый фенил, R4' обозначает, как вариант, замещаемый алкил, a G обозначает кислород, с амином формулы HNR1R2, где R1 и R2 соответствуют определению для соединения формулы (I) в условиях, описанных в п.8. 17. Соединение формулы (I), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, получается при реакции соединения по формуле (XVII),где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения по формуле (I), G обозначает кислород, R1', R2' и R3' представляют, как вариант, замещаемый алкил или, как вариант, замещаемый фенил, и R4' обозначает, как вариант, замещаемый алкил, с виниловым соединением по формуле (VI), гдеR3 и R4 соответствуют определению для соединения формулы (I), в присутствии фтористого реагента,такого как фторид калия или фторид тетрабутиламмония, например THF, в условиях, описанных в пункте (13). Схема 3 а-9 020755 17 а. В качестве альтернативы соединение формулы (I), где A1, A2, A3, A4, R3 и R4 соответствуют данному здесь определению, a G обозначает кислород, получается при обработке соединения формулы(IA), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает С 1-С 6 алкокси, в гидролитических условиях с последующим декарбоксилированием. Таким условиями являются, например, обработка гидроксидом щелочного металла, таким как гидроксид натрия или гидроксид калия, в растворителе, таком как этанол или тетрагидрофуран, в присутствии воды. Альтернативным способом является обработка эфира кислотой, такой как трифторуксусная кислота, в растворителе, таком как дихлорметан, с последующим добавлением воды. Реакция проводится предпочтительно при температуре от -20 до 100 С, более предпочтительно от 20 до 80 С, особенно при 50 С. 17b. Соединение формулы (IA), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает С 1-С 6 алкокси, получается при реакции соединения формулы (XVII), где А 1, А 2, А 3, А 4 соответствуют определению для соединения формулы (I), R1', R2' иR3' представляют, как вариант, замещаемый алкил или, как вариант, замещаемый фенил, R4' обозначает,как вариант, замещаемый алкил, a G обозначает кислород, с виниловым соединением формулы (VIA),где R3 и R4 соответствуют определению для соединения формулы (I) и R обозначает С 1-С 6 алкокси, в присутствии фтористого реагента, такого как фторид калия или фторид тетрабутиламмония, например THF. Реакция проводится предпочтительно при температуре от -20 до 500 С, более предпочтительно от 0 до 100 С, особенно при комнатной температуре. Виниловые соединения формулы (VIA) описаны в специальной литературе (например, J. Org. Chem. (2003), 68(15), 5925-5929) либо могут быть получены с помощью известных специалисту методов. Схема 4 18. Соединение формулы (I), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют данному здесь определению, a G обозначает кислород, получается при реакции соединения формулы (XX), где A1, A2, A3, A4,R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, с восстанавливающим веществом, таким как Zn/HCl, в растворителе, например воде или DMF, или их смеси. Реакция проводится предпочтительно при температуре от -20 до 500 С, более предпочтительно от 0 до 100 С, особенно при 80 С. 19. Соединение формулы (XX), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, получается при реакции соединения формулы (XXI),где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород (который можно получить в соответствии с методами, описанными в WO 2009/080250), с нитрометаном в присутствии основания, такого как NaOH, в растворителе, например воде или DMF, или их смеси. Реакция проводится предпочтительно при температуре от -20 до 500 С, более предпочтительно от 0 до 100 С, в частности при комнатной температуре. 20. В качестве альтернативы соединение формулы (I), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют данному здесь определению, a G обозначает кислород, как показано на схеме 4, можно получить из соединения формулы (XX), где А 1, А 2, А 3, А 4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, через промежуточное вещество (XIX), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, например, при условиях реакции, описанной в п.18. Репрезентативные экспериментальные условия для данной трансформации также описаны в издании Tetrahedron Letters 2003, 44, 3701-3703. 21. Соединение формулы (III), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, может быть получено из соединения формулы (XI), где A1,A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает C1-С 6 алкокси при условиях, описанных в п.6. 22. Соединение формулы (XI), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), G обозначает кислород, a R обозначает С 1-С 6 алкокси, может быть получено из соединения формулы (XXII), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, a G обозначает кислород, как описано в п.5. 23. Соединение формулы (XXII), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), ХА обозначает замещаемую группу, например атом галогена, такого как атом брома,a G обозначает кислород, может быть получено в результате реакции соединения формулы (XXIV), гдеA1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, a G обозначает кислород, как описано в п.18. 24. В качестве альтернативы соединения формулы (XXII), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), ХА обозначает замещаемую группу, например атом галогена,такого как атом брома, a G обозначает кислород, как показано на схеме 5, можно получить из соединения формулы (XXIV), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, a G обозначает кислород, через промежуточное вещество (XIII), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, a G обозначает кислород, например, при условиях реакции, описанной в п.18. 25. Соединение формулы (XXIV), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), ХА обозначает замещаемую группу, например атом галогена, такой как атом брома, aG обозначает кислород, может быть получено в результате реакции соединения формулы (XXV), где A1,A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, a G обозначает кислород (который можно получить в соответствии с методами, описанными в WO 2009/080250), согласно п.19. 26. В качестве альтернативы соединение формулы (I), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, можно получить реакцией соединения формулы (XXVI), где А 1, А 2, А 3, А 4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, с восстанавливающим веществом, таким как ренеевский Ni/Н 2, в растворителе, например метаноле или этаноле. Реакция проводится предпочтительно при температуре от-20 до 500 С, более предпочтительно от 0 до 100 С. Репрезентативные экспериментальные условия для данной трансформации также описаны авторами Allen, C.F.H. и Wilson, C.V. в издании Org Synth. (1947),27. 27. Соединение формулы (XXVI), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород, может быть получено реакцией соединения формулы(XXI), где A1, A2, A3, A4, R1, R2, R3 и R4 соответствуют определению для соединения формулы (I), a G обозначает кислород (который может быть получен в соответствии с методами, описанными в WO 2009/080250), с источником цианида, таким как цианид натрия, цианид калия, цианид триметилсилила,ацетонциангидрин или цианид диэтилалюминия, в растворителе, например толуоле, тетрагидрофуране,ацетоне, уксусной кислоте, этаноле или воде или их смеси. Реакция проводится предпочтительно при температуре от -20 до 500 С, более предпочтительно от 0 до 100 С, особенно при комнатной температуре. Репрезентативные экспериментальные условия для данной трансформации описаны в издании Tetrahedron 64(17), 3642-3654; 2008. Схема 7 28. Соединение формулы (XXII), где А 1, А 2, А 3, А 4, R3 и R4 соответствуют определению для соединения формулы (I), X обозначает замещаемую группу, например атом галогена, такой как атом брома, aG обозначает кислород, может быть получено в результате реакции соединения формулы (XXVII), гдеA1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), ХА обозначает замещаемую группу, например атом галогена, такого как атом брома, a G обозначает кислород (который можно получить в соответствии с методами, описанными в WO 2009/080250), как описано в п.26. 29. Соединение формулы (XXVII), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), XA обозначает замещаемую группу, например атом галогена, такого как атом брома, a G обозначает кислород, может быть получено в результате реакции соединения формулы(XXV), где A1, A2, A3, A4, R3 и R4 соответствуют определению для соединения формулы (I), XA обозначает замещаемую группу, например атом галогена, такого как атом брома, a G обозначает кислород, как описано в п.27. Соединения формулы (I) включают хиральный центр и соответственно могут создавать энантиомеры формул (I) и (I) Энантиомерно обогащенные смеси соединений формулы (I) или (I) можно готовить, например, в соответствии со схемами 4 или 5 путем образования промежуточного вещества (XX) или (XXIV) через асимметричное присоединение по Михаэлю; примеры см. в J. Org. Chem. 2008, 73, 3475-3480 и указанных там ссылках. В качестве альтернативы такие энантиомерно обогащенные смеси можно готовить по схемам 6 или 7 путем стереоселективного добавления цианида; см., например, J. Am. Chem. Soc. 2008,130, 6072-6073. Соединение формулы (I) может быть смесью соединений (I) и (I) в любом соотношении, например с молярным соотношением от 1:99 до 99:1, например от 10:1 до 1:10, например с базовым молярным соотношением 50:50. Например, в энантиомерно обогащенной смеси формулы (I) молярная пропорция соединения (I) по сравнению с общим количеством обоих энантиомеров может быть больше 50%, т.е. составлять не менее 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98 или как минимум 99%. Аналогично, в энантиомерно обогащенной смеси формулы (I) молярная пропорция соединения формулы (I) по сравнению с общим количеством обоих энантиомеров может быть больше 50%, т.е. составлять не менее 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98 или как минимум 99%. Соединения формулы (I) могут использоваться для борьбы с нашествиями насекомых-вредителей,таких как Lepidoptera, Diptera, Hemiptera, Thysanoptera, Orthoptera, Dictyoptera, Coleoptera, Siphonaptera,Hymenoptera и Isoptera, а также с другими беспозвоночными вредителями, такими как акариды, нематоды и моллюски. В дальнейшем насекомые, акариды, нематоды и моллюски совместно именуются вредителями. К вредителям, с которыми можно бороться при помощи соединений, являющихся предметом данного изобретения, относятся вредители, связанные с сельскохозяйственным производством (включая выращивание культур с целью производства продовольствия и волоконных продуктов), садоводством и огородничеством, а также животноводством, содержанием домашних животных, лесоводством и хранением продукции растительного происхождения (например, фруктов, зерна, древесины); сюда также относятся вредители, вызывающие повреждение рукотворных сооружений и являющиеся переносчиками болезней людей и животных, а также досаждающие вредители (такие как мухи). Описываемые в изобретении соединения могут использоваться, например, для газонов, декоративных насаждений, таких как цветы, кустарники, широколиственные деревья или вечнозеленые растения,например хвойные, а также для прививок деревьев, борьбы с вредителями и т.п. Примеры видов вредителей, с которыми можно бороться с помощью соединений формулы (I):(уксусная нематода), Trichostrongylus spp. (нематоды желудочно-кишечного тракта) и Deroceras reticulatum (слизняк). Таким образом, изобретение предлагает метод борьбы с насекомыми, акаридами, нематодами или моллюсками, состоящий в обработке достаточным для уничтожения насекомых, акарид, нематод или моллюсков количеством соединения формулы (I) или композиции, имеющей в составе соединения формулы (I) вредителя, очага скопления вредителей (предпочтительно на растении) или же растения, восприимчивого к нападению вредителя. Соединения формулы (I) предпочтительно используются против насекомых и акарид. Описанные в данном изобретении соединения также могут использоваться для борьбы с насекомыми, устойчивыми к известным инсектицидным веществам. Термин "растение" в контексте данного изобретения подразумевает саженцы, кустарники и деревья. Под "сельскохозяйственными культурами" следует также понимать культуры с выработанной устойчивостью к токсичному воздействию гербицидов или классов гербицидов (таких как ALS-, GS-,EPSPS-, РРО- и HPPD-ингибиторы) с помощью традиционных методов селекции или способами генной инженерии. Примером сельскохозяйственной культуры с устойчивостью к имидазолинонам, например имазамоксу, выработанной традиционными методами селекции, является сурепица (канола) Clearfield. В качестве примера сельскохозяйственных культур с устойчивостью к гербицидам, являющейся результатом применения генной инженерии, можно привести стойкие к глифосату и глуфосинату разновидности кукурузы, доступные на рынке под торговыми названиями RoundupReady и LibertyLink. Под "сельскохозяйственными культурами" следует также понимать культуры, резистентные к вредным насекомым благодаря методам генной инженерии; к таким относятся, например, Bt-кукуруза (устойчивая к мотыльку кукурузному), Bt-хлопок (устойчивый к хлопковому долгоносику), а также Btкартофель (устойчивый к колорадскому жуку). Примерами Bt-кукурузы являются гибриды кукурузы Bt 176 от NK (Syngenta Seeds). Примерами трансгенных растений с одим или более генов, отвечающим за устойчивость к инсектицидам и отражение одного или более токсинов, являются KnockOut (кукуруза),Yield Gard (кукуруза), NuCOTIN33B (хлопок), Bollgard (хлопок), NewLeaf (картофель), NatureGard и Protexcta. Посевы этих растений или их семенной материал могут быть резистентными к гербицидам и в то же время устойчивыми к поеданию насекомыми ("сложенные" трансгенные явления). Например, семя может обладать способностью продуцировать инсектицидный белок Cry3 и в то же время быть устойчивым к глифозату. Под "сельскохозяйственными культурами" следует также понимать культуры, полученные с помощью традиционных методов селекции или генной инженерии и содержащие так называемые выходные свойства (output traits), такие как повышенная стабильность при хранении, увеличенная питательная ценность и улучшенный аромат. Для обработки вредителя, очага скопления вредителей либо растения, восприимчивого к нападению вредителя, соединением формулы (I) в качестве инсектицида, акарицида, нематоцида или моллюскоцида соединение формулы (I) обычно вводится в композицию, куда кроме соединения формулы (I) входят соответствующий инертный разбавитель или носитель и (как вариант) поверхностно-активное вещество(ПАВ). ПАВ представляют собой химические вещества, способные изменять характеристики граничного слоя материала (к примеру, в комбинациях состояний граничного слоя жидкое/твердое, жидкое/газообразное или жидкое/жидкое) путем снижения поверхностного натяжения, тем самым приводя к изменениям других характеристик (например, рассеивание, эмульгирование и смачивание). Предпочтительно, чтобы все композиции (как твердые, так и жидкие препаративные формы) составляли от 0,0001 до 95 вес.%, более предпочтительно от 1 до 85%, например от 5 до 60%, соединения формулы (I). Композиция обычно используется для борьбы с вредителями таким образом, чтобы обеспечить расход соединения формулы (I) в норме от 0,1 г до 10 кг на 1 га, предпочтительно от 1 г до 6 кг на 1 га, более предпочтительно от 1 г до 1 кг на 1 га. При использовании соединения формулы (I) для протравливания семян норма его расхода составляет от 0,0001 до 10 г (например, 0,001 или 0,05 г), предпочтительно от 0,005 до 10 г, более предпочтительно от 0,005 до 4 г на 1 кг семян. В другом варианте настоящее изобретение предлагает инсектицидную, акарицидную, нематоцидную или моллюскоцидную композицию, содержащую эффективное количество соединения формулы (I) для борьбы с вредителями-насекомыми, акаридами, нематодами или моллюсками, и, например, совместимый с ней носитель или разбавитель. Композиция предпочтительно является инсектицидной или акарицидной. Композиции можно выбирать из нескольких типов препаративных форм, включая дусты (ДП), растворимые порошки (РП), водорастворимые гранулы (ВРГ), водно-диспергируемые гранулы (ВДГ), смачиваемые порошки (СП), гранулы (ГР) (медленного или быстрого высвобождения), растворимые кон- 14020755 центраты (РК), жидкости, смешивающиеся с маслом (МЖ), жидкости для ультрамалообъемного внесения (УЖ), эмульгируемые концентраты (КЭ), диспергируемые концентраты (КД), эмульсии (как типа"масло в воде" - ЭВ, так и типа "вода в масле" - ЭМ), микроэмульсии (МЭ), концентраты суспензий (КС),аэрозоли, препаративные формы для образования тумана/дыма, капсульные суспензии (СК) и препаративные формы для обработки семян. Выбранная препаративная форма в любом отдельном случае будет зависеть от конкретной намеченной цели и физических, химических и биологических характеристик соединения формулы (I). Дусты (ДП) приготавливаются путем смешивания состава формулы (I) с одним или более твердых разбавителей (ими являются природные глины, каолин, пирофиллит, бентонит, глинозем, монтмориллонит, диатомит, мел, диатомовая земля, фосфаты кальция, карбонаты кальция и магния, сера, известняк,тонкие порошки, тальк и другие органические и неорганические твердые носители) и механического растирания смеси до получения тонкоизмельченного порошка. Растворимые порошки (РП) можно приготовить путем смешивания соединения формулы (I) с одной или более водорастворимых неорганических солей (таких как бикарбонат натрия, карбонат натрия или сульфат магния) или с одной или более водорастворимых органических пород (таких как полисахарид) и,как вариант, с одним или более смачивающих агентов, одним или более диспергирующих агентов или смесью упомянутых агентов для улучшения степени дисперсности/растворимости в воде. Затем смесь растирают до получения тонкоизмельченного порошка. Аналогичные составы можно также гранулировать для получения водорастворимых гранул (ВРГ). Смачиваемые порошки (СП) можно приготовить путем смешивания соединения формулы (I) с одним или более твердых разбавителей или носителей, одним или более смачивающих агентов и предпочтительно одним или более диспергирующих агентов и, как вариант, одним или более суспендирующих агентов для облегчения диспергирования в жидкостях. Затем смесь растирают до получения тонкоизмельченного порошка. Аналогичные составы можно также гранулировать для получения воднодиспергируемых гранул (ВДГ). Гранулы (ГР) можно получить либо путем гранулирования смеси соединения формулы (I) и одного или более порошкообразных твердых разбавителей или носителей, либо из предварительно сформированных пустых гранул путем абсорбирования соединения формулы (I) (или его раствора в совместимом агенте) в пористом гранулированном материале (таком как пемза, аттапульгитовые глины, фуллерова земля, диатомит, диатомовая земля или перемолотая кукурузная кочерыжка) либо путем абсорбирования соединения формулы (I) (или его раствора в подходящем агенте) в твердом заполнителе (таком как пески, силикаты, природные карбонаты, сульфаты или фосфаты) и высушивания при необходимости. Вещества, широко используемые для облегчения процессов абсорбирования или адсорбирования, включают растворители (такие как алифатические и ароматические нефтяные растворители, спирты, эфиры, кетоны и сложные эфиры) и липкие вещества (такие как поливинил ацетаты, поливиниловые спирты, декстрины,сахара и растительные масла). Гранулы могут также включать одну или более других добавок (например,эмульгирующий агент, смачивающий агент или диспергирующий агент). Диспергируемые концентраты (КД) можно приготовить путем растворения соединения формулы (I) в воде или органическом растворителе, таком как кетон, спирт или эфир гликоля. Эти растворы могут содержать поверхностно-активные вещества (например, для улучшения растворения в воде или предотвращения кристаллизации химиката в баке опрыскивателя). Эмульгируемые концентраты (КЭ) или эмульсии масло-в-воде (ЭВ) можно приготовить путем растворения соединения формулы (I) в органическом растворителе (которые может содержать один или более смачивающих агентов, один или более эмульгирующих агентов или смесь упомянутых агентов). Применимые в КЭ органические растворители включают ароматические углеводороды (такие как алкилбензолы или алкилнафталины, известные в торговле под наименованиями SOLVESSO 100, SOLVESSO 150 и SOLVESSO 200; SOLVESSO является зарегистрированной торговой маркой), кетоны (такие как циклогексанон или метилциклогексанон) и спирты (такие как бензиловый спирт, фурфуриловый спирт или бутанол), N-алкилпирролидоны (такие как N-метилпирролидон или N-октилпирролидон), диметиламиды или жирные кислоты (такие как C8-C10 диметиламид жирной кислоты) или хлорированные углеводороды. При добавлении воды продукт КЭ может спонтанно эмульгировать, образуя эмульсию со значительной степенью устойчивости, обеспечивающей распыление аэрозоля с помощью соответствующего оборудования. Процесс приготовления ЭВвключает получение соединения формулы (I) либо в виде жидкости (если соединение не является жидкостью комнатной температуры, его можно растопить при умеренной температуре, обычно ниже 70 С), либо в виде раствора (путем растворения в применимом растворителе), с последующим эмульгированием полученной жидкости или раствора в воде, содержащей одно или более ПАВ, в условиях высокого градиента скорости сдвига, для образования эмульсии. Применимые в ЭВ растворители включают растительные масла, хлорированные углеводороды (такие как хлорбензолы), ароматические растворители (такие как алкилбензолы или алкилнафталины) и другие применимые органические растворители с низкой растворимостью в воде. Микроэмульсии (МЭ) можно приготовить путем смешивания воды со смесью одного или более растворителей с одним или более ПАВ, в результате чего спонтанно образуется препаративная форма термодинамически стабильной изотропной жидкости. Соединение формулы (I) исходно присутствует либо в воде, либо в смеси растворителя/ПАВ. Применимые в МЭ растворители включают растворители,ранее описанные для использования в КЭ или в ЭВ. МЭ может являться системой либо типа "масло в воде", либо типа "вода в масле" (определить, какая из двух систем имеется в конкретном случае, можно посредством измерения электрической проводимости) и подходит для смешивания водорастворимых или маслорастворимых пестицидов в аналогичной препаративной форме. МЭ подходит для растворения в воде, сохраняя состояние микроэмульсии или образуя традиционную эмульсию типа "масло в воде". Концентраты суспензий (КС) могут быть как водными, так и не водными суспензиями тонкоизмельченных твердых частиц соединения формулы (I). КС можно приготовить путем размола на шаровой мельнице твердого соединения формулы (I) в соответствующей среде, как вариант - с одним или более диспергирующих агентов, для производства суспензии тонкоизмельченных частиц соединения. В композицию могут быть включены один или более смачивающих агентов, а для снижения скорости оседания частиц можно также включить суспендирующий агент. Соединение формулы (I) можно также измельчить в мельнице для сухого размола и добавить в воду, содержащую ранее описанные агенты, для образования требуемого конечного продукта. Аэрозольные препаративные формы содержат соединение формулы (I) и применимое распыляющее вещество (например, n-бутан). Соединение формулы (I) можно также растворить или диспергировать в применимом веществе (например, в воде или смешиваемой с водой жидкости, такой как n-пропанол) с целью получения композиций для использования в ручных насосах для опрыскивания при нормальном давлении. Соединение формулы (I) в сухой форме можно смешивать с пиротехнической смесью для образования композиции, которая подходит для создания в замкнутом пространстве дыма, содержащего соединение. Капсульные суспензии (СК) можно приготовить способом, аналогичным способу приготовления препаративных форм ЭВ, но с добавлением этапа полимеризации для того, чтобы получить водную дисперсию масляных капелек, в которой каждая капелька заключена в полимерную оболочку и содержит соединение формулы (I) и, как вариант, его носитель или разбавитель. Полимерная оболочка образуется либо в ходе реакции межфазной поликонденсации, либо путем формирования комплекса донорноакцепторного типа. Композиции могут использоваться для контролированного высвобождения соединения формулы (I) и для обработки семян. Соединение формулы (I) можно также заключить в биологически разлагаемую полимерную матрицу для обеспечения медленного контролируемого высвобождения соединения. Композиция может включать одну или более добавок для оптимизации ее биологических характеристик (например, для улучшения смачивания, удерживаемости или распределения на поверхностях,устойчивости к атмосферным осадкам на обработанных поверхностям или поглощения либо подвижности соединения формулы (I. Такие добавки включают поверхностно-активные вещества, аэрозольные добавки на основе масел, например некоторых минеральных масел или естественных растительных масел (таких как соевое масло и рапсовое масло), и их смесей с другими биостимулирующими присадками(ингредиентами, которые могут способствовать действию соединения формулы (I) или изменять его). Соединение формулы (I) можно также вводить в составы для обработки семян, например в виде порошковой композиции, включая порошок для сухой обработки семян (ПС), водорастворимый порошок(ВРП) или диспергируемый в воде порошок для обработки семян суспензией (ВС), либо в виде жидкой композиции, включая текучий концентрат (ТС), раствор (PC) или капсульную суспензию (КС). Подготовка композиций ПС, ВРП, ВС, ТС и PC очень похожа на описанную выше подготовку композиций ДП,РП, СП, КС и КД. В композиции для обработки семян может входить агент для облегчения прикрепления композиции к семени (например, минеральное масло или пленкообразующий защитный материал). Смачивающие агенты, диспергирующие агенты и эмульгирующие агенты могут представлять собой поверхностные ПАВ катионного, анионного, амфотерного или неионогенного типа. Применимые ПАВ катионного типа включают четвертичные соединения аммония (например, цетилтриметил-аммония бромид), имидазолоны и аминные соли. Применимые анионные ПАВ включают соли жирных кислот щелочных металлов, соли алифатических моноэфиров серной кислоты (например, лаурилсульфат натрия), соли сульфонированных ароматических соединений (например, додецилбензолсульфонат натрия, додецилбензолсульфонат кальция, бутилнафталинсульфонат и смесь ди-изопропил- и три-изопропилнафталинсульфонатов натрия), эфир сульфаты, алкоголь эфир сульфаты (например, лаурет-3-сульфат натрия), эфир-карбоксилаты (например,лаурет-3-карбоксилат натрия), фосфатные эфиры (продукты реакции между одним или более жирных спиртов и фосфорной кислотой (преимущественно моноэфиры) или фосфорный ангидрид (преимущественно диэфиры), например путем реакции между лауриловым спиртом и тетрафосфорной кислотой; кроме того, эти продукты могут быть этоксилированы), сульфосукцинаматы, парафин или олефинсульфонаты, таураты и лигносульфонаты. Применимые ПАВ амфотерного типа включают бетаины, пропионаты и глицинаты. Применимые ПАВ неионогенного типа включают продукты конденсации алкиленоксидов, таких как окись этилена, окись пропилена, окись бутилена и их смеси с жирными спиртами (такими как олеиловый или цетиловый спирт) или с алкилфенолами (такими как октилфенол, нонилфенол и октилкрезол); неполные эфиры, получаемые из жирных кислот с длинными цепями или безводных гекситов; продукты конденсации указанных неполных эфиров с оксидом этилена; блок-полимеры (содержащие окись этилена и окись пропилена); алканоламиды; простые эфиры (например, эфиры жирных кислот полиэтиленгликоля); аминооксиды (например, лаурил диметил амин оксид) и лецитины. Применимыми суспендирующими агентами являются гидрофильные коллоиды (такие как полисахариды, поливинилпирролидон или натриевая соль карбоксиметилцеллюлозы) и набухающие глины (такие как бентонит или аттапульгит). Применение соединения формулы (I) осуществляется любым известным способом обработки пестицидными соединениями. Например, соединением (самостоятельно или в составе с другими веществами) можно обрабатывать вредителей и очаги скопления вредителей (такие как зона обитания вредителей или живое растение, подвергшееся нападению вредителей), а также любую часть растения, в том числе листву, стебли, ветви или корни; соединением можно обрабатывать семена перед посадкой; его можно вносить в среду, в которой растут или будут выращиваться растения (например, почва вокруг корней,почва вообще, вода рисовых чеков или гидропонные системы) непосредственно разбрызгиванием, опылением, протравливанием методом погружения, нанесением кремообразной или пастообразной композиции, обработки паром, а также путем внесения или заделки композиции (гранулированной композиция или композиции, упакованной в водорастворимый пакет) в почву или водную среду. Соединение формулы (I) можно также впрыскивать в растения или распылять на растительный покров средствами электродинамического распыления или с помощью других экономичных способов либо наносить с помощью систем наземного или воздушного орошения. Композиции для использования в виде водных препаративных форм (водных растворов или дисперсий) обычно поставляются в форме концентратов с высокой массовой долей действующего вещества; концентрат перед использованием разбавляют водой. Часто требуется, чтобы указанные концентраты,которые могут включать КД, КС, КЭ, ЭВ, МЭ, ВРГ, РП, СП, ВДГ и СК, хорошо сохранялись при длительном хранении и не утратили после такого хранения способности к растворению в воде и образованию водных препаратов, поддерживающих гомогенность в течение времени, достаточного для их нанесения с помощью обычного распылительного оборудования. Такие водные препаративные формы могут содержать различное количество соединения формулы (I) (например, от 0,0001 до 10 вес.%) в зависимости от цели их применения. Соединение формулы (I) можно использовать в смесях с удобрениями (в частности, азотными, калиевыми или фосфорсодержащими удобрениями). Применимыми являются гранулированные виды удобрений. Такие смеси предпочтительно содержат до 25 вес.% соединения формулы (I). Таким образом, изобретение предлагает композицию удобрения, содержащую удобрение и соединение формулы (I). Композиции согласно настоящему изобретению могут содержать и другие соединения, обладающие биологической активностью, в частности питательные микроэлементы и соединения, обладающие фунгицидной активностью или проявляющие свойства регуляторов роста растений, гербицидов, инсектицидов, нематоцидов или акарицидов. Соединение формулы (I) может быть единственным действующим веществом композиции или, где это необходимо, может примешиваться к одному или более дополнительных действующих веществ, таких как пестицид, фунгицид, синергист, гербицид или регулятор роста растений. Дополнительное действующее вещество может создавать композицию, обладающую более широким спектром активности или повышенной стойкостью в местах нанесения; подкреплять или дополнять действие (например, за счет увеличения скорости влияния или преодоления отталкивающей способности) соединения формулы (I); содействовать в преодолении или предотвращении развития устойчивости вредителей к отдельным компонентам. Выбор конкретного дополнительного действующего вещества определяется назначением композиции. Примеры применимых пестицидов: а) пиретроиды, такие как перметрин, циперметрин, фенвалерат, эсфенвалерат, дельтаметрин, цигалотрин (в особенности лямбда-цигалотрин, гамма-цигалотрин), бифентрин, фенпропатрин, цифлутрин,тефлутрин, безопасные для рыб пиретроиды (к примеру, этофенпрокс), натуральный пиретрин, тетраметрин, s-биоаллетрин, фенфлутрин, праллетрин или 5-бензил-3-фурилметил-(Е)-(1R,3S)-2,2-диметил-3(2-оксотиолан-3- илиденметил) циклопропанкарбоксилат; б) органические фосфаты, в частности профенофос, сульпрофос, ацефат, метилпаратион, азинфосметил, диметон-s-метил, гептенофос, тиометон, фенамифос, монокротофос, профенофос, триазофос, метамидофос, диметоат, фосфамидон, малатион, хлорпирифос, фозалон, тербуфос, фенсульфотион, фонофос, форат, фоксим, пиримифос-метил, пиримифос-этил, фенитротион, фостиазат или диазинон; в) карбаматы (в том числе арилкарбаматы), такие как пиримикарб, триазамат, клоэтокарб, карбофуран, фуратиокарб, этнофенкарб, альдикарб, тиофурокс, карбосульфан, бендиокарб, фенобукарб, пропоксур, метомил или оксамил); г) бензоилмочевины, такие как дифлубензурон, трифлумурон, гексафлумурон, флуфеноксурон или хлорфлуазурон; д) оловоорганические соединения, такие как цигексатин, фенбутатиноксид или азоциклотин; е) пиразолы, такие как тебуфенпирад и фенпироксимат; ж) макролиды, такие как авермектины или милбемицины, например абамектин, эмамектин бензоат,ивермектин, милбемицин, спиносад, азадирахтин или спинеторам; з) гормоны или феромоны; и) хлорорганические соединения, такие как эндосульфан (в особенности альфа-эндосульфан), гексахлорбензол, ДДТ, хлордан или диэльдрин; к) амидины, такие как хлордимеформ или амитраз; л) фумигантные средства, такие как хлорпикрин, дихлорпропан, метилбромид или метам; м) неоникотиноидные соединения, такие как имидаклоприд, тиаклоприд, ацетамиприд, нитенпирам,динотефуран, тиаметоксам, клотианидин, нитиазин или флоникамид; н) диацилгидразины, такие как тебуфенозид, хромафенозид или метоксифенозид; о) дифениловые эфиры, такие как диофенолан или пирипроксифен; п) индоксакарб; р) хлорфенапир; с) пиметрозин; т) спиротетрамат, спиродиклофен или спиромесифен; у) диамиды, такие как флубендиамид, хлорантранилипрол или циантранилипрол; ф) сульфоксафлор; х) метафлумизон; ц) фипронил и этипрол или ч) пирифлукиназон. Помимо основных химических классов пестицидов, перечисленных выше, в состав соответствующих смесей могут включаться и другие пестициды целевого действия. Например, при защите посевов риса могут использоваться селективные инсектициды для конкретных растений, например инсектициды,специфичные по отношению к стебельным пилильщикам (картап) или по отношению к прыгающим насекомым (бупрофецин). Как вариант, в состав композиций могут также входить инсектициды или акарициды, специфичные для контроля определенных видов насекомых/стадий роста насекомого (например,акарицидные оволарвициды, такие как хлофентезин, флубензимин; гекситиазокс или тетрадифон; акарицидные мотилициды, такие как дикофол или пропаргит; акарициды, такие как бромопропилат или хлорбензилат; или регуляторы роста, такие как гидраметилнон, циромазин, метопрен, хлорфлуазурон или дифлубензурон). Примерами фунгицидных соединений, которые могут входить в состав композиции согласно настоящему изобретению, являются (Е)-N-метил-2-[2-(2,5-диметилфеноксиметил)фенил]-2-метоксииминоацетамид (SSF-129), 4-бром-2-циано-N,N-диметил-6-трифторметилбензимидазол-1-сульфонамид,-[N-(3-хлор-2,6-ксилил)-2-метоксиацетамидо]бутиролактон,4-хлор-2-циано-N,N-диметил-5-ртолилимидазол-1-сульфонамид (IKF-916, циамидазосульфамид), 3-5-дихлор-N-(3-хлор-1-этил-1-метил-2 окосопропил)-4-метилбензамид (RH-7281, зоксамид), N-аллил-4,5,-диметил-2-триметилсилилтиофен-3 карбоксамид(АС 382042), N-(2-метокси-5-пиридил)-циклопропан карбоксамид, ацибензолар (CGA245704) (например,ацибензолар-S-метил), аланикарб, альдиморф, анилазин, азаконазол, азоксистробин, беналаксил, беномил, бентиаваликарб, билоксазол, битертанол, биксафен, бластицидин S, боскалид, бромуконазол, бупиримате, каптафол, каптан, карбендазим, хлоргидрат карбендазима, карбоксин, карпропамид, карвон,CGA41396, CGA41397, хинометионат, хлороталонил, хлорозолинат, клозилакон, медьсодержащие соединения, такие как оксихлорид меди, оксихинолят меди, сульфат меди, таллат меди и бордосская жидкость, циклофенамид, цимоксанил, ципроконазол, ципродинил, дебакарб, 1,1'-диоксид ди-2 пиридилдисульфида, дихлорфлуанид, дикломезин, диклоран, диэтофенкарб, дифеноконазол, дифензокат,дифлуметорим, О,О-ди-изопропил-S-бензилтиофосфат, димефлуазол, диметконазол, диметоморф, диметиримол, диниконазол, динокап, дитианон, додецил диметил аммония хлорид, додеморф, додин, догуадин, эдифенфос, эпоксиконазол, этиримол, этил-(Z)-N-бензил-N-([метил(метил-тиоэтилиденаминооксикарбонил)амино]тио)аланинат, этридиазол, фамоксадон, фенамидон (RPA407213), фенаримол,фенбуконазол, фенфурам, фенгексамид (KBR2738), фенпиклонил, фенпропидин, фенпропиморф, ацетат фентина, гидроксид фентина, фербам, феримзон, флуазинам, флудиоксонил, флуметовер, флуопирам,флуоксастробин, флуороимид, флуквинконазол, флузилазол, флутоланил, флутриафол, флуксапироксад,фолпет, фуберидазол, фуралаксил, фураметпир, гуазатин, гексаконазол, гидроксиизоксазол, гимексазол,имазалил, имибенконазол, иминоктадин, иминоктадин триацетат, ипконазол, ипробенфос, ипродион,ипроваликарб (SZX0722), изопропанилбутилкарбамат, изопротиолан, касугамицин, крезоксим-метил,LY186054, LY211795, LY248908, манкозеб, мандипропамид, манеб, мефеноксам, металаксил, мепанипирим, мепронил, металаксил, метконазол, метирам, метирам-цинк, метоминостробин, миклобутанил, неоазозин, диметилдитиокарбамат никеля, нитротал-изопропил, нуаримол, офурас, ртутьорганические со- 18020755 Соединения формулы (I) можно смешивать с почвой, торфом и другой корневой средой для защиты растений от грибковых заболеваний, поражающих семена, почву или листья. Примеры применимых синергистов для применения в композициях включают бутоксид пиперонила, сезамекс, сафроксан и додецилимидазол. Выбор гербицидов и регуляторов роста растений для включения в композиции будут зависеть от предполагаемого назначения и требуемого эффекта. Примером гербицида, селективного в отношении риса, который может быть включен в композицию, является пропанил. Примером регулятора роста растений для использования на хлопке являетсяPIX. Некоторые смеси могут содержать действующие вещества с существенно различающимися физическими, химическими или биологическими характеристиками, в связи с чем их непросто привести к одинаковому традиционному типу препаративной формы. В таких случаях можно приготовить другие типы препаративных форм этих веществ. Например, в случае, если одно действующее вещество является водорастворимым твердым веществом, а другое - нерастворимой в воде жидкостью, все же представляется возможным диспергировать каждое из них в аналогичной постоянной водяной фазе путем диспергирования твердого действующего вещества в виде суспензии (методом, аналогичным приготовлению КС), а жидкий активный ингредиент - в виде эмульсии (методом, аналогичным приготовлению ЭВ). Полученная композиция является препаративной формой суспоимульсии (СЭ). Приведенные ниже примеры являются иллюстрацией к настоящему изобретению, но не ограничивают его. Примеры приготовления В этом разделе были использованы следующие сокращения: s = синглет; bs = широкий синглет; d = дублет; dd = двойной дублет; dt = двойной триплет, t = триплет, tt = тройной триплет, q = квартет, sept = септет; m = мультиплет; Me = метил; Et = этил; Pr = пропил; Bu = бутил; М.р. = температура плавления;RT = продолжительность отстаивания, [М+Н]+ = молекулярный вес молекулярного катиона, [М-Н]- = молекулярный вес молекулярного аниона. Для характеристики соединений были использованы следующие методы ЖХ/МС (жидкостной хроматографии с масс-спектрометрией): Метод А В раствор 4-бром-3-метилбензонитрил (коммерческий продукт) (15 г) в диэтиловом эфире (150 мл) в аргоновой атмосфере добавлен раствор алюмогидрида лития (1 М) (150 мл) при комнатной температуре. Реакционную смесь перемешивали при температуре 40 С в течение 2 ч. Затем реакционную смесь охлаждали до 0 С, реакцию гасили последовательным добавлением воды (10,5 мл), водного раствора гидроксида натрия (20% в весовом отношении) (7,5 мл) и воды (37,5 мл). Фазы разделяли. Органическую фазу фильтровали через заглушку из силикагеля; отфильтрованный материал концентрировали до получения 4-бром-3-метилбензиламина (15,11 г) в виде желтого масла. 1H-NMR (400 МГц, CDCl3): 7,47 (d,1H), 7,19 (s, 1 Н), 6,98 (d, 1 Н), 3,80 (s, 2 Н), 2,39 (s, 3H) ppm. Пример I2. Получение N-(4-бром-3-метилбензил)формамида В раствор 4-бром-3-метилбензиламина (15,11 г) (пример I1) в этилформиате (150 мл) добавляли триэтиламин (1,5 мл) при комнатной температуре. Реакционную смесь перемешивали при температуре кипения в течение 16 ч. Реакционная смесь концентрировалась, остаток растирался с диизопропиловым эфиром (1:1) (100 мл) для получения N-(4-бром-3-метилбензил)формамид (14,04 г) как белого твердого вещества. 1H-NMR (400 МГц, CDCl3): 8,28 (s, 1H), 7,49 (m, 1H), 7,16 (s, 1H), 6,97 (m, 1H), 5,85 (s, 1H),4,42 (m, 2H), 2,39 (s, 3H) ppm. В раствор N-(4-бром-3-метилбензила)формамида (4,3 г) (пример I2) в дихлорметане (70 мл) добавляли раствор оксилфлорида фосфора (2,8 г) в дихлорметане (15 мл) при 0-5 С. Реакционную смесь смешивали при комнатной температуре в течение 16 ч. Реакционную смесь вылили в смесь воды и льда (400 мл) с добавлением водного раствора бикарбоната натрия (насыщенного) (100 мл) и этилацетата (250 мл). Фазы разделялись, органическую фазу промывали рассолом, высушивали над сульфатом натрия и упаривали для получения 1-бром-4-изоцианометил-2-метилбензин (4,52 г) в виде коричневого масла. 1H-NMR Смесь 1,3-дихлор-5-(1-трифторметилвинил)бензола (8,03 г) (полученного в соответствии с описанием в ЕР 1731512), 1-бром-4-изоцианометил-2-метилбензола (пример I3) (4,16 г) и оксида меди(I) (0,13 г) в толуоле (50 мл) перемешивали при температуре 110 С в течение 16 ч. Реакционную смесь упаривали, а остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат/гептан) для получения 2-(4-бром-3-метилфенил)-4-(3,5-дихлорфенил)-4-трифторметил-3,4-дигидро-2H-пиррола (2,39 г). 1(m, 1H) ppm. Пример I5. Получение 4-[4-(3,5-дихлорфенил)-4-трифторметил-3,4-дигидро-2H-пиррол-2-ил]-2 метилбензойной кислоты этил эфира(пример I4) (7,0 г) в смеси этанола (60 мл) и диметилформамида (20 мл), добавляли продукт присоединения дихлор 1,1'-бис-(дифенилфосфин)ферроцен палладия(II) дихлорметана ("Pd(dppf)Cl2") (0,8 г) и ацетат натрия (1,4 г) при комнатной температуре. Реакционную смесь перемешивали в реакторе для создания давления в атмосфере монооксида углерода (6 бар) при 85 С в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, этанол испаряли с добавлением водного раствора гидрокарбоната натрия (насыщенного) (200 мл) и этилацетата (250 мл). Фазы разделяли, органическую фазу высушивали над сульфатом натрия и упаривали. Остаток очищали с помощью хроматографии на силикагеле (элюент: градиент 0-4% в объемном отношении метанола в дихлорметане) для получения 4-[4-(3,5-дихлорфенил)4-трифторметил-3,4-дигидро-2H-пиррол-2-ил]-2-метилбензойной кислоты этил эфира (2,8 г). 1H-NMR В раствор 4-[4-(3,5-дихлорфенил)-4-трифторметил-3,4-дигидро-2H-пиррол-2-ил]-2-метилбензойной кислоты этил эфира (пример I5) (2,8 г) в этаноле (40 мл) добавляли раствор гидроксида натрия (0,51 г) в воде (15 мл). Реакционную смесь перемешивали при температуре кипения в течение 1 ч. После охлаждения до температуры окружающей среды добавили водный раствор хлористого водорода (1 М) (20 мл),воду (150 мл) и этилацетат (200 мл). Фазы разделяли, органическую фазу промывали соляным раствором,высушивали над сульфатом натрия и упаривали. Осадок повторно кристаллизовали из эфира диизопропила для получения 4-[4-(3,5-дихлорфенил)-4-трифторметил-4,5-дигидро-3H-пиррол-2-ил]-2 метилбензойной кислоты (2,02 г) в виде белого твердого вещества. 1H-NMR (d6-DMSO, 400 МГц): 13,07 Пример I7. Получение метил эфира 2-метил-N-триметилсиланилметилтерефталамовой кислоты В раствор 2-метилтерефталевой кислоты 1-метилэфир (получение см. в WO 2000/021920) (1,43 г) в дихлорметане (10 мл) добавили N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорид (1,84 г),N,N-диметиламинопиридин (0,41 г) и триметилсилилметиламин (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь упаривали, а остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат/гептан 1:3) для получения сложного метилового эфира 2-метил-N-триметилсиланилметил-терефталамовой кислоты (1,85 г). 1H-NMR (400 МГц, CDCl3): 7,72 (d, 1H), 7,45 (s, 1H), 7,40 (d, 1H), 5,85 (s, 1H), 3,78 (s, 3H), 2,84 (d, 2H), 2,49 (s, 3H), 0,00 (s, 9H) ppm. Эфир трет бутила 2-метил-N-триметилсиланилметил-терефталамовой кислоты был получен с помощью сходной процедуры. 1H-NMR (400 МГц, CDCl3): 7,82 (d, 1H), 7,48 (s, 1H), 7,39 (d, 1H), 5,70 (s, 1H), 2,82(d, 2H), 2,48 (s, 3H), 1,48 (s, 9H), 0,00 (s, 9H) ppm. Пример I8. Получение эфира метила 2-метил-4-(триметилсиланилметилтиокарбамоил)бензойной кислоты В раствор эфира метила 2-метил-N-триметилсиланилметил-тиерефталамовой кислоты (пример I7)(реагент Лоуссона) (2,65 г). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, а затем при температуре 110 С в течение 1,5 ч. Реакционную смесь упаривали, а остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат/гептан 1:5) для получения метилового эфира 2-метил-4-(триметилсиланилметил-тиокарбомоил)бензойной кислоты (1,85 г). 1H-NMR (400 МГц,CDCl3): 7,75-7,20 (m, 3H), 3,70 (s, 3H), 3,35 (m, 2H), 2,45 (s, 3H), 0,00 (s, 9H) ppm. Эфир трет бутила 2 метил-4-(триметилсиланилметил-тиокарбомоил)бензойной кислоты был получен с помощью сходной процедуры. 1H-NMR (400 МГц, CDCl3): 7,62 (d, 1H), 7,40 (s, br, 1H), 7,35 (s, 1H), 7,25 (d, 1H), 3,35 (d, 2H),2,40 (s, 3H), 1,40 (s, 9H), 0,00 (s, 9H) ppm. Пример I9. Получение эфира метила 2-метил-4-([метилсульфанил-триметилсиланилметилимино]метил)бензойной кислоты В раствор метилового эфира 2-метил-4-(триметилсиланилметил-тиокарбомоил)бензойной кислоты(пример I8) (200 мг) в ацетонитриле (4 мл) добавляли карбонат калия (140 мг) и йодистый метил (120 мг). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. В реакционную смесь добавляли воду и ацетат метила. Фазы разделяли, органическую фазу промывали соляным раствором,высушивали над сульфатом натрия и упаривали. Остаток очищали с помощью хроматографии на силикагеле(элюент: этилацетат/гептан 1:5) для получения метилового эфира 2-метил-4([метилсульфанил/триметилсиланилметилимино]метил)бензойной кислоты (124 мг). 1H-NMR (400 МГц,CDCl3): 7,82-7,20 (m, 3H), 3,80 (s, 3H), 3,50 (m, 2H), 2,50 (s, 3H), 1,92 (s, 3H), 0,00 (s, 9H) ppm. Эфир трет бутила 2-метил-4-метилсульфанил-[(Е)-триметилсиланилметилимино]метилбензойной кислоты был получен с помощью сходной процедуры. 1H-NMR (400 МГц, CDCl3): 7,62 (d, 1H), 7,23-7,20(m, 2H), 3,03 (m, 2H), 2,48 (s, 3H), 1,95 (s, 3H), 1,45 (s, 9H), 0,00 (s, 9H) ppm. Пример I10. Получение метилового эфира 4-[4-(3,5-бис-трифторметилфенил)-4-трифторметил-3,4 дигидро-2 Н-пиррол-2-ил]-2-метилбензойной кислоты В раствор метилового эфира 2-метил-4-метилсульфанил-[(Е)-триметилсиланилметилимино]метилбензойной кислоты (пример I9) (135 мг) и 1,3-бис-трифторметил-5-(1 трифторметилвинил)бензола (см. WO 2007125984) (179 мг) в THF (5 мл) добавили при температуре 5 С фторид тетрабутиламмония (TBAF) (0,11 мл, 1 М в THF). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь фильтровали через двуокись кремния, а затем упаривали. Осадок очищали с помощью подготовленного HPLC для получения метилового эфира 4-[4-(3,5 бис-трифторметилфенил)-4-трифторметил-3,4-дигидро-2 Н-пиррол-2-ил]-2-метилбензойной кислоты (124 мг). 1H-NMR (400 МГц, CDCl3): 8,60-7,70 (m, 6 Н), 5,03 (d, 1 Н), 4,52 (d, 1H), 3,98-3,90 (m, 4H), 3,55-3,40(m, 1H), 2,68 (s, 3H) ppm. Метиловый эфир 2-метил-4-[4-(3,4,5-трихлорофенил)-4-трифторметил-4,5-дигидро-3H-пиррол-2 ил]бензойной кислоты был получен с помощью сходной процедуры. 1H-NMR (400 МГц, CDCl3): 8,0-7,42 В раствор метилового эфира 2-метил-4-(метилсульфанил/триметилсиланилметилимино]метил)бензойной кислоты (пример I10) (115 мг) в THF (4 мл) и воде (2 мл) добавляли моногидрат гидроксида лития (24 мг). Реакционную смесь перемешивали при температуре 50 С в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой, окисляли добавлением водного раствора хлористого водорода (1 М) и экстрагировали дважды этилацетатом. Объединенные органические фазы промывали рассолом, высушивали над сульфатом натрия и упаривали для получения 4-[4-(3,5-бис-трифторметилфенил)-4-трифторметил-4,5-дигидро-3H-пиррол-2-ил]-2-метилбензойной кислоты (109 мг). 1H-NMR (400 МГц, CDCl3): 8,15-7,72 (m, 6 Н), 5,05 (d, 1H), 4,55 (d, 1H), 3,95 (d, 1H), 3,55(d, 1H), 2,70 (s, 3H) ppm. 2-Метил-4-[4-(3,4,5-трихлорофенил)-4-трифторметил-4,5-дигидро-3H-пиррол-2-ил]бензойная кислота была получен с помощью сходной процедуры. 1H-NMR (400 МГц, CDCl3): 7,95-7,55 (m, 5H), 4,76(5,29 г),N,Nдиметиламинопиридин (1,19 г) и триметилсилилметиламин (2,85 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. В реакционную смесь добавляли воду и дихлорметан. Фазы разделяли, органическую фазу промывали соляным раствором, высушивали над сульфатом натрия и фильтровали через силикагель. Реакционную смесь упаривали для получения 4-бром-3-хлор-Nтриметилсиланилметил-бензамида (4,87 г). 1H-NMR (400 МГц, CDCl3): 7,68 (d, 1H), 7,55 (s, 1H), 7,33 (d,1H), 5,85 (s, 1H), 2,84 (d, 2H), 0,00 (s, 9H) ppm. Пример I13. Получение 4-бром-3-хлор-N-триметилсиланилметилтиобензамида В раствор 4-бром-3-хлор-N-триметилсиланилметилбензамида (пример I12) (4,6 г) в толуоле (150 мл) добавили 2,4-бис-(4-метоксифенил)-1,3,2,4-дитиадифосфетан 2,4-дисульфид (реагент Лоуссона) (5,8 г). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, а затем при температуре 110 С в течение 1,5 ч. Реакционную смесь упаривали, а остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат/гептан 1:5) для получения 4-бром-3-хлор-Nтриметилсиланилметил-тиобензамида (4,64 г). 1H-NMR (400 МГц, CDCl3): 7,60 (d, 1H), 7,45 (s, 1H), 7, 30(s, 1H), 7,25 (d, 1H), 3,33 (d, 2H), 0,00 (s, 9H) ppm. Пример I14. Получение метилового эфира 4-бром-3-хлор-N-триметилсиланилметилтиобензимидной кислоты(80 мл) добавляли карбонат калия (2,73 г) и йодистый метил (1,02 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь упаривали, а остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат/гептан 1:5) для получения метилового эфира В раствор метилового эфира 4-бром-3-хлор-N-триметилсиланилметил-тиобензимидной кислоты(25 мл) добавили при -5 С тригидрат фторида тетрабутиламмония (TBAF) (0,41 г), растворенный в THF(15 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь упаривали, а остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат/гептан 1:6) для получения 5-(4-бром-3-хлорфенил)-3-(3,5-дихлорфенил)-3-метил-3,4-дигидро-2 Нпиррола (2,50 г). 1H-NMR (400 МГц, CDCl3): 7,95-7,25 (m, 6 Н), 4,88 (d, 1H), 4,42 (d, 1H), 3,75 (d, 1H), 3,40(d, 1H) ppm. Пример I16. Получение эфира бутила 2-хлор-4-[4-(3,5-дихлорфенил)-4-трифторметил-4,5-дигидро 3H-пиррол-2-ил]бензойной кислотыCataxium A (68 мг) и ацетат палладия (13 мг) растворили в бутаноле (30 мл) в аргонной атмосфере. Диамин тетраметилена (0,29 мл) и 5-(4-бром-3-хлорфенил)-3-(3,5-дихлорфенил)-3-метил-3,4-дигидро 2 Н-пиррол (1,11 г) были добавлены при комнатной температуре. Реакционную смесь перемешивали в реакторе для создания давления в атмосфере монооксида углерода (6 бар) при 115 С в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали и добавили этилацетат (250 мл). Смесь промывали водой (50 мл), рассолом (50 мл), высушивали над безводным сульфатом натрия, фильтровали через тонкий слой двуокиси кремния и упаривали. Остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат/гептан 1:4) для получения эфира бутила 2-хлор-4-[4-(3,5 дихлорфенил)-4-трифторметил-4,5-дигидро-3H-пиррол-2-ил]бензойной кислоты (0,49 гр). 1H-NMR (400 МГц, CDCl3): 7,95-7,25 (m, 6 Н), 4,92 (d, 1H), 4,45 (d, 1H), 4,37 (t, 2H), 3,78 (d, 1H), 3,45 (d, 1H), 1,75 (m,2H), 1,50 (m, 2H), 0,95 (t, 3H) ppm. Пример В раствор бутилового эфира 2-хлор-4-[4-(3,5-дихлорфенил)-4-трифторметил-4,5-дигидро-3Hпиррол-2-ил]бензойной кислоты (пример I16) (0,48 мг) в THF (16 мл) и воде (8 мл) добавляли моногидрат гидроксида лития (103 мг). Реакционную смесь перемешивали при температуре 50 С в течение 20 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой, окисляли добавлением водного раствора хлористого водорода (1 М) и экстрагировали дважды этилацетатом. Объединенные органические фазы промывали рассолом, высушивали над сульфатом натрия и упаривали для получения 2-хлор-4-[4-(3,5-дихлорфенил)-4-трифторметил-4,5-дигидро-3H-пиррол-2-ил]бензойной кислоты (459 мг). 1H-NMR (400 МГц, CDCl3): 8,15-7,40 (m, 6H), 4,95 (d, 1H), 4,30 (d, 1H), 3,85 (d, 1H), 3,35 (d, 1H) ppm. Пример но]метилбензойной кислоты (см. пример I9) (118 мг) в дихлорметане (15 мл) добавили трифторуксусную кислоту (0,22 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Добавили дополнительное количество трифторуксусной кислоты (0,11 мл) и смесь перемешивали в течение следующих 3 ч при комнатной температуре. Добавили воду, смесь экстрагировали дважды дихлорметаном. Объединенные органические фазы промывали рассолом, высушивали над сульфатом натрия и упаривали для получения 2-метил-4-метилсульфанил-[(2)-триметилсиланил метилимино]метилбензойной кислоты, которая использовалась без дополнительного очищения на следующем шаге. ЖХ/МС (метод A): RT (мин): = 1,32, [М+Н]+ = 296. ПримерI19. Получение метилового эфира 3-метил-4-(тиетан-3-ил-карбамоил)-Нтриметилсиланилметил-тиобензимидной кислоты(0,248 мл) и 2-бром-1-этилпиридиним тетрафторборат (169 мг). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавили воду, смесь экстрагировали дважды дихлорметаном. Объединенные органические фазы промывали рассолом, высушивали над сульфатом натрия и упаривали. Остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат/гептан 1:3) для получения метилового эфира 3-метил-4-(тиетан-3-ил-карбамоил)-N-триметилсиланилметилтиобензимидной кислоты (16 мг). 1H-NMR (400 МГц, CDCl3): 7,40-7,20 (m, 3H), 6,20 (d, 1H); 5,30 (m, 1H),3,55 (s, 2H), 3,35 (m, 2H), 3,25 (m, 2H), 2,35 (s, 3H), 1,95 (s, 3H), 0,00 (s, 9H) ppm. ЖХ/МС (метод A): RT В раствор метилового эфира 3-метил-4-(тиетан-3-ил-карбамоил)-N-триметилсиланилметилтиобензимидной кислоты (пример I19) (16 мг) и 1,3-дихлор-5-(1-трифторметилвинил)бензола (см. WO 2007/125984) (12 мг) в THF (2 мл) добавили при -5 С тригидрат фторида тетрабутиламмония (TBAF)(0,41 г), растворенный в THF (1,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Добавили воду, смесь экстрагировали дважды этилацетатом. Объединенные органические фазы промывали рассолом, высушивали над сульфатом натрия и упаривали. Остаток очищали с помощью хроматографии на силикагеле (элюент: этилацетат/гептан 1:2) для получения 4-[4-(3,5 дихлорфенил)-4-трифторметил-4,5-дигидро-3H-пиррол-2-ил]-2-метил-N-тиетан-3-ил-бензамида (20 мг). 1(общая процедура получения описана в WO 2009/080250) (100 мг) в DMF (1 мл) нитрометана (0,011 мл) и 1 М гидроксида натрия (0,211 мл) добавили при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Добавили воду, смесь экстрагировали дважды этилацетатом. Объединенные органические фазы промывали соленым раствором, высушивали над сульфатом натрия и упаривали. Осадок очищали подготовленным HPLC для получения 4-[3-(3,5-дихлорфенил)4,4,4-трифтор-3-нитрометилбутирил]-2-метил-N-тиетан-3-ил-бензамида (78 мг). 1H-NMR (400 МГц,CDCl3): 7,85-7,20 (m, 6H), 6,25 (d, 1H), 5,62 (d, 1H), 5,45 (m, 2H), 4,15 (d, 1H), 4,00 (d, 1H), 3,58-3,38 (m,4H), 2,55 (s, 3H) ppm. В раствор 4-[3-(3,5-дихлорфенил)-4,4,4-трифтор-3-нитрометилбутирил]-2-метил-N-тиетан-3-илбензамида (пример I21) (78 мг) в DMF (1,5 мл) при комнатной температуре добавили цинковый порошок(48 мг). Реакционную смесь нагревали до 80 С, после чего медленно добавляли концентрированный раствор хлористого водорода (0,3 мл). Реакционную смесь перемешивали при температуре 80 С в течение 4 ч. Добавили воду, смесь экстрагировали дважды этилацетатом. Объединенные органические фазы промывали рассолом, высушивали над сульфатом натрия и упаривали. Осадок очищали подготовленным В раствор подходящей карбоновой кислоты (30 мкмоль), например 4-[4-(3,5-дихлорфенил)-4 трифторметил-4,5-дигидро-3H-пиррол-2-ил]-2-метилбензойной кислоты (пример I6) в случае соединенияА 1 из табл. А, в диметилацетамиде (0,4 мл) добавили последовательно раствор амина формулыHNR1R2 (36 мкмоль), например 1,1-диоксотиетан-3-иламин (получение описано, например, в WO 2007/080131) в случае соединенияА 1 из табл. А, в диметилацетамиде (0,145 мл), диизопропилэтиламин ("основание Хунига") (0,02 мл, 100 мкмоль), и раствор бис-(2-оксо-3-оксазолидинил)фосфиновый хлорид ("BOP-Cl") (15,3 мг) в диметилацетамиде (0,2 мл). Реакционную смесь перемешивали при температуре 100 С в течение 16 ч. Затем реакционную смесь разбавили ацетонитрилом (0,6 мл) и образец использовали для анализа ЖХ/МС. Оставшуюся смесь снова разбавили ацетонитрилом/диметилформамидом (4:1) (0,8 мл) и очистили с помощью HPLC. Этот метод использовали для параллельного приготовления ряда соединений (соединения А 1-А 4 в табл. А). Соединения А 5-А 10, с В 1 по В 4 и с С 1 по С были получены с использованием сходной процедуры. В табл. А указаны соединения формулы (Ia), где G обозначает кислород, R3 обозначает трифторметил, R4 обозначает 3,5-дихлорфенил-, R5 обозначает метил, a R1 и R2 имеют значения, указанные в таблице ниже. Таблица А В табл. В указаны соединения формулы (Ia), где G обозначает кислород, R1 обозначает водород, R5 обозначает метил, R3 обозначает трифторметил, a R2 и R4 имеют значения, указанные в таблице ниже. В табл. С указаны соединения формулы (Ia), где G обозначает кислород, R1 обозначает водород, R4 обозначает 3,5-дихлорфенил-, a R2, R3 и R5 имеют значения, указанные в таблице ниже. Таблица С В табл. D указаны соединения формулы (Ib), где G обозначает кислород, R3 обозначает трифторметил, R4 обозначает 3,5-дихлорфенил-, a R1 и R2 имеют значения, указанные в таблице ниже. Таблица D Биологические примеры. Настоящий пример иллюстрирует инсектицидные и акарицидные свойства соединений формулыSpodoptera littoralis (египетская хлопковая совка). Листья хлопка помещали на агар в 24-луночный титрационный микропланшет и опрыскивали испытуемыми растворами при норме внесения 200 ppm. После высушивания листья заражали 5 личинками первого личиночного возраста (L1). Через 3 дня после обработки (DAT) образцы проверяли на смертность, пищевое поведение и регуляцию роста. Эффективность представленных ниже соединений в борьбе со Spodoptera littoralis составила не менее 80%: А 1, А 2, A3, А 4, А 5, А 6, А 7, А 8, А 9, А 10, В 1, В 2, В 3, В 4, В 5, В 6, С 1, С 2, C3, D1, D2, D3.Heliothis virescens (табачная листовертка). Яйца (возрастом 0-24 ч) помещали в 24-луночный титрационный микропланшет на искусственную питательную среду и обрабатывали испытуемыми растворами при норме внесения 200 ppm (концентрация в лунке 18 ppm) путем отмеривания пипеткой. По окончании инкубационного периода в 4 дня образцы проверяли на смертность яиц, смертность личинок и регуляцию роста. Эффективность представленных ниже соединений в борьбе с Heliothis virescens составила не менее 80%: А 1, А 2, A3, А 4, А 5, А 6, А 7, А 8, А 9, А 10, В 1, В 2, B3, В 4, В 5, B6, C1, C2, C3, D1, D2, D3.Plutella xylostella (капустная серпокрылая моль). 24-луночный титрационный микропланшет (МТР) с искусственной питательной средой обрабатывали испытуемыми растворами при норме внесения 200 ppm (концентрация в лунке 18 ppm) путем отмеривания пипеткой. После высушивания МТР заражали личинками второго личиночного возраста (L2) (712 личинок на лунку). По окончании инкубационного периода в 6 дней образцы проверяли на смертность личинок и регуляцию роста. Эффективность представленных ниже соединений в борьбе с Plutella xylostella составила не менее 80%: А 1, А 2, A3, А 4, А 5, А 6, А 7, А 8, А 9, А 10, В 1, В 2, B3, В 4, В 5, B6, C1, C2, C3, D1, D2, D3.Diabrotica balteata (кукурузная корневая гусеница). 24-луночный титрационный микропланшет (МТР) с искусственной питательной средой обрабатывали испытуемыми растворами при норме внесения 200 ppm (концентрация в лунке 18 ppm) путем отмеривания пипеткой. После высушивания МТР заражали личинками второго личиночного возраста (L2) (610 личинок на лунку). По окончании инкубационного периода в 5 дней образцы проверяли на смертность личинок и регуляцию роста. Эффективность представленных ниже соединений в борьбе с Diabrotica balteata составила не менее 80%: А 1, А 2, A3, А 4, А 5, А 6, А 7, А 8, А 9, А 10, В 1, В 2, B3, В 4, В 5, B6, C1, C2, C3, D1, D2, D3.Thrips tabaci (табачный трипс). Листья подсолнуха помещали на агар в 24-луночный титрационный микропланшет и опрыскивали испытуемыми растворами при норме внесения 200 ppm. После высушивания листья заражали популяцией тли смешанного возраста. По окончании инкубационного периода в 7 дней образцы проверяли на смертность. Эффективность представленных ниже соединений в борьбе с Thrips tabaci составила не менее 80%: А 1, А 2, A3, А 4, А 5, А 6, А 7, А 8, А 9, А 10, В 1, В 2, B3, В 4, В 5, В 6, C1, C2, C3, D1, D2, D3.Tetranychus urticae (клещик паутинный двупятнистый). Листья фасоли помещали на агар в 24-луночный титрационный микропланшет и опрыскивали испытуемыми растворами при норме внесения 200 ppm. После высушивания листья заражали популяциями клещей смешанного возраста. Через 8 дней диски проверяли на смертность яиц, смертность личинок и смертность взрослых особей. Эффективность представленных ниже соединений в борьбе с Tetranychus urticae составила не менее 80%: А 1, А 2, A3, А 4, А 5, А 6, А 7, А 8, А 9, А 10, В 1, В 2, B3, В 4, В 5, B6, C1, C2, C3, D1, D2, D3. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) где А 1, А 2, А 3 и А 4, независимо друг от друга, обозначают С-Н или C-R5;R2 обозначает группу формулы (II) где L обозначает одинарную связь или С 1-С 6 алкилен иY1, Y2 и Y3, независимо друг от друга, обозначают CR8R9, C=N-OR10, S, SO или SO2 при условии,что по крайней мере один из Y1, Y2 или Y3 не является CR8R9 или C=N-OR10;R4 обозначает арил, замещенный 1-5 R7, или гетероарил, замещенный 1-5 R7; каждый R5, независимо от других, обозначает галоген, С 1-С 8 алкил, С 1-С 8 галоалкил или С 1-С 8 алкенил, или два R5 на смежных атомах углерода совместно образуют мост -СН=СН-СН=СН-;R6 обозначает водород или С 1-С 8 алкил; каждый R7, независимо от других, обозначает галоген, циано, С 1-С 8 алкил, C1-С 8 галоалкил или С 1-С 8 алкокси-; каждый R8 и R9, независимо от других, обозначает водород, галоген, С 1-С 8 алкил или С 1-С 8 галоалкил; каждый R10, независимо от других, обозначает водород, С 1-С 8 алкил, С 1-С 8 галоалкил,арил-С 1-С 4 алкилен- или арил-С 1-С 4 алкилен-, где фрагмент арила заменен 1-3 R12;
МПК / Метки
МПК: C07D 417/14, C07D 403/04, C07D 413/12, C07D 413/14, A01N 43/40, C07D 207/20, C07D 401/04, C07D 409/12, A01N 43/80, A01N 43/36, C07D 409/14
Метки: соединения, инсектицидные
Код ссылки
<a href="https://eas.patents.su/30-20755-insekticidnye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Инсектицидные соединения</a>
Предыдущий патент: Абсорбент и способ для удаления кислого газа из потока текучей среды
Следующий патент: Новые формы полициклического соединения
Случайный патент: Антивирусные соединения