Инсектицидные соединения
Номер патента: 16685
Опубликовано: 30.06.2012
Авторы: Цамбах Вернер, Лутц Уилльям, Майенфиш Петер, Жанг Пьер, Штоллер Андре, Годфри Кристофер Ричард Эйлес
Формула / Реферат
1. Соединение формулы (I)
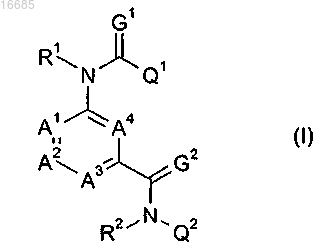
где A1, A2, A3 и А4, независимо один от другого, означают C-H, C-CN, CF, C-OMe или азот, при условии, что по меньшей мере один из А1, A2, A3 и А4 означает C-H, C-CN, CF, C-OMe и не более чем два из А1, A2, A3 и А4 означают азот;
R1 означает H, метил, аллил, этил;
R2 означает H, аллил, пропаргил;
G1 и G2 оба означают кислород;
Q1 означает фенил, необязательно замещенный от одного до пяти заместителями, выбранными из галогена, нитро, циано, метила, метокси, трифторметила, трифторметокси, диметиламино, метилтио, метоксикарбонила, этила, метилсульфонила, метилсульфинила, или нафтален, необязательно замещенный от одного до пяти заместителями, выбранными из циано, или гетероарил, выбранный из фурана, пиридина, пиридиноксида, тиофена, пиразола, тиадиазола, изоксазола, тиазола, индазола, пиразина, необязательно замещенных одним двумя заместителями, выбранными из галогена, метила, тиометила, трифторметила, нитро, метилкарбонила; и
Q2 означает фенил формулы (II)
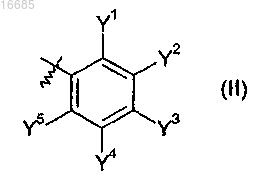
где Y1 и Y5 означают метил, этил, галоген, метоксиметил, трифторметил, трифторметилтио, трифторметилсульфанил, метилтио, метилсульфинил, трифторметилсульфонил;
Y3 означает н-С3-С6перфторалкил;
Y2 и Y4 означают водород, метил, фтор;
или его соль или N-оксид.
2. Соединение по п.1, где Y3 означает гептафторпроп-2-ил или нонафторбут-2-ил.
3. Соединение по п.1 или 2, где A1 означает C-H, C-CN, CF, C-OMe или азот.
4. Соединение по пп.1-3, где A2 означает C-H, C-CN, CF, C-OMe или азот.
5. Соединение по любому из пп.1-4, где А3 означает C-H, C-CN, CF, C-OMe или азот.
6. Соединение по любому из пп.1-5, где А4 означает C-H, C-CN, CF, C-OMe или азот.
7. Соединение по любому из пп.1-6, где один, два или три из А1, A2, A3 и А4 означает C-H, C-CN, CF, C-OMe, и не более чем два из A1, A2, A3 и A4 означает азот.
8. Соединение формулы (XIII)
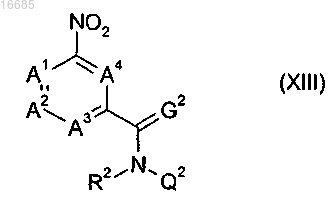
где A1, A2, A3, A4, R2, G2 и Q2 имеют значения, как определено в п.1;
или его соль или N-оксид.
9. Соединение формулы (IX')

где A1, A2, A3, A4, R2, G2 и Q2 имеют значения, как определено в п.1; или его соль или N-оксид.
10. Соединение формулы (IX)
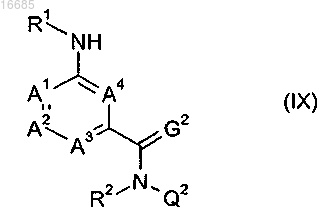
где A1, A2, A3, A4, R1, R2, G2 и Q2 имеют значения, как определено в п.1; или его соль или N-оксид.
11. Соединение формулы (XI)
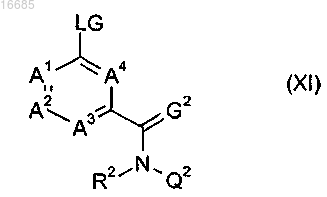
где A1, A2, A3, A4, R2, G2 и Q2 имеют значения, как определено в п.1, и LG представляет собой уходящую группу; или его соль или N-оксид.
12. Способ борьбы и контроля насекомых, клещей, нематод или моллюсков, включающий нанесение на вредителя, местоположение вредителя или растение, способное подвергаться нападению вредителей, инсектицидно, акарицидно, нематицидно или моллюскоцидно эффективного количества соединения формулы (I), как определено по любому из пп.1-7.
13. Инсектицидная, акарицидная или нематицидная композиция, включающая инсектицидно, акарицидно или нематицидно эффективное количество соединения формулы (I), как определено по любому из пп.1-7 в качестве активного ингредиента.
Текст
Изобретение относится к соединению формулы (I), где A1, A2, A3, A4, R1, R2, G1, G2, Q1 и Q2 имеют значения, как определено в п.1; или его соли или N-оксиду. Кроме того, настоящее изобретение относится к способам и промежуточным продуктам для получения соединений формулы(I), к содержащим их инсектицидным, акарицидным, моллюскоцидным или нематицидным композициям и к способам их применения для борьбы и контроля в отношении насекомых, клещей,моллюсков и нематод. Жанг Пьер, Годфри Кристофер Ричард Эйлес, Лутц Уилльям,Майенфиш Петер (CH), Штоллер Андре (FR), Цамбах Вернер (CH) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: СИНДЖЕНТА ПАРТИСИПЕЙШНС АГ (CH) 016685 Изобретение относится к некоторым ароматическим бисамидным производным, способам и промежуточным продуктам для их получения, содержащим их инсектицидным, акарицидным, моллюскоцидным и нематицидным композициям и способам их применения для борьбы и контроля насекомых, клещей, моллюсков и нематод. Ароматические бисамидные производные с инсектицидными свойствами описаны, например, в EP 1714958, JP 2006/306771, WO 06/137376, WO 06/137395 и WO 07/017075. В настоящее время неожиданно было обнаружено, что некоторые ароматические бисамидные производные, имеющие по меньшей мере один циано-, тиоцианато-, аминотиокарбонильный, N-C1 С 4 алкиламинотиокарбонильный или N,N-диС 1-С 4 алкиламинотиокарбонильный заместитель в центральном ароматическом кольце, обладают инсектицидными свойствами. Настоящее изобретение, следовательно, относится к соединению формулы (I) где A1, A2, A3 и A4, независимо один от другого, означают C-H, C-CN, CF, C-OMe или азот, при условии, что по меньшей мере один из A1, A2, A3 и A4 означает C-H, C-CN, CF, C-OMe и не более чем два из A1, A2, A3 и A4 означают азот;Q1 означает фенил, необязательно замещенный от одного до пяти заместителями, выбранными из галогена, нитро, циано, метила, метокси, трифторметила, трифторметокси, диметиламино, метилтио, метоксикарбонила, этила, метилсульфонила, метилсульфинила или нафтален, необязательно замещенный от одного до пяти заместителями, выбранными из циано или гетероарил, выбранный из фурана, пиридина, пиридиноксида, тиофена, пиразола, тиадиазола, изоксазола, тиазола, индазола, пиразина, необязательно замещенных одним двумя заместителями, выбранными из галогена, метила, тиометила, трифторметила, нитро, метилкарбонила; иQ2 означает фенил формулы (II)Y2 и Y4 означают водород, метил, фтор; или его соль или N-оксид. Соединения формулы (I) могут существовать в виде различных геометрических или оптических изомеров или в таутомерных формах. Данное изобретение включает все такие изомеры и таутомеры, и их смеси в любых соотношениях, а также изотопные формы, такие как дейтерированные соединения. Каждый алкильный фрагмент, или отдельно или как часть большей группы (такой как алкокси, алкоксикарбонил, алкилкарбонил, алкиламинокарбонил, диалкиламинокарбонил) имеет линейную или разветвленную цепь и представляет собой, например, метил, этил, н-пропил, н-бутил, изопропил, н-бутил,втор-бутил, изобутил или трет-бутил. Алкильные группы предпочтительно представляют собой C1-C6 алкильные группы, более предпочтительно С 1-С 4 алкильные группы и наиболее предпочтительно C1-C3 алкильные группы. Алкенильные и алкинильные фрагменты (или отдельно или как часть большей группы, такой как алкенилокси или алкинилокси) могут быть в виде линейных или разветвленных цепей, и алкенильные фрагменты, где это соответствует, могут быть или (E) - или (Z)-конфигурации. Примерами являются винил, аллил и пропаргил. Алкенильные и алкинильные группы представляют собой предпочтительно C2 С 6 алкенильные или алкинильные группы, более предпочтительно С 2-С 4 алкенильные или алкинильные группы и наиболее предпочтительно С 2-С 3 алкенильные или алкинильные группы. Галоген означает фтор, хлор, бром или йод. Галогеналкильные группы (или отдельно или как часть большей группы, такой как галогеналкокси или галогеналкилтио) представляют собой алкильные группы, которые замещены одним или несколькими одинаковыми или различными атомами галогена, и означают, например, -CF3, -CF2Cl, -CH2CF3 или-CH2CHF2. Перфторалкильные группы (или отдельно или как часть большей группы, такой как перфторалкилтио) представляют собой отдельный тип галогеналкильной группы; они представляют собой алкильные группы, которые полностью замещены атомами фтора, и означают, например, -CF3, -CF2CF3 или-CF(CF3)2. Галогеналкенильные и галогеналкинильные группы (или отдельно или как часть большей группы,такой как галогеналкенилокси или галогеналкинилокси) представляют собой алкенильные и алкинильные группы, соответственно, которые замещены одним или несколькими одинаковыми или различными атомами галогена, и означают, например, -CH=CF2, -CCl=CClF или -CHClCCH. Циклоалкильные группы могут быть в моно- или бициклической форме и могут быть необязательно замещены одной или несколькими метильными группами. Циклоалкильные группы предпочтительно содержат 3-8 атомов углерода, более предпочтительно 3-6 атомов углерода. Примерами моноциклических циклоалкильных групп являются циклопропил, 1-метилциклопропил, 2-метилциклопропил, циклобутил, циклопентил и циклогексил. Галогенциклоалкильные группы представляют собой циклоалкильные группы, которые замещены одним или несколькими одинаковыми или различными атомами галогена и могут быть необязательно замещены одной или несколькими метильными группами. Примерами моноциклических галогенциклоалкильных групп являются 2,2-дихлорциклопропил, 2,2-дихлор-1-метилциклопропил и 2-хлор-4 фторциклогексил. В контексте настоящего описания термин арил относится к кольцевой системе, которая может быть моно-, би- или трициклической. Примеры таких колец включают фенил, нафталинил, антраценил,инденил или фенантренил. Предпочтительной арильной группой является фенил. Термин "гетероарил" относится к ароматической кольцевой системе, содержащей по меньшей мере один гетероатом и состоящей или из одного кольца или из двух или более конденсированных колец. Предпочтительно одиночные кольца содержат вплоть до трех гетероатомов, и бициклические системы содержат вплоть до четырех гетероатомов, которые, предпочтительно, могут быть выбраны из атомов азота, кислорода и серы. Примеры таких групп включают пиридил, пиридазинил, пиримидинил, пиразинил, фуранил, тиофенил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил,пирролил, пиразолил, имидазолил, триазолил и тетразолил. Предпочтительной гетероарильной группой является пиридин. Примерами бициклических групп являются бензотиофенил, бензимидазолил, бензотиадиазолил, хинолинил, циннолинил и хиноксалинил. Термин "гетероциклил" включает гетероарил и, в дополнение, его ненасыщенные или частично ненасыщенные аналоги, такие как 4,5,6,7-тетрагидробензотиофенил, 9 Н-флуоренил, 3,4-дигидро-2H-бензо 1,4-диоксепинил, 2,3-дигидробензофуранил, пиперидинил, 1,3-диоксоланил, 1,3-диоксанил, 4,5 дигидроизоксазолил, тетрагидрофуранил и морфолинил. Предпочтительно R1 означает водород, метил или этил. Более предпочтительно R1 означает водород или метил. Наиболее предпочтительно R1 означает водород. Предпочтительно R2 означает водород. Предпочтительно Q1 означает фенил, необязательно замещенный от одного до пяти заместителями,выбранными из галогена, нитро, циано, метила, метокси, трифторметила, трифторметокси, диметиламино, метилтио, метоксикарбонила, этила, метилсульфонила, метилсульфинила или нафтален, необязательно замещенный от одного до пяти заместителями, выбранными из циано или Q1 означает гетероарил,выбранный из фурана, пиридина, пиридиноксида, тиофена, пиразола, тиадиазола, изоксазола, тиазола,индазола, пиразина, необязательно замещенных одним двумя заместителями, выбранными из галогена,метила, тиометила, трифторметила, нитро, метилкарбонила. Более предпочтительно Q1 означает фенил, пиридил, фуранил, тиофенил, пиразолил или 1,2,3 тиадиазолил, или фенил, пиридил, фуранил, тиофенил, пиразолил или 1,2,3-тиадиазолил, замещенный одним-чeтырьмя заместителями, независимо выбранными из группы, состоящей из циано, нитро, брома,хлора, фтора, метила, трифторметила, метокси, трифторметокси, метилтио, метилсульфинила, метилсульфонила или фенила. Примерами таких более предпочтительных групп для Q1 являются 5 бромфуран-2-ил, 2-бромфенил, 5-бромпирид-3-ил, 2-хлор-4-фторфенил, 3-хлор-2-фторфенил, 5-хлор-2 фторфенил, 3-хлор-2-метилфенил, 2-хлор-4-нитрофенил, 2-хлор-5-нитрофенил, 2-хлорфенил, 3 хлорфенил, 2-хлорпирид-3-ил, 2-хлорпирид-4-ил, 6-хлорпирид-3-ил, 5-хлортиофен-2-ил, 3-хлор-5 трифторметилпирид-2-ил, 4-циано-2-фторфенил, 4-цианофенил, 2,5-дихлорфенил, 2,3-дифторфенил, 1,3 диметил-1H-пиразол-5-ил, 2-фторфенил, 4-фторфенил, 2-фторпирид-3-ил, 2-фтор-3-трифторметилфенил,2-фтор-5-трифторметилфенил,4-фтор-3-трифторметилфенил,фуран-2-ил,2-метоксифенил,2 метилфенил, 3-метилпирид-2-ил, 4-метил-1,2,3-тиадиазол-5-ил, 4-метилтиофенил, 2-метилтиопирид-3 ил, 4-нитрофенил, фенил, пирид-3-ил, пирид-4-ил, 1,2,3-тиадиазол-4-ил, тиофен-2-ил, 2-трифторметоксифенил, 4-трифторметоксифенил, 2-трифторметилфенил и 4-трифторметилфенил. Еще более предпочтительно Q1 означает фенил, пиридил, фуранил, тиофенил, пиразолил или 1,2,3 тиадиазолил, или фенил, пиридил, фуранил, тиофенил, пиразолил или 1,2,3-тиадиазолил, замещенный одним-тремя заместителями, независимо выбранными из группы, состоящей из циано, нитро, брома,хлора, фтора, метила, трифторметила, метокси, метилтио, метилсульфинила, метилсульфонила.-2 016685 Даже более предпочтительно Q1 означает фенил или пиридил, или фенил или пиридил, замещенный одним-двумя заместителями, независимо выбранными из группы, состоящей из циано, хлора, фтора, метила, трифторметила, метокси, метилтио, метилсульфинила, метилсульфонила. Наиболее предпочтительно Q1 означает фенил, замещенный одним-двумя заместителями, выбранными из хлора, фтора или метила. В одном предпочтительном варианте осуществления Q1 означает 2-хлор-4-фторфенил. В одном предпочтительном варианте осуществления Q1 означает 3-хлор-2-фторфенил. В одном предпочтительном варианте осуществления Q1 означает 5-хлор-2-фторфенил. В одном предпочтительном варианте осуществления Q1 означает 3-хлор-2-метилфенил. В одном предпочтительном варианте осуществления Q1 означает 2-хлорфенил. В одном предпочтительном варианте осуществления Q1 означает 3-хлорфенил. В одном предпочтительном варианте осуществления Q1 означает 4-цианофенил. В одном предпочтительном варианте осуществления Q1 означает 2,5-дихлорфенил. В одном предпочтительном варианте осуществления Q1 означает 2,3-дифторфенил. В одном предпочтительном варианте осуществления Q1 означает 2-фторфенил. В одном предпочтительном варианте осуществления Q1 означает 4-фторфенил. В одном предпочтительном варианте осуществления Q1 означает 2-метилфенил. Предпочтительно Q1 означает фенил или фенил, замещенный одним-четырьмя заместителями, независимо выбранными из группы, состоящей из циано, нитро, брома, хлора, фтора, метила, трифторметила, метокси, трифторметокси, метилтио, метилсульфинила, метилсульфонила. Более предпочтительно Q1 означает фенил или фенил, замещенный одним-тремя заместителями,независимо выбранными из группы, состоящей из циано, нитро, брома, хлора, фтора, метила, трифторметила, метокси, метилтио, метилсульфинила, метилсульфонила. Наиболее предпочтительно Q1 означает фенил или фенил, замещенный одним-двумя заместителями, независимо выбранными из группы, состоящей из циано, хлора, фтора, метила, трифторметила, метокси, метилтио, метилсульфинила, метилсульфонила. Предпочтительно Q1 означает пиридил, фуранил, тиофенил, пиразолил или 1,2,3-тиадиазолил, или пиридил, фуранил, тиофенил, пиразолил или 1,2,3-тиадиазолил, замещенный одним-двумя заместителями, независимо выбранными из группы, состоящей из брома, хлора, фтора, метила, метилтио, трифторметила, нитро. Даже более предпочтительно Q1 означает пиридил или пиридил, замещенный одним-двумя заместителями, независимо выбранными из группы, состоящей из хлора, фтора, метила, трифторметила, метилтио. Наиболее предпочтительно, Q1 означает пиридил, замещенный одним-двумя заместителями, независимо выбранными из хлора, фтора или метила. Предпочтительно Y1 означает циано, галоген, метил, этил, трифторметил или метоксиметил. Более предпочтительно Y1 означает циано, бром, хлор, метил, этил, трифторметил или метоксиметил. Даже более предпочтительно Y1 означает бром, хлор, метил, этил или метоксиметил. Еще более предпочтительно Y1 означает бром, метил или этил. Даже более предпочтительно Y1 означает метил или этил. Наиболее предпочтительно Y1 означает метил. Предпочтительно Y2 означает водород. Предпочтительно Y3 означает гептафторпропил, гептафторпроп-2-ил. В одном варианте осуществления Y3 означает С 2-С 6 перфторалкил, более предпочтительно, Y3 означает гептафторпроп-2-ил или нонафторбут-2-ил. В одном варианте осуществления Y3 означает гептафторпроп-2-ил. В одном варианте осуществления Y3 означает нонафторбут-2-ил. Наиболее предпочтительно Y4 означает водород. Предпочтительно Y5 означает галоген, метил, этил или трифторметил. Более предпочтительно Y5 означает циано, бром, хлор, метил, этил или трифторметил. Даже более предпочтительно Y5 означает бром, хлор, метил или этил. Еще более предпочтительно Y5 означает бром, метил или этил. Даже более предпочтительно Y5 означает метил или этил. Наиболее предпочтительно, Y5 означает метил. Предпочтительный вариант осуществления представляют собой соединения формулы (Ia), где A1 означает C-CN, и A2, A3 и A4 означают CH. Предпочтительный вариант осуществления представляют собой соединения формулы (Ib), где A2 означает C-CN, и A1, A3 и A4 означают CH. Предпочтительный вариант осуществления представляют собой соединения формулы (Ic), где A3 означает C-CN, и A1, A2 и A4 означают CH. Предпочтительный вариант осуществления представляют собой соединения формулы (Id), где A4 означает C-CN, и A1, A2 и A3 означают CH. Предпочтительный вариант осуществления представляют собой соединения формулы (Ie), где A1 означает C-CN, A4 означает C-F, и A2 и A3 означают CH.-3 016685 Предпочтительный вариант осуществления представляют собой соединения формулы (If), где A1 означает C-CN, A2 и A4 означают C-F, и A3 означает CH. В предпочтительном варианте осуществления Q2 означает 2,6-диметил-4-(гептафторпроп-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2-этил-6-метил-4-(гептафторпроп-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2,6-диэтил-4-(гептафторпроп-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2-метоксиметил-6-метил-4(гептафторпроп-2-ил)фенил. В предпочтительном варианте осуществления Q2 означает 2-бром-6-метил-4-(гептафторпроп-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2-бром-6-этил-4-(гептафторпроп-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2,6-дихлор-4-(гептафторпроп-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2,6-дибром-4-(гептафторпроп-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2,6-диметил-4-(нонафторбут-2-ил)фенил. В предпочтительном варианте осуществления Q2 означает 2-этил-6-метил-4-(нонафторбут-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2,6-диэтил-4-(нонфторбут-2-ил)фенил. В предпочтительном варианте осуществления Q2 означает 2-метоксиметил-6-метил-4(нонафторбут-2-ил)фенил. В предпочтительном варианте осуществления Q2 означает 2-бром-6-метил-4-(нонафторбут-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2-бром-6-этил-4-(нонафторбут-2 ил)фенил. В предпочтительном варианте осуществления Q2 означает 2,6-дихлор-4-(нонафторбут-2-ил)фенил. В предпочтительном варианте осуществления Q2 означает 2,6-дибром-4-(нонафторбут-2-ил)фенил. Предпочтительными значениями для Y1 и Y5 являются такие как указано для соединений формулы(I), за исключением того, что Y1 не может означать метоксиметил. Некоторые промежуточные продукты являются новыми и как таковые составляют дальнейший аспект данного изобретения. Одной группой новых промежуточных продуктов являются соединения формулы (XIII): где A1, A2, A3, A4, R2, G2 и Q2 имеют значения, как определено в случае формулы (I); или их соли или N-оксиды. Предпочтительными для A1, A2, A3, A4, R2, G2 и Q2 являются значения, аналогичные предпочтительным значениям, как определено для соответствующих заместителей соединений формулы (I). Другой группой новых промежуточных продуктов являются соединения формулы (IX') где A1, A2, A3, A4, R2, G2 и Q2 имеют значения, как определено в случае формулы (I); или их соли или N-оксиды. Предпочтительными для A1, A2, A3, A4, R2, G2 и Q2 являются значения, аналогичные предпочтительным значениям, как определено для соответствующих заместителей соединений формулы (D). Дальнейшей группой новых промежуточных продуктов являются соединения формулы (IX) где A1, A2, A3, A4, R1, R2, G2 и Q2 имеют значения, как определено в случае формулы (I); или их соли или N-оксиды. Предпочтительными для A1, A2, A3, A4, R1, R2, G2 и Q2 являются значения, аналогичные предпочтительным значениям, как определено для соответствующих заместителей соединений формулы(I). Другой группой новых промежуточных продуктов являются соединения формулы (XI) где A1, A2, A3, A4, R2, G2 и Q2 имеют значения, как определено в случае формулы (I), и LG представляет собой уходящую группу; или их соли или N-оксиды. Предпочтительными для A1, A2, A3, A4, R2, G2 иQ2 являются значения, аналогичные предпочтительным значениям, как определено для соответствующих заместителей соединений формулы (I). Предпочтительно LG означает галоген, более предпочтительно фтор или хлор, наиболее предпочтительно фтор. Соединения в табл. 1-63, приведенных ниже, иллюстрируют соединения согласно данному изобретению. Таблица 1. Табл. 1 включает 38 соединений формулы (Ia), где Q2 означает 2,6-диметил-4(гептафторпроп-2-ил)фенил, и Q1 имеет значения, перечисленные в таблице ниже. Таблица 1-8 016685 Таблица 69. Табл. 69 включает одно соединение формулы (XIIIb), где Q2 означает 2,6-диметил-4(гептафторпроп-2-ил)фенил. Таблица 70. Табл. 70 включает одно соединение формулы (XIIIc), где Q2 означает 2,6-диметил-4(гептафторпроп-2-ил)фенил. Таблица 71. Табл. 71 включает одно соединение формулы (XIIId), где Q2 означает 2,6-диметил-4(гептафторпроп-2-ил)фенил. Таблица 75. Табл. 75 включает одно соединение формулы (IXb), где Q2 означает 2,6-диметил-4(гептафторпроп-2-ил)фенил.-9 016685 Таблица 76. Табл. 76 включает одно соединение формулы (IXc), где Q2 означает 2,6-диметил-4(гептафторпроп-2-ил)фенил. Таблица 77. Табл. 77 включает одно соединение формулы (IXd), где Q2 означает 2,6-диметил-4(гептафторпроп-2-ил)фенил. Соединения согласно данному изобретению можно получить различными способами. 1) Соединения формулы (I), где G1 и G2 означают кислород, можно получить путем обработки соединений формулы (V), где G1 означает кислород, и R означает OH, С 1-С 6 алкокси или Cl, F или Br, амином формулы NHR2Q2. Когда R означает OH, такие реакции обычно осуществляют в присутствии реагента сочетания, такого как DCC (N,N'-дициклогексилкарбодиимид), EDC (гидрохлорид 1-этил-3-[3-диметиламинопропил] карбодиимида) или BOP-Cl (бис(2-оксо-3-оксазолидинил)фосфонохлорид), в присутствии основания,такого как пиридин, триэтиламин, 4-(диметиламино)пиридин или диизопропилэтиламин, и, необязательно, в присутствии нуклеофильного катализатора, такого как гидроксибензотриазол. Когда R означает Cl,такие реакции обычно осуществляют в щелочных условиях (например, в присутствии пиридина, триэтиламина, 4-(диметиламино)пиридина или диизопропилэтиламина), необязательно, в присутствии нуклеофильного катализатора. Альтернативно, можно проводить реакцию в двухфазной системе, включающей органический растворитель, предпочтительно, этилацетат, и водный растворитель, предпочтительно раствор гидрокарбоната натрия. Когда R означает С 1-С 6 алкокси, иногда можно преобразовывать сложный эфир непосредственно в амид путем нагревания сложного эфира и амина вместе при термическом процессе. 2) Галогенангидриды кислот формулы (V), где G1 означает кислород, и R означает Cl, F или Br,можно получить из карбоновых кислот формулы (V), где G1 означает кислород, и R означает OH, в стандартных условиях, таких как обработка тионилхлоридом или оксалилхлоридом. 3) Карбоновые кислоты формулы (V), где G1 означает кислород, и R означает OH, можно получить из сложных эфиров формулы (V), где G1 означает кислород, и R означает С 1-С 6 алкокси. Специалисту в данной области известно, что существует множество способов гидролиза таких сложных эфиров в зависимости от природы алкоксильной группы. Одним, широко используемым способом для достижения такого преобразования является обработка сложного эфира гидроксидом щелочного металла, таким как гидроксид натрия, в растворителе, таком как этанол и/или вода. 4) Сложные эфиры формулы (V), где G1 означает кислород, и R означает С 1-С 6 алкокси, можно получить путем обработки соединений формулы (IV), где R означает С 3-С 6 алкокси, путем ацилирования карбоновой кислотой формулы Q1-COOH или галогенангидридом кислоты формулы Q1-COHal, где Hal означает Cl, F или Br, в стандартных условиях, как описано в п.1).- 10016685 5) Соединения формулы (IV), где R означает С 1-С 6 алкокси, можно получить из соединений формулы (VI) путем последовательной обработки спиртом R-OH в кислых условиях и последующего образования связи N-R1. Специалисту в данной области известно, что существует множество описанных способов для образования этой связи в зависимости от природы заместителя R1. Альтернативно, могут быть использованы реакции, основанные на окисленных вариантах спиртов,таких как соответствующие альдегиды и кетоны, или основанные на более активированных аналогах спиртов, таких как соответствующие галогениды или сульфонаты. Например, восстановительного аминирования можно достигнуть путем обработки амина альдегидом или кетоном и восстановителем, таким как цианоборгидрид натрия или боргидрид натрия. Альтернативно, алкилирования можно достигнуть путем обработки амина алкилирующим агентом, таким как алкилгалогенид, необязательно в присутствии основания. Альтернативно, арилирования можно достигнуть путем обработки амина арилгалогенидом или арилсульфонатом, в присутствии подходящей системы катализатор/лиганд, часто, в присутствии комплекса палладия (0). Соединения формулы (VI) и спирты формулы R-OH или являются известными соединениями, или их можно получить с помощью известных способов, которые известны специалисту в данной области. 6) Альтернативно, соединения формулы (IV), где R означает С 1-С 6 алкокси, можно получить из соединения формулы (VII), где R означает С 1-С 6 алкокси, и LG представляет собой уходящую группу, такую как фтор, хлор или сульфонат, путем нуклеофильного замещения уходящей группы амином формулы R1-NH2. Соединения формулы (VII) и амины формулы R1-NH2 или являются известными соединениями, или их можно получить известными способами, которые известны специалисту в данной области. 7) Альтернативно, соединения формулы (I), где G1 и G2 означают кислород, можно получить путем обработки соединений формулы (IX), где G2 означает кислород, карбоновой кислотой формулы Q1COOH или галогенангидридом кислоты формулы Q1-COHal, где Hal означает Cl, F или Br, в стандартных условиях, как описано в п.1). 8) Соединения формулы (IX), где G2 означает кислород, можно получить из соединений формулы(VIII), где P представляет собой подходящую защитную группу, и R означает OH, Cl или С 1-С 6 алкокси,путем образования амидной связи с амином формулы NHR2Q2, в стандартных условиях, как описано в п.1), с последующим удалением защитной группы P, в стандартных условиях. 9) Соединения формулы (VIII), где R означает OH или С 1-С 6 алкокси, можно получить путем защиты функциональной аминогруппы в соединениях формулы (IV), где R означает OH или С 1-С 6 алкокси. Подходящие защитные группы включают карбаматы (такие как трет-бутилоксикарбонил, аллилоксикарбонил и бензилоксикарбонил), триалкилсилильные группы (такие как трет-бутилдиметилсилил) и ацильные группы (такие как ацетил). Образование и удаление таких групп широко описано в литературе и известно специалисту в данной области. 10) В случае соединений формулы (VIII) и соединений формулы (IV), сложные эфиры (где R озна- 11016685 чает С 1-С 6 алкокси) можно гидролизовать до получения кислот (где R означает OH) путем обработки гидроксидом щелочного металла, такого как гидроксид натрия, в растворителе, таком как этанол. Кислоты (где R означает OH) можно преобразовывать в хлорангидриды кислот (где R означает Cl) путем обработки тионилхлоридом или оксалилхлоридом, как описано в п.2) и п.3). 12) Альтернативно, может быть возможным преобразование соединений формулы (IV), где R означает OH, Cl, F, Br или С 1-С 6 алкокси, непосредственно в соединения формулы (IX) путем образования амидной связи с амином формулы NHR2Q2, в стандартных условиях, как описано в п.1). 13) Альтернативно, соединения формулы (IX), где G2 означает кислород, можно получить из соединений формулы (XI), где G2 означает кислород, и LG представляет собой уходящую группу, такую как фтор, хлор или сульфонат, путем замены уходящей группы соединением формулы R1-NH2. Такие реакции обычно проводят в щелочных условиях. 14) Соединения формулы (XI) можно получить из соединений формулы (X), где R означает Cl илиOH, и LG представляет собой уходящую группу, как описано в п.14), посредством образования амидной связи, в стандартных условиях, как описано в п.1). Соединения формулы (X) и формулы (IV) или являются известными соединениями, или их можно получить способами, известными специалисту в данной области. 15) Альтернативно, соединения формулы (IX), где G2 означает кислород, можно получить путем образования связи N-R1 в соединении формулы (IX'), где G2 означает кислород, используя способы, как описано в п.5). 16) Соединения формулы (IX'), где G2 означает кислород, можно получить путем восстановления нитросоединения формулы (XIII), где G2 означает кислород. Существуют многочисленные способы для достижения такого преобразования, описанные в литературе, такие как обработка хлоридом олова в кислых условиях или гидрирование, катализируемое благородным металлом, таким как палладий-науглероде. 17) Соединения формулы (XIII), где G2 означает кислород, можно получить из соединений формулы (XII), где R означает OH, Cl или С 1-С 6 алкокси, путем ацилирования амином формулы NHR2Q2, в стандартных условиях, как описано в п.1). 18) В случае соединений формулы (XII), сложные эфиры (где R означает С 1-С 6 алкокси) можно гидролизовать до образования кислот (где R означает OH) путем обработки гидроксидом щелочного металла, таким как гидроксид натрия, в растворителе, таком как этанол, как описано в п.3). Кислоты (где R означает ОН) можно преобразовать в хлорангидриды кислот (где R означает Cl) путем обработки тионилхлоридом или оксалилхлоридом, как описано в п.2). Соединения формулы (XII) или являются известными, или их можно получить способами, известными специалисту в данной области. 19) Соединения формулы (XII), где R3 означает циано, можно получить из соединений формулы(XII'), где LG означает галоген, такой как фтор или хлор, путем взаимодействия с цианидом, таким как цианид калия, необязательно в присутствии основания, такого как карбонат калия.- 12016685 Замену галогена цианидом также можно осуществлять в случае промежуточных продуктов формулы (XIII). В обоих случаях, присутствие нитрогруппы способствует замене уходящей группы цианидионом. Также, соединения формулы (XII) или формулы (XIII), где R3 означает тиоцианато, можно получить из соединения формулы (XII') или формулы (XIII'), где LG означает галоген, такой как йод, фтор или хлор, путем взаимодействия с тиоцианатом, таким как тиоцианат калия или тиоцианат меди, как описано, например, в Journal of the Chemical Society, Chemical Communications, (2), 8102, 1989; или Synthetic Communications, 10(8), 633-6, 1980. 20) Соединения формулы (XII), где R3 означает циано, можно получить из соединений формулы(XII'), где LG означает амин, путем взаимодействия с цианидом, таким как цианид меди, через реакцию диазотирования. Замену амина цианидом также можно осуществлять в случае промежуточных продуктов формулы (XIII). Соединения формулы (I) можно использовать для борьбы и контроля в отношении инвазий насекомых-вредителей, таких как Lepidoptera, Diptera, Hemiptera, Thysanoptera, Orthoptera, Dictyoptera, Coleoptera, Siphonaptera, Hymenoptera и Isoptera, a также других беспозвоночных вредителей, как, например,клещи, нематоды и моллюски. Насекомые, клещи, нематоды и моллюски в дальнейшем все вместе приводятся как вредители. Вредители, с которыми можно бороться и которые можно контролировать путем использования соединений согласно данному изобретению, включают вредителей, связанных с сельским хозяйством (такой термин включает возделывание сельскохозяйственных культур для получения пищевых и волокнистых продуктов), с садоводством и животноводством, сопутствующими животными, с лесоводством и хранением продуктов растительного происхождения (таких как плоды, зерновые культуры и лесоматериалы); вредителей, связанных с повреждением созданных человеком сооружений и переносом заболеваний людям и животным; а также надоедливых вредителей (таких как мухи). Примеры видов вредителей, которых можно контролировать с помощью соединений формулы (I),включают: Myzus persicae (тля персиковая), Aphis gossypii (тля растительная), Aphis fabae (тля растительная), Lygus spp. (капсиды), Dysdercus spp. (капсиды), Nilaparvata lugens (дельфациды), Nephotettixcspp. (желудочно-кишечные нематоды) и Deroceras reticulatum (слизень). Данное изобретение, следовательно, относится к способу борьбы и контроля в отношении насекомых, клещей, нематод и моллюсков, который включает нанесение инсектицидного, акарицидного, нематицидного или моллюскоцидного эффективного количества соединения формулы (I) или композиции,содержащей соединение формулы (I), на вредителей, местоположение вредителей, предпочтительно растение или растение, способное подвергаться нападению вредителей. Соединения формулы (I) предпочтительно применяют против насекомых, клещей или нематод. Термин "растение", как используется в данном описании, включает рассаду, кустарники и деревья. Для нанесения соединения формулы (I) в качестве инсектицидного, акарицидного, нематицидного или моллюскоцидного средства на вредителей, местоположение вредителей или на растение, способное подвергаться нападению вредителей, соединение формулы (I) обычно используют для получения композиции, которая содержит, кроме соединения формулы (I), подходящий инертный разбавитель или носитель и, необязательно, поверхностно-активное вещество (SFA). SFA представляют собой химикаты, которые способны модифицировать свойства поверхности раздела (например, поверхности раздела жид- 13016685 кость/твердое вещество, жидкость/воздух или жидкость/жидкость) путем снижения межфазного натяжения и, таким образом, приведения к изменениям в случае других свойств (например, диспергирование,эмульгирование и смачивание). Предпочтительно, все композиции (как твердые, так и жидкие препараты) содержат, 0,0001-95 мас.%, более предпочтительно 1-85 мас.%, например 5-60 мас.%, соединения формулы (I). Композицию обычно используют для контроля вредителей таким образом, что соединение формулы (I) наносят в дозе от 0,1 г до 10 кг на гектар, предпочтительно от 1 г до 6 кг на гектар, более предпочтительно от 1 г до 1 кг на гектар. В случае использования при протравливании семян, соединение формулы (I) применяют в дозе от 0,0001 г до 10 г (например, 0,001 или 0,05 г), предпочтительно от 0,005 до 10 г, более предпочтительно от 0,005 до 4 г на 1 кг семян. В другом аспекте, настоящее изобретение относится к инсектицидной, акарицидной, нематицидной или моллюскоцидной композиции, содержащей инсектицидно, акарицидно, нематицидно или моллюскоцидно эффективное количество соединения формулы (I) и подходящий носитель или разбавитель для этой цели. Композиция предпочтительно является инсектицидной, акарицидной, нематицидной или моллюскоцидной композицией. Композиции могут быть выбраны из множества типов препаратов, включая порошки для опыливания (DP), растворимые порошки (SP), растворимые в воде гранулы (SG), диспергируемые в воде гранулы(WG), смачивающиеся порошки (WP), гранулы (GR) (с медленным или быстрым высвобождением), растворимые концентраты (SL), маслосмешивающиеся жидкости (OL), жидкости для ультрамалообъемного опрыскивания (UL), эмульгируемые концентраты (EC), диспергируемые концентраты (DC), эмульсии(SC), аэрозоли, препараты для покрытия туманом/окуривания, капсулированные суспензии (CS) и препараты для обработки семян. Тип препарата, выбираемый в любом случае, зависит от конкретной предусматриваемой цели и физических, химических и биологических свойств соединения формулы (I). Порошки для опыливания (DP) можно получить путем смешения соединения формулы (I) с одним или несколькими твердыми разбавителями (как, например, природные глины, каолин, пирофиллит, бентонит, глинозем, монтмориллонит, кизельгур, мел, диатомовые земли, фосфаты кальция, карбонаты кальция и магния, сера, известь, мука, тальк и другие органические и неорганические твердые носители) и механического размалывания смеси до получения тонкоизмельченного порошка. Растворимые порошки (SP) можно получить путем смешения соединения формулы (I) с одной или несколькими, растворимыми в воде, неорганическими солями (такими как гидрокарбонат натрия, карбонат натрия или сульфат магния), или одним или несколькими, растворимыми в воде, органическими твердыми веществами (такими как полисахарид) и, необязательно, одним или несколькими смачивателями, одним или несколькими диспергаторами или смесью вышеуказанных средств для улучшения диспергируемости/растворимости в воде. Смесь затем подвергают дроблению до получения тонкоизмельченного порошка. Подобные композиции также можно гранулировать для получения растворимых в воде гранул (SG). Смачивающиеся порошки (WP) можно получить путем смещения соединения формулы (I) с одним или несколькими твердыми разбавителями или носителями, с одним или несколькими смачивателями и,предпочтительно, с одним или несколькими диспергаторами и, необязательно, с одним или несколькими суспендирующими агентами, чтобы способствовать диспергируемости в жидкостях. Смесь затем подвергают дроблению до получения тонкоизмельченного порошка. Подобные композиции также можно гранулировать для получения диспергируемых в воде гранул (WG). Гранулы (GR) можно получить или путем гранулирования смеси соединения формулы (I) и одного или нескольких порошкообразных твердых разбавителей или носителей, или из предварительно полученных незаполненных гранул путем абсорбции соединения формулы (I) (или его раствора, в подходящем средстве) в пористом гранулированном материале (таком как пемза, аттапульгитовые глины, фуллерова земля, кизельгур, диатомовые земли или размолотые сердцевины кукурузных початков) или путем адсорбции соединения формулы (I) (или его раствора, в подходящем средстве) на твердом материале(таком как песок, силикаты, минеральные карбонаты, сульфаты или фосфаты) и путем высушивания,если необходимо. Средства, которые обычно используют, чтобы способствовать абсорбции или адсорбции, включают растворители (такие как алифатические и ароматические нефтяные растворители, спирты, простые эфиры, кетоны и сложные эфиры) и способствующие прилипанию средства (такие как поливинилацетаты, поливиниловые спирты, декстрины, сахара и растительные масла). Одну или несколько других добавок также можно включать в гранулы (например, эмульгатор, смачиватель или диспергатор). Диспергируемые концентраты (DC) можно получить путем растворения соединения формулы (I) в воде или в органическом растворителе, таком как кетон, спирт или простой гликолевый эфир. Такие растворы могут содержать поверхностно-активное вещество (например, для улучшения разбавления водой или предотвращения кристаллизации в резервуаре опрыскивателя). Эмульгируемые концентраты (EC) или эмульсии масло-в-воде (EW) можно получить путем растворения соединения формулы (I) в органическом растворителе (необязательно содержащем один или несколько смачивателей, один или несколько эмульгаторов или смесь вышеуказанных средств). Подходя- 14016685 щие органические растворители для использования в случае EC включают ароматические углеводороды(такие как алкилбензолы или алкилнафталины, выпускаемые, например, под названиями SOLVESSO 100, SOLVESSO 150 и SOLVESSO 200; SOLVESSO является зарегистрированной торговой маркой), кетоны (такие как циклогексанон или метилциклогексанон) и спирты (такие как бензиловый спирт, фурфуриловый спирт или бутанол), N-алкилпирролидоны (такие как N-метилпирролидон или Nоктилпирролидон), диметиламиды жирных кислот (такие как диметиламид C8-C10-жирной кислоты) и хлорированные углеводороды. EC-продукт может самопроизвольно эмульгироваться при добавлении к воде, давая эмульсию с достаточной стабильностью для возможности нанесения спрея при использовании соответствующего оборудования. Приготовление EW включает получение соединения формулы (I) или в виде жидкости (если оно не является жидкостью при температуре окружающей среды, его можно расплавлять при приемлемой температуре, обычно ниже 70C) или в виде раствора (путем растворения его в соответствующем растворителе), с последующим эмульгированием полученной жидкости или раствора в воде, содержащей одно или несколько SFA, при высоком усилии сдвига, для получения эмульсии. Подходящие растворители для использования в случае EW включают растительные масла, хлорированные углеводороды (такие как хлорбензолы), ароматические растворители (такие как алкилбензолы или алкилнафталины) и другие соответствующие органические растворители, которые обладают низкой растворимостью в воде. Микроэмульсии (ME) можно приготовлять путем смешения воды со смесью одного или нескольких растворителей с одним или несколькими SFA, получая самопроизвольно термодинамически стабильный жидкий изотропный препарат. Соединение формулы (I) первоначально находится или в воде, или в смеси растворитель/SFA. Подходящие растворители для использования в случае ME включают растворители, указанные выше для использования в случае EC или в случае EW. ME может быть или в виде системы масло-в-воде, или системы вода-в-масле (какая система имеется, может быть определено путем измерений электропроводности) и может быть подходящей для смешения с водорастворимыми и маслорастворимыми пестицидами в одном и том же препарате. ME пригодна для разбавления в воде, или оставаясь в виде микроэмульсии или образуя обычную эмульсию масло-в-воде. Суспензионные концентраты (SC) могут включать водные или неводные суспензии тонкоизмельченных нерастворимых твердых частиц соединения формулы (I). SC можно получить путем измельчения в шаровой или бисерной мельнице твердого соединения формулы (I), в подходящей среде, необязательно с одним или несколькими диспергаторами, для получения тонкой суспензии частиц соединения. В данную композицию можно включать один или несколько смачивателей и можно включать суспендирующий агент для уменьшения скорости оседания частиц. Альтернативно, соединение формулы (I) можно измельчать в сухом состоянии и добавлять к воде, содержащей вышеуказанные средства, получая желаемый конечный продукт. Аэрозольные препараты включают соединение формулы (I) и подходящий пропеллент (например,н-бутан). Соединение формулы (I) также можно растворять или диспергировать в подходящей среде (как,например, вода или смешивающаяся с водой жидкость, такая как н-пропанол), в целях получения композиций для использования в не являющихся нагнетательными ручных насосах для опрыскивания. Соединение формулы (I) можно смешивать в сухом состоянии с пиротехнической смесью для получения композиции, пригодной для генерирования, в огороженном пространстве, дыма, содержащего соединение. Капсулированные суспензии (CS) можно получить способом, подобно получению EW-препаратов,однако, с дополнительной стадией полимеризации, таким образом, чтобы получить водную дисперсию масляных капелек, в которой каждая масляная капелька инкапсулирована полимерной оболочкой и содержит соединение формулы (I) и, необязательно, носитель или разбавитель для этой цели. Полимерную оболочку можно получить или путем межфазной реакции поликонденсации, или за счет процесса коацервации. Композиции могут быть предусмотрены для контролируемого высвобождения соединения формулы (I) и их можно использовать для обработки семян. Соединение формулы (I) также может быть использовано для получения препарата в биоразлагаемой полимерной матрице для обеспечения медленного контролируемого высвобождения соединения. Композиция может включать одну или несколько добавок для улучшения биологической характеристики композиции (например, за счет улучшения смачиваемости, удерживания или распределения на поверхности; устойчивости к дождю на обработанных поверхностях; или поглощения или мобильности соединения формулы (I. Такие добавки включают поверхностно-активные вещества, распыляемые добавки, основанные на маслах, например, некоторых минеральных маслах или природных растительных маслах (таких как соевое масло и масло из семян рапса), и их смеси с другими биоусиливающими адъювантами (ингредиенты, которые могут способствовать воздействию или модифицировать воздействие соединения формулы (I. Соединение формулы (I) также можно использовать для получения препарата в целях применения в качестве средства для обработки семян, например, в виде порошкообразной композиции, включая порошок для сухой обработки семян (DS), водорастворимый порошок (SS) или диспергируемый в воде порошок для обработки густой суспензией (WS), или в виде жидкой композиции, включая текучий концен- 15016685 трат (FS), раствор (LS) или инкапсулированную суспензию (CS). Способы получения композиций DS,SS, WS, FS и LS очень схожи со способами, соответственно, в случае композиций DP, SP, WP, SC и DC,описанными выше. Композиции для обработки семян могут включать агент, способствующий адгезии композиции к семенам (например, минеральное масло или пленкообразующий барьер). Смачиватели, диспергаторы и эмульгаторы могут быть поверхностно-активными веществами (SFA) катионогенного, анионогенного, амфотерного или неионогенного типа. Подходящие SFA катионогенного типа включают четвертичные аммониевые соединения (например, цетилтриметиламмонийбромид), имидазолины и соли аминов. Подходящие анионогенные SFA включают соли щелочных металлов жирных кислот, соли алифатических моноэфиров серной кислоты (например, лаурилсульфат натрия), соли сульфированных ароматических соединений (например, додецилбензолсульфонат натрия, додецилбензолсульфонат кальция,бутилнафталинсульфонат и смеси диизопропил- и триизопропилнафталинсульфонатов натрия), оксисульфаты, оксисульфаты спиртов (например, лаурет-3-сульфат натрия), оксикарбоксилаты (например,лаурет-3-карбоксилат натрия), сложные эфиры фосфорной кислоты (продукты взаимодействия между одним или несколькими жирными спиртами и фосфорной кислотой (с преобладанием сложных моноэфиров) или пентоксидом фосфора (с преобладанием сложных диэфиров), например, путем взаимодействия между лауриловым спиртом и тетрафосфорной кислотой; кроме того, указанные продукты могут быть этоксилированы), сульфосукцинаматы, парафиновые или олефиновые сульфонаты, таураты и лигносульфонаты. Подходящие SFA амфотерного типа включают бетаины, пропионаты и глицинаты. Подходящие SFA неионогенного типа включают продукты конденсации алкиленоксидов, таких как этиленоксид, пропиленоксид, бутиленоксид или их смеси, с жирными спиртами (такими как олеиловый спирт или цетиловый спирт) или с алкилфенолами (такими как октилфенол, нонилфенол или октилкрезол); неполные сложные эфиры, производные длинноцепочечных жирных кислот или ангидридов и гексита; продукты конденсации вышеуказанных неполных сложных эфиров с этиленоксидом; блоксополимеры (включающие этиленоксид и пропиленоксид); алканоламиды; просто сложные эфиры (например,полиэтиленгликолевые эфиры жирной кислоты); аминоксиды (например, лаурилдиметиламиноксид); и лецитины. Подходящие суспендирующие агенты включают гидрофильные коллоиды (такие как полисахариды,поливинилпирролидон или натрийкарбоксиметилцеллюлоза) и разбухающие глины (такие как бентонит или аттапульгит). Соединение формулы (I) можно наносить любым из известных способов нанесения пестицидных соединений. Например, его можно наносить в препаративной форме или в непрепаративной форме, непосредственно на вредителей или на местоположение вредителей (как например место обитания вредителей или растущее растение, подверженное инвазии вредителями) или на любую часть растения, включая листву, стебли, ветки или корни, на семенной материал до его посева или на другие среды, на которых растения культивируют или на которые должны быть посажены (такие как почва, окружающая корни, почва вообще, падди-вода или система гидропонной культуры), или оно может быть нанесено путем опрыскивания, опыливания, путем окунания, в виде кремообразного или пастообразного препарата, в виде пара или путем разбрасывания или внесения композиции (как например гранулированная композиция или композиция, упакованная в растворимый в воде пакет) в почву или в водную окружающую среду. Соединение формулы (I) также может быть инъецировано в растения или нанесено путем опрыскивания на вегетативную часть, используя электродинамические методы опрыскивания или другие низкообъемные методы, или нанесено при использовании почвенных или воздушных систем орошения. Композиции для применения в виде водных препаратов (водные растворы или дисперсии) обычно поставляют в форме концентрата, содержащего высокую долю активного ингредиента, причем концентрат добавляют в воду перед применением. Такие концентраты, которые могут содержать DC, SC, EC,EW, ME, SG, SP, WP, WG и CS, часто нуждаются в устойчивости при хранении в течение продолжительных периодов времени и после такого хранения должны быть способны к добавлению в воду для получения водных препаратов, которые остаются гомогенными в течение достаточного количества времени,давая возможность наносить их при использовании стандартного оборудования для опрыскивания. Такие водные препараты могут содержать различные количества соединения формулы (I) (например, 0,0001-10 мас.%), в зависимости от цели, для которой они должны быть использованы. Соединение формулы (I) можно использовать в смесях с удобрениями (например, азотсодержащими, калийсодержащими или фосфорсодержащими удобрениями). Подходящие типы препаратов включают гранулы удобрения. Смеси подходящим образом содержат до 25 мас.%, соединения формулы (I). Данное изобретение, следовательно, также относится к композиции удобрения, включающему удобрение и соединение формулы (I). Композиции данного изобретения могут содержать другие соединения, обладающие биологической активностью, например питательные микроэлементы или соединения, обладающие фунгицидной активностью, или соединения, которые обладают регулирующей рост растения, гербицидной, инсектицидной,- 16016685 нематицидной или акарицидной активностью. Соединение формулы (I) может быть единственным активным ингредиентом композиции или оно может быть смешано с одним или несколькими дополнительными активными ингредиентами, такими как пестицид, фунгицид, синергист, гербицид или регулятор роста растения соответственно. Дополнительный активный ингредиент может: обеспечивать получение композиции, имеющей широкий спектр активности или повышенную персистентность в местоположении вредителей; синергизировать активность или дополнять активность (например, путем увеличения скорости воздействия или преодоления репеллентности) соединения формулы (I); или способствовать преодолению или предотвращению развития резистентности к индивидуальным компонентам. Конкретный дополнительный активный ингредиент зависит от предназначаемой полезности композиции. Примеры подходящих пестицидов включают следующие:a) пиретроиды, такие как перметрин, циперметрин, фенвалерат, эсфенвалерат, дельтаметрин, цигалотрин (в частности, лямбда-цигалотрин), бифентрин, фенпропатрин, цифлутрин, тефлутрин, безопасные для рыб пиретроиды (например, этофенпрокс), природный пиретрин, тетраметрин, s-биоаллетрин, фенфлутрин, праллетрин или 5-бензил-3-фурилметил-(E)-(1R,3S)-2,2-диметил-3-(2-оксотиолан-3-илиденметил)циклопропанкарбоксилат;f) пиразолы, такие как тебуфенпирад и фенпироксимат;g) макролиды, такие как авермектины или милбемицины, например абамектин, эмамектинбензоат,ивермектин, милбемицин, спиносад или азадирактин;j) амидины, такие как хлордимеформ или амитраз;n) дифениловые эфиры, такие как диофенолан или пирипроксифен;s) флубендиамид или ринаксипир. В дополнение к основным химическим классам пестицидов, перечисленным выше, другие пестициды, имеющие конкретные целенаправленности, могут быть использованы в композиции, если подходят для предназначаемой полезности композиции. Например, могут быть использованы селективные инсектициды для конкретных сельскохозяйственных культур, как, например, специфические в отношении древоточцев инсектициды (такие как картап) или специфические в отношении прыгающих насекомых инсектициды (такие как бупрофезин), для применения в случае риса. Альтернативно, инсектициды или акарициды, специфические в отношении видов/стадий конкретного насекомого, также могут быть включены в композиции (например, акарицидные оволарвициды, такие как клофентезин, флубензимин, гекситиазокс или тетрадифон; акарицидные мотилициды, такие как дикофол или пропаргит; акарициды, такие как бромпропилат или хлорбензилат; или регуляторы роста, такие как гидраметилнон, циромазин, метопрен, хлорфлуазурон или дифлубензурон). Примерами фунгицидных соединений, которые можно включать в композиции согласно данному изобретению, являются (E)-N-метил-2-[2-(2,5-диметилфеноксиметил)фенил]-2-метоксииминоацетамид(MON65500), N-(1-циано-1,2-диметилпропил)-2-(2,4-дихлорфенокси)пропионамид (AC382Q42), N-(2- 17016685 метокси-5-пиридил)циклопропанкарбоксамид, ацибензолар (CGA245704), аланикарб, алдиморф, анилазин, азаконазол, азоксистробин, беналаксил, беномил, билоксазол, битертанол, бластицидин S, бромуконазол, бипиримат, каптафол, каптан, карбендазим, карбендазимхлоргидрат, карбоксин, карпропамид,карвон, CGA41396, CGA41397, хинометионат, хлорталонил, хлорзолинат, клозилакон, содержащие медь соединения, такие как оксихлорид меди, оксихинолят меди, сульфат меди, таллат меди или бордосская жидкость, цимоксанил, ципроконазол, ципродинил, дебакарб, ди-2-пиридилдисульфид-1,1'-диоксид,дихлофлуанид, дихломезин, дихлоран, диэтофенкарб, дифеноконазол, дифензоквиат, дифлуметорим,O,O-диизопропил-S-бензилтиофосфат, димефлуазол, диметконазол, диметоморф, диметиримол, диниконазол, динокап, дитианон, додецилдиметиламмонийхлорид, додеморф, додин, догуадин, эдифенфос,эпоксиконазол, этиримол, этил-(Z)-N-бензил-N-([метил(метилтиоэтилиденаминооксикарбонил)амино] тио)аланинат, этридиазол, фамоксадон, фенамидон (RPA407213), фенаримол, фенбуконазол, фенфурам, фенгексамид (KBR2738), фенпиклонил, фенпропидин, фенпропиморф, фентинацетат, фентингидроксид, фербам, феримзон, флуазинам, флудиоксонил, флуметовер, фторимид, флуквинконазол, флусилазол, флутолаиил, флутриафол, фолпет, фуберидазол, фуралаксил, фураметпир, гуазатин, гексаконазол,гидроксиизоксазол, гумексазол, имазалил, имибенконазол, иминоктадин, иминоктадинтриацетат, ипконазол, ипробенфос, ипродион, ипроваликарб (SZX0722), изопропанилбутилкарбамат, изопротиолан, казугамицин, крезоксимметил, LY186054, LY211795, LY248908, манкозеб, манеб, мефеноксам, мепанипирим, мепронил, металаксил, метконазол, метирам, метирам-цинк, метоминостробин, миклобутанил, неоазозин, диметилдитиокарбамат никеля, нитротализопропил, нуаримол, офурак, ртутьорганические соединения, оксадиксил, оксасульфурон, оксолиновая кислота, окспоконазол, оксикарбоксин, пефуразоат,пенконазол, пенцицирон, феназиноксид, фоцетил-Al, фосфорные кислоты, фталид, пикоксистробин(ZA1963), полиоксин D, полирам, пробеназол, прохлораз, процимидон, пропамокарб, пропиконазол,пропинеб, пропионовая кислота, пиразофос, пирифенокс, пириметанил, пироквилон, пироксифур, пирролнитрин, соединения четвертичного аммония, квинометионат, квиноксифен, квинтозен, сипконазол (F155), пентахлорфенат натрия, спироксамин, стрептомицин, сера, тебуконазол, теклофталам, текназен,тетраконазол, тиабендазол, тифлузамид, 2-(тиоцианометилтио)бензотиазол, тиофанатметил, тирам, тимибенконазол, толклофосметил, толилфлуанид, триадимефон, триадименол, триазбутил, триазоксид,трициклазол, тридеморф, трифлоксистробин (CGA279202), трифорин, трифлумизол, тритиконазол, валидамицин A, варам, винклозолин, зинеб и зирам. Соединения формулы (I) можно смешивать с почвой, торфом или другими средами укоренения для защиты от передающихся с семенами, передающихся с почвой или лиственных грибковых заболеваний. Примеры подходящих синергистов для использования в композициях включают пиперонилбутоксид, сезамекс, сафроксан и додецилимидазол. Подходящие гербициды и регуляторы роста растений для включения в композиции зависят от предназначаемой цели и необходимого эффекта. Примером селективного в случае риса гербицида, который может быть включен, является пропанил. Примером регулятора роста растений для применения в случае хлопчатника является PIX. Некоторые смеси могут включать активные ингредиенты, которые обладают значительно различными физическими, химическими или биологическими свойствами, такими, что они сами легко не приводят к одному и тому же типу стандартного препарата. В этих случаях могут быть получены другие типы препаратов. Например, когда один активный ингредиент представляет собой нерастворимое в воде твердое вещество, а другой - не растворимую в воде жидкость, тем не менее, может быть возможным диспергирование каждого активного ингредиента в одной и той же непрерывной водной фазе путем диспергирования твердого активного ингредиента в виде суспензии (используя получение, аналогично получению в случае SC), с другой стороны, путем диспергирования жидкого активного ингредиента в виде эмульсии (используя приготовление, аналогично получению в случае EW). Полученная композиция является препаратом в виде суспоэмульсии (SE). Следующие примеры иллюстрируют данное изобретение, но не ограничивая его. Примеры получения Пример I1. Получение 4-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3 нитробензамида. К раствору N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-4-фтор-3-нитробензамида (2,008 г, 4,4 ммоль) (полученный согласно WO 05/073165) в N,N-диметилформамиде (25 мл) добавляют цианид натрия (0,237 г, 4,84 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 48 ч. Затем добавляют воду (20 мл) и органическую фазу три раза экстрагируют этилацетатом (3 раза по 100 мл). Объединенные органические экстракты промывают водой и насыщенным раствором соли, сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хро- 18016685 матографией на силикагеле (элюент: циклогексан/этилацетат=1:4), получая 4-циано-N-[2,6-диметил-4(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3-нитробензамид (1,0 г, выход 49%). 1H-ЯМР (400 МГц, CDCl3): 8,85 (д, 1H), 8,38 (кв., 1H), 8,1 1 (д, 1H), 7,55 (с, 1H), 7,40 (с, 2H), 2,33 (с,6H) м.д. Аналогичные методики используют для получения следующих соединений. 4-Циано-N-[2,6-диэтил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3-нитробензамид. 1H-ЯМР (400 МГц, CDCl3): 8,87 (с, 1H), 8,39 (д, 1H), 8,10 (д, 1H), 7,80 (с, 1H), 7,74 (с, 1H), 7,56 (с,1H), 2,77 (кв., 2H), 1,29 (т, 3H) м.д. 4-Циано-N-[2,6-дибром-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3-нитробензамид. Данный продукт используют на следующей стадии без дальнейшей очистки. 4-Циано-N-[2-этил-6-метил-4-(1,2,2,3,3,3-гексафтор-1-трифторметилпропил)фенил]-3-нитробензамид. 1 4-Циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3-нитробензамид (1,0 г,2,16 ммоль) (пример I1) растворяют в диметиловом эфире диэтиленгликоля ("диглим") (25 мл) и добавляют хлорид олова (1,229 г, 6,48 ммоль). Полученную смесь охлаждают до температуры 0C и медленно добавляют водный раствор хлористоводородной кислоты (концентрированный) (4 мл). Реакционную смесь перемешивают при температуре 80C в течение 0,5 ч. Добавляют водный раствор гидроксида натрия (30% мас./об.) (80 мл) до доведения pH до 7-8. Водную фазу три раза экстрагируют этилацетатом(200 мл). Объединенные органические экстракты сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=от 1:1 до 0:1),получая 3-амино-4-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамидH-ЯМР (400 МГц, CDCl3): 7,54 (с, 1H), 7,49 (д, 2H), 7,36 (м, 3H), 7,15 (кв., 1H), 2,3 (с, 6H) м.д. Аналогичные методики или хорошо известные методики, такие как гидрирование в присутствии палладиевого катализатора, как описано, например, в Journal of Medicinal Chemistry (2005), 48(24), 7560,или в Journal of Medicinal Chemistry (2005), 48(6), 1729, и восстановление гидросульфитом натрия в- 19016685 двухфазной системе с тетрабутиламмонийбромидом в качестве межфазного катализатора (см. примерI3), как описано, например, в Journal of Medicinal Chemistry (2006), 49(3), 955-970, используют для получения следующих соединений. 3-Амино-4-циано-N-[2,6-диэтил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамид. 1(63,9 г, 102,6 ммоль) растворяют в тетрагидрофуране (1200 мл). Добавляют водный раствор гидроксида натрия (0,1 М раствор, 550 мл), гидросульфит натрия (65,3 г, 307,7 ммоль) и тетрабутиламмонийбромид(TBAB) (3,4 г, 10,3 ммоль). Смесь энергично перемешивают при температуре 65C. Добавляют следующие порции гидросульфита натрия, спустя 20 мин (65,3 г, 307.7 ммоль) и спустя 80 мин (32,7 г, 153,8 ммоль). Реакционную смесь перемешивают при температуре 65C в течение 30 мин. Затем реакционную смесь охлаждают до температуры 25C и разбавляют этилацетатом (1300 мл). Фазы разделяют и органическую фазу экстрагируют этилацетатом (300 мл). Объединенные органические фазы промывают водой,водным раствором гидрокарбоната натрия (10% мас./об.) (400 мл) и насыщенным раствором соли, сушат над сульфатом натрия и концентрируют, получая 3-амино-N-[2-бром-6-этил-4-(1,2,2,3,3,3-гексафтор-1 трифторметилпропил)фенил]-4-цианобензамид в виде желтого твердого вещества (63,1 г), которое используют на следующий стадии без дальнейшей очистки. Пример I4. Получение 4-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3- 20016685 метиламинобензамида. 3-Амино-4-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамид (3,01 г,6,95 ммоль) (пример I2) растворяют в ацетонитриле (50 мл) и последовательно добавляют водный раствор формальдегида (36,5% мас./об.) (0,64 мл, 6,95 ммоль) и уксусную кислоту (30 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 45 мин. Затем добавляют боргидрид натрия (0,44 г, 6,95 ммоль) и еще уксусную кислоту (5 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 2 ч. Реакционную смесь концентрируют. Остаток растворяют в этилацетате и полученный раствор промывают водным раствором гидроксида натрия (1 н. раствор). Водную фазу три раза экстрагируют этилацетатом (200 мл). Объединенные органические экстракты сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагелеH-ЯМР (400 МГц, CDCl3): 7,53 (д, 1H), 7,37 (с, 3H), 7,23 (с, 1H), 7,10 (кв., 1H), 5,88 (д, 1H), 3,02 (д,3H), 2,35 (с, 6H) м.д. Аналогичную методику используют для получения следующего соединения: 4-циано-N-[2,6-диэтил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3-метиламинобензамид. Температура плавления: 199-202C. 1H-ЯМР (400 МГц, CDCl3) : 7,53 (д, 1H), 7,40 (с, 2H), 7,31 (с, 1H), 7,23 (с, 1H), 7,08 (кв., 1H), 5,88 (д,1H), 3,02 (д, 3H), 2,69 (кв., 4H), 1,24 (т, 6H) м.д. Общую методику, как описано в примере P2, затем используют для получения ряда соединений(соединенияC1-C40 табл. C), параллельно. Аналогичную методику используют для получения следующего соединения: 4-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3-этиламинобензамид,используя в качестве реагента ацетальдегид. 1 Раствор 1. 3-Амино-5-нитробензойную кислоту (10 г, 54,9 ммоль) растворяют в водном растворе хлористоводородной кислоты (концентрированный) (55 мл) и разбавляют водой (200 мл). При температуре 0-5C добавляют раствор нитрита натрия (3,788 г, 54,90 ммоль) в воде (30 мл). Раствор 2. К раствору гидрата сульфата меди (28,786 г, 115,29 ммоль) в воде (120 мл) добавляют раствор цианида калия (27,528 г, 422,73 ммоль) в воде (30 мл). Раствор 2 нагревают до температуры 65C. Значение рН раствора 1 доводят до 6-7 водным раствором карбоната натрия (насыщенный раствор), при температуре 0-5C. Раствор 1, по каплям, добавляют к раствору 2, при температуре 65C. Реакционную смесь кипятят с обратным холодильником в течение 40 мин. Реакционную смесь оставляют охлаждаться до температуры окружающей среды и подкисляют водным раствором хлористоводородной кислоты (2 н. раствор). Водную фазу три раза экстрагируют этилацетатом (3 раза по 200 мл). Объединенные органические экстракты промывают водным раствором фосфита натрия (насыщенный раствор), водой, насыщенным раствором соли и концентрируют, получая 3 циано-5-нитробензойную кислоту (7,2 г, выход 68%), которую используют без дальнейшей очистки. 1H-ЯМР (400 МГц, ДМСО-d6): 9,0 (с, 1H), 8,82 (с, 1H), 8,70 (с, 1H) м.д. Аналогичным образом, 4-циано-3-нитробензойную кислоту получают из 4-амино-3 нитробензойной кислоты. 1- 21016685 ммоль) растворяют в дихлорметане (1100 мл). Смесь желтого цвета охлаждают до температуры 0C и по каплям добавляют ангидрид трифторметансульфокислоты (87,8 г, 311 ммоль) в течение 60 мин при температуре 0-5C. После выдерживания в течение 90 мин при температуре 5C, реакционную смесь промывают водным раствором хлористоводородной кислоты (2 М раствор), затем водным раствором гидрокарбоната натрия (10% мас./об.) и, наконец, насыщенным раствором соли. Органическую фазу сушат над сульфатом натрия и концентрируют, получая метиловый эфир 3-нитро-4-трифторметансульфонилоксибензойной кислоты (89,7 г) в виде желтого масла, которое используют на следующей стадии без дальнейшей очистки. 1H-ЯМР (400 МГц, CDCl3): 8,80 (с, 1H), 8,40 (д, 1H), 7,58 (д, 1H), 4,00 (с, 3H) м.д. Метиловый эфир 3-нитро-4-трифторметансульфонилоксибензойной кислоты (89,7 г, 272 ммоль),цианид цинка (19,2 г, 163 ммоль) и тетракис(трифенилфосфин)палладий-(0) (15 г) суспендируют в N,Nдиметилформамиде (2500 мл). Реакционную смесь перемешивают в течение 3 ч при температуре 100C,в инертной атмосфере. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (элюент:циклогексан/этилацетат=3:1), получая метиловый эфир 4-циано-3-нитробензойной кислоты (34,0 г, выход 60,7%). 1H-ЯМР (400 МГц, CDCl3) : 8,92 (с, 1H), 8,48 (д, 1H), 8,04 (д, 1H), 4,03 (с, 3H) м.д. Метиловый эфир 4-циано-3-нитробензойной кислоты (13,4 г, 61,6 ммоль) растворяют в тетрагидрофуране (74 мл) и добавляют водный раствор гидроксида натрия (1 М раствор) (73,9 мл). Реакционную смесь перемешивают при температуре 25C в течение 4 ч. Затем реакционную смесь разбавляют водой(700 мл) и подкисляют водным раствором хлористоводородной кислоты (1 М раствор). Полученную смесь экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют. 4-Циано-3-нитробензойную кислоту (12,0 г) используют на следующей стадии без дальнейшей очистки. 1 В инертной атмосфере перйодную кислоту (492 г, 2,17 моль) растворяют в ацетонитриле (7,7 л) при энергичном перемешивании и затем, спустя 15 мин, последовательно добавляют оксид хрома-(VI) (25 г,0,25 моль) и 4-метил-2-нитробензонитрил (100 г, 0,62 моль). Реакционную смесь перемешивают при температуре окружающей среды в течение 16 ч. Реакционную смесь декантируют и супернатант отфильтровывают. Фильтрат концентрируют и остаток распределяют между водным раствором карбоната натрия (1 М раствор) и дихлорметаном. Осадок выделяют фильтрованием, получая 4-циано-3 нитробензойную кислоту (150 г). Фильтрат дважды экстрагируют дихлорметаном и затем подкисляют добавлением водного раствора хлористоводородной кислоты (4 н. раствор) до pH 1. Подкисленный фильтрат затем три раза экстрагируют дихлорметаном. Объединенные органические экстракты сушат над сульфатом натрия и концентрируют. Остаток распределяют между водным раствором карбоната натрия (1 М раствор) и дихлорметаном. Осадок выделяют фильтрованием, получая 4-циано-3 нитробензойную кислоту (26,67 г). Общий выход: 150 г+26,67 г=176,67 г; выход 74,5%. Пример I8. Получение 3-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-5 нитробензамида. К суспензии 3-циано-5-нитробензойной кислоты (7,2 г, 37,5 ммоль) (пример I5) в дихлорметане (40 мл) добавляют оксалилхлорид (3,808 мл, 45 ммоль) при температуре окружающей среды, затем N,Nдиметилформамид (0,2 мл). Реакционную смесь перемешивают в течение 1 ч при температуре окружающей среды и затем кипятят с обратным холодильником в течение 3 ч. Реакционную смесь оставляют охлаждаться до температуры окружающей среды и затем концентрируют. Остаток суспендируют в тетрагидрофуране (50 мл). 2,6-Диметил-4-(гептафторпроп-2-ил)анилин (9,761 г, 33,7 ммоль) (полученный согласно EP 1006102) растворяют в тетрагидрофуране (50 мл) и добавляют пиридин (6,035 мл, 75 ммоль). Полученную смесь охлаждают до температуры 0C и добавляют раствор 2-фтор-5-нитробензоилхлорида. Реакционную смесь перемешивают при температуре окружающей среды в течение 12 ч. Затем добавляют водный раствор гидрокарбоната натрия (насыщенный раствор) (100 мл) и органическую фазу дважды экстрагируют этилацетатом (2 раза по 200 мл). Объединенные органические экстракты сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=6:1), получая 3-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил) 3-Циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-5-нитробензамид (12,0 г,25,9 ммоль) (пример I8) растворяют в изопропаноле (200 мл) и добавляют хлорид олова (14,73 г, 77,7 ммоль). Полученную смесь охлаждают до температуры 0C и медленно добавляют водный раствор хлористоводородной кислоты (концентрированный) (30 мл). Реакционную смесь перемешивают при температуре 80C в течение 0,5 ч. Выпаривают 1/3 общего объема изопропанола. К концентрированной смеси добавляют воду (100 мл) и водный раствор гидроксида натрия (4 н. раствор) для доведения рН до 7-8. Водную фазу три раза экстрагируют этилацетатом (3 раза по 200 мл). Объединенные органические экстракты сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=от 4:1 до 0:1), получая 5-амино-3-циано-N-[2,6-диметил-4(1,2,2,2-тетрафтор-1-трифторметилэтил)-фенил]бензамид (10,6 г, выход 94,4%). 1 Раствор перйодной кислоты (4,787 г, 21 ммоль) в ацетонитриле (75 мл) в атмосфере азота перемешивают при температуре окружающей среды в течение 15 мин перед добавлением оксида хрома-(VI)(120 мг, 1,2 ммоль) и 2,3-дифтор-4-метилбензонитрила (0,919 г, 6 ммоль). Реакционную смесь перемешивают в течение одного часа при температуре окружающей среды. Реакционную смесь отфильтровывают и фильтрат концентрируют. Остаток обрабатывают водным раствором карбоната натрия (1 М раствор) и дважды промывают дихлорметаном. Водную фазу подкисляют водным раствором хлористоводородной кислоты (4 М раствор) и три раза экстрагируют дихлорметаном. Объединенные органические фазы сушат над сульфатом натрия и концентрируют, получая 4-циано-2,3-дифторбензойную кислоту (0,77 г, выход 70%), которую используют без дальнейшей очистки. Пример I11. Получение 4-циано-2,3-дифтор-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамида. К раствору 4-циано-2,3-дифторбензойной кислоты (623 мг, 3,4 ммоль) (пример I10) и N,Nдиметилформамида (2 капли) в дихлорметане (17 мл) в атмосфере азота добавляют оксалилхлорид(0,3455 мл, 4,08 ммоль). Реакционную смесь перемешивают в течение одного часа при температуре окружающей среды и затем в течение 1,5 ч при температуре 60C. Реакционную смесь концентрируют и остаток растворяют в тетрагидрофуране (5 мл). Полученный раствор по каплям добавляют к раствору 2,6-диметил-4-(гептафторпроп-2-ил)анилина (полученный согласно EP 1006102) (787 мг, 2,72 ммоль) и пиридина (547 мкл, 6,8 ммоль) в тетрагидрофуране (12 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 16 ч. Затем реакционную смесь выливают в водный раствор гидрокарбоната натрия (1 М раствор) и смесь три раза экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток очищают хроматографией с обращенными фазами (элюент: трифторуксусная кислота/вода/ацетонитрил=от 1:4:5 до 1:1:8), получая 4-циано 2,3-дифтор-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамид (0,675 г, выход К раствору 4-циано-2,3-дифтор-N-[2,6-диметил-4-(1,2, 2, 2-тетрафтор-1-трифторметилэтил)фенил] бензамида (0,693 г, 1,53 ммоль) (пример I11) в диметилсульфоксиде (2,32 мл) добавляют карбонат аммония (69 мг, 1,75 ммоль). Реакционную смесь нагревают при температуре 100C в течение 16 ч. Реакционную смесь оставляют охлаждаться до температуры окружающей среды и затем распределяют между водой и этилацетатом. Органическую фазу сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=7:3), получая 3 амино-4-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-2-фторбензамидH-ЯМР (400 МГц, CDCl3): 2,35 (6H, с), 4,68 (1H, ушир.с), 7,35-7,41 (4H, м), 7,74 (1H, д) м.д. Аналогичные методики используют для получения следующих соединений. 3-Амино-4-циано-N-[2,6-диэтил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-2-фторбензамид. 1 Газообразный аммиак вводят в течение 30 минут в раствор 4-циано-3-фтор-N-[2-метоксиметил-6 метил-4-(1,2,2,3,3,3-гексафтор-1-трифторметилпропил)фенил]бензамида (0,981 г, 1,90 ммоль) (пример 11) в диметилсульфоксиде (20 мл). Реакционную смесь нагревают при температуре 100C в течение 16 ч. Реакционную смесь оставляют охлаждаться до температуры окружающей среды и вводят еще газообразный аммиак. Реакционную смесь нагревают при температуре 100C в течение следующих 16 ч. Реакционную смесь оставляют охлаждаться до температуры окружающей среды и затем распределяют между водой и этилацетатом. Водную фазу 3 раза экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=3:1), получая 3-амино-4-циано-N-[2-метоксиметил-6 метил-4-(1,2,2,3,3,3-гексафтор-1-трифторметилпропил)фенил]бензамид (640 мг, выход 66%). 1 3-Амино-2,4,5-трифторбензойную кислоту (коммерчески доступна) (12,5 г, 65,50 ммоль) нагревают с тионилхлоридом (110 мл) при температуре 90C в течение 2 ч в атмосфере азота. Избыток тионилхлорида удаляют в вакууме. К раствору остатка (13,37 г, 52,30 ммоль) в дихлорметане (218 мл) в атмосфере азота добавляют раствор 2,6-диметил-4-(гептафторпроп-2-ил)анилина (полученный согласно EP 1006102) (15,12 г, 52,30 ммоль) в пиридине (4,2 мл, 52,30 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 2 ч и затем экстрагируют водным раствором хлористоводородной кислоты (1 М раствор). Водную фазу дважды экстрагируют дихлорметаном. Объединенные органические фазы промывают водным раствором гидрокарбоната натрия (1 М раствор), сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=7:3), получая 3-амино-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-2,4,5-трифторбензамид (18,4 г, выход 16%). 1 К раствору 3-амино-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-2,4,5-трифторбензамида (32,8 г, 71 ммоль) (пример I14) и трифторуксусной кислоты (237 мл) в хлороформе (118 мл) добавляют по каплям водный раствор пероксида водорода (67 мл) (35% мас./об.). Реакционную смесь поддерживают при температуре приблизительно 50C с помощью наружного охлаждения. Реакционную смесь перемешивают при температуре 55C в течение 30 мин, затем выливают в смесь льда и воды. Полученную смесь дважды экстрагируют дихлорметаном. Объединенные органические фазы промывают водным раствором гидрокарбоната натрия (1 М раствор), сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=7:3),получаяN-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3-нитро-2,4,5 трифторбензамида (6,11 г, 13,75 ммоль) (пример I15) в N,N-диметилформамиде (137 мл) при температуре 0C добавляют цианид натрия (740 мг, 15,13 ммоль). Реакционную смесь перемешивают при температуре 0C в течение одного часа и затем при температуре окружающей среды в течение 16 ч. Реакционную смесь концентрируют и остаток распределяют между водой и дихлорметаном. Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=8:2), получая 4-циано-2,5-дифтор-N-[2,6-диметил-4(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3-нитробензамид (3,2 г, выход 46,6%). 1 Раствор 4-циано-2,5-дифтор-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3 нитробензамида (5,99 г, 12 ммоль) (пример I16) в метаноле подвергают взаимодействию с водородом в течение 16 ч, в присутствии 10%-ного палладия-на-углероде (40 бар, температура 40C). Реакционную- 25016685 смесь фильтруют для удаления катализатора и фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=7:3), получая 3-амино-4-циано-2,5 дифтор-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамид (0,953 г, выход 17%). 1H-ЯМР (400 МГц, CDCl3): 2,36 (6H, с), 4,82 (2H, ушир.с), 7,12 (1H, м), 7,38 (2H, с), 7,78 (1H, д) м.д. Аналогичные методики используют для получения следующих соединений. 3-Амино-4-циано-N-[2,6-диэтил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-2,5 дифторбензамид. 1 3-Амино-4-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамид (65 мг,0,15 ммоль) (пример I2) растворяют в двухфазной смеси этилацетата (3 мл) и водного раствора гидрокарбоната натрия (1 н. раствор) (3 мл). Добавляют 4-цианобензоилхлорид (50 мг, 0,30 ммоль) при энергичном перемешивании. Реакционную смесь перемешивают в течение 3 ч при температуре окружающей среды. Фазы разделяют. Органическую фазу сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=2:1), получая соединениеA1 табл. A (81,5 мг, выход 97%). 1H-ЯМР (400 МГц, CHCl3): 9,15 (с, 1H), 8,5 (с, 1H), 8,05 (м, 2H), 7,88 (м, 4H), 7,7 (с, 1H), 7,4 (м, 2H),2,4 (с, 6 Н) м.д. Пример P2. Общая методика ацилирования аминобензамида, параллельно. Раствор A получают путем растворения аминобензамида (0,65 ммоль), 3-амино-4-циано-N-[2,6 диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамида (пример I2), в случае соединенияA3 табл. A, в толуоле (7,8 мл). Раствор B получают путем растворения хлорангидрида кислоты (1,0 моль), 2-фторбензоилхлорида, в случае соединенияA3 табл. A, в толуоле (8 мл). Раствор A (0,3 мл, 25 мкмоль) помещают в резервуар и последовательно добавляют раствор B (0,4 мл, 50 мкмоль) и диизопропилэтиламин (основание Хенига) (30 мкл, 150 мкмоль). Смесь перемешивают при температуре 55C в течение 16 ч. Смесь разбавляют смесью ацетонитрила (0,6 мл) и N,Nдиметилацетамида (0,2 мл) и затем очищают ВЭЖХ, получая желаемое соединение. Такую общую методику используют для получения ряда соединений (соединенияА 3-А 220 табл.A, соединенияB2-B15 табл. B, соединенияD1-D56 табл. D), параллельно. Пример P3. Дальнейшая общая методика ацилирования аминобензамида, параллельно.- 26016685 Раствор A получают путем растворения аминобензамида (0,65 ммоль), 3-амино-4-циано-2,5 дифтор-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамида (пример I16), в случае соединенияЕ 43 табл. E, в N,N-диметилацетамиде (18,2 мл). Раствор B получают путем добавления порошкообразного гидрида натрия (9,6 мг, 0,4 ммоль) в N,N-диметилацетамид (2 мл). Раствор C получают путем растворения хлорангидрида кислоты (0,025 моль), 2-фторбензоилхлорида, в случае соединенияE43 табл. E, в N,N-диметилацетамиде (0,2 мл). Раствор A (0,7 мл, 25 мкмоль) помещают в резервуар и добавляют раствор B (0,5 мл, 100 мкмоль). Смесь перемешивают при температуре окружающей среды в течение 30 мин. Затем добавляют раствор C(0,2 мл, 2 5 мкмоль) и смесь перемешивают при температуре окружающей среды в течение 16 ч. Смесь разбавляют водой и три раза экстрагируют дихлорметаном. Органические фазы объединяют, фильтруют и концентрируют. Остаток очищают ВЭЖХ, получая желаемое соединение. Такую общую методику используют для получения ряда соединений (соединенияE1-E59 табл. К раствору 5-амино-3-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамида (0,199 мг, 0,46 ммоль) (пример I9) в тетрагидрофуране (3 мл) последовательно добавляют пиридин (0,117 мл, 1,45 ммоль) и 4-цианобензоилхлорид (80 мг, 0,48 ммоль). Реакционную смесь перемешивают в течение 2 ч при температуре окружающей среды. Добавляют водный раствор гидрокарбоната натрия (насыщенный) и фазы разделяют. Водную фазу дважды экстрагируют этилацетатом. Объединенные органические экстракты сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат=2:1), получая соединениеВ 1 табл. BH-ЯМР (400 МГц, CHCl3): 8,45 (с, 1H), 8,36 (с, 1H), 8,27 (с, 1H), 8,00 (м, 3H), 7,84 (м, 2H), 7,63 (с,1H), 7,37 (с, 2H), 2,34 (с, 6H) м.д. Аналогичные методики используют для получения следующих соединений: соединенияF1 и F2 таблицы F и соединенияG1-G3 табл. G. Пример P5. Получение 4-циано-3-[(4'-цианобензоил)этиламино]-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]бензамида (соединениеC43 табл. C). К раствору 4-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-3-этиламинобензамида (198 мг, 0,43 ммоль) (пример I4) в тетрагидрофуране (5 мл) последовательно добавляют пиридин (0,138 мл, 1,72 ммоль) и 4-цианобензоилхлорид (0,214 мг, 1,29 ммоль). Реакционную смесь нагревают при температуре 50C в течение 16 ч. Реакционную смесь оставляют охлаждаться до температуры окружающей среды. Добавляют вторую порцию 4-цианобензоилхлорида (0,107 мг, 0,645 ммоль), пиридина (0,138 мл, 1,72 ммоль) и продолжают нагревать при температуре 90C в течение 2 ч. Реакционную смесь оставляют охлаждаться до температуры окружающей среды и затем распределяют между водным раствором гидрокарбоната натрия (1 М раствор) и этилацетатом. Водную фазу дважды экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат/циклогексан=1:4),получая соединениеC43 табл. C (0,24 г, выход 94%). Аналогичные методики используют для получения следующих соединений: соединенияC41 и К раствору 3-амино-4-циано-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил)фенил]-2 фторбензамида (68 мг, 0,15 ммоль) (пример I12) в тетрагидрофуране (2 мл) добавляют пиридин (36 мкл,0,45 ммоль) и бензоилхлорид (21 мкл, 0,18 ммоль). Реакционную смесь нагревают при облучении микроволнами, при температуре 140C в течение 30 мин. Реакционную смесь оставляют охлаждаться до температуры окружающей среды. Добавляют вторую порцию бензоилхлорида (21 мкл, 0,18 ммоль) и продолжают нагревать при температуре 140C в течение 30 мин. Реакционную смесь оставляют охлаждаться до температуры окружающей среды и затем распределяют между раствором гидрокарбоната натрия (1 М раствор) и этилацетатом. Водную фазу дважды экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток очищают хроматографией с обращенными фазами (элюент: трифторуксусная кислота/вода/ацетонитрил=от 1:4:5 до 1:1:8), получая соединение К раствору 3-амино-4-циано-2,5-дифтор-N-[2,6-диметил-4-(1,2,2,2-тетрафтор-1-трифторметилэтил) фенил]бензамида (70 мг, 0,15 ммоль) (пример I16) в хлороформе (0,75 мл) добавляют 1,8 диазабициклоундец-7-ен ("DBU") (49 мкл, 0,33 ммоль) и бензоилхлорид (17 мкл, 0,15 ммоль). Реакционную смесь нагревают при облучении микроволнами, при температуре 140C в течение 30 мин. Добавляют две дополнительные порции бензоилхлорида (17 мкл, 0,15 ммоль) и каждый раз продолжают нагревание при температуре 140C в течение 30 мин. Реакционную смесь распределяют между водой и хлороформом. Водную фазу дважды экстрагируют хлороформом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют. Остаток очищают хроматографией с обращенными фазамиE (0,013 г, выход 15%) в виде не совсем белого твердого вещества. Температура плавления: 245-248C. 1H-ЯМР (400 МГц, CDCl3): 2,28 (6H, с), 7,38 (2H, с), 7,15-8,1 (8H, м) м.д. Следующие способы используют для анализа ВЭЖХ-МС. Способ A. Способ (Water Alliance 2795 LC) со следующими градиентными условиями ВЭЖХ (растворитель A: 0,1% муравьиной кислоты в смеси вода/ацетонитрил (9:1), и растворитель B: 0,1% муравьиной кислоты в ацетонитриле). Тип колонки: Water atlantis dcl8; длина колонки: 20 мм; внутренний диаметр колонки: 3 мм; размер частиц: 3 мкм; температура: 40C. Способ B. Способ (Agilent 1100er Series) со следующими градиентными условиями ВЭЖХ (растворитель A: 0,1% муравьиной кислоты в смеси вода/ацетонитрил (9:1); растворитель B: 0,1% муравьиной кислоты в ацетонитриле; растворитель C: 0,1% муравьиной кислоты в воде; растворитель D: 0,1% муравьиной кислоты в воде). Тип колонки: Water atlantis dcl8; длина колонки: 20 мм; внутренний диаметр колонки: 3 мм; размер частиц: 3 мкм; температура: 40C. Характерные значения, полученные для каждого соединения, включают время удерживания ("RT",выраженное в мин) и молекулярный ион, обычно, катион MH+, как перечислено в табл. A и B. Таблица A. Соединения формулы (Ia)
МПК / Метки
МПК: A01N 43/48, A01N 37/34, C07C 255/58
Метки: инсектицидные, соединения
Код ссылки
<a href="https://eas.patents.su/30-16685-insekticidnye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Инсектицидные соединения</a>
Предыдущий патент: Автоматически раскладываемый демонстрационный стенд
Следующий патент: Способ укрепления скважины или трубы при помощи накачиваемой камеры
Случайный патент: Светодиодная световая панель












