Способ лечения лимфомы ходжкина с использованием комбинации гемцитабина и конъюгата антитела против cd30 с ауристатином
Номер патента: 20696
Опубликовано: 30.01.2015
Авторы: Сиверс Эрик, Офлазоглу Эзогелин, Гербер Ханс-Петер
Формула / Реферат
1. Способ лечения лимфомы Ходжкина у субъекта, включающий введение гемцитабина и конъюгата антитела против CD30 с соединением ауристатина.
2. Способ по п.1, в котором введение указанного соединения конъюгата антитело-лекарственное средство осуществляют в течение цикла лечения, причем общая вводимая доза в течение цикла лечения составляет от 0,1 до 3,2 мг/кг веса тела субъекта.
3. Способ по п.2, в котором общая вводимая доза в течение цикла лечения составляет от приблизительно 0,6 до приблизительно 3,2 мг/кг веса тела субъекта.
4. Способ по п.2 или 3, в котором введение указанного соединения конъюгата антитело-лекарственное средство осуществляют в виде дробной дозы в течение цикла лечения.
5. Способ по п.2 или 3, в котором введение указанного соединения конъюгата антитело-лекарственное средство осуществляют в виде однократной дозы в течение цикла лечения.
6. Способ по любому одному из пп.2-5, в котором цикл лечения составляет три недели.
7. Способ по любому одному из пп.2-5, в котором цикл лечения составляет четыре недели.
8. Способ по п.1, где соединение конъюгата антитело-лекарственное средство вводят в интервале доз от 0,4 до 1 мг/кг веса тела субъекта.
9. Способ по любому из пп.1-8, в котором гемцитабин вводят в дозе от 500 до 1500 мг/м2.
10. Способ по любому одному из пп.2-9, в котором указанный конъюгат и гемцитабин вводят во время цикла лечения, составляющего три или четыре недели, и при этом во время цикла лечения не вводят дополнительные противораковые средства.
11. Способ по любому из пп.1-10, в котором указанный субъект страдает лимфомой Ходжкина поздней стадии.
12. Способ по любому из пп.1-10, в котором указанный субъект имеет рецидивирующую или не поддающуюся лечению лимфому Ходжкина.
13. Способ по п.1, в котором указанное соединение конъюгата антитело-лекарственное средство вводят в течение двух или более циклов лечения, составляющих три или четыре недели.
14. Способ по любому из пп.1-13, в котором соединение ауристатина конъюгировано с антителом против CD30 посредством линкера, который является расщепляемым во внутриклеточных условиях так, что расщепление линкера высвобождает соединение ауристатина из конъюгата антитело-лекарственное средство во внутриклеточном окружении.
15. Способ по п.14, в котором указанный конъюгат имеет следующую структуру:
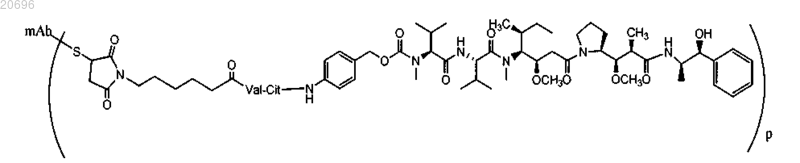
где mAb-S представляет антитело против CD30; р составляет примерно от 1 до 10.
16. Способ по любому из пп.1-13, в котором соединение ауристатина конъюгировано с антителом против CD30 посредством линкера, который является не расщепляемым во внутриклеточных условиях, и соединение ауристатина высвобождается из конъюгата посредством деградации антитела.
17. Способ по п.16, в котором указанный конъюгат имеет следующую структуру:
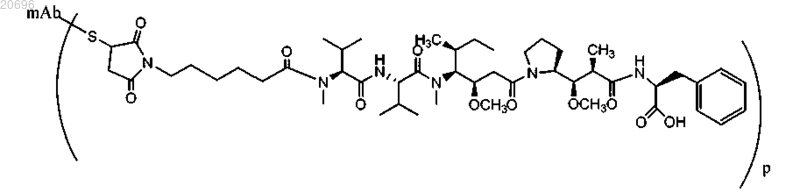
где mAb-S представляет антитело против CD30; p составляет примерно от 1 до 10.
18. Способ по п.15 или 17, в котором с каждым антителом конъюгировано в среднем 4 соединения ауристатина.
19. Способ по любому пп.1-13, в котором указанное антитело против CD30 представляет собой химерное антитело АС10 или конкурирует за связывание с химерным антителом АС10.
20. Способ по п.19, в котором антитело против CD30 представляет собой химерное антитело АС10.
21. Применение гемцитабина и конъюгата антитела против CD30 с соединением ауристатина для производства лекарственного средства для лечения лимфомы Ходжкина у субъекта.
Текст
СПОСОБ ЛЕЧЕНИЯ ЛИМФОМЫ ХОДЖКИНА С ИСПОЛЬЗОВАНИЕМ КОМБИНАЦИИ ГЕМЦИТАБИНА И КОНЪЮГАТА АНТИТЕЛА ПРОТИВ CD30 С АУРИСТАТИНОМ Изобретение относится к медицине, в частности к способу лечения лимфомы Ходжкина. Способ предусматривает введение гемцитабина и конъюгата антитела против CD30 с соединением ауристатина. Изобретение позволяет увеличить эффективность лечения лимфомы Ходжкина. Преемственность По заявке на настоящий патент испрашивается приоритет предварительной заявки на патент США 60/979594, поданной 10 декабря 2007 г., предварительной заявки на патент США 60/027668, поданной 2 ноября 2008 г., и предварительной заявки на патент США 61/040641, поданной 28 марта 2008 г., содержание которых полностью включено в настоящее описание посредством ссылки. Область техники Настоящее изобретение относится, в числе прочего, к способам лечения лимфомы Ходжкина,включающим назначение нуждающемуся в этом субъекту как схемы химиотерапевтического лечения,так и соединения конъюгата антитело-лекарственное средство. Предпосылки создания изобретения Лимфома Ходжкина (HL) является опухолью лимфоидной ткани, которая гистопатологически определяется по присутствию злокачественных клеток Ходжкина-Рида-Штернберга (HRS). Характерным поверхностным антигеном, экспрессируемым на клетках HRS, является CD30. По оценке 8000 новых случаев HL диагностируется ежегодно в Соединенных Штатах и Канаде. Успехи в использовании комбинированной терапии и лучевой терапии при HL в течение последнего полувека привели к степени длительной ремиссии, составляющей приблизительно 70%. Однако эти схемы назначения множества средств вызывают у пациентов значительное число клинических проявлений, включающих вторичные злокачественные опухоли, болезни сердца и бесплодие. Кроме того, приблизительно 30% пациентов, имеющих HL, становятся нечувствительными к первоначальной терапии или переносят рецидив. Схемы "химиотерапии спасения" (резервной химиотерапии) и трансплантация аутологичных стволовых клеток (ASCT) представляют собой дополнительные возможности для этих пациентов, но и эти схемы, и трансплантация сопровождаются значительным числом клинических проявлений и ограниченным контролем длительного заболевания. Пациенты, которые переносят рецидив после ASCT или непригодны для терапии спасения, имеют очень плохой прогноз. В настоящее время отсутствуют хорошо переносимые, эффективные возможности лечения этих пациентов. Гемцитабин, отдельно или в комбинации с другой химиотерапией, был изучен в ситуации до и после ASCT. В случае не подвергавшихся трансплантации пациентов с HL, перенесших рецидив или не поддающихся лечению, которые были подвергнуты лечению гемцитабином, доли ответных реакций достигают 39% (Santoro et al., J. Clin. Oncol. 2000 18(13): 2615-2619). В случае перенесших рецидив/не поддающихся лечению пациентов, когда большинство пациентов были подвергнуты предшествующей аутологичной или аллогенной трансплантации, доли ответных реакций на гемцитабин снижены (22%), и гематологическая токсичность схемы вызывает необходимость в уменьшении дозы до 1000 мг/м 2 (Venkatesh et al., Clin. Lymphoma 2004 5(2): 110-115). Для схемы комбинированного лечения, в которой используется гемцитабин, винорелбин и пегилированный липосомальный доксорубицин, (GVD) показана многообещающая эффективность при рецидивирующей/не поддающейся лечению HL. В совместном анализе пациентов до и после ASCT наблюдались доли всех ответных реакций, составляющие 70%, однако при этом в популяции до ASCT наблюдались ограничивающие дозу токсичности, состоящие из мукозита, а в популяции после ASCT наблюдалась лихорадочная нейтропения (Bartlett et al., CALGB 59804Ann. Oncoo, 2007, 18(6): 1071-1079). Только 32 и 26% пациентов, которые не подвергались трансплантации и после ASCT, соответственно, смогли получить все дозы по схеме в полной дозе. Для пациентов, не отвечающих на стандартную химиотерапию или перенесших рецидив, единственной потенциально лечебной терапией является высокодозовая химиотерапия в комбинации с трансплантацией стволовых клеток. Это лечение также сопровождается значительным числом клинических проявлений и значительной смертностью, и долей выживания в течение 5 лет, составляющей 50%. Следовательно, сохраняется неудовлетворенная терапевтическая потребность для пациентов, страдающих HL. Настоящее изобретение направлено на эту и другие потребности. Краткое описание чертежей Фиг. 1 А. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с ABVD в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клетки HLL540cy в правый бок. Группы мышей (9-10/группа) не подвергались лечению или получали cAC10vcMMAE (1 мг/кг, q4d3 (раз в 4 дня 3), внутрибрюшинно) и/или ABVD: адриамицин (1 мг/кг, q4d3,внутривенно), блеомицин (7,5 мк/кг, q4d3, внутрибрюшинно), винбластин (0,015 мг/кг, q4d3, внутрибрюшинно) и дакарбазин (20 мг/кг, q3d4, внутрибрюшинно), когда размеры опухолей колебались около среднего размера, составляющего приблизительно 100 мм 3. Фиг. 1 В. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с ABVD в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клетки HLL540cy в правый бок. Группы мышей (9-10/группа) не подвергались лечению или получали cAC10vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) и/или ABVD: адриамицин (0,75 мг/кг, q4d3, внутривенно),блеомицин (6 мк/кг, q4d3, внутрибрюшинно), винбластин (0,01 мг/кг, q4d3, внутрибрюшинно) и дакарбазин (15 мг/кг, q3d4, внутрибрюшинно), когда размеры опухолей колебались около среднего размера, составляющего приблизительно 300 мм 3. Фиг. 2 А. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с гемцитабином в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клеткиHL L540cy в правый бок. Группы мышей (5-10/группа) не подвергались лечению или получали cAC10vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, гемцитабин (120 мг/кг, q4d3, внутрибрюшинно) отдельно или комбинированное лечение с использованием cAC10-vcMMAE и гемцитабина, когда размеры опухолей колебались около среднего размера, составляющего приблизительно 100 мм 3. Фиг. 2 В. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с гемцитабином в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клеткиHL L540cy в правый бок. Группы мышей (5-10/группа) не подвергались лечению или получали cAC10vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, гемцитабин (120 мкг/кг, q4d3, внутрибрюшинно) отдельно или комбинированное лечение с использованием cAC10-vcMMAE и гемцитабина, когда размеры опухолей колебались около среднего размера, составляющего приблизительно 300 мм 3. Фиг. 3A. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с GVD в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клетки HLL540cy в правый бок. Группы мышей (8-10/группа) не подвергались лечению или получали cAC10vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, GVD отдельно или комбинированное лечение с использованием cAC10-vcMMAE и GVD, когда размеры опухолей колебались около среднего размера,составляющего приблизительно 100 мм 3. Схема лечения GVD включала гемцитабин в дозе 60 мг/кг,q4d3, внутрибрюшинно, винорелбин в дозе 2 мг/кг, q5d3, внутрибрюшинно и доксорубицин в дозе 1,5 мг/кг, q4d3, внутривенно. Фиг. 3 В. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с GVD в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клетки HLL540cy в правый бок. Группы мышей (8-10/группа) не подвергались лечению или получали cAC10vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, GVD отдельно или комбинированное лечение с использованием cAC10-vcMMAE и GVD, когда размеры опухолей колебались около среднего размера,составляющего приблизительно 100 мм 3. Схема лечения GVD включала гемцитабин в дозе 60 мг/кг,q4d3, внутрибрюшинно, винорелбин в дозе 2 мг/кг, q5d3, внутрибрюшинно и доксорубицин в дозе 1,5 мг/кг, q4d3, внутривенно. Фиг. 4 А. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с винорелбином в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клетки HL L540cy в правый бок. Группы мышей (5-10/группа) не подвергались лечению или получалиcAC10-vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, винорелбин (4 мг/кг, q5d3) отдельно или комбинированное лечение с использованием cAC10-vcMMAE и винорелбина, когда размеры опухолей колебались около среднего размера, составляющего приблизительно 100 мм 3. Фиг. 4 В. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с винорелбином в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клеткиHL L540cy в правый бок. Группы мышей (5-10/группа) не подвергались лечению или получали cAC10vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, винорелбин (4 мг/кг, q5d3) отдельно или комбинированное лечение с использованием cAC10-vcMMAE и винорелбина, когда размеры опухолей колебались около среднего размера, составляющего приблизительно 100 мм 3. Фиг. 5 А. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с доксорубицином в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клетки HL L540cy в правый бок. Группы мышей (5-10/группа) не подвергались лечению или получалиcAC10-vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, доксорубицин (3 мг/кг, q4d3) отдельно или комбинированное лечение с использованием cAC10-vcMMAE и доксорубицина, когда размеры опухолей колебались около среднего размера, составляющего приблизительно 100 мм 3. Фиг. 5 В. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с доксорубицином в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клетки HL L540cy в правый бок. Группы мышей (5-10/группа) не подвергались лечению или получалиcAC10-vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, доксорубицин (1,5 мг/кг, q4d3) отдельно или комбинированное лечение с использованием cAC10-vcMMAE и доксорубицина, когда размеры опухолей колебались около среднего размера, составляющего приблизительно 100 мм 3. Фиг. 6. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с винбластином в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клеткиHL L540cy в правый бок. Группы мышей (7-10/группа) не подвергались лечению или получали cAC10vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, винбластином (0,1 мг/кг, q4d3) отдельно или комбинированное лечение с использованием cAC10-vcMMAE и винбластина, когда размеры опухолей колебались около среднего размера, составляющего приблизительно 300 мм 3. Фиг. 7. Противоопухолевая активность cAC10-vcMMAE отдельно или в комбинации с гемцитабином в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клеткиHL L540cy в правый бок. Группы мышей (6-8/группа) не подвергались лечению или получали cAC10-2 020696vcMMAE (1 мг/кг, q4d3, внутрибрюшинно) отдельно, гемцитабин (120 мг/кг, q4d3, внутрибрюшинно) отдельно или комбинированное лечение с использованием cAC10-vcMMAE и гемцитабина, когда размеры опухолей колебались около среднего размера, составляющего приблизительно 100 мм 3. Фиг. 8. Противоопухолевая активность cAC10-mcMMAF отдельно или в комбинации с гемцитабином в отношении подкожных опухолей HL L540cy у мышей SCID. Мышам SCID имплантировали клеткиHL L540cy в правый бок. Группы мышей (10/группа) не подвергались лечению или получали cAC10mcMMAF (1 мг/кг, q4d3, внутрибрюшинно) отдельно, гемцитабин (120 мг/кг, q4d3, внутрибрюшинно) отдельно или комбинированное лечение с использованием cAC10-mcMMAF и гемцитабина, когда размеры опухолей колебались около среднего размера, составляющего приблизительно 100 мм 3. Фиг. 9. Измененная схема назначения доз cAC10-vcMMAE. Общее количество cAC10-vcMMAE сохраняли постоянным на уровне 3 мг/кг, и дозу дробили в различных схемах. Подробное описание иллюстративных вариантов осуществления изобретения А. Общее введение. Настоящим изобретением предоставляются, в числе прочего, способы лечения лимфомы Ходжкина. Авторы настоящего изобретения обнаружили, что комбинированная терапия с использованием двух различных классов противораковых соединений, соединений конъюгатов антитело-лекарственное средство и химиотерапевтических средств, может увеличить терапевтическую пользу для субъектов, страдающихHL. В частности, авторы настоящего изобретения установили, что комбинированная терапия с использованием гемцитабина и антитела против CD30, конъюгированного с соединением ауристатином, обеспечивает синергетические терапевтические эффекты при лечении HL. До создания настоящего изобретения нельзя было ожидать, что химиотерапевтическое средство и антитело против CD30, конъюгированное с соединением ауристатином, могут иметь синергетический эффект при лечении HL. В целях ясности описания, но не в качестве ограничения, подробное описание настоящего изобретения разделено на следующие подразделы. В. Краткое изложение. Настоящее изобретение основано, среди прочего, на обнаружении того, что комбинированная терапия с использованием гемцитабина, и антитела против CD30, конъюгированного с соединением ауристатином, обеспечивает синергетические терапевтические эффекты при лечении HL. В одном варианте осуществления предоставляются способы лечения лимфомы Ходжкина. Способы включают введение нуждающемуся в этом субъекту гемцитабина и соединения конъюгата антителолекарственное средство. Введение соединения конъюгата антитело-лекарственное средство и гемцитабина обеспечивает синергетический эффект при лечении лимфомы Ходжкина у пациента. Соединением конъюгата антитело-лекарственное средство является антитело против CD30, конъюгированное с соединением ауристатином. В другом варианте осуществления способы лечения лимфомы Ходжкина у субъекта, по существу,состоят из введения нуждающемуся в этом субъекту гемцитабина и соединения конъюгата антителолекарственное средство. Введение соединения конъюгата антитело-лекарственное средство и гемцитабина обеспечивает синергетический эффект при лечении лимфомы Ходжкина у пациента. Соединением конъюгата антитело-лекарственное средство является антитело против CD30, конъюгированное с соединением ауристатином. Доставку соединения конъюгата антитело-лекарственное средство обычно осуществляют в течение цикла лечения. Цикл лечения может быть любой подходящей продолжительности по времени. В одном аспекте он составляет три или четыре недели. Настоящим изобретением также предоставляется применение соединения конъюгата антителолекарственное средство для производства лекарственного средства, вводимого при комбинированной терапии с использованием гемцитабина для лечения лимфомы Ходжкина у субъекта. Введение соединения конъюгата антитело-лекарственное средство и гемцитабина обеспечивает синергетический эффект при лечении лимфомы Ходжкина у пациента. Соединением конъюгата антитело-лекарственное средство является антитело против CD30, конъюгированное с соединением ауристатином. С. Определения и сокращения. Кроме случаев, оговоренных особо, все используемые в настоящем документе технические и научные термины имеют то же значение, что и значение, в котором они обычно понимаются специалистом со средним уровнем компетентности в области техники, имеющей отношение к описанным в настоящем документе способам и композициям. Используемые в настоящем документе следующие термины и выражения имеют приписанные им значения, кроме особо оговоренных случаев. Используемый в настоящем документе термин "ингибирует" или "ингибирование" означает уменьшение на измеряемое количество или полное предотвращение. Используемое в настоящем документе промежуточное выражение "по существу, состоящий из" огранивает объем притязания до точно определенных активных агентов или стадий и тех дополнительных активных агентов и стадий, которые не оказывают существенное влияние на свойства точно определенных активных агентов. Используемый в настоящем документе термин "агент" ("средство") означает элемент, соединение или молекулярную сущность, в том числе, например, фармацевтическое, терапевтическое или фармакологическое соединение. Агенты могут быть природными или синтетическими или их комбинацией. "Терапевтическим противораковым средством" является средство, оказывающее терапевтический (например, положительный) эффект на раковые клетки или отдельно или в комбинации с другим агентом. Как правило, терапевтическими противораковыми средствами, используемыми в соответствии со способами и композициями, описанными в настоящем документе, являются средства, проявляющие цитотоксический и/или цитостатический эффект на клетки-мишени. В применении к эффекту агента на клетку "цитотоксический эффект" означает уничтожение клетки."Цитотоксический эффект" означает ингибирование пролиферации клеток. Под "цитотоксическим агентом" подразумевается агент, который оказывает цитотоксический или цитостатический эффект на клетку, тем самым сокращая или ингибируя рост, соответственно, клеток в популяции клеток. В контексте эффекта конъюгата антитело против CD30-лекарственное средство, термин "истощает" относится к снижению или ликвидации CD30-экспрессирующих клеток. Термины "специфическое связывание" или "специфически связывается" означают, что антитело против CD30 будет взаимодействовать высоко избирательным образом с соответствующей ему мишенью, CD30, но не с множеством других антигенов. Как правило, антитело против CD30 связывается с аффинностью, составляющей по крайней мере приблизительно 110-7 М и предпочтительно от 10-8 М до 10-9 М, 10-10 М, 10-11 М или 10-12 М. Используемый в настоящем документе термин "антитело" относится к (а) полипептидам иммуноглобулинам или иммунологически активным частям полипептидов иммуноглобулинов, т.е. полипептидам семейства иммуноглобулинов или их фрагментам, которые содержат антигенсвязывающий сайт, который иммуноспецифически связывается с конкретным антителом (например, CD30), или (b) консервативно замещенным производным таких полипептидов иммуноглобулинов или фрагментов, которые иммуноспецифически связываются с антителом (например, CD30). Антитела в общих чертах описываются,например, HarlowLane в Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1988). Используемый в настоящем документе термин "антитело" включает антитела, которые были модифицированы путем ковалентного присоединения гетерологичной молекулы, такого как, например, присоединение гетерологичного полипептида, или путем гликозилирования, ацетилирования или фосфорилирования, обычно не ассоциированных с антителом, и подобного. Термин "моноклональное антитело" относится к антителу, которое происходит из клона одной клетки, в том числе клона любой эукариотической или прокариотической клетки, или фагового клона, а не к способу, с помощью которого его получают. Следовательно, используемый в настоящем документе термин "моноклональное антитело" не ограничивается антителами, полученными благодаря гибридомной технологии. Термины "идентичные" или "идентичность в процентах", в контексте двух или более последовательностей нуклеиновых кислот или полипептидных последовательностей, относятся к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или имеют точно определенный процент нуклеотидов или аминокислотных остатков, которые являются одинаковыми, при сравнении и выравнивании для максимального соответствия. Для определения идентичности в процентах последовательности выравнивают в целях оптимального сравнения (например, в первую аминокислотную или нуклеотидную последовательность для оптимального выравнивания со второй аминокислотной или нуклеотидной последовательностью могут быть введены разрывы (gap. Затем сравнивают аминокислотные остатки или нуклеотиды в соответствующих положениях аминокислот или нуклеотидов. Когда положение в первой последовательности и соответствующее положение во второй последовательности занимает один и тот же аминокислотный остаток или нуклеотид, молекулы являются идентичными по этому положению. Идентичность в процентах между двумя последовательностями зависит от числа идентичных положений, общих для последовательностей (т.е. идентичность в % =идентичных положений/общееположений (например, перекрывающихся положений)100). В некоторых вариантах осуществления длины двух последовательностей являются одинаковыми. Термин "в значительной степени идентичные", в контексте двух нуклеиновых кислот или полипептидов, относится к двум или более последовательностям или подпоследовательностям, которые идентичны по крайней мере на 70% или по крайней мере 75%, обычнее по крайней мере 80% или по крайней мере 85% и даже обычнее по крайней мере 90%, по крайней мере 95% или по крайней мере 98% (как определено с использованием одного из изложенных способов)."Сходство" или "сходство в процентах", в контексте двух или более полипептидных последовательностей, относится к двум или более последовательностям или подпоследовательностям, которые имеют точно определенный процент аминокислотных остатков, которые являются одинаковыми или консервативно замещены после сравнения и выравнивания для максимального соответствия, определяемый, используя один из изложенных ниже способов. В качестве примера первая аминокислотная последовательность считается сходной со второй аминокислотной последовательностью, когда первая аминокислотная последовательность идентична или консервативно замещена по крайней мере на 50, 60, 70, 75, 80, 90 или даже 95% второй аминокислотной последовательности после сравнения с числом аминокислот, равным числу аминокислот, содержащихся в первой последовательности, или после сравнения с выравниванием полипептидов, которое было осуществлено с помощью известной в данной области техники компьютерной программы для определения сходства. Термин "значительное сходство", в контексте полипептидных последовательностей, означает, что область полипептида имеет последовательность по крайней мере с 70%, обычно по крайней мере 80%,обычнее по крайней мере 85% или даже обычнее по крайней мере 90% или по крайней мере 95% сходством с контрольной последовательностью. Например, полипептид в значительной степени сходен со вторым полипептидом, например, когда два пептида отличаются одной или более консервативными заменами. Определение идентичности или сходства в процентах между двумя последовательностями можно успешно выполнить, используя математический алгоритм. Предпочтительным, не ограничивающим примером математического алгоритма, используемого для сравнения двух последовательностей, является алгоритм Karlin и Altschul, 1990, Proc. Natl. Acad. Sci. USA 87: 2264-2268, модифицированный, как описано Karlin и Altschul, 1993, в Proc. Natl. Acad. Sci. USA 90: 5873-5877. Такой алгоритм включен в программы NBLAST и XBLAST, созданные Altschul и др., 1990, J. Mol. Biol. 215: 403-410. Поиски нуклеотидных последовательностей-гомологов BLAST можно выполнить с использованием программыNBLAST, при оценке в баллах = 100, размере слова = 12, для получения нуклеотидных последовательностей, гомологичных нуклеиновой кислоте, кодирующей представляющий интерес белок. Поиски белковгомологов BLAST можно выполнить с использованием программы XBLAST, при оценке в баллах = 50,размере слова = 3, для получения аминокислотных последовательностей, гомологичных представляющему интерес белку. Для выполнения в целях сравнения выравниваний с использованием пропусков можно использовать BLAST с введением разрывов, описанную Altschul и др., 1997, Nucleic Acids Res. 25: 3389-3402. В альтернативном случае можно использовать PSI-Blast для выполнения повторяющегося поиска, с помощью которого выявляется дальнее родство между молекулами (Id.). При использовании программ BLAST, BLAST с введением пропусков и PSI-BLAST можно использовать параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST) (см., например, по адресу Интернет-сервера: www.ncbi.nlm.nih.gov). Другим предпочтительным, не ограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Myers иMiller, CABIOS (1989). Такой алгоритм включен в программу ALIGN (версии 2.0), которая является частью пакета программ для выравнивания последовательностей GCG. При использовании программыALIGN для сравнения аминокислотных последовательностей можно использовать таблицу остатков в соответствии с массой РАМ 120, штраф за размер пропуска - 12 и штраф за пропуск в последовательности - 4. Дополнительные алгоритмы для анализа последовательностей известны в данной области техники и включают ADVANCE и ADAM, описанные Torellis и Robotti, 1994, в Coraput. Appl. Biosci. 10: 3-5, иFASTA, описанный Pearson и Lipman, 1988, в Proc. Natl. Acad. Sci. 85: 2444-2448. В FASTA ktup является регулировочной опцией, устанавливающей дискретность и скорость поиска. Если ktup = 2, сходные области в двух сравниваемых последовательностях обнаруживают при проверке пар выравненных остатков; если ktup = 1, проверяют одиночные выравненные аминокислоты. Можно установить ktup = 2 или 1 для последовательностей белков или от 1 до 6 для последовательностей ДНК. Ktup по умолчанию, в случае отсутствия оговорки, равняется 2 для последовательностей белков или от 1 до 6 для последовательностей ДНК. В отношении дополнительного описания параметров FASTA см., например, bioweb.pasteur.fr/docs/man/man/fasta.1.htmlsect2, содержание которого включено сюда посредством ссылки. В альтернативном случае выравнивание последовательностей белков можно выполнить, используя алгоритм CLUSTAL W, описанный Higgins и др., 1996, в Methods Enzymol. 266: 383-402. Используемые в настоящем документе термины "лечение" или "подвергаться лечению" относится к замедлению, остановке или реверсированию развития HL у субъекта, что подтверждается уменьшением или устранением клинического или диагностического симптома заболевания. Лечение может включать,например, уменьшение тяжести симптома, числа симптомов или частоты рецидива, например, ингибирование роста опухоли, остановку роста опухоли или регрессию уже существующих опухолей. Используемый в настоящем документе термин "противораковое средство" относится к любому средству, которое замедляет, останавливает или вызывает реверсию развития рака у субъекта. Например,противораковым средством является средство, которое ингибирует рост опухоли, останавливает рост опухоли и/или вызывает регрессию уже существующих опухолей. Противовоспалительные средства или другие агенты, назначаемые страдающему раком субъекту для лечения сопровождающих рак симптомов, включающих, например, воспаление, потерю веса и общее недомогание, не считаются противораковыми средствами. Используемый в настоящем документе термин "фармацевтически приемлемый" относится к таким соединениям, материалам, композициям и/или лекарственным формам, которые, в рамках тщательной медицинской оценки, подходят для приведения в контакт с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, которые соот-5 020696 ветствуют приемлемому отношению польза/риск. Термин "фармацевтически совместимый ингредиент" относится к фармацевтически приемлемому разбавителю, адъюванту, наполнителю или носителю, с которым вводится соединение конъюгата антитело-лекарственное средство. Используемый в настоящем документе при упоминании комбинированной терапии термин "терапевтически эффективное количество" означает такое количество комбинации взятых вместе агентов, что их комбинированное действие вызывает требуемую биологическую или терапевтическую реакцию, т.е. ингибирует возникновение или уменьшает интенсивность одного или более клинических или диагностических симптомов лимфомы Ходжкина. Например, используемый в настоящем документе при упоминании комбинированной терапии термин "терапевтически эффективное количество" мог бы быть количеством соединения конъюгата антитело-лекарственное средство или количеством химиотерапевтического средства (средств), которые после введения вместе, либо последовательно, либо одновременно, в одни и те же или различные дни во время цикла лечения, имеют суммарный эффект, который является терапевтически эффективным и синергетическим. Кроме того, квалифицированному в данной области техники специалисту будет понятно, что в случае комбинированной терапии с использованием терапевтически эффективного количества, как в приведенном выше примере, количество соединения конъюгата антитело-лекарственное средство и/или количество химиотерапевтического средства (средств) индивидуально может быть или может не быть терапевтически эффективным. Сокращение "ММАЕ" относится к монометилауристатину Е. Сокращение "MMAF" означает довалин-валин-долаизолейцин-долапроин-фенилаланин. Сокращение "fk" и "phe-lys" относится к дипептиду фенилаланин-лизин. Сокращение "vc" и "val-cit" относится к дипептиду валин-цитруллин. Термин "соединение" относится и включает само химическое соединение, а также, указано ли явно или нет, и кроме случаев, когда контекст разъясняет, что должно быть исключено следующее: аморфные и кристаллические формы соединения, включающие полиморфные формы, причем эти формы могут быть частью смеси или в выделенной форме; формы соединений в виде свободных кислот и свободных оснований, которые обычно являются формами, продемонстрированными в предоставленных в настоящем документе структурах; изомеры соединения, которое относится к оптическим изомерам, и таутомерные изомеры, причем оптические изомеры включают энантиомеры и диастереомеры, хиральные изомеры и нехиральные изомеры, и оптические изомеры включают выделенные оптические изомеры, а также смеси оптических изомеров, включающие рацемические и нерацемические смеси; причем изомер может быть в выделенной форме или в смеси с одним или более другими изомерами; изотопы соединения,включающие содержащие дейтерий и тритий соединения, и включающие соединения, содержащие радиоизотопы, в том числе терапевтически и диагностически эффективные радиоизотопы; мультимерные формы соединения, включающие димерные, тримерные и т.п. формы; соли соединения, предпочтительно фармацевтически приемлемые соли, включающие соли присоединения кислоты и соли присоединения основания, включающие соли, имеющие органические противоионы и неорганические противоионы, и включающие цвитер-ионные формы, причем, если соединение сопровождается двумя или более противоионами, два или более противоиона могут быть одинаковыми или различными; и сольваты соединения, включающие полусольваты, моносольваты, дисольваты и т.п., включающие органические сольваты и неорганические сольваты, при этом указанные неорганические сольваты включают гидраты; причем,если соединение сопровождается двумя или более молекулами сольвента, две или более молекулы сольвента могут быть одинаковыми или различными. В некоторых случаях приведенная в настоящем документе ссылка на соединение настоящего изобретения будет включать прямую ссылку на одну или более из вышеуказанных форм, например соли и/или сольваты; однако эта ссылка приведена только для акцента и не должна быть истолкована как исключение других форм, идентифицированных выше. В настоящем документе "фармацевтически приемлемые соли" относятся к производным описанных в настоящем документе соединений, причем исходное соединение модифицируют путем получения его соли присоединения кислоты или основания. Примеры фармацевтически приемлемых солей включают,но без ограничения, соли, полученные взаимодействием основных остатков, таких как амины, с минеральными или органическими кислотами; соли, полученные взаимодействием кислотных остатков, таких как карбоновые кислоты, с щелочами или органическими основаниями; и т.п. Фармацевтически приемлемые соли включают общепринятые нетоксичные соли или четвертичные аммонийные соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие общепринятые нетоксичные соли включают соли, получаемые из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и т.п.; и соли, приготовленные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая,стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная,фумаровая кислота, толуолсульфокислота, метансульфокислота, этандисульфокислота, щавелевая, изэтионовая кислота и т.п. Эти физиологически приемлемые соли готовят известными в данной области техники способами, например растворением оснований в виде свободных аминов с избытком кислоты в водном спирте или нейтрализацией свободной карбоновой кислоты основанием в виде щелочного метал-6 020696 ла, таким как гидроксид, или амином. Кроме особо оговоренных случаев, термин "алкил" относится к насыщенному неразветвленному или разветвленному углеводороду, имеющему от приблизительно 1 до приблизительно 20 атомов углерода (и все комбинации и субкомбинации диапазонов и конкретных чисел атомов углерода в нем), при этом предпочтительным является диапазон от приблизительно 1 до приблизительно 8 атомов углерода. Примерами алкильных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил,трет-бутил, н-пентил, 2-пентил, 3-пентил, 2-метил-2-бутил, н-гексил, н-гептил, н-октил, н-нонил, ндецил, 3-метил-2-бутил, 3-метил-1-бутил, 2-метил-1-бутил, 1-гексил, 2-гексил, 3-гексил, 2-метил-2 пентил, 3-метил-2-петил, 4-метил-2-пентил, 3-метил-3-пентил, 2-метил-3-пентил, 2,3-диметил-2-бутил и 3,3-диметил-2-бутил. Алкильные группы, отдельно или в виде части другой группы, могут быть необязательно замещены одной или более группами, предпочтительно 1-3 группами (и любыми дополнительными заместителями,выбираемыми из галогена), включающими, но без ограничения, -галоген, -O-(C1-C8-алкил), -O-(C2-C8 алкенил), -O-(C2-C8-алкинил), -арил, -C(O)R', -OC(O)R', -C(О)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2,-NHC(O)R', -SR', -SO3R', -S(O)2R', -S(O)R', -OH, =O, -N3, -NH2, -NH(R'), -N(R')2 и -CN, где каждый R' независимо выбирают из -Н, -C1-C8-алкила, -C2-C8-алкенила, -C2-C8-алкинила или -арила, и где указанные группы -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2-C8-алкинил), -арил, -C1-C8-алкил, -C2-C8-алкенил и-C2-C8-алкинил могут быть необязательно дополнительно замещены одной или более группами, включающими, но без ограничения, -C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил, -галоген, -O-(C1-C8-алкил),-O-(C2-C8-алкенил), -O-(C2-C8-алкинил), -арил, -C(O)R", -OC(O)R", -C(О)OR, -C(O)NH2, -C(O)NHR",-C(O)N(R")2, -NHC(O)R", -SR", -SO3R", -S(O)2R", -S(O)R", -OH, -N3, -NH2, -NH(R"), -N(R")2 и -CN, где каждый R независимо выбирают из -Н, -C1-C8-алкила, -C2-C8-алкенила, -C2-C8-алкинила или -арила. Кроме особо оговоренных случаев, термины "алкенил" и "алкинил" относятся к неразветвленным и разветвленным углеводородным цепям, имеющим от приблизительно 2 до приблизительно 20 атомов углерода (и все комбинации и субкомбинации диапазонов и конкретных чисел атомов углерода в нем),при этом предпочтительным является диапазон от приблизительно 2 до приблизительно 8 атомов углерода. Алкенильная цепь имеет по крайней мере одну двойную связь в цепи, а алкинильная цепь имеет по крайней мере одну тройную связь в цепи. Примеры алкенильных групп включают, но без ограничения,этилен или винил, аллил, -1-бутенил, -2-бутенил, -изобутиленил, -1-пентенил, -2-пентенил, -3-метил-1 бутенил, -2-метил-2-бутенил и -2,3-диметил-2-бутенил. Примеры алкинильных групп включают, но без ограничения, ацетиленовую группу, пропаргил, ацетиленил, пропинил, -1-бутинил, -2-бутинил, -1 пентинил, -2-петинил и -3-метил-1-бутинил. Алкенильные или алкинильные группы, отдельно или в виде части другой группы, могут быть необязательно замещены одной или более группами, предпочтительно 1-3 группами (и любыми дополнительными заместителями, выбираемыми из галогена), включающими, но без ограничения, -галоген, -O(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2-C8-алкинил), -арил, -C(O)R', -OC(O)R', -С(О)OR', -C(O)NH2,-C(O)NHR', -C(O)N(R')2, -NHC(O)R', -SR', -SO3R', -S(O)2R', -S(O)R', -OH, =O, -N3, -NH2, -NH (R'), -N(R')2 и-CN, где каждый R' независимо выбирают из -Н, -C1-C8-алкила, -C2-C8-алкенила, -C2-C8-алкинила или-арила, и где указанные группы -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2-C8-алкинил), -арил, -C1-C8 алкил, -C2-C8-алкенил и -C2-C8-алкинил могут быть необязательно дополнительно замещены одним или более заместителями, включающими, но без ограничения, -C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил,-галоген, -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2-C8-алкинил), -арил, -C(O)R, -OC(O)R, -C(О)OR",-C(O)NH2, -C(O)NHR", -C(O)N(R")2, -NHC(O)R", -SR", -SO3R", -S(O)2R", -S(O)R", -OH, -N3, -NH2,-NH(R), -N(R")2 и -CN, где каждый R независимо выбирают из -Н, -C1-C8-алкила, -C2-C8-алкенила, -C2C8-алкинила или -арила. Кроме особо оговоренных случаев, термин "алкилен" относится к насыщенному углеводородному радикалу с неразветвленной или разветвленной цепью, имеющему от приблизительно 1 до приблизительно 20 атомов углерода (и все комбинации и субкомбинации диапазонов и конкретных чисел атомов углерода в нем), при этом предпочтительным является диапазон от приблизительно 1 до приблизительно 8 атомов углерода, и имеющему два одновалентных радикальных центра, возникающих при удалении двух атомов водорода от одного и того же или двух различных атомов углерода исходного алкана. Типичные алкилены включают, но без ограничения, метилен, этилен, пропилен, бутилен, пентилен, гексилен, гептилен, окситилен, нонилен, декален, 1,4-циклогексилен и т.п. Алкиленовые группы, отдельно или в виде части другой группы, могут быть необязательно замещены одной или более группами, предпочтительно 1-3 группами (и любыми дополнительными заместителями, выбираемыми из галогена), включающими, но без ограничения, -галоген, -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2-C8-алкинил), -арил,-C(O)R', -OC(O)R', -C(О)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2, -NHC(O)R', -SR', -SO3R', -S(O)2R',-S(O)R', -OH, =O, -N3, -NH2, -NH(R'), -N(R')2 и -CN, где каждый R' независимо выбирают из -Н, -C1-C8 алкила, -C2-C8-алкенила, -C2-C8-алкинила или -арила, и где указанные группы -O-(C1-C8-алкил), -O-(C2C8-алкенил), -O-(C2-C8-алкинил), -арил, -C1-C8-алкил, -C2-C8-алкенил и -C2-C8-алкинил могут быть необязательно дополнительно замещены одним или более заместителями, включающими, но без ограничения,-C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил, -галоген, -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2-C8-7 020696 алкинил), -арил, -C(O)R, -OC(O)R", -C(О)OR", -C(O)NH2, -C(O)NHR", -C(O)N(R")2, -NHC(O)R", -SR",-SO3R", -S(O)2R", -S(O)R", -OH, -N3, -NH2, -NH(R"), -N(R)2 и -CN, где каждый R независимо выбирают из -Н, -C1-C8-алкила, -C2-C8-алкенила, -C2-C8-алкинила или -арила. Кроме особо оговоренных случаев, термин "алкенилен" относится к необязательно замещенной алкиленовой группе, содержащей по крайней мере одну углерод-углеродную двойную связь. Приводимые в качестве примеров алкениленовые группы включают, например, этенилен (-CH=CH-) и пропенилен(-CH=CHCH2-). Кроме особо оговоренных случаев, термин "алкинилен" относится к необязательно замещенной алкиленовой группе, содержащей по крайней мере одну углерод-углеродную тройную связь. Приводимые в качестве примеров алкиниленовые группы включают, например, ацетилен (-СС-), пропаргил(-CH2CС-) и 4-пентинил (-CH2CH2CH2CCH-). Кроме особо оговоренных случаев, термин "арил" относится к одновалентному ароматическому углеводородному радикалу, имеющему 6-20 атомов углерода (и все комбинации и субкомбинации диапазонов и конкретных чисел атомов углерода в нем), возникающему при удалении одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Некоторые арильные группы представлены в приводимых в качестве примеров структурах как "Ar". Типичные арильные группы включают, но без ограничения, радикалы, возникающие из бензола, замещенного бензола, фенила, нафталина, антрацена, бифенила и т.п. Арильная группа, отдельно или в виде части другой группы, может быть необязательно замещена одной или более, предпочтительно 1-5 или даже 1-2 группами, включающими, но без ограничения,-галоген, -C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил, -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2-C8 алкинил), -арил, -C(O)R', -OC(O)R', -C(О)OR', -C(O)NH2, C(O)NHR', -C(O)N(R')2, -NHC(O)R', -SR', -SO3R',-S(O)2R', -S(O)R', -OH, -NO2, -N3, -NH2, -NH(R'), -N(R')2 и -CN, где каждый R' независимо выбирают из-Н, -C1-C8-алкила, -C2-C8-алкенила, -C2-C8-алкинила или -арила, и где указанные группы -C1-C8-алкил,-C2-C8-алкенил, -C2-C8-алкинил, -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2-C8-алкинил) и -арил могут быть необязательно дополнительно замещены одним или более заместителями, включающими, но без ограничения, -C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил, -галоген, -O-(C1-C8-алкил), -O-(C2-C8 алкенил), -О-(C2-C8-алкинил), -арил, -C(O)R", -OC(O)R", -C(О)OR", -C(O)NH2, -C(O)NHR", -C(O)N(R")2,-NHC(O)R", -SR", -SO3R", -S(O)2R", -S(O)R", -OH, -N3, -NH2, -NH(R"), -N (R")2 и -CN, где каждый R независимо выбирают из -Н, -C1-C8-алкила, -C2-C8-алкенила, -C2-C8-алкинила или -арила. Кроме особо оговоренных случаев, термин "арилен" относится к необязательно замещенной арильной группе, которая является двухвалентной (т.е. возникающей при удалении двух атомов водорода от одного и того же или двух различных атомов углерода исходной ароматической кольцевой системы), и заместители которой могут находиться в орто-, мета- или пара-положениях, как продемонстрировано в следующих структурах, при этом фенил является приводимой в качестве примера арильной группой: Типичные группы "-(C1-C8-алкилен)арил", "-(C2-C8-алкенилен)арил" и "-(C2-C8-алкинилен)арил" включают, но без ограничения, бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2 нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. Кроме особо оговоренных случаев, термин "гетероцикл" относится к моноциклической, бициклической или полициклической системе, имеющей от 3 до 14 кольцевых атомов (также называемых членами кольца(ец, причем по крайней мере один кольцевой атом в по крайней мере одном кольце является гетероатомом, выбираемым из N, О, Р или S (и все комбинации и субкомбинации диапазонов и конкретных чисел атомов углерода и гетероатомов в нем). Гетероцикл может иметь от 1 до 4 гетероатомов, независимо выбираемых из N, О, P или S. Один или более атомов N, С или S в гетероцикле могут быть оксидированными. Моноциклический гетероцикл предпочтительно имеет 3-7 членов кольца (например, 2-6 атомов углерода и 1-3 гетероатомов, независимо выбираемых из N, О, Р или S), а бициклический гетероцикл предпочтительно имеет 5-10 членов колец (например, 4-9 атомов углерода и 1-3 гетероатомов, независимо выбираемых из N, О, Р или S). Кольцо, которое включает гетероатом, может быть ароматическим или неароматическим. Кроме особо оговоренных случаев, гетероцикл присоединен к боковой группе при любом гетероатоме или атоме углерода, который дает стабильную структуру. Гетероциклы описаны в Paquette, "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, NewJ. Am. Chem. Soc. 82: 5566 (1960). Кроме особо оговоренных случаев, термин "гетероцикло" относится к необязательно замещенной гетероциклической группе, определенной выше, которая является двухвалентной (т.е. возникающей при удалении двух атомов водорода от одного и того же или двух различных атомов углерода исходной гете-8 020696 роциклической кольцевой системы). Примеры "гетероциклических" групп включают, в качестве неограничивающего примера, пиридил,дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, пиримидинил, фуранил, тиенил, пирролил,пиразолил, имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил,изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, бис-тетрагидрофуранил, тетрагидропиранил, бис-тетрагидропиранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил,триазинил, 6 Н-1,2,5-тиадиазинил, 2 Н,6 Н-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатинил, 2 Н-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, 1 Н-индазолил, пиринил, 4 Н-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4 Н-карбазолил, карбазолил, карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатиноил. Предпочтительные "гетероциклические" группы включают, но без ограничения, бензофуранил, бензотиофенил, индолил, бензопиразолил, кумаринил, изохинолинил, пирролил, тиофенил, фуранил, тиазолил, имидазолил, пиразолил, триазолил, хинолинил, пиримидинил, пиридинил, пиридонил, пиразинил, пиридазинил, изотиазолил, изоксазолил и тетразолил. Гетероциклическая группа, отдельно или в виде части другой группы, может быть необязательно замещена одной или более группами, предпочтительно 1-2 группами, включающими, но без ограничения, -C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил, галоген, -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2C8-алкинил), -арил, -C(O)R', -OC(O)R', -C(О)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2, -NHC(O)R', -SR',-SO3R', -S(O)2R', -S(O)R', -OH, -N3, -NH2, -NH(R'), -N(R')2 и -CN, где каждый R' независимо выбирают из-Н, -C1-C8-алкила, -C2-C8-алкенила, -C2-C8-алкинила или -арила, и где указанные группы -O-(C1-C8 алкил), -О-(C2-C8-алкенил), -O-(C2-C8-алкинил), -C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил и -арил могут быть необязательно дополнительно замещены одним или более заместителями, включающими, но без ограничения, -C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил, -галоген, -O-(C1-C8-алкил), -O-(C2-C8 алкенил), -О-(C2-C8-алкинил), -арил, -C(O)R", -OC(O)R", -C(О)OR, -C(O)NH2, -C(O)NHR", -C(O)N(R")2,-NHC(O)R", -SR", -SO3R", -S(O)2R", -S(O)R", -OH, -N3, -NH2, -NH(R"), -N(R")2 и -CN, где каждый R независимо выбирают из -Н, -C1-C8-алкила, -C2-C8-алкенила, -C2-C8-алкинила или арила. В качестве неограничивающего примера гетероциклы со связью при атоме углерода могут быть связаны в следующих положениях: в положении 2, 3, 4, 5 или 6 пиридина; в положении 3, 4, 5 или 6 пиридазина; в положении 2, 4, 5 или 6 пиримидина; в положении 2, 3, 5 или 6 пиразина; в положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола; в положении 2, 4 или 5 оксазола, имидазола или тиазола; положении 3, 4 или 5 изоксазола, пиразола или изотиазола; в положении 2 или 3 азиридина; в положении 2, 3 или 4 азетидина; в положении 2, 3, 4, 5, 6, 7 или 8 хинолина или в положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. Тем не менее, обычнее гетероциклы со связью при атоме углерода включают 2-пиридил, 3-пиридил, 4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4 пиридазинил, 5-пиридазинил, 6-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6 пиримидинил, 2-пиразинил, 3-пиразинил, 5-пиразинил, 6-пиразинил, 2-тиазолил, 4-тиазолил или 5 тиазолил. В качестве примера, а не ограничения, гетероциклы со связью при атоме азота могут быть связаны в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола,имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина или 1 Н-индазола; в положении 2 изоиндола или изоиндолина; в положении 4 морфолина и в положении 9 карбазола или -карболина. Тем не менее, обычнее гетероциклы со связью при атоме азота включают 1-азиридил, 1-азетедил, 1-пирролил, 1-имидазолил, 1-пиразолил и 1-пиперидинил. Кроме особо оговоренных случаев, термин "карбоцикл" относится к насыщенной или ненасыщенной неароматической моноциклической, бициклической или полициклической системе, имеющей от 3 до 14 кольцевых атомов (и все комбинации и субкомбинации диапазонов и конкретных чисел атомов углерода в нем), причем все кольцевые атомы являются атомами углерода. Моноциклические карбоциклы предпочтительно имеют 3-6 кольцевых атомов, тем не менее, предпочтительнее 5 или 6 кольцевых атомов. Бициклические карбоциклы предпочтительно имеют 7-12 кольцевых атомов, например, с расположением в виде бицикло[4,5], [5,5], [5,6] или [6,6] системы, или 9 или 10 кольцевых атомов с расположением в виде [5,6] или [6,6] системы. Термин "карбоцикл" включает, например, моноциклическое карбоциклическое кольцо, слитое с арильным кольцом (например, моноциклическое карбоциклическое кольцо, слитое с бензольным кольцом). Предпочтительно, карбоциклы имеют 3-8 кольцевых атомов углерода. Карбоциклические группы, отдельно или в виде части другой группы, могут быть необязательно замещены, например, одной или более группами, предпочтительно 1 или 2 группами (и любыми дополнительными заместителями, выбираемыми из галогена), включающими, но без ограничения, -галоген,-C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил, -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -О-(C2-C8-алкинил),-арил, -C(O)R', -OC(O)R', -C(О)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2, -NHC(O)R', -SR', -SO3R', -S(O)2R',-S(O)R', -OH, =O, -N3, -NH2, -NH(R'), -N(R')2 и -CN, где каждый R' независимо выбирают из -Н, -C1-C8 алкила, -C2-C8-алкенила, -C2-C8-алкинила или -арила, и где указанные группы -C1-C8-алкил, -C2-C8 алкенил, -C2-C8-алкинил, -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -O-(C2-C8-алкинил) и -арил могут быть необязательно дополнительно замещены одним или более заместителями, включающими, но без ограничения, -C1-C8-алкил, -C2-C8-алкенил, -C2-C8-алкинил, -галоген, -O-(C1-C8-алкил), -O-(C2-C8-алкенил), -О(C2-C8-алкинил), -арил, -C(O)R", -OC(O)R", -C(О)OR", -C(O)NH2, -C(O)NHR", -C(O)N(R")2, -NHC(O)R",-SR", -SO3R", -S(O)2R", -S(O)R", -OH, -N3, -NH2, -NH (R"), -N(R")2 и -CN, где каждый R независимо выбирают из -Н, -C1-C8-алкила, -C2-C8-алкенила, -C2-C8-алкинила или -арила. Примеры моноциклических карбоциклических заместителей включают -циклопропил, -циклобутил,-циклопентил, -1-циклопент-1-енил, -1-циклопент-2-енил, -1-циклопент-3-енил, циклогексил, -1 циклогекс-1-енил, -1-циклогекс-2-енил, -1-циклогекс-3-енил, циклогептил, -циклооктил, -1,3 циклогексадиенил, -1,4-циклогексадиенил, -1,3-циклогептадиенил, -1,3,5-циклогептатриенил и"Карбоцикло", отдельно или в виде части другой группы, относится к необязательно замещенной карбоциклической группе, определенной выше, которая является двухвалентной (т.е. возникающей при удалении двух атомов водорода от одного и того же или двух различных атомов углерода исходной карбоциклической кольцевой системы). Когда любая переменная встречается более одного раза в любой составляющей или в любой формуле, ее определение в каждом случае не зависит от ее определения в каждом другом случае. Комбинации заместителей и/или переменных допустимы, только если такие комбинации дают в результате стабильные соединения. Если в контексте не оговорено иное, тире (-) обозначает место присоединения боковой молекулы. Соответственно, термин "-(C1-C8-алкилен)арил" или "-C1-C8-алкилен(арил)" относится к определенному в настоящем документе C1-C8-алкиленовому радикалу, причем алкиленовый радикал присоединен к боковой молекуле при любом из атомов углерода алкиленового радикала, и один из атомов водорода, связанный с атомом углерода алкиленового радикала, замещен арильным радикалом, определенным в настоящем документе. Когда конкретная группа является "замещенной", эта группа может иметь один или более заместителей, предпочтительно от одного до пяти заместителей, более предпочтительно, от одного до трех заместителей, наиболее предпочтительно, от одного до двух заместителей, независимо выбираемых из перечня заместителей. Однако группа может, как правило, иметь любое число заместителей, выбираемых из галогена. Являющиеся замещенными группы, таким образом, указываются. Предполагается, что определение любого заместителя или переменной в конкретном положении в молекуле не зависит от его определений еще где-нибудь в этой молекуле. Подразумевается, что заместители или наборы заместителей в соединениях этого изобретения могут быть выбраны специалистом со средним уровнем компетентности в данной области техники для обеспечения соединений, которые являются химически стабильными, и которые можно легко синтезировать с помощью методов, известных в данной области техники, а также тех способов, которые в настоящем документе изложены. Защитные группы в настоящем документе относятся к группам, которые избирательно блокируют,или временно, или постоянно, один реакционноспособный сайт в многофункциональном соединении. Подходящие защитные группы для гидроксигрупп для использования в настоящем изобретении являются фармацевтически приемлемыми и могут нуждаться или могут не нуждаться в отщеплении от исходного соединения после введения субъекту для того, чтобы соединение было активным. Отщепление происходит благодаря нормальному метаболическому процессу в организме. Защитные группы для гидроксигрупп хорошо известны в данной области техники, см. документ Protective Groups in Organic Synthesis byT.W. Greene and P.G.M. Wuts (John WileySons, 3rd Edition), который включен сюда целиком в качестве ссылки, и включают, например, защитные группы, образующие простой эфир (например, алкиловые эфиры и силиловые эфиры, включающие, например, диалкилсилиловый эфир, триалкилсилиловый эфир,диалкилалкоксисилиловый эфир), сложный эфир, карбонат, карбаматы, сульфонат и фосфат. Примеры защитных группы для гидроксигрупп включают, но без ограничения, группы, образующие метиловый эфир, метоксиметиловый эфир, метилтиометиловый эфир, (фенилдиметилсилил)метоксиметиловый эфир, бензилоксиметиловый эфир, параметоксибензилоксиметиловый эфир, паранитробензилоксиметиловый эфир, ортонитробензилоксиметиловый эфир, (4-метоксифенокси)метиловый эфир, гваяколметиловый эфир, трет-бутоксиметиловый эфир, 4-пентенилоксиметиловый эфир, силоксиметиловый эфир, 2 метоксиэтоксиметиловый эфир, 2,2,2-трихлорэтоксиметиловый эфир, бис(2-хлорэтокси)метиловый эфир,2-(триметилсилил)этоксиметиловый эфир, ментоксиметиловый эфир, тетрагидропираниловый эфир, 1 метоксициклогексиловый эфир,4-метокситетрагидротиопираниловый эфир,4 метокситетрагидротиопираниловый эфир 3,3-диоксид, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин- 10020696 4-иловый эфир, 1-(2-фторфенил)-4-метоксипиперидин-4-иловый эфир, 1,4-диоксан-2-иловый эфир, тетрагидрофураниловый эфир, тетрагидротиофураниловый эфир; замещенные этиловые эфиры, такие как 1 этоксиэтиловый эфир, 1-(2-хлорэтокси)этиловый эфир, 1-[2-(триметилсилил)этокси]этиловый эфир, 1 метил-1-метоксиэтиловый эфир, 1-метил-1-бензилоксиэтиловый эфир, 1-метил-1-бензилокси-2 фторэтиловый эфир, 1-метил-1-феноксиэтиловый эфир, 2-триметилсилиловый эфир, трет-бутиловый эфир, аллиловый эфир, пропаргиловые эфиры, парахлорфениловый эфир, параметоксифениловый эфир,бензиловый эфир, параметоксибензиловый эфир, 3,4-диметоксибензиловый эфир, триметилсилиловый эфир, триэтилсилиловый эфир, трипропилсилиловый эфир, диметилизопропилсилиловый эфир, диэтилизопропилсилиловый эфир, диметилгексилсилиловый эфир, трет-бутилдиметилсилиловый эфир, дифенилметилсилиловый эфир, эфир бензоилмуравьиной кислоты, эфир уксусной кислоты, эфир хлоруксусной кислоты, эфир дихлоруксусной кислоты, эфир трихлоруксусной кислоты, эфир трифторуксусной кислоты, эфир метоксиуксусной кислоты, эфир трифенилметоксиуксусной кислоты, эфир фенилуксусной кислоты, эфир бензойной кислоты, алкилметилкарбонат, алкил-9-флуоренилметилкарбонат, алкилэтилкарбонат, алкил-2,2,2-трихлорэтилкарбонат, 1,1-диметил-2,2,2-трихлорэтилкарбонат, алкилсульфонат, метансульфонат, бензилсульфонат, тозилат, метиленацеталь, этилиденацеталь и третбутилметилиденкеталь. Предпочтительные защитные группы представлены формулами -Ra,Si(Ra)(Ra)(Ra), -C(O)Ra, -C(O)ORa, -C(O)NH(Ra), -S(O)2Ra, S(O)2OH, -P(O)(OH)2 и -P(O)(OH)ORa, где Ra представляет собой -C1-C20-алкил, -C2-C20-алкенил, -C2-C20-алкинил, -C1-C20-алкилен (карбоцикл), -C2C20-алкенилен (карбоцикл), -C2-C20-алкинилен (карбоцикл), -C6-C10-арил, -C1-C20-алкилен (арил), -C2-C20 алкенилен(гетероцикл),-C2-C20-алкенилен (гетероцикл) или -C2-C20-алкинилен(гетероцикл), где указанные алкильные, алкенильные, алкинильные, алкиленовые, алкениленовые и алкиниленовые радикалы, отдельно или в виде части другой молекулы, необязательно замещены одной или более группами, независимо выбираемыми из A1,указанные карбоциклические радикалы, отдельно или в виде части другой молекулы, необязательно замещены одной или более группами, независимо выбираемыми из А 2, указанные арильные радикалы,отдельно или в виде части другой молекулы, необязательно замещены одной или более группами, независимо выбираемыми из A3, и указанные гетероциклические радикалы, отдельно или в виде части другой молекулы, необязательно замещены одной или более группами, независимо выбираемыми из А 4. А 1,А 2, A3 и А 4 имеют определенные в настоящем документе значения.D. Конъюгат антитело-лекарственное средство. Описанные в настоящем документе способы включают применение соединения конъюгата антитело-лекарственное средство в комбинированной терапии для лечения HL. Соединение конъюгата антитело-лекарственное средство для применения в настоящем изобретении включает антитело против CD30,т.е. антитело, которое специфически связывается с CD30, связанное с составляющей в виде лекарственного средства. Составляющей в виде лекарственного средства является лекарственное средство типа ауристатина, который, как было установлено, препятствует динамике микротрубочек и ядерному и клеточному делению и обладает противораковой активностью. Ауристатины настоящего изобретения связываются с тубулином и оказывают цитотоксический или цитостатический эффект на линию клеток HL, например, линию клеток L540cy. В некоторых вариантах осуществления настоящего изобретения лекарственное средство ауристатин конъюгировано с антителом против CD30 посредством линкера, который является расщепляемым во внутриклеточных условиях так, что расщепление линкера приводит к высвобождению соединения ауристатина от антитела во внутриклеточном окружении. В уже других вариантах осуществления единица линкера является не расщепляемой, и лекарственное средство высвобождается посредством деградации антитела. Существует ряд различных анализов, которые можно использовать для определения того, оказывает ли ауристатин или полученный конъюгат антитело-лекарственное средство цитостатический или цитотоксический эффект на линию клеток HL. В одном примере для определения того, оказывает ли ауристатин или полученный конъюгат антитело-лекарственное средство цитотоксический или цитостатический эффект на линию клеток HL, используют анализ включения тимидина. Например, клетки HL при плотности 5000 клеток/лунка 96-луночного планшета культивируют в течение 72-часового периода времени и подвергают воздействию 0,5 мкКи 3 Н-тимидина в течение завершающих 8 ч 72-часового периода времени, и включение 3 Н-тимидина в клетки культуры измеряют в присутствии или в отсутствие ауристатина или конъюгата антитело-лекарственное средство. Ауристатин или полученный конъюгат антителолекарственное средство имеют цитостатический или цитотоксический эффект на линию клеток HL, если клетки культуры характеризуются уменьшенным включением 3 Н-тимидина по сравнению с клетками той же линии клеток, подвергнутыми культивированию в тех же условиях, но не приводимыми в контакт с ауристатином или конъюгатом антитело-лекарственное средство. Для определения цитотоксичности можно определять некроз или апоптоз (запрограммированную гибель клеток). Некроз обычно сопровождается увеличением проницаемости плазматической мембраны,разбуханием клетки и разрывом плазматической мембраны. Апоптоз обычно характеризуется образованием мембранных везикул, конденсацией цитоплазмы и активацией эндогенных эндонуклеаз. Определение любого из этих эффектов на клетки HL указывает на то, что ауристатин или конъюгат антитело- 11020696 лекарственное средство применимы для лечения или предупреждения HL. В другом примере для определения того, оказывает ли ауристатин или полученный конъюгат антитело-лекарственное средство цитостатический или цитотоксический эффект на линию клеток HL, определяют жизнеспособность клеток путем определения внедрения в клетку красителя, такого как нейтральный красный, трипановый синий или ALAMAR синий (см., например, Page et al., 1993, Intl. J. ofOncology 3: 473-476). В таком анализе клетки инкубируют в средах, содержащих краситель, клетки отмывают и спектрофотометрически определяют остающийся краситель, являющийся отражением внедрения красителя в клетку. Для определения цитотоксичности можно также использовать белоксвязывающий краситель сульфородамин В (SRB) (Skehan et al., 1990, J. Natl. Cancer Inst. 82: 1107-1112). Предпочтительные конъюгаты антитело-лекарственное средство включают конъюгаты со значением IC50 (определяемой как концентрация мАВ, которая дает 50% гибель клеток), составляющим менее 1000 нг/мл,предпочтительно менее 500 нг/мл, более предпочтительно менее 100 нг/мл, наиболее предпочтительно даже менее 50 нг/мл или даже менее 10 нг/мл на линии клеток лимфомы Ходжкина, например линии клеток L540cy. Способы определения того, связывается ли соединение с тубулином, известны в данной области техники. См., например, Muller et al., Anal. Chem. 2006, 78, 4390-4397; Hamel et al., Molecular Pharmacology, 1995, 47: 965-976; и Hamel et al., The Journal of Biological Chemistry, 1990, 265: 17141-17149. Для целей настоящего изобретения можно определять относительное сродство соединения с тубулином. Предпочтительные ауристатины настоящего изобретения связываются с тубулином со сродством, находящимся в диапазоне от в 10 раз меньшего (более слабого) сродства связывания ММАЕ с тубулином до в 10 раз, 2 0 раз или даже 100 раз большего (более сильного) сродства связывания ММАЕ с тубулином. Е. Гемцитабин. Некоторые способы настоящего изобретения включают введение соединения конъюгата антителолекарственное средство и гемцитабина для лечения лимфомы Ходжкина. Гемцитабин,4-амино-1-[(2R,4R,5R)-3,3-дифтор-4-гидрокси-5-(гидроксиметил)оксолан-2 ил]пиримидин-2-он, в настоящее время продается под маркой GEMZAR Eli Lilly and Company. Гемцитабин, аналог цитарабина, является антиметаболитом пиримидина, который, как установлено, демонстрирует широкий спектр активности при HL. Настоящим изобретением охватывается комбинированная терапия с использованием соединения конъюгата антитело-лекарственное средство, гемцитабина и необязательно одного или более дополнительных агентов, например, противораковых средств, включающих химиотерапевтические средства. Например, один или более из винорелбина, дексаметазона, цисплатина и доксорубицина, в том числе пегилированного липосомального доксорубицина, можно вводить в качестве части комбинированной терапии (например, схемы GVD). В некоторых вариантах осуществления, однако, гемцитабин будет единственным химиотерапевтическим средством, вводимым в качестве части комбинированной терапии с использованием соединения конъюгата антитело-лекарственное средство. Например, в некоторых вариантах осуществления, во время одного или более циклов терапии, гемцитабин будет единственным химиотерапевтическим средством, вводимым в качестве части комбинированной терапии с использованием соединения конъюгата антитело-лекарственное средство. В некоторых вариантах осуществления гемцитабин будет единственным противораковым средством, вводимым в качестве части комбинированной терапии с использованием соединения конъюгата антитело-лекарственное средство. В некоторых вариантах осуществления доксорубицин, или конкретнее пегилированный липосомальный доксорубицин,будет, в частности, исключен из комбинированной терапии. В некоторых вариантах осуществления винорелбин и доксорубицин или винорелбин и пегилированный липосомальный доксорубицин будут исключены из комбинированной терапии.F. Синергизм. В предпочтительных вариантах осуществления настоящего изобретения терапия с использованием соединения конъюгата антитело-лекарственное средство и химиотерапевтического средства (средств) обеспечивает синергетический эффект при лечении лимфомы Ходжкина у пациента. Используемый в настоящем документе термин "синергизм" или "синергетический эффект" при использовании в связи с описанием эффективности комбинации агентов означает любой определяемый эффект комбинации, который превышает эффект, предсказанный на основе суммы эффектов индивидуальных агентов. Соответственно, настоящее изобретение включает варианты осуществления, в которых субъекты, подвергнутые лечению как соединением конъюгата антитело-лекарственное средство, так и химиотерапевтическим средством (средствами), имеют значительно лучшие результаты лечения, чем субъекты, подвергнутые лечению только соединением конъюгата антитело-лекарственное средство или только химиотерапевтическим средством (средствами), с назначением тех же схем введения и дозирования. Настоящее изобретение включает варианты осуществления, в которых субъекты имеют лучшие результаты лечения, чем результаты, которые могли бы ожидаться на основе суммы эффектов лечения только соединением конъюгата антитело-лекарственное средство и только схемы химиотерапевтического лечения, с назначением тех же схем введения и дозирования. Способы определения такого синергизма известны в данной области техники. В одном примере сингенные (одной и той же генной линии) опухоли получают от донорных животных, подвергают дезагрегации, определению количества и инъецируют обратно сингенным (одной и той же генной линии) мышам-хозяевам. Противораковые комбинации обычно затем инъецируют в некоторые более поздние моменты (момент) времени, с помощью или внутрибрюшинного, внутривенного пути введения, или перорального пути введения, и определяют скорости роста опухолей и/или выживание по сравнению с не подвергнутыми лечению контролями и контролями, подвергнутыми воздействию только одной из терапий. Скорости роста обычно определяют для опухолей, растущих в передней боковой стороне животного, причем диаметры, перпендикулярные горизонтальному размеру опухоли, переводят в оценку общей массы и объема опухоли. Затем сравнивают время, требуемое для достижения заданной массы (например, время, требуемое для трехкратного увеличения опухоли, или время, требуемое для четырехкратного увеличения опухоли), со временем, требуемым для трехкратного увеличения опухоли, или время, требуемое для четырехкратного увеличения опухоли, со временем, требуемым для равного увеличения опухоли у контрольных животных. Если время, требуемое для достижения заданной массы, для животного,подвергнутого лечению комбинированной терапией, превышает величину, полученную суммированием времени, требуемого для достижения заданной массы, для животного, подвергнутого лечению терапией"А", и для животного, подвергнутого лечению терапией "В" (т.е. отдельно каждой терапией), можно сказать, что комбинированная терапия обеспечивает синергетический эффект. В другом примере время,требуемое для достижения заданной массы, для животного, подвергнутого лечению комбинированной терапией, может не превышать величину, полученную суммированием времени, требуемого для достижения заданной массы, для животного, подвергнутого лечению терапией "А", и для животного, подвергнутого лечению терапией "В"; однако другой определяемый эффект комбинации, который превышает эффект, предсказанный на основе суммы эффектов индивидуальных агентов, является адекватным для идентификации/определения комбинированной терапии как синергетической. Например, если число длительных ответных реакций для животных, подвергнутых лечению комбинированной терапией, превышает сумму числа длительных ответных реакций в каждой группе лечения отдельно, комбинированная терапия обеспечивает синергетический эффект. Длительную ответную реакцию (DR) определяют как отсутствие пальпируемой опухоли у животного.G. Введение (назначение). Конъюгат антитело-лекарственное средство и гемцитабин вводят таким образом, чтобы они обеспечивали синергетический эффект при лечении HL у пациента. Введение может быть осуществлено любым подходящим способом при условии, что назначение обеспечивает требуемый терапевтический эффект, т.е. синергизм. В предпочтительных вариантах осуществления соединение конъюгата антителолекарственное средство и гемцитабин вводят во время одного и того же цикла терапии, например во время одного цикла терапии, например периода времени, составляющего три или четыре недели, как соединение конъюгата антитело-лекарственное средство, так и заданное химиотерапевтическое средство(а) вводят субъекту. В некоторых вариантах осуществления настоящего изобретения введение соединения конъюгата антитело-лекарственное средство будет осуществлено в такое время, что оно будет сенсибилизировать раковые клетки к лечению гемцитабином, т.е. последовательно, например, непосредственно перед химиотерапевтическим лечением, например менее чем за 2 ч до химиотерапевтического лечения. Доза соединения конъюгата антитело-лекарственное средство, вводимая пациенту с HL, будет также зависеть от частоты введения. Настоящим изобретением предусматривается доставка соединения конъюгата антитело-лекарственное средство только во время цикла лечения или с помощью дробной доставки. Настоящее изобретение включает варианты осуществления, в которых соединение конъюгата антитело-лекарственное средство будет вводиться в диапазоне доз, составляющем от 0,1 до 2,7 мг/кг веса тела субъекта в каждом дозе, от 0,2 до 1,8 мг/кг веса тела субъекта в каждом дозе, от 0,2 до 1,2 мг/кг веса тела субъекта в каждом дозе, от 0,4 до 1 мг/кг веса тела субъекта в каждом дозе, от 1 до 1,5 мг/кг веса тела субъекта в каждом дозе и от 0,5 до 1 мг/кг веса тела субъекта в каждом дозе. Настоящим изобретением охватываются другие диапазоны, если они приводят к требуемому результату. Настоящее изобретение включает схемы лечения, в которых общая доза соединения конъюгата антитело-лекарственное средство, вводимая пациенту с HL, будет составлять, например, от 0,1 до 5 мг/кг,от 0,1 до 4 мг/кг, от 0,1 до 3,2 мг/кг или от 0,1 до 2,7 мг/кг веса тела субъекта в течение цикла лечения,например, периода времени, составляющего 3 или 4 недели. В некоторых вариантах осуществления общая доза соединения конъюгата антитело-лекарственное средство, вводимая пациенту с HL, будет составлять, например, от приблизительно 0,6 до 3,2 мг/кг, от приблизительно 0,6 до приблизительно 2,7 мг/кг или даже от приблизительно 1,5 до приблизительно 3 мг/кг в течение цикла лечения, например,периода времени, составляющего 3 или 4 недели. В некоторых вариантах осуществления доза будет составлять приблизительно 0,6 мг/кг, приблизительно 0,7 мг/кг, приблизительно 0,8 мг/кг, приблизительно 0,9 мг/кг, приблизительно 1,0 мг/кг, приблизительно 1,1 мг/кг, приблизительно 1,2 мг/кг, приблизительно 1,3 мг/кг, приблизительно 1,4 мг/кг, приблизительно 1,5 мг/кг, приблизительно 1,6 мг/кг, приблизительно 1,7 мг/кг, приблизительно 1,8 мг/кг, приблизительно 1,9 мг/кг, приблизительно 2 мг/кг, приблизительно 2,1 мг/кг, приблизительно 2,2 мг/кг, приблизительно 2,3 мг/кг, приблизительно 2,4 мг/кг, приблизительно 2,5 мг/кг, приблизительно 2,6 мг/кг, приблизительно 2,7 мг/кг, приблизительно 2,8 мг/кг, приблизительно 2,9 мг/кг, приблизительно 3 мг/кг, приблизительно 3,1 мг/кг, приблизительно 3,2 мг/кг, приблизительно 3,3 мг/кг, приблизительно 3,4 мг/кг, приблизительно 3,5 мг/кг, приблизительно 3,6 мг/кг, приблизительно 3,7 мг/кг или приблизительно 3,8 мг/кг веса тела субъекта в течение цикла лечения, например, периода времени, составляющего 3 или 4 недели. Настоящим изобретением предусматривается введение лекарственного средства в течение одного или более циклов лечения, например, 1, 2, 3, 4, 5, 6 или более циклов лечения. В некоторых вариантах осуществления между одним или более циклами лечения будут периоды покоя. Например, в некоторых вариантах осуществления период покоя будет между вторым и третьим циклом лечения, но не между первым и вторым циклом лечения. В другом варианте осуществления период покоя мог бы быть между первым и вторым циклом лечения, но не между вторым и третьим циклом лечения. Схемы введения доз включают, например, введение соединения конъюгата антителолекарственное средство один раз во время схемы лечения, например, в день 1 21-дневного цикла, дважды во время цикла лечения, например, в дни 1 и 15 28-дневного цикла и трижды во время цикла лечения,например, в дни 1, 8 и 15 28-дневного цикла. Настоящим изобретением охватываются другие схемы введения доз. Настоящее изобретение включает схемы лечения, в которых соединение конъюгата антителолекарственное средство вводят один раз во время цикла лечения, например, периода времени, составляющего 3 или 4 недели. Например, в некоторых вариантах осуществления конъюгат антителолекарственное средство будут вводить на третьей недели цикла лечения, составляющего 3 или 4 недели,например, в день 21 цикла, составляющего три или четыре недели. В некоторых вариантах осуществления конъюгат антитело-лекарственное средство будут вводить в день 1 цикла лечения, составляющего 3 или 4 недели, или любой другой день цикла лечения, составляющего три или четыре недели. В некоторых таких вариантах осуществления доза соединения конъюгата антитело-лекарственное средство, вводимая пациенту с HL, будет, как правило, составлять, например, от 0,1 до 5 мг/кг веса тела субъекта в течение цикла лечения, например, периода времени, составляющего 3 или 4 недели. Конкретнее, доза будет составлять от 0,1 до 4 мг/кг, от 0,1 до 3,2 мг/кг, от 0,1 до 2,7 мг/кг, от 1 до 2,7 мг/кг, от 1,5 до 2,7 мг/кг или от 1,5 до 2 мг/кг веса тела субъекта в течение цикла лечения, например, периода времени, составляющего 3 или 4 недели. В некоторых вариантах осуществления общая доза соединения конъюгата антитело-лекарственное средство, вводимая пациенту с HL, будет составлять, например, от приблизительно 0,6 до приблизительно 5 мг/кг, от приблизительно 0,6 до приблизительно 4 мг/кг, от приблизительно 0,6 до 3,2 мг/кг, от приблизительно 0,6 до приблизительно 2,7 мг/кг или даже от приблизительно 1,5 до приблизительно 3 мг/кг в течение цикла лечения, например, периода времени, составляющего 3 или 4 недели. В некоторых вариантах осуществления доза будет составлять приблизительно 0,6 мг/кг,приблизительно 0,7 мг/кг, приблизительно 0,8 мг/кг, приблизительно 0,9 мг/кг, приблизительно 1,0 мг/кг,приблизительно 1,1 мг/кг, приблизительно 1,2 мг/кг, приблизительно 1,3 мг/кг, приблизительно 1,4 мг/кг,приблизительно 1,5 мг/кг, приблизительно 1,6 мг/кг, приблизительно 1,7 мг/кг, приблизительно 1,8 мг/кг,приблизительно 1,9 мг/кг, приблизительно 2 мг/кг, приблизительно 2,1 мг/кг, приблизительно 2,2 мг/кг,приблизительно 2,3 мг/кг, приблизительно 2,4 мг/кг, приблизительно 2,5 мг/кг, приблизительно 2,6 мг/кг,приблизительно 2,7 мг/кг, приблизительно 2,8 мг/кг, приблизительно 2,9 мг/кг, приблизительно 3 мг/кг,приблизительно 3,1 мг/кг, приблизительно 3,2 мг/кг, приблизительно 3,3 мг/кг, приблизительно 3,4 мг/кг,приблизительно 3,5 мг/кг, приблизительно 3,6 мг/кг, приблизительно 3,7 мг/кг или приблизительно 3,8 мг/кг веса тела субъекта в течение цикла лечения. В других вариантах осуществления соединение конъюгата антитело-лекарственное средство будет вводиться более одного раза во время цикла лечения. Например, в некоторых вариантах осуществления соединение конъюгата антитело-лекарственное средство будет вводиться раз в неделю в течение трех следующих друг за другом недель в цикле лечения, составляющем 3 или 4 недели. Например, в некоторых вариантах осуществления соединение конъюгата антитело-лекарственное средство будет вводиться в дни 1, 8 и 15 каждого цикла лечения, составляющего 28 дней. В некоторых таких вариантах осуществления доза соединения конъюгата антитело-лекарственное средство, вводимая пациенту с HL, может,например, составлять от 0,1 до 5 мг/кг, от 0,1 до 4 мг/кг, от 0,1 до 3,2 мг/кг или от 0,1 до 2,7 мг/кг веса тела субъекта в течение цикла лечения. В некоторых вариантах осуществления общая доза соединения конъюгата антитело-лекарственное средство, вводимая пациенту с HL, будет составлять, например, от приблизительно 0,6 до приблизительно 5 мг/кг, от приблизительно 0,6 до приблизительно 4 мг/кг, от приблизительно 0,6 до 3,2 мг/кг, от приблизительно 0,6 до приблизительно 2,7 мг/кг или даже от приблизительно 1,5 до приблизительно 3 мг/кг в течение цикла лечения. В некоторых вариантах осуществления доза будет составлять приблизительно 0,6 мг/кг, приблизительно 0,7 мг/кг, приблизительно 0,8 мг/кг,приблизительно 0,9 мг/кг, приблизительно 1,0 мг/кг, приблизительно 1,1 мг/кг, приблизительно 1,2 мг/кг,приблизительно 1,3 мг/кг, приблизительно 1,4 мг/кг, приблизительно 1,5 мг/кг, приблизительно 1,6 мг/кг,приблизительно 1,7 мг/кг, приблизительно 1,8 мг/кг, приблизительно 1,9 мг/кг, приблизительно 2 мг/кг,приблизительно 2,1 мг/кг, приблизительно 2,2 мг/кг, приблизительно 2,3 мг/кг, приблизительно 2,4 мг/кг,приблизительно 2,5 мг/кг, приблизительно 2,6 мг/кг, приблизительно 2,7 мг/кг, приблизительно 2,8 мг/кг,- 14020696 приблизительно 2,9 мг/кг, приблизительно 3 мг/кг, приблизительно 3,1 мг/кг, приблизительно 3,2 мг/кг,приблизительно 3,3 мг/кг, приблизительно 3,4 мг/кг, приблизительно 3,5 мг/кг, приблизительно 3,6 мг/кг,приблизительно 3,7 мг/кг, приблизительно 3,8 мг/кг, приблизительно 3,9 мг/кг или приблизительно 4,0 мг/кг веса тела субъекта в течение цикла лечения. В некоторых вариантах осуществления доза будет обычно составлять от 0,1 до 5 мг/кг веса тела субъекта, от 0,1 до 3,2 мг/кг веса тела субъекта, даже обычнее от 0,1 до 2,7 мг/кг, от 0,2 до 1,8 мг/кг, от 0,2 до 1,2 мг/кг, от 0,2 до 1 мг/кг, от 0,4 до 1 мг/кг или от 0,4 до 0,8 мг/кг веса тела субъекта в дни 1, 8 и 15 каждого 28-дневного цикла. В некоторых вариантах осуществления доза будет составлять приблизительно 0,2 мг/кг, приблизительно 0,3 мг/кг, приблизительно 0,4 мг/кг, приблизительно 0,5 мг/кг, приблизительно 0,6 мг/кг, приблизительно 0,7 мг/кг, приблизительно 0,8 мг/кг, приблизительно 0,9 мг/кг, приблизительно 1,0 мг/кг, приблизительно 1,1 мг/кг, приблизительно 1,2 мг/кг, приблизительно 1,3 мг/кг, приблизительно 1,4 мг/кг или приблизительно 1,5 мг/кг веса тела субъекта в дни 1, 8 и 15 каждого 28-дневного цикла. В равных других вариантах осуществления соединение конъюгата антитело-лекарственное средство будет вводиться каждые две недели в цикле лечения, составляющем четыре недели. Например, в некоторых вариантах осуществления соединение конъюгата антитело-лекарственное средство будет вводиться в дни 1 и 15 каждого 28-дневного цикла лечения. В некоторых таких вариантах осуществления доза соединения конъюгата антитело-лекарственное средство, вводимая пациенту с HL, может, например, составлять от 0,1 до 5 мг/кг, от 0,1 до 4 мг/кг, от 0,1 до 3,2 мг/кг или от 0,1 до 2,7 мг/кг веса тела субъекта в течение цикла лечения. В некоторых вариантах осуществления общая доза соединения конъюгата антитело-лекарственное средство, вводимая пациенту с HL, будет составлять, например, от приблизительно 0,6 до приблизительно 5 мг/кг, от приблизительно 0,6 до приблизительно 4 мг/кг, от приблизительно 0,6 до 3,2 мг/кг, от приблизительно 0,6 до приблизительно 2,7 мг/кг или даже от приблизительно 1,5 до приблизительно 3 мг/кг в течение цикла лечения. В некоторых вариантах осуществления доза будет составлять приблизительно 0,6 мг/кг, приблизительно 0,7 мг/кг, приблизительно 0,8 мг/кг,приблизительно 0,9 мг/кг, приблизительно 1,0 мг/кг, приблизительно 1,1 мг/кг, приблизительно 1,2 мг/кг,приблизительно 1,3 мг/кг, приблизительно 1,4 мг/кг, приблизительно 1,5 мг/кг, приблизительно 1,6 мг/кг,приблизительно 1,7 мг/кг, приблизительно 1,8 мг/кг, приблизительно 1,9 мг/кг, приблизительно 2 мг/кг,приблизительно 2,1 мг/кг, приблизительно 2,2 мг/кг, приблизительно 2,3 мг/кг, приблизительно 2,4 мг/кг,приблизительно 2,5 мг/кг, приблизительно 2,6 мг/кг, приблизительно 2,7 мг/кг, приблизительно 2,8 мг/кг,приблизительно 2,9 мг/кг, приблизительно 3 мг/кг, приблизительно 3,1 мг/кг, приблизительно 3,2 мг/кг,приблизительно 3,3 мг/кг, приблизительно 3,4 мг/кг, приблизительно 3,5 мг/кг, приблизительно 3,6 мг/кг,приблизительно 3,7 мг/кг или приблизительно 3,8 мг/кг веса тела субъекта в течение цикла лечения. В некоторых вариантах осуществления доза соединения конъюгата антитело-лекарственное средство будет обычно составлять от 0,1 до 5 мг/кг веса тела субъекта, от 0,1 до 3,2 мг/кг веса тела субъекта, обычнее от 0,1 до 2,7 мг/кг, даже обычнее от 0,2 до 1,8 мг/кг, от 0,2 до 1,2 мг/кг, от 0,2 до 1,5 мг/кг, от 1 до 1,5 мг/кг или от 0,5 до 1,2 мг/кг веса тела субъекта в дни 1 и 15 каждого 28-дневного цикла. В некоторых вариантах осуществления доза будет составлять приблизительно 0,5 мг/кг, приблизительно 0,6 мг/кг, приблизительно 0,7 мг/кг, приблизительно 0,8 мг/кг, приблизительно 0,9 мг/кг, приблизительно 1,0 мг/кг, приблизительно 1,1 мг/кг, приблизительно 1,2 мг/кг, приблизительно 1,3 мг/кг, приблизительно 1,4 мг/кг, приблизительно 1,5 мг/кг, приблизительно 1,6 мг/кг, приблизительно 1,7 мг/кг или приблизительно 1,8 мг/кг веса тела субъекта в дни 1 и 15 каждого 28-дневного цикла. Квалифицированным в данной области техники специалистам будет абсолютно очевидно, что другие дозы или частоты введения соединения конъюгата антитело-лекарственное средство, которые обеспечивают требуемый терапевтический эффект, подходят для применения в настоящем изобретении. Введение соединения конъюгата антитело-лекарственное средство и гемцитабина может осуществляться в одни и те же или различные дни при условии, что введение обеспечивает требуемый терапевтический эффект. Настоящее изобретение включает, например, варианты осуществления, в которых гемцитабин вводят раз в неделю в течение трех следующих друг за другом недель в цикле лечения, составляющем четыре недели, например в дни 1, 8 и 15 28-дневного цикла. Настоящее изобретение включает,например, варианты осуществления, в которых гемцитабин вводят два раза в цикле лечения, составляющем четыре недели, например в дни 1 и 15 28-дневного цикла. Настоящее изобретение включает, например, варианты осуществления, в которых гемцитабин вводят два раза в цикле лечения, составляющем три недели, например в дни 1 и 8 или дни 1 и 15 21-дневного цикла. В некоторых вариантах осуществления настоящего изобретения введение соединения конъюгата антитело-лекарственное средство и гемцитабина будет осуществляться в одни и те же дни, например в дни 1, 8 и 15 цикла, составляющего четыре недели, или дни 1 и 15 цикла, составляющего четыре недели. В некоторых вариантах осуществления настоящего изобретения введение соединения конъюгата антитело-лекарственное средство и гемцитабина будет осуществляться в одни и те же и/или различные дни, например конъюгат антитело-лекарственное средство будет вводиться в день 1 21-дневного цикла, а гемцитабин будет вводиться в дни 1 и 8 или дни 1 и 15 21-дневного цикла. В некоторых вариантах осуществления соединение конъюгата антителолекарственное средство и гемцитабин будут вводиться в одни и те же дни, и гемцитабин будет вводиться после завершения введения конъюгата антитело-лекарственное средство, например гемцитабин будет вводиться менее чем через 2 ч после введения конъюгата антитело-лекарственное средство, например через 30 мин после введения конъюгата антитело-лекарственное средство. Настоящим изобретением охватываются альтернативные схемы лечения, если они приводят к требуемому результату. В некоторых вариантах осуществления гемцитабин будут назначать на уровнях, в настоящее время предписанных в данной области для лечения HL, или на более низких или более высоких уровнях, чем уровни, в настоящее время предписанные в данной области для лечения HL, при условии, что такая доза обеспечивает терапевтический эффект. Варианты осуществления настоящего изобретения включают,например, варианты, в которых схему лечения гемцитабином назначают приблизительно в MTD, максимальной переносимой дозе. Варианты осуществления настоящего изобретения включают варианты, в которых гемцитабин вводят в диапазоне доз, составляющем от приблизительно 100 до приблизительно 2000 мг/м 2, от приблизительно 500 до приблизительно 1500 мг/м 2, от приблизительно 500 до приблизительно 1250 мг/м 2 или от приблизительно 750 до приблизительно 1250 мг/м 2 на каждое введение. В особенно предпочтительных вариантах осуществления гемцитабин вводится в диапазоне доз, составляющем от приблизительно 750 до приблизительно 1250 мг/м 2 на каждое введение или от приблизительно 1000 до приблизительно 1250 мг/м 2 на каждое введение. Например, в некоторых вариантах осуществления гемцитабин будет вводиться в диапазоне доз, составляющем от приблизительно 750 до приблизительно 1250 мг/м 2 или от приблизительно 1000 до приблизительно 1250 мг/м 2, в дни 1, 8 и 15 28-дневного цикла лечения. В некоторых вариантах осуществления гемцитабин будет вводиться в диапазоне доз, составляющем от приблизительно 750 до приблизительно 1250 мг/м 2 или от приблизительно 1000 до приблизительно 1250 мг/м 2, в дни 1 и 15 28-дневного цикла лечения. В некоторых вариантах осуществления гемцитабин будет вводиться в диапазоне доз, составляющем от приблизительно 750 до приблизительно 1250 мг/м 2 или от приблизительно 1000 до приблизительно 1250 мг/м 2, в дни 1 и 8 или дни 1 и 15 21-дневного цикла лечения. Настоящим изобретением предусматривается введение гемцитабина в течение одного или более циклов лечения, например 1, 2, 3, 4, 5, 6 или более циклов лечения. Варианты осуществления настоящего изобретения включают варианты, в которых гемцитабин вводят с помощью внутривенной инфузии на протяжении 30 мин. В некоторых вариантах осуществления доставку приблизительно 1000 мг/м 2 осуществляют с помощью внутривенной инфузии на протяжении 30 мин в дни 1, 8 или 15 каждого 28-дневного цикла лечения. Будет понятно, что любой из указанных в настоящем документе диапазонов доз для лечения гемцитабином можно скомбинировать с любым из указанных в настоящем документе диапазонов доз для лечения соединением конъюгата антитело-лекарственное средство при условии, что назначение обеспечивает требуемый терапевтический эффект, т.е. синергизм. В некоторых особенно предпочтительных примерах настоящего изобретения введение синергетического количества терапевтических средств включает введение соединения конъюгата антителолекарственное средство в диапазоне общей дозы, составляющем от приблизительно 0,5 до приблизительно 5 мг/кг, от приблизительно 0,6 до приблизительно 5 мг/кг, от приблизительно 0,6 до приблизительно 2,7 мг/кг, от приблизительно 0,8 до приблизительно 2,7 мг/кг, от приблизительно 1 до приблизительно 5 мг/кг, от приблизительно 1 до приблизительно 4 мг/кг, от приблизительно 1 до приблизительно 3,5 мг/кг, от приблизительно 1,5 до приблизительно 3,5 мг/кг или даже от приблизительно 1,8 до приблизительно 2,5 мг/кг в течение 21- или 28-дневного цикла, независимо от схемы введения доз, в комбинации с введением гемцитабина в стандартных схемах введения доз, известных в данной области техники,например от приблизительно 800 до приблизительно 1500 мг/м 2 на каждое введение гемцитабина во время цикла лечения, предпочтительно от приблизительно 1000 до приблизительно 1250 мг/м 2 на каждое введение гемцитабина во время цикла лечения (например, 1-3 раз во время 21- или 28-дневного цикла лечения). В некоторых особенно предпочтительных примерах настоящего изобретения введение синергетического количества терапевтических средств включает введение соединения конъюгата антителолекарственное средство один раз во время цикла лечения (например, 21- или 28-дневного цикла лечения) в диапазоне, составляющем от приблизительно 0,5 до приблизительно 2,7 мг/кг, от приблизительно 0,6 до приблизительно 2,7 мг/кг, от приблизительно 0,6 до приблизительно 2 мг/кг, от приблизительно 0,6 до приблизительно 1 мг/кг, от приблизительно 0,8 до приблизительно 2,7 мг/кг, от приблизительно 0,8 до приблизительно 2 мг/кг, от приблизительно 1 до приблизительно 2,7 мг/кг, от приблизительно 1,5 до приблизительно 2,7 мг/кг или даже предпочтительнее от приблизительно 1,0 до приблизительно 2 мг/кг или от приблизительно 1,5 до приблизительно 2 мг/кг веса тела субъекта, в комбинации с введением гемцитабина в стандартных схемах введения доз, известных в данной области техники, например, от приблизительно 800 до приблизительно 1500 мг/м 2 на каждое введение гемцитабина во время цикла лечения, предпочтительно от приблизительно 1000 до приблизительно 1250 мг/м 2 на каждое введение гемцитабина во время цикла лечения (например, 1-3 раз во время цикла лечения). Например, в одном варианте осуществления введение синергетического количества терапевтических средств включает введение соединения конъюгата антитело-лекарственное средство один раз во время 3-недельного цикла лечения (например, в день 1 21-дневного цикла лечения) в диапазоне, составляющем от приблизительно 0,5 до приблизительно 2,7 мг/кг, от приблизительно 0,6 до приблизительно 2,7 мг/кг, от приблизительно 0,8 до приблизительно 2 мг/кг, от приблизительно 1,5 до приблизительно 2,7 мг/кг или от приблизительно 1,5 до приблизительно 2 мг/кг веса тела субъекта, в комбинации с введением гемцитабина в дни 1 и 8 или дни 1 и 15 21-дневного цикла лечения в диапазоне, составляющем от приблизительно 800 до приблизительно 1500 мг/м 2, предпочтительно от приблизительно 1000 до приблизительно 1250 мг/м 2. В некоторых особенно предпочтительных примерах настоящего изобретения введение синергетического количества терапевтических средств включает введение соединения конъюгата антителолекарственное средство три раза во время цикла лечения (например, 21- или 28-дневного цикла лечения) в диапазоне, составляющем от приблизительно 0,4 до приблизительно 2,0 мг/кг, от приблизительно 0,4 до приблизительно 1,8 мг/кг, от приблизительно 0,4 до приблизительно 1 мг/кг, от приблизительно 0,4 до приблизительно 1,5 мг/кг на каждое введение, в комбинации с введением гемцитабина в стандартных схемах введения доз, известных в данной области техники, например, от приблизительно 800 мг/м 2 до приблизительно 1500 мг/м 2 на каждое введение гемцитабина во время цикла лечения, предпочтительно от приблизительно 1000 мг/м 2 до приблизительно 1250 мг/м 2 на каждое введение гемцитабина во время цикла лечения (например, 1-3 раз во время цикла лечения). Например, в одном варианте осуществления введение синергетического количества терапевтических средств включает введение соединения конъюгата антитело-лекарственное средство в дни 1, 8 и 15 28-дневного цикла в диапазоне, составляющем от приблизительно 0,4 до приблизительно 2 мг/кг, от приблизительно 0,4 до приблизительно 1,8 мг/кг, от приблизительно 0,4 до приблизительно 1 мг/кг веса тела субъекта, от приблизительно 0,4 до приблизительно 1,5 мг/кг веса тела субъекта на каждое введение, в комбинации с введением гемцитабина в дни 1,8 и 15 28-дневного цикла в диапазоне, составляющем от приблизительно 800 до приблизительно 1250 мг/м 2, предпочтительно от приблизительно 1000 до приблизительно 1250 мг/м 2 на каждое введение. В некоторых особенно предпочтительных примерах настоящего изобретения введение синергетического количества терапевтических средств включает введение соединения конъюгата антителолекарственное средство два раза во время цикла лечения (например, 21- или 28-дневного цикла лечения) в диапазоне, составляющем от приблизительно 0,4 до приблизительно 2,0 мг/кг, от приблизительно 0,4 до приблизительно 1,8 мг/кг, от приблизительно 0,4 до приблизительно 1 мг/кг, от приблизительно 0,4 до приблизительно 1,5 мг/кг на каждое введение, в комбинации с введением гемцитабина в стандартных схемах введения доз, известных в данной области техники, например, от приблизительно 800 до приблизительно 1500 мг/м 2 на каждое введение гемцитабина во время цикла лечения, предпочтительно от приблизительно 1000 до приблизительно 1250 мг/м 2 на каждое введение гемцитабина во время цикла лечения (например, 1-3 раз во время цикла лечения). Например, введение синергетического количества терапевтических средств включает введение соединения конъюгата антитело-лекарственное средство в дни 1 и 15 28-дневного цикла в диапазоне, составляющем от приблизительно 0,4 до приблизительно 2 мг/кг, от приблизительно 0,4 мг/кг до приблизительно 1,8 мг/кг, от приблизительно 0,4 до приблизительно 1 мг/кг веса тела субъекта, от приблизительно 0,4 до приблизительно 1,5 мг/кг веса тела субъекта на каждое введение, в комбинации с введением гемцитабина в дни 1, 8 и 15 28-дневного цикла в диапазоне, составляющем от приблизительно 800 до приблизительно 1250 мг/м 2, предпочтительно от приблизительно 1000 до приблизительно 1250 мг/м 2 на каждое введение. Н. Фармацевтические композиции. Различные системы доставки известны и могут использоваться для введения соединений конъюгата антитело-лекарственное средство и химиотерапевтических средств. Способы введения включают, но без ограничения, внутрикожный, внутримышечный, внутрибрюшинный, внутривенный и подкожный пути введения. Введение может осуществляться, например, с помощью инфузии или болюсной инъекции. В некоторых предпочтительных вариантах осуществления введение и химиотерапевтического средства, и соединения конъюгата антитело-лекарственное средство осуществляют с помощью инфузии. Соединение конъюгата антитело-лекарственное средство и химиотерапевтические средства можно вводить в виде фармацевтических композиций, содержащих один или более фармацевтически совместимых ингредиентов. Например, фармацевтическая композиция обычно включает один или более фармацевтических носителей (например, стерильных жидкостей, таких как вода и масла, включающие масла минерального, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и подобные). Вода является более типичным носителем, когда фармацевтическую композицию вводят внутривенно. Солевые растворы и водные растворы декстрозы и глицерина могут также использоваться в качестве жидких носителей, в частности, для инъецируемых растворов. Подходящие фармацевтические наполнители известны в данной области техники. Композиция, при желании, может также содержать незначительные количества смачивающих агентов или эмульгаторов, или pH-буферных агентов. Примеры подходящих фармацевтических носителей приведены в "Remington's Pharmaceutical Sciences" by E.W. Martin. Композиции соответствуют способу введения. В типичных вариантах осуществления фармацевтическую композицию составляют в соответствии с обычными процедурами в виде фармацевтической композиции, адаптированной для внутривенного введения людям. Как правило, композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости, лекарственное средство может также включать солюбилизирующий агент и местный анестетик, такой как лигнокаин, для ослабления боли в месте инъекции. Как правило, ингредиенты поставляются или по отдельности, или смешанными вместе в форме стандартной дозы, например в виде сухого лиофилизированного порошка или концентрата без воды в герметизированном контейнере, таком как ампула или саше, на котором указывается количество активного агента. Если лекарственное средство должно вводиться с помощью инфузии, его можно диспергировать с использованием, например, бутыли для инфузии, содержащей стерильную воду или солевой раствор фармацевтического класса. Если лекарственное средство вводится с помощью инъекции,может быть предоставлена, например, ампула со стерильной водой для инъекции или солевым раствором при таком условии, что ингредиенты можно смешать до введения.I. Субъекты. Способы настоящего изобретения включают назначение субъекту комбинированной терапии для лечения лимфомы Ходжкина. Субъектами, подвергаемыми лечению способами настоящего изобретения, являются субъекты, у которых диагностирована лимфома Ходжкина, или субъекты с подозрением на наличие лимфомы Ходжкина. Диагностирование может быть осуществлено известными в данной области техники способами,включающими, например, биопсию лимфатических узлов. После диагностирования лимфомы Ходжкина,при желании, заболевание субъекта можно классифицировать в соответствии с его стадией, используя одну из известных схем классификации. Одной такой схемой классификации является схема классификации в соответствии со стадией Cotswold's. Вкратце, стадия I может характеризоваться поражением одной лимфоузловой области или лимфоидной структуры, стадия II может характеризоваться поражением двух или более лимфоузловых областей или лимфоузловых структур с одной и той же стороны диафрагмы, стадия III может характеризоваться поражением лимфоузловых областей или лимфоузловых структур с обеих сторон диафрагмы, и стадия IV может характеризоваться диффузным или диссеминированным поражением одного или более внеузловых органов или тканей, помимо тех, которые обозначены Е,с поражением лимфатических узлов или без такого поражения. Обозначение Е относится к распространению на соседние внеузловые органы или ткани, которое может быть включено в область облучения,подходящую для болезни лимфатических узлов одинаковой анатомической степени. Субъекты на стадиях I или II могут иметь благоприятный или неблагоприятный прогноз в зависимости от наличия или отсутствия определенных клинических признаков. Для целей настоящего изобретения заболевание ранней стадии у субъектов относят к стадии I или II, в то время как заболевание поздней стадии у субъектов относят к стадии III или IV. Способы настоящего изобретения можно использовать для лечения субъектов,заболевания которых отнесены к одной из четырех стадий заболевания, в том числе субъектов с заболеваний поздней стадии. Способы настоящего изобретения включают лечение субъекта, у которого недавно диагностирована HL и который ранее не подвергался лечению, связанному с HL. Способы настоящего изобретения можно также использовать для лечения субъектов с не поддающейся лечению и/или рецидивирующей лимфомой Ходжкина. Субъектом с не поддающейся лечению лимфомой Ходжкина является субъект, не отвечающий на терапию для HL, т.е. субъект продолжает проявлять развитие заболевание, несмотря на терапию. Субъектом с рецидивирующей лимфомой Ходжкина является субъект, который имел ответную реакцию на терапию для HL в один момент времени, но имел рецидив или дальнейшее развитие заболевания после ответной реакции. Способы настоящего изобретения также включают лечение субъекта, ранее подвергшегося лечению с использованием схемы химиотерапевтического лечения лимфомы Ходжкина первой линии, или субъекта, подвергшегося лечению с использованием и схемы химиотерапевтического лечения первой линии,и/или схемы химиотерапии спасения. Схемы химиотерапевтического лечения лимфомы Ходжкина первой линии включают, например, схему ABVD (Bonadonna and Santoro, Cancer Treat Rev. 1982; 9: 21-35),схему BEACOPP (Diehl et al., N. Engl. J. Med. 2003; 348: 2386-2395), схему BEACOPP с увеличением доз(Diehl et al., N. Engl. J. Med. 2003; 348: 2386-2395), схему МОРР (Devita et al., Ann. Inter. Med. 1970; 73: 881-895) и схему Stanford V (Horning et al., J. Clin. Oncol. 2000; 18: 972-980). Схемы химиотерапии спасения включают, например, схему ESHAP (Aparicio et al., Ann. Oncol. 1999; 10: 593-595), модифицированную схему Stanford V (Aviles et al., Med. Oncol. 2001; 18: 261-267), схему GDP (Baetz et al., Ann. Oncol. 2003; 14: 1762-1767), схему Mini-Beam (Colwill et al., J. Clin. Oncol. 1995; 13: 396-402; Fernandez-JimenezAm. 1998; 4: 254-260). Способы настоящего изобретения также включают лечение субъекта, который ранее был подвергнут трансплантации стволовых клеток.J. Антитела против CD30. Антитела против CD30, подходящие для применения в соответствии с композициями и способами настоящего изобретения, включают любое антитело, которое специфически связывается с антигеномCD30. Антитела против CD30 являются предпочтительно моноклональными и могут включать, например, химерные (например, имеющие константную область человека и вариабельную область мыши), гуманизированные антитела или антитела человека; одноцепочечные антитела или подобные. Молекулы иммуноглобулинов могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например,IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса молекулы иммуноглобулина. В некоторых вариантах осуществления антителом является антигенсвязывающий фрагмент антитела, такой как, например, Fab, F(ab'), F(ab')2, Fd-цепь, одноцепочечный Fv (scFv), одноцепочечное антитело, дисульфидсвязанный Fv (sdFv), фрагмент, включающий или VL-, или VH-домен, или фрагменты, полученные с использованием экспрессирующей Fab библиотеки, или CD30-связывающий фрагмент любого из указанных выше антител. Антигенсвязывающие фрагменты антител, в том числе одноцепочечные антитела, могут включать вариабельную область(и) отдельно или вместе со всей совокупностью или частью следующих доменов: шарнирной области, CH1-, CH2-, CH3- и CL-доменов. Также антигенсвязывающие фрагменты могут включать любую комбинацию вариабельной области(ей) с шарнирной областью, CH1-, CH2-, CH3- и CL-доменами. Как правило, антитела являются антителами человека, грызуна(например, мыши и крысы), осла, овцы, кролика, козы, морской свинки, верблюда, лошади или курицы. Как в настоящем документе используются, антитела "человека" включают антитела, имеющие аминокислотную последовательность иммуноглобулина человека, и включают антитела, выделенные из библиотеки иммуноглобулинов человека, из В-клеток человека или из животных, трансгенных по одному или более иммуноглобулинам человека (см., например, в патентах США 5939598 и 6111166). Антитела могут быть моноспецифическими, биспецифическими, триспецифическими или с большей степенью полиспецифичности (см., например, публикации РСТ-заявок WO 93/17715, WO 92/08802,WO 91/00360 и WO 92/05793; Tutt et al., 1991, J. Immunol. 147: 60-69; патенты США 4474893, 4714681,4925648, 5573920 и 5601819; Kostelny et al., 1992, J. Immunol. 148: 1547-1553). Приводимые в качестве примеров антитела против CD30 включают, но без ограничения, гуманизированные или химерные антитела АС 10 или HeFi-1. Соответственно, приводимое в качестве примера антитело против CD30 включает один или более CDR HeFi-1 мыши (SEQ ID NO: 20, SEQ ID NO: 22, SEQNO: 6, SEQ ID NO: 8, SEQ ID NO: 12, SEQ ID NO: 14 или SEQ ID NO: 16). В некоторых вариантах осуществления антитело против CD30 включает одну или более вариабельных областей HeFi-1 мыши (SEQID NO: 18 или SEQ ID NO: 26) или АС 10 мыши (SEQ ID NO: 2 или SEQ ID NO: 10). Ниже приведена таблица, в которой указана область АС 10 или HeFi-1, которой соответствует каждый SEQ ID NO. Приводимые в качестве примеров антитела против CD30 включают функциональные производные или аналоги АС 10 или HeFi-1. Используемый в настоящем документе термин "функциональный" в этом контексте означает, что функциональное производное или аналог АС 10 или HeFi-1 способны к связыванию с CD30. В некоторых вариантах осуществления антитела против CD30 не только иммуноспецифически связываются с CD30, то также оказывают цитостатический и/или цитотоксический эффект на раковые клетки при HL, причем цитостатический или цитотоксический эффект является комплементзависимым и может быть достигнут в отсутствие (i) конъюгации с цитостатическим или цитотоксическим средством или(ii) клеток-эффекторов. Определение или спецификацию антител против CD30 можно осуществить по конкретным CDR,которые они включают. В некоторых вариантах осуществления антитела включают CDR AC10 и/илиHeFi-1. В некоторых вариантах осуществления антитела являются химерными или гуманизироваными формами АС 10 или HeFi-1. Настоящим изобретением охватывается антитело, которое включает вариабельный домен тяжелой или легкой цепи, при этом указанный вариабельный домен включает (а) совокупность из трех CDR, которая происходит из мышиного моноклонального антитела АС 10 или HeFi-1, и(b) совокупность из четырех каркасных областей, которая отличается от совокупности каркасных областей в мышином моноклональном антителе АС 10 или HeFi-1, и которое иммуноспецифически связывается с CD30. В конкретном варианте осуществления настоящим изобретением охватывается антитело, которое включает вариабельный домен тяжелой цепи, при этом указанный вариабельный домен включает (a) совокупность из трех CDR, которая включает SEQ ID NO: 4, 6 или 8 или включает аминокислотные последовательности, которые в значительной степени идентичны аминокислотным последовательностям,представленным в SEQ ID NO: 4, 6 или 8; (b) совокупность из четырех каркасных областей, которая отличается от совокупности каркасных областей в мышином моноклональном антителе АС 10, и которое иммуноспецифически связывается с CD30. В конкретном варианте осуществления настоящим изобретением охватывается антитело, которое включает вариабельный домен тяжелой цепи, при этом указанный вариабельный домен включает (а) совокупность из трех CDR, которая включает SEQ ID NO: 20, 22 или 24 или включает аминокислотные последовательности, которые в значительной степени идентичны аминокислотным последовательностям, представленным в SEQ ID NO: 20, 22 или 28; (b) совокупность из четырех каркасных областей, которая отличается от совокупности каркасных областей в мышином моноклональном антителе HeFi-1,которое иммуноспецифически связывается с CD30. В конкретном варианте осуществления настоящим изобретением охватывается антитело, которое включает вариабельный домен легкой цепи, при этом указанный вариабельный домен включает (а) совокупность из трех CDR, которая включает SEQ ID NO: 12, 14 или 16 или включает аминокислотные последовательности, которые в значительной степени идентичны аминокислотным последовательностям,представленным в SEQ ID NO: 12, 14 или 16; (b) совокупность из четырех каркасных областей, которая отличается от совокупности каркасных областей в мышином моноклональном антителе АС 10, которое иммуноспецифически связывается с CD30. В конкретном варианте осуществления настоящим изобретением охватывается антитело, которое включает вариабельный домен легкой цепи, при этом указанный вариабельный домен включает (а) совокупность из трех CDR, которая включает SEQ ID NO: 28, 30 или 32 или включает аминокислотные последовательности, которые в значительной степени идентичны аминокислотным последовательностям,представленным в SEQ ID NO: 28, 30 или 32; (b) совокупность из четырех каркасных областей, которая отличается от совокупности каркасных областей в мышином моноклональном антителе HeFi-1, которое иммуноспецифически связывается с CD30. Настоящее изобретение включает варианты осуществления, в которых химерное антитело АС 10 включает вариабельную область тяжелой цепи, представленную в SEQ ID NO: 2, вариабельную область легкой цепи, представленную в SEQ ID NO: 10, константную область гамма I человека, представленную в SEQ ID NO: 33 или аминокислотами 1-329 SEQ ID NO: 33, и константную область каппа человека,представленную в SEQ ID NO: 34. Кроме того, определение или спецификацию антител можно также осуществить по их первичным структурам. Антитела против CD30, которые идентичны по крайней мере на 80%, по крайней мере 85%,по крайней мере 90%, по крайней мере 95% и наиболее предпочтительно по крайней мере 98% (что рассчитано, используя способы, известные в данной области техники и описанные в настоящем документе) вариабельным областям АС 10 или HeFi-1 мыши, также включены в настоящее изобретение. Определение или спецификацию антител настоящего изобретения можно также осуществить по их аффинности связывания с CD30. Предпочтительные аффинности связывания включают те, которые характеризуются константной диссоциации или Kd, составляющей менее 510-6 М, 10-6 М, 510-7 М, 10-7 М, 510-8 М, 10-8 М, 510-9 М, 10-9 М, 510-10 М, 10-10 М, 510-11 М, 10-11 М, 510-12 М, 10-12 М, 510-13 М, 10-13 М, 510-14 М,10-14 М, 510-15 М или 10-15 М. Антитела можно очистить, например, с помощью аффинной хроматографии с использованием антигена CD30. В некоторых вариантах осуществления чистота антитела составляет по крайней мере 50%,по крайней мере 60%, по крайней мере 70% или по крайней мере 80%. В других вариантах осуществления чистота антитела составляет более 85%, более 90%, более 95% или более 99%. Антитела также включают антитела, которые являются модифицированными, например, путем присоединения к антителу любого типа молекулы так, что присоединение не препятствует связыванию антитела с CD30. Например, но не в качестве ограничения, термин "антитело" включает антитела, которые были модифицированы, например, с помощью гликозилирования, дегликозилирования, ацетилирования, пегилирования, фосфорилирования, амидирования, получения производных с использованием известных защитных/блокирующих групп, связывания с клеточным лигандом или другим белком и т.п. Любую из многочисленных химических модификаций можно выполнить с помощью известных методов,включающих, но без ограничения, специфическое химическое расщепление, ацетилирование, введение радикала СНО, метаболический синтез туникамицина и т.п. Антитела настоящего изобретения можно создать с помощью любого подходящего способа, известного в данной области техники. Поликлональные антитела против CD30 можно продуцировать с по- 21020696 мощью различных способов, широко известных в данной области техники. Например, CD30 можно ввести различным животным-хозяевам, включающим, но без ограничения, кроликов, мышей, крыс и т.п.,для индукции продукции сывороток, содержащих поликлональные антитела, специфичные для этого белка. Различные адъюванты можно использовать для увеличения иммунологической реакции, в зависимости от вида хозяина. Моноклональные антитела можно приготовить, используя широкий выбор методов, известных в данной области техники, включающих использование гибридомы, рекомбинантных технологий и технологий фагового дисплея или их комбинации. Например, моноклональные антитела можно продуцировать, используя гибридомные технологии, включающие те, которые известны в данной области техники и доступны, например, в Harlow et al., Anitibodies: A Laboratory Manual (Cold Spring Harbor LaboratoryPress, 2nd ed., 1998); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier,N.Y., 1981) (указанные ссылки включены полностью посредством ссылки). Способы получения и скрининга специфических антител, используя гибридомную технологию, являются обычными и широко известными в данной области техники. В не ограничивающем примере мышей можно иммунизировать CD30 или экспрессирующей CD30 клеткой, или его фрагментом или производным. После выявления иммунного ответа, например, выявления антител, специфичных для CD30, в мышиной сыворотке, получают селезенку мыши, и выделяют спленоциты. Затем спленоциты сливают с помощью широко известных методов с любыми подходящими миеломными клетками, например, клетками линии клеток SP20, доступной из Американской коллекции типовых культур, Rockville, MD(АТСС). Гибридомы отбирают и клонируют методом серийных разведений. Затем гибридомные клоны исследуют с помощью известных в данной области техники способов на наличие клеток, которые секретируют антитела, способные к связыванию с CD30. Асцитическую жидкость, которая обычно содержит высокие уровни антител, можно получить путем инъецирования мышам положительных гибридомных клонов. Соответственно, настоящим изобретением предоставляются способы создания моноклональных антител, а также антител, продуцируемых с помощью способа, включающего культивирование секретирующей антитело гибридомной клетки, причем предпочтительно гибридому создают слиянием спленоцитов, выделенных из иммунизированной антигеном настоящего изобретения мыши, с миеломными клетками и затем скринингом гибридом, являющихся следствием слияния, для получения гибридомных клонов, которые секретируют антитело, способное к связыванию с CD30. Фрагменты антител, которые распознают специфические эпитопы, можно создать с помощью известных методов. Например, Fab- и F(ab')2-фрагменты можно получить при протеолитическом расщеплении молекул иммуноглобулинов, используя такие ферменты, как папаин (для получения Fabфрагментов) или пепсин (для получения F(ab')2-фрагментов). F(ab')2-фрагменты содержат вариабельную область, константную область легкой цепи и СН 1-домен тяжелой цепи. Антитела можно также создать, используя различные способы фагового дисплея, известные в данной области техники. В способах фагового дисплея функциональные домены антител представлены на поверхности фаговых частиц, которые несут кодирующие их последовательности нуклеиновых кислот. В конкретном варианте осуществления такой фаг может использоваться для дисплея антигенсвязывающих доменов, экспрессируемых из репертуарной или комбинаторной библиотеки антител (например, человека или мыши). В частности, последовательности ДНК, кодирующие VH- и VL-домены, амплифицируют из библиотек кДНК животного (например, библиотек кДНК из лимфоидных тканей человека или мыши). ДНК, кодирующие VH- и VL-домены, соединяют снова вместе с использованием scFv-линкера с помощью ПЦР и клонируют в фагемидный вектор (например, pCANTAB 6 или pComb 3 HSS). Вектор подвергают электропорации в E.coli, и E.coli инфицируют фагом-помощником. Используемыми в этих способах фагами обычно являются нитевидные фаги fd и М 13, включающие связывающие домены, экспрессируемые с фага в составе Fab-, Fv-доменов или Fv-домена со стабилизацией дисульфидных связей (dsFv) антител, рекомбинантно слитых с фаговым белком или гена III, или гена VIII. Фаг, экспрессирующий антигенсвязывающий домен, который связывается с CD30, или вариабельную область АС 10 или HeFi-1,можно отобрать или идентифицировать с использованием антигена, например, используя меченый антиген или антиген, связанный или зафиксированный на твердой поверхности или шарике. Примеры способов фагового дисплея, которые можно использовать для создания антител настоящего изобретения,включают способы, раскрытые в Brinkman et al., 1995, J. Immunol. Methods 182: 41-50; Ames et al., 1995, J.Immunol. Methods 184: 177-186; Kettleborough et al., 1994, Eur. J. Immunol. 24: 952-958; Persic et al., 1997,Gene 187: 9-18; Burton et al., 1994, Advances in Immunology, 191-280; РСТ-заявкаPCT/GB91/01134; публикации РСТ-заявок WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; и патенты США 5698426, 5223409, 5403484, 5580717, 5427908, 5750753,5821047, 5571698, 5427908, 5516637, 5780225, 5658727, 5733743 и 5969108, все включены полностью посредством ссылки. Как описано в вышеприведенных ссылках, после отбора фагов кодирующие антитела районы можно выделить из фага и использовать для создания цельных антител, в том числе антител человека, или любого другого желаемого антигенсвязывающего фрагмента и экспрессировать в любом желаемом хозяине, в том числе клетках млекопитающих, клетках насекомых, клетках растений, дрожжах и бактериях,например, как подробно описано ниже. Например, методы рекомбинантной продукции Fab-, Fab' иF(ab')2-фрагментов можно также применять, используя способы, известные в данной области техники,такие как способы, раскрытые в публикации РСТ-заявки WO 92/22324; Mullinax et al., BioTechniques 1992, 12(6): 864-869; Sawai et al., 1995, AJRI 34: 26-34; и Better et al., 1988, Science 240: 1041-1043 (указанные ссылки включены полностью посредством ссылки). Примеры методов, которые можно использовать для получения одноцепочечных Fv и антител,включают методы, описанные в патентах США 4946778 и 5258498; Huston et al., 1991, Methods in Enzymology 203: 46-88; Shu et al., 1993, PNAS 90: 7995-7999; и Skerra et al., 1988, Science 240: 1038-1040. Для некоторых применений, в том числе in vivo использования антител для людей и in vitro исследования пролиферации и реакции цитотоксичности, предпочтительно использовать химерные, гуманизированные антитела или антитела человека. Химерным антителом является молекула, в которой различные части антитела происходят из различных видов животных, такая как антитела, имеющие вариабельную область, происходящую из мышиного моноклонального антитела и константную область иммуноглобулина человека. Способы продуцирования химерных антител известны в данной области техник. См., например, Morrison, Science, 1985, 229: 1202; Oi et al., 1986, BioTechniques 4: 214; Gillies et al., 1989, J. Immunol.Methods 125: 191-202; патенты США 5807715, 4816567 и 4816397, которые включены сюда в целом путем представления ссылки на них. Гуманизированные антитела представляют собой молекулы антител, происходящие из антитела не являющегося человеком вида, связывающегося с желаемым антигеном, имеющие один или более CDR, происходящих из не являющегося человеком вида, и каркасные и константные области из молекулы иммуноглобулина человека. Часто остатки в каркасных областях человека будут замещены соответствующими остатками из антитела-донора CDR для изменения, предпочтительно увеличения, связывания с антигеном. Эти замены в каркасных областях определяют с помощью способов, широко известных в данной области техники, например, с помощью моделирования взаимодействий остатков CDR и каркасных областей для идентификации остатков каркасных областей, важных для связывания с антигеном, и сравнения последовательностей для идентификации необычных остатков каркасных областей в конкретных положениях (см., например, Queen et al., патент США 5585089;Riechmann et al., 1988, Nature 332: 323, которые включены сюда в целом путем представления ссылки на них). Антитела можно гуманизировать, используя ряд известных в данной области техники методов,включающих, например, CDR-пересадку (ЕР 239400; публикация РСТ-заявки WO 91/09967; патенты США 5225539, 5530101 и 5585089), венирование или поверхностное изменение (ЕР 592106, ЕР 519596; Padlan, Molecular Immunology, 1991, 28(4/5): 489-498; Studnicka et al., 1994, Protein Engineering 7(6): 805-814; Roguska et al., 1994, PNAS 91: 969-973) и перестановку цепей (патент США 5565332). Полностью человеческие антитела особенно желательны для терапевтического лечения являющихся людьми пациентов. Антитела человека можно создать рядом известных в данной области техники способов, включающих способы фагового дисплея, описанные выше, используя библиотеки антител,полученные из последовательностей иммуноглобулинов человека. См. также патенты США 4444887 и 4716111 и публикации РСТ-заявок WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741, все из которых включены сюда в целом путем представления ссылки на них. Антитела человека можно также продуцировать с использованием трансгенных мышей, которые экспрессируют гены иммуноглобулинов человека. Для обзора этой технологии продуцирования антител человека см. Lonberg and Huszar, 1995, Int. Rev. Immunol. 13: 65-93. Для подробного обсуждения этой технологии продуцирования антител человека и моноклональных антител человека и протоколов для продукции таких антител см. публикации РСТ-заявок WO 98/24893, WO 92/01047, WO 96/34096, WO 96/33735; Европейский патент 0598877; патенты США 5413923, 5625126, 5633425, 5569825,5661016, 5545896, 5814318, 5885793, 5916771 и 5939598, все включены полностью посредством ссылки. Кроме того, можно привлечь такие компании, как Amgen (Thousand Oaks, CA) и Medarex (Princeton, NJ),к предоставлению антител человека, направленных против выбранного антитела, при использовании технологии, схожей с описанной выше технологией. Полностью человеческие антитела, которые распознают выбранный эпитоп, можно создать, используя технологию, названную "управляемым отбором". В этом подходе отобранное нечеловеческое моноклональное антитело, например мышиное антитело, используют для управления отбором полностью человеческого антитела, распознающего тот же эпитоп (Jespers et al., 1994, BioTechnology 12: 899903). Антитела для использования в настоящем изобретении включают химерное и гуманизированное АС 10, а также химерное и гуманизированное HeFi-1. Антитела для использования в настоящем изобретении включают антитела, которые конкурентно ингибируют связывание АС 10 или HeFi-1 мыши сCD30, что определяют с помощью любого известного в данной области техники способа определения конкурентного связывания. Например, антитело может ингибировать связывание АС 10 или HeFi-1 сCD30 по крайней мере на 50%, по крайней мере 60%, по крайней мере 70%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90% или даже по крайней мере 95%. Одним примером анализа конкурентного связывания является радиоиммуноанализ, включающий инкубацию меченого (например, 3 Н или 125I) CD30 с представляющим интерес антителом в присутствии увеличивающихся количеств немеченого CD30 и выявление антитела, связавшегося с меченым CD30. Аффинность антитела в отношенииCD30 и скорости диссоциации при связывании можно затем определить на основе данных графика Скэтчарда. Конкуренцию со вторым антителом (таким как АС 10 или HeFi-1) можно также определить, используя радиоиммуноанализы. В этом случае CD30 инкубируют с представляющим интерес антителом,конъюгированным с меченым соединением (например, 3 Н или 125I) в присутствии увеличивающихся количеств немеченого второго антитела. Антитела для использования в настоящем изобретении также включают антитела, отличные от химерного или гуманизированного АС 10 или HeFi-1, которые специфически связываются с CD30. Один способ, с помощью которого выявляются взаимодействия белков in vivo, двухгибридная система, детально описывается только для иллюстративных целей, а не в качестве ограничения. Один вариант этой системы был описан (Chien et al., 1991, Proc. Natl. Acad. Sci. USA, 88: 9578-9582), и его можно купить у Clontech (Palo Alto, CA). После идентификации связывающегося с CD30 белка, при желании, можно определить его способность (отдельно или после мультимеризации или слияния с доменом димеризации или мультимеризации) к вызову цитостатического или цитотоксического эффекта на клетки HL путем приведения культуры линии клеток HL, такой как L428, L450, HLLM2 или KM-H2, в контакт с белком. Условия культивирования наиболее предпочтительно представляют собой приблизительно 5000 клеток на площади культивирования, составляющей приблизительно 0,33 см 2, и период контактирования, составляющий приблизительно 72 ч. Затем культуру подвергают воздействию 0,5 мкКи 3 Н-тимидина в течение завершающих 8 ч 72-часового периода времени и определяют включение 3 Н-тимидина в клетки культуры. Белок имеет цитостатический или цитотоксический эффект на линию клеток HL, если клетки культуры характеризуются уменьшенным включением 3 Н-тимидина по сравнению с клетками той же линий клеток, подвергнутыми культивированию в тех же условиях, но не приводимыми в контакт с белком. Квалифицированным в данной области техники специалистам известно множество других реакций цитотоксичности. В способах настоящего изобретения можно использовать любой из них. Антитела против CD30, применимые в способах настоящего изобретения, можно продуцировать с помощью любого известного в данной области техники способа синтеза белков, как правило, например, с помощью методов рекомбинантной экспрессии. Рекомбинантная экспрессия антитела или его производного, которое связывается с CD30 и сокращает или ингибирует пролиферацию экспрессирующих CD30 клеток, может включать конструирование экспрессионного вектора, содержащего нуклеиновую кислоту,которая кодирует антитело или его производное. После получения нуклеиновой кислоты, кодирующей такой белок, можно получить вектор для продукции молекулы белка с помощью технологии рекомбинантных ДНК, используя широко известные в данной области техники методы. Для способов рекомбинантных нуклеиновых кислот, синтеза нуклеиновых кислот, культивирования клеток, включения трансгенов и экспрессии рекомбинантных белков можно использовать стандартные методы, такие как, например, методы, описанные в Sambrook and Russell, Molecular Cloning: A Laboratory Manual (Cold SpringHarbor Laboratory Press, Cold Spring Harbor, N.Y., 3rd ed., 2001); Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2nd ed., 1989); Short Protocols in Molecular Biology (Ausubel et al., John WileySons, New York, 4th ed., 1999); GlickPasternak,Molecular Biotechnology: Principles and Applications of Recorabinant DNA (ASM Press, Washington, D.C.,2nd ed., 1989). Например, для рекомбинантной экспрессии антитела против CD30 экспрессионный вектор может кодировать его тяжелую или легкую цепь или вариабельный домен тяжелой или легкой цепи, функционально связанные с промотором. Экспрессионный вектор может включать, например, нуклеотидную последовательность, кодирующую константную область молекулы антитела (см., например, публикацию РСТ-заявки WO 86/05807; публикацию РСТ-заявки WO 89/01036; и патент США 5122464), и в такой вектор можно клонировать вариабельный домен антитела для экспрессии полной тяжелой или легкой цепи. Экспрессионным вектором трансфицируют клетку-хозяина с помощью общепринятых методов, и трансфицированные клетки затем культивируют с использованием общепринятых методов для продукции антитела против CD30. В обычных вариантах осуществления для экспрессии двухцепочечных антител векторы, кодирующие и тяжелую, и легкую цепи, можно коэкспрессировать в клетке-хозяине для экспрессии полной молекулы иммуноглобулина. Для экспрессии антитела против CD30 или его производного можно использовать ряд систем экспрессии с использованием векторов в прокариотических или эукариотических хозяевах. Как правило, для экспрессии рекомбинантного белка, особенно целых молекул рекомбинантного антитела против CD30,используют эукариотические клетки. Например, клетки млекопитающих, такие как клетки яичника китайского хомячка (СНО), в соединении с вектором, включающим, например, основной непосредственно ранний промоторный элемент гена из цитомегаловируса, является эффективной экспрессионной системой для продукции антител против CD30 (см., например, Foecking et al., 1986, Gene 45: 101; Cockett et al.,- 24020696CHEF (см., например, патент США 5888809). Другие системы экспрессии в хозяевах включают, например, системы экспрессии с использованием векторов на основе плазмид в бактериальных клетках (см., например, Ruther et al., 1983, EMBO 1, 2: 1791; InouyrInouyr, 1985, Nucleic Acids Res. 13: 3101-3109; Van HeekeSchuster 1989, J. Biol. Chem. 24: 5503-5509); системы экспрессии в клетках насекомых, такие как, например, использование экспрессионного вектора на основе вируса ядерного полиэдроза Autographa californica (AcNPV) в клетках Spodoptera frugiperda; и системы экспрессии с использованием векторов на основе вирусов в клетках млекопитающих, такие как, например, системы с использованием векторов на основе аденовирусов (см., например, LoganShenk, 1984, Proc. Natl. Acad. Sci. USA 81: 355-359; Bittner et al., 1987, Methods in Enzymol. 153: 51-544). Кроме того, можно выбрать штамм клетки-хозяина, который модулирует экспрессию встроенных последовательностей или модифицирует и подвергает процессингу продукт гена желаемым специфическим образом. Соответствующие линии клеток или системы-хозяев можно выбрать для гарантии правильной модификации и процессинга (например, гликозилирования, фосфорилирования и расщепления) экспрессируемого чужеродного белка. Для этого можно использовать эукариотические клетки-хозяева,которые обладают клеточным аппаратом для правильного процессинга первичного транскрипта и продукта гена. Такие клетки млекопитающих-хозяев включают, например, СНО (например, DG44 и CHO-S),VERO, BHK, HeLa, COS, MDCK, 293, 4 Т 3 и W138. Устойчивую экспрессионную систему обычно используют для длительной продукции с высоким выходом рекомбинантного антитела против CD30. Например, линии клеток, которые устойчиво экспрессируют антитело против CD30 или его производное, можно создать путем трансформации клеток-хозяев ДНК, контролируемой соответствующими контролирующими экспрессию элементами (например, промоторными, энхансерными последовательностями, терминаторами транскрипции, сайтами полиаденилирования) и селектируемым маркером, с последующим выращиванием трансформированных клеток в селективных средах. Селектируемый маркер придает устойчивость к селекции и предоставляет клеткам возможность устойчивой интеграции ДНК в свои хромосомы и роста с образованием фокусов, которые, в свою очередь, можно клонировать и нарастить в линии клеток. Можно использовать ряд систем для селекции, включающих, например, гены тимидинкиназы вируса простого герпеса, гипоксантингуанинфосфорибозилтрансферазы и аденин-фосфорибозилтрансферазы, которые можно использовать в tk-,hgprt- или aprt- клетках соответственно. Также можно использовать устойчивость к антиметаболитам в качестве основы селекции для следующих генов: dhfr, который придает устойчивость к метотрексату;gpt, который придает устойчивость к микофеноловой кислоте; neo, который придает устойчивость к аминогликозиду G-418; и hygro, который придает устойчивость к гигромицину. Для отбора желаемого рекомбинантного клона могут обычно применяться способы, общеизвестные в области технологии рекомбинантных ДНК, и такие способы описаны, например, в Current Protocols in Molecular Biology (Ausubel et(Stockton Press, N.Y., 1990); Current Protocols in Human Genetics (Dracopoli et al. eds., John WileySons,N.Y., 1994, Chapters 12 and 13); Colberre-Garapin et al., 1981, J. Mol. Biol. 150: 1. После продуцирования антитела против CD30 (например, с использованием животного, химического синтеза или рекомбинантной экспрессии) его можно очистить с помощью любого подходящего способа очистки белка, в том числе, например, хроматографии (например, ионообменной или аффинной хроматографии (такой как, например, хроматография с использованием белка А для очистки антител, имеющих интактную Fc-область), центрифугирования, дифференциальной растворимости или с помощью любого другого стандартного метода очистки белков. Антитело против CD30 можно, например, слить с последовательностью-маркером, например, пептидом, для облегчения очистки с помощью аффинной хроматографии. Подходящие аминокислотные последовательности-маркеры включают, например, пептид в виде гексагистидина, такой как tag, предусмотренный в векторе pQE (QIAGEN, Inc., 9259 Eton Avenue, Chatsworth, CA, 91311), и метку "НА", которая соответствует эпитопу, происходящему из белка гемагглютинина вируса гриппа (Wilson et al., 1984, Cell 37: 161), и метку "flag".K. Единицы конъюгата антитело-лекарственное средство. Описанные в настоящем документе способы включают использование антител, которые (а) специфически связываются с CD30 и (b) конъюгированы с соединением ауристатином. Соединения конъюгата антитело-лекарственное средство включают антитело против CD30, ковалентно связанное с по крайней мере одной единицей лекарственного средства, причем единицей лекарственного средства является соединение ауристатин. Единицы лекарственного средства могут быть ковалентно связаны напрямую или через единицу линкера (-LU-). В некоторых вариантах осуществления соединение конъюгата антитело-лекарственное средство имеет следующую формулу: или является фармацевтически приемлемой солью или сольватом соединения с такой формулой, гдеL представляет собой единицу антитела, т.е. антитела против CD30 (включающего фрагменты антитела против CD30);(LU-D) представляет собой составляющую в виде единица линкера-единица лекарственного средства, где LU представляет собой единицу линкера;-D представляет собой соединение ауристатин, обладающее цитостатической или цитотоксической активностью в отношении клетки-мишени;p является целым числом от 1 до приблизительно 20. В некоторых вариантах осуществления p находится в диапазоне от 1 до приблизительно 10, от 1 до приблизительно 9, от 1 до приблизительно 8, от 1 до приблизительно 7, от 1 до приблизительно 6, от 1 до приблизительно 5, от 1 до приблизительно 4, от 1 до приблизительно 3 или от 1 до 2. В некоторых вариантах осуществления р находится в диапазоне от 2 до приблизительно 10, от 2 до приблизительно 9, от 2 до приблизительно 8, от 2 до приблизительно 7, от 2 до приблизительно 6, от 2 до приблизительно 5, от 2 до приблизительно 4 или от 2 до 3. В других вариантах осуществления p равняется 1, 2, 3, 4, 5 или 6. В некоторых вариантах осуществления p равняется 2 или 4. В некоторых вариантах осуществления соединение конъюгата антитело-лекарственное средство имеет следующую формулу: или является фармацевтически приемлемой солью или сольватом соединения с такой формулой, гдеL представляет собой единицу антитела, т.е. антитела против CD30 (включающего фрагменты антитела против CD30);-Aa-Ww-Yy- представляет собой единицу линкера (LU), где-А- представляет собой единицу удлинителя;a равняется 0 или 1; каждая -W- независимо представляет собой аминокислотную единицу;-Y- является единицей самоуничтожающегося спейсера;-D представляет собой соединение ауристатин, обладающее цитостатической или цитотоксической активностью в отношении клетки-мишени;p является целым числом от 1 до приблизительно 20. В некоторых вариантах осуществления а равняется 0 или 1, w равняется 0 или 1, у равняется 0, 1 или 2. В некоторых вариантах осуществления, если w находится в диапазоне от 1 до 12, у равняется 1 или 2. В некоторых вариантах осуществления w находится в диапазоне от 2 до 12, у равняется 1 или 2. В некоторых вариантах осуществления w равняется 0, у равняется 0, a равняется 1. В некоторых вариантах осуществления а равняется 0 или 1, w равняется 0 или 1, у равняется 0 или 1. В некоторых вариантах осуществления р находится в диапазоне от 1 до приблизительно 10, от 1 до приблизительно 9, от 1 до приблизительно 8, от 1 до приблизительно 7, от 1 до приблизительно 6, от 1 до приблизительно 5, от 1 до приблизительно 4, от 1 до приблизительно 3 или от 1 до 2. В некоторых вариантах осуществления р находится в диапазоне от 2 до приблизительно 8, от 2 до приблизительно 7, от 2 до приблизительно 6, от 2 до приблизительно 5, от 2 до приблизительно 4 или от 2 до 3. В других вариантах осуществления р равняется 1, 2, 3, 4, 5 или 6. В некоторых вариантах осуществления р равняется 2 или 4. Загруженность лекарственным средством, среднее число молекул лекарственного средства на каждое антитело в молекуле, представлена р. Загруженность лекарственным средством может находиться в диапазоне, составляющем от 1 до 20 лекарственных средств (D) на каждое антитело. Среднее число лекарственных средств на каждое антитело в препарате реакций конъюгации можно определить с помощью общепринятого способа, такого как масс-спектрометрия, анализ ELISA и HPLC. Можно также определить количественное распределение конъюгатов антитело-лекарственное средство по показателю р. В некоторых случаях можно успешно выполнить отделение, очистку и определение характеристики гомогенных конъюгатов антитело-лекарственное средство, в которых р представляет собой определенное значение, от конъюгатов антитело-лекарственное средство с другими загруженностями лекарственным средством таким способом, как HPLC с обращенной фазой или электрофорез. В приводимых в качестве примеров вариантах осуществления р находится в диапазоне от 2 до 8. Каждая из этих единиц подробнее описывается в настоящем документе. Единицы линкера. Как правило, соединения конъюгатов антитело-лекарственное средство включают линкерный район между соединением ауристатин и антителом против CD30. "Единица линкера" (LU) является бифункциональным соединением, которое можно использовать для соединения единицы лекарственного средства и единицы антитела с образованием соединения конъюгата антитело-лекарственное средство. В некоторых вариантах осуществления линкер является расщепляемым во внутриклеточных условиях так,что расщепление линкера отсоединяло соединение ауристатин от антитела во внутриклеточной среде. Например, в некоторых вариантах осуществления линкер является расщепляемым под действием расщепляющего агента, который присутствует во внутриклеточной среде (например, внутри лизосомы,или эндосомы, или кальвеолы). Линкер может быть, например, пептидильным линкером, который является расщепляемым под действием внутриклеточного фермента пептидазы или протеазы, в том числе, но без ограничения, лизосомальной или эндосомальной протеазы. Как правило, длина пептидильного линкера составляет по крайней мере две аминокислоты или по крайней мере три аминокислоты. Расщепляющие агенты могут включать катепсины В и D и плазмин, все из которых, как известно, гидролизуют дипептидные производные лекарственного средства, приводя к отсоединению активного лекарственного средства внутри клеток-мишеней (см., например, Dubowchik and Walker, 1999, Pharm. Therapeutics 83: 67123). Самыми обычными являются пептидильные линкеры, которые являются расщепляемыми под действием ферментов, которые присутствуют в экспрессирующих CD30 клетках. Например, можно использовать пептидильный линкер, который является расщепляемым под действием тиолзависимой протеазы катепсина-В, который в высокой степени экспрессируется в раковой ткани (например, линкер Phe-Leu или Gly-Phe-Leu-Gly). Другие такие линкеры описаны, например, в патенте США 6214345. В конкретных вариантах осуществления пептидильным линкером, расщепляемым под действием внутриклеточной протеазы, является линкер Val-Cit или линкер Phe-Lys (см., например, патент США 6214345, в котором описывается синтез доксорубицина с линкером Val-Cit). Одним преимуществом использования внутриклеточного протеолитического отсоединения терапевтического средства является то, что средство обычно является аттенюированным после конъюгирования, и стабильность конъюгатов в сыворотке обычно является высокой. В других вариантах осуществления расщепляемый линкер является чувствительным к pH, т.е. чувствительным к гидролизу при определенных значениях pH. Как правило, чувствительный к рН линкер является гидролизуемым в кислотных условиях. Например, можно использовать кислотонеустойчивый линкер, который является гидролизуемым в лизосоме (например, гидразон, семикарбазон, тиосемикарбазон, амид цис-аконитовой кислоты, ортоэфир, ацеталь, кеталь или подобные) (см., например, патенты США 5122368, 5824805, 5622929; Dubowchik and Walker, 1999, Pharm. Therapeutics 83: 67-123; Nevilleet al., 1989, Biol. Chem. 264: 14 653-14 661). Такие линкеры относительно устойчивы в нейтральных условиях рН, таких как условия в крови, но являются неустойчивыми при рН ниже 5,5 или 5,0, приблизительном рН в лизосоме. В некоторых вариантах осуществления гидролизуемым линкером является тиоэфирный линкер (такой как, например, тиоэфир, присоединенный к терапевтическому средству через ацилгидразонную связь (см., например, патент США 5622929. В еще одних вариантах осуществления линкер является расщепляемым в восстанавливающих условиях (например, дисульфидный линкер). В данной области техники известен ряд дисульфидных линкеров, включающий, например, линкеры, которые могут быть образованы, используя SATA (Nсукцинимидил-S-ацетилтиоацетат), SPDP (N-сукцинимидил-3-(2-пиридилдитио)пропионат), SPDB (Nсукцинимидил-3-(2-пиридилдитио)бутират) и SMPT (N-сукцинимидилоксикарбонил-альфа-метил-альфа(2-пиридилдитио)толуол), SPDB и SMPT (см., например, Thorpe et al., 1987, Cancer Res. 47: 5924-5931;Vogel ed., Oxford U. Press, 1987; см. также патент США 4880935). В еще одних конкретных вариантах осуществления линкер является малонатным линкером (Johnsonet al., 1995, Anticancer Res. 15: 1387-1393), малеимидобензоильным линкером (Lau et al., 1995, BioorgMed-Chem. 3(10): 1299-1304) или 3'-N-амидным аналогом (Lau et al., 1995, Bioorg-Med-Chem. 3(10): 13051312). В еще одних вариантах осуществления единица линкера является нерасщепляемой, и лекарственное средство отсоединяется при деградации антитела (см., публикацию заявки на патент США 20050238649, которая включена полностью посредством ссылки). Как правило, линкер является не в значительной степени чувствительным к экстраклеточной среде. Как в настоящем документе используется, "не в значительной степени чувствительный к экстраклеточной среде", в контексте линкера, означает, что расщепляемыми являются не более чем приблизительно 20%, обычно не более чем приблизительно 15%, обычнее не более чем приблизительно 10% и даже обычнее не более чем приблизительно 5%, не более чем приблизительно 3% или не более чем приблизительно 1% линкеров в образце соединения конъюгата антитело-лекарственное средство, когда соединение конъюгата антитело-лекарственное средство присутствует в экстраклеточной среде (например, в плазме). Является ли линкер не в значительной степени чувствительным к экстраклеточной среде, можно определить, например, с помощью инкубации с плазмой соединения конъюгата антитело-лекарственное средство в течение заранее заданного периода времени (например, 2, 4, 8, 16 или 24 ч) и затем определения количества свободного лекарственного средства, присутствующего в плазме. В других, невзаимоисключающих вариантах осуществления линкер ускоряет интернализацию в клетку. В некоторых вариантах осуществления линкер ускоряет интернализацию в клетку после конъюгирования с терапевтическим средством (т.е. внутри составляющей линкер-терапевтическое средство соединения конъюгата антитело-лекарственное средство, описанного в настоящем документе). В еще одних вариантах осуществления линкер ускоряет интернализацию в клетку после конъюгирования как с соединением ауристатином, так и с антителом против CD30. Ряд линкеров, которые можно использовать с композициями и способами настоящего изобретения,описан, например, в WO 2004-010957, публикациях заявок на патент США 20060074008, 20050238649 и 20060024317 (все из которых включены сюда в целом путем представления ссылки на них и для всех целей). В некоторых вариантах осуществления единица линкера имеет формулу где -А- представляет собой единицу удлинителя;a равняется 0 или 1; каждая -W- независимо представляет собой аминокислотную единицу;-Y- является единицей самоуничтожающегося спейсера;y равняется 0, 1 или 2. В некоторых вариантах осуществления а равняется 0 или 1, w равняется 0 или 1, у равняется 0, 1 или 2. В некоторых вариантах осуществления, если w находится в диапазоне от 1 до 12, у равняется 1 или 2. В некоторых вариантах осуществления w находится в диапазоне от 2 до 12, у равняется 1 или 2. В некоторых вариантах осуществления а равняется 0 или 1, w равняется 0 или 1, у равняется 0 или 1. В некоторых вариантах осуществления р находится в диапазоне от 1 до приблизительно 10, от 1 до приблизительно 9, от 1 до приблизительно 8, от 1 до приблизительно 7, от 1 до приблизительно 6, от 1 до приблизительно 5, от 1 до приблизительно 4, от 1 до приблизительно 3 или от 1 до 2. В некоторых вариантах осуществления р находится в диапазоне от 2 до приблизительно 8, от 2 до приблизительно 7, от 2 до приблизительно 6, от 2 до приблизительно 5, от 2 до приблизительно 4 или от 2 до 3. В других вариантах осуществления р равняется 1, 2, 3, 4, 5 или 6. В некоторых вариантах осуществления р равняется 2 или 4. Единица удлинителя. Единица удлинителя (А), когда присутствует, способна к связыванию единицы антитела с аминокислотной единицей (-W-), если присутствует, с единицей спейсера (-Y-), если присутствует, или с единицей лекарственного средства (-D). Пригодные функциональные группы, которые могут присутствовать на антителе против CD30, или природно или благодаря химической манипуляции, включают, но без ограничения, сульфгидрильную группу, аминогруппу, гидроксильную, аномерную гидроксильную группу углевода или карбоксил. Подходящими функциональными группами являются сульфгидрильные группы и аминогруппы. Сульфгидрильные группы могут образовываться при восстановлении внутримолекулярных дисульфидных связей антитела против CD30. В альтернативном случае сульфгидрильные группы могут образовываться при взаимодействии аминогруппы лизиновой составляющей антитела противCD30 с 2-иминотиоланом (реагентом Трота) или другими создающими сульфгидрильные группы реагентами. В некоторых вариантах осуществления антитело против CD30 является рекомбинантным антителом и сконструировано так, что оно несет один или более лизинов. В некоторых других вариантах осуществления рекомбинантное антитело против CD30 сконструировано так, что оно несет дополнительные сульфгидрильные группы, например, дополнительные цистеины. В некоторых вариантах осуществления единица удлинителя образует связь с атомом серы единицы антитела. Атом серы может происходить из сульфгидрильной группы антитела. Репрезентативные единицы удлинителя этого варианта осуществления представлены в квадратных скобках формул IIIa и IIIb, где L-, -W-, -Y-, -D, w и у имеют значения, определенные выше, R17 выбирают из радикалов: -C1-C10-алкилен-, -C1-C10-алкенилен-, -C1-C10-алкинилен-, -карбоцикло-, -O-(C1-C8 алкилен)-, -O-(C1-C8-алкенилен)-, -O-(C1-C8-алкинилен)-, -арилен-, -C1-C10-алкилен-арилен-, -C2-C10 алкенилен-арилен-, -C2-C10-алкинилен-арилен-, -арилен-C1-C10-алкилен-, -арилен-C2-C10-алкенилен-, арилен-C2-C10-алкинилен-, -C1-C10-алкилен-(карбоцикло)-, -C2-C10-алкенилен-(карбоцикло)-, -C2-C10-алкинилен-(карбоцикло)-, (карбоцикло)-C1-C10-алкилен-, -(карбоцикло)-C2-C10-алкенилен-, -(карбоцикло)-C2C10-алкинилен-, гетероцикло-, -C1-C10-алкилен-(гетероцикло)-, -C2-C10-алкенилен-(гетероцикло)-, -C2-C10 алкинилен-(гетероцикло)-, -(гетероцикло)-C1-C10-алкилен-, (гетероцикло)-C2-C10-алкенилен-, -(гетероцикло)-C2-C10-алкинилен-, -(СН 2 СН 2 О)r или -(СН 2 СН 2 О)r-CH2-, r является целым числом, находящимся в диапазоне от 1 до 10, где указанные алкильные, алкенильные, алкинильные, алкиленовые, алкениленовые, алкиниленовые, арильные, карбоциклические, гетероциклические и ариленовые радикалы, отдельно или в виде части другой группы, необязательно замещены. Алкиленовые, алкениленовые, алкиниленовые радикалы, отдельно или в виде части другой группы, могут быть необязательно замещены, например, одной или более группами, независимо выбираемыми из А 1; карбоциклические радикалы, отдельно или в виде части другой группы, могут быть необязательно замещены, например, одной или более группами, независимо выбираемыми из А 2; ариленовые радикалы, отдельно или в виде части другой группы,могут быть необязательно замещены, например, одной или более группами, независимо выбираемыми изA3; гетероциклические радикалы, отдельно или в виде части другой группы, могут быть необязательно замещены, например, одной или более группами, независимо выбираемыми из А 4. A1, A2, A3 и А 4 имеют определенные в настоящем документе значения. Исходя из всех приведенных в качестве примеров вариантов осуществления, должно быть понятно, что даже если прямо не отмечено, с антителом может быть связано от 1 до 20 составляющих в виде лекарственных средств (p=1-20). Иллюстративной единицей удлинителя является единица формулы IIIa, где R17 представляет собой-(СН 2)5 Другой иллюстративной единицей удлинителя является единица формулы IIIa, где R17 представляет собой -(СН 2 СН 2 О)r-CH2-; r равняется 2 Иллюстративной единицей удлинителя является единица формулы IIIa, где R17 представляет собой-арилен- или -арилен-C1-C10-алкилен-. В некоторых вариантах осуществления арильной группой является незамещенная фенильная группа. Тем не менее, другой иллюстративной единицей удлинителя является единица формулы IIIb, гдеR17 представляет собой -(СН 2)5 В некоторых вариантах осуществления единица удлинителя связана с единицей антитела благодаря дисульфидной связи между атомом серы единицы антитела и атомом серы единицы удлинителя. Репрезентативная единица удлинителя этого варианта осуществления представлена в квадратных скобках формулы IV, где R17, L-, -W-, -Y-, -D, w и у имеют значения, определенные выше. Следует отметить, что по всему этому изобретению составляющая S в приведенной ниже формуле относится к атому серы единицы антитела, если в контексте не оговорено иное. В еще одних вариантах осуществления удлинитель содержит реакционноспособный сайт, который может образовывать связь с первичной или вторичной аминогруппой антитела. Примеры таких реакционноспособных сайтов включают, но без ограничения, активированные сложные эфиры, такие как сукцинимидные эфиры, 4-нитрофенильные эфиры, пентафторфенильные эфиры, тетрафторфенильные эфиры, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты. Репрезентативные единицы удлинителя этого варианта осуществления представлены в квадратных скобках формул Va и В других вариантах осуществления удлинитель содержит реакционноспособный сайт, который вступает в реакции с группой (-CHO) модифицированного углевода, которая присутствует на антителе. Например, углевод может быть подвергнут окислению в легкой степени, используя такой реагент, как
МПК / Метки
МПК: A61K 38/00, A61K 31/7064
Метки: против, использованием, способ, лимфомы, конъюгата, гемцитабина, комбинации, ауристатином, лечения, антитела, ходжкина
Код ссылки
<a href="https://eas.patents.su/30-20696-sposob-lecheniya-limfomy-hodzhkina-s-ispolzovaniem-kombinacii-gemcitabina-i-konyugata-antitela-protiv-cd30-s-auristatinom.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения лимфомы ходжкина с использованием комбинации гемцитабина и конъюгата антитела против cd30 с ауристатином</a>
Предыдущий патент: Производные пирандионов и циклогексатрионов в качестве гербицидов
Следующий патент: Способ лечения психиатрического пациента путем введения палиперидона пальмитата
Случайный патент: Способ и промежуточные продукты для получения пиридин-2,3-дикарбоксилатов












