Пептиды скорпиона, блокирующие калиевые каналы человеческого т-лимфоцита, и способы их применения
Номер патента: 20131
Опубликовано: 29.08.2014
Авторы: Варга Зольтан С., Гашпар Режё, Поссани Постай Лоуриваль Домингос, Паньи Дьёрдь, Гуррола-Брионес Хеоргина, Феррейра Батиста Сесар Висенте, Салас-Кастильо Сайда Патрисия
Формула / Реферат
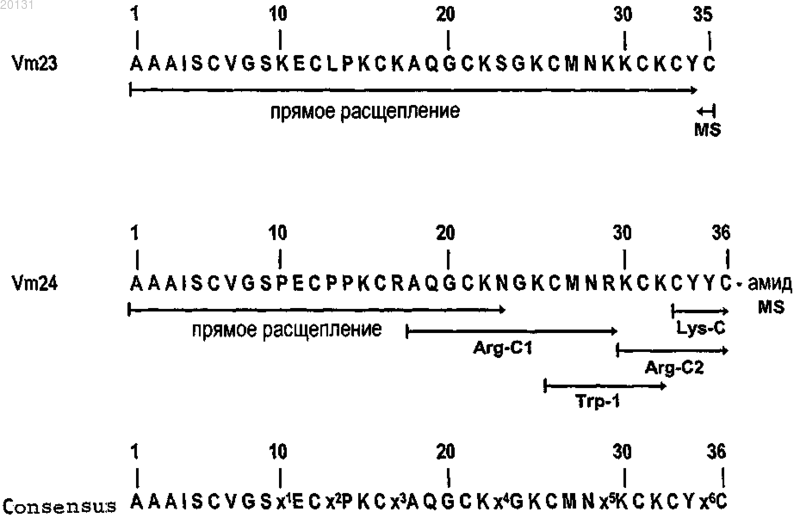
1. Выделенный и очищенный пептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 и их функциональных эквивалентных аналогов, где указанные функциональные эквивалентные аналоги имеют как минимум 83% попарную идентичность последовательности по 36 выровненным позициям SEQ ID NO:3 и указанный пептид способен блокировать с высокой аффинностью и специфичностью калиевый канал Kv1.3.
2. Применение пептида по п.1 для ослабления кальциевого пути передачи сигнала в Т-лимфоидных клетках млекопитающего, где применение предусматривает контактирование популяции указанных Т-лимфоидных клеток с пептидом.
3. Применение по п.2, где указанным млекопитающим является человек.
4. Способ ингибирования активности Kv1.3 калиевого канала в клетке млекопитающего, включающий контактирование указанной клетки млекопитающего с эффективным количеством пептида по п.1 или его фармацевтически приемлемой соли.
5. Способ по п.4, в котором указанная клетка млекопитающего представляет собой человеческую лимфоидную клетку.
6. Способ ослабления кальциевого пути передачи сигнала в Т-лимфоидной клетке, включающий контактирование указанной Т-лимфоидной клетки с эффективным количеством пептида по п.1.
7. Применение пептида по п.1 или его фармацевтически приемлемой соли для подавления процесса активации T-клетки в иммунной системе млекопитающего, где применение предусматривает контактирование популяции указанных T-клеток с пептидом.
8. Применение по п.7, где указанным млекопитающим является человек.
9. Применение по п.7, где активация T-клетки вызвана иммунной реакцией у указанного млекопитающего.
10. Применение по п.9, где указанная иммунная реакция является результатом отторжения гетерогенного органа или результатом аутоиммунной болезни.
11. Способ подавления процесса активации T-клетки в иммунной системе млекопитающего, включающий контактирование популяции указанных T-клеток с эффективным количеством пептида по п.1 или его фармацевтически приемлемой соли.
12. Способ по п.11, в котором указанным млекопитающим является человек.
13. Способ по п.11, в котором указанная активация T-клетки вызвана иммунной реакцией у указанного млекопитающего.
14. Способ по п.13, в котором указанная иммунная реакция является результатом отторжения гетерогенного органа или результатом аутоиммунной болезни.
15. Способ подавления иммунной реакции у млекопитающих, включающий введение указанному млекопитающему состава, включающего пептид, имеющего эффективное количество пептида по п.1 или его фармацевтически приемлемой соли для подавления указанной реакции у указанного млекопитающего.
16. Способ по п.15, в котором указанная иммунная реакция является результатом отторжения гетерогенного органа или результатом аутоиммунной болезни.
17. Способ профилактического или терапевтического лечения отторжения гетерогенного органа у нуждающегося в таком лечении субъекта, включающий введение субъекту эффективного количества состава, включающего пептид по п.1 или его фармацевтически приемлемую соль.
18. Способ по п.17, в котором отторгаемый орган представляет собой сердце, легкое, печень, почки или поджелудочную железу.
19. Способ по п.17, в котором нуждающийся в лечении субъект является человеком.
20. Способ профилактического или терапевтического лечения аутоиммунной болезни, связанной с лимфоидной ТЕМ, у нуждающегося в таком лечении субъекта, включающий введение субъекту эффективного количества состава, включающего пептид по п.1 или его фармацевтически приемлемую соль.
21. Способ по п.20, в котором аутоиммунная болезнь, связанная с лимфоидной ТЕМ, выбрана из группы, состоящей из рассеянного склероза, ревматоидного артрита, диабета типа 1, аутоиммунного псориаза, красной волчанки, неспецифического язвенного колита, симпатической офтальмии, периодонтальной болезни резорбции кости, иммунной тромбоцитопенической пурпуры и аутоиммунного лимфопролиферативного синдрома.
22. Способ по п.20, в котором нуждающийся в указанном лечении субъект является человеком.
23. Способ по п.20, включающий также введение указанному субъекту как минимум одного дополнительного иммунодепрессивного средства.
24. Способ по п.23, в котором дополнительное иммунодепрессивное средство выбрано из группы, состоящей из циклоспорина, рапамицина, азатиоприна, преднизона, ShK токсина, ShK производных и дезоксиспергуалина, их производных или соли.
25. Состав, содержащий пептид по п.1 или его фармацевтически приемлемую соль, для применения при профилактическом или терапевтическом подавлении иммунной реакции у млекопитающих.
26. Состав по п.25, где указанная иммунная реакция является результатом отторжения гетерогенного органа или результатом аутоиммунной болезни.
27. Состав по п.26, где указанный отторгаемый орган представляет собой сердце, легкое, печень, почки или поджелудочную железу, а нуждающийся в лечении субъект является человеком.
28. Состав по п.26, где аутоиммунная болезнь у субъекта связана с лимфоидной ТЕМ.
29. Состав по п.28, где нуждающийся в указанном лечении субъект является человеком, а указанная аутоиммунная болезнь, связанная с лимфоидной ТЕМ, выбрана из группы, состоящей из рассеянного склероза, ревматоидного артрита, диабета типа 1, аутоиммунного псориаза, красной волчанки, неспецифического язвенного колита, симпатической офтальмии, периодонтальной болезни резорбции кости, иммунной тромбоцитопенической пурпуры и аутоиммунного лимфопролиферативного синдрома.
30. Состав по п.25, дополнительно содержащий по меньшей мере одно дополнительное иммунодепрессивное средство, выбранное из группы, состоящей из циклоспорина, рапамицина, азатиоприна, преднизона, ShK токсина, ShK производных и дезоксиспергуалина, их производных или соли.
31. Фармацевтический состав, включающий как минимум один пептид по п.1 или его фармацевтически приемлемую соль, фармацевтически приемлемый носитель и, необязательно, как минимум одно дополнительное иммуносупрессивное средство, в котором предпочтительно необязательное дополнительное иммуносупрессивное средство выбрано из группы, состоящей из циклоспорина, рапамицина, азатиоприна, преднизона, ShK токсина, ShK производных и деоксиспергуалина, их производных или соли.
32. Состав по пп.25, 28 или 29, который пригоден для введения местно, системно, внутривенно, внутрибрюшинно, внутримышечно, подкожно, интраназально, трансдермально, перорально или с помощью внутрикожной инъекции, внутрибронхиальной инстилляции, желудочно-кишечной доставки или трансмукозальной доставки.
33. Пептид по п.1, который дополнительно содержит вещество мечения.
34. Меченый пептид по п.33, в котором вещество мечения выбрано из группы, состоящей из радиоактивного изотопа, флуоресцентного вещества, хемилюминесцентного вещества, хромофора, лиганда, такого как биотин, и белка, где предпочтительно белок мечения представляет собой антитело, или зеленый флуоресцентный белок, или белок, полученный из зеленого флуоресцентного белка с различными спектрами эмиссии.
35. Способ идентификации клеток, экспрессирующих Kv1.3 каналы, включающий стадии а) контактирования популяции клеток-мишеней с меченым пептидом по п.33 и b) выявления связи меченого пептида с Kv1.3 калиевыми каналами, представляющими указанную популяцию клеток-мишеней, с помощью методики детекции.
36. Способ по п.35, в котором указанные клетки представляют собой человеческие лимфоциты.
37. Способ количественного анализа числа Kv1.3 каналов, экспрессированных в клетке, включающий стадии а) контактирования клетки с меченым пептидом по п.34 и b) выявления и количественного определения связи меченого пептида с Kv1.3 калиевыми каналами, представленными в указанной популяции клеток-мишеней, с помощью количественной методики детекции.
38. Способ по п.37, в котором указанные клетки представляют собой человеческие лимфоциты.
Текст
ПЕПТИДЫ СКОРПИОНА, БЛОКИРУЮЩИЕ КАЛИЕВЫЕ КАНАЛЫ ЧЕЛОВЕЧЕСКОГО Т-ЛИМФОЦИТА, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ Известно, что калиевые каналы hKv1.3 вовлечены в иммунологические болезни и отторжение трансплантата. Раскрыты пептиды, способные блокировать с высокой аффинностью и специфичностью калиевые каналы hKv1.3, их фармацевтические композиции и способы их использования для блокирования Kv1.3 калиевых каналов, для лечения различных иммунологических состояний и применения в диагностических целях. Описаны способы их химического синтеза и методики правильного сворачивания пептидных цепей. Предложенные пептиды соответствуют двум белковым компонентам (Vm23 и Vm24), выделенным из яда мексиканского скорпиона Vaejovis mexicanus smithi. Vm23 и Vm24 связываются с hKv1.3 каналами почти необратимым образом, показывая значение Kd в нижнем пикомолярном диапазоне порядка 3 пмоль, при применении к человеческим лимфоцитам in vitro. Предлагаются способы и методики, применимые для их химической и функциональной характеристики, а также результаты экспериментов in vivo относительно реакции гиперчувствительности замедленного типа (DTHреакции) у сенсибилизированных крыс. Ни Vm24, ни синтезированный Vm24 не токсичны для мышей при введении при относительно высокой концентрации (анализ проводился вплоть до 200 мкг/мышь весом тела 20 г, т.е. 10000 мкг/кг веса мыши). Такие пептиды (Vm23 иVm24) и их функциональные эквивалентные аналоги по крайней мере с 83% идентичностью их последовательностей подходят для лечения различных иммунологических состояний и применения в диагностических целях. Поссани Постай Лоуриваль Домингос,Гуррола-Брионес Хеоргина, СаласКастильо Сайда Патрисия, Феррейра Батиста Сесар Висенте (MX), Варга Зольтан С., Паньи Дьрдь, Гашпар Реж (HU) Дементьев В.Н. (RU)(71)(73) Заявитель и патентовладелец: УНИВЕРСИДАД НАСИОНАЛЬ АУТОНОМА ДЕ МЕХИКО (MX) Область техники, к которой относится изобретение Настоящее изобретение в основном относится к области биохимии, молекулярной биологии, иммунологии и электрофизиологии. Приводятся данные о пептидах, их фармацевтических составах и способах их использования для блокирования Kv1.3 калиевых каналов, для лечения различных иммунологических состояний и применения в диагностических целях; также описаны способы химического синтеза и методики правильного сворачивания пептидных цепей, соответствующих двум белковым компонентам,выделенным из яда мексиканского скорпиона Vaejovis mexicanus smithi (далее сокращенно:V.mexicanus), которые представляют новое подсемейство специфических лигандов калиевого канала,способных блокировать с высокой аффинностью и специфичностью подтип калиевых каналов (hKv1.3),продемонстрировавших, что они могут быть вовлечены в иммунологические болезни и отторжение трансплантата. Предлагаются способы и методики, применимые для их химической и функциональной характеристики, а также результаты экспериментов in vivo относительно реакции гиперчувствительности замедленного типа (DTH-реакции) у сенсибилизированных крыс при лечении пептидом Vm24. Этот пептид (Vm24), его гомологический Vm23 и их функциональные эквивалентные аналоги представляют собой кандидаты для лечения различных иммунологических состояний и применения в диагностических целях. Предпосылки создания изобретения Общие соображения. В отношении предмета изобретения, о котором идет речь в данном документе, необходимо учесть несколько аспектов, среди которых важные достижения в области биохимии, молекулярной биологии,иммунологии и электрофизиологии, относящиеся к знаниям, накопленным в отношении: 1) наличия целых белков биологических мембран, получивших название "ионные каналы", которые играют основную роль в клеточной коммуникации, метаболических путях трансдукции сигнала и общего гомеостаза тканей и различных функциях органов; 2) разных уровней экспрессии этих каналов в клетках иммунной системы, главным образом в Тлимфоцитах, которые играют, как выяснилось, очевидную роль в событиях, связанных с началом аутоиммунных болезней; 3) возможного контроля функции канала, следовательно, возможного лечения нарушений, путем добавления различных химических препаратов, природных лигандов и искусственно приготовленных веществ либо репродуцированием лиганда, как встречающегося в природе, либо приготовлением подобных производных соединений (пептидомиметики). За последние 15 лет было обнаружено множество калиевых каналов (K), о чем имеются публикации, которые допускают их выделение, индивидуальную экспрессию и функциональный анализ. Это мультимерные белки, вовлеченные в определение потенциала клеточной мембраны, тем самым контролируя тон гладкой мышцы, синаптическую чувствительность, выброс нейромедиатора и другие процессы. В данном изобретении авторы хотели подчеркнуть важность разновидности K канала, подтипKv1.3 и его роль в пролиферации лимфоцита и в контроле аутоиммунных болезней посредством ингибирования этого канала. Это канал "замедленного выпрямителя", преимущественно экспрессированный в Т-лимфоцитах [Grissmer et al., 1990; Lewis and Cahalan, 1995], отличающийся от подтипов Kv1.1, Kv1.2,широко распространенных в головном мозге или Kv1.5 в ткани сердца, упомянуты лишь несколько из подтипов K каналов. В настоящее время в нескольких лабораториях исследуются механизмы, с помощью которых модуляция активности Kv1.3 каналов воздействует на пролиферацию лимфоцита, они были предметом многих последних публикаций (рассмотрены в [Beeton and Chandy, 2005; Judge and Bever, 2006, Panyi et al.,2006], включая несколько патентов (см. патент США 5397702, авторы Cahalan et al., 1995 и патент США 6077680, авторы Kern et al., 2000). Аутоиммунные болезни известны своим широким распростронением во всем мире. Среди этих болезней: сахарный диабет типа 1 (инсулинозависимый), рассеянный склероз (MS), ревматоидный артрит,синдром Шегрена, смешанное поражение соединительной ткани, системная красная волчанка (SLE), миастения gravis, упомянуты только некоторые из них. Соответствующей экспериментальной моделью аутоиммунных болезней является экспериментальный аутоиммунный энцефаломиелит (ЕАЕ). Общепринято, что эти аутоиммунные болезни являются результатом реакции иммунной системы, разрушающей специфические ткани либо за счет прямой атаки на клетки, либо путем выработки аутоантител. Сверхэкспрессия Kv1.3 каналов - это отличительная особенность автореактивных T-клеток, обеспечивающих,таким образом, превосходную возможность модификации их пролиферации блокаторами Kv1.3. В рамках этих исследований и экспериментирования были описаны и даже запатентованы несколько веществ. Один такой пример - это токсин ShK из морской анемоны Stichodactyla helianthus и несколько его производных, заявленных как обладающие защитным эффектом против нескольких аутоиммунных болезней (см. патент США 6077680, авторы Kem et al. 2000). К числу других природных лигандов, способных влиять на функцию ионных каналов, принадлежат токсические пептиды, выделенные из ядов скорпиона. Специфические к K каналу пептиды, выделенные из этих ядов, - это пептиды с короткой цепью, содержащие от 22 до 42 аминокислот, укомплектованных тремя или четырьмя дисульфидными связями. Они представляют собой блокаторы многих различных подтипов каналов с очень большой вариабильностью селективности и аффинности (рассмотрены в[Giangiacomo et al., 2004; Rodriguez de la Vega and Possani, 2004]). Например, харибдотоксин - мощный блокатор каналов замедленного выпрямителя вибраторного типа Kv1.1, Kv1.2 и Kv1.3, но также блокирует и K(Ca) каналы maxi-типа [Rauer et al., 2000]. У маргатоксина, другого пептида яда скорпиона, отсутствует K(Ca) канал, блокирующий активность, но он сохраняет высокоаффинное блокирование Kv1.3 каналов. [Garcia-Calvo et al., 1993]. Агитотоксин, noxius токсин, калиотоксин являются примерами токсинов скорпиона, которые влияют на различные типы K каналов с различной аффинностью и селективностью, но обычно модифицируют несколько подтипов каналов (недавно рассмотрены в [Panyi et al.,2006]). Вследствие их относительно жесткой пространственной структуры, прочно поддерживаемой дисульфидными связями, некоторые из этих пептидов скорпиона использовали в качестве "молекулярных толщиномеров" для измерения интервалов между остатками аминокислоты K канала во внешнем преддверии каналов [Krezel et al., 1995; Garcia et al., 2000]. Трехмерная структура многих токсинов скорпиона, специфических к K каналам, была разрешена методом ядерного магнитного резонанса и/или рентгенографическим методом, и в сочетании с известной структурой некоторых K каналов дала ключ к модели взаимодействия между рецептором (ионный канал) и лигандом (токсин скорпиона). Сайтнаправленный мутагенез остатков аминокислоты и в ионных каналах, и в лигандах обеспечил информацию для идентификации поверхности предполагаемого взаимодействия в этой паре рецептор-лиганд белков [Rodriguez de la Vega et al., 2003]. Это установочные данные для рациональной разработки возможных препаратов с потенциальными фармакологическими применениями. Единственная проблема в использовании этих встречающихся в природе пептидов в качестве потенциальных препаратов - отсутствие специфичности и аффинности. В настоящее время существует 20 подсемейств токсинов скорпиона,включая более 125 структурно связанных пептидов, классифицированных по их сходству последовательностей и возможных функций [Tytgat et al., 1999; Rodriguez de la Vega and Possani, 2004]. Молекулярная база для терапии аутоиммунных болезней на основании Kv1.3 ингибитора. В этом разделе представлена информация о текущем состоянии дел в данной области относительно контроля некоторых иммунологических болезней простым применением лигандов (пептиды или органические соединения), способных блокировать с высокой аффинностью и высокой специфичностью Kv1.3 ионные каналы "T-клеток эффекторной памяти" (TEM) лимфоцитов. Ранее было доказано, что механизм, с помощью которого Kv1.3 ингибиторы вмешиваются в процессы активации лимфоцитов, вызванных физиологической антигенной стимуляцией или митогенами,представляет собой деполяризацию мембраны и последовательное ингибирование Ca2+ сигнала, необходимого для нормального развития клеточного цикла до пролиферации и получения T-клеточных клонов,специфических к сенсибилизирующему антигену (рассмотрены в [Cahalan et al., 2001; Panyi et al., 2004;Panyi et al., 2006]). Существуют два типа K каналов, отвечающих за поддержание достаточно гиперполяризованного мембранного потенциала (-50, -60 мВ) [Verheugen et al., 1995] T-клеток, потенциалозависимый и активируемый деполяризацией канал, обозначенный Kv1.3 [Decoursey et al., 1984; Matteson andKCa3.1. согласно последней номенклатуре) [Grissmer et al., 1993]. Активность этих каналов обеспечивает истечение уравновешивающего положительного заряда, необходимого для поддержания отрицательного потенциала мембраны во время поступления Ca2+ в T-клетки по активируемым Ca2+ выбросом Ca2+ каналам [Feske et al., 2006; Yeromin et al., 2006]. Вклад этих 2 типов K каналов в мембранный потенциалT-клеток зависит от состояния активации клеток (покоящаяся клетка против активируемой) и их функциональной роли в иммунной системе, определяемой степенью конечной дифференцировки T-клеток,как отмечается ниже [Wulff et al., 2003]. Два типа T-клеток, необученных T-клеток и T-клеток центральной памяти (TCM), требуют сильной антигенной стимуляции и костимуляции в периферических (вторичных) лимфоидных органах, подвергающихся активации. Необученные T-клетки, которые раньше не сталкивались с антигеном, подвергаются экспрессии функционального маркера CCR7+CD45RA+. T-клетки центральной памяти (ТСМ,CCR7+CD45RA-), клетки, которые опосредуют реактивную память, вероятно, подавляются на промежуточных стадиях конечной дифференцировки, чтобы превратиться в клетки эффекторной памяти (ТЕМ)[Sallusto et al., 2004]. Эти клетки имеют небольшую эффекторную функцию или не имеют эффекторной функции, но легко пролиферируют и дифференцируются относительно эффекторных клеток в ответ на антигенную стимуляцию. Защитная память управляется TEM клетками эффекторной памяти(CCR7-CD45RA+/-). TEM клетки отображают характеристическое множество рецепторов хемокинов и адгезионных молекул, необходимых для хоминга к воспаленным тканям, где они проявляют прямую эффекторную функцию. При некоторых аутоиммунных болезней, включая рассеянный склероз (MS) (Wulffet al., 2003), ревматоидный артрит и сахарный диабет типа 1 [Beeton et al., 2006], аутоиммунный псориаз,красную волчанку, неспецифический язвенный колит, метастатическую офтальмию и периодонтальную болезнь резорбции кости, хронически активируемые TEM клетки отвечают за повреждение тканей, таким образом, селективное ингибирование пролиферации и функциональной активности этих клеток имеет огромное значение в ведении этих болезней (рассмотрены в [Chandy et al., 2004; Beeton and Chandy, 2005;Panyi et al., 2006]. Покоящиеся человеческие необученные ТСМ и TEM клетки, либо CD4+ (клетка-хелпер), либо CD8+(цитотоксическая клетка) фенотипа, экспрессируют сходное количество (200-300) Kv1.3 каналов и менее 30 IKCa1 каналов на клетку [Wulff et al., 2003]. Трансформация необученных и ТСМ клеток в пролиферирующие бластные клетки стимуляцией специфических антигенов сопровождается незначительным(1,5-кратным) увеличением количества Kv1.3 каналов на клетку, тогда как количество IKCa1 каналов увеличивается существенно (500 каналов/клетку), и, таким образом, они приобретают фенотип ионного канала IKCa1highKv1.3low [IKCa1highKv1.3low]. Напротив, активация TEM фенотипа CD4+ или CD8+ в периферических тканях сопровождается значительным увеличением количества Kv1.3 каналов до 1500/клетку без изменения уровня IKCa1, тем самым фенотип канала активируемой TEM превращается вIKCa1lowKv1.3high [IKCa1low Kv1.3 высокий]. Причинная связь между Kv1.3high TEM и аутоиммунными нарушениями доказана следующими данными, полученными при наблюдении болезней человека: 1) миелинореактивные T-клетки из периферической крови пациентов с рассеянным склерозом (MS) представляют собой Kv1.3high [Wulff et al., 2003]; 2) миелинореактивные T-клетки из периферической крови здоровых контрольных пациентов представляют собой Kv1.3low, сопоставимый с необученным/ТСМ фенотипом; 3) стимуляция T-клеток пациентов с болезнью MS иррелевантными антигенами, такими как пептид инсулина, яичный белок или условными митогенами, не индуцировала генерацию TEM с фенотипом канала Kv1.3highIKCa1low; 4) Kv1.3high TEM клетки были обнаружены после вскрытия в воспалительных инфильтратах мозга,пораженного рассеянным склерозом, и в паренхеме демиелинизирующих очагов рассеянного склероза[Rus et al., 2005]; 5) T-клетки, выделенные из синовиальной жидкости пациентов, страдающих ревматоидным артритом (RA), экспрессируют большие количества Kv1.3 по сравнению с T-клетками того же донора, но выделенные из периферической крови. Эти Kv1.3high T-клетки были CCR7-, указывая, что они являются TEM клетками [Beeton et al., 2006]; 6) кратковременные антиген-специфические CD4+ T-клеточные линии (TCL), полученные из лимфоцитов периферической крови пациентов, больных сахарным диабетом типа 1 (T1DM), и специфические к инсулину T1DM-связанных аутоантигенов и GAD65, отображают отличительные свойства TEM клеток, включая отсутствие CCR7 антигена (CCR7-) и Kv1.3high фенотип канала [Beeton et al., 2006]. Поскольку контроль мембранного потенциала TEM клеток выполняется исключительно под влиянием активности Kv1.3 каналов, пролиферация этих клеток, их функциональная активность и, таким образом, симптомы аутоиммунной болезни, необходимо улучшать за счет применения Kv1.3 ингибиторов. Следующие данные in vitro и in vivo из литературы подтверждают этот сценарий: 1) пролиферация in vitro хронически активируемых человеческих T-клеточных линий, обладающих характеристиками TEM (CCR7-, Kv1.3high) и специфических к антигену миелина [Wulff et al., 2003], илиTEM клеток, выделенных из синовиальной жидкости пациентов с заболеванием RA, полностью и постоянно подавляется пептидом Kv1.3 специфических блокаторов, таких как ShK [Wulff et al., 2003], ShK(L5) или низкомолекулярным Kv1.3 блокатором РАР-1 [Beeton et al., 2006]; 2) эксперименты in vivo с использованием маргатоксина, других высокоаффинных Kv1.3 блокаторов пептидов показали, что блокирование Kv1.3 ведет к ингибированию реакции гиперчувствительности замедленного типа у мини-свиньи; эта реакция - хороший критерий активности T-клеток эффекторной памяти [Koo et al., 1997]; 3) лечение МВР-специфических крысиных T-клеток с помощью ShK или ShK-Dap22 во время их invitro стимуляции посредством МБР (фаза сенсибилизации) наряду с повторным введением пептидов животным-реципиентам (во время эффекторной фазы) предотвратило адоптивный перенос экспериментального аутоиммунного энцефаломиелита (АТ-ЕАЕ) крысам Левис [Beeton et al., 2001]. ЕАЕ у крыс[Ben Nun and Cohen, 1982] - лучшая охарактеризованная модель болезни человека Рассеянный Склероз,характеризующейся сходным патогенезом и неврологическими расстройствами, а вызывающая болезньT-клеточная популяция - это миелин-специфическая TEM, имеющая фенотип канала Kv1.3high. Применение в комплексе Kv1.3 и IKCa1 блокаторов канала также улучшило симптомы ЕАЕ при введении после ее наступления [Beeton et al., 2001]; 4) модель пристан-индуцированного хронического артрита МНС класса II (PIA) у темных агути крыс - это крысиная модель для болезни человека Ревматоидный Артрит. Инъекции один раз в день ShK(L5) значительно сократили число пораженных болезнью суставов в течение испытательного срока (до 34 дней) [Beeton et al., 2006]; 5) эффективность Kv1.3 ингибитора по предупреждению экспериментального аутоиммунного диабета (EAD, крысиная модель для T1DM у людей) была изучена на крысах с МНС класса II DP-BB/W[Beeton et al., 2006]. Было установлено, что повторное ежедневное введение РАР-1, низкомолекулярный блокатор Kv1.3 высокой аффинности и селективности, сократило фракцию крыс с проявлением симптомов EAD на 50%(анализ проводился в возрасте 110 дней) по сравнению с контрольными особями, которых лечили только носителем. Это сопровождалось снижением инфильтрации T-клетками внутриостровка и макрофагами и уменьшением деструкцииклетки в группе, которую лечили РАР-1, по сравнению с контрольными особями, которых лечили носителем (анализ проводился в возрасте 35-70 дней) [Beeton et al., 2006]. Ингибирование пролиферации T-клеток с помощью Kv1.3-специфических ингибиторов специфично для TEM клеток, что делает эти соединения идеальным средством для лечения или профилактики аутоиммунных болезней. Хотя антиген-индуцированная пролиферация покоящихся необученных TCM клеток частично чувствительна к Kv1.3-опосредованному ингибированию, транскрипционная повышающая регуляция каналов IKCa1 преодолевает ее в преактивированных T-клетках и воспроизводит пролиферацию этих клеток, чтобы они были чувствительными к IKCa1 ингибиторам, а не к Kv1.3 ингибиторам[Ghanshani et al., 2000]. Это ограниченное действие Kv1.3 и IKCa1 ингибиторов на различные субпопуляции T-клеток лежит в основе значения селективности данной молекулы для Kv1.3 по сравнению сIKCa1. Недавно также было установлено, что ингибирование пролиферации TEM с помощью Kv1.3 ингибиторов может быть преодолено избыточной антигенной стимуляцией, имитирующей активацию TEM клеток болезнетворными организмами и вакцинными антигенами во время нормальных защитных иммунных реакций памяти [Beeton et al., 2006]. Таким образом, применение Kv1.3 ингибиторов высокой аффинности и высокой селективности в идеале нацелено на TEM клетки, неоднократно активируемых во время аутоиммунных реакций, тогда как другие защитные функции иммунной системы остаются неизменными. Дополнительно к человеческим Т и В лимфоцитам Kv1.3 каналы также экспрессируются в некоторых органах и тканях (включая центральную нервную систему, почки, печень, скелетные мышцы), а блокирование Kv1.3 каналов в клетках может вызвать значительные побочные эффекты. Комплексные испытания in vitro и острые и хронические in vivo токсикологические испытания были проведены ранее дляShK (L5) [Beeton et al., 2005; Beeton et al., 2006] из группы пептидных блокаторов и для РАР-1 [Schmitz etal., 2005; Beeton et al., 2006] из группы низкомолекулярных блокаторов. Эти исследования показали отсутствие клинических симптомов для неврологических и кардиальных побочных эффектов или гистопатологических изменений в тканях, где экспрессирован Kv1.3. Таким образом, полезные лечебные эффекты Kv1.3 блокаторов, перечисленные выше, в сочетании с минимальным или полным отсутствием побочных эффектов указывает на применимость селективных Kv1.3 блокаторов при ведении аутоиммунных болезней. Резюмируем, что приведенные выше данные говорят о важной роли Kv1.3 K каналов в физиологической иммунной реакции и указывают на применимость терапевтического вмешательства в аутоиммунную болезнь ингибированием каналов Kv1.3. Сущность изобретения Настоящее изобретение касается идентификации и использования новых пептидов, выделенных из яда мексиканского скорпиона V.mexicanus: Vm23, Vm24 и их функциональные эквивалентные аналоги,способные ингибировать функцию hKv1.3 каналов из человеческих лимфоцитов с высокой аффинностью и специфичностью, блокируя специфическую ионную проводимость. В других осуществлениях настоящего изобретения изобретатели описывают фармацевтические составы, включающие Vm23, Vm24 и их функциональные эквивалентные аналоги, способы их использования для блокирования Kv1.3 калиевых каналов для лечения различных иммунологических состояний и для применения в диагностических целях, а также способы их химического синтеза и правильного сворачивания. Пептиды выделены с помощью традиционной высокоэффективной жидкостной хроматографии, их первичная аминокислотная последовательность определена расщеплением по Эдману и масс-спектрометрией, демонстрирующей первичную структуру, представленную в SEQ ID NO:1 и SEQ ID NO:2. Vm24 содержит 36 аминокислот с молекулярным весом 3863,5 Да. Это компактная молекула, поддержанная четырьмя дисульфидными связями, установленными масс-спектрометрией между парами цистеинов в позициях С 6 и С 26, С 12 и С 31,С 16 и С 33 и С 21 и С 36, где С обозначает аббревиатуру остатков цистеина, а цифры соответствуют их взаимным позициям в аминокислотной последовательности. Аминокислота на карбоксильном конце пептида амидируется. Весь пептид был химически синтезирован твердофазным методом Меррифилда, а правильное сворачивание синтетического пептида было достигнуто и подтверждено как химическим, так и функциональным анализами. Vm24 не токсичен для мышей при введении при относительно высокой концентрации (анализ проводился вплоть до 200 мкг/мышь с весом тела 20 г, т.е. 10000 мкг/кг веса мыши). При применении к человеческим лимфоцитам in vitro он демонстрирует очень высокую аффинность к hKv1.3 каналам, испытанным с помощью метода "открытия-закрытия". Он связывается с этими каналами почти необратимым образом, показывая значение Kd в нижнем пикомолярном диапазоне (менее 3 пМ). Он не модифицирует калиевые токи следующих ионных каналов: liKv1.4, liKv1.5, rKv2.1, hBK иhERG-канал и токи потенциалозависимого кардиального Na+ канала (hNav1.5), когда анализ проводится при концентрации 10 нМ. Ингибирование тока при концентрации 10 нМ для каналов hIKCa1, mKv1.1 иhKv1.2 составляет приблизительно 20-50%, по сравнению со 100%-ной блокировкой для hKv1.3 каналов. Токсин блокирует более 50% тока hKv1.3 при концентрации уже 3 пМ, таким образом, приблизительно в 1500 раз более эффективно на этом канале, чем на любом другом канале, который подвергался анализу. Испытания на летальность, проведенные с применением Vm24, не вызвали никаких наблюдаемых признаков интоксикации при концентрациях вплоть до 200 мкг/20 г веса мыши. Vm24, примененный к крысиной модели для гиперчувствительности замедленного типа (DTH), защитил экспериментальных животных. Сенсибилизация кожи экспериментальных крыс динитрофторбензолом (DNEB) вызывает значительную иммунологическую реакцию (краснота и сильное раздражение ушей). Группы крыс при одной инъекции 10 мкг Vm24 на шестой день после начала лечения показывают значительное ослабление иммунной реакции; раздражение леченых ушей значительно уменьшилось (стало как минимум на 60% меньше) по сравнению с контрольными крысами, которым вводили только растворитель. Родственный пептид, получивший название Vm23, был также выделен из того же яда и полностью упорядочен, как показано в SEQ ID NO:2. Этот пептид на 83% идентичен Vm24, имеет 35 аминокислотных остатков, укомплектованных четырьмя дисульфидными связями, и показывает молекулярный вес 3665 Да. Vm23 отображает равноценную функцию, как и Vm24: высокая аффинность и специфичность для hKv1.3 каналов. Блокировка токов для каналов hKv1.3, hIKCa1, mKv1.1 и hKv1.2 при концентрации 10 нМ Vm23 составила приблизительно 95, 1, 3 и 9% соответственно. Филогенетический анализ, проведенный с обоими пептидами с использованием более 125 других известных пептидов скорпиона [Bagdany et al., 2005], специфических для K каналов, показал, что Vm23 иVm24 не входят ни в одно из 20 подсемейств уже описанных структур токсина скорпиона. Это два первых примера нового структурного подсемейства, в настоящем описании предлагается его название: KTx 21. Vm24 и Vm23, таким образом, следует обозначать -KTx 21.1 и -KTx 21.2 соответственно. Критерии, используемые для определения новых подсемейств токсинов скорпиона, специфических к K каналам, согласно международной коллегии ученых, которая установила применяемую в настоящее время систематическую систему условных обозначений (см. [Tytgat et al., 1999]), содержат необходимое условие, по которому первичная структура должна отличаться от других как минимум на 50%. Фактически, и Vm23 и Vm24 обнаруживают сходство последовательности менее чем приблизительно на 50% с другими известными токсинами. На основании современных сведений в данной области эти свойства делают Vm23, Vm24 и их функциональные эквивалентные аналоги превосходными кандидатами для имммуносупрессии, а также для диагноза и лечения иммунологических болезней. Краткое описание чертежей Чертежи, включенные в данное описание, составляют часть настоящей спецификации и включены для демонстрации некоторых аспектов настоящего изобретения. Изобретение в полном объеме можно лучше понять, если использовать один или несколько из этих чертежей в сочетании с подробным описанием представленных конкретных осуществлений изобретения, в частности в разделе ниже, где приведены примеры. Фиг. 1. Выделение с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) 1 мг растворимого яда из скорпиона V.mexicanus. Более 80 различных компонентов было отдельно получено путем загрузки растворимого яда в С 18 колонку с обращенной фазой (каталожный номер 218 ТР 54 от Vydac, Гисперия, шт. Калифорния), уравновешенной раствором А (вода в 0,10% TFA - трифторуксусная кислота), с использованием градиента от 0 до 60%-ного раствора В (ацетонитрил в 0,12% TFA) в течение 60 мин. Цифры 1 и 2 при времени удерживания 23 и 24 мин указывают элюционную позицию Vm23 и Vm24 соответственно. Дополнительное выделение каждой из этих 2 хроматографических фракций проводилось в той же системе, но с использованием линейного градиента от раствора А до 40%-ного раствора В в течение 60 мин для обоих пептидов. Результаты показаны на вкладке к фиг. 1. Звездочки на вставках указывают позицию элюции высокоочищенных пептидов. Фиг. 2. Аминокислотная последовательность пептидов Vm23, Vm24 и согласованность. Последовательности пептидов Vm23 и Vm24 были получены прямым расщеплением по Эдману нативных пептидов и редуцированных и алкилированных образцов, в сочетании с массспектрометрическим анализом пептидов, полученных ферментативным расщеплением чистого пептида специфическими энзимами (эндопротеаза Arg-C и Lys-C), как указывают ниже соответствующие последовательности. Аминокислотные последовательности пептидов, очищенных после ферментативного гидролиза и ВЭЖХ разделения, были идентифицированы с помощью масс-спектрометрического анализа(MS/MS - тандемная масс-спектрометрия, означает масс-спектрометрическую фрагментацию путем электрораспылительной ионизации). Под каждой последовательностью находятся указатели сегментов, идентифицированных различными используемыми способами. Прямая означает расщепление по Эрдману,Arg-C и Lys-C - это фрагменты, очищенные после ферментативного переваривания. Только MS означает идентификацию, основанную на молекулярной массе недостающей аминокислоты. Согласованная последовательность имеет 30 аминокислотных остатков, идентичных аминокислотным остаткам Vm23 илиVm24. Позиции, обозначенные "х": х 1 - любая аминокислота при условии, что она не разрывает трехмерную укладку белка или даже лучше K или Р; х 2 - любая аминокислота при условии, что она не разрывает трехмерную укладку белка или даже лучше L или Р; х 3 - любая аминокислота при условии, что она не-5 020131 разрывает трехмерную укладку белка или даже лучше K или R; х 4 - любая аминокислота при условии,что она не разрывает трехмерную укладку белка или даже лучше S или N; х 5 - любая аминокислота при условии, что она не разрывает трехмерную укладку белка или даже лучше K или R; и х 6 - любая аминокислота, при условии, что она не разрывает трехмерную укладку белка или даже лучше Y или ни одного. Фиг. 3. Vm24 имеет амидированный С конец. Столкновительно-индуцированная диссоциация (CED) [М+Н]+ иона на С-конце при отношении массы к заряду (m/z), равном 909,4 a.m.u. [атомная единица массы] (моноизотопный молекулярный вес),показывает на 1,0 единицу меньше, чем ожидаемое теоретическое значение [М+Н]+ 910,5 a.m.u. Ионный ряд у (курсив), соответствующий последовательности амидированного С-конца, показан на вставке, обозначенной 1). Сравнение теоретических значений у ионного ряда для свободного карбоксиконцевого пептида (TV-COOH), теоретических значений у ионного ряда для амидированного С-конца (TV-NH2) и экспериментальных значений у ионного ряда (EXP) приводится во вставленной таблице (вставка, обозначенная 2). Фиг. 4. Гетеродимеры Vm24 для задания дисульфида. Номера 1 и 2 указывают молекулярный вес и схематические структуры гетеродимеров, полученных одновременным протеолитическим расщеплением Vm24 с помощью трипсина и химотрипсина при рН 6,5. [М+Н]+ ион при отношении массы к заряду (m/z), равном 788,0 a.m.u., соответствует молекулярной массе гетеродимера, содержащего цистиновую полупару С 4-С 8 (номер 1) и [М+Н]+ ион при m/z, равном 560,4 a.m.u., по отношению к цистиновой полупаре С 3-С 7 (номер 2). Фиг. 5. Цистиновые полупары Vm24: А - Масс-спектр, соответствующий структуре сложного ядра, содержащего обе цистиновые полупары, С 1-С 4 и С 2-С 6 с [М+2 Н]+2 ионом при m/z, равном 1099,7 a.m.u. Было выполнено фрагментирование для получения MS/MS спектра, который показан на фиг. 4 В. Значения b ионного ряда от 1137 до 1507 a.m.u. определенно представляют метку GSPE, подтверждающую назначение последних 2 цистиновых полупар. В - Показано полное расположение дисульфидных связей пептида Vm24, определенных массспектрометрическим анализом, который описан в части А этой фигуры. Фиг. 6. ВЭЖХ очистка синтетического Vm24. Синтетически приготовленный Vm24 (белок 50 мг) был выделен в препаративной колонке с обращенной фазой С 18. Номер 1 указывает элюционную позицию синтетического и правильно уложенногоVm24, тогда как 2 и 3 обозначают неправильно уложенные или усеченные последовательности. Дополнительное разделение этой хроматографической фракции проводилось в той же системе, но с применением аналитической колонки, развернутой с линейным градиентом от раствора А до 40%-ного раствора В, в течение 60 мин. Результаты показаны на вставке к фигуре. Фиг. 7. ВЭЖХ сравнение синтетического и природного Vm24 пептида: А - Введение 10 мкг нативного Vm24 в аналитическую С 18 колонку (каталожный номер 218 ТР 54 отVydac, Гисперия, шт. Калифорния) в системе ВЭЖХ, представленной на фиг. 1, демонстрирует, что чистый пептид элюирует за 32,67 мин, когда развернут с линейным градиентом от раствора А до 40%-ного раствора В, в течение 60 мин. В - Хроматограмма 15 мкг синтетически полученного и свернутого Vm24 в той же системе и при таких же условиях. С - Совместная инжекция смеси 1:1 синтетического и природного Vm24 (всего 8 мкг) показывает,что они элюируют за одно и то же время удерживания. Следует упомянуть, что ось X на графике смещена вправо для букв В и С, чтобы можно было наблюдать эти три графика сравнительно, но раздельно, в противном случае время элюции в трех независимых выполнениях ВЭЖХ попало бы на один и тот же пик и различить их было бы невозможно. Фиг. 8. Анализ последовательности и филогенетический анализ Vm23 и Vm24:A - Выравнивание множества последовательностей Vm24 и Vm23 с их наиболее близко связанными-KTx. Выравнивание выполнялось по программе CLUSTALX [Thompson et al., 1997], а идентичность последовательностей с помощью Vm24 (%I, последняя колонка), рассчитанной при помощи BioEdit. В - Упрощенное филогенетическое дерево, рассчитанное с помощью MrBayes 3.0b4 [Huelsenbeckand Ronquist, 2001; Ronquist and Huelsenbeck, 2003]. Vm23 и Vm24 сгруппированы вместе и значительно отличаются от членов подсемейства -KTx 6. Фиг. 9. Селективное блокирование ионных каналов лимфоцита с помощью Vm24: А - Калиевые токи всей клетки по каналам hKv1.3 были вызваны из человеческой T-клетки в ответ на деполяризующие импульсы до +50 мВ от исходного потенциала -120 мВ каждые 15 с. Токи в отсутствие Vm24 (контрольный образец, обозначенный стрелкой) почти полностью блокируются, когда в клетку вводится 1 нМ Vm24 путем перфузии внеклеточной питательной средой. Стрелка указывает 1-й импульс в Vm24. В - Показаны нормализованные максимальные токи как функция времени после введения 1 нМ введения токсина. С - Показаны нормализованные максимальные токи лимфоцита как функция времени, по мере того,как в клетку вводят 3 пМ Vm24, а затем выводят (промывка) из внеклеточной питательной среды. Перфузия питательной средой без токсина вызвала очень медленное частичное восстановление из блокирования с временной константой 3800 с. Импульсы подавали каждые 30 с.D - Зависимость доза-реакция для Vm24 была получена построением оставшейся токовой фракции(RCF=I/I0) как функция концентрации токсина, где I и I0 - максимальные токи, измеренные при наличии и отсутствии токсина соответственно, и согласованием базовых координат с функцией: RCF =Kdn/(Kdn+[Тх]п), где [Тх] обозначает концентрацию токсина, a Kd - это константа диссоциации. Величины ошибки обозначают SEM (n=3-6). Функция реакция-доза, построенная таким образом, дает Kd=2,9 пМ и коэффициент Хилла n равен 1. Е) Ca2+-активированные K каналы Т-лимфоцитов (hIKCa1) были экспрессированы в Cos-7 клетках,а токи вызывали линейными изменениями напряжения от -120 до +50 мВ от исходного потенциала -120 мВ каждые 10 с. Показаны следы тока, зарегистрированные перед введением токсина (контрольный образец), после установления равновесия блокирования при наличии 10 нМ Vm24 в течение 4,5 мин и после промывки (вымывания) токсина в течение 2,5 мин.F) Оставшаяся фракция hIKCa1 тока при наличии 1 и 10 нМ Vm24 была рассчитана s/s0, где s и s0 уклоны соотношений I-V, вызванных линейными изменениями напряжения при наличии и отсутствииVm24 соответственно. Величины ошибки обозначают SEM (n=3). Фиг. 10. Vm24 селективен для hKv1.3 среди каналов семейства Shaker (Kv1.x). Показаны следы тока, зарегистрированные перед введением токсина (контрольный образец), после установления равновесия блокирования с помощью 10 нМ Vm24 и после промывки (вымывания) токсина:A) mKv1.1 каналы были экспрессированы L929 клетками, а токи вызывали скачками напряжения до+50 мВ от исходного потенциала -120 мВ каждые 30 с. Уравновешенное блокирование индуцировалось через 6 мин, время промывки составило 5 мин. В) hKv1.2 каналы экспрессировались Cos-7 клетками, а токи вызывали скачками напряжения до+50 мВ от исходного потенциала -120 мВ каждые 30 с. Уравновешенное блокирование индуцировалось через 5,5 мин, время промывки составило 7 мин. С) hKv1.3 каналы были экспрессированы эндогенно лимфоцитами периферической крови, а токи вызывали скачками напряжения до +50 мВ от исходного потенциала -120 мВ каждые 15 с. Уравновешенное блокирование индуцировалось через 3,5 мин, время промывки составило 4,5 мин.D) Удаленные быстрой инактивацией hKv1.4 (Kv1.4AN) каналы были экспрессированы Cos-7 клетками, а токи вызывали скачками напряжения до +50 мВ от исходного потенциала -120 мВ каждые 30 с. Продолжительность введения Vm24 и периода промывки составила 5 и 4,5 мин соответственно. Е) hKv1.5 каналы были экспрессированы MEL клетками, а токи вызывали скачками напряжения до+50 мВ от исходного потенциала -120 мВ каждые 15 с. Продолжительность введения Vm24 и периода промывки составила 6 и 3,5 мин соответственно. Фиг. 11. Vm24 не блокирует или ингибирует ряд биологически важных ионных каналов. Показаны следы тока, зарегистрированные перед введением токсина (контрольный экземпляр) после установления равновесия блокирования с помощью 10 нМ Vm24 и после промывки (вымывания) токсина:A) rKv2.1 каналы были экспрессированы Cos-7 клетками, а токи вызывали скачками напряжения до+50 мВ от исходного потенциала -120 мВ каждые 30 с. Продолжительность введения Vm24 и периода промывки составила 7 и 3 мин соответственно. В) hERG каналы были экспрессированы HEK клетками, а токи вызывали скачками напряжения до+20 мВ с последующим скачком до -40 мВ, во время которого измерили максимальный ток. Исходный потенциал составил -80 мВ, импульсы подавали каждые 30 с. Продолжительность введения Vm24 и периода промывки составила 5 и 2,5 мин соответственно. С) hBK (KCa1.1) каналы были экспрессированы tsA-201 клетками, а токи вызывали скачком напряжения до +50 мВ, чему предшествовала 10-ms гиперполяризация до -120 мВ от исходного потенциала 0 мВ. Импульс подавали каждые 5 с. Продолжительность введения Vm24 и периода промывки составила 4 и 1 мин соответственно.D) Nav1.5 были экспрессированы Cos-7 клетками, а токи вызывали скачками напряжения до 0 мВ от исходного напряжения -120 мВ каждые 15 с. Продолжительность введения Vm24 и периода промывки составила 1 и также 1 мин соответственно. Фиг. 12. Профиль селективности Vm24. На столбиках гистограммы показаны оставшиеся фракции тока при равновесном блокировании обозначенных каналов с помощью Vm24, введенного в концентрации 1 нМ (А) или 10 нМ (В). Данные представлены как средние SEM, для n3 независимых экспериментов. Подробные сведения о системе экспрессии и расчете RCF и другие условия приведены в надписях к фиг. 9-11.A) Калиевые токи всей клетки вызывали по каналам hKv1.3 из человеческой Т-клетки в ответ на деполяризующие импульсы до +50 мВ от исходного потенциала -120 мВ каждые 30 с. Токи, зарегистрированные в отсутствие пептида (контрольный экземпляр, обозначенный стрелкой), почти полностью блокируются (90%) при введении в клетку 100 пМ синтетического Vm24 (sVm24) путем перфузии внеклеточной питательной средой. Стрелка указывает 1-й импульс в sVm24. В) Показаны нормализованные максимальные токи как функция времени после введения 100 пМsVm24. Стрелка указывает начало введения токсина. При перфузии клетки раствором, не содержащемsVm24 (стрелка указывает начало периода промывки), значительное восстановление из блокирования не достигается. С) На масштабированных шкалах показаны оставшиеся фракции тока при равновесном блокирования hKv1.3 с помощью sVm24 и Vm24, введенных в концентрации 100 пМ. Данные представлены как средние SEM, для n3 независимых экспериментов. Подробные сведения о системе экспрессии, расчетеRCF и другие условия приведены в надписях к фиг. 9-11. Фиг. 14. Vm23 селективен для hKv1.3. Показаны следы тока, зарегистрированные перед введением токсина (контрольный экземпляр) после уравновешивания блокирования с помощью 10 нМ Vm23 и после вымывания (промывания) токсина. Для фармакологического анализа профиля Vm23 были выбраны ионные каналы, достоверно блокированные Vm24 в концентрации 10 нМ:A) hKv1.3 каналы были эндогенно экспрессированы лимфоцитами периферической крови, а токи вызывали скачками напряжения до +50 мВ от исходного потенциала -120 мВ каждые 15 с. Равновесное блокирование развивалось через 3,5 мин, а время промывки составило 2 мин. В) Ca2+-активированные K каналы Т-лимфоцитов (hIKCa1) были экспрессированы Cos-7 клетками,а токи вызывали линейным изменением напряжения от -120 до +50 мВ от исходного потенциала -120 мВ каждые 15 с. Продолжительность введения Vm23 и периода промывки составила 3,5 и 2 мин соответственно. С) mKv1.1 каналы были экспрессированы L929 клетками, а токи вызывали скачками напряжения до+50 мВ от исходного потенциала -120 мВ каждые 15 с. Продолжительность введения Vm23 и периода промывки составила 3,5 и 1 мин соответственно.D) hKv1.2 каналы были экспрессированы Cos-7 клетками, а токи вызывали скачками напряжения до+50 мВ от исходного потенциала -120 мВ каждые 15 с. Равновесное блокирование развивалось через 3,5 мин, время промывки составило 2 мин. Фиг. 15. Профиль селективности Vm23. На масштабированных шкалах показаны оставшиеся фракции тока при равновесном блокировании обозначенных каналов с помощью Vm23, введенного в концентрации 10 нМ. Данные представлены как средние SEM, для n3 независимых экспериментов. Подробные сведения о системе экспрессии и расчете RCF и другие условия приведены в надписях к фиг. 9 и 14. Фиг. 16. Реакция гиперчувствительности замедленного типа (DTH) у крыс. Две группы из 3 крыс каждая были сенсибилизированы и подвергнуты контрольному заражению путем введения DNFB. Одной группе инъецировали только PBS (контрольный образец, номер 1), а другой ввели однократную инъекцию 10 мкг Vm24 (группа 2). Измерения уха провели спустя 24 ч после такого лечения. На контрольной шкале показана толщина ушей после стимуляции с помощью DNFB у контрольных крыс, тогда как шкала, соответствующая испытательной группе (группа 2), показывает толщину ушей у крыс, подвергавшихся лечению с помощью Vm24. Наблюдалось приблизительно 60% уменьшение воспаления у крыс, получивших Vm24, по сравнению с контрольными крысами. Подробное описание изобретения Определения. Если не определено иначе, все технические и научные термины, используемые в данном документе,имеют значения, которые обычно приняты у специалистов данной области, к которой также относится и настоящее изобретение. В соответствии с использованием в настоящем описании следующие термины имеют значения, которые им приписаны, если не определено иначе. Несмотря на то что при практическом применении или при испытании настоящего изобретения могут использоваться любые способы и материалы, эквивалентные описанным в данном документе, здесь приводятся описания предпочтительных способов и материалов. В целях настоящего изобретения ниже определены следующие термины. В настоящем изобретении термины "пептид", "полипептидный" и "белок" используются только как относящиеся к пептидным молекулам настоящего изобретения. Термин "блокирующая Kv1.3 калиевый канал активность" обычно относится к фактической оценке степени ингибирования потока ионов калия через упомянутые Kv1.3 каналы, вызванное наличием ингибитора Kv1.3 калиевого канала. Термин "блокатор Kv1.3 калиевого канала" обычно означает вещество, которое ингибирует поток ионов калия через Kv1.3 канал клеточной мембраны, которая содержит упомянутый канал, перекрывая непосредственно ионный проводящий путь. Термин "аналог" обычно означает любую полипептидную цепь, которая имеет как минимум 83% попарную идентичность последовательностей по 36 выравненным позициям SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3 (30 совпадений по 36 позициям). Он может включать, но это не предел, до шести аминокислотных изменений, один или несколько искусственных аминокислотных остатков, химическую дериватизацию одного или нескольких остатков и удлинения N-конца и/или С-конца либо другими аминокислотными остатками, либо другими органическими веществами. Термин "процент попарной идентичности последовательности" обычно означает коэффициент между позициями аминокислотного остатка, которые имеют одинаковую аминокислоту в 2 выровненных последовательностях по всем позициям, когда выравниваются две последовательности белка. Термин "функциональный эквивалент" обычно означает любую молекулярную структуру, которая отображает аналогичную аффинность и селективность к Kv1.3, как сформулировано в SEQ ID NO:1 илиSEQID NO:2, при условии, что она содержит такие же структурные эпитопы аффинности и/или специфичности, которые сообщают этим последовательностям высокую аффинность и селективность по отношению к каналам Kv1.3. Это может быть либо аналог, либо пептидомиметик. Термин "структурные эпитопы аффинности и/или специфичности" обычно означает все функциональные группы и их трехмерные позиции на полипептидной структуре, которая придает SEQ ID NO:1 иSEQ ID NO:2 высокую аффинность и специфичность по отношению к hKv1.3 каналам. Эти структурные эпитопы аффинности и специфичности могут быть связаны с одинаковыми, частично перекрывающимися или разными аминокислотными остатками. Термин "функциональная группа" обычно означает заданное химическое вещество в пределахSEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3 либо в основной полипептидной цепи, либо в боковых цепях ее аминокислотных остатков, что создает специфические и прочные контакты с каналами hKv1.3,определяя тем самым аффинность и селективность SEQ ID NO:1, SEQ ID NO:2 по отношению к hKv1.3 каналам. Термин "функциональный эквивалентный аналог" обычно означает любую полипептидную цепь,которая имеет как минимум 83%-ную попарную идентичность последовательностей по 36 выравненным позициям SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3 (30 совпадений по 36 позициям). Он может включать, но это не предел, один или несколько искусственных аминокислотных остатков, химическую дериватизацию одного или нескольких остатков и удлинения N-конца и/или С-конца либо другими аминокислотными остатками, либо другими органическими веществами, которые отображают одинаковую аффинность и селективность по отношению к hKv1.3, как сформулировано в SEQ ID NO:1 илиSEQ ID NO:2. Термин "пептидоминик" обычно означает любое химическое соединение, которое отображает одинаковые функциональные группы в одинаковых трехмерных позициях, как в SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3, следовательно, имитируя специфические контакты SEQ ID NO:1, SEQ ID NO:2 сhKv1.3 каналами. Термин "пептиды по настоящему изобретению" обычно означает пептиды, имеющие SEQ ID NO:3,с третичной структурой, поддерживаемой четырьмя дисульфидными связями, установленными между парами цистеинов в позициях С 6 и С 26, С 12 и С 31, С 16 и С 33 и С 21 и С 36, где С обозначает аббревиатуру остатков цистеина, а цифры соответствуют их взаимным позициям в выровненной аминокислотной последовательности. Примерами предпочтительных пептидов являются пептиды, имеющие последовательность SEQ ID NO:1 (Vm23) и SEQ ID NO:2 (Vm24). Вышеуказанные пептиды способны блокировать калиевый канал Kv1.3 с высокой аффинностью и специфичностью. Включены функциональные эквивалентные аналоги SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3, т.е. которые имеют как минимум 83% попарную идентичность последовательностей по 36 выравненным позициям SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3 (30 совпадений по 36 позициям), они сохраняют третичную структуру, поддерживаемую четырьмя дисульфидными связями, и отображают сходную аффинность и селективность по отношению к hKv1.3, как сформулировано в SEQ ID NO:1 или SEQ ID NO:2. Термин "фармацевтически приемлемый носитель" охватывает все стандартные фармацевтические носители, буферы и наполнители, включая забуференный фосфатом физиологический раствор, воду и эмульсии (такие как масляно-водяная или водно-масляная эмульсия), и различные типы смачивающих средств и/или адъювантов. Пригодные фармацевтические носители и их составы описаны в Remington'sPharmaceutical Sciences - Фармацевтические науки Ремингтона (Mack Publishing Co., г. Истон, 19-е изд. 1995). Предпочтительные фармацевтические носители зависят от предполагаемого способа введения активного агента. Ниже приводится описание типичных способов. Термин "фармацевтически приемлемая соль" относится к нетоксичным кислотно-аддитивным солям, включая соли, образованные неорганическими кислотами, такими как соляная, гидробромистая,фосфорная, серная и хлорная кислоты, и соли, образованные органическими кислотами, такими как уксусная, щавелевая, малеиновая, яблочная, винная, лимонная, янтарная или малоновая кислоты. Другие фармацевтически приемлемые соли включают неорганический нитрат, сульфат, ацетат, малат, формат,лактат, тартрат, сукцинат, цитрат, р-толуенсульфонат и т.п., включая, но не ограничиваясь этим, катио-9 020131 ны, основанные на щелочных и щелочно-земельных металлах, таких как натрий, литий, калий, кальций,магний и т.п., а также нетоксичный аммоний, четверичный аммоний, и катионы амина, включая, но не ограничиваясь этим, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п. Термин "фармацевтический состав" означает состав, пригодный для фармацевтического применения субъекту, включая млекопитающий субъект или человеческий субъект. Фармацевтический состав обычно включает эффективное количество активного агента и фармацевтически приемлемого носителя. Термин "эффективное количество" означает дозировку специфического активного агента, в данном случае пептида, обладающего блокирующей Kv1.3 калиевый канал активностью, достаточную для получения желательного результата, например подавление иммунной реакции у млекопитающих, лечение аутоиммунной болезни у нуждающегося в этом субъекта, подавление процессов T-клеточной активации в иммунной системе млекопитающих, ослабление метаболических путей сигнализации кальция в Т-лимфоците. Желательный результат может включать субъективное или объективное улучшение у субъекта (включая клетки), получающего такую дозировку. Термин "субъект" означает млекопитающий животный организм, включая человека. Нечеловеческие млекопитающие, подвергающиеся лечению, включают, например, коров, овец, свиней, лошадей,собак и котов. Термин "аутоиммунная болезнь" обычно означает патологическое состояние, управляемое иммунными клетками организма, которое воздействует на гомеостаз упомянутого организма. Термин "аутоиммунная болезнь, связанная с лимфоцитами TEM" означает любую аутоиммунную болезнь, при которой клетка, воздействующая на организм, - это клетка лимфоцита TEM. В число этих болезней входят, но не ограничивается этим, рассеянный склероз, ревматоидный артрит, диабет типа 1,аутоиммунный псориаз, красная волчанка, неспецифический язвенный колит, симпатическая офтальмия и периодонтальная болезнь резорбции кости."Профилактическое лечение" - это лечение, назначаемое субъекту, у которого нет проявлений симптомов болезни или проявляются только ранние признаки болезни, такое лечение назначают с целью уменьшить риск развития патологической ситуации, в частности аутоиммунной болезни, точнее, аутоиммунной болезни, связанной с лимфоцитами TEM."Терапевтическое лечение" - это лечение, назначаемое субъекту, у которого присутствуют признаки патологии, такое лечение назначают с целью уменьшения или исключения этих паталогических признаков, точнее, аутоиммунной болезни, связанной с лимфоцитами TEM. Термин "орган" означает такие системы тела, как сердце, печень, легкие, почки, мозг, система надпочечников, сосудисто-эндотелиальная система, иммунная система и т.п. Термин "молекулярный зонд" обычно означает любое химическое или биологическое вещество, которое может использоваться специально для идентификации клеток-мишеней, клеточных структур, рецепторов или любой молекулы, с которой зонд может связаться с высокой аффинностью и специфичностью. Термин "заменимая аминокислота" обычно означает любую аминокислоту в пределах SEQ ID NO:1,SEQ ID NO:2 или SEQ ID NO:3, которую можно заменить любой другой аминокислотой, в основном не изменяя аффинность или специфичность получаемого в результате аналога по отношению к каналамKv1.3. Основные выводы. Основной предмет настоящего изобретения касается 2 новых пептидов (Vm23 и Vm24), их аминокислотных последовательностей (SEQ ID NO:1 и SEQ ID NO:2), а также возможных функциональных эквивалентных аналогов и их потенциального использования в качестве специфических иммунодепрессивных средств. Vm23 и Vm24 - высокоселективные блокаторы калиевых ионных каналов подтипаKv1.3, в частности человеческих лимфоцитов (hKv1.3), и in vivo было обнаружено, что они снижают воспалительную реакцию в ответ на реакции гиперчувствительности замедленного типа у крыс, следовательно, эти два пептида и их функциональные эквивалентные аналоги - ведущие соединения для применения в лечении некоторых иммунологических болезней, связанных с атипичными T-клеточными иммунными реакциями. Прежде чем перейти к подробному описанию этих иммунодепрессивных средств и их влияния на hKv1.3 каналы, важно рассмотреть некоторые фундаментальные знания в данной области. Регулирование мембранного потенциала всех клеток в основном поддерживается наличием ионных каналов, проницаемых к ионам калия, названных просто K каналами. Отдельные клетки могут экспрессировать несколько отдельных K каналов, которые могут открыться или закрыться в ответ на изменения напряжения, внутриклеточных уровней кальция или специфических лигандов, хотя потенциалозависимые каналы самые распространенные [Gutman et al., 2005]. Среди природных лигандов, которые могут модулировать функцию K каналов, токсины из ядов пчел, скорпионов, змей и морской анемоны [Castle etal., 1989; Jouirou et al., 2004; Rodriguez de la Vega and Possani, 2004]. Примерами таких токсинов являютсяnoxius токсин из скорпиона Centruroides noxius [Carbone et al., 1982], харибдотоксин из скорпиона Leiurusquinquestriatus [Miller et al., 1985], Anuroc токсин из скорпиона Anuroctonus phayodactilus [Bagdany et al.,2005], BgK из анемоны Bundosoma granulifera [Aneiros et al., 1993] и ShK из Stichodactyla helianthus[Castaneda et al., 1995]. Эти токсины показали способность блокировать целый ряд различных типов и подтипов K+ каналов, включая Kv1.3 с разной аффинностью и специфичностью [рассмотрено в Panyi etal. 2006]. Kv1.3 канал был вовлечен в пролиферацию Т-лимфоцита и получение лимфокина, а блокаторыKv1.3 канала представляют интерес как потенциальные иммунодепрессанты [Panyi et al. 2006]. У нескольких из этих K-канал специфических токсинов была определена их пространственная структура (рассмотрено в [Mouhat et al., 2004]. Благодаря решению трехмерной структуры 2 потенциалозависимых K каналов, которые содержат шесть трансмембранных сегментов [Lee et al., 2005: Long et al.,2005], и экспериментам, проведенным с двойными мутантами (токсины и каналы) несколькими группами [Goldstein et al., 1994; Stampe et al., 1994; Aiyar et al., 1995; Hidalgo and Mackinnon, 1995], была идентифицирована область межклеточного контакта нескольких из этих лигандов с K каналами. В отношении токсинов скорпиона, известных до настоящего времени, было исследовано более 125 различных пептидов, об аминокислотных последовательностях которых были сообщения в публикациях [Rodriguez de laVega and Possani, 2004]. Эти пептиды были сгруппированы в 20 различных подсемейств, основанных главным образом по трем критериям: первичное подобие последовательностей, позиция дисульфидных связей и специфичность функции. Для осуществления настоящего изобретения были выделены, очищены, упорядочены и испытаны оба пептида (Vm23 и Vm24). Полученная информация о существенной новизне и праве собственности - это уникальность их первичной структуры и высокоспецифичная функция,не очевидная при простом наблюдении их структурных характеристик, а требующая экспериментального доказательства функция, как in vitro, так и in vivo, как показано и заявлено в данном изобретении. Эта работа началась со сбора скорпионов V.mexicanus вида в полевых условиях и получения их яда с помощью электростимуляции. Скорпионы собирали в штате Морелос, Мексика. Авторы имеют официальное разрешение на это (документ номер SGPA/DGVS/02483 от 18 марта 2005 г., выданный Secretariade Medio Ambiente у Recursos Naturales мексиканского правительства). Обычно "доили" 30 скорпионов после анестезии двуокисью углерода (СО 2). Сырой яд либо сразу же обрабатывали, либо хранили в замороженном состоянии при -20 С до использования. Растворимый яд впоследствии разделили с помощью ВЭЖХ (высокоэффективная жидкостная хроматография). Очищенный пептид, предмет настоящего изобретения, затем прошел испытание in vivo с использованием мышей в качестве животных моделей для возможных токсических эффектов (испытания на летальность), и получили их первичную структуру, определенную расщеплением по Эдману и массспектрометрией. Подробные данные этих экспериментов описаны в примере 1 ниже. Вследствие того, что количество этих пептидов относительно небольшое в яде, для дальнейшей характеристики их функциональности и специфичности действия на каналы hKv1.3 химическим способом было синтезировано значительное количество Vm24. Химический синтез Vm24. Синтез пептида твердофазными методами включает использование твердофазной смолы, такой как,но не ограничиваясь, полистирол, полиакриламид, некоторые волокна или другие устойчивые полимеры. Дериватизацию твердофазной смолы можно выполнять с помощью соответствующей основы, например хлоротритил хлорид, 2-хлоротритил хлорид, гидрометилфенил, Sasrin в качестве средства функционального получения С-концевой кислоты, или можно приготовить протеолитической стабилизацией с помощью линкера смолы, такого как, но не ограничиваясь, 4-(2',4'-диметоксифенил-Fmocаминометил)феноксиметильная группа. Сборка цепи обычно включает одну из стратегий защитных групп, где аминокислотная защитная группа представляет собой либо t-бутилоксикарбонил (Вос), либо 9-флуоренилметилоксикарбонил(Fmoc). Реактивные боковые цепи различных аминокислот, используемых для синтеза пептида, как правило, защищены. Обычно используемые защитные группы включают t-бутил, бензил, тритил, метилтритил, бензилметилбензил, тозил, бензилоксиметил, t-бутилоксикарбонил, 2-хлорбензил, 2-бромбензил,метоксибензил, формил, ацетомидометил, пентаметилхроман сульфонил, пентаметилдигидробензофуран-сульфонил, нитро для аминов, гуанидинов, фенолов, спиртов, кислот, имидазолов, тиолов и индолов в боковой цепи. Можно разработать другие защитные группы, которые выполняют такую же цель отщепления нежелательных побочных реакций во время сборки первичной цепи. Синтез амидной связи во время добавления новых аминокислот к растущему пептиду можно выполнять любым способом кислотного активирования, включая, но не ограничиваясь, симметричные ангидриды (карбодиимид), сложные эфиры НОВТ, фторангидриды, активаторы урония, такие как, и не только, TBTU, HATU или HBTU, активаторы фосфония, такие как, и не только, BP, PyBOP, PyBrOP. Это все методы активации карбоксильной группы, которые, вероятно, известны специалистам, имеющим опыт работы в области синтеза пептида. Синтез аналоговых структур, которые включают подстановку не встречающихся в природе аминокислот в последовательности SEQ ID NO:1 (Vm23), SEQ ID NO:2 (Vm24) или SEQ ID NO:3 (Vm23 иVm24 согласованная последовательность), может также быть пригоден для некоторых осуществлений изобретения. Использование сходящихся методов, посредством которых фрагменты пептида собираются таким образом, что окончательный продукт - это Vm23, Vm24 или их аналоги, также известны и могут использоваться специалистами в этой области. Способы расщепления синтетического пептида из твер- 11020131 дофазной подложки в конце процедуры синтеза и правильное сворачивание дисульфидных связей для получения последовательностей SEQ NO:1 и SEQ NO:2 или их аналогов также известны и могут быть воспроизведены специалистами на современном техническом уровне предмета обсуждения. Окончательное расщепление и снятие защитных групп, а также сворачивание токсина могут быть, но не ограничиваются, либо HF, либо TFA, в зависимости от применяемой для синтеза стратегии. Формирование дисульфидной связи включает любой ортогональный подход, когда может быть использована дифференциальная Cys защита для позиционирования дисульфидных связей в правильном виде: С 6-С 26, С 12-С 31,С 16-С 33 и С 21-С 36 сцепление для Vm24. Однако формирование дисульфидной связи может быть также достигнуто окислением воздуха или реакциями перетасовки, которым способствует наличие восстановленного и окисленного глутатиона в различных пропорциях. Следуя этой базовой методологии, искусственно были получены различные встречающиеся в природе токсины от змеи, скорпиона и морского анемона, мечены радиоактивной меткой I, которые использовались в качестве молекулярных зондов для исследования структуры и функции калиевых каналов[Strong, 1990; Moczydlowski et al., 1998; Garcia et al., 2001, Kern et al., патент США 6077680]. Многие из этих токсинов селективны для конкретных подтипов K канала [Auguste et al., 1990; Galvez et al., 1990;Crest et al., 1992; Garcia-Calvo et al., 1993; Garcia et al., 1994, Kem et al., патент США 6077680]. Среди наиболее часто приводимых примеров дендротоксин из яда змеи Dendroaspis polylepsis [Harvey, 1997],BgK от морской анемоны Bunodosoma granulifera [Aneiros et al., 1993; Alessandri Haber et al., 1999] и ShK от анемоны Stichodactyla helianthus [Castaneda et al., 1995; Pennington et al., 1995] и несколько токсинов скорпиона, таких как noxius токсин от Centruroides noxius [Drakopoulou et al., 1995] и харибдотоксин отLeiurus quinquestratus [Sugg et al., 1990], и это только несколько из тех, которые можно назвать. Некоторые из этих токсинов, такие как ShK, блокируют K каналы Kv1.3 типа в Jurkat Т-лимфоцитах при очень низких концентрациях (1 нМ). Однако многим из них не хватает специфичности. То есть, при концентрациях порядка 10-100 нМ они также могут блокировать и другие подтипы каналов. В силу того, как это будет продемонстрировано в примерах далее, что Vm23 и Vm24 исключительно специфичны для hKv1.3 каналов и имеют первичную структуру, отличную от других пептидов, описанных до настоящего времени в литературе, было принято решение о приготовлении Vm24 искусственно. Ковалентная структура Vm24 была получена химическим синтезом согласно твердофазной системе Меррифильда [Merrifield, 1964], с использованием Fmoc-аминокислоты, как ранее описано нашей группой [Drakopoulou et al., 1995]. Возможность замены некоторых аминокислот первичной структуры последовательностейSEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3 другими модифицированными аминокислотами с целью получения пептида-аналога с более высоким периодом полувыведения in vivo, снижая, таким образом,восприимчивость протеазы нативных пептидов, входит в объем настоящего изобретения. Это может быть замещение или замена второстепенных остатков консервативными изостерными замещениями; например, лизин на глутамин или ацетил-лизин, или нейтральная аминокислота, такая как аланин, или замещение Na-метилированной аминокислоты в некоторых позициях для снижения протеолитического расщепления биологически активных пептидов. Кроме того, усечение первичной последовательности удалением некоторых аминокислот, несущественных для функции, или добавлением дополнительных остатков может обеспечить аналоговую структуру с более высокой стабильностью in vivo. Некоторые несущественные остатки пептидов по настоящему изобретению, идентифицированные выравниваниемSEQ ID NO:3. Пептид-аналог функционального эквивалента можно получить включением выбранныхD-аминокислот или химическим синтезом ретроинверсного аналога, где все остатки - этоD-аминокислоты, а аминокислотная последовательность реверсирована [Jameson et al., 1994; Juvvadi etal., 1996]. Эти модификации могут повысить стабильность продукта. Другой важный подход - разработка низкомолекулярных весовых соединений на основе структурных эпитопов аффиности и специфичности SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3 для создания непептидика (пептидомиметика). В результате этих исследований разработаны и синтезированы непептидные каркасы, содержащие основные функциональные группы от связывающей поверхности калиевого канала исходного полипептида. Существует много примеров, в которых природные низкомолекулярные, непептидные соединения демонстрируют свою способность имитировать или противодействовать влиянию полипептидного или белкового лиганда. Были разработаны и синтезированы пептидомиметические соединения для ряда терапевтически пригодных пептидов. Была разработана и синтетически получена петля, присутствующая на CD4 рецепторе, который связывается с HIV gpl20 белком [Chen et al.,1992], и было показано, что она может быть эффективным блокатором gpl20 связывания с CD4 рецептором при низких микромолярных концентрациях. FTI-276 - другой пример миметика из С-концевой зоныRas белка, который является мощным блокатором передачи сигналов онкогенного Ras [Lerner et al.,1995]. Как можно заключить из приведенного выше описания, существует много способов приготовления функциональных эквивалентных аналогов этих 2 пептидов Vm23 и Vm24, которые можно использовать в качестве основных препаратов для контроля атипичных функций Т-лимфоцитов. Ошибочная активация Т-лимфоцитов, как известно, вызывает аутоиммунные болезни (такие как рассеянный склероз, ревматоидный артрит, диабет типа 1, аутоиммунный псориаз, красная волчанка, неспецифический язвенный колит, симпатическая офтальмия и периодонтальная болезнь резорбции кости) и, помимо прочих, отторжение трансплантата. Для проверки эффективности возможных новых иммунодепрессантов существует много животных моделей, которые обеспечивают адекватные in vivo образцы для испытания эффективности и возможных побочных эффектов нового неизвестного соединения, поскольку имеет место реакция, известная как гиперчувствительность замедленного типа (DTH-реакция) у крыс, которая использовалась в настоящем изобретении. Как будет показано и описано ниже, для оценки защитного эффекта пептидов по настоящему изобретению были испытаны малые дозы Vm24 для контроля воспалительной реакцией, проявляющейся на ухе у крыс, предварительно сенсибилизированных динитрофлуоробензолом (DNFB). Такой анализ широко используется и принят в качестве адекватной модели для целей настоящего изобретения[Phanuphak et al., 1974]. Иммунодепрессант. Такие иммунодепрессанты, как циклоспорин и FK506, дают тяжелые побочные эффекты, что ограничивает их терапевтическое применение. В результате исследований, проведенных с этими двумя соединениями, удалось распознать, по меньшей мере, некоторые молекулярные механизмы, отвечающие за нежелательные побочные эффекты после введения этих препаратов. Циклоспорин взаимодействует с циклофилином белка, который присутствует во многих разных тканях, тогда как FK506 вызывает токсичность, потому что его объект - FK-связывающий белок, также обнаруженный во многих разных тканях. Поэтому потребовались большие усилия, чтобы идентифицировать новые иммунодепрессанты без серьезных побочных эффектов. Одна из основных целей состоит в том, чтобы идентифицировать новые мишени, экспрессируемые преимущественно в Т-лимфоцитах, такие как Kv1.3 ионный канал. Kv1.3 калиевые каналы, экспрессируемые в Т-лимфоцитах, очень важны для некоторых клеточных функций, хотя кодирование РНК для этого белка также обнаружено в других клетках (В-лимфоциты, микроглия, макрофаги, остеокласты, тромбоциты и некоторые клетки мозга). Однако только в Т-лимфоцитах Kv1.3 доминирует над мембранным потенциалом и имеет значительные функциональные последствия блокирования. Вследствие особого механизма действия Kv1.3 блокаторов и относительно ограниченного распределения ткани Kv1.3 каналов предполагается, что специфический и высокоаффинный блокатор Kv1.3 продемонстрирует менее токсичные побочные эффекты, чем циклоспорин и FK-506, следовательно, может доказать свою пригодность в лечении аутоиммунных болезней, так же как для терапии трансплантации. Ученые из Merck Sharpe и Dohme показали, что маргатоксин (другой пептид токсина скорпиона) обладает мощным влиянием в качестве блокатора канала Kv1.3 и способен подавлять иммунную реакцию в животной модели (свинья). Однако маргатоксин не специфичен для каналов Kv1.3, а также воздействует на канал Kv1.2 с аналогичной эффективностью. Так как сердечные и мозговые ткани также экспрессируют каналы Kv1.2, его блокирование могло бы иметь серьезные вредные воздействия. Другой пептид, выделенный из морской анемоны, ShK, является мощным блокатором Kv1.3 (см. Kem et al., 2000,патент США 6077680), который также воздействует на другие связанные Kv1 каналы, но для аналогичного блокирования потребуется в 100 раз более высокая концентрация. Это означает, что чувствительность связанных каналов к его применению 100 раз ниже по сравнению с Kv1.3. Пептиды Vm23 иVm24, предмет настоящего изобретения, происходят из другого биологического источника, имеют определенно другую первичную структуру, отличную от первичной структуры ShK и более специфичны дляhKv1.3 каналов, чем ShK. Vm23 и Vm24 блокируют 50% некоторых других K каналов, если применяются при концентрации, более чем в 3000 раз превышающей необходимую для блокирования такой же фракции hKv1.3 каналов, как это будет продемонстрировано и описано подробно в примерах ниже (примеры 7-10). Настоящее изобретение также включает получение Vm23, Vm24 и их функциональных эквивалентных аналогов твердофазным методом. Процедуры, используемые для химического синтеза, включают ряд известных специалистам в этой области протоколов, подробно представленных в рамках описания примера 3. Электрофизиологическая характеристика. Для разработки эффективной иммунной реакции против чужеродных или аутологичных антигенов необходима активация и пролиферация лимфоцитов, специфических к данному антигену. Это требует хорошо скоординированного взаимодействия между различными клеточными компонентами иммунной системы. Первый шаг в этом процессе - представление обработанных антигенов лимфоцитам профессиональными антигенпредставляющими клетками [Janeway et al., 2001]. В рамках предмета настоящего изобретения находится регулирование опосредованных Т-лимфоцитом иммунных реакций (например,гиперчувствительность замедленного типа) блокаторами, специфическими к потенциалозависимому K каналу, Kv1.3. Таким образом, ограничиваем детальную разработку вовлечения K каналов в активацию лимфоцита T-клетками. Однако следует упомянуть, что пролиферация некоторых субпопуляций В лимфоцитов также зависит от активности Kv1.3 каналов [Wulff et al., 2004]. Распознавание представленного антигена антигенным рецептором T-клеток ведет к активации, пролиферации и конечной дифференциации клеток [Sallusto et al., 2004]. Метаболические пути трансмембранной передачи сигналов, запущенные распознаванием антигена, включают активацию нескольких протеинкиназ и, следовательно, активацию фосфолипазы С- (PLC-). Образование инозитол 1,4,5 трифосфата (IP3) PLCопосредованным гидролизом мембранного фосфолипид фосфатидилинозит 4,5 бифосфата (PiP2) инициирует бифазный Ca2+ сигнал, необходимый для коммитирования до пролиферации в T-клетках [Lewis, 2001]. IP3 диффундирует и связывается с рецепторами в эндоплазматической сети (ER), что приводит к выбросу Ca2+ в цитозоль и значительному повышению концентрации цитозольного свободного кальция ([Ca2+]i). Переходного увеличения [Ca2+]i после выброса из ER недостаточно для выполнения каскада сигнальной трансдукции, необходим устойчивый Ca2+ сигнал. Это реализуется с помощью втекания Ca2+ из внеклеточного пространства по Ca2+ каналам в клеточной мембране по активированным выбросом кальция Ca2+ каналам (CRAC каналы) [Zweifach and Lewis, 1993]. Несмотря на то что CRAC каналы по своей природе потенциалонезависимы, Ca2+ ток чувствителен к электрохимическому градиенту для Ca2+, на который влияет мембранный потенциал клеток [Panyi et al.,2004]. Деполяризация втекания Ca2+ должна уравновешиваться активацией K каналов, чтобы зафиксировать мембранный потенциал на отрицательных значениях и обеспечить, таким образом, достаточную движущую силу для дальнейшего поступления Ca2+ [Fanger et al., 2001]. Селективное регулируемое K+ истечение - это один из главных эпитопов мембранного потенциала человеческих Т-лимфоцитов, который равен приблизительно -(50-60) мВ. Два типа K каналов проводят наружу K+ потоки при физиологических условиях в этих клетках. Доминирующий потенциалозависимый K канал в человеческих Тлимфоцитах, Kv1.3, открывается при мембранной деполяризации с порогом активации, близким к остаточному потенциалу клеток [Matteson and Deutsch, 1984]. Ca2+-активированный калиевый канал человеческих T-клеток, IKCa1 (или KCa3.1), активируется исключительно повышением концентрации цитозольного свободного кальция свыше 200 нМ, независимо от мембранного потенциала [Grissmer et al.,1993]. Участие Kv1.3 и IKCa1 каналов в контроле мембранного потенциала T-клеток зависит от активационного статуса клеток (покоящаяся клетка против активированной) и их функциональной роли в иммунной системе, определяемой степенью конечной дифференциации T-клеток [Wulff et al., 2003], как детально описано в разделе "Предпосылки создания изобретения". С точки зрения терапевтической применимости Kv1.3 блокаторов в аутоиммунных болезнях важно особо подчеркнуть, что селективность дляKv1.3 каналов по сравнению с IKCa1 каналами имеет чрезвычайно большое значение [Wulff et al., 2003].T-клетки эффекторной памяти (TEM), которые опосредуют повреждение ткани, например, при рассеянном склерозе, ревматоидном артрите, диабете типа 1, аутоиммунном псориазе, красной волчанке, неспецифическом язвенном колите, симпатической офтальмии и периодонтальной болезни резорбции кости,избирательно повышающе регулируют Kv1.3 каналы при активации; таким образом, контроль мембранного потенциала этих клеток определяется исключительно Kv1.3 каналами [Beeton et al., 2006]. Следовательно, пролиферация этих клеток может эффективно и постоянно подавляться селективными Kv1.3 ингибиторами [Wulff et al., 2003; Vennekamp et al., 2004; Beeton et al., 2005]. Напротив, необученные клетки и T-клетки центральной памяти (TCM) избегают опосредованного блокированием Kv1.3 ингибирования пролиферации [Wulff et al., 2003] за счет транскрипционной повышающей регуляции IKCa1 [Ghanshani etal., 2000]. Пролиферация этих преактивированных клеток становится чувствительной к IKCa1 ингибиторам, но не к Kv1.3 ингибиторам. Таким образом, основанная на Kv1.3 терапия, подавляющая активациюTEM клеток без значительного ухудшения пролиферации необученных и TCM клеток, может найти применение в ведении аутоиммунных болезней, особенно аутоиммунных болезней, связанных с лимфоцитомTEM, таких как сахарный диабет типа 1 [Viglietta et al., 2002; Beeton et al., 2006], ревматоидный артрит[Beeton et al., 2006], рассеянный склероз, воспалительная резорбция кости при экспериментальной периодонтальной болезни [Valverde et al., 2004] и состояния, связанные с отторжением органа, такие как привычное отторжение трансплантата и реакция "трансплантат против хозяина", которые по предположению могут быть поддержанными постоянно активируемыми TEM клетками [Yamashita et al., 2004]. Оценка селективности. Некоторые высокоаффинные пептидные блокаторы Kv1.3 селективны для Kv1.3 по отношению кIKCa1, по аналогии с Vm24. Они включают токсины скорпиона, например Маргатоксин (MgTx), Noxius токсин (Ntx), Kalio токсин, Anuroc токсин и ShK токсин, выделенные из морской анемоны. Однако ионные каналы, важные в нейронной и мышечной возбудимости, также ингибируются этими токсинами с наномолекулярной-пикомолекулярной аффинностью, например Kv1.1 ShK токсином [Kalman et al., 1998] и Kalio токсином [Grissmer et al., 1994], тогда как Kv1.2 блокируется MgTx токсином [Kox et al., 1997],Ntx токсином [Grissmer et al., 1994] и Anuroc токсином [Bagdany et al., 2005]. Недостаток специфичности токсинов дает возможность значительных биологических действий. Ионные каналы Kv семейства широко распространены в классически раздражимых и нераздражимых клетках (всеобъемлющий обзор можно найти в [Gutman et al., 2005]). В нейронах, скелетных клетках и клетках сердечной мышцы эти каналы являются критическими эпитопами электрической возбудимости. Они участвуют в поддержании остаточного потенциала мембраны, формировании потенциалов действия за счет воздействия на скорость реполяризации и определяют спайк частотный и нейронный после гиперполяризации (всеобъемлющий обзор можно найти в [Gutman et al., 2005]). Ионные каналы, экспрессируемые в центральной нервной системе, более защищены от систематически применяемых токсинов благодаря гематоэнцефалическому барьеру, однако при рассеянном склерозе, который является зоной приложения потенциала Kv1.3 ингибиторов, этот барьер нарушается, что ведет к невральной токсичности у животных моделей с MS [Beeton et al., 2005]. Вследствие прямого контакта клеток с кровотоком кардиомиоциты более чувствительны к побочному эффекту потенциала неселективного Kv1.3 ингибитора. У человека в предсердных миоцитах Kv1.5 [Feng et al., 1997] и в желудочковых миоцитах Kv1.4 [Pateland Campbell, 2005] и hERG (рассмотрены в [Sanguinetti and Tristani-Firouzi, 2006]) каналы определяют критически фазу реполяризации потенциала действия, тогда как Nav1-5 отвечает за фазу деполяризации[Rogart et al., 1989]. BK Ca2+-активируемые K каналы повсеместно распространены в человеческом теле(мозг, скелетные мышцы, гладкие мышцы, клетки панкреатического островка и т.д. (рассмотрены в [Weiet al., 2005] и регулируют ряд физиологических функций, включая электрическую возбудимость нейронов и клеток скелетных мышц и Ca переходные процессы в гладких мышцах. BK каналы блокируются токсинами в -KTxl.x семействе (например, харибдотоксин [Miller et al., 1985]). Наличие рентгеновской кристаллографической структуры бактериального [Doyle et al., 1998] и человеческого потенциалозависимого K канала [Long et al., 2005] значительно расширило понимание молекулярной основы -KTx специфичности для разных ионных каналов за последнее десятилетие [Giangiacomo et al., 2004], однако в настоящее время прогнозирование в отношении селективности, профиля данного токсина пептида, основанное на его первичной структуре, не возможно. Это доказывает экспериментальное определение селективности Vm24 по отношению к ионным каналам, имеющим биологическое значение и известную восприимчивость для блокирования животными токсинами. Прогресс молекулярной биологии и имитации генов ионного канала обеспечивает возможность проведения фармакологических исследований на рекомбинантных ионных каналах. Экспрессия рекомбинантных каналов в соответствующих клеточных линиях дает некоторые преимущества для фармакологических экспериментов, например величина нежелательных токов пренебрежимо мала, а амплитуда токов пригодна для фармакологических испытаний. Кроме того, экспрессированные рекомбинантные каналы сохраняют фармакологические характеристики каналов, экспрессированных в нативных клетках. Фармацевтические составы. Изобретение предусматривает фармацевтические составы, включающие пептиды по настоящему изобретению. Как уже упоминалось, эти пептиды пригодны для подавления иммунной реакции у млекопитающих, когда определенная субпопуляция T-клеток активизируется. В частности, фармацевтические составы, включающие пептиды по настоящему изобретению, пригодны для лечения или предупреждения состояния, при котором иммунная реакция является результатом отторжения гетерологического органа(например, сердце, легкое, печень, почка или поджелудочная железа) или результатом аутоиммунной болезни, связанной с лимфоцитами ТЕМ. Согласно предпочтительной особенности изобретения фармацевтические составы включают пептиды по настоящему изобретению или их фармацевтически приемлемую соль, а также фармацевтически приемлемый носитель. Предпочтительная форма этих фармацевтических составов и выбор фармацевтически приемлемого носителя зависят от предполагаемого способа введения и терапевтического применения. Фармацевтические составы включают (в зависимости от требуемой рецептуры) фармацевтически приемлемые, неядовитые носители или разбавители, которые определяются как наполнители, используемые обычно для приготовления фармацевтических составов для введения животным или людям. Дополнительно и опционно фармацевтические составы могут также включать не менее одного дополнительного иммунодепрессивного препарата, который может иметь дополнительный эффект при лечении. В качестве некоторых иллюстративных иммунодепрессивных препаратов можно привести циклоспорин,рапамицин, имуран, преднизон, ShK токсин, производные ShK и деоксиспергуалин, их производные или соль этих препаратов. Фармацевтические составы по настоящему изобретению могут вводиться согласно описанию, приведенному ниже. Терапевтические и профилактические способы. В изобретении предлагаются способы терапевтического или профилактического лечения состояний, при которых у млекопитающих необходимо подавить иммунную реакцию, особенно когда у субъектов, которым необходимо такое лечение, активированы T-клетки и когда указанные состояния включают отторжение гетерологического органа (например, сердце, легкое, печень, почка или поджелудочная железа) или аутоиммунные болезни (например, рассеянный склероз, ревматический артрит, диабет типа 1 ,аутоиммунный псориаз, красная волчанка, язвенный колит, симпатическая офтальмия и периодонтальная болезнь резорбции кости). В число таких субъектов могут входить люди и другие млекопитающие, такие как собаки, коты, козлы, коровы, лошади, свиньи, овцы, упомянуты не все. В одной особенности настоящего изобретения предлагаются способы для профилактического или терапевтического лечения состояний, поддающихся лечению ингибированием, чувствительных к ингибированию или сензитивных к ингибированию Kv1.3 калиевых каналов в клеточных мембранах T-клеток у субъектов, нуждающихся в таком лечении. Эти способы включают введение субъекту, нуждающемуся в этом, включая человека,эффективного количества пептида по настоящему изобретению согласно описанию, приведенному выше. Как правило, этот пептид может включать пептиды Vm24 с SEQ ID NO:1, Vm23 с SEQ ID NO:2 или пептид, имеющий последовательность SEQ ID NO: 3, или их функциональные эквивалентные аналоги или фармацевтически приемлемую соль. В предпочтительном осуществлении настоящего изобретения предлагаются способы, предназначенные, в частности, для лечения и предупреждения аутоиммунных болезней, связанных с T-клеточной активацией или чувствительных к ингибированию Kv1.3 калиевых каналов. Такие аутоиммунные болезни включают, но не ограничиваются, рассеянный склероз, ревматоидный артрит, диабет типа 1, аутоиммунный псориаз, красную волчанку, неспецифический язвенный колит, симпатическую офтальмию и периодонтальную болезнь резорбции кости. Эти способы включают введение субъекту, нуждающемуся в этом, включая человеческий субъект, эффективное количество пептида по настоящему изобретению, как описано выше. В другом предпочтительном осуществлении настоящего изобретения предлагаются способы, предназначенные, в частности, для лечения и предупреждения отторжения гетерологического органа (например, сердце, легкое, печень, почка или поджелудочная железа). Эти способы включают введение субъекту, нуждающемуся в этом (т.е. субъекту, которому предстоит или который перенес трансплантацию органа), включая человеческий субъект, эффективное количество пептида по настоящему изобретению, как описано выше. Дозировки и способы введения. В терапевтических целях пептид по изобретению можно вводить субъекту, уже страдающему болезнью или нежелательным состоянием (например, аутоиммунной болезнью или отторжением гетерологичного органа соответственно), в количестве, достаточном для лечения, исцеления, частичного подавления или очевидного замедления развития болезни и ее осложнений. Эффективное для терапевтических целей количество пептида по изобретению будет зависеть от серьезности состояния, общего состояния субъекта и пути введения. Эффективное количество пептида в терапевтических целях будет, как правило, в диапазоне от приблизительно 0,1 до приблизительно 10 мк/кг пептида (или его фармацевтически приемлемой соли) на дозу. В профилактических целях рассматриваемые пептиды или их фармацевтические составы вводятся субъектам с повышенным риском, но уже не страдающих болезнью или нежелательным состоянием. Эффективное количество вводимого пептида будет зависеть от состояния здоровья субъекта и общего статуса иммунной системы. Эффективное количество пептида в профилактических целях, как правило,будет в диапазоне приблизительно от 0,1 до приблизительно 10 мк/кг пептида на дозу. Путь доставки пептидов и фармацевтических составов по настоящему изобретению определяется болезнью или клиническими показаниями и участком, где требуется лечение. Для болезни определенного типа, лимитированного ограниченной областью тела, желательно введение пептида или его состава на локальном участке (местное применение). И наоборот, при развитии болезни или одновременно с местным применением может потребоваться введение пептида или состава системно. По другим показаниям пептиды и фармацевтические составы по изобретению могут доставляться с помощью внутривенной, внутрибрюшной, внутримышечной, подкожной, внутриносовой и внутрикожной инъекции, а также внутрибронхиальной инстилляцией (например, с помощью распылителя) и чресслизистой, системной, трансдермальной (например, с помощью жирорастворимого носителя в кожном пластыре), ротовой и желудочно-кишечной доставки (например, в виде капсулы или таблетки). Один или несколько пептидов по изобретению можно вводить в комбинированной терапии. Например, один или несколько рассматриваемых пептидов можно вводить в сочетании с другим иммунодепрессивным средством (таким как упомянутые выше) субъекту, нуждающемуся в таком лечении. Существуют некоторые идиопатические аутоиммунные болезни, такие как иммунная тромбоцитопеническая пурпура [Cooper and Bussel, 2006] или аутоиммунный лимфопролиферативный синдром [Oren et al.,2002], при лечении которых может потребоваться мультицелевой подход, поэтому необходимо не одно иммунодепрессивное вещество. Пептиды по изобретению можно вводить отдельно или в комбинации с фармацевтически приемлемым носителем, как описано выше в разделе "Фармацевтические составы". Пептиды можно вводить в одноразовой дозе или многократных дозах. В число пригодных фармацевтических носителей входят инертные твердые разбавители или наполнители, стерильные водные растворы и различные нетоксичные органические растворители. Фармацевтические составы, образованные соединением рассматриваемого пептида с фармацевтически приемлемым носителем, можно легко вводить в различных лекарственных формах, таких как таблетки, пастилки, сиропы, инъецируемые растворы и т.п. По желанию, фармацевти- 16020131 ческие носители могут содержать дополнительные ингредиенты, такие как ароматизирующие вещества,связывающие вещества, инертные наполнители и т.п. При пероральном введении таблетки, содержащие различные инертные наполнители, такие как натрий цитрат, кальций карбонат и фосфат кальция, можно применять вместе с различными разрыхлителями, такими как крахмал, предпочтительно картофельный крахмал или крахмал тапиоки, альгиновая кислота и некоторые комплексные силикаты, вместе со связующими веществами, такими как поливинилпирролидон, сахароза, желатин и акация. Смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк, также добавляют для таблетирования. Твердые составы сходного типа можно также использовать в качестве наполнителей в солевых и твердых желатиновых капсулах. Предпочтительные материалы для этой цели включают лактозу или молочный сахар и полиэтиленгликоли с высоким молекулярным весом. Когда для перорального приема требуются водные суспензии эликсиров, обязательный активный ингредиент пептида можно соединять с различными подслащивающими или придающими вкус агентами, красителями или красками и, по желанию, эмульгирующими или суспендирующими средствами, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их комбинации. Для парентерального введения можно использовать растворы пептидов по настоящему изобретению в сезамовом масле или арахисовом масле или в водном полипропиленгликоле, а также стерильные водные физиологические растворы соответствующих ранее описанных водорастворимых фармацевтически приемлемых солей металла. Такой водный раствор должен быть соответственно забуферен, при необходимости, а жидкий разбавитель сначала делают изотоническим достаточно соленым или глюкозным. Эти конкретные водные растворы особенно подходят для внутривенной, внутримышечной, подкожной и внутрибрюшинной инъекции. Используемую стерильную водную среду можно легко получить по стандартным методикам, известным специалистам в этой области. Кроме того, вышеуказанные составы можно вводить местно (например, через установленный катетер), используя соответствующий раствор, пригодный для конкретной цели.Vm23, Vm24 и функциональные эквивалентные аналоги в качестве молекулярных зондов. Помимо терапевтического применения пептидов по настоящему изобретению их можно использовать для детектирования и определения характеристик уровня экспрессии каналов Kv1.3 в самых разных клетках, полученных либо из тканей животных, либо из устойчивых культур. Значение определения характеристик экспрессии Kv1.3 в T-клетках уже освещалось в данном документе, поэтому изобретение также касается использования пептидов по настоящему изобретению в качестве молекулярных зондов для физиологической характеристики экспрессирующих Kv1.3 канал клеток. Детектирование и определение характеристик экспрессии Kv1.3 можно выполнять с помощью различных техник детектирования с использованием удобно меченых пептидов по настоящему изобретению, включая, но не ограничиваясь этим, цитометрию в потоке, конфокальную и традиционную флуоресцентную микроскопию, общую флуоресценцию, методики радиоактивного связывания и смещения и иммунологические "понижающие" анализы. Количественное определение каналов Kv1.3, экспрессированных в заданной клетке, можно выполнять с помощью количественных техник детектирования, включая, но не ограничиваясь этим, подсчет каналов с помощью конфокальной микроскопии лазерного сканирования, иммунологического детектирования золотом и методик радиоактивного связывания и смещения. Кроме того, модификации химической структуры полипептидной цепи или боковых цепей нескольких заменимых аминокислот могут обеспечить меченые функциональные эквивалентные аналоги, которые можно использовать для детекции и количественного анализа канала Kv1.3. В свою очередь, эти функциональные эквивалентные аналоги можно использовать в качестве молекулярных зондов для поиска специфических лигандов при условии, что эти новые лиганды находятся в том же центре связывания на Kv1.3, что и Vm23, Vm24 и их функциональные эквивалентные аналоги. После любой такой химической модификации должны остаться немодифицированными структурные эпитопы Vm23, Vm24 и их функциональных эквивалентных аналогов, которые передают им высокую аффинность и специфичность по отношению к Kv1.3. Химическая модификация полипептидных цепей - это общая процедура получения пригодных молекулярных зондов; специалисты в данной области могут добиться такой модификации с помощью различных широко применяемых способов и использовать ее систематически. Метка, которую обеспечивает модификация, может включать, но не ограничиваться, радиоактивный изотоп, флуоресцентные, хемилюминесцентные или хромогенные агенты и сшивание или слияние с мечеными белками (антитела, биотин, зеленый флуоресцентный белок или его производные соединения). В следующих примерах подробно описано, как были выделены, очищены и химически охарактеризованы эти новые пептиды по настоящему изобретению. Описан синтез типового пептида, Vm24, а также детально представлены два типовых пептида по настоящему изобретению (Vm23 и Vm24) на Kv1.3 каналах человеческих Т-лимфоцитов. Наконец, также дано описание защитного действия Vm24 при низкой концентрации при анализе in vivo для реакции гиперчувствительности замедленного типа у крыс. Примеры Нижеследующие примеры приводятся для демонстрации типичных предпочтительных осуществлений изобретения. Специалисты в данной области могут внести целый ряд изменений в конкретные осуществления изложенных примеров и получить такой же или подобный результат, не отступая от сущности и объема настоящего изобретения. Если конечные продукты включают последовательности, представленные в данном документе (SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3), или их функциональные эквивалентные аналоги, они обязательно должны давать такие же результаты, как и описанные в данном документе, и, таким образом, предполагается хорошо действовать при практическом осуществлении заявленного изобретения. Пример 1. Выделение, испытание на летальность у мышей и определение первичной структурыVm23 и Vm24. Все использованные растворители и химические вещества были химически чистые, и на протяжении всех исследований использовался дистиллят двойной перегонки, как описано ранее [Batista et al.,2007]. Методика выделения. В методиках, которые использовались для выделения различных природных лигандов, которые упоминаются выше, использованы хроматографические способы. Яд растворили в воде и центрифугировали при 10000g в течение 5 мин. Супернатант восстановили и выделили с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). 100 мкл с содержанием 1,0 мг растворимого белка яда загрузили в аналитическую С 18 колонку с обращенной фазой (размеры 10250 мм, каталожный номер 238 ТР),от Vydac (Гисперия, шт. Калифорния, США), системы ВЭЖХ (Millenium Millipore, Милфорд, шт. Массачусетс). Компоненты очистили с применением линейного градиента от раствора А (0,12% трифторуксусная кислота -TFA в воде) до 60% раствора В (0,10% TFA в ацетонитриле), прогнали в течение 60 мин. Детекцию контролировали поглощением при 230 нм и элюировали при расходе 1 мл/мин. Фракции собрали вручную и высушили в сушилке Savant Speed-Vac. Как показано на фиг. 1, после такого ВЭЖХ разделения было собрано более 80 отдельных фракций. Фракции, которые элюируют в периоды удержания от 20 до 35 мин, обычно соответствуют времени элюирования большинства специфических токсинов скорпиона K канала других изученных ядов скорпиона [Batista et al., 2007]. По этой причине особое внимание было уделено компонентам яда, элюирующим за те же периоды времени. В частности, затем были проанализированы две фракции: одна, элюируюшаяся за 23 мин, а другая за 24 мин, потому что массспектрометрическое определение пептидов по этим периодам элюирования было тесно связано со значениями, установленными для других специфических токсинов K канала, т.е. их молекулярные массы составили приблизительно 4000 Да. Поскольку эти компоненты все еще были не гомогенны, провели второе хроматографическое разделение с использованием такой же ВЭЖХ системы, но элюировали с другим градиентом (растворитель А до 40% растворителя В в течение 60 мин с помощью колонки С 18 (каталожный номер 218 ТР 54 от Vydac, Гисперия, шт. Калифорния. Как показано на вставках фиг. 1, из каждой из этих начальных фракций (отмеченные звездочкой) был выделен основной компонент. Вставка с левой стороны соответствует фракции, элюирующей за 23 мин, а правая вставка соответствует фракции, элюирующей за 24 мин. При анализе масс-спектрометрическим определением и секвенированием с помощью автоматического расщепления по Эдману было установлено, что оба пептида гомогенны. Сначала в экспериментальных условиях было проанализировано одно элюирование в течение 24 мин. Оно было чистым и показало молекулярную массу 3864 атомных единиц массы (a.m.u). В этом документе для определения одной единицы молекулярной массы будем использовать поочередно a.m.u. или Да. Поэтому пептид получил название Vm24, обозначающий пептид яда V.mexicanus, который элюировал за 24 мин в экспериментальных условиях. Хроматограмма, показанная на вставке с левой стороны (фиг. 1),соответствует выделению пептида, названного Vm23. Он обозначает пептид яда V.mexicanus, который элюировал за 23 мин. Как было определено, экспериментальная молекулярная масса для этого компонента составила 3665 Да. Определение in vivo токсичности полного яда V.mexicanus и испытания на летальность очищенныхVm23 и Vm24. Действие ядов и чистых пептидов обычно демонстрируется в лаборатории как минимум на трех биологических моделях: млекопитающие, сверчки и ракообразные, так как известно, что яд скорпиона содержит специфичную разновидность токсинов. Существуют токсины, специфические для млекопитающих или для различных типов членистоногих (рассмотрены в [Possani et al., 1999]). В целях настоящего изобретения авторы провели эксперименты, взяв в качестве животной модели мышей, потому что результаты должны были стать достоверным показателем того, что могло случиться с людьми при контакте с ядом или очищенными токсинами. У мышей, которым инъецировали различное количество растворимого яда V.mexicanus (от 50 до 200 мкг белка на мышь с весом тела 20 г), симптомов интоксикации не было. Обычно, если яд содержит токсины с таким количеством продукта, должны быть явные симптомы интоксикации, такие как возбудимость, слюноотделение, расстройство дыхания (одышка), паралич задних конечностей, диарея, судороги или даже смерть [Possani et al., 1985]. Пептид считается "ток- 18020131 сичным", если у инъецированного животного проявляется любой из описанных выше симптомов, но выздоровление наступает в течение 24 ч после введения пептида, тогда как, если мышь погибает, он называется "летальным". Нетоксичные компоненты - это те компоненты, которые не вызывают симптомов интоксикации, а вызывают такое же поведение, что и у мышей, которым инъецировали PBSфизиологический раствор, рН 7,2 [Possani et al., 1985]. В конечном счете, цельный яд при относительно низкой дозировке не токсичен, но очищенные пептиды в таких же дозах могут вызвать симптомы интоксикации, потому что во время очистки образец обогащается этим конкретным компонентом. По этой причине и принимая в расчет, что растворимый яд V.mexicanus не был токсичным при дозе 200 мкг/мышь весом 20 г, чистый пептид Vm24 вводили мышам в разных концентрациях. Самая высокая использованная доза составила 200 мкг/20 г, т.е. 10000 мг/кг веса мыши, при этом никаких симптомов интоксикации не наблюдалось. Это, конечно, по сравнению с летальными компонентами, такими как токсин Cn2 очищенный, полученный из яда другого мексиканского скорпиона Centruroides noxius. 50%-ная летальная доза (LD50,означающая дозу, которая вызывает 50%-ную летальность в группе испытываемых животных), для Cn2 у мышей составляет 0,25 мкг/мышь весом 20 г [Zamudio et al., 1992]. Это означает, что Vm24 при концентрации белка в 800 раз выше не токсичен для мышей, тогда как Cn2 убивает половину популяции. Анализ аминокислотной последовательности Vm23 и Vm24. Использовали две методики: автоматическое расщепление по Эдману и масс-спектрометрический(MS) анализ. Был выполнен прямой способ определения аминокислотной последовательности чистого токсина с использованием Beckman LF 3000 Protein Sequencer (Пало Альто, Калифорния, США) с помощью химических веществ и процедур, предоставленных этой компанией. Редуцированный и алкилированный образец чистого пептида был ферментативно расщеплен Arg-C эндопептидазой (RocheDiagnostics, Базель, Швейцария) с помощью таких же процедур, какие были ранее описаны для других компонентов скорпиона [Valdez et al., 2004; Batista et al., 2007; Diego-Garcia et al., 2007]. Соответствующие пептиды были очищены с помощью ВЭЖХ и секвенированы. Для масс-спектрометрии образцы непосредственно ввели в ионную масс-спектрометрическую ловушку Finnigan LCQDUO (Сан-Хосе, шт. Калифорния) с помощью системы доставки со шприцевым насосом Surveyor MS. Элюат был расщеплен со скоростью 10 мкл/мин, чтобы обеспечить поступление только 5% образца в наноспрейный источник (0,5 мкл/мин). Напряжение распыляемого раствора было задано равным 1,7 кВ, а капиллярная температура 130 С. Для экспериментов MS/MS источник фрагментации работал при 25 В энергии столкновения, 3545% (произвольно выбранные единицы) нормализованной энергии столкновения и скане с активированной широкой полосой. Все спектры были получены в режиме положительного иона. Сбор информации и деконволюция данных выполнялись при помощи программы Xcalibur в системе программирования Windows NT. Спектры MS/MS от ферментативно полученных пептидов были проанализированы вручную и при помощи программы Sequest [Batista et al., 2007]. Были определены первичные структуры обоих пептидов Vm23 и Vm24 (см. фиг. 2), пептиды использовали для электрофизиологических экспериментов согласно описанию, приведенному ниже (см. прилагаемые примеры 7-10 настоящего изобретения). Была дана полная характеристика нативного пептида, вторично очищенного от фракции, элюирующей за 23 мин (см. левую вставку на фиг. 1). Было установлено, что его экспериментальная молекулярная масса составила 3665 Да. 1 нмоль этого пептида загрузили в секвенатор, и первые 34 аминокислоты были непосредственно идентифицированы расщеплением по Эдману (подчеркнутая прямая). Остатки цистеина были подтверждены редукцией и алкилированием при помощи методологии, предоставленной компанией Beckman. Последний остаток Vm23 в позиции 35 был определен масс-спектрометрией. Ожидаемая теоретическая средняя молекулярная масса,основанная на вычисленной последовательности, составила 3665,51 Да, что подтверждает тем самым однозначное определение всей последовательности. И экспериментально вычисленная, и ожидаемая теоретическая молекулярные массы были одинаковые, в пределах погрешности использованного прибора(Finnigan ионная масс-спектрометрическая ловушка LCQDUO). Аналогично, 1 нмоль гомогенного пептида Vm24 (вторично очищенного, как показано на вставке справа фиг. 1) подвергли автоматическому расщеплению по Эдману, что позволило идентифицировать первые 28 аминокислотных остатков (фиг. 2, меченый Vm24). Анализ, проведенный с разными аликвотными пробами редуцированного и алкилированного пептида, использовали для подтверждения остатков цистеина и для расщепления эндопептидазами. В результате расщепления пептида Vm24 ArgCэндопептазой получили три подпептида: один, подтвердивший последовательность от остатков Alal доArg17 (на фигуре не обозначен, потому что он включает такую же N-концевую последовательность, которая уже была определена при анализе нативного пептида - подчеркнутая "прямая"); другой - от Ala18 до Arg29, обозначенный подчеркнутым "Arg-Cl", и последний - от Lys30 до Cys36 (подчеркнутыйArg-C2). Эти последовательности были получены расщеплением по Эдману в комбинации с MS/MS фрагментацией (см. фиг. 2, Vm24). Так как последние остатки были идентифицированы с помощью CID(индуцированная столкновениями фрагментация), аминокислотами в позициях 30 и 32 могли быть либо лизин, либо глутамин (с теми же молекулярными массами). Чтобы разрешить неопределенность, провели дополнительное ферментативное расщепление этого последнего подпептида трипсином. С помощью ВЭЖХ были выделены три малых пептида, у которых аминокислотные последовательности, определенные при помощи CID, были идентифицированы от позиций Cys26 до Lys30 (подчеркнутый Trp1), Cys26 до Lys32 (не обозначен, для упрощения системы обозначений) и Cys33 до Cys36 (также не обозначен). Так как трипсин расщепляет пептидные связи на С-конце лизинов, эти две позиции были определены как остатки лизина, что однозначно решает полную последовательность. Последние четыре аминокислоты на самом большом С-конце были также идентифицированы MS/MS фрагментацией пептида, выделенного после гидролиза Lys-C эндопротеазой (подчеркнутый Lys-C). Теоретическая средняя молекулярная масса ожидаемого пептида при условии амидированной С-концевой аминокислоты составила 3863,64 Да,а полученное экспериментально значение равнялось 3864,0 Да, что подтверждает полную последовательность. Поскольку точность трехмерных ионных ловушек лежит в диапазоне 100 млн-1 для пептидов меньше 1000 Да, небольшая разница 0,36 единиц находится в пределах ожидаемого значения (ссылку на точность оборудования можно найти в [Aebersold and Goodlett, 2001]). В отношении настоящего изобретения важно выделить пять характеристик Vm23 и Vm24: 1) Их первичные структуры в сравнении со всеми другими токсинами скорпиона, известными к настоящему времени, отличаются более чем на 50% (см. пример 6 ниже). Этот факт объясняет существование нового подсемейства (неизвестного до настоящего времени), которое предложено в данном описании под номером -KTx21; примеры -KTx21.1 и -KTx21.2. Это - первое раскрытие сущности изобретения,окончательно демонстрирующее, что оба пептида структурно отличаются от всех других подобных лигандов, включая лиганды из пептидов ядов морской анемоны, пчел и змеи. 2) N-концевые сегменты обеих последовательностей вплоть до аминокислоты в позиции 10 идентичны, а 7 из 8 позиций цистеинов, которые поддерживают дисульфидные связи, находятся в одинаковых локализациях первичной структуры. Восьмой цистеин (С 8) Vm23 расположен в позиции 35, в экстремуме С-концевой стороны, одна аминокислота, которая раньше сравнивалась с Vm24. По этой причине Vm24 имеет 36 остатков, тогда как Vm23 имеет 35 аминокислотных остатков. Последний цистеинVm23 не амидированный, однако авторы изобретения предполагают, что структурное сворачивание такое же, как и для Vm24. Так как физиологические действия и Vm23, и Vm24 сопоставимы, предполагается, что для активности аминокислотная последовательность в N-концевой зоне решающая. При сравнении первичных структур Vm23 и Vm24 было установлено пять отличий в позициях: 10, 13, 17, 23 и 29, и одна делеция между последней аминокислотой и предыдущей (Y34 в Vm23 и Y35 в Vm24). Наиболее вариабельная область находится в центральной части обоих пептидов (остатки 10-30, в которых локализованы пять отличий из шести), и предполагается, что, возможно, эти остатки не настолько критичны для функции любого из пептидов. Следует упомянуть, что подстановки в позиции 17 (R/K), 23 (N/S) и 29(R/K) - это консервативные модификации, потому что и аргинин (R), и лизин (K) - это полные основные аминокислоты, тогда как аспарагины (N) и серии (S) - неполные гидрофильные аминокислотные остатки. Отсутствие тирозина в позиции 35 (замещенный на цистеин в Vm23) по сравнению с Vm24 предполагает, что достаточно только одного тирозина для одинакового сворачивания и функции обоих пептидов. 3) Наиболее вариабельная область, таким образом, расположена в центральной части, обеспечивая возможность консервативных замещений. Любой специалист в данной области может легко рассчитать ее, а модификации или замещения аминокислотой со сходными физико-химическими свойствами в выровненных позициях, которая имеет как минимум 83% попарную идентичность последовательностей(как показано в данном описании для случая с Vm23 и Vm24), создают, по предположению, функциональный эквивалентный аналог со сходными свойствами, и, таким образом, находятся в объеме настоящего изобретения. 4) Но самая важная особенность, как показано и описано в примерах 7-10 ниже, - это высокая аффинность, которой обладают и Vm23, и Vm24 по отношению к hKv1.3 каналам при сравнении с другими подтипами калиевых каналов. Vm23 и Vm24 имеют более высокую аффинность по отношению к hKv1.3,чем другие известные блокаторы, такие как Харибдотоксин, Anuroc токсин, BgK, ShK и т.д. [Panyi et al.,2006]. Другие упомянутые выше блокаторы имеют существенно отличающиеся аминоксилотные последовательности и/или дисульфидные конъюгации, или отображают другую специфичность действия и аффинность связывания по отношению к Kv1.3 каналам. Из простого анализа первичных структур Vm23 и Vm24 не очевидно, что они должны воздействовать на Kv1.3 каналы одинаково, как они демонстрируют для других токсинов скорпиона или морской анемоны. Таким образом, последовательности, по которым в данном документе выдвигается притязание на информацию о праве собственности и использование относительно Vm23 и Vm24, не могут быть очевидными из знаний о других пептидах, воздействующих на каналы Kv1.3. В настоящем изобретении приводится описание совершенон отличающихся и новых аминокислотных последовательностей (см. SEQ ID NO: 1 и SEQ ID NO:2). Следующее доказательство, демонстрирующее, что вычисленная последовательность правильная, исходит из результатов, полученных на искусственно приготовленном Vm24. Как нативный Vm24, так и искусственно приготовленный имеют одинаковое физиологическое действие, как показано ниже (пример 9). 5) Наконец, другой важный факт, установленный с помощью этих 2 пептидов, - то, что они не токсичны при инъецировании экспериментальным животным при относительно высокой концентрации (до 10000 мкг/мышь весом 20 г). Это гораздо существеннее при сравнении с другими известными токсинами яда скорпиона, например, Cn2 из Centruroides noxius, как упоминалось ранее [Zamudio et al., 1992]. Cn2,инъецированный мышам при дозировке приблизительно в 800 раз меньше, чем Vm24, вызывает 50%ную летальность. Пример 2. Массовый анализ методом отпечатков пальцев компонентов, присутствующих в ядеV.mexicanus. Яды скорпиона - очень сложные смеси компонентов, включая короткоцепочечные и длинноцепочечные пептиды, активные на ионных каналах (рассмотрены в [Possani and Rodriguez de la Vega, 2006]),свободные амины, нуклеотиды, углеводы, липиды (рассмотрены в Possani et al., 1999), такие ферменты,как фосфолипазы [Zamudio et al., 1997: Valdez et al., 2004], гиалуронидазы и лизозимы [Batista et al., 2007] и многие другие белковые компоненты неизвестной функции [Diego-Garcia et al., 2007]. Кроме того,скорпионы - очень древние существа с эволюционным периодом на поверхности Земли более трехсот миллионов лет, и у них было время, чтобы найти особые средства для охоты за своей добычей или для защиты от хищников. Поэтому вполне разумно и мудро заняться поиском наличия биологически активных компонентов в их ядах. Благодаря последним достижениям в области методик и оборудования массспектрометрии, сейчас можно проводить массовый анализ методом отпечатков пальцев цельного яда. Поэтому одно из первых исследований, проведенных с растворимым ядом V.mexicanus, было исследование по определению молекулярных масс всех компонентов, которые могут быть идентифицированы с помощью ионной масс-спектрометрической ловушки Finnigan 5 LCQDUO (Сан-Хосе, шт. Калифорния)(EIS/MS) и прибора времяпролетной ионизации лазерной десорбцией с использованием матрицы(MALDI-TOF), модель Ettan MALDI-TOF/Pro компании Amersham Biosciences (Упсала, Швеция). Примененная стратегия заключалась в том, чтобы предварительно выбрать с помощью ВЭЖХ разделения чистые пептиды или семейства связанных компонентов, элюирующих как смеси в С 18 колонке с обращенной фазой (фиг. 1), и затем проанализировать их молекулярную массу масс-спектрометрией. В табл. 1 указано время удерживания фракций, собранных из ВЭЖХ системы с указанными после него молекулярными массами компонентов, обнаруженных в каждой фракции. Было определено свыше 340 отличающихся компонентов молекулярной массы. Следует упомянуть, что некоторые компоненты появляются в 2 смежных подфракциях ВЭЖХ системы разделения, и в таких случаях считали только один. Кроме того, некоторые фракции не были идентифицированы (отмечены ND). Компоненты, отмеченные жирным шрифтом, означают, что они присутствовали в более высокой концентрации в яде, тогда как отмеченные курсивом означают, что компонент был идентифицирован только на EIS/MS спектрометре. Если перед временем удержания стоит буква S, это значит, что хроматографический пик не был симметричным, и собранная фракция соответствует восходящему сегменту кривой, тогда как если стоит буква В, она означает нисходящий сегмент кривой. Курсивные цифры означают, что соответствующая молекулярная масса была получена только с помощью EIS/MS. Некоторые значения не были определены (ND). Различные компоненты, внесенные в табл. 1, были проанализированы и произвольно сгруппированы по молекулярному весу с приращениями 1000, начиная с компонентов менее 500 Да, затем от 500-1000, 1000-2000 и т.д. до 9000-10000 Да (с разницей 1000 в каждой группе). Более 90% идентифицированных компонентов имеют молекулярные массы меньше 10000 Да молекулярного веса. Три группы имели как минимум 60 разных компонентов. Они попадают в диапазон 1000-2000; 2000-3000 и 3000-4000 Да. Более чем у 40 компонентов молекулярная масса составила 4000-5000 Да. Эти результаты были важны при выборе соответствующих пептидов для функционального анализа. Использованные доводы описаны и опубликованы в последней работе нашей группы на примере скорпиона Tityus stigmurus [Batista et al., 2007], в которой сравнительный анализ проводился с учетом различных массовых анализов методом отпечатков пальцев разных видов скорпионов (не включаяV.mexicanus). Принято считать, что пептиды с молекулярным весом порядка 4000 Да специфичны к распознаванию ионных каналов, проницаемых к K+ ионам. По этой причине для физиологических исследований, описанных ниже, были выбрали пептиды в этом диапазоне молекулярной массы. В соответствии с этой стратегией два пептида: Vm23 и Vm24 были отобраны для определения первичной структуры(фиг. 2) и следующих физиологических анализов (см. примеры 7-10). Пример 3. Определение характеристик С-концевой аминокислотной последовательности Vm23 иVm24. Относительно последнего остатка на С-концевой аминокислотной последовательности пептидаVm23 результаты очевидны. Секвенирование, описанное в примере 1 данного описания, последовательность которого показана на фиг. 2, оставляет небольшое сомнение, что последний остаток не амидирован и заканчивает первичную структуру свободным карбоксильным цистеиновым остатком. Однако в отношении Vm24 по результатам масс-спектрометрии С-концевой остаток может быть амидирован. В литературе есть примеры, в которых амидирование последней аминокислоты данного пептида важно для определения его биологической функции. Один такой пример - это случай, установленный для токсина HsTxl скорпиона Heterometrus spinnifer [Lebrun et al., 1997]. Электрофизиологические эксперименты продемонстрировали, что амидированная форма этого токсина в 5 раз более мощная,чем свободная-карбоксильная-концевая форма, и до 300 раз более активная в экспериментах связывания на синаптосомах мозга крыс [Lebrun et al., 1997]. Поэтому было очень важно убедиться в химической форме последнего остатка Vm24. Как упоминается в описании примера 1, экспериментальная молекулярная масса, полученная для Vm24, составила 3864 Да, а теоретический молекулярный вес, предполагаемый на основании аминокислотной последовательности, показанной на фиг. 2, составил 3864,6 Да. Две величины отличаются на 0,6 a.m.u, что можно было бы отнести на счет наличия амидированного С-концевого остатка Vm24. Эксперименты по индуцированной столкновениями диссоциации (CID), проведенные с С-концевым пептидом (909,4 a.m.u. - моноизотопная масса), полученным Arg-C расщеплением, показывают все значения у ионного ряда на 1.0 a.m.u. ниже теоретически ожидаемых для свободного карбоксильно-концевого пептида и точные значения для b ионного ряда, подтверждая, что С-концевой токсин амидирован (фиг. 3). Для этого эксперимента аликвоту из 25 мкг белка пептида Vm24 ферментативно расщепили ферментом Arg-C согласно процедуре, описанной в примере 1 [Valdez et al., 2004; Batista et al., 2007]. Продукт ферментативного гидролиза разделили с помощью ВЭЖХ в такой же системе, которая представлена на фиг. 1. Все пептиды с гомогенной формой были систематически проанализированы с помощью MS и пептид с молекулярной массой 909,5 a.m.u. подвергли MS/MS анализу. По протоколу эксперимента, заданному для источника наноионизации распылением масс-спектрометра, установлено 130C для нагревающего капилляра и 1,65 кВ в качестве напряжения распыляемого раствора. Система доставки растворителя с дозиметром работала с расходом 0,6 мкл/мин 50%-ного ацетонитрила (AcCN) в линейном режиме. MS/MS сканы определили при 200 сканах/мс времени впрыска, активированной полосе частот,энергии столкновений 25 В, ширине выделения 1,0 (m/z) и 40% нормализованной энергии столкновений. Данные были проанализированы вручную и автоматически с помощью инструментария MS-product Protein Prospector (http://prospector.ucsf.edu/), разработанного Калифорнийским Университетом - San Francisco Mass Spectrometry Facility. Инструментарий MS-product позволил определить возможные ионные фрагменты, полученные для пептида KCKCYYC, используя моноизотопную массу, немодифицированные цистеины и неблокированный N-концевой остаток. Расчет выполнялся как для свободного конца карбоновой кислоты, так и для амидированного С-концевого пептида. Для этой оценки был выбран прибор Ионная Ловушка ESI. Теоретическая фрагментация амидированного С-концевого пептида выполнялась с помощью Protein Prospector, который показал точно такие же значения для полученных экспери- 24020131 ментально для b (232,11; 360,21; 463,22; 626,28 и 789,34) и для у ионов (782,27; 679,26; 551,16; 448,15; 285,09 и 122,03). Следовательно, пептид Vm24 обладает амидированным С-концом, т.е. цистеинамидным остатком. Пример 4. Определение дисульфидных связей Vm24. Благодаря своему небольшому размеру Vm24 токсин - идеальная молекула для изучения соотношений структура-функция. Пептид содержит восемь цистеиновых остатков, расположенных в позициях 6,12, 16, 21, 26, 31, 33 и 36, которые образуют четыре внутримолекулярные дисульфидные связи. В этом примере приводится определение модели дисульфидной связи Vm24 с использованием расщепления по Эдману и масс-спектрометрическое определение пептидов, очищенных RP-ВЭЖХ колонками, после дробления протеолитическими ферментами. Дисульфидная конъюгация была определена масс-спектрометрическим анализом фрагментов пептида, полученных после дробления эндопептидазой чистого токсина и их разделения с помощью ВЭЖХ. Образец токсина, содержащий 25 мкг белка, инкубировали равной смесью (0,5 мкг каждый) химотрипсина и трипсина (Boehring Manheim, Германия) в 150 мМ Tris-HCl, pH 6,8, в течение 12 ч при 37 С. Полученные пептиды выделили с помощью ВЭЖХ, используя С 18 колонку с обращенной фазой (каталожный номер 218 ТР 54, от Vydac, Гисперия, шт. Калифорния). K колонке использовали линейный градиент от растворителя А (0,12% TFA в воде) до 60%-ного растворителя В (0,10% TFA в ацетонитриле), операция выполнялась в течение 60 мин. Максимальные выбросы элюата собрали и сразу подвергли сублимационной сушке. Отдельные пептиды проанализировали масс-спектрометрической фрагментацией(MS/MS), в результате которой была получена аминокислотная последовательность. Поскольку первичная структура была известна, можно было сделать выводы о назначении дисульфидных связей. Сравнение молекулярной массы редуцированных и окисленных форм Vm24 показывает разность ровно 8 a.m.u.; экспериментальная молекулярная масса, определенная для нативного пептида, составила 3864.0 a.m.u., а для полного редуцированного пептида - 3872 a.m.u., подтверждая, что все цистеины вовлечены в формирование дисульфидных связей. Три основных фрагмента пептида были получены при одновременном ферментативном гидролизе химотрипсина и трипсина при рН 6.8 (слабокислотный рН,чтобы предотвратить реаранжировки смешанных дисульфидов), показывая моноизотопные молекулярные массы [М+Н]+ 788,0, [М+Н]+ 560,4 и [М+2 Н]2+ 1099,7 a.m.u. (фиг. 4-1, 4-2 и 5 А). Пептид с [М+Н]+ 788,0 соответствует точно ожидаемому молекулярному весу цистин-пар (С 4-С 8), аминокислотной последовательности гетеродимера AQGCK-CY (фиг. 4-1). Вторая определенная дисульфидная связь С 3-С 6,которая имеет равные теоретические и экспериментальные значения 560,4 a.m.u. (фиг. 4-2). Оба пептида были далее охарактеризованы с помощью CID экспериментов, демонстрирующих ожидаемые аминокислотные последовательности. Сигнал при m/z [M+2H]2+ 1099,7 a.m.u. (2197,4 масса после деконволюции) поступает из ядра гетеродимера, содержащего последние две цистиновые полупары (фиг. 5 А). Этот фрагмент был проанализирован напрямую. Ряд CID ионов от сигнала при m/z [M+2H]2+ 1099,7 показывает два ионных значения, которые удовлетворяют условию полного определения последних 2 цистиновых пар. Ион b при 1507,4 и у-ион при 691,3, которые являются продуктами одинаковой связи дробления амида между глутаминовой кислотой (Е 11) и цистеином (С 12), четко определяют полупары С 2-С 7 и С 1-С 5. Кроме того, значения фрагментации in tandem от 1710,5 b-иона до 1137,3 у-иона характеризуют внутреннюю метку (GSPEC-C) с однозначными значениями массы, подтверждающими аранжировку дисульфидной связи, схематично представленной на фиг. 5 В. Пример 5. Химический синтез Vm24. В этом примере, прежде чем приступить к описанию химического синтеза Vm24, важно рассмотреть некоторые основные концепции относительно химического состава пептида и логического обоснования получения лигандов химическим синтезом, а не естественной экстракцией существующих продуктов. Многие токсичные полипептиды были очищены из источников яда и проявили себя как ценный инструмент для изучения клеточной связи, потому что они воздействуют на ионное распределение через биологическую мембрану связыванием с рецепторами (главным образом ионные каналы для случая токсинов скорпиона), и они вызывают деполяризацию клетки или модуляцию электрических потенциалов через мембраны, тем самым контролируя клеточную функцию. По этим причинам обнаружение специфических токсических пептидов, которые могут опознавать разные типы или подтипы ионных каналов,играет очень важную терапевтическую роль в лечении целого ряда физиологических или атипичных состояний экспериментальных животных, и в конечном счете для лечения патологий человека. Большинство из известных пептидов короткие, хорошо свернутые и упакованные структуры, представляющие ряд преимуществ по сравнению с другими органическими соединениями, такими как высокая активность,хорошая целевая специфичность, высокая растворимость и быстрое начало действия. Кроме того, это часто бывают малые белки, поперечно сшитые несколькими дисульфидными связями. Такие структурные характеристики придают этим пептидам высокую степень стабильности, хотя правильное сворачивание искусственно приготовленного производного соединения ставит некоторые дополнительные проблемы для надлежащего синтеза. Однако количество этих полипептидов в источниках яда обычно довольно небольшое. Фактически, поскольку они такие специфические и эффективные по своим физиоло- 25020131 гическим действиям, нет необходимости для животного, которое производит эти пептиды, производить их в больших количествах для эффективного применения - для захвата своей добычи или для защиты от хищников. Несмотря на то что количества этих различных пептидов, непосредственно выделенных из источников, обычно достаточно, чтобы охарактеризовать общий механизм действия, и они позволяли, в прошлом, проводить структурную характеризацию пептида, главным образом с помощью технологий ядерного магнитного резонанса, обычно требуется искусственное получение подобного пептида или их производных соединений, в зависимости от объема, который ставится целью исследовательских или клинических применений. Определение трехмерной структуры пептидов и идентификация поверхности,вовлеченной в распознавание сторон рецептора (ионные каналы), фундаментальны для разработки модифицированных версий исходной модели или для синтеза пептидомиметиков. В данном документе представлено описание химического синтеза Vm24. Исторически Vm24 был идентифицирован раньше, чем Vm23. Поэтому большая часть этой детальной работы, предмета данного изобретения, была выполнена и описана здесь для случая Vm24, а затем ее справедливость подтверждена для обоих пептидов. Линейный аналог Vm24 был синтезирован в соответствии с твердофазной методологией на RinkCorp) использовали со следующей защитой в боковой цепи Arg(Pbf), Asn(Trt), Cys(Trt), Gln(Trt),Glu(OtBu), Lys(Boc), Ser(tBu) и Tyr(tBu). Группа Fmoc была удалена обработкой 20%-ным пиперидином в диметилформамиде (DMF) в течение 20 мин с последующим вымыванием с помощью DMF. Fmoc-аминокислоты (0,5 ммоль) были соединены как активные сложные эфиры, подготовленные в DMF с помощью HBTU (2-(l-Н-бензотриазол-1 ил)-1,1,3,3-тетраметил-уроний гексафторфосфат)/DIEA (диизопропилэтиламин) (0,45 ммоль/0,75 ммоль,активация 2 мин) в качестве активирующих агентов. Время связывания 30 мин. Непрореагировавшие или разблокированные свободные амины проверили нингидриновой реакцией (Sarin et al. 1981) в каждом цикле синтеза пептида. Во время полного синтеза, перед связыванием следующей аминокислоты, нежелательные остаточные свободные амины были блокированы ацетилированием. Все операции выполнялись вручную в стеклянном реакционном сосуде объемом 50 мл с навинчивающейся пробкой с тефлоновым покрытием. Пептид-смола взбалтывалась легким переворачиванием на этапах N-депротекции и связывания. После окончательного удаления Fmoc-группы пептидная смола (1,7 г) была гидролизована из смолы и одновременно были сняты защитные группы с помощью реагента K [Drakopoulou et al., 1995] в течение 2 ч при комнатной температуре. После расщепления сырой пептид отстоялся, его промыли ледяным t-бутиловым эфиром, затем растворили в 20%-ной водной уксусной кислоте. Продукт высушили сублимацией и хранили в высушенном виде при -20 С до использования. Реакция циклизации для создания соответствующих дисульфидных связей молекулы была выполнена в 0,1 М NaCl, 5 мМ редуцированном глутатионе, 0,5 мМ окисленном глутатионе, 20 мМ Na2HPO4(рН 7,8) и 30 мкМ развернутого синтетического Vm24. Сырой циклизованный продукт очистили в два этапа с помощью ВЭЖХ. На первом этапе, на котором использовали препаративную колонку C18(238TP1022 Vydac), с линейным градиентом раствора А (0,12% TFA в воде) до раствора В (0,1% TFA в ацетонитриле), достигли 60% В за 60 мин. Профиль полученной хроматограммы показан на фиг. 6. Основной компонент (обозначенный номером 1 на фиг. 6, был окончательно очищен с помощью аналитической колонки C18 (218TP54 Vydac), работавшей с линейным градиентом от растворителя А до 40% В,через 60 мин (вкладка фиг. 6). Структура и чистота синтетического токсина были подтверждены аналитической ВЭЖХ, определением аминокислотной последовательности и масс-спектрометрическим определением. Аминокислотная последовательность была выполнена в Beckman LF3000 Protein Sequencer(Фулертон, шт. Калифорния), а масс-спектрометрический анализ был проведен в спектрометреFinniganLCQDUO (Сан-Хосе, шт. Калифорния. США). Правильность аминокислотной последовательности была проверена прямым расщеплением по Эдману до остатка номер 30. Время элюции из колонки ВЭЖХ точно совпало со временем, когда нативный пептид элюирует из той же колонки в идентичных условиях. Примеры модели элюции, полученной с нативным Vm24 (фиг. 7 А), синтетическим Vm24, как представлено в данном описании (фиг. 7 В), и эквимолярной смеси нативного и синтетического Vm24(фиг. 7C) показаны на фиг. 7. Определенная масс-спектрометрией молекулярная масса составила 3864 Да, что показывает ее точное соответствие молекулярной массе ожидаемой последовательности. Следует отметить, что использованная смола разработана для получения С-концевого амидированного пептида,точно так же, как и в случае с Vm24. Из приблизительно 1,7 г смолы, содержащей искусственно приготовленный пептид с ожидаемой первичной последовательностью Vm24, было получено приблизительно 300 мг исправленного свернутого пептида, что представляет выход 30% от теоретического ожидаемого значения (от исходной смолы). Пример 6. Сравнение аминокислотной последовательности. Последовательности SEQ NO:1 и SEQ NO:2 демонстрируют некоторое подобие с другими короткоцепочечными токсинами скорпиона, классифицированными в рамках семейства -KTx [Tytgat et al.,- 26020131 1999], такими как цепь короткого пептида, обогащенного основными аминокислотными остатками, и со сходной цистеиновой моделью. Все представители этого семейства структурно связаны и выполняют такие же функции, как и блокаторы калиевого канала; тем не менее, они отображают переменную селективность для некоторых типов и подтипов калиевых каналов [Rodriguez de la Vega and Possani, 2004; Panyi et al., 2006]. Логическое обоснование, которому следовала международная экспертная группа, предложившая такую классификацию, заключалось в том, что данное подсемейство можно идентифицировать высоким процентом сходства между его представителями и низкой идентичностью с представителями других подсемейств [Tytgat et al., 1999]. Далее было продемонстрировано, что это различие отражало, до некоторой степени, фармакологический спектр большинства подсемейств [Rodriguez de la Vega etal., 2003; Zhu et al., 2004]. Следовательно, учитывая относительно ограниченную вариабельность семейства - вследствие его уменьшенного размера - важно идентифицировать молекулярные и структурные характеристики, которые сообщают заданный функциональный спектр. Этот вид анализа обычно выполняется путем сравнения последовательностей и филогенетического заключения. Лежащая в основе этих сравнений идея опирается на предположение, что белки, принадлежащие к одной и той же линии дифференцировки, должны быть связаны событиями видообразования, последовавшими за дупликацией и дивергенцией предкового гена(ов) или сопутствующими им, обеспечивая возможность реконструкции их эволюционной истории с помощью биоинформационных анализов и помогая очистить ландшафт пригодности в пределах заданного пространства последовательностей [Thornton and DeSalle, 2000; Orengoand Thornton, 2005]. С помощью программ, выполняющих эвристические исследования в пределах локальных выравниваний (BLAST [Altschul et al., 1990] и FASTA 3 [Pearson and Lipman, 1988]) для идентификации подобий последовательностей Vm24 и Vm23, определили несколько родственных форм с достаточно низкими ожидаемыми значениями (Е-величина)10-5). При более тщательном изучении по сравнению со всеми короткоцепочечными токсинами, о которых имеются сведения на настоящее время, выясняется, чтоVm24 и Vm23 - это вероятные новые члены -KTx подсемейства 6 (следуя предложению [Tytgat et al.,1999]). Попарное сравнение, однако, выявляет низкую идентичность с другими представителями подсемейства (фиг. 8). При большом разнообразии последовательностей -KTx семейства очень трудно решить, действительно ли Vm24 и Vm23 принадлежат или нет к какому-то из 20 ранее охарактеризованных-KTx подсемейств. Для объяснения взаимосвязи с -KTx семейством согласно приведенному ранее описанию был проведен байесовский анализ филогенетического заключения [Bagdany et al., 2005] с помощью MrBayes 3.04b [Huelsenbeck and Ronquist, 2001; Ronquist and Huelsenbeck, 2003], используя метод выравнивания кратных последовательностей для 92 последовательностей, принадлежащих к -KTx семейству. Байесовское филогенетическое заключение оценивает апостериорную вероятность данной древовидной топологии по методике выборочного исследования на основании цепи Маркова Монте-Карло(МСМС) на n-1 стохастически порожденных деревьях. Одна цепь Маркова сохраняет эвристический поиск в пределах древовидной топологии с лучшей апостериорной вероятностью при заданном шаге методики выборочного исследования; оцененном при соблюдении заданной модели замещения аминокислоты (весь процесс называется цепь Маркова Монте-Карло со связью Метрополиса или МС 3 - метод Монте-Карло). Для этого анализа создали четыре цепи с 250000 деревьями, каждая, по модели замещения аминокислоты JTT и отобрали образец из каждой 250-й итерации. Коалесценцию получили приблизительно на 175000 итерации, а оставшиеся 250 деревьев с лучшими апостериорными вероятностями были слиты для расчета 50% консенсусного древа мажоритарного правила. Это дерево четко показывает, что-KTx подсемейство 6 разделяется на 92% конечного древовидного набора как монофилетическая группа, включая все ее элементы и два близко связанных токсина из подсемейства 7. Анализ также определяет местоположение Vm24 и Vm23 как однотипной группы этого клада (конкретное разделение преобладает на 81% конечных деревьев, см. фиг. 8); что убедительно подтверждает, что Vm24 и Vm23 составляют новое -KTx подсемейство. На основании этих анализов и учитывая правила, предложенные международной экспертной группой, которые классифицировали токсины скорпиона, специфические к K каналам [Tytgat et al., 1999], несомненно, что Vm23 и Vm24 составляют новое подсемейство токсина скорпиона, которые опознают K каналы. Самая высокая идентичность последовательностей между этими токсинами расположена на С-концевом участке, подобно другим подсемействам блокаторов K канала. Сегмент N-конца - это наиболее вариабельная область этого подсемейства, и только Vm24 и Vm23 представляют редко встречающийся непрерывный тройной сегмент Аланина в начале последовательности. Пример 7. Vm24 селективно блокирует потенциалозависимый hKv1.3 канал по сравнению сCa2+-активированным K каналом hIKCa1 T-клеток. Высокоаффинное блокирование hKv1.3 каналов пептидом Vm24. Блокирование hKv1.3 каналов с помощью Vm24 было охарактеризовано в каналах, эндогенно экспрессированных в T-клетках периферической крови человека [Peter et al., 2001; Bagdany et al., 2005]. Ниже приводится краткое описание процедуры получения T-клеток для электрофизиологических экспериментов. У здоровых добровольцев взяли гепаринизированную периферическую венозную кровь. Мононуклеарные клетки разделили фиколл-гипак центрифугированием в градиенте плотности. Собранные- 27020131 клетки дважды промыли раствором Хэнкса без Ca2+ и Mg2+, содержащим 25 мМ HEPES буфера (рН 7,4). Клетки культивировали в термостате с 5% СО 2 при 37 С на 24-луночных культуральных планшетах вRPMI-1640 с добавлением 10% FCS/Hyclone, (Логан, шт. Юта, США), 100 мкг/мл пенициллина,100 мкг/мл стрептомицина и 2 мМ L-глутамида при плотности 0,5106 /мл в течение 3-4 дней. Культуральная среда также содержала 6 или 8 мкг/мл фитогемагглютинина А (РНА-Р, Sigma-Aldrich Kft, Венгрия) для усиления экспрессии K канала [Deutsch et al., 1986]. Отобрали Т-лимфоциты для регистрации тока инкубацией с помощью антител мыши против антител человека CD2 (Becton-Dickinson, Сан-Хосе,шт. Калифорния, США) с последующим избирательным прилипанием к чашкам Петри, покрытым антителами козла против антител мыши IgG (Biosource, Camarilo, шт. Калифорния, США), как описано Мэтсоном и Дойч (Matteson et al., 1984). Чашки осторожно вымыли пять раз в 1 мл нормального внеклеточного состава ванны (см. ниже) для экспериментов фиксации потенциала. Были измерены токи всей клетки в T-клетках с фиксацией потенциала с помощью усилителейAxopatch 200A или Multiclamp 700B, соединенных с персональными компьютерами аппаратными средствами сбора данных Axon Digidata 1200 или Digidata 1322 А. Для минимизации погрешностей напряжения и достижения хороших условий фиксации напряжения использовали компенсацию сопротивления потерь до 85%. Для сбора данных и анализа использовали пакет программ pClamp8 или pClamp9 (Molecular Devices Inc, Саннивейл, шт. Калифорния). Прежде чем приступить к анализу, в следы тока всей клетки была введена поправка на омическую утечку и была выполнена цифровая фильтрация (узкополосное сглаживание по 3 точкам). Определение максимальных токов при высокой степени блокирования тока проводилось путем аппроксимации нарастающей биквадратной экспоненциальной функции к трассировкам данных [модель Ходжкина-Хаксли] с временными константами, прикрепленными к тем, которые определены при отсутствии токсина для отделения амплитуды нарастающей составляющей. Пипетки были вытянуты из капиллярных трубок из боросиликатного стекла Clark GC 150 F-15 в пять этапов и оплавлены, в результате получили электроды с сопротивлением 2-3 Мом в ванне. Раствор ванны состоял из (мМ): 145 NaCl, 5 KCl, 1 MgCl2, 2,5 CaCl2, 5,5 глюкозы, 10 HEPES (рН 7,35), с добавлением 0,1 мг/мл бычьего сывороточного альбумина (Sigma). Измеренная осмолярность внешнего раствора составила от 302 до 308 миллиосмолей (mOsm). Наполняющий пипетку раствор (внутренний раствор) состоял из (мМ): 140 KF, 2 MgCl2, 1 CaCl2, 10 HEPES, 11 EGTA (рН 7,22). Измеренная осмолярность внутренних растворов составила приблизительно 295 mOsm. Перфузия раствора вокруг измеренной клетки различными тест-растворами выполнялась с помощью установки самотечной перфузии с 6 входными линиями и выпускным наконечником РЕ 10 полиэтиленовой трубки с фланцевым отверстием для уменьшения турбулентности потока. Избыточную жидкость непрерывно удаляли. Стандартный протокол напряжения для индуцирования K+ токов напряжения в T-клетках включает серию деполяризаций длиной 14 мс до +50 мВ от исходного потенциала -120 мВ. Интервал между импульсами напряжения был установлен 15 с во избежание совокупной инактивации hKv1.3 каналов. Типичные следы тока в нормальном растворе ванны показаны на фиг. 9 А (контроль). В применяемых экспериментальных условиях (отсутствие Ca2+ в наполняющем пипетку растворе и тип протокола напряжения) токи всей клетки пропускали только hKv1.3 каналы [Peter et al., 2001]. На фиг. 9 А отображены макроскопические K+ токи через hKv1.3 каналы, зарегистрированные последовательно в той же клетке, до(контрольные следы) и после добавления 1 нМ Vm24 во внешний перфузионный раствор. Kv1.3 ток полностью исчезал к 12-му импульсу (соответствующий 3 мин) при наличии 1 нМ Vm24. Кинетика развития блокирования при концентрации Vm24 1 нМ (заштрихованные кружки) и 0,3 нМ (незаштрихованные кружки) показана на фиг. 9 В. После 4-го импульса в контрольном растворе внеклеточную перфузию переключили на содержащий токсин раствор, а деполяризующие импульсы продолжались каждые 15 с. Максимальные токи были определены и приведены к максимальному току в контрольном растворе и представлены графически как функция времени. На фигуре видно, что при более высокой концентрации токсина кинетика развития блокирования быстрее, как и предполагалось из реакции псевдопервого порядка между токсином и каналами, однако при обеих концентрациях токсина достигается полное блокирование тока Kv1.3 всей клетки. Данные для концентрации Vm24 1 нМ взяты из эксперимента, показанного на фиг. 9 А. Опрыскивание регистрирующей камеры контрольным раствором без токсина дало в результате очень небольшое снижение блокирования в течение первых 8 мин (не показано). В течение 10,5-минутного периода применения токсина при концентрации 3 пМ (фиг. 9 С) токовые потери, по-видимому, насыщаются при 36% максимума, зарегистрированного в контрольном растворе. За этим периодом следовал 30-минутный период промывки (стрелка указывает начало обрызгивания не содержащим токсин раствором), в течение которого третья часть заблокированного тока восстанавливается с очень медленной кинетикой (рассчитанная временная константа для промывки составляет 3800 с в соответствии со скоростью диссоциации 2,610-4 с-1). Общий механизм, с помощью которого токсины скорпиона блокируют K каналы, - это закупорка пути ионной проводимости после их связывания с внеклеточным преддверием канала [Goldstein and Miller, 1993]. Низкая и неполная обратимость приведения токов при наличии Vm24, однако, могла указывать на неспецифическое влияние пептида на мембрану, а не блокирование hKv1.3. Приведем следующие до- 28020131 воды против такого сценария: 1) скорость нарастания потерь тока (при высоких концентрациях токсина) зависела от концентрации Vm24 и больше при более высоких концентрациях токсина (фиг. 9 В); 2) ток утечки не увеличивался при наличии токсина, что указывает на отсутствие общего повреждения мембраны под действием Vm2; 3) Vm24 не ингибировал некоторые другие K+ токи или ингибировал их быстро и обратимо (см. далее профиль селективности токсина), что очень убедительно опровергает неспецифическое действие токсина на структуру плазматической мембраны или индуцированную токсином потерю функции мембранных белков в целом; 4) одновременное применение ChTx, хорошо известного блокатора пор Kv1.3, и Vm24 продемонстрировало конкуренцию между этими двумя токсинами для одного и того же участка связывания, что явствовало из замедления кинетики блокирования Vm24 при возрастающих концентрациях ChTx (данные не показаны). Очень низкие скорости ассоциации и диссоциации токсина, наложившие ограничения на возникновение зависимости доза-реакция, представлены на вкладке D фиг. 9. В общем, для равновесного блокирования каналов при разных концентрациях пептида оставшаяся фракция тока (RCF) рассчитывается какI/I0, где I и I0 - максимальные токи, зарегистрированные при наличии и отсутствии токсина соответственно. Вследствие очень низкой скорости ассоциации при низких концентрациях пептида определение I было проблематичным, поскольку снижение максимального тока от случая к случаю было настолько незначительным, что очевидное насыщение наблюдалось при сборе данных, хотя блокирование не могло еще достичь своего равновесного значения. Более длительные применения токсина ограничивались стабильностью максимальных токов при регистрации фиксации потенциала всей клетки. Кроме того, снижение пиков нельзя было определить независимо вследствие чрезвычайно длительного периода промывки пептида. Таким образом, данные, представленные на фиг. 9D, означают верхние пределы для значений I/I0 при разных концентрациях токсина, следовательно, Kd, вычисленный из зависимости доза-реакция, также представляет завышенное значение реального Kd. Зависимость доза-реакция на фиг. 9D была приведена в соответствие с функцией RCF = Kdn/(Kdn + [Тх]n), где [Тх] обозначает концентрацию токсина, Kd константу диссоциации, a n - коэффициент Хилла. Прилегающая сплошная линия указывает наилучшее соответствие параметрам Kd=2,9 пМ и коэффициент Хилла 1. Планки погрешностей указывают SEM(n=3-6). Значение n, равное 1, для коэффициента Хилла указывает, что отдельная молекула токсина взаимодействует с каналом (стехиометрия 1:1). Насколько известно, Vm24 имеет самую высокую аффинность в качестве блокатора hKv1.3 в электрофизиологических анализах.Vm24 - низкоаффинный блокатор hIKCa1 каналов. Как уже было указано во введении примера 7, одно из самых важных требований, чтобы пептид был селективным иммунодепрессантом, - его селективность к Kv1.3 по сравнению с IKCa1. КаналыIKCa1 также эндогенно экспрессированы в T-клетках [Grissmer et al., 1993]. Ток, проходящий по каналамIKCa1, можно измерить с помощью наполняющего пипетку раствора с концентрацией свободного Ca2+ 1 мкМ, что достаточно, чтобы полностью активировать эти каналы [Grissmer et al., 1993]. Однако одновременное присутствие каналов Kv1.3 в одних и тех же клетках затрудняет фармакологическую характеристику каналов IKCa1 и ограничивает изучение мембранными потенциалами, где каналы Kv1.3 не активированы [Grissmer et al., 1993; Bagdany et al., 2005]. Это и относительно небольшое количество IKCa1 каналов даже в индуцированных T-клетках побудило авторов изобретения к изучению фармакологииEGFP-меченый человеческий IKCa1 ген (AF033021) был подвергнут трансфекции в Cos-7 клетки при помощи реагента Lipofectamine 2000 в соответствии с регламентированной процедурой производителя (Invitrogen, Карлсбад, шт. Калифорния, США). Ранее было доказано, что EGFP-меченый hIKCa1 клон имеет идентичные биофизические и фармакологические свойства нативному IKCa1 в T-клетках и,таким образом, широко применяется в фармакологических исследованиях [Wulff et al., 2001]. Cos-7 клетки сохраняли в нормальных для культивирования клеток условиях [Bagdany et al., 2005]. Токи регистрировались через 2-3 дня после трансфекции. GFP положительные трансфектанты идентифицировали флуоресцентным микроскопом Nikon TE2000U и использовали для регистрации тока. Нормальный внеклеточный раствор был идентичен описанному выше. Состав наполняющего пипетку раствора был (мМ): 150 K-аспартат, 5 HEPES, 10 EGTA, 8,7 CaCl2, 2 MgCl2 (pH 7,2). Раствор содержал концентрацию 1 мкМ свободного Ca2+ для полной активации hIKCa1 тока. Все другие условия регистрации (сбор информации,перфузия и т.д.) были аналогичны вышеприведенному описанию для Kv1.3 каналов. Чтобы вызвать hIKCa1 токи в Cos-7 клетках (скорость линейного изменения 0,85 мВ/мс),использовали линейные изменения напряжения длиной 200 мс от -120 до +50 мВ от исходного потенциала -120 мВ. Линейные изменения напряжения были каждые 10 с. След тока, зарегистрированный при отсутствии Vm24 (контроль), на фиг. 9 Е показывает, что чистые, непотенциалозависимые hIKCa1 токи были вызваны примененным протоколом потенциала. Потенциал реверсии тока составляет -75 мВ, что характерно для K+ проводимости, основанной на ионном составе регистрирующих растворов. Чтобы охарактеризовать блокирование тока, для IKCa1 токов можно использовать наклон (s) линейной вольтамперной характеристики [Grissmer et al., 1993]. Величина s уменьшается до 52% контрольного образца при наличии 10 нМ Vm24 во время экспериментов, показанных на фиг. 9 Е, равновесное блокирование достигается через 4,5 мин (27 эпизодов). Блокирование тока полностью реверсировалось через 2,5 мин
МПК / Метки
МПК: A61K 38/04, C07K 14/435, G01N 33/68, G01N 33/94
Метки: человеческого, т-лимфоцита, скорпиона, применения, пептиды, калиевые, способы, каналы, блокирующие
Код ссылки
<a href="https://eas.patents.su/30-20131-peptidy-skorpiona-blokiruyushhie-kalievye-kanaly-chelovecheskogo-t-limfocita-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пептиды скорпиона, блокирующие калиевые каналы человеческого т-лимфоцита, и способы их применения</a>
Предыдущий патент: Специфичное к антигену са6 антитело, содержащий его цитотоксический конъюгат и способы применения конъюгата
Следующий патент: Новые производные триазиндиона в качестве модуляторов рецептора гамкв
Случайный патент: Фармацевтические композиции соединения платины












