Специфичное к антигену са6 антитело, содержащий его цитотоксический конъюгат и способы применения конъюгата
Формула / Реферат
1. Антитело позвоночного, которое связывается с гликотопом СА6, включающее по меньшей мере одну вариабельную область легкой цепи и по меньшей мере одну вариабельную область тяжелой цепи, где последовательность данной вариабельной области тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 10 или SEQ ID NO: 11.
2. Антитело по п.1, где указанная вариабельная область легкой цепи включает аминокислотную последовательность SEQ ID NO: 8.
3. Антитело по п.1 или 2, где указанная вариабельная область тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 11 и где указанная вариабельная область легкой цепи включает аминокислотную последовательность SEQ ID NO: 8.
4. Антитело по любому из пп.1-3, полученное с помощью способа гуманизации, включающего:
(а) сопоставление позиций исходя из распределений относительной доступности на основании рентгеновских кристаллографических структур совокупности вариабельных областей тяжелых и легких цепей антител человека и грызунов с получением набора экспонированных на поверхности позиций каркаса вариабельной области тяжелой и легкой цепи, где позиции в выравнивании для всех вариабельных областей грызунов и человека являются по меньшей мере на 98% идентичными;
(б) определение для антитела грызуна или его эпитоп-связывающего фрагмента набора экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи с использованием названного набора экспонированных на поверхности позиций каркаса вариабельной области тяжелой и легкой цепи, созданного на указанной стадии (а);
(в) идентификацию на основании аминокислотных последовательностей человеческих антител набора аминокислотных остатков, экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи, которые наиболее близко идентичны названному набору экспонированных на поверхности аминокислотных остатков антитела грызуна, определенному на указанной стадии (б);
(г) замещение в аминокислотной последовательности каркаса вариабельной области названного антитела грызуна или его эпитоп-связывающего фрагмента этого названного набора экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи, определенного на указанной стадии (б), указанным набором экспонированных по поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи, идентифицированным на указанной стадии (в);
(д) конструирование трехмерных моделей указанных вариабельных областей названного антитела грызуна или его эпитоп-связывающего фрагмента и указанной вариабельной области указанного антитела грызуна или его эпитоп-связывающего фрагмента, являющихся результатом указанного замещения на стадии (г);
(е) сравнение названных трехмерных моделей, сконструированных на указанной стадии (д), и идентификацию любых аминокислотных остатков из указанного набора, идентифицированного на указанных стадиях (б) или (в), которые находятся в пределах 5Å от любого атома любого остатка в областях, определяющих комплементарность, указанного антитела грызуна или его эпитоп-связывающего фрагмента;
(ж) изменение любых аминокислотных остатков, идентифицированных на указанной стадии (е), с человеческих на исходные аминокислотные остатки антитела грызуна, чтобы таким образом определить гуманизирующий набор экспонированных на поверхности аминокислотных остатков;
(з) замену набора экспонированных на поверхности аминокислотных остатков каркаса вариабельной области антитела грызуна, определенного на стадии (б), гуманизирующим набором экспонированных на поверхности аминокислотных остатков каркаса вариабельной области, определенным на указанной стадии (ж);
(и) получение указанного гуманизированного антитела грызуна или его эпитоп-связывающего фрагмента, которые связываются с СА6 гликотопом.
5. Антитело по п.4, где указанное антитело выбрано из группы, состоящей из Fab фрагмента, Fab' фрагмента, F(ab')2 фрагмента, Fd фрагмента, в котором, необязательно, указанные аминокислотные остатки, экспонированные на поверхности, являются аминокислотными остатками, чья доступность для растворителя выше 30%.
6. Цитотоксический конъюгат, включающий антитело по любому из пп.1-5 и цитотоксический агент.
7. Цитотоксический конъюгат по п.6, где указанное антитело и указанный цитотоксический агент связаны ковалентно, в частности через линкерную группу PEG или через тиоловую или дисульфидную функциональные группы цитотоксического агента.
8. Цитотоксический конъюгат по п.6, где указанное антитело является гуманизированным антителом.
9. Цитотоксический конъюгат по п.8, где указанное гуманизированное антитело является поверхностно-перестроенным антителом.
10. Цитотоксический конъюгат по пп.6-8, где указанный цитотоксический агент выбран из группы, состоящей из майтансиноидного соединения, таксоидного соединения, соединения СС-1065, соединения доластатина, соединения даунорубицина и соединения доксорубицина.
11. Цитотоксический конъюгат по п.10, где указанным цитотоксическим агентом является мейтансиноид DM1 формулы (I)
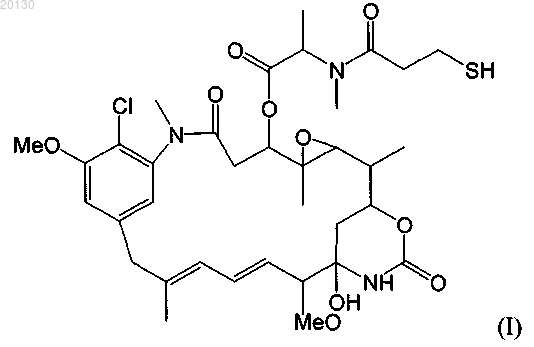
или указанным цитотоксическим агентом является мейтансиноид DM4 формулы (II)
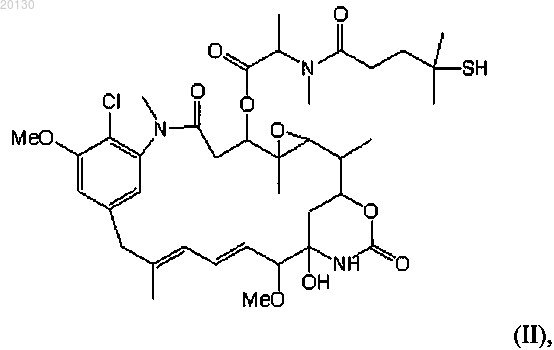
указанное антитело и указанный цитотоксический агент ковалентно связаны через линкер N-сукцинимидил-4-(2-пиридилдитио)бутаноата (SPDB), причем с указанным антителом связаны 1-10 молекул DM4, в частности с антителом связаны примерно 3 молекулы DM4;
или указанный цитотоксический агент является майтансиноидом формулы (III)
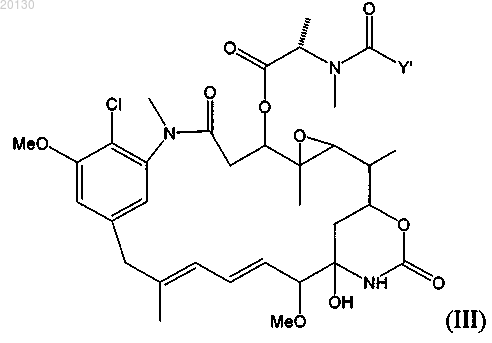
где Y' означает (CR7R8)l(CR9=CR10)p(CºC)qAo(CR5R6)mDu(CR11=CR12)r(CºC)sBt(CR3R4)nCR1R2SZ,
где R1 и R2, каждый, являются независимо СН3, С2Н5 линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом и дополнительно R2 может быть Н;
А, В, D являются циклоалкилом или циклоалкенилом, имеющим 3-10 атомов углерода, простым или замещенным арилом или гетероциклическим ароматическим или гетероциклическим радикалом;
R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо друг от друга означают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал;
l, m, n, о, p, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5 при условии, что по крайней мере два из них не равны 0 одновременно;
Z означает Н, SR или -COR, где R означает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический радикал, или
R1 означает метил, R2 означает Н, a Z означает Н, или
R1 и R2 означают метил, a Z означает Н, или
R1 означает метил, R2 означает Н, a Z означает -SCH3, или
R1 и R2 означают метил, a Z означает -SCH3.
12. Цитотоксический конъюгат по п.10, где указанный цитотоксический агент выбран из группы, включающей формулы (IV-L), (IV-D) и (IV-D,L)
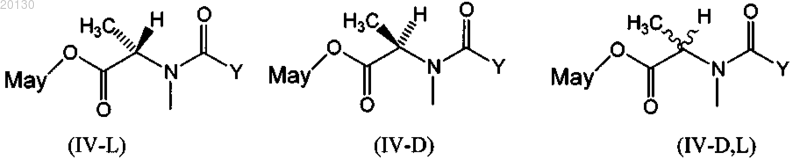
где Y означает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2SZ,
где R1 и R2 независимо друг от друга означают СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал, при этом R2 может означать Н;
R3, R4, R5, R6, R7 и R8 независимо друг от друга означают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал;
l, m и n независимо друг от друга означают целое число от 1 до 5, при этом n может означать 0;
Z означает Н, SR или -COR, где R означает линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический радикал;
May означает майтансиноид, несущий боковую цепь в положении С-3, С-14 - гидроксиметил, С-15 - гидрокси или С-20 - десметил, или
R1 означает метил, R2 означает Н, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0, a Z означает Н, или
R1 и R2 означают метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0, а Z означает Н, или
R1 означает метил, R2 означает Н, R5, R6, R7 и R8 независимо означают Н, l и m равны l, n равно 0, a Z означает -SCH3, или
R1 и R2 означают метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0, а Z означает -SCH3.
13. Цитотоксический конъюгат по п.12, где цитотоксический агент представлен формулой (IV-L).
14. Цитотоксический конъюгат по п.10, где указанный цитотоксический агент является майтансиноидом формулы (V)
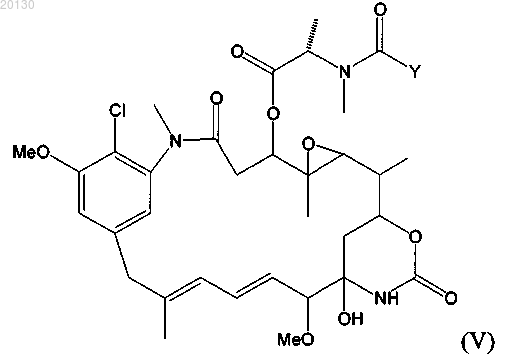
где Y означает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2SZ,
где R1 и R2 независимо друг от друга означают СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал, при этом R2 может означать Н;
R3, R4, R5, R6, R7 и R8 независимо друг от друга означают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал;
l, m и n независимо друг от друга означают целое число от 1 до 5, при этом n может означать 0;
Z означает Н, SR или -COR, где R означает линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический радикал, или
R1 означает метил, R2 означает Н, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0, a Z означает Н, или
R1 и R2 означают метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0, а Z означает Н, или
R1 означает метил, R2 означает Н, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0, a Z означает -SCH3.
15. Цитотоксический конъюгат по п.10, где указанный цитотоксический агент выбран из группы, включающей формулы (VI-L), (VI-D) и (VI-D,L)
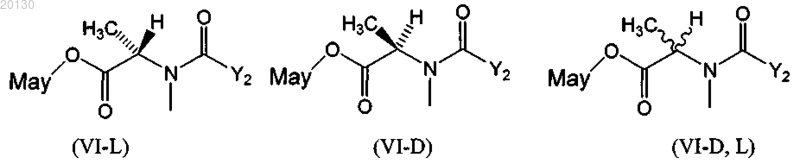
где Y2 означает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2SZ2,
где R1 и R2 независимо друг от друга означают СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал, при этом R2 может означать Н;
R3, R4, R5, R6, R7 и R8 независимо друг от друга означают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал;
l, m и n независимо друг от друга означают целое число от 1 до 5, при этом n может означать 0;
Z2 означает SR или -COR, где R означает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический радикал;
May означает майтансиноид или
указанный цитотоксический агент является майтансиноидом формулы (VII)
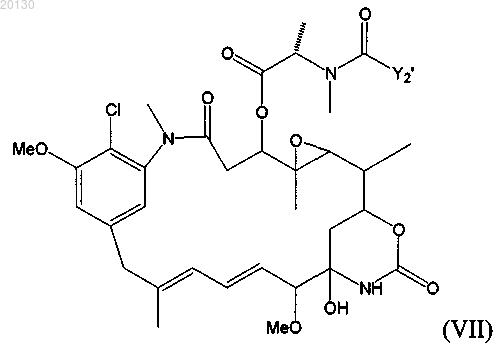
где Y2' означает (CR7R8)l(CR9=CR10)p(CºC)qAo(CR5R6)mDu(CR11=CR12)r(CºC)sBt(CR3R4)nCR1R2SZ2,
где R1 и R2 независимо друг от друга означают СН3, С2Н5, линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал, при этом R2 может означать Н;
А, В и D независимо друг от друга означают циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический радикал;
R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо друг от друга означают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал;
l, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5 при условии, что по крайней мере два из них не равны 0 одновременно;
Z2 означает SR или -COR, где R означает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический радикал, или
R1 означает метил, a R2 означает Н, или
где указанный цитотоксический агент является майтансиноидом формулы (VIII)
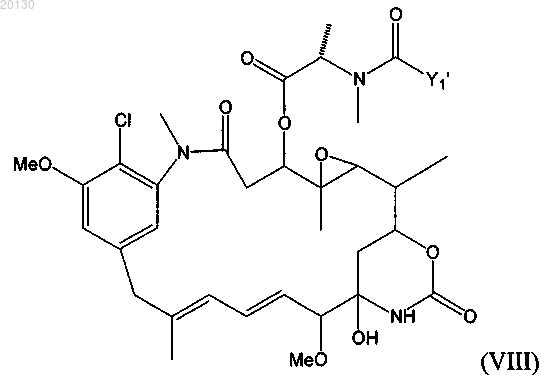
где Y1' означает (CR7R8)l(CR9=R10)p(C=C)qAo(CR5R6)mDu(CR11=CR12)r(C=C)sBt(CR3R4)nCR1R2S-,
где А, В и D независимо друг от друга означают циклоалкил или циклоалкенил, содержащий 3-10 атомов углерода, простой или замещенный арил либо гетероциклический радикал;
R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо друг от друга означают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал;
l, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5 при условии, что по крайней мере два из них не равны 0 одновременно, или
R1 означает метил, a R2 означает Н, или
R1 и R2 означают метил, или
где указанный цитотоксический конъюгат выбран из группы, состоящей из формул (IX-L), (IX-D) и (IX-D,L)
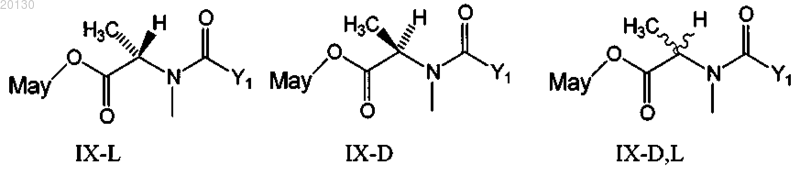
где Y1 означает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2S-,
где R1 и R2 независимо друг от друга означают СН3, C2H5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, гетероциклический радикал, при этом R2 может означать Н;
R3, R4, R5, R6, R7 и R8 независимо друг от друга означают Н, СН3, C2H5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал;
l, m и n независимо друг от друга означают целое число от 1 до 5, при этом n может означать 0;
May означает майтансиноид, несущий в положении С-3, С-14-гидроксиметила, С-15-гидрокси или С-20-десметила боковую цепь, или
R1 означает метил, а R2 означает Н, либо R1 и R2 означают метил, или
R1 означает метил, R2 означает Н, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0, или
R1 и R2 означают метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0.
16. Цитотоксический конъюгат по п.15, где майтансиноид представлен формулой (IX-L) и R1 означает метил, a R2 означает Н, либо R1 и R2 означают метил или R1 означает метил, R2 означает Н, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0.
17. Цитотоксический конъюгат по п.10, где указанный цитотоксический агент является майтансиноидом формулы (X)
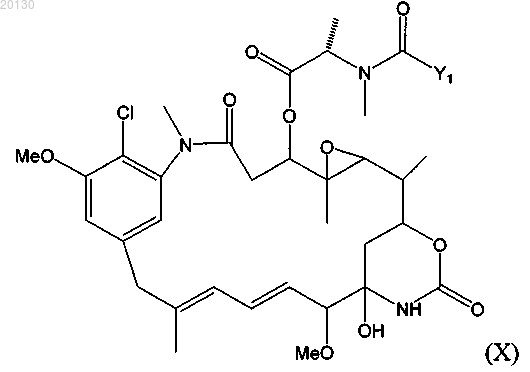
где Y1 означает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2S-,
где R1 и R2 независимо друг от друга означают СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, гетероциклический радикал, при этом R2 может означать Н;
R3, R4, R5, R6, R7 и R8 независимо друг от друга означают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический радикал;
l, m и n независимо друг от друга означают целое число от 1 до 5, при этом n может означать 0,
May означает майтансиноид, несущий в положении С-3, С-14-гидроксиметила, С-15-гидрокси или С-20-десметила боковую цепь, или
R1 означает метил, R2 означает Н, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0, или
R1 и R2 означают метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n равно 0.
18. Цитотоксический конъюгат по п.11, где указанное антитело является гуманизированной версией мышиного анти-СА6 моноклонального антитела DS6, в котором вариабельная область тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 11, а вариабельная область легкой цепи включает аминокислотную последовательность SEQ ID NO: 8, и где цитотоксический агент является DM1 или DM4.
19. Цитотоксический конъюгат по п.10, где цитотоксический агент является таксаном формулы (XI)
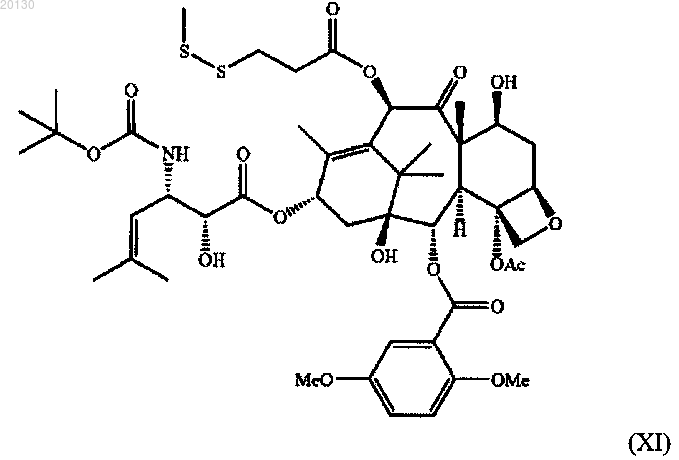
20. Способ ингибирования роста клетки, экспрессирующей СА6 гликотоп, включающий обеспечение контактирования клетки, экспрессирующей СА6 гликотоп, с цитотоксическим конъюгатом по любому из пп.6-19.
21. Способ по п.20, где цитотоксический конъюгат включает анти-СА6 моноклональное антитело, в котором указанная вариабельная область тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 11, а вариабельная область легкой цепи включает аминокислотную последовательность SEQ ID NO: 8, и где цитотоксическим агентом является DM1 или DM4.
22. Способ по п.20, который осуществляют in vivo, in vitro или ex vivo.
23. Терапевтическая композиция, включающая цитотоксический конъюгат по любому из пп.6-19 и фармацевтически приемлемый носитель или наполнитель.
24. Терапевтическая композиция по п.23, где цитотоксический конъюгат включает анти-СА6 моноклональное антитело, в котором указанная вариабельная область тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 11, а указанная вариабельная область легкой цепи включает аминокислотную последовательность SEQ ID NO: 8, и где цитотоксическим агентом является DM1 или DM4.
25. Способ лечения субъекта, больного раком, при котором экспрессируется или сверхэкспрессируется СА6 гликотоп, включающий введение указанному субъекту терапевтически эффективного количества терапевтической композиции по п.23.
26. Способ лечения субъекта по п.25, где рак выбран из группы, включающей серозную карциному яичника, эндометриоидную карциному яичника, новообразование шейки матки, новообразование эндометрия, новообразование вульвы, карциному молочной железы, опухоль поджелудочной железы и уротелиальную опухоль.
27. Набор для лечения субъекта, больного раком, включающий цитотоксический конъюгат по любому из пп.6-19 и инструкцию по использованию набора, где инструкция представляет собой инструкцию по лечению субъекта, больного раком, при котором экспрессируется или сверхэкспрессируется гликотоп СА6.
28. Набор по п.27, где рак выбран из группы, включающей серозную карциному яичника, эндометриоидную карциному яичника, новообразование шейки матки, новообразование эндометрия, новообразование вульвы, карциному молочной железы, опухоль поджелудочной железы и уротелиальную опухоль.
29. Набор для лечения субъекта, больного раком, включающий терапевтическую композицию по п.23 или 24 и инструкцию по применению набора, где инструкция представляет собой инструкцию по лечению субъекта, больного раком, при котором экспрессируется или сверхэкспрессируется гликотоп СА6.
30. Набор по п.29, где рак выбран из группы, включающей серозную карциному яичника, эндометриоидную карциному яичника, новообразование шейки матки, новообразование эндометрия, новообразование вульвы, карциному молочной железы, опухоль поджелудочной железы и уротелиальную опухоль.
31. Набор по п.30, где цитотоксический конъюгат включает анти-СА6 моноклональное антитело, включающее по меньшей мере одну вариабельную область легкой цепи и по меньшей мере одну вариабельную область тяжелой цепи, где вариабельная область тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 11, а вариабельная область легкой цепи включает аминокислотную последовательность SEQ ID NO: 8, и где цитотоксическим агентом является DM1 или DM4.
32. Способ по любому из пп.25-26, где цитотоксический конъюгат включает анти-СА6 моноклональное антитело, включающее по меньшей мере одну вариабельную область легкой цепи и по меньшей мере одну вариабельную область тяжелой цепи, где вариабельная область тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 11, а вариабельная область легкой цепи включает аминокислотную последовательность SEQ ID NO: 8, и где цитотоксическим агентом является DM1 или DM4.
Текст
ИСПРАВЛЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ 2005.08.22 СПЕЦИФИЧНОЕ К АНТИГЕНУ СА 6 АНТИТЕЛО, СОДЕРЖАЩИЙ ЕГО ЦИТОТОКСИЧЕСКИЙ КОНЪЮГАТ И СПОСОБЫ ПРИМЕНЕНИЯ КОНЪЮГАТА Изобретение направлено на моноклональное антитело и его эпитопсвязывающие фрагменты,которые распознают и связываются с гликотопом СА 6, в частности на гуманизованные или поверхностно-перестроенные варианты моноклонального антитела DS6 мыши против СА 6 и его эпитопсвязывающие фрагменты. Изобретение также относится к цитотоксическому конъюгату,содержащему указанные антитела, и к композициям, содержащим конъюгат, которые могут использоваться при ингибировании роста клеток и лечении раковых заболеваний. Примечание: библиография отражает состояние при переиздании Область техники, к которой относится изобретение Настоящее изобретение направлено на мышиное моноклональное антитело против гликотопа СА 6 и его гуманизованные или поверхностно-перестроенные варианты. Настоящее изобретение также направлено на эпитоп-связывающие фрагменты моноклонального антитела против гликотопа СА 6, а также на эпитоп-связывающие фрагменты гуманизованных или поверхностно-перестроенных вариантов моноклонального антитела против гликотопа СА 6. Настоящее изобретение также направлено на цитотоксические конъюгаты, включающие агент, связывающий клетку, и цитотоксический агент, терапевтические композиции, включающие конъюгат, способы применения этих конъюгатов при ингибировании роста клеток и лечении заболеваний, а также набор, включающий цитотоксический конъюгат. В частности, агентом, связывающим клетку, является моноклональное антитело или его эпитоп-связывающий фрагмент, который распознает и связывается с гликотопом СА 6 или его гуманизованным или поверхностно-перестроенным вариантом. Уровень техники Предпринимались многочисленные попытки разработать противораковые терапевтические средства, специфически разрушающие заданные раковые клетки, но не повреждающие окружающие нераковые клетки и ткани. Такие терапевтические средства способны сильно улучшить лечение рака у пациентов. Один из перспективных подходов состоит в том, чтобы соединить агент, связывающий клетку, типа моноклонального антитела с цитотоксическим препаратом (Sela et al, in Immunoconjugates 189-236 (С.(J. Rodwell, ed. 1988); Bumol et al., in Antibody mediated delivery systems 55-79 (J. Rodwell, ed. 1988. В зависимости от агента, связывающего клетку, можно разработать такие цитотоксические конъюгаты,которые будут распознаваться и связываться только со специфическими типами раковых клеток, исходя из профиля экспрессии молекул, экспрессируемых на поверхности таких клеток. В таких цитотоксических конъюгатах использовались цитотоксические препараты, такие как метотрексат, даунорубицин, доксорубицин, винкристин, винбластин, мелфалан, митомицин С и хлорамбуцил, присоединенные к целому ряду мышиных моноклональных антител. В некоторых случаях молекулы лекарств соединяли с молекулами антител через промежуточную молекулу-носитель типа сывороточного альбумина (Garnett et al., 46 Cancer Res. 2407-2412 (1986); Ohkawa et al., 23 Cancer Immunol. Immunother. 81-86 (1986); Endo et al., 47 Cancer Res. 1076-1080 (1980), декстрана (Hurwitz et al., 2 Appl. Biochem. 25-35 (1980); Manabi et al., 34 Biochem. Pharmacol. 289-291 (1985); Dillman et al., 46 Cancer Res. 4886-4891(1986); Shoval et al., 85 Proc. Natl. Acad. Sci. 8276-8280 (1988) или полиглутаминовой кислоты (Tsukada etBr. J. Cancer 111-116 (1985. В качестве примера одного специфического конъюгата, подающего некоторые надежды, приводится конъюгат из антитела С 242, направленного против антигена CanAg, экспрессированного на колоректальных и панкреатических опухолях, и производного майтансина DM1 (Liu et al., Proc. Natl. Acad. Sci.USA, 93: 8618-8623 (1996. Изучение этого конъюгата in vitro показало, что он обладает высоким сродством связывания с CanAg, экспрессированным на клеточной поверхности, при этом значение кажущейся Kd составляет 310-11 М, и обладает высокой цитотоксической активностью на CanAg-положительные клетки, при этом значение IC50 составляет 610-11 М. Цитотоксичность была зависимой от антигена, так как она блокировалась избытком неконъюгированных антител, а антиген-отрицательные клетки были в 100 с лишним раз менее чувствительными к конъюгату. Другие примеры конъюгатов типа антитело-DMl с высоким сродством к соответствующим клеткам-мишеням и высокой антиген-селективной цитотоксичностью включают конъюгаты с huN901, гуманизованным вариантом антитела к CD56 человека;huMy9-6, гуманизованным вариантом антитела к CD33 человека; huC242, гуманизованным вариантом антитела против эпитопа Mucl CanAg; huJ591, деиммунизованным антителом к PSMA; трастузумаб, гуманизованным антителом к Her2/neu; и биватузумаб, гуманизованным антителом к CD44v6. Разработка дополнительных цитотоксических конъюгатов, специфически распознающих определенные типы раковых клеток, имеет важное значение для постоянного усовершенствования способов лечения больных раком. С этой целью настоящее изобретение направлено на разработку антител, распознающих и связывающихся с молекулами/рецепторами, экспрессированными на поверхности раковых клеток, и на разработку новых цитотоксических конъюгатов, включающих агенты, связывающие клетку, типа антител и цитотоксические агенты, специфически нацеленные на молекулы/рецепторы, экспрессированные на поверхности раковых клеток. В частности, настоящее изобретение направлено на изучение характеристик нового сиалогликотопа СА 6 на рецепторах муцина Mucl, экспрессируемых раковыми клетками, и на получение антител, предпочтительно гуманизованных антител, распознающих новый сиалогликотоп СА 6 муцина Mucl, которые можно было бы использовать для ингибирования роста клеток, экспрессирующих гликотоп СА 6, в качестве цитотоксического агента. Раскрытие изобретения Настоящее изобретение охватывает антитела, специфически распознающие и связывающиеся с новым сиалогликотопом СА 6 рецепторов муцина Mucl, или их эпитоп-связывающие фрагменты. В другом воплощении настоящее изобретение охватывает гуманизованные антитела или их эпитопосвязывающие фрагменты, распознающие новый сиалогликотоп СА 6 ("гликотоп СА 6 ") рецепторов муцина Mucl. В предпочтительном воплощении настоящее изобретение включает мышиное моноклональное антитело DS6 к СА 6 ("антитело DS6"), а также поверхностно-перестроенные или гуманизованные варианты антитела DS6, у которых выходящие на поверхность остатки антитела или его эпитопосвязывающих фрагментов на легких и тяжелых цепях заменены так, чтобы они были больше похожи на поверхности известных антител человека. Гуманизованные антитела и их эпитопосвязывающие фрагменты по настоящему изобретению обладают улучшенными свойствами в том, что они значительно менее иммуногенны (либо полностью не иммуногенны) в организме человека, которому они введены, чем их полностью мышиные варианты. Таким образом, гуманизованные антитела DS6 и их эпитоп-связывающие фрагменты по настоящему изобретению специфически распознают новый сиалогликотоп на рецепторах муцина Mucl, т.е. гликотоп СА 6, и в то же время не иммуногенны для человека. Эти гуманизованные антитела и их эпитоп-связывающие фрагменты могут быть конъюгированы с лекарственным веществом типа майтансиноида с образованием пролекарства, обладающего специфической цитотоксичностью к антиген-экспрессирующим клеткам, направляя лекарство на сиалогликотоп СА 6 Mucl. При этом цитотоксические конъюгаты, содержащие такие антитела и небольшие, сильно токсичные препараты (напр.,майтансиноиды, таксаны, аналоги СС-1065), могут применяться в качестве терапевтических препаратов для лечения раковых опухолей типа опухолей молочной железы и яичников. Гуманизованные варианты антител DS6 по настоящему изобретению полностью в нем охарактеризованы в отношении соответствующих аминокислотных последовательностей вариабельных областей их легких и тяжелых цепей, последовательностей ДНК генов вариабельных областей их легких и тяжелых цепей, идентификации участков CDR, идентификации их поверхностных аминокислот и изложения способа их экспрессии в рекомбинантном виде. В одном воплощении представлены гуманизованные антитела DS6 или их эпитоп-связывающие фрагменты, содержащие тяжелую цепь, включающую участки CDR, имеющие аминокислотные последовательности, представленные SEQ ID NO: 1-3: Также представлены гуманизованные антитела DS6 и их эпитоп-связывающие фрагменты, содержащие вариабельную область легкой цепи, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной SEQ ID NO: 7 или SEQ ID NO: 8: Также представлены гуманизованные антитела DS6 и их эпитоп-связывающие фрагменты, содержащие вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной SEQ ID NO: 9,SEQ ID NO: 10 или SEQ ID NO: 11: В другом воплощении представлены гуманизованные антитела DS6 и их эпитоп-связывающие фрагменты, содержащие гуманизованную или поверхностно-перестроенную вариабельную область легкой цепи, имеющую аминокислотную последовательность, соответствующую SEQ ID NO: 8: Также представлены гуманизованные антитела DS6 и их эпитоп-связывающие фрагменты, содержащие гуманизованную или поверхностно-перестроенную вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, соответствующую SEQ ID NO: 10 или SEQ ID NO: 11, соответственно: Гуманизованные антитела DS6 и их эпитопосвязывающие фрагменты по настоящему изобретению также могут включать замены аминокислотных остатков в легкой и/или тяжелой цепи по одному или нескольким положениям, представленным звездочками в табл. 1, которые представляют собой остатки на поверхности мышиного каркаса, находящиеся в пределах 5 от CDR, требующие замены на остаток человека. Например, первый аминокислотный остаток Q в мышиной последовательности (SEQ ID NO: 7) был заменен на Е (SEQ ID NO: 8) при гуманизации антитела. Однако, вследствие близости этого участка к CDR, для сохранения аффинности антител может потребоваться обратная мутация на мышиный остаток Q. Таблица 1 Это также показано в табл. 2, где представлено сопоставление поверхностных остатков вариабельной области с поверхностными остатками трех наиболее гомологичных вариабельных областей человека. Аминокислотные остатки в табл. 1 соответствуют подчеркнутым аминокислотным остаткам в табл. 2. Таблица 2 Настоящее изобретение также предусматривает цитотоксические конъюгаты, включающие: (1) агента, связывающего клетку, распознающего и связывающегося с гликотопом СА 6, и (2) цитотоксического агента. В цитотоксических конъюгатах агент, связывающий клетку, обладает высоким сродством к гликотопу СА 6, а цитотоксический агент обладает высокой степенью цитотоксичности для клеток, экспрессирующих гликотоп СА 6, при этом цитотоксические конъюгаты настоящего изобретения образуют эффективные поражающие средства. В предпочтительном воплощении агентом, связывающим клетку, является антитело к СА 6 или его эпитоп-связывающий фрагмент, более предпочтительно гуманизованное антитело к СА 6 или его эпитопсвязывающий фрагмент, причем цитотоксический агент ковалентно присоединен, непосредственно или через расщепляемый или нерасщепляемый линкер, к антителу или его эпитоп-связывающему фрагменту. В более предпочтительных воплощениях агентом, связывающим клетку, является гуманизованное антитело DS6 или его эпитоп-связывающий фрагмент, а цитотоксическим агентом является таксол, майтансиноид, СС-1065 или аналог СС-1065. В предпочтительных воплощениях изобретения агентом, связывающим клетку, является гуманизованное антитело к СА 6, а цитотоксическим агентом является цитотоксический препарат, к примеру, майтансиноид или таксан. Более предпочтительно агентом, связывающим клетку, является гуманизованное антитело DS6 к СА 6, а цитотоксическим агентом является соединение майтансина типа DM1 или DM4. Настоящее изобретение также включает способ ингибирования роста клеток, экспрессирующих гликотоп СА 6. В предпочтительных воплощениях способ ингибирования роста клеток, экспрессирующих гликотоп СА 6, осуществляется in vivo и приводит к гибели клеток, хотя включено и его применениеin vitro и ex vivo. Настоящее изобретение также предусматривает терапевтическую композицию, включающую цитотоксический конъюгат и фармацевтически приемлемый носитель или наполнитель. Настоящее изобретение также включает способ лечения больных, страдающих раком, с помощью терапевтической композиции. В предпочтительных воплощениях цитотоксический конъюгат включает антитело к СА 6 и цитотоксического агента. В более предпочтительных воплощениях цитотоксический конъюгат включает конъюгат гуманизованного антитела DS6 с DM1, гуманизованного антитела DS6 сDM4 или гуманизованного антитела DS6 с таксаном, причем конъюгат вводится вместе с фармацевтически приемлемым носителем или наполнителем. Настоящее изобретение также включает набор, включающий конъюгат антитела к СА 6 с цитотоксическим агентом и инструкции по применению. В предпочтительных воплощениях антитело к СА 6 представляет собой гуманизованное антитело DS6, цитотоксическим агентом является соединение майтансина типа DM1 или DM4 либо таксан, а инструкции по применению предназначены для применения конъюгата при лечении больных, страдающих раком. Набор также может включать и компоненты, необходимые для приготовления фармацевтически приемлемой лекарственной формы, к примеру, разбавитель, если конъюгат находится в лиофилизованном состоянии или в концентрированном виде, а также для применения лекарственной формы. Настоящее изобретение также включает производные антител, которые специфически связываются с и распознают гликотоп СА 6. В предпочтительных воплощениях производные антител получают путем перестройки поверхности или гуманизации антител, связывающихся с гликотопом СА 6, при этом производные обладают пониженной иммуногенностью в отношении хозяина. Настоящее изобретение также предусматривает гуманизованные антитела или их фрагменты, которые дополнительно помечены для применения в исследованиях или в диагностике. В предпочтительных воплощениях метка представляет собой радиометку, флуорофор, хромофор, контрастирующее вещество или ион металла. Также предусматривается способ диагностики, в котором данные меченные гуманизованные антитела или их эпитоп-связывающие фрагменты вводятся пациенту, у которого есть подозрение на рак, и измеряется или отслеживается распределение метки в организме пациента. Настоящее изобретение также предусматривает способы лечения больных, страдающих раком, путем введения конъюгата гуманизованного антитела по настоящему изобретению, одного или в сочетании с другими цитотоксическими или терапевтическими веществами. Рак может представлять собой, к примеру, рак молочной железы, рак толстой кишки, рак яичников, рак эндометрия, остеосаркому, рак шейки матки, рак простаты, рак легких, синовиальную карциному, рак поджелудочной железы, саркому или карциному, при которой экспрессируется СА 6, или другой вид рака, еще не известный, при котором преимущественно экспрессируется гликотоп СА 6. Если только не указано иначе, все ссылки и патенты, цитируемые в настоящем изобретении, включены путем отсылки. Краткое описание фигур На фиг. 1 представлены результаты исследований, проведенных для определения способности антитела DS6 к связыванию с поверхностью выбранных линий раковых клеток. Измеряли флуоресценцию клеток, инкубированных с первичным антителом DS6 и с вторичными антителами против IgG (H+L) мыши, конъюгированными с FITC, методом проточной цитометрии. Антитело DS6 связывалось с клетками Caov-3 (фиг. 1 А) и T-47D (фиг. 1 В) с кажущимся значением Kd, равным 1,848 и 2,586 нМ, соответственно. Клетки отрицательных по антигену линий SK-OV-3 (фиг. 1 С) и Со 1 о 205 (фиг. 1D) не проявляли специфичного к антигену связывания. На фиг. 2 представлены результаты анализа экспрессии эпитопа методом дот-гибридизации. Лизаты клеток Caov-3 (фиг. 2 А и 2 В), SKMEL28 (фиг. 2 С) и Colo205 (фиг. 2D) индивидуально наносили на нитроцеллюлозные мембраны, а затем индивидуально инкубировали с проназой, протеиназой К, нейраминидазой или йодной кислотой. После этого мембраны подвергали иммуноблоттингу с антителом DS6(фиг. 2 А), антителом СМ 1 (фиг. 2 В), антителом R24 (фиг. 2 С) или антителом С 242 (фиг. 2D). На фиг. 3 представлены результаты анализа экспрессии антигена DS6 методом дот-гибридизации. Лизаты клеток Caov-3 индивидуально наносили на мембраны PVDF, а затем инкубировали в присутствии трифторметансульфоновой кислоты (TFMSA). После этого мембраны подвергали иммуноблоттингу с антителом СМ 1 (1 и 2) или антителом DS6 (3 и 4). На фиг. 4 представлены результаты анализа гликотопов антигена DS6. Лизаты клеток Caov-3, предварительно обработанные N-гликаназой ("N-gly"), О-гликаназой ("О-gly") и/или сиалидазой ("S"), наносили на нитроцеллюлозные мембраны, а затем подвергали иммуноблоттингу с антителом DS6 или антителом СМ 1 (VNTR Muc-1). На фиг. 5 представлены результаты анализа антигена DS6 методом вестерн-гибридизации. Лизаты клеток подвергали иммунопреципитации ("IP") и иммуноблоттингу с антителом DS6. Антиген соответствует полосе белка 250 кДа, наблюдаемой у антиген-положительных клеток Caov-3 (фиг. 5 А и 5 В) и T47D (фиг. 5 С). Отрицательные по антигену клетки линий SK-OV-3 (фиг. 5D) и Со 1 о 205 (фиг. 5 Е) не проявляли этой полосы. После иммунопреципитации шарики с белком G из лизатов клеток Caov-3 инкубировали с нейраминидазой ("N") (фиг. 5 А) или йодной кислотой ("РА") (фиг. 5 В). На том же геле разгоняли и контроли: антитело , проточные фракции лизатов до IP ("Lys") и после IP ("FT"). Иммунопреципитаты Caov-3 также инкубировали с N-гликаназой ("N-gly"), О-гликаназой ("O-gly") и/или сиалидазой("S") (см. фиг. 5F, на которой блот-мембраны альтернативно подвергались гибридизации с биотинилированным DS6 и стрептавидин-HRP). На фиг. 6 представлены результаты иммунопреципитации и/или иммуноблоттинга лизатов клетокCaov-3 (фиг. 6 А) и HeLa (фиг. 6 В) с помощью антитела DS6 или антитела СМ 1. Перекрывание сигналов от СМ 1 и DS6 на вестерн-блотах означает, что антиген DS6 находится на белке Mucl. У лизатов HeLa раздвоение полосы Mucl возникает из-за того, что экспрессия Mucl управляется разными аллелями, которые отличаются по числу тандемных повторов. На фиг. 7 представлена схема определения антител DS6 методом сэндвич-ELISA (фиг. 7 А) и стандартная кривая (фиг. 7 В). Стандартная кривая была получена при известных концентрациях коммерчески доступных стандартов СА 15-3 (при этом 1 ед. СА 15-3 = 1 ед. DS6). На фиг. 8 представлены стандартные кривые для количественного метода ELISA. Стандартные кривые по сигналам детектирующего антитела (стрептавидин-HRP/биотин-DS6) (фиг. 8 С) определяли при известных концентрациях биотин-DS6, захваченного нанесенным на планшет козьим антителом против IgG мыши (фиг. 8 А), либо нанесенного непосредственно на планшет для ELISA (фиг. 8 В). На фиг. 9 представлены последовательности кДНК и аминокислотные последовательности вариабельных областей легкой цепи (фиг. 9 А) и тяжелой цепи (фиг. 9 В) мышиного антитела DS6. В каждой последовательности подчеркнуты три участка CDR (согласно определению Кабата). На фиг. 10 представлены участки CDR легкой (фиг. 10 А) и тяжелой цепи (фиг. 10 В) мышиного антитела DS6, определенные по правилам Кабата. Моделирование с помощью программы AbM дает несколько другую картину для участков CDR тяжелой цепи (фиг. 10 С). На фиг. 11 представлены аминокислотные последовательности легкой цепи ("muDS6LC") (остатки 1-95 в SEQ ID NO: 7) и тяжелой цепи ("muDS6HC") (остатки 1-98 в SEQ ID NO: 9) мышиного антителаDS6, сопоставленные с эмбриональными последовательностями генов IgVk ap4 (SEQ ID NO: 23) и IgVhJ558.41 (SEQ ID NO: 24). Серым цветом обозначено расхождение последовательностей. На фиг. 12 представлены десять последовательностей легких цепей и тяжелых цепей, наиболее гомологичных последовательностям легкой цепи ("muDS6LC") и тяжелой цепи ("muDS6HC") мышиного антитела DS6, по которым имеются файлы разрешенных структур в базе данных Brookhaven. Последовательности расположены в порядке от наибольшей до наименьшей гомологии. На фиг. 13 представлены данные и расчеты по поверхностной доступности для прогнозирования тех остатков вариабельных областей легкой цепи мышиного антитела DS6, которые доступны с поверхности. Положения, имеющие среднюю поверхностную доступность в 25-35% и отмеченные как ,подвергали второму циклу анализа. Вариабельные области легкой цепи (фиг. 13 А) и вариабельные области тяжелой цепи (фиг. 13 В) антитела DS6. На фиг. 14 представлена карта экспрессионной плазмиды для млекопитающих prDS6 v1-0. Эту плазмиду использовали для создания и экспрессии рекомбинантных химерных и гуманизованных антител DS6. На фиг. 15 представлены аминокислотные последовательности вариабельных доменов легкой цепи На фиг. 16 представлена последовательность кДНК и аминокислотная последовательность вариабельной области легкой цепи гуманизованного антитела DS6 ("huDS6")(1.01 и 1 .21). На фиг. 17 представлена последовательность кДНК и аминокислотная последовательность вариабельной области тяжелой цепи варианта 1.01 (фиг. 17 А) и 1.21 (фиг. 17 В) гуманизованного антитела DS6("huDS6"). На фиг. 18 представлены полученные методом проточной цитометрии кривые связывания мышиного DS6 (muDS6), химерного DS6 (chDS6), варианта 1.01 (huDS6 v1.01) и варианта 1.21 (huDS6 v1.21) гуманизованного DS6 из опыта, проведенного на клетках KB. Авидности мышиных, химерных и гуманизованных (v1.01 и v1.21) антител DS6 (muDS6 = 0,82 нМ, chDS6 = 0,69 нМ, huDS6vl.01 = 0,82 нМ иhuDS6v1.21 = 0,85 нМ) сравнимы, свидетельствуя о том, что перестройка поверхности не привела к уменьшению авидности. На фиг. 19 представлены результаты анализа конкуренции за связывание антител muDS6, chDS6,huDS6v1.01 и huDS6v1.21 с биотинилированным muDS6. Различные концентрации "голых" muDS6,chDS6, huDS6v1.01 и huDS6vl.21 комбинировали с 2 нМ биотин-muDS6 и стрептавидин-DTAF (вторичным антителом). Значения IC50 (muDS6 = 1,9 нМ, chDS6 = 1,7 нМ, huDS6v1.01 = 3,0 нМ и huDS6v1.21 = 1,9 нМ) у всех антител были близкими, свидетельствуя о том, что гуманизация не привела к уменьшению авидности. На фиг. 20 представлены результаты определения аффинности связывания неконъюгированного антитела DS6 по сравнению с конъюгатом антитело DS6-DM1. Результаты показали, что конъюгирование сDM1 не оказывает отрицательного эффекта на аффинность связывания антитела. Кажущееся значение Kd у конъюгата антитело DS6-DM1 (3,902 нМ) ("DS6-DM1") было слегка выше, чем у "голого" антитела(2,020 нМ) ("DS6"). На фиг. 21 представлены результаты косвенного определения жизнеспособности клеток с помощью антитела DS6 в присутствии и в отсутствие конъюгата антител против IgG (H+L) мыши с DM1 (2AbDM1). Антиген-положительные клетки Caov-3 погибали зависящим от антитела DS6 образом (IC50 = 424,9 пМ) только в присутствии вторичного конъюгата ("DS6 + 2Ab-DM1"). На фиг. 22 представлены результаты анализа комплемент-зависимой цитотоксичности (CDC) антитела muDS6. Результаты показывают отсутствие эффекта типа CDC у антитела DS6 на клетки HPAC(фиг. 22 А) и ZR-75-1 (фиг. 2 В). На фиг. 23 представлены результаты анализа цитотоксичности in vitro конъюгата антитело DS6DM1 по сравнению со свободным майтансином. Клоногенным методом тестировали на цитотоксичность положительные по антигену DS6 клетки раковых линий яичников (фиг. 23 А), молочной железы (фиг. 23 В), шейки матки (фиг. 23 С) и поджелудочной железы (фиг. 23D) при непрерывном воздействии конъюгата антитело DS6-DM1 (слева). Клетки этих линий таким же образом тестировали на чувствительность к майтансину при воздействии свободного майтансина в течение 72 ч (справа). При тестировании использовали следующие линии раковых клеток: из яичников - OVCAR5, TOV-21G, Caov-4 и Caov-3; молочной железы - T47D, ВТ-20 и ВТ-483; шейки матки - KB, HeLa и WISH; поджелудочной железы HPAC, Hs766T и HPAF-IL. На фиг. 24 представлены результаты анализа цитотоксичности in vitro конъюгата антитело DS6DM1. При определении жизнеспособности клеток методом МТТ раковые клетки яичников (фиг. 24 А,24 В и 24 С), молочной железы (фиг. 24D и 24 Е), шейки матки (фиг. 24F и 24G) и поджелудочной железы(фиг. 24H и фиг 24I) человека погибали зависящим от конъюгата антитело DS6-DM1 образом. "Голые"DS6 не оказывали отрицательного эффекта на рост этих клеток, свидетельствуя, что для цитотоксичности необходимо конъюгирование с DM1. На фиг. 25 А представлены результаты исследования противоопухолевого действия in vivo конъюгата антитело DS6-DM1 на привитые подкожно опухоли ксенотрансплантатов KB. Раковые клетки инокулировали в день 0, а первую обработку проводили в день 6. Обработку иммуноконъюгатом продолжали ежедневно до введения всех 5 доз. Контрольным животным, получавшим PBS, делали эвтаназию после того, как объем опухоли превышал 1500 мм 3. Конъюгат вводили в дозе 150 или 225 мкг/кг DM1, что соответствует концентрации антител 5,7 и 8,5 мг/кг, соответственно. Во время исследования регистрировали вес тела мышей (фиг. 25 В). На фиг. 26 представлены результаты исследования противоопухолевого действия конъюгата антитело DS6-DM1 на привитые подкожно ксенотрансплантаты опухолей. Клетки OVCAR5 (фиг. 26 А и 26 В),TOV-21G (фиг. 26C и 26D), НРАС (фиг. 26C и 26F) и HeLa (фиг. 26G и 26 Н) инокулировали в день 0, а обработку иммуноконъюгатом проводили в день 6 и 13. Контрольным животным, получавшим PBS, делали эвтаназию после того, как объем опухоли превышал 1000 мм 3. Конъюгат вводили в дозе 600 мкг/кгDM1, что соответствует концентрации антител 27,7 мг/кг. Во время исследования регистрировали объем опухолей (фиг. 26 А, 26C, 26 Е и 26G) и вес тела (фиг. 26 В, 26D, 26F и 26 Н) мышей. На фиг. 27 представлены результаты исследования действия конъюгата антитело muDS6-DM1 на внутрибрюшинные опухоли OVCAR5. Раковые клетки вводили внутрибрюшинно в день 0, а обработку иммуноконъюгатом проводили в день 6 и 13. Животным делали эвтаназию после того, как потеря веса тела превышала 20%. На фиг. 28 представлена полученная методом проточной цитометрии кривая связывания из исследования аффинности связывания "голых" и конъюгированных с таксаном антител DS6 на клетках HeLa. Конъюгирование с таксаном (MM1-202) не оказывает отрицательного эффекта на аффинность связывания антител. Кажущееся значение Kd у конъюгата DS6-MM1-202 (1,24 нМ) было слегка выше, чем у "голого" антитела DS6 (620 пМ). На фиг. 29 представлено связывание in vitro и активность конъюгата гуманизованного варианта 1.01 антитела DS6. Конъюгирование huDS6v1.01 с DM4 оказывает незначительное влияние на авидностьhuDS6v1.01 к клеткам KB (фиг. 29 А). Конъюгат huDS6vl.01-DM4 проявляет сильную цитотоксичность invitro на экспрессирующие DS6 клетки WISH, при этом значение IC50 составляет 0,44 нМ (фиг. 29 В). На фиг. 30 представлены результаты исследования действия in vivo конъюгата huDS6v1.01-DM4 на модели рака поджелудочной железы HPAC. Конъюгат huDS6v1.01-DM4 проявляет сильную противоопухолевую активность, тогда как контрольный конъюгат B4-DM4, мишень которого не экспрессируется на модели HPAC, практически не обладает активностью (фиг. 30 А). Вводимая доза 200 мкг/кг не была токсичной для животных, о чем свидетельствует отсутствие потери веса (фиг. 30 В). Осуществление изобретения Настоящее изобретение предусматривает, среди прочих особенностей, моноклональные антитела к СА 6, гуманизованные антитела к СА 6 и фрагменты антител к СА 6. Каждое из антител и фрагментов антител настоящего изобретения предназначено для распознавания и связывания с гликотопом СА 6 на поверхности клетки. Известно, что СА 6 экспрессируется во многих типах опухолей человека: 95% серозных карцином яичников, 50% эндометриозных карцином яичников, 50% новообразований шейки матки,69% новообразований эндометрия, 80% новообразований вульвы, 60% карцином молочной железы, 67% опухолей поджелудочной железы и 48% опухолей уротелиальных опухолей, но редко экспрессируется в нормальных тканях человека. В работе Kearse et al., Int. J. Cancer 88(6): 866-872 (2000) белок, на котором находится эпитоп СА 6,был ошибочно идентифицирован, как белок в 80 кДа, содержащий N-связанный углевод, который содержит эпитоп СА 6, когда они использовали супернатант гибридомы для его изучения. Используя очищенный DS6, мы после этого показали, что эпитоп СА 6 находится на О-связанном углеводе гликопротеида более 250 кДа, не связанного дисульфидными связями. Более того, гликопротеид был идентифицирован как муцин Mucl. Поскольку разные аллели Mucl имеют различное число тандемных повторов в домене вариабельного числа тандемных повторов (VNTR), то клетки зачастую экспрессируют два разных белка Mucl различного размера (Taylor-Papadimitriou, Biochem. Biophys. Acta 1455(2-3): 301-13(1999). Вследствие отличий по числу повторов в домене VNTR, а также отличий по гликозилированию,молекулярный вес Mucl различается в зависимости от клеточной линии. Чувствительность иммунореактивности СА 6 к йодной кислоте означает, что эпитоп СА 6 является углеводным "гликотопом". Кроме того, чувствительность иммунореактивности СА 6 к обработке нейраминидазой из Vibrio cholera означает, что эпитоп СА 6 является гликотопом, зависящим от сиаловой кислоты, то есть "сиалогликотопом". Подробные характеристики СА 6 можно найти в примере 2 (см. ниже). Дополнительные подробности о СА 6 можно найти в WO 02/16401; Wennerberg et al., Am. J. Pathol. 143(4): 1050-1054 (1993); Smith et(2002). Настоящее изобретение также включает цитотоксические конъюгаты, содержащие два первичных компонента. Первым компонентом является агент, связывающий клетку, который распознает и связывается с гликотопом СА 6. Агент, связывающий клетку, должен распознавать сиалогликотоп СА 6 на Mucl с высокой степенью специфичности с тем, чтобы цитотоксические конъюгаты распознавали и связывались только с теми клетками, для которых они предназначены. Высокая степень специфичности позволяет конъюгатам действовать направленным образом с незначительными побочными эффектами, возникающими из-за неспецифического связывания. В следующем воплощении агент, связывающий клетку, по настоящему изобретению также распознает гликотоп СА 6 с высокой степенью аффинности с тем, чтобы конъюгаты находились в контакте с клетками-мишенями в течение достаточного времени, позволяющего цитотоксической лекарственной части конъюгата действовать на клетку, и/или дающего конъюгатам достаточно времени, за которое они будут интернализованы клеткой. В предпочтительном воплощении цитотоксические конъюгаты включают в качестве агента, связывающего клетку, антитело к СА 6, более предпочтительно мышиное моноклональное антитело DS6 к СА 6. В более предпочтительном воплощении цитотоксические конъюгаты включают гуманизованное антитело DS6 или его эпитоп-связывающий фрагмент. Антитело DS6 способно распознавать СА 6 с высокой степенью специфичности и направляет цитотоксический агент к аномальной клетке или ткани типа раковых клеток целенаправленным образом. Вторым компонентом цитотоксических конъюгатов настоящего изобретения является цитотоксический агент. В предпочтительном воплощении цитотоксическим агентом является таксол, майтансиноид типа DM1 или DM4, СС-1065 или аналог СС-1065. В предпочтительных воплощениях агенты, связывающие клетки, по настоящему изобретению ковалентно соединяются, непосредственно либо через расщепляемый или нерасщепляемый линкер, с цитотоксическим агентом. Агенты, связывающие клетки, цитотоксические агенты и линкеры рассмотрены более подробно ниже. Агенты, связывающие клетки Эффективность соединений настоящего изобретения в качестве терапевтических средств зависит от тщательного выбора соответствующего агента, связывающего клетку. Агенты, связывающие клетку, могут быть любого типа, известного в настоящее время или ставшего известным, причем не только пептиды. Агентом, связывающим клетку, может быть любое соединение, которое может связаться с клеткой как специфическим, так и неспецифическим образом. В общем, ими могут быть антитела (особенно моноклональные антитела), лимфокины, гормоны, факторы роста, витамины, молекулы переносчиков питательных веществ (к примеру, трансферрина) или любые другие молекулы либо вещества, связывающиеся с клетками. Более конкретные примеры агентов, связывающих клетку, которые можно использовать, включают:(c) фрагменты антител типа Fab, Fab' и F(ab')2, Fv (Parham., J. Immunol. 131: 2895-2902 (1983); Spring(f) гормоны, такие как инсулин, TRH (тиреотропин-высвобождающий гормон), MSH (меланоцитстимулирующий гормон), стероидные гормоны типа андрогенов и эстрогенов;(i) витамины, такие как фолат. Антитела Выбор надлежащего агента, связывающего клетку, является важным делом, которое зависит от того, какая популяция клеток должна стать мишенью, но в общем случае предпочтительны антитела, если имеется или может быть получено надлежащее антитело, более предпочтительно моноклональное антитело. Методы моноклональных антител позволяют получить чрезвычайно специфические агенты, связывающие клетку, в виде специфических моноклональных антител. В данной области особенно хорошо известны методы получения моноклональных антител путем иммунизации мышей, крыс, хомяков или любых других млекопитающих соответствующим антигеном, к примеру, интактными клетками мишени,выделенными из клеток мишени антигенами, целыми вирусами, ослабленными целыми вирусами и такими вирусными белками, как белки оболочки вируса. Также можно использовать сенсибилизированные клетки человека. Другим методом получения моноклональных антител является использование фаговых библиотек scFv (одноцепочечных вариабельных участков, в частности scFv человека (напр., см. Griffithset al., US Patent Nos. 5,885,793 и 5,969,108; McCafferty et al., WO 92/01047; Liming et al., WO 99/06587). Типичное антитело состоит из двух идентичных тяжелых цепей и двух идентичных легких цепей,которые соединяются дисульфидными связями. Вариабельная область представляет собой часть тяжелой цепи или легкой цепи антитела, которая отличается по последовательности от других антител и кооперативно участвует в связывании и специфичности каждого конкретного антитела к антигену. Обычно вариабельность не распределяется равномерно по вариабельным участкам антител. Как правило, она сосредоточена в трех сегментах вариабельной области, именуемых участками, определяющими комплементарность (CDR), или гипервариабельными участками, как в легкой цепи, так и в тяжелой цепи. Очень консервативные части вариабельных областей называют каркасными участками. Вариабельные области тяжелых и легких цепей содержат по четыре каркасных участка, которые в основном принимают конфигурацию -листа, при этом каждый каркасный участок соединяется тремя участками CDR, которые образуют петли, соединяющие структуры типа -листа, а в некоторых случаях сами входят в эти структуры типа -листа. Участки CDR в каждой цепи удерживаются близко друг к другу каркасными участками,при этом участки CDR из другой цепи вносят вклад в образование антигенсвязывающего сайта антител(Е.A. Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, 1991, NIH). Константная область входит в состав тяжелой цепи. Хотя она и не участвует непосредственно в связывании антитела с антигеном, но она выполняет различные эффекторные функции, такие как участие антитела в клеточной токсичности антител. Подходящим моноклональным антителом для применения в настоящем изобретении является мышиное моноклональное антитело DS6 (U.S. Patent No. 6,596,503; депонировано в ATCC под номером РТА-4449). Гуманизованные или поверхностно-перестроенные антитела DS6 Предпочтительно в качестве агента, связывающего клетку, по настоящему изобретению используется гуманизованное антитело к СА 6. Предпочтительным воплощением такого гуманизованного антитела является гуманизованное антитело DS6 или его эпитоп-связывающий фрагмент. Целью гуманизации является уменьшение иммуногенности чужеродного антитела типа мышиного антитела для введения его человеку, при сохранении полной аффинности связывания анигена и специфичности антитела. Гуманизованные антитела могут быть получены при помощи нескольких технологий, таких как перестройка поверхности и пересадка участков CDR. В настоящем изобретении в технологии перестройки поверхности применяется сочетание молекулярного моделирования, статистического анализа и мутагенеза для изменения не входящих в CDR поверхностей вариабельной области антител с тем, чтобы они были похожи на поверхности известных антител организма-хозяина. Подходы и методы перестройки поверхности антител, как и другие способы уменьшения иммуногенности антител в другом организме, изложены в US Patent 5639641 (Pedersen et al.), который включен в настоящее изобретение во всей полноте путем отсылки. Вкратце, в предпочтительном способе: (1) проводится сопоставление положений вариабельных областей тяжелой и легкой цепи ряда антител, чтобы получить такой набор выходящих на поверхность положений каркаса вариабельных областей тяжелой и легкой цепи, в котором совмещенные положения всех вариабельных областей будут идентичными по меньшей мере на 98%; (2) определяется набор выходящих на поверхность аминокислотных остатков каркаса вариабельных областей тяжелой и легкой цепи для антитела (или его фрагмента) грызуна; (3) устанавливается набор выходящих на поверхность аминокислотных остатков каркаса вариабельных областей тяжелой и легкой цепи, который более всего идентичен набору выходящих на поверхность аминокислотных остатков грызуна; (4) набор выходящих на поверхность аминокислотных остатков каркаса вариабельных областей тяжелой и легкой цепи, определенный на стадии 2, заменяется набором выходящих на поверхность аминокислотных остатков каркаса вариабельных областей тяжелой и легкой цепи,установленным на стадии 3, за исключением тех аминокислотных остатков, которые находятся в пределах 5 от любого атома любого остатка участков CDR антитела грызуна; и (5) вырабатывается гуманизованное антитело грызуна, которое обладает специфичностью связывания. Антитела могут быть гуманизированы при помощи ряда других методов, в том числе пересадки CDR (ЕР 0239400; WO 91/09967;U.S. Pat. Nos. 5530101 и 5585089), гиперхимеризации или перестройки поверхности (ЕР 0592106; ЕР 0519596; Padlan E.A., 1991, Molecular Immunology 28(4/5): 489-498; Studnicka G.M. et al., 1994, ProteinEngineering 7(6): 805-814; Roguska M.A. et al., 1994, PNAS 91: 969-973) и перетасовки цепей (US Pat. No. 5565332). Антитела человека могут быть получены рядом методов, известных в данной области, включая методы фагового дисплея. См. также US Pat. Nos. 4444887, 4716111, 5545806 и 5814318; и публикации международных патентных заявок WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741 (данные ссылки включены путем отсылки во всей полноте). В предпочтительном воплощении настоящее изобретение предусматривает гуманизованные антитела или их фрагменты, которые распознают новый сиалогликотоп (гликотоп СА 6) на муцине Mucl. В другом воплощении гуманизованные антитела или их эпитоп-связывающие фрагменты обладают дополнительной способностью к ингибированию роста клеток, экспрессирующих гликотоп СА 6. В более предпочтительных воплощениях представлены поверхностно-перестроенные или гуманизованные варианты антитела DS6, у которых выходящие на поверхность остатки антитела или его фрагментов подвергаются замене на легких и тяжелых цепях с тем, чтобы они стали более похожими на поверхности известных антител человека. Гуманизованные антитела DS6 или их эпитоп-связывающие фрагменты специфически распознают новый сиалогликотоп (гликотоп СА 6) на муцине Mucl. Более предпочтительно гуманизованные антитела DS6 или их эпитопосвязывающие фрагменты обладают дополнительной способностью к ингибированию роста клеток, экспрессирующих гликотоп СА 6. Гуманизованное антитело или его эпитоп-связывающий фрагмент может быть конъюгировано с лекарственным препаратом типа майтансиноида с образованием пролекарства, обладающего специфической цитотоксичностью к экспрессирующим антиген клеткам, направляя лекарство на сиалогликотоп СА 6 Mucl. Цитотоксические конъюгаты, включающие такие антитела и небольшие, сильно токсичные препараты (например, майтансиноиды, таксаны, аналоги СС-1065), могут применяться в качестве терапевтических препаратов для лечения раковых опухолей типа опухолей молочной железы и яичников. Гуманизованные варианты антитела DS6 по настоящему изобретению полностью в нем охарактеризованы в отношении соответствующих аминокислотных последовательностей вариабельных областей их легких и тяжелых цепей, последовательностей ДНК генов вариабельных областей их легких и тяжелых цепей, идентификации участков CDR, идентификации их поверхностных аминокислот и изложения способа их экспрессии в рекомбинантном виде. В одном воплощении представлены гуманизованные антитела или их эпитоп-связывающие фрагменты, содержащие тяжелую цепь, включающую участки CDR, имеющие аминокислотные последовательности, представленные SEQ ID NO: 1-3: При определении участков CDR тяжелой цепи с помощью моделирующей программы AbM они представлены SEQ ID NO: 20-22: В том же воплощении гуманизованные антитела или их эпитоп-связывающие фрагменты содержат легкую цепь, содержащую участки CDR, имеющие аминокислотные последовательности, представленные SEQ ID NO: 4-6: Также представлены гуманизованные антитела и их эпитоп-связывающие фрагменты, содержащие вариабельную область легкой цепи, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной SEQ ID NO: 7 или Также представлены гуманизованные антитела и их эпитоп-связывающие фрагменты, содержащие вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной SEQ ID NO: 9, SEQ В другом воплощении представлены гуманизованные антитела DS6 и их эпитоп-связывающие фрагменты, содержащие гуманизованную или поверхностно-перестроенную вариабельную область легкой цепи, имеющую аминокислотную последовательность, соответствующую SEQ ID NO: 8: Также представлены гуманизованные антитела DS6 и их эпитоп-связывающие фрагменты, содержащие гуманизованную или поверхностно перестроенную вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, соответствующую SEQ ID NO: 10 или SEQ ID NO: 11, соответственно: Гуманизованные антитела и их эпитоп-связывающие фрагменты по настоящему изобретению также могут включать такие варианты вариабельных областей легкой и/или тяжелой цепи, у которых поверхностные аминокислотные остатки человека вблизи от CDR заменены соответствующими поверхностными остатками muDS6 по одному или нескольким положениям, представленным звездочками в табл. 1(нумерация по Кабату), чтобы сохранить аффинность связывания и специфичность muDS6. Таблица 1 В настоящем изобретении раскрыты первичные аминокислотные последовательности и последовательности ДНК легких и тяжелых цепей антитела DS6 и их гуманизованных вариантов. Однако рамки настоящего изобретения не ограничиваются антителами и фрагментами, содержащими эти последовательности. Наоборот, в настоящее изобретение включены все антитела и фрагменты, которые специфически связываются с СА 6 как с уникальным опухолеспецифичным гликотопом на рецепторе Mucl. Предпочтительно антитела и фрагменты, которые специфически связываются с СА 6, также являются антагонистами биологической активности этого рецептора. Более предпочтительно такие антитела также практически лишены активности агониста. Таким образом антитела и фрагменты антител настоящего изобретения могут отличаться от антитела DS6 и его гуманизованных производных по аминокислотной последовательности каркаса, участков CDR и/или легкой цепи и тяжелой цепи, и тем не менее попадать в рамки настоящего изобретения. Участки CDR антитела DS6 были идентифицированы путем моделирования и были предсказаны их молекулярные структуры. Опять же, хотя участки CDR и важны для распознавания эпитопа, но они не являются основными для антител и фрагментов по изобретению. Соответственно, предусмотрены антитела и фрагменты, обладающие улучшенными свойствами, которые получают, к примеру, при созревании аффинности антител настоящего изобретения. Эмбриональный ген легкой цепи мыши IgVk ap4 и эмбриональный ген тяжелой цепи мыши IgVhJ558.41, из которых вероятно происходит DS6, представлены на фиг. 11 в сопоставлении с последовательностью антитела DS6. При сравнении идентифицированы вероятные соматические мутации в антителе DS6, в том числе несколько в участках CDR. Последовательности вариабельной области тяжелой цепи и легкой цепи антитела DS6, а также последовательности участков CDR антитела DS6 ранее не были известны и приводятся на фиг. 9 А и 9 В. Такая информация может использоваться для получения гуманизованных вариантов антитела DS6. Фрагменты антител Антитела настоящего изобретения включают как целые антитела, рассмотренные выше, так и эпитопосвязывающие фрагменты. В настоящем изобретении "фрагменты антител" охватывают любые части антитела, сохраняющие способность к связыванию с эпитопом, распознаваемым целым антителом, которые обычно именуются "эпитопосвязывающими фрагментами". Примеры фрагментов антител включают,не ограничиваясь этим, фрагменты Fab, Fab' и F(ab')2, Fv, одноцепочечные Fv (scFv), одноцепочечные антитела, связанные дисульфидными связями Fv (dsFv) и фрагменты, содержащие область VL ИЛИ VH. Эпитопосвязывающие фрагменты, в том числе одноцепочечные антитела, могут включать одни только вариабельные области или в сочетании с полным участком или частью следующего шарнирного участка доменов CH1, CH2 и CH3. Такие фрагменты могут содержать один или оба фрагмента Fab либо фрагмент F(ab')2. Предпочтительно фрагменты антител содержат все шесть участков CDR полного антитела, хотя функциональными являются и фрагменты, содержащие не все такие участки, скажем, три, четыре или пять CDR. Кроме то- 11020130 го, фрагменты могут принадлежать к любому или составлять комбинацию из представителей любого из следующих классов иммуноглобулинов: IgG, IgM, IgA, IgD или IgE, а также их подклассов. Фрагменты Fab и F(ab')2 могут быть получены путем протеолитического расщепления с помощью таких ферментов, как папаин (фрагменты Fab) или пепсин (фрагменты F(ab')2). Одноцепочечные фрагменты Fv (scFv) представляют собой эпитопосвязывающие фрагменты, содержащие по меньшей мере один фрагмент вариабельной области тяжелой (VH) антитела, соединенный по меньшей мере с одним фрагментом вариабельной области легкой цепи (VL) антитела. Линкером может быть короткий, гибкий пептид, выбранный таким образом, чтобы обеспечить правильную трехмерную укладку областей VL И VH после их соединения с тем, чтобы сохранилась специфичность связывания с молекулой мишени того целого антитела, из которого получен одноцепочечный фрагмент антитела. Через линкер карбоксильный конец последовательности VL или VH может ковалентно соединяться с аминокислотным концом комплементарной последовательности VL или VH. Одноцепочечные фрагменты антител настоящего изобретения содержат аминокислотные последовательности, содержащие по меньшей мере одну из вариабельных областей или участков комплементарности (CDR) целых антител, описанных в настоящем описании, но не содержат некоторых или всех константных доменов этих антител. Эти константные домены не нужны для связывания антигена, но они составляют большую часть структуры целых антител. Поэтому одноцепочечные фрагменты антител могут преодолеть некоторые проблемы, связанные с использованием антител, содержащих часть или весь константный домен. Например, одноцепочечные фрагменты антител обычно свободны от нежелательных взаимодействий между биологическими молекулами и константной областью тяжелой цепи или иной нежелательной биологической активности. Кроме того, одноцепочечные фрагменты антител являются значительно меньшими, чем целые антитела, поэтому они могут обладать большей капиллярной проницаемостью, чем целые антитела, что позволяет им более эффективно располагаться на и связываться с антигенсвязывающими сайтами мишени. К тому же фрагменты антител могут быть получены в сравнительно большом количестве в прокариотических клетках, что облегчает их получение. Более того,сравнительно небольшой размер одноцепочечных фрагментов антител делает менее вероятным индукцию иммунного ответа у реципиента, чем целые антитела. Одноцепочечные фрагменты антител могут быть созданы методами молекулярного клонирования,библиотеки фагового дисплея антител или сходными методами, хорошо известными специалистам. Эти белки можно продуцировать, к примеру, в эукариотических или прокариотических клетках, включая бактерии. Эпитоп-связывающие фрагменты по настоящему изобретению также могут быть созданы различными методами фагового дисплея, известными в данной области. В методах фагового дисплеяфункциональные домены антител выставляются на поверхности частиц фага, несущих кодирующие их полинуклеотидные последовательности. В частности, такой фаг может быть использован для дисплея эпитопосвязывающих доменов, экспрессируемых из репертуара или комбинаторной библиотеки антител(напр., человека или мыши). Фаг, экспрессирующий эпитоп-связывающий домен, который связывается с нужным антигеном, может быть выбран или идентифицирован с помощью антигена, например, с помощью меченого антигена, связанного или фиксированного на твердой поверхности или шариках. Как правило, в этих методах используются нитчатые фаги, включая fd и М 13, при этом происходит экспрессия связывающих доменов из фага вместе с Fab, Fv или стабилизированными дисульфидными связями доменами Fv антител, слитыми рекомбинантным путем с белком гена III или гена VIII самого фага. Примеры методов фагового дисплея, которые могут быть использованы для получения эпитопосвязывающих фрагментов по настоящему изобретению, включают методы, изложенные в Brinkman et al.,1995, J. Immunol. Methods 182: 41-50; Ames et al., 1995, J. Immunol. Methods 184: 177-186; Kettleborough etal., 1994, Eur. J. Immunol. 24: 952-958; Persic et al., 1997, Gene 187: 9-18; Burton et al., Advances in Immunology 57: 191-280; заявке РСТ No. PCT/GB91/01134; публикациях РСТ WO 90/02809, WO 91/10737, WO 92/01047, WO 92/18619, WO 93/11236, WO 95/15982, WO 95/20401 и US Pat. Nos. 5698426, 5223409,5403484, 5580717, 5427908, 5750753, 5821047, 5571698, 5427908, 5516637, 5780225, 5658727, 5733743 и 5969108; которые все включены в настоящее изобретение путем отсылки во всей полноте. После селекции фага можно выделить участки фага, кодирующие фрагменты, и использовать их для создания эпитоп-связывающих фрагментов посредством экспрессии в выбранном организме хозяина,включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжей и бактерий, используя методы рекомбинантной ДНК, например, как описано подробно ниже. Например, для получения фрагментов Fab, Fab' и F(ab')2 можно использовать методы, известные в данной области типа тех, что изложены в публикации РСТ WO 92/22324; Mullinax et al., 1992, BioTechniques 12(6): 864-869; Sawai et al., 1995,AJRI 34: 26-34 и Better et al., 1988, Science 240: 1041-1043; которые включены путем отсылки во всей полноте. Примеры методов, которые могут быть использованы для получения одноцепочечных Fv и антител, включают методы, описанные в US. Pat. Nos. 4946778 и 5258498; Huston et al., 1991, Methods inEnzymology 203: 46-88; Shu et al., 1993, PNAS 90: 7995-7999; Skerra et al., 1988, Science 240: 1038-1040. Функциональные эквиваленты В рамки изобретения также входят функциональные эквиваленты антитела к СА 6 и гуманизованного антитела к СА 6. Термин "функциональные эквиваленты" охватывает антитела с гомологическими по- 12020130 следовательностями, химерные антитела, искусственные антитела и модифицированные антитела, к примеру, при этом каждый функциональный эквивалент определяется по способности к связыванию с СА 6. Специалисты должны понимать, что группа молекул, называемых "фрагментами антител", перекрывается с группой, именуемой "функциональными эквивалентами". Способы получения функциональных эквивалентов изложены, к примеру, в заявке РСТ WO 93/21319; европейской патентной заявкеNo. 239400; заявке РСТ WO 89/09622; европейской патентной заявке No. 338745 и европейской патентной заявке ЕР 332,424; которые все включены во всей полноте путем отсылки. Антитела с гомологическими последовательностями представляют собой такие антитела, у которых аминокислотные последовательности гомологичны аминокислотной последовательности антитела к СА 6 и гуманизованного антитела к СА 6 по настоящему изобретению. Предпочтительно гомологичность относится к аминокислотной последовательности вариабельных областей антитела к СА 6 и гуманизованного антитела к СА 6 по настоящему изобретению. "Гомологичность последовательности" в применении к аминокислотной последовательности в настоящем изобретении определяется как то, что последовательность по меньшей мере на 90, 91, 92, 93 или 94%, более предпочтительно на 95, 96, 97, 98 или 99% гомологична другой аминокислотной последовательности при определении, к примеру, методом поискаFASTA согласно Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85, 2444-2448 (1988). В настоящем изобретении химерное антитело означает такое антитело, у которого различные части происходят из разных видов животных. Например, антитело, содержащее вариабельную область из мышиного моноклонального антитела вместе с константной областью иммуноглобулина человека. Способы получения химерных антител известны в данной области. Например, см. Morrison, 1985, Science 229: 1202; Oi et al., 1986, BioTechniques 4: 214; Gillies et al., 1989, J. Immunol. Methods 125: 191-202; US Pat.Nos. 5807715, 4816567 и 4816397; которые включены в настоящее изобретение путем отсылки во всей полноте. Гуманизованные формы химерных антител получают путем замены участков комплементарности(CDR), к примеру, из антитела мыши в каркасный домен человека, например, см. РСТ Pub. No. WO 92/22653. Гуманизованные химерные антитела предпочтительно содержат константные области и вариабельные области, у которых участки комплементарности (CDR) не происходят практически или исключительно из соответствующих участков антител человека, а происходят практически или исключительно из других млекопитающих. Искусственные антитела охватывают фрагменты scFv, диантитела (diabody), триантитела (triabody),тетрантитела (tetrabody) и mru (см. обзоры Winter G. and Milstein С, 1991, Nature 349: 293-299; HudsonP.J., 1999, Current Opinion in Immunology 11: 548-557), которые все обладают способностью к связыванию антигена. У одноцепочечных фрагментов Fv (scFv) домены VH и VL антитела соединяются гибким пептидом. Как правило, такой пептид-линкер состоит примерно из 15 аминокислот. Если линкер намного меньше, к примеру, из 5 аминокислот, то образуются диантитела, которые представляют собой двухвалентные димеры scFv. Если же линкер уменьшить до менее трех аминокислотных остатков, то образуются тримерные и тетрамерные структуры, называемые триантителами и тетрантителами. Наименьшей связывающей единицей антитела является участок CDR, как правило, это CDR2 тяжелой цепи, который обладает достаточно специфичным распознаванием и связыванием, так что его можно использовать отдельно. Такой фрагмент называют молекулярной единицей распознавания, или mru. Несколько такихmru можно соединить короткими пептидами-линкерами, при этом образуется искусственный связывающий белок с более высокой авидностью, чем у одиночного звена mru. Функциональные эквиваленты по настоящей заявке также включают модифицированные антитела,напр., антитела, модифицированные ковалентным присоединением какой-нибудь молекулы к антителу. Так, модифицированные антитела охватывают такие антитела, которые подверглись модификации, напр.,гликозилированию, ацетилированию, ПЭГилированию, фосфорилированию, амидированию, образованию известных защитных/блокирующих групп, протеолитическому расщеплению, присоединению к клеточному лиганду или другому белку и т.п. Ковалентное присоединение не мешает выработке антиидиотипического ответа антитела. Такие модификации могут осуществляться известными методами,включая, но не ограничиваясь этим, специфическое химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина и др. Кроме того, модифицированные антитела могут содержать одну или несколько необычных аминокислот. Функциональные эквиваленты могут быть получены путем замены различных участков CDR на разных цепях в различных каркасах. Так, например, для данного набора CDR возможны разные классы антител при замене различных тяжелых цепей, при этом, к примеру, можно получить антитела типаIgG1-4, IgM, IgA1-2, IgD, IgE и их изотипов. Также в рамках настоящего изобретения искусственные антитела могут быть получены встраиванием данного набора CDR в полностью синтетический каркас. Функциональные эквиваленты можно легко получить при помощи мутации, делении и/или вставки в пределах вариабельной и/или константной области последовательности, обрамляющей определенный набор CDR, используя широкий спектр методов, известных в данной области. Фрагменты антител и функциональные эквиваленты по настоящему изобретению охватывают такие молекулы, которые обладают заметной степенью связывания с СА 6 по сравнению с антителом DS6. За- 13020130 метная степень связывания включает все значения в интервале как минимум 10-100%, предпочтительно по меньшей мере 50, 60 или 70%, более предпочтительно по меньшей мере 75, 80, 85, 90, 95 или 99% от связывающей способности мышиного антитела DS6 к СА 6. Усовершенствованные антитела Участки CDR имеют первостепенное значение для распознавания эпитопа и связывания антитела. Тем не менее, можно произвести изменения в остатках, входящих в состав CDR, без ухудшения способности антитела к распознаванию и связыванию со своим эпитопом. Например, можно произвести изменения, не влияющие на распознавание эпитопа, но повышающие сродство антитела к эпитопу. Так, в рамки настоящего изобретения также включены и усовершенствованные варианты мышиных и гуманизованных антител, которые тоже специфически распознают и связываются с СА 6, предпочтительно с повышенной аффинностью. В нескольких исследованиях изучались эффекты введения одной или нескольких замен аминокислот в различных положениях последовательности антитела, исходя из первичной последовательности антитела, на такие его свойства, как связывание и уровень экспрессии (Yang W.P. et al., 1995, J. Mol. Biol., 254, 392-403; Rader С et al., 1998, Proc. Natl. Acad. Sci. USA, 95, 8910-8915; Vaughan T.J. et al., 1998,Nature Biotechnology, 16, 535-539). В этих исследованиях создавались эквиваленты первичного антитела путем изменения последовательностей генов тяжелой и легкой цепи в районе CDR1, CDR2, CDR3 или каркасной области, используя такие методы, как направленный мутагенез с помощью олигонуклеотидов, кассетный мутагенез, подверженная ошибкам реакция ПЦР, перетасовка ДНК или штаммы-мутаторы Е. coli (Vaughan T.J. et al.,1998, Nature Biotechnology, 16, 535-539; Adey N.B. et al., 1996, Chapter 16, pp. 277-291, in "Phage Display ofPeptides and Proteins", Eds. Kay B.K. et al., Academic Press). Эти методы изменения последовательности первичного антитела привели к улучшению аффинности вторичных антител (Gram H. et al., 1992, Proc.Davies J. and Riechmann L., 1996, Immunotechnology, 2, 169-179; Thompson J. et al., 1996, J. Mol. Biol., 256,77-88; Short M.K. et al., 2002, J. Biol. Chem., 277, 16365-16370; Furukawa K. et al., 2001, J. Biol. Chem., 276,27622-27628). При аналогичной стратегии направленного изменения одного или нескольких аминокислотных остатков антитела можно использовать описанные в настоящем изобретении последовательности антител для разработки антител к СА 6 с улучшенными функциями, включая увеличение аффинности к СА 6. К усовершенствованным антителам также относятся антитела, обладающие улучшенными характеристиками, которые получены стандартными методами иммунизации животных, получения гибридомы и отбора антител с определенными характеристиками. Цитотоксические агенты Цитотоксическим агентом в цитотоксическом конъюгате настоящего изобретения может быть любое соединение, вызывающее гибель клетки или клеточную смерть либо тем или иным образом снижающее жизнеспособность клетки. Предпочтительными цитотоксическими агентами являются, к примеру, майтансиноиды и аналоги майтансиноидов, таксоиды, СС-1065 и аналоги СС-1065, доластатин и аналоги доластатина, определенные ниже. Эти цитотоксические агенты подвергаются конъюгированию с антителами, фрагментами антител, функциональными эквивалентами, усовершенствованными антителами и их аналогами, как изложено в настоящем изобретении. Цитотоксические конъюгаты могут быть получены методами in vitro. Для того чтобы соединить лекарственный препарат или пролекарство с антителом, используется соединительная группа. Подходящие соединительные группы хорошо известны в данной области и включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, подверженные пептидазам группы и подверженные эстеразам группы. Предпочтительными соединительными группами являются дисульфидные группы и тиоэфирные группы. Например, можно конструировать конъюгаты при помощи реакции обмена дисульфидов или образования тиоэфирной связи между антителом и препаратом или пролекарством. Майтансиноиды В число цитотоксических агентов, которые можно использовать в настоящем изобретении для образования цитотоксических конъюгатов, входят майтансиноиды и аналоги майтансиноидов. Примеры подходящих майтансиноидов включают майтансинол и аналоги майтансинола. Майтансиноиды представляют собой вещества, ингибирующие образование микротрубочек, которые сильно токсичны для клеток млекопитающих. Примеры подходящих аналогов майтансинола включают аналоги с модифицированным ароматическим кольцом и аналоги с модификациями по другим положениям. Такие подходящие майтансиноиды раскрыты в US Patent Nos. 4424219, 4256746, 4294757, 4307016, 4313946, 4315929, 4331598, 4361650,4362663, 4364866, 4450254, 4322348, 4371533, 6333410, 5475092, 5585499 и 5846545. Конкретные примеры подходящих аналогов майтансинола с модифицированным ароматическим кольцом включают:(3) С-20-деметокси, С-20-ацилокси (-OCOR), +/- С-19-дехлоро (US Pat. No. 4294757) (получают ацилированием с помощью хлорангидридов). Конкретные примеры подходящих аналогов майтансинола с модификациями по другим положениям включают:(1) C-9-SH (US. Pat. No. 4424219) (получают при реакции майтансинола с H2S или P2S5);(4) С-15-гидрокси/ацилокси (US. Pat. No. 4,364,866) (получают при превращении майтансинола с помощью Streptomyces);(7) 4,5-дезокси (US. Pat. No. 4371533) (получают восстановлением майтансинола с помощью трихлорида титана/LAH). В предпочтительном воплощении в качестве цитотоксического агента цитотоксических конъюгатов настоящего изобретения используют тиол-содержащий майтансиноид DM1, формально именуемый N2'деацетил-N2'-(3-меркапто-1-оксопропил)майтансином. DM1 представлен следующей структурной формулой I: В другом предпочтительном воплощении в качестве цитотоксического агента цитотоксических конъюгатов настоящего изобретения используют тиол-содержащий майтансиноид N2'-деацетил-N2'-(4 метил-4-меркапто-1-оксопентил)майтансин. DM4 представлен следующей структурной формулой II: В следующих воплощениях изобретения могут использоваться другие майтансины, в том числе тиол- и дисульфид-содержащие майтансиноиды, несущие моно- или диалкильное замещение на атоме углерода, несущем атом серы. К ним относятся майтансиноиды, содержащие в положении С-3, С-14 гидроксиметила, С-15-гидрокси или С-20-десметила боковую цепь ацилированной аминокислоты с ацильной группой, несущей блокированную сульфгидрильную группу, причем атом углерода ацильной группы, несущей функциональную группу тиола, содержит один или два заместителя, которыми являются СН 3, С 2 Н 5, линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода,циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал, при этом одним из заместителей может быть Н, а ацильная группа имеет линейную цепь длиной по меньшей мере в три атома углерода между функциональной группой карбонила и атомом серы. К таким дополнительным майтансинам относятся соединения, представленные формулой IIIR1 и R2 независимо друг от друга означают СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероцикический радикал, при этом R2 может означать Н; А, В, D означают циклоалкил или циклоалкенил, содержащий 3-10 атомов углерода, простой или замещенный арил либо гетероциклический ароматический или гетероциклический радикал;R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо друг от друга означают Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал;l, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5 при условии,что по крайней мере два из них не равны 0 одновременно; иZ означает Н, SR или -COR, где R означает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический ароматический или гетероциклический радикал. Предпочтительные воплощения формулы III включают соединения формулы III, у которыхR1 и R2 означают метил, a Z означает -SCH3. К таким дополнительным майтансинам также относятся соединения, представленные формулой IV-L, IVD или IV-D, L:R1 и R2 независимо друг от друга означают СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал, при этом R2 может означать Н;R3, R4, R5, R6, R7 и R8 независимо друг от друга означают Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал;l, m и n независимо друг от друга означают целое число от 1 до 5, при этом n может означать 0;Z означает Н, SR или -COR, где R означает линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический ароматический или гетероциклический радикал; иMay означает майтансиноид, несущий в положении С-3, С-14-гидроксиметила, С-15-гидрокси или С-20-десметила боковую цепь. Предпочтительные воплощения формул IV-L, IV-D и IV-D, L включают соединения формул IV-L,IV-D и IV-D,L, у которыхR1 и R2 означают метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n = 0, a Z означает SCH3. Предпочтительно цитотоксический агент представлен формулой IV-L. К таким дополнительным майтансинам также относятся соединения, представленные формулой VR1 и R2 независимо друг от друга означают СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал, при этом R2 может означать Н;R3, R4, R5, R6, R7 и R8 независимо друг от друга означают Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал;l, m и n независимо друг от друга означают целое число от 1 до 5, при этом n может означать 0; иZ означает Н, SR или -COR, где R означает линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический ароматический или гетероциклический радикал. Предпочтительные воплощения формулы V включают соединения формулы V, у которыхR1 и R2 означают метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n = 0, a Z означает SCH3. К таким дополнительным майтансинам также относятся соединения, представленные формулой VIL, VI-D или VI-D,L:R1 и R2 независимо друг от друга означают СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал, при этом R2 может означать Н;R3, R4, R5, R6, R7 и R8 независимо друг от друга означают Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал; 1, m и n независимо друг от друга означают целое число от 1 до 5, при этом n может означать 0;Z2 означает SR или -COR, где R означает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический ароматический или гетероциклическийMay означает майтансиноид. К таким дополнительным майтансинам также относятся соединения, представленные формулой VIIR1 и R2 независимо друг от друга означают СН 3, C2H5, линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал, при этом R2 может означать Н; А, В и D независимо друг от друга означают циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический ароматический или гетероциклоалкильный радикал;R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо друг от друга означают Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал;l, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5 при условии,что по крайней мере два из них не равны 0 одновременно; иZ2 означает SR или -COR, где R означает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил либо гетероциклический ароматический или гетероциклический радикал. Предпочтительные воплощения формулы VII включают соединения формулы VII, у которых R1 означает метил, a R2 означает Н. Вышеприведенные майтансиноиды могут быть конъюгированы с антителом DS6 к СА 6 либо его гомологом или фрагментом, причем антитело соединяется с майтансиноидом с помощью функциональной группы тиола или дисульфида, которая находится на ацильной группе боковой цепи ацилированной аминокислоты, находящейся в положении С-3, С-14-гидроксиметила, С-15-гидрокси или С-20-десметила майтансиноида, причем ацильная группа боковой цепи ацилированной аминокислоты содержит функциональную группу тиола или дисульфида, которая находится на атоме углерода, содержащем один или два заместителя, которыми являются СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал, при этом одним из заместителей может быть Н, а ацильная группа имеет линейную цепь длиной,по меньшей мере, в три атома углерода между функциональной группой карбонила и атомом серы. Предпочтительным конъюгатом настоящего изобретения является конъюгат, включающий антитело DS6 к СА 6 либо его гомолог или фрагмент, конъюгированный с майтансиноидом формулы VIII где Y1' означает (CR7R8)l(CR9=R10)p(C=C)qAo(CR5R6)mDu(CR11=CR12)r(C=C)sBt(CR3R4)nCR1R2S-, где А, В и D независимо друг от друга означают циклоалкил или циклоалкенил, содержащий 3-10 атомов углерода, простой или замещенный арил либо гетероциклический ароматический или гетероциклический радикал;R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо друг от друга означают Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал; иl, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5 при условии,что по крайней мере два из них не равны 0 одновременно. Предпочтительно R1 означаетметил, а R2 означает Н, либо R1 и R2 означают метил. Еще более предпочтительным конъюгатом настоящего изобретения является конъюгат, включающий антитело DS6 к СА 6 либо его гомолог или фрагмент, конъюгированный с майтансиноидом формулыR1 и R2 независимо друг от друга означают СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, гетероциклический ароматический или гетероциклический радикал, при этом R2 может означать Н;R3, R4, R5, R6, R7 и R8 независимо друг от друга означают Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклический радикал;l, m и n независимо друг от друга означают целое число от 1 до 5, при этом п может означать 0; иMay означает майтансиноид, несущий в положении С-3, С-14-гидроксиметила, С-15-гидрокси или С-20-десметила боковую цепь. Предпочтительные воплощения формул IX-L, IX-D и IX-D,L включают соединения формул IX-L,IX-D и IX-D,L, у которых:R1 и R2 означают метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, n =0. Предпочтительно цитотоксический агент представлен формулой IX-L. Еще одним предпочтительным конъюгатом настоящего изобретения является конъюгат, включающий антитело DS6 к СА 6 либо его гомолог или фрагмент, конъюгированный с майтансиноидом формулы где заместители соответствуют определениям для приведенной выше формулы IX. Особенно предпочтительны любые из вышеописанных соединений, у которых R1 означает Н, R2 - метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, а n = 0. Еще более предпочтительны любые из вышеописанных соединений, у которых R1 и R2 означают метил, R5, R6, R7 и R8 независимо означают Н, l и m равны 1, а n = 0. Кроме того, предпочтительны L-аминоацильные стереоизомеры. В цитотоксических конъюгатах настоящего изобретения могут использоваться все майтансиноиды,приведенные в находящейся на рассмотрении патентной заявке США 10/849,136 от 20 мая 2004 г. Все содержание патентной заявки США 10/849,136 включено в настоящее изобретение путем отсылки. Дисульфид-содержащие соединительные группы Для соединения майтансиноида с агентом, связывающим клетку, типа антитела DS6 майтансиноид должен включать соединительную часть. Соединительная часть содержит химическую связь, позволяющую высвобождение полностью активных майтансиноидов в определенном месте. Подходящие химические связи хорошо известны в данной области и включают дисульфидные связи, кислотолабильные связи, фотолабильные связи, подверженные пептидазам связи и подверженные эстеразам связи. Предпочтительными являются дисульфидные связи. Соединительная часть также включает реакционно-способную химическую группу. В предпочтительном воплощении реакционно-способная химическая группа может быть ковалентно связана с майтансиноидом через дисульфидную связь соединительной части. Особенно предпочтительными реакционно-способными химическими группами являются Nсукцинимидиловые эфиры и N-сульфосукцинимидиловые эфиры. Особенно предпочтительными майтансиноидами, включающими соединительную часть, содержащую реакционно-способную химическую группу, являются С-3-эфиры майтансинола и его аналогов, у которых соединительная часть содержит дисульфидную связь, а химическая реакционно-способная группа включает N-сукцинимидиловый эфир или N-сульфосукцинимидиловый эфир. Многие положения на майтансиноидах могут служить для химической связи с соединительной частью. Например, следует ожидать, что будут полезными положение С-3, содержащее гидроксильную группу, положение С-14, модифицированное гидроксиметилом, положение С-15, модифицированное гидроксилом, и положение С-20, содержащее гидроксильную группу. Однако предпочтительным является положение С-3, а особенно предпочтительным является положение С-3 майтансинола. Несмотря на то, что синтез эфиров майтансинола, содержащих соединительную часть, описан в отношении соединительных частей, содержащих дисульфидную связь, специалисты в этой области должны понимать, что в настоящем изобретении можно использовать соединительные части и с другими химическими связями (как описано выше), а также и другие майтансиноиды. Конкретные примеры других химических связей включают кислотолабильные связи, фотолабильные связи, подверженные пептидазам связи и подверженные эстеразам связи. Содержание патента США 5208020, включенного в настоящее изобретение, предусматривает получение майтансиноидов, несущих такие связи. Синтез майтансиноидов и их производных, содержащих дисульфидную часть, несущую реакционно-способную группу, описан в патентах США 6441163 и 6333410 и заявке США 10/161651, которые включены в настоящее изобретение путем отсылки. Майтансиноиды, содержащие реакционно-способные группы, к примеру, DM1, подвергают реакции с антителом, к примеру, антителом DS6, получая цитотоксические конъюгаты. Такие конъюгаты могут быть очищены методом HPLC или гель-фильтрации. Некоторые отличные схемы получения таких конъюгатов антитело-майтансиноид представлены в патенте США 6333410 и заявках США 09/867598, 10/161,651 и 10/024,290, которые включены в настоящее изобретение во всей полноте. В общем, раствор антитела в водном буфере можно проинкубировать с молярным избытком майтансиноидов, содержащих дисульфидную часть, несущую реакционно-способную группу. Реакционную смесь можно остановить добавлением избытка амина (к примеру, этаноламина, таурина и др.). Затем конъюгат майтансиноид-антитело можно очистить методом гель-фильтрации. Число молекул майтансиноида, связанных с одной молекулой антитела, можно определить по спектрофотометрическому измерению соотношения поглощения при 252 нм и 280 нм. Предпочтительно в среднем 1-10 молекул майтансиноида на молекулу антитела. Конъюгаты антител с препаратами майтансиноидов можно исследовать на их способность к подавлению пролиферации различных нежелательных линий клеток in vitro. Например, для оценки цитотоксичности этих соединений можно с легкостью использовать такие клеточные линии, как клетки эпидермоидной карциномы человека А-431, клетки мелкоклеточного рака легких человека SW2, клетки опухоли молочной железы человека SKBR3 и клетки лимфомы Беркитта Namalwa. Клетки для исследования можно подвергнуть воздействию соединений на 24 ч и измерить долю выживших клеток прямо в опыте известными методами. Затем из полученных результатов можно вычислить значения IC50. ПЭГ-содержащие соединительные группы Майтансиноиды также можно соединить с агентами, связывающими клетку, с помощью ПЭГсодержащих соединительных групп, как изложено в заявке США 10/024,290. Такие содержащие ПЭГ соединительные группы растворимы как в воде, так и в неводных растворителях, и могут быть использованы для соединения одного или нескольких цитотоксических агентов с агентом, связывающим клетку. Примеры ПЭГ-содержащих соединительных групп включают гетеробифункциональные линкеры на основе ПЭГ, которые связываются с цитотоксическими агентами и агентами, связывающими клетку, на противоположных концах линкеров через функциональную сульфгидрильную или дисульфидную группу на одном конце и активный эфир на другом конце. В качестве общего примера синтеза цитотоксического конъюгата с помощью ПЭГ-содержащей соединительной группы можно опять привести заявку США 10/024290 в отношении конкретных деталей. Синтез начинается с реакции одного или нескольких цитотоксических агентов, несущих реакционноспособную группировку ПЭГ, с агентом, связывающим клетку, что приводит к вытеснению концевого активного эфира из каждой реакционноспособной молекулы ПЭГ аминокислотным остатком агента, связывающего клетку, с образованием цитотоксического конъюгата, включающего один или несколько цитотоксических агентов, ковалентно связанных с агентом, связывающим клетку, через ПЭГ-содержащую соединительную группу. Таксаны Цитотоксическим агентом в цитотоксических конъюгатах по настоящему изобретению также может быть таксан или его производное. Таксаны представляют собой семейство соединений, включающее паклитаксель (таксол), натуральный цитотоксический препарат, и доцетаксель (таксотер), его полусинтетическое производное, то есть два соединения, которые широко применяются при лечении рака. Таксаны являются ядами для митотического веретена, которые ингибируют деполимеризацию тубулина, что ведет к гибели клетки. Хотя доцетаксель и паклитаксель являются полезными средствами при лечении рака, однако их противораковая активность ограничена вследствие неспецифической токсичности в отношении нормальных клеток. Кроме того, соединения типа паклитакселя и доцетакселя сами по себе не являются достаточно сильнодействующими для использования в конъюгатах с агентами, связывающими клетку. Предпочтительным таксаном для получения цитотоксических конъюгатов является таксан формулы Способы синтеза таксанов, пригодных для цитотоксических конъюгатов настоящего изобретения,вместе с методами конъюгирования таксанов с агентами, связывающими клетку, типа антител, подробно описаны в патентах США 5416064, 5475092, 6372738 и 6436931 и заявках США 10/024290,10/144042, 10/207814, 10/210112 и 10/369563. Аналоги СС-1065 Цитотоксическим агентом в цитотоксических конъюгатах по настоящему изобретению также может быть СС-1065 или его производное. СС-1065 является сильнодействующим противоопухолевым антибиотиком, который выделен из культуральной жидкости Streptomyces zelensis. СС-1065 примерно в 1000 раз более активен in vitro, чем такие распространенные противораковые препараты, как доксорубицин, метотрексат и винкристин (В.K.Bhuyan et al., Cancer Res.,42, 3532-3537 (1982. СС-1065 и его аналоги раскрыты в патентах США 6372738, 6340701, 5846545 и 5585499. Цитотоксическая активность СС-1065 коррелирует с его алкилирующим действием и связыванием с ДНК или интеркалированием в ДНК. Эти две активности принадлежат разным частям молекулы. Так,алкилирующее действие присуще циклопропапирролоиндоловой (CPI) субъединице, а связывание с ДНК свойственно двум пирролоиндоловым субъединицам. Несмотря на то, что СС-1065 как цитотоксический агент обладает некоторыми привлекательными характеристиками, он имеет ограничения при терапевтическом применении. Введение СС-1065 мышам вызывало отсроченную гепатотоксичность и приводило к смертельному исходу на 50-й день после однократной внутривенной дозы в 12,5 мкг/кг (V.L. Reynolds et al., J. Antibiotics, XXIX, 319-334 (1986. Это ускорило попытки разработать аналоги, не вызывающие отсроченной гепатотоксичности, и был описан синтез более простых аналогов наподобие СС-1065 (М.А. Warpehoski et al., J. Med. Chem., 31, 590603(1988. У следующей серии аналогов молекулу CPI заменили молекулой циклопропабензиндола (CBI) (D.L.(1991. Эти соединения сохраняют высокую активность in vitro исходного соединения, не вызывая отсроченной токсичности у мышей. Как и СС-1065, эти соединения являются алкилирующими реагентами,которые связываются с малой бороздкой ДНК ковалентным образом, вызывая гибель клетки. Но клиническая оценка наиболее перспективных аналогов, адозелесина и карзелесина, привела к неутешительным результатам (B.F. Foster et al., Investigational New Drugs, 13, 321-326 (1996); I. Wolff et al., Clin. CancerRes., 2, 1717-1723 (1996. Эти препараты проявляют слабые терапевтические эффекты вследствие их высокой системной токсичности. Терапевтическая эффективность аналогов СС-1065 может быть сильно улучшена при изменении распределения in vivo посредством направленной доставки на место опухоли, что приведет к уменьшению токсичности для остальных тканей и тем самым к снижению системной токсичности. Для достижения этой цели описаны конъюгаты аналогов и производных СС-1065 с агентами, связывающими клетку,специфически нацеленными на раковые клетки (патенты США 5475092, 5585499, 5846545). Как правило, эти конъюгаты проявляют высокую, специфичную к мишени цитотоксичность in vitro и исключительную противоопухолевую активность на моделях привитых опухолей человека у мышей (R.V.J. Chariet al., Cancer Res., 55, 4079-4084 (1995. Способы синтеза аналогов СС-1065, пригодных для цитотоксических конъюгатов настоящего изобретения, вместе с методами конъюгирования этих аналогов с агентами, связывающими клетку, типа антител, подробно описаны в патентах США 5,475,092, 5,846,545, 5,585,499, 6,534,660 и 6,586,618 и заявках США 10/116,053 и 10/265,452. Другие препараты Такие препараты, как метотрексат, даунорубицин, доксорубицин, винкристин, винбластин, мельфалан, митомицин С, хлорамбуцил, каличамицин, тубулизин и его аналоги, дуокармицин и его аналоги,доластатин и его аналоги также пригодны для получения конъюгатов настоящего изобретения. Молекулы лекарств также можно соединить с молекулами антител через молекулу промежуточного носителя типа сывороточного альбумина. Соединения доксарубицин и данорубицин, как описано, к примеру, вU.S. Serial No. 09/740991, также могут оказаться полезными цитотоксическими агентами. Терапевтические композиции Настоящее изобретение также предусматривает терапевтические композиции, включающие:(а) эффективное количество одного или нескольких цитотоксических конъюгатов,(б) фармацевтически приемлемый носитель. Также настоящее изобретение предусматривает способ торможения роста выбранных популяций клеток, включающий контактирование искомых клеток или ткани, содержащей искомые клетки, с эффективным количеством цитотоксического конъюгата или терапевтического средства, включающего цитотоксический конъюгат, одного или в сочетании с другими цитотоксическими или терапевтическими средствами. Настоящее изобретение также включает способ лечения субъекта, страдающего раком, с помощью терапевтической композиции настоящего изобретения. Цитотоксические конъюгаты могут быть исследованы в отношении активности и специфичности invitro ранее описанными методами (напр., см. R.V.J. Chari et al., Cancer Res., 55, 4079-4084 (1995. Противоопухолевую активность можно оценить на моделях привитых опухолей человека у мышей также ранее описанными методами (напр., см. Liu et al., Proc. Natl. Acad. Sci. USA, 93: 8618-8623 (1996. Подходящие фармацевтически приемлемые носители хорошо известны и могут быть установлены рядовым специалистом в данной области в соответствии с клинической ситуацией. В настоящем изобретении носители включают разбавители и наполнители. Примеры подходящих носителей, разбавителей и/или наполнителей включают: (1) физраствор Дюльбекко с фосфатным буфером, рН 7,4, содержащий или не содержащий от 1 мг/мл до 25 мг/мл сывороточного альбумина человека; (2) 0,9% физраствор (0,9% раствор NaCl); и (3) 5% раствор декстрозы; они могут также содержать антиоксидант типа триптамина и стабилизирующее вещество типа Tween 20. Способ торможения роста выбранных популяций клеток может выполняться in vitro, in vivo или exvivo. В настоящем изобретении торможение роста означает замедление роста клеток, снижение жизнеспособности клеток, причинение гибели клеток, лизирование клеток и индуцирование клеточной смерти как в течение короткого, так и продолжительного периода времени. Примеры применения in vitro включают обработку аутологического костного мозга перед трансплантацией его тому же пациенту с тем, чтобы уничтожить больные или злокачественные клетки; обработку костного мозга перед трансплантацией с тем, чтобы уничтожить компетентные Т-клетки и предотвратить отторжение трансплантата; обработку клеточных культур с тем, чтобы уничтожить все клетки за исключением нужных вариантов, не экспрессирующих антиген мишени; либо уничтожить варианты,экспрессирующие ненужный антиген. Условия неклинического применения in vitro может легко установить рядовой специалист в данной области. Примеры клинического применения ex vivo заключаются в удалении раковых клеток или лимфоидных клеток из костного мозга перед аутологической трансплантацией при лечении рака или при лечении аутоиммунных заболеваний; либо удалении Т-клеток и других лимфоидных клеток из аутологического или аллогенного костного мозга или ткани перед трансплантацией с тем, чтобы предотвратить отторжение трансплантата. Обработка может проводиться следующим образом. Костный мозг извлекают из пациента или иного индивидуума, а затем инкубируют в среде, содержащей сыворотку, в которую добавляют цитотоксического агента изобретения. Концентрации составляют от 10 мкМ до 1 пМ, на протяжении от 30 мин до 48 ч при 37 С. Точные условия концентрации и времени инкубации, т.е. дозировку,может легко установить рядовой специалист. После инкубации клетки костного мозга отмывают средой,содержащей сыворотку, и возвращают в организм пациента путем внутривенной инфузии согласно известным методам. В тех случаях, когда пациенту проводят другую обработку, к примеру, курс абляционной химиотерапии либо облучение всего организма между извлечением костного мозга и обратным введением обработанных клеток, обработанные клетки костного мозга хранят замороженными в жидком азоте, используя стандартное медицинское оборудование. Для клинического применения in vivo цитотоксический конъюгат изобретения должен храниться в виде раствора, который подвергают тестированию на стерильность и уровень эндотоксина. Примеры подходящих методик применения цитотоксических конъюгатов заключаются в следующем. Конъюгаты вводят внутривенно болюсом раз в неделю на протяжении 4 недель. Болюсные дозы вводятся в 50-100 мл физраствора, в который можно добавить 5-10 мл сывороточного альбумина человека. Дозировка составляет от 10 мкг до 100 мг за один раз внутривенно (от 100 нг до 1 мг/кг в день). Более предпочтительно дозировка составляет от 50 мкг до 30 мг. Наиболее предпочтительно дозировка составляет от 1 мг до 20 мг. После 4-недельного курса пациент может продолжать лечение по еженедельной схеме. Конкретные клинические методики в отношении способа применения, наполнителей, разбавителей, дозировки,времени и т.д. могут быть установлены рядовым специалистом в соответствии с клинической ситуацией. Примеры медицинских заболеваний, которые можно лечить в соответствии со способом уничтожения выбранных популяций клеток in vivo или ex vivo, включают злокачественные опухоли любого типа,в том числе, к примеру, рак легких, молочной железы, толстой кишки, простаты, почек, поджелудочной железы, яичников, шейки матки и лимфатических органов, остеосаркому, синовиальную карциному, саркому или карциному, при которой экспрессируется СА 6, и другие виды рака, еще неизвестные, при которых преимущественно экспрессируется гликотоп СА 6; аутоиммунные заболевания, такие как системная волчанка, ревматоидный артрит и множественный склероз; отторжение трансплантата, к примеру, отторжение почечного трансплантата, отторжение печеночного трансплантата, отторжение легочного трансплантата, отторжение сердечного трансплантата и отторжение трансплантата костного мозга; реакцию "трансплантат против хозяина"; вирусные инфекции, такие как mV-инфекция, ВИЧ-инфекция,СПИД и др.; и паразитарные инфекции, такие как жиардиаз, амебиаз, шистосомоз и др., что устанавливается рядовыми специалистами в данной области. Наборы Настоящее изобретение также включает наборы, например, включающие описанный цитотоксический конъюгат и инструкции по применению цитотоксического конъюгата для уничтожения определенных типов клеток. Инструкции могут включать указания по применению цитотоксических конъюгатов invitro, in vivo или ex vivo. Как правило, набор имеет отсек, содержащий цитотоксический конъюгат. Цитотоксический конъюгат может находиться в лиофилизованном виде, жидком виде или ином виде, в котором его можно включить в набор. Набор также может содержать дополнительные элементы, необходимые для выполнения способа, описанного в инструкции к набору, как-то стерильный раствор для растворения лиофилизованного порошка, дополнительные реагенты, объединяемые с цитотоксическим конъюгатом перед введением его пациенту, и приспособления, помогающие вводить конъюгат пациенту. Дополнительные воплощения Настоящее изобретение также предусматривает моноклональные антитела, гуманизованные антитела и их эпитопосвязывающие фрагменты, которые дополнительно помечены для применения в исследованиях или в диагностике. В предпочтительных воплощениях метка представляет собой радиоактив- 23020130 ную метку, флуорофор, хромофор, контрастирующее вещество или ион металла. Также предусматривается способ диагностики, в котором данные меченые антитела или их эпитопосвязывающие фрагменты вводятся субъекту, у которого есть подозрение на рак, и измеряется или отслеживается распределение метки в организме субъекта. Примеры Широкие рамки данного изобретения лучше всего раскрываются на следующих примерах, которые не предназначаются для ограничения изобретения конкретными воплощениями. Пример 1. Идентификация положительных и отрицательных по антигену клеточных линий при анализе связывания методом проточной цитометрии Использовали анализ методом проточной цитометрии для локализации эпитопа СА 6 антитела DS6 на поверхности клеток. Линии клеток человека получали из Американской коллекции типовых культур(АТСС) за исключением клеток OVCAR5 (Kearse et al., Int. J. Cancer 88(6): 866-872 (2000, OVCAR8 иIGROV1 (M. Seiden, Massachusetts General Hospital). Все клетки культивировали в среде RPMI 1640 с добавлением 4 мМ L-глутамина, 50 Ед/мл пенициллина, 50 мкг/мл стрептомицина (Cambrex BioScience,Rockland, ME) и 10% эмбриональной телячьей сыворотки (Atlas Biologicals, Fort Collins, CO), которая в дальнейшем именуется культуральной средой. Клетки содержали в увлажнительном инкубаторе при 37 С, 5% СО 2. Клетки (1-210-5 клеток на лунку) инкубировали на льду в течение 3-4 ч вместе с серийными разведениями антитела DS6, приготовленными на буфере FACS (2% козьей сыворотки, RPMI), в 96-луночных планшетах. Клетки осаждали в настольной центрифуге при 1500 об/мин 5 мин при 4 С. После удаления среды лунки снова заполняли 150 мкл буфера FACS. Затем повторяли отмывку. FITC-меченное козье антитело против IgG мыши (Jackson Immunoresearch) разводили 1:100 буфером FACS и инкубировали с клетками в течение 1 ч. на льду. Планшет закрывали фольгой, чтобы предотвратить фотообесцвечивание сигнала. После двух отмывок клетки фиксировали 1% формальдегидом и анализировали на проточном цитометре. Преимущественно эпитоп СА 6 обнаруживался в линиях клеток, происходящих из яичников, молочной железы, шейки матки и поджелудочной железы (табл. 3), как и предполагалось по данным иммуногистохимии опухолей. Однако некоторые линии клеток из других типов опухолей проявляли ограниченную экспрессию СА 6. Антитело DS6 связывается с кажущимся значением Kd в 135,6 пМ (на клетках РС-3, табл. 3). Максимальная средняя флуоресценция (табл. 3) на кривых связывания (фиг. 1) в положительных по антигену линиях клеток свидетельствует об относительной плотности антигена. Таблица 3 среднее значение максимальной относительной флуоресценции Пример 2. Характеристика эпитопа DS6 Свойства антигена СА 6 антитела DS6 анализировали методом иммуноблоттинга на дот-блотах лизатов СА 6-положительных клеток (Caov-3), подвергнутых расщеплению путем протеолитической и/или гликолитической обработки. В качестве положительного контроля тестировали другие антитела, распознающие целый ряд эпитопов, на лизатах антиген-положительных линий клеток (Caov-3 и СМ 1; Со 1 о 205 и С 242; SKMEL28 и R24). Антитело СМ 1 распознает белковый эпитоп из домена с вариабельным числом тандемных повторов (VNTR) Muc-1, и поэтому оно служит контролем на белковый эпитоп. С 242 связывается с новым гликотопом на Muc-1 (CanAg), связанным с сиаловой кислотой и специфичным для рака прямой и толстой кишки, который служит контролем на гликотоп на белке. R24 связывается с ганглиозидом GD3, специфичным для меланомы, и поэтому служит контролем на гликотоп на небелковом каркасе. Клетки Caov-3, Colо 205 и SKMEL28 высеивали на чашки для тканевой культуры диаметром 15 см. Культуральную среду (30 мл на чашку) меняли за день до лизирования. Модифицированный буфер RIPA(50 мМ трис-HCl рН 7,6, 150 мМ NaCl, 5 мМ ЭДТА, 1% NP40, 0,25% дезоксихолата натрия), ингибиторы протеаз (PMSF, пепстатин А, лейпептин и апротинин) и PBS предварительно охлаждали на льду. После отсасывания культуральной среды из чашек клетки дважды промывали 10 мл охлажденного PBS. Все последующие операции выполнялись на льду и/или в холодной комнате при 4 С. После удаления последней порции PBS клетки лизировали в 1-2 мл лизирующего буфера (буфера RIPA с добавлением свежих ингибиторов протеаз до конечной концентрации 1 мМ PMSF, 1 мкМ пепстатина А, 10 мкг/мл лейпептина и 2 мкг/мл апротинина). Лизаты отделяли от чашек с помощью съемника и суспендировали,пропуская 5-10 раз через пипетку с иглой 18G. Лизаты вращали в течение 10 мин, а затем центрифугировали в микроцентрифуге до максимума (13000 об/мин) в течение 10 мин. Осадки отбрасывали, а в супернатантах определяли белок с помощью набора для метода Брэдфорда (BioRad). Лизаты (2 мкл) наносили пипеткой прямо на сухие нитроцеллюлозные мембраны 0,2 мкм. Их оставляли сохнуть на воздухе примерно на 30 мин. Мембраны нарезали на кусочки, содержащие по одному пятну. Пятна инкубировали в присутствии проназы (1 мг/мл фермента, 50 мМ трис рН 7,5, 5 мМ CaCl2),протеиназы К (1 мг/мл фермента, 50 мМ трис рН 7,5, 5 мМ CaCl2), нейраминидазы (20 мЕд/мл фермента,50 мМ ацетата натрия рН 5, 5 мМ CaCl2, 100 мкг/мл BSA) или перйодной кислоты (20 мМ, 0,5 М ацетат натрия рН 5) в течение 1 ч при 37 С. Реагенты приобретали у фирмы Roche (ферменты) и VWR (перйодную кислоту). Мембраны отмывали (5 мин) буфером T-TBS (0,1% Tween 20, 1X TBS), блокировали в блокирующем буфере (3% BSA, T-TBS) в течение 2 ч при комнатной температуре и инкубировали в течение ночи с первичным антителом (т.е. DS6, СМ 1, С 242, R24) при 2 мкг/мл в блокирующем буфере при 4 С. Мембраны отмывали три раза по 5 мин буфером T-TBS, а затем инкубировали со вторым, конъюгированным с HRP козьим антителом против IgG мыши (или человека) (Jackson Immunoresearch); разведение 1:2000 в блокирующем буфере, в течение 1 ч при комнатной температуре. Иммуноблоты отмывали три раза и проявляли с помощью системы ECL (Amersham). Иммуноблоты (фиг. 2) подвергнутых расщеплению контрольных лизатов показали, что сигнал CM1 разрушается при протеолитической обработке, тогда как сигналы при гликолитической обработке не менялись, как и следовало ожидать от антитела, распознающего белковый эпитоп. Сигнал С 242 разрушался как при протеолитической, так и при гликолитической обработке, как и следовало ожидать от антитела,распознающего гликотоп, находящийся на белке. Сигнал R24, на который не влияла протеолитическая обработка, устранялся при обработке нейраминидазой или перйодатом, как и следовало ожидать от антитела, распознающего ганглиозид. Иммуноблоттинг DS6 на пятнах подвергнутого расщеплению лизатаCaov-3 проявлял потерю сигнала при обработке как протеолитическими, так и гликолитическими соединениями. Таким образом, как и С 242, DS6 связывается с углеводным эпитопом на белковом остове. Кроме того, сигнал при иммуноблоттинге DS6 оказался чувствительным к обработке нейраминидазой. Следовательно, СА 6, как и CanAg, является гликотопом, связанным с сиаловой кислотой. Для подтверждения углеводной природы СА 6 лизат Caov-3 наносили на мембрану PVDF и обрабатывали дегликозилирующим реагентом, трифторметансульфоновой кислотой (TFMSA), в атмосфере азота при комнатной температуре в течение 5 мин. Блот промывали буфером T-TBS и подвергали иммуноблоттингу с СМ 1 или с DS6 (фиг. 3). Сигнал DS6 разрушался при обработке кислотой, что дополнительно свидетельствует о том, что СА 6 представляет собой гликотоп. Усиление сигнала СМ 1 при обработкеTFMSA означает, что обработка кислотой не влияет на белок на фильтре и свидетельствует о том, что гликолитическая обработка демаскирует белковый эпитоп, распознаваемый СМ 1. Для дальнейшего выяснения структуры того углевода, на котором располагается СА 6, дот-блоты подвергали расщеплению N-гликаназой, О-гликаназой и/или сиалидазой (фиг. 4). Лизаты клеток Caov-3(100 мкг, 30 мкл) инкубировали при 100 С в течение 5 мин с 2,5 мкл денатурирующего буфера (Glyko),содержащего SDS и -меркаптоэтанол. Затем денатурированные лизаты подвергали расщеплению с помощью 1 мкл N-гликаназы, О-гликаназы и/или сиалидазы A (Glyko) при 37 С в течение 1 ч. После этого подвергнутые расщеплению лизаты наносили (2 мкл) на нитроцеллюлозу и подвергали иммуноблоттингу, как описано выше.N-гликаназа не оказывала заметного влияния на сигналы иммуноблота DS6. Однако образцы, обработанные сиалидазой, не давали никакого сигнала. Поскольку O-гликаназа не способна расщеплять сиалилированные О-связанные углеводы без предварительной обработки сиалидазой, сигнал DS6 в образцах, обработанных одной лишь О-гликаназой, не должен меняться. Напротив, для действия N-гликаназы не требуется предварительная обработка какими-либо гликозидазами. То, что обработка N-гликаназой не влияет на сигнал DS6, свидетельствует о том, что эпитоп СА 6, скорее всего, находится на сиалилированных цепях О-связанного углевода. Пример 3. Выявление антигена, на котором находится эпитоп СА 6 Для идентификации антигена, на котором находится эпитоп СА 6, иммунопреципитаты DS6 анализировали методами SDS-PAGE и вестерн-гибридизации. Супернатанты лизатов клеток (1 мл на образец,3-5 мг белка) осветляли при помощи шариков с белком G (30 мкл), уравновешенных в 1 мл буфера RIPA в течение 1-2 ч, с вращением, при 4 С. Все последующие операции выполнялись на льду и/или в холодной комнате при 4 С. Шарики быстро (2-3 с) осаждали в микроцентрифуге. Осветленные супернатанты переносили в новые пробирки и инкубировали в течение ночи с 2 мкг DS6, с вращением. В лизаты добавляли новые уравновешенные шарики с белком G (30 мкл) и инкубировали в течение 1 ч, с вращением. Суспензии шариков в лизатах подвергали кратковременному центрифугированию в микроцентрифуге и необязательно отбирали образцы лизатов после иммунопреципитации. Шарики отмывали 5-10 раз с помощью 1 мл буфера RIPA. Подвергнутые иммунопреципитации образцы DS6 затем расщепляли с помощью 30 мкл нейраминидазы (20 мЕд нейраминидазы (Roche), 50 мМ ацетата натрия рН 5, 5 мМ CaCl2, 100 мкг/мл BSA) или 30 мкл перйодной кислоты (20 мМ перйодной кислоты (VWR), 0,5 М ацетата натрия рН 5) в течение 1 ч при 37 С. Затем их ресуспендировали в 30 мкл 2-кратного буфера для нанесения образцов (содержащего-меркаптоэтанол). Шарики кипятили в течение 5 мин и супернатанты в буфере для нанесения образцов наносили на 4-12% или 4-20% гели с трис-глицином (Invitrogen). Гели разгоняли в буфере для электрофореза методом Леммли при 125 В в течение 1,5 ч. Образцы гелей подвергали переносу в течение ночи при 20 мА, на нитроцеллюлозные мембраны 0,2 мкм при помощи установки для переноса Mini Trans-blot(BioRad). Мембраны подвергали иммуноблоттингу с DS6, как описано выше в примере 2. В качестве альтернативы подвергнутые иммунопреципитации шарики сначала денатурировали, а затем подвергали энзиматическому расщеплению N-гликаназой, О-гликаназой и/или сиалидазой A(Glyko). Шарики ресуспендировали в 27 мкл инкубационного буфера и 2 мкл денатурирующего раствора(Glyko) и инкубировали при 100 С в течение 5 мин. После охлаждения до комнатной температуры добавляли раствор детергента (2 мкл) и инкубировали образцы с 1 мкл N-гликаназы, О-гликаназы и/или сиалидазы А при 37 С в течение 4 ч. После добавления 5-кратного буфера для нанесения образцов (7 мкл) образцы кипятили в течение 5 мин. Образцы подвергали SDS-PAGE и иммуноблоттингу, как описано выше.DS6 вызывает иммунопреципитацию полосы белка 250 кДа, которая наблюдается в лизатах антиген-положительных клеток (фиг. 5 А, В и С). В некоторых линиях клеток (Т-47D) наблюдается двойная полоса. Полоса 250 кДа устранялась в иммунопреципитатах, обработанных нейраминидазой или перйодной кислотой (фиг. 5 А и В), свидетельствуя о том, что эпитоп CA6 находится в полосе 250 кДа. Также оказалось, что полоса 250 кДа нечувствительна к обработке иммунопреципитатов нейраминидазой, что согласуется с тем, что CA6 располагается на О-связанном углеводе (фиг. 5F). Дополнительным подтверждением того, что полоса в 250 кДа представляет собой антиген CA6, является то, что DS6 не вызывает иммунопреципитации такой полосы из отрицательных по антигену DS6 клеток (фиг. 5D и 5 Е). Есть несколько доводов в пользу того, что антигеном СА 6 является Mucl. Вследствие большого молекулярного веса и чувствительности к гликолитичсским ферментам, специфичным к О-связанным углеводам, кажется весьма вероятным, что антиген СА 6 представляет собой муцин. Суперэкспрессия муцинов в опухолях хорошо изучена, особенно в опухолях молочной железы и яичников, что совпадает с основной реактивностью DS6 в отношении опухолей. Более того, СА 6, как и CanAg (сиалогликотоп наMucl), не подвержен осаждению перйодной кислотой, свидетельствуя о том, что антиген СА 6 сильно Огликозилирован. Тот факт, что в некоторых экспрессирующих DS6 клеточных линиях DS6 вызывал иммунопреципитацию двойной полосы 250 кДа, говорит о том, что СА 6 представляет собой Mucl. Отличительной особенностью Mucl у человека является наличие двух разных аллелей Mucl, отличающихся числом тандемных повторов, что приводит к экспрессии двух белков Mucl различного молекулярного веса. Для проверки того, что СА 6 находится на Mucl, иммунопреципитаты DS6 из лизата Caov-3 подвергали SDS-PAGE и иммуноблоттингу с антителом DS6 или с антителом СМ 1 к VNTR Mucl. Как видно из фиг. 6 А, СМ 1 дает сильную реакцию с полосой 250 кДа, иммунопреципитацию которой вызывает DS6. На фиг. 6 В иммунопреципитаты DS6 и СМ 1 из лизата клеток HeLa проявляют все ту же двойную полосу 250 кДа при иммуноблоттинге как с DS6, так и с СМ 1. Эти результаты показывают, что эпитоп СА 6 действительно локализуется на белке Мис-1. Двойная полоса от DS6, наблюдавшаяся в клетках HeLa (иT-47D), может объясняться тем, что экспрессия Muc-1 управляется разными аллелями, имеющими различное число тандемных повторов. Несмотря на то что СМ 1 и DS6 связываются с одним и тем же белком Мис-1, они являются разными эпитопами. Химическое дегликозилирование дот-блотов лизата Caov-3 с помощью трифторметансульфоновой кислоты (TFMSA) устраняло сигнал DS6 (фиг. 3). Однако та же обработка усиливала сигнал СМ 1. Видимо, дегликозилирование выявило скрытые эпитопы для антитела СМ 1. Более того, сравнение результатов по связыванию DS6 и СМ 1 методом проточной цитометрии (табл. 4) показывает, что эпитоп СА 6 существует не на всех клетках, экспрессирующих Mucl. Интересно то, что эпитоп СА 6 не экспрессируется на клетках линии Colo205 (табл. 3), у которых на высоком уровне экспрессируется сиалогликотоп CanAg Mucl. среднее значение максимальной относительной флуоресценции Пример 4. Количественный анализ сбрасываемого эпитопа СА 6 Поскольку эпитоп СА 6 располагается на молекуле Mucl, которая сбрасывается в кровоток у многих больных раком, то был предпринят количественный подход с целью определения того, не помешает ли такой уровень терапии с помощью антитела DS6. Связывание циркулирующего антитела с антигеном обычно ведет к быстрому выведению таких комплексов из крови. Если значительная доля введенной дозы антитела быстро удаляется из кровотока, то уменьшится количество, достигающее опухоли, что приведет к снижению противоопухолевой активности терапевтического антитела. При конъюгировании антитела с сильнодействующим цитотоксическим соединением быстрый клиренс конъюгата способен повысить неспецифическую токсичность. Таким образом, в случае таких конъюгатов антител с небольшими веществами, как DS6-DM1, можно ожидать, что высокий уровень сбрасываемого антигена вызовет снижение противоопухолевого эффекта и повышение ограничивающей дозировку токсичности. Недавние клинические испытания терапевтических антител дали информацию о влиянии концентрации сбрасываемого антигена на фармакокинетику. Например, при клинических испытаниях антитела трастузумаб (Herceptin), используемого для лечения экспрессирующего her2/neu метастазирующего рака молочной железы, фармакокинетика трастузумаба не менялась, когда уровень сбрасываемого her2/neu составлял менее 500 нг/мл (Pegram et al., J. Clin. Oncol. 16(8): 2659-71 (1998. При молекулярном весеher2/neu 110 000 дальтон молярная концентрация сбрасываемого her2/neu менее 4,5 нМ почти не влияет на фармакокинетику. В другом примере клинические испытания кантузумаб-мертансина (huC242-DM1) показали отсутствие корреляции между уровнем сбрасываемого CanAg (эпитопа С 242) перед обработкой и фармакокинетикой клиренса антител (Tolcher et al., J. Clin. Oncol. 21(2): 211-22 (2003. Эпитоп CanAg, как и эпитоп СА 6, распознаваемый DS6, является уникальным опухолеспецифичным О-связанным сиалогликотопом на Mucl. Однако гетерогенность эпитопа CanAg затрудняет его количественное определение в молях. В генеральной популяции аллели Mucl имеют разную длину в зависимости от числа тандемных повторов в домене с вариабельным числом тандемных повторов (VNTR). В каждом тандемном повторе имеется несколько сайтов О-гликозилирования. Сложности экспрессии CanAg способствует и колебания уровня собственной гликозилтрансферазной активности от клетки к клетке. Таким образом, даже у одного и того же пациента возможен широкий интервал числа эпитопов CanAg на молекуле Mucl. Более того, число эпитопов CanAg на одной молекуле Mucl будет разным по всей популяции пациентов. По этой причине уровень сбрасываемого CanAg в образцах сыворотки измеряют методом сэндвич-ELISA, в котором сброшенный Mucl с эпитопом CanAg фиксируется на С 242 и детектируется при помощи системы биотинилированное антитело С 242/стрептавидин-HRP. Сброшенный CanAg количественно выражают в стандартных единицах (ед.), пропорциональных количеству эпитопов на 1 мл сыворотки, а не в виде молярной концентрации Mucl. По аналогии такая же ситуация возникает и при количественном определении сброшенных эпитопов СА 6. Напротив, у трастузумаба есть только один эпитоп на одну сбрасываемую молекулу her2/neu, что сильно упрощает количественное определение сбрасываемого антигена. Для того, чтобы установить связь между уровнем сбрасываемого эпитопа СА 6 и уровнем, выявленным при клинических испытаниях трастузумаба и кантузумаб-мертансина, был разработан метод получения молярных концентраций таких сложных сбрасываемых эпитопов, как сиалогликотопы на Mucl. Во-первых, была составлена простая методика сэндвич-ELISA на DS6. Схема метода представлена на фиг. 7 А. Для фиксации Mucl с эпитопом СА 6 использовали DS6. Поскольку каждая молекула Mucl содержит несколько эпитопов СА 6, то еще использовали биотинилированное антитело DS6 в качестве трейсера. Биотинилированное DS6, связавшееся с фиксированным СА 6, детектировали с помощью стрептавидин-HRP, используя в качестве субстрата ABTS. Эпитоп СА 6 фиксировали из сыворотки больных раком яичников или из стандартов, полученных из коммерчески доступного набора для теста наMucl (CA15-3), который применяется для мониторинга сбрасываемого Mucl у больных раком молочной железы. Содержание DS6 в единицах на мл было произвольно приравнено к содержанию стандартов СА 15-3 в единицах на мл. На фиг. 7 В представлены результаты метода сэндвич-ELISA на DS6, для которых использовали стандарты СА 15-3. Полученная кривая очень близка к кривой, полученной со стандартами СА 15-3 при определении СА 15-3. Для того, чтобы перевести содержание DS6 в единицах на мл в молярную концентрацию СА 6, необходима стандартная кривая для биотинилированного DS6, на которой сигнал переводится в пикограммы DS6. При условии, что стехиометрия между эпитопом СА 6 и биотинилированнымDS6 равна 1:1, а молекулярный вес биотинилированного DS6 равен 160000 Да, можно рассчитать количество молей фиксированного СА 6 в одном объеме внесенного образца. На фиг. 8 А и В представлены два альтернативных способа получения стандартной кривой для биотинилированного DS6. На фиг. 8 А для фиксации биотинилированного DS6 использовали козье поликлональное антитело против IgG мыши, которое в свою очередь детектировали способом, идентичным тому,который использовался в методе сэндвич-ELISA на фиг. 7. В методе, представленном на фиг. 8 В, биотинилированное DS6 вносили непосредственно на планшет для ELISA и детектировали, как на фиг. 8 А. Как видно из фиг. 8 С, стандартные кривые для биотинилированного DS6, полученные каждым способом,хорошо совпадают друг с другом. В табл. 5 представлен анализ образцов сыворотки больных раком яичников на различные сбрасываемые антигены. Метод ELISA на СА 125 обычно применяется для мониторинга лечения больных раком яичников путем измерения сбрасываемого СА 125 в единицах на мл. Содержание СА 125 было проставлено на образцах сыворотки. Метод ELISA на СА 15-3 обычно применяется для мониторинга лечения больных раком молочной железы путем измерения сбрасываемого Mucl в единицах на мл с помощью фиксирующего и детектирующего антител, распознающих эпитопы, отличные от тех, которые распознает DS6. В табл. 5 измеряли СА 15-3 в образцах сыворотки больных раком яичников. Таблица 5 определяли с помощью набора для ELISA определяли по коммерческим стандартам СА 15-3 (1 ед. СА 15-3 = 1 ед. DS6) 3 стандартная кривая, козье антитело к IgG мыши + биотин-DS6 4 стандартная кривая, биотин-DS6 2 Для значений СА 15-3, приведенных в табл. 5, использовали коммерчески доступный набор для иммуноферментного анализа СА 15-3 от CanAg Diagnostics. Для значений DS6 в единицах на мл стандартную кривую составляли, используя стандарты СА 15-3 (из набора для иммуноферментного анализа СА 153 от CanAg Diagnostics) методом сэндвич-ELISA. DS6 в единицах на мл произвольно приравняли к единицам СА 15-3 на мл. В двух последних столбцах рассчитано содержание сбрасываемого СА 6 в пикомолях (пМ) по стандартным кривым для биотинилированного DS6, приведенным на фиг. 8 С. Для количественного анализа уровня CanAg использовали данные по уровню CanAg в сыворотке у пациентов, принимавших участие в клиническом испытании кантузумаб-мертансина перед лечением(Tolcher et al., J. Clin. Oncol. 21(2): 211-22 (2003. Для составления стандартной кривой по стандартамCanAg использовали методику ELISA, аналогичную той, что описана для DS6. Для фиксации стандартовABTS. Стандартную кривую для биотинилированного С 242 составляли так же, как и для биотинилированного DS6, что дало возможность перевести единицы/мл в молярные концентрации циркулирующих эпитопов CanAg. В табл. 6 приведены уровни CanAg у пациентов из клинического испытания кантузумаб-мертансина вместе с соответствующими рассчитанными молярными концентрациями циркулирующего CanAg.
МПК / Метки
МПК: C12P 21/06, C12N 5/07, A61K 39/395
Метки: антигену, способы, применения, конъюгат, содержащий, антитело, са6, конъюгата, цитотоксический, специфичное
Код ссылки
<a href="https://eas.patents.su/30-20130-specifichnoe-k-antigenu-sa6-antitelo-soderzhashhijj-ego-citotoksicheskijj-konyugat-i-sposoby-primeneniya-konyugata.html" rel="bookmark" title="База патентов Евразийского Союза">Специфичное к антигену са6 антитело, содержащий его цитотоксический конъюгат и способы применения конъюгата</a>
Предыдущий патент: Твердая лекарственная форма, обладающая анорексигенным действием (варианты)
Следующий патент: Пептиды скорпиона, блокирующие калиевые каналы человеческого т-лимфоцита, и способы их применения
Случайный патент: Замещённые тетралины и инданы и их применение












