Способы получения высокой плотности жизнеспособных клеток в культуре клеток млекопитающих
Формула / Реферат
1. Способ увеличения плотности жизнеспособных клеток в подпитываемых культурах эукариотических клеток, включающий следующие этапы:
a) культивирование эукариотической клеточной линии, экспрессирующей один или более гетерологичных генов устойчивости к апоптозу (апоптозныхR) и один или более представляющих интерес генов; и
b) поддержание высокого содержания глюкозы в среде в течение экспоненциальной и стационарной фаз роста клеточной культуры, где апоптозныеR гены представляют собой гены E1B19K и AVEN, а концентрация лактата в клеточной культуре составляет приблизительно 1 г/л или менее после 5 дней культивирования.
2. Способ по п.1, в котором эукариотическая клеточная линия представляет собой клетки яичника китайского хомячка (СНО).
3. Способ по п.2, в котором клеточная линия СНО представляет собой клетки CHO-K1.
4. Способ по п.2, в котором клеточная линия СНО представляет собой клетки CHO-K1SV.
5. Способ по п.1, в котором эукариотическая клеточная линия представляет собой клетки миеломы.
6. Способ по п.5, в котором клеточная линия миеломы представляет собой клетки NS0.
7. Способ по п.5, в котором клеточная линия миеломы представляет собой клетки Sp2/0.
8. Способ по п.1, в котором эукариотическая клеточная линия представляет собой клетки гибридомы.
9. Способ по п.1, в котором апоптозныеR гены дополнительно включают ген XIAPδ.
10. Способ по п.1, в котором пик плотности жизнеспособных клеток (VCD) увеличен.
11. Способ по п.1, в котором длительность жизни клеточной культуры увеличена.
12. Способ по п.1, в котором титр клеточной культуры увеличен.
13. Способ по п.1, в котором общее число жизнеспособных клеток (IVCC) клеточной культуры увеличено.
14. Способ по п.1, в котором поток кальция в клетках уменьшен.
15. Способ по п.1, в котором мембранный потенциал митохондрий увеличен.
16. Способ по п.1, в котором представляющие интерес гены кодируют тяжелую и легкую цепи антитела.
17. Способ по п.1, в котором высокая концентрация глюкозы в среде составляет приблизительно 60 мМ, а концентрация лактата в клеточной культуре составляет приблизительно 0,1 г/л или менее после 7 дней культивирования.
Текст
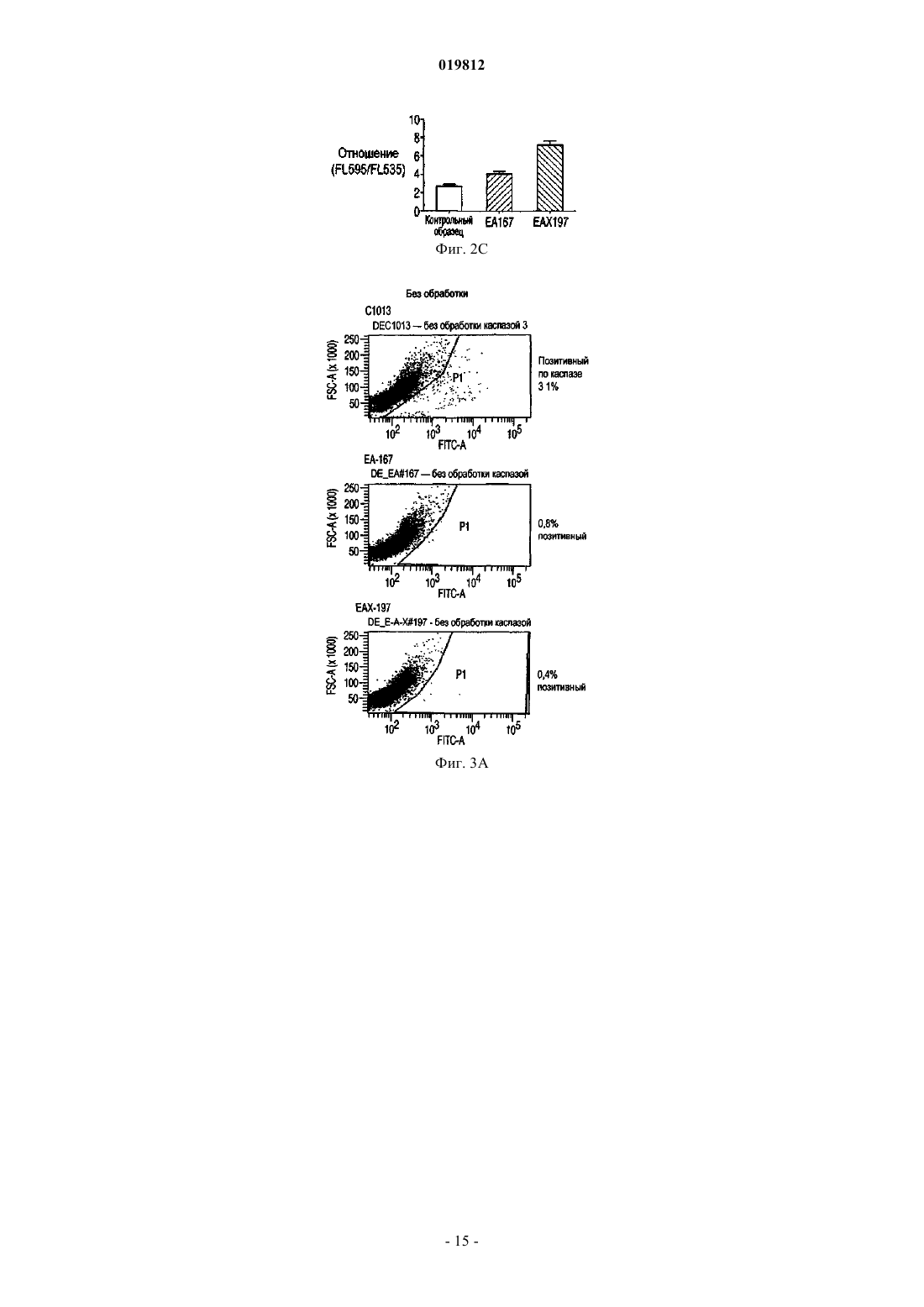
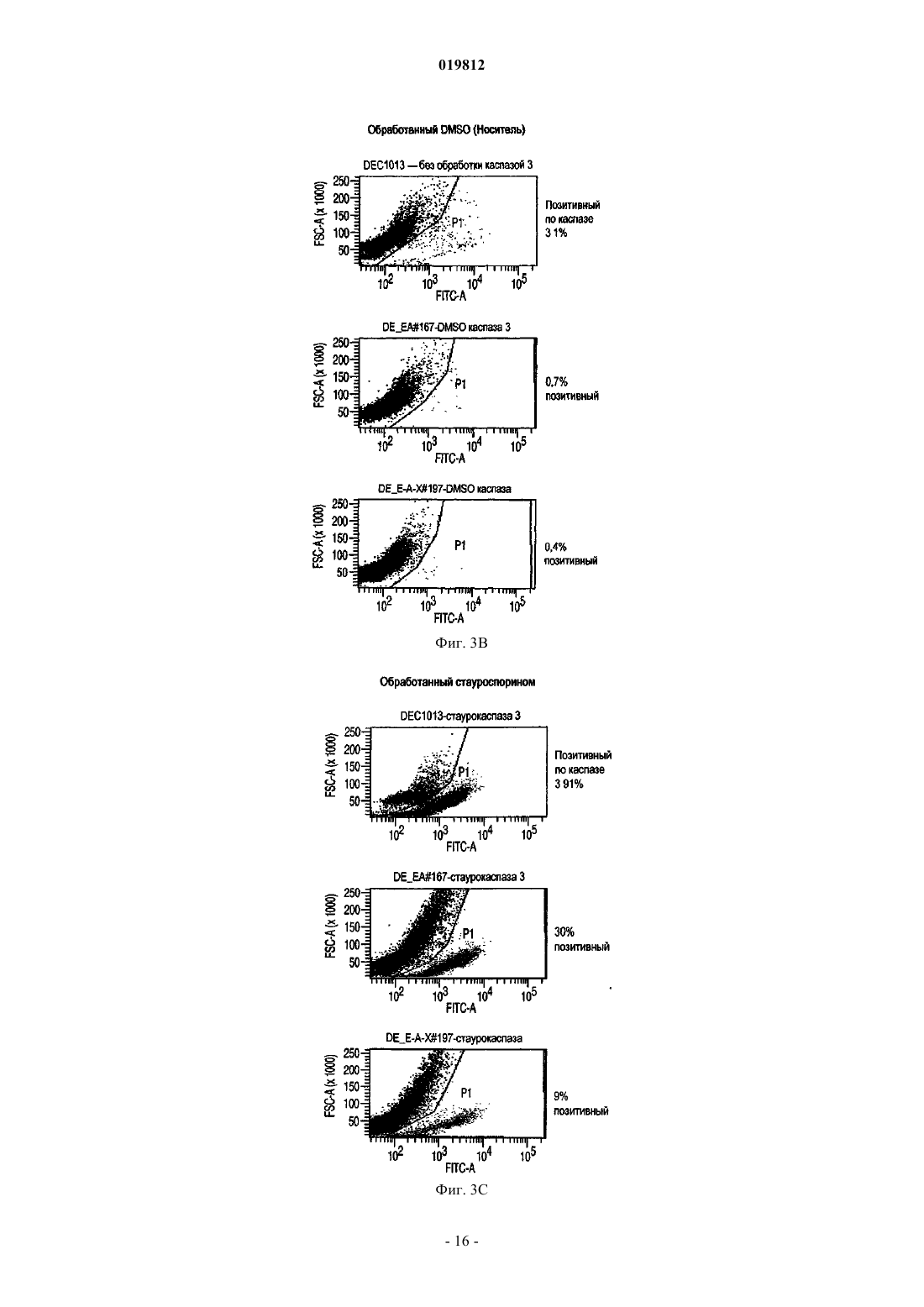
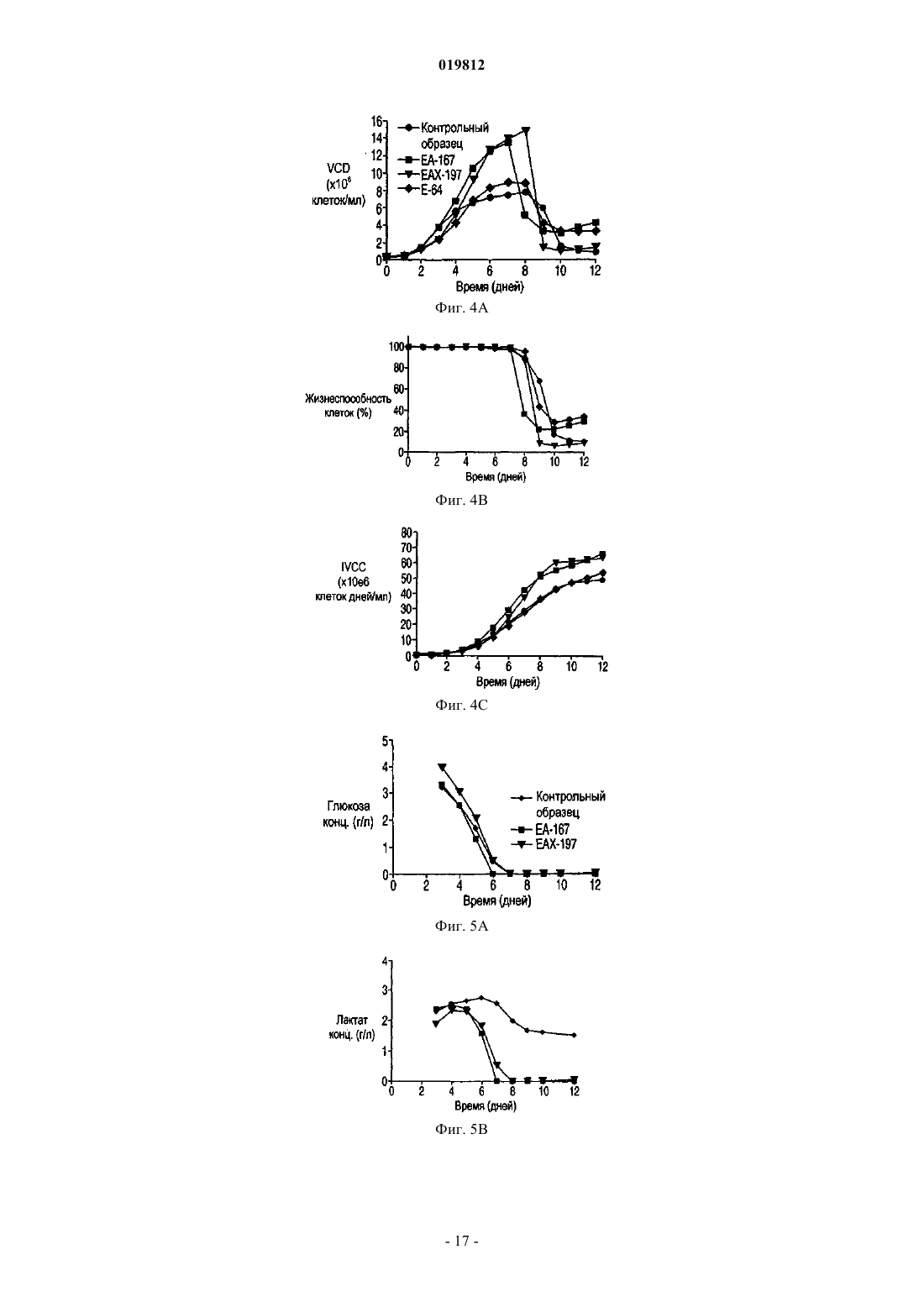
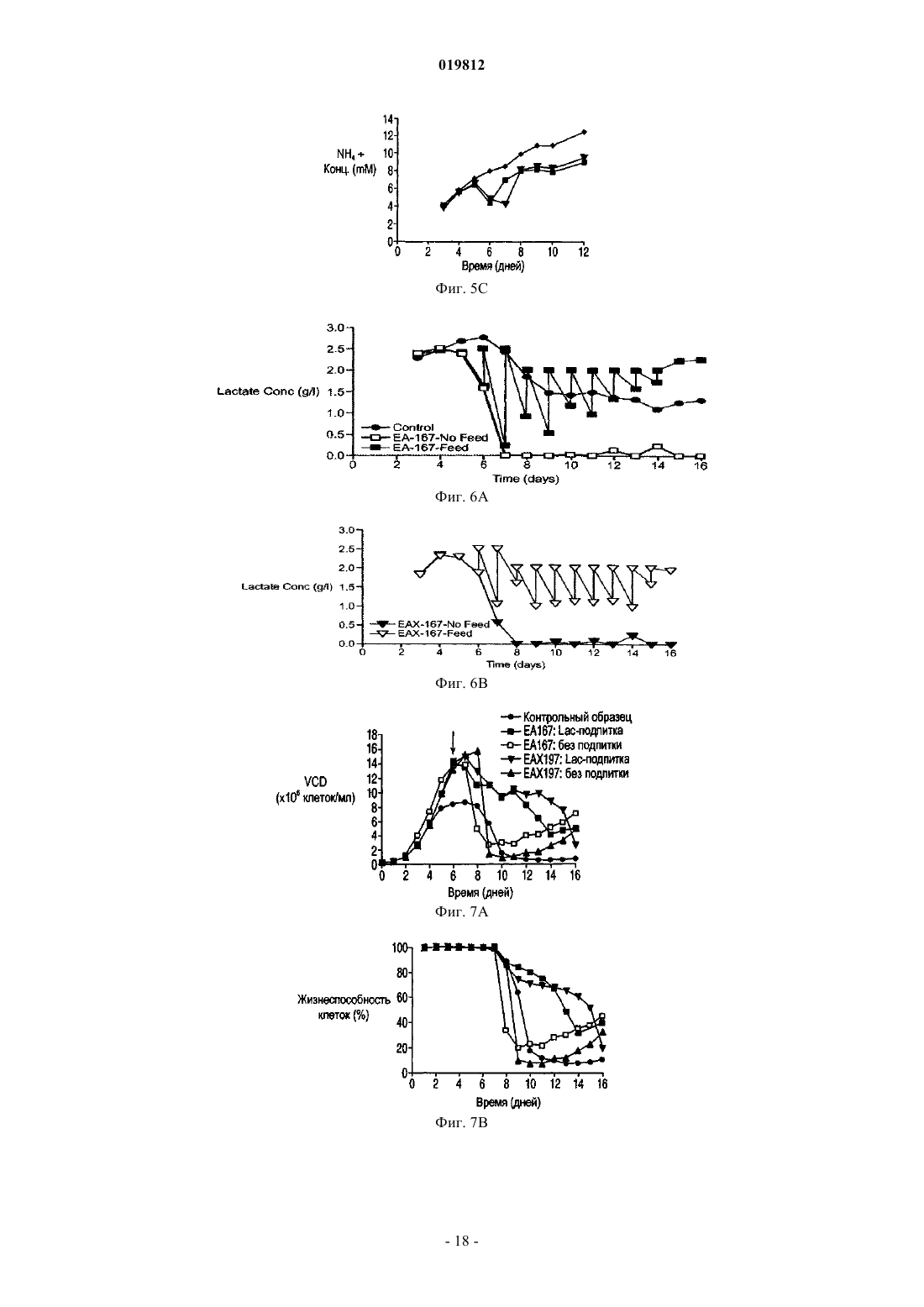
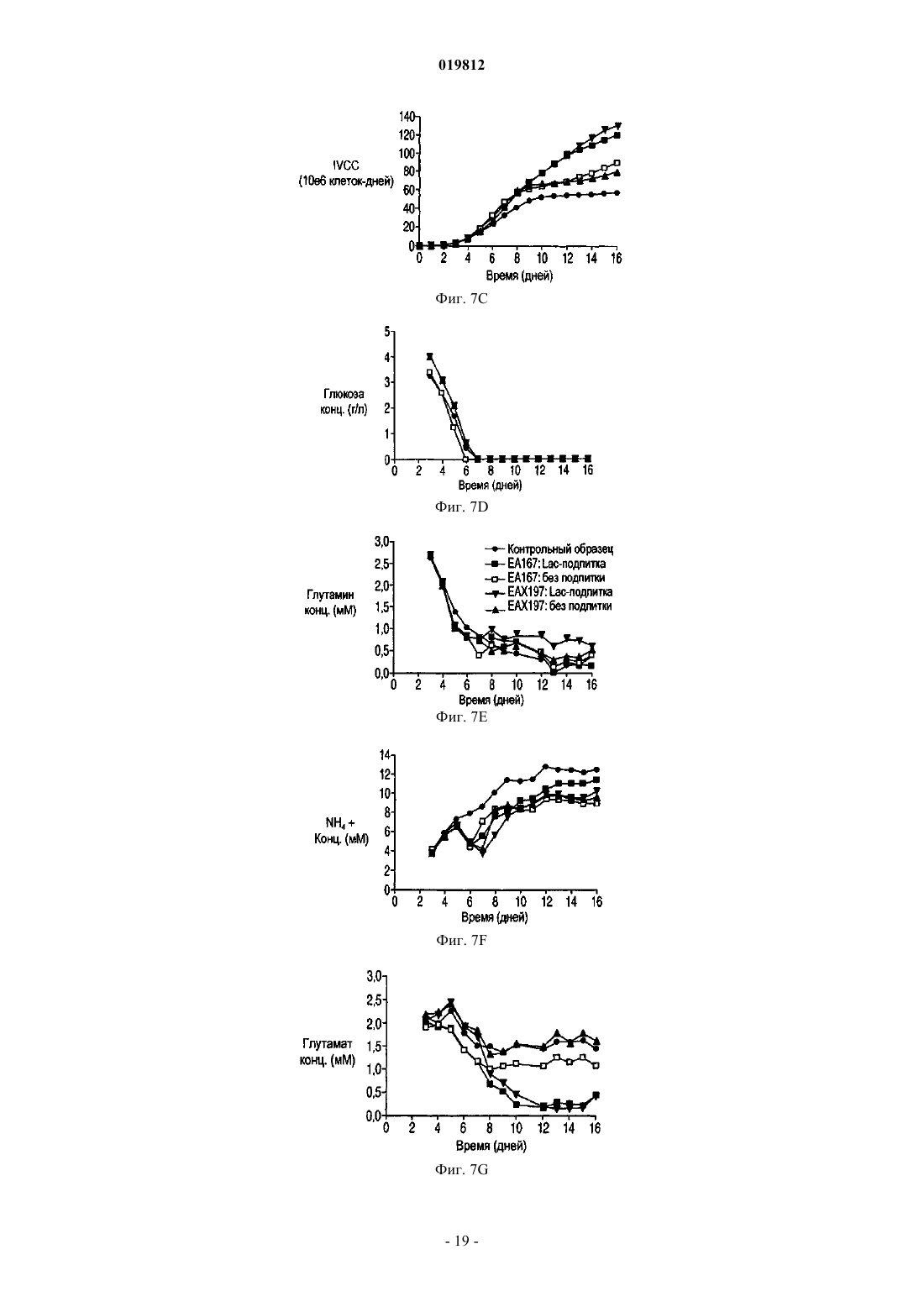
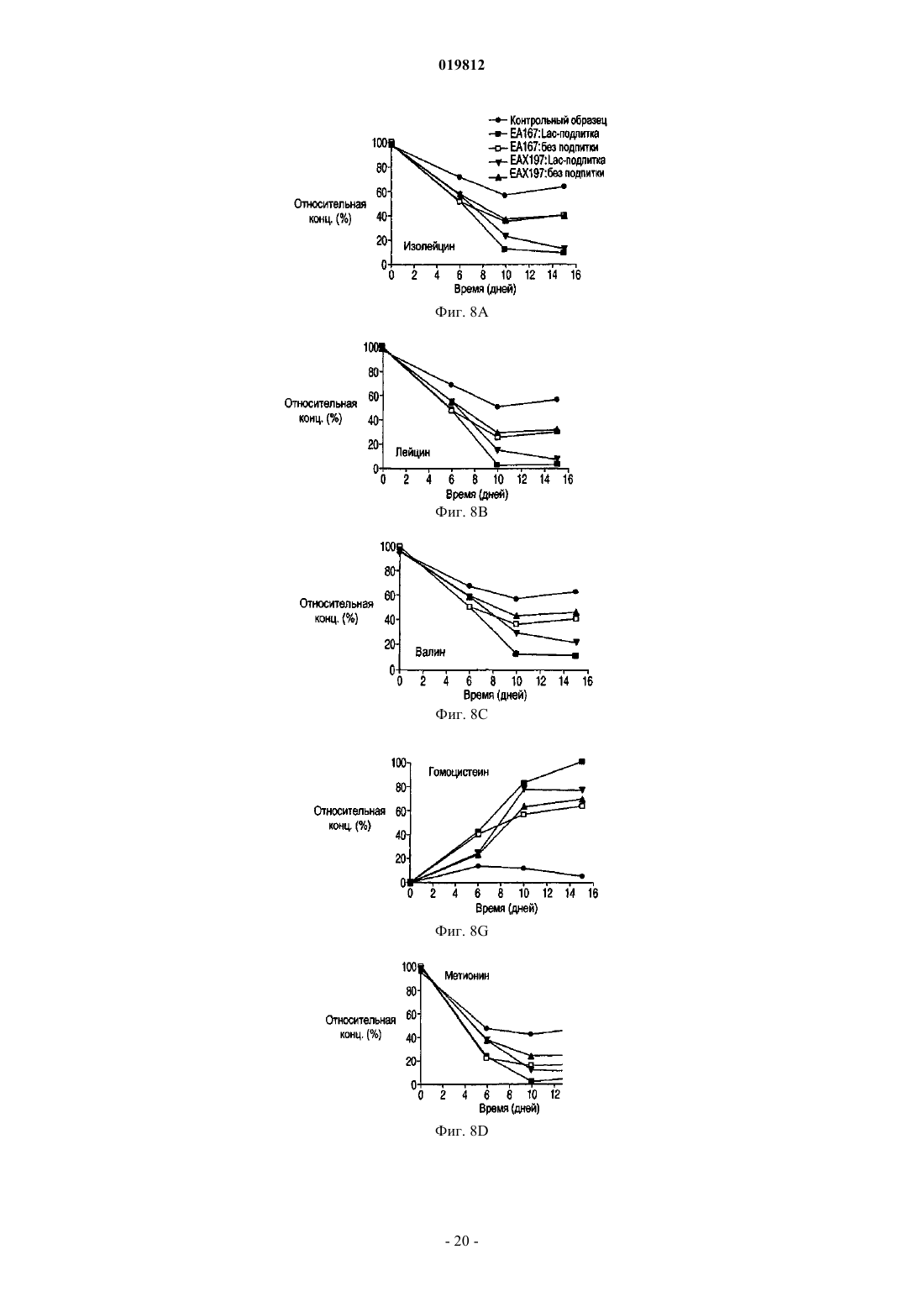
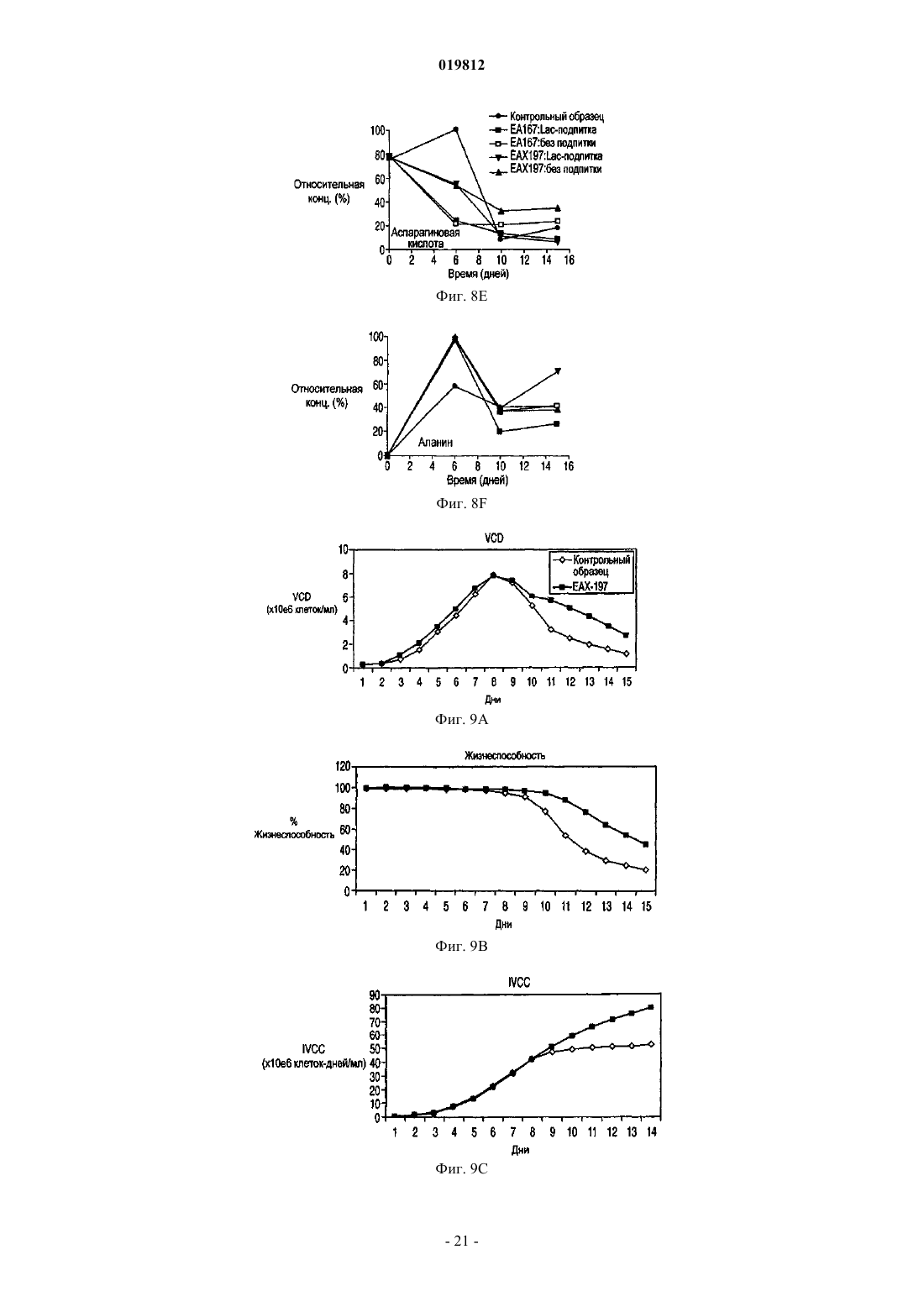
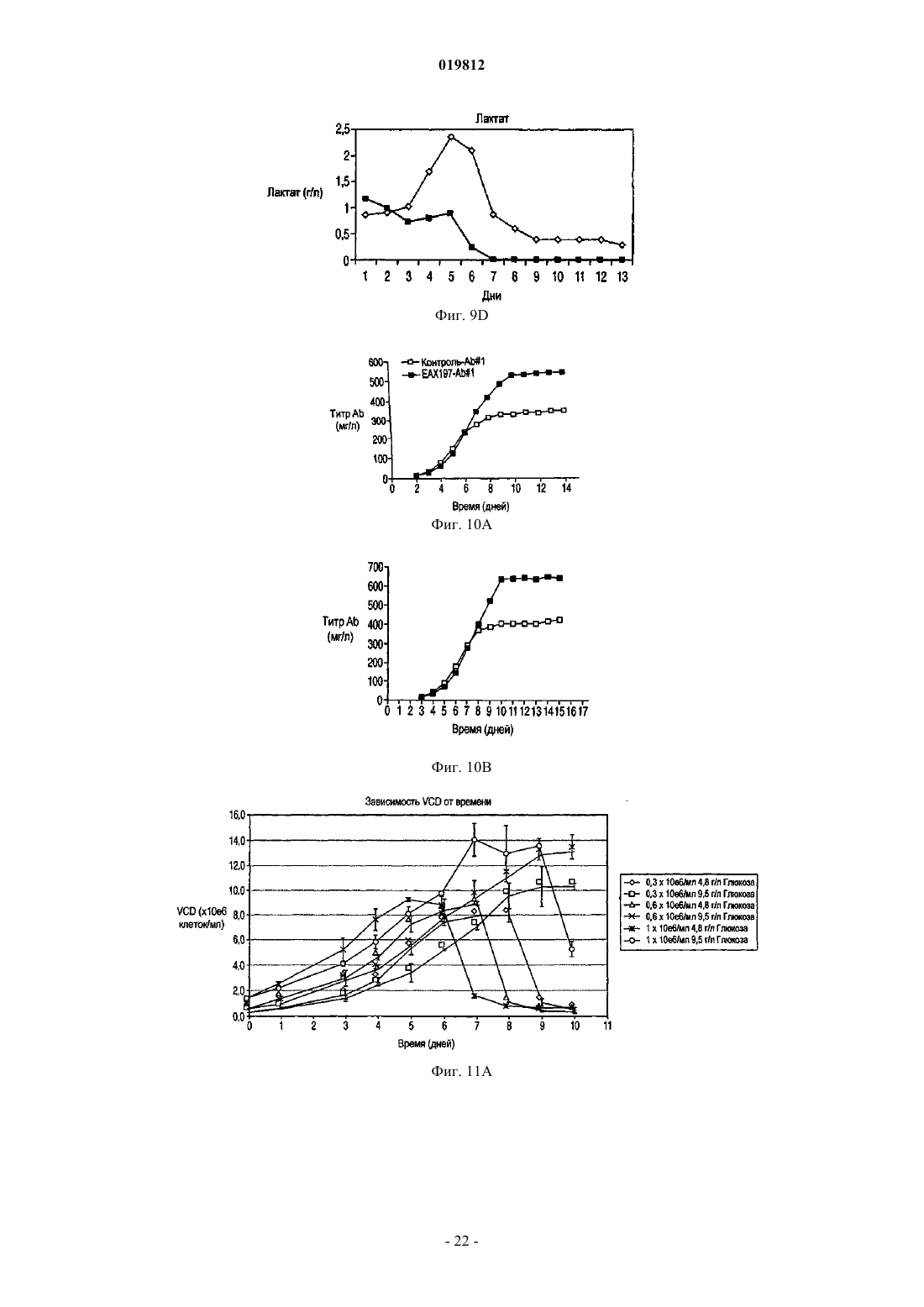
СПОСОБЫ ПОЛУЧЕНИЯ ВЫСОКОЙ ПЛОТНОСТИ ЖИЗНЕСПОСОБНЫХ КЛЕТОК В КУЛЬТУРЕ КЛЕТОК МЛЕКОПИТАЮЩИХ Заявляются способы увеличения жизнеспособности в подпитываемой культуре эукариотических клеточных линий.(71)(73) Заявитель и патентовладелец: СЕНТОКОР ОРТО БАЙОТЕК ИНК. Область изобретения Настоящее изобретение относится к способам, позволяющим достичь получения высокой плотности жизнеспособных клеток и увеличения продолжительности жизни подпитываемой клеточной культуры за счет использования среды, обогащенной глюкозой. Предложенные способы могут быть использованы для увеличения производства любых представляющих интерес секретируемых белков. Предпосылки создания изобретения Культура клеток млекопитающих является предпочтительной системой для производства многих рекомбинантных белков благодаря способности производить белки с требуемыми посттрансляционными модификациями. Вследствие увеличения спроса на производство таких белков существует сильная мотивация для улучшения эффективности процесса за счет увеличения производства продукта. Увеличение производства биотерапевтических или других белков в процессе промышленного производства до необходимого уровня, исчисляемого в г/л, основывается на оптимизации как культуры клеток млекопитающих, так и инженерных методов. Проблема клеточной гибели является обычной для культуры клеток млекопитающих высокой плотности, не содержащей белка, причем до 80% клеточной гибели в типичном биореакторе с подпиткой приходится на долю апоптоза, индуцированного в ответ на такие условия, как недостаток фактора роста, питательных веществ, нехватка кислорода, накопление токсинов и напряжение сдвига (Goswami et al., Biotechnol Bioeng 62:632-640 (1999. Апоптоз ограничивает максимальную плотность жизнеспособных клеток, ускоряет наступление фазы клеточной гибели и потенциально уменьшает производство гетерологичного белка (Chiang and Sisk, Biotechnol Bioeng 91:779-792 (2005);Figueroa et al., Biotechnol Bioeng 73:211-222 (2001), Metab Eng 5:230-245 (2003), Biotechnol Bioeng 85:589600 (2004); Mercille and Massie, Biotechnol Bioeng 44:1140-1154 (1994. Апоптоз является результатом сложной сети сигнальных путей, которые активизируются как внутри, так и снаружи клетки и кульминацией которых является активация специфических цистеиновых протеаз, расщепляющих белки после остатков аспарагиновой кислоты (Cys-Asp-протеаз, сокращенно каспаз) и опосредующих финальные стадии клеточной смерти; см. фиг. 1. Для поддержания жизнеспособности клеток в культуре клеток млекопитающих в течение удлиненного производственного цикла используются различные методы (Arden and Betenbaugh, Trends Biotechnol 22:174-180 (2004); Vives et al., Metab Eng 5:124-132 (2003. Изменение внеклеточной среды за счет добавления к среде факторов роста, гидролизатов и лимитирующих питательных компонентов обычно приводит к увеличению производства белка и снижению апоптоза (Burteau et al., In Vitro Cell Dev Biol Anim. 39:291-296 (2003); Zhang and Robinson,Cytotechnology 48: 59-74 (2005. Некоторые исследователи склоняются к использованию химических и генетических стратегий с целью ингибирования внутриклеточного апоптозного сигнального каскада(Sauerwald et al., Biotechnol Bioeng 77:704-716 (2002), Biotechnol Bioeng 81:329-340 (2003. Ученые обнаружили, что сверхэкспрессия генов, которые интенсивно производятся в раковых клетках, может увеличить продолжительность жизни у клеток, культивируемых в биореакторах, за счет предотвращения апоптоза до момента активации каспаз (Goswami et al., выше; Mastrangelo et al., TrendsBiotechnol 16:88-95 (1998); Meents et al., Biotechnol Bioeng 80:706-716 (2002); Tey et al., J. Biotechnol 79:147-159 (2000) и Biotechnol Bioeng 68:31-43 (2000. Увеличенная экспрессия этих белков в продуктивных клеточных линиях эффективно супрессирует апоптозный сигнальный процесс внутри клетки,уменьшая тем самым в некоторых случаях гибель клеток, поддерживая жизнеспособность и увеличивая выход биотерапевтической продукции. Проблема аккумуляции продуктов жизнедеятельности и их отрицательное влияние на клеточный рост также является обычной для культур клеток млекопитающих высокой плотности, свободных от белка. Лактат и аммиак являются двумя наиболее часто встречаемыми в клеточных культурах продуктами жизнедеятельности. Для решения проблемы аккумуляции избыточного лактата были предложены многочисленные стратегии, включая: 1) поддержание низкой концентрации глюкозы в питательной среде (Kurokawa et al., Biotechnol Bioeng 44:95-103 (1994); Xie and Wang, Biotechnol Bioeng 43:1175-1189(2006), Walschin and Wu, J. Biotechnol 131:168-176 (2007; 3) частичное подавление экспрессии лактатдегидрогеназы (LDH) за счет гомологичной рекомбинации или siRNA-технологии; 4) сверхэкспрессию пируваткарбоксилазы; 5) использование дихлорацетата (DCA), являющегося активатором пируватдегидрогеназы (PDH) (за счет ингибирования PDH-киназы); 6) использование оксаминовой кислоты, являющейся конкурирующим ингибитором LDH, и 7) удаление с помощью перфузии (заявка на патент США 2009/0042253 А 1). Первоначально предполагалось, что исключительной функцией многих белков, участвующих в процессе апоптоза, является связывание с мембраной митохондрий и регулирование апоптоза за счет изменения проницаемости митохондрий. Недавние открытия показали, что ключевые белки, вовлеченные в апоптозный сигнальный процесс, оказывают влияние на те белки и взаимодействуют с теми белками, которые контролируют метаболизм и энергетический гомеостаз клетки. С обзором можно ознакомиться в работах Majors et al., Metab Eng 9:317-326 (2007) и White et al., Nat Cell Biol 7:1021-1028 (2005). Микроматричный анализ сверхэкспрессирующих белок Bcl-XL клеток культуры CHO, проведенный в одном из недавних исследований, показал, что лактатдегидрогеназа, являющаяся ключевым ферментом глюконеогенеза, имеет повышенную экспрессию. Некоторые клетки и вирусы производят антиапоптозные белки, участвующие в митохондриальном апоптозном пути. Они могут быть разделены на три группы: 1) белки, которые действуют в начале апоптозного пути, такие как белки семейства Bcl-2; 2) белки, которые действуют в середине пути, разрушая или ингибируя апоптосомный комплекс, например, Aven, и 3) белки, которые действуют на поздних этапах апоптозного пути, например ингибиторы каспазы, такие как XIAP. Действие большинства названных генов было изучено с помощью сверхэкспрессии в экспрессионной системе млекопитающих, и в некоторых случаях был определен эффект одновременной сверхэкспрессии двух или большего числа генов,относящихся к разным периодам апоптозного пути. Примеры включают: 1) аддитивный эффект гена BclXL и делеционной мутации XIAP (XIAP) в клетках СНО (Figueroa et al., Metab. Eng. 5:230-245 (2003; 2) гены Е 1 В-19K и Aven в клетках BHK (Nivitchanyong et al., Biotechnol Bioeng 98:825-841 (2007 и 3) гены Bcl-XL, Aven и XIAP (Sauerwald et al., выше (2003); Sauerwald et al., Biotechnol Bioeng 94:362-369(2006. Однако ни в одной из указанных работ не был исследован эффект антиапоптозных генов на состояние клеточного метаболизма. Итак, существует необходимость оптимизации условий потребления питательных веществ и аккумуляции метаболитов в культуре клеток млекопитающих с целью увеличения плотности жизнеспособных клеток, длительности жизни и продуктивности. Краткое описание фигур На фиг. 1 показаны компоненты митохондриального апоптозного пути. На фиг. 2 А-2 С показаны характеристики клеточных линий в состоянии апоптоза R. На фиг. 3 с использованием метода поточной цитометрии показано подтверждение апоптоза R в культурах ЕА 167 и ЕАХ 197. На фиг. 4 А-4 С показаны кривые роста апоптозных R клеточных линий, полученных в результате трансфекции генами E1B-19K, Е 1 В-19K+Aven и E1B-19K+Aven+XIAP. Плотность жизнеспособных клеток и жизнеспособность изучались в контрольных полунепрерывных культурах, культивируемых в качалочных колбах, а также в линиях Е 64. На фиг. 5 А-5 С показаны кривые, характеризующие метаболизм в апоптозных R клеточных линиях,полученных в результате трансфекции генами E1B-19K+AVENXIAP. Наличие различных метаболитов исследовалось в полунепрерывных контрольных культурах, культивируемых в качалочных колбах, а также в клеточных линиях ЕА 167 и ЕАХ 197 На фиг. 6 А и 6 В показано ежедневное увеличение лактата в апоптозных R клеточных линиях. А) контроль, ЕА 167: без подпитки, и подпитка лактатом, В) ЕАХ 197 без подпитки и подпитка лактатом). На фиг. 7A-7G показаны кривые роста и метаболизма контрольных и апоптозных R клеточных линий ЕА 167 и ЕАХ 197, при применении и без применения подпитки лактатом. Контроль без подпитки и подпитка лактатом), ЕАХ 197 без подпитки и подпитка лактатом). На фиг. 8A-8G показаны кривые уменьшения концентрации аминокислот в апоптозных R клеточных линиях при подпитке лактатом. Контроль подпитка лактатом), без подпитки и подпитка лактатом). ЕАХ 197 На фиг. 9A-9D показаны кривые роста и кривые накопления лактата в контрольных и апоптозных R клеточных линиях ЕАХ 197, культивированных при высокой концентрации глюкозы в адаптированной среде. Апоптозные R клеточные линии ЕАХ 197 контрольные клеточные линии На фиг. 10 А и 10 В показаны титры антител в линии ЕАХ 197 и в контрольных линиях клетокхозяев; культивированных в адаптированной среде, содержащей 30 либо 60 мМ глюкозы. Апоптозные R клеточные линии ЕАХ 197 контрольные клеточные линии На фиг. 11 А и 11 В показаны VCD и титры клеточных линий, содержащих апоптозный R ген Bcl-2,при условиях высокой и низкой плотности посева, а также при содержании глюкозы 30 и 60 мМ. Краткое описание изобретения Первый аспект настоящего изобретения заключается в способе достижения высокой плотности жизнеспособных клеток в подпитываемых эукариотических культурах клеток, включающем следующие этапы:a) культивирование эукариотической клеточной линии, экспрессирующей один или более гетерологичных генов устойчивости к апоптозу (апоптозный R), а также один или более представляющих интерес генов; иb) поддержание высокого уровня глюкозы в среде в течение экспоненциальной и стационарной фаз роста клеточной культуры. Другой аспект изобретения заключается в способе увеличения производства секретируемых белков в подпитываемой культуре клеток эукариот, включающем следующие этапы:a) культивирование эукариотических клеточных линий, экспрессирующих один или более гетерологичных генов устойчивости к апоптозу (апоптозный R), а также один или более представляющих интерес генов; иb) поддержание высокого уровня глюкозы в среде в течение экспоненциальной и стационарной фаз роста клеточной культуры. Подробное описание изобретения Все публикации, упоминаемые в данном описании, включая патенты и патентные заявки, но не ограничиваясь ими, включенные путем ссылок, являются частью настоящего документа, как если бы они были изложены непосредственно в настоящем документе. Термин "подпитываемая клеточная культура", используемый в настоящем документе, относится к процессу культивирования клеток, основанному на добавлении лимитирующего питательного субстрата в культуру. Стратегия подпитываемой культуры обычно используется в биопромышленных процессах для достижения высокой клеточной плотности в биореакторе. Однако добавление такого питательного вещества, как глюкоза, приводит к образованию лактата и аммиака в качестве продуктов метаболизма. Согласно опубликованным данным концентрации лактата 18 мМ (Kurano et al., 1990) и аммиака 8 мМ(Hansen and Emborg, 1994) являются ингибиторами роста эукариотических клеток. Для решения проблемы аккумуляции избыточного лактата в полунепрерывных клеточных культурах были предложены различные стратегии, описанные выше. В настоящем изобретении представлен альтернативный подход к уменьшению концентрации лактата и увеличению плотности жизнеспособных клеток и жизнеспособности. Предложенный способ использует сверхэкспрессию одного или более антиапоптозных генов в линии клеток-хозяев. Получаемые при этом устойчивые к апоптозу клеточные линии стимулируют дыхание митохондрий и аккумулируют меньше лактата. Поэтому данные клеточные линии хорошо развиваются при содержании в средах с высоким содержанием глюкозы. Следовательно, культуры устойчивых к апоптозу клеточных линий могут достигать высокой плотности жизнеспособных клеток. Благодаря устойчивости к апоптозу эти клеточные линии также обладают продленной продолжительностью жизни. Предложенные в изобретении способы могут быть полезны для увеличения плотности жизнеспособных клеток и жизнеспособности в подпитываемых клеточных линиях, таких как культура клеток яичника китайского хомячка (СНО), культуры клеток миеломы и гибридомы. В частности, предложенные в данном изобретении способы могут использоваться для увеличения общего числа жизнеспособных клеток (IVCC) в культурах клеток СНО. Предложенный в изобретении способ состоит из определенных этапов: культивирования клеточной линии, экспрессирующей один или более гетерологичных генов устойчивости к апоптозу (апоптозный R) и один или более представляющих интерес генов, а также поддержания высокого содержания глюкозы в питательной среде в течение экспоненциальной и стационарной фаз роста клеточной культуры. Эти культуры являются превосходными хозяевами для создания производственных клеточных линий, экспрессирующих представляющие интерес белки, такие как пептиды, пептиды слияния, факторы роста, гормоны, антитела, сконструированные белки с анкириновыми повторами(DARPin) и другие полипептиды, используемые в терапевтических, диагностических либо исследовательских целях. Клеточные линии СНО, которые могут быть использованы в предложенном в изобретении способе, включают линии CHO-K1 (Invitrogen, Carlsbad, CA) и CHO-K1SV (Lonza Biologies, Slough,UK). Клеточные линии миеломы, используемые в данном способе, включают линии NS0 и Sp2/0. Все клеточные линии, которые могут быть использованы в предложенном в изобретении способе,экспрессируют один или более гетерологичных антиапоптозных генов. В частности, могут быть использованы гены, кодирующие белки E1B19K (SEQ ID NO: 1 и 2) и Aven (SEQ ID NO: 3 и 4). Также может быть использован ген, кодирующий XIAP (SEQ ID NO: 5 и 6). Эти антиапоптозные гены представляют собой гены, действующие на ранних, средних и поздних стадиях апоптозного сигнального пути соответственно. Кроме того, также может быть использован ген, кодирующий Bcl-2 (SEQ ID NO: 7 и 8). Экспрессия антиапоптозных генов может быть достигнута с помощью методик трансфекции, хорошо знакомых специалистам, работающим в области. Предполагается, что в предложенных способах возможно также использование других участвующих в указанных выше стадиях апоптозного сигнального пути антиапоптозных генов, таких как MDM2 (SEQ ID NO: 9 и 10) и Bcl-XL (SEQ ID NO: 11 и 12). Использование в настоящем изобретении клеточных линий, экспрессирующих гетерологичные антиапоптозные гены, позволяет обеспечить уменьшение секреции лактата или, как вариант, потребление аккумулированного лактата и достигнуть практически в два раза большего общего числа жизнеспособных клеток (IVCC), чем в контрольных клеточных линиях, при сохранении высокого содержания глюкозы в питательной среде. При увеличении плотности жизнеспособных клеток в культуре продуктивных клеточных линий увеличивается также выход продукта, получаемого в результате одного цикла работы биореактора. В результате увеличения производительности может быть достигнуто снижение стоимости сложных биологических продуктов, кроме того, отсутствие лизиса нежизнеспособных клеток позволяет произвести продукт лучшего качества, так как в результате лизиса освобождаются протеазы, приводящие к деградации продукта. В соответствии с вышесказанным данные линии являются превосходными хозяевами для создания продуктивных клеточных линий, экспрессирующих один или более представляющих интерес белков. Предложенный в изобретении способ предлагает стратегию культивирования клеточных культур,позволяющую обеспечить рост культуры как при высоком содержании глюкозы, так и при снижении ее концентрации, на основе способности апоптозных R клеточных линий потреблять лактат или производить меньшее количество лактата, который в других линиях накапливается как продукт метаболизма. В разнообразных примерах осуществления предложенный в изобретении способ обеспечивает увеличение пиковой плотности жизнеспособных клеток, продолжительности жизни культуры, увеличение титра секретируемых белков, общего числа жизнеспособных клеток, а также уменьшение потока кальция и увеличение мембранного потенциала митохондрий в полунепрерывных клеточных культурах. Кроме того, для высокой продуктивности клеточных линий нет необходимости в стратегиях подпитываемого культивирования, которые ранее использовались для ограничения высокого содержания токсичных веществ, таких как лактат и аммиак. При трансфекции место хромосомной интеграции антиапоптозного трансгена может определять уровень его экспрессии. Более того, при трансфекции нескольких антиапоптозных генов уровень экспрессии отдельного антиапоптозного трансгена может влиять на активность остальных антиапоптозных белков, находящихся в клетке, так как многие из них прямо или косвенно взаимодействуют друг с другом, производя физиологические изменения в клетке. Таким образом, определение количественного вклада каждого отдельного антиапоптозного гена в общие апоптозные R характеристики клеточной линии, содержащей множество генов, может быть затруднено вследствие синергического эффекта апоптозных R генов. Кроме этого, имеет место значительное варьирование между клонами в отношении апоптозных R характеристик, даже если все клоны были получены при трансфекции идентичным набором трансгенов. Из результатов, приведенных в примерах ниже, ясно, что каждый тестированный антиапоптозный ген добавляет некоторое улучшение к апоптозным R характеристикам клеточной линии-хозяина, подвергнутой трансфекции. В пределах указанных ограничений, тройные трансфектанты обычно превосходили двойные трансфектанты, которые, в свою очередь, были лучше трансфектантов, сверхэкспрессирующих только один антиапоптозный трансген. Вследствие трансфекции соответствующими векторами экспрессии были получены клоны с варьирующим уровнем экспрессии E1B-19K, Aven и XIAP. Уровень экспрессии белка E1B-19K был относительно низкий, и редкие клоны, имевшие высокий уровень экспрессии этого белка, были либо нестабильны, либо имели слабую способность к росту (данные не приводятся). В приведенных ниже примерах, в клетках СНО, экспрессирующих только белок E1B-19K, наблюдалась лишь ограниченная защита от клеточной гибели (фиг. 4). В противоположность результатам, полученным при наблюдении клеточных линий, экспрессирующих только E1B-19K, данные, представленные в приведенных ниже примерах, показывают, что клеточные линии СНО-K1, экспрессирующие совместно Aven (EA167) или Aven и XIAP (ЕАХ 197), проявили улучшения в жизнеспособности, клеточной плотности и IVCC. Результаты, представленные в приведенных ниже примерах, демонстрируют, что экспрессия двух антиапоптозных генов в клетках линии СНО-K1 приводит к значительному уменьшению активности каспазы и улучшению мембранного потенциала митохондрий при повреждающих воздействиях, таких как воздействие стауроспорина или продленное культивирование. В приведенных ниже примерах исследуется влияние экспрессии гена E1B-19K, функционального гомолога Bcl-XL, в комбинации с генами Aven и XIAP на замедление клеточной гибели. Уровень экспрессии белка XIAP в трансфицированных клетках был невысокий по отношению к эндогенному белкуXIAP дикого типа, уже присутствующему в клетке, вероятно, вследствие использования в этой системе двух введенных плазмид. Тем не менее, введение гена XIAP в клеточную линию ЕАХ 197 (дополнительно к генам Aven и E1B-19K) обеспечило стабильное увеличение максимальной плотности жизнеспособных клеток в обеих культурах, как в культуре без добавления лактата (фиг. 5 и 7), так и в культуре с подпиткой лактатом (фиг. 7). Действительно, клеточная линия ЕАХ 197, культивируемая в среде с добавлением лактата, была способна поддерживать высокую жизнеспособность на приблизительно 60% или немногим больше, в течение 14 дней, что оказалось на два дня больше, чем в линии ЕА 167, и на четыре дня больше, чем в контрольной культуре. Включение в клетку гена XIAP приводит к увеличению устойчивости клетки к активации каспазы, это также подтверждается очень низкой активностью каспазы в линии ЕАХ 197, показанной на фиг. 3, даже после обработки стауроспорином. Кроме того, использование мутантного гена XIAP (XIAP) приводит к усилению апоптозной устойчивости по сравнению с геномXIAP дикого типа. Таким образом, защищающая способность делеционного мутанта XIAP (XIAP) может быть значительной, даже если экспрессия белка в линии СНО невысока. В приведенных ниже примерах была исследована роль одного или более антиапоптозных генов в-4 019812 клеточном метаболизме. В апоптозных R клеточных линиях, экспрессирующих белок E1B-19K в комбинации с белками Aven и/или XIAP, было определено потребление питательных веществ и производство продуктов метаболизма. В частности, накопление двух самых обычных продуктов жизнедеятельности в клеточных культурах (а именно, лактата и аммония) сравнили в апоптозных R и контрольной клеточных линиях. В данных, представленных ниже, показано, что при полунепрерывном культивировании в качалочных колбах в среде CD-CHO, на 6-7-й день после посева контрольная культура аккумулировала лактат в количестве 2,8 г/л (31 мМ) и аммоний - 12 мМ (фиг. 5), что значительно выше концентрации лактата 18 мМ (Kurano et al., выше) и аммония 8 мМ (Hansen and Emborg, выше), являющихся лимитирующими для клеточного роста, согласно опубликованным данным. Высокий уровень лактата и аммония частично объясняют потерю жизнеспособности, отмеченную в контрольной линии СНО на 8-й день после инокуляции (фиг. 4). Несмотря на то что представленные ниже данные демонстрируют, что апоптозные R клеточные линии накапливают некоторое количество лактата в начале процесса культивации, эти линии начинали потреблять лактат в течение экспоненциальной фазы и продолжали наращивать VCD, значительно превосходя по этому показателю контрольные культуры. Либо способность потреблять лактат после исчезновения в среде глюкозы, либо усиленное ингибирование апоптоза, либо оба фактора одновременно внесли вклад в продление клеточного роста. Более того, апоптозные R клетки вступают в стационарную фазу роста только после исчерпания всего эндогенного лактата. С целью определить, является ли потребление лактата общей характеристикой сконструированных клеточных линий, для восполнения потребленного лактата к апоптозным R культурам был добавлен экзогенный лактат (фиг. 6). Результаты, представленные в приведенных ниже примерах, показывают, что апоптозные R культуры потребляли добавленный лактат и сохраняли высокие показатели VCD и жизнеспособность на 4-7 дней дольше, чем контрольные культуры (без добавления лактата и при подпитке лактатом соответственно; фиг. 7 А и 7 В). Дополнительным преимуществом процесса является то, что низкий уровень лактата в апоптозных R клеточных линиях приводит к низкой осмолярности и высокому значению рН, а оба этих показателя являются в высшей степени желательными для улучшения качества продукта. Некоторые исследователи уже отмечали потребление лактата в клеточных линиях гибридомы, миеломы NS0 и культурах СНО (deZengotita et al., 2000; Zhou et al., 1995 и 1997; Burky et al., 2007; Pascoe etal., 2007). Однако для этих клеток типично производство лактата во время экспоненциальной фазы роста и переход к потреблению этого соединения во время стационарной фазы, что позволяет предположить,что лактат может представлять собой как промежуточный продукт метаболизма, так и углеводный источник (Burky et al., 2007; Brooks et al., 1985). В результатах, представленных ниже, контрольные культуры СНО потребляли некоторое количество лактата во время стационарной фазы роста, в особенности в среде с высоким содержанием глюкозы (фиг. 9), как уже было отмечено в предыдущих исследованиях. Апоптозные R клетки, напротив, вели себя совершенно иначе: в этих клетках лактат потреблялся в течение экспоненциальной фазы, и клетки вступали в стационарную фазу, только когда экзогенный лактат был исчерпан. Превращение пирувата в лактат, катализируемое лактатдегидрогеназой (LDH), является обратимым, но равновесие значительно сдвинуто в сторону формирования лактата с константой равновесия,равной 3,6104/М. Тем не менее, когда гликолиз не успевает удовлетворять потребность в трикарбоновых кислотах (ТСА), лактат может быть вновь превращен в пируват одним из изоэнзимов LDH, катализирующим эту реакцию. Потребляемый в апоптозных R клеточных линиях лактат, вероятно, используется в цикле трикарбоновых кислот, принимая тем самым участие в клеточной энергетике и производстве аминокислот. Интересно, что апоптозные R культуры отличаются от контрольных культур в отношении концентрации аммиака: в них отмечается периодичное преходящее снижение производства аммиака как без добавления, так и при добавлении лактата в клеточную культуру, а также общее уменьшение производства аммиака. Использование аминокислот в качестве источника энергии в цикле ТСА способствует накоплению аммиака. Уменьшение производства аммиака, следовательно, позволяет предположить, что апоптозные R клеточные линии получают меньшее количество энергии из расщепления аминокислот,чем контрольные линии, что кажется вполне обоснованным, поскольку апоптозные R клетки также потребляют большее количество лактата в качестве источника энергии. Следует отметить, тем не менее,что снижение содержания аммиака является временным и что апоптозные R клетки все же могут использовать аминокислоты в качестве источника энергии. Действительно, три аминокислоты, изолейцин, лейцин и валин, являющиеся аминокислотами с разветвленной цепью, потреблялись быстрее в апоптозных R клеточных линиях, и их потребление было особенно выражено при подпитке лактатом (фиг. 8 А-8 С). Так как в апоптозных R клеточных линиях период роста был продлен по сравнению с контрольными клеточными линиями, эти три аминокислоты могут быть использованы в качестве блоков в формировании жирных кислот и других белков, необходимых апоптозным R клеткам, а также могут расщепляться в цикле ТСА в качестве источника энергии. Сходная динамика потребления наблюдается также в отношении метионина (фиг. 8D). В противоположность названным аминокислотам, концентрация которых в среде уменьшалась, не-5 019812 которые аминокислоты, такие как аланин и аспартат, временно секретировались в контрольной культуре. Некоторая часть пирувата может быть превращена в аланин при содействии аланинаминотрансферазы. Вполне вероятно, что данный путь является более активным в апоптозных R клетках, что приводит к увеличению концентрации аланина по сравнению с контрольными клеточными линиями (фиг. 8 В). Аспартат, кроме того, относится к аминокислотам семейства аспарагиновой кислоты и образуется вместе с альфа-кетоглутаровой кислотой в результате превращения оксалоацетата и глутамата, промежуточных соединений, образующихся в цикле ТСА при участии аспартатаминотрансминазы. Уровень аспартата увеличивается только в контрольных клетках в течение первых шести дней, в апоптозных R клеточных линиях он постоянно понижается. Поскольку указанная реакция является обратимой, уменьшение концентрации аспартата в апоптозных R клеточных линиях в самом начале фазы роста указывает, возможно,на присутствие ограничения количества обратимого оксалоацетата, образующегося в результате цикла ТСА в апоптозных R клеточных линиях. Учитывая, что оксалоацетат в начальной стадии цикла ТСА также взаимодействует с ацетил-СоА, увеличение превращения пирувата, забираемого из обратимого равновесия с лактатом, в ацетил-СоА, может усиливать потребность в оксалоацетате в апоптозных R клеточных линиях. Контрольные клеточные линии, наоборот, нуждаются в меньшем количестве ацетил-СоА,поскольку они не усваивают лактат и, следовательно, производят аспартат из оксалоацетата. Действительно, отсутствие потребности в ацетил-СоА могло бы приводить к увеличению концентрации лактата,являющегося альтернативным побочным продуктом при образовании ацетил-СоА, в контрольных клетках в течение первых семи дней культивирования. С другой стороны, отсутствие потребления лактата в контрольных клеточных линиях может привести к ограничению запаса ацетил-СоА и сопутствующему увеличению производства аспартата. Данные результаты указывают на повышенную энергетическую эффективность цикла ТСА в клеточных линиях, экспрессирующих антиапоптозные гены, несмотря на то, что для точной интерпретации реакций, происходящих в клетке, необходим детальный анализ метаболических путей. Вне зависимости от дальнейшей судьбы потребленного лактата, в настоящем изобретении продемонстрировано, что апоптозные R клеточные линии потребляют накопленный лактат, что, в свою очередь, способствует увеличению длительности жизни и увеличению IVCC. Если апоптозные R клеточные линии уникальны в том, что они могут увеличивать длительность своей жизни, потребляя накопленный лактат, тогда существует возможность для культивирования этих линий в среде, содержащей лактат, или в среде, содержащей глюкозу в концентрации, превышающей норму. Несмотря на то что при использовании лактата в качестве единственного источника углерода клеточная линия любого типа едва ли имела хорошие показатели роста и жизнеспособности, в апоптозных R клеточных линиях наблюдалось потребление лактата, когда он добавлялся в качестве одного из компонентов, в дополнение к глюкозе (данные не приводятся), либо когда лактат накапливался в культуре в результате жизнедеятельности. Эти наблюдения позволяют предположить, что апоптозные R клетки не могут осуществлять глюконеогенез из пирувата или получать достаточно энергии из лактата, но, если глюкоза присутствует вместе с лактатом, клетки могут потреблять как глюкозу, так и накопленный или добавленный в культуру лактат. Кроме того, в среде с высоким содержанием глюкозы (60 мМ) IVCC (а также VCD и жизнеспособность, фиг. 9 А-9 С) апоптозных R клеточных линий значительно превышали соответствующие показатели контрольных клеточных линий. Это являлось следствием того, что в среде с высоким содержанием глюкозы контрольные клеточные линии накапливали лактат в количестве, превышающем 20 мМ, которое могло быть токсичным. Напротив, апоптозные R клеточные линии потребляли лактат в начале фазы роста и поэтому содержали большее число жизнеспособных клеток, которое, в пересчете на прирост IVCC, превышало контроль на 170% (фиг. 9C). Поскольку апоптозные R клеточные линии потребляли лактат и достигали более высокого показателя IVCC, производственные клеточные линии, экспрессирующие представляющие интерес белки, например терапевтические антитела, полученные из апоптозных R линий-хозяев, достигали значительно более высокого титра производимого продукта, чем контрольные клеточные линии. Более высокие титры производимых белков иллюстрируют потенциальные коммерческие преимущества использования антиапоптозных генов в клеточных линиях млекопитающих, производящих терапевтические или какие-либо другие представляющие интерес белки. Настоящее изобретение далее будет рассмотрено со ссылкой на конкретные, но не лимитирующие примеры. Примеры В следующих примерах перемешиваемых культур клеток СНО, содержащихся в качалочных колбах и характеризующихся сверхэкспрессией антиапоптозных генов, были проанализированы пик плотности жизнеспособных клеток, продолжительность жизни, активация каспазы 3, а также мембранный потенциал митохондрий (ММР). Кроме того, чтобы понять, оказывает ли экспрессия антиапоптозных генов какое-либо влияние на потребление питательных веществ и аккумуляцию метаболитов в системе культуры клеток млекопитающих, потребление питательных веществ и производство метаболитов сравнили в клеточных линиях, содержащих антиапоптозные гены, с соответствующими показателями в контрольных клеточных линиях. Материалы и способы. Клеточные культуры. Клеточная линия CHO-K1SV (Lonza Biologics, Slough, UK), обозначенная как контрольная клеточная линия С 1013 А, культивировалась в среде CD-CHO (Cat. No. 10743-011, Invitrogen, Carlsbad, CA), содержащей 30 мМ глюкозы при добавлении 6 мМ L-глутамина (Invitrogen Cat. No. 10313-021). В некоторых примерах была использована другая среда, свободная от животного белка и содержащая различные концентрации глюкозы, включая также концентрацию 60 мМ (обозначенная как среда с высоким содержанием глюкозы). Эмбриональная бычья сыворотка была приобретена у Hyclone Labs, Logan, UT (Cat.No. SH30071.03). Наблюдение клеточных культур производилось с помощью автоматического счетчика клеток Cedex (Innovatis, Germany). Общее число жизнеспособных клеток (IVCC, клеток-дней/мл) определялось согласно следующей формуле: где VCD - плотность жизнеспособных клеток. Конструкция плазмид. Вектор pBUDCE4.1 предназначался для конститутивной экспрессии E1B-19K (EF-1a промотор),либо в одиночку, либо вместе с Aven (CMV промотор), и был охарактеризован в других работах (Nivitchanyong et al., 2007). Вектор, экспрессирующий XIAP (CMV промотор), был сконструирован согласноSauerwald et al., 2002. Название "пустой вектор" относится к оригинальному вектору pBUDCE4.1. Экспрессирующий вектор для модельных антител (Ab 1) был сконструирован за счет клонирования кДНК, кодирующей тяжелую и легкую цепи, в экспрессирующий вектор, содержащий глутаминсинтетазу (GS) (получен от Lonza Biologics, Slough, UK, по исследовательской лицензии). Создание апоптозных R клеточных линий. Клеточная линия CHO-K1SV, находящаяся в экспоненциальной фазе роста, была трансфицирована векторами: 1) pBUDCE4.1; 2) pBUDCE4.1-E1B-19K; 3) pBUDCE4.1-E1B-19K-Aven и 4) pBUDCE4.1-E1B19K-Aven и pCMV-XIAP. Трансфекция была выполнена с помощью реагента Fugene (Roche, Cat.1815075, Basel, Switzerland) в соответствии с рекомендациями производителя. Спустя два дня клетки были помещены для роста в 96-луночные планшеты, питательную среду, содержащую 300 мкг/мл зеоцина(для перечисленных выше трансфекций 1, 2 и 3); 300 мкг/мл зеоцина и 400 мкг/мл гидромицина (для трансфекций 4), см. таблицу. Приблизительно 200 устойчивых к антибиотику клонов были размножены; активность каспаз 3 и 7 была проанализирована, как описано далее. Представляющие интерес клоны были проверены на стабильность в течение 10 этапов в отсутствие антибиотика. В первую очередь были созданы контрольные клеточные линии за счет трансфекции пустого вектора в клетки линии CHO-K1SV и отбора устойчивых к зеоцину клонов. Показатель IVCC в этих клеточных линиях был в среднем на 20% ниже, чем в нетрансфицированных контрольных линиях CHO-K1SV,поэтому линии CHO-K1SV были использованы во всех последующих экспериментах в качестве контрольных. Апоптозная R клеточная линия ЕАХ 197, представляющая наибольший интерес, а также контрольная клеточная линия были впоследствии использованы для создания продуктивной линии, экспрессирующей модельные антитела, с помощью экспрессирующего вектора, содержащего GS, в соответствии с рекомендациями производителя. Содержание антител в клеточной культуре измерялось посредством нефелометрии (Beckman Array System). Культивирование апоптозных R клеточных линий в качалочных колбах. Отобранные апоптозные R клеточные линии культивировались подпитываемым способом в средеCD-CHO с добавлением 6 мМ глутаминовой кислоты и необходимого для отбора антибиотика. В некото-7 019812 рых экспериментах в полунепрерывные культуры апоптозных R клеточных линий добавляли лактат для восполнения его содержания в среде. Кроме того, отобранные клеточные линии, экспрессирующие Ab,культивировались в адаптированной среде, свободной от животного белка, с добавлением 6 мМ глутаминовой кислоты и 60 мМ глюкозы. Анализ активности каспаз 3 и 7. Клетки каждого клона, приблизительно 3105, были высеяны в 1 мл питательной среды на 24 луночный планшет. На четвертый день (d4) после посева клетки, приблизительно 1105, перенесли на 96 луночный планшет, сделав три копии. До начала анализа активности каспаз 3 и 7 клетки инкубировались в среде с добавлением стауроспорина (2 мкМ fc) в течение 16 ч; оценка производилась с помощью набора реагентов APO-ONE (BD Labs). Процедуру повторили на 10-й день без стауроспорина. Клоны, проявившие значительно более низкую активность каспаз 3 и 7 в оба указанных дня, были пересеяны на бессывороточную среду (SF). Апоптозные R свойства выбранных клонов были подтверждены с помощью поточной цитометрии (см. далее) и в отдельных случаях измерением мембранного потенциала митохондрий. Анализ апоптозных R клонов в системе поточной цитометрии. Клетки были взяты из линий, культивируемых в качалочных колбах и находящихся на экспоненциальной фазе роста, приблизительно 1106 из каждой культуры, и перенесены на 24-луночный планшет; клетки инкубировались в течение 16 ч в среде со стауроспорином (2 мкМ fc), затем были собраны и отмыты в фосфатно-солевом буферном растворе. После этого клетки были подвергнуты инкубации с CytoPerm (Cat. No. 2075KK, BD BioScience) для фиксации и достижения проницаемости. После промывания в фосфатно-солевом буферном растворе и до анализа в системе поточной цитометрии клетки инкубировались с антителами к каспазе 3, меченными FITC (Cat. No. 68654, BD BioScience). Анализ мембранного потенциала митохондрий (ММР). Клетки, культивируемые в качалочных колбах, были взяты на 6-й день после посева и инкубировались в присутствии стауроспорина (5 мкМ fc) в течение 2 ч. Затем клетки были промыты и обработаны липофильным катионным красителем JC-1 (Cayman Labs, Ann Arbor, MI) в соответствии с рекомендациями производителя. Сканирование спектра эмиссии планшетов проводилось на каналах, соответствующих длинам волн 535 и 595 нм; было рассчитано соотношение полученных величин. Вестерн-блоттинг. Клетки из указанных культур, приблизительно 1107, были собраны, промыты в фосфатно-солевом буферном растворе и подвергнуты лизису в буфере RIPA, содержащем 1% NP-40, 120 мМ Tris-HCl, 150 мМ NaCl, 0,2 мМ PMSF и 1 мМ EDTA. 50 мкг цитозольного белка из каждого образца поместили в градиентный гель NuPAGE 4-12% и разделили с помощью метода SDS-PAGE в системе Novex (Invitrogen). Разделенные белковые полосы были перенесены на нитроцеллюлозу и проанализированы с использованием: 1) антимышиных антител к человеческому белку E1B-19K, разведение 1:40 (Cat No. DP-17, CalBiochem, Gibbstown, MD); 2) антикроличьих антител к человеческому белку Aven, разведение 1:1000 (CatNo. 616713, BD BioScience). Вышеизложенный протокол, включая использованные антитела, был оптимизирован и стандартизирован с использованием известных количеств (10 нг каждого) очищенных белков E1B-19K, Aven и XIAP, приобретенных в коммерческих фирмах. Для визуализации белковых зон был использован набор ECL (GE Healthcare, Piscataway, NJ). Определение концентрации метаболитов в среде. Концентрации ключевых метаболитов и продуктов жизнедеятельности были определены в автоматическом анализаторе YSI 2700. Концентрация ионов аммония определялась с помощью проточноинжекционного анализа (Campmajo et al., 1994). Аминокислоты измерялись с помощью HPLC (Waters,Milford, MA), используя колонку с обратимой фазой (Waters). Пример 1. Создание устойчивых к апоптозу клеточных линий и исследование их свойств. Список клеточных линий, использованных в настоящем исследовании, экспрессионные плазмиды,которые были использованы для трансфекции при создании каждой клеточной линии, и селективные агенты, использованные для изоляции трансфектом, перечислены в приведенной выше таблице. Указанные в таблице клеточные линии представляют собой множественные клоны, созданные в результате каждой трансфекции. Название каждой клеточной линии является производным от антиапоптозных генов,трансфицированных в клеточную линию-хозяина. Например, ЕАХ 197 - это клеточная линия, которая была трансфицирована генами E1B-19K (Е), Aven (А) и XIAP (X). Название "апоптозная R " будет в дальнейшем использоваться для обозначения клеточных линий, трансфицированных одним или более указанными антиапоптозными генами. Оценка свойств апоптозных R клеточных линий, использованных в настоящей работе, была произведена с помощью вестерн-блоттинга, анализа активности каспаз 3 и 7, а также с помощью анализа мембранного потенциала митохондрий (данные не приводятся). Как единичные Е 64, так и двойные трансфектанты ЕА 63, ЕА 112, ЕА 167 и ЕА 190 экспрессировали большее, чем фоновое, наблюдаемое в не-8 019812 трансфицированных контрольных линиях С 1013 А, количество белка E1B-91K. Из четырех клеточных линий, являющихся двойными трансфектантами, ЕА 112 и ЕА 167 экспрессировали как белок E1B-19K(19 кДа), так и белок Aven (55 кДа). Клеточные линии ЕА 63 и ЕА 190 экспрессировали белок E1B-19K в довольно большом количестве, тогда как производство белка Aven было очень низким. Из четырех клеточных линий, созданных при трансфекции двойными векторами pBUDCE4.1-E1B-19K-Aven иpCMV-XIAP, а именно линий ЕАХ 64, ЕАХ 99, ЕАХ 148 и ЕАХ 197, только линия ЕАХ 197 экспрессировала все три белка в детектируемых количествах. Полоса, соответствующая белку с массой 55 кДа, наблюдалась во всех лунках планшета, включая лунку, соответствующую нетрансфицированной контрольной линии С 1013 А; выше рекомбинантного белка Aven предположительно располагалась полоса, соответствующая эндогенному белку Aven, как подтверждалось постиммунной, но не преимунной сывороткой (Sauerwald et al., 2002, Chau et al., 2000). У трансфицированного гена Aven отсутствуют первые шесть аминокислот, которые, как оказывается, не нарушают биологическую активность белка. Следовательно, трансфицированный Aven немного меньше,чем его эндогенный аналог. Полоса, соответствующая массе 40 кДа, которая, вероятно, представляет собой частично разрушенный белок Aven, присутствовала во всех клеточных линиях, сверхэкспрессирующих этот белок одновременно с E1B-19K. Деградированные продукты сходных размеров наблюдались и прежде при одновременной сверхэкспрессии Aven с Bcl-XL (Sauerwald et al., 2005) или с Bcl-2 (Figueroa,неопубликованные данные). Кроме того, экспрессия Aven была значительно ниже в тройных трансфектантах, включая линию ЕАХ 197, сверхэкспрессирующую E1B-19K, Aven и XIAP. Любопытно, что уровень экспрессии трансфицированного XIAP был значительно ниже, чем эндогенный уровень оригинального белка XIAP. Заметим, что значительные отличия между XIAP и XIAP в уровнях экспрессии отчасти могут быть объяснены отличием в эффективности связывания антител этими различными формами антиапоптозного белка. Столь явные отличия в экспрессии между эндогеннымXIAP и трансгенным XIAP ставят под сомнение вклад последнего в предотвращение апоптоза. Действительно, настоящее исследование позволяет предположить, что прямая корреляция между уровнем экспрессии данного антиапоптозного гена и уровнем защиты от апоптоза, который соответствующий белок обеспечивает клеточной линии, существует не всегда. Активность каспаз 3 и 7 анализировалась в каждой апоптозной R клеточной линии с помощью APOONE, поскольку активность каспазы служит индикатором степени устойчивости клеточной линии к апоптозу. Коротко говоря, этот анализ состоит в том, что профлюоресцентный субстрат Z-DEVD-R110 расщепляется каспазами 3 и 7, причем эффективность разрушения зависит от количества каспаз. Культуры ЕА 167 и ЕАХ 197, находящиеся в экспоненциальной фазе роста, также как и контрольная клеточная линия, инкубировались в присутствии стауроспорина в течение 16 ч с целью индукции апоптоза, после чего измерялась активность каспаз 3 и 7. Активность каспаз 3 и 7 в обработанных стауроспорином контрольных клеточных линиях была принята за 100%. В этом случае активность каспазы в клетках линий ЕА 167 и ЕАХ 197 составила соответственно 30 и 35% от контроля, позволяя предположить, что эти клеточные линии имели, по крайней мере, частичную устойчивость к индукции апоптоза (фиг. 2 А). Для дальнейшего выяснения апоптозных R свойств ЕА 167 и ЕАХ 197 обработанные стауроспорином культуры этих двух клеточных линий, также как и контрольной клеточной линии, инкубировались с антителами против каспазы 3, меченными FITC, и затем были проанализированы в системе поточной цитометрии. На фиг. 3 можно увидеть, что все три клеточные линии, вне зависимости от того, подвергались ли они обработке веществом-носителем (в данном случае был использован DMSO), имели 1% или меньшее количество клеток, позитивных в отношении каспазы 3. Однако 91% популяции контрольных клеток после обработки стауроспорином являлись позитивными в отношении каспазы 3. Напротив, только 9% всей популяции, полученной из клеточной линии ЕАХ 197, и 30% клеток, полученных из клеточной линии ЕА 167, были позитивны к каспазе 3, подтверждая апоптозный R фенотип этих двух клеточных линий. Чтобы проверить, приводит ли устойчивость к апоптозу к увеличению длительности жизни, в достаточно большом числе клеточных линий ЕА, культивируемых в качалочных колбах (продленное культивирование), измеряли плотность жизнеспособных клеток (VCD) и общее число жизнеспособных клеток (IVCC). Увеличение общего числа жизнеспособных клеток улучшает продуктивность культуры в заданном объеме, при допущении, что продуктивность каждой конкретной клетки остается неизменной. Таким образом, показатель IVCC может быть использован в качестве параметра для отбора лучших апоптозных R клеточных линий, которые могут быть использованы в качестве хозяев при создании продуктивных клеточных линий. Как показано на фиг. 2 В, клеточные линии с относительно низкой активностью каспаз 3 и 7, как правило, позволяли создавать клеточные линии с более высоким показателемIVCC. Несмотря на то что любая клеточная линия ЕА имела уменьшенную по сравнению с контролем активность каспаз 3 и 7, показатель IVCC не имел четкой корреляции с уровнем активности каспаз 3 и 7,присутствующих в каждой клеточной линии. Кроме того, некоторые апоптозные R клеточные линии проявляли большую стабильность, чем их клоны, в отношении выраженности антиапоптозного фенотипа. Клеточная линия ЕА 167 была использована для дальнейшего изучения, потому что она имела значительную антиапоптозную активность и устойчивый рост при культивировании в качалочных колбах. Кроме того, ЕА 167 являлась самой стабильной из всех использованных клеточных линий и интенсивно экспрессировала Aven, что было подтверждено с помощью вестерн-блоттинга. Многие сигнальные молекулы, участвующие в апоптозном пути, либо взаимодействуют с митохондриями, либо находятся внутри них. Эти белки взаимодействуют с митохондриальной мембраной и регулируют апоптоз за счет изменения проницаемости митохондрий. Поэтому мембранный потенциал митохондрий (ММР) служит дополнительным показателем физиологии клетки, по которому можно сравнивать апоптозные R свойства линий ЕА 167 и ЕАХ 197 относительно контроля. Как можно проследить по результатам анализа, представленным на фиг. 2 С, обе клеточные линии ЕА 167 и ЕАХ 197 имели более высокий ММР, чем контрольные линии. Пример 2. Влияние E1B-19K на плотность жизнеспособных клеток в клеточной линии CHO-K1SV. На фиг. 4 сравнивается динамика роста двойных трансфектантов, сверхэкспрессирующих белокAven и XIAP (EAX197), а также трансфектантов, сверхэкпрессирующих только E1B-19K (Е 64), с динамикой роста контрольной линии (линии-хозяина). Тогда как пик VCD контрольной клеточной линии составил 7,7106 клеток/мл, а линии Е 64 (экспрессирующей только E1B-19K) - 8,9106 клеток/мл, тот же показатель в линии ЕА 167 достиг 1,4107 клеток/мл, а в линии ЕАХ 197 - более чем 1,5107 клеток/мл,что составило увеличение до 190% относительно контрольной линии. Жизнеспособность линий ЕА 167 и ЕАХ 197 резко снизилась на 8-й или 9-й день после посева, что предположительно явилось следствием снижения содержания питательных веществ в среде, при этом в контрольной линии и в клеточных линиях Е 64 жизнеспособность снижалась значительно медленнее (фиг. 4 В). Суммарное влияние на IVCC показано на фиг. 4 С. Показатель IVCC контрольной линии составил 4,9107 клеток-дней/мл, за ней следовала линия Е 64 (5,2107 клеток-дней/мл). Очевидно, что показатели IVCC двух апоптозных R клеточных линий, ЕА 167 (6,3107 клеток-дней/мл) и ЕАХ 197 (6,6107 клеток-дней/мл) были значительно выше, чем в контроле (136 и 140% в ЕА 167 и ЕАХ 197 соответственно). Так же как ЕА 167 и ЕАХ 197, несколько других апоптозных R линий проявили сходный фенотип,производя низкое количество лактата (данные не приводятся). Кроме того, было отмечено существование редких клеточных линий дикого типа, производящих мало лактата (Pascoe et al., 2007). Пример 3. Динамика метаболизма в апоптозных R клеточных линиях. С целью сравнения физиологических характеристик апоптозных R клеточных линий ЕА 167 и ЕАХ 197, предположительно защищенных от апоптоза, и контрольной линии в полунепрерывных культурах, исследовались концентрации основных питательных веществ и аминокислот: глюкозы, глутамата и глутамина, добавленных в полунепрерывную культуру в самом начале процесса культивации. Кроме того, также происходило наблюдение за накоплением отходов жизнедеятельности, таких как аммиак и лактат. На фиг. 5 показаны количества названных метаболитов в линиях ЕАХ 197 и ЕА 167, а также в контрольной линии при культивировании в качалочных колбах в полунепрерывном режиме на серийно выпускаемой среде CD-CHO. Как показано на фиг. 5 А, концентрация глюкозы в среде быстро уменьшается во всех трех клеточных линиях на 6-7-й день после посева. Не было замечено сколько-нибудь значимых различий в снижении концентрации глутамина между апоптозными R и контрольными клеточными линиями; уровень глутамата также не варьировал - ни между культурами, ни по дням культивирования(данные не приводятся). Все три клеточные линии накапливали лактат в течение первых четырех дней культивирования, соответствовавших начальной фазе роста культуры (фиг. 5 В). Контрольная клеточная линия продолжала накапливать лактат вплоть до 6-го дня (к этому времени его концентрация достигала 2,8 г/л), затем наблюдалось небольшое уменьшение концентрации лактата до 1,8 г/л. Считается, что такое количество лактата снижает рН в культуре, а поскольку в биореакторе рН контролируется добавлением бикарбоната, то это может приводить к увеличению осмолярности. Эти факторы, наряду с другими стрессовыми факторами, могут приводить к формированию токсичной для животных клеток среды. Напротив, концентрация лактата в апоптозных R клеточных линиях возрастала в течение меньшего промежутка времени, а затем, начиная с 5-го дня резко снижалась, так что лактат полностью исчезал на 7-й (в линии ЕА 167)-8-й (в линии ЕАХ 197) день жизни культуры. Интересно, что в последних двух линиях,вслед за моментом, когда концентрация лактата опускалась до нуля, сразу же наступал период резкого снижения VCD, как это можно проследить по фиг. 5 А, позволяя предположить, что потеря жизнеспособности клеток была следствием отсутствия глюкозы или лактата в среде. Динамика концентрации аммиака в среде выявила еще одно отличие между апоптозной R и контрольной клеточными линиями (фиг. 5 С). Концентрация аммиака слегка уменьшалась на 6-й день в линиях ЕА 167 и ЕАХ 197 (с этим периодом также совпадало начало уменьшения концентрации лактата), а затем снова увеличивалась. Тем не менее, итоговый уровень аммиака в апоптозных R линиях был ниже,чем в контрольных, что удивительно, если иметь в виду, что апоптозные R линии достигали более высокого показателя IVCC и, следовательно, большего итогового роста по сравнению с контрольными клеточными линиями (фиг. 4 С).- 10019812 Приведенные данные свидетельствуют о том, что характеристики апоптозных R клеточных линий существенно отличаются от свойств контрольных линий. Тем не менее, среди апоптозных R трансфектантов можно встретить широкий спектр фенотипов при наблюдении большого числа клонов в слегка отличающихся экспериментальных условиях. Поскольку в разных изолированных клонах контрольной линии также наблюдается фенотипическое разнообразие, то при применении соответствующих режимов отбора можно выделить редкие апоптозные R клоны из контрольной клеточной линии. С этой целью Mattanovich и Borth (2006) проанализировали использование методов сортировки клеток для изоляции редких вариантов с желаемыми характеристиками непосредственно из клеточной линии дикого типа (контрольной линии). Пример 4. Влияние добавления лактата в культуру. Количество лактата, присутствующего в клеточной культуре в некоторый момент времени, зависит от количества секретированного клетками лактата, а также от количества потребленного ими лактата. С целью определить, действительно ли апоптозные R клеточные линии потребляли лактат, или же итоговая продукция лактата в этих линиях была ниже, производили ежедневное наблюдение за всеми тремя линиями, и любое фиксируемое отличие в концентрации лактата между апоптозными R и контрольными клеточными линиями устранялось за счет добавления экзогенного лактата. Как указано выше, уровень лактата в апоптозных R линиях ЕА 167 и ЕАХ 197 в условиях культивирования без подпитки начинал снижаться на 5-й день (фиг. 6 А и 6 В), полное исчезновение происходило на 7-й день (в линии ЕА 67, без подпитки) или 8-й день (в линии ЕАХ 197, без подпитки). Содержание лактата в контрольной клеточной линии продолжало увеличиваться вплоть до 6-го дня, затем слегка уменьшалось в течение следующих трех дней, но никогда не падало до нуля. Лактат добавляли в отдельные подпитываемые апоптозные R культуры, доводя его количество до 2,5 г/л на 7-й день культивирования (для линии ЕА 167, фиг. 6 А) и до 2 г/л на 8-й день культивирования (для линии ЕАХ 197, фиг. 6 В), так чтобы количество лактата было сходно с контрольными культурами; при этом наблюдение за культурами велось ежедневно. Даже при добавлении дополнительного лактата, в апоптозных R культурах его количество уменьшалось значительно быстрее, чем в контрольных, в промежуток между 6-м и 12-м днями культивирования. Действительно,в то время как в культуре ЕА 167 с подпиткой количество лактата снижалось с 2,5 до 0,2 г/л с 6-го на 7-й день, в контрольной культуре происходило всего лишь снижение с 2,7 до 2,4 г/л. Таким образом, в апоптозных R клеточных линиях лактат потреблялся быстрее, чем в контрольных, в течение по крайней мере 7 дней после добавления лактата. Влияние добавления лактата на VCD и жизнеспособность клеток иллюстрируется на фиг. 7 А и 7 В соответственно. Как уже отмечалось (фиг. 5 А), показатель VCD апоптозных R культур без подпитки быстро уменьшался, начиная с 8-го (в линии ЕА 167) и 9-го (в линии ЕАХ 197) дней. Вероятно, это происходило в результате полного истощения одного или более существенных компонентов среды, включая глюкозу и (или) лактат. Контрольные клеточные линии проявляли легкое снижение, начиная с 7-го дня. Однако добавление лактата в культуры (ЕА 167, подпитка лактатом, и ЕАХ 197, подпитка лактатом) приводило к значительно более медленному снижению VCD, а в одной клеточной линии (ЕАХ 197, подпитка лактатом) показатель VCD стабилизировался между 8106 и 10106 клеток/мл и поддерживался вплоть до 14-го дня, когда эта линия погибла. Аналогично, жизнеспособность клеток в двух апоптозных R культурах, показанная на фиг. 7 В, проявила более плавное снижение при добавлении лактата в среду. Эти результаты позволяют предположить, что апоптозные R клеточные линии способны эффективно усваивать как эндогенный, так и добавленный в среду лактат, восстанавливая плотность жизнеспособных клеток и жизнеспособность, тогда как контрольные клеточные линии неспособны использовать столь эффективную стратегию потребления лактата. Указанное отличие находит отражение в IVCC: апоптозные R культуры при подпитке лактатом имели показатель IVCC приблизительно 180-220%, если сравнивать с апоптозными R культурами без подпитки, и почти 235-250%, если сравнивать с контрольными культурами. Динамика большинства других питательных веществ и метаболитов, показанная на фиг. 7D-7F, была аналогична динамике соответствующих компонентов, характерной для рассмотренных культур без подпитки (см. фиг. 5). Глюкоза и глутамин активно потреблялись уже на ранних этапах жизни культуры. Кривая, характеризующая концентрацию аммиака в апоптозных R культурах, проявляла легкое снижение в тот момент, когда начиналось потребление лактата, как в культурах подпиткой, так и в культурах без подпитки лактатом. Как и в предыдущих экспериментах, конечный уровень аммиака в апоптозных R клеточных линиях был ниже, чем в контроле, даже несмотря на то, что показатель IVCC был значительно выше во всех четырех апоптозных R культурах. Культуры, как с подпиткой, так и без подпитки лактатом отличались по содержанию глутамата в среде, причем снижение уровня глутамата было более выражено в культурах с подпиткой, чем в культурах без подпитки и контрольных культурах. Пример 5. Изменение концентрации аминокислот в апоптозных R и контрольных клеточных линиях. Концентрация каждой из двадцати аминокислот исследовалась в контрольных клеточных линиях, а также в апоптозных R культурах с подпиткой и без подпитки лактатом (фиг. 8). Рассматривая потребле- 11019812 ние или производство аминокислот, кроме глутамина и глутамата, в первую очередь следует отметить,что ни одна из девяти незаменимых аминокислот (фенилаланин, треонин, метионин, лизин, триптофан,лейцин, изолейцин, валин и гистидин) не была полностью исчерпана. В апоптозных R культурах (без подпитки) и в культурах контрольных клеточных линий аспарагин, серин, триптофан и цистеин (выделены курсивом) были исчерпаны практически полностью. Интересно, что концентрация всех трех аминокислот с разветвленной цепью: изолейцина, лейцина и валина - в апоптозных R культурах уменьшалась быстрее, чем в контроле, и была более выражена в культурах с подпиткой лактатом (фиг. 8A-8D). Как и в случае глутамата, финальный уровень трех названных аминокислот был значительно ниже, чем в культурах с подпиткой лактатом. Аминокислоты, потребленные в большом количестве (финальная концентрация составила менее 50% от начальной концентрации) включали тирозин, фенилаланин, метионин(фиг. 8D) и аспарагиновую кислоту (фиг. 8 Е). Интересно также сравнить аминокислоты, секретируемые в среду, в культуре контрольных и апоптозных R клеточных линий. На фиг. 8 Е показано, что контрольные клеточные линии накапливали аспарагиновую кислоту в течение первых шести дней, тогда как во всех четырех апоптозных R культурах в продолжение того же периода происходило уменьшение концентрации аспарагиновой кислоты. Кроме того,апоптозные R клеточные линии секретировали значительно больше аланина (фиг. 8F) в течение первых шести дней, чем контрольные клеточные линии, причем все клеточные линии начинали потреблять аланин позднее. Кроме того, за весь период культивирования в целом, апоптозные R клеточные линии производили больше гомоцистеина, чем контрольные культуры (фиг. 8G). Пример 6. Характеристики полунепрерывных культур при высокой концентрации глюкозы. Если апоптозные R клеточные линии могут усваивать лактат, то существует вероятность, что эти линии будут хорошо развиваться при концентрациях глюкозы, обычно являющихся лимитирующими для роста контрольных клеточных линий из-за накопления токсичных уровней лактата. Кроме того, возможно, что эти линии будут иметь лучшие показатели роста в среде, содержащей лактат в качестве единственного источника углерода. Среда CD-CHO, использованная в предыдущих экспериментах, оказалась непригодной в данном случае, поскольку такая высокая концентрация глюкозы привела бы к непереносимому повышению осмолярности, таким образом, возникла необходимость в новой среде. Поэтому мы сравнили кинетику роста клеточной линии ЕАХ 197, показавшей наибольший устойчивый рост в предыдущих экспериментах, и контрольных линий при культивировании на адаптированной среде, не содержащей животного белка, в присутствии 60 мМ глюкозы (высокий уровень глюкозы) или 30 мМ лактата. Ни апоптозные R, ни контрольные клеточные линии не имели устойчивого роста при полном отсутствии глюкозы, например, только в присутствии лактата (данные не приводятся). Когда оба типа клеточных линий культивировали в одинаковой адаптированной среде, содержащей"высокую" (60 мМ) концентрацию глюкозы, клеточные линии ЕАХ 197 имели более высокие показателиVCD, жизнеспособности и IVCC (фиг. 9 А-9 С), чем контрольные линии, в особенности на более поздних этапах культивирования. Клеточные линии ЕАХ 197 показали меньшее по сравнению с контролем увеличение IVCC (130%), чем это было отмечено в среде CD-CHO, использованной в предыдущих экспериментах, но отличие все же было значимым вследствие увеличения жизнеспособности на более поздних этапах. Кривые концентрации лактата в среде этих двух клеточных линий при культивировании в условиях "высокого" содержания глюкозы, показаны на фиг. 9D. Так же как и в случае с IVCC, динамика изменения лактата в культурах обеих клеточных линий отличалась от динамики, наблюдаемой в среде CDCHO (фиг. 5D). В соответствии с результатами, полученными в среде CD-CHO, при содержании в адаптированной среде, апоптозные R клеточные линии начали потребление лактата раньше (на 2-й день, как показано на фиг. 9D), чем контрольные культуры, и максимальное содержание лактата, достигнутое в этих культурах, было ниже (1,2 г/л против 2,4 г/л в контрольных клеточных линиях). Контрольные клетки производили лактат до пятого дня, после чего перешли к потреблению лактата. Поскольку среда CDCHO - это коммерчески реализуемый продукт, формула которого не разглашается, не представлялось возможным детальное сравнение компонентов сред, чтобы понять, по какой причине клеточные линии демонстрируют различия в потреблении лактата. Пример 7. Продуктивность апоптозных R клеточных линий в среде, содержащей высокую концентрацию глюкозы. Апоптозная R клеточная линия ЕАХ 197, также как и контрольная линия, впоследствии были использованы в качестве линий-хозяев для создания продуктивных клеточных линий, экспрессирующих модельные антитела. Для каждой клеточной линии было исследовано одинаковое количество клонов; в условиях полунепрерывного культивирования в качалочных колбах сравнивалась продуктивность по Ab между лучшими клонами, произошедшими от разных линий-хозяев. Для сравнения поведения клеточных линий в условиях высокой концентрации глюкозы использовалась адаптированная среда, содержащая 60 мМ ("высокое" содержание) глюкозы в качестве источника углерода. На стандартной среде (фиг. 10 А),титр продукции клеточных линий, производных от линии ЕАХ 197, составил 489 мг/л, что представляет собой 145% увеличение по сравнению с контролем, в котором титр составил 337 мг/л. Те же линии в среде с высоким содержанием глюкозы (фиг. 10 В) имели титр 687 мг/л, что означало увеличение на 178% по сравнению с контрольными линиями (384 мг/л). Увеличение продуктивности произошло, по крайней мере отчасти, благодаря увеличению на 188% показателя IVCC в линиях ЕАХ 197 по сравнению с контрольными клеточными линиями (данные не приводятся). Пример 8. Влияние сверхэкспрессии генов E1B19K+AVENXIAP на предотвращение апоптоза. Основные активаторы апоптозного каскада в митохондриях показаны на фиг. 1. С целью создания устойчивых против апоптоза клеточных линий СНО авторы изобретения остановили свой выбор на трех антиапоптозных генах, действующих на ранней, средней и поздней стадиях апоптозного процесса. Это были гены E1B19K (Е), AVEN (А) и XIAP (X). Клеточная линия CHO-K1SV, наиболее часто используемая в качестве клеточной линии-хозяина, была трансфицирована генами E1B19K+AVEN с/без XIAP. Исследованию подвергли большое число трансфектом, и несколько клонов от каждой трансфекции было отобрано для дальнейшего изучения. Эти линии характеризовались очень высоким показателем VCD в целом, показатель IVCC в этих линиях был почти в два раза выше, чем в контроле. Жизнеспособность в апоптозных R клеточных линиях уменьшалась на 8-й день после посева, однако восстанавливалась на 10 й день, за счет потребления лактата. Среда апоптозных R линий, экспрессирующих белкиE1B19K+AVENXIAP имела следовые или невыявляемые количества аммиака и лактата, а также характеризовалась истощением запасов глутамата. Пример 9. Использование Bcl-2d для увеличения титра антител. Приведенные выше результаты показывают, что апоптозные R клеточные линии накапливают меньше лактата, чем контрольные линии, а также, что жизнеспособность апоптозных R культур может поддерживаться в среде с высоким содержанием глюкозы. Эксперимент заключался в том, что посев апоптозных R линий, экспрессирующих Bcl-2d, а также тяжелую и легкую цепи антитела (С 2088 В), произвели при различных плотностях при условиях нормальной (4,8 г/л) и высокой концентрации глюкозы(9,5 г/л); полунепрерывное культивирование осуществлялось в качалочных колбах. Результаты показывают, что апоптозные R клеточные линии, посеянные при плотности 16 клеток/мл в среду, содержащую 9,5 г/л глюкозы, достигли пика VCD, равного 146 клеток/мл на 7-й день после посева (фиг. 11 А), а титр антител составил 2 г/л. Для сравнения, в линии С 2088 В, культивированной в стандартных условиях(инокуляция при 0,35 клеток/мл и 4,8 г/л), наблюдался пик VCD, составивший 76 клеток/мл, а титр антител составил 1 г/л (фиг. 11 В). Это равнозначно 200% увеличению титра антител при высоком содержании глюкозы по сравнению со стандартными условиями (а именно, плотность посева 0,36 клеток/мл в среде, содержащей 4,8 г/л глюкозы). В завершение полного описания настоящего изобретения подразумевается, как известно специалисту в данной области, что в описываемые объекты может быть внесено множество изменений и модификаций, не выходящих за пределы сущности и объема предлагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ увеличения плотности жизнеспособных клеток в подпитываемых культурах эукариотических клеток, включающий следующие этапы:a) культивирование эукариотической клеточной линии, экспрессирующей один или более гетерологичных генов устойчивости к апоптозу (апоптозных R) и один или более представляющих интерес генов; иb) поддержание высокого содержания глюкозы в среде в течение экспоненциальной и стационарной фаз роста клеточной культуры, где апоптозные R гены представляют собой гены E1B19K и AVEN, а концентрация лактата в клеточной культуре составляет приблизительно 1 г/л или менее после 5 дней культивирования. 2. Способ по п.1, в котором эукариотическая клеточная линия представляет собой клетки яичника китайского хомячка (СНО). 3. Способ по п.2, в котором клеточная линия СНО представляет собой клетки CHO-K1. 4. Способ по п.2, в котором клеточная линия СНО представляет собой клетки CHO-K1SV. 5. Способ по п.1, в котором эукариотическая клеточная линия представляет собой клетки миеломы. 6. Способ по п.5, в котором клеточная линия миеломы представляет собой клетки NS0. 7. Способ по п.5, в котором клеточная линия миеломы представляет собой клетки Sp2/0. 8. Способ по п.1, в котором эукариотическая клеточная линия представляет собой клетки гибридомы. 9. Способ по п.1, в котором апоптозные R гены дополнительно включают ген XIAP. 10. Способ по п.1, в котором пик плотности жизнеспособных клеток (VCD) увеличен. 11. Способ по п.1, в котором длительность жизни клеточной культуры увеличена. 12. Способ по п.1, в котором титр клеточной культуры увеличен. 13. Способ по п.1, в котором общее число жизнеспособных клеток (IVCC) клеточной культуры уве- 13019812 личено. 14. Способ по п.1, в котором поток кальция в клетках уменьшен. 15. Способ по п.1, в котором мембранный потенциал митохондрий увеличен. 16. Способ по п.1, в котором представляющие интерес гены кодируют тяжелую и легкую цепи антитела. 17. Способ по п.1, в котором высокая концентрация глюкозы в среде составляет приблизительно 60 мМ, а концентрация лактата в клеточной культуре составляет приблизительно 0,1 г/л или менее после 7 дней культивирования.
МПК / Метки
МПК: C12N 5/10
Метки: млекопитающих, жизнеспособных, способы, высокой, культуре, клеток, получения, плотности
Код ссылки
<a href="https://eas.patents.su/30-19812-sposoby-polucheniya-vysokojj-plotnosti-zhiznesposobnyh-kletok-v-kulture-kletok-mlekopitayushhih.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения высокой плотности жизнеспособных клеток в культуре клеток млекопитающих</a>
Предыдущий патент: Способ эксплуатации регенеративного нагревателя
Следующий патент: Резиновая композиция для протектора зимней шины
Случайный патент: Аэродинамическая установка для сухого обогащения дисперсных материалов