Способ усиления миграции гемопоэтических стволовых клеток, способ получения популяции указанных клеток и способы лечения с их использованием
Формула / Реферат
1. Способ усиления миграции гемопоэтических стволовых клеток (ГСК) из костного мозга в кровоток, включающий введение млекопитающему, нуждающемуся в этом, композиции, содержащей липопептид, представляющий собой соединение формулы
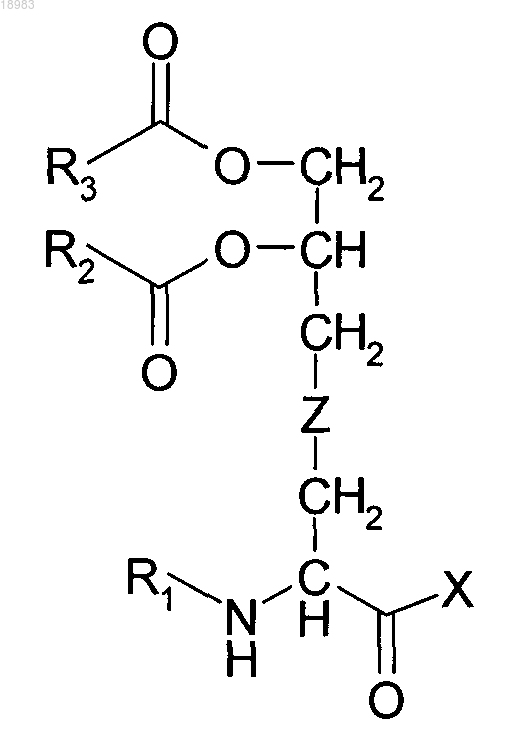
где R1 представляет собой Н или -CO-R4;
R2, R3 и R4 независимо представляют собой Н или возможно замещенные алифатические C8-C16 радикалы;
X представляет собой пептид и
Z представляет собой S или СН2.
2. Способ по п.1, где пептид содержит любую из последовательностей SEQ ID NO: 1-52.
3. Способ по п.2, где первые пять аминокислот пептида выбраны из аминокислот, указанных для соответствующих позиций в табл. 3.
4. Способ по п.2, где пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 8, 16-18, 20 и 21, а также их замен.
5. Способ по п.1, где R1 представляет собой Н, a R2 и R3 представляют собой C16 алифатические радикалы.
6. Способ по п.1, где липопептид представляет собой соединение формулы

7. Способ по п.1, дополнительно включающий введение радиопротектора.
8. Способ по п.7, где радиопротектор представляет собой антиоксидант.
9. Способ по п.7, где радиопротектор представляет собой цитокин.
10. Способ по п.9, где цитокин является фактором стволовой клетки.
11. Способ по п.7, где радиопротектор представляет собой флагеллин.
12. Способ по п.7, где радиопротектор представляет собой фактор роста опухоли - бета (TGFβ).
13. Способ лечения заболевания, связанного с гемопоэтическим и/или лимфоидным повреждением, включающий усиление миграции гемопоэтических стволовых клеток из костного мозга в кровоток способом по п.1.
14. Способ по п.13, где заболевание выбрано из группы, состоящей из рака, аутоиммунного заболевания, анемии, незлокачественного гематологического расстройства, синдрома Вискотта-Элдрича, синдрома Чедиака-Хигаси, тяжелого комбинированного иммунодефицита (SCID), талассемии и серповидно-клеточной анемии.
15. Способ по п.14, где рак выбран из группы, состоящей из лейкемии, лимфомы, злокачественного гематологического заболевания, рака молочной железы, рака яичка, нейробластомы, рака яичников, миеломы и макроглобулинемии Вальденстрема.
16. Способ получения популяции стволовых клеток, включающий:
(а) усиление миграции гемопоэтических стволовых клеток (ГСК) из костного мозга в кровоток способом по п.1 и
(б) выделение белых кровяных клеток периферической крови у млекопитающего, причем указанные белые кровяные клетки периферической крови содержат популяцию стволовых клеток.
17. Способ лечения последствия терапии рака, которое связано с гибелью стволовых клеток в костном мозге пациента, включающий введение популяции стволовых клеток, полученной способом по п.16, пациенту, перенесшему лечение от рака.
Текст
СПОСОБ УСИЛЕНИЯ МИГРАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК,СПОСОБ ПОЛУЧЕНИЯ ПОПУЛЯЦИИ УКАЗАННЫХ КЛЕТОК И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ИСПОЛЬЗОВАНИЕМ В изобретении предложен способ увеличения числа гемопоэтических стволовых клеток в костном мозге, усиления миграции этих клеток из костного мозга в кровоток и в другие ткани, а также увеличения числа дифференцирующихся гемопоэтических стволовых клеток в кровотоке. Область изобретения Настоящее изобретение относится к применению агента, увеличивающего количество гемопоэтических стволовых клеток и мобилизацию этих клеток в кровоток. Уровень техники Клетки крови отвечают за постоянное поддержание и иммунную защиту каждого типа клеток в организме. Клетки крови, наряду с клетками кожи, обладают наибольшим потенциалом самообновления по сравнению с любой взрослой тканью. Стволовые клетки, образующие кровяные и иммунные клетки, называют гемопоэтическими стволовыми клетками (ГСК). Они, в конечном итоге, отвечают за постоянное обновление крови путем образования биллионов новых клеток крови каждые сутки. У ГСК есть две особенности: они могут самовоспроизводиться и могут образовывать клетки, которые дают начало всем дифференцированным типам клеток крови. Дальнейшее исследование показало, что после разведения клетка ГСК может дифференцироваться не только в клетки крови, но также и в мышечные клетки (скелетные миоциты и кардиомиоциты), клетки мозга, клетки печени, клетки кожи, клетки легкого, клетки почек, клетки кишечника и клетки поджелудочной железы. Костный мозг представляет собой классический источник ГСК, однако в качестве такового его используют нечасто по причине инвазивной процедуры сбора, которая требует проведения общей анестезии для донора стволовых клеток. В ходе клинической процедуры пересадки костного мозга обычно делают костную пункцию в области тазовой кости и клетки костного мозга вытягивают с помощью шприца. Приблизительно 1 на каждые 100000 клеток в мозге представляет собой долгоживущую стволовую клетку, образующую кровь. В настоящее время для клинической трансплантации человеческих ГСК врачи предпочитают отбирать донорские клетки из циркулирующей периферической крови. В течение нескольких десятилетий считалось, что в кровотоке циркулирует небольшое число стволовых клеток и клеток-предшественников,однако за последние 10 лет ученые обнаружили, что можно добиться миграции клеток из костного мозга в кровь в большем количестве путем введения донору цитокина, такого как гранулоцитарный колониестимулирующий фактор (G-CSF). Донору вводят инъекцией G-CSF за несколько дней до сбора клеток. Чтобы собрать клетки, внутривенную трубку вводят в вену донора, и венозная кровь проходит через фильтрующую систему, на которой собираются CD34+ белые кровяные клетки, а красные кровяные клетки возвращаются донору. Эту процедуру обычно называют "аферезисом стволовых клеток". Как известно в отношении костного мозга, CD34+ клетки представляют собой смесь стволовых клеток, предшественников и белых кровяных клеток с различными степенями созревания. Из собранных клеток 5-20% будут являться настоящими ГСК. Соответственно в данной области существует потребность в увеличении числа ГСК в кровотоке. Настоящее изобретение направлено на решение этой проблемы и предлагает способ увеличения числа ГСК в костном мозге и усиления мобилизации этих ГСК в отношении миграции из костного мозга в периферический кровоток. Краткое изложение сущности изобретения В соответствии с изобретением предложен способ улучшения характеристики популяции ГСК. Характеристикой может быть число клеток. Также характеристикой может быть подвижность. Способ может включать введение композиции, которую можно вводить нуждающемуся в этом млекопитающему. Этим способом можно увеличивать число ГСК в костном мозге. Также этим способом можно увеличивать мобилизацию ГСК из костного мозга в кровоток. Популяция стволовых клеток может содержать стабильные ГСК или коммитированные клетки-предшественники. Композиция может содержать агент, которым может быть липопептид. Липопептид может представлять собой соединение формулыR2, R3 и R4 независимо представляют собой Н или возможно замещенный алифатический C8-C16;X представляет собой пептид иZ представляет собой S или СН 2. Указанный пептид может содержать любую из последовательностей SEQ ID NO: 1-52. Первые пять аминокислот пептида могут быть выбраны из аминокислот в положениях, указанных в табл. 3. Пептид также может содержать последовательность, выбранную из группы, состоящей из SEQ ID NO: 8, 16-18,-1 018983 21, 21 и их заместителей. R1 может представлять собой Н, a R2 и R3 могут представлять собой C16 алифатические радикалы или их заместители. Соединение может представлять собой RR- или RS-стереоизомер либо их смесь. Соединение также может иметь формулу Указанный агент также может представлять собой липосахарид, который может иметь формулуR2, R3 и R4 независимо представляют собой Н или возможно замещенные алифатические C8-C16 радикалы;X представляет собой сахарид иZ представляет собой S или СН 2. Способ может включать введение млекопитающему, нуждающемуся в этом, указанного агента в комбинации с агонистом рецептора G-CSF. Способ может включать введение агента в комбинации с GCSF. Способ может включать введение агента в комбинации с антагонистом CXCR4. Способ может включать введение агента вместе с AMD3100. Способ может включать введение агента в комбинации сG-CSF и антагонистом CXCR4. Способ может включать введение агента в комбинации с G-CSF иAMD3100. Способ может включать введение агента в комбинации с G-CSF, AMD3100 и антагонистомCXCR4. Агент можно вводить до, вместе с введением G-CSF или после введения G-CSF. Агент можно вводить за 1 ч перед или после введения G-CSF. Агент можно начинать вводить в любое время в пределах 96 ч перед или после введения G-CSF. Способ может дополнительно включать сбор мононуклеарных клеток периферической крови млекопитающих. Способ может дополнительно включать введение радиопротектора, который может представлять собой антиоксидант, флагеллин, TGF (фактор роста опухоли - бета), активатор Толл-подобных рецепторов (TLR) или цитокин. Цитокин может представлять собой фактор стволовой клетки. Указанным способом можно лечить последствие патологического состояния, при этом осуществляют увеличение числа клеток популяции ГСК и увеличение движения в кровоток в соответствии с описанным здесь. Патологическое состояние может быть выбрано из группы, состоящей из радиации, ран,отравлений, инфекции, аутологического трансплантата костного мозга и повреждения костного мозга. Также предложен способ лечения заболевания. Заболевание может быть связано с гемопоэтическим и/или лимфоидным повреждением. Заболевание может представлять собой злокачественное или незлокачественное гематологическое расстройство, тяжелый комбинированный иммунодефицит (SCID), синдром Вискотта-Олдрича или синдром Чедиака-Хигаси. Способ также может включать увеличение числа клеток популяции ГСК и мобилизацию в соответствии с описанным здесь способом. Заболевание может быть выбрано из группы, состоящей из рака, аутоиммунного заболевания, иммунодепрессивного заболевания, анемии, талассемии и серповидноклеточной анемии. Рак может быть выбран из группы, состоящей из рака молочной железы, рака яичка, нейробластомы, рака яичника, лейкемии, лимфомы, миеломы и макроглобулинемии Вальденстрема. Аутоиммунное заболевание может представлять собой ВИЧинфекцию. Также предложен способ получения аутологической популяции стволовых клеток у млекопитающего, при котором осуществляют улучшение характеристики популяции ГСК и выделение белых кровяных клеток периферической крови. Белые кровяные клетки периферической крови могут содержать аутологическую популяцию стволовых клеток. Также предлагается способ лечения последствия лечения рака, который может включать введение аутологической популяции стволовых клеток млекопитающему, перенесшему лечение от рака. Лечение рака может представлять собой химиотерапию или лучевую терапию. Аутологическую популяцию стволовых клеток можно вводить путем инъекции или трансфузии. Также предложен способ выделения ГСК из образца крови. Способ может включать введение композиции, содержащей агент, нуждающемуся в этом человеку. Способ также может включать выделение ГСК из образца. Агент может представлять собой описанный здесь липопептид. Краткое описание чертежей: на фиг. 1 представлена структура липополисахарида; на фиг. 2 представлены эффекты липопептида CBLB601 на массу селезенки и массу организма мыши после облучения всего организма (ОВО) 6 Гр; на фиг. 3 представлен статус ГСК в костном мозге. Процент клеток костного мозга, которые являются ГСК, у мышей линии ICR, обработанных CLBLB601, по сравнению с контролем; на фиг. 4 представлен гемопоэтический статус стволовых клеток в крови; количество ГСК на 1 мл крови у мышей линии ICR, обработанных CBLB601, по сравнению с контролем; на фиг. 5 объединены данные анализа клеточным сортером с активацией флуоресценции (анализаFACS) для костного мозга и образцов крови, взятых у макаки-резус, которой вводили G-CSF, в качестве контроля по сравнению с обезьянами, которым вводили 0,25 мг/кг CBLB612; на фиг. 6 представлены данные анализа FACS для костного мозга и образцов крови, взятых у макакрезус (в качестве контроля) или обезьян, которым вводили 0,25 мг/кг CBLB612 (липопептида); на фиг. 7 представлены данные, относящиеся к кинетическим изменениям в количестве клеток с фенотипом стволовой клетки в крови мышей после однократной инъекции CBLB612 с последующимAMD3100; на фиг. 8 представлены данные, относящиеся к кинетическим изменениям в количестве клеток с фенотипом предшественников в крови мышей после однократной инъекции CBLB612 с последующим введением AMD3100; на фиг. 9 представлены данные, относящиеся к кинетическим изменениям в количестве клеток с фенотипом стволовых клеток в костном мозге мышей после однократной инъекции CBLB612 с последующим введением AMD3100; на фиг. 10 представлены данные, относящиеся к кинетическим изменениям в количестве клеток с фенотипом предшественников в костном мозге мышей после однократной инъекции CBLB612 с последующим введением AMD3100; на фиг. 11 представлены данные, относящиеся к кинетическим изменениям в количестве клеток с фенотипом стволовых клеток в крови мышей после однократной инъекции CBLB612 с последующим введением AMD3100; на фиг. 12 представлены данные, относящиеся к кинетическим изменениям в количестве клеток с фенотипом предшественников в крови мышей после однократной инъекции CBLB612 с последующим введением AMD3100; на фиг. 13 представлены данные, относящиеся к кинетическим изменениям в количестве клеток с фенотипом стволовых клеток в костном мозге мышей после однократной инъекции CBLB612 с последующим введением AMD3100; на фиг. 14 представлены данные, относящиеся к кинетическим изменениям в количестве клеток с фенотипом стволовых клеток в костном мозге мышей после однократной инъекции CBLB612 с последующим введением AMD3100; на фиг. 15 представлены данные, относящиеся к кинетическим изменениям в количестве клеток с фенотипом предшественников в костном мозге мышей после однократной инъекции CBLB612 с последующим введением AMD3100. Подробное описание изобретения В соответствии с настоящим изобретением предложен способ увеличения числа ГСК и мобильности этих клеток в кровоток. Способ может включать введение композиции, включающей агент, который может вызывать увеличение числа ГСК в костном мозге, периферической крови и крови пуповины. Агент также может увеличивать мобильность ГСК в отношении миграции из костного мозга в кровоток. Агент может представлять собой липопептид, липополисахарид или липосахарид. Вместе с указанным агентом можно вводить радиопротектор или костимулятор ГСК. Способ можно применять для лечения последствий патологических состояний, таких как облучение, раны, отравления, инфекция, аутологические трансплантаты костного мозга и поражение костного мозга. Способ также можно применять для лечения заболеваний, как, например, рака, аутоиммунного заболевания и серповидноклеточной анемии. Также предложен способ выделения ГСК из образца крови. Способ может включать введение композиции, содержащей агент, который увеличивает или повышает число ГСК и обеспечивает подвижность клеток в кровь. Другие аспекты изобретения станут очевидными специалистам в данной области техники с помощью дальнейшего описания изобретения. 1. Определения. Понятно, что используемая здесь терминология служит только для целей описания конкретных воплощений и не предполагается, что она ограничивает объем изобретения. Необходимо отметить, что используемые в описании и формуле изобретения существительные в единственном числе относятся и к этим объектам во множественном числе, если из контекста ясно не следует обратное. Термин "вводить", как используется здесь для описания режима введения агента, может обозначать однократную дозу или многократные дозы агента. Термин "алифатический радикал", используемый здесь, может относиться к неразветвленной, разветвленной или циклической углеводородной группе, которая может быть замещенной или незамещенной, а также может быть насыщенной или ненасыщенной, но которая не является ароматической. Термин"алифатический радикал" ("алифатический радикал") может охватывать алифатические группы, которые содержат атомы кислорода, азота, серы или фосфора взамен одного или более чем одного атома углерода углеводородного скелета. Термин "алкил", используемый здесь самостоятельно или в сочетаниях, может относиться к разветвленной или неразветвленной насыщенной алифатической группе. Типичные примеры алкильных групп могут включать метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, октил, децил, тетрадецил, гексадецил, эйкозил, тетракозил и т.п. Термин "алкенил", используемый здесь самостоятельно или в сочетаниях, может относиться к разветвленной или неразветвленной ненасыщенной алифатической группе, содержащей по меньшей мере одну углерод-углеродную двойную связь, которая может находиться в любой стабильной точке на протяжении цепи. Типичные примеры алкенильных групп могут включать этенил, Е- и Z-пентенил, деценил и т.п. Термин "алкинил", используемый здесь самостоятельно или в сочетаниях, может относиться к разветвленной или неразветвленной ненасыщенной алифатической группе, содержащей по меньшей мере одну углерод-углеродную тройную связь, которая может находиться в любой стабильной точке на протяжении цепи. Типичные примеры алкинильных групп могут включать этинил, пропинил, пропаргил,бутинил, гексинил, децинил и т.п. Термин "аналог" применительно к пептиду или полипептиду может обозначать пептид или полипептид, содержащий одну или более чем одну нестандартную аминокислоту или другие структурные варианты из традиционного набора аминокислот. Используемый здесь термин "антитело" может обозначать антитело классов IgG, IgM, IgA, IgD илиIgE или их фрагменты либо производные, включая Fab, F(ab')2, Fd, а также антитела с одной цепью, диатела, биспецифичные антитела, бифункциональные антитела или их производные. Антитело может представлять собой моноклональное антитело, поликлональное антитело, аффинно-очищенное антитело или их смеси, которые проявляют существенную специфичность связывания с желаемым эпитопом, или последовательности, производные от них. Антитело также может представлять собой химерное антитело. Можно получить производное антитела путем присоединения одной или более химических, пептидных или полипептидных группировок, известных в данной области. Антитело можно конъюгировать с химической группировкой. Используемый здесь термин "апоптоз" может относиться к форме гибели клетки, когда происходит прогрессирующее уменьшение объема клетки с сохранением целостности цитоплазматических органелл: конденсация хроматина (т.е. ядерная конденсация), как можно видеть с помощью световой или электронной микроскопии; и/или расщепление ДНК на фрагменты размером с нуклеосому, что определяется анализом с помощью осаждения центрифугированием. Гибель клетки происходит при нарушении целостности ее мембраны (например, блеббинг мембраны) с поглощением интактных клеточных фрагментов("апоптотических телец") фагоцитирующими клетками. Используемый здесь термин "рак" может обозначать любое состояние, характеризующееся устойчивостью к апоптотическим стимулам. Используемый здесь термин "лечение рака" может обозначать любое лечение рака, известное в данной области, включающее химиотерапию или лучевую терапию, но не ограничивается ими. Используемое здесь словосочетание "комбинация с" может означать, что агент может быть введен до, вместе с дополнительным лечением или после дополнительного лечения либо их комбинации. Термин "производное", используемый применительно к пептиду или полипептиду, может обозначать пептид или полипептид, отличающийся не первичной структурой (аминокислотами или аналогами аминокислот), а другим. В качестве иллюстрации производные могут отличаться тем, что они гликозилированы, что является одной из форм пост-трансляционной модификации. Например, пептиды или полипептиды могут демонстрировать признаки гликозилирования вследствие их экспрессии в гетерологичных системах. Если по меньшей мере одна биологическая активность сохраняется, то эти пептиды или полипептиды представляют собой производные по настоящему изобретению. Другими производными могут быть слитые пептиды или полипептиды, имеющие ковалентно модифицированный N- или Сконец, ПЭГилированные пептиды или полипептиды, пептиды или полипептиды, ассоциированные с липидными группировками, алкилированные пептиды или полипептиды, пептиды или полипептиды, связанные через функциональную группу боковой цепи аминокислоты с другими пептидами, полипептидами или химическими соединениями, а также дополнительные модификации, понятные в данной области. Термин "фрагмент", используемый применительно к пептиду или полипептиду, может обозначать пептид длиной от приблизительно 6 до приблизительно 10 аминокислот. Фрагмент может иметь в длину 6, 7, 8, 9 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 и 25 аминокислот. Используемый здесь термин "гемопоэтическая стволовая клетка", или ГСК", может относиться к стволовой клетке, которую можно выделить из костного мозга, периферической крови, пуповинной крови или эмбриональных стволовых клеток. ГСК может быть способна к образованию кровяных клеток лимфоидной, миелоидной, а также эритроидной линий. ГСК может быть способна к продуцированию таких клеток, как эритроциты (красные кровяные клетки), тромбоциты, гранулоциты (такие как нейтрофилы, базофилы и эозинофилы), макрофаги, В-лимфоциты, Т-лимфоциты, а также естественные киллеры. ГСК могут быть способны к самовоспроизведению или они могут оставаться стволовыми клетками после клеточного деления. Также ГСК могут быть способны к дифференцировке или могут вставать на путь образования зрелой гемопоэтической клетки. Также может регулироваться мобильность или миграция ГСК, кроме того, апоптоз или запрограммированная клеточная гибель могут регулировать ГСК. ГСК также могут быть способны к дифференцировке в такие клетки, как мышечные клетки (скелетные миоциты и кардиомиоциты), клетки мозга, печени, кожи, легкого, почки, кишечника и поджелудочной железы. ГСК могут быть также такими, как описано в Stem Cell Information [World Wide Web site], Bethesda,MD: National Institutes of Health, U.S. Department of Health and Human Services, 2006 [cited Monday, January 08, 2007], доступный по ссылке http://stemcells.nih.gov/info/scireport/2006report, содержание которого включено сюда путем ссылки. Термин "гомолог", используемый применительно к пептиду или полипептиду, может обозначать пептиды или полипептиды, имеющие общего эволюционного предшественника. Используемый здесь термин "насыщенный" может относиться к группе, в которой все возможные валентные связи атомов в скелете молекулы присоединены к другим атомам. Используемый здесь термин "стволовая клетка" может относиться к любой клетке, которая обладает способностью делиться в течение неопределенных периодов времени и давать начало специализированным клеткам. Стволовые клетки могут происходить из всех зародышевых слоев (т.е. эктодермы, мезодермы и эндодермы). К типичным источникам стволовых клеток относятся эмбрионы, костный мозг,периферическая кровь, пуповинная кровь, плацентарная кровь и жировая ткань. Стволовые клетки могут быть плюрипотентными, что означает, что они способны давать к генерации большинства тканей организма. Например, плюрипотентные стволовые клетки могут продуцировать клетки кожи, печени, крови,мышц, костей и т.д. В противоположность мультипотентные или взрослые стволовые клетки обычно являются источником ограниченного числа типов клеток. Жизнеспособные клетки представляют собой клетки, которые являются живыми и часто способны к росту и делению. Специалистам в данной области известны способы определения жизнеспособности клеток, например, по способности не включать краситель трипанового синего. Термин "стволовая клетка", как он используется здесь, охватывает клеткипредшественники, если не указано иное. Используемый здесь термин "замещенный" может относиться к группе, у которой один или более атомов водорода или других атомов удалены с атома углерода и замещены другой(ими) группой(ами). Замещенные группы могут быть замещены заместителями в количестве от одного до пяти или от одного до трех. Типичные примеры таких заместителей включают алифатические группы, ароматические группы, алкил, алкенил, алкинил, арил, алкокси, галогено, арилокси, карбонил, акрил, циано, амино, нитро,фосфатсодержащие группы, серусодержащие группы, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, ациламино, амидино,имино, алкилтио, арилтио, тиокарбоксилат, алкилсульфинил, трифторметил, азидо, гетероциклил, алкиларил, гетероарил, семикарбазида, тиосемикарбазидо, малеимидо, оксимино, имидат, циклоалкил, циклоалкилкарбонил, диалкиламино, арилциклоалкил, арилкарбонил, арилалкилкарбонил, арилциклоалкилкарбонил, арилфосфинил, арилалкилфосфинил, арилциклоалкилфосфинил, арилфосфонил, арилалкилфосфонил, арилциклоалкилфосфонил, арилсульфонил, арилалкилсульфонил, арилциклоалкилсульфонил,их комбинации и их заместители, но не ограничиваются ими. Термины "лечить" или "лечение" применительно к защите млекопитающего от состояния могут обозначать профилактику, подавление, сдерживание или устранение состояния. Профилактика состояния включает введение млекопитающему композиции по изобретению до того, как состояние возникло. Подавление состояния включает введение млекопитающему композиции по изобретению после возникновения состояния, но до его клинического проявления. Сдерживание состояния включает введение млекопитающему композиции по изобретению после клинического проявления состояния с тем, чтобы ослабить состояние или не дать ему прогрессировать. Устранение состояния предполагает введение млекопитающему композиции по изобретению после клинического проявления состояния с тем, чтобы млекопитающее больше не страдало от этого состояния. Используемый здесь термин "ненасыщенный" может относиться к группе, в которой по меньшей мере одна возможная валентная связь у двух соседних атомов углеродной цепи не присоединена к другим атомам. Используемый здесь термин "незамещенный" может относиться к группе, которая не имеет какихлибо дополнительных групп, присоединенных к ней или являющихся заместителями на ней. Используемый здесь применительно к пептиду или полипептиду термин "вариант" обозначает пеп-5 018983 тид или полипептид, отличающийся последовательностью аминокислот, а именно наличием вставок,делеций или консервативных замен аминокислот, но сохраняющий по меньшей мере одну биологическую активность. В контексте настоящего изобретения термин "биологическая активность" подразумевает способность связываться со специфичным антителом. Консервативная замена аминокислоты, т.е. замена аминокислоты другой аминокислотой, обладающей похожими свойствами (например, гидрофильностью, степенью заряженности и распределением заряженных областей), обычно рассматривается в данной области как дающая минорное изменение. Некоторые из этих минорных изменений можно идентифицировать с помощью гидропатического индекса аминокислот, как известно в данной области (Kyteet al., J. Mol. Biol., 157:105-132, 1982). Гидропатический индекс аминокислоты основан на определении ее гидрофобности и заряда. В данной области известно, что может быть произведена замена одну на другую аминокислот, обладающих одинаковыми гидропатическими индексами, при этом функция белка будет сохраняться. В одном из аспектов изобретения аминокислоты, обладающие гидропатическими индексами 2, являются взаимозаменяемыми. Гидрофильность аминокислот также может быть использована для выявления замен, которые дадут белки, сохраняющие биологическую функцию. Рассмотрение гидрофильности аминокислот в пептидах позволяет рассчитать наибольшую локальную среднюю гидрофильность для этого пептида, представляющую собой хороший критерий, который, как сообщалось, хорошо коррелирует с антигенностью и иммуногенностью (патент США 4554101, включенный сюда путем ссылки). Замена аминокислот, обладающих похожими значениями гидрофильности, друг на друга может привести в результате к пептидам, сохраняющим биологическую активность, например имунногеность, как известно в данной области. Согласно одному из аспектов изобретения замены осуществляют аминокислотами, имеющими значения гидрофильности в пределах 2 друг относительно друга. Как на индекс гидрофобности, так и на значение гидрофильности аминокислот влияет конкретная боковая цепь этой аминокислоты. В соответствии с этим обзором понятно, что замены аминокислот, совместимые с биологической функцией, зависят от относительного сходства аминокислот и, в частности, от боковых цепей этих аминокислот, что можно определить по гидрофобности, гидрофильности, заряду, размерам и другим свойствам. 2. Способ повышения или увеличения характеристики популяции ГСК. Настоящим изобретением предложен способ увеличения или повышения характеристики популяции ГСК. Характеристика популяции ГСК может представлять собой количество клеток, а также может представлять собой мобильность клеток. а. Число клеток. Число клеток может представлять собой общий размер популяции ГСК. Число клеток также может представлять собой общее число индивидуальных ГСК. Число клеток можно увеличить или повысить путем увеличения скорости деления ГСК с образованием дополнительных ГСК, что может увеличить или повысить общее число ГСК в костном мозге, кровотоке, пуповине или эмбрионе. Число клеток также можно увеличить или повысить, увеличивая общее количество популяции ГСК, или путем увеличения количества, числа или уровней популяции ГСК. б. Мобильность клеток. Мобильность клеток можно повысить или увеличить, увеличив число индивидуальных ГСК, которые мигрируют из костного мозга в периферическую кровь. Клеточную мобильность также можно повысить или увеличить путем увеличения числа индивидуальных ГСК, которые мигрируют из костного мозга в периферическую кровь, а затем из периферической крови в отдельные ткани или органы, такие как лимфатические узлы, сердце, легкие, печень, кожа, селезенка, тонкий и толстый кишечник, желудок или поджелудочная железа. ГСК могут мигрировать из костного мозга в кровоток. Увеличение числа или мобильности клеток популяции ГСК также может привести к увеличению скорости дифференцировки популяции ГСК в различные линии клеток. ГСК также могут быть способны к дифференцировке или могут стать на путь превращения в зрелые гемопоэтические клетки. Например,клеточная дифференцировка популяции ГСК может привести к увеличению числа обычных миелоидных клеток-предшественников в костном мозге или периферической крови. Также клеточная дифференцировка популяции ГСК может привести к повышению числа клеток-предшественников гранулоцитов/макрофагов или клеток-предшественников мегакариоцитов/эритроцитов в костном мозге или в периферической крови. ГСК может дифференцироваться в общий миелоидный предшественник. Увеличение числа общих миелоидных клеток-предшественников может привести к дифференцировке в клеткипредшественники гранулоцитов/макрофагов или клетки-предшественники мегакариоцитов/эритроцитов. Клетки-предшественники гранулоцитов/макрофагов далее могут дифференцироваться в гранулоциты,такие как нейтрофилы, эозинофилы, базофилы, предшественники тканевых клеток, моноциты, а также незрелые дендритные клетки. Клетки-предшественники мегакариоцитов/эритроцитов могут дифференцироваться в мегакариоциты, эритробласты. Клетка - общий лимфоидный предшественник может дифференцироваться в В-лимфоциты и Т-лимфоциты. В-лимфоциты могут дифференцироваться в клетки,секретирующие антитела, тогда как Т-лимфоциты могут дифференцироваться в эффекторные Т-клетки. Гранулоциты могут далее дифференцироваться в тканевые тучные клетки, макрофаги, а также незрелые дендритные клетки. Мегакариоциты могут дифференцироваться в тромбоциты. Эритробласт может дифференцироваться в эритроциты. ГСК также могут быть способны дифференцироваться в такие клетки, как мышечные клетки (скелетные миоциты и кардиомиоциты), клетки мозга, печени, кожи, легкого,почки, кишечника, а также поджелудочной железы. Число и соотношение клеток, презентирующих особые молекулярные маркеры или маркеры клеточной поверхности, могут быть показателями клетки ГСК или популяции ГСК. ГСК могут быть способны самообновляться или оставаться стволовыми клетками после клеточного деления. Также можно регулировать миграцию или апоптоз либо запрограммированную гибель ГСК. ГСК также способны дифференцироваться в клетки, такие как мышечные клетки (скелетные миоциты и кардиомиоциты), клетки мозга, печени, кожи, легких, почек, кишечника, а также поджелудочной железы. Без привязки к теории в норме одна на каждые 10000-15000 клеток костного мозга может представлять собой стволовую клетку. В кровотоке соотношение может быть ниже - до 1 на 100000 клеток крови. Введение агента in vivo может повысить число всех популяций стволовых клеток в кровотоке в течение приблизительно 1, 2, 3, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 или 30 ч после инъекции и накопление стволовых клеток, включая ГСК, в крови может достигать максимального значения через примерно 65,66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86 87, 88, 89, 90, 91, 92, 93, 94, 95,96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109 и 110 ч после введения. 3. Композиция. Предлагаемый способ может включать введение млекопитающему, нуждающемуся в этом, композиции для увеличения или повышения характеристики популяции ГСК. Композицию можно применять при лечении патологических состояний, связанных с воздействием радиации, побочными эффектами лечения рака, стрессом, старением клеток и болезнями. Композиция может представлять собой фармацевтическую композицию, которую можно приготовить хорошо известными в данной области методами. Композиция может содержать агент, который может быть способен увеличивать характеристику популяции ГСК у млекопитающих. Также композиция может содержать радиопротектор, костимулятор ГСК,экзогенный фактор роста, цитокин или их комбинацию. а. Агент. Агент может содержать липопептид, липополисахарид, липосахарид или их комбинацию.(1) Липопептид. Липопептид можно выделить из части внешней мембраны грамм-отрицательных бактерий, граммположительных бактерий или микоплазмы. Бактериальные липопептиды могут не иметь сходства в последовательностях, но характеризуются необычной N-концевой аминокислотой 5'-(2,3 дигидроксипропил)-L-цистеином, которая ацилирована двумя или тремя жирными кислотами. Бактериальные липопептиды представляют собой сильные иммуномодуляторы, которые активируют ранний ответ в организме хозяина после инфекции путем передачи сигнала через гетеродимеры TLR2-TLR1 илиTLR2-TLR6, приводя к активации NF-В и продукции цитокинов. Синтетические аналоги N-концевых липопептидов природных липопептидов являются сильными активаторами TLR и NF-В, а также иммуноадъювантам in vivo и in vitro. Липопептид может представлять собой соединение формулыR2, R3 и R4 независимо представляют собой Н или возможно замещенный алифатический радикал;Z представляет собой S или СН 2. Липопептид может содержать две или три жирные кислоты. Алифатические заместители R2, R3 и R4 могут содержать от 6 до 20 атомов углерода. R2, R3 и R4 могут представлять собой С 6-С 20 алкил, С 6 С 20 алкенил или С 6-С 20 алкинил. Типичные примеры алкильных заместителей на R2, R3 и R4 включают С 6,C8, C9, С 10, C12, C14 и С 16. Типичные примеры алкенильных заместителей на R2, R3 и R4 включаютC10:1D1 транс, C18:1D9 и C18:2D9,12. Пептид может содержать по меньшей мере 4 или 5 аминокислот, но не больше чем 20, 30 или 40 аминокислот. Пептидная группировка может быть важна для активности и активность липопептида можно модулировать аминокислотной последовательностью, но в отношении большинства пептидных последовательностей биологическая активность может не проявляться (Spohn et al., Vaccine, 22(19):2494-7 018983 9, 2004, содержание включено сюда путем ссылки). Пептид может содержать последовательность, представленную в табл. 2, любую последовательность, по меньшей мере на 80, 85, 90 или 95% идентичную ей, или любой ее аналог, производное, фрагмент, гомолог, вариант или замену. Пептид может нести суммарный отрицательный заряд. Таблица 1 Первые четыре-пять аминокислот пептидной группировки липопептида могут быть выбраны из аминокислот, приведенных для каждой позиции в табл. 3. Эта таблица основана на Spohn et al., Vaccine,22(19):2494-9, 2004 и Reutter et al., J. Peptide Res., 65, 375-383, 2005, содержание которых включено сюда путем ссылки. Таблица 2 В отношении стереохимии N-концевой липоаминокислоты липопептид может представлять собойRR- или RS-стереоизомер или их смесь. Липопептид может быть растворим в воде. Липопептид может представлять собой соединение CBLB601 или CBLB612, где оба подпадают под общую формулу(2) Липополисахарид и липосахариды. Липополисахарид или липосахарид можно применять в качестве описанного здесь агента. Липополисахарид может представлять собой соединение формулыR2, R3 и R4 независимо представляют собой Н или возможно замещенный алифатический радикал;Z представляет собой S или СН 2. Липополисахарид или липосахарид может содержать две или три жирные кислоты. Алифатические заместители R2, R3 и R4 могут содержать от 6 до 20 атомов углерода. R2, R3 и R4 может представлять собой С 6-С 20 алкил, С 6-С 20 алкенил или С 6-С 20 алкинил. Типичные примеры алкильных заместителей на R2,R3 и R4 включают С 6, С 8, С 9, С 10, C12, C14 и С 16. Типичные примеры алкенильных заместителей на R2, R3 иR4 включают C10:1D1 транс, C18:1D9 и C18:2 D9,12. Липополисахарид можно выделить из клеточной стенки грамм-отрицательных бактерий. Липополисахарид (LPS) (также известный как эндотоксин) может представлять собой сложный гликолипид массой приблизительно 10 кДа. Базовая структура LPS может включать три сравнительно хорошо определенных участка и может быть сходна у всех грамм-отрицательных бактерий. Эти участки могут представлять собой участок О-антигена, коровый полисахарид и липид А (см. фиг. 1). Участок О-антиген может содержать повторяющиеся полисахаридные единицы, каждая из которых включает 2-6 сахаридов. Участок О-антиген может значительно варьировать среди видов грамм-отрицательных бактерий и, таким образом, может служить в качестве маркера индивидуальных видов бактерий на основании связывания со специфичными моноклональными антителами. Коровый полисахарид может находится между участком - О-антигеном и липидом А и может представлять собой разветвленный полисахарид, содержащий репрезентативные сахара, такие как глюкоза,N-ацетилглюкозамин и галактоза. В противоположность участку - О-антигену в пределах корового участка могут быть только незначительные вариации, причем структура является высококонсервативной во внутренней области корового участка, находящейся в том конце, который ближе к липиду А. Наиболее высококонсервативным участком молекулы LPS может быть липид А, дисахарид дифосфат, к которому присоединены длинноцепочечные жирные кислоты. Участок молекулы липид А может придавать токсичность практически всем сложным эукариотическим организмам. У людей это может быть связано с индукцией цитокинов, лихорадкой, лейкоцитозом, рекрутингом и активацией лейкоцитов, разрушением сосудов, расширением сосудов, внутрисосудистым свертыванием и повреждением органов. б. Радиопротекторы. Описанная здесь композиция также может содержать радиопротектор. Радиопротектор можно применять для повышения уровня защиты от ионизирующей радиации. Радиопротектор можно применять для лечения последствий воздействия радиации. Радиопротектор может представлять собой антиоксидант, ловушку свободных радикалов, цитокин, флагеллин и латентный TGF. Радиопротектор также может представлять собой цитокин, который может индуцировать экспрессию клеточных антиоксидантных белков, таких как дисмутаза двуокиси марганца (MnSOD) и металлотионеин. Радиопротектор также может представлять собой антиоксидант и ловушку свободных радикалов,которые могут включать тиолы, например цистеин, цистеамин, глютатион и билирубин; амифостин (WR2721); витамин А; витамин С; витамин Е; а также флаваноиды, такие как Индийский базилик священный(Ocimum sanctum), ориентин и виценин. Радиопротектор может представлять собой комбинацию цитокинов и факторов роста, которые обеспечивают защиту от радиоактивного излучения путем компенсации и/или защиты чувствительных к радиации популяций стволовых клеток. Радиопротектор может представлять собой цитокины, к которым относятся фактор стволовых клеток (SCF, c-kit лиганд), Flt-3 лиганд, фрагмент интерлейкина-1 IL-1b-rd и фактор роста кератиноцитов (KGF). Также радиопротектор может стимулировать пролиферацию иммуноцитов. Радиопротектор может представлять собой 5-AED (5-андростендиол), который представляет собой стероид, стимулирующий экспрессию цитокинов и синтетических соединений, таких как аммоний трихлор(диоксоэтилен-О,О')теллурат (AS-101). Радиопротектор может представлять собой латентный TGF, флагеллин и производ- 10018983 ные флагеллина, которые являются сильными индукторами активности NF-В, как представлено в международных заявках на патент PCT/US 2004/040656 и PCT/US 2004/040753 и заявке на патент США 60/693826, содержание которых включено сюда путем ссылки. в. Костимуляторы ГСК. Описанная здесь композиция может также включать в себя костимулятор ГСК. Например, композицию можно вводить в сочетании с экзогенными факторами роста и цитокинами, которые специально выбирают для достижения конкретного результата. Костимуляторы могут представлять собой факторы роста и цитокины, которые стимулируют пролиферацию и дифференцировку такого типа клеток. Костимулятор может представлять собой интерлейкины-1, -2, -3, -4, -5, -6, -7, -9, -10, -11, -12, -13 и 17, которые вовлечены в дифференцировку лимфоцитов. Интерлейкины-3 и -4 вовлечены в дифференцировку жировых клеток. Костимулятор может представлять собой колониестимулирующий фактор гранулоцитов и макрофагов (GMCSF), интерлейкин-3 и интерлейкин-5, которые вовлечены в дифференцировку эозинофилов. Костимулятор также может представлять собой GMCSF, колониестимулирующий фактор макрофагов(MCSF) и IL-3, которые вовлечены в дифференцировку макрофагов. Костимулятор также может представлять собой GM-CSF, GCSF и IL-3, которые вовлечены в дифференцировку нейтрофилов. Костимулятор также может представлять собой GMSCF, IL-1, IL-3, IL-6, IL-8, PIXY-321 (слитый белок GM-CSF/IL3), макрофагальный белок воспаления, фактор стволовых клеток, тромбопоэтин, связанный с ростом онкоген, IL-11 и ТРО, которые вовлечены в дифференцировку тромбоцитов. Костимулятор также может представлять собой лиганд Flt3, который вовлечен в рост дендритных клеток. Костимулятор также может представлять собой GMCSF, IL-3 и эритропоэтин, которые вовлечены в дифференцировку эритроцитов. Костимулятор может представлять собой SCF, лиганд Flt3, G-CSF, IL-3, IL-6 и IL-11, которые восстанавливают примитивные плюрипотентные клетки-предшественники, способные поддерживать гемопоэз. Костимулятор может представлять собой антибиотики, витамины, экстракты из трав, противовоспалительные средства, глюкозу, жаропонижающие средства, болеутоляющие средства. Можно использовать композицию с другими костимуляторами, такими как AMD3100 ([1,1'-[1,4 фенилен-бис-(метилен)]-бис]-1,4,8,11-тетраазациклотетрадекан) и его производными, или другими костимуляторами, как описано в патенте США 6987102, содержание которого включено сюда путем ссылки. AMD3100 представляет собой антагонист с CXCR4 хемокиновым рецептором. Это соединение может мешать связыванию выделенного из клеток стромы костного мозга SDF-1 (фактора клеток стромы- 1) с CXCR4 на стволовых клетках, что может привести к высвобождению ГСК из костного мозга в кровоток. 4. Идентификация гемопоэтических стволовых клеток. Предложенный способ также можно использовать для идентификации и выделения ГСК из костного мозга, периферической крови, пуповинной крови или эмбриональных стволовых клеток. Способ может включать стадии введения агента млекопитающему или человеку, нуждающемуся в этом, что увеличивает количество ГСК в костном мозге и мобилизует эти клетки из костного мозга в кровоток. Способ может дополнительно включать выделение ГСК из крови. Не ограничиваясь теорией, популяция стволовых клеток в кровотоке может быть гетерогенной и может включать некоторое количество ГСК, представляющих собой действительно долго живущие, самообновляющиеся стволовые клетки, некоторое количество предшественников с более коротким сроком жизни и некоторое количество клеток, не являющихся стволовыми. Стволовые клетки также могут выглядеть как многие другие клетки костного мозга или крови. Идентификация ГСК может требовать обнаружения присутствия или отсутствия специфических маркеров клеточной поверхности. ГСК могут дифференциально экспрессировать такие молекулярные маркеры, как Sca-1, CD27, CD34, CD38, CD43,CD90.1, CD117 (c-Kit), AA4.1, МНС класс I, CD150, Lin, CD45RO, CD45RA, CD59, CD90, CD109, CD133,CD166, а также HLA DR. Свойства маркеров клеточной поверхности ГСК у мышей и людей могут быть разными. В табл. 1 приведены маркеры клеточной поверхности, которые могут быть характерными для мышиных и человеческих ГСК, поскольку они существуют в недифференцированном виде in vivo и in vitro. Когда ГСК начинают делиться и развиваться в различные клеточные линии, маркеры клеточной поверхности и уровни их экспрессии могут меняться. Таблица 3 Маркеры клеточной поверхности недифференцированных ГСК Клетки Lin- лишены 13-14 маркеров различных зрелых клеточных линий крови. Например, разработано несколько комбинаций, которые могут быть показателями мышиных ГСК. К ним относятся [CD117high, CD90.1low, Linneg/low, Sca-lpos, Flk2/flt3-], [CD90.1low, Linneg, Sca-lposRhodamine123low]. [CD34neg//low, CD117pos, Sca-lpos, Linneg], а также клетки "боковой популяции" с использованием красителя Хехста (Hoechst-dye). Специфическое обнаружение этих комбинаций позволяет осуществить очистку ГСК до состояния, близкого к гомогенности.[CD34neg/low, CD117 (c-kit)pos, Sca-lpos, Linneg] можно отбирать с помощью клеточного сортера с активацией флуоресценции (FACS), где одновременно идентифицируются и выделяются несколько отдельных популяций гемопоэтических стволовых клеток: популяция [CD117(c-kit)pos, Linneg] (KL), содержащая общие миелоидные предшественники (СМР); популяция [CD117(c-kit)pos, Sca-lpos, Linneg, CD34neg/low](KSL/CD34+), состоящая из долгоживущих ГСК (LT-ГСК); и популяция [CD117 (c-kit)pos, Sca-lpos, Linneg,CD34pos] (KSL/CD34+), содержащая короткоживущие ГСК (ST-ГСК) и мультипотентные предшественники (МРР) с непрерывным лимфомиелопоэзом. Маркеры клеточной поверхности ГСК также можно обнаружить с использованием метаболических маркеров/красителей, таких как родамин 123, Хехст 33342, Пиронин-Y и ВААА. Также ГСК можно обнаружить с помощью моноклональных антител, несущих флюоресцентную метку и выделенных из костного мозга с помощью FACS. 5. Замена клеток, подвергнувшихся стрессу, или мертвых клеток. Настоящим изобретением предлагается также способ замены клеток, поврежденных или погибших вследствие патологического состояния или стресса, включающий применение способа увеличения характеристики ГСК. Эти поврежденные или мертвые клетки могут быть клетками крови лимфоидной,миелоидной или эритроидной линий. Эти поврежденные или мертвые клетки могут представлять собой эритроциты (красные кровяные клетки), тромбоциты, гранулоциты (такие как нейтрофилы, базофилы и эозинофилы), макрофаги, В-лимфоциты, Т-лимфоциты или естественные киллеры. Эти поврежденные или мертвые клетки могут быть дифференцированными клетками, такими как мышечные клетки (скелетные миоциты и кардиомиоциты), клетки мозга, печени, кожи, легких, почек, кишечника или поджелудочной железы. Репрезентативные примеры состояний, стрессов или способов лечения, которые могут вызвать повреждение или гибель клеток, включают лечение рака, например лучевую терапию или химиотерапию; температурный шок; воздействие вредной дозы радиации, например, на работников атомных электростанций, оборонной промышленности или радиофармацевтического производства либо на солдат; клеточное старение; ранение; отравление, химические или термические ожоги, вирусные инфекции и бактериальные инфекции. Способ замещения поврежденных или убитых клеток может предусматривать применение к пациенту, нуждающемуся в этом, аутологичных или гетерологичных режимов лечения. Возвращение пациенту собственных стволовых клеток или введение ему донорских стволовых клеток может дополнить пул ГСК пациента или заново создать в нем популяции. Композицию можно вводить пациенту да или после того, как клетки пациента были повреждены или убиты. Например, пациента можно лечить композицией, а ГСК можно выделить у пациента через какое-то время. После этого организм пациента может подвергаться повреждению, стрессу или состоянию. Затем пациенту можно вводить его/ее собственные выделенные ГСК. Аналогично, способ можно осуществлять с привлечением донора. Донору можно ввести композицию. Через некоторое время ГСК можно выделить у донора и ввести пациенту. а. Лечение клеток, поврежденных или погибших при лечении рака. Патологическое состояние может представлять собой повреждение нормальных тканей и клеток,имеющее место при раке или возникающее при лечении рака. Например, предложенный способ можно применять для обеспечения запаса стволовых клеток у пациента, подвергающегося химиотерапии. Лечение рака, направленное на уничтожение популяции раковых клеток пациента, может уничтожать стволовые клетки в костном мозге пациента. Возвращение пациенту его собственных стволовых клеток или введение сохраненных стволовых клеток донора может in vivo дополнить пул ГСК пациента или заново создать в нем популяции. Этот способ может увеличить число ГСК и мобилизовать эти клетки из костного мозга в кровоток, а также может позволить осуществлять большие терапевтические воздействия, на- 12018983 правленные против рака, такие как воздействия хемо- или радиотерапией, с меньшим риском по сравнению с трансплантацией костного мозга.(1) Трансплантаты аутологичных и гетерологичных популяций стволовых клеток. Композицию можно вводить пациенту до прохождения лечения от рака или донору. Клетки крови или белые клетки периферической крови (PWBC), которые могут включать популяцию стволовых клеток, содержащую ГСК, можно выделить у пациента или донора. Клетки можно отбирать у пациента после введения композиции и до осуществления лечения от рака. Аутологичные и гетерологичные популяции стволовых клеток можно хранить для применения в будущем. Пациенту, прошедшему лечение от рака, можно впоследствии ввести популяцию стволовых клеток. В дополнение, сохраненные аутологичные стволовые клетки можно применять в качестве трансплантатов. Композицию можно применять при гематологической трансплантации стволовых клеток костного мозга. Композиция может способствовать успеху трансплантации до, во время и после иммуноподавляющих процедур. Трансплантаты аутологичных стволовых клеток могут иметь то преимущество, что риск отторжения и инфекции ниже, поскольку восстановление иммунной функции может быть эффективным. Число пациентов, перенесших заболевание "трансплантат против хозяина", может быть очень низким, когда донор и реципиент - одно и то же лицо.(2) Химиотерапия. Лечение рака может включать введение цитотоксического агента или цитостатического агента либо их комбинации. Цитотоксические агенты препятствуют размножению раковых клеток посредством (1) подавления способности клеток к репликации ДНК и (2) индукции клеточной гибели и/или апоптоза в раковых клетках. Цитостатические агенты действуют, модулируя, препятствуя или подавляя в клетках процессы передачи сигнала, регулирующие клеточную пролиферацию. Классы соединений, которые можно использовать в качестве цитотоксических агентов, включают следующие: алкилирующие агенты (к которым относятся, но без ограничения ими, азотистые иприты,производные этиленимина, алкилсульфонаты, нитрозомочевины и триазены): урамустин, хлорметин,циклофосфамид (Cytoxan), ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтилен-меламин, триэтилентиофосфорамин, бусульфан, кармустин, ломустин, стрептозоцин, дакарбазин и темозоломид; антиметаболиты (включающие антагонисты фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозин деаминазы, но не ограничиваясь ими): метотрексат, 5-фторурацил, флоксуридин,цитарабин, 6-меркаптопурин, 6-тиогуанин, флударабина фосфат, пентостатин и гемцитабин, натуральные продукты и их производные (например, алкалоиды барвинка, противоопухолевые антибиотики, ферменты, лимфокины и эпиподофиллотоксины): винбластин, винкристин, виндесин, блеомицин, дактиномицин, даунорубицин, доксорубицин, эпирубицин, идарубицин, цитозин-арабинозид, паклитаксел (паклитаксел имеется в продаже под товарным знаком TAXOL), митрамицин, дезоксикоформицин, митомицин-с, 1-аспарагиназа, интерфероны (предпочтительно интерферон(IFN-, этопозид и тенипозид. Другие цитотоксические агенты, воздействующие на пролиферацию, представляют собой навелбен,СРТ-11, анастразол, летразол, капецитабин, релоксафин, циклофосфамид, ифосамид и дролоксафин. Агенты, действующие на микротрубочки, препятствуют клеточному митозу и хорошо известны в данной области благодаря своей цитотоксической активности. Агенты, действующие на микротрубочки,которые можно использовать, включают аллоколхицин (NSC 406042), галихондрин В (NSC 609395),колхицин (NSC 757), производные колхицина (например, NSC 33410), доластатин 10 (NSC 376128), майтансин (NSC 153858), ризоксин (NSC 332598), паклитаксел (TAXOL, NSC 125973), производныеTAXOL (например, NSC 608832), тиоколхицин (NSC 361792), тритилцистеин (NSC 83265), винбластинсульфат (NSC 49842), винкристинсульфат (NSC 67574), натуральные и синтетические эпотилоны,включающие, но не ограничиваясь этим, эпотилон А, эпоптилон В, а также дискодермолид (см. Service,(1996) Science, 274:2009) эстрамустин, нокодазол, МАР 4 и т.п., но не ограничиваются ими. Примеры таких агентов описаны также в Bulinski (1997) J. Cell Sci. 110:3055 3064; Panda (1997) Proc. Natl. Acad. Sci.Vasquez (1997) Mol. Biol. Cell. 8:973-985; а также Panda (1996) J. Biol. Chem 271:29807-29812. Также подходящими являются цитотоксические агенты, такие как эпидофиллотоксин; противоопухолевый фермент; ингибитор топоизомеразы, прокарбазин; митоксантрон; координационные комплексы с платиной, например цисплатин и карбоплатин; модификаторы биологического ответа; ингибиторы роста; антигормональные терапевтические агенты; лейковорин, тегафур; а также гемопоэтические факторы роста. К цитостатическим агентам, которые можно использовать, относятся также гормоны и стероиды (в том числе синтетические аналоги): 17 -этинилэстрадиол, диэтилстильбестрол, тестостерон, преднизон,флуоксиместерон, дромостанолон пропионат, тестолактон, мегестролацетат, метилпреднизолон, метилтестостерон, преднизолон, триамицинолон, хлортрианизен, гидроксипрогестерон, аминоглютетимид,эстрамустин, медроксипрогестеронацетат, леупролид, флутамид, торемифен и золадекс. Также применимы другие цитостатические агенты, препятствующие росту сосудов, такие как ингибиторы матриксных металлопротеиназ, а также другие ингибиторы фактора роста эндотелия сосудов(VEGF), такие как антитела к VEGF и небольшие молекулы, такие как ZD6474 и SU6668. Также можно использовать антитела к рецептору человеческого эпидермального фактора роста 2 типа (Her-2) отGenentech. Подходящим ингибитором рецептора эпидермального фактора роста (EGFR) является EKB569 (необратимый ингибитор). Также применимо антитело С 225 Imclone, иммуноспецифичное к EGFR, и ингибиторы src. Кроме того, в качестве цитостатического агента можно использовать Casodex (бикалутамид, AstraZeneca), который препятствует пролиферации андрогензависимых карцином. Еще одним примером цитостатического агента является антиэстроген Tamoxifen, ингибирующий пролиферацию или рост эстрогензависимого рака молочной железы. Ингибиторы передачи пролиферативных сигналов в клетке являются цитостатическими агентами. Типичные примеры включают ингибиторы эпидермального фактора роста, ингибиторы Her-2, ингибиторы МЕК-1 киназы, ингибиторы МАРК киназы, ингибиторы фосфатидилинозитола 3 PI3, ингибиторы Src-киназы, а также ингибиторы фактора роста тромбоцитов (PDGF).(3) Лучевая терапия рака. Лечение рака может включать лучевую терапию. Лучевая терапия может представлять собой дистанционную лучевую терапию, внутреннюю лучевую терапию или конформационную лучевую терапию,при которой используют компьютер для придания потоку лучей формы, соответствующей форме опухоли. При лучевой терапии можно использовать разные источники облучения, включая рентгеновские лучи, пучок электронов или гамма-излучение. Дозы и время воздействия радиоактивным излучением при лучевой терапии можно и будет варьировать в зависимости от местонахождения и стадии рака. При лучевой терапии можно вводить композицию с радиопротектором, как описано выше. б. Химиотерапия/лучевая терапия и/или противовирусная терапия для лечения ВИЧ инфекции. Указанный способ может включать введение композиции, которая повышает количество ГСК в костном мозге и мобилизует эти клетки к миграции в кровоток, чтобы облегчить или вылечить последствия химиотерапии или лучевой терапии, назначаемой для лечения иммунодефицитного состояния. Композицию можно вводить пациенту, подвергавшемуся лучевой терапии или химиотерапии без отделения миелоцитов при СПИДе. Например, композицию можно вводить пациенту для мобилизации или увеличения числа ГСК из костного мозга пациента. Мобилизованные ГСК можно затем собрать из периферической крови с помощью лейкафереза. ГСК затем можно собрать из отобранной периферической крови с помощью иммуноадсорбции с использованием анти-CD34 - антител. По желанию количество собранных ГСК можно увеличить ex vivo культивированием их в присутствии агентов, стимулирующих пролиферацию стволовых клеток. После проведения лучевой терапии или химиотерапии без отделения миелоцитов собранные и по желанию размноженные ГСК можно затем вернуть в кровоток пациента и позволить им самим внедриться в костный мозг. Кроме того, факультативно, этот способ также включает введение пациенту соединений, действующих против ВИЧ, например противовирусных средств, например AZT, растворимых CD4 и CD4 направленных блокаторов вируса СПИДа или антисмысловых или антигенных олигонуклеотидов, либо до, либо после возвращения выделенных и дополнительно размноженных ГСК в циркулирующую кровь пациента. Эта стадия несет функцию "зачистки", чтобы предотвратить инфицирование остаточным вирусом потомства возвращенных стволовых клеток. в. Модуляция возраста клеток. Описанным здесь способом можно увеличить число ГСК и мобилизовать эти клетки в кровоток. Аутологичные стволовые клетки можно выделить из крови или белых клеток периферической крови и вводить для замещения клеток, подвергнутых стрессу или мертвых по причине клеточного старения. г. Радиация. Описанным здесь способом можно замещать клетки, перенесшие стресс или мертвые в результате воздействия радиации. Данным способом также можно заместить клетки, перенесшие стресс или мертвые в результате лучевой терапии. Воздействие ионизирующего излучения (ИИ) может быть коротким или длительным, оно может воздействовать в виде разовой дозы или множества доз, на весь организм или локально. Так, ядерные аварии или военные действия могут приводить к разовой высокой дозе облучения всего организма (иногда за этим следует длительное отравление радиоактивными изотопами). Аналогично, разовую дозу радиации, как правило, используют для предварительного воздействия на пациентов трансплантации костного мозга, когда необходимо подготовить кроветворные органы хозяина к пересадке в них донорского костного мозга путем "очищения" их от клеток-предшественников крови хозяина. На молекулярном и клеточном уровне радиоактивные частицы могут приводить к повреждению ДНК и перекрестному связыванию между молекулами ДНК, повреждению белков, клеточных мембран и других макромолекулярных структур. Ионизирующее излучение может вызывать также вторичное повреждение клеточных компонентов путем образования свободных радикалов и реактивных форм кислорода (ROS). Множество восстанавливающих систем противостоят такому повреждению, как, например,несколько путей репарации ДНК, которые восстанавливают целостность и точность ДНК, и антиоксидантные химические соединения и ферменты, которые захватывают свободные радикалы и ROS и вос- 14018983 станавливают окисленные белки и липиды. Существуют клеточные системы контроля, обнаруживающие дефекты ДНК и тормозящие прохождение клеточного цикла до устранения вреда или до принятия решения прекратить рост клетки или подвергнуть ее запрограммированной гибели (апоптоз). На уровне организма немедленные эффекты низких или умеренных уровней радиации в основном обусловлены гибелью клеток, что приводит к воспалению от радиации. При более высоких уровнях радиации так называемые гемопоэтические и желудочно-кишечные синдромы приводят к смерти от кратковременного воздействия радиации. Гемопоэтический синдром характеризуется утратой кроветворных клеток и их предшественников, таким образом делая невозможной регенерацию кровеносной и лимфатической системы. Гибель обычно происходит в результате инфекции (вследствие иммуносупрессии),кровотечения и/или анемии. Желудочно-кишечный синдром характеризуется масштабной клеточной гибелью в кишечном эпителии, преимущественно в тонкой кишке, с последующим разрушением стенки кишечника и смертью от бактериемии и сепсиса. Гемопоэтический синдром проявляется при меньших дозах радиации и приводит к замедленной смерти по сравнению с желудочно-кишечным синдромом. Очень высокие дозы радиации могут вызывать почти мгновенную смерть вследствие дегенерации нейронов. Описанным здесь способом можно также повышать степень защиты от ионизирующего излучения. д. Лечение ожогов. Способ может включать введение композиции, которая повышает количество ГСК в костном мозге и мобилизует эти клетки в кровоток для облегчения или лечения ожогов. Способ может включать увеличение характеристики популяции ГСК и выделение белых клеток из периферической крови. Белые клетки периферической крови могут содержать аутологические стволовые клетки, которые можно вводить обожженному млекопитающему. Аутологические стволовые клетки могут быть источником трофических факторов, которые способствуют регенерации ткани при ожоге. Ожог может быть связан с воздействием радиации. 6. Лечение заболеваний. Также предлагается способ лечения заболевания с помощью ГСК. Способ может включать введение композиции, которая увеличивает количество ГСК в костном мозге и мобилизует эти клетки в кровоток для замещения больных клеток. а. Пулы репопулирующих гемопоэтических клеток. Композицию можно применять в способе лечения заболевания или состояния, для которого показано репопулирование пула эритроидных, миелоидных или лимфоидных гемопоэтических клеток. Например, композицию можно применять в способе лечения заболевания или состояния, при котором показана трансплантация ГСК, как, например, трансплантация костного мозга, животному или человеку. Композицию можно применять для восстановления или предотвращения дефицита числа гемопоэтических клеток у субъекта. Дефицит может возникать, например, по причине доброкачественного заболевания или состояния, генетической аномалии, заболевания, стресса, химиотерапии или вследствие лучевой терапии. Способ включает такие же стадии, как описано для трансплантации мобилизованных ГСК пациенту, который подвергался химиотерапии или лучевой терапии для лечения СПИД, как описано выше. б. Лечение рака. Способ может включать введение композиции, которая увеличивает число ГСК в костном мозге, а также мобилизует эти клетки в кровоток, чтобы облегчить или вылечить рак. Рак может представлять собой гематологическое злокачественное новообразование, включающее, без ограничений, гемопоэтические опухоли лимфоидной линии, включая лейкемию, острую лимфоцитарную лейкемию, острую лимфобластическую лейкемию, В-клеточную лимфому, Т-клеточную лимфому, Ходжкинскую лимфому,неходжкинскую лимфому, волосатоклеточную лимфому, гистиоцитарную лимфому, а также лимфому Буркета; гемопоэтические опухоли миелоидной линии, включая острую и хроническую миелогенные лейкемии, миелодиспластический синдром, миелоидную лейкемию, а также промиелоцитарную лейкемию. Другие виды рака, которые можно лечить, включают следующие: карциному, включая карциному мочевого пузыря (в т.ч. ускоренный и метастатический рак мочевого пузыря), карциному молочной железы, прямой кишки (включая колоректальный рак), почек, печени, легких (включая мелкоклеточный и немелкоклеточный рак легкого и аденокарциному легких), рак яичников, простаты, семенников, мочеполового тракта, лимфатической системы, гортани, поджелудочной железы (включая экзокринную карциному поджелудочной железы), ротовой полости, глотки, пищевода, желудка, тонкого кишечника, толстой кишки, прямой кишки, желчного пузыря, шейки матки, щитовидной железы, а также кожи (включая плоскоклеточную карциному); опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому, а также шванному; опухоли мезенхимального происхождения, включая фибросаркому, рабдомиосаркому, а также остеосаркому; и другие виды опухолей, включая меланому, пигментную ксеродерму, кератоактантому, семиному, фолликулярный рак щитовидной железы, тератокарциному. в. Заболевание крови/аутоиммунное заболевание. Способ может включать введение композиции, которая увеличивает число ГСК в костном мозге и мобилизует эти клетки в кровоток, чтобы смягчить или предотвратить симптомы доброкачественного заболевания или состояния. Доброкачественное заболевание или расстройство может быть связано с гемопоэтической системой, включая, без ограничений, гемоглобинопатию, синдром недостаточности костного мозга, иммунодефицит, метаболическое заболевание/болезнь накопления, болезнь нейтрофилов,болезнь тромбоцитов, вирусную инфекцию, такую как ВИЧ-инфекция, а также аутоиммунное заболевание. Гемоглобинопатия может представлять собой талассемию (например, зависимую от трансфузии талассемию, эритробластическую талассемию и т.д.) или талассемию серповидноклеточную анемию или серповидно-клеточную болезнь. 7. Введение композиции. Введение композиций с применением описанного здесь способа может быть пероральным, парентеральным, подъязычным, трансдермальным, ректальным, введением через слизистые оболочки, местным введением, введением путем ингаляции, трансбуккальным введением или их комбинацией. Парентеральное введение включает внутривенное, внутриартериальное, внутрибрюшинное, подкожное, внутримышечное, внутриоболочечное и внутрисуставное введение, но не ограничивается ими. При использовании в ветеринарии композицию можно вводить в подходящем препарате в соответствии с обычной ветеринарной практикой. Ветеринар легко может определить режим приема и путь введения, наиболее подходящий для данного животного. Композиции можно вводить людям, собакам, кошкам, крупным животным или птицам. Композицию можно вводить одновременно или чередуя с осуществлением других методов лечения. Используемые здесь термины "одновременный" и "одновременно" обозначают, что введение композиции и другое лечение можно осуществлять с интервалом в 48 ч, предпочтительно 24 ч, более предпочтительно 12 ч, еще более предпочтительно 6 ч и наиболее предпочтительно 3 ч. Используемый здесь термин"чередовать" обозначает введение композиции в моменты времени, отличающиеся от времени осуществления другого лечения, и с определенной частотой повторения введения. Композицию можно вводить в любое время до воздействия аномальных условий, стресса или лечения, в т.ч. за 120, 118, 116, 114, 112, 110, 108, 106, 104, 102, 100, 98, 96, 94, 92, 90, 88, 86, 84, 82, 80, 78, 76,74, 72, 70, 68, 66, 64, 62, 60, 58, 56, 54, 52, 50, 48, 46, 44, 42, 40, 38, 36, 34, 32, 30, 28, 26, 24, 22, 20, 18, 16,14, 12, 10, 8, 6, 4, 3, 2 или за 1 ч до воздействия. Также композицию можно вводить в любое время после воздействия, в т.ч. приблизительно через 1, 2, 3, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36,38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96,98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118 и 120 ч после воздействия. Композицию можно вводить донору до проведения действий с ГСК приблизительно за 120, 118,116, 114, 112, 110, 108, 106, 104, 102, 100, 98, 96, 94, 92, 90, 88, 86, 84, 82, 80, 78, 76, 74, 72, 70, 68, 66, 64,62, 60, 58, 56, 54, 52, 50, 48, 46, 44, 42, 40, 38, 36, 34, 32, 30, 28, 26, 24, 22, 20, 18, 16, 14, 12, 10, 8, 6, 4, 3, 2 или за 1 ч перед проведением действий. 8. Приготовление композиции. Способ может включать введение композиции, которая увеличивает число ГСК в костном мозге и мобилизует эти клетки в кровоток для облегчения или лечения симптомов заболевания или состояния. Предложенные здесь композиции могут быть в форме таблеток или леденцов, приготовленных традиционными методами. Например, таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, включая связывающие вещества, наполнители, скользящие вещества, разрыхлители и увлажняющие вещества, но не ограничивающиеся ими. Связывающие вещества включают сироп, аравийскую камедь, желатин, сорбит, трагакантовую камедь, крахмальный клейстер и поливиниллпирролидон, но не ограничиваются ими. Наполнители включают лактозу, сахар, микрокристаллическую целлюлозу, кукурузный крахмал, ортофосфат кальция и сорбит, но не ограничиваются ими. Скользящие вещества включают стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль и диоксид кремния, но не ограничиваются ими. Разрыхлители включают картофельный крахмал и натрия крахмалгликолят, но не ограничиваются ими. Увлажнители включают лаурилсульфат натрия, но не ограничиваются им. Таблетки могут быть покрыты оболочкой, что осуществляют способами, хорошо известными в данной области. Предложенные здесь композиции также могут представлять собой жидкие препараты, включая водные или масляные суспензии, растворы, эмульсии, сиропы и эликсиры, но не ограничиваясь ими. Композиции также могут быть приготовлены в виде сухого продукта для разведения водой или другим подходящим разбавителем перед применением. Такие жидкие препараты могут содержать добавки,включающие суспендирующие агенты, эмульгаторы, неводные разбавители и консерванты, но не ограничивающиеся ими. Суспендирующие агенты включают сироп сорбита, метилцеллюлозу, глюкозный/сахарный сироп, желатин, гидроксицеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия, а также гидрогенизированные пищевые жиры, но не ограничиваются ими. Эмульгаторы включают лецитин, сорбитанмоноолеат и аравийскую камедь, но не ограничиваются ими. Неводные разбавители включают пищевые масла, миндальное масло, фракционированное кокосовое масло, масляные эфиры, пропиленгликоль и этиловый спирт, но не ограничиваются ими. Консерванты включают метил или пропил пара-гидроксибензоат и сорбиновую кислоту, но не ограничиваются ими. Предложенные здесь композиции также могут быть приготовлены в форме суппозиториев, которые могут содержать основы для суппозиториев, включая масло какао или глицериды, но не ограничиваясь ими. Предложенные здесь композиции также могут быть приготовлены для введения ингаляцией, которую можно проводить с использованием раствора, суспензии или эмульсии, причем композицию можно вводить в виде сухого порошка или в форме аэрозоля с использованием пропеллента, такого как дихлордифторметан или трихлорфторметан. Предложенные здесь композиции также могут быть приготовлены в виде препаратов для трансдермального введения, содержащих водные или неводные разбавители, к ним относятся кремы, мази, лосьоны, пасты, лекарственные пластыри, накладки или мембраны, но не ограничивают их этим. Предложенные здесь композиции также могут быть приготовлены для парентерального введения, в т.ч. инъекцией или продолжительной инфузией, но не ограниченного этим. Препараты для инъекций могут быть представлены в форме суспензий, растворов или эмульсий в масляных или водных разбавителях, а также могут содержать дополнительные агенты, в т.ч. суспендирующие агенты, стабилизаторы,диспергаторы, но не ограничиваясь ими. Композиция также может быть предложена в форме порошка для разведения подходящим разбавителем, включая стерильную апирогенную воду, но не ограничиваясь ею. Предложенные здесь композиции также могут быть приготовлены в форме депо-препарата, который можно вводить путем имплантации или внутримышечной инъекции. Композиции могут быть приготовлены с применением подходящих полимерных или гидрофобных материалов (таких как, например,эмульсия в подходящем масле), ионообменных смол или с умеренно растворимыми производными (такими как, например, умеренно растворимая соль). 9. Дозировка композиции. Способ может предусматривать введение терапевтически эффективного количества композиции пациенту, нуждающемуся в этом. Терапевтически эффективное количество, требующееся для проведения терапии, варьирует в зависимости от природы состояния, которое лечат, желаемого времени усиления выведения ГСК в кровоток, а также от возраста/состояния пациента. В целом, однако, дозы, применяемые для лечения взрослого человека, обычно находятся в пределах от 0,001 до приблизительно 200 мг/кг в сутки. Доза может составлять приблизительно от 1 до приблизительно 100 мг/кг в сутки. Желаемую дозу можно удобно вводить в виде разовой дозы или многократным приемом через соответствующие интервалы времени, например в виде двух, трех, четырех или более субдоз в сутки. Многократный прием может быть желательным или необходимым. Дозировка может представлять собой любую дозировку, включая приблизительно 1, 25, 50, 75, 100,125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650,675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975 или 1 мг/кг, но не ограничиваясь этим. 10. Генная терапия. Настоящим предложен способ осуществления генной терапии у пациентов, имеющих различные генетические и приобретенные заболевания, с использованием композиции, которая увеличивает число ГСК в костном мозге, а также мобилизует эти клетки в кровоток. Согласно этому способу ГСК можно мобилизовать из кровотока пациента путем введения указанной композиции. Периферическую кровь затем забирают с помощью лейкафереза. ГСК можно дополнительно обогащать, отделяя от забранной периферической крови с помощью иммуноадсорбции с использованием анти-CD34 антител. По желанию число обогащенных ГСК затем увеличивают ex vivo выращиванием их в присутствии агентов, которые стимулируют пролиферацию стволовых клеток. Обогащенные и, необязательно, в увеличенном количестве стволовые клетки затем трансдуцируют амфотрофным ретровирусным вектором или другими подходящими векторами, которые экспрессируют ген, облегчающий генетическое или приобретенное заболевание. Факультативно, вектор также может нести экспрессирующийся селективный маркер, в этом случае успешно трансдуцированные клетки можно отбирать по наличию селективного маркера. Трансдуцированные и, возможно, отобранные ГСК затем возвращают в кровоток пациента и позволяют им внедриться в костный мозг. Изобретение имеет множество аспектов, проиллюстрированных следующими не ограничивающими объем изобретения примерами. Примеры Пример 1. Липопептиды при защите против радиации. Липопептиды способны защищать млекопитающее от воздействия радиации. Этот эффект был продемонстрирован с помощью наблюдения за иммунной системой селезенки (по массе) после воздействия ионизирующего излучения. Мышам линии ICR вводили PBS (физиологический раствор, забуференный фосфатом) или 3 мкг CBLB601 и затем подвергали воздействию 0 или 6 Гр ионизирующего излучения на весь организм (ИИВО). Каждые 3 дня умерщвляли группы по пять мышей от каждого испытания, их селезенки и тимусы извлекали и взвешивали. Массы селезенок стандартизировали по отношению к массе организма для каждого соответствующего животного. На фиг. 2 представлен график средних масс селезенок, взятых у контрольных облученных мышей и мышей, которым вводили CBLB601. На графике нанесены значения отношения массы селезенки к массе организма для мышей, подвергавшихся 0 или 6 Гр ИИВО с последующим внутримышечным введением PBS или 3 мкг CBLB601 на мышь за 24 ч до воз- 17018983 действия ионизирующим излучением. Селезенки мышей, которым вводили PBS и которых подвергали воздействию 6 Гр радиации, возвращались к нормальной массе через 13-14 суток. Для сравнения селезенки мышей, которым вводили CBLB601 и которых подвергали воздействию такого же количества радиации, возвратились к нормальной массе через 8 суток. Пример 2. Кровь, перелитая от обработанных липопептидом мышей, способна защитить от радиации. Кровь, перелитая от мышей, получавших липопептид, способна защитить мышь-реципиента от последствий радиации. Это продемонстрировано с помощью введения мышам каждый день 50 мкг липопептида CBLB612 в течение трех суток подряд. Чтобы контролировать эффекты CBLB612, группе мышей ежедневно в течение четырех суток подряд водили 100 мкг/кг G-CSF или PBS. После последней инъекции у обработанных мышей кровь собирали путем сердечной пункции и для каждой группы объединяли (т.е. PBS отрицательные контроли, G-CSF положительные контроли, а такжеCBLB612 экспериментальные образцы). Затем белые клетки периферической крови (PWBC) фракционировали и 200 мкл фракционированных PWBC вводили инъекцией в хвостовые вены подвергнутых облучению мышей-реципиентов. Количество перелитых PWBC было эквивалентно количеству, полученному от одной мыши. В качестве дополнительных контролей одна группа мышей не получила переливание, а другой группе вводили 3106 клеток костного мозга от интактных мышей. За мышами из пяти экспериментальных групп (т.е. мыши, получавшие PBS, G-CSF и CBLB612, которым сделали переливание, мыши без переливания и мыши с инъекцией костного мозга), предварительно подвергнутыми облучению 9 Гр (летальная доза для мышей линии С 57/В 6) за 2 ч до переливания,наблюдали и оценивали их выживания после переливания. В табл. 4 приведены результаты эксперимента Таблица 4 Мыши, которым не делали переливания, или которым перелили PWBC от мышей, обработанныхPBS, продемонстрировали низкие уровни выживания через 21 сутки после облучения. В противоположность этому, все мыши, которым перелили PWBC, полученные от мышей, обработанных CBLB612, выжили на 24 сутки после ионизирующего облучения. Этот уровень выживания равен уровню выживания мышей, обработанных PWBC, выделенных из мышей, обработанных G-CSF, и мышей, которым инъецировали клетки костного мозга от интактных мышей до ионизирующего облучения. Это свидетельствует о том, что кровь мышей, обработанных липопептидом, способна защитить против эффектов летальных уровней облучения при переливании облученным реципиентным мышам. Пример 3. Липопептиды способны увеличивать количество и мобильность ГСК. Ниже показано, что липопептиды действительно способны увеличивать число ГСК и мобилизовать их из костного мозга (ВМ) в кровоток. Этот эффект наблюдали, проводя мониторинг известных маркеров ГСК в клетках ВМ и клетках периферической крови. Клетки выделяли из ВМ мышей, получавшихCBLB601, или контрольных мышей и эти клетки затем анализировали с помощью сортера с активацией флуоресценции (FACS). FACS затем применяли для отбора клеточных популяций KL, презентирующихCD 117 (с-kit)pos и Linneg, которые являются маркерами обычных миелоидных предшественников; клеточных популяций KSL/CD34", презентирующих CD 117 (c-kit)pos, Sca-lpos, Linneg, а также CD34neg/low, которые являются маркерами долгоживущих ГСК; а также клеточные популяции KSL/CD34+, презентирующие CD 117 (c-kit)pos, Sca-lpos, Linreg, CD34pos, которые являются маркерами короткоживущих ГСК и мультипотентных предшественников с непрерывным лимфопоэзом, но предпочтительно восстанавливающих лимфопоэз, а не миелопоэз. На фиг. 3 продемонстрировано, что содержание (в процентах) клеток c-kitpos,KSL, KSL/CD34", а также KSL/CD34" клеток в ВМ повышено у мышей, получавших CBLB601, по сравнению с контролем и достигает своего пика через 72 ч после введения CBLB601. Следовательно, долгоживущие и короткоживущие клеточные популяции ГСК так же, как обычные и мультипотентные попу- 18018983 ляции миелоидных клеток-предшественников, увеличиваются при лечении CBLB601. Кроме того, ГСК мобилизовались из ВМ в кровоток в результате лечения CBLB601. Для анализа клеточных популяций в крови мышей, получавших CBLB601, по сравнению с контрольными мышами применяли FACS. На фиг. 4 продемонстрировано, что число клеток LSK, LSK/CD34- и LSK/CD34+/мл крови повышено у мышей, которым вводили CBLB601, по сравнению с контролем. Увеличение числа клеток ГСК в периферической крови достигает пика через 72 ч после обработки CBLB601. Соответственно эти эксперименты показывают, что радиопротекторный эффект липопептидов опосредован усилением гематопоэза. Пример 4. Липопептиды способны мобилизовать множественные популяции стволовых клеток. Ниже продемонстрировано, что липопептиды способны мобилизовать множественные популяции стволовых клеток в крови. С 57/В 6 мыши получали одну подкожную (SC) инъекцию или четыре ежедневных SC инъекции по 50 мкг CBLB612. Образцы крови брали у каждой мыши и анализировали с помощью FACS с использованием следующих молекулярных маркеров, общих для популяций стволовых клеток: Lin, sca-1, c-Kit и CD34. В табл. 5 ниже показано количество клеток/мл для различных клеточных популяций в разные моменты времени, как было проанализировано с помощью FACS. Lin-, sca-1+ и cKit+ (LSK) представляют собой маркеры, общие для всех стволовых клеток. Клетки, обладающиеLSK7CD34-, представляют собой настоящие плюрипотентные долгоживущие гемопоэтические стволовые клетки, тогда как клетки с LSK/CD34+ являются короткоживущими ГСК и мультипотентными предшественниками. Таблица 5 Кинетика мобилизации гемопоэтических стволовых клеток в кровоток после инъекцииCBLB612 (среднее значение для трех животных) Уровни плюрипотентных долгоживущих гемопоэтических стволовых клеток, коммитированных стволовых клеток-предшественников, а также стволовых клеток, в общем, возрастают через 72 ч после обработки липопептидом CBLB612. Эти данные показывают, что липопептиды способны повышать уровни широкого спектра стволовых клеток, представляющих практически все типы, и мобилизовать эти клетки в кровь. Пример 5. Липопептиды способны увеличивать число ГСК в костном мозге и мобильность в периферическую кровь у макаки-резус. Ниже продемонстрировано, что липопептиды способны увеличивать количество ГСК и мобилизовать их из костного мозга (bone marrow, BM) в кровоток. Этот эффект наблюдали, осуществляя мониторинг известных маркеров ГСК в ВМ в клетках и периферических клетках макаки-резус. Шесть макак-резус изучали для определения эффектов CBLB612. Макаки-резус, выступающие в качестве положительного контроля, получали ежедневно подкожную дозу 100 мкг/кг G-CSF в течение четырех дней подряд перед днем "0" (т.е. "Дни 4-1"). В "День 1" у экспериментальных макак-резус(обезьяны 1-6) отбирали кровь до того, как они получали назначенное лечение. Макаки-резус 2-5 получали 0,25 мг/кг CBLB612 внутримышечно в День 1. Обезьяна 6 - отрицательный контроль (интактная) - не получала ни G-CSF, ни CBLB612. Затем кровь отбирали в Дни испытания со 2 по 5 у обезьян 2-6. Костный мозг отбирали в День 1 у обезьяны 6 (интактной), в День 2 у обезьяны 2, на 3 День у обезьяны 3, на 4 День у обезьяны 4 и на 5 День у обезьяны 5 (см. табл. 6). Таблица 6 Субпопуляции всех белых клеток крови (white blood cells, WBC) из ВМ и периферической крови(peripheral blood, PB) анализировали с помощью FACS с целью отобрать гемопоэтические плюрипотентные стволовые клетки, презентирующие маркер CD34+ (Lin-CD34+CD38-), который представляет собой маркер, обычно используемый в клинической практике для очистки ГСК от РВ или ВМ (см. фиг. 6). Темные клетки в табл. 5 показывают уровень клеток, несущих CD34+, экспрессирующихся в ВМ. Клетки, не выделенные цветом в табл. 5, свидетельствуют о количестве CD34+ клеток, присутствующих в РВ. В табл. 7 показано, что липопептиды могут стимулировать пролиферацию CD34+ и их мобилизацию из ВМ в РВ. Табл. 7 также свидетельствует о том, что даже единственный забор ВМ может стимулировать пролиферацию CD34+ клеток и их мобилизацию в РВ. Эти данные дополнительно объединены на фиг. 5. На фиг. 5 показано, что уровень CD34+ клеток, рекрутированных в РВ, достигает своего пика после введения CBLB612. Таблица 7 Пример 6. Мобилизация ГСК зависит от дозы CBLB612. Это было продемонстрировано введением скорректированных доз лекарства, пропорциональных среднему весу мышей в данной группе после распределения. Дозы рассчитывались с учетом заданной дозы/кг средней массы. Корректировку дозы осуществляли путем корректировки концентрации в устройстве для инъекции, при этом объем инъекции был постоянным; см. табл. 8. Таблица 8 Получение соединений В соответствии с табл. 9 все группы получили единственную подкожную (subcutaneous, SC) инъекцию 5 мг/кг AMD3100 за 1 ч до эвтаназии. Контрольной группе 1 инъецировали только 5 мг/кгAMD3100. Контрольной группе 2 ежесуточно делали четыре SC инъекции 0,1 мг/кг G-CSF и на пятые сутки мышам вводили AMD3100. Контрольная группа 8 состояла из мышей линии ICR, и они получали такое же лечение, как контрольная группа 2. Экспериментальные группы 3-6 получили единственную SCAMD3100 5 мг/кг за 1 ч до эвтаназии на пятые сутки после первой инъекции G-CSF. Измерением количеств гемопоэтических стволовых клеток и клеток-предшественников в периферической крови С 57 В 1 мышей, обработанных единственной инъекцией разных доз CBLB612 с последующей однократной инъекцией AMD3100 за 1 ч до забора крови, выявили, что минимальная дозаCBLB612, которая приводит к максимальному числу ГСК и мобилизации клеток-предшественников, составляет 1,2 мг/кг; см. табл. 10 и фиг. 7, 8. Эта доза также приводит к максимальному увеличению ГСК в костном мозге; см. табл. 11 и фиг. 9, 10. Обработка мышей линии C57B1/6NHsd совместно CBLB612 иAMD3100 была приблизительно в три раза более эффективной в отношении мобилизации ГСК, чем обработка совместно G-CSF и AMD3100, тогда как обработка этих мышей всеми тремя соединениями мобилизовала приблизительно в два раза больше ГСК, чем комбинации CBLB612 плюс AMD3100 и G-CSF плюс AMD3100 вместе; см. табл. 10. Мыши линии ICR демонстрировали большую эффективность в отношении мобилизации при введении G-CSF плюс AMD3100, чем мыши линии C57B1/6NHsd; см. табл. 10. Таблица 9 Обзор эксперимента Таблица 10 Средние количества и стандартное отклонение разных популяций гемопоэтических стволовых клеток и клеток-предшественников в периферической крови мышей С 57 В 1 Таблица 11 Средние количества и стандартное отклонение различных популяций гемопоэтических стволовых клеток и клеток-предшественников в костном мозге мышей После обработки мышей однократной дозой 1,2 мг/кг CBLB612 за 72 ч до забора крови, плюс четыре инъекции 0,1 мг/кг G-CSF ежедневно и плюс однократная инъекция 5 мг/кг AMD3100 за 1 ч до эвтаназии обнаружили, что мобилизация ГСК является синергичной (приблизительно в 6-8 раз выше) по сравнению с обработкой двумя лекарствами: CBLB612 и AMD3100 или G-CSF и AMD 1300. Обнаружили, что минимальная доза, которая приводила к максимальному повышению ГСК в костном мозге, составила 1,2 мг/кг CBLB612. Пример 7. Кинетика мобилизации ГСК. Мобилизация ГСК и клеток-предшественников из костного мозга в периферическую кровь после инъекции CBLB612 продемонстрирована введением доз лекарств, скорректированных так, чтобы они были пропорциональны средней массе мышей в данной группе распределения. Дозы рассчитывали с учетом заданной дозы/кг средней массы. Корректировку дозы осуществляли путем корректировки концентрации в устройстве для инъекции, при этом объем инъекции был постоянным; см. табл. 12. Как видно из табл. 13, все группы, за исключением PBS-контрольной группы 8, получали дозуAMD3100 5 мг/кг за 1 ч до эвтаназии. Контрольная группа 7 получила дозу AMD3100 6,5 мг/кг. Отрицательная контрольная группа 8 получила однократную SC инъекцию 200 мкл PBS за 1 ч до забора крови. Экспериментальные группы 1-6 получили однократные SC инъекции CBLB12 2 мг/кг в разное время до забора крови. Положительная контрольная группа 9 получала четыре SC инъекции 0,1 мг/кг G-CSF ежесуточно. мышей не взвешивали перед введением AMD Измерением количеств гемопоэтических стволовых клеток и клеток-предшественников в периферической крови мышей линии С 57 В 1, которым делали однократную инъекцию CBLB612 в разные моменты времени с последующей однократной инъекцией AMD3100 за 1 ч до забора крови, выявили, что максимальная мобилизация этих клеток происходит приблизительно через 72-96 ч после инъекцииCBLB612. Количества настоящих плюрипотентных ГСК (KSL/CD34), ST-ГСК (KSL/CD34) и коммитированных предшественников (наиболее коммитированные к миелоидной линии; LIN7scal7kit+) - все были повышены; см. табл. 14 и фиг. 11-12. Однократная инъекция CBLB612 увеличивала число ГСК в костном мозге с пиком, наступающим приблизительно через 12-24 ч после инъекции; см. табл. 15 и фиг. 13-15. Таблица 14 Средние количества и стандартное отклонение различных популяций гемопоэтических стволовых клеток и клеток-предшественников в периферической крови мышей С 57 В 1 Таблица 15 Средние количества и стандартное отклонение различных популяций гемопоэтических стволовых клеток и клеток-предшественников в костном мозге мышей С 57 В 1 Однократная инъекция CBLB612 увеличивала число ГСК в костном мозге с пиком, наступающим приблизительно через 12-24 ч после инъекции.
МПК / Метки
МПК: A61P 43/00, C12N 5/00, A61P 35/02
Метки: усиления, способ, клеток, миграции, лечения, гемопоэтических, указанных, использованием, популяции, получения, способы, стволовых
Код ссылки
<a href="https://eas.patents.su/30-18983-sposob-usileniya-migracii-gemopoeticheskih-stvolovyh-kletok-sposob-polucheniya-populyacii-ukazannyh-kletok-i-sposoby-lecheniya-s-ih-ispolzovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Способ усиления миграции гемопоэтических стволовых клеток, способ получения популяции указанных клеток и способы лечения с их использованием</a>
Предыдущий патент: Фармацевтические составы, содержащие ингибиторы деацетилазы гистонов
Следующий патент: Производные пиразолона как ингибиторы pde4












