Радиоактивно меченные pde10 лиганды
Номер патента: 19673
Опубликовано: 30.05.2014
Авторы: Андрес-Хиль Хосе Игнасио, Селен Софи Жанн Леопольдин, Де Анхелис Мери, Борман Ги Мориц Р.
Формула / Реферат
1. Соединение формулы (I)
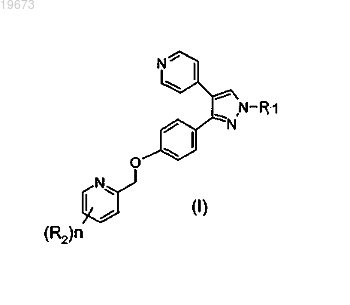
или его стереоизомерная форма, где
R1 представляет собой 2-фторэтил, 2,2,2-трифторэтил или 3-фторпропил;
n равно 1, 2 или 3;
каждый R2 независимо представляет собой С1-3алкил, циклопропил, C1-3алкилокси, галогенС1-3алкилокси, галоген, трифторметил, трифторметокси, дифторметокси или циано,
где по меньшей мере один F представляет собой [18F],
или его сольват либо соль.
2. Соединение по п.1, где R1 представляет собой 2-фторэтил.
3. Соединение по п.1, где R2 представляет собой 6-метил, 3,5-диметил или 5-метокси.
4. Соединение по п.1, где соединение представляет собой 2-[[4-[1-(2-фторэтил)-4-(4-пиридинил)-7Н-пиразол-3-ил]фенокси]метил]-3,5-диметилпиридин×сукцинат.
5. Стерильная композиция, содержащая соединение формулы (I) по п.1, растворенное в солевом растворе.
6. Применение соединения формулы (I) по п.1 для получения изображения ткани, клеток или организма in vitro или in vivo.
7. Способ получения изображения ткани, клеток или организма, включающий контактирование с тканью, клетками или организмом или введение в ткань, клетки или в организм соединения формулы (I) по п.1 и получение изображения ткани, клеток или организма с использованием системы визуализации методом позитрон-эмиссионной томографии.
8. Промежуточное соединение формулы (VI)
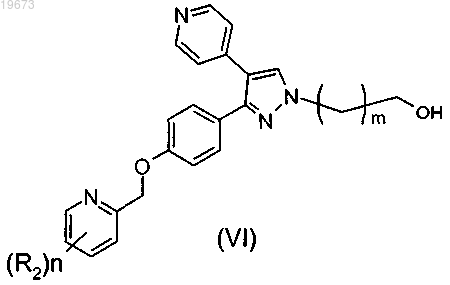
или его стереоизомерная форма, где
m равно 1 или 2;
n равно 1, 2 или 3;
каждый R2 независимо представляет собой C1-3алкил, циклопропил, С1-3алкилокси, галогенC1-3алкилокси, галоген, трифторметил, трифторметокси, дифторметокси или циано,
или его сольват либо соль.
Текст
Изобретение относится к новым селективным радиоактивно меченным PDE10 лигандам, которые являются полезными для визуализации и количественного определения PDE10A фермента в тканях с использованием позитрон-эмиссионной томографии (PET). Изобретение также направлено на композиции, содержащие такие соединения, на способы получения таких соединений и композиций и на применение таких соединений и композиций для получения изображения ткани,клеток или организма in vitro или in vivo. Андрес-Хиль Хосе Игнасио, Де Анхелис Мери (ES), Борман Ги Мориц Р., Селен Софи Жанн Леопольдин(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Область техники, к которой относится изобретение Настоящее изобретение относится к новым селективным радиоактивно меченным PDE10 лигандам,которые являются полезными для визуализации и количественного определения PDE10A фермента в тканях с использованием позитрон-эмиссионной томографии (PET). Настоящее изобретение также направлено на композиции, содержащие такие соединения, на способы получения таких соединений и композиций, и на применение таких соединений и композиций для получения изображения ткани, клеток или организма in vitro или in vivo. Предпосылки создания изобретения Фосфодиэстеразы (PDE) представляют собой семейство ферментов, кодируемых 21 геном и подразделяющееся на 11 отдельных семейств в соответствии со структурными и функциональными свойствами. Эти ферменты метаболически инактивируют широко распространенные внутриклеточные вторичные мессенджеры, 3',5'-циклический аденозинмонофосфат (сАМР) и 3',5'-циклический гуанозинмонофосфат (cGMP). Эти два мессенджера регулируют множество различных биологических процессов,включая продукцию и действие провоспалительного медиатора, функцию ионных каналов, мышечное сокращение, способность к обучению, дифференциацию, апоптоз, липогенез, гликогенолиз и глюконеогенез. Они делают это путем активации протеинкиназы А (PKA) и протеинкиназы G (PKG), которые, в свою очередь, фосфорилируют различные субстраты, включая факторы транскрипции и ионные каналы,которые регулируют бесчисленное количество физиологических ответов. В нейронах это включает активацию сАМР и cGMP-зависимых киназ и последующее фосфорилирование белков, вовлеченных в острую регуляцию синаптической трансмиссии, а также в дифференциацию и выживание нейронов. Внутриклеточные концентрации сАМР и cGMP строго регулируются скоростью биосинтеза посредством циклаз и скоростью расщепления посредством PDE. PDE представляют собой гидролазы, которые инактивируют сАМР и cGMP путем каталитического гидролиза 3'-сложноэфирной связи, образуя неактивный 5'-монофосфат (схема 1). Схема 1 На основании специфичности в отношении субстрата PDE семейства можно разделить на три группы: i) сАМР-специфические PDE, которые включают PDE4, -7 и -8; ii) cGMP-селективные ферментыPDE5 и -9 и iii) имеющие два субстрата PDE, PDE1, -2 и -3, а также PDE10 и -11. Об открытии фосфодиэстеразы 10 А (PDE10A) сообщалось в 1999 году. Из всех 11 известных PDE семейств PDE10A имеет наиболее ограниченное распределение с высокой экспрессией только в головном мозге и мужской половой железе. В головном мозге мРНК и белок PDE10A высокоэкспрессируются в полосатом теле. Такое уникальное распределение PDE10A в головном мозге, вместе с его возросшими фармакологическими характеристиками, указывает на потенциальное использование ингибиторов PDE10A для лечения неврологических и психиатрических расстройств, таких как шизофрения. Позитрон-эмиссионная томография (PET) представляет собой неинвазивный метод визуализации,который предлагает наибольшее пространственное и временное разрешение из всех методов ядерной визуализации, и обладает дополнительным преимуществом, поскольку делает возможным действительное количественное определение концентрации радиоактивного индикатора в тканях. В этом методе используют позитрон-испускающие радионуклиды, такие как, например, 15 О, 13N, 11C и 18F, для детекции. В WO 2006/072828 (Pfizer) раскрыты гетероароматические хинолиновые соединения в качестве селективных ингибиторов PDE10. В WO-2007/129183 (Pfizer) раскрыты бициклические гетероарильные соединения в качестве ингибиторов PDE10.Zhude Tu et al. описали [11C]-папаверин в качестве радиоактивного индикатора для PET для визуализации PDE10A (Nuclear Medicine and Biology, 37, 509-516, 2010) и сделали заключение, что он не является идеальным радиолигандом для клинической визуализации PDE10A в центральной нервной системе. Существует мнение, что необходимы аналоги, обладающие более высокой селективностью в отношенииPDE10A по сравнению с PDE3 и улучшенными фармакокинетическими свойствами. В WO 2010/097367 раскрыты радиоактивно меченные хинолиновые соединения, например 2-4-[1(2-[18F]фторэтил)-4-пиридин-4-ил-1 Н-пиразол-3-ил]феноксиметилхинолин, полезные в качестве Краткое описание изобретения Настоящее изобретение относится к соединению, имеющему формулу (I) или его стереоизомерной форме, гдеn равен 1, 2 или 3; каждый R2 независимо представляет собой C1-3 алкил, циклопропил, галогенС 1-3 алкилокси, галоген,трифторметил, трифторметокси, дифторметокси или циано,где по меньшей мере один F представляет собой [18F],или к его сольвату или его солевой форме. Настоящее изобретение также относится к соединениям-предшественникам для синтеза соединений форммулы (I), как определено выше, где указанные соединения имеют формулу (VI)n равен 1, 2 или 3; каждый R2 независимо представляет собой C1-3 алкил, циклопропил, галогенС 1-3 алкилокси, галоген,трифторметил, трифторметокси, дифторметокси или циано,или к их сольвату или солевой форме. Настоящее изобретение также относится к ссылочным соединениям, соответствующим [19F]соединениям формулы (I). Иллюстративной для настоящего изобретения является стерильная композиция, содержащая соединение формулы (I), как описано в настоящем описании, растворенное в подходящем составе. Иллюстративным для настоящего изобретения является применение соединения формулы (I), как описано в настоящем описании, для получения или способ получения изображения ткани, клеток или организма in vitro или in vivo. Также иллюстративным для настоящего изобретения является способ получения изображения ткани, клеток или организма, включающий контактирование с тканью, клетками или организмом, или введение в ткань, клетки или в организм соединения формулы (I), как описано в настоящем описании, и получение изображения ткани, клеток или организма с использованием системы визуализации методом позитрон-эмиссионной томографии. Кроме того, настоящее изобретение относится к способу получения соединения формулы (I), как описано в настоящем описании, включающему стадию взаимодействия соединения формулы (V), как описано в настоящем описании, с 11CH3I или 11CH3OTf в присутствии основания в инертном растворителе. Подробное описание изобретения Настоящее изобретение направлено на соединения формулы (I), как определено выше, и их фармацевтически приемлемые сольваты и солевые формы. Настоящее изобретение, кроме того, направлено на соединения-предшественники формулы (VI). В одном варианте осуществления R1 представляет собой 2-фторэтил. В другом варианте осуществления R2 представляет собой 6-метил, 3,5-диметил или 5-метокси. В предпочтительном варианте осуществления соединение формулы (I) представляет собой 2-4-[1(2-фторэтил)-4-(4-пиридинил)-7 Н-пиразол-3-ил]фенокси]метил]-3,5-диметилпиридинсукцинат (В-3). Соединения формулы (I) и композиции, содержащие соединения формулы (I), можно использовать для получения изображения ткани, клеток или организма in vitro или in vivo. В частности, настоящее изобретение относится к способу визуализации или количественного определения PDE10A в ткани,клетках или в организме in vitro или in vivo. Клетки и ткани предпочтительно представляют собой клетки и ткани центральной нервной системы, в которых PDE10A присутствует в большом количестве. Как уже было сказано, PDE10A присутству-2 019673 ет в большом количестве в тканях центральной нервной системы, более конкретно, в ткани центральной нервной системы, образующей головной мозг; еще более конкретно, образующей полосатое тело. Когда способ осуществляют in vivo, организмом является млекопитающее. В таких конкретных случаях соединение формулы (I) вводят внутривенно, например путем инъекции через шприц или с использованием периферийной внутривенной линии, такой как короткий катетер. Когда организмом является человек, соединение формулы (I) или стерильную композицию, содержащую стерильный солевой раствор соединения формулы (I), можно, в частности, вводить путем внутривенного введения в руку, в любую определяемую вену, в частности в тыльную сторону ладони или в среднюю локтевую вену около локтя. Таким образом, в конкретном варианте осуществления настоящее изобретение относится к способу получения изображения ткани или клетки у млекопитающего, включающему внутривенное введение млекопитающему соединения формулы (I), как определено в настоящем описании, или композиции, содержащей соединение формулы (I), и получение изображения ткани или клетки с использованием системы визуализации методом позитрон-эмиссионной томографии. Таким образом, в следующем конкретном варианте осуществления настоящее изобретение относится к способу получения изображения ткани или клетки человека, включающему внутривенное введение человеку соединения формулы (I), как определено в настоящем описании, или композиции, представляющей собой стерильный солевой раствор, содержащий соединение формулы (I), и получение изображения ткани или клетки с использованием системы визуализации методом позитрон-эмиссионной томографии. В следующем варианте осуществления настоящее изобретение относится к способу визуализации или количественного определения PDE10A у млекопитающего, включающему внутривенное введение млекопитающему соединения формулы (I) или композиции, содержащей соединение формулы (I), и получение изображения с использованием системы визуализации методом позитрон-эмиссионной томографии. В другом варианте осуществления настоящее изобретение относится к применению соединения формулы (I) для получения изображения ткани, клеток или организма in vitro или in vivo, или настоящее изобретение относится к соединению формулы (I), применяемому для получения изображения ткани,клеток или организма in vitro или in vivo с использованием позитрон-эмиссионной томографии. Определения"C1-3 алкил", отдельно или в сочетании с другими терминами, означает линейную или разветвленную насыщенную алкильную группу, содержащую 1, 2 или 3 атомов углерода, например метил, этил, 1 пропил и 2-пропил. Как он используется в настоящем описании, термин "композиция" охватывает продукт, содержащий указанные ингредиенты в указанных количествах, а также любой продукт, который является результатом, прямым или косвенным, комбинации указанных ингредиентов в указанных количествах. Термин "стереоизомерные формы", как он используется в настоящем описании выше или далее, означает все возможные стереоизомерные формы, которые могут иметь аддитивные соли соединений формулы (I) и их аддитивные соли. Если не оговорено или не указано иное, химическое название соединений означает смесь всех возможных стереохимически изомерных форм. Приемлемые соли соединений формулы (I) представляют собой такие, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, являются они фармацевтически приемлемыми или нет,включены в объем настоящего изобретения. Фармацевтически приемлемые соли определены как включающие терапевтически активные нетоксичные кислотно-аддитивные солевые формы, которые могут образовывать соединения формулы (I). Указанные соли можно получить путем обработки основной формы соединений формулы (I) подходящими кислотами, например неорганическими кислотами, такими как галогеноводородные кислоты, в частности хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, оксиуксусной кислотой, пропановой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой,фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, цикламиновой кислотой, салициловой кислотой, п-аминосалициловой кислотой и памовой кислотой. И наоборот, указанные солевые формы можно преобразовать в форму свободного основания путем обработки подходящим основанием. Термин "организм" относится к млекопитающему, в частности к человеку, крысам, мышам, собакам. Термин "клетка" относится к клетке, экспрессирующей или содержащей PDE10A фермент. Пиридиновые соединения по настоящему изобретению структурно отличаются от соединений предшествующего уровня техники, которые неизменно включают гетероароматическую бициклическую группу. Функционально они отличаются тем, что они имеют уменьшенную липофильность, и поэтому они демонстрируют меньшее неспецифическое связывание с белками и жирами головного мозга, что делает их более привлекательными в качестве потенциальных PET радиолигандов. При сравнении с 2-4[1-(2-[18F]фторэтил)-4-пиридин-4-ил-1 Н-пиразол-3-ил]феноксиметилхинолином соединения по настоящему изобретению имеют более быструю кинетику, что обеспечивает меньшее время обнаружения в клиническом применении для получения показателей устойчивого объема распределения и достижение более высоких отношений полосатое тело-к-мозжечку, давая более высокое качество in vivo визуализации и более точное количественное определение потенциала связывания PDE10A. Получение Соединения согласно настоящему изобретению, как правило, могут быть получены путем осуществления последовательных стадий, каждая из которых известна специалистам в данной области. В частности, соединения можно получить согласно следующим способам синтеза. А. Получение конечных соединений. Соединения формулы (I) в их не меченной радиоактивным изотопом форме можно получить способами синтеза, хорошо известными специалистам в данной области. Соединения по настоящему изобретению могут быть получены, например, тремя разными общими способами. Способ А. Следующая последовательность реакций показана на схеме 2. Схема 2 Таким образом, соединение формулы (II) может быть подвергнуто взаимодействию с коммерчески доступным агентом алкилирования формулы (III), где Z представляет собой подходящую удаляемую группу, такую как галоген, например бром или йод, в присутствии подходящего основания, такого как карбонат цезия или карбонат калия, в инертном растворителе, таком как, например, диметилформамид,при перемешивании реакционной смеси при подходящей температуре, обычно при 100-150 С, с использованием обычного нагревания или в условиях микроволнового облучения, в течение времени, необходимого для достижения полного завершения реакции, обычно 10-20 мин в микроволновой печи. Реакция алкилирования обычно дает смесь двух возможных региоизомеров, образованных в результате алкилирования по обоим атомам азота пиразольного кольца, которые можно разделить хроматографическими методами, либо при помощи колоночной хроматографии, либо ВЭЖХ. Альтернативно, Z может представлять собой гидроксильную группу, в этом случае, взаимодействие с соединением (II) можно осуществить с использованием традиционных условий Мицунобу, которые хорошо известны специалистам в данной области. Таким образом, соединение (II) может быть подвергнуто взаимодействию с соединением (III), где Z представляет собой гидроксил-, в присутствии диэтил-,ди-трет-бутил- или диизопропилазодикарбоксилата и трифенилфосфина, в инертном растворителе, таком как, например, тетрагидрофуран, при перемешивании реакционной смеси при подходящей температуре,обычно при 120 С, в условиях микроволнового облучения, в течение подходящего периода времени, позволяющего полностью завершить реакцию, обычно 20 мин. Реакция Мицунобу обычно дает смесь двух возможных региоизомеров, образованных в результате алкилирования по обоим атомам азота пиразольного кольца, которые можно разделить хроматографическими методами, либо при помощи колоночной хроматографии, либо ВЭЖХ. Способ В. Альтернативно, соединения формулы (I) также можно получить через последовательность реакций,показанную на схеме 3. Схема 3 Следовательно, соединение формулы (IV) может быть подвергнуто взаимодействию с соединением формулы (V) с использованием традиционных условий Мицунобу, которые хорошо известны специалистам в данной области. Таким образом, соединение (IV) может быть подвергнуто взаимодействию с соединением (V) в присутствии диэтил-, ди-трет-бутил- или диизопропилазодикарбоксилата и трифенилфосфина, в инертном растворителе, таком как, например, тетрагидрофуран, при перемешивании реакци-4 019673 онной смеси при подходящей температуре, обычно при 120 С, в условиях микроволнового облучения, в течение подходящего периода времени, позволяющего полностью завершить реакцию, обычно 15-20 мин. Соединения формулы (V) либо являются коммерчески доступными, либо они описаны в химической литературе, и они могут быть получены по стандартным методам синтеза, хорошо известным специалистам в данной области. Способ С. Альтернативно, соединения формулы (I), где R1 представляет собой 2-фторэтил или 3-фторпропил,также можно получить через последовательность реакций, как показано на схеме 4. Схема 4 Следовательно, в соединении формулы (VI) гидроксильная группа может быть преобразована в подходящую удаляемую группу LG, такую как метансульфонат или тозилат, способами, хорошо известными специалистам в данной области, с получением промежуточного соединения формулы (VII). Затем удаляемая группа может быть замещена фтором с использованием стандартных способов, хорошо известных специалистам в данной области, таких как, например, взаимодействие с тетрабутиламмонийфторидом в инертном растворителе, таком как, например, тетрагидрофуран, при перемешивании реакционной смеси при подходящей температуре, обычно при 70 С, в условиях микроволнового облучения, в течение подходящего периода времени, позволяющего полностью завершить реакцию, обычно 10 мин. Альтернативно, соединения формулы (I) также можно получить путем непосредственного взаимодействия промежуточного соединения формулы (VI) с агентом фторирования, таким как, например, трифторид (N,N-диэтиламино)серы (DAST), с использованием известных в данной области методик. Включение радиоактивных атомов фтора в боковую цепь R1 соединений формулы (I), где R1 представляет собой 2-фторэтил или 3-фторпропил, можно осуществить с использованием методик, известных в данной области, например, путем взаимодействия подходящего предшественника формулы (VII) с нуклеофильным радиоактивным фторирующим реагентом, таким как K[18F]/Kryptofix 222 или соли тетраалкиламмония, включающие радиоактивный фторид, в инертном растворителе, таком как, например,диметилформамид, при перемешивании реакционной смеси при подходящей температуре, с использованием обычного нагревания или в условиях микроволнового облучения, в течение времени, необходимого для достижения полного завершения реакции. Альтернативно, включение радиоактивного фтора также можно осуществить путем реакции алкилирования промежуточного соединения формулы (II) с использованием либо 1-бром-2-[18F]фторэтана,либо 1-бром-3-[18F]фторпропана, в присутствии основания, такого как, например, карбонат цезия, в инертном растворителе, таком как, например, диметилформамид, при перемешивании реакционной смеси при подходящей температуре, с использованием обычного нагревания или в условиях микроволнового облучения, в течение времени, необходимого для достижения полного завершения реакции, обычно 15 мин при 90 С с использованием обычного нагревания. В этом случае, желаемое радиоактивно меченное соединение (I) можно отделить от другого радиоактивно меченного региоизомера и от непрореагировавшего предшественника при помощи ВЭЖХ. Включение либо радиоактивных атомов углерода, либо радиоактивных атомов фтора в группы заместителей R2 соединений формулы (I) также можно осуществить с использованием радиохимических методов, хорошо известных специалистам в данной области. Например, [11 С]метоксигруппа может быть включена путем взаимодействия подходящего предшественника формулы (I), где один R2 представляет собой ОН, с [11C]CH3I или [11C]CH3OTf в присутствии основания, такого как, например, карбонат цезия,в инертном растворителе, таком как, например, диметилформамид, при перемешивании реакционной смеси при подходящей температуре с использованием обычного нагревания, в течение подходящего периода времени, позволяющего полностью завершить реакцию. Включение радиоактивного атома фтора вR2 можно осуществить, например, путем взаимодействия подходящего предшественника формулы (I),где один R2 представляет собой нитрогруппу, хлор или бром в положении либо 4, либо 6 пиридинильного кольца, с нуклеофильным радиоактивным фторирующим реагентом, таким как K[18F]/Kryptofix 222,в инертном растворителе, таком как, например, диметилформамид, диметилсульфоксид или ацетонитрил, при перемешивании реакционной смеси при подходящей температуре с использованием обычного нагревания или в условиях микроволнового облучения, в течение времени, необходимого для достижения полного завершения реакции. Преобразования различных функциональных групп, присутствующих в конечных соединениях, в другие функциональные группы формулы (I), можно осуществить способами синтеза, хорошо известными специалистам в данной области. Таким образом, например, соединение формулы (I), где R2 представ-5 019673 ляет собой атом брома, может быть подвергнуто взаимодействию с метиловым эфиром (фторсульфонил)дифторуксусной кислоты в присутствии иодида меди в инертном растворителе, таком как, например,диметилформамид, при перемешивании реакционной смеси при подходящей температуре, обычно при 120 С, с использованием обычного нагревания или в условиях микроволнового облучения, в течение времени, необходимого для достижения полного завершения реакции, обычно 2 ч при обычном нагревании, с получением соединения формулы (I), где R2 представляет собой трифторметил. В другом примере,соединение формулы (I), где R2 представляет собой атом брома, может быть подвергнуто взаимодействию с алкил- или циклоалкилбороновой кислотой, в присутствии подходящего основания, такого как,например, водный раствор карбонат натрия, и катализатора на основе комплекса палладия, такого как,например, тетракис(трифенилфосфин)палладий(0), в инертном растворителе, таком как, например, диоксан, при перемешивании реакционной смеси при подходящей температуре с использованием обычного нагревания или в условиях микроволнового облучения, в течение времени, необходимого для достижения полного завершения реакции, обычно 15 мин при 130 С в микроволновой печи, с получением соединения формулы (I), где R2 представляет собой C1-3 алкил или циклопропил. В. Получение промежуточных соединений. Промежуточные соединения формулы (II) могут быть получены способами синтеза, хорошо известными специалистам в данной области, например путем осуществления последовательности реакций,как показано на схеме 5, которая основана на способе, описанном в J. Med. Chem., 2009, 52 (16), 51885196. Схема 5 Следовательно, соединение формулы (VIII) может быть подвергнуто взаимодействию с избыточным количеством коммерчески доступного диметоксиметилдиметиламина при перемешивании реакционной смеси при температуре кипения с обратным холодильником в течение времени, необходимого для достижения полного завершения реакции, обычно в течение 1 ч. После упаривания досуха полученный остаток можно обработать гидразингидратом в метаноле при перемешивании реакционной смеси при температуре кипения с обратным холодильником в течение времени, необходимого для достижения полного завершения реакции, обычно в течение 1 ч. Промежуточные соединения формулы (VIII) можно получить путем последовательного осуществления трехстадийной реакции, по существу, следуя способу синтеза, аналогично описанному в J. Med.Chem., 2009, 52 (16), 5188-5196, как показано на схеме 6. Схема 6 Следовательно, соединение формулы (IX) может быть подвергнуто взаимодействию сначала с тионилхлоридом для образования соответствующего ацилхлорида, а затем in situ с О,Nдиметилгидроксиламином в присутствии подходящего основания, такого как, например, триэтиламин, в инертном растворителе, таком как, например, тетрагидрофуран, при перемешивании реакционной смеси при комнатной температуре в течение времени, необходимого для достижения полного завершения реакции, обычно от 6 до 18 ч. Полученный, таким образом, N-метокси-N-метилбензамид затем может быть подвергнут взаимодействию с 4-пиколином в присутствии литийорганического реагента, обычно диизопропиламида лития, в инертном и безводном растворителе, таком как, например, тетрагидрофуран, при перемешивании реакционной смеси при -78 С в течение времени, достаточного, чтобы обеспечить полное завершение реакции. Промежуточные соединения формулы (IX) могут быть получены способами синтеза, хорошо известными специалистам в данной области, например, с использованием последовательности реакций,показанной на схеме 7. Следовательно, соединение формулы (V) может быть подвергнуто взаимодействию сначала с коммерчески доступным метиловым эфиром 4-оксибензойной кислоты с использованием традиционных условий Мицунобу, которые хорошо известны специалистам в данной области. Таким образом, соединение(V) может быть подвергнуто взаимодействию с метиловым эфиром 4-оксибензойной кислоты в присутствии диэтил-, ди-трет-бутил- или диизопропилазодикарбоксилата и трифенилфосфина, в инертном растворителе, таком как, например, тетрагидрофуран, при перемешивании реакционной смеси при подходящей температуре, обычно при 120 С, в условиях микроволнового облучения, в течение подходящего периода времени, позволяющего полностью завершить реакцию, обычно 20 мин. Затем соответствующее метилэфирное производное соединения (IX), полученное таким образом, может быть гидролизовано в щелочных условиях, с использованием разбавленного основания, такого как, например, водный раствор гидроксида натрия или гидроксида калия в инертном растворителе, таком как, например, метанол, тетрагидрофуран или смесь метанол/тетрагидрофуран, при перемешивании реакционной смеси при подходящей температуре либо при комнатной температуре в течение подходящего периода времени, позволяющего полностью завершить реакцию, обычно 18 ч, или при 150 С в условиях микроволнового облучения в течение 10 мин. Соединения формулы (V) либо являются коммерчески доступными, либо они описаны в химической литературе, и они могут быть получены с использованием простых стандартных методик синтеза, хорошо известных специалистам в данной области. Промежуточные соединения формулы (IV) могут быть получены способами синтеза, хорошо известными специалистам в данной области, такими как, например, последовательность реакций, показанная на схеме 8. Схема 8 Следовательно, соединение формулы (X), где Y представляет собой фенил или 2-хинолинил, может быть подвергнуто реакции гидролиза в подходящем инертном растворителе, таком как, например, этанол, в присутствии катализатора, такого как, например, 5 или 10% палладий на активированном угле, в течение подходящего периода времени, позволяющего полностью завершить реакцию, обычно при 5080 С и давлении 1 атм. водорода в H-cube аппарате. Промежуточные соединения формулы (X) могут быть получены способами синтеза, хорошо известными специалистам в данной области, например, как описано выше в способе синтеза соединений формулы (I), с использованием последовательности реакций, показанной на схеме 9. Схема 9 Таким образом, соединение формулы (XI), где Y представляет собой фенил или 2-хинолинил, может быть подвергнуто взаимодействию с коммерчески доступным агентом алкилирования формулы (III),где Z представляет собой подходящую удаляемую группу, такую как галоген, например бром или йод, в присутствии подходящего основания, такого как карбонат цезия или карбонат калия, в инертном растворителе, таком как, например, диметилформамид, при перемешивании реакционной смеси при подходящей температуре, обычно при 100-150 С, с использованием обычного нагревания или в условиях микроволнового облучения, в течение времени, необходимого для достижения полного завершения реакции,обычно 5-20 мин в микроволновой печи. В конкретном случае, когда R1 представляет собой -СН 2-COOAlk, конкретная температура реакции является комнатной температурой и необходимое время составляет 3 ч. Реакция алкилирования обычно дает смесь двух возможных региоизомеров, образованных в результате алкилирования по обоим атомам азота пиразольного кольца, которые можно разделить хроматографическими методами, либо при помощи колоночной хроматографии, либо ВЭЖХ. Альтернативно, Z может представлять собой гидроксильную группу, в этом случае взаимодействие с соединением (XI) можно осуществить с использованием традиционных условий Мицунобу, которые хорошо известны специалистам в данной области. Таким образом, соединение (XI) может быть подвергнуто взаимодействию с соединением (III), где Z представляет собой гидроксил, в присутствии диэтил-,ди-трет-бутил- или диизопропилазодикарбоксилата и трифенилфосфина, в инертном растворителе, таком как, например, тетрагидрофуран, при перемешивании реакционной смеси при подходящей температуре,обычно при 120 С, в условиях микроволнового облучения, в течение подходящего периода времени, позволяющего полностью завершить реакцию, обычно 20 мин. Реакция Мицунобу обычно дает смесь двух возможных региоизомеров, образованных в результате алкилирования по обоим атомам азота пиразольного кольца, которые можно разделить хроматографическими методами, либо при помощи колоночной хроматографии, либо ВЭЖХ. Синтез соединения формулы (XI), где Y представляет собой фенил, описан в патентной заявке WO 2006/072828. Синтез соединения формулы (XI), где Y представляет собой 2-хинолинил, описан в J. Med.Chem. 2009, 52 (16), 5188-5196. Промежуточные соединения формулы (VI) могут быть получены способами синтеза, хорошо известными специалистам в данной области, например, с использованием последовательности реакций,показанной на схеме 10. Схема 10 Следовательно, соединение формулы (II) может быть подвергнуто взаимодействию с коммерчески доступным агентом алкилирования формулы (XII), где Z представляет собой подходящую удаляемую группу, такую как галоген, при этом наиболее предпочтительным является бром, в присутствии подходящего основания, такого как карбонат цезия или карбонат калия, в инертном растворителе, таком как,например, диметилформамид, при перемешивании реакционной смеси при подходящей температуре,обычно при 100 С, с использованием обычного нагревания или в условиях микроволнового облучения, в течение времени, необходимого для достижения полного завершения реакции, обычно 10 мин в микроволновой печи. Реакция алкилирования обычно дает смесь двух возможных региоизомеров, образованных в результате алкилирования по обоим атомам азота пиразольного кольца, которые можно разделить хроматографическими методами, либо при помощи колоночной хроматографии, либо ВЭЖХ. Альтернативно, соединения формулы (VI-а), где n равен 1, также можно получить с использованием последовательности реакций, показанной на схеме 11. Схема 11 Таким образом, сложноэфирная группа соединения формулы (XIII) может быть восстановлена до спирта способами синтеза, хорошо известными специалистам в данной области, такими как, например,взаимодействие с боргидридом натрия или цианоборгидридом натрия, в подходящем инертном растворителе или смеси растворителей, такой как, например, дихлорметан и метанол, при перемешивании реакционной смеси при подходящей температуре, обычно при комнатной температуре, в течение времени,необходимого для достижения полного завершения реакции, обычно 2 ч, с получением соединения формулы (VI-а), где n равен 1. Промежуточные соединения формулы (XIII) могут быть получены способами синтеза, хорошо известными специалистам в данной области, например, с использованием последовательности реакций,показанной на схеме 12. Схема 12 Таким образом, соединение формулы (II) может быть подвергнуто взаимодействию с коммерчески доступным метил- или этилбромацетатом в присутствии подходящего основания, такого как карбонат цезия или карбонат калия, в инертном растворителе, таком как, например, диметилформамид, при перемешивании реакционной смеси при подходящей температуре, обычно при комнатной температуре, в течение времени, необходимого для достижения полного завершения реакции, обычно 3-6 ч, с получением соединения формулы (XIII). Реакция алкилирования обычно дает смесь двух возможных региоизомеров,образованных в результате алкилирования по обоим атомам азота пиразольного кольца, которые можно разделить хроматографическими методами, либо при помощи колоночной хроматографии, либо ВЭЖХ. Альтернативно, промежуточное соединение формулы (XIII) также можно получить через последовательность реакций, как показано на схеме 13. Схема 13 Следовательно, соединение формулы (IV-a) может быть подвергнуто взаимодействию с соединением формулы (V) с использованием традиционных условий Мицунобу, которые хорошо известны специалистам в данной области. Таким образом, соединение (IV-a) может быть подвергнуто взаимодействию с соединением (V) в присутствии диэтил-, ди-трет-бутил- или диизопропилазодикарбоксилата и трифенилфосфина, в инертном растворителе, таком как, например, тетрагидрофуран, при перемешивании реакционной смеси при подходящей температуре, обычно при 120 С, в условиях микроволнового облучения, в течение подходящего периода времени, позволяющего полностью завершить реакцию, обычно 1520 мин. Соединение формулы (IV-а) можно синтезировать, следуя последовательности реакций гидрогенолиза, которая показана выше на схеме 8, исходя из соединения формулы (Х-а), где R1 представляет собой -СН 2-СО-OAlk, которое можно синтезировать согласно последовательности реакций, показанной выше на схеме 9. Активность соединений формулы (I) определяли путем измерения ингибирования крысиногоPDE10A2-CAMP, и значение pIC50 находилось в пределах от 6,60 до 8,79. Селективность по сравнению с другими PDE также измеряли, и во всех случаях она была выше в 50 раз, и для многих соединений в 100 раз. Применения Соединения согласно настоящему изобретению находят различное применение для получения изображения тканей, клеток или организма как in vitro, так и in vivo. Таким образом, например, их можно использовать для получения карты дифференциального распределения PDE10 у субъектов разного возраста и пола. Кроме того, они обеспечивают возможность исследования дифференциального распределения PDE10 у субъектов, страдающих различными заболеваниями или расстройствами. Таким образом,аномальное распределение может способствовать постановке диагноза, выявлению случаев заболевания,стратификации популяций субъектов и контролю прогрессирования заболевания у отдельных субъектов. Радиолиганды также могут найти применение в определении занятия сайта PDE10A другими лигандами. Поскольку радиолиганды вводят в следовых количествах, это не дает какого-либо терапевтического эффекта. Экспериментальная часть.I. Химия. Здесь и далее термин "ЖХМС" означает жидкостную хроматографию/масс-спектрометрию,"ГХМС" означает газовую хроматографию/масс-спектрометрию, "ВЭЖХ" означает высокоэффективную жидкостную хроматографию, "DCM" означает дихлорметан, "ДМФА" означает диметилформамид,"EtOAc" означает этилацетат, "ТГФ" означает тетрагидрофуран, "мин" означает минуты, "ч" означает часы, "Rt означает время удерживания (в минутах), "[М+Н]+" означает протонированную массу свободного основания соединения, "[М-Н]-" означает депротонированную массу свободного основания соединения, "т.пл." означает температуру плавления. Реакции в условиях микроволнового облучения осуществляли в одномодовом реакторе: микроволновой реактор Biotage Initiator Sixty (Biotage) или в мультимодовом реакторе: MicroSYNTH Labstation(Milestone, Inc.). Реакции гидрогенизации осуществляли в проточном гидрогенизаторе H-CUBE от ThalesNanoNanotechnology Inc. Тонкослойную хроматографию (ТСХ) осуществляли на пластинах с силикагелем 60 F254 (Merck) с использованием растворителей, имеющих чистоту реактивов. Колоночную флэш-хроматографию осуществляли на силикагеле, размер частиц 230-400 меш и размер пор 60 (Merck) с использованием стандартных методик. Автоматизированную колоночную флэш-хроматографию осуществляли с использованием готовых для подсоединения картриджей от компании Merck, на нестандартном силикагеле, размер частиц 15-40 мкм (доступные флэш-колонки с нормальной фазой) на SPOT или FLASH системе от компании Некоторые способы получения соединений по настоящему изобретению проиллюстрированы в следующих ниже примерах, которые предназначены для иллюстрации, а не для ограничения объема настоящего изобретения. Если не указано иное, все исходные вещества получали от коммерческих поставщиков и использовали без дополнительной очистки. А. Синтез промежуточных соединений и предшественников. Промежуточное соединение 1. Метиловый эфир 4-(6-метилпиридин-2-илметокси)бензойной кислоты (I-1) Смесь 6-метил-2-пиридинметанола (7,0 г, 56,84 ммоль), метил-4-гидроксибензоата (8,65 г, 56,84 ммоль), диизопропилазодикарбоксилата (14,65 мл, 73,9 ммоль) и трифенилфосфина (19,38 г, 73,9 ммоль) в ТГФ (42 мл) нагревали в микроволновой печи при 120 С в течение 20 мин (реакционную смесь разделяли на 7 партий). Затем смесь гасили водой, экстрагировали DCM, растворитель выпаривали досуха в вакууме и неочищенный остаток очищали колоночной хроматографией (силикагель; гептан/EtOAc от 80/20 до 50/50). Желаемые фракции собирали и упаривали в вакууме с получением желаемого промежуточного соединения I-1 в виде оранжевого масла, имеющего около 50% чистоты, при этом основная примесь представляла собой трифенилфосфиноксид. Смесь использовали в реакции на следующей стадии без дополнительной очистки (25 г, 85,5%). C15H15NO3. Промежуточное соединение 2. 4-(6-Метилпиридин-2-илметокси)бензойная кислота (I-2) К раствору промежуточного соединения I-1 в 150 мл смеси метанол/ТГФ (2:1) добавляли 2 М водный раствор гидроксида натрия (49 мл, 97,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем при 60 С в течение 2 ч. После выпаривания органического растворителя водную фазу промывали EtOAc и затем подкисляли разбавленной HCl до рН 5-6. Промежуточное соединение 1-2, которое осаждалось, отфильтровывали, сушили и использовали для следующей реакционной стадии без дополнительной очистки (9,0 г, 76,2%). C14H13NO3. Промежуточное соединение 3. N-Метокси-N-метил-4-(6-метилпиридин-2-илметокси)бензамид (I-3) Смесь промежуточного соединения I-2 (9,0 г, 37,0 ммоль) и тионилхлорида (50 мл) перемешивали при комнатной температуре в течение 3 ч. Смесь затем концентрировали досуха и неочищенный хлорангидрид кислоты растворяли в ТГФ (100 мл). Затем медленно добавляли триэтиламин (20,5 мл, 148 ммоль) и гидрохлорид О,N-диметилгидроксиламина (10,8 г, 111 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. После гашения водой смесь экстрагировали EtOAc,сушили над сульфатом натрия, фильтровали и упаривали в вакууме. Остаток очищали колоночной хроматографией (силикагель; гептан/EtOAc от 40/60 до 0/100) с получением промежуточного соединения I-3 в виде оранжевого масла, которое использовали для следующей реакции без дополнительной очистки (6,2 г, 46,8%). C16H18N2O3. Промежуточное соединение 4. 2-Пиридин-4-ил-1-[4-(6-метилпиридин-2-илметокси)фенил]этанон К раствору диизопропиламида лития (2 М раствор в ТГФ, 43,3 мл, 86,6 ммоль) в ТГФ (35 мл) добавляли по каплям 4-метилпиридин (8,43 мл, 86,6 ммоль) при 0 С в атмосфере азота. Через 30 мин смесь охлаждали до -78 С и 35 мл полученного раствора добавляли по каплям к другому раствору промежуточного соединения I-3 (6,2 г, 17,32 ммоль) в ТГФ (65 мл), также охлажденному до -78 С. Смесь перемешивали при этой температуре в течение 2 ч и затем добавляли по каплям еще 20 мл изначально полученного раствора. Полученный раствор перемешивали при -78 С еще в течение 1 ч. Затем реакционную смесь гасили водой и экстрагировали DCM. Органический слой сушили над сульфатом натрия, фильтровали и упаривали в вакууме. Полученный неочищенный остаток промывали и растирали с диэтиловым эфиром с получением промежуточного соединения I-4 (4,7 г, 85,2%) в виде бледно-желтого твердого вещества. C20H18N2O2. Раствор промежуточного соединения I-4 (4,7 г, 14,76 ммоль) в диметоксиметилдиметиламине (15 мл) перемешивали при температуре кипения с обратным холодильником в течение 1 ч. После выпаривания растворителя неочищенный остаток растворяли в метаноле (50 мл) и добавляли гидразингидрат (1,08 мл, 22,24 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 1 ч, затем растворитель выпаривали с получением твердого остатка, который промывали и растирали со смесью диэтиловый эфир/EtOAc с получением промежуточного соединения I-5 (3,4 г, 67,3%) в виде бледно-желтого твердого вещества. C21H18N4O. ЖХМС: Rt 2,48, m/z 343 [М+Н]+ (способ 7). Промежуточное соединение 6. 4-[3-(4-Бензилоксифенил)-1-(2-фторэтил)-1 Н-пиразол-4-ил]пиридин Смесь 4-[3-(4-бензилоксифенил)-1 Н-пиразол-4-ил]пиридина (6,7 г, 20,47 ммоль), который синтезировали, следуя способу, описанному в патентной заявке WO 2006/072828, 1-бром-2-фторэтана (3,22 г,24,56 ммоль) и карбоната цезия (20 г, 61,4 ммоль) в ДМФА (42 мл) нагревали в микроволновой печи при 150 С в течение 5 мин (реакционную смесь разделяли на 6 партий). После охлаждения до комнатной температуры твердое вещество отделяли путем фильтрования, раствор гасили водой и затем экстрагировали EtOAc. Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали в вакууме. Неочищенный остаток очищали колоночной хроматографией(силикагель; ацетонитрил/диизопропиловый эфир от 30/70 до 80/20 и затем снова EtOAc/гептан 70/30). Желаемые фракции собирали и упаривали досуха, с получением желаемого промежуточного соединения I-6 (4 г, 52,3%) в виде масла. C23H20FN3O. ЖХМС: Rt 4,22, m/z 374 [М+Н]+ (способ 1). Соответствующий региоизомер 1-6'. 4-[5-(4-Бензилоксифенил)-1-(2-фторэтил)-1 Н-пиразол-4 ил]пиридин также выделяли в результате хроматографической очистки (2 г, 26,2%). C23H20FN3O. Промежуточное соединение 7. 4-[1-(2-Фторэтил)-4-пиридин-4-ил-1 Н-пиразол-3-ил]фенол (I-7) Промежуточное соединение 1-6 (4 г, 10,71 ммоль) растворяли в этаноле (200 мл) и подвергали гидрогенизации в системе Н-CUBE с использованием Pd/C 5% в качестве катализатора (полное заполнение водородом, 2,5 мл/мин) при 80 С и атмосферном давлении. Растворитель выпаривали досуха в вакууме с получением промежуточного соединения I-7 (2,5 г, 82,4%), которое использовали для следующей реакции без дополнительной очистки. C16H14FN3O. ЖХМС: Rt 1,57, m/z 284 [М+Н]+ (способ 8). Промежуточное соединение 8. 4-[1-(3-Фторпропил)-4-пиридин-4-ил-1 Н-пиразол-3-ил]фенол (I-8) Следовали методике получения промежуточного соединения I-7, но заменяя 4-[3-(4 бензилоксифенил)-1-(2-фторэтил)-1 Н-пиразол-4-ил]пиридин 4-[3-(4-бензилоксифенил)-1-(2-фторпропил)-1 Н-пиразол-4-ил]пиридином с получением промежуточного соединения I-8 (90%). C17H16FN3O. ЖХМС: Rt 1,81, m/z 298 [М+Н]+ (способ 7). Промежуточное соединение 9. 4-[3-(4-Бензилоксифенил)-1-(2,2,2-трифторэтил)-1 Н-пиразол-4 ил]пиридин (I-9)(0,733 мл, 7,33 ммоль) и карбоната цезия (5,97 г, 18,3 ммоль) в ДМФА (12 мл) нагревали в микроволновой печи при 120 С в течение 20 мин. После охлаждения до комнатной температуры смесь гасили водой и затем экстрагировали EtOAc. Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; ацетонитрил/диизопропиловый эфир от 50/50 до 80/20). Желаемые фракции собирали и упаривали досуха с получением желаемого промежуточного соединения I-9, имеющего около 80% чистоты (1,2 г, 38,4%) в виде масла. C23H18F3N3O. ЖХМС: Rt 4,86, m/z 410 [М+Н]+ (способ 2). Соответствующий региоизомер 1-9'. 4-[5-(4-Бензилоксифенил)-1-(2,2,2-трифторэтил)-1 Н-пиразол-4 ил]пиридин также выделяли в результате хроматографической очистки (0,4 г, 14,6%). C23H18F3N3O. Промежуточное соединение 10. 4-[4-Пиридин-4-ил-1-(2,2,2-трифторэтил)-1 Н-пиразол-3-ил]фенол Промежуточное соединение 1-9 растворяли в этаноле (50 мл) и подвергали гидрогенизации в системе H-CUBE с использованием Pd/C 5% в качестве катализатора (полное заполнение водородом, 1,5 мл/мин) при 80 С и атмосферном давлении. Растворитель выпаривали досуха в вакууме с получением промежуточного соединения I-10 (0,55 г, 75,4%) в виде белого твердого вещества, которое использовали для следующей реакции без дополнительной очистки. C16H12F3N3O. ЖХМС: Rt 1,82, m/z 320 [М+Н]+ К перемешиваемому раствору промежуточного соединения 1-5 (0,30 г, 0,876 ммоль) в ДМФА (6 мл) добавляли метилбромацетат (0,20 мл, 1,051 ммоль) и карбонат цезия (0,86 г, 2,63 ммоль). Смесь перемешивали при комнатной температуре в течение 6 ч. Затем смесь гасили водой и экстрагировали EtOAc. Органические растворители отделяли, сушили над сульфатом натрия и упаривали досуха в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; EtOAc/метанол от 100/0 до 90/10). Желаемые фракции собирали и упаривали в вакууме с получением смеси двух региоизомеров 111 и 1-11', которую использовали как таковую для следующей реакции без дополнительной очистки (0,21 г, 49,2%). C24H22N4O3. Промежуточное соединение 12. 2-3-[4-(6-Метилпиридин-2-илметокси)фенил]-4-пиридин-4 илпиразол-1-илэтанол (I-12) К перемешиваемому раствору смеси промежуточных соединений I-11 и I-11' (0,21 г, 0,507 ммоль) в смеси DCM (4 мл) и метанола (1 мл) добавляли боргидрид натрия (0,096 г, 2,536 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь затем гасили водой, экстрагировали дополнительным количеством DCM, органический растворитель сушили над сульфатом натрия и упаривали досуха. Неочищенный остаток очищали колоночной хроматографией (силикагель;EtOAc/метанол от 100/0 до 90/10). Желаемые фракции собирали и упаривали в вакууме с получением промежуточного соединения I-12 (0,22 г, 61,2%). C23H22N4O2. ЖХМС: Rt 3,48, m/z 387 [М+Н]+ (способ 3). Соответствующий региоизомер I-12'. 2-5-[4-(6-Метилпиридин-2-илметокси)фенил]-4-пиридин-4 илпиразол-1-илэтанол также выделяли в результате хроматографического разделения (0,045 г, 23%). К перемешиваемому раствору 2-[4-(4-пиридин-4-ил-2 Н-пиразол-3-ил)феноксиметил]хинолина (0,5 г, 1,33 ммоль), который синтезировали, следуя способу, описанному в J. Med. Chem. 2009, 52 (16), 51885196, в ДМФА (10 мл) добавляли метилбромацетат (0,25 мл, 1,60 ммоль) и карбонат цезия (1,30 г, 3,99 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч. Затем смесь гасили водой и экстрагировали EtOAc. Органические растворители отделяли, сушили над сульфатом натрия и упаривали досуха в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель;EtOAc/метанол от 100/0 до 95/5). Желаемые фракции собирали и упаривали в вакууме с получением смеси двух региоизомеров I-13 и I-13', которую использовали для следующей реакции без дополнительной очистки (0,47 г, 47%). C27H22N4O3. Промежуточное соединение 14. Метиловый эфир [3-(4-гидроксифенил)-4-пиридин-4-илпиразол-1 ил]уксусной кислоты (1-14) и метиловый эфир [5-(4-гидроксифенил)-4-пиридин-4-илпиразол-1 ил]уксусной кислоты (I-14') Смесь промежуточного соединения I-13 и I-13' (0,47 г, 1,043 ммоль) растворяли в этаноле (20 мл) и подвергали гидрогенизации в системе H-CUBE с использованием Pd/C 5% в качестве катализатора(полное заполнение водородом, 1,5 мл/мин) при 70 С и атмосферном давлении. Растворитель выпаривали досуха в вакууме с получением желтого масла, которое отверждали путем обработки DCM. Твердое вещество промывали дополнительным количеством DCM с получением смеси двух промежуточных соединений I-14 и I-14', которую использовали для следующей реакции без дополнительной очистки (0,235 г, 73%). C17H15N3O3. ЖХМС: Rt 0,95 (основной региоизомер), Rt 1,00 (второстепенный региоизомер), m/z 310 [М+Н]+ (способ 8). Промежуточное соединение 15. Метиловый эфир 3-[4-(3,5-диметилпиридин-2-илметокси)фенил]4-пиридин-4-илпиразол-1-илуксусной кислоты (I-15) и метиловый эфир 5-[4-(3,5-диметилпиридин-2 илметокси)фенил]-4-пиридин-4-илпиразол-1-илуксусной кислоты (I-15') Смесь двух региоизомеров I-14 и I-14' (0,235 г, 0,760 ммоль), 3,5-диметил-2 гидроксиметилпиридина (0,256 г, 1,24 ммоль), диизопропилазодикарбоксилата (0,2 62 г, 1,24 ммоль) и трифенилфосфина (0,299 г, 1,24 ммоль) в ТГФ (6 мл) нагревали в микроволновой печи при 120 С в течение 20 мин. Затем смесь гасили насыщенным водным раствором карбоната натрия, экстрагировалиEtOAc, сушили над сульфатом натрия и растворитель выпаривали досуха в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; EtOAc/метанол от 100/0 до 95/5). Желаемые фракции собирали и растворитель выпаривали в вакууме с получением смеси двух промежуточных соединений I-15 и I-15', которую использовали для следующей реакции без дополнительной очистки (0,28 г, 55%). C25H24N4O3. К перемешиваемому раствору смеси промежуточных соединений I-15 и I-15' (0,28 г, 0,420 ммоль) в смеси DCM (4 мл) и метанола (1 мл) добавляли боргидрид натрия (0,079 г, 2,20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь затем гасили водой, экстрагировали дополнительным количеством DCM, органический растворитель сушили над сульфатом натрия и упаривали досуха. Неочищенный остаток очищали колоночной хроматографией (силикагель;EtOAc/метанол от 100/0 до 90/10). Желаемые фракции собирали и упаривали в вакууме с получением промежуточного соединения I-16 (0,22 г, 61,2%). Другой региоизомер не выделяли при хроматографическом разделении. C24H24N4O2. ЖХМС: Rt 2,53, m/z 401 [М+Н]+ (способ 6). Промежуточное соединение 17. Метиловый эфир 3-[4-(5-метоксипиридин-2-илметокси)фенил]-4 пиридин-4-илпиразол-1-илуксусной кислоты (I-17) и метиловый эфир 5-[4-(5-метоксипиридин-2 илметокси)фенил]-4-пиридин-4-илпиразол-1-илуксусной кислоты (I-17') Смесь двух региоизомеров I-14 и I-14' (0,27 г, 0,550 ммоль), (5-метоксипиридин-2-ил)метанола(0,215 г, 0,825 ммоль), описанного в Bioorg. Med. Chem. 2005, 13, 6763-6770, диизопропилазодикарбоксилата (0,290 г, 0,825 ммоль) и трифенилфосфина (0,216 г, 0,825 ммоль) в ТГФ (4 мл) нагревали в микроволновой печи при 120 С в течение 20 мин. Затем растворитель выпаривали досуха в вакууме и неочищенный остаток очищали колоночной хроматографией (силикагель; EtOAc/метанол от 100/0 до 95/5). Желаемые фракции собирали и растворитель выпаривали в вакууме с получением смеси двух промежуточных соединений I-17 и I-17', которую использовали для следующей реакции без дополнительной очистки (0,28 г, 76%). C24H22N4O4. Промежуточное соединение 18. 2-3-[4-(5-Метоксипиридин-2-илметокси)фенил]-4-пиридин-4 илпиразол-1-илэтанол (I-18) К перемешиваемому раствору смеси промежуточных соединений I-17 и I-17' (0,28 г, 0,418 ммоль) в смеси DCM (4 мл) и метанола (1 мл) добавляли боргидрид натрия (0,079 г, 2,09 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь затем гасили водой, экстрагировали дополнительным количеством DCM, органический растворитель сушили над сульфатом натрия и выпаривали досуха в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель;EtOAc/метанол от 100/0 до 90/10). Желаемые фракции собирали и упаривали в вакууме с получением промежуточного соединения I-18 (0,09 г, 53,5%). Другой региоизомер не выделяли при хроматографическом разделении. C23H22N4O3. ЖХМС: Rt 2,87, m/z 403 [М+Н]+ (способ 2). Промежуточное соединение 19. 2-3-[4-(3,5-Диметилпиридин-2-илметокси)фенил]-4-пиридин-4 илпиразол-1-илэтиловый эфир метансульфоновой кислоты (I-19) К раствору промежуточного соединения I-16 (5 мг, 0,012 ммоль) в DCM (1 мл) добавляли пиридин(11 мкл) и полученный раствор перемешивали при 0 С. Затем добавляли метансульфоновый ангидрид(16,5 мг, 0,095 ммоль) и перемешивание продолжали в течение 4 ч при 0 С, затем растворитель выпаривали путем продувки азотом. Неочищенную смесь снова растворяли в метаноле (0,5 мл), разбавляли водой (4,5 мл) и пропускали через C18 SepPak картридж (Waters, Milford, MA, USA), предварительно обработанный метанолом (3 мл) и milliQ водой (6 мл). Картридж затем промывали три раза дополнительным объемом воды (2 мл) для удаления непрореагировавшего метансульфонового ангидрида насколько это возможно. Продукт элюировали из картриджа с использованием ацетонитрила (3 мл) и растворители выпаривали при пониженном давлении. Перед выпариванием растворителей проводили ВЭЖХ анализ для определения конверсии гидроксильного предшественника I-16 в его О-мезильное производное I-19. Этот ВЭЖХ анализ осуществляли на аналитической колонке XTerra RP C18 (Waters), которую элюировали с использованием градиентных смесей воды и ацетонитрила (0 мин: 95:5 об./об., 25 мин: 10:90 об./об., 30 мин: 10:90 об./об., линейный градиент) при скорости потока 1 мл/мин. Анализ показал, что средняя степень конверсии составляла 98% (n=9). Остаточную воду удаляли азеотропной перегонкой с ацетонитрилом и смесь сушили в течение ночи в вакуумной печи. В день экспериментов с введением радиоактивной метки, обычно осуществляемых на следующий день, полученный продукт реакции растворяли в безводном растворе ДМФА (1,5 мл) и использовали (0,3 мл) для прямого нуклеофильного радиофторирования. C25H26N4O4S. Промежуточное соединение I-20. 2-3-[4-(5-Метоксипиридин-2-илметокси)фенил]-4-пиридин-4 илпиразол-1-илэтиловый эфир метансульфоновой кислоты (I-20) К раствору промежуточного соединения I-18 (5 мг, 0,012 ммоль) в DCM (1 мл) добавляли пиридин(11 мкл) и полученный раствор перемешивали при 0 С. Затем добавляли метансульфоновый ангидрид(16,5 мг, 0,095 ммоль) и перемешивание продолжали в течение 4 ч при 0 С, затем растворитель выпаривали путем продувки азотом. Неочищенную смесь снова растворяли в метаноле (0,5 мл), разбавляли водой (4,5 мл) и пропускали через C18 SepPak картридж (Waters, Milford, MA, USA), предварительно обработанный метанолом (3 мл) и milliQ водой (6 мл). Картридж затем промывали три раза дополнительным объемом воды (2 мл) для удаления непрореагировавшего метансульфонового ангидрида насколько это возможно. Продукт элюировали из картриджа с использованием ацетонитрила (3 мл) и растворители выпаривали при пониженном давлении. Перед выпариванием растворителей проводили ВЭЖХ анализ для определения конверсии гидроксильного предшественника I-18 в его О-мезильное производное I-20. Анализ ВЭЖХ осуществляли на аналитической колонке XTerra RP C18 (Waters), элюирование осуществляли с использованием градиентных смесей воды и ацетонитрила (0 мин: 95:5 об./об., 25 мин: 10:90 об./об., 30 мин: 10:90 об./об., линейный градиент) при скорости потока 1 мл/мин. Анализ показал, что средняя степень конверсии составляла 98% (n=9). Остаточную воду удаляли азеотропной перегонкой с ацетонитрилом и смесь сушили в течение ночи в вакуумной печи. В день экспериментов с введением радиоактивной метки, обычно осуществляемых на следующий день, полученный продукт реакции растворяли в безводном ДМФА (1,5 мл) и использовали (0,3 мл) для прямого нуклеофильного радиофторирования. C24H24N4O5S. В. Получение конечных соединений. Пример В 1. 2-4-[1-(2-Фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-6 метилпиридиндигидрохлорид (В-1). Смесь промежуточного соединения 1-5 (0,30 г, 0,876 ммоль), 1-бром-2-фторэтана (0,083 мл, 1,051 ммоль) и карбоната цезия (0,86 г, 2,63 ммоль) в ДМФА (5 мл) нагревали в микроволновой печи при 150 С в течение 10 мин. Затем реакционную смесь гасили водой и экстрагировали EtOAc. Органический слой сушили над сульфатом натрия и растворитель выпаривали досуха в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; EtOAc/метанол от 100/0 до 90/10) с получением смеси двух изомеров. Полученную смесь снова подвергали очистке методом колоночной хроматографии(силикагель; ацетонитрил/метанол от 100/0 до 95/5). Желаемые фракции собирали и упаривали в вакууме с получением желаемого соединения В-1 в виде масла (0,25 г, 44,2%). Обработка полученного маслянистого соединения раствором хлористого водорода в изопропиловом спирте с последующей кристаллизацией из смеси диэтиловый эфир/DCM давали соединение В-1 в форме соли хлористо-водородной кислоты в виде желтого твердого вещества. C23H21FN4O2HCl. ЖХМС: Rt 3,82, m/z 389 [М+Н]+ (способ 3). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 2,66 (с, 3 Н), 4,56 (дт, J=28,0, 4,6 Гц, 2 Н), 4,88 (дт, J=47,2, 4,6 Гц,2 Н), 5,37 (с, 2 Н), 7,15 (д, J=8,8 Гц, 2 Н), 7,44 (д, J=8,6 Гц, 2 Н), 7,57 (д, J=7,2 Гц, 1 Н), 7,67 (д, J=7,2 Гц, 1 Н),7,80 (д, J=6,9 Гц, 2 Н), 8,13 (т, J=7,1 Гц, 1 Н), 8,71 (с, 1 Н), 8,74 (д, J=6,9 Гц, 2 Н). Соответствующий региоизомер 2-4-[2-(2-фторэтил)-4-пиридин-4-ил-2 Н-пиразол-3 ил]феноксиметил-6-метилпиридин (В-1') также выделяли в результате хроматографического разделения с 70% чистотой (0,25 г, 30,8%) в виде масла. C23H21FN4O. Радиосинтез. Получение [18F]фторэтилбромида и [18F]B-1.[18F] фторид ([18F]F) получали взаимодействием [18O(п, н) 18F] путем облучения 1,95 мл 97% обогащенного [18 О]Н 2 О (Rotem HYOX18, Rotem Industries, Beer Sheva, Israel) в ниобиевой мишени с использованием 18 MeV протонов из циклотрона Cyclone 18/9 (Ion Beam Applications, Louvain-la-Neuve, Belgium). После облучения в течение около 60 мин полученный [18F]F- отделяли от [18 О]Н 2 О с использованием анионообменного картриджа SepPak Light Accell plus QMA (Waters), который был предварительно обработан последовательно 0,5 М раствором K2CO3 (10 мл) и водой (210 мл). [18F]F- затем элюировали из картриджа в конический реакционный сосуд (1 мл) с использованием раствора, содержащего карбонат калия (2,47 мг) и Kryptofix 222 (27,92 мг), растворенные в H2O/CH3CN (0,75 мл; 5:95 об./об.). Растворители выпаривали при 110 С с использованием обычного нагревания в течение 2 мин. После выпаривания растворителя [18F]F- дополнительно сушили азеотропной перегонкой следовых количеств воды с использованием ацетонитрила (1 мл) при температуре 110 С до полного удаления влаги. Раствор 2-бромэтилтрифлата (5 мкл, IsoSciences, Pennsylvania, USA) в о-дихлорбензоле (0,7 мл) добавляли в сосуд, содержащий [18F]F-. Полученный [18F]FEtBr затем подвергали дистилляции при 120 С с использованием потока гелия (3-4 мл/мин) и барботировали во второй реакционный сосуд, содержащий предшественник 1-5 (0,2 мг) и небольшое количество (1-3 мг) Cs2CO3 в безводном ДМФА (0,2 мл). После перегонки достаточного количества радиоактивности в раствор предшественника реакционный сосуд закрывали и нагревали при 90 С в течение 15 мин. После взаимодействия неочищенную смесь разбавляли 1,6 мл воды и вводили в систему ВЭЖХ, состоящую из полупрепаративной колонки XBridge (C18, 5 мкм, 4,6150 мм; Waters), и для элюирования использовали смесь 0,05 М натрийацетатого буфера рН 5,5 и EtOH (70:30 об./об.) при скорости потока 1 мл/мин. УФ-детекцию ВЭЖХ элюата осуществляли при 254 нм. Радиоактивно меченный продукт [F]B-1 собирали примерно через 37 мин (нежелательный изомер элюировался примерно через 45 мин). В среднем 50 мКи (n=2) очищенного [18F]B-1 собирали в объеме 1,5-2 мл (подвижная фаза). Собранный пик, соответствующий [18F]B-1, затем разбавляли изотоническим раствором (Mini Plasco, Braun, Melsungen, Germany) для снижения концентрации этанола до 5% и подвергали стерильному фильтрованию через 0,22-мкм мембранный фильтр (Millex-GV, Millipore, Ireland). Чистоту радиоактивного индикатора анализировали с использованием системы аналитической ВЭЖХ, состоящей из колонки XBridge (C18, 3,5 мкм, 3100 мм; Waters) при элюировании смесью 0,05 М натрийацетатного буфера рН 5,5 и ацетонитрила (70:30 об./об.) при скорости потока 0,8 мл/минут(Rt=7,5 мин). [18F]B-1 синтезировали с радиохимическим выходом 57% (относительно [18F]FEtBr- исходной радиоактивности, n=2). Радиохимическая чистота, которую проверяли с использованием описанной выше системы аналитической ВЭЖХ, составляла 99%. Пример В 2. Гидрохлорид 2-4-[1-(3-фторпропил)-4-(4-пиридинил)-1 Н-пиразол-3 ил]фенокси]метил]-6-метилпиридина (В-2). Смесь промежуточного соединения I-5 (0,30 г, 0,876 ммоль), 3-фторпропан-1-ола (0,203 г, 1,314 ммоль), диизопропилазодикарбоксилата (0,261 мл, 1,314 ммоль) и трифенилфосфина (0,345 г, 1,314 ммоль) в ТГФ (3 мл) нагревали в микроволновой печи при 120 С в течение 20 мин. Затем растворитель выпаривали досуха в вакууме и неочищенный остаток очищали колоночной хроматографией (силикагель; ацетонитрил/метанол от 100/0 до 95/5). Желаемые фракции собирали и упаривали в вакууме с получением желаемого соединения В-2 в виде бесцветного масла, которое преобразовывали в соответствующую соль хлористо-водородной кислоты (0,075 г, 19,5%) (точная стехиометрия неизвестна) в виде белого твердого вещества. C24H23FN4OHCl. ЖХМС: Rt 4,09, m/z 403 [М+Н]+ (способ 3). 1 Н ЯМР (500 МГц, ДМСО-d6)м.д. 2,20-2,34 (м, 2 Н), 2,62 (с, 3 Н), 4,33 (т, J=6,9 Гц, 2 Н), 4,54 (ддд,J=47,3, 5,6, 5,5 Гц, 2 Н), 5,32 (с, 2 Н), 7,14 (д, J=8,7 Гц, 2 Н), 7,43 (д, J=8,7 Гц, 2 Н), 7,50 (д, J=6,6 Гц, 1 Н),7,60 (д, J=6,4 Гц, 1 Н), 7,78 (д, J=6,6 Гц, 2 Н), 8,05 (ушир.с, 1 Н), 8,69 (с, 1 Н), 8,73 (д, J=6A Гц, 2 Н). Соответствующий региоизомер 2-4-[2-(3-фторпропил)-4-пиридин-4-ил-2 Н-пиразол-3 ил]феноксиметил-6-метилпиридина (В-2') также выделяли в результате хроматографического разделения и преобразовывали в его соответствующую соль хлористо-водородной кислоты (0,07 г, 18,2%) в виде белого порошка. C24H23FN4O. Пример В 3. 2-4-[1-(2-Фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-3,5 диметилпиридинсукцинат (В-3). Смесь промежуточного соединения(0,20 г,0,706 ммоль),3,5-диметил-2 гидроксиметилпиридина (0,226 г, 0,918 ммоль), диизопропилазодикарбоксилата (0,211 г, 0,918 ммоль) и трифенилфосфина (0,241 г, 0,918 ммоль) в ТГФ (4 мл) нагревали в микроволновой печи при 120 С в течение 15 мин. Затем смесь гасили насыщенным водным раствором карбоната натрия и экстрагировалиDCM. Органический растворитель сушили над сульфатом натрия и выпаривали досуха в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; EtOAc/метанол от 100/0 до 95/5). Желаемые фракции собирали и растворитель выпаривали в вакууме с получением соединения В-3 в виде бесцветного масла. Остаток растворяли в метаноле (2 мл) и медленно добавляли раствор янтарной кислоты (0,073 г, 0,619 ммоль) в метаноле (2 мл). Растворитель выпаривали досуха и твердый остаток промывали несколько раз диэтиловым эфиром с получением конечного соединения В-3 в форме соли янтарной кислоты (0,295 г, 80,3%) в виде белого твердого вещества. C24H23FN4OC4H6O4. ЖХМС: Rt 3,08, m/z 403 [М+Н]+ (способ 7). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 2,28 (с, 3 Н), 2,35 (с, 3 Н), 2,42 (с, 4 Н), 4,49 (дт, J=27,7, 4,7 Гц,2 Н), 4,85 (дт, J=47,2, 4,6 Гц, 2 Н), 5,16 (с, 2 Н), 7,05 (д, J=8,8 Гц, 2 Н), 7,23 (д, J=6,0 Гц, 2 Н), 7,32 (д, J=8,8[18F]фторид ([18F]F-) получали таким же способом, как описано выше для радиосинтеза [18F]FEtBr, с некоторой модификацией, которая состояла в том, что элюирование [18F]F осуществляли из картриджа с использованием раствора 0,45 мл Kryptofix 222/раствор K2CO3 и 0,3 мл ацетонитрила. Используемый для радиоактивного мечения предшественник I-19 (0, 6 мг в 0,3 мл ДМФА) добавляли к высушенному [18F] F/K2CO3/Kryptofix 222 комплексу и осуществляли реакцию нуклеофильного замещения путем обычного нагревания при 90 С в течение 15 мин. После завершения реакции неочищенную смесь разбавляли 1,4 мл воды и вводили в систему ВЭЖХ, состоящую из полупрепаративной колонки XBridge (C18, 5 мкм, 4,6150 мм; Waters), с использованием для элюирования смеси 0,05 М натрийацетатного буфера рН 5,5 и EtOH (65:35 об./об.) при скорости потока 1 мл/мин. УФ-детекцию ВЭЖХ элюата осуществляли при 254 нм. Радиомеченный продукт [18F]B-3 собирали примерно через 26 мин. В среднем 100 мКи (n=7, минимум 60 мКи, максимум 180 мКи) очищенного [18F]B-3 собирали в объеме 1,5-2 мл (подвижная фаза). Собранный пик, соответствующий [F]B-3, затем разбавляли изотоническим раствором (Mini Plasco, Braun, Melsungen, Germany) для снижения концентрации этанола до 5% и подвергали стерильному фильтрованию через 0,22-мкм мембранный фильтр (Millex-GV, Millipore, Ireland). Чистоту радиорадиоактивного индикатора анализировали с использованием системы аналитической ВЭЖХ, состоящей из колонки XBridge (C18, 3,5 мкм, 3100 мм; Waters) при элюировании смесью 0,05 М натрийацетатного буфера рН 5,5 и ацетонитрила (65:35 об./об.) при скорости потока 0,8 мл/мин (Rt=5,6 мин). УФ-детекцию ВЭЖХ элюата осуществляли при 254 нм. [18F]B-3 синтезировали с радиохимическим выходом 16% (относительно исходной радиоактивности [18F]F-, n=7). Радиохимическая чистота, которую проверяли с использованием описанной выше системы аналитической ВЭЖХ,составляла 98%. Средняя удельная радиоактивность радиоактивного индикатора, которую проверяли с использованием описанной выше системы аналитической ВЭЖХ, была определена как 176 GBq/мкмоль(4764 Ки/ммоль, n=7) в конце синтеза (EOS). Пример В 4. 2-4-[1-(2-Фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-5 метоксипиридин (В-4). Смесь промежуточного соединения I-7 (0,23 г, 0,344 ммоль), (5-метоксипиридин-2-ил)метанола(0,072 г, 0,516 ммоль), полученного, как описано в Bioorg. Med. Chem. 2005, 13, 6763-6770, диизопропилазодикарбоксилата (0,20 мл, 0,516 ммоль) и трифенилфосфина (0,235 г, 0,516 ммоль) в ТГФ (4 мл) нагревали в микроволновой печи при 120 С в течение 20 мин. Затем смесь гасили насыщенным водным раствором карбоната натрия, экстрагировали EtOAc, сушили над сульфатом натрия и упаривали досуха в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; EtOAc/метанол от 100/0 до 95/5). Желаемые фракции собирали и растворитель выпаривали в вакууме с получением соединения В-4 (0,22 г, 86,2%) в виде белого твердого вещества. C23H21FN4O2. ЖХМС: Rt 2,7, m/z 405 [М+Н]+[18F] фторид ([18F]F-) получали точно таким способом, как описано выше для радиосинтеза соедине 18 ния [ F]B-3. Используемый для радиоактивного мечения предшественник I-20 (0,6 мг в 0,3 мл ДМФА) добавляли к высушенному [18F]F-/K2CO3/Kryptofix 222 комплексу и осуществляли реакцию нуклеофильного замещения путем обычного нагревания при 90 С в течение 10 мин. После завершения реакции неочищенную смесь разбавляли 1,4 мл воды и вводили в систему ВЭЖХ, состоящую из полупрепаративной колонки XBridge (C18, 5 мкм, 4,6150 мм; Waters) с использованием для элюирования смеси 0,05 М натрийацетатного буфера рН 5,5 и EtOH (70:30 об./об.) при скорости потока 1 мл/мин. УФ-детекцию ВЭЖХ элюата осуществляли при 254 нм. Радиомеченный продукт [18F]B-4 собирали примерно через 35 мин. Как правило, собирали около 90 мКи очищенного [18F]B-4 в объеме 1,5-2 мл (подвижная фаза). Собранный пик, соответствующий [18F]B-4, затем разбавляли изотоническим раствором (Mini Plasco,Braun, Melsungen, Germany) для снижения концентрации этанола до 5% и подвергали стерильному фильтрованию через 0,22-мкм мембранный фильтр (Millex-GV, Millipore, Ireland). Чистоту радиорадиоактивного индикатора анализировали с использованием системы аналитической ВЭЖХ, состоящей из колонки XBridge (C18, 3,5 мкм, 3100 мм; Waters) при элюировании смесью 0,05 М натрийацетатного буфера рН 5,5 и ацетонитрила (70:30 об./об.) при скорости потока 0,8 мл/мин (Rt=7,2 мин). УФдетекцию ВЭЖХ элюата осуществляли при 254 нм. [18F]B-4 синтезировали с радиохимическим выходом 15% (относительно исходной радиоактивности [18F]F-, n=2). Радиохимическая чистота, которую проверяли с использованием описанной выше системы аналитической ВЭЖХ, составляла 99%. Средняя удельная радиоактивность радиоактивного индикатора, которую проверяли с использованием описанной выше системы аналитической ВЭЖХ, была определена как 141 GBq/мкмоль (3800 Ки/ммоль, n=2) на EOS. Пример В 5. 5-Метокси-2-4-[4-(4-пиридинил)-1-(2,2,2-трифторэтил)-7 Н-пиразол-3 ил]фенокси]метил]пиридин (В-5). Смесь промежуточного соединения 1-10 (0,25 г, 0,47 ммоль), (5-метоксипиридин-2-ил)метанола(0,098 г, 0,70 ммоль), диизопропилазодикарбоксилата (0,24 мл, 0,70 ммоль) и трифенилфосфина (0,285 г,0,70 ммоль) в ТГФ (3 мл) нагревали в микроволновой печи при 120 С в течение 20 мин. Затем смесь гасили насыщенным водным раствором карбоната натрия и экстрагировали EtOAc. Органический растворитель сушили над сульфатом натрия и выпаривали досуха в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; EtOAc/метанол от 100/0 до 95/5). Желаемые фракции собирали и растворитель выпаривали в вакууме с получением соединения В-5 (0,21 г, 53,2%) в виде бесцветного масла, которое отверждалось при стоянии, с получением белого твердого вещества. C23H19F3N4O2. ЖХМС: Rt 4,27, m/z 441 [М+Н]+ (способ 2). 1 Н ЯМР (400 МГц, CDCl3)м.д. 3,87 (с, 3 Н), 4,77 (кв, J=8,3 Гц, 2 Н), 5,17 (с, 2 Н), 6,97 (д, J=9,0 Гц,2 Н), 7,19 (д, J=6,2 Гц, 2 Н), 7,23 (дд, J=8,6, 3,0 Гц, 1 Н), 7,38 (д, J=8,8 Гц, 2 Н), 7,44 (д, J=8,6 Гц, 1 Н), 7,71 (с,1 Н), 8,30 (д, J=2,8 Гц, 1 Н), 8,51 (д, J=6,0 Гц, 2 Н). Пример В 6. 2-Бром-6-4-[1-(2-фторэтил)-4-(4-пиридинил)-7 Н-пиразол-3-ил]фенокси]метил]пиридин 0,75 сукцинат (В-6). Смесь промежуточного соединения I-7 (0,30 г, 1,06 ммоль), (6-бромпиридин-2-ил)метанола (0,30 г,1,59 ммоль), диизопропилазодикарбоксилата (0,315 мл, 1,59 ммоль) и трифенилфосфина (0,417 г, 1,59 ммоль) в ТГФ (5 мл) нагревали в микроволновой печи при 100 С в течение 30 мин. Затем смесь гасили насыщенным водным раствором карбоната натрия и экстрагировали DCM. Органический растворитель сушили над сульфатом натрия и выпаривали досуха в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; сначала EtOAc/гептан 70/30, затем диэтиловый эфир/DCM 70/30). Желаемые фракции собирали и растворитель выпаривали в вакууме с получением соединения В-6 (0,30 г,53,2%) в виде бесцветного масла. Некоторое количество соединения В-6 (0,08 г) преобразовывали в соответствующую соль янтарной кислоты, аналогично описанному выше для конечного соединения В-3, с получением конечного соединения В-6 в виде белого твердого вещества. C22H18BrFN4O0,75 С 4 Н 6 О 4. ЖХМС: Rt 3,22, m/z 453 [М+Н]+ (способ 7). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 2,42 (с, 3 Н), 4,50 (дт, J=27,7, 4,6 Гц, 2 Н), 4,85 (дт, J=47,2, 4,7 Гц,2 Н), 5,20 (с, 2 Н), 7,06 (д, J=8,8 Гц, 2 Н), 7,22 (д, J=6,0 Гц, 2 Н), 7,35 (д, J=8,8 Гц, 2H), 7,59 (д, J=7,4 Гц, 1 Н),7,63 (д, J=7,9 Гц, 1 Н), 7,82 (т, J=7,7 Гц, 1 Н), 8,24 (с, 1 Н), 8,46 (д, J=6,0 Гц, 2 Н), 12,16 (ушир.с, 1,5 Н). Пример В 7. 2-4-[1-(2-Фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-6(трифторметил)пиридин (В-7). Соединение В-6 (0,45 г, 0,725 ммоль) растворяли в ДМФА (3 мл) и затем к раствору добавляли метиловый эфир (фторсульфонил)дифторуксусной кислоты (0,464 мл, 3,62 ммоль) и иодид меди (0,69 г,3,62 ммоль). Реакционную смесь нагревали при 120 С в герметично закрытой пробирке в течение 2 ч. Реакционную смесь гасили водным раствором 1 М гидроксида натрия и экстрагировали DCM. Органический растворитель сушили над сульфатом натрия и упаривали досуха в вакууме. Остаток очищали колоночной хроматографией (силикагель; EtOAc/гептан от 70/30 до 100/0). Желаемые фракции собирали и растворитель выпаривали в вакууме с получением желаемого соединения в виде желтого масла, которое содержало трифенилфосфиноксид в виде основной примеси. Неочищенное соединение подвергали дополнительной очистке препаративной ВЭЖХ (С 18 XBridge 30100; водный раствор карбоната аммония рН 9/ацетонитрил, градиент от 80/20 до 0/100) с получением В-7 в виде бесцветного масла. Полученное соединение отверждали путем добавления смеси диэтиловый эфир/гептан и, наконец, перекристаллизовывали из диизопропилового эфира с получением конечного соединения В-7 (0,023 г, 7,2%) в виде белого твердого вещества. C23H18F4N4O. ЖХМС: Rt 3,73, m/z 443 [М+Н]+ (способ 4). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 4,50 (дт, J=27,8, 4,7 Гц, 2 Н), 4,85 (дт, J=47,2, 4,6 Гц, 2 Н), 5,31 (с,2 Н), 7,09 (д, J=8,8 Гц, 2 Н), 7,22 (д, J=6,0 Гц, 2 Н), 7,35 (д, J=8,8 Гц, 2 Н), 7,89 (д, J=7,9 Гц, 1 Н), 7,89 (д,J=7,6 Гц, 1 Н), 8,18 (т, J=7,9 Гц, 1 Н), 8,24 (с, 1 Н), 8,46 (д, J=6,0 Гц, 2 Н). Пример В 8. 2-Циклопропил-6-4-[1-(2-фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3 ил]фенокси]метил]пиридинсукцинат (В-8). Смесь соединения В-6 (0,24 г, 0,263 ммоль), циклопропилбороновой кислоты (0,029 г, 0,341 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,015 г, 0,013 ммоль) в смеси водный раствор карбоната натрия/диоксан 1:1 (5 мл) нагревали в микроволновой печи при 130 С в течение 15 мин. После охлаждения до комнатной температуры неочищенную смесь разбавляли водой и экстрагировали DCM. Органический растворитель сушили над сульфатом натрия и выпаривали досуха в вакууме. Остаток очищали колоночной хроматографией (силикагель; EtOAc), желаемые фракции собирали и растворитель выпаривали в вакууме с получением желаемого соединения в виде бесцветного масла, которое содержало трифенилфосфиноксид в виде основной примеси. Полученное соединение подвергали дополнительной очистке препаративной ВЭЖХ (С 18 XBridge 19100; водный раствор карбоната аммония рН 9/ацетонитрил, градиентот 80/20 до 0/100), с получением В-8 в виде бесцветного масла. Остаток растворяли в метаноле (2 мл) и медленно добавляли раствор янтарной кислоты (0,017 г, 0,244 ммоль) в метаноле (1 мл). Раствори- 18019673 тель выпаривали досуха и остаток обрабатывали смесью DCM/диизопропиловый эфир, с получением соли янтарной кислоты конечного соединения В-8 (0,076 г, 54,4%) в виде белого твердого вещества.C25H23FN4OC4H6O4. ЖХМС: Rt 4,29, m/z 415 [М+Н]+ (способ 2). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 0,87-0,99 (м, 4 Н), 2,05-2,16 (м, 1 Н), 2,42 (с, 4 Н), 4,49 (дт, J=27,7,4,6 Гц, 2 Н), 4,85 (дт, J=47,2, 4,7 Гц, 2 Н), 5,10 (с, 2 Н), 7,04 (д, J=9,0 Гц, 2 Н), 7,20-7,24 (м, 3 Н), 7,26 (д, J=7,4 Гц, 1 Н), 7,33 (д, J=8,8 Гц, 2 Н), 7,68 (т, J=7,7 Гц, 1 Н), 8,24 (с, 1 Н), 8,45 (д, J=6,2 Гц, 2 Н), 12,17 (ушир.с,1 Н). Следующие соединения получали, следуя одному из способов синтеза, описанных выше. 3-Метокси-2-4-[4-(4-пиридинил)-1-(2,2,2-трифторэтил)-7 Н-пиразол-3-ил]фенокси]метил]пиридин(В-9). Следовали методике получения соединения В-5, но заменяли (5-метоксипиридин-2-ил)метанол (3 метоксипиридин-2-ил)метанолом, с получением конечного соединения В-9 (58%) в виде белого твердого вещества, которое затем кристаллизовали из диизопропилового эфира. C23H19F3N4O2. ЖХМС: Rt 3,01,m/z 441 [М+Н]+ (способ 7). 1 Н ЯМР (400 МГц, CDCl3)м.д. 3,89 (с, 3 Н), 4,77 (кв, J=8,3 Гц, 2 Н), 5,26 (с, 2 Н), 7,02-7,07 (м, 2 Н),7,17-7,21 (м, 2 Н), 7,23 (дд, J=8,3, 1,6 Гц, 1 Н), 7,27 (дд, J=8,3, 4,6 Гц, 1 Н), 7,34-7,41 (м, 2 Н), 7,70 (с, 1 Н),8,25 (дд, J=4A, 1,6 Гц, 1 Н), 8,49-8,53 (м, 2 Н). 3-(2-Фторэтокси)-2-4-[4-(4-пиридинил)-1-(2,2,2-трифторэтил)-7 Н-пиразол-3-ил]фенокси]метил]пиридинсукцинат (В-10). Следовали методике получения соединения В-5, но заменяли (5-метоксипиридин-2-ил)метанол [3(2-фторэтокси)пиридин-2-ил]метанолом, с получением конечного соединения В-10, которое преобразовывали в соответствующую соль янтарной кислоты, аналогично тому, как описано выше для конечного соединения В-3, которое кристаллизовали из диэтилового эфира, с получением соли янтарной кислоты конечного соединения В-10 (33,8%) в виде белого твердого вещества. C24H20F4N4O2C4H6O4. ЖХМС: Rt 2,96, m/z 473 [М+Н]+ (способ 7). 1(В-11). Следовали методике получения соединения В-5, но заменяли (5-метоксипиридин-2-ил)метанол [5(2-фторэтокси)пиридин-2-ил]метанолом, с получением конечного соединения В-11 (20,3%) в виде белого твердого вещества после кристаллизации из смеси диизопропиловый эфир/гептан. C24H20F4N4O2. ЖХМС:Rt 3,9, m/z 473 [М+Н]+ (способ 5). 1 Н ЯМР (400 МГц, CDCl3)м.д. 4,22-4,34 (м, 2 Н), 4,70-4,87 (м, 2 Н), 4,77 (кв, J=8,3 Гц, 2 Н), 5,18 (с,2 Н), 6,94-7,00 (м, 2 Н), 7,17-7,21 (м, 2 Н), 7,27 (дд, J=8,6, 2,8 Гц, 1 Н), 7,35-7,41 (м, 2 Н), 7,46 (д, J=8,6 Гц,1 Н), 7,71 (с, 1 Н), 8,33 (д, J=2,8 Гц, 1 Н), 8,49-8,54 (м, 2 Н). 2-4-[1-(3-Фторпропил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-3-метоксипиридин (В 12). Следовали методике получения соединения В-5, но заменяли (5-метоксипиридин-2-ил)метанол (3 метоксипиридин-2-ил)метанолом и промежуточное соединение I-10 - промежуточным соединением I-8, с получением конечного соединения В-12 (40%) в виде белого твердого вещества. C24H23FN4O2. ЖХМС: Rt 3,78, m/z 419 [М+Н]+ (способ 2). 1H ЯМР (500 МГц, CDCl3)м.д. 2,34 (квин., J=26,9, 6,0, 6,0, 6,0, 6,0 Гц, 2 Н), 3,89 (с, 3 Н), 4,33 (т,J=6,8 Гц, 2 Н), 4,51 (дт, J=47,1, 5,5 Гц, 2 Н), 5,25 (с, 2 Н), 7,01-7,06 (м, 2 Н), 7,16-7,20 (м, 2 Н), 7,23 (дд, J=8,4,1,2 Гц, 1 Н), 7,27 (дд, J=8,4, 4,7 Гц, 1 Н), 7,34-7,41 (м, 2 Н), 7,63 (с, 1 Н), 8,25 (дд, J=4,5, 1,6 Гц, 1 Н), 8,458,50 (м, 2 Н). 3-(2-Фторэтокси)-2-4-[1-(3-фторпропил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]пиридинсукцинат (В-13). Следовали методике получения соединения В-5, но заменяли (5-метоксипиридин-2-ил)метанол [3(2-фторэтокси)пиридин-2-ил]метанолом и промежуточное соединение I-10 - промежуточным соединением I-8, с получением конечного соединения В-13, которое преобразовывали в соответствующую соль янтарной кислоты, аналогично тому, как описано выше для конечного соединения В-3, которую кристаллизовали из смеси диэтиловый эфир/диизопропиловый эфир, с получением соли янтарной кислоты конечного соединения В-13 (39,2%) в виде белого твердого вещества. C25H24F2N4O2C4H6O2. ЖХМС: Rt 2,75, m/z 451 [М+Н]+ (способ 7). 1 Н ЯМР (500 МГц, ДМСО-d6)м.д. 2,25 (квин., J=26,3, 6,4, 6,4, 6,4, 6,4 Гц, 2 Н), 2,42 (с, 4 Н), 4,27 (т,J=6,9 Гц, 2 Н), 4,37 (дт, J=29,8, 3,8 Гц, 2 Н), 4,53 (дт, J=47,4, 5,7 Гц, 2 Н), 4,75 (дт, J=47,7, 3,5 Гц, 2 Н), 5,18 2 Н). 2-4-[1-(3-Фторпропил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-5-метоксипиридин 0,5 сукцинат (В-14). Следовали методике получения соединения В-5, но заменяли (5-метоксипиридин-2-ил)метанол для(5-метоксипиридин-2-ил)метанолом и промежуточное соединение I-10 - промежуточным соединением I8, с получением конечного соединения В-14 в виде бесцветного масла, которое преобразовывали в соответствующую соль янтарной кислоты, аналогично тому, как описано выше для конечного соединения В 3, которую кристаллизовали из диэтилового эфира, с получением соли янтарной кислоты конечного соединения В-14 (25,6%) в виде белого твердого вещества. C24H23FN4O20,5C4H6O4. ЖХМС: Rt 3,97, m/z 419(ушир.д, J=8,8 Гц, 2 Н), 7,43 (дд, J=8,3, 3,0 Гц, 1 Н), 7,50 (д, J=8,6 Гц, 1 Н), 8,23 (с, 1 Н), 8,29 (д, J=2,8 Гц,1 Н), 8,40-8,48 (м, 2 Н), 12,18 (ушир.с, 1 Н). 5-(2-Фторэтокси)-2-4-[1-(3-фторпропил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]пиридин (В-15). Следовали методике получения соединения В-5, но заменяли (5-метоксипиридин-2-ил)метанол [5(2-фторэтокси)пиридин-2-ил]метанолом и промежуточное соединение I-10 промежуточным соединениемI-8, с получением соединения В-15 в виде бесцветного масла, которое отверждалось при стоянии. В завершение обработки соединение промывали диизопропиловым эфиром, с получением конечного соединения В-15 (35,8%) в виде белого твердого вещества. C25H24F2N4O2C4H6O4. ЖХМС: Rt 3,69, m/z 451(ушир.д, J=6,1 Гц, 2 Н), 7,27 (дд, J=8,7, 2,9 Гц, 1 Н), 7,35-7,41 (м, 2 Н), 7,46 (д, J=8,7 Гц, 1 Н), 7,64 (с, 1 Н),8,33 (ушир.д, J=2,9 Гц, 1 Н), 8,48 (ушир.д, J=6,1 Гц, 2 Н). 2-4-[1-(2-Фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-3-метоксипиридинсукцинат (В-16). Следовали методике получения соединения В-4, но заменяли (5-метоксипиридин-2-ил)метанол (3 метоксипиридин-2-ил)метанолом, с получением соединения В-16, которое преобразовывали в соответствующую соль янтарной кислоты, аналогично тому, как описано выше для конечного соединения В-3,которую кристаллизовали из диэтилового эфира, с получением соли янтарной кислоты конечного соединения В-16 (32,5%) в виде белого твердого вещества. C23H21FN4O2C4H6O4. ЖХМС: Rt 3,52, m/z 405(м, 2 Н), 12,16 (ушир.с, 2 Н). 3-(2-Фторэтокси)-2-4-[1-(2-фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]пиридинсукцинат (В-17). Следовали методике получения соединения В-4, но заменяли (5-метоксипиридин-2-ил)метанол [3(2-фторэтокси)пиридин-2-ил]метанолом, с получением соединения В-17, которое преобразовывали в соответствующую соль янтарной кислоты, аналогично тому, как описано выше для конечного соединения В-3, которую кристаллизовали из диэтилового эфира, с получением соли янтарной кислоты конечного соединения В-17 (78,3%) в виде белого твердого вещества. C24H22F2N4O2C4H6O4. ЖХМС: Rt 2,52, m/z 437(ушир.д, J=9,0 Гц, 2 Н), 7,40 (дд, J=8,4, 4,6 Гц, 1 Н), 7,56 (д, J=8,1 Гц, 1 Н), 8,19 (д, J=4,6 Гц, 1 Н), 8,23 (с,1 Н), 8,44-8,48(м, 2 Н), 12,16 (ушир.с, 2 Н). 3-Фтор-2-4-[1-(2-фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]пиридин 1,2 сукцинат (В-18). Следовали методике получения соединения В-6, но заменяли (6-бромпиридин-2-ил)метанол (3 фторпиридин-2-ил)метанолом, с получением соединения В-18, которое преобразовывали в соответствующую соль янтарной кислоты, аналогично тому, как описано выше для конечного соединения В-3,которую кристаллизовали из диэтилового эфира, с получением соли янтарной кислоты конечного соединения В-18 (23,9%) в виде белого твердого вещества. C22H18F2N4O1,2 С 4 Н 6 О 4. ЖХМС: Rt 2,63, m/z 393(В-19). Следовали методике получения соединения В-4, но заменяли (5-метоксипиридин-2-ил)метанол [5(2-фторэтокси)пиридин-2-ил]метанолом, с получением соединения В-19 (56,3%) в виде белого твердого вещества после обработки диизопропиловым эфиром. C24H22F2N4O2. ЖХМС: Rt 3,48, m/z 437 [М+Н]+(способ 5). 1 Н ЯМР (400 МГц, CDCl3)м.д. 4,22-4,34 (м, 2 Н), 4,47 (дт, J=27,1, 4,9 Гц, 2 Н), 4,70-4,87 (м, 2 Н),4,84 (дт, J=46,9, 4,6 Гц, 2 Н), 5,18 (с, 2 Н), 6,97 (ушир.д, J=8,8 Гц, 2 Н), 7,16-7,21 (м, 2 Н), 7,27 (дд, J=8,6, 2,8 Гц, 1 Н), 7,36-7,42 (м, 2 Н), 7,46 (д, J=8,6 Гц, 1 Н), 7,70 (с, 1 Н), 8,33 (д, J=2,8 Гц, 1 Н), 8,45-8,52 (м, 2 Н). 5-Бром-2-4-[1-(2-фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]пиридин (В-20). Следовали методике получения соединения В-6, но заменяли (6-бромпиридин-2-ил)метанол (5 бромпиридин-2-ил)метанолом, с получением соединения В-20 (15,6%) в виде белого твердого вещества после обработки диэтиловым эфиром. C22H18BrFN4O. ЖХМС: Rt 3,29, m/z 453 [М+Н]+ (способ 7). 1 Н ЯМР (400 МГц, CDCl3)м.д. 4,47 (дт, J=27,0, 4,6 Гц, 2 Н), 4,84 (дт, J=46,9, 4,9 Гц, 2 Н), 5,18 (с,2 Н), 6,93-6,98 (м, 2 Н), 7,17-7,20 (м, 2 Н), 7,38-7,42 (м, 2 Н), 7,45 (дд, J=8,3, 0,7 Гц, 1 Н), 7,70 (д, J=0,5 Гц,1 Н), 7,85 (дд, J=8,3, 2,3 Гц, 1 Н), 8,47-8,51 (м, 2 Н), 8,66 (дд, J=2,3, 0,5 Гц, 1 Н). 6-4-[1-(2-Фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-3-пиридинкарбонитрил (В 21). Следовали методике получения соединения В-6, но заменяли (6-бромпиридин-2-ил)метанол 6(гидроксиметил)никотинонитрилом, с получением соединения В-21 (39,4%) в виде белого твердого вещества. C23H18FN5O. ЖХМС: Rt 3,2 1, m/z 400 [М+Н]+ (способ 4). 1 Н ЯМР (500 МГц, CDCl3)м.д. 4,48 (дт, J=27,2, 4,6 Гц, 2 Н), 4,85 (дт, J=46,8, 4,6 Гц, 2 Н), 5,28 (с,2 Н), 6,96 (ушир.д, J=9,0 Гц, 2 Н), 7,16-7,21 (м, 2 Н), 7,39-7,45 (м, 2 Н), 7,72 (д, J=8,4 Гц, 1 Н), 7,71 (с, 1 Н),8,00 (дд, J=8,1, 2,0 Гц, 1 Н), 8,49 (ушир.д, J=6,1 Гц, 2 Н), 8,87 (д, J=1,4 Гц, 1 Н). 2-4-[1-(2-Фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-5-(трифторметил)пиридин(В-22). Следовали методике получения соединения В-6, но заменяли (6-бромпиридин-2-ил)метанол (5 трифторметилпиридин-2-ил)метанолом, с получением соединения В-22 (29,4%) в виде белого твердого вещества. C23H18F4N4O. ЖХМС: Rt 3,37, m/z 443 [М+Н]+ (способ 7). 1 Н ЯМР (400 МГц, CDCl3)м.д. 4,48 (дт, J=27,0, 4,6 Гц, 2 Н), 4,84 (дт, J=46,9, 4,6 Гц, 2 Н), 5,29 (с,2 Н), 6,95-7,00 (м, 2 Н), 7,16-7,21 (м, 2 Н), 7,39-7,45 (м, 2 Н), 7,70 (д, J=6,5 Гц, 1 Н), 7,70 (с, 1 Н), 7,97 (дд,J=8,2, 2,0 Гц, 1 Н), 8,46-8,53 (м, 2 Н), 8,86 (ушир.с, 1 Н). 5-Циклопропил-2-4-[1-(2-фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]пиридин(В-23). Следовали методике получения соединения В-4, но заменяли (5-метоксипиридин-2-ил)метанол (5 циклопропилпиридин-2-ил)метанолом, с получением соединения В-23 в виде бесцветного масла, которое отверждалось при стоянии. В завершение обработки соединение промывали диизопропиловым эфиром с получением конечного соединения В-23 (45,6%) в виде белого твердого вещества. C25H23FN4O. ЖХМС:Rt 3,24, m/z 415 [М+Н]+ (способ 7). 1 Н ЯМР (500 МГц, CDCl3)м.д. 0,67-0,78 (м, 2 Н), 0,96-1,10 (м, 2 Н), 1,87-1,95 (м, 1 Н), 4,47 (дт,J=26,9, 4,8 Гц, 2 Н), 4,84 (дт, J=47,1, 4,7 Гц, 2 Н), 5,19 (с, 2 Н), 6,94-6,99 (м, 2 Н), 7,16-7,21 (м, 2 Н), 7,32 (дд,J=8,1, 2,3 Гц, 1 Н), 7,36-7,41 (м, 3 Н), 7,70 (с, 1 Н), 8,40 (д, J=2,0 Гц, 1 Н), 8,48 (ушир.д, J=6,1 Гц, 2 Н). 2-4-[1-(2-Фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-6-метоксипиридинсукцинат (В-24). Следовали методике получения соединения В-4, но заменяли (5-метоксипиридин-2-ил)метанол (6 метоксипиридин-2-ил)метанолом, с получением соединения В-24, которое преобразовывали в соответствующую соль янтарной кислоты аналогично тому, как описано выше для конечного соединения В-3, которую кристаллизовали из диэтилового эфира, с получением соли янтарной кислоты конечного соединения В-24 (25,8%) в виде белого твердого вещества. C23H21FN4O2C4H6O4. ЖХМС: Rt 4,26, m/z 405 [М+Н]+(м, 2 Н), 7,31-7,36 (м, 2 Н), 7,74 (дд, J=8,2, 7,4 Гц, 1 Н), 8,24 (с, 1 Н), 8,42-8,49 (м, 2 Н), 12,17 (ушир.с, 2 Н). 2-Этокси-6-4-[1-(2-фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]пиридинсукцинат (В-25). Следовали методике получения соединения В-4, но заменяли (5-метоксипиридин-2-ил)метанол (6 этоксипиридин-2-ил)метанолом, с получением соединения В-25, которое преобразовывали в соответствующую соль янтарной кислоты, аналогично тому, как описано выше для конечного соединения В-3,которую кристаллизовали из диэтилового эфира, с получением соли янтарной кислоты конечного соединения В-25 (39,6%) в виде белого твердого вещества. C24H23FN4O2C4H6O4. ЖХМС: Rt 3,56, m/z 419(дт, J=27,7, 4,6 Гц, 2 Н), 4,85 (дт, J=47,4, 4,9 Гц, 2 Н), 5,10 (с, 2 Н), 6,74 (д, J=8,3 Гц, 1 Н), 7,03-7,08 (м, 2 Н),7,10 (д, J=7,2 Гц, 1 Н), 7,20-7,25 (м, 2 Н), 7,29-7,37 (м, 2 Н), 7,73 (дд, J=8,2, 7,3 Гц, 1 Н), 8,24 (с, 1 Н), 8,438,48 (м, 2 Н), 12,19 (ушир.с, 2 Н). 6-4-[1-(2-Фторэтил)-4-(4-пиридинил)-1 Н-пиразол-3-ил]фенокси]метил]-2-пиридинкарбонитрил (В 26). Следовали методике получения соединения В-6, но заменяли (6-бромпиридин-2-ил)метанол 6 гидроксиметил-2-цианопиридином, с получением соединения В-26 (40,8%) в виде белого твердого вещества после обработки диэтиловым эфиром. C23H18FN5O. ЖХМС: Rt 2,68, m/z 400 [М+Н]+ (способ 7). 1(В-27). Следовали методике получения соединения В-6, но заменяли (6-бромпиридин-2-ил)метанол 3-6 ром 2-(гидроксиметил)-6-метоксипиридином, с получением конечного соединения В-27 (54,2%) в виде белого твердого вещества. C23H20BrFN4O2. ЖХМС: Rt 4,58, m/z 483 [М+Н]+ (способ 2). 1 Н ЯМР (400 МГц, CDCl3)м.д. 3,85 (с, 3 Н), 4,47 (дт, J=26,8, 4,6 Гц, 2 Н), 4,84 (дт, J=46,9, 4,6 Гц,2 Н), 5,22 (с, 2 Н), 6,61 (д, J=8,6 Гц, 1 Н), 6,98-7,03 (м, 2 Н), 7,17-7,21 (м, 2 Н), 7,36-7,41 (м, 2 Н), 7,68-7,72 (м,2 Н), 8,46-8,51 (м, 2 Н). 2-4-[1-(2-фторэтил)-4-(4-пиридинил)-7 Н-пиразол-3-ил]фенокси]метил]-3,4,5 триметилпиридинсукцинат (В-28). Следовали методике получения соединения В-3, но заменяли 3,5-диметил-2-гидроксиметилпиридин(3,4,5-триметилпиридин-2-ил)метанолом, с получением конечного соединения В-28 (56,8%) в форме соли янтарной кислоты в виде белого твердого вещества. C25H25FN4OC4H6O4. ЖХМС: Rt 3,53, m/z 417In vitro анализ. Рекомбинантный PDE10A крысы (rPDE10A) экспрессировали в Sf9 клетках с использованием рекомбинантной rPDE10A бакуловирусной конструкции. Клетки собирали через 48 ч после инфицирования и rPDE10A белок очищали хроматографией с использованием метало-хелатного соединения на Niсефарозе 6FF. Тестируемые соединения растворяли и разбавляли в 100% ДМСО до 100-кратной концентрации относительно конечной концентрации в анализе. Разведения соединений (0,4 мкл) добавляли в 384-луночные планшеты к 20 мкл инкубационного буфера (50 мМ Tris pH 7,8, 8,3 мМ MgCl2, 1,7 мМEGTA). Добавляли 10 мкл rPDE10A фермента в инкубационном буфере и реакцию начинали путем добавления 10 мкл субстрата до конечной концентрации 60 нМ сАМР и 0,008 мкКи 3 Н-сАМР. Реакционную смесь инкубировали в течение 60 мин при комнатной температуре. После инкубации реакцию останавливали с использованием 20 мкл 17,8 мг/мл PDE SPA шариков. После осаждения шариков в течение 30 мин измеряли радиоактивность в сцинтилляционном счетчике Perkin Elmer Topcount и результаты выражали как число импульсов в 1 мин. Для получения значений слепого эксперимента фермент не использовали в реакции и заменяли инкубационным буфером. Контрольные значения получали путем добавления конечной концентрации 1% ДМСО вместо соединения. Наиболее соответствующую кривую подгоняли с использованием метода суммы минимальных квадратов к графику, представляющему процент контрольного значения минус слепой контроль против концентрации соединения, и pIC50 значение получали из этой кривой. С. Аналитическая часть. Температуры плавления. Значения представляют собой максимальные значения, и их получали с экспериментальными неточностями, которые обычно связывают с этим аналитическим методом. Для ряда соединений, где указано "DSC" в представленной выше таблице, температуры плавления определяли при помощи DSC823e (Mettler-Toledo). Температуры плавления измеряли с температурным градиентом 30 С/1 мин. Максимальная температура составляла 400 С. Для ряда соединений температуру плавления определяли в открытых капиллярных пробирках на устройстве Mettler FP62. Температуру плавления измеряли с температурным градиентом 10 С/мин. Максимальная температура составляла 300 С. Температуры плавления считывали с цифрового дисплея. Ядерный магнитный резонанс (ЯМР). 1 Н ЯМР спектры регистрировали либо на спектрометре Bruker DPX-400, либо Bruker AV-500 со стандартными последовательностями импульсов, работающих при 400 и 500 МГц соответственно. Хи- 23019673 мические сдвигиуказывали в миллионных долях (м.д.) ниже от тетраметилсилана (TMS), который использовали в качестве внутреннего стандарта. ЖХМС-методы. Для ЖХМС-характеризации соединений по настоящему изобретению использовали следующие способы. Общая методика для HP 1100-MS оборудования (TOF или SOD). ВЭЖХ измерение осуществляли с использованием HP 1100 (Agilent Technologies) системы, включающей насос (квадратурный или бинарный) с дегазатором, автоматическим пробоотборником, колоночным нагревателем, детектором на диодной матрице (DAD) и колонкой, указанной в соответствующих способах. MS детектор был оснащен либо источником ионизации электрораспылением, либо ESCI источником двойной ионизации (электрораспыление в сочетании с химической ионизацией атмосферного давления). Азот использовали в качестве распыляющего газа. Температуру источника поддерживали либо при 140 С, либо при 100 С. Сбор данных осуществляли либо с использованием программы MassLynxOpenlynx, либо программы Chemsation-Agilent Data Browser. Общая методика для Acquitv-SQD оборудования.Acquity UPLC (Waters) системы, включающей пробоотборник, бинарный насос с дегазатором, четырехколоночный нагреватель, детектор на диодной матрице (DAD) и колонку, указанную в соответствующих способах. MS детектор был оснащен ESCI источником двойной ионизации (электрораспыление в сочетании с химической ионизацией атмосферного давления). Азот использовали в качестве распыляющего газа. Температуру источника поддерживали при 140 С. Сбор данных осуществляли с использованием программы MassLynx-Openlynx. МС методика для ЖХ способов 1 и 2. Масс-спектры высокого разрешения (времяпролетный детектор TOF) получали только в режиме положительной ионизации или в режимах положительной/отрицательной ионизации путем сканирования от 100 до 750 ед.мас. (umas). Напряжение на игле капилляра было 2,5 кВ для режима положительной ионизации и 2,9 кВ для режима отрицательной ионизации. Напряжение на конусе было 20 В для обоих режимов положительной и отрицательной ионизации. Стандартное вещество лейцин-энкефалин использовали для точного определения массы. МС методика для ЖХ способов 3, 4, 5, 6, 7 и 8. Масс-спектры низкого разрешения (одинарный квадрупольный детектор SQD) получали только в режиме положительной ионизации или в режимах положительной/отрицательной ионизации путем сканирования от 100 до 1000 ед.мас. (umas). Напряжение на игле капилляра было 3 кВ. Для режима положительной ионизации напряжение на конусе составляло 20, 25 или 20/50 В. Для режима отрицательной ионизации напряжение на конусе составляло 30 В. Способ 1. В добавление к общей методике: ВЭЖХ с обращенной фазой осуществляли на картридже XDB-C18(1,8 мкм, 2,230 мм) от Agilent со скоростью потока 1 мл/мин при 60 С. Используемые условия градиента: 90% (0,5 г/л раствора ацетата аммония), 5% В (ацетонитрил), 5% С (метанол) до 50% В и 50% С, затем до 100% В, и уравновешивали до начальных условий к 9,0 мин эксперимента. Объем вводимой пробы - 2 мкл. Способ 2. В добавление к общей методике: ВЭЖХ с обращенной фазой осуществляли на колонке Sunfire-C18(2,5 мкм, 2,230 мм) от Waters со скоростью потока 1,0 мл/мин при 60 С. Используемые условия градиента: 95% (0,5 г/л раствора ацетата аммония+5% ацетонитрила), 5% В (ацетонитрил или ацетонитрил/метанол 1/1), до 100% В, и уравновешивали до начальных условий к 9 или 7 мин эксперимента. Объем вводимой пробы - 2 мкл. Способ 3. В добавление к общей методике: ВЭЖХ с обращенной фазой осуществляли на картридже XDB-C18(1,8 мкм, 2,230 мм) от Agilent со скоростью потока 0,8 мл/мин при 60 С. Используемые условия градиента: 90% (0,5 г/л раствора ацетата аммония), 10% В (смесь ацетонитрил/метанол, 1/1), до 100% В, и уравновешивали до начальных условий к 9,0 мин эксперимента. Объем вводимой пробы - 2 мкл. Способ 4. В добавление к общей методике: ВЭЖХ с обращенной фазой осуществляли на колонке Sunfire-C18(2,5 мкм, 2,230 мм) от Waters со скоростью потока 1,0 мл/мин при 60 С. Используемые условия градиента: 95% (0,5 г/л раствора ацетата аммония+5% ацетонитрила), 5% В (смесь ацетонитрил/метанол, 1/1),до 100% В, и уравновешивали до начальных условий к 7 мин эксперимента. Объем вводимой пробы - 2 мкл. Способ 5. В добавление к общей методике: ВЭЖХ с обращенной фазой осуществляли на колонке XBridgeC18 (2,5 мкм, 2,230 мм) от Waters со скоростью потока 1,0 мл/мин при 60 С. Используемые условия градиента: 95% (0,5 г/л раствора ацетата аммония+5% ацетонитрила), 5% В (смесь ацетонитрил/метанол,1/1), до 100% В, и уравновешивали до начальных условий к 9,0 мин эксперимента. Объем вводимой пробы - 2 мкл. Способ 6. В добавление к общей методике: ВЭЖХ с обращенной фазой осуществляли на колонке Eclipse PlusC18 (3,5 мкм, 2,230 мм) от Agilent со скоростью потока 1,0 мл/мин при 60 С. Используемые условия градиента: 95% (0,5 г/л раствора ацетата аммония+5% ацетонитрила), 5% В (ацетонитрил или смесь ацетонитрил/метанол, 1/1), до 100% В, и уравновешивали до начальных условий к 7 мин эксперимента. Объем вводимой пробы - 2 мкл. Способ 7. В добавление к общей методике: UPLC с обращенной фазой осуществляли на ВЕН-С 18 колонки(1,7 мкм, 2,250 мм) от Waters со скоростью потока 0,8 мл/мин при 60 С. Используемые условия градиента: 95% (0,5 г/л раствора ацетата аммония+5% ацетонитрила), 5% В (смесь ацетонитрил/метанол, 1/1),до 20% А, 8 0% В, затем до 100% В, и уравновешивали до начальных условий к 7 или 5 мин эксперимента. Объем вводимой пробы - 0,5 мкл. Способ 8. В добавление к общей методике: UPLC с обращенной фазой осуществляли на колонке ВЕН-С 18(1,7 мкм, 2,250 мм) от Waters со скоростью потока 1,0 мл/мин при 50 С. Используемые условия градиента: 95% (0,5 г/л раствора ацетата аммония+5% ацетонитрила), 5% В (ацетонитрил), до 40% А, 60% В,затем до 5% А, 95% В, и уравновешивали до начальных условий к 5 мин эксперимента. Объем вводимой пробы - 0,5 мкл.II. Исследования биораспределения. Общий способ. Исследования биораспределения осуществляли с использованием здоровых самцов крыс Wister(масса тела 200-500 г) через 2, 30 и 60 мин после инъекции (п.и.) (n=3/точка времени). Для [18F]B-4 исследовали только точки времени 2 и 30 мин. Крысам вводили путем инъекции около 30 мкКи радиоактивного индикатора через хвостовую вену под анестезией (2,5% изофлурана в О 2 при скорости потока 1 л/1 мин) и их умерщвляли путем декапитации в указанных выше точках времени. Кровь и основные органы собирали в тарированные пробирки и взвешивали. Радиоактивность в крови, органах и других частях тела измеряли с использованием автоматического гамма-счетчика. Распределение радиоактивности в различных частях тела в различных точках времени п.и. радиоактивного индикатора рассчитывали и выражали в виде процента от введенной путем инъекции дозы (% ID) и в виде процента от введенной путем инъекции дозы на 1 г ткани (% ID/г) для выбранных органов. % ID рассчитывали в виде имп./мин в органе/общее полученное количество имп./мин. Для расчета общей радиоактивности в крови массу крови принимали за 7% от массы тела. А. Результаты анализа биораспределения для соединения [18F]B-1. Результаты in vivo анализа распределения [18F]B-1 у самцов крыс Wistar представлены в табл. 1 и 2. В табл. 1 представлен % ID на момент времени 2, 30 и 60 мин п.и. радиорадиоактивного индикатора. В точке времени 2 мин п.и. около 4,0% от введенной дозы присутствовало в крови, и это количество уменьшалось до 2,2% к точке времени 60 мин после инъекции радиоактивного индикатора. Общее начальное накопление радиоактивного индикатора в головном мозге составляло 0,59%, при этом 0,09% в мозжечке, и 0,49% ID в остальных частях головного мозга. В точке времени 60 мин после введения радиорадиоактивного индикатора 54% ID присутствовало в печени и кишечнике. Из-за липофильного характера радиоактивного индикатора его выведение с мочой было минимальным и только 2,6% ID присутствовало в мочевой системе через 60 мин п.и. Наблюдали увеличивающееся накопление в желудке(3% ID, 10% ID, 17% ID в точке времени соответственно 2, 30 и 60 мин п.и.). Благодаря большой массе туловища животного значительное количество введенной дозы (28% ID) присутствовало в туловище животного во всех точках времени, в которых осуществляли исследования. Обычно масса туловища животного составляет до 90% от общей массы тела животного. В табл. 2 представлены значения % ID/г для различных органов в точках времени 2, 30 и 60 мин п.и. Данные выражали как среднее значение SD;n=3 на точку времени; а процент от введенной путем инъекции дозы рассчитывали как имп./мин в органе/общее полученное значение имп./мин. Данные выражали как среднее значение SD;% ID/г значения рассчитывали как % ID/масса органа, г. Поскольку почки и печень являются органами выведения, они имели самые высокие значения %ID/г, около 1,8% ID/г для почек и 3,4% ID/г для печени в точке времени 2 мин п.и. Значения % ID/г для различных отделов головного мозга, а именно полосатого тела, гиппокампа, коры головного мозга и мозжечка, представлены в табл. 2. Для введения поправки на разницу в массе тела между разными животными значение (%) ID/г ткани нормализовали в соответствии с массой тела. Нормализованные значения представлены в табл. 3. Для всех исследованных областей головного мозга наблюдали значительное уменьшение концентрации радиоактивности в период времени от 2 до 30 мин (0,07% ID/г, скорректированное на массу тела в точке времени 30 мин п.и.), что указывало на значительное вымывание радиоактивного индикатора из всех исследуемых областей головного мозга. Таблица 3 Концентрация [18F]B-1 в различных органах в точке времени 2, 30 и 60 мин п.и.,нормализованная в соответствии с массой тела животного Данные выражали как среднее значение SD;% ID/г значения рассчитывали как % ID/масса органа, г. ветствии с массой тела животного) для различных областей головного мозга. Для всех областей головного мозга отношения 2/30 мин составляли 2,49, указывая на то, что уже началось вымывание в течение этого периода времени. Самое медленное вымывание наблюдали для полосатого тела, представляющего собой область с самой высокой экспрессией PDE 10. Таблица 4 Выведение [18F]B-1 из различных областей головного мозга, рассчитанное как отношение 2/30 мин и 2/60 мин для % ID/г значений (нормализованных в соответствии с массой тела животного) В табл. 5 представлены отношения между полосатым телом и другими областями головного мозга,а также кровью в различных точках времени после инъекции [18F]B-1. Полосатое тело рассматривали какPDE 10 А-обогащенную область и мозжечок как сравнительную область. Поэтому высокое отношение полосатое тело-к-мозжечку желательно для получения хорошего качества изображения in vivo. Максимальное отношение полосатое тело-к-мозжечку составляло около 2, что является достаточно низким для хорошего агента визуализации PDE10. Результаты этих исследований биораспределения показывают, что отсутствует какое-либо существенное удерживание [18F]B-1 в PDE 10 А-обогащенной области, т.е. в полосатом теле. Таблица 5 Отношения полосатое тело-к-другим областям головного мозга (рассчитанное из % ID/г значений,нормализованных в соответствии с массой тела животного) в точке времени 2, 30 и 60 мин после инъекции [18F]B-1B Результаты in vivo исследования распределения [18F]B-3 у самцов крыс Wistar представлены в табл. 6 и 7. В табл. 6 представлены значения % ID в точке времени 2, 30 и 60 мин п.и. радиорадиоактивного индикатора. Общее начальное накопление радиоактивного индикатора в головном мозге достаточно низкое: 0,39% ID в точке времени 2 мин п.и., при этом 0,31% ID в головном мозге и 0,07% ID в мозжечке. В точке времени 30 мин п.и. 0,035% ID обнаружено в полосатом теле, которое имеет самую высокую экспрессию PDE10A и где радиоактивный индикатор, как предполагают, должен продемонстрировать связывание. Скорость выведения из кровотока достаточно медленная. В точке времени 2 мин п.и. около 4,0% от введенной дозы присутствовало в крови, и это количество уменьшалось до 3,3% к 60 мин п.и. Радиоактивный индикатор выводился преимущественно посредством гепатобилиарной системы, поскольку в целом 50% ID обнаружено в печени и кишечнике через 60 мин после введения радиорадиоактивного индикатора. Из-за липофильного характера радиоактивного индикатора его выведение с мочой было минимальным и только 3,2% ID обнаружено в мочевой системе через 60 мин п.и. Также неожиданно высокую аккумуляцию наблюдали в желудке (2,6% ID, 6,7% ID, 20% ID в точке времени соответственно 2, 30 и 60 мин п.и.). Благодаря большой массе туловища животного значительное количество введенной дозы (27% ID) присутствовало в туловище животного во всех точках времени, в которых осуществляли исследования. Обычно масса туловища животного составляет до 90% от общей массы тела животного. В табл. 7 представлены значения % ID/г для различных органов в точке времени 2, 30 и 60 мин п.и. Данные выражали как среднее значение SD;n=3 на точку времени; а процент от введенной путем инъекции дозы рассчитывали как имп./мин в органе/общее полученное значение имп./мин. Данные выражали как среднее значение SD;% ID/г значения рассчитывали как % ID/масса органа, г. Поскольку почки и печень являются органами выведения, они имели самые высокие значения %ID/г, около 1,9% ID/г для почек и 5,5% ID/г для печени в точке времени 2 мин п.и. Значения % ID/г для различных областей головного мозга, а именно полосатого тела, гиппокампа, коры головного мозга и мозжечка, представлены в табл. 7. Для введения поправки на разницу в массе тела между различными животными значения % ID/г ткани нормализовали в соответствии с массой тела. Нормализованные значения представлены в табл. 8. В точке времени 2 мин п.и. самую высокую концентрацию радиоактивности в головном мозге наблюдали в области полосатого тела (0,098% ID/г, скорректировано на массу тела), и она увеличивалась со временем (0,221% ID/г корр. в точке времени 30 мин и 0,278% ID/г корр. в точке времени 60 мин п.и.). Эта аккумуляция радиоактивности в полосатом теле согласуется с более высокой экспрессией PDE10 фермента в этой области. Для гиппокампа, коры головного мозга и мозжечка,областей с минимальной экспрессией PDE10A, концентрация в точке времени 30 мин снижалась по сравнению с точкой времени 2 мин, указывая на вымывание радиоактивного индикатора из этих областей головного мозга. Небольшое увеличение в точке времени 60 мин для этих областей головного мозга может быть из-за образования радиоактивного метаболита(метаболитов), который проникает в головной мозг. В табл. 9 представлены отношения 2/30 мин и 2/60 мин для значений % ID/г (нормализованных в соответствии с массой тела животного) для различных областей головного мозга. Что касается отношений 2 мин/30 мин, мозжечок имел самое высокое отношение 2,71, указывая на то, что скорость выведения радиоактивного индикатора из этой области самая высокая, затем следуют кора головного мозга(2,54) и гиппокамп (2,24), т.е. области с минимальной экспрессией PDE10. Для полосатого тела, с другой стороны, 2/60 мин отношение (0,55) было меньше, чем 2/30 мин отношение (0,81), указывая на аккумуляцию [18F]B-3 в PDE10A-обогащенном полосатом теле. Таблица 9 Выведение [18F]B-3 из различных областей головного мозга, рассчитанное как отношение 2/30 мин и 2/60 мин для значений % ID/г(скорректированных на массу тела животного) В табл. 10 представлены отношения между полосатым телом и другими областями головного мозга,а также кровью в различных точках времени после инъекции [18F]B-3. Полосатое тело рассматривали какPDE10A-обогащенную область и мозжечок как сравнительную область. Поэтому высокие отношения полосатое тело-к-мозжечку желательны для получения хорошего качества изображений in vivo. В точке времени 2 мин п.и. отношение полосатое тело-к-мозжечку составляло около 1,6, и это отношение увеличивалось до 6,6 к точке времени 60 мин после введения радиоактивного индикатора. Отношения полосатое тело-к-коре головного мозга и полосатое тело-к-гиппокампу также составляли 6,5 (60 мин п.и.),подтверждая специфическое удерживание [18F]B-3 в полосатом теле. Таблица 10 Отношения полосатое тело-к-другим областям головного мозга(рассчитанное из % ID/г значений, нормализованных в соответствии с массой тела животного) в точке времени 2, 30 и 60 мин после инъекции [18F]B-3 Результаты этих анализов биораспределения показывают, что хотя начальное накопление в головном мозге было достаточно низким, наблюдали непрерывную аккумуляцию [18F]B-3 в полосатом теле, в то время как со временем происходило вымывание из сравнительной области мозжечка. Это предполагает специфическое удерживание [18F]B-3 в PDE10A-обогащенной области, которой является полосатое тело. С. Результаты анализа биораспределения для соединения [18F]B-4. Результаты in vivo исследования распределения [18F]B-4 у самцов крыс Wistar представлены в табл. 11 и 12. Из-за достаточно низкого начального накопления в головном мозге и низкой аккумуляции в полосатом теле анализ биораспределения в точке времени 60 мин не осуществляли. В табл. 11 представлены значения % ID в точке времени 2 и 30 мин п.и. радиорадиоактивного индикатора. Общее начальное
МПК / Метки
МПК: A61K 51/04, C07D 401/14
Метки: радиоактивно, pde10, лиганды, меченные
Код ссылки
<a href="https://eas.patents.su/30-19673-radioaktivno-mechennye-pde10-ligandy.html" rel="bookmark" title="База патентов Евразийского Союза">Радиоактивно меченные pde10 лиганды</a>