Ингибиторы limk2 и способы их применения
Номер патента: 19488
Опубликовано: 30.04.2014
Авторы: Уитлок Норрис Эндрю, Лю Ин, Хили Джейсон Патрик, Гудвин Николь Кэтлин, Маринелли Бретт, Роулинс Дэвид Брент, Райс Деннис Стюарт, Мейбон Росс, Бергун Хью Альфред, Харрисон Брайс Олден
Формула / Реферат
1. Соединение формулы
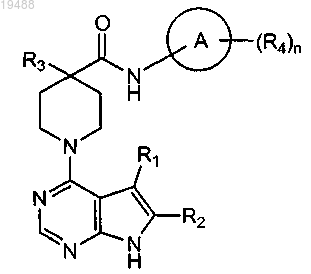
или его фармацевтически приемлемая соль, где
А представляет собой необязательно замещенный фенил;
R1 представляет собой водород, галоген, циано или необязательно замещенный алкил;
R2 представляет собой водород;
R3 представляет собой R3A, OR3B или N(R3B)2;
каждый R3A представляет собой необязательно замещенный алкил, алкилфенил, фенил или гетероалкил;
каждый R3B представляет собой независимо водород или необязательно замещенный алкил;
каждый R4 представляет собой независимо галоген, OR4A, ОС(О)N(R4A)2, SO2R4A или необязательно замещенный алкил, гетероалкил или гетероарил;
каждый R4A представляет собой независимо водород или необязательно замещенный алкил; и
n представляет собой 0 или 1;
с условием, что когда R1 и R2 оба представляют собой водород, R4 не является галогеном, и
где "алкил" означает с прямой цепью или разветвленный углеводород, имеющий от 1 до 4 атомов углерода,
"гетероалкил" относится к C1-10алкильной группе, в которой по меньшей мере один из ее атомов углерода замещен N, О или S;
"гетероарил" означает арильную группу, в которой по меньшей мере один из ее атомов углерода замещен N или О.
2. Соединение по п.1, в котором R1 представляет собой водород.
3. Соединение по п.1, в котором R1 представляет собой галоген.
4. Соединение по п.1, в котором R1 представляет собой необязательно замещенный алкил.
5. Соединение по п.1, в котором R3 представляет собой R3A.
6. Соединение по п.5, в котором R3A представляет собой необязательно замещенный алкил.
7. Соединение по п.1, в котором R3 представляет собой OR3B или N(R3B)2.
8. Соединение по п.7, в котором R3B представляет собой водород.
9. Соединение по п.7, в котором R3B представляет собой необязательно замещенный алкил.
10. Соединение по п.1, в котором R4 представляет собой галоген.
11. Соединение по п.1, в котором R4 представляет собой OC(O)N(R4A)2.
12. Соединение по п.11, в котором по меньшей мере один R4a представляет собой алкил.
13. Соединение по п.1, имеющее формулу

14. Соединение по п.13, в котором R1 представляет собой водород.
15. Соединение по п.13, в котором R1 представляет собой галоген.
16. Соединение по п.13, в котором R1 представляет собой необязательно замещенный алкил.
17. Соединение по п.13, в котором R3 представляет собой R3A.
18. Соединение по п.17, в котором R3A представляет собой необязательно замещенный алкил.
19. Соединение по п.13, в котором R3 представляет собой OR3B или N(R3B)2.
20. Соединение по п.19, в котором R3B представляет собой водород.
21. Соединение по п.19, в котором R3B представляет собой необязательно замещенный алкил.
22. Соединение по п.13, в котором R4 представляет собой галоген.
23. Соединение по п.13, в котором R4 представляет собой OC(O)N(R4A)2.
24. Соединение по п.23, в котором по меньшей мере один R4A представляет собой алкил.
25. Способ понижения внутриглазного давления у пациента, который включает введение пациенту, нуждающемуся в таком лечении, терапевтически или профилактически эффективного количества соединения по п.1.
26. Способ лечения, контроля или предотвращения заболевания или нарушения, затрагивающего зрение пациента, который включает введение пациенту, нуждающемуся в таком лечении, терапевтически или профилактически эффективного количества соединения по п.1.
27. Способ по п.26, в котором заболевание или нарушение, затрагивающее зрение, представляет собой глаукому, нейродегенерацию или инфекцию.
Текст
Раскрыты ингибиторы киназы LIM 2 и способами их применения. Отдельные соединения имеют формулу (I) Настоящая заявка испрашивает приоритет на основании заявки на патент США 61/046602, поданной 21 апреля 2008, которая включена в настоящее описание в полном объеме посредством ссылки. 1. Область техники, к которой относится изобретение Изобретение относится к ингибиторам киназы, композициям, содержащим их, и способам их применения для лечения различных заболеваний и нарушений. 2. Уровень техники Протеинкиназы представляют собой класс ферментов, которые катализируют перенос -фосфатной группы от АТФ до белка реципиента. Оценивают, что геном человека кодирует более 500 различных протеинкиназ, многие из которых были вовлечены в широкий диапазон заболеваний и нарушений, включая рак и воспаление. Киназы LIM (LIMK) были связаны с р 53 сигнальным путем. См., например, международная заявка номер WO 02/099048. LIMK принадлежит к небольшому подсемейству киназ с уникальной комбинацией двух N-концевых LIM фрагментов и С-концевого домена протеинкиназы. Эти фрагменты LIM и домены киназы связаны с помощью пролин- и серинобогащенного участка, содержащего несколько предполагаемых киназ казеина и участков узнавания киназы митогенактивируемого белка. Полагают, что киназыLIM и их белки сигнальных путей, вносят свой вклад в Rho-индуцированную реорганизацию актинового цитоскелета. Id. Члены семейства киназ LIM включают киназу LIM 1 (LIMK1) и киназу LIM 2 (LIMK2). Обе фосфорилируют кофилин и регулируют Rho семействазависимую актинцитоскелетную перестановку. Id. Ингибиторы киназы LIM были предложены для лечения рака. Id. Также было предложено, что ингибиторы LIMK могут быть пригодными при лечении глаукомы, стимулируя деполимеризацию актина в трабекулярных клетках и понижая глазное напряжение. См. международную заявку номер WO 04/047868. Текущие терапии глаукомы действуют с помощью различных механизмов. Аналоги простагландина F2a (например, латанопрост) действуют на независимое увеличение внутриглазного давления(ВГД) при вытекании жидкости из глаза. Углеродные безводные ингибиторы (например, ацетазоламид),бета-блокаторы (например, тимолол), симпатомиметики (например, пилокарпин) и агонисты альфаадренергических рецепторов (например, бримонидин) уменьшают выработку внутриглазной жидкости. Огромное число соединений с широким разнообразием хемотипов было заявлено в качестве ингибиторов киназы. Например, были раскрыты фенилзамещенные соединения пиримидина, которые по имеющимся сведениям являются пригодными в качестве ингибиторов LIMK. См. международную заявкуWO 2006/084017. Соединения на основе пиррол[2,3-d]пиримидина были раскрыты в качестве ингибиторов множества различных киназ. См., например, публикацию патента США 2004/0058922; международную заявку WO 2007/125325; международную заявку WO 2007/125321; международную заявку WO 2006/046024; публикацию патента США номер 2005/0130954; и публикацию патента США номер 2006/0189638. 3. Сущность изобретения Изобретение относится, в частности, к соединениям формулы и их фармацевтически приемлемым солям, заместители которых определены в настоящем описании. Определенные соединения представляют собой сильные ингибиторы LIMK2. Один вариант осуществления изобретения охватывает способы применения соединений, раскрытых в настоящем описании, для лечения, контроля и предотвращения различных заболеваний и нарушений,связанных с LIMK2, включая рак, воспалительные заболевания и нарушения и заболевания и нарушения,затрагивающие зрение (например, заболевания и нарушения глаз), такие как глаукома, нейродегенерация и инфекция. 4. Краткое описание чертежей Фиг. 1 показывает эффект двух соединений при анализе глазной гипертензии, описанный в примерах ниже. Соединение А представляет собой соединение изобретения, дозируемое 3 мкг на глаз. Другое соединение, тимолол, дозировали 15 мкг на глаз. Данные для контрольного наполнителя представляют собой среднее значение восьми экспериментов, используя различные наполнители. Данные для соединения А представляют собой среднее значение восьми экспериментов, используя различные наполнители. Данные для тимолола представляют собой среднее значение двух экспериментов, полученные, используя коммерческий состав. 5. Подробное описание изобретения Изобретение базируется, в частности, на открытии новых соединений, которые являются ингибиторами киназы LIM 2 (LIMK2). Ингибиторы LIMK2 могут применять для лечения, контроля и/или предот-1 019488 вращения различных заболеваний и нарушений глаза, таких как глаукома. См., например, заявку на патент США номер 12/188515, поданную 8 августа 2008. Предпочтительные соединения настоящего изобретения являются стабильными в растворе и, следовательно, могут быть включены в жидкие формы дозировки, такие как глазные капли. Кроме того, определенные соединения являются водорастворимыми. 5.1. Определения. Если не указано иначе, термин "алкенил" означает с прямой цепью, разветвленный и/или циклический углеводород, имеющий от 2 до 20 (например, от 2 до 10 или от 2 до 6) атомов углерода и включающий по меньшей мере одну двойную связь углерод-углерод. Типичные группы алкенила включают винил, аллил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2 бутенил, 2,3-диметил-2-бутенил, 1-гексенил, 2-гексенил, 3-гексенил, 1-гептенил, 2-гептенил, 3-гептенил,1-октенил, 2-октенил, 3-октенил, 1-ноненил, 2-ноненил, 3-ноненил, 1-деценил, 2-деценил и 3-деценил. Если не указано иначе, термин "алкокси" означает -O-алкильную группу. Примеры алкоксигрупп включают, но не ограничиваются ими, -ОСН 3, -ОСН 2 СН 3, -О(СН 2)2 СН 3, -О(СН 2)3 СН 3, -О(СН 2)4 СН 3 и-О(СН 2)5 СН 3. Если не указано иначе, термин "алкил" означает с прямой цепью, разветвленный и/или циклический("циклоалкил") углеводород, имеющий от 1 до 20 (например, от 1 до 10 или от 1 до 4) атомов углерода. Алкильные группы, содержащие от 1 до 4 углеродов, называются как "низшие алкилы". Примеры алкильных групп включают, но не ограничиваются ими, метил, этил, пропил, изопропил, н-бутил, третбутил, изобутил, пентил, гексил, изогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил,нонил, децил, ундецил и додецил. Циклоалкильные группы могут быть моноциклическими или полициклическими, и примеры включают циклопропил, циклобутил, циклопентил, циклогексил и адамантил. Дополнительные примеры алкильных групп имеют линейные, разветвленные и/или циклические части(например, 1-этил-4-метил-циклогексил). Термин "алкил" включает насыщенные углеводороды, также как алкенильные и алкинильные группы. Если не указано иначе, термин "алкиларил" или "алкил-арил" означает алкильную группу, связанную с арильной группой. Если не указано иначе, термин "алкилгетероарил" или "алкил-гетероарил" означает алкильную группу, связанную с гетероарильной группой. Если не указано иначе, термин "алкилгетероцикл" или "алкил-гетероцикл" означает алкильную группу, связанную с гетероциклической группой. Если не указано иначе, термин "алкинил" означает с прямой цепью, разветвленный и/или циклический углеводород, имеющий от 2 до 20 (например, от 2 до 20 или от 2 до 6) атомов углерода и включающий по меньшей мере одну тройную связь углерод-углерод. Типичные алкинильные группы включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-бутинил, 4-пентинил,1-гексинил, 2-гексинил, 5-гексинил, 1-гептинил, 2-гептинил, 6-гептинил, 1-октинил, 2-октинил, 7 октинил, 1-нонинил, 2-нонинил, 8-нонинил, 1-децинил, 2-децинил и 9-децинил. Если не указано иначе, термин "арил означает ароматическое кольцо или ароматическую или частично ароматическую кольцевую систему, составленную из атомов углерода и водорода. Арильная группа может содержать многочисленные кольца, связанные или соединенные вместе. Примеры арильных групп включают, но не ограничиваются ими, антраценил, азуленил, бифенил, флуоренил, индан, инденил, нафтил, фенантренил, фенил, 1,2,3,4-тетрагидронафталин и толил. Если не указано иначе, термин "арилалкил" или "арил-алкил" означает арильную группу, связанную с алкильной группой. Если не указано иначе, термины "галоген" и "гало" охватывают фтор, хлор, бром и иод. Если не указано иначе, термин "гетероалкил" относится к алкильной группе (например, линейной,разветвленной или циклической), в которой, по меньшей мере, один из ее атомов углерода замещен гетероатомом (например, N, О или S). Если не указано иначе, термин "гетероалкиларил" или "гетероалкил-арил" относится к гетероалкильной группе, связанной с алкильной группой. Если не указано иначе, термин "гетероалкилгетероцикл" или "гетероалкил-гетероцикл" относится к гетероалкильной группе, связанной с гетероциклической группой. Если не указано иначе, термин "гетероарил" означает арильную группу, в которой по меньшей мере один из ее атомов углерода замещен гетероатомом (например, N, О или S). Примеры включают, но не ограничиваются ими, акридинил, бензимидазолил, бензофуранил, бензоизотиазолил, бензоизоксазолил,бензохиназолинил, бензотиазолил, бензоксазолил, фурил, имидазолил, индолил, изотиазолил, изоксазолил, оксадиазолил, оксазолил, фталазинил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидинил,пиримидил, пирролил, хиназолинил, хинолинил, тетразолил, тиазолил и триазинил. Если не указано иначе, термин "гетероарилалкил" или "гетероарил-алкил" означает гетероарильную группу, связанную с алкильной группой. Если не указано иначе, термин "гетероцикл" относится к ароматическому, частично ароматическому или неароматическому моноциклическому или полициклическому кольцу или кольцевой системе,-2 019488 состоящей из углерода, водорода и по меньшей мере одного гетероатома (например, N, О или S). Гетероцикл может содержать многочисленные (то есть, два или более) кольца, соединенные или связанные вместе. Гетероциклы включают гетероарилы. Примеры включают, но не ограничиваются ими, бензо[1,3] диоксолил, 2,3-дигидробензо[1,4]диоксинил, циннолинил, фуранил, гидантоинил, морфолинил, оксетанил, оксиранил, пиперазинил, пиперидинил, пирролидинонил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и валеролактамил. Если не указано иначе, термин "гетероциклалкил" или "гетероцикл-алкил" относится к гетероциклической группе, связанной с алкильной группой. Если не указано иначе, термин "гетероциклоалкил" относится к неароматическому гетероциклу. Если не указано иначе, термин "гетероциклоалкилалкил" или "гетероциклоалкил-алкил" относится к гетероциклоалкильной группе, связанной с алкильной группой. Если не указано иначе, термин "LIMK2 IC50" представляет собой IC50 определяемого соединения,используя in vitro анализ ингибирования человеческой киназы LIM 2, описанный в примерах ниже. Если не указано иначе, термины "контролировать", "контролирующий" и "контроль" охватывают предотвращение повторного появления указанного заболевания или нарушения у пациента, который уже имел заболевание или нарушение, и/или удлинение времени, при котором пациент, который пострадал от заболевания или нарушения, остается в ремиссии. Термины охватывают модулирование пороговой величины, развитие и/или протекание заболевания или нарушения, или изменение пути, при котором пациент реагирует на заболевание или нарушение. Если не указано иначе, термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных кислот или оснований, включая неорганические кислоты и основания и органические кислоты и основания. Подходящие фармацевтически приемлемые основно-аддитивные соли включают, но не ограничиваются ими, соли металлов, полученные из алюминия, кальция, лития, магния, калия, натрия и цинка, или органические соли, полученные из лизина, N,N'дибензилэтилендиамина, хлоропрокаина, холина, диэтаноламина, этилендиамина, меглумина (Nметилглюкамина) и прокаина. Подходящие нетоксичные кислоты включают, но не ограничиваются ими,неорганические и органические кислоты, такие как уксусная, альгиновая, аминобензойная, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуранкарбоновая, галактуроновая, глюконовая, глюкуроновая, глутаминовая, гликолевая, бромисто-водородная, хлористо-водородная, изэтиновая, молочная, малеиновая, яблочная, миндальная, метансульфоновая,муциновая, азотная, памовая, пантотеновая, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, янтарная, сульфаниловая, серная, винная кислота и п-толуолсульфоновая кислота. Определенные нетоксичные кислоты включают хлористо-водородную, бромисто-водородную, фосфорную, серную и метансульфоновую кислоты. Примеры определенных солей, таким образом, включают соли гидрохлорида и мезилата. Другие являются хорошо известными в данной области техники. См., например, Remington's Pharmaceutical Sciences, 18th ed. (Mack Publishing, Easton PA: 1990) and Remington: The Science andPractice of Pharmacy, 19th ed. (Mack Publishing, Easton PA: 1995). Если не указано иначе, "сильный ингибитор LIMK2" представляет собой соединение, которое имеетLIMK2 IC50 менее чем приблизительно 250 нм. Если не указано иначе, термины "предотвращают", "предотвращающий" и "предотвращение" рассматривают действие, которое происходит прежде, чем пациент начинает страдать от указанного заболевания или нарушения, которое ингибирует или сокращает тяжесть заболевания или нарушения. Другими словами, термины охватывают профилактику. Если не указано иначе, "профилактически эффективное количество" соединения представляет собой количество, достаточное для предотвращения заболевания или нарушения или одного или более симптомов, связанных с заболеванием или нарушением, или предотвращения его повторного проявления. "Профилактически эффективное количество" соединения означает количество терапевтического агента, отдельно или в комбинации с другими агентами, которое обеспечивает профилактическое преимущество при предотвращении заболевания. Термин "профилактически эффективное количество" может охватывать количество, которое улучшает общую профилактику или увеличивает профилактическую эффективность другого профилактического агента. Если не указано иначе, термин "стереоизомерная смесь" охватывает рацемические смеси, также как стереоизомерно обогащенные смеси (например, R/S = 30/70, 35/65, 40/60, 45/55, 55/45, 60/40, 65/35 и 70/30). Если не указано иначе, термин "стереоизомерно чистый" означает композицию, которая содержит один стереоизомер соединения и является, по существу, свободной от других стереоизомеров того соединения. Например, стереоизомерно чистая композиция соединения, имеющая один стереоцентр, будет по существу свободной от противоположного стереоизомера соединения. Стереоизомерно чистая композиция соединения, имеющая два стереоцентра, будет, по существу, свободной от других диастереомеров соединения. Типичное стереоизомерно чистое соединение содержит более чем приблизительно 80 вес.% одного стереоизомера соединения и менее чем приблизительно 20 вес.% других стереоизомеров соеди-3 019488 нения, более чем приблизительно 90 вес.% одного стереоизомера соединения и менее чем приблизительно 10 вес.% других стереоизомеров соединения, более чем приблизительно 95 вес.% одного стереоизомера соединения и менее чем приблизительно 5 вес.% других стереоизомеров соединения, более чем приблизительно 97 вес.% одного стереоизомера соединения и менее чем приблизительно 3 вес.% других стереоизомеров соединения или более чем приблизительно 99 вес.% одного стереоизомера соединения и менее чем приблизительно 1 вес.% других стереоизомеров соединения. Если не указано иначе, термин "замещенный" при использовании для описания химической структуры или группы относится к производному той структуры или группы, в котором один или более его атомов водорода замещены химической группой или функциональной группой, такой как, но не ограничиваясь ими, спирт, альдегид, алкокси, алканоилокси, алкоксикарбонил, алкенил, алкил (например, метил, этил, пропил, трет-бутил), алкинил, алкилкарбонилокси (-ОС(О)алкил), амид (например, С(О)NHалкил-, -алкил-NHC(О)алкил), амидинил (например, С(NH)NH-алкил-, -C(NR)NH2), амин (первичный,вторичный и третичный, такой как алкиламино, ариламино, арилалкиламино), ароил, арил, арилокси, азо,карбамоил (например, -NHC(O)O-алкил-, -ОС(О)NH-алкил), карбамил (например, CONH2, CONH-алкил,CONH-арил, CONH-арилалкил), карбонил, карбоксил, карбоновая кислота, ангидрид карбоновой кислоты, хлорид карбоновой кислоты, циано, сложный эфир, эпоксид, эфир (например, метокси, этокси), гуанидино, гало, галоалкил (например, -CCl3, -CF3, -C(CF3)3), гетероалкил, гемиацеталь, имин (первичный и вторичный), изоцианат, изотиоцианат, кетон, нитрил, нитро, оксо, фосфодиэфир, сульфид, сульфонамидо(например, SO2NH2), сульфон, сульфонил (включая алкилсульфонил, арилсульфонил и арилалкилсульфонил), сульфоксид, тиол (например, сульфгидрил, тиоэфир) и мочевина (например, -NHCONH-алкил-). Если не указано иначе, "терапевтически эффективное количество" соединения представляет собой количество, достаточное для обеспечения терапевтической полезности при лечении или контроле заболевания или состояния, или задержки или минимизирования одного или более симптомов, связанных с заболеванием или состоянием. "Терапевтически эффективное количество" соединения означает количество терапевтического агента, отдельно или в комбинации с другими терапиями, которое обеспечивает терапевтическую выгоду при лечении или контроле заболевания или состояния. Термин "терапевтически эффективное количество" может охватить количество, которое улучшает общую терапию, сокращает или уничтожает симптомы или причины заболевания или состояния, или увеличивает терапевтическую эффективность другого терапевтического агента. Если не указано иначе, термины "лечить", "лечащий" и "лечение" рассматривают действие, которое происходит в то время, как пациент страдает от указанного заболевания или нарушения, которое уменьшает тяжесть заболевания или нарушения или задерживает или замедляет прогрессирование заболевания или нарушения. Если не указано иначе, термин "включают" имеет то же самое значение, как "включают, но не ограничиваются ими" и термин "включает" имеет то же самое значение, как "включает, но не ограничивается ими". Точно так же термин "такой как" имеет то же самое значение, как термин "такой как, но не ограничиваясь ими". Если не указано иначе, одно или более прилагательных, непосредственно предшествующих ряду существительных, должно быть рассмотрено как применение к каждому из существительных. Например,фраза "необязательно замещенный алкилом, арилом или гетероарилом" имеет то же самое значение как"необязательно замещенный алкилом, необязательно замещенный арилом или необязательно замещенный гетероарилом". Следует отметить, что химическая группа, которая образует часть большего соединения, может быть описана в настоящей заявке, используя название, обычно представляющее его, когда оно существует в виде единичной молекулы, или название, обычно представляющее его радикал. Например, термины"пиридин" и "пиридил" представляют одинаковое значение при использовании для описания группы,присоединенной к другим химическим группам. Таким образом, две фразы "ХОН, в которой X представляет собой пиридил" и "ХОН, в которой X представляет собой пиридин" имеют одинаковое значение и охватывают соединения пиридин-2-ол, пиридин-3-ол и пиридин-4-ол. Следует также отметить, что, если стереохимия структуры или части структуры не обозначена, например, жирными или пунктирными линиями, структура или часть структуры должна интерпретироваться как охватывающая все ее стереоизомеры. Кроме того, предполагают, что любой атом, показанный на рисунке, с ненасыщенной валентностью, присоединяет достаточно атомов водорода, чтобы соблюдать валентность. Кроме того, химические связи, изображенные с одной жирной линией, параллельной одной пунктирной линии, охватывают и одинарную, и двойную (например, ароматическую) связь, если позволяют валентности. 5.2. Соединения. Настоящее изобретение охватывает соединения формулы и их фармацевтически приемлемые соли, в которой: А представляет собой необязательно замещенный фенил;R1 представляет собой водород, галоген, циано или необязательно замещенный алкил;R3 представляет собой R3A, OR3B или N(R3B)2; каждый R3A представляет собой необязательно замещенный алкил, алкилфенил, фенил или гетероалкил; каждый R3B представляет собой независимо водород или необязательно замещенный алкил; каждый R4 представляет собой независимо галоген, OR4A, ОС(О)N(R4A)2, SO2R4A или необязательно замещенный алкил, гетероалкил или гетероарил; каждый R4A представляет собой независимо водород или необязательно замещенный алкил; иn представляет собой 0 или 1; с условием, что когда R1 и R2 оба представляют собой водород, R4 не является галогеном. В определенном варианте осуществления соединение представляет собой такое, что: 1) каждый R4A представляет собой независимо водород или необязательно замещенный алкил; и 2) когда R1 и R2 оба представляют собой водород и А представляет собой фенил, R4 не является галогеном. В одном варианте осуществления А представляет собой необязательно замещенный фенил. В одном варианте осуществления R1 представляет собой водород, галоген, циано или необязательно замещенный низший алкил. В определенном варианте осуществления R1 представляет собой водород. В другом R1 представляет собой галоген (например, хлор). В другом R1 представляет собой необязательно замещенный низший алкил (например, метил). В одном варианте осуществления R2 представляет собой водород. В одном варианте осуществления R3 представляет собой R3A, OR3B, или N(R3B)2. В определенном варианте осуществления R3 представляет собой R3A и R3A представляет собой необязательно замещенный алкил, алкилфенил, фенил или гетероалкил. В определенном варианте осуществления R3A представляет собой необязательно замещенный алкил. В другом R3A представляет собой необязательно замещенный алкилфенил. В другом R3A представляет собой необязательно замещенный гетероалкил. В определенном варианте осуществления R3 представляет собой OR3B или N(R3B)2 и R3B представляет собой водород или необязательно замещенный алкил. В определенном варианте осуществления R3B представляет собой водород. В другом R3B представляет собой необязательно замещенный алкил. В одном варианте осуществления R4 представляет собой галоген. В другом R4 представляет собойOC(O)N(R4A)2 и по меньшей мере один R4A представляет собой, например, низший алкил (например, метил). Определенные соединения изобретения являются сильными ингибиторами LIMK2. Определенные соединения имеют LIMK2 IC50 менее чем приблизительно 100, 75, 50, 25 или 10 нМ. 5.3. Способы синтеза. Соединения изобретения могут получить с помощью способов, известных в данной области техники. См., например, публикации патентов США 2004/0058922 и 2005/0130954. Пирролопиримидины могут получить с помощью множества способов, известных в данной области техники. См., например, West, J. Org. Chem. 26:4959 (1961); Aono et al., ЕР 0733633-В 1. Один подход описан в заявке на патент США 11/876051, поданной 22 октября 2007 и показанной ниже в схеме 1. Схема 1 Результирующее соединение 4-гидроксипирроло[2,3-d]пиримидин затем превращают в соответствующее 4-хлор соединение (соединение f на cхеме 2, ниже), используя способы, известные в данной области техники. См., например, West, J. Org. Chem. 26:4959 (1961). Такое соединение затем используют для получения соединений изобретения, как показано ниже на cхеме 2. В способе, представленном на схеме 2, коммерчески доступный 1-трет-бутил-4-этилпиперидин-1,4 дикарбоксилат (а) алкилируют с помощью соответствующего основания (например, лития диизопропиламид) и алкилирующего агента (например, алкилбромид или хлорид) с получением соединения b. Другие соединения формулы b являются коммерчески доступными. Гидролиз соединения b с основанием,таким как LiOH или NaOH в водном растворе дает карбоновую кислоту с, которая может быть соединена с аминами формулы NH2A, используя подходящие реагенты (например, HATU с диизопропилэтиламином в изопропилацетате) с получением амида d. Обработка соединения d подходящей кислотой (например, HCl в МеОН или TFA в CH2Cl2) удаляет Boc группу с получением амина е. Нагревание амина е и хлорида f с соответствующим основанием (например, диизопропилэтиламин) в соответствующем растворителе (например, изопропанол, изобутанол) позволяет получить соединение h. При необходимости могут использовать известные способы для превращения такого соединения в различные другие, охваченные согласно настоящему изобретению. 5.4. Способы применения. Настоящее изобретение охватывает способ ингибирования LIMK2, который включает взаимодействие LIMK2 с сильным ингибитором LIMK2. Предпочтительные сильные ингибиторы LIMK2 представляют собой соединения изобретения, (то есть, соединения, раскрытые в настоящем описании). Определенный вариант осуществления охватывает способ лечения, контроля или предотвращения воспалительного заболевания или нарушения у пациента, который включает введение пациенту, нуждающемуся в таком лечении, терапевтически или профилактически эффективного количества соединения изобретения. Другой вариант осуществления охватывает способ лечения, контроля или предотвращения рака у пациента, который включает введение пациенту, нуждающемуся в таком лечении, терапевтически или профилактически эффективного количества соединения изобретения. Другой вариант осуществления охватывает способ понижения внутриглазного давления у пациента,который включает ингибирование активности или экспрессии LIMK2 у пациента, нуждающегося в таком лечении. В одном способе активность LIMK2 ингибируют с помощью взаимодействия глаза пациента с сильным ингибитором LIMK2. Определенные сильные ингибиторы LIMK2 раскрыты в настоящем описании. В другом способе экспрессию LIMK2 ингибируют с помощью введения в глаз пациента соединения (например, миРНК), которое ингибирует экспрессию LIMK2. Другой вариант осуществления охватывает способ лечения, контроля или предотвращения заболевания или нарушения, затрагивающего зрение у пациента, который включает ингибирование активности или экспрессии LIMK2 у пациента, нуждающегося в таком лечении. В одном способе активность LIMK2 ингибируют с помощью взаимодействия глаза пациента с сильным ингибитором LIMK2. Определенные сильные ингибиторы LIMK2 раскрыты в настоящем описании. Заболевания и нарушения, затрагивающие зрение, включают глаукому, нейродегенеративные заболевания и инфекционные заболевания. 6. Примеры. Аспекты настоящего изобретения можно понять из следующих примеров, которые не ограничивают его возможности. 6.1. Пример 1. Синтез 1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-N-(3-(4-фторфенокси)фенил)-4 метилпиперидин-4-карбоксамидаA. Получение трет-бутил 4-(3-(4-фторфенокси)фенилкарбамоил)-4-метилпиперидин-1 карбоксилата. 1-(трет-бутоксикарбонил)-4-метилпиперидин-4-карбоновую кислоту (243 мг, 1,0 ммоль), 3-(4 фторфенокси)анилин (203 мг, 1,0 ммоль), ДЦК (20 6 мг, 1,0 ммоль) и HOAt (138 мг, 1,01 ммоль) объединяли в EtOAc (50 мл) и ДМФ (5 мл). Реакционную смесь нагревали при 80 С в течение 20 ч. Большую часть EtOAc испаряли, приводя к осаждению твердого вещества, которое удаляли с помощью фильтрования. Фильтрат растворяли EtOAc, промывали 1 н. водн. HCl и солевым раствором, высушивали и концентрировали под вакуумом с получением указанного в заголовке соединения. MS (ES+) [М+Н]+ = 429.B. Получение N-(3-(4-фторфенокси)фенил)-4-метилпиперидин-4-карбоксамида. Трет-бутил 4-(3-(4-фторфенокси)фенилкарбамоил)-4-метилпиперидин-1-карбоксилат из стадии А обрабатывали 4 н. HCl в диоксане в течение 16 ч при комнатной температуре. Продукт выделяли с помощью фильтрования и промывали эфиром для получения указанного в заголовке соединения (206 мг, 56% за две стадии) в виде соли гидрохлорида. MS (ES+) [М+Н]+ = 329.NCS (134 мг, 1,0 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 ч, отфильтровывали и концентрировали под вакуумом с получением указанного в заголовке соединения, которое переносили в неочищенном виде. MS (ES+) [М+Н]+ = 189.N-(3-(4-фторфенокси)фенил)-4-метилпиперидин-4-карбоксамид из стадии В (50 мг, 0,13 ммоль),4,5-дихлор-7H-пирроло[2,3-d] пиримидин из стадии С (19 мг, 0,1 ммоль) и триэтиламин (0,04 мл, 0,3 ммоль) объединяли в изопропаноле (1 мл) и нагревали при 130 С в течение 30 мин при микроволновых условиях. Продукт выделяли с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения. 1 А. Получение 5-бром-4-хлор-7H-пирроло[2,3-d]пиримидина. К раствору 4-хлор-7H-пирроло[2,3-d]пиримидина (1,2 г, 7,8 ммоль) в CH2Cl2 (25 мл) добавляли Nбромацетамид (1,2 г, 8,7 ммоль) в CH2Cl2 (25 мл). Реакционную смесь нагревали с обратным холодильником в течение 40 мин, затем концентрировали и промывали холодной водой. Неочищенный продукт перекристаллизовывали из минимального количества изопропанола и высушивали под вакуумом с получением указанного в заголовке соединения (82%) в виде светло-серого твердого вещества. MS (ES+)(36 мг, 0,1 ммоль) в изопропаноле (1 мл) добавляли 5-бром-4-хлор-7H-пирроло[2,3-d] пиримидин из стадии А (24 мг, 0,1 ммоль) и тризтиламин (0,04 мл, 0,3 ммоль). Реакционную смесь нагревали при 100 С в течение 10 мин при микроволновых условиях и затем концентрировали под вакуумом. Продукт выделяли с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения. 1 ммоль) и триэтиламин (0,04 мл, 0,3 ммоль). Реакционную смесь нагревали при 180 С в течение 30 мин при микроволновых условиях и затем концентрировали под вакуумом. Продукт выделяли с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения. 1A. Получение 4-фенилпиперидин-4-карбоновой кислоты. 1-(трет-бутоксикарбонил)-4-фенилпиперидин-4-карбоновую кислоту (1,0 г, 3,3 ммоль) обрабатывали с 4 н. HCl в диоксане (20 мл) в течение 2 ч при комнатной температуре. Продукт выделяли с помощью фильтрования с получением указанного в заголовке соединения (0,74 г, 93%) в виде белого твердого вещества. MS (ES+) [M+Н]+ = 206.B. Получение 1-(5-метил-4,7-дигидро-3H-пирроло[2,3-d]пиримидин-4-ил)-4-фенилпиперидин-4 карбоновой кислоты. К раствору 4-фенилпиперидин-4-карбоновой кислоты из стадии А (0,74 г, 3,1 ммоль) в изопропаноле (10 мл) добавляли 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин (0,52 г, 3,1 ммоль) и триэтиламин (1,0 мл, 9,8 ммоль). Реакционную смесь нагревали при 180 С в течение 180 мин при микроволновых условиях и затем концентрировали под вакуумом. Осадок растворяли в ледяной воде и нейтрализовали до рН 4 с помощью добавления 1 н. водн. HCl. Продукт выделяли с помощью фильтрования и высушивали под вакуумом в течение 3 ч при 65 С с получением указанного в заголовке соединения (62%) в виде коричневого твердого вещества. MS (ES+) [М+Н]+ = 336.C. Получение N-(3-трет-бутилфенил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-фенилпиперидин-4-карбоксамида. К раствору 1-(5-метил-4,7-дигидро-3H-пирроло[2,3-d]пиримидин-4-ил)-4-фенилпиперидин-4-карбоновой кислоты из стадии В (33 мг, 0,1 ммоль) в ДМФ (2 мл) добавляли 3-трет-бутиланилин (15 мг, 1,0 ммоль), ВОР (50 мг, 0,11 ммоль) и триэтиламин (0,04 мл, 0,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч и продукт амида выделяли с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения. 1A. Получение трет-бутил-4-аллил-4-(3-хлорфенилкарбамоил)пиперидин-1-карбоксилата. Под атмосферой N2 4-аллил-1-(трет-бутоксикарбонил)пиперидин-4-карбоновую кислоту (0,158 г,0,586 ммоль), пиридин (0,189 мл, 2,34 ммоль) и ДМФ (3 капли) растворяли в CH2Cl2 (10 мл) и охлаждали на ледяной бане. К охлажденному раствору по каплям добавляли оксалилхлорид (0,056 мл, 0,645 ммоль). Реакцию перемешивали в течение 40 мин, после этого времени добавляли 3-хлоранилин (0,061 мл, 0,586 ммоль). Реакцию удаляли из ледяной бани и перемешивали при комнатной температуре в течение ночи. Неочищенную реакционную смесь промывали 1 н. водн. HCl и солевым раствором, высушивали надMgSO4 и концентрировали под вакуумом. Осадок очищали с помощью колоночной хроматографии на силикагеле (градиент этилацетат/гексан) с получением указанного в заголовке соединения с выходом 51%. MS (ES+) [М+Н]+ = 379.(0,172 г, 0,453 ммоль) в МеОН (10 мл) добавляли 4 М HCl в диоксане (0,340 мл, 1,36 ммоль). Реакцию нагревали при 50 С в течение 30 мин и затем концентрировали под вакуумом, повторно растворяли в МеОН и повторно концентрировали дважды с получением указанного в заголовке соединения в виде соли гидрохлорида. MS (ES+) [М+Н]+ = 279. С. Получение 4-аллил-N-(3-хлорфенил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин 4-карбоксамида. 4-Аллил-А-(3-хлорфенил) пиперидин-4-карбоксамид из стадии В (0,142 г, 0,453 ммоль), 4-хлор-5 метил-7H-пирроло[2,3-d] пиримидин (0,075 г, 0,453 ммоль), N,N-диизопропилэтиламин (0,236 мл, 1,35 ммоль) и изопропанол (5 мл) объединяли и нагревали при 120 С в течение ночи в сосуде под давлением. Неочищенную реакционную смесь растворяли в CH2Cl2, промывали Н 2 О и солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом. Осадок очищали с помощью колоночной хроматографии на силикагеле (градиент МеОН:CH2Cl2) с получением указанного в заголовке соединения с выходом 61%. 1 А. Получение 4-метилпиперидин-4-карбоновой кислоты. 1-(трет-Бутоксикарбонил)-4-метилпиперидин-4-карбоновую кислоту (0,500 г, 2,06 ммоль) обрабатывали с 4 М HCl в диоксане (10 мл) в течение 2 ч при комнатной температуре с получением указанного в заголовке соединения (0,294 г, 100%) в виде соли гидрохлорида. MS (ES+) [М+Н]+ = 144,0.B. Получение 4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоновой кислоты. К раствору 4-хлор-5-метил-7H-пирроло[2,3-d] пиримидина (0,274 г, 1,64 ммоль) в изопропаноле (10 мл) добавляли 4-метилпиперидин-4-карбоновую кислоту хлористо-водородную кислоту из стадии А(0,294 г, 1,64 ммоль) и триэтиламин (0,654 мл, 4,92 ммоль). Реакцию нагревали при 180 С в течение 1 ч при микроволновых условиях, концентрировали, поглощали ледяной водой и нейтрализовали при рН 3 с помощью 6 н. водн. HCl для осаждения продукта. Продукт собирали с помощью фильтрования и высушивали под вакуумом в течение ночи с получением указанного в заголовке соединения (0,42 г, 75%) в виде серого твердого вещества. MS (ES+) [М+Н]+ = 275,2.C. Получение N-(3-метоксифенил)-4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоксамида. К раствору 4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбновой кислоты из стадии В (0,020 г, 0,073 ммоль) в ДМФ (1 мл) добавляли реактив ВОР (0,065 г, 0,15 ммоль), триэтиламин (0,019 мл, 0,15 ммоль) и 3-метоксианилин (0,012 мл, 0,11 ммоль). Реакцию перемешивали в течение ночи и затем концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения (0,091 г, 33%). 1 Н ЯМР (CD3OD):8,07 (1 Н, уш.с), 7,00-7,17 (3 Н, м), 6,89 (1 Н, с), 6,58-6,61 (1 Н, с), 3,62-3,72 (5 Н,м), 3,22-3,34 (2 Н, м), 2,12-2,33 (5 Н, м), 1,62-1,71 (2 Н, м), 1,29 (3 Н, с); MS (ES+) [М+Н]+ = 380,1. 6.7. Пример 7. Синтез 4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-N-п-толилпиперидин-4-карбоксамида. К раствору 4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоновой кислоты из примера 6, стадии В (0,020 г, 0,073 ммоль) в ДМФ (1 мл) добавляли реактив ВОР (0,065 г, 0,15 ммоль), триэтиламин (0,019 мл, 0,15 ммоль) и 4-метиланилин (0,012 мл, 0,11 ммоль). Реакцию перемешивали в течение ночи и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения (0,0133 г, 50%). 1 К раствору 4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоновой кислоты из примера 6, стадии В (0,030 г, 0,11 ммоль) в ДМФ (1 мл) добавляли HATU (0,042 г, 0,11 ммоль),триэтиламин (0,028 мл, 0,22 ммоль) и 3-амино-N-изопропилбензамид (0,029 мг, 0,17 ммоль). Реакцию перемешивали при 50 С в течение 48 ч и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения (0,023 г, 48%). 1 Н ЯМР (CD3OD):8,19 (1 Н, с), 7,99 (1 Н, м), 7,7-7,72 (1 Н, м), 7,56-7,58 (1 Н, м), 7,41-7,43 (1 Н, J=8 Гц и 15,6 Гц, дд), 7,00 (1 Н, J=0,8 Гц, д), 4,20-4,23 (1 Н, м), 3,79-3,85 (2 Н, м), 3,36-3,46 (2 Н, м), 2,38-2,44A. Получение трет-бутил-4-(3-трет-бутилфенилкарбамоил)-4-метилпиперидин-1-карбоксилата. К раствору 1-(трет-бутоксикарбонил)-4-метилпиперидин-4-карбоновой кислоты (0,30 г, 1,2 ммоль),ДМФ (20 капель) и пиридина (0,38 г, 4,8 ммоль) в дихлорэтане (10 мл) добавляли оксалилхлорид (0,15 г,1,2 ммоль). Смесь перемешивали в течение 40 мин и добавляли 3-трет-бутиланилин. Смесь перемешивали в течение 1 ч, разбавляли дихлорметаном, промывали дважды каждый раз нас. водн. NaHCO3 и 1,0 н. водн. HCl, высушивали над MgSO4 и концентрировали. Хроматография на силикагеле (0-2%B. Получение N-(3-трет-бутилфенил)-4-метилпиперидин-4-карбоксамида. трет-Бутил-4-(3-трет-бутилфенилкарбамоил)-4-метилпиперидин-1-карбоксилат из стадии А (0,4 г,1,07 ммоль) обрабатывали HCl (4,0 н в диоксане, 1,3 мл, 5,34 ммоль) в метаноле (5,0 мл) при 50 С в течение 30 мин. Смесь концентрировали с получением указанного в заголовке соединения в виде соли гидрохлорида с количественным выходом. MS (ES+) [М+Н] + = 275.N-(3-трет-Бутилфенил)-4-метилпиперидин-4-карбоксамид из стадии В (0,33 г, 1,07 ммоль), 4-хлор 5-метил-7H-пирроло[2,3-d] пиримидин (0,18 г, 1,07 ммоль), N,N-диизопропилэтиламин (0,69 г, 5,34 ммоль) и изопропанол (7 мл) объединяли в запаянную трубку высокого давления и нагревали при 100 С в течение 18 ч. Смесь концентрировали и поглощали дихлорметаном, из которого собирали осадок (0,18 г). Раствор подвергали хроматографии (SiO2, 0-2% MeOH:CH2Cl2) и материал из колонки (0,15 г) объединяли с осадком и растворяли в метаноле (15 мл) при 60 С. Добавляли воду (5,0 мл) и смесь охлаждали. Результирующий осадок отфильтровывали, промывали водой и высушивали с получением указанного в заголовке соединения с выходом 50%. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 11,51 (с, 1 Н), 9,31 (с, 1 Н), 8,19 (с, 1 Н), 7,62 (с, 1 Н), 7,59 (д, J=8,0 Гц, 1 Н), 7,22 (т, J=8 Гц и 16 Гц, 1 Н), 7,08 (д, J=8,0 Гц, 1 Н), 3,63-3,68 (м, 2 Н), 3,28-3,33 (м, 2 Н), 2,36 (с,3 Н), 2,25-2,29 (м, 2 Н), 1,63-1,68 (м, 2 Н), 1,31 (с, 3 Н), 1,27 (с, 9 Н); MS (ES+) [М+Н]+ = 406. 6.10. Пример 10. Синтез 4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-N-(3-(оксазол-5 ил)фенил)пиперидин-4-карбоксамида А. Получение трет-бутил-4-метил-4-(3-(оксазол-5-ил)фенилкарбамоил)пиперидин-1-карбоксилата. К раствору 1-(трет-бутоксикарбонил)-4-метилпиперидин-4-карбоновой кислоты (61,3 мг, 0,2 52 ммоль) и пиридина (79,7 мг, 0,08 мл, 1,01 ммоль) в 1,2-дихлорэтане (2 мл) при 0 С добавляли ДМФ (1-2 капли) с последующим добавлением оксалилхлорида (31,9 мг, 0,022 мл, 0,252 ммоль). Реакцию перемешивали в течение 0,5 ч и добавляли 3-(оксазол-5-ил)анилин (40,4 мг, 0,252 ммоль). Реакцию перемешивали в течение еще 1,5 ч. Смесь разбавляли этилацетатом (10 мл) и органические вещества промывали 0,1 н. HCl (210 мл), солевым раствором (4 мл), высушивали над MgSO4, отфильтровывали и концентрировали с получением указанного в заголовке соединения, которое использовали в следующей стадии без дальнейшей очистки. MS (ES+) [М+Н]+ = 386,2.B. Получение 4-метил-N-(3-(оксазол-5-ил)фенил)пиперидин-4-карбоксамида. К раствору трет-бутил-4-метил-4-(3-(оксазол-5-ил)фенилкарбамоил)пиперидин-1-карбоксилата из стадии А (77,7 мг, 0,202 ммоль) в метаноле (3 мл) добавляли HCl (4,0 н. в диоксане, 0,4 мл, 1,6 ммоль). Реакцию перемешивали в течение 15 ч и затем концентрировали досуха с получением указанного в заголовке соединения в виде соли гидрохлорида. MS (ES+) [М+Н]+ = 286,2.C. Получение 4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-N-(3-(оксазол-5-ил)фенил) пиперидин-4-карбоксамида. В сосуд под давлением загружали раствор 4-метил-N-(3-(оксазол-5-ил)фенил)пиперидин-4 карбоксамида гидрохлорида из стадии В (51,9 мг, 0,17 ммоль) и изопропанола (3 мл) и к этому раствору добавляли 4-хлор-5-метил-7H-пирроло[2,3-d] пиримидин (55,0 мг, 0,329 ммоль) и N,Nдиизопропилэтиламин (297,9 мг, 0,40 мл, 2,31 ммоль). Сосуд герметизировали и реакцию нагревали до 105 С в течение 15 ч. Реакцию обрабатывали с помощью обычных средств и осадок очищали с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения в виде белого твердого вещества с желтоватым или сероватым оттенком. 1A. Получение трет-бутил 4-метил-4-(3-сульфамоилфенилкарбамоил)пиперидин-1-карбоксилата. К раствору 1-(трет-бутоксикарбонил)-4-метилпиперидин-4-карбоновой кислоты (60 мг, 0,25 ммоль) в дихлорэтане (2,0 мл) добавляли ДМФ (2 капли) и пиридин (78 мг, 0,99 ммоль) с последующим добавлением оксалилхлорида (31 мг, 0,25 ммоль). Смесь перемешивали в течение 40 мин и добавляли 3 аминобензолсульфонамид. Смесь нагревали при 50 С в течение 3 ч и охлаждали, разбавляли дихлорметаном, промывали два раза каждый раз нас. водн. NaHCO3 и 1,0 н. водн. HCl, высушивали над MgSO4 и концентрировали. Хроматография на силикагеле (2-5% МеОН:CH2Cl2) давала указанное в заголовке соединение с выходом 40%. MS (ES+) [М+Н]+ = 398.B. Получение 4-метил-N-(3-сульфамоилфенил) пиперидин-4-карбоксамида. трет-Бутил-4-метил-4-(3-сульфамоилфенилкарбамоил)пиперидин-1-карбоксилат из стадии А (39 мг,0,098 ммоль) обрабатывали HCl (4,0 н в диоксане, 98 мкл, 0,39 ммоль) в метаноле (1,0 мл) при 50 С в течение 45 мин. Смесь концентрировали с получением указанного в заголовке соединения в виде соли гидрохлорида с количественным выходом. MS (ES+) [М+Н]+ = 298.C. Получение 4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-N-(3-сульфамоилфенил)пиперидин-4-карбоксамида. 4-Метил-N-(3-сульфамоилфенил)пиперидин-4-карбоксамид из стадии В (33 мг, 0,098 ммоль), 4 хлор-5-метил-7H-пирроло[2,3-d]пиримидин (16 мг, 0,098 ммоль), N,N-диизопропилэтиламин (51 мг, 0,39 ммоль) и изопропанол (1,0 мл) объединяли в запаянную трубку высокого давления и нагревали при 105 С в течение 18 ч. Смесь концентрировали и осадок очищали с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения с выходом 21%. 1 карбоксилата. К раствору 1-(трет-бутоксикарбонил)-4-метилпиперидин-4-карбоновой кислоты (100 мг, 0,41 ммоль) в дихлорэтане (2,0 мл) добавляли ДМФ (2 капли) и пиридин (0,13 г, 1,6 ммоль) с последующим добавлением оксалилхлорида (57 мг, 0,45 ммоль). Смесь перемешивали в течение 40 мин и добавляли 3(1H-тетразол-5-ил)фениламин. Смесь перемешивали в течение 2 ч и образовывался розовый осадок. Смесь отфильтровывали и фильтрат промывали 1,0 н. водн. HCl и солевым раствором, высушивали надN-(3-(1H-тетразол-5-ил)фенил)-4-метилпиперидин-4-карбоксамид из стадии В (93 мг, 0,29 ммоль),4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин (49 мг, 0,29 ммоль), N,N-диизопропилэтиламин (0,19 г,1,45 ммоль), изопропанол (4,0 мл) и ДМСО (0,5 мл) объединяли в запаянную трубку высокого давления и нагревали при 105 С в течение 18 ч. Смесь концентрировали и осадок очищали с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения с выходом 4,3%. 1 А. Получение трет-бутил 4-(3-(диметилкарбамоилокси)фенилкарбамоил)-4-метилпиперидин-1 карбоксилата. 1-(трет-Бутоксикарбонил)-4-метилпиперидин-4-карбоновую кислоту (67 мг, 0,28 ммоль), EDC (64 мг, 0,33 ммоль), НОВТ (45 мг, 0,33 ммоль) и дихлорэтан (2,0 мл) объединяли в запаянную трубку высокого давления и перемешивали в течение 45 мин. Добавляли 3-аминофенилдиметилкарбамат (50 мг, 0,28 ммоль) и смесь нагревали при 85 С в течение 18 ч. Смесь концентрировали и подвергали хроматографииB. Получение 3-(4-метилпиперидин-4-карбоксамидо)фенилдиметилкарбамата. трет-Бутил 4-(3-(диметилкарбамоилокси)фенилкарбамоил)-4-метилпиперидин-1-карбоксилат из стадии А (56 мг, 0,138 ммоль) обрабатывали HCl (4,0 н. в диоксане, 0,17 мл, 0,69 ммоль) в метаноле (2,0 мл) при 40 С в течение 3 ч. Смесь концентрировали с получением указанного в заголовке соединения в виде соли гидрохлорида с количественным выходом. MS (ES+) [М+Н]+ = 306.C. Получение 3-(4-метил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. 3-(4-метилпиперидин-4-карбоксамидо)фенилдиметилкарбамат из стадии В (47 мг, 0,14 ммоль), 4 хлор-5-метил-7H-пирроло[2,3-d]пиримидин (23 мг, 0,138 ммоль), N,N-диизопропилэтиламин (54 мг, 0,41 ммоль), и изопропанол (1,0 мл) объединяли в запаянную трубку высокого давления и нагревали при 100 С в течение 18 ч. Смесь концентрировали и осадок очищали с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения с выходом 53%. 1 Н ЯМР (400 МГц, CD3OD)м.д. 8,18 (с, 1 Н), 7,50 (с, 1 Н), 7,42-7,44 (д, J=8 Гц, 1 Н), 7,34 (т, J=8 и 16 Гц, 1 Н), 7,0 (с, 1 Н), 6,87-6,89 (м, 1 Н), 3,79-3,85 (м, 2 Н), 3,37-3,44 (м, 2 Н), 3,14 (с, 1 Н), 3,01 (с, 3 Н), 2,44 (с,3 Н), 2,36-2,40 (м, 2 Н), 1,75-1,81 (м, 2 Н), 1,40 (с, 3 Н); MS (ES+) [М+Н]+ = 437. 6.14. Пример 14. Синтез 3-(4-бензил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4 карбоксамидо)фенилдиметилкарбаматаA. Получение трет-бутил-4-бензил-4-(3-(диметилкарбамоилокси)фенилкарбамоил)пиперидин-1 карбоксилата. Под атмосферой N2 4-бензил-1-(трет-бутоксикарбонил)пиперидин-4-карбоновую кислоту (0,2 г,0,626 ммоль), пиридин (0,202 мл, 2,5 ммоль) и ДМФ (3 капли) растворяли в CH2Cl2 (10 мл) и охлаждали на ледяной бане. К охлажденному раствору по каплям добавляли оксалилхлорид (0,06 мл, 0,688 ммоль). Реакцию затем удаляли из ледяной бани и перемешивали при комнатной температуре в течение 30 мин. Реакцию повторно охлаждали на ледяной бане и добавляли одну часть 3-аминофенилдиметилкарбамата(0,112 г, 0,626 ммоль). Реакцию перемешивали в течение ночи и затем промывали 1 н. водн. HCl и солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом. Осадок очищали с помощью хроматографии на силикагеле (градиент этилацетат:гексан) с получением указанного в заголовке соединения с выходом 54%. MS (ES+) [M+NH4]+ = 500.B. Получение 3-(4-бензилпиперидин-4-карбоксамидо)фенилдиметилкарбамата. К раствору трет-бутил-4-бензил-4-(3-(диметилкарбамоилокси)фенилкарбамоил)пиперидин-1 карбоксилата из стадии А (0,162 г, 0,336 ммоль) в МеОН (5 мл) добавляли 4 М HCl в диоксане (0,250 мл,1,00 ммоль). Реакцию нагревали при 50 С в течение 1 ч и затем концентрировали под вакуумом, повторно растворяли в МеОН и повторно дважды концентрировали с получением указанного в заголовке соединения в виде соли гидрохлорида. MS (ES+) [М+Н]+ = 382.BOMCl (0,6 г, 3,88 ммоль). Реакцию оставляли нагреваться до комнатной температуры и затем гасили водн. NH4Cl. Водный слой экстрагировали EtOAc и органический экстракт промывали солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом. Осадок очищали с помощью флэшхроматографии (80 г SiO2, 0-10% этилацетат:гексан) с получением указанного в заголовке соединенияB. Получение 4-(бензилоксиметил)-1-(трет-бутоксикарбонил)пиперидин-4-карбоновой кислоты. 1-трет-Бутил-4-этил-4-(бензилоксиметил)пиперидин-1,4-дикарбоксилат из стадии А (0,500 г, 1,3 ммоль) растворяли в 1 н водн. LiOH (15 мл) и ТГФ (10 мл) и нагревали при 50 С в течение 24 ч. Реакционную смесь подкисляли 1 н. HCl и экстрагировали Et2O. Органический экстракт промывали солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом с получением указанного в заголовке соединения (0,3 г, 65%). MS (ES+) [М+Н]+ = 349.C. Получение трет-бутил-4-(бензилоксиметил)-4-(3-(диметилкарбамоилокси)фенилкарбамоил)пиперидин-1-карбоксилата. К раствору 4-(бензилоксиметил)-1-(трет-бутоксикарбонил)пиперидин-4-карбоновой кислоты из стадии В (0,3 г, 0,85 ммоль) в изопропилацетате (10 мл) добавляли N,N-диизопропилэтиламин (0,165 мл,0,94 ммоль) и НАТО (0,94 ммоль). Реакцию нагревали при 85 С в течение 30 мин и к смеси добавляли 3 аминофенилдиметилкарбамат. Реакцию нагревали при 85 С в течение 2 ч, затем обрабатывали с помощью стандартных методик. Продукт выделяли с помощью флэш-хроматографии (40 г SiO2, 0-30% этилацетат:гексан) с получением указанного в заголовке соединения (0,25 г, 57%). MS (ES+) [М+Н]+ = 512.D. Получение 3-(4-(бензилоксиметил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. трет-Бутил-4-(бензилоксиметил)-4-(3-(диметилкарбамоилокси)фенилкарбамоил)пиперидин-1 карбоксилат из стадии С (0,25 г, 0,49 ммоль) растворяли в изопропаноле, обрабатывали 4 н. HCl и пере- 13019488 мешивали в течение двух часов. Реакционную смесь доводили до рН 7-8 с помощью NaHCO3 и затем экстрагировали Et2O. Органические экстракты концентрировали под вакуумом с получением указанного в заголовке соединения (0,2 г, 100%). MS (ES+) [М+Н]+ = 412. Е. Получение 3-(4-(бензилоксиметил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4 карбоксамидо)фенилдиметилкарбамата. К раствору 3-(4-(бензилоксиметил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата из стадииD (0,2 г, 0,49 ммоль) в изопропаноле (5 мл) добавляли N,N-диизопропилэтиламин (0,167 мл, 0,98 ммоль) и 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин (0,08 г, 0,49 ммоль). Реакцию нагревали при 85 С в течение ночи, разбавляли EtOAc, промывали солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом. Осадок очищали с помощью флэш-хроматографии (40 г SiO2, 0-80% этилацетат:гексан) с получением указанного в заголовке соединения (0,1 г, 38%). 1 К раствору 3-(4-(бензилоксиметил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4 карбоксамидо)фенилдиметилкарбамата из примера 15, стадии Е (30 мг, 0,055 ммоль) в ТГФ (2 мл) добавляли Pd/C (10%). Реакционную смесь перемешивали под атмосферой Н 2 при 60 фунт/кв. дюйм в течение ночи. Смесь отфильтровывали и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ (30250 мм С 18 колонка, 10-100% MeCN:H2O (10 мМ NH4OAc), 18 мин, 45 мл/мин) с получением указанного в заголовке соединения (1 мг). 1-78 С под атмосферой азота добавляли по каплям LDA (1,5 М в ТГФ, 4,0 мл, 6,10 ммоль). Этот раствор перемешивали в течение 1 ч при -78 С, после этого добавляли метоксиметилхлорид (0,8 мл, 10,5 ммоль). Систему оставляли нагреваться до комнатной температуры более чем 2 ч. Реакцию гасили водным NH4Cl и экстрагировали этилацетатом (350 мл). Органический слой высушивали над подкладкой из силикагеля и растворитель удаляли под вакуумом. Указанное в заголовке соединение выделяли с помощью хроматографии на силикагеле (5-10% этилацетат:гексан) в виде светлого маслянистого вещества (830 мг,69% выход). MS (ES+) [М+Н]+ = 302,4.B. Получение 1-(трет-бутоксикарбонил)-4-(метоксиметил)-пиперидин-4-карбоновой кислоты. К раствору 1-трет-бутил-4-этил-4-(метоксиметил)пиперидин-1,4-дикарбоксилата из стадии А (732 мг, 2,63 ммоль) в 1:2 этанол/вода (9 мл) добавляли лития гидроксид моногидрат (700 мг). Смесь нагревали при 75 С в течение 1 ч. Реакцию охлаждали до комнатной температуры и выливали в 50 мл нас. водн.NaHSO4. Водный слой экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом с получением указанного в заголовке соединения в виде вязкого желтого маслянистого вещества, которое переносили в следующую стадию без дополнительной очистки. MS (ES+) [М+Н]+ = 274,2. С. Получение трет-бутил-4-(3-(диметилкарбамоилокси)фенилкарбамоил)-4-(метоксиметил)пиперидин-1-карбоксилата. К раствору 1-(трет-бутоксикарбонил)-4-(метоксиметил)пиперидин-4-карбоновой кислоты из стадии В (718 мг, 2,63 ммоль), пиридина (0,84 мл, 10,52 ммоль) и ДМФ (каталитическое количество, 3 капли) вCH2Cl2 (13 мл) добавляли по каплям оксалилхлорид (0,25 мл, 2,89 ммоль, осторожно: реакция экзотерми- 14019488 ческая). После прекращения выделения газа реакцию перемешивали при температуре окружающей среды в течение 30 мин. К этому раствору добавляли одну часть 3-аминофенилдиметилкарбамата (475 мг,2,63 ммоль) и перемешивали в течение еще 30 мин. Реакцию гасили насыщенным водным NH4Cl и водный слой экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали солевым раствором, высушивали над MgSO4, отфильтровывали и концентрировали под вакуумом. Хроматография на силикагеле (50% этилацетат:гексан) давала указанное в заголовке соединение (1,03 г, 90% выход за две стадии). MS (ES+) [M+NH]+ = 453,3D. Получение 3-(4-(метоксиметил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. К раствору трет-бутил-4-(3-(диметилкарбамоилокси)фенилкарбамоил)-4-(метоксиметил)пиперидин-1-карбоксилата из стадии С (1,03 г, 2,37 ммоль) в метаноле (10 мл) добавляли HCl (4 М раствор в диоксане, 2 мл). Реакцию нагревали при 50 С в течение 1 ч и затем концентрировали под вакуумом с получением указанного в заголовке соединения в виде соли гидрохлорида. MS (ES + ) [М+Н]+ = 336,3. Е. Получение 3-(4-(метоксиметил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4 карбоксамидо)фенилдиметилкарбамата. К раствору 3-(4-(метоксиметил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата из стадии D иN,N-диизопропилэтиламина (2 мл, 11,9 ммоль) в изопропаноле (5 мл) добавляли 4-хлор-5-метил-7Hпирроло[2,3-d]пиримидин (397 мг, 2,37 ммоль). Реакционную смесь нагревали при 110 С в запаянной виале под высоким давлением в течение 17 ч, в течение этого времени смесь стала гомогенной. Реакцию концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле (3-5% метанол:CH2Cl2). Продукт промывали холодным метанолом с получением указанного в заголовке соединения в виде белого с желтоватым или сероватым оттенком твердого вещества (462 мг, 42% выход). 1 А. Получение 1-трет-бутил-4-этил-4-2-метоксиэтокси)метил)пиперидин-1,4-дикарбоксилата. К раствору 1-трет-бутил-4-этилпиперидин-1,4-дикарбоксилата (2,0 г, 7,8 ммоль) в ТГФ (70 мл) при 78 С по каплям добавляли LDA более чем 8 мин, поддерживая температуру ниже -75 С. Смесь перемешивали при -78 С в течение 1 ч. По каплям добавляли 1-хлорметокси-2-метоксиэтан (0,97 г, 7,8 ммоль),поддерживая температуру ниже -75 С. Смесь перемешивали при -78 С в течение 3 ч и затем медленно нагревали до комнатной температуры в течение ночи. Смесь гасили нас. водн. NH4Cl и экстрагировали 3 раза EtOAc. Органические вещества объединяли, промывали солевым раствором, высушивали надMgSO4 и концентрировали. Хроматография на силикагеле (10-20% этилацетат:гексан) давала указанное в заголовке соединение с выходом 67%. MS (ES+) [M+Н]+ = 346.B. Получение 1-(трет-бутоксикарбонил)-4-(2-метоксиэтокси)пиперидин-4-карбоновой кислоты. 1-трет-Бутил-4-этил-4-2-метоксиэтокси)метил)пиперидин-1,4-дикарбоксилат из стадии А (1,78 г,5,15 ммоль) обрабатывали LiOH (0,62 г, 26 ммоль) в этаноле (12 мл) и воде (24 мл) при 80 С в течение 18 ч. Смесь охлаждали, разбавляли дихлорметаном и промывали нас. водн. NaHSO4. Водные фазы снова экстрагировали дихлорметаном (3) и органические вещества объединяли, промывали солевым раствором, высушивали над MgSO4 и концентрировали с получением указанного в заголовке соединения с количественным выходом. MS (ES+) [М+Н]+ = 318.C. Получение трет-бутил-4-(3-(диметилкарбамоилокси)фенилкарбамоил)-4-(2-метоксиэтокси)пиперидин-1-карбоксилата. К раствору 1-(трет-бутоксикарбонил)-4-(2-метоксиэтокси)пиперидин-4-карбоновой кислоты из стадии В (1,6 г, 5,1 ммоль) в дихлорэтане добавляли пиридин (1,6 г, 20 ммоль) и ДМФ (0,05 мл) с последующим добавлением оксалилхлорида (0,65 г, 5,1 ммоль). Смесь перемешивали в течение 30 мин и затем добавляли 3-аминофенилдиметилкарбамат (0,91 г, 5,04 ммоль). Смесь перемешивали в течение 18 ч, затем разбавляли дихлорметаном, промывали дважды 1 н. водн. HCl и один раз солевым раствором, высушивали над MgSO4 и концентрировали. Хроматография на силикагеле (0-5% МеОН:CH2Cl2) давала указанное в заголовке соединение с выходом 88%. MS (ES+) [М+Н]+ = 480. карбоксилат из стадии С (2,1 г, 4,4 ммоль) обрабатывали HCl (4,0 н. в диоксане, 5,5 мл, 22 ммоль) в метаноле (20 мл) при 50 С в течение 30 мин. Смесь концентрировали с получением указанного в заголовке соединения в виде соли гидрохлорида с количественным выходом. MS (ES+) [М+Н]+ = 380. Е. Получение 3-(4-2-метоксиэтокси)метил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. 3-(4-(2-Метоксиэтокси)пиперидин-4-карбоксамидо)фенил-диметилкарбамат из стадии D (1,82 г,4,38 ммоль), 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин (0,73 г, 4,4 ммоль), N,N-диизопропилэтиламин (2,8 г, 22 ммоль) и изопропанол (50 мл) объединяли в запаянную трубку высокого давления и нагревали при 115 С в течение 18 ч. Смесь концентрировали и подвергали хроматографии (SiO2, 0-5%A. Получение 1-трет-бутил-4-метил-4-бензилоксикарбониламино)метил)пиперидин-1,4 дикарбоксилата. К раствору 1-трет-бутил-4-метил-4-(аминометил)пиперидин-1,4-дикарбоксилата (0,300 г, 1,1 ммоль) и N,N-диизопропилэтиламина (0,229 мл, 1,32 ммоль) в CH2Cl2 (5 мл) при 0 С добавляли бензилхлорформиат. Реакцию перемешивали в течение ночи и затем разбавляли CH2Cl2 и промывали Н 2 О и солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом. Осадок очищали с помощью хроматографии на силикагеле (градиент EtOAc:гексан) с получением указанного в заголовке соединения с выходом 82%. MS (ES+) [M+Н]+ = 407.B. Получение 4-бензилоксикарбониламино)метил)-1-(трет-бутоксикарбонил)пиперидин-4 карбоновой кислоты. К раствору 1-трет-бутил-4-метил-4-бензилоксикарбониламино)метил)пиперидин-1,4 дикарбоксилата из стадии А в метаноле (5 мл) добавляли 1 н водн. NaOH (0,615 мл, 0,615 ммоль). Реакцию нагревали при 50 С в течение ночи, подкисляли до рН 5 с помощью 1 н. водн. HCl и экстрагировали 3CH2Cl2. Объединенные органические экстракты промывали солевым раствором, высушивали надNa2SO4 и концентрировали под вакуумом с получением указанного в заголовке соединения, которое переносили в неочищенном виде. MS (ES+) [М+Н]+ = 393.C. Получение трет-бутил-4-бензилоксикарбониламино)метил)-4-(3-(диметилкарбамоилокси)фенилкарбамоил)пиперидин-1-карбоксилата. Под атмосферой N2 4-бензилоксикарбониламино)метил)-1-(трет-бутоксикарбонил)пиперидин-4 карбоновую кислоту (0,240 г, 0,611 ммоль) из стадии В, пиридин (0,197 мл, 2,44 ммоль) и ДМФ (3 капли) растворяли в CH2Cl2 (10 мл) и охлаждали на ледяной бане. Оксалилхлорид (0,064 мл, 0,733 ммоль) добавляли по каплям к раствору. Реакцию затем удаляли из ледяной бани и перемешивали при комнатной температуре в течение 30 мин. Реакцию повторно охлаждали в ледяной бане и добавляли одну часть 3 аминофенилдиметилкарбамата (0,110 г, 0,611 ммоль). Реакцию перемешивали в течение ночи и затем промывали 1 н. водн. HCl и солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом. Осадок очищали с помощью хроматографии на силикагеле (градиент этилацетат:гексан) с получением указанного в заголовке соединения с выходом 72%. MS (ES+) [M+NH4]+ = 573.HCl в диоксане (0,331 мл, 1,32 ммоль). Реакцию нагревали при 50 С в течение 1 ч и затем концентрировали под вакуумом, повторно растворяли в МеОН и повторно концентрировали дважды с получением указанного в заголовке соединения в виде соли гидрохлорида. MS (ES+) [М+Н]+ = 455. Е. Получение 3-(4-бензилоксикарбониламино)метил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4- 16019488 ил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. 3-(4-Бензилоксикарбониламино)метил)пиперидин-4-карбоксамидо)фенилдиметилкарбамат (0,216 г, 0,441 ммоль) из стадии D, 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин (0,073 г, 0,441 ммоль), N,Nдиизопропилэтиламин (0,230 мл, 1,32 ммоль) и изопропанол (5 мл) объединяли и нагревали при 120 С в течение ночи в сосуде под давлением. Неочищенную реакционную смесь разбавляли CH2Cl2 и промывали Н 2 О и солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом. Осадок очищали с помощью хроматографии на силикагеле (градиент MeOH:CH2Cl2) с получением указанного в заголовке соединения с выходом 54%. 1 3-(4-Бензилоксикарбониламино)метил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин 4-карбоксамидо)фенилдиметилкарбамат (0,140 г, 0,239 ммоль) из примера 19, стадии Е, Pd/C (10% Pd/C,Pearlman) и метанол (5 мл) объединяли и гидрировали в течение ночи при 1 атмосфере. Реакцию отфильтровывали через целит, концентрировали под вакуумом и очищали с помощью нейтральной фазы препаративной ВЭЖХ с получением указанного в заголовке соединения в виде соли ацетата с выходом 52%. 1 К раствору соли ацетата 3-(4-(аминометил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата из примера 20 (14 мг, 0,027 ммоль), уксусной кислоты (6,2 мкл, 0,11 ммоль) и NaBH3CN (2,1 мг, 0,034 ммоль) добавляли формальдегид (37% в Н 2 О, 48 мкл, 0,064 ммоль). Реакцию перемешивали в течение ночи, затем концентрировали и осадок очищали с помощью препаративной ВЭЖХ (30100 мм С 18 колонка, 5-70% MeCN: Н 2 О (10 мМ NH4OAc), 12 мин, 4 5 мл/мин) и лиофилизировали с получением указанного в заголовке соединения (8 мг, 0,014 ммоль, 57%) в виде соли ацетата. 1-78 С добавляли по каплям LDA (1,5 М в циклогексане, 2 мл, 3 ммоль). После перемешивания в течение 30 мин добавляли 2-бром-N,N-диметилэтанамин (370 мг, 2,4 ммоль) в ТГФ (3 мл). Реакцию перемешивали в течение 30 мин при -78 С, затем оставляли нагреваться до комнатной температуры, перемешивали в течение 2 ч, затем гасили нас. водн. NaHCO3, разбавляли EtOAc, промывали нас. водн. NaHCO3 и соле- 17019488 вым раствором (с обратной экстракцией), высушивали над MgSO4 и концентрировали под вакуумом. Осадок очищали с помощью флэш-хроматографии (40 г SiO2, 0-15% MeOH:CH2Cl2) с получением указанного в заголовке соединения (328 мг, 1,0 ммоль, 50%) в виде желтого маслянистого вещества. MSB. Получение 1-(трет-бутоксикарбонил)-4-(2-(диметиламино)этил)пиперидин-4-карбоновой кислоты. 1-трет-Бутил-4-этил-4-(2-(диметиламино)этил)пиперидин-1,4-дикарбоксилат из стадии А (328 мг,1,0 ммоль) обрабатывали в течение ночи лития гидроксидом моногидратом (210 мг, 5 ммоль) в 1:1EtOH:H2O (5 мл) при 60 С. Реакцию охлаждали до комнатной температуры, нейтрализовали до рН 6 с помощью 1 н. водн. HCl и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ и лиофилизировали дважды с получением указанного в заголовке соединения (191 мг, 64%) в виде белого твердого вещества. MS (ES+) [М+Н]+ = 301.C. Получение трет-бутил-4-(2-(диметиламино)этил)-4-(3-(диметилкарбамоилокси)фенилкарбамоил) пиперидин-1-карбоксилата. 1-(трет-Бутоксикарбонил)-4-(2-(диметиламино)этил)пиперидин-4-карбоновую кислоту из стадии В(100 мг, 0,33 ммоль), HATU (175 мг, 0,46 ммоль) и N,N-диизопропилэтиламин (0,116 мл, 0,67 ммоль) перемешивали в изопропилацетате в течение 10 мин. Добавляли 3-аминофенилдиметилкарбамат (90 мг,0,5 ммоль) и реакцию перемешивали при 85 С в течение 2 ч, охлаждали до комнатной температуры, перемешивали в течение ночи и затем разбавляли EtOAc, промывали нас. водн. Na2CO3 и солевым раствором (с обратной экстракцией), высушивали над MgSO4, отфильтровывали и концентрировали под вакуумом с получением указанного в заголовке соединения в виде вязкого маслянистого вещества. MS (ES+)D. Получение 3-(4-(2-(диметиламино)этил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. Неочищенный трет-бутил-4-(2-(диметиламино)этил)-4-(3-(диметилкарбамоилокси)фенилкарбамоил)пиперидин-1-карбоксилат из стадии С обрабатывали 1:1 TFA:CH2Cl2 (1,5 мл) в течение 45 мин. Реакцию концентрировали под вакуумом и осадок очищали с помощью препаративной ВЭЖХ (30100 мм С 18 колонка, 0-50% MeOH:H2O (0,1% TFA), 12 мин, 45 мл/мин) и лиофилизировали с получением указанного в заголовке неочищенного соединения (173 мг) в виде соли TFA. MS (ES+) [М+Н]+ = 363. Е. Получение 3-(4-2-(диметиламино)этил-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. Неочищенный 3-(4-(2-(диметиламино)этил)пиперидин-4-карбоксамидо)фенилдиметилкарбамат из стадии D (173 мг) объединяли с 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидином (50 мг, 0,30 ммоль) иN,N-диизопропилэтиламином (0,17 4 мл, 5 ммоль) в изобутаноле (0,4 мл) и нагревали при 110 С в течение 7 ч. Реакцию охлаждали до комнатной температуры и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ (30100 мм С 18 колонка, 10-70% MeCN:H2O (10 мМ NH4OAc),12 мин, 45 мл/мин) и лиофилизировали с получением указанного в заголовке соединения (60 мг) в виде соли диацетата. 1A. Получение 1-трет-бутил-4-этил-4-1-тритил-1H-имидазол-4-ил)метил)пиперидин-1,4-дикарбоксилата. К раствору 1-трет-бутил-4-этилпиперидин-1,4-дикарбоксилата (360 мг, 1,39 ммоль) в безводном ТГФ (10 мл) при -78 С добавляли по каплям LDA (1,7 М в ТГФ, 1,07 мл, 1,8 ммоль) более чем 10 мин. Реакционную смесь перемешивали при -78C в течение 1 ч и медленно добавляли 4-(хлорметил)-1 тритил-1H-имидазол (500 мг, 13,9 ммоль) в ТГФ (5 мл). Реакционную смесь оставляли нагреваться до комнатной температуры более чем 1 ч, подавляли нас. водн. NH4Cl (10 мл) и экстрагировали EtOAc(320 мл). Объединенные органические экстракты промывали солевым раствором, высушивали над Na2SO4,фильтровали и концентрировали под вакуумом. Очистка с помощью хроматографии на силикагеле (1050% EtOAc:гексан) обеспечивала указанное в заголовке соединение (403 мг, 51%). MS (ES+) [М+Н]+ = 580,3.B. Получение 1-(трет-бутоксикарбонил)-4-1-тритил-1H-имидазол-4-ил)метил)пиперидин-4 карбоновой кислоты. К раствору 1-трет-бутил-4-этил-4-1-тритил-1H-имидазол-4-ил)метил)пиперидин-1,4-дикарбоксилата из стадии А (330 мг, 0,57 ммоль) в 1:1:2 ТГФ:МеОН:Н 2 О (10 мл) добавляли LiOH (136 мг, 5,7 ммоль). Смесь нагревали с обратным холодильником, пока ЖХМС не показала полное превращение продукта, затем концентрировали под вакуумом, растворяли в воде (3 мл), нейтрализовали до рН 5-6 водн. NaHSO4 и экстрагировали этилацетатом (310 мл). Объединенные органические фазы промывали солевым раствором, высушивали над Na2SO4 и концентрировали под вакуумом с получением указанного в заголовке соединения (273 мг, 86%). MS (ES+) [М+Н]+ = 552,2.C. Получение трет-бутил-4-(3-(диметилкарбамоилокси)фенилкарбамоил)-4-1-тритил-1Hимидазол-4-ил)метил)пиперидин-1-карбоксилата. К раствору 1-(трет-бутоксикарбонил)-4-1-тритил-1H-имидазол-4-ил)метил)пиперидин-4-карбоновой кислоты из стадии В (270 мг, 0,6 ммоль) в изопропилацетате (5 мл) добавляли HATU (273 мг, 0,73 ммоль) и N,N-диизопропилэтиламин (205 мкл, 1,2 ммоль). Смесь перемешивали в течение 5 мин и добавляли 3-аминофенилдиметилкарбамат (108 мг, 0,6 ммоль). Результирующую смесь нагревали при 90 С в течение 2 ч. Реакционную смесь разбавляли EtOAc (10 мл), промывали водным NaHCO3 и солевым раствором, высушивали над Na2SO4, отфильтровывали и концентрировали под вакуумом. Осадок очищали с помощью хроматографии на силикагеле (10-70% EtOAc:гексан) с получением указанного в заголовке соединения (185 мг, 43%). MS (ES+). [М+Н]+ = 714,2.D. Получение 3-(4-1H-имидазол-4-ил)метил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. К раствору трет-бутил-4-(3-(диметилкарбамоилокси)фенилкарбамоил)-4-1-тритил-1H-имидазол-4 ил)метил)пиперидин-1-карбоксилата из стадии С (180 мг) в МеОН (5 мл) добавляли HCl (1 н. в диоксане,1 мл). Реакцию нагревали при 60 С в течение 1 ч и затем концентрировали под вакуумом. Осадок растворяли в EtOAc (5 мл), промывали NaHCO3 и солевым раствором, высушивали над Na2SO4, отфильтровывали и концентрировали под вакуумом с получением указанного в заголовке соединения (84 мг, 93%).MS (ES+) [М+Н]+ = 372,2. Е. Получение 3-(4-(1H-имидазол-4-ил)метил)-1-(5-метил-(7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. 3-(4-1H-имидазол-4-ил)метил)пиперидин-4-карбоксамидо)фенилдиметилкарбамат из стадии D (10 мг, 0,027 ммоль), 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин (5 мг, 0,03 ммоль) и N,Nдиизопропилэтиламин (23 мкл, 0,135 ммоль) объединяли в изопропаноле (0,5 мл). Результирующую смесь нагревали при 100 С в запаянной трубке высокого давления в течение 24 ч. Реакционную смесь охлаждали и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ (1095% МеОН:Н 2 О с 0,1% НСООН), затем обрабатывали АсОН в Н 2 О и лиофилизировали с получением указанного в заголовке соединения (5,7 мг, 42%) в виде соли ацетата. 1A. Получение 1-трет-бутил-4-метил-4-гидроксипиперидин-1,4-дикарбоксилата. К раствору метил-4-гидроксипиперидин-4-карбоксилата (полученному, как описано в заявке на патент США 2005/0080095 от Zheng et al., поданной 14 апреля 2005) (792 мг, 4,98 ммоль) и триэтиламина(1,04 мл, 7,47 ммоль) в дихлорметане (25 мл) добавляли ди-трет-бутилдикарбонат (1,26 мл, 5,48 ммоль). Протекание реакции проверяли с помощью анализа TCX/ELSD. После завершения летучие вещества удаляли под вакуумом. Хроматография на силикагеле (0-10% MeOH:CH2Cl2) обеспечивала указанное в заголовке соединение в виде светлого маслянистого вещества (1,25 г, 99% выход). MS (ES+) [М+Н]+ = 250,2.B. Получение 1-трет-бутил-4-метил-4-(бензилокси)пиперидин-1,4-дикарбоксилата. К раствору 1-трет-бутил-4-метил-4-гидроксипиперидин-1,4-дикарбоксилата из стадии А (535 мг,2,06 ммоль) в ДМФ (8,2 мл) осторожно добавляли гидрид натрия (60% дисперсия в минеральном масле,124 мг, 3,09 ммоль). Смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли бензилбромид (0,29 мл, 2,47 ммоль) и реакцию перемешивали в течение еще 30 мин. После завершения, как проверено с помощью анализа ТСХ, реакцию гасили 50 мл из 1:1 нас. водн. NH4Cl:вода. Водный слой экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом. Хроматография на силикагеле (5-10% этилацетат:гексан) обеспечивала указанное в заголовке соединение в виде светлого маслянистого вещества (359 мг, 54% выход). MS (ES+) [М+Н]+ =340,3. С. Получение 1-(трет-бутоксикарбонил)-4-(бензилокси)пиперидин-4-карбоновой кислоты. К раствору 1-трет-бутил-4-метил-4-(бензилокси)пиперидин-1,4-дикарбоксилата из стадии В (350 мг, 1,00 ммоль) в 1:2 метанол/вода (6 мл) добавляли лития гидроксид моногидрат (200 мг). Смесь нагревали до 60 С в течение 30 мин и затем охлаждали до комнатной температуры и выливали в насыщенный водный NaHSO4 (25 мл). Водный слой экстрагировали этилацетатом (325 мл). Объединенные органические слои промывали солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом с получением указанного в заголовке соединения в виде вязкого маслянистого вещества, которое переносили в следующую стадию без дальнейшей очистки.D. Получение трет-бутил-4-(бензилокси)-4-(3-(диметилкарбамоилокси)фенилкарбамоил)пиперидин-1-карбоксилата. К раствору 1-(трет-бутоксикарбонил)-4-(бензилокси)пиперидин-4-карбоновой кислоты из стадии СCH2Cl2 (6,8 мл) по каплям добавляли оксалилхлорид (0,13 мл, 1,49 ммоль, осторожно: реакция экзотермическая). После прекращения выделения газа реакцию перемешивали при температуре окружающей среды в течение 30 мин. К этому раствору добавляли одну часть 3-аминофенилдиметилкарбамата (244 мг, 1,35 ммоль), который перемешивали в течение еще 30 мин. Реакцию гасили насыщенным воднымNH4Cl и водный слой экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали солевым раствором, высушивали над MgSO4, отфильтровывали и концентрировали под вакуумом. Хроматография на силикагеле (40% этилацетат:гексан) обеспечивала указанное в заголовке соединение в виде белого твердого вещества (406 мг, 82% выход). MS (ES + ) [M+NH4]+ = 515,4.E. Получение 3-(4-(бензилокси)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. К раствору трет-бутил-4-(бензилокси)-4-(3-(диметилкарбамоилокси)фенилкарбамоил)пиперидин-1 карбоксилата из стадии D (400 мг, 0,804 ммоль) в метаноле (4 мл) добавляли HCl (4 М раствор в диоксане, 0,8 мл). Реакцию нагревали при 50 С в течение 1 ч и затем концентрировали под вакуумом с получением указанного в заголовке соединения в виде соли гидрохлорида. MS (ES+) [М+Н]+ = 398,4.N,N-диизопропилэтиламина (0,7 мл, 4,02 ммоль) в изопропаноле (1,6 мл) добавляли 4-хлор-5-метил-7Hпирроло[2,3-d]пиримидин (135 мг, 0,804 ммоль). Реакционную смесь нагревали до 110 С в запаянной виале под высоким давлением в течение 17 ч, в течение этого времени смесь становилась гомогенной. Реакцию концентрировали под вакуумом и половину вещества очищали с помощью препаративной ВЭЖХ (30100 мм С 18 колонка, 20-100% ацетонитрил:вода (10 мМ ацетат аммония), 15 мин, 45 мл/мин) с получением указанного в заголовке соединения (33,4 мг) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CD3OD)м.д. 9,71-9,74 (уш.с, 1 Н), 8,22 (с, 1H), 7,51 (прибл. кв, J=1,85 Гц, 1 Н),7,44-7,49 (м, 2 Н), 7,29-7,42 (м, 5 Н), 7,03 (д, J=1,01 Гц, 1 Н), 6,89 (ддд, J=7,83, 2,27, 1,26 Гц, 1 Н), 4,54 (с,2 Н), 3,91-3,99 (м, 2 Н), 3,45-3,54 (м, 2 Н), 3,14 (с, 3 Н), 3,01 (с, 3 Н), 2,46 (д, J=1,01 Гц, 3 Н), 2,22-2,36 (м, 4 Н); Неочищенный 3-(4-(бензилокси)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоксамидо)фенилдиметилкарбамат из примера 24, стадии F (85% чистота, приблизительно 80 мг) поглощали в метаноле (2 мл) и добавляли каталитическое количество катализатора Перлмана. Систему гидрировали при 60 фунт/кв. дюйм в течение 24 ч, после которых наблюдали небольшое количество продукта. Добавляли трифторуксусную кислоту (0,1 мл) и гидрирование продолжали при 60 фунт/кв. дюйм Н 2 в течение 3 дней, после которых реакция была приблизительно на одну треть от завершения. Реакцию фильтровали и продукт выделяли с помощью препаративной ВЭЖХ (30100 мм С 18 колонка, 10-100% ацетонитрил:вода (10 мМ ацетат аммония), 15 мин, 45 мл/мин) с получением указанного в заголовке соединения (9,6 мг) в виде белого твердого вещества. 1A. Получение 1-трет-бутил-4-метил-4-(2-метоксиэтокси)пиперидин-1,4-дикарбоксилата. К раствору 1-трет-бутил-4-метил-4-гидроксипиперидин-1,4-дикарбоксилата (360 мг, 1,39 ммоль) в ДМФ (5,6 мл) аккуратно добавляли гидрид натрия (60% дисперсия в минеральном масле, 84 мг, 2,08 ммоль). Смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли 1-хлор-2 метоксиэтан (0,38 мл, 4,17 ммоль) и реакцию перемешивали при 60 С в течение 72 ч. Реакцию гасили 25 мл воды. Водный слой экстрагировали этилацетатом (325 мл). Объединенные органические слои промывали солевым раствором, высушивали над MgSO4 и концентрировали под вакуумом. Хроматография на силикагеле (20-35% этилацетат:гексан) давала указанное в заголовке соединение и исходный материал в виде смеси, которую переносили далее (150 мг, 1:2 продукт:исходный материал).B. Получение 1-(трет-бутоксикарбонил)-4-(2-метоксиэтокси)пиперидин-4-карбоновой кислоты. Смесь продуктов из стадии А (150 мг) поглощали в 1:2 метанол:вода (3 мл). Добавляли лития гидроксид моногидрат (150 мг) и смесь нагревали при 60 С в течение 2 ч. Реакцию охлаждали до комнатной температуры и выливали в насыщенный водный NaHSO4 (25 мл). Водный слой экстрагировали этилацетатом (325 мл). Объединенные органические слои промывали солевым раствором, высушивали надMgSO4 и концентрировали под вакуумом с получением 2:1 смеси 1-(трет-бутоксикарбонил)-4 гидроксипиперидин-4-карбоновой кислоты и 1-(трет-бутоксикарбонил)-4-(2-метоксиэтокси)пиперидин 4-карбоновой кислоты, соответственно, в виде вязкого маслянистого вещества, которое переносили в следующую стадию без дальнейшей очистки. MS (ES+) [M+H]+ = 304,2. С. Получение трет-бутил-4-(3-(диметилкарбамоилокси)фенилкарбамоил)-4-(2-метоксиэтокси)пиперидин-1-карбоксилата. К раствору карбоновых кислот из стадии В, пиридина (0,2 мл, 2,48 ммоль) и ДМФ (каталитическое количество, 2 капли) в CH2Cl2 (3,1 мл) по каплям добавляли оксалилхлорид (60 мкл, 0,68 ммоль, осторожно: реакция экзотермическая). После прекращения выделения газа реакцию перемешивали при температуре окружающей среды в течение 30 мин. К этому раствору добавляли одну часть 3 аминофенилдиметилкарбамата (112 мг, 0,62 ммоль), который перемешивали в течение еще 30 мин. Реакцию гасили насыщенным водным NH4Cl и водный слой экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали солевым раствором, высушивали над MgSO4, отфильтровывали и концентрировали под вакуумом. Хроматография на силикагеле (80% этилацетат:гексан) обеспечивала указанное в заголовке соединение в виде белого с желтоватым или сероватым оттенком твердого вещества (150 мг). MS (ES+) [M+CH3CN]+ = 529,3.D. Получение 3-(4-(2-метоксиэтокси)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. К раствору трет-бутил-4-(3-(диметилкарбамоилокси)фенилкарбамоил)-4-(2-метоксиэтокси)пиперидин-1-карбоксилата из стадии С (150 мг, 0,322 ммоль) в метаноле (2 мл) добавляли HCl (4 М раствор в диоксане, 0,3 мл). Реакцию нагревали при 50 С в течение 1 ч и затем концентрировали под вакуумом с получением указанного в заголовке соединения в виде соли гидрохлорида. MS (ES+) [М+Н]+ = 366,3. Е. Получение 3-(4-(2-метоксиэтокси)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4 карбоксамидо)фенилдиметилкарбамата. К раствору 3-(4-(2-метоксиэтокси)пиперидин-4-карбоксамидо)фенилдиметилкарбамата из стадии D и N,N-диизопропилэтиламина (0,28 мл, 1,6 ммоль) в изопропаноле (1,0 мл) добавляли 4-хлор-5-метил 7 Н-пирроло[2,3-d]пиримидин (55 мг, 0,322 ммоль). Реакционную смесь нагревали до 110 С в запаянной виале под высоким давлением в течение 17 ч, в течение этого времени смесь стала гомогенной. Реакцию концентрировали под вакуумом и очищали с помощью препаративной ВЭЖХ (30100 мм С 18 колонка,5-100% ацетонитрил:вода (NH4OAc на 10 мм), 15 мин, 45 мл/мин) с получением указанного в заголовке соединения (17,4 мг) в виде белого твердого вещества. 1N-Boc-амино-(4-N-Boc-пиперидинил)карбоновую кислоту (0,114 г, 0,33 ммоль), HATU (0,151 г,0,40 ммоль) и N,N-диизопропилэтиламин (128 мг, 1,0 ммоль) объединяли в изопропилацетате (2,3 мл) и перемешивали при комнатной температуре в течение 15 мин. Добавляли 3-аминофенилдиметилкарбамат(0,072 г, 0,40 ммоль) и смесь нагревали при 80C в течение 1,5 ч. Реакционную смесь охлаждали, разбавляли EtOAc, промывали 2 н Na2CO3, 1 н. HCl и солевым раствором и затем высушивали над MgSO4 и концентрировали. Очистка с помощью хроматографии на силикагеле (60% EtOAc/гексан) давала указанное в заголовке соединение (0,075 г, 45%) в виде белого твердого вещества. MS (ES+)[M+NH4]+ = 524.B. Получение 3-(4-аминопиперидин-4-карбоксамидо)фенилдиметилкарбамата. К раствору трет-бутил-4-(трет-бутоксикарбониламино)-4-(3-(диметилкарбамоилокси)фенилкарбамоил)пиперидин-1-карбоксилата из стадии А (0,141 г, 0,28 ммоль) в МеОН (2 мл) добавляли HCl (4 н в диоксане, 0,21 мл, 0,84 ммоль). Смесь перемешивали при комнатной температуре в течение 14 ч. Далее добавляли эквиваленты HCl/диоксан в это время и смесь перемешивали при комнатной температуре в течение дополнительных 24 ч. Растворитель удаляли под вакуумом с получением указанного в заголовке соединения (0,084 г, 98%), которое переносили в неочищенном виде. MS (ES+) [М+Н]+ = 307.C. Получение 3-(4-амино-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоксамидо)фенилдиметилкарбамата. 3-(4-аминопиперидин-4-карбоксамидо)фенилдиметилкарбамат из стадии В (0,109 г, 0,36 ммоль), 4 хлор-5-метил-7H-пирроло[2,3-d] пиримидин (0,060 г, 0,36 ммоль) и N,N-диизопропилэтиламин (0,277 г,2,14 ммоль) объединяли в изопропаноле (5 мл) и нагревали в запаянной трубке при 120 С в течение 18 ч. Смесь концентрировали и осадок очищали с помощью хроматографии на силикагеле (0-10%MeOH/CH2Cl2) с получением указанного в заголовке соединения (0,085 г, 55%) в виде белого твердого вещества. 1 3-(4-амино-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4 карбоксамидо)фенилдиметилкарбамат из примера 27, стадии С (0,028 г, 0,064 ммоль) растворяли в МеОН (1 мл). Добавляли формальдегид (37 вес.% раствор в Н 2 О, 0,15 ммоль, 12 мкл) с последующим добавлением АсОН (0,26 ммоль, 15 мкл) и NaBH3CN (0,008 г, 0,13 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч перед концентрированием под вакуумом. Очистка с помощью препаративной ВЭЖХ обеспечивала указанное в заголовке соединение (0,017 г, 57%) в виде белого твердого вещества. 1 раствор перемешивали в течение 20 мин. при комнатной температуре. К этому раствору добавляли соль ацетата 3-(4-(аминометил)-1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-карбоксамидо) фенилдиметилкарбамата (из примера 20, 0,500 г, 0,97 8 ммоль) и N,N-диизопропилэтиламин (0,17 мл) вCH2Cl2 (5 мл). Реакцию перемешивали при комнатной температуре в течение б ч и затем разбавляли Н 2 О(10 мл) и CH2Cl2 (20 мл). Смесь экстрагировали CH2Cl2 (210 мл) и объединенные органические вещества промывали NaHCO3 (10 мл) и солевым раствором (10 мл), высушивали над MgSO4 и концентрировали под вакуумом. Осадок очищали с помощью флэш-хроматографии (3-10% МеОН:CH2Cl2) с получением указанного в заголовке соединения (0,393 г, 72% выход) в виде белого твердого вещества. Это твердое вещество суспендировали в воде и добавляли уксусную кислоту, пока раствор не становился прозрачным. Этот раствор замораживали и лиофилизировали до соли диацетата указанного в заголовке соединения (0,477 г). 1[М+Н]+ = 560. 6.30. Пример 30. Дополнительные соединения. Используя методики, описанные в настоящей заявке, и способы, известные в данной области техники, получали дополнительные соединения, перечисленные ниже в табл. 1. Данные LIMK2 IC50, которые показаны ниже для некоторых из соединений, определяли, используя анализ, описанный в примере 32. Таблица 1
МПК / Метки
МПК: A61P 27/06, C07D 487/04, A61P 35/00, A61P 31/00, A61K 31/519, A61P 27/02, A61P 25/28
Метки: limk2, применения, ингибиторы, способы
Код ссылки
<a href="https://eas.patents.su/30-19488-ingibitory-limk2-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы limk2 и способы их применения</a>
Предыдущий патент: Соединения в качестве ингибиторов plk, фармацевтические композиции, их содержащие, и их применение
Следующий патент: Система и способ получения высококачественного бензина гидрированием с рекомбинацией углеводородного компонента перегонки нефти
Случайный патент: Получение наноразмерных материалов