Набор для сбора крови, предпочтительно периферической крови, для получения стволовых клеток
Формула / Реферат
1. Набор для сбора крови, предпочтительно периферической крови, для получения плюрипотентных стволовых клеток, характеризующийся тем, что включает в себя контейнер (12) для взятой крови, в котором находится антикоагулянт и вещество макрофагальный колониестимулирующий фактор (MCSF).
2. Набор по п.1, характеризующийся тем, что концентрация MCSF в контейнере (12) составляет от примерно 2 до примерно 20 нМ.
3. Набор по п.2, характеризующийся тем, что концентрация MCSF в контейнере (12) составляет от примерно 8 до примерно 10 нМ.
4. Набор по пп.1, 2 или 3, характеризующийся тем, что антикоагулянтом является гепарин или ЭДТА.
5. Набор по любому из предшествующих пунктов, характеризующийся тем, что он включает в себя закрывающий контейнер элемент (22).
6. Набор по любому из предшествующих пунктов, характеризующийся тем, что он также включает контейнеры (18, 20), у которых, по меньшей мере, внутренняя стенка выполнена из материала, предотвращающего адгезию стволовых клеток.
7. Набор по п.6, характеризующийся тем, что указанный материал является пластиковым материалом, таким как полипропилен (РР), обработанным инфракрасными и/или гамма-лучами.
8. Набор по п.6 или 7, характеризующийся тем, что он включает в себя закрывающие для каждого из контейнеров (18, 20) элементы (24).
Текст
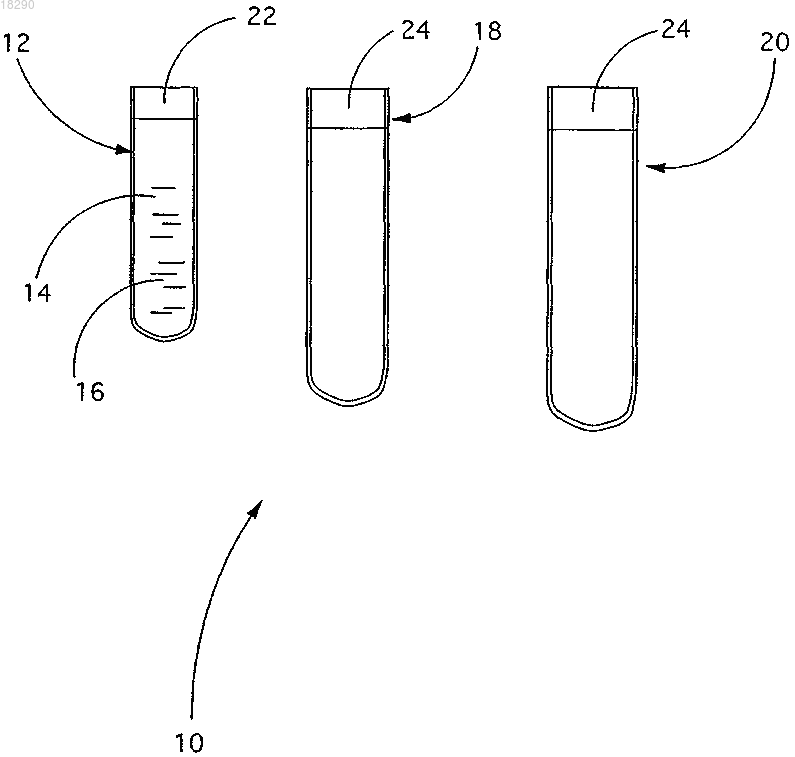
НАБОР ДЛЯ СБОРА КРОВИ, ПРЕДПОЧТИТЕЛЬНО ПЕРИФЕРИЧЕСКОЙ КРОВИ,ДЛЯ ПОЛУЧЕНИЯ СТВОЛОВЫХ КЛЕТОК Изобретение относится к набору (10) для сбора крови, предпочтительно периферической крови,для получения плюрипотентных стволовых клеток, включающему в себя, по меньшей мере, первый контейнер (12), который способен содержать взятую кровь и в котором находится антикоагулянт и вещество MCSF (макрофагальный колониестимулирующий фактор). Область изобретения Данное изобретение касается набора для сбора крови, предпочтительно периферической крови, для получения стволовых клеток взрослого организма. Уровень изобретения В последние годы использование стволовых клеток в терапии вызывает широкое одобрение в связи с успехами, полученными при лечении патологий, которые до сих пор считались неизлечимыми. Тем не менее, известные способы получения стволовых клеток являются длительными, трудоемкими и дорогостоящими. Плюрипотентные стволовые клетки (PSC, pluripotent stem cells) являются источником, доступным не только для исследований, но также для создания лекарственных препаратов и для трансплантации(Wagers A.J. et al., 2002; Griffith L.G. et al., 2002). Существуют стволовые клетки эмбриона и взрослого организма: эмбриональные получают из 8 дневного бластоциста, в то время как взрослые могут быть получены главным образом из костного мозга, жировой или мышечной ткани, периферической крови и пуповины. Определение стволовой клетки постоянно развивается, и на данный момент не существует общего консенсуса или стандартного способа их выделения или идентификации. Для всех этих клеток, эмбриональных (ES, embryonic stem cells) и взрослых, гематопоэтических (HSC, haemopoietic stem cells) и мезенхимальных (MSC, mesenchymal stem cells) (Kuwana M. et al., 2003), были определены различные генетические маркеры, некоторые из которых являются общими для многих типов клеток (Condomines M. etal., 2006; Kang W.J. et al., 2006; Zhao Y. et al., 2003; Rabinovitch M. et al., 1976). На данный момент исследование в большей степени ориентировано на применение стволовых клеток, выделенных из эмбриональных тканей, плодов и пуповины, но это создает правовые и этические проблемы. Прежде всего, на сегодняшний день применение этих клеток имеет различные противопоказания,такие как риск инфицирования, риск отторжения при трансплантации, а у некоторых млекопитающих,таких как лошади, развитие тератом. Для преодоления этих проблем в терапии in vivo известно применение аутологичных стволовых клеток, предпочтительно выделенных из костного мозга, жировой ткани или периферической крови. Начиная со стволовых клеток взрослого организма, проводят этап дифференциации in vitro (или ex vivo) стволовых клеток в желаемую клеточную линию с помощью специфических факторов индукции дифференциации, а затем этап трансплантации in vivo полученных дифференцированных клеточных линий. У этих способов есть недостаток - феномен отказа, когда дифференцированные клетки, повторно введенные в организм, не распознаются как собственные клетки, так как они теряют факторы самораспознавания на этапе индуцированной дифференциации in vitro. У человека получение стволовых клеток из периферической крови влечет за собой их очистку посредством процесса, называемого аферезом или лейкаферезом. Клетки выделяют из крови, собирают и затем вводят пациентам сразу после химиотерапии или лучевой терапии. В аферезе, который длится от 6 до 8 ч, кровь берут из вены руки или вены шеи или груди и пропускают через устройство, удаляющее стволовые клетки. Кровь, очищенную таким образом, возвращают в организм пациента, в то время как собранные клетки сохраняют путем замораживания в жидком азоте(Condomines M. et al., 2006; Kang W.J. et al., 2006). Эта методика, помимо того что болезненна, также крайне стрессорна для пациента. Прежде всего, методика не обеспечивает реальное различение и/или очистку циркулирующих стволовых клеток. Основными известными методиками очистки являются следующие: использование факторов роста или производных тромбоцитов (TGF-B, VEGF), но экономическая стоимость их выделения чрезмерно высока (Hou M. et al., 2006); выделение стволовых клеток, взятых из костного мозга, которое позволяет очистить и, следовательно, использовать для терапии примерно 15% клеток, содержащихся во взятом материале; выделение стволовых клеток из жировой ткани, которое требует предварительного хирургического удаления значительного количества тканей донора и делает невозможным внутривенное введение;UBM (матрикс мочевого пузыря): получен от свиньи, содержит цитокины (но не нуклеарные клетки), которые индуцируют рубцевание ран, но не регенерацию зоны поражения (Zhang Y.S. et al., 2005). Другой известный способ описан Zhao Y. et al. в статье "A human peripheral blood monocyte-derivedsubset acts as pluripotent stem cells" и в WO-A-2004/043990. Это способ изготовления стволовых клеток путем их получения из моноцитов, который включает этапы выделения моноцитов из периферической крови, введения их в контакт с митогенным компонентом, а затем культивирования моноцитов из периферической крови в условиях, подходящих для размножения клеток. Этот способ, в котором вначале необходим этап выделения моноцитов, а затем этап размножения в культуральной среде, требует большого времени, примерно 15-20 дней, чтобы получить значительное количество стволовых клеток, и не позволяет получить плюрипотентные стволовые клетки, т.е. не специализированные, подходящие для введения в организм пациента сразу и через некоторое время.-1 018290 Опять же в рамках получения стволовых клеток из моноцитов также известны документы WO-A2005/046570, WO-A-2007/131200 и WO-A-03/083092. Тем не менее, поскольку необходимо выполнять предварительную очистку крови для выделения только клеточной фракции, т.е. моноцитов, а затем вызывать их размножение с целью получения желаемых стволовых клеток, способы, описанные в этих документах, требуют очень большого времени, снова примерно 15-40 дней, для получения приемлемого количества стволовых клеток. В свете вышеизложенного существует очевидная необходимость усовершенствовать способ размножения или разделения и очистки взрослых стволовых клеток из легко доступных источников, в частности крови, предпочтительно периферической крови, что также позволит получить стволовые клетки,подходящие для фармакологического лечения. Существует также очевидная необходимость начинать получение стволовых клеток из крови, предпочтительно периферической, в кратчайшие сроки, с тем чтобы иметь возможность своевременно ввести их пациенту. Поэтому целью данного изобретения является получение набора для сбора крови, предпочтительно периферической крови, для получения плюрипотентных стволовых клеток, с тем чтобы обеспечить быстрый запуск получения плюрипотентных стволовых клеток. Заявитель разработал, испытал и воплотил данное изобретение для преодоления недостатков уровня техники и для достижения этих и других целей и преимуществ. Сущность изобретения Данное изобретение изложено и охарактеризовано в независимом пункте формулы изобретения, в то время как зависимые пункты формулы изобретения описывают другие характеристики изобретения или варианты основной идеи изобретателей. Способ выращивания и очистки in vitro стволовых клеток из крови, предпочтительно периферической крови, разработанный авторами и под названием данной заявки описанный в международной патентной заявке PCT/ЕР 2007/059531, которая включена в нее полностью посредством ссылки, позволяет получить взрослые плюрипотентные клетки и содержит первый этап с двумя подэтапами: а) первый подэтап выращивания стволовых клеток периферической крови после взятия крови путем обработки in vitro MCSF (макрофагальным колониестимулирующим фактором) в концентрации 8-15 нМ,предпочтительно 10 нМ; б) второй подэтап очистки, предпочтительно путем фракционирования в градиенте плотности фиколла. Первый подэтап выращивания может иметь различную продолжительность в соответствии с условиями, в которых проводится обработка in vitro; авторы экспериментально, путем определения маркеров стволовых клеток CD90, CD90/34, CD34 и CD117, установили, что продолжительность обработки MCSFin vitro от 24 до 96 ч, предпочтительно от 48 до 72 ч, приводит к стабилизации роста. Это условие считается оптимальным. Очистка на втором подэтапе, по существу, направлена на разрушение эритроцитов. Второй этап, на котором используются полупродукты, полученные на этапе б), обеспечивает в) рост стволовых клеток периферической крови, очищенных на этапе б) путем обработки MCSF in vitro в концентрации от 35 до 55 нМ, предпочтительно 50 нМ, более предпочтительно 45 нМ. С такими концентрациями MCSF клетки сохраняют фенотип взрослых плюрипотентных стволовых клеток. Этот второй этап может иметь продолжительность от 24 до 96 ч, предпочтительно от 48 до 72 ч. Было отмечено, что, напротив, при использовании MCSF в концентрации более 55 нМ (например,70 нМ) уже после 24 ч клетки не сохраняют фенотип плюрипотентных стволовых клеток. В частности, этап а) разделения и предварительного роста в суспензии с MCSF после взятия крови позволяет увеличить процент стволовых клеток. Следующий этап б) позволяет получить взрослые плюрипотентные стволовые клетки, которые при введении их пациенту дифференцируются непосредственноin vivo, не вызывая явлений отторжения или инфицирования. Эффективность этого получения подтверждается наличием маркеров стволовых клеток CD90,CD90/34, CD34 и CD117, а также тем фактом, что стволовые клетки не теряют факторов самораспознавания при последующем разделении или размножении. Такие стволовые клетки при введении их пациенту не дают побочных эффектов, таких как феномен отторжения, инфицирование, развитие тератом, и могут дифференцироваться in vivo и вести себя как плюрипотентные стволовые клетки. Авторы увидели, что клетки, выращенные таким образом путем разделения или размножения, при введении их локально или внутривенно приобретают in vivo (а не in vitro, как и в известных способах уровня техники с помощью соответствующих факторов роста и/или химических стимуляторов (Gulati R.et al., 2003; Katz R.L. et al., 2002; Okazaki T. et al., 2005 все морфологические и химические характеристики макрофагальных, лимфоцитарных, эпителиальных, эндотелиальных, нервных и гепатоцитарных клеток в соответствии с потребностями и патологиями живого организма, подвергающегося лечению. Способ является менее инвазивным, чем другие способы, используемые до сих пор для сбора стволовых клеток, безболезненным (в отличие от афереза) и экономичным.-2 018290 Наконец, возможность легкого получения этих клеток, а затем их сохранения в течение долгого времени, например замороженными в жидком азоте, делает клетки, полученные способом в соответствии с изобретением, пригодными для аутологичной трансплантации и для лечения многих патологий (повреждений различного типа, метаболических заболеваний, острых и хронических неврологических и воспалительных патологий). В соответствии с одной характеристикой данного изобретения набор для сбора крови, предпочтительно периферической крови, для получения стволовых клеток с помощью описанного выше способа включает первый контейнер, который может содержать взятую кровь, например пробирку, содержащую антикоагулянт и вещество MCSF. Как правило, первый контейнер изготовлен из стекла. С помощью данного набора можно собрать кровь, предпочтительно периферическую кровь, чтобы быстро начать рост и продукцию стволовых клеток с помощью описанного выше способа и поэтому сделать их производство более быстрым. В связи с этим основным преимуществом данного изобретения является то, что оно позволяет получить достаточное количество стволовых клеток за очень ограниченное время, даже всего за 48 ч, по сравнению со способами, известными в уровне техники в работе непосредственно с цельной кровью. Таким образом, набор для сбора крови в соответствии с данным изобретением предлагается в качестве быстрого и эффективного решения проблемы получения плюрипотентных стволовых клеток непосредственно из крови, предпочтительно периферической крови. Как правило, концентрация MCSF в пробирке набора в соответствии с данным изобретением варьирует от 2 до 20 нМ, предпочтительно примерно от 8 до 10 нМ. Обычно в качестве антикоагулянта используется гепарин или ЭДТА. Наличие антикоагулянта является необходимым для предотвращения свертывания крови, в то время как MCSF является ответственным за порядок роста и размножения стволовых клеток. В соответствии с вариантом воплощения изобретения набор может содержать один или более контейнер помимо первого контейнера, например пробирку. У последних предпочтительно, по меньшей мере, внутренняя стенка сделана из материала, например пластика, такого как полипропилен (РР), обработанного инфракрасными или гамма-лучами, что препятствует адгезии стволовых клеток к стенке и,следовательно, их агрегации, которая считается условием, которого следует избегать. Как правило, данные контейнеры представляют собой второй контейнер, который содержит стволовые клетки, полученные для внутривенного введения, и третий контейнер различных размеров для местного применения. Стволовые клетки, которые получены в указанных контейнерах, можно использовать сразу либо они могут быть сохранены в жидком азоте и использованы в дальнейшем, когда возникнет такая необходимость. В соответствии с другим вариантом указанные контейнеры, и тот, который используется для взятия крови, в котором содержится антикоагулянт и MCSF, и те, которые используются для сохранения, можно определить по серийному номеру, общему, последовательному или полученному в соответствии с заданным критерием, для облегчения идентификации в лаборатории, где получают стволовые клетки, и в момент отправки. Для однозначной идентификации можно использовать штрих-коды и/или RFID-метки формата reading (однократной записи и многократного считывания) или reading/writing (многократной записи и многократного считывания), прикрепленные к контейнерам, вместе с соответствующим оптическим или электромагнитным считывающим устройством. Первый подэтап роста описанного выше способа предпочтительно начинают сразу после взятия крови, чтобы кровь тем временем не свернулась. Под словами "сразу после" имеется в виду минимально возможное время между взятием крови и ее свертыванием, так чтобы предотвратить свертывание крови и начать размножение стволовых клеток в кратчайшее время после взятия крови. Другими словами, "сразу после" относится к тому факту, что рост стволовых клеток начинается сразу после взятия у пациента крови, принимая во внимание, что для данного изобретения важно, что указанный процесс размножения начинается до того, как кровь сворачивается. Фактически кровь, только что взятую у пациента, помещают в пробирку с антикоагулянтом иMCSF. Антикоагулянт блокирует начало коагуляции, в то время как одновременное присутствие MCSF обеспечивает быстрое начало процесса размножения и гарантирует минимизацию времени до начала лечения пациента. Это определение также включает случай, когда образец крови, предпочтительно периферической,взят у пациента, к нему добавлен антикоагулянт для того, чтобы блокировать свертывание крови, которая подвергается хранению, в процессе которого не меняется возможность получения стволовых клеток. При необходимости кровь берут из места ее хранения и подвергают процессу размножения стволовых клеток, описанному выше, т.е. добавляют MCSF, очень быстро получая необходимое количество стволовых клеток. Таким образом, в область данного изобретения вводится процедура взятия и сохранения крови,-3 018290 предпочтительно периферической, с помощью которой можно получить стволовые клетки в соответствующих банках крови и затем при необходимости использовать их для получения плюрипотентных стволовых клеток путем добавления MCSF. Как правило, после взятия крови из места ее хранения ее помещают в пробирку, которая уже содержит MCSF в концентрации от 2 до 20 нМ, предпочтительно от 8 до 10 нМ. Это позволяет избежать сложной и дорогостоящей процедуры сохранения стволовых клеток, которая требует, например, использования жидкого азота, как упоминалось выше, и вместо этого позволяет использовать только традиционные методики сохранения крови. Подробное описание предпочтительной формы воплощения Со ссылкой на прилагаемую фигуру набор 10 для сбора периферической крови в соответствии с данным изобретением для получения стволовых клеток включает в себя первую пробирку 12, изготовленную из стекла, содержащую вещество MCSF 14 и в данном случае гепарин 16. Концентрация MCSF в пробирке 11 составляет от 8 до 10 нМ. Набор включает еще две пробирки 18 и 20, изготовленные из пластика, такого как полипропилен(РР), обработанного инфракрасными или гамма-лучами. Вторая пробирка 18 предназначена для сохранения клеток, полученных для внутривенного введения, а третья пробирка 20 - для местного применения. Важно, что пробирки 12, 18 и 20 гарантируют стерильность их содержимого. Все пробирки 12, 18 и 20 снабжены соответствующими пробками 22, 24 для их закрывания. Пробки 22, 24 могут закрываться при надавливании, могут быть винтового или другого типа. Пробка 22 контейнера 12 может, например, закрываться при надавливании. Пробка 24 каждой из пробирок 18 и 20 может быть, например, винтового типа. Размеры второй пробирки 18 составляют: высота 115 мм, диаметр 17 мм, толщина 0,3 мм, емкость 12 мл, в то время как размеры третьей пробирки 20 составляют: высота 110 мм, диаметр 30 мм, толщина 0,3 мм, емкость 40 мл. После размножения с помощью MCSF в соответствии с данным изобретением клетки, выделенные из периферической крови, действуют in vivo как плюрипотентные стволовые клетки (PSC) и подходят для разрешения в течение нескольких месяцев неизлечимых повреждений и патологий или излечимых классическими способами и/или лекарствами, но только медленно. Материалы и методы. Взятие образцов. Каждый образец периферической крови, примерно 0,5-7 мл, берут у лошадей и собак из нижних конечностей и немедленно вносят в пробирки, содержащие соответствующее количество гепарина и MCSF(10 нМ). В любом случае могут быть использованы другие антикоагулянты, такие как ЭДТА. В этот момент проводится первый подэтап обработки in vitro, на котором происходит разделение и предварительный рост стволовых клеток с помощью MCSF. Очистка. Образцы крови разводят в соотношении 1:5 в PBS (фосфатно-солевом буфере), содержащем NH4Cl(200 мМ), чтобы вызвать лизис эритроцитов, центрифугируют при 10000g, дважды промывают PBS и вновь центрифугируют при 200g. Полученные нуклеарные клетки инкубируют в течение 7-12 ч при 37C, предпочтительно в течение 10-12 ч и очищают путем фракционирования в градиенте плотности фиколла, затем выделяют и три раза промывают средой RPMI 1640 (Life Technologies, Гранд-Айленд,Нью-Йорк). После очищения клетки инкубируют еще 24-72 ч в присутствии 50 нг/мл MCSF 45 нМ, чтобы получить примерно 95% клеток с фенотипом CD90 (который определяют посредством флуориметрического анализа с использованием проточного фотометра FACScan от Becton Dickinson), а затем вызывают их размножение, получая количество клеток, необходимое для местного лечения, или центрифугируют при 10000g и суспендируют в PBS в концентрации примерно 90103 клеток/мл для внутривенного введения. Иммуноокрашивание. Для цитофенотипирования клетки промывают в PBS, а затем фиксируют на слайде в 4% формальдегиде в PBS в течение 20 мин при 20C. Для выявления внутриклеточных белков клетки пермеабилизируют с помощью 0,5% Triton X-100 в течение 5 мин при 20C, а затем инкубируют в течение 1 ч с первичными антителами, разведенными вPBS, содержащем 1% BSA (для блокирования неспецифических антигенных сайтов). После трех последовательных промываний слайды инкубируют в течение 45 мин с вторичными антителами, конъюгированными с наиболее подходящим флуорохромом: FITC или изотиоцианатом тетраметилродамина В(TRITC) или Cy5. Все вторичные антитела были изготовлены в Jackson ImmunoResearch с использованием осла в качестве хозяина.-4 018290 Иммуноцитохимический анализ проводят при температуре 4C и в насыщенной водяным паром атмосфере. После трехкратного промывания слайды устанавливают с помощью "gelvatolPBS". Затем с помощью флуоресцентного микроскопа получают флуоресцентные изображения, используя в качестве внутреннего стандарта прямую иммунофлуоресценцию против глицеральдегид-3-фосфат дегидрогеназы (поликлональные овечьи антитела производства Cortex Biochem, Сан-Леандро, Калифорния). В качестве отрицательных контролей и для калибровки уровней фона флуоресценции используют слайды, инкубированные с неспецифическими антителами того же изотипа, что и исследуемые образцы. Только что описанный способ используют для выявления всех маркеров (CD90, CD90/34, CD34 и Ясно, что в описанный выше набор для сбора крови, предпочтительно периферической крови, для получения стволовых клеток можно внести изменения и/или добавить части, не выходя из области и за рамки данного изобретения. Также ясно, что, хотя данное изобретение описано со ссылкой на примеры, специалист в данной области определенно способен получить многие другие эквивалентные формы набора для сбора крови,предпочтительно периферической крови, для получения стволовых клеток, имеющие характеристики,изложенные в формуле изобретения и, следовательно, входящие в область защиты, определенную таким образом. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Набор для сбора крови, предпочтительно периферической крови, для получения плюрипотентных стволовых клеток, характеризующийся тем, что включает в себя контейнер (12) для взятой крови, в котором находится антикоагулянт и вещество макрофагальный колониестимулирующий фактор (MCSF). 2. Набор по п.1, характеризующийся тем, что концентрация MCSF в контейнере (12) составляет от примерно 2 до примерно 20 нМ. 3. Набор по п.2, характеризующийся тем, что концентрация MCSF в контейнере (12) составляет от примерно 8 до примерно 10 нМ. 4. Набор по пп.1, 2 или 3, характеризующийся тем, что антикоагулянтом является гепарин или ЭДТА. 5. Набор по любому из предшествующих пунктов, характеризующийся тем, что он включает в себя закрывающий контейнер элемент (22). 6. Набор по любому из предшествующих пунктов, характеризующийся тем, что он также включает контейнеры (18, 20), у которых, по меньшей мере, внутренняя стенка выполнена из материала, предотвращающего адгезию стволовых клеток. 7. Набор по п.6, характеризующийся тем, что указанный материал является пластиковым материалом, таким как полипропилен (РР), обработанным инфракрасными и/или гамма-лучами. 8. Набор по п.6 или 7, характеризующийся тем, что он включает в себя закрывающие для каждого из контейнеров (18, 20) элементы (24).
МПК / Метки
МПК: G01N 33/50, B01L 3/00, C12Q 1/68
Метки: клеток, периферической, стволовых, сбора, предпочтительно, крови, набор, получения
Код ссылки
<a href="https://eas.patents.su/7-18290-nabor-dlya-sbora-krovi-predpochtitelno-perifericheskojj-krovi-dlya-polucheniya-stvolovyh-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Набор для сбора крови, предпочтительно периферической крови, для получения стволовых клеток</a>
Предыдущий патент: Мембранная биологическая реакторная система на основе суспендированного гранулированного активированного угля
Следующий патент: Способ удаления глинистых отложений, образовавшихся на буровом долоте, с применением окисляющих агентов
Случайный патент: Способ обработки сейсмических данных











