Способы увеличения продукции тромбоцитов и гематопоэтических стволовых клеток
Формула / Реферат
1. Способ обеспечения гематопоэтических стволовых клеток у субъекта, включающий в себя следующие стадии:
введение соединения-миметика тромбопоэтина (ТПО) субъекту для повышения уровня стволовых клеток у указанного субъекта;
забор одной или более стволовых клеток;
лечение указанного субъекта путем аблативной терапии костного мозга;
трансплантацию субъекту взятых у него стволовых клеток,
где соединение-миметик ТПО имеет следующую последовательность:
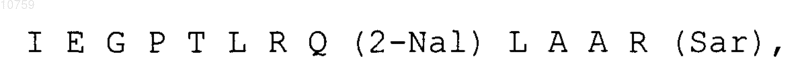
где 2-Nal представляет собой b-(2-нафтил)аланин, a Sar представляет собой саркозин.
2. Способ по п.1, где субъектом является человек.
3. Способ по п.1, где одна или более стволовых клеток после забора подвергаются криоконсервированию.
4. Способ по п.3, где одну или более криоконсервированных стволовых клеток размораживают и определяют их жизнеспособность перед трансплантацией субъекту.
5. Способ по п.1, где соединение-миметик ТПО имеет уменьшенную иммуногенность по сравнению с иммуногенностью одного или более из rhТПО и rhIL-11.
6. Способ по п.1, где соединение-миметик ТПО имеет улучшенный фармакокинетический профиль по сравнению с таковым одного или более из rhТПО и rhIL-11.
7. Способ уменьшения времени приживления стволовых клеток после повторной инфузии субъекту, включающий в себя следующие стадии:
введение субъекту соединения-миметика ТПО для повышения уровня стволовых клеток у указанного субъекта;
забор одной или более стволовых клеток;
лечение указанного субъекта путем аблативной терапии костного мозга;
трансплантация субъекту одной или более взятых у него стволовых клеток,
где соединение-миметик ТПО имеет следующую последовательность:
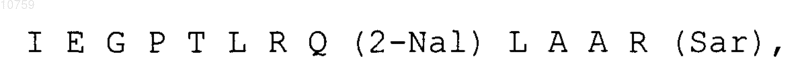
где 2-Nal представляет собой b-(2-нафтил)аланин, a Sar представляет собой саркозин.
8. Способ уменьшения числа случаев отсроченного первичного приживления стволовых клеток, включающий в себя следующие стадии:
введение субъекту соединения-миметика тромбопоэтина (ТПО) для повышения уровня стволовых клеток у указанного субъекта;
забор одной или более стволовых клеток;
лечение указанного субъекта путем аблативной терапии костного мозга;
трансплантация субъекту одной или более взятых у него стволовых клеток,
где соединение-миметик ТПО имеет следующую последовательность:
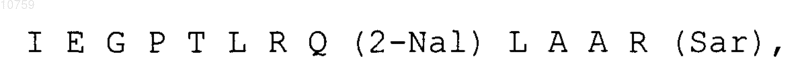
где 2-Nal представляет собой b-(2-нафтил)аланин, a Sar представляет собой саркозин.
9. Способ уменьшения числа случаев вторичной несостоятельности продукции тромбоцитов у субъекта, включающий в себя следующие стадии:
введение субъекту соединения-миметика тромбопоэтина (ТПО) для повышения уровня стволовых клеток у указанного субъекта;
забор одной или более стволовых клеток;
лечение указанного субъекта путем аблативной терапии костного мозга;
трансплантация субъекту одной или более взятых у него стволовых клеток,
где соединение-миметик ТПО имеет следующую последовательность:
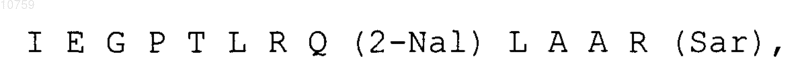
где 2-Nal представляет собой b-(2-нафтил)аланин, a Sar представляет собой саркозин.
10. Способ уменьшения времени приживления тромбоцитов и/или нейтрофилов после повторной инфузии стволовых клеток субъекту, включающий в себя следующие стадии:
введение субъекту соединения-миметика тромбопоэтина (ТПО) для повышения уровня стволовых клеток у указанного субъекта; забора одной или более стволовых клеток;
лечение указанного субъекта путем аблативной терапии костного мозга;
трансплантация субъекту одной или более взятых у него стволовых клеток,
где соединение-миметик ТПО имеет следующую последовательность:
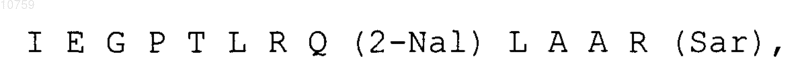
где 2-Nal представляет собой b-(2-нафтил)аланин, a Sar представляет собой саркозин.
11. Способ по п.1, где указанное соединение-миметик ТПО ковалентно связано с гидрофильным полимером.
12. Способ по п.11, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 500 до 40000 Да.
13. Способ по п.12, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 5000 до 20000 Да.
14. Способ по п.13, где указанный гидрофильный полимер имеет средний молекулярный вес около 20000 Да.
15. Способ по п.11, где указанный полимер представляет собой полиэтиленгликоль.
16. Способ по п.1, где соединение-миметик ТПО имеет следующую формулу:
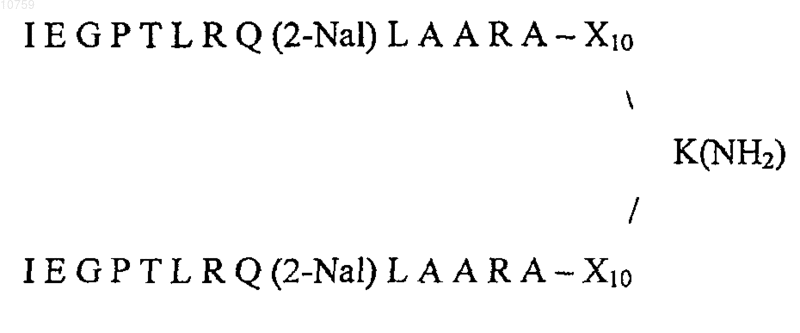
где (2-Nal) представляет собой b-(2-нафтил)аланин, a Sar представляет собой саркозин.
17. Способ по п.16, где указанное соединение-миметик ТПО ковалентно связано с гидрофильным полимером.
18. Способ по п.17, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 500 до 40000 Да.
19. Способ по п.17, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 5000 до 20000 Да.
20. Способ по п.19, где указанный гидрофильный полимер имеет средний молекулярный вес около 20000 Да.
21. Способ по п.20, где указанный полимер представляет собой полиэтиленгликоль.
22. Способ по п.16, где каждая из димерных субъединиц указанного соединения-миметика ТПО ковалентно связана с гидрофильным полимером.
23. Способ по п.22, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 500 до 40000 Да.
24. Способ по п.22, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 5000 до 20000 Да.
25. Способ по п.24, где указанный гидрофильный полимер имеет средний молекулярный вес около 20000 Да.
26. Способ по п.25, где указанный полимер представляет собой полиэтиленгликоль.
27. Способ по п.1, где указанные стволовые клетки находятся в костном мозге указанного субъекта.
28. Способ по п.1, где указанные стволовые клетки находятся в периферическом кровообращении указанного субъекта.
29. Способ по п.1, где указанный субъект подвергается химиотерапевтическому лечению.
30. Способ по п.1, где указанный субъект подвергается радиационной терапии.
Текст
010759 В заявке на данное изобретение испрашивается приоритет по заявке 60/411779 и 60/411700, поданной 18 сентября 2002 г. Уровень техники Тромбопоэтин (ТПО), первоначально клонированный как главный регулятор продукции тромбоцитов, играет центральную роль в биологии гематопоэтических стволовых клеток (ГСК), Kaushansky et al.,Nature, 369:568-571 (1994). Фактически все простые ГСК, которые проявляют репопуляционную активность, экспрессируют c-Mpl, рецептор ТПО, Solar et al., Blood, 92:4-10 (1998). ТПО, один или в сочетании с другими действующими ранними цитокинами, такими как фактор стволовых клеток (SCF), интерлейкин 3 (IL-3) или Flt-3 лиганд, увеличивает пролиферацию примитивных ГСК in vitro, Ku et al., Blood,87:4544-4551 (1996); Sitnicka et al., Blood, 87:4998-5005 (1996). Исследования in vivo подтвердили данные выводы, Kimura et al., Proc. Natl. Acad. Sci. U.S.A., 95:1195-1200(1998). Важность ТПО в самообновлении стволовой клетки и размножении была также подтверждена клиническими наблюдениями того, что мутации гена c-Mpl вызывали врожденную амегакариоцитарную тромбоцитопению - заболевание, при котором все гематопоэтические линии дифференцировки перестают действовать в детском возрасте,Ballmaier et al., Blood, 97:139-146 (2001). Обнаружено, что размножение ГСК в зрелом костном мозге является в 10-20 раз менее устойчивым у ТПО-/- мышей после трансплантации костного мозга. Добавленный извне ТПО избавлял от этого дефекта, Fox et al., J. Clin. Invest., 110:389-394 (2002). Данные статьи показывают, что ТПО является главным нередундантным (нерезервным) фактором, способствующим самообновлению и развитию ГСК. Трансплантация аутологичной стволовой клетки (ТАСК) все более широко применяется как способ воспроизведения костного мозга вслед за применением потенциально лечебной, миелоаблативной химиотерапии высокими дозами. Основой такой технологии является мобилизация ГСК из костного мозга в периферическую кровь (с применением G-CSF+/-примирующей химиотерапии), из которой они забираются путем афереза. Эти стволовые клетки, которые образуют меньшинство забираемой популяции,впоследствии способны к воссозданию костного мозга при их повторной инфузии после миелоаблативной химиотерапии. Стволовые клетки, полученные из периферической крови с помощью такой технологии, оказываются схожими с клетками пуповинной крови и превосходят клетки костного мозга по способности восстанавливать костный мозг после миелоаблативной терапии, с временем приживления нейтрофилов и тромбоцитов, составляющим менее 10 дней. Наиболее широко распространенными типами опухолей, при которых применяется ТАСК, являются миелома, лимфома (как болезнь Ходжкина, так и не-ходжкинская лимфома) и острая миелоидная лейкемия. Химиотерапия высокими дозами с ТАСК может чаще применяться как оперативная терапия, особенно при миеломе, но она также применяется и в качестве паллиативной терапии после неудачи оперативной химиотерапии. Такие субъекты часто получают интенсивное предварительное лечение и, следовательно, имеют костный мозг с ослабленным гематопоэтическим потенциалом. После повторной инфузии таких забранных клеток субъекту наступает период, в течение которого субъект, например больной человек, подвержен риску развития инфекции (низкий уровень нейтрофилов) или кровотечения (низкий уровень тромбоцитов). Длительность этого периода варьирует в зависимости от количества повторно инфузированных стволовых клеток, которое, в свою очередь, зависит от их способности стимулировать приток стволовых клеток из костного мозга. Кроме того, у некоторых субъектов также развивается недостаточность костного мозга после начального периода приживления. Трансплантация стволовых клеток также применяется в аллогенном окружении, когда стволовые клетки периферической крови мобилизованы и отобраны у HLA-совместимых доноров. Данные аллогенные трансплантаты применяются реже, чем ТАСК из-за возникновения реакции трансплантат против хозяина, но могут применяться, когда нет возможности получить достаточного количества стволовых клеток у пациента. Тем не менее, применение аллогенных стволовых клеток для получения неполного приживления при отсутствии полной миелоаблации ("мини-трансплантат") может также оказывать терапевтическую пользу благодаря эффекту трансплантата против опухоли. Другим возможным применением в настоящее время у крайне малого числа пациентов является область генной терапии, когда здоровые аллогенные клетки костного мозга или аутологичные клетки, передаваемые с нормальной копией поврежденного гена, могут быть лечебными для некоторых наследственных заболеваний, вызванных дефектами единственного гена. Аллогенные трансплантаты также подвергаются исследованию в качестве выбора терапии для аутоимунных заболеваний. Несмотря на потенциальную универсальность и простоту ТАСК, существуют значительные ограничения для ее широкого применения после ожидаемого периода панцитопении, который требует интенсивной поддержки пациента, чтобы позволить повторно инфузированным клеткам возобновить уровни гемопоэза, достаточные для поддержания формулы периферической крови. Значительная часть (до 40%) подвергнутых трансплантации субъектов требует продолжительных переливаний тромбоцитов после трансплантации (первичная несостоятельность приживления). В меньшей группе (5-10% при аутологичной, но 20% с аллогенной трансплантацией) развивается вторичная тромбоцитопения, несмотря на первоначальное приживление, что иногда требует продолжительных переливаний. Несостоявшееся приживление или отсроченное приживление связаны с повышенной смертностью, повышенными затратами на-1 010759 здравоохранение и ухудшением качества жизни субъекта. Таким образом, существует необходимость увеличения продукции ГСК у этих субъектов. Исследования показали, что введение пациентам ТПО приводит к мобилизации клеток-предшественников периферической крови. В одном исследовании выявили мобилизацию колониеобразующих клеток из множественных линий и клеток CD34+ в периферическую кровь после введения многократной дозы ТПО в сочетании с гранулоцитарным колониеобразующим фактором (G-CSF). В другом исследовании было установлено 6-кратное увеличение циркулирующих клеток CD34+ после 3-7-дневного введения единичной дозы ТПО у онкологических пациентов с нарушенным гематопоэзом. В этом исследовании обогащенная субфракция (CD34+Thy+Lin-) была увеличена 9-кратно, и коммитированная мегакариоцитарная субфракция (CD34+ CD41+ CD14-) была увеличена 15-кратно. Данное исследование предполагает, что ТПО способен мобилизовать как самообновляющиеся ГСК, так и коммитированные дочерние клетки из костного мозга. Несмотря на то, что с доступностью рекомбинантного ТПО (rhТПО) появилась надежда на увеличение продукции ГСК, существует необходимость в улучшении ТПО-терапии путем усовершенствования способа доставки лекарственного средства. Следовательно, существует потребность в малых молекулах-миметиках соединений ТПО, которые в значительной степени сохраняют активность полного агониста ТПО, в то же самое время позволяя применять различные способы введения. Также существует потребность в малых молекулах-миметиках соединений ТПО, имеющих пониженную иммуногенность по отношению к одному или более из rhТПО и rhIL-11, а также улучшенный фармакокинетический профиль по отношению к одному или более из rhТПО и rhIL-11. Сущность изобретения Настоящее изобретение относится к способу увеличения продукции ГСК у субъекта, включающему в себя этап введения соединения-миметика ТПО субъекту. Соединение-миметик ТПО может быть введено субъекту отдельно или с фармацевтически приемлемым носителем. Соединение-миметик ТПО может применяться отдельно или в сочетании с одним или более дополнительными соединениями-миметиками ТПО/или другими средствами, которые могут усиливать мобилизацию стволовых клеток из костного мозга, включая, например, G-CSF, SCF, IL-3 и/или Flt-3. Настоящее изобретение, следовательно, также относится к ТПО-миметической фармацевтической композиции, которая содержит эффективное количество соединения-миметика ТПО и фармацевтически приемлемый носитель. Эффективное количество соединения-миметика ТПО присутствует, когда при введении соединения-миметика ТПО усиливается рост популяции стволовых клеток в пределах костного мозга субъекта и/или мобилизуются стволовые клетки в периферическое кровообращение субъекта. Настоящее изобретение также относится к способу предоставления ГСК субъекту. Способ может включать в себя этапы введения соединения-миметика ТПО субъекту для усиления роста популяции стволовых клеток в пределах костного мозга субъекта и/или мобилизации стволовых клеток в периферическое кровообращение субъекта. Затем способ может включать в себя забор одной или более стволовых клеток у субъекта - либо из костного мозга, либо из периферического кровообращения - и затем трансплантацию забранной одной или более стволовых клеток субъекту. Настоящее изобретение также относится к способу обеспечения ГСК, взятых у донора, субъектуреципиенту. Перечень фигур На фиг. 1 представлена схема, на которой изображена регуляция продукции тромбоцитов и ГСК в соответствии со способом согласно изобретению. На фиг. 2 представлен перечень ингредиентов, которые могут подходить для применения в способе согласно изобретению. Подробное описание изобретения Соответствующие части публикаций патента и приводимая здесь литература включены в виде ссылки. В одном варианте осуществления настоящее изобретение относится к способу увеличения продукции ГСК путем введения субъекту пептида ТПО, соединения-миметика ТПО, включая, без ограничения,соединения, показанные на фиг. 2, и ПЭГилированные формы соединений, показанные на фиг. 2. Методология, которая может применяться для ПЭГилирования соединений, показанных на фиг. 2, описана в патенте США 5869451. В варианте осуществления настоящее изобретение направлено на увеличение продукции ГСК путем введения субъекту пептида-миметика ТПО, как описано в соответствующей заявке США (поверенный реестр 038073-5005 PR), поданной 28 августа 2003 г., полное содержание которой включено в настоящее описание в виде ссылки. Согласно данному варианту осуществления пептид ТПО представляет собой соединение, имеющее (1) молекулярный вес менее чем примерно 5000 Да и (2) аффинность связывания с рецептором ТПО, выраженную через IC50 составляющую, не более чем 100 мкМ, в котором любое количество C(O)NH-связей пептидов, включая ноль, было замещено связью, выбранной из группы, состоящей из -CH2OC(O)NR-связи; фосфонатной связи; -CH2S(O)2NR-связи; CH2NR-связи;C(O)NR6-связи и -NHC(O)NH-связи, где R представляет собой водород или низший алкил и R6 представ-2 010759 ляет собой низший алкил, кроме того, в котором N-концевая группа указанного соединения выбрана из группы, состоящей из группы -NRR1; группы -NRC(O)OR; группы -NRS(O)2R; группы -NHC(O)NHR; сукцинимидной группы; группы бензилоксикарбонил-NH и бензилоксикарбонил-NH-группы, содержащей от 1 до 3 заместителей на фенильном кольце, выбранных из группы, состоящей из низшего алкила,низшего алкокси, хлоро и бромо, где R и R1 независимо выбраны из группы, состоящей из водорода и низшего алкила, а кроме того, когда C-концевая группа соединения имеет формулу-C(O)R2, где R2 выбран из группы, состоящей из гидрокси, низшего алкокси, и NR3R4, где R3 и R4 независимо выбраны из группы, состоящей из водорода и низшего алкила и где атом азота группы -NR3R4 может, по выбору,быть аминогруппой N-концевой группы пептида так, чтобы образовывать циклический пептид и его физиологически приемлемую соль. В связанном варианте осуществления пептид-миметик ТПО содержит последовательность аминокислот X9X8GX1X2X3X4X5X6X7, где X9 представляет собой A, C, E, G, I, L, M, P, R, Q, S, T или V;X4 представляет собой любую из 20 генетически кодируемых L-аминокислот; X5 представляет собой A,D, E, G, K, M, Q, R, S, T, V или Y; a X7 представляет собой C, G, I, K, L, M, N, R или V. Особенно предпочтительным пептидом-миметиком ТПО является IEGPTLRQ (2-Nal) LAARA. В другом варианте осуществления пептид-миметик ТПО димеризован или олигомеризован для увеличения аффинности и/или активности соединения. Пример такого соединения включает в себя где Х 10 представляет собой саркозин или остаток -аланина или ПЭГилированную форму этого соединения. ПЭГилированная форма может включать в себя остаток 20k MPEG, ковалентно связанный с каждым N-концевым изолейцином. Один или более пептидов-миметиков ТПО, в особенности ПЭГилированных пептидов-миметиков ТПО (носящих здесь общее название "соединения-миметики ТПО" или "соединения-миметики ТПО согласно изобретению"), могут быть использованы для увеличения числа стволовых клеток в костном мозге. Важные данные, свидетельствующие в пользу применения соединений-миметиков ТПО при ТАСК,представлены в публикации Somlo et al., Blood, 93(9): 2798-2806 (1999), где было показано, что рекомбинантный человеческий тромбопоэтин (rhТПО) способен усиливать мобилизацию и выход при аферезе стволовых клеток CD34+ в ответ на G-CSF с последующим уменьшением числа аферезов. Впоследствии приживление повторно инфузированных клеток было также улучшено с точки зрения сокращенного времени для ANC0,5109/л и независимости трансфузии тромбоцитов, хотя этот эффект не достигал статистически значимого результата в пробах маленького размера, применяемых в данном пилотном исследовании. Увеличивая число стволовых клеток, можно существенно улучшить общий забор стволовых клеток у субъекта. Кроме того, увеличивая число стволовых клеток, забранных у субъекта, можно также значительно улучшить число стволовых клеток, пригодных для трансплантации обратно субъекту, таким образом потенциально уменьшая время приживления (время, в течение которого субъект имеет недостаточно нейтрофилов и тромбоцитов), предотвращая таким образом осложнения. Кроме того, настоящее изобретение может также способствовать уменьшению той части субъектов,которые не способны собрать достаточного количества клеток для продолжения лечения своих первичных заболеваний, например химиотерапии и других аблативных терапий костного мозга. Кроме того,может быть уменьшена также доля субъектов с отложенным первичным приживлением. Соединения-миметики ТПО, как, например, те, что приведены на фиг. 2 и раскрыты здесь, могут применяться для увеличения продукции ГСК. Это достигается введением одного или более соединений субъекту. Соединения, показанные на фиг. 2 и раскрытые здесь, а также ПЭГилированные формы соединений, показанные на фиг. 2, могут обладать уменьшенной иммуногенностью по сравнению с одним или более из rhТПО и rhIL-11. Соединения-миметики ТПО могут также быть использованы для обеспечения аутологичных ГСК субъекту. Обычно это включает в себя стадии введения соединения-миметика ТПО нуждающемуся в этом субъекту для усиления роста популяции стволовых клеток в пределах костного мозга и/или мобилизации стволовых клеток в периферическом кровообращении; забора одной или более стволовых клеток костного мозга или одной или более стволовых клеток в периферическом кровообращении; трансплантации одной или более забранных стволовых клеток обратно субъекту.-3 010759 В дополнение, стволовые клетки, полученные путем забора согласно описанному выше способу согласно изобретению, могут быть криоконсервированы с применением способов, известных в данной области для криоконсервирования стволовых клеток. Таким образом, с применением криоконсервирования стволовые клетки могут быть сохранены так, что, если вдруг субъект будет нуждаться в трансплантации стволовых клеток, стволовые клетки могут быть разморожены и трансплантированы обратно субъекту. Соединения-миметики ТПО, включая соединения, показанные на фиг. 2 и раскрытые здесь, а также ПЭГилированные формы соединений, показанных на фиг. 2, могут, следовательно, применяться, помимо прочего, для уменьшения времени приживления после повторной инфузии стволовых клеток субъекту; уменьшения частоты случаев замедленного первичного приживления; уменьшения частоты случаев вторичной недостаточности продукции тромбоцитов и уменьшения времени приживления тромбоцитов и/или нейтрофилов после повторной инфузии стволовых клеток субъекту. Данные способы обычно включают в себя стадии введения соединения-миметика ТПО нуждающемуся в этом субъекту для усиления роста популяции стволовых клеток в костном мозге и/или мобилизации стволовых клеток в периферическом кровообращении, а затем забора одной или более стволовых клеток костного мозга или стволовых клеток из периферического кровообращения, а затем трансплантации забранных клеток обратно субъекту в подходящее время, определяемое специфическими потребностями субъекта. Способ согласно изобретению может быть также использован для увеличения количества стволовых клеток, взятых у субъекта-донора, чьи клетки потом применяются для спасения субъектареципиента, который получил аблативную терапию костного мозга.A. Дозированные формы и пути введения. Соединения-миметики ТПО, используемые в настоящем изобретении, могут быть введены в виде лекарственных композиций, содержащих в качестве активного ингредиента по меньшей мере один из пептидов или пептидных миметиков, показанных на фиг. 2, и/или раскрытых здесь, и/или описанных в патенте США 5869451, полное содержание которого включено в данное описание в виде ссылки, в сочетании с фармацевтическим носителем или растворителем. Соединения могут быть введены пероральным, легочным, парентеральным (внутримышечно, интраперитонеально, внутривенно (BB) или путем подкожной инъекции), ингаляционным (с помощью тонкоизмельченной порошковой лекарственной формы), чрескожным, назальным, вагинальным, ректальным или сублингвальным путями введения и могут быть составлены в лекарственные формы, соответствующие каждому из путей введения. См., например, Bernstein et al., PCT публикацию патентаWO 93/25221; Pitt et al., PCT публикацию патентаWO 94/17784 и Pitt et al., европейскую патентную заявку EP 613683, каждая из которых включена в настоящее описание в виде ссылки. Твердые лекарственные формы для перорального введения включают в себя капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение может быть смешано по меньшей мере с одним инертным фармацевтически приемлемым носителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут также содержать, как обычно дополнительные вещества, иные, чем инертные растворители, например смазывающие средства, такие как стеарат магния. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать забуферивающие средства. Таблетки и пилюли могут быть дополнительно приготовлены с энтеросолюбильным покрытием. Жидкие лекарственные формы для перорального введения включают в себя фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы с эликсирами, содержащими инертные растворители,обычно применяемые в данной области, такие как вода. Кроме таких инертных растворителей, композиции могут также включать в себя вспомогательные вещества, такие как увлажняющие средства, эмульгирующие и суспендирующие средства и подсластители, вкусовые и ароматизирующие добавки. Препараты для парентерального введения включают в себя стерильные водные и неводные растворы, суспензии или эмульсии. Примерами безводных растворителей или носителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло и кукурузное масло, желатин и органические сложные эфиры для инъекций, такие как этилолеат. Такие лекарственные формы могут также содержать вспомогательные вещества, такие как консервирующие, увлажняющие, эмульгирующие и диспергирующие средства. Они могут быть стерилизованы, например, путем фильтрации через бактериальный задерживающий фильтр, путем введения стерилизующих средств в композиции. Они могут также производиться с применением стерильной воды или некоторых других стерильных иньекционных средств непосредственно перед применением. Композиции для ректального и вагинального введения представляют собой предпочтительно суппозитории, которые могут содержать, в дополнение к активному веществу, наполнители, такие как масло какао или парафин для свечей. Композиции для назального и сублингвального введения также приготавливают со стандартными наполнителями, хорошо известными в данной области. Композиции согласно изобретению могут быть также микроинкапсулированы, например, способом Тайса и Биби (in Treatise on Controlled Drug Delivery, ed. A. Kydonieus, Marcel Dekker, New York (1992), p. 315-339).-4 010759 Композиции могут также комбинироваться, помимо прочего, с гранулоцитарным колониеобразующим фактором (G-CSF), SCF, IL-3, Flt-3 и/или другими средствами, которые могут усиливать мобилизацию стволовых клеток из костного мозга (включая примирующую химиотерапию и антагонисты интегрина).B. Количество дозировки. Количества соединения-миметика ТПО, необходимые согласно изобретению, зависят от многих различных факторов, включая средства введения, расположение сайта-мишени, физиологическое состояние субъекта и других вводимых лекарств. Следовательно, дозировки для лечения должны быть оттитрованы с целью оптимизации безопасности и эффективности. Обычно дозировки, применяемые invitro, могут служить полезной инструкцией в отношении количеств, используемых для введения данных реагентов in situ. Испытание на животных эффективных доз для лечения отдельных заболеваний обеспечит дальнейшие предварительные указания в отношении дозировок для человека. Различные варианты оценки описаны, например, у Gilman, et al., (eds), Goodman and Gilman's: The Pharmacological Basis ofTherapeutics, 8th ed., Pergamon Press (1990); and Remington's Pharmaceutical Sciences, 7th Ed., Mack Publishing Co., Easton, Pa. (1985); каждое из которых включено в настоящее описание в виде ссылки. Соединения-миметики ТПО применимы в настоящем изобретении, когда их вводят в диапазоне дозировки примерно от 0,001 примерно до 20 мг/кг веса тела в день. Наоборот, в некоторых случаях можно также вводить от 0,0001 примерно до 10 мг/кг. Применяемые специфические дозы зависят от особенностей состояния, подвергаемого лечению, пути введения, а также мнения лечащего врача, которое зависит от таких факторов, как тяжесть состояния, возраст и общее состояние субъекта и пр.C. Субъекты и показания. Здесь под субъектом подразумевается любой, кто является кандидатом на аутологичную трансплантацию стволовой клетки или костного мозга в течение курса лечения злокачественного заболевания или в качестве компонента генной терапии. Другими возможными кандидатами являются субъектыдоноры стволовых клеток или костного мозга для аллогенной трансплантации субъектам при злокачественном заболевании или генной терапии. Для того чтобы обеспечить приемлемую вероятность приживления трансплантата, нужно обеспечить минимальное количество забранных стволовых клеток. Хотя точно не ограничено, в большинстве случаев принято, что должно быть забрано 2-3106 CD34+ клеток/кг, чтобы обеспечить реальные шансы на приживление. С точки зрения времени приживления оказывается, что повторная инфузия 5106 клеток/кг дает оптимальные результаты. Такое большое количество клеток нужно потому, что действительное количество специфической субпопуляции клеток CD34+, которые способны к длительному восстановлению костного мозга, очень мало. Считается, что до 20% трансплантированных пациентов являются плохими мобилизаторами, требующими множественных аферезов для генерации достаточного количества клеток. Хотя одним из наиболее важных прогностических факторов для слабой мобилизации является возраст пациента, предварительное лечение интенсивной химиотерапией также представляет собой существенный фактор. Вероятно, существует большое число пациентов, особенно пожилых пациентов с миеломой или HXЛ, которые не рассматриваются как кандидаты на ТАСК из-за низкой вероятности успешного приживления трансплантата. Следовательно, способ согласно изобретению обеспечивает неудовлетворенные потребности в ТАСК, т.е. способствует улучшению соотношения пациентов с успешным и быстрым приживлением. Это прежде всего достигается благодаря улучшению мобилизации стволовых клеток либо за счет увеличения числа мобилизованных клеток, либо за счет увеличения доли ГСК в мобилизованной популяцииCD34+. Способ согласно изобретению, таким образом, обеспечивает следующие преимущества. 1. Позволяет приступить к трансплантации у пациентов, которые в другом случае не рассматривались бы в качестве кандидатов из-за неприемлемо высокого риска неудачного приживления трансплантата. 2. Уменьшает число аферезов, необходимых для генерации минимально приемлемого забора клеток. 3. Уменьшает количество случаев первичного или вторичного неудачного приживления трансплантата в результате увеличения числа ГСК, доступных для трансплантации. 4. Сокращает время, требуемое для первичного приживления трансплантата, путем увеличения числа коммитированных предшественников важных гемопоэтических направлений дифференцировки. В соответствии с установленным эффектом ТПО в отношении ГСК соединения-миметики ТПО согласно изобретению могут обладать следующими клиническими преимуществами в трансплантации стволовых клеток: улучшением выходов афереза: многочисленные исследования предполагают, что число повторно инфузированных стволовых клеток CD34+ является важным фактором в определении времени приживления. Как показано с ТПО, добавление соединения-миметика ТПО может ускорить мобилизацию клетокCD34+, в дополнение к общепринятым режимам мобилизации G-CSF и химиотерапии. Первостепенное преимущество касается улучшения перспективы быстрого и последующего длительного приживления.-5 010759 Уменьшение числа аферезов, требуемых для продукции приемлемого числа клеток, должно уменьшить стоимость и неудобства для пациентов. Улучшение выхода при аферезе особенно полезно для пациентов с факторами риска слабой мобилизации (возраст и интенсивное предварительное лечение). Такие пациенты в ином случае не могут быть кандидатами на ТАСК; улучшением потенциала приживления аферезных клеток: длительное приживление после миелоаблативной терапии вызвано малой фракцией клеточной популяции CD34+ (наиболее вероятно, в пределахCD34+CD38-Lin- популяции). Поскольку они являются такими редкими, требуются большие количестваCD34+ клеток для обеспечения эффективного приживления (2-5106/кг). G-CSF не влияет на соотношение различных субпопуляций клеток CD34+ и просто применяется в качестве средства, которое может увеличивать количество данных клеток в периферической крови перед забором. Первичная химиотерапия может в действительности быть токсичной для таких клеток. Однако ТПО все больше и больше становится признанным как средство, которое может усилить самообновление большинства примитивных стволовых клеток, которые способны к продолжительному восстановлению гемопоэза. Подобный эффект соединения-миметика ТПО может, следовательно, увеличивать количественное соотношение популяции клеток CD34+, которые могут внести вклад в длительное приживление, а следовательно, уменьшить риск неудачного приживления. ТПО может также увеличить количество стволовых клеток, коммитированных к направлению дифференцировки в мегакариоциты, таким образом создавая раннюю независимость от трансфузии тромбоцитов, т.е. уменьшая время приживления. Два преимущественных эффекта, описанных выше, могут быть добавочными или синергичными, приводя к большему сокращению времени приживления, чем может наблюдаться со средствами, которые только усиливают мобилизацию стволовых клеток. Применение соединения-миметика ТПО согласно изобретению, вероятно, потребует лишь малого количества вводимых доз, например внутривенно или подкожно, перед аферезом. Подобный режим дозирования способствовал бы минимизации риска значительной антигенности, которая, по прогнозам,должна быть низкой уже благодаря применению ПЭГилированного продукта. Соединение-миметик ТПО согласно изобретению сначала вводят здоровым добровольцам, чтобы: 1) установить эффект соединения-миметика ТПО в отношении популяции клеток CD34+ периферической крови, числа тромбоцитов и других гематологических параметров; 2) установить предварительный профиль безопасности соединения-миметика ТПО на основе ограничивающей дозу токсичности и высокой частоты побочных явлений; 3) определить наиболее подходящую дозу, режим дозирования и распределение дозы во времени при дозировании перед аферезом соединения-миметика ТПО; 4) определить фармакокинетический профиль соединения-миметика ТПО у человека. 5) сформировать предварительную сравнительную информацию по эффектам соединения-миметика ТПО согласно изобретению и G-CSF в отношении потенциала множественных направлений дифференцировки стволовых клеток периферической крови. Здоровые добровольцы, которые являются наиболее подходящей популяцией для оценки фармакокинетики и начального профиля безопасности, обеспечивают наиболее ясное понимание эффектов соединения-миметика ТПО в отношении ГСК из-за отсутствия фоновых эффектов химиотерапии и заболевания. Исследование должно быть спланировано как одиночный слепой метод исследования, исследование возрастающих доз, в котором здоровые добровольцы получают единственную внутривенную дозу соединения-миметика ТПО согласно изобретению, вводимую в виде одночасовой инфузии. Начальная доза будет составлять 15 мкг/кг. Группы, которым вводили возрастающие дозы, получат 25, 50, 100 и 200 мкг/кг. В каждую группу будут входить четыре субъекта, трое из которых получат активную терапию, а один будет получать плацебо. Каждый субъект будет наблюдаться через регулярные (15-минутные) интервалы в процессе инфузии и будет оставаться в качестве стационарного пациента в течение 24 ч для тщательного мониторинга безопасности и исследования фармакокинетики. Дальнейшее наблюдение за безопасностью амбулаторного пациента, оценка фармакокинетики и фармакодинамики происходят на 2-, 4-, 7-, 14-, 21- и 28-й дни. Каждая группа, получающая следующую дозу, будет получать ее через две недели после предыдущей группы. Когда будет достигнута доза, при которой наблюдаются признаки фармакодинамического эффекта(определяемого как 50% увеличение числа тромбоцитов по отношению к значению до лечения) у 2/3 активно леченых субъектов, дозирование на данном уровне продлевается для включения дополнительных четырех субъектов (3/1 активное лечение/плацебо). Если эффективность подтвердится, для апробации очередной дозы будет введена еще одна дополнительная группа из шести субъектов (4/2 активное лечение/плацебо) для дальнейшего подтверждения фармакодинамического эффекта. Если фармакодинамический эффект наблюдается только на высшей запланированной дозе, рассматривается дальнейшее повышение дозы, естественно, в отсутствие признаков токсичности. Если явление безопасности/устойчивости, которое, возможно или вероятно, связано с изучаемым лечением, встречается у единственного активно леченого субъекта при какой-нибудь дозе, четыре до-6 010759 полнительных субъекта (3/1 активное лечение/плацебо) включаются при данной дозе, чтобы определить,была ли установлена ограничивающая дозу токсичность. Берутся образцы крови для измерения уровней лекарственного средства через 30 мин после начала инфузии, в конце инфузии и в последующие моменты времени после окончания инфузии: через 5, 15, 30 мин, 1, 2, 4, 8, 12, 24, 48, 96 ч и 7 и 14, 21 и 28 дней. Измерение уровней соединения будет проводиться либо на основе биологической активности клеток, либо методом ELISA. Для сравнения однократную дозу G-CSF будут вводить трем субъектам для измерения эффектов в отношении клеток CD34+. Воздействие соединения-миметика ТПО на число клеток CD34+ в периферической крови, если оно есть, будет отсрочено на несколько дней (3-7, если эффект подобен тромбопоэтину). Кроме того, из-за неизвестного влияния фармакокинетики соединения-миметика ТПО на фармакодинамический профиль,не определено, когда будет наблюдаться максимальный эффект однократной дозы. Это расчет времени максимального эффекта, которое определяет интервал между дозированием соединения-миметика ТПО и забором клеток CD34+ при последующем исследовании пациентов. Показана хорошая корреляция между числом CD34+ в периферической крови и количеством в последовательных заборах, что предполагает,что данный подход является корректным. Возможно, целесообразно вводить соединение-миметик ТПО согласно изобретению перед G-CSF для создания условий для роста популяции ГСК в костном мозге с последующей мобилизацией образовавшейся популяции. В большинстве исследований с использованиемG-CSF для стимуляции мобилизации лекарственное средство дают в течение 5 дней с точно определенным забором к концу периода дозирования. Возможно, что фармакодинамический профиль соединениямиметика ТПО будет требовать дозирования за несколько дней до G-CSF. Влияние соединения-миметика ТПО на количество самообновляющихся ГСК в мобилизованной популяции может обеспечить увеличение способности к самообновлению, которая может привести к успешному приживлению с наименьшим количеством мобилизованных клеток, большей легкости выполнения тандемных трансплантатов и вероятности, что соединение-миметик ТПО может в конечном счете заменить G-CSF в качестве стандартного мобилизующего средства. Данный аспект клинической фармакологии соединения-миметика ТПО может быть направлен на измерение способности к самообновлению популяций CD34+, полученных из крови здоровых добровольцев, как при исследовании in vitro способности поддерживать длительное колониеобразование (культура LTC-IC), так и в предпринятых опытах по репродуцированию клеток в организме мышейSCID/NOD, при которых мобилизованные клетки инфузируют в организм летально облученной мышиSCID/NOD. Предварительные расчеты показывают, что такие исследования выполнимы с участием клеток CD34+, содержащихся в 30-50 мл крови, при условии, что число CD34+ достигает приблизительно 15103/мл. Предположения, лежащие в основе данного утверждения, изложены ниже. 1. Моноциты периферической крови (МПК) из здоровых субъектов получают путем разделения наFicoll/Hypaque и затем Lin+ клетки удаляются с использованием отрицательной селекции. CD34+CD38 субфракции данной обогащенной популяции затем изолируются с помошью FACS и вводятся мышамSCID/NOD. Мыши также получают дополнительные клетки и факторы роста, что позволяет использовать наименьшие количества CD34+CD38-Lin- клеток на мышь (Bonnet et al., Bone, Marrow Transplantation, 23:203-209 (1999. Альтернативно, исходная популяция МПК применяется без дальнейшей очистки для обеспечения как репродуцирующихся, так и вспомогательных клеток. 2. Главной конечной целью данного испытания является выживание реципиентной мыши. Тем не менее, также выполняются методы расчета Southern Blot для выявления ДНК в реципиентной мыши. Если возможно, выявление человеческих клеток-предшественников устанавливается человеческими селективными пролонгированными костно-мозговыми культурами и/или проточной цитометрией с человеческими специфичными моноклональными антителами. 3. Каждый субъект предоставляет достаточно крови для тестирования четырех доз CD34+CD38-Linклеток (250, 500, 1000 и 2000 клеток/мышь). Каждая доза клеток дается 5 мышам. При постановке опыта приблизительно 1,9104 CD34+CD38-Lin- клеток необходимо получить от каждого субъекта. Если выполняются дополнительные исследования колониеобразования in vitro, потребуется больше клеток. 4. Каждый здоровый субъект предоставляет данный образец крови только единожды и только тогда, когда число клеток CD34+ в периферической крови достигнет 15103/мл. CD34+CD38-Lin- популяция представляет 5-8% популяции CD34+ (Gallacher et al., Blood, 95:2813-2820 (2000. Исследования с ТПО у здоровых добровольцев показали, что 16103 клеток CD34+/мл обнаруживается в периферической крови. 5. Для получения 2,25-3,6104 клеток от каждого субъекта требуется 30 мл крови. 6. Невозможно выполнить данные исследования у субъектов, леченых плацебо, вследствие низкого уровня клеток CD34+ (3103/мл). Для сравнения подобные количества клеток берутся у субъектов, леченых G-CSF. Каждой мыши инфузируют равные количества клеток. 7. Правильность данных посылок проверяется независимыми данными. Приблизительно 1 из 6106 моноцитов периферической крови (МПК) способен к репродуцированию в организме мыши SCID/NOD(Wang et al., Blood, 89:3919-3924(1997. Из данной популяции клеток популяция CD34+ представлена 0,13-0,39%, и 5-8% этой субпопуляции представлено клетками CD34+CD38-Lin- (Tichelli et al., Br. J. Hematol., 106:152-158 (1999. Это составляет 390-1872 клеток из первичных МПК. В отдельном исследовании было показано, что частота SCID/NOD-репродукции клеток в популяции CD34+CD38-Lin- составляет 1 из 617 (Bhatia et al., PNAS, 94:5320-5325 (1997. Данное количество согласуется с экстраполяцией частоты встречаемости в неселектируемых клетках. 8. Если количество клеток ограничено, группа мышей, которым вводят самую высокую дозу, выпадает. Клетки CD34+, полученные у добровольцев, которым вводят G-CSF, используют в этих исследованиях в качестве контроля. Предложенное исследование здоровых добровольцев обеспечит базу данных, необходимую для определения планирования схемы исследования пациента в отношении дозы, режима введения и распределения доз во времени, а также убедительное фармакодинамическое доказательство, которое позволит предсказывать клиническую эффективность. В следующей фазе клинической фармакологической программы будут стремиться воспроизвести наблюдаемые эффекты у пациентов, которым планируют трансплантировать стволовые клетки, а также обеспечить данные по переносу, которые бы показывали взаимосвязь между описанными выше результатами изучения фармакодинамики и клиническими результатами, необходимыми для одобрения регулирующими организациями. Соединение-миметик согласно изобретению вводят затем нуждающимся в этом пациентам, чтобы: 1) выявить группу риска, чтобы начать изучать действие соединения-миметика ТПО среди различных популяций пациентов, которые являются кандидатами для аутологичной трансплантации стволовой клетки; и 2) получить предварительное доказательство вероятных эффектов соединения-миметика ТПО на выход при аферезе стволовых клеток CD34+ периферической крови и результаты после приживления. Первое тестирование пациента вновь будет связано с введением однократной дозы в режиме повышения этой дозы (при условии, что нет никаких причин вводить дозу соединения-миметика ТПО в виде раздельных доз). Дозирование соединения-миметика ТПО будет проводиться в стандартном режиме мобилизации с интервалами доз между дозированием и забором, которые были отработаны при исследованиях на добровольцах. Такая же фармакодинамика будет оцениваться и в данном исследовании, как и в предыдущем исследовании, но, кроме того, будут получены также и данные по выходу при аферезах,количеству аферезов и последовательным скоростям и временам приживления. Дозирование будут проводить путем однократного применения 10-20 мг флакона, содержащего лиофилизированный порошок в виде однократной дозы, внутривенно вводя болюс перед аферезом и после повторной инфузии забранных клеток. Подкожная доза биоэквивалента может быть введена внутривенно. Считается, что такая доза должна составлять примерно 10-300 мкг/кг. Ключевой аспект данного исследования будет связан с выявлением группы риска, чтобы приступить к изучению действия соединения-миметика ТПО среди различных популяций пациентов. Возрастает число пациентов, которые будут получать высокую дозу миелоаблативной терапии с ТАСК относительно на более ранних стадиях заболевания. Такие пациенты часто имеют относительно здоровый костный мозг и у них, особенно если они молоды, с большой долей вероятности мобилизуется приемлемое количество клеток CD34+ с последующей высокой вероятностью быстрого приживления. В данной популяции потенциальное влияние дополнительного средства для ускорения мобилизации может быть ограничено, однако это влияние может проявляться даже как более быстрое приживление с сохранением забранных клеток для тандемной трансплантации. Тем не менее, данная популяция, которая имеет наибольшее сходство со здоровой популяцией, по меньшей мере, в плане ответной реакции костного мозга,представляет собой важную группу переноса для усовершенствования соединения-миметика ТПО. У пациентов, которые становятся кандидатами на ТАСК после многократных предшествующих курсов терапии, часто обнаруживаются большие трудности в генерировании достаточного количества клеток CD34+ для адекватного забора. Следовательно, многие из этих пациентов нуждаются в пролонгированных схемах афереза из-за более высокой частоты встречаемости отсроченного приживления или его несостоятельности. Часть таких пациентов не в состоянии перенести аутологичную трансплантацию и должна вместо этого прибегать к аллогенной трансплантации с повышенным риском осложнений после трансплантации. Это именно та популяция, которой средство для дополнительной мобилизации может принести большую пользу. Следовательно, первое исследование пациентов позволяет внести в список пациентов из обеих категорий. Данные из группы "хорошие мобилизаторы" применяются в качестве точки отсчета для определения влияния соединения-миметика ТПО в группе "слабые мобилизаторы". Будет включена также группа нелеченых больных, получающих только стандартную медицинскую помощь. Указанные выше результаты фармакодинамики будут служить твердой основой для возможного клинического преимущества соединения-миметика ТПО при ТАСК. Окончательные исследования будут проводиться в виде исследований с параллельной группой, с двойными слепыми пробами и с контролем плацебо. Как только возникнет рандомизация, клинические-8 010759 решения о трансплантации будут приниматься в соответствии с предварительно утвержденными правилами и принятой клинической практикой. Главным результатом исследований будет среднее время приживления после повторной инфузии забранных клеток. Время приживления будет определяться как количество дней, необходимых для того,чтобы количество тромбоцитов поддерживалось выше 20109/л без трансфузионной поддержки в течение 7-дневного периода. Побочные результаты будут включать в себя следующее: 1) время приживления нейтрофилов (определяемое как количество нейтрофилов, поддерживаемое на уровне выше 0,5109/л); 2) время, необходимое для того, чтобы количество тромбоцитов составляло 50109/л (поддерживаемое в течение 7 дней без трансфузионной поддержки); 3) доля пациентов с отсроченным приживлением тромбоцитов; 4) доля пациентов с вторичной недостаточностью приживления тромбоцитов; 5) доля пациентов, у которых не вырабатывается количество клеток для минимального забора, необходимого для трансплантации; 6) забор CD34 + (CD34+ клеток/кг); 7) количество аферезов, требуемых для забора; и 8) количество трансфузий тромбоцитов. Ключевым фактором в схеме исследования будет являться отбор целевой популяции. Опубликованные данные указывают на то, что количество забранных клеток CD34+ является основным определяющим фактором кинетики последующего приживления, и, следовательно, оно будет непосредственно влиять на точку отсчета в этих исследованиях. Ключевыми демографическими признаками, которые будут влиять на способность мобилизовать клетки CD34+, являются количество предварительных лечебных воздействий и возраст пациента. При этом необходимо учитывать ряд обстоятельств. 1. Если выбирается популяция со слабой мобилизирующей способностью, это дает наибольшую возможность выявить улучшение в скорости приживления, но способность костного мозга отвечать на соединение-миметик ТПО может быть так нарушена, что никакой ответ не возможен. 2. Если выбирается популяция с сильно мобилизирующей способностью, возможность выявить ответ на фоне базовой терапии может быть ограничена вследствие того, что будет повторно инфузировано оптимальное количество самообновляющихся ГСК, независимо от добавления соединения-миметика ТПО. 3. Существенный эффект соединения-миметика ТПО согласно изобретению в плане повышения мобилизации может препятствовать точному отнесению (популяции к разряду) сильных или слабых мобилизаторов. 4. Возможность выявления влияния на приживление на уровне увеличения самообновляющихся ГСК может быть заметна только у пациентов, у которых количество этих клеток является лимитирующим фактором в кинетике приживления. Исходя из указанных обстоятельств, очень важно иметь в виду, что изучение популяции в плане данных исследований ограничено в числе пациентов в крайних положениях интервала мобилизации. В каждом из крайних положений могут возникать трудности для демонстрации эффективности соединения. Этого можно избежать путем исключения некоторых групп пациентов, которые с высокой степенью вероятности попадут в группу с крайними значениями мобилизации (например, пациенты, получающие первый этап терапии, пациенты с миелодисплазией и/или низким резервом костного мозга), а также путем обеспечения того, чтобы уровень во взятом за основу образце определялся пациентами, у которых при заборе достигается предопределенный (количественный) интервал клеток CD34+ (т.е. рандомизированные пациенты, которые не соответствуют данным критериям, должны быть заменены). Если следовать такого типа схеме, большинство пациентов, которые будут влиять на главный конечный результат в группе плацебо, должны иметь выход клеток CD34+, относящийся к следующим категориям в соотношении 2:3:1 соответственно: 2,0106/кг (среднее время приживления = 17 дней),2-5106/кг (среднее время приживления = 12 дней),5106/кг (среднее время приживления = 10 дней). В популяции такого типа ожидаемое среднее время приживления составляет 13-14 дней. Если эффект соединения-миметика ТПО на выход клеток CD34+ таков, что меняется соотношение различных категорий забора с 2:3:1 до 1:2:3, то само это изменение приводит к уменьшению среднего времени приживления на 1,66 дней. Если на это накладывается улучшенное время приживления, в рамках каждой категории вызванное повышенным количеством самообновляющихся ГСК, так что среднее время приживления улучшается на 5 дней в группе с самым низким выходом (т.е. пациенты этой группы ведут себя подобно пациентам в группе со средним выходом) и на 2 дня в средней группе (т.е. они ведут себя подобно группе с высоким выходом), дополнительное сокращение среднего времени приживления составляет 1,66 дней. Никакого влияния на время приживления в группе с высоким выходом не предпола-9 010759 гается. В целом, влияние лечения соединением-миметиком ТПО на среднее время приживления тромбоцитов, при расчете уровня во взятом за основу образце, составляет 3 дня. Чтобы по возможности определить максимальную клиническую пользу соединения-миметика ТПО, нужно установить относительно низкий порог для минимального забора, необходимого для продолжения миелоаблативности. Возможность продемонстрировать эффективность соединения-миметика ТПО при ТАСК представляется относительно простой, так как достаточно будет наблюдения повышенного количества стволовых клеток CD34+ в периферической крови здоровых добровольцев, леченых однократными дозами. Первое обследование человека, следовательно, покажет соответствующий биологический эффект. В нескольких исследованиях уровень клеток CD34+ в периферической крови определяется как важный показатель для предсказания выхода при последующем аферезе. Однако влияние на мобилизацию стволовых клеток, в сочетании с G-CSF, не будет установлено, пока первое обследование пациента не завершится. Труднее будет установить, что мобилизованные клетки CD34+ содержат повышенное количество стволовых клеток отчасти из-за трудности измерения низких уровней ГСК у нестимулированных пациентов. Однако,поскольку сообщалось, что G-CSF не влияют на соотношение ГСК в популяции CD34+, можно судить о некотором воздействии соединения-миметика ТПО на количество самообновляющихся ГСК в пределах популяции мобилизованных клеток путем сравнения с клетками, мобилизованными под действиемG-CSF. Наиболее важным фактором, предсказывающим успех, является выход при аферезе. Количество повторно инфузируемых клеток является важным фактором, позволяющим предсказать время последующего приживления. Следовательно, часть пациентов с клинически приемлемыми или высокими выходами будет составлять основное количество претендующих на сокращение времени приживления, а часть пациентов - на отсроченное или несостоятельное приживление. Ожидается, что соединение-миметик ТПО является столь же или даже более полезным, чем G-CSF,в мобилизации стволовых клеток и что соединение-миметик ТПО обеспечивает улучшенное качество мобилизованной популяции стволовых клеток. Планируется одинарное слепое исследование для оценки эффекта соединения-миметика ТПО на мобилизацию стволовых клеток CD34+ в периферической крови, вдобавок к стандартным мобилизирующим режимам, у пациентов, которым планируют проводить миелоаблативную химиотерапию с трансплантацией аутологичных стволовых клеток. Чтобы установить эффект соединения-миметика ТПО на мобилизацию стволовых клеток до афереза, будут проведены исследования однократной дозы, повышения дозы, с применением доз, обеспечивающих мобилизацию клеток CD34+ у здоровых добровольцев. Группа каждой дозы будет состоять из 6 пациентов, получающих активное медикаментозное лечение, и двоих, получающих только фоновую терапию G-CSF. Каждая группа делится на две подгруппы: 3 активных пациента и 1 плацебо-пациент. Одну группу будут составлять пациенты, получающие аутологичные CTK в качестве первичной терапии, в то время как другую будут составлять предварительно интенсивно леченые пациенты, получающие аутологичные CTK в качестве паллиативной терапии. Когда достигается доза, которая вызывает повышенный выход клеток CD34+ относительно такового у пациента из группы плацебо (нужно, чтобы определялась величина эффекта) и исторических контролей действия G-CSF на мобилизацию стволовых клеток,набирается восемь дополнительных пациентов (на подгруппу) при данной дозе, чтобы закрепить доказательство эффективности и исследовать дополнительные пре- и посттрансплантационные предельные значения (включить количество аферезов, необходимых для выхода 3106 клеток/кг, долю пациентов, у которых достигается адекватный забор, и время посттрансплантационного восстановления нейтрофилов,независимо от переливания тромбоцитов). Дальнейшее повышение доз будет происходить в соответствии с первичной схемой рандомизации. Если в одной подгруппе достигается плато эффективности или лимитирующая дозу токсичность, в оставшихся подгруппах повышение доз продолжается. Во время афереза получают образец аферезных клеток для исследования мультипотентной способности забранных клеток (при условии, что величина забора не ограничивается). После скрининга на критерии соответствия и сбора базовых образцов крови пациент получает однократную дозу исследуемого лекарственного средства в виде внутривенной инфузии в течение 60-минутной инфузии. Последующие контрольные визиты происходят каждые 48 ч до завершения отбора стволовых клеток. Считается, что отбор стволовых клеток не удался, если в результате 10 аферезов не удалось отобрать достаточное количество клеток для успешного приживления (минимум 2106/кг). Затем пациенту будут продолжать миелоаблативную терапию, повторную инфузию стволовых клеток и завершать соответствующей поддерживающей терапией,согласно протоколу, определяемому опухолью пациента. Данные по приживлению резюмируются из первичных документов согласно стандартным спецификациям. Образцы будут отбираться для контроля фармакокинетики при каждом запланированном визите больного. Уровни соединения будут определяться методом ELISA. Считается, что введение соединения-миметика ТПО в соответствии со способом согласно изобретению даст ряд преимуществ, включая, помимо прочего, следующие: уменьшение среднего времени приживления тромбоцитов (определяемое как число тромбоцитов- 10010759 20109/л) на 3 дня, когда этот способ добавляется к стандартной терапии. Уменьшение составляет 1 день, когда способ применяется вместо стандартной терапии; уменьшение доли пациентов с отсроченным бременем приживления тромбоцитов от 40 до 10%; увеличение доли пациентов, которые достигают первичного восстановления тромбоцитов (определяемое как число пациентов, у которых поддерживается число тромбоцитов 50000 в течение 7 дней) от 60 до 85%; уменьшение количества необходимых инфузий тромбоцитов (в среднем от 5 до 3); уменьшение среднего времени для ANC 0,5109/л на 1 день; уменьшение доли пациентов, у которых не удается забрать минимальное количество стволовых клеток (3106/кг) для трансплантации (от 35 до 5%) при использовании комбинированной с G-CSF терапии; увеличение выхода клеток CD34+ при использовании комбинированной с G-CSF терапии (4106/кг вместо 1106/кг); уменьшение количества заборов, необходимых для получения достаточного количества клеток для поддержания трансплантации при использовании комбинированной с G-CSF терапии (в среднем от 3 до 1). Терапия удобной однократной дозой предлагается для улучшения эффективности трансплантации стволовых клеток, для более агрессивного лечения солидных опухолей, миеломы и лимфомы и для увеличения количества кандидатов на трансплантацию стволовых клеток. Несмотря на то, что выше описаны только особые варианты осуществления изобретения, следует учитывать, что возможны модификации и изменения изобретения без отклонения от сущности и предполагаемого объема изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ обеспечения гематопоэтических стволовых клеток у субъекта, включающий в себя следующие стадии: введение соединения-миметика тромбопоэтина (ТПО) субъекту для повышения уровня стволовых клеток у указанного субъекта; забор одной или более стволовых клеток; лечение указанного субъекта путем аблативной терапии костного мозга; трансплантацию субъекту взятых у него стволовых клеток,где соединение-миметик ТПО имеет следующую последовательность: где 2-Nal представляет собой -(2-нафтил)аланин, a Sar представляет собой саркозин. 2. Способ по п.1, где субъектом является человек. 3. Способ по п.1, где одна или более стволовых клеток после забора подвергаются криоконсервированию. 4. Способ по п.3, где одну или более криоконсервированных стволовых клеток размораживают и определяют их жизнеспособность перед трансплантацией субъекту. 5. Способ по п.1, где соединение-миметик ТПО имеет уменьшенную иммуногенность по сравнению с иммуногенностью одного или более из rhТПО и rhIL-11. 6. Способ по п.1, где соединение-миметик ТПО имеет улучшенный фармакокинетический профиль по сравнению с таковым одного или более из rhТПО и rhIL-11. 7. Способ уменьшения времени приживления стволовых клеток после повторной инфузии субъекту,включающий в себя следующие стадии: введение субъекту соединения-миметика ТПО для повышения уровня стволовых клеток у указанного субъекта; забор одной или более стволовых клеток; лечение указанного субъекта путем аблативной терапии костного мозга; трансплантация субъекту одной или более взятых у него стволовых клеток,где соединение-миметик ТПО имеет следующую последовательность: где 2-Nal представляет собой -(2-нафтил)аланин, a Sar представляет собой саркозин. 8. Способ уменьшения числа случаев отсроченного первичного приживления стволовых клеток,включающий в себя следующие стадии: введение субъекту соединения-миметика тромбопоэтина (ТПО) для повышения уровня стволовых клеток у указанного субъекта; забор одной или более стволовых клеток; лечение указанного субъекта путем аблативной терапии костного мозга;- 11010759 трансплантация субъекту одной или более взятых у него стволовых клеток,где соединение-миметик ТПО имеет следующую последовательность: где 2-Nal представляет собой -(2-нафтил)аланин, a Sar представляет собой саркозин. 9. Способ уменьшения числа случаев вторичной несостоятельности продукции тромбоцитов у субъекта, включающий в себя следующие стадии: введение субъекту соединения-миметика тромбопоэтина (ТПО) для повышения уровня стволовых клеток у указанного субъекта; забор одной или более стволовых клеток; лечение указанного субъекта путем аблативной терапии костного мозга; трансплантация субъекту одной или более взятых у него стволовых клеток,где соединение-миметик ТПО имеет следующую последовательность: где 2-Nal представляет собой -(2-нафтил)аланин, a Sar представляет собой саркозин. 10. Способ уменьшения времени приживления тромбоцитов и/или нейтрофилов после повторной инфузии стволовых клеток субъекту, включающий в себя следующие стадии: введение субъекту соединения-миметика тромбопоэтина (ТПО) для повышения уровня стволовых клеток у указанного субъекта; забора одной или более стволовых клеток; лечение указанного субъекта путем аблативной терапии костного мозга; трансплантация субъекту одной или более взятых у него стволовых клеток,где соединение-миметик ТПО имеет следующую последовательность: где 2-Nal представляет собой -(2-нафтил)аланин, a Sar представляет собой саркозин. 11. Способ по п.1, где указанное соединение-миметик ТПО ковалентно связано с гидрофильным полимером. 12. Способ по п.11, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 500 до 40000 Да. 13. Способ по п.12, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 5000 до 20000 Да. 14. Способ по п.13, где указанный гидрофильный полимер имеет средний молекулярный вес около 20000 Да. 15. Способ по п.11, где указанный полимер представляет собой полиэтиленгликоль. 16. Способ по п.1, где соединение-миметик ТПО имеет следующую формулу: где (2-Nal) представляет собой -(2-нафтил)аланин, a Sar представляет собой саркозин. 17. Способ по п.16, где указанное соединение-миметик ТПО ковалентно связано с гидрофильным полимером. 18. Способ по п.17, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 500 до 40000 Да. 19. Способ по п.17, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 5000 до 20000 Да. 20. Способ по п.19, где указанный гидрофильный полимер имеет средний молекулярный вес около 20000 Да. 21. Способ по п.20, где указанный полимер представляет собой полиэтиленгликоль. 22. Способ по п.16, где каждая из димерных субъединиц указанного соединения-миметика ТПО ковалентно связана с гидрофильным полимером. 23. Способ по п.22, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 500 до 40000 Да. 24. Способ по п.22, где указанный гидрофильный полимер имеет средний молекулярный вес приблизительно от 5000 до 20000 Да. 25. Способ по п.24, где указанный гидрофильный полимер имеет средний молекулярный вес около 20000 Да. 26. Способ по п.25, где указанный полимер представляет собой полиэтиленгликоль. 27. Способ по п.1, где указанные стволовые клетки находятся в костном мозге указанного субъекта. 28. Способ по п.1, где указанные стволовые клетки находятся в периферическом кровообращении- 12010759 указанного субъекта. 29. Способ по п.1, где указанный субъект подвергается химиотерапевтическому лечению. 30. Способ по п.1, где указанный субъект подвергается радиационной терапии.
МПК / Метки
МПК: A61K 38/18, A61P 7/00, A61P 43/00
Метки: гематопоэтических, тромбоцитов, продукции, стволовых, способы, увеличения, клеток
Код ссылки
<a href="https://eas.patents.su/14-10759-sposoby-uvelicheniya-produkcii-trombocitov-i-gematopoeticheskih-stvolovyh-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Способы увеличения продукции тромбоцитов и гематопоэтических стволовых клеток</a>












