Фармацевтические составы, содержащие ингибиторы деацетилазы гистонов
Формула / Реферат
1. Фармацевтическая композиция для ингибирования деацетилазы гистонов и лечения состояний, опосредуемых деацетилазой гистонов, у субъекта, представляющего собой животное или человека, включающая:
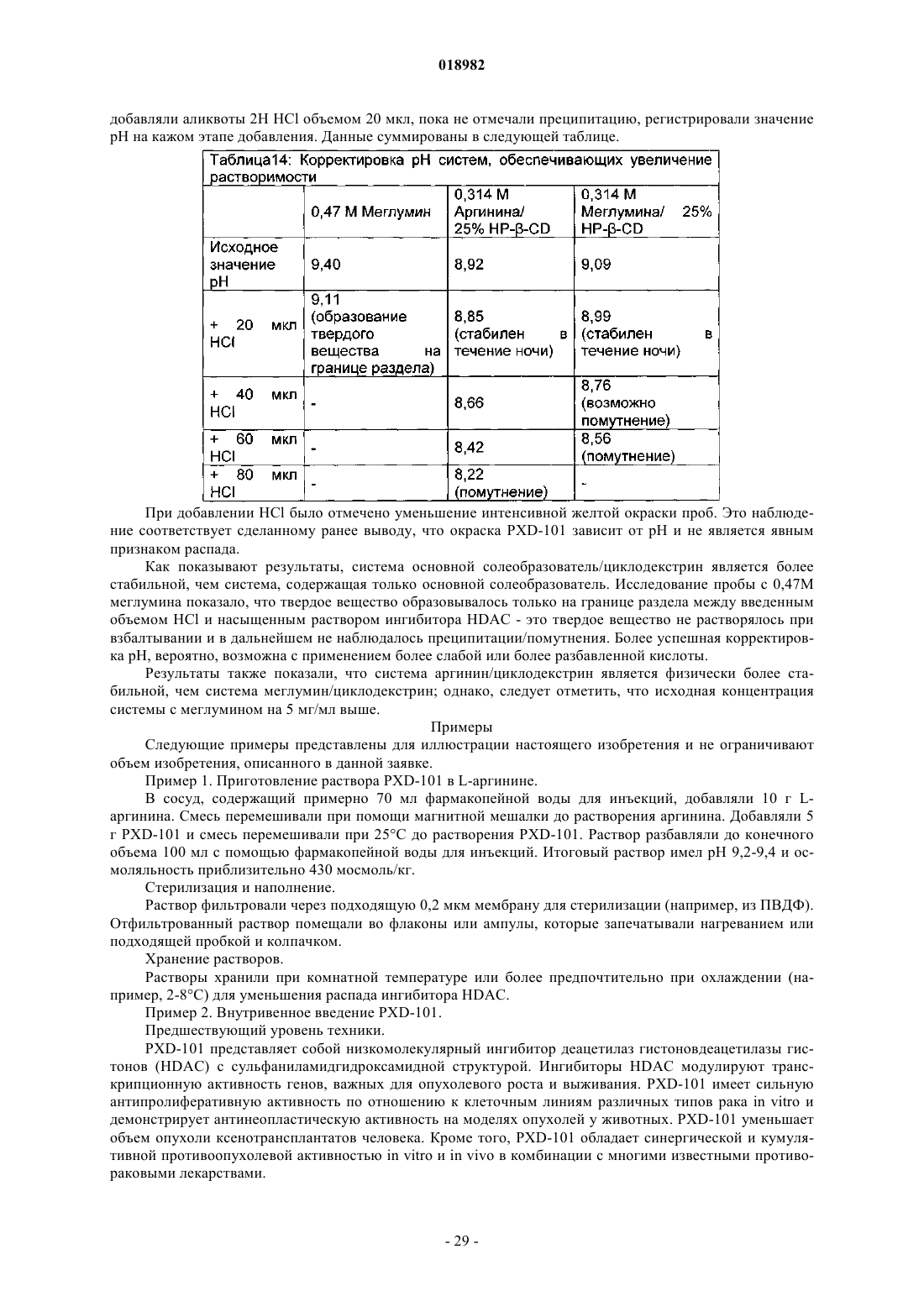
(а) ингибитор деацетилазы гистонов, причем указанный ингибитор деацетилазы гистонов представляет собой соединение следующей формулы или фармацевтически приемлемую соль или сольват указанного соединения:
и (b) свободный аргинин или фармацевтически приемлемую соль аргинина.
2. Фармацевтическая композиция по п.1, включающая:
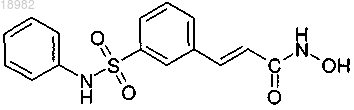
(а) ингибитор деацетилазы гистонов, причем ингибитор деацетилазы гистонов представляет собой
и (b) свободный аргинин или фармацевтически приемлемую соль аргинина.
3. Фармацевтическая композиция по п.1 или 2, в которой (b) представляет собой свободный L-аргинин или фармацевтически приемлемую соль L-аргинина.
4. Фармацевтическая композиция по п.1 или 2, в которой (b) представляет собой свободный аргинин.
5. Фармацевтическая композиция по п.1 или 2, в которой (b) представляет собой свободный L-аргинин.
6. Фармацевтическая композиция по любому из пп.1-5, в которой молярное отношение компонента (b) к указанному ингибитору деацетилазы гистонов составляет по меньшей мере 0,5.
7. Фармацевтическая композиция по любому из пп.1-5, в которой молярное отношение компонента (b) к указанному ингибитору деацетилазы гистонов составляет от 0,5 до 5.
8. Фармацевтическая композиция по любому из пп.1-5, в которой молярное отношение компонента (b) к указанному ингибитору деацетилазы гистонов составляет от 0,8 до 4.
9. Фармацевтическая композиция по любому из пп.1-8, дополнительно включающая один или более дополнительных фармацевтически приемлемых ингредиентов.
10. Фармацевтическая композиция по любому из пп.1-9, которая является стерильной и апирогенной.
11. Фармацевтическая композиция по любому из пп.1-10, которая является жидкой.
12. Фармацевтическая композиция по любому из пп.1-10, которая представляет собой водный раствор.
13. Фармацевтическая композиция по любому из пп.1-12, дополнительно включающая воду для инъекций, водный солевой раствор, водный раствор глюкозы, раствор Рингера или раствор Рингера с лактатом.
14. Фармацевтическая композиция по любому из пп.1-12, дополнительно включающая солевой раствор для инъекции/инфузии или раствор глюкозы для инъекции/инфузии.
15. Фармацевтическая композиция по любому из пп.1-12, дополнительно включающая водный солевой раствор или водный раствор глюкозы.
16. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 0,1-1000 мг/мл.
17. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 100-1000 мг/мл.
18. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 30-300 мг/мл.
19. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 0,3-3000 мМ.
20. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 100-1000 мМ.
21. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 100-500 мМ.
22. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 0,01-300 мг/мл.
23. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации ~50 мг/мл.
24. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 1,0-10 мг/мл.
25. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 1,0-5 мг/мл.
26. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 0,01-100 мМ.
27. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 3-30 мМ.
28. Фармацевтическая композиция по любому из пп.11-15, которая включает указанный ингибитор деацетилазы гистонов в концентрации 0,1-5 мМ.
29. Фармацевтическая композиция по любому из пп.1-28, которая представлена в форме, подходящей для парентерального введения пациенту.
30. Фармацевтическая композиция по любому из пп.1-28, которая представлена в форме, подходящей для введения пациенту путем инъекции.
31. Фармацевтическая композиция по любому из пп.1-28, которая представлена в форме, подходящей для введения пациенту путем инфузии.
32. Фармацевтическая композиция по любому из пп.1-10, которая является твердой.
33. Фармацевтическая композиция по любому из пп.1-10, которая имеет форму порошка, гранул, таблеток или лиофилата/лиофилизата.
34. Мешок для внутривенной (в.в) инфузии, содержащий фармацевтическую композицию по любому из пп.11-31.
35. Флакон или ампула, содержащая фармацевтическую композицию по любому из пп.11-31.
36. Фармацевтическая композиция по любому из пп.1-33, причем патологическое состояние, опосредуемое деацетилазой гистонов, представляет собой пролиферативное патологическое состояние.
37. Фармацевтическая композиция по любому из пп.1-33, причем патологическое состояние, опосредуемое деацетилазой гистонов, представляет собой рак.
38. Фармацевтическая композиция по любому из пп.1-33, причем патологическое состояние, опосредуемое деацетилазой гистонов, представляет собой псориаз.
39. Фармацевтическая композиция по любому из пп.1-33, причем патологическое состояние, опосредуемое деацетилазой гистонов, представляет собой фиброз печени, атеросклероз, рестеноз, болезнь Альцгеймера, болезнь Паркинсона, хорею Хантингтона, амиотропный латеральный склероз, спиноцеребеллярную дегенерацию, остеоартрит, ревматоидный артрит, диабетическую ретинопатию, анемию, серповидноклеточную анемию, талассемию, малярию, трипанозомоз, гельминтоз, рассеянный склероз, аутоиммунный диабет, волчанку, атопический дерматит, астму, аллергический ринит или воспалительное заболевание кишечника.
40. Набор, включающий:
(a) фармацевтическую композицию по любому из пп.1-33, предоставленную в подходящем контейнере и/или с подходящей упаковкой; и
(b) инструкции по применению, представляющие собой письменные инструкции по введению композиции.
41. Набор, включающий:
(a) фармацевтическую композицию по любому из пп.1-39, предоставленную в подходящем контейнере и/или с подходящей упаковкой; и
(b) инструкции по применению, представляющие собой письменные инструкции по приготовлению соответствующего фармацевтического состава из композиции и возможно по дальнейшему введению состава.
42. Применение фармацевтической композиции по любому из пп.1-33 в производстве лекарственного препарата для лечения патологического состояния, опосредуемого деацетилазой гистонов.
43. Применение фармацевтической композиции по любому из пп.1-33 в производстве лекарственного препарата для лечения пролиферативного состояния.
44. Применение фармацевтической композиции по любому из пп.1-33 в производстве лекарственного препарата для лечения рака.
45. Применение фармацевтической композиции по любому из пп.1-33 в производстве лекарственного препарата для лечения псориаза.
46. Применение фармацевтической композиции по любому из пп.1-33 в производстве лекарственного препарата для лечения фиброза печени, атеросклероза, рестеноза, болезни Альцгеймера, болезни Паркинсона, хореи Хантингтона, амиотропного латерального склероза, спиноцеребеллярной дегенерации, остеоартрита, ревматоидного артрита, диабетической ретинопатии, анемии, серповидноклеточной анемии, талассемии, малярии, трипанозомоза, гельминтоза, рассеянного склероза, аутоиммунного диабета, волчанки, атопического дерматита, астмы, аллергического ринита или воспалительного заболевания кишечника.
47. Способ лечения патологического состояния, опосредуемого деацетилазой гистонов, включающий введение пациенту, нуждающемуся в лечении, фармацевтической композиции по любому из пп.1-33.
48. Способ лечения пролиферативного патологического состояния, включающий введение пациенту, нуждающемуся в лечении, фармацевтической композиции по любому из пп.1-33.
49. Способ лечения рака, включающий введение пациенту, нуждающемуся в лечении, фармацевтической композиции по любому из пп.1-33.
50. Способ лечения псориаза, включающий введение пациенту, нуждающемуся в лечении, фармацевтической композиции по любому из пп.1-33.
51. Способ лечения фиброза печени, атеросклероза, рестеноза, болезни Альцгеймера, болезни Паркинсона, хореи Хантингтона, амиотропного латерального склероза, спиноцеребеллярной дегенерации, остеоартрита, ревматоидного артрита, диабетической ретинопатии, анемии, серповидноклеточной анемии, талассемии, малярии, трипанозомоза, гельминтоза, рассеянного склероза, аутоиммунного диабета, волчанки, атопического дерматита, астмы, аллергического ринита или воспалительного заболевания кишечника, включающий введение пациенту, нуждающемуся в лечении, фармацевтической композиции по любому из пп.1-33.
52. Способ (а) ингибирования пролиферации клеток; (б) ингибирования хода клеточного цикла; (в) стимуляции апоптоза или (г) комбинации одного или более из перечисленного, in vitro или in vivo, причем указанный способ включает приведение клетки в контакт с фармацевтической композицией по любому из пп.1-33.
53. Применение:
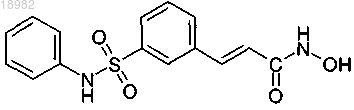
(а) ингибитора деацетилазы гистонов, причем ингибитор деацетилазы гистонов представляет собой соединение следующей формулы или фармацевтически приемлемую соль или сольват указанного соединения:

и (b) свободного аргинина или фармацевтически приемлемой соли аргинина
в производстве лекарственного препарата для лечения патологического состояния, опосредуемого деацетилазой гистонов.
54. Применение:
(а) ингибитора деацетилазы гистонов, причем ингибитор деацетилазы гистонов представляет собой соединение следующей формулы или фармацевтически приемлемую соль или сольват указанного соединения:
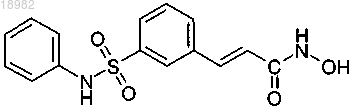
и (b) свободного аргинина или фармацевтически приемлемой соли аргинина
в производстве лекарственного препарата для лечения пролиферативного патологического состояния.
55. Применение:
(а) ингибитора деацетилазы гистонов, причем ингибитор деацетилазы гистонов представляет собой соединение следующей формулы или фармацевтически приемлемую соль или сольват указанного соединения:
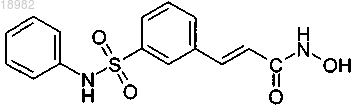
и (b) свободного аргинина или фармацевтически приемлемой соли аргинина
в производстве лекарственного препарата для лечения рака.
56. Применение:
(а) ингибитора деацетилазы гистонов, причем ингибитор деацетилазы гистонов представляет собой соединение следующей формулы или фармацевтически приемлемую соль или сольват указанного соединения:

и (b) свободного аргинина или фармацевтически приемлемой соли аргинина
в производстве лекарственного препарата для лечения псориаза.
57. Применение:
(а) ингибитора деацетилазы гистонов, причем ингибитор деацетилазы гистонов представляет собой соединение следующей формулы или фармацевтически приемлемую соль или сольват указанного соединения:
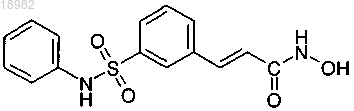
и (b) свободного аргинина или фармацевтически приемлемой соли аргинина
в производстве лекарственного препарата для лечения фиброза печени, атеросклероза, рестеноза, болезни Альцгеймера, болезни Паркинсона, хореи Хантингтона, амиотропного латерального склероза, спиноцеребеллярной дегенерации, остеоартрита, ревматоидного артрита, диабетической ретинопатии, анемии, серповидноклеточной анемии, талассемии, малярии, трипанозомоза, гельминтоза, рассеянного склероза, аутоиммунного диабета, волчанки, атопического дерматита, астмы, аллергического ринита или воспалительного заболевания кишечника.
Текст
ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ, СОДЕРЖАЩИЕ ИНГИБИТОРЫ ДЕАЦЕТИЛАЗЫ ГИСТОНОВ Данное изобретение относится к фармацевтическим композициям, включающим некоторые соединения карбаминовой кислоты (например, которые ингибируют активность HDAC(деацетилаз гистонов, деацетилазы гистонов (например, PXD-101, N-гидрокси-3-(3 фенилсульфамоилфенил)акриламид) и один или более из дополнительных компонентов,выбранных из циклодекстрина, аргинина и меглумина. Настоящее изобретение также относится к применению таких композиций, например, в ингибировании HDAC и лечении патологических состояний, опосредуемых HDAC, рака, пролиферативных патологических состояний, псориаза и т.п. Родственные заявки Настоящая заявка является родственной по отношению к предварительной заявке на патент США 60/681215, поданной 13 мая 2005 г.; и предварительной заявке на патент США 60/681234, поданной 13 мая 2005 г., содержание которых в полном объеме включено в данное описание посредством ссылки. Область техники Настоящее изобретение в целом относится к области фармацевтических препаратов и фармацевтики и, в частности, к фармацевтическим композициям, включающим некоторые соединения карбаминовой кислоты (например, соединения, которые ингибируют активность деацетилазы гистонов (HDAC и один или более дополнительных компонентов, выбранных из циклодекстрина, аргинина и меглумина. Настоящее изобретение также относится к применению таких композиций, например, для ингибированияHDAC и лечения патологических состояний, опосредуемых HDAC. Уровень техники Деацетилаза гистонов (HDAC). В клетках эукариот ДНК прочно связана с белками (гистонами), образуя хроматин. Гистоны представляют собой небольшие положительно заряженные белки, богатые основными аминокислотами (положительно заряженными при физиологических значениях рН), которые контактируют с фосфатными группами (отрицательно заряженными при физиологических значениях рН) ДНК. Существует пять основных классов гистонов: Н 1, Н 2 А, Н 2 В, Н 3 и Н 4. Последовательности аминокислот гистонов Н 2 А,Н 2 В, Н 3 и Н 4 демонстрируют исключительную консервативность у различных видов, тогда как Н 1 является отчасти вариабельным и в некоторых случаях замещается другим гистоном, например Н 5. Четыре пары каждого из Н 2 А, Н 2 В, Н 3 и Н 4 совместно образуют дискообразное октомерное белковое ядро("кор"), которое вместе с "обернутой" вокруг него ДНК (около 140 пар оснований) образует нуклеосому. Отдельные нуклеосомы соединены небольшими участками линкерной ДНК, ассоциированными с другой молекулой гистона (например, Н 1 или в некоторых случаях Н 5). В результате образуется структура, напоминающая нитку с нанизанными на нее бусинами, которая, в свою очередь, уложена по спирали, по форме похожую на соленоид. Большинство гистонов синтезируются в ходе S фазы клеточного цикла, и вновь синтезированные гистоны быстро попадают в ядро и связываются с ДНК. В течение нескольких минут с момента синтеза вновь синтезированная ДНК связывается с гистонами с образованием нуклеосом. Небольшая часть гистонов, а именно аминогруппы их боковых цепей, подвергаются фермантативной модификации, заключающейся в посттрансляционном присоединении метильных, ацетильных или фосфатных групп, нейтрализующих положительный заряд боковой цепи или изменяющих его на отрицательный заряд. Например, группы лизина и аргинина могут быть метилированы, лизин может быть ацетилирован, а группы серина могут быть фосфорилированы. Боковая цепь лизина -(CH2)4-NH2 может быть ацетилирована, например, ферментом ацетилтрансферазой с образованием амида -(CH2)4-NHC(=O)CH3. Метилирование, ацетилирование и фосфорилирование аминоконцов гистонов, выступающих из ядра нуклеосомы, влияет на структуру хроматина и экспрессию генов (см., например, Spencer, V.A. and Davie,J.R., 1999, Gene, vol. 240(1), pp. 1-12). Ацетилирование и деацетилирование гистонов ассоциировано с процессами транскрипции, приводящими к пролиферации и/или дифференцировке клеток. Ацетилирование также опосредует регуляцию функции факторов транскрипции. Последние обзоры по деацетилированию гистонов включают следующие: Kouzarides, Т., 1999, "Histone acetylases and deacetylases in cell proliferation," Curr. Opin. Genet. Dev.,Vol. 9, No. 1, pp. 40-48; Pazin, M.J., et al., 1997, "What's up and down with histone deacetylation and transcription" Cell, Vol. 89, No. 3, pp. 325-328. Корреляция между состоянием ацетилирования гистонов и транскрипцией генов известна более 30 лет (см, например, Howe, L., et al., 1999, Grit. Rev. Eukaryot. Ген Expr., Vol. 9(3-4), pp. 231-243). Некоторые ферменты, в частности ацетилазы (например, гистон ацетилтрасфераза, ГАТ(НАТ и деацетилазы(например, деацетилаза гистонов, HDAC), которые регулируют состояние ацетилирования гистонов, обнаружили у многих организмов и выяснили, что они вовлечены в регуляцию многих генов, что подтверждает существование связи между ацетилированием и транскрипцией. См., например, Davie, J.R., 1998,"Covalent modifications of histones: expression from chromatic templates", Curr. Opin. Genet. Dev., Vol. 8, pp. 173-178. В целом, ацетилирование гистонов коррелирует с активацией транскрипции, тогда как деацетилирование гистонов связано с репрессией генов. Идентифицировано большое число деацетилаз гистонов (HDAC), в том числе HDAC1-HDAC11(см., например, Ng, H.H. and Bird, A., 2000, Trends Biochem. Sci., Vol. 25(3), pp. 121-126). Также идентифицирован ряд деацетилаз гистонов дрожжей и деацетилаз гистонов растений. Первая деацетилаза,HDAC1, была идентифицирована в 1996 (см., например, Taunton, J., et al., 1996, Science, Vol. 272, pp. 408411). Впоследствии были обнаружены две других ядерных деацетилазы млекопитающих, HDAC2 иHDAC функционируют в составе больших мультибелковых комплексов, которые связываются с промотором и подавляют транскрипцию. Хорошо охарактеризованные репрессоры транскрипции, такие как Mad (Laherty, CD., et al., 1997, Cell, Vol. 89(3), pp. 349-356), pRb (Brehm, A., et al., 1998, Nature, 1998,Vol. 391, pp. 597-601), ядерные репрессоры (Wong, J., et al., 1998, EMBO J., Vol. 17(2), pp. 520-534) и YY1(Yang, W.M., et al., 1997, J. Biol. Chem., Vol. 272, pp. 28001-28007), ассоциируют с комплексами HDAC,что обеспечивает выполнение их репрессорной функции. Роль HDAC в пролиферации клеток. Исследование ингибиторов деацетилаз гистонов показало, что эти ферменты играют важную роль в пролиферации и дифференцировке клеток. Ингибитор трихостатин A (Trichostatin A, TSA) (Yoshida, M.,et al., 1990, J. Biol. Chem., Vol. 265(28), pp. 17174-17179) вызывает блок клеточного цикла как в фазе G1,так и в G2 (Yoshida, M., Beppu, Т., 1988, Exp. Cell. Res., Vol. 177, pp. 122-131), восстанавливает трансформированный фенотип различных линий клеток и стимулирует дифференцировку клеток лейкемии Фрейнда и других (Yoshida, M., et al., 1990, J. Antibiot. (Tokyo), Vol. 43(9), pp. 1101-1106). Было показано,что TSA (как и SAHA) ингибирует рост клеток, индуцирует терминальную дифференцировку и предотвращает образование опухолей у мышей (Finnin et al., 1999, Nature, Vol. 401, pp. 188-193). Блокировка клеточного цикла ингибитором TSA коррелирует с повышенной экспрессией гельзолина (Hoshikawa, Y.,et al., 1994, Exp. Cell. Res., Vol. 214(1), pp. 189-197), белка, регулирующего актин, активность которого подавляется при развитии злокачественной опухоли груди (Mielnicki, L.M., et al., 1999, Exp. Cell. Res.,Vol. 249(1), pp. 161-176). Аналогичное воздействие на клеточный цикл и дифференцировку характерны для ряда ингибиторов деацетилаз (Kim et al., 1999, Oncoqene, Vol. 18(15), pp. 2461-2470). Очевидное участие HDAC в контроле пролиферации и дифференцировки клеток позволяет предположить, что аберрантная активность HDAC может играть роль в развитии рака. Наиболее наглядное подтверждение участия деацетилаз в развитии рака следует из анализа различных типов острой промиелоцитарной лейкемии (ОПЛ). У большинства субъектов, страдающих ОПЛ, транслокация хромосом 15 и 17(t(15;17, приводит к экспрессии гибридного белка, содержащего N-концевую часть продукта гена PML,соединенную с большей частью RAR (рецептор ретиноевой кислоты). В некоторых случаях другая транслокация (t(11;17 приводит к гибридизации PLZF, содержащего домен "цинковые пальцы" белка, иRAR. В отсутствие лиганда RAR дикого типа подавляет гены-мишени путем связывания репрессорного комплекса HDAC с ДНК промотора. В ходе нормального гемопоэза ретиноевая кислота (RA, РК) связывается с RAR и смещает репрессорный комплекс, делая возможной экспрессию генов, вовлеченных в дифференцировку миелоидных клеток. Гибридные белки RAR, встречающиеся в организме у субъектов, страдающих ОПЛ, уже не являются чувствительными к физиологическим уровням РК и препятствуют экспрессии генов, индуцируемых РК, которые стимулируют дифференцировку миелоидных клеток. Это приводит к клональной экспансии клеток-промиелоцитов и развитию лейкемии. Эксперименты invitro показали, что TSA способен восстанавливать чувствительность гибридных белков RAR к РК и делать возможным дифференцировку миелоидных клеток. Эти результаты позволяют установить связь между HDAC и онкогенезом и предположить, что HDAC являются потенциальными мишенями для фармацевтического воздействия на субъектов, страдающих ОПЛ. (См., например, Kitamura, K., et al., 2000,Br. J. Haematol., Vol. 108(4), pp. 696-702; David, G., et al., 1998, Oncoqene, Vol. 16(19), pp. 2549-2556; Lin,R.J., et al., 1998, Nature, Vol. 391(6669), pp. 811-814). Кроме того, другие источники позволяют предположить, что HDAC могут быть важными мишенями терапии при других типах рака. Ингибиторы HLAC стимулируют дифференцировку линий клеток,полученных от множества различных карцином (простаты, колоректального рака, рака груди, нейронов,печени) (Yoshida, M. and Horinouchi, S., 1999, Ann. N.Y. Acad. Sci., Vol. 886, pp. 23-36). Изучен ряд ингибиторов HDAC на моделях рака у животных. Они замедляют рост опухолей и продлевают срок жизни мышей с различными типами трансплантированных опухолей, включая меланому, лейкемию, карциномы толстой кишки, легкого, желудка и т.п. (Ueda, H., et al., 1994, J., Antibiot. (Tokyo), Vol. 47(3), pp. 315-323;Kim et al., 1999, Oncoqene, Vol. 18(15), pp. 246I-2470). Псориаз представляет собой общее хроническое обезображивающее заболевание кожи, характеризующееся хорошо различимыми красными, уплотненными чешуйчатыми бляшками: они могут быть ограниченными или широкораспространенными. Степень распространнности псориаза составляет примерно 2%, т.е. 12,5 млн больных в странах "триады" (США/Европа/Япония). Несмотря на то, что болезнь редко является летальной, она несомненно оказывает отрицательное воздействие на качество жизни субъекта, которое усугубляется отсутствием эффективных способов терапии. Существующие способы лечения являются либо неэффективными, неприемлемыми с косметической точки зрения, либо обладают нежелательными побочными эффектами. Таким образом, в клинике существует значительная неудовлетворенная потребность в эффективных и безопасных иHDAC ДЛЯ лечения данного патологического состояния. Псориаз представляет собой заболевание сложной этиологии. Хотя и существует явная генетическая составляющая заболевания, включающая ряд локусов генов, существуют также неопределенные факторы окружающей среды, стимулирующие начало этого заболевания. Вне зависимости от исходной причины псориаза на клеточном уровне он характеризуется локальным воспалением, опосредуемым Тклетками, повышенной пролиферацией кератиноцитов и локальным ангиогенезом. Во все эти процессы вовлечены деацетилазы гистонов (см., например, Saunders, N. et al., 1999, Cancer Res., Vol. 59, No. 2 pp. 399-404; Bernhard, D. et al., 1999, FASEB J., Vol. 13, No. 14, pp. 1991-2001; Takahashi et al., 1996, J. Antibiot. (Tokyo), Vol. 49, No. 5, pp. 453-457; Kim et al., 2001, Nature Medicine, Vol. 7, No. 4, pp. 437-443). Следовательно, ингибиторы HDAC можно применять в терапии псориаза. Скрининг возможных иHDAC можно провести, например, с помощью анализа пролиферации Т-клеток и/или кератиноцитов. Ингибиторы HDAC. Один из важных классов ингибиторов HDAC представляют собой соединения карбаминовой кислоты, включающие сульфаниламидные связи, как описано, например, в работе Watkins и соавторов (Watkins, С., et al., 2002), публикация международной заявки на патент (РСТ) WO 02/30879. Особенно перспективным соединением является N-гидрокси-3-(3-фенилсульфамоилфенил)акриламид (упоминаемый в данной заявке как PXD-101). Получение составов, содержащих многие потенциально полезные HDAC, сопряжено с одной или несколькими проблемами, такими как, например, низкая растворимость в водных растворах, необходимость обеспечения неприемлемо высокого или низкого уровня рН для солюбилизации иHDAC, физическая и/или химическая нестабильность в водных растворах, физическая и/или химическая нестабильность при последующем разбавлении и т.п. Аналогичные и другие проблемы возникают при получении составов для таких соединений, как PXD-101. Таким образом, одна из задач настоящего изобретения состоит в обеспечении улучшенных фармацевтических композиций (например, составов и предварительных составов), включающих PXD-101 или близкие по структуре соединения, которые решают одну или более из вышеуказанных и других проблем. Авторы настоящего изобретения обнаружили конкретные комбинации компонентов, которые удивительным и неожиданным образом позволяют получить фармацевтические композиции, обладающие значительно улучшенными свойствами. Такие фармацевтические композиции представляют одно или более из следующих преимуществ:(а) более высокая концентрация иHDAC;(б) повышенная стабильность в концентрированной жидкой форме (например, для хранения);(в) повышенная стабильность в разбавленной жидкой форме (например, в готовой для введения форме);(г) возможность получения композиции, например, в форме готового для применения раствора,концентрата для экстемпорального разбавления и/или лиофилата/лиофилизата. Для более полного описания и раскрытия изобретения и уровня техники в области, к которой принадлежит данное изобретение, в данной заявке процитирован ряд патентов и публикаций. Текст настоящей заявки содержит полные сссылки на эти источники. Каждый из этих источников в полном объеме включен в настоящее описание посредством ссылки. Краткое описание изобретения Согласно одному аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая: (а) ингибитор HDAC (как определено в данной заявке) и (б) один или более из циклодекстрина, аргинина и меглумина. В одном из вариантов реализации ингибитор HDAC выбирают из соединений следующей формулы и их фармацевтически приемлемых солей, сольватов, амидов, сложных эфиров, простых эфиров, химически защищенных форм и предшественников: Согласно одному из аспектов настоящего изобретения предложена фармацевтическая композиция(такая как, например, состав, предварительный состав) в подходящем контейнере (например, флаконе,ампуле, емкости для внутривенной (в.в.) инфузии). Согласно одному аспекту настоящего изобретения предложен флакон или ампула, содержащий(ая) фармацевтическую композицию (например, состав, предварительный состав), описанную в данной заявке. Согласно одному аспекту настоящего изобретения предложена емкость для внутривенной (в.в.) инфузии, содержащая фармацевтическую композицию (например, состав), описанную в данной заявке. Согласно одному аспекту настоящего изобретения предложена тврдая лекарственная форма (например, таблетка, капсула или желатиновая таблетка), содержащая фармацевтическую композицию (например, состав), описанную в данной заявке. Согласно одному аспекту настоящего изобретения предложен способ получения композиции (например, предварительного состава, состава) (описанных в данной заявке) путем объединения: (а) ингибитора деацетилазы гистонов (HDACi), описанного в данной заявке, и (б) одного или более из следующих дополнительных компонентов: циклодекстрин, аргинин и меглумин и, возможно, одного или более из других дополнительных фармацевтически приемлемых компонентов (описанных в данной заявке). Согласно одному аспекту настоящего изобретения предложен способ получения состава ингибитора HDAC (описанного в данной заявке), включающий стадию объединения указанного иHDAC с одним или более из следующих дополнительных компонентов: циклодекстрин, аргинин и меглумин (как описано в данной заявке) и, возможно, одного или более из другоих дополнительных фармацевтически приемлемых компонентов (описанных в данной заявке). Согласно одному аспекту настоящего изобретения предложен способ увеличения концентрации ингибитора HDAC (описанного в данной заявке) в фармацевтической композиции, включающий этап введения в состав состава указанного иHDAC с одним или более из следующих дополнительных компонентов: циклодекстрин, аргинин и меглумин (описанные в данной заявке) и, возможно, одного из других фармацевтически приемлемых компонентов (описанных в данной заявке). Согласно одному аспекту настоящего изобретения предложены компоненты фармацевтической композиции, описанной в данной заявке (например, ингибитор HDAC; один или более из циклодекстрина, аргинина и меглумина и т.п.), для применения в способе лечения человека или животного путем терапии. Согласно одному из аспектов настоящего изобретения предложена фармацевтическая композиция(например, предварительный состав, состав), описанная в данной заявке, для применения в способе лечения человека или животного путем терапии. Согласно одному из аспектов настоящего изобретения предложено применение компонентов фармацевтической композиции, описанной в данной заявке (например, иHDAC; одного или более из циклодекстрина, аргинина и меглумина и т.п.), в производстве лекарственного препарата для лечения патологического состояния, описанного в данной заявке. Согласно одному из аспектов настоящего изобретения предложено применение фармацевтической композиции (например, предварительного состава), описанной в данной заявке, в производстве лекарственного препарата для лечения патологического состояния, описанного в данной заявке. Согласно одному из аспектов настоящего изобретения предложен способ лечения, включающий введение субъекту, нуждающемуся в лечении, фармацевтической композиции (например, препарата),описанной в данной заявке. Согласно одному из аспектов настоящего изобретения предложен способ: (а) регуляции (например,ингибирования) пролиферации клеток; (б) ингибирования хода клеточного цикла; (в) стимуляции апоптоза или (г) комбинации одного или более из перечисленного, in vitro или in vivo, причем указанный способ включает приведение клетки в контакт с фармацевтической композицией (например, составом), описанной в данной заявке. Согласно одному из аспектов настоящего изобретения предложен способ введения игнибитораHDAC, описанного в данной заявке, субъекту, включающий введение указанному субъекту фармацевтической композиции (например, состава), описанной в данной заявке. Согласно одному из аспектов настоящего изобретения предложен набор (или набор компонентов),включающий: (а) фармацевтическую композицию (например, предварительный состав или состав), описанную в данной заявке, предпочтительно предоставляемый в подходящем контейнере и/или с подходящей упаковкой, и (б) инструкцию по применению, например письменную инструкцию по введению состава и т.п. Согласно одному из аспектов настоящего изобретения предложен набор (или набор компонентов),включающий: (а) фармацевтическую композицию (например, предварительный состав), описанную в данной заявке, предпочтительно предоставляемую в подходящем контейнере и/или с подходящей упаковкой, и (б) инструкцию по применению, например письменную инструкцию по приготовлению соответствующего фармацевтического состава из композиции (например, предварительного состава) и последующему введению состава и т.п. Как очевидно для специалиста в данной области, характерные признаки предпочтительных вариантов реализации одного аспекта изобретения также относятся к другим аспектам изобретения. Краткое описание графических материалов На фиг. 1 представлена диаграмма фазовой растворимости для гидроксипропилциклодекстрина(HPCD) в виде графика зависимости концентрации ингибитора HDAC (PXD-101) (мг/мл) от концентрации HPCD (мг/мл). На фиг. 2 представлен профиль растворимости в буферизованном до заданного значения рН циклодекстрине в виде графика зависимости концентрации ингибитора HDAC (PXD-101) (мг/мл) от рН для 25% мас./об. НРCD. На фиг. 3 представлена диаграмма фазовой растворимости in situ солеобразователей аргинина и меглумина, которая представляет собой график зависимости концентрации ингибитора HDAC (PXD 101)(мг/мл) от концентрации солеобразователей (аргинин (ромбы) или меглумина (квадраты (мг/мл). На фиг. 4 представлена диаграмма фазовой растворимости для комбинации циклодекстрина и in situ солеобразователей аргинина и меглумина в виде графика зависимости концентрации ингибитора HDAC(PXD 101) (мг/мл) от концентраций солеобразователя (аргинина или меглумина) (мг/мл) как в присутствии (сплошные линии; аргинин = треугольники; меглумин = квадраты), так и в отсутствие (пунктирные линии; аргинин = ромбы; меглумин = квадраты) 25% мас./об. HPCD. На фиг. 5 представлена диаграмма профиля рН для комбинации циклодекстрина и in situ солеобразователей аргинина и меглумина в виде графика зависимости концентрации ингибитора HDAC концентрации (PXD 101) (мг/мл) от рН фосфатного буфера (ромбы), аргинина (квадраты) или меглумина (треугольники) в каждом случае с 25% мас./об. HPCD. На фиг. 6 представлен график, показывающий средние значения Cmax (SD) после в.в. введенияPXD 101 на 1-е сутки, измеренные у 2-4 субъектов для каждого уровня дозы. На фиг. 7 представлен график, показывающий средние значения площади под кривой (ФГС) (SD) после в.в. введения PXD 101 в день 1, измеренные у 2-4 субъектов при каждом уровне дозы. На фиг. 8 представлен график, показывающий средние значения выведения (клиренса) (SD) после в.в. введения PXD 101 в день 1, измеренные у 2-4 субъектов при каждом уровне дозы. На фиг. 9 представлены данные Вестерн-блот анализа, демонстрирующие ацетилирование гистонов Н 3 и Н 4 в мононуклеарах периферической крови в указанные моменты времени после введения дозы. На фиг. 10 представлен график, демонстрирующий степень ацетилирования, выраженную в форме денситометрического показателя ацетилирования Н 4 в образцах МНПК относительно Н 4 в обработанной стандартной клеточной линии (А 2780) как функции времени. На фиг. 11 представлены данные Вестерн-блот анализа, демонстрирующие экспрессию белков(p19SKP1, p21CIP1WAF1, Apaf-1 и винкулин), вовлеченных в блокирование клеточного цикла и апоптоз, из лимфоцитов, полученных от субъекта в ходе 2 и 4 цикла лечения PXD 101 при 900 мг/м 2. На фиг. 12 представлен график, демонстрирующий сравнительные данные по в.в. и пероральному введению препарата 3 субъектам (оба анализа проведены на одних и тех же субъектах, пероральное введение осуществляли на 1-е сутки, цикл 3) при 900 и 1200 мг/м 2. Уровни в плазме нормировали по дозе 900 мг/м 2, предполагая прямую пропорциональность доз. Значение = среднееSE. Подробное описание изобретения Согласно одному из аспектов настоящего изобретения предложены фармацевтические композиции,пригодные для введения субъекту (в дальнейшем называемые "составами"), а также фармацевтические композиции (например, лиофилат/лиофилизаты, концентраты и т.п.), из которых можно получить такие составы (в дальнейшем называемые "предварительными составами"). Введение. В одном из вариантов реализации введение представляет собой парентеральное введение. В одном из вариантов реализации введение представляет собой введение путем инъекции, включая,например, подкожную, внутрикожную, внутримышечную, внутривенную, внутриартериальную, внутрисердечную, интратекальную, интраспинальную, интракапсулярную, субкапсулярную, интраорбитальную, внутрибрюшинную, внутритрахеальную, субкутикулярную, внутрисуставную, субарахноидальную и надчревную инъекцию. В одном из вариантов реализации введение представляет собой внутривенное введение. В одном из вариантов реализации введение представляет собой введение путем внутривенной инъекции. В одном из вариантов реализации введение представляет собой введение путем инфузии. В одном из вариантов реализации введение представляет собой введение путем внутривенной инфузии. Например, в одном из предпочтительных вариантов реализации композицию (например, предварительный состав) добавляют к солевому раствору или раствору глюкозы (например, в стандартный мешок объемом 1 л с солевым раствором или раствором глюкозы для внутривенного введения) и используют полученную композицию (например, состав) для введения путем внутривенной инфузии."Инфузия" отличается от "инъекции" тем, что термин "инфузия" описывает пассивное поступление вещества (например, жидкости, ингибитора HDAC, электролита и т.п.) в вену или ткани под действием силы тяжести, тогда как термин "инъекция" описывает активное введение вещества в вену или ткани за счет дополнительных сил, например давления в шприце. Введение можно осуществлять в виде одной дозы, непрерывно или с промежутками (например,частями дозы через определенные интервалы) на протяжении курса лечения. Способы определения наиболее эффективных средств и дозировок введения хорошо известны специалистам в данной области и зависят от конкретного препарата, применяемого для терапии, задачи терапии, клетки(клеток)-мишени,на которую направлено лечение, и субъекта, подвергаемого лечению. Дозы и схемы для однократного или многократного введения могут быть выбраны лечащим врачом, вречом-консультантом или ветери-5 018982 наром. Субъект. В одном из вариантов реализации изобретения субъект представляет собой животное; млекопитающее; плацентарное млекопитающее, грызуна (например, морскую свинку, хомяка, крысу, мышь), животное семейства мышиных (например, мышь), животное семейства зайцеобразных (например, кролика),животное семейства собачьих (например, собаку), животное семейства кошачьих (например, кошку),животное семейства лошадиных (например, лошадь), животное семейства свиней (например, свинью),животное семейства овец (например, овцу), животное семейства быков (например, корову), примата, животное подотряда обезьян (например, низшую узконосую обезьяну или человекообразную обезьяну),низшую узконосую обезьяну (например, мартышку, павиана), человекообразную обезьяну (например,гориллу, шимпанзе, орангутана, гиббона) или человека. В одном из вариантов реализации субъект представляет собой человека, то есть живого человека, включая живого зародыша человека, живого ребенка и живого взрослого. Компоненты. Фармацевтические композиции согласно настоящему изобретению включают, по меньшей мере,следующие компоненты:(б) один или более из следующих дополнительных ингредиентов: циклодекстрин, аргинин и меглумин. В одном из вариантов реализации (б) представляет собой циклодекстрин. В одном из вариантов реализации (б) представляет собой аргинин. В одном из вариантов реализации (б) представляет собой меглумин. В одном из вариантов реализации (б) представляет собой циклодекстрин и аргинин. В одном из вариантов реализации (б) представляет собой циклодекстрин и меглумин. В одном из вариантов реализации (б) представляет собой аргинин и меглумин. В одном из вариантов реализации (б) представляет собой циклодекстрин, аргинин и меглумин. Каждый из этих компонентов обсуждается более подробно ниже. В одном из вариантов реализации фармацевтическая композиция включает один или более другой дополнительный ингредиент (например, фармацевтически приемлемый носитель и т.п.). Ингибитор HDAC. Фармацевтические композиции согласно настоящему изобретению включают ингибитор HDAC,который представляет собой соединение карбаминовой кислоты, содержащее сульфаниламидную связь. Примеры таких ингибиторов HDAC представлены, например, в работе Watkins и соавторов (Watkins, С.,et al., 2002, публикация международной заявки на патент (РСТ) номер WO 02/30879). В одном из вариантов реализации ингибитор HDAC представляет собой соединение карбаминовой кислоты, включающее сульфаниламидную связь, как определено в работе Watkins и соавторов (Watkins,С., et al., 2002, публикация международной заявки на патент (РСТ) WO 02/30879). В одном из вариантов реализации изобретения ингибитор HDAC выбирают из соединений следующей формулы: где А независимо представляет собой С 6-20 карбоарил или С 5-20 гетероарил и является незамещенным или замещенным;Q1 независимо представляет собой ковалентную связь, C1-7 алкилен, C2-7 алкенилен и является незамещенным или замещенным;J независимо представляет собой -NRN-S(=O)2- или -S(=O)2-NRN-;RN независимо представляет собой -Н, C1-7 алкил, С 3-20 гетероциклил, С 6-20 карбоарил, С 5-20 гетероарил,С 6-20 карбоарил-С 1-7 алкил или С 5-20 гетероарил-С 1-7 алкил и является незамещенным или замещенным;Q2 независимо представляет собой С 6-20 карбоарилен, С 5-20 гетероарилен, С 6-20 карбоарилен-C1-7 алкилен, С 5-20 гетероарилен-C1-7 алкилен, С 6-20 карбоарилен-C2-7 алкенилен, С 5-20 гетероарилен-С 2-7 алкенилен, C1-7 алкилен С 6-20 карбоарилен, С 1-7 алкилен С 5-20 гетероарилен, С 2-7 алкенилен С 6-20 карбоарилен, С 2-7 алкенилен С 5-20 гетероарилен, С 1-7 алкилен С 6-20 карбоарилен-С 1-7 алкилен, С 1-7 алкилен-С 5-20 гетероарилен-С 1-7 алкилен,С 2-7 алкенилен-С 6-20 карбоарилен-С 1-7 алкилен, С 2-7 алкенилен-С 5-20 гетероарилен-С 1-7 алкилен, С 1-7 алкилен С 6-20 карбоарилен С 2-7 алкенилен, С 1-7 алкилен-С 5-20 гетероарилен-C2-7 алкенилен, С 2-7 алкенилен-С 6-20 карбоарилен-C2-7 алкенилен или С 2-7 алкенилен-С 5-20 гетероарилен-С 2-7 алкенилен и является незамещенным или замещенным; и его фармацевтически приемлемых солей, сольватов, амидов, сложных эфиров, простых эфиров химически защищенных форм и пролекарств. В одном из вариантов реализации изобретения ингибитор HDAC также является ингибитором деацетилазы гистонов. Специалист в данной области без труда сможет определить, является ли предполагаемый ингибиторHDAC ингибитором HDAC или нет. Способы анализа, которые можно применять для оценки ингибирования HDAC, описаны в работе Watkins и соавторов (Watkins, С., et al., 2002), см. публикацию международной заявки (РСТ) WO 02/30879. В предпочтительном варианте реализации группа карбаминовой кислоты, -C(=O)NHOH, не модифицирована (например, не является сложным эфиром). Не предполагается, что Q1 и Q2 напрямую связаны друг с другом. Не предполагается, что Q1 и RN напрямую связаны друг с другом. Не предполагается, что Q2 и RN напрямую связаны друг с другом. Не предполагается, что А и RN напрямую связаны друг с другом. Не предполагается, что А и Q2 напрямую связаны друг с другом. Ингибиторы HDAC: группа А. Группа А независимо представляет собой С 6-20 карбоарил или С 5-20 гетероарил и является незамещенной или замещенной. В одном из вариантов реализации А независимо представляет собой C6-10 карбоарил или С 5-10 гетероарил и является незамещенным или замещенным. В одном из вариантов реализации А независимо представляет собой С 6 карбоарил или С 5-6 гетероарил и является незамещенным или замещенным. В одном из вариантов реализации А независимо представляет собой производное бензола, нафталина, карбазола, пиридина, пиррола, фурана, тиофена или тиазола и является незамещенным или замещенным. Фраза "представляет собой производное" в данном контексте относится к соединениям, которые имеют такие же атомы кольца в такой же ориентации/конфигурации, как и родительская циклическая группа, и таким образом включает, например, гидрированное (например, частично насыщенное, полностью насыщенное), карбонилзамещенное и другие замещенные производные. Например, и "пирролидон",и "N-метилпиррол" являются производными пиррола. В одном из вариантов реализации изобретения А независимо представляет собой фенил, нафтил,карбазолил, пиридинил, пирролил, фуранил, тиенил или тиозолил и является незамещенным или замещенным. В одном из вариантов реализации А независимо представляет собой фенил и является незамещенным или замещенным (например, содержит 1, 2, 3, 4 или 5 заместителей). В одном из вариантов реализации изобретения А независимо представляет собой В одном из вариантов реализации n представляет собой 0, 1, 2, 3, 4 или 5. В одном из вариантов реализации n представляет собой 0, 1, 2, 3 или 4. В одном из вариантов реализации n представляет собой 0, 1, 2 или 3. В одном из вариантов реализации n представляет собой 0, 1 или 2. В одном из вариантов реализации n представляет собой 0 или 1. В одном из вариантов реализации n представляет собой 1, 2, 3,4 или 5. В одном из вариантов реализации n представляет собой 1, 2, 3 или 4. В одном из вариантов реализации n представляет собой 1, 2 или 3. В одном из вариантов реализации n представляет собой 1 или 2. В одном из вариантов реализации n представляет собой 5. В одном из вариантов реализации n представляет собой 4. В одном из вариантов реализации n представляет собой 3. В одном из вариантов реализации n представляет собой 2. В одном из вариантов реализации n представляет собой 1. В одном из вариантов реализации n представляет собой 0. В одном из вариантов реализации изобретения каждый из заместителей RA, если присутствует, независимо имеет значение, определенное ниже под заголовком "Ингибиторы HDAC: заместители". В одном из вариантов реализации А является незамещенным. Ингибитор HDAC: группа Q1. Группа Q1 независимо представляет собой ковалентную связь, C1-7 алкилен или С 2-7 алкенилен и является незамещенной или замещенной. В одном из вариантов реализации Q1 независимо представляет собой ковалентную связь или C1-7 алкилен и является незамещенной или замещенной. Термин "алкилен" в данной заявке относится к бидентатной группе, полученной путем удаления двух атомов водорода, либо находящихся у одного атома углерода или по одному у каждого из двух разных атомов углерода, насыщенного углеводородного соединения (соединения, состоящего из атомов углерода и атомов водорода), имеющего от 1 до 20 атомов углерода (если не указано другое), которое может быть алифатическим (т.е. линейным или разветвленным) или алициклическим (т.е. циклическим,но не ароматическим соединением). Термин "алкенилен" при использовании в данной заявке относится к бидентатной группе, полученной путем удаления двух атомов водорода, которые либо оба находятся у одного и того же атома углерода или по одному у каждого из двух разных атомов углерода, углеводородного соединения (соединения,состоящего из атомов углерода и атомов водорода), имеющего от 1 до 20 атомов углерода (если не ука-7 018982 зано иначе) и имеющего по меньшей мере одну углерод-углеродную двойную связь, и которое может быть алифатическим (т.е. линейным или разветвленным) или алициклическим (т.е. циклическим, но не ароматическим соединением). В одном из вариантов реализации изобретения Q1 независимо представляет собой С 1-7 алкилен или С 2-7 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 1-4 алкилен или С 2-4 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации изобретения Q1 независимо представляет собой C1-3 алкилен или С 2-3 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации изобретения Q1 независимо представляет собой С 2-7 алкилен или С 2-7 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 2-4 алкилен или С 2-4 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 2-3 алкилен или С 2-3 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 2 алкилен или С 2 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 1-7 алкилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 1-4 алкилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой C1-3 алкилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 2-7 алкилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 2-4 алкилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 2-3 алкилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо представляет собой С 2 алкилен и является незамещенным или замещенным. В одном из вариантов реализации Q1 независимо является алифатическим. В одном из вариантов реализации Q1 независимо является линейным. В одном из вариантов реализации Q1 независимо является разветвленным. В одном из вариантов реализации Q1 независимо является незамещенным. Все вероятные комбинации вариантов реализаций, описанные выше, явным образом раскрыты в данной заявке, как если бы каждая комбинация была описана в отдельности и явным образом. В одном из вариантов реализации Q1 независимо представляет собой ковалентную связь, -СН 2-,-(СН 2)2-, -(СН 2)3-, -(СН 2)4-, -СН=СН-, -СН=СНСН 2-, -СН 2 СН=СНСН 2-, -СН=СНСН=СН- или-СН 2 СН 2 СН=СН-. В одном из вариантов реализации Q1 независимо представляет собой ковалентную связь, -СН 2-,-СН 2 СН 2- или -СН=СН-. В одном из вариантов реализации Q1 независимо представляет собой ковалентную связь, -СН 2 СН 2 или -СН=СН-. В одном из вариантов реализации Q1 независимо представляет собой ковалентную связь. В одном из вариантов реализации Q1 независимо представляет собой -СН 2 СН 2- или -СН=СН-. В одном из вариантов реализации Q1 независимо представляет собой -СН 2 СН 2-. Ингибитор HDAC: группа J. Группа J независимо представляет собой -NRN-S(=O)2- или -S(=O)2-NRN-. В одном из вариантов реализации J независимо представляет собой -NRN-S(=O)2- (обратный сульфаниламид). В одном из вариантов реализации J независимо представляет собой -S(=O)2-NRN- (прямой сульфаниламид). Ингибитор HDAC: группа RN. Группа RN независимо представляет собой -Н, С 1-7 алкил, С 3-20 гетероциклил, С 6-20 карбоарил, С 5-20 гетероарил, С 6-20 карбоарил-С 1-7 алкил или С 5-20 гетероарил-С 1-7 алкил и является незамещенной или замещенной. В одном из вариантов реализации RN независимо представляет собой -Н, С 1-7 алкил, С 6-20 карбоарил или С 6-20 карбоарил-С 1-7 алкил и является незамещенным или замещенным. В одном из вариантов реализации каждый С 6-20 карбоарил представляет собой С 6-10 карбоарил. В одном из вариантов реализации каждый С 5-20 гетероарил представляет собой С 5-10 гетероарил. В одном из вариантов реализации каждый С 6-20 карбоарил представляет собой С 6 карбоарил. В одном из вариантов реализации определенный или любой C5-20 гетероарил представляет собой С 5-6 гетероарил. В одном из вариантов реализации C3-20 гетероциклил представляет собой C3-10 гетероциклил. В одном из вариантов реализации C3-20 гетероциклил представляет собой С 5-7 гетероциклил. В одном из вариантов реализации каждый С 1-7 алкил представляет собой C1-4 алкил. В одном из вариантов реализации каждый С 1-7 алкил представляет собой С 1-3 алкил. В одном из вариантов реализации каждый С 1-7 алкил представляет собой C1-2 алкил. В одном из вариантов реализации каждый алкил независимо является алифатическим. В одном из вариантов реализации каждый алкил независимо является линейным. В одном из вариантов реализации каждый алкил независимо является разветвленным. В одном из вариантов реализации каждый алкил независимо является насыщенным. В одном из вариантов реализации каждый алкил независимо является частично насыщенным. В одном из вариантов реализации RN независимо является незамещенным. Все вероятные комбинации вариантов реализаций, описанных выше, явным образом раскрыты в данной заявке, как если бы каждая комбинация была описана в отдельности и явным образом. В одном из вариантов реализации RN независимо представляет собой -Н или C1-7 алкил и является незамещенным или замещенным. В одном из вариантов реализации RN независимо представляет собой -Н или незамещенный C1-4 алкил. В одном из вариантов реализации RN независимо представляет собой -Н или незамещенный насыщенный C1-4 алкил. В одном из вариантов реализации RN независимо представляет собой -Н или незамещенный насыщенный алифатический C1-4 алкил. В одном из вариантов реализации RN независимо представляет собой -Н, -Me, -Et, -nPr, -iPr, -nBu,-sBu, -iBu или -tBu. В одном из вариантов реализации RN независимо представляет собой -Н, -Me или -Et. В одном из вариантов реализации RN независимо представляет собой -Н или -Me. Ингибитор HDAC: группа Q2. Группа Q2 независимо представляет собой С 6-20 карбоарилен, С 5-20 гетероарилен, С 6-20 карбоарилен-C1-7 алкилен, C5-20 гетероарилен-C1-7 алкилен, С 6-20 карбоарилен-С 2-7 алкенилен, С 5-20 гетероарилен-С 2-7 алкенилен, С 1-7 алкилен-С 6-20 карбоарилен, C1-7 алкилен-С 5-20 гетероарилен, С 2-7 алкенилен-С 6-20 карбоарилен, C2-7 алкенилен-С 5-20 гетероарилен, С 1-7 алкилен-C6-20 карбоарилен-С 1-7 алкилен, С 1-7 алкилен-С 5-20 гетероарилен-С 1-7 алкилен, С 2-7 алкенилен-C6-20 карбоарилен-С 1-7 алкилен, С 2-7 алкенилен-С 5-20 гетероарилен-С 1-7 алкилен, С 1-7 алкилен-С 6-20 карбоарилен-С 2-7 алкенилен, С 1-7 алкилен-С 5-20 гетероарилен-С 2-7 алкенилен, С 2-7 алкенилен-С 6-20 карбоарилен-С 2-7 алкенилен или С 2-7 алкенилен-С 5-20 гетероарилен-С 2-7 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации Q2 независимо представляет собой C6-10 карбоарилен, С 5-10 гетероарилен, C6-10 карбоарилен-С 1-7 алкилен, С 5-10 гетероарилен-С 1-7 алкилен, С 6-10 карбоарилен-С 2-7 алкенилен,C5-10 гетероарилен-C2-7 алкенилен, С 1-7 алкилен-C6-10 карбоарилен, С 1-7 алкилен-С 5-10 гетероарилен, С 2-7 алкенилен-С 6-10 карбоарилен, С 2-7 алкенилен-С 5-10 гетероарилен, C1-7 алкилен-C6-10 карбоарилен-C1-7 алкилен, C1-7 алкилен-C5-10 гетероарилен-C1-7 алкилен, С 2-7 алкенилен-С 6-10 карбоарилен-C1-7 алкилен, С 2-7 алкенилен-С 5-10 гетероарилен-C1-7 алкилен, C1-7 алкилен-С 6-10 карбоарилен-С 2-7 алкенилен, C1-7 алкилен-С 5-10 гетероарилен-С 2-7 алкенилен, C2-7 алкенилен-С 6-10 карбоарилен-C2-7 алкенилен или C2-7 алкенилен-С 5-10 гетероарилен-C2-7 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации Q2 независимо представляет собой С 6 карбоарилен, С 5-6 гетероарилен, С 6 карбоарилен-С 1-7 алкилен, С 5-6 гетероарилен-С 1-7 алкилен, С 6 карбоарилен-С 2-7 алкенилен, С 5-6 гетероарилен-С 2-7 алкенилен, C1-7 алкилен-С 6 карбоарилен, C1-7 алкилен-С 5-6 гетероарилен, С 2-7 алкениленС 6 карбоарилен, C2-7 алкенилен-С 5-6 гетероарилен, С 1-7 алкилен-С 6 карбоарилен-С 1-7 алкилен, С 1-7 алкилен-С 5-6 гетероарилен-С 1-7 алкилен, С 2-7 алкенилен-С 6 карбоарилен-С 1-7 алкилен, С 2-7 алкенилен-С 5-6 гетероарилен-С 1-7 алкилен, С 1-7 алкилен-С 6 карбоарилен-С 2-7 алкенилен, С 1-7 алкилен-С 5-6 гетероарилен-С 2-7 алкенилен, С 2-7 алкенилен-С 6 карбоарилен-С 2-7 алкенилен или С 2-7 алкенилен-С 5-6 гетероарилен-С 2-7 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации Q2 независимо представляет собой фенилен, фенилен-С 1-7 алкилен, фенилен-С 2-7 алкенилен, С 1-7 алкилен фенилен, С 2-7 алкенилен фенилен, С 1-7 алкилен фенилен-C1-7 алкилен, С 2-7 алкенилен фенилен-C1-7 алкилен, C1-7 алкилен фенилен-C2-7 алкенилен или С 2-7 алкенилен фенилен-С 2-7 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации Q2 независимо представляет собой фенилен, фенилен-С 1-7 алкилен или фенилен-С 2-7 алкенилен и является незамещенным или замещенным. В одном из вариантов реализации каждый C1-7 алкилен представляет собой C1-4 алкилен. В одном из вариантов реализации каждый C1-7 алкилен представляет собой C1-3 алкилен. В одном из вариантов реализации каждый C1-7 алкилен представляет собой C1-2 алкилен. В одном из вариантов реализации каждый C1-7 алкилен представляет собой С 2 алкилен. В одном из вариантов реализации каждый C1-7 алкилен представляет собой C2-4 алкенилен. В одном из вариантов реализации каждый C1-7 алкилен представляет собой С 2-3 алкенилен. В одном из вариантов реализации каждый C1-7 алкилен представляет собой С 2 алкенилен. В одном из вариантов реализации присоединение к фенилену происходит в мета- или параположении. В одном из вариантов реализации присоединение к фенилену происходит в мета-положении. В одном из вариантов реализации присоединение к фенилену происходит в пара-положении. В одном из вариантов реализации Q2 независимо представляет собой орто-, мета- или парафениленэтилен и является незамещенным или замещенным. В одном из вариантов реализации Q2 независимо представляет собой орто-, мета- или парафениленэтенилен и является незамещенным или замещенным. В одном из вариантов реализации этенилен представляет собой цис- или транс-этенилен. В одном из вариантов реализации этенилен представляет собой транс-этенилен. В одном из вариантов реализации Q2 независимо представляет собой метафениленэтенилен и является незамещенным или замещенным. В одном из вариантов реализации Q2 является незамещенным. Все вероятные комбинации вариантов реализаций, описанных выше, явным образом раскрыты в данной заявке, как если бы каждая комбинация была описана в отдельности и явным образом. В одном из вариантов реализации Q2 независимо представляет собой В одном из вариантов реализации Q2 независимо представляет собой Ингибитор HDAC: заместители. В одном из вариантов реализации каждый заместитель (например, у A, Q1, RN, Q2) (например, RA),если присутствует, независимо выбран из (1) карбоновой кислоты; (2) сложного эфира; (3) амидо или тиоамидо; (4) ацила; (5) гало; (6) циано; (7) нитро; (8) гидрокси; (9) простого эфира; (10) тиола; (11) тиоэфира; (12) ацилокси; (13) карбамата; (14) амино; (15) ациламино или тиоациламино; (16) аминоациламино или аминотиоациламино; (17) сульфонамино; (18) сульфонила; (19) сульфоната; (20) сульфонамидо; (21) оксо; (22) имино; (23) гидроксиимино; (24) С 5-20 арил-С 1-7 алкила; (25) С 5-20 арила; (26) С 3-20 гетероциклила; (27) С 1-7 алкила; (28) бидентатной диоксигруппы. В одном из вариантов реализации каждый из заместителей (например, у A, Q1, RN, Q2) (например,A(3) -C(=O)NR2R3 или -C(=S)NR2R3, где каждый из R2 и R3 независимо является -Н или имеет значение, определенное в (24), (25), (26) или (27); или R2 и R3 вместе с атомом азота, к которому они присоединены, образуют кольцо, имеющее от 3 до 7 атомов кольца;(13) -OC(=O)NR8R9, где каждый из R8 и R9 независимо является -Н или имеет значение, определенное в (24), (25), (26) или (27); или R8 и R9 вместе с атомом азота, к которому они присоединены, формируют кольцо, имеющее от 3 до 7 атомов кольца;(14) -NR10R11, где каждый из R10 и R11 независимо является -Н или таким, как определено в (24),(25), (26) или (27); или R10 и R11 вместе с атомом азота, к которому они присоединены, формируют кольцо, имеющее от 3 до 7 атомов кольца;(20) -SO2NR21R22, где каждый из R21 и R22 независимо является -Н или таким, как определено в (24),(25), (26) или (27); или R21 и R22 вместе с атомом азота, к которому они присоединены, формируют кольцо, имеющее от 3 до 7 атомов кольца;(24) С 5-20 арил-С 1-7 алкил, например, где С 5-20 арил определен в (25); незамещенный или замещенный,например, одной или более группами, определенными в (1)-(28);(25) С 5-20 арил, включая С 6-20 карбоарил и С 5-20 гетероарил; незамещенный или замещенный, например, одной или более группами, определенными в (1)-(28);(26) C3-20 гетероциклил, незамещенный или замещенный, например, одной или более группами, определенными в (1)-(28);(27) С 1-7 алкил, С 2-7 алкенил, С 2-7 алкинил, С 3-7 циклоалкил, С 3-7 циклоалкенил, С 3-7 циклоалкинил, незамещенный или замещенный, например, одной или более группами, определенными в (1)-(26); и(28) -O-R25-O-, где R25 независимо представляет собой насыщенный C1-3 алкил и независимо является незамещенным или замещенным одним или более (например, 1, 2, 3, 4) из заместителей, определенных в (5). Некоторые примеры (27) включают следующее: гало-C1-7 алкил; амино-C1-7 алкил (например, -(СН 2)w-амино, w представляет собой 1, 2, 3 или 4); амидо-C1-7 алкил (например, -(СН 2)w-амидо, w представляет собой 1, 2, 3 или 4); ациламидо-C1-7 алкил (например, -(СН 2)w-ациламидо, w представляет собой 1, 2, 3 или 4); карбокси-C1-7 алкил (например, -(CH2)w-COOH, w представляет собой 1, 2, 3 или 4); ацил-C1-7 алкил (например, -(ацил CH2)w-, w представляет собой 1, 2, 3 или 4); гидрокси-C1-7 алкил (например, -(CH2)w-OP, w представляет собой 1, 2, 3 или 4); С 1-7 алкокси-С 1-7 алкил (например, -(CH2)w-O-C1-7 алкил, w представляет собой 1, 2, 3 или 4). В одном из вариантов реализации каждый из заместителей (например, у A, Q1, RN, Q2) (например,RA), если присутствует, независимо выбран из(28) -O-CH2-O-, -O-CH2-CH2-O-, -O-CH2-CH2-CH2-O-, -O-CF2-O- и -O-CF2-CF2-O-. Ингибитор HDAC: некоторые предпочтительные примеры. Все вероятные комбинации вариантов реализации, описанных выше, явным образом раскрыты в данной заявке, как если бы каждая комбинация была описана в отдельности и явным образом. В одном предпочтительном варианте реализации ингибитор HDAC выбирают из соединений следующей формулы: где А независимо представляет собой фенил и является незамещенным или замещенным;Q1 независимо представляет собой ковалентную связь, -СН 2-, -СН 2 СН 2-, -СН=СН-;J независимо представляет собой -NRN-S(=O)2- или -S(=O)2-NRN-;RN независимо представляет собой -Н или C1-4 алкил и является незамещенным;Q2 независимо представляет собой фенилен-C1-4 алкилен, фенилен-C2-4 алкенилен и является незамещенным; и их фармацевтически приемлемые соли, сольваты, амиды, сложные эфиры, простые эфиры, химически защищенные формы и предшественники. В одном из вариантов реализации ингибитор HDAC выбирают из соединений следующих формул и их замещенных аналогов (например, аналогов, в которых концевая фенильная группа или азот сульфаниламида и т.п. несут замещение, например, одним или более из заместителей, определенных выше под заголовком "Ингибитор HDAC: заместители") и их фармацевтически приемлемых солей, сольватов, амидов, сложных эфиров, простых эфиров, химически защищенных форм и предшественников: В одном из вариантов реализации иHDАС выбирают из соединений следующей формулы и их замещенных аналогов (например, аналогов, в которых концевая фенильная группа, азот сульфониламида и т.д. несут замещение, например, одним или более из заместителей, описанных в разделе "ИнгибиторHDAC: заместители") и их фармацевтически приемлемых солей, сольватов, амидов, сложных эфиров,простых эфиров, химически защищенных форм и предшественников: В одном из вариантов реализации ингибитор HDAC выбирают из следующего соединения и его фармацевтически приемлемых солей, сольватов, амидов, сложных эфиров, простых эфиров, химически защищенных форм и предшественников: Ингибитор HDAC: другие формы. Некоторые соединения могут существовать в одной или более из конкретных геометрических, оптических, энантиомерных, диастереомерных, эпимерных, атропных, стереоизомерных, таутомерных,конформационных или аномерных форм, включая, без ограничения, цис- и транс-формы; Е- и Z-формы; с-, t- и r-формы; эндо- и экзо-формы; R-, S- и мезо-формы; D- и L-формы; d- и l-формы; (+) и (-) формы; кето- , енольную и енолятную формы; син- и антиформы; синклинальную и антиклинальную формы; и -формы; аксиальные и экваториальные формы; конформации "ванна", "кресло", "твист", "конверт" и"полукресло" и их комбинации, которые в дальнейшем в совокупности упоминаются как "изомеры" (или"изомерные формы"). Следует отметить, что за исключением, как обсуждается ниже, таутомерных форм, в понятие термина "изомеры" в данной заявке особым образом не включенны структурные (или конституционнальные) изомеры (т.е. изомеры, которые отличаются по характеру связей между атомами, а не просто по положению атомов в пространстве). Например, при упоминании метоксигруппы, -ОСН 3 не подразумевается ее структурный изомер, гидроксиметильная группа, -СН 2 ОН. Аналогично, при упоминании ортохлорфенила не подразумевается его структурный изомер, метахлорфенил. Однако при упоминании класса структур как раз могут учитываться структурные изомеры, находящиеся в пределах этого класса (например, C1-7 алкил включает н-пропил и изопропил; бутил включает н-, изо-, втор- и трет-бутил; метоксифенил включает орто-, мета- и параметоксифенил. Указанное выше исключение не относится к таутомерным формам, например кето-, енольной и енолятной формам, как, например, в следующих таутомерных парах: кето/енол (представлены ниже),имин/енамин, амид/иминоспирт, амидин/амидин, нитрозо/оксим, тиокетон/ентиол, N-нитрозо/гидроксиазо и нитро/ацинитро. Следует отметить, что особым образом в понятие термина "изомеры" включены соединения с одним или более изотопическим замещением. Например, Н может находиться в любой изотопической форме, включая 1 Н, 2 Н(D) и 3 Н(Т); С может находиться в любой изотопической форме, включая 12 С, 13 С и 14 С; О может быть в любой изотопической форме, включая 16 О и 18 О и т.п. Если не указано другое, упоминание конкретного соединения подразумевает все такие изомерные формы, включая (целиком или частично) рацемические и другие их смеси. Способы получения (например, асимметрический синтез) и разделения (например, фракционная кристаллизация и хроматографические способы) таких изомерных форм либо хорошо известны в данной области, либо могут быть легко получены при модификации известных способов известным образом. Если не указано другое, упоминание конкретного соединения также подразумевает его ионную форму, соль, сольват, защищенную форму и предшественники, например, как рассматривается ниже. Могут оказаться целесообразными или желательными получение, очистка и/или переработка соответствующей соли активного соединения, например фармацевтически приемлемой соли. Примеры фармацевтически приемлемых солей рассматриваются в работе Берджа и соавторов Berge et al., 1977, "Pharmaceutically Acceptable Salts", J. Pharm. Sci., Vol. 66, pp. 1-19. Например, если соединение является анионным или имеет функциональную группу, которая может быть анионной (например, -СООН может быть -COO-), можно образовать соль с подходящим катионом. Примеры подходящих неорганических катионов включают, без ограничения, ионы щелочных металлов,такие как Na+ и K+, катионы щелочно-земельных металлов, такие как Са 2+ и Mg2+, и другие катионы, такие как Al+3. Примеры подходящих органических катионов включают, без ограничения, ион аммония(т.е. NH4+) и замещенные ионы аммония (например, NH3R+, NH2R2+, NHR3+, NR4+). Примерами некоторых подходящих замещенных ионов аммония являются ионы, полученные из этиламина, диэтиламина,дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислот, таких как лизин и аргинин. Примером обычного четверичного иона аммония является N(CH3)4+. Если соединение является катионным или имеет функциональную группу, которая может быть катионной (например, -NH2, которая может переходить может быть в -NH3+), то можно образовать соль с подходящим анионом. Примеры подходящих неорганических анионов включают, без ограничения,анионы, полученные из следующих неорганических кислот: соляной, бромисто-водородной, иодистоводородной, серной, сернистой, азотной, азотистой, фосфорной и фосфористой. Примеры подходящих органических анионов включают, бех ограничения, анионы, полученные из следующих органических кислот: 2-ацетиоксибензойной, уксусной, аскорбиновой, аспарагиновой, бензойной, камфорсульфоновой, коричной, лимонной, этилендиаминтетрауксусной, этандисульфоновой,этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глютаминовой, гликолевой, гидроксималеиновой, гидроксинафталенкарбоновой, изэтиновой, молочной, лактобионовой, лауриновой, малеиновой, яблочной, метансульфоновой, муциновой, олеиновой, щавелевой, пальмитиновой, памоевой, пантотеновой, фенилуксусной, фенилсульфоновой, пропионовой, пировиноградной, салициловой, стеариновой, янтарной, сульфаниловой, виннокаменной, толуолсульфоновой и валериановой. Примеры подходящих полимерных органических анионов включают, без ограничения, анионы, полученные из следующих полимерных кислот: дубильной кислоты, карбоксиметилцеллюлозы. Могут оказаться целесообразными или желательными получение, очистка и/или переработка соответствующего сольвата активного соединения. Термин "сольват" используется в данном описании в общепринятом значении и обозначает комплекс растворенного вещества (например, активного соединения,соли активного соединения) и растворителя. Если растворитель представляет собой воду, сольват можно для удобства называть гидратом, например моногидратом, дигидратом, тригидратом и т.п. Могут оказаться целесообразными или желательными получение, очистка и/или переработка активного соединения в химически защищенной форме. Термин "химически защищенная форма" используется в данном описании в общепринятом в химии значении и относится к соединению, в котором одна или более реакционноспособная функциональная группа защищена от нежелательных химических реакций при определенных условиях (например, рН, температура, радиация, растворитель и т.п.). Чтобы обратимо сделать функциональную группу, которая в противном случае была бы реакционноспособной, не способной к реакции в определеннных условиях, на практике применяют хорошо известные химические способы. В химически защищенной форме одна или более их реакционноспособных функциональных групп находятся в форме защищенной или защитной группы (также известной как экранированная или экранирующая группа, либо блокированная или блокирующая группа). Защита реакционноспособной функциональной группы позволяет осуществлять реакции с участием других незащищенных реакционноактивных функциональных групп, не затрагивая защищенную группу; защитную группу можно удалить, обычно в последующем этапе, без значительного воздействия на остальную часть молекулы. См.,например, Protective Groups in Organic Synthesis (Т. Green and P. Wuts; 3rd Edition; John Wiley and Sons,1999). Большое разнообразие таких способов "защиты", "блокирования" или "экранирования" широко распространено и хорошо известно в органическом синтезе. Могут оказаться целесообразными или желательными получение, очистка и/или переработка соответствующего активного соединения в форме проингибитора HDAC. Термин "проингибитор HDAC" в данной заявке относится к соединению, которое при метаболизировании (например, in vivo) дает желаемое активное соединение. Как правило, про-иHDAC является неактивным или менее активным, чем активное соединение, но может обладать полезными свойствами, проявляющимися при переработке, введении или метаболизировании. Например, некоторые предшественники представляют собой сложные эфиры активного соединения (например, физиологически приемлемые легко метаболизируемые сложные эфиры). В процессе метаболизма, сложноэфирная связь (-C(=O)OR) гидролизуется с образованием активного ингибитора HDAC. Такие сложные эфиры могут быть получены путем этерификации, например,- 14018982 любой карбоксильной кислотной группы (С(=О)ОН) исходного соединения, при необходимости с предварительной защитой любой другой реакционноспособной группы исходного соединения, с последующим снятием защитных групп в случае необходимости. Циклодекстрин. Термин "циклодекстрин" в данной заявке (например, в связи с компонентом (б относится к циклодекстрину как таковому, а также к производным циклодекстрина, в том числе, например, производным циклодекстрина, описанным в данной заявке. Циклодекстрины, также известные как циклоамилозы, циклоглюканы и декстрины Шардингера,представляют собой природные клатраты, получаемые, например, при воздействии амилазы Bacillusmacerans на крахмал с формированием однородных циклических соединенных -(14) связями глюкопиранозных единиц, -, - и -циклодекстрины образованы шестью, семью и восемью единицами соответственно и имеют молекулярную массу 972,84, 1134,98 и 1297,12 г/моль соответственно. Циклодекстрины имеют гидрофобные полости и образуют соединения с органическим веществом, солями и галогенами в твердом состоянии или в водных растворах. Их применяют в качестве комплексообразующих веществ и при исследовании действия ферментов. До настоящего времени циклодекстрины применяли только в ограниченном числе препаратов небольшого объема для парентерального введения. См., например, Loftsson, Т., 1998, "Cyclodextrins in Pharmaceutical Formulations," Report for Nordic Industrial Fund); иStrickley, R., 2004, "Solubilising Excipients in Oral and Injectable Formulations", Pharm. Res., Vol. 21, No. 2,pp. 201-230. Известен ряд производных циклодекстринов, в которых, например, одна или более из первичных или вторичных боковых гидроксильных групп (-ОН) участвуют в образовании производных с образованием простых эфирных групп (например, диметилового эфира; гидроксиэтилового эфира; 2 гидроксипропилового эфира; карбоксиметилового эфира; карбоксиэтилового эфира; глюкозилового эфира; мальтозилового эфира; сульфобутилового эфира). Обычно степень молярного замещения составляет,например, 0,6, 0,8 и 1,0 (например, 0,5-1,0). В одном из вариантов реализации циклодекстрин выбирают из -циклодекстрина; циклодекстрина; -циклодекстрина; (C1-4 алкил)циклодекстрина; (C1-4 алкил)циклодекстрина; (С 1-4 алкил)циклодекстрина; (гидрокси-C1-4 алкил)циклодекстрина; (гидрокси-C1-4 алкил)циклодекстрина; (гидрокси-C1-4 алкил)циклодекстрина; (карбокси-C1-4 алкил)циклодекстрина; (карбокси-C1-4 алкил)циклодекстрина; (карбокси-C1-4 алкил)циклодекстрина; сахаридных эфиров -циклодекстрина; сахаридных эфиров -циклодекстрина; сахаридных эфиров -циклодекстрина и сульфобутиловых эфиров-циклодекстрина, -циклодекстрина или -циклодекстрина. Примеры C1-4 алкильных групп в этом контексте включают -Me, -Et, -nPr, -iPr и -cPr. Примеры сахаридных эфиров в этом контексте включают глюкозиловые и мальтозиловые эфиры. Особенно предпочтительным циклодекстрином является гидроксипропилциклодекстрин. Предпочтительно циклодекстрин имеет фармацевтическую степень чистоты или эквивалентную. Следующее циклодекстрины и производные циклодекстринов могут быть получены в WackerChemie GmbH, Munich, Germany:-циклодекстрин (Cavamax W6 pharma); гидроксипропил -циклодекстрин (Cavasol W6 HP TL); гидроксипропилциклодекстрин (Cavasol W7 HP pharma); гидроксипропилциклодекстрин (Cavasol W7 HP pharma). Вне связи с какой-либо конкретной теорией авторы изобретения полагают, что концевая фенильная группа PXD-101 (или, возможно, замещенная концевая фенильная группа аналогов PXD-101) образует комплекс с циклодекстрином, таким как, гидроксипропилциклодекстрин. Аргинин. Аргинин, также известный как L-аргинин, 2-амино-5-гуанидиновалериановая кислота и (S)-2 амино-5-[(аминоиминометил)амино]пентановая кислота, имеет молекулярную массу 174,20. Он растворим в воде (насыщенный водный раствор содержит 15% мас./мас. при 21 С) и является щелочным по природе (но менее щелочным, чем меглумин). Он часто представлен в форме кислотно-аддитивной соли,например гидрохлорида. Аргинин хорошо переносится человеком в дозах до 30 г/кг, например, в виде пищевой добавки. В одном из вариантов реализации аргинин представляет собой свободный аргинин или фармацевтически приемлемую соль аргинина. Предпочтительно аргинин представляет собой L-аргинин. В одном из вариантов реализации аргинин представляет собой свободный L-аргинин или фармацев- 15018982 тически приемлемую соль L-аргинина. Предпочтительно аргинин имеет фармацевтическую степень чистоты или эквивалентную.L-аргинин для препаратов ингибиторов HDAC (соответствующий как европейским стандартам, так и стандартам Соединенных Штатов) может быть получен, например, от Ajinomoto, Kanagawa, Япония(каталог 2). Вне связи с какой-либо конкретной теорией авторы изобретения полагают, что акриламидные и/или сульфаниламидные группы PXD-101 (и его аналогов) участвуют в in situ солеобразовании с аргинином (и меглумином, описанным ниже) и, таким образом, способствуют улучшению растворимости. Меглумин. Меглумин, также известный как N-метилглюкамин, 1-дезокси-1-(метиламино)-D-глюцитол и Nметил-О-глюкамин, имеет молекулярную массу 195,21 г/моль и температуру плавления около 129-131 С. Он растворим в воде (100 г в 100 мл при 25 С), является щелочным по природе (и более щелочным, чем аргинин) (рН 10,5 для 1 мас.% водного раствора). Он образует соли с кислотами и комплексы с металлами и применяется во многих фармацевтических препаратах. В одном из вариантов реализации меглумин представляет собой свободный меглумин или фармацевтически приемлемую соль меглумина. Предпочтительно меглумин имеет фармацевтическую степень чистоты или эквивалентную. Меглумин для препаратов ингибиторов HDAC (соответствующих как европейским стандартам, так и стандартам Соединенных Штатов) может быть получен, например, в Merck KgaA, Германия. Другие дополнительные компоненты. В одном из вариантов реализации фармацевтическая композиция дополнительно включает один или более из других дополнительных фармацевтически приемлемых компонентов (например, фармацевтически приемлемый носитель и т.п.). В одном из вариантов реализации фармацевтическая композиция дополнительно включает один или более из других фармацевтически приемлемых компонентов, хорошо известных специалистам в данной области, включая, без ограничения, фармацевтически приемлемый носитель, разбавитель, наполнитель, адъювант, буфер, модификатор рН, консервант, антиоксидант, бактериостатик, стабилизатор,суспендирующее средство, солюбилизатор, поверхностно-активное вещество (например, смачивающий реагент), окрашивающее вещество и изотонирующее растворенное вещество (то есть вещество, которое делает состав изотоничным крови или другой соответствующей жидкости организма предполагаемого реципиента). Подходящие носители, разбавитель, наполнители и т.п. можно найти в стандартных фармацевтических руководствах. См., например, Handbook of Pharmaceutical Additives, 2nd Edition (eds. M. Ashand I. Ash), 2001 (Synapse Information Resources, Inc., Endicott, New York, USA), Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Company, Easton, Pa., 1990; и Handbook of Pharmaceutical Excipients, 2nd edition, 1994. Термин "фармацевтически приемлемый" в данной заявке относится к соединениям, компонентам,веществам, композициям, лекарственным формам и т.п., применение которых, включающее контакт с тканями рассматриваемого субъекта (например, человека), имеет логичное медицинское обоснование и не связано с повышенной нежелательной токсичностью, раздражением, аллергической реакцией или другими проблемами или осложнениями и соответствуют разумному соотношению польза/риск. Каждый носитель, разбавитель, наполнитель и т.п. должен также быть "приемлемым" в том смысле, что он должен быть совместим с другими компонентами композиции. В одном из вариантов реализации композиция дополнительно включает другие активные вещества,например другие терапевтические или профилактические агенты. Формат. В данной заявке термин "состав" описывает вещество, которое существует в форме (например,жидкой), готовой для введения, тогда как термин "предварительный состав" описывает вещество (например, лиофилат/лиофилизат, концентрат и т.п.), из которого может быть получен препарат (например,путем регидратации, разбавления и т.п.). В одном из вариантов реализации композиция (например, состав, предварительный состав) является жидкой (например, при комнатной температуре, т.е. 25 С, и стандартном атмосферном давлении, т.е. 1,01325 бар). Жидкая композиция (например, состав, предварительный состав) может представлять собой раствор, суспензию, эмульсию и т.п., в которых растворены, суспендированы или другим способом пред- 16018982 ставлены (например, в виде липосом или других микрочастиц) ингибитор HDAC и другие компоненты(например, циклодекстрин, аргинин, меглумин и т.п.). В одном из вариантов реализации композиция (например, состав, предварительный состав) представляет собой водный раствор (например, включающий по меньшей мере 30% мас./мас. воды, например по меньшей мере 50% мас./мас. воды, по меньшей мере 70% мас./мас. воды). В одном из вариантов реализации композиция (например, состав, предварительный состав) представляет собой водный изотонический раствор (например, изотоничный крови). В одном из вариантов реализации композиция (например, состав, предварительный состав) является стерильной и апирогенной (т.е. свободной от пирогенов). В одном из вариантов реализации композиция (например, предварительный состав) представляет собой жидкий концентрат, из которого можно получить состав, например, путем разбавления. В одном из вариантов реализации композиция (например, предварительный состав) представлена твердой формой (например, при комнатной температуре, т.е. 25 С, и стандартном атмосферном давлении, т.е. 1,01325 бар) (например, порошком, гранулами, таблетками, лиофилатами/лиофилизатами и т.п.),из которой можно получить препарат, например, путем гидратации (или регидратации), возможно, с последующим дополнительным разбавлением. Вещества, подходящие для разбавления, гидратации и/или регидратации, включают, например, воду для инъекций, водный солевой раствор (например, 0,9% мас./об. NaCl), водный раствор глюкозы, например 5% мас./об. фармакопейной глюкозы), раствор для инъекции/инфузии, глюкозу для инъекции/инфузии, раствор Рингера, раствор Рингера с лактатом и т.п. Подходящий солевой раствор ("физиологический раствор для инфузии", 0,9% мас./об. фрамакопейного хлорида натрия) может быть получен, например, от Baxter Healthcare Ltd., Thetford, Norfolk, UK(код продукта FUE1322). Подходящий растовр глюкозы ("глюкоза для инфузий", 5% мас./об. фармакопейной глюкозы) может быть получен, например, от Baxter Healthcare Ltd., Thetford, Norfolk, UK (код продукта FUE1322). Фармацевтические композиции (например, составы, предварительные составы) могут быть представлены в герметизированных контейнерах, рассчитанных на одну или несколько доз, например в ампулах и флаконах. Фармацевтический состав может быть получен, например, из предварительного состава, экстемпорально, например непосредственно перед применением, например, в мешке для внутривенной (в.в.) инфузии. Один аспект настоящего изобретения относится к фармацевтической композиции (например, составу, предварительному составу), описанной в данной заявке, в подходящем контейнере (например, флаконе, ампуле, мешке для внутривенной (в.в.) инфузии. Один аспект настоящего изобретения относится к флакону или ампуле, содержащим фармацевтическую композицию (например, состав, предварительный состав), описанную в данной заявке. Один аспект настоящего изобретения относится к флакону или ампуле, содержащей фармацевтический предварительный состав (например, жидкий концентрат), описанной в данной заявке. Один аспект настоящего изобретения относится к мешку для внутривенной (в.в.) инфузии, содержащему фармацевтическую композицию (например, состав), описанную в данной заявке. Количество ингибитора HDAC. Фармацевтический препарат включает терапевтически эффективное количество ингибитора HDAC. Фармацевтическая композиция содержит такое количество ингибитора HDAC, что при последующем получении фармацевтического состава из указанной фармацевтической композиции (например, путем разбавления, гидратации, регидратации и т.п.) указанный фармацевтический состав содержит терапевтически эффективное количество ингибитора HDAC. Специалисту в данной области очевидно, что соответствующие дозы ингибитора HDAC (и концентрация ингибитора HDAC в составах и композициях) для разных субъектов можно варьировать. Определение оптимальной дозы обычно включает уравновешивание уровня терапевтической полезности и любого риска или отрицательных побочных эффектов. Выбранный уровень дозирования зависит от разнообразных факторов, включающих, без ограничения, активность конкретного соединения, путь введения,время введения, показатель экскреции соединения, длительность лечения, другие ингибиторы HDAC,соединения и/или вещества, применяемые в комбинации с ингибиторами HDAC, степень тяжести состояния, а также вид, пол, возраст, вес, состояние, общее состояние здоровья и предшествующую историю болезни объекта. Количество иHDAC и путь введения в конечном счете находится на усмотрении врача, ветеринара или врача-консультанта, хотя обычно дозировку выбирают для достижения локальной концентрации в месте действия, которая обеспечивала бы желаемый эффект, не вызывая значительных отрицательных или вредных побочных эффектов. Пример предпочтительной дозировки - 150 мкмоль/кг. Для ингибитора HDAC (например, PXD-101) с молекулярной массой 318 г/моль она составляет 47,7 мг/кг. Для субъекта массой 70 кг она составляет 3,3 г. При разбавлении в мешке для внутривенного введения объемом 1,0 мл концентрация состава составлят 3,3 г/л (3,3 мг/мл) или 10 мМ. Подходящий жидкий концентрат (например, предварительный состав) может иметь концентрацию в 10-100 раз больше, чем необходимый состав, и, таким образом, его концентрация составляет 33-330 г/л (33-330 мг/мл, например 50 мг/мл) или 0,1-1,0 М. В одном из вариантов реализации концентрация ингибитора HDAC в композиции (например, составе) составляет по меньшей мере 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1,0, 2,0 или 5,0 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC в композиции (например, составе) составляет до 200, 100, 50, 20, 10, 5, 2, 1, 0,5 или 0,2 мг/мл включительно. В одном из вариантов реализации концентрация ингибитора HDAC составляет 0,1-10 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 0,5-10 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 1,0-10 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 0,1-5 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 0,5-5 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 1,0-5 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC в композиции (например, составе) составляет по меньшей мере 0,01, 0,03, 0,05, 0,1, 0,3, 0,5, 1,0, 3,0, 5,0 или 10 мМ. В одном из вариантов реализации концентрация ингибитора HDAC в композиции (например, составе) составляет до 300, 200, 100, 50, 30, 20, 15, 10, 5, 3, 1, 0,5 или 0,3 мМ включительно. В одном из вариантов реализации концентрация ингибитора HDAC составляет 0,3-30 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 1,0-30 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 2,0-30 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 3,0-30 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 0,3-15 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 1,0-15 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 2,0-15 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 3,0-15 мМ. Концентрация ингибитора HDAC в композиции (например, в предварительном составе) может быть, например, в 1-1000 раз выше, чем концентрация ингибитора HDAC в соответствующем составе. В одном из вариантов реализации композиция (например, предварительный препарат) имеет концентрацию иHDAC по меньшей мере в 1, 2, 5, 10, 20, 50 или 100 раз выше. В одном из вариантов реализации композиция (например, предварительный препарат) имеет концентрацию иHDAC до 1000, 500, 200, 100, 50, 20, 10, 5 или 2 раз включительно выше. В одном из вариантов реализации концентрация ингибитора HDAC в 10-500 раз выше. В одном из вариантов реализации концентрация ингибитора HDAC в 10-200 раз выше. В одном из вариантов реализации концентрация ингибитора HDAC в 10-100 раз выше. В одном из вариантов реализации концентрация ингибитора HDAC в 10-50 раз выше. В одном из вариантов реализации концентрация ингибитора HDAC в 10-20 раз выше. Например, в одном из вариантов реализации концентрация ингибитора HDAC в композиции (например, предварительном составе) составляет 30-600 мМ (соответственно, в 10-20 раз выше чем 3,0-30 мМ). В одном из вариантов реализации концентрация ингибитора HDAC в композиции (например, предварительном составе) составляет по меньшей мере 0,1, 0,2, 0,5, 1,0, 2,0, 5,0, 10, 20, 30 или 50 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC в композиции (например, предварительном составе) составляет до 1000, 500, 300, 200, 100, 50, 20, 10, 5 или 2 мг/мл включительно. В одном из вариантов реализации концентрация ингибитора HDAC составляет 5-500 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 10-500 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 20-500 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 30-500 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 5-300 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 10-300 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 20-300 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 30-300 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC составляет 50 мг/мл. В одном из вариантов реализации концентрация ингибитора HDAC в композиции (например, предварительном составе) составляет по меньшей мере 0,3, 0,5, 1,0, 1,5, 2,0, 3,0, 5,0, 10, 30, 50, 100 мМ. В одном из вариантов реализации концентрация ингибитора HDAC в композиции (например, предварительном составе) составляет до 3000, 1000, 500, 300, 100, 50, 30, 20, 15, 10, 5 или 3 мМ включительно. В одном из вариантов реализации концентрация ингибитора HDAC составляет 10-1000 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 30-1000 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 50-1000 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 100-1000 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 10-500 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 30-500 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 50-500 мМ. В одном из вариантов реализации концентрация ингибитора HDAC составляет 100-500 мМ. В случае, если ингибитор HDAC представлен в форме соли, количество рассчитывают на основе исходного соединения. Следовательно, указанные выше значения (например, 30-300 мг/мл, 50 мг/мл) соответствуют исходному соединению, а не, например, его соли. Количество циклодекстрина. В одном из вариантов реализации, если циклодекстрин присутствует, то молярное отношение циклодекстрина к ингибитору HDAC составляет по меньшей мере 0,5, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4 или 1,5. В одном из вариантов реализации, если циклодекстрин присутствует, то молярное отношение циклодекстрина к ингибитору HDAC составляет до 5, 4, 3,5, 3, 2,5, 2,0, 1,9, 1,8, 1,7, 1,6 или 1,5 включительно. В одном из вариантов реализации молярное отношение составляет 0,5-5. В одном из вариантов реализации молярное отношение составляет 0,8-4. В одном из вариантов реализации молярное отношение составляет 1-3. В одном из вариантов реализации молярное отношение составляет 1,2-2,5. В одном из вариантов реализации молярное отношение составляет 1,4-2. В одном из вариантов реализации молярное отношение составляет 1,5-1,9. Пример предпочтительной концентрации ингибитора HDAC для композиции (например, предварительного состава, состава) составляет 10 мМ. Если такая композиция (например, предварительный состав, состав) должна иметь молярное отношение циклодекстрина к ингибитору HDAC 1,5-1,9, то это соответствует концентрации циклодекстрина 15-19 мМ. Примером предпочтительного ингибитора HDAC является PXD-101, имеющий молекулярную массу 318 г/моль. -циклодекстрин имеет молекулярную массу 1135 г/моль. Отношение молекулярных масс циклодекстрина к ингибитору HDAC составляет 1135/318 или 3,57. Если композиция (например,предварительный состав, состав) должна иметь молярное отношение циклодекстрина к инигибиторуHDAC 1,5-1,9, это соответствует массовому отношению циклодекстрина к ингибитору HDAC 5,3-6,8(т.е. 5,3-6,8 г -циклодекстрина на каждый грамм PXD-101). Может быть предпочтительным обеспечение общей дозы циклодекстрина менее 5000, 2000, 1000,500, 400, 300, 200, 100 или 50 мг/кг. Количество аргинина. В одном из вариантов реализации, если аргинин присутствует, то молярное отношение аргинина к ингибитору HDAC составляет по меньшей мере 0,5, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4 или 1,5. В одном из вариантов реализации, если аргинин присутствует, то молярное отношение аргинина к ингибитору HDAC составляет до 5, 4, 3,5, 3, 2,5, 2,0, 1,9, 1,8, 1,7, 1,6 или 1,5 включительно. В одном из вариантов реализации молярное отношение составляет 0,5-5. В одном из вариантов реализации молярное отношение составляет 0,8-4. В одном из вариантов реализации молярное отношение составляет 1-3. В одном из вариантов реализации молярное отношение составляет 1,2-2,5. В одном из вариантов реализации молярное отношение составляет 1,4-2. В одном из вариантов реализации молярное отношение составляет 1,5-1,9. Пример предпочтительной концентрации ингибитора HDAC для композиции (например, состава) составляет 10 мМ. Если эта композиция (например, состав) должна иметь молярное отношение аргинина к ингибитору HDAC 1,5-1,9, это соответствует концентрации аргинина 15-19 мМ. Примером предпочтительного ингибитора HDAC является PXD-101, который имеет молекулярную массу 318 г/моль. Свободный аргинин имеет молекулярную массу 174 г/моль. Отношение молекулярных масс аргинина и ингибитора HDAC составляет 174/318 или 0,547. Если композиция (например,предварительный состав, состав) должна иметь молярное отношение аргинина к ингибитору HDAC 1,51,9, это соответствует массовому отношению аргинина к ингибитору HDAC 0,82-1,04 (т.е. 0,82-1,04 г аргинина на каждый грамм PXD-101). Может быть предпочтительным обеспечение общей дозы аргинина менее 200, 100, 50, 30 или 20 г/кг. Количество меглумина. В одном из вариантов реализации, если меглумин присутствует, то молярное отношение меглумина к ингибитору HDAC составляет по меньшей мере 0,5, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4 или 1,5. В одном из вариантов реализации, если меглумин присутствует, то молярное отношение меглумина к ингибитору HDAC составляет до 5, 4, 3,5, 3, 2,5, 2,0, 1,9, 1,8, 1,7, 1,6 или 1,5 включительно. В одном из вариантов реализации молярное отношение составляет 0,5-5. В одном из вариантов реализации молярное отношение составляет 0,8-4. В одном из вариантов реализации молярное отношение составляет 1-3. В одном из вариантов реализации молярное отношение составляет 1,2-2,5. В одном из вариантов реализации молярное отношение составляет 1,4-2. В одном из вариантов реализации молярное отношение составляет 1,5-1,9. Пример предпочтительной концентрации ингибитора HDAC для композиции (например, препарата) 10 мМ. Если такая композиция (например, препарат) должна иметь молярное отношение меглумина к ингибитору HDAC 1,5-1,9, то это соответствует концентрации меглумина 15-19 мМ. Примером предпочтительного ингибитора HDAC является PXD-101, имеющий молекулярную массу 318 г/моль. Свободный меглумин имеет молекулярную массу 195 г/моль. Отношение молекулярных масс меглумина и ингибитора HDAC составляет 195/318 или 0,613. Если композиция (например, предварительный состав, состав) должна иметь молярное отношение меглумина и ингибитора HDAC 1,51,9, то это соответствует массовому отношению меглумина к ингибитору HDAC 0,92-1,17 (т.е. 0,92-1,17 г меглумина на каждый грамм PXD-101). Может быть предпочтительным обеспечение общей дозы меглумина менее 200, 100, 50, 30 или 20 г/кг. Получение композиций. Композиции (например, предварительный составы, составы) могут быть получены с применением стандартных способов, хорошо известных в области фармацевтики. Например, способы, задействующие стандартную лабораторию или оборудование для фармацевтического производства, хорошо известны специалистам в области фармацевтики. Один из аспектов настоящего изобретения относится к способу получения композиции (например,предварительного состава, состава) (как описано в данной заявке) путем объединения: (а) ингибитораHDAC, определенного в данной заявке, и (б) одного или более из следующих дополнительных компонентов: циклодекстрина, аргинина и меглумина и, возможно, одного или более их других дополнительных фармацевтически приемлемых компонентов (описанных в данной заявке). Например, соответствуюшее количество чистого, сухого ингибитора HDAC (например, PXD-101) можно растворить в растворе солеобразователя (например, аргинина, меглумина) или циклодекстрина в воде в соответствующей концентрации, как описано в данной заявке. Растворение можно осуществить в течение периода от примерно 1 мин до примерно 1 ч путем помешивания, например, с применением магнитной мешалки, лопастной мешалки или турбинной мешалки, с подводом тепла или без него. Образующийся раствор затем разбавляют до конечного объема, например, водой соответствующего класса и дополнительно перемешивают в течение некоторого времени, пока раствор не станет гомогенным. В случае необходимости можно изменить рН раствора с применением подходящей кислоты (например, HCl) для достижения рН, равного примерно 8,5 или выше. Однако при изменении рН может возникнуть риск преципитации ингибитора HDAC. Раствор пропускают через подходящий фильтр (например, 0,2 мкм фильтр для стерилизации) и помещают в подходящие контейнеры (например, флаконы, ампулы и т.п.) в подходящей фармацевтической производственной среде и гермитизуют/запечатывают. Можно лиофилизат приготовить, поместив раствор во флаконы, имеющие предназначенные для лиофилизации пробки, и удалив воду замораживанием-высушиванием с получением порошка, пригодного для восстановления/регидратации с применением подходящей для регидратации среды (например,солевого раствора, глюкозы и т.п.). После замораживания-высушивания флаконы гермитизуют и запечатывают. Один из аспектов настоящего изобретения относится к способу получения состава (описанного в данной заявке) путем разбавления, восстановления, гидратации, регидратации и т.п. предварительного состава (описанного в данной заявке). Один из аспектов настоящего изобретения относится к фармацевтической композиции (например,составу) (описанной в данной заявке), полученной путем разбавления, восстановления, гидратации, регидратации и т.п. предварительного состава (описанного в данной заявке). Один из аспектов настоящего изобретения относится к фармацевтической композиции (например,составу) (описанному в данной заявке), полученной путем разбавления, восстановления, гидратации,регидратации и т.п. предварительного состава (описанного в данной заявке). Например, составы могут быть получены из предварительных составов, например, экстемпорально,путем разбавления, восстановления, гидратации, регидратации и т.п. с применением соответствующих жидкостей, например воды (например, воды для инъекции), водного солевого раствора (например, 0,9% мас./об. солевого раствора), водного раствора глюкозы (например, 5% мас./об. раствор глюкозы) и т.п. Например, соответствующее количество жидкой концентрированной композиции (например, предварительного состава) (первоначально предоставленной во флаконе или ампуле) можно поместить в типичный 1 л мешок для внутривенного введения с солевым или глюкозным раствором и полученный состав применять для введения путем внутривенной инфузии. Например, соответствующее количество лиофилата/лиофилизата композиции (например, предварительного состава) можно восстановить (или регидратировать) добавлением подходящей водной среды(например, воды для инъекций, 0,9% солевого раствора, 5% раствора глюкозы и т.п.), например, во флакон, содержащий лиофилат/лиофилизат, например, с помощью подходящего шприца и иглы. Содержимое флакона можно затем взболтать для растворения лиофилизированного порошка. Полученную в результате композицию можно затем применять как состав и вводить субъекту либы можно применять ее как предварительный состав и разбавлять до необходимой концентрации, например, добавлением в подходящую для инфузии среду, например в мешок для инфузии. Один из аспектов настоящего изобретения относится к способу получения состава ингибитораHDAC (описанного в данной заявке), включающему стадию объединения указанного ингибитора HDAC с одним или более из следующих дополнительных компонентов: циклодекстрин, аргинин, и меглумин(описанных в данной заявке); и, возможно, одним или более из других дополнительных фармацевтически приемлемых компонентов (описанных в данной заявке). Один из аспектов настоящего изобретения относится к способу повышения концентрации иHDАС(как описано в данной заявке) в фармацевтической композиции, включающему стадию получения препарата указанного иHDAC с одним или более из следующих дополнительных компонентов: циклодекстрин,аргинин и меглумин (как описано в данной заявке); и, возможно, одного или более другого дополнительного фармацевтически приемлемого компонента (как описано в данной заявке). Твердые формы. Один из аспектов настоящего изобретения относится к фармацевтической композиции, включающей ингибитор HDAC (например, PXD-101) в твердой лекарственной форме (например, таблетка, капсула, желатиновая таблетка и т.п.) (например, желатиновая капсула). Один из аспектов настоящего изобретения относится к твердой лекарственной форме (например,таблетке, капсуле, желатиновой таблетке и т.п.) (например, желатиновой капсуле), содержащей ингибитор HDAC, описанный в данной заявке. Один из аспектов настоящего изобретения относится к твердой лекарственной форме (например,таблетке, капсуле, желатиновой таблетке и т.п.) (например, желатиновой капсуле), содержащей фармацевтическую композицию (например, состав), описанную в данной заявке. Медицинское применение, способы лечения и т.п. Один из аспектов настоящего изобретения относится к компонентам фармацевтической композиции, описанной в данной заявке (например, ингибитору HDAC; одному или более из циклодекстрина,аргинина и меглумина и т.п.) для применения в способе лечения человека или животного посредством терапии. Один из аспектов настоящего изобретения относится к фармацевтической композиции (например,предварительному составу, составу), описанной в данной заявке, для применения в способе лечения организма человека или животного посредством терапии. Один из аспектов настоящего изобретения относится к применению компонентов фармацевтической композиции, описанной в данной заявке (например, ингибиторов HDAC; одного или более из циклодекстрина, аргинина и меглумина и т.п.), в производстве лекарственного препарата для лечения патологического состояния, описанного в данной заявке. Один из аспектов настоящего изобретения относится к применению фармацевтической композиции(например, предварительного состава), описанного в данной заявке, в производстве лекарственного препарата для лечения патологического состояния, описанного в данной заявке. Один из аспектов настоящего изобретения относится к способу лечения, включающему введение субъекту, нуждающемуся в лечении, фармацевтической композиции (например, состава), описанной в данной заявке. Один из аспектов настоящего изобретения относится к способу (а) регуляции (например, ингибирования) пролиферации клеток; (б) ингибирования хода клеточного цикла; (в) стимуляции апоптоза или (г) комбинации одного или более из перечисленного, in vitro или in vivo, включая контакт клетки с фармацевтической композицией (например, препаратом), как описано в данной заявке. Лечению могут подвергаться любые типы клеток, включающие, без ограничения, клетки легкого,желудочно-кишечного тракта (включая, например, кишку, толстую кишку, ободочную и прямую кишку),груди (молочной железы), яичника, простаты, печени (печеночные), почки (почечные), мочевого пузыря,поджелудочной железы, мозга и кожи. Один из аспектов настоящего изобретения относится к способу введения ингибитора HDAC, определенного в данной заявке, субъекту, включающему введение указанному субъекту фармацевтической композиции (например, состава), описанного в данной заявке. Лечение. Термин "лечение" в данной заявке применительно к лечению патологического состояния относится,как правило, к лечению и терапии либо человека, либо животного (например, при применении в ветеринарии), при котором достигается некоторый желательный терапевтический эффект, например ингибирование прогрессирования патологического состояния, и включает снижение степени прогрессирования,остановку прогрессирования, снижение степени выраженности патологического состояния и излечение патологического состояния. Этот термин также охватывает лечение как профилактическую меру (т.е. профилактика). Например, применение в отношении субъектов, у которых еще не развилось патологическое состояние, но с повышенным риском развития такого патологического состояния также входит в понятие термина "лечение". Термин "терапевтически эффективное количество" в данной заявке соответствует такому количеству ингибитора HDAC, которое эффективно для получения некоторого желательного терапевтического эффекта, связано с приемлемым соотношением польза/риск при введении в соответствии с необходимым режимом лечения. Термин "лечение" включает комбинированные способы лечения и терапии, в которых два или более способа лечения или терапии объединяют, например, последовательно или одновременно. Например,соединения, описанные в данной заявке, можно также примениять в комбинированных способах терапии, например, вместе с другими агентами, например цитотоксическими агентами и т.п Примеры способов лечения и терапии включают, без ограничения, химиотерапию (введение активных агентов, включая, например, ингибитор HDAC, антитела (например, при иммунотерапии), предшественники (например, при фотодинамической терапии, пролекарственной генонаправленной терапии (GDEPT), антителонаправленной пролекарственной терапии ферментами (ADEPT) и т.п.); хирурги; радиационной терапии; и генотерапии. Патологические состояния. В одном из вариантов реализации лечение представляет собой лечение пролиферативного патологического состояния. Термины "пролиферативное патологическое состояние", "пролиферативное нарушение" или "пролиферативное заболевание" используются в данной заявке равнозначно и относятся к нежелательной или неконтролируемой клеточной пролиферации избыточных или аномальных клеток, которая является нежелательной, например неопластическому или гиперпластическому росту. В одном из вариантов реализации лечение представляет собой лечение пролиферативного патологического состояния, характеризующегося доброкачественной, предзлокачественной или злокачественной пролиферацией клеток, включая, без ограничения, неоплазмы, гиперплазии и опухоли (например,гистиоцитому, глиому, астроцитому, остеому), рак (см. ниже), псориаз, болезни костей, фибропролиферативные нарушения (например, соединительных тканей), фиброз лгких, атеросклероз, пролиферацию клеток гладких мышц в кровеносных сосудах, например, стеноз или рестеноз после ангиопластики. В одном из вариантов реализации лечение представляет собой лечение рака. В одном из вариантов реализации лечение представляет собой лечение рака легкого, мелкоклеточного рака легкого, рака желудочно-кишечного тракта, рака толстой кишки, рака прямой кишки, колоректального рака, рака груди, рака яичников, рака простаты, рака яичек, рака печени, рака почки, рака мочевого пузыря, рака поджелудочной железы, рака мозга, саркомы, остеосаркомы, саркомы Капоши, меланомы, злокачественной меланомы, базально-клеточного рака или лейкемии. В одном из вариантов реализации лечение представляет лечение патологического состояния, опосредуемого HDAC. Термин "патологическое состояние, опосредуемое HDAC" в данной заявке относится к патологическому состоянию, при котором HDAC и/или действие HDAC является важным или необходимым, например, для возникновения, прогрессирования, проявления и т.п. этого патологического состояния или патологического состояния, которое, как известно, лечат ингибиторами HDAC (такими как, например,трихостатин А). Специалист в данной области легко может определить, лечит или нет возможный ингибитор HDAC патологическое состояние, опосредуемое HDAC, в любом конкретном типе клеток. Например, можно применять стандартные способы анализа для оценки активности конкретного соединения,описанные в работе Watkins et al., 2002 (публикация международной заявки WO 02/30879). Примеры таких патологических состояний включают, без ограничения, следующие: рак (см., например, Vigushin et al., 2001, Clin. Cancer Res., Vol. 7, No. 4, pp. 971-976); псориаз (см., например, lavarone et al., 1999, Mol. Cell Biol., Vol. 19, No. 1, pp. 916-922); фибропролиферативные нарушения (e.g., фиброз печени) (см., например, Niki et al., 1999, Hepatology, Vol. 29, No. 3, pp. 858-867; Corneil et al., 1998, опубликованная заявка на японский патент JP 10114681 А 2); пролиферативные нарушения гладких мышц мускулатуры (например, атеросклероз, рестеноз) (см.,например, Kimura et al., 1994, Biol. Pharm. Bull., Vol. 17, No. 3, pp. 399-402); нейродегенеративные заболевания (например, болезнь Альцгеймера, болезнь Паркинсона, хорея Хантингтона, амиотропный латеральный склероз, дегенерация спинного мозга и мозжечка) (см., например, Kuusisto et al., 2001, Biochem. Biophys. Res. Commun., Vol. 280, No. 1, pp. 223-228; Stefan, J., et al.,2002, публикация международного патента (РСТ) номер WO 02/090534); воспалительные заболевания (например, остеоартрит, ревматоидный артрит) (см., например, Dangond et al., 1998, Biochem. Biophys. Res. Commun., Vol. 242, No. 3, pp. 648-652; Takahashi, I., et al., 1996, J.(см., например, McCaffrey et al., 1997, Blood, Vol. 90, No. 5, pp. 2075-2083); вызванные грибами инфекции (см., например, Bernstein et al., 2000, Proc. Natl. Acad. Sci. USA, Vol. 97, No. 25, pp. 13708-13713; Tsuji et al., 1976, J. Antibiot. (Tokyo), Vol. 29, No. 1, pp. 1-6); паразитарные инфекции (например, малярия, трипаносомоз, гельминтоз, протозойная инфекция вирусные инфекции (см., например, Chang et al., 2000, Nucleic Acids Res., Vol. 28, No. 20, pp. 39183925); патологические состояния, которые поддаются лечению иммуномодуляцией (например, рассеянный склероз, аутоиммунный диабет, волчанка, атопический дерматит, аллергия, астма, аллергический ринит,воспалительная болезнь кишечника и для улучшения приживления трансплантата) (см., например, Dangond et al., 1998, Biochem. Biophys. Res. Commun., Vol. 242, No. 3, pp. 648-652; Takahashi et al., 1996, J.Antibiot. (Tokyo), Vol. 49, No. 5, pp. 453-457). Дозирование. Введение можно осуществлять в виде одной дозы, непрерывно или с промежутками (например,частями дозы с соответствующими интервалами) в течение всего курса лечения. Способы определения наиболее эффективного способа и дозы введения хорошо известны специалистам в данной области и зависят от конкретного состава, применяемого для терапии, цели терапии, клетки(клеток) мишеней, на которые направлено лечение, и субъекта, подвергающегося лечению. Однократное или многократное введение может быть осуществлено с применением уровня дозы и схемы, выбранной лечащим врачом,врачом-консультантом или ветеринаром. В одном из вариантов реализации объект получает ингибитор HDAC внутривенно или подкожно в количествах, достаточных для доставки около 3-1500 мг/м 2 в день, например около 3, 30, 60, 90, 180, 300,600, 900, 1000, 1200 или 1500 мг/м 2 в день. Такие количества можно вводить с помощью ряда подходящих способов, например большие объемы ингибитора HDAC в низкой концентрации в течение одного продолжительного периода времени или несколько раз в день. Необходимое количество можно вводить в течение одного или более последовательных дней, через день, с перерывами или с применением комбинации перечисленного в течение недели (7-дневный срок). Кроме того, можно ввводить небольшие объемы ингибитора HDAC в высокой концентрации в течение короткого периода времени, например один раз в день в течение одного или более дней либо последовательно, через день, с перерывами или с применением комбинации перечисленного в течение недели (7-дневный срок). Например, можно вводить дозу 300 мг/м 2 в день в течение 5 последовательных дней, в общей сложности 1500 мг/м 2 за период лечения. При другом режиме дозирования число последовательных дней может также составлять 5, при этом лечение продолжают в течение 2 или 3 последовательных недель до достижения общего количества 3000 мг/м 2 и 4500 мг/м 2 за период лечения. Как правило, можно приготовить состав для внутривенного введения, содержащий ингибиторHDAC в концентрации от примерно 1,0 до примерно 10 мг/мл, например 1,0, 2,0, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0,9,0 и 10 мг/мл, и вводить в количестве, необходимом для достижения описанных выше доз. В одном примере субъекту можно ввести достаточный объем препарата для внутривенного введения в день, таким образом, чтобы общая дневная доза составила от примерно 300 до примерно 1200 мг/м 2. В конкретном варианте реализации каждые 24 ч внутривенно вводят 900 мг/м 2 PXD-101 в течение по меньшей мере пяти последовательных дней. В другом конкретном варианте реализации каждые 24 ч внутривенно вводят 100 мг/м 2 PXD-101 в течение по меньшей мере пяти последовательных дней. В другом варианте реализации дозы ингибитора HDAC для перорального введения при применении его для лечения желаемого патологического состояния может изменяться от примерно 2 до примерно 2000 мг в день, например от примерно 20 до примерно 2000 мг в день, например от примерно 200 до примерно 2000 мг в день. Например, доза для перорального введения может составлять примерно 2,примерно 20, примерно 200, примерно 400, примерно 800, примерно 1200, примерно 1600 или примерно 2000 мг в день. Очевидно, что общее ежедневное количество можно вводить в виде одной дозы или можно вводить в виде множественных доз, например два, три или четыре раза в день. Например, субъект может получить от примерно 2 до примерно 2000 мг/день, например от примерно 20 до примерно 2000 мг/день, например от примерно 200 до примерно 2000 мг/день, например от примерно 400 до примерно 1200 мг/день. Таким образом, лекарственный препарат, приготовленный соответствующим образом и предназначенный для введения один раз в день, может содержать от примерно 2 до примерно 2000 мг, например от примерно 20 до примерно 2000 мг, например от примерно 200 до примерно 1200 мг, например от примерно 400 до примерно 1200 мг/день. Ингибиторы HDAC можно вводить в виде одной дозы или частями общей дозы два, три или четыре раза в день. Для введения два раза в день соответствующим образом приготовленный лекарственный препарат должен, следовательно,содержать половину необходимой ежедневной дозы. Наборы. Один из аспектов настоящего изобретения относится к набору (или набору компонентов), включающему: (а) фармацевтическую композицию (например, предварительный состав, состав), описанную в данной заявке, предпочтительно предоставленную в подходящем контейнере и/или с подходящей упаковкой, и(б) инструкции по применению, например письменную инструкцию по введению препарата и т.п. Один из аспектов настоящего изобретения относится к набору (или набору компонентов), включающему: (а) фармацевтическую композицию (например, предварительный состав), как описанную в данной заявке, предпочтительно предоставленную в подходящем контейнере и/или с подходящей упаковкой, и (б) инструкции по применению, например письменные инструкции по приготовлению соответ- 23018982 ствующего фармацевтического состава из композиции (например, предварительного состава и последующему введению препарата и т.п.). Набор может включать дополнительные компоненты, включающие, например, соответствующие растворы для разбавления (например, физиологический солевой раствор, раствор глюкозы и т.п.), реагенты (например, для изменения рН) и устройства (например, мешки, пробирки, шприцы, иглы, устройства для переноса) для сборки и применения (например, при приготовлении составов и последующем введении). Письменные инструкции могут также включать перечень показаний, при которых состав (например, содержащий ингибитор HDAC) является подходящим лечением. Исследования препаратов. Эти исследования демонстрируют значительное увеличение растворимости ингибитора HDAC (порядка 500-кратного увеличения для PXD-101) при применении одного или более из: циклодекстрина,аргинина и меглумина. Образующиеся композиции стабильны и могут быть разбавлены до необходимой заданной концентрации без риска преципитации. Кроме того, композиции имеют рН, который хотя и выше идеального, является приемлемым для применения. Поглощение УФ. Значения коэффициента поглощения света ультрафиолетовой области (УФ) Е 11 для PXD-101 определяли путем построения калибровочной кривой зависимости от концентрации PXD-101 в 50:50 метанол/вода при max для вещества 269 нм. Определенное данным методом значение Е 11 составило 715,7. В исследованиях растворимости смесь метанол/вода, а не чистый метанол (или другой органический растворитель), была выбрана в качестве среды для последовательных разбавлений для того, чтобы уменьшить риск преципитации циклодекстрина. Растворимость в деминерализованной воде. Установили, что растворимость PXD-101 для деминерализованной воды составила 0,14 мг/мл. Улучшение растворимости при помощи циклодекстринов. Получали насыщенные образцы PXD-101 в водных растворах двух природных циклодекстринов (CD и -CD) и гидроксипропиловых производных ,ициклодекстринов (НРCD, HPCD и HP-CD). Все эксперименты завершали при концентрации циклодекстрина 250 мг/мл, за исключением циклодекстрина D, растворимость которого была недостаточной для достижения этой концентрации. Данные суммированы в следующей таблице. HPCD обеспечивает наилучшее увеличение растворимости PXD-101. Определение фазовой растворимости HPCD. Диаграмму фазовой растворимости для HPCD получили при концентрациях циклодекстрина от 50 до 500 мг/мл (5-50% мас./об). Была построена зависимость расчетных значений растворимости ингибитора HDAC в комплексе от концентрации циклодекстрина. См. фиг. 1. Как показывает график, существует приблизительно линейная зависимость между концентрациями циклодекстрина и ингибитора HDAC при молярном отношении примерно 4:1. Такой тип диаграммы фазовой растворимости для циклодекстринов называют графиком фазовой растворимости типа А. На графике видно незначительное положительное отклонение отношения ингибитора HDAC к циклодекстрину. Это отклонение может быть следствием экспериментальной ошибки, связанной с решением использовать массу вместо объема для дозирования более концентрированных образцов циклодекстрина вследствие их вязкости. Кроме того, возможно, что существует незначительное отклонение от линейного характера фазовой растворимости типа А. Для получения изотонических растворов для составов для инъекций обычно применяют концентрацию HPCD от 250 до 300 мг/мл, поэтому для дальнейших исследований выбрали концентрацию циклодекстрина 250 мг/мл или 25% мас./об. рН профиль растворимости. Получали рН профиль растворимости для 25% мас./об. HPCD с применением ряда буферных систем, как определено в Buffers for pH and Metal Ion Control, D. PerrinB. Dempsey, ChapmanHall,New York, 1983. Поскольку циклодекстрин может образовывать комплекс с буферными агентами, было важно выбрать адекватную буферную систему: для рН 4 выбрали смесь янтарная кислота/NaOH буфер; для дипазона рН 6-8 выбрали фосфатный буфер; и для диапазона рН 8-9 выбрали глицин/NaOH буфер. Было отмечено, что цвиттер-ионы могут сами по себе обладать свойством буферизации и этот эффект вызывал некоторую нестабильность в емкости буферных систем при высоком значении рН. В следствие этого, требуемое рН можно было достичь только корректировкой рН системы путем добавления 1 М NaOH. Данные суммированы в следующей таблице. рН профиль растворимости показан на фиг. 2. рН корректировали добавлением 1 М NaOH до получения фактического рН У всех образцов, полученных при рН выше 6, наблюдали желтую окраску, которая становилась интенсивнее по мере увеличения рН. С учетом того, что концентрация образцов при рН от 6 до 8 значительно не меняется, решили, что изменение цвета связано с рН. Этот вывод подтверждается уменьшением интенсивности окраски образцов при корректировке рН. Улучшение растворимости при помощи in situ солеобразователей. Первоначальные эксперименты с кислыми и основными in situ солеобразователями были основаны на предположении, что солеобразователь и ингибитор HDAC образуют соль в соотношении один к одному. Из расчета предпочтительной концентрации ингибитора HDAC (PXD-101) 50 мг/мл (соответствующей 0,157 М) были получены растворы солеобразователя с концентрацией 0,16 М. Кислые in situ солеобразователи. Кислые in situ солеобразователи оказались неэффективными в плане улучшения растворимостиPXD-101. Данные суммированы в следующей таблице. Уменьшение расчетной растворимости для аскорбиновой кислоты предполагает химическое взаимодействие или эффект высаливания. Концентрация соли эквивалентна 0,16 М. Молярное отношение S/D - отношение солеобразователь-ингибитор HDAC. Основные солеобразователи in situ. Все основные солеобразователи in situ продемонстрировали значительное увеличение растворимости PXD-101. Данные суммированы в следующей таблице. 2 Концентрация соли эквивалентна 0,16 М Было отмечено, что большинство полученных образцов имели интенсивную желтую окраску. Исключение составили триэтаноламин и трис, хотя это, вероятно, было обусловлено тем, что концентрация ингибитора HDAC в растворе была сравнительно низкой. Четыре основные соли, которые давали наибольшее усиление растворимости: этилендиамин, меглумин, L-аргинин и L-лизин. Насыщенные растворы иHDAC далее тестировали в серии экспериментов с разбавлениями (с 5% мас./об. раствором глюкозы и 0,9% мас./об. солевым раствором) для определения того, можно ли разбавить растворы до необходимой концентрации ингибитора HDAC для инфузии, равной 3,5 мг/мл. Эти эксперименты позволили сделать предположение о несовместимости между этилендиамином и 5% мас./об. раствором глюкозы. Тем не менее, другие соли могут быть разбавлены без признаков преципитации. Диаграммы фазовой растворимости для аргинина и меглумина. Диаграммы фазовой растворимости как для аргинина, так и меглумина были получены с использованием трех дополнительных концентраций этих солеобразователей (0,5, 2 и 3 0,16 М концентрации,использованные в предыдущем исследовании), как показано в следующей таблице. Данные суммированы в следующей таблице. Диаграммы фазовой растворимости показаны на фиг. 3. На графике видна линейная зависимость между растворимостью ингибитора HDAC и концентрацией солеобразователя как для аргинина, так и меглумина. На основании данной линейной зависимости можно предсказать, что и аргинин, и меглумин можно применять для получения концентраций ингибитора HDAC, превышающих 100 мг/мл. Минимальные предполагаемые концентрации основного in situ солеобразователя, необходимые для достижения расчетной концентрации ингибитора HDAC (PXD-101), суммированы в следующей таблице. Таким образом, видно, что требуется примерно 1,8 частей аргинина для растворения 1 части ингибитора HDAC (PXD-101) и примерно 1,6 частей меглумина для растворения 1 части ингибитора HDAC(PXD-101). рН насыщенных растворов ингибитора HDAC незначительно возрастает с повышением концентрации солеобразователя, при этом пробы с аргинином (рКа = 9,0 (аминогруппа имеют немного более низкий рН, чем пробы с меглумином (рКа = 9,5) при таком же молярном соотношении. Это различие, как предполагается, основано на рКа двух солей. Данные суммированы в следующей таблице. Эксперименты по разбавлению. Насыщенные растворы ингибитора HDAC с 0,47 М аргинина и 0,47 М меглумина разбавляли 5% мас./об. раствором глюкозы и 0,9% мас./об. солевым раствором с получением расчетной концентрации 3,5 мг/мл ингибитора HDAC для инфузии. Эти образцы успешно разбавляли, они были физически стабильны в течение более 24 ч. Конечное значение рН разбавленных проб суммировано в следующей таблице. Насыщенные пробы также разбавляли фосфатным буфером с рН 7,4, но менее успешно. Разбавление проб с 0,47 М и 0,314 М меглумина фосфатным буфером с рН 7,4 мгновенно приводило к помутнению растворов. При разбавлении проб с 0,47 М и 0,314 М аргинина фосфатным буфером с рН 7,4 сначала получали прозрачные растворы, но после хранения разбавленных растворов в течение ночи при комнатной температуре отмечали некоторую кристаллизацию. Это означает, что разбавленные пробы с аргинином были супернасыщенными и их можно считать физически нестабильными. Измерение рН разбавленных буфером проб показало, что рН изменился до рН 8,5-8,7, что является слишком низким уровнем рН для поддержания PXD-101 в растворе при необходимой концентрации, равной или больше 50 мг/мл. Улучшение растворимости: циклодекстрины и in situ солеобразователи. Получали пробы, содержащие 25% мас./об. HPCD и 0,157 М или 0,314 М аргинина или меглумина и изучали растворимость ингибитора HDAC (PXD-101) в этих пробах. Комбинация циклодекстрина и солеобразователя (аргинина или меглумина) неожиданно оказалась в значительной степени синергической и обеспечивала заметное увеличение растворимости ингибитора HDAC. Данные суммированы в следующей таблице. Диаграмма фазовой растворимости показана на фиг. 4. Также с помощью графика зависимости концентрации иHDAC от рН систем солеобразователь/циклодекстрин и систем буферный рН/циклодекстрин (описанных выше) было показано, что увеличение растворимости, наблюдаемое для солеобразователей, было больше, чем то, которое обеспечивалось бы исключительно эффектом рН. Данные суммированы в следующуей таблице. Профиль рН представлен на фиг. 5. Это наблюдение является дополнительным подтверждением того, что аргинин и меглумин действуют как in situ солеобразователи. С применением системы in situ солеобразователь/циклодекстрин можно достичь более высоких концентраций ингибитора HDAC с добавлением меньшего количества солеобразователя. Следовательно,такая система обеспечивает образование концентрата ингибитора HDAC с более низким значением рН по сравнению с системой, в которой применяют только солеобразователь. Данные суммированы в следующей таблице. Разбавление растворов ингибитора HDAC с получением расчетной концентрации ингибитораHDAC для инфузии, равной 3,5 мг/мл, оказалось успешным как с применением 0,9% мас./об. солевого раствора, так и 5% мас./об. глюкозы. Во многих случаях более низкое значение рН в исходной системе приводило к более низким значениям рН в разбавленном растворе, что дает лучшую переносимость инфузии объектом. Данные суммированы в следующей таблице. Дальнейшая корректировка рН. Значение рН систем, содержащих аргинин или меглумин, составляет примерно 9. Однако возможно, что ингибитор HDAC (например, PXD-101) является химически нестабильным при рН выше 8,5. По этой причине были предприняты попытки уменьшения рН насыщенных систем с применением 2 Н HCl с целью улучшения химической стабильности ингибитора HDAC. В аликвоту насыщенной пробы объемом 1 мл добавляли 20 мкл 2 Н HCl. Полученную пробу оставляли на ночь для стабилизации и регистрировали новое значение рН системы. Затем к пробам быстро добавляли аликвоты 2 Н HCl объемом 20 мкл, пока не отмечали преципитацию, регистрировали значение рН на кажом этапе добавления. Данные суммированы в следующей таблице. При добавлении HCl было отмечено уменьшение интенсивной желтой окраски проб. Это наблюдение соответствует сделанному ранее выводу, что окраска PXD-101 зависит от рН и не является явным признаком распада. Как показывают результаты, система основной солеобразователь/циклодекстрин является более стабильной, чем система, содержащая только основной солеобразователь. Исследование пробы с 0,47 М меглумина показало, что твердое вещество образовывалось только на границе раздела между введенным объемом HCl и насыщенным раствором ингибитора HDAC - это твердое вещество не растворялось при взбалтывании и в дальнейшем не наблюдалось преципитации/помутнения. Более успешная корректировка рН, вероятно, возможна с применением более слабой или более разбавленной кислоты. Результаты также показали, что система аргинин/циклодекстрин является физически более стабильной, чем система меглумин/циклодекстрин; однако, следует отметить, что исходная концентрация системы с меглумином на 5 мг/мл выше. Примеры Следующие примеры представлены для иллюстрации настоящего изобретения и не ограничивают объем изобретения, описанного в данной заявке. Пример 1. Приготовление раствора PXD-101 в L-аргинине. В сосуд, содержащий примерно 70 мл фармакопейной воды для инъекций, добавляли 10 г Lаргинина. Смесь перемешивали при помощи магнитной мешалки до растворения аргинина. Добавляли 5 г PXD-101 и смесь перемешивали при 25 С до растворения PXD-101. Раствор разбавляли до конечного объема 100 мл с помощью фармакопейной воды для инъекций. Итоговый раствор имел рН 9,2-9,4 и осмоляльность приблизительно 430 мосмоль/кг. Стерилизация и наполнение. Раствор фильтровали через подходящую 0,2 мкм мембрану для стерилизации (например, из ПВДФ). Отфильтрованный раствор помещали во флаконы или ампулы, которые запечатывали нагреванием или подходящей пробкой и колпачком. Хранение растворов. Растворы хранили при комнатной температуре или более предпочтительно при охлаждении (например, 2-8 С) для уменьшения распада ингибитора HDAC. Пример 2. Внутривенное введение PXD-101. Предшествующий уровень техники.PXD-101 представляет собой низкомолекулярный ингибитор деацетилаз гистоновдеацетилазы гистонов (HDAC) с сульфаниламидгидроксамидной структурой. Ингибиторы HDAC модулируют транскрипционную активность генов, важных для опухолевого роста и выживания. PXD-101 имеет сильную антипролиферативную активность по отношению к клеточным линиям различных типов рака in vitro и демонстрирует антинеопластическую активность на моделях опухолей у животных. PXD-101 уменьшает объем опухоли ксенотрансплантатов человека. Кроме того, PXD-101 обладает синергической и кумулятивной противоопухолевой активностью in vitro и in vivo в комбинации с многими известными противораковыми лекарствами.
МПК / Метки
МПК: A61K 47/26, A61K 47/40, A61K 47/18, A61K 31/18, A61P 35/00
Метки: гистонов, содержащие, деацетилазы, ингибиторы, составы, фармацевтические
Код ссылки
<a href="https://eas.patents.su/30-18982-farmacevticheskie-sostavy-soderzhashhie-ingibitory-deacetilazy-gistonov.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические составы, содержащие ингибиторы деацетилазы гистонов</a>
Предыдущий патент: Оптически активные производные 3-[(фенилпиперазин-1-ил)алкил]-3-алкилоксиндола, обладающие активностью в отношении центральной нервной системы (цнс)
Следующий патент: Способ усиления миграции гемопоэтических стволовых клеток, способ получения популяции указанных клеток и способы лечения с их использованием
Случайный патент: Система элементов для монтажа интерьерной перегородки