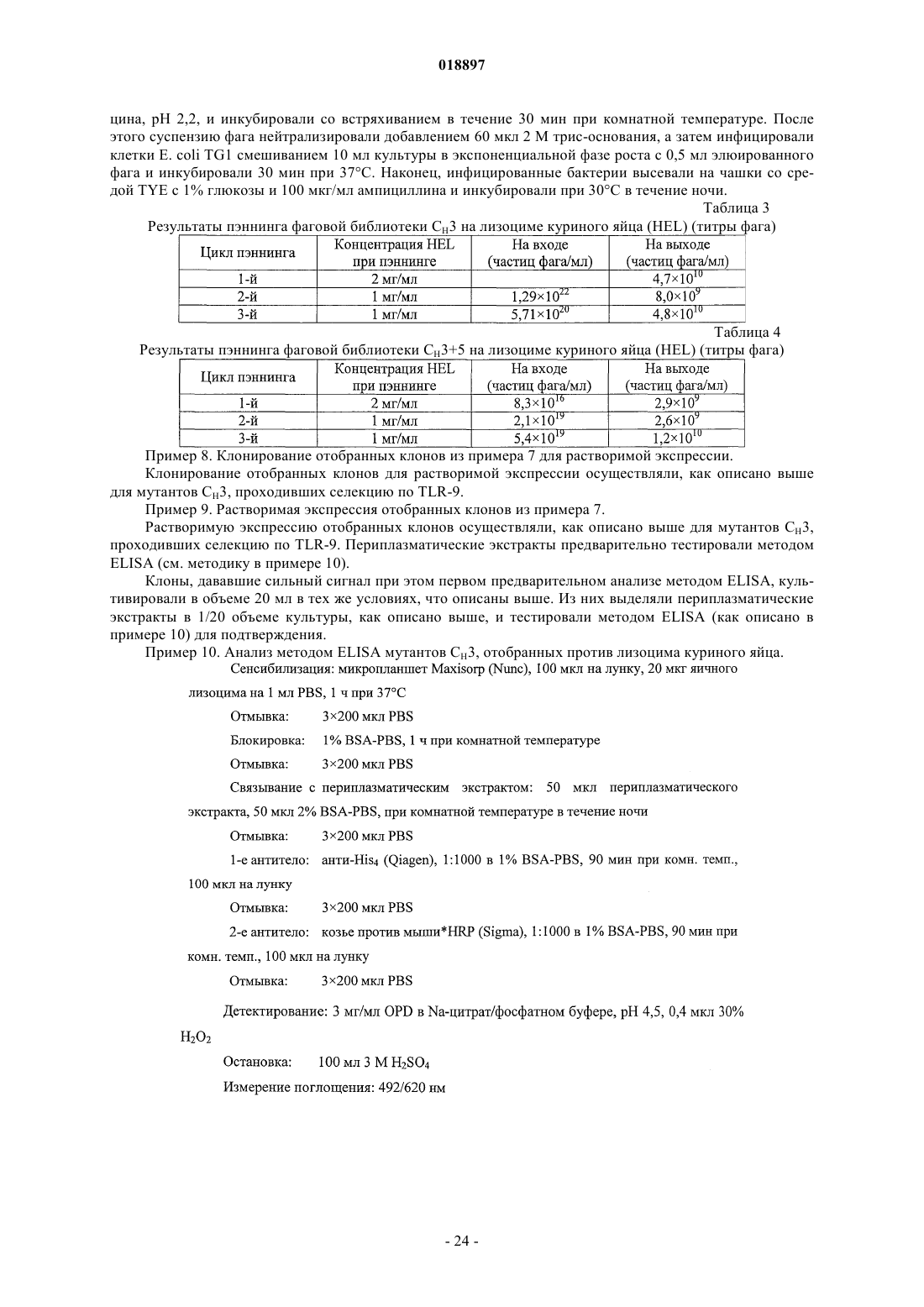
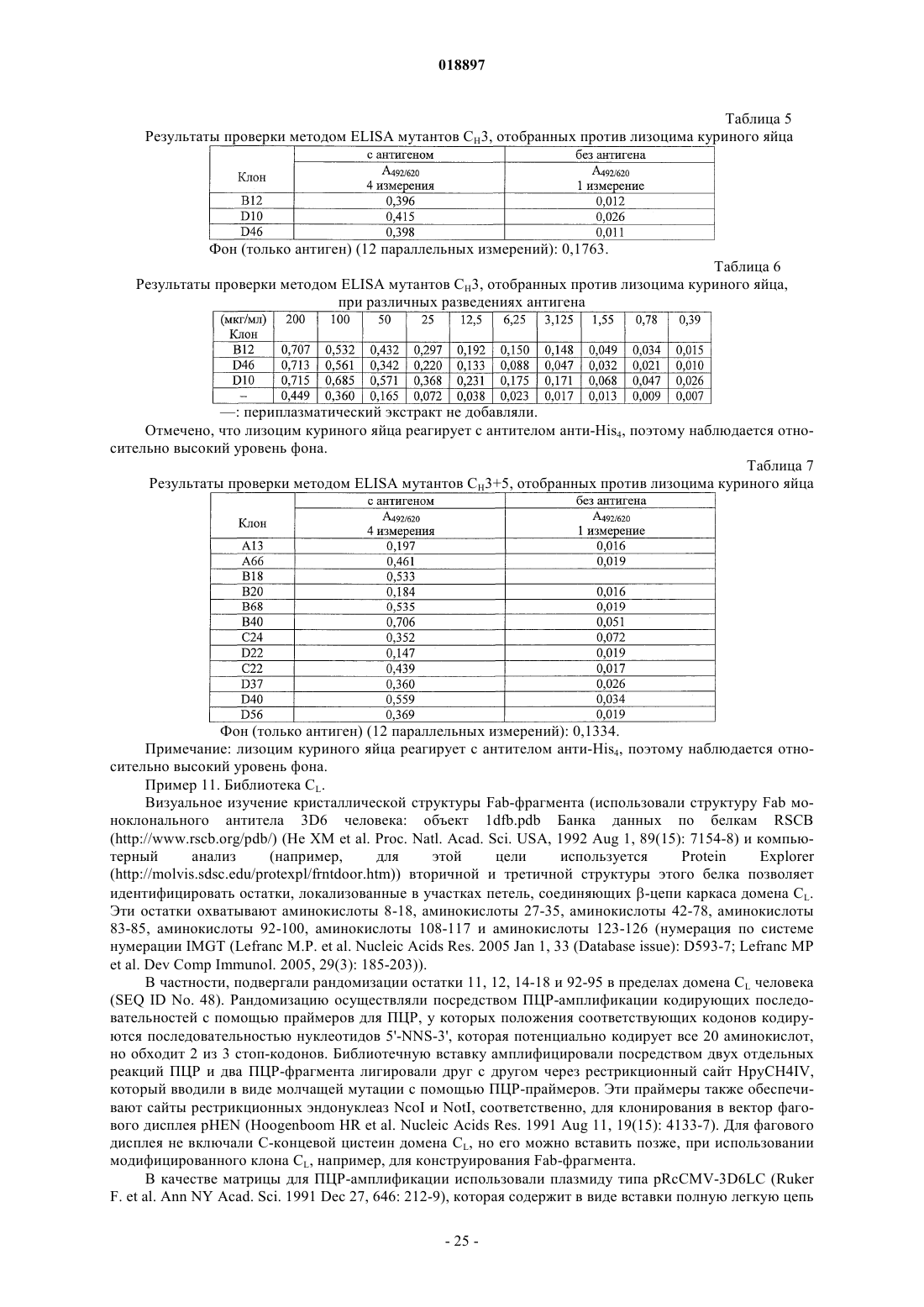
Молекулы иммуноглобулина, содержащие модифицированные участки структурных петель, обладающие свойством связывания, и способ их получения
Номер патента: 18897
Опубликовано: 29.11.2013
Авторы: Возняк-Кнопп Гордана, Химмлер Готфрид, Рюкер Флориан
Формула / Реферат
1. Способ конструирования иммуноглобулина, содержащего по меньшей мере один модифицированный участок структурной петли для обеспечения отличного от CDR (гипервариабельный участок) сайта связывания и определения связывания указанного иммуноглобулина с эпитопом антигенной молекулы, причем немодифицированный участок структурной петли не связывается существенно с указанным эпитопом, причем способ включает стадии:
(a) получения нуклеиновой кислоты, кодирующей иммуноглобулин, содержащий по меньшей мере один участок структурной петли;
(b) модификации по меньшей мере одного нуклеотидного остатка указанной нуклеиновой кислоты, кодирующей участок структурной петли, путем мутагенеза, причем указанная модификация осуществляется методом мутагенеза, выбранным из группы, состоящей из случайной, полуслучайной или сайт-специфической рандомизации, сканирующего мутагенеза или комбинаторных подходов, причем указанная модификация соответственно обеспечивает:
i) получение иммуноглобулина, содержащего любой из участков структурных петель CH1, CH2, CH3 и CH4, где по меньшей мере в одном из положений аминокислот в аминокислотной последовательности, выбранной из группы, состоящей из аминокислот 7-21, аминокислот 25-39, аминокислот 41-81, аминокислот 83-85, аминокислот 89-103 и аминокислот 106-117, произошла модификация; или
ii) получение иммуноглобулина, содержащего любой из участков структурных петель легкой цепи Ig-каппа или Ig-лямбда, где по меньшей мере в одном из положений аминокислот в аминокислотной последовательности, выбранной из группы, состоящей из аминокислот 8-18, аминокислот 27-35, аминокислот 42-78, аминокислот 83-85, аминокислот 92-100, аминокислот 108-117 и аминокислот 123-126, произошла модификация; или
iii) получение иммуноглобулина, содержащего любой из участков структурных петель вариабельного домена, где по меньшей мере в одном из положений аминокислот в аминокислотной последовательности, выбранной из группы, состоящей из аминокислот 8-20, аминокислот 44-50, аминокислот 67-76, аминокислот 89-101, произошла модификация; где нумерация приведена в соответствии с IMGT;
(c) переноса указанной модифицированной нуклеиновой кислоты в экспрессионную систему;
(d) экспрессии указанного модифицированного иммуноглобулина;
(e) контактирования экспрессированного модифицированного иммуноглобулина с эпитопом и
(f) определения того, связывается ли указанный модифицированный иммуноглобулин с указанным эпитопом.
2. Способ по п.1, в котором указанная модификация обеспечивает модификацию более чем одной структурной петли для обеспечения сайта, связывающегося с указанным эпитопом.
3. Способ по п.1 или 2, в котором указанная модификация исключает встраивание биологически активного пептида длиной от 2 до 40 аминокислот в Fc-домен.
4. Способ по любому из пп.1-3, в котором указанная антигенная молекула представляет собой молекулу, выбранную из группы, состоящей из аллергенов, раковых антигенов, аутоантигенов, ферментов, бактериальных антигенов, грибковых антигенов, вирусных антигенов и протозойных антигенов.
5. Способ по любому из пп.1-4, характеризующийся тем, что указанный иммуноглобулин специфически связывается по меньшей мере с двумя различными эпитопами.
6. Способ по любому из пп.1-5, характеризующийся тем, что указанный иммуноглобулин является мультиспецифическим, специфически связывающимся по меньшей мере с одной первой антигенной молекулой и по меньшей мере с одной второй антигенной молекулой посредством по меньшей мере одной модификации по меньшей мере в одном участке структурной петли указанного иммуноглобулина, причем вторая молекула выбрана из группы, состоящей из аллергенов, раковых антигенов, аутоантигенов, ферментов, бактериальных антигенов, грибковых антигенов, вирусных антигенов и протозойных антигенов.
7. Способ по любому из пп.1-6, характеризующийся тем, что указанная антигенная молекула выбрана из группы, состоящей из раковых антигенов, в частности ЕрСАМ, ракового гликопротеина-72 (TAG-72), ракового антигена СА 125, простата-специфического мембранного антигена (PSMA), высокомолекулярного антигена, связанного с меланомой (HMW-MAA), ракового антигена, экспедирующего Y-сцепленный углевод Льюиса, раково-эмбрионального антигена (СЕА), СЕАСАМ5, HMFG РЕМ, MUC1 муцина, MUC18 и ракового антигена цитокератина, бактериальных антигенов, вирусных антигенов, аллергенов, флуоресцеина, лизоцима, toll-подобного рецептора 9, эритропоэтина, CD2, CD3, CD3E, CD4, CD11, CD11a, CD14, CD18, CD19, CD20, CD22, CD23, CD25, CD28, CD29, CD30, CD33 (белка р67), CD38, CD40, CD40L, CD52, CD54, CD56, CD80, CD147, GD3, IL-1, IL-1R, IL-2, IL-2R, IL-4, IL-5, IL-6, IL-6R, IL-8, IL-12, IL-15, IL-18, IL-23, α-интерферона, β-интерферона, γ-интерферона, TNF-α, TNF-β2, TNF-αβ, TNF-R1, TNF-RII, FasL, CD27L, CD30L, 4-1BBL, TRAIL, RANKL, TWEAK, APRIL, BAFF, LIGHT, VEG1, OX40L, рецептора-1 TRAIL, А1-рецептора аденозина, рецептора β-лимфотоксина, TACI, BAFF-R, EPO, LFA-3, ICAM-1, ICAM-3, β1-интегрина, β2-интегрина, α4/β7-интегрина, α2-интегрина, α3-интегрина, α4-интегрина, α5-интегрина, α6-интегрина, αV-интегрина, αV/β3-интегрина, FGFR-3, фактора роста кератиноцитов, VLA-1, VLA-4, L-селектина, анти-Id, Е-селектина, HLA, HLA-DR, CTLA-4, Т-клеточных рецепторов, В7-1, В7-2, VNR-интегрина, TGF-β1, TGF-β2, эотаксина-1, BLyS (стимулятора В-лимфоцитов), комплемента С5, IgE, фактора VII, CD64, CBL, NCA 90, EGFR (ErbB-1), Her2/neu (ErbB-2), Her3 (ErbB-3), Her4 (ErbB-4), тканевого фактора, VEGF, VEGF-R, рецептора эндотелина, VLA-4, таких углеводов, как антигены групп крови и родственные углеводы, Galili-гликозилирования, гастрина, рецепторов гастрина, раковых углеводов, гаптена NP-cap или NIP-cap, Т-клеточного рецептора α/β, Е-селектина, дигоксина, плацентарной щелочной фосфатазы (PLAP) и PLAP-подобной щелочной фосфатазы яичек, рецептора трансферрина, гепараназы I, сердечного миозина человека, гликопротеида IIb/IIIa (GPIIb/IIIa), гликопротеида gH оболочки цитомегаловируса человека (HCMV), gp120 ВИЧ, HCMV, гликопротеида F респираторного синцитиального вируса (RSV), Fgp RSVF, VNR-интегрина, gp120 вируса Hep В, CMV, gpIIbIIIa, петли V3 gp120 ВИЧ IIIB, Fgp респираторного синцитиального вируса (RSV), гликопротеида gD вируса Herpes simplex (HSV), гликопротеида gB HSV, гликопротеида gB оболочки HCMV, токсина Clostridium perfringens и их фрагментов.
8. Способ по п.7, в котором указанный модифицированный иммуноглобулин обладает специфичностью связывания с неонатальным Fc-рецептором (FcRn).
9. Способ по п.7, в котором указанный модифицированный иммуноглобулин обладает специфичностью связывания с эффекторной молекулой.
10. Способ по любому из пп.1-9, характеризующийся тем, что иммуноглобулин включает тяжелую и/или легкую цепь иммуноглобулина или ее часть.
11. Способ по любому из пп.1-10, характеризующийся тем, что иммуноглобулин включает по меньшей мере один константный домен и/или по меньшей мере один вариабельный домен иммуноглобулина.
12. Способ по любому из пп.1-11, характеризующийся тем, что иммуноглобулин содержит по меньшей мере один одиночный домен или его часть, включая мини-домен, состоящий из двух бета-цепей домена иммуноглобулина, соединенных структурной петлей, одиночный вариабельный домен иммуноглобулина или одноцепочечный Fv.
13. Способ по любому из пп.1-12, характеризующийся тем, что иммуноглобулин выбран из группы, состоящей из Fab-фрагмента, Fc-фрагмента, одиночного домена иммуноглобулина, одноцепочечного димера CH3 (scCH3), scCH2, scCH1/CL и полноразмерного иммуноглобулина.
14. Способ по любому из пп.1-13, характеризующийся тем, что иммуноглобулин содержит константный домен, выбранный из группы CH1, CH2, CH3, CH4, CL и их комбинаций, включая Fab-фрагмент, Fc-фрагмент или полноразмерный иммуноглобулин.
15. Способ по любому из пп.1-14, характеризующийся тем, что иммуноглобулин содержит легкую цепь Ig-каппа или Ig-лямбда.
16. Способ по любому из пп.1-15, характеризующийся тем, что иммуноглобулин является человеческим, гуманизированным, химерным, мышиным или верблюжьим иммуноглобулином или его гомологом.
17. Способ по любому из пп.15, 16, характеризующийся тем, что иммуноглобулин выбран из группы, состоящей из IgA, IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG2A, IgG2B, IgG2C, IgG3, IgG4 и IgM.
18. Способ по любому из пп.1-17, характеризующийся тем, что указанная модификация приводит к замене, и/или делеции, и/или вставке нуклеотида.
19. Способ по любому из пп.1-18, характеризующийся тем, что указанная модифицированная нуклеотидная последовательность содержит по меньшей мере одно повторяющееся нуклеотидное звено с последовательностью 5'-NNS-3', 5'-NNN-3' или 5'-NNK-3'.
20. Способ по любому из пп.1-19, характеризующийся тем, что модифицированный иммуноглобулин экспрессируют в хозяине, выбранном из группы, состоящей из бактериального хозяина, дрожжевой клетки, растительной клетки, животной клетки, растения и животного.
21. Способ по любому из пп.1-20, характеризующийся тем, что специфическое связывание модифицированного иммуноглобулина с эпитопом антигенной молекулы определяют методом определения связывания, выбранным из группы, состоящей из иммунологических методов, предпочтительно методов ферментного иммуносорбентного анализа (ELISA), поверхностного плазмонного резонанса, разностной спектроскопии ядерного магнитного резонанса с насыщающим переносом, спектроскопии ядерного магнитного резонанса с переносом NOE (trNOE), конкурентными методами, методами тканевого связывания, методами связывания с живыми клетками и методами клеточных экстрактов.
22. Способ по любому из пп.1-21, характеризующийся тем, что модифицированный иммуноглобулин конъюгируют с меткой, выбранной из группы, состоящей из органических молекул, ферментных меток, радиоактивных меток, окрашенных меток, флуоресцентных меток, хромогенных меток, люминесцентных меток, гаптенов, дигоксигенина, биотина, комплексных соединений металлов, металлов, коллоидного золота и их смесей.
23. Способ изготовления фармацевтического препарата, содержащего иммуноглобулин, посредством конструирования модифицированного иммуноглобулина способом по любому из пп.1-22 и введения указанного модифицированного иммуноглобулина в фармацевтический препарат.
24. Способ получения библиотеки модифицированных иммуноглобулинов, модифицированных способом по любому из пп.1-22, включающий стадии
получения нуклеиновой кислоты, кодирующей иммуноглобулин, содержащий по меньшей мере один участок структурной петли;
модификации по меньшей мере одного нуклеотидного остатка в участке нуклеиновой кислоты, кодирующем по меньшей мере один из указанных участков структурных петель методом мутагенеза;
переноса указанной модифицированной нуклеиновой кислоты в экспрессионную систему;
экспрессии модифицированного иммуноглобулина с получением библиотеки модифицированных иммуноглобулинов и
определения в указанной библиотеке ряда иммуноглобулинов, которые связываются с указанным эпитопом.
25. Способ получения библиотеки нуклеиновых кислот, кодирующих иммуноглобулины, модифицированные способом по любому из пп.1-22, включающий стадии
получения нуклеиновой кислоты, кодирующей иммуноглобулин, содержащий по меньшей мере один участок структурной петли;
модифицикации по меньшей мере одного нуклеотидного остатка в участке нуклеиновой кислоты, кодирующем по меньшей мере один из указанных участков структурных петель с получением библиотеки нуклеиновых кислот, кодирующих модифицированные иммуноглобулины.
26. Способ по п.24 или 25, в котором указанная модификация обеспечивает модификацию более чем одной структурной петли для обеспечения нового сайта связывания для указанного эпитопа.
27. Способ по любому из пп.24-26, в котором указанная модификация приводит к мутациям по меньшей мере в 6 аминокислотных положениях по меньшей мере в одном участке структурной петли.
28. Библиотека, получаемая способом по любому из пп.24-27.
29. Библиотека по п.28, включающая по меньшей мере 10 модифицированных иммуноглобулинов, имеющих одинаковую или разную специфичность.
30. Библиотека по п.28 или 29, включающая по меньшей мере 10 различных модифицированных иммуноглобулинов, имеющих одинаковую специфичность и связывающихся с одним и тем же эпитопом.
31. Библиотека по любому из пп.28-30, в которой указанный иммуноглобулин содержит по меньшей мере один одиночный домен или его часть, включая мини-домен, состоящий из двух бета-цепей домена иммуноглобулина, соединенных структурной петлей, одиночный вариабельный домен или одноцепочечный Fv.
32. Библиотека по любому из пп.28-31, отличающаяся тем, что модифицированный участок структурной петли происходит из константного домена иммуноглобулина, выбранного из группы, состоящей из CH1, CH2, CH3, CH4, CL, где модификация затрагивает по меньшей мере одно положение аминокислот в аминокислотной последовательности, выбранных из группы, состоящей из аминокислот 7-21, аминокислот 25-39, аминокислот 41-81, аминокислот 83-85, аминокислот 89-103 и аминокислот 106-117, где нумерация приведена в соответствии с IMGT.
33. Библиотека по любому из пп.28-32, отличающаяся тем, что иммуноглобулин содержит константный домен иммуноглобулина, выбранный из группы, состоящей из CH1, CH2, CH3, CH4, CL и их комбинаций, включая Fab-фрагмент, Fc-фрагмент или полноразмерный иммуноглобулин.
34. Библиотека по любому из пп.28-33, отличающаяся тем, что модифицированный участок структурной петли происходит из легкой цепи Ig-каппа или Ig-лямбда, где модификация затрагивает по меньшей мере одно из положений аминокислот в аминокислотной последовательности, выбранных из группы, состоящей из аминокислот 8-18, аминокислот 27-35, аминокислот 42-78, аминокислот 83-85, аминокислот 92-100, аминокислот 108-117 и аминокислот 123-126.
35. Библиотека по любому из пп.28-34, в которой иммуноглобулин содержит вариабельный домен с модифицированным участком структурной петли, где модификация затрагивает по меньшей мере одно из положений аминокислот в аминокислотной последовательности, выбранных из группы, состоящей из аминокислот 8-20, аминокислот 44-50, аминокислот 67-76, аминокислот 89-101, где нумерация приведена в соответствии с IMGT.
36. Библиотека по любому из пп.28-35, которая представляет собой библиотеку иммуноглобулинов.
37. Библиотека по любому из пп.28-36, которая представлена на поверхности хозяина.
38. Библиотека по п.37, в которой указанный хозяин выбран из группы, состоящей из клеток млекопитающих, бактерий, насекомых или дрожжей.
39. Библиотека по любому из пп.28-38, которая представлена фагами, фагмидами или вирусами.
40. Библиотека по любому из пп.28-39, которая представляет собой библиотеку нуклеиновых кислот, кодирующих модифицированные иммуноглобулины.
41. Библиотека по любому из пп.28-40, которая представлена технологией дисплея in vitro.
42. Способ специфического связывания и/или детектирования антигенной молекулы, включающий стадии:
(a) контактирования библиотеки модифицированных иммуноглобулинов по любому из пп.28-41 с тестируемым образцом, содержащим указанную молекулу и
(b) детектирования образованного специфического комплекса "модифицированный иммуноглобулин/молекула".
43. Способ специфического выделения модифицированного иммуноглобулина, связывающегося с антигенной молекулой, включающий стадии:
(a) контактирования библиотеки модифицированных иммуноглобулинов по любому из пп.28-41 с образцом, содержащим указанную молекулу;
(b) отделения образовавшегося специфического комплекса "модифицированный иммуноглобулин/молекула" и
(c) выделения модифицированного иммуноглобулина из указанного комплекса.
44. Константный домен иммуноглобулина, полученного способом по любому из пп.1-22, или его часть, содержащий по меньшей мере один участок структурной петли любого из CH1 домена, CH2 домена, CH3 домена, CH4 домена или CL домена, причем указанный по меньшей мере один участок структурной петли содержит по меньшей мере одну модификацию, обеспечивающую связывание указанного по меньшей мере одного модифицированного участка петли с эпитопом антигена, где константный домен немодифицированного иммуноглобулина не связывается с указанным эпитопом, причем указанная модификация исключает из своего числа встраивание фармакологически активного пептида длиной от 2 до 40 аминокислот в Fc домен.
45. Модифицированный иммуноглобулин, содержащий константный домен иммуноглобулина или его часть по п.44, в котором указанный модифицированный участок петли находится в любом из доменов легкой цепи Ig-лямбда или Ig-каппа, Fab-фрагмента или Fc-фрагмента.
46. Модифицированный иммуноглобулин, содержащий константный домен иммуноглобулина или его часть по любому из пп.44, 45, который происходит из IgG.
47. Модифицированный иммуноглобулин, содержащий константный домен иммуноглобулина или его часть по любому из пп.44-46 по меньшей мере с двумя модифицированными участками структурных петель.
48. Иммуноглобулин, включающий по меньшей мере один модифицированный иммуноглобулин, содержащий константный домен иммуноглобулина или его часть по любому из пп.44-47, в котором указанный модифицированный участок структурной петли включает по меньшей мере 6 аминокислотных модификаций.
49. Нуклеиновая кислота, кодирующая иммуноглобулин, содержащий константный домен иммуноглобулина или его часть по любому из пп.44-48.
50. Вариабельный домен иммуноглобулина или его часть, который может быть получен способом по любому из пп.1-22, включающий по меньшей мере один участок структурной петли вариабельного домена тяжелой или легкой цепи иммуноглобулина, причем указанный по меньшей мере один участок структурной петли включает по меньшей мере одну модификацию для обеспечения отличного от CDR сайта связывания, связывающегося с эпитопом антигена, где немодифицированный участок структурной петли не связывается с указанным эпитопом, где указанная модификация является:
модификацией иммуноглобулина, содержащего любой из участков структурных петель CH1, CH2, CH3 и CH4, по меньшей мере в одном из положений аминокислот в аминокислотной последовательности, выбранных из группы, состоящей из аминокислот 7-21, аминокислот 25-39, аминокислот 41-81, аминокислот 83-85, аминокислот 89-103 и аминокислот 106-117, или
модификацией иммуноглобулина, содержащего любой из участков структурных петель Ig-каппа или Ig-лямбда, по меньшей мере в одном из положений аминокислот в аминокислотной последовательности, выбранных из группы, состоящей из аминокислот 8-18, аминокислот 27-35, аминокислот 42-78, аминокислот 83-85, аминокислот 92-100, аминокислот 108-117 и аминокислот 123-126, или модификацией иммуноглобулина, содержащего любой из участков структурных петель вариабельного домена, по меньшей мере в одном из положений аминокислот в аминокислотной последовательности, выбранных из группы, состоящей из аминокислот 8-20, аминокислот 44-50, аминокислот 67-76, аминокислот 89-101, где нумерация приведена в соответствии с IMGT.
51. Модифицированный иммуноглобулин, содержащий вариабельный домен иммуноглобулина или его часть по п.50, в котором указанный модифицированный участок петли находится в любом из VH, Vk, VL или Vd доменов.
52. Модифицированный иммуноглобулин, содержащий вариабельный домен иммуноглобулина или его часть по п.50 или 51, в котором указанный модифицированный участок петли находится в С-концевой области.
53. Модифицированный иммуноглобулин, содержащий вариабельный домен иммуноглобулина или его часть по любому из пп.50-52, в котором указанная модификация включает мутагенез нижней петли, выбранной из группы, состоящей из петель, соединяющих бета-цепи А-В, С-С', C"-D и E-F вариабельного домена.
54. Модифицированный иммуноглобулин, содержащий вариабельный домен иммуноглобулина или его часть по любому из пп.50-53, который включает бивалентный или биспецифичный домен.
55. Модифицированный иммуноглобулин, содержащий вариабельный домен иммуноглобулина или его часть по любому из пп.50-54, который включает одиночный домен иммуноглобулина или одноцепочечный Fv.
56. Модифицированный иммуноглобулин, содержащий вариабельный домен иммуноглобулина или его часть по любому из пп.50-55, по меньшей мере с двумя модифицированными участками структурных петель.
57. Иммуноглобулин, включающий по меньшей мере один модифицированный иммуноглобулин, содержащий вариабельный домен иммуноглобулина или его часть по любому из пп.50-56, в котором указанный модифицированный участок структурной петли включает по меньшей мере 6 аминокислотных модификаций.
58. Нуклеиновая кислота, кодирующая иммуноглобулин, содержащий вариабельный домен иммуноглобулина или его часть по любому из пп.50-57.
59. Иммуноглобулин, содержащий константный домен иммуноглобулина или его часть по любому из пп.44-48 и/или вариабельный домен иммуноглобулина или его часть по любому из пп.50-57, который обладает специфичностью связывания в отношении FcRn или эффекторной молекулы.
60. Фармацевтический препарат, содержащий иммуноглобулин, содержащий константный домен иммуноглобулина или его часть по любому из пп.44-48 и/или вариабельный домен иммуноглобулина или его часть по любому из пп.50-57.
Текст
МОЛЕКУЛЫ ИММУНОГЛОБУЛИНА, СОДЕРЖАЩИЕ МОДИФИЦИРОВАННЫЕ УЧАСТКИ СТРУКТУРНЫХ ПЕТЕЛЬ, ОБЛАДАЮЩИЕ СВОЙСТВОМ СВЯЗЫВАНИЯ,И СПОСОБ ИХ ПОЛУЧЕНИЯ Способ конструирования иммуноглобулина, содержащего по меньшей мере одну модификацию на участке структурной петли данного иммуноглобулина, и определения связывания данного иммуноглобулина с эпитопом антигена, причем немодифицированный иммуноглобулин практически не связывается с данным эпитопом, при этом способ включает стадии: обеспечения нуклеиновой кислоты, кодирующей иммуноглобулин, содержащий по меньшей мере один участок структурной петли; модификации по меньшей мере одного нуклеотидного остатка по меньшей мере одного из данных участков структурной петли; переноса данной модифицированной нуклеиновой кислоты в экспрессионную систему; экспрессии данного модифицированного иммуноглобулина; контактирования экспрессированного модифицированного иммуноглобулина с эпитопом и определения того, связывается ли данный модифицированный иммуноглобулин с данным эпитопом; а также сами модифицированные иммуноглобулины. Область техники, к которой относится изобретение Изобретение касается способа конструирования и получения модифицированных иммуноглобулинов. Основная область - конструирование белков с целью придания им определенных параметров связывания. В частности, подлежащими конструированию белками в настоящем изобретении являются иммуноглобулины (антитела), более конкретно - одиночные домены или пары либо комбинации одиночных доменов иммуноглобулинов. Параметры специфического связывания иммуноглобулинов являются важными характеристиками, так как они контролируют взаимодействие с другими молекулами типа антигенов и делают иммуноглобулины полезными для применения в диагностике и терапии. Уровень техники Основная структура антител будет раскрыта далее на примере интактного иммуноглобулина IgG1. Две идентичные тяжелые (Н) и две идентичные легкие (L) цепи объединяются с образованием Yобразной молекулы антитела. Каждая тяжелая цепь имеет четыре домена. N-концевые вариабельные домены находятся на верхних концах Y. За ними следуют три константных домена: CH1, CH2 и С-концевойCH3, находящийся в основании ножки Y. Короткий отрезок - перемычка соединяет вариабельные и константные области тяжелой цепи. Шарнирная область соединяет CH1 и CH2 с остальной частью антитела(фрагментами Fab). При протеолитическом расщеплении шарнирной области интактной молекулы антитела можно получить один фрагмент Fc и два идентичных фрагмента Fab. Легкие цепи состоят из двух доменов - вариабельного (VL) и константного (CL), разделенных перемычкой. Дисульфидные связи в шарнирной области соединяют две тяжелые цепи. Легкие цепи присоединяются к тяжелым цепям дополнительными дисульфидными связями. Связанные через Asn углеводные молекулы присоединяются по различным положениям в константных доменах в зависимости от класса иммуноглобулина. У IgG1 две дисульфидные связи в шарнирной области, между парами Cys235 иCys238, соединяют две тяжелые цепи. Легкие цепи присоединены к тяжелым цепям дополнительными дисульфидными связями, между Cys229s в доменах CH1 и Cys214s в доменах Cl. Молекулы углеводов присоединяются к Asn306 каждого CH2, образуя отчетливый выступ в ножке Y. Эти особенности имеют глубокие функциональные последствия. Вариабельные области тяжелых и легких цепей (VH и VL) находятся на верхушках Y, в такой позиции, где они реагируют с антигеном. Верхушка молекулы является тем местом, на котором располагается N-конец аминокислотной последовательности. Ножка Y выступает таким образом, что она эффективно опосредует эффекторные функции,такие как активация комплемента и взаимодействие с Fc-рецепторами или ADCC и ADCP. Е доменыCH2 и CH3 образуют выступ, способствуя взаимодействию с эффекторными белками. С-конец аминокислотной последовательности находится на противоположной от верхушки стороне, которую можно назвать "ножкой" Y. Структура интактного IgG1 представлена на фиг. 1 а. В антителах имеется два типа легких цепей, именуемых лямбдаи каппа . Конкретный иммуноглобулин имеет либо цепи , либо цепи , но никогда не имеет обеих. Функциональных различий между антителами, имеющими легкие цепиили , не обнаружено. Структурная организация мономеров основных классов иммуноглобулина человека представлена на фиг. 1b. Эти классы отличаются составом и последовательностью соответствующих тяжелых цепей. ВIgM и IgE отсутствует шарнирная область, но они содержат дополнительный домен тяжелой цепи (CH4). Количество и расположение дисульфидных связей (линии), соединяющих эти цепи, различается между изотипами. Они также отличаются распределением N-связанных углеводных групп, символически представленных кружочками. Каждый домен в молекуле антитела обладает сходным строением из двух -слоев, тесно упакованных друг относительно друга в виде сжатого антипараллельного -цилиндра. Такое консервативное строение именуется укладкой иммуноглобулина. Укладка иммуноглобулина в константных доменах содержит слой из 3 цепей, упакованный относительно слоя из 4 цепей. Укладка стабилизирована водородными связями между -цепями каждого слоя, гидрофобными связями между остатками противоположных слоев во внутренней части и дисульфидной связью между слоями. Слой из 3 цепей включает цепи С,F и G, а слой из 4 цепей включает цепи А, В, Е и D. Буквы от А до G обозначают последовательное положение -отрезков вдоль аминокислотной последовательности укладки иммуноглобулина. Укладка вариабельных доменов содержит 9 -цепей, составляющих два слоя из 4 и 5 цепей. Слой из 5 цепей структурно гомологичен слою из 3 цепей константного домена, но содержит дополнительные цепи С' и С". Остальные цепи (А, В, С, D, E, F, G) имеют такую же топологию и такое же строение, как и их аналоги в укладке иммуноглобулина константных доменов. Дисульфидная связь соединяет цепи В и F в противоположных слоях, как и у константных доменов. Укладка иммуноглобулина проиллюстрирована на фиг. 2 для константного и вариабельного домена иммуноглобулина. Вариабельные домены легких и тяжелых цепей иммуноглобулина содержат три гипервариабельные петли, или участки, определяющие комплементарность (CDR). Три CDR V-домена (CDR1, CDR2, CDR3) собраны на одном конце -цилиндра. Эти CDR представляют собой петли, соединяющие -отрезки В-С,С'-С" и F-G в укладке иммуноглобулина. Остатки в этих CDR варьируют от одной молекулы иммуноглобулина к другой, что придает антигенную специфичность каждому антителу. Домены VH и VL на концах молекул антител тесно упакованы таким образом, что 6 CDR (по 3 на каждом домене) совместно образуют поверхность (или полость) для специфического связывания антигена. Таким образом, естественный антигенсвязывающий сайт антитела состоит из петель, соединяющих отрезки В-С, С'-С" и F-G вариабельного домена легкой цепи и отрезки В-С, С'-С" и F-G вариабельного домена тяжелой цепи. Используя 3-мерную структуру белка как пособие при проектировании, аминокислотные остатки,расположенные на поверхности многих белков, подвергали рандомизации, используя коровую структуру белка в качестве каркаса. Примеры такой стратегии описаны или рассмотрены в следующих работах,включенных в настоящее изобретение путем ссылки: Nygren P.A., Uhlen M. Curr Opin Struct Biol. (1997),7: 463-9; Binz H.K., Amstutz P., Kohl A., Stumpp M.T., Briand C., Forrer P., Grutter M.G., Pluckthun A. NatBiotechnol. (2004) 22: 575-82; Vogt M., Skerra A. Chembiochem. (2004) 5: 191-9; US 6562617. Основополагающий принцип этого метода основан на том наблюдении, что многие белки имеют устойчивую основу, образованную специфическим расположением таких элементов вторичной структуры, как -структуры или -спирали, соединяющиеся между собой такими структурами, как петли, складки или беспорядочные клубки. Как правило, эти последние три структурных элемента менее важны для полной структуры белка, и аминокислотные остатки в этих структурных элементах зачастую могут быть заменены без разрушения общей укладки белка. Естественным примером для такого принципа проектирования являются участки CDR антител. Искусственные примеры включают липокалины, анкирины и другие белковые каркасы. Петли, не относящиеся к петлям CDR в нативном иммуноглобулине, не обладают специфичностью связывания антигена или эпитопа, но способствуют правильной укладке всей молекулы иммуноглобулина и/или его эффекторным или иным функциям, поэтому они именуются структурными петлями в целях настоящего изобретения. В патенте США 6294654 показано, что можно получить измененные антитела, в которых пептидный антиген может быть встроен в петлю антитела (Ab) вне CDR в участок CH1 между шарнирной и вариабельной областью, а полученное Ab может быть захвачено антигенпрезентирующей клеткой (АРС) с тем, что пептидный антиген будет презентирован на поверхности АРС в контексте МНС II, и при этом возникнет иммунный ответ. Встраиваемые пептиды являются эпитопами, а общая структура молекулыносителя не имеет значения. Было показано, что пептид ras может быть встроен в петлю иммуноглобулина (вне CDR) и этот иммуноглобулин все-таки будет секретироваться. В клетках есть строгий "контроль качества", который предотвращает секрецию иммуноглобулина, если тот имеет неправильную укладку, а изменение аминокислотной последовательности петли может вызвать укладку иммуноглобулина в такую структуру, которую клетка будет воспринимать как неправильную и поэтому разрушит его. Так,помимо представленных примеров, дальнейшее модифицирование структурных петель без изменения самой природы иммуноглобулина посчитали затруднительным. В патентной заявке US 2004/0101905 описаны связывающиеся молекулы, содержащие сайт связывания мишени и эффекторный пептид Fc. Эффекторный пептид Fc представляет собой такой пептид,который взаимодействует с эффекторной молекулой. Показано встраивание эффекторного пептида в петлю вне CDR домена CH1 фрагмента иммуноглобулина. Эффекторные пептиды Fc представляют собой структуры, которые встречаются в природе в петлях вне CDR антител, поэтому можно ожидать, что они не будут нарушать структуру иммуноглобулина при пересадке в другое эквивалентное место в иммуноглобулине. Тем не менее, каждый пептид, пересаженный в петлю вне CDR согласно этому описанию, имеет большой шанс оказаться неактивным при другом структурном окружении, выбранном для него. В обоих документах предшествующего уровня, приведенных выше, указывается, что трудно встроить пептиды в такую петлю, которая должна сохранять свою структуру и функцию, поскольку нужно не нарушить структуру укладки иммуноглобулина, так как это важно для функционирования и секреции. В патентных заявках US 2004/0132101 и 2005/0244403 описаны мутантные иммуноглобулины с измененной аффинностью связывания с эффекторным лигандом, которые являются естественными лигандами для структурных петель антител. В этом документе описан ряд мутаций в различных участках по всей молекуле иммуноглобулина, которые влияют на эффекторную функцию всего антитела. В других документах предшествующего уровня показано, что до настоящего времени иммуноглобулиноподобный каркас использовался в целях манипулирования существующего антигенсвязывающего сайта, при этом вводились новые параметры связывания. Однако до сих пор только участки CDR подвергались конструированию для связывания антигена, иными словами, в случае укладки иммуноглобулина модификации подвергался только естественный антигенсвязывающий сайт для того, чтобы изменить его аффинность или специфичность связывания. Существует обширная литература, в которой описаны различные форматы таких модифицированных иммуноглобулинов, которые зачастую экспрессируют в виде одноцепочечных фрагментов Fv (scFV) или фрагментов Fab, либо в виде дисплея на поверхности фаговых частиц или в растворимом виде в различных прокариотических или эукариотических системах экспрессии. К ведущим авторам в данной области относятся Greg Winter, Andreas Pluckthun и Hennie Сущность изобретения Задачей настоящего изобретения является получение иммуноглобулинов с новыми введенными антигенсвязывающими сайтами и способов конструирования и получения таких иммуноглобулинов. Таким образом, настоящее изобретение касается способа конструирования иммуноглобулина, содержащего по меньшей мере одну модификацию на участке структурной петли данного иммуноглобулина, и определения связывания данного иммуноглобулина с эпитопом антигена, причем немодифицированный иммуноглобулин практически не связывается с данным эпитопом, при этом способ включает стадии: обеспечения нуклеиновой кислоты, кодирующей иммуноглобулин, содержащий по меньшей мере один участок структурной петли; модифицирования по меньшей мере одного нуклеотидного остатка по меньшей мере одного из указанных участков структурных петель; переноса данной модифицированной нуклеиновой кислоты в экспрессионную систему; экспрессирования данного модифицированного иммуноглобулина; контактирования экспрессированного модифицированного иммуноглобулина с эпитопом и определения того, связывается ли данный модифицированный иммуноглобулин с данным эпитопом. В частности, настоящее изобретение касается способа конструирования иммуноглобулина, специфически связывающегося с эпитопом антигена, выбранного из группы, состоящей из аллергенов, раковых антигенов, аутоантигенов, ферментов, бактериальных антигенов, грибковых антигенов, протозойных антигенов и вирусных антигенов. Путем модификации в участке структурной петли иммуноглобулин может быть сконструирован так, чтобы связываться с эпитопом. В предпочтительном воплощении иммуноглобулин специфически связывается по меньшей мере с двумя такими эпитопами, отличающимися друг от друга, из того же самого антигена или из разных антигенов. Например, способ по изобретению касается конструирования иммуноглобулина, специфически связывающегося по меньшей мере с одним первым эпитопом и содержащего по меньшей мере одну модификацию по меньшей мере в одном участке структурной петли данного иммуноглобулина, и определения специфического связывания данного по меньшей мере одного участка петли по меньшей мере с одним вторым эпитопом, выбранным из вышеприведенной группы антигенов, причем немодифицированный участок структурной петли (участок вне CDR) не связывается специфически с данным по меньшей мере одним вторым эпитопом, при этом способ включает стадии: обеспечения нуклеиновой кислоты, кодирующей иммуноглобулин, специфически связывающийся по меньшей мере с одним первым эпитопом и содержащий по меньшей мере один участок структурной петли; модификации по меньшей мере одного нуклеотидного остатка по меньшей мере одного из данных участков петель, кодируемых данной нуклеиновой кислотой; переноса данной модифицированной нуклеиновой кислоты в экспрессионную систему; экспрессирования данного модифицированного иммуноглобулина; контактирования экспрессированного модифицированного иммуноглобулина с данным по меньшей мере одним вторым эпитопом и определения того, связывается ли данный модифицированный иммуноглобулин специфически со вторым эпитопом. Способ по изобретению предпочтительно касается по меньшей мере одной модификации по меньшей мере в одном участке структурной петли данного иммуноглобулина и определения специфического связывания данного по меньшей мере одного участка петли по меньшей мере с одним антигеном, выбранным из группы, состоящей из аллергенов, раковых антигенов, аутоантигенов, ферментов, бактериальных антигенов, грибковых антигенов, вирусных антигенов и протозойных антигенов, причем иммуноглобулин, содержащий немодифицированный участок структурной петли, не связывается специфически с данным по меньшей мере одним антигеном. Осуществление изобретения Термин "иммуноглобулины" по настоящему изобретению, которые подлежат модификации (в настоящем изобретении термины иммуноглобулин и антитело являются взаимозаменяемыми), могут проявлять характеристики моно- или мультиспецифического либо мультивалентного связывания как минимум по двум, предпочтительно по меньшей мере трем сайтам специфического связывания эпитопов, например эпитопов антигенов, эффекторных молекул/белков. Иммуноглобулинами по изобретению также являются признанные в этой области функциональные фрагменты, такие как Fc, Fab, scFv, одноцепочечные димеры доменов CH/CL, Fv или другие производные или комбинации иммуноглобулинов, домены вариабельной (такие как Fd, VL, V, VH) и константной области (такие как CH1, CH2, CH3, CH4, С и C) тяжелых и легких цепей интактных антител, а также мини-домены, состоящие из двух -отрезков домена иммуноглобулина, соединенных структурной петлей. Подразумевается, что термины "иммуноглобулин", "модифицированный иммуноглобулин" или"иммуноглобулин в соответствии с изобретением" также охватывают производные иммуноглобулинов. Производным является любая комбинация из одного или нескольких иммуноглобулинов по изобретению и/или слитый белок, у которого любой домен или мини-домен иммуноглобулина по изобретению может быть слит по любому положению с одним или несколькими другими белками (к примеру, другими иммуноглобулинами, лигандами, каркасными белками, ферментами, токсинами и др.). Производное иммуноглобулина по изобретению также может быть получено путем связывания с другими веществами при помощи различных химических методов, таких как ковалентное присоединение, электростатическое взаимодействие, образование дисульфидной связи и т.п. Другие вещества, связывающиеся с иммуноглобулинами, могут представлять собой липиды, углеводы, нуклеиновые кислоты, органические и неорганические молекулы или любые их комбинации (например, ПЭГ, пролекарства или лекарства). Производным также является иммуноглобулин с такой же аминокислотной последовательностью, но полностью или частично состоящий из аминокислот, не встречающихся в природе или подвергшихся химической модификации. Подвергнутые конструированию молекулы по настоящему изобретению будут полезными как в виде самостоятельных белков, так и в виде слитых белков или производных, как правило, слитых таким образом, чтобы они вошли в состав более крупных структур антител или полных молекул антител или таких фрагментов антител, как фрагменты Fab, фрагменты Fc, фрагменты Fv и другие. Подвергнутые конструирования белки можно будет использовать для получения молекул, являющихся моноспецифическими, биспецифическими, триспецифическими, может быть, даже несущих еще больше специфичностей одновременно, и в то же время можно будет контролировать и заранее выбирать валентность одновременного связывания в соответствии с потребностями планируемого применения таких молекул. В соответствии с настоящим изобретением в структурную петлю данной структуры антитела можно вводить участки связывания с антигенами или антигенсвязывающие сайты для всевозможных аллергенов, раковых антигенов, аутоантигенов, ферментов, бактериальных антигенов, грибковых антигенов,протозойных антигенов и вирусных антигенов. Термин "антиген" по настоящему изобретению должен означать молекулы или структуры, которые взаимодействуют или способны взаимодействовать с участком CDR-петли иммуноглобулинов. Участки структурных петель из предшествующего уровня техники не взаимодействуют с антигенами, а только вносят вклад в общую структуру и/или способствуют связыванию с эффекторными молекулами. Термин "аллергены, раковые антигены, аутоантигены, ферменты, бактериальные антигены, грибковые антигены, протозойные антигены и вирусные антигены" по настоящему изобретению должен охватывать все аллергены и антигены, которые могут распознаваться структурой антитела, а также фрагменты таких молекул (в особенности такие субструктуры, которые обычно именуются "эпитопами" (например, эпитопы В-клеток, если только они являются иммунологически значимыми, т.е. также распознаются природными или моноклональными антителами. Термин "эпитоп" по настоящему изобретению должен означать такую молекулярную структуру,которая может полностью быть партнером специфического связывания или быть частью партнера специфического связывания для связывающего домена или иммуноглобулина настоящего изобретения. В химическом отношении эпитоп может состоять из углевода, липида, жирной кислоты, неорганического вещества или их производных и любых комбинаций. Если эпитопом является полипептид, то он обычно включает по меньшей мере 3 аминокислоты, предпочтительно от 8 до 50 аминокислот, более предпочтительно около 10-20 аминокислот в пептиде. Не существует критического верхнего предела для длины пептида, который может охватывать почти всю длину последовательности полипептида. Эпитопы могут быть линейными или конформационными. Линейный эпитоп состоит из одного сегмента первичной последовательности полипептидной цепи. Линейные эпитопы могут быть смежными или перекрывающимися. Конформационные эпитопы состоят из аминокислот, сведенных вместе при укладке полипептида с образованием третичной структуры, а аминокислоты не обязательно находятся рядом друг с другом в линейной последовательности. В частности, эпитопы, как минимум, входят в состав диагностически важных молекул, т.е. отсутствие или присутствие эпитопа в образце качественно или количественно коррелирует либо с болезнью,либо с состоянием здоровья или с состоянием процесса на производстве или с экологическим и продовольственным положением. Эпитопы также могут и входить в состав терапевтически важных молекул,т.е. таких молекул, которые могут быть мишенью специфического связывающегося домена, который изменит течение болезни. Предпочтительными "аллергенами, раковыми антигенами, аутоантигенами, ферментами, бактериальными антигенами, грибковыми антигенами, протозойными антигенами и вирусными антигенами" являются те аллергены или антигены, которые уже оказались или могут оказаться иммунологически или терапевтически важными, особенно такие, в отношении которых проводилась проверка клинической эффективности. С другой стороны, согласно другому аспекту настоящего изобретения в участки структурных петель могут вводиться и другие способности к связыванию, например способность к связыванию небольших молекул типа лекарств либо ферментов, каталитических сайтов ферментов или субстратов фермен-4 018897 тов, либо к аналогам переходного состояния субстрата фермента. Предпочтительно новый антигенсвязывающий сайт в структурной петле является чужеродным для немодифицированного иммуноглобулина. Следовательно, такие мишени, как эффекторные молекулы или Fc-рецепторы, предпочтительно исключаются из числа связывающихся молекул и специфичности иммуноглобулинов по изобретению. Предпочтительно новые антигенсвязывающие сайты вводятся в структурные петли путем замещения, делеции и/или вставки в иммуноглобулине, кодируемом выбранной нуклеиновой кислотой. Согласно другому предпочтительному воплощению настоящего изобретения модификация по крайней мере одного нуклеотида приводит к замещению, делеции и/или вставке в иммуноглобулине,кодируемом данной нуклеиновой кислотой. Модификация по меньшей мере одного участка петли может привести к замене, делеции и/или вставке 1 или нескольких аминокислот, предпочтительно точечной мутации, замене целых петель, более предпочтительно изменению по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10 и вплоть до 30 аминокислот. Также предпочтителен сайт-специфический случайный мутагенез. Этим методом один или несколько специфических аминокислотных остатков петли подвергаются замене или вводятся с помощью создаваемых случайным образом вставок в такие структурные петли. В качестве альтернативы предпочтительно применяются комбинаторные подходы. По меньшей мере один участок петли предпочтительно подвергается мутагенезу или модификации методами случайного, полуслучайного или, в особенности, сайт-специфического случайного мутагенеза. Эти методы могут применяться для получения модификаций аминокислот в желательных положениях иммуноглобулина настоящего изобретения. В таких случаях положения выбираются случайным образом либо замены аминокислот производятся по упрощенным правилам. Например, можно мутировать все остатки в аланин, что именуется сканированием по аланину. Такие методы могут сочетаться с более сложными инженерными подходами, в которых применяются методы селекции для скрининга более высокой степени разнообразия последовательности. Предпочтительно метод по изобретению относится к модифицированным случайным образом молекулам нуклеиновой кислоты, содержащим по меньшей мере одно повторяющееся звено нуклеотидов с последовательностью 5'-NNS-3', 5'-NNN-3' или 5'-NNK-3'. Модифицированная случайным образом молекула нуклеиновой кислоты может содержать вышеприведенные повторяющиеся звенья, которые кодируют все известные природные аминокислоты. Как это хорошо известно в данной области, существует целый ряд методов селекции, которые можно использовать для идентификации и выделения белков с определенными характеристиками и аффинностью связывания, включая, к примеру, методы дисплея типа фагового дисплея, рибосомного дисплея,дисплея на клеточной поверхности и т.п., как описано ниже. Методы получения и скринирования вариантов антител хорошо известны в данной области. Общие методы молекулярной биологии, экспрессии,очистки и скрининга антител описаны в Antibody Engineering, edited by DuebelKontermann, SpringerVerlag, Heidelberg, 2001; и HayhurstGeorgiou, 2001, Curr Opin Chem Biol 5: 683-689; MaynardGeorgiou, 2000, Annu Rev Biomed Eng 2: 339-76."Структурную петлю" или "петлю вне CDR" по настоящему изобретению следует понимать следующим образом: иммуноглобулины состоят из доменов с так называемой укладкой иммуноглобулина. В сущности, антипараллельные -слои соединяются петлями с образованием сжатого антипараллельного-цилиндра. В вариабельной области некоторые петли доменов вносят существенный вклад в специфичность антитела, т.е. связывание с антигеном. Эти петли именуются CDR-петлями. Все другие петли доменов антител скорее вносят вклад в структуру молекулы и/или эффекторные функции. Эти петли определяются в настоящем изобретении как структурные петли или петли вне CDR. Молекулы нуклеиновых кислот, кодирующих модифицированные иммуноглобулины (что всегда включает по всему описанию и фрагменты иммуноглобулинов), можно клонировать в клетки хозяина,экспрессировать и проверить на специфичность связывания. Эти процедуры выполняются по хорошо известным методикам, и целый ряд методов, которые могут найти применение в настоящем изобретении,описан в Molecular Cloning: A Laboratory Manual, 3rd Ed. (Maniatis, Cold Spring Harbor Laboratory Press,New York, 2001) и Current Protocols in Molecular Biology (John WileySons). Нуклеиновые кислоты, кодирующие модифицированные иммуноглобулины настоящего изобретения, могут быть встроены в экспрессионный вектор для того, чтобы экспрессировать данные иммуноглобулины. Экспрессирующий вектор обычно включает иммуноглобулин, функционально связанный, т.е. находящийся в функциональной взаимосвязи, с контрольными или регуляторными последовательностями, селекционные маркеры, какиелибо партнеры слияния и/или дополнительные элементы. Модифицированные иммуноглобулины настоящего изобретения могут быть получены путем культивирования клеток хозяина, трансформированных нуклеиновой кислотой, предпочтительно экспрессирующим вектором, содержащим нуклеиновую кислоту, кодирующую модифицированный иммуноглобулин, в соответствующих условиях, индуцирующих или вызывающих экспрессию модифицированного иммуноглобулина. Методы введения экзогенных молекул нуклеиновой кислоты в организм хозяина хорошо известны в данной области и варьируют в зависимости от хозяина. Конечно, для экспрессии модифицированных иммуноглобулинов можно ис-5 018897 пользовать и неклеточные или бесклеточные системы экспрессии. В предпочтительном воплощении настоящего изобретения модифицированные иммуноглобулины после экспрессии подвергаются очистке или выделению. Модифицированные иммуноглобулины могут быть выделены или очищены рядом способов, известных специалистам в данной области. Стандартные методы очистки включают хроматографические методы, методы электрофореза, иммунологические методы, методы осаждения, диализа, фильтрации, концентрирования и хроматофокусирования. Зачастую очистке может способствовать определенный партнер по слиянию. Например, антитела можно очистить с помощью глутатионовой смолы, если используется слияние с GST, при помощи Ni2+-аффинной хроматографии, если используется His-метка, или иммобилизованных антител к метке flag, если используетсяflag-метка. Насчет общего руководства по подходящим методам очистки см. Antibody Purification: Principles and Practice, 3rd Ed., Scopes, Springer-Verlag, NY, 1994. Конечно, также можно экспрессировать модифицированные иммуноглобулины по настоящему изобретению на поверхности хозяина, в частности на поверхности бактериальных клеток или клеток насекомых или дрожжей, либо на поверхности фагов или вирусов. Модифицированные иммуноглобулины можно подвергнуть скринингу целым рядом методов,включая методы, в которых применяются анализы in vitro, in vivo и на клетках, а также технологии селекции, но не ограничиваясь этим. В процедурах скрининга может применяться автоматизация и технологии высокопроизводительного скрининга. Для скрининга могут использоваться партнеры по слиянию или метки, например, ферменты, иммунологические метки, изотопные метки или метки на основе небольших молекул типа флуоресцентных или колориметрических красителей или люминесцентных молекул. В предпочтительном воплощении функциональные и/или биофизические свойства иммуноглобулинов подвергают скринингу методом анализа in vitro. В предпочтительном воплощении антитела подвергают скринингу на функциональность, например на способность катализировать реакцию или на афинность связывания с мишенью. Для анализов можно использовать целый ряд методов детектирования, включая, но не ограничиваясь этим, хромогенные, флуоресцентные, люминесцентные или изотопные метки. Как известно в данной области, подгруппу методов скрининга составляют методы, в которых происходит селекция подходящих представителей библиотеки. Эти методы в настоящем описании именуются "селекционными методами" и они находят применение в настоящем изобретении для скрининга модифицированных иммуноглобулинов. При скрининге библиотек иммуноглобулинов селекционным методом подвергаются размножению, выделению и/или наблюдению только те представители библиотеки,которые подходят, т.е. соответствуют некоторым критериям селекции. Следует иметь в виду, что поскольку наблюдаются только наиболее приспособленные варианты, то такие методы позволяют скринировать более крупные библиотеки, чем те, которые можно скринировать методами, в которых пригодность представителей библиотеки определяется индивидуально. Селекция становится возможной при помощи любого способа, метода или партнера для слияния, связывающего, ковалентным или нековалентным образом, фенотип иммуноглобулина с его генотипом, т.е. функцию антитела с кодирующей его нуклеиновой кислотой. Например, применение фагового дисплея в качестве метода селекции становится возможным при слиянии представителей библиотеки с белком гена III. Таким образом, при селекции или выделении модифицированных иммуноглобулинов, соответствующих некоторым критериям, например,аффинности связывания с мишенью иммуноглобулина, также происходит селекция или выделение кодирующей его нуклеиновой кислоты. После выделения гена или генов, кодирующих модифицированные иммуноглобулины, их можно затем амплифицировать. Этот процесс выделения и амплификации, именуемый пэннингом, можно повторять, что позволяет обогащение подходящими вариантами антител в библиотеке. В конечном счете, секвенирование привязанной нуклеиновой кислоты позволяет идентифицировать гены. В этой области известен целый ряд селекционных методов, которые могут найти применение в настоящем изобретении для скрининга библиотек иммуноглобулинов. К ним относятся, не ограничиваясь этим, фаговый дисплей (Phage display of peptides and antibodies: a laboratory manual, Key et al., 1996, Academic Press, San Diego, Calif, 1996; Lowman et al., 1991, Biochemistry 30: 10832-10838; Smith, 1985, Science 228: 1315-1317) и такие его разновидности, как селективное инфицирование фагом (Malmborg et al., 1997,J. Mol Biol 273: 544-551), избирательная инфективность фага (Krebber et al., 1997, J. Mol Biol 268: 619630) и пэннинг на основе отсроченной инфективности (Benhar et al., 2000, J. Mol Biol 301: 893-904), дисплей на клеточной поверхности (Wittrup, 2001, Curr Opin Biotechnol 12: 395-399), к примеру, дисплей на клетках бактерий (Georgiou et al., 1997, Nat Biotechnol, 15: 29-34; Georgiou et al., 1993, Trends Biotechnol,11: 6-10; Lee et al., 2000, Nat. Biotechnol. 18: 645-648; Jun et al., 1998, Nat. Biotechnol. 16: 576-80), дрожжей(BoderWittrup, 2000, Methods Enzymol 328: 430-44; BoderWittrup, 1997, Nat. Biotechnol. 15: 553-557) и млекопитающих (Whitehora et al., 1995, Biotechnology 13: 1215-1219), а также технологии дисплея invitro (Amstutz et al., 2001, Curr Opin Biotechnol 12: 400-405), к примеру, дисплей на полисомах (Mattheakiset al., 1994, Proc. Natl. Acad. Sci. USA 91: 9022-9026), дисплей на рибосомах (Hanes et al., 1997, Proc. Natl.Acad. Sci. USA 94: 4937-4942), дисплей на мРНК (RobertsSzostak, 1997, Proc. Natl. Acad. Sci. USA 94:(Zhou et al., 2002, J. Am Chem Soc 124: 538-543). Другие селекционные методы, которые могут найти применение в настоящем изобретении, включают методы, которые не основаны на дисплее, к примеру, методы in vivo, в том числе, но не ограничиваясь этим, экспрессирование в периплазме и цитометрический скрининг (Chen et al., 2001, Nat. Biotechnol. 19: 537-542), метод комплементации фрагментов антител (JohnssonVarshavsky, 1994, Proc. Natl.Acad. Sci. USA 91: 10340-10344; Pelletier et al., 1998, Proc. Natl. Acad. Sci. USA 95: 12141-12146) и скрининг по двум гибридам на дрожжах (FieldsSong, 1989, Nature 340: 245-246) в режиме селекции (Visintin et al., 1999, Proc. Natl. Acad. Sci. USA 96: 11723-11728). В альтернативном воплощении селекция становится возможной при помощи партнера по слиянию, который связывается со специфической последовательностью на экспрессирующем векторе, при этом партнер по слиянию и связанный с ним представитель библиотеки типа Fc-варианта связывается ковалентным или нековалентным образом с кодирующей их нуклеиновой кислотой. Например, в РСТ WO 00/22906, РСТ WO 01/49058, РСТ WO 02/04852, РСТWO 02/04853, РСТ WO 02/08023, РСТ WO 01/28702 и РСТ WO 02/07466 описан такой партнер по слиянию и методика, которая может найти применение в настоящем изобретении. В альтернативном воплощении селекция может происходить in vivo, если экспрессия антитела дает клетке какое-нибудь преимущество в росте, размножении или выживаемости. Одну подгруппу селекционных методов, именуемую методами "направленной эволюции", составляют методы, включающие спаривание или разведение подходящих последовательностей во время селекции, иногда с включением новых мутаций. Как это известно специалистам в данной области, методы направленной эволюции могут облегчить идентификацию наиболее подходящих последовательностей в библиотеке и могут повысить разнообразие последовательностей, подвергаемых скринингу. В данной области известен целый ряд методов направленной эволюции, которые могут найти применение в настоящем изобретении для скрининга вариантов антител, в том числе, но не ограничиваясь этим, перетасовка ДНК (РСТ WO 00/42561 A3; РСТ WO 01/70947 A3), перестановка экзонов (US Patent6365377;KolkmanStemmer, 2001, Nat. Biotechnol. 19: 423-428), семейная перетасовка (Crameri et al., 1998, Nature 391: 288-291; US Patent6376246), RACHITT (Coco et al., 2001, Nat. Biotechnol. 19: 354-359; PCT WO 02/06469), STEP и произвольное примирование рекомбинации in vitro (Zhao et al., 1998, Nat. Biotechnol. 16: 258-261; Shao et al., 1998, Nucleic Acids Res 26: 681-683), сборка генов, опосредованная экзонуклеазой(US Patent6352842; US Patent6361974), насыщающий мутагенез сайта гена (US Patent6358709),перестройка гена (US Patent6358709), SCRATCHY (Lutz et al., 2001, Proc. Natl. Acad. Sci. USA 98: 11248-11253), методы фрагментирования ДНК (Kikuchi et al., Gene 236: 159-167), перетасовка одноцепочечной ДНК (Kikuchi et al., 2000, Gene 243: 133-137) и технология конструирования антител методом направленной эволюции AMEsystem (прикладной молекулярной эволюции) (US Patent5824514;US Patent5817483; US Patent5814476; US Patent5763192; US Patent5723323). В предпочтительном воплощении для скрининга вариантов антител используют один или несколько клеточных методов или методов in vivo. В таких методах очищенные или неочищенные модифицированные иммуноглобулины обычно добавляют извне таким образом, что клетки подвергаются воздействию индивидуальных иммуноглобулинов или пулов иммуноглобулинов, принадлежащих к библиотеке. Как правило, но не всегда, эти методы основываются на функции иммуноглобулина, т.е. на способности антитела связываться с мишенью и вызывать какое-нибудь биохимическое явление, к примеру, эффекторную функцию, ингибирование связывания лиганд/рецептор, апоптоз и т.п. Такие методы зачастую включают регистрацию реакции клеток на антитело, например выживаемость клеток, гибель клеток, изменение морфологии клеток или активацию транскрипции типа экспрессии клетками природного гена или гена-репортера. Например, в таких методах можно измерять способность вариантов антител вызывать ADCC, ADCP или CDC. В некоторых методах может потребоваться добавление дополнительных клеток или компонентов, т.е. вдобавок к клеткам мишени, к примеру, сывороточный комплемент или такие эффекторные клетки, как моноциты периферической крови (РВМС), клетки NK, макрофаги и т.п. Такие дополнительные клетки могут происходить из любого организма, предпочтительно человека, мышей, крыс, кроликов и обезьян. Иммуноглобулины могут вызвать апоптоз определенных линий клеток,экспрессирующих мишень, либо они могут опосредовать атаку на клетки-мишени иммунных клеток,добавленных в пробу. Методы регистрации гибели клеток или жизнеспособности клеток известны в данной области, они включают применение красителей, иммунохимических, цитохимических и радиоактивных реагентов. Например, методы окрашивания на каспазу позволяют измерять апоптоз, а поглощение или выделение радиоактивных субстратов или флуоресцентных красителей типа Alamar Blue позволяет регистрировать рост клеток или активацию. В предпочтительном воплощении можно использовать метод определения цитотоксичности на основе DELFIA EuTDA (Perkin Elmer, MA). С другой стороны,мертвые или поврежденные клетки-мишени можно регистрировать, измеряя выделение одного или нескольких естественных внутриклеточных компонентов, к примеру, лактатдегидрогеназы. Активация транскрипции также может служить методом анализа функции в клеточных методах. В этом случае реакцию можно регистрировать анализом естественных генов или иммуноглобулинов, которые могут под-7 018897 вергаться повышающей регуляции, например, можно измерять выделение определенных интерлейкинов,а с другой стороны, е можно регистрировать при помощи репортерной конструкции. Клеточные методы также могут включать измерение морфологических изменений клеток как реакцию на присутствие модифицированных иммуноглобулинов. Клетки для таких методов могут быть прокариотическими или эукариотическими, а также можно использовать целый ряд клеточных линий, известных в данной области. В качестве альтернативы клеточный скрининг проводится на клетках, трансформированных или трансфецированных нуклеиновой кислотой, кодирующей эти варианты. Т.е. варианты антител не добавляются к клеткам извне. Например, в одном воплощении при клеточном скрининге применяется дисплей на клеточной поверхности. Можно использовать партнеров по слиянию, позволяющих осуществлять дисплей модифицированных иммуноглобулинов на поверхности клеток (Wittrup,2001, Curr Opin Biotechnol. 12: 395-399). В предпочтительном воплощении иммуногенность модифицированных иммуноглобулинов можно определять экспериментально одним или несколькими клеточными методами. В предпочтительном воплощении для экспериментального определения иммуногенности применяется анализ активации Тклеток ex vivo. В этом методе антигенпрезентирующие клетки и наивные Т-клетки от совпадающих доноров обрабатывают представляющим интерес пептидом или целым антителом один или несколько раз. Затем можно определить активацию Т-клеток рядом методов, например, по регистрации продукции цитокинов или по измерению захвата меченного тритием тимидина. В наиболее предпочтительном воплощении регистрируют продукцию -интерлейкина методом Elispot (Schmittel et al., 2000, J. Immunol Meth 24: 17-24). Биологические свойства модифицированных иммуноглобулинов настоящего изобретения можно изучать в опытах на клетках, тканях и целом организме. Как это известно в данной области, лекарственные препараты часто тестируют на животных, в том числе, но не ограничиваясь этим, на мышах, крысах,кроликах, собаках, кошках, свиньях и обезьянах, чтобы измерить эффективность препарата при лечении заболевания или на модели заболевания либо измерить фармакокинетику, токсичность и другие свойства препарата. Животных можно считать моделью заболевания. Лекарственные препараты часто тестируют на мышах, в том числе, но не ограничиваясь этим, на мышах nude, SCID, мышах с ксенотрансплантатами и трансгенных мышах (включая мышей "нок-ин" и "нокаут"). Такое экспериментирование может дать существенные данные для определения потенциала антитела при использовании в качестве лекарственного препарата. Для тестирования можно использовать любой организм, предпочтительно млекопитающих. Так, вследствие генетической близости к человеку обезьяны могут служить подходящей терапевтической моделью и поэтому могут использоваться для проверки эффективности, токсичности, фармакокинетики или других свойств модифицированных иммуноглобулинов настоящего изобретения. В конечном счете для одобрения препарата необходимо тестирование на человеке, поэтому, конечно, такие эксперименты предусматриваются. Таким образом, модифицированные иммуноглобулины настоящего изобретения можно тестировать на человеке, чтобы определить их терапевтическую эффективность, токсичность, иммуногенность, фармакокинетику и/или другие клинические свойства. Модифицированные иммуноглобулины настоящего изобретения могут найти применение в широком круге продуктов на основе антител. В одном воплощении вариант антитела настоящего изобретения применяется для терапии или профилактики, для препаративного или аналитического использования, как средство диагностики, промышленное соединение или исследовательский реагент, предпочтительно лекарственное средство. Вариант антитела может найти применение в композиции такого антитела, которое является моноклональным или поликлональным. В предпочтительном воплощении модифицированные иммуноглобулины настоящего изобретения применяются для уничтожения клеток-мишеней, несущих антиген-мишень, например раковых клеток. В другом воплощении модифицированные иммуноглобулины настоящего изобретения применяются как блокаторы, антагонисты или агонисты антигенамишени, например как антагонисты цитокинов или рецепторов цитокинов. В другом предпочтительном воплощении модифицированные иммуноглобулины настоящего изобретения применяются как блокаторы, антагонисты или агонисты антигена-мишени для уничтожения клеток-мишеней, несущих антигенмишень. В другом предпочтительном воплощении модифицированные иммуноглобулины настоящего изобретения применяются как блокаторы, антагонисты или агонисты факторов роста или рецепторов факторов роста для уничтожения клеток-мишеней, несущих или нуждающихся в антигене-мишени. В другом предпочтительном воплощении модифицированные иммуноглобулины настоящего изобретения применяются как блокаторы, антагонисты или агонисты ферментов и субстратов ферментов. Модифицированные иммуноглобулины настоящего изобретения могут применяться для различных терапевтических целей. В предпочтительном воплощении антитело, включающее модифицированный иммуноглобулин, вводится пациенту для лечения определенного заболевания. "Пациент" в целях настоящего изобретения включает и человека, и других животных, предпочтительно млекопитающих и наиболее предпочтительно человека. Под "определенным заболеванием" подразумевается такое заболевание, которое может улучшиться при введении фармацевтической композиции, включающей модифицированный иммуноглобулин настоящего изобретения. В одном воплощении модифицированный иммуноглобулин по настоящему изобретению является единственным терапевтически активным средством, вводимым пациенту. В качестве альтернативы модифицированный иммуноглобулин по настоящему изобретению вводится в комбинации с одним или несколькими другими терапевтическими средствами, включая, но не ограничиваясь этим, цитотоксические средства, химиотерапевтические средства, цитокины, средства, ингибирующие рост, антигормональные средства, ингибиторы киназ, антиангиогеннные средства, кардиопротекторы и другие терапевтические средства. Модифицированные иммуноглобулины можно вводить в сочетании с одним или несколькими другими терапевтическими режимами. Например, вариант антитела по настоящему изобретению можно вводить пациенту вместе с химиотерапией, лучевой терапией или с химиотерапией и лучевой терапией одновременно. В одном воплощении модифицированные иммуноглобулины настоящего изобретения можно вводить в сочетании с одним или несколькими антителами, которые могут включать или не включать вариант антитела по настоящему изобретению. В соответствии с другим воплощением изобретения модифицированные иммуноглобулины настоящего изобретения и одна или несколько других противораковых терапий применяются для обработки раковых клеток ex vivo. Предусматривается, что такая обработка ex vivo может быть полезной при пересадке костного мозга, в особенности при аутологичной пересадке костного мозга. Конечно, предусматривается, что антитела по изобретению могут применяться и в сочетании с другими терапевтическими методами типа хирургии. Целый ряд других терапевтических средств может найти применение для введения вместе с модифицированными иммуноглобулинами настоящего изобретения. В одном воплощении модифицированный иммуноглобулин вводится вместе с антиангиогенным средством, т.е. соединением, блокирующим или мешающим в некоторой степени развитию кровеносных сосудов. Антиангиогенный фактор может представлять собой, к примеру, небольшую молекулу или белок, например антитело, слитый Fc или цитокин, который связывается с фактором роста или рецептором фактора роста, участвующего в стимуляции ангиогенеза. Предпочтительным антиангиогенным фактором в настоящем изобретении является антитело, связывающееся с фактором роста сосудистого эндотелия (VEGF). В другом воплощении модифицированный иммуноглобулин вводится вместе с терапевтическим средством, вызывающим или усиливающим адаптивный иммунный ответ, например антителом, для которого мишенью является CTLA-4. В следующем воплощении модифицированный иммуноглобулин вводится вместе с ингибитором тирозинкиназ, т.е. молекулой, ингибирующей в некоторой степени тирозинкиназную активность тирозинкиназ. В другом воплощении модифицированный иммуноглобулин настоящего изобретения вводится вместе с цитокином. Под "цитокином" в настоящем изобретении имеется в виду обобщающий термин для белков, которые выделяются одной популяцией клеток и действуют на другие клетки в качестве межклеточных посредников, включая хемокины. Предусматриваются фармацевтические композиции, в состав которых входят модифицированные иммуноглобулины настоящего изобретения вместе с одним или несколькими терапевтически активными средствами. Композиции вариантов антител настоящего изобретения готовятся для хранения путем смешивания данного иммуноглобулина, имеющего желательную степень чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol A, Ed., 1980) в виде лиофилизованных составов или водных растворов. Композиции, предназначенные для введения in vivo, предпочтительно являются стерильными. Это легко осуществляется путем фильтрования через стерильные фильтрационные мембраны или другими методами. Модифицированные иммуноглобулины и другие терапевтически активные средства, изложенные в настоящем изобретении, также могут быть составлены в виде иммунолипосом и/или заключены в микрокапсулы. Введение фармацевтической композиции, включающей модифицированный иммуноглобулин настоящего изобретения, предпочтительно в виде стерильного водного раствора, может осуществляться рядом способов, в том числе, но не ограничиваясь этим, перорально, подкожно, внутривенно, интраназально, интраотикально, трансдермально, местно (например, гели, мази, лосьоны, кремы и т.п.), внутрибрюшинно, внутримышечно, внутрилегочно (например, ингаляционная технология AERx, коммерчески доступная от Aradigm, или система легочного введения Inhance, коммерчески доступная от InhaleTherapeutics), вагинально, парентерально, ректально или интраокулярно. В настоящем изобретении термин "специфически связывается" относится к реакции связывания,которая ограничивается соответствующим узнаваемым лигандом в гетерогенной популяции молекул. Таким образом, в заданных условиях (например, условиях иммуноанализа в случае иммуноглобулина) определенное антитело связывается со своей конкретной "мишенью" и не связывается в заметной степени с другими молекулами в образце. Как и участки CDR антител, модифицированные участки структурных петель являются антиген- или молекулосвязывающими частями молекулы белка, а вовсе не антигенами. Термин "система экспрессии" относится к молекулам нуклеиновой кислоты, содержащим требуемую кодирующую последовательность и функционально связанные контрольные последовательности,так что реципиент, трансформированный или трансфецированный этими последовательностями, спосо-9 018897 бен вырабатывать кодируемые белки. Для того чтобы осуществить трансформацию, система экспрессии может быть включена в вектор; однако соответствующая ДНК также может быть встроена в хромосомы хозяина. Согласно предпочтительному воплощению настоящего изобретения система экспрессии включает вектор. Для этой цели можно использовать любой известный в этой области экспрессионный вектор, который подойдет. Модифицированный иммуноглобулин предпочтительно подвергается экспрессии в организме реципиента, предпочтительно в бактериальных, дрожжевых, растительных клетках, в животных клетках либо в растениях или животных. Для экспрессии модифицированных иммуноглобулинов можно использовать широкий круг подходящих клеток хозяина, включая, но не ограничиваясь этим, клетки млекопитающих (животные клетки),растительные клетки, бактерии (например, Bacillus subtilis, Escherichia coli), клетки насекомых и дрожжей (например, Pichia pastoris, Saccharomyces cerevisiae). Так, целый ряд клеточных линий, которые могут найти применение в настоящем изобретении, описан в каталоге клеточных линий АТСС, доступном от Американской коллекции типовых культур. Кроме того, в качестве хозяина можно также использовать растения и животных для экспрессии иммуноглобулинов по настоящему изобретению. Вектора или кассеты для экспрессии и для трансфекции можно выбирать в соответствии с используемым организмом хозяина. Конечно, также можно использовать и неклеточные или бесклеточные системы экспрессии белка. Системы экспрессии с транскрипцией/трансляцией белка in vitro, вырабатывающие достаточное количество белка, обладают многими преимуществами бесклеточной экспрессии белка, устраняя необходимость в трудоемких предшествующих и последующих стадиях (например, трансформации, культивирования или лизиса клеток хозяина), обычно связанных с клеточными системами экспрессии. Другой аспект настоящего изобретения касается способа получения иммуноглобулина или его фармацевтического препарата, содержащего по меньшей мере одну модификацию на участке структурной петли данного иммуноглобулина, и определения связывания данного иммуноглобулина с эпитопом антигена, причем немодифицированный иммуноглобулин практически не связывается с данным эпитопом,при этом способ включает стадии: обеспечения нуклеиновой кислоты, кодирующей иммуноглобулин, содержащий по меньшей мере один участок петли; модификации по меньшей мере одного нуклеотидного остатка по меньшей мере одного из данных участков петель; переноса данной модифицированной нуклеиновой кислоты в экспрессионную систему; экспрессии данного модифицированного иммуноглобулина; контактирования экспрессированного модифицированного иммуноглобулина с эпитопом; определения того, связывается ли данный модифицированный иммуноглобулин с данным эпитопом; получения модифицированного иммуноглобулина, связывающегося с данным эпитопом, и необязательно доведения его до фармацевтического препарата. В частности, настоящее изобретение касается способа получения мультиспецифического иммуноглобулина или его фармацевтического препарата, специфически связывающегося по меньшей мере с одной первой молекулой и содержащего по меньшей мере одну модификацию по меньшей мере в одном участке структурной петли данного иммуноглобулина, и определения специфического связывания данного по меньшей мере одного участка петли по меньшей мере с одной второй молекулой, выбранной из группы, состоящей из аллергенов, раковых антигенов, аутоантигенов, ферментов, бактериальных антигенов, грибковых антигенов, протозойных антигенов и вирусных антигенов, причем иммуноглобулин,содержащий немодифицированный участок структурной петли, не связывается специфически с данной по меньшей мере одной второй молекулой, при этом способ включает стадии: обеспечения нуклеиновой кислоты, кодирующей иммуноглобулин, специфически связывающийся по меньшей мере с одной первой молекулой и содержащий по меньшей мере один участок структурной петли; модификации по меньшей мере одного нуклеотидного остатка по меньшей мере одного из данных участков петель, кодируемых данной нуклеиновой кислотой; переноса данной модифицированной нуклеиновой кислоты в экспрессионную систему; экспрессии данного модифицированного иммуноглобулина; контактирования экспрессированного модифицированного иммуноглобулина с данной по меньшей мере одной второй молекулой; определения того, связывается ли данный модифицированный иммуноглобулин специфически со второй молекулой, и получения модифицированного иммуноглобулина, специфически связывающегося с данной по меньшей мере одной второй молекулой, и необязательно доведения его до фармацевтического препарата. Предпочтительным является встраивание более чем одной специфичности в одного из членов спе- 10018897 цифически связывающейся пары (Kufer et al. (2004), Trends in Biotechnology, vol. 22, p. 238-244). Предпринимались многочисленные попытки получения мультиспецифических, например, биспецифических моноклональных антител или фрагментов антител. Одна из проблем при получении биспецифических антител, состоящих из двух разных полипептидных цепей (тяжелой и легкой цепи), заключается в необходимости экспрессировать четыре различные цепи (две тяжелые и две легкие цепи) в одной клетки, что приводит к большому числу разнообразных комбинаций молекул, которые приходится отделять от требуемой биспецифической молекулы в смеси. Вследствие их схожести разделение этих молекул является затруднительным и дорогостоящим. Применялось несколько разных методик, чтобы свести к минимуму встречаемость таких нежелательных пар (Carter (2001), Journal of ImmunologicalMethods, vol. 248, p. 7-15). Одним из решений проблемы является получение одной полипептидной цепи с двумя специфичностями типа двух scFv, соединенных друг с другом, или получение так называемых диател. Такие молекулы, как оказалось, весьма далеки от укладки природной молекулы, и их чрезвычайно трудно получить(Le Gall et al. (2004), Protein Engineering, DesignSelection, vol 17, p. 357-366). Другой проблемой при текущей разработке биспецифических антител является то, что даже если исходные антитела двухвалентны по связыванию со своим партнером связывания (например, IgG), то образующееся биспецифическое антитело одновалентно по каждому из соответствующих партнеров связывания. Предпочтительные мультиспецифические молекулы настоящего изобретения решают эти проблемы. Становится возможной экспрессия биспецифической молекулы в виде одной полипептидной цепи(модифицированный домен Ig с двумя специфичностями связывания, см. раздел "Примеры"), что легче осуществить, чем экспрессирование двух полипептидных цепей антител (Cabilly et al. Proc. Natl. Acad.Sci. USA 81: 3273-3277 (1984. Она также может быть получена в виде антителоподобной молекулы (т.е. состоящей из 2 полипептидных цепей) благодаря тому, что вторая специфичность располагается в невариабельной части молекулы, поэтому нет необходимости в двух различных тяжелых цепях или различных легких цепях. Таким образом, отпадает возможность неправильного спаривания двух цепей. Антитело настоящего изобретения может состоять из тяжелой цепи и легкой цепи, которые вместе образуют вариабельную область, связывающуюся со специфическим партнером связывания, а вторая специфичность может быть образована модифицированной петлей любой из структурных петель тяжелой цепи или же легкой цепи. Сайт связывания также может быть образован более чем одной петлей внеCDR, которая по структуре может оказаться по соседству (на тяжелой цепи или на легкой цепи либо на обеих цепях). Модифицированное антитело или производное может представлять собой полное антитело или фрагмент антитела (например, Fab, CH1-CH2, CH2-CH3). Оно может связываться как одно- или многовалентное антитело с партнерами связывания или даже с различной валентностью для разных партнеров связывания, в зависимости от конструкции. Поскольку имеется несколько разных петель, доступных для селекции и разработки специфического сайта связывания в участках вне CDR тяжелых и легких цепей, то можно разработать производные антител даже с более чем двумя специфичностями без указанных выше проблем. Домены специфического связывания в пределах одной полипептидной цепи могут соединяться пептидным линкером или без него. Некоторые классы антител можно рассматривать как мультиспецифические, в частности биспецифические от природы: они связываются с антигеном (который, как правило, является чужеродной структурой или связан с раком) по вариабельной области и с Fc-эффекторными молекулами по Fc-части (например, Fc-рецепторами на различных иммунных клетках или белке комплемента), поэтому становятся возможными такие эффекты, как ADCC, ADCP или CDC.Fc-эффекторные молекулы связываются Fc-частью молекулы иммуноглобулина (у IgG1 она состоит из доменов CH2 и CH3), и описано несколько методов оптимизации эффекторной функции путем усовершенствования связывания Fc-части молекулы антител либо методами гликоконструирования(US 6602684), либо белковой конструирования как непосредственно на Fc (US 2005/0054832), так и косвенным образом через конструирование вне области Fc (US 2005/02444403). Такими методами изменяется связывание Fc-области с Fc-рецептором и/или связывание с белками комплемента типа Cq1. Обычно стремятся улучшить аффинность связывания с такими Fc-эффекторными молекулами, так как это коррелирует с улучшением эффекторных функций. С помощью настоящего изобретения можно разрабатывать антитела, связывающиеся с Fcэффекторными молекулами за пределами естественной области Fc-связывания. Модифицированные петли в доменах антител, отличные от петель, участвующих в "естественном" связывании Fc-эффекторных молекул, могут быть выбраны из библиотеки или разработаны таким образом, чтобы они связывали одну или несколько Fc-эффекторных молекул. Антитело с такими дополнительными сайтами связывания Fcэффекторных молекул будут обладать более сильной авидностью к определенной Fc-эффекторной моле- 11018897 куле или к эффекторным клеткам, обладающим Fc-эффекторными молекулами, и поэтому могут оказывать более сильный эффект, чем подвергшиеся гликоконструирования антитела или усовершенствованные Fc-области. Однако в некоторых воплощениях настоящего изобретения эффекторные характеристики данного антитела, подлежащего модификации, не должны непосредственно изменяться, а должны остаться не затронутыми модификацией в структурной петле согласно настоящему изобретению. Фрагменты антител имеют определенные преимущества перед целыми антителами. Фрагменты обычно обладают хорошими параметрами биораспределения, и они легче получаются. Однако большинство конструкций фрагментов антител не обладает эффекторными функциями и имеет короткое время полужизни in vivo (Holliger P. et al. Nat. Biotechnol. (2005), 23:1126-36). Ни домены CH1, ни домены C или С не опосредуют эффекторные функции, по этой причине Fabфрагменты не проявляют ADCC, ADCP или CDC. В WO 02/44215 описаны связывающиеся молекулы,состоящие из антигенсвязывающего сайта антитела и пептидсвязывающих Fc-эффекторных молекул. Таким путем можно сконструировать фрагмент антитела, проявляющий эффекторные функции. Пептид встраивают в связывающуюся молекулу в таком положении, которое не разрушает ни связывание антигена, ни способность пептида к связыванию с Fc-эффекторной молекулой. Однако согласно настоящему изобретению связывание с Fc-эффекторными молекулами может осуществляться с помощью модифицированных доменов иммуноглобулина, прошедших селекцию на связывание Fc-эффекторных молекул, из библиотек случайных последовательностей петель в пределах фиксированного каркаса домена иммуноглобулина. Таким образом, можно проводить селекцию на определенные последовательности петель, которые не будут связываться с Fc-эффекторными молекулами за пределами каркаса домена Ig. Поэтому полипептиды, получаемые по настоящему изобретению, могут предпочтительно состоять из более чем 100 аминокислот. Для того чтобы провести селекцию на потенциальную эффекторную функцию таких доменов согласно настоящему изобретению, можно подвергнуть селекции библиотеки мутантных доменов CH1, C или С на связывание с Fc-рецепторами и/или такими факторами комплемента, как C1q. Для того чтобы повысить время полужизни in vivo молекулы, состоящей из или содержащей такой домен (например, CH1, CH2, CH3, CH4, C, С), можно провести селекцию на связывание с FcRn с помощью библиотек мутантных доменов, например доменов CH1, CH2, CH3, CH4, C, С согласно настоящему изобретению. Рецепторы FcRn для селекции можно получить либо на поверхности клеток, экспрессирующих естественным образом соответствующие рецепторы, либо путем экспрессии и очистки внеклеточной части соответствующего рецептора. В целях настоящего изобретения при первом скрининге на FcRn можно проводить селекцию по мутантным доменам, которые можно далее тестировать in vitro, а затем охарактеризовать в опытах FACS по связыванию с клетками, экспрессирующими рецепторы FcRn. Их можно дополнительно охарактеризовать по степени аффинности связывания с различными рекомбинантнымиFcRn, изоформами и аллотипами FcRn, например методом поверхностного плазмонного резонанса. Согласно предпочтительному воплощению настоящего изобретения иммуноглобулин происходит из человека или мыши. Поскольку модифицированный иммуноглобулин может использоваться для разнообразных целей, в частности, в фармацевтических композициях, то иммуноглобулин предпочтительно происходит из человека или мыши. Конечно, модифицированный иммуноглобулин также может представлять собой гуманизованный или химерный иммуноглобулин. Согласно другому предпочтительному воплощению настоящего изобретения иммуноглобулин человека выбирают из группы, состоящей из IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 и IgM. Мышиный иммуноглобулин предпочтительно выбирают из группы, состоящей из IgA, IgD, IgE,IgGl, IgG2A, IgG2B, IgG2C, IgG3 и IgM. Модифицированный иммуноглобулин может происходить из одного из вышеприведенных классов иммуноглобулина. Иммуноглобулин предпочтительно включает тяжелую и/или легкую цепь иммуноглобулина или е часть. Модифицированный иммуноглобулин может включать тяжелую и/или легкую цепь, по меньшей мере один вариабельный и/или константный домен. Иммуноглобулин по настоящему изобретению предпочтительно включает по меньшей мере один константный и/или по меньшей мере один вариабельный домен иммуноглобулина или его часть, в том числе мини-домен. Константный домен представляет собой звено укладки иммуноглобулина в константной части молекулы иммуноглобулина и также именуется доменом константной области (например, CH1, CH2, CH3,CH4, C, С). Вариабельный домен представляет собой звено укладки иммуноглобулина в вариабельной части молекулы иммуноглобулина и также именуется доменом вариабельной области (например, VH, V, V,Vd). Предпочтительный иммуноглобулин по изобретению состоит из константного домена, выбранного из группы, состоящей из CH1, CH2, CH3, CH4, C, С или его части, в том числе мини-домена, по меньшей мере с одним участком петли, и отличается тем, что данный по меньшей мере один участок петли содержит по меньшей мере одну аминокислотную модификацию, образующую по меньшей мере один модифицированный участок петли, причем данный по меньшей мере один модифицированный участок петли специфически связывается по меньшей мере с одним эпитопом антигена. Другой предпочтительный иммуноглобулин по изобретению состоит из вариабельного домена тяжелой или легкой цепи или его части, в том числе мини-домена, по меньшей мере с одним участком петли, и отличается тем, что данный по меньшей мере один участок петли содержит по меньшей мере одну аминокислотную модификацию, образующую по меньшей мере один модифицированный участок петли,причем данный по меньшей мере один модифицированный участок петли специфически связывается по меньшей мере с одним эпитопом антигена. Согласно предпочтительному воплощению константный домен выбирают из группы CH1, CH2, CH3,CH4, C, С и их комбинаций. Модифицированный иммуноглобулин по настоящему изобретению может содержать один или несколько константных доменов (например, по меньшей мере два, три, четыре, пять, шесть, десять доменов). Если в модифицированном иммуноглобулине содержится более одного домена, эти домены могут быть одного и того же типа или различных типов (например, CH1-CH2-CH3, CH3-CH3). Конечно, и порядок расположения доменов может быть любым (например, CH1-CH3-CH2, CH4-CH1-CH3-CH2). Нумерация всех аминокислотных последовательностей иммуноглобулинов соответствует системе нумерации IMGT (Международная система информации по иммуногенетике на сайте imgt.cines.fr;http://imgt.cines.fr; Lefranc et al., 1999, Nucleic Acids Res. 27: 209-212; Ruiz et al., 2000, Nucleic Acids Res. 28: 219-221; Lefranc et al., 2001, Nucleic Acids Res. 29: 207-209; Lefranc et al., 2003, Nucleic Acids Res. 31: 307-310; Lefranc et al., 2005, Dev Comp Immunol. 29: 185-203). Согласно другому предпочтительному воплощению настоящего изобретения модифицированные участки петель в CH1, CH2, CH3 и CH4 включают аминокислоты 7-21, аминокислоты 25-39, аминокислоты 41-81, аминокислоты 83-85, аминокислоты 89-103 и аминокислоты 106-117. Участки петель в C и С иммуноглобулина человека предпочтительно включают аминокислоты 818, аминокислоты 27-35, аминокислоты 42-78, аминокислоты 83-85, аминокислоты 92-100, аминокислоты 108-117 и аминокислоты 123-126. Участки петель в C и С иммуноглобулина мыши предпочтительно включают аминокислоты 8-20,аминокислоты 26-36, аминокислоты 43-79, аминокислоты 83-85, аминокислоты 90-101, аминокислоты 108-116 и аминокислоты 122-125. Участки структурных петель вариабельного домена иммуноглобулина человека предпочтительно включают аминокислоты 8-20, аминокислоты 44-50, аминокислоты 67-76 и аминокислоты 89-101. Согласно предпочтительному воплощению настоящего изобретения участки структурных петель вариабельного домена иммуноглобулина мыши включают аминокислоты 6-20, аминокислоты 44-52,аминокислоты 67-76 и аминокислоты 92-101. Вышеприведенные аминокислотные отрезки соответствующих иммуноглобулинов составляют подлежащие модификации участки петель. Иммуноглобулин по изобретению предпочтительно происходит из верблюда. Верблюжьи антитела содержат только одну тяжелую цепь и имеют такое же сродство к антигену,как и нормальные антитела, состоящие из легких и тяжелых цепей. Вследствие этого верблюжьи антитела намного меньше, чем, например, антитела человека, что позволяет им проникать в плотные ткани и достигать антигена там, где более крупные белки не могут. Более того, сравнительная простота, высокое сродство и специфичность, а также возможность достижения и взаимодействия с активными сайтами,дают состоящим из тяжелой цепи верблюжьим антителам преимущества перед обычными антителами при разработке, получении и применении клинически ценных соединений. Иммуноглобулин из верблюда предпочтительно содержит по меньшей мере один константный домен, выбранный из группы, состоящей из CH1, CH2 и CH3. Согласно предпочтительному воплощению настоящего изобретения участки петель в CH1, CH2 иCH3 верблюжьего иммуноглобулина включают аминокислоты 8-20, аминокислоты 24-39, аминокислоты 42-78, аминокислоты 82-85, аминокислоты 91-103 и аминокислоты 108-117. Согласно предпочтительному воплощению настоящего изобретения специфическое связывание модифицированного иммуноглобулина с молекулой определяют методом связывания, выбранным из группы, состоящей из иммунологических методов, предпочтительно методов ферментного иммуносорбентного анализа (ELISA), поверхностного плазмонного резонанса, разностной спектроскопии ядерного магнитного резонанса с насыщающим переносом, спектроскопии ядерного магнитного резонанса с переносом NOE (trNOE), конкурентными методами, методами тканевого связывания, методами связывания с живыми клетками и методами клеточных экстрактов. Анализ связывания может проводиться рядом методов, известных в этой области, включая, но не ограничиваясь этим, методы на основе FRET (флуоресценции с резонансным переносом энергии) иBRET (биолюминесценции с резонансньм переносом энергии), AlphaScreen (гомогенного анализа близости по усилению люминесценции), анализа близости по сцинтилляции, ELISA (ферментного иммуносорбентного анализа), SPR (поверхностного плазмонного резонанса, также известного как Biacore),изотермической титрационной калориметрии, дифференциальной сканирующей калориметрии, гельэлектрофореза и хроматографии, включая гель-фильтрацию. В этих и других методах могут использоваться партнеры по слиянию или метки. Модифицированный иммуноглобулин предпочтительно конъюгируют с меткой, выбранной из группы, состоящей из органических молекул, ферментных меток, радиоактивных меток, окрашенных меток, флуоресцентных меток, хромогенных меток, люминесцентных меток, гаптенов, дигоксигенина,биотина, комплексных соединений металлов, металлов, коллоидного золота и их смесей. Модифицированный иммуноглобулин может быть конъюгирован с другими молекулами, которые позволяют простое детектирование данного конъюгата, к примеру, в методах анализа связывания (например, ELISA) и в опытах по связыванию. Следующий аспект настоящего изобретения касается иммуноглобулина, состоящего из константного домена, выбранного из группы, состоящей из CH1, CH2, CH3, CH4, C, С, или его части, в том числе мини-домена, или их комбинаций, по меньшей мере с одним участком петли, и отличающегося тем, что данный по меньшей мере один участок петли содержит по меньшей мере одну аминокислотную модификацию, образующую по меньшей мере один модифицированный участок петли, причем данный по меньшей мере один модифицированный участок петли специфически связывается по меньшей мере с одним эпитопом антигена. Предпочтительно по меньшей мере один модифицированный домен антитела (= связывающийся со специфическим партнером через невариабельные последовательности или структурную петлю) молекулярно соединяют по меньшей мере с одной другой связывающейся молекулой, которая может представлять собой антитело, фрагмент антитела, растворимый рецептор, лиганд или другой модифицированный домен антитела. Молекулу выбирают из группы, состоящей из белковых молекул, нуклеиновых кислот и углеводов. Участки петель модифицированных иммуноглобулинов могут специфически связываться со связывающимися молекулами любого типа, в частности с белковыми молекулами, белками, пептидами, полипептидами, нуклеиновыми кислотами, гликанами, углеводами, липидами, небольшими органическими молекулами, неорганическими молекулами. Конечно, модифицированные иммуноглобулины могут содержать по меньшей мере два участка петель, при этом каждый из участков петель может специфически связываться с другими молекулами или эпитопами. Согласно предпочтительному воплощению настоящего изобретения с модифицированным участком структурной петли связывается молекула, выбранная из группы, состоящей из раковых антигенов, в частности ЕрСАМ, ракового гликопротеина-72 (TAG-72), ракового антигена СА 125, специфического мембранного антигена простаты (PSMA), высокомолекулярного антигена, связанного с меланомойTRAIL, A1-рецептора аденозина, рецептора -лимфотоксина, TACI, BAFF-R, EPO, LFA-3, ICAM-1,ICAM-3, 1-интегрина, 2-интегрина, 4/7-интегрина, 2-интегрина, 3-интегрина, 4-интегрина, 5 интегрина, 6-интегрина, V-интегрина, V/3-интегрина, FGFR-3, фактора роста кератинбцитов, VLA1, VLA-4, L-селектина, анти-Id, Е-селектина, HLA, HLA-DR, CTLA-4, Т-клеточных рецепторов, В 7-1, В 72, VNR-интегрина, TGF-1, TGF-2, эотаксина-1, BLyS (стимулятора В-лимфоцитов), комплемента С 5,IgE, фактора VII, CD64, CBL, NCA 90, EGFR (ErbB-1), Her2/neu (ErbB-2), Her3 (ErbB-3), Her4 (ErbB4),тканевого фактора, VEGF, VEGF-R, рецептора эндотелина, VLA-4, таких углеводов, как антигены групп крови и родственные углеводы, Galili-гликозилирования, гастрина, рецепторов гастрина, раковых углеводов, гаптена NP-cap или NIP-cap, Т-клеточного рецептора /, Е-селектина, дигоксина, плацентарной щелочной фосфатазы (PLAP) и PLAP-подобной щелочной фосфатазы яичек, рецептора трансферрина,гепараназы I, сердечного миозина человека, гликопротеида IIb/IIIa (GPIIb/IIIa), гликопротеида gH оболочки цитомегаловируса человека (HCMV), gp120 ВИЧ, HCMV, гликопротеида F респираторного синцитиального вируса (RSV), Fgp RSVF, VNR-интегрина, gp120 вируса Hep В, CMV, gpIIbIIIa, петли V3gp120 ВИЧ IIIB, Fgp респираторного синцитиального вируса (RSV), гликопротеида gD вируса Herpes Модифицированный иммуноглобулин по настоящему изобретению может предпочтительно связываться с одной из молекул, приведенных выше. Эти молекулы также охватывают аллергены. Согласно следующему предпочтительному воплощению настоящего изобретения подвергаются модификации аминокислотные остатки CH3 в положениях 15-17, 29-34, 85.4-85.3, 92-94, 97-98 и/или 108110. Модификация иммуноглобулина по настоящему изобретению предпочтительно представляет собой делецию, замену или вставку. Согласно настоящему изобретению по меньшей мере 1, предпочтительно по меньшей мере 2, 3, 4,5, 6, 7, 8, 9, 10 и 15 аминокислот подвергаются делеции, замене на другие аминокислоты (в том числе модифицированные аминокислоты) или вставке в участок петли иммуноглобулина. Однако максимальное число аминокислот, вставленных в участок петли иммуноглобулина, не может превышать 30, предпочтительно 25, более предпочтительно 20 аминокислот. Замена и вставка аминокислот предпочтительно осуществляется случайным образом известными в этой области методами и так, как изложено в настоящем патенте. Иммуноглобулин по изобретению согласно конкретному воплощению отличается тем, что участокCH3 включает SEQ ID No. 16 или SEQ ID No. 18, если с данным иммуноглобулином связывается EpCam,SEQ ID No. 20, если с данным иммуноглобулином связывается флуоресцеин, SEQ ID No. 22, 24, 26, 28,30 или 32, если с данным иммуноглобулином связывается лизоцим, SEQ ID No. 34, 36, 38 или 40, если с данным иммуноглобулином связывается TLR9, и SEQ ID No. 42, если с данным иммуноглобулином связывается лизоцим и/или эритропоэтин. Согласно особому воплощению изобретения иммуноглобулин отличается тем, что он включаетSEQ ID No. 44 или SEQ ID No. 46, если с данным иммуноглобулином связывается лизоцим и gp41. Модифицированный иммуноглобулин предпочтительно конъюгируют с меткой или репортерной молекулой, выбранной из группы, состоящей из органических молекул, ферментных меток, радиоактивных меток, окрашенных меток, флуоресцентных меток, хромогенных меток, люминесцентных меток,гаптенов, дигоксигенина, биотина, комплексных соединений металлов, металлов, коллоидного золота и их смесей. Модифицированные иммуноглобулины, конъюгированные с метками, как указано выше, могут применяться, к примеру, в диагностических методах. Следующий аспект настоящего изобретения касается применения иммуноглобулина по настоящему изобретению или получаемого способом согласно настоящему изобретению для получения вакцины для активной иммунизации. При этом иммуноглобулин используется либо как антигенное лекарственное вещество для составления вакцины, либо для вылавливания или захвата антигенных структур для применения в составе вакцины. Следующий аспект настоящего изобретения касается применения иммуноглобулина по настоящему изобретению или получаемого способом согласно настоящему изобретению для получения белковой библиотеки иммуноглобулинов. Следующий аспект настоящего изобретения касается способа специфического связывания и/или детектирования молекул, включающего стадии:(a) контактирования модифицированного иммуноглобулина по настоящему изобретению или модифицированного иммуноглобулина, получаемого способом по настоящему изобретению, с тестируемым образцом, предположительно содержащим данную молекулу;(b) детектирования возможного образования специфического комплекса иммуноглобулин/молекула. Следующий аспект настоящего изобретения касается способа специфического выделения молекул,включающего стадии:(a) контактирования модифицированного иммуноглобулина по настоящему изобретению или модифицированного иммуноглобулина, получаемого способом по настоящему изобретению, с образцом,содержащим данную молекулу;(b) отделения образовавшегося специфического комплекса иммуноглобулин/молекула и(c) необязательно выделения молекулы из данного комплекса. Иммуноглобулины по настоящему изобретению могут применяться для специфического выделения молекул из образца. При использовании мультиспецифических иммуноглобулинов из образца можно выделить более одного вида молекул. Особенно предпочтительно применение модифицированных иммуноглобулинов в таких методах, так как это позволяет, например, создать матрикс, имеющий однородную поверхность с определенным количеством иммобилизованных на ней партнеров связывания (т.е. модифицированных иммуноглобулинов), способных связываться с выделяемыми молекулами. В отличие от этого при использовании моноспецифических партнеров связывания невозможно создать однородный матрикс, так как одинарные партнеры связывания не связываются с матриксом с такой же эффективностью. Следующий аспект настоящего изобретения касается способа доставки соединения к мишени,включающего стадии:(a) контактирования модифицированного иммуноглобулина по настоящему изобретению или модифицированного иммуноглобулина, получаемого способом по настоящему изобретению, способного специфически связываться с данным соединением;(b) доставки комплекса иммуноглобулин/соединение к мишени. Модифицированные иммуноглобулины по настоящему изобретению могут применяться для доставки по меньшей мере одного соединения, связанного с участками CDR или модифицированными участками петель, к мишени. Такие иммуноглобулины могут применяться для доставки лекарственных веществ к предпочтительному месту действия в ходе лечения заболевания. Следующий аспект настоящего изобретения касается белковой библиотеки, содержащей иммуноглобулины по настоящему изобретению или получаемые способом по настоящему изобретению. Предпочтительные методы конструирования такой библиотеки можно найти выше и в примерах. Библиотека по настоящему изобретению может применяться для идентификации иммуноглобулинов,связывающихся с определенной молекулой. В частности, настоящее изобретение касается применения белковой библиотеки, содержащей иммуноглобулины по настоящему изобретению или получаемые способом по настоящему изобретению,для разработки производных иммуноглобулина. Существующий иммуноглобулин можно изменить введением антигенсвязывающих сайтов в любой домен или мини-домен с помощью белковой библиотеки соответствующего домена из по меньшей мере 10, предпочтительно 100, более предпочтительно 1000,еще более предпочтительно 10000, еще более предпочтительно 100000, наиболее предпочтительно более чем 1000000 вариантов домена по меньшей мере с одной модифицированной петлей. Затем библиотека подвергается скринингу на связывание со специфическим антигеном. После молекулярной характеристики насчет желательных свойств отобранный домен или мини-домен клонируют в исходный иммуноглобулин методами генетической конструирования с тем, чтобы он заменил участок дикого типа. С другой стороны, можно заменить только ДНК, кодирующую петли или кодирующую мутантные аминокислоты, получая иммуноглобулин с дополнительным сайтом связывания для определенного антигена. Выбор места для мутированной, специфической к антигену структурной петли зависит от структуры исходного иммуноглобулина и от назначения дополнительного сайта связывания. Если, к примеру,исходная молекула представляет собой полный иммуноглобулин, в который нужно вставить дополнительный антигенсвязывающий сайт, не нарушая эффекторную функцию, то подлежащие модификации петли отбирают из доменов, удаленных от CH2 и CH3, которые являются естественными партнерами связывания для Fc-эффекторных молекул. Если же исходный иммуноглобулин представляет собой Fab, то возможна модификация петель в константных доменах легких или тяжелых цепей либо соответствующих вариабельных доменов. Для создания библиотеки можно получить библиотеки из мутантных исходных молекул, имеющих мутации в одной или нескольких структурных петлях одного или нескольких доменов. Селекция полных мутированных исходных молекул может иметь некоторые преимущества, так как селекция на связывание антигена с модифицированной структурной петлей будет давать стерически выгодные модификации, если их тестировать также и на другие свойства, которые должен проявлять мутированный иммуноглобулин. Требования к размеру белковой библиотеки (т.е. количеству вариантов белка) мутированного домена или мини-домена либо слитой молекулы домена зависит от задачи. В общем, для создания антигенсвязывающего сайта de novo библиотека должна быть большей, чем библиотека, используемая для дополнительной модификации уже существующего встроенного антигенсвязывающего сайта, образованного из модифицированной структурной петли (например, для повышения сродства или изменения тонкой специфичности к антигену). Настоящее изобретение также касается библиотеки иммуноглобулинов или библиотеки нуклеиновых кислот, содержащей несколько иммуноглобулинов, например, константный или вариабельный домен, мини-домен и/или по меньшей мере один участок структурной петли, содержащийся в минидомене, либо молекулы нуклеиновых кислот, их кодирующих. Библиотека содержит представителей с различными модификациями, причем множество определяется модификациями по меньшей мере в одном участке структурной петли. Библиотека нуклеиновых кислот предпочтительно включает по меньшей мере 10 различных представителей (происходящих из замены одной аминокислоты), более предпочтительно включает по меньшей мере 100, более предпочтительно 1000 или 10000 различных представителей (например, сконструированных методами рандомизации или комбинаторными методами). Также предпочтительно еще большее разнообразие количества индивидуальных представителей, например, по меньшей мере 1000000 или по меньшей мере 10000000. Следующий аспект изобретения составляет комбинирование двух разных доменов или минидоменов, выбранных по меньшей мере из двух библиотек согласно изобретению для создания мультиспецифических иммуноглобулинов. Эти выбранные специфические иммуноглобулины можно комбинировать друг с другом и с другими молекулами, по блочному принципу, чтобы разработать оптимальное расположение доменов или мини-доменов и получить желательные свойства. Кроме того, можно ввести один или несколько модифицированных иммуноглобулинов в различные или во все возможные сайты белка, не нарушая структуру белка. Таким методом "перетасовки доменов" создаются новые библиотеки, которые можно опять подвергнуть селекции на желательные свойства. Предпочтительно библиотека содержит иммуноглобулины по изобретению, выбранные из группы,состоящей из доменов иммуноглобулина, мини-доменов или их производных. Предпочтительное воплощение изобретения составляют молекулы, связывающие антиген (антигенсвязывающие молекулы), содержащие по меньшей мере один домен иммуноглобулина и участок структурной петли, подвергшийся модификации согласно настоящему изобретению для связывания с антигеном, причем данные связывающие молекулы не содержат вариабельных доменов антител. Они могут содержать другие части, используемые для активности антител (например, природные или модифицированные эффекторные участки (последовательности, однако они не содержат "природного" связывающего участка антител, т.е. вариабельных доменов в их естественном положении. Эти антигенсвязывающие молекулы по настоящему изобретению обладают преимуществами, описанными выше для данных молекул, хотя и без специфической связывающей активности антител, но с новой специфической связывающей активностью, введенной в участок структурной петли. Предпочтительно эти антигенсвязывающие молекулы по настоящему изобретению содержат CH1,CH2, CH3, CH4, C, С и их комбинации, причем данные комбинации включают по меньшей мере два,предпочтительно по меньшей мере четыре, в особенности по меньшей мере шесть константных доменов и по меньшей мере один участок структурной петли, модифицированный согласно настоящему изобретению. Предпочтительно эти участки структурных петель соединяются либо через участок структурной петли, модифицированный по настоящему изобретению, либо через структурные петли, находящиеся естественным образом между двумя такими константными доменами. Одно воплощение этих антигенсвязывающих молекул по настоящему изобретению состоит из Fc-участка антитела по меньшей мере с одной модификацией в структурной петле согласно настоящему изобретению. В отношении антигенсвязывающих молекул по настоящему изобретению также предпочтительно, чтобы новые антигенсвязывающие сайты вводились в структурные петли по принципу рандомизации, т.е. путем замены одного или нескольких аминокислотных остатков петли слепыми методами или путем введения созданных случайным образом вставок в такие структурные петли. В качестве альтернативы предпочтительно применение комбинаторных подходов. Согласно следующему аспекту настоящее изобретение касается модифицированного иммуноглобулина, содержащего антигенсвязывающий сайт, чужеродный по отношению к немодифицированному иммуноглобулину и встроенный в одну или несколько структурных петель. Термин "чужеродный" означает то, что антигенсвязывающий сайт не образован естественным путем в специфической области иммуноглобулина, и связывается с ним не естественный партнер связывания иммуноглобулина, а чужеродный партнер связывания. Это значит, что такой связывающийся партнер, как Fc-рецептор или эффектор иммунной системы, не может связываться антигенсвязывающим сайтом, чужеродным по отношению к немодифицированному иммуноглобулину. Предпочтительно антиген выбирают из группы, состоящей из антигенов патогенных микроорганизмов, раковых антигенов, ферментов, субстратов, аутоантигенов, органических молекул или аллергенов. Более предпочтительно антиген выбирают из группы, состоящей из вирусных антигенов, бактериальных антигенов или антигенов из патогенов эукариот или фагов. К предпочтительным вирусным антигенам относятся антигены HAV, HBV, HCV, HIV I, HIV II, парвовируса, вируса гриппа, HSV, вирусов гепатита, флавивирусов, вируса Западного Нила, вируса Эбола, поксвирусов, вируса оспы, вируса кори,герпесвирусов, аденовирусов, вируса папилломы, вируса полиомы, парвовирусов, риновирусов, вируса Коксаки, вируса полиомиелита, эховирусов, вируса японского энцефалита, вируса Денге, вируса клещевого энцефалита, вируса желтой лихорадки, коронавирусов, респираторного синцитиального вируса, вируса парагриппа, вируса Ла Кросс, вируса Ласса, вируса бешенства, ротавирусов; к предпочтительньм бактериальным антигенам относятся антигены Pseudomonas, Mycobacterium, Staphylococcus, Salmonella,Meningococcus, Borellia, Listeria, Neisseria, Clostridium, Escherichia, Legionella, Bacillus, Lacrobacillus,Streptococcus, Enterococcus, Corynebacterium, Nocardia, Rhodococcus, Moraxella, Brucella, Campylobacter,Cardiobacterium, Francisella, Helicobacter, Haemophilus, Klebsiella, Shigella, Yersinia, Vibrio, Chlamydia,Leptospira, Rickettsia, Mycobacterium, Treponema, Bartonella. К предпочтительным антигенам патогенных эукариот относятся антигены из Giardia, Toxoplasma, Cyclospora, Cryptosporidium, Trichinella, дрожжей,Candida, Aspergillus, Cryptococcus, Blastomyces, Histoplasma, Coccidioides. Предпочтительно иммуноглобулины по настоящему изобретению содержат по меньшей мере два антигенсвязывающих сайта, при этом первый сайт связывается с первым эпитопом, а второй сайт связывается со вторым эпитопом. Согласно предпочтительному воплощению иммуноглобулин настоящего изобретения содержит по меньшей мере два участка петель, при этом первый участок петли связывается с первым эпитопом, а второй участок петли связывается со вторым эпитопом. По меньшей мере либо первый, либо второй участок петли, либо оба могут содержать структурную петлю. Иммуноглобулины по настоящему изобретению охватывают и их фрагменты, о которых в данной области известно, что они являются функциональными, и которые содержат основные элементы по настоящему изобретению: участок структурной петли,модифицированный согласно настоящему изобретению. Предпочтительно иммуноглобулин по настоящему изобретению состоит по меньшей мере из двух доменов иммуноглобулина или их частей, включая мини-домены, и каждый домен содержит по меньшей мере один антигенсвязывающий сайт. Также предпочтительно иммуноглобулин по изобретению содержит по меньшей мере один домен константной области и/или по меньшей мере один домен вариабельной области иммуноглобулина либо их части, включая мини-домены. Таким образом, одним из предпочтительных воплощений является вариабельный домен, который, к примеру, модифицирован по С-концевому участку, либо вариабельный домен, соединенный с модифицированным участком CH1, к примеру, модифицированным мини-доменомCH1. Предпочтительный иммуноглобулин по изобретению содержит домен, который по меньшей мере на 50% гомологичен немодифицированному домену. Термин "гомология" означает, что полипептиды имеют одинаковые или консервативные остатки в соответствующих положениях их первичной, вторичной или третичной структуры. Этот термин также распространяется на две или больше нуклеотидные последовательности, кодирующие гомологичные полипептиды."Гомологичный домен иммуноглобулина" означает такой домен иммуноглобулина по изобретению,у которого аминокислотная последовательность по меньшей мере на 50% идентична по отношению к полной нативной последовательности домена иммуноглобулина или любого другого фрагмента полной последовательности домена иммуноглобулина. Предпочтительно у гомологичного домена иммуноглобулина аминокислотная последовательность по меньшей мере на 50% идентична, предпочтительно по меньшей мере на 55% идентична, более предпочтительно по меньшей мере на 60% идентична, более предпочтительно по меньшей мере на 65% идентична, более предпочтительно по меньшей мере на 70% идентична, более предпочтительно по меньшей мере на 75% идентична, более предпочтительно по меньшей мере на 80% идентична, более предпочтительно по меньшей мере на 85% идентична, более предпочтительно по меньшей мере на 90% идентична, более предпочтительно по меньшей мере на 95% идентична последовательности нативного домена иммуноглобулина или любого другого специфически определенного фрагмента полноразмерной последовательности домена иммуноглобулина, раскрытой в настоящем изобретении."Степень (%) идентичности аминокислотной последовательности" в отношении последовательностей доменов иммуноглобулина, приведенных в настоящем изобретении, определяется как процентное содержание таких аминокислотных остатков в рассматриваемой последовательности, которые идентичны аминокислотным остаткам в последовательности определенного домена иммуноглобулина после совмещения последовательностей и введения пробелов, если нужно, для достижения максимального процента идентичности последовательностей, при этом не рассматривая консервативные замены как часть идентичности последовательностей. Совмещение в целях определения степени идентичности аминокислотной последовательности может осуществляться различными способами, которые доступны специалистам в этой области, например, с помощью таких общедоступных компьютерных программ, как BLAST,BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в состоянии определить надлежащие параметры для измерения степени совпадения, включая алгоритмы, необходимые для достижения максимального совпадения по всей длине сравниваемых последовательностей. Значения % идентичности аминокислотной последовательности можно получить, как описано ниже, с помощью компьютерной программы WU-BLAST-2 (Altschul et al., Methods in Enzymology 266: 460480 (1996. Большинство значений параметров поиска в WU-BLAST-2 устанавливают по умолчанию. Те параметры, которые не устанавливаются по умолчанию, т.е. настраиваемые параметры, устанавливают на следующие значения: overlap span=1, overlap fraction=0,125, word threshold (T)=11 и scoring matrix=BLOSUM62. При использовании WU-BLAST-2 значение % идентичности аминокислотной последовательности определяется делением (а) числа идентичных аминокислотных остатков, совпадающих между аминокислотной последовательностью рассматриваемого домена иммуноглобулина, у которого последовательность происходит из нативного домена иммуноглобулина, и используемой для сравнения аминокислотной последовательностью (т.е. той последовательностью, с которой сравнивают рассматриваемый домен иммуноглобулина, и которой может служить немодифицированный домен иммуноглобулина),определенного программой WU-BLAST-2, на (б) общее число аминокислотных остатков, не подвергавшихся рандомизации частей рассматриваемого домена иммуноглобулина. Например, в выражении "полипептид, имеющий аминокислотную последовательность А, которая по меньшей мере на 80% идентична аминокислотной последовательности В" аминокислотная последовательность А является рассматриваемой сравниваемой аминокислотной последовательностью, а аминокислотная последовательность В является аминокислотной последовательностью рассматриваемого домена иммуноглобулина. В предпочтительном воплощении иммуноглобулин по изобретению представляет собой биспецифическое антитело или биспецифическое одноцепочечное антитело. Также предпочтительно иммуноглобулин включает биспецифический домен или его часть, в том числе мини-домен. Иммуноглобулин по настоящему изобретению может применяться для любых целей, известных в этой области для иммуноглобулинов, но делает возможными и такие применения, которые зависят от комбинации специфичностей, введенных по настоящему изобретению. Соответственно, иммуноглобули- 18018897 ны по настоящему изобретению предпочтительно используются для терапевтического и профилактического применения (например, в качестве активной или пассивной иммунотерапии), для препаративного и аналитического применения и для диагностического применения. Следующий аспект настоящего изобретения касается набора партнеров связывания, содержащего:(a) модифицированный иммуноглобулин, содержащий антигенсвязывающий сайт, чужеродный для этого иммуноглобулина, встроенный в одну или несколько структурных петель, и(b) связывающуюся молекулу, содержащую эпитоп данного антигена. Такая связывающаяся молекула из этого набора по настоящему изобретению может применяться для идентификации специфичности связывания модифицированного иммуноглобулина согласно настоящему изобретению. С помощью связывающейся молекулы из этого набора по настоящему изобретению можно определять активность (силу действия) модифицированных иммуноглобулинов по настоящему изобретению. Активность в настоящем изобретении определяется как свойство связывания модифицированной молекулы со своим антигеном. Связывание может определяться количественно и/или качественно в смысле специфичности и/или авидности, как это делается в целях контроля качества. Кроме того, связывающаяся молекула из набора по настоящему изобретению может применяться для селекции модифицированного иммуноглобулина по настоящему изобретению из библиотеки, состоящей по меньшей мере из 10, предпочтительно по меньшей мере 100, более предпочтительно по меньшей мере 1000, более предпочтительно по меньшей мере 10000, в особенности по меньшей мере 100000 иммуноглобулинов с различными модификациями в структурных петлях. В соответствии с настоящим изобретением одна из ключевых особенностей настоящего изобретения состоит в том, что конструирование доменов иммуноглобулина происходит в тех участках, которые в норме не участвуют в связывании антигена, иными словами, в участках антитела, отличных от участков CDR. Было отмечено, что специфическая укладка доменов иммуноглобулина позволяет вводить случайные мутации в такие участки, которые по структуре аналогичны участкам CDR, но отличаются положением в последовательности. Участки, идентифицированные в настоящем изобретении, как и участкиCDR, представляют собой участки петель, соединяющих -отрезки в укладке иммуноглобулина. В частности, в настоящем изобретении описано, что при введении случайных мутаций в петли, соединяющие -отрезки А-В и E-F домена CH3 IgG1 человека, были отобраны мутированные домены CH3,которые специфически связываются либо с пептидом-9 Toll-подобного рецептора (TLR-9), либо с яичным лизоцимом курицы, причем данный пептид и данный белок, соответственно, в норме не распознаются и не связываются доменами CH3 IgG1 человека. Введенные нами мутации включают такие мутации,при которых отдельные аминокислотные остатки в последовательности дикого типа были заменены выбранными случайным образом остатками, а также они включают вставку дополнительных аминокислотных остатков в петли, указанные выше. По аналогии, домены иммуноглобулинов из любого класса иммуноглобулинов и полученных из любых видов могут быть подвергнуты конструированию этого типа. Кроме того, таким же образом можно видоизменять не только конкретные петли, затрагиваемые в настоящем изобретении, но и любые петли, соединяющие -цепи в доменах иммуноглобулина. Подвергшиеся конструированию домены иммуноглобулина из любого организма и из любого класса иммуноглобулинов могут применяться по настоящему изобретению либо как таковые (в виде одиночных доменов), либо в составе более крупных молекул. Например, они могут входить в состав интактного иммуноглобулина, у которого, соответственно,будет свой "нормальный" антигенсвязывающий участок, образованный 6 участками CDR, и новый,встроенный антигенсвязывающий участок. Аналогичным образом можно создать мультиспецифический,например, биспецифический иммуноглобулин. Подвергшиеся конструированию домены иммуноглобулина также могут входить в состав любого слитого белка. Применение таких подвергшихся конструированию доменов иммуноглобулина входит в общую область применения иммуноглобулинов. Под доменами иммуноглобулина подразумеваются домены следующих иммуноглобулинов: 1. Одиночные домены иммуноглобулина, подвергнутые рандомизации с одной стороны, т.е. либо в петлях, соединяющих -цепи В-С, D-E или F-G ("верхушка" за исключением тех вариабельных доменов,которые защищены многими патентами), либо -отрезки А-В, C-D (С-С и C"-D в случае вариабельных доменов) или E-F ("основание"). Рандомизации могут подвергаться одиночные петли или любые комбинации петель. Остатки могут подвергаться замене, делеции или вставке добавочных остатков. 2. Одиночные домены иммуноглобулина, подвергнутые рандомизации с обеих сторон, на верхушке и основании. 3. Любые белки, содержащие один из подвергнутых рандомизации одиночных доменов, как то:b) одноцепочечные Fv, подвергнутые рандомизации по "основанию", т.е. со стороны, противоположной участкам CDR;c) фрагменты Fab, подвергнутые рандомизации по "основанию", т.е. на С-конце домена CH1 и домена CL;d) фрагменты Fc (т.е. белки, состоящие из CH2-CH3), подвергнутые рандомизации с одной или с обеих сторон,e) полные иммуноглобулины, подвергнутые рандомизации по основанию Fc,f) другие подходящие домены. Главные преимущества одиночных доменов: очень похожи на все те доводы, которые использовались для внедрения верблюжьих VH-молекул ("нанотел", см. www.ablynx.com). Рандомизированные домены иммуноглобулина являются очень небольшими белками (молекулярный вес около 12-15 кДа в зависимости от количества встроенных аминокислотных остатков), поэтому они должны обладать следующими преимуществами перед обычными антителами или фрагментами антител типа scFv и Fab: распознавание редко встречающихся или скрытых эпитопов, связывание в полости или активном сайте белка мишени, легкость получения и многие другие. В случае домена иммуноглобулина, подвергнутого рандомизации с обеих сторон, можно создать двухвалентную или биспецифическую молекулу. Основным преимуществом одиночных доменов в составе слитых белков является то, что можно встроить дополнительные параметры связывания в любой другой белок. Предусматривается, что для получения этих белков можно использовать любые системы экспрессии. Аналогию описанным в настоящем изобретении одиночным доменам можно обнаружить в антителах верблюда, у которых есть только VH, но нет VL. В этих белках за связывание антигена отвечают только 3 участка CDR (вместо 6 у "нормальных" антител). Следующие патентные ссылки включены в настоящее изобретение путем отсылки во всей полноте.US 5844094. Target binding polypeptide. Далее настоящее изобретение иллюстрируется нижеследующими фигурами и примерами, но не ограничивается ими. Краткое описание фигур На фиг. 1 а представлена структура интактного IgG1. Домены показаны стрелками. На фиг. 1b представлена структурная организация мономеров основных изотипов иммуноглобулина человека. Дисульфидные связи представлены линиями, N-связанные группы углеводов показаны кружочками. На фиг. 2 представлена укладка иммуноглобулина для константного (слева) и вариабельного (справа) домена иммуноглобулина. -Отрезки указаны стрелками. На фиг. 3 представлена молекулярная модель подвергнутого конструированию домена CH1 согласно настоящему изобретению, при этом рандомизованная часть представлена доступной растворителю поверхностью. Эта поверхность обведена кружком. На фиг. 4 представлена схема реакций ПЦР для получения фрагментов, использовавшихся для сборки мутированного домена CH3. Праймеры для ПЦР указаны стрелками при соответствующей ориентации 5'-3', а вертикальные линии обозначают приблизительное положение введенных сайтов рестрикции, использовавшихся для сборки мутированного гена. В праймерах для лигирования ПЦР-фрагментов содержатся следующие рестрикционные сайты: CH3LNCO: NcoI; CH3LSAC и CH3CSAC: SacI;CH3CHIN и CH3RHIN: HindIII; CH3RNOT: NotI. На фиг. 5 представлены некоторые примеры того, как могут использоваться домены иммуноглобулина по настоящему изобретению. Рандомизованные участки обозначены звездочками. Специфичности рандомизованных участков могут быть как идентичными, так и различными. На фиг. 6 представлена схема конструирования биспецифического искусственного домена CH3. Названия праймеров приведены в рамках, а стрелками указано направление, в котором происходит наращивание праймера. Косой штриховкой обозначено относительное положение участков, подвергавшихся рандомизации в данной конструкции, а прямой штриховкой обозначено относительное положение участ- 20018897 ков, введенных для получения клона С 24, и приведены рестрикционные сайты, использовавшиеся при клонировании. На фиг. 7 представлена схема конструирования биспецифического искусственного домена CH3. Приведена нуклеотидная последовательность и е трансляция в основной конструкции биспецифического искусственного домена CH3. Красным цветом выделены участки, подвергавшиеся рандомизации для создания биспецифической конструкции, а зеленым цветом выделены участки, в которых проводилась рандомизация последовательности для создания клона С 24. На фиг. 8 представлен перечень последовательностей, раскрытых в настоящем изобретении. Примеры Пример 1. Конструирование библиотеки CH3 и дисплей на поверхности фага. При конструировании мутированного домена CH3 использовали кристаллическую структуру Fcфрагмента IgG1, которая опубликована в базе данных Brookhaven как объект loqo.pdb. Последовательность, лежащая в основе конструкции библиотеки CH3, приведена в SEQ ID No. 1. В этой последовательности первая аминокислота соответствует пролину 343 цепи А объекта loqo.pdb базы данных Brookhaven. Последним остатком, содержащимся в loqo.pdb, является серин 102 из SEQ ID No. 1. После детального анализа структуры loqo.pdb и визуального осмотра остатков, образующих петли, соединяющие -отрезки, было решено подвергнуть рандомизации остатки 17, 18 и 19, которые входят в состав петли, соединяющей -цепи А-В, а также остатки 71, 72, 73, 76 и 77, которые входят в состав петли, соединяющей -цепи E-F в SEQ ID No. 1. Молекулярная модель подвергаемого конструированию домена CH3, на которой рандомизованная часть представлена как доступная растворителю поверхность,приведена на фиг. 3. Подвергаемый конструированию ген получали при помощи ряда реакций ПЦР с последующим лигированием продуктов ПЦР. Чтобы облегчить лигирование, некоторые кодоны в нуклеотидной последовательности, кодирующей SEQ ID No. 1, подвергали модификации так, чтобы получить рестрикционные сайты без изменения аминокислотной последовательности (молчащие мутации). Для встраивания в клонирующий вектор pHENl (Nucleic Acids Res. 1991 Aug 11, 19(15): 4133-7. Multisubunit proteins on the surface of filamentous phage: methodologies for displaying antibody (Fab) heavy andlight chains. Hoogenboom HR, Griffiths AD, Johnson KS, Chiswell DJ, Hudson P, Winter G.) в одной рамке с сигналом секреции pelB на 5'-конец последовательности вставляли дополнительные нуклеотиды, кодирующие Met-Ala, получая сайт рестрикции NcoI. Для рандомизации остатков выбрали кодон NNS (кодIUPAC, где S означает С или G), который кодирует все 20 встречающихся в природе аминокислот, но обходит 2 из 3 стоп-кодонов. Подвергаемая конструированию последовательность приведена в виде нуклеотидной последовательности SEQ ID No. 2 и в виде аминокислотной последовательности SEQ ID No. 3. Буквой X в SEQ ID No. 3 обозначены подвергаемые рандомизации аминокислотные остатки. Последовательности праймеров для ПЦР при сборке мутированного домена CH3 приведены в SEQ ID No. 4-9. На фиг. 4 схематически представлены ПЦР-фрагменты, созданные для сборки мутированного гена, и использовавшиеся для этого праймеры. В качестве матрицы для реакций ПЦР использовали кДНК тяжелой цепи моноклонального антитела 3D6 человека (Felgenhauer M., Kohl J., Ruker F. Nucleotide sequences of the cDNAs encoding the Vregions of H- and L-chains of a human monoclonal antibody specific to HIV-1 gp41. Nucleic Acids Res. 1990Aug 25, 18(16): 4927). Bce 3 продукта ПЦР расщепляли с помощью SacI и/или HindIII, соответственно, и лигировали друг с другом. Продукт лигирования далее расщепляли с помощью NcoI и NotI и лигировали в фагомидный вектор для поверхностного дисплея pHEN1, предварительно расщепленный NcoI и NotI. Несколько отобранных клонов проверяли рестрикционным анализом и секвенированием ДНК и убедились, что они содержат намеченную вставку, включая встроенные правильным образом рандомизованные последовательности. На последующих стадиях получения фага следовали стандартным методикам. Вкратце, смесью для лигирования трансформировали клетки Е. coli TG1 методом электропорации. После этого из клеток Е. coli TG1 выделяли частицы фага с помощью фага-хелпера M13-K07. Затем частицы фага осаждали из супернатантов культур с помощью ПЭГ/NaCl в 2 стадии, растворяли в воде и использовали для селекции методом пэннинга или, в качестве альтернативы, хранили при -80 С. Пример 2. Конструирование библиотеки CH3+3. Эту библиотеку конструировали и клонировали таким же образом, как и библиотеку CH3. Аминокислотная последовательность конструкции приведена в SEQ ID No. 10, соответствующая нуклеотидная последовательность - в SEQ ID No. 11, и при конструировании использовали праймеры SEQ ID No. 4-7,SEQ ID No. 9 и SEQ ID No. 12. Пример 3. Конструирование библиотеки CH3+5. Эту библиотеку конструировали и клонировали таким же образом, как и библиотеку CH3. Аминокислотная последовательность конструкции приведена в SEQ ID No. 13, соответствующая нуклеотидная последовательность - в SEQ ID No. 14, и при конструировании использовали праймеры SEQ ID No. 4-7,SEQ ID No. 9 и SEQ ID No. 15. Пример 4. Пэннинг фаговой библиотеки CH3 на пептиде TLR-9. Проводили 3 цикла пэннинга по стандартным методикам. Вкратце, применяли следующий метод. 96-луночные планшеты Maxisorp (Nunc) сенсибилизировали синтетическим пептидом, составляющим часть последовательности Toll-подобного рецептора-9 (TLR-9). В лунки вносили по 200 мкл следующего раствора: 0,1 М Na-карбонатный буфер, рН 9,6, при следующих концентрациях растворенного пептида: Инкубировали в течение 1 ч при 37 С, а затем блокировали 2% сухим молоком (M-PBS) по 200 мкл на лунку в течение 1 ч при комнатной температуре. После этого библиотеку дисплея на поверхности фага оставляли реагировать с фиксированным пептидом добавлением 100 мкл суспензии фага и 100 мкл 4% сухого молока (M-PBS), а затем инкубировали в течение 45 мин со встряхиванием и 90 мин без встряхивания при комнатной температуре. Несвязавшиеся частицы фага отмывали следующим образом. После 1-го цикла пэннинга: 10300 мкл T-PBS, 5300 мкл PBS; после 2-го цикла пэннинга: 15300 мкл Т-PBS, 10300 мкл PBS; после 3-го цикла пэннинга: 20300 мкл T-PBS, 20300 мкл PBS. Элюирование связавшихся частиц фага осуществляли добавлением в лунки по 200 мкл 0,1 М глицина, рН 2,2 и инкубировали со встряхиванием в течение 30 мин при комнатной температуре. После этого суспензию фага нейтрализировали добавлением 60 мкл 2 М трис-основания, а затем инфицировали клетки Е. coli TG1 смешиванием 10 мл культуры в экспоненциальной фазе роста с 0,5 мл элюированного фага и инкубировали 30 мин при 37 С. Наконец, инфицированные бактерии высевали на чашки со средой TYE с 1% глюкозы и 100 мкг/мл ампициллина и инкубировали при 30 С в течение ночи. Таблица 1 Результаты пэннинга фаговой библиотеки CH3 на пептиде TLR-9 (титры фага) Пример 5. Клонирование отобранных клонов мутантов CH3 при селекции по TLR-9 для растворимой экспрессии. Выделяли фагомидную ДНК методом Midi-prep из фага, прошедшего 3 цикла селекции пэннингом. ДНК, кодирующую мутированные участки CH3, целиком амплифицировали методом ПЦР и клонировали по NcoI-NotI в вектор pNOTBAD/Myc-His, представляющий собой вектор pBAD/Myc-His (Invitrogen) для экспрессии в Е. coli со вставленным сайтом рестрикции NotI, облегчающим клонирование. Лигированными конструкциями трансформировали клетки Е. coli LMG194 (Invitrogen) методом электропорации и культивировали при 30 С на среде TYE с 1% глюкозы и ампициллином в течение ночи. Отобранные клоны инокулировали в 200 мкл среды 2YT с ампициллином, культивировали в течение ночи при 30 С и индуцировали добавлением L-арабинозы до конечной концентрации 0,1%. После экспрессирования при 16 С в течение ночи клетки собирали центрифугированием и обрабатывали 100 мкл Na-боратного буфера, рН 8,0, при 4 С в течение ночи для получения периплазматических экстрактов. По 50 мкл периплазматических экстрактов использовали в методе ELISA (см. ниже). Пример 6. ELISA мутантов CH3, отобранных по TLR-9. Отобранные клоны анализировали на специфическое связывание с пептидом TLR-9 методом Таблица 2 Результаты проверки методом ELISA Фон (только антиген) (12 параллельных измерений): 0,0115. Пример 7. Пэннинг фаговой библиотеки CH3 и CH3+5 на лизоциме куриного яйца. Проводили 3 цикла пэннинга. 96-луночные планшеты Maxisorp (Nunc) сенсибилизировали лизоцимом куриного яйца (HEL) внесением 200 мкл на лунку следующего раствора: PBS, при следующих концентрациях растворенного яичного лизоцима: Инкубировали в течение 1 ч при 37 С, а затем блокировали 2% сухим молоком (M-PBS) по 200 мкл на лунку в течение 1 ч при комнатной температуре. После этого библиотеку дисплея на поверхности фага оставляли реагировать с фиксированным яичным лизоцимом добавлением 100 мкл суспензии фага и 100 мкл 4% сухого молока (M-PBS), а затем инкубировали в течение 45 мин со встряхиванием и 90 мин без встряхивания при комнатной температуре. Несвязавшиеся частицы фага отмывали следующим образом: Элюирование связавшихся частиц фага осуществляли добавлением в лунки по 200 мкл 0,1 М гли- 23018897 цина, рН 2,2, и инкубировали со встряхиванием в течение 30 мин при комнатной температуре. После этого суспензию фага нейтрализировали добавлением 60 мкл 2 М трис-основания, а затем инфицировали клетки Е. coli TG1 смешиванием 10 мл культуры в экспоненциальной фазе роста с 0,5 мл элюированного фага и инкубировали 30 мин при 37 С. Наконец, инфицированные бактерии высевали на чашки со средой TYE с 1% глюкозы и 100 мкг/мл ампициллина и инкубировали при 30 С в течение ночи. Таблица 3 Результаты пэннинга фаговой библиотеки CH3 на лизоциме куриного яйца (HEL) (титры фага) Таблица 4 Результаты пэннинга фаговой библиотеки CH3+5 на лизоциме куриного яйца (HEL) (титры фага) Пример 8. Клонирование отобранных клонов из примера 7 для растворимой экспрессии. Клонирование отобранных клонов для растворимой экспрессии осуществляли, как описано выше для мутантов CH3, проходивших селекцию по TLR-9. Пример 9. Растворимая экспрессия отобранных клонов из примера 7. Растворимую экспрессию отобранных клонов осуществляли, как описано выше для мутантов CH3,проходивших селекцию по TLR-9. Периплазматические экстракты предварительно тестировали методомELISA (см. методику в примере 10). Клоны, дававшие сильный сигнал при этом первом предварительном анализе методом ELISA, культивировали в объеме 20 мл в тех же условиях, что описаны выше. Из них выделяли периплазматические экстракты в 1/20 объеме культуры, как описано выше, и тестировали методом ELISA (как описано в примере 10) для подтверждения. Пример 10. Анализ методом ELISA мутантов CH3, отобранных против лизоцима куриного яйца. Таблица 5 Результаты проверки методом ELISA мутантов CH3, отобранных против лизоцима куриного яйца Фон (только антиген) (12 параллельных измерений): 0,1763. Таблица 6 Результаты проверки методом ELISA мутантов CH3, отобранных против лизоцима куриного яйца,при различных разведениях антигена: периплазматический экстракт не добавляли. Отмечено, что лизоцим куриного яйца реагирует с антителом анти-His4, поэтому наблюдается относительно высокий уровень фона. Таблица 7 Результаты проверки методом ELISA мутантов CH3+5, отобранных против лизоцима куриного яйца Фон (только антиген) (12 параллельных измерений): 0,1334. Примечание: лизоцим куриного яйца реагирует с антителом анти-His4, поэтому наблюдается относительно высокий уровень фона. Пример 11. Библиотека CL. Визуальное изучение кристаллической структуры Fab-фрагмента (использовали структуру Fab моноклонального антитела 3D6 человека: объект 1dfb.pdb Банка данных по белкам RSCB(http://molvis.sdsc.edu/protexpl/frntdoor.htm вторичной и третичной структуры этого белка позволяет идентифицировать остатки, локализованные в участках петель, соединяющих -цепи каркаса домена CL. Эти остатки охватывают аминокислоты 8-18, аминокислоты 27-35, аминокислоты 42-78, аминокислоты 83-85, аминокислоты 92-100, аминокислоты 108-117 и аминокислоты 123-126 (нумерация по системе нумерации IMGT (Lefranc M.P. et al. Nucleic Acids Res. 2005 Jan 1, 33 (Database issue): D593-7; Lefranc MPet al. Dev Comp Immunol. 2005, 29(3): 185-203. В частности, подвергали рандомизации остатки 11, 12, 14-18 и 92-95 в пределах домена CL человека(SEQ ID No. 48). Рандомизацию осуществляли посредством ПЦР-амплификации кодирующих последовательностей с помощью праймеров для ПЦР, у которых положения соответствующих кодонов кодируются последовательностью нуклеотидов 5'-NNS-3', которая потенциально кодирует все 20 аминокислот,но обходит 2 из 3 стоп-кодонов. Библиотечную вставку амплифицировали посредством двух отдельных реакций ПЦР и два ПЦР-фрагмента лигировали друг с другом через рестрикционный сайт HpyCH4IV,который вводили в виде молчащей мутации с помощью ПЦР-праймеров. Эти праймеры также обеспечивают сайты рестрикционных эндонуклеаз NcoI и NotI, соответственно, для клонирования в вектор фагового дисплея pHEN (Hoogenboom HR et al. Nucleic Acids Res. 1991 Aug 11, 19(15): 4133-7). Для фагового дисплея не включали С-концевой цистеин домена CL, но его можно вставить позже, при использовании модифицированного клона CL, например, для конструирования Fab-фрагмента. В качестве матрицы для ПЦР-амплификации использовали плазмиду типа pRcCMV-3D6LC (RukerF. et al. Ann NY Acad. Sci. 1991 Dec 27, 646: 212-9), которая содержит в виде вставки полную легкую цепь моноклонального антитела 3D6 человека. Для библиотек CL+3 (SEQ ID No. 50, 51) и CL+5 (SEQ ID No. 52, 53), которые содержат дополнительные остатки, вставленные между положениями 92 и 95 домена CL, использовали праймеры CLRHPY3 и CLRHPY5 соответственно вместо праймера CLRHPY. Нуклеотидная и аминокислотная последовательность конечного продукта реакций ПЦР и лигирования, клонированного в pHEN1 по сайту NcoI, что ведет к присоединению лидерной последовательности pelB на N-конец конструкции, представлены ниже (SEQ ID No. 48, 49): Перечень праймеров для библиотеки CL Несколько отобранных библиотечных клонов (мутированные домены CL, клонированные в фагомидный вектор pHEN1) проверяли рестрикционным анализом и секвенированием ДНК и убедились, что они содержат намеченную вставку, включая встроенные правильным образом рандомизованные после- 26018897 довательности. На последующих стадиях получения фага следовали стандартным методикам. Вкратце,смесью для лигирования трансформировали клетки Е. coli TG1 методом электропорации. После этого из клеток Е. coli TG1 выделяли частицы фага с помощью фага-хелпера M13-K07. Затем частицы фага осаждали из супернатантов культур с помощью ПЭГ/NaCl в 2 стадии, растворяли в воде и использовали для селекции методом пэннинга или, в качестве альтернативы, хранили при -80 С. Пример 12. Библиотека CH1. Визуальное изучение кристаллической структуры Fab-фрагмента (использовали структуру Fab моноклонального антитела 3D6 человека: объект 1dfb.pdb Банка данных по белкам RSCB) и компьютерный анализ (для этой цели использовали Protein Explorer) вторичной и третичной структуры этого белка позволяет идентифицировать остатки, локализованные в участках петель, соединяющих -цепи каркаса домена CH1. Эти остатки охватывают аминокислоты 7-21, аминокислоты 25-39, аминокислоты 41-81,аминокислоты 83-85, аминокислоты 89-103 и аминокислоты 106-117 (нумерация по системе нумерацииIMGT). В частности, подвергали рандомизации остатки 12-19 и 93-100 в пределах домена CH1 человека(SEQ ID No. 54, 55). Рандомизацию осуществляли посредством ПЦР-амплификации кодирующих последовательностей с помощью праймеров для ПЦР, у которых положения соответствующих кодонов кодируются последовательностью нуклеотидов 5'-NNS-3', которая потенциально кодирует все 20 аминокислот, но обходит 2 из 3 стоп-кодонов. Библиотечную вставку амплифицировали посредством двух отдельных реакций ПЦР и два ПЦР-фрагмента лигировали друг с другом через рестрикционный сайт BstEII,который встречается естественным образом в домене CH1. Эти праймеры также обеспечивают сайты рестрикционных эндонуклеаз NcoI и NotI, соответственно, для клонирования в вектор фагового дисплеяpHEN. Для фагового дисплея не включали С-концевой цистеин домена CH1, но его можно вставить позже, при использовании модифицированного клона CH1, например, для конструирования Fab-фрагмента. В качестве матрицы для ПЦР-амплификации использовали плазмиду типа pRcCMV-3D6HC, которая содержит в виде вставки полную тяжелую цепь моноклонального антитела 3D6 человека. Нуклеотидная и аминокислотная последовательность конечного продукта реакций ПЦР и лигирования, клонированного в pHEN1 по сайту NcoI, что ведет к присоединению лидерной последовательности pelB на N-конец конструкции, представлены ниже (SEQ ID No. 54, 55): Перечень праймеров для библиотеки CH1: Несколько отобранных библиотечных клонов (мутированные домены CH1, клонированные в фагомидный вектор pHEN1) проверяли рестрикционным анализом и секвенированием ДНК и убедились, что они содержат намеченную вставку, включая встроенные правильным образом рандомизованные последовательности. На последующих стадиях получения фага следовали стандартным методикам. Вкратце,смесью для лигирования трансформировали клетки Е. coli TG1 методом электропорации. После этого из клеток Е. coli TG1 выделяли частицы фага с помощью фага-хелпера M13-KO7. Затем частицы фага осаждали из супернатантов культур с помощью ПЭГ/NaCl в 2 стадии, растворяли в воде и использовали для селекции методом пэннинга или, в качестве альтернативы, хранили при -80 С. Пример 13. Пэннинг фаговой библиотеки CH1 на яичном лизоциме курицы (HEL). Проводили 3 цикла пэннинга с фаговой библиотекой CH1 (см. пример 12). 96-луночные планшетыMaxisorp (Nunc) сенсибилизировали лизоцимом куриного яйца внесением 200 мкл на лунку следующего раствора: PBS, при следующих концентрациях растворенного яичного лизоцима: Инкубировали в течение 1 ч при 37 С, а затем блокировали 2% сухим молоком (M-PBS) по 200 мкл на лунку в течение 1 ч при комнатной температуре. После этого библиотеку дисплея на поверхности фага оставляли реагировать с фиксированным яичным лизоцимом добавлением 100 мкл суспензии фага и 100 мкл 4% сухого молока (M-PBS), а затем инкубировали в течение 45 мин со встряхиванием и 90 мин без встряхивания при комнатной температуре. Несвязавшиеся частицы фага отмывали следующим образом: Элюирование связавшихся частиц фага осуществляли добавлением в лунки по 200 мкл 0,1 М глицина, рН 2,2, и инкубировали со встряхиванием в течение 30 мин при комнатной температуре. После этого суспензию фага нейтрализировали добавлением 60 мкл 2 М трис-основания, а затем инфицировали клетки Е. coli TG1 смешиванием 10 мл культуры в экспоненциальной фазе роста с 0,5 мл элюированного фага и инкубировали 30 мин при 37 С. Наконец, инфицированные бактерии высевали на чашки со средой TYE с 1% глюкозы и 100 мкг/мл ампициллина и инкубировали при 30 С в течение ночи. Клонирование отдельных клонов мутантов CH1, отобранных против лизоцима, для растворимой экспрессии. Выделяли фагомидную ДНК методом Midi-prep из фага, прошедшего 3 цикла селекции пэннингом. ДНК, кодирующую мутированные домены CH1, целиком амплифицировали методом ПЦР и клонировали по NcoI-NotI в вектор pNOTBAD/Myc-His, представляющий собой вектор pBAD/Myc-His (Invitrogen) для экспрессии в Е. coli со вставленным сайтом рестрикции NotI, облегчающим клонирование. Лигированными конструкциями трансформировали клетки Е. coli LMG194 (Invitrogen) методом электропорации и культивировали при 30 С на среде TYE с 1% глюкозы и ампициллином в течение ночи. Отобранные клоны инокулировали в 200 мкл среды 2YT с ампициллином, культивировали в течение ночи при 30 С и индуцировали добавлением L-арабинозы до конечной концентрации 0,1%. После экспрессирования при 16 С в течение ночи клетки собирали центрифугированием и обрабатывали 100 мкл Na-боратного буфера, рН 8,0, при 4 С в течение ночи для получения периплазматических экстрактов. По 50 мкл периплазматических экстрактов использовали в методе ELISA. Клоны, дававшие сильный сигнал при этом первом предварительном анализе методом ELISA, куль- 28018897 тивировали в объеме 20 мл в тех же условиях, что описаны выше. Из них выделяли периплазматические экстракты в 1/20 объеме культуры, как описано выше, и тестировали методом ELISA (как описано ниже) для подтверждения. Анализ методом ELISA мутантов CH1, отобранных против лизоцима куриного яйца Клоны считались положительными, если их сигнал ELISA по меньшей мере в три раза превышал фоновый сигнал. Пример 14. Пэннинг фаговой библиотеки CL на лизоциме куриного яйца (HEL). Проводили 3 цикла пэннинга с фаговой библиотекой CL (см. пример 11). 96-луночные планшетыMaxisorp (Nunc) сенсибилизировали яичным лизоцимом курицы внесением 200 мкл на лунку следующего раствора: PBS, при следующих концентрациях растворенного яичного лизоцима: Инкубировали в течение 1 ч при 37 С, а затем блокировали 2% сухим молоком (M-PBS) по 200 мкл на лунку в течение 1 ч при комнатной температуре. После этого библиотеку дисплея на поверхности фага оставляли реагировать с фиксированным яичным лизоцимом добавлением 100 мкл суспензии фага и 100 мкл 4% сухого молока (M-PBS), а затем инкубировали в течение 45 мин со встряхиванием и 90 мин без встряхивания при комнатной температуре. Несвязавшиеся частицы фага отмывали следующим образом: Элюирование связавшихся частиц фага осуществляли добавлением в лунки по 200 мкл 0,1 М глицина, рН 2,2, и инкубировали со встряхиванием в течение 30 мин при комнатной температуре. После этого суспензию фага нейтрализировали добавлением 60 мкл 2 М трис-основания, а затем инфицировали клетки Е. coli TG1 смешиванием 10 мл культуры в экспоненциальной фазе роста с 0,5 мл элюированного фага и инкубировали 30 мин при 37 С. Наконец, инфицированные бактерии высевали на чашки со средой TYE с 1% глюкозы и 100 мкг/мл ампициллина и инкубировали при 30 С в течение ночи. Клонирование отдельных клонов мутантов CL, отобранных против лизоцима, для растворимой экспрессии. Выделяли фагомидную ДНК методом Midi-prep из фага, прошедшего 3 цикла селекции пэннингом. ДНК, кодирующую мутированные домены CL, целиком амплифицировали методом ПЦР и клонировали по NcoI-NotI в вектор pNOTBAD/Myc-His, представляющий собой вектор pBAD/Myc-His (Invitrogen) для экспрессии в Е. coli со вставленным сайтом рестрикции NotI, облегчающим клонирование. Лигированными конструкциями трансформировали клетки Е. coli LMG194 (Invitrogen) методом электропорации и
МПК / Метки
МПК: C07K 16/00, C07K 19/00, C12N 15/62
Метки: участки, петель, получения, содержащие, обладающие, способ, модифицированные, свойством, молекулы, иммуноглобулина, структурных, связывания
Код ссылки
<a href="https://eas.patents.su/30-18897-molekuly-immunoglobulina-soderzhashhie-modificirovannye-uchastki-strukturnyh-petel-obladayushhie-svojjstvom-svyazyvaniya-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Молекулы иммуноглобулина, содержащие модифицированные участки структурных петель, обладающие свойством связывания, и способ их получения</a>
Предыдущий патент: Система для очистки и утилизации тепла сточных вод
Следующий патент: Способ лечения амилоидоза
Случайный патент: Способ изготовления сита вибросита