Способы и нуклеиновые кислоты для анализов нарушений клеточной пролиферации
Номер патента: 18010
Опубликовано: 30.04.2013
Авторы: Тетцнер Раймо, Модель Фабиан, Либенберг Фолькер, Левин Йорн, Дистлер Юрген, Кортезе Рене
Формула / Реферат
1. Способ обнаружения нарушений клеточной пролиферации у индивида, включающий определение уровней экспрессии по меньшей мере одного гена или геномной последовательности SHOX2 в биологическом образце, взятом у указанного индивида, при этом гиперметилирование и/или низкая экспрессия являются показателем наличия указанного нарушения.
2. Способ по п.1, в котором указанное нарушение является раком.
3. Способ по п.2, в котором указанная карцинома является карциномой легких.
4. Способ по любому из пп.1-3, в котором указанный уровень экспрессии определяют по наличию уровня мРНК, транскрибированной из указанного гена.
5. Способ по любому из пп.1-3, в котором указанный уровень экспрессии определяют по наличию уровня полипептида, кодированного указанным геном или его последовательностью.
6. Способ по любому из пп.1-3, в котором указанный уровень экспрессии определяют по наличию или отсутствию метилирования CpG в указанном гене, в котором наличие метилирования указывает на наличие нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2.
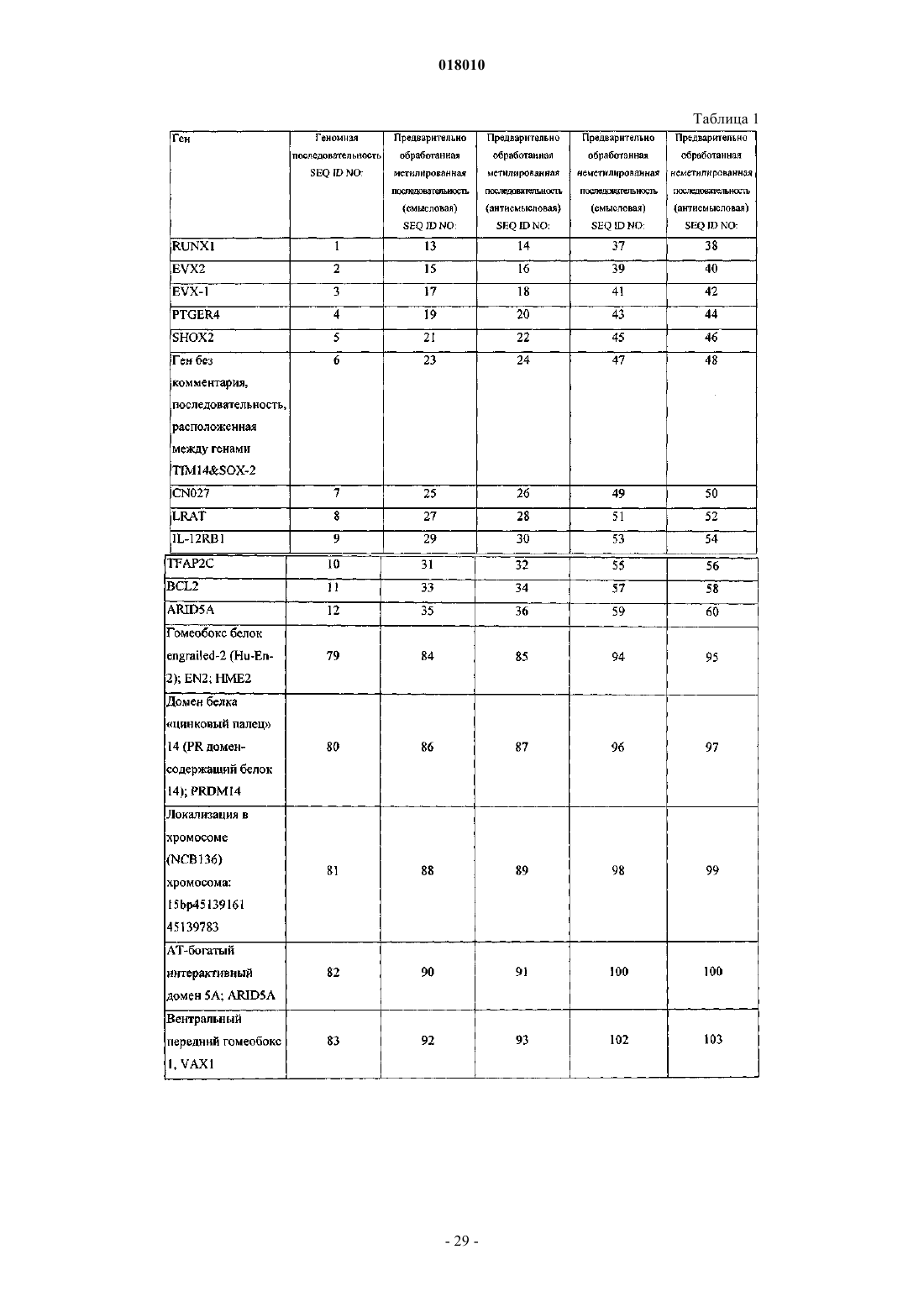
7. Способ обнаружения нарушений клеточной пролиферации по любому из пп.1-3, включающий контактирование геномной ДНК, выделенной из биологического образца, взятого у указанного пациента по меньшей мере с одним реагентом или группами реагентов, с помощью которых можно различить метилированные и неметилированные динуклеотиды CpG по меньшей мере в одной области-мишени геномной ДНК, где область-мишень содержит или гибридизуется в жестких условиях с последовательностью по меньшей мере из 16 смежных нуклеотидов SEQ ID NO:5, где указанные смежные нуклеотиды содержат по меньшей мере одну динуклеотидную последовательность CpG, посредством чего обеспечивается обнаружение нарушений клеточной пролиферации.
8. Способ обнаружения нарушений клеточной пролиферации по любому из пп.1-3, включающий:
a) экстракцию или выделение иным образом геномной ДНК из биологического образца, взятого у индивида;
b) обработку геномной ДНК со стадии а) или ее фрагмента одним или несколькими реагентами для преобразования оснований цитозинов, которые являются неметилированными в 5-положении, в урацил или другое основание, которое обнаруживается иначе по сравнению с цитозином в отношении гибридизирующих свойств;
c) контактирование обработанной геномной ДНК или ее обработанного фрагмента с ферментом для амплификации и по меньшей мере одним праймером, содержащим смежную последовательность по меньшей мере из 9 нуклеотидов, которая является комплементарной или гибридизуется в условиях средней жесткости или жестких условиях с последовательностью, выбранной из группы, состоящей из SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:45 или SEQ ID NO:46 и комплементарных им последовательностей, где обработанную геномную ДНК или ее фрагмент амплифицируют с получением по меньшей мере одного амплификата или не амплифицируют; и
d) определение, основываясь на наличии или отсутствии или на свойстве указанного амплификата, состояния метилирования по меньшей мере одного динуклеотида CpG SEQ ID NO:5 или в среднем, или по показателю, отражающему среднее состояние или уровень метилирования множества динуклеотидов CpG SEQ ID NO:5, посредством чего обеспечивается по меньшей мере одно из обнаружения и диагностики нарушений клеточной пролиферации.
9. Способ по п.8, в котором обработка геномной ДНК или ее фрагмента на стадии b) включает использование реагента, выбранного из группы, состоящей из бисульфита, вторичного кислого сульфита, дисульфита и их комбинаций.
10. Способ по любому из пп.1-9, в котором биологический образец, полученный от индивида, выбран из группы, состоящей из клеток или клеточных линий, гистологических препаратов, материала биопсии, залитой в парафин ткани, жидкостей организма, эякулята, мочи, плазмы крови, сыворотки крови, цельной крови, выделенных клеток крови, мокроты и биологического вещества, полученных при бронхоскопии (включая, но не ограничиваясь ими, бронхиальный лаваж, бронхоальвеолярный лаваж, щеточную биопсию бронхов, абразию бронхов) и их комбинаций.
11. Способ обнаружения нарушений клеточной пролиферации по любому из пп.1-3, включающий:
a) экстракцию или выделение иным образом геномной ДНК из биологического образца, взятого у индивида;
b) расщепление геномной ДНК со стадии а) или ее фрагмента одной или более чувствительной к метилированию рестриктазой; контактирование смеси после расщепления ДНК рестриктазой со стадии b) с ферментом для амплификации и по меньшей мере двумя праймерами, подходящими для амплификации последовательности, содержащей по меньшей мере один динуклеотид CpG SEQ ID NO:5;
c) определение, основываясь на наличии или отсутствии амплификата, уровня метилирования по меньшей мере одного динуклеотида CpG SEQ ID NO:5, посредством чего обеспечивается по меньшей мере одно из обнаружения и диагностики нарушений клеточной пролиферации.
12. Нуклеиновая кислота, содержащая по меньшей мере 16 смежных нуклеотидов обработанной последовательности геномной ДНК, выбранной из группы, состоящей из SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:45 или SEQ ID NO:46 и комплементарных им последовательностей.
13. Нуклеиновая кислота, содержащая по меньшей мере 50 смежных нуклеотидов последовательности ДНК, выбранной из группы, состоящей из SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:45 или SEQ ID NO:46 и комплементарных им последовательностей.
14. Нуклеиновая кислота по любому из пп.12, 13, где смежная последовательность оснований содержит по меньшей мере одну CpG-, TpG- или СрА-динуклеотидную последовательность.
15. Применение нуклеиновой кислоты, содержащей по меньшей мере 16 смежных нуклеотидов обработанной последовательности геномной ДНК, выбранной из группы, состоящей из SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:45 или SEQ ID NO:46 и комплементарных им последовательностей, в качестве диагностических средств.
16. Набор, подходящий для проведения способа по п.4, включающий:
(а) множество олигонуклеотидов или полинуклеотидов, способных гибридизоваться в жестких условиях или условиях средней жесткости с продуктами транскрипции по меньшей мере одного гена или геномной последовательности SHOX2;
(b) подходящий контейнер, содержащий олигонуклеотиды или полинуклеотиды и биологический образец пациента, содержащий продукты транскрипции, где олигонуклеотиды или полинуклеотиды могут гибридизоваться в жестких условиях или условиях средней жесткости с продуктами транскрипции;
(с) средства для обнаружения гибридизации на стадии (b) и, необязательно,
(d) инструкции по применению и интерпретации результатов применения набора.
17. Набор, подходящий для осуществления способа по п.5, включающий:
(а) средства для обнаружения по меньшей мере одного гена или геномной последовательности SHOX2;
(b) подходящий контейнер, содержащий указанные средства и биологический образец пациента, содержащий полипептиды, где средства могут образовывать комплексы с полипептидами;
(с) средства для обнаружения комплексов со стадии (b).
18. Набор, подходящий для осуществления способа по п.6, включающий:
(а) бисульфитный реагент;
(b) подходящий контейнер, содержащий указанный бисульфитный реагент и биологический образец пациента;
(с) по меньшей мере один набор олигонуклеотидов, содержащий два олигонуклеотида, последовательности которых в каждом случае идентичны, комплементарны или гибридизуются в жестких условиях или условиях высокой жесткости с сегментом длиной 9 или более предпочтительно 18 оснований последовательности, выбранной из SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:45 или SEQ ID NO:46.
19. Применение способа по пп.1-11, нуклеиновой кислоты по пп.12-15 и/или набора по пп.16-18 при диагностике и/или обнаружении нарушений клеточной пролиферации.
Текст
СПОСОБЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ ДЛЯ АНАЛИЗОВ НАРУШЕНИЙ КЛЕТОЧНОЙ ПРОЛИФЕРАЦИИ Изобретение относится к способам, нуклеиновым кислотам и наборам для обнаружения нарушений клеточной пролиферации. Изобретение раскрывает геномные последовательности, профили метилирования которых применимы для улучшенного обнаружения указанного нарушения,посредством чего обеспечивается более эффективная диагностика и лечение пациентов. Область техники, к которой относится изобретение Настоящее изобретение относится к последовательностям геномной ДНК, которые имеют измененные параметры экспрессии при патологических состояниях по сравнению с нормой. Конкретные варианты осуществления относятся к способам, нуклеиновым кислотам, нуклеиновым кислотам-чипам и наборам, которые могут использоваться для обнаружения или диагностики нарушений клеточной пролиферации. Уровень техники Метилирование островков CpG. Было показано, что помимо мутаций к транскрипционному молчанию некоторых генов, что ранее связывали с патогенезом различных нарушений клеточной пролиферации, включая злокачественные опухоли, приводит патологическое метилирование островков CpG. Островки CpG являются короткими последовательностями, которые богаты динуклеотидами CpG, и обычно обнаруживаются в 5'-области примерно у 50% всех генов человека. Метилирование цитозинов этих островков приводит к прекращению генной экспрессии и, как сообщалось, к инактивации X-хромосомы и геномному импринтингу. Разработка медицинских тестов. Двумя ключевыми показателями любого медицинского скрининга или диагностического теста являются чувствительность и специфичность, которые определяют, каким образом с помощью теста можно точно обнаружить всех пораженных индивидов без исключения и без ложного включения индивидов, у которых отсутствует интересуемое заболевание (прогностическая ценность). Исторически, большое число диагностических тестов вызывало критику из-за низкой чувствительности и специфичности. Истинноположительным результатом (ТР) является результат, при котором тест является положительным, и заболевание присутствует. Ложноположительный результат (FP) представляет результат, при котором тест является положительным, но заболевание отсутствует. Истинноотрицательным результатом(TN) является результат, при котором тест является отрицательным, и заболевание отсутствует. Ложноотрицательный результат (FN) представляет результат, при котором тест является отрицательным, но заболевание имеет место. В данном контексте: чувствительность = ТР/(TP+FN); специфичность =TN/(FP+TN) и прогностическая ценность = ТР/ (TP+FP). Чувствительность является показателем способности теста правильно обнаруживать интересуемое заболевание у индивидуума, у которого проводят тестирование. Тест с низкой чувствительностью дает большое число ложноотрицательных результатов, т.е. число индивидов, которые имеют заболевание, но которые были ложно идентифицированы как индивиды, у которых отсутствует заболевание. Потенциальная опасность ложноотрицательных результатов заключается в том, что индивидов не диагностируют и не лечат в течение некоторого периода времени, во время которого заболевание может прогрессировать и перейти на более поздние стадии, при которых лечение может быть менее эффективным или бесполезным. Примером теста с низкой чувствительностью является тест на основе белка крови для диагностики ВИЧ. Этот тип теста имеет низкую чувствительность в результате того, что с его помощью невозможно обнаружить наличие вируса до тех пор, пока заболевание сильно не прогрессирует, и вирус не появляется в кровяном русле с высоким титром. Противоположным примером теста, обладающего высокой чувствительностью, является обнаружение вируса с использованием полимеразной цепной реакции(ПЦР). Тест имеет высокую чувствительность, поскольку с помощью данного типа теста можно обнаруживать очень небольшие количества вируса. Высокая чувствительность имеет особое значение, если отсутствие своевременного диагноза влечет за собой значительные последствия. С другой стороны, специфичность является показателем способности теста правильно идентифицировать индивидов, у которых заболевание отсутствует. Тест с низкой специфичностью дает большое число ложноположительных результатов, т.е. число индивидов, которых ложно идентифицируют как индивидов с заболеванием. Недостатком ложноположительных результатов является то, что пациенты вынуждены подвергаться ненужным медицинским процедурам, несущим риск, эмоциональный стресс и финансовые затраты, и которые могут оказать неблагоприятное воздействие на здоровье пациентов. Характерным признаком заболеваний, для которых трудно разработать диагностические тесты с высокой специфичностью, является сложный механизм развития заболевания, в частности нарушений клеточной пролиферации, в который вовлечены множество генов и белков. Кроме того, уровень некоторых белков может быть повышен по причинам, не связанным с заболеванием. Специфичность важна, когда стоимость или риск, связанные с дополнительными диагностическими процедурами или дополнительным медицинским вмешательством, являются очень высокими. Сущность изобретения Настоящее изобретение относится к способу обнаружения нарушений клеточной пролиферации,предпочтительно приведенных в табл. 2, и наиболее предпочтительно карциномы легких у индивида,причем способ включает определение уровня экспрессии по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX1; SHOX2;SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1,в биологическом образце, взятом у указанного индивида, при этом гиперметилирование и/или низкая экспрессия являются показателем наличия указанного нарушения. Различные аспекты настоящего изобретения относятся к эффективному или уникальному генетическому маркеру, а анализ экспрессии указанного маркера делает возможным определить нарушения клеточной пролиферации, предпочтительно приведенные в табл. 2, с особо высокой чувствительностью, специфичностью и/или прогностической ценностью. Предпочтительным нарушением является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. В одном из вариантов осуществления изобретение относится к способу обнаружения нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2(наиболее предпочтительно карциномы легких), у индивида, причем способ включает определение уровней экспрессии по меньшей мере одного гена или геномной последовательности, выбранной из группы,состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL-12RB1;TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1, в биологическом образце, взятом у указанного индивида, а низкая экспрессия и/или метилирование CpG являются показателем наличия указанного нарушения. В одном из вариантов осуществления указанный уровень экспрессии определяют по наличию, отсутствию или уровню экспрессии мРНК, транскрибированной из указанного гена. В дополнительном варианте осуществления указанный уровень экспрессии определяют по наличию, отсутствию или уровню полипептида, кодированного указанным геном или его последовательностью. В дополнительном предпочтительном варианте осуществления указанную экспрессию определяют по наличию или отсутствию метилирования CpG в указанном гене, где низкая экспрессия указывает на наличие нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Указанный способ включает следующие стадии:i) контактирование геномной ДНК, выделенной из биологического образца (предпочтительно выбранного из группы, состоящей из клеток или клеточных линий, гистологических препаратов, материала биопсии, залитой в парафин ткани, жидкостей организма, эякулята, мочи, плазмы крови, сыворотки крови, цельной крови, выделенных клеток крови, мокроты и биологического вещества, полученных при бронхоскопии (включая, но не ограничиваясь ими, бронхиальный лаваж, бронхоальвеолярный лаваж,щеточную биопсию бронхов, абразию бронхов), взятого у индивидов по меньшей мере с одним реагентом или группами реагентов, с помощью которых можно различить метилированные или неметилированные динуклеотиды CpG по меньшей мере в одной области-мишени геномной ДНК, в которой нуклеотидная последовательность указанной области-мишени содержит по меньшей мере одну динуклеотидную последовательность CpG по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1; иii) обнаружение нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2(наиболее предпочтительно карциномы легких), по меньшей мере частично. Предпочтительно областьмишень содержит или гибридизуется в жестких условиях с последовательностью по меньшей мере из 16 смежных нуклеотидов SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83. Предпочтительно чувствительность указанного обнаружения находится в пределах примерно от 75 до примерно 96%, или примерно от 80 до примерно 90%, или примерно от 80 до примерно 85%. Предпочтительно специфичность составляет примерно от 75 до примерно 96%, или примерно от 80 до примерно 90%, или примерно от 80 до примерно 85%. Указанное использование гена можно осуществлять посредством любого анализа экспрессии гена,посредством анализа экспрессии мРНК или анализа экспрессии белка. Однако в наиболее предпочтительном варианте осуществления изобретения обнаружение нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), проводят посредством анализа статуса метилирования по меньшей мере одного гена или геномной последовательности,выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027;LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1, и/или их промоторов или регуляторных элементов. Изобретение относится к способу анализа биологических образцов на характерные признаки, связанные с развитием нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), где способ отличается тем, что нуклеиновая кислота или ее фрагмент с последовательностью SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 контактирует с реагентом или группой реагентов, с помощью которых можно различить метилированные или не-2 018010 метилированные динуклеотиды CpG в геномной последовательности. Настоящее изобретение относится к способу установления эпигенетических параметров геномной ДНК, связанных с развитием нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Способ можно использовать для усовершенствованного обнаружения и диагностики указанного заболевания. Предпочтительно источник тестируемого образца выбран из группы, состоящей из клеток, клеточных линий, гистологических препаратов, материала биопсии, залитой в парафин ткани, жидкостей организма, эякулята, мочи, плазмы крови, сыворотки крови, цельной крови, выделенных клеток крови, мокроты и биологического вещества, полученных при бронхоскопии (включая, но не ограничиваясь ими,бронхиальный лаваж, бронхоальвеолярный лаваж, щеточную биопсию бронхов, абразию бронхов), и их комбинаций. Более предпочтительный тип образцов выбран из группы, состоящей из плазмы крови,мокроты и биологического вещества, полученных при бронхоскопии (включая, но не ограничиваясь ими,бронхиальный лаваж, бронхоальвеолярный лаваж, щеточную биопсию бронхов, абразию бронхов) и всех их возможных комбинаций. В частности, настоящее изобретение относится к способу обнаружения нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), которые могут использоваться в качестве диагностического инструмента, включающему получение биологического образца, содержащего геномную нуклеиновую кислоту(ы); приведение нуклеиновой кислоты(т) или ее фрагмента в контакт с реагентом или множеством реагентов, достаточных для того, чтобы различить метилированные или неметилированные динуклеотидные последовательности CpG в последовательности-мишени этой нуклеиновой кислоты, где последовательность-мишень содержит или гибридизуется в жестких условиях с последовательностью, содержащей по меньшей мере 16 смежных нуклеотидов SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, где указанные смежные нуклеотиды содержат по меньшей мере одну динуклеотидную последовательность CpG; и определение, основываясь,по меньшей мере частично, на указанном различии, состояния метилирования по меньшей мере одной динуклеотидной последовательности-мишени CpG, или в среднем, или по показателю, отражающему среднее состояние метилирования множества динуклеотидных последовательностей-мишеней CpG. Предпочтительно различие между метилированными или неметилированными динуклеотидными последовательностями CpG в последовательности-мишени включает зависимое от состояния метилирования преобразование или отсутствие преобразования по меньшей мере одной такой динуклеотидной последовательности CpG в соответствующую преобразованную или непреобразованную динуклеотидную последовательность в последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и их смежных областей, соответствующих последовательности-мишени. Дополнительные варианты осуществления относятся к способу обнаружения нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких),включающему получение биологического образца с данной геномной ДНК; экстракцию геномной ДНК; обработку геномной ДНК или ее фрагмента одним или несколькими реагентами с преобразованием неметилированных оснований цитозина в 5-положении в урацил или другое основание, которое обнаруживается иначе по сравнению с цитозином в отношении гибридизирующих свойств; контактирование обработанной геномной ДНК или ее обработанного фрагмента с ферментом для амплификации и по меньшей мере двумя праймерами, содержащими в каждом случае смежную последовательность длиной по меньшей мере 9 нуклеотидов, которая является комплементарной или гибридизуется в условиях средней жесткости или жестких условиях с последовательностью, выбранной из группы, состоящей из последовательностей SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарных им последовательностей, где обработанная ДНК или ее фрагмент либо амплифицируют с получением амплификата, либо не амплифицируют; и определение, основываясь на наличии или отсутствии или на свойстве указанного амплификата состояния метилирования или в среднем, или по показателю, отражающему средний уровень метилирования по меньшей мере одного, но более предпочтительно множества динуклеотидных последовательностей CpG SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83. Предпочтительно определение включает использование по меньшей мере одного способа, выбранного из группы, состоящей из:i) гибридизации по меньшей мере одной молекулы нуклеиновой кислоты, содержащей смежную последовательность длиной по меньшей мере 9 нуклеотидов, которая является комплементарной или гибридизуется в условиях средней жесткости или жестких условиях с последовательностью, выбранной из группы, состоящей из SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарных им последовательностей;ii) гибридизации по меньшей мере одной молекулы нуклеиновой кислоты, связанной с твердой фазой, содержащей смежную последовательность длиной по меньшей мере 9 нуклеотидов, которая является комплементарной или гибридизуется в условиях средней жесткости или жестких условиях с последовательностью, выбранной из группы, состоящей из SEQ ID NO:13-SEQ ID NO:60;iii) гибридизации по меньшей мере одной молекулы нуклеиновой кислоты, содержащей смежную последовательность длиной по меньшей мере 9 нуклеотидов, которая является комплементарной или гибридизуется в условиях средней жесткости или жестких условиях с последовательностью, выбранной из группы, состоящей из SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарных им последовательностей; и элонгации по меньшей мере одной такой гибридизованной молекулы нуклеиновой кислоты по меньшей мере одним нуклеотидом; иiv) секвенирования амплификата. Дополнительные варианты осуществления относятся к способу анализа (т.е. обнаружения или диагностики) нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2(наиболее предпочтительно карциномы легких), включающему получение биологического образца, с данной геномной ДНК; экстракцию геномной ДНК; приведение геномной ДНК или ее фрагмента в контакт, содержащей одну или несколько последовательностей, выбранных из группы, состоящей изSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, или последовательности, которая гибридизуется в жестких условиях с ними, с одной или более чувствительных к метилированию рестриктаз, где геномную ДНК либо расщепляют с получением тем самым фрагментов расщепления, либо не подвергают расщеплению; и определение, основываясь на наличии или отсутствии или на свойстве по меньшей мере одного такого фрагмента состояния метилирования по меньшей мере одной динуклеотидной последовательности CpG SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, или в среднем, или по показателю, отражающему среднее состояние метилирования множества динуклеотидных последовательностей CpG. Предпочтительно расщепленную или нерасщепленную геномную ДНК амплифицируют перед указанным определением. Дополнительные варианты осуществления относятся к новым геномным и химически модифицированным последовательностям нуклеиновых кислот, а также олигонуклеотидам и/или PNA-олигомерам для анализа параметров метилирования цитозина в последовательностях SEQ ID NO:1-SEQ ID NO:12;SEQ ID NO:79-SEQ ID NO:83. Подробное описание изобретения Определения. Термин "наблюдаемое/предполагаемое отношение" ("отношение Н/П") относится к частоте динуклеотидов CpG в конкретной последовательности ДНК и соответствует [число сайтов CpG /(число оснований Счисло оснований G)]/длина полосы для каждого фрагмента. Термин "островок CpG" относится к смежной области геномной ДНК, которая соответствует критериям: (1) имеет частоту динуклеотидов CpG, соответствующих "наблюдаемому/предполагаемому отношению" 0,6; и (2) имеет "содержание GC" 0,5. Как правило, но не всегда, островки CpG имеют длину примерно от 0,2 до примерно 1 т.п.н. или до примерно 2 т.п.н. Термин "состояние метилирования" или "статус метилирования" относится к наличию или отсутствию 5-метилцитозина ("5-mCyt") в одном или множестве динуклеотидов CpG в последовательности ДНК. Состояния метилирования в одном или более определенных сайтах CpG метилирования (каждый имеющий две динуклеотидные последовательности CpG) в последовательности ДНК включают "неметилированные", "полностью метилированные" и "полуметилированные". Термин "полуметилирование" относится к состоянию метилирования двухцепочечной ДНК, в которой метилирована только одна цепь ДНК. В контексте настоящего изобретения термин "AUC" означает сокращенное название площади под кривой. В частности, он относится к площади под кривой функциональных характеристик приемника(ROC). Кривая ROC представляет график истинноположительных результатов против ложноположительных результатов для различных возможных уровней отсечения диагностического теста. Кривая ROC показывает баланс между чувствительностью и специфичностью в зависимости от выбранного порога отсечения (любое повышение чувствительности будет сопровождаться снижением специфичности). Площадь под кривой ROC (AUC) является показателем точности диагностического теста (чем больше площадь, тем лучше, оптимально она равняется 1, произвольный тест будет иметь кривую ROC, лежащую на диагонали с площадью 0,5; источник: J.P. Egan. Signal Detection Theory and ROC Analysis, Academic Press, New York, 1975). Термин "микрочип" в широком смысле относится к "микрочипам ДНК" и "ДНК-чипу(ам)", известным в данной области, включающему все известные в данной области твердые подложки, и он включает все способы фиксации молекул нуклеиновых кислот к ним или синтез нуклеиновых кислот на них."Генетические параметры" представляют мутации и полиморфизмы генов и последовательностей,дополнительно необходимых для их регуляции. Мутации представляют, в частности, инсерции, делеции,точковые мутации, инверсии и полиморфизмы и особенно предпочтительные SNP (однонуклеотидные полиморфизмы)."Эпигенетические параметры" представляют, в частности, метилирование цитозина. Дополнительные эпигенетические параметры включают, например, ацетилирование гистонов, которые, однако, невозможно непосредственно анализировать с использованием описанного способа, но которые, в свою очередь, коррелируют с метилированием ДНК. Термин "бисульфитный реагент" относится к реагенту, содержащему бисульфит, дисульфит, вторичный кислый сульфит или их комбинации, которые могут использоваться, как описано в настоящем описании, для обеспечения отличия метилированных и неметилированных динуклеотидных последовательностей CpG. Термин "тест оценки метилирования" относится к любому тесту для определения состояния метилирования одной или более динуклеотидных последовательностей CpG в последовательности ДНК. Термин "MS.AP-PCR" (чувствительная к метилированию произвольно-праймированная полимеразная цепная реакция) относится к хорошо известной в данной области технологии, которая позволяет проводить глобальное сканирование генома с использованием CG-богатых праймеров для фокусирования на областях, которые с наибольшей вероятностью содержат динуклеотиды CpG, и она описана Gonzalgo etal., Cell proliferative disorders, preferably those according to Cancer Research. 57:594-599, 1997. Термин "MethyLight" относится к хорошо известной в данной области основанной на флуоресценции ПЦР в режиме реального времени, описанной Eads et al., Cell proliferative disorders, preferablythose according to Cancer Research. 59:2302-2306, 1999. Термин "анализ HeavyMethyl" в одном из вариантов осуществления настоящего изобретения относится к тесту, в котором специфические к метилированию блокирующие зонды (также называемые в настоящем описании блокаторами), покрывающие положения CpG или покрытые праймерами для амплификации, делают возможным протекание специфической к метилированию избирательной амплификации образца нуклеиновой кислоты. Термин "анализ HeavyMethyl MethyLight" в одном из вариантов осуществления настоящего изобретения относится к тесту HeavyMethyl MethyLight, который представляет собой вариант тестаMethyLight, в котором тест MethyLight объединяют со специфическими к метилированию блокирующими зондами, покрывающими положениями CpG между праймерами для амплификации. Термин "Ms-SNuPE" (чувствительная к метилированию однонуклеотидная элонгация праймера) относится к хорошо известному в данной области тесту, описанному GonzalgoJones, Nucleic Acids Res.,25:2529-2531, 1997. Термин "MSP" (специфическая к метилированию ПЦР) относится к хорошо известному в данной области тесту оценки метилирования, описанному Herman et al., Proc. Natl. Acad. Sci. USA, 93:9821-9826,1996 и в патенте США 5786146. Термин "COBRA" (объединенный бисульфитный рестрикционный анализ) относится к хорошо известному в данной области тесту оценки метилирования, описанному XiongLaird, Nucleic Acids Res.,25:2532-2534, 1997. Термин "MCA" (амплификация метилированных островков CpG) относится к тесту оценки метилирования, описанному Toyota et al., Cell proliferative disorders, preferably those according to Cancer Res.,59:2307-12, 1999 и в заявке WO 00/26401 A1. Под термином "гибридизация" следует понимать как связывание олигонуклеотида с комплементарной последовательностью вдоль линий спаривания оснований в модели Уотсона-Крика в образце ДНК с образованием дуплексной структуры."Жесткие условия гибридизации" в контексте настоящего изобретения включают гибридизацию при 68 С в 5SSC/5 раствор Дэнхардта/1,0% SDS и промывание в 0,2SSC/0,1% SDS при комнатной температуре или включают известные в данной области их эквивалентные варианты (например, условия,в которых гибридизацию проводят при 60 С в буфере 2,5SSC с последующими несколькими стадиями промывания при 37 С в буфере с низкой концентрацией, которая остается постоянной). Условия средней жесткости в контексте настоящего изобретения включают промывание в буфере 3SSC при 42 С или известные в данной области их эквивалентные варианты. Параметры концентрации соли и температуры могут варьировать для достижения оптимального уровня идентичности между зондом и нуклеиновой кислотой-мишенью. В данной области имеются рекомендации, касающиеся таких условий, Sambrook etal., 1989, Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, N.Y. и Ausubel et al. (eds.),1995, Current Protocols in Molecular Biology (John WileySons, N.Y.) на unit 2.10. Под термином "специфические к метилированию рестриктазы" или "чувствительные к метилированию рестриктазы" следует понимать фермент, который избирательно расщепляет нуклеиновую кислоту в зависимости от состояния метилирования его сайтов распознавания. В случае таких рестриктаз, которые специфически расщепляют, если сайт распознавания не метилирован или полуметилирован, то расщепление не будет иметь место или будет проходить с существенно пониженной эффективностью, если сайт распознавания метилирован. В случае таких рестриктаз, которые расщепляют специфически, если сайт распознавания метилирован, то расщепление не будет иметь место или будет проходить с существенно пониженной эффективностью, если сайт распознавания не метилирован. Предпочтительными являются специфические к метилированию рестриктазы, последовательность распознавания которых содержит динуклеотид CG (например, cgcg или cccggg). Дополнительными предпочтительными для некоторых вариантов осуществления являются рестриктазы, которые не расщепляют, если цитозин в данном динук-5 018010 леотиде метилирован по атому углерода С 5. "Неспецифические к метилированию рестриктазы" или "нечувствительные к метилированию рестриктазы" представляют рестриктазы, которые расщепляют последовательность нуклеиновой кислоты независимо от состояния метилирования примерно с одинаковой эффективностью. Их также называют "неспецифическими к метилированию рестриктазами". В отношении сложного спектра последовательностей выражение "смежные нуклеотиды" относится к смежной области последовательности любой отдельной смежной последовательности сложного спектра, но не включает область сложного спектра последовательностей, которая включает "узел", имеющий значения, определенные выше. Термин "по меньшей мере один ген или геномная последовательность, выбранные из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C;BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1", включает все варианты их транскриптов и все их промоторы и регуляторные элементы. Кроме того, поскольку известно множество SNP в указанном гене,то термин включает все варианты их последовательностей. Обзор. Настоящее изобретение относится к способу обнаружения нарушений клеточной пролиферации,предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), у индивида,включающему определение уровней экспрессии по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6;CN027; LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1, в биологическом образце, взятом у указанного индивида, в котором гиперметилирование и/или низкая экспрессия являются показателем наличия указанного нарушения. Указанные маркеры можно использовать для диагностики нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Кроме приведенных выше вариантов осуществления, в которых проводят анализ метилирования по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей изPRDM14; SEQ ID NO:81; ARID5A; VAX1, изобретение относится к дополнительным панелям генов, содержащим по меньшей мере один ген или геномную последовательность, выбранные из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C;BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1, с новым вариантом использования для обнаружения нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Бисульфитная модификация ДНК является хорошо известным в данной области инструментом, используемым для оценки статуса метилирования CpG. 5-Метилцитозин представляет собой наиболее частую ковалентную модификацию основания в ДНК эукариотических клеток. Он играет роль, например, в регуляции транскрипции в генетическом импринтинге и опухолегенезе. Следовательно, идентификация 5-метилцитозина в качестве компонента генетической информации представляет большой интерес. Однако положения 5-метилцитозина невозможно идентифицировать секвенированием, поскольку 5-метилцитозин обладает тем же характером спаривания оснований, что и цитозин. Кроме того, эпигенетическая информация, которую несет 5-метилцитозин, полностью теряется, например, во время амплификации ПЦР. Наиболее часто используемый метод анализа ДНК на наличие 5-метилцитозина основан на специфической реакции бисульфита с цитозином, посредством чего при последующем щелочном гидролизе цитозин преобразуется в урацил, который по своему поведению при спаривании оснований соответствует тимину. Однако важно, что 5-метилцитозин остается немодифицированным в данных условиях. Следовательно, исходная ДНК преобразуется таким образом, что метилцитозин, который первоначально невозможно было отличить от цитозина по его характеру гибридизации, после этого можно обнаружить в качестве единственного оставшегося цитозина с использованием стандартных, известных в области молекулярной биологии методов, например амплификацией и гибридизацией или секвенированием. Все эти методы основаны на различающихся свойствах в отношении спаривания оснований, которые на данное время можно полностью использовать. На предшествующем уровне чувствительность определяют способом, содержащим включение ДНК, которая подвергается анализу, в агарозный матрикс с предупреждением тем самым диффузии и ренатурации ДНК (бисульфит реагирует только с одноцепочечной ДНК) и замещением всех стадий преципитации и очистки на быстрый диализ (Olek et al., A modified and improved method for bisulfite basedcytosine methylation analysis, Nucleic Acids Res., 24:5064-6, 1996). Таким образом, становится возможным анализировать отдельные клетки в отношении статуса метилирования, что демонстрирует использование и чувствительность способа. Обзор известных в данной области способов обнаружения 5-метилцитозина приведен в статье Rein Т., et al., Nucleic Acids Res., 26:2255, 1998. Бисульфитный способ, за некоторым исключением (например, Zeschnigk M. et al., Eur. J. Hum.Genet., 5:94-98, 1997), является единственным используемым в настоящее время способом для исследований. Во всех случаях короткие специфические фрагменты известного гена амплифицируют после об-6 018010 работки бисульфитом и либо полностью секвенируют (OlekWalter, Nat. Genet., 1997, 17:275-6, 1997),подвергнув одной или нескольким реакциям элонгации с праймерами (GonzalgoJones, Nucleic AcidsRes., 25:2529-31, 1997; заявка WO 95/00669; патент США 6251594) для анализа отдельных положений цитозина, либо обрабатывают ферментативным расщеплением (XiongLaird, Nucleic Acids Res., 25:25324, 1997). В данной области также описано обнаружение гибридизацией (Olek et al., WO 99/28498). Кроме того, описано использование бисульфитного способа обнаружения метилирования в отношении отдельных генов (GriggClark, Bioessays, 16:431-6, 1994; Zeschnigk M. et al., Hum. Mol. Genet. 6:387-95, 1997;WO 9515373). Настоящее изобретение относится к использованию бисульфитного способа в сочетании с одним или несколькими анализом оценки метилирования для определения статуса метилирования динуклеотидных последовательностей CpG SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83. Геномные динуклеотиды CpG могут быть метилированными или неметилированными (альтернативно известные соответственно как высоко- или низкометилированные). Однако способы по настоящему изобретению подходят для анализа биологических образцов гетерогенной природы, например небольшого количества опухолевых клеток на фоне крови. Следовательно, при анализе статуса метилирования положения CpG в таком образце специалист в данной области может использовать количественный анализ для определения уровня (например, процента, фракции, соотношения, относительного количества или степени) метилирования в определенном положении CpG по сравнению с состоянием метилирования. Следовательно,термин статус метилирования или состояние метилирования следует также понимать как показатель,отражающий степень метилирования положений CpG. Если не указано иначе, то под терминами "гиперметилированный" или "высокометилированный" следует понимать уровень метилирования, который выше определенного порога отсечения, где указанный порог отсечения может представлять показатель,представляющий средний или усредненный уровень для определенной популяции или предпочтительно оптимизированный уровень отсечения. "Порог отсечения" также относится в настоящем описании к "пороговому уровню". В контексте настоящего изобретения термины "метилированный", "гиперметилированный" или "высокометилированный" включают уровень метилирования, который выше порога отсечения, равного нулевому (0) % (или его эквивалентным вариантам) метилирования для всех положенийCpG в или связанных с (например, промоторах или регуляторных областях) по меньшей мере одном гене или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1;ARID5A; VAX1. По настоящему изобретению определение статуса метилирования динуклеотидных последовательностей CpG SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 можно использовать при диагностике и обнаружении нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2(наиболее предпочтительно карциномы легких). Тесты оценки метилирования. В данной области известны различные тесты оценки метилирования и их можно использовать в сочетании с настоящим изобретением. Эти тесты позволяют определить состояние метилирования одного или множества динуклеотидов CpG (например, островков CpG) в последовательности ДНК. Такие тесты включают, среди других методов, секвенирование обработанной бисульфитом ДНК, ПЦР (для последовательность-специфической амплификации), саузерн-блоттинг и применение чувствительных к метилированию рестриктаз. Например, геномное секвенирование было упрощено для анализа параметров метилирования ДНК и распределения 5-метилцитозина с использованием обработки бисульфитом (Frommer et al., Proc. Natl.Acad. Sci. USA, 89:1827-1831, 1992). Кроме того, используют расщепление рестриктазами продуктов ПЦР, амплифицированных из преобразованной под действием бисульфита ДНК, например, с использованием метода, описанного SadriHornsby (Nucl. Acids Res., 24:5058-5059, 1996), или COBRA (комбинированный бисульфитный рестрикционный анализ) (XiongLaird, Nucleic Acids Res., 25:2532-2534, 1997).COBRA. Анализ COBRA является количественным анализом оценки метилирования, подходящим для определения уровней метилирования ДНК в определенных локусах гена в небольших количествах геномной ДНК (XiongLaird, Nucleic Acids Res., 25:2532-2534, 1997). Коротко, используют расщепление рестриктазами для выявления зависимых от метилирования различий последовательностей в продуктах ПЦР,обработанной бисульфитом натрия ДНК. Вначале в геномную ДНК вводят метилирование - зависимые различия последовательностей с использованием обычной обработки бисульфитом согласно способу,описанному Frommer et al. (Proc. Natl. Acad. Sci. USA, 89:1827-1831, 1992). Затем проводят амплификацию ПЦР, преобразованной под действием бисульфита ДНК, с использованием праймеров, специфичных для интересующих островков CpG с последующим расщеплением рестрицирующими эндонуклеазами,электрофорезом и обнаружением с использованием специфических, меченых гибридизующихся зондов. Уровни метилирования в исходном образце ДНК представлены относительными количествами расщепленного и нерасщепленного продукта ПЦР в линейной зависимости среди широкого спектра уровней метилирования ДНК. Кроме того, этот метод можно надежно использовать для ДНК, полученной из микропрепаратов, залитых в парафин образцов тканей. Характерные реагенты (например, которые можно найти в обычном наборе для COBRA) для анализа COBRA могут включать, но не ограничиваются ими, праймеры для ПЦР для определенного гена(или обработанной бисульфитом последовательности ДНК или островка CpG); рестриктазу и соответствующий буфер; олигонуклеотид, гибридизирующийся с геном; контрольный гибридизирующийся олигонуклеотид; набор для мечения киназой для олигонуклеотидного зонда и меченые нуклеотиды. Кроме того, реагенты для преобразования бисульфитом могут включать буфер для денатурации ДНК; буфер для сульфонирования; реагенты или наборы для выделения ДНК (например, преципитации, ультрафильтрации, аффинной колонки); буфер для десульфонирования и компоненты для выделения ДНК. Предпочтительно используют такие анализы, как "MethyLight" (основанная на флуоресценции ПЦР в режиме реального времени) (Eads et al., Cell proliferative disorders, preferably those according to Cancer Res., 59:2302-2306, 1999); Ms-SNuPE реакции (чувствительная к метилированию однонуклеотидная элонгация праймера) (GonzalgoJones, Nucleic Acids Res., 25:2529-2531, 1997); специфическая к метилированию ПЦР ("MSP"; Herman et al., Proc. Natl. Acad. Sci. USA, 93:9821-9826, 1996; патент США 5786146); амплификация метилированных островков CpG ("MCA"; Toyota et al., Cell proliferativedisorders, preferably those according to Cancer Res., 59:2307-12, 1999), одни или в сочетании с другими из данных методов. Тест "HeavyMethyl" представляет количественный метод для оценки различий в метилировании,основанный на специфической к метилированию амплификации обработанной бисульфитом ДНК. Специфические к метилированию блокирующие зонды (также называемые в описании блокаторами), покрывающие положения CpG или покрытые праймерами для амплификации, делают возможным проведение специфической к метилированию избирательной амплификации образца нуклеиновой кислоты. Термин анализ "HeavyMethyl MethyLight" в одном из вариантов осуществления настоящего изобретения относится к тесту HeavyMethyl MethyLight, который представляет собой вариант тестаMethyLight, в котором тест MethyLight объединяют со специфическими к метилированию блокирующими зондами, покрывающими положения CpG между праймерами для амплификации. ТестHeavyMethyl также можно использовать в комбинации со специфическими к метилированию праймерами для амплификации. Характерные реагенты (например, которые можно найти в наборе для теста MethyLight) для анализа HeavyMethyl могут включать, но не ограничиваются ими, ПЦР-праймеры для определенных генов(или обработанной бисульфитом последовательности ДНК или островка CpG); блокирующие олигонуклеотиды; оптимизированные буферы для ПЦР и дезоксинуклеотиды и Taq-полимеразу.MSP (специфическая к метилированию ПЦР) позволяет оценить статус метилирования практически любой группы сайтов CpG в островке CpG независимо от использования чувствительных к метилированию рестриктаз (Herman et al., Proc. Natl. Acad. Sci. USA, 93:9821-9826, 1996; патент США 5786146). Коротко, ДНК модифицируют преобразованием с использованием бисульфита натрия всех неметилированных, но неметилированных цитозинов в урацил, и затем амплифицируют с использованием праймеров, специфических для метилированной, но не для неметилированной ДНК. Для MSP необходимы только очень небольшие количества ДНК и метод чувствителен к 0,1% метилированных аллелей данного локуса островка CpG и его можно проводить на ДНК, экстрагированной из залитых в парафин образцов. Характерные реагенты (например, которые можно найти в обычном наборе для MSP) для анализаMSP могут включать, но не ограничиваются ими, метилированные и неметилированные ПЦР-праймеры для определенного гена (или обработанной бисульфитом последовательности ДНК или островка CpG); оптимизированные буферы для ПЦР и дезоксинуклеотиды и специфические зонды."MethyLight". Тест "MethyLight" представляет высокоэффективный количественный метод оценки метилирования, в котором используется основанная на флуоресценции ПЦР в режиме реального времени (TaqMan),для которой не требуются дополнительные манипуляции после стадии ПЦР (Eads et al., Cancer Res.,59:2302-2306, 1999). Коротко, процесс MethyLight начинается со смешанного образца геномной ДНК,которую преобразуют, в реакции с бисульфитом натрия, в смешанный пул зависимых от метилирования различий последовательностей согласно стандартным методам (в результате процесса с бисульфитом происходит преобразование остатков цитозина в урацил). Затем проводят ПЦР, основанную на флуоресценции, в "несимметричной" реакции (с праймерами для ПЦР, которые перекрывают известные динуклеотиды CpG). Различие последовательностей может иметь место на уровне амплификации и на уровне обнаружения флуоресценции. Тест MethyLight можно использовать в качестве количественного анализа для оценки параметров метилирования в образце геномной ДНК, в котором отличие последовательностей имеет место на уровне гибридизации зонда. В этой количественной версии реакцию ПЦР проводят для специфической к метилированию амплификации в присутствии флуоресцентного зонда, который перекрывает определенный предполагаемый сайт метилирования. Объективный контроль для количества входной ДНК обеспечивается реакцией, в которой ни праймеры, ни зонд не перекрывают динуклеотиды CpG. Альтернативно, количественный анализ для геномного метилирования проводят зондированием несимметричного пула ПЦР либо с контрольными олигонуклеотидами, которые не "покрывают" известные сайты метилирования (основанная на флуоресценции версия методов MethyLight и MSP), либо с олигонуклеотидами,покрывающими потенциальные сайты метилирования. Процесс MethyLight можно использовать с любыми подходящими зондами, например"TaqMan", Lightcycler и т.д. Например, двухцепочечную геномную ДНК обрабатывают бисульфитом натрия и подвергают одному из двух циклов реакций ПЦР с использованием зондов TaqMan; например, с праймерами MSP и/или олигонуклеотидами-блокаторами HeavyMethyl и зондом TaqMan. ЗондTaqMan имеет двойную метку молекулами флуоресцентного "репортера" и "гасителя" и сконструирован со специфичностью для области с относительно высоким содержанием GC таким образом, что он плавится при температуре примерно на 10 С выше, чем прямой или обратный праймеры в цикле ПЦР. Это позволяет зонду TaqMan оставаться полностью гибридизованным во время стадий отжига/элонгации при ПЦР. По мере того как Taq-полимераза ферментативно синтезирует новую цепь во время ПЦР, она будет достигать подвергнутого отжигу зонда TaqMan. Затем 5'-3' эндонуклеазная активность Taq-полимеразы будет вытеснять зонд TaqMan его расщеплением с высвобождением флуоресцентной репортерной молекулы для количественного обнаружения его непогашенного сигнала с использованием системы флуоресцентного обнаружения в режиме реального времени. Характерные реагенты (например, которые можно найти в обычном наборе для теста MethyLight) для анализа MethyLight могут включать, но не ограничиваются ими, ПЦР-праймеры для определенных генов (или обработанной бисульфитом последовательности ДНК или островка CpG); зонды TaqMan или Lightcycler; оптимизированные буферы для ПЦР и дезоксинуклеотиды и Taq-полимеразу. Тест QM (количественное метилирование) представляет собой альтернативный количественный анализ для оценки параметров метилирования в образцах геномной ДНК, где различие последовательностей имеет место на уровне гибридизации зонда. В данной количественной версии реакцию ПЦР проводят для объективной амплификации в присутствии флуоресцентного зонда, который перекрывает определенный предполагаемый сайт метилирования. Объективный контроль для количества входной ДНК обеспечивается реакцией, в которой ни праймеры, ни зонд не перекрывают динуклеотиды CpG. Альтернативно, качественный тест для геномного метилирования проводят зондированием несимметричного пула ПЦР либо с контрольными олигонуклеотидами, которые не "покрывают" известные сайты метилирования (основанная на флуоресценции версия методов HeavyMethyl и MSP), либо с олигонуклеотидами, покрывающими потенциальные сайты метилирования. Анализ QM можно использовать с любыми подходящими зондами, например "TaqMan",Lightcycler и т.д., в процессе амплификации. Например, двухцепочечную геномную ДНК обрабатывают бисульфитом натрия и подвергают воздействию объективных праймеров ПЦР и зонду TaqMan. ЗондTaqMan имеет двойную метку из молекул флуоресцентного "репортера" и "гасителя" и сконструирован со специфичностью для области с относительно высоким содержанием GC таким образом, что он плавится при температуре примерно на 10 С выше, чем прямой или обратный праймеры в цикле ПЦР. Это позволяет зонду TaqMan оставаться полностью гибридизованным во время стадий отжига/элонгации ПЦР. По мере того как Taq-полимераза ферментативно синтезирует новую цепь во время ПЦР, она будет достигать подвергнутого отжигу зонда TaqMan. Затем 5'-3' эндонуклеазная активность Taq-полимеразы будет вытеснять зонд TaqMan, расщепляя его с высвобождением флуоресцентной репортерной молекулы для количественного обнаружения его непогашенного сигнала с использованием системы флуоресцентного обнаружения в режиме реального времени. Характерные реагенты (например, которые можно найти в обычном наборе для теста QM) для анализа QM могут включать, но не ограничиваются ими, ПЦР-праймеры для определенного гена (или обработанной бисульфитом последовательности ДНК или островка CpG); зонды TaqMan илиLightcycler; оптимизированные буферы для ПЦР и дезоксинуклеотиды и Taq-полимеразу.Ms-SNuPE. Метод Ms-SNuPE представляет количественный метод для оценки различий в метилировании в определенных сайтах CpG, основанный на обработке ДНК бисульфитом. с последующей однонуклеотидной элонгацией праймеров (GonzalgoJones, Nucleic Acids Res., 25:2529-2531, 1997). Коротко, геномную ДНК подвергают взаимодействию с бисульфитом натрия с преобразованием неметилированного цитозина в урацил, в то время как 5-метилцитозин остается без изменений. Затем проводят амплификацию желаемой последовательности-мишени с использованием специфических ПЦР-праймеров, для преобразованной под действием бисульфита ДНК, и полученный продукт выделяют и используют в качестве матрицы для анализа метилирования в интересующем сайте(ах) CpG. Можно анализировать небольшие количества ДНК (например, микропрепараты патологических срезов), при этом устраняется необходимость в применении рестриктаз для оценки статуса метилирования в сайтах CpG. Характерные реагенты (например, которые можно найти в обычном наборе для Ms-SNuPE) для анализа Ms-SNuPE могут включать, но не ограничиваются ими, праймеры для ПЦР для определенного гена (или обработанной бисульфитом последовательности ДНК или островка CpG); оптимизированные буферы для ПЦР и дезоксинуклеотиды; набор для экстракции геля; положительные контрольные праймеры; праймеры Ms-SNuPE для определенного гена; буфер для реакции (для реакции Ms-SNuPE) и меченые нуклеотиды. Кроме того, реагенты для преобразования бисульфитом могут включать буфер для денатурации ДНК; буфер для сульфонирования; реагенты или наборы для выделения ДНК (например,преципитации, ультрафильтрации, аффинной колонки); буфер для десульфонирования и компоненты для выделения ДНК. Было установлено, что геномные последовательности SEQ ID NO:1-SEQ ID NO:12;SEQ ID NO:79-SEQ ID NO:83 и их неприродные обработанные варианты SEQ ID NO:13-SEQ ID NO:60;SEQ ID NO:84-SEQ ID NO:103 имеют новый вариант использования для обнаружения нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). В одном из вариантов осуществления способ по изобретению включает следующие стадии:i) определение экспрессии по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027;ii) определение наличия или отсутствия нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Способ по изобретению можно осуществлять анализом экспрессии РНК, транскрибированной из них или полипептида, или белка, транслированного из указанной РНК, предпочтительно посредством анализа экспрессии мРНК или анализа экспрессии полипептида. Однако в наиболее предпочтительном варианте осуществления изобретения обнаружение нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), можно проводить посредством анализа статуса метилирования по меньшей мере одного гена или геномной последовательности,выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027;LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1 и/или их промоторов или регуляторных элементов. Следовательно, настоящее изобретение также относится к диагностическим теста и способам, количественным и качественным для обнаружения экспрессии по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2;SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1,у индивида и определение по ней наличия или отсутствия нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких) у индивида. Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Патологическая экспрессия мРНК, транскрибированной по меньшей мере из одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1;ARID5A; VAX1, связана с наличием нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. По настоящему изобретению гиперметилирование и/или низкая экспрессия связана с наличием нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Для обнаружения кодирующих мРНК гена или геномной последовательности у пациента берут пробу. Проба может представлять любой подходящий образец, содержащий клеточное вещество опухоли. Подходящие типы проб включают клетки или клеточные линии, гистологические препараты, материал биопсии, залитую в парафин ткань, жидкости организма, эякулят, мочу, плазму крови, сыворотку крови, цельную кровь, выделенные клетки крови, мокроту и биологическое вещество, полученные при бронхоскопии (включая, но не ограничиваясь ими, бронхиальный лаваж, бронхоальвеолярный лаваж,щеточную биопсию бронхов, абразию бронхов) и все их возможные комбинации. Более предпочтительный вариант проб выбран из группы, состоящей из плазмы крови, мокроты и биологического вещества,полученных при бронхоскопии (включая, но не ограничиваясь ими, бронхиальный лаваж, бронхоальвеолярный лаваж, щеточную биопсию бронхов, абразию бронхов) и всех их возможных комбинаций. Образец можно обработать для экстракции РНК, содержащейся в нем. Затем полученную из образца нуклеиновую кислоту анализируют. В данной области известно большое число методов определения абсолютного и относительного уровня экспрессии генов, наиболее часто используемые методы, которые могут использоваться в настоящем изобретении, включают гибридизацию in situ (например, FISH), нозерн-блоттинг, тесты защиты от РНКазы (RPA), микрочипы и методы, основанные на ПЦР, такой как количественная ПЦР и ПЦР с дифференциальным дисплеем, или любой другой метод обнаружения нуклеиновых кислот. Особенно предпочтительным является использование способа обратной транскрипции/полимеразной цепной реакции (ОТ-ПЦР). Метод ОТ-ПЦР хорошо известен в данной области (например, см. Watson и Fleming, см. выше). ОТ-ПЦР можно провести следующим образом. Выделяют общую клеточную фракцию РНК, например, обычным способом с использованием гуанидина изотиоцианата и общую РНК подвергают обратной транскрипции. Обратная транскрипция включает синтез ДНК на матрице РНК с использованием фермента обратной транскриптазы и 3'-концевого олигонуклеотидного dT-праймера и/или произвольных гексамерных праймеров. Затем полученную таким образом кДНК амплифицируют с помощью ПЦРPress, N.Y., Vol. 152, p. 316-325, 1987, эти источники включены в настоящее описание для сведения). Еще более предпочтительным вариантом является вариант ОТ-ПЦР в "режиме реального времени", в котором продукт ПЦР обнаруживают с использованием гибридизирующихся зондов (например, TaqMan, Lightcycler, Molecular BeaconsScorpion) или SYBR зеленого. Затем обнаруживаемый сигнал от зондов илиSYBR зеленого оценивают количественно по калибровочной кривой или сравнением со значениями Ct для стандарта, используемого для построения калибровочной кривой. Часто используют анализ генов"домашнего хозяйства" для нормализации данных. При нозерн-блоттинге общую фракцию или поли(А)+ мРНК помещают на агарозный гель и обнаруживают по гибридизации с меченым зондом непосредственно в высушенном геле или на мембране. Полученный сигнал пропорционален количеству РНК-мишени в популяции РНК. При сравнении сигналов двух или более клеточных популяций или тканей выявляют относительные различия в уровнях экспрессии генов. Абсолютное количественное определение можно проводить при сравнении сигнала с калибровочной кривой, полученной in vitro с использованием известных количеств транскрипта, соответствующего мРНК-мишени. Анализ генов "домашнего хозяйства", генов, уровни экспрессии которых предположительно остаются относительно постоянными независимо от условий, часто используют для нормализации данных, что приводит к устранению любых кажущихся различий, вызванных неправильным переносом РНК на мембрану или неправильным нанесением РНК на гель. Первой стадией при нозерн-блоттинге является выделение чистой, интактной РНК из интересующих клеток или ткани. В результате того, что при нозерн-блоттинге молекулы РНК различаются по размеру, целостность образца оказывает влияние на степень, с которой сигнал локализуется в одной полосе. Частично разрушенные образцы РНК будут приводить к появлению сигнала, который размыт или распределен на несколько полос с общей потерей в чувствительности и возможно ошибочной интерпретацией данных. При нозерн-блоттинге можно использовать ДНК-, РНК- и олигонуклеотидные зонды, и эти зонды предпочтительно метят (например, радиоактивными метками, массовыми метками или флуоресцентными метками). Размер РНК-мишени, но не зонда, будет определять размер обнаруживаемой полосы, таким образом, методы произвольного праймированного мечения, которые обеспечивают зонды различных длин, являются подходящими для синтеза зондов. Специфическая активность зонда будет определять уровень чувствительности метода, таким образом, предпочтительно чтобы использовались зонды с высокой специфической активностью. В тесте защиты от РНКазы РНК-мишень и РНК-зонд определенной длины гибридизуют в растворе. После гибридизации РНК расщепляют РНКазой, специфичной для одноцепочечных нуклеиновых кислот, для удаления любой негибридизованной, одноцепочечной РНК-мишени и зонда. РНКазы инактивируют и отделяют РНК, например, электрофорезом в денатурирующем полиакриламидном геле. Количество интактного РНК-зонда пропорционально количеству РНК-мишени в популяции РНК. RPA можно использовать для относительного и абсолютного количественного анализа экспрессии гена и также картирования структуры РНК, такого как определение границ интрона/экзона и стартовых сайтов транскрипции. Тест защиты от РНКазы предпочтителен по сравнению с нозерн-блоттингом, поскольку обычно он имеет более низкий предел обнаружения. Антисмысловые РНК-зонды, используемые в RPA, получают транскрипцией ДНК-матрицы в условиях in vitro с определенной конечной точкой, и, как правило, их длина составляет примерно 50-600 нуклеотидов. Использование РНК-зондов, которые включают дополнительные последовательности, не гомологичные РНК-мишени, позволяет отличить защищенный фрагмент от полноразмерного зонда. Как правило, РНК-зонды используют вместо ДНК-зондов за счет простоты получения одноцепочечных РНКзондов и воспроизводимости и надежности расщепления дуплекса РНК:РНК РНКазой (Ausubel et al.,2003), особенно предпочтительными являются зонды с высокой специфической активностью. Особенно предпочтительно использование микрочипов. Анализ с использованием микрочипов можно разделить на две основные части. Первая представляет иммобилизацию известных последовательностей генов на предметных стеклах или другой твердой подложке с последующей гибридизацией меченной флуоресцентной меткой кДНК (содержащей последовательности для анализа) с известными генами, иммобилизованными на предметном стекле (или другой твердой фазе). После гибридизации чипы сканируют с использованием флуоресцентного сканера для микрочипов. Анализ относительной интенсивности флуоресценции различных генов дает показатель различий в экспрессии генов. ДНК-микрочипы можно получить иммобилизацией предварительно синтезированных олигонуклеотидов на полученные предметные стекла или других твердых поверхностях. В данном случае получают и готовят характерные последовательности генов с использованием методов синтеза и очистки олигонуклеотидов. Данные синтезированные последовательности генов являются комплементарными транскрипту(м) РНК по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C;BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1, и они являются более короткими последовательностями с длиной в пределах 25-70 нуклеотидов. Альтернативно, иммобилизованные олигонуклеотиды можно синтезировать химически in situ на поверхности предметного стекла. Синтез олигонуклеотидов insitu включает последовательное добавление соответствующих нуклеотидов на точки на микрочипах; точки, на которые не наносили нуклеотид, защищают на каждой стадии процесса с использованием физических или виртуальных "масок". Предпочтительно указанные синтезированные нуклеиновые кислоты представляют замкнутые нуклеиновые кислоты. В опытах с микрочипами по определению характера экспрессии используемые РНК-матрицы представляют характер транскрипции клеток или тканей, которые исследуют. Вначале выделяют РНК из клеточных популяций или тканей, которые используют для сравнения. Затем каждый образец РНК используют в качестве матрицы с получением меченных флуоресцентной меткой кДНК посредством реакции обратной транскрипции. Введение флуоресцентной метки в кДНК можно проводить либо прямым мечением, либо опосредованным мечением. Во время прямого мечения модифицированные флуоресцентной меткой нуклеотиды (например, Су 3- или Cy-5-dCTP) включаются непосредственно в кДНК во время обратной транскрипции. Альтернативно, можно проводить опосредованное мечение включением аминоаллил-модифицированных нуклеотидов во время синтеза кДНК и затем конъюгированием красителяN-гидроксисукцинимидного (NHS) эфира с аминоаллил-модифицированной кДНК после завершения реакции обратной транскрипции. Альтернативно, в зонд можно не вводить метку, но можно сделать его обнаруживаемым посредством специфического связывания с лигандом, который является меченым, напрямую или опосредованно. Подходящие метки и способы мечения лигандов (и зондов) известны в данной области и к ним относятся, например, радиоактивные метки, которые можно вводить известными способами (например, ник-трансляцией или мечением киназой). Другие подходящие метки включают, но не ограничиваются ими, флуоресцентные группы, хемилюминесцентные группы (например, диоксетаны,в частности "запущенные" диоксетаны), ферменты, антитела и т.п. Для дифференциального анализа экспрессии генов кДНК, полученную из различных образцов РНК, метят Су 3. Полученную меченую кДНК очищают для удаления невключенных нуклеотидов, свободного красителя и остаточной РНК. После очистки меченые образцы кДНК гибридизуют с микрочипами. Жесткость условий гибридизации определяют с учетом ряда факторов во время гибридизации и во время отмывки, включающих температуру, ионную силу, время и концентрацию формамида. Данные факторы описаны, например, Sambrook etal. (Molecular Cloning: A Laboratory Manual, 2nd ed., 1989). После гибридизации микрочипы сканируют с использованием флуоресцентного сканера для микрочипов. Интенсивность флуоресценции каждой точки указывает на уровень экспрессии анализируемого гена; яркие пятна соответствуют генам с высокой экспрессией, в то время как тусклые пятна означают слабую экспрессию. После получения изображений необработанные данные необходимо подвергнуть анализу. Вначале фоновую флуоресценцию следует вычесть из значения флуоресценции каждой точки. Затем данные нормализуют к контрольной последовательности, такой как экзогенно внесенные нуклеиновые кислоты(предпочтительно РНК или ДНК), или к панели генов "домашнего хозяйства" для учета любой неспецифической гибридизации, несовершенства микрочипов или вариабельности в микрочипах, мечении кДНК,гибридизации или отмывке. Нормализация данных позволяет сравнить результаты множества микрочипов. Другой аспект изобретения относится к набору для использования в диагностике нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких и дополнительно предпочтительной карциномы легких, выбранной из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких), у индивида согласно способам по настоящему изобретению, где указанный набор содержит средства для определения уровня транскрипции по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1;ARID5A; VAX1. В предпочтительном варианте осуществления средства для определения уровня транскрипции включают олигонуклеотиды или полинуклеотиды, способные гибридизоваться в жестких условиях или условиях средней жесткости с продуктами транскрипции по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1;ARID5A; VAX1. В наиболее предпочтительном варианте осуществления уровень транскрипции определяют способами, выбранными из группы, состоящей из нозерн-блоттинга, обратной транскрипции-ПЦР,ПЦР в режиме реального времени, теста защиты от РНКазы и технологии микрочипов. В еще одном варианте осуществления изобретения набор дополнительно содержит средства для получения биологического образца у пациента. Предпочтительным является набор, который дополнительно содержит контейнер, который наиболее предпочтительно подходит для включения средств для определения уровня транскрипции и биологического образца пациента и наиболее предпочтительно дополнительно содержит инструкции по применению и интерпретации результатов применения набора. В предпочтительном варианте осуществления набор содержит:(а) множество олигонуклеотидов или полинуклеотидов, способных гибридизоваться в жестких условиях или условиях средней жесткости с продуктами транскрипции по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1;(b) контейнер, предпочтительно подходящий для введения олигонуклеотидов или полинуклеотидов и биологического образца пациента, содержащего продукты транскрипции, где олигонуклеотиды или полинуклеотиды могут гибридизоваться в жестких условиях или условиях средней жесткости с продуктами транскрипции;(с) средства для обнаружения гибридизации по (b); и, необязательно,(d) инструкции по применению и интерпретации результатов применения набора. Также набор может содержать другие компоненты, такие как буфер для гибридизации (где олигонуклеотиды используют в качестве зонда), упакованные в отдельном контейнере. Альтернативно, когда олигонуклеотиды используют для амплификации области-мишени, то набор может содержать упакованные в отдельных контейнерах полимеразу и буфер для реакции, оптимизированный для элонгации праймера, опосредованной полимеразой, такой как для ПЦР. Предпочтительно указанная полимераза является обратной транскриптазой. Дополнительно предпочтительно, чтобы указанный набор содержал реагент РНКазу. Дополнительно, настоящее изобретение относится к способам обнаружения наличия полипептида,кодированного указанными последовательностями генов в образце, полученном от пациента. Патологические уровни экспрессии полипептидов, кодированных по меньшей мере одним геном или геномной последовательностью, выбранными из группы, состоящей из PTGER4; RUNX1; EVX2;ARID5A; VAX1, связаны с наличием нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. По настоящему изобретению низкая экспрессия указанных полипептидов связана с наличием нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Можно использовать любой метод, известный в данной области, для обнаружения полипептидов. Такие методы включают, но не ограничиваются ими, масс-спектрометрию, иммунодиффузию, иммуноэлектрофорез, иммунохимические методы, тесты на основе образования комплекса связывающее вещество-лиганд, иммуногистохимические методы, агглютинацию и тесты с комплементом (например, см.Basic and Clinical Immunology, Sites and Terr, eds., AppletonLange, Norwalk, Conn., p. 217-262, 1991, этот источник включен в настоящее описание для сведения). Предпочтительными являются методы иммуноанализа на основе комплексов связывающее вещество-лиганд, включающие взаимодействие антител с эпитопом или эпитопами и конкурентное вытеснение меченого полипептида или его производного. Некоторые варианты осуществления настоящего изобретения включают применение антител, специфических к полипептиду(м), кодированному по меньшей мере одним геном или геномной последовательностью, выбранными из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2;SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1. Такие антитела являются подходящими для диагностики нарушений клеточной пролиферации,предпочтительно приведенных в табл. 2, наиболее предпочтительно для диагностики карциномы легких. Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкокле- 13018010 точной карциномы легких. В некоторых вариантах осуществления продукцию моноклональных или поликлональных антител можно индуцировать применением эпитопа, кодированного полипептидом по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей изPRDM14; SEQ ID NO:81; ARID5A; VAX1, в качестве антигена. В свою очередь, такие антитела можно использовать для обнаружения экспрессированных полипептидов в качестве маркеров для нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2, наиболее предпочтительно для диагностики карциномы легких. Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Уровни таких присутствующих полипептидов можно количественно определить обычными методами. Связывание антитело-полипептид можно обнаружить и оценить количественно различными средствами, известными в данной области, такими как введение флуоресцентной метки или радиоактивных лигандов. Изобретение дополнительно включает наборы для указанных выше методов, где такие наборы содержат антитела, специфичные для исследуемых полипептидов. В данной области хорошо известны многочисленные иммунологические методы конкурентного и неконкурентного связывания полипептидов. Антитела, используемые в таких тестах, могут быть без метки, например, которые используют в тестах агглютинации, или они могут содержать метку и использоваться в самых различных аналитических тестах. Метки, которые можно использовать, включают радионуклиды, ферменты, флуоресцентные метки, люминесцентные метки, субстраты ферментов или кофакторы, ингибиторы ферментов, частицы, краски и т.п. Предпочтительные тесты включают, но не ограничиваются ими, радиоиммуноанализ (RIA), иммуноферментные тесты, например, твердофазный иммуноферментный метод (ELISA), флуоресцентные иммунологические тесты и т.п. Можно получить поликлональные или моноклональные антитела или эпитопы для использования в любом из ряда иммунологических способов, известных в данной области. В альтернативном варианте осуществления способа белки можно обнаружить посредством вестернблоттинга. Указанный анализ является обычным в данной области, и, коротко, белки разделяют электрофорезом, например электрофорезом в SDS-PAGE. Затем разделенные белки переносят на подходящую мембрану (или бумагу), например нитроцеллюлозную мембрану, сохраняя их пространственное разделение с помощью электрофореза. Затем мембрану инкубируют с блокирующим реагентом для связывания оставшихся липких мест на мембране, обычно используемые реагенты включают белок-генерик (например, белок молока). Затем добавляют антитело, специфичное к интересующему белку, где указанное антитело содержит обнаруживаемую метку, например краски или ферменты (например, щелочную фосфатазу или пероксидазу из хрена). Затем обнаруживают локализацию антитела на мембране. В альтернативном варианте осуществления способа белки можно обнаружить посредством иммуногистохимии (применение антител к антигенам, специфичных к зонду, в образце). Указанный анализ является обычным в данной области, когда обнаружение антигенов в тканях известно как иммуногистохимия, в то время как обнаружение в культивированных клетках обычно называют иммуноцитохимией. Коротко, первичное антитело обнаруживают по связыванию с его специфическим антигеном. Затем комплекс антитело-антиген связывают со вторым антителом, конъюгированным с ферментом. В присутствии необходимого субстрата и хромогена связанный фермент обнаруживают по окрашенным отложениям в местах связывания антитела-антигена. Существует широкий ряд подходящих типов образцов, аффинности антиген-антитело, типов антител и методов усиления обнаружения. Таким образом, специалистам в данной области необходимо определить оптимальные условия для иммуногистохимического или иммуноцитохимического обнаружения для каждого отдельного случая. Одним подходом для получения антител к полипептиду является выбор и получение аминокислотной последовательности всего или фрагмента полипептида, химический синтез аминокислотной последовательности и его введение соответствующему животному, обычно кролику или мыши (Milstein andTechniques, 73:1-46, Langone and Banatis eds., Academic Press, 1981, эти источники в полном объеме включены в настоящее описание для сведения). Способы получения полипептидов или их эпитопов включают, но не ограничиваются ими, химический синтез, методы рекомбинантной ДНК или выделение из биологических образцов. На конечной стадии способа пациенту ставят диагноз, при этом низкая экспрессия (мРНК или полипептидов) указывает на наличие нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Термин "низкая экспрессия" следует понимать как экспрессию на уровне обнаружения, который ниже заранее определенного порога отсечения, который можно выбрать из группы, состоящей из среднего, усредненного или оптимизированного порогового значения. Термин "гиперэкспрессия" следует понимать как экспрессию на уровне обнаружения, который выше заранее определенного порога отсечения,который можно выбрать из группы, состоящей из среднего, усредненного или оптимизированного поро- 14018010 гового значения. Другой аспект изобретения относится к набору для использования при диагностике нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), у индивида согласно способам по настоящему изобретению, включающим средства для обнаружения по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из полипептидов PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT;IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1. Средства для обнаружения полипептидов предпочтительно включают антитела, производные антител или фрагменты антител. Наиболее предпочтительно полипептиды обнаруживают посредством вестерн-блоттинга с использованием меченых антител. В еще одном варианте осуществления изобретения набор дополнительно содержит средства для получения биологического образца у пациента. Предпочтительным является набор, который дополнительно содержит подходящий контейнер, содержащий средства для обнаружения полипептидов в биологическом образце пациента, наиболее предпочтительно набор дополнительно содержит инструкции по применению и интерпретации результатов применения набора. В предпочтительном варианте осуществления набор содержит: (а) средства для обнаружения по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из полипептидов PTGER4; RUNX1; EVX2;ARID5A; VAX1; (b) подходящий контейнер, содержащий указанные средства и биологический образец пациента, содержащий полипептиды, где средства могут образовывать комплексы с полипептидами; (с) средства для обнаружения комплексов по (b) и, необязательно, (d) инструкции по применению и интерпретации результатов применения набора. Также набор может содержать другие компоненты, такие как буферы или растворы, подходящие для блокирования, промывания или покрытия, упакованные в отдельные контейнеры. Конкретные варианты осуществления настоящего изобретения относятся к новому применению анализа уровней и/или параметров метилирования по меньшей мере в одном гене или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2;SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1,что делает возможным обнаружить, охарактеризовать и/или лечить нарушения клеточной пролиферации,предпочтительно приведенные в табл. 2 (наиболее предпочтительно карциному легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Раннее обнаружение нарушений клеточной пролиферации, в частности карциномы легких, непосредственно связано с прогнозом заболевания, и, таким образом, раскрытый способ делает возможным,чтобы врач и пациент лучше и более информировано принимали решение по поводу лечения. В наиболее предпочтительном варианте осуществления способа наличие или отсутствие нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких, в частности карциномы легких, выбранной из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких), определяют анализом статуса метилирования одного или более динуклеотидов CpG по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4;SEQ ID NO:81; ARID5A; VAX1. В одном из вариантов осуществления изобретения указанный способ включает следующие стадии:i) контактирование геномной ДНК, выделенной из биологического образца (предпочтительно выделенного из жидкостей организма), взятого у индивида, по меньшей мере с одним реагентом или группами реагентов, с помощью которых можно различить метилированные или неметилированные динуклеотидыCpG, по меньшей мере в одном гене или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C;ii) обнаружение нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Предпочтительно, чтобы указанный один или более динуклеотидов CpG по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2;ARID5A; VAX1, находились в их соответствующей геномной последовательности-мишениSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 и комплементарных им последовательностях. Настоящее изобретение дополнительно относится к способу установления генетических и/или эпигенетических параметров по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL-12RB1;SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, у индивида анализом метилирования цито- 15018010 зина. Указанный способ включает контактирование нуклеиновой кислоты, содержащей последовательности SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, в биологическом образце, взятом у указанного индивида, по меньшей мере с одним реагентом или группами реагентов, где с помощью указанного реагента или групп реагентов можно различить метилированные и неметилированные динуклеотиды CpG в нуклеиновой кислоте-мишени. В предпочтительном варианте осуществления указанный способ включает следующие стадии: на первой стадии получают образец ткани для анализа. Источником может быть любой подходящий источник, такой как клетки или клеточные линии, гистологические препараты, материал биопсии, залитую в парафин ткань, жидкости организма, эякулят, моча, плазма крови, сыворотка крови, цельная кровь, выделенные клетки крови, мокрота и биологическое вещество, полученные при бронхоскопии (включая, но не ограничиваясь ими, бронхиальный лаваж, бронхоальвеолярный лаваж, щеточную биопсию бронхов,абразию бронхов) и все их возможные комбинации. Более предпочтительный тип образца выбран из группы, состоящей из плазмы крови, мокроты и биологического вещества, полученных при бронхоскопии (включая, но не ограничиваясь ими, бронхиальный лаваж, бронхоальвеолярный лаваж, щеточную биопсию бронхов, абразию бронхов) и всех их возможных комбинаций. Затем из образца выделяют геномную ДНК. Геномную ДНК можно выделить обычными методами в данной области, включая применение промышленно доступных наборов. Коротко, в том случае, когда интересующая ДНК инкапсулирована клеточной мембраной, то биологический образец необходимо разрушить и лизировать ферментативным, химическим или механическим способом. Затем раствор ДНК очищают от белков и других примесей, например расщеплением с помощью протеиназы K. Далее геномную ДНК выделяют из раствора. Это можно проводить с помощью различных методов, включая высаливание, экстракцию органическим растворителем или связывание ДНК с твердофазной подложкой. На выбор метода будут оказывать влияние несколько факторов, которые включают время, стоимость и необходимое количество ДНК. В том случае, когда образец ДНК не находится в мембране (например, циркулирующая ДНК из образца крови), то можно использовать методы, известные в данной области для выделения и/или очистки ДНК. Такие методы включают применение разрушающего белок реагента, например хаотропной соли,например, гуанидина гидрохлорида или мочевины; или детергента, например додецилсульфата натрия(SDS), бромистого циана. Альтернативные методы включают, но не ограничиваются ими, преципитацию этанолом или преципитацию пропанолом, концентрирование в вакууме, среди прочего, с помощью центрифуги. Также специалист в данной области может применить устройства, такие как устройства для фильтрования, например для ультрафильтрации, поверхности или мембраны из диоксида кремния, магнитные частицы, частицы из полистирола, поверхности из полистирола, положительно заряженные поверхности и положительно заряженные мембраны, заряженные мембраны, заряженные поверхности,мембраны с переключаемым зарядом, поверхности с переключаемым зарядом. После экстракции нуклеиновых кислот геномную двухцепочечную ДНК используют для анализа. На второй стадии способа образец геномной ДНК обрабатывают таким образом, что основания цитозины, которые не метилированы в 5'-положении, преобразуются в урацил, тимидин или другое основание, которое отличается от цитозина в отношении поведения при гибридизации. Эту стадию следует понимать в настоящем описании как "предварительную обработку" или "обработку". Это предпочтительно достигается обработкой бисульфитным реагентом. Термин "бисульфитный реагент" относится к реагенту, включающему бисульфит, дисульфит, вторичный кислый сульфит или их комбинации, подходящему, как раскрыто в настоящем описании, для обеспечения различия метилированных и неметилированных динуклеотидных последовательностей CpG. Методы указанной обработки известны в данной области (например, описаны в РСТ/ЕР 2004/011715, этот источник в полном объеме включен в настоящее описание для сведения). Предпочтительно, чтобы обработку бисульфитом проводили в присутствии денатурирующих растворителей, таких как, но не ограничиваясь ими, налкиленгликоль, в частности диметиловый эфир диэтиленгликоля (DME), или в присутствии диоксана или производных диоксана. В предпочтительном варианте осуществления денатурирующие растворители используют в концентрации в пределах от 1 до 35% (об./об.). Также предпочтительно, чтобы реакцию с бисульфитом проводили в присутствии поглотителей, таких как, но не ограничиваясь ими, производные хромана, например 6-гидрокси-2,5,7,8-тетраметилхроман 2-карбоновая кислота, или тригидроксибензойная кислота и ее производные, например галловая кислота (см. РСТ/ЕР 2004/011715, этот источник в полном объеме включен в настоящее описание для сведения). Преобразование с использованием бисульфита предпочтительно проводят при температуре реакции между 30 и 70 С, затем температуру повышают до более чем 85 С в течение коротких периодов времени во время проведения реакции (см. РСТ/ЕР 2004/011715, этот источник в полном объеме включен в настоящее описание для сведения). Обработанную бисульфитом ДНК предпочтительно очищают перед количественным анализом. Это можно проводить любыми средствами, известными в данной области, такими как, но не ограничиваясь ими,ультрафильтрация, предпочтительно ее проводят с помощью колонок Microcon (TM) (производства Millipore (TM. Очистку проводят по модифицированному протоколу изготовителя (см. РСТ/ЕР 2004/011715, этот источник в полном объеме включен в настоящее описание для сведения). На третьей стадии способа фрагменты обработанной ДНК амплифицируют с использованием рядов олигонуклеотидов-праймеров по настоящему изобретению и фермента для амплификации. Амплификацию нескольких сегментов ДНК можно проводить одновременно в одном и том же реакционном сосуде. Как правило, амплификацию проводят с использованием полимеразной цепной реакции (ПЦР). Предпочтительно указанные амплификаты имеют длину от 100 до 2000 п.н. Ряд олигонуклеотидов-праймеров включает по меньшей мере два олигонуклеотида, последовательности каждого из которых обратно комплементарны, идентичны или гибридизуются в жестких условиях или условиях высокой жесткости, по меньшей мере, с сегментом длиной 16 пар оснований из одной последовательности основанийSEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарных им последовательностей. В альтернативном варианте осуществления способа статус метилирования заранее выбранных положений CpG по меньшей мере в одном гене или геномной последовательности, выбранной из группы,состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL-12RB1;TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1, и предпочтительно в последовательностях нуклеиновых кислот SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 можно обнаружить при использовании специфических к метилированию олигонуклеотидов-праймеров. Данный метод(MSP) описан в патенте США 6265171, Herman. Применение специфических к статусу метилирования праймеров для амплификации обработанной бисульфитом ДНК позволяет дифференцировать метилированные и неметилированные нуклеиновые кислоты. Пары праймеров MSP включают по меньшей мере один праймер, который гибридизуется с обработанным бисульфитом динуклеотидом CpG. Следовательно, последовательность указанных праймеров содержит по меньшей мере один динуклеотид CpG. MSP праймеры, специфичные для неметилированной ДНК, содержат "Т" в С-положении в CpG. Следовательно, предпочтительно, чтобы последовательность оснований указанных праймеров включала последовательность с длиной по меньшей мере 9 нуклеотидов, которая гибридизуется с обработанной последовательностью нуклеиновой кислоты SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарными им последовательностями, где последовательность оснований указанных олигомеров содержит по меньшей мере один динуклеотид CpG. Дополнительный предпочтительный вариант осуществления способа включает применение олигонуклеотидов-блокаторов (тест HeavyMethyl). Применение таких олигонуклеотидов-блокаторов описано Yu et al., BioTechniques, 23:714-720, 1997. Блокирующие олигонуклеотиды-зонды гибридизуются с обработанной бисульфитом нуклеиновой кислотой одновременно с ПЦР-праймерами. Амплификация нуклеиновой кислоты ПЦР заканчивается в 5'-положении блокирующего зонда так, что амплификация нуклеиновой кислоты подавляется, когда имеется комплементарная последовательность для блокирующего зонда. Можно сконструировать зонды для гибридизации с обработанной бисульфитом нуклеиновой кислотой со специфическим для статуса метилирования профилем. Например, для обнаружения метилированных нуклеиновых кислот в популяции неметилированных нуклеиновых кислот необходимо подавить амплификацию нуклеиновых кислот, которые неметилированы в интересующем положении, с помощью блокирующих зондов, содержащих "CpA" или"ТрА" в интересующем положении, в противоположность "CpG", когда желательно подавить амплификацию метилированных нуклеиновых кислот. Для методов на основе ПЦР, в которых используются олигонуклеотиды-блокаторы, необходимо эффективное подавление опосредованной полимеразой амплификации для того, чтобы олигонуклеотиды-блокаторы не подвергались элонгации под действием полимеразы. Предпочтительно это достигается применением блокаторов, которые представляют собой 3'-дезоксиолигонуклеотиды или олигонуклеотиды, дериватизованные в 3'-положении иной группой, чем "свободная" гидроксильная группа. Например,3'-О-ацетилолигонуклеотиды являются примерами предпочтительной группы молекулы блокатора. Кроме того, следует предотвратить опосредованное полимеразой разрушение олигонуклеотидовблокаторов. Предпочтительно такое предупреждение включает применение полимеразы, у которой отсутствует 5'-3'-экзонуклеазная активность, или применение модифицированных олигонуклеотидовблокаторов, содержащих, например, тиоатные мостики на их 5'-концах, что придает молекуле блокатора устойчивость к воздействию нуклеазы. Для определенных применений могут не потребоваться такие 5'-модификации блокатора. Например, если связывающие сайты блокатора и праймера перекрываются,тем самым при этом предупреждается связывание праймера (например, избытком блокатора), то деградация олигонуклеотида-блокатора будет, по существу, исключаться. Это происходит в результате того,что полимераза не будет наращивать праймер в направлении к и через (в 5'-3'-направлении) блокатор процесс, который обычно приводит к разрушению гибридизованного олигонуклеотида-блокатора. Особенно предпочтительным вариантом осуществления блокатора/ПЦР для целей настоящего изобретения, который обеспечивается в настоящем описании, является применение в качестве блокирующих олигонуклеотидов пептидных олигомеров нуклеиновых кислот (PNA). Такие PNA блокаторыолигомеры подходят идеально, поскольку они не разрушаются и не подвергаются наращению под действием полимеразы. Следовательно, предпочтительно, чтобы последовательность оснований указанных блокирующих олигонуклеотидов содержала последовательность длиной по меньшей мере 9 нуклеотидов,которая гибридизуется с одной из обработанных последовательностей нуклеиновых кислотSEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарными им последовательностями, где последовательность оснований указанных олигонуклеотидов содержит по меньшей мере один динуклеотид CpG, TpG или СрА. Фрагменты, полученные посредством амплификации, могут нести прямо или опосредованно обнаруживаемую метку. Предпочтительными являются метки в виде флуоресцентных меток, радионуклидов или отщепляемых молекулярных фрагментов с типичной массой, которую можно обнаружить на массспектрометре. В том случае, когда указанные метки представляют массовые метки, предпочтительно чтобы меченые амплификаты имели один положительный или отрицательный общий заряд, позволяющий лучше обнаружить на масс-спектрометре. Обнаружение и визуализацию можно проводить посредством, например, масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией(MALDI) или с использованием масс-спектрометрии с электрораспылением (ESI). Масс-спектрометрия с матрично-активированной лазерной десорбцией/ионизацией (MALDI-TOF) представляет собой очень хорощую разработку для анализа биологических молекул (KarasHillenkamp,Anal. Chem., 60:2299-301, 1988). Анализируемое вещество погружают в абсорбирующий свет матрикс. Матрикс выпаривают под действием короткого лазерного импульса так, что молекула анализируемого вещества переходит в паровую фазу в нефрагментированной форме. Анализируемое вещество ионизируется при столкновении с молекулами матрикса. Под действием приложенного напряжения ионы поступают в пролетную трубку без поля. За счет разницы в массах ионы передвигаются с различными скоростями. Более мелкие ионы достигают детектора раньше по сравнению с более крупными. MALDI-TOF спектрометрия хорошо подходит для анализа пептидов и белков. Анализ нуклеиновых кислот является несколько более трудным (GutBeck, Current Innovations and Future Trends, 1:147-57, 1995). Чувствительность при анализе нуклеиновых кислот примерно в 100 раз ниже по сравнению с пептидами, и она непропорционально снижается с увеличением размера фрагмента. Кроме того, нуклеиновые кислоты имеют скелет с множеством отрицательных зарядов, и процесс ионизации через матрикс является существенно менее эффективным. При MALDI-TOF спектрометрии выбор матрикса играет очень важную роль. Для десорбции пептидов было найдено несколько очень эффективных матриксов, которые обеспечивают очень хорошую кристаллизацию. В настоящее время имеется несколько подходящих для ДНК матриксов, что, однако, не привело к уменьшению различий в чувствительности анализа пептидов и нуклеиновых кислот. Однако данное различие в чувствительности можно снизить посредством химической модификации ДНК таким образом, что она приближается к таковой для пептида. Например, фосфоротиоатные нуклеиновые кислоты, в которых обычные фосфаты скелета замещены на тиофосфаты, можно превратить в ДНК с нейтральным зарядом с использованием обычного алкилирования (GutBeck,Nucleic Acids Res., 23:1367-73, 1995). Сочетание метки-заряда с данной модифицированной ДНК приводит к повышению чувствительности MALDI-TOF до уровня, аналогичного для пептидов. Дополнительным преимуществом введения зарядной метки является повышенная стабильность анализа против примесей, что делает обнаружение немодифицированных субстратов значительно более трудным. На четвертой стадии способа амплификаты, полученные на третьей стадии способа, анализируют для установления статуса метилирования динуклеотидов CpG, который был перед обработкой. В вариантах осуществления, где амплификаты получали посредством MSP-амплификации, присутствие или отсутствие амплификата само по себе указывает на состояние метилирования положений CpG,покрытых праймером, соответственно последовательностям оснований указанного праймера. Амплификаты, полученные с помощью стандарта и специфической к метилированию ПЦР, можно дополнительно анализировать посредством методов основание-основание, таких как, но не ограничиваясь ими, технология микрочипов и технологии на основе зондов, а также с помощью методов, таких как секвенирование и направленное матрицей наращение. В одном из вариантов осуществления способа амплификаты, синтезированные на третьей стадии,затем гибридизуют с микрочипами или рядом олигонуклеотидов и/или PNA-зондов. В данном контексте гибридизация происходит следующим образом: ряд зондов, использованных во время гибридизации,предпочтительно состоит по меньшей мере из 2 олигонуклеотидов или PNA-олигомеров; в способе амплификаты служат в качестве зондов, которые гибридизуются с олигонуклеотидами, предварительно связанными с твердой фазой; затем негибридизованные фрагменты удаляют; указанные олигонуклеотиды содержат по меньшей мере одну последовательность длиной по меньшей мере 9 нуклеотидов, которая обратно комплементарна или идентична сегменту последовательностей оснований, приведенных в списке последовательностей; и сегмент содержит по меньшей мере один динуклеотид CpG, TpG или СрА. Гибридизующийся фрагмент гибридизующихся нуклеиновых кислот, как правило, имеет длину по меньшей мере 9, 15, 20, 25, 30 или 35 нуклеотидов. Однако применимы молекулы с большей длиной, и,таким образом, они находятся в объеме настоящего изобретения. В предпочтительном варианте осуществления указанный динуклеотид находится в центральной трети олигомера. Например, когда олигомер содержит один динуклеотид CpG, то указанный динуклеотид предпочтительно является пятым-девятым нуклеотидом с 5'-конца 13-мера. Один олигонуклеотид имеется для анализа каждого динуклеотида CpG в последовательности, выбранной из группы, состоящей из SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, и эквивалентные положения в последова- 18018010 тельностях SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103. Указанные олигонуклеотиды также могут находиться в форме пептидных нуклеиновых кислот. Затем негибридизованные амплификаты удаляют. Затем обнаруживают гибридизованные амплификаты. В данном контексте предпочтительно,чтобы метки, присоединенные к амплификатам, были идентифицируемыми в каждом положении твердой фазы, на которой находится олигонуклеотидная последовательность. В еще одном варианте осуществления способа статус геномного метилирования положений CpG можно оценить с помощью олигонуклеотидных зондов (как подробно описано выше), которые гибридизуются с обработанной бисульфитом ДНК одновременно с ПЦР-праймерами для амплификации (где указанные праймеры могут быть специфическими к метилированию или обычными). Особенно предпочтительным вариантом осуществления данного способа является применение основанной на флуоресценции количественной ПЦР в режиме реального времени (Heid et al., Genome Res.,6:986-994, 1996; также см. патент США 6331393) с использованием флуоресцентных олигонуклеотидных зондов с двойной меткой (TaqMan ПЦР с использованием прибора ABI Prism 7700 SequenceDetection System, Perkin Elmer Applied Biosystems, Foster City, California). В реакции TaqMan ПЦР используется ненаращиваемый любопытный олигонуклеотид, называемый TaqMan зондом, который в предпочтительных вариантах осуществления сконструирован для гибридизации с богатой последовательностью CpG, расположенной между прямым и обратным праймерами для амплификации. ЗондTaqMan дополнительно содержит флуоресцентную "репортерную группу" и "гасящую группу", ковалентно связанные с линкерами (например, фосфорамидитами), соединенными с нуклеотидами TaqMan олигонуклеотида. Для анализа метилирования в нуклеиновых кислотах после обработки бисульфитом необходимо, чтобы зонд был специфичным для метилирования, как описано в патенте США 6331393(этот источник включен в полном объеме в настоящее описание для сведения), также известный как тестMethyLight. Варианты методологии обнаружения с использованием TaqMan, которые также подходят для использования в описанном изобретении, включают использование технологии с двумя зондами(Lightcycler) или флуоресцентных праймеров для амплификации (технологии Sunrise). Оба метода можно адаптировать таким образом, чтобы они подходили для использования с обработанной бисульфитом ДНК и, кроме того, для анализа метилирования в динуклеотидах CpG. В дополнительном предпочтительном варианте осуществления способа четвертая стадия способа включает применение направляемой матрицей элонгации олигонуклеотидов, такой как MS-SNuPE, как описано GonzalgoJones, Nucleic Acids Res., 25:2529-2531, 1997. В еще одном варианте осуществления способа четвертая стадия способа включает секвенирование и последующий анализ последовательности амплификата, полученного на третьей стадии способа(Sanger F. et al., Proc. Natl. Acad. Sci. USA, 74:5463-5467, 1977). Описание наиболее предпочтительного варианта осуществления В наиболее предпочтительном варианте осуществления способа геномные нуклеиновые кислоты выделяют и обрабатывают согласно первым трем стадиям способа, описанного выше, а именно:a) получение у индивида биологического образца с данной геномной ДНК;b) экстракция или выделение иным образом геномной ДНК;c) обработка геномной ДНК со стадии b) или ее фрагмента одним или несколькими реагентами для преобразования оснований цитозинов, которые являются неметилированными в 5-положении, в урацил или другое основание, которое обнаруживается иначе по сравнению с цитозином в отношении гибридизирующих свойств; гдеd) амплификацию после обработки на стадии с) проводят специфическим к метилированию образом, а именно применением специфических к метилированию праймеров или блокирующих олигонуклеотидов, и далее, гдеe) обнаружение амплификатов проводят посредством обнаружения зонда в режиме реального времени, как описано выше. Предпочтительно, когда последующую амплификацию на стадии d) проводят с помощью специфических к метилированию праймеров, как описано выше, то указанные специфические к метилированию праймеры содержат последовательность длиной по меньшей мере 9 нуклеотидов, которая гибридизуется с одной из обработанных последовательностей нуклеиновых кислот SEQ ID NO:13-SEQ ID NO:60;SEQ ID NO:84-SEQ ID NO:103 и комплементарными им последовательностями, где последовательность оснований указанных олигомеров содержит по меньшей мере один динуклеотид CpG. Стадия е) способа, а именно обнаружение специфических амплификатов, указывающих на статус метилирования одного или более положений CpG в последовательностях SEQ ID NO:1-SEQ ID NO:12;SEQ ID NO:79-SEQ ID NO:83, проводят с помощью способов обнаружения в режиме реального времени,как описано выше. Дополнительные варианты осуществления изобретения относятся к способу анализа статуса метилирования по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CNO27; LRAT; IL-12RB1; TFAP2C;SEQ ID NO:79-SEQ ID NO:83 и комплементарных им последовательностей), без необходимости в преобразовании с использованием бисульфита. В данной области известны способы, в которых чувствительные к метилированию рестриктазы или группы рестриктаз, включающие чувствительные к метилированию рестриктазы, с помощью которых можно различить метилированные и неметилированные динуклеотиды CpG в области-мишени, используют для определения метилирования, например, но не ограничиваясь ими, DMH. На первой стадии таких дополнительных вариантов осуществления геномную ДНК выделяют из тканевых или клеточных источников. Геномную ДНК можно выделить обычными методами в данной области, включая применение промышленно доступных наборов. Коротко, в том случае, когда интересующая ДНК инкапсулирована клеточной мембраной, биологический образец необходимо разрушить и лизировать ферментативным, химическим или механическим способом. Затем раствор ДНК можно очистить от белков и других примесей, например, расщеплением с помощью протеиназы K. Затем геномную ДНК выделяют из раствора. Это можно проводить с помощью различных методов, включая высаливание, экстракцию органическим растворителем или связывание ДНК с твердофазной подложкой. На выбор метода будут оказывать влияние несколько факторов, которые включают время, стоимость и необходимое количество ДНК. Все типы образцов, имеющих клиническое значение, содержащих неопластический или потенциально неопластический материал, подходят для использования в настоящем способе,предпочтительными являются клетки или клеточные линии, гистологические препараты, материал биопсии, залитая в парафин ткань, жидкости организма, эякулят, моча, плазма крови, сыворотка крови,цельная кровь, выделенные клетки крови, мокрота и биологическое вещество, полученные при бронхоскопии (включая, но не ограничиваясь ими, бронхиальный лаваж, бронхоальвеолярный лаваж, щеточную биопсию бронхов, абразию бронхов) и их комбинации. Более предпочтительный тип образцов выбран из группы, состоящей из плазмы крови, мокроты и биологического вещества, полученных при бронхоскопии (включая, но не ограничиваясь ими, бронхиальный лаваж, бронхоальвеолярный лаваж, щеточную биопсию бронхов, абразию бронхов) и всех их возможных комбинаций. После экстракции нуклеиновых кислот геномную двухцепочечную ДНК используют для анализа. В предпочтительном варианте осуществления ДНК можно расщепить до обработки чувствительными к метилированию рестриктазами. Такие методы известны в данной области, и они могут включать физические и ферментативные средства. Особенно предпочтительным является применение одной или множества рестриктаз, которые не являются чувствительными к метилированию, и чьи сайты распознавания являются АТ-богатыми и не содержат CG-динуклеотидов. Применение таких ферментов делает возможным сохранить островки CpG и богатые области CpG во фрагментированной ДНК. Неспецифичные к метилированию ферменты предпочтительно выбраны из группы, состоящей из MseI, BfaI, Csp6I,TrulI, TvulI, Tru9I, Tvu9I, MaeI и XspI. Особенно предпочтительным является применение двух или трех таких ферментов. Особенно предпочтительным является применение комбинации ферментов MseI, BfaI и Csp6I. Затем фрагментированную ДНК можно лигировать с олигонуклеотидами-адаптерами для облегчения протекания последующей ферментативной амплификации. В данной области известно лигирование олигонуклеотидов к затупленным и липким концевым фрагментам ДНК, и его проводят посредством дефосфорилирования концов (например, с использованием бычьей или креветочной щелочной фосфатазы) и последующего лигирования с использованием ферментов лигаз (например, Т 4 ДНК-лигазы) в присутствии dATP. Как правило, олигонуклеотиды-адаптеры имеют длину по меньшей мере 18 пар оснований. На третьей стадии ДНК (или ее фрагменты) затем расщепляют с помощью одной или более чувствительных к метилированию рестриктаз. Расщепление проводят таким образом, что гидролиз ДНК в сайтах рестрикции является показателем статуса метилирования определенного динуклеотида CpG по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей изPRDM14; SEQ ID NO:81; ARID5A; VAX1. Предпочтительно специфическая к метилированию рестриктаза выбрана из группы, состоящей изBsi E1, Hga I HinPl, Hpy991, Ava I, Bce AI, Bsa HI, BisI, BstUI, BshI2361, AccII, BstFNI, McrBC, GlaI,MvnI, HpaII (HapII), HhaI, AciI, SmaI, HinP1I, HpyCH4IV, EagI и смеси двух или более указанных выше ферментов. Предпочтительной является смесь, содержащая рестриктазы BstUI, HpaII, HpyCH4IV иHinP1I. На четвертой стадии, которая является необязательным, но предпочтительным вариантом осуществления, фрагменты рестрикции амплифицируют. Это предпочтительно проводят с использованием полимеразной цепной реакции, и указанные амплификаты могут содержать подходящие обнаруживаемые метки, описанные выше, а именно флуорофоры, радионуклиды и массовые метки. Особенно предпочтительной является амплификация с использованием фермента для амплификации и по меньшей мере двух праймеров, содержащих в каждом случае смежную последовательность длиной по меньшей мере 16 нуклеотидов, которая является комплементарной или гибридизуется в условиях средней жесткости или же- 20018010SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 и комплементарных им последовательностей. Предпочтительно указанная смежная последовательность имеет длину по меньшей мере 16, 20 или 25 нуклеотидов. В альтернативном варианте осуществления указанные праймеры могут быть комплементарны любым адаптерам, связанным с фрагментами. На пятой стадии амплификаты обнаруживают. Обнаружение можно проводить любыми известными в данной области способами, например гель-электрофорезом, гибридизацией, включением обнаруживаемых меток в продукты ПЦР, анализом ДНК-микрочипов, MALDI или ESI анализом. Предпочтительно указанное обнаружение проводят гибридизацией по меньшей мере с одной нуклеиновой кислотой или пептидной нуклеиновой кислотой, содержащей в каждом случае смежную последовательность длиной по меньшей мере 16 нуклеотидов, которая комплементарна или гибридизуется в условиях средней жесткости или жестких условиях с последовательностью, выбранной из группы, состоящей изSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 и комплементарных им последовательностей. Предпочтительно указанная смежная последовательность имеет длину по меньшей мере 16, 20 или 25 нуклеотидов. После определения состояния или уровня метилирования геномных нуклеиновых кислот о наличии,отсутствии нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), судят на основе состояния или уровня метилирования по меньшей мере одной динуклеотидной последовательности CpG в SEQ ID NO:1-SEQ ID NO:12;SEQ ID NO:79-SEQ ID NO:83, или в среднем, или по показателю, отражающему среднее состояние метилирования множества динуклеотидных последовательностей CpG в SEQ ID NO:1-SEQ ID NO:12;SEQ ID NO:79-SEQ ID NO:83, где метилирование связано с наличием нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). В том случае, когда метилирование определяют количественными способами, предел отсечения для определения указанного наличия метилирования, предпочтительно равняется нулю (т.е., где образец показывает любую степень метилирования, то его определяют как имеющий метилированный статус в анализированном положении CpG). Тем не менее, можно предвидеть, что специалист в данной области может пожелать скорректировать указанное значение порога отсечения для обеспечения теста с особенно предпочтительной чувствительностью или специфичностью. Следовательно, указанное значение порога отсечения можно увеличить (с повышением, таким образом, специфичности), где указанное значение порога отсечения может находиться в пределах, выбранных из группы, состоящей из 0-5%, 5-10%, 10-15%, 1520%, 20-30% и 30-50%. Особенно предпочтительными порогами отсечения являются значения 10, 15, 25 и 30%. После определения метилирования и/или экспрессии по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2;SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1,определяют наличие или отсутствие нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), где гиперметилирование и/или низкая экспрессия указывает на наличие нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), и гипометилирование и/или повышенная экспрессия указывает на отсутствие нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), у индивида. Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Дополнительные усовершенствования. Раскрытое изобретение относится к обработанным нуклеиновым кислотам, полученным из геномных последовательностей SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, где обработка подходит для преобразования по меньшей мере одного неметилированного основания цитозина геномной последовательности ДНК в урацил или другое основание, которое обнаруживается иначе по сравнению с цитозином в отношении гибридизации. Интересующие геномные последовательности могут содержать одно или несколько последовательных метилированных положений CpG. Предпочтительно указанная обработка включает применение реагента, выбранного из группы, состоящей из бисульфита, дисульфита, вторичного кислого сульфита или их комбинаций. В предпочтительном варианте осуществления изобретение относится к неприродным модифицированным нуклеиновым кислотам, содержащим последовательность длиной по меньшей мере 16 смежных нуклеотидных оснований, последовательности, выбранной из группы, состоящей из SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103. В дополнительных предпочтительных вариантах осуществления изобретения указанная нуклеиновая кислота имеет длину по меньшей мере 50, 100, 150, 200, 250 или 500 пар оснований сегмента последовательности нуклеиновой кислоты SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103. Особенно предпочтительной является молекула нуклеиновой кислоты, которая не идентична или не комплементарна всем или части последовательностей SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103,но не последовательностям SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, или другим есте- 21018010 ственным ДНК. Предпочтительно, чтобы указанная последовательность содержала по меньшей мере один динуклеотид CpG, TpA или СрА и комплементарные ему последовательности. ПоследовательностиSEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 представляют неприродные модифицированные варианты нуклеиновой кислоты с последовательностями SEQ ID NO:1-SEQ ID NO:12;SEQ ID NO:79-SEQ ID NO:83, где модификация каждой геномной последовательности приводит к синтезу нуклеиновой кислоты с последовательностью, которая является уникальной и отличной от указанной геномной последовательности в следующем. Для каждой смысловой цепи геномной ДНК, напримерSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, раскрыто четыре преобразованных варианта. Первый вариант, в котором "C" преобразован в "Т", но "CpG" остается "CpG" (т.е. соответствует случаю,когда для геномной последовательности все остатки "C" динуклеотидных последовательностей CpG метилированы и, таким образом, не подверглись преобразованию); второй вариант представляет комплемент раскрытой геномной последовательности ДНК (т.е. антисмысловую цепь), где "C" преобразован в"Т", но "CpG" остается "CpG" (т.е. соответствует случаю, когда все остатки "C" динуклеотидных последовательностей CpG метилированы и, таким образом, не подверглись преобразованию). "Высокометилированные" последовательности SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 соответствуют последовательностям SEQ ID NO:13-SEQ ID NO:36; SEQ ID NO:84-SEQ ID NO:93. Обеспечивается третий химически преобразованный вариант каждой геномной последовательности, где "C" преобразован в "Т" для всех "C" остатков, включая таковые в "CpG"-динуклеотидных последовательностях (т.е. соответствует случаю, когда для геномных последовательностей все "C" остатки "CpG" динуклеотидных последовательностей не метилированы); последний химически модифицированный вариант каждой последовательности раскрывает комплемент раскрытой последовательности геномной ДНК (т.е. антисмысловую цепь), где "C" преобразован в "Т" для всех "C" остатков, включая таковые в "CpG"динуклеотидных последовательностях (т.е. соответствует случаю, когда для комплемента (антисмысловой цепи) каждой геномной последовательности все "C" остатки "CpG"-динуклеотидных последовательностей не метилированы). Модицифированные последовательности с низким метилированиемSEQ ID NO:37-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:93. Следовательно, важно, что последовательности нуклеиновых кислот и молекулыSEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 не принимают участия или не связаны с обнаружением или диагностикой нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. В альтернативном предпочтительном варианте осуществления изобретение дополнительно относится к олигонуклеотидам или олигомерам, которые могут использоваться в способах по изобретению для обнаружения состояния метилирования цитозина в геномной или обработанной (химически модифицированной) ДНК SEQ ID NO:1-SEQ ID NO:60; SEQ ID NO:79-SEQ ID NO:103. Указанные олигонуклеотидные или олигомерные нуклеиновые кислоты обеспечивают новые диагностические средства. Указанные олигонуклеотид или олигомер, содержащие последовательность нуклеиновой кислоты длиной по меньшей мере 9 нуклеотидов, которая идентична, гибридизуется в условиях средней жесткости или жестких условиях (которые определены в настоящем описании выше) с обработанной последовательностью нуклеиновой кислоты SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и/или комплементарными им последовательностями, или геномной последовательностьюSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83, и/или комплементарными им последовательностями. Таким образом, настоящее изобретение включает молекулы нуклеиновых кислот (например, олигонуклеотиды и пептидные нуклеиновые кислоты (PNA) (PNA-олигомеры), которые гибридизуются в условиях средней жесткости или жестких условиях со всеми или частью последовательностейSEQ ID NO:1-SEQ ID NO:60; SEQ ID NO:79-SEQ ID NO:103 или комплементарными им последовательностями. Особенно предпочтительной является молекула нуклеиновой кислоты, которая гибридизуется в условиях средней жесткости или жестких условиях со всеми или частью последовательностейSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 или другими человеческими геномными ДНК. Как правило, длина идентичного или гибридизующегося фрагмента гибридизующихся нуклеиновых кислот составляет по меньшей мере 9, 16, 20, 25, 30 или 35 нуклеотидов. Однако применимость по изобретению имеет более длинные молекулы, и, таким образом, они входят в объем настоящего изобретения. Предпочтительно гибридизующийся фрагмент по изобретению гибридизующихся нуклеиновых кислот по меньшей мере на 95%, или по меньшей мере на 98%, или на 100% идентичен последовательности или ее участку SEQ ID NO:1-SEQ ID NO:60; SEQ ID NO:79-SEQ ID NO:103 или их комплементарным последовательностям. Гибридизующиеся нуклеиновые кислоты типа, описанного в настоящем описании, можно использовать, например, в качестве праймера (например, праймера для ПЦР) или диагностического зонда или праймера. Предпочтительно гибридизацию олигонуклеотидного зонда с нуклеиновой кислотой образца проводят в жестких условиях, и зонд на 100% идентичен последовательности-мишени. Стабильность дуплекса нуклеиновой кислоты или гибрида выражается в виде температуры плавления или Tm, которая является температурой, при которой зонд диссоциирует от ДНК-мишени. Температуру плавления используют для определения условий необходимой жесткости. Для последовательностей-мишеней, которые близки или, по существу, идентичны соответствующей последовательности SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 (такой как аллельные варианты и SNP), в большей степени идентичны, является подходящим вначале установить самую низкую температуру, при которой имеет место только гомологичная гибридизация при определенной концентрации соли (например, SSC или SSPE). Затем с учетом того, что со снижением Tm на 1 С имеет место 1% ошибочных спариваний, следовательно, температуру конечного промывания при постановке реакции гибридизации уменьшают (например, если проводят поиск последовательностей, которые обладают идентичностью 95% с зондами, то температуру конечного промывания снижают на 5 С). На практике изменение Tm может составлять от 0,5 до 1,5 С на 1% ошибочного спаривания. Примеры олигонуклеотидов по изобретению с длиной X (в нуклеотидах), как указано положениями полинуклеотида по отношению, например, к SEQ ID NO:1, включают таковые, соответствующие рядам(смысловым и антисмысловым рядам) последовательно перекрывающихся олигонуклеотидов длиной X,где олигонуклеотиды в каждом последовательно перекрывающемся ряду (соответственно данному значению X) определяются как ограниченный ряд Z олигонуклеотидов по положениям в нуклеотиде:Y равен длине (в нуклеотидах или парах оснований) SEQ ID NO:1 (3905);X равен обычной длине (в нуклеотидах) каждого олигонуклеотида в ряду (например, Х=20 для группы последовательно перекрывающихся 20-меров); количество (Z) последовательно перекрывающихся олигомеров длиной X для данной последовательности SEQ ID NO:1 длиной Y равно Y-(X-1), например Z=3905-19=3886 для каждого смыслового или антисмыслового ряда SEQ ID NO:1, где X=20. Предпочтительно ряд ограничивается такими олигомерами, которые содержат по меньшей мере один динуклеотид CpG, TpG или СрА. Примеры 20-мерных олигонуклеотидов по изобретению включают следующий ряд из 3905 олигомеров (и антисмысловые комплементарные к ним), указанные положениями в полинуклеотидах по отношению к SEQ ID NO:1: 1-20, 2-21, 3-22, 4-23, 5-24,и 3886-3905. Предпочтительно ряд ограничивается такими олигомерами, которые содержат по меньшей мере один динуклеотид CpG, TpG или СрА. Аналогично примеры 25-мерных олигонуклеотидов по изобретению включают следующий ряд 3881 олигомеров (и антисмысловый ряд, комплементарный ему), указанные положениями в полинуклеотидах по отношению к SEQ ID NO:1: 1-25, 2-26, 3-27, 4-23, 5-29,и 3886-3905. Предпочтительно ряд ограничивается такими олигомерами, которые содержат по меньшей мере один динуклеотид CpG, TpG или СрА. Настоящее изобретение включает для каждой из последовательностей SEQ ID NO:1-SEQ ID NO:60;SEQ ID NO:79-SEQ ID NO:103 (смысловые и антисмысловые) множественные последовательно перекрывающиеся ряды олигонуклеотидов или модифицированных олигонуклеотидов длиной X, где, например, X = 9, 10, 17, 20, 22, 23, 25, 27, 30 или 35 нуклеотидам. Олигонуклеотиды или олигомеры по настоящему изобретению представляют эффективные инструменты, подходящие для установлениия генетических и эпигенетических параметров геномной последовательности SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83. Предпочтительные ряды таких олигонуклеотидов или модифицированных олигонуклеотидов длиной X представляют последовательно перекрывающиеся ряды олигомеров SEQ ID NO:1-SEQ ID NO:60; SEQ ID NO:79-SEQ ID NO:103(и комплементарных им последовательностей). Предпочтительно указанные олигомеры содержат по меньшей мере один динуклеотид CpG, TpG или СрА. Особенно предпочтительные олигонуклеотиды или олигомеры по настоящему изобретению представляют таковые, в которых цитозин динуклеотида CpG (или его соответствующего преобразованного динуклеотида TpG или СрА) находится в средней трети олигонуклеотида; т.е., когда олигонуклеотид имеет длину, например, 13 оснований, то динуклеотид CpG, TpG или СрА находится в пятом-девятом нуклеотиде от 5'-конца. Олигонуклеотиды по изобретению также можно модифицировать химическим связыванием олигонуклеотида с одной или более группами или конъюгатами для повышения активности, стабильности или обнаружения олигонуклеотида. Такие группы или конъюгаты включают хромофоры, флуорофоры, липиды, такие как холестерин, холиевую кислоту, тиоэфир, алифатические цепи, фосфолипиды, полиамины,полиэтиленгликоль (ПЭГ), пальмитильные группы и другие, раскрытые, например, в патентах США 5514758, 5565552, 5567810, 5574142, 5585481, 5587371, 5597696 и 5958773. Зонды также могут находиться в виде PNA (пептидной нуклеиновой кислоты), которая обладает особенно предпочтительными свойствами к спариванию. Таким образом, олигонуклеотид может включать другие присоединенные группы, такие как пептиды, и может включать "запущенные" гибридизацией расщепляющие агенты (Krolet al., BioTechniques, 6:958-976, 1988) или интеркалирующие агенты (Zon, Pharm. Res., 5:539-549, 1988). Наконец, олигонуклеотид можно конъюгировать с другой молекулой, например хромофором, флуорофором, пептидом, "запущенным" гибридизацией сшивающим агентом, транспортером, "запущеным" гибридизацией расщепляющим агентом и т.д. Также олигонуклеотид может содержать по меньшей мере один известный в данной области модифицированный сахар и/или основание или может включать модифицированный скелет или неприродную межнуклеозидную связь. Олигонуклеотиды или олигомеры по конкретным вариантам осуществления настоящего изобретения, как правило, используют в "рядах", которые содержат по меньшей мере один олигомер для анализа каждого из динуклеотидов CpG геномной последовательности, выбранной из группы, состоящей изSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 и комплементарных им последовательностей,или соответствующего динуклеотида CpG, TpG или СрА в последовательности обработанных нуклеиновых кислот SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарных им последовательностей. Однако полагается, что в результате экономических или других факторов может быть предпочтительным проводить анализ ограниченного числа динуклеотидов CpG в данных указанных последовательностях, и, следовательно, состав ряда олигонуклеотидов будет изменяться. Следовательно, в конкретных вариантах осуществления настоящее изобретение относится к ряду по меньшей мере 2 олигонуклеотидов и/или PNA-олигомеров, подходящих для обнаружения состояния метилирования цитозина в обработанной геномной ДНК (SEQ ID NO:13-SEQ ID NO:60;SEQ ID NO:79-SEQ ID NO:83 и комплементарных им последовательностях). С помощью данных зондов становится возможным диагностировать и обнаруживать нарушения клеточной пролиферации, предпочтительно приведенные в табл. 2 (наиболее предпочтительно карциному легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Ряд олигомеров также можно использовать для обнаружения однонуклеотидных полиморфизмов(SNP) в обработанной геномной ДНК (SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103) или в геномной ДНК (SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83 и комплементарных им последовательностей). В предпочтительных вариантах осуществления по меньшей мере один и более предпочтительно все члены ряда олигонуклеотидов связаны с твердой фазой. В дополнительных вариантах осуществления настоящее изобретение относится к ряду по меньшей мере 2 олигонуклеотидов, которые используются в качестве "праймера" - олигонуклеотидов для амплификации последовательностей ДНК SEQ ID NO:1-SEQ ID NO:60; SEQ ID NO:79-SEQ ID NO:103 и комплементарных им последовательностей. Полагается, что олигонуклеотиды могут составлять все или часть "чипов" или "ДНК-чипов" (т.е. расположение различных олигонуклеотидов и/или PNA-олигомеров, связанных с твердой фазой). Такие чипы с различными последовательностями олигонуклеотидов и/или PNA-олигомеров можно охарактеризовать, например, в том отношении, что они расположены на твердой фазе в виде прямоугольной или шестиугольной решетки. Поверхность твердой фазы может быть из силикона, стекла, полистирола, алюминия, стали, железа, меди, никеля, серебра или золота. Также можно использовать нитроцеллюлозу, а также пластики, такие как нейлон, которые могут находиться в виде гранул или также в виде резиновой матрицы. Обзор данных предшествующего уровня по производству чипов олигомеров можно найти вNature Genetics (Nature Genetics Supplement, Volume 21, January 1999 и в источниках литературы, цитированных в настоящем описании). Часто используют меченные флуоресцентной меткой зонды для сканирования иммобилизованных ДНК-чипов. Простое присоединение Су 3 и Су 5 красителей к 5'-ОН конкретного зонда особенно подходит в качестве флуоресцентных меток. Обнаружение флуоресценции гибридизованных зондов можно проводить, например, с помощью конфокального микроскопа. Су 3 и Су 5 красители, помимо многих других, являются промышленно доступными. Также полагается, что олигонуклеотиды или их конкретные последовательности могут составлять все или часть "виртуальных чипов", где олигонуклеотиды или их конкретные последовательности используют, например, в качестве "определителей" как часть или в комбинации с другой популяцией уникальных меченых зондов для анализа сложной смеси анализируемых веществ. Такой метод, например,описан в заявке на патент США 2003/001391 (серийный номер заявки на патент США 09/898743, опубликованной 16 января 2003 г.). В данных методах получают достаточное количество меток, так что каж- 24018010 дая нуклеиновая кислота в сложной смеси (т.е. каждое анализируемое вещество) может быть уникально связана с уникальной меткой и, таким образом, обнаруживаться (каждую метку непосредственно определяют количественно, приводя к цифровым данным по каждому виду молекул в смеси). Особенно предпочтительным является то, что олигомеры по изобретению используют для обнаружения или диагностики нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2(наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Наборы. Кроме того, дополнительным аспектом настоящего изобретения является набор, содержащий средства для определения экспрессии метилирования по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6;CN027; LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1. Средства для определения экспрессии по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL-12RB1;TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1, предпочтительно включают бисульфитсодержащий реагент; один или множество олигонуклеотидов, последовательности которых в каждом случае идентичны, комплементарны или гибридизуются в жестких условиях или условиях высокой жесткости с сегментом длиной 9 или более предпочтительно 18 оснований последовательности, выбранной из SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103, и, необязательно, инструкции для проведения или оценки описанного способа анализа метилирования. В одном из вариантов осуществления последовательность оснований указанных олигонуклеотидов содержит по меньшей мере один динуклеотид CpG, TpG или СрА. В дополнительном варианте осуществления указанный набор может дополнительно содержать стандартные реагенты для специфического анализа метилирования CpG-положений,где указанный анализ включает один или более из следующих тестов: MS-SNuPE, MSP, MethyLight,HeavyMethyl, COBRA и секвенирование нуклеиновой кислоты. Однако набор соответственно направлениям настоящего изобретения также может содержать только часть указанных выше компонентов. В предпочтительном варианте осуществления набор может содержать дополнительные бисульфитные реагенты для преобразования, выбранные из группы, состоящей из буфера для денатурации ДНК; буфера для сульфонирования; реагентов или наборов для выделения ДНК (например, преципитации,ультрафильтрации, аффинную колонку); буфера для десульфонирования и компонентов для выделения ДНК. В дополнительном альтернативном варианте осуществления набор может содержать упакованные в отдельных контейнерах полимеразу и буфер для проведения реакции, оптимизированный для элонгации праймера, опосредованной полимеразой, такой как в ПЦР. В другом варианте осуществления изобретения набор дополнительно содержит средства для получения биологического образца у пациента. Предпочтительным является набор, который дополнительно содержит подходящий контейнер, содержащий средства для определения метилирования по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027;LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1, в биологическом образце, взятом у пациента, и наиболее предпочтительно дополнительно содержит инструкции по применению и интерпретации результатов применения набора. В предпочтительном варианте осуществления набор содержит:(b) подходящий контейнер, содержащий указанный бисульфитный реагент и биологический образец пациента;(с) по меньшей мере один ряд праймеров-олигонуклеотидов, содержащий два олигонуклеотида, последовательности которых в каждом случае идентичны, комплементарны или гибридизуются в жестких условиях или условиях высокой жесткости с сегментом длиной 9 или более предпочтительно 18 оснований последовательности, выбранной из SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103; и,необязательно,(d) инструкции по применению и интерпретации результатов применения набора. В альтернативном предпочтительном варианте осуществления набор содержит:(b) подходящий контейнер, содержащий указанный бисульфитный реагент и биологический образец пациента;(с) по меньшей мере один олигонуклеотид и/или PNA-олигомер длиной по меньшей мере 9 или 16 нуклеотидов, который идентичен или гибридизуется с одной из предварительно обработанных последовательностей нуклеиновых кислот SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарных им последовательностей; и, необязательно,(d) инструкции по применению и интерпретации результатов применения набора. В альтернативном варианте осуществления набор содержит:(b) подходящий контейнер, содержащий указанный бисульфитный реагент и биологический образец пациента;(с) по меньшей мере один ряд праймеров-олигонуклеотидов, содержащий два олигонуклеотида, последовательности которых в каждом случае идентичны, комплементарны или гибридизуются в жестких условиях или условиях высокой жесткости с сегментом длиной 9 или более предпочтительно 18 оснований последовательности, выбранной из SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103;(d) по меньшей мере один олигонуклеотид и/или PNA-олигомер длиной по меньшей мере 9 или 16 нуклеотидов, который идентичен или гибридизуется с одной из предварительно обработанных последовательностей нуклеиновых кислот SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарных им последовательностей; и, необязательно,(е) инструкции по применению и интерпретации результатов применения набора. Также набор может содержать другие компоненты, такие как буферы или растворы, подходящие для блокирования, промывания или покрытия, упакованные в отдельные контейнеры. Другой аспект изобретения относится к набору для использования при определении наличия и/или диагностики нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Указанный набор предпочтительно содержит средства для определения уровня транскрипции по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей изPRDM14; SEQ ID NO:81; ARID5A; VAX1, и средства для определения метилирования по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1;NO:81; ARID5A; VAX1. Характерные реагенты (например, которые можно найти в обычном наборе для COBRA) для анализа COBRA могут включать, но не ограничиваются ими, праймеры для ПЦР по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2;ARID5A; VAX1; рестриктазу и соответствующий буфер; олигонуклеотид, гибридизующийся с геном; контрольный гибридизующийся олигонуклеотид; набор для мечения олигонуклеотидного зонда киназой и меченые нуклеотиды. Характерные реагенты (например, которые можно найти в обычном наборе для теста MethyLight) для анализа MethyLight могут включать, но не ограничиваются ими, ПЦРпраймеры для преобразованной под действием бисульфита последовательности по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2;ARID5A; VAX1; бисульфит-специфические зонды (например, TaqMan или Lightcycler); оптимизированные буферы для ПЦР и дезоксинуклеотиды и Taq-полимеразу. Характерные реагенты (например, которые можно найти в обычном наборе для Ms-SNuPE) для анализа Ms-SNuPE могут включать, но не ограничиваются ими, ПЦР-праймеры для определенного гена (или обработанной бисульфитом последовательности ДНК или островка CpG); оптимизированные буферы для ПЦР и дезоксинуклеотиды; набор для экстракции геля; положительные контрольные праймеры; праймеры Ms-SNuPE для преобразованной под действием бисульфита последовательности по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей изPRDM14; SEQ ID NO:81; ARID5A; VAX1; буфер для реакции (для реакции Ms-SNuPE) и меченые нуклеотиды. Характерные реагенты (например, которые можно найти в обычном наборе для MSP) для анализаMSP могут включать, но не ограничиваются ими, метилированные и неметилированные ПЦР-праймеры для преобразованной под действием бисульфита последовательности по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1;ARID5A; VAX1; оптимизированные буферы для ПЦР и дезоксинуклеотиды и специфические зонды. Кроме того, дополнительным аспектом настоящего изобретения является альтернативный набор,содержащий средства для определения метилирования по меньшей мере одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2;SEQ ID NO:6; CN027; LRAT; IL-12RB1; TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1,где указанные средства предпочтительно содержат по меньшей мере одну специфическую к метилированию рестриктазу; один или множество праймеров-олигонуклеотидов (предпочтительно одну или множе- 26018010 ство пар праймеров), подходящих для амплификации последовательности, содержащей по меньшей мере один динуклеотид CpG последовательности, выбранной из SEQ ID NO:1-SEQ ID NO:12;SEQ ID NO:79-SEQ ID NO:83; и, необязательно, инструкции для постановки и оценки описанного способа анализа метилирования. В одном из вариантов осуществления последовательность оснований указанных олигонуклеотидов идентична, комплементарна или гибридизуется в жестких условиях или условиях высокой жесткости с сегментом длиной по меньшей мере 18 оснований последовательности, выбранной из SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83. В дополнительном варианте осуществления указанный набор содержит один или множество олигонуклеотидных зондов для анализа фрагментов расщепления, где предпочтительно указанные олигонуклеотиды идентичны, комплементарны или гибридизуются в жестких условиях или условиях высокой жесткости с сегментом длиной по меньшей мере 16 оснований последовательности, выбранной изSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83. В предпочтительном варианте осуществления набор может содержать дополнительные реагенты,выбранные из группы, состоящей из буфера (например, буферов для рестриктазы, ПЦР, хранения или промывания); реагенты или наборы для выделения ДНК (например, преципитация, ультрафильтрация,аффинная колонка); компоненты для выделения ДНК. В дополнительном альтернативном варианте осуществления набор может содержать упакованные в отдельных контейнерах полимеразу и буфер для проведения реакции, оптимизированный для элонгации праймера, опосредованного полимеразой, такой как в ПЦР. В другом варианте осуществления изобретения набор дополнительно содержит средства для получения биологического образца у пациента. В предпочтительном варианте осуществления набор содержит: (а) специфическую к метилированию рестриктазу; (b) подходящий контейнер, содержащий указанный реагент и биологический образец пациента; (с) по меньшей мере один ряд олигонуклеотидов одной или множества нуклеиновых кислот или пептидных нуклеиновых кислот, которые идентичны, комплементарны или гибридизуются в жестких условиях или условиях высокой жесткости с сегментом длиной по меньшей мере 9 оснований последовательности,выбранной из SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83; и, необязательно, (d) инструкции по применению и интерпретации результатов применения набора. В альтернативном предпочтительном варианте осуществления набор содержит: (а) специфическую к метилированию рестриктазу; (b) подходящий контейнер, содержащий указанный реагент и биологический образец пациента; (с) по меньшей мере один ряд праймеров-олигонуклеотидов, подходящих для амплификации последовательности, содержащей по меньшей мере один динуклеотид CpG последовательности, выбранной из SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83; и, необязательно,(d) инструкции по применению и интерпретации результатов применения набора. В альтернативном варианте осуществления набор содержит: (а) специфическую к метилированию рестриктазу; (b) подходящий контейнер, содержащий указанный реагент и биологический образец пациента; (с) по меньшей мере один ряд праймеров-олигонуклеотидов, подходящих для амплификации последовательности, содержащей по меньшей мере один динуклеотид CpG последовательности, выбранной из SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83; (d) по меньшей мере один ряд олигонуклеотидов одной или множества нуклеиновых кислот или пептидных нуклеиновых кислот, которые идентичны, комплементарны или гибридизуются в жестких условиях или условиях высокой жесткости с сегментом длиной по меньшей мере 9 оснований последовательности, выбранной изSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83; и, необязательно, (е) инструкции по применению и интерпретации результатов применения набора. Также набор может содержать другие компоненты, такие как буферы или растворы, подходящие для блокирования, промывания или покрытия, упакованные в отдельные контейнеры. Изобретение дополнительно относится к набору для использования при диагностике наличия или отсутствия нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2 (наиболее предпочтительно карциномы легких), у индивида с помощью анализа со специфическими к метилированию рестриктазами. Указанный набор содержит контейнер и компонент на основе ДНК-микрочипов. Указанный компонент на основе ДНК-микрочипов представляет поверхность, на которой иммобилизовано множество олигонуклеотидов в определенных положениях, где олигонуклеотид содержит по меньшей мере один сайт метилирования CpG. По меньшей мере один из указанных олигонуклеотидов является специфическим по меньшей мере для одного гена или геномной последовательности, выбранной из группы, состоящей из PTGER4; RUNX1; EVX2; EVX-1; SHOX2; SEQ ID NO:6; CN027; LRAT; IL-12RB1;TFAP2C; BCL2; EN2; PRDM14; SEQ ID NO:81; ARID5A; VAX1, и содержит последовательность длиной по меньшей мере 15 пар оснований, но не более чем из 200 п.о., последовательностиSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83. Предпочтительно указанная последовательность имеет длину по меньшей мере 15 пар оснований, но не более чем из 80 п.о., последовательностиSEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83. Дополнительно, предпочтительно, чтобы указанная последовательность имела длину по меньшей мере 20 пар оснований, но не более чем из 30 п.о., последовательности SEQ ID NO:1-SEQ ID NO:12; SEQ ID NO:79-SEQ ID NO:83. Предпочтительно, чтобы указанный набор для тестирования дополнительно содержал компонент рестриктазу, включающий одну или множество специфических к метилированию рестриктаз. В дополнительном варианте осуществления изобретение относится к указанному набору для тестирования дополнительно отличается тем, что он содержит по меньшей мере одну специфическую к метилированию рестриктазу, в котором олигонуклеотиды содержат сайт рестрикции для указанной по меньшей мере одной специфической к метилированию рестриктазы. Набор может дополнительно содержать один или несколько из следующих компонентов, которые известны в данной области для обогащения ДНК: белковый компонент, где указанный белок избирательно связывается с метилированной ДНК; триплекс-образующий компонент нуклеиновой кислоты,один или множество линкеров, необязательно в подходящем растворе; соединения или растворы для проведения лигирования, например буферы для лигаз; соединения или растворы для проведения колоночной хроматографии; соединения или растворы для проведения обогащения, основанного на иммунологических методах (например, иммунопреципитации); соединения или растворы для проведения амплификации нуклеиновых кислот, например ПЦР; красителей или нескольких красителей, если они применимы с реагентом для сочетания, если они применимы в растворе; соединения или растворы для проведения гибридизации и/или соединения или растворы для проведения стадии промывания. Описанное изобретение дополнительно относится к композиции вещества, подходящей для обнаружения или диагностики нарушений клеточной пролиферации, предпочтительно приведенных в табл. 2(наиболее предпочтительно карциномы легких). Особенно предпочтительной является карцинома легких, выбранная из группы, состоящей из аденокарциномы легких; крупноклеточной карциномы легких; плоскоклеточной карциномы легких; мелкоклеточной карциномы легких. Указанная композиция предпочтительно содержит по меньшей мере одну нуклеиновую кислоту длиной 18 пар оснований сегмента последовательности нуклеиновой кислотыSEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и одно или более соединений, выбранных из группы, включающей 1-5 мМ хлорида магния, 100-500 мкМ dNTP, 0,5-5 Ед. Taq-полимеразы, бычий сывороточный альбумин, олигомер, в частности олигонуклеотид или пептидную нуклеиновую кислоту(PNA)-олигомер, где указанный олигомер содержит в каждом случае по меньшей мере одну последовательность оснований длиной по меньшей мере 9 нуклеотидов, которая является комплементарной или гибридизуется в условиях средней жесткости или жестких условиях с заранее обработанной геномной ДНК SEQ ID NO:13-SEQ ID NO:60; SEQ ID NO:84-SEQ ID NO:103 и комплементарными им последовательностями. Предпочтительно, чтобы указанная композиция вещества содержала буферный раствор,подходящий для стабилизации указанной нуклеиновой кислоты в водном растворе и способствующий протеканию реакций с участием полимеразы в указанном растворе. В данной области известны подходящие буферы, и они являются промышленно доступными. В дополнительных предпочтительных вариантах осуществления изобретения указанная по меньшей мере одна нуклеиновая кислота имеет длину по меньшей мере 50, 100, 150, 200, 250 или 500 пар оснований сегмента последовательности нуклеиновой кислоты SEQ ID NO:13-SEQ ID NO:60;
МПК / Метки
МПК: C12Q 1/68
Метки: кислоты, нарушений, анализов, способы, нуклеиновые, пролиферации, клеточной
Код ссылки
<a href="https://eas.patents.su/30-18010-sposoby-i-nukleinovye-kisloty-dlya-analizov-narushenijj-kletochnojj-proliferacii.html" rel="bookmark" title="База патентов Евразийского Союза">Способы и нуклеиновые кислоты для анализов нарушений клеточной пролиферации</a>
Предыдущий патент: Способ повторного использования отходов
Следующий патент: Катехоламиновые производные, полезные для лечения болезни паркинсона
Случайный патент: Рама из профиля для оконной или дверной рамы