Фармацевтическая композиция на основе транскаротиноидов и способы лечения опухоли
Формула / Реферат
1. Фармацевтическая композиция, содержащая:
i) соль биполярного транскаротиноида, имеющего формулу
YZ-TCRO-ZY,
где Y, который может быть одинаковым или различным на двух концах, представляет собой Н или катион, отличный от H, являющийся Na+, или K+, или Li+, или органический катион, такой как R4N+, R3S+, где R означает Н, или CnH2n+1, где n равно 1-10;
Z, который может быть одинаковым или различным на двух концах, представляет собой полярную группу, выбранную из карбоксильной (COO-) группы, или CO группы, или гидроксильной группы, сульфатной группы (OSO3-) или моносульфатной группы (ОРО3-), (ОР(ОН)О2-), дифосфатной группы, трифосфатной или комбинации указанных групп, или COOR группы, где R означает CnH2n+1, где n определен выше; и
TCRO означает линейный транскаротиноидный скелет с конъюгированными углерод-углеродными двойными связями и одинарными связями, содержащий менее 100 атомов углерода и имеющий пендантные группы X, которые могут быть одинаковыми или разными и представляют собой линейный или разветвленный углеводород, имеющий 10 или менее атомов углерода, или галоген;
ii) циклодекстрин.
2. Композиция по п.1, где солью биполярного транскаротиноида является соль лития, калия или натрия.
3. Композиция по п.2, где соль транскаротиноида является транснатрийкроцетинатом (TSC), имеющим структуру
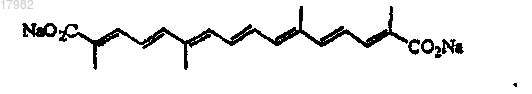
4. Композиция по п.1, включающая транснатрийкроцетинат (TSC), имеющий структуру
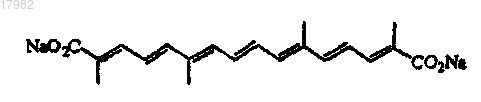
и циклодекстрин, выбранный из группы, состоящей из α-циклодекстрина, β-циклодекстрина, 2-гидроксилпропил-β-циклодекстрина, 2-гидроксилпропил-γ-циклодекстрина и γ-циклодекстрина.
5. Композиция по п.1, где соль биполярного транскаротиноида является транснатрийкроцетинатом (TSC), имеющим структуру
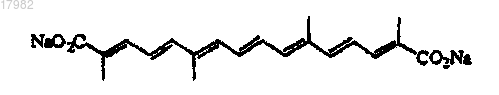
и где циклодекстрином является γ-циклодекстрин.
6. Композиция по п.1, где циклодекстрином является α-циклодекстрин.
7. Композиция по п.1, где циклодекстрином является β-циклодекстрин.
8. Композиция по п.1, где циклодекстрином является 2-гидроксилпропил-β-циклодекстрин.
9. Композиция по п.1, где циклодекстрином является γ-циклодекстрин.
10. Композиция по п.1, где циклодекстрином является 2-гидроксилпропил-γ-циклодекстрин.
11. Композиция по п.1, дополнительно содержащая маннит.
12. Композиция по п.1, дополнительно содержащая физиологический раствор.
13. Композиция по п.1, дополнительно содержащая соединение для регулирования рН.
14. Композиция по п.13, где указанное соединение для регулирования рН выбирают из группы, включающей такие соединения, как уксусная кислота, лимонная кислота, бикарбонат или глицин.
15. Композиция по п.1, которая является лиофилизованной.
16. Композиция по п.1, где Y является ионом моновалентного металла.
17. Композиция по п.1, где Y является Na+, K+ или Li+.
18. Композиция по п.1, где Y является органическим катионом.
19. Композиция по п.1, где Y является органическим соединением, выбранным из группы, состоящей из R4N+, R3S+, где R означает Н, или CnH2n+1, где n равно 1-10.
20. Композиция по п.1, где Z включает концевой углерод TCRO.
21. Композиция по п.1, где Z выбирают из группы, состоящей из карбоксильной (COO-) группы, CO группы и гидроксильной группы.
22. Композиция по п.21, где CO группа представляет собой группу сложного эфира, альдегида или кетона.
23. Композиция по п.1, где Z выбирают из группы, состоящей из сульфатной группы (OSO3-), монофосфатной группы (ОРО3-), (ОР(ОН)О2-), дифосфатной группы и трифосфатной группы.
24. Композиция по п.1, где Z представляет собой COOR группу, где R означает CnH2n+1.
25. Композиция по п.1, где Y является Na+, Z является карбоксильной группой и пендантные группы X являются метильными группами.
26. Композиция по п.1, где TCRO содержит менее 100 атомов углерода.
27. Композиция по п.1, где TCRO является симметричным.
28. Композиция по п.1, где пендатные группы X являются метильными группами.
29. Композиция по п.1, где пендатные группы X, которые могут быть одинаковыми или разными, являются линейными или разветвленными углеводородными группами, имеющими 4 или менее атомов углерода.
30. Композиция по п.1, где пендатные группы X, которые могут быть одинаковыми или разными, выбирают из группы, состоящей из метильных групп (CH3) и этильных групп (С2Н5).
31. Композиция по п.1, где соль биполярного транскаротеноида является литиевой, калиевой или натриевой солью кроцетина.
32. Способ лечения опухоли у млекопитающего, включающий введение млекопитающему:
i) соли биполярного транскаротиноида, имеющего формулу
YZ-TCRO-ZY,
где Y, который может быть одинаковым или различным на двух концах, представляет собой Н или катион, отличный от H, являющийся Na+, или K+, или Li+, или органический катион, такой как R4N+, R3S+, где R означает Н, или CnH2n+1, где n равно 1-10;
Z, который может быть одинаковым или различным на двух концах, представляет собой полярную группу, выбранную из карбоксильной (COO-) группы, или CO группы, или гидроксильной группы, сульфатной группы (OSO3-) или моносульфатной группы (ОРО3-), (ОР(ОН)О2-), дифосфатной группы, трифосфатной или комбинации указанных групп, или COOR группы, где R означает CnH2n+1, где n определен выше;
TCRO означает линейный транскаротиноидный скелет с конъюгированными углерод-углеродными двойными связями и одинарными связями, содержащий менее 100 атомов углерода и имеющий пендантные группы X, которые могут быть одинаковыми или разными и представляют собой линейный или разветвленный углеводород, имеющий 10 или менее атомов углерода, или галоген;
ii) облучение указанной опухоли,
где указанная соль биполярного транскаротиноида вводят до, во время или после указанного облучения.
33. Способ по п.32, где облучение назначают при дозе около 6000-6500 сГр за несколько недель.
34. Способ по п.32, где опухоль выбирают из группы, включающей глиобластомы, плоскоклеточные карциномы, меланомы, лимфомы, саркомы, саркоиды, остеосаркомы, опухоли, связанные с раком кожи, раком молочной железы, раком головы и шеи, гинекологическим раком, урологическим раком и мужских половых органов, раком мочевого пузыря, раком предстательной железы, раком костей, раковые опухоли эндокринных желез, раковые опухоли желудочно-кишечного тракта, раковые опухоли основных пищеварительных желез/органов, раковую опухоль ЦНС и рак легких.
35. Способ по п.32, где опухоль представляет собой опухоль головного мозга.
36. Способ по п.32, где соль биполярного транскаротиноида является транснатрийкроцетипатом (TSC), имеющим структуру
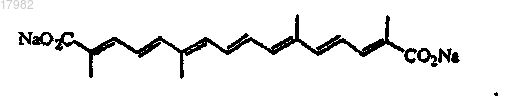
37. Способ по п.36, где TSC вводят при дозе 0,02-2 мг/кг перед каждым облучением.
38. Способ по п.32, где млекопитающим является человек.
39. Способ по п.36, где млекопитающим является человек и TSC вводят при дозе 0,02-2 мг/кг перед каждым облучением.
40. Способ лечения опухоли у млекопитающего, включающий введение млекопитающему:
i) соли биполярного транскаротиноида, имеющего формулу
YZ-TCRO-ZY,
где Y, который может быть одинаковым или различным на двух концах, представляет собой Н или катион, отличный от H, являющийся Na+, или K+, или Li+, или органический катион, такой как R4N+, R3S+, где R означает Н, или CnH2n+1, где n равно 1-10;
Z, который может быть одинаковым или различным на двух концах, представляет собой полярную группу, выбранную из карбоксильной (COO-) группы, или CO группы, или гидроксильной группы, сульфатной группы (OSO3-) или моносульфатной группы (ОРО3-), (ОР(ОН)О2-), дифосфатной группы, трифосфатной или комбинации указанных групп, или COOR группы, где R означает CnH2n+1, где n определен выше;
TCRO означает линейный транскаротиноидный скелет с конъюгированными углерод-углеродными двойными связями и одинарными связями, содержащий менее 100 атомов углерода и имеющий пендантные группы X, которые могут быть одинаковыми или разными и представляют собой линейный или разветвленный углеводород, имеющий 10 или менее атомов углерода, или галоген;
ii) химиотерапии,
где указанную соль биполярного транскаротиноида вводят до, во время или после указанной химиотерапии.
41. Способ по п.40, где опухоль выбирают из группы, включающей глиобластомы, плоскоклеточные карциномы, меланомы, лимфомы, саркомы, саркоиды, остеосаркомы, опухоли, связанные с раком кожи, раком молочной железы, раком головы и шеи, гинекологическим раком, урологическим раком и мужских половых органов, раком мочевого пузыря, раком предстательной железы, раком костей, раковые опухоли эндокринных желез, раковые опухоли желудочно-кишечного тракта, раковые опухоли основных пищеварительных желез/органов, раковую опухоль ЦНС и рак легких.
42. Способ по п.40, где опухоль представляет собой опухоль головного мозга.
43. Способ по п.40, где соль биполярного транскаротиноида является транснатрийкроцетипатом (TSC), имеющим структуру
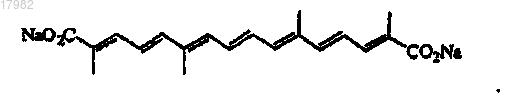
44. Способ по п.43, где TSC вводят при дозе 0,02-2 мг/кг перед каждой химиотерапией.
45. Способ по п.40, где млекопитающим является человек.
46. Способ по п.43, где млекопитающим является человек и TSC вводят при дозе 0,02-2 мг/кг перед каждой химиотерапией.
47. Способ по п.32 или 40, где указанная соль биполярного транскаротеноида находится в форме композиции с циклодекстрином.
48. Способ по п.32 или 40, где Y является ионом моновалентного металла.
49. Способ по п.32 или 40, где Y является Na+, K+ или Li+.
50. Способ по п.32 или 40, где Y является органическим катионом.
51. Способ по п.32 или 40, где Y является органическим соединением, выбранным из группы, состоящей из R4N+, R3S+, где R означает Н, или CnH2n+1, где n равно 1-10.
52. Способ по п.32 или 40, где Z включает концевой углерод TCRO.
53. Способ по п.32 или 40, где Z выбирают из группы, состоящей из карбоксильной (COO-) группы, CO группы и гидроксильной группы.
54. Способ по п.53, где CO группа представляет собой группу сложного эфира, альдегида или кетона.
55. Способ по п.32 или 40, где Z выбирают из группы, состоящей из сульфатной группы (OSO3-), монофосфатной группы (ОРО3-), (ОР(ОН)О2-), дифосфатной группы и трифосфатной группы.
56. Способ по п.32 или 40, где Z представляет собой COOR группу, где R означает CnH2n+1.
57. Способ по п.32 или 40, где TCRO содержит менее 100 атомов углерода.
58. Способ по п.32 или 40, где TCRO является симметричным.
59. Способ по п.32 или 40, где пендатные группы X являются метильными группами.
60. Способ по п.32 или 40, где пендатные группы X, которые могут быть одинаковыми или разными, являются линейными или разветвленными углеводородными группами, имеющими 4 или менее атомов углерода.
61. Способ по п.32 или 40, где пендатные группы X, которые могут быть одинаковыми или разными, выбирают из группы, состоящей из метильных групп (CH3) и этильных групп (С2Н5).
Текст
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ТРАНСКАРОТИНОИДОВ И СПОСОБЫ ЛЕЧЕНИЯ ОПУХОЛИ Изобретение касается фармацевтических композиций на основе транскаротиноидных соединений общей формулы YZ-TCRO-ZY, где определения приведены в формуле изобретения, и их соответствующих солей, а также способов применения транскаротиноидных соединений в лечении опухоли. Указанные соединения полезны для улучшения способности кислорода к диффузии между эритроцитами и тканями организма млекопитающих, включая человека.(71)(73) Заявитель и патентовладелец: ДИФФЬЮЖН ФАРМАСЬЮТИКАЛЗ ЭлЭлСи (US) По заявке на данный патент испрашивается приоритет на основании предварительной заявки 60/655422, поданной 24 февраля 2005 г., содержание которой полностью включено в данное описание в качестве ссылки. Настоящее изобретение выполнено при государственной поддержке по контрактуN00014-04-C0146, предоставленной управлением военно-морских исследований. Государство имеет определенные права на изобретение. Настоящее изобретение включает усовершенствованные способы химического синтеза, направленные на получение транскаротиноидов, биполярных транскаротиноидов (BTC), включая соли биполярных транскаротиноидов (BTCS), такие как транснатрийкроцетинат (TSC), соединения как таковые, способы получения композиций, способы введения и применения указанных соединений. Предшествующий уровень техники Каротиноиды представляют собой класс углеводородов, состоящих из изопреноидных звеньев, соединенных таким образом, что расположение указанных звеньев является обращенным относительно центра молекулы. Основная цепь (скелет) молекулы состоит из сопряженных углерод-углеродных двойных и простых связей и может также содержать боковые группы. Хотя в одно время полагали, что скелет каротиноида содержит 40 атомов углерода, давно общепризнано, что каротиноиды могут также иметь углеродные скелеты, содержащие меньше 40 атомов углерода; 4 простые связи, которые относительно углерод-углеродной двойной связи лежат в одной плоскости. Если боковые группы находятся по одну сторону углерод-углеродной двойной связи, то группы называют цис-; если указанные группы находятся на противоположных сторонах от углерод-углеродной связи, такие группы называют транс-. По причине наличия большого числа двойных связей существует широкая возможность геометрической (цис/транс)изомерии каротиноидов, и изомеризация легко протекает в растворе. Серия книг может служить превосходными ссылками в отношении многих свойств и прочих каротиноидов ("Carotenoids", edited by G. Britton, S. Liaaen-Jensen and H. Pfander, Birkhauser Verlag, Basel, 1995, полностью включенные в данное описание в качестве ссылки). Многие каротиноиды являются неполярными и, таким образом, нерастворимыми в воде. Такие соединения являются чрезвычайно гидрофобными, что затрудняет получение указанных соединений в целях биологического применения, поскольку для растворения приходится использовать скорее органический растворитель, чем водный растворитель. Другие каротиноиды являются монополярными и обладают характеристиками поверхностно-активных веществ (гидрофобная часть и гидрофильная полярная группа). Как таковые, указанные соединения скорее притягиваются к поверхности водного раствора, чем растворяются в жидкой фазе. Существует незначительное число природных биполярных каротиноидных соединений, и такие соединения содержат центральный гидрофобный участок, а также две полярные группы на разных концах молекулы. Сообщается ("Carotenoids", Vol. IA, p. 283), что сульфаты каротиноидов обладают "существенной растворимостью в воде, до 0,4 мг/мл". Остальные каротиноиды, которые могут рассматриваться как биполярные, также незначительно растворимы в воде. Указанные каротиноиды включают диальдегиды и дикетоны. Описана также дипиридиновая соль кроцетина, но растворимость указанной соли в воде составляет менее 1 мг/мл при комнатной температуре. Другими примерами биполярных каротиноидов являются кроцетин и кроцин (оба обнаружены в пряном шафране). Однако, кроцетин лишь умеренно растворим в воде. Фактически, из всех природных биполярных каротиноидов только кроцин проявляет значительную растворимость в воде. Патенты США 4176179; 4070460; 4046880; 4038144; 4009270; 3975519; 3965261; 3853933 и 3788468(каждый из которых полностью включен в данное описание в качестве ссылки) касаются различных применений кроцетина. Патент США 6060511 касается транснатрийкроцетината (TSC) и применений указанного соединения. TSC получают взаимодействием природного шафрана с гидроксидом натрия с последующими экстракциями. Патент '511 охватывает способы экстракции, предназначенные для получения биполярной транскаротиноидной соли (транснатрийкроцетината), очищенную композицию, получаемую после экстракции, и различные применения композиции, такие как улучшение диффузионной способности кислорода и лечение геморрагического шока.PCT заявка US 03/05521 касается способа химического синтеза, направленного на получение биполярных транскаротиноидных солей, и способов получения указанных соединений. Приведенная ниже схема представляет несколько последних стадий способа химического синтеза Полная методика синтеза TSC, как описано в заявке РСТ, приходит к основным промежуточным соединениям, "соединению А" и "соединению В", через многостадийный синтез, показанный на двух схемах, приведенных ниже. Изомеризация нежелательных изомеров до требуемого диальдегида: Общей формой терапии злокачественных опухолей, или рака, является облучение. Применяемое облучение может быть в форме электромагнитных волн, либо заряженных или нейтральных частиц. Электромагнитные волны представлены рентгеновскими лучами или гамма-лучами. Заряженные части-2 017982 цы имеют форму электронов, протонов или тяжелых ионов, тогда как нейтроны являются примером нейтральных частиц. Курс лечения может осуществляться с применением дистанционной лучевой терапии,внедренного имплантата, либо комбинации двух указанных методов. При облучении общепринятыми единицами измерения являются рад и грей. Доза в один рад для любого типа облучения приводит к поглощению 100 эргов энергии на 1 г ткани-мишени; 1 грей равен 100 радам. Далее, 1 сантигрей (сГр) эквивалентен 1 рад. Для большинства более мелких опухолей головы и шеи курс радиотерапии, составляющий 6000-6500 сГр за 6-6,5 недель, большей частью является достаточным. Дозы 6500-7000 сГр за 6,5-7,5 недель могут быть необходимы для подавления роста более крупных опухолей и еще большие дозы требуются в случае массивного поражения при лимфогранулематозе. Показано, что доза в 5000 сГр за 5 недель сдерживает субклиническое заболевание у 90-95% пациентов. Жизнеспособная опухолевая клетка является клеткой, имеющей способность к неограниченному делению. Опухолевая клетка должна утратить эту репродуктивную способность, чтобы считаться убитой. Радиотерапевтический контроль опухоли достигается путем уничтожения всех жизнеспособных клеток опухоли, и полученная доза облучения, при каждом введении, приводит к гибели определенной части (не количества) жизнеспособных клеток. Следовательно, чем больше объем опухоли, тем большая суммарная доза облучения требуется для подавления роста опухоли. Опухолевая клетка, стерилизованная или убитая с помощью радиотерапии, не обязательно является морфологически измененной, и обычно гибель клеток обнаруживается во время митотического деления (клеточного деления). Важно отметить, что указанная гибель может не проявиться при первом клеточном делении после облучения. Вероятно, некоторые успешные клеточные циклы могут протекать до того, как гибель клеток станет явно проявляться, но клетка все же считается более не жизнеспособной, поскольку неограниченный репродуктивный потенциал такой клетки уже утрачен. Радиочувствительность опухолевых клеток находится под влиянием многих факторов. Недавно полагали, что гистология опухоли и локализация играют основные роли в потенциальной возможности подавления роста опухолей при помощи радиотерапии, но теперь гистология более не считается столь важной. Число жизнеспособных опухолевых клеток и доля гипоксических (испытывающих недостаток в кислороде) клеток в опухоли вносят основной вклад в радиочувствительность, и оба указанных фактора являются функцией размера данной опухоли. Многие годы считалось, что кислород играет важную роль в чувствительности опухоли к радиационной терапии. Точно установлено, что гипоксические опухолевые клетки являются более радиорезистентными. Хотя механизм этого явления полностью не ясен, считается, что наличие кислорода устраняет радиационное повреждение в клетках, которое является лабильным и, в противном случае, требует восстановления. Максимальное изменение радиочувствительности возникает в интервале значений 0-20 мм рт.ст. при значении, которое намного ниже парциального давления кислорода в венозной крови. Значительная гипоксия обнаружена в экспериментальных солидных опухолях, а также важное косвенное доказательство указывает на гипоксические состояния в опухолях человека. Гипоксические состояния развиваются, поскольку опухоль часто опережает в развитии существующее кровоснабжение. Химиотерапия является еще одним способом, применяемым для лечения рака. Вводят лекарства, такие как кармустин (BCNU), темозоламид (TMZ), цисплатин, метотрексат и пр., и указанные лекарственные средства приводят в конце концов к гибели или прекращению роста опухолевых клеток. Замечено, что химиотерапия, подобно радиационной терапии, менее эффективна в отношении гипоксических клеток, часто возникающих в опухолях. Высокое кровяное давление, или гипертензия, сказывается почти на каждом четвертом американце. Это потенциально опасное для жизни состояние может существовать фактически без симптомов. Кровяное давление характеризуется двумя величинами: систолическим артериальным давлением и диастолическим артериальным давлением. Диагноз гипертензия обычно ставят при систолическом давлении свыше 140 мм рт.ст. или диастолическом давлении свыше 90 мм рт.ст.; однако, эти границы меняются, и некоторые врачи полагают, что кровяное давление должно оставаться на уровне 120/70 всю жизнь либо естественным путем, либо благодаря применению противогипертонического лекарственного средства. У некоторых людей система, регулирующая кровяное давление, сбивается: артериолы во всем организме становятся суженными, что приводит к возрастанию давления в более крупных кровеносных сосудах. Устойчивое высокое кровяное давление - свыше 140/90 мм рт.ст. по мнению большинства специалистов - носит название гипертензия. Около 90% всех людей с высоким кровяным давлением имеет,как сейчас называется, "эссенциальную" гипертензию - что, как подразумевается, означает неидентифицируемую причину. В остальных 10% случаев повышенное кровяное давление вызвано заболеванием почек, диабетом или другим лежащим в основе заболеванием. Сущность изобретения Изобретение касается ряда новых транскаротиноидных соединений, а также множества композиций, содержащих транскаротиноидное соединение, включая композиции, содержащие транскаротиноид и циклодекстрин. Изобретение также охватывает способ синтеза каротиноидных соединений, имеющих формулуTCRO - симметричный или асимметричный транскаротиноидный скелет,включающий следующие стадии: связывание диальдегида, содержащего сопряженные углеродуглеродные двойные связи, с агентом Виттига и, необязательно, омыление продукта стадии связывания. В других вариантах осуществления изобретение касается способа лечения опухоли у млекопитающего, включающего введение млекопитающему i) транскаротиноида и проведение ii) облучения или химиотерапии, а также способов лечения гипертензии, фибрилляции желудочков или тахикардии, или высоких уровней липидов у млекопитающего, включающих введение нуждающемуся в лечении млекопитающему эффективного количества транскаротиноида. Подробное описание изобретения Изобретение касается усовершенствованного способа химического синтеза, направленного на получение транскаротиноидов, биполярных транскаротиноидов (BTC), солей биполярных транскаротиноидов (BTCS), включая транснатрийкроцетинат (TSC), соединений как таковых, способов получения композиций и способов применения указанных соединений. Как использовано здесь, термин "биполярный" означает имеющий две полярных группы, по одной на каждом конце молекулы. Описанный здесь новый способ синтеза по изобретению представляет собой усовершенствованный способ описанного выше синтеза, т.е. в заявке США 10/647132, полностью включенной в данное описание в качестве ссылки. В данном изобретении соединение В заменено соединением D. Разработанный в результате синтез протекает до конечного продукта (например, транснатрийкроцетинат) через новое предпоследнее промежуточное соединение, соединение Е (приведенное на следующей схеме). Соединение D В новом, усовершенствованном способе синтеза соединение А (2,7-диметилокта-2,4,6-триен-1,8 диаль) комбинируют с соединением D (2-(этоксикарбонил)-2-бутен-4-илтрифенилфосфонийбромид),галогенидом C5- сложного эфира Виттига. Указанные два соединения взаимодействуют с образованием диэтилкроцетината или соединения Е (диэтил-2,6,11,15-тетраметилгексадека-2 Е,4 Е,6 Е,8 Е,10 Е,12 Е,14 Егептаен-1,16-диотат). Соединение Е затем омыляют (применяя гидроксид натрия/этанол), что приводит к образованию конечного требуемого продукта, транснатрийкроцетината. Соединения по изобретению. Данное изобретение касается транскаротиноидов, включая такие соединения, как сложные диэфиры, диспирты, дикетоны и дикислоты транскаротиноидов, биполярные транскаротиноиды (BTC) и соли биполярных транскаротиноидов (BTCS), и синтеза указанных соединений, имеющих структуруYZ-TCRO-ZY,где Y (который может быть одинаковым или различным на двух концах) - Н или катион, отличный от H, предпочтительно Na+, или K+, или Li+. Y означает преимущественно одновалентный ион металла. Y может также представлять собой органический катион, например R4N+, R3S+, где R означает H илиZ (который может быть одинаковым или различным на двух концах) - полярная группа, которая связана с H или катионом. Необязательно, включая концевой углерод на каротиноиде (или родственном каротиноиду соединении), эта группа может означать карбоксильную (COO-) группу или CO группу (например, группу сложного эфира, альдегида или кетона), или гидроксильную группу. Указанная группа может также означать сульфатную группу (OSO3-) или моносульфатную группу (ОРО 3-), (OP(OH)О 2-),дифосфатную группу, трифосфатную или комбинации указанных групп. Данная группа может также означать сложноэфирную группу COOR, где R означает CnH2n+1;TCRO - транскаротиноидный или родственный каротиноиду скелет (преимущественно менее 100 атомов углерода), который является линейным, имеет боковые группы (указаны ниже) и обычно содержит "сопряженные" или чередующиеся углерод-углеродные двойные и простые связи (по одному из вариантов осуществления, TCRO является не полностью сопряженным, как в ликопине). Боковые группы(X) означают обычно метильные группы, но могут означать другие группы, как рассматривается ниже. В предпочтительном варианте осуществления звенья скелета соединены таким образом, что расположение указанных звеньев является обращенным относительно центра молекулы. 4 простые связи, которые окружают углерод-углеродную двойную связь, все лежат в одной и той же плоскости. Если боковые группы находятся по одну и ту же сторону углерод-углеродной двойной связи, группы обозначаются как цис(известны также как "Z"); если боковые группы находятся на противоположной стороне углеродуглеродной двойной связи, группы обозначаются как транс- (известны также, как "E"). В данном случае изомеры везде обозначаются как цис- и транс-. Соединения по данному изобретению являются транс-. Цис-изомер обычно невыгоден и не приводит к повышенной диффузионной способности. По одному из вариантов осуществления цис-изомер может быть использован там, где скелет остается линейным. Расположение боковых групп может быть симметричным относительно центра молекулы или может быть асимметричным, так что левая сторона молекулы не выглядит также, как правая сторона молекулы, что касается как типа боковой группы, так и пространственного расположения боковых групп относительно центрального углерода. Боковые группы X (которые могут быть одинаковыми или различными) означают атомы водорода(H) или линейную или разветвленную углеводородную группу с 10 или менее атомами углерода, преимущественно 4 или менее (необязательно содержащую галоген), или галоген. X может также означать сложноэфирную группу (COO-) или этокси/метоксигруппу. Примерами X служат метильная группа(CH3), этильная группа (С 2 Н 5), фенил или отдельная ароматическая циклическая структура, содержащая либо не содержащая боковые группы, идущие от цикла, галогенсодержащая алкильная группа (С 1-С 10),такая как CH2Cl, или галоген, такой как Cl или Br, либо метокси (ОСН 3) или этокси (ОСН 2 СН 3). Боковые группы могут быть одинаковыми или различными, но использованные боковые группы должны сохранять линейный скелет. Хотя многие каротиноиды существуют в природе, это не относится к солям каротиноидов. Патент США общего пользования 6060511, полностью включенный в данное описание в качестве ссылки, касается транснатрийкроцетината (TSC). TSC получают при взаимодействии природного шафрана с гидроксидом натрия и последующими экстракциями, подобранными, в первую очередь, для транс-изомера. Наличие цис- и транс-изомеров каротиноида или соли каротиноида может быть установлено по спектру в ультрафиолетовой и видимой области образца каротиноида, растворенного в водном растворе. Полученный спектр с величиной поглощения максимального пика, наблюдающегося в видимой области длин волн, от 380 до 470 нм (величина зависит от используемого растворителя и длины цепи ВТС илиBTCS; введение боковых групп или изменение длин цепи изменяет величину этого максимального поглощения, но специалисты в данной области принимают наличие пика поглощения в видимой области за соответствие сопряженной структуре основной цепи указанных молекул), имеющий пик поглощения в УФ-области при длине волны от 220 до 300 нм, может быть использован для определения уровня чистоты транс-изомера. Когда сложный диэфир транскаротиноида (TCD) или BTCS растворяют в воде, максимальный пик, наблюдающийся в видимой области длин волн, находится в пределах от 380 до 470 нм (в зависимости от точной химической структуры, длины основной цепи и боковых групп) и пик в УФобласти при длине волны в пределах от 220 до 300 нм. Согласно М. Craw and С. Lambert, Photochemistryand Photobiology, Vol. 38 (2), 241-243 (1983), полностью включенному в данное описание в качестве ссылки, результат расчета (в этом случае анализируют кроцетин) дает значение 3,1, которое возрастает до 6,6 после очистки. При проведении анализа Craw и Lambert'а с использованием кюветы, предназначенной для УФ и видимого диапазона волн, для натриевой соли транскроцетина, согласно патенту США общего пользования 6060511 (TSC получают взаимодействием природного шафрана с гидроксидом натрия и последующими экстракциями, подобранными, в первую очередь, для транс-изомера), получено значение, составляющее примерно 6,8. При проведении указанного испытания на синтетическом TSC по данному изобретению это соотношение превышает 7,0 (например, от 7,0 до 8,5), преимущественно свыше 7,5 (например, 7,5-8,5), наиболее предпочтительно свыше 8. Синтезированное вещество представляет собой Асимметричные соединения. Некоторые примеры асимметричных соединений включают, но не в порядке ограничения, следующие. 1) По примеру 6 - синтез соединения Р. Соединение О(Динатрий-2,4,9,13-тетраметилтетрадека-2 Е,4 Е,6 Е,8 Е,10 Е,12 Е-гексаен-1,14-диотат) Специалисту в данной области понятно, что асимметрия может быть достигнута за счет пространственного размещения боковых групп по длине цепи TCRO или изменения типа боковых групп на любой стороне, или на обеих. Вдобавок, как в случае симметричных транскаротиноидных молекул, асимметричные транскаротиноидные молекулы могут иметь отличающиеся катионы, полярные концевые группы и длины цепей. Промежуточные соединения. При получении каротиноидных соединений и соответствующих солей, прежде чем получить конечный продукт, синтезируют некоторые промежуточные соединения. Например, для случая синтеза TSC основные промежуточные соединения, после связывания соединений А и D по способу данного изобретения, представлены ниже. Первым является диэтилкроцетинат. Вместо диэтилкроцетината может также быть использован диметилкроцетинат, также возможны дипропиловая и пр. формы соединения. Структуры некоторых из указанных промежуточных соединений (для ряда молекул BTCS, приведенных здесь в примерах) показаны ниже. Соединение Е(Диэтил-2,4,8,13,17,19-гексаметилэйкоза-2 Е,4 Е,6 Е,8 Е,10 Е,12 Е,14 Е,16 Е,18 Е-нонаен-1,10-диотат) Синтез соединений по изобретению. Один из вариантов осуществления данного изобретения касается усовершенствований нескольких последних стадий способа, раскрытого в заявке PCT общего пользования US 03/05521 и заявке США 10/647132. В новом изобретении C10- диаль (показанный выше как соединение А) или C20- диаль для синтеза длинноцепных каротиноидов подвергают взаимодействию с солью Виттига (C2-, C3-, C5-, C10-,C15- или другой) по одностадийной или двухстадийной реакции связывания, приводящей к образованию либо одного промежуточного соединения, либо двух промежуточных соединений (по одному на каждой стадии связывания). Конечное промежуточное соединение затем омыляют до образования BTCS требуемой длины цепи, симметрии или нужного типа соли. В частности, применительно к синтезу TSC (подробно описанному здесь в примерах 1 и 2) изобретение касается реакции связывания, в которой участвуют соединения А и соединение D (вместо соединения В), приводящей к получению предпоследнего промежуточного соединения, соединения Е. Соединение Е превращают затем в TSC по реакции омыления с помощью гидроксида натрия. По изобретению образующийся TSC-продукт получают с более высоким выходом и большей чистотой (композиционной и изомерной), чем указано в предшествующей заявке общего пользования. Усовершенствования синтеза каротиноидов, таких как транснатрийкроцетинат (TSC), приводящие к более высокому выходу и большей чистоте. 1) Растворитель на основе бутиленоксида для реакционной системы. По данному изобретению реакция связывания соединений А и D протекает в системе растворителей на основе бутиленоксида. В качестве реакционного разбавителя для связывания используют систему бутиленоксид/толуол. Выход на этой стадии обычно составляет в пределах 55-60%. Для сравнения отметим, что синтез, описанный в заявке РСТ US03/05521, с использованием бензола в качестве разбавителя для аналогичной реакции связывания (между соединениями А и В) дает на этой стадии выход 33%. Бутиленоксид используют в качестве растворителя для данной реакции связывания, поскольку бутиленоксид представляет собой pH-нейтральную систему растворителей для реакции Виттига. pH-нейтральная система удобна, поскольку 1) в pH-нейтральной среде не происходит образования соли, 2) образование спиртовых продуктов ингибируется или исключается и 3) ингибируется осаждение конечного соединения. Вдобавок, применение бутиленоксида и исходных материалов очень высокой чистоты (соединений А и D) исключает необходимость второй реакционной стадии с применением NaOH для фосфор-илидной конверсии (описанной в заявке РСТ). Стадия связывания по данному изобретению сводится, таким образом, к одной реакционной стадии с повышенным суммарным выходом продукта. Другие растворители, полезные на данной стадии, включают метиленхлорид/гидроксид натрия и этилат натрия или метилат натрия. 2) Этанол на стадии омыления. На второй стадии нового способа синтеза омыление сложного диэфира (соединение Е) до TSC осуществляют, используя этанол в качестве растворителя. Использование разбавителя этанол/гидроксид натрия для реакционной смеси приводит к 92,0% выходу на данной стадии (без учета поправок) и выходу 80% с учетом поправок. Указанные здесь выходы являются выходами после выделения. Наблюдается полное превращение реагентов. Сложный диэтиловый эфир (соединение Е) плохо растворим в воде и в растворителе, таком как ТГФ, используемом в способе синтеза по заявке PCT US 03/05521. Поэтому применение этанола в данном изобретении, который является более подходящим растворителем для сложного диэтилового эфира,существенно сокращает реакционное время и, в конечном счете, приводит к более высоким выходам. Другой подходящей альтернативой на данной стадии является изопропанол или метанол. Результаты изменений, произведенных в способе синтеза, сведены в таблицу, приведенную ниже,где указаны различия в чистоте и выходе между способом по данному изобретению и способом по заявкеPCT US 03/05521 и заявке США 10/647132. Важно отметить, что рассматриваемый способ основан на диэтилкроцетинате (соединение Е) на предпоследней стадии, тогда как способ по заявке PCTUS 03/05521 основан на диметилкроцетинате (соединение С) на той же стадии. Улучшенное гранулометрическое распределение. Промывка этанолом. В экспериментах, где использована стадия промывки этанолом, конечное содержание воды в продукте ниже (т.е. 0,5 мас.%) по сравнению с применением стадии промывки водой, где конечное содержание воды в продукте составляет 1,8 мас.%. Использование промывки этанолом снижает изменчивость размера частиц во всей партии продукта, делая распределение более однородным. Распределение TSC,полученного способом по заявке PCT US 03/05521, является бимодальным, тогда как вместо этого, в случае настоящего изобретения, обнаружено простое гауссовское распределение. Данное усовершенствование в особенности важно, поскольку размер частиц может влиять на растворимость и более гомогенное распределение допускает более однородную способность к растворению. Таким образом, изобретение включает способ синтеза транскаротиноидного соединения, имеющего формулуYZ-TCRO-ZY,где Y (который может быть одинаковым или различным на двух концах) - H или катион, предпочтительно Na+ или K+, или Li+. Y означает преимущественно одновалентный ион металла. Y может также представлять собой органический катион, например, R4N+, R3S+, где R означает H, или CnH2n+1, где n равно 1-10, целесообразно 1-6. Например, R может означать метил, этил, пропил или бутил.Z (который может быть одинаковым или различным на двух концах) - полярная группа, которая связана с Н или катионом. Необязательно, включая концевой углерод на каротиноиде (или родственном каротиноиду соединении), эта группа может означать карбоксильную (COO-) группу или CO группу (например, группу сложного эфира, альдегида или кетона) или гидроксильную группу. Указанная группа может также означать сульфатную группу (OSO3-) или моносульфатную группу (ОРО 3-), (ОР(ОН)О 2-),дифосфатную группу, трифосфатную или комбинации указанных групп. Данная группа может также означать сложноэфирную группу COOR, где R означает CnH2n+1.TCRO - транскаротиноидный или родственный каротиноиду скелет (преимущественно менее 100 атомов углерода), который является линейным, имеет боковые группы (указаны ниже) и обычно содержит "сопряженные" или чередующиеся углерод-углеродные двойные и простые связи (по одному из вариантов осуществления, TCRO является не полностью сопряженным, как в ликопине). Боковые группы означают обычно метильные группы, но могут означать другие группы, как рассматривается ниже. В предпочтительном варианте осуществления звенья скелета соединены таким образом, что расположение указанных звеньев является обращенным относительно центра молекулы. 4 простых связи, которые окружают углерод-углеродную двойную связь, все лежат в одной и той же плоскости. Если боковые группы находятся по одну и ту же сторону углерод-углеродной двойной связи, группы обозначаются как цис-; если боковые группы находятся на противоположной стороне углерод-углеродной двойной связи, группы обозначаются как транс-. Соединения по данному изобретению являются транс-. Цис-изомер обычно невыгоден- и не приводит к повышенной диффузионной способности. По одному из вариантов осуществления цисизомер может быть использован там, где скелет остается линейным. Расположение боковых групп может быть симметричным относительно центра молекулы или может быть асимметричным, так что левая сторона молекулы не выглядит также как правая сторона молекулы, что касается как типа боковой группы,так и пространственного расположения боковых групп относительно центрального углерода. Способ включает связывание симметричного диальдегида, содержащего сопряженные углеродуглеродные двойные связи, с агентом Виттига, таким как трифенилфосфоран, например [3 карбометокси-2-бутен-1-илиден]трифенилфосфоран, или трифенилфосфонийбромидом, например гало-9 017982 генидом C5- сложного эфира Виттига, таким как D (2-(этоксикарбонил)-2-бутен-4 илтрифенилфосфонийбромид), или C2-, C3- или C5- сложным фосфоноэфиром, таким как трифенилфосфоноацетат. Агент Виттига может также представлять собой трифенилфосфонийхлорид или смесь бромистых или хлористых соединений. Необходима либо одностадийная, либо двухстадийная реакция связывания, в зависимости от длины цепи требуемого TCRO. Как показано здесь на примерах, большие длины цепей требуют более одной реакции связывания либо с тем же самым, либо с иным агентом Виттига на каждой стадии. Преимущественно реакцию связывания выполняют в системе растворителей с нейтральным pH, такой как система растворителей на основе бутиленоксида, необязательно, включающая толуол, или метиленхлорид/гидроксид натрия и этилат натрия или метилат натрия. После стадии связывания идет стадия выделения требуемого продукта реакции связывания. После стадии связывания либо осуществляют вторую стадию связывания и продукт выделяют, как указано выше, либо выделенный продукт вышеуказанной стадии омыляют до образования соединенияBTCS. Если включена вторая реакция связывания, продукт данной второй стадии выделяют и затем омыляют. Продукт можно омылять, используя раствор NaOH, LiOH, KOH и метанол, этанол или изопропанол в качестве растворителя. После стадии омыления требуемый продукт может быть промыт этанолом или водой. В некоторых случаях пригодным для промывки растворителем является метанол или изопропанол. Получение композиций и введение соединений фармацевтической степени чистоты и композиций по изобретению. Получение композиций транскаротиноидов, включая BTCS, такие как транснатрийкроцетинат(повышения концентрации активного ингредиента (например, TSC) в растворе), устойчивости, биодоступности и изотонического равновесия ВТС, снижения рН водного раствора и/или повышения осмоляльности водного раствора. Наполнитель должен действовать как добавка для предупреждения аутоагрегации мономерных ВТС-звеньев в растворе или для предупреждения преждевременного осаждения ВТС. Введение наполнителя должно способствовать решению по меньшей мере одной из указанных проблем. Молекулы биполярных транскаротиноидов (BTC) могут быть получены рядом способов. Основным составом является смесь ВТС в стерильной воде, вводимая путем внутривенной инъекции. Указанный состав может быть видоизменен путем введения различных фармацевтических наполнителей, включая циклодекстрины. Такие составы также могут быть введены путем внутривенной инъекции. Любой из вышеуказанных различных жидких составов может быть высушен сублимацией (лиофилизован), что дает сухой порошок с улучшенными характеристиками растворимости и устойчивости. Такие порошкообразные формы затем перерастворяют в целях введения. Один из способов состоит в перерастворении порошка в жидкости, такой как физиологический раствор или стерильная вода для инъекции, и последующем введении путем внутривенной инъекции. Указанный способ может включать применение многосекционного шприца, содержащего порошок в одном отделении и жидкость в другом отделении. Аналогичным образом, продукт может быть закупорен во флаконы, содержащие перегородку, отделяющую порошок от жидкости. Перед введением перегородку взламывают и компоненты смешивают перед внутривенной инъекцией. Кроме внутривенного введения способы введения специально полученных молекул транскаротиноидов включают внутримышечную инъекцию, доставку путем ингаляции, пероральное введение и трансдермальное введение. Циклодекстрины. Для введения некоторых лекарственных средств необходимо добавить другое соединение, способствующее повышению всасывания/растворимости/концентрации активного фармацевтического ингредиента (API). Такие соединения называются наполнителями, примерами наполнителей являются циклодекстрины. Циклодекстрины имеют циклические углеводородные цепи, являющиеся производными крахмала. Циклодекстрины отличаются друг от друга числом глюкопиранозных звеньев в структуре. Исходные циклодекстрины содержат шесть, семь и восемь глюкопиранозных звеньев и называются альфа-, бета- и гамма-циклодекстринами соответственно. Циклодекстрины впервые были обнаружены в 1891 г. и использовались в течение ряда лет в составе фармацевтических препаратов. Циклодекстрины являются циклическими (альфа-1,4)-связанными олигосахаридами альфа-Dглюкопиранозы, содержащими сравнительно гидрофобную центральную полость и гидрофильную наружную поверхность. В фармацевтической промышленности циклодекстрины в основном используются в качестве комплексообразующих агентов для повышения водорастворимости плохо растворимых в воде лекарственных средств и для повышения биодоступности и устойчивости лекарственных средств. Вдобавок, циклодекстрины используют для ослабления или предупреждения желудочно-кишечного раздражения или раздражения слизистой оболочки глаз, для снижения или устранения неприятных запахов или вкусов, для предотвращения взаимодействий лекарство-лекарство или лекарство-добавка или даже для превращения масляных и жидких лекарственных средств в микрокристаллические или аморфные порошки. Хотя ВТС-соединения растворимы в воде, использование циклодекстринов может повысить ука- 10017982 занную растворимость еще больше, так что меньший объем лекарственного раствора можно вводить для обеспечения заданной дозы. Существует ряд циклодекстринов, которые могут быть использованы с соединениями по изобретению. См., например, патент США 4727064, полностью включенный в данное описание в качестве ссылки. Предпочтительными циклодекстринами являются -циклодекстрин, 2 гидроксилпропилциклодекстрин и 2-гидроксипропилциклодекстрин, либо другие циклодекстрины,повышающие растворимость ВТС. Использование гамма-циклодекстрина с TSC повышает растворимость TSC в воде в 3-7 раз. Хотя это не столь большая величина, как наблюдается в ряде других случаев повышения растворимости активного ингредиента с помощью циклодекстрина, важно, что становится возможным парентеральное введение TSC людям (или животным) в меньших объемных дозах. Дозы TSC и гамма-циклодекстрина приводят к водным растворам, содержащим до 44 мг TSC на мл раствора. Растворы не обязательно должны быть эквимолярными. Включение гамма-циклодекстрина также обеспечивает всасывание TSC в кровь при внутримышечной инъекции. Всасывание быстрое, и эффективные уровни TSC в крови достигаются быстро (как показано на крысах). Получение композиций с циклодекстрином может быть использовано для других транскаротиноидов и солей каротиноидов. Данное изобретение также включает новые композиции из каротиноидов, не являющихся солями (например, кислотные формы, такие как кроцетин, кроцин или вышеуказанные промежуточные соединения), и циклодекстрин. Другими словами, транскаротиноиды, не являющиеся солями, могут быть включены в композицию с циклодекстрином. Маннит может быть добавлен для осмоляльности, либо смесь циклодекстрин-ВТС может быть добавлена к физиологическому раствору (см. ниже). Количество используемого циклодекстрина равно тому количеству, которое удерживает транскаротиноид, но не столь велико, чтобы препятствовать высвобождению транскаротиноида. Циклодекстрин-маннит. Транскаротиноид, такой как TSC, может быть включен в композицию циклодекстрином, как указано выше, и не разлагающимся в организме сахаром, таким как маннит (например, d-маннит для доведения осмотического давления до такой же величины, как кровяное давление). Таким образом, могут быть получены растворы, содержащие свыше 20 мг TSC/мл раствора. Указанный раствор может быть добавлен к физиологическому раствору или другим изотоническим растворам с целью разведения и сохранения при этом надлежащей осмоляльности (см. пример 12). Маннит/уксусная кислота.BTCS, такой как TSC, может быть включен в композицию с маннитом, таким как d-маннит, и слабой кислотой, такой как уксусная кислота или лимонная кислота, с целью регулирования pH. pH раствора должен быть около 8-8,5. Раствор должен быть близким к изотоническому раствору и как таковой может быть инъецирован непосредственно в кровь (см. пример 13). Вода + физиологический раствор.BTCS, такой как TSC, может быть растворен в воде (преимущественно в воде для инъекций). Такой раствор может быть затем разведен водой, изотоническим раствором хлорида натрия, лактатом Рингера или фосфатным буфером, и полученная смесь может быть введена путем инфузии либо инъекции. Буферы. Буфер, такой как глицин или бикарбонат, может быть добавлен к составу на уровне порядка 50 мМ для устойчивости ВСТ, такого как TSC.TSC и гамма-циклодекстрин. Соотношение TSC и циклодекстрина основано на данных по растворимости TSC:циклодекстрин. Например, 20 мг/мл TSC, 8% гамма-циклодекстрин, 50 мМ глицин, 2,33% маннит с рН 8,20,5 или 10 мг/мл TSC и 4% циклодекстрин, или 5 мг/мл and 2% циклодекстрин. Как очевидно для специалиста в данной области, соотношения указанных ингредиентов могут быть несколько изменены. Маннит может быть использован для регулирования осмоляльности, и концентрация маннита изменяется в зависимости от концентрации других ингредиентов. Глицин сохраняется постоянным. TSC более устойчив при повышенных значениях рН. рН около 8,20,5 требуется для устойчивости и физиологической совместимости. Применение глицина совместимо с лиофилизацией. Альтернативно, TSC и циклодекстрин получают, используя 50 мМ бикарбонатный буфер вместо глицина. Удаление эндотоксина гамма-циклодекстрина. Коммерчески доступный циклодекстрин фармацевтической степени чистоты имеет эндотоксиновые уровни, несовместимые с внутривенной инъекцией. Эндотоксиновые уровни должны быть снижены для использования циклодекстрина в составах ВТС, предназначенных для внутривенной инъекции. Лиофилизация. Лиофилизация, так же как и другие способы кристаллизации, могут быть использованы для сушки ВТС-лекарственного средства. Соединения по изобретению могут также быть получены согласно разделу, который касается составов, приведенному в заявке США 10/647132. Пульмональное введение. Показано, что после пульмонального введения TSC всасывается в кровь. Включение циклодекстрина усиливает всасывание TSC в большой круг кровообращения - при общем эффекте увеличения плазменного клиренса. Также увеличение инъекционного объема приводит к лучшему всасыванию TSC и в течение более длительного периода времени. Таким образом, больший инъекционный объем, при той же самой дозе, приводит к большей биодоступности. Установлено, что геморрагический шок у крыс можно успешно лечить путем введения TSC пульмональным способом. Для пульмонального всасывания циклодекстрины не требуются. Пульмональные исследования,включающие TSC при рН дважды деионизованной воды, свидетельствуют об эффективном всасывании в кровь. Внутримышечное введение.TSC не всасывается внутримышечным путем, когда просто растворен в деионизованной воде; однако добавление циклодекстрина (в виде полученного лекарственного продукта) приводит к всасыванию в кровь. Введение -циклодекстрина с TSC приводит к существенному всасыванию в большой круг кровообращения. Установлено, что геморрагический шок у крыс можно успешно лечить путем введения TSC посредством внутримышечной инъекции. Получение композиций TSC с пропиленгликолем, полимерами полиэтиленгликоля (PEG) и другими агентами способствует всасыванию в кровь при введении TSC путем внутримышечных инъекций. Указанные агенты могут также быть использованы с другими ВСТами для внутримышечного введения. Трансдермальное введение.TSC, как показано на крысах, всасывается в кровь после трансдермального введения, если включен в композицию с циклодекстринами. Получение композиций TSC с пропиленгликолем, полимерами полиэтиленгликоля (PEG), ДМСО и другими агентами также способствует всасыванию в кровь, когда TSC вводят трансдермально. Указанные агенты могут также быть использованы с другими ВСТами для трансдермального введения. Пероральное введение. Показано, что TSC всасывается в кровь после перорального введения. Установлено, что включение циклодекстрина, такого как -циклодекстрин, в ВСТ, такой как TSC, усиливает всасывание TSC в большой круг кровообращения. Получение композиций ВСТ с пропиленгликолем, полимерами полиэтиленгликоля (PEG) и другими агентами также усиливает пероральное всасывание в кровь. Применение соединений и композиций по изобретению. Соединения и композиции по данному изобретению могут быть использованы для лечения различных нарушений у млекопитающих, включая человека. Вышеуказанные соединения по изобретению,включая промежуточные соединения, могут применяться в указанных ниже целях, а также для целей,указанных в заявке США 10/647132. Транскаротиноиды и облучение злокачественных опухолей. В целях преодоления гипоксии опухолевых клеток, приводящей к радиорезистентности, полезна кислородная терапия. Действительно, была определена величина, которая известна как коэффициент кислородного усиления (OER). Данная величина указывает, что доза облучения, приводящая к заданному уровню выживаемости клеток, больше на постоянный коэффициент при гипоксических условиях, чем соответствующая доза в условиях, когда клетки хорошо оксигенированы. Для большинства клеток млекопитающих OER равен 2,5-3. Другими словами, для того чтобы убить гипоксические клетки, требуется 2,5-3-кратная доза от облучения, требуемого, чтобы убить хорошо оксигенированные клетки. Таким образом, увеличение переноса кислорода к опухолям позволяет использовать более низкие дозы облучения для того, чтобы "убить" злокачественные клетки. Это важно для многих типов опухолей. Показано, что использование биполярного транскаротиноидного соединения, такого как транснатрийкроцетинат, повышает количество гипоксических тканей с проникающим кислородом; таким образом, указанное соединение является очень полезным радиосенсибилизатором. Данное соединение позволяет использовать сниженные дозы облучения или повышает эффективность облучения и обеспечивает регрессию опухоли и выздоровление. Указанное соединение полезно для любого типа злокачественного новообразования, при котором обычно используется облучение. Лучевая терапия назначается приблизительно 60% раковых больных, и обычно используется доза облучения порядка 6000-6500 сГр за несколько недель. ВТС или BTCS, такой как TSC, может быть использован в сочетании с облучением для достижения более высокого показателя эффективности лечения. По одному из вариантов осуществленияTSC вводят при 0,02-2 мг/кг, преимущественно 0,05-1 мг/кг перед каждой дозой облучения. Более высокие дозы используют при другом типе дозирования (например, в 3 раза больше, поскольку TSC не весь всасывается при других способах применения). По еще одному варианту осуществления другой способ, такой как применение гипербарического кислорода, вдыхание чистого газообразного кислорода или введение другого соединения, такого как мисонидизол, применяют в дополнение к введению ВТС-соединения, такого как TSC, для повышения эффективности облучения. Указанные дополнительные способы могут также осуществляться в случае дру- 12017982 гих применений, описанных ниже (например, химических). Соединения по изобретению наряду с лучевой терапией могут быть использованы для лечения многих типов опухолей, включая плоскоклеточные карциномы, меланомы, лимфомы, саркомы, саркоиды,остеосаркомы, опухоли, связанные с раком кожи, раком молочной железы, раком головы и шеи, гинекологическим раком, раком урологическим и мужских половых органов, раком мочевого пузыря, раком предстательной железы, раком костей, раковые опухоли эндокринных желез, раковые опухоли желудочно-кишечного тракта (например, толстой кишки), раковые опухоли основных пищеварительных желез/органов (например, желудка, печени, поджелудочной железы), раковую опухоль ЦНС (включая раковые опухоли головного мозга, такие как глиомы) и рак легких. Транснатрийкроцетинат (TSC) успешно применен в качестве радиосенсибилизатора для пересаженной мышам карциномы человека. Проведены исследования, на основании которых сделан вывод, что доза TSC в пределах от 0,07 до 0,18 мг/кг повышает эффект облучения такого типа опухолей. Транскаротиноиды и химиотерапия. Показано, что транскаротиноидные соединения, такие как транснатрийкроцетинат, повышают количество гипоксических тканей с проникающим кислородом; что делает указанные соединения полезными в комбинации с химиотерапией рака. Такая комбинация позволяет увеличить эффективность химиотерапии. Указанная комбинация полезна для любого типа раковой опухоли, для которой в настоящее время используется химиотерапия. Химиотерапия с применением множества различных типов агентов показана большинству раковых больных. ВТС или BTCS, такой как TSC, может быть использован в сочетании с химиотерапией для достижения регрессии опухоли и более высокого показателя эффективности лечения. По одному из вариантов осуществления TSC вводят при 0,02-2 мг/кг, преимущественно 0,05-1 мг/кг до, во время или после внутривенного дозированного введения химиотерапевтического средства. При дозировании другим способом дозу необходимо увеличить в 2-3 раза с учетом сниженной биодоступности. Соединения по изобретению наряду с химиотерапией могут быть использованы для лечения многих типов опухолей, включая плоскоклеточные карциномы, меланомы, лимфомы, саркомы, саркоиды, остеосаркомы, опухоли, связанные с раком кожи, раком молочной железы, раком головы и шеи, гинекологическим раком, раком урологическим и мужских половых органов, раком мочевого пузыря, раком предстательной железы, раком костей, раковые опухоли эндокринных желез, раковые опухоли желудочнокишечного тракта (например, толстой кишки), раковые опухоли основных пищеварительных желез/органов (например, желудка, печени, поджелудочной железы), раковую опухоль ЦНС (включая раковые опухоли головного мозга, такие как глиомы) и рак легких. Фибрилляция желудочков. При прохождении электрических сигналов сердце сокращается. Фибрилляция желудочков ("V fib") является состоянием, при котором нарушается сердечная электрическая активность. Когда случается указанное нарушение, нижние (откачивающие) камеры сердца сокращаются быстро, несинхронно (желудочки "трепещут", а не сокращаются). Сердце перекачивает мало крови или не перекачивает кровь. Фибрилляция желудочков является очень тяжелым состоянием. Коллапс и внезапная сердечная смерть следует мгновенно, если медицинская помощь не обеспечивается немедленно. Если лечиться своевременно, V fib и тахикардия желудочков (чрезвычайно быстрое сердцебиение) могут быть переведены в нормальный ритм. По существующей для такого состояния терапии требуется вызывать шок сердца с помощью устройства, называемого дефибриллятор. Другой эффективный способ корректирования опасных для жизни ритмов состоит в использовании электронного прибора, называемого имплантируемый кардиовертер-дефибриллятор. Такой прибор вызывает шок сердца в целях нормализации сердцебиения, если нарушаются собственные электрические сигналы сердца. Как фибрилляция желудочков, так и тахикардия может также "корректироваться" путем применения соединения по изобретению, такого как транснатрийкроцетинат (TSC). TSC в случае внутривенной инъекции во время преклинической стадии инфаркта миокарда предупреждает фибрилляцию желудочков. Вдобавок, показано, что TSC ослабляет тахикардию у крыс, испытывающих геморрагический шок. Предпочтительная доза TSC составляет 0,02-2 мг/кг и преимущественно 0,05-1 мг/кг при внутривенном дозированном введении. При дозировании другим способом дозу необходимо увеличить в 2-3 раза с учетом сниженной биодоступности. Гипертензия. С возрастом поглощение кислорода у людей снижается. Кроме того, с возрастом растет заболеваемость гипертензией. Не ограничиваясь рамками конкретной теории, предполагается, что эти два фактора взаимосвязаны, т.е. после снижения поглощения кислорода тканями кровяное давление возрастает так,чтобы обеспечивать ткань большим количеством кислорода. Таким образом, если дополнительное количество кислорода обеспечить некоторым другим способом, кровяное давление должно снизиться. Предпочтительная доза TSC составляет 0,02-2 мг/кг и преимущественно 0,05-1 мг/кг при внутривенном дозированном введении. При дозировании другим способом дозу необходимо увеличить в 2-3 раза с учетом сниженной биодоступности. Соединения по изобретению, такие как TSC, снижают систолическое артериальное давление, сни- 13017982 жая также и диастолическое давление. Указанные соединения могут также вызывать снижение частоты сердечных сокращений и, таким образом, вызывать снижение частоты пульса, которая часто повышена у гипертоника. Предпочтительная доза TSC для лечения гипертензии составляет 0,02-2 мг/кг и более предпочтительно 0,05-1 мг/кг. Высокие уровни липидов. Соединения по изобретению, такие как TSC, могут снижать уровни липидов в плазме, включая уровни триглицерида и холестерина. Предпочтительная доза TSC составляет 0,02-2 мг/кг и преимущественно 0,05-1 мг/кг при внутривенном дозированном введении. При дозировании другим способом дозу необходимо увеличить в 2-3 раза с учетом сниженной биодоступности. Применение для недоношенных детей. Соединения по изобретению, такие как TSC, могут применяться на недоношенных детях в целях предупреждения притупления умственной способности. Предпочтительная доза TSC составляет 0,02-2 мг/кг и преимущественно 0,05-1 мг/кг при внутривенном дозированном введении. При дозировании другим способом дозу необходимо увеличить в 2-3 раза с учетом сниженной биодоступности. Применение при родах. Соединения по изобретению, такие как TSC, могут быть применяться для введения плоду или матери во время родов для предупреждения кислородной недостаточности плода во время родов. Кислородная недостаточность плода во время родов может привести к повреждению головного мозга или аутизму. Предпочтительная доза TSC составляет 0,02-2 мг/кг и преимущественно 0,05-1 мг/кг при внутривенном дозированном введении. При дозировании другим способом дозу необходимо увеличить в 2-3 раза с учетом сниженной биодоступности. Применение после отравления дымом. Соединения по изобретению, такие как TSC, могут быть введены после сильного отравления дымом. Предпочтительная доза TSC составляет 0,02-2 мг/кг и преимущественно 0,05-1 мг/кг при внутривенном дозированном введении. При дозировании другим способом дозу необходимо увеличить в 2-3 раза с учетом сниженной биодоступности. Фибромиалгия. Соединения по изобретению, такие как TSC, могут быть использованы для лечения фибромиалгии путем увеличения клеточных уровней кислорода. Предпочтительная доза TSC составляет 0,02-2 мг/кг и преимущественно 0,05-1 мг/кг при внутривенном дозированном введении. При дозировании другим способом дозу необходимо увеличить в 2-3 раза с учетом сниженной биодоступности. Следующие примеры являются иллюстративными, но не ограничивающими соединения, композиции и способы по настоящему изобретению. Другие приемлемые общеупотребительные видоизменения и адаптации ряда условий и параметров, очевидные для специалистов в данной области, входят в рамки сущности и объема данного изобретения. Примеры Перечень принятых в примерах сокращений а/а [%] относительная чистота в % АР водный слойE-No. ссылочный номер каждого индивидуального соединенияFW молекулярная масса по формуле соединенияGMP принципы изготовления изделия Н час (ч)H-NMR ядерный магнитный резонанс по водороду (Н-ЯМР)HPLC высокоэффективная жидкостная хроматография (ВЭЖХ) протокол основных операций без учета поправки (бп.) органический слой комнатная температура (ок. 22C) насыщенный (нас.) раствор исходный материал температура трифторуксусная кислота теоретический трифенилфосфиноксид тонкослойная хроматография (ТСХ) транснатрийкроцетинат (C-013229) ультрафиолетовая спектроскопия выход Используемый материал представляет собой смесь солей, содержащую 48% бромида и 52% хлорида согласно СоА поставщика. Таким образом,реальная масса отличается от теоретической массы, как указано в композиционной схеме. Методика. 1. Колбу вакуумируют и продувают азотом. 2. В колбу загружают соединение А (1) и соединение D (2) при JT=20C. 3. Бутиленоксид (3) и толуол (4) загружают в колбу при JT=20C. Колбу дважды вакуумируют и продувают азотом. Реакционную смесь нагревают до JT=100C. Получают гомогенный раствор. 4. Раствор перемешивают при JT=100C в течение 6,5 ч (IT составляет около 93C). 5. Отбирают пробу для IPC. 6. Смесь медленно охлаждают до IT=20C (15 ч). 7. Образуется красная суспензия. Суспензию охлаждают до IT=1C в течение 2 ч. 8. Суспензию фильтруют на фильтре-осушителе за несколько минут. 9. Охлажденный этанол (5) при 2C используют для ополаскивания колбы. Промывочный раствор переносят на фильтр-осушитель. 10. Фильтровальный осадок промывают метилциклогексаном (6) при 22C. 11. Фильтровальный осадок сушат на роторном испарителе в течение 5 ч при 55C. 12. 139,6 г соединения Е получают в виде красного твердого вещества. Идентичность устанавливают по 1 Н-ЯМР. Чистота, установленная по ВЭЖХ, составляет 93,68% а/а. Кроме того, обнаружено также 2,90 + 3,00% цис-изомеров. Выход (бп.) составляет 45,9%. 13. Маточный раствор (около 3 л) концентрируют до 40% от исходного объема (все еще красный раствор) перемешивают при JT=100C в течение 15 ч (IT составляет около 100C). 14. Образуется красная суспензия. Отбирают пробу для IPC. 15. Смесь разбавляют бутиленоксидом (7) и толуолом (8, все еще суспензия) и охлаждают доIT=2,9C в течение 3,5 ч. 16. Суспензию фильтруют на фильтре-осушителе за 10 мин. 17. Охлажденный этанол (9) (около 2C) используют для ополаскивания колбы. Промывочный раствор переносят на фильтр-осушитель. 18. Фильтровальный осадок промывают метилциклогексаном (10) при 18C. 19. Фильтровальный осадок сушат на роторном испарителе в течение 15 ч при 50C. 20. 384,5 г сырого продукта получают в виде красного твердого вещества. 1 Н-ЯМР показывает наличие ТРРО в дополнение к требуемому продукту. 21. Сырой продукт обрабатывают метанолом (11) и перемешивают в течение 30 мин при JT=60C. 22. Суспензию охлаждают до JT=0C в течение 60 мин. 23. Суспензию фильтруют на фильтре-осушителе за несколько минут. 24. Метанол (11) используют для ополаскивания колбы. Промывочный раствор переносят на фильтр-осушитель. 25. Фильтровальный осадок сушат на роторном испарителе в течение 2 ч при 55C. 26. 143,2 г сырого продукта получают в виде красного твердого вещества. Идентичность устанавливают по 1 Н-ЯМР. Чистота составляет 96,99% а/а по ВЭЖХ. Кроме того, обнаружено 1,02 + 1,26% цисизомеров. Выход (бп.) равен 47,0%. 1 Н-ЯМР обнаруживает около 11,5% ТРРО. Примечания. 1) Первый IPC производят спустя 2,5 ч. Указанный контроль свидетельствует о полном расходовании альдегида и дополнительном образовании цис-изомера. При взаимодействии соотношение изомеров со временем улучшается. Подготовка пробы. Точное количество исходного материала несколько меньше, чем указано,поскольку вторая порция (46 г) содержит согласно 1 Н-ЯМР около 11,5% ТРРО. Методика. 1. Колбу вакуумируют и продувают азотом. 2. В колбу загружают соединение Е (1) при JT=20C. 3. Этанол (2) и 30% NaOH (3) загружают в колбу при JT=20C. Колбу дважды вакуумируют и продувают азотом. Реакционную смесь нагревают до JT=90C. Получают густую оранжевую суспензию. 4. Суспензию перемешивают при JT=90C в течение 47 ч (IT около 77C). 5. Смесь охлаждают до IT=21C в течение 16 ч. Отбирают пробу для IPC. 6. Смесь разбавляют водой (4). 7. Суспензию фильтруют на фильтре-осушителе в течение 50 мин. 8. Холодную воду (5) при 3C используют для ополаскивания колбы и промывания фильтровального осадка. 9. Фильтровальный осадок дополнительно промывают холодной водой (6+7) при 5 и 2C. 10. Фильтровальный осадок сушат на роторном испарителе в течение 20 ч при 55C. 11. 164,9 г TSC получают в виде оранжевого твердого вещества. Идентичность устанавливают по 1 Н-ЯМР. Чистота, установленная по ВЭЖХ, составляет 97,56% а/а. Выход (бп.) равен 92,0%. Установлено содержание воды, равное 1,89 м/м%; УФ-соотношение при 421-254 нм равно 8,42. Анал., вычислено для C20H22O4Na2-0,5H2O-0,2NaOH: C, 61,41; H, 6,03; Na, 12,93; O, 19,63. Найдено: C, 61,5; Н, 6,2; Na, 13,0; О, 19,8. Подготовка пробы. Исходные материалы. Проведен контроль качества исходных материалов (соединения А и D), результаты исследования приведены далее. Все материалы удовлетворяют данным спецификациям (соединение D: 97,0%; соединение А: 94,0%). Кроме того, все материалы получены синтетически, без применения каких-либо животных компонентов или каких-либо компонентов, полученных из животных продуктов. С-10- диаль (соединение А) представляет собой желтый кристаллический порошок. Фосфоран, соединение D, представляет собой порошок цветом от белого до желтого. Идентичность контролируют методом 1H-ЯМР. Синтез соединения Е. Используемый материал представляет собой смесь солей, содержащую 48% бромида и 52% хлорида согласно СоА поставщика. Таким образом, реальная масса отличается от теоретической массы, как указано в композиционной схеме. Методика. 1. Реактор на 100 л дважды вакуумируют и продувают азотом. 2. В реактор на 100-л колбу загружают соединение А (1) и соединение D (2) при JT=20C. 3. Бутиленоксид (3) и толуол (4) загружают в реактор при JT=20C. Реактор на 100 л дважды вакуумируют и продувают азотом. Реакционную смесь нагревают до JT=100C. Получают гомогенный раствор. 4. Раствор перемешивают при JT=100C в течение 4 ч (IT составляет около 98C). 5. Раствор концентрируют при слабом вакууме, при JT=110C. Удаляют 9,0 л растворителя. Смесь перемешивают при JT=110C в течение 13 ч (IT составляет около 105C). 6. Смесь разбавляют бутиленоксидом (5) и охлаждают до IT=20C (2,75 ч). Образуется красная суспензия. 7. Отбирают пробу для IPC. 8. Смесь охлаждают до IT=0C (80 мин). 9. Суспензию фильтруют на фильтре-осушителе в течение 100 мин. 10. Охлажденный этанол (6) используют для ополаскивания 100-л реактора. Промывочный раствор переносят на фильтр-осушитель. 11. Фильтровальный осадок промывают метилциклогексаном (7). 12. Фильтровальный осадок сушат на роторном испарителе в течение 4,5 ч при 55C. 13. 5,246 кг сырого продукта получают в виде красного твердого вещества. 1 Н-ЯМР-спектр показывает наличие существенного количества ТРРО (около 25-30%) в дополнение к требуемому продукту. 14. Сырой продукт переносят на фильтр-осушитель и промывают метанолом (8). 15. Фильтровальный осадок сушат на роторном испарителе в течение 19 ч при 55C. 16. 3,787 кг соединения Е получают в виде красного твердого вещества (сырой 31). Идентичность устанавливают по 1 Н-ЯМР. Чистота составляет 93,70% а/а по ВЭЖХ. Кроме того, обнаружено 3,17 + 2,54% цис-изомеров. Выход (бп.) равен 54,1%. 17. Маточный раствор (около 81 л) концентрируют при низком вакууме, при JT=100C. Удаляют 30,0 л растворителя. Смесь перемешивают при JT=110C в течение 12,5 ч (IT составляет около 105C). 18. Смесь разбавляют бутиленоксидом (9) и толуолом (10) и охлаждают до IT=20C (2,75 ч). Образуется красная суспензия. 19. Отбирают пробу для IPC, охлаждают до 0C и фильтруют. 20. Смесь разбавляют бутиленоксидом (11) и толуолом (12), нагревают до JT=60C и вновь охлаждают до JT=20C. 21. Отбирают отфильтрованную пробу и промывают метанолом. 22. Суспензию охлаждают до 1C в течение 60 мин и фильтруют на фильтре-осушителе в течение 60 мин. 23. Фильтровальный осадок промывают метилциклогексаном (13). 24. Фильтровальный осадок дважды промывают метанолом (14+15). 25. Фильтровальный осадок сушат на роторном испарителе в течение 4,5 ч при 55C. 26. 705 г сырого продукта получают в виде красного твердого вещества (сырой 21). Идентичность устанавливают по 1 Н-ЯМР. Чистота составляет 90,01% а/а по ВЭЖХ. Кроме того, согласно ВЭЖХ отмечено 3,83 + 5,34% цис-изомеров. Суммарный выход с учетом поправок равен 63,0%. Примечания. 1) Соотношение изомеров согласно ВЭЖХ приблизительно равно 60:40 транс/цис. Подготовка пробы. Методика. 1. Реактор на 100 л вакуумируют и дважды продувают азотом. 2. В реактор на 100 л загружают соединение Е (1) при JT=20C. 3. Этанол (2) и 30% NaOH (3) загружают в реактор на 100 л при JT=20C. 100-л реактор дважды вакуумируют и продувают азотом. Реакционную смесь нагревают до JT=90C. Получают густую оранжевую суспензию. 4. Суспензию перемешивают при JT=90C в течение 63 ч (IT при 81C). 5. Смесь охлаждают до IT=21C в течение 2 ч. Отбирают пробу для IPC. 6. Смесь разбавляют водой (4). 7. Суспензию фильтруют на фильтре-осушителе в течение 15 ч. 8. Этанол (5) используют для ополаскивания 100-л реактора. 9. Фильтровальный осадок трижды промывают холодной водой (6, 7+8), в пределах 0C-5C. 10. Фильтровальный осадок промывают этанолом (9). 11. Фильтровальный осадок сушат на роторном испарителе в течение 5 ч при 50C. 12. 2,186 кг TSC получают в виде оранжевого твердого вещества. Идентичность устанавливают по 1 Н-ЯМР. Чистота, установленная по ВЭЖХ, составляет 97,96% а/а. Выход (бп.) равен 61,2%; см. примечание 1. Установлено содержание воды, равное 1,58 м/м%, и УФ-соотношение при 421-254 нм равно 8,9. Анал., вычислено для C20H22O4Na2-0,34H2O: С, 63,47; Н, 6,04; Na, 12,15; О, 18,35. Найдено: С, 63,81; Н,5,64; Na, 12,21; О, 18,34. 13. 2,184 кг сырого продукта 11 встряхивают в блендере при комнатной температуре в течение 4 дней. Оставшиеся куски легко размалывают в ступе. Получают 2,183 кг сырого твердого вещества 21 оранжевого цвета (соотв. АА-013329-партия 01-2004). Чистота составляет 98,76%, как определяется ВЭЖХ. Измерение при помощи ДСК не выявляет различий. Примечания. 1) Продукт растворим в воде. Таким образом, длительное время фильтрования, а также дополнительная промывка водой могут приводить к низкому выходу, наблюдаемому в данной конкретной ситуации. Третью промывку водой осуществляют для доведения до требуемой величины содержания натрия в продукте. Подготовка пробы. Интеграционные параметры: нет. Идентификационная таблица для соотнесения ВЭЖХ-кривых самописца: характерные времена удерживания для G-1172 с колонкой LC-0402. УФ-методы. Модифицированная методика для данного синтеза: Пример 3. Синтез транскалийкроцетината (дикалий-2,6,11,15-тетраметилгексадека-2 Е,4 Е,6 Е,8 Е,10 Е,12 Е,14 Егептан-1,16-диотат). Транскалийкроцетинат обозначается также ниже как TPG или соединение F. Химический синтез приведен ниже. Реакцию омыления (последнюю стадию синтеза) осуществляют способом, аналогичным способу,используемому в вышеуказанных примерах 1 и 2. Сложный диэтиловый эфир, соединение Е, получают,как указано выше в примерах 1 и 2. В данном примере соединение Е обрабатывают 30% гидроксидом калия (KOH) (1,5 мл/ммоль) в этаноле (EtOH) (1,5 мл/ммоль) при 90C в течение 4 дней. Смесь разбавляют этанолом, поскольку некоторое количество растворителя теряется в ходе процесса обработки. Оранжевый продукт выделяют фильтрованием при комнатной температуре (22C) и промывают 50% этанолом в воде (3). Продукт сушат на роторном испарителе в течение 5 ч при JT=60C. Указанный способ дает реакционный выход 86%(12 г определено экспериментально). Спектр 1 Н-ЯМР и спектр ЖХ-МС подтверждают, что требуемый продукт представляет собой транскалийкроцетинат. Контроль качества по ВЭЖХ дает 98,3% при использовании метода ВЭЖХ, указанного выше в примере 2, при длине волны детектирования 421 нм. Пример 4. Синтез транслитийкроцетината (дилитий-2,6,11,15-тетраметилгексадека-2 Е,4 Е,6 Е,8 Е,10 Е,12 Е,14 Егептан-1,16-диотат). Транслитийкроцетинат обозначается также ниже как TLC или соединение G. Химический синтез приведен ниже. Реакцию омыления осуществляют способом, аналогичным приведенному в примерах 1-3. В этом случае, однако, в качестве омыляющего агента используют гидроксид лития. В данном примере соединение Е вновь синтезируют, как описано в примерах 1 и 2. Соединение Е обрабатывают 10% гидроксидом лития (LiOH) (2,8 мл/ммоль) в этаноле (EtOH) (1,5 мл/ммоль) при 90C в течение 4 дней. Темнооранжевую суспензию фильтруют при комнатной температуре (22C) и промывают 50% этанолом в воде(3) и чистым этанолом. Темно-оранжевый твердый продукт сушат на роторном испарителе в течение 5 ч при температуре рубашки (JT)=60C. Указанный способ дает 9,5 г темно-оранжевого твердого вещества. Анализом ВЭЖХ данного соединения обнаружено 38% а/а исходного материала, оставшегося в дополнение к требуемому продукту. Значительное количество остаточного исходного материала является,по-видимому, результатом использования менее концентрированного раствора основания (LiOH) в данной реакции омыления. В этом случае, такая концентрация обусловлена ограниченной растворимостьюLiOH в воде, используют лишь 10% раствор LiOH в воде. В других примерах (1-3, описанных здесь) используют 30% раствор основания в воде. В целях повышения реакционного выхода выделенный на предыдущей стадии продукт обрабатывают твердым LiOH (13 экв.) в 50% EtOH в воде (2,9 мл/ммоль) при 95C в течение еще 2 дней. Оранжевый продукт, полученный в результате указанной второй обработки гидроксидом лития, выделяют фильтрованием при комнатной температуре и промывают 50% EtOH в воде (3) и чистым EtOH. Полученный твердый продукт сушат на роторном испарителе в течение 3 ч при температуре рубашки = 60C. Указанная обработка дает выход продукта 14 г. Поскольку данный выход больше, чем теоретический выход, дополнительно получают суспензию в воде (1,6 мл/ммоль) для удаления избытка LiOH. Оранжевый продукт выделяют фильтрованием при комнатной температуре и промывают 50% EtOH в воде (3) и чистым EtOH. Продукт сушат на роторном испарителе в течение 2 ч при температуре рубашки = 60C. Указанная обработка дает выход 8,5 г, что отвечает общему реакционному выходу 67% (12 г определено экспериментально). Как спектр 1 Н-ЯМР, так и спектр ЖХ-МС подтверждают получение требуемого продукта, транслитийкроцетината. Контроль качества по ВЭЖХ дает 99,7% при использовании метода анализа, описанного в примере 1, и длине волны детектирования 421 нм. Пример 5. Синтез С-14- производного TSC (динатрий-4,9-диметилдодека-2 Е,4 Е,6 Е,8 Е,10 Е-пентан-1,12 диотат). Синтез симметричных соединений с более короткой длиной цепи, чем TSC, требует применения агента Виттига, отличного от соединения В, указанного в примерах 1-4. ВРТС-соединения с более короткой длиной цепи синтезируют, используя соединение А, ранее применяемый С-10- диальдегид. Соединение А подвергают затем превращению или по реакции Хорнера-Эммонса, или по реакции связывание Виттига либо с коммерчески доступным С 2- или C3- фосфонатом, либо с фосфонийбромидом (соединение Н) с образованием соответствующих С 14- и С 16- сложных эфиров соответственно. Гидролиз с помощью NaOH/EtOH завершает взаимодействие, приводя к образованию требуемых С 14- или С 16 производных TSC. Синтез С-1 производного TSC, соединения J, завершают взаимодействием соединения А и соединения Н (этоксикарбонилметилтрифенилфосфонийбромид). Соединения А и Н взаимодействуют с образованием конечного промежуточного соединения I, с последующей стадией омыления, приводящей к получению соединения J, как указано ниже. Реакция связывания с образованием соединения I. Наилучший способ получения соединения I состоит в использовании С 2- фосфонийбромида (соединение Н). Указанную реакцию связывания осуществляют в смеси бутиленоксид/толуол 2:1 (0,7 мл + 1,4 мл/ммоль), используемой в указанных выше примерах 1-4. Результатом является достаточное образование продукта с 3 экв. реагента Виттига при температуре рубашки = 100C. Желтый продукт выделяют фильтрованием при 0C и промывают (дважды) метилциклогексаном. Выход на данной стадии составляет 56-61% (в количестве 10 г). Установлена чистота, равная 83,4% а/а транс-изомера, при использовании ВЭЖХ с длиной волны детектирования 369 нм (11,5 мин). В дополнение к соединению I обнаружено наличие еще трех дополнительных соединений на ВЭЖХ-кривой самописца, предположительно являющихся цис-изомерами соединения I (1,0% а/а, 10,5 мин; 13,4% а/а, 11,2 мин; 2,0% а/а, 11,9 мин). Реакция омыления с образованием конечного продукта (соединение J). Реакцию омыления для превращения соединения I в соединение J осуществляют способом, аналогичным описанному в примерах 1-4. Сложный диэтиловый эфир, соединение I, обрабатывают 30% NaOH(2 мл/ммоль) в EtOH (4 мл/ммоль) при 90C в течение 3 дней. Желтый продукт выделяют фильтрованием при комнатной температуре и промывкой 50% EtOH в воде (5) и чистым EtOH (3). Реакция омыления дает выход сырого продукта около 100%. С целью повышения чистоты смесь суспендируют в 30% NaOH(0,5 мл/ммоль) в EtOH (1 мл/ммоль) при 90C в течение 4 ч. Суспензию фильтруют при 0C и промываютEtOH (3), получая желтый продукт, соответствующий без учета поправок выходу 79% (в количестве 10 г). На основании 1 Н-ЯМР установлено, что требуемый продукт, соединение J, синтезирован с качеством по ВЭЖХ 97,8% при устанавливаемой длине волны детектирования 383 нм. Пример 6. Синтез С-15- производного TSC (динатрий-2,4,9-триметилдодека-2 Е,4 Е,6 Е,8 Е,10 Е-пентаен-1,12 диотат). Соединение А подвергают взаимодействию с соединением K (1-(этоксикарбонил)этилтрифенилфосфонийбромид), C3- фосфониевой солью/C3- бромидом сложного эфира Виттига, получая первое промежуточное соединение в данной реакционной последовательности, соединение М. Альтернативно, на данной первой стадии тот же самый результат может быть достигнут, если соединение А подвергают взаимодействию с соединением L (триэтил-2-фосфонопропионат), C3- сложным фосфоноэфиром, получая промежуточное соединение М. На второй реакции связывания соединение М подвергают взаимодействию с соединением Н(этоксикарбонилметилтрифенилфосфонийбромид), С 2- фосфониевой солью/С 2- бромидом сложного эфира Виттига, получая предпоследнее промежуточное соединение О. Альтернативно, соединение О может быть получено при взаимодействии между соединением М и соединением N (триэтилфосфоноацетат), С 2-сложным фосфоноэфиром. На конечной стадии взаимодействия соединение О подвергают реакции омыления с образованием С-15-, асимметричного производного TSC, соединения Р. Реакционная схема представлена ниже. Для С 15- производного требуется применение двух последовательных различных реакций моносвязывания, первой реакции с C3- сложным фосфоновым эфиром или фосфонийбромидом и второй - с С 2 фосфонийбромидом. По причине образования некоторого количества С 16- сложного диэтилового эфира сырой продукт первой реакции моносвязывания очищают хроматографией на силикагеле. Первая реакция связывания с образованием соединения М. Соединение А обрабатывают 1 экв. С-3- фосфонийбромида (соединение K) при 100C в течение 1 дня. Данную реакцию связывания осуществляют в смеси бутиленоксид/толуол 2:1 (0,7 мл + 1,4 мл/ммоль), отмечается достаточное образование продукта. При охлаждении до комнатной температуры и далее до 0C осадок не образуется. Оранжевую смесь фильтруют затем через силикагель(0,33 г/ммоль). Фильтровальный осадок промывают толуолом (1,7 мл/ммоль). Фильтраты объединяют и упаривают досуха при JT=45C, получая сырой продукт в виде оранжевого масла. Затем реакционную смесь упаривают досуха. Остаток суспендируют в MeOH для получения сырого продукта в твердой форме и затем промывают MeOH (3). Качество полученного сырого продукта плохое по причине наличия С 16- сложного диэтилового эфира в дополнение к требуемому С 13- продукту моносвязывания, соединению М. Поэтому осуществляют стадию очистки на силикагеле, используя смесь 10:1 метилциклогексан/EtOAc. Сырой продукт растворяют в дихлорметане (0,3 мл/ г сырого продукта). С-16- сложный диэтиловый эфир (около 7%) является первым элюируемым соединением. После осуществления данной стадии выход составляет 45% (20 г определено экспериментально). На малом масштабе выходы достигают до 70%. Установлено, что продукт наилучшего качества содержит 98,1% а/а трансизомера при длине волны детектирования 383 нм (9,22 мин). Присутствует дополнительное соединение(1,7% а/а, 9,47 мин), которое предположительно является цис-изомером соединения М. Вторая реакция связывания с образованием соединения О. Соединение М обрабатывают 1,5 экв. С-2- фосфонийбромида (соединение Н) при 100C. Данную реакцию связывания осуществляют в смеси бутиленоксид/толуол 2:1 (0,5 мл + 1,0 мл/ммоль), и отмечается достаточное образование продукта. Желтый продукт выделяют фильтрованием при 0C и дважды промывают метилциклогексаном. Выход на данной стадии составляет 36%. В целях увеличения выхода маточный раствор концентрируют приблизительно до половины исходного объема и охлаждают до 0C, получая продукт второго сбора с выходом 27%. Общий выход объединенного продукта обоих сборов составляет 63% (в количестве 13 г). Установлено, что продукт наилучшего качества (соединение О) содержит 87,0% а/а транс-изомера при длине волны детектирования 383 нм (12,4 мин). Вдобавок, второе соединение отмечено на ВЭЖХкривой самописца (11,3% а/а, 11,8 мин), являющееся, по-видимому, цис-изомером соединения О. Реакция омыления с образованием конечного продукта (соединение Р). Сложный диэтиловый эфир, соединение О, обрабатывают 30% NaOH (2 мл/ммоль) в EtOH(4 мл/ммоль) при 90C в течение 3 дней. Зеленовато-желтый продукт выделяют фильтрованием при комнатной температуре и промывают 50% EtOH в воде (5) и EtOH (3). Реакция омыления дает выход 83%(в количестве 6 г). 1 Н-ЯМР-эксперимент подтверждает наличие требуемого продукта, соединения Р. Контроль качества по ВЭЖХ дает 97,0% соединения Р при длине волны детектирования 383 нм. Вдобавок, отмечены другие возможные цис-изомеры, соответствующие 1,4% а/а + 1,2% а/а. ЖХ-МС-данные подтверждают данную структуру. Пример 7. Синтез С-16- производного TSC (динатрий-2,4,9,11-тетраметилдодедека-2 Е,4 Е,6 Е,8 Е,10 Е-пентаен 1,12-диотат). Соединение А подвергают взаимодействию с соединением L (триэтил-2-фосфонопропионат), C3 сложным фосфоноэфиром, что приводит к образованию особо важного промежуточного соединения для данного синтеза, соединения Q. Альтернативно, соединение Q может быть получено при взаимодействии между соединением А и соединением K (1-(этоксикарбонил)этилтрифенилфосфонийбромид), C3- фосфониевая соль/C3- бромид сложного эфира Виттига. Хотя исходные реагенты (соединения А, K и L) те же самые, что предусмотрены в примере 6, используемые здесь реакционные условия приводят к другому, симметричному промежуточному соединению, соединению Q. На последней стадии реакции соединение Q подвергают взаимодействию с гидроксидом натрия и этанолом по реакции омыления, приводящей к образованию конечного продукта, соединения R. Соединение R (динатрий-2,4,9,11-тетраметилдодедека-2 Е,4 Е,6 Е,8 Е,10 Е-пентаен-1,12-диотат) является С-16-,симметричным производным TSC. Реакционная схема приведена ниже. Реакция связывания с образованием соединения Q (использование соединения L в качестве реагента). Синтез С 16- производного (соединение R) начинают совершенно аналогично синтезу, указанному в примере 6, с реакции связывания между соединением А и соединением L. Соединение А обрабатывают соединением L при 100C в смеси толуол/бутиленоксид 2:1. Химическое взаимодействие не наблюдается без добавления основания и в этом случае смесь охлаждают до 0C и добавляют NaOMe (3 экв.). К реакционной смеси добавляют вторую порцию реагента, полученного из С-3- сложного фосфоноэфира (21,5 экв.) и NaOMe в двойном количестве DCM. Смесь перемешивают при JT=65C и получают более высокий процент требуемых продуктов. ВЭЖХ-кривые самописца показывают, что только небольшой процент непрореагировавшего соединения А остается (2,3% а/а). Реакционную смесь гасят водой и органическую фазу промывают раствором, содержащим воду, насыщенный раствор NaHCO3 и 50% насыщенный раствор NaCl. В результате, после выпаривания, получают 36,4 г соединения Q. Очистку соединения Q выполняют, используя силикагель и смесь 10:1 метилциклогексан/EtOAc. В результате получают 0,26 г светло-желтого продукта (соединение Q) и 4,0 г желтого твердого вещества(соединение М). Продукт переэтерификации, соединение Q (сложный диметиловый эфир вместо сложного диэтилового эфира), выделяют с выходом 32%, используя MeOH в качестве растворителя. Спиртовый растворитель также является подходящим для реакции связывания. В целом, качество продукта на данной стадии превосходное, при чистоте 85,7%. ВЭЖХ-эксперименты показывают, что преобладающее большинство примесей составляют цис-изомеры соединения Q. Реакция связывания с образованием соединения Q (применение соединения K в качестве реагента). Во втором эксперименте по крупномасштабному получению соединения Q в реакции связывания соединение L заменяют соединением K. Указанная замена приводит к большей суммарной реакционной конверсии. Реакцию связывания между соединением А и соединением K проводят в смеси бутиленоксид/толуол 2:1 (0,9 мл + 1,8 мл/ммоль), установлено достаточное образование продукта с 3 экв. реагента Виттига при JT=100C (22 ч). Желтый продукт выделяют фильтрованием при 0C и дважды промывают метилциклогексаном. Выход равен 61-62% (в количестве 10 г). ВЭЖХ-анализ подтверждает чистоту соединения Q при 85,2% а/а транс-изомера, 369 нм (13,3 мин), при этом основной примесью является цисизомер. Реакция омыления с образованием конечного продукта (соединение R). Реакцию омыления с образованием соединения R осуществляют способом, аналогичным описанному в примере 5. Сложный диэтиловый эфир (соединение Q) обрабатывают 30% NaOH (2 мл/ммоль) вEtOH (4 мл/ммоль) при 90 С в течение 3 дней. Омыление дает выход 85% (в количестве 12,5 г), после фильтрования при комнатной температуре и промывки 50% EtOH в воде (3) и EtOH (3). 1 Н-ЯМР подтверждает, что требуемый продукт представляет собой соединение R. Контроль качества по ВЭЖХ дает 95,7% при длине волны детектирования 383 нм. Кроме того, обнаружено 3,8% цис-изомера. ЖХ-МСданные подтверждают данную структуру. Пример 8. Синтез С-17- производного TSC (динатрий-2,6,11-триметилтетрадека-2 Е,4 Е,6 Е,8 Е,10 Е,12 Е-гексаен 1,14-диотат). Получение длинноцепного, асимметричного производного TSC осуществляют, используя соединения А и D в качестве исходных материалов, как в примерах 1-2. Однако, в данном случае, реакционные условия изменяют, чтобы способствовать образованию первого промежуточного соединения связывания,соединения S. Соединение S затем подвергают взаимодействию во второй реакции связывания с соединением Н, что приводит к образованию соединения Т. На конечной стадии данной реакционной последовательности соединение Т подвергают реакции омыления с гидроксидом натрия и этанолом, что дает конечный, требуемый продукт, соединение U. Соединение U является С-17- производным TSC и асимметричным по расположению боковых метильных групп относительно диеновой основной цепи. Подробная схема синтетической последовательности приведена ниже. Первая реакция связывания с образованием соединения S. Соединение А обрабатывают 1 экв. соединения D при 100C в течение 1 дня. Данную реакцию связывания осуществляют в смеси бутиленоксид/толуол 2:1 (0,44 мл + 0,88 мл/ммоль), используемой в примере 1 и приводящей к достаточному образованию продукта. Во время последующей стадии охлаждения до 0C из исходного темно-красного раствора образуется суспензия. В конечном счете красно-оранжевое твердое вещество выделяют фильтрованием при 0C и промывке метилциклогексаном (3). Указанное красно-оранжевое твердое вещество идентифицировано как соединение Е, ранее описанное в примерах 1-4. Выход соединения Е в данном случае составляет около 4%. Маточный раствор от вышеуказанной стадии упаривают досуха при JT=45C, получая сырой продукт-соединение S в виде красного масла. Качество полученного сырого продукта низкое по причине наличия некоторого количества соединения Е в дополнение к требуемому продукту, соединению S. С целью выделения соединения S осуществляют стадию очистки на силикагеле с применением смеси 8:1 метилциклогексан/EtOAc. Для этого сначала растворяют сырой продукт в дихлорметане (0,3 мл/г сырого продукта), получая сольват. Первым элюируемым из указанной смеси продуктом является С-20- сложный диэтиловый эфир (соединение Е). Остающаяся фракция содержит смесь соединений, включая требуемое соединение S. Выход оранжевого, твердого вещества на данной стадии составляет 46% (30 г определено экспериментально). Контроль качества (по ВЭЖХ) дает 71,2% а/а транс-изомера при длине волны детектирования 369 нм (10,4 мин). Кроме того, идентифицированы два дополнительных соединения 0% а/а + 4,9% а/а), являющиеся, по-видимому, цис-изомерами соединения S. Вторая реакция связывания с образованием соединения Т. Соединение S подвергают взаимодействию с 1,5 экв. соединения Н при 100C. Данную реакцию связывания осуществляют в смеси бутиленоксид/толуол 2:1 (0,6 мл + 1,2 мл/ммоль), отмечено достаточное образование продукта. Красный продукт, соединение Т, выделяют фильтрованием при 0C и дважды промывают метилциклогексаном. Выход равен 58% (в количестве 10 г). Контроль качества дает 97,2% а/а транс-изомера при длине волны детектирования 421 нм (14,2 мин). Кроме того, обнаружены два других соединения, предположительно, цис-изомеры соединения Т. Реакция омыления с образованием соединения U. Реакцию омыления осуществляют совершенно аналогично примерам 1-4. Соединение Т обрабатывают 30% NaOH (2 мл/ммоль) в EtOH (2 мл/ммоль) при 90C в течение 4 дней. Спустя 2 дня смесь разбавляют водой (1 мл/ммоль). Желтый продукт, соединение U, выделяют фильтрованием при комнатной температуре и промывают 50% EtOH в воде (2) и EtOH (3). Реакция омыления дает выход 93% (в количестве 7 г). На основании 1 Н-ЯМР установлено, что требуемый продукт представляет собой соединение U. Контроль качества по ВЭЖХ дает 97,8% при длине волны детектирования 399 нм, обнаружена одна основная примесь на уровне 0,7%. Пример 9. Синтез С-18- производного TSC (динатрий-2,4,9,13-тетраметилтетрадека-2 Е,4 Е,6 Е,8 Е,10 Е,12 Егексаен-1,14-диотат). С-18- производное TSC, соединение W, получают двумя последовательными реакциями моносвя- 29
МПК / Метки
МПК: C07C 59/185
Метки: лечения, транскаротиноидов, композиция, фармацевтическая, основе, способы, опухоли
Код ссылки
<a href="https://eas.patents.su/30-17982-farmacevticheskaya-kompoziciya-na-osnove-transkarotinoidov-i-sposoby-lecheniya-opuholi.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция на основе транскаротиноидов и способы лечения опухоли</a>
Предыдущий патент: Способ выявления источника синхронных колебаний
Следующий патент: Дейтерированные производные катехоламина и лекарственные средства, содержащие указанные соединения
Случайный патент: Одноразовый кишечный интубатор с дренажом и ирригатором