Выделенные, по существу очищенные, поверхностные антигены белковой природы neisseria meningitidis и neisseria gonorrhoeae, их фрагменты и последовательности днк
Номер патента: 1789
Опубликовано: 27.08.2001
Авторы: Хамел Хосе, Риу Клеман, Бродор Бернар Р., Мартэн Денис
Формула / Реферат
1. Выделенный, по существу очищенный, высокоустойчивый к протеиназе K поверхностный антиген белковой природы Neisseria meningitidis мол. массы 22 кДа, определенной методом гель-электрофореза в полиамидном геле, иммунологически доступный в клетках более чем 50%, в частности примерно 99%, известных штаммов N. meningitidis, или выделенный, по существу очищенный, высокоустойчивый к протеиназе K поверхностный антиген белковой природы Neisseria gonorrhoeae мол. массы 22 кДа, определенной методом гель-электрофореза в полиамидном геле.
2. Поверхностный антиген белковой природы N. meningitidis по п.1, отличающийся тем, что его иммунологическая доступность в клетках штамма определяется при использовании агглютинационного теста, ELISA, радиоиммунологического теста, иммуноблоттинга, дот-энзим теста, теста на поверхностную доступность или комбинацию данных тестов.
3. Поверхностный антиген белковой природы N. meningitidis по п.1, отличающийся тем, что он иммунологически доступен в клетках штамма 608В N. meningitidis и имеет следующую аминокислотную последовательность:
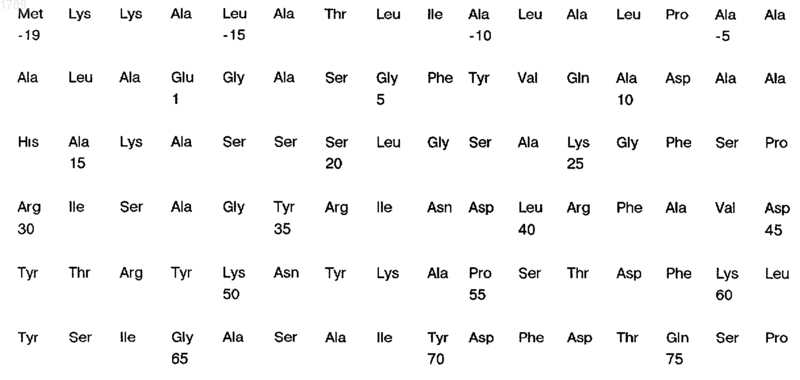

(SEQ ID NO:2).
4. Выделенный, по существу очищенный, поверхностный антиген белковой природы N. meningitidis по п.1, отличающийся тем, что он иммунологически доступен в клетках штамма МСН88 N. meningitidis и имеет следующую аминокислотную последовательность:
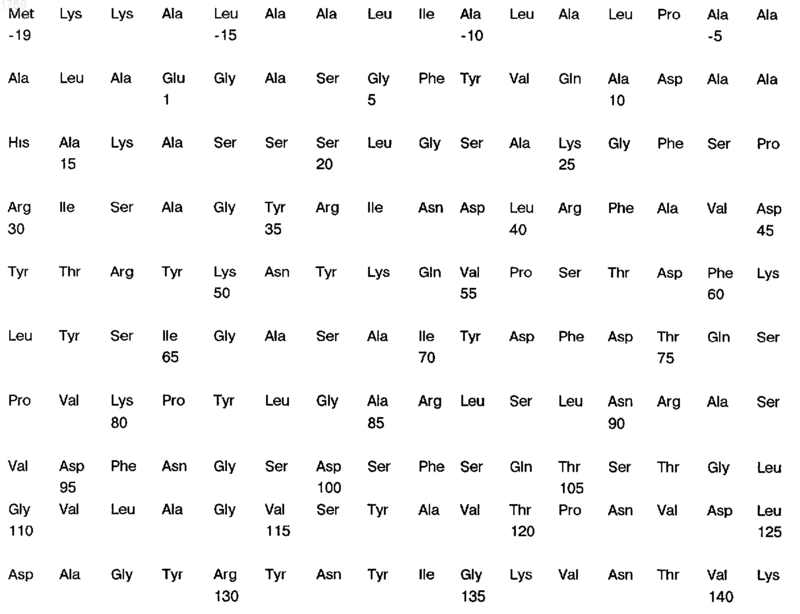
![]()
(SEQ ID NO:4).
5. Выделенный, по существу очищенный, поверхностный антиген белковой природы N. meningitidis по п.1, отличающийся тем, что он иммунологически доступен в клетках штамма Z4063 N. meningitidis и имеет следующую аминокислотную последовательность:
(SEQ ID NO:6).
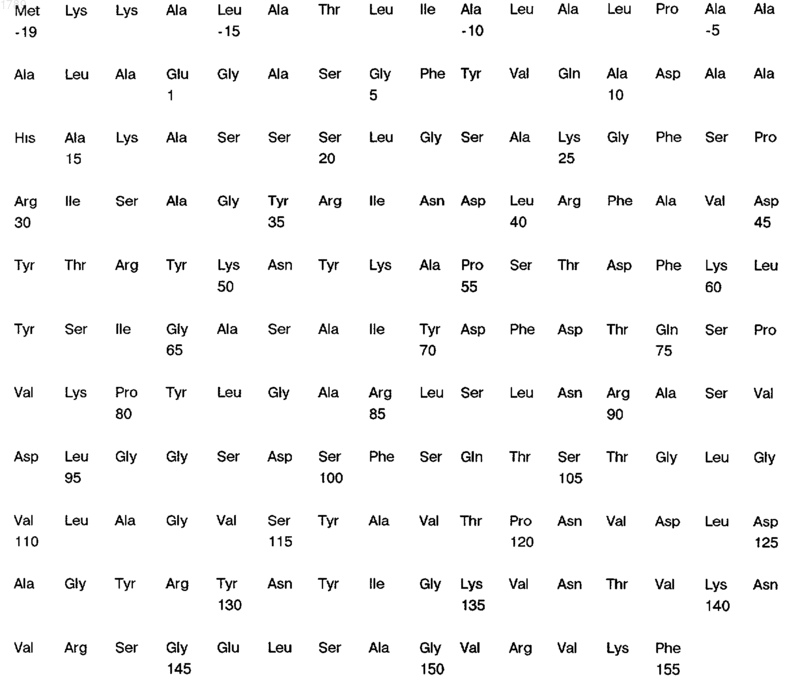
6. Выделенный, по существу очищенный, поверхностный антиген белковой природы N. gonorrhoeae по п.1, отличающийся тем, что он иммунологически доступен в клетках штамма b2 N. gonorrhoeae и имеет следующую аминокислотную последовательность:
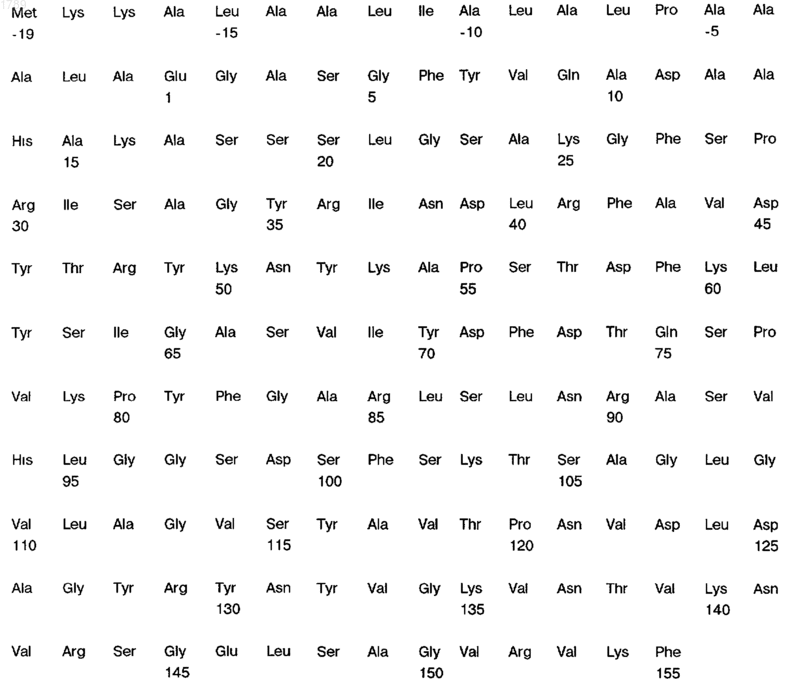
(SEQ ID NO:8).
7. Фрагмент антигена по любому из пп.1-6, обладающий иммунологической активностью данного антигена.
8. Последовательность ДНК, кодирующая антиген или фрагмент антигена по любому из пп.1-7, выбранная из группы, включающей:
а) последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме 608В Neisseria meningitidis, которая имеет следующую последовательность нуклеотидов:
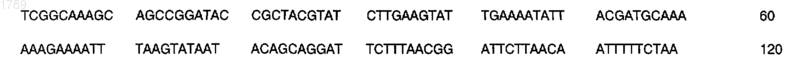
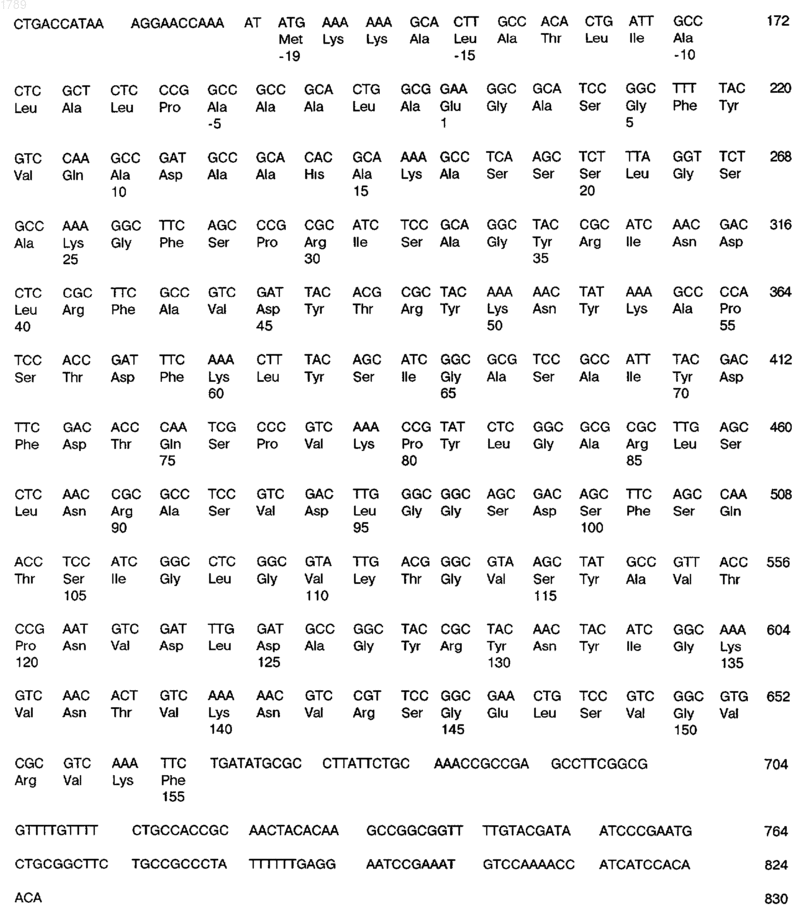
(SEQ ID No:1),
б) последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме МСН88 Neisseria meningitidis, которая имеет следующую последовательность нуклеотидов:
![]()
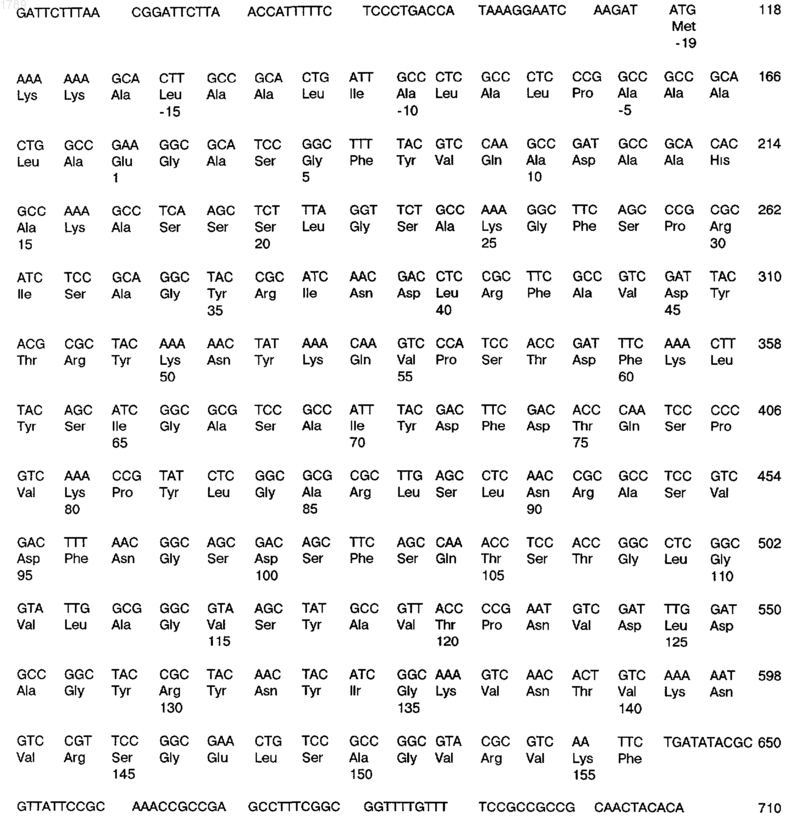
(SEQ ID No:3),
в) последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме Z4063 Neisseria meningitidis, которая имеет следующую последовательность нуклеотидов:

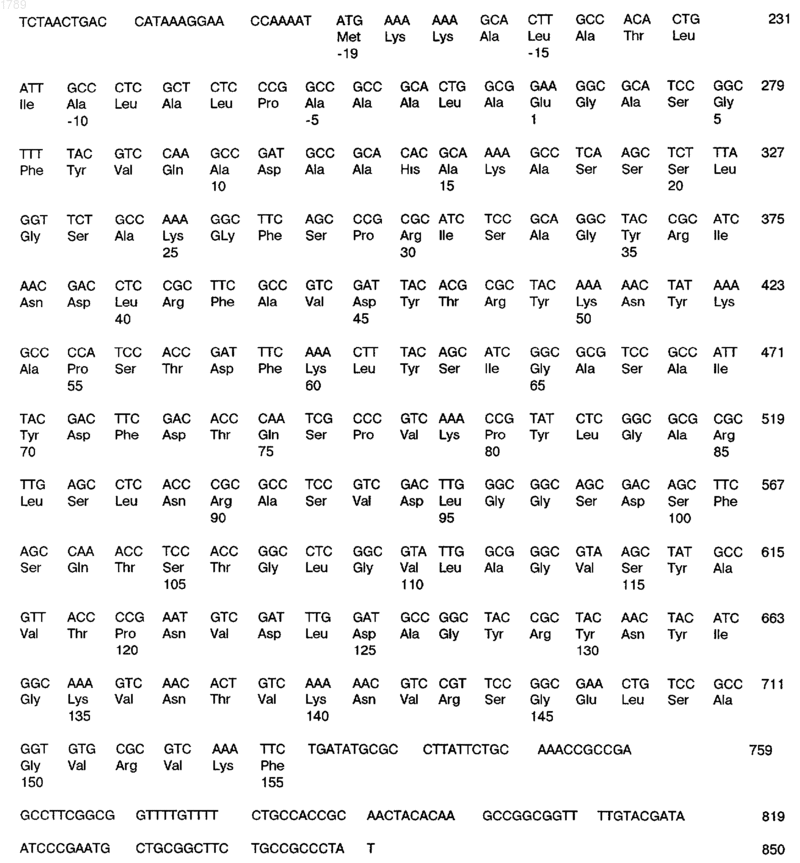
(SEQ ID No:5),
г) последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме b2 Neisseria gonorrhoeae, которая имеет следующую последовательность нуклеотидов:

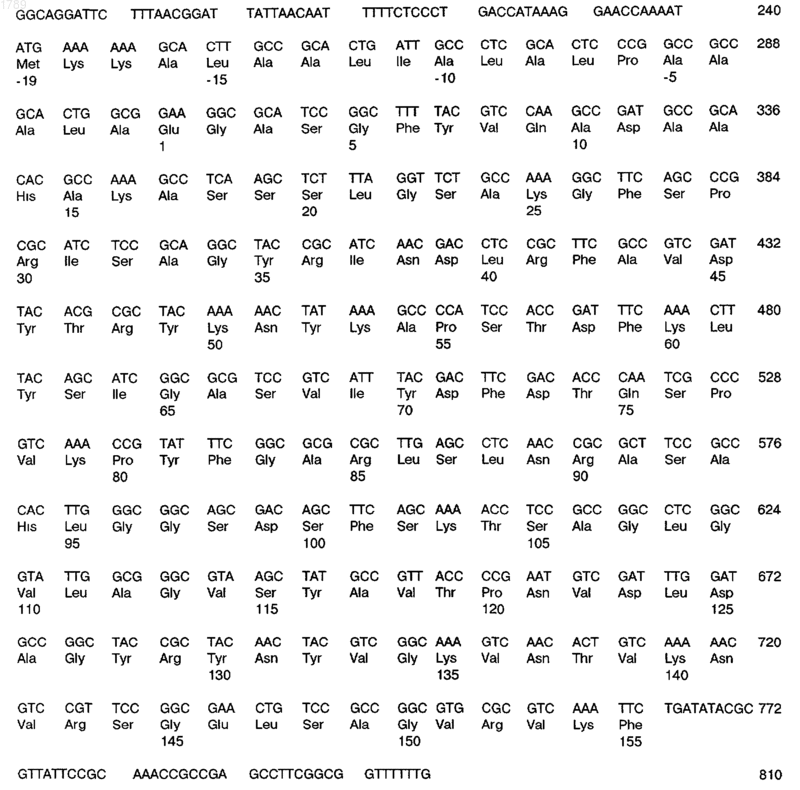
(SEQ ID No:7).
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к высококонсервативным иммунологически доступным антигенам на поверхности организмовNeisseria meningitidis и Neisseria gonorrhoeae и фрагментам антигенов. Эти уникальные антигены обеспечивают возможность разработки новых иммунотерапевтических, профилактических и диагностических агентов, применяемых для лечения, предотвращения и диагностики заболеваний, вызываемых Neisseria meningitidis и Neisseria gonorrhoeae. В частности, настоящее изобретение относится к высокоустойчивому к протеиназе К поверхностному белку Neisseriameningitidis и к высокоустойчивому к протеиназе К поверхностному белку Neisseria gonorrhoeae, имеющим молекулярную массу 22 кДа, и к соответствующим нуклеотидной и выведенной на ее основе аминокислотной последовательностям (от SEQ ID NO:1 до SEQ ID NO:26). Уровень техникиNeisseria meningitidis является одной из основных причин заболеваемости и смертности в мире. Neisseria meningitidis вызывает как эндемические, так и эпидемические заболевания, в основном менингит и менингококцемию [Gold,Evolution of meningococcal desease, p.69, VedrosN.A. CRC Press (1987); Schwartz et al., Clin. Microbiol. Rev., 2, p. S118 (1989)]. После Haemophilis influenzae типа b данный организм служит одной из главных причин бактериального менингита в США, вызывая приблизительно 20% случаев. Достоверно показано, что сывороточная бактерицидная активность является главным защитным механизмом против Neisseria meningitidis и что защита против бактериальной инвазии коррелирует с наличием в сыворотке антименингококковых антител [Goldschneider et al.,J. Exp. Med. 129, р. 1307 (1969); Goldschneider etNeisseria meningitidis подразделяют на серологические группы по наличию капсулярных антигенов. В настоящее время различают 12 серогрупп, из которых серогруппы А, В, С, Y иW-135 распространены наиболее широко. По белкам внешней мембраны и липополисахаридам внутри серогрупп могут быть идентифицированы серотипы, субтипы и иммунотипы[Frasch et al., Rev. lnfect. Dis. 7, p.504 (1985)]. Имеющиеся сегодня вакцины на основе капсулярных полисахаридов эффективны против далеко не всех изолятов Neisseria meningitidis и не вызывают эффективного образования защитных антител у маленьких детей [Frasch,Clin. Microbiol. Rev. 2, p.S134 (1989); Reingold etand Levine, New generation vaccines, p.325, Marcel Dekker Inc. N.Y. (1990)]. В настоящее время в производстве вакцин против данного микроорганизма применяют капсулярные полисахариды серогрупп А, В, С, Y и W-135. Данные 2 полисахаридные вакцины эффективны в течение короткого времени, у вакцинированных пациентов не происходит развития иммунологической памяти и для поддержания определенного уровня устойчивости их необходимо ревакцинировать в течение трех лет. Кроме того, указанные полисахаридные вакцины не индуцируют образования такого количества бактерицидных антител у детей моложе двух лет, которое достаточно для обеспечения желаемой защиты. А именно, дети этого возраста становятся основными жертвами данной инфекции. Не существует эффективной вакцины против изолятов серогруппы В, при том что эти микроорганизмы являются главными возбудителями менингококковых инфекций в развивающихся странах. Очевидно, полисахарид серогруппы В не может служить хорошим иммуногеном, индуцируя слабый непротективный ответ на основе антител IgM низкой специфичности [Gotschlich et al., J. Exp. Med., 129,p.1349 (1969); Skevakis et al., J. Infect. Dis., 149,p.387 (1984); Zollinger et al., J. CIin. Invest., 63,p.836 (1979)]. Кроме того, присутствие весьма сходных, перекрестно-реагирующих структур в гликопротеинах, обнаруживаемых в тканях неонатального мозга [Finne et al., Lancet, p.355(1983)] может свести на нет попытки усовершенствовать иммуногенность полисахарида серогруппы В. Для получения более эффективных вакцин изучают другие поверхностные антигены Neisseria meningitidis, такие как липополисахарид,белки фимбрий и белки, представленные на внешней мембране. Было показано развитие иммунного ответа и наличие бактерицидных антител к некоторым из указанных поверхностных антигенов в сыворотках иммунизированных добровольцев и переболевших пациентовMicrobiol., 25, p.1349 (1987)]. Кроме того, моноклональные антитела к наружным мембранным белкам, таким как белки класса 1, 2/3 и 5, также обладaют бактерицидными свойствами и предотвращают развитие экспериментальной инфекции и животных [Brouder et al., Infect. Immun., 50, р.510(1989)]. Было показано, что антигенные препараты,основанные на белках внешней мембраны Neisseria meningitidis, обладают иммуногенностью у животных и людей и некоторые из этих препаратов были проверены в клинических испытаниях [Bjune et al., Lancet, p.1093 (1991); Costa etal., NIPH Annals, 14, p.211 (1991)]. Однако значительная внутриштаммовая антигенная вариабельность белков внешней мембраны может ограничить их применение в качестве вакцин[Frasch, Clin.Microb., Rev.2, p.S134 (1989)]. Действительно, применение большинства указанных препаратов приводит к образованию бактерицидных антител, направленных против того же самого или родственного серотипа, из которого был экстрагирован антиген [Zollinger, inWoodrow and Levine, New generation vaccines,p.325, Marcel Dekker Inc. N.Y. (1990)]. Кроме того, защита, обеспечиваемая данными вакцинами у маленьких детей, еще нуждается в подтверждении. Высококонсервативные белки внешней мембраны Neisseria meningitidis, такие как белок класса 4 [Munkley et al., Microb.Pathogen., 11, p.447 (1991)] и lip-белок (называемый также Н.8) [Woods et al., Infect. Immun.,55, p.1927 (1987)] не являются перспективными для разработки вакцин, поскольку они не генерируют образования бактерицидных антител. Для совершенствования подобных вакцинных препаратов необходимы высококонсервативные белки, которые были бы представлены на поверхности бактерий Neisseria meningitidis всех штаммов и были бы способны индуцировать образование бактерицидных антител, что смогло бы обеспечить возможность разработки вакцины широкого спектра. В настоящее время в лабораторной диагностике Neisseria meningitidis обычно используют окрашивание мазков по Граму, латексную агглютинацию или коагглютинацию, а также выделение возбудителя в культуре на обогащенных и селективных средах [Morello et al., in(1991)]. Для подтверждения идентификации изолятов Neisseria meningitidis обычно проводят анализы на деградацию углеводов. Большинство из описанных методов являются трудоемкими,длительными и требуют квалифицированного персонала. Для быстрой идентификации Neisseria meningitidis используют коммерческие наборы для агглютинации и коагглютинации, которые содержат поливалентные сыворотки против капсульных антигенов, экспрессируемых бактериями преобладающих серогрупп. Однако эти поливалентные сыворотки часто неспецифически перекрестно реагируют с другими видами 4 бактерий и потому должны использоваться только в сочетании с окрашиванием по Граму и культивированием. Следовательно, имеется потребность в эффективных альтернативах существующим диагностическим методам, которые позволили бы повысить надежность и скорость диагностики. Сущность изобретения Настоящее изобретение позволяет решить описанную выше проблему, и предлагает выделенный, по существу очищенный, высокоустойчивый к протеиназе К поверхностный антиген белковой природы Neisseria meningitidis мол. массы 22 кДа, определенной методом гельэлектрофореза в полиамидном геле, который иммунологически доступен в клетках более, чем 50%, в частности, примерно 99% известных штаммов N. meningitidis, и выделенный, по существу очищенный, высокоустойчивый к протеиназе К поверхностный антиген белковой природы Neisseria gonorrhoeae мол. массы 22 кДа, определенной методом гель-электрофореза в полиамидном геле. Указанные антигены характеризуются аминокислотными последовательностями SEQID No 2, SEQ ID No 4, SEQ ID No 6 и SEQ ID No 8. Другим объектом изобретения являются фрагменты указанных выше антигенов, обладающие иммунологической активностью данных антигенов. Следующим объектом изобретения является последовательность ДНК, кодирующая указанный антиген или его фрагмент, выбранная из группы, включающей последовательность ДНК,кодирующую антиген или фрагмент антигена,иммунологически доступный в штамме 608 ВNeisseria meningitidis, которая имеет последовательность нуклеотидов SEQ ID No 1, последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме МСН 88 Neisseria meningitidis,которая имеет последовательность нуклеотидовSEQ ID No 3, последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме Z4063 Neisseria meningitidis, которая имеет последовательность нуклеотидов SEQ ID No 5 и последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме b2 Neisseria gonorrhoeae, которая имеет последовательность нуклеотидов SEQ IDNo 7. Главным антигеном является 22 кДа поверхностный белок Neisseria meningitidis, а также его фрагменты, аналоги и производные. Основными антителами являются моноклональные антитела Ме-1 и Ме-7, специфичные к 22 кДа поверхностному белку Neisseria meningitidis. Данные антитела высокобактериолитичны по отношению к Neisseria meningitidis и пассивно защищают мышей против экспериментальной инфекции. 5 Данное изобретение также относится к способам выделения новых поверхностных антигенов Neisseria meningitidis, а также к способам получения специфичных по отношению к ним антител. Перечень фигур чертежей Фиг. 1 - приведены нуклеотидная и выведенная на ее основе аминокислотная последовательности 22 кДа поверхностного белка Neisseria meningitidis штамма 608 В (SEQ ID NO:1;SEQID NO:2). Для обозначения аминокислот использованы принятые трехбуквенные символы. Открытая рамка считывания простирается от стартового кодона в положении основания 143 до стоп-кодона в положении основания 667. Прямоугольником отмечен предполагаемый сайт связывания рибосом, а предполагаемая -10 промоторная последовательность подчеркнута. 19-ти аминокислотный сигнальный пептид также подчеркнут. Фиг. 2 - приведена фотография окрашенного Кумасси синим 14% SDS-PAGE геля, в котором проводили разделение обработанных-химотрипсином и трипсином препаратов внешних мембран Neisseria meningitidis штамма 608 В (В:2 а:Р 1.2). На полосе 1 представлены следующие маркеры молекулярного веса: фосфорилаза b (97 000); бычий сывороточный альбумин (66 200); овальбумин (45 000); карбонильная ангидраза (31 000); соевый ингибитор трипсина (21 500); и лизоцим (14 400). Полоса 2 содержит контрольный нерасщепленный препарат внешних мембран. Полоса 3 содержит препарат, обработанный -химотрипсином (2 мг фермента на мг белка); полоса 4 содержит препарат, обработанный трипсином. Фиг. 3 а - приведена фотография окрашенного Кумасси синим 14% SDS-PAGE геля, в котором проводили разделение обработанных протеиназой К препаратов внешних мембранNeisseria meningitidis штамма 608 В (В:2 а:Р 1.2). Полосы 1, 2, 5 и 7 содержат необработанный контроль. Полосы 2, 4, 6 и 8 содержат препараты внешних мембран, обработанные протеиназой К (2 IU на мг белка). Полосы с 1 по 4 содержат препараты, обработанные при рН 7,2. Полосы с 5 по 8 содержат препараты, обработанные при рН 9,0. Полосы 1, 2, 5 и 6 содержат препараты, обработанные без SDS. Полосы 3, 4,7 и 8 содержат препараты, обработанные в присутствии SDS. Маркеры молекулярного веса показаны слева (в килодальтонах). Фиг. 3b. Приведена фотография окрашенного Кумасси синим 14% SDS-PAGE геля, на которой даны миграционные профили аффинно очищенного рекомбинантного 22-кДа белка. На полосе 1 представлены следующие маркеры молекулярного веса: фосфорилаза b (97 000); бычий сывороточный альбумин (66 200); овальбумин (45 000); карбонильная ангидраза (31 000); соевый ингибитор трипсина (21 500); и 6 лизоцим (14 400). Полоса 2 содержит 5 мкг контрольного аффинноочищенного рекомбинантного 22-кДа белка. Полоса 3 содержит 5 мкг аффинно очищенного рекомбинантного 22-кДа белка, прогрето при 100 С 5 мин. Полоса 4 содержит 5 мкг аффинноочищенного рекомбинантного 22-кДа белка, прогретого при 100 С 10 минут. Полоса 5 содержит 5 мкг аффинноочищенного рекомбинантного 22-кДа белка, прогретого при 100 С 15 мин. Фиг. 4 - приведена фотография окрашенных Кумасси синим 14% SDS-PAGE гелей и соответствующих Вестерн-иммуноблотов, демонстрирующих реактивность моноклональных антител, специфичных к 22-кДа поверхностному белку Neisseria meningitidis. Препараты внешних мембран Neisseria meningitidis штамма 608 В (В:2 а:Р 1.2) (А) - необработанные; (В) обработанные протеиназой К (2 IU на мг белка). Полоса 1 содержит маркеры молекулярного веса и характерный миграционный профиль препаратов внешних мембран в 14% SDS-PAGE. Полоса 2 содержит Ме-2; Полоса 3 содержит Ме-3; Полоса 4 содержит Ме-5; Полоса 5 содержит Ме-7 и полоса 6 содержит контрольные посторонние моноклональные антитела. Использованы следующие маркеры молекулярного веса: фосфорилаза b (97 000); бычий сывороточный альбумин (66 200); овальбумин (45 000); карбонильная ангидраза (31 000); соевый ингибитор трипсина (21 500); и лизоцим (14 400). Приведенные на фиг. 4 результаты иммуноблоттинга для моноклональных антител Ме-2, Ме-3,Ме-5, Ме-6 и Ме-7 совпадают с результатами иммуноблоттинга для антител Ме-1. Фиг. 5 - является графическим изображением связывающей активноcти моноклональных антител с интактными бактериальными клетками. Данные для репрезентативных моноклональных антител Ме-5 и Ме-7 приведены в импульсах в минуту ("СРМ") на вертикальной оси. На горизонтальной оси приведены различные бактериальные штаммы, использованные в тесте. В качестве отрицательного контроля использовали моноклональное антитело, специфичное к порину Haemophilus influenzae. Отмечен фоновый счет менее 500 СРМ и данную величину вычитали из значений связывания. Фиг. 6 - приведена фотография окрашенных 14% SDS-PAGE гелей и соответствующих Вестерн-иммуноблотов, демонстрирующих очистку рекомбинантного 22-кДа поверхностного белка Neisseria meningitidis из концентрированного культурального супернатанта Escherichiacoli штамма BL21 (DE3). Фиг. 6 А является фотографией окрашенного Кумасси синим и серебром 14% SDS-PAGE геля. На полосе 1 представлены следующие маркеры молекулярного веса: фосфорилаза b (97 000); бычий сывороточный альбумин (66 200); овальбумин (45 000); карбонильная ангидраза(31 000); соевый ингибитор трипсина (21 500); и 7 лизоцим (14 400). Полоса 2 содержит препарат внешних мембран Neisseria meningitidis штамма 608 В (В:2 а:Р 1.2) (10 мг). Полоса 3 содержит концентрированный культуральный супернатант Escherichia coli штамма BL21 (DE3) (10 мг). Полоса 4 содержит аффинно очищенный рекомбинантный 22-кДа поверхностный белок Neisseria meningitidis (1 мг). Фиг. 6 В является фотографией окрашенного Кумасси синим и серебром 14% SDS-PAGE геля, в котором разделяли перевары аффинно очищенного рекомбинантного 22-кДа поверхностного белка Neisseria meningitidis -химотрипсином, трипсином и протеиназой К. На полосе 1 представлены следующие маркеры молекулярного веса: фосфорилаза b (97 000); бычий сывороточный альбумин (66 200); овальбумин (45 000); карбонильная ангидраза (31 000); соевый ингибитор трипсина (21 500); и лизоцим (14 400). Полосы 2-5 содержат очищенный рекомбинантный 22-кДа поверхностный белок Neisseria meningitidis (2 мг). Полосы 7-10 содержат бычий сывороточный альбумин (2 мг). Полосы 2 и 7 содержат нерасщепленный белок ("NT"). Полосы 3 и 8 содержат белок, обработанный химотрипсином ("С") (2 мг фермента на мг белка). Полосы 4 и 9 содержат белок, обработанный трипсином ("Т") (2 мг фермента на мг белка). Полосы 5 и 10 содержат белок, обработанный протеиназой К ("К") (2 мг фермента на мг белка). Фиг. 6 С является фотографией Вестерниммуноблота и соответствующего геля с моноклональным антителом Ме-5. Фиг. 7 служит графическим изображением бактерицидной активности очищенных с помощью белка-А моноклональных антител к 22-кДа поверхностному белку Neisseria meningitidis штамма 608 В (В:2 а:Р 1.2). На вертикальной оси приведен процент выживших бaктерий Neisseriameningitidis после обработки различными концентрациями моноклональных антител (показано на горизонтальной оси). Фиг. 8 - приведены нуклеотидная и выведенная на ее основе аминокислотная последовательности 22-кДа поверхностного белка Neisseria meningitidis штамма МСН 88 (SEQ ID NO:3;SEQ ID NO:4). Для обозначения аминокислот использованы принятые трехбуквенные символы. Открытая рамка считывания простирается от стартового кодона в положении основания 116 до стоп-кодона в положении основания 643. Фиг. 9 - приведены нуклеотидная и выведенная на ее оcнове аминокислотная последовательности 22-кДа поверхностного белка Neisseria meningitidis штамма Z4063 (SEQ ID NO:5;SEQ ID NO:6). Для обозначения аминокислот использованы принятые трехбуквенные символы. Открытая рамка считывания простирается от стартового кодона в положении основания 208 до стоп-кодона в положении основания 732. 8 Фиг. 10 - приведены нуклеотидная и выведенная на ее основе аминокислотная последовательности 22-кДа поверхностного белка Neisseria gonorrhoeae штамма b2 (SEQ ID NO:7; SEQID NO:8). Для обозначения аминокислот использованы принятые трехбуквенные символы. Открытая рамка считывания простирается от стартового кодона в положении основания 241 до стоп-кодона в положении основания 765. Фиг. 11 - приведена консенсусная последовательность, выведенная на основе последовательностей ДНК четырех штаммов Neisseria. Отмечены замены и инсерции нуклеотидов, характерные для каждого штамма. Фиг. 12 - приведена консенсусная последовательность, выведенная на основе белковых последовательностей четырех штаммов Neisseria. Отмечены замены и инсерции аминокислотных остатков, характерные для каждого штамма. Фиг. 13 - отражает временной график иммунного ответа кроликов на рекомбинантный 22-кДа белок. Величина ответа выражена в реципрокном ELISA-титре. Кроликам вводили препараты мембран клеток E.coli штаммаJM109, содержащих плазмиду pNP2202 или контрольную плазмиду pWKS30. Развитие специфического гуморального ответа анализировали ELISA с использованием в качестве "покрывающего" антигена препаратов внешних мембран, полученных из Neisseria meningitidis штамма 608 В (В:2 а:Р 1.2). Фиг. 14 - отражает временной график иммунного ответа обезьян Масаса fascicularis (циномолгус) на рекомбинантный 22-кДа белок. Величина ответа выражена в реципрокномELISA-титре. Двум обезьянам вводили соответственно 100 мкг (К 28) и 200 мкг (I276) аффинно очищенного 22-кДа белка при каждой инъекции. Контрольную обезьяну (К 65) иммунизировали по той же схеме введением 150 мкг постороннего рекомбинантного белка. Развитие специфического гуморального ответа анализировали ELISA с использованием в качестве "покрывающего" антигена препаратов внешних мембран, полученных из Neisseria meningitidis штамма 608 В (В:2 а:Р 1.2). Фиг. 15 - приведено графическое изображение синтетических пептидов, описанных в настоящем изобретении. Показано также относительное положение данных пептидов на полноразмерном 22-кДа белке Neisseria meningitidis штамма 608 В (В:2 а:Р 1.2). Фиг. 16 - приведена карта плазмидыpNP2204, которая содержит ген, кодирующий 22-кДа поверхностный белок Neisseria meningitidis; AmpiR, область, определяющую устойчивость к ампициллину; СоlЕ 1, начало репликации; сl857, температурочувствительный репрессор бактериофагаcl857; PL, транскрипционный промотор бактерифага ; Т 1, терминатор 9 транскрипции. Направление транскрипции показано стрелками. ВgIII и ВаmHl-сайты рестрикции, использованные для вставки гена 22 кДа в плазмиду р 629. Сведения, подтверждающие возможность осуществления изобретения При изучении ультраструктуры внешней мембраны Neisseria meningitidis авторы изобретения идентифицировали новый низкомолекулярный белок размером 22 кДа, обладающий уникальными свойствами. Этот белок внешней мембраны оказался высоко устойчивым к жесткой обработке протеолитическими ферментами,такими как протеиназа К, сериновая протеаза,полученная из плесени Tritirachium album. Этот факт представляется весьма удивительным, поскольку устойчивые к протеиназе К белки чрезвычайно редки в силу широкого оптимума рН,высокой активности и низкой специфичности по отношению к пептидным связям данного фермента [Barrett, A.J. and N.D. Rawlings, Biochem.Soc. Transactions (1991) 19: 707-715]. Имеется всего несколько работ, в которых описаны белки прокариотической природы, устойчивые к энзиматической деградации под действием протеиназы К. Устойчивые к протеиназе К белки обнаружены у Leptospira [Nicholson, V.M. andal., Microbiol. Immunol. (1991) 37:311-316; Pruisner, S.B. et al., Proc. Natl. Acad. Sci. USA (1993) 90: 2793-2797]. В настоящей заявке описывается применение данного белка для разработки усовершенствованных способов предотвращения,лечения и диагностики инфекций, вызываемыхNeisseria meningitidis. Один из аспектов изобретения относится к высококонсервативному, иммунологически доступному поверхностному белку Neisseria meningitidis, его фрагментам, аналогам и производным. Как следует из контекста изобретения,"поверхностный белок Neisseria meningitidis" означает любой поверхностный белок NeisseriaNeisseria meningitidis. Белок Neisseria meningitidis, заявленный согласно настоящему изобретению, может быть естественного происхождения или может быть получен путем применения подходов молекулярной биологии, используемых для получения рекомбинантных белков или их фрагментов. Термин "высококонсервативный" означает,что ген поверхностного белка Neisseria meningitidis и сам белок существуют более, чем в 50% известных штаммов Neisseria meningitidis. Предпочтительно, ген и кодируемый им белок существуют более, чем в 99% известных штаммов Neisseria meningitidis. Примеры 2 и 4 описывают методы, которые позволяют проверить 10 многочисленные поверхностные белки Neisseriameningitidis на предмет их "высокой консервативности". Термин "иммунологически доступный" означает, что поверхностный белок Neisseriameningitidis локализуется на поверхности организма и доступен антителам. В примере 2 описаны методы, которые позволяют проверить многообразные различные поверхностные белкиNeisseria meningitidis на предмет их "иммунологической доступности". Иммунологическая доступность может быть определена и другими методами, включая агглютинационный тест,ELISA, RIA, иммуноблоттинг, дотэнзим тест,тест на поверхностную доступность, электронную микроскопию, или сочетанием данных методов. Термин "фрагменты" по отношению к поверхностному белку Neisseria meningitidis обозначает полипептиды, имеющие, по меньшей мере, один пептидный эпитоп, или его аналоги и производные. Такого рода пептиды могут быть получены методами молекулярной биологии или быть синтезированы с использованием обычных методов жидкофазного или твердофазного синтеза пептидов. Термин "аналоги" по отношению к поверхностному белку Neisseria meningitidis обозначает белки или их фрагменты, у которых один или более аминокислотных остатков в природной последовательности заменены другими аминокислотными остатками, при том, что общая функциональность и протективные свойства данного белка сохраняются. Подобные аналоги могут быть получены синтетически, методами рекомбинантных ДНК или, например, путем мутагенеза природного поверхностного белка Neissena meningitidis. Подобные методы хорошо известны из уровня техники. Например, один из подобных аналогов выбран из рекомбинантного белка, кодируемого геном 22 кДа белка Neisseria gonorrhoeae штамма b2, как это изображено на фиг. 10. Другой аналог может быть получен путем выделения соответствующего гена из Neisseria lactamica. Термин "производное" по отношению к поверхностному белку Neisseria meningitidis обозначает белок или его фрагмент, который был ковалентно модифицирован, например, динитрофенолом, для обеспечения его иммуногенности у человека. В контексте данного изобретения к производным относятся также производные аминокислотных аналогов. Как будет понятно из приведенных ниже примеров, квалифицированный специалист способен без излишних экспериментов определить,может ли данный конкретный фрагмент, аналог или производное оказаться полезным при диагностике, профилактике или лечении вызываемых Neisseria meningitidis заболеваний. В объем настоящего изобретения включены также полимерные формы поверхностных белков Neisseriameningitidis, их фрагментов, аналогов и производных. Такие полимерные формы включают,например, один или несколько полипептидов,"сшитых" такими соединяющими агентами, как авидин/биотин, глутаральдегид или диметилсуберимидат. Подобные полимерные формы включают также полипептиды, состоящие из двух или более тандемных или инвертированных смежных последовательностей Neisseriameningitidis, полученных из полицистронных мРНК, которые в свою очередь были получены методами рекомбинантных ДНК. В объем настоящего изобретения включены также по существу очищенные повеpхностные белки Neisseria meningitidis. Термин "по существу очищенный" означает, что заявленный в настоящем изобретении поверхностный белок Neisseriameningitidis свободен от других белков Neisseriameningitidis. Препараты по существу очищенного поверхностного белка Neisseria meningitidis могут быть получены различными известными способами, например такими, которые описаны в примерах 3 и 11. Кроме того, в настоящем изобретении заявлен 22-кДа поверхностный белок NeisseriaID NO:2), или фрагмент, аналог или производное данного белка. В настоящем изобретении также заявлен 22-кДа поверхностный белок Neisseria meningitidis, имеющий аминокислотную последовательность, представленную на фиг. 8 (SEQ IDNO:4), фиг. 9 (SEQ ID NO:6) или фрагмент, аналог или производное данного белка. Подобный фрагмент может быть выбран из группы пептидов, перечисленных на фиг. 15 (от SEQ ID NO:9 до SEQ ID NO:26). В настоящем изобретении также заявлен 22-кДа поверхностный белок Neisseria gonorrhoeae, имеющий аминокислотную последовательность, представленную на фиг. 10 (SEQ IDN0:8), или фрагмент, аналог или производное данного белка. Как следует из контекста изобретения, любое упоминание 22-кДа поверхностного белка Neisseria meningitidis подразумевает и 22-кДа белки, выделенные из (или полученные с помощью генных технологий) других видовNeisseria lactamica. Заявленный в настоящем изобретении 22 кДа поверхностный белок Neisseria meningitidis может быть охарактeризован по одному или более из следующих параметров:(1) он имеет примерный молекулярный вес около 22 кДа, как это определено SDS-PAGE;(2) его электрофоретическая подвижность в SDS-PAGE не изменяется при обработке восстанавливающими агентами;(3) он имеет изоэлектрическую точку (рI) в интервале от рI 8 до рI 10;(4) он высоко устойчив к деградации такими протеолитическими ферментами как химотрипсин, трипсин и протеиназа К;(5) окисление периодатом не отменяет специфического связывания антител, специфичных к 22-кДа поверхностному белку Neisseria(6) он представляет собой высококонсервативный антиген;(7) на поверхности интактных организмовNeisseria meningitidis данный белок доступен для антител;(8) он может индуцировать образование бактерицидных антител;(9) он может индуцировать образование антител, способных защищать против экспериментального заражения;(10) при введении животному данный белок может индуцировать развитие иммунологического ответа, защищающего от инфекцииNeisseria meningitidis. В настоящем изобретении впервые описана последовательность ДНК, кодирующая 22 кДа поверхностный белок Neisseria meningitidis(SEQ ID NO:1, NO:3, No:5 и NO:7). Предпочтительно, чтобы данная последовательность была выбрана из группы, включающей следующие последовательности: а) последовательность ДНК (SEQ IDNO:7), приведенную на фиг. 10; д) аналоги или производные упомянутых последовательностей; е) последовательности ДНК, полученные на основе любой из упомянутых последовательностей, с учетом вырожденности генетического кода; ж) фрагменты любой из упомянутых последовательностей, при том, что данные последовательности кодируют продукт, обладающий иммунологической активностью 22-кДа поверхностного белка Neisseria meningitidis. Такие фрагменты являются предпочтительно пептидами, изображенными на фиг. 15 (сSEQ ID NO:9 по SEQ ID NO:26). В настоящем изобретении впервые описана последовательность ДНК, кодирующая 22 кДа поверхностный белок Neisseria meningitidis(SEQ ID NO:1). Предпочтительные последовательности должны быть выбраны из группы,включающей следующие последовательности: а) последовательность ДНК (SEQ IDNO:1), приведенную на фиг. 1; б) аналоги или производные упомянутой последовательности; в) последовательности ДНК, полученные на основе любой из упомянутых последователь 13 ностей, с учетом вырожденности генетического кода; ж) фрагменты любой из упомянутых последовательностей, при том, что данные последовательности кодируют продукт, обладающий иммунологической активностью 22-кДа поверхностного белка Neisseria meningitidis. Аналоги и производные гена, кодирующего 22-кДа поверхностный белок Neisseria meningitidis, будут гибридизоваться с геном, кодирующим данный белок, в условиях, описанных в примере 4. Согласно контексту данного изобретения,фрагменты, аналоги и производные 22-кДа поверхностного белка Neisseria meningitidis будут иметь "иммунологическую активность" 22-кДа поверхностного белка Neisseria meningitidis в том случае, если при введении животному они способны индуцировать развитие иммунологического ответа, способного защищать от инфекции Neisseria meningitidis. Квалифицированный специалист с применением методов, описанных в примере 6, может определить, кодирует ли некая конкретная последовательность ДНК продукт, обладающий иммунологической активностью 22-кДа поверхностного белка Neisseriameningitidis. Заявленный в настоящем изобретении поверхностный белок Neisseria meningitidis может быть выделен по методике, состоящей из следующих стадий: а) выделение культуры бактерий Neisseriameningitidis,б) выделение фракции внешних мембран из культуры бактерий; и в) выделение указанного белка из фракции внешних мембран. В частности, упомянутая стадия в) может включать дополнительный этап обработки экстрактов внешних мембран Neisseria meningitidis протеиназой К с последующим фракционированием белков обычными методами разделения,такими как ионообменная хроматография, гельхроматография и электрофорез. Альтернативно(и предпочтительно) поверхностные белки Neisseria meningitidis, заявленные в настоящем изобретении, могут быть получены при помощи технологий рекомбинантных ДНК, как это более подробно описано в примере 3. Применение молекулярно-биологических методов особенно предпочтительно для получения по существу очищенного рекомбинантного 22-кДа поверхностного белка Neisseria meningitidis. Таким образом, в объем притязаний настоящего изобретения входит способ получения рекомбинантного 22-кДа поверхностного белкаNeisseria meningitidis, включая его фрагменты,аналоги и производные, состоящий из следующих стадий:(1) культивирование одноклеточного организма-хозяина, трансформированного молекулой рекомбинантной ДНК, в состав которой 14 входит последовательность ДНК, кодирующая данный белок, фрагмент, аналог или производное. В состав рекомбинантной молекулы ДНК также входят одна или более последовательностей, контролирующих экспрессию, которые функционально связаны с кодирующей последовательностью ДНК;(2) выделение по существу очищенного белка, его фрагмента, аналога или производного. Как хорошо известно из уровня техники,для получения высоких уровней экспрессии трансфицированного гена в определенном хозяине, данный ген должен быть функционально связан с последовательностями, контролирующими экспрессию на уровне транскрипции и трансляции, и данные последовательности должны быть функционально активны в данном конкретном хозяине. Предпочтительно, чтобы контролирующие экспрессию последовательности и ген, экспрессию которого желательно получить, были введены в состав вектора экспрессии, который содержит также бактериальный селективный маркер и начало репликации. Если экспрессирующим хозяином является эукариотическая клетка, то вектор экспрессии может также содержать маркер экспрессии, приемлемый для данного хозяина. Для экспрессии заявленных в настоящем изобретении последовательностей может быть использовано широкое разнообразие сочетаний хозяин/вектор. Для экспрессии генов в эукариотических клетках приемлемы векторы, несущие регуляторные последовательности вируса SV40,вируса бычьей папилломы, аденовируса или цитомегаловируса. Приемлемые для бактериальных клеток векторы экспрессии включают известные бактериальные плазмиды, такие как плазмиды E.coli, включая Col E1, pCR1,pBR322, pMB9 и их производные, плазмиды с широким кругом хозяев, такие как PR4, фаговые ДНК, например, многочисленные производные фага(NM989) и другие ДНК-содержащие фаги, такие как М 13 и нитчатые фаги с одноцепочечной ДНК. Вектором, приемлемым для экспрессии в клетках дрожжей, является, например,плазмида мю-2 и ее производные. Векторы для экспрессии в клетках насекомых включают плазмиду pVL941. Для экспрессии заявленных в настоящем изобретении последовательностей ДНК при помощи перечисленных выше векторов могут быть использованы разнообразные последовательности, контролирующие экспрессию. К таким регуляторным последовательностям, контролирующим экспрессию, относятся последовательности, ассоциированные со структурными генами перечисленных векторов экспрессии. Примерами подобных регуляторных последовательностей могут служить следующие: ранний и поздний промоторы вируса SV40 и аденовируса,lac-система, tpr-система, система ТАС или TRC, 15 главные операторные и промоторные области фага , регуляторная область поверхностного белка fd, промотор 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислой фосфатазы, например, Pho5, промоторы а системы спаривания у дрожжей, или другие последовательности, контролирующие экспрессию генов в прокариотических и эукариотических клетках или у вирусов, представленные в различных комбинациях. Для экспрессии 22-кДа поверхностного белка Neisseria meningitidis в клетках E.coli (пример 3) особенно полезны регуляторные последовательности, контролирующие экспрессию 22-кДа поверхностного белка в клетках Neisseria meningitidis. Другой аспект настоящего изобретения относится к клеткам-хозяевам, трансформированным перечисленными выше векторами. Для заявленных в настоящем изобретении последовательностей ДНК может быть использовано широкое разнообразие одноклеточных хозяев. Среди этих хозяев могут быть хорошо известные эукариотические и прокариотические хозяева,такие как Е.соli различных штаммов, Pseudomonas, Bacillus, Streptomyces, грибы, дрожжи,клетки насекомых, например, Spodoptera frugiperda (SF9), клетки животных, такие как СНО и клетки мыши, клетки африканской зеленой мартышки, такие как СOS1, COS7, BSC1,BSC40 и ВМТ 10, клетки человека и растительные клетки в культуре. Предпочтительными являются такие бактерии, как E.coli и Bacillussubtilis, а также клетки млекопитающих в культуре. Необходимо понимать, что не все векторы и регуляторные последовательности будут функционировать с одинаковой эффективностью при экспрессии последовательностей ДНК,заявленных в настоящем изобретении. Также не все хозяева будут одинаково хорошо работать с одной конкретной системой экспрессии. Однако квалифицированный специалист может выбрать соответствующий вектор, регуляторные последовательности и организм-хозяин без выполнения специальных экспериментов и не выходя за рамки настоящего изобретения. Например, при выборе вектора необходимо выбирать и хозяина, поскольку вектор должен реплицироваться именно в этом хозяине. Необходимо учитывать также число копий вектора, возможность контролирования этого числа, а также возможность экспрессии других кодируемых вектором белков, например, маркеров, определяющих устойчивость к антибиотикам. Определенный набор факторов должен также учитываться при выборе последовательностей, контролирующих экспрессию. Эти факторы включают, например, относительную силу последовательности, возможность контролирования этой величины, совместимость с заявленными последовательностями ДНК, особенно в отношении возможных вторичных структур. 16 Одноклеточные хозяева должны выбираться с учетом их совместимости с выбранным вектором, токсичности продукта, кодируемого предложенными последовательностями ДНК, их способности к секреции, их способности осуществлять правильную укладку белка, их культуральных характеристик, и легкости выделения и очистки из них продуктов, кодируемых предложенными последовательностями ДНК. С учетом перечисленных параметров квалифицированный специалист может выбрать различные сочетания "вектор/регуляторные последовательности/хозяин" для экспрессии предложенных в настоящем изобретении последовательностей ДНК путем ферментации бактерий или крупномасштабного культивирования клеток животных. Полипептиды, кодируемые предложенными в настоящем изобретении последовательностями ДНК, могут быть выделены из ферментационной среды или культуры клеток и очищены с применением разнообразных обычных методов. Квалифицированный специалист может выбрать наиболее приемлемые методы выделения и очистки, не выходя за рамки настоящего изобретения. Поверхностные белки Neisseria meningitidis или Neisseria gonorrhoeae, предложенные в настоящем изобретении, могут быть использованы в профилактических, терапевтических и диагностических композициях для предотвращения, лечения и диагностики заболеваний,вызываемых Neisseria meningitidis или Neisseriagonorrhoeae. Поверхностные белки Neisseria meningitidis, предложенные в настоящем изобретении,могут быть использованы в профилактических,терапевтических и диагностических композициях для предотвращения, лечения и диагностики заболеваний, вызываемых Neisseria gonorrhoeae или Neisseria lactamica. Поверхностные белки Neisseria meningitidis, предложенные в настоящем изобретении особенно хорошо применимы для получения антител и генерации протективного ответа против Neisseria meningitidis. Поверхностные белки Neisseria meningitidis, предложенные в настоящем изобретении особенно хорошо применимы для получения антител и генерации протективного ответа против Neisseгia gonorrhoeae или Neisseria lactamica. В частности, авторы описали 22 кДа поверхностный белок Neisseria meningitidis,имеющий аминокислотную последовательность,представленную на фиг. 1 (SEQ ID NO:2), его фрагмент, аналог или производное, для применения в качестве иммуногена и вакцины. В частности, авторы описали 22-кДа поверхностный белок Neisseria meningitidis,имеющий аминокислотную последовательность,представленную на фиг.1 (SEQ ID NO:2), фиг. 8 17 фиг.10 (SEQ ID NO:8), его фрагмент, аналог или производное, для применения в качестве иммуногена и вакцины. К поверхностным белкам Neisseria meningitidis могут быть применены стандартные иммунологические подходы для использования их в качестве иммуногена и вакцины. В частности,любому приемлемому хозяину может быть введено фармацевтически эффективное количество 22-кДа поверхностного белка Neisseria meningitidis для получения моноклональных или поливалентных антител против Neisseria meningitidis или для индукции протективного иммунологического ответа, защищающего от вызываемых Neisseria meningitidis заболеваний. Перед введением хозяину поверхностные белкиNeisseria meningitidis могут быть введены в состав соответствующей композиции и, таким образом, авторы предлагают фармацевтическую композицию на основе одного или более поверхностных антигенов Neisseria meningitidis или их фрагментов. Предпочтительно, в состав такой композиции входят антиген (поверхностный 22-кДа белок Neisseria meningitidis, его фрагменты, аналоги или производные) и один или более фармацевтически приемлемый растворитель. В контексте данного изобретения "фармацевтически эффективное количество" означает количество одного или более поверхностных антигеновNeisseria meningitidis, или его фрагментов, которое обеспечивает достаточный титр антител,специфичных к Neisseria meningitidis, который достаточен для лечения или предотвращения инфекции, вызванной Neisseria meningitidis. Поверхностные белки Neisseria meningitidis, заявленные в настоящем изобретении, могут составлять основу диагностического теста на инфицирование Neisseria meningitidis. Возможны несколько способов диагностики. Например,в настоящем изобретении заявлен способ обнаружения антигена Neisseria meningitidis в биологических образцах, содержащих антиген Neisseria meningitidis или подозреваемых на наличие данного антигена, включающий следующие стадии: а) получение биологического образца от пациента; б) инкубирование антитела или его фрагмента с биологическим образцом с образованием смеси; и в) выявление специфически связанного антитела или его связанного фрагмента в смеси,что указывает на наличие антигена Neisseriameningitidis. Предпочтительными антителами для осуществления указанного выше диагностического способа являются Ме-1 и Ме-7. Альтернативно, в настоящем изобретении заявлен способ обнаружения антитела, специфичного к антигену Neisseria meningitidis, в биологических образцах, содержащих указанное 18 антитело или подозреваемых на наличие данного антитела, включающий следующие стадии: а) получение биологического образца от пациента; б) инкубирование антигена или его фрагмента с биологическим образцом с образованием смеси; и в) выявление специфически связанного антигена или его связанного фрагмента в смеси,что указывает на наличие антитела, специфичного к антигену Neisseria meningitidis. Квалифицированному специалисту понятно, что данный диагностический тест может быть выполнен различным образом, включая такие иммунологические методы, как ELISA,радиоиммунологический тест или латексную агглютинацию, которые достаточны и необходимы для определения наличия в оpганизме антител, специфичных к данному белку. Заявленные в настоящем изобретении последовательности ДНК могут быть использованы для конструирования ДНК-зондов, используемых для определения патогенных бaктерийNeisseria в биологическом материале, подозреваемом на наличие таких бактерий. Заявленный в настоящем изобретении способ обнаружения включает следующие стадии: а) получение биологического образца от пациента; б) инкубирование ДНК-зонда, имеющего последовательность ДНК, в соответствии с данным изобретением, с биологическим образцом с образованием смеси; и в) выявление специфически связанного ДНК-зонда в смеси, что указывает на наличие бактерии Neisseria meningitidis. Предпочтительные ДНК-зонды имеют последовательность оснований, представленную на фиг. 1 (SEQ ID NO:1), фиг. 8 (SEQ ID NO:3),фиг. 9 (SEQ ID NO:5), или фиг. 10 (SEQ IDNO:7), или консенсусную последовательность,представленную на фиг. 11 (SEQ ID NO:9). Более предпочтительный ДНК-зонд имеет последовательность из 525 пар оснований, приведенную на фиг. 10 (SEQ ID NO:7). Заявленные в настоящем изобретении ДНК-зонды могут также быть использованы для обнаружения в образце циркулирующих нуклеиновых кислот Neisseria meningitidis, в частности, с применением полимеразной цепной реакции в качестве метода диагностики инфекции Neisseria meningitidis. Зонд можно синтезировать обычными методами и иммобилизовать на твердой фазе, или же он может быть связан с выявляемой меткой. Предпочтительным ДНК-зондом является олигомер с последовательностью, комплементарной по крайней мере шести последовательным нуклеотидам гена, кодирующего 22-кДа поверхностный белок Neisseria meningitidis, как показано на (фиг.1), (SEQ ID NО:1), фиг. 8 (SEQNО:9). Более предпочтительным ДНК-зондом является олигомер с последовательностью, комплементарной по крайней мере шести последовательным нуклеотидам гена, кодирующего 22 кДа поверхностный белок Neisseria meningitidis,как показано на фиг. 1, (SEQ ID NO:1). Другой диагностический метод обнаружения Neisseria meningitidis у пациента, включает следующие стадии: а) мечение антитела или фрагмента антитела выявляемой меткой; б) введение меченого антитела или его меченого фрагмента пациенту; и в) выявление специфически связанного меченого антитела или его фрагмента у пациента, что указывает на присутствие Neisseria meningitidis. Для очистки антитела, специфичного к поверхностному белку Neisseria meningitidis, может быть применена аффинная хроматография с использованием в качестве аффинного сорбента иммобилизованного поверхностного белка Neisseria meningitidis. Так, в настоящем изобретении заявлен 22 кДа поверхностный белок Neisseria meningitidis,имеющий аминокислотную последовательность,выбранную из следующих последовательностей:NO:8), представленной на фиг. 10, а также его фрагмент или аналог, ковалентно связанный с нерастворимым матриксом. Согласно предпочтительному аспекту настоящего изобретения заявлен 22-кДа поверхностный белок Neisseria meningitidis, имеющий аминокислотную последовательность, представленную на фиг. 1, (SEQ ID NO:2), его фрагмент или аналог, ковалентно связанный с нерастворимым матриксом. Другим аспектом настоящего изобретения является применение поверхностных белковNeisseria meningitidis а качестве иммуногенов для получения специфических антител, которые, в свою очередь, применяются для диагностики и в особенности для лечения инфекции,вызываемой Neisseria meningitidis. Подходящие антитела можно отобрать с использованием соответствующих методов скрининга, например,определяя способность конкретного антитела пассивно защищать от инфекции Neisseria meningitidis на модельной системе. Одним из примеров модельных систем является описанная в примерах настоящего изобретения модельная система на мышах. Антитело может быть целым антителом или его антиген-связывающим фрагментом и, вообще, может принадлежать к любому классу иммуноглобулинов. Антитело или его фрагмент могут быть получены от живот 001789 20 ных, в частности, от млекопитающих и, более конкретно, иметь мышиную, крысиную или человеческую природу. Это может быть природное антитело или его фрагмент, или, при необходимости, рекомбинантное антитело или его фрагмент. Термин "рекомбинантное антитело",или его фрагмент, обозначает антитело или его фрагмент, полученное методами рекомбинантных ДНК. Антитело или фрагменты антител могут быть поликлональными или, предпочтительно, моноклональными. Антитело может быть специфично к ряду эпитопов, ассоциированных с поверхностными белками Neisseriameningitidis, но предпочтительна специфичность к одному эпитопу. Предпочтительно, чтобы антитело или его фрагменты были специфичны к одному или нескольким эпитопам, ассоциированным с 22-кДа поверхностным белком Neisseria meningitidis. Наиболее предпочтительными являются моноклональные антитела Ме-1 и Ме 7, заявленные в настоящем изобретении. Примеры. Для лучшего понимания настоящего изобретения приведены следующие примеры. Данные примеры служат только для целей иллюстрации и не должны рассматриваться как ограничивающие объем притязаний данного изобретения. Пример 1 описывает обработку фракции внешних мембран Neisseria meningitidis протеолитическими ферментами и последующую идентификацию 22-кДа поверхностного белкаNeisseria meningitidis. Пример 2 описывает получение моноклональных антител к 22-кДа поверхностному белку Neisseria meningitidis. Пример 3 описывает получение рекомбинантного 22-кДа поверхностного белка Neisseria meningitidis. Пример 4 описывает применение ДНКзондов для идентификации организмов, экспрессирующих 22-кДа поверхностный белокNeisseria meningitidis. Пример 5 описывает применение моноклонального антитела против 22-кДа поверхностного белка Neisseria meningitidis для защиты мышей от инфекции Neisseria meningitidis. Пример 6 описывает применение очищенного рекомбинантного 22-кДа поверхностного белка для индукции защитного ответа против инфекции Neisseria meningitidis. Пример 7 описывает идентификацию последовательности 22-кДа белка и гена, кодирующего данный белок, у других штаммов Neisseria meningitidis (МСН 88 и Z4063) и одного штамма Neisseria gonorrhoeae. Пример 8 демонстрирует иммунологический ответ кроликов и обезьян на 22-кДа поверхностный белок Neisseria meningitidis. Пример 9 описывает подход,использованный для картирования различных иммунологических эпитопов 22-кДа поверхностного белка Neisseria meningitidis. 21 Пример 10 описывает тепловую индукцию экспрессирующего вектора для крупномасштабного производства 22-кДа поверхностного белка. Пример 11 описывает процесс очистки 22-кДа поверхностного белка, полученного путем рекомбинантной технологии. Пример 12 описывает применение 22-кДа поверхностного белка в качестве вакцины для человека. Пример 1. Обработка препаратов внешних мембран Neisseria meningitidis протеолитическими ферментами и последующая идентификация устойчивого к ферментам 22-кДа поверхностного белка Neisseria meningitidis. Для изучения ультраструктуры внешней мембраны Neisseria meningitidis использовали несколько антигенных препаратов, полученных из целых клеток, а также литий-хлоридных или саркозильных экстрактов. Внешняя мембрана грамотрицательных бактерий служит разделительным барьером между окружающей средой и внутренней средой клетки и содержит большинство антигенов, доступных для иммунной системы хозяина. Главной целью исследования являлась идентификация новых антигенов, способных индуцировать протективный ответ против Neisseria meningitidis. Один из использованных авторами изобретения подходов для идентификации подобных антигенов, состоял в частичном расщеплении упомянутых выше антигенных препаратов протеолитическими ферментами. Антигенные детерминанты, полученные в результате обработки ферментами, могут быть затем идентифицированы путем анализа иммунологических и протективных свойств упомянутых выше обработанных антигенных препаратов. К удивлению, авторы обнаружили, что при электрофоретическом разделении литий-хлоридного экстракта внешних мембран Neisseriameningitidis одна из низкомолекулярных белковых полос, окрашиваемых Кумасси бриллиантовым голубым R-250, не разрушается обработкой протеолитическими ферментами. Кумасси голубой используют для окрашивания белков и пептидов, он имеет очень низкую (или не имеет вовсе) аффинность к полисахаридам или липидам, которые также являются важными компонентами внешней мембраны. Тот факт, что данный низкомолекулярный антиген окрашивался Кумасси голубым, свидетельствует о том, что он, по меньшей мере, частично состоит из полипептидов, нерасщепляемых протеолитическими ферментами, или же он защищен от действия этих ферментов другими поверхностными структурами. Кроме того, как будет показано далее, очень сильный фермент протеиназа К не расщепляет этот низкомолекулярный антиген даже при длительной обработке. Для получения препаратов внешних мембран Neisseria meningitidis различных штаммов применяют экстракцию хлоридом лития, как это было ранее описано заявителями [Brouder et al., lnfect. lmmun., 50,p.510 (1985)]. Содержание белка в данных пре 001789 22 паратах определяют по методу Лоури, адаптированному для мембранных фракций [Lоwrу еt аl., J. Biol. Chem. 193, р. 265 (1951)]. Препараты внешних мембран, полученные из клеток Neisseria meningitidis штамма 608 В (В:2 а:Р 1.2) обрабатывали 24 ч при 37 С и постоянном встряхивании -химотрипсином из бычьей поджелудочной железы (Е.С.3.4.21.1) (Сигма) или трипсином типа 1 из бычьей поджелудочной железы(Е.С.3.4.21.4) (Сигма). Концентрацию фермента доводили до 2 мг на мг обрабатываемого белка. Те же препараты внешних мембран обрабатывали различными концентрациями (от 0,5 до 24 мг на мг белка) протеиназы К из Tritirachium album(Сигма или Берингер Маннхайм, Лаваль, Канада) (Е.С.3.4.21.14). Для ускорения расщепления белка протеиназой К использовали различные экспериментальные условия. Образцы инкубировали 1 ч, 2 ч, 24 ч или 48 ч при 37 С или 56 С при встряхивании и без встряхивания, рН проб доводили до 7,2 или 9,0. В отдельные пробы также добавляли SDS до конечной концентрации 1% (объем/объем). Немедленно после обработки образцы фракционировали электрофорезом (SDS-PAGE) с использованием системыMiniProteanll (Био-Рад, Миссисога, Онтарио,Канада) для 14%-ных (вес/объем) гелей, согласно инструкции производителя. Белки прогревали при 100 С 5 мин в присутствии 2 меркаптоэтанола и SDS, разделяли в 14%-ных гелях и окрашивали Кумасси бриллиантовым голубым R-250. На фиг. 2 представлены миграционные профили белков в 14%-ных гелях (SDS-PAGE),которые содержатся в препаратах внешних мембран Neisseria meningitidis штамма 608 В(В:2 а;Р 1.2), после обработки -химотрипсином и трипсином при 37 С в течение 24 ч. В обработанных образцах (фиг. 2, полосы 3 и 4) в сравнении с необработанным контролем (фиг. 2,полоса 2) можно наблюдать значительное протеолитическое расщепление высокомолекулярных белков. Напротив, полоса, соответствующая белку с молекулярной массой 22-кДа, осталась неизменной даже после 24 ч контакта с каждым из протеолитических ферментов. Данный уникальный белок в дальнейшем обрабатывали более сильнодействующим протеолитическим ферментом протеиназой К (фиг. 3). Протеиназа К является одним из самых сильных изо всех известных протеолитических ферментов, поскольку она имеет низкую пептидную специфичность и широкий оптимум рН. Удивительно, но 22-кДа белок оказался устойчив к обработке двумя международными единицами (2 IU) протеиназы К в течение 24 ч при 56 С (фиг. 3, полоса 2). Такая обработка часто используется в лаборатории авторов при получении липополисахаридов или ДНК, практически свободных от белков. Конечно, после такой 23 препаратах внешних мембран можно обнаружить только маленькие пептиды. Кроме того,увеличение времени обработки до 48 ч или повышение концентрации фермента (до 24 IU) не изменяет количества 22-кДа белка. Ни количество, ни миграция белка в SDS-PAGE не изменялись при повышении рН реакционной смеси до 9,0 или при добавлении 1% SDS, эффективно денатурирующего белки агента (фиг.3, полосы 4,6, и 8). Комбинированное действие двух указанных денатурирующих факторов обычно приводит к полному расщеплению белков, присутствующих в препаратах внешних мембран, оставляя только аминокислотные остатки. Низкомолекулярные пептиды часто обнаруживают в переварах; считается, что они являются фрагментами чувствительных белков, которые были недостаточно эффективно расщеплены при ферментных обработках. Наиболее вероятно,что эти фрагменты были защищены от дальнейшей деградации углеводами и липидами,присутствующими во внешней мембране. Полосы, соответствующие молекулярной массе 28 и 34 кДа, обнаруживаемые в обработанных образцах, соответствуют остаточному ферменту и контаминантному белку, присутствующему во всех проверенных ферментных препаратах. Примечательно, что в ходе исследования устойчивости 22-кДа белка к протеазам, был обнаружен другой белок с молекулярной массой около 18 кДа, который оказался также устойчив к ферментному расщеплению (фиг. 3 а). Объяснение появлению 18-кДа полосы было получено при анализе миграционных профилей в SDSPAGE аффинно очищенного рекомбинантного 22-кДа белка (фиг. 3b). Полоса, соответствующая 18-кДа белку, появлялась только в том случае, когда до нанесения на гель аффинно очищенный рекомбинантный 22-кДа белок нагревали продолжительное время в буфере, содержащем SDS. Анализ N-концевых аминокислот деградацией по Эдману (пример 3) ясно показал, что аминокислотные остатки (E-G-A-S-G-FY-V-Q), обнаруженные в 18-кДа белке, соответствуют аминокислотам 1-9 22-кДа белка (SEQID NO:1). Эти результаты свидетельствуют о том, что различимые при SDS-PAGE полосы 18 и 22 кДа получены из одного и того же белка. Последний результат также показывает, что от зрелого 18-кДа белка отщепляется лидерная последовательность. Должны быть проведены дальнейшие исследования для определения молекулярных модификаций, объясняющий этот сдвиг молекулярного веса, и для оценки их вклада в антигенные и протективные свойства белка. Обнаружение белка внешней мембраныNeisseria meningitidis с очень редким свойством устойчивости к протеолитическому расщеплению обусловило необходимость дальнейшего изучения его молекулярных и иммунологических свойств. Очищенный рекомбинантный 22 001789 24 кДа поверхностный белок, продуцируемый Е.соli, как описано в примере 3, был также высокоустойчив к расщеплению протеиназой К. В настоящее время авторы пытаются выяснить механизм, обеспечивающий эту необычную устойчивость 22-кДа поверхностного белка Neisseria meningitidis к протеолитическим ферментам. Пример 2. Получение моноклональных антител, специфичных к 22 кДа поверхностному белку Neisseria meningitidis. Моноклональные антитела, описанные в настоящем изобретении, были получены в результате трех независимых опытов по слиянию. Самок мышей Balb/c (Лаборатория Чарльз Ривер, Сент-Констан, Квебек, Канада) иммунизировали препаратами внешних мембран, полученными из штаммов Neisseria meningitidis 604A, 608 В и 2241 С, относящихся соответственно к серогруппам А, В и С. Для получения препаратов внешних мембран использовали литий-хлоридные экстракты, которые получали согласно методу, описанному ранее заявителями. [Brodeur et al., Infect. Immun. 50, р.510(1985)]. Содержание белка в данных препаратах определяли по методу Лоури, адаптированному для мембранных фракций [Lowry et al., J. Biol.Chem. 193, р.265 (1951)]. Группам мышей дважды вводили внутрибрюшинно или подкожно с трехнедельными интервалами по 10 мг различных сочетаний описанных выше препаратов внешних мембран. В зависимости от группы мышей для иммунизации использовали следующие адъюванты: полный или неполный адъювант Фрейнда (Гибко Лабораториз, Грэнд Айленд, Нью-Йорк) или QuilA (Седарлэйн Лабораториз, Хорнби, Онтарио, Канада). За три дня до слияния иммунизированным мышам вводили внутривенно последнюю порцию из 10 мг одного из описанных выше препаратов внешних мембран. Протокол слияния, использованный для получения гибридомных клеточных линий, секретирующих желаемое моноклональное антитело, был описан ранее заявителями [Hamel et al., J. Med. Microbiol., 25, р.2434(1987)]. Класс, подкласс и тип легких цепей моноклональных антител Ме-1, Ме-2, Ме-3, Ме-5,Ме-6 и Ме-7 определяли ELISA, как описано ранее [Martin et al., J. Clin. Microbiol., 28, p.1720(1990)] и представлено в таблице 1. Специфичность моноклональных антител устанавливали с помощью Вестерн-иммуноблоттинга согласно методике, описанной ранее заявителями [Martinet al., Eur. J.lmmunol, 18, p.601 (1988)], со следующими модификациями. Препараты внешних мембран, полученные из различных штаммовNeisseria meningitidis, фракционировали в 14%ных гелях методом SDS-PAGE. Белки переносили из гелей на нитроцеллюлозные фильтры при помощи "полусухого" прибора (Био-Рад). Ток в 60 мА на гель (6 х 10 см) пропускали в течение 10 минут через буфер для электроблот 25 тинга, состоящий из: 25 мМ Трис-HCl, 192 мМ глицина и 20% (объем/объем) метанола, рН 8,3. Вестерн-иммуноблоттинг ясно показал, что моноклональные антитела Ме-1, Ме-2, Ме-3, Ме-5,Ме-6 и Ме-7 распознают специфические эпитопы 22-кДа белка Neisseria meningitidis (фиг. 4 А). Анализ SDS-PAGE гелей и соответствующих Вестерн-иммуноблотов показывает, что молекулярный вес данного белка не изменяется от штамма к штамму. Однако количество белка,представленного в препаратах внешних мембран, варьирует от штамма к штамму и не зависит от серогруппы данного штамма. Кроме того,указанные моноклональные антитела продолжают распознавать свои эпитопы на 22-кДа поверхностном белке Neisseria meningitidis и после обработки препарата внешних мембран 2 IU протеиназы К на мг белка (обработка описана выше в примере 1) (фиг. 4 В). Примечательно,что эпитопы оставались интактными после обработки ферментом, т.е. в препарате внешних мембран эпитопы оставались доступны для антител и не разрушались обработкой ферментом. Последний результат дает основания полагать,что механизм, обусловливающий наблюдаемую устойчивость к протеиназе К, по всей вероятности, не связан с поверхностными структурами,блокирующими доступ фермента к белку, или с тем, что белок глубоко "вмонтирован" в мембрану. Хотя результаты иммуноблоттинга антител Ме-1 и не приведены на фиг. 4, они вполне согласуются с результатами, полученными для пяти других антител. Серия опытов была проведена для того,чтобы частично охарактеризовать 22-кДа поверхностный белок Neisseria meningitidis и дифференцировать его от других известных менингококковых поверхностных белков. МетодомSDS-PAGE не было обнаружено изменений молекулярного веса 22-кДа поверхностного белкаNeisseria meningitidis при нагревании препаратов внешних мембран при 100 С в течение 5 мин, или при 37 С и 56 С в течение 30 мин в электрофорезном буфере в присутствии или отсутствии 2-меркаптоэтанола. Следовательно,скорость миграции 22-кДа поверхностного белка, находящегося на внешней мембране, не зависит от нагревания и обработки 2-меркаптоэтанолом. Окисление периодатом натрия было использовано для получения ответа на вопрос о том, реагируют ли моноклональные антитела c углеводными эпитопами, представленными в препаратах внешних мембран, полученными из микроорганизмов Neisseria meningitidis. Методика постановки данного эксперимента была ранее описана заявителями. [Martin et al., Infect.Immun., 60, pp.2718- 2725 (1992)]. Обработка препаратов внешних мембран 100 мМ периодата натрия в течение 1 ч при комнатной температуре не изменяет реактивности моноклональных антител по отношению к 22-кДа поверхностно 001789 26 му белку Neisseria meningitidis. Обычно такая обработка предотвращает связывание антител,специфичных к углеводам. Моноклональное антитело 2-1-СА 2 (предоставлено д-ром А. Бхаттачарджи, Военный исследовательский институт Уолтер Рид, Вашингтон, округ Колумбия) специфично по отношению к белку "lip" (называемому также Н.8), поверхностному антигену, общему для всех видов патогенных Neisseria. Реактивность данного моноклонального антитела с препаратами внешних мембран сравнивали с реактивностью моноклонального антитела Ме-5. Lipспецифическое моноклональное антитело реагирует c белковой полосой молекулярной массы 30 кДа, а моноклональное антитело Ме-5 реагирует с белковой полосой 22 кДа. Данный результат ясно свидетельствует об отсутствии связи между 22-кДа поверхностным белком Neisseria meningitidis и lip белком, другим высококонсервативным белком наружной мембраны. Для подтверждения экспозиции 22-кДа белка на поверхности интактных бактериальных клеток Neisseria meningitidis осуществляют радиоиммунологический тест, как ранее описано заявителями [Proulx et al., Infect. Immun., 59,p.963 (1991)]. Шесть моноклональных антител вводят в реакцию с 9-ю штаммами Neisserialactamica ("NL"). Радиоиммунологический тест подтверждает тот факт, что распознаваемые моноклональными антителами эпитопы экспонированы на поверхности интактных изолятовNeisseria rneningitidis различных серотипов и серогрупп и должны быть доступны протеолитическим ферментам (фиг. 5). Моноклональные антитела прочно связываются со своими эпитопами-мишенями на поверхности всех исследованных штаммов Neisseria meningitidis. Установленные величины связывания (в пределах 3000-35000 cpm) варьируют от штамма к штамму и зависят от физиологического состояния бактерий. Моноклональные антитела к поринуHaemophilus influenzae были использованы в качестве отрицательного контроля для каждого штамма бактерий. Была получена величина порядка 500 cpm, которую затем вычитали из каждого значения связывания. Применительно к штаммам Neisseria meningitidis, исследованным в настоящем опыте, результаты, полученные для моноклональных антител Ме-5 и Ме-7 (фиг. 5),являются репрезентативными и в отношении моноклональных антител Ме-1, Ме-2, Ме-3 и Ме-6. Применительно к другим бактериальным штаммам величины связывания, приведенные для моноклональных антител Ме-7, являются репрезентативными для других моноклональных антител, распознающих данный бактериальный штамм. 27 Оценивают также антигенную консервативность эпитопов, распознаваемых моноклональными антителами. Для быстрого скрининга моноклональных антител, взаимодействующих с большим числом бактериальных штаммов,применяют дот-энзим иммунотест. Данный тест проводят, как это описано ранее заявителями[Lussier et al., J. lmmunoassay, 10, р.373 (1989)]. В данном исследовании используют коллекцию из 71 штамма Neisseria meningitidis. Образцы включают 19 изолятов серогруппы А, 23 изолята серогруппы В, 13 изолятов серогруппы С, 1 изолят серогруппы 29 Е, 6 изолятов серогруппыW-135, 1 изолят серогруппы X, 2 изолята серогруппы Y, 2 изолята серогруппы Z, и 4 изолята неопределенной серогруппы ("NS"). Данные изоляты были получены из Карибского эпидемиологического центра, Порт-оф-Спейн, Тринидад; Детского госпиталя Восточного Онтарио,Канада; Департамента здравоохранения Саскачеван, Регина, Канада; Лаборатории здравоохранения Квебека, Монреаль, Канада; Института молекулярной генетики Макса-Планка,Берлин, ФРГ; Монреальской детской больницы,Монреаль, Канада; Больницы Виктории, Галифакс, Канада, а также из нашей собственной коллекции штаммов. Были исследованы также следующие виды бактерий: 16 Neisseria gonorrhoeae, 4 Neisseria cinerea, 5 Neisseria lactamica, 1(ATCC 13315), 1 Pseudomonas aeruginosa (ATCC 9037), 1 Salomonella typhimirium (ATCC 14028),1 Serrati marcescens (ATCC 8100), Shigella flexneri (ATCC 12022), 1 Shigella sonnei (ATCC 9290). Данные штаммы были получены из Американской коллекции культур клеток или коллекции, поддерживаемой в лаборатории Центра по борьбе с инфекциями, Оттава, Канада. Реактивность моноклональных антител с наиболее часто встречающимися штаммами Neisseria представлена в таблице 1. Одно из моноклональных антител, Ме-7, распознавало свой специфический эпитоп в 100% из 71 проверенного штамма Neisseria meningitidis. Данное монокло 001789 28 нальное антитело, также как и Ме-2, Ме-3, Ме-5 и Ме-6, также реагировало с отдельными штаммами, относящимися к другим видам Neisseria,следовательно их специфический эпитоп экспрессируется и другими близкородственнымиNeisseriaceae. За исключением слабой реакции с одним штаммом Neisseria lactamica, моноклональное антитело Ме-1 реагировало только с изолятамиNeisseria meningitidis. Антитело Ме-1 было в дальнейшем проверено с другими образцами 177 изолятов Neisseria meningitidis и было способно правильно идентифицировать более чем 99% всех проверенных штаммов Neisseria meningitidis. Кроме штаммов Neisseria, представленных в таблице 1, моноклoнальные антитела не реагировали ни с одним из перечисленных выше видов бактерий. Таким образом, заявителями были получены шесть моноклональных антител, специфически реагирующих с 22-кДа поверхностным протеином Neisseria meningitidis. С использованием данных антител было показано, что их специфические эпитопы 1) локализованы на устойчивом к протеиназе К 22-кДа белке, представленном на внешней мембране Neisseria meningitidis,2) консервативны среди изолятов Neisseriameningitidis, 3) экспонированы на поверхности интактных клеток Neisseria meningitidis и доступны антителам и 4) реактивность данных моноклональных антител по отношению к 22-кДа поверхностому белку Neisseria meningitidis не модифицируется обработкой периодатом натрия и, следовательно, их специфические эпитопы не расположены в углеводной части. Подвижность 22-кДа поверхностного белка Neisseria meningitidis при нагревании в жестких условиях смещается до молекулярного веса в 18 кДа, но его подвижность не модифицируется обработкой 2-меркаптоэтанолом. Авторы также показали, что 22-кДа поверхностный белок Neisseria meningitidis не имеет антигенного родства с "liр"-протеином,другим низкомолекулярным и высококонсервативным белком, представленным на внешней мембране Neisseria meningitidis. Как будет показано в примере 3, данные моноклональные антитела также реагируют с очищенным рекомбинантным 22 кДа поверхностным белком, полученным после трансформации Escherichia coli штамма BL21 (DE3) плазмидным вектором pNP2202, содержащим ген,кодирующий 22 кДа поверхностный белок Neisseria meningitidis. Таблица 1. Реактивность моноклональных антител с изолятами Neisseria Количество изолятов Neisseria, распознаваемых моноклональными антителами Серогруппа Neisseria meningitidis ОбознаMoraxella Общее чение ИзотипNeisseria meningitidis. А. Молекулярное клонирование. Библиотека геномной ДНК Lambda GEM11 из Neisseria meningitidis штамма 608 В(В:2 а:Р 1.2) была получена согласно рекомендациям производителя (Промега, Мэдисон, Висконсин). Геномную ДНК штамма 608 В частично переваривали рестриктазой Sau AI, затем фрагменты ДНК с молекулярным весом от 9 до 23 килобаз очищали электрофорезом в геле агарозы и лигировали по BamHI сайтам с плечамиLambdaGEM-11. Полученные рекомбинантные фаги использовали для инфицирования клетокEschenchia coli штамма LE392 (Промега), которые затем высевали на чашки в LB-агаром. После иммуно-скрининга библиотеки с моноклональными антителами, специфичными к 22-кДа поверхностому белку Neisseria meningitidis и описанными в примере 2, было идентифицировано девятнадцать положительных бляшек. Скрининг вели согласно следующей методике. Чашки инкубировали 15 мин при -20 С для затвердения верхнего агара. Затем на поверхность чашек помещали нитроцеллюлозные фильтры на 30 мин при 4 С для адсорбции белков, продуцируемых рекомбинантными вирусными клонами. Фильтры ополаскивали в ФБР-твин 0,02%(объем/объем) и подвергали иммуноблоттингу,как описано ранее [Lussier et al., J. lmmunoassay,10, р.373 (1989)]. После амплификации и очистки ДНК для последующего субклонирования был отобран один вирусный клон, обозначенный "клон 8", который содержал 13-килобазную вставку. После переваривания данного клона рестриктазой Sac I были получены два фрагмента 5 и 8 килобаз. Данные фрагменты были очищены в агарозном геле и лигированы в рестрикционный сайт Sас I низкокопийной плазмиды(1991)]. Рекомбинантными плазмидами трансформировали путем электропорации клетки Escherichia coli штамма JM109 (Промега). Использовали электропоратор Био-Рад (Био-Рад, Миссисога, Онтарио, Канада). Полученные колонии скринировали с моноклональными антителами,специфичными к 22-кДа поверхностному белку 2. Положительные колонии наблюдались только в том случае, когда бактерии трансформировали плазмидой, несущей 8-килобазную вставку. Анализ положительных клонов при помощи Вестерн-блоттинга (по методу, описанному в примере 2) показал, что экспрессируемыйEcherichia coli белок является полным и мигрирует в SDS-РАGЕ аналогично 22-кДа поверхностному белку Neisseria meningitidis. Для дальнейшего уменьшения размера вставки, клон,содержащий 8-килобазный фрагмент, рестрицировали Cla I и полученный фрагмент в 2,75 килобаз лигировали в Cla I сайт плазмиды рWКS30. Анализ положительных клонов при помощи Вестерн-блоттинга опять же показал,что экспрессируемый Echerichia coli белок является полным и мигрирует в SDS-PAGE аналогично нативному 22-кДа поверхностному белкуNeisseria meningitidis. После рестрикционного анализа было установлено, что два клона, обозначенныеpNP2202 и pNP2203, несут 2,75-килобазную вставку в противоположной ориентации. Данные клоны были использованы для секвенирования гена, кодирующего 22 кДа поверхностный белок Neisseria meningitidis. Для получения наборов фиксированных делеций в обоих клонах был использован набор "Double StrandedNested Deletion Kit" фирмы Фармация Биотех Инк (Пискатавэй, Нью Джерси). Полученные усеченные вставки секвенировали с форвардного праймера М 13, представленного в вектореpWKS30, при помощи набора для секвенирования "Taq Dye Deoxy Terminator Cycle Sequiencing Kit" на автоматическом секвенаторе модели 373 А фирмы Эпплайд Байосистемз Инк. (Фостер Сити, Калифорния) согласно рекомендациям производителя. В. Секвенирование последовательностей. После того, как вставки были просеквенированы в обоих направлениях, в нуклеотидной последовательности была выявлена открытая рамка считывания, состоящая из 525 нуклеотидов (включая стоп-кодон), кодирующая белок в 174 аминокислотных остатка с предположительным молекулярным весом в 18 000 Дальтон и рl 9,93. Нуклеотидная последовательность и выведенная из нее аминокислотная последовательность представлены на фиг. 1 (SEQ ID 31 Для подтверждения правильной экспрессии клонированного гена была определена Nконцевая аминокислотная последовательность нативного 22-кДа поверхностного белка Neisseria meningitidis штамма 608 В, что давало возможность сравнить ее с аминокислотной последовательностью, выведенной на основе последовательности нуклеотидов. Препарат внешних мембран Neisseria meningitidis штамма 608 В разделяли электрофоретически в 14%-ных полиакриламидных гелях с SDS и переносили на поливинилидин дифлуоридные фильтры (Миллипор Продактс, Бедфорд, Массачусетс) согласно описанному ранее методу [Sambrook et al.,Molecular Cloning; A laboratory manual, ColdSpring Harbor Laboratory Press (1989)]. Полосу белка 22 кДа вырезали из геля и затем проводили деградацию по Эдману на автоматическом белковом секвенаторе модели 473 А фирмы Эпплайд Байосистемз Инк. (Фостер Сити, Калифорния) согласно рекомендациям производителя. Аминокислотная последовательность E-GA-S-G-F-Y-V-Q-A соответствовала аминокислотам 1-10 (SEQ ID NO:2) открытой рамки считывания, что указывает на наличие в 22-кДа поверхностном белке Neisseria meningitidis штамма 608 В 19-аминокислотного лидерного пептида (аминокислотные остатки от -19 до -1 последовательности SEQ ID NO:2). Поиск, проведенный с использование доступных баз данных, подтвердил тот факт, что 22-кДа поверхностный белок Neisseria meningitidis штамма 608 В (SEQ ID NO:2) или его ген(SEQ ID NO:1) не были описаны ранее. С. Высокоэффективная экспрессия и очистка рекомбинантного 22-кДа поверхностного белка Neisseria meningitidis. Для увеличения выхода и совершенствования способов очистки рекомбинантного 22-кДа поверхностного белка Neisseria meningitidis,экспрессируемого в Escherichia соli, был разработан следующий метод. Данный метод основан на том наблюдении, что рекомбинантный 22 кДа поверхностный белок, продуцируемый клетками Escherichia соli штамма BL21(DE3)(1986)], несущими плазмиду pNP2202, может быть обнаружен в больших количествах во внешней мембране, а кроме того, может быть получен из супернатанта культур, в котором данный белок является доминирующим. Таким образом, источником материала для очистки 22 кДа рекомбинантного белка аффинной хроматографией служил супернатант культур (фиг. 6 А). Для получения матрикса для аффинной хроматографии моноклональные антитела Ме-2,Ме-3 и Ме-5 (описаны в примере 2) иммобилизовывали на CNBr-активированной сефарозе 4 В 32 Для получения супернатанта культур ночную культуру клеток Eschenchia coli штаммаBL21(DE3), несущих плазмиду pNP2202, инокулировали в LB-бульон (Гибко Лабраториз,Грэнд Айленд, Нью-Йорк), содержащий 25 мг/мл ампициллина (Сигма), и инкубировали 4 часа при 37 С при встряхивании. Бактериальные клетки удаляли из культуральной среды двумя центрифугированиями при 10 000 g в течение 10 мин при 4 С. Культуральный супернатант фильтровали через фильтр 0,22 мкм (Миллипор,Бедфорд, Массачусетс) и затем концентрировали примерно в 100 раз с использованием ультрафильтрационной мембраны (Амикон Ко., Биверли, Массачусетс) с молекулярным порогом 10 000 дальтон. Для полной солюбилизации мембранных пузырьков к концентрированному культуральному супернатанту добавляли Empigen ВВ (Кэлбиохем Ко., Ла Холла, Калифорния)до конечной концентрации 1% (объем/объем). Суспензию инкубировали при комнатной температуре в течение одного часа, диализовали в течение ночи против нескольких литров 10 мМ Трис-НСl буфера, рН 7,3, содержащего 0,05% Empigen ВВ (объем/объем), и центрифугировали при 10 000 g 20 мин при 4 С. Затем к аффинному матриксу добавляли антиген и инкубировали ночь при 4 С и постоянном встряхивании. Гелевой массой заполняли хроматографическую колонку, которую затем тщательно промывали 10 мМ Трис-НСl буфером,рН 7,3, содержащим 0,05% Empigen ВВ (объем/объем). Рекомбинантный 22-кДа белок элюировали с колонки 1 М LiCl в 10 мМ ТрисНСl буфере, рН 7,3. Раствор, содержащий элюированный белок, затем диализовали против нескольких литров 10 мМ Трис-НСl буфера, рН 7,3, содержащего 0,05% Empigen ВВ. На каждом этапе процесса очистки для оценки чистоты рекомбинантного 22 кДа поверхностного протеина использовали SDS-PAGE с последующей окраской гелей Кумасси синим и серебром [Tsai(1982)]. Результаты представлены на фиг. 6 А. Окраска гелей серебром явно доказывает, что получен по существу очищенный рекомбинантный 22-кДа белок с очень небольшим количеством липополисахарида Escherichia coli. Исследовали также устойчивость очищенного рекомбинантного 22-кДа белка к протеолитическому расщеплению. Результаты данных исследований представлены на фиг. 6 В. Очищенный рекомбинантный 22-кДа поверхностный белок обрабатывали, как это описано в примере 1, -химотрипсином и трипсином в количестве 2 мг на мг белка и 2 IU протеиназы К на мг белка в течение 1 ч при 37 С и постоянном встряхивании. После ни одной из указанных обработок не отмечено уменьшения количества белка. В сравнении с указанным, частичное или полное расщепление в зависимости от выбранного фермента было отмечено для кон 33 трольного белка, которым в данном случае служил бычий сывороточный альбумин (БСА,Сигма). Кроме того, более длительная обработка теми же ферментами не приводила к модификации белка. Эти результаты свидетельствуют о том, что трансформированные клетки Escherichia coli могут экспрессировать полный рекомбинантный 22-кДа поверхностный белок и что этот белок так же высоко устойчив к действию трех упомянутых выше ферментов, как и нативный, обнаруживаемый в Neisseria meningitidis. Кроме того, очищенный рекомбинантный 22-кДа поверхностный белок, не встроенный во внешнюю мембрану Escherichia coli, все еще высоко устойчив к действию протеолитических ферментов. Авторы изобретения также изучали эффект обработки ферментами на антигенные свойства рекомбинантного 22-кДа белка. Как показали результаты ELISA и Вестерн иммуноблоттинга,описанные в примере 2 моноклональные антитела хорошо распознают рекомбинантный 22 кДа поверхностный белок, очищенный в соответствии с описанным выше методом (фиг. 6 С). Кроме того, реактивность моноклонального антитела Ме-5, также как и реактивность других моноклональных антител, специфичных к 22 кДа белку, по отношению к очищенному рекомбинантному 22-кДа поверхностному белку не изменялась в результате обработок ферментами. Это подтверждает вывод о том, что антигенные свойства рекомбинантного 22-кДа белка аналогичны таковым нативного белка. Данные, приведенные в примере 3, можно суммировать следующим образом: 1) были получены полные нуклеотидная и аминокислотная последовательности 22-кДа поверхностного белка Neisseria meningitidis(SEQ ID NO:1; SEQ ID NO:2); 2) N-концевое секвенирование нативного белка подтвердило, что клонирован был действительно ген 22-кДа белка Neisseria meningitidis; 3) данный белок не был описан ранее; 4) возможна трансформация такого хозяина, как Escherichia соli, и экспрессия рекомбинантного 22-кДа поверхностного белка Neisseriameningitidis с высоким выходом; 5) можно получить рекомбинантный белок, свободный от других молекул Neisseriameningitidis и практически свободный от компонентов, продуцируемых Escherichia соli; 6) очищенный рекомбинантный 22-кДа поверхностный белок Neisseria meningitidis остается высоко устойчивым к действию таких протеолитических ферментов, как -химотрипсин,трипсин и протеиназа К; и 7) антигенные свойства рекомбинантного 22-кДа белка сравнимы с таковыми, описанными для нативного 22-кДа поверхностного белка 34 Пример 4. Молекулярная консервативность гена, кодирующего 22-кДа поверхностный белок Neisseria meningitidis. Для исследования молекулярной консервативности гена, кодирующего 22-кДа поверхностный белок Neisseria meningitidis у различных изолятов Neisseria, проводят дот-блот гибридизацию ДНК при использовании различных штаммов Neisseria и бактерий других видов. Ген размером 525 пар оснований, кодирующий 22 кДа поверхностный белок Neisseria meningitidis,амплифицируют с помощью ПЦР, очищают в геле агарозы и метят выборочным праймированием с применением нерадиоактивной системыDIG (Берингер Маннхайм, Лаваль, Канада), согласно инструкции производителя. Дот-блот тест ДНК осуществляют согласно инструкции производителя (Берингер Маннхайм). Бактериальные клетки штаммов, предназначенных для анализа, наносят на положительно заряженный найлоновый фильтр (Берингер Маннхайм), высушивают и затем обрабатывают согласно инструкции к набору DIG System для переноса колоний. Прегибридизацию и гибридизацию проводят при 42 С в растворе, содержащем 50% формамида (Сигма). Прегибридизационный раствор также содержит 100 мг/мл денатурированной ДНК спермы лосося (Берингер Маннхайм) в качестве дополнительного блокирующего агента для предотвращения неспецифической гибридизации ДНК-зонда. Процедуры отмывания и этапы детекции с помощью хемилюминесцентного субстрата PPD выполняют согласно инструкции производителя системы DIG. Для 71 штамма Neisseria meningitidis результаты, полученные с применением моноклонального антител Ме-7 и ДНК-зонда размером 525 пар оснований, практически полностью совпадают. Согласно этим результатам, все исследованные штаммы Neisseria meningitidis имеют ген, кодирующий 22-кДа поверхностный белок Neisseria meningitidis, и экспрессируют данный белок, поскольку все они распознаются моноклональным антителом Ме-7. Указанное подтверждает высокую консервативность данного белка среди изолятов Neisseria meningitidismeningitidis, во всех исследованных штаммахNeisseria gonorrhoeae. Наоборот, моноклональное антитело Ме-7 реагирует только с 2 из 16 исследованных штаммов Neisseria gonorrhoeae. Следовательно,специфический эпитоп отсутствует, недоступен или модифицирован у Neisseria gonorrhoeae, или же большинство штаммов Neisseria gonorrhoeae не экспрессирует данный белок при том, что кодирующая его последовательность присутствует в их геноме (таблица 2). 35 Четкая корреляция между двумя методами детекции наблюдается также и в случае Neisseria lactamica, поскольку обнаружен только один штамм Neisseria lactamica, содержащий ген, но не экспрессирующий белок (таблица 2). Этот результат может иметь объяснение, аналогичное приведенному выше. Следовательно, хотя 22-кДа белок не экспрессируется или не доступен на поверхности большинства штаммов Neisseria gonorrhoeae,ген, кодирующий 22-кДа белок Neisseria gonorrhoeae и Neisseria lactamica, может быть использован при конструировании рекомбинантных плазмид, используемых для последующего получения 22-кДа поверхностного белка или его аналогов. Все подобные белки или их аналоги могут быть использованы для предотвращения,обнаружения или диагностики инфекции Neisseria. В частности, подобный подход дает возможность различить инфекции, вызванные Neisseria meningitidis, Neisseria gonorrhoeae и Neisseria lactamica. Таким образом, 22-кДа поверхностный белок или его аналоги могут быть использованы для получения вакцины против подобных инфекций. Кроме того, 22-кДа белок или его аналоги могут быть использованы для получения наборов для диагностики и обнаружения подобных инфекций. Результаты, полученные для штаммов Moraxella catharralis, показывают, что из 5 исследованных штаммов 3 реагировали с моноклональным антителом Ме-7, но ни один из них не реагировал с ДНК-зондом, что указывает на отсутствие гена 22-кДа поверхностного белка Neisseria meningitidis в геноме данных штаммов (таблица 2). Были исследованы также другие видыNeisseria и бактерии других видов (см. сноску к таблице 2), но ни один из этих видов не оказался положительным ни в одном из двух тестов. Последний результат свидетельствует о том, что ген 22-кДа поверхностного белка является общим только для близкородственных видов Neisseriacae. Таблица 2. Реактивность ДНК-зонда размером 525 пар оснований и моноклонального антитела Ме-7 с различными видами Neisseria Виды Neisseria Число определяемых штаммовNeisseria lactamica (5) 4 5 Следующие виды Neisseria и бактерии других видов были также проверены двумя указанными тестами и дали отрицательные результаты: 1 Neisseria cinerea, 1 Neisseria Гибридизационный анализ с использованием ДНК-зонда четко указывает на тот факт,что ген, кодирующий 22-кДа поверхностный белок Neisseria meningitidis, является высококонсервативным среди патогенных Neisseria. Кроме того, полученные результаты свидетельствуют о том, что использованный ДНК-зонд может стать полезным инструментом для быстрого и прямого обнаружения патогенных бактерий Neisseria в клинических образцах. Указанный ДНК-зонд может быть усовершенствован таким образом, чтобы обнаруживать различия между Neisseria meningitidis и Neisseria gonorrhoeae. Пример 5. Бактериолитические и протективные свойства моноклональных антител. Бактериолитическую активность очищенных моноклональных антител, специфичных к 22-кДа поверхностному белку Neisseria meningitidis, оценивают in vitro согласно методике,описанной ранее [Broudeur et al., Infect. Immun.,50, р.510 (1985); Martin et al., Infect. Immun., 60,p.2718 (1992)]. В присутствии комплемента из сыворотки морских свинок очищенные моноклональные антитела Ме-1 и Ме-7 эффективно"убивают" бактерий Neisseria meningitidis штамма 608 В. Относительно низкие концентрации каждого из указанных моноклональных антител снижают число жизнеспособных бактерий более, чем на 50%. Использование более высоких концентраций очищенных моноклональных антител Ме-1 и Ме-7 приводит к резкому снижению (до 99%) числа бактериальных колониеобразующих единиц. Примечательно,что бактериолитическая активность данных моноклональных антител является комплементзависимой, поскольку инактивация сыворотки морских свинок в течение 30 мин при 56 С полностью снимает бактерицидную активность антител. Другие моноклональные антитела не обладают значительной бактериолитической активностью по отношению к указанному штамму бактерий. Совокупность результатов нескольких экспериментов представлена на фиг. 7. При этом, приведенные для моноклонального антитела Ме-7 результаты совпадают с таковыми,полученными для антитела Ме-1. Результаты,приведенные для моноклонального антитела Ме-2, совпадают с результатами, полученными для моноклональных антител Ме-3, Ме-5 и Ме 6. Для оценки протективной активности каждого моноклонального антитела осуществляют экспериментальное заражение мышей, как описано ранее одним из заявителей [Brouder et al.,Infect. Immun., 50, р. 510 (1985); Brouder et al., 37Can. J. Microbiol., 32, p.33 (1986)]. За 18 ч до заражения мышам линии Balb/c вводят внутрибрюшинно 600 мкл асцитной жидкости, содержащей моноклональные антитела. Затем мышей заражают введением 1 мл бактериальной суспензии, содержащей 1000 колоние образующих единиц Neisseria meningitidis штамма 608 В, 4% муцина (Сигма) и 1,6% гемоглобина (Сигма). Суммированные результаты нескольких экспериментов приведены в таблице 3. Необходимо отметить, что только бактериолитические моноклональыне антитела Ме-1 и Ме-7 защищают мышей от экспериментального заражения Neisseria meningitidis. Введение до бактериального заражения асцитной жидкости, содержащей два указанные моноклональные антитела, значительно (до 70% и выше) повышает число выживших мышей Balb/c в сравнении с 9% для мышей контрольных групп, которым вводят 600 мкл асцитной жидкости, индуцированной клетками Sp2/0, или 600 мкл асцитной жидкости,содержащей посторонние моноклональные антитела. Около 80% мышей выживают при заражении, если за 18 ч до инъекции бактерий им вводят 400 мкг отчищенных при помощи белка А антител Ме-7. В настоящее время проводятся эксперименты с целью определения минимальной концентрации антител, достаточной для выживания 50% зараженных мышей. Более низкий процент выживаемости (от 20 до 40%) был получен для других моноклональных антител,специфичных к 22-кДа поверхностному белкуNeisseria meningitidis. Таблица 3. Оценка иммунопротективного потенциала моноклональных антител, специфичных к 22-кДа поверхностному белку Neisseria Число живых мышей после введения 24 ч 72 ч 29/30 23/30 17/20 3/20 5/10 2/10 11/20 8/20 10/10 7/10 13/15 12/15 31/100 9/100 Приведенные результаты явно свидетельствуют о том, что антитела, специфичные к 22 кДа поверхностному белку Neisseria meningitidis, могут эффективно защищать мышей при экспериментальном летальном заражении. Индукция антигеном протективных антител является наиболее важным критерием при отборе потенциальных кандидатов для получения вакцины. Пример 6. Иммунизация очищенным рекомбинантным 22-кДа поверхностным белком обеспечивает защиту от последующего бактериального заражения. Рекомбинантный 22-кДа поверхностный белок очищают согласно методике, представ 38 ленной в примере 1, и используют для иммунизации мышей Balb/c с целью определения его протективного эффекта против заражения летальной дозой Neisseria meningitidis штамма 608 В (В:2 а:Р 1.2). Было решено использовать рекомбинантный очищенный белок вместо нативного менингококкового белка, чтобы исключить возможность присутствия других менингококковых антигенов в вакцинных препаратах,используемых в данных экспериментах. Модель инфекции на мышах, используемая в данных экспериментах, была описана ранее одним из заявителей [Brouder et al., Infect. lmmun., 50,р.510 (1985); Brouder et al., Can. J. Microbiol., 32,р.33 (1986)]. Мышам трехкратно подкожно вводили с трехнедельными интервалами 100 мкл антигенного препарата, содержащего 10 или 20 мкг очищенного рекомбинантного 22-кДа поверхностного белка. В данных опытах применяли в качестве адъюванта QuilA в количестве 25 мкг на инъекцию. Мышам контрольной группы по той же схеме вводили 10 или 20 мкг бычьего сывороточного альбумина, 20 мкг концентрированного культурального супернатанта клетокEscherichia coli штамма BL21 (DE3), несущих плазмиду pWKS30 без вставки гена менингококкового белка, и приготовленного, как описано в примере 3, или фосфатный буферный раствор. Для оценки динамики развития иммунного ответа перед каждой инъекцией у мышей брали образцы сыворотки. Через две недели после третьей инъекции мышам всех групп вводили внутрибрюшинно 1 мл суспензии, содержащей 1000 колониеобразующих единиц Neisseriameningitidis штамма 608 В (В:2 а:Р 1.2) в 4% муцине (Сигма) и 1,6% гемоглобине (Сигма). Результаты данных экспериментов представлены в таблице 4. Восемьдесят процентов(80%) мышей, иммунизированных очищенным рекомбинантным 22-кДа поверхностным белком, пережили бактериальное заражение в сравнении с 0-42% в контрольных группах. Важно,что мыши контрольной группы, которым вводили концентрированный супернатант культурыEscherichia coli, не были защищены от бактериальной инфекции. Последний результат свидетельствует о том, что компоненты культуральной среды и антигены Escherichia coli, которые в небольших количествах могут оставаться после очистки, не вносят вклада в наблюдаемую защиту от Neisseria meningitidis. Таблица 4. Иммунизация очищенным рекомбинантным 22-кДа поверхностным белком обеспечивает защиту от последующего бактериального заражения Neisseria meningitidis штамма 608 В (В:2 а: Р 1.2) Эксперимент Число живых мышей после заражения 20 мкг очищенного 22-кДа белка 20 мкг конц. супернатанта E.coli 20 мкг БСА Фосфатный буферный раствор Заключение Введение очищенного рекомбинантного 22-кДа поверхностного белка в значительной степени защищает иммунизированных мышей от развития летальной инфекции Neisseria meningitidis. Примерами заявленных в настоящем изобретении антител могут служить моноклональные антитела Ме-1 и Ме-7, продуцируемые гибридомными клеточными линиями, депонированными в Американской коллекции клеточных культур в Роквилле, Мериленд, США, 21 июля 1995. Депоненты получили номера НВ 11959 (Ме-1) и НВ 11958 (Ме-7). Пример 7. Анализ последовательностей других штаммов Neisseria meningitidis и Neisseria gonorrhoeae. Из геномной ДНК различных штаммовClalрестрикционный фрагмент, содержащий ген,который кодирует 22-кДа поверхностный белок,как это описано в примере 3. а) штамм МСН 88: нуклеотидная последовательность штамма МСН 88 (клинический изолят) представлена на фиг. 8 (SEQ ID NO:3). Из экспериментальных данных, полученных для штамма 608 В (пример 3), была выведена предполагаемая лидерная последовательность, соответствующая аминокислотам с -19 до -1 (М-КK-A-L-A-A-L-I-A-L-A-L-P-A-A-A-L-A). Поиск,проведенный с использованием доступных баз данных, показал, что 22-кДа поверхностный белок Neisseria meningitidis штамма МСН 88(SEQ ID NO: 4) или кодирующий его ген (SEQID N0:3) не были описаны ранее. б) штамм Z4063: нуклеотидная последовательность штамма Z4063 [Wang et al., Infect.Immun., 60, p.5267 (1992)] представлена на фиг. 9 (SEQ ID NO:5). Из экспериментальных данных, полученных для штамма 608 В (пример 3),была выведена предполагаемая лидерная последовательность, соответствующая амнокислотам с -19 до -1 (M-K-K-A-L-A-A-L-I-A-L-A-L-P-AA-A-L-A). Поиск, проведенный с использованием доступных баз данных, показал, что 22-кДа поверхностный белок Neisseria meningitidis штамма Z4063 (SEQ ID NO:6) или кодирующий его ген (SEQ ID NO:5) не были описаны ранее. в) штамм b2 Neisseria gonorrhoeae: нуклеотидная последовательность штамма b2 NeisseriaNeisseria, LCDC, Оттава, Канада) представлена на фиг. 10 (SEQ ID NO:7). Из экспериментальных данных, полученных для штамма 608 В(пример 3), была выведена предполагаемая ли 40 дерная последовательность, соответствующая аминокислотам с -19 до -1 (M-K-K-A-L-A-A-L-IA-L-A-L-P-A-A-A-L-A). Поиск, проведенный с использованием доступных баз данных, показал, что 22-кДа поверхностный белок Neisseriagonorrhoeae штамма b2 (SEQ ID NO:8) или кодирующий его ген (SEQ ID NO:7) не были описаны ранее. На фиг. 11 приведена консенсусная последовательность, полученная на основе последовательностей ДНК всех четырех исследованных штаммов. Для штамма МСН 88 показана вcтавка кодона (ТСА) в положении нуклеотида 217, но в целом для четырех штаммов характерна поразительная гомология. Фиг. 12 отражает гомологию между выведенными аминокислотными последовательностями для четырех штаммов. Показана более чем 90% идентичность данных последовательностей. Пример 8. Иммунологический ответ кроликов и обезьян на 22-кДа поверхностный белокNeisseria meningitidis. Кроликов и обезьян иммунизировали рекомбинантным 22-кДа белком для получения антительного ответа у представителей биологических видов, отличных от мышей. а) Кролики. Самцов новозеландских кроликов иммунизировали препаратами внешних мембран, полученными из E.coli штамма JM109, несущей плазмиду pNP2202 или контрольную плазмидуpWKS30 (штамм и плазмиды описаны в примере 1). Для получения этих препаратов внешних мембран применяли экстракцию хлоридом лития, описанную ранее заявителями [Brouder etal., Infect. Immun. 50,510 (1985)]. Содержание белка в данных препаратах определяли по методу Лоури, адаптированному для мембранных фракций [Lowry et al., J. Biol. Chem. 193, р.265(1951)]. Кроликам вводили подкожно или внутримышечно в разные места дважды с трехнедельным интервалом по 150 мкг один из описанных выше препаратов внешних мембран. Для иммунизации использовали адъювант QuilА(Седарлэйн Лабораториз, Хорнби, Онтарио, Канада). О развитии специфического гуморального ответа судили по результатам ELISA с применением в качестве покрывающего антигена препаратов внешних мембран, выделенных изNeisseria meningitidis штамма 608 В (В:2 а:Р 1.2) и по результатам Вестерн-иммуноблоттинга, как это описано ранее заявителями [Brouder et al.,Infect. Immunol. 18, 601 (1988)]. В данных тестах применяли ослиные анти-кроличьи иммуноглобулины, меченные щелочной фосфатазой или пероксидазой (Джексон Иммьюноресерч Лабораториз, Уэст Гроув, Пенсильвания). Инъекция препарата внешних мембран Е.соli, содержащего 22-кДа рекомбинантный белок, в сочетании с QuilA адъювантом вызывала у кроликов сильный гуморальный ответ с 41 титром антител 1/32 000, как это показали результаты ELISA (фиг. 13). Антитела, индуцированные введением рекомбинантного 22-кДа белка, реагируют с очищенным рекомбинантным 22-кДа белком, но, что более важно, они также распознавали нативный белок, экспрессированный, собранный и "вмонтированный" на внешней мембране Neisseria meningitidis. Результаты Вестерн-иммуноблоттинга четко указывают на то, что антитела, взятые у кроликов после второй инъекции, распознают на нитроцеллюлозных фильтрах ту же самую белковую полосу, что и моноклональные антитела Ме-2(описаны в примере 2), которые специфичны к 22-кДа белку. б) Обезьяны. Двух обезьян Масаса fascicularis (циномолгус) иммунизировали двухкратным введением соответственно по 100 мкг (К 28) и 200 мкг(I276) аффинно очищенного рекомбинантного 22-кДа белка. Методики, использованные для получения и очистки белка из E.coli штаммаBL21De3 описаны в примере 3. Для данных иммунизаций использовали в качестве адъюванта альгидрогель в конечной концентрации 20%(объем/объем) (Седарлэйн Лабораториз, Хорнби, Онтарио, Канада). Обезьянам делали две внутримышечные инъекции с трехнедельным интервалом. Контрольную обезьяну (К 65) иммунизировали препаратом постороннего рекомбинантного белка по той же схеме. Сыворотки анализировали как описано выше. В данных тестах применяли козьи античеловеческие иммуноглобулины, меченные щелочной фосфатазой или пероксидазой (Джексон Иммьюноресерч Лабораториз, Уэст Гроув, Пенсильвания). Специфический антительный ответ обезьяны К 28, которую иммунизировали 100 мкг очищенного белка на инъекцию, проявился быстрее и был сильнее, чем ответ обезьяны I276,которой вводили по 200 мкг белка (фиг. 14). Из результатов Вестерн-иммуноблоттинга следует,что антитела, специфичные к нативному 22-кДа белку, также присутствовали в сыворотках иммунизированных обезьян спустя двадцать один день после первой инъекции, но отсутствовали в сыворотке контрольной обезьяны после двух введений контрольного антигена. Выводы Представленные в примерах 2 и 5 результаты четко показывают, что введение рекомбинантного 22-кДа белка может индуцировать у мышей защитный гуморальный ответ, который направлен против штаммов Neisseria meningitidis. Что более важно, приведенные в настоящем примере результаты показывают, что иммунологический ответ не ограничивается одним биологическим видом, а рекомбинантный поверхностный белок может также стимулировать иммунную систему таких видов, как кролик или обезьяна. 42 Пример 9. Картирование эпитопов 22-кДа белка Neisseria meningitidis. Картирование эпитопов 22-кДа белка Neisseria meningitidis проводили по методу, описанному ранее одним из заявителей [Martin et al.,Infec. Immun. (1991): 59:1457-1464). Идентификацию линейных эпитопов проводили с использованием 18-ти перекрывающихся синтетических пептидов, перекрывающих всю последовательность 22-кДа белка Neisseria meningitidis штамма 608 В (фиг. 15), и гипериммунных сывороток, полученных после иммунизации данным белком. Идентификация иммунодоминантных частей 22-кДа белка может оказаться полезной при конструировании новых эффективных вакцин. Кроме того, локализация этих В-клеточных эпитопов дает ценную информацию о структурной конфигурации белка во внешней мембранеNeisseria meningitidis. Все пептиды были синтезированы компанией Байокем Иммьюносистемз Инк. (Монреаль, Канада) на автоматическом пептидном синтезаторе Эпплайд Байосистемз (Фостер Сити,Калифорния). Синтетические пептиды очищали обратнофазовой жидкостной хроматографией высокого давления. Пептиды CS-845, CS-847,CS-848, CS-851, CS-852 и CS-856 (фиг. 15) солюбилизировали в в малом объеме 6 М гуанидин-НСl (Дж.Т. Бейкер, Онтарио, Канада) или диметилсульфоксида (Дж.Т. Бейкер). Концентрацию пептидов доводили до 1 мг/мл дистиллированной водой. Остальные пептиды были легкорастворимы в дистиллированной воде и их концентрацию также доводили до 1 мг/мл. Для проведения ELISA синтетические пептиды наносили на плашки для микротитрования(Иммулон 4, Дайнатек Лабораториз Инк., Шантилли, Вашингтон) в концентрации 50 мкг/мл в 50 мМ карбонатном буфере рН 9.6. После инкубации в течение ночи при комнатной температуре плашки отмывали фосфатным буферным раствором(вес/объем) твин 20 (Сигма Кемикал Ко.,Ст.Луис), и блокировали PBS, содержащим 0,5% (вес/объем) бычьего сывороточного альбумина (Сигма). Мышиные и обезьяньи антисыворотки, полученные после иммунизации аффинно очищенным рекомбинантным 22-кДа белком, разводили и по 100 мкл каждого разведения вносили в лунки плашек для ELISA, которые затем инкубировали 1 ч при 37 С. Плашки ополаскивали три раза и наносили по 100 мкл на лунку антимышиных или античеловеческих иммуноглобулинов, конъюгированных с щелочной фосфатазой (Джексон ИммьюноРесерч Лабораториз, Уэст Гроув, Пенсильвания) в разведениях,рекомендованных производителем. После инкубации при 37 С в течение 1 ч плашки ополаскивали и добавляли по 100 мкл на лунку диэтаноламина (10%, объем/объем, рН 9,8), содержащего р-нитрофенил фосфат (1 мг/мл, Сигма). Через 43 60 мин реакцию учитывали спектрофотометрически при длине волны 410 нм. Мышиные и обезьяньи антисыворотки, полученные после иммунизации аффинноочищенным рекомбинантным 22-кДа белком (пример 8), были успешно использованы в сочетании с восемнадцатью перекрывающимися синтетическими пептидами для локализции на белке Вклеточных эпитопов. Данные эпитопы собраны на белке в три антигенных домена. Первая область была локализована между аминокислотными остатками 51 и 86. Компьютерный анализ с использованием различных алгоритмов дает основания полагать, что данная область с высокой вероятностью иммунологически значима, поскольку она гидрофильна и экспонирована на поверхности. Кроме того,сравнение четырех белковых последовательностей, представленных на фиг. 12, показывает,что одна из главных вариаций, а именно вставка амикислотного остатка в положении 73, также расположена в указанном домене. При помощи антисывороток был идентифицирован второй антигенный домен, расположенный между аминокислотными остатками 110 и 140. Примечательно, что семь из четырнадцати аминокислотных остатков, не являющихся консервативными среди четырех белковых последовательностей, расположены именно в этом домене. Третий антигенный домен расположен в высококонсервативной области белка между аминокислотными остатками 31 и 55 и распознается только обезьяньими сыворотками. Пример 10. Температурo-индуцибельный вектор экспрессии для крупномасштабного получения 22-кДа поверхностного белка. Ген, кодирующий 22-кДа поверхностный белок Neisseria meningitidis, был введен в плазмиду р 629 [George et al., Bio/technology 5: 600603 (1987)]. Кассета температуро-чувствительного гена-репрессора бактериофагасl857,из которой делетирован функциональный промотор PL, была встроена в плазмиду р 626, в которой промотор PL контролирует синтез 22 кДа поверхностного белка. Инактивация репрессора сl587 сдвигом температуры от 30 до 38 С и выше приводит к образованию белка,кодируемого плазмидой. Индукция экспрессии гена в клетках E.coli температурным сдвигом является преимуществом при крупномасштабной ферментации, поскольку в современных ферментерах воспроизвести такой сдвиг весьма просто. В случае других индуцибельных векторов экспрессии для индукции экспрессии желаемого гена обычно требуется добавление специальных веществ, таких как лактоза или изопропилтио-бета-D-галактозид (IPTG). Из геномной ДНК Neisseria meningitidis штамма 608 В был амплифицирован 540 нуклеотидный фрагмент с применением ПЦР со следующими олигонуклеотидными праймерами:AAGACTTCTAGATTA-5'). Данные праймеры соответствуют нуклеотидным последовательностям, обнаруживаемым на обоих концах гена 22-кДа белка. Для упрощения клонирования продукта ПЦР в нуклеотидную последовательность данных праймеров был введен сайт рестрикции ВgIII (AGATCT). Перед рестрикцией ВgIII, продукт ПЦР очищали электрофорезом в геле агарозы. Фрагмент приблизительно в 525 пар оснований, полученный после рестрикции ПЦР-продукта рестриктазой ВgIII, клонировали по сайтам ВgIII и BamHI в плазмиду р 629. Плазмида, содержащая данную вставку, была обозначена, как pNP2204 и использована для трансформации Е.соli штамма DH5F'IQ. На фиг. 16 приведена частичная карта плазмидыpNP2204. Полученные в результате трансформации бактериальные колонии скринировали на наличие 22-кДа поверхностного белка Neisseriameningitidis при помощи моноклональнах антител, описанных в примере 2. Анализ полученных клонов Вестерн-блоттингом четко показал,что синтезируемый Е.соli белок является полным и мигрирует в SDS-PAGE гелях аналогично нативному 22-кДа поверхностному белку Neisseria meningitidis. Из отобранного клона выделяли плазмидную ДНК, которую затем секвенировали. Нуклеотидная последовательность вставки, присутствующей в плазмиде, полностью совпадает с нуклеотидной последовательностью гена, кодирующего 22-кДа поверхностный белок Neisseria meningitidis, представленной на фиг. 1. Для изучения уровня синтеза 22-кДа поверхностного белка, температуро-индуцибельной плазмидой pNP2204 трансформировалиE.coli следующих штаммов: W3110, JM105,BL21, ТОРР 1, ТОРР 2 и ТОРР 3. Для каждого штамма определяли уровень синтеза 22-кДа поверхностного белка и его локализацию в различных клеточных фракциях. Культивирование бактерий в колбах при встряхивании в LB бульоне (Гибко БРЛ, Лайф Текнолоджиз, Грэнд Айленд, Нью-Йорк) показало, что температурный сдвиг от 30 С до 39 С эффективно индуцирует экспрессию гена. Временная оценка уровня синтеза белка при помощи SDS-PAGE показывает,что белок появляется уже через 30 мин после начала индукции и количество его постоянно возрастает во время всего периода индукции. Для штаммов Е.соli W3110 и ТОРР 1 были определены уровни экспрессии от 8 до 10 мг 22-кДа белка на литр культуры. В случае обоих штаммов основная масса 22-кДа белка была включена во внешнюю бактериальную мембрану. Пример 11. Очистка 22-кДа белка Neisseriameningitidis. Поскольку основная масса 22-кДа белка включена во внешнюю мембрану клеток Е.соli схема очистки, представленная в настоящем 45 примере, отличается от схемы, описанной в примере 3, где большие количества белка выделялись в культуральный супернатант. Ночную культуру E.coli штаммов W3110 или ТОРР 1,несущих плазмиду pNP2204, выращенную при 30 С, инокулировали в LB бульон, содержащий 50 мг/мл ампициллина (Сигма), и выращивали при 30 С и постоянном встряхивании (250 об/мин) до достижения плотности клеток 0.6 (= 600 нм). В этой точке температуру инкубации поднимали до 39 С на три-пять часов для индукции образования белка. Бактериальные клетки собирали центрифугированием при 8 000 g в течение 15 мин при 4 С и дважды промывалиPBS рН 7,3. Бактериальные клетки разрушали ультразвуком (можно использовать также баллистическую дезинтеграцию или механическую дезинтеграцию при помощи пресса Френча). Неразрушенные клетки удаляли центрифугированием при 5 000 д в течение 5 мин и отбрасывали. Внешние мембраны отделяли от компонентов цитоплазмы центрифугированием при 100 000 g в течение 1 ч при 10 С. Содержащий мембраны осадок ресуспендировали в небольшом объеме PBS рН 7,3. Для солюбилизации 22 кДа поверхностного белка из мембран использовали такие детергенты как Еmрigen ВВ (Кэлбиохем Ко, Ла Холла, Калифорния), цвиттергент-3,14 (Кэлбиохем Ко) или бета-октилгликозид (Сигма). Детергент добавляли к фракции мембран до конечной концентрации 3% и смесь инкубировали при 20 С 1 ч. Нерастворимый материал удаляли центрифугированием при 100 000 g 1 ч при 10 С. 22-кДа белок эффективно солюбилизировался любым из трех приведенных выше детергентов, однако бета-октилгликозид имел преимущество, состоящее в легкости удаления отдельных нежелательных мембранных белков,поскольку они не солюбилизировались и могли быть отделены от супернатанта центрифугированием. Для удаления детергента супернатант,содержащий 22-кДа белок, продолжительно диализовали против PBS, несколько раз заменяя буфер. Для последующего удаления нежелательных белков из препарата 22-кДа поверхностного белка может быть использована обработка протеиназой К (как это описано в примере 1). Дифференциальная преципитация сульфатом аммония или органическими растворителями, а затем ультрафильтрация - вот две дополнительные стадии, которые предпочтительно использовать для удаления нуклеиновых кислот и липополисахаридов прежде, чем применять гельэлектрофорез и ионообменную хроматографию для получения очищенного 22-кДа белка. Для очистки 22-кДа белка может быть также применена аффинная хроматография, как это описано в примере 3. Пример 12. Применение 22-кДа поверхностного белка в качестве вакцины для человека. 46 При определении состава вакцины для человека могут быть использованы соответствующие антигены 22-кДа поверхностного белка,выбранные из описанных в настоящем изобретении полипептидов. Например, квалифицированный специалист может сконструировать вакцину на основе 22-кДа полипептида или его фрагментов, содержащих иммуногенный эпитоп. Применение молекулярно-биологических методов особенно предпочтительно при получении препаратов высокоочищенных рекомбинантных белков. Вакцина может быть представлена различными фармакологическими формами, которые могут включать твердые, полутвердые и жидкие формы, такие как порошки, жидкие растворы или суспензии, и липосомы. Исходя из убеждения авторов, что антигены 22 кДа поверхностного белка, описанного в настоящем изобретении, при введении человеку вызывают протективный иммунный ответ, можно предложить состав вакцины, аналогичный таковому в случае вакцин на основе других иммунизирующих белков, например, столбнячных и дифтерийных. Таким образом, заявленые вакцинные композиции должны предпочтительно включать: фармацевтически приемлемый адъювант, такой как неполный адъювант Фрейнда, гидроокись алюминия, мурамил пептид, водно-масляную эмульсию, липосомы, ISCOM или СТВ, или нетоксичную В-субъединичную форму холерного токсина. Наиболее предпочтительно, чтобы в состав вакцины входила водно-масляная эмульсия или гидроокись алюминия в качестве адъюванта. Иммуногенная композиция может быть введена пациенту любым фармакологически приемлемым путем, включая внутримышечное,внутрикожное, подкожное введение, аппликации или другие способы. Предпочтительно вводить вакцину внутримышечно. В целом иммунизация обычно состоит из нескольких инъекций. Первоначальная доза,предпочтительно с адъювантом, содержит от 0,01 до 10 мг (лучше - от 0,1 до 1,0 мг) антигенного 22-кДа поверхностного белка. Затем должны следовать одна или несколько бустерных инъекций. Бустерные инъекции предпочтительно проводить через 1 и 6 месяцев после первоначальной инъекции. При разработке вакцины необходимо учитывать возможность генерации серозного иммунитета. Идеальная серозная вакцина должна быть безопасной при оральном и интраназальном однократном или многократном применении и, наряду с системным иммунитетом, должна обеспечивать сосредоточение защитных антител на соответствующих слизистых поверхностях. В состав серозной вакцины могут входить адъюванты, инертные частицы-носители или живые рекомбинантные векторы. 47 Антитела к 22-кДа поверхностному белку,описанные в настоящем изобретении, могут быть использованы для пассивной иммунотерапии и иммунопрофилактики людей, инфицированных Neisseria meningitidis или такими родственными бактериями, как Neisseria gonorrhoeae или Neisseria lactamica. Дозировка и способы введения вакцин для такой пассивной иммунизации обычно аналогичны таковым в случае пассивной иммунотерапии других инфекций. Примерами антител, описанных в настоящем изобретении, могут служить моноклональные антитела Ме-1 и Ме-7, продуцируемые гибридомами, которые депонированы в Американской Коллекции клеточных культур в Роквилле,Мэриленд, США, 21 июля 1995 года и обозначены как мышиные гибридомные клеточные линии Ме-1 и Ме-7 соответcтвенно. Данные депозиты получили номера НВ 11959 (Ме-1) и НВ 11958 (Ме-7). При том что в материалах заявки приведены отдельные варианты осуществления изобретения, очевидно, что они могут быть модифицированы при использовании заявленных способов. Таким образом, объем притязаний настоящего изобретения включает все альтернативные варианты его осуществления и модификации, охватываемые описанием и формулой изобретения. Изобретение не может быть ограничено отдельными вариантами осуществления,приведенными здесь в качестве примеров. Список последовательностей(I) ЗАЯВИТЕЛЬ: Бродор Бернар Р. Мартэн Денис Риу Клеман Хамел Хосе(II) НАЗВАНИЕ ИЗОБРЕТЕНИЯ: Выделенный по существу очищенный поверхностный антиген белковой природы Neisseria и фрагмент этого антигена. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенный, по существу очищенный,высокоустойчивый к протеиназе K поверхностный антиген белковой природы Neisseria meningitidis мол. массы 22 кДа, определенной методом гель-электрофореза в полиамидном геле,иммунологически доступный в клетках более 57 чем 50%, в частности примерно 99%, известных штаммов N. meningitidis, или выделенный, по существу очищенный, высокоустойчивый к протеиназе K поверхностный антиген белковой природы Neisseria gonorrhoeae мол. массы 22 кДа, определенной методом гель-электрофореза в полиамидном геле. 2. Поверхностный антиген белковой природы N. meningitidis по п.1, отличающийся тем,что его иммунологическая доступность в клетках штамма определяется при использовании агглютинационного теста, ELISA, радиоиммунологического теста, иммуноблоттинга, дотэнзим теста, теста на поверхностную доступность или комбинацию данных тестов. 3. Поверхностный антиген белковой природы N. meningitidis по п.1, отличающийся тем,что он иммунологически доступен в клетках штамма 608 В N. meningitidis и имеет следующую аминокислотную последовательность:meningitidis по п.1, отличающийся тем, что он иммунологически доступен в клетках штаммаZ4063 N. meningitidis и имеет следующую аминокислотную последовательность:(SEQ ID No:6). 6. Выделенный, по существу очищенный,поверхностный антиген белковой природы N.gonorrhoeae по п.1, отличающийся тем, что он иммунологически доступен в клетках штаммаb2 N. gonorrhoeae и имеет следующую аминокислотную последовательность:(SEQ ID No:2). 4. Выделенный, по существу очищенный,поверхностный антиген белковой природы N.meningitidis по п.1, отличающийся тем, что он иммунологически доступен в клетках штамма МСН 88 N. meningitidis и имеет следующую аминокислотную последовательность:(SEQ ID No:8). 7. Фрагмент антигена по любому из пп.1-6,обладающий иммунологической активностью данного антигена. 8. Последовательность ДНК, кодирующая антиген или фрагмент антигена по любому из пп.1-7, выбранная из группы, включающей: а) последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме 608 В Neisseria meningitidis, которая имеет следующую последовательность нуклеотидов:(SEQ ID No:4). 5. Выделенный, по существу очищенный,поверхностный антиген белковой природы N.(SEQ ID No:1),б) последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме МСН 88 Neisseriameningitidis, которая имеет следующую последовательность нуклеотидов:(SEQ ID No:3),в) последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме Z4063 Neisseria meningitidis, которая имеет следующую последовательность нуклеотидов:(SEQ ID No:5),г) последовательность ДНК, кодирующую антиген или фрагмент антигена, иммунологически доступный в штамме b2 Neisseria gonorrhoeae, которая имеет следующую последовательность нуклеотидов:
МПК / Метки
МПК: G01N 33/569, C12Q 1/68, C12N 15/31, C07K 14/22, A61K 38/16, C12N 1/21
Метки: gonorrhoeae, существу, очищенные, фрагменты, поверхностные, neisseria, meningitidis, природы, последовательности, белковой, днк, антигены, выделенные
Код ссылки
<a href="https://eas.patents.su/30-1789-vydelennye-po-sushhestvu-ochishhennye-poverhnostnye-antigeny-belkovojj-prirody-neisseria-meningitidis-i-neisseria-gonorrhoeae-ih-fragmenty-i-posledovatelnosti-dnk.html" rel="bookmark" title="База патентов Евразийского Союза">Выделенные, по существу очищенные, поверхностные антигены белковой природы neisseria meningitidis и neisseria gonorrhoeae, их фрагменты и последовательности днк</a>
Предыдущий патент: Насадка для поточного цитометра с высокоэффективной сортировкой клеток
Следующий патент: Катанка, приспособленная для использования в качестве усиливающего элемента
Случайный патент: Способ формирования монокристаллической структуры и кремниевый материал, стойкий к воздействию н и он












