Полимер и способ его получения, фармацевтическая композиция в форме наночастиц, способ и набор для ее получения и способ лечения патологических состояний у людей или животных
Номер патента: 17682
Опубликовано: 28.02.2013
Авторы: Сингх Шобхит, Хаттар Дхирадж, Прустхи Дипак, Мукерджи Рама, Сингх Манодж Кумар, Джагги Ману, Гупта Паван Кумар, Кумар Мукеш, Правин Раджендран, Муллик Санджой, Бурман Ананд Ц.
Формула / Реферат
1. Способ получения полимера, включающего три мономерных звена, выбранных из 1-винилпирролидона (VP), N-изопропилакриламида (NIPAM) и сложного эфира малеинового ангидрида и полиэтиленгликоля (MPEG), поперечно сшитых дифункциональным виниловым производным, содержащего каждый из токсичных мономерных контаминантов в количествах менее чем 0,001%, при этом способ включает стадии, на которых:
i) растворяют приемлемые количества трех мономеров NIPAM, VP и MPEG в воде;
ii) добавляют последовательно в раствор со стадии i) приемлемые количества поперечно-сшивающего агента и активатора;
iii) барботируют инертный газ в раствор со стадии ii) в течение 30-60 мин;
iv) добавляют приемлемое количество активатора и инициатора полимеризации в раствор со стадии iv);
v) полимеризуют раствор со стадии iv) при температуре от 25 до 45°С в атмосфере инертного газа в течение 3-6 ч;
vi) подвергают раствор со стадии v) фильтрации через предварительно стерилизованные фильтры, а фильтрат собирают;
vii) подвергают фильтрат со стадии vi) диафильтрации, а фильтрат собирают;
viii) факультативно подвергают фильтрат со стадии vii) дополнительной диафильтрации, а фильтрат собирают и
ix) факультативно подвергают фильтрат со стадии vii) или viii) лиофилизации для получения лиофилизованного порошка полимера.
2. Способ по п.1, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 55:22 до 65:35, а весовое соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 90:10 до 95:5.
3. Способ по п.1, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 58:32 до 62:28, а весовое соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 80:20 до 95:5.
4. Способ по п.1, где поперечно-сшивающий агент представляет собой дисфункциональное виниловое соединение.
5. Способ по п.4, где дисфункциональное виниловое соединение представляет собой N,N¢-метилен-бис-акриламид.
6. Способ по п.1, где поперечно-сшивающий агент применяют в количествах в диапазоне от 1,3 до 1,5 вес.% в расчете на общее количество мономеров.
7. Способ по п.6, где поперечно-сшивающий агент применяют в количествах в диапазоне от 1,35 до 1,4 вес.% в расчете на общее количество мономеров.
8. Способ по п.1, где активатор выбирают из тетраметилэтилендиамина или аммония-железа сульфата, или их комбинации.
9. Способ по п.1, где активатор применяют в количествах в диапазоне от 15 до 18 вес.% в расчете на вес общего количества мономеров.
10. Способ по п.9, где активатор применяют в количествах в диапазоне от 15 до 16 вес.% в расчете на общее количество мономеров.
11. Способ по п.1, где инициатор полимеризации представляет собой по меньшей мере одно или более пероксидных соединений, таких как диацилпероксид, бензоилпероксид, диацетилпероксид, диалкилпероксиды, третичный бутилпероксид и третичный амилпероксид, или инициаторов полимеризации на основе нитрила, таких как 2,2'-азо-бис-изобутиронитрил (AIBN), или инициаторов полимеризации на основе неорганической соли, таких как пердисульфат аммония или персульфат аммония.
12. Способ по п.11, где инициатор полимеризации представляет собой пердисульфат аммония или персульфат аммония.
13. Способ по п.1, где инициатор полимеризации применяют в количествах в диапазоне от 20 до 30 вес.% в расчете на общее количество мономеров.
14. Способ по п.13, где инициатор полимеризации применяют в количествах в диапазоне от 23 до 25 вес.% в расчете на общее количество мономеров.
15. Способ по п.1, где инертный газ представляет собой аргон или азот.
16. Способ по п.1, где предварительно стерилизованный фильтр, применяемый на стадии vi), представляет собой одноразовые 0,2 мкм капсульные фильтры с полиэфирсульфоновой мембраной 1", имеющие размер пор 0,8 и 0,2 мкм.
17. Способ по п.1, где оборудование диафильтрации, применяемое на стадиях vi) и vii), представляет собой устройство диафильтрации Proflux M12 от Millipore.
18. Полимер, полученный способом по п.1, включающий три мономерных звена, выбранных из 1-винилпирролидона (VP), N-изопропилакриламида (NIPAM) и сложного эфира малеинового ангидрида и полиэтиленгликоля (MPEG), поперечносшитых дифункциональным виниловым производным, содержащий каждый из токсичных мономерных контаминантов в количествах менее чем 0,001%.
19. Полимер по п.18, содержащий токсичный 1-винилпирролидон (VP) в количестве менее чем 0,001%.
20. Полимер по п.18, содержащий токсичный N-изопропилакриламид (NIPAM) в количестве менее чем 0,001%.
21. Полимер по п.18, где дисфункциональным виниловым поперечно-сшивающим агентом является N,N¢-метилен-бис-акриламид (МВА).
22. Полимер по п.18, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 55:22 до 65:35.
23. Полимер по п.18, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 58:32 до 62:28.
24. Полимер по п.18, где весовое соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 90:10 до 95:5.
25. Полимер по п.18, где весовое соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 80:20 до 95:5.
26. Полимер по п.18, имеющий пики δ в 174, 76,6-77,6, 70,6, 41,6, 31,8 и 22,6 в 13С ЯМР-спектре.
27. Полимер по п.18, имеющий пики δ в 1,14, 1,45, 1,63, 1,99, 2,36, 3,0, 3,23, 3,62-3,66, 3,72 и 3,97 в 1Н ЯМР-спектре.
28. Полимер по п.18, имеющий частоту значений см-1 в 3500, 3296, 2972-2933, 1546, 1387, 1367 и 1172-1129 в ИК-Фурье спектре.
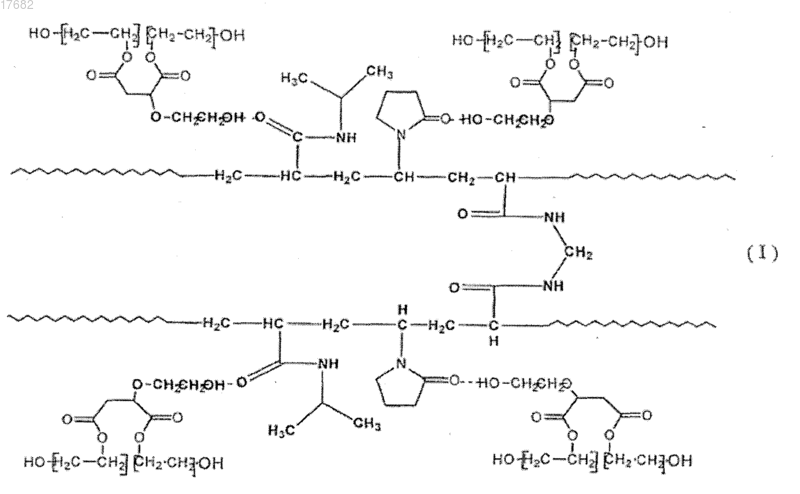
29. Полимер по п.18, имеющий структуру формулы (I)
30. Полимер по п.18, который является биологически совместимым.
31. Полимер по п.18, который является небиодеградируемым.
32. Полимер по п.18, который является нетоксичным.
33. Полимер по п.18, имеющий значение Т1/2 (K10) 0,152 ± 0,018 ч.
34. Полимер по п.18, имеющий значение Т1/2 (α) 0,065 ± 0,014 ч.
35. Полимер по п.18, имеющий значение Т1/2 (β) 0,448 ± 0,0157 ч.
36. Полимер по п.18, имеющий значение Cmax 82,96 ± 5,11 мкг/мл.
37. Полимер по п.18, имеющий значение площади под кривой (AUC) 18,29 ± 1,62 ч ´ мкг/мл.
38. Полимер по п.18, имеющий значение времени клиренса (CL) 54,67 ± 4,86 мл/ч.
39. Полимер по п.18, имеющий значение среднего времени удержания (MRT) 0,465 ± 0,13 ч.
40. Полимер по п.18, имеющий значение объемного распределения при стабилизированном состоянии (Vss) 25,43 ± 5,2 мл/ч.
41. Полимер по п.18, который является выделенным из мочи, кала, тканей и смыва.
42. Полимер по п.18, который является преимущественно выделенным из мочи и кала.
43. Полимер по п.18, около 67% которого являются выделенными из мочи через 48 ч после дозирования.
44. Полимер по п.18, около 17% которого являются выделенными из кала через 48 ч после дозирования.
45. Полимер по п.18, около 84% которого являются выделенными из мочи, кала, тканей и смыва через 48 ч после дозирования.
46. Полимер по п.18, который не вызывает локальной токсичности на участке введения через 48 ч после подкожного введения водного раствора полимера в ухо кролика.
47. Полимер по п.18, который не вызывает локальной токсичности на участке введения через 24 ч после внутривенного введения водного раствора полимера в ушную вену кролика.
48. Полимер по п.18, который не вызывает общей токсичности, если вводится внутривенным болюсным путем крысам Вистара до пяти последовательных дней при дозе от 400 до 800 мг/кг.
49. Полимер по п.18, который не вызывает значительной гематологической токсичности, если вводится внутривенным болюсным путем крысам Вистара до пяти последовательных дней при дозе от 400 до 800 мг/кг.
50. Полимер по п.18, представляющий собой [14С]-меченный полимер, включающий три мономерных звена, выбранных из 1-винилпирролидона (VP), N-изопропилакриламида (NIPAM) и сложного эфира малеинового ангидрида и полиэтиленгликоля (MPEG), поперечносшитых N,N¢-метилен-бис-акриламидом (МВА).
51. Полимер по п.18, представляющий собой [14С]-меченный полимер, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 55:22 до 65:35, а соотношение мономеров (NIPAM + VP): MPEG находится в диапазоне от 90:10 до 95:5.
52. Полимер по п.50 или 51, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 58:32 до 62:28, а соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 80:20 до 95:5.
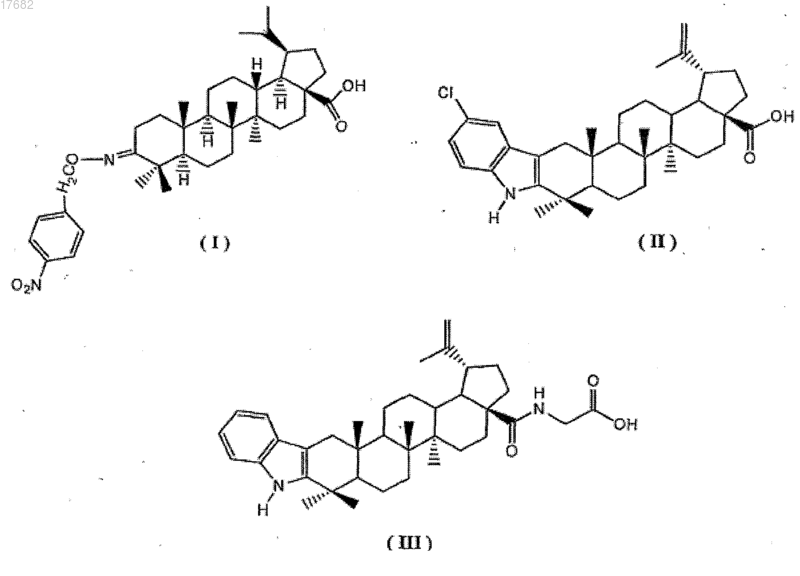
53. Набор, включающий (а) ампулу, содержащую раствор слабо растворимого в воде лекарственного средства или соединения в водорастворимом растворителе или смеси водорастворимых растворителей, и (b) другую ампулу, содержащую раствор полимера по п.18, и фармацевтически приемлемые наполнители, где растворы в ампулах (а) и (b) находятся в объемном соотношении от 1:1 до 1:10, при этом набор предназначен для получения фармацевтической композиции слабо растворимых в воде лекарственных средств или соединений в форме наночастиц для введения пациентам.
54. Набор по п.53, где слаборастворимые в воде лекарственные средства или соединения имеют растворимость в воде менее чем 10 мг/мл.
55. Набор по п.53, где слаборастворимое в воде лекарственное средство или соединение выбрано из класса противораковых агентов, противовоспалительных агентов, противогрибковых агентов, противорвотных средств, противогипертензивных агентов, половых гормонов, стероидов, антибиотиков, анестезирующих средств или иммуномодуляторов.
56. Набор по п.55, где противораковые агенты выбраны из Паклитаксела, Доцетаксела и таксановых производных; Иринотекана, Топотекана и кампотециновых производных; Доксорубицина, Дауномицина и антрациклиновых производных; Цисплатина; Оксалиплатина; 5-Фторурацила; Митомицина; Метотрексата; Этопосида; бетулиновой кислоты и ее производных; и Веделолактона и его производных.
57. Набор по п.55, где противовоспалительные агенты выбраны из Индометацина, Ибупрофена, Кетопрофена, Флубипрофена, Пироксикама, Теноксикама и Напроксена.
58. Набор по п.55, где противогрибковые агенты выбраны из Кетоконазола и Амфотерицина В.
59. Набор по п.55, где половые гормоны выбраны из Тестостерона, Эстрогена, Прогестерона и Эстрадиола.
60. Набор по п.55, где стероиды выбраны из Дексаметазона, Преднизолона и Триамцинолона.
61. Набор по п.55, где противогипертензивные агенты выбраны из Каптоприла, Рамиприла, Теразозина, Миноксидила и Празозина.
62. Набор по п.55, где противорвотные средства выбраны из Ондансетрона и Гранисетрона.
63. Набор по п.55, где антибиотики выбраны из Метронидазола и фусидовой кислоты.
64. Набор по п.55, где иммуномодуляторы выбраны из Циклоспорина и бифенилдиметил дикарбоновой кислоты.
65. Набор по п.55, где анестезирующие средства выбраны из Прополола, Альфаксалона и Гексобарбитала.
66. Набор по п.56, где производные бетулиновой кислоты выбраны из MJ-1098 формулы (II), DRF-4012 формулы (III) и DRF-4015 формулы (IV)
67. Набор по п.53, где водорастворимый растворитель выбран из этанола, диметилформамида, диметилацетамида, диметилсульфоксида, диэтилсульфоксида, полиэтиленгликолей различного молекулярного веса, полипропиленгликолей различного молекулярного веса, полисорбата 80, полисорбата 20, полиоксиэтилированного растительного масла, полиэтоксилированного касторового масла или глицерина и их смесей.
68. Набор по п.53, где фармацевтически приемлемые наполнители выбраны из натрия дезоксихолата; солей желчных кислот, полисорбата 80; полисорбата 20, полиоксиэтилированного растительного масла; полиэтоксилированного касторового масла; полисахаридов, подобных декстрозе, сахарозе, лактозе и маннитолу; сложных эфиров сорбитана или спанов различных марок, сложных эфиров жирных кислот различных марок (myrj) или полоксомеров различных марок и их смесей.
69. Набор по п.68, где фармацевтически приемлемые наполнители дополнительно включают буферный агент.
70. Набор по п.69, где буферный агент является цитратом натрия.
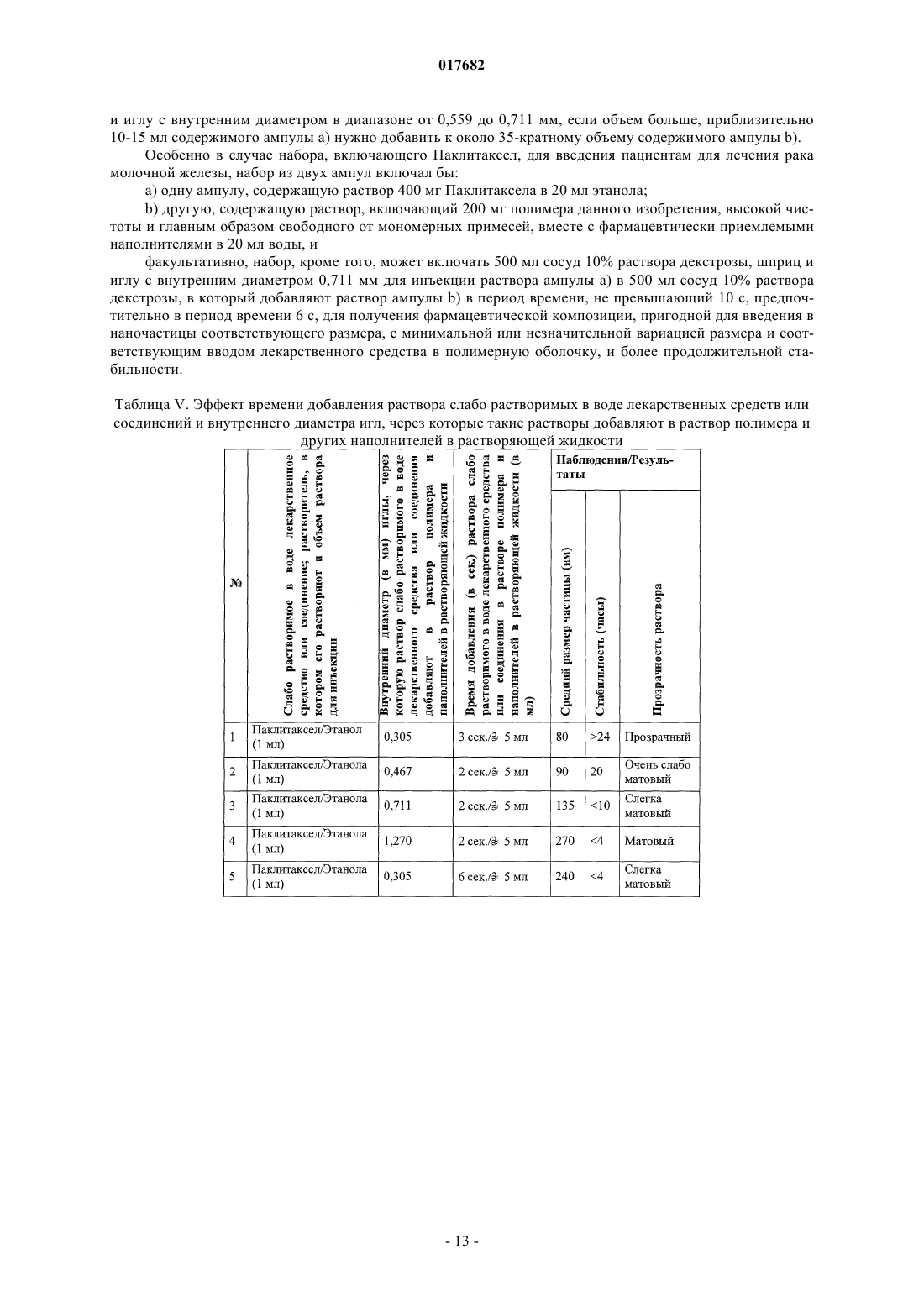
71. Набор по п.53, факультативно включающий растворяющую жидкость, шприц и иглу, имеющую внутренний диаметр в диапазоне от 0,305 до 0,356 мм, если объем небольшой, 1-5 мл раствора ампулы а) добавить до около 35-кратного ее объема, включающего содержимое ампулы b) в растворяющую жидкость, или шприц и иглу, имеющую внутренний диаметр в диапазоне от 0,559 до 0,711 мм, если объем больше, 10-15 мл содержимого ампулы а) нужно добавить до около 35-кратного ее объема, включающего содержимое ампулы b) в растворяющую жидкость.
72. Фармацевтическая композиция в форме наночастиц, пригодная для введения пациентам, включающая слаборастворимое в воде лекарственное средство или соединение, водорастворимый растворитель, полимер по п.18 и фармацевтически приемлемые наполнители, все из которых содержатся в растворяющей жидкости.
73. Фармацевтическая композиция по п.72, где слаборастворимые в воде лекарственные средства выбраны из класса противораковых агентов, противовоспалительных агентов, противогрибковых агентов, противорвотных средств, противогипертензивных агентов, половых гормонов, стероидов, антибиотиков, анестезирующих средств или иммуномодуляторов.
74. Фармацевтическая композиция по п.72, где фармацевтически приемлемые наполнители выбраны из натрия дезоксихолата, солей желчных кислот, полисорбата 80; полисорбата 20, полиоксиэтилированного растительного масла, полиэтоксилированного касторового масла, полисахаридов, подобных декстрозе, сахарозе, лактозе и маннитолу, сложных эфиров сорбитана или спанов различных марок, сложных эфиров жирных кислот различных марок (myrj) или полоксомеров различных марок и их смесей.
75. Фармацевтическая композиция по п.72, где водорастворимые растворители выбраны из этанола, диметилформамида, диметилацетамида, диметилсульфоксида, диэтилсульфоксида, полиэтиленгликолей различного молекулярного веса, полипропиленгликолей различного молекулярного веса, полисорбата 80, полисорбата 20, полиоксиэтилированного растительного масла, полиэтоксилированного касторового масла или глицерина и их смесей.
76. Фармацевтическая композиция по п.72, где растворяющая жидкость выбрана из воды, солевого раствора, 5 и 10% растворов декстрозы, раствора декстрозы и натрия хлорида, раствора натрия лактата, лактированного раствора Рингера, раствора маннитола, раствора маннитола с декстрозой или натрия хлоридом, раствора Рингера, раствора натрия хлорида, стерильной воды для инъекции и сложных растворов электролитов, включающих различные комбинации электролитов, декстрозы, фруктозы и инвертированного сахара.
77. Фармацевтическая композиция по п.72, где слаборастворимое в воде лекарственное средство или соединение заключено в полимерную оболочку в форме наночастиц.
78. Фармацевтическая композиция по п.77, где размер наночастиц находится в диапазоне от 30 до 150 нм.
79. Фармацевтическая композиция по п.72, где полимер имеет структуру формулы (I), содержит мономерные VP и NIPAM в количествах менее чем 0,001%; имеет пики δ в 174, 76,6-77,6, 70,6, 41,6, 31,8 и 22,6 в 13С ЯМР спектре; имеет пики δ в 1,14, 1,45, 1,63, 1,99, 2,36, 3,0, 3,23, 3,62-3,66, 3,72 и 3,97 в 1Н ЯМР спектре; имеет частоту значений см-1 в 3500, 3296, 2972-2933, 1546, 1387, 1367 и 1172-1129 в ИК-Фурье спектре.
80. Фармацевтическая композиция по п.72, где полимер имеет структуру формулы (I); содержит мономерные VP и NIPAM в количествах менее чем 0,001%; имеет значение Т1/2 (K10) 0,152 ± 0,018 ч; значение Т1/2 (α) 0,065 ± 0,014 ч; значение T1/2 (β) 0,448 ± 0,0157 ч; значение Cmax 82,96 ± 5,11 мкг/мл; значение площади под кривой (AUC) 18,29 ± 1,62 ч ´ мкг/мл; значение времени клиренса (CL) 54,67 ± 4,86 мл/ч; значение среднего времени удержания (MRT) 0,465 ± 0,13 ч; значение объемного распределения в стабилизированном состоянии (Vss) 25,43 ± 5,2 мл/ч.
81. Фармацевтическая композиция по п.72, имеющая рН от 6,0 до 8,5.
82. Способ получения фармацевтической композиции слаборастворимых в воде лекарственных средств или соединений в форме наночастиц по п.72, включающий стадии, на которых:
i) получают концентрат лекарственного средства/соединения путем растворения слаборастворимого в воде лекарственного средства или соединения в пригодном водорастворимом растворителе или смеси водорастворимых растворителей;
ii) получают водный концентрат полимера и фармацевтически приемлемых наполнителей, при этом:
a) сначала добавляют необходимое количество полимера формулы (I), имеющего уровень токсичных NIPAM и VP < 0,001%, к приемлемому количеству воды для инъекции для получения раствора;
b) добавляют фармацевтически приемлемые наполнители и буферный агент в раствор полимера в воде;
iii) смешивают раствор со стадии ii b) с растворяющей жидкостью до получения прозрачного раствора;
iv) применяют иглу с внутренним диаметром от 0,305 до 0,356 мм для добавления меньшего объема раствора со стадии i) в раствор со стадии iii) за 4 с; или
v) применяют иглу с внутренним диаметром от 0,559 до 0,711 мм для добавления большего объема раствора со стадии i) в раствор со стадии iii) за 10 с;
vi) вводят раствор со стадии i) в раствор со стадии iii), где игла шприца, через который добавляют раствор со стадии i), должна остаться погруженной в раствор со стадии iii); и
vii) факультативно, держат контейнер, содержащий раствор со стадии iii), в перевернутом положении во время инъекции раствора со стадии i).
83. Способ по п.82, где применяемые слаборастворимые в воде лекарственные средства выбраны из класса противораковых агентов, противовоспалительных агентов, противогрибковых агентов, противорвотных средств, противогипертензивных агентов, половых гормонов, стероидов, антибиотиков, анестезирующих средств или иммуномодуляторов.
84. Способ по п.82, где применяемые фармацевтически приемлемые наполнители выбраны из натрия дезоксихолата; солей желчных кислот, полисорбата 80; полисорбата 20, полиоксиэтилированного растительного масла; полиэтоксилированного касторового масла; полисахаридов, подобных декстрозе, сахарозе, лактозе и маннитолу; сложных эфиров сорбитана или спанов различных марок, сложных эфиров жирных кислот различных марок (myrj) или полоксомеров различных марок и их смесей.
85. Способ по п.82, где водорастворимые растворители выбраны из этанола, диметилформамида, диметилацетамида, диметилсульфоксида, диэтилсульфоксида; полиэтиленгликолей различного молекулярного веса; полипропиленгликолей различного молекулярного веса; полисорбата 80, полисорбата 20, полиоксиэтилированного растительного масла, полиэтоксилированного касторового масла или глицерина и их смесей.
86. Способ по п.82, где применяемые растворяющие жидкости выбраны из воды, солевого раствора, 5 и 10% растворов декстрозы, раствора декстрозы и натрия хлорида, раствора натрия лактата, лактированного раствора Рингера, раствора маннитола, раствора маннитола с декстрозой или натрия хлоридом, раствора Рингера, раствора натрия хлорида, стерильной воды для инъекции и сложных растворов электролитов, включающих различные комбинации электролитов, декстрозы, фруктозы и инвертированного сахара.
87. Способ по п.82, где меньший объем раствора на стадии iv) относится к объему 1-5 мл раствора со стадии i).
88. Способ по п.82, где больший объем раствора на стадии v) относится к объему 10-15 мл раствора со стадии i).
89. Способ по п.82, где размеры частиц слаборастворимых в воде лекарственных средств или соединений, заключенных в полимерную оболочку в полученной фармацевтической композиции, находятся в диапазоне от 30 до 150 нм.
90. Фармацевтическая композиция по п.72, полученная способом по п.82.
91. Фармацевтическая композиция по п.72, полученная способом по п.82, где полимер имеет структуру формулы (I); содержит мономерные VP и NIPAM в количестве менее чем 0,001% и является безопасным и нетоксичным для введения людям или животным.
92. Фармацевтическая композиция по п.72, полученная способом по п.82, пригодная для лечения патологических состояний, для которых эффективны слаборастворимые в воде лекарственные средства или соединения, выбранные из класса противораковых агентов, противовоспалительных агентов, противогрибковых агентов, противорвотных средств, противогипертензивных агентов, половых гормонов, стероидов, антибиотиков, анестезирующих средств или иммуномодуляторов.
93. Способ лечения патологических состояний у людей или животных, для которых эффективны слаборастворимые в воде лекарственные средства или соединения по пп.55-66, включающий введение фармацевтической композиции наночастиц по п.72, содержащей слаборастворимое в воде лекарственное средство или соединение.
94. Способ по п.93, включающий внутривенные, внутримышечные или подкожные инъекции.
Текст
ПОЛИМЕР И СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ НАНОЧАСТИЦ, СПОСОБ И НАБОР ДЛЯ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ У ЛЮДЕЙ ИЛИ ЖИВОТНЫХ Данное изобретение касается биологически совместимого, небиодеградируемого и нетоксичного полимера формулы (I), включающего три мономерных единицы, выбранных из 1 винилпирролидона (VP), N-изопропилакриламида (NIPAM) и сложного эфира малеинового ангидрида и полиэтиленгликоля (MPEG), поперечно сшитых с дифункциональным виниловым соединением, высокой чистоты и главным образом свободного от относительно токсичных мономерных примесей, и способа его получения. Данное изобретение, кроме того, касается фармацевтических композиций в форме наночастиц слабо растворимых в воде лекарственных средств или соединений, включающих полимер данного изобретения, которые являются безопасными, менее токсичными и удобными для введения лежачим пациентам, нуждающимся в этом. Кроме того, данное изобретение касается высокоселективного способа получения фармацевтических композиций наночастиц слабо растворимых в воде лекарственных средств или соединений.(71)(73) Заявитель и патентовладелец: ФРЕСЕНИУС КАБИ ОНКОЛОДЖИ ЛТД. (IN) 017682 Область данного изобретения Данное изобретение предусматривает биологически совместимый и небиодеградируемый полимер высокой чистоты, главным образом свободный от мономерных примесей, и способ его получения. Данное изобретение далее предусматривает фармацевтические композиции слабо растворимых в воде лекарственных средств или соединений в форме наночастиц, использующие указанный полимер данного изобретения. Кроме того, данное изобретение касается высокоселективного способа получения фармацевтических композиций слабо растворимых в воде лекарственных средств или соединений в форме наночастиц,а также способа введения их пациентам, нуждающимся в этом. Полимер данного изобретения, являющийся нетоксичным и безопасным, таким образом, делает фармацевтические композиции в форме наночастиц слабо растворимых в воде лекарственных средств или соединений, включающие указанный полимер, также менее токсичными и более безопасными для введения. Предпосылки данного изобретения Последние годы наблюдается постоянно возрастающий интерес к применению новых материалов в области медицины и фармацевтики, или в качестве протезов, или в медицинских устройствах, разработанных для контакта с биологической средой живого организма. Из этих материалов полимеры, в основном синтетические полимеры, являются, безусловно, самыми разнообразными классами, которые, как находят, обеспечивают значительные преимущества медицинской помощи для пациента. Применение полимеров в области медицины и фармацевтики широко варьирует. В медицине полимеры применяют как импланты или опорные материалы, такие как искусственные органы, сосудистые трансплантаты, внутриглазные линзы, искусственные суставы, протезы молочной железы, шовные материалы, экстракорпоральные терапевтические средства или другие опорные материалы, такие как используемые в гемоперфузии, оксигенаторы крови, катетеры, трубка для крови, материалы, покрывающие раны и ожоги, шины, контактные линзы и т.п. В фармацевтической области полимеры особенно использовались в развитии систем доставки наночастиц и систем доставки регулируемого высвобождения. Обширные исследования также осуществляют нацеливание лекарственных средств с системами доставки в желательный участок. Кроме того, полимеры нашли широкое применение в других направлениях, например, таких как пластыри для трансдермальной доставки лекарственного средства, микросферы, биопроцессы, такие как ферментная и клеточная иммобилизация и т.д. Среди таких применений системы доставки в форме наночастиц лекарственных средств более широко изучены, а также широко изучены носители лекарственных средств нанометрового размера с гидрофильными поверхностями, особенно те, что включают две сферические совместно ориентированные области полимерных мицел - плотно упакованное ядро гидрофобного материала, который отвечает за захват гидрофобного лекарственного средства или соединения, и внешняя оболочка, выполненная из гидрофильного материала. Выяснили, что такие системы избегают распознавания и поглощения ретикуло-эндотелиальными системами (RES), и, таким образом, могут циркулировать в крови длительное время. Кроме того, из-за их чрезвычайно маленького размера (полимерная мицелла обычно состоит из нескольких сотен блок-сополимеров и имеет диаметр от около 20 до 50 нм), частицы проникают пассивным механизмом нацеливания из сосудов на патологические участки, такие как солидные опухоли. Полимеры получают диапазон свойств, относящихся к их химическим и структуральным особенностям. Полимерные цепи в основном могут быть линейными, разветвленными или поперечно сшитыми с соседними цепями. Кроме того, эти цепи могут быть неупорядоченными, упорядоченными или ориентированными в одном направлении. Эти структуральные особенности вместе с химической композицией обеспечивают разнообразие свойств полимерам, что приводит к разнообразию применений конечного назначения. Кроме того, эти структуральные особенности вместе с химической композицией могут сообщить или лишить образованный полимер биосовместимости и устойчивости к биодеградации средой тканей хозяина. Эти факторы также влияют на другие свойства, такие как растворимость, и способы обработки и формирования. Более того, когда полимер вводят млекопитающим, он обычно медленно исчезает из участка введения, однако, это исчезновение происходит из-за химической реакции, такой как гидролиз, который обычно является частью способа биотрансформации, и указанный полимер метаболизируется и выделяется из организма. Однако это иногда приводит к ненужным метаболитам, которые оказывают неблагоприятные влияния на различные биологические системы. Поэтому полимеры, которые инертны в/к среде применения и выделены или экстрагированы неповрежденными из участка введения, а также служат, в основном, как ограничивающий скорость барьер для транспорта и высвобождения лекарственного средства из него, могут иметь большое значение, основанное на намеченных функциях. К тому же, биодеградируемость полимера зависит от механических и химических свойств полимера. Множество натуральных, синтетических и биосинтетических полимеров являются био- и экологически разлагаемыми. Полимер на основе С-С скелета склонен быть небиодеградируемым, тогда как содержащие гетероатомы полимерные скелеты способны к биодеградации. Поэтому небиодеградируемость/биодеградируемость можно получить в полимерах продуманной делеци-1 017682 ей/добавлением химических связей, таких как ангидридные, эфирные или амидные связи и т.д. Общие примеры небиодеградируемых полимерных материалов включают полиэтиленвинилацетат, полидиметилсилоксан, полиэфируретан, этилцеллюлозу, целлюлозы ацетат, полиэтилен и поливинилхлорид. Существует путаница в сообщениях, основанных на попытках, сделанных за последние десятилетия, или на развитие систем доставки из наночастиц для широкого ряда лекарственных средств, использующих полимеры. Приведены некоторые из них.i) Sakurai et al. в патенте США 5412072 показали, что комплекс, включающий лекарственное средство, ковалентно связан с полимером, состоящим из гидрофильных и гидрофобных фрагментов, что делает указанный комплекс водорастворимым и, таким образом, пригодным для введения. Лекарственные средства, применяемые здесь, обычно менее водорастворимые или нерастворимые соединения, а комплекс лекарственного средства с полимером, как сообщили, формирует полимерные мицеллы в водных растворах и становится растворимым в воде высокомолекулярным полимеризированным лекарственным средством, пригодным и приемлемым для введения.ii) Yokoyama et al. в патенте США 5449513 сообщают о полимерной мицелле, которая в отличие от раскрытой Sakurai et al. в патенте США 5412072, не является комплексом, где лекарственное средство ковалентно связано с полимером, а скорее где лекарственное средство захвачено полимером. Лекарственные средства, применяемые в захваченном состоянии, являются гидрофобными по природе. Полимерная мицелла, в свою очередь, получена путем захвата гидрофобных лекарственных средств внутри полимерной оболочки традиционными способами, такими как обработка ультразвуком, с последующей очисткой мицелл, полученных таким образом, с помощью диализа.iii) Desai et al. в патенте США 5439686; в патенте США 5362478; в патенте США 5916596; в патенте США 6096331; в патенте США 6537579 и в патенте США 6749868 показали получение полимерной мицеллы существенно нерастворимых в воде соединений. Не растворимое в воде соединение, как сообщили, захвачено внутрь полимерной оболочки до значительной степени и пригодно для введения пациенту,нуждающемуся в этом, или в форме раствора, или в форме суспензии. Полимеры, применяемые Sakurai et al. в патенте США 5412072, обычно включают гидрофильный сегмент, выбранный из полиэтиленгликоля, полисахаридов, полиакриламида и т.д., и гидрофобный сегмент, выбранный из полиаспарагиновой кислоты, полиглутаминовой кислоты, полилизина и т.д. Полимеры, применяемые Yokoyama et al. в патенте США 5449513, обычно включают гидрофильный сегмент, выбранный из полиэтилен оксида, полияблочной кислоты, полиаспарагиновой кислоты,полиглутаминовой кислоты, полилизина, полисахарида и т.д., и гидрофобного сегмента, выбранного из полиф-бензил L-аспартата), поли(-бензил L-глутамата), поли(-замещенного аспартата), поли(замещенного глутамата), поли(L-лейцина), поли(L-валина), поли(L-фенилаланина), гидрофобных полиаминокислот, полистирола, полиметакрилата, полиакрилата, полиметакрилат амида, полиакрилат амида,полиамида, полиэфира, полиалкиленоксида и гидрофобных полиолефинов. Полимеры, применяемые Desai et al. в патенте США 5439686; в патенте США 5362478; в патенте США 5916596; в патенте США 6096331; в патенте США 6537579 и в патенте США 6749868, в основном несут сульфгидрильные группы или дисульфидные связи в своей структуре, например альбумин (который содержит 35 цистеиновых остатков), инсулин (который содержит 6 цистеиновых остатков), гемоглобин (который содержит 6 цистеиновых остатков на 22 единицу), лизоцим (который содержит 8 цистеиновых остатков), иммуноглобулины, -2-макроглобулин, витронектин, витронектин, фибриноген и т. д. Такие полимеры, главным образом, поперечно сшиты путем формирования дисульфидных связей. Такие полимеры включают и синтетические, и натуральные полимеры, упомянутые ранее, несут сульфгидрильные группы или дисульфидные связи в своей структуре. Сульфгидрильные группы или дисульфидные мостики, как сообщают, или уже существуют, или получены приемлемыми химическими модификациями. Натуральные полимеры, как сообщают, являются предпочтительными и включают альбуминовые белки, олигопептиды, полинуклеиновые кислоты и т.д. Однако недостаток полимерных мицелл, описанных Sakurai et al., Yokoyama et al. и Desai et al., заключается в том, что все они используют полимеры, синтетические и натуральные, которые являются биодеградируемыми. Следует упомянуть, что биодеградируемые полимеры, хотя и способны влиять на образец высвобождаемого лекарственного средства, а также на кинетические характеристики высвобождения помещенного лекарственного средства, однако, особенно не желательны в системах доставки лекарственного средства, потому что они:a) имеют низкое время существования в плазме из-за их быстрого захвата клетками системы мононуклеарных фагоцитов (MPS);b) не отвечают на физиологические изменения;c) не имеют последовательных кинетических характеристик высвобождения лекарственного средства, что может причинять экономическую и терапевтическую потерю лекарственных средств и другие неблагоприятные эффекты; иd) могут вызывать повышение токсичности или иммуногенности, поскольку инкапсуляция белковых лекарственных средств включает органические растворители, которые могут вызывать денатурацию-2 017682 белка. Применялись системы доставки, где полимеры не являются биодеградируемыми, они раскрыты;i) Maitra et al. в патенте США 5874111, где лекарственное средство захвачено в полимер, что приводит к формированию высокомонодисперсной полимерной гидрофильной наночастицы. Применяемые полимеры включают мономеры, подобные винилпирролидону (VP) или смеси винилпирролидона и полиэтиленгликольфумарата (PEGF) и т.д.ii) Maitra et al. в патенте США 6322817, где применяемые полимеры включают по меньшей мере один тип амфифильного мономера, выбранного из группы, включающей винилпирролидон, акриловую кислоту, алкилакрилаты, имеющие длину цепи С 3-С 6, функционализированный полиэтиленгликоль молекулярного веса от 2000 до 6000, N-алкилакриламид, имеющий длину цепи С 3-С 6, и алкилцианоакрилат,имеющий длину цепи С 3-С 6. Лекарственные средства, захваченные в полимерные мицеллы, представляют собой таксановые производные, в частности Паклитаксел.iii) Lowe et al. в заявке на патент США 2005/0169882, где применяемые полимеры включают эффективный сегмент (который является небиодеградируемым) и биодеградируемый сегмент. Более конкретно, эффективный небиодеградируемый сегмент включает поли(N-изопропилакриламид), поли(Nалкилакриламид), поли(N-n-пропилакриламид), поли(N-изопропилметакриламид), поли(этиленоксид)поли(пропиленоксид)-поли(этиленоксид), подобные эластину полипептиды или его производное, а биодеградируемый сегмент включает полисахарид, декстран, полиэфир, полилактид, поли(L-молочную кислоту), поли(D,L-молочную кислоту), поли(лактид-ко-гликолиды), биотинилированную поли(этиленгликоль-блок-молочную кислоту) и т.д. В случае полимеров, раскрытых в патенте США 5874111, следует отметить, что такие полимеры получают путем полимеризации соответствующих мономеров, а полимерный материал, полученный таким образом, очищают и выделяют из водной среды, содержащей его, способом диализа. В случае полимеров, раскрытых также в патенте США 6322817, полимеры получают путем полимеризации соответствующих мономеров, очищают и выделяют из водной среды путем диализа. Аналогично, полимеры, раскрытые Lowe et al. в заявке на патент США 2005/0169882, также очищают и выделяют из водной среды, содержащей их, путем диализа. По отношению к соединениям или лекарственным средствам, раскрытым Maitra et al. в патенте США 5874111, заключаемые в раскрытые там полимеры, это, прежде всего, - антигены, бычья сыворотка и т. д. В случае патента США 6322817, лекарственные средства, заключаемые в раскрытые там полимеры, - это, прежде всего, нерастворимые в воде таксановые производные, особенно Паклитаксел, тогда как Lowe et al. в заявке на патент США 2005/0169882 раскрыли широкое множество лекарственных средств, которые могут быть захвачены в полимерную оболочку, раскрытую там. В дополнение к вышеупомянутому, Burman et al. в патенте США 6365191 предлагают фармацевтическую композицию, включающую полимер, раскрытый в патенте США 6322817, и более конкретно фармацевтическую композицию таксановых производных, особенно Паклитаксела. Здесь указанную фармацевтическую композицию получают путем добавления раствора Паклитаксела в этаноле в инфузионный носитель, включающий раствор декстрозы, к которому добавили раствор полимера в воде, содержащий анионный сурфактант и буферный агент. Burman et al., кроме того, заявили, что фармацевтическая композиция стабильна в течение более чем 12 ч без какого-либо осаждения лекарственного средства из перфузионной жидкости, и что более чем 90% лекарственного средства (как проанализировано с помощью HPLC (высокоэффективная жидкостная хроматография захвачено в полимерную мицеллу даже через 24 ч получения перфузионной жидкости. Несмотря на то, что Burman et al. в патенте США 6365191 заявили, что фармацевтическая композиция, раскрытая там, находится в форме наночастиц, однако, в описании отсутствует упоминание относительно размера заявленной формы наночастиц. Единственное упоминание о размере частиц полимерных мицелл, содержащих Паклитаксел, можно найти в раскрытом Maitra et al. патенте США 6322817, где указанные наночастицы, содержащие Паклитаксел, как сообщают, имеют диаметр в диапазоне 30-150 нм. Аналогично, нет упоминания о размере частиц полимерных мицелл композиций, раскрытых Lowe et al. в заявке на патент США 2005/0169882. Важно отметить, что полимеры, раскрытые в патенте США 5874111; в патенте США 6322817; в патенте США 6365191 и в заявке на патент США 2005/0169882, получают из одного или более мономеров,которые включают винилпирролидон и N-изопропилакриламид. Кроме того, важно отметить, что винилпирролидон и N-азопропилакриламид являются токсичными соединениями, чье присутствие в фармацевтической композиции, предназначенной для употребления человеком или животным, не только не одобрено Органами Здравоохранения во всем мире, но также находится под строгим соблюдением качества со строгими пределами, установленными всемирными фрамокопейными форумами. Например, уровень мономерного винилпирролидона в полимере, поливинилпирролидона, а также какого-либо другого полимера, содержащего винилпирролидон как мономер, предписанный Фармокопеями Европы и США, не должен превышать предел 0,001% (т. е. 10 ppm). Существует серьезная опасность, что в способах получения и выделения полимеров, раскрытых в-3 017682 патенте США 5874111; в патенте США 6322817; в патенте США 6365191 и в заявке на патент США 2005/0169882, содержащих винилпирролидон в качестве одного из мономеров, указанный мономер, т. е. винилпирролидон, может присутствовать в пределах выше 0,001% (т. е. 10 ppm). В равной мере существует серьезная опасность, что фармацевтические композиции, содержащие такие полимеры, содержащие винилпирролидон в качестве одного из мономеров, могут также содержать винилпирролидон как мономерный контаминант, и что указанный мономер, т. е. винилпирролидон, может также присутствовать в пределах выше 0,001% (т. е. 10 ppm). Это могло быть верно, особенно по отношению к фармацевтическим композициям, раскрытым в патенте США 6322817; в патенте США 6365191 и в заявке на патент США 2005/0169882. Не следует слишком подчеркивать, что какая-либо химическая реакция, включая реакцию получения полимеров, никогда не доходит до конца, в том смысле, что неизменно один или более из реагентов переносится в продукт. Это применимо к реакциям полимеризации, включающим винилпирролидон как мономер и зависящим от молярных или весовых пропорций применяемого винилпирролидона, существует возможность, что некоторое количество винилпирролидона останется, как контаминант, в полимерных продуктах, полученных из него. В связи с вышеупомянутым, интересы данных изобретателей были найдены верными, где анализ показал, что полимер, полученный полимеризацией трех мономеров, т.е. винилпирролидона (VP), Nизопропилакриламида (NIPAM) и сложного эфира малеинового ангидрида и полиэтиленгликоля (MPEG),точно как по описанию в примерах I, II и III патента США 6322817, как выявили, содержит количествоN-изопропилакриламида (NIPAM) и винилпирролидона (VP), представленное в табл. I. Таблица I. Количество остаточных мономеров в полимере, полученном по способу, описанному в примерах I, II и III патента США 6322817 Очевидно, что количество винилпирролидона, найденного в полимере по меньшей мере в девять раз больше предела токсичности 0,001% (т. е. 10 ppm), фармацевтическая композиция, содержащая такой полимер, была бы очень опасной и высоко токсичной для введения людям или животным. Потребность, если не крайняя необходимость, существует не только в полимере, главным образом свободном от токсичных мономеров, таких как N-изопропилакриламид (NIPAM) и винилпирролидон(VP), но также в фармацевтических композициях, включающих полимер, которые, главным образом,свободны от токсичных мономерных примесей, таких как N-изопропилакриламид (NIPAM) и винилпирролидон (VP). Можно также отметить, что фармацевтические композиции, раскрытые Burman et al. в патенте США 6365191, как сообщают, имеют стабильность только около 12 ч или более с 90% или более лекарственного средства, захваченного в полимерную мицеллу, к исходу 24 ч. Кроме того, фармацевтические композиции, раскрытые Lowe et al. в заявке на патент США 2005/0169882, как сообщают, имеют загруженность биологически активными веществами только приблизительно 40%, с высвобождением биологически активного вещества от нескольких часов до нескольких дней. Существует дополнительная потребность в фармацевтических композициях, которые имеют более длительную стабильность, а также более высокую загруженность лекарственным средством, и, более того, являются безопасными и менее токсичными. Данное изобретение является шагом вперед не только в разработке полимера, главным образом свободного от токсичных мономерных примесей, но также в разработке фармацевтической композиции,включающей такой желательный полимер, который является безопасным для введения человеку или животному и имеет более длительную стабильность. Цели данного изобретения Цель данного изобретения заключается в обеспечении биологически совместимого и небиодеградируемого полимера высокой чистоты, главным образом свободного от мономерных примесей. Другая цель данного изобретения заключается в обеспечении способа получения биологически совместимого и небиодеградируемого полимера высокой чистоты, главным образом свободного от мономерных примесей. Еще одна цель данного изобретения заключается в обеспечении фармацевтических композиций слабо растворимых в воде лекарственных средств или соединений в форме наночастиц, включающих биологически совместимые и небиодеградируемые полимеры высокой чистоты, главным образом свободные от мономерных примесей. Дополнительная цель данного изобретения заключается в обеспечении способа получения фармацевтических композиций слабо растворимых в воде лекарственных средств или соединений в форме наночастиц, использующих биологически совместимые и небиодеградируемые полимеры высокой чисто-4 017682 ты, главным образом свободные от мономерных примесей. Дополнительная цель данного изобретения заключается в обеспечении фармацевтических композиций наночастиц слабо растворимых в воде лекарственных средств или соединений, включающих биологически совместимые и небиодеградируемые полимеры высокой чистоты, свободные от мономерных примесей, которые безопасны и менее токсичны. Другой целью данного изобретения является обеспечение высоко селективного способа получения фармацевтических композиций в форме наночастиц, включающих слабо растворимые в воде лекарственные средства или соединения и биологически совместимый и небиодеградируемый полимер высокой чистоты, свободный от мономерных примесей. Еще одной целью данного изобретения является обеспечение способа введения фармацевтических композиций в форме наночастиц, включающих биологически совместимый и небиодеградируемый полимер высокой чистоты, главным образом свободный от мономерных примесей, пациентам, нуждающимся в этом. Дополнительная цель данного изобретения заключается в обеспечении фармацевтических композиций в форме наночастиц, включающих биологически совместимый и небиодеградируемый полимер высокой чистоты, свободный от мономерных примесей, которые являются стабильными более продолжительные периоды времени. Аббревиатуры, применяемые в данном изобретении Краткое описание графических материалов Фиг. 1: 1H-ЯМР (ядерно-магнитный резонанс) спектр полимера данного изобретения. Фиг. 2: 13 С-ЯМР спектр полимера данного изобретения. Фиг. 3: Спектр преобразования Фурье в инфракрасной области (ИК-Фурье) полимера данного изобретения. Фиг. 4: Термограмма TGA полимера данного изобретения. Фиг. 5: Термограмма DSC полимера данного изобретения. Фиг. 6: Фармакокинетический профиль крови [14 С]-меченного полимера данного изобретения. Фиг. 7: Фотографии окрашенного солохромом и эозином участка мочки уха кролика через 48 ч после подкожного введения 10% раствора декстрозы (Контроль). Фиг. 8: Фотографии окрашенного солохромом и эозином участка мочки уха кролика через 48 ч после подкожного введения водного раствора полимера данного изобретения. Фиг. 9: Фотографии окрашенного солохромом и эозином участка краевой вены уха кролика через 24 ч после внутривенного введения 10% раствора декстрозы (Контроль). Фиг. 10: Фотографии окрашенного солохромом и эозином участка краевой вены уха кролика через 24 ч после внутривенного введения водного раствора полимера данного изобретения. Фиг. 11: Изображение типичного способа получения и введения пациентам, нуждающимся в этом,фармацевтической композиции в форме наночастиц данного изобретения. Краткое описание данного изобретения Выяснили, что можно достичь всех сформулированных целей, которые преодолевают большинство,если не все, ограничения известного уровня техники. Во-первых, выявили, что можно получить полимер, включающий мономерную единицу NIPAM иVP, где количество соответствующих отдельных мономерных примесей в полимере, полученном таким-5 017682 образом, ниже допустимых пределов токсичности. В частности, выявили, что можно получить полимер, включающий NIPAM, VP и MPEG как мономерные единицы, который является главным образом свободным от мономерных примесей токсичныхNIPAM и VP. В частности, выявили, что можно получить такой полимер с высокой чистотой, содержащий указанные контаминанты NIPAM и VP на уровнях много ниже 0,001% вес./вес. Полимер, имеющий желательные характеристики, можно получить высокоселективным способом,при котором подвергают водный раствор, содержащий полимер, полученный полимеризацией NIPAM,VP и MPEG, стадии диафильтрации или ультрафильтрации, в отличие от способов диализа, как поясняется в известном уровне техники. Такой полимер, полученный способом данного изобретения, превосходящим известные способы,особенно способ, раскрытый в патенте США 6322817, включающий стадию диализа, можно лучше понять из сравнения остаточных мономеров, содержащихся в соответствующих полимерах, как представлено в табл. II. Таблица II. Сравнение мономерных примесей, содержащихся в полимере, полученном согласно способу,раскрытому в патенте США 6322817, использующему диализ, по отношению к полимеру, полученному согласно данному изобретению, использующему диафильтрацию Следует отметить, что диализ является способом, который включает медленное отделение меньших молекул от больших молекул или растворенных веществ от коллоидных частиц в растворе путем селективной диффузии через полупроницаемую мембрану. В типичном способе диализа раствор полимера для очистки содержится в полупроницаемой мембране, а растворы с низким молекулярным весом (мономеры) удалены путем добавления чистого растворителя, обычно вода находится вне мембраны. Этот растворитель меняют периодически или непрерывно, пока концентрация способных диффундировать растворов (мономеры, подобные NIPAM и VP) в раствор, содержащий полимер, не снижается. В отличие от способа диализа методика диафильтрации включает механический поток жидкости с помощью насоса через мембрану, посредством чего жидкость нагнетается тангенциально (из-за чего диафильтрация также известна как фильтрация тангенциального потока) по поверхности мембраны. Приложенное давление заставляет порцию жидкости диффундировать селективно через мембрану в сторону фильтрата. Оставшиеся полимерные компоненты не накапливаются на поверхности полупроницаемой мембраны. В отличие от способа диализа, где начальное количество или объем водного раствора полимера,взятого для очистки, остается как таковой/или такой же или становится растворенным в конце или при завершении указанной операции в способе диафильтрации, с другой стороны, поскольку водный раствор полимера захвачен тангенциальным потоком, одновременно дает концентрацию указанного раствора,содержащего полимер, что приводит к еще более концентрированному раствору полимера. Например,если раствор, содержащий приблизительно 100 г полимера в 5,0 л воды, подвергают диализу и диафильтрации, соответственно, в конце первого способа, получают раствор, содержащий 100 г полимера в 4,5-5,5 л воды, тогда как в конце последнего способа снижение концентрации начального объема составляет обычно от одной четвертой до одной шестой (1/4-1/6) начального объема, и в конце получают раствор 100 г полимера в около 0,8-1,3 л воды. Кроме того, как упоминается выше, в способе диализа растворитель вне мембраны, содержащий раствор полимера, необходимо заменять периодически или непрерывно вручную, тогда как при способе диафильтрации нет необходимости в такой ручной операции периодической или непрерывной замены какого-либо растворителя. Это делает первый способ трудоемким, требующим неавтоматизированного контроля во время операции, тогда как последний способ полностью автоматизирован и регулирован и,следовательно, менее трудоемкий и удобный, не требующий неавтоматизированного контроля во время этой операции. Кроме того, благодаря способу диафильтрации, действующему в закрытой среде, по сравнению со способом диализа, который действует в открытой среде, какая-либо возможность микробной контаминации является минимальной или не существует в первом способе, и он поэтому квалифицируется как операция в асептических условиях, соответствующих не только Правилам организации производства и контроля качества лекарственных средств, а также соответствующих Нормативным рекомендациям во всем мире.-6 017682 Кроме того, благодаря не только использованию ручной операции, а также неотъемлемому принципу, при котором работает способ диализа, временной цикл единичной операции является длительным и обычно занимает около 24-36 ч. Для сравнения, для способа диафильтрации, благодаря неотъемлемому принципу, при котором он работает, нужен очень короткий временной цикл, и для завершения обычно нужно менее одного часа. Говоря другими словами, способ диафильтрации по меньшей мере в двадцать пять (25) раз быстрее, чем способ диализа и поэтому промышленно более приемлемый. В то время как способ диализа предусматривает довольно длинный временной цикл для операции и завершения, другим присущим недостатком указанного способа является то, что он позволяет очистить только небольшой объем/количество раствора полимера. Такие ограничения не касаются способа диафильтрации, и вообще он позволяют очистить больший объем/количество раствора по меньшей мере приблизительно в 4-5 раз. Например, если способом диализа можно очистить раствор 100 г полимера в 5,0 л воды в одном цикле, способом диафильтрации можно очистить в одном цикле от 400 до 500 г полимера в 20,0-25,0 л воды. Излишне упоминать, что большая обрабатывающая способность способа диафильтрации является дополнительным преимуществом вдобавок к другим, уже обсуждаемым выше, т. е. меньшее время операции, автоматизация и регуляция операции, удобство и меньшая трудоемкость, конкурентная концентрация или снижение объема исходного раствора, соответствующее правилам организации производства и контроля качества лекарственных средств и нормативным рекомендациям, минимальная или отсутствующая микробная контаминация и т.д. Однако, как упоминалось и обсуждалось выше, наиболее важным преимуществом способа диафильтрации над способом диализа является чистота полимера, полученного соответствующими способами, первый способ производит полимер, главным образом, свободный от мономерных примесей и,поэтому, нетоксичный и безопасный для потребления человеком/животным [см. Таблицу II]. Последнее, но не наименьшее, характерное преимущество способа диафильтрации заключается в том, что если полимер требуется/необходимо выделить в твердой форме из раствора путем выпаривания растворителя, например, с помощью лиофилизации, тогда благодаря указанному способу, приводящему к снижению концентрации или исходного объема раствора полимера, обычно до от около одной четвертой до одной шестой (1/4-1/6) исходного объема, временной цикл выпаривания/лиофилизации будет также сильно сокращен. В способе диализа, поскольку не происходит снижение концентрации или исходного объема, если полимер требуется/необходимо выделить в твердой форме из раствора, временной цикл выпаривания/лиофилизации будет много длиннее. Вкратце, способ диафильтрации по сравнению со способом диализа легко расширяется для крупного производства, соответствующего правилам организации производства и контроля качества лекарственных средств, и, поэтому, промышленно более целесообразный и благоприятный. Существенные различия между способами диафильтрации и диализа приведены в табл. III для быстрой ссылки. В то время как до некоторой степени методика диафильтрации или ультрафильтрации применяется для различных очисток, однако не сообщается о ее применении в области полимеров и формируется новый и изобретательский аспект данного изобретения. Кроме того, данное изобретение далее охарактеризовало полимер высокой чистоты и главным образом свободный от мономерных примесей, полученный таким образом, различными спектроскопическими способами, такими как 1 Н-ЯМР (ядерно-магнитный резонанс), 13 С-ЯМР и преобразование Фурье в инфракрасной области (ИК-Фурье), и определило его структуру (I), как показано ниже. Кроме того, на основании исследований с радиомеченным полимером на самцах швейцарских мышей-альбиносов, как будет очевидно из деталей, приведенных в дальнейшей части данного описания [см. табл. VI и VII и фиг. 6], выявили, что полимер данного изобретения является небиодеградируемым и быстро выделяется из организма без отложения и нарушения в жизненно важных органах, и предложили безопасность и выгоду полимера для использования человеком/животным.-7 017682 Таблица III. Сравнение способов диализа и диафильтрации по отношению к очистке водного раствора полимера данного изобретения Кроме того, на основе обширных исследований токсичности, таких как локализованная токсичность (подкожная и внутривенная), дозовая токсичность целевых органов до 800 мг/кг веса животного организма, токсичность шестимесячной циклической дозы и т.д., как будет очевидно из деталей, приведенных в дальнейшей части данного описания [см. фиг. 7-10], обнаружили, что полимер данного изобретения является нетоксичным, биологически совместимым и биологически безопасным для применения в создании фармацевтических композиций, предназначенных для применения и введения человеку/животному. Кроме того, обнаружили, что полимер данного изобретения, который является высокочистым и главным образом свободным от мономерных примесей и, кроме того, является биологически совместимым, небиодеградируемым, безопасным и нетоксичным, особенно пригодный для получения фармацевтических композиций, включающих указанный полимер в форме наночастиц вместе с фармацевтически приемлемыми наполнителями, которые, в свою очередь, безопасны и менее токсичны для применения человеком/животным и/или введения. Особенно, биологически совместимый, небиодеградируемый, безопасный и нетоксичный полимер данного изобретения, как обнаружили, заключает полностью или почти полностью в свою полимерную оболочку множество слабо растворимых в воде лекарственных средств или соединений, где указанные слабо растворимые в воде лекарственные средства или соединения находятся в форме наночастиц с размером частиц от 30 до 150 нм. В частности, обнаружили, что полимер данного изобретения можно применять для получения фармацевтической композиции в форме наночастиц, вместе с фармацевтически приемлемыми наполнителями, захватывающими множество слабо растворимых в воде лекарственных средств или соединений полностью или почти полностью в свою полимерную оболочку. Такие слабо растворимые в воде лекарственные средства или соединения имеют растворимость в воде менее 10 мг/мл. Примеры таких слабо растворимых в воде лекарственных средств или соединений включают, но не ограничиваются, противораковые агенты, противовоспалительные агенты, противогрибковые агенты, противорвотные средства, противогипертензивные агенты, половые гормоны, стероиды, антибиотики, иммуномодуляторы, анестезирующие средства и т.д. Типичными примерами противораковых агентов, которые могут быть захвачены в полимерную оболочку, являются Паклитаксел, Доцетаксел и другие родственные таксановые производные; Иринотекан, Топотекан и другие родственные Кампотециновые производные; Доксорубицин,Дауномицин и родственные антрациклиновые производные; Цисплатин; Оксалиплатин; 5-Фторурацил; Митомицин; Метотрексат; Этопосид; бетулиновая кислота и ее производные и Веделолактон и его производные. Типичные примеры противовоспалительных агентов, которые могут быть захвачены в полимерную оболочку, включают Индометацин, Ибупрофен, Кетопрофен, Флубипрофен, Пироксикам, Теноксикам и Напроксен. Типичные примеры противогрибковых агентов, которые могут быть захвачены в полимерную оболочку, включают Кетоконазол и Амфотерицин В. Типичные примеры половых гормонов, которые могут быть захвачены в полимерную оболочку, включают Тестостерон, Эстроген, Прогестерон и Эстрадиол. Типичные примеры стероидов, которые могут быть захвачены в полимерную оболочку, включают Дексаметазон, Преднизолон и Триамцинолон. Типичные примеры противогипертензивных агентов, которые могут быть захвачены в полимерную оболочку, включают Каптоприл, Рамиприл, Теразозин, Миноксидил и Празозин. Типичные примеры противорвотных средств, которые могут быть захвачены в полимерную оболочку, включают Ондансетрон и Гранисетрон. Типичные примеры антибиотиков, которые могут быть захвачены в полимерную оболочку, включают Метронидазол и фусидовую кислоту. Типичные примеры иммуномодуляторов, которые могут быть захвачены в полимерную оболочку, включают Циклоспорин и бифенилдиметилдикарбоновую кислоту. Типичные примеры анестезирующих средств, которые могут быть захвачены в полимерную оболочку, включают Пропофол,Альфаксалон и Гексобарбитал. Выявили, что по отношению к противораковым агентам, в частности, полимер данного изобретения способен заключать полностью в свою полимерную оболочку слабо растворимые в воде лекарственные средства или соединения, подобные Паклитакселу, Доцетакселу, Этопосиду и различным производным бетулиновой кислоты, обозначенным как MJ-1098, DRF-4012 и DRF-4015, имеющим следующие структуры (II), (III) и (IV), которые, в свою очередь, раскрыты в патенте США 6403816 и заявке на патент Индии 265/DEL/2005, поданной 09 февраля 2005 г. Фармацевтические композиции в форме наночастиц слабо растворимых в воде лекарственных средств или соединений, упомянутых выше, и особенно фармацевтические композиции в форме наночастиц слабо растворимых в воде лекарственных средств или соединений, подобных Паклитакселу, Доцетакселу и Этопосиду, и сильнодействующих противораковых соединений, подобных MJ-1098, DRF-4012 и DRF-4015, упомянутым выше, как выявили, имеют более длительную стабильность более 24 ч по сравнению с фармацевтической композицией наночастиц Паклитаксела, полученной по способу Burman etal., раскрытому в патенте США 6365191, которая, как заявлено в указанном патенте, имеет стабильность только 12 ч. Что касается выражения "стабильность", его следует рассматривать как обозначение периода, измеряемого в часах, где слабо растворимое в воде лекарственное средство или соединение остается в растворе в фармацевтической композиции, включающей его, без какого-либо осаждения лекарственного средства или соединения из него. Кроме того, в фармацевтических композициях в форме наночастиц слабо растворимых в воде лекарственных средств или соединений, упомянутых выше, и особенно в фармацевтических композициях в форме наночастиц слабо растворимых в воде лекарственных средств или соединений, подобных Паклитакселу, Доцетакселу и Этопосиду, и сильнодействующих противораковых соединений, подобных MJ 1098, DRF 4012 и DRF 4015, упомянутых выше, указанные лекарственные средства или соединения, как выявили, захвачены в полимерную мицеллу до более 95% даже через 24 ч. Для сравнения, в фармацевтической композиции в форме наночастиц Паклитаксела, полученного по способу Burman et al., раскрытому в патенте США 636519, лекарственное средство, как обнаружили, захвачено в полимерную мицеллу только до 90% даже через 24 ч. Сравнение фармацевтических композиций слабо растворимых в воде лекарственных средств или соединений в форме наночастиц, включающих полимер высокой чистоты и главным образом свободный от мономерных примесей данного изобретения, с фармацевтической композицией Паклитаксела, также в форме наночастиц, как раскрыто в патенте США 6365191, будет очевидно из сравнения, приведенного в табл. IV.- 10017682 Таблица IV.Сравнение фармацевтической композиции слабо растворимых в воде лекарственных средств или соединений данного изобретения по отношению к фармацевтической композиции, раскрытой в патенте США 6365191 В дополнение к преимуществам не только полимера высокой чистоты и главным образом свободного от мономерных примесей, полученного по способу данного изобретения, а также преимуществам фармацевтических композиций слабо растворимых в воде лекарственных средств или соединений, включающих полимер данного изобретения, над полимерами и фармацевтическими композициями предшествующего уровня техники, как обсуждалось в деталях выше, данное изобретение, кроме того, представляет высокоселективный способ получения фармацевтических композиций слабо растворимых в воде лекарственных средств или соединений, где указанное слабо растворимое в воде лекарственное средство или соединение, захваченное в полимерную оболочку применяемого здесь полимера, получено в форме наночастиц соответствующего размера. Этот высокоселективный способ формирует другой аспект данного изобретения. В первую очередь, следует отметить, что из описания, содержащегося в примерах 1-40, и приведенного под заголовком "Предпочтительная композиция" и "Формуляция для инфузии" в патенте США 6365191 Burman et al., фармацевтическую композицию Паклитаксела, очевидно, получают сначала растворением необходимого количества полимера в необходимом количестве растворяющей жидкости(обычно 5 или 10% раствор декстрозы) с последующим добавлением анионного сурфактанта для получения прозрачного раствора, рН которого факультативно регулируют буферным агентом. К полученному прозрачному раствору полимера и анионного сурфактанта в растворяющей жидкости затем добавляют спиртовой раствор Паклитаксела для получения концентрации лекарственного средства, изменяющейся от 0,1 до 10 мг/мл, которое, как заявлено, в основном представляет собой фармацевтическую композицию в форме наночастиц, пригодную для введения. Как упоминается выше, в то время как в патенте США 6365191 ничего не сказано о размере наночастиц, полученных таким образом, тем не менее, оказалось, производятся или даются несоответствующие размеры наночастиц в работе данных изобретателей в их попытках получить фармацевтическую композицию Паклитаксела по способу, описанному в примерах 1-40 и под заголовком "Предпочтительная композиция" и "Формуляция для инфузии" в патенте США 6365191 Burman et al. На этом фоне данное изобретение показывает, что образование наночастиц соответствующих размеров высокоселективно и в большей степени зависит от:i) скорости, с которой спиртовой раствор Паклитаксела добавляют в раствор полимера и других наполнителей в растворяющей жидкости;ii) объема спиртового раствора Паклитаксела и объема растворяющей жидкости, к которому добавляют предыдущее;iii) внутреннего диаметра или размера просвета иглы, через которую спиртовой раствор Паклитаксела добавляют в раствор полимера и фармацевтически приемлемые наполнители в растворяющей жидкости; иiv) положения контейнера, который содержит растворяющую жидкость, полимер и фармацевтически приемлемые наполнители во время добавления спиртового раствора Паклитаксела.a) добавление спиртового раствора Паклитаксела через шприц в раствор полимера и других наполнителей в растворяющей жидкости в определенный период времени;b) использование иглы, имеющей внутренний диаметр от 0,305 до 0,356 мм, для добавления меньшего объема спиртового раствора Паклитаксела в раствор полимера и фармацевтически приемлемых наполнителей в растворяющую жидкость илиc) использование иглы, имеющей внутренний диаметр от 0,559 до 0,711 мм, для добавления большего объема спиртового раствора Паклитаксела в раствор полимера и фармацевтически приемлемых наполнителей в растворяющей жидкости;d) инъекцию спиртового раствора Паклитаксела в раствор полимера и других наполнителей в растворяющей жидкости, где игла шприца, через который спиртовой раствор Паклитаксела добавляют,должна остаться погруженной в раствор растворяющей жидкости; иe) факультативно, удерживание контейнера, содержащего указанную растворяющую жидкость, в перевернутом положении во время инъекции спиртового раствора Паклитаксела в раствор полимера и других наполнителей в растворяющей жидкости,будет достигнуто получение наночастиц соответствующего размера с минимальной или незначительной вариацией размера и соответствующий ввод лекарственного средства в полимерную оболочку. Кроме того, только с помощью селективного способа обнаружили, что можно достичь более продолжительной стабильности фармацевтической композиции. Кроме того, обнаружили, что упомянутый выше высокоселективный способ не ограничен только получением наночастиц Паклитаксела, а также равно эффективный в получении наночастиц соответствующего размера других слабо растворимых в воде лекарственных средств или соединений, особенно Доцетаксела, Этопосида, бетулиновой кислоты, сильнодействующих противораковых производных бетулиновой кислоты, подобных MJ-1098 формулы (II), DRF-4012 формулы (III), DRF-4015 формулы (IV),рассмотренных выше. В частности обнаружили, что если время добавления меньшего объема, приблизительно от 1 до 5 мл раствора слабо растворимого в воде лекарственного средства или соединения в раствор (около 35 раз инъецированного объема) полимера и других наполнителей в растворяющей жидкости, превышает 4 с,или если внутренний диаметр иглы (через которую вводят раствор слабо растворимого в воде лекарственного средства или соединения) находится вне диапазона 0,305-0,356 мм, тогда такое добавление приводит к получению несоответствующего размера наночастиц слабо растворимых в воде лекарственных средств или соединений, а также дает фармацевтическую композицию обладающую слабой стабильностью, из-за чего раствор не остается прозрачным в течение более продолжительных периодов времени, а становится матовым в более короткие промежутки времени. Аналогично, в частности обнаружили, что если время добавления большего объема приблизительно от 5 до 15 мл раствора слабо растворимого в воде лекарственного средства или соединения в раствор(около 35 раз инъецированного объема) полимера и других наполнителей в растворяющей жидкости превышает 10 с, или если внутренний диаметр иглы (через которую вводят раствор слабо растворимого в воде лекарственного средства или соединения) находится вне диапазона 0,559-0,711 мм, тогда такое добавление приводит к получению несоответствующего размера наночастиц слабо растворимых в воде лекарственных средств или соединений, а также дает фармацевтическую композицию, обладающую слабой стабильностью, из-за чего раствор не остается прозрачным в течение более продолжительных периодов времени, а становится матовым в более короткие промежутки времени. Примером могут служить фармацевтические композиции двух слабо растворимых в воде противораковых лекарственных средств или соединений, т.е. Паклитаксела и производного бетулиновой кислоты, DRF-4012 формулы (III), где эффект времени добавления раствора указанных лекарственных средств и внутренние диаметры игл, через которые такие растворы добавляют в раствор полимера и фармацевтически приемлемых наполнителей в растворяющей жидкости, приведены в табл. V. Фармацевтическая композиция данного изобретения традиционно представлена как набор из двух ампул:a) одна включает раствор слабо растворимого в воде лекарственного средства или соединения в водорастворимом растворителе или их смесей при приемлемой концентрации указанного лекарственного средства иb) другая включает раствор полимера данного изобретения, высокой чистоты и главным образом свободного от мономерных примесей, вместе с фармацевтически приемлемыми наполнителями в водном растворителе, обычно вода для инъекции, обе ампулы являются стерильными и произведены и укупорены в асептических условиях. Содержимое двух ампул затем добавляют в растворяющую жидкость перед введением людям/животным. Факультативно, набор, кроме того, может включать растворяющую жидкость, шприц и иглу с внутренним диаметром в диапазоне от 0,305 до 0,356 мм, если объем небольшой, приблизительно 1-5 мл содержимого ампулы а) нужно добавить к около 35-кратному объему содержимого ампулы b), или шприц- 12017682 и иглу с внутренним диаметром в диапазоне от 0,559 до 0,711 мм, если объем больше, приблизительно 10-15 мл содержимого ампулы а) нужно добавить к около 35-кратному объему содержимого ампулы b). Особенно в случае набора, включающего Паклитаксел, для введения пациентам для лечения рака молочной железы, набор из двух ампул включал бы:b) другую, содержащую раствор, включающий 200 мг полимера данного изобретения, высокой чистоты и главным образом свободного от мономерных примесей, вместе с фармацевтически приемлемыми наполнителями в 20 мл воды, и факультативно, набор, кроме того, может включать 500 мл сосуд 10% раствора декстрозы, шприц и иглу с внутренним диаметром 0,711 мм для инъекции раствора ампулы а) в 500 мл сосуд 10% раствора декстрозы, в который добавляют раствор ампулы b) в период времени, не превышающий 10 с, предпочтительно в период времени 6 с, для получения фармацевтической композиции, пригодной для введения в наночастицы соответствующего размера, с минимальной или незначительной вариацией размера и соответствующим вводом лекарственного средства в полимерную оболочку, и более продолжительной стабильности. Таблица V. Эффект времени добавления раствора слабо растворимых в воде лекарственных средств или соединений и внутреннего диаметра игл, через которые такие растворы добавляют в раствор полимера и других наполнителей в растворяющей жидкости В итоге, данное изобретение, как упоминается выше, является шагом вперед в обеспечении решения большинства, если не всех, ограничений способов известного уровня техники в области технологии наночастиц и предусматривает:i) полимер, включающий три мономерных единицы, выбранных из NIPAM, VP и MPEG, высокой чистоты и главным образом свободный от мономерных примесей с уровнем токсичных NIPAM и VP в полимере 0,001%; который, более того, как установлено биологически совместимый, небиодеградируемый, безопасный и нетоксичный для применения человеком/животным;ii) высокоселективный способ получения полимера, включающего три мономерные единицы, выбранные из NIPAM, VP и MPEG, высокой чистоты и главным образом свободного от мономерных примесей с уровнем токсичных NIPAM и VP в полимере 0,001%, при котором подвергают водный раствор полимера, полученный таким образом, диафильтрации;iii) фармацевтическую композицию слабо растворимых в воде лекарственных средств или соединений в форме наночастиц, включающую полимер высокой чистоты и главным образом свободный от мономерных примесей вместе с фармацевтически приемлемыми наполнителями, который является безопасным и нетоксичным и, следовательно, высоко приемлемым для применения человеком/животным или введения;iv) высокоселективный способ получения фармацевтической композиции слабо растворимых в воде лекарственных средств или соединений в форме наночастиц, включающей полимер высокой чистоты и главным образом свободный от мономерных примесей вместе с фармацевтически приемлемыми наполнителями, имеющий соответствующий размер наночастиц, и введенное соответствующее лекарственное средство; иv) фармацевтическую композицию слабо растворимых в воде лекарственных средств или соединений в форме наночастиц, включающую полимер высокой чистоты и главным образом свободный от мономерных примесей вместе с фармацевтически приемлемыми наполнителями, имеющий соответствующий размер наночастиц с более высоким вводом лекарственного средства и более продолжительной стабильностью. Детальное описание данного изобретения А. Получение полимера данного изобретения Полимер данного изобретения включает три мономерные единицы, выбранные из NIPAM, VP иMPEG, где полимерные цепи поперечно сшиты поперечно-сшивающим агентом, который не содержит какие-либо сульфгидрильные группы или дисульфидные связи. Поперечно-сшивающий агент играет важную роль во время полимеризации, обеспечивая поперечные связи в линейных полимерных цепях, и, в общем, представляет собой дифункциональное виниловое- 14017682 соединение, когда бы не использовался. Он может быть более чем дифункциональным, т. е. может иметь более чем два реакционных участка. Дифункциональное виниловое соединение, которое можно успешно применять, представляет собой N,N'-метилен-бис-акриламид (MBA), являющийся предпочтительным. Полимер данного изобретения можно получить общими способами, обычно адаптированными для реакций полимеризации. В конкретном варианте осуществления полимер данного изобретения можно получить, подвергая мономеры N-изопропилакриламид (NIPAM), 1-винил-2-пирролидон (VP) и полиэтиленгликоль (молекулярный вес 6000) сложный эфир малеинового ангидрида (MPEG) свободнорадикальной полимеризации в присутствии активатора, инициатора полимеризации и поперечно сшивающего агента в водной среде. Комбинацию мономеров, N-изопропил акриламида (NIPAM) и винилпирролидона (VP), можно применять в весовом соотношении от 55:22 до 65:35, в то время как комономерная композиция (NIPAM+ VP): MPEG, которую можно применять, находится в диапазоне от 80:20 до 95:5. Более конкретно и предпочтительно комбинацию мономеров N-изопропилакриламида (NIPAM) и винилпирролидона (VP) применяют в весовом соотношении от 58:32 до 62:28, а комономерную композицию (NIPAM + VP):MPEG применяют в диапазоне 90:10 или 95:5, который, как выяснили, придает желательную биосовместимость, небиодеградируемость и биологически безопасный профиль полимерам по причине того, что это конкретное соотношение соответственно приводит к формированию свободно гиперразветвленной кополимерной единицы NIPAM и VP, которая стабилизирована покрытием внешней оболочки, сформованной из водородного связывания с помощью диэфирного аддукта (мажор) и моноэфирного аддукта(минор) малеинового ангидрида - полиэтиленгликоля (MPEG). Инициаторы полимеризации играют важную роль в инициации свободнорадикального формирования. Инициаторами, которые можно применять, могут быть пероксидные соединения, такие как диацил пероксид, бензоил пероксид, диацетил пероксид, диалкил пероксиды, третичный бутил пероксид и третичный амил пероксид, или инициаторы полимеризации на основе нитрила, такие как 2,2'-азо-бисизобутиронитрил (AIBN), или инициаторы полимеризации на основе неорганической соли, такие как аммония пердисульфат или аммония персульфат (APS), применяемые или отдельно, или в комбинации. Среди вышеупомянутых инициаторов полимеризации предпочтительным является аммония персульфат (APS). Хотя инициаторы полимеризации инициируют полимеризацию, однако реакция полимеризации,как находят, ускоряется присутствием активирующих агентов (часто известных как активаторы), которые катализируют формирование свободных радикалов из инициаторов полимеризации. Такие активаторы можно выбрать из тетраметилэтилендиамина (TMED) и аммония-железа сульфата (FAS), из которых комбинация TMED и FAS является предпочтительной. Для реакции полимеризации можно применять какую-либо комбинацию инициатора полимеризации и активатора. Можно также применять два или более инициаторов. Аналогично, можно применять два или более активатора. Как упоминается выше, поперечно-сшивающий агент играет важную роль во время полимеризации,обеспечивая поперечные связи в линейных полимерных цепях, и, в общем, представляет собой дифункциональное виниловое соединение, когда бы не использовался. Он может быть более чем дисфункциональным, т.е. может иметь более чем два реакционных участка. Дисфункциональным виниловым производным, которое предпочтительно можно применять, является N,N'-метилен-бис-акриламид (МВА). Полимеризацию выполняют в присутствии инертного газа, который может быть азотом или аргоном. Обычно реакцию полимеризации выполняют, во-первых, растворяя приемлемые количества соответствующих мономеров, т.е. N-изопропилакриламида (NIPAM), 1-винил-2-пирролидона (VP) и полиэтиленгликоля (молекулярный вес 6000) сложного эфира малеинового ангидрида (MPEG) в водном растворителе, которым обычно является вода. К водному раствору соответствующих мономеров, полученных таким образом, добавляют последовательно водный раствор поперечно сшивающего агента и активатора. Раствор деаэрируют путем барботирования инертного газа на протяжении около 30-60 мин. К деаэрированному раствору добавляют водный раствор инициаторов полимеризации и раствор подвергают полимеризации при температуре от 25 до 45 С, предпочтительно при температуре от 25 до 35 С при непрерывном барботировании инертным газом, пока не завершится полимеризация. Поперечно-сшивающий агент можно применять в количествах в диапазоне 1,3-1,5% вес./вес. общего содержания мономеров и более предпочтительно в диапазоне 1,35-1,4% вес./вес. общего содержания мономеров. Активаторы можно применять в количествах в диапазоне 15-18% вес./вес. общего содержания мономеров и более предпочтительно в диапазоне 15-16% вес./вес. общего содержания мономеров. Инициатор полимеризации можно применять в количествах в диапазоне 20-30% вес./вес. общего содержания мономеров и более предпочтительно в диапазоне 23-25% вес./вес. общего содержания мономеров. Ход реакции полимеризации наблюдают с помощью HPLC, и обычно реакция занимает около 3-6 ч. После завершения реакции полимеризации раствор подвергают фильтрации через предварительно стерилизованные одноразовые 0,2 мкм капсульные фильтры с полиэфирсульфоновой мембраной 1", раз- 15017682 мер пор 0,8 и 0,2 мкм; Type DPS-5101 АА-201 (изготовленные M/s Advanced Microdevices Pvt. Ltd, Индия). Фильтрованное содержимое реакционного сосуда подвергают диафильтрации с помощью устройства диафильтрации Proflux M12 (Millipore) для удаления мономерных примесей и других низкомолекулярных примесей. Диафильтрация обычно длится менее чем один час и обычно дает не только раствор, главным образом свободный от мономерных примесей, а также в концентрированной форме, обычно от одной четвертой до одной шестой (1/4-1/6) исходного объема раствора, подвергнутого диафильтрации. Если необходимо, концентрированный раствор, полученный таким образом, который главным образом свободный от мономерных примесей, можно подвергнуть другому циклу диафильтрации. Концентрированный раствор полимера данного изобретения высокой чистоты и главным образом свободный от мономерных примесей можно подвергнуть стадии лиофилизации для получения полимера в твердой лиофилизованной форме для применения в фармацевтических композициях, или концентрированный раствор, как таковой,можно непосредственно применять для формуляции указанных фармацевтических композиций. В типичном варианте осуществления реакцию полимеризации выполняют, растворяя приемлемое количество соответствующих мономеров, т.е. N-изопропилакриламида (NIPAM), 1-винил-2-пирролидона(VP) и полиэтиленгликоля (молекулярный вес 6000) сложного эфира малеинового ангидрида (MPEG), в воде. К водному раствору соответствующих мономеров, полученному таким образом, добавляют приемлемый объем водного раствора (около 5% вес./об.) поперечно-сшивающего агента, N,N'-метилен-бисакриламида (около 1,37% вес./вес. общего содержания мономеров) и комбинацию активаторов, включающую приемлемый объем тетраметилэтилен диамина (TMED, около 15,4% вес./вес. общего содержания мономеров) и водный раствор (0,5% вес./об.) аммония-железа сульфата (около 0,1% вес./вес. общего содержания мономеров). Предпочтительно добавлять сначала один из активаторов, а другой вместе с инициатором полимеризации, который добавляют позже. Раствор деаэрируют барботированием азота в течение около 30 мин. К деаэрированному раствору добавляют приемлемый объем водного раствора(около 80% вес./об.) инициаторов полимеризации, аммония персульфат (около 24% вес./вес. общего содержания мономеров), а раствор подвергают полимеризации при температуре предпочтительно от 25 до 35 С при непрерывном барботировании азотом, пока не завершится полимеризация. Обычно реакция полимеризации занимает 3-5 ч. После завершения реакции полимеризации раствор подвергают фильтрации через предварительно стерилизованный, одноразовый 0,2 мкм капсульный фильтр с полиэфирсульфоновой мембраной 1" (размер пор 0,8 + 0,2 мкм). Фильтрованное содержимое реакционного сосуда подвергают диафильтрации для удаления мономерных примесей и других низкомолекулярных примесей. В типичном варианте осуществления раствор полимера в воде при концентрации приблизительно 1 г в 50 мл можно было бы подвергнуть диафильтрации, вследствие чего после диафильтрации получают концентрированный раствор полимера от около одной четвертой до одной шестой (1/4-1/6) исходного объема, приблизительно 1 г полимера в около 12-13 мл воды, который содержит менее чем 0,001% вес./вес. и NIPAM, и VP. Определение количества остаточных мономеров, особенно остаточных VP и NIPAM, в полимере выполняют с помощью HPLC. Системой HPLC, которую можно использовать для определения мономеров, являются серии Agilent 1100 или эквиваленты, использующие колонки обратной фазы RP-18 (С-18)[Lichrospher RP-18e, 5, 250 мм 4 мм]. Используемой подвижной фазой является смесь воды и ацетонитрила в соотношении 80:20 при скорости потока 1 мл/мин с инъекционным объемом образца 50 мкл. Время разгонки составляет 10 мин, колоночная температура составляет 30 С, а длина волны детектора составляет 226 нм. При описанных выше условиях NIPAM имеет время удержания около 3 мин, тогда как время удержания VP составляет около 5 мин. Концентрированный раствор полимера, полученный таким образом, является высоко чистым и главным образом свободным от мономерных примесей, его можно подвергнуть стадии лиофилизации для получения полимера в твердой лиофилизованной форме для применения в фармацевтических композициях или концентрированный раствор, как таковой, можно непосредственно применять для формуляции указанной фармацевтической композиции. Предпочтительно применять концентрированный раствор полимера, как таковой, для формуляции в фармацевтических композициях. В. Характеристика полимера данного изобретения Полимер данного изобретения, полученный упомянутым выше способом, подвергают экстенсивному спектроскопическому анализу, такому как 1H-ЯМР, 13 С-ЯМР, преобразование Фурье в инфракрасной области (ИК-Фурье), и термальному анализу, такому как дифференциальная сканирующая калориметрия(DSC) и термогравиметрический анализ (TGA) и т.д., для выяснения структуры полученного таким образом полимера. 1 Н-ЯМР спектр полимера данного изобретения в CDCl3 показывает пики при(ppm) 1,14 (br, -СНCH(CH3)2); 3,97 (Br, СН). 1H-ЯМР спектр полимера данного изобретения приведен на фиг. 1. 13 С-ЯМР спектр полимера данного изобретения показывает пики при(ppm) 174 (C=O); 76,6-77,6(мультиплет для CDCl3 и СН для полимерного скелета); 70,6 (СН 2 MPEG); 41,6 (СН для изопропиловой единицы); 31,8 (СН 2, полимерный скелет); 22,6 (СН 3, изопропил). С-ЯМР спектр полимера данного изобретения приведен на фиг. 2. Преобразование Фурье в инфракрасной области (ИК-Фурье) спектра полимера данного изобретения показывает пики при следующих значениях частот (см-1) 3500 (s, ОН); 3296 (s, NH, sec-амид); 2972-2933(s, СН, СН 2, СН 3); 1651 (br, сильные, раздвоенные пики сложного эфира С=O и С=O амида I); 1546 (s, NH изгиб амида II и возможно С=O свободной кислоты, минор); 1387, 1367 (дуплет изопропиловой группы,СН 3, деформация); 1172-1129 (m, О-С-О). Преобразование Фурье в инфракрасной области (ИК-Фурье) спектра полимера данного изобретения приведен на фиг. 3. Эти изучения характеристик подтверждают, что полимер данного изобретения имеет структуру, которая ниже изображена как формула (I). Кроме того, для характеристики физико-химических свойств полимера в деталях, оценивали различные свойства полимера, такие как термические свойства, критическая мицеллиальная концентрация(CMC), растворимость и рН, стабильность при хранении. Термогравиметрический анализ (TGA) показал, что существует некоторая потеря веса от 51-260 С,которая показывает потерю растворителя и некоторые макромолекулярные реакции, которые могли бы происходить особенно в единице MPEG полимера, перед тем как начинается деградация при около 310 С. Это показывает, что полимер имеет высокую термическую стабильность, которая в большей степени может обеспечиваться единицами MPEG. Термограмма TGA полимера данного изобретения приведена на фиг. 4. Кроме того, профиль дифференциальной сканирующей калориметрии (DSC) полимера, представленный на фиг. 5, не показывает какой-либо температуры стеклования (Tg), а только наблюдается температура плавления (Tm) 58 С и температура точки рекристаллизации (TC) 38,4 С. Отсутствие какой-либо четкой Tg может свидетельствовать о высокожесткой гиперразветвленной структуре, чему также способствует экстенсивное водородное связывание с MPEG. Структура полимера данного изобретения Более низкая критическая температура раствора (LCST) полимера имеет значения в диапазоне 5060 С. Это важный параметр для амфифильных полимеров в водной фазе, проявляющийся в реагирующих на тепло фазовых переходах при определенной температуре, названной LCST. Ниже LCST полимер покажет растворимую расширенную конфигурацию цепи, т.е. гидрофильное поведение. Выше LCST полимер подвергается фазовому переходу, чтобы выполнить формирование нерастворимого, гидрофобного агрегата. Это свойство используется для определения способности формировать мицеллы в приемлемом растворителе и действовать в системах доставки лекарственных средств в фармацевтических применениях. Критическая мицеллиальная концентрация (CMC) является другим важным параметром, который определяет капсулирующую способность наноносителя и определяет стабильность. Это самая низкая концентрация для амфифильного полимера или мономолекулярных мицелл для формирования мицеллярной структуры, способной капсулировать лекарственное средство в своем гидрофобном ядре. Значение CMC для данного полимера составляет около 0,2 мг/мл. Кроме того, полимер, включающий чувствительные к температуре и рН-чувствительные мономеры, такие как N-изопропилакриламид (NIPAM) и 1 винилпирролидин-2-он (VP), хорошо известны как биологически совместимые с белками и клетками- 17017682 крови. Кроме того, биомедицинские применения поли (NIPAM) достаточно распространены из-за их обратимого температурного перехода, т.е. LCST, исключительного водородного связывания, способностей формировать мицеллы и гидрогели. Аналогично, поливинилпирролидоновые (также известные как Повидон) полимеры также высоководорастворимы и формируют экстенсивное водородное связывание с водой. Намеченное применение этого полимера должно было воплотить новую систему, включающую эффективности различных предварительно определенных мономеров, приводя к формированию чувствительных к температуре, рН-чувствительных, стабильных полимерных наночастиц, содержащих гидрофильные и гидрофобные группы для повышения растворимости лекарственных средств, слабо растворимых в воде. Обнаружили, что формирование произвольно гиперразветвленной кополимерной единицы, состоящей из NIPAM и VP, стабилизированной покрытием внешней оболочки, сформированным водородным связыванием диэфирным аддуктом (мажор) и моноэфирным аддуктом (минор) малеинового ангидрида полиэтиленгликоля (MPEG), имеющей комономерную композицию (NIPAM + VP): MPEG в диапазоне от 80:20 до 95:5, а также единицы NIPAM: VP в диапазоне от 55:22 до 65:35, придает полимерам желательную биосовместимость, небиодеградируемость и биологически безопасный профиль. В частности, обнаружили, что лучшие результаты (более высокая LCST, более высокий выход, процент высвобождения из наночастиц Паклитаксела) получили, когда композиция (NIPAM + VP): MPEG имела диапазон 90:10 или 95:5, а единицы NIPAM: VP применялись в диапазоне от 58:32 до 62:28. Соотношение применяемого мономера также соответствует финальному полимеру и подтверждается различными исследованиями,такими как исследования 1 Н-ЯМР, 13 С-ЯМР и преобразование Фурье в инфракрасной области (ИКФурье) спектра. С. Биосовместимость и небиодеградируемость полимера данного изобретения Когда оценили фармакокинетические показатели, биораспределение и выведение [14 С]-меченного полимера на самцах швейцарских машей-альбиносов, профиль концентрации радиоактивности в крови показал двухфазную кривую (фиг. 6), с коротким периодом полувыведения Т 1/2 0,4480,157 аса(26,88 мин) и быстрым очищением 54,7 мл/ч. Результаты исследования приведены в табл. VI и VII. Таблица VI. Параметры фармакокинетических показателей полимера данного изобретения Обнаружили, что преобладающим путем выведения являлась моча (моча, 66,91% по сравнению с калом, 17,39% за 48 ч) и данные восстановления, собранные за 48 ч, составляют 84,87% введенной радиоактивности. Распределение в тканях было незначительным. Почка, печень, кожа и кишечник, как выявили, являются мишеневыми органами. Однако уровень полимера в ткани быстро снижался через мочу и кал. Таблица VII. Восстановление радиомеченного полимера данного изобретения Таким образом, в заключение, полимер, как обнаружили, быстро выделяется из организма, не являясь отложенным и ухудшенным в жизненных органах, что обеспечивает безопасность и приемлемость полимера для применения человеком.D. Исследования токсичности полимера данного изобретения Исследования токсичности полимера формулы (I) выполняли для оценивания:(ii) дозовой токсичности мишеневых органов до 800 мг/кг веса животного организма и(iii) шестимесячной циклической дозовой токсичности.D(i) Люкализованная токсичность (подкожная и внутривенная) Токсичность полимера определяли после отдельного подкожного введения 100 мкл 75-мг/мл полимера в ухо кролика, что вызывало слабое воспаление на участке инъекции, при анализе через 48 ч после инъекции предположили, что данный полимер не вызывает какую-либо локальную токсичность на участке введения после подкожного введения. Токсичность данного полимера определяли на протяжении пяти дней непрерывного внутривенного введения 75-мг/мл данного полимера при дозе 125 мг/кг в ушную вену кролика и получили подобные результаты, кроме того, подтвердили, что данный полимер не вызывает какую-либо локальную токсичность на участке введения. Представленные фотографии окрашенного солохромом/эозином участка мочки уха кролика через 48 ч подкожной инъекции с 10% раствором декстрозы показаны на фиг. 7, а фотографии окрашенного солохромом/эозином участка мочки уха кролика через 48 ч подкожной инъекции с водным раствором полимера показаны на фиг. 8. Представленные фотографии окрашенного солохромом/эозином участка краевой вены уха кролика через 24 ч внутривенной инъекции с 10% раствором декстрозы показаны на фиг. 9, и фотографии окрашенного солохромом/эозином участка краевой вены уха кролика через 24 ч внутривенной инъекции с водным раствором полимера показаны на фиг. 10.D(ii) Дозовая токсичность мишеневых органов (до 800 мг/кг веса животного организма) Кроме того, токсичность оценивали на возможном мишеневом органе(органах) со специальными ссылками на микроциркуляцию и определяли с помощью отдельного внутривенного болюсного введения на крысах Вистара. Полимер вводили двумя различными дозировками 400 и 800 мг/кг. При условиях исследования отдельное внутривенное болюсное введение данного полимера при какой-либо дозе не приводит к какой-либо смертности или какому-либо заметному признаку токсичности или симптомам у крыс. Отдельные и средние веса тела крыс показали устойчивое повышение в группах, обработанных полимером и контрольных. Не отметили никакой значительной разницы по весу тела опытных животных при обеих дозах по сравнению с таковыми контроля. У крыс, обработанных полимером, гематологические параметры находились в пределах нормы на протяжении исследования. Биохимические параметры также находились в пределах нормы у животных,обработанных обеими дозами. Анализ с помощью актометра показал, что не существует значительной разницы двигательной активности между контрольной и опытной группами на день 7 и 21, соответственно, подсказывая, что полимер не обладает какой-либо нейротоксичностью. Образцы опытной и контрольной групп показали подобные гистологические особенности. Гистологическое исследование выполняли на жизненно важных органах, таких как печень, сердце, легкие, почки,селезенка, желудок, толстая кишка, мышца бедра и глаз. Все исследованные органы показали нормальную структуру при обследовании на световом микроскопе. Внимательно проверили микроциркуляцию в каждом органе, и не заметили никаких патологических особенностей в каком-либо из органов. Кроме того, не было изменений в микроциркуляции животных, обработанных полимером. Из вышеупомянутых наблюдений стало достаточно очевидно, что полимер данного изобретения при дозе или 400 мг/кг, или 800 мг/кг веса тела, который вводили в течение пяти последовательных дней,не вызвал какой-либо общей токсичности или какой-либо значительной гематологической токсичности,показав биологически безопасный и нетоксичный профиль данного полимера.D(iii) Токсичность шестимесячной циклической дозы Кроме того, токсичность шестимесячной критической дозы изучали на крысах с помощью внутривенной инъекции полимера, используемого в формуляции в форме наночастиц. Для исследования использовали самцов и самок крыс Вистара, а дозирование выполняли внутривенно в боковую хвостовую вену циклически один раз каждые три недели в течение 180 дней (приблизительно 26 недель). Животные опытной и контрольной групп обычно оставались активными и здоровыми в течение периода исследования. Эквивалент концентрации полимера 10 мг/кг лекарственного средства выявили безопасным у животных при исследовании. Минимальные изменения в гематологических параметрах отметили в нормальном диапазоне для крыс Вистара и не нашли их зависимыми от лечения. Вышеупомянутые исследования наводят на мысль, что синтезированный полимер нетоксичен и биологически безопасный для применения в создании фармацевтических композиций. Е. Фармацевтические композиции, включающие полимер данного изобретения Как обсуждалось выше, полимер данного изобретения формулы (I), высокой чистоты и главным образом свободный от мономерных примесей, в частности имеющий остаточные мономерные NIPAM иVP 0,001% можно применять с пользой для получения фармацевтических композиций слабо растворимых в воде лекарственных средств или соединений в форме наночастиц, которые безопасны и нетоксичны для введения или применения человеку или животному. В частности, полимер данного изобретения можно применять для получения фармацевтической композиции в форме наночастиц, вместе с фармацевтически приемлемыми наполнителями, который захватывает множество слабо растворимых в воде лекарственных средств или соединений полностью или- 19017682 почти полностью в свою полимерную оболочку. Кроме того, как обсуждалось выше, слабо растворимые в воде лекарственные средства или соединения, которые можно применять в фармацевтических композициях данного изобретения, обычно имеют растворимость в воде менее 10 мг/мл. Примеры таких слабо растворимых в воде лекарственных средств или соединений включают, но не ограничиваются, противораковые агенты, противовоспалительные агенты, противогрибковые агенты,противорвотные средства, противогипертензивные агенты, половые гормоны, стероиды, антибиотики,иммуномодуляторы, анестезирующие средства и т.д. Типичными примерами противораковых агентов,которые могут быть захвачены в полимерную оболочку, являются Паклитаксел, Доцетаксела и другие родственные таксановые производные; Иринотекан, Топотекан и другие родственные кампотециновые производные; Доксорубицин, Дауномицин и родственные антрациклиновые производные; Цисплатин; Оксалиплатин; 5-фторурацил; Митомицин; Метотрексат; Этопосид; бетулиновая кислота и ее производные; Веделолактон и его производные. Типичные примеры противовоспалительных агентов, которые могут быть захвачены в полимерную оболочку, включают Индометацин, Ибупрофен, Кетопрофен, Флубипрофен, Пироксикам, Теноксикам и Напроксен. Типичные примеры противогрибковых агентов, которые могут быть захвачены в полимерную оболочку, включают Кетоконазол и Амфотерицин В. Типичные примеры половых гормонов, которые могут быть захвачены в полимерную оболочку, включают Тестостерон, Эстроген, Прогестерон и Эстрадиол. Типичные примеры стероидов, которые могут быть захвачены в полимерную оболочку, включают Дексаметазон, Преднизолон и Триамцинолон. Типичные примеры противогипертензивных агентов, которые могут быть захвачены в полимерную оболочку, включают Каптоприл, Рамиприл, Теразозин, Миноксидил и Празозин. Типичные примеры противорвотных средств, которые могут быть захвачены в полимерную оболочку, включают Ондансетрон и Гранисетрон. Типичные примеры антибиотиков, которые могут быть захвачены в полимерную оболочку, включают Метронидазол и фусидовую кислоту. Типичные примеры иммуномодуляторов, которые могут быть захвачены в полимерную оболочку, включают Циклоспорин и бифенил диметил дикарбоновую кислоту. Типичные примеры анестезирующих средств, которые могут быть захвачены в полимерную оболочку,включают Пропопол, Альфаксалон и Гексобарбитал. Фармацевтическая композиция слабо растворимых в воде лекарственных средств или соединений типично представлен набором из двух ампул, включающим, с одной стороны, ампулу содержащую раствор слабо растворимого в воде лекарственного средства в водорастворимом растворителе или их смеси при приемлемой концентрации указанного лекарственного средства или соединения; и включающим, с другой стороны, ампулу, содержащую раствор полимера данного изобретения, высокой чистоты и главным образом свободного от мономерных примесей, и фармацевтически приемлемых наполнителей в водном растворителе, обычно воде для инъекции, обе ампулы набора являются стерильными, произведены и запакованы в асептических условиях. Содержимое двух ампул затем добавляют последовательно в растворяющую жидкость для введения людям/животным. Следует отметить, что, как обсуждалось выше,а так же будет обсуждаться далее, слабо растворимое в воде лекарственное средство или соединение захватывается в полимерную оболочку применяемого здесь полимера и производится в форме наночастиц соответствующего размера. Соотношение раствора слабо растворимого в воде лекарственного средства в водорастворимом растворителе или их смесях к раствору слабо растворимого в воде лекарственного средства в водорастворимом растворителе или их смесях, содержащихся в двух ампулах обычно составляет от 1:1 до 1:10 по объему, предпочтительно соотношение составляет 1:1. Факультативно, набор из двух ампул, кроме того, может включать растворяющую жидкость, шприц и иглу с внутренним диаметром в диапазоне от 0,305 до 0,356 или от 0,559 до 0,711 мм, который зависит от объема раствора лекарственного средства и объема растворяющей жидкости, содержащей полимер и наполнители, подлежащие смешиванию для введения людям/животным, нуждающимся в этом. Пригодные водорастворимые растворители, которые можно применять для растворения слабо растворимого в воде лекарственного средства или соединения, включают алифатический спирт, особенно этанол; диалкиламиды, особенно диметилформамид и диметилацетамид; диалкилсульфоксиды, особенно диметилсульфоксид и диэтилсульфоксид; полиэтиленгликоли различного молекулярного веса; полипропилен гликоли различного молекулярного веса; сурфактанты, особенно полисорбат 80, полисорбат 20,полиоксиэтилированное растительное масло и полиэтоксилированное касторовое масло; глицерин и т. д. Фармацевтически приемлемые наполнители, которые можно преимущественно применять, включают натрия дезоксихолат; различные соли желчных кислот; полисорбаты различных сортов, особенно полисорбат 80, полисорбат 20, полиоксиэтилированное растительное масло и полиэтоксилированное касторовое масло; полисахариды, подобные декстрозе, сахарозе, лактозе, маннитолу и т.д.; сложные эфиры сорбитана или спанов различных марок, myrj (сложных эфиров жирных кислот) различных марок или полоксомеров различных марок и т.д., и буферный агент для регулирования рН. Какой-либо буферный агент, известный в данной области, можно применять для регулирования рН раствора, а в предпочтительном варианте осуществления предпочтительно использовать натрия цитрат в качестве буферного агента. Из фармацевтически приемлемых наполнителей предпочтительным является натрия дезоксихолат,- 20017682 поскольку он влияет на стабилизацию фармацевтической композиции, тогда как буферный агент используют для регулировки рН перфузионной жидкости в диапазоне от 6,0 до 8,5, который также влияет, как обнаружили, на стабилизацию фармацевтической композиции. Фармацевтическая композиция может иметь пригодный ввод или дозу слабо растворимого в воде лекарственного средства или соединения, и выбор оптимального ввода или дозы указанного лекарственного средства или соединения в значительной степени зависит от природы лекарственного средства или соединения, его растворимости, а также от терапевтического нарушения, для которого его вводили. В случае фармацевтически приемлемых наполнителей пропорция или количество, которые можно применять в фармацевтической композиции аналогично, в свою очередь зависят от природы и ввода слабо растворимого в воде лекарственного средства или соединения, содержащихся в композиции. Фармацевтическую композицию в форме наночастиц слабо растворимых в воде лекарственных средств или соединений данного изобретения можно получить следующим путем:i) получают концентрат лекарственного средства, включая растворение слабо растворимого в воде лекарственного средства или соединения в пригодном водорастворимом растворителе или их смесях;ii) получают водный концентрат полимера и фармацевтически приемлемых наполнителей, включая стадии, на которых:a) сначала добавляют необходимое количество полимера формулы (I), высокой чистоты и главным образом свободного от мономерных примесей, особенно имеющего уровень токсичных NIPAM и VP 0,001%, в приемлемое количество воды для инъекции для получения раствора;b) добавляют фармацевтически приемлемые наполнители и буферный агент в раствор полимера в воде;iii) смешивают раствор со стадии ii b) с растворяющей жидкостью до получения прозрачного раствора;iv) используют иглу, имеющую внутренний диаметр от 0,305 до 0,356 мм, для добавления меньшего объема раствора со стадии i) в раствор со стадии iii); илиv) используют иглу, имеющую внутренний диаметр от 0,559 до 0,711 мм, для добавления большего объема раствора со стадии i) в раствор со стадии iii);vi) вводят раствор со стадии i) в раствор со стадии iii), где игла шприца, через который добавляют раствор со стадии i) должна оставаться погруженной в раствор со стадии iii); иvii) факультативно удерживают контейнер, содержащий раствор со стадии iii), в перевернутом положении во время введения раствора со стадии i),чтобы полностью захватить слабо растворимое в воде лекарственное средство или соединение полностью или почти полностью в полимерную оболочку и получить наночастицы лекарственного средства или соединения, имеющие размер от 30 до 150 нм. Такая перфузионная жидкость остается стабильной на протяжении более чем 24 ч с более чем 95% лекарственного средства, оставшегося введенным в полимерные мицеллы. Следует отметить, что выбор растворяющей жидкости главным образом зависит от природы слабо растворимого в воде лекарственного средства или применяемого соединения, а также от нарушения, для лечения которого вводят фармацевтическую композицию. Пригодные растворяющие жидкости можно выбрать из, без ограничения, воды, солевого раствора, 5% и 10% растворов декстрозы, раствора декстрозы и натрия хлорида, раствора натрия лактата, лактированного раствора Рингера, раствора маннитола,раствора маннитола с декстрозой или натрия хлорида, раствора Рингера, раствора натрия хлорида, стерильной воды для инъекции и растворов разнообразных электролитов, включая меняющиеся комбинации электролитов, декстрозы, фруктозы и инвертированного сахара. Предпочтительно растворяющей жидкостью является жидкость, включающая декстрозу и воду, а более предпочтительно 5 и 10% растворы декстрозы. Предпочтительный способ получения фармацевтической композиции наночастиц данного изобретения и ее введения пациентам, нуждающимся в этом, графически представлен на фиг. 11. Данное изобретение, кроме того, описано в деталях, что касается следующих неограничивающих примеров, которые, однако, никоим образом не должны быть рассмотрены как ограничение объема данного изобретения. Следует отметить, что в примерах, приведенных ниже, оборудование диафильтрации, применяемое для очистки полимера, представляло собой устройство диафильтрации Proflux M12 (производство Millipore), а оборудование для диализа, применяемое для очистки полимера, представляло собой целлюлозную мембрану - D-9402 (производство Sigma). Экспериментальный раздел Ссылочный пример 1. Получение полимера с помощью способа диализа Реакцию полимеризации выполняют в 2-л стеклянном сосуде. К около 2 л воды добавляют 24 г Nизопропил акриламида, 12 мл дистиллированного 1-винил-2-пирролидона и 4 г полиэтиленгликоля (молекулярный вес 6000) сложного эфира малеинового ангидрида (MPEG). К этому добавляют 11,2 мл водного раствора N,N'-метилен-бис-акриламида (МВА) [49 мг/мл] и 8 мл тетраметилэтилендиамина (d = 0,77- 21017682 г/мл). Раствор деаэрируют путем барботирования газообразного азота 30 мин. Затем добавляют 8 мл водного аммония-железа сульфата (0,5% вес./об.) и 12 мл водного аммония персульфата (80% вес/об.), и реакция продолжается 3 ч с непрерывным барботированием азота. Полимеризацию выполняют при 34 С в водяной бане со взбалтыванием при 80 об./мин. Раствором наполняют диализные емкости и спускают в воду (среду диализа). Диализ выполняют 24 ч, один раз меняя воду. Через 24 ч раствор удаляют из диализных емкостей и лиофилизируют в круглодонных колбах. Определение и количественное определение остаточных мономеров, особенно остаточных VP иNIPAM, в полимере выполняют с помощью системы HPLC серий Agilent 1100, используя обратно фазовые RP-18 (С-18) колонки [Lichrospher RP-18e, 5, 250 мм 4 мм]. Используемой мобильной фазой является смесь воды и ацетонитрила в соотношении 80:20 при скорости потока 1 мл/мин с объемом образца инъекции 50 мкл. Время разгонки составляет 10 мин, температура колонки 30 С, а длина волны детектора 226 нм. При описанных выше условиях NIPAM имеет время удержания около 3 мин, тогда как VP имеет время удержания около 5 мин. Аналитические данные: % остаточных мономеров i) NIPAM = 0,066% (660 ppm) и ii) VP = 0,011%(110 ppm). Пример 1. Получение полимера с помощью способа диафилътрации Реакцию полимеризации выполняют в двух 5-л стеклянных сосудах для размера партии 160 г (4 л 2) полимера. В каждый сосуд добавляют 48 г N-изопропилакриламида, 23 мл дистиллированного 1 винил-2-пирролидона и 8 г полиэтиленгликоля (молекулярный вес 6000) сложного эфира малеинового ангидрида (MPEG) к около 4 л воды. К этому добавляют 22,4 мл водного раствора N,N'-метилен-bisакриламида (МВА) [49 мг/мл] и 16 мл тетраметилэтилендиамина. Раствор деаэрируют с помощью барботирования газообразным азотом 30 мин. Затем добавляют 16 мл водного аммония-железа сульфата (0,5% вес./об.) и 24 мл водного аммония персульфата (80% вес./об.), и реакция длится 3 ч при непрерывном барботировании азотом. Полимеризацию выполняют при 34 С в водяной бане со взбалтыванием при 80 об./мин. Во время полимеризация образцы отбирают в приемлемые точки времени (0, 15, 60 и 180 мин) для наблюдения за реакцией. После завершения полимеризации раствор фильтруют через предварительно стерилизованные одноразовые 0,2 мкм капсульные фильтры с полиэфирсульфоновой мембраной 1" с размером пор 0,8 и 0,2 мкм (тип DPS-5101 АА-201, производства Advanced Microdevices Pvt. Ltd, Индия). Фильтрованное содержимое обоих реакционных сосудов объединяют и подвергают фильтрации тангенциального потока с помощью устройства диафилътрации Proflux M12 (Millipore) для удаления остаточных мономеров и других примесей с низким молекулярным весом. Комбинированную партию 8 л реакционной смеси сначала концентрируют до около 2,2 л путем диафильтрации, а затем образованный концентрат подвергают диафильтрации с помощью около 30 л высоко очищенной воды. Во время диафильтрации реакционную смесь концентрируют до около 1 л. Общее время обработки диафильтрацией для размера партии 160 г (8 л) составляет около 4-6 ч. Диафильтрованный раствор затем подвергают лиофилизации. Определение и количественное определение остаточных мономеров, особенно остаточных VP иNIPAM, в полимере выполняют с помощью системы HPLC серий Agilent 1100, используя обратно фазовые RP-18 (С-18) колонки [Lichrospher RP-18e, 5, 250 мм 4 мм]. В качестве мобильной фазы используют смесь воды и ацетонитрила в соотношение 80:20 при скорости потока 1 мл/мин с объемом образца инъекции 50 мкл. Время разгонки составляет 10 мин, температура колонки 30 С, а длина волны детектора 226 нм. При описанных выше условиях NIPAM имеет время удержания около 3 мин, тогда как VP имеет время удержания около 5 мин. Аналитические данные: % остаточных мономеров i) NIPAM0,001% (10 ppm) и ii) VP0,001%(10 ppm). Полимер имеет следующие спектральные характеристики, а именно: 1 Н ЯМР (300 MHz, спектрометр Bruker, CDCl3,ppm): 1,15 (br, -CH(CH3)2); 1,45 (br, -СН 2-СНN(VP-Кольцо); 1,63 (br, -CH2-CHC(=O)NH); 1,99 (br, -CHC(=O)NH-), CH2 (VP кольцо), 2,36 (CH2, VP кольцо), 3,0 (-O-CH2-CH2-), 3,23 (CH2-N-); 3,62-3,66 (Br, CH2, MPEG); 3,72 (NH-CH(CH3)2); 3,97 (Br, CH); 13C ЯМР (300 MHz, спектрометр Bruker, CDCl3,ppm): 174 (C=O); 76,6-77,6 (мультиплет для CDCl3 и СН для полимерного скелета), 70,6 (CH2's MPEG), 41,6 (СН для изопропиловой единицы), 31,8 (CH2's,полимерный скелет), 22,6 (CH3's, изопропил);- 22017682 Пример 2. Получение фармацевтической композиции Паклитаксела в форме наночастиц (воспроизведение в небольшом объеме, т.е. до 40 мл)A) Получение спиртового раствора Паклитаксела (20 мг/мл): 200 мг Паклитаксела растворяют в 10,0 мл этанола.B) Получение водного концентрата полимера и наполнителей: 100 мг полимера, полученного по примеру 1, 66,7 мг натрия дезоксихолата и 100 мг натрия цитрата растворяют в 10 мл воды для получения прозрачного раствора.C) Получение наночастиц Паклитаксела (0,6 мг/мл): 1,0 мл водного концентрата полимера и наполнителей со стадии В) растворяют в 31,3 мл 10% раствора декстрозы для получения прозрачного раствора. 1,0 мл спиртового раствора Паклитаксела стадии А) добавляют в упомянутый выше раствор через иглу,имеющую внутренний диаметр 0,330 мм, за 4 с для получения наночастиц Паклитаксела с концентрацией 0,6 мг/мл. Фармацевтическая композиция, полученная таким образом, имеет следующие характеристики: Пример 3. Получение фармацевтической композиции Паклитаксела в форме наночастиц (воспроизведение в большем объеме, т.е. до 500 мл)A) Получение спиртового раствора Паклитаксела (20 мг/мл): 400 мг Паклитаксела растворяют в 20,0 мл этанола.B) Получение водного концентрата полимера и наполнителей: 200 мг полимера, полученного по примеру 1, 133,4 мг натрия дезоксихолата и 200 мг натрия цитрата растворяют в 20 мл воды для получения прозрачного раствора.C) Получение наночастиц Паклитаксела (0,6 мг/мл): 15,0 мл водного концентрата полимера и наполнителей стадии В) растворяют в 500 мл 10% раствора декстрозы для получения прозрачного раствора. 15,0 мл спиртового раствора Паклитаксела стадии А) добавляют в вышеупомянутый раствор через иглу, имеющую внутренний диаметр 0,711 мм, за 8 с для получения наночастиц Паклитаксела с концентрацией 0,6 мг/мл. Фармацевтическая композиция, полученная таким образом, обладает следующими характеристиками: Пример 4. Получение фармацевтической композиции в форме наночастиц производного бетулиновой кислоты [MJ-1098 формулы (II)]B) Получение водного концентрата полимера и наполнителей: 10 мг полимера, полученного по примеру 1, 6,67 мг натрия дезоксихолата и 10 мг натрия цитрата растворяют в 1 мл воды для получения прозрачного раствора.C) Получение наночастиц MJ-1098 (0,75 мг/мл): 0,3 мл водного концентрата полимера и наполнителей стадии В) растворяют в 9,2 мл 5% раствора декстрозы для получения прозрачного раствора. К вышеупомянутому раствору добавляют 0,5 мл раствора MJ-1098 стадии А) через иглу с внутренним диаметром 0,330 мм за 3 с для получения наночастиц MJ-1098 с концентрацией 0,75 мг/мл. Фармацевтическая композиция, полученная таким образом, обладает следующими характеристиками:- 23017682 Пример 5. Получение фармацевтической композиции в форме наночастиц производного бетулиновой кислоты [DRF-4012 формулы (III)]B) Получение водного концентрата полимера и наполнителей: 10 мг полимера, полученного по примеру 1, 6,67 мг натрия дезоксихолата и 10 мг натрия цитрата растворяют в 1 мл воды для получения прозрачного раствора.C) Получение наночастиц DRF-4012 (0,60 мг/мл): 0,33 мл водного концентрата полимера и наполнителей стадии В) растворяют в 10,44 мл 5% раствора декстрозы для получения прозрачного раствора. 0,33 мл раствора DRF-4012 стадии А) добавляют к вышеупомянутому раствору через иглу с внутренним диаметром 0,305 мм за 3 с для получения наночастиц DRF-4012 с концентрацией 0,6 мг/мл. Фармацевтическая композиция, полученная таким образом, обладает следующими характеристиками: Пример 6. Получение фармацевтической композиции в форме наночастиц производного бетулиновой кислоты [DRF-4015 формулы (IV)]B) Получение водного концентрата полимера и наполнителей: 10 мг полимера, полученного по Примеру 1, 6,67 мг натрия дезоксихолата и 10 мг натрия цитрата растворяют в 1 мл воды для получения прозрачного раствора.C) Получение наночастиц DRF-4015 (0,60 мг/мл): 0,33 мл водного концентрата полимера и наполнителей стадии В) растворяют в 10,44 мл 5% раствора декстрозы для получения прозрачного раствора. 0,33 мл раствора DRF-4015 стадии А) добавляют к вышеупомянутому раствору через иглу с внутренним диаметром 0,330 мм за 4 секунды для получения наночастиц DRF-4015 с концентрацией 0,6 мг/мл. Фармацевтическая композиция, полученная таким образом, обладает следующими характеристиками: Пример 7. Получение фармацевтической композиции Доцетаксела в форме наночастиц А) Получение спиртового раствора Доцетаксела (40 мг/мл): 200 мг Доцетаксела растворяют в 5,0 мл этанола.B) Получение водного концентрата полимера и наполнителей: 400 мг полимера, полученного по примеру 1, 400 мг натрия дезоксихолата и 400 мг натрия цитрата растворяют в 10 мл воды для получения прозрачного раствора.C) Получение наночастиц Доцетаксела (0,5 мг/мл): 4,0 мл водного концентрата полимера и наполнителей стадии В) растворяют в 35,5 мл 10% раствора декстрозы для получения прозрачного раствора. 0,5 мл спиртового раствора Доцетаксела стадии А) добавляют к вышеупомянутому раствору через иглу с внутренним диаметром 0,330 мм за 3 с для получения наночастиц Доцетаксела с концентрацией 0,5 мг/мл. Фармацевтическая композиция, полученная таким образом, обладает следующими характеристиками: Пример 8. Получение фармацевтической композиции Этопосида в форме наночастицA) Получение раствора Этопосида (20 мг/мл): 20 мг Этопосида растворяют в смеси 0,10 мл N,Nдиметил ацетамида и 0,90 мл этанола под ультразвуком.B) Получение водного концентрата полимера и наполнителей: 10 мг полимера, полученного по примеру 1, 6,67 мг натрия дезоксихолата и 10 мг натрия цитрата растворяют в 10 мл воды для получения прозрачного раствора.C) Получение наночастиц Этопосида (0,6 мг/мл): 0,3 мл водного концентрата полимера и наполнителей стадии В) растворяют в 9,4 мл 5% раствора декстрозы для получения прозрачного раствора. 0,3 мл спиртового раствора Этопосида стадии А) добавляют к вышеупомянутому раствору через иглу с внутренним диаметром 0,330 мм за 3 с для получения наночастиц Этопосида с концентрацией 0,6 мг/мл. Фармацевтическая композиция, полученная таким образом, обладает следующими характеристиками: Пример 9. Определение фармакокинетических показателей, биораспределения и выведения [С]меченного полимера у мышей 30 Самцов швейцарских мышей-альбиносов возрастом 6-8 недель массой приблизительно 25-30 г произвольно распределили на пять групп по шесть животных в каждой. [14 С]-меченный полимер растворили в деоинизированной воде до 5 мг/мл с учетом определенной активности полимера. Все животные получили однократную дозу [14 С] полимера 40 мг/кг путем внутривенной инъекции. При исследовании фармакокинетических показателей 100 мкл крови отобрали у животных путем ретроорбитального кровоизлияния под анестезией с точками времени 3, 10, 30 мин, 1, 2, 4, 8, 16 и 24 ч после введения в пробирки, содержащие EDTA. Для исследований выделения собирают мочу и кал из обменной камеры или силой (10 мин). В завершение (10, 60 мин, 24 и 48 ч) отбирают пробы надпочечника, мозга, легких, печени, сердца, почек, селезенки, желудка, тонкой кишки, толстой кишки, кала, мочи,мочевого пузыря, глаза, кожи, мышцы бедра и эпидидимуса, промывают, иссекают и взвешивают. Концентрации [14 С] полимера в крови и моче определяют путем комбинирования 50 мкл крови/мочи с 5 мл жидкой сцинтилляционной смеси. Кал и ткань (не более 0,5 мг) гомогенизируют в деионизированной воде для получения 20% гомогената перед комбинированием 500 мкл с 5 мл жидкой сцинтилляционной смеси. Образцы анализируют анализатором жидкой сцинтилляции. Число импульсов в минуту (СРМ) пересчитали на количество [14 С] полимера в мкг/мл, исходя из линейности и кривых тушения. Профиль концентрации радиоактивности в крови показывает двухфазную кривую с коротким периодом полувыведения Т 1/20,4480,157 асов (26,88 мин) и быстрым очищением 54,7 мл/ч. Обнаружили, что доминантным путем выведения является моча (моча, 66,91% по сравнению с калом, 17,39% через 48 ч), и данные восстановления, собранные до 48 ч, составляют 84,87%) введенной радиоактивности. Тканевое распределение незначительное. Почка, печень, кожа и кишечник, как выявили, являются мишеневыми органами. Однако уровень полимера в ткани быстро снижается через мочу и кал. Тканевое распределение незначительно в почке, печени, коже и кишечнике, представляя самые высокие уровни радиоактивности. Однако уровни полимера в ткани быстро снижаются через мочу и кал. В заключение исследование показывает, что полимер быстро выделяется из организма, не откладываясь в жизненно важных органах. Хотя, как известно, полимер является небиодеградируемым, быстрое и эффективное очищение главным образом через мочу предполагает безопасность и применимость полимера для применения на людях. Пример 10. Определение возможной локальной токсичности, если таковая имеется, на участке введения при пятидневном внутривенном болюсном введение 125 мг/кг полимера на кроликах Анализируемое вещество, растворенное в 10% декстрозе с концентрацией 75 мг/мл, вводят внутривенно 5 мл одноразовым шприцем и иглой 23G в краевую вену правого уха каждого кролика при 125 мг/кг ежедневно в течение пяти последовательных дней. Левое ухо служит контролем и получает 10% декстрозу тем же путем. Объем дозирования доводят до не более чем 3,5 мл/кг веса тела животного. Периодические наблюдения за локальной токсичностью выполняют на участке инъекции через 5, 10, 30, 60 мин и 24 ч каждый день в течение дней 1-5. Пункционную биопсию на участке инъекции выполняют для обоих ушей всех шести кроликов в день 7. Пятидневное непрерывное внутривенное введение 75 мг/мл полимера при дозе 125 мг/кг в ушную вену кролика вызывает тромбофлебит, от слабого до умеренного, на участке инъекции 10% декстрозы у кроликов. Можно заключить, что выбранная доза полимера не вызывает какой-либо локальной токсич- 25017682 ности на участке введения. Пример 11. Определение токсичности возможного мишеневого органа(ов) со специальной ссылкой на микроциркуляцию при пятидневном внутривенном болюсном введение 400 мг/кг полимера на крысах Вистара Анализируемое вещество растворяют в 10% декстрозе и вводят внутривенно с помощью 5 мл одноразового шприца и мглы 23 G в хвостовую вену каждой крысы при 400 мг/кг. Контрольные животные получают только 05 декстрозу тем же самым путем. Объем дозирования доводят до 5 мл/кг веса тела животного. Регистрируют периодические наблюдения (день 7, 14 и 21 после обработки) за неблагоприятными эффектами (обычное обследование и лабораторные параметры) и случаи смерти. Всех животных умертвили и вскрыли. При условиях исследования пятидневное внутривенное болюсное введение полимера при уровне дозы 400 мг/кг веса организма не вызывает какой-либо смертности или каких-либо физических признаков токсичности или симптомов у обработанных крыс. Отдельные и средние веса тел крыс показывают стойкое повышение у обработанных полимером и контрольных групп. Никакой значительной разницы не отмечают для веса тела опытных животных по сравнению с контрольными. У крыс, обработанных полимером, гематологические параметры находятся в пределах нормы на протяжении исследования. Значительные различия определяют при исходных данных для общего билирубина (р = 0,0471) и мочевой кислоты (р = 0,0157) для временной группы и общего белка (р = 0,0005) и мочевой кислоты (р = 0,0404) для конечной группы животных по сравнению с контрольными животными. Однако все значения находятся в пределах нормы. Анализ с помощью актометра показывает, что нет значительной разницы двигательной активности между контрольными и опытными группами в дни 7 и 21, соответственно, что предполагает, что полимер не обладает какой-либо нейротоксичностью. Образцы опытных и контрольных групп показывают подобные гистологические особенности. Все исследованные органы показывают нормальную структуру при световой микроскопии. Микроциркуляцию каждого органа тщательно обследуют и не выявляют патологические особенности в каком-либо из органов. Кроме того, нет изменений в микроциркуляции полимера опытных животных. Из вышеупомянутых наблюдений видно, что полимер при дозе 400 мг/кг веса тела, введенный в течение пяти последовательных дней, не вызывает какой-либо общей токсичности или какой-либо значительной гематологической токсичности. Однако выявили, что общий билирубин значительно выше у окончательной группы по сравнению с контрольной группой в день 21. Пример 12. Определение токсичности возможного мишеневого органа(ов) со специальными ссылками на микроциркуляцию при отдельном внутривенном болюсном введении 800 мг/кг полимера на крысах Вистара Анализируемое вещество, растворенное в 10% декстрозе, вводят с помощью 1 мл одноразового шприца и иглы 26 G в хвостовую вену каждой крысы при 800 мг/кг. Контрольные животные получают только 10% декстрозу тем же самым путем. Объем дозирования доводят до 5 мл/кг веса тела животного. Регистрируют периодические наблюдения (день 1, 3 и 7 после обработки) за неблагоприятными эффектами (общее обследование и лабораторные параметры) и случаи смерти. Всех животных умерщвляют и вскрывают. При условиях исследования отдельное внутривенное болюсное введение полимера при уровне дозы 800 мг/кг веса тела не вызывает какой-либо смертности или каких-либо заметных признаков или симптомов токсичности у крыс. Отдельные и средние веса тела крыс показывают стойкое повышение у обработанных полимером и контрольных групп. У крыс, обработанных полимером, гематологические параметры находятся в пределах нормы на протяжении исследования. У крыс, обработанных полимером, биохимические параметры находятся в пределах нормы на протяжении исследования. Гистопатологические исследования показывают, что нет значительной разницы между контрольными и опытными группами крыс. Фотомикрографии обработанных полимером крыс, умерщвленных в день 3 и день 7 после инъекции, показывают, что изменения в микроциркуляции у всех четырех обследованных органов (мозг, глаз, почка и кожа) не проявляются. Из вышеупомянутого наблюдения видно, что полимер при дозе 800 мг/кг веса тела не вызывает какой-либо общей токсичности или какой-либо значительной гематологической и биохимической токсичности или изменений в микроциркуляции и считается безопасным при внутривенном введении крысам. Пример 13. Определение возможной локальной токсичности, если таковая имеется, на участке (подкожного) введения полимера у кроликов Отдельную инъекцию 0,1 мл анализируемого вещества, растворенного в 10% декстрозе с концентрацией 75 мг/мл, вводят подкожно 1 мл одноразовым шприцем и иглой 23G в правую мочку уха каждого из шести кроликов. Контролем служит 0,1 мл 10% декстрозы тем же самым путем в левую мочку уха всех шести кроликов. Выполняют периодические наблюдения локальной токсичности на участке инъекции через 5, 10, 30, 60 мин и 24 ч.- 26017682 Отдельное подкожное введение 100 мкл 75 мг/мл полимера или 100 мкл декстрозы в ухо кролика вызывает слабое воспаление на участке инъекции через 48 ч после инъекции. Можно заключить, что выбранный полимер не вызывает какой-либо локальной токсичности на участке введения после подкожного введения. Пример 14. Определение шестимесячной дозовой токсичности полимера, введенного внутривенным путем, на крысах Полимер, применяемый в формуляции в форме наночастиц, вводят с уровнем дозы, эквивалентным 10 мг/кг лекарственного средства. Контролем вводят декстрозу (10%) внутривенно в боковую хвостовую вену циклически один раз каждые три недели в течение 180 дней (приблизительно 26 недель). Наблюдения включают смертность, клинические признаки, вес тела, потребление пищи и воды, клинические лабораторные исследования, вес органов и гистопатологию. Животные опытных и контрольных групп остаются обычно активными и здоровыми в течение периода исследования. Не наблюдается связанной с обработкой смертности, за исключением нескольких случаев смерти из-за инфекций в опытных и контрольных группах. Животные обоих полов показывают прогрессивное повышение веса тела и отсутствие изменений в потреблении пищи или воды в течение исследования. Гематологические параметры и самцов, и самок в пределах нормы, характерных для крыс Вистара. Однако в опытной группе наблюдается минорное снижение, только в пределах нормы, WBC и нейтрофильных единиц у самцов и нейтрофильных единиц у самок. Слабое повышение в ретикулоцитной единице отмечают у опытных и контрольных групп. Биохимические параметры крови и у самцов и самок в пределах нормы, характерных для крыс Вистара. Минорные изменения, включающие слегка более высокие по сравнению с нормой, значения глюкозы, ALP и креатина и у самцов и у самок опытных и контрольных групп. Слабое повышение триглицеридов опытной группы самцов наблюдают 6 месяцев. Параметры мочи самцов и самок находятся в пределах нормы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения полимера, включающего три мономерных звена, выбранных из 1 винилпирролидона (VP), N-изопропилакриламида (NIPAM) и сложного эфира малеинового ангидрида и полиэтиленгликоля (MPEG), поперечно сшитых дифункциональным виниловым производным, содержащего каждый из токсичных мономерных контаминантов в количествах менее чем 0,001%, при этом способ включает стадии, на которых:i) растворяют приемлемые количества трех мономеров NIPAM, VP и MPEG в воде;ii) добавляют последовательно в раствор со стадии i) приемлемые количества поперечносшивающего агента и активатора;iii) барботируют инертный газ в раствор со стадии ii) в течение 30-60 мин;iv) добавляют приемлемое количество активатора и инициатора полимеризации в раствор со стадииv) полимеризуют раствор со стадии iv) при температуре от 25 до 45 С в атмосфере инертного газа в течение 3-6 ч;vi) подвергают раствор со стадии v) фильтрации через предварительно стерилизованные фильтры, а фильтрат собирают;vii) подвергают фильтрат со стадии vi) диафильтрации, а фильтрат собирают;viii) факультативно подвергают фильтрат со стадии vii) дополнительной диафильтрации, а фильтрат собирают иix) факультативно подвергают фильтрат со стадии vii) или viii) лиофилизации для получения лиофилизованного порошка полимера. 2. Способ по п.1, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 55:22 до 65:35, а весовое соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 90:10 до 95:5. 3. Способ по п.1, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 58:32 до 62:28, а весовое соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 80:20 до 95:5. 4. Способ по п.1, где поперечно-сшивающий агент представляет собой дисфункциональное виниловое соединение. 5. Способ по п.4, где дисфункциональное виниловое соединение представляет собой N,N-метиленбис-акриламид. 6. Способ по п.1, где поперечно-сшивающий агент применяют в количествах в диапазоне от 1,3 до 1,5 вес.% в расчете на общее количество мономеров. 7. Способ по п.6, где поперечно-сшивающий агент применяют в количествах в диапазоне от 1,35 до 1,4 вес.% в расчете на общее количество мономеров. 8. Способ по п.1, где активатор выбирают из тетраметилэтилендиамина или аммония-железа суль- 27017682 фата, или их комбинации. 9. Способ по п.1, где активатор применяют в количествах в диапазоне от 15 до 18 вес.% в расчете на вес общего количества мономеров. 10. Способ по п.9, где активатор применяют в количествах в диапазоне от 15 до 16 вес.% в расчете на общее количество мономеров. 11. Способ по п.1, где инициатор полимеризации представляет собой по меньшей мере одно или более пероксидных соединений, таких как диацилпероксид, бензоилпероксид, диацетилпероксид, диалкилпероксиды, третичный бутилпероксид и третичный амилпероксид, или инициаторов полимеризации на основе нитрила, таких как 2,2'-азо-бис-изобутиронитрил (AIBN), или инициаторов полимеризации на основе неорганической соли, таких как пердисульфат аммония или персульфат аммония. 12. Способ по п.11, где инициатор полимеризации представляет собой пердисульфат аммония или персульфат аммония. 13. Способ по п.1, где инициатор полимеризации применяют в количествах в диапазоне от 20 до 30 вес.% в расчете на общее количество мономеров. 14. Способ по п.13, где инициатор полимеризации применяют в количествах в диапазоне от 23 до 25 вес.% в расчете на общее количество мономеров. 15. Способ по п.1, где инертный газ представляет собой аргон или азот. 16. Способ по п.1, где предварительно стерилизованный фильтр, применяемый на стадии vi), представляет собой одноразовые 0,2 мкм капсульные фильтры с полиэфирсульфоновой мембраной 1", имеющие размер пор 0,8 и 0,2 мкм. 17. Способ по п.1, где оборудование диафильтрации, применяемое на стадиях vi) и vii), представляет собой устройство диафильтрации Proflux M12 от Millipore. 18. Полимер, полученный способом по п.1, включающий три мономерных звена, выбранных из 1 винилпирролидона (VP), N-изопропилакриламида (NIPAM) и сложного эфира малеинового ангидрида и полиэтиленгликоля (MPEG), поперечно сшитых дифункциональным виниловым производным, содержащий каждый из токсичных мономерных контаминантов в количествах менее чем 0,001%. 19. Полимер по п.18, содержащий токсичный 1-винилпирролидон (VP) в количестве менее чем 0,001%. 20. Полимер по п.18, содержащий токсичный N-изопропилакриламид (NIPAM) в количестве менее чем 0,001%. 21. Полимер по п.18, где дисфункциональным виниловым поперечно-сшивающим агентом являетсяN,N-метилен-бис-акриламид (МВА). 22. Полимер по п.18, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 55:22 до 65:35. 23. Полимер по п.18, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 58:32 до 62:28. 24. Полимер по п.18, где весовое соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 90:10 до 95:5. 25. Полимер по п.18, где весовое соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 80:20 до 95:5. 26. Полимер по п.18, имеющий пикив 174, 76,6-77,6, 70,6, 41,6, 31,8 и 22,6 в 13 С ЯМР-спектре. 27. Полимер по п.18, имеющий пикив 1,14, 1,45, 1,63, 1,99, 2,36, 3,0, 3,23, 3,62-3,66, 3,72 и 3,97 в 1 Н ЯМР-спектре. 28. Полимер по п.18, имеющий частоту значений см-1 в 3500, 3296, 2972-2933, 1546, 1387, 1367 и 1172-1129 в ИК-Фурье спектре. 29. Полимер по п.18, имеющий структуру формулы (I) 30. Полимер по п.18, который является биологически совместимым. 31. Полимер по п.18, который является небиодеградируемым. 32. Полимер по п.18, который является нетоксичным. 33. Полимер по п.18, имеющий значение Т 1/2 (K10) 0,1520,018 ч. 34. Полимер по п.18, имеющий значение Т 1/20,0650,014 ч. 35. Полимер по п.18, имеющий значение Т 1/20,4480,0157 ч. 36. Полимер по п.18, имеющий значение Cmax 82,965,11 мкг/мл. 37. Полимер по п.18, имеющий значение площади под кривой (AUC) 18,291,62 чмкг/мл. 38. Полимер по п.18, имеющий значение времени клиренса (CL) 54,674,86 мл/ч. 39. Полимер по п.18, имеющий значение среднего времени удержания (MRT) 0,4650,13 ч. 40. Полимер по п.18, имеющий значение объемного распределения при стабилизированном состоянии (Vss) 25,435,2 мл/ч. 41. Полимер по п.18, который является выделенным из мочи, кала, тканей и смыва. 42. Полимер по п.18, который является преимущественно выделенным из мочи и кала. 43. Полимер по п.18, около 67% которого являются выделенными из мочи через 48 ч после дозирования. 44. Полимер по п.18, около 17% которого являются выделенными из кала через 48 ч после дозирования. 45. Полимер по п.18, около 84% которого являются выделенными из мочи, кала, тканей и смыва через 48 ч после дозирования. 46. Полимер по п.18, который не вызывает локальной токсичности на участке введения через 48 ч после подкожного введения водного раствора полимера в ухо кролика. 47. Полимер по п.18, который не вызывает локальной токсичности на участке введения через 24 ч после внутривенного введения водного раствора полимера в ушную вену кролика. 48. Полимер по п.18, который не вызывает общей токсичности, если вводится внутривенным болюсным путем крысам Вистара до пяти последовательных дней при дозе от 400 до 800 мг/кг. 49. Полимер по п.18, который не вызывает значительной гематологической токсичности, если вводится внутривенным болюсным путем крысам Вистара до пяти последовательных дней при дозе от 400 до 800 мг/кг. 50. Полимер по п.18, представляющий собой [14 С]-меченный полимер, включающий три мономерных звена, выбранных из 1-винилпирролидона (VP), N-изопропилакриламида (NIPAM) и сложного эфира малеинового ангидрида и полиэтиленгликоля (MPEG), поперечно сшитых N,N-метилен-бисакриламидом (МВА). 51. Полимер по п.18, представляющий собой [14 С]-меченный полимер, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 55:22 до 65:35, а соотношение мономеров (NIPAM +VP): MPEG находится в диапазоне от 90:10 до 95:5. 52. Полимер по п.50 или 51, где весовое соотношение мономеров NIPAM:VP находится в диапазоне от 58:32 до 62:28, а соотношение мономеров (NIPAM + VP):MPEG находится в диапазоне от 80:20 до 95:5. 53. Набор, включающий (а) ампулу, содержащую раствор слабо растворимого в воде лекарственного средства или соединения в водорастворимом растворителе или смеси водорастворимых растворителей, и (b) другую ампулу, содержащую раствор полимера по п.18, и фармацевтически приемлемые наполнители, где растворы в ампулах (а) и (b) находятся в объемном соотношении от 1:1 до 1:10, при этом набор предназначен для получения фармацевтической композиции слабо растворимых в воде лекарственных средств или соединений в форме наночастиц для введения пациентам.
МПК / Метки
МПК: C08F 220/00
Метки: патологических, набор, получения, лечения, животных, состояний, форме, фармацевтическая, композиция, способ, полимер, наночастиц, людей
Код ссылки
<a href="https://eas.patents.su/30-17682-polimer-i-sposob-ego-polucheniya-farmacevticheskaya-kompoziciya-v-forme-nanochastic-sposob-i-nabor-dlya-ee-polucheniya-i-sposob-lecheniya-patologicheskih-sostoyanijj-u-lyudejj-ili.html" rel="bookmark" title="База патентов Евразийского Союза">Полимер и способ его получения, фармацевтическая композиция в форме наночастиц, способ и набор для ее получения и способ лечения патологических состояний у людей или животных</a>
Предыдущий патент: Сельскохозяйственная система кондиционирования выбросов выхлопных газов
Следующий патент: Гипсовые строительные плиты
Случайный патент: Частицы ядро-оболочка с каталитической активностью