1,4-дигидропиридин-конденсированные гетероциклы, способы их получения, применение и содержащие их композиции
Номер патента: 16815
Опубликовано: 30.07.2012
Авторы: Бьергард Кирстен, Комбо Сесиль, Наир Анил, Може Жак, Филош-Ромм Брюно, Ма Нина, Мину Эрве, Ангуйан-Бонифас Одиль, Карри Жан-Кристоф, Миньяни Серж, Клерк Франсуа, Шио Лоран
Формула / Реферат
1. Соединение, соответствующее общей формуле (I)
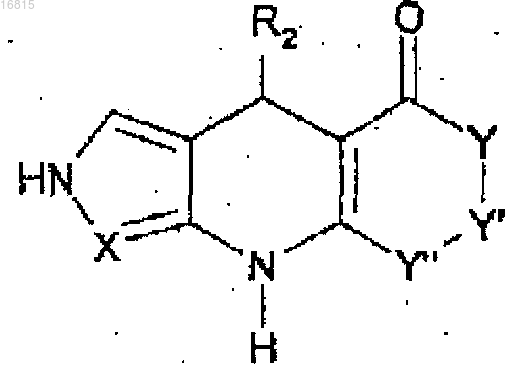
где X представляет собой N или CR7,
когда X представляет собой N, R2 представляет собой
фенил, замещенный заместителем, выбранным из S-R9, NH-R9, (С=O)-NH-R9, (С=O)-NH-CH2-R9, NH-(С=O)-R9, NH-(С=O)-NH-R9, (SO2)-NH-R9, или
фурил, тиенил или тиазолил, каждый из которых замещен заместителем, выбранным из O-R9, S-R9, NH-R9, (С=O)-NH-R9, (С=O)-NH-CH2-R9, NH-(С=O)-R9, NH-(С=O)-NH-R9, (SO2)-NH-R9;
когда X представляет собой CR7, R2 представляет собой фенил, фурил, тиенил или тиазолил, каждый из которых замещен заместителем, выбранным из O-R9, S-R9, NH-R9, (С=O)-NH-R9, (С=O)-NH-CH2-R9,
NH-(С=O)-R9, NH-(С=O)-NH-R9, (SO2)-NH-R9;
R9 выбран из фенила, бензимидазолила, бензотиазолила, бензоксазолила, имидазолила или имидазопиридинила, каждый из которых необязательно замещен заместителем, выбранным из Н, F, Cl, Br, ОН, SH, CF3, OCF3, ОСН3, SCF3, SCH3, OCHF2, OCH2F, (C1-C6)алкила, О-аллила, фенила и фенила, замещенного галогеном;
Y, Y' и Y":
(i) каждый независимо, представляют собой заместитель, выбранный из СН2, CHR5, CR5R6, С=O, O, S, NH и NR7; или
(ii) вместе представляют заместитель, выбранный из цепных фрагментов -СН2-O-(С=O)-, -(СН2)4- и -(СН2)2-;
R7 представляет собой заместитель, выбранный из R8, -COOR8, COR8 и CONHR8;
каждый из R5 и R6, независимо, представляет собой R8;
R8 представляет собой Н или необязательно замещенный -(С1-С6)алкил, фенил, фурил, бензодиоксолил, пиперидинил, изоксазолил, тиадиазолил, пиридинил или -(С1-С6)алкилморфолинил; где заместители выбраны из атомов галогена, гидроксила и (С1-С6)алкоксильных радикалов.
2. Соединение по п.1, где Y" представляет собой СН2.
3. Соединение по п.1 или 2, где Y представляет собой СН2.
4. Соединение по пп.1-3, где Y' выбирают из СН2, СНСН3, С(СН3)2, СН-фенила, СН-фурила, СН-(бензодиоксолила), СН-(замещенного фенила), причем заместители определены в п.1, О, S, NH и NR7.
5. Соединение по любому из пп.1-4, где R2 представляет собой фурил, замещенный SR9, тиенил, замещенный SR9, или тиазолил, замещенный SR9.
6. Соединение по п.5, где R9 представляет собой необязательно замещенный бензимидазолил, необязательно замещенный бензотиазолил, необязательно замещенный бензоксазолил, необязательно замещенный имидазолил или необязательно замещенный имидазопиридинил, где необязательные заместители определены в п.1.
7. Соединение по пп.1-6, где R9 представляет собой необязательно замещенный бензимидазолил или необязательно замещенный имидазолил, где необязательные заместители определены в п.1.
8. Соединение по п.1, где R2 представляет собой замещенный фурил или замещенный тиенил, где заместители определены в п.1.
9. Соединение по любому из пп.1-7, где X представляет собой CR7.
10. Соединение по п.8, где R7 представляет собой -COOR8 или CONHR8.
11. Соединение формулы (I) по п.1, выбранное из следующей группы:
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-1,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7,7-диметил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-метил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-фенил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-6,6-диметил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-изопропил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-(4-метоксифенил)-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-(2,4-дихлорфенил)-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-фуран-2-ил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
7-бензо[1,3]диоксол-5-ил-4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-(3,4-диметоксифенил)-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-пентил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-(2-фторфенил)-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-(2-метоксифенил)-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-4,6,7,8,9,10-гексагидро-2Н-1,2,10-триазациклогепта[f]инден-5-он;
4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7-(трет-бутилоксикарбонил)-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
3-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)-N-(4-трифторметоксибензил)безамид;
3-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)-N-(3-трифторметоксибензил)бензамид;
4-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)-N-(3-трифторметоксифенил)бензамид;
3-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)-N-(4-трифторметоксифенил)бензамид;
3-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)-N-(3-трифторметоксифенил)бензамид;
4-хлор-N-[3-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)фенил]бензамид;
4-хлор-N-[5-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)тиазол-2-ил]бензамид;
1-(4-хлорфенил)-3-[3-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)фенил]мочевина;
4-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)-N-(4-трифторметоксифенил)бензолсульфонамид;
N-(4-хлорфенил)-4-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)бензолсульфонамид;
4-[5-(5-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
7,7-диметил-4-[5-(5-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-хлорбензотиазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-хлорбензотиазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
4-[5-(5-хлорбензотиазол-2-илсульфанил)фуран-2-ил]-7,7-диметил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-дифторметокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(6-метокси-1Н-бензимидазол-2-илокси)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(4-метил-1Н-имидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-метокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-метокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-метокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7,7-диметил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(1-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
7,7-диметил-4-[5-(1-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5,6-дихлор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5,6-дихлор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
4-[5-(5,6-дихлор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7,7-диметил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-хлорбензоксазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
этиловый эфир 9-[5-(5-гидрокси-1Н-бензоимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
4-[5-(5-хлорбензоксазол-2-илсульфанил)фуран-2-ил]-7,7-диметил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
7,7-диметил-4-[5-(4-метил-1Н-имидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-{5-[5-(4-хлорфенил)-1-метил-1Н-имидазол-2-илсульфанил]фуран-2-ил}-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-{5-[5-(4-хлорфенил)-1-метил-1Н-имидазол-2-илсульфанил]фуран-2-ил}-7,7-диметил-2,4,6,7,8,9-
гексагидропиразоло[3,4-b]хинолин-5-он;
4-{5-[5-(4-хлорфенил)-1-метил-1Н-имидазол-2-илсульфанил]фуран-2-ил}-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
4-[5-(5-трифторметил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-1,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-трифторметил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-7,7-диметил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-трифторметил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
4-[5-(4,5-диметил-1Н-имидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(4,5-диметил-1Н-имидазол-2-илсульфанил)фуран-2-ил]-7,7-диметил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(4,5-диметил-1Н-имидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
4-[5-(5-метил-1Н-бензимидазол-2-илсульфанил)тиофен-2-ил]-1,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
7,7-диметил-4-[5-(5-метил-1Н-бензимидазол-2-илсульфанил)тиофен-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
4-[5-(5-метил-1Н-бензимидазол-2-илсульфанил)тиофен-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
этиловый эфир 9-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
этиловый эфир 9-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 9-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-6,6-диметил-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 10-[5-(1Н-бензоимидазол-2-илсульфанил)фуран-2-ил]-9-оксо-2,4,5,6,7,8,9,10-октагидро-2,4-диазациклогепта[f]инден-3-карбоновой кислоты;
этиловый эфир 9-[5-(5-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 6,6-диметил-9-[5-(5-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 9-[5-(5-метокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 9-[5-(5-метокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b][1,7]нафтиридин-3-карбоновой кислоты;
этиловый эфир 9-[5-(3Н-имидазо[4,5-b]пиридин-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 9-[5-(3Н-имидазо[4,5-b]пиридин-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b][1,7]нафтиридин-3-карбоновой кислоты;
этиловый эфир 9-[5-(5,6-дифтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 9-[5-(5,6-дифтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b][1,7]нафтиридин-3-карбоновой кислоты;
этиловый эфир 9-[5-(5,6-дихлор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 9-[5-(3Н-имидазо[4,5-с]пиридин-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 9-[2-(1Н-бензимидазол-2-илсульфанил)тиазол-5-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир (+)-9-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты и
этиловый эфир (-)-9-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
(+)-4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он и
(-)-4-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
этиловый эфир 9-[5-(6,7-дифтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 8-оксо-9-[5-(4,5,6-трифтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
гидрохлорид этилового эфира 9-[5-(5-гидрокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
9-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-6,6-диметил-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновая кислота;
9-[5-(1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-6,6-диметил-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоксамид;
этиловый эфир 9-[5-(5-дифторметокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 6-трет-бутилокси-9-[5-(5-дифторметокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-2,4,5,7,8,9-гексагидропирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
гидрохлорид этилового эфира 9-[5-(5-дифторметокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
этиловый эфир 9-[5-(5-хлор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 6-трет-бутилокси-9-[5-(5-хлор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-2,4,5,7,8,9-гексагидропирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
гидрохлорид этилового эфира 9-[5-(5-хлор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b][1,7]нафтиридин-3-карбоновой кислоты;
этиловый эфир 8-оксо-9-[5-(5-трифторметил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 9-[5-(5-хлор-6-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 6-трет-бутилокси-9-[5-(5-хлор-6-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-2,4,5,7,8,9-гексагидропирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
гидрохлорид этилового эфира 9-[5-(5-хлор-6-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
этиловый эфир 9-[5-(5-хлор-7-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
этиловый эфир 6-трет-бутилокси-9-[5-(5-хлор-7-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-2,4,5,7,8,9-гексагидропирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
гидрохлорид этилового эфира 9-[5-(5-хлор-7-метил-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
этиловый эфир 9-[5-(4,6-дифтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
гидрохлорид этилового эфира 9-[5-(5,7-дифтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
4-[5-(5,7-дифтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он;
гидрохлорид 4-[5-(5,7-дифтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он;
этиловый эфир 9-[5-(6-хлор-5-фтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
гидрохлорид этилового эфира 9-[5-(6-хлор-5-фтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
этиловый эфир 9-[5-(5-фтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
гидрохлорид этилового эфира 9-[5-(5-фтор-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-8-оксо-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]-1,7-нафтиридин-3-карбоновой кислоты;
этиловый эфир 8-оксо-9-[5-(5-трифторметокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b]хинолин-3-карбоновой кислоты;
гидрохлорид этилового эфира 8-оксо-9-[5-(5-трифторметокси-1Н-бензимидазол-2-илсульфанил)фуран-2-ил]-4,5,6,7,8,9-гексагидро-2Н-пирроло[3,4-b][1,7]нафтиридин-3-карбоновой кислоты.
12. Соединение по любому из предшествующих пунктов в виде рацемической формы, обогащенное одним энантиомером, обогащенное одним диастереомером, его таутомеры и фармацевтически приемлемые соли.
13. Применение соединения по п.1 в качестве агента, который ингибирует киназу Aurora.
14. Применение по п.13 в качестве агента, ингибирующего пролиферацию опухолевых клеток.
15. Применение продукта по любому из пп.1-12 для получения лекарственного средства для применения при лечении патологического состояния.
16. Применение по п.15, где патологическое состояние выбирают из рака, псориаза, лейкемии и волчанки.
17. Применение по п.15, где патологическое состояние представляет собой рак.
Текст
(57) Изобретение относится к соединениям общей формулы (I), где значения радикалов определены в описании и формуле изобретения, и их применению для получения лекарственных средств. Данные соединения действуют как ингибиторы киназ Aurora А и/или В и соответственно могут использоваться для лечения таких патологических состояний, как рак, псориаз, лейкемия и волчанка. 016815 Настоящее изобретение относится к новым химическим соединениям, в частности к новым замещенным дигидропиридин-конденсированным гетероциклам, к содержащим их композициям и их применению в качестве лекарственных средств. Более конкретно, изобретение относится к определенным, частично насыщенным конденсированным с пирролом или пиразолом 5-оксогексагидронафтиридинам или 5-оксогексагидрохинолинам, проявляющим противораковую активность посредством модулирования активности белков, в частности киназ. К настоящему времени большинство коммерчески доступных соединений, используемых в химиотерапии, представляют собой цитотоксические агенты, для которых характерны значительные проблемы,связанные с побочными действиями и переносимостью пациентами. Такие действия можно ограничить,если используемые лекарственные средства будут действовать селективно на раковые клетки, исключая здоровые клетки. Следовательно, одно из решений проблемы ограничения неблагоприятного действия химиотерапии может состоять в применении лекарственных средств, которые действуют на метаболические пути или составляющие элементы таких путей, экспрессируемые главным образом в раковых клетках, и которые экспрессировались бы в незначительной степени или не экспрессировались бы здоровыми клетками. Протеинкиназы представляют собой семейство ферментов, которые катализируют фосфорилирование гидроксильных групп остатков специфических белков, таких как остатки тирозина, серина или треонина. Такое фосфорилирование может широко модифицировать функцию белков; так, протеинкиназы играют важную роль в регулировании большого числа клеточных процессов, включая, в частности, метаболизм, пролиферацию клеток, дифференциацию клеток, миграцию клеток и жизнеспособность клеток. Среди различных клеточных функций, в которые вовлечена активность протеинкиназы, некоторые процессы представляют собой привлекательные мишени для лечения связанных с раком заболеваний, а также других заболеваний. Таким образом, одна из задач настоящего изобретения заключается в создании композиций, обладающих противораковой активностью, в частности воздействующих на киназы. Среди киназ, модулирование активности которых рассматривается, предпочтительными являются Aurora А и В. Обзор применения ингибиторов киназы Aurora в качестве противораковых агентов был сделан недавно в "Aurorakinase inhibitors as anticancer agents", N. Keen and S. Taylor, Nature Reviews 2004, 4, 927-936. Многие белки, вовлеченные в сегрегацию хромосом и образование веретена, были выявлены в дрожжах и дрозофилах. Дезорганизация функции данных белков ведет к отсутствию сегрегации хромосом и образованию монополярного или дезорганизованного веретена. Среди данных белков некоторые киназы, включая Aurora и Ipl1, имеющие происхождение из дрозофилы и S. cerevisiae, соответственно необходимы для сегрегации хромосом и отделения центросомы. Человеческий аналог Ipl1 дрожжей недавно был клонирован и охарактеризован в различных лабораториях. Данная киназа, называемаяAurora2, Aurora A, STK15 или BTAK, принадлежит к семейству серин/треониновых киназ. Bischoff et al. показали, что Aurora2 является онкогенной и распространена в клетках рака прямой и ободочной кишки(EMBO J., 1998, 17, 3052-3065). Подобные примеры также были показаны на других видах рака, включая опухоли эпителия, такие как рак молочной железы. Заслуживает внимания тот факт, что одним из преимуществ настоящего изобретения является разработка действительно селективных соединений. Действительно, данные соединения обычно не ингибируют киназы, вовлеченные в клеточную транскрипцию, что может приводить к серьезным побочным действиям и/или более высокой токсичности по отношению к клеткам в фазе покоя. В результате, соединения согласно изобретению обычно не ингибируют CDK7 и/или CDK9 киназы или, по крайней мере,соотношение ингибирования складывается в пользу киназы Aurora. Следующие публикации авторы настоящей заявки полагают ближайшими найденными аналогами соединений формул (I) и (II) согласно изобретению:tricyclic dihydroisoxozolone as potassium channel openers". Публикация заявки на патент США 2002007059(1978), 43(8), 2037-40. В настоящем документе описано, что продукты, соответствующие приведенной ниже общей формуле, представляют особый интерес для ингибирования киназы Aurora где R1 представляет собой Н, алкил, арил, гетероарил, замещенный алкил, замещенный арил или замещенный гетероарил;R2 представляет собой замещенный арил или замещенный гетероарил;(i) каждый независимо, представляют собой заместитель, выбранный из СН 2, CHR5, CR5R6, С=O, О,S, NH и NR7; или(ii) вместе представляют собой заместитель, выбранный из цепочечных фрагментов -СН 2-O-(С=O)-,-(СН 2)4- и -(СН 2)2-; каждый из R4 и R7, независимо, представляет собой заместитель, выбранный из R8, -COOR8, COR8 иR8 представляет собой Н или необязательно замещенный алкил, -алкилалкилен, -алкилен,-гетероциклоалкил, циклоалкил, -арил, -гетероарил, -алкилгетероциклоалкил, алкилциклоалкил,-алкиларил или -алкилгетероарил, -алкил-NRaRb. Ra и Rb, каждый независимо, представляют собой Н или алкил при условии, что R1 представляет собой Н, когда X представляет собой N и Y' представляет собой CR5R6. Настоящее изобретение относится к соединениям, соответствующим общей формуле (I) где X представляет собой NH или CR7 и когда X представляет собой NH, R2 представляет собой фенил, замещенный заместителем, выбранным из S-R9, NHR9, (C=O)-NH-R9, (С=O)-NH-CH2-R9,NH-(С=O)-R9, NH-(С=O)-NH-R9, (SO2)-NH-R9, или фурил, тиенил или тиазолил, каждый из которых замещен заместителем, выбранным из O-R9, S-R9,NH-R9, (С=O)-NH-R9, (С=O)-NH-CH2-R9, NH-(С=O)-R9, NH-(С=O)-NH-R9, (SO2)-NH-R9; когда X представляет собой CR7, R2 представляет собой фенил, фурил, тиенил или тиазолил, каждый из которых замещен заместителем, выбранным из O-R9, S-R9, NH-R9, (С=O)-NH-R9, (С=O)-NH-CH2R9, NH-(С=O)-R9, NH-(С=O)-NH-R9, (SO2)-NH-R9;R9 выбран из фенила, бензимидазолила, бензотиазолила, бензоксазолила, имидазолила или имидазопиридинила, каждый из которых необязательно замещен заместителем, выбранным из Н, F, Cl, Br, ОН,SH, CF3, OCF3, ОСН 3, SCF3, SCH3, OCHF2, OCH2F, (C1-С 6)алкила, О-аллила, фенила и фенила, замещенного галогеном;(i) каждый независимо, представляют собой заместитель, выбранный из СН 2, CHR5, CR5R6, С=O, O,S, NH и NR7; или(ii) вместе представляют заместитель, выбранный из цепных фрагментов -СН 2-O-(С=O)-, -(СН 2)4- иR8 представляет собой Н или необязательно замещенный (С 1-С 6)алкил, фенил, фурил, бензодиоксолил, пиперидинил, изоксазолил, тиадиазолил, пиридинил или -(С 1-С 6)алкилморфолинил; где заместители выбраны из атомов галогена, гидроксила и (С 1-С 6)алкоксильных радикалов. Формула (I) включает все возможные таутомерные формы. Предпочтительно объектом изобретения является соединение формулы (I), где Y и Y представляют собой СН 2. Предпочтительно объектом изобретения является соединение формулы (I), где Y' выбирают из СН 2,СНСН 3, С(СН 3)2, СН-фенила, СН-фурила, СН-(бензодиоксолила), СН-(замещенного фенила), причем заместители определены выше, О, S, NH и NR7. Предпочтительно объектом изобретения является соединение формулы (I), где R2 представляет собой фурил, замещенный SR9, тиенил, замещенный SR9, или тиазолил, замещенный SR9. Предпочтительно объектом изобретения является соединение формулы (I), где R9 представляет собой необязательно замещенный бензимидазолил, необязательно замещенный бензотиазолил, необязательно замещенный бензоксазолил, необязательно замещенный имидазолил или необязательно замещенный имидазопиридинил, где необязательные заместители определены в общей формуле (I) выше. Предпочтительно объектом изобретения является соединение формулы (I), где R9 представляет собой необязательно замещенный бензимидазолил или необязательно замещенный имидазолил, где необязательные заместители определены в общей формуле (I) выше. Настоящее изобретение также относится к соединению формулы (I), где R2 представляет собой замещенный фурил или замещенный тиенил, где заместители определены в п.1. В конкретном воплощении соединения формулы (I) X представляет собой CR7. В некоторых конкретных воплощениях R7 представляет собой -COOR8 или CONHR8. Также здесь описано соединение формулы (Ia) соответствующее соединениям формулы (I), в котором X=N, Y=Y=CH2 и Y'=NH, где R2 представляет собой замещенный арил. Также описаны соединения формулы (Ia), как определено выше, где R2 представляет собой замещенную гетероарильную группу. Также описано соединение формулы (I'а) соответствующее соединению формулы (I), в котором X=N, Y=Y"=CH2 и Y'=CR5R6, R5 и R6 являются такими, как определено выше, где R2 представляет собой замещенную арильную группу. Также описано соединение формулы (I'а), как определено выше, где R2 представляет собой замещенную гетероарильную группу. Также здесь описано соединение формулы (Ib) соответствующее соединению формулы (I), в котором X=CR7, Y=Y"=CH2 и Y'=NH, R7 является таким, как определено выше, где R2 представляет собой замещенную арильную группу. Также описано соединение формулы (Ib), как определено выше, где R2 представляет собой замещенную гетероарильную группу.-3 016815 Также здесь описано соединение формулы (I'b) соответствующее соединению формулы (I), в котором X=CHR7, Y=Y"=CH2 и Y'=CR5R6, R5, R6 и R7 являются такими, как определено выше, где R2 представляет собой замещенную арильную группу. Также здесь описано соединение формулы (I'b), как определено выше, где R2 представляет собой замещенную гетероарильную группу. Также здесь описано соединение формулы (Ia) или (Ib), где R2 представляет собой замещенную фенильную или гетероарильную группу; где присутствует от одного до четырех заместителей, выбранных из галогена, алкила, ОН, OR8, CH2-OR8, SH, SR8, NH2, NHR8, CONHR8, CONHCH2R8, NHCOR8,NHCONHR8, SO2-NHR8, фенила, незамещенного или замещенного алкилом, ОН или галогеном, где R8 является таким, как определено выше. Более конкретно, в описных выше соединениях R8 выбирают из фенила и гетероарила, незамещенного или замещенного одним-четырьмя заместителями, независимо выбранными из F, Cl, Br, ОН, SH,CF3, OCF3, OCH3, SCF3, SCH3, OCHF2, OCH2F, SCH2F, (C1-C6)алкила, О-аллила, фенила и фенила, замещенного галогеном. Также здесь описано соединение формулы (I'а) или (I'b), где R2 представляет собой замещенную гетероарильную группу; где присутствует от одного до четырех заместителей, выбранных из галогена, алкила, ОН, OR8, CH2-OR8, SH, SR8, NH2, NHR8, CONHR8, CONHCH2R8, NHCOR8, NHCONHR8, SO2-NHR8,фенила, незамещенного или замещенного алкилом, ОН или галогеном, где R8 является таким, как определено выше. Более конкретно, в описанных здесь соединениях R8 представляет собой фенил или гетероарил, незамещенный или замещенный одним-четырьмя заместителями, независимо выбранными из F, Cl, Br, ОН,SH, CF3, OCF3, OCH3, SCF3, SCH3, OCHF2, OCH2F, SCH2F, (C1-C6)алкила, О-аллила, фенила и фенила,замещенного галогеном. Также здесь описано соединение формул (I), (Ia), (Ib), (I'a) и (I'b), где R2 представляет собой гетероарил, замещенный SR8. Также здесь описано соединение формул (I), (Ia), (Ib), (I'a) и (I'b), где R2 представляет собой фурил или тиенил, замещенный SR8. Более конкретно, в описанных здесь соединениях R8 представляет собой бензимидазолил или имидазолил, незамещенный или замещенный одним-четырьмя заместителями, независимо выбранными из F,Cl, Br, ОН, SH, CF3, OCF3, OCH3, SCF3, SCH3, OCHF2, OCH2F, SCH2F, (C1-C6)алкила, О-аллила, фенила и фенила, замещенного галогеном. Также здесь описано соединение формул (I), (I'a) и (I'b), где оба R5 и R6 представляют собой водород или оба представляют собой метил. Также здесь описано соединение формул (I), (I'a) и (I'b), где R5 представляет собой водород и R6 представляет собой (С 1-С 6)алкил, замещенный или незамещенный, или фенил, замещенный или незамещенный. Также здесь описано соединение формул (I), (Ib) и (I'b), где R7 представляет собой группу -CO2Et. Также здесь описано соединение, полученное в соответствии с примерами приведенной далее экспериментальной части. Соединение в соответствии с первым аспектом изобретения может представлять собой рацемическую форму, обогащенную одним энантиомером, обогащенную одним диастереомером, свои таутомеры,свои пролекарства и свои фармацевтически приемлемые соли. В продуктах, раскрытых в настоящем описании, алкильные, циклоалкильные, гетероциклоалкильные, арильные, гетероарильные, аралкильные или гетероаралкильные радикалы необязательно могут быть замещенными одним или несколькими радикалами, которые могут быть одинаковыми или разными, выбранными из атомов галогена; и следующими радикалами: гидроксил; циклоалкил, содержащий не больше 6 кольцевых членов, ацил, содержащий не больше 7 атомов углерода; циано; нитро; свободный,солеобразующий и сложноэфирный карбоксил; тетразолил; -NH2, NH(alk), -N(alk)(alk); SO2-NH-СО-NHалкил; SO2-NH-CO-NH-фенил; -C(O)-NH2; -C(O)-NH(alk); -С(O)-N(alk)(alk), -NH-C(O)-(alk), -N(alk)-C(O)(alk); тиенил; фенил, алкил, алкилтио, алкокси и фенокси, которые сами необязательно могут быть замещенными одним или несколькими радикалами, выбранными из атомов галогена и гидроксила, алкокси,алкильного, -NH2, -NH(alk) и N(alk)(alk) радикалов. Более конкретно, в продуктах, раскрытых в настоящем описании, алкильный, циклоалкильный, гетероциклоалкильный, арильный, гетероарильный, аралкильный или гетероаралкильный радикалы необязательно могут быть замещенными одним или несколькими радикалами, которые могут быть одинако-4 016815 выми или разными, выбранными из атомов галогена; и следующих радикалов: гидроксил; свободный,солеобразующий и сложноэфирный карбоксил; -NH2,- NH(alk), -N(alk)(alk); фенил, алкил и алкокси, которые сами необязательно могут быть замещенными одним или несколькими радикалами, выбранными из атомов галогена и гидроксила, алкокси, алкильного,-NH2,-NH(alk) и-N(alk)(alk) радикалов. Еще более конкретно, в продуктах, раскрытых в настоящем описании, алкильный, алкенильный,алкинильный, циклоалкильный, гетероциклоалкильный, арильный, гетероарильный, аралкильный или гетероаралкильный радикалы необязательно могут быть замещенными одним или несколькими радикалами, которые могут быть одинаковыми или разными, выбранными из атомов галогена, гидроксила и алкоксильных радикалов. В продуктах, раскрытых в настоящем описании, указанные термины имеют следующее значение: термин "галоген" относится к атомам фтора, хлора, брома, иода и предпочтительно атомам фтора,хлора или брома; термин "алкильный радикал" относится к линейному или разветвленному радикалу, содержащему не больше 12 атомов углерода, выбранному из метильного, этильного, пропильного, изопропильного,бутильного, изобутильного, втор-бутильного, трет-бутильного, пентильного, изопентильного, вторпентильного, трет-пентильного, неопентильного, гексильного, изогексильного, втор-гексильного и третгексильного радикалов, и также гептильного, октильного, нонильного, децильного, ундецильного и додецильного радикалов, а также их линейных и разветвленных изомеров положения. Более конкретно,отметим алкильные радикалы, содержащие не больше 6 атомов углерода, и, в частности, метильный,этильный, пропильный, изопропильный, н-бутильный, изобутильный, трет-бутильный, линейный или разветвленный пентильный, линейный или разветвленный гексильный радикалы; термин "алкоксильный радикал", который может быть представлен, например OR, относится к линейному или разветвленному радикалу, содержащему не больше 12 атомов углерода и предпочтительно не больше 6 атомов углерода, выбранный, например, из метокси, этокси, пропокси, изопропокси, линейного, вторичного или третичного бутокси, пентокси, гексокси или гептокси радикалов, а также из линейных или разветвленных изомеров положения; термин "алкилтио" или "алкил-S-", который может быть представлен, например SR3, относится к линейному или разветвленному радикалу, содержащему не больше 12 атомов углерода, и, в частности,метилтио, этилтио, изопропилтио и гептилтио радикалам. В радикалах, содержащих атом серы, атом серы может быть окислен до SO или S(О)2 радикала; термин "ацильный радикал" (COR) относится к линейному или разветвленному радикалу, содержащему не больше 12 атомов углерода, в котором радикал R представляет собой атом водорода или алкильный, циклоалкильный, циклоалкенильный, циклоалкильный, гетероциклоалкильный или арильный радикалы, данные радикалы имеют указанные выше значения и необязательно являются замещенными,как указано; отметим, например, формильный, ацетильный, пропионильный, бутирильный или бензоильный радикалы или еще валерильный, гексаноильный, акрилоильный, кротонильный или карбамоильный радикалы; термин "циклоалкильный радикал" относится к моноциклическому или бициклическому карбоциклическому радикалу, содержащему от 3 до 10 членов кольца и относящемуся, в частности, к циклопропильному, циклобутильному, циклопентильному и циклогексильному радикалам; термин "циклоалкилалкилый радикал" относится к радикалу, в котором циклоалкил и алкил выбраны из их значений, указанных выше; таким образом, данный радикал относится, например, к циклопропилметильному, циклопентилметильному, циклогексилметильному и циклогептилметильному радикалам; термин "ацилоксирадикал" предназначен для обозначения ацил-О-радикалов, в которых ацил имеет указанные выше значения; отметим, например, ацетокси- или пропионилоксирадикалы; термин "ациламинорадикал" предназначен для обозначения ацил-N-радикалов, в которых ацил имеет указанные выше значения; термин "арильный радикал" относится к ненасыщенным карбоциклическим радикалам, которые являются моноциклическими или включают конденсированные кольца; в качестве примеров таких арильных радикалов можно отметить фенильный, нафтильный, антренильный и фенантренильный радикалы; более конкретно следует отметить фенильный радикал; термин "арилалкил" предназначен для обозначения радикалов, являющихся результатом комбинации отмеченных выше алкильных радикалов, которые необязательно являются замещенными, и арильных радикалов, также отмеченных выше, которые необязательно являются замещенными; отметим, например, бензильный, фенилэтильный, 2-фенэтильный, трифенилметильный или нафталинметильный радикалы; термин "гетероциклический радикал" относится к насыщенному (гетероциклоалкил) или ненасыщенному (включая гетероарил) (не все ненасыщенные гетероарилы обязательно являются ароматическими, например хроманил, тетрагидрохинолил) карбоциклическому радикалу, включающему не более 6 кольцевых членов, прерываемых одним или несколькими одинаковыми или различными гетероатомами,выбранными из атомов кислорода, азота или серы.-5 016815 В качестве гетероциклических радикалов конкретно можно отметить диоксолановый, диоксановый,дитиолановый, тиооксолановый, тиооксановый, оксиранильный, оксоланильный, диоксоланильный, пиперазинильный, пиперидильный, пирролидинильный, имидазолидинильный, пиразолидинильный, морфолинильный, тетрагидрофурильный, тетрагидротиенильный, хроманильный, дигидробензофурильный,индолинильный, пиперидильный, пергидропиранильный, пиридолинильный, тетрагидрохинолинильный,тетрагидроизохинолинильный, бензоксазинильный или тиоазолидинильный радикалы, все из которых необязательно являются замещенными. Среди гетероциклических радикалов конкретно можно отметить необязательно замещенный пиперазинильный, необязательно замещенный пиперидильный, необязательно замещенный пирролидинильный, имидазолидинильный, пиразолидинильный, морфолинильный или тиоазолидинильный радикалы. Термин "гетероциклоалкилалкильный радикал" предназначен для обозначения радикалов, в которых гетероциклоалкильный и алкильный остатки имеют вышеуказанные значения; Среди гетероарильных радикалов с 5 членами кольца можно отметить фурильные радикалы, такие как 2-фурил и 3-фурил, тиенильные радикалы, такие как 2-тиенил и 3-тиенил, и пирролильный, диазолильный, тиазолильный, тиадиазолильный, тиатриазолильный, изотиазолильный, оксазолильный, оксадиазолильный, 3- или 4-изоксазолильный, имидазолильный, пиразолильный и изоксазолильный, триазолильный, триазинильный и тетразолильный радикалы. Среди гетероарильных радикалов с 6 членами кольца можно отметить в особенности пиридильные радикалы, такие как 2-пиридил, 3-пиридил и 4-пиридил, и пиримидильный, пиримидинильный, пиридазинильный и пиразинильный радикалы. В качестве конденсированных гетероарильных радикалов, содержащих по крайней мере один гетероатом, выбранный из серы, азота и кислорода, можно отметить, например, бензотиенил, такой как 3 бензотиенил, бензофурил, бензотиазолил, индолил, бензимидазолил, бензоксазолил, тионафтил, индолил, изоиндолил, индазолил, пиридопирролил, пиридопиразолил, нафтимидазолил, имидазохинолил,бензизотиазолил, бензизоксазолил, пуринил, хинолинил, изохинолинил и нафтиридинил. Среди конденсированных гетероарильных радикалов более конкретно можно отметить бензотиенил, бензофуранил,индолил или хинолинил, бензимидазолил, бензотиазолил, индолизинил, изохинолинил, хиназолинильную группу, данные радикалы необязательно являются замещенными, как указано для гетероарильных радикалов. Аддитивные соли с неорганическими или органическими кислотами продуктов формулы (I) могут,например, представлять собой соли, образованные хлористо-водородной кислотой, бромистоводородной кислотой, иодисто-водородной кислотой, азотной кислотой, серной кислотой, фосфорной кислотой, пропионовой кислотой, уксусной кислотой, трифторуксусной кислотой, муравьиной кислотой,бензойной кислотой, малеиновой кислотой, фумаровой кислотой, янтарной кислотой, винной кислотой,лимонной кислотой, щавелевой кислотой, глиоксалевой кислотой, аспаргиновой кислотой, аскорбиновой кислотой, алкилмоносульфоновыми кислотами, такими как, например, метансульфоновая кислота, этансульфоновая кислота или пропансульфоновая кислота, алкилдисульфоновыми кислотами, такими как,например, метандисульфоновая кислота или альфа,бета-этандисульфоновая кислота, арилмоносульфоновыми кислотами, такими как бензолсульфоновая кислота, и арилдисульфоновыми кислотами. Также здесь описана фармацевтическая композиция, включающая продукт согласно первому аспекту изобретения, в сочетании с фармацевтически приемлемым эксципиентом. Также здесь описаны терапевтические композиции, содержащие соединения согласно изобретению в сочетании с фармацевтически приемлемым эксципиентом в зависимости от выбранного пути введения. Фармацевтическая композиция может быть в твердой или в жидкой форме или в виде липосом. Среди твердых композиций можно отметить порошки, желатиновые капсулы и таблетки. В число пероральных форм также могут быть включены твердые формы, защищенные от кислой среды желудка. Носители, используемые для твердых форм, состоят, в частности, из минеральных носителей, таких как фосфаты или карбонаты, или органических носителей, таких как лактоза, целлюлоза, крахмал или полимеры. Жидкие формы включают растворы, суспензии или дисперсии. Они содержат в качестве диспергирующего носителя либо воду, либо органический растворитель (этанол, НМП или тому подобные) или смеси поверхностно-активных веществ и растворителей либо комплексообразующих веществ и растворителей. Жидкие формы предпочтительно будут формами, предназначенными для инъекций, и соответственно будут иметь рецептурный состав, приемлемый для такого применения. Приемлемые пути введения с помощью инъекций включают внутривенный, внутрибрюшинный,внутримышечный и подкожный пути введения, где внутривенное введение является предпочтительным. Вводимая доза соединений по изобретению будет подобрана лечащим врачом в зависимости от пути введения пациенту и состояния указанного пациента. Соединения по настоящему изобретению можно вводить самостоятельно или в виде смеси с другими противораковыми агентами. К возможным комбинациям, которые можно отметить, относятся алкилирующие агенты и в особенности циклофосфамид, мелфалан, ифосфамид, хлорамбуцил, бусульфан, тиотепа, преднимустин, кармустин, ломустин, семустин, стептозотоцин, декарбазин, темозоло-6 016815 мид, прокарбазин и гексаметилмеламин; производные платины, в особенности такие как цисплатин, карбоплатин или оксалиплатин; антибиотики, особенно такие как винбластин, винкристин, виндезин или таксоиды (паклитаксел и доцетаксел); антрациклины, в особенности такие как доксорубицин, даунорубицин, идарубицин, эпирубицин,митоксантрон или лозоксантрон; топоизомеразы группы I и II, такие как этопозид, тенипозид, амсакрин, иринотекан, топотекан и томудекс; фторпиримидины, такие как 5-фторурацил, UFT или флоксуридин; аналоги цитидина, такие как 5-азацитидин, цитарабин, гемцитабин, 6-меркаптомурин или 6 тиогуанин; аналоги аденозина, такие как пентостатин, цитарабин или флударабин фосфат; метотрексат и фолиевая кислота; различные ферменты и соединения, такие как L-аспарагиназа, гидроксимочевина, транс-ретиноевая кислота, сурамин, дексразоксан, амифостин, герцептин и гормоны эстроген и андроген; противососудистые агенты, такие как комбретастатин, или производные колхицина и их пролекарства. Также можно комбинировать соединения по настоящему изобретению с лучевой терапией. Такое лечение можно применять одновременно, раздельно или последовательно. Лечение будет подобрано практикующим врачом для определенного пациента, подвергаемого лечению. В соответствии со вторым аспектом изобретение относится к применению продукта в соответствии с его первым аспектом в качестве агента, который ингибирует киназу Aurora. Также здесь описано применение продукта в соответствии с его первым аспектом в качестве агента,который ингибирует пролиферацию опухолевых клеток. В соответствии с третьим аспектом изобретение относится к применению продукта в соответствии с его первым аспектом для получения лекарственного средства для применения при лечении патологического состояния, в особенности ракового состояния. В качестве ингибитора пролиферации опухолевых клеток указанное соединение можно использовать для предотвращения и лечения лейкозов как первичных, так и метастатических плотных опухолей,карцином и различных видов рака, в частности рака молочной железы; рака легких; рака тонкого кишечника; рака прямой и ободочной кишки; рака дыхательных путей, ротовой части глотки и подглоточника; рака пищевода; рака печени, рака желудка, рака желчных протоков, рака желчного пузыря, рака поджелудочной железы; рака мочевыводящих путей, включая почки, мочеточники и мочевой пузырь; рака женских половых путей, включая рак матки, шейки матки, яичников, хлориокарциному и трофобластическую опухоль; рак мужских половых путей, включая рак предстательной железы, семенных пузырьков, яичек, рак зародышевых клеток, рак эндокринных желез, включая рак щитовидной железы, рак слизистых желез, рак надпочечников; рак кожи, включая гемангиомы, меланомы, саркомы, включая саркому Капоши; опухоли мозга, нервов, глаз, менингеальных оболочек, включая астроцитомы, глиомы, глиобластомы, ретинобластомы, нейриномы, нейробластомы, шванномы, менингиомы, злокачественные гематопоэтические опухоли; лейкемии (острая лимфоцитная лейкемия (ALL), острая миелоидная лейкемия(AML), хроническая миелоидная лейкемия (CML), хроническая лимфоцитная лейкемия (CLL, хлорлейкоз, плазмоцитомы, лейкоз Т или В клеток, лимфомы не Ходкиновского типа и лимфомы Ходкина, миеломы и различные злокачественные гемопатии. Также здесь описано получение трициклического дигидропиридина формулы (I) в соответствии со следующим общим способом: Смесь 1 экв. пиразола или пиррола (X=N или CR7), 1 экв. альдегида R2-CHO и 1 экв. дикетопроизводного нагревают при температуре кипения с обратным холодильником в спирте, таком как этанол или 1-бутанол в течение от 1/2 ч до нескольких часов. Раствор охлаждают до комнатной температуры. Целевое соединение или выделяют фильтрованием, или растворитель удаляют в вакууме. При необходимости неочищенный продукт очищают на силикагеле или с использованием препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ). Когда Y' представляет собой N-Boc, проводят снятие защитной группы в продукте с использованием раствора трифторуксусной кислоты в дихлорметане (50/50) или раствора хлористо-водородной кислоты в диоксане. Таким образом, здесь описан способ получения соединений формулы (I), отличающийся тем, что: а) производное аминопиразола (Х=NH) или аминопиррола (X=CR7) формулы (II)R2-CHO и с) производное дикетона формулы (IV) где R1, R2, R7, Y, Y', Y" являются такими, как определено в п.1 формулы изобретения, смешивают в спиртовом растворителе при температуре кипения, получая неочищенное соединение формулы (I), которое затем необязательно переводят на стадию снятия защитной группы и/или стадию очистки и/или стадию солеобразования. А. Общий способ получения N-замещенных трициклических дигидропиридинов Трициклическое соединение I в растворе дихлорметана (ДХМ) обрабатывают 2 экв. бензилоксикарбонилхлорида, 2 экв. диизопропилэтиламина (DIEA) и каталитическим количеством 4 диметиламинопиридина (DMAP) при комнатной температуре в течение 24 ч. Реакционную смесь выливают в 10%-ный раствор гидросульфата калия и экстрагируют ДХМ. Органическую фазу промывают водой, сушат над сульфатом магния (MgSO4) и концентрируют в вакууме. Неочищенный продукт очищают на силикагеле, получая Cbz-защищенное производное III. Вос-защитную группу удаляют при обработке соединения III смесью трифторуксусной кислоты(ТФУК) и ДХМ (50/50) при комнатной температуре в течение 1 ч. После упаривания растворителя неочищенный продукт очищают на силикагеле, получая IV. Ацильные производные общей формулы V получают в 2 стадии. Соединения формулы IV первона-8 016815 чально ацилируют различными ацилхлоридами в ДХМ с использованием DIEA и каталитического количества DMAP. Реакционную смесь перемешивают в течение ночи при комнатной температуре и выливают в воду. Смесь экстрагируют ДХМ. Органическую фазу промывают водой, сушат над MgSO4 и концентрируют в вакууме. Соединения V очищают с использованием препаративной ВЭЖХ. Алкильные производные общей формулы VI получают из соединений IV с использованием соответствующих эпоксидов в этаноле. Раствор либо нагревают при температуре кипения с обратным холодильником в течение 2 ч, либо подвергают микроволновому облучению при 110 С в течение 10 мин. Смесь выливают в воду и экстрагируют ДХМ. Раствор в ДХМ промывают водой, сушат над MgSO4 и концентрируют. Полученный продукт гидрируют с использованием Pd/C в атмосфере водорода. После фильтрования через Целит и упаривания неочищенный продукт очищают с использованием препаративной жидкостной хроматографии в сочетании с масс-спектрометрией (ЖХ/МС). Ацильные производные общей формулы VII получают прямым ацилированием I ацилхлоридами,как описано для III, или ангидридами кислот в ДХМ с использованием DIEA в течение 2 ч при комнатной температуре. Смесь выливают в 10%-ный раствор гидросульфата калия и экстрагируют ДХМ. Органический раствор промывают водой, сушат над MgSO4 и концентрируют. Неочищенный продукт непосредственно обрабатывают раствором ТФУК/ДХМ (50/50) в течение 1 ч при комнатной температуре. Неочищенные продукты очищают с использованием препаративной ЖХ/МС, получая VII. Алкильные производные общей формулы VIII получают обработкой в приборе для микроволнового облучения при 150 С соединения I соответствующим эпоксидом в N,N-диметилформамиде (ДМФ). Промежуточное соединение очищают с использованием препаративной ВЭЖХ. Защитную группу в полученном производном снимают с использованием раствора ТФУК/ДХМ (50/50). Неочищенный продукт очищают с использованием препаративной ЖХ/МС. В. Общий способ получения коммерчески недоступных альдегидов R2-CHO формулы (III). Альдегиды общего строения IX Смесь 1 экв. формилбензойной кислоты и 1 экв. производного анилина или бензиламина в этилацетате (AcOEt) обрабатывают дициклогексилкарбодиимидом (DCC) при 60 С в течение нескольких часов. Смесь выливают в 1 н. HCl. Органическую фазу собирают и последовательно промывают водой, раствором бикарбоната натрия и насыщенным раствором соли. Раствор сушат над MgSO4 и концентрируют. Неочищенные продукты при необходимости очищают на силикагеле. Альдегиды общего строения X Смесь 1 экв. аминобензальдегида и 1 экв. производного бензоилхлорида в ДМФ обрабатывают 2 экв. DIEA при микроволновом облучении при 110 С в течение 10 мин. Соединения X обычно выпадают в осадок, и их собирают фильтрованием. Альдегиды общего строения XI Смесь 1 экв. аминобензальдегида и 1 экв. производного фенилизоцианата в ДМФ обрабатывают при микроволновом облучении при 110 С в течение 10 мин. Соединения XI обычно выпадают в осадок,и их собирают фильтрованием. Альдегиды общего строения XII Смесь 1 экв. хлорсульфонилбензальдегида и 1 экв. производного анилина в дихлор-1,2-этане (DCE) обрабатывают избытком пиридина в течение нескольких часов. Смесь выливают в 10%-ный раствор HCl и экстрагируют ДХМ. Органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенные продукты очищают на силикагеле, получая альдегиды XII. Альдегиды общего строения XV и XVI К раствору 1 экв. соединения общей формулы XIII или XIV в сухом тетрагидрофуране (ТГФ) добавляют от 1 до 1,5 экв. суспензии NaH при комнатной температуре. Смесь перемешивают при комнатной температуре до прекращения выделения газа и необязательно нагревают при 80 С в течение 30 мин. Реакционную смесь охлаждают до комнатной температуры и добавляют раствор 1 экв. 5 нитрофуральдегида в ТГФ. Реакционную смесь перемешивают до момента завершения реакции, затем выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. При необходимости неочищенные продукты очищают колоночной хроматографией на силикагеле или перекристаллизацией, получая соединения формулы XV илиXVI. Альдегиды общего строения XVII и XVIII Смесь 1 экв. 5-бромтиофен-2-карбоксальдегида, 1 экв. соединения общей формулы XIII или XIV и 2 экв. карбоната калия нагревают при 120 С до завершения реакции. Затем реакционную смесь выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенные продукты при необходимости очищают на силикагеле, получая соединения XVII или XVIII. Альдегиды общего строения XIX К раствору 1 экв. соединения общей формулы XIIIa в сухом ТГФ добавляют от 1 до 1,5 экв. суспензии NaH при комнатной температуре. Смесь перемешивают при комнатной температуре до прекращения выделения газа. Добавляют раствор 1 экв. 2-хлор-1,3-тиазол-5-карбальдегида в ТГФ. Реакционную смесь перемешивают до завершения реакции и затем выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Альтернативный способ обработки реакционной смеси может включать фильтрование реакционной смеси. Твердое вещество затем разбавляют водой и экстрагируют этилацетатом и дихлорметаном. Органические экстракты объединяют, сушат над MgSO4 и концентрируют. При необходимости неочищенные продукты очищают колоночной хроматографией на силикагеле или перекристаллизацией,получая соединения формулы XIX. Экспериментальная часть. Методы. Аналитическая ЖХ/МС, способ А. Анализы методом аналитической ЖХ/МС проводили с использованием насоса для ВЭЖХ ShimadzuSPD-10A; масс-спектрометра модели РЕ Sciex API 100LC на основе YMC основной колонки S5 при элюировании с градиентом ацетонитрила (ACN), содержащего 0,1% ТФУК, в воде при скорости потока 0,1 мл/мин, подробности градиента приведены для каждого примера. Соединения, элюированные с колонки, обнаруживали методом масс-спектроскопии с электрораспылением (МС EI). Аналитическая ЖХ/МС, способ В. Анализ проводили на масс-спектрометре Waters модели ZQ, работающем в режиме электрораспыления положительных и отрицательных ионов (диапазон масс - 100-1200 атомных единиц массы), установленном на ВЭЖХ приборе Agilent HP1100. Разделение проводили на колонке Waters Xbridge C18(350 мм, диаметр частиц 2,5 мкм), поддерживаемой при температуре 60 С при элюировании градиентом ацетонитрила в воде, содержащей 0,1% (об./об.) муравьиной кислоты при скорости потока 1,1 мл/мин.- 11016815 Форма градиента была следующей: от 5 до 100% ацетонитрила в течение 5 мин, поддержание 100% ацетонитрила в течение 0,5 мин, затем опять до 5% ацетонитрила в течение 1 мин. Общее время прохода составляет 7 мин. Помимо масс-спектрометрии осуществляли УФ-детектирование массива при длинах волн 210 до 400 нМ и рассеяние света в парах проводили с использованием прибора Sedere Sedex 85. Аналитическая ЖХ/МС, способ С. Анализ проводили на масс-спектрометре Waters модели ZQ, работающем в режиме электрораспыления положительных и отрицательных ионов (диапазон масс - 100-1200 атомных единиц массы), установленном на приборе Waters Acquity UPLC. Разделение проводили на колонке Waters UPLC BeH C18(2,150 мм, диаметр частиц 1,7 мкм), поддерживаемой при температуре 55 С при элюировании градиентом ацетонитрила в воде, содержащей 0,1% (об./об.) муравьиной кислоты при скорости потока 1,2 мл/мин. Форма градиента была следующей: от 5 до 100% ацетонитрила в течение 3 мин, затем опять до 5% ацетонитрила в течение 1 мин. Общее время прохода составляет 4,5 мин. Помимо массспектрометрии осуществляли УФ-детектирование массива при длинах волн = 210 до 400 нМ. Препаративная ЖХ/МС, способ А. Разделение методом препаративной ЖХ/МС проводили на приборах Waters HPLC: насос 515 HPLC; модуль бинарного градиента 2525; 2487 DAD (детектор двойного поглощения); устройство для управления образцами 2767, соединенное с масс-спектрометром Micromass. Продукты разделяли на колонкеYMC Combi Prep Pro CI8, элюируя градиентом ацетонитрила, содержащего 0,1% ТФУК, в воде, содержащей 0,1% ТФУК, при скорости потока 32 мл/мин. Для каждого разделения программирование градиента подбирали на основе аналитической хроматограммы ЖХ/МС образца. Препаративная ЖХ/МС, способ В. Соединения очищают с помощью ЖХ/МС с использованием системы Waters FractionLynx, состоящей из градиентного насоса Waters, модель 600, регенерирующего наоса Waters, модель 515, насоса подпитки Waters Reagent Manager, автоинжектора Waters, модель 2700, двух переключателей Rheodyne, модель LabPro, фотодиодного детектора массива Waters, модель 996, масс-спектрометра Waters, модельZMD, и сборщика фракций Gilson, модель 204. Прибор управляется программным обеспечением WatersFractionLynx. На выходе делительной колонки поток расщепляется в соотношении 1/1000 с использованием сплиттера LC Packing AccuRate, 1/1000 часть потока смешивается с метанолом (скорость потока 0,5 мл/мин) и посылается к детекторам, данный поток опять расщепляется: 3/4 потока посылается на фотодиодный детектор массива и 1/4 на масс-спектрометр, остаток на выходе из колонки (999/1000) посылается в коллектор фракций, где поток направляется обычно в отход, если ожидаемый сигнал массы не детектируется программным обеспечением FractionLynx. Программное обеспечение FractionLynx содержит молекулярные формулы ожидаемых соединений и запускает коллекцию соединений, когда детектируется сигнал массы, соответствующий [М+Н]+ и [M+Na]+. В некоторых случаях (в зависимости от результата аналитической ЖХ/МС, когда детектируется [М+2 Н] в качестве интенсивного иона) программное обеспечение FractionLynx дополнительно обеспечено расчетом половины молекулярной массы (MW/2), в данных условиях когда детектируется сигнал с массой, соответствующей [М+2 Н] и [M+Na+H] также запускается программа сбора образца. Соединения собирают во взвешенные стеклянные пробирки. После сбора растворитель упаривают на центрифужном роторе Jouan, модель RC 10.10, и определяют массу соединения, взвешивая пробирки после упаривания растворителя. Подробности, касающиеся колонки и градиента, приведены в следующей части для каждого примера. Пример 1. 4-(4-Гидрокси-3-метилфенил)-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5 он; соединение с трифторуксусной кислотой К смеси 213 мг N-Boc-3,5-дикетопиперидина (1 ммоль) (N-Вос-3,5-дикетопиперидин может быть получен в соответствии с патентом WO 06003096 А 1) и 83 мг 3-аминопиразола (1 ммоль) в 5 мл этанола добавляют 136,2 мг 4-гидрокси-3-метилбензальдегида (1 ммоль). Смесь нагревают при температуре кипения с обратным холодильником в течение 2 ч и охлаждают до комнатной температуры. Осадок собирают фильтрованием и промывают этанолом, получая 316 мг бледно-желтого твердого вещества (выход=80%). Аналитическая ЖХ/МС, способ А: время удерживания (RT)=3,8 мин (2-85% ACN/H2O градиент в течение 7 мин). EI MC ([М+Н]+): 397.N-Boc-3,5-дикетопиперидин может быть получен в соответствии с патентом WO 2006003096 А 1. 100 мг выделенного соединения растворяют в 5 мл ДХМ и обрабатывают 5 мл ТФУК в течение 1 ч при комнатной температуре. После упаривания растворителя неочищенный продукт непосредственно- 12016815 очищают с использованием препаративной ВЭЖХ с обращенной фазой. 50 мг целевого соединения выделяют после лиофилизации фракций (выход=50%). Аналитическая ЖХ/МС, способ А: (2-85% ACN/H2O градиент в течение 7 мин). MC EI ([М+Н]+): 297, RT=2,31. 1 К смеси 107 мг N-Boc-3,5-дикетопиперидина (0,5 ммоль) и 42 мг 3-аминопиразола (0,5 ммоль) в 2,5 мл этанола добавляют 0,116 мл 3-(4-хлорфенокси)бензальдегида (0,5 ммоль). Смесь нагревают при температуре кипения с обратным холодильником в течение 1/2 ч и охлаждают до комнатной температуры. Раствор концентрируют в вакууме. Полученный маслянистый остаток растворяют в 2,5 мл ДХМ и обрабатывают 2,5 мл ТФУК при комнатной температуре в течение 1 ч. После упаривания растворителя неочищенный продукт непосредственно очищают с использованием препаративной ВЭЖХ с обращенной фазой, получая 70 мг белого твердого вещества после лиофилизации фракций (выход=31%). Аналитическая ЖХ/МС, способ А: (2-85% ACN/H2O градиент в течение 7 мин). MC EI ([М+Н]+): 393, RT=3,91. 1 Н ЯМР (D6-ДМСО) (300 МГц, прибор Brucker): 3,70 (АВ, 2 Н); 4,18 (АВ, 2 Н); 5,17 (с, 1 Н); 6,65 (д,1 Н); 6,94 (м, 4 Н); 7,22 (м, 1 Н); 7,45 (м, 3 Н); 9,80 (с, 2 Н); 10,4 (с, 1 Н). Пример 3. 4-[5-(1 Н-Бензимидазол-2-илсульфанил)фуран-2-ил]-1,4,6,7,8,9-гексагидропиразоло[3,4b]хинолин-5-он К смеси 225 мг 1,3-циклогександиона (2 ммоль) и 183 мг 3-аминопиразола (2,2 ммоль) в этаноле добавляют 490 мг 5-(1 Н-бензимидазол-2-ил-сульфанил)фуран-2-карбальдегида (2 ммоль). Смесь нагревают при температуре кипения с обратным холодильником в течение 1/2 ч и охлаждают до комнатной температуры. Осадок собирают фильтрованием и промывают этанолом, получая 460 мг бледно-желтого твердого вещества (выход=58%). Аналитическая ЖХ/МС, способ А: (2-85% ACN/H2O градиент в течение 7 мин); МС EI ([М+Н]+): 404, RT=3,13 мин. 1 Н ЯМР (D6-ДМСО) (300 МГц, прибор Brucker): 1,96 (м, 2 Н); 2,26 (м, 2 Н); 2,54 (м, 2 Н); 4,11 (с, 1 Н); 5,22 (с, 1 Н); 5,97 (с, 1 Н); 6,85 (с, 1 Н); 7,16 (м, 2 Н); 7,37 (м, 1 Н); 7,46 (с, 1 Н); 7,55 (м, 1 Н); 10,0 (с, 1 Н); 12,2 К раствору 156 мг димедона (1 ммоль) и 91 мг 3-аминопиразола (1,1 ммоль) в 5 мл этанола добавляют 244 мг 5-(1 Н-бензимидазол-2-илсульфанил)фуран-2-карбальдегида (1 ммоль). Смесь нагревают при кипении с обратным холодильником в течение 1 ч. Раствор охлаждают до комнатной температуры и концентрируют в вакууме. Неочищенный продукт непосредственно очищают на силикагеле с использованием смеси дихлорметан/метанол 98/2, затем 96/4 в качестве элюента. После упаривания фракций выделяют 250 мг бледно-желтого твердого вещества (58%). Аналитическая ЖХ/МС, способ А: (2-85% ACN/H2O градиент в течение 7 мин). MC EI ([М+Н]+): 432, RT: 2,56 мин. 1 Н ЯМР (D6-ДМСО) (300 МГц, прибор Brucker): 0,81 (с, 3 Н); 0,87 (с, 3 Н); 2,00 (АВ, 2 Н); 2,29 (АВ,- 13016815 2 Н); 5,02 (с, 1 Н); 5,85 (с, 1 Н); 6,72. Следующие примеры соединений были получены с использованием такого же способа, как описано в примере 1. Таблица 1 Следующие примеры соединений были получены с использованием таких же способов, как описано в примерах 3 и 4. К смеси 443 мг N-Boc-3,5-дикетопиперидина (2,08 ммоль) и 173 мг 3-аминопиразола (2,08 ммоль) в 10 мл этанола добавляют 508 мг 5-(1 Н-бензимидазол-2-илсульфанил)фуран-2-карбальдегида (2,08 ммоль). Смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч и охлаждают до комнатной температуры. Раствор концентрируют и неочищенный продукт очищают на силикагеле с использованием ДХМ/МеОН (95/5) в качестве элюента. Выделяют 590 мг бледно-желтого твердого вещества 44 (выход=56%). Аналитическая ЖХ/МС, способ А: (2-85% ACN/H2O градиент в течение 7 мин). MC EI ([М+Н]+): 505, RT: 3,79 мин. Пример 45. 4-[5-(1 Н-Бензимидазол-2-илсульфанил)фуран-2-ил]-7-(2-гидрокси-3-пиперидин-1 илпропил)-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он; соединение с трифторуксусной кислотой 300 мг твердого вещества 44 (0,59 ммоль) растворяют в 4 мл ДХМ и добавляют 0,184 мл бензил- 22016815 хлорформиата (1,3 ммоль) с последующим добавлением 0,385 мл DIEA (2,36 моль) и 20 мг DMAP (0,16 ммоль). Реакционную смесь встряхивают в течение ночи при комнатной температуре, затем выливают в 80 мл 10% (вес./об.) раствора KH2SO4 и экстрагируют дважды 40 мл этилацетата. Объединенные органические экстракты промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Остаток непосредственно обрабатывают 10 мл раствора ТФУК/ДХМ (50/50) в течение 1 ч при комнатной температуре. Раствор концентрируют в вакууме. Половину полученного остатка растворяют в 2 мл этанола и непосредственно используют в конечной стадии. Раствор обрабатывают при микроволновом облучении избытком свежеполученного 1-оксиранилметилпиперидина (получен при перемешивании 274 мг эпибромгидрина (2 ммоль) и 0,198 мл пиперидина (2 ммоль) в 10 мл метанола в течение ночи при комнатной температуре). Смесь облучают микроволновым излучением в течение 15 мин при 150 С. Раствор концентрируют и полученный остаток очищают с использованием препаративной ВЭЖХ. Выделяют 29 мг ожидаемого соединения 45 (выход=4%). Аналитическая ЖХ/МС, способ А: (2-85% ACN/H2O градиент в течение 7 мин). ([М+Н]+): 546, RT: 2,67 мин. Примеры 46-50. 4-[3-(4-Хлорфенокси)фенил]-7-(2-гидрокси-3-морфолин-4-илпропил)-2,4,6,7,8,9 гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он; соединение с трифторуксусной кислотой (пример 50) Соединение 50 получают с использованием такого же способа, как в примере 45, с использованием 3-(4-хлорфенокси)бензальдегид в качестве альдегида. К смеси 1,07 г N-Boc-3,5-дикетопиперидина (5 ммоль) и 415 мг 3-аминопиразола (5 ммоль) в 10 мл этанола добавляют 962 мг 3-(4 хлорфенокси)бензальдегида (5 ммоль). Смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч и охлаждают до комнатной температуры. Раствор концентрируют и неочищенный продукт очищают на силикагеле с использованием ДХМ/МеОН (95/5) в качестве элюента. Выделяют 1,33 г бледно-желтого твердого вещества 46 (выход=54%). Аналитическая ЖХ/МС, способ А: МС EI([М+Н]+): 493, RT: 3,28 мин (градиент от 30 до 90% ацетонитрила в течение 7 мин). 1,21 г вышеуказанного твердого соединения (2,46 ммоль) растворяют в 20 мл ДХМ и добавляют 0,184 мл бензилхлорформиата (4,92 ммоль) с последующим добавлением 1,6 мл DIEA (9,84 моль) и 20 мгDMAP (0,16 ммоль). Реакционную смесь встряхивают в течение ночи при комнатной температуре и затем выливают в 80 мл 10% (вес./об.) раствора KH2SO4 и экстрагируют дважды 40 мл этилацетата. Объединенные органические экстракты промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают на силикагеле с использованием раствора ДХМ/МеОН 98/2 в качестве элюента. Выделяют 1,6 г целевого соединения 47 (количественный выход). Аналитическая ЖХ/МС, способ А: МС EI ([М+Н]+): 627, RT: 4,52 мин (градиент от 30 до 90% ацетонитрила в течение 7 мин). Продукт 47 обрабатывают 20 мл раствора ТФУК/ДХМ (50/50) в течение 1 ч при комнатной температуре. Раствор концентрируют в вакууме. Полученный продукт очищают на силикагеле с использованием ДХМ/МеОН 90/10 в качестве элюента. Выделяют 0,91 г ожидаемого соединения 48 (выход=64%). Аналитическая ЖХ/МС, способ А: МС EI ([М+Н]+): 527. Время удерживания: 2,66 мин (градиент от 30 до 90% ацетонитрила в течение 7 мин). Раствор 53 мг 48 (0,1 ммоль) и 21 мг 4-оксиранилметилморфолина (0,15 ммоль) в 1 мл этанола нагревают при температуре кипения с обратным холодильником в течение 2 ч. После охлаждения смесь выливают в 80 мл воды и экстрагируют дважды 50 мл ДХМ. Объединенные органические экстракты промывают 50 мл 0,5 н. HCl, насыщенным раствором соли, сушат над MgSO4 и концентрируют. Остаток 49 непосредственно гидрируют в атмосфере водорода с использованием 0,01 ммоль палладия-на-угле. Реакционную смесь перемешивают в течение ночи и затем фильтруют через Целит. Фильтрат концентрируют и неочищенный продукт непосредственно очищают с использованием препаративной ЖХ/МС, способ А. Выделяют 45 мг целевого соединения 50 (выход=85%). Аналитическая ЖХ/МС, способ А: [М+Н]+): 536, RT: 3,77 мин (градиент от 5 до 85% ацетонитрила в течение 7 мин). К раствору 50 мг соединения 44 (0,1 ммоль) в 1 мл EtOH и 1 мл ДМФ добавляют 21 мг 4 оксиранилметилморфолина (0,15 ммоль). Раствор нагревают при 150 С при микроволновом облучении в течение 20 мин. Раствор концентрируют и остаток очищают с использованием препаративной ЖХ/МС,способ А. Соединение 51 затем обрабатывают 2 мл раствора ТФУК/ДХМ (50/50) в течение 1 ч при комнатной температуре. Конечный продукт очищают препаративной ЖХ/масс-спектрометрией (способ А). Выделяют 19 мг соединения 52 (выход=29%). Аналитическая ЖХ/МС, способ А: ([М+Н]): 548, RT: 2,58 мин (градиент от 5 до 85% ацетонитрила в течение 7 мин). Пример 53. 4-[3-(4-Хлорфенокси)фенил]-7-(3,5-диметилизоксазол-4-карбонил)-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-5-он; соединение с трифторуксусной кислотой К раствору 26,3 мг (0,05 ммоль) соединения 48 в 0,5 мл ДХМ последовательно добавляют 12 мг 3,5 диметилизоксазол-4-карбонилхлорида (0,75 ммоль), 16 мкл DIEA (0,1 ммоль) и 5 мг DMAP (0,04 ммоль). Реакционную смесь перемешивают в течение ночи, затем выливают в 20 мл воды и экстрагируют дважды 10 мл ДХМ. Объединенные органические экстракты промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Полученный остаток растворяют в смеси 1 мл метанола и 0,1 мл уксусной кислоты. Соединение гидрируют с использованием Pd/C в атмосфере водорода. После гидрирования в течение 20 ч смесь фильтруют через Целит и фильтрат концентрируют в вакууме. Неочищенный продукт очищают препаративной ЖХ/масс-спектрометрией (способ А), получая 2,3 мг продукта 53 (выход=7,4%). Аналитический способ А [М+Н]+: 516, RT: 4,45 мин (градиент от 5 до 85% ацетонитрила в течение 7 мин). Следующие соединения были получены таким же способом: К раствору 25 мг (0,048 ммоль) соединения 48 в 1 мл ДХМ последовательно добавляют 6 мкл уксусного ангидрида (0,06 ммоль) и 16 мкл DIEA (0,1 ммоль). Раствор перемешивают в течение ночи и выливают в 20 мл воды. Смесь экстрагируют дважды 15 мл ДХМ. Объединенные органические экстракты промывают 10%-ным раствором дигидросульфата калия, водой, сушат над MgSO4 и концентрируют. Неочищенный продукт непосредственно гидрируют в атмосфере водорода с использованием Pd/C в качестве катализатора. Реакционную смесь перемешивают в течение ночи и затем фильтруют через Целит. Фильтрат концентрируют в вакууме и полученный остаток очищают с помощью препаративной ЖХ/МС(способ А). Выделяют 1,1 мг целевого продукта 57 (выход=4%). Аналитическая ЖХ/МС, способ А:- 25016815 К раствору 25 мг (0,048 ммоль) соединения 46 в 0,5 мл ДХМ последовательно добавляют 11 мкл уксусного ангидрида (0,11 ммоль) и 33 мкл DIEA (0,2 ммоль). Раствор перемешивают при комнатной температуре в течение 2 ч и выливают в 20 мл воды. Смесь экстрагируют дважды 15 мл ДХМ. Объединенные органические экстракты промывают 10%-ным раствором дигидросульфата калия, водой, сушат надMgSO4 и концентрируют. Неочищенный продукт непосредственно обрабатывают 1 мл раствора ТФУК/ДХМ (50/50) при комнатной температуре в течение 1 ч. Смесь концентрируют в вакууме и полученный остаток очищают с помощью препаративной ЖХ/МС (способ А). Выделяют 23 мг целевого продукта 58 (выход=52%). Аналитическая ЖХ/МС, способ А: [М+Н]+): 435, RT: 4,33 мин (градиент от 5 до 85% ацетонитрила в течение 7 мин). Пример 59. 4-[5-(1 Н-Бензимидазол-2-илсульфанил)фуран-2-ил]-9-метил-2,4,6,7,8,9-гексагидропиразоло[3,4-b]хинолин-5-он; соединение с трифторуксусной кислотой К раствору 30 мг (0,075 ммоль) соединения 3 и 14 мкл иодистого метила (0,225 ммоль) в 1 мл ДМФ добавляют 31 мг карбоната калия (0,225 ммоль). Раствор перемешивают в течение 20 ч при комнатной температуре и выливают в 20 мл воды. Смесь экстрагируют дважды 15 мл ДХМ. Объединенные органические экстракты промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают с помощью препаративной ЖХ/МС (способ А). Выделяют 2,2 мг целевого продукта 59 (выход=6%). Аналитическая ЖХ/МС, способ А: [М+Н]+): 418, RT: 2,54 мин (градиент от 5 до 85% ацетонитрила в течение 7 мин). Пример 60. 3-(5-Оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)-N-(4-трифторметоксибензил)бензамид; соединение с трифторуксусной кислотой Получение альдегида. К раствору 300 мг 3-карбоксибензальдегида (2 ммоль) и 382 мг 4(трифторметокси)бензиламина (2 ммоль) в 5 мл ДХМ последовательно добавляют 540 мг 1 гидроксибензотриазола (HOBt) (4 ммоль) и 0,63 мг диизопропилкарбодиимида (DIC) (4 ммоль). Реакционную смесь перемешивают в течение ночи при комнатной температуре и затем выливают в 20 мл 10%ного раствора KH2SO4. Смесь экстрагируют дважды 15 мл этилацетата. Объединенные органические экстракты промывают 20 мл воды и 20 мл насыщенного раствора соли, сушат над MgSO4 и концентрируют,получая 670 мг 3-формил-N-(4-трифторметоксибензил)бензамида (выход=85%). Аналитическая ЖХ/МС,способ А: ([М+Н]+): 324, RT: 5,24 мин (градиент от 5 до 85% ацетонитрила в течение 7 мин). Соединение 60 получают, как описано в примере 2, исходя из 21,3 мг N-Boc-3,5-дикетопиперидина (0,1 ммоль), 8,3 мг 3-аминопиразола (0,1 ммоль) и 32,3 мг 3-формил-N-(4-трифторметоксибензил)бензамида (0,1 ммоль) в смеси 0,5 мл этанола и 0,5 мл ДМФ, получая 22,5 мг продукта 60 после очистки с помощью препаративной ЖХ/МС (способ А, выход=38%). Аналитическая ЖХ/МС, способ А: ([М+Н]+): 484, RT: 2,51 мин Соединение 61 получали с использованием такого же способа, как описано для 60, исходя из 3- 26016815(трифторметокси)бензиламина. С помощью препаративной ЖХ/МС выделяли 25,5 мг целевого соединения (способ А, выход=43%). Аналитическая ЖХ/МС, способ А: [М+Н]+): 484, RT: 2,47 мин (градиент от 2 до 80% ацетонитрила в течение 7 мин). Пример 62. 4-(5-Оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)-N-(3-трифторметоксифенил)бензамид; соединение с трифторуксусной кислотой Получение альдегида. К раствору 300 мг 4-карбоксибензальдегида (2 ммоль) и 382 мг 3(трифторметокси)анилина (2 ммоль) в 5 мл этилацетата добавляют 830 мг дициклогексилкарбодиимида(DCC) (4 ммоль). Реакционную смесь нагревают при 60 С в течение ночи и затем выливают в 60 мл 1 н. раствора HCl. Смесь экстрагируют дважды 30 мл этилацетата. Объединенные органические экстракты промывают 50 мл воды, 50 мл насыщенного раствора бикарбоната натрия и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают на силикагеле, получая 233 мг 4-формил-N-(3-трифторметоксифенил)бензамид (выход=38%). Аналитическая ЖХ/МС, способ А:([М+Н]+): 310, RT: 5,60 мин (градиент от 5 до 85% ацетонитрила в течение 7 мин). Исходя из 30,9 мг вышеуказанного альдегида (0,1 ммоль) и с использованием такого же способа,как в примере 2, получают 22,3 мг продукта 62 после препаративной ЖХ/МС (способ А, выход=43%). Аналитическая ЖХ/МС, способ А: ([М+Н]+): 470, RT: 2,61 мин (градиент от 2 до 80% ацетонитрила в течение 7 мин). Следующие примеры соединений были получены с использованием такого же способа. Таблица 4 Получение альдегида. К раствору 242 мг 3-аминобензальдегида (2 ммоль) и 250 мкл 4 хлорбензоилхлорида (2 ммоль) в 5 мл ДМФ добавляют 700 мкл DIEA (4 ммоль). Реакционную смесь облучают микроволновым излучением при 110 С в течение 10 мин. Образующийся осадок отфильтровы- 27016815 вают и промывают метанолом. Выделяют 670 мг 4-хлор-N-(3-формилфенил)бензамид в виде белого твердого вещества (выход=85%). Аналитическая ЖХ/МС, способ А: ([МН-Н]+): 260. Исходя из 26 мг вышеуказанного альдегида (0,1 ммоль) и с использованием такого же способа, как в примере 2, получали 25 мг продукта 65 после препаративной ЖХ/МС (способ А, выход=53%). Аналитическая ЖХ/МС, способ А: ([М+Н]+): 420, RT: 2,14 мин (градиент от 2 до 80% ацетонитрила в течение 7 мин). Пример 66. 4-Хлор-N-[5-(5-оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)тиазол 2-ил]бензамид; соединение с трифторуксусной кислотой Соединение 66 получали с использованием такого же способа, как описано для 65, 266 мг 4-хлор-N(5-формилтиазол-2-ил)бензамида получали из 256 мг 2-аминотиазол-5-карбальдегида (2 ммоль) и 250 мкл 4-хлорбензоилхлорида (2 ммоль) (выход=26%). Аналитическая ЖХ/МС, способ А: ([М+Н]+): 282,RT: 6,10 мин (градиент от 2 до 80% ацетонитрила в течение 7 мин). Исходя из 27 мг вышеуказанного альдегида (0,1 ммоль) 15,2 мг целевого соединения 66 выделяли после очистки с помощью препаративной ЖХ/МС (способ А, выход=28%). Аналитическая ЖХ/МС, способ А: ([М+Н]+): 427, RT: 2,53 мин Получение альдегида. Смесь 360 мг 3-аминобензальдегида (0,3 ммоль) и 460 мг 4-хлорфенилизоцианата (0,3 ммоль) в 3 мл ДМФ нагревают при микроволновом облучении при 110 С в течение 10 мин. Образующийся осадок отфильтровывают, получая целевую 1-(4-хлорфенил)-3-(3-формилфенил)мочевину. Аналитическая ЖХ/МС, способ А: ([М+Н]+): 351, RT: 5,30 мин (градиент от 5 до 85% ацетонитрила в течение 7 мин). Исходя из 27 мг вышеуказанного альдегида (0,1 ммоль) и с использованием такого же способа, как в примере 2, получали 2 3 мг продукта 67 в результате ЖХ/МС (способ А, выход=42%). Аналитическая ЖХ/МС, способ А: ([М+Н]+): 435, RT: 2,26 мин (градиент от 2 до 80% ацетонитрила в течение 7 мин). Пример 68. 4-(5-Оксо-2,4,6,7,8,9-гексагидропиразоло[3,4-b]-1,7-нафтиридин-4-ил)-N-(4-трифторметоксифенил)бензолсульфонамид; соединение с трифторуксусной кислотой Получение альдегида. К смеси 610 мг 4-хлорсульфонилбензальдегида (3 ммоль) и 460 мг 4-трифторметоксианилина (3 ммоль) в 2 мл дихлорэтана добавляют 2 мл пиридина (25 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 ч и затем выливают в 100 мл 10% HCl раствор. Смесь экстрагируют дважды 30 мл ДХМ. Объединенные органические экстракты промывают 30 мл воды, 30 мл насыщенного раствора бикарбоната натрия и насыщенным раствором соли, раствор сушат над MgSO4 и концентрируют. Неочищенный продукт очищают на силикагеле с использованием смеси ДХМ/AcOEt 90/10 в качестве элюента. Выделяют 0,48 г 4-формил-N-(4-трифторметоксифенил)бензолсульфонамида в виде белого твердого вещества (выход=47%). Аналитическая ЖХ/МС, способ А: ([М+Н]+): 346, RT: 5,53 мин (градиент от 5 до 85% ацетонитрила в течение 7 мин).
МПК / Метки
МПК: C07D 471/14, A61K 31/4162, C07D 471/04
Метки: содержащие, композиции, применение, 1,4-дигидропиридин-конденсированные, гетероциклы, получения, способы
Код ссылки
<a href="https://eas.patents.su/30-16815-14-digidropiridin-kondensirovannye-geterocikly-sposoby-ih-polucheniya-primenenie-i-soderzhashhie-ih-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">1,4-дигидропиридин-конденсированные гетероциклы, способы их получения, применение и содержащие их композиции</a>
Предыдущий патент: Замещенные изотопами ингибиторы протонного насоса
Следующий патент: Способ нанесения покрытия на изделия












