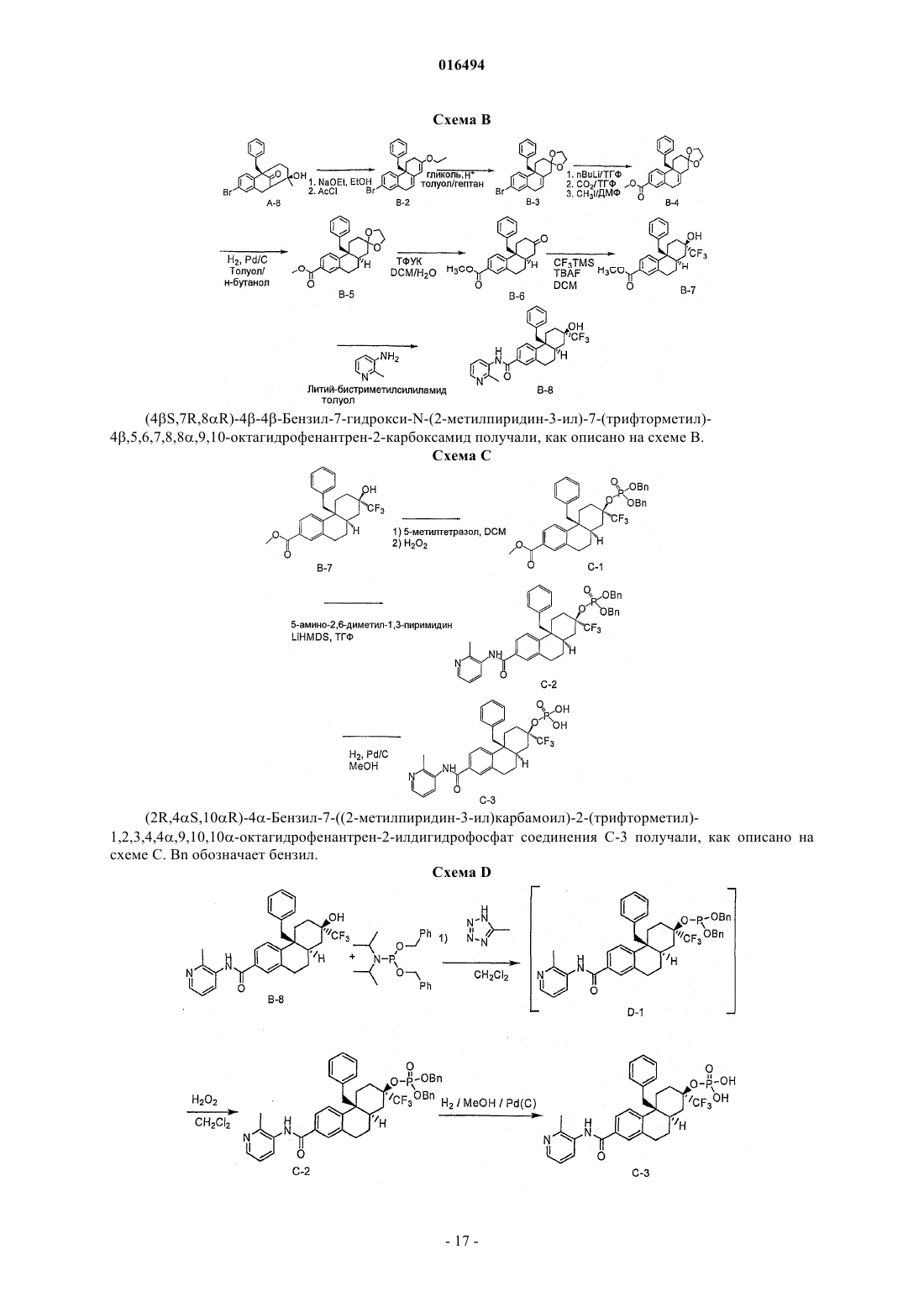
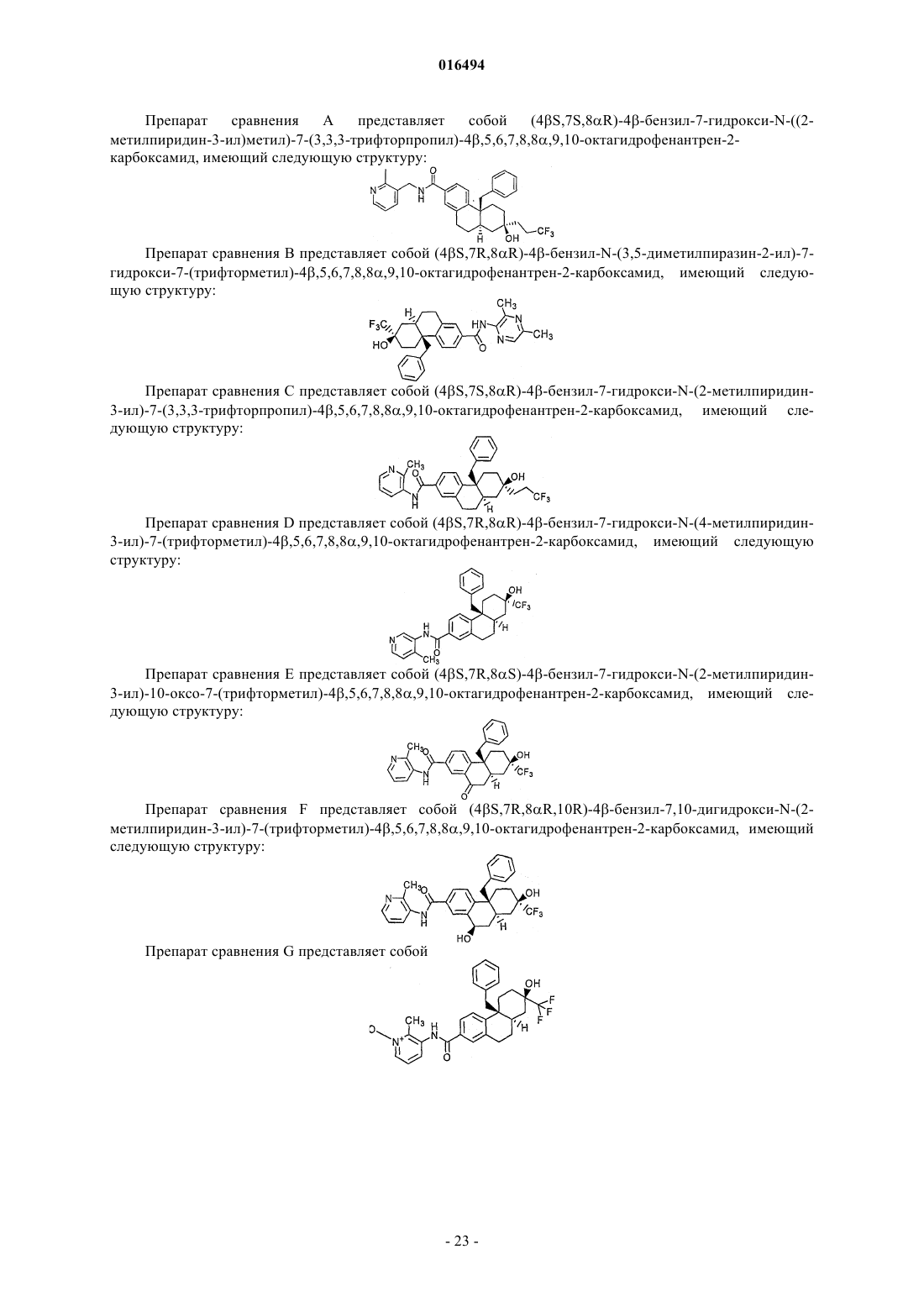
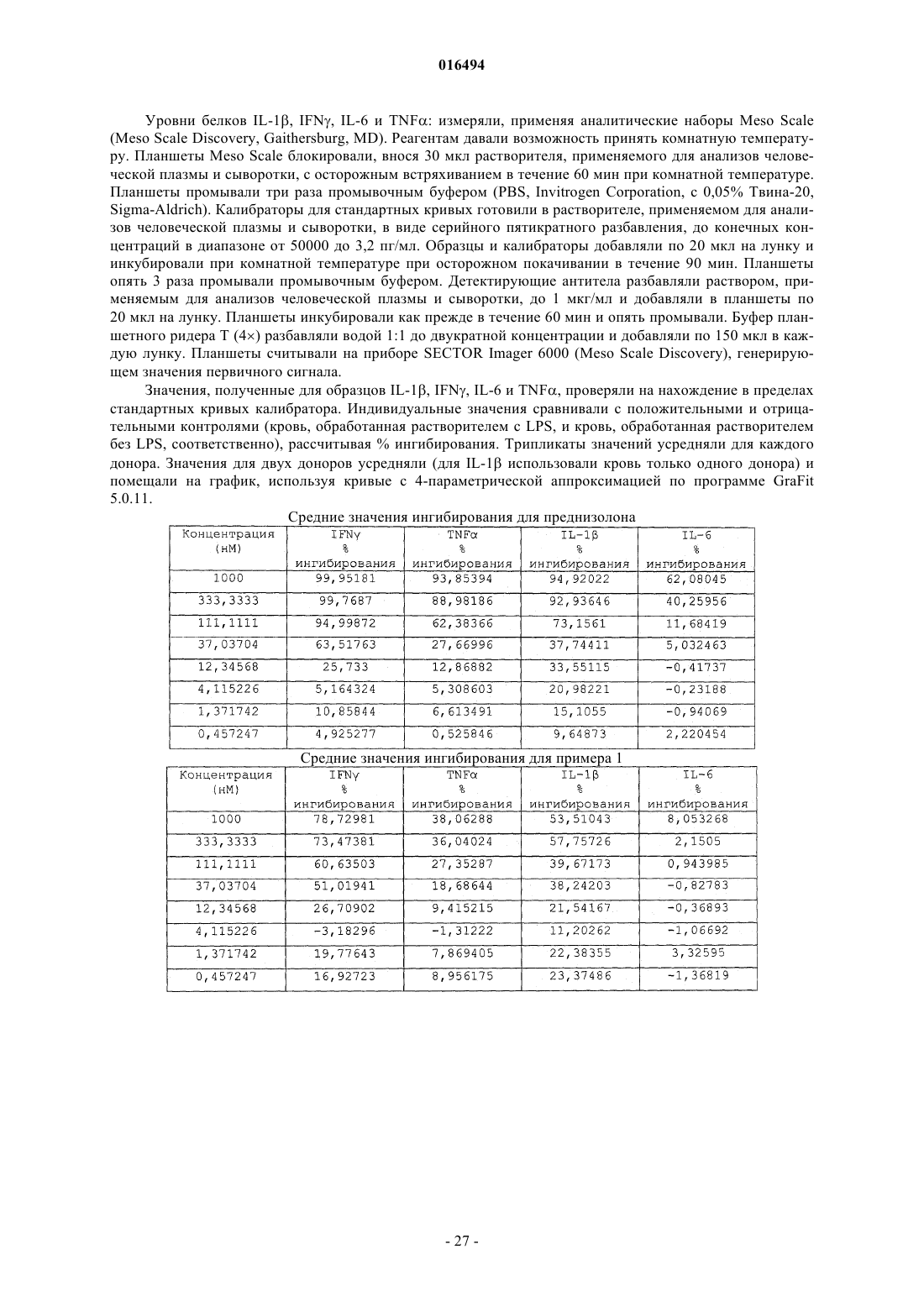
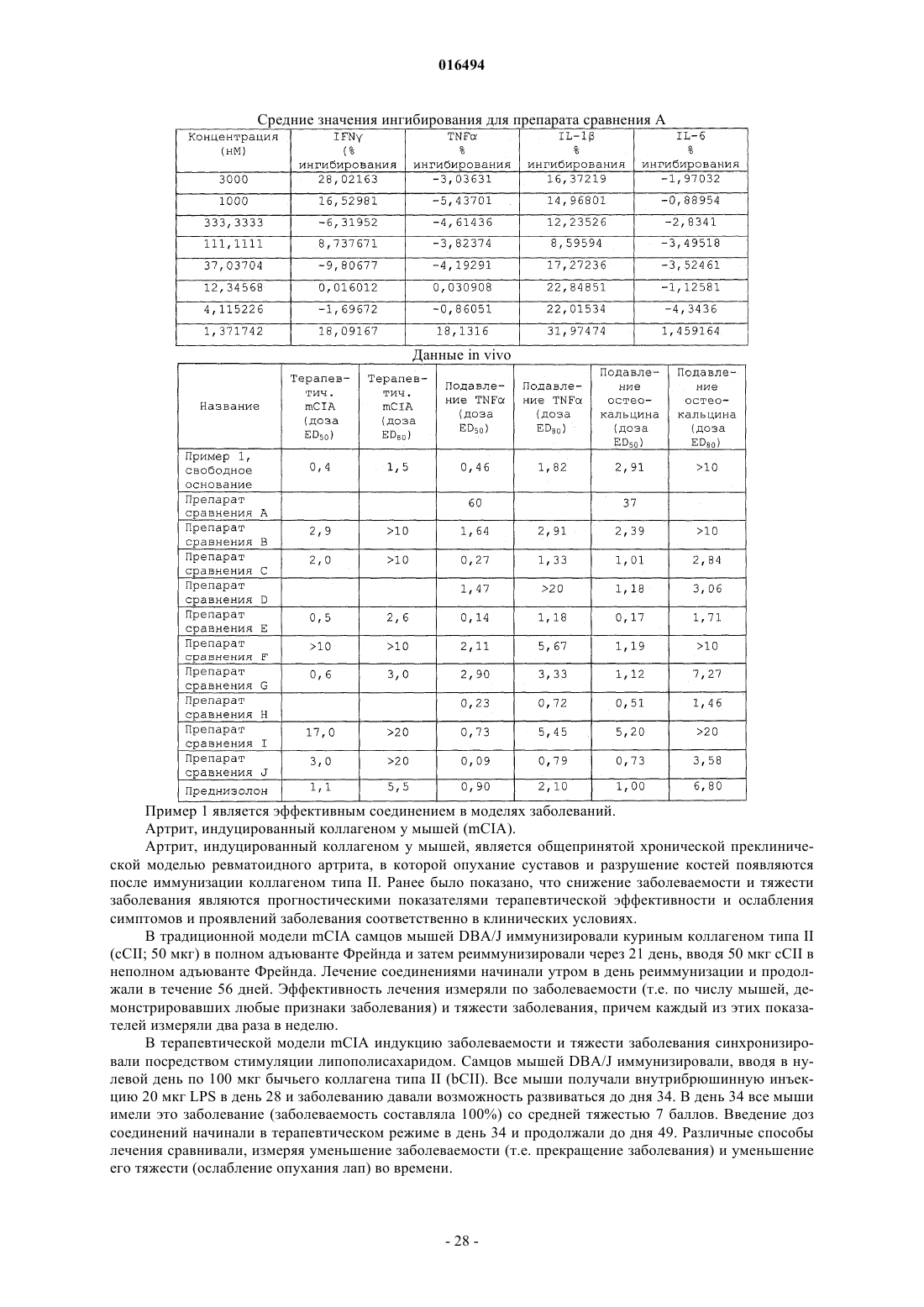
(2r,4αs,10αr)-4α-бензил-7-((2-метилпиридин-3-ил)карбамоил)-2-(трифторметил)-1,2,3,4,4α,9,10,10α-октагидрофенантрен-2-илдигидрофосфат или его соль
Номер патента: 16494
Опубликовано: 30.05.2012
Авторы: Рукер Пол Винсент, Олсон Лиза, Веббер Рональд Кит, Ху Сяо, Деврадж Раджеш Венкатесваран, Обукович Марк Джерард, Джером Кевин Диуэйн, Де Крешенцо Гэри Э.
Формула / Реферат
1. Соединение формулы I
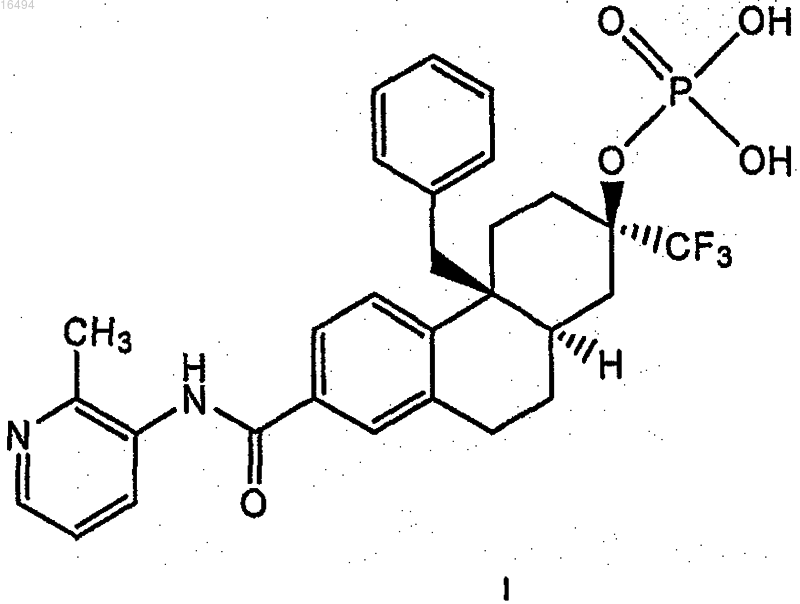
или его соль.
2. Соединение по п.1, в котором соединение представляет собой

3. Соединение по п.1, представляющее собой кальциевую соль.
4. Соединение по п.1, представляющее собой натриевую соль.
5. Фармацевтическая композиция, содержащая соединение по п.1 или его соль и носитель.
6. Способ модулирования активности глюкокортикоидного рецептора, включающий контактирование глюкокортикоидного рецептора с соединением по п.1 или его солью.
7. Способ лечения состояния, опосредуемого активностью глюкокортикоидного рецептора у субъекта, включающий введение субъекту соединения формулы I

или его соли.
8. Способ по п.7, в котором состояние представляет собой состояние, связанное с воспалением.
9. Способ по п.7, в котором состояние представляет собой астму, дерматит, воспалительное заболевание кишечника, болезнь Альцгеймера, психотическую глубокую депрессию, невропатию, отторжение трансплантата, рассеянный склероз, хронический увеит или хроническое обструктивное заболевание легких.
10. Способ по п.7, в котором состояние представляет собой ревматоидный артрит.
11. Способ по п.7, в котором состояние представляет собой дерматит.
12. Способ по п.7, в котором состояние представляет собой астму.
13. Способ по п.7, в котором состояние представляет собой болезнь Альцгеймера.
14. Способ по п.7, в котором состояние представляет собой воспалительное заболевание кишечника.
Текст
(2R,4S,10R)-4-БЕНЗИЛ-7-2-МЕТИЛПИРИДИН-3-ИЛ)КАРБАМОИЛ)-2(ТРИФТОРМЕТИЛ)-1,2,3,4,4,9,10,10-ОКТАГИДРОФЕНАНТРЕН-2 ИЛДИГИДРОФОСФАТ ИЛИ ЕГО СОЛЬ Настоящее изобретение направлено на соединения формулы I Деврадж Раджеш Венкатесваран, Де Крешенцо Гэри Э., Ху Сяо, Джером Кевин ДиУэйн, Обукович Марк Джерард, Олсон Лиза, Рукер Пол Винсент, Веббер Рональд Кит (US) или их соли, которые являются модуляторами глюкокортикоидного рецептора. Соединения и соли согласно настоящему изобретению можно применять для лечения состояний, опосредуемых активностью глюкокортикоидного рецептора. 016494 Область техники, к которой относится изобретение Настоящее изобретение включает соединения, которые являются модуляторами глюкокортикоидного рецептора. Настоящее изобретение также включает композиции и способы применения соединений и композиций. Предпосылки создания изобретения Модуляторы глюкокортикоидного рецептора являются лигандами глюкокортикоидного рецептора,применяемыми для лечения разнообразных патологических состояний благодаря высокой противовоспалительной, антипролиферативной и иммуномодулирующей активности. J. Miner, et al., Expert Opin.Investig. Drugs (2005), 14(12):1527-1545. Примеры модуляторов глюкокортикоидного рецептора включают дексаметазон, преднизон, преднизолон, RU-486 и соединения, описанные в WO 2000/66522 и WO 2004/005229. Лечение модуляторами глюкокортикоидного рецептора часто связано с побочными эффектами, такими как разрежение кости и остеопороз. Обнаружение модулятора глюкокортикоидного рецептора, который являлся бы эффективным,сильным и характеризовался бы ослабленными побочными эффектами, удовлетворило бы потребности медицины. Сущность изобретения В одном варианте осуществления настоящее изобретение относится к соединению формулы I или его соли. В предпочтительном варианте настоящее изобретение относится к соединению, которое представляет собой В другом предпочтительном варианте настоящее изобретение относится к соединению, представляющему собой кальциевую соль или натриевую соль. В ещ одном варианте настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы I или его соль и носитель. В другом варианте настоящее изобретение относится к способу модулирования активности глюкокортикоидного рецептора, включающему контактирование глюкокортикоидного рецептора с соединением формулы I или его солью. В ещ одном варианте настоящее изобретение относится к способу лечения состояния, опосредуемого активностью глюкокортикоидного рецептора у субъекта, включающему введение субъекту соединения формулы I или его соли. В частности, состояние, опосредуемое активностью глюкокортикоидного рецептора у субъекта,представляет собой состояние, связанное с воспалением. В ещ одном варианте настоящего изобретения указанное состояние представляет собой астму,дерматит, воспалительное заболевание кишечника, болезнь Альцгеймера, психотическую глубокую депрессию, невропатию, отторжение трансплантата, рассеянный склероз, хронический увеит или хроническое обструктивное заболевание легких.-1 016494 Подробное описание изобретения Настоящее подробное описание вариантов осуществления предназначено для ознакомления специалистов в данной области с изобретениями, принципами и областями практического применения, с тем чтобы другие специалисты в данной области могли приспосабливать и применять настоящие изобретения во многих их формах, наилучшим образом соответствующих требованиям практического применения. Поэтому настоящие изобретения не ограничены вариантами осуществления, описанными в настоящей спецификации, и могут быть модифицированы. А. Определения. Для следующих определенных терминов следует применять эти определения, если не дано другое определение в пунктах формулы изобретения или в ином месте в настоящей спецификации. Термин "носитель" описывает ингредиент, отличный от соединения. Носителями могут быть фармацевтически приемлемый материал или наполнитель. Примеры включают жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал. Выражение "контактирование с глюкокортикоидным рецептором" означает, что in vivo, ex vivo илиin vitro имеет место контакт с глюкокортикоидным рецептором, и включает введение соединения или соли согласно настоящему изобретению субъекту, имеющему глюкокортикоидный рецептор, а также,например, введение соединения или соли согласно настоящему изобретению в образец, содержащий клеточный, неочищенный или очищенный препарат, содержащий глюкокортикоидный рецептор. Например,контактирование включает такие взаимодействия между соединением и рецептором, как связывание. Выражение "состояние, связанное с воспалением", включает артрит, фибромиалгию, анкилозирующий спондилоартрит, псориаз, системную красную волчанку, подагру, недифференцированную спондилоартропатию, юношеский спондилоартрит, болезнь Крона, язвенный колит, синдром раздраженной толстой кишки, воспалительную болезнь кишечника и боль, связанную с вышеуказанными состояниями. Конкретные примеры артрита включают ревматоидный артрит, остеоартрит, реактивный артрит, инфекционный артрит, псориатический артрит, полиартрит, ювенильный (юношеский) артрит, ювенильный ревматоидный артрит, ювенильный реактивный артрит и ювенильный псориатический артрит. Термин "модуляция (модулирование)" или "модуляторы" включает термины "антагонист", "агонист", "частичные антагонисты" и "частичные агонисты". Термин "субъект" относится к любому животному, включая млекопитающих, таких как мыши,крысы, другие грызуны, кролики, собаки, кошки, свиньи, крупный рогатый скот, овцы, лошади, приматы или люди. Термин "лечебный" (и соответствующие термины "лечить" и "лечение") включает паллиативное,восстановительное и предупреждающее ("профилактическое") лечение субъекта. Термин "паллиативное лечение" относится к такому лечению, которое облегчает или ослабляет эффект или интенсивность патологического состояния у субъекта без излечения данного патологического состояния. Термин "предупреждающее лечение" (и соответствующий термин "профилактическое лечение") относится к такому лечению, которое предупреждает появление патологического состояния у субъекта. Термин "восстановительное лечение" ("излечивающее") относится к такому лечению, которое останавливает прогредиентное развитие патологического состояния, ослабляет его патологические проявления или полностью его устраняет у субъекта. Лечение может быть проведено с терапевтически эффективным количеством соединения, соли или композиции, которое вызывает биологический или медицинский ответ ткани, физиологической системы или субъекта и которое является предметом поиска для таких лиц, как ученый-исследователь, врач, ветеринар или клиницист. В. Соединения. Настоящее соединение включает, частично, трициклические соединения формулы I. Эти соединения можно применять в качестве модуляторов глюкокортикоидного рецептора. Настоящее изобретение включает соединение формулы I-2 016494 В предпочтительном варианте настоящее изобретение включает соединение, которое представляет собой В предпочтительном варианте настоящего изобретения соединение представляет собой кальциевую соль или натриевую соль. Соли соединений согласно настоящему изобретению включают их кислотно-аддитивные соли и соли оснований (включая двойные соли). В одном варианте осуществления настоящее изобретение включает гидрохлоридную соль соединения формулы I. В другом варианте осуществления настоящее изобретение включает кальциевую соль соединения формулы I. В другом варианте осуществления настоящее изобретение включает натриевую соль соединения формулы I. Подходящие кислотно-аддитивные соли образованы из кислот, которые образуют нетоксичные соли. Примеры включают ацетатные, аспартатные, бензоатные, безилатные, бикарбонатные/карбонатные,бисульфатные/сульфатные, боратные, камзилатные, цитратные, эдизилатные, эзилатные, формиатные,фумаратные, глуцептатные, глюконатные, глюкуронатные, гексафторфосфатные, гибензатные, гидрохлоридные/хлоридные, гидробромидные/бромидные, гидройодидные/йодидные, изетионатные, лактатные, малатные, малеатные, малонатные, мезилатные, метилсульфатные, нафтилатные, 2-напсилатные,никотинатные,нитратные,оротатные,оксалатные,пальмитатные,памоатные,фосфатные/гидрофосфатные/дигидрофосфатные, сахаратные, стеаратные, сукцинатные, тартратные, тозилатные и трифторацетатные соли. Подходящие соли оснований образованы из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Обзор подходящих солей см. в "Handbook of Pharmaceutical Salts: Properties, Selection and Use" byStahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Соль может быть легко получена смешиванием соответствующим образом растворов соединений согласно настоящему изобретению и желаемой кислоты или основания. Соль может осаждаться из раствора и может быть собрана фильтрованием или может быть получена выпариванием растворителя. Степень ионизации в соли может изменяться от полностью ионизованного до почти неионизованного состояния. Соединения согласно настоящему изобретению могут быть введены в качестве пролекарств. В частности, определенные производные, которые могут иметь лишь небольшую фармакологическую активность или могут не иметь ее совсем, при введении внутрь или поверхностном нанесении могут быть преобразованы в соединения согласно настоящему изобретению, обладающие желаемой активностью, например, посредством гидролитического расщепления. Такие производные называют "пролекарствами". Дальнейшую информацию о применении пролекарств можно найти в "Pro-drugs as Novel DeliverySystems", Vol. 14, ACS Symposium Series (T. Higuchi и W. Stella) и "Bioreversible Carriers in Drug Design",Pergamon Press, 1987 (ed. E.B. Roche, American Pharmaceutical Association). Пролекарства, например, могут быть произведены посредством замены соответствующих функциональных групп, присутствующих в соединениях согласно настоящему изобретению, определенными фрагментами, известными специалистам в данной области как "профрагменты", как описано, например, в"Design of Prodrugs", H. Bundgaard (Elsevier, 1985). Некоторые примеры таких пролекарств включают следующие варианты:(i) в случае соединения, содержащего спиртовую функциональную группу (-ОН), пролекарством является его простой эфир, например при замене водорода на (C1-C6)алканоилоксиметил; и(ii) в случае соединения, содержащего вторичную аминную функциональную группу, пролекарством является его амид, например при замене водорода на (C1-C10)алканоил. И, наконец, определенные соединения согласно настоящему изобретению сами могут действовать в качестве пролекарств других соединений согласно настоящему изобретению. Например, определенные соединения формулы I или II можно рассматривать в качестве пролекарств других соединений, охваченных формулой I или II.-3 016494 Все изомеры, такие как стереоизомеры, геометрические изомеры (цис/транс или Z/E) и таутомерные формы соединений или солей включены в объем настоящего изобретения, включая соединения или соли, имеющие более одного типа изомерии, и смеси одного или более из них. Например, следующий чертеж изображает соединение формулы I и таутомер Кроме того, включены кислотно-аддитивные соли или соли оснований, в которых противоион является оптически активным, например D-лактат или L-лизин, или рацемическим, например DL-тартрат илиDL-аргинин. Изомеры могут быть разделены традиционными способами, хорошо известными специалистам в данной области. Настоящее изобретение включает изотопно меченые соединения согласно настоящему изобретению, в которых один или более атомов заменены атомами, имеющими тот же атомный номер, но другие атомную массу или массовое число, отличные от атомной массы или массового числа, обычно встречающихся в природе. Изотопно меченые соединения согласно настоящему изобретению обычно можно получать традиционными способами, хорошо известными специалистам в данной области, или способами, аналогичными способам, описанным в примерах и препаративных схемах с использованием соответствующего изотопно меченого реагента вместо немеченого реагента, применявшегося прежде. Для лечения патологических состояний, указанных ниже, можно вводить соединения согласно настоящему изобретению. Можно также применять соли соединений согласно настоящему изобретению. С. Композиции. Соединения или соли согласно настоящему изобретению могли бы быть частью композиции. Композиции могут также включать одно или более соединений или солей согласно настоящему изобретению. Композиция может также включать энантиомерный избыток одного или более соединений согласно настоящему изобретению. В композицию могут быть включены другие фармакологически активные вещества и носители. Настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы I или его соль и носитель. Например, носителем может быть эксципиент. Выбор эксципиента будет в большой степени зависеть от конкретного способа введения, влияния эксципиента на растворимость и стабильность и природы дозированной формы. Композиция может быть твердым веществом, жидкостью или и тем и другим и может быть приготовлена с соединением в виде единичной дозированной композиции, например таблетки, которая может содержать от 0,05 до 95 мас.% активных соединений. Соединения или соли согласно настоящему изобретению могут быть связаны с подходящими полимерами в качестве направляемых носителей лекарственных средств.D. Способы. Настоящее изобретение включает способ модулирования активности глюкокортикоидного рецептора, включающий контактирование глюкокортикоидного рецептора с соединением формулы I или его солью. Настоящее изобретение также включает способ лечения состояния, опосредуемого активностью глюкокортикоидного рецептора у субъекта, включающий введение субъекту соединения формулы I. Состояние, опосредуемое активностью глюкокортикоидного рецептора, включает:a) эндокринные расстройства, такие как первичная или вторичная недостаточность коры надпочечников, врожденная гиперплазия надпочечников, негнойный тиреоидит и гиперкальциемия, связанная с раком;b) ревматические расстройства, такие как псориатический артрит, ревматоидный артрит, включая ювенильный ревматоидный артрит, анкилозирующий спондилоартрит, острый и подострый бурсит, острый неспецифический тендосиновит, острый подагрический артрит, посттравматический остеоартрит,синовит при остеоартрите и эпикондилит;c) коллагенозы, такие как системная красная волчанка и острый ревмокардит;d) дерматологические заболевания, такие как пемфигус, буллезный герпетиформный дерматит, тяжелая экссудативная полиформная эритема (синдром Стивенса-Джонсона), эксфолиативный дерматит,грибовидный микоз, псориаз и себорейная экзема;e) аллергические состояния, такие как сезонные или постоянные (круглогодичные) аллергии, аллергический ринит, бронхиальная астма, контактный дерматит, атопический дерматит, сывороточная болезнь и реакции повышенной чувствительности к лекарственным средствам;f) глазные болезни и патологические состояния, такие как аллергические маргинальные язвы роговицы, глазной опоясывающий герпес, воспаление переднего сегмента, диффузный задний увеит и хориоидит, хронический увеит, симпатическая офтальмия, аллергический конъюнктивит, кератит, хориоретинит, ретробульбарный неврит, ирит и иридоциклит;g) респираторные заболевания, такие как симптоматический саркоидоз, синдром Леффлера, бериллиоз, скоротечный или острый (диссеминированный) туберкулез легких и аспирационный пневмонит;h) гематологические заболевания, такие как идиопатическая тромбоцитопеническая пурпура, вторичная тромбоцитопения, приобретенная (аутоиммунная) гемолитическая анемия, эритробластопенияi) неопластические заболевания, такие как лейкоз и лимфома;j) отечные состояния, такие как индуцирующий диурез или выделение белка с мочой при нефротическом синдроме идиопатического типа без уремии или вследствие красной волчанки;k) желудочно-кишечные заболевания, такие как язвенный колит, регионарный энтерит, воспалительная болезнь кишечника, болезнь Крона, гастрит, синдром раздраженной толстой кишки;l) прочие патологические состояния, такие как туберкулезный менингит и трихинеллез; иm) неврологические заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз, повреждение спинного мозга, психотическая глубокая депрессия и периферическая невропатия. Состояния, опосредуемые активностью глюкокортикоидного рецептора, также включают отторжение трансплантата (например, почки, печени, сердца, легкого, поджелудочной железы (например, островковых клеток), костного мозга, роговицы, тонкой кишки), кожных аллотрансплантатов, кожных гомотрансплантатов (таких как применяемые при лечении ожогов), ксенотрансплантатов сердечных клапанов, сывороточную болезнь и гомологичную болезнь (реакция "трансплантат против хозяина"), аутоиммунные заболевания, такие как ревматоидный артрит, псориатический артрит, рассеянный склероз, диабет типа I и типа II, ювенильный диабет, ожирение, астма, воспалительная болезнь кишечника (такая как болезнь Крона и язвенный колит), гангренозная пиодермия, волчанка (системная красная волчанка),бульбоспинальный паралич (злокачественная миастения), псориаз, дерматит, дерматомиозит; экзему, себорею, воспаление легких, глазной увеит, гепатит, болезнь Грейвса, тиреоидит Хашимото, аутоиммунный тиреоидит, синдром Бехчета или Шегрена (сухость глаз или рта), злокачественную или иммуногемолитическую анемию, атеросклероз, болезнь Аддисона (аутоиммунное заболевание надпочечников), идиопатическую недостаточность надпочечников, аутоиммунное полигландулярное заболевание (также известное как аутоиммунный полигландулярный синдром), гломерулонефрит, склеродермию, кольцевидную склеродермию, красный плоский лишай, витилиго (депигментацию кожи), очаговую алопецию, аутоиммунную алопецию, аутоиммунный гипопитуитаризм, миелополирадикулоневрит (синдром Guillain-Barre) и альвеолит; состояния гиперчувствительности, опосредуемые Т-клетками, включая контактную гиперчувствительность, гиперчувствительность замедленного типа, контактный дерматит (включая контактный дерматит, обусловленный сумахом укореняющимся), крапивницу, кожные аллергии, респираторные аллергии (сенная лихорадка, аллергический ринит) и глютензависимую энтеропатию (целиакию); воспалительные заболевания, такие как остеоартрит, острый панкреатит, хронический панкреатит, острый респираторный дистресс-синдром, синдром Сезари; и сосудистые заболевания, имеющие воспалительный или пролиферативный компонент, такие как рестеноз, стеноз и артериосклероз. Состояния, опосредуемые активностью глюкокортикоидного рецептора также включают:a) астму любого типа, этиологии или патогенеза, в частности астму, которая является членом, выбранным из группы, состоящей из атопической астмы, неатопической астмы, аллергической астмы, атопической бронхиальной IgE-опосредуемой астмы, бронхиальной астмы, эссенциальной астмы, истинной астмы, эндогенной астмы, вызванной патофизиологическими нарушениями, экзогенной астмы, вызванной факторами окружающей среды, эссенциальной астмы неизвестного или неявного генеза, эмфизематозной астмы, астмы, вызванной физическим усилием, астмы, индуцированной аллергеном, астмы, индуцированной холодным воздухом, профессиональной астмы, инфекционной астмы, вызванной бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергической астмы, ранней астмы, синдрома стридора у детей и бронхиолита;b) хроническую или острую бронхоконстрикцию, хронический бронхит, обструкцию нижних дыхательных путей и эмфизему;c) обструктивные или воспалительные заболевания дыхательных путей любого типа, этиологии или патогенеза, в частности обструктивное или воспалительное заболевание дыхательных путей, которое является членом, выбранным из группы, состоящей из хронической эозинофильной пневмонии, хронического обструктивного заболевания легких (ХОЗЛ), ХОЗЛ, которое включает хронический бронхит, эмфизему легких или одышку, связанную или несвязанную с ХОЗЛ, ХОЗЛ, которое характеризуется необратимой прогрессирующей обструкцией дыхательных путей, синдрома расстройства дыхания у взрослых(СРДВ), обострения повышенной реактивности дыхательных путей после применения других лекарст-5 016494 венных средств и заболевания дыхательных путей, связанного с легочной гипертензией;d) бронхит любого типа, этиологии или патогенеза, в частности бронхит, являющийся членом, выбранным из группы, состоящей из острого бронхита, острого ларинготрахеального бронхита, арахидного бронхита, катарального бронхита, крупозного бронхита, сухого бронхита, инфекционного астматического бронхита, первичного пластического бронхита, стафилококкового или стрептококкового бронхита и везикулярного бронхита, острого повреждения легкого;e) бронхоэктаза любого типа, этиологии или патогенеза, в частности бронхоэктаза, который является членом, выбранным из группы, состоящей из цилиндрического бронхоэктаза, мешотчатого бронхоэктаза, веретенообразного бронхоэктаза, капиллярного бронхоэктаза, кистозного бронхоэктаза, сухого бронхоэктаза и фолликулярного бронхоэктаза. Соединения или соли согласно настоящему изобретению применяют при лечении обструктивных или воспалительных заболеваний дыхательных путей любого типа, этиологии или патогенеза, в частности обструктивного или воспалительного заболевания, являющегося членом, выбранным из группы, состоящей из хронической эозинофильной пневмонии, хронического обструктивного заболевания легких(ХОЗЛ), ХОЗЛ, которое включает хронический бронхит, эмфизему легких или одышку, связанную или не связанную с ХОЗЛ, ХОЗЛ, которое характеризуется необратимой прогрессирующей обструкцией дыхательных путей, синдрома расстройства дыхания у взрослых (СРДВ), обострения повышенной реактивности дыхательных путей после применения других лекарственных средств и заболевания дыхательных путей, связанного с легочной гипертензией, или астмы любого типа, этиологии или патогенеза, в частности астмы, которая является членом, выбранным из группы, состоящей из атопической астмы, неатопической астмы, аллергической астмы, атопической бронхиальной IgE-опосредуемой астмы, бронхиальной астмы, эссенциальной астмы, истинной астмы, эндогенной астмы, вызванной патофизиологическими нарушениями, экзогенной астмы, вызванной факторами окружающей среды, эссенциальной астмы неизвестного или неявного генеза, неатопической астмы, эмфизематозной астмы, астмы, вызванной физическим усилием, астмы, индуцированной аллергеном, астмы, индуцированной холодным воздухом, профессиональной астмы, инфекционной астмы, вызванной бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергической астмы, ранней астмы, синдрома стридора у детей и бронхиолита. Настоящее изобретение включает способ лечения состояния, связанного с воспалением, у субъекта,включающий введение субъекту соединения или соли согласно настоящему изобретению. Настоящее изобретение включает способ лечения состояний, таких как астма, дерматит, воспалительное заболевание кишечника, болезнь Альцгеймера, глубокая психотическая депрессия, невропатия,отторжение трансплантата, рассеянный склероз, хронический увеит или хроническое обструктивное заболевание легких у субъекта, включающий введение субъекту соединения или соли согласно настоящему изобретению. Настоящее изобретение включает способ лечения ревматоидного артрита у субъекта, включающий введение субъекту соединения или соли согласно настоящему изобретению. Ревматоидный артрит считают хроническим аутоиммунным и воспалительным заболеванием, вызывающим воспаление суставов, с их отечностью, болезненностью и разрушением суставного хряща,кости и связок. Результатом ревматоидного артрита является деформация, неустойчивость и тугоподвижность сустава и рубцевание в суставе. Степень повреждения суставов может быть весьма различной. На характер заболевания могут влиять многие факторы, включая генетическую предрасположенность. Люди с ревматоидным артритом могут иметь мягкое течение заболевания, случайные приступы с длительными периодами ремиссии без заболевания или постоянное прогредиентное течение заболевания,которое может быть медленным или быстрым. Ревматоидный артрит может начаться внезапно, с одновременным воспалением многих суставов. Более часто он начинается не резко, постепенно поражая разные суставы. Обычно воспаление является симметричным, с поражением суставов с обеих сторон тела. Как правило, первыми начинают воспаляться малые суставы в пальцах рук и ног, кистях рук, стопах,запястьях, локтях и лодыжках, за которыми следуют коленные и тазобедренные суставы. Боль, обусловленная ревматоидным артритом, обычно является соматической ноцицептивной суставной болью. Отечные запястья могут ущемлять нерв, результатом чего является онемение или ощущение покалывания, обусловленное кистевым туннельным синдромом. За пораженными коленными суставами могут формироваться кисты, разрыв которых может вызывать боль и отекание голеней. Настоящее изобретение включает способ лечения дерматита у субъекта, включающий введение субъекту соединения или соли согласно настоящему изобретению. Настоящее изобретение включает способ лечения хронического обструктивного заболевания легких у субъекта, включающий введение субъекту соединения или соли согласно настоящему изобретению. Настоящее изобретение включает способ лечения астмы у субъекта, включающий введение субъекту соединения или соли согласно настоящему изобретению. Настоящее изобретение включает способ лечения болезни Альцгеймера у субъекта, включающий введение субъекту соединения или соли согласно настоящему изобретению.E. Дозирование и введение. Для выбора наиболее подходящей лекарственной формы и пути введения при лечении по предполагаемому показанию соединения или соли согласно настоящему изобретению можно оценивать по их биофармацевтическим свойствам, таким как растворимость, стабильность растворов (при различных рН) и проницающая способность. Дозы соединений или солей согласно настоящему изобретению находятся в диапазоне от 0,1 до 100 мг для перорального введения, и дозы находятся в диапазоне от 2 мг или менее для ингаляционного введения. Доза может быть введена в виде единичной дозы или раздельными дозами и может выходить за пределы типичного диапазона, указанного в настоящем документе. Дозы основаны в расчете на среднего человека, имеющего массу от 60 до 70 кг. Дозы и режим дозирования зависят от конкретного субъекта и разнообразных условий, которые могут влиять на дозирование (возраст, пол, масса тела и т.д.). Врач сможет легко определить дозы и для субъектов, массы тела которых выходят за пределы этого диапазона, таких как дети и пожилые люди. Пероральное введение. Соединения согласно настоящему изобретению и их соли можно вводить перорально. Пероральное введение может состоять в проглатывании, при котором соединение или соль входят в желудочнокишечный тракт, и/или в буккальном, лингвальном или сублингвальном введении, при котором соединение или соль входят в кровоток непосредственно из полости рта. Лекарственные формы, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или жесткие капсулы, содержащие мульти- или наноразмерные измельченные материалы, жидкости или порошки; лепешки (включая формы с жидким наполнителем); жевательные резинки; гели (желе); быстродиспергирующиеся дозированные формы; пленки; овальные свечи или таблетки; аэрозоли и буккальные/мукоадгезивные наклейки. Кроме того, соединение или соли согласно настоящему изобретению могут быть введены в виде аэрозольно высушенной дисперсии. Жидкие лекарственные формы включают суспензии, растворы, сиропы и эликсиры. Такие лекарственные формы можно применять в качестве наполнителей мягких или твердых капсул (изготовленных,например, из желатина или гидроксипропилметилцеллюлозы); обычно они содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло и один или более эмульгаторов и/или суспендирующих агентов. Жидкие лекарственные формы могут также быть получены восстановлением твердого вещества, например из саше. Соединения согласно настоящему изобретению и их соли можно также применять в быстрорастворимых, быстродиспергируемых дозированных формах, таких как описанные в Expert Opinion inTherapeutic Patents, 11 (6), 981-986, Liang и Chen (2001). Для таблетированных лекарственных форм, в зависимости от дозы, лекарственное средство может составлять от 1 до 80 мас.% дозированной формы, более типично от 5 до 60 мас.% дозированной формы. Кроме лекарственного средства, таблетки обычно содержат дезинтегрант. Примеры дезинтегрантов включают натриевую соль гликолата крахмала, натрий-карбоксиметилцеллюлозу, кальцийкарбоксиметилцеллюлозу, натрий-кроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшим алкилом, крахмал, пептизированный крахмал и альгинат натрия. Обычно дезинтегрант составляет от 1 до 25 мас.%,предпочтительно от 5 до 20 мас.% дозированной формы. Связующие обычно применяют для придания когезивных свойств таблетированной лекарственной форме. Подходящие связующие включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, естественные и синтетические камеди, поливинилпирролидон, пептизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, аэрозольно высушенный моногидрат, безводная форма и т.п.), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция. Таблетки могут также необязательно содержать поверхностно-активные средства, такие как лаурилсульфат натрия и полисорбат 80, и глиданты, такие как диоксид кремния и тальк. В тех случаях, когда они присутствуют, поверхностно-активные средства могут составлять от 0,2 до 5 мас.% таблетки и глиданты могут составлять от 0,2 до 1 мас.% таблетки. Кроме того, таблетки обычно содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие вещества обычно составляют от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.% таблетки. Другие возможные ингредиенты включают антиоксиданты, красители, отдушки, консерванты и вещества, исправляющие вкус. Типичные таблетки содержат примерно до 80% лекарственного средства, примерно 10-90 мас.% связующего, примерно 0-85 мас.% разбавителя, примерно 2-10 мас.% дезинтегранта и примерно 0,25-10 мас.% смазывающего вещества.-7 016494 Твердые лекарственные формы могут быть изготовлены для немедленного и/или модифицированного высвобождения. Лекарственные средства с модифицированным высвобождением включают задержанное, постоянное, пульсовое, контролируемое, направленное и программированное высвобождение. Лекарственные формы с модифицированным высвобождением, подходящие для целей настоящего изобретения, описаны в патенте США 6106864. Подробности других применимых технологий высвобождения, таких как высокоэнергетические дисперсии и осмотические частицы и частицы с покрытием,можно найти в Pharmaceutical Technology On-line, 25(2), 1-14, Verma et al. (2001). Диапазоны доз для перорального введения также составляют 0,1-80 мг, 15-80 мг, 0,1-25 мг. Парентеральное введение. Соединения или соли согласно настоящему изобретению можно также вводить прямо в кровоток, в мышцу или во внутренний орган. Пример 2 можно было бы вводить в кровоток. Подходящие средства для парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, внутрижелудочковое, интрауретральное, внутригрудинное, внутричерепное, внутримышечное, внутрисуставное и подкожное введение. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) инъекторы, безыгольные инъекторы и инфузионные средства. Парентеральные лекарственные формы обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные вещества (предпочтительно для рН от 3 до 9), но для некоторых областей применения они могут быть изготовлены более подходящим образом в виде стерильных неводных растворов или в виде сухой формы для применения в сочетании с подходящим наполнителем, таким как стерильная апирогенная вода. Получение парентеральных лекарственных форм в стерильных условиях, например посредством лиофилизации, может быть легко осуществлено с применением стандартных фармацевтических процедур, хорошо известных специалистам в данной области. Растворимость соединений согласно настоящему изобретению и их солей, применяемых при получении парентеральных растворов, может быть повышена посредством применения соответствующих препаративных приемов, таких как включение средств, повышающих растворимость. Лекарственные формы для парентерального введения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Лекарственные формы с модифицированным высвобождением включают отсроченное, замедленное, в импульсном решении, контролируемое, направленное и программированное высвобождение. Так, соединения согласно настоящему изобретению могут быть получены в виде суспензии или твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в виде имплантированного депо, предоставляющего модифицированное высвобождение активного соединения. Примеры таких лекарственных форм включают стенты и полутвердые материалы, покрытые лекарственными средствами, и суспензии, содержащие микросферы сополимера DL-молочной и гликолевой кислоты (PGLA), нагруженные лекарственными средствами. Местное введение. Соединения или соли согласно настоящему изобретению можно также применять местно, (внутри)кожно или чрескожно на коже или слизистой. Пример 1 можно было бы наносить на кожу. Типичные лекарственные формы для этой цели включают гели (желеобразные формы), гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пенообразные формы, пленки, кожные пластыри, облатки, импланты, губчатые тампоны, волокнистые материалы, бинты и микроэмульсии. Можно также применять липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий петролатум (вазелиновое масло), медицинский вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены вещества, повышающие проницающую способность, см., например, J. Pharm. Sci., 88(10), 955958, Finnin и Morgan (October 1999). Другие средства местного применения включают доставку посредством электропорации, ионтофорез, фонофорез, сонофорез и микроигольную и безыгольную (например, Powderject, Bioject и т.д.) инъекцию. Лекарственные формы для местного применения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Лекарственные формы с модифицированным высвобождением включают задержанное, постоянное, пульсовое, контролируемое, направленное и программированное высвобождение. Ингаляционное/интраназальное введение. Соединения или соли согласно настоящему изобретению можно также вводить интраназально или ингаляционно, обычно в форме сухого порошка (либо отдельно, в виде смеси, например в виде сухой смеси с лактозой, либо в виде частицы смешанных компонентов, например смешанных с фосфолипидами, такими как фосфатидилхолин) из сухого порошкового ингалятора, в виде аэрозольного спрея из контейнера с повышенным давлением, насоса, спрея, пульверизатора (предпочтительно пульверизатора, использующего электрогидродинамику для получения тонкого тумана) или распылителя с применением или без применения подходящего газа-вытеснителя (пропелланта), такого как 1,1,1,2-тетрафторэтан или-8 016494 1,1,1,2,3,3,3-гептафторпропан, или в виде назальных капель. Порошок для интраназального применения может содержать биоадгезивное средство, например хитозан или циклодекстрин. Контейнер с повышенным давлением, насос, спрей (аэрозольный баллон) или распылитель содержат раствор или суспензию соединения(ий) согласно настоящему изобретению, содержащие, например,этанол, водный этанол или подходящее альтернативное вещество для диспергирования, солюбилизации или продленного высвобождения активного вещества, пропеллент(ы) в качестве растворителя и необязательное поверхностно-активное вещество, такое как триолеат сорбитана, олеиновая кислота или олигомолочная кислота. До применения лекарственной формы в виде сухого порошка или суспензии лекарственный продукт тонко измельчают до размера, подходящего для доставки посредством ингаляции (обычно менее 5 мкм). Это может быть достигнуто любым соответствующим способом измельчения, таким как помол со спиральным выбросом, технология сверхкритических жидкостей с образованием наночастиц, гомогенизация при высоком давлении или пульверизационная сушка. Капсулы (изготовленные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для применения в ингаляторе или вдувателе могут содержать порошкообразную смесь соединения согласно настоящему изобретению, подходящую основу порошка, такую как лактоза или крахмал, и вещество, повышающее эффективность, такое как L-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, предпочтительна последняя форма. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящая лекарственная форма в виде раствора для применения в пульверизаторе с использованием электрогидродинамики может включать соединение согласно настоящему изобретению, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые можно применять вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Лекарственные формы для ингаляционного/интраназального введения могут быть изготовлены для немедленного и/или модифицированного высвобождения с применением, например, PGLA. Лекарственные формы с модифицированным высвобождением включают задержанное, постоянное, пульсовое, контролируемое, направленное и программированное высвобождение. В случае ингаляторов сухих порошков и аэрозолей дозированную единицу определяют посредством клапана, который предоставляет отмеренное количество. Единицы согласно настоящему изобретению обычно организованы для введения отмеренной дозы или "впрыска", которые можно вводить в виде одной дозы или более обычно - в виде разделенных доз в течение дня. Диапазоны доз для ингаляционного введения находятся в пределах от 2 до 1 мг или менее. Комбинация. Соединения или соли согласно настоящему изобретению можно вводить в комбинации с одним или более других терапевтических средств, таких как лекарственное средство. Соединение согласно настоящему изобретению или его соль можно вводить одновременно или в разное время с одним или более других терапевтических средств. Например, выражение "в комбинации" включает одновременное введение субъекту комбинации соединения или соли согласно настоящему изобретению и терапевтического средства, когда такие компоненты приготовлены совместно в единой дозированной форме, которая высвобождает указанному субъекту указанные компоненты существенно в одно и то же время; существенно одновременное введение субъекту, нуждающемуся в лечении, комбинации соединения или соли согласно настоящему изобретению и терапевтического средства, когда такие компоненты приготовлены отдельно один от другого в раздельных дозированных формах, которые указанный субъект принимает существенно в одно и то же время, после чего указанные компоненты высвобождаются указанному субъекту существенно в одно и то же время; последовательное введение субъекту комбинации соединения или соли согласно настоящему изобретению и терапевтического средства, когда такие компоненты изготовлены раздельно один от другого в раздельных дозированных формах, которые указанный субъект принимает в последовательные моменты времени со значительным временным интервалом между каждым введением, после чего указанные компоненты высвобождаются указанному субъекту существенно в разные моменты времени; и последовательное введение субъекту такой комбинации соединения или соли согласно настоящему изобретению и терапевтического средства, когда такие компоненты изготовлены совместно в единой дозированной форме, которая высвобождает указанные компоненты контролируемым образом, после чего они вводятся указанному субъекту одновременно, последовательно и/или в перекрывающихся временных интервалах в одно и то же время или в различные моменты времени, где каждая часть может быть введена тем же или иным путем. Например, соединения или соли согласно настоящему изобретению можно применять в комбинации, частично или полностью, в дополнение к другим противовоспалительным средствам. Подходящие противовоспалительные средства включают циклоспорин, золедроновую кислоту, эфализумаб, алефацепт, этодолак, лорноксикам, ОМ-89, валдекоксиб, тоцилизумаб, абатацепт, мелоксикам, этанерцепт,набуметон, римексолон, 153Sm-EDTMP, просорбу, салицилат имидазола, опрелвекин, гиалуроновую кислоту, напроксен, пироксикам, диацереин, лумиракоксиб, такролимус, ацеклофенак, актарит, тенокси-9 016494 кам, росиглитазон, дефлазакорт, адалимумаб, лефлуномид, ризедронат натрия, мисопростол и диклофенак, SK-1306X, инфликсимаб, анакинру, целекоксиб, диклофенак, эторикоксиб и фелбинак, реуматон,голимумаб, деносумаб, офатумумаб, антитело 10rT1, пелубипрофен, ликофелон, темсиролимус, экулизумаб, игуратимод и преднизон. Другие подходящие противоспалительные средства включают СР-481715, ABN-912, MLN-3897, HuMax-IL-15, RA-1, паклитаксел, Org-37663, Org 39141, AED-9056,AMG-108, фонтолизумаб, пегсунерцепт, пралнакасан, апилимод, GW-274150, АТ-001, 681323 (GSK)K-832, R-1503, окрелизумаб, DE-096, Cpn10, THC+CBD (GW Pharma), 856553 (GSK), ReN-1869,иммуноглобулин, mm-093, амелубант, SCIO-469, ABT-874, LenkoVAX, LY-2127399, TRU-015, KC-706,дипиридамол, амоксапин и дипиридамол, TAK-715, PG 760564, VX-702, преднизолон и дипиридамол,РМХ-53, белимумаб, принаберел, CF-101, tgAAV-TNF-R:Fc, R-788, преднизолон и SSRI, дексаметазон,СР-690550 и PMI-001. Специалисту с обычной квалификацией в данной области будет также понятно, что, когда соединения согласно настоящему изобретению или их соли применяют при лечении конкретного заболевания,эти соединения согласно настоящему изобретению можно сочетать с различными существующими терапевтическими агентами, применяемыми при данном заболевании. Например, соединения или соли согласно настоящему изобретению можно сочетать со средствами,которые модулируют одну или более из следующих мишеней: циклооксигеназа 2 (синтаза эндопероксида простагландина, тип 2); TNF-R (рецептор фактора некроза опухолей, тип 1); циклооксигеназа (Cox 1 и 2; неспецифическая); Мар-киназа р 38 (неспецифическая); рецептор II1 (тип I и II, неспецифический); арахидонат-5-липоксигеназа; глюкокортикоидный рецептор (GR); NFB; фактор некроза опухолейADAM-17 (фермент, превращающий TNF-альфа); ICE (бета-конвертаза каспазы-1/интерлейкина-1); ферменты синтеза простагландинов (неспецифические); рецептор субстанции-Р (рецептор SPR/NK-1); рецептор простаноида (неспецифический); белок адгезии васкулярных клеток, тип 1 (VCAM 1); ММР-13(C5AR); ингибиторный фактор миграции макрофагов (MIF); фосфорилаза пуриновых нуклеозидов (PNP); бета-1-интерферон; ММР-3 (стромелизин 1); CCR2-рецептор хемокина; ММР-2 (желатиназа А); рецептор фактора некроза опухолей, тип 5 (CD40); антиген CD44 (функция хоминга и система индийской группы крови); CCR5-рецептор хемокина; простагландин-Е-синтаза; гамма-рецептор, активированный пероксисомальным пролифератором (PPAR-гамма); CXCR4-рецептор хемокина; катепсин S; тирозинкиназа протоонкогена LCK; CXCR3-рецептор хемокина; рецептор PDGF; FKBP (12 FK-506);(IKK БЕТА); рецептор активирующего фактора тромбоцитов (PAF-R); фарнезилпирофосфатсинтетаза(FPP-синтетаза); CXCR1-рецептор хемокина; рецептор макрофагального колониестимулирующего фактора, тип I (CSF-1R); рецептор IL-18, тип 1; рецептор аденозина, тип A3; гранулоцитарныймакрофагальный колониестимулирующий фактор (GMCSF); SYK-тирозинкиназа; рецептор CRF (неспецифический); гетеродимер альфа/бета-тубулина; тирозинкиназа (неспецифическая); бета-амилоид; макрофагальный колониестимулирующий фактор (MCSF); член 11 суперсемейства лигандов фактора некроза опухолей (рецепторный активатор b-лиганда ядерного фактора каппа); фосфолипаза (неспецифическая); рецептор эстрогенов (альфа/бета; неспецифический); ММР-9 (желатиназа В); синтаза оксида азота(неспецифическая); индуцируемая синтаза оксида азота (неспецифическая); клеточный опухолевый антиген р 53; инсулиноподобный ростовой фактор 1 (соматомедин С); комплекс никотинового и ацетилхолинового рецепторов; опиоидный рецептор типа Mu (MOR-1); IL-11; тирозинкиназа рецептораCCR3-рецептор хемокина; канал K+ (калиевый) (неспецифический); митоген-активируемая протеинкиназа, тип 14 (MAPK14/Р 38-альфа); кальциевые каналы типа L (неспецифические); CCR6-рецептор хемокина; PDE3 (фосфодиэстераза 3; неспецифическая); цистеинпротеаза (неспецифическая); натрийзависимый переносчик адреналина (NAT); МАР 2-киназа (MEKs; неспецифическая); RAF-киназа (неспецифическая); фактор 1-альфа, индуцируемый гипоксией; рецептор NMDA; эстрогеновый бета-рецептор(ER-бета); человеческая ДНК; рецептор холецистокинина типа В (CCKB); В 1-рецептор брадикинина(неспецифическая); сосудистый эндотелиальный фактор роста (VEGF); тромбин; андрогеновый рецептор; Map-киназа (неспецифическая); глобулин, связывающий половые гормоны; хемокин CCL2(H+K+-АТРаза); каспаза (неспецифическая); рецептор FGF (неспецифический); альфа-рецептор, активируемый пероксисомальным пролифератором (PPAR-альфа); рецептор MIP1a (неспецифический); кальций-связывающий белок S100 (неспецифический); рецептор PGE (неспецифический); пептидиларгининдезиминаза, тип IV; комплекс PDGF (а/b); бета-лактамаза и PBPs (биосинтез клеточной стенки); опиоидный рецептор (неспецифический); ангиотензин-превращающий фермент 1 (АСЕ 1); активатор плазминогена урокиназного типа (UPA); фосфодиэстераза (неспецифическая PDE); прогестероновый рецептор (PR); рецептор 5-HT (серотонина) (неспецифический); член 5 суперсемейства (лигандов) фактора некроза опухолей (CD40-лиганд); тимидилатсинтаза; взаимодействие альфа-4-интегрина с паксиллином; альфа-4-интегрин (VLA-4/CD49D); ERK1; глюкозофосфатизомераза (аутокринный фактор мотильности); дофаминовый рецептор (неспецифический); хемокин CXCL12 (SDF-1); микросомальный белок транспорта триглицеридов; альфа-5/бета-1-интегрин; передатчик сигнала и активатор транскрипции типа 3 (фактор реакции острой фазы); ингибитор активатора плазминогена, тип 1 (PAI-1); рецептор витамина D3 (рецептор VDR/1,25-дигидроксивитамина D3); комплекс ароматазы (P450arom и NADPHцитохром-Р 450-редуктаза); протеин-тирозинфосфатаза (неспецифическая); 3-гидрокси-3-метилглутарилкофермент-А-редуктаза (HMG-CoA); бета-1-интегрин (бета-субъединица рецептора фибронектина); бета 1/альфа-11-интегрин; п-селектин (GMP140/гранулярный мембранный белок-140); белок, активирующий липоксигеназу-5 (FLAP); H+/K+-АТРаза (неспецифическая); канал Na+ (натриевый) (неспецифический); тиреоидная пероксидаза; потенциал-зависимый натриевый канал-альфа-1 мозга; бета-2-адренергический рецептор; BCL1 (циклин D1); рецептор тиреоидных гормонов (неспецифический); рецептор васкулярного эндотелиального фактора роста, тип 2 (VEGFR-2/FLK1); альфа-V/бета-6-интегрин; альфа-V-интегрин(альфа-субъединица рецептора витронектина/CD51); SRC-киназа; плейотрофин (гепаринсвязывающий фактор роста 8, фактор, стимулирующий рост невритов, тип 1); остеопонтин (секретируемый фосфопротеин 1); толл-подобный рецептор 4 (TLR4); ваниллоидный рецептор (неспецифический); PI3-киназа (неспецифическая); поли(ADP-рибоза)полимераза (PARP); рецептор PPAR (неспецифический); бетаадренергический рецептор (неспецифический); член 1 V-подсемейства катионного канала переходного рецепторного потенциала (TRPV1); топоизомераза I; гистаминовый рецептор H1; кининоген; IKK-киназа(неспецифическая); HIV ТАТ белок; толл-подобный рецептор 2; член 4 семейства 22 переносчиков растворенного вещества (транспортер органических катионов) (SLC22A4); RXR-рецептор (неспецифический); ренин (ангиотензиногеназа); рецептор гонадолиборина (GNRH-R); пенициллинсвязывающий белок(неспецифическая); транстиретин (TTR); CX3CR1-рецептор; фактор свертывания крови III (тромбопластин, тканевый фактор); натрийзависимый переносчик серотонина (5-HTT); колониестимулирующий фактор 1 (макрофагальный); тканевая трансглутаминаза (трансглутаминаза 2/TGM2); рецептор, специфичный к конечному продукту углубленного (интенсивного, ускоренного, распространенного) гликозилирования; моноаминоксидаза (А и В; неспецифические); гистаминовый рецептор (неспецифический); натрий-зависимый переносчик дофамина (DAT); тромбопоэтин (лиганд онкогена вируса миелопролиферативного лейкоза, мегакариоцитарный фактор роста и развития); сигнальная молекула активации лимфоцитов; нейтральная эндопептидаза (NEP/неприлизин); рецептор эндотелина-1 (ЕТА); тирозиназа; митоген-активируемая протеинкиназа 8 (MAPK8/JNK1); IAP (ингибитор апоптоза) неспецифический; фосфоинозитид-3-киназа; рецептор простагландина F2-альфа (простаноидный рецептор FP); человеческий гормон роста; вазопрессиновый рецептор (неспецифический); рецептор фактора роста тучных/стволовых клеток (C-KIT); CDK (неспецифическая); D4/5-HT1a (дофаминовый рецептор D4, серотониновый рецептор 1 а); рецептор ангиопоэтина 1 (TIE-2) (TEK); эстрогеновый альфа-рецептор (ERальфа); рецептор эпидермального фактора роста; киназа фокальной адгезии (неспецифическая); периферический рецептор бензодиазепинов (HPBS); окситоциназа; цитозольная фосфолипаза А 2; эндопептидаза(неспецифическая); FGFR1 FGF-рецептор 1; рецептор нейрокинина NK1/NK2; комплекс пропил-4 гидроксилазы; альфа-5-интегрин (альфа-субъединица рецептора фибронектина/VLA-5/CD49E); мускариновый ацетилхолиновый рецептор (неспецифический); тирозинпротеинкиназа JAK3 (JANUS-киназа 3);(ген, мутированный при атаксии-телеангиоэктазии/АТМ.); рецептор эритропоэтина; фактор роста соединительной ткани; RAC-альфа серин/треонин-киназа (протеинкиназа В); толл-подобный рецептор 9; нейрональная синтаза оксида азота (NOS1); опиоидный рецептор типа каппа (KOR-1); сердечный комплекс канала Na+; протеин-тирозинкиназа рецептора ERBB-2 (HER2-рецептор поверхности клетки, тирозинкиназный тип); рецептор тромбина (PAR-1); PDE4B (сАМР-специфическая фосфодиэстераза 4B/HSPDE4B); бета-полипептид тромбоцитарного фактора роста; FKBP-рапамицин-ассоциированный белок (FRAP, mTOR); тромбомодулин; HIV-протеаза (ретропепсин); PDE4D (сАМР-специфическая фосфодиэстераза 4D/HSPDE4D); аденозинкиназа; гистондеацетилаза (неспецифическая); рецептор простагландина Е 2, подтип ЕР 4 (простаноидный рецептор ЕР 4); киназа-3 митоген-активируемой протеинкиназы (MAP2K3); ММР-12 (металлоэластаза); ОХ 40-рецептор; неспецифическая человеческая убиквитинлигаза; рецептор сульфонилмочевины (SUR1 (панкреатический) и SUR2 (сердечной и гладкой- 11016494 мышцы; фактор свертывания крови X (фактор Стюарта); протеинкиназа 2, активируемая МАР-киназой(MAPKAPK-2); константная область тяжелой цепи IgE; рецепторы дофамина D2 + 5-HT2A; 5-гидрокситриптаминовый рецептор 4 (5-HT4); рецептор ангиотензина II, тип 1 (AT1); цитохром Р 450 3 А 4; Т-клеточный циклофилин (циклофилин А); рецептор нейромедина K (рецептор NKR/NK-3); рецептор лейкотриена В 4; тирозинкиназа Братона (BTK); киназа-6 митоген-активируемой протеинкиназы(MAP2K6); эндоглин; M1/D2/5-HT2; натрийзависимый переносчик норадреналина + дофаминовый рецептор D4; киназа-4 митоген-активируемой протеинкиназы (MAP2K4); белок теплового шока Hsp90 А/В; гистидиндекарбоксилаза; член 5 семейства 22 носителей растворенных веществ (переносчик органических катионов) (SLC22A5); CSK-тирозинкиназа; пропилэндопептидаза; рецептор цистеинил-лейкотриена(CYSLT1); ядерный рецептор NURR1 (белок немедленной/ранней реакции NOT); толл-подобный рецептор 3; рецептор, активируемый протеиназой, тип 2 (PAR-2); рецептор простациклина (простаноидный рецептор IP); ингибитор сериновых (или цистеиновых) протеиназ, клад F (альфа-2-антиплазмин, фактор пигментного эпителия), член 1; рецептор полипептида, активирующего гипофизарную аденилатциклазу,тип 1 (PACAP-R-1); член 10 суперсемейства (лигандов) фактора некроза опухолей; С-MAF (короткая форма); ацетилхолинэстераза (ACHE); альфа-1-адренергический рецептор (неспецифический); GABA-Aрецептор, связывающий Bz; рецептор лизосфинголипидов EDG-1; молекула клеточной адгезии 1 адресина слизистой (MAdCam); альфа-1L-адренергический рецептор; рецептор гепатоцитарного фактора роста(МЕТ протоонкогенная тирозинкиназа); мускариновый ацетилхолиновый рецептор М 3; MEK1; инсулиновый рецептор; рецептор GABA (А+В; неспецифические); каталитическая гамма-субъединица фосфатидилинозит-3-киназы (гамма-PI3-киназа); костный морфогенетический белок 2 (ВМР 2); рецептор SKYтирозин-протеинкиназы (TYRO3) (RSE); член 2 семейства рецепторов домена дискоидина (DDR2); потенциалзависимый натриевый рецептор KV (неспецифический); сфингозинкиназа (неспецифическая); рецептор высокоаффинного фактора роста нервов (TRK-A); карбоангидразы (все); рецептор тромбопоэтина; сосудистый эндотелиальный фактор роста С; ангиотензиноген; член 1 подсемейства В (MDR/TAP) АТР-связывающей кассеты (АВСВ 1) (Р-гликопротеин множественной лекарственной резистентности(MDR1; киназа-7 митоген-активируемой протеинкиназы (MAP2K7); мускариновый ацетилхолиновый рецептор M1; обратная транскриптаза HIV; PDE5A (cGMP-связывающая, cGMP-специфическая фосфодиэстераза 5A/HSPDE5A); альфа-адренергический рецептор (неспецифический); ингибитор свертывания крови, ассоциированный с липопротеином; карбоксипептидаза В 2 (TAFI); холинэстераза (неспецифическая); В 2-рецептор брадикинина (BK2); альдозоредуктаза; фактор свертывания крови XI (предшественник плазматического тромбопластина); серин/треонин-протеинкиназа Р 78; метионин-аминопептидаза 2; растворимая гуанилатциклаза (неспецифическая); киназа рибосомального белка S6; метаботропный глутаматный рецептор 1; нерецепторная тирозин-протеинкиназа TYK2; метаботропный глутаматный рецептор (неспецифический); рецептор сосудистого эндотелиального фактора роста, тип 3 (VEGFR-3/FLT4); митоген-активируемая протеинкиназа 13 (MAPK13/Р 38-дельта); белок активации фибробластов (сепараза); рецептор кортиколиберина, тип 1 (CRF1); митоген-активируемая протеинкиназа 11 (MAPK11/Р 38 бета); компонент 5 комплемента; FL-рецептор цитокина (FLT3); рецептор АМРА (глутаматные рецепторы 1-4); рецептор фактора роста нервов; ацил-СоА:холестерин-ацилтрансфераза 1 (АСАТ 1); сглаженный гомолог Frizzled-подобного рецептора (SMO); рецептор, сопряженный с G-белком BONZO (STRL33,CXCR6); IKCa-белки; рецептор TGF-бета, тип II (TGFR-2); HIV-vif-белок; 5-гидрокситриптаминовый рецептор 2 В (5-HT2B); белок, связывающий жирные кислоты (неспецифический); толл-подобный рецептор 7 (TLR7); грелин; антиген CD36 (рецептор коллагена типа I, рецептор тромбоспондина); киназа-3 киназы митоген-активируемой протеинкиназы (MAP3K3/MEKK3); FMLP-родственный рецептор I(MAPK9/JNK2); Р 2 Х-рецептор (неспецифический); казеинкиназа I (неспецифическая); сульфотрансферазы (неспецифические); ядерный рецептор ROR-альфа-1; катехол-O-метилтрансфераза (СОМТ); моноаминоксидаза А (МАОА); гамма-глутамилгидролаза; протеинкиназа С, альфа-тип (PKC-альфа); митогенактивируемая протеинкиназа 12 (MAPK12/ERK6/P38-гамма); кальциевый канал альфа-2-дельта; комплекс тканевого фактора с фактором VIIa; анкилостомный фактор, ингибирующий нейтрофилы; калиевый канал IKr; гистаминовый рецептор Н 4 (JAR3) (PFI-13); 5-гидрокситриптаминовый рецептор 2 А(5-HT2A); холецистокининовый рецептор типа А (CCKA); 11-бета-гидроксистероиддегидрогеназа 1; соматолиберин; альфа-7-белок никотинового ацетилхолинового рецептора; рецептор 5-HT2 (неспецифический); натрий-протонный обменник, изоформа 1 (NHE1); рецептор субстанции K (SKR/NK-2-рецептор); 5-гидроксириптаминовый рецептор 1D (5-HT1D); 5-HT1B/1D-рецепторы; сахараза-изомальтаза; бета-3 адренергический рецептор; рецептор пептида, относящегося к гену кальцитонина (GGRP), тип 1; циклинзависимая киназа 4 (CDK4); альфа-1 А-адренергический рецептор; Р 2Y12 тромбоцитарный рецепторG-белкового сигналинга; киназа, ассоциированная с рецептором интерлейкина-1 (IRAK); неорганическая пирофосфатаза (ppase); ITK/TSK-тирозинкиназа; RAR-гамма; AXL-тирозин-протеинкиназа (UFO, GAS6 рецептор); киназа-1, подобная рецептору активина (ALK-1); фактор транскрипции 2 семейства Runt; АМР-дезаминаза (неспецифическая); CCR8-рецептор хемокина; CCR11-рецептор хемокина; рецептор ноцицептина; рецептор инсулиноподобного ростового фактора-1; Р 2Y-рецептор (неспецифический);- 12016494 протеинкиназа С, тип тета (NPKC-тета); ДНК-метилтрансфераза (неспецифическая); киназа фосфорилазы (неспецифическая); хемотаксический рецептор анафилатоксина С 3 А (C3AR); сфингозинкиназа 2 (SPHK2); казеинкиназа II (неспецифическая); фосфоглицераткиназа 1; UDP-Gal:beatGlcNAc-бета-1,4 галактозилтрансфераза 2 (B4GALT2); член 5 (SLC7A5) sapiens-семейства 7 носителей растворенных веществ (переносчик катионных аминокислот, система у+); ММР-17 (МТ-ММР 4); альфа-цепь казеинкиназы II (CK II); вещество 6, специфичное для остановки роста (GAS6); протеинкиназа 3, активируемая МАР-киназой (MAPKAPK-3); протеинкиназа-1, активируемая митогеном и стрессом (MSK1); простагландин-D2-синтаза (21 кД, мозговая форма); панкреатический канал K+ (неспецифический); рецептор TGF-бета, тип I (TGFR-1/киназа-5, подобная рецептору активина/ALK-5); циклинзависимая киназа 2 (CDK2); АСАТ (АСАТ-ферменты 1 и 2; неспецифические); дельта-тип опиоидного рецептора (DOR1); 5-гидрокситриптаминовый рецептор 6 (5-HT6); 5-гидрокситриптаминовый рецептор 1 А(Р 2 Х 4); рецептор лектиноподобного окисленного LDL (LOX-1); эпоксидгидролаза 2 (гидролаза трансстиролоксида) (растворимая эпоксидгидролаза) (sEH); дигидропиколинатсинтаза (dhdps) (DapA); комплекс СаМ-киназы II; LXR-альфа/бета (неспецифическая LXR); второй митохондриальный активатор каспазы; интегринсвязанная киназа (ILK); киназа фокальной адгезии 2 (FADK 2); аденозиновый рецептор А 2 В; WEE1-подобная протеинкиназа; checkpoint-киназа (CHK2); бактериальный SecA-белок; бета-2 белок никотинового ацетилхолинового рецептора; киназа-1 киназы митоген-активируемой протеинкиназы (MAP3K1/MEKK1); протеинкиназа С, дзета-тип (NPKC-дзета); PDK1 (3-фосфоинозитидзависимая протеинкиназа-1); 5-гидрокситриптаминовый рецептор 5 А (5-HT5A); стероид-5-альфа-редуктаза; киназа 8 киназы митоген-активируемой протеинкиназы (MAP3K8/COT); протеин-тирозинфосфатаза 1 В; Р 2Yпуринорецептор 1 (P2Y1); альфа-1D-адренергический рецептор; казеинкиназа I-эпсилон (CKI-эпсилон); 5-гидрокситриптаминовый рецептор 7 (5-HT7); фактор свертывания крови VII (эптаког-альфа); киназа пируватдегидрогеназы (PDHK; неспецифическая); PDE7A (сАМР-специфическая фосфодиэстераза 7A/HSPDE7A); рецептор глюкагоноподобного пептида 1 (GLP-1R); субъединица р 3 РНК-полимеразы вируса гриппа (pb2-эндонуклеаза); вирусная протеаза (неспецифическая); топоизомераза IV; рецептор паратиреоидного гормона (РТН 2-рецептор); протеинкиназа С, тип бета-I (PKC-бета-1); дофамин-бетагидроксилаза; протеинкиназа, ассоциированная с галактозилтрансферазой P58/GTA; пресинаптический белок SAP97; синовиальный ингибитор апоптоза 1, синовиолин (SYVN1) (HRD1) (HRD-1); скваленэпоксидаза (ERG1); протеинкиназа С, тип эпсилон (NPKC-эпсилон); рецептор-2 кортиколиберина (CRF2); кальций-активируемый калиевый канал промежуточной проводимости (IK1); нуклеозиддифосфаткиназаA (NDKA) (NM23-H1); киназа 4, ассоциированная с рецептором интерлейкина-1 (IRAK-4); киназа-3 альфа гликогенсинтазы (GSK-3-альфа); член 2 семейства 22 носителей растворенных веществ (переносчик органических катионов (SLC22A2); киназа-1 пируватдегидрогеназы (PDK1); PAK-альфа-киназа(PAK-1); человеческие белки 14-3-3; изолейцил-тРНК-синтетаза; прецистеиновая карбоксилметилтрансфераза (РССМТ); CKLF1 и NAALAD-аза II. Соединения или соли согласно настоящему изобретению можно, кроме того, вводить в комбинации с одним или более таких средств, как селективные ингибиторы обратного захвата серотонина (SSRI),ингибиторы металлопротеиназы матрикса (ММР), ингибиторы аггреканазы, ингибиторы индуцируемой синтазы оксида азота (iNOS), ингибиторы экспрессии или активности инсулиноподобного фактора роста(IGF), ингибиторы экспрессии или активности фактора роста фибробластов (FGF), ингибиторы экспрессии или активности CD44, ингибиторы экспрессии или активности интерлейкина (IL), ингибиторы экспрессии или активности фактора некроза опухолей альфа (TNF-альфа), ингибиторы экспрессии или активности белка 6, индуцируемого фактором некроза опухолей (TSG-6), ингибирование экспрессии или активности бикунина, ингибиторы бета-секретазы (ВАСЕ), ингибиторы РАСЕ-4, ингибирование экспрессии или активности ядерного рецептора rev-ErbA-альфа (NR1D1), ингибирование экспрессии или активности рецептора-1 для G-белка, связанного со сфинголипидом и участвующего в эндотелиальной дифференцировке (EDG-1), ингибирование экспрессии или активности рецептора, активируемого протеиназой (PAR), ингибирование экспрессии или активности хрящевого белка, чувствительного к ретиноевой кислоте (CD-RAP), ингибиторы протеинкиназы С-дзета (PKCz), ингибирование экспрессии или активности резистина, ингибирование дизинтегрина и металлопротеиназы 8 (ADAM8), ингибирование экспрессии или активности субкомпонента компонента комплемента 1s (C1s), ингибирование экспрессии или активности формилированного пептида, подобного рецептору 1 (FPRL1). Дополнительные примеры средств, применимых в комбинации с соединениями или солями согласно настоящему изобретению, включают ингибиторы ММР-2, -3, -9 или -13; ингибиторы аггреканазы-1 или -2; ингибиторы экспрессии или активности IGF-1 или -2; ингибиторы экспрессии или активностиFGF-2, -18 или -9 и ингибиторы экспрессии или активности IL-1, -4 или -6.- 13016494 Другие примеры средств, применимых в комбинации с соединениями или солями согласно настоящему изобретению, включают антитела к IGF-1 или -2; антагонисты FGF-рецептора-2 или -3, антитела кCD44, антитела к IL-1, -4 или -6, антитела к TNF-альфа; антитела к TSG-6; антитела к бикунину; антагонисты NR1D1; антагонисты EDG-1; антагонисты PAR, антитела к CD-RAP, антитела к резистину, антитела к C1s и антитела к FPRL1. Дополнительные примеры соединений, которые можно вводить с соединениями или солями согласно настоящему изобретению, включают селективные ингибиторы циклооксигеназы-2 (СОХ-2), такие как целекоксиб, рофекоксиб, парекоксиб, валдекоксиб, деракоксиб, эторикоксиб и лумиракоксиб; опиоидные анальгетики, такие как морфин, гидроморфон, оксиморфон, фентанил, кодеин, дигидрокодеин,оксикодон, гидрокодон, бупренорфин, трамадол и налбуфин; нестероидные противовоспалительные лекарственные средства (NSAID), такие как аспирин, диклофенак, дифлунисал, ибупрофен, фенопрофен,напроксен, непафенак и ацетаминофен; ингибиторы фосфодиэстеразы V (PDEV), такие как силденафил; альфа-2-дельта-лиганды, такие как габапентин и прегабалин; и местные анестетики, такие как бензокаин,лидокаин, ропивакаин, ментол, камфара и метилсалицилат. Примеры других типов соединений и классов соединений, которые можно применять в комбинации с соединениями или солями согласно настоящему изобретению, включают анальгетики, барбитуратные седативные средства; бензодиазепины; антагонисты гистамина H1, обладающие седативным действием; седативные средства; релаксанты скелетной мускулатуры; антагонисты рецептора N-метил-Dаспарагиновой кислоты (NMDA); альфа-адренергетики; трициклические антидепрессанты; антиконвульсанты, такие как карбамазепин; антагонисты тахикинина (NK), в частности антагонисты NK-3, NK-2 илиNK-1, мускариновые антагонисты; нейролептики; агонисты или антагонисты ваниллоидного рецептора; бета-адренергетики; кортикостероиды; агонисты или антагонисты серотонинового (5-HT) рецептора,такие как антагонисты рецептора 5-HT1B/1D 5-HT2A и 5-HT3; холинергические (никотиновые) анальгетики; каннабиноиды; антагонисты метаботропного глутаматного рецептора подтипа 1 (mGluR1); ингибиторы обратного захвата серотонина, такие как сертралин; ингибиторы обратного захвата серотонина, такие как ребоксетин, в частности (S,S)-ребоксетин; двойные ингибиторы обратного захвата серотонинанорадреналина, такие как дулоксетин; ингибиторы индуцируемой синтазы оксида азота (iNOS), такие как(ЕР 4), такие как N-[(2-[4-(2-этил-4,6-диметил-1 Н-имидазо[4,5-с]пиридин-1-ил)фенил]этиламино)карбонил]-4-метилбензолсульфонамид или 4-[(1S)-1-([5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбониламино)этил]бензойная кислота; антагонисты лейкотриена В 4, такие как 1-(3-бифенил-4-илметил-4 гидроксихроман-7-ил)циклопентанкарбоновая кислота; ингибиторы 5-липоксигеназы и блокаторы натриевого канала. Комбинации с соединениями или солями согласно настоящему изобретению также включают анальгетики, такие как ацетаминофен, напроксен-натрий, ибупрофен, трамадол, тразодон, циклобензаприн, аспирин, целекоксиб, валдекоксиб, индометацин и другие NSAID; антидепрессанты, такие как трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина, например такие антидепрессанты, как амитриптилин, имипрамин, нортриптилин,доксепин, флуоксетин, сертралин и пароксетин; мышечные релаксанты, такие как циклобензаприн, снотворные, такие как золпидем. Комбинации с соединениями или солями согласно настоящему изобретению также включают анальгетики, такие как ацетаминофен, напроксен-натрий, ибупрофен, трамадол, аспирин, целекоксиб, валдекоксиб, индометацин и другие NSAID; модифицирующие заболевание антиревматические лекарственные средства (DMARD), такие как сульфасалазин или метотрексат; кортикостероиды и блокаторы фактора некроза опухолей (TNF), такие как этанерцепт и инфликсимаб. Комбинации с соединениями или солями согласно настоящему изобретению включают местные кортикостероиды; аналоги витамина D, такие как кальципотриен; антралин; местные ретиноиды (т.е. производные витамина А), такие как ацитретин и тазаротен; пропионат клобетазола; метотрексат; азатиоприн; циклоспорин; гидроксимочевина; и иммуномодулирующие лекарственные средства, такие как алефацепт, эфализумаб и этанерцепт. В сочетании с соединениями или солями согласно настоящему изобретению и вышеуказанными комбинациями можно применять лечение фототерапией, включая терапию препаратом псорален-ультрафиолет А (псорален UVA или PUVA), терапию узкополосным ультрафиолетом В (UVB) и комбинированную фототерапию.- 14016494 Комбинации с соединениями или солями согласно настоящему изобретению включают NSAID, такие как ацетаминофен, напроксен-натрий, ибупрофен, трамадол, аспирин, целекоксиб, валдекоксиб и индометацин; и кортикостероиды, такие как преднизон. Комбинации с соединениями или солями согласно настоящему изобретению включают анальгетики, такие как ацетаминофен, напроксен-натрий, ибупрофен, трамадол, аспирин, целекоксиб, валдекоксиб, индометацин и другие NSAID; противовоспалительные лекарственные средства; сульфасалазин, месаламин, балсалазид и олсалазин; кортикостероиды; преднизон; будесонид; иммуносупрессантные лекарственные средства, такие как азатиоприн, меркаптопурин; блокаторы TNF, такие как инфликсимаб и адалимумаб, метотрексат и циклоспорин; антибиотики, такие как метронидазол и ципрофлоксацин; закрепляющие средства, такие как лоперамид; слабительные; антихолинергические лекарственные средства; антидепрессанты, такие как трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина, например такие антидепрессанты,как амитриптилин, имипрамин, нортриптилин, доксепин, флуоксетин, сертралин и пароксетин; алосетрон и тегасерод. Соединения или соли согласно настоящему изобретению можно было бы также вводить с долгодействующим бета-агонистом. Подходящие примеры других терапевтических средств, которые можно применять в комбинации с соединениями или солями согласно настоящему изобретению, включают ингибиторы 5-липоксигеназы(5-LO) или антагонисты белка, активирующего 5-липоксигеназу, антагонисты лейкотриена (LTRA),включая антагонисты LTB4, LTC4, LTD4 и LTE4, антагонисты гистаминового рецептора, включая антагонисты H1 и Н 3, вазоконстрикторные симпатомиметические агенты со свойствами агонистов 1- и 2-адренорецепторов для противоотечного применения, антагонисты мускаринового М 3-рецептора или антихолинергические средства, ингибиторы PDE, например ингибиторы PDE3, PDE4 и PDE5, теофиллин, кромогликат натрия, ингибиторы СОХ, как неселективные, так и селективные ингибиторы СОХ-1 или СОХ-2 (NSAID), пероральные или ингаляционные глюкокортикостероиды, моноклональные антитела, активные против эндогенных воспалительных факторов, 2-агонисты, включая длительно действующие 2-агонисты, ингибиторы молекулы адгезии, включая антагонисты VLA-4, антагонисты кининового рецептора B1 и В 2, иммуносупрессивные средства, ингибиторы металлопротеиназ матрикса (ММР), антагонисты рецепторов тахикинина NK1, NK2 и NK3, ингибиторы эластазы, агонисты аденозинового рецептора А 2 а, ингибиторы урокиназы, соединения, которые действуют на дофаминовые рецепторы, например агонисты D2, модуляторы пути NFB, например ингибиторы IKK, модуляторы цитокиновых сигнальных путей, такие как ингибиторы syk-киназы или JAK-киназы, агенты, которые можно классифицировать как муколитики или противокашлевые средства и антибиотики. Согласно настоящему изобретению соединения или соли согласно настоящему изобретению можно комбинировать с Н 3-антагонистами, антагонистами мускаринового М 3-рецептора, ингибиторами PDE4,глюкокортикостероидами, агонистами аденозинового рецептора А 2 а, 2-агонистами, модуляторами цитокиновых сигнальных путей, такими как syk-киназа, или антагонистами лейкотриена (LTRA), включая антагонисты LTB4, LTC4, LTD4 и LTE4. Согласно настоящему изобретению соединения или соли согласно настоящему изобретению можно также комбинировать с глюкокортикостероидами, такими как ингаляционные глюкокортикостероиды со сниженными системными побочными эффектами, включая преднизон, преднизолон, флунизолид, триамцинолонацетонид, дипропионат беклометазона, будесонид, пропионат флутиказона, циклесонид и фуроат мометазона и моногидрат фуроата мометозона; антагонисты мускаринового рецептора М 3 или антихолинергические средства, включая, в частности, соли ипратропия, такие как бромид ипратропия, соли тиотропия, такие как бромид тиотропия, соли окситропия, такие как бромид окситропия, перензепин и телензепин, или 2-агонисты, такие как долгодействующие 2-агонисты, включая салметерол, формотерол, QAB-149 и CHF-4226.F. Применение при получении композиции или лекарственного средства. Соединения или соли согласно настоящему изобретению применяют для лечения состояний, опосредуемых активностью глюкокортикоидного рецептора. Соединения или соли согласно настоящему изобретению используют для получения композиции или лекарственного средства для (лечения) воспаления, состояния, связанного с воспалением, ревматоидного артрита, дерматита, болезни Альцгеймера. Соединения или соли согласно настоящему изобретению используют для получения композиции или лекарственного средства для лечения одного или более состояний, подробно описанных в разделеG. Схемы. Соединения согласно настоящему изобретению могут быть получены с применением способов,проиллюстрированных на общих схемах синтеза, и экспериментальных процедур, подробно описанных ниже. Реакции в способах синтеза, указанных в настоящем документе, проводят в подходящих растворителях, которые может легко выбрать специалист в органическом синтезе, причем указанными растворителями обычно является любой растворитель, который существенно не реагирует с исходными материалами (реагентами), промежуточными соединениями или продуктами при температурах, при которых проводят реакции. Данная реакция может быть проведена в одном растворителе или в смеси растворителей числом более одного. В зависимости от конкретной стадии реакции могут быть выбраны растворители, подходящие для конкретной стадии реакции. Получение соединений согласно настоящему изобретению может включать защиту различных химических групп и снятие такой защиты. Необходимость защиты и снятия защиты и выбор соответствующих защитных групп могут быть легко определены специалистом в данной области. Химию защитных групп можно найти, например, в T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis,3rd Ed., WileySons, Inc., New York (1999), которая включена в настоящий документ посредством ссылки во всей своей полноте. Мониторинг реакций можно проводить любым подходящим способом, известным в данной области. Например, образование продукта можно мониторировать спектроскопическими средствами, такими как спектроскопия ядерного магнитного резонанса (например, 1 Н или 13 С), инфракрасная спектроскопия,спектрофотометрия (например, УФ видимая) или масс-спектрометрия, или посредством хроматографии,такой как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография. Исходные материалы, применяемые в настоящем изобретении, являются либо доступными коммерчески, либо могут быть получены обычными способами синтеза. Общие схемы синтеза представлены для целей иллюстрирования и не являются ограничивающими. Схема А 1(R)-Бензил-5-бром-9(S)-гидро-10(R)-гидрокси-10(R)-метилтрицикло[7.3.1.02,7]тридека-2,4,6-триен 13-он формулы А-8 получали, применяя протокол, описанный на схеме А, который в общем виде раскрыт в WO 00/66522. Ph обозначает фенил; Bn обозначает бензил. Соединение А-1 можно приобрести,например, у VOUS and Riverside; CAS No. 4133-35-1). Соединение А-2 может быть получено, как описано в Org. Syn. 1971, 51, 109-112.(4S,7R,8R)-4-4-Бензил-7-гидрокси-N-(2-метилпиридин-3-ил)-7-(трифторметил)4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамид получали, как описано на схеме В. Схема С(2R,4S,10R)-4-Бензил-7-2-метилпиридин-3-ил)карбамоил)-2-(трифторметил)1,2,3,4,4,9,10,10-октагидрофенантрен-2-илдигидрофосфат соединения С-3 получали, как описано на схеме С. Bn обозначает бензил. Схема D(2R,4S,10R)-4-Бензил-7-2-метилпиридин-3-ил)карбамоил)-2-(трифторметил)1,2,3,4,4,9,10,10-октагидрофенантрен-2-илдигидрофосфат соединения С-3 получали, как описано на схеме D. Bn обозначает бензил; Ph обозначает фенил. Схема Е(2R,4S,10R)-4-Бензил-7-2-метилпиридин-3-ил)карбамоил)-2-(трифторметил)-(2R,4S,10R)4-октагидрофенантрен-2-илдигидрофосфат соединения С-3 получали, как описано на схеме Е. Bn обозначает бензил; Ph обозначает фенил. Н. Приготовления и примеры. Исходным материалом А-8 является 1(R)-бензил-5-бром-9(S)-гидро-10(R)-гидрокси-10(R)метилтрицикло[7.3.1.02,7]тридека-2,4,6-триен-13-он, как показано следующей формулой: Исходный материал А-8 (450 г; 1,17 моль) растворяли в этаноле (4,5 л) при температуре окружающей среды. Добавляли 21% этоксид натрия в этаноле (44 мл; 0,12 моль) и смесь нагревали до кипения с обратным холодильником в течение 3 ч. После потребления исходного материала А-8 реакционную смесь охлаждали до -25 С. К смеси медленно добавляли ацетилхлорид (250 мл; 3,51 моль), поддерживая температуру около -25 С. После завершения добавления смесь нагревали до 0 С и выдерживали при этом до потребления всего промежуточного енона. В это время смесь представляет собой густую суспензию (пульпу). К смеси добавляли 21% этоксид натрия в этаноле (1,31 л; 3,51 моль), поддерживая температуру между -5 и 5 С. Если смесь не была основной, дополнительно добавляли этоксид натрия. Температуру смеси повышали до 25 С и затем смесь разбавляли водой (5,9 л). Смесь фильтровали и твердое вещество промывали водой (3). Соединение, указанное в заголовке, (440 г; 85% по площади) получали в виде твердого вещества бежевого цвета. 1 Н ЯМР (ДМСО)м.д.: 1,27 (т, 3 Н), 1,65 (дт, 1 Н), 2,06 (д, 1 Н), 2,21 (дд, 1 Н), 2,49 (м, 1 Н), 2,65 (м,2 Н), 2,89 (м, 2 Н), 3,85 (кв, 2 Н), 5,45 (м, 2 Н), 6,44 (д, 2 Н), 6,98 (т, 2 Н), 7,06 (м, 2 Н), 7,25 (д, 1 Н), 7,33 (дд,1 Н).(S)-4-Бензил-7-бром-2-этокси-3,4,4,9-тетрагидрофенантрен (1270 г; 3,2 моль; 85% чистоты, вычисленной хроматографически, который можно получать, как описано в приготовлении 1) растворяли в толуоле (6,45 л). Добавляли этиленгликоль (898 мл; 16,1 моль) и п-толуолсульфоновую кислоту (6,1 г; 0,03 моль) и реакцию нагревали до кипения с обратным холодильником. Из смеси отгоняли растворитель(1 л), заменяя его свежим толуолом (1 л). Этот процесс отгонки повторяли еще два раза. При каждом добавлении свежего толуола дополнительно добавляли п-толуолсульфоновую кислоту (6,1 г). В течение реакции, по мере преобразования субстрата в продукт, образовывались два промежуточных соединения(детектированных жидкостной хроматографией). Конечной точкой реакции была точка равновесия между этими двумя промежуточными соединениями и продуктом. После достижения конечной точки смесь охлаждали до температуры окружающей среды. Смесь промывали 0,5 М NaOH (2 л). Фазы разделялись быстро и обе были темными с небольшим слоем хлопьев. Смесь промывали водой (2 л). Фазы разделялись очень медленно. Смесь сушили азеотропной перегонкой. К смеси добавляли метанол (4 л) и из смеси отгоняли растворитель (4 л). Добавление метанола и отгонку растворителя повторяли еще два раза. К смеси добавляли метанол, и через несколько минут появлялся осадок. К смеси дополнительно добавляли метанол (4 л) и затем ее доводили до кипения с обратным холодильником. Через 30 мин смесь охлаждали до 0 С. Смесь фильтровали и твердое вещество промывали холодным метанолом (22 л). Твердое вещество сушили в вакуумной печи при 65 С. Соединение, указанное в заголовке (882 г; 98% чистоты, вычисленной хроматографически), получали в виде твердого вещества бежевого цвета. 1 Н ЯМР (ДМСО)м.д.: 1,71 (м, 2 Н), 2,06 (м, 2 Н), 2,31 (дд, 1 Н), 2,39 (м, 1 Н), 2,68 (д, 1 Н), 2,77 (м,1 Н), 2,86 (дд, 1 Н), 3,36 (д, 1 Н), 3,86 (м, 4 Н), 5,45 (м, 1 Н), 6,50 (м, 2 Н), 7,00 (м, 4 Н), 7,37 (дд, 1 Н), 7,44 (д,1 Н). Приготовление 3. (S)-Метил-4-бензил-7,7-(1,2-этилендиокси)-4,5,6,7,8,10-гексагидрофенантрен 2-карбоксилат(S)-4-Бензил-7-бром-2,2-(1,2-этилендиокси)-1,2,3,4,4,9-гексагидрофенантрен (719 г; 1,75 моль,который может быть получен, как описано в приготовлении 2) растворяли в тетрагидрофуране (7,19 л) и охлаждали до -70 С. 1,6 М н-бутиллитий в гексане (2270 мл; 2,27 моль) добавляли с такой скоростью,чтобы поддерживать температуру ниже -60 С. После этого добавления смесь выдерживали в течение дополнительных 15 мин. Добавляли диоксид углерода (108 г; 2,45 моль), поддерживая температуру ниже-60 С. После этого добавления смесь выдерживали в течение дополнительных 15 мин. Смесь нагревали до температуры окружающей среды. Из смеси отгоняли растворитель (7 л) при атмосферном давлении. К смеси добавляли DMF (7 л). Смесь охлаждали до температуры окружающей среды. Добавляли метилйодид (152 мл; 2,45 моль) и смесь выдерживали до завершения реакции (1 ч). Смесь нагревали до 70 С и растворитель отгоняли, постепенно снижая давление до 70 мм рт.ст. После прекращения отгонки смесь охлаждали до комнатной температуры. К смеси медленно добавляли воду (6,5 л) для осаждения продукта. Смесь фильтровали и твердое вещество промывали водой (3). Твердое вещество сушили на фильтре. Неочищенный продукт (736 г; 74% чистоты, вычисленной хроматографически) получали в виде твердого вещества бежевого цвета. Продукт очищали хроматографией. Хроматография давала 463 г продукта. Этот материал отделяли от н-гептана (6130 мл). Выход соединения, указанного в заголовке, составлял 394 г. Дополнительные 70 г соединения, указанного в заголовке, получали из маточной жидкости посредством хроматографии. 1 Н ЯМР (ДМСО)м.д.: 1,74 (м, 2 Н), 2,10 (м, 2 Н), 2,33 (дд, 1 Н), 2,45 (м, 1 Н), 2,72 (д, 1 Н), 2,79 (м,1 Н), 2,94 (дд, 1 Н), 3,40 (д, 1 Н), 3,87 (м, 7 Н), 5,49 (м, 1 Н), 6,47 (м, 2 Н), 6,93 (м, 2 Н), 7,01 (м, 1 Н), 7,42 (д,1 Н), 7,64 (д, 1 Н), 7,79 (дд, 1 Н).(201 г; 0,515 моль, который может быть получен, как описано в приготовлении 3) и 50 мл этиленгликоля растворяли в толуоле (2,0 л) в автоклаве. К этому раствору добавляли 10 г 5% Pd/C (сухой катализатор). Затем автоклав закрывали и продували азотом (три цикла), затем водородом (три цикла). Реакцию проводили в течение 18 ч при давлении 5500 ГПа (5,4 атм) и температуре 50 С. ВЭЖХ анализ применяли для определения завершения и селективности (типичная транс/цис-селективность была 95/5). Суспензию фильтровали через Celite для удаления катализатора и толуольный раствор концентрировали при 50 С в вакууме приблизительно до 200 мл. Продолжая поддерживать 50 С, добавляли 1 л 1-бутанола и раствор нагревали до 60 С, пока он не становился прозрачным. После охлаждения образовавшееся твердое соединение, указанное в заголовке, выделяли вакуумным фильтрованием (196 г; 97%; транс/цис=95,75/4,24). 1 Н ЯМР (300 МГц, CDCl3)м.д.: 7,79 (ушир.с, 1 Н, Ar-H), 7,47 (д, J=9 Гц, 1 Н, Ar-H), 7,13-7,05 (см,3 Н, Ar-H), 6,56-6,53 (см, 2 Н, Ar-H), 6,43 (д, J=9 Гц, 1 Н, Ar-H), 4,04-3,93 (см, 4 Н, 2-СН 2), 3,89 (с, 3 Н, СН 3),3,08-3,03 (см, 3 Н, СН 2, СН-Н), 2,63 (д, J=15 Гц, СН-Н), 2,22-1,72 (см, 8 Н, 4-СН 2), 1,57 (см, 1 Н, СН-Н); 13 С ЯМР (CDCl3) : 167,7, 149,2, 137,7, 136,4, 131,1, 130,5, 127,8, 127,7, 127,4, 126,3, 125,5, 108,9,64,6, 64,5, 52,1, 40,5, 39,8, 38,3, 35,8, 31,6, 30,3, 27,9, 24,6. Приготовление 5. (4S,8R)-Метил-4-бензил-7-оксо-4,5,6,7,8,8,9,10-октагидрофенанотрен-2 карбоксилат(4S,8R)-Метил-4-бензил-7,7-(1,2-этилендиокси)-4,5,6,7,8,8,9,10-октагидрофенантрен-2 карбоксилат (150 г, 382 ммоль, который может быть получен, как описано в приготовлении 4) растворяли в дихлорметане (630 мл). При перемешивании добавляли воду (270 мл), затем из капельной воронки в течение 30 мин добавляли трифторуксусную кислоту (73 мл, 1150 ммоль), поддерживая внутреннюю температуру ниже 30 С. После завершения добавления реакцию нагревали при 40 С в течение 2 ч. В ходе процесса контрольный анализ показал неполную реакцию с 9% (чистоты, вычисленной хроматографически) исходного материала. Разделяли слои и добавляли свежую воду (270 мл) и трифторуксусную кислоту (31 мл). Реакционную смесь нагревали при 40 С в течение 1 ч. Этот процесс продолжали до потребления всего исходного материала. Органическую фазу промывали 5% водным бикарбонатом натрия(300 мл), водой (300 мл), сушили над MgSO4 и концентрировали до сухого состояния, получая 126,4 г соединения, указанного в заголовке (выход 95%). 1 Н ЯМР (ДМСО)м.д.: 7,70 (с, 1 Н), 7,37 (д, J=8,4 Гц, 1 Н), 7,11 (м, 3 Н), 6,6 (д, J=5,70 Гц, 2 Н), 6,45(4S,8R)-Метил-4-бензил-7-оксо-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат (118 г,0,339 моль, который может быть получен, как описано в приготовлении 5), растворенный в дихлорметане, охлаждали до -50 С. Раствор становился мутным. Без заметного изменения температуры добавляли 1,0 М раствор тетрабутиламмонийфторида в THF (3,4 мл, 0,003 моль). В течение 20 мин добавляли трифторметилтриметилсилан (79 мл, 0,51 моль), что сопровождалось изменением цвета сначала до ярко- 20016494 оранжевого, затем до светло-красного. Реакционную смесь выдерживали при -50 С в течение примерно 2 ч и давали возможность нагреваться до 0 С. Очень медленно, в течение 45 мин, к реакционной смеси добавляли тетрабутиламмонийфторид (340 мл, 0,34 моль). Наблюдали выделение тепла и газа. Реакционную смесь перемешивали в течение 10 мин, ВЭЖХ-анализ показывал полное десилилиалирование. К реакционной смеси при интенсивном перемешивании добавляли воду (1 л) и смеси давали возможность нагреваться до комнатной температуры. Органический слой промывали водой (1 л). Органический слой концентрировали и хроматографировали, получая 72 г, 51% соединения, указанного в заголовке, с дополнительными 32 г неочищенного продукта. 1 Н ЯМР (ДМСО)м.д.: 7,70 (с, 1 Н), 7,37 (д, J=8,1 Гц, 1 Н), 7,09 (м, 3 Н), 6,5 (дд, J=1,2, 6,6 Гц, 2 Н),6,38 (д, J=8,4 Гц, 1 Н), 3,80 (с, 3 Н), 3,80 (м, 2 Н), 3,09-1,21 (м, 13 Н). Приготовление 7. (4S,7R,8R)-Метил-4-бензил-7-(бис-(бензилокси)фосфорилокси)-7-(трифторметил)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат(4S,7R,8R)-Метил-4-бензил-7-гидрокси-7-(трифторметил)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат (5,0 г; 11,9 ммоль, который может быть получен, как в приготовлении 6) и 5-метилтетразол (3,6 г; 43,0 ммоль) смешивали в дихлорметане (50 мл) при температуре окружающей среды. Добавляли дибензилдиизопропилфосфорамидит (8,3 мл; 25,1 ммоль) и смесь перемешивали до завершения реакции (1 ч). Смесь охлаждали до 0 С и добавляли 30%-ный пероксид водорода (10 мл). Реакционную смесь перемешивали до завершения окисления (30 мин). Водную фазу отделяли от органической фазы. Органическую фазу промывали 10%-ным метабисульфитом натрия (50 мл). Органическую фазу сушили безводным сульфатом магния и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле с использованием 15% этилацетата в гексанах. Очищенное соединение, указанное в заголовке, (8,41 г; выход 94%) получали в виде бесцветного масла, которое содержало 6 мас.% этилацетата. 1 Н ЯМР (ДМСО)м.д.: 1,31 (т, 1 Н), 1,63-1,92 (м, 3 Н), 2,05-2,35 (м, 3 Н), 2,63 (д, 1 Н), 2,75-3,16 (м,4 Н), 3,80 (с, 3 Н), 5,13 (м, 4 Н), 6,43 (д, 1 Н), 6,49 (м, 2 Н), 7,04-7,17 (м, 3 Н), 7,33-7,42 (м, 12 Н), 7,71 (д, 1 Н). Приготовление 8. Дибензил(2R,4S,10R)-4-бензил-7-2-метилпиридин-3-ил)карбамоил)-2(трифторметил)-1,2,3,4,4,9,10,10-октагидрофенантрен-2-илфосфат(4S,7R,8R)-Метил-4-бензил-7-(бис-(бензилокси)фосфорилокси)-7-(трифторметил)4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат (7,9 г; 11,6 ммоль, который может быть получен как в приготовлении 7) и 3-амино-2-пиколин (1,3 г; 12,2 ммоль) смешивали в тетрагидрофуране (80 мл) и охлаждали до 0 С. Добавляли 1 М раствор литий-бис-(триметилсилил)амида в тетрагидрофуране (24 мл; 24,4 ммоль), поддерживая температуру ниже 10 С. Смесь перемешивали в течение 30 мин. К реакционной смеси добавляли воду (50 мл). Смесь экстрагировали этилацетатом. Органический экстракт промывали водой. Органическую фазу сушили безводным сульфатом магния и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле с использованием 70% этилацетата в гексанах. Очищенное соединение, указанное в заголовке, (6,79 г; выход 68%) получали в виде желтой смолы, которая содержала 6 мас.% этилацетата. 1 Н ЯМР (ДМСО)м.д.: 1,33 (т, 1 Н), 1,66-1,93 (м, 3 Н), 2,08-2,34 (м, 3 Н), 2,41 (с, 3 Н), 2,68 (д, 1 Н),2,76-3,19 (м, 4 Н), 5,14 (м, 4 Н), 6,47 (д, 1 Н), 6,56 (м, 2 Н), 7,07-7,19 (м, 3 Н), 7,20-7,53 (м, 12 Н), 7,71 (д, 1 Н),7,76 (s, 1H), 8,32 (д, 1 Н), 9,93 (с, 1 Н).(4S,7R,8R)-Метил-4-бензил-7-гидрокси-7-(трифторметил)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат (10 г; 23,9 ммоль, который может быть получен, как описано в приготовлении 6) и 3-амино-2-пиколин (2,71 г; 25,1 ммоль) растворяли в толуоле (200 мл). 1 М литий-бис(триметилсилил)амид в тетрагидрофуране (74,1 мл; 74,1 ммоль) добавляли с такой скоростью, чтобы поддерживать температуру ниже 35 С. Имело место слабое выделение тепла и при добавлении происходило осаждение твердого вещества. После этого добавления смесь выдерживали в течение дополнительных 30 мин. К смеси добавляли воду (250 мл). Имело место слабое выделение тепла и происходило растворение твердого вещества. Для предотвращения осаждения продукта к смеси добавляли этилацетат(50 мл). Перемешивание прекращали, чтобы дать возможность разделиться фазам. Водную фазу удаляли. Органическую фазу промывали водой (250 мл). Из органической фазы отгоняли растворитель (230 мл) при атмосферном давлении. Смесь охлаждали до температуры окружающей среды. Смесь фильтровали и твердое вещество промывали толуолом (2 раза), затем гептаном (2 раза). Твердое вещество сушили в вакуумной печи при 70 С. Соединение, указанное в заголовке настоящего примера, (10 г) получали в виде твердого вещества бежевого цвета. 1 Н ЯМР (ДМСО)м.д.: 1,32 (м, 1 Н), 1,82 (м, 4 Н), 2,10 (м, 4 Н), 2,41 (с, 3 Н), 2,68 (д, 1 Н), 3,08 (м, 3 Н),6,00 (с, 1 Н), 6,43 (д, 1 Н), 6,59 (м, 2 Н), 7,12 (м, 3 Н), 7,25 (дд, 1 Н), 7,44 (дд, 1 Н), 7,71 (дд, 1 Н), 7,75 (д, 1 Н),8,31 (дд, 1 Н), 9,91 (с, 1 Н). Пример 2. Дибензил-(2R,4S,10R)-4-бензил-7-2-метилпиридин-3-ил)карбамоил)-2-(трифторметил)1,2,3,4,4,9,10,10-октагидрофенантрен-2-илфосфат (6 г; 7,9 ммоль, который может быть получен, как описано в приготовлении 8) растворяли в метаноле (120 мл). К смеси добавляли 5% палладия-науглероде (63% воды) (1,3 г; 0,4 ммоль). Смесь обрабатывали водородом (50 psi, 3400 ГПа, 3,4 атм) при комнатной температуре. Реакция затухала с 12% остающегося монобензильного промежуточного соединения. Смесь фильтровали через слой материала Celite. Добавляли свежий катализатор (1,3 г) и возобновляли условия гидрирования. После завершения реакции смесь фильтровали через слой материалаCelite. Раствор концентрировали с отгонкой и без нее примерно до 60 мл с использованием роторного испарителя. При отгонке происходило осаждение белого твердого вещества. Смесь охлаждали до температуры окружающей среды. Смесь фильтровали и твердое вещество промывали метанолом. Твердое вещество сушили в вакуумной печи при 70 С. Соединение настоящего примера (3,36 г; выход 75%) получали в виде белого твердого вещества с хроматографической (ЖХ) чистотой 98% (по площади). 1I. Биологические данные. Для следующих описаний препараты сравнения представляют собой трициклические соединения(см., например, WO 2000/66522). Соединения примеров и препаратов сравнения были получены у Pfizer. Преднизолон применяли как клинически важный препарат сравнения (Р-6004; Sigma-Aldrich, St. Louis). Преобразование примера 2 в пример 1. Монослой клеток Сасо-2 представляет собой модель культуры ткани кишечного эпителия in vitro. Эти клетки происходят из толстой кишки человека; через 2-3 недели они становятся поляризованными,полностью дифференцированными энтероцитами. В дифференцированном состоянии эти клетки имеют плотные контакты и экспрессируют разнообразные биохимические процессы, такие как транспортеры активного эффлюкса, включая Р-гликопротеин (Р-gp). С этой моделью можно определять эффективную(кажущуюся) проницаемость (Papp) соединения сквозь поляризованный клеточный монослой Сасо-2. АВ-тест проводят с монослоями клеток Сасо-2 для определения Рарр для соединения, проникающего из камеры А в камеру В. Эта Рарр является показателем транспорта соединения из люминального пространства (кишечник) в серозное (кровь) через кишечный эпителий, что можно видеть при абсорбции в кишечнике. Пример 2 не совершал значительного пересечения монослоя клеток Сасо-2 (АВ, Рарр=1,15 е-6 см/с),тогда как нанесение примера 2 на апикальный компартмент приводило к значительному повышению уровня примера 1 как в апикальном, так и в базолатеральном компартментах. Эти данные указывают на механизм, в котором участвует дефосфорилирование примера 2 до примера 1, осуществляемое мембранными щелочными фосфатазами, локализованными в кишечных эпителиях, за которым следует всасывание примера 1 через монослой клеток Сасо-2 (АВ, Papp=37,5 е-6 см/с). Пероральное введение примера 2 (30 и 200 мг/кг) крысам с канюлированными портальными венами приводило к детектированию примера 1, но не примера 2, в образцах плазмы из портальной вены в течение периода продолжительностью 4 ч. Эти результаты указывали на проявление гидролиза примера 1 до примера 2 при первом прохождении и на избирательное кишечное всасывание примера 1.- 24016494 Пример 2 демонстрирует повышенную растворимость и внутреннее разложение, что приводит к улучшенному профилю пероральной абсорбции у крыс вследствие более продолжительного воздействия(1,61 мкгч/мл [по сравнению с 0,46 мкгч/мл для примера 1]) и увеличенной Cmax (0,59 мкг/мл [по сравнению с 0,13 мкг/мл для примера 1]), а также уменьшения времени до достижения Cmax (0,8 ч [по сравнению с 1,5 ч для примера 1]) у собак. У крыс биодоступность примера 2 была лучше, чем биодоступность примера 1 (биодоступность=59% для примера 2; биодоступность=17% для примера 1). Данные in vitroGRFP: Связывание с гликокортикоидным рецептором. Для оценки прямого связывания испытуемых соединений с белком глюкокортикоидного рецептора(GR) полной длины проводили исследование связывания с гликокортикоидным рецептором по поляризации флуоресценции. Реагенты для этого исследования приобретали у Invitrogen в виде аналитического набора. В качестве флуоресцентного индикатора, с которым конкурирует испытуемое соединение за связывание с GR, применяли флуоресцентно меченый лиганд GR. Изменение значения поляризации в присутствии испытуемых соединений является следствием связывания испытуемых соединений с GR; эти изменения использовали для определения IC50 и относительного сродства при связывании испытуемого соединения с GR.IC50 и % ингибирования для IL-6. Эпителиальные клетки легкого человека А 549 (Американская коллекция типовых культур,Rockville, MD) культивировали в среде Kaighn's F-12K с пенициллином и стрептомицином (10 ед./мл) и 10% термоинактивированной эмбриональной телячьей сыворотки (все от Invitrogen, Grand Island, NY). Клетки А 549 высевали при плотности 30000 клеток на лунку в 96-луночные планшеты и инкубировали в течение ночи при 37 С и с 5% СО 2. Клетки освобождали от сыворотки, заменяя ростовую среду бессывороточной средой Kaighn's F-12K с пенициллином и стрептомицином (10 ед./мл) и опять инкубировали в течение ночи при 37 С и с 5% СО 2. На 3-й день среду заменяли свежей бессывороточной средой и клетки инкубировали с соединением или без него (растворителем был DMSO, в максимальной концентрации 0,1%) в течение приблизительно 1 ч и затем стимулировали рекомбинантным человеческим IL(1 нг/мл; RD Systems, Minneapolis, MN) в течение 20 ч при 37 С и с 5% СО 2. Клеточные супернатанты собирали для определения уровней IL-6, используя 96-луночные планшеты MSD Single Spot (Meso ScaleDiscovery, Gaithersburg, MD) согласно инструкциям изготовителя. Планшеты считывали на приборе MSDSector Imager 6000. Преднизолон (1 мкМ) применяли в качестве максимального ингибитора как контроль- 25016494 со 100%-ным ингибированием. Растворитель применяли как контроль нулевого (0%) ингибирования. Процент ингибирования для каждой концентрации соединения относительно этих контролей рассчитывали с использованием Excel (Microsoft, Redmond, WA). Значения IC50 генерировала программа анализа данных GraFit 5.0 (Erithacus Software Ltd., Surrey, UK).IC50 и % ингибирования для TNF. Человеческие премоноцитарные клетки U937 (Американская коллекция типовых культур, Rockville,MD) культивировали в среде RPMI 1640 с глутамином (2 мМ), пенициллином-стрептомицином(10 ед./мл) и 10% термоинактивированной эмбриональной телячьей сывороткой (все от Invitrogen, GrandIsland, NY). Клетки дифференцировали в моноцитарный/макрофагальный фенотип форбол-12-миристат 13-ацетатом (Sigma-Aldrich, St. Louis, МО), 20 нг/мл, в течение ночи. Затем клетки центрифугировали,отсасывали среду, клетки ресуспендировали в равном объеме свежей среды RPMI 1640 с глутамином,пенициллином-стрептомицином и эмбриональной телячьей сывороткой, как указано выше, и инкубировали в течение 48 ч при 37 С и с 5% СО 2. После этого клетки снимали с подложки, подсчитывали и высевали согласно схеме эксперимента до стимуляции LPS, как описано ниже. Клетки U937 дифференцировали и высевали при плотности 200000 клеток на лунку в 96-луночные планшеты. Клетки инкубировали с соединением или без него (растворителем был DMSO в максимальной концентрации 1%) в течение приблизительно 1 ч и затем стимулировали липополисахаридом (LPS; 100 нг/мл) Е.coli серотипа 0111:В 4 (Sigma-Aldrich, St. Louis, МО) в течение 4 ч при 37 С и с 5% CO2. Клеточные супернатанты собирали для определения уровней TNF, применяя собственный вариант иммуноферментного анализа типа сэндвич-ELISA. Мышиные моноклональные антитела к человеческомуTNF (клон 28401.111) и биотинилированные козьи антитела к человеческому TNF (RD Systems,Minneapolis, MN) применяли как связывающие и детектирующие антитела соответственно. В качестве детектирующей системы применяли конъюгат стрептавидина с пероксидазой хрена (HRP) (RD Systems,Minneapolis, MN) и K-Blue Substrate/Red Stop (Neogen, Lexington, KY). Оптическую плотность измеряли при 650 нм. Концентрации TNF интерполировали из стандартной кривой для рекомбинантного белка человеческого TNF (RD Systems, Minneapolis, MN), применяя четырехпараметрическую логарифмическую модель программы анализа данных Magellan 4.11 (Tecan, Durham, NC). Преднизолон (1 мкМ) применяли в качестве максимального ингибитора как контроль со 100%-ным ингибированием. Растворитель применяли как контроль нулевого (0%) ингибирования. Процент ингибирования для каждой концентрации соединения относительно этих контролей рассчитывали с использованием Excel (Microsoft,Redmond, WA). Значения IC50 генерировала программа анализа данных LabStats Fit Curve V4.R7.MO(Pfizer Sandwich Laboratories, UK и Tessella Support Services plc, Abingdon UK). Цельная кровь человека ex vivo. Настоящее исследование сравнивает ингибирование продуцирования IL-1, IFN, IL-6 и TNF в цельной крови человека, стимулированной липополисахаридом ex vivo, производимое лигандами глюкокортикоидного рецептора (GR), в качестве которых использовали препарат сравнения А, пример 1 и преднизолон. Венозную кровь от доноров собирали в виде аликвот по 10 мкл в пробирки, содержащие натрийгепарин (BD Vacutainer от Becton Dickinson and Company, Franklin Lakes, NY). Кровь добавляли в стерильные полистирольные круглодонные 96-луночные планшеты для культивирования тканей (CorningCostar) по 100 мкл на лунку, оставляя свободными краевые лунки. Среды (RPMI Medium 1640 сL-глутамином, Invitrogen Corporation, Carlsbad, CA) добавляли к крови аликвотами по 90 мкл до общего объема 190 мкл. В краевые лунки вносили по 200 мкл среды. Кровь помещали во влажный инкубатор при 37 С с 5% CO2 на время подготовки соединений (приблизительно 60 мин). Соединения подготавливали из 10 мМ запасных растворов в диметилсульфоксиде (DMSO,Sigma-Aldrich). Запасное соединение серийно разбавляли в три раза добавлением DMSO (т.е. 5 мкл соединения + 10 мкл ДМСО), с последующим разбавлением в 167 раз в растворе-наполнителе (2% DMSO,30% этанола (AAPER Alcohol и Chemical Company) и 68% изотонического раствора хлорида натрия с фосфатным буфером (Dulbecco's Phosphate Buffered Saline без хлорида кальция, без хлорида магния,Invitrogen Corporation, Carlsbad CA. Соединение или раствор-наполнитель добавляли к крови трипликатами аликвот по 10 мкл. Конечные концентрации преднизолона и примера 1 в тесте были в диапазоне от 1000 до 0,457 нМ. Концентрации препарата сравнения А были в диапазоне от 3000 до 1,4 нМ. Конечные концентрации ДМСО и этанола в тесте составляли 0,1 и 1,5% соответственно. Образцы дважды осторожно перемешивали и опять помещали в инкубатор. Запасной липополисахарид (LPS) (E.coli серотипа 0111:В 4, Sigma-Aldrich), хранившийся в аликвотах по 100 мкг/мл в RPMI при -20 С, разбавляли в 50 раз в RPMI для получения рабочего запасного раствора. После 60 мин инкубации 10 мкл приготовленного рабочего запасного раствора LPS добавляли к крови до конечной концентрации 100 нг/мл, оставляя свободными краевые лунки планшета, предназначенные для использования в качестве отрицательного контроля. Образцы опять осторожно перемешивали и планшеты инкубировали 22 ч в течение ночи. После инкубации кровь центрифугировали при 1500g в течение 5 мин и отделяли плазму, которую замораживали при -20 С или анализировали на выделение цитокинов.- 26016494 Уровни белков IL-1, IFN, IL-6 и TNF: измеряли, применяя аналитические наборы Meso Scale(Meso Scale Discovery, Gaithersburg, MD). Реагентам давали возможность принять комнатную температуру. Планшеты Meso Scale блокировали, внося 30 мкл растворителя, применяемого для анализов человеческой плазмы и сыворотки, с осторожным встряхиванием в течение 60 мин при комнатной температуре. Планшеты промывали три раза промывочным буфером (PBS, Invitrogen Corporation, с 0,05% Твина-20,Sigma-Aldrich). Калибраторы для стандартных кривых готовили в растворителе, применяемом для анализов человеческой плазмы и сыворотки, в виде серийного пятикратного разбавления, до конечных концентраций в диапазоне от 50000 до 3,2 пг/мл. Образцы и калибраторы добавляли по 20 мкл на лунку и инкубировали при комнатной температуре при осторожном покачивании в течение 90 мин. Планшеты опять 3 раза промывали промывочным буфером. Детектирующие антитела разбавляли раствором, применяемым для анализов человеческой плазмы и сыворотки, до 1 мкг/мл и добавляли в планшеты по 20 мкл на лунку. Планшеты инкубировали как прежде в течение 60 мин и опять промывали. Буфер планшетного ридера Т (4) разбавляли водой 1:1 до двукратной концентрации и добавляли по 150 мкл в каждую лунку. Планшеты считывали на приборе SECTOR Imager 6000 (Meso Scale Discovery), генерирующем значения первичного сигнала. Значения, полученные для образцов IL-1, IFN, IL-6 и TNF, проверяли на нахождение в пределах стандартных кривых калибратора. Индивидуальные значения сравнивали с положительными и отрицательными контролями (кровь, обработанная растворителем с LPS, и кровь, обработанная растворителем без LPS, соответственно), рассчитывая % ингибирования. Трипликаты значений усредняли для каждого донора. Значения для двух доноров усредняли (для IL-1 использовали кровь только одного донора) и помещали на график, используя кривые с 4-параметрической аппроксимацией по программе GraFit 5.0.11. Средние значения ингибирования для преднизолона Средние значения ингибирования для примера 1- 27016494 Средние значения ингибирования для препарата сравнения А Пример 1 является эффективным соединением в моделях заболеваний. Артрит, индуцированный коллагеном у мышей (mCIA). Артрит, индуцированный коллагеном у мышей, является общепринятой хронической преклинической моделью ревматоидного артрита, в которой опухание суставов и разрушение костей появляются после иммунизации коллагеном типа II. Ранее было показано, что снижение заболеваемости и тяжести заболевания являются прогностическими показателями терапевтической эффективности и ослабления симптомов и проявлений заболевания соответственно в клинических условиях. В традиционной модели mCIA самцов мышей DBA/J иммунизировали куриным коллагеном типа II(cCII; 50 мкг) в полном адъюванте Фрейнда и затем реиммунизировали через 21 день, вводя 50 мкг cCII в неполном адъюванте Фрейнда. Лечение соединениями начинали утром в день реиммунизации и продолжали в течение 56 дней. Эффективность лечения измеряли по заболеваемости (т.е. по числу мышей, демонстрировавших любые признаки заболевания) и тяжести заболевания, причем каждый из этих показателей измеряли два раза в неделю. В терапевтической модели mCIA индукцию заболеваемости и тяжести заболевания синхронизировали посредством стимуляции липополисахаридом. Самцов мышей DBA/J иммунизировали, вводя в нулевой день по 100 мкг бычьего коллагена типа II (bCII). Все мыши получали внутрибрюшинную инъекцию 20 мкг LPS в день 28 и заболеванию давали возможность развиваться до дня 34. В день 34 все мыши имели это заболевание (заболеваемость составляла 100%) со средней тяжестью 7 баллов. Введение доз соединений начинали в терапевтическом режиме в день 34 и продолжали до дня 49. Различные способы лечения сравнивали, измеряя уменьшение заболеваемости (т.е. прекращение заболевания) и уменьшение его тяжести (ослабление опухания лап) во времени. Пример 1 имел число баллов менее 2 для mCIA (ED80) и. менее 1 для mCIA (ED50). Подавление TNF и остеокальцина (ОС). Соединения взвешивали и суспендировали в растворителе, содержащем 0,5% метилцеллюлозы,0,025% Твина 20 (Sigma-Aldrich, St. Louis, МО). Суспензии соединений гомогенизировали в тканевом гомогенизаторе Polytron PT-3100, создавая очень тонкую суспензию, и затем обрабатывали ультразвуком в течение 10 мин в ультразвуковой водяной бане. Аликвоты каждой суспензии готовили для ежедневного дозирования по 0,2 мл на дозу. Самок мышей Swiss Webster возрастом 10-12 недель, 28-29 г (Taconic,Germantown, NY) использовали согласно правилам Institutional Animal Care и Use Committee и согласно правилам NIH по содержанию лабораторных животных. Мышей акклиматизировали в виварии Pfizer в течение 3-7 дней до их использования в исследовании. Преднизолон и соединения вводили посредством орального зонда в течение всего 28 дней. Группы для каждого типа воздействия состояли из 5-10 мышей. Для выбора режима дозирования в этих исследованиях проводили пилотный фармакодинамический эксперимент во времени для количественного определения репрессии TNF после однократной ED80-дозы. Соединения, которые подавляли TNF, вводили один раз в день, а соединения, которые за 24 ч подавляли TNF менее чем на 50%, вводили два раза в день. Массу тела измеряли в первый и последний день каждого эксперимента. Образцы крови получали после трех недель дозирования для стационарного фармакокинетического (PK) анализа. Для оценки эффектов соединения на LPS-индуцированный TNF все мыши получали внутрибрюшинную инъекциюLPS (Salmonella typhosa, L-7895; Sigma-Aldrich, St. Louis,) через 2,5 ч после последней дозы в день 28. Мышей забивали через 90 мин после введения LPS. В образцах сыворотки количественно определяли остеокальцин и TNF, применяя мультиплексные тесты (Linco Research, Inc, St. Charles, MO; Luminex 100, Austin, TX). Образцы разбавляли 1:20 и проводили анализ согласно инструкциям изготовителя. Стандарт остеокальцина приобретали отдельно (Biomedical Technologies Inc., Stoughton, MA). В течение 4 ч перед отбором сыворотки для определения уровней TNF и остеокальцина мышей не кормили. Для каждого эксперимента выявляли выбросы результатов, рассчитывая число стандартных отклонений от среднегруппового значения. Если рассматриваемое значение отличалось от среднего более чем на 2,5 стандартных отклонения, его исключали из остальных расчетов. Затем для каждой мыши рассчитывали значения процента ингибирования, используя средние значения для контрольных групп с растворителем и 10 мг/кг преднизолона. Значения процента ингибирования для индивидуальных мышей аппроксимировали четырехпараметрической логарифмической моделью, использующей средние дозы для каждой группы. Поскольку были установлены все четыре параметра, а нижнее плато не было зафиксировано при 0% и верхнее плато не было зафиксировано при 100%,значения ED50 и ED80 рассчитывали по формуле обратной калибровки для ответа, равного 50 или 80% ингибирования или активации. Значения ED50 и ED80 представляют собой дозы (в мг/кг), требующиеся для достижения 50 или 80% эффекта соответственно на конкретной конечной точке. Значения ED50 и ED80 получали для различных конечных точек, применяя четырехпараметрическую логарифмическую аппроксимацию. Для тех соединений, которые испытывали многократно, значения ED50 и ED80 получали, применяя четырехпараметрические логарифмические аппроксимации данных, объединенных из многократных экспериментов. Для соединений, которые не достигали 80%-ного эффекта, значение ED80 обозначено как 10 или 20 мг/кг в зависимости от наибольшей испытанной дозы. Модель астмы, обусловленной домашним пылевым клещом. Мышам вводили три дозы примера 1 (0,1, 1 и 10 мг/кг, перорально, два раза в день) или преднизолона (0,1, 1 и 10 мг/кг, перорально, два раза в день). Отдельным группам животных вводили соответствующие растворители; они не показали никакого эффекта в отношении индуцированного домашним пылевым клещом прироста числа воспалительных клеток в жидкости бронхоальвеолярного лаважа. Пример 1 дозозависимым образом уменьшал инфильтрацию клеток в жидкость бронхоальвеолярного лаважа. Подсчет клеток различных типов в жидкости бронхоальвеолярного лаважа, выполненный с использованием проточной цитометрии, показал значительное снижение числа эозинофилов, нейтрофилов, лимфоцитов и Т-клеток. По сравнению с этим, сходные дозы преднизолона вызывали сходное снижение инфильтрации клеток в жидкости бронхоальвеолярного лаважа (данные не показаны).
МПК / Метки
МПК: A61P 19/02, A61P 29/00, A61P 1/00, A61K 31/44, A61P 11/06, C07F 9/58, A61P 25/28
Метки: соль, 2r,4αs,10αr)-4α-бензил-7-((2-метилпиридин-3-ил)карбамоил)-2-(трифторметил)-1,2,3,4,4α,9,10,10α-октагидрофенантрен-2-илдигидрофосфат
Код ссылки
<a href="https://eas.patents.su/30-16494-2r4alphas10alphar-4alpha-benzil-7-2-metilpiridin-3-ilkarbamoil-2-triftormetil-12344alpha91010alpha-oktagidrofenantren-2-ildigidrofosfat-ili-ego-sol.html" rel="bookmark" title="База патентов Евразийского Союза">(2r,4αs,10αr)-4α-бензил-7-((2-метилпиридин-3-ил)карбамоил)-2-(трифторметил)-1,2,3,4,4α,9,10,10α-октагидрофенантрен-2-илдигидрофосфат или его соль</a>
Предыдущий патент: Фунгицидные комбинации биологически активных веществ
Следующий патент: Гетероциклические соединения, содержащие их композиции и способы их применения
Случайный патент: Фунгицидные смеси на базе производных имидазола