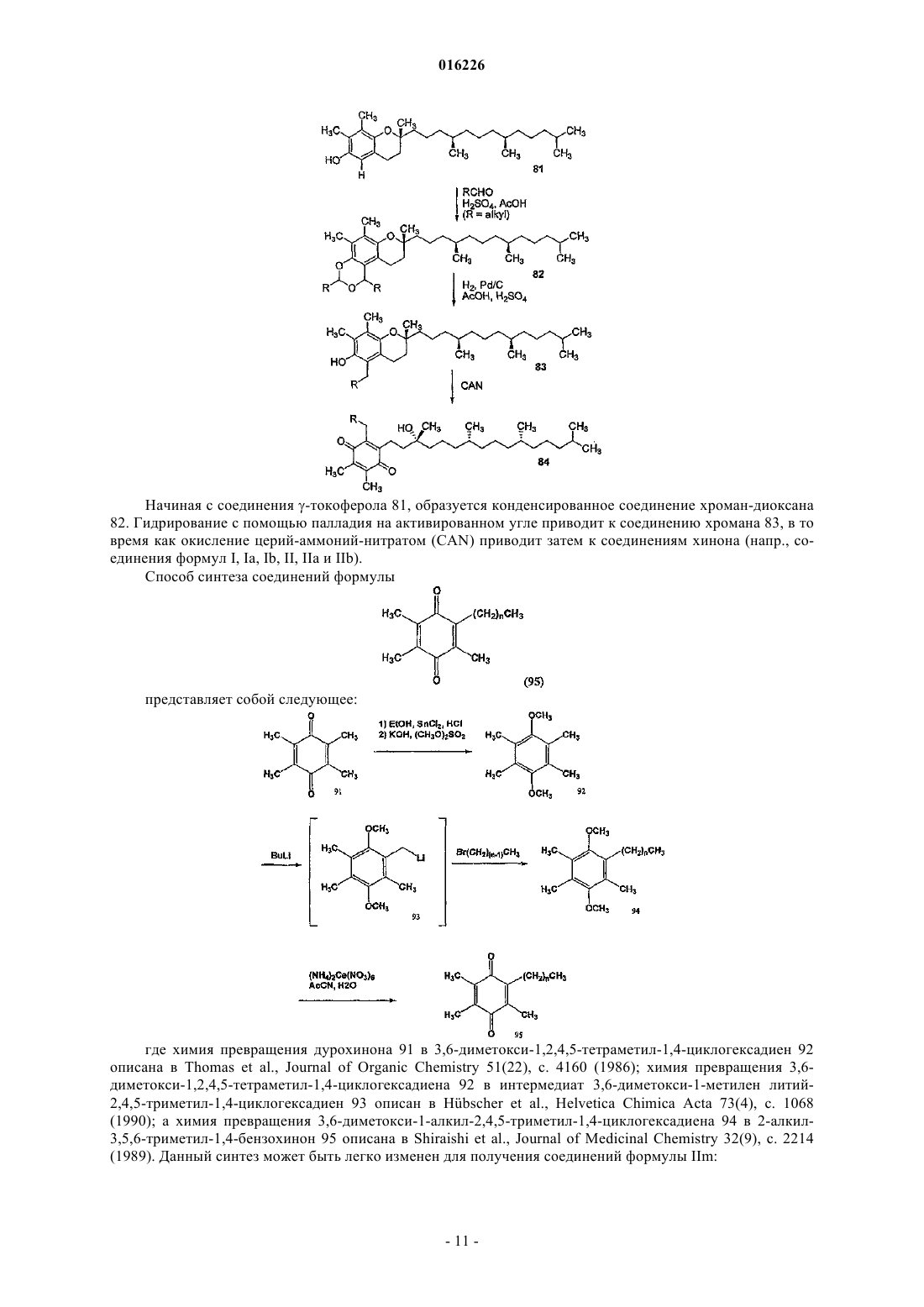
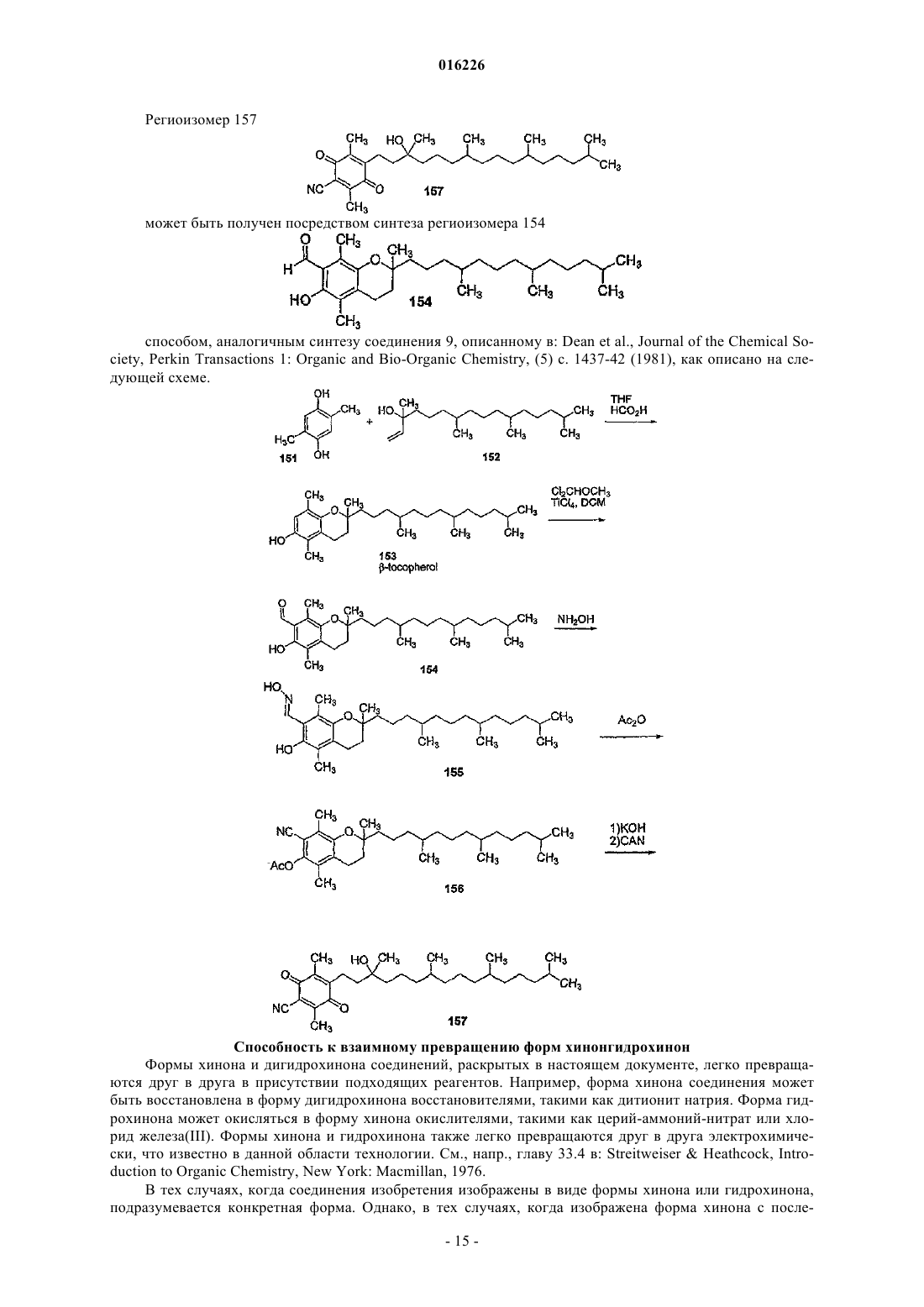
Редокс-активные терапевтические соединения для лечения митохондриальных заболеваний
Формула / Реферат
1. Способ лечения митохондриального нарушения, включающий введение пациенту терапевтически эффективного количества или эффективного количества одного или более соединения формулы
где R11, R12 и R13 независимо выбраны из Н, -С1-С4алкила, -С1-С4-алоалкила, -CN, -F, -Cl, -Br и -I с условием, что если любой из R11, R12 или R13 представляет собой Н, то по меньшей мере один из других двух заместителей не является ни Н, ни метилом; или его соли, стереоизомера, смеси стереоизомеров, сольвата или гидрата.
2. Способ по п.1, где одно или более соединение выбрано из соединения формулы

или его соли, стереоизомера, смеси стереоизомеров, сольвата или гидрата.
3. Способ по п.2, где соединение представляет собой
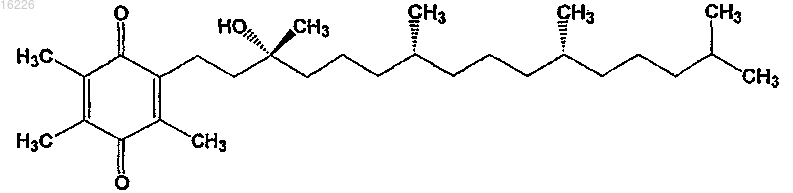
или его соль, стереоизомер, смесь стереоизомеров, сольват или гидрат.
4. Способ по п.1, где ни один из R11, R12 и R13 не является Н и по меньшей мере один из R11, R12 и R13 не является метилом.
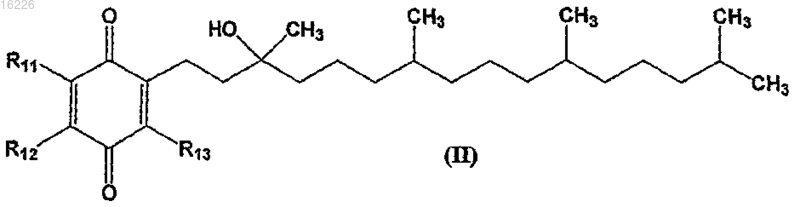
5. Соединение формулы
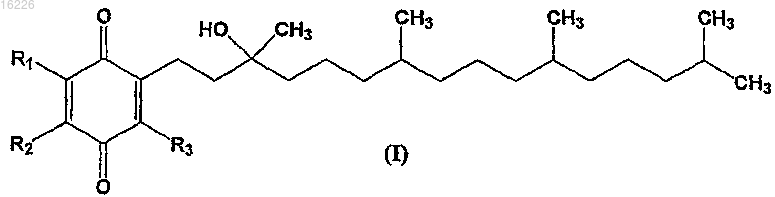
где R1, R2 и R3 независимо выбраны из -С1-С4алкила, -С1-С4галоалкила, -CN, -F, -Cl, -Br и -I с условием, что по меньшей мере один из R1, R2 и R3 не является метилом; или его соль, стереоизомер, смесь стереоизомеров, сольват или гидрат.
6. Способ лечения митохондриального нарушения, включающий введение пациенту терапевтически эффективного количества или эффективного количества одного или более соединений по п.5.
7. Фармацевтическая композиция, содержащая соединение формулы
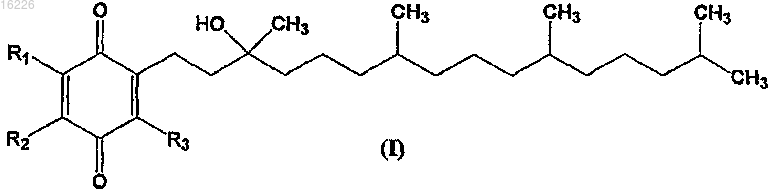
где R1, R2 и R3 независимо выбраны из -С1-С4алкила, -С1-С4галоалкила, -CN, -F, -Cl, -Br и -I с условием, что по меньшей мере один из R1, R2 и R3 не является метилом; или его соль, стереоизомер, смесь стереоизомеров, сольват или гидрат, дополнительно содержащая фармацевтически приемлемый наполнитель.
8. Способ по п.1, где митохондриальное нарушение выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с разрывом красных мышечных волокон (MERRF); митохондриальной миопатии, энцефалопатии, молочно-кислого ацидоза, инсульта (MELAS); наследственной оптической невропатии Лебера (LHON); болезни Ли; синдрома Кернса-Сейра (KSS); атаксии Фридрейха (FA); других миопатий; кардиомиопатии; энцефаломиопатии; почечного тубулярного ацидоза; нейродегенеративных заболеваний; болезни Паркинсона; болезни Альцгеймера; амиотрофического бокового склероза (ALS); мотонейронных заболеваний; других неврологических заболеваний; эпилепсии; генетических заболеваний; болезни Гентингтона; расстройств настроения; шизофрении; биполярных расстройств; заболеваний, связанных с возрастом; дистрофии желтого пятна; диабета и рака.
9. Способ по п.8, в котором митохондриальное нарушение представляет собой наследственную оптическую невропатию Лебера (LHON).
10. Способ по п.8, в котором митохондриальное нарушение представляет собой атаксию Фридрейха (FA).
11. Способ по п.8, в котором митохондриальное нарушение представляет собой болезнь Паркинсона.
12. Способ по п.8, в котором митохондриальное нарушение представляет собой болезнь Гентингтона.
13. Способ по п.8, в котором митохондриальное нарушение представляет собой болезнь Ли.
14. Способ по п.2, где митохондриальное нарушение выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с разрывом красных мышечных волокон (MERRF); митохондриальной миопатии, энцефалопатии, молочно-кислого ацидоза, инсульта (MELAS); наследственной оптической невропатии Лебера (LHON); болезни Ли; синдрома Кернса-Сейра (KSS); атаксии Фридрейха (FA); других миопатий; кардиомиопатии; энцефаломиопатии; почечного тубулярного ацидоза; нейродегенеративных заболеваний; болезни Паркинсона; болезни Альцгеймера; амиотрофического бокового склероза (ALS); мотонейронных заболеваний; других неврологических заболеваний; эпилепсии; генетических заболеваний; болезни Гентингтона; расстройств настроения; шизофрении; биполярных расстройств; заболеваний, связанных с возрастом; дистрофии желтого пятна; диабета и рака.
15. Способ по п.14, в котором митохондриальное нарушение представляет собой наследственную оптическую невропатию Лебера (LHON).
16. Способ по п.14, в котором митохондриальное нарушение представляет собой атаксию Фридрейха (FA).
17. Способ по п.14, в котором митохондриальное нарушение представляет собой болезнь Паркинсона.
18. Способ по п.14, в котором митохондриальное нарушение представляет собой болезнь Гентингтона.
19. Способ по п.14, в котором митохондриальное нарушение представляет собой болезнь Ли.
20. Способ по п.3, где митохондриальное нарушение выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с разрывом красных мышечных волокон (MERRF); митохондриальной миопатии, энцефалопатии, молочно-кислого ацидоза, инсульта (MELAS); наследственной оптической невропатии Лебера (LHON); болезни Ли; синдрома Кернса-Сейра (KSS); атаксии Фридрейха (FA); других миопатий; кардиомиопатии; энцефаломиопатии; почечного тубулярного ацидоза; нейродегенеративных заболеваний; болезни Паркинсона; болезни Альцгеймера; амиотрофического бокового склероза (ALS); мотонейронных заболеваний; других неврологических заболеваний; эпилепсии; генетических заболеваний; болезни Гентингтона; расстройств настроения; шизофрении; биполярных расстройств; заболеваний, связанных с возрастом; дистрофии желтого пятна; диабета и рака.
21. Способ по п.20, в котором митохондриальное нарушение представляет собой наследственную оптическую невропатию Лебера (LHON).
22. Способ по п.20, в котором митохондриальное нарушение представляет собой атаксию Фридрейха (FA).
23. Способ по п.20, в котором митохондриальное нарушение представляет собой болезнь Паркинсона.
24. Способ по п.20, в котором митохондриальное нарушение представляет собой болезнь Гентингтона.
25. Способ по п.20, в котором митохондриальное нарушение представляет собой болезнь Ли.
Текст
РЕДОКС-АКТИВНЫЕ ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ МИТОХОНДРИАЛЬНЫХ ЗАБОЛЕВАНИЙ Раскрываются способы лечения или супрессии митохондриальных заболеваний, таких как атаксия Фридрейха (FRDA), наследственная оптическая невропатия Лебера (LHON), митохондриальная миопатия, энцефалопатия, молочнокислый ацидоз, инсульт (MELAS) или синдром КернсаСейра (KSS), а также соединения, применимые в способах изобретения, такие как хинон альфа-токоферола. Также раскрываются способы и соединения, применимые в лечении других нарушений.desaturases//FEBS Letters, 1999-V.446. 1, с. 1,левая колонка, 1 абзац, с. 3, фиг. 1, реферат ТИМОЧКО М.Ф. и др. Метаболiчнi аспекти формувания кисневого гомеостазу в екстремальних станах, Львов, 1998, он-лайн 016226 Ссылки на родственные заявки Данная заявка заявляет права на приоритет предварительной заявки США 60/686826, зарегистрированной 1 июня 2005 г., предварительной заявки США 60/701815, зарегистрированной 21 июля 2005 г., и предварительной заявки США 60/776028, зарегистрированной 22 февраля 2006 г. Полные содержания указанных заявок тем самым включены в настоящий документ путем отсылки. Область техники, к которой относится изобретение Заявка раскрывает композиции и способы, применимые для лечения или супрессии заболеваний,вызванных митохондриальными нарушениями, таких как атаксия Фридрейха, наследственная оптическая невропатия Лебера, синдром Кернса-Сейра и митохондриальная миопатия, энцефалопатия, молочнокислый ацидоз, инсульт у пациента. Уровень техники Митохондрии представляют собой органеллы в эукариотических клетках, обычно называемые"электростанцией" клетки. Молекулы аденозинтрифосфата (АТФ) действуют как энергетическая "валюта" или носитель энергии в клетке, и эукариотические клетки получают большую часть своего АТФ в результате биохимических процессов, проходящих в митохондриях. Данные биохимические процессы включают цикл лимонной кислоты (цикл трикарбоновых кислот, или цикл Кребса), который генерирует восстановленный аденинникотинамиддинуклеотид (NADH + Н+) из окисленного аденинникотинамиддинуклеотида (NAD+), и окислительное фосфорилирование, в ходе которого NADH + Н+ окисляется обратно в NAD+. (Цикл лимонной кислоты также восстанавливает флавинадениндинуклеотид, или FAD, вFADH2; FADH2 также участвует в окислительном фосфорилировании). Электроны, высвободившиеся при окислении NADH + H+, обратимо циркулируют через последовательность белковых комплексов (Комплекс I, Комплекс II, Комплекс III и Комплекс IV), известную как дыхательная цепь. Эти комплексы встроены во внутреннюю мембрану митохондрии. Комплекс IV в конце цепи передает электроны к кислороду, который восстанавливается до воды. Энергия, высвободившаяся вследствие перемещения электронов в комплексах, используется для создания градиента протонов через внутреннюю мембрану митохондрии, что создает электрохимический потенциал через внутреннюю мембрану. Другой белковый комплекс, Комплекс V (который непосредственно не связан с Комплексами I, II, III и IV), использует энергию, сохраненную электрохимическим градиентом, для преобразования АДФ в АТФ. Циклу лимонной кислоты и окислительного фосфорилирования предшествует гликолиз, в котором молекула глюкозы разрывается на две молекулы пирувата, образуя в результате две молекулы АТФ из одной молекулы глюкозы. Молекулы пирувата затем поступают в митохондрию, где они полностью окисляются в CO2 и H2O через окислительное фосфорилирование (процесс в целом известен как аэробное дыхание). Полное окисление двух молекул пирувата в углекислый газ и воду приводит примерно, по меньшей мере, к 28-29 молекулам АТФ, в дополнение к 2 молекулам АТФ, генерируемым при трансформировании глюкозы в две молекулы пирувата. Если кислород не доступен, молекула пирувата не поступает в митохондрию, а скорее превращается в лактат в процессе анаэробного дыхания. В результате общий выход АТФ из молекулы глюкозы, таким образом, составляет приблизительно по меньшей мере 30-31 молекулу. АТФ используется, чтобы привести в действие, прямо или косвенно,все остальные биохимические реакции в клетке. Таким образом, дополнительные приблизительно по меньшей мере 28 или 29 молекул АТФ, внесенные при окислительном фосфорилировании во время аэробного дыхания, являются критичными для нормального функционирования клетки. Нехватка кислорода препятствует аэробному дыханию и приведет к окончательной гибели почти всех аэробных организмов; лишь некоторые организмы, такие как дрожжи, способны выжить с использованием или аэробного, или анаэробного дыхания. Если клетки в организме временно лишаются кислорода, анаэробное дыхание используется до тех пор, пока кислород снова не станет доступным, или клетка умирает. Пируват, генерируемый во время гликолиза, превращается в лактат во время анаэробного дыхания. Накапливание молочной кислоты, как полагают, ответственно за усталость мышцы во время интенсивных периодов активности, когда кислород не может быть доставлен в мышечные клетки. Если кислород снова становится доступным, лактат преобразовывается назад в пируват для использования в окислительном фосфорилировании. Генетические дефекты в белках, составляющих дыхательную цепь, приводят к тяжелым болезненным состояниям. Одно такое заболевание представляет собой атаксию Фридрейха (FRDA или FA). Атаксия Фридрейха является аутосомным рецессивным нейродегенеративным и кардиодегенеративным нарушением, вызванным пониженными уровнями белка фратаксина. Фратаксин важен для блока железосерных кластеров в митохондриальных комплексах дыхательной цепи. Оценка распространенностиFRDA в Соединенных Штатах лежит в диапазоне от 1 на 22000-29000 человек (см.(www.umccares.org/healthinfo/ADAM/Articles/001411.asp). Заболевание вызывает прогрессирующую потерю произвольной моторной координации (атаксию) и сердечные осложнения. Симптомы обычно проявляются в детстве, и заболевание прогрессивно ухудшается по мере того, как пациент становится старше; пациенты, в конечном счете, оказываются прикованными к инвалидному креслу в связи с двигательной беспо-1 016226 мощностью. Другим заболеванием, связанным с митохондриальной дисфункцией, является наследственная оптическая невропатия Лебера (LHON). Заболевание характеризуется слепотой, которая встречается в среднем в возрасте между 27 и 34 годами (www.ncbi.nlm.nih.gov/entrez/dispomim.cgiid=535000); слепота может развиться в обоих глазах одновременно или последовательно (слепота развивается в одном глазу с последующей слепотой в другом глазу в среднем в течение двух месяцев). Могут также встречаться другие симптомы, такие как сердечные заболевания и неврологические осложнения. Другими разрушительными синдромами, вызываемыми митохондриальными дефектами, являются митохондриальная миопатия, энцефалопатия, молочнокислый ацидоз и инсульт (MELAS). Заболевание может проявиться непосредственно у младенцев, детей или у взрослых в молодом возрасте. Инсульты,сопровождаемые рвотой и приступами, являются одним из самых серьезных симптомов; постулируется,что за смерть клетки и неврологические поражения ответственно метаболическое повреждение митохондрии в определенных областях мозга, а не нарушение кровотока, что наблюдается при ишемическом инсульте. Часто встречаются другие тяжелые осложнения, включая неврологические симптомы, а также наблюдаются повышенные уровни молочной кислоты в крови. Другое митохондриальное заболевание представляет собой синдром Кернса-Сейра (KSS). KSS отличается триадой признаков, включающих: (1) типичное возникновение у лиц моложе 20 лет; (2) хроническая, прогрессивная, внешняя офтальмоплегия; и (3) пигментная дегенерация сетчатки. Кроме того,KSS может включать нарушения сердечной проводимости, мозжечковую атаксию и увеличение содержания белка в цереброспинальной жидкости (CSF) (например,100 мг/дл). Дополнительные признаки,связанные с KSS, могут включать миопатию, дистонию, эндокринные расстройства (например, диабет,замедление роста или низкий рост и гипопаратиреоз), двустороннюю нейросенсорную глухоту, деменцию, катаракту и проксимальный почечный тубулярный ацидоз. Таким образом, KSS может поражать системы многих органов. Четыре вышеуказанных заболевания, по-видимому, вызваны дефектами в комплексе I дыхательной цепи. Перенос электронов из комплекса I к остатку дыхательной цепи осуществляется посредством соединения кофермент Q (также известный как убихинон). Окисленный кофермент Q (CoQox или убихинон) восстанавливается комплексом I в восстановленный кофермент Q (CoQred или убихинол). Восстановленный кофермент Q затем передает свои электроны комплексу III дыхательной цепи (минуя комплекс II), где он повторно окисляется в CoQox (убихинон). CoQox может затем участвовать в дальнейших циклах переноса электронов. Для пациентов, страдающих данными заболеваниями, доступны очень немного видов лечения. Недавно для лечения атаксии Фридрейха было предложено соединение идебенон. Несмотря на то, что клинический эффект идебенона является относительно слабым, осложнения митохондриальных заболеваний могут быть настолько тяжелыми, что даже малоэффективное лечение является предпочтительным по сравнению с отсутствием лечения в ходе заболевания. Для лечения митохондриальных нарушений было предложено другое соединение, MitoQ (см. опубликованную заявку на патент США 2005/0043553); о клинических результатах для MitoQ еще не сообщали. При KSS введение кофермента Q10 (CoQ10) и витаминных добавок показало только кратковременные благоприятные воздействия в отдельных случаях. Соответственно, существует серьезная и нереализованная потребность в эффективном лечении митохондриальных нарушений, таких как атаксия Фридрейха, наследственная оптическая невропатия Лебера, MELAS, и синдром Кернса-Сейра. Способность регулировать биологическое производство энергии имеет применение не только для заболеваний, описанных выше. Различные другие нарушения могут привести к недостаточным уровням энергетических биомаркеров (иногда также называемых индикаторами энергетической функции), таким,как уровни АТФ. Необходимо также лечение этих нарушений для того, чтобы модулировать один или более энергетических биомаркеров для улучшения здоровья пациента. В других практических применениях может быть желательно модулировать определенные энергетические биомаркеры далеко за пределы их нормальных значений у индивидуумов, не страдающих от заболевания. Например, если индивидуум испытывает чрезвычайно напряженную нагрузку, может быть желательно поднять уровень АТФ у этого индивидуума. Раскрытие изобретения В одном варианте реализации изобретение охватывает соединения формулы I где R1, R2 и R3 независимо выбраны из -С 1-С 4 алкила, -С 1-С 4 галоалкила, -CN, -F, -Cl, -Br и -I с усло-2 016226 вием, что по меньшей мере один из R1, R2 и R3 не является метилом; или их соли, стереоизомеры, смеси стереоизомеров сольваты или гидраты. В другом варианте реализации изобретение охватывает соединения формулы Ia где R1, R2 и R3 независимо выбраны из -С 1-С 4 алкила с условием, что по меньшей мере один из R1,R2 и R3 не являются метилом; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или их гидраты. В другом варианте реализации изобретение охватывает соединения формулы Ia, где R1 независимо выбран из метила, этила, н-пропила, изопропила, циклопропила, н-бутила, изобутила, втор-бутила, третбутила, циклобутила, циклопропилметила и метилциклопропана, где место присоединения R1 к остатку молекулы может быть в любом месте алкильного фрагмента; где R2 независимо выбран из метила, этила,н-пропила, изопропила, циклопропила, н-бутила, изобутила, втор-бутила, трет-бутила, циклобутила,циклопропилметила и метилциклопропана, где место присоединения R2 к остатку молекулы может быть в любом месте алкильного фрагмента; и где R3 независимо выбран из метила, этила, н-пропила, изопропила, циклопропила, н-бутила, изобутила, втор-бутила, трет-бутила, циклобутила, циклопропилметила и метилциклопропана, где место присоединения R3 к остатку молекулы может быть в любом месте алкильного фрагмента; с условием, что по меньшей мере один из R1, R2 и R3 не является метилом; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или гидраты. В другом варианте реализации изобретение охватывает соединения формулы Ia, где R1, R2, и R3 независимо выбраны из метила, этила, н-пропила и н-бутила с условием, что по меньшей мере один из R1,R2, и R3 не является метилом; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или гидраты. В другом варианте реализации изобретение охватывает соединения формулы Ia, где R1, R2, и R3 независимо выбраны из С 2-С 4 алкила; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или гидраты. В другом варианте реализации изобретение охватывает соединения формулы Ia, где R1, R2, и R3 независимо выбраны из С 2-С 4 н-алкила; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или гидраты. В другом варианте реализации изобретение охватывает соединения формулы Ia, где R1 независимо выбран из этила, н-пропила, изопропила, циклопропила, н-бутила, изобутила, втор-бутила, трет-бутила,циклобутила, циклопропилметила и метилциклопропана, где место присоединения R1 к остатку молекулы может быть в любом месте алкильного фрагмента; где R2 независимо выбран из этила, н-пропила,изопропила, циклопропила, н-бутила, изобутила, втор-бутила, трет-бутила, циклобутила, метилциклопропила, и метилциклопропана, где место присоединения R2 к остатку молекулы может быть в любом месте алкильного фрагмента; и где R3 независимо выбран из этила, н-пропила, изопропила, циклопропила, н-бутила, изобутила, втор-бутила, трет-бутила, циклобутила, циклопропилметила и метилциклопропана, где место присоединения R3 к остатку молекулы может быть в любом месте алкильного фрагмента; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или гидраты. В другом варианте реализации изобретение охватывает соединения формулы Ia, где любой из R1,R2, и R3 является метилом, а оставшиеся группы независимо выбраны из C2-С 4 алкила; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или гидраты. С 2-С 4 алкильные группы независимо выбраны из этила, н-пропила, изопропила, циклопропила, н-бутила, изобутила, втор-бутила, трет-бутила, циклобутила, циклопропилметила и метилциклопропана, где место присоединения C2-С 4 алкильной группируются к остатку молекулы, могут быть при любой локализацией на алкил фрагменты. В другом варианте реализации изобретение охватывает соединения формулы Ia, где любые два изR1, R2, и R3 являются метилами, а оставшаяся группа независимо выбрана из C2-С 4 алкила; или их соли,стереоизомеры, смеси стереоизомеров, сольваты или гидраты. C2-C4 алкильная группа независимо выбрана из этила, н-пропила, изопропила, циклопропила, н-бутила, изобутила, втор-бутила, трет-бутила,циклобутила, циклопропилметила и метилциклопропана, где место присоединения C2-C4 алкильной группы к остатку молекулы может быть в любом месте алкильного фрагмента. В другом варианте реализации изобретение охватывает соединения формулы Ib где R1, R2, и R3 являются такими, как определено выше для формулы I, формулы Ia и всех вариантов-3 016226 реализации формулы Ia. В другом варианте реализации изобретение охватывает способ лечения или супрессии митохондриального нарушения, модуляции одного или более энергетических биомаркеров, нормализации одного или более энергетических биомаркеров или повышения одного или более энергетических биомаркеров путем введения терапевтически эффективного количества или эффективного количества одного или более соединений формулы I, формулы Ia или формулы Ib, или вариантов реализации формулы I, формулыIa или формулы Ib, как описано выше. В другом варианте реализации изобретение охватывает способ лечения или супрессии митохондриального нарушения, модуляции одного или более энергетических биомаркеров, нормализации одного или более энергетических биомаркеров или повышения одного или более энергетических биомаркеров путем введения терапевтически эффективного количества или эффективного количества одного или более соединений формулы II где R11, R12, и R13 независимо выбраны из Н, -C1-С 4 алкила, -С 1-С 4 галоалкила, -CN, -F, -Cl, -Br, и -I с условием, что если любой из R1, R2, и или R3 представляет собой Н, то по меньшей мере один из других двух заместителей не является ни Н, ни метилом; или их соли, стереоизомеры, смеси стереоизомеров,сольваты или гидраты. В одном варианте реализации все R11, R12 и R13 являются метилами. В другом варианте реализации по меньшей мере один из R11, R12 и R13 не является метилом. В другом варианте реализации изобретение охватывает способ лечения или подавления митохондриального нарушения, модуляции одного или более энергетических биомаркеров, нормализации одного или более энергетических биомаркеров или повышения одного или более энергетических биомаркеров путем введения терапевтически эффективного количества или эффективного количества хинона альфатокоферола. В другом варианте реализации изобретение охватывает способ лечения или супрессии митохондриального нарушения, модуляции одного или более энергетических биомаркеров, нормализации одного или более энергетических биомаркеров или повышения одного или более энергетических биомаркеров путем введения терапевтически эффективного количества или эффективного количества одного или более соединений формулы IIa где R11 независимо выбран из Н, метила, этила, н-пропила, изопропила, циклопропила, н-бутила,изобутилен, втор-бутила, трет-бутила, циклобутила, циклопропилметила и метилциклопропана, где место присоединения R11 к остатку молекулы может быть в любом месте алкильного фрагмента; где R12 независимо выбран из Н, метила, этила, н-пропила, изопропила, циклопропила, н-бутила, изобутила,втор-бутила, трет-бутила, циклобутила, циклопропилметила и метилциклопропана, где место присоединения R12 к остатку молекулы может быть в любом месте алкильного фрагмента; и где R13 независимо выбран из Н, метила, этила, н-пропила, изопропила, циклопропила, н-бутила, изобутила, втор-бутила,трет-бутила, циклобутила, циклопропилметила и метилциклопропана, где место присоединения R13 к остатку молекулы может быть в любом месте алкильного фрагмента; с условием, что, если любой из R11,R12 или R13 представляет собой Н, то по меньшей мере один из двух других заместителей не является ни Н, ни метилом; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или гидраты. В одном варианте реализации все R11, R12 и R13 являются метилом. В другом варианте реализации по меньшей мере один из R11, R12 и R13 не является метилом. В другом варианте реализации изобретение охватывает способ лечения или супрессии митохондриального нарушения, модуляции одного или более энергетических биомаркеров, нормализации одного или более энергетических биомаркеров или повышения одного или более энергетических биомаркеров путем введения терапевтически эффективного количества или эффективного количества одного или более соединений формулы IIa, где R11, R12 и R13 независимо выбраны из Н, метила, этила, н-пропила и нбутила; с условием, что если любой из R11, R12 или R13 является Н, то по меньшей мере один из других двух заместителей не является ни Н, ни метилом; или их соли, стереоизомеры, смеси стереоизомеров,сольваты или гидраты.-4 016226 В другом варианте реализации изобретение охватывает способ лечения или супрессии митохондриального нарушения, модуляции одного или более энергетических биомаркеров, нормализации одного или более энергетических биомаркеров или повышения одного или более энергетических биомаркеров путем введения терапевтически эффективного количества или эффективного количества одного или более соединений формулы IIa, где R11, R12 и R13 независимо выбраны из -С 1-С 4 алкила; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или гидраты. В другом варианте реализации изобретение охватывает способ лечения или супрессии митохондриального нарушения, модуляции одного или более энергетических биомаркеров, нормализации одного или более энергетических биомаркеров, или повышения одного или более энергетических биомаркеров путем введения терапевтически эффективного количества или эффективного количества одного или более соединений формулы IIa, где R11, R12 и R13 независимо выбраны из -С 1-С 4 н-алкила; или их соли, стереоизомеры, смеси стереоизомеров, сольваты или гидраты. В другом варианте реализации изобретение охватывает способ лечения или супрессии митохондриального нарушения, модуляции одного или более энергетических биомаркеров, нормализации одного или более энергетических биомаркеров, или повышения одного или более энергетических биомаркеров путем введения терапевтически эффективного количества или эффективного количества одного или более соединений формулы IIb где R11, R12 и R13 являются такими, как описано выше для формулы II или формулы IIa. В одном варианте реализации все R11, R12 и R13 представляют собой метил. В другом варианте реализации по меньшей мере один из R11, R12, и R13 не является метилом. В другом варианте реализации, включающем любой из предшествующих вариантов реализации,митохондриальное нарушение выбирается из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с разрывом красных мышечных волокон (MERRF); митохондриальной миопатии, энцефалопатии, молочнокислого ацидоза, инсульта (MELAS); наследственной оптической невропатии Лебера (LHON); заболевания Ли; синдрома Кернса-Сейра (KSS); атаксии Фридрейха(FA); других миопатий; кардиомиопатии; энцефаломиопатии; почечного тубулярного ацидоза; нейродегенеративньгх заболеваний; болезни Паркинсона; болезни Альцгеймера; бокового амиотрофического склероза (ALS); мотонейронных заболеваний; других неврологических заболеваний; эпилепсии; генетических заболеваний; заболевания Гентингтона; расстройств настроения; шизофрении; биполярных расстройств; заболеваний, связанных с возрастом; дистрофии желтого пятна; диабета и рака. В другом варианте реализации, включающем любой из предшествующих вариантов реализации,митохондриальное нарушение выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с разрывом красных мышечных волокон (MERRF); митохондриальной миопатии, энцефалопатии, молочнокислого ацидоза, инсульта (MELAS); наследственной оптической невропатии Лебера (LHON); заболевания Ли; синдрома Кернса-Сейра (KSS) и атаксии Фридрейха(FA). В другом варианте реализации изобретения, включающем любой из предшествующих вариантов реализации, митохондриальное нарушение представляет собой атаксию Фридрейха (FRDA). В другом варианте реализации изобретения митохондриальное нарушение представляет собой наследственную оптическую невропатию Лебера (LHON). В другом варианте реализации изобретения митохондриальное нарушение представляет собой митохондриальную миопатию, энцефалопатию, молочнокислый ацидоз,инсульт (MELAS). В другом варианте реализации изобретения митохондриальное нарушение представляет собой синдром Кернса-Сейра (KSS). В другом варианте реализации изобретения митохондриальное нарушение представляет собой миоклоническую эпилепсию с разрывом красных мышечных волокон(MERRF). В другом варианте реализации изобретения митохондриальное нарушение представляет собой болезнь Паркинсона. В другом варианте реализации изобретения, включающем любой из предшествующих вариантов реализации, соединения, описанные в настоящем документе, вводят пациентам, страдающим от митохондриального нарушения, для модуляции одного или более различных энергетических биомаркеров,включая, но, не ограничиваясь, уровни молочной кислоты (лактата) или в цельной крови, плазме, цереброспинальной жидкости, или в церебровентрикулярной жидкости; уровни пировиноградной кислоты(NADPH + Н+); NAD или уровни NADP; уровни АТФ; уровни восстановленного кофермента Q (CoQred);-5 016226 уровни окисленного кофермента Q (CoQox); уровни общего кофермента Q (CoQtot); уровни окисленного цитохрома С; уровни восстановленного цитохрома С; отношение окисленный цитохром С/восстановленный цитохром С; уровни ацетоацетата; уровни бета-гидроксибутирата; отношение ацетоацетат/бета-гидроксибутират; уровни 8-гидрокси-2'-дезоксигуанозина (8-OHdG); уровни соединений активного кислорода; потребление кислорода (VO2), образование углекислого газа (VCO2), дыхательный коэффициент (VCO2/VO2), и модуляции отсутствия выносливости при физической нагрузке (или наоборот, модуляции выносливости при физической нагрузке), и модуляции анаэробного порога. Энергетические биомаркеры могут измеряться в цельной крови, плазме, цереброспинальной жидкости, церебровентрикулярной жидкости, артериальной крови, венозной крови или любой другой жидкости организма,газе тела, или другом биологическом образце, применимом для такого измерения. В одном варианте реализации уровни модулируются до значения в пределах примерно 2 стандартных отклонения от значения для здорового пациента. В другом варианте реализации уровни модулируются в пределах примерно 1 стандартное отклонение от значения для здорового пациента. В другом варианте реализации уровни у пациента изменяются по меньшей мере примерно на 10% выше или ниже уровня у пациента до модуляции. В другом варианте реализации уровни изменяются по меньшей мере примерно на 20% выше или ниже уровня у пациента до модуляции. В другом варианте реализации уровни изменяются по меньшей мере примерно на 30% выше или ниже уровня у пациента до модуляции. В другом варианте реализации уровни изменяются по меньшей мере примерно на 40% выше или ниже уровня у пациента до модуляции. В другом варианте реализации уровни изменяются по меньшей мере примерно на 50% выше или ниже уровня у пациента до модуляции. В другом варианте реализации уровни изменяются по меньшей мере примерно на 75% выше или ниже уровня у пациента до модуляции. В другом варианте реализации уровни изменяются по меньшей мере примерно на 100% выше или по меньшей мере примерно на 90% ниже уровня у пациента до модуляции. В другом варианте реализации изобретение охватывает одно или более соединений формулы I, Ia,Ib, IIa, IIb в комбинации с фармацевтически приемлемым инертным наполнителем, носителем или средством доставки. В другом варианте реализации изобретение охватывает применение одного или более соединений формулы I, Ia, Ib, IIa, IIb в терапии. В другом варианте реализации изобретение охватывает применение одного или более соединений формулы I, Ia, Ib, IIa, IIb в терапии митохондриальной болезни. В другом варианте реализации изобретение охватывает применение одного или более соединений формулы I, Ia,Ib, IIa, IIb в производстве лекарственного препарата для применения в терапии митохондриальной болезни. Для всех соединений и способов, описанных выше, форма хинона может также использоваться в ее восстановленной форме (гидрохинон), если желательно. Аналогично, форма гидрохинона может также использоваться в ее окисленной форме (хинон), если желательно. Осуществление изобретения Изобретение охватывает соединения, применимые в лечении или супрессии митохондриальных нарушений, и способы использования таких соединений для модуляции энергетических биомаркеров. Окислительно-восстановительно активная терапия для лечения или супрессии митохондриальных болезней и связанных аспектов изобретения описывается более подробно в настоящем документе. Под "испытуемым", "индивидуумом" или "пациентом" понимают индивидуальный организм, предпочтительно позвоночный, более предпочтительно млекопитающее, наиболее предпочтительно человек."Лечение" заболевания соединениями и способами, обсуждаемыми в настоящем документе, определяется как применение одного или более соединений, обсуждаемых в настоящем документе, с или без дополнительных терапевтических средств для уменьшения или прекращения или заболевания, или одного или более симптомов заболевания, или для замедления прогрессирования заболевания или одного или более симптомов заболевания, или уменьшения серьезности заболевания или одного или более симптомов заболевания. "Супрессия" заболевания соединениями и способами, обсуждаемыми в настоящем документе, определяется как применение одного или более соединений, обсуждаемых в настоящем документе, с или без дополнительных терапевтических средств для супрессии клинического проявления заболевания или супрессии проявления неблагоприятных симптомов заболевания. Различие между лечением и супрессией заключается в том, что лечение проводится после того, как у пациента проявляются неблагоприятные симптомы заболевания, в то время как супрессия проводится до того, как у пациента проявляются неблагоприятные симптомы заболевания. Супрессия может быть частичной, практически полной или полной. Поскольку многие из митохондриальных нарушений являются наследственными, для идентификации пациентов с опасностью заболевания может использоваться генетический скрининг. Затем соединения и способы изобретения могут вводиться бессимптомным пациентам из-за опасности развития клинических симптомов заболевания для подавления проявления любых неблагоприятных симптомов. "Терапевтическое применение" соединений, обсуждаемых в настоящем документе, определяется как использование одно или более соединений, обсуждаемых в настоящем документе, для лечения или супрессии заболеваний, как определено выше. "Эффективное количество" соединения является количеством соединения, достаточного для модуляции, нормализации или повышения одного или более энерге-6 016226 тических биомаркеров (термины модуляция, нормализация и усиление определены ниже). "Терапевтически эффективное количество" соединения является количеством соединения, которого при введении пациенту достаточно для уменьшения или устранения или заболевания, или одного или более симптомов заболевания, или замедления прогрессирования заболевания или одного или более симптомов заболевания, или уменьшения серьезности заболевания или одного или более симптомов заболевания, или подавления клинического проявления заболевания, или подавления проявления неблагоприятных симптомов заболевания. Терапевтически эффективное количество может вводиться однократно или за несколько приемов. "Эффективное количество" соединения включает как терапевтически эффективное количество,так и количество, достаточное для модуляции, нормализации или повышения одного или более энергетических биомаркеров у пациента."Модуляция" или "модулировать" энергетический биомаркер означает изменение уровня энергетического биомаркера до желательного значения, или изменение уровня энергетического биомаркера в желательном направлении (например, увеличение или уменьшение). Модуляция может включать, но не ограничивается, нормализацию и увеличение, как определено ниже."Нормализация" или "нормализовать" энергетический биомаркер определяется как изменение уровня энергетического биомаркера от патологического значения до нормального значения, где нормальное значение энергетического биомаркера может быть 1) уровнем энергетического биомаркера у здорового человека или пациента или 2) уровнем энергетического биомаркера, облегчающим один или более нежелательных симптомов у человека или пациента. Таким образом, подвергать нормализации энергетический биомаркер, который понижен в состоянии заболевания, означает увеличить уровень энергетического биомаркера до нормального (здорового) значения или до значения, которое облегчает нежелательный симптом; нормализовать энергетический биомаркер, который повышен в состоянии заболевания, означает уменьшить уровень энергетического биомаркера до нормального (здорового) значения или до значения, которое облегчает нежелательный симптом."Повышение" или "повышать" энергетические биомаркеры означает преднамеренное изменение уровня одного или более энергетических биомаркеров от или нормального значения, или значения перед повышением для достижения полезного или желательного эффекта. Например, в ситуации, где пациент испытывает значительные энергетические потребности, может быть желательно повысить уровень АТФ у этого пациента до уровня выше нормального уровня АТФ для этого пациента. Повышение может также иметь благоприятное воздействие для пациента, страдающего от заболевания или патологии, такой как митохондриальное заболевание, при котором нормализация энергетического биомаркера не позволяет достигнуть оптимального результата для пациента; в таких случаях повышение одного или более энергетических биомаркеров может быть полезным, например, для такого пациента могут быть полезными уровень АТФ выше нормального, или уровень молочной кислоты (лактата) ниже нормального. Под модуляцией, нормализацией или повышением энергетического биомаркера Кофермента Q подразумевается корректировка, нормализация или повышение варианта или вариантов Кофермента Q, который является преобладающим у интересующей особи. Например, вариантом Кофермента Q, который преобладает у человека, является Кофермент Q10. Если у особи или пациента есть более одного варианта Кофермента Q, присутствующих в значительном количестве (то есть, присутствующих в количестве,которое при модуляции, нормализации или увеличении может иметь благоприятное воздействие для особи или пациента), корректировка, нормализация или повышение Кофермента Q может относиться к модуляции, нормализации или повышению любых вариантов Кофермента Q, присутствующих у особи или пациента. Несмотря на то, что соединения, описанные в настоящем документе, могут находиться и использоваться в виде нейтральных соединений (не солей), данное описание предназначено для того, чтобы охватить все соли соединений, описанных в настоящем документе, а также способы использования таких солей соединений. В одном варианте реализации соли соединений включают фармацевтически приемлемые соли. Фармацевтически приемлемые соли представляют собой соли, которые можно вводить в качестве лекарственных средств или фармацевтических препаратов людям и/или животным и которые при введении сохраняют по меньшей мере часть биологической активности свободного соединения (нейтрального соединения, или соединения, не являющегося солью). Желательная соль основного соединения может быть приготовлена способами, известными специалистам в данной технологии, путем обработки соединения кислотой. Примеры неорганических кислот включают, но не ограничиваются, соляную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту. Примеры органических кислот включают, но не ограничиваются, муравьиную кислоту, уксусную кислоту,пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, сульфокислоты и салициловую кислоту. Соли основных соединений с аминокислотами, такими как соли аспартата и соли глутамата,также могут быть приготовлены. Желательная соль кислого соединения может быть приготовлена способами, известными специалистам, путем обработки соединения основанием. Примеры неорганических солей кислотных соединений включают, но не ограничиваются, соли щелочных и щелочно-земельных-7 016226 металлов, таких как соли натрия, соли калия, соли магния и соли кальция; соли аммония и соли алюминия. Примеры органических солей кислотных соединений включают, но не ограничиваются, новокаин,дибензиламин, N-этилпиперидин, N,N'-дибензилэтилендиамин и соли триэтиламина. Соли кислых соединений с аминокислотами, как например, соли лизина, также могут быть приготовлены. Изобретение также включает все стереоизомеры соединений, включая диастереомеры и энантиомеры. Изобретение также включает смеси стереоизомеров в любом соотношении, включая, но не ограничиваясь, рацемические смеси. Если в структуре стереохимия явно не обозначена, структура предназначена для того, чтобы охватить все возможные стереоизомеры изображенного соединения. Если стереохимия явно указана для одной части или частей молекулы, но не для другой части или частей молекулы, структура предназначена для того, чтобы охватить все возможные стереоизомеры для части или частей, для которых стереохимия явно не обозначена. Соединения могут вводиться в форме пролекарства. Пролекарства - производные соединений, которые самостоятельно относительно неактивны, но которые превращаются в активное соединение при введении пациенту, для которого они используются, химическим или биологическим процессом in vivo,таким как ферментативное превращение. Пригодные составы пролекарства включают, но не ограничиваются, пептидные конъюгаты соединений изобретения и сложные эфиры соединений изобретения. Дальнейшее обсуждение пригодных пролекарств представлено в Н. Bundgaard, Design of Prodrugs, Newof Biopharmaceutical Properties Through Prodrugs and Analogs (Symposium sponsored by Medicinal Chemistry Section, APhA Academy of Pharmaceutical Sciences, November 1976 national meeting, Orlando, Florida),Washington: The Academy, 1977. Различные соединения изобретения, особенно соединения V, Va, Vb, VI, VIa и VIb, а также различные варианты их реализации, могут вводиться или как терапевтические средства сами по себе, или как пролекарства, которые преобразуются в другие терапевтически эффективные или эффективные вещества в организме. Метаболиты соединений также охватываются в соответствии с изобретением. Однако метаболиты веществ, которые у испытуемых образуются естественным путем, такие как метаболиты хинона альфатокоферола, исключаются из заявленных соединений изобретения."С 1-С 4 алкил", как предполагается, охватывает метил (Me), этил (Et), пропил (Pr), н-пропил (nPr),изопропил (iPr), бутил (Bu), н-бутил (nBu), изобутил (iBu), втор-бутил (sBu), трет-бутил (tBu), циклопропил (cyclPr), циклобутил (cyclBu), метилциклопропил (cyclPr-Ме) и метилциклопропан (Ме-cyclPr), где С 1-С 4 алкильная группа может присоединяться через любую валентность С 1-С 4 алкильной группы. Заместители "галогенный" или "гало" обозначают фтор (-F), хлор (-Cl), бром (-бром) и йод (-I)."С 1-С 4 галоалкил", как предполагается, охватывает любой С 1-С 4 алкильный заместитель, имеющий по меньшей мере один галогенный заместитель; галоген может присоединяться через любую валентность С 1-С 4 алкильной группы. Одна подгруппа С 1-С 4 галоалкила представляет собой -CF3, -CCl3, -CBr3 и-CI3. Другая подгруппа С 1-С 4 галоалкила представляет собой подгруппу точно с одним галогенным заместителем. Другая подгруппа C1-С 4 галоалкила представляет собой подгруппу С 1-С 4 пергалоалкила; то есть С 1-С 4 алкил, в котором все доступные валентности замещены галогенами. Другая подгруппа С 1 С 4 галоалкила представляет собой подгруппу С 1-С 4 перфтороалкила; то есть С 1-С 4 алкил, в котором все доступные валентности замещены фтором. Другая подгруппа галоалкила С 1-С 4 представляет собой подгруппу С 1-С 4 перхлороалкила; то есть С 1-С 4 алкил, в котором все доступные валентности в замещены хлором. Одним важным соединением, которое можно использовать в любом из способов изобретения, является хинон -токоферола. Структура хинона альфа-токоферола (Dтокоферолхинон; альфатокоферилхинон; 2-[(3R,7R,11R)-3-гидрокси-3,7,11,15-тетраметилгексадецил]-3,5,6-триметил-2,5 циклогексадиен-1,4-дион, регистрационный номер CAS 7559-04-8) представляет собой Другим названием хинона альфа-токоферола является альфа-токоферилхинон. Данное соединение соответствует соединению формулы IIb, где все R11, R12, и R13 являются метилом. В моделях FRDA на клеточной культуре человека хинон альфа-токоферола показывает EC50 в 105 раз ниже (т.е. в 100 000 раз более сильное) чем идебенон, используемое в настоящее время терапевтическое средство для пациентов с FRDA; см. Пример 2. В той же самой модели клеточной культуры хинон альфа-токоферола имеет ЕС 50 в 10 раз ниже (т.е. в 10000 раз более сильное), чем альфа-D-токоферол, (2R)-3,4-дигидро-2,5,7,8-8 016226 тетраметил-2-[(4R,8R)-4,8,12-триметилтридецил]-2H-1-бензопиран-6-ол, обычная форма витамина Е. Другая группа важных соединений представляется формулой IIm: где отсутствие обозначений стереохимии указывает на то, что данная структура предназначена для представления всех восьми возможных стереоизомеров, поскольку существуют 2 различные возможные ориентации в положениях 3, 7 и 11, как показано на графическом изображении формулы IIm. ФормулаIIm соответствует формуле II, в которой все R11, R12 и R13 являются метилом. Восемь стереоизомеров,охваченных данным изображением структуры, включают: [(3R,7R,11R)-3-гидрокси-3,7,11,15 тетраметилгексадецил]-3,5,6-триметил-2,5-циклогексадиен-1,4-дион); 3R,7R,11S-соединение; 3R,7S,11Rсоединение; 3S,7R,11R-соединение; 3R,7S,11R-соединение; 3S,7R,11S-соединение; 3S,7S,11Rсоединение и 3S,7S,11S-соединение. Синтез соединений формулы I и формулы II Соединения формулы I и формулы II могут легко синтезироваться множеством способов. Синтез хинона альфа-токоферола подробно описан в нескольких ссылках, например, США 3406188 (GB 1059155) и США 4310465. Синтез соединений типа бензохинона раскрывается в патентах США 5229385 и США 4393075. В нескольких из нижеупомянутых способов используется окислитель. Окислители, пригодные для использования в способах синтеза, включают, но не ограничиваются, церий-аммоний-нитрат (CAN),FeCl3, 2,3-дихлоро-5,6-дициано-1,4-бензохинон (DDQ) или атмосферный кислород (то есть, окисление воздухом). Для получения соединений формул I, Ia, Ib, II, IIa, IIb могут применяться несколько способов. Один такой способ использует оксисульфониевую перегруппировку следующим образом: Исходный материал 4-гидрокси-2,3,6-триметилфенилацетат, 51, получают, как описано в Weichet etal., Coll. Czech. Chem. Comm., 31, с. 4598 (1966). Соединение 52 получают и подвергают взаимодействию с соединением 51 и сульфурилхлоридом как в Inoue et al., J. Org. Chem. Soc, 52, с. 5495 (1987) с образованием соединения 53. Удаление изопропил-сульфидной функциональной группы на никеле Ренея, сопровождаемое удалением ацетильных групп с литий-алюминийгидридом, приводит к соединению гидрохинона 54, соответствующему формуле IVb, где R11, R12 и R13 являются метилом. Окисление соединения гидрохинона 54 хлоридом железа (III) (Shiraishi et al., J. Med. Chem., 32, с. 2214-2221 (1989 приводит к соединению хинона 55, соответствующему формуле IIb, где R11, R12 и R13 являются метилом. При использовании исходного материала в форме вместо 51, может быть синтезирован полный ряд соединений формул I, Ia, Ib, II, IIa, IIb. Исходный материал дигидрохинона может быть приготовлен множеством способов, например, описанных в патентах США 3909376,5132468, и 6303801 и в патенте ГерманииDE 3818696; затем может быть приготовлен ацетилированный предшественник дигидрохинона для вышеупомянутого синтеза, как вWeichet et al., Coll. Czech. Chem. Comm., 31, с. 4598 (1966). Альтернативный способ синтеза соединений формул I, Ia, Ib, II, IIa, IIb использует раскрытие эпоксида, как описано в Hbscher et al., Helvetica Chimica Acta, 73, с. 1068-1083 (1990). 2,5-Диметокси-3,4,6-триметил бензиллитий 61 реагирует с эпоксидным соединением 62 с образованием производного 1,4-диметоксибензола 63. Последующее окисление церий-аммоний-нитратом (CAN) приводит к соединению 64, соответствующему формуле IIb, где R11, R12 и R13 представляют собой метил. Дополнительный способ синтеза соединений формул I, Ia, Ib, II, IIa и IIb предполагает использование перегруппировки Кляйзена следующим образом, по методике, адаптированной из Green et al., J. В 71 вводят аллильную группу для получения 72 и затем подвергают воздействию условий, вызывающих перегруппировку в 73 (напр., таким образом, как описано на схеме 3, Zheng et al., J. Org. Chem. 64, с. 156 (1999. Затем гидрирование 73 (напр., с помощью палладия на активированном угле) приводит к пропил-замещенному гидрохинону (не показан); последующее окисление FeCl3 приводит к пропилзамещенному хинону 74 (напр., для соединений формул I, Ia, Ib, II, IIa и IIb). Другой способ синтеза соединений I, Ia, Ib, II, IIa и IIb использует альдегидную конденсацию Начиная с соединения -токоферола 81, образуется конденсированное соединение хроман-диоксана 82. Гидрирование с помощью палладия на активированном угле приводит к соединению хромана 83, в то время как окисление церий-аммоний-нитратом (CAN) приводит затем к соединениям хинона (напр., соединения формул I, Ia, Ib, II, IIa и IIb). Способ синтеза соединений формулы где химия превращения дурохинона 91 в 3,6-диметокси-1,2,4,5-тетраметил-1,4-циклогексадиен 92 описана в Thomas et al., Journal of Organic Chemistry 51(22), с. 4160 (1986); химия превращения 3,6 диметокси-1,2,4,5-тетраметил-1,4-циклогексадиена 92 в интермедиат 3,6-диметокси-1-метилен литий 2,4,5-триметил-1,4-циклогексадиен 93 описан в Hbscher et al., Helvetica Chimica Acta 73(4), с. 1068(1989). Данный синтез может быть легко изменен для получения соединений формулы IIm: при использовании следующего интермедиата: где PG обозначает защитную группу, такую как метилметоксиметильную (MOM) или метоксиэтоксиметильную (MEM) группу. Другие защитные группы, пригодные для данной и других реакций,описанных в настоящем документе, подробно описаны в книге: Theodora W. Greene и Peter G. M. Wuts,Protective Groups in Organic Synthesis, 3rd edition, Hoboken, NJ: Wiley-Interscience, 1999. Другим способом создания соединений формулы 95 является следующий: где химия превращения 1,4-гидрокси-2,3,5-триметилбензола 100 в 2,3,5-триметил-1,4-бензохинон 101 описана в Pelter et al., J. Chem. Soc, Perkin Trans. 1, (16), с. 1891 (1993), химия превращения соединения бензохинона 102 в 2-алкил-3,5,6-триметил-1,4-бензохинон 95 описана в Fieser et al., Journal of theAmerican Chemical Society 64(9), с. 2060 (1942), а химия превращения алканоилхлорида 103 в диалканоилпероксид 104 описана в Silbert et al., Journal of the American Chemical Society 81(10), с. 2364 (1959). Алканоилхлорид 106 может использоваться для получения соединений формулы IIm по данному маршруту. Соединения формулы I и формулы II могут быть получены по данному маршруту начиная с подходящего 1,4 дигидрокси-2,3,5-замещенного-1,4-бензохинона и с использованием интермедиата 106. Способы, пригодные для получения соединений изобретений с галоген-заместителями в кольце хинона, описываются следующим образом (См. Fujishima et al. Arch. Pharm. Pharm. Med. Chem. 329, с. 27-34 2,6-Диметилхинон 111 восстанавливают дитионитом натрия в гидрохинон 112, который затем реагирует с 3,7,11,15-тетраметил-3-гидрокси-1-гексадеценом 113 и ZnCl2 с образованием 6-хроманола 114. За превращением в защищенный интермедиат 115 следует бромирование с Br2 и трифторацетатом серебра с образованием бромида 116. Наконец, с 116 может быть снята защита и он может окисляться церийаммоний-нитратом (CAN) с получением 117. Йод может вводиться в кольцо хинона с использованием методики, изложенной на следующей схеме (см. Kumadaki, I. et al. Synthetic Communications 19, с. 173-177 (1989) для дополнительной информации). Защищенный хроманол 120 обрабатывают I2 и трифторацетатом серебра с образованием йодированного производного 121, с последующим снятием защиты/окислением церий-аммоний-нитратом с получением 122. Способ, пригодный для синтеза нитрил-содержащего соединения формулы I, формулы II (включая все изменения в формулах) изображен на следующей схеме. Схема поясняет синтез, начинающийся с атокоферола и заканчивающийся цианозамещенным хиноном, но может быть легко обобщена для других соединений изобретения при использовании подходящих групп вместо 2-метильной и 3-метальной групп и подходящей концевой группы. Синтез, начиная с превращения -токоферола 131 в 5-бромометильное производное с защищенной ацетатом 6-гидроксильной группой 132, с последующим окислением в альдегидный интермедиат 133 безводным N-метилморфолин-N-оксидом (NMMO), описан в Mazzini et al., Tetrahedron с. 813-817 (2005). Затем используют гидроксиламин для получения оксима 134 с последующей дегидратацией оксима уксусным ангидридом (см., например, методику, описанную в Organic Syntheses, Coll. Vol. 3, с. 690 (1955);Vol. 20, с. 74 (1940 с получением 135. Удаление ацетатных защитных групп и окисление церийаммоний-нитратом (CAN) дает 136. Другой способ, пригодный для синтеза нитрил-содержащих соединений формулы I, формулы II(включая все изменения в формулах) изображен на следующей схеме, начиная с интермедиата 114 одного из представленных выше синтезов для получения соединений изобретений с галоген-заместителями в кольце хинона. Соединение 114 обрабатывают триметилсилил цианидом и трифторметан сульфокислотой в трифторуксусной кислоте для введения формильной группы, получая в результате соединение 142. Фенольную группу защищают и используют гидроксиламин для превращения альдегидного соединения 142 в оксимное соединение 143. Дегидратация оксима для получения нитрила 144 может сопровождаться удалением защиты и окислением с образованием 145; в качестве альтернативы, у 144 может быть удалена защита с образованием соединений типа 6-хроманола (для дополнительной информации см. Fujishima et может быть получен посредством синтеза региоизомера 154 способом, аналогичным синтезу соединения 9, описанному в: Dean et al., Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry, (5) с. 1437-42 (1981), как описано на следующей схеме. Способность к взаимному превращению форм хинонгидрохинон Формы хинона и дигидрохинона соединений, раскрытых в настоящем документе, легко превращаются друг в друга в присутствии подходящих реагентов. Например, форма хинона соединения может быть восстановлена в форму дигидрохинона восстановителями, такими как дитионит натрия. Форма гидрохинона может окисляться в форму хинона окислителями, такими как церий-аммоний-нитрат или хлорид железа(III). Формы хинона и гидрохинона также легко превращаются друг в друга электрохимически, что известно в данной области технологии. См., напр., главу 33.4 в: StreitweiserHeathcock, Introduction to Organic Chemistry, New York: Macmillan, 1976. В тех случаях, когда соединения изобретения изображены в виде формы хинона или гидрохинона,подразумевается конкретная форма. Однако, в тех случаях, когда изображена форма хинона с после- 15016226 дующей фразой "ее восстановленный аналог", или "восстановленная форма", или подобное, структура и последующая фраза предназначены для того, чтобы охватить как хинон, так и гидрохинон. Точно также,в тех случаях, когда изображена форма гидрохинона с последующей фразой "ее окисленный аналог", или"ее окисленная форма", или подобное, структура и последующая фраза предназначены для того, чтобы охватить как гидрохинон, так и хинон. Заболевания, подлежащие лечению или супрессии соединениями и способами изобретения Полагают, что множество заболеваний вызвано или осложнено митохондриальными нарушениями и нарушенной переработкой энергии и может быть вылечено или супрессировано с использованием соединений и способов изобретения. Такие заболевания включают, но не ограничиваются, наследственные митохондриальные заболевания, такие как миоклоническая эпилепсия с разрывом красных мышечных волокон (MERRF), митохондриальная миопатия, энцефалопатия, молочнокислый ацидоз, инсульт (MELAS), наследственная оптическая невропатия Лебера (LHON, также называемая болезнью Лебера, оптической атрофией Лебера (LOA), или оптической невропатией Лебера (LON, болезнь Ли или синдром Ли, синдром Кернса-Сейра (KSS), атаксия Фридрейха (FA), другие миопатии (включая кардиомиопатию и энцефаломиопатию), и почечный тубулярный ацидоз; нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, амиотрофический боковой склероз (ALS, также известный как заболевание Луи Герига), мотонейронные заболевания; другие неврологические заболевания, такие как эпилепсия; генетические заболевания, такие как ацидоз; нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, амиотрофический боковой склероз (ALS, также известный как заболевание Луи Герига), мотонейронные заболевания; другие неврологические заболевания, такие как эпилепсия; генетические заболевания, такие как болезнь Гентингтона (которое является также неврологическим заболеванием); расстройства настроения, такие как шизофрения и биполярные расстройства; и некоторые заболевания, связанные с возрастом, особенно заболевания, для лечения которых был предложен CoQ10, такие как дистрофия желтого пятна, диабет и рак. Клиническое исследование митохондриалъной дисфункции и эффективность терапии Для оценки метаболического состояния пациентов с митохондриальными нарушениями используются несколько легко измеримых клинических маркеров. Данные маркеры могут также использоваться как индикаторы эффективности данной терапии, поскольку уровень маркера смещается от патологического значения к здоровому значению. Данные клинические маркеры включают, но не ограничиваются,один или более ранее обсуждавшихся энергетических биомаркеров, таких как уровни молочной кислоты(лактата) или в цельной крови, плазме, цереброспинальной жидкости или в церебровентрикулярной жидкости; уровни пировиноградной кислоты (пирувата) или в цельной крови, плазме, цереброспинальной жидкости, или в церебровентрикулярной жидкости; отношения лактат/пируват или в цельной крови,плазме, цереброспинальной жидкости, или в церебровентрикулярной жидкости; уровни фосфокреатина,NADH (NADH + Н+) или NADPH (NADPH + Н+) уровни; NAD или уровни NADP; уровни АТФ; анаэробный порог; уровни восстановленного кофермента Q (CoQred); уровни окисленного кофермента Q (CoQox); уровни общего кофермента Q (CoQtot); уровни окисленного цитохрома С; уровни восстановленного цитохрома С; отношение окисленный цитохром С/восстановленный цитохром С; уровни ацетоацетата,уровни -гидроксибутирата, отношение ацетоацетат/-гидроксибутират, уровни 8-гидрокси-2'дезоксигуанозина (8-OHdG); уровни соединений активного кислорода и уровни потребления кислорода(VO2), уровни выделения углекислого газа (VCO2), и дыхательный коэффициент (VCO2/VO2). Некоторые из этих клинических маркеров обычно измеряются в лабораториях физиологии физических упражнений и предоставляют удобную оценку метаболического состояния пациента. В одном варианте реализации изобретения уровень одного или более энергетических биомаркеров у пациентов, страдающих от митохондриальньгх заболеваний, таких как атаксия Фридрейха, наследственная оптическая невропатия Лебера, MELAS, или KSS, улучшается до двух стандартных отклонений от среднего уровня для здорового пациента. В другом варианте реализации изобретения уровень одного или более этих энергетических биомаркеров у пациентов, страдающих от митохондриальньгх заболеваний, таких как атаксия Фридрейха, наследственная оптическая невропатия Лебера, MELAS, или KSS, улучшается до одного стандартного отклонения от среднего уровня для здорового пациента. Отсутствие выносливости при физической нагрузке может также использоваться как индикатор эффективности данной терапии, где улучшение физической выносливости (то есть, уменьшение отсутствия выносливости при физической нагрузке) показывает эффективность данной терапии. Для оценки эффективности CoQ10 уже использовались несколько метаболических биомаркеров, и эти метаболические биомаркеры могут быть рассматриваться как энергетические биомаркеры для применения в способах текущего изобретения. Пируват, продукт анаэробного метаболизма глюкозы, удаляется путем восстановления до молочной кислоты в анаэробном окружении или окислительным метаболизмом, который зависит от функционирования митохондриальной дыхательной цепи. Дисфункция дыхательной цепи может привести к недостаточному удалению лактата и пирувата из системы кровообращения, и при митохондриальных цитопатиях наблюдаются увеличение отношения лактат/пируват (см.- 16016226 лактат/пируват в крови (Chariot et al., Arch. Pathol. Lab. Med. 118(7):695-7 (1994 широко используется как неинвазивное исследование на обнаружение митохондриальных цитопатий (см. опять Scriver CR, Themetabolic and molecular bases of inherited disease, 7th ed., New York: McGraw-Hill, Health Professions Division, 1995; и Munnich et al., J. Inherit. Metab. Dis. 15(4):448-55 (1992 и токсических митохондриальных миопатий (Chariot et al., Arthritis Rheum. 37(4):583-6 (1994. Изменения в окислительновосстановительном состоянии митохондрий печени могут исследоваться путем измерения артериального отношения кетоновых тел (ацетоацетат/3-гидроксибутират:АКВ 11) (Ueda et al., J. Cardiol. 29(2), с. 95-102(1997. Выделение 8-гидрокси-2'-дезоксигуанозина (8-OHdG) с мочой часто используется как биомаркер для оценки степени восстановления ROS-индуцированного повреждения ДНК как в клиническом, так и в профессиональном окружении (Erhola et al., FEBS Lett. 409(2), с. 287-91 (1997); Honda et al., Leuk. Res. 24(6), с. 461-8 (2000); Pilger et al., Free Radic. Res. 35(3), с. 273-80 (2001); Kim et al. Environ Health Perspect 112(6), с. 666-71 (2004. Спектроскопия магнитного резонанса (MRS) была полезной для диагностики митохондриальных цитопатий путем демонстрации повышения лактата в цереброспинальной жидкости (CSF) и белом веществе коры мозга с использованием протонной MRS (1H-MRS) (Kaufmann et al., Neurology 62(8), с. 1297302 (2004. MRS на фосфоре (31P-MRS) использовалась для демонстрации низкого уровня коркового фосфокреатина (PCr) (Matthews et al., Ann. Neurol. 29(4):435-8 (1991 и задержки в кинетике восстановления PCr в скелетной мышце после нагрузки (Matthews et al., Ann. Neurol. 29(4):435-8 (1991); Barbiroli etal., J. Neurol. 242(7):472- 7 (1995); Fabrizi et al., J. Neurol. Sci. 137(l):20-7 (1996. Низкий PCr в скелетной мышце также подтверждался у больных с митохондриальной цитопатией прямыми биохимическими измерениями. Исследование под нагрузкой особенно полезно как инструмент для оценки и скрининга при хромосомных миопатиях. Одним из отличительных признаков митохондриальных миопатий является снижение максимального общего потреблении кислорода организмом (VO2max) (Taivassalo et al.,. Brain 126(Pt 2):413-23 (2003. Учитывая, что VO2max определяется разностью сердечного выброса (Qc) и периферической кислородной экстракции (общее артериально-венозное содержание кислорода), отдельные митохондриальные цитопатии нарушают сердечную функцию в случае, если доставка может изменяться; однако, большинство митохондриальных миопатий демонстрируют выраженный дефицит периферической кислородной экстракции (разность A-V O2) и увеличенную доставку кислорода (гиперкинетическое кровообращение) (Taivassalo et al., Brain 126(Pt 2), с. 413-23 (2003. Данное явление может быть доказано недостатком дезоксигенации венозной крови, вызванной нагрузкой, с прямыми измерениями баланса AV(Lynch et al., Muscle Nerve 25(5), с 664-73 (2002); van Beekvelt et al., Ann. Neurol. 46(4), с. 667-70 (1999. Несколько из этих энергетических биомаркеров обсуждаются далее более подробно. Следует подчеркнуть, что несмотря на то, что в настоящем документе обсуждаются и перечисляются определенные энергетические биомаркеры, изобретение не ограничивается модуляцией, нормализацией или повышением только этих перечисленных энергетических биомаркеров. Уровни молочной кислоты (лактата): Митохондриальная дисфункция обычно приводит к патологическим уровням молочной кислоты, поскольку увеличивается уровень пирувата, и пируват превращается в лактат для поддержания способности к гликолизу. Митохондриальная дисфункция может также приводить к патологическим уровням NADH + Н+, NADPH + Н+, NAD, или NADP, поскольку восстановленные аденин никотинамид динуклеотиды неэффективно перерабатываются дыхательной цепью. Уровни лактата могут измеряться при взятии образцов подходящих физических жидкостей, таких как цельная кровь,плазма, или цереброспинальная жидкость. Используя магнитный резонанс, можно измерить уровни лактата в фактически любом желаемом участке тела, таком как мозг. Измерение церебрального молочнокислого ацидоза с использованием магнитного резонанса у пациентов с MELAS описывается в Kaufmann et al., Neurology 62(8), с. 1297 (2004). Значения уровней молочной кислоты в боковых желудочках мозга представлены для двух мутаций, приводящих к MELAS,A3243G и A8344G. Уровни лактата в цельной крови, плазме и цереброспинальной жидкости могут измеряться коммерчески доступным оборудованием, таким как YSI 2300 STAT Plus анализатор глюкозы и лактата (YSI Life Sciences, Ohio). Уровни NAD, NADP, NADH и NADPH: Измерение NAD, NADP, NADH (NADH + H+) или NADPH(NADPH + H+) может осуществляться множеством флуоресцентных, ферментативных или электрохимических методик, например электрохимическим количественным анализом, описанным в US 2005/0067303. Потребление кислорода (vO2 или VO2), выделение углекислого газа (vCO2 или VCO2) и дыхательный коэффициент (VCO2/VO2): vO2 обычно измеряется также в покое (vO2 в покое) или при максимальной интенсивности физической нагрузки (vO2 макс.). Оптимально, если будут измерены оба значения. Однако для тяжелобольных пациентов измерение vO2 макс. может быть неосуществимо. Измерение обоих видов vO2 легко осуществляется с использованием стандартного оборудования от многих производителей, например, Korr Medical Technologies, Inc. (Salt Lake City, Utah). VCO2 также может быть легко измерен, и отношение VCO2 к VO2 в тех же самых условиях (VCO2/VO2, или в покое или при нагрузке- 17016226 максимальной интенсивности) предоставляет собой дыхательный коэффициент (RQ). Окисленный Цитохром С, восстановленный Цитохром С, и отношение окисленного Цитохрома С к восстановленному Цитохрому С: Показатели цитохрома С, такие как уровни окисленного цитохрома С(Cyt Cox), уровни восстановленного цитохрома С (Cyt Cred) и отношение окисленный цитохром С/восстановленный цитохром С (Cyt Сох)/(Cyt Cred), может быть измерено in vivo ближней инфракрасной спектроскопией. См., например, Rolfe, P., "In vivo near-infrared spectroscopy," Annu. Rev. Biomed. Eng. 2,c. 715-54 (2000) и Strangman et al., "Non-invasive neuroimaging using near-infrared light" Biol. Psychiatry 52,с. 679-93 (2002). Выносливость при физической нагрузке/Отсутствие выносливости при физической нагрузке Отсутствие выносливости при физической нагрузке определяется как "пониженная способность выполнять действия, которые вовлекают динамическое перемещение больших скелетных мышц из-за симптомов одышки или усталости" (Pia et al., Circulation 107, с. 1210 (2003. Отсутствие выносливости при физической нагрузке часто сопровождается миоглобинурией вследствие распада ткани мышцы и последующего выделения мышечного миоглобина с мочой. Могут использоваться различные способы измерения отсутствия выносливости при физической нагрузке, такие как время, затраченное на ходьбу или бег на бегущей дорожке до утомления, время, затраченное на упражнения на велосипеде (велотренажер) до утомления, и т.п. Лечение соединениями или способами изобретения может привести к примерно 10% или большему улучшению выносливости к физической нагрузке (например, примерно 10% или большее увеличение времени до утомления, например от 10 до 11 мин), примерно 20% или большее улучшение выносливости при физической нагрузке, примерно 30% или большее улучшение выносливости к физической нагрузке, примерно 40% или большее улучшение выносливости при физической нагрузке, примерно 50% или большее улучшение выносливости при физической нагрузке, примерно 75% или большее улучшение выносливости при физической нагрузке, или примерно 100% или большее улучшение выносливости при физической нагрузке. Несмотря на то, что выносливость при физической нагрузке не является, строго говоря, энергетическим биомаркером, для целей изобретения модуляция,нормализация или повышение энергетических биомаркеров включает модуляцию, нормализацию или повышение выносливости к физической нагрузке. Точно так же испытания на нормальные и патологические значения уровней пировиноградной кислоты (пируват), отношения лактат/пируват, уровней АТФ, анаэробного порога, уровней восстановленного кофермента Q (CoQred), уровней окисленного кофермента Q (CoQox), уровней общего кофермента Q(CoQtot), уровней окисленного цитохрома С, уровней восстановленного цитохрома С, отношения окисленный цитохром С/восстановленный цитохром С, уровней ацетоацетата, уровней -гидроксибутирата,отношения ацетоацетат/-гидроксибутират, уровней 8-гидрокси-2'-дезоксигуанозина (8-OHdG) и уровней соединений активного кислорода, известны в технологии и могут использоваться для оценки эффективности соединений и способов изобретения (для целей изобретения модуляция, нормализация или повышение энергетических биомаркеров включают модуляцию, нормализацию, или повышение анаэробного порога). Табл. 1 ниже показывает влияние, которое различные дисфункции могут оказывать на биохимию и энергетические биомаркеры. Она также показывает физическое влияние (такое как симптомы заболевания или другие эффекты дисфункции), обычно связанное с данной дисфункцией. Следует отметить, что любой из энергетических биомаркеров, перечисленных в таблице, в дополнение к энергетическим биомаркерам, перечисленным в другом месте, может также быть модулирован, увеличен или нормализован соединениями и способами изобретения. RQ = дыхательный коэффициент; BMR = безальный метаболический уровень; HR (СО) = частота сердечных сокращений (сердечный выброс); Т = температура тела(предпочтительно измеренная как внутренняя температура); AT = анаэробный порог; рН = рН крови (венозной и/или артериальной). Таблица 1 Лечение пациента, пораженного митохондриальным заболеванием, в соответствии со способами изобретения, может привести к уменьшению или облегчению симптомов у пациента, например, остановить дальнейшее прогрессирование заболевания. Частичная или полная супрессия митохондриального заболевания может привести к уменьшению серьезности одного или более симптомов, которые в противоположном случае испытывал бы пациент. Например, частичная супрессия MELAS может привести к снижению числа инсультоподобных или эпилептических приступов. Любой отдельно взятый или любая комбинация описанных здесь энергетических биомаркеров предусматривает удобно измеримые показатели для оценки эффективности лечения или супрессорной терапии. Дополнительно, другие энергетические биомаркеры, известные специалистам, могут контролироваться для оценки эффективности лечения или супрессорной терапии. Применение соединений в исследовательских практических применениях, экспериментальных системах и количественных анализах Соединения изобретения могут также использоваться в исследовательских практических применениях. Например, хинон альфа-токоферола может использоваться в экспериментах in vitro, in vivo или exvivo для модуляции одного или более энергетических биомаркеров в экспериментальной системе. Такие экспериментальные системы могут быть образцами клетки, образцами ткани, компонентами клетки или смесями компонентов клетки, частей органов, целых органов или организмов. Любое одно или более соединений формулы I, Ia, Ib, II, IIa и IIb может использоваться в экспериментальных системах или исследовательских практических применениях. Такие исследовательские практические применения могут включать, но не ограничиваются, применение в качестве реагентов для количественного анализа, выявления биохимических проводящих путей или оценки влияния других средств на метаболическое состояние экспериментальной системы при наличии/отсутствии одного или более соединений изобретения. Дополнительно, соединения изобретения могут использоваться в биохимических испытаниях или количественных анализах. Такие испытания могут включать инкубацию одного или более соединений изобретения с образцом ткани или клетки пациента для оценки потенциального отклика пациента (или отклика отдельной субпопуляции пациента) на прием одного или более упомянутых соединений или для определения того, какое соединение изобретения оказывает оптимальное влияние на отдельных испытуемых или подгруппу испытуемых. Одно такое испытание или количественный анализ может включать 1) получение образца клетки или образца ткани от пациента, по которому может быть оценена модуляция одного или более энергетических биомаркеров; 2) введение одного или более соединений изобрете- 19016226 ния в образец клетки или образец ткани и 3) определение величины модуляции одного или более энергетических биомаркеров после приема одного или более соединений по сравнению со статусом энергетического биомаркера до приема одного или более соединений. Другое такое испытание или количественный анализ может включать 1) получение от пациента образца клетки или образца ткани, по которому можно оценить модуляцию одного или более энергетических биомаркеров; 2) введение по меньшей мере двух соединений изобретения в образец клетки или образец ткани; 3) определение величины модуляции одного или более энергетических биомаркеров после введения по меньшей мере двух соединений по сравнению со статусом энергетического биомаркера до введения по меньшей мере соединений, и 4) выбор соединения для применения при лечении, супрессии, или модуляции, основанной на величине модуляции, определенной на стадии 3). Фармацевтические рецептуры Соединения, описанные в настоящем документе, могут быть сформулированы как фармацевтические композиции путем составления рецептур с добавками, такими как фармацевтически приемлемые инертные наполнители, фармацевтически приемлемые носители и фармацевтически приемлемые средства доставки. Пригодные фармацевтически приемлемые инертные наполнители, носители и средства доставки включают средства для обработки и модификаторы и ускорители доставки лекарства, такие как,например, фосфат кальция, стеарат магния, тальк, моносахариды, дисахариды, крахмал, желатин, целлюлоза, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, глюкоза, гидроксипропил-циклодекстрин, поливинилпирролидон, низкоплавкие воски, ионнообменые смолы и т.п., а также комбинацию любых двух или более из них. Другие пригодные фармацевтически приемлемые инертные наполнители описываются в "Remington's Pharmaceutical Sciences," Mack Pub. Co., New Jersey (1991) и "Remington: The Science and Practice of Pharmacy," Lippincott WilliamsWilkins, Philadelphia, 20 выпуск (2003) и 21 выпуск (2005), включенных в настоящем документе ссылкой. Фармацевтическая композиция может включать состав со стандартной дозой, где стандартная доза представляет собой дозу, достаточную для получения терапевтического или супрессивного эффекта или количество, эффективное для модулирования, нормализации или повышения энергетического биомаркера. Стандартная доза может быть достаточной в качестве однократной дозы, имеющей терапевтический или супрессивный эффект. Альтернативно, стандартная доза может быть дозой, которую вводят периодически в курсе лечения или супрессии нарушения. Фармацевтические композиции, содержащие соединения изобретения, могут находиться в любой форме, пригодной для намеченного способа введения, включая, например, раствор, суспензию или эмульсию. При приготовлении растворов, суспензий и эмульсий обычно используются жидкие носители. Жидкие носители, предполагаемые для применения в практике настоящего изобретения, включают, например, воду, соль, фармацевтически приемлемый органический растворитель(и), фармацевтически приемлемые масла или жиры, и т.п., а также смеси двух или более из них. Жидкий носитель может содержать другие пригодные фармацевтически приемлемые добавки, такие как солюбилизаторы, эмульгаторы,питательные вещества, буферы, консерванты, суспендирующие агенты, загустители, регуляторы вязкости, стабилизаторы и т.п. Пригодные органические растворители включают, например, одноатомные спирты, такие как этанол, и многоатомные спирты, такие как гликоли. Пригодные масла включают, например, соевое масло, кокосовое масло, оливковое масло, сафлоровое масло, хлопковое масло и т.п. Для парентерального введения носитель может также являться сложным эфиром масла, таким как этилолеат,изопропилмиристинат и т.п. Композиции настоящего изобретения могут также быть в форме микрочастиц, микрокапсул, липосомальных инкапсулятов и т.п., а также комбинацией любых двух или более из них. Могут использоваться системы с замедленным или контролируемым высвобождением, такие как контролируемые диффузией матричные системы или эродируемые системы, как описано, например, в:"Treatise on Controlled Drug Delivery", A. Kydonieus Ed., Marcel Dekker, Inc., New York 1992. Матрица может быть, например, биоразлагаемым материалом, который может разлагаться спонтанно in situ и invivo, например, путем гидролиза или ферментативного разложения, например протеазами. Система доставки может быть, например, встречающимся в природе или синтетическим полимером или сополимером, например в форме гидрогеля. Примеры полимеров с легко разрывающимися связями включают полиэфиры, полиортоэфиры, полиангидриды, полисахариды, полифосфоэфиры, полиамиды, полиуретаны,полиимидокарбонаты и полифосфазены. Соединения изобретения могут вводиться энтерально, перорально, парентерально, сублингвально,ингаляционно (например, как аэрозоли или спреи), ректально или местно в составах со стандартной дозой, содержащих обычные нетоксичные фармацевтически приемлемые носители, вспомогательные вещества и средства доставки, если необходимо. Например, пригодные способы введения включают пероральный, подкожный, трансдермальный, трансмукозальный, ионофорез, внутривенный, внутриартериальный, внутримышечный, интраперитонеальный, назальный (например, через слизистую оболочку носа), субдуральный, ректальный, желудочно-кишечный, и т.п., а также непосредственно в конкретный или поврежденный орган или ткань. Для доставки к центральной нервной системе может использоваться- 20016226 введение в позвоночник и эпидурально, или введение в желудочки мозга. Местное введение может также включать использование трансдермального введения, такого как трансдермальные повязки или устройства для ионофореза. Термин парентеральный, который используется в настоящем документе, включает подкожные инъекции, внутривенную, внутримышечную, надчревную инъекцию, или инфузионные методы. Соединения смешивают с фармацевтически приемлемыми носителями, вспомогательными веществами и средствами доставки, подходящими для требуемого пути введения. Пероральное введение является предпочтительным путем введения, и составы, пригодные для перорального введения, являются предпочтительными составами. Соединения, описанные для применения в настоящем документе, можно вводить в твердой форме, в жидкой форме, в форме аэрозоля или в форме таблеток, пилюль, порошковых смесей, капсул, гранул, впрыскиваний, кремов, растворов, свеч, клизм, ирригаций ободочной и толстой кишки, эмульсий, дисперсий, пищевых премиксов и в других пригодных формах. Соединения можно также вводить в липосомные рецептуры. Соединения можно также вводить как пролекарства, где пролекарство подвергается превращению в лечащемся пациенте в терапевтически эффективную форму. Дополнительные способы введения известны в данной области. Препараты для инъекций, например стерильные водные или маслянистые суспензии для инъекций,могут быть составлены в соответствии с известной технологией с использованием диспергирующих или смачивающих веществ и суспендирующих агентов. Стерильные препараты для инъекций могут также быть стерильным раствором или суспензией для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствором в пропиленгликоле. Среди приемлемых средств доставки и растворителей, которые могут использоваться, находятся вода, раствор Рингера и изотонический раствор хлористого натрия. Кроме того, в качестве растворителя или суспендирующей среды традиционно используются стерильные нелетучие масла. С этой целью может использоваться любое легкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, при производстве препаратов для инъекций находят применение жирные кислоты, такие как олеиновая кислота. Свечи для ректального введения лекарственного средства могут быть изготовлены путем смешивания лекарственного средства с пригодным нераздражающим инертным наполнителем, таким как масло какао и полиэтиленгликоли, которые являются твердыми при комнатной температуре и жидкостью при ректальной температуре, и поэтому будут плавиться в прямой кишке и высвобождать лекарственное средство. Твердые лекарственные формы для перорального введения могут включать капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение может быть смешано с по меньшей мере одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут также включать дополнительные вещества, помимо инертных разбавителей, например, лубриканты, такие как стеарат магния. В случае капсул, таблеток и пилюль лекарственные формы могут также включать буферные средства. Таблетки и пилюли могут дополнительно быть изготовлены с кишечнорастворимой оболочкой. Жидкие лекарственные формы для перорального введения могут включать фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обычно используемые в данной области, такие как вода. Такие композиции могут также включать вспомогательные вещества, такие как смачивающие вещества, эмульгаторы и суспендирующие агенты, циклодекстрины, подсластители и вкусо-ароматические добавки. Соединения настоящего изобретения могут также вводиться в форме липосом. Как известно в технологии, липосомы в общем случае получают из фосфолипидов или других липидных субстанций. Липосомы образуются моно- или многослойными гидратированными жидкими кристаллами, которые диспергируют в водной среде. Может использоваться любой нетоксичный, физиологически приемлемый и метаболизируемый липид, способный к образованию липосом. Настоящие композиции в липосомной форме могут содержать, в дополнение к соединению настоящего изобретения, стабилизаторы, консерванты, инертные наполнители и т.п. Предпочтительными липидами являются фосфолипиды и холины фосфатидила (лецитины), как природные, так и синтетические. Способы получения липосом известны в технологии. См., например, Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York,N.W., с. 33 et seq (1976). Изобретение также предоставляет промышленные изделия и наборы, содержащие материалы, применимые для лечения или супрессии митохондриальных заболеваний. Промышленное изделие включает сосуд с этикеткой. Пригодный сосуд включает, например, бутыли, флаконы и пробирки. Сосуд может быть изготовлен из различных материалов, таких как стекло или пластмасса. Сосуд содержит композицию, включающую активное средство, эффективное для лечения или супрессии митохондриальных заболеваний. Активное средство в композиции является одним или более из соединений формул I, Ia, Ib, II,IIa, IIb. Этикетка на емкости указывает, что композиция используется для лечения или супрессии митохондриальных заболеваний, и может также указать направления использования или для in vivo, или дляin vitro, таких как описанные выше. Изобретение также предоставляет наборы, включающие одно или более соединений формул I, Ia,Ib, II, IIa, IIb. В некоторых вариантах реализации набор изобретения включает сосуд, описанный выше. В- 21016226 других вариантах реализации набор изобретения включает сосуд, описанный выше, и второй сосуд, содержащий буфер. Он может также включать другие материалы, желательные с промышленной точки зрения и точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями для реализации любых способов, описанных в настоящем документе. В других аспектах наборы могут использоваться для любого из способов, описанных в настоящем документе, включая, например, лечение индивидуума с митохондриальным нарушением, или супрессию митохондриального нарушения у индивидуума. Количество активного ингредиента, который может комбинироваться с материалами носителя для производства разовой лекарственной формы, меняется в зависимости от организма, которому вводится активный ингредиент, и особенности способа введения. Будет подразумеваться, однако, что индивидуальный уровень дозы для любого отдельного пациента будет зависеть от множества факторов, включая действие каждого используемого соединения, возраст, вес тела, площадь тела, индекс массы тела (BMI),общее здоровье, пол, диета, время введения, путь введения, скорость выделения, комбинацию лекарственного средства, а также тип, прогрессирование и серьезность конкретного заболевания, подвергающегося лечению. Выбранную фармацевтическую стандартную дозу обычно изготавливают и вводят для обеспечения определенной конечной концентрации лекарственного средства в крови, тканях, органах или другой заданной области тела. Терапевтически эффективное количество или эффективное количество для данной ситуации может быть легко определено обычным экспериментом и находится в рамках знаний и суждений обычного клинического врача. Примерами дозировок, которые могут использоваться, являются эффективные количества в интервале дозировок от примерно 0,1 до примерно 300 мг/кг, или в интервале от примерно 1,0 до примерно 40 мг/кг массы тела, или в интервале от примерно 1,0 до примерно 20 мг/кг массы тела, или от примерно 1,0 до примерно 10 мг/кг массы тела, или в интервале от примерно 10,0 до примерно 10 мг/кг массы тела,или в интервале от примерно 100 до примерно 10 мг/кг массы тела, или в интервале от примерно 1,0 до примерно 10 мг/кг массы тела, или в интервале от примерно 10 до примерно 100 мг/кг массы тела, или в интервале от примерно 50 до примерно 150 мг/кг массы тела, или в интервале от примерно 100 до примерно 200 мг/кг массы тела, или в интервале от примерно 150 до примерно 250 мг/кг массы тела, или в интервале от примерно 200 до примерно 300 мг/кг массы тела, или в интервале от примерно 250 до примерно 300 мг/кг массы тела. Другие дозировки, которые могут использоваться, представляют собой примерно 0,01 мг/кг массы тела, примерно 0,1 мг/кг массы тела, примерно 1 мг/кг массы тела, примерно 10 мг/кг массы тела, примерно 20 мг/кг массы тела, примерно 30 мг/кг массы тела, примерно 40 мг/кг массы тела, примерно 50 мг/кг массы тела, примерно 75 мг/кг массы тела, примерно 100 мг/кг массы тела, примерно 125 мг/кг массы тела, примерно 150 мг/кг массы тела, примерно 175 мг/кг массы тела, примерно 200 мг/кг массы тела, примерно 225 мг/кг массы тела, примерно 250 мг/кг массы тела, примерно 275 мг/кг массы тела или примерно 300 мг/кг массы тела. Соединения настоящего изобретения можно вводить в однократной суточной дозе или общую суточную дозу можно вводить раздельными дозами два,три или четыре раза в день.-Хинон токоферола представляет собой встречающееся в природе вещество, которое обычно находится в сыворотке (Pollok et al., J. Chromatogr. A. 1056, с. 257 (2004 и в митохондриальных мембранах(Gregor et al., Biochem Pharmacol. 71, с. 1589 (2006. Соответственно, если -хинон токоферола вводят для лечения или супрессии митохондриальных заболеваний или модулирования энергетических биомаркеров, его можно вводить в количестве, достаточном для увеличения уровней -хинона токоферола в сыворотке, внутри клеток, или в митохондриальной мембране по меньшей мере примерно на 10%, по меньшей мере примерно на 25%, по меньшей мере примерно на 50%, по меньшей мере примерно на 75%,по меньшей мере примерно на 100%, по меньшей мере примерно на 150%, или по меньшей мере примерно на 200% по сравнению с уровнем -хинона токоферола до приема -хинона токоферола. Восстановленный -хинон токоферола также встречается в природе. Соответственно, если -хинон токоферола вводят для лечения или супрессии митохондриальных заболеваний или модулирования энергетических биомаркеров, он может быть введен в количестве, достаточном для увеличения уровней в сыворотке,уровней внутри клеток или уровней в митохондриальной мембране его восстановленного аналога, восстановленного -хинона токоферола, по меньшей мере примерно на 10%, по меньшей мере примерно на 25%, по меньшей мере примерно на 50%, по меньшей мере примерно на 75%, по меньшей мере примерно на 100%, по меньшей мере примерно на 150%, или по меньшей мере примерно на 200% по сравнению с уровнем восстановленного -хинона токоферола до введения -хинона токоферола. Альтернативно,восстановленный -хинон токоферола можно вводить вместо -хинона токоферола для лечения или супрессии митохондриальных заболеваний или модулирования энергетических биомаркеров, и он может быть введен в количестве, достаточном для увеличения уровней восстановленного -хинона токоферола в сыворотке, уровней внутри клеток или уровней в митохондриальной мембране по меньшей мере примерно на 10%, по меньшей мере примерно на 25%, по меньшей мере примерно на 50%, по меньшей мере примерно на 75%, по меньшей мере примерно на 100%, по меньшей мере примерно на 150% или по- 22016226 меньшей мере примерно на 200% по сравнению с уровнем восстановленного -хинона токоферола до введения восстановленного -хинона токоферола. Хотя соединения изобретения можно вводить в виде единственного активного фармацевтического средства, они могут также использоваться в комбинации с одним или более других средств, используемых для лечения или супрессии нарушений. Отдельные препараты, применимые в комбинации с соединениями изобретения для лечения или супрессии митохондриальных заболеваний, включают, но не ограничиваются, Кофермент Q, витамин Е, идебенон, MitoQ, витамины и антиоксиданты. Если в комбинации с соединениями настоящего изобретения используются дополнительные активные вещества, дополнительные активные вещества могут в общем случае применяться в терапевтическом количестве, как указано в Physicians' Desk Reference (PDR) 53rd Edition (1999), который включен в настоящее описание путем отсылки, или в таких терапевтически применимых количествах, какие были бы известны специалисту с обычными знаниями в данной области техники. Соединения изобретения и другие терапевтически активные вещества можно вводить при рекомендуемой максимальной клинической дозировке или в более низких дозах. Уровни дозировки активных соединений в композициях изобретения могут изменяться так, чтобы получить желательный терапевтический отклик в зависимости от пути введения, серьезности заболевания и реакции пациента. При введении в комбинации с другими терапевтическими веществами терапевтические вещества могут быть получены как отдельные композиции, которые даются в то же самое время или различное время, или терапевтические вещества могут вводиться как единая композиция. Изобретение будет далее разъяснено на следующих неограничивающих примерах. Примеры Пример 1. Синтез соединений Пример 1 А. Синтез смеси стереоизомеров соединения VIII-i (R/S,R,R)-2,3,5-триметил-6-(3,7,11,15 тетраметилгексадецил)-[1,4]бензохинона Стадия 1. В 50 мл RBF (круглодонную колбу) помещали (R,R,R)-2-(3-гидрокси-3,7,11,15-тетраметилгексадецил)-3,5,6-триметил-[1,4]бензохинон (Пр-1 А-1) (2,0 г, 4,40 ммоль) и пиридин (10 мл), и охлаждали реакционную смесь до 0 С. Добавляли чистый POCI3 (520 мл, 5,60 ммоль). Реакционной смеси позволили нагреться до RT (комнатной температуры) и перемешивали в течение 16 ч. Реакцию контролировали методом ТСХ (3:1 гептан:ЕТОАс). Реакционную смесь разбавляли насыщенным NH4Cl (10 мл) и метил-трет-бутиловым эфиром (МТВЕ) (10 мл), а затем экстрагировали МТВЕ (310 мл). Объединенные слои МТВЕ пропускали через короткую колонку силикагеля и затем промывали 0,1 HCl (310 мл). Затем слой МТВЕ концентрировали на роторном испарителе до образования желтого масла (1,95 г, 100%). Неочищенный материал, представлявший собой смесь региоизомеров и геометрических изомеров алкена,использовали в следующей стадии без дополнительной очистки. Стадия 2. Сырую смесь региоизомеров и геометрических изомеров алкена (13,3 г, 31,0 ммоль, приготовленную как описано в стадии 1), растворяли в EtOAc (100 мл) и гидрировали с использованием PtO2 (250 мг) при давлении H2 50 фунт/дюйм 2. Спустя 6 ч оставалось 30% ненасыщенного материала (1H ЯМР). Добавили дополнительный PtO2 (250 мг) и продолжали гидрирование в течение 16 ч. Реакционную смесь- 23016226 фильтровали через целит, который затем промывали EtOAc (50 мл). Фильтрат концентрировали на роторном испарителе до получения (R/S,R,R)-2,3,5-триметил-6-(3,7,11,15-тетраметилгексадецил)бензол 1,4-диола (Пр-1 А-2) в виде белого воскообразного твердого вещества (12,7 г, 95%). 1(10,2 г, 0,24 г) в дихлорметане (DCM) (100 мл) оставили перемешиваться с SiO2 (500 мг) на воздухе в течение 4 дней. Затем реакционную смесь фильтровали и концентрировали на роторном испарителе до получения оранжевого масла (10,0 г, 98%). Часть неочищенного продукта (5,0 г) очищали с использованием автоматического прибора для хроматографии Biotage (градиентное элюирование DCM:тептан) до получения чистого (R/S,R,R)-2,3,5-триметил-6-(3,711,15-тетраметилгексадецил)-[1,4]бензохинона (Пр 1 А-3, смесь стереоизомеров соединения VIII-i) (1,98 г, 40%). 1 Стадия 1. В трехгорлую колбу объемом 2 л поместили 2,3,5-триметилбензол-1,4-диол (Пр-1B-1) (50 г, 0,33 моль) и метилэтилкетон (МЕК) (750 мл) до получения раствора янтарного цвета. К раствору добавили карбонат калия (210 г, 1,64 моль). Спустя 30 мин при RT к суспензии янтарного цвета добавили MeI (81.2 мл, 1.31 моль). Реакционную смесь нагревали до 65 С в течение 72 ч. После охлаждения до RT реакционную смесь концентрировали насухо на роторном испарителе до получения белой пасты. Пасту промыли EtOAc (3300 мл). Экстракты EtOAc объединяли и концентрировали на роторном испарителе. Полученное желто-коричневое масло хроматографировали (80:20/ гептан:EtOAc) до получения 1,4-диметокси 2,3,5-триметилбензола (Пр-1 В-2) (47.2 г, 80%). 1H ЯМР (400 МГц, CDCl3)(м.д.): 6,55 (с, 1H), 3,80 (с, 3H), 3,68 (с, 3H), 2,30 (с, 3H), 2,22 (с, 3H),2,14 (с, 3H). Стадия 2: в колбу поместили 1,4-диметокси-2,3,5-триметил-бензол (Пр-1 В-2) (47,2 г, 0,26 моль), ледяную уксусную кислоту (250 мл) и параформальдегид (39,3 г, 1,31 моль) до получения желтой суспензии. Затем через реакционную смесь медленно барботировали безводный газообразный HCl в течение 1,5 ч, получая прозрачный коричневый раствор. Затем реакционную смесь разбавляли водой (300 мл) и экстрагировали МТВЕ (3 х 300 мл). Объединенные слои МТВЕ сушили над Na2SO4, фильтровали и концентрировали на роторном испарителе. Очистка сырого продукта колоночной хроматографией(95:5/гептаны: EtOAc) дала 48,7 г 1-хлорметил-2,5-диметокси-3,4,6-триметилбензола (Пр-1 В-3) (81%). 1 Н ЯМР (400 МГц, CDCl3)(м.д.): 4,76 (с, 2H)5 3,81 (с, 3H), 3,68 (с, 3H), 2,36 (с, 3H), 2,23 (с., 3H),2,21 (с, 3H). Стадия 3. В колбу загружали 1-хлорметил-2,5-диметокси-3,4,6-триметилбензол (Пр-1 В-3) (6,37 г, 27,9 ммоль) и ACN (10 мл), затем охлаждали до 0 С. В колбу добавили раствор CAN (31,3 г, 57,1 ммоль) в воде (10 мл). Спустя 1 час реакционную смесь экстрагировали МТВЕ (350 мл). Затем объединенные МТВЕ слои промыли водой (50 мл), сушили над MgSO4, фильтровали и концентрировали на роторном испарителе.- 24016226 Растирание сырого продукта в порошок с МеОН дало 4,49 г 2-хлорметил-3,5,6-триметил-[1,4]бензохинон(Пр-1 В-4) (81%) в виде ярко-желто-оранжевого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3)(м.д.): 4,77 (с, 2H), 2,17 (с, 3H), 2,07 (с, 3H), 2,06 (с, 3H). Стадия 4. В трехгорлую 100 мл колбу поместили PCl3 (2,8 мл, 31,6 ммоль) и сухой DMF (32 мл), затем перемешивали при RT в течение 1 ч. В отдельную 50 мл колбу поместили фарнезол (Пр-1 В-5) (10,0 г, 45,2 ммоль) и DMF (10 мл). Затем раствор PCl3/DMF перенесли в раствор фарнезола и перемешивали полученный темно-оранжевый раствор в течение часа. Реакцию останавливали добавлением твердогоNaHCO3 (2,5 г, 63,2 ммоль). Растворитель удаляли в высоком вакууме на роторном испарителе до получения маслянистого оранжевого остатка. К остатку добавили МТВЕ (40 мл) и воду (40 мл). Водную фазу промыли МТВЕ (320 мл). Слои МТВЕ объединяли, промывали раствором соли (220 мл), сушили надMgSO4, фильтровали и наконец концентрировали на роторном испарителе до получения 1-хлор-3,7,11 триметил-додека-2,6,10-триена (Пр-1 В-6) в виде желтого масла (9,89 г, 92%). 1H ЯМР (400 МГц, CDCl3)(м.д.): 5,47 (широкий т., J= 8,3 Гц, 1H), 5,15-5,07 (м., 2H), 4,12 (д., J=8,1 Гц, 2H), 2,18-1,95 (м., 8H), 1,75 (с, 3H), 1,70 (с, 3H), 1,62 (с, 6 Н). Стадия 5. В 3-горлую 250 мл колбу, заполненную инертным газом, поместили TMS-пропин (6,90 мл, 46,2 ммоль) и THF (90 мл). Реакционную смесь охладили до -40 С, после чего добавили BuLi (18,5 мл, 46,2 ммоль). Спустя 45 мин реакционную смесь охладили дополнительно (-70 С) и добавили в течение 10 мин предварительно охлажденный (-70 С) раствор 1-хлор-3,7,11-триметил-додека-2,6,10-триена (Пр-1 В 6) (8,9 г, 37,0 ммоль) в THF (50 мл). Спустя 1 ч реакцию нагрели до RT и остановили добавлением насыщенного NH4Cl (20 мл) и МТВЕ (25 мл). Водный слой отделили и промыли МТВЕ (25 мл). Затем объединенные органические слои промыли раствором соли и сушили над MgSO4, фильтровали и концентрировали до получения желтой жидкости (10,3 г). Неочищенное масло очищали с помощью колоночной хроматографии (99:1/гептаны:МТВЕ) с получением триметил-(6,10,14-триметилпентадека-5,9,13-триен 1-инил)силана (Пр-1 В-7). 1 Н ЯМР (400 МГц, CDCl3)(м.д.): 5,22-5,16 (м., 1H), 5,16-5,08 (м., 2H), 2,27-2,22 (м., 4H), 2,15-1,94(м., 8H), 1,70 (с, 3H), 1,65 (с, 3H), 1,62 (с, 6H), 0,17 (с, 9H). Стадия 6. В трехгорлую 250 мл колбу помещали триметил-(6,10,14-триметилпентадека-5,9,13 триен-1-инил)силана (Пр-1 В-7) (19,38 г, 64,1 ммоль) и NaOEt (42 мл 21 мас.% раствора, 112 ммоль). Реакционную смесь перемешивали при 60 С в течение 4 ч. После охлаждения до RT реакционную смесь разбавляли МТВЕ (100 мл) и водой (100 мл) и затем фильтровали для удаления осадка, присутствующего на границе раздела фаз. Водный слой экстрагировали МТВЕ (3100 мл). Объединенные слои МТВЕ промывали раствором соли (100 мл), сушили над MgSO4, фильтровали и концентрировали на роторном испарителе с образованием 12,43 г 6,10,14-триметилпентадека-5,9,13-триен-1-ина (Пр-1 В-8) в виде темнооранжевого масла (96%). 1 Н ЯМР (400 МГц, CDCl3)(м.д.): 5,23-5,17 (м, 1H), 5,17-5,07 (м, 2H), 2,29-1,95 (м, 13H), 1,70 (с,3H), 1,65 (с, 3H), 1,62 (с, 6 Н). Стадия 7. Трехгорлую 250 мл колбу, снабженную термометром, магнитной мешалкой и вакуумным переходным устройством с краном, вакуумировали, сушили в пламени и продували N2 (3) через линию Шленка с одной гребенкой. В колбу помещали бис(циклопентадиенил)циркония дихлорид (Cp2ZrCl2) (2,16 г, 7,4 ммоль) и сухой DCE (40 мл). Реакционную смесь охлаждали до -20 С. По каплям в течение 5 мин добавили AlMe3 (36,8 мл, 73,6 ммоль) до получения желтой суспензии. Через 15 мин при -20 С по каплям в течение 5 мин добавили воду (220 мкл, 12,3 ммоль) до получения зелено-желтого раствора. После перемешивания в течение 30 мин при -20 С раствор 6,10,14-триметилпентадека-5,9,13-триен-1-ина (Пр-1 В-8)(6,0 г, 24,6 ммоль) в сухом DCE (20 мл) добавили по каплям в течение 5 мин. Реакционная смесь стала темно-коричневого, а затем коричневого цвета. Реакционную смесь оставили нагреваться до RT в течение 2 ч. 1 Н ЯМР-анализ аликвоты, погашенной DCl, показал 95% включение дейтерия. Растворитель удаляли под вакуумом при RT. Полученный остаток промывали гептанами (240 мл) через спеченную стеклянную фритту в заполненную инертом 250 мл трехгорлую колбу, снабженную магнитной мешалкой и вакуумным адаптером с краном. Реакцию оставили перемешиваться на ночь. Растворитель удаляли под вакуумом и замещали путем добавления сухого дегазированного THF (40 мл). Погашенная аликвота реакционной смеси показала включение 92% дейтерия согласно 1 Н ЯМРспектроскопии. Раствор 2-хлорметил-3,5,6-триметил-[1,4]бензохинона (Пр-1 В-4) (3,0 г, 15,0 ммоль) в сухом дегазированном THF (20 мл) добавляли в колбу, которую затем охлаждали до 0 С. В отдельную заполненную инертом 50 мл колбу помещали (PPh3)2NiCl2 (750 мг, 1,3 ммоль) и сухой дегазированныйTHF (20 мл). К коричневой суспензии Ni(II) добавляли BuLi (1,4 мл, 2,6 ммоль), чтобы получить кроваво-красный раствор. Раствор перемешивали в течение 5 мин, а затем добавили к раствору винилалан/хинона (Пр-1 В-9/Пр-1 В-4). Коричневый раствор стал серо-голубого цвета. Спустя 5 мин реакция закончилась согласно 1 Н ЯМР-анализу погашенной аликвоты.- 25016226 Реакцию останавливали путем очень медленного добавления 1 М HCl (в данной процедуре следует соблюдать большую осторожность, поскольку она является чрезвычайно экзотермической) так, чтобы температура не превышала 15 С. Реакционную смесь разбавляли МТВЕ (20 мл). Полученную суспензию фильтровали. Водный слой фильтрата промывали МТВЕ (325 мл). Объединенные слои МТВЕ сушили над MgSO4, фильтровали и концентрировали на роторном испарителе до получения коричневого масла(12 г). Очистка неочищенного масла колоночной хроматографией (гептан до 1:2 /гептар:DCM) дала чистый 2,3,5-триметил-6-(3,7,11,15-тетраметил-гексадека-2,6,10,14-тетраенил)-[1,4]бензохинон (Пр-1 В-11,или соединение IX-i) (5,25 г, 83%, 96% согласно ВЭЖХ). 1 Стадия 1. В 25 мл RBF поместили бутиральдегид (155 мг, 2,16 ммоль), АсОН (2 мл) и H2SO4 (1 капля). В колбу добавили раствор (+)токоферола (Пр-1 С-1) (300 мг, 0,72 ммоль) в АсОН (3 мл) по каплям в течение 2 ч с помощью шприцевого насоса. Затем реакцию перемешивали в течение 16 ч и контролировали ТСХ(9:1 гепт.:EtOAc). Затем реакционную смесь разбавляли водой (15 мл) и экстрагировали DCM (3 х 20 мл). Объединенные органические слои промывали водой (315 мл), сушили над Na2SO4, фильтровали и концентрировали на роторном испарителе до получения 7,9,10-триметил-2,4-дипропил-7-(4,8,12-триметилтридецил)-4,5,6,7-тетрагидро-1,3,8-триоксафенантрена (Пр-1 С-2) в виде светло-бурого масла (425 мг,100%), которое использовали без дальнейшей очистки. Стадия 2. Раствор 7,9,10-триметил-2,4-дипропил-7-(4,8,12-триметилтридецил)-4,5,6,7-тетрагидро-1,3,8 триоксафенантрен (Пр-1 С-2) (180 мг вышеупомянутой формы сырого материала) в АсОН (10 мл) и конц.H2SO4 (10 капель) гидрировали (H2, 50 фунт/дюйм 2, RT) на 5% Pd/C (20 мг влажного 50 мас.%) при RT в течение 16 ч. Реакционную смесь фильтровали через целит. Целит промывали DCM (22 мл). Слои DCM концентрировали на роторном испарителе до получения светло-коричневого масла. Масло растворяли вDCM (15 мл) и пропускали через короткую колонку силикагеля. DCM концентрировали на роторном испарителе до получения (R,R,R)-5-бутил-2,7,8-триметил-2-(4,8,12-триметилтридецил)хроман-6-ола (Пр 1 С-3) в виде мутного желтого масла (165 мг, 100%), которое использовали немедленно без дополнительной очистки. Стадия 3. В 50 мл RBF помещали (R,R,R)-5-бутил-2,7,8-триметил-2-(4,8,12-триметилтридецил)хроман-6-ол(Пр-1 С-3) (120 мг, 0,25 ммоль) и ACN (25 мл), затем охлаждали до 0 С. К реакционной смеси добавляли по каплям в течение 1 мин раствор CAN (268 мг, 0,49 ммоль) в воде (1 мл), получая в результате яркооранжевый раствор. Через 10 мин реакцию считали завершившейся (ТСХ - 9:1 гептан: EtOAc). Реакцию разбавляли DCM (10 мл) и водой (10 мл). Водный слой промывали DCM (10 мл). Слои DCM промывали раствором соли (5 мл), пропускали через короткую колонку силикагеля и концентрировали на роторном испарителе до получения (R,R,R)-2-бутил-3-(3-гидрокси-3,7,11,15-тетраметилгексадецил)-5,6-диметил- 26016226[1,4]бензохинона (Пр-1 С-4) в виде оранжевого масла (105 мг, 85%). 1 Стадия 1. В 50 мл RBF помещали (+)токоферол (Пр-1D-1) (300 мг, 0,72 ммоль), K2CO3 (199 мг,1,44 ммоль), аллилбромид (182 мкл, 1,44 ммоль) и ацетон (8 мл). Реакционную смесь нагревали до кипения в течение 20 ч, после данного времени реакцию считали завершившейся согласно ТСХ (1:5EtOAc:Hept). Реакционную смесь разбавляли водой (10 мл). Водный слой отделяли и промывали DCM(310 мл). Объединенные слои DCM сушили над Na2SO4, фильтровали и концентрировали на роторном испарителе до получения бледно-желтого масла. Масло пропускали через короткую колонку силикагеля(1:1: DCM:тептан). После концентрирования элюента получили (R,R,R)-6-аллилокси-2,7,8-триметил-2(4,8,12-триметилтридецил)хроман (Пр-1D-2) в виде прозрачного бесцветного масла (334 мг, 100%), которое использовали без дополнительной очистки. Стадия 2. (R,R,R)-6-аллилокси-2,7,8-триметил-2-(4,8,12-триметил-тридецил)-хроман (Пр-1D-2) (0,33 г, 0,72 ммоль) нагревали до 200 С в течение 1 ч, после данного времени реакцию считали завершенной(ТСХ). Реакционную смесь охлаждали до RT и очищали флэш-хроматографией (1:1 DCM:тептан) до получения продукта перегруппировки (R,R,R)-5-аллил-2,7,8-триметил-2-(4,8,12-триметилтридецил)хроман 6-ол (Пр-1D-3) (112 мг, 34%), который использовали без дополнительной очистки. Стадия 3. В 50 мл RBF помещали (R,R,R)-5-аллил-2,7,8-триметил-2-(4,8,12-триметилтридецил)хроман-6-ол (Пр-1D-3) (120 мг, 0,26 ммоль) и ACN (20 мл), затем охлаждали до 0 С. Раствор CAN (285 мг, 0,52 ммоль) в воде (1 мл) добавляли по каплям в течение 1 мин к реакционной смеси, получая в ре- 27016226 зультате ярко-оранжевый раствор. Спустя 15 мин реакцию считали завершенной (ТСХ - 9:1 гепт.:EtOAc). Реакционную смесь разбавляли МТВЕ (10 мл) и водой (10 мл). Водный слой промывали МТВЕ (310 мл). Объединенные слои МТВЕ промывали раствором соли (5 мл), сушили над MgSO4, фильтровали и концентрировали на роторном испарителе до получения оранжевого масла. Масло растворяли в DCM (10 мл) и пропускали через короткую колонку силикагеля. Элюент DCM концентрировали на роторном испарителе до получения(R,R,R)-2-аллил-3-(3-гидрокси-3,7,11,15-тетраметилгексадецил)-5,6-этан[1,4]бензохинона (Пр-1D-4) в виде оранжевого масла (100 мг, 80%). 1 Н ЯМР (400 МГц, CDCl3)(м.д.): 5,83 (ддт., 1H), 5,10-5,05 (м, 2H), 3,29 (д, J = 6,2 Гц, 2H), 2,59-2,45(R,R,R)-аллил-3-(3-гидрокси-3,7,11,15-тетраметилгексадецил)-5,6-диметил-[1,4]бензохинон (Пр-1D4) (50 мг, 0,1 ммоль) гидрировали на PtO2 (5 мг) при 50 фунт/дюйм в течение 2 ч в растворе EtOAc (5 мл). Суспензию фильтровали через целит, который промывали DCM (22 мл). Бледно-желтый раствор концентрировали на роторном испарителе до получения бледно-желтого масла (Пр-1D-5). Масло растворяли в DCM (5 мл) и перемешивали с силикагелем (20 мг) в течение 5 дней. Ярко-желтую суспензию фильтровали через ватный тампон и концентрировали на роторном испарителе до получения (R,R,R)-2-(3 гидрокси-3,7,11,15-тетраметилгексадецил)-5,6-этан-3-пропил-[1,4]бензохинона (Пр-1D-6) в виде яркожелтого масла (38 мг, 76%). 1 Н ЯМР (400 МГц, CDCl3)(м.д.): 2,57-2,52 (м, 2H), 2,48-2,44 (м, 2H), 2,02 (с, 6H), 1,57-1,04 (м,26H), 0,99 (т, J = 7,4 Гц, 3H), 0,89-0,85 (м, 15H). Пример 1E. Стадия 1. В 50 мл RBF помещали (+)токоферол (Пр-1 Е-1) (1,04 г, 2,58 ммоль), K2CO3 (715 мг, 5,17 ммоль),аллилбромид (450 мкл, 5,17 ммоль) и ацетон (10 мл). Реакционную смесь нагревали до кипения в течение 16 ч, после данного времени реакцию считали законченной по данным ТСХ (1:5 EtOAc:гепт.). Реакционную смесь разбавляли водой (10 мл) и DCM (10 мл). Водный слой отделяли и промывали DCM (310 мл). Объединенные слои DCM сушили над MgSO4, фильтровали и концентрировали на роторном испарителе до получения бледно-желтой жидкости (1,09 г). Жидкость от промывания прогоняли через короткую колонку силикагеля (1:1: DCM:гепт.). После концентрирования элюента получали (R,R,R)-6 аллилокси-2,8-диметил-2-(4,8,12-триметилтридецил)хроман (Пр-1 Е-2) в виде прозрачного бесцветного масла (0,97 г, 85%).- 28016226 Стадия 2. (R,R,R)-6-аллилокси-2,8-диметил-2-(4,8,12-триметилтридецил)хроман (Пр-1 Е-2) (0,97 г,2,19 ммоль) нагревали до 200 С в течение 3 ч, после чего реакцию считали завершенной (1 Н ЯМР - 4: 1 смесь изомеров). Затем реакцию охлаждали до RT с образованием (R,R,R)-5-аллил-2,8-этан-2-(4,8,12 триметилтридецил)хроман-6-ола (Пр-1 Е-3) в виде коричневого масла (0,97 г, 100%), с которым продолжили работу в следующей стадии без дополнительной очистки. Стадия 3. В 50 мл RBF помещали (R,R,R)-5-аллил-2,8-этан-2-(4,8,12-триметилтридецил)хроман-6-ол (Пр-1 Е 3) (280 мг, 0,63 ммоль) и ACN (14 мл), затем охлаждали до 0 С. К реакционной смеси добавляли по каплям в течение 1 мин раствор CAN (710 мг, 1,30 ммоль) в воде (2 мл), что приводило к образованию яркооранжевого раствора. Спустя 15 мин реакцию считали завершенной (ТСХ - 5:1 гепт.:EtOAc). Реакционную смесь экстрагировали МТВЕ (315 мл). Объединенные слои МТВЕ сушили над Na2SO4, фильтровали и концентрировали на роторном испарителе до получения (R,R,R)-2-аллил-3-(3-гидрокси-3,7,11,15 тетраметил-гексадецил)-5-метил-[1,4]бензохинона (Пр-1 Е-4) в виде оранжевого масла (270 мг, 96%). 1 Н ЯМР (400 МГц, CDCl3)(м.д.): 6,59 (д, J = I,4 Гц, 1H), 5,82 (д.д.т., 1H), 5,10-5,06 (м., 2H), 3,27 (д,J = 6,2 Гц, 2H), 2,60-2,56 (м, 2H), 2,06 (с, 6H), 1,59-1,04 (м, 21H), 0,89-0,85 (м, 15H). Стадия 4.(115 мг, 0,25 ммоль) гидрировали с использованием PtO2 (6 мг) при 50 фунт/дюйм 2 в течение 3 ч в растворе EtOAc (7 мл). Суспензию фильтровали через силикагель, который промывали EtOAc (40 мл). Раствор концентрировали на роторном испарителе до получения (R,R,R)-3-(3-гидрокси-3,7,11,15 тетраметилгексадецил)-5-метил-2-пропилбензол-1,4-диола (Пр-1 Е-5) в виде прозрачного бесцветного масла (110 мг, 96%), с которым продолжили работу на следующей стадии без дополнительной очистки. Стадия 5. В 50 мл RBF помещали (R,R,R)-3-(3-гидрокси-3,7,11,15-тетраметилгексадецил)-5-метил-2-пропилбензол-1,4-диол (Пр-1 Е-5) (110 мг, 0,24 ммоль), ACN (15 мл) и DCM (2 мл), затем охлаждали до 0 С. Раствор CAN (269 мг, 0,49 ммоль) в воде (1 мл) добавляли к реакционной смеси по каплям в течение 1 мин, что приводило к образованию ярко-оранжевого раствора. Реакционную смесь перемешивали в течение 15 мин, затем разбавляли водой (5 мл). Водный слой промывали DCM (330 мл). Объединенные слои DCM сушили над Na2SO4, фильтровали и концентрировали на роторном испарителе до получения оранжевого масла. Масло очищали колоночной хроматографией (градиент от гепт. до 20:1 гептан:EtOAc) с получением(R,R,R)-3-(3-гидрокси-3,7,11,15-тетраметилгексадецил)-5-метил-2-пропил-[1,4]бензохинона (Пр-1 Е-6) в виде оранжевого масла (50 мг, 44%). 1 Н ЯМР (400 МГц, CDCl3)(м.д.): 6,56 (с, 1H), 2,58-2,54 (м, 2H), 2,45 (т, J = 7,9 Гц, 2H), 2,04 (с, 3H),1,55-1,04 (м, 26H), 1,00 (т, J = 7,4 Гц, 3H), 0,89-0,85 (м, 15H). Пример 1F.
МПК / Метки
МПК: A61P 43/00, A61K 31/355, A61K 31/047, A61K 31/352, A61K 31/122
Метки: митохондриальных, соединения, лечения, редокс-активные, заболеваний, терапевтические
Код ссылки
<a href="https://eas.patents.su/30-16226-redoks-aktivnye-terapevticheskie-soedineniya-dlya-lecheniya-mitohondrialnyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Редокс-активные терапевтические соединения для лечения митохондриальных заболеваний</a>
Предыдущий патент: Способ производства электроэнергии и аэродинамическая электростанция для его осуществления
Следующий патент: Способ лечения офтальмологических неоваскулярных расстройств
Случайный патент: Сварочный агрегат для сварки двух рельсов пути и способ сварки