Замещенные n-фенилметил-5-оксопролин-2-амиды в качестве антагонистов р2х7-рецептора и способы их применения
Номер патента: 16076
Опубликовано: 30.01.2012
Авторы: Глив Роберт, Чеймберз Лора Дж, Уолтер Дэрил Саймон, Зенгер Штефан
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
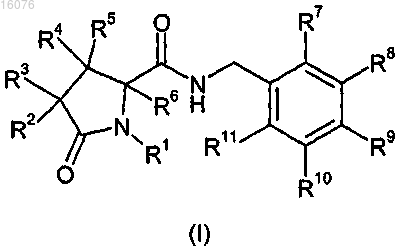
где R1 представляет собой метил, или этил, или C3-5циклоалкил, пиридинилметил, или фенил, или бензил;
R2 и R3 независимо представляют собой водород, галоген, C1-6алкил, нафтилметил-, бензил, C2-6алкенил, C2-6 алкинил или C3-6циклоалкилметил-; и любой из указанных выше C1-6алкила, нафтилметила-, бензила, C2-6 алкенила, C2-6алкинила или C3-6циклоалкилметила- необязательно замещен 1, 2 или 3 атомами галогена;
R4, R5 и R6 независимо представляют собой водород, или фтор, или метил;
R7, R8, R9, R10 и R11 независимо представляют собой водород, галоген, циано, C1-6алкил, C2-6алкенил, C2-6алкинил, C3-6циклоалкил или фенил, и любой из указанных выше C1-6алкила, C2-6алкенила, C2-6алкинила, C3-6 циклоалкила или фенила необязательно замещен 1, 2 или 3 атомами галогена; или R10 и R11 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо, которое необязательно замещено 1, 2 или 3 атомами галогена;
при условии, что, когда R7 и R11, оба, выбраны из водорода или фтора, по меньшей мере один из R8, R9 и R10 представляет собой атом галогена, или R8, R9 и R10 выбирают из группы, состоящей из водорода и CF3, и один, но не более чем один из R8, R9 и R10 представляет собой CF3.
2. Соединение формулы (I) или его фармацевтически приемлемая соль

где R1 представляет собой метил, или этил, или незамещенный C3-6циклоалкил, фенил, или бензил;
R2 и R3 независимо представляют собой водород, галоген, C1-6алкил, нафтилметил-, бензил, C2-6алкенил, C2-6 алкинил или C3-6циклоалкилметил-; и любой из указанных выше C1-6алкила, нафтилметила-, бензила, C2-6 алкенила, C2-6алкинила или C3-6циклоалкилметила- необязательно замещен 1, 2 или 3 атомами галогена;
R4, R5 и R6 независимо представляют собой водород или фтор;
R7, R8, R9, R10 и R11 независимо представляют собой водород, галоген, циано, C1-6алкил, C2-6алкенил, C2-6алкинил, C3-6циклоалкил или фенил, и любой из указанных выше C1-6алкила, C2-6алкенила, C2-6алкинила, C3-6 циклоалкила или фенила необязательно замещен 1, 2 или 3 атомами галогена; или R10 и R11 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо, которое необязательно замещено 1, 2 или 3 атомами галогена;
при условии, что, когда R7 и R11, оба, выбраны из водорода или фтора, по меньшей мере один из R8, R9 и R10 представляет собой атом галогена, и один, но не более чем один из R8, R9 и R10 представляет собой CF3.
3. Соединение формулы (I) или его соль по п.1, где R4, R5 и R6 независимо представляют собой водород или метил.
4. Соединение формулы (I) или его соль по п.1 или 3, где R7, R8, R9, R10 и R11 независимо представляют собой водород, галоген, циано, трифторметил, C1-6алкил; или R10 и R11 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо.
5. Соединение формулы (I) или его соль по любому одному из пп.1-4, где R1 представляет собой метил или этил.
6. Соединение формулы (I) или его соль по любому одному из пп.1-5, где R2 и R3 независимо представляют собой водород, фтор или метил.
7. Соединение формулы (I) или его соль по любому одному из пп.1-6, где R7, R8, R9, R10 и R11 независимо представляют собой водород, хлор, фтор, бром, метил или трифторметил.
8. Соединение формулы (I) по п.1 или его соль, представляющее собой соединение, представленное ниже, или его фармацевтически приемлемую соль
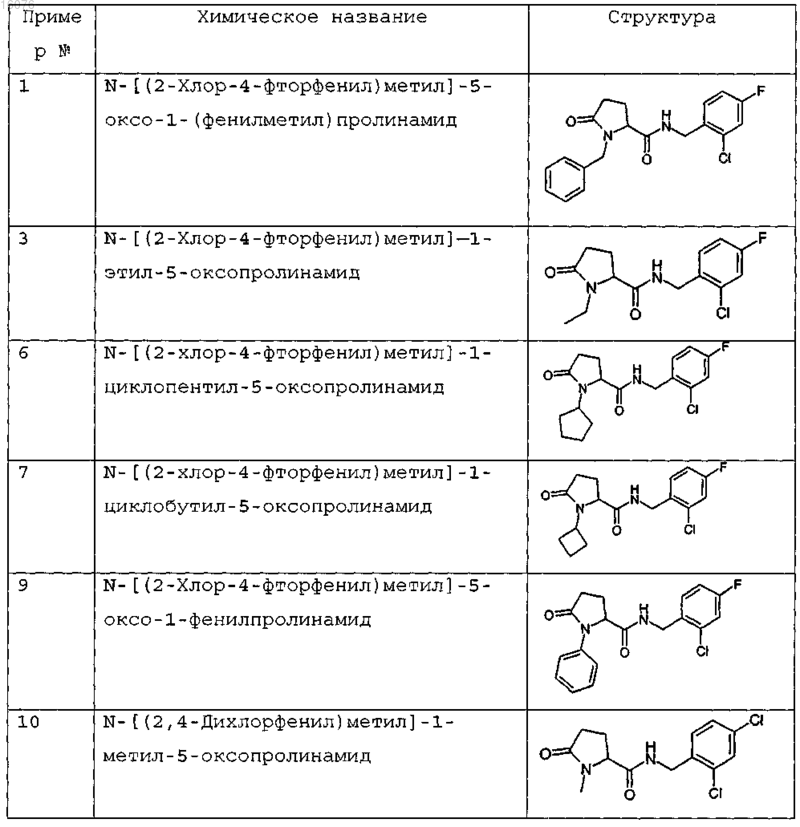
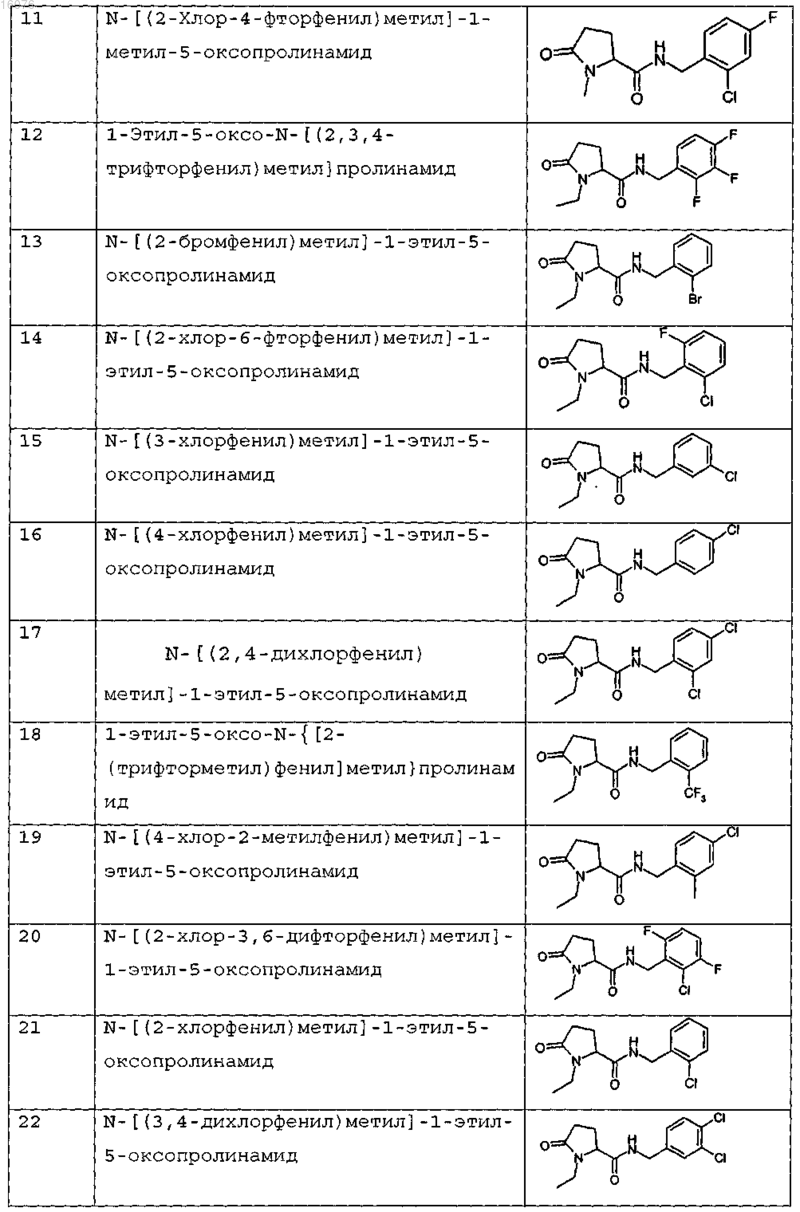
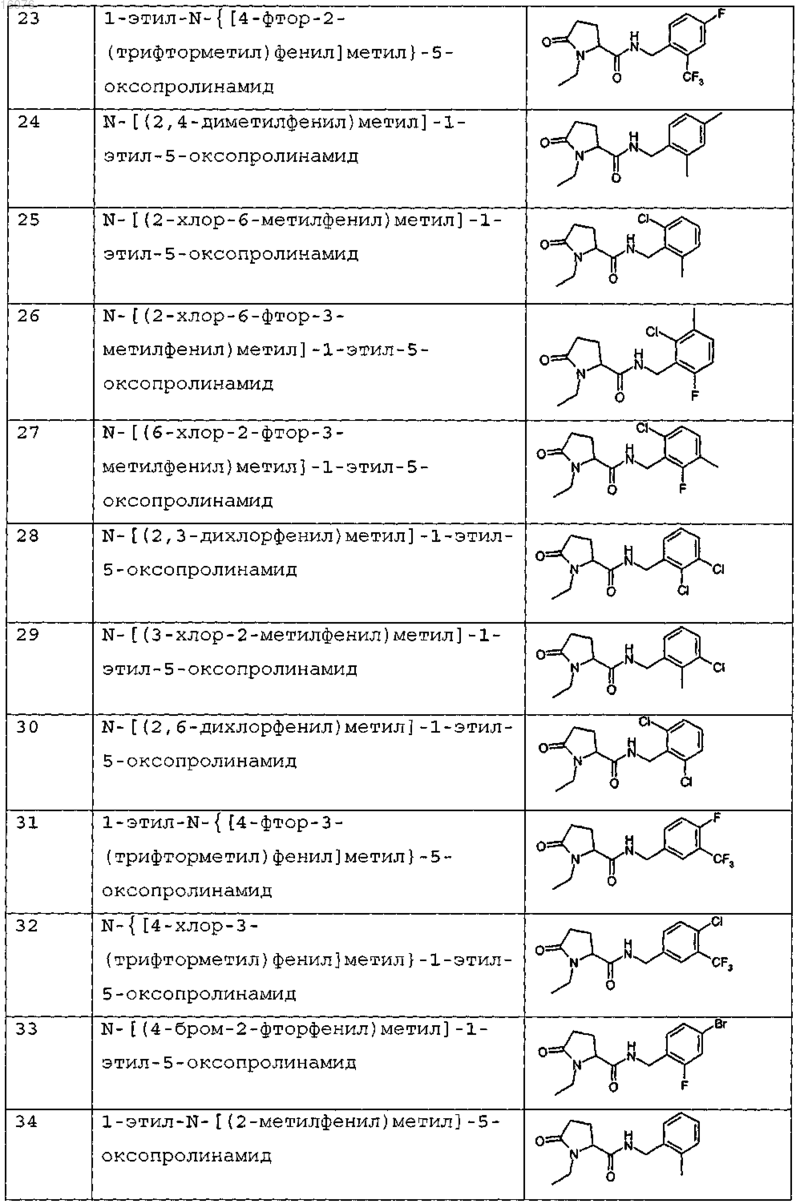
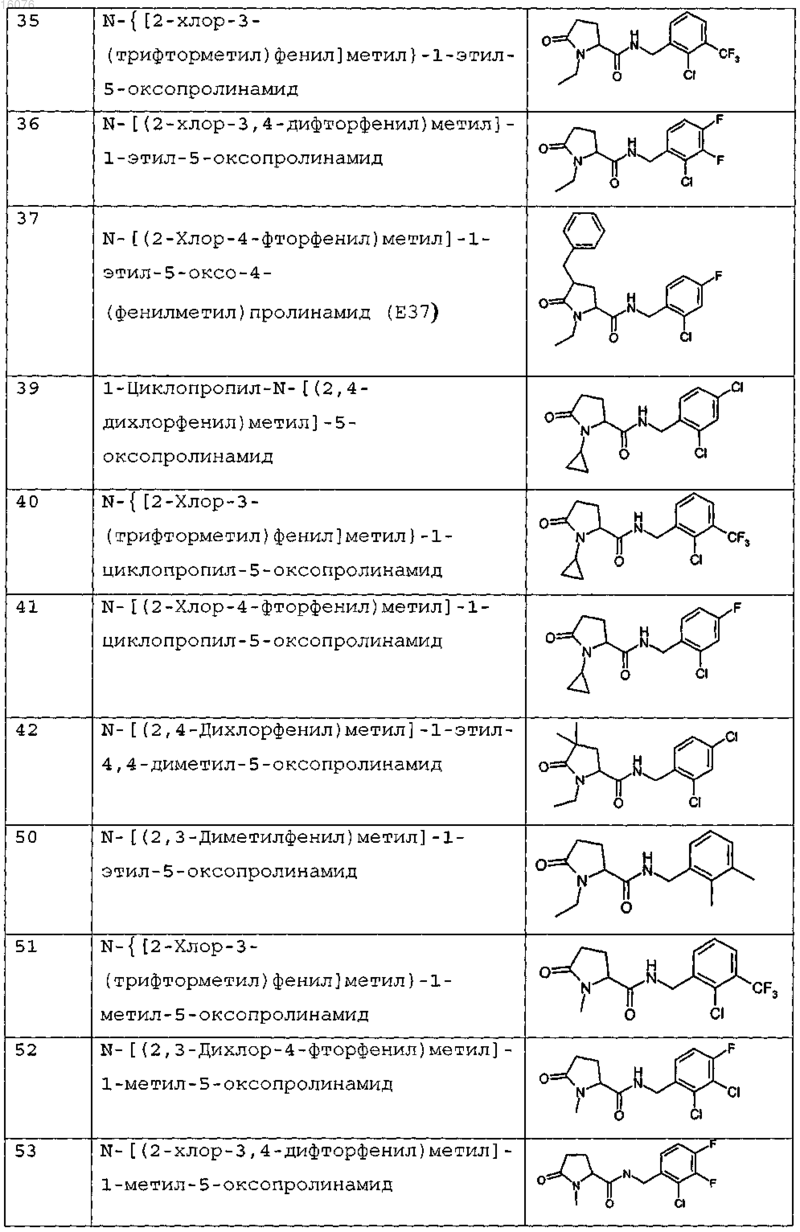
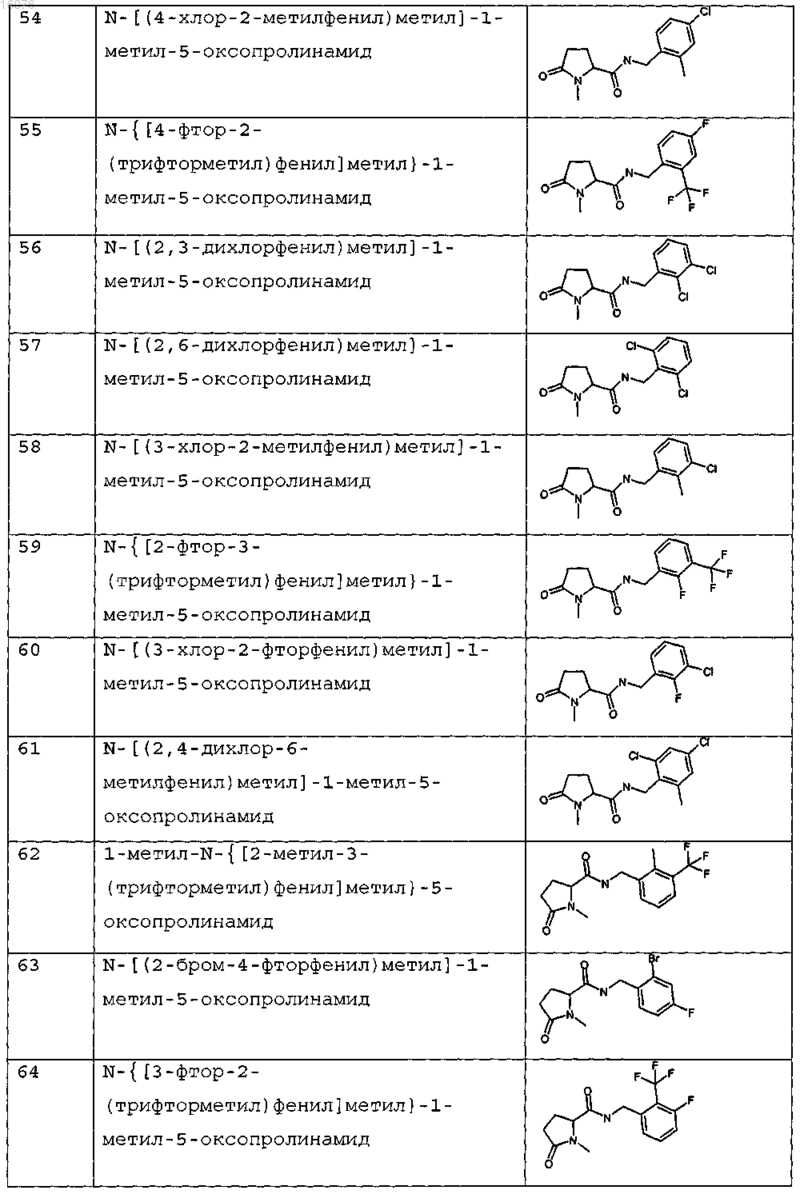
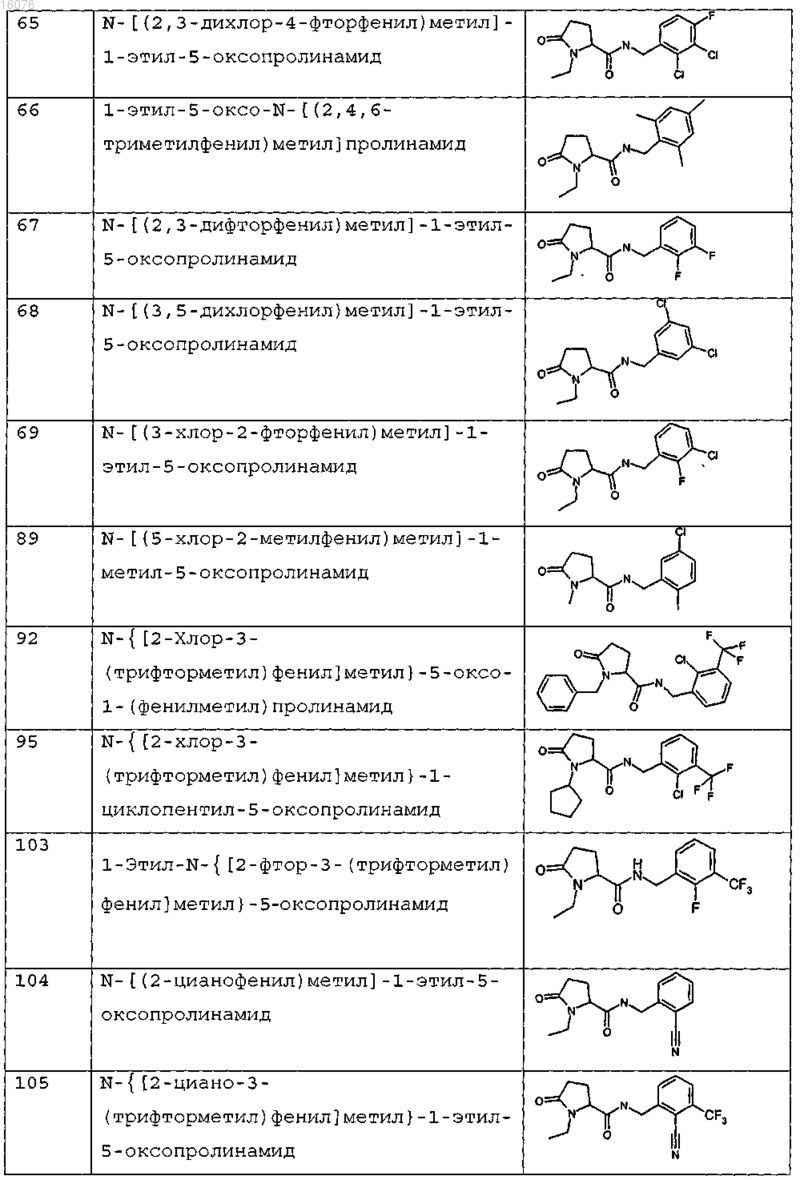
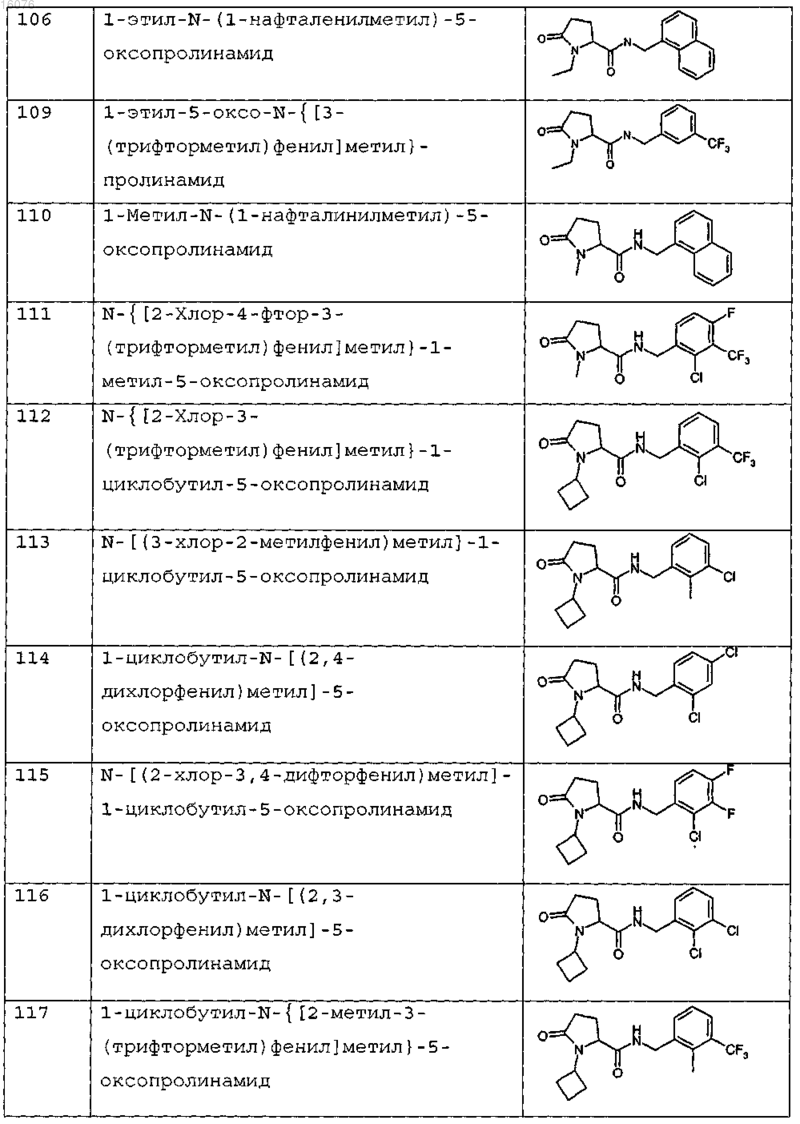
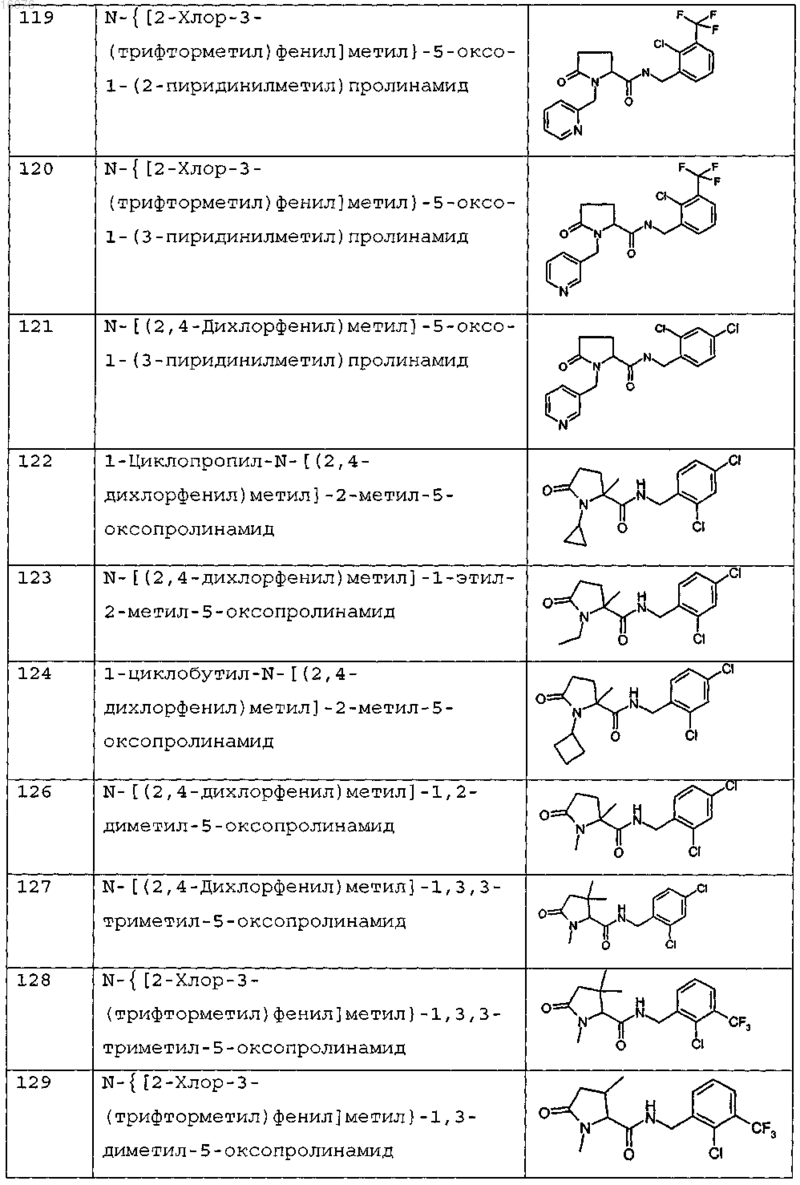
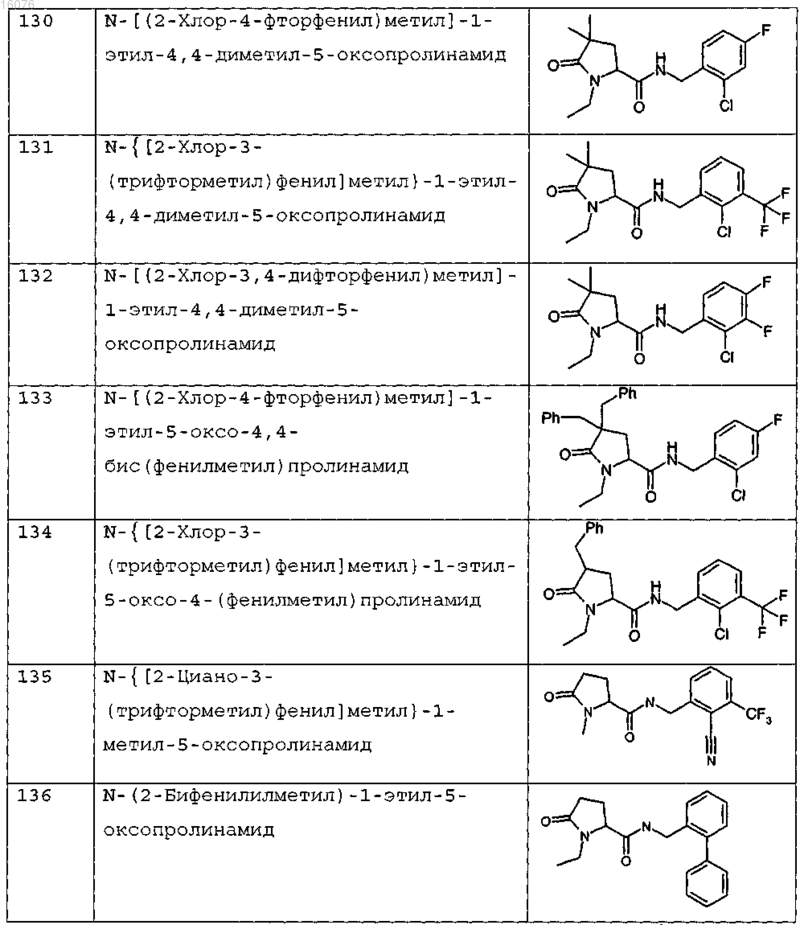
9. Соединение по п.1, представляющее собой N-{[2-хлор-3-(трифторметил)фенил]метил}-1-метил-5-оксопролинамид или его фармацевтически приемлемую соль.
10. Соединение по п.1, представляющее собой N-{[2-хлор-3-(трифторметил)фенил]метил}-1-метил-5-оксо-L-пролинамид оксопролинамид или его фармацевтически приемлемую соль.
11. Соединение по п.1, представляющее собой N-[(2,4-дихлорфенил)метил]-1-метил-5-оксопролинамид или его фармацевтически приемлемую соль.
12. Соединение по п.1, представляющее собой N-[(2,4-дихлорфенил)метил]-1-метил-5-оксо-L-пролинамид оксопролинамид или его фармацевтически приемлемую соль.
13. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из предшествующих пунктов, и фармацевтически приемлемый носитель или эксципиент.
14. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-12 в терапии.
15. Применение соединения по п.14 или его соли для лечения или предупреждения боли, воспаления или нейродегенеративного заболевания.
16. Соединение формулы (I) или его фармацевтически приемлемая соль
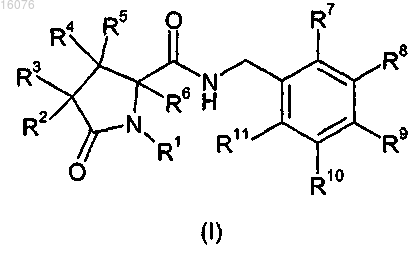
где R1 представляет собой C1-6алкил, C2-6алкенил, C2-6алкинил, C3-6циклоалкил, C3-6циклоалкилметил- или пиридинилметил-, любой из которых необязательно замещен 1, 2 или 3 атомами галогена; или незамещенный фенил, или бензил;
R2 и R3 независимо представляют собой водород, галоген, C1-6алкил, нафтилметил-, бензил, C2-6алкенил, C2-6 алкинил или C3-6циклоалкилметил-; и любой из указанных выше C1-6алкила, нафтилметила-, бензила C2-6 алкенила, C2-6алкинила или C3-6циклоалкилметила- необязательно замещен 1, 2 или 3 атомами галогена;
R4, R5 и R6 независимо представляют собой водород, фтор или метил;
R7, R8, R9, R10 и R11 независимо представляют собой водород, галоген, циано, C1-6алкил, C2-6алкенил, C2-6 алкинил, C3-6циклоалкил или фенил, и любой из указанных выше C1-6алкила, C2-6алкенила, C2-6алкинила, C3-6 циклоалкила или фенила необязательно замещен 1, 2 или 3 атомами галогена; или R10 и R11 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо, которое необязательно замещено 1, 2 или 3 атомами галогена;
при условии, что, когда R7 и R11, оба, выбраны из водорода или фтора, по меньшей мере один из R8, R9 и R10 представляет собой атом галогена, или R8, R9 и R10 выбирают из группы, состоящей из водорода и CF3, и один, но не более чем один из R8, R9 и R10 представляет собой CF3,
для лечения или профилактики боли, воспаления или нейродегенеративного заболевания.
17. Соединение формулы (I) или его соль по п.16, где R1 представляет собой C1-4алкил, C2-4алкенил, C3-5 циклоалкил, пиридинилметил-, фенил или бензил.
18. Соединение формулы (I) или его соль по п.17, где
R1 представляет собой C1-4алкил, C2-4алкенил, C3-5циклоалкил, пиридинилметил-, фенил или бензил;
R2 и R3, оба, представляют собой водород;
R4, R5 и R6 независимо представляют собой метил;
R7, R8, R9, R10 и R11 независимо представляют собой водород, хлор, фтор, бром, метил или трифторметил;
при условии, что, когда R7 и R11, оба, выбраны из водорода или фтора, по меньшей мере один из R8, R9 и R10 представляет собой атом галогена, или R8, R9 и R10 выбирают из группы, состоящей из водорода и CF3, и один, но не более чем один из R8, R9 и R10 представляет собой CF3.
19. Соединение формулы (I) или его соль по любому одному из пп.16-18 для лечения или профилактики боли при воспалении, нейропатической боли или висцеральной боли или для лечения или профилактики болезни Альцгеймера.
20. Способ лечения человека или животного, страдающего от боли, воспаления или нейродегенеративного заболевания, включающий введение указанному выше субъекту эффективного количества соединения формулы (I) по любому из пп.1-12 или 16-18.
21. Способ по п.20, где человек или животное страдают болью при воспалении, нейропатической болью или висцеральной болью либо болезнью Альцгеймера.
22. Применение соединения по любому из пп.1-12 или 16-18 для получения лекарственного средства для лечения или профилактики боли, воспаления или нейродегенеративного заболевания.
23. Применение по п.22, где болью является нейропатическая боль или висцеральная боль и заболеванием является болезнь Альцгеймера.
Текст
Дата публикации и выдачи патента Номер заявки Настоящее изобретение относится к новым оксопролинамидным производным формулы (I),которые модулируют функцию Р 2 Х 7-рецептора и способны вызывать антагонизм в отношении воздействий АТФ на Р 2 Х 7-рецептор, и применению таких соединений или содержащих их фармацевтических композиций при лечении нарушений, опосредуемых Р 2 Х 7-рецептором,например боли, воспаления и нейродегенерации.(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) 016076 Настоящее изобретение относится к гетероциклическим амидным производным, которые модулируют функцию Р 2 Х 7-рецептора и способны вызывать антагонизм в отношении воздействий АТФ на Р 2 Х 7-рецептор (антагонисты Р 2 Х 7-рецептора); к способам их получения; к содержащим их фармацевтическим композициям и к применению таких соединений в терапии. Р 2 Х 7-рецептор представляет собой открываемый лигандом ионный канал, который экспрессируется в клетках гематопоэтической линии дифференцировки, например макрофагах, микроглиальных клетках, мастоцитах и лимфоцитах (Т и В) (см., например, Collo et al., Neuropharmacology, 36, 1277-1283(1997 и активируется внеклеточными нуклеотидами, в частности аденозинтрифосфатом (АТФ). Активация Р 2 Х 7-рецепторов вовлечена в образование гигантской клетки, дегрануляцию, цитолитическую гибель клетки, потерю CD62L, регуляцию клеточной пролиферации и высвобождение провоспалительных цитокинов, таких как интерлейкин 1 бета (IL-1) (например, Ferrary et al., J. Immunol., 176, 38773883 (2006 и альфа-фактор некроза опухоли (TNF) (например, Hide et al., Journal of Neurochemistry, 75,965-972 (2000. Р 2 Х 7-Рецепторы также локализуются в антигенпрезентирующих клетках, кератиноцитах, относящихся к околоушной железе клетках, гепатоцитах, эритроцитах, эритролейкозных клетках,моноцитах, фибробластах, клетках костного мозга, нейронах и почечных мезангиальных клетках. Кроме того, Р 2 Х 7-рецептор экспрессируется пресинаптическими окончаниями в центральной и периферической нервных системах и показано, что он опосредует высвобождение глутамата из глиальных клеток(Anderson С. et al., Drug. Dev. Res., 50, 92 (2000. Локализация Р 2 Х 7-рецетора в ключевых клетках иммунной системы, связанная с его способностью высвобождать в значительной степени воспалительные медиаторы из этих клеток, наводит на мысль о потенциальной роли антагонистов Р 2 Х 7-рецептора при лечении большого ряда заболеваний, включая боль и нейродегенеративные нарушения. В последних преклинических исследованиях in vivo подразумевается непосредственное участие Р 2 Х 7-рецептора как в воспалительной боли, так и в невропатической боли (Dell'Antonio et al., Neurosci. Lett., 327, 87-90 (2002); Chessel I.P. et al., Pain, 114, 386-396 (2005);Honore et al., J. Pharmacol. Exp. Ther., 319, 1376-1385 (2006, тогда как имеется доказательство in vitro,что P2X7-рецепторы опосредуют индуцируемую микроглиальной клеткой гибель кортикальных нейронов (Skaper S.D. et al., Glia, 54, 234-242 (2006. В дополнение, положительная регуляция Р 2 Х 7-рецептора обнаружена вблизи -амилоидных бляшек на трансгенной мышиной модели болезни Альцгеймера(Parvathenani L. et al., J. Biol. Chem., 278(15), 13309-13317 (2003. Настоящее изобретение относится к соединениям, которые модулируют функцию Р 2 Х 7-рецептора и способны вызывать антагонизм в отношении воздействий АТФ на Р 2 Х 7-рецептор (антагонисты Р 2 Х 7 рецептора). В первом аспекте предложены соединение формулы (I) или его фармацевтически приемлемая соль где R1 представляет собой C1-6 алкил, C2-6 алкенил, C2-6 алкинил, С 3-6 циклоалкил, C3-6 циклоалкилметил- или пиридинилметил-, любой из которых необязательно замещен 1, 2 или 3 атомами галогена; или незамещенный фенил, или бензил;R2 и R3 независимо представляют собой водород, галоген, C1-6 алкил, арилметил-, C2-6 алкенил,C2-6 алкинил или C3-6 циклоалкилметил-; и любой из указанных выше C1-6 алкила, арилметила-,C2-6 алкенила, C2-6 алкинила или C3-6 циклоалкилметила- необязательно замещен 1, 2 или 3 атомами галогена;R4, R5 и R6 независимо представляют собой водород, фтор или метил;R7, R8, R9, R10 и R11 независимо представляют собой водород, галоген, циано, C1-6 алкил, С 2-6 алкенил,C2-6 алкинил, C3-6 циклоалкил или фенил, и любой из указанных выше C1-6 алкила, C2-6 алкенила,C2-6 алкинила, C3-6 циклоалкила или фенила необязательно замещен 1, 2 или 3 атомами галогена; или R10 иR11 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо, которое необязательно замещено 1, 2 или 3 атомами галогена; при условии, что, когда R7 и R11, оба, выбраны из водорода или фтора, по меньшей мере один из R8,9R и R10 представляет собой атом галогена, или R8, R9 и R10 выбирают из группы, состоящей из водорода и CF3, и один, но не более чем один из R8, R9 и R10, представляет собой CF3. В одном варианте осуществления предложены соединение формулы (I) или его фармацевтически приемлемая соль где R1 представляет собой C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-6 циклоалкил или C3-6 циклоалкилметил,любой из которых может быть необязательно замещен 1, 2 или 3 атомами галогена; или незамещенный фенил, или бензил;R2 и R3 независимо представляют собой водород, галоген, C1-6 алкил, арилметил, C2-6 алкенил,C2-6 алкинил или C3-6 циклоалкилметил; и любой из указанных выше С 1-6 алкила, арилметила, C2-6 алкенила,C2-6 алкинила или C3-6 циклоалкилметила может быть необязательно замещен 1, 2 или 3 атомами галогена;R4, R5 и R6 независимо представляют собой водород или фтор; иR7, R8, R9, R10 и R11 независимо представляют собой водород, галоген, циано, C1-6 алкил, C2-6 алкенил,C2-6 алкинил, C3-6 циклоалкил или фенил; и любой из указанных выше C1-6 алкила, С 2-6 алкенила,С 2-6 алкинила, C3-6 циклоалкила или фенила может быть необязательно замещен 1, 2 или 3 атомами галогена; при условии, что, когда R7 и R11 независимо представляют собой водород или фтор, по меньшей мере один из R8, R9 и R10 представляет собой атом галогена. В одном варианте осуществления предложены соединение формулы (I) или его фармацевтически приемлемая соль где R1 представляет собой C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-6 циклоалкил, C3-6 циклоалкилметил- или пиридинилметил-, любой из которых необязательно замещен 1, 2 или 3 атомами галогена; или незамещенный фенил, или бензил;R2 и R3 независимо представляют собой водород, галоген, C1-6 алкил, арилметил-, С 2-6 алкенил,C2-6 алкинил или С 3-6 циклоалкилметил-; и любой из указанных выше C1-6 алкила, арилметила-,С 2-6 алкенила, С 2-6 алкинила или С 3-6 циклоалкилметила- необязательно замещен 1, 2 или 3 атомами галогена;R4, R5 и R6 независимо представляют собой водород, фтор или метил;R7, R8, R9, R10 и R11 независимо представляют собой водород, галоген, циано, C1-6 алкил, C2-6 алкенил,C2-6 алкинил, C3-6 циклоалкил или фенил, и любой из указанных выше C1-6 алкила, C2-6 алкенила,C2-6 алкинила, C3-6 циклоалкила или фенила необязательно замещен 1, 2 или 3 атомами галогена; или R10 иR11 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо, которое необязательно замещено 1, 2 или 3 атомами галогена; при условии, что, когда R7 и R11, оба, выбраны из водорода или фтора, по меньшей мере один из R8,9R и R10 представляет собой атом галогена или не более чем один из R8, R9 и R10 представляет собой группу CF3. Как используется в данном описании, термин "алкил" (когда он используется в качестве группы или части группы) относится к линейной или разветвленной углеводородной цепи, содержащей определенное число атомов углерода. Например, C1-6 алкил представляет собой линейную или разветвленную углеводородную цепь, содержащую по меньшей мере 1-6 атомов углерода. Примеры алкила включают, но, не ограничиваясь ими, метил (Me), этил (Et), н-пропил, изопропил, н-гексил или изогексил. Как используется в данном описании, термин "алкенил" относится к линейной или разветвленной углеводородной цепи, содержащей определенное число атомов углерода, где по меньшей мере одна связь углерод-углерод является двойной связью. Примеры алкенила включают, но, не ограничиваясь ими, этенил, пропенил, н-бутенил, изобутенил, н-пентенил и изопентенил. Как используется в данном описании, термин "алкинил" относится к линейной и разветвленной углеводородной цепи, содержащей определенное число атомов углерода, где по меньшей мере одна связь углерод-углерод является тройной связью. Примеры алкинила включают, но, не ограничиваясь ими, этинил, пропинил, бутинил, изопентинил, н-пентинил, изогексинил и н-гексинил. Термин "циклоалкил", если не указано иное, представляет собой замкнутое 3-6-членное неароматическое кольцо, например циклопропил, циклобутил, циклопентил или циклогексил. Термин "арил", как используется в данном описании, относится к C6-10 моноциклическому или бициклическому углеводородному кольцу, где по меньшей мере одно кольцо является ароматическим. Примеры таких групп включают фенил и нафтил.-2 016076 Термин "галоген", как используется в данном описании, относится, если не указано иное, к группе,выбранной из фтора, хлора, брома или йода. В некоторых вариантах осуществления данного изобретения R1 представляет собой C1-6 алкил,C2-6 алкенил, C2-6 алкинил, C3-6 циклоалкил или пиридинилметил-, любой из которых необязательно замещен 1, 2 или 3 атомами галогена; или незамещенный фенил, или бензил. В одном варианте осуществления R1 представляет собой незамещенный C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-6 циклоалкил, пиридинилметил-, фенил или бензил. В другом варианте осуществления R1 представляет собой незамещенныйR1 представляет собой метил или этил. В некоторых вариантах осуществления данного изобретения R2 и R3 независимо представляют собой водород, галоген, C1-6 алкил, бензил, C2-6 алкенил, С 2-6 алкинил или C3-6 циклоалкилметил; и любой из указанных выше C1-6 алкила, бензила, C2-6 алкенила, C2-6 алкинила или C3-6 циклоалкилметила- может быть необязательно замещен 1, 2 или 3 атомами галогена. В одном варианте осуществления R2 и R3 независимо представляют собой водород или галоген, незамещенный C1-6 алкил, бензил, C2-6 алкенил, C2-6 алкинил или C3-6 циклоалкилметил-. В другом варианте осуществления R2 и R3 независимо представляют собой водород, фтор или метил. В дальнейшем варианте осуществления R2 и R3, оба, представляют собой водород. В одном варианте осуществления данного изобретения R4 и R5 независимо представляют собой водород или метил. В другом варианте осуществления R6 представляет собой водород или метил. В дополнительном варианте осуществления R4, R5 и R6 все представляют собой водород. В другом варианте осуществления данного изобретения R7, R8, R9, R10 и R11 независимо представляют собой водород, галоген, циано, трифторметил или незамещенный C1-6 алкил; или R10 и R11 вместе с атомами углерода, к которым они присоединены, образуют незамещенное бензольное кольцо. В дополнительном варианте осуществления R7, R8, R9, R10 и R11 независимо представляют собой водород, галоген, циано, метил или трифторметил; или R10 и R11 вместе с атомами углерода, к которым они присоединены, образуют незамещенное бензольное кольцо. Еще в одном другом варианте осуществления R7, R8,R9, R10 и R11 независимо представляют собой водород, хлор, фтор, бром, метил или трифторметил. В одном варианте осуществления данное изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли, где R1 представляет собой незамещенный C1-4 алкил, C2-4 алкенил,C3-5 циклоалкил, пиридинилметил-, фенил или бензил;R4, R5 и R6 независимо представляют собой водород или метил; иR7, R8, R9, R10 и R11 независимо представляют собой водород, хлор, фтор, бром, метил или трифторметил; при условии, что, когда R7 и R11, оба, выбраны из водорода или фтора, по меньшей мере один из R8,9R и R10 представляет собой атом галогена, или R8, R9 и R10 выбирают из группы, состоящей из водорода и CF3, и один, но не более чем один из R8, R9 и R10 представляет собой CF3. Конкретные соединения согласно данному изобретению включают соединения примеров 1-136, как показано ниже, или их фармацевтически приемлемые соли. Антагонисты Р 2 Х 7 могут быть полезны для предупреждения, лечения или облегчения различных болевых состояний (например, невропатическая боль, хроническая воспалительная боль или висцеральная боль), воспаления и нейродегенерации, в частности болезни Альцгеймера. Антагонисты Р 2 Х 7 также могут представлять собой полезные терапевтические средства при лечении ревматоидного артрита и воспалительного кишечного заболевания. Соединения настоящего изобретения, которые модулируют функцию Р 2 Х 7-рецептора и способны вызывать антагонизм в отношении воздействий АТФ на Р 2 Х 7-рецептор (антагонисты Р 2 Х 7-рецептора),могут быть конкурентными антагонистами, обратными агонистами, отрицательными аллостерическими модуляторами или непрямыми модуляторами функции рецептора. Определенные соединения формулы (I) в некоторых случаях могут образовывать их аддитивные соли кислот. Следует понимать, что для применения в медицине соединения формулы (I) могут быть использованы в виде солей, для которых соли должны быть фармацевтически приемлемыми. Фармацевтически приемлемые соли включают соли, описанные Berge, Bighley и Monkhouse, J. Pharm. Sci., 66, 1-19(1977). Основные соединения формулы (I) могут образовывать соли с фармацевтически приемлемыми кислотами, включая неорганические и органические кислоты. Такие кислоты включают уксусную кислоту, бензолсульфоновую кислоту, бензойную кислоту, камфорсульфоновую кислоту, лимонную кислоту,этансульфоновую кислоту, фумаровую кислоту, глюконовую кислоту, глутаминовую кислоту, бромистоводородную кислоту, хлористо-водородную кислоту, изетионовую кислоту, молочную кислоту, малеиновую кислоту, яблочную кислоту, миндальную кислоту, метансульфоновую кислоту, слизевую кислоту,азотную кислоту, памоевую кислоту, лантотеновую кислоту, фосфорную кислоту, янтарную кислоту,серную кислоту, винную кислоту, п-толуолсульфоновую кислоту и т.п. Примеры фармацевтически приемлемых солей включают соли, образованные с малеиновой кислотой, фумаровой кислотой, бензойной кислотой, аскорбиновой кислотой, памоевой кислотой, янтарной-3 016076 кислотой, хлористо-водородной кислотой, серной кислотой, бисметиленсалициловой кислотой, метансульфоновой кислотой, этандисульфоновой кислотой, пропионовой кислотой, винной кислотой, салициловой кислотой, лимонной кислотой, глюконовой кислотой, аспарагиновой кислотой, стеариновой кислотой, пальмитиновой кислотой, итаконовой кислотой, гликолевой кислотой, п-аминобензойной кислотой, глутаминовой кислотой, бензолсульфоновой кислотой, циклогексилсульфаминовой кислотой, фосфорной кислотой и азотной кислотой. Соединения формулы (I) могут быть получены в кристаллической или некристаллической форме и,если в кристаллической, могут быть необязательно сольватированы, например, в виде гидрата. Данное изобретение включает в свой объем стехиометрические сольваты (например, гидраты), а также соединения, содержащие различные количества растворителя (например, воды). Соединения формулы (I) способны существовать в стереоизомерных формах (например, диастереомеры и энантиомеры), и данное изобретение распространяется на каждую из таких стереоизомерных форм и их смеси, включая рацематы. Различные стереоизомерные формы могут быть отделены одна от другой обычными способами или любой данный изомер может быть получен путем стереоспецифического или асимметрического синтеза. В примерах, где стереохимический состав конечного продукта определяют хиральной ВЭЖХ (более конкретно, способами (А), (В), (С) или (D), как показано в примерах),соответствующее стереоспецифическое название и структуру приписывают конечному продукту, где энантиомерный избыток указанного выше продукта составляет более 70%. Предназначение абсолютной стереохимии основывается на известной хиральности исходного вещества. В примерах, где состав конечного продукта не характеризуется хиральной ВЭЖХ, стереохимия конечного продукта не указывается. Однако полагают, что хиральность основного компонента полученной смеси должна отражать хиральность исходного вещества и энантиомерный избыток зависит от используемого способа синтеза и,вероятно, должен быть подобен способу, определяемому для аналогичного примера (где такой пример существует). Таким образом, полагают, что соединения, представленные в одной хиральной форме, могут быть получены в альтернативной хиральной форме, используя соответствующее исходное вещество. Альтернативно, если используют рацемические исходные вещества, нужно полагать, что должен быть получен рацемический продукт и отдельные энантиомеры могут быть выделены обычными способами. Данное изобретение также включает любые таутомерные формы и их смеси. В объем данного изобретения также включены меченные изотопами соединения, которые идентичны соединениям, подпадающим под формулу (I) и последующие, но при том обстоятельстве, что один или более атомов заменены атомом, имеющим атомную массу или массовое число, отличную (отличное) от атомной массы или массового числа, наиболее часто встречающихся в природе. Примеры изотопов,которые можно вводить в соединения согласно данному изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, йода и хлора, такие как 3 Н, 11C, 14C, 18F, 123I и 125I. Соединения настоящего изобретения и фармацевтически приемлемые соли указанных выше соединений, которые содержат вышеуказанные изотопы и/или другие изотопы других атомов, входят в объем настоящего изобретения. Меченные изотопами соединения настоящего изобретения, например, в которые введены радиоактивные изотопы, такие как 3 Н, 14 С, пригодны для анализов в отношении распределения в ткани лекарственного средства и/или субстрата. Меченные тритием, т.е. 3 Н, и углеродом-14, т.е. 14 С, изотопы особенно предпочтительны вследствие легкости их получения и детектируемости. Изотопы 11 С и 18F особенно пригодны в PET (позитронная эмиссионная томография), и изотопы 125I особенно пригодны в SPECT (гамма-томография, однофотонная эмиссионная компьютерная томография). PET иSPECT пригодны для получения изображения головного мозга. Далее, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может давать определенные терапевтические преимущества, проистекающие от большей метаболической стабильности, например увеличенный период полураспада invivo или сниженные требования в отношении дозировки, и, следовательно, может быть предпочтительно в некоторых случаях. Меченные изотопами соединения формулы (I) и последующих согласно данному изобретению, как правило, можно получить путем осуществления методик синтеза, раскрытых на схемах и/или в примерах ниже, путем замены немеченного изотопом реагента легко доступным, меченным изотопом, реагентом. Кроме того, соединения формулы (I) можно вводить в виде пролекарств. Как используется в данном описании, "пролекарство" соединения формулы (I) представляет собой функциональное производное соединения, которое после его введения пациенту, в конце концов, высвобождает соединение формулы(I) in vivo. Введение соединения формулы (I) в виде пролекарства дает возможность специалисту в данной области выполнять одно или более из следующего: (а) модифицировать начало действия соединенияin vivo; (b) модифицировать продолжительность действия соединения in vivo; (с) модифицировать транспортировку или распределение соединения in vivo; (d) модифицировать растворимость соединения invivo и (е) преодолевать или компенсировать побочный эффект или другое затруднение, встречающиеся при применении соединения. Типичные функциональные производные, используемые для получения пролекарств, включают модификации соединения, которые являются химически или ферментативно расщепляемыми in vivo. Такие модификации хорошо известны специалисту в данной области. Соединения формулы (I), где переменные являются такими, как описано выше, и их соли и сольваты можно получить путем методики, раскрытой ниже, составляющей дальнейший аспект данного изобретения. Способ получения соединения формулы (I) согласно данному изобретению включает:(a) сочетание карбоновой кислоты формулы (2) (или ее активированного производного) с амином формулы (3) (см. схему 1), где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как описано выше. Соединения (2) и (3) необязательно защищены;(b) взаимодействие дикарбонильного соединения формулы (4), изоцианида формулы (5) и амина формулы (6) в подходящем растворителе, таком как метанол, и при подходящей температуре, такой как 100 С (см. схему 2), где R1, R2, R3, R4, R5, R7, R8, R9, R10 и R11 являются такими, как описано выше, и R6 представляет собой водород или метил. Соединения (4), (5) и (6) необязательно защищены. Способы такого типа описаны ранее в химической литературе (например, Н. Туе and M. Whittaker, Org. Biomol.(c) снятие защиты с соединения формулы (I), которое защищено. Примеры защитных групп и способы их удаления можно найти у T.W. Greene и P.G.M. Wuts в руководстве "Protective Groups in Organic(d) взаимопреобразование соединений формулы (I) в другие соединения формулы (I). Примеры стандартных способов взаимопреобразования включают эпимеризацию, окисление, восстановление, алкилирование, ароматическое замещение, нуклеофильное замещение, амидное сочетание и гидролиз сложного эфира. Схема 1 Сочетание кислоты формулы (2) и амина формулы (3) обычно включает использование активирующих агентов, таких как гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида или нанесенный на полимер карбодиимид, 1-гидроксибензотриазол (НОВТ) или 1-гидрокси-7-азабензотриазол(HOAt), и, необязательно, подходящего основания, такого как третичный алкиламин (например, диизопропилэтиламин, N-этилморфолин, триэтиламин) или пиридина, в подходящем растворителе, таком как ДМФА и/или дихлорметан, и при подходящей температуре, например в диапазоне от 0 С до комнатной температуры. Альтернативно, сочетание соединений (2) и (3) можно осуществлять обработкой гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония и подходящего третичного алкиламина, такого как диизопропилэтиламин, в подходящем растворителе, таком как диметилформамид, при подходящей температуре, такой как комнатная температура. Альтернативно, соединение формулы (2) можно использовать в виде активированного производного (например, хлорангидрид кислоты, смешанный ангидрид, активированный сложный эфир (например, О-ацилизомочевина, и в таких случаях способ (а) обычно включает обработку указанного выше активированного производного амином (Ogliaruso М.А., Wolfe J.F., in The Chemistry of Functional Groups (изд. Patai S.), Suppl. B: The Chemistry of Acid Derivatives, Pt. 1 (John Wiley and Sons, 1979), c. 442-8; Beckwith A.L.J. in The Chemistry of Functional Groups Примеры способов получения соединений формулы (2) представлены на приводимых ниже схемах 3-9. Схема 3 где R1, R2, R3, R4 и R5 являются такими, как описано выше, R6 является Н или F, и Р 1 и Р 2 представляют собой подходящие защитные группы, такие как C1-6 алкил, или Р 1 и Р 2 являются Н. Аналогичные способы, описанные ниже для преобразований, представленных на схеме 3, описаны ранее в химической литературе (например, G. Verardo, P. Geatti, E. Pol and A.G. Giumanini, Can. J. Chem.,80: 779-788 (2002); T. Godet et. al., Organic Letters (2004), 6(19), 3281-3284). Стадия (i) обычно включает начальную обработку соединения (7) основанием, таким как гидроксид натрия, в подходящем растворителе, таком как метанол, при подходящей температуре, такой как 0 С, с последующим восстановительным алкилированием, которое обычно включает последовательную обработку альдегидом или кетоном и кислотой, такой как уксусная кислота, и затем добавление восстановителя, такого как боргидрид натрия, при подходящей температуре, такой как температура в диапазоне от 0 С до комнатной температуры. Стадия (ii) может происходить самопроизвольно, на которой соединение (9) непосредственно выделяют из реакционной смеси соединения (7), как описано на стадии (i) выше, но, как правило, соединение(8) нагревают при подходящей температуре, такой как 110 С, в подходящем растворителе, таком как толуол, получая соединение (9). Снятие защиты на стадии (iii) обычно представляет собой стандартную методику для преобразования эфира карбоновой кислоты в кислоту, как, например, использование соответствующего гидроксида где R1, R2, R3, R4 и R5 являются такими, как описано выше, R6 является Н или F, L1 представляет собой подходящую группу, такую как галоген (например, хлор или бром) или бороновая кислота или эфир бороновой кислоты, и Р 3 представляет собой подходящую защитную группу, такую как C1-6 алкил. Способы, аналогичные описанным ниже, для представленных на схеме 4 преобразований, описаны ранее в химической литературе (например, Т. Itoh et al., Tetrahedron., 59 (2003), 3527-3536; Т. Simandan и М.В. Smith, Synthetic Communications, 26(9), 1827-1838 (1996. Стадия (i) обычно включает обработку соединения (10) основанием, таким как гидрид натрия, и алкилирующим агентом, таким как алкилгалогенид, в подходящем растворителе, таком как тетрагидрофуран, при подходящей температуре, такой как в диапазоне от 0 С до комнатной температуры, или, альтернативно, стадия может включать обработку соединения (10) арилгалогенидом или арил- или алкенилбороновой кислотой (или эфиром), в подходящем растворителе, таком как толуол, в присутствии подходящего катализатора, такого как смесь трис(дибензилиденацетон)дипалладия(0) и Xantphos (9,9-диметил 4,5-бис-(дифенилфосфино)ксантен), и подходящего основания, такого как карбонат цезия, при подходящей температуре, такой как 120 С.-6 016076 Снятие защиты на стадии (ii) обычно включает стандартную методику преобразования эфира карбоновой кислоты в кислоту как, например, использование соответствующего гидроксида (например, гидроксид натрия), в соответствующем растворителе, таком как метанол, при подходящей температуре, такой как в диапазоне от 0 С до комнатной температуры; или использование соответствующей кислоты где R1, R2, R3, R4 и R5 являются такими, как описано выше, и R6 является Н или F. Способы, аналогичные описанным ниже, для преобразования, представленного на схеме 5, описаны ранее в химической литературе (например, S. Aoki et al., Tetrahedron, 60 (2004), 7053-7059). Стадия (i) обычно включает нагревание соединения (12) в автоклаве или герметично закрытом сосуде, в подходящем растворителе, таком как вода, и при подходящей температуре, такой как 100-140 С, с использованием или без микроволнового излучения. Схема 6 где R1, R4 и R5 являются такими, как описано выше, R2 представляет собой группу, как указано выше,другую, чем водород или галоген, R6 является Н или F, L1 представляет собой подходящую удаляемую группу, такую как галоген (например, хлор или бром), и Р 4 и Р 5 представляют собой подходящие защитные группы, такие как C1-6 алкил и C1-6 алкоксикарбонил соответственно. Способы, аналогичные описанным ниже, для преобразований, представленных на схеме 6, описаны ранее в химической литературе (например, A. Bassoli et al., Eur. J. Org. Chem., 2005, 2518-2525). Стадия (i) обычно включает защиту соединения (13) при использовании стандартных методик, как например, обработка алкоксикарбонилангидридом, таким как ди-трет-бутилдикарбонат, и основанием,таким как триэтиламин, и катализатора, такого как 4-диметиламинопиридин, в подходящем растворителе, таком как дихлорметан, при подходящей температуре, такой как комнатная температура. Стадия (ii) обычно включает обработку соединения (14) основанием, таким как литий-бис(триметилсилил)амид, и алкилирующим агентом, таким как алкилгалогенид, в подходящем растворителе, таком как тетрагидрофуран, при подходящей температуре, такой как в диапазоне от -78 С до комнатной температуры. Стадия (iii) обычно включает снятие защиты с соединения (15) при использовании стандартных методик, как, например, для случая, когда Р 5 представляет собой трет-бутоксикарбонильную группу, обработка хлористо-водородной кислотой, в подходящем растворителе, таком как диоксан, и при подходящей температуре, такой как комнатная температура. Стадия (iv) обычно включает способ, описанный выше для стадий, представленных на схеме 4. Схема 7 где R1, R2, R3, R4 и R5 являются такими, как описано выше, и R6 является Н или F, Р 5, Р 6 и Р 7 представля-7 016076 ют собой подходящие защитные группы, например, Р 5 может быть C1-6 алкоксикарбонилом и Р 6 и Р 7 могут быть C1-6 алкилом (Р 6 и Р 7 не должны быть одинаковыми). L1 представляет собой подходящую удаляемую группу, такую как галоген (например, хлор или бром). Стадия (i) обычно включает обработку соединения (17) подходящим основанием, таким как гексаметилдисилазид калия, и алкилирующим агентом, таким как алкилгалогенид, в подходящем растворителе, таком как тетрагидрофуран, при подходящей температуре, такой как в диапазоне от -78 С до комнатной температуры. Стадия (ii) обычно включает стандартную методику для преобразования эфира карбоновой кислоты в кислоту, как, например, обработка подходящей кислотой (например, трифторуксусная кислота), в соответствующем растворителе, таком как дихлорметан, при подходящей температуре, такой как комнатная температура. Схема 8 где R1, R2, R3, R4 и R5 являются такими, как описано выше, и R6 является Н или F, Р 8, Р 9 и Р 10 представляют собой подходящие защитные группы, такие как С 1-6 алкил, в случаях Р 8 и Р 9 (Р 8 и Р 9 не должны быть одинаковыми), и группу, происходящую от подходящего ациклического или циклического кетона, для Р 10. Способы, аналогичные описанным ниже для преобразований, представленных на стадиях (i)-(iii) схемы 8, описаны ранее в химической литературе (например, J. Wehbe et al., Tetrahedron: Asymmetry, 14(2003), 1123-1126). Стадия (i) обычно включает обработку соединения (19) подходящим кетоном, таким как(1R,2R,5R)-2-гидроксипинан-3-он, и кислотой Льюиса, такой как эфират трифторида бора, в подходящем растворителе, таком как толуол, при подходящей температуре, такой как 110 С. Стадия (ii) обычно включает обработку соединения (20) реактивом Гриньяра, таким как метилмагнийбромид, и основанием, таким как 1,8-диазабицикло[5.4.0]ундец-7-ен, с последующей обработкой ненасыщенного сложного эфира (21), такого как этилкротонат, в подходящем растворителе, таком как тетрагидрофуран, при подходящей температуре, такой как -30 С. Стадия (iii) обычно включает стандартную методику для преобразования имина в амин, такую как обработка подходящей кислотой (например, 15%-ный водный раствор лимонной кислоты), в соответствующем растворителе, таком как тетрагидрофуран, при подходящей температуре, такой как комнатная температура. Стадия (iv) обычно включает нагревание соединения (23) в подходящем растворителе, таком как толуол, при подходящей температуре, такой как в диапазоне от комнатной температуры до 120 С. Стадия (v) обычно включает способ, описанный выше для стадий, представленных на схеме 4. где R1, R4, R5 и R6 являются такими, как описано выше, R2 и R3, каждый, представляют собой группу, как указанную выше, другую, чем галоген, L1 и L2 представляют собой подходящие удаляемые группы, такие как галоген (например, хлор или бром), и Р 11 представляет собой подходящую защитную группу,такую как тритил. Стадия (i) обычно включает обработку соединения (25) основанием, таким как гидрид натрия, и алкилирующим агентом, таким как алкилгалогенид, в подходящем растворителе, таком как диметилформамид, при подходящей температуре, такой как в диапазоне от 0 С до комнатной температуры. Стадия (ii) обычно включает обработку соединения (26) основанием, таким как литийдиизопропиламид, и алкилирующим агентом, таким как алкилгалогенид, в подходящем растворителе, таком как тетрагидрофуран, при подходящей температуре, такой как в диапазоне от -78 С до комнатной температуры. Стадия (iii) обычно включает обработку соединения (27) основанием, таким как диизопропиламид лития, и алкилирующим агентом, таким как алкилгалогенид, в подходящем растворителе, таком как тетрагидрофуран, при подходящей температуре, такой как в диапазоне от -78 С до комнатной температуры. Стадия (iv) обычно включает стандартную методику для снятия защиты со спирта. Например, когда Р 11 представляет собой тритил, проводят обработку соединения (28) подходящей кислотой, такой какAmberlyst 15, в подходящем растворителе, таком как метанол, и при подходящей температуре, такой как комнатная температура. Стадия (v) обычно включает стандартную методику для окисления спирта в соответствующую карбоновую кислоту, как, например, обработка спирта (29) окислителем, таким как комбинация хлорита натрия, TEMPO (свободный 2,2,6,6-тетраметил-1-пиперидинилокси радикал) и отбеливателя (раствор гипохлорита натрия), в подходящем растворителе, таком как смесь буферного водного раствора одноосновного фосфата натрия и ацетонитрила, при подходящей температуре, такой как 40 С. Стадией (ii) или стадией (iii) можно пренебречь, как необходимой для получения соединений, гдеR2 является Н или R3 является Н соответственно. Соединения общих формул (3), (4), (5), (6), (7), (10), (12), (13), (17), (19), (21) и (25) обычно либо доступны из коммерческих источников, либо могут быть получены специалистом в данной области, используя способы, описанные в химической литературе (или используя аналогичные способы). Где уместно, фармацевтически приемлемые соли могут быть получены обычно путем взаимодействия с соответствующей кислотой или производным кислоты. Клинические показания. Полагают, что, так как соединения настоящего изобретения модулируют функцию Р 2 Х 7-рецептора и способны вызывать антагонизм в отношении воздействий АТФ на Р 2 Х 7-рецептор, они могут быть полезны при лечении боли, включая острую боль, хроническую боль, хроническую суставную боль, костно-мышечную боль, невропатическую боль, воспалительную боль, висцеральную боль, связанную с раковым заболеванием боль, связанную с мигренью боль, головную боль вследствие давления и мигрени,связанную с функциональными кишечными расстройствами боль, задненижнюю и шейную боль, связанную с растяжениями и нагрузками боль, сохраняемую в отношении симпатической нервной системы боль; миозит, боль, связанную с (эпидемическим) гриппом или другими вирусными инфекциями, такими как насморк, связанную с ревматической атакой боль, связанную с миокардиальной ишемией боль, послеоперационную боль, раковую химиотерапию, цефалгию, зубную боль и дисменорею. Состояния хронической суставной боли включают ревматоидный артрит, остеоартрит, ревматоидный спондилит, подагрический артрит и ювенильный артрит. Связанная с функциональными кишечными расстройствами боль включает неязвенную диспепсию,экстракардиальную грудную боль и синдром раздраженной толстой кишки. Невропатические болевые синдромы включают диабетическую невропатию, ишиалгию, неспецифическую задненижнюю боль, тригеминальную невралгию, связанную с рассеянным склерозом боль,фибромиалгию, связанную с ВИЧ невропатию, постгерпетическую невралгию, тригеминальную невралгию и боль, проистекающую от физической травмы, ампутации, фантомного синдрома, спинно-мозговой хирургии, рака, токсинов или хронических воспалительных состояний. Кроме того, невропатические бо-9 016076 левые состояния включают боль, связанную с обычно неболезненными ощущениями, как, например,"покалывания и пунктирования" (параэстезия и дизестезия), повышенной чувствительностью к прикосновению (гиперэстезия), болезненным восприятием после безвредной стимуляции (динамическая, статическая, термическая или холодовая аллодиния), повышенной чувствительностью к вредным стимулам(термическая, холодовая, механическая гипералгезия), продолжающимся болевым ощущением после прекращения стимуляции (гиперпатия) или в случае отсутствия или дефицита селективных сенсорных проводящих путей (гипоалгезия). Другие состояния, которые потенциально можно лечить с помощью соединений настоящего изобретения, включают лихорадку, воспаление, иммунологические заболевания, связанные с анормальной тромбоцитной функцией заболевания (например, обтурирующие васкулярные заболевания), импотенцию или эректильную дисфункцию; костное заболевание, характеризующееся анормальным костным метаболизмом или резорбцией, гемодинамические побочные эффекты нестероидных противовоспалительных лекарственных средств (NSAID) и ингибиторов циклооксигеназы-2 (СОХ-2), сердечно-сосудистые заболевания; нейродегенеративные заболевания и нейродегенерацию, нейродегенерацию после травмы, шум в ушах, зависимость от вызывающего зависимость средства, такого как опиоиды (например, морфин),депрессанты центральной нервной системы (например, этанол), психостимуляторы (например, кокаин) и никотин; осложнения вследствие диабета типа 1, почечную дисфункцию, печеночную дисфункцию (например, гепатит, цирроз), желудочно-кишечную дисфункцию (например, диарея), рак ободочной кишки,повышенную активность мочевого пузыря и побудительное недержание. Депрессию и алкоголизм потенциально также можно лечить с помощью соединений настоящего изобретения. Воспаление и воспалительные состояния, связанные с указанным выше воспалением, включают состояния кожи (например, солнечная эритема, ожоги, экзема, дерматит, аллергический дерматит, псориаз), менингит, глазные заболевания, такие как глаукома, ретинит, ретинопатии, увеиты и острая травма глазной ткани (например, конъюнктивит), воспалительные легочные нарушения (например, астма, бронхит, эмфизема, аллергический ринит, респираторный дистресс-синдром, болезнь любителей птиц, экзогенный аллергический альвеолит, хроническое обструктивное заболевание легких (COPD), гиперчувствительность дыхательных путей); расстройства желудочно-кишечного тракта (например, афтозная язва,болезнь Крона, атопический гастрит, вариолиформа гастрита, язвенный колит, глютеновая энтеропатия,региональный илеит, синдром раздраженной толстой кишки, воспалительное кишечное заболевание, желудочно-кишечный рефлюкс); трансплантацию органов и другие состояния с воспалительным компонентом, такие как васкулярное заболевание, мигрень, узелковый периартериит, тиреоидит, гипопластическая анемия, болезнь Ходжкина, склеродермия, тяжелая миастения, рассеянный склероз, соркоидоз, нефротический синдром, синдром Бехчета, гингивит, миокардиальная ишемия, гипертермия, системная красная волчанка, полимиозит, тендинит, бурсит и синдром Шегрена. Иммунологические заболевания включают аутоиммунные заболевания, иммунологические болезни,вызываемые нехваткой факторов питания, или трансплантацию органов. Костные заболевания, характеризующиеся анормальным костным метаболизмом или резорбцией,включают остеопороз (главным образом, постклимактерический остеопороз), гиперкальциемию, гиперпаратиреоидизм, костные болезни Педжета, остеолиз, злокачественную гиперкальциемию с костными метастазами или без них, ревматоидный артрит, периодонтит, остеоартрит, остеалгию, остеопению, карциномную кахексию, калькулез, литиаз (особенно уролитиаз), солидную карциному, подагрический и анкилозирующий спондилоартрит, тендинит и бурсит. Сердечно-сосудистые заболевания включают гипертензию или миокардиальную ишемию; атеросклероз; функциональную или органическую венозную недостаточность; варикозную терапию; геморроидальные узлы и шоковые состояния, связанные с заметным снижением артериального давления (например, септический шок). Нейродегенеративные заболевания включают деменцию, особенно дегенеративную деменцию(ALS) и мотонейронное заболевание); сосудистую деменцию (включая многоинфарктную деменцию); а также деменцию, связанную с патологическими изменениями, "оккупирующими" интракраниальное пространство; травму; инфекции и родственные состояния (включая ВИЧ-инфекцию, менингит и опоясывающие лишаи); метаболизм; токсины; гипоксию и витаминную недостаточность; и легкое когнитивное ухудшение, связанное со старением, особенно связанное с возрастом ухудшение памяти. Соединения формулы (I) также могут быть пригодны для нейрозащиты и при лечении нейродегенерации после травмы, как, например, инсульт, внезапная остановка сердца, обходной анастомоз легкого,черепно-мозговая травма, спинно-мозговая травма и т.п. Соединения настоящего изобретения также могут быть полезны при лечении в отношении развития злокачественных клеток и/или метастазирования и гранулярного лейкоза. Осложнения в случае диабета типа 1 включают диабетическую микроангиопатию, диабетическую ретинопатию, диабетическую нефропатию, дегенерацию желтого пятна, глаукому, нефротический синдром, гипопластическую анемию, увеит, болезнь Кавасаки и саркоидоз.- 10016076 Почечная дисфункция включает нефрит, гломерулонефрит, особенно мезангиальный пролиферативный гломерулонефрит и почечный синдром. Следует понимать, что ссылка на лечение включает как лечение установленных симптомов, так и профилактическую обработку, если не указано иное. Согласно дальнейшему аспекту настоящего изобретения предоставлено соединение формулы (I) или его фармацевтически приемлемая соль для применения в медицине или ветеринарии. Согласно еще одному аспекту настоящего изобретения предоставлено соединение формулы (I) или его фармацевтически приемлемая соль для применения при лечении состояния, которое опосредуется Р 2 Х 7-рецепторами. Согласно следующему аспекту настоящего изобретения предоставлен способ лечения человека или животного, страдающего от состояния, опосредуемого Р 2 Х 7-рецепторами, который включает введение указанному выше субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно другому аспекту настоящего изобретения предоставлен способ лечения человека или животного, страдающего от боли, воспаления или нейродегенеративного заболевания, который включает введение указанному выше субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно еще одному другому аспекту настоящего изобретения предоставлен способ лечения человека или животного, страдающего от воспалительной боли, невропатической боли или висцеральной боли, который включает введение указанному выше субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно дальнейшему аспекту настоящего изобретения предоставлен способ лечения субъекта,например человека, страдающего от болезни Альцгеймера, который включает введение указанному выше субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно еще одному аспекту настоящего изобретения предоставлено применение соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения состояния, опосредуемого воздействием Р 2 Х 7-рецепторов. Согласно еще одному аспекту настоящего изобретения предоставлено применение соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или предотвращения боли, воспаления или нейродегенеративного заболевания. Согласно еще одному аспекту настоящего изобретения предоставлено применение соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или предотвращения воспалительной боли, невропатической боли или висцеральной боли. Согласно одному аспекту настоящего изобретения предоставлено применение соединения формулы(I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или предотвращения болезни Альцгеймера. Для применения соединения формулы (I) или его фармацевтически приемлемой соли для лечения людей и других млекопитающих его обычно используют для получения готового лекарственного препарата в соответствии со стандартной фармацевтической практикой в виде фармацевтической композиции. Поэтому согласно еще одному аспекту настоящего изобретения предоставлена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, адаптированная для применения в медицине или ветеринарии. Для применения соединений формулы (I) в терапии их обычно используют для получения готового лекарственного препарата в виде фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Настоящее изобретение также относится к фармацевтической композиции, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль, и необязательно фармацевтически приемлемый носитель. Фармацевтически композиция согласно изобретению, которая может быть получена путем смешивания, подходящим образом, при комнатной температуре и атмосферном давлении, обычно адаптируется для перорального, парентерального или ректального введения и, как таковая, может быть в форме таблеток, капсул, пероральных жидких препаратов, порошков, гранул, лепешек, реконструируемых порошков,инъецируемых или вводимых путем инфузии растворов или суспензий или суппозиториев. Обычно предпочтительны перорально вводимые композиции. Таблетки и капсулы для перорального введения могут быть в единичной дозированной форме и могут содержать обычные эксципиенты, такие как связующие вещества, наполнители, лубриканты для таблетирования, дезинтеграторы и приемлемые смачиватели. На таблетки могут быть нанесены покрытия в соответствии со способами, хорошо известными в обычной фармацевтической практике. Пероральные жидкие препараты могут быть в форме, например, водной или масляной суспензии,растворов, эмульсий, сиропов или эликсиров или могут быть в форме сухого продукта для реконструирования перед применением с помощью воды или другой подходящей среды. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, эмульгаторы, неводные среды(которые могут включать пищевые масла), консерванты и, если желательно, обычные ароматизаторы или красители. Для парентерального введения жидкие единичные дозированные формы получают, используя соединение согласно изобретению или его фармацевтически приемлемую соль и стерильную среду. Соединение в зависимости от используемой среды и концентрации может быть либо суспендировано, либо растворено в среде. Для приготовления растворов соединение может быть растворено для инъекции и стерилизовано фильтрованием перед заполнением в подходящий флакон или ампулу и запаиванием. Преимущественно адъюванты, такие как локальный анестетик, консерванты и буферирующие агенты,растворяют в среде. Для повышения стабильности композиция может быть заморожена после заполнения в ампулу и вода удалена в вакууме. Парентеральные суспензии получают, по существу, таким же образом, за исключением того, что соединение суспендируют в среде вместо растворения и стерилизация не может быть осуществлена фильтрованием. Соединение может быть стерилизовано путем воздействия этиленоксида перед суспендированием в стерильной среде. Преимущественно поверхностно-активное вещество или смачиватель включают в композицию для облегчения однородного распределения соединения. Композиция может содержать от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.% активного ингредиента в зависимости от способа введения. Дозу соединения, используемого при лечении указанных выше нарушений, можно изменять обычным путем в зависимости от опасности нарушений, массы испытывающего страдание пациента и других подобных факторов. Однако в качестве общего указания разовые дозы могут составлять от 0,05 до 1000 мг, более предпочтительно от 0,05 до 200 мг, например от 20 до 40 мг; и такие разовые дозы предпочтительно должны быть введены один раз в сутки, хотя может требоваться введение более чем один раз в сутки; и такая терапия может продолжаться в течение некоторого количества недель или месяцев. Все публикации, включая, но без ограничения, патенты и заявки на патент, цитированные в настоящем описании, включены в данное описание посредством ссылки, как если бы каждая индивидуальная публикация конкретно и индивидуально была включена в данное описание полностью. Следующие описания и примеры иллюстрируют получение соединений настоящего изобретения,но не подразумевается, что они ограничивают объем настоящего изобретения. Примеры Общие способы (a)-(d), вместе со способами синтеза, представленными выше на схемах 1-9, для получения соединений настоящего изобретения проиллюстрированы далее с помощью следующих примеров. Пример 1. N-[(2-Хлор-4-фторфенил)метил]-5-оксо-1-(фенилметил)пролинамид (Е 1) 5-Оксо-1-(фенилметил)пролин (0,176 г, 0,80 ммоль, полученный, как описано ниже) растворяют в дихлорметане (3 мл) и к полученному раствору добавляют 1-гидроксибензотриазол (0,119 г, 0,88 ммоль),триэтиламин (0,113 мл, 0,81 ммоль), [(2-хлор-4-фторфенил)метил]амин (0,134 г, 0,84 ммоль) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,169 г, 0,88 ммоль) в атмосфере аргона. Смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют дихлорметаном и последовательно промывают 2 М водным раствором хлористого водорода и насыщенным водным раствором гидрокарбоната натрия. Органический слой фильтруют через фазовый разделитель и затем выпаривают,получая неочищенный продукт. Неочищенный продукт очищают автоматизированной масснаправленной ВЭЖХ, получая чистый N-[(2-хлор-4-фторфенил)метил]-5-оксо-1-(фенилметил)пролинамид (0,112 г), в виде белого твердого вещества. ЖХ/МС (жидкостная хроматография/масс-спектрометрия) [М+Н]+=361,2; время удерживания=2,55 мин. 5-Оксо-1-(фенилметил)пролин, используемый в приведенной выше методике, получают следующим образом.(i) Гидрохлорид диметил-L-глутамата (0,500 г, 2,37 ммоль) растворяют в метаноле (10 мл) и охлаждают до температуры 0 С. Смесь затем обрабатывают гидроксидом натрия (0,099 г, 2,49 ммоль), затем уксусной кислотой (0,136 мл, 2,37 ммоль) и бензальдегидом (0,361 мл, 3,55 ммоль). После перемешивания в течение 10 мин при температуре 0 С добавляют боргидрид натрия (0,088 г, 2,37 ммоль), смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Смесь снова охлаждают до температуры 0 С и затем обрабатывают дополнительным количеством боргидрида натрия (0,044 г,1,18 ммоль). Смесь снова оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Метанол выпаривают, получая остаток, который обрабатывают этилацетатом и фильтруют. Фильтрат затем промывают насыщенным водным раствором гидрокарбоната натрия, фильтруют через фазовый- 12016076 разделитель (при перемешивании) и выпаривают, получая прозрачное масло (0,56 г). Масло растворяют в метаноле и нагревают в герметично закрытой пробирке в микроволновом реакторе в течение 10 мин при температуре 120 С и затем в течение 15 мин при температуре 140 С (ЖХ/МС показывает, что эта фаза нагрева существенно не изменяет состава смеси). Растворитель выпаривают и остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя градиентом 15-20% этилацетата в гексане, с получением чистого метил-5-оксо-1-(фенилметил)пролината (0,212 г) в виде прозрачного масла. ЖХ/МС [М+Н]+=234; время удерживания=2,15 мин.(ii) Метил-5-оксо-1-(фенилметил)пролинат (0,212 г, 0,91 ммоль) растворяют в воде (3 мл) и метаноле (0,5 мл) и обрабатывают 2 М водным раствором гидроксида натрия (0,682 мл, 1,36 ммоль). Смесь перемешивают в течение ночи при комнатной температуре и затем промывают дихлорметаном. Водный слой выпаривают и остаток обрабатывают избытком 1 М раствора хлористого водорода в диэтиловом эфире (5 мл). Смесь выпаривают еще раз и остаток растирают в дихлорметане. Твердый продукт удаляют и объединенные дихлорметановые фракции выпаривают, получая 5-оксо-1-(фенилметил)пролин(0,182 г) в виде желтого масла, которое используют без дальнейшей очистки. ЖХ/МС [М+Н]+=220; время удерживания=1,72 мин. Пример 2. N-[(2-Хлор-4-фторфенил)метил]-1-(1-метилэтил)-5-оксопролинамид (Е 2) 1-(1-Метилэтил)-5-оксопролин (0,060 г, 0,35 ммоль, полученный, как описано ниже) растворяют в дихлорметане (3 мл) и диметилформамиде (1 мл) и к полученному раствору добавляют 1 гидроксибензотриазол (0,052 г, 0,39 ммоль), [(2-хлор-4-фторфенил)метил]амин (0,061 г, 0,39 ммоль) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,074 г, 0,39 ммоль) в атмосфере аргона. Полученную смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют дихлорметаном и последовательно промывают 2 М водным раствором хлористого водорода и насыщенным водным раствором гидрокарбоната натрия. Органический слой фильтруют через фазовый разделитель и затем выпаривают, получая неочищенный продукт. Неочищенный продукт очищают автоматизированной масс-направленной ВЭЖХ, получая чистый N-[(2-хлор-4-фторфенил)метил]-1-(1-метилэтил)-5 оксопролинамид (0,032 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=313,1, время удерживания=2,26 мин. 1-(1-Метилэтил)-5-оксопролин, используемый в приведенной выше методике, получают следующим образом.(i) Гидрохлорид диметил-L-глутамата (0,500 г, 2,37 ммоль) растворяют в метаноле (4 мл) и тетрагидрофуране (8 мл) и смесь затем обрабатывают измельченным гидроксидом натрия (0,099 г, 2,49 ммоль) в течение 10 мин. На данной стадии к смеси добавляют уксусную кислоту (0,136 мл, 2,37 ммоль) и ацетон (0,261 мл, 3,55 ммоль), вместе, в виде раствора в тетрагидрофуране (1 мл). После перемешивания в течение 10 мин смесь охлаждают до температуры 0 С и обрабатывают гранулами боргидрида натрия(0,088 г, 2,37 ммоль). Смесь затем оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Метанол выпаривают, получая остаток, который обрабатывают этилацетатом и фильтруют. Фильтрат затем промывают насыщенным водным раствором гидрокарбоната натрия, фильтруют через фазовый разделитель (при перемешивании) и выпаривают, получая прозрачное масло (0,217 г). Полученное масло очищают колоночной флэш-хроматографией на силикагеле, получая чистый диметил-N(1-метилэтил)глутамат (0,200 г).(ii) Диметил-N-(1-метилэтил)глутамат (0,200 г) растворяют в метаноле и нагревают в герметично закрытой пробирке в микроволновом реакторе при температуре 140 С в течение 20 мин. Тонкослойная хроматография показывает, что исходное вещество остается непрореагировавшим, поэтому растворитель выпаривают и заменяют толуолом. Смесь кипятят с обратным холодильником в течение 3 ч и затем выпаривают, получая метил-1-(1-метилэтил)-5-оксопролинат (0,152 г) в виде светло-желтого масла, которое используют на следующей стадии без дальнейшей очистки.(iii) Метил-1-(1-метилэтил)-5-оксопролинат (0,152 г, 0,82 ммоль) растворяют в воде (3 мл) и метаноле (0,5 мл) и обрабатывают 2 М водным раствором гидроксида натрия (0,682 мл, 1,36 ммоль). Полученную смесь перемешивают в течение 4 ч при комнатной температуре и затем промывают дихлорметаном. Водный слой выпаривают и остаток обрабатывают избытком 1 М раствора хлористого водорода в диэтиловом эфире (5 мл). Смесь выпаривают еще раз и остаток растирают в дихлорметане. Твердый продукт удаляют и объединенные дихлорметановые фракции выпаривают, получая 1-(1-метилэтил)-5 оксопролин (0,060 г) в виде желтого масла, которое кристаллизуется при стоянии. Метил-1-этил-5-оксопролинат (0,135 г, 0,79 ммоль, полученный, как описано ниже) растворяют в метаноле (4 мл) и обрабатывают 2 М водным раствором гидроксида натрия (0,592 мл, 1,18 ммоль). Смесь перемешивают в течение 4 ч при комнатной температуре и затем выпаривают, получая остаток, который затем обрабатывают избытком 1 М раствора хлористого водорода в диэтиловом эфире (5 мл) в течение 10 мин. Смесь выпаривают еще раз, остаток растворяют в дихлорметане (4 мл) и диметилформамиде (2 мл) и фильтруют для удаления твердых веществ. Полученный раствор переносят в реакционную пробирку и затем добавляют 1-гидроксибензотриазол (0,117 г, 0,87 ммоль), [(2-хлор-4-фторфенил)метил]амин (0,138 г, 0,87 ммоль) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида(0,167 г, 0,87 ммоль). Смесь продувают аргоном и затем перемешивают при комнатной температуре в течение уикенда. Смесь затем разбавляют дихлорметаном и последовательно промывают 2 М водным раствором хлористого водорода и насыщенным водным раствором гидрокарбоната натрия. Органический слой фильтруют через фазовый разделитель и затем выпаривают, получая неочищенный продукт. Неочищенный продукт очищают автоматизированной масс-направленной ВЭЖХ, получая чистый N-[(2 хлор-4-фторфенил)метил]-1-этил-5-оксопролинамид (0,086 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=299,1; время удерживания=2,13 мин. Энантиомерный избыток=100,0%, как определено хиральной хроматографией, способ В, показывающей N-[(2-хлор-4-фторфенил)метил]-1-этил-5-оксо-L-пролинамид; время удерживания=8,05 мин. Метил-1-этил-5-оксопролинат, используемый в приведенной выше методике, получают следующим образом.(i) Гидрохлорид диметил-L-глутамата (0,500 г, 2,37 ммоль) растворяют в метаноле (4 мл) и тетрагидрофуране (8 мл) и смесь затем обрабатывают измельченным гидроксидом натрия (0,099 г, 2,49 ммоль) в течение 10 мин. На данной стадии к смеси добавляют уксусную кислоту (0,136 мл, 2,37 ммоль) и ацетальдегид (0,199 мл, 3,55 ммоль), вместе, в виде раствора в тетрагидрофуране (1 мл). После перемешивания в течение 10 мин смесь охлаждают до температуры 0 С и обрабатывают гранулами боргидрида натрия (0,088 г, 2,37 ммоль). Полученную смесь затем оставляют нагреваться до комнатной температуры. Когда смесь достигает комнатной температуры, ее разбавляют этилацетатом (30 мл) и промывают насыщенным водным раствором гидрокарбоната натрия, фильтруют через фазовый разделитель (при перемешивании) и выпаривают, получая маслянистый остаток. Масло растворяют в толуоле и кипятят с обратным холодильником в течение 4 ч. По достижении завершения реакции смесь затем кипятят с обратным холодильником в течение ночи. Растворитель затем выпаривают и полученный остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя градиентом 30-50% этилацетата в гексане, с получением неочищенного метил-1-этил-5-оксопролината (0,135 г) в виде прозрачного масла, которое используют без дальнейшей очистки. Примеры 4-8. По методике, аналогично описанной выше для примера 3, соединения, сведенные в приведенную ниже табл. 1, получают путем замены соответствующим альдегидом (или кетоном) ацетальдегида, используемого в приведенной выше методике. Все альдегиды и кетоны, используемые для получения соединений, указанных в табл. 1, доступны из коммерческих источников или их можно получить, используя способы, описанные ранее в химической литературе. 5-Оксо-1-фенилпролин (0,047 г, 0,23 ммоль, полученный, как описано ниже) растворяют в дихлорметане (2 мл) и диметилформамиде (1 мл) и к полученному раствору добавляют 1-гидроксибензотриазол (0,034 г, 0,25 ммоль), [(2-хлор-4-фторфенил)метил]амин (0,040 г, 0,25 ммоль), Nэтилморфолин (0,032 мл, 0,25 ммоль) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида(0,048 г, 0,25 ммоль). Смесь перемешивают при комнатной температуре в течение 4,5 ч. Смесь разбавляют еще дихлорметаном и последовательно промывают 2 М водным раствором хлористого водорода и насыщенным водным раствором гидрокарбоната натрия. Органический слой фильтруют через фазовый разделитель и затем выпаривают, получая неочищенный продукт. Неочищенный продукт очищают автоматизированной масс-направленной ВЭЖХ, получая чистый N-[(2-хлор-4-фторфенил)метил]-5-оксо-1 фенилпролинамид (0,032 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=347,1; время удерживания=2,51 мин. 5-Оксо-1-фенилпролин, используемый в приведенной выше методике, получают следующим образом.(i) Метил-5-оксо-L-пролинат (0,204 мл, 1,75 ммоль) растворяют в толуоле (5 мл) и обрабатывают трис(дибензилиденацетон)дипалладием(0) (0,024 г, 0,03 ммоль), бромбензолом (0,184 мл, 1,75 ммоль),карбонатом цезия (0,795 г, 2,45 ммоль) и Xantphos (0,040 г, 0,07 ммоль). Полученную смесь нагревают при температуре 120 С в течение 18 ч и затем оставляют охлаждаться до комнатной температуры. Смесь разбавляют этилацетатом и последовательно промывают 2 М водным раствором хлористого водорода, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли. Фильтруют через фазовый разделитель, затем выпаривают, получая желто-коричневого масло (0,200 г). Неочищенный продукт очищают автоматизированной масс-направленной ВЭЖХ, получая чистый метил-5 оксо-1-фенилпролинат (0,054 г) в виде масла, которое кристаллизуется при стоянии. ЖХ/МС [М+Н]+=220;(ii) Метил-5-оксо-1-фенилпролинат (0,054 г, 0,25 ммоль) объединяют с 2 М водным раствором гидроксида натрия (0,160 мл, 0,32 ммоль) в метаноле (1 мл) и перемешивают в течение ночи при комнатной температуре. Растворитель затем выпаривают и остаток обрабатывают этилацетатом и промывают 2 М водным раствором хлористого водорода. Водный слой отделяют, еще дважды промывают этилацетатом и затем объединенные этилацетатные слои сушат, используя фазовый разделитель, и выпаривают, получая 5-оксо-1-фенилпролин (0,047 г) в виде прозрачного масла. Пример 10. N-[(2,4-Дихлорфенил)метил]-1-метил-5-оксопролинамид (E10) 1-Метил-5-оксопролин (0,057 г, 0,4 ммоль, полученный, как описано ниже) растворяют в безводном дихлорметане (6 мл) и к полученному раствору добавляют 1-гидроксибензотриазол (0,060 г, 0,4 ммоль),[(2,4-дихлорфенил)метил]амин (0,055 мл, 0,4 ммоль), диизопропиламин (0,140 мл, 0,8 ммоль) и гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (0,152 г, 0,4 ммоль). Смесь перемешивают при комнатной температуре (20 С) в атмосфере аргона в течение 3 ч и затем в течение ночи. Смесь разбавляют еще дихлорметаном (25 мл) и последовательно промывают 2 М водным раствором хлористого водорода (20 мл), насыщенным водным раствором гидрокарбоната натрия (20 мл), 10%-ным водным раствором карбоната натрия (20 мл) и насыщенным раствором соли (20 мл). Органический слой фильтруют через гидрофобную фритту и затем выпаривают, получая неочищенный продукт. Неочищенный продукт растворяют в смеси диметилсульфоксида (0,9 мл) и ацетонитрила (0,9 мл) и затем очищают автоматизированной масс-направленной ВЭЖХ, получая чистый N-[(2,4-дихлорфенил)метил]-1-метил-5 оксопролинамид (0,085 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=301; время удерживания=2,16 мин. 1-Метил-5-оксопролин, используемый в приведенной выше методике, получают следующим образом.(i) N-Метил-L-глутаминовую кислоту (0,500 г, 3,1 ммоль) растворяют в воде (1 мл) и нагревают в герметично закрытой пробирке при температуре 140 С в течение 30 мин в микроволновом реакторе. Воду затем выпаривают и остаток растирают в диэтиловом эфире, получая после сушки 1-метил-5 оксопролин (0,298 г) в виде белого твердого вещества.N-[(2,4-Дихлорфенил)метил]-1-метил-5-оксопролинамид также может быть получен, как описано ниже. 1-Метил-5-оксопролин (36,79 г, 0,257 моль, полученный, как описано выше) суспендируют в DCM(дихлорметан) (500 мл). Добавляют EEDQ (2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, 66,7 г,0,27 моль, 1,05 экв.) в виде одной порции. Вся совокупность веществ кажется растворенной, образуя непрозрачную смесь, и температуру понижают с 21 до 10 С. Полученную смесь перемешивают в течение 20 мин в атмосфере аргона и затем по каплям добавляют раствор 2,4-дихлорбензиламина (36 мл,0,27 моль, 1,05 экв.) в DCM (100 мл) в течение 40 мин. Во время добавления в капельной воронке образуется белый осадок. Смесь умеренно кипит и используют баню лед/вода для поддерживания температуры 15-20 С. После завершения добавления амина капельную воронку затем ополаскивают DCM (50 мл) для смывания полностью осадка в реакционную смесь. Смесь затем оставляют нагреваться до комнатной температуры и перемешивают в течение приблизительно 18 ч. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия (200 мл) и перемешивают в течение 5 мин. Органический слой затем отделяют и промывают 2 н. раствором HCl (3250 мл). Во время промывок кислотой в органическом слое начинают образовываться кристаллы, поэтому его затем разбавляют DCM (200 мл). Органический слой сушат, пропуская через гидрофобную фритту, и затем концентрируют в вакууме, получая 65 г розовых твердых веществ. Твердые вещества образуют крупные куски, поэтому неочищенный продукт размалывают пестиком в ступке. Затем полученные твердые вещества растирают в диэтиловом эфире (400 мл),твердые вещества отфильтровывают и затем промывают Et2O (2200 мл). Затем после сушки получают 52,96 г бледно-розовых твердых веществ. Твердые вещества объединяют с двумя другими порциями,полученными таким же путем (всего 141,42 г), затем суспендируют в этаноле (430 мл) и воде (715 мл) и постепенно нагревают до температуры 65 С (температура растворения). Смесь дает почти прозрачный раствор (насыщенный розовый цвет), за исключением очень тонкой суспензии твердого вещества. После нагревания при температуре 65 С в течение 20 мин колбу снимают с нагревателя и оставляют доходить до комнатной температуры в течение ночи. Спустя это время, из раствора осаждаются игольчатые белые кристаллы. Смесь охлаждают на ледяной бане в течение 20 мин, для осаждения всех твердых веществ. Белые твердые вещества затем отфильтровывают из розового раствора и промывают порциями смеси(3:5) EtOH/H2O (2400 мл), которую охлаждают на ледяной бане. Твердые вещества сушат в вакуумном сушильном шкафу (температура 40 С) в течение в общем 5 суток, получая чистый N-[(2,4 дихлорфенил)метил]-1-метил-5-оксопролинамид (125,37 г) в виде бесцветных кристаллов.(дд, 1 Н, J=9,1, 4,2 Гц), 4,49 (дд, 1 Н, J=14,9, 5,9 Гц), 4,55 (дд, 1 Н, J=14,8, 6,1 Гц), 6,56 (уш.т, 1 Н, J=5,7 Гц),7,24 (дд, 1 Н, J=8,2, 2,1 Гц), 7,33 (д, 1 Н, J=8,2 Гц), 7,40 (д, 1 Н, J=2,1 Гц). 13 С-ЯМР, : 175,9, 171,3, 134,5, 134,3, 133,7, 131,5, 129,6, 127,5, 63,8, 41,2, 29,4, 29,2, 23,4. Энантиомерный избыток=99,5%, как определено хиральной хроматографией, способ А, показывающей N-[2,4-дихлорфенилметил]-1-метил-5-оксо-L-пролинамид; время удерживания=9,89 мин; 1-Метил-5-оксопролин (0,050 г, 0,35 ммоль, полученный, как описано ниже) растворяют в безводном дихлорметане (7 мл) и к полученному раствору добавляют 1-гидроксибензотриазол (0,047 г,0,42 ммоль), [(2-хлор-4-фторфенил)метил]амин (0,056 мл, 0,42 ммоль), N-этилморфолин (0,166 мл,1,04 ммоль) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,067 г, 0,42 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют дополнительную аликвоту [(2-хлор-4-фторфенил)метил]амина (0,100 мл, 0,8 ммоль) и перемешивание продолжают еще немного, пока ВЭЖХ не показывает, что в дальнейшем продукт не образуется. Смесь последовательно промывают 2 М водным раствором хлористого водорода (5 мл) и насыщенным водным раствором гидрокарбоната натрия (5 мл). Органический слой отделяют и выпаривают, получая неочищенный продукт. Неочищенный продукт очищают автоматизированной масс-направленной ВЭЖХ, получая чистый N-[(2 хлор-4-фторфенил)метил]-1-метил-5-оксопролинамид (0,015 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=285; время удерживания=2,04 мин. 1-Метил-5-оксопролин, используемый в приведенной выше методике, получают следующим образом.(i) Метиловый эфир (L)-пироглутаминовой кислоты (1 г, 6,99 ммоль) растворяют/смешивают с тетрагидрофураном (10 мл) и охлаждают до температуры 0 С, используя ледяную баню. К смеси добавляют гидрид натрия (0,201 г 60%-ной суспензии в масле, 8,38 ммоль). Когда кипение прекращается, добавляют метилиодид (0,522 мл, 8,38 ммоль), смесь оставляют нагреваться до комнатной температуры и затем перемешивают в течение 1 ч. Растворитель выпаривают и добавляют воду (1 мл). Водный слой затем экстрагируют дихлорметаном. Дихлорметан выпаривают, получая неочищенный метил-1-метил-5 оксопролинат (0,308 г), который используют на следующей стадии без дальнейшей очистки.(ii) Метил-1-метил-5-оксопролинат (0,308 г, 1,96 ммоль) растворяют в метаноле (10 мл) и к полученному раствору добавляют раствор гидроксида натрия (0,157 г, 3,92 ммоль) в воде (10 мл). Смесь кипятят с обратным холодильником в течение 3 ч, затем охлаждают и выпаривают, оставляя минимальное количество воды. Подкисляют до рН 1, используя 2 М водный раствор хлористого водорода. Водный слой промывают дихлорметаном и затем отделяют и выпаривают, получая 1-метил-5-оксопролин в виде белого твердого вещества (0,300 г). Пример 12. 1-Этил-5-оксо-N-[(2,3,4-трифторфенил)метил]пролинамид (Е 12) 1-Этил-5-оксопролин (0,050 г, 0,32 ммоль) растворяют в безводном дихлорметане (7 мл) и диметилформамиде (1 мл) и к полученному раствору добавляют 1-гидроксибензотриазол (0,052 г,0,38 ммоль), [(2,3,4-трифторфенил)метил]амин (0,103 г, 0,64 ммоль), N-этилморфолин (0,151 мл,0,95 ммоль) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,073 г, 0,38 ммоль). Смесь встряхивают при комнатной температуре в течение уикенда. К смеси добавляют дополнительную аликвоту [(2,3,4-трифторфенил)метил]амина (0,051 г, 0,32 ммоль) и перемешивание продолжают еще немного, пока ВЭЖХ не показывает, что в дальнейшем продукт не образуется. Смесь разбавляют 2 М водным раствором хлористого водорода (5 мл) и затем фильтруют через фазовый разделитель. Органический слой затем промывают насыщенным водным раствором гидрокарбоната натрия и снова фильтруют через фазовый разделитель. Органический слой затем выпаривают, получая неочищенный продукт. Неочищенный продукт очищают автоматизированной масс-направленной ВЭЖХ, получая чистый 1 этил-5-оксо-N-[(2,3,4-трифторфенил)метил]пролинамид (0,032 г). ЖХ/МС [М+Н]+=301;(i) Гидрохлорид диметил-L-глутамата (5,0 г, 23,7 ммоль) растворяют в метаноле (100 мл) и смесь затем обрабатывают гидроксидом натрия (1,0 г, 24,9 ммоль) в атмосфере аргона и при комнатной температуре. Спустя 5 мин добавляют ацетальдегид (1,99 мл, 35,5 ммоль) и продолжают перемешивание в течение 10 мин. Полученную смесь охлаждают до температуры 0 С и обрабатывают гранулами боргидрида натрия (0,701 г, 18,95 ммоль). Продолжают перемешивание в течение 1 ч при температуре 0 С, затем метанол выпаривают и остаток обрабатывают этилацетатом и фильтруют. Фильтрат затем промывают насыщенным раствором соли и насыщенный солевой раствор после промывки экстрагируют этилацетатом. Объединенные этилацетатные фракции фильтруют через гидрофобную фритту и выпаривают, получая прозрачное масло (3,2 г). Полученное масло растворяют в толуоле (30 мл) и кипятят с обратным холодильником в течение ночи. Толуол затем выпаривают, получая светло-оранжевый остаток, который очищают колоночной флэш-хроматографией на силикагеле, элюируя градиентом 20-60% этилацетата в гексане, с получением не совсем чистого метил-1-этил-5-оксопролината (1,9 г) в виде прозрачного масла. Его используют на следующей стадии без дальнейшей очистки.(ii) Метил-1-этил-5-оксопролинат (1,91 г, 11,17 ммоль) растворяют в метаноле (25 мл) и обрабатывают 2 М водным раствором гидроксида натрия (7,3 мл, 14,52 ммоль). Смесь перемешивают в течение 4 ч при комнатной температуре и затем промывают дихлорметаном. Водный слой выпаривают и остаток обрабатывают избытком 1 М раствора хлористого водорода в диэтиловом эфире (5 мл). Смесь выпаривают еще раз и остаток растирают в дихлорметане. Твердое вещество удаляют и объединенные дихлорметановые фракции выпаривают, получая прозрачное масло, которое кристаллизуется при стоянии. Растирание в гексане и диэтиловом эфире и сушка приводят к получению чистого 1-этил-5-оксопролина(0,271 г) в виде белого твердого вещества. Альтернативно, 1-этил-5-оксопролин может быть получен следующим образом (способ В).(i) 1,1-Диметилэтил-5-оксо-L-пролинат (2,7 г, 12 ммоль, полученный, как описано в Synth. Comm.,35(8), 1129 (2005 добавляют к суспензии гидрида натрия (0,428 г (60%-ная суспензия в масле),10,7 ммоль) в тетрагидрофуране (6 мл) и смесь перемешивают при комнатной температуре в течение 5 мин. Затем добавляют этилиодид (1,67 г, 10,7 ммоль) и смесь нагревают при температуре 40 С в течение 2 ч. Добавляют дополнительное количество гидрида натрия (0,24 г) и продолжают перемешивание в течение ночи при комнатной температуре. На данной стадии к смеси добавляют дополнительное количество этилиодида (0,86 мл) и смесь оставляют стоять при комнатной температуре в течение уикенда. К смеси добавляют воду (10 мл) и смесь перемешивают в течение 15 мин. Тетрагидрофуран выпаривают и остающийся водный слой экстрагируют дихлорметаном (250 мл) и смесью (3:1) хлороформа и изопропанола (50 мл). Объединенные органические слои фильтруют через гидрофобную фритту и выпаривают,получая желтое масло. К смеси добавляют толуол и затем выпаривают еще раз, получая желтое масло. Полученное вещество очищают автоматизированной колоночной флэш-хроматографией на силикагеле(ii) 1,1-Диметилэтил-1-этил-5-оксопролинат (0,965 г) растворяют в дихлорметане (5 мл) и обрабатывают трифторуксусной кислотой (1 мл). Смесь перемешивают при комнатной температуре в течение 1,5 ч и затем выпаривают. Полученное вещество представляет собой, главным образом, исходное вещество, поэтому добавляют дополнительное количество трифторуксусной кислоты (1 мл) и дихлорметана(5 мл) и смесь перемешивают при комнатной температуре в течение 36 ч. Смесь выпаривают, затем к остатку добавляют толуол и его, в свою очередь, также выпаривают. После повторения этого процесса еще раз получают неочищенный 1-этил-5-оксопролин в виде темно-желтого масла, которое используют без дополнительной очистки. Альтернативно, 1-этил-5-оксопролин может быть получен следующим образом (способ С).(i) Гидрохлорид 1-(1,1-диметилэтил)-5-метил-L-глутамата (5,0 г, 19,71 ммоль) растворяют в смеси метанола (30 мл) и тетрагидрофурана (60 мл) и смесь затем обрабатывают измельченным, порошкообразным гидроксидом натрия (0,828 г, 20,69 ммоль) в атмосфере аргона и при комнатной температуре. После перемешивания в течение 10 мин добавляют ацетальдегид (1,11 мл, 19,71 ммоль) и уксусную кислоту (1,13 мл, 19,71 ммоль) и продолжают перемешивание в течение 10-15 мин. Смесь охлаждают до температуры 0 С на ледяной бане и обрабатывают гранулами боргидрида натрия (0,746 г, 19,71 ммоль). Продолжают перемешивание в течение 1 ч при температуре 0 С в атмосфере аргона. Смесь оставляют нагреваться до комнатной температуры, получая густую суспензию. Тонкодисперсные белые твердые вещества отфильтровывают, затем метанол выпаривают, остаток обрабатывают дихлорметаном (50 мл) и промывают насыщенным водным раствором гидрокарбоната натрия (25 мл). Органический слой отделяют, используя фазовый разделитель, и затем водный слой экстрагируют еще дихлорметаном(220 мл). Объединенные органические слои выпаривают, получая бесцветное масло (4 г). Полученное масло (3 г, примерно 14,8 ммоль) растворяют в толуоле (30 мл) и кипятят с обратным холодильником в- 18016076 течение 16 ч в течение ночи, получая оранжевый раствор. Толуол затем выпаривают, получая оранжевое масло (2,6 г). Его объединяют с дополнительной порцией масла (0,850 г), которое получают подобным образом и затем очищают автоматизированной колоночной флэш-хроматографией на силикагеле(Biotage SP4), при элюировании градиентом 20-80% этилацетата в гексане, получая чистый 1,1 диметилэтил-1-этил-5-оксопролинат (2,14 г).(ii) 1,1-Диметилэтил-1-этил-5-оксопролинат (0,933 г) растворяют в дихлорметане (5 мл) и обрабатывают трифторуксусной кислотой (1 мл). Смесь перемешивают в течение 3 ч при комнатной температуре и затем выпаривают. Остаток обрабатывают толуолом и выпаривают еще раз. Получают не совсем чистый (95%) 1-этил-5-оксопролин в виде оранжево/желтого масла (0,914 г), которое используют без дальнейшей очистки. Примеры 13-36. По методике, аналогично описанной для приведенного выше примера 12, соединения, сведенные в приведенную ниже табл. 2, получают путем замены соответствующим амином (или его солью) [(2,3,4 трифторфенил)метил]амина, используемого в приведенной выше методике. Все амины, использованные для получения соединений, указанных в табл. 2, доступны из коммерческих источников или их можно получить, используя способы, раскрытые ранее в химической литературе, или с помощью аналогичных способов. 1-Этил-5-оксопролин, используемый в реакции, получают, в каждом случае, указанным способом. Там, где определено (путем хиральной ВЭЖХ), энантиомерный избыток (е.е.) указанного изомера также указан вместе с его стереоспецифическим названием, используемым хиральным способом выделения (указанным в скобках) и соответствующим временем удерживания (r.t.), согласно данному способу. Таблица 2 Гидрохлорид [(2-хлор-3,4-дифторфенил)метил]амина, необходимый для синтеза N-[(2-хлор-3,4 дифторфенил)метил]-1-этил-5-оксопролинамида (пример 36), получают следующим образом.(i) Раствор N,N,N',N'-тетраметилэтилендиамина (39,6 мл, 264 ммоль) в тетрагидрофуране (170 мл) охлаждают в атмосфере аргона до температуры -70 С перед добавлением втор-бутиллития (205 мл,288 ммоль). К смеси затем добавляют 3,4-дифторбензойную кислоту (19 г, 120 ммоль) в виде раствора в тетрагидрофуране (80 мл) в течение 40 мин, обеспечивая температуру смеси не выше -60 С. Смесь затем перемешивают при температуре от -68 до -70 С в течение 1 ч перед добавлением раствора гексахлорэтана (100 г, 422 ммоль) в тетрагидрофуране (170 мл) в течение 35 мин при сохранении температуры смеси ниже -60 С. Смесь перемешивают при температуре от -65 до -70 С в течение 2 ч. Смесь оставляют нагреваться до температуры -10 С и затем добавляют воду (500 мл) для гашения реакции. Смесь разбавляют диэтиловым эфиром (250 мл) и два полученных слоя разделяют. Водный слой подкисляют до рН 1,используя концентрированный водный раствор хлористого водорода, и затем экстрагируют 2500 мл аликвотами диэтилового эфира. Объединенные органические экстракты пропускают через гидрофобную фритту и концентрируют в вакууме, получая желтое твердое вещество. Полученное вещество перекристаллизовывают из этилацетата, получая две порции (8,35 г и 4,47 г) чистой 2-хлор-3,4-дифторбензойной кислоты.(3,04 мл) и смесь нагревают при температуре 80 С в течение 90 мин. Смесь затем охлаждают и концентрируют в вакууме. Остаток растворяют в безводном 1,4-диоксане (10 мл) и смесь затем охлаждают на бане лед/вода. 0,88 Аммиак (водный раствор, 25 мл) по каплям добавляют к смеси, которую затем оставляют нагреваться до температуры 22 С в течение 2 ч. Этот процесс повторяют, используя 10,8 г 2-хлор 3,4-дифторбензойной кислоты, 8,2 мл тионилхлорида и 45 мл 0,88 аммиака, затем обе смеси объединяют и распределяют между этилацетатом (150 мл) и водой (100 мл). Водный слой отделяют и экстрагируют 2150 аликвотами этилацетата. Объединенные органические экстракты затем промывают насыщенным водным раствором гидрокарбоната натрия (100 мл), сушат, используя гидрофобную фритту, и концентрируют в вакууме, получая 2-хлор-3,4-дифторбензамид (11,86 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=192/194; время удерживания=1,69 мин.(iii) 2-Хлор-3,4-дифторбензамид (11,85 г, 62 ммоль) растворяют в тетрагидрофуране (200 мл) и обрабатывают 1 М раствором борана в тетрагидрофуране (247 мл, 247 ммоль). Смесь нагревают при температуре 70 С и перемешивают в течение 18 ч. Смесь затем охлаждают на бане лед/вода и по каплям добавляют концентрированный водный раствор хлористого водорода (150 мл). Нагревание при перемешивании при температуре 70 С затем продолжают в течение следующих 2 ч. Смесь затем оставляют охлаждаться и растворитель выпаривают в вакууме. Остаток распределяют между этилацетатом (200 мл) и 2 н. водным раствором хлористого водорода (200 мл). Водный слой отделяют и рН доводят до 8-9 добавлением по каплям 5 н. водного раствора гидроксида натрия. Полученную непрозрачную суспензию экстрагируют этилацетатом (4200 мл), объединенные органические экстракты затем пропускают через гидрофобную фритту и концентрируют до объема 200 мл. Смесь затем подкисляют добавлением 1 М раствора хлористого водорода в диэтиловом эфире (100 мл), что приводит к образованию осадка. Растворитель выпаривают в вакууме, получая белое твердое вещество. Твердое вещество перекристаллизовывают из денатурата (60 мл), получая три порции чистого гидрохлорида [(2-хлор-3,4-дифторфенил)метил]амина(объединенная масса=4,46 г), в виде белого твердого вещества. Пример 37. N-[(2-Хлор-4-фторфенил)метил]-1-этил-5-оксо-4-(фенилметил)пролинамид (Е 37) Неочищенный 1-этил-5-оксо-4-(фенилметил)пролин (0,052 г, 0,09 ммоль, полученный, как описано ниже) суспендируют в смеси дихлорметана (0,5 мл) и диметилформамида (0,5 мл) и к полученному раствору добавляют N-этилморфолин (0,034 мл, 0,27 ммоль), чтобы способствовать растворению, в большей степени, вещества. Затем добавляют 1-гидроксибензотриазол (0,016 г, 0,12 ммоль) и гидрохлорид N-(3 диметиламинопролил)-N'-этилкарбодиимида (0,022 г, 0,12 ммоль) и смесь перемешивают в течение 10 мин перед добавлением [(2-хлор-4-фторфенил)метил]амина (0,019 г, 0,12 ммоль). Смесь затем оставляют стоять при комнатной температуре в течение ночи. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия (2 мл) и перемешивают в течение 10 мин. Органический слой отделяют фильтрованием через фазовый разделитель и затем промывают 2 М водным раствором хлористого водорода. Органический слой снова отделяют и выпаривают, получая желтое масло, которое очищают автоматизированной масс-направленной ВЭЖХ, получая чистый N-[(2-хлор-4-фторфенил)метил]-1-этил-5 оксо-4-(фенилметил)пролинамид (0,004 г) в виде бесцветного масла. ЖХ/МС [М+Н]+=389; время удерживания=2,90 мин.- 23016076 1-Этил-5-оксо-4-(фенилметил)пролин, используемый в приведенной выше методике, получают следующим образом (способ А).(5 мл) и обрабатывают триэтиламином (0,869 мл, 6,24 ммоль) и 4-диметиламинопиридином (0,010 г). К полученному раствору добавляют ди-трет-бутилдикарбонат (1,36 г, 6,24 ммоль) и полученный оранжевый раствор оставляют перемешиваться в течение ночи. Смесь изменяет цвет с голубого на серый, и выпаривание растворителя приводит к получению сероватого масла (1,4 г). Его очищают автоматизированной колоночной флэш-хроматографией на силикагеле (Biotage SP4) при элюировании градиентом 0-60% этилацетата в гексане, получая 1-(1,1-диметилэтил)-2-метил-5-оксо-1,2-пирролидиндикарбоксилат(1,37 г) в виде бесцветного масла, которое кристаллизуется при стоянии.(ii) 1-(1,1-Диметилэтил)-2-метил-5-оксо-1,2-пирролидиндикарбоксилат (0,324 г, 1,33 ммоль) растворяют в тетрагидрофуране (3 мл) и смесь охлаждают до температуры -78 С, используя баню ацетон/сухой лед, в атмосфере аргона. По каплям добавляют 1 М раствор литий-бис-(триметилсилил)амида в тетрагидрофуране (1,4 мл, 1,40 ммоль) и перемешивают в атмосфере аргона в течение 1 ч. К полученному раствору затем добавляют бензилбромид (0,174 мл, 1,46 ммоль) и смесь перемешивают при температуре-78 С в течение еще 2,5 ч. Смесь затем оставляют нагреваться до комнатной температуры, гасят добавлением насыщенного водного раствора хлорида аммония (5 мл) и затем оставляют стоять в течение ночи при комнатной температуре. Органический слой отделяют, водный слой разбавляют еще водой(5 мл) и экстрагируют этилацетатом (310 мл). Объединенные органические слои сушат над безводным сульфатом натрия, затем фильтруют и концентрируют, получая желтое масло (0,700 г). Его очищают автоматизированной колоночной флэш-хроматографией на силикагеле (Biotage SP4) при элюировании градиентом 0-35% этилацетата в гексане, получая после выпаривания растворителя 1-(1,1-диметилэтил)2-метил-5-оксо-4-(фенилметил)-1,2-пирролидиндикарбоксилат в виде белого твердого вещества(iii) 1-(1,1-Диметилэтил)-2-метил-5-оксо-4-(фенилметил)-1,2-пирролидиндикарбоксилат (0,415 г,1,24 ммоль) растворяют в 4 М растворе хлористого водорода в диоксане (2 мл) и перемешивают при комнатной температуре в течение 2 ч. Растворитель выпаривают, получая бесцветное масло, которое кристаллизуется при стоянии, получая метил-5-оксо-4-(фенилметил)пролинат в виде кремово/белого твердого вещества (0,205 г). Полученное вещество используют без дальнейшей очистки на следующей стадии.(2,5 мл) и обрабатывают этилиодидом (0,077 мл, 0,97 ммоль). Смесь затем охлаждают до температуры 0 С и обрабатывают гидридом натрия (0,037 г 60%-ной суспензии в масле, 0,92 ммоль). После перемешивания при температуре 0 С в течение 10-15 мин раствор нагревают до комнатной температуры и перемешивают еще в течение 3,5 ч. Смесь затем обрабатывают насыщенным водным раствором хлорида аммония (2 мл) и разбавляют дихлорметаном (5 мл). Органический слой отделяют фильтрованием через гидрофобную фритту (промывка водного слоя дополнительными аликвотами дихлорметана (25 мл. Выпаривание объединенных органических фаз приводит к получению коричневого масла (0,100 г). Полученное масло очищают автоматизированной колоночной флэш-хроматографией на силикагеле, элюируя градиентом 0-100% этилацетата в гексане, с получением не совсем чистого (90% чистоты) метил-1 этил-5-оксо-4-(фенилметил)пролината (0,024 г) в виде желтого масла, которое используют на следующей стадии без дальнейшей очистки.(0,5 мл) и охлаждают до температуры 0 С на ледяной бане. К смеси добавляют 2 М водный раствор гидроксида натрия (0,137 мл, 0,27 ммоль) и продолжают перемешивание при температуре 0 С в течение 3 ч. Растворитель выпаривают и остаток подкисляют обработкой 2 М водным раствором хлористого водорода (0,2 мл), получая непрозрачный раствор. Его выпаривание приводит к получению неочищенного 1 этил-5-оксо-4-(фенилметил)пролина (0,052 г) в виде смеси твердых веществ белого цвета и маслянистых остатков желтого цвета. Полученную смесь используют без дальнейшей очистки. Альтернативно, 1-этил-5-оксо-4-(фенилметил)пролин также может быть получен следующим образом (способ В).(i) (S)-(+)-L-5-тритилоксиметил-2-пирролидинон (1,88 г, 20 ммоль) растворяют в диметилформамиде (9 мл) при температуре 0 С и обрабатывают гидридом натрия (60%-ная суспензия в масле, 0,220 г,5,5 ммоль). Смесь перемешивают при температуре 0 С в течение 30 мин и затем обрабатывают этилиодидом (0,444 мл, 5,5 ммоль). Смесь оставляют нагреваться до комнатной температуры и затем перемешивают в течение ночи. Смесь затем распределяют между этилацетатом и насыщенным водным раствором хлорида аммония и экстрагируют этилацетатом (3). Объединенные органические экстракты последовательно промывают водой, 50%-ным водным раствором хлорида натрия (2) и насыщенным водным раствором хлорида натрия и затем сушат над сульфатом натрия. Концентрируют, получая бежевое твердое вещество, которое очищают автоматизированной колоночной флэш-хроматографией на силикагеле(Biotage SP4) при элюировании градиентом 0-100% этилацетата в гексане, получая чистый 1-этил-5[(трифенилметил)окси]метил-2-пирролидинон (1,78 г).(ii) 2 M Раствор литийдиизопропиламина в тетрагидрофуране (1,050 мл, 2,1 ммоль) добавляют при температуре -78 С к раствору 1-этил-5-[(трифенилметил)окси]метил-2-пирролидинона (0,771 г,2 ммоль) в тетрагидрофуране (10 мл) и полученную смесь перемешивают в течение 1 ч при температуре-78 С. Затем добавляют бензилбромид (0,262 мл, 2,2 ммоль), затем перемешивают в течение следующего часа при температуре -78 С и смесь оставляют нагреваться до комнатной температуры в течение ночи. Смесь гасят насыщенным водным раствором хлорида аммония и затем экстрагируют этилацетатом (3). Объединенные органические экстракты промывают водой и затем насыщенным водным раствором хлорида натрия (2), сушат над безводным сульфатом магния и концентрируют, получая неочищенное масло (1,27 г). Неочищенное масло очищают автоматизированной колоночной флэш-хроматографией на силикагеле (Biotage SP4), при элюировании градиентом 0-100% этилацетата в гексане, получая желаемый продукт (т.е. 1-этил-3-(фенилметил)-5-[(трифенилметил)окси]метил-2-пирролидинон (0,561 г,который используют на следующей стадии, а также не прореагировавшее исходное вещество и продукт диалкилирования,1-этил-3,3-бис-(фенилметил)-5-[(трифенилметил)окси]метил-2-пирролидинон(iii) 1-Этил-3-(фенилметил)-5-[(трифенилметил)окси]метил-2-пирролидинон (0,561 г, 1,1 ммоль) перемешивают в течение 24 ч при комнатной температуре в смеси ацетонитрила (21 мл) и муравьиной кислоты (3 мл). Реакция не завершается на данной стадии, поэтому растворитель выпаривают, заменяют муравьиной кислотой (10 мл) и продолжают перемешивание в течение 3 ч. Реакция все еще не завершается, поэтому смесь концентрируют в вакууме (азеотропная перегонка с метанолом для удаления всего количества муравьиной кислоты) и затем растворяют в метаноле (20 мл). К смеси затем добавляют смолуAmberlyst 15 и продолжают перемешивание при комнатной температуре в течение ночи. Смолу фильтруют, промывают еще метанолом и фильтрат концентрируют, получая смолу (0,625 г). Полученную смолу очищают автоматизированной колоночной флэш-хроматографией на силикагеле (Biotage SP4) при элюировании градиентом 0-100% этилацетата в гексане, получая 1-этил-5-(гидроксиметил)-3(фенилметил)-2-пирролидинон (0,170 г), который используют на следующей стадии.(iv) 1-Этил-5-(гидроксиметил)-3-(фенилметил)-2-пирролидинон (0,748 г, 3,21 ммоль) растворяют в ацетонитриле (5 мл) и добавляют 1 М водный одноосновный буферный раствор фосфата натрия (3,69 мл,3,69 ммоль), несколько кристаллов TEMPO (свободный 2,2,6,6-тетраметил-1-пиперидинилоксирадикал) и хлорит натрия (0,580 г, 6,41 ммоль) и смесь нагревают до температуры 40 С. Затем к смеси добавляют приблизительно 1 каплю отбеливателя (раствор гипохлорита натрия с содержанием хлора 12%) и продолжают перемешивание при температуре 40 С в течение 3 ч. Смесь затем выливают в смесь воды со льдом, содержащую 1% мас./мас., сульфита натрия, и полученную смесь доводят до рН 2, используя 5 н. водный раствор хлористого водорода, и затем экстрагируют этилацетатом (3). Объединенные органические экстракты промывают насыщенным водным раствором хлорида натрия, затем сушат над сульфатом магния и концентрируют, получая 1-этил-5-оксо-4-(фенилметил)пролин (0,807 г) в виде твердого вещества, которое используют без дополнительной очистки. Пример 38. N-[(2-Хлор-4-фторфенил)метил]-1-(2-метил-2-пропен-1-ил)-5-оксопролинамид (Е 38) Неочищенный 1-(2-метил-2-пропен-1-ил)-L-оксопролин (0,075 г, 0,41 ммоль, полученный, как описано ниже) растворяют в дихлорметане (5 мл) и к полученному раствору добавляют 1 гидроксибензотриазол (0,061 г, 0,45 ммоль), [(2-хлор-4-фторфенил)метил]амин (0,068 г, 0,43 ммоль) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,087 г, 0,45 ммоль). Смесь затем перемешивают при комнатной температуре в течение 24 ч. Смесь разбавляют еще дихлорметаном, затем последовательно промывают 2 М водным раствором хлористого водорода и насыщенным водным раствором гидрокарбоната натрия. Органический слой фильтруют через фазовый разделитель и выпаривают,получая коричневый остаток, который очищают автоматизированной масс-направленной ВЭЖХ, получая чистый N-[(2-хлор-4-фторфенил)метил]-1-(2-метил-2-пропен-1-ил)-5-оксопролинамид (0,018 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=325,1; время удерживания=2,40 мин. 1-(2-Метил-2-пропен-1-ил)-5-оксопролин, используемый в приведенной выше методике, получают следующим образом.(i) Метанол (55 мл) охлаждают до температуры -10 С (используя баню сухой лед/тетрахлорид углерода) при перемешивании и затем по каплям добавляют тионилхлорид в течение 45 мин. Затем тремя порциями добавляют (D)-глутаминовую кислоту (10 г, 67,96 ммоль) в течение 5 мин и затем реакционную смесь перемешивают в течение 3 ч, пока она не нагреется до температуры 21 С. Растворители выпа- 25016076 ривают в вакууме, получая прозрачное масло (15 г), которое растворяют в смеси воды (150 мл) и диоксана (150 мл). К полученному раствору затем медленно добавляют карбонат натрия (46 г, 340 ммоль) при перемешивании. Затем добавляют бензилхлорформиат (9,64 мл, 68 ммоль) и продолжают перемешивание в течение ночи. Смесь осторожно обрабатывают 2 н. водным раствором хлористого водорода(250 мл) и затем экстрагируют этилацетатом (2250 мл). Объединенные органические фракции промывают насыщенным раствором соли, затем сушат и выпаривают, получая прозрачное масло (18,7 г). Полученное масло растворяют в дихлорметане (400 мл) и обрабатывают концентрированной серной кислотой(1 мл). Затем конденсируют большой избыток изобутилена в смесь и затем перемешивают в течение ночи при температуре 21 С. Затем к смеси осторожно добавляют насыщенный водный раствор гидрокарбоната натрия (400 мл) и затем органическую фазу отделяют, промывают насыщенным раствором соли,сушат и выпаривают в вакууме, получая прозрачное масло (21,9 г). Полученное масло очищают на силикагеле колоночной хроматографией при элюировании смесью циклогексана и этилацетата (3:1), получая чистый 1-(1,1-диметилэтил)-5-метил-N-[(фенилметил)окси]карбонилглутамат (4,87 г).(ii) К раствору гексаметилдисилазида калия (10 мл 0,6 М раствора в толуоле, 6 ммоль) в тетрагидрофуране (25 мл) при температуре -70 С по каплям добавляют раствор 1-(1,1-диметилэтил)-5-метил-N[(фенилметил)окси]карбонилглутамата (1,05 г, 3 ммоль) в тетрагидрофуране (10 мл) в течение 5 мин. Полученную смесь перемешивают при температуре -70 С в течение 1 ч и затем обрабатывают металлилиодидом (2,18 г, 12 ммоль) в тетрагидрофуране (10 мл). Продолжают перемешивание при температуре-78 С в течение 2 ч и затем нагревают до температуры 21 С. После перемешивания в течение следующего часа смесь выливают в 1 н. водный раствор хлористого водорода и экстрагируют этилацетатом(250 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат и выпаривают в вакууме, получая желтое масло (1,03 г). Полученное масло очищают колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата (4:1), с получением чистого 1,1 диметилэтил-1-(2-метил-2-пропен-1-ил)-5-оксопролината в виде прозрачного масла (0,322 г).(iii) 1,1-Диметилэтил-1-(2-метил-2-пропен-1-ил)-5-оксопролинат (0,099 г, 0,41 ммоль) растворяют в смеси дихлорметана (2 мл) и трифторуксусной кислоты (2 мл) и перемешивают в течение ночи при комнатной температуре. Растворитель выпаривают (азеотропная перегонка с толуолом для удаления следов трифторуксусной кислоты), получая неочищенный 1-(2-метил-2-пропен-1-ил)-5-оксопролин в виде коричневого масла, которое используют без дальнейшей очистки. Пример 39. 1-Циклопропил-N-[(2,4-дихлорфенил)метил]-5-оксопролинамид (Е 39)(15% в воде, 0,26 мл, 0,4 ммоль) в метаноле (1,75 мл) добавляют циклопропиламин (0,042 мл, 0,6 ммоль). Смесь нагревают при температуре 100 С в течение 30 мин в микроволновом реакторе. Растворитель удаляют в вакууме и остаток очищают автоматизированной масс-направленной ВЭЖХ, получая 1 циклопропил-N-[(2,4-дихлорфенил)метил]-5-оксопролинамид (0,072 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=326/328; время удерживания=2,29 мин. Пример 40. N-[2-Хлор-3-(трифторметил)фенил]метил-1-циклопропил-5-оксопролинамид (Е 40) К раствору [2-хлор-3-(трифторметил)фенил]метилизоцианида (0,088 г, 0,4 ммоль) и полуальдегида янтарной кислоты (15% в воде, 0,26 мл, 0,4 ммоль) в метаноле (1,75 мл) добавляют циклопропиламин(0,042 мл, 0,6 ммоль). Смесь нагревают при температуре 100 С в течение 30 мин в микроволновом реакторе. Растворитель удаляют в вакууме и остаток очищают автоматизированной масс-направленной ВЭЖХ, получая N-[2-хлор-3-(трифторметил)фенил]метил-1-циклопропил-5-оксопролинамид (0,076 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=361/363; время удерживания=2,39 мин.(i) Раствор [2-хлор-3-(трифторметил)фенил]метиламина (1,05 г, 5 ммоль) в безводном тетрагидрофуране (10 мл) по каплям добавляют к раствору N-формилбензотриазола (0,772 г, 5,25 ммоль) в безводном тетрагидрофуране (10 мл). Реакционную смесь перемешивают при температуре 22 С в течение 18 ч, затем концентрируют в вакууме и остаток распределяют между дихлорметаном (75 мл) и 2 н. водным раствором гидроксида натрия (40 мл). Органический слой отделяют и экстрагируют 2 н. водным рас- 26016076 твором гидроксида натрия (40 мл). Органический слой пропускают через гидрофобную фритту и концентрируют в вакууме, получая белое твердое вещество. Неочищенный продукт очищают автоматизированной колоночной флэш-хроматографией на силикагеле (Biotage SP4), элюируя градиентом растворителя,0-10% этилацетата в дихлорметане, с получением [2-хлор-3-(трифторметил)фенил]метилформамида в виде белого твердого вещества.(ii) Раствор [2-хлор-3-(трифторметил)фенил]метилформамида (0,67 г, 2,82 ммоль) в безводном дихлорметане (20 мл) охлаждают в атмосфере аргона на бане лед/вода перед добавлением диизопропиламина (1,78 мл, 12,7 ммоль) и последующего добавления оксихлорида фосфора (0,393 мл, 4,23 ммоль). Реакционную смесь перемешивают при температуре 2-5 С в течение 2 ч. Смесь затем концентрируют в вакууме и остаток обрабатывают насыщенным водным раствором гидрокарбоната натрия (20 мл) и экстрагируют дихлорметаном (20 мл). Органический слой пропускают через гидрофобную фритту и концентрируют в вакууме, получая желтое твердое вещество. Дальнейшее сушка в вакууме приводит к получению [2-хлор-3-(трифторметил)фенил]метилизоцианида в виде оранжевой смолы (0,66 г), которую используют без дальнейшей очистки. Пример 41. N-[(2-Хлор-4-фторфенил)метил]-1-циклопропил-5-оксопролинамид (Е 41) К раствору [2-хлор-4-фторфенил]метилизоцианида (0,068 г, 0,4 ммоль) и полуальдегида янтарной кислоты (15% в воде, 0,26 мл, 0,4 ммоль) в метаноле (1,75 мл) добавляют циклопропиламин (0,042 мл,0,6 ммоль). Смесь нагревают при температуре 100 С в течение 30 мин в микроволновом реакторе. Растворитель удаляют в вакууме и остаток очищают автоматизированной масс-направленной ВЭЖХ, получая бесцветную смолу, которую растирают в диэтиловом эфире, получая N-[(2-хлор-4 фторфенил)метил]-1-циклопропил-5-оксопролинамид в виде бледно-кремового твердого вещества[2-Хлор-4-фторфенил]метилизоцианид, используемый в качестве исходного вещества, получают способом, аналогично описанному для получения [2-хлор-3-(трифторметил)фенил]метилизоцианида в примере 40, но используя [2-хлор-4-фторфенил]метиламин вместо [2-хлор-3-(трифторметил)фенил]метиламина. Пример 42. N-[(2,4-Дихлорфенил)метил]-1-этил-4,4-диметил-5-оксопролинамид (Е 42)(2 М раствор в воде, 0,3 мл, 0,6 ммоль) и смесь нагревают в герметично закрытом сосуде при температуре 100 С в течение 30 мин в микроволновом реакторе. Смесь оставляют стоять в течение уикенда, затем растворитель удаляют в вакууме и полученное оранжевое масло очищают автоматизированной масснаправленной ВЭЖХ, получая прозрачную маслянистую смолу, которую растирают в диэтиловом эфире,получая N-[(2,4-дихлорфенил)метил]-1-этил-4,4-диметил-5-оксопролинамид в виде белого твердого вещества (0,024 г). ЖХ/МС [М+Н]+=343; время удерживания=2,57 мин. 2,2-Диметил-4-оксобутановую кислоту, используемую в качестве исходного вещества в приведенной выше методике, получают следующим образом.(i) 2,2-Диметил-4-пентеновую кислоту растворяют в дихлорметане (25 мл) и охлаждают до температуры -78 С на бане CO2/ацетон и барботируют через смесь кислород в течение 5 мин. Включают генератор озона и озон барботируют через смесь в течение 15 мин. Поток озона затем прекращают, смесь продувают кислородом в течение 5 мин и затем аргоном в течение 2 мин. Тонкослойная хроматография показывает, что реакция существенно не прогрессирует, поэтому озон барботируют через смесь еще в течение следующих 15 мин, причем спустя это время сохраняется бледно-голубая окраска и образуется суспензия. Поток озона прекращают, смесь продувают кислородом в течение 5 мин и затем аргоном в течение 10 мин (до тех пор, пока выпускной газ не даст отрицательной реакции на увлажненной йод/крахмальной бумаге). Затем к смеси добавляют диметилсульфид (1,72 мл, 23,41 ммоль) и смесь оставляют нагреваться до комнатной температуры. После перемешивания при комнатной температуре в течение 2 ч смесь концентрируют, получая бесцветное масло (1,5 г). 1,4 г полученного вещества очищают колоночной флэш-хроматографией на силикагеле при элюировании градиентом 0-50% этилацетата в дихлорметане, получая 2,2-диметил-4-оксобутановую кислоту в виде бесцветного масла (0,649 г). 1-(1-Метилэтил)-5-оксопролин (0,100 г, 0,58 ммоль) растворяют в дихлорметане (20 мл) и к полученному раствору добавляют гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,111 г,0,58 ммоль), 1-гидроксибензотриазол (0,078 г, 0,58 ммоль) и N-этилморфолин (0,223 мл, 1,75 ммоль). Наконец, к смеси добавляют [2-хлор-3-(трифторметил)фенил]метиламин и продолжают перемешивание в течение -48 ч. Смесь затем обрабатывают насыщенным водным раствором гидрокарбоната натрия(20 мл) и энергично перемешивают. Водный слой удаляют, используя фазовый разделитель, и затем растворитель удаляют из органического слоя, используя устройство для продувки аргоном. Полученный остаток обрабатывают смесью воды и этилацетата (25 мл, 1:1) и водный слой затем удаляют. Органический слой фильтруют через фазовый разделитель и выпаривают, получая масло. Полученное масло растирают в диэтиловом эфире, получая твердое вещество, которое затем очищают автоматизированной масс-направленной ВЭЖХ, получая N-[2-хлор-3-(трифторметил)фенил]метил-1-(1-метилэтил)-5 оксопролинамид (0,097 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=363; время удерживания=2,48 мин. 1-(1-Метилэтил)-5-оксопролин, используемый в приведенной выше методике, получают способом,аналогично описанному выше для синтеза метил-1-этил-5-оксопролината (см. пример 3), но используя ацетон вместо ацетальдегида и добавляя последующую стадию удаления сложноэфирной защитной группы (при использовании стандартных условий, т.е. гидроксида натрия в метаноле) (в противоположность комбинированному снятию защиты и сочетанию амида, описанному в примере 3). Примеры 44-49. По методике, аналогично описанной выше для примера 43, соединения, сведенные в представленную ниже табл. 3, получают путем замены соответствующим амином (или его солью) [2-хлор-3(трифторметил)фенил]метиламина, используемого в указанной выше методике. Все амины, используемые для получения соединений, указанных в табл. 3, доступны из коммерческих источников или их можно получить с использованием способов, описанных ранее в химической литературе, если не указано иное. Таблица 3- 28016076 Гидрохлорид [(2,3-дихлор-4-фторфенил)метил]амина, необходимый для синтеза N-[(2,3-дихлор-4 фторфенил)метил]-1-(1-метилэтил)-5-оксо-L-пролинамида (пример 48), получают следующим образом.(i) Нитрит натрия (0,172 г, 2,5 ммоль) добавляют к перемешиваемому раствору 2-хлор-6-фтор-3 метилфениламина (0,400 г, 2,5 ммоль) в воде (20 мл) и 37%-ному водному раствору хлористого водорода(5 мл) при температуре -5 С. Смесь перемешивают при температуре -5 С в течение 5 мин и затем добавляют в такую же емкость к раствору хлорида меди(I) (0,742 г, 7,5 ммоль) в 37%-ном водном растворе хлористого водорода (5 мл) при поддерживании температуры от -5 до 0 С. Реакционную смесь нагревают до температуры 38 С и перемешивают в течение 1 ч, затем смесь охлаждают и добавляют диэтиловый эфир (20 мл). Органическую фазу отделяют и промывают 1 н. водным раствором хлористого водорода и затем водой. Органический слой затем сушат над сульфатом натрия и концентрируют в вакууме. Неочищенный остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя петролейным эфиром, с получением 2,3-дихлор-1-фтор-4-метилбензола (0,090 г, 0,5 ммоль) в виде белого твердого вещества.(ii) 2,3-Дихлор-1-фтор-4-метилбензол (0,090 г, 0,5 ммоль) добавляют к перемешиваемой смеси дихромата калия (0,284 г, 1 ммоль) в уксусной кислоте (1 мл). Затем 97%-ную серную кислоту (0,5 мл) медленно добавляют к смеси, которую затем нагревают при температуре 100 С в течение 2 ч. После охлаждения до комнатной температуры добавляют воду и лед, полученное таким образом зеленое твердое вещество отфильтровывают и промывают холодной водой, получая 2,3-дихлор-4-фторбензойную кислоту(0,056 г, 0,27 ммоль) в виде белого твердого вещества.(iii) Раствор 2,3-дихлор-4-фторбензойной кислоты (0,200 г, 0,92 ммоль) в дихлорметане (4 мл) обрабатывают 1-гидроксибензотриазолом (0,162 г, 1,2 ммоль), гидрохлоридом N-(3-диметиламинопропил)N'-этилкарбодиимида (0,230 г, 1,2 ммоль) и триэтиламином (0,56 мл, 4,0 ммоль) в атмосфере аргона и при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 40 мин, затем обрабатывают 32%-ным водным раствором гидроксида аммония (0,088 мл) и перемешивают в течение ночи при комнатной температуре. Смесь разбавляют дихлорметаном и промывают затем водой и насыщенным водным раствором гидрокарбоната натрия. Органический слой отделяют и сушат над сульфатом натрия, затем концентрируют, получая 2,3-дихлор-4-фторбензамид (0,156 г) в виде белого твердого вещества, которое используют без дальнейшей очистки.(iv) Раствор 2,3-дихлор-4-фторбензамида (0,750 г, 3,62 ммоль) в безводном тетрагидрофуране (2 мл) нагревают до температуры 90 С в атмосфере азота. К горячему раствору добавляют 10 М раствор комплекса боргидрида и диметилсульфида в тетрагидрофуране (1,05 мл, 5,43 ммоль) и продолжают перемешивание в течение 4 ч. Смесь затем обрабатывают 6 н. водным раствором хлористого водорода и продолжают нагревать в течение 30 мин. Растворители выпаривают и неочищенный остаток очищают наSCX-картридже с последующей колоночной флэш-хроматографией на силикагеле, элюируя 5% метанолом в дихлорметане. Полученный амин обрабатывают раствором хлористого водорода в диэтиловом эфире, получая гидрохлорид [(2,3-дихлор-4-фторфенил)метил]амина (0,360 г) в виде белого твердого вещества. Пример 50. N-[(2,3-Диметилфенил)метил]-1-этил-5-оксопролинамид (Е 50) 1-Этил-5-оксопролин (0,080 г, 0,51 ммоль, полученный способом, аналогично описанному для примера 12, способ А) растворяют в дихлорметане (5 мл) и к полученному раствору добавляют гидрохлоридN-(3-диметиламинопропил)-N'-этилкарбодиимида (0,117 г, 0,61 ммоль), N-этилморфолин (0,195 мл,1,53 ммоль) и 2,3-диметилбензиламин (0,082 г, 0,61 ммоль). Полученную смесь перемешивают в течение 17 ч и затем оставляют стоять в течение уикенда. Смесь затем обрабатывают насыщенным водным раствором гидрокарбоната натрия (3 мл) и энергично перемешивают в течение 10 мин. Органический слой отделяют, используя гидрофобную фритту, и водный слой экстрагируют еще дихлорметаном(2 мл). Объединенные органические слои концентрируют, получая желтое масло (0,2 г). Полученное масло затем очищают автоматизированной масс-направленной ВЭЖХ, получая чистый N-[(2,3 диметилфенил)метил]-1-этил-5-оксопролинамид (0,072 г) в виде белого твердого вещества. ЖХ/МС [М+Н]+=275; время удерживания=2,12 мин. Пример 51. N-[2-Хлор-3-(трифторметил)фенил]метил-1-метил-5-оксопролинамид (Е 51) 1-Метил-5-оксопролин (2,27 г, 15,88 ммоль, полученный, как описано ниже) растворяют в дихлорметане (150 мл) и к полученному раствору добавляют гидрохлорид N-(3-диметиламинопропил)-N'этилкарбодиимида (3,35 г, 17,47 ммоль) и 1-гидроксибензотриазол (2,36 г, 17,47 ммоль). Смесь перемешивают в течение 10 мин, затем добавляют триэтиламин (2,21 мл, 15,88 ммоль) и [2-хлор-3- 29
МПК / Метки
МПК: C07D 207/28, C07D 401/06, A61K 31/4015, A61K 31/402, A61P 29/00, A61P 25/28
Метки: антагонистов, n-фенилметил-5-оксопролин-2-амиды, р2х7-рецептора, замещенные, способы, качестве, применения
Код ссылки
<a href="https://eas.patents.su/30-16076-zameshhennye-n-fenilmetil-5-oksoprolin-2-amidy-v-kachestve-antagonistov-r2h7-receptora-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные n-фенилметил-5-оксопролин-2-амиды в качестве антагонистов р2х7-рецептора и способы их применения</a>
Предыдущий патент: Устройство мобильной станции, устройство базовой станции, способ обработки для устройства мобильной станции и способ обработки для устройства базовой станции
Следующий патент: Способ нагрева в печи с использованием топлива со слабой тепловой мощностью и печь, в которой применяется этот способ
Случайный патент: Соль пиперазина и способ ее получения












