Моноклональное анти-мет антитело, его фрагменты и векторы для лечения опухолей и соответствующие продукты
Номер патента: 15580
Опубликовано: 31.10.2011
Авторы: Винья Элиза, Джордано Силвия, Комольо Паоло Мария
Формула / Реферат
1. Применение:
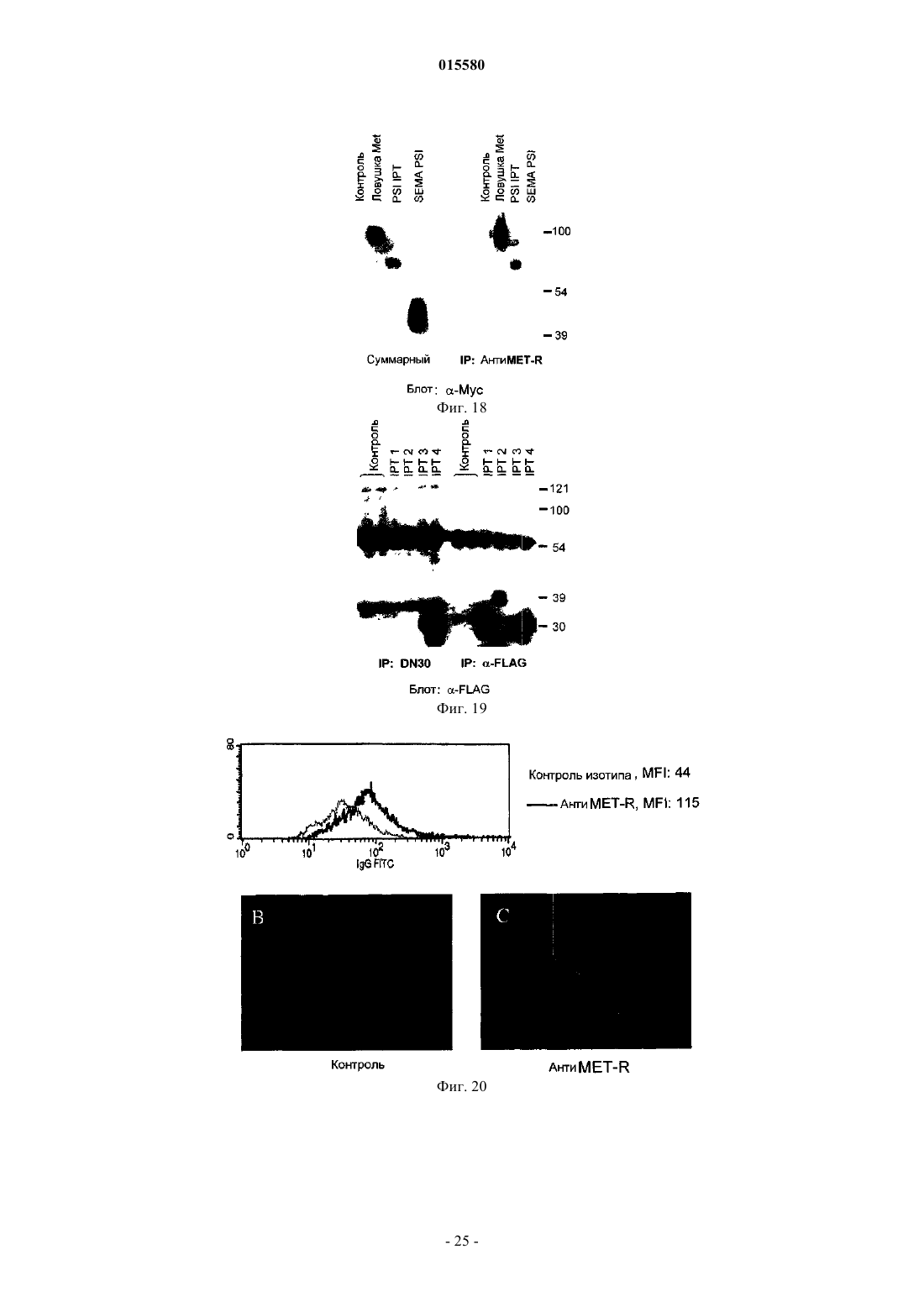
i) моноклонального анти-cMet антитела анти-MET-R,
ii) фрагмента (i), содержащего определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13, и/или
iii) генетически сконструированного антитела, содержащего определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13,
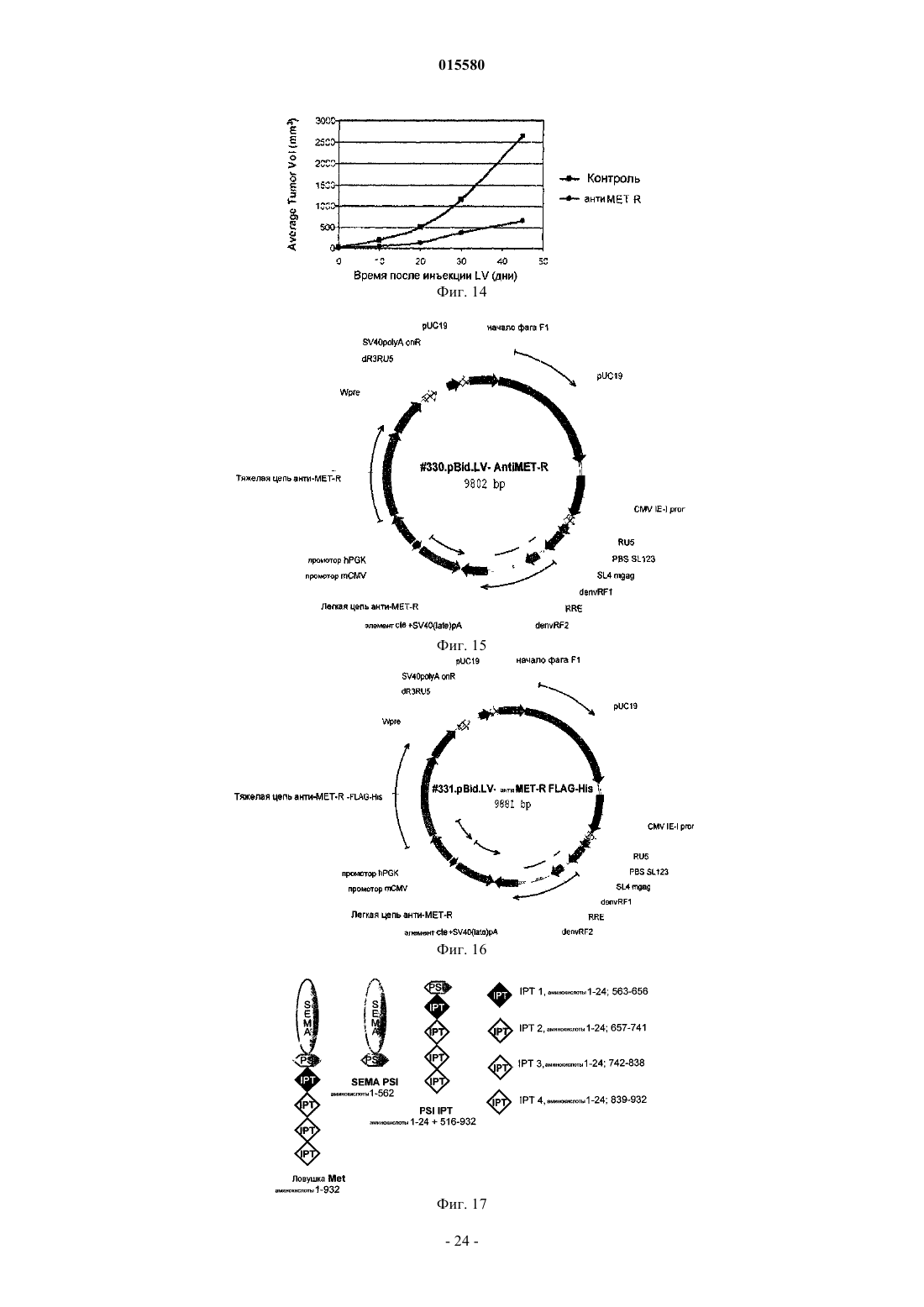
для получения лекарственного средства для лечения опухолей и/или метастазов у пациента, страдающего опухолью, где указанное антитело анти-MET-R продуцируется линией клеток гибридомы ICLC PD 05006.
2. Применение по п.1, отличающееся тем, что указанное антитело, указанный фрагмент и/или указанное генетически сконструированное антитело находятся в форме растворимого белка.
3. Применение по п.1, отличающееся тем, что указанное антитело и/или указанное генетически сконструированное антитело получают способом, выбранным из группы, состоящей из технологии рекомбинантных ДНК, твердофазного синтеза, синтеза в жидкой фазе.
4. Применение по п.1, отличающееся тем, что указанный фрагмент выбран из группы, состоящей из Fab, F(ab')2, Fab', Fv, scFv и пептида, содержащего определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13.
5. Применение по п.1, отличающееся тем, что указанный фрагмент получают способом, выбранным из группы, состоящей из протеолитического расщепления указанного антитела, технологии рекомбинантных ДНК, твердофазного синтеза, синтеза в жидкой фазе.
6. Применение по п.1, отличающееся тем, что указанное лекарственное средство вводят посредством инъекции или инфузии.
7. Применение по п.1, отличающееся тем, что указанная опухоль выбрана из опухоли прямой и ободочной кишки и опухоли печени.
8. Применение нуклеотидной последовательности, кодирующей:
i) моноклональное анти-cMet антитело анти-MET-R,
ii) фрагмент (i), содержащий определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13, и/или
iii) генетически сконструированное антитело, содержащее определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13,
для получения лекарственного средства для лечения опухолей и/или метастазов у пациента, страдающего опухолью, где указанное моноклональное анти-cMet антитело анти-MET-R продуцируется линией клеток гибридомы ICLC PD 05006.
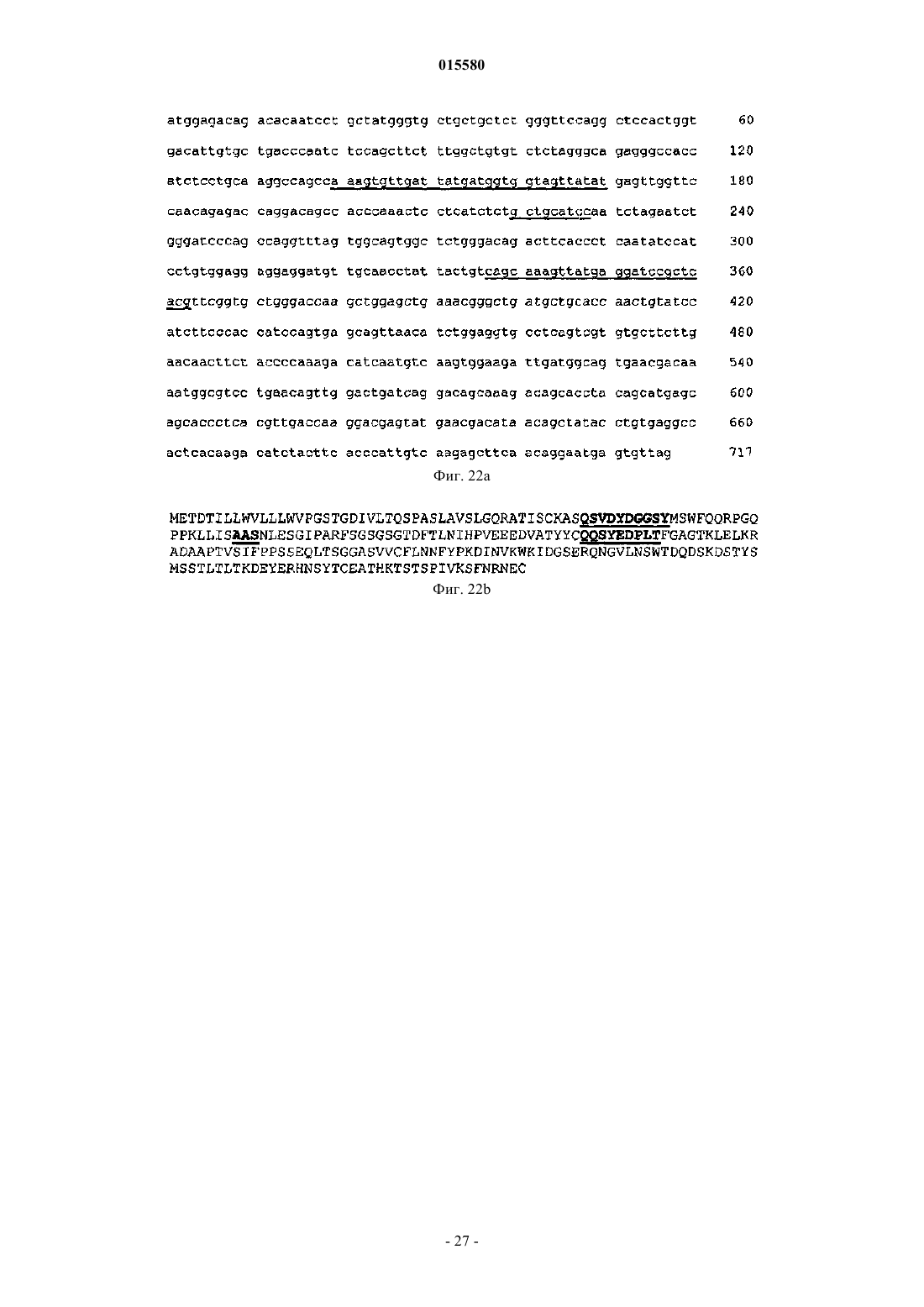
9. Применение по п.8, отличающееся тем, что нуклеотидная последовательность содержит, по меньшей мере:
i) последовательность SEQ ID NO: 1 и SEQ ID NO: 2,
ii) нуклеотидную последовательность, соответствующую последовательности SEQ ID NO: 1 и SEQ ID NO: 2, в которой присутствует одна или несколько "молчащих" замен.
10. Применение вектора, содержащего, по меньшей мере, нуклеотидную последовательность, кодирующую:
i) моноклональное анти-cMet антитело анти-MET-R,
ii) фрагмент (i), содержащий определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13, и/или
iii) генетически сконструированное антитело, содержащее определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13, где моноклональное анти-cMet антитело анти-MET-R продуцируется линией клеток гибридомы ICLC PD 05006,
для получения лекарственного средства для лечения опухоли и/или метастазов у субъекта, страдающего опухолью.
11. Применение по п.10, отличающееся тем, что указанный вектор содержит нуклеотидную последовательность, выбранную из:
i) последовательностей SEQ ID NO: 1 и SEQ ID NO: 2,
ii) нуклеотидной последовательности, соответствующей последовательности SEQ ID NO: 1 и SEQ ID NO: 2, в которой присутствуют одна или несколько "молчащих" замен.
12. Применение по п.10, отличающееся тем, что указанный вектор находится в форме частицы.
13. Продукт, содержащий:
i) моноклональное анти-cMet антитело анти-MET-R,
ii) фрагмент (i), содержащий определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13, и/или
iii) генетически сконструированное антитело, содержащее определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13, и по меньшей мере один ингибитор киназы в виде комбинированного препарата для одновременного, раздельного или последовательного применения для лечения опухолей и/или метастазов, где указанное моноклональное анти-cMet антитело анти-MET-R продуцируется линией клеток гибридомы ICLC PD 05006.
14. Продукт по п.13, отличающийся тем, что указанное антитело и/или указанный по меньшей мере один его фрагмент находятся в форме растворимого белка.
15. Продукт по п.13, отличающийся тем, что указанное антитело и/или указанное генетически сконструированное антитело получают способом, выбранным из группы, состоящей из технологии рекомбинантных ДНК, твердофазного синтеза или синтеза в жидкой фазе.
16. Продукт по п.13, отличающийся тем, что указанный фрагмент выбран из группы, состоящей из Fab, F(ab')2, Fab', Fv, scFv, пептида, содержащего определяющие комплементарность области (CDR) моноклонального анти-cMeb антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13.
17. Продукт по п.13, отличающийся тем, что указанный фрагмент получают способом, выбранным из группы, состоящей из протеолитического расщепления указанного антитела, технологии рекомбинантных ДНК, твердофазного синтеза или синтеза в жидкой фазе.
18. Продукт по п.13, отличающийсч тем, что указанный по меньшей мере один ингибитор киназы выбран из группы, состоящей из аналога стауроспорина K252А; (3Z)-5-[(2,6-дихлорбензил)сульфонил]-3-[(3,5-диметил-4-{[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил}-1Н-пиррол-2-ил)метилен]-1,3-дигидро-2Н-индол-2-она; [(3Z)-N-(3-хлорфенил)-3-({3,5-диметил-4-[(4-метилпиперазин-1-ил)карбонил]-1Н-пиррол-2-ил}метилен)-N-метил-2-оксоиндолин-5-сульфонамида]; [(3Z)-5-(2,3-дигидро-1Н-индол-1-илсульфонил)-3-({3,5-диметил-4-[(4-метилпиперазин-1-ил)карбонил]-1Н-пиррол-2-ил}метилен)-1,3-дигидро-2Н-индол-2-она]; [(3Z)-N-(3-хлорфенил)-3-{[3,5-диметил-4-(3-морфолин-4-илпропил)-1Н-пиррол-2-ил]метилен}-N-метил-2-оксоиндолин-5-сульфонамида].
19. Продукт по п.13, отличающийся тем, что указанный продукт вводят посредством инъекции или инфузии.
Текст
Дата публикации и выдачи патента Номер заявки Описано применение моноклонального антитела, направленного против внеклеточного домена фактора роста гепатоцитов,для получения лекарственного средства для лечения опухолей и/или метастазов и диагностического средства для выявления неопластических клеток, а также векторов, содержащих по меньшей мере часть нуклеотидной последовательности,кодирующей моноклональное анти-Met антитело, продуктов, содержащих моноклональное анти-Met антитело и/или по меньшей мере один его фрагмент и по меньшей мере один ингибитор киназы. МОНОКЛОНАЛЬНОЕ АНТИ-МЕТ АНТИТЕЛО, ЕГО ФРАГМЕНТЫ И ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ И СООТВЕТСТВУЮЩИЕ ПРОДУКТЫ(71)(73) Заявитель и патентовладелец: МЕТЕРЕЗИС ТРАНСЛЕЙШНЛ РЕСЕРЧ С.А. (CH) 015580 Изобретение относится к применению моноклонального антитела, его фрагментов и/или частей и к применению нуклеотидной последовательности, кодирующей моноклональное антитело, его фрагменты и/или части для получения лекарственного средства для лечения опухолей и метастазов и диагностических устройств для выявления непластических клеток либо in vivo, либо in vitro. В частности настоящее изобретение относится к применению моноклонального анти-Met антитела, направленного против внеклеточного домена рецептора фактора роста гепатоцитов. Уровень техники Научное исследование иммунотерапии злокачественных опухолей началось в 1950 годы, и первое применение было основано на поликлональных антителах. В настоящее время спустя более пяти десятилетий, иммунотерапия моноклональными антителами продолжает предлагать многообещающую альтернативу лечения злокачественных опухолей (1,2). Несколько антител, направленных к мишени - тирозинкиназным рецепторам (RTK) в злокачественной опухоли, используются в настоящее время в клинической практике (3). Механизм действия таких антител в разных случаях различный, и - несмотря на примеры успешного применения - зачастую плохо понятны (4). Мишенями бевацизумаба и цетуксимаба являются VEGF-VEGFR и EGF-EGFR, соответственно, и они действуют, предотвращая взаимодействие лиганд-рецептор (5, 6). Герцептин является моноклональным антителом, специфичным к HER2, представителю семейства EGFR. Механизм действия, лежащий в основе эффективности герцептина, не совсем понятен, но было показано, что он стимулирует распад HER2, таким образом снижая уровни рецептора на поверхности опухолевых клеток (7). Онкоген МЕТ, кодирующий тирозинкиназный рецептор для фактора роста гепатоцитов (HGF), контролирует генетические программы, приводящие к клеточному росту, инвазии и защите от апоптоза. Не регулируемая активация HGFR важна не только для приобретения канцерогенных свойств, но также для достижения инвазивного фенотипа (8). Роль МЕТ в опухолях человека выяснена с использованием нескольких экспериментальных способов и с определенностью доказана благодаря открытию мутаций, активирующих МЕТ, при наследуемых формах карцином (9, 10). Кроме того, конститутивная активацияHGFR также часто встречается при спорадических злокачественных опухолях, и исследования данной и других лабораторий показали, что онкоген МЕТ сверхэкспрессируется в опухолях определенных гистотипов или активируется посредством аутокринных механизмов. Кроме того, ген МЕТ амплифицируется в гематогенных метастазах карцином прямой и ободочной кишки (11). Таким образом, вмешательство в активацию Met становится многообещающим способом, препятствующим канцерогенным и метастатическим процессам. В последние годы предложено несколько методик блокирования аномальной передачи сигнала HGFR, нацеленных либо на HGFR, либо на его лиганд. Такие подходы включают применение антагонистов HGF, нейтрализующих антител к HGF, ловушек HGFR, низкомолекулярных ингибиторов сайтов связывания АТФ на HGFR или таких малых молекул, как гелданамицин, полипептидов доменаSH2 и рибозимов (обзор 12). Сущность изобретения Настоящее изобретение относится к применению моноклонального антитела, направленного против внеклеточного домена рецептора фактора роста гепатсцитов (HGFR), в лечении опухолей и/или метастазов у субъекта, пораженного опухолью, и в диагностических устройствах для выявления неопластических клеток либо in vivo, либо in vitro. Таким образом, целью настоящего изобретения является применение i) моноклонального анти-Met антитела, ii) фрагмента, содержащего область связывания эпитопа моноклонального анти-Met- антитела и/или iii) генетически сконструированного антитела, содержащего область связывания эпитопа или определяющие комплементарность области (CDR) моноклонального анти-Met антитела для получения лекарственного средства для лечения опухолей и метастазов у субъекта, страдающего опухолью, и для диагностических устройств для выявления неопластических клеток либо in vivo, либо in vitro, где моноклональное анти-Met антитело - обозначенное анти-MET-R - получают с использованием линии клеток гибридомы, депонированной в Advanced Biotechnology Center (ABC), Interlab Cell Line Collection (ICLC), S.S. Banca Cellule e Colture in GMP, Largo Rosanna Benzi 10, Genova, Italy с номером доступа ICLC PD 05006. Другой целью настоящего изобретения является применение вектора, содержащего по меньшей мере часть нуклеотидной последовательности, кодирующей область связывания эпитопа или области CDR моноклонального анти-Met антитела, полученного с использованием линии клеток гибридомы ICLC PD 05006, для получения лекарственного средства для лечения опухолей и метастазов у субъекта, пораженного опухолью. Другой целью настоящего изобретения является применение i) моноклонального анти-Met антитела, ii) фрагмента, содержащего область связывания эпитопа моноклонального анти-Met антитела и/илиiii) генетически сконструированного антитела, содержащего область связывания эпитопа или областиCDR моноклонального анти-Met антитела и по меньшей мере одного ингибитора киназы в виде комбинированного препарата для одновременного, раздельного или последовательного применения в терапии опухоли и/или метастазов. Другой целью настоящего изобретения является способ скрининга соединений, способных связы-1 015580 ваться по меньшей мере с одной частью внеклеточного домена рецептора фактора роста гепатоцитов(HGFR) для идентификации соединений, фармакологически активных для профилактики и/или лечения опухоли и/или метастазов. Другой целью настоящего изобретения является применение антитела анти-MET-R, его фрагментов и/или генетически сконструированных антител, содержащих область связывания эпитопа или областиCRD антитела анти-MET-R, в виде диагностического средства для выявления неопластических клеток либо in vivo, либо in vitro. Согласно настоящему изобретению указанные цели достигают способами, определенными формулой изобретения, которая следует далее, являющейся неотъемлемой частью технического описания настоящего изобретения. Краткое описание чертежей Фиг. 1. Анти-MET-R снижает активацию HGFR и сигнальную трансдукцию. (А) Оценка активацииHGFR. На клетки GTL16 воздействовали анти-MET-R в течение указанных периодов времени. HGFR иммунопреципитировали из клеточных лизатов и Вестерн-блоты анализировали с использованием в качестве зондов указанных антител. Обработка анти-MET-R приводила к снижению активации рецептора более явно, чем супрессия рецептора, как показано при количественной оценке плотности полосы. (В) Анализ передачи сигнала HGFR. Клетки предварительно обрабатывали либо VSV-G, либо анти-MET-R и затем стимулировали HGF в течение указанных периодов времени. Фосфорилирование Akt оценивали в общих лизатах клеток. Как показано на верхней панели, анти-MET-R снижали как основную, так и HGFиндуцированную активацию Akt. Фиг. 2. Анти-MET-R ингибирует трансформированный фенотип злокачественных клеток in vitro.(А) Независимый от заякоривания рост клеток GTL16. Предварительно обработанные клетки высевали в 0,5% агар. Затем клетки поддерживали в присутствии указанных количеств антител анти-MET-R илиVSV-G и через 10 дней выросшие колонии окрашивали. Независимый от заякоривания рост был в значительной степени ингибирован даже при низких дозах анти-MET-R. (В) Анализ инвазии. MDA-MB-4354 предварительно обрабатывали указанными антителами в течение 24 ч перед посевом в покрытую матригелем камеру Transwell. Нижнюю камеру заполняли DMEM 2%FBS+100 нг/мл HGF. Через 24 ч мигрировавшие клетки окрашивали и подсчитывали. Способность к инвазии в ответ на HGF выражали в виде кратности увеличения по сравнению с нестимулированными клетками. Как показано, обработка антиMET-R значительно снижала инвазию клеток. Фиг. 3. Анти-MET-R ингибирует трансформированный фенотип злокачественных клеток in vivo (А,В). Анализ образования опухолей. Мышам nude подкожно инъецировали 1,5106 клеток GTL16. После появления опухолей отбирали мышей, у которых наблюдали опухоли одного и того же размера, и затем инъецировали in situ дважды в неделю 2 мкг/г либо VSV-G, либо анти-MET-R. Объем опухолей измеряли в разных временных точках (А). Как показано, анти-MET-R снижает рост опухолей у мышей nude, которым прививали опухолевые клетки человека. Мышей умерщвляли через 8 недель после обработки и оценивали массу опухолей (В). У мышей, обработанных анти-MET-R, опухоли были значимо меньше, чем у контрольных мышей (р 0,05). (С) Оценка активации HGFR. Срезы опухолей мышей, обработанныхVSV-G (панель А) или анти-MET-R (панель В) окрашивали антителом против фосфо-HGFR человека. Иммуногистохимический анализ опухолей выявил, что уровни активированного HGFR были сильно снижены у мышей, обработанных анти-MET-R. Фиг. 4. Обработка анти-MET-R препятствует прогрессированию опухолей in vivo. Мышам nude подкожно прививали 2,5106 клеток MDA-MB-435 4. Рост опухолей оценивали у необработанных мышей (А) и у мышей, обработанных: 10 мкг/г VSV-G, введенного в/б (В), 1 мкг/г анти-MET-R, в/б (С), 10 мкг/г анти-MET-R в/б (D) и 2 мкг/г анти-MET-R IS (E). Как показано на диаграмме (К), анти-MET-R ингибировало рост опухоли у мышей nude, которым прививали опухолевые клетки человека. Иммуногистохимическое окрашивание антителами против фосфо-HGFR человека осуществляли на срезах опухоли,показанных на левой панели. Сильная активация HGFR имела место как у необработанных мышей (F),так и у мышей, обработанных контрольным антителом (G). Введение анти-MET-R приводило к ингибированию HGFR, которое происходило параллельно с нарушением роста опухоли. (L) Анализ легочных метастазов. Метастазы подсчитывали при микроскопическом обследовании срезов легкого после окрашивания гематоксилином/эозином. Зависимое от дозы снижение количества метастазов наблюдали у мышей, обработанных анти-MET-R. (M-N) Оценка васкуляризации опухолей. Иммунофлуоресцентное окрашивание гистологических срезов опухолей осуществляли с использованием антитела против CD31 мыши. Количество и площадь сосудов оценивали флуоресцентной микроскопией. Как показано, и количество и размер сосудов уменьшались в ответ на обработку анти-MET-R. Фиг. 5. Анти-MET-R индуцирует супрессию HGFR. Клетки GTL16 (А) и MDA-MB-435 4 (В) обрабатывали анти-MET-R в течение указанных периодов времени. Равные количества суммарных клеточных лизатов обрабатывали для Вестерн-блоттинга и анализировали, используя антитела анти-HGFR(верхние панели) или в качестве контроля загрузки анти-Hsp70 (нижние панели). Как показано, антиMET-R способно индуцировать супрессию HGFR как в сверхэкспрессирующих клетках (GTL16), так и в-2 015580 клетках, экспрессирующих нормальные уровни HGFR (MDA-MB-435 4). (С) Цитофлуориметрическая количественная оценка HGFR на поверхности клеток. Клетки MDA-MB-435 4 инкубировали в среде отдельно (черные столбики) или с HGF (серые столбики) или анти-MET-R (белые стоблики). В указанных временных точках клетки окрашивали антителами против внеклеточного домена HGFR (DO24). Как показано, анти-MET-R способно эффективно снижать количество поверхностного HGFR, при этом максимальное снижение наблюдается через 30 ч после обработки. Фиг. 6. Индуцированная антителом и зависимая от лиганда супрессия происходит различными путями. (А) Клетки HeLa (верхняя панель) и GTL16 (нижняя панель) предварительно обрабатывали либо лактацистином (lact), либо конканамицином (conc), либо обоими препаратами в течение 2 ч перед обработкой HGF или анти-MET-R. Супрессию HGFR оценивали в общих лизатах клеток. В присутствии ингибиторов протеасом индуцированная лигандом супрессия HGFR была ослаблена, тогда как индуцированная Ат супрессия не была ослаблена. В указанных условиях в клетках накапливался фрагмент 60 кД(стрелка), выявляемый только Ат, направленным против внутриклеточной части (анти-внутриклеточная часть Met). Кроме того, анализ с использованием в качестве зонда антител против убиквитина (В, верхняя панель) показал, что данный фрагмент мечен остатками убиквитина, что ожидаемо для молекулы,подвергаемой расщеплению протеосомами. Фиг. 7. Анти-MET-R индуцирует протеолитическое расщепление HGFR и шеддинг внеклеточного домена (эктодомена). (А) Клетки GTL16 метаболически метили 35S-метионином и 35S-цистеином и затем обрабатывали либо HGF, либо анти-MET-R в течение 4 ч. Надосадки собирали и иммунопрециптировали анти-HGFR-AT, направленных против внеклеточного домена. Разгонку в гелях осуществляли в невосстанавливающих (верхняя панель) или восстанавливающих (нижняя панель) условиях. В отсутствие восстановителей цепииHGFR мигрировали в виде комплекса, тогда как две полосы двигались отдельно в присутствии -меркаптоэтанола. Как показано на фиг., анти-MET-R, но не HGF, способно индуцировать щеддинг эктодомена HGFR. (В) Анти-MET-R также индуцирует шеддинг эктодомена в эндотелиальных клетках. Клетки HUVEC подвергали воздействию антитела в течение указанных периодов времени. Культуральную среду собирали и иммунопреципитировали антителом, узнающим внеклеточную часть -цепи HGFR. Вестерн-блоты анализировали, используя в качестве зонда такое же антитело против внеклеточного домена HGFR. (С, D) шеддинг эктодомена HGFR зависит от дозы и времени. Клетки стимулировали возрастающими количествами анти-MET-R (С) или в течение различных периодов времени (D). Культуральную среду обрабатывали, как описано в пункте (В). Фиг. 8. Активация сигнальной трансдукции не требуется для шеддинга эктодомена HGFR. КлеткиCos-7 трансфицировали различными мутантами HGFR и через 48 ч обрабатывали анти-MET-R в течение 4 ч. Равные количества общих клеточных лизатов и кондиционированных сред обрабатывали для Вестерн-блоттинга. Как показано, анти-MET-R способно индуцировать супрессию и шеддинг эктодомена всех мутантов HGFR. HGFR KD = HGFR с недействующей киназой, т.е. с утратой киназной активности;HGFR Double = мутант HGFR, в котором отсутствуют 2 стыковочных тирозина 1349, 1356, и которые,соответственно, не способны привлекать к себе трансдукторов сигнала; HGFR-GFP = мутант HGFR, в котором внутриклеточная часть полностью заменена последовательностью GFP. Фиг. 9. "Сброшенный" эктодомен HGFR ведет себя как "ловушка". Клетки, предварительно обработанные анти-MET-R, стимулировали, используя HGF, либо в отсутствие, либо в присутствии эктодоменаAkt и вел себя как "ловушка". Фиг. 10. Клетки, генетически модифицированные посредством опосредованным лентивирусом переносом генов, экспрессируют анти-MET-R. (А) Схематичное изображение двунаправленного лентивирусного вектора (интегрируемая форма), используемого для экспрессии анти-MET-R; LTR: длинные концевые повторы HIV-1; область U3 делетирована в положении -18 из области R. SD: донор сплайсинга.SA: акцептор сплайсинга. Поли-А SV40: сайт полиаденилирования вируса обезьян 40. Cte: конститутивный транспортный элемент. полученный из вируса обезьян Мейзена-Пфейзера. PminCMV: минимальный промотор, полученный из цитомегаловируса. hPGK: промотор гена фосфоглицерокиназы человека. PRE. Посттранскрипционный регуляторный элемент вируса гепатита сурка. FLAG-метка: последовательность,кодирующая 3-кратно повторяемый эпитоп DYKDDDK. His-метка: последовательность, кодирующая 7 остатков гистидина. (В) Вестерн-блот-анализ надосадков культур, не содержащих сыворотки (75 мкл каждого образца), собранных из двух типичных клеточных линий, трансдуцированных лентивирусным вектором, несущим кДНК анти-MET-R. Образцы подвергали SDS-ПААГ в восстанавливающих условиях и соответствующие фильтры анализировали, используя антитело против Ig мыши. (С) Таблица, в которой показана количественная оценка анти-MET-R в надосадках культуры, полученных из панели клеточных линий, трансдуцированных лентивирусным вектором, несущим кДНК анти-MET-R. Фиг. 11. Рекомбинантное анти-MET-R связывает с высокой аффинностью внеклеточный домен Met.(А) Вестерн-блот-анализ клеточных лизатов, содержащих рецептор Met, иммунопреципитированный анти-MET-R-антителом, полученным из разных источников (гибридома или генетически модифицированная линия клеток карциномы). Иммунопреципитацию осуществляли, инкубируя сефарозу-белок G с-3 015580 надосадками культуры клеток из 1: гибридомы, продуцирующей неродственное моноклональное антитело; 2: гибридомы, продуцирующей моноклональное антитело анти-MET-R; 3: клеток MDA-MB 435, инфицированных лентивирусным вектором, несущим кДНК моноклонального антитела анти-MET-R; 4: неинфицированные клетки MDA-MB 435. Образцы подвергали SDS-ПААГ в восстанавливающих условиях и соответствующие фильтры анализировали, используя анти-Met антитело, направленное против Сконца рецептора. (В) Анализ связывания анти-MET-R и рекомбинантного анти-MET-R с внеклеточным доменом рецептора Met. 96-луночный планшет, покрытый очищенным внеклеточным доменом МЕТ,слитым с Fc-доменом, полученным из Ig человека, (100 нг/лунку) инкубировали с возрастающими концентрациями очищенного анти-MET-R или рекомбинантного анти-MET-R (от 0 до 5,5 нМ). Кривую связывания получали, используя связанное с HRP антитело против Ig мыши. Для контроля специфичности связывания авторы осуществляли такой же анализ, используя лунки, покрытые Fc-Ron (химерным белком, образованным слиянием Fc-домена Ig человека с внеклеточным доменом рецептора Ron, белка, относящегося к семейству рецепторов Met). Фиг. 12. Рекомбинантное анти-MET-R индуцирует протеолитическое расщепление HGFR и шеддинг внеклеточного домена (эктодомена). Клетки линии НСТ-116, линии клеток карциномы прямой и ободочной кишки, инкубировали в отсутствие сыворотки в течение 24 ч с указанным количеством очищенного анти-MET-R (А) или рекомбинантного анти-MET-R (В). Общие клеточные лизаты (верхние панели) и надосадки культур клеток (нижние панели) подвергали SDS-ПААГ с последующим Вестернблот-анализом. Уменьшение количества зрелой формы Met (p145) в клетках и соответствующее увеличение количества эктодомена Met (р 80) в надосадках культуры контролировали, анализируя фильтры с использованием анти-Met моноклонального антитела DL-21, которое узнает домен, локализованный во внеклеточной части -цепи Met. Фиг. 13. Трансдукция лентивирусным вектором, кодирующим анти-MET-R, ингибирует трансформированный фенотип злокачественных клеток in vitro и in vivo. (А) Анализ независимого от заякоривания роста. Клетки НСТ-116, трансдуцированные (анти-MET-R) или нетрансдуцированные (WT) лентивирусным вектором, кодирующим анти-MET-R, высевали в 0,5% агар. Затем клетки поддерживали в среде с добавлением 2% FCS + 80 нг/мл HGF. Колонии подсчитывали через 14 дней; сверху показана типичная лунка; снизу на графике представлено количество колоний (подсчитано на основании трех повторов). (В) Анализ инвазии. Клетки НСТ-116, трансдуцированные (анти-MET-R) или нетрансдуцированные (WT) лентивирусным вектором, кодирующим анти-MET-R, помещали в покрытую матригелем камеру Transwell. Нижнюю камеру заполняли средой с 2% FE5S + 80 нг/мл HGF. Через 24 ч подсчитывали клетки, прикрепленные к нижней части фильтров. Картины представляют типичные области фильтров. (С) Инкубационный период опухоли in vivo. Клетки НСТ-116, трансдуцированные (анти-MET-R) или нетрансдуцированные (WT) лентивирусным вектором, кодирующим анти-MET-R, инъецировали подкожно в бок бестимусных мышей nude (3106 клеток/мышь, n=6 для каждой группы). Массу опухолей оценивали каждые 2 дня с помощью циркуля. Мыши считались позитивными в отношении присутствия опухоли, когда масса опухоли превышала 15 мм 3. (D) Рост опухолей in vivo. Клетки НСТ-116, трансдуцированные (анти-MET-R) или нетрансдуцированные (WT) лентивирусным вектором, кодирующим анти-MET-R, инъецировали подкожно в бок бестимусных мышей nude (3106 клеток/мышь, n=6 для каждой группы). Кинетику роста опухоли оценивали, измеряя массу опухоли с помощью циркуля каждые 3 дня. На 65 день всех мышей умерщвляли. Фиг. 14: Прямая доставка внутрь опухоли лентивирусного вектора, кодирующего анти-MET-R, ингибирует рост опухоли. Клетки НСТ-116 (4106 клеток/мышь) инъецировали подкожно в бок бестимусных мышей nude. Когда масса опухоли составляла около 10 мм 3 лентивирусные векторные частицы (1[мкг р 24 /мышь) вводили внутрь опухоли в 0 день и 3 день. Одна группа (контроль) получала векторные частицы, кодирующие GFP, тогда как другая группа получала векторные частицы, кодирующие антиMET-R (анти-MEt-R). Кинетику роста опухоли оценивали, измеряя массу опухоли с помощью циркуля каждые 3 дня. Фиг. 15. Карта плазмиды, кодирующей анти-MET-R. Фиг. 16. Карта плазмиды, кодирующей анти-MET-R FLAG-His. Фиг. 17. Схематичное изображение доменов, полученных из внеклеточной части HGFR (эктодоменMet). Фиг. 18. Анти-MET-R специфично узнает эпитоп, локализованный в области IPT. Кондиционированные среды от клеток MDA-MB-435, трансдуцированных лентивирусными векторными частицами,кодирующими меченую myc ловушку Met, меченый myc SEMA PSI и меченый myc PSI IPT1-4, иммунопреципитировали анти-MET-R-антителом и выявляли с помощью Вестерн-блота, используя биотинилированное анти-myc-антитело (правая панель). Равные количества кондиционированной среды наносили в качестве контроля экспрессии белка (левая панель). Контроль: кондиционированная среда от клетокMDA-MB-435, трансдуцированнх пустым лентивирусным вектором. Ловушка Met: кондиционированная среда от клеток MDA-MB-435, трансдуцированных лентивирусным вектором, экспрессирующим полный внеклеточный домен HGFR. PSI-IPT: кондиционированная среда от клеток MDA-MB-435, трансдуциро-4 015580 ванных лентивирусным вектором, экспрессирующим домены PSI, IPT-1, IPT-2, IPT-3, IPT-4 HGFR.SEMA-PSI: кондиционированная среда от клеток MDA-MB-435, трансдуцированных лентивирусным вектором, экспрессирующим домены Sema и PSI HGFR. Справа показана молекулярная масса в кД. Фиг. 19. Анти-MET-R узнает эпитоп, локализованный в области IPT-4. Клеточные лизаты клетокMDA-MB-435, трансдуцированных лентивирусными векторными частицами, экспрессирующими отдельные области IPT-1, IPT-2, IPT-3, IPT-4, причем все области мечены flag, иммунопреципитировали анти-МЕТ-R-антителом и выявляли на Вестерн-блоте, используя анти-flag-антитело (левая панель); в качестве контроля экспрессии белка сходные количества клеточных лизатов иммунопреципитировали анти-flag-антителом и выявляли на Вестерн-блоте, используя такое же анти-flag-антитело (правая панель). Контроль: клеточный лизат клеток MDA-MB-435, трансдуцированных пустым лентивирусным вектором. IPT1: клеточный лизат клеток MDA-MB-435, трансдуцированных лентивирусным Еектором,экспрессирующим область IPT-1 HGFR. IPT2: клеточный лизат клеток MDA-MB-435, трансдуцированных лентивирусным вектором, экспрессирующим область IPT-2 HGFR. IPT3: клеточный лизат клетокIPT4: клеточный лизат клеток MDA-MB-435, трансдуцированных лентивирусным вектором, экспрессирующим область IPT-4 HGFR. Справа показана молекулярная масса в кД. Фиг. 20. Анти-Met-R специфично красит рецептор HGF в интактных клетках. Панель А: Профил=GTL-16, анализируемых проточной цитометрией с использованием анти-Met-R-антитела. Тонкая линия:GTL-16, инкубированные с антителом, являющимся контролем изотипа; жирная линия: GTL-16, инкубированные с анти-Met-R. MFI: Средняя интенсивность флуоресценции. Панель С: Анализ иммунофлуоресценции клеток GTL-16, меченых анти-Met-R-антителом, выявляемых антителом козы против Ig мыши, конъюгированным с флуорохромом Alexa Fluor 488. Панель В: Клетки GTL-16, меченые только антителом против Ig мыши/Alexa Fluor 488. (Исходное увеличение 63). Фиг. 21. Последовательность нуклеиновой кислоты (а) и аминокислотная последовательность (b) тяжелой цепи анти-MET-R. Области CDR подчеркнуты как в нуклеотидной, так и в аминокислотной последовательности. Фиг. 22. Последовательность нуклеиновой кислоты (а) и аминокислотная последовательность (b) легкой цепи анти-MET-R. Области CDR подчеркнуты как в нуклеотидной, так и в аминокислотной последовательности. Подробное описание изобретения Рецептор фактора роста гепатоцитов, кодируемый протоонкогеном МЕТ, является тирозинкиназным рецептором, который при активации вызывает сложный спектр биологических ответов, известных как "инвазивный рост" (8). Инвазивный рост включает индукцию и координирование: пролиферации клеток, миграции, дифференцировки и жизнеспособности. При физиологических условиях такая программа инвазивного роста играет центральную роль в органогенезе во время развития эмбриона, но при запуске в случае злокачественной опухоли она вносит вклад в прогрессирование опухоли и метастазы(13). Вовлечение HGFR в опухоли человека в настоящее время твердо установлено, так как миссенсмутации зародышевой линии гена МЕТ ответственны за некоторые наследственные формы злокачественных опухолей (9, 10), и аномальная активация HGFR показана в большинстве типов солидных опухолей, что часто коррелирует с плохим прогнозом (14). Наиболее частым изменением в злокачественных опухолях человека является сверхэкспрессия (15), которая приводит к конститутивной димеризации и активации рецептора даже в отсутствие лиганда (16). Повышенная экспрессия HGFR может быть следствием (i) амплификации гена, как в опухолях прямой и ободочной кишки, где МЕТ дает неопластическим клеткам избирательное преимущество в отношении метастазирования в печень (11), (ii) усиленной транскрипции, индуцированной другими онкогенами, такими как Ras, Ret и Ets (17, 18), (iii) активируемой гипоксией транскрипции, в данном случае более высокое количество рецептора делает клетки гиперчувствительными к HGF и стимулирует инвазию опухоли (19). В настоящее время в клинической практике используют две методики вмешательства в тирозинкиназные рецепторы (RTK): (i) лечение малыми молекулами, ингибирующими активность тирозинкиназы;(ii) лечение антителами, мешающими активации рецептора. Настоящее изобретение относится к применению терапии опухолей анти-HGFR антителом, и в частности, моноклональным анти-Met антителом обозначенным анти-MET-R, продуцируемым линией клеток гибридомы, депонированной в ICLC с номером доступа PD 05006, которое, как было неожиданно обнаружено, способно индуцировать супрессию рецептора. В одном варианте настоящее изобретение относится к применению моноклонального антитела анти-MET-R для получения лекарственного средства для лечения опухолей и метастазов у пациента, страдающего опухолью. В следующем варианте настоящее изобретение относится к применению анти-MET-R антитела для производства диагностических устройств для выявления неопластических клеток либо in vivo, либо invitro. Анти-MET-R является моноклональным антителом (мАт), специфичным к внеклеточному доменуHGFR (20). Указанное моноклональное антитело не запускает все биологические эффекты, вызываемые фактором роста гепатоцитов (подвижность, пролиферацию, жизнеспособность клеток, инвазию, тубулогенез и ангиогенез), а индуцирует только подвижность. Кроме того, оно усиливает конститутивную экспрессию активатора плазминогена урокиназного типа, но не способно индуцировать и поддерживать экспрессию рецептора активатора плазминогена урокиназного типа в течение длительных периодов времени. Указанное мАт активирует фосфорилирование рецептора, которое будучи строго зависимым от бивалентности мАт требует димеризации рецептора. Агонистическая способность данного антитела как такового не достаточна, чтобы подтвердить его терапевтическую активность. Действительно, другое моноклональное анти-MET-R антитело (DO-24),которое исследовали авторы изобретения, не способно индуцировать эффективную супрессию рецептора, и оно не стимулирует шеддинг внеклеточной части рецептора. Анти-MET-R не препятствует взаимодействию HGFR с HGF, но эффективно стимулирует супрессию HGFR, как показано в примере 4 ниже и обсуждается при описании фиг. 5. Такое взаимодействие приводит к ингибированию опосредованной HGFR сигнальной трансдукции и, в частности, пути Akt,который как известно вовлечен в антиапоптозный ответ. Как будет понятно из описанных ниже результатов, авторы настоящего изобретения показали, что обработка in vitro антителом анти-MET-R приводила к ухудшению способности клеток расти независимым от заякоривания образом (см. пример 2 и фиг. 2), свойства, которое требует избегания апоптоза вследствие отсутствия заякоривания. Кроме того, как подробно описано в примере 3, авторы настоящего изобретения наблюдали, что in vivo у животных, обработанных анти-MET-R, в опухолях проявляется повышенная скорость апоптоза без значительных изменений скорости пролиферации. С другой стороны,авторы изобретения не наблюдали модификации свойств клеточного роста в ответ на антитело, ни in vitro, ни in vivo, что согласуется с отсутствием ингибирующего влияния анти-MET-R на активацию пути МАРК. Такое расстройство способности HGFR активировать различные пути не является новым, оно уже было показано для различных мутантов HGFR (21) и в ответ на частичные агонисты HGFR (22). Индуцированная антителом супрессия HGFR включает шеддинг внеклеточной части рецептора. Шеддинг эктодомена представляет собой процесс, при котором внеклеточный домен мембранных белков протеолитически высвобождается с клеточной поверхности, таким образом обеспечивая клетке возможность быстро изменять свою поверхность в ответ на стимулы окружающей среды и давать растворимые регуляторы. Авторы настоящего изобретения приводят доказательство такой активности антиМЕТ-R в примерах 6 и 7. В настоящей заявке авторы изобретения представляют доказательства - в частности, в примере 3 что антитело анти-MET-R является активным in vivo, при этом оно ослабляет рост опухоли и образование спонтанных метастазов из злокачественных клеток, прививаемых мышам nude. Эксперименты свидетельствуют, что указанные эффекты опосредованы действием антитела как на злокачественные клетки,так и на микроокружение. Действительно, эндотелиальные клетки экспрессируют HGFR (24), и авторы изобретения показали, что анти-Met-R индуцирует шеддинг HGFR также и в таком типе клеток (данные не показаны). Неоваскуляризация первичной опухоли является обязательным требованием как для роста опухоли, так и для метастазов (23), и твердо установлено, что HGF является сильным ангиогенным фактором (24). Кроме того, при активации HGFR происходит увеличение высвобождения VEGF и других ангиогенных факторов (48-49-40). Таким образом, влияние на васкуляризацию опухоли также может быть непрямым, так как ингибирование функции Met в опухолевых клетках может отменять высвобождение таких факторов из опухоли. Авторы настоящего изобретения наблюдали значимое снижение неоваскуляризации в опухоли вследствие уменьшения количества прорастающих сосудов микроокружения после обработки анти-MET-R. Неважно, что активность анти-MET-R по отношению к клеткам-хозяевам не влияет на функционирование различных органов, таких как селезенка, костный мозг, печень, сердце, кости и почки, в которых не наблюдается явных патологических изменений (данные не показаны) после долговременного воздействия антителом. Таким образом, несмотря на узнавание HGF-R как в нормальных, так и в неопластических клетках, анти-MET-R проявляет способность выявлять сверхэкспрессию HGF-R и индуцировать изменения жизнеспособности клеток. В заключение, результаты показали, что индуцированная анти-MET-R супрессия HGFR представляет собой механизм, который может быть выбран для иммунотерапии, и применение анти-MET-R или его фрагментов в фармацевтической композиции может обеспечить дальнейший путь лечения опухолей и профилактики метастазов у пациентов, пораженных опухолью. Кроме того, анти-MET-R можно использовать в качестве диагностического средства для выявления неопластических клеток либо in vivo, либо in vitro, например, используя мечение анти-MET-R подходящими метками. Анти-MET-R согласно настоящему изобретению может быть получено обычными способами у животных или предпочтительно способами генетической инженерии. Подразумевается, что применение моноклонального антитела анти-MET-R согласно настоящему изобретению также включает применение генетически сконструированных и гуманизированных антител-6 015580 и антител, меченых подходящими диагностическими маркерами. Генетически сконструированные и гуманизированные антитела и способы их получения известны в данной области. См. обзор (25). Применение анти-MET-R также включает применение фрагментов, содержащих область связывания эпитопа, например пептидов, содержащих область связывания эпитопа или определяющих комплементарность области (CDR), фрагменты Fv, scFv, Fab, Fab', F(ab')2. Обычные фрагменты, как правило,получают протеолитическим расщеплением, но также их можно получать химическим синтезом, таким как синтез в жидкой или твердой фазе, а также технологией рекомбинантных ДНК. Анти-MET-R и его фрагменты предпочтительно используют в фармацевтических композициях в форме растворимого белка, доставку которого можно осуществлять, используя обычные способы доставки лекарственных средств. Введение фармацевтических композиций, содержащих антитело антиMET-R и/или его фрагменты, можно осуществлять любым способом, известным специалисту. Например,композицию можно вводить в водном растворе, который инъецируют или инфузируют пациенту. Определение точной дозы зависит от ряда конкретных переменных, включая возраст и массу пациента, и заключается в рутинном экспериментировании в рамках компетенции специалиста. Другой вариант осуществления настоящего изобретения заключается в получении фармацевтических композиций, содержащих моноклональное антитело анти-MET-R, меченое подходящим диагностическим маркером, для выявления in vivo или in vitro неопластических клеток у пациента страдающего опухолью. Настоящее изобретение относится к получению ДНК-вектора, содержащего синтетический промотор, полученный связыванием минимального корового промотора (промотор minCMV) перед и в противоположной ориентации по отношению к эффективному промотору гена фосфоглицераткиназы человека, и ДНК, кодирующую по меньшей мере часть моноклонального антитела анти-MET-R. Последовательности ДНК, находящиеся в векторе, кодируют легкую и/или тяжелую цепь анти-MET-R; консервативные замены в последовательностях ДНК также входят в объем настоящего изобретения, а также последовательности, модифицированные добавлением последовательностей меток на 5'- или 3'-конце. Нуклеотидные последовательности кодирующие тяжелую и легкую цепь анти-MET-R, представлены в SEQID NO: 1 и SEQ ID NO: 2, соответственно. Кроме того, авторы изобретения модифицировали тяжелую цепь, добавив последовательность метки к 3'-концу тяжелой цепи анти-MET-R (SEQ ID NO: 3). Такая последовательность обеспечивает возможность очистки моноклонального антитела с использованием колонки с никелем и специфично распознается анти-FLAG антителами (SIGMA). Хотя получение ДНК-векторов согласно настоящему изобретению можно осуществлять различными способами, известными в данной области, получение проиллюстрировано в примере 10. В другом варианте настоящее изобретение относится к применению ДНК-вектора, содержащего ДНК, кодирующую связывающую эпитоп область моноклонального антитела анти-MET-R, для получения лекарственного средства для лечения опухоли и метастазов у субъекта. Доставка ДНК-векторов согласно настоящему изобретению может быть осуществлена с использованием известных способов генной терапии. Например, см. (10). Следующий вариант осуществления настоящего изобретения относится к продукту, содержащему антитело анти-MET-R и/или его фрагменты и ингибиторы киназ в виде комбинированного препарата для одновременного, раздельного или последовательного применения в терапии опухолей. Примерами ингибиторов киназ, которые предпочтительно можно использовать в настоящем изобретении, являются аналог стауроспорина К 252 А (Calbiochem-Novabiochem Intl.; 36); РНА-665752 (3Z)-5-[(2,6-дихлорбензил) сульфонил]-3-[(3,5-диметил-4-[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил-1 Н-пиррол 2-ил)метилен]-1,3-дигидро-2 Н-индол-2-он (34); SU11274 [(3Z)-N-(3-хлорфенил)-3-(3,5-диметил-4-[(4 метилпиперазин-1-ил)карбонил]-1 Н-пиррол-2-илметилен)-N-метил-2-оксоиндолин-5-сульфонамид] (37,38, 35); SU11271 [(3Z)-5-(2,3-дигидро-1 Н-индол-1-илсульфонил)-3-(3,5-диметил-4-[(4-метилпиперазин 1-ил)карбонил]-1 Н-пиррол-2-илметилен)-1,3-дигидро-2 Н-индол-2-он][(3Z)-N-(3 хлорфенил)-3-[3,5-диметил-4-(3-морфолин-4-илпропил)-1 Н-пиррол-2-ил]метилен-N-метил-2 оксоиндолин-5-сульфонамид] (38). Авторы изобретения действительно наблюдали, что механизм ингибирования, активируемый антиMET-R, не требует тирозинкиназной активности HGFR. Указанное свойство дает существенное преимущество в способе терапии. Действительно, в клинической практике часто комбинируют разные лекарственные средства, чтобы усилить влияние на молекулу-мишень. Таким образом, в случае HGFR можно комбинировать ингибиторы киназ с антителом, обеспечивая одновременное действие как на активацию,так и на уровни HGFR. Вероятно это усиливает терапевтическую эффективность целенаправленной терапии опухолей, сверхэкспрессирующих Met, благодаря предотвращению как роста опухоли, так и приобретения инвазивного-метастатического фенотипа. Часть продукта согласно настоящему изобретению, представленного антителом анти-MET-R и его фрагментами, получают как указано выше. Ингибиторы киназ, используемые в комбинированном препарате согласно настоящему изобретению, могут быть получены обычными способами химического синтеза или генетической инженерии.-7 015580 В следующем варианте настоящее изобретение относится к способу скрининга соединений, способные связываться по меньшей мере с одной частью внеклеточного домена рецептора фактора роста гепатоцитов, при этом такие соединения обладают агонистической активностью по отношению к рецептору фактора роста гепатоцитов и являются фармакологически активными в профилактике и/или лечении опухоли и/или метастазов. В частности, такие соединения способны индуцировать супрессию рецептора фактора роста гепатоцитов или шеддинг по меньшей мере части внеклеточного домена рецептора фактора роста гепатоцитов. Настоящее изобретение далее будет описано с обращением к предпочтительным вариантам в качестве неограничивающих примеров. Антитела, ингибиторы и другие реагенты Моноклональное анти-HGFR анти-MET-R первоначально описано Prat (20). Другими антителами,используемыми для иммунопреципитации и Вестерн-блот-анализа, являются: анти-HGFR-антителаPY20 (Transduction Laboratories), против убиквитина (Babco), против Hsp70 (Stressgen), против фосфоAkt (Ser473, Cell Signaling Technology), против Akt (Santa Cruz Biotechnologies), против внутриклеточного домена HGFR (C12, Santa Cruz Biotechnologies). Иммуногистохимические окрашивания осуществляли,используя: антитело против фосфо-HGFR человека (Cell Signaling) и антитело против CD31 мыши(Pharmingen). В случае экспериментов in vitro и in vivo в качестве контроля использовали антитело против вируса везикулярного стоматита (VSV-G, Sigma). Лактацистин и конканамицин приобретали из Calbiochem. Нуклеотидные и аминокислотные последовательности анти-MET-R Трансляция нуклеотидной последовательности тяжелой цепи анти-MET-R, соответствующей последовательности SEQ ID NO: 1 и фиг. 21 а, показана на фиг. 21b и в SEQ ID No: 6. Нуклеотидные и аминокислотные последовательности, соответствующие областям CDR, подчеркнуты на фиг. 21 а и 21b; их аминокислотные последовательности представляют собой следующие последовательности: CDR-H1: GYTFTSYW (SEQ ID NO: 8); CDR-H2: INPSSGRT (SEQ ID NO: 9); CDR-H3:ASRGY (SEQ ID NO: 10). Трансляция нуклеотидной последовательности легкой цепи анти-MET-R, соответствующей последовательности SEQ ID NO: 2 и фиг. 22 а, показана на фиг. 22b и в SEQ ID No: 7. Нуклеотидные и аминокислотные последовательности, соответствующие областям CDR, подчеркнуты на фиг. 22 а и 22b; их аминокислотные последовательности представляют собой следующие последовательности: CDR-L1: QSVDYDGGSY (SEQ ID NO: 11); CDR-L2: AAS (SEQ ID NO: 12); CDR-L3:QQSYEDPLT (SEQ ID NO: 13). Временная трансфекция клеток 293 Т для продуцирования лентивирусных векторов Примерно за 24 ч до трансфекции 6,0106 клеток 293 Т высевали на чашки диаметром 15 см. За 2 ч до трансфекции культуральную среду заменяли, добавляя 22 мл IMDM, дополненной инактивированной нагреванием FBS (1,0%), пенициллином (25 ед./мл), стрептомицином (25 ед./мл) и глутамином (1%). Смесь плазмидной ДНК для трансфекции получали добавлением: плазмиды ENV (VSV-G), 9 мкг; плазмиды PACKAGING pMDLg/pRRE, 16,2 мкг; плазмиды REV, 6, 25 мкг; векторной плазмиды для переноса 330 или 331, 37,5 мкг. Раствор плазмид готовили в конечном объеме 1125 мкл, используя 0,1XTE/dH2O (2:1). Добавляли 125 мкл 2,5 М CaCl2 и оставляли при комнатной температуре на 5'. Затем при встряхивании с полной скоростью добавляли 1250 мкл 2 Х-раствора HBS и затем сразу же по каплям добавляли в культуру клеток. CaPi-преципитированную плазмидную ДНК инкубировали в течение 14-16 ч,затем среду заменяли свежей средой с добавлением 1 мМ бутирата натрия (18 мл на чашку). Надосадок культуры клеток, содержащий векторные частицы, собирали через 30-36 ч после замены среды. После сбора надосадки центрифугировали при 2500 об./мин в течение 10', фильтровали через 0,2 мкм-фильтр и хранили при -80 С. Инфекция клеток-мишеней надосадком клеток, содержащим лентивирусный вектор 105 клеток высевали в свежей культуральной среде с добавлением 10% FBS, глутамина. Для инфекции линии клеток инкубировали в присутствии 8 мкг/мл полибрена с надосадком, содержащим лентивирусные векторные частицы, полученные как описано выше, с конечной концентрацией векторных частиц от 10 до 150 нг/мл эквивалента Gag p24 ВИЧ-1 (измерение в анализе ELISA). Через 18 ч среду заменяли и клетками давали возможность расти. Когда культура достигала слияния в монослое на 80% клетки инкубировали в бессывороточной среде и через 72 ч собирали надосадок, содержащий анти-MET-R. Анализ супрессии HGFR Клетки поддерживали в среде Игла, модифицированной Дульбекко (DMEM) с добавлением 10% фетальной сыворотки теленка. Обработки антителами и HGF осуществляли в бессывороточной среде,используя 80 мкг/мл и 80 нг/мл, соответственно. В указанных случаях клетки перед стимуляцией предварительно инкубировали в течение 2 ч либо с 10 мкМ лактацистина, либо 100 нМ конканамицина. Для анализа расщепления HGFR клетки лизировали в LB-буфере (2% SDS, 0,5 М трис-HCl рН 6,8) и концентрацию белка в клеточных лизатах оценивали, используя набор для анализа белка ВСА (Pierce). Затем эквивалентные количества суммарных белков анализировали в SDS-ПААГ и на Вестерн-блотах. Для-8 015580 экспериментов по иммунопреципитации клетки лизировали в буфере ЕВ (20 мМ трис-HCl, рН 7,4, 5 мМEDTA, 150 мМ NaCl, 10% глицерина, 1% тритона Х-100) в присутствии ингибиторов протеаз и 1 мМ Naортованадата. После иммунопреципитации соответствующими антителами осуществляли промывки в условиях высокой жесткости. Затем иммунопреципитированные белки обрабатывали для Вестернблоттинга согласно стандартным способам. Конечное выявление осуществляли, используя систему регистрации ECL (Amersham). Метаболическое мечение и анализ шеддинга HGFR. Клетки подвергали голоданию без сыворотки в течение 16 ч, импульсно метили [35S]-метионином и [35S]-цистеином (100 мккюри/мл, Amersham Corp.) в течение 30 мин в среде DMEM, не содержащей метионина и цистеина, и затем обрабатывали либо антиMET-R, либо VSV-G или HGF в течение 4 ч. Кондиционированные среды собирали и подвергали иммунопреципитации антителом против внеклеточного домена HGFR. Иммунопреципитированные белки разделяли в SDS-ПААГ и осуществляли авторадиографию, как описано ранее в (26). Биологические анализы in vitro Для оценки независимого от заякоривания роста GTL16 предварительно обрабатывали либо антиMET-R, либо VSV-G в истощенной среде в течение 48 ч. Затем 1500 клеток высевали в DMEM с 2% FBS плюс 0,5% мягкого агара (агароза SeaPlaque, ВМА) в каждой лунке и поддерживали в присутствии указанных количеств антител и HGF в течение 10 дней. Наконец, выросшие колонии визуализировали, используя окрашивание тетразолием (47). Анализ инвазии осуществляли в камерах Transwell (Corning). Поликарбонатные фильтры (размер пор 8 мкм) покрывали 15 мкг/см 2 базальной мембраны Matrigel (Collaborative Research). Обработку антителами осуществляли, предварительно инкубируя клетки в течение 24 ч перед посевом 20 нМ анти-MET-R или VSV-G. Затем 5104 клеток высевали на верхнюю сторону фильтров и инкубировали в DMEM+2% FBS с 100 нг/мл HGF, добавляемыми в нижние лунки камер. Через 48 ч клетки с верхней стороны фильтров удаляли механически. Клетки, мигрировавшие на нижнюю сторону фиксировали, окрашивали и подсчитывали. Коэффициент миграции получали делением количества клеток, мигрировавших при стимуляции HGF, на количество мигрировавших без стимуляции. Мечение HGFR антителами анти-Met-R in vitro Для проточно-цитометрического анализа 105 клеток GTL-16 открепляли, используя 0,025% PBSEDTA, промывали PBS и инкубировали с 50 мкг/мл анти-Met-R-антитела или таким же количеством используемого в качестве контроля изотипа мышиного Ig в течение 15' при комнатной температуре. После 2 промывок PBS клетки инкубировали с 15 мкг/мл конъюгированного с ФИТЦ козьего антитела противIg мыши (Jackson Immunoresearch laboratories) в течение 15' при комнатной температуре. Затем клетки промывали, ресуспендировали в PBS-5% БСА и анализировали проточной цитометрией (Becton Dickinson, Mountain View, CA). Клетки GTL-16 фиксировали в смеси метанол:ацетон (3:1) в течение 5' на льду,затем блокировали 2% сывороткой козы в PBS в течение 30' при комнатной температуре. Очищенное анти-Met-R добавляли в концентрации 2,5 мкг/мл в PBS с 2% сыворотки козы и инкубировали 1 ч при комнатной температуре, затем после 3 промывок PBS связанное анти-HGFR-антитело выявляли, используя 4 мкг/мл антитела против Ig мыши, конъюгированного с Alexa Fluor 488 (Molecular Probes). Анализ образцов осуществляли во флуоресцентном микроскопе (DM-IRB, Leica Microsystems). Эксперименты in vivo Эксперименты in vivo осуществляли, инокулируя подкожно либо 1106 GTL16, либо 2,5 106 MDAMB-4354 в заднюю часть бока шестинедельных иммунодефицитных самок мышей nu/nu на фоне SwissCD1 (Charles River Laboratories). После появления опухоли отбирали мышей, несущих образования сравнимого размера, и инокулировали либо в/б, либо IS (IS только в случае мышей, которым инъецировалиGTL16) дважды в неделю идентичными количествами анти-MET-R и анти-VSV-G. После 8 недель обработки мышей умерщвляли и оценивали массу опухолей. У мышей, которым инъецировали MDA-MB 4354, анализировали легкие в отношении наличия спонтанных метастазов. Иммуногистохимическое окрашивание первичных опухолей для оценки фосфорилированного HGFR осуществляли на залитых парафином 5 мкм-срезах опухоли, используя анти-фосфо-HGFR антитело (Cell Signaling, 1:100). Количество метастазов устанавливали с помощью микроскопического исследования легких после окрашивания гематоксилином/эозином, выполненного согласно протоколу Masson-Trichrome (Sigma) для обычного патологического обследования. Оценку васкуляризации опухолей осуществляли с помощью иммуногистохимии на образцах, залитых в соединение Tissue-Tek ОСТ (Sakura Finetek), и сразу замораживали при-80 С. Для иммуногистохимического окрашивания использовали моноклональное антитело крысы против CD31 мыши (Pharmingen). Оценка апоптоза Морфологическую оценку апоптоза осуществляли согласно критериям Kerr. Вследствие большого количества отдельных некротических клеток и индуцированного ишемией апоптоза вблизи некротических очагов только ткань по меньшей мере в 1 HPF (поле зрения при большом увеличении =0,63 мм) вдали от областей некроза считали подходящей для подсчета апоптоза. Случаи с массивными некрозами опухолей не оценивали. Все случаи относили к одной из двух категорий: больше или меньше 10 картин апоптоза/10 HPF.-9 015580 Ингибирование протеаз Перед стимуляцией антителом клетки обрабатывали в течение 2 ч следующими ингибиторами: 4 мМ амилорид (Sigma), чтобы ингибировать урокиназу; 5 мМ 1,10-фенантролин (Sigma), чтобы ингибировать ADAM и Zn-зависимые протеазы; 20 мкг/мл апротинина и 100 мкг/мл лейпептина, чтобы ингибировать сериновые и цистеиновые протеазы, 10 мкг/мл пепстатина А, чтобы ингибировать кислые протеазы (Calbiochem). РКС ингибировали обработкой клеток 1 мкМ ТРА в течение 24 ч. Способы скрининга Изобретение относится к анализам для скрининга тестируемых соединений, которые модулируют экспрессию/функцию/биологическую активность HGFR или индуцируют шеддинг внеклеточного доменаHGFR в присутствии или в отсутствие HGF или других агонистов рецептора. Тестируемое соединение связывается с HGFR, предпочтительно взаимодействуя с внеклеточной частью рецептора. Более предпочтительно тестируемое соединение снижает биологическую активность,опосредованную HGFR, по меньшей мере примерно на 10, предпочтительно примерно на 50, более предпочтительно примерно на 75, 90 или 100% по сравнению с активностью в отсутствие тестируемого соединения. Кроме того, тестируемое соединение предпочтительно регулирует экспрессию HGFR. Более предпочтительно тестируемое соединение супрессирует транскрипт или белок HGFR, по меньшей мере примерно на 10, предпочтительно примерно на 50, более предпочтительно примерно на 75, 90 или 100% по сравнению с ситуацией в отсутствие тестируемого соединения. Тестируемые соединения Тестируемые соединения могут представлять собой фармакологические средства, пептиды или белки, уже известные в данной области, или могут представлять собой ранее неизвестные соединения, обладающие какой-либо фармакологической активностью. Тестируемые соединения могут быть природными или сконструированными в лаборатории. Они могут быть выделены из микроорганизмов, животных или растений, могут быть получены рекомбинантными способами или синтезированы химическими способами, известными в данной области. При необходимости тестируемые соединения могут быть получены с использованием любого из многочисленных способов, основанных на комбинаторных библиотеках,известных в данной области, включая без ограничения способы, основанные на биологических библиотеках, пространственно адресуемых параллельных твердофазных или жидкофазных библиотеках, синтетических библиотеках, требующих деконволюции, способ на основе библиотеки "один шарик-одно соединение" и способы на основе синтетических библиотек с использованием селекции, основанной на аффинной хроматографии. Способ с использование биологических библиотек ограничен библиотеками полипептидов, в то время как другие четыре способа применимы к библиотекам соединений полипептидов, непептидных олигомеров или малых молекул. Анализы связывания В случае анализов связывания тестируемое соединение предпочтительно представляет собой молекулу, которая связывается с внеклеточной частью HGFR, при этом указанная молекула имитирует антиMet-R активность, тем самым предотвращая нормальную биологическую активность HGFR. Примеры таких молекул включают без ограничения малые молекулы, пептиды или пептидоподобные молекулы. В анализах связывания либо тестируемое соединение, либо внеклеточная часть HGFR могут содержать регистрируемую метку, такую как радиоизотопная, флуоресцентная, хемилюминесцентная или ферментная метка (например, радиоактивно меченый йод, радиоактивно меченый фосфор, флюорофоры или флуоресцирующие белки, люцифераза, пероксидаза хрена или щелочная фосфатаза). Затем может быть осуществлено выявление тестируемого соединения, которое связано с внеклеточным доменомHGFR, например, прямым подсчетом радиоизлучения, счетом сцинтилляции или определением превращения соответствующего субстрата в регистрируемый продукт, при этом HGFR или часть его внеклеточного домена связаны с подложкой или экспрессируются клеткой или могут быть извлечены хорошо известными специалисту в данной области способами. Функциональные анализы Тестируемые соединения могут быть исследованы в отношении способности уменьшать биологический эффект HGFR. Такие биологические эффекты можно определить, используя функциональные анализы, описанные в настоящей заявке. Такие анализы называют анализом независимого от заякоривания роста и анализом инвазии (оба способа подробно описаны в примерах 2 и 11) и оценкой трансформированного фенотипа in vivo (подробно описана в примерах 3, 11, 12). Таким образом, функциональные анализы могут быть осуществлены in vitro с использованием линии клеток, экспрессирующих HFGR, илиin vivo с использованием любой животной модели, в которой возможно исследование развития экспериментальной или встречающейся в природе опухоли, экспрессирующей HGFR. Тестируемое соединение,которое снижает биологическую активность HFGR по меньшей мере примерно на 10, предпочтительно примерно на 50, более предпочтительно примерно на 75, 90 или 100%, идентифицируют как потенциальное фармакологическое средство для снижения биологической активности HGFR. Примеры Пример 1. Анти-Met антитело анти-MET-R снижает сигнальную трансдукцию HGFF. Анти-MET-R является моноклональным антителом, направленным против внеклеточного домена- 10015580 рецептора HGF, при этом оно узнает эпитоп, отличный от эпитопа, связываемого лигандом. Такое моноклональное антитело ведет себя как частичный агонист, так как оно не запускает все биологические эффекты, вызываемые фактором роста гепатоцитов (подвижность, пролиферацию, жизнеспособность клеток, инвазию, тубупогенез и ангиогенез), а индуцирует только подвижность. Кроме того, оно действует как стимулятор конститутивной экспрессии активатора плазминогена урокиназного типа, но не способно индуцировать и поддерживать экспрессию рецептора активатора плазминогена урокиназного типа в течение длительных периодов времени. Указанное моноклонарное антитело активирует фосфорилирование рецептора, которое, будучи строго зависимым от бивалентности моноклонарного антитела, требует димеризации рецептора. Задаваясь вопросом, может ли анти-MET-R антитело представлять собой средство, препятствующее конститутивной активации рецептора HGF в сверхэкспрессирующих опухолях, авторы изобретения сначала проанализировали его биохимическую и биологическую активность в опухолевых клетках, на которые хронически воздействовали антителом. В качестве модели авторы изобретения использовали клеткиGTL16, полученные из карциномы желудка человека, в которых HGFR сверхэкспрессируется и поэтому олигомеризуется и конститутивно активируется (27). На фиг. 1 А показано значимое снижение экспрессии HGFR и фосфорилирования тирозина. Затем оценивали влияние антитела на сигнальную трансдукцию HGFR. Так как известно, что HGFR стимулирует мощную антиапоптозную программу посредством стимулирования активации Akt, то авторы изобретения оценивали уровень фосфорилирования Akt после обработки анти-MET-R. Как показано на фигуре 1 В, фосфорилирование Akt было ингибировано как в исходных условиях, так и в HGFстимулированных клетках. Другим важным путем, активируемым HGFR, является путь МАРК, который, как известно, вовлечен в стимуляцию клеточного роста. Авторы изобретения проверяли уровень активации МАРК в клетках, обработанных антителом, но не обнаружили значимого ингибирования указанного пути (данные не показаны). Пример 2. Анти-MET-R ингибирует трансформированный фенотип злокачественных клеток in vitro. Влияние антитела на рост клеток и на трансформированный фенотип оценивали, измеряя способность клеток расти зависимым от заякоривания и независимым от заякоривания образом и прорастать во внеклеточный матрикс. Как показано на фиг. 2 А, не наблюдали различия в способности клеток расти в условиях зависимости от заякоривания после обработки антителом. Независимый от заякоривания рост строго зависим от способности клеток преодолевать апоптоз изза отсутствия заякоривания, так называемый "аноикис"; указанное свойство обычно анализируют посредством оценки способности клеток расти в мягком агаре (28). Так как во многих сообщениях показано, что активация HGFR может придавать клеткам такое свойство, авторы изобретения высевали клеткиGTL16 в 0,5% агар и поддерживали культуру в присутствии или в отсутствие разных количеств антиMET-R или нерелевантного совпадающего по изотипу антитела (VSV-G) в качестве контроля. Как показано на фиг. 2 В, клетки, обработанные VSV-G, а также необработанных клетки способны образовывать многочисленные колонии. Напротив, анти-MET-R значительно ингибировало независимый от заякоривания рост злокачественных клеток зависимым от дозы образом. Интересно отметить, что клетки GTL16 способны образовывать колонии при анализе в мягком агаре даже в исходных условиях вследствие конститутивной активации HGFR, и что антитело ослабляло трансформированный фенотип таких клеток как в присутствии, так и в отсутствие HGF. Чтобы оценить способность антитела препятствовать инвазивности клеток, авторы изобретения исследовали MDA-MB-435 4, линию клеток карциномы млекопитающих, которые в ответ на HGF способны прорастать в реконструированные базальные мембраны (29). Как показано на фиг. 2 С, обработка invitro таких клеток анти-MET-R антителом приводила к зависимому от дозы ослаблению инвазивных свойств в ответ на HGF. Пример 3. Анти-MET-R ингибирует трансформированный фенотип in vivo. Чтобы оценить активность анти-MET-R на рост опухоли in vivo, авторы изобретения подкожно инокулировали клетки GTL16 в заднюю часть бока иммунодефицитных самок мышей nu/nu. Животных обрабатывали дважды в неделю либо анти-MET-R, либо VSV-G, вводимым in situ (2 мкг/г). Терапию начинали через 1 неделю после трансплантации, после появления опухолей в месте инъекции: только животных, несущих опухоли сравнимого размера, обрабатывали в течение 4 недель. Объем опухоли контролировали на протяжении всей обработки, и сниженный рост наблюдали у мышей, обработанных анти-MET-R (фиг. 3 А). После обработки мышей подвергали аутопсии и опухоли вырезали и взвешивали. Как показано на фиг. 3 В, у мышей, обработанных анти-MET-R, опухоли были значимо меньше, чем в контролях (р 0,05). В таких опухолях уровень активации HGFR, показанный при окрашивании специфичными антителами против фосфорилированной формы рецептора, был снижен (фиг. 3 С), в то время как процентное содержание апоптозных клеток было значимо увеличено (фиг. 3D). Кроме того, авторы настоящего изобретения оценивали на срезах опухолей после окрашивания гематоксилином/эозином апоптозные и митотические картины. Хотя апоптоз был значимо повышен в опухолевых тканях, полученных от мышей, обработанных анти-MET-R, количество митозов было почти неизменным (данные не- 11015580 показаны). Авторы изобретения также осуществляли эксперименты подобного рода на клетках MDA-MB-4354, модельной системе спонтанных метастазов in vivo (29). Животных обрабатывали дважды в неделю разными дозами анти-MET-R или контрольным антителом, вводимыми либо системно (1 мкг/г или 10 мкг/г внутрибрюшинно), либо в опухоль (2 мкг/г in situ). Терапию начинали в день трансплантации и осуществляли в течение восьми недель (время проявления метастатического потенциала). После обработки мышей подвергали аутопсии и проводили анализ первичных опухолей и легких (преимущественное место метастазов для таких клеток). Также обследовали разные органы (селезенку, костный мозг,печень, сердце, кости и почки), чтобы исключить возможные токсические эффекты. Данные макроскопического анализа показали, что обработка анти-MET-R приводила к ингибированию роста первичных опухолевых образований (фиг. 4 А-Е и К). Иммуногистохимическое окрашивание антителами, узнающими фосфорилированную по тирозину форму HGFR, и в таком случае показало заметное снижение активации рецептора (фиг. 4F-J). Кроме того, микроскопический анализ срезов легкого выявил, что и инъекция внутрь опухоли и системное введение анти-MET-R предотвращало появление отдаленных метастазов в легком и в обследованных органах (фиг. 4L). Так как во многих работах показано, что HGF является сильным ангиогенным фактором и что передача сигнала HGFR вносит вклад в ангиогенез опухолей, авторы изобретения анализировали васкуляризацию опухолей после обработки анти-МЕТ-R. В таких опухолях авторы изобретения обнаружили значимое снижение количества сосудов (которые были меньше и больше по размеру) и их ответвлений (фиг. 4 М, N). Таким образом, авторы изобретения пришли к выводу, что наблюдаемое противоопухолевое и противометастатическое влияние обработки было следствием комбинированного действия антитела на опухоль и на прорастание сосудов микроокружения. Пример 4. Анти-MET-R индуцирует супрессию HGFR. Чтобы исследовать механизм, посредством которого анти-МЕТ-R способно препятствовать активации HGFR, авторы изобретения обрабатывали либо анти-MET-R, либо VSV-G клетки, сверхэкспрессирующие HGFR; такой случай сходен с тем, что часто наблюдается во многих встречающихся в природе опухолях. Как показано на фиг. 5 А, авторы изобретения наблюдали, что общее количество HGFR снижалось зависимыми от времени образом при обработке анти-MET-R, но не при обработке VSV-G. Полученные данные свидетельствуют, что анти-Met антитело специфично индуцировало супрессию рецептора. Интересно подчеркнуть, что в таких клетках, сверхэкспрессирующих HGFR, лиганд HGF был неспособен индуцировать супрессию рецептора (фиг. 6, нижняя панель). Затем авторы изобретения проверяли, может ли анти-MET-R-антитело также запускать супрессию рецептора в клетках, экспрессирующих нормальные уровни HGFR. Как показано на фиг. 5 В, левая панель, в таких клетках также анти-MET-R эффективно вызывало супрессию HGFR. Индуцированное антителом уменьшение количества HGFR, экспонированного на клеточной мембране, также оценивали вFACS-анализе. Цитофлуориметрический анализ показал, что обработка антителом снижала количествоHGFR, экспрессированного на клеточной поверхности с более высокой эффективность, чем сам HGF(фиг. 5 В, правая панель). Сходное снижение в таком же анализе наблюдали также в клетках GTL16 (не показано). Пример 5. Молекулярный механизм индуцированной анти-MET-R супрессии HGFR. Зависимая от лиганда и индуцированная антителом супрессия может происходить разными путями. Зависимая от лиганда супрессия RTK является многостадийным процессом, включающим интернализацию, убиквитинилирование, сортировку в эндосомах и наконец расщепление в лизосомах или протеасомах (30). Чтобы оценить, какой путь расщепления вовлечен в индуцированную антителом супрессию HGFR,авторы изобретения блокировали активность либо лизосом, либо протеасом специфичными ингибиторами конканамицином и лактацистином, соответственно, перед стимуляцией антителом. Неожиданно, в то время как ингибирование протеасомного пути сильно снижало индуцированное лигандом расщеплениеHGFR, оно не оказывало влияния на супрессию рецептора вследствие обработки анти-MET-R (фиг. 6 А,верхняя панель), таким образом показывая, что антитело и лиганд стимулируют супрессию HGFR посредством разных молекулярных механизмов. Кроме того, когда активность протеасом была снижена,фрагмент 60 кД, регистрируемый только в исходных условиях, в большой степени накапливался в клетках после обработки антителом (фиг. 6 А, нижняя панель). Указанный фрагмент можно было выявить на Вестерн-блотах только с использованием антитела против внутриклеточной части HGFR и он находился в цитоплазматическом домене рецептора. Кроме того, как предполагалось для молекул, подвергаемых расщеплению протеасомами, фрагмент 60 кД был мечен остатками убиквитина (фиг. 6 В). Так как внеклеточный домен (эктодомен) рецептора не выявляется в клеточных лизатах после обработки анти-MET-R, авторы изобретения проверяли, высвобождается ли он вне клеток при расщеплении - явление, известное как "шеддинг" (31). Чтобы проверить такую гипотезу авторы изобретения определяли присутствие эктодомена HGFR в культуральной среде для клеток. Клетки метаболически метили радиоактивными 35S-цистеином и 35S-метионином и затем обрабатывали либо HGF, либо анти-MET-R в течение 4 ч. Среды собирали и подвергали иммунопреципитации анти-HGFR-антителом, узнающим вне- 12015580 клеточный домен. Как показано на фиг. 7 А, из культуральных сред метаболически меченых клеток авторы изобретения иммунопреципитировали полосу, которая двигалась в невосстанавливающих условиях с кажущейся молекулярной массой 130 кД (соответствующей комплексу внеклеточных ,-цепей); при разгонке в геле в восстанавливающих условиях комплекс разделялся на две полосы 80 кД (-цепь) и 45 кД (-цепь). Несмотря на то что стимуляция HGF не усиливала указанный процесс, шеддинг рецептора значительно увеличивался при связывании антитела. Согласно предыдущим данным (15) известно, что небольшое количество эктодомена HGFR конститутивно высвобождается во внеклеточную среду. Интересно подчеркнуть, что индуцированный антителом шеддинг эктодомена также наблюдали в клетках,экспрессирующих нормальные уровни HGFR, таких как эндотелиальные клетки (фиг. 7 В). При обработке клеток возрастающими количествами антитела в течение 4 ч авторы изобретения наблюдали, что опосредованный антителом шеддинг HGFR зависел от дозы (фиг. 7 С). Чтобы проанализировать кинетику индуцированного антителом шеддинга HGFR, авторы изобретения стимулировали клетки одинаковым количеством либо анти-MET-R, либо VSV-G в течение разных периодов времени. Возрастающие уровни эктодомена выявляли в среде клеток, обработанных анти-MET-R, но не VSV-G,что показывает, что наблюдаемый индуцированным антителом шеддинг было специфичным и зависел от времени (фиг. 7D). Пример 6. Индуцированный антителом шеддинг HGFR происходит на поверхности клеток. Чтобы проверить, требуется ли эндоцитоз для шеддинга HGFR, авторы изобретения использовали линию клеток, стабильно трансфицированных мутантной формой динамина (Dyn K44A), который как известно, нарушает зависимый от клатрина эндоцитоз, и экспрессия которого находится под контролем системы, регулируемой тетрациклином. Клетки поддерживали в течение 48 ч либо в присутствии (Ctr),либо в отсутствие (К 44 А Dyn) тетрациклина, чтобы ослабить эндоцитоз вследствие экспрессии мутантного динамина. Как показано на фиг. 7D, индуцированный антителом шеддинг не нарушался в клетках, в которых ингибирован зависимый от клатрина эндоцитоз. Протеазы, обычно вовлеченные в шеддинг мембранных белков, относятся к -секретазам семействаADAM. Пытаясь идентифицировать фермент, ответственный за шеддинг HGFR, Zn-хелатирующий агент 1,10-фенантролин, ингибитор ADAM и Zn-зависимых протеаз, добавляли к клеткам перед обработкой антителом. Такие условия не влияли на шеддинг рецептора (данные не показаны), что свидетельствует о том, что протеолитическое отщепление эктодомена HGFR не опосредовано -секретазой, а опосредовано независимой от Zn протеазой. Так как известно, что HGFR транскрипционно регулирует гены, вовлеченные в свертывание крови,авторы изобретения также проверяли, может ли протеаза системы коагуляции отвечать за шеддинг эктодомена. Однако роль прокоагулянтных факторов в указанном процессе была исключена, так как их ингибирование апротинином не изменяло индуцируемый антителом шеддинг эктодомена HGFR (данные не показаны). Используя панель других ингибиторов (амилорида, пепстатина А, лейпептина) авторы изобретения также исключили участие других известных гидролаз, таких как урокиназа, кислые протеазы,сериновые и цистеиновые протеазы (данные не показаны). Кроме того, авторы изобретения также доказали, что шеддинг эктодомена не зависит от активации РКСа, так как ингибирование указанного фермента высокой дозой (1 мкМ) и длительной обработкой (24 ч) форболовым эфиром ТРА не уменьшало шеддинг эктодомена (данные не показаны). Указанная группа экспериментов, которые все проводились с соответствующими позитивными контролями, показывает, что фермент, ответственный за шеддинг эктодомена HGFR не входит в список протеаз, очевидно вовлеченных в шеддинг рецепторов. Пример 7. Активация HGFR не требуется для индуцированного антителом шеддинга. Как сообщали авторы изобретения ранее, тримерный комплекс, содержащий эндофилин, CIN85 иCbl, опосредует зависимую от лиганда супрессию HGFR (32). Такой комплекс привлекается к рецептору при активации HGFR и стимулирует эндоцитоз, убиквитинилирование и расщепление рецептора. Чтобы проверить, требуется ли активация рецептора и сигнальная трансдукция для индуцируемого антителом понижающего модулирования и шеддинга, авторы изобретения исследовали способность анти-MET-R вызывать супрессию различных мутантов HGFR. Авторы изобретения экспрессировали в клетках COS-7 либо HGFR дикого типа, либо следующие мутанты: i) MET KD, кодирующий рецептор "смерти", не имеющий тирозинкиназной активности вследствие замены Lys-Ala в связывающем АТФ кармане, ii)MET "двойной", кодирующий HGFR в котором отсутствуют тирозины Y1349, Y1356, присоединяющие трансдукторы сигнала, iii) MET-GFP, доминантный негативный мутант, в котором последовательность,кодирующая целый внутриклеточный домен рецептора, заменяли последовательностями GFP. Через сорок восемь часов после трансфекции клетки обрабатывали анти-MET-R в течение 3 ч. Клеточные экстракты и внеклеточные среды анализировали, используя Вестерн-блот. Неожиданно анти-MET-R оказалось способным запускать супрессию и индуцировать шеддинг HGFR во всех мутантах (фиг. 8). Указанный эксперимент свидетельствует, что индуцируемая антителом супрессия рецептора HGF не требует ни киназной активности рецептора, ни привлечения цитоплазматических трансдукторов и что целый внутриклеточный домен необязателен для данного процесса. Это дополнительно подтверждает, что антитело- 13015580 и лиганд активируют разные механизмы супрессии. Пример 8. "Сброшенный" эктодомен HGFR ведет себя как "ловушка". Так как было показано, что генетически сконструированный внеклеточный домен HGFR может эффективно функционировать в качестве доминантной негативной молекулы-"ловушки" (33), авторы изобретения тестировали способность сброшенного эктодомена в ингибировании передачи сигнала HGFR. Клетки, предварительно обработанные в течение 72 ч анти-MET-R или VSV-G, стимулировали в течение разных периодов времени HGF либо в присутствии (фиг. 9, дорожки 4-6), либо в отсутствие (дорожки 79) эктодомена HGFR в культуральной среде. Как показано, в присутствии эктодомена HGFR запускаемоеHGF фосфорилирование Akt сильно нарушено, таким образом подтверждая идею, что сброшенный фрагмент подобно ловушке (33) действует и как конкурент за связывание HGF и как доминантная негативная молекула, препятствующая активации HGFR. Пример 9. Агонистическое анти-МЕТ-R-антитело DO-24 не индуцирует шеддинг эктодомена. Агонистическая способность данного антитела как таковая не достаточна для подтверждения его терапевтической активности. Действительно, другое моноклональное анти-MET-R-антитело (DO-24),которое авторы исследовали, не стимулирует шеддинг внеклеточной части рецептора, но способно полностью активировать рецептор. Пример 10. Получение анти-MET-R с использованием переноса гена посредством лентивирусного вектора. Авторы изобретения встраивали последовательности тяжелой и легкой цепи анти-MET-R в двунаправленный лентивирусный вектор (51) (фиг. 10 А, 15 и 16). Такой лентивирусный вектор обеспечивает координированную экспрессию двух отдельных кДНК благодаря присутствию синтетического промотора (ACCTGGGTT, SEQ ID NO: 4), полученного связыванием минимального корового промотора (промотор minCMV) выше и в противоположной ориентации по отношению к промотору hPGK (51). Такой синтетический промотор способен управлять транскрипционной активностью в обоих направлениях. Таким образом, помещая две кДНК, кодирующие анти-MET-R, одну выше в антисмысловой ориентации (легкая цепь), а другую ниже в смысловой ориентации (тяжелая цепь), можно координировано создать две независимые мРНК. Авторы изобретения получали векторные частицы с использованием временной трансфекции клеток 293 Т, как описано. Затем, чтобы постоянно модифицировать геном клеток-мишеней, авторы изобретения инфицировали панель полученных из карциномы линий клеток надосадком, содержащим векторные частицы. После инфекции клетки подвергали голоданию в среде без сыворотки и инкубировали в течение 72 ч, чтобы собрать надосадки культур клеток. Присутствие анти-MET-R антитела оценивали вестерн-блот-анализом (фиг. 10 В), и количественную оценку анти-MET-R осуществляли посредством ELISA (фиг. 10 С). Все трансдуцированные линии клеток продуцировали анти-MET-R антитело, которое правильно секретировалось в надосадок культуры. Продуцирование антитела варьировало в диапазоне 0,2-6 мкг/мл в зависимости от анализируемой линии клеток. Специфичность рекомбинантного анти-MET-R контролировали, используя анализ иммунопреципитации (фиг. 11 А), тогда как аффинность связывания оценивали в анализе ELISA (фиг. 11 В). Рекомбинантное анти-MET-R способно специфично узнавать рецептор Met с аффинностью в таком же диапазоне, что и аффинность, получаемая в случае анти-MET-R, продуцируемого обычным образом гибридомой. Кроме того, рекомбинантное анти-МЕТ-R,как и анти-MET-R, продуцируемое гибридомой, способно индуцировать протеолитическое расщеплениеMet и шеддинг внеклеточного домена (фиг. 12). Пример 11. Трансдукция лентивирусным вектором, кодирующим анти-MET-R, ингибирует трансформированный фенотип злокачественных клеток in vitro и in vivo. Авторы изобретения трансдуцировали клетки НСТ-116 лентивирусным вектором, кодирующим анти-MET-R (25 нг р 24/мл). Трансдуцированные клетки тестировали в сравнении с клетками дикого типа в отношении их трансформированного фенотипа, анализируя независимый от заякоривания рост и инвазивные свойства при канцерогенезе in vitro и in vivo. Для независимого от заякоривания роста авторы изобретения высевали клетки, продуцирующие анти-MET-R и клетки дикого типа в качестве контроля в 0,5% агаре и подсчитывали колонии, полученные после 15 дней культивирования. Способность трансдуцированных клеток к независимому от заякоривания росту была подавлена, так как они давали меньшее количество колоний, меньшего размера по сравнению с колониями, образуемыми клерками дикого типа(фиг. 13 А). Чтобы тестировать инвазивность клеток авторы изобретения анализировали способность клеток проникать в реконструированные базальные мембраны. Как показано на фиг. 13 В, имело место снижение инвазивных свойств трансдуцированных клеток. Авторы изобретения также тестировали образование опухолей in vivo клетками, трансдуцированными лентивирусным вектором, кодирующим антиMET-R, инъецируя их подкожно в бок бестимусным мышам nude. Данные, показанные на фиг. 13 С и D,свидетельствуют, что у трансдуцированных клеток нарушены канцерогенные свойства in vivo, так как инкубационный период опухоли и рост опухоли были ингибированы по сравнению с клетками дикого типа. Пример 12. Направленное введение внутрь опухоли лентивирусного вектора, кодирующего антиMET-R, ингибирует рост опухоли. Чтобы получить формальное доказательство эффективности переноса гена анти-MET-R, авторы- 14015580 изобретения вводили лентивирусные векторные частицы, несущие кДНК, кодирующие антитело, непосредственно в ранее образованные опухоли, полученные подкожной инъекцией клеток НСТ-116 в бок мышей nude. Опухоли, обработанные векторами, кодирующими анти-MET-R, имели более медленную скорость роста по сравнению с опухолями, обработанными контрольным вектором (фиг. 14). Пример 13. Участок связывания анти-MET-R на эктодомене Met. Чтобы картировать эпитоп, узнаваемый анти-MET-R, проводили эксперименты по иммунопреципитации с использованием разных внеклеточных доменов рецептора фактора роста гепатоцитов (также называемого эктодоменом Met) (фиг. 17): ловушка Met (аминокислоты 1-932): это растворимый рекомбинантный белок, соответствующий полной внеклеточной области Met человека, отсеченной перед трансмембранным доменом (Michieli et al. 2004);SEMA PSI (аминокислоты 1-562): это укороченная форма ловушки Met, содержащая домен SEMAPSI IPT (аминокислоты 1-24; 516-932): это укороченная форма ловушки Met, содержащая эндогенную лидерную последовательность (аминокислоты 1-24), слитую с областью PSI (аминокислоты 516562) и четырьмя доменами IPT (аминокислоты 563-932) (Bork et al., 1999; Gherardi et al., 2004). Полигистидиновую метку и Мус-эпитопную метку добавляли к С-концу каждой молекулы. Последовательность ловушки Met получали из последовательности, имеющей номер доступа вGene Bank X54559 (Giordano et al., 1991); такая последовательность соответствует основному транскрипту гена Met человека, который кодирует белок тирозинкиназы, который правильно процессируется и локализован в мембране. Другие публикации относятся к последовательности, имеющей номер доступа в Gene Bank J02958(Park et al., 1987); указанный номер соответствует альтернативно сплайсируемому минорному транскрипту, содержащему инсерцию длиной 54 п.о. в положении от нуклеотида 2264 до нуклеотида 2318. Указанный транскрипт кодирует белок тирозинкиназы, который неправильно процессирован и не локализован в мембране (Rodriguez et al., 1991). В соответствии с такой последовательностью внеклеточная область Met соответствует аминокислотам 1-950, и третий домен IPT (IPT3) содержит инсерцию 18 аминокислот. В табл. 1 суммированы положения разных доменов Met, соответствующих последовательностям Х 54559 и J02958. Таблица 1 кДНК для конструируемых молекул субклонировали в лентивирусном вектореpRRL.sin.PPT.CMV.Wpre (Follenzi et al., 2000); рекомбинантные лентивирусные частицы получали в большом масштабе и использовали для трансдукции линий опухолевых клеток человека (Michieli et al.,2004). Кондиционированные среды от клеток MDA-MB-435, трансдуцированных ловушкой Met, SEMAPSI и PSI IPT, мечеными myc, иммунопреципитировали анти-MET-R-антителом и выявляли с помощью Вестерн-блота, используя биотинилированное анти-тус-антитело (фиг. 18, правая панель). Равные количества кондиционированной среды наносили в качестве контроля экспрессии белка (фиг. 18, левая панель), при этом контролем является кондиционированная среда клеток MDA-MB-435, трансдуцированных пустым лентивирусным вектором. Как показано на правой панели фигуры 18, анти-MET-R способно иммунопреципитировать ловушку Met и P5I-IPT, но не SEMA-PSI. Следовательно антитело узнает эпитоп в области IPT. Чтобы более подробно картировать эпитоп, узнаваемый антителом анти-MET-R, осуществляли эксперименты по иммунопреципитации, используя отдельные домены IPT (Bork et al., 1999). Каждый IPT представляет собой укороченную форму PSI-IPT, содержащую эндогенную лидерную последовательность (аминокислоты 1-24), слитую с IPT 1 (аминокислоты 563-656) или IPT 2 (аминокислоты 657-741) или IPT 3 (аминокислоты 742-838) или IPT 4 (аминокислоты 839-932).- 15015580 Полигистидиновую метку и Flag-эпитопную метку добавляли к С-концу каждой молекулы. кДНК для конструируемых молекул субклонировали в таком же лентивирусном векторе, который указан ранее,и рекомбинантные лентивирусные частицы использовали для трансдукции линий опухолевых клеток человека. Все рекомбинантные белки представляют собой растворимые факторы, но IPT 2 не секретируется в кондиционированную среду трансдуцированных клеток. По этой причине эксперименты по иммунопреципитации проводили на лизатах клеток. Клеточные лизаты клеток MDA-MB-435, трансдуцированных flag-мечеными отдельными IPT, иммунопреципитировали анти-MET-R-антителом и выявляли на Вестерн-блоте, используя анти-flagантитело (фиг. 19, левая панель); сходные количества клеточных лизатов иммунопреципитировали антиflag-антителом и выявляли на Вестерн-блоте, используя такое же анти-flag-антитело, в качестве контроля экспрессии белка (фиг. 19, правая панель). Как показано на левой панели, анти-MET-R способно иммунопреципитировать IPT 4, но не способно иммунопреципитировать три другие домена IPT. Анти-MET-R узнает эпитоп, находящийся в доменеIPT 4 внеклеточной области МЕТ. Пример 14. Анти-MET-R узнавало HGFR в интактных клетках как в анализе FACS, так и в анализе иммунофлуоресценции. Клетки GTL-16, линию клеток карциномы желудка человека, инкубировали с анти-MET-Rантителом. Профиль GTL-16, полученный при анализе проточной цитометрией, выявил, что анти-MET-R способно специфично окрашивать клетки, экспрессирующие HGFR. Действительно, среднее значение интенсивности флуоресценции в клетках, меченых анти-Met-R-антителом, было повышено по сравнению с контрольными клетками (фиг. 20, панель А). Клетки GTL-16 также после фиксации инкубировали с анти-Met-R антителом, чтобы осуществить анализ иммунофлуоресценции. Окрашивание показало специфичное мечение клеточной поверхности, соответствующей рецептору Met (фиг. 20, панели В, С). Конечно, хотя принцип изобретения остается таким же, детали конструирования и варианты осуществления могут широко варьировать по сравнению с описанными и проиллюстрированными только в качестве примера, не выходя за рамки объема настоящего изобретения, который определен в прилагаемой формуле изобретения. Библиография 1. Hudson, P. J. (1999) Curr. Opin. Immunol. 11, 548-557. 2. Hudson, P. J.Souriau, С. (2003) Nat. Med. 9, 129-134. 3. Gschwind, A., Fischer, O. M.Ullrich, A. (2004) Nat. Rev. Cancer 4, 361-370. 4. Cragg, M. S., French, R. R.Glennie, M. J. (1999) Curr. Opin. Immunol. 11, 541-547. 5. Ferrara, N., Hillan, K. J., Gerber, H. P.Novotny, W. (2004) Nat. Rev. Drug Dlscov. 3, 391-400. 6. Li, S., Schmitz, K. R., Jeffrey, P. D., Wiltzius, J. J., Kussie, P.Ferguson, К. М. (2005) Cancer Cell 7,301-311. 7. Hynes, N. E.Lane, H. A. (2005) Nat. Rev. Cancer 5, 341-354. 8. Trusolino, L.Comoglio, P. M. (2002) Nat. Rev. Cancer 2, 289-300. 9. Schmidt, L., Duh, F. M., Chen, F., Kishida, Т., Glenn, G., Choyke, P., Scherer, S. W., Zhuang, Z.,Lubensky, I., Dean, M. et al. (1997) Nat. Genet. 16, 68-73. 10. Kim, I. J., Park, J. H., Kang, H. C., Shin, Y., Lim, S. В., Ku, J. L., Yang, H. K., Lee, K. U.Park, J.i) моноклонального анти-cMet антитела анти-MET-R,ii) фрагмента (i), содержащего определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ IDiii) генетически сконструированного антитела, содержащего определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ IDNO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13,для получения лекарственного средства для лечения опухолей и/или метастазов у пациента, страдающего опухолью, где указанное антитело анти-MET-R продуцируется линией клеток гибридомы ICLCPD 05006. 2. Применение по п.1, отличающееся тем, что указанное антитело, указанный фрагмент и/или указанное генетически сконструированное антитело находятся в форме растворимого белка.- 17015580 3. Применение по п.1, отличающееся тем, что указанное антитело и/или указанное генетически сконструированное антитело получают способом, выбранным из группы, состоящей из технологии рекомбинантных ДНК, твердофазного синтеза, синтеза в жидкой фазе. 4. Применение по п.1, отличающееся тем, что указанный фрагмент выбран из группы, состоящей изFab, F(ab')2, Fab', Fv, scFv и пептида, содержащего определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDRH2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ IDNO: 13. 5. Применение по п.1, отличающееся тем, что указанный фрагмент получают способом, выбранным из группы, состоящей из протеолитического расщепления указанного антитела, технологии рекомбинантных ДНК, твердофазного синтеза, синтеза в жидкой фазе. 6. Применение по п.1, отличающееся тем, что указанное лекарственное средство вводят посредством инъекции или инфузии. 7. Применение по п.1, отличающееся тем, что указанная опухоль выбрана из опухоли прямой и ободочной кишки и опухоли печени. 8. Применение нуклеотидной последовательности, кодирующей:i) моноклональное анти-cMet антитело анти-MET-R,ii) фрагмент (i), содержащий определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ IDiii) генетически сконструированное антитело, содержащее определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ IDNO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13,для получения лекарственного средства для лечения опухолей и/или метастазов у пациента, страдающего опухолью, где указанное моноклональное анти-cMet антитело анти-MET-R продуцируется линией клеток гибридомы ICLC PD 05006. 9. Применение по п.8, отличающееся тем, что нуклеотидная последовательность содержит, по меньшей мере:ID NO: 2, в которой присутствует одна или несколько "молчащих" замен. 10. Применение вектора, содержащего, по меньшей мере, нуклеотидную последовательность, кодирующую:i) моноклональное анти-cMet антитело анти-MET-R,ii) фрагмент (i), содержащий определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ IDiii) генетически сконструированное антитело, содержащее определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ IDNO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13, где моноклональное анти-cMet антитело анти-MET-R продуцируется линией клеток гибридомы ICLC PD 05006,для получения лекарственного средства для лечения опухоли и/или метастазов у субъекта, страдающего опухолью. 11. Применение по п.10, отличающееся тем, что указанный вектор содержит нуклеотидную последовательность, выбранную из:ID NO: 2, в которой присутствуют одна или несколько "молчащих" замен. 12. Применение по п.10, отличающееся тем, что указанный вектор находится в форме частицы. 13. Продукт, содержащий:i) моноклональное анти-cMet антитело анти-MET-R,ii) фрагмент (i), содержащий определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ IDiii) генетически сконструированное антитело, содержащее определяющие комплементарность области (CDR) моноклонального анти-cMet антитела анти-MET-R, где CDR-H1 представляет собой SEQ IDNO: 8, CDR-H2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ ID NO: 13, и по меньшей мере один ингибитор киназы в виде комбинированного препарата для одновременного, раздельного или последовательного применения для лечения опухолей и/или метастазов, где указанное моноклональное анти-cMet антитело анти-MET-R продуцируется линией клеток гибридомы ICLC PD 05006. 14. Продукт по п.13, отличающийся тем, что указанное антитело и/или указанный по меньшей мере один его фрагмент находятся в форме растворимого белка. 15. Продукт по п.13, отличающийся тем, что указанное антитело и/или указанное генетически сконструированное антитело получают способом, выбранным из группы, состоящей из технологии рекомбинантных ДНК, твердофазного синтеза или синтеза в жидкой фазе. 16. Продукт по п.13, отличающийся тем, что указанный фрагмент выбран из группы, состоящей изFab, F(ab')2, Fab', Fv, scFv, пептида, содержащего определяющие комплементарность области (CDR) моноклонального анти-cMeb антитела анти-MET-R, где CDR-H1 представляет собой SEQ ID NO: 8, CDRH2 представляет собой SEQ ID NO: 9, CDR-H3 представляет собой SEQ ID NO: 10, CDR-L1 представляет собой SEQ ID NO: 11, CDR-L2 представляет собой SEQ ID NO: 12 и CDR-L3 представляет собой SEQ IDNO: 13. 17. Продукт по п.13, отличающийся тем, что указанный фрагмент получают способом, выбранным из группы, состоящей из протеолитического расщепления указанного антитела, технологии рекомбинантных ДНК, твердофазного синтеза или синтеза в жидкой фазе. 18. Продукт по п.13, отличающийсч тем, что указанный по меньшей мере один ингибитор киназы выбран из группы, состоящей из аналога стауроспорина K252 А; (3Z)-5-[(2,6-дихлорбензил)сульфонил]-3[(3,5-диметил-4-[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил-1 Н-пиррол-2-ил)метилен]1,3-дигидро-2 Н-индол-2-она; [(3Z)-N-(3-хлорфенил)-3-(3,5-диметил-4-[(4-метилпиперазин-1-ил)карбонил]-1 Н-пиррол-2-илметилен)-N-метил-2-оксоиндолин-5-сульфонамида]; [(3Z)-5-(2,3-дигидро-1 Н-индол-1-илсульфонил)-3-(3,5-диметил-4-[(4-метилпиперазин-1-ил)карбонил]-1 Н-пиррол-2-илметилен)1,3-дигидро-2 Н-индол-2-она];[(3Z)-N-(3-хлорфенил)-3-[3,5-диметил-4-(3-морфолин-4-илпропил)-1 Нпиррол-2-ил]метилен-N-метил-2-оксоиндолин-5-сульфонамида]. 19. Продукт по п.13, отличающийся тем, что указанный продукт вводят посредством инъекции или инфузии.
МПК / Метки
МПК: A61P 35/00, C12N 15/13, C07K 16/28, G01N 33/50, C07K 14/71, A61K 39/395, C12N 15/867, A61P 35/04, A61K 48/00
Метки: моноклональное, соответствующие, анти-мет, векторы, продукты, лечения, опухолей, фрагменты, антитело
Код ссылки
<a href="https://eas.patents.su/30-15580-monoklonalnoe-anti-met-antitelo-ego-fragmenty-i-vektory-dlya-lecheniya-opuholejj-i-sootvetstvuyushhie-produkty.html" rel="bookmark" title="База патентов Евразийского Союза">Моноклональное анти-мет антитело, его фрагменты и векторы для лечения опухолей и соответствующие продукты</a>
Предыдущий патент: Способы обработки подземных пластов растворами, основанными на гетерополисахаридах
Следующий патент: Способ обработки компонентсодержащего материала и устройство
Случайный патент: Вращающийся асинхронный преобразователь и генераторное устройство