Замещенные соединения пиридиниламиноалкилен- и пиридинилоксиалкилен-циклопропанамина, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 15227
Опубликовано: 30.06.2011
Авторы: Голдштейн Соло, Шартон Ив, Лестаж Пьерр, Гиллонно Клод, Локхарт Брайан
Формула / Реферат
1. Соединения формулы (I)

в которой
n представляет собой целое число от 1 до 6 включительно,
X представляет собой атом кислорода или группу NR6,
Y представляет собой атом углерода или атом азота, где если Y представляет собой атом азота, то Rd отсутствует,
Z представляет собой атом углерода или атом азота, где если Z представляет собой атом азота, то Rc отсутствует,
R1 и R2, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляет собой атом водорода, линейную или разветвленную (C1-С6)алкильную группу или арил-(С1-С6)алкильную группу, в которой алкильная часть может быть линейной или разветвленной,
R3 и R4, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу,
R5 представляет собой атом водорода, линейную или разветвленную (С1-С6)алкильную группу, галоген, гидрокси, линейную или разветвленную (С1-С6)алкоксигруппу, циано, нитро, линейную или разветвленную (С2-С6)ацильную группу, линейную или разветвленную (С1-С6)алкоксикарбонильную группу, линейную или разветвленную (C1-С6)тригалоалкильную группу или линейную или разветвленную (С1-С6)тригалоалкоксигруппу, или аминогруппу, необязательно замещенную одной или двумя линейными или разветвленными (C1-С6)алкильными группами, или представляет собой арильную или гетероарильную группу,
R6 представляет собой атом водорода, линейную или разветвленную (C1-С6)алкильную группу или арил-(С1-С6)алкильную группу, в которой алкильная часть может быть линейной или разветвленной,
Ra, Rb, Rc, Rd и Re которые могут быть одинаковыми или разными, каждый независимо друг от друга представляет собой атом водорода, линейную или разветвленную (С1-С6)алкильную группу, галоген, линейную или разветвленную (C1-С6)галоалкильную группу, гидрокси, линейную или разветвленную (С1-С6)алкоксигруппу, линейную или разветвленную (C1-С6)гидроксиалкильную группу, циано, нитро, карбокси, изотиоцианат, линейную или разветвленную (С2-С6)ацильную группу, линейную или разветвленную (С1-С6)алкоксикарбонильную группу, линейную или разветвленную (С1-С6)тригалоалкильную группу, линейную или разветвленную (С1-С6)тригалоалкоксигруппу или линейную или разветвленную (С1-С6)алкилтиогруппу, (С1-С6)алкилкарбониламиногруппу, в которой алкильная часть может быть линейной или разветвленной, гало-(С1-С6)алкилкарбониламиногруппу, в которой алкильная часть может быть линейной или разветвленной, аминокарбонильную группу, аминогруппу, необязательно замещенную одной или двумя линейными или разветвленными (С1-С6)алкильными группами, или тетразолильную группу,
где под арильной группой подразумевается фенильная, бифенильная, нафтильная, дигидронафтильная, тетрагидронафтильная, инданильная или инденильная группа, каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейной или разветвленной (C1-С6)алкильной группы, гидрокси, циано, нитро, линейной или разветвленной (С1-С6)алкоксигруппы, линейной или разветвленной (С2-С7)ацильной группы, линейной или разветвленной (C1-С6)алкоксикарбонильной группы, линейной или разветвленной (C1-С6)тригалоалкильной группы и линейной или разветвленной (С1-С6)тригалоалкоксигрупп и аминогрупп, необязательно замещенных одной или двумя линейными или разветвленными (С1-С6)алкильными группами,
под гетероарильной группой подразумевается ароматическая моноциклическая система или бициклическая система, содержащая от 5 до 12 кольцевых членов и включающая от одного до трех одинаковых или различных гетероатомов, выбранных из кислорода, азота и серы, где одно из колец в случае бициклической системы имеет ароматический характер, тогда как другое кольцо может быть ароматическим или частично гидрированным, и где каждая из этих групп необязательно может быть замещена одной или несколькими одинаковыми или разными группами, выбранными из заместителей, указанных выше для арильной группы.
2. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (I/A):
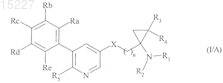
в которой R1, R2, R3, R4, R5, Ra, Rb, Rc, Rd, Re, X и n имеют значения, указанные выше.
3. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (I/B)
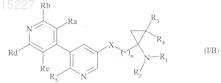
в которой R1, R2, R3, R4, R5, Ra, Rb, Rd, Re, X и n имеют значения, указанные выше.
4. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (I/C)
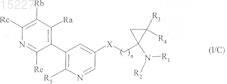
в которой R1, R2, R3, R4, R5, Ra, Rb, Rc, Re, X и n имеют значения, указанные выше.
5. Соединения формулы (I) по п.1, отличающиеся тем, что n представляет собой целое число, равное 1, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, отличающиеся тем, что R1 и R2, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляет собой атом водорода или линейную или разветвленную (C1-С6)алкильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по п.1, отличающиеся тем, что R3 и R4, которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или метильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по п.1, отличающиеся тем, что R5 представляет собой атом водорода, атом галогена или метильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по п.1, отличающиеся тем, что R6 представляет собой атом водорода или метильную группу, их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по п.1, которые представляют собой
[1-({[5-(3-метоксифенил)пиридин-3-ил]окси}метил)циклопропил] метиламин дигидрохлорид,
[1-({[6-хлор-5-(3-метоксифенил)пиридин-3-ил]окси}метил)циклопропил] метиламин дигидрохлорид,
[1-({[5-(4-метоксифенил)пиридин-3-ил]окси}метил)циклопропил]метил амин дигидрохлорид,
[1-({[5-(4-хлорфенил)пиридин-3-ил]окси}метил)циклопропил]метиламин гидрохлорид,
[1-({[6-хлор-5-(4-фторфенил)пиридин-3-ил]окси}метил)циклопропил]метиламин гидрохлорид,
{1-[({6-хлор-5-[4-(метилтио)фенил]пиридин-3-ил}окси)метил]циклопропил}метиламин дигидрохлорид,
[1-({[6-хлор-5-(3,5-дихлорфенил)пиридин-3-ил]окси}метил)циклопропил] метиламин гидрохлорид,
N-[3-(2-хлор-5-{[1-(метиламино)циклопропил]метокси}пиридин-3-ил)фенил]ацетамид гидрохлорид,
этил 4-(2-хлор-5-{[1-(метиламино)циклопропил]метокси}пиридин-3-ил)бензоат дигидрохлорид,
4-(2-хлор-5-{[1-(метиламино)циклопропил]метокси}пиридин-3-ил)бензамид гидрохлорид,
гидрохлорид 4-(2-хлор-5-{[1-(метиламино)циклопропил]метокси}пиридин-3-ил)бензойной кислоты,
(1-{[(2-хлор-3,4'-бипиридин-5-ил)окси]метил}циклопропил)метиламин дигидрохлорид,
{1-[({6-хлор-5-[4-(2Н-тетразол-5-ил)фенил]пиридин-3-ил}окси)метил]циклопропил}метиламин дигидрохлорид,
[1-({[5,6-бис(4-хлорфенил)пиридин-3-ил]окси}метил)циклопропил]метиламин дигидрохлорид,
5-(4-аминофенил)-6-метил-N-{[1-(метиламино)циклопропил]метил}пиридин-3-амин тригидрохлорид,
их энантиомеры, диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
11. Способ получения соединений формулы (I), отличающийся тем, что в качестве исходного вещества применяют соединение формулы (II)
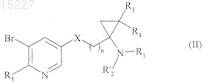
в которой R'2представляет собой атом водорода, метильную группу или трет-бутоксикарбонильную группу и R1, R3, R4, R5, X и n имеют значения, указанные для формулы (I), где соединения формулы (II) подвергают реакции с соединением формулы (III)
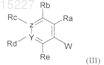
где W представляет собой -Sn(C4H9)3, -В(ОН)2или
![]()
группу, и Ra, Rb, Rc, Rd, Re, Y и Z имеют значения, указанные для формулы (I), в присутствии Pd(PPh3)4, в щелочной среде, получая соединения формулы (IV)
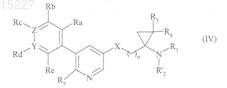
в которой R1, R'2, R3, R4, R5, X, Y, Z, Ra, Rb, Rc, Rd, Re и n имеют значения, указанные выше,
где соединения формулы (IV), где R'2представляет собой трет-бутоксикарбонильную группу, помещают в присутствие соляной кислоты, получая соединения формулы (I/а), частный случай соединений формулы (I)
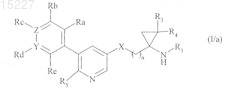
в которой R1, R3, R4, R5, X, Y, Z, Ra, Rb, Rc, Rd, Re и n имеют значения, указанные выше,
где соединения формулы (I/а) подвергают реакции с соединением формулы (V)
![]()
в которой R''2представляет собой линейную или разветвленную (C1-С6)алкильную группу или арил-(C1-С6)алкильную группу, в которой алкильная часть может быть линейной или разветвленной, и L2 представляет собой уходящую группу, обычную в органической химии, в щелочной среде, получая соединения формулы (I/b), частный случай соединений формулы (I)
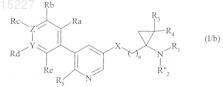
в которой R1, R"2, R3, R4, R5, X, Y, Z, Ra, Rb, Rc, Rd, Re и n имеют значения, указанные выше,
совокупность соединений формул (I/а) и (I/b), представляющая собой совокупность соединений по изобретению, очищают, если это является подходящим, в соответствии с обычными методиками очистки, может быть разделена на их разные изомеры в соответствии с обычной методикой разделения и превращена, если это является подходящим, в их соли присоединения с фармацевтически приемлемой кислотой или основанием.
12. Фармацевтическая композиция, содержащая в качестве активного компонента по меньшей мере одно соединение по любому из пп.1-10, отдельно или в сочетании с одним или несколькими фармацевтически приемлемыми инертными, нетоксичными наполнителями или носителями.
13. Фармацевтическая композиция по п.12, содержащая по меньшей мере один активный компонент по любому из пп.1-10, для применения в качестве специфического никотинового лиганда a4b2 рецепторов.
14. Фармацевтическая композиция по п.12, содержащая по меньшей мере один активный компонент по любому из пп.1-10, для лечения недостаточности памяти, связанной со старением головного мозга и с нейродегенеративными заболеваниями, а также для лечения нарушений настроения, синдрома Туретта, синдрома гиперактивности с недостаточностью внимания, абстинентного табачного синдрома и боли.
15. Фармацевтическая композиция по п.12, содержащая по меньшей мере один активный компонент по любому из пп.1-10, для лечения недостаточности памяти, связанной с болезнью Альцгеймера, болезнью Паркинсона, болезнью Пика, корсаковским психозом или деменциями лобной доли и подкорковыми деменциями.
Текст
ЗАМЕЩЕННЫЕ СОЕДИНЕНИЯ ПИРИДИНИЛАМИНОАЛКИЛЕН- И ПИРИДИНИЛОКСИАЛКИЛЕНЦИКЛОПРОПАНАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) в которой n представляет собой целое число от 1 до 6 включительно, X представляет собой атом кислорода или группу NR6, Y представляет собой атом углерода или атом азота, Z представляет собой атом углерода или атом азота, R1 и R2 представляют собой атом водорода или алкильную или арилалкильную группу, R3 и R4 представляют собой атом водорода или алкильную группу,R5 представляет собой атом водорода или алкил, галоген, гидрокси, алкокси, циано, нитро, ацил,алкоксикарбонил, тригалоалкил, тригалоалкокси или необязательно замещенную аминогруппу,R6 представляет собой атом водорода или алкильную или арилалкильную группу, Ra, Rb, Rc, Rd и Re имеют значения, указанные в описании, а также к способу их получения и фармацевтическим композициям, содержащим их. 015227 Изобретение относится к новым многократно замещенным соединениям пиридиламиноалкилен- и пиридилоксиалкилен-циклопропанамина, к способу их получения и к фармацевтическим композициям,которые их содержат. Соединения согласно настоящему изобретения являются чрезвычайно ценными в фармакологии,поскольку они специфически взаимодействуют с центральными никотиновыми рецепторами 42 типа,и применяются для лечения патологий нервной системы, связанных со старением головного мозга, а также для лечения нарушений настроения, боли и абстинентного табачного синдрома. Старение популяции в связи с повышением предполагаемой продолжительной жизни при рождении приводит к значительному повышению случаев патологий нервной системы, связанных со старением, в особенности болезни Альцгеймера. Основными клиническими проявлениями старения головного мозга и в особенности нейропатологий, связанных со старением, являются недостаточности процессов памяти и познавательных способностей, что может приводить к слабоумию. В результате многочисленных исследований было показано, что среди различных нейромедиаторов ацетилхолин играет важную роль в процессах памяти и что при определенных нейродегенеративных заболеваниях происходит значительное повреждение холинергических путей передачи сигналов в нейронах или при старении головного мозга происходит неадекватная активация. В связи с этим различные терапевтические подходы направлены на предотвращение разрушения нейромедиатора путем ингибирования ацетилхолинэстеразы или обеспечение замены для недостающего нейромедиатора. В последнем случае были предложены холинергические агонисты мускаринового типа, которые специфичны к постсинаптическим M1 рецепторам. В последнее время было показано, что холинергические повреждения, связанные с болезнью Альцгеймера, поражают в большей степени нейроны, несущие никотиновые рецепторы, по сравнению с нейронами, несущими мускариновые рецепторы (Schroder и др., "Alzheimer disease: therapeutic strategies",Birkhauser Boston, 1994, 181-185). Кроме того, в различных исследованиях было показано, что никотин обладает свойствами, улучшающими память (Prog. Neuropsychopharmacol., 1992, 16, 181-191) и что эти свойства оказывают влияние как на процессы памяти (Psychopharmacol., 1996, 123, 88-97), так и на улучшение внимания и бодрствования (Psychopharmacol., 1995, 118, 195-205). Кроме того, никотин обладает нейрозащитным действием по отношению к возбуждающе-токсическим средствам, таким как глутамат(Brain Res., 1994, 644, 181-187). Все эти результаты с большой вероятностью могут быть связаны с эпидемиологическими исследованиями, в которых была показана низкая степень проявления болезни Альцгеймера и болезни Паркинсона у курильщиков. Кроме того, в некоторых исследованиях была показана ценность никотина для лечения нарушений настроения, таких как депрессивные состояния, страх или шизофрения. В завершение,было показано, что никотин обладает обезболивающими свойствами. Все терапевтические свойства никотина, а также свойства, описанные для других никотиновых средств, основываются на действии на центральные рецепторы, которые структурно и фармакологически отличаются от периферических рецепторов (мышц и ганглий). Центральные рецепторы 42 типа наиболее часто встречаются в центральной нервной системе и вовлечены в большинство терапевтических действий никотина (Life Sci., 1995, 56,545-570). В некоторых документах, таких как Synlett, 1999, 7, 1053-1054; J. Med. Chem, 1985, 28(12), 19531957 и 1980, 23(3), 339-341; 1970, 13(5), 820-826; 1972, 15(10), 1003-1006; J. Am. Chem. Soc, 1987, 109(13),4036-4046, или нескольких патентах или патентных заявках, таких как DE 36 08 727, ЕР 124 208 или WO 94/10158, описаны и заявлены соединения, содержащие 1,1- или 1,2-дизамещенную циклопропановую часть. Ни в одном из перечисленных документов не было описано или предположено, что эти соединения обладают фармакологическим действием, специфическим для никотиновых рецепторов, и, в особенности, для центральных никотиновых рецепторов 42 типа, и это новое свойство соединений описано заявителем. В патентной заявке ЕР 1170281 описаны 1,1- и 1,2-дизамещенные циклопропановые соединения, которые являются никотиновыми лигандами. Следовательно, соединения согласно настоящему изобретению являются новыми и представляют собой эффективные селективные никотиновые лиганды центрального рецептора подтипа 42. Поэтому они применяются для лечения недостаточности памяти, связанной со старением головного мозга и с нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, корсаковский психоз и деменция лобной доли и подкорковая деменция, а также для лечения нарушений настроения, синдрома Туретта, синдрома гиперактивности с недостаточностью внимания, абстинентного табачного синдрома и боли. В частности, настоящее изобретение относится к соединениям формулы (I)-1 015227 в которой n представляет собой целое число от 1 до 6 включительно,X представляет собой атом кислорода или NR6 группу,Y представляет собой атом углерода или атом азота, где, если Y представляет собой атом азота, тоRd отсутствует,Z представляет собой атом углерода или атом азота, где, если Z представляет собой атом азота, тоRe отсутствует,R1 и R2, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляют собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу или арил-(С 1 С 6)алкильную группу, в которой алкильная часть может быть линейной или разветвленной,R3 и R4, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляют собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,R5 представляет собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную, галоген,гидрокси, линейную или разветвленную (С 1-С 6)алкокси, циано, нитро, линейную или разветвленную (С 2 С 6)ацильную, линейную или разветвленную (С 1-С 6)алкоксикарбонильную, линейную или разветвленную(С 1-С 6)тригалоалкильную или линейную или разветвленную (С 1-С 6)тригалоалкокси группу, или амино группу, необязательно замещенную одной или двумя линейными или разветвленными (C1-С 6)алкильными группами, или представляет собой арильную или гетероарильную группу,R6 представляет собой атом водорода, линейную или разветвленную (C1-С 6)алкильную группу или арил-(C1-С 6)алкильную группу, в которой алкильная часть может быть линейной или разветвленной,Ra, Rb, Re, Rd и Re, которые могут быть одинаковыми или разными, каждый независимо друг от друга представляют собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную, галоген, линейную или разветвленную (С 1-С 6)галоалкильную, гидрокси, линейную или разветвленную (C1-С 6)алкокси, линейную или разветвленную (С 1-С 6)гидроксиалкильную, циано, нитро, карбокси, изотиоцианат,линейную или разветвленную (С 2-С 6)ацильную, линейную или разветвленную (C1-С 6)алкоксикарбонильную, линейную или разветвленную (С 1-С 6)тригалоалкильную, линейную или разветвленную (С 1 С 6)тригалоалкокси или линейную или разветвленную (С 1-С 6)алкилтио группу, (С 1-С 6)алкилкарбониламино группу, в которой алкильная часть может быть линейной или разветвленной, гало-(C1-С 6) алкилкарбониламино группу, в которой алкильная часть может быть линейной или разветвленной, аминокарбонильную группу, аминогруппу, необязательно замещенную одной или двумя линейными или разветвленными (С 1-С 6)алкильными группами, или тетразолильную группу,где под арильной группой подразумевается фенильная, бифенильная, нафтильная, дигидронафтильная, тетрагидронафтильная, инданильная или инденильная группа, каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейной или разветвленной (C1-С 6)алкильной, гидрокси, циано, нитро, линейной или разветвленной(С 1-С 6)алкокси, линейной или разветвленной (С 2-С 7)ацильной, линейной или разветвленной (С 1-С 6)алкоксикарбонильной, линейной или разветвленной (C1-С 6)тригалоалкильной и линейной или разветвленной (С 1-С 6)тригалоалкокси групп и аминогрупп, необязательно замещенных одной или двумя линейными или разветвленными (С 1-С 6)алкильными группами,под гетероарильной группой подразумевается ароматическая моноциклическая система или бициклическая система, содержащая от 5 до 12 кольцевых членов и включающая от одного до трех одинаковых или различных гетероатомов, выбранных из кислорода, азота и серы, где одно из колец, в случае бициклической системы, имеет ароматический характер, тогда как другое кольцо может быть ароматическим или частично гидрированным, и где каждая из этих групп необязательно может быть замещена одной или несколькими одинаковыми или разными группами, выбранными из заместителей, указанных выше для арильной группы. В соответствии с благоприятным вариантом осуществления изобретения, предпочтительными соединениями являются соединения формулы (I/A) в которой R1, R2, R3, R4, R5, Ra, Rb, Re, Rd, Re, X и n имеют значения, указанные выше. В соответствии со вторым благоприятным вариантом осуществления изобретения, предпочтительными соединениями по изобретению являются соединения формулы (I/B)-2 015227 в которой R1, R2, R3, R4, R5, Ra, Rb, Rd, Re, X и n имеют значения, указанные выше. В соответствии с третьим благоприятным вариантом осуществления изобретения, предпочтительными соединениями по изобретению являются соединения формулы (I/C) в которой R1, R2, R3, R4, R5, Ra, Rb, Rc, Re, X и n имеют значения, указанные выше. Предпочтительным соединениям по изобретению являются соединения, в которых n представляет собой целое число, равное 1. Предпочтительными заместителями R1 и R2 в соответствии с изобретением являются атом водорода и линейная или разветвленная (С 1-С 6)алкильная группа. Предпочтительными заместителями R1 и R2 в соответствии с изобретением являются более предпочтительно атом водорода и метильная группа. Предпочтительными заместителями R3 и R4 в соответствии с изобретением являются атом водорода и метильная группа. Предпочтительным заместителем R5 в соответствии с изобретением является атом водорода, атом галогена или линейная или разветвленная (С 1-С 6)алкильная группа. Предпочтительным заместителем R6 в соответствии с изобретением является атом водорода или метильная группа. Благоприятно, предпочтительными соединениями по изобретению являются те соединения, в которых Y представляет собой атом азота и Z представляет собой атом углерода, необязательно замещенныйRc. Благоприятно, предпочтительными соединениями по изобретению являются те соединения, в которых Y представляет собой атом азота, Z представляет собой атом углерода, Ra представляет собой атом водорода, Rb представляет собой атом водорода, Rc представляет собой атом водорода и Re представляет собой атом водорода. Чрезвычайно благоприятно, предпочтительными соединениями по изобретению являются те соединения, в которых Y представляет собой атом углерода, необязательно замещенный Rd, и Z представляет собой атом азота. Благоприятно, предпочтительными соединениями по изобретению являются те соединения, в которых Y представляет собой атом углерода, Z представляет собой атом азота, Ra представляет собой атом водорода, Rb представляет собой атом водорода, Rd представляет собой атом водорода и Re представляет собой атом водорода. Обозначение (1S,2S),(1R,2R) после названия соединения указывает на то, что полученный продукт представляет собой рацемическую смесь, следовательно, присутствуют обе конфигурации. Например(1R,2R)-2-этил-1-[(3-пиридинилокси)метил]циклопропанамин. Обозначение (R или S) после названия соединения указывает на то, что полученный продукт представляет собой оптически чистый энантиомер. Присутствие (-) и/или (+) указывает направление вращения плоскости поляризации света. Обозначение (R,S) после названия соединения указывает на то, что полученный продукт представляет собой рацемическую смесь и следовательно, присутствуют обе конфигурации. Обозначение (1S,2S) или (1R,2R) после названия соединения указывает на то, что полученный продукт представляет собой оптически чистый энантиомер. Присутствие (-) и/или (+) указывает направление вращения плоскости поляризации света. Например:(1S,2S)- или (1R,2R)-(-)-R2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид указывает на то, что полученный продукт, оптически чистый энантиомер, представляет собой (1S,2S)-(-)N,2-диметил-1-[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид или (1R,2R)-(-)-N,2-диметил 1-[(3-пиридинилокси)метил]циклопропанамин дигидрохлорид. Подиэнантиомерами подразумевают оптически чистые энантиомеры данной рацемической смеси. В особенно благоприятном варианте осуществления предпочтительные соединения по изобретению представляют собой:[1-([5-(4-хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид,[1-([6-хлор-5-(4-фторфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид,1-[(6-хлор-5-[4-(метилтио)фенил]пиридин-3-илокси)метил]циклопропилметиламин дигидрохлорид,[1-([6-хлор-5-(3,5-дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид,N-[3-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)фенил]ацетамид гидрохлорид,этил 4-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензоат дигидрохлорид,4-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензамид гидрохлорид,гидрохлорид 4-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты,(1-[(2-хлор-3,4'-бипиридин-5-ил)окси]метилциклопропил)метиламин дигидрохлорид,1-[(6-хлор-5-[4-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропилметиламин дигидрохлорид,[1-([5,6-бис(4-хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид,5-(4-аминофенил)-6-метил-]N-[1-(метиламино)циклопропил]метилпиридин-3-амин тригидрохлорид,Энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием предпочтительных соединений составляют неотъемлемую часть изобретения. Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно отметить, но не ограничиваясь только ими,гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Настоящее изобретение также относится к способу получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества используют соединение формулы (II) в которой R'2 представляет собой атом водорода, метальную группу или трет-бутоксикарбонильную группу и R1, R3, R4, R5, X и n имеют значения, указанные для формулы (I), где соединения формулы (II) подвергают реакции с соединением формулы (III) группу, и Ra,Rb, Rc, Rd, Re, Y и Z имеют значения, указанные для формулы (I), в присутствии Pd(PPh3)4, в щелочной среде, получая соединения формулы (IV) в которой R1, R'2, R3, R4, R5, X, Y, Z, Ra, Rb, Rc, Rd, Re и n имеют значения, указанные выше,где соединения формулы (IV), где R'2 представляет собой трет-бутоксикарбонильную группу, помещают в присутствие соляной кислоты, получая соединения формулы (I/а), частный случай соединений формулы (I) в которой R1, R3, R4, R5, X, Y, Z, Ra, Rb, Rc, Rd, Re и n имеют значения, указанные выше,где соединения формулы (I/а) подвергают реакции с соединением формулы (V) в которой R"2 представляет собой линейную или разветвленную (C1-С 6)алкильную группу или арил(С 1-С 6)алкильную группу, в которой алкильная часть может быть линейной или разветвленной, и L2 представляет собой уходящую группу, обычную в органической химии, в щелочной среде, получая соединения формулы (I/b), частный случай соединений формулы (I) в которой R1, R"2, R3, R4, R5, X, Y, Z, Ra, Rb, Rc, Rd, Re и n имеют значения, указанные выше,совокупность соединений формул (I/а) и (I/b), представляющее собой совокупность соединений по изобретению, очищают, если это является подходящим, в соответствии с обычными методиками очистки, могут быть разделены на их разные изомеры в соответствии с обычной методикой разделения, и превращены, если это является подходящим, в их соли присоединения с фармацевтически приемлемой кислотой или основанием. В соответствии с одним вариантом осуществления изобретения, соединения формулы (II), в случае,если X представляет собой атом кислорода, R3 и R4 каждый представляет собой атом водорода и R'2 представляет собой трет-бутоксикарбонильную группу, формулы (II/а) в которой Boc представляет собой трет-бутоксикарбонильную группу и R1, R5 и n имеют значения,указанные выше,могут быть получены, используя в качестве исходного вещества соединение формулы (VI) в которой n имеет значения, указанные выше, которое подвергают реакции с дифенилфосфорилазидом в щелочной среде и затем помещают в присутствие трет-бутанола, получая соединения формулы в которой n и Вос имеют значения, указанные выше,где соединения формулы (VII) подвергают реакции с группой формулы (VIII) в которой R'1 представляет собой линейную или разветвленную (C1-С 6)алкильную группу или арил(С 1-С 6)алкильную группу, в которой алкильная часть может быть линейной или разветвленной и L1 представляет собой уходящую группу, обычную в органической химии, в щелочной среде, получая соединения формулы (IX) в которой R'1, Boc и n имеют значения, указанные выше, соединения формул (VII) и (IX), представляющие собой соединения формулы (X) в которой R1 имеет значения, указанные для формулы (I), и Boc и n имеют значения, указанные-5 015227 выше,где соединения формулы (X) помещают в присутствие восстановителя, получая соединения формулы (XI) в которой R1, Вос и n имеют значения, указанные выше,где соединения формулы (XI) помещают в присутствие четырехбромистого углерода и трифенилфосфина, получая соединения формулы (XII) в которой R1, Вос и n имеют значения, указанные выше, где соединения формулы (XII) подвергают реакции с соединением формулы (XIII) в которой R5 имеет значения, указанные для формулы (I), в щелочной среде, получая соединения формулы (II/а), как определено выше. В соответствии с другим вариантом осуществления изобретения, соединения формулы (II), в случае, если X представляет собой атом кислорода, n имеет значение 1, R'2 представляет собой метильную группу и одна из групп R3 или R4 представляет собой метильную группу, а другая группа R3 или R4 представляет собой атом водорода, формулы (II/b) в которой R1 и R5 имеют значения, указанные выше, могут быть получены, используя в качестве исходного вещества 1,2-дибромпропан и этилизоцианат в щелочной среде, получая соединение формулы где соединение формулы (XIV) помещают в присутствие восстановителя, получая соединение формулы (XV) где соединение формулы (XV) подвергают реакции с соединением формулы (XVI) в которой R5 в которой n имеет значения, указанные выше, в щелочной среде, получая соединения формулы (XVII) в которой R5 имеет значения, указанные выше,где соединения формулы (XVII) подвергают реакции с соединением формулы (VIII), как определено выше, в тех же самых условиях, что и для соединений формулы (VII), получая соединения формулы в которой R'1 и R5 имеют значения, указанные выше, соединения формул (XVII) и (XVIII), представляющие собой соединения формулы (II/b), как определено выше.-6 015227 В соответствии с другим вариантом осуществления изобретения, соединения формулы (II), в случае, если X представляет собой NR6 группу и R'2 представляет собой трет-бутоксикарбонильную группу,формулы (II/с) в которой R1, R3, R4, R5, R6, Boc и n имеют значения, указанные выше, могут быть получены, используя в качестве исходного вещества соединение формулы (XI), как определено выше, которое помещают в присутствие оксалилхлорида и ДМСО, получая соединения формулы (XIX) в которой R1, R3, R4, Boc и n имеют значения, указанные выше, где соединения формулы (XIX) подвергают реакции с соединением формулы (XX) в которой R5 имеет значения, указанные выше, в присутствии уксусной кислоты, затем цианоборогидрида натрия, получая соединения формулы (XXI) в которой R1, R3, R4, R5, Boc и n имеют значения, указанные выше, где соединения формулы (XXI) или помещают в присутствие муравьиной кислоты и уксусного ангидрида, получая соединения формулы в которой R1, R3, R4, R5, Boc и n имеют значения, указанные выше, где соединения формулы (XXII) помещают в присутствие боран диметилсульфидного комплекса, получая соединения формулы (XXIII) в которой R1, R3, R4, R5, Boc и n имеют значения, указанные выше, или подвергают реакции с соединением формулы (XXIV) в которой R'6 представляет собой линейную или разветвленную (C1-С 6)алкильную группу или арил(C1-С 6)алкильную группу, в которой алкильная часть может быть линейной или разветвленной и L6 представляет собой уходящую группу, обычную в органической химии, в щелочной среде, получая соединения формулы (XXV) в которой R1, R3, R4, R5, R'6, Boc и n имеют значения, указанные выше, соединения формул (XXI),(XXIII) и (XXV), представляющие собой соединения формулы (II/с), как определено выше. Благодаря их фармакологическим свойствам в качестве никотиновых лигандов и их избирательности по отношению к рецептору подтипа 42, соединения согласно настоящему изобретению применяются для лечения недостаточности памяти, связанной со старением головного мозга и с нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, корсаковский психоз и деменция лобной доли и подкорковая деменциям, а также для лечения нарушений настроения, синдрома Туретта, синдрома гиперактивности с недостаточностью внимания, абстинентного-7 015227 табачного синдрома и боли. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного компонента по меньшей мере одно соединение формулы (I), его изомер или его соль присоединения с фармацевтически приемлемой кислотой или основанием, отдельно или в сочетании с одним или несколькими фармацевтически приемлемыми, инертными, нетоксичными наполнителями или носителями. Фармацевтические композиции в соответствии с изобретением для парентерального введения включают, главным образом, стерильные водные или неводные растворы, дисперсии, суспензии и эмульсии, а также стерильные порошки для восстановленных растворов для инъекций или дисперсий. Фармацевтические композиции согласно изобретению для перорального введения в виде твердых форм включают, в особенности, таблетки или драже, подъязычные таблетки, саше, желатиновые капсулы и гранулы, а для перорального, назального, трансбуккального или внутриглазного введения в виде жидких форм включают, в особенности, эмульсии, растворы, суспензии, капли, сиропы и аэрозоли. Фармацевтические композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, а композиции для чрескожного введения включают, в особенности, порошки, аэрозоли, кремы, мази, гели и пластыри. Фармацевтические композиции, указанные выше, приведены только с целью иллюстрации изобретения и никоим образом его не ограничивают. Среди фармацевтически приемлемых, инертных, нетоксичных, наполнителей или носителей можно отметить, но только с целью иллюстрации и никоим образом не ограничиваясь ими, разбавители, растворители, консерванты, смачивающие вещества, эмульгирующие средства, диспергирующие средства, связывающие вещества, агенты, вызывающие набухание, дезинтеграторы, вещества для замедленного высвобождения, замасливатели, абсорбенты, суспендирующие вещества, красители, ароматизаторы и т.д. Полезная дозировка изменяется в зависимости от возраста и веса пациента, пути введения и применяемой фармацевтической композиции, природы и тяжести расстройства, и применения любых сопутствующих видов лечения. Дозировка находится в диапазоне от 1 мг до 500 мг в сутки на одно или больше введений. Примеры, представленные ниже, приведены только с целью иллюстрации и никоим образом не ограничивают изобретение. Используемые исходные материалы являются известными продуктами или продуктами, которые получают в соответствии с известными способами. Разные примеры получения приводят к синтезу промежуточных продуктов, которые пригодны для получения соединений согласно изобретению. Структуры соединений, описанных в примерах и в получениях, были определены согласно обычным спектрофотометрическим способам (инфракрасная спектрометрия, ядерный магнитный резонанс,масс-спектрометрия, и т.д). Точки плавления определяли при помощи нагревающей пластинки Кофлера или нагревающей пластинки под микроскопом. Получение 1. трет-Бутил (1-[(5-бромпиридин-3-ил)окси]метилциклопропил)метилкарбамат. Этап 1. Метил 1-[(трет-бутоксикарбонил)амино]циклопропанкарбоксилат. Раствор 80 г 1-(метоксикарбонил)циклопропанкарбоновой кислоты и 78 мл триэтиламина в 550 мл толуола, к которому добавляли 152 г дифенилфосфорилазида, нагревали до 80 С. После прекращения выделения газа, температуру доводили до 50 С и добавляли 61 г трет-бутанола. После осуществления реакции в течение 7 ч при 80 С, смесь концентрировали. Остаток ресуспендировали в простом эфире,промывали насыщенным раствором Na2CO3, а затем 1 н. раствором соляной кислоты, и после этого раствором NaHCO3. После высушивания и удаления органической фазы путем упаривания, остаток ресуспендировали в 300 мл циклогексана и затем концентрировали насухо. Полученный остаток растирали в порошок в пентане, фильтровали и затем высушивали, что позволяло выделить ожидаемый продукт. Этап 2. Метил 1-[(трет-бутоксикарбонил)(метил)амино]циклопропанкарбоксилат. 24,7 г 60% гидрида натрия порциями добавляли к раствору, охлажденному до 5 С, 99,7 г соединения, полученного на вышеописанном этапе 1, в 1,7 л безводного диметилформамида. После осуществления реакции в течение 15 мин при 5 С и затем 3 ч при температуре окружающей среды, по каплям добавляли 38,2 мл метилйодида. После осуществления реакции в течение 20 ч смесь упаривали. Остаток ресуспендировали в простом эфире и затем обрабатывали обычным способом. При осуществлении хроматографии на силикагеле (дихлорметан) выделяли ожидаемый продукт. Этап 3. трет-Бутил 1-(гидроксиметил)циклопропил(метил)карбамат. 100 мл раствора 2 М борогидрида лития в тетрагидрофуране добавляли к раствору 23 г соединения,полученного на вышеописанном этапе 2, в 100 мл тетрагидрофурана. После перемешивания в течение 20 ч при температуре окружающей среды, затем в течение 8 ч в колбе с обратным холодильником, реакционную смесь охлаждали до 0 С, гидролизировали, разводили простым эфиром, декантировали, высушивали и концентрировали. При хроматографировании остатка на силикагеле (дихлорметан/ тетрагидрофуран : 95/5) выделяли ожидаемый продукт. Этап 4. трет-Бутил 1-(бромметил)циклопропил(метил)карбамат.-8 015227 При 20 С, 7,9 г трифенилфосфина и затем 9,9 г тетрабромметана добавляли к раствору 4 г соединения, полученного на вышеописанном этапе 3, в 100 мл простого эфира. После перемешивания в течение 24 ч, фильтрования и концентрирования насухо, хроматографирования на силикагеле (дихлорметан) выделяли ожидаемый продукт. Температура плавления: 62-64 С. Этап 5. трет-Бутил (1-[(5-бромпиридин-3-ил)окси]метилциклопропил)метилкарбамат. 12,3 г порошкообразного гидроксида калия добавляли к раствору 13,1 г 5-бромпиридин-3-ола в 375 мл ДМФА. Реакционную смесь перемешивали в течение 40 минут и затем добавляли раствор 24,3 г соединения, полученного на вышеописанном этапе 4, в 115 мл ДМФА в течение 20 мин. Всю смесь нагревали в течение 8 ч при 85 С и затем ДМФА упаривали. Остаток ресуспендировали в водном растворе 10% хлорида лития и повторно экстрагировали этилацетатом, высушивали над сульфатом натрия и затем упаривали. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 98/2) получали 23,9 г ожидаемого продукта. Получение 2. трет-Бутил (1-[(5-бром-6-хлорпиридин-3-ил)окси]метилциклопропил) метилкарбамат. 9,5 г карбоната цезия добавляли к раствору 7,3 г соединения, полученного на этапе 4 Приготовления 1 и 7,5 г 5-бром-6-хлорпиридин-3-ола в 200 мл в 2-бутанона. Реакционную смесь нагревали в колбе с обратным холодильником в течение 20 ч и затем бутанон упаривали. Остаток ресуспендировали в насыщенном водном растворе карбоната натрия и затем повторно экстрагировали простым эфиром. После этого объединенные эфирные фазы промывали насыщенными водными растворами карбоната натрия и хлорида натрия и затем высушивали над сульфатом натрия и концентрировали, получая 10,6 г ожидаемого продукта. Получение 3. трет-Бутил (1-[(5-бром-6-метилпиридин-3-ил)окси]метилциклопропил)метилкарбамат. 13 г карбоната цезия добавляли к раствору 10,5 г соединения, полученного на этапе 4 приготовления 1, и 7,5 г 5-бром-6-метилпиридин-3-ола в 300 мл в 2-бутанона. Реакционную смесь нагревали в колбе с обратным холодильником в течение 20 ч. После возвращения до температуры окружающей среды, минеральные вещества отфильтровали и бутанон упаривали. При осуществлении хроматографии на силикагеле (дихлорметан/бутанон : 95/5) получали 14,8 г ожидаемого продукта. Получение 4. трет-Бутил (1-[(5-бром-6-фторпиридин-3-ил)окси]метилциклопропил)метилкарбамат. 12,9 г карбоната цезия добавляли к раствору 10,5 г соединения, полученного на этапе 4 приготовления 1, и 5,8 г 5-бром-6-фторопиридин-3-ола в 300 мл бутанона. Реакционную смесь нагревали в течение 20 ч в колбе с обратным холодильником и затем фильтровали и концентрировали. Остаток ресуспендировали в дихлорметане. После промывания насыщенным раствором хлорида натрия и высушивания над сульфатом натрия, органическую фазу концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/бутанон : 98/2) получали 10,7 г ожидаемого продукта. Получение 5. трет-Бутил (1 - [(5-бром-6-хлорпиридин-3-ил)окси]метилциклопропил)карбамат. Этап 1. трет-Бутил 1-(гидроксиметил)циклопропилкарбамат. 100 мл раствора 2 М борогидрида лития в тетрагидрофуране добавляли к раствору 23 г соединения,полученного на этапе 1 приготовления 1, в 100 мл тетрагидрофурана. После перемешивания в течение 20 ч при температуре окружающей среды и затем в течение 8 ч в колбе с обратным холодильником, реакционную смесь охлаждали до 0 С, гидролизировали, разводили простым эфиром, декантировали, высушивали и концентрировали. При хроматографировании остатка на силикагеле (дихлорметан/ тетрагидрофуран : 95/5) выделяли ожидаемый продукт. Температура плавления: 80-82 С. Этап 2. трет-Бутил [1-(бромметил)циклопропил]карбамат. Раствор 92,5 г четырехбромистого углерода в 150 мл простого эфира добавляли при температуре окружающей среды к раствору 34,5 г соединения, полученного на вышеописанном этапе 1 и 73,5 г трифенилфосфина в 750 мл простого эфира. После перемешивания в течение 20 ч, реакционную смесь фильтровали и концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/циклогексан : 50/50) получали 15 г ожидаемого продукта. Этап 3. трет-Бутил (1-[(5-бром-6-хлорпиридин-3-ил)окси]метилциклопропил)карбамат. Соединение получали в соответствии с методикой приготовления 3, используя соединение с вышеописанного этапа 2 и заменяя 5-бром-6-метилпиридин-3-ол на 5-бром-6-хлорпиридин-3-ол. Получение 6. (1S,2R),(1R,2S)-1-[(5-Бром-3-пиридинил)окси]метил-N,2-диметилциклопропанамин. Этап 1. Этил (1R,2S),(1S,2R)-1-изоциано-2-метилциклопропанкарбоксилат. Раствор 2,5 г этилизоцианата, 2,3 см 3 1,2-дибромпропана, 25 см 3 диметилсульфоксида и 60 см 3 простого эфира по каплям добавляли в течение одного часа к суспензии 1,93 г 60% гидрида натрия в масле в 20 см 3 простого эфира. После нагревания в колбе с обратным холодильником в течение 2 ч, реакционную смесь охлаждали и вливали в смесь 50 см 3 воды со льдом и 50 см 3 простого эфира. Водную фазу отбрасывали и снова экстрагировали простым эфиром (340 см 3). Объединенные органические фазы промывали с помощью водного раствора хлорида натрия, высушивали над сульфатом натрия и упаривали. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 97/3) получали 4,88 г-9 015227 ожидаемого продукта. Диастереоизомерное соотношение : 90/10. Этап 2. [(1R,2S),(1S,2R-2-Метил-1-(метиламино)цииклопропил]метанол. Раствор 4,88 г соединения, полученного на вышеописанном этапе 1, в 85 см 3 простого эфира по каплям добавляли к суспензии 3,73 г литийалюминийгидрида в 250 см 3 простого эфира. Реакционную смесь нагревали в колбе с обратным холодильником в течение 4 ч и затем перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь охлаждали на ледяно-водяной бане, после этого добавляли сульфат натрия, пропитанный водой. После перемешивания в течение двух часов, минеральные вещества отфильтровали, и эфирную фазу высушивали над сульфатом натрия и затем упаривали, получая 2,75 г ожидаемого продукта. Диастереоизомерное соотношение : 90/10. Этап 3. (1S,2R),(1R,2S)-1-[(5-Бром-3-пиридинил)окси]метил-N,2-диметилциклопропанамин. 1,7 г 60% гидрида натрия в масле добавляли к 4,6 г соединения, полученного на вышеописанном этапе 2, в 160 см 3 диметилформамида. Реакционную смесь перемешивали в течение одного часа при температуре окружающей среды и затем по каплям добавляли 10,2 г 3,5-дибромпиридина. Реакционную смесь нагревали в течение 16 ч при 60 С и затем диметилформамид упаривали. Остаток ресуспендировали в 300 см 3 простого эфира. Органическую фазу промывали с помощью водного раствора хлорида лития и затем высушивали над сульфатом натрия и концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/метанол : 96/4) получали 4,86 г ожидаемого соединения. Масс-спектрометрия(ESI): m/z = 271,1 Th ([M+H]+). Получение 7. трет-Бутил 1-(формил)циклопропил(метил)карбамат. При -60 С, 33,5 г диметилсульфоксида добавляли в течение 20 мин к раствору, содержащему 25,8 г оксалилхлорида в 430 мл дихлорметана. После перемешивания в течение 20 мин при -60 С, добавляли смесь, содержащую 34,3 г соединения, полученного на этапе 3 приготовления 1, в 100 мл дихлорметана в течение одного часа при -60 С. После перемешивания в течение 30 мин при -60 С, добавляли 81 мл триэтиламина в течение 20 мин при -60 С и затем температуре позволяли возвратиться до 20 С. Добавляли 60 мл воды и водную фазу отбрасывали и повторно экстрагировали дихлорметаном. Объединенные дихлорметановые фазы промывали с помощью насыщенного раствора хлорида натрия и высушивали над сульфатом натрия и затем концентрировали насухо. При осуществлении хроматографии на силикагеле(дихлорметан/тетрагидрофуран: 97/3) получали 31,2 г ожидаемого продукта. Получение 8. трет-Бутил (1-[(5-бромпиридин-3-ил)амино]метилциклопропил)метилкарбамат. 6 мл уксусной кислоты добавляли к раствору, содержащему 6 г соединения из приготовления 7 и 5,2 г (0,03 моль) 3-амино-5-бромпиридина в 60 мл метанола. Перемешивали в течение 30 мин при температуре окружающей среды. Охлаждали до 5 С и порциями добавляли 2,44 г цианоборогидрида натрия. Перемешивали в течение 4 дней при температуре окружающей среды. Добавляли 6,3 мл воды и концентрировали насухо. Остаток ресуспендировали в 30 мл насыщенного раствора карбоната калия в воде и экстрагировали дихлорметаном. Фильтрат высушивали над сульфатом натрия и затем концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/бутанон : 90/10) получали 7,6 г ожидаемого продукта. Температура плавления (капилляр): 96 С. Получение 9. трет-Бутил (1-[(5-бромпиридин-3-ил)(метил)амино]метилциклопропил)метилкарбамат. Этап 1. трет-Бутил (1-[(5-бромпиридин-3-ил)(формил)амино]метилциклопропил)метилкарбамат. 2,69 мл муравьиной кислоты в 5,38 мл уксусного ангидрида добавляли при 0 С в течение 20 мин к 7,64 г соединения из приготовления 8. Смесь нагревали при 50 С в течение 2 ч. Ей позволяли охладиться до 20 С и добавляли 5,38 мл тетрагидрофурана. Охлаждали до -20 С. Добавляли 7,64 г соединения из приготовления 8, растворенного в 11 мл тетрагидрофурана. Перемешивали в течение 1 ч при -20 С и после этого смесь выдерживали при 0 С в течение 20 ч. Концентрировали насухо и остаток ресуспендировали в дихлорметане. Всю смесь два раза промывали водным 10% раствором карбоната натрия, высушивали над сульфатом натрия и концентрировали насухо. При осуществлении хроматографии на силикагеле (дихлорметан/бутанон : 90/10) получали 8,09 г ожидаемого продукта. Этап 2. трет-Бутил (1-[(5-бромпиридин-3-ил)(метил) амино]метилциклопропил)метилкарбамат. При 0 С, 5 мл боран диметилсульфидного комплекса (BMS) вливали в раствор 7,7 г (0,02 моль) продукта, полученного на вышеописанном этапе 1, в 80 мл тетрагидрофурана. Температуре позволяли повышаться до 20 С и после этого нагревали в колбе с обратным холодильником в течение 3 ч. Охлаждали до 0 С, и затем добавляли 10 мл метанола по каплям. Концентрировали насухо и остаток ресуспендировали в дихлорметане, промывали водным 10% раствором карбоната натрия, высушивали над сульфатом натрия и концентрировали насухо. При осуществлении хроматографии на силикагеле (дихлорметан) получали 5,68 г ожидаемого продукта. Получение 10. трет-Бутил (1-[(5-Бром-6-хлорпиридин-3-ил)амино]метилциклопропил)метилкарбамат. Соединение получали в соответствии с методикой приготовления 8, заменяя 3-амино-5 бромпиридин на 3-амино-5-бром-6-хлорпиридин. Получение 11. трет-Бутил (1-[(5-бром-6-хлорпиридин-3-ил)(метил)амино]метилциклопропил)метилкарбамат.- 10015227 Этап 1. трет-Бутил (1-[(5-бром-6-хлорпиридин-3-ил)(формил)амино]метилциклопропил)метилкарбамат. Соединение получали в соответствии с методикой этапа 1 приготовления 9, заменяя соединение из приготовления 8 на соединение из приготовления 10. Этап 2. трет-Бутил (1-[(5-бром-6-хлорпиридин-3-ил)(метил)амино]метилциклопропил)метилкарбамат. Соединение получали в соответствии с методикой этапа 2 приготовления 9, используя соединение,полученное на вышеописанном этапе 1. Получение 12. трет-Бутил (1-[(5-бром-6-метилпиридин-3-ил)амино]метилциклопропил)метилкарбамат. Соединение получали в соответствии с методикой приготовления 8, заменяя 3-амино-5 бромпиридин на 3-амино-5-бром-6-метилпиридин. Получение 1. трет-Бутил (1-[(5-бром-6-метилпиридин-3-ил)метил)амино]метилциклопропил)метилкарбамат. Этап 1. трет-Бутил (1-[(5-Бром-6-метилпиридин-3-ил)(формил)амино]метилциклопропил)метилкарбамат. Соединение получали в соответствии с методикой этапа 1 приготовления 9, заменяя соединение из приготовления 8 на соединение из приготовления 12. Этап 2. трет-Бутил (1-[(5-бром-6-метилпиридин-3-ил)метил)амино]метилциклопропил)метилкарбамат. Соединение получали в соответствии с методикой этапа 2 приготовления 9, используя соединение,полученное на вышеописанном этапе 1. Пример 1. [1-([5-(3-Метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(3-метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. 1 г тетракис(трифенилфосфин)палладия добавляли в атмосфере азота к раствору 6,3 г соединения из приготовления 1 в 120 мл толуола. Смесь перемешивали в течение 20 мин и затем добавляли раствор 4,09 г (3-метоксифенил)бороновой кислоты в 110 мл этанола и 60 мл насыщенного водного раствора гидрокарбоната натрия. Реакционную смесь нагревали в течение 4 ч при 80 С и затем фильтровали и декантировали. Органическую фазу промывали с помощью 10% раствора гидрокарбоната натрия и затем 10% раствора хлорида натрия и после этого высушивали над сульфатом натрия и концентрировали. При хроматографировании остатка на силикагеле (дихлорметан/тетрагидрофуран : 97/3) получали 5,06 г ожидаемого продукта. Этап 2. [1-([5-(3-Метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. 50 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 5 г соединения, полученного на вышеописанном этапе 1 в 25 мл диоксана. Смесь перемешивали в течение 20 ч, разводили простым эфиром и затем фильтровали, получая 4,6 г желательного продукта. Температура плавления (капилляр): 210-212 С. Масс-спектрометрия (ESI) m/z = 285,1582 Th ([M+H]+). Пример 2. Метил[1-([5-(4-метилфенил)пиридин-3-ил]оксиметил)циклопропил]амин дигидрохлорид. Этап 1. трет-Бутил метил[1-([5-(4-метилфенил)пиридин-3-ил]оксиметил)циклопропил] карбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил) бороновую кислоту на (4-метилфенил)бороновую кислоту. Этап 2. Метил[1-([5-(4-метилфенил)пиридин-3-ил 1 оксиметил)циклопропил]амин дигидрохлорид. 10 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 0,78 г соединения, полученного на вышеописанном этапе 1 в 5 мл диоксана. Смесь перемешивали в течение 20 ч и затем растворитель упаривали. Остаток растворяли в этаноле и после этого этанол упаривали. Кристаллизованный продукт перемешивали в присутствии простого эфира и затем фильтровали и высушивали, получая 0,7 гm/z = 269,1643 Th ([M+H]+). Пример 3. [1-([5-(4-Метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (4-метоксифенил)бороновую кислоту. Этап 2. [1-([5-(4-Метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полу- 11015227 ченное на вышеописанном этапе 1. Температура плавления (капилляр): 215-220 С. Масс-спектрометрияfESI) m/z = 285,1585 Th ([M+H]+). Пример 4. Метил(1-[(5-фенилпиридин-3-ил)окси]метилциклопропил)амин дигидрохлорид. Этап 1. трет-Бутил метил(1-[(5-фенилпиридин-3-ил)окси]метилциклопропил)карбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3 метоксифенил)бороновую кислоту на фенилбороновую кислоту. Этап 2. Метил(1-[(5-фенилпиридин-3-ил)окси]метилциклопропил)амин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 205-210 С. Масс-спектрометрия(ESI) m/z = 255,1481 Th ([M+H]+). Пример 5. [1-([5-(4-Фторфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-фторфенил)пиридин-3-ил] оксиметил)циклопропил] метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил) бороновую кислоту на (4-фторфенил)бороновую кислоту. Этап 2. [1-([5-(4-Фторфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 218-223 С. Масс-спектрометрия(ESI) m/z = 273,1402 Th ([M+H]+). Пример 6. [1-([5-(4-Нитрофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-нитрофенил)пиридин-3-ил ]оксиметил)циклопропил 1 метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3 метоксифенил)бороновую кислоту на (4-нитрофенил)бороновую кислоту. Этап 2. [1-([5-(4-Нитрофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 212-217 С. Масс-спектрометрия(ESP m/z = 300,1340 Th ([M+H]+). Пример 7. [1-([5-(4-Хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (4-хлорфенил)бороновую кислоту. Этап 2. [1-([5-(4-Хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 208-213 С. Масс-спектрометрия(ESP m/z = 289,1108 Th ([M+H]+). Пример 8. [1-([6-Хлор-5-(3-метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([6-хлор-5-(3-метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 2 вместо соединения из приготовления 1. Этап 2. [1-([6-Хлор-5-(3-метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESI) m/z = 319,1219 Th ([M+H]+). Пример 9. (1-[(6-Хлор-5-фенилпиридин-3-ил)окси]метилциклопропил)метиламин дигидрохлорид. Этап 1. трет-Бутил (1-[(6-хлор-5-фенилпиридин-3-ил)окси]метилциклопропил)метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 2 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на фенилбороновую кислоту. Этап 2. (1-[(6-Хлор-5-фенилпиридин-3-ил)окси]метилциклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 130-135 С. Масс-спектрометрия(ESP m/z = 289,1094 Th ([M+H]+). Пример 10. [1-([6-Хлор-5-(4-метилфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([6-хлор-5-(4-метилфенил)пиридии-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из при- 12015227 готовления 2 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-метилфенил)бороновую кислоту. Этап 2. [1-([6-Хлор-5-(4-метилфенил)пиридин-3-ил]оксиметил)циклопропил] метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 150-155 С. Масс-спектрометрия(ESI) m/z = 303,1249 Th ([M+H]+). Пример 11. [1-([5-(4-Метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([6-хлор-5-(4-метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 2 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-метоксифенил)бороновую кислоту. Этап 2. 1-([5-(4-Метоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 180-185 С. Масс-спектрометрия(ESI) m/z = 319,1199 Th ([M+H]+). Пример 12. [1-([6-Хлор-5-(4-нитрофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Этап 1. трет-Бутил [1-([6-хлор-5-(4-нитрофенил)пиридин-3-ил]оксиметил)циклопропил] метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1 путем взаимодействия 1,1 г соединения из приготовления 2 и 0,7 г (4-нитрофенил)бороновой кислоты. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 97/3) получали 0,63 г ожидаемого продукта. Этап 2. [1-([6-Хлор-5-(4-нитрофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 145-150 С. Масс-спектрометрия(ESI) m/z = 334,0945 Th ([M+H]+). Пример 13. [1-([5-(4-Хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Этап 1. трет-Бутил [1-([6-хлор-5-(4-хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 12, заменяя (4-нитрофенил)бороновую кислоту на (4-хлорфенил)бороновую кислоту. Этап 2. [1-([5-(4-Хлорфенил)пиридин-3-ил ]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 160-165 С. Масс-спектрометрия(ESP m/z = 323,0699 Th ([M+H]+). Пример 14. [4-(2-Хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)фенил]метанол дигидрохлорид. Этап 1. трет-Бутил 1-[(6-хлор-5-[4-(гидроксиметил)фенил 1 пиридин-3-илокси)метил]циклопропилметилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 2 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-гидроксиметилфенил)бороновую кислоту. Этап 2. [4-(2-Хлор-5-[1-(метиламино)циклопропил 1 метоксипиридин-3-ил)фенил]метанол дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 1, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 142-146 С. Масс-спектрометрия(ESI) m/z = 319 Th ([M+H]+). Пример 15. [1-([5-(4-Хлорфенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-хлорфенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 3 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-хлорфенил)бороновую кислоту. Этап 2. [1-([5-(4-Хлорфенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полу- 13015227 ченное на вышеописанном этапе 1. Температура плавления (капилляр): 194-199 С. Масс-спектрометрия(ESP m/z = 303,1 Th ([M+H]+). Пример 16. [1-([5-(3-Хлорфенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метиламиндигидрохлорид. Этап 1. трет-Бутил 1-([5-(3-хлорфенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 3 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(3-хлорфенил)бороновую кислоту. Этап 2. [1-([5-(3-Хлорфенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 223-227 С. Масс-спектрометрия(ESI) m/z = 303,1 Th ([M+H]+). Пример 17. 3-(2-Метил-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил дигидрохлорид. Этап 1. трет-Бутил [1-([5-(3-циианофенил)-6-метилпиридин-3-ил 1 окси)метил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 3 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(3-цианофенил)бороновую кислоту. Этап 2. 3-(2-Метил-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 238-242 С. Масс-спектрометрия(ESI) m/z = 294,2 Th ([M+H]+). Пример 18. 4-(2-Хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил гидрохлорид. Этап 1. трет-Бутил 1-([6-хлор-5-(4-цианофенил)пиридин-3-ил]оксиметил)циклопропил 1 метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 12, заменяя (4 нитрофенил)бороновую кислоту на (4-цианофенил)бороновую кислоту. Этап 2. 4-(2-Хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил гидрохлорид. 8 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 0,6 г соединения, полученного на вышеописанном этапе 1 в 100 мл ацетонитрила. После перемешивания в течение 16 ч, реакционную смесь разводили простым эфиром и осадок отфильтровали. Осадок растворяли в этаноле, раствор концентрировали и затем полученный остаток повторно растворяли в этаноле. После разведения в простом эфире и фильтрования, получали 0,53 г ожидаемого соединения. Температура плавления (капилляр): 215-220 С. Масс-спектрометрия (ESP m/z = 314 Th ([M+H]+). Пример 19. 4-(2-Метил-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-циианофенил)-6-метилпиридин-3-ил]оксиметил)циклопропилметил] карбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 3 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-цианофенил)бороновую кислоту. Этап 2. 4-(2-Метил-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 18, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 220-224 С. Масс-спектрометрия (ESI) m/z = 294,1622 Th([M+H]+). Пример 20. 4-(5-[1-(Метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-цианофенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (4-цианофенил)бороновую кислоту. Этап 2. 4-(5-[1-(Метиламино)циклопропил]метокси]пиридин-3-ил)бензонитрил дигидрохлорид. 7,5 мл трифторуксусной кислоты добавляли к раствору 0,85 г соединения, полученного на вышеописанном этапе 1, в 7,5 мл дихлорметана. После перемешивания в течение 20 ч, реакционную смесь концентрировали насухо и ресуспендировали в смеси дихлорметана и насыщенного водного раствора- 14015227 карбоната натрия. Органическую фазу отбрасывали, высушивали над сульфатом натрия и затем концентрировали. При хроматографировании остатка на силикагеле (толуол/этанол : 93/7) получали основание желательного соединения. После растворения основания в простом эфире, добавления раствора соляной кислоты в простом эфире, фильтрования и высушивания, получали 0,52 г ожидаемого продукта. Температура плавления (капилляр): 150-160 С. Масс-спектрометрия (ESI) m/z = 280,1439 Th([M+H]+). Пример 21. 3-(5-[1-(Метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил дигидрохлорид. Этап 1. трет-Бутил [1-([5-(3-цианофенил)пиридин-3-ил ]окси)метил)циклопропил ]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (3-цианофенил)бороновую кислоту. Этап 2. 3-(5-[1-(Метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 20, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 110-120 С. Масс-спектрометрия(ESP m/z = 280,1435 Th ([M+H]+). Пример 22. [1-([5-(4-Хлорфенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Этап 1. трет-Бутил [1-([5-(4-хлорфенил)-6-фторпиридин-3-ил]окси)метил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 4 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-хлорфенил)бороновую кислоту. Этап 2. [1-([5-(4-Хлорфенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. 2,5 мл трифторуксусной кислоты добавляли к раствору 0,4 г соединения, полученного на вышеописанном этапе 1 в 5 мл дихлорметана. После перемешивания в течение 20 ч реакционную смесь концентрировали насухо и ресуспендировали в смеси дихлорметана и насыщенного водного раствора карбоната натрия. Органическую фазу отбрасывали, высушивали над сульфатом натрия и затем концентрировали. Полученное основание ресуспендировали в этаноле, и гидрохлорид осаждали путем добавления раствора соляной кислоты в простом эфире и затем разведения простым эфиром. После фильтрования и высушивания, получали 0,24 г ожидаемого продукта. Температура плавления (капилляр): 55-60 С. Массспектрометрия (ESP m/z = 307,1043 Th ([M+H]+). Пример 23. [1-([5-(3-Хлорфенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Этап 1. трет-Бутил (1-([5-(3-хлорфенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 4 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(3-хлорфенил)бороновую кислоту. Этап 2. [1-([5-(3-Хлорфенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 22, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 126-130 С. Масс-спектрометрия(ESI) m/z = 307,1018 Th ([М+Н]+). Пример 24. 4-(2-Фтор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил гидрохлорид. Этап 1: трет-Бутил [1-([6-фтор-5-(4-цианофенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 4 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-цианофенил)бороновую кислоту. Этап 2. 4-(2-Фтор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил гидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 22, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 90-105 С. Масс-спектрометрия(ESI) m/z = 298,1370 Th ([M+H]+). Пример 25. 3-(2-Фтор-5-[1 -(метил амино)циклопропил]метоксипиридин-3-ил)бензонитрил гидрохлорид. Этап 1. трет-Бутил [1-([6-фтор-5-(3-цианофенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 4 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(3-цианофенил)бороновую кислоту. Этап 2. 3-(2-Фтор-5-[1-(метиламино)циклопропил]метокси)пиридин-3-ил)бензонитрил гидрохлорид Соединение получали в соответствии с методикой этапа 2 примера 22, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 211-215 С. Масс-спектрометрия(ESI) m/z = 298,1363 Th ([M+H]+). Пример 26. [1-([6-Хлор-5-(4-фторфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. 0,16 г тетракис(трифенилфосфин)палладия (Pd(PPh3)4) добавляли, в аргоне, к раствору 1,63 г соединения из приготовления 2 в 30 мл толуола. Смесь перемешивали в течение 45 мин и затем раствор 0,59 г(4-фторфенил)бороновой кислоты в 15 мл этанола и добавляли 15 мл насыщенного водного раствора гидрокарбоната натрия. Реакционную смесь нагревали в течение 4 ч 30 мин при 85 С и затем фильтровали и декантировали. Органическую фазу высушивали над сульфатом натрия и концентрировали, получая 1,95 г неочищенного продукта сочетания. Неочищенный продукт растворяли в 15 мл дихлорметана и затем добавляли 3,5 мл трифторуксусной кислоты. После перемешивания в течение 20 ч, снятие защиты завершалось и реакционную смесь концентрировали. Полученный остаток хроматографировали на колонке RP18, 12-25(вода/трифторуксусная кислота: 1000/2,5 до вода/ацетонитрил/трифторуксусная кислота: 750/250/2,5). Хроматографические фракции анализировали и объединяли, и затем ацетонитрил упаривали. Оставшийся водный раствор нейтрализовали и затем насыщали твердым гидрокарбонатом натрия и после этого экстрагировали этилацетатом. После высушивания над сульфатом натрия и концентрирования органической фазы, полученное основание растворяли в этаноле и добавляли 1,5 мл 4 н. раствора соляной кислоты в диоксане. После концентрирования и кристаллизации, затем промывания простым эфиром и высушивания, получали 0,86 г ожидаемого продукта. Температура плавления (капилляр): 194-196 С. Масс-спектрометрия (ESI) m/z = 307,0998 Th ([M+H]+) Пример 27. [1-([5-(3-Аминофенил)-6-хлорпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (3-аминофенил)бороновую кислоту. Масс-спектрометрия (ESI), m/z = 304,1146 Th([M+H]+). Пример 28. [1-([6-Хлор-5-(3-нитрофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (3-нитрофенил)бороновую кислоту. Температура плавления (капилляр): 229-232 С. Масс-спектрометрия (ESI) m/z = 334,0923 Th ([M+H]+). Пример 29. 1-[(6-Хлор-5-[4-(метилтио)фенил]пиридин-3-илокси)метил]циклопропилметиламин дигидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (4-метилтиофенил)бороновую кислоту. Температура плавления (капилляр): 144-148 С. Масс-спектрометрия (ESI) m/z = 335,0952 Th ([M+H]+). Пример 30. [1-([6-Хлор-5-(4-этилфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил) бороновую кислоту на (4-этилфенил)бороновую кислоту. Температура плавления (капилляр): 112-114 С. Массспектрометрия (ESI) m/z = 317,1382 Th ([M+H]+). Пример 31. [1-([6-Хлор-5-(2-метилфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (2-метилфенил)бороновую кислоту. Температура плавления (капилляр): 130-132 С. Масс-спектрометрия (ESI) m/z = 303,1326 Th([M+H]+). Пример 32. [1-([6-Хлор-5-(3-фторфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (3-фторфенил)бороновую кислоту. Температура плавления (капилляр): 172-175 С. Масс-спектрометрия (ESI) m/z = 307,0976 Th ([M+H]+). Пример 33. [1-([6-Хлор-5-(3-метилфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил) бороновую кислоту на (3-метилфенил)бороновую кислоту. Температура плавления (капилляр): 152-154 С. Масс-спектрометрия (ESI) m/z = 303,1239 Th ([M+H]+). Пример 34. [1-([6-Хлор-5 -(3-хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид.- 16015227 Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил) бороновую кислоту на (3-хлорфенил)бороновую кислоту. Температура плавления (капилляр): 182-184 С. Массспектрометрия (ESI) m/z = 323,0724 Th ([M+H]+). Пример 35. 3-(2-Хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (3-цианофенил)бороновую кислоту. Температура плавления (капилляр): 228-232 С. Масс-спектрометрия (EST) m/z = 314,1034 Th ([M+H]+). Пример 36. 1-([6-Хлор-5-(2,3,4-триметоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (2,3,4-триметоксифенил)бороновую кислоту. Температура плавления (капилляр): 168170 С. Масс-спектрометрия (ESI) m/z = 379,1433 Th ([M+H]+). Пример 37. [1-([6-Хлор-5-(3,4,5-триметоксифенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (3,4,5-триметоксифенил)бороновую кислоту. Температура плавления (капилляр): 138140 С. Масс-спектрометрия (ESI) m/z = 379,1436 Th ([M+H]+). Пример 38. 1-[(5-[3,5-бис(Трифторметил)фенил]-6-хлорпиридин-3-ил окси)метил]циклопропил метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на [3,5-бис(трифторметил)фенил)]бороновую кислоту. Температура плавления (капилляр): 182-188 С. Масс-спектрометрия (ESI) m/z = 425,0875 Th([M+H]+). Пример 39. [1-([6-Хлор-5-(2,5-дифторфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (2,5-дифторфенил)бороновую кислоту. Температура плавления (капилляр): 140-142 С. Масс-спектрометрия (ESI) m/z = 325,0887 Th ([M+H]+). Пример 40. [1-([6-Хлор-5-(2,5-дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (2,5-дихлорфенил)бороновую кислоту. Температура плавления (капилляр): 140-142 С. Масс-спектрометрия (ESI) m/z - 357,0330 Th ([M+H]+). Пример 41. [1-([6-Хлор-5-(3,5-дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (3,5-дихлорфенил)бороновую кислоту. Температура плавления (капилляр): 186-188 С. Масс-спектрометрия (ESI) m/z = 357,0308 Th ([M+H]+). Пример 42. [1-([6-Хлор-5-(2,6-дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил)бороновую кислоту на (2,6-дихлорфенил)бороновую кислоту. Температура плавления (капилляр): 182-186 С. Масс-спектрометрия (ESI) m/z = 357,0322 Th ([M+H]+). Пример 43. N-[3-(2-Хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)фенил]ацетамид гидрохлорид. Соединение получали, в соответствии с методикой из примера 26, заменяя (4-фторфенил бороновую кислоту на (3-[(метиламино)карбонил]фенил)бороновую кислоту. Температура плавления (капилляр): 220-222 С. Масс-спектрометрия (ESI) m/z = 346,1324 Th ([M+H]+). Пример 44. [1-([5-(3-Метилфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(3-метилфенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (3-метилфенил)бороновую кислоту. Этап 2. [1-([5-(3-Метилфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. 25 мл 1,5 н. раствора соляной кислоты в этаноле добавляли к 0,9 г соединения, полученного на вышеописанном этапе 1. Смесь перемешивали в течение 20 ч и затем добавляли 10 мл 6 н. раствора соляной кислоты в этаноле для завершения снятия защиты. После перемешивания дополнительно в течение 20 ч,объем реакционной смеси доводили до 100 мл с помощью простого эфира и осадок отфильтровали и высушивали, получая 0,64 г ожидаемого продукта. Температура плавления (капилляр): 215-218 С. Массспектрометрия (ESP m/z = 269.1655 Th ([M+H]+). Пример 45. [1-([5-(3-Нитрофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохло- 17015227 рид. Этап 1. трет-Бутил [1-([5-(3-нитрофенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил) бороновую кислоту на (3-нитрофенил)бороновую кислоту. Этап 2. [1-([5-(3-Нитрофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 220-225 С. Масс-спектрометрия(ESI) m/z = 300,1347 Th ([M+H]+). Пример 46. [1-([5-(3-Хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(3-хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (3-хлорфенил)бороновую кислоту. Этап 2. [1-([5-(3-Хлорфенил)пиридин-3-ил ]оксиметил)циклопропил ]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр) : 230-235 С. Масс-спектрометрия(ESI) m/z = 289,1074 Th ([M+H]+). Пример 47. [1-([5-(3-Фторфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(3-фторфенил)пиридин-3-ил ]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (3-фторфенил)бороновую кислоту. Этап 2. [1-([5-(3-Фторфенил)пиридин-3-ил ]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 210-214 С. Масс-спектрометрия(ESI) m/z = 273,1387 Th ([М+Н]+). Пример 48. Метил 1-[(5-[4-(метилтио)фенил]пиридин-3-илокси)метил]циклопропиламин дигидрохлорид. Этап 1. трет-Бутил метил 1-[(5-Г 4-(метилтио)фенил]пиридин-3-илокси)метил]цииклопропил карбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на [4-(метилтио)фенил]бороновую кислоту. Этап 2. Метил 1-[(5-[4-(метилтио)фенил]пиридин-3-илокси)метил]циклопропиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 232-235 С. Масс-спектрометрия(ESI) m/z = 301,1367 Th ([М+Н]+). Пример 49. [1-([5-(4-Этилфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-этилфенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (4-этилфенил)бороновую кислоту. Этап 2. [1-([5-(4-Этилфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 197-200 С. Масс-спектрометрия(ESI) m/z = 283,1796 Th ([M+H]+). Пример 50. Метил [1-([5-(2-метилфенил)пиридин-3-ил]оксиметил)циклопропил]амин дигидрохлорид. Этап 1. трет-Бутил метил [1-([5-(2-метилфенил)пиридин-3-ил]оксиметил)циклопропил 1 карбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3 метоксифенил)бороновую кислоту на (2-метилфенил)бороновую кислоту. Этап 2. Метил [1-([5-(2-метилфенил)пиридин-3-ил]оксиметил)циклопропил]амин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 192-196 С. Масс-спектрометрия- 18015227 Этап 2. [1-([5-(2,5-Дифторфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 188-192 С. Масс-спектрометрия(ESP m/z = 291 Th ([M+H]+). Пример 52. [1-([5-(3,5-Дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(3,5-дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3 метоксифенил)бороновую кислоту на (3,5-дихлорфенил)бороновую кислоту. Этап 2. [1-([5-(3,5-Дихлорфенил)пиридин-3-ил]оксиметил)циклопропил ]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 215-220 С. Масс-спектрометрия(ESP m/z = 323 Th ([M+H]+). Пример 53. Метил [1-([5-(3,4,5-триметоксифенил)пиридин-3-ил]оксиметил)циклопропил]амин гидрохлорид. Этап 1. трет-Бутилметил[1-([5-(3,4,5-триметоксифенил)пиридин-3-ил]оксиметил)циклопропил] карбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (3,4,5-триметоксифенил)бороновую кислоту. Этап 2. Метил[1-([5-(3,4,5-триметоксифенил)пиридин-3-ил]оксиметил)циклопропил ]амин гидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 116-120 С. Масс-спектрометрия(ESP m/z = 345,1801 Th ([M+H]+). Пример 54. [1-([5-(2,5-Дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(2,5-дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на (2,5-дихлорфенил)бороновую кислоту. Этап 2. [1-([5-(2,5-Дихлорфенил)пиридин-3-ил]оксиметил)циклопропил ]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 195-200 С. Масс-спектрометрия(ESI) m/z = 323 Th ([M+H]+). Пример 55. [1-([5-(2,6-Дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(2,6-дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3 метоксифенил)бороновую кислоту на (2,6-дихлорфенил)бороновую кислоту. Этап 2. [1-([5-(2,6-Дихлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESP m/z = 323,0699 Th ([M+H]+). Пример 56. 1-[(5-[3,5-бис(Трифторметил)фенил]пиридин-3-илокси)метил]циклопропилметиламин гидрохлорид. Этап 1. трет-Бутил 1-[(5-[3,5-бис(трифторметил)фенил]пиридин-3-илокси)метил]циклопропил метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на [3,5-бис(трифторметил)фенил]бороновую кислоту. Этап 2. 1-[(5-[3,5-бис(Трифторметил)фенил]пиридин-3-илокси)метил]циклопропилметиламин гидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 132-136 С. Масс-спектрометрия- 19015227 карбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3 метоксифенил)бороновую кислоту на (2,3,4-триметоксифенил)бороновую кислоту. Этап 2. Метил[1-([5-(2,3,4-триметоксифенил)пиридин-3-ил]оксиметилциклопропил]амин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESP m/z = 345,1783 Th ([M+H]+). Пример 58. N-[3-(5-[1-(Метиламино)циклопропил]метоксипиридин-3-ил)фенил]ацетамид дигидрохлорид. Этап 1. трет-Бутил 1-[(5-[3-(ацетиламино)фенил]пиридин-3-илокси)метил]циклопропилметилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3-метоксифенил)бороновую кислоту на [3-(ацетиламино)фенил]бороновую кислоту. Этап 2. N-[3-(5-[1-(Метиламино)циклопропил]метоксипиридин-3-ил)фенил]ацетамид дигидрохлорид. 1,05 г продукта, полученного на вышеописанном этапе 1, растворяли в 5 мл этанола и добавляли 15 мл 5 н. раствора соляной кислоты в этаноле. После перемешивания в течение 20 ч реакционную смесь концентрировали на три четверти и разводили простым эфиром. Осадок ресуспендировали в насыщенном растворе карбоната натрия и экстрагировали этилацетатом. Органическую фазу высушивали над сульфатом натрия и затем упаривали. Полученную смесь хроматографировали на 40 г силикагеля, выделяя 0,13 г основания ожидаемого продукта. Основание ресуспендировали в этаноле и, после добавления раствора соляной кислоты в простом эфире и фильтрования, собранное твердое вещество восстанавливали и лиофилизировали, получая 0,14 г ожидаемого продукта. Масс-спектрометрия (ESP m/z = 312,1704Th ([M+H]+). Пример 59. [1-([5-(3-Аминофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин тригидрохлорид. Этап 1. трет Бутил [1-([5-(3-аминофенил)пиридин-3-ил]оксиметил)циклопропил ]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, заменяя (3 метоксифенил)бороновую кислоту на (3-аминофенил)бороновую кислоту. Этап 2. [1-([5-(3-Аминофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин тригидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 44, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 185-190 С. Масс-спектрометрия(ESP m/z = 270,1604 Th ([M+H]+). Пример 60. [1-([5-(3-Аминофенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(3-аминофенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 4 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(3-аминофенил)бороновую кислоту. Этап 2. [1-([5-(3-Аминофенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. 75 мл диоксана и затем 10 мл 4 н. раствора соляной кислоты в диоксане добавляли к 1,03 г продукта,полученного на вышеописанном этапе 1. 50 мл этанола добавляли для осуществления полной гомогенизации реакционной смеси. После перемешивания в течение 20 ч растворители упаривали, и остаток ресуспендировали в растворе карбоната натрия и экстрагировали дихлорметаном. После высушивания над сульфатом натрия, органическую фазу концентрировали и полученный остаток хроматографировали на силикагеле (дихлорметан/метанол : 97/3), получая 0,53 г основания ожидаемого продукта. После добавления раствора соляной кислоты в простом эфире и фильтрования, получали 0,5 г ожидаемого продукта. Температура плавления (капилляр): 158-161 С. Масс-спектрометрия (ESI) m/z = 288,1488 Th ([M+H]+). Пример 61. [1-([5-(3-Аминофенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метиламин тригидрохлорид. Этап 1. трет-Бутил [1-([5-(3-аминофенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 3 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(3-аминофенил)бороновую кислоту. Этап 2. [1-([5-(3-Аминофенил)-6-метилпиридин-3-ил]окси)метил)циклопропил]метиламин тригидрохлорид. 40 мл диоксана и затем 10 мл 4 н. раствора соляной кислоты в диоксане добавляли к 1,05 г продукта,- 20015227 полученного на вышеописанном этапе 1. Добавляли 40 мл этанола для осуществления полной гомогенизации реакционной смеси. После перемешивания в течение 20 ч, растворители упаривали и остаток ресуспендировали в небольшом количестве этанола. После разведения в простом эфире и фильтрования,получали 0,71 г ожидаемого продукта. Температура плавления (капилляр): 222-228 С. Масс-спектрометрия (ESI) m/z = 284,1783 Th([M+H]+). Пример 62. Этил 4-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензоат дигидрохлорид. Этап 1. Этил 4-[5-(1-[(трет-бутоксикарбонил)(метил)амино]циклопропилметокси)-2-хлорпиридин-3-ил]бензоат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 2 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-этоксикарбонилфенил)бороновую кислоту. Этап 2. Этил 4-(2-хлор-5-[1 -(метиламино)циклопропил] метоксипиридин-3-ил)бензоат дигидрохлорид. 5 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 0,5 г продукта, полученного на вышеописанном этапе 1 в 5 мл диоксана и 5 мл этанола. После перемешивания в течение 20 ч снятие защиты завершалось и реакционную смесь концентрировали. Полученный остаток хроматографировали на колонке RP18, 12-25(вода/трифторуксусная кислота : 1000/2,5 до вода/ацетонитрил/трифторуксусная кислота : 450/550/2,5). Хроматографические фракции объединяли и затем ацетонитрил упаривали. Оставшийся водный раствор нейтрализовали и затем насыщали твердым гидрокарбонатом натрия и после этого экстрагировали этилацетатом. После высушивания над сульфатом натрия и концентрирования органической фазы, полученное основание растворяли в этаноле и добавляли 4 н. раствора соляной кислоты в диоксане. После концентрирования и кристаллизации, затем промывания простым эфиром и высушивания получали 0,25 г ожидаемого продукта. Температура плавления (капилляр): 146-148 С. Масс-спектрометрия (ESP m/z = 361,1357 Th([M+H]+). Пример 63. Этил 3-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензоат дигидрохлорид. Этап 1. Этил 3-[5-(1-[(трет-бутоксикарбонил)(метил)амино]циклопропилметокси)-2-хлорпиридин-3-ил]бензоат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 2 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(3-этоксикарбонилфенил)бороновую кислоту. Этап 2. Этил 3-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензоат дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 62, используя соединение, полученное на вышеописанном этапе 1. Конечный продукт ресуспендировали в воде и затем лиофилизировали. Масс-спектрометрия (ESI) m/z = 361,1328 Th ([M+H]+). Пример 64. [1-([6-Хлор-5-(4-метоксифенил)пиридин-3-ил]оксиметил)циклопропил]амин дигидрохлорид. Этап 1. трет-Бутил [1-[6-хлор-5-(4-метоксифенил)пиридин-3-ил]оксиметил)циклопропил ]карбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 2 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-метоксифенил)бороновую кислоту. Температура плавления (капилляр): 131 С. Этап 2. [1-([6-Хлор-5-(4-метоксифенил)пиридин-3-ил]оксиметил)циклопропил]амин дигидрохлорид. 2 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 1,64 г продукта, полученного на вышеописанном этапе 1, в 40 мл метанола. После перемешивания в течение 20 ч растворители упаривали и остаток растирали в порошок в простом эфире и затем фильтровали. Твердое вещество ресуспендировали в 20 мл 1,5 н. раствора соляной кислоты в метаноле. Нагревание осуществляли до тех пор, пока происходило растворение, и затем реакционная смесь, которой позволяли возвратиться до температуры окружающей среды, кристаллизовалась. После фильтрования и высушивания получали 0,95 г ожидаемого продукта. Температура плавления (капилляр) : 207-211 С Масс-спектрометрия (ESP m/z = 305,1046 Th([M+H]+). Пример 65. [1-([6-Хлор-5-(4-метоксифенил)пиридин-3-ил]оксиметил)циклопропил]диметиламин гидрохлорид. Раствор 1,28 г соединения, полученного на этапе 1 примера 11, в 12,5 мл муравьиной кислоты перемешивали в течение 2 ч при температуре окружающей среды. Добавляли 12,5 мл 40% раствора формальдегида в воде и затем реакционную смесь нагревали в течение 2 ч при 70 С. К реакционной смеси- 21015227 добавляли 2,5 мл муравьиной кислоты и дополнительно 2,5 мл раствора формальдегида, и нагревание при 70 С продолжали в течение 2 ч. Реакционную смесь концентрировали, и затем добавляли 15 мл насыщенного водного раствора карбоната калия и экстрагировали дихлорметаном. Дихлорметановую фазу высушивали над сульфатом натрия и упаривали. Полученный остаток хроматографировали на силикагеле (дихлорметан/метанол : 97/3), выделяя 0,63 г основания. 1,1 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору в 5 мл этанола вышеописанного выделенного основания. Реакционную смесь разводили с помощью 100 мл простого эфира и перемешивали в течение 30 мин. После фильтрования и высушивания получали 0,57 г ожидаемого продукта. Температура плавления (капилляр): 208-210 С. Масс-спектрометрия (ESI) m/z = 333,1377 Th ([M+H]+). Пример 66. [1-([6-Хлор-5-(хлорметил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Этап 1. трет-Бутил 1-([6-хлор-5-(хлорметил)пиридин-3-ил]оксиметил)циклопропил ]метилкарбамат. 1,65 г трифенилфосфина добавляли к раствору 2 г соединения, полученного на этапе 1 примера 14 в 10 мл четыреххлористого углерода. Смесь нагревали в колбе с обратным холодильником до тех пор, пока исходного вещества не обнаруживалось согласно тонкослойной хроматографии и после этого охлаждали до температуры окружающей среды и фильтровали. Фильтрат концентрировали и полученный остаток хроматографировали на силикагеле (дихлорметан/тетрагидрофуран : 97/3), получая 1,8 г ожидаемого продукта. Этап 2. [1-([6-хлор-5-(Хлорметил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 136-140 С. Пример 67. 4-(2-Хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензамид гидрохлорид. 1,2 г карбоната калия добавляли к раствору 2,2 г соединения, полученного на этапе 1 примера 18 в 30 мл диметилсульфоксида. Реакционную смесь охлаждали до температуры от 0 до 5 С со смесью воды со льдом и затем по каплям добавляли 3,6 мл водного 30% раствора перекиси водорода. После перемешивания в течение 45 мин реакционную смесь разводили водой и затем фильтровали. Собранное твердое вещество промывали водой и ресуспендировали в этилацетате. Этилацетатный раствор высушивали над сульфатом натрия и затем концентрировали. 2,1 г неочищенного промежуточного соединения, третбутил [1-([5-(аминокарбонил)-6-хлорпиридин-3-ил]оксиметил)циклопропил]метилкарбамат, ресуспендировали в 10 мл этанола и затем добавляли мл 4 н. раствора соляной кислоты в диоксане. После перемешивания в течение 20 ч, реакционную смесь разводили простым эфиром и затем фильтровали. Собранное твердое вещество хроматографировали на колонке RP18, 12-25(вода/трифторуксусная кислота : 1000/2,5 до вода/ацетонитрил/трифторуксусная кислота : 675/325/2,5). Хроматографические фракции объединяли и затем ацетонитрил упаривали. Оставшийся водный раствор нейтрализовали и затем насыщали твердым гидрокарбонатом натрия и после этого экстрагировали дихлорметаном. После высушивания над сульфатом натрия и концентрирования органической фазы, полученное основание растворяли в 25 мл этанола и добавляли 1 мл 4 н. раствора соляной кислоты в диоксане. После концентрации и кристаллизирования в простом эфире, кристаллы отфильтровали и высушивали, получая 1,1 г ожидаемого продукта. Температура плавления (капилляр): 130 С. Масс-спектрометрия (ESP m/z = 332,1184 Th([М+Н]+). Пример 68. Дигидрохлорид 3-(5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты Этап 1. 3-[5-(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропил)метокси)пиридин-3-ил]бензойная кислота. 25 мл водного 0,4 М раствора карбоната натрия и 0,58 г (3-карбоксифенил)бороновой кислоты добавляли к раствору 1 г соединения из приготовления 1 в 25 мл ацетонитрила. После перемешивания в течение 45 мин в аргоне, добавляли 0,15 г тетракис(трифенилфосфин)палладия и затем смесь нагревали в течение 5 ч 30 мин при 80 С. Реакционную смесь фильтровали горячей, и рН охлажденного фильтрата доводили до 5,5, используя рН-метр, путем добавления водного 1 н. раствора соляной кислоты. Реакционную смесь экстрагировали этилацетатом. Органическую фазу высушивали над сульфатом натрия и затем концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/метанол : 97/3) получали 0,9 г ожидаемого продукта. Этап 2. Дигидрохлорид 3-(5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты. 5 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 0,9 г соединения, полученного на вышеописанном этапе 1, в 10 мл диоксана. Смесь перемешивали в течение 20 ч, разводили простым эфиром и затем фильтровали. Собранное твердое вещество ресуспендировали в 25 мл воды, получая,после лиофилизации, 0,595 г ожидаемого продукта. Масс-спектрометрия (ESP m/z = 299,1374 Th- 22015227 Пример 69. Дигидрохлорид 4-(5-[1-(метиламино)циклопропил]метоксипиридин-4-ил)бензойной кислоты. Этап 1. 4-[5-(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметокси)пиридин-3-ил]бензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 68, заменяя (3 карбоксифенил)бороновую кислоту на (4-карбоксифенил)бороновую кислоту. Этап 2. Дигидрохлорид 4-(5-[1-(метиламино)циклопропил]метоксипиридин-4-ил)бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 68, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESI) m/z = 299,1372 Th ([M+H]+). Пример 70. Гидрохлорид 3-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты. Этап 1. 3-[5-(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметокси)-2-хлорпиридин-3 ил]бензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 68, используя соединение из приготовления 2 вместо соединения из приготовления 1. Этап 2. Гидрохлорид 3-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 68, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESI) m/z = 333,1004 Th ([M+H]+). Пример 71. Гидрохлорид 4-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты. Этап 1. 4-[5-(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметокси)-2-хлорпиридин-3 ил]бензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 68, используя соединение из приготовления 2 вместо соединения из приготовления 1 и заменяя (3-карбоксифенил)бороновую кислоту на (4-карбоксифенил)бороновую кислоту. Этап 2. Гидрохлорид 4-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 68, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESP m/z = 333,1003 Th ([M+H]+). Пример 72. Дигидрохлорид 3-(2-фтор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил) бензойной кислоты. Этап 1. 3-[5-(1-[(трет-Бутоксикарбонил)(метил)амино]ииклопропилметокси)-2-фторпиридин-3 ил]бензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 68, используя соединение из приготовления 4 вместо соединения из приготовления 1. Этап 2. Дигидрохлорид 3-(2-фтор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 68, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESI) m/z = 317,1315 Th ([M+H]+). Пример 73. Дигидрохлорид 4-(2-фтор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил) бензойной кислоты. Этап 1. 4-[5-(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметокси)-2-фторпиридин-3 ил]бензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 68, используя соединение из приготовления 4 вместо соединения из приготовления 1 и заменяя (3-карбоксифенил)бороновую кислоту на (4-карбоксифенил)бороновую кислоту. Этап 2. Дигидрохлорид 4-(2-фтор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 1, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 211-215 С. Масс-спектрометрия(ESI) m/z = 317,1324 Th ([M+H]+). Пример 74. Дигидрохлорид 3-(2-метил-5-[1-(метиламино)циклопропил]метоксипиридин-3 ил)бензойной кислоты. Этап 1. 3-[5-(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметокси)-2-метилпиридин-3 ил]бензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 68, используя соединение из приготовления 3 вместо соединения из приготовления 1. Этап 2. Дигидрохлорид 3-(2-метил-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 1, используя соединение, полу- 23015227 ченное на вышеописанном этапе 1. Температура плавления (капилляр): 210-215 С Масс-спектрометрия(ESI) m/z = 313,1515 Th ([M+H]+). Пример 75. Дигидрохлорид 4-(2-метил-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил) бензойной кислоты. Этап 1. 4-[5-(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметокси)-2-метилпиридин-3 ил]бензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 68, используя соединение из приготовления 3 вместо соединения из приготовления 1 и заменяя (3-карбоксифенил)бороновую кислоту на (4-карбоксифенил)бороновую кислоту. Этап 2. Дигидрохлорид 4-(2-метил-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 1, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 228-235 С. Масс-спектрометрия(ESP m/z = 313,1580 Th ([M+H]+). Пример 76. (1-[(2-Хлор-3,3'-бипиридин-5-ил)окси]метилциклопропил)метиламин дигидрохлорид. Этап 1. трет-Бутил (1-[(2-хлор-3,3'-бипиридин-5-ил)окси]метилциклопропил)метилкарбамат. 0,87 г тетракис(трифенилфосфин)палладия добавляли в атмосфере азота к раствору 2,91 г соединения из приготовления 2 в 45 мл толуола. Смесь перемешивали в течение 20 мин и затем добавляли раствор 3 г 3-(1,1,1-трибутилстаннил)пиридина в 6 мл толуола и реакционную смесь нагревали в колбе с обратным холодильником в течение 20 ч. Добавляли вторую фракцию 0,87 г Pd(PPh3)4 и продолжали нагревать в колбе с обратным холодильником в течение 24 ч. После охлаждения реакционную смесь разводили с помощью 120 мл толуола и затем промывали водным 50% раствором карбоната калия. Органическую фазу высушивали над сульфатом натрия и концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/бутанон : 97/3 до дихлорметан/бутанон : 80/20) получали 1,76 г ожидаемого продукта. Этап 2. (1-[(2-Хлор-3,3'-бипиридин-5-ил)окси]метил циклопропил) метиламин дигидрохлорид. 24,6 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 2,46 г соединения, полученного на вышеописанном этапе 1, в 24,6 мл метанола. После перемешивания в течение 20 ч растворители упаривали и остаток ресуспендировали в водном 50% растворе карбоната калия и экстрагировали дихлорметаном. Органическую фазу высушивали над сульфатом натрия и концентрировали. Остаток хроматографировали на силикагеле (дихлорметан/метанол : 97/3), выделяя 1,05 г основания. Основание ресуспендировали в 120 мл этанола и добавляли раствор соляной кислоты в этаноле до получения кислого значения рН. Реакционную смесь концентрировали и затем растирали в порошок в простом эфире,получая после кристаллизации, фильтрования и высушивания, 1,15 г ожидаемого продукта. Температура плавления (капилляре : 210-215 С Масс-спектрометрия (ESP m/z = 290.1037 Th ([M+H]+). Пример 77. (1-[(2-Хлор-3,4'-бипиридин-5-ил)окси]метил циклопропил)метиламин дигидрохлорид. Этап 1. трет-Бутил (1-[(2-хлор-3,4'-бипиридин-5-ил)окси]метилциклопропил)метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 76, заменяя 3-(1,1,1 трибутилстаннил)пиридин на 4-(1,1,1-трибутилстаннил)пиридин. Этап 2. (1-[(2-Хлор-3,4'-бипиридин-5-ил)окси]метил циклопропил) метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 76, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 125-130 С. Масс-спектрометрия(ESP m/z = 290,1035 Th ([M+H]+). Пример 78. (1-[(2-Фтор-3,3'-бипиридин-5-ил)окси]метилциклопропил)метиламин дигидрохлорид. Этап 1. трет-Бутил (1-[(2-фтор-3,3'-бипиридин-5-ил)окси]метилциклопропил)метилкарбамат. 0,76 г тетракис(трифенилфосфин)палладия добавляли в атмосфере азота к раствору 2,5 г соединения из приготовления 4 в 40 мл толуола. Смесь перемешивали в течение 20 мин и затем добавляли раствор 2,6 г 3-(1,1,1-трибутилстаннил)пиридина в 5 мл толуола и реакционную смесь нагревали в колбе с обратным холодильником в течение 20 ч. После охлаждения реакционную смесь разводили с помощью толуола и затем промывали водным 50% раствором карбоната калия. Органическую фазу высушивали над сульфатом натрия и концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/бутанон : 97/3 до дихлорметан/бутанон : 90/10) получали 1,66 г ожидаемого продукта. Этап 2. (1-[(2-Фтор-3,3'-бипиридин-5-ил)окси]метилциклопропил)метиламин дигидрохлорид. 16 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 1,6 г соединения, полученного на вышеописанном этапе 1 в 100 мл этанола. После перемешивания в течение 20 ч растворители упаривали, остаток растворяли в небольшом количестве этанола и добавляли простой эфир. Перемешивали в течение 20 ч, растворители отбрасывали и к твердому остатку снова добавляли простой эфир, получая после кристаллизации фильтрования и высушивания 0,7 г ожидаемого соединения. Масс-спектрометрия- 24015227 Соединение получали в соответствии с методикой этапа 1 примера 78, заменяя 3-(1,1,1 трибутилстаннил)пиридин на 4-(1,1,1-трибутилстаннил)пиридин. Этап 2. (1-[(2-Фтор-3,4'-бипиридин-5-ил)окси]метилциклопропил)метиламин дигидрохлорид. 24 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 2,4 г соединения, полученного на вышеописанном этапе 1 в 120 мл этанола. После перемешивания в течение 20 ч растворители упаривали и остаток ресуспендировали в водном 50% растворе карбоната калия и экстрагировали дихлорметаном. Органическую фазу высушивали над сульфатом натрия и концентрировали. Остаток хроматографировали на силикагеле (дихлорметан/метанол : 97/3). Основание растворяли в небольшом количестве этанола и добавляли раствор соляной кислоты в простом эфире до получения кислого значения рН. Реакционную смесь концентрировали и затем растирали в порошок в простом эфире, получая после кристаллизации, фильтрования и высушивания 1 г ожидаемого продукта. Масс-спектрометрия (ESP m/z = 274,1344 Th ([М+Н]+). Пример 80. Метил (1-[(2-метил-3,3'-бипиридин-5-ил)окси]метилциклопропил)амин тригидрохлорид. Этап 1. трет-Бутил метил(1-[(2-метил-3,3'-бипиридин-5-ил)окси]метилциклопропил)карбамат. Соединение получали в соответствии с методикой этапа 1 примера 78, используя соединение из приготовления 3 вместо соединения из приготовления 4. Этап 2. Метил (1-[(2-метил-3,3'-бипиридин-5-ил)окси] метилциклопропиламин тригидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 78, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESP m/z = 270,1619 Th ([M+H]+). Пример 81. Метил (1-[(2-метил-3,4'-бипиридин-5-ил)окси]метил циклопропил)амин тригидрохлорид. Этап 1. трет-Бутил метил(1-[(2-метил-3,4'-бипиридин-5-ил)окси]метилциклопропил)карбамат. Соединение получали в соответствии с методикой этапа 1 примера 78, используя соединение из приготовления 3 вместо соединения из приготовления 4 и заменяя 3-(1,1,1-трибутилстаннил)пиридин на 4-(1,1,1-трибутилстаннил)пиридин. Этап 2. Метил (1-[(2-метил-3,4'-бипиридин-5-ил)окси]метилциклопропил)амин тригидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 78, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 130-138 С. Масс-спектрометрия[1-([5-(4-Аминофенил)-6-хлорпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-аминофенил)-6-хлорпиридин-3-ил] окси)метил)циклопропил] метилкарбамат. 0,67 г тетракис(трифенилфосфин)палладия добавляли в атмосфере азота к раствору 1 г соединения из приготовления 2 и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина в 30 мл тетрагидрофурана. Смесь перемешивали в течение 20 мин и затем добавляли раствор 1,65 г карбоната натрия в 10 мл воды и реакционную смесь нагревали в течение 20 ч при 60 С. Растворители упаривали и затем остаток ресуспендировали в растворе карбоната натрия и экстрагировали дихлорметаном. Органическую фазу высушивали над сульфатом натрия и концентрировали. При осуществлении хроматографии на силикагеле(дихлорметан/этилацетат : 98/2 до 90/10) получали 0,87 г ожидаемого продукта. Этап 2. [1-([5-(4-Аминофенил)-6-хлорпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 240-243 С. Масс-спектрометрия(ESI) m/z = 304 Th ([M+H]+). Пример 83. [1-([5-(4-Аминофенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5-(4-аминофенил)-6-фторпиридин-3-ил]оксиметил)циклопропил] метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 82, используя соединение из приготовления 4 вместо соединения из приготовления 2. Этап 2. [1-([5-(4-Аминофенил)-6-фторпиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 22, используя соединение полученное на вышеописанном этапе 1. Температура плавления (капилляр): 225-230 С. Масс-спектрометрия(EST) m/z = 288,1521 Th ([M+H]+). Пример 84. 4-5-[(1- Аминоциклопропил)метокси]-2-хлорпиридин-3-илфенол дигидрохлорид. Этап 1. трет-Бутил [1-([6-хлор-5-(4-гидроксифенил)пиридин-3-ил]оксиметил)циклопропил]карбамат. Соединение получали в соответствии с методикой этапа 1 примера 82, используя соединение из приготовления 5 вместо соединения из приготовления 2 и заменяя 4-(4,4,5,5-тетраметил-1,3,2- 25015227 диоксаборолан-2-ил)анилин на 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол. Этап 2. 4-5-[(1-Аминоциклопропил)метокси]-2-хлорпиридин-3-илфенол дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 1, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): разложение 200 С. Массспектрометрия (ESP m/z = 291,0894 Th ([M+H]+). Пример 85. 4-(2-Хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)фенол дигидрохлорид. Этап 1. трет-Бутил [1-([6-хлор-5-(4-гидроксифенил)пиридин-3-ил ]оксиметил)циклопропил 1 метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 82, заменяя 4-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)анилин на 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол. Этап 2. 4-(2-Хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)фенол дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 1, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр) : 216-220 С. Масс-спектрометрия(ESI) m/z = 305,1062 Th ([M+H]+). Пример 86. 2-Хлор-N-[4-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)фенил] ацетамид гидрохлорид. Этап 1. трет-Бутил (1-[(6-хлор-5-4-[(хлорацетил)амино]фенилпиридин-3-ил)окси]метилциклопропил)метилкарбамат. 0,44 г хлорацетилхлорида добавляли при 10 С к раствору 1,5 г соединения, полученного на этапе 1 примера 82 и 0,54 мл триэтиламина в 20 мл тетрагидрофурана. Реакционную смесь перемешивали в течение 20 час при температуре окружающей среды и затем концентрировали. Остаток ресуспендировали в смеси простого эфира и воды и затем концентрировали. Органическую фазу отбрасывали и затем высушивали над сульфатом натрия и концентрировали, получая 1,7 г ожидаемого продукта. Этап 2. 2-Хлор-N-[4-(2-хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)фенил]ацетамид гидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 1, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 140-144 С. Масс-спектрометрия (ESI) m/z = 380,0928 Th([M+H]+). Пример 87. [1-([6-Хлор-5-(4-изотиоцианатофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин гидрохлорид. Этап 1. трет-Бутил [1-([6-хлор-5-(4-изотиоцианатофенил)пиридин-3-ил]оксиметил)циклопропил] метилкарбамат. Раствор 1,05 г гидрокарбоната натрия в 20 мл воды добавляли к раствору 1,01 г соединения, полученного на этапе 1 примера 82 в 20 мл тетрагидрофурана. После этого по каплям добавляли 1,38 г тиофосгена и затем оранжевую реакционную смесь перемешивали в течение одного часа при температуре окружающей среды. Добавляли 30 мл насыщенного водного раствора гидрокарбоната натрия и реакционную смесь экстрагировали дихлорметаном. Органическую фазу высушивали над сульфатом натрия и концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 98/2) получали 1 г ожидаемого продукта. Этап 2. [1-([6-Хлор-5-(4-изотиоцианатофенил)пиридин-3-ил]оксиметил)циклопропил ]метиламин гидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 1, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 172-176 С. Масс-спектрометрия(ESI) m/z = 346,0770 Th ([M+H]+). Пример 88. Метил 1-[(5-[3-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропил амин дигидрохлорид. Этап 1. трет-Бутил метил 1-[(5-[3-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропилкарбамат. 1,2 г азидотриметилолова добавляли к раствору 0,7 г соединения, полученного на этапе 1 примера 21 в 20 мл толуола. Реакционную смесь нагревали в колбе с обратным холодильником в течение 20 ч и затем концентрировали. При осуществлении хроматографии на силикагеле (дихлорметан/метанол: 95/5) получали 0,7 г ожидаемого продукта. Этап 2. Метил 1-[(5-[3-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропиламин дигидрохлорид. 10 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 0,65 г соединения, полученного на вышеописанном этапе 1, в 10 мл этанола. После перемешивания в течение 20 ч, реакционную смесь разводили простым эфиром и затем фильтровали. Собранное твердое вещество ресуспендировали в воде и водный раствор лиофилизировали, получая 0,49 г ожидаемого продукта. Масс-спектрометрия- 26015227 амин дигидрохлорид. Этап 1. трет-Бутил метил 1-[(5-[4-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 88, используя соединение с этапа 1 примера 20 вместо соединения, полученного на этапе 1 примера 21. Этап 2. Метил 1-[(5-[4-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 88, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESI) m/z = 323,1610 Th ([M+H]+). Пример 90. 1-[(6-Хлор-5-[4-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропил метиламин дигидрохлорид. Этап 1. трет-Бутил 1-[(6-хлор-5-[4-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропилметилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 88, используя соединение с этапа 1 примера 18 вместо соединения, полученного на этапе 1 примера 21. Этап 2. 1-[(6-Хлор-5-[4-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропилметиламин дигидрохлорид. 6 мл 4 н. раствора соляной кислоты в диоксане добавляли к раствору 0,84 г соединения, полученного на вышеописанном этапе 1, в 15 мл этанола. После перемешивания в течение 20 ч реакционную смесь разводили простым эфиром и затем фильтровали, получая после высушивания твердого вещества 0,75 г ожидаемого продукта. Температура плавления (капилляр): разложение 160 С. Масс-спектрометрия (ESP m/z = 357,1216Th ([M+H]+). Пример 91. 1-[(6-Хлор-5-[3-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропил метиламин дигидрохлорид. Этап 1. 3-(2-Хлор-5-[1-(метиламино)циклопропил]метоксипиридин-3-ил)бензонитрил. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 2 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(3-цианофенил)бороновую кислоту. Этап 2. трет-Бутил 1-[(6-хлор-5-[3-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропилметилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 88, используя соединение, полученное на вышеописанном этапе 1. Этап 3. 1-[(6-Хлор-5-[3-(2 Н-тетразол-5-ил)фенил]пиридин-3-илокси)метил]циклопропилметиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 88, используя соединение, полученное на вышеописанном этапе 2. Масс-спектрометрия (ESI) m/z = 357,1230 Th ([М+Н]+). Пример 92. (1S,2R),(1R,2S)-N,2-Диметил-1-([5-(2-метилфенил)пиридин-3-ил]оксиметил)циклопропанамин дигидрохлорид. 0,17 г тетракис(трифенилфосфин)палладия добавляли в атмосфере азота к раствору 1 г соединения из приготовления 6 в 20 мл толуола. Смесь перемешивали в течение 20 мин и затем добавляли раствор 0,61 г (2-метилфенил)бороновой кислоты в 10 мл этанола и 10 мл насыщенного водного раствора гидрокарбоната натрия. Реакционную смесь нагревали в течение 12 ч при 80 С и затем фильтровали и декантировали. Органическую фазу высушивали над сульфатом натрия и концентрировали. Остаток хроматографировали на колонке RP18, 12-25(вода/трифторуксусная кислота : 1000/2,5 до вода/ацетонитрил/ трифторуксусная кислота : 800/200/2,5). Хроматографические фракции объединяли и затем ацетонитрил упаривали. Оставшийся водный раствор нейтрализовали и затем насыщали твердым гидрокарбонатом натрия и после этого экстрагировали дихлорметаном. После высушивания над сульфатом натрия и концентрирования органической фазы, 0,57 г полученного основания растворяли в 10 мл этанола и добавляли 1,35 мл 4 н. раствора соляной кислоты в диоксане. После концентрации и кристаллизирования в простом эфире, фильтрования и высушивания получали 0,51 г ожидаемого продукта. Температура плавления (капилляр): 198-201 С. Масс-спектрометрия (ESI) m/z = 282 Th ([M+H]+) Пример 93. (1S,2R),(1R,2S)-1-[(5-[3,5-бис(Трифторметил)фенил]пиридин-3-илокси)метил]-N,2 диметилциклопропанамин дигидрохлорид. Соединение получали, в соответствии с методикой из примера 92, заменяя (2-метилфенил) бороновую кислоту на [3,5-бис(трифторметил)фенил]бороновую кислоту. Температура плавления (капилляр): 117-120 С. Масс-спектрометрия (ESI) m/z = 405,1418 Th([M+H]+). Пример 94. (1S,2R),(1R,2S)-N,2-Диметил-1-([5-(2,3,4-триметоксифенил)пиридин-3-ил]оксиметил) циклопропанамин дигидрохлорид. Соединение получали, в соответствии с методикой из примера 92, заменяя (2-метилфенил) бороновую кислоту на (2,3,4-триметоксифенил)бороновую кислоту. Температура плавления (капилляр): 196- 27015227 199 С. Масс-спектрометрия (ESI) m/z = 359,1964 Th ([M+H]+). Пример 95. [1-([5,6-бис(4-Хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-[5,6-бис(4-хлорфенил)пиридин-3-ил ]оксиметил)циклопропил ] метилкарбамат. Соединение, продукт дизамещения, получали при осуществлении методики этапа 1 примера 13. Этап 2. [1-5,6-бис(4-Хлорфенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 220-225 С. Масс-спектрометрия(ESP m/z = 399,1033 Th ([M+H]+). Пример 96. [1-([5,6-бис(4-Нитрофенил)пиридин-3-ил]оксиметил)циклопропил]метиламин дигидрохлорид. Этап 1. трет-Бутил [1-([5,6-бис(4-нитрофенил)пиридин-3-ил]оксиметил)циклопропил метилкарбамат. Соединение, продукт дизамещения, получали при осуществлении методики этапа 1 примера 12. Этап 2. [1-([5,6-бис(4-Нитрофенил)пиридин-3-ил]окси)метил)циклопропил]метиламин дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 215-220 С. Масс-спектрометрия(ESP m/z = 421,1500 Th ([М+Н]+). Пример 97. 4,4'-(5-[1-(Метиламино)циклопропил]метоксипиридин-2,3-диил)дибензонитрил дигидрохлорид. Этап 1. трет-Бутил [1-(5,6-бис(4-цианофенил)пиридин-3-ил]оксиметил)циклопропил 1 метилкарбамат. Соединение, продукт дизамещения, получали при осуществлении методики этапа 1 примера 18. Этап 2. 4.4'-(5-[1-(Метиламино)циклопропил]метоксипиридин-2,3-диил)дибензонитрил дигидрохлорид. Соединение получали в соответствии с методикой этапа 2 примера 2, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр). 205-208 С. Масс-спектрометрия(ESI) m/z = 381,1718 Th ([M+H]+). Пример 98. [1-([5-(4-Аминофенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метиламин тригидрохлорид. Этап 1. трет-Бутил [1-([5-(4-аминофенил)-6-метилпиридин-3-ил]оксиметил) циклопропил]метилкарбамат. Соединение получали в соответствии с методикой этапа 1 примера 1, используя соединение из приготовления 3 вместо соединения из приготовления 1 и заменяя (3-метоксифенил)бороновую кислоту на(4-аминофенил)бороновую кислоту. Этап 2. [1-([5-(4-Аминофенил)-6-метилпиридин-3-ил]оксиметил)циклопропил]метиламин тригидрохлорид. 40 мл диоксана и затем 10 мл 4 н. раствора соляной кислоты в диоксане добавляли к 1,05 г продукта,полученного на вышеописанном этапе 1. Добавляли 40 мл этанола для осуществления полной гомогенизации реакционной смеси. После перемешивания в течение 20 ч, растворители упаривали и остаток ресуспендировали в небольшом количестве этанола. После разведения в простом эфире, фильтрования и высушивания, получали 0,9 г ожидаемого продукта. Температура плавления (капилляр): 245-250 С. Масс-спектрометрия (ESP m/z = 284,169 Th ([M+H]+). Пример 99. Дигидрохлорид 3-[5-([1-(метиламино)циклопропил]метиламино)пиридин-3-ил] бензойной кислоты. Этап 1. 3-5-[(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметил)амино]пиридин-3-ил бензойная кислота. Раствор, содержащий 3,96 г карбоната натрия в 94 мл воды и затем 2,05 г 3-карбоксифенилбороновой кислоты, последовательно добавляли к смеси, содержащей 140 мл ацетонитрила и 4,68 г соединения из приготовления 8. Смесь перемешивали в течение одного часа в атмосфере азота и затем добавляли 0,55 г тетракис(трифенилфосфин)палладия. Перемешивали в течение 1 ч при 20 С и затем в течение 20 ч в колбе с обратным холодильником. Смесь концентрировали насухо, ресуспендировали в 40 мл воды и повторно экстрагировали простым эфиром. Водную фазу подкисляли с помощью н. соляной кислоты до достижения значения рН 5,5. Экстрагировали дихлорметаном, высушивали над сульфатом натрия и концентрировали насухо. При осуществлении хроматографии на силикагеле (дихлорметан/метанол : 95/5) получали 2,4 г ожидаемого продукта. Температура плавления (капилляр): 109 С. Этап 2. Дигидрохлорид 3-[5-([1-(метиламино)циклопропил ] метил) амино)пиридин-3-ил ]бензойной кислоты. 2,26 г соединения, полученного на вышеописанном этапе 1, растворяли в 44 мл диоксана. Добавля- 28015227 ли 44 мл 4 М соляной кислоты в диоксане и затем, после перемешивания в течение одного часа, добавляли 7,3 мл воды. Перемешивали в течение 20 ч. Фильтровали с отсасыванием, и осадок промывали с помощью простого эфира и высушивали при 60 С под давлением 0,5 торр. Получали 1,96 г ожидаемого продукта. Температура плавления (капилляр): 248-250 С. Масс-спектрометрия (ESI) (H2O/CH3CN) m/z = 298,1527 Th ([M+H]+). Пример 100. Дигидрохлорид 4-[5-([1-метиламино)циклопропил]метиламино)пиридин-3-ил]бензойной кислоты. Этап 1. 4-5-[(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметил)амино]пиридин-3-ил бензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 99, заменяя 3 карбоксифенилбороновую кислоту на 4-карбоксифенилбороновую кислоту. Температура плавления (капилляр): 120 С. Этап 2. Дигидрохлорид 4-[5-([1-метиламино)циклопропил]метил амино)пиридин-3-ил] бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 99, используя соединение, полученное на вышеописанном этапе 1. Температура плавления (капилляр): 256-260 С. Масс-спектрометрия(ESI) (H2O/CH3CN) m/z = 298,1522 Th ([M+H]+). Пример 101. Дигидрохлорид 4-[5-(метил[1-(метиламино)циклопропил]метиламино)пиридин-3 ил]бензойной кислоты. Этап 1. 4-5-[(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметил)(метил)амино]пиридин-3-илбензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 99, используя соединение из приготовления 9 вместо соединения из приготовления 8 и заменяя 3-карбоксифенилбороновую кислоту на 4-карбоксифенилбороновую кислоту. Этап 2. Дигидрохлорид 4-[5-(метил[1-(метиламино)циклопропил]метиламино)пиридин-3-ил)бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 99, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESI) (H2O/CH3CN)m/z = 312,1676 Th ([M+H]+). Пример 102. Дигидрохлорид 3-[5-(метил[1-(метиламино)циклопропил]метиламино)пиридин-3 ил]бензойной кислоты. Этап 1. 3-5-[(1-[трет-Бутоксикарбонил)(метил)амино]циклопропилметил)(метил)амино]пиридин-3-ил] бензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 99, используя соединение из приготовления 9 вместо соединения из приготовления 8. Этап 2. Дигидрохлорид 3-[5-(метил[1-(метиламино)циклопропил]метиламино)пиридин-3-ил]бензойной кислоты. Соединение получали в соответствии с методикой этапа 2 примера 99, используя соединение, полученное на вышеописанном этапе 1. Масс-спектрометрия (ESI) (H2O/CH3CN) m/z = 312,1689 Th ([M+H]+). Пример 103. 2-Хлор-N-[1-(метиламино)циклопропил]метил-3,3'-бипиридин-5-амин тригидрохлорид. Этап 1. трет-Бутил 1-[(2-хлор-3,3'-бипиридин-5-ил)амино]метилциклопропил)метилкарбамат. Смесь, состоящую из 1 г соединения из приготовления 10, 25 мл толуола и 0,15 г тетракис(трифенилфосфин)палладия перемешивали в течение одного часа при 20 С. Последовательно добавляли 0,39 г 3-пиридинбороновой кислоты, 12,5 мл этанола и 12,5 мл насыщенного водного раствора гидрокарбоната натрия. Смесь нагревали в течение 20 ч при 80 С при интенсивном перемешивании. После охлаждения толуол добавляли, декантировали, и органическую фазу высушивали над сульфатом натрия и концентрировали насухо. При осуществлении хроматографии на силикагеле (дихлорметан/тетрагидрофуран : 97/3) получали 0,99 г ожидаемого продукта. Этап 2. 2-Хлор-N-[1-(метиламино)циклопропил]метил-3,3'-бипиридин-5-амин тригидрохлорид. 1,0 г продукта, полученного на вышеописанном этапе 1, перемешивали в течение 20 ч при температуре окружающей с 50 мл этанола и 10 мл 4 н. соляной кислоты в диоксане. Разводили простым эфиром,после этого фильтровали с отсасыванием и высушивали 60 С под давлением 1 торр. Получали 0,78 г желательного продукта. Температура плавления (капилляр): 180-185 С. Масс-спектрометрия (ESI)(H2O/CH3CN) m/z = 289,1219 Th ([M+H]+). Пример 104. Дигидрохлорид 3-[2-хлор-5-([1-(метиламино)циклопропил]метиламино)пиридин-3 ил]бензойной кислоты. Этап 1. 3-5-[(1-[(трет-Бутоксикарбонил)(метил)амино]циклопропилметил)амино]-2-хлорпиридин-3-илбензойная кислота. Соединение получали в соответствии с методикой этапа 1 примера 99, используя соединение из приготовления 10 вместо соединения из приготовления 8. Этап 2. Дигидрохлорид 3-[2-хлор-5-([1-(метиламино)циклопропил]метиламино)пиридин-3-ил]
МПК / Метки
МПК: C07D 401/10, A61K 31/4418, A61P 25/00, C07D 213/65
Метки: соединения, получения, композиции, замещенные, способ, содержащие, фармацевтические, пиридиниламиноалкилен, пиридинилоксиалкилен-циклопропанамина
Код ссылки
<a href="https://eas.patents.su/30-15227-zameshhennye-soedineniya-piridinilaminoalkilen-i-piridiniloksialkilen-ciklopropanamina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные соединения пиридиниламиноалкилен- и пиридинилоксиалкилен-циклопропанамина, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Гетероциклические сетр ингибиторы
Следующий патент: Фосфонатные и фосфинатные соединения в качестве активаторов глюкокиназы
Случайный патент: Фармацевтическая композиция для лечения заболеваний, характеризующихся снижением и/или нарушением когнитивных функций












