Высоковязкие диутановые камеди и способы их получения
Номер патента: 15170
Опубликовано: 30.06.2011
Авторы: Пейтел Ямини Н., Хардинг Нэнси Е., Коулман Расселл, Матцке Стивен
Формула / Реферат
1. Диутановая камедь, имеющая внутреннюю (собственную) вязкость более 150 дл/г.
2. Диутановая камедь по п.1, имеющая внутреннюю вязкость более 155 дл/г.
3. Диутановая камедь по п.2, имеющая внутреннюю вязкость более 160 дл/г.
4. Диутановая камедь, имеющая вязкость в морской воде при 3 об/мин более 35 показаний шкалы прибора.
5. Диутановая камедь по п.4, имеющая вязкость в морской воде при 3 об/мин более 37 показаний шкалы прибора.
6. Диутановая камедь по п.5, имеющая вязкость в морской воде при 3 об/мин более 40 показаний шкалы прибора.
7. Диутановая камедь по п.6, имеющая вязкость в морской воде при 3 об/мин более 42 показаний шкалы прибора.
8. Диутановая камедь, имеющая вязкость в морской воде при 0,3 об/мин более 35000 сП.
9. Диутановая камедь по п.8, имеющая вязкость в морской воде при 0,3 об/мин более 35000 сП.
10. Диутановая камедь по п.9, имеющая вязкость в морской воде при 0,3 об/мин более 38000 сП.
11. Диутановая камедь по п.10, имеющая вязкость в морской воде при 0,3 об/мин более 40000 сП.
12. Диутановая камедь по п.11, имеющая вязкость в морской воде при 0,3 об/мин более 41000 сП.
13. Диутановая камедь, имеющая вязкость при низкой скорости сдвига в присутствии полиэтиленгликоля в качестве дисперсанта более 3500 сП.
14. Диутановая камедь по п.13, имеющая вязкость при низкой скорости сдвига в присутствии полиэтиленгликоля в качестве дисперсанта более 3700 сП.
15. Диутановая камедь по п.14, имеющая вязкость при низкой скорости сдвига в присутствии полиэтиленгликоля в качестве дисперсанта более 3900 сП.
16. Диутановая камедь по п.15, имеющая вязкость при низкой скорости сдвига в присутствии полиэтиленгликоля в качестве дисперсанта более 4000 сП.
17. Способ получения диутановой камеди, включающий
введение кодирующей последовательности по меньшей мере для одного фермента, катализирующего биосинтез диутана, в продуцирующий диутан организм-хозяин Sphinogomonas;
культивирование организма-хозяина в условиях ферментации, при этом организм-хозяин продуцирует диутановую камедь, которая имеет по меньшей мере одну из следующих характеристик:
а) внутреннюю вязкость более 150 дл/г;
б) вязкость в морской воде при 3 об/мин более 35 показаний шкалы прибора;
в) вязкость в морской воде при 0,3 об/мин более 35000 сП и
г) вязкость при низкой скорости сдвига в присутствии полиэтиленгликоля в качестве дисперсанта более 3500 сП.
18. Способ по п.17, в котором по меньшей мере один фермент, катализирующий биосинтез диутана, является DpsG полимеразой.
19. Способ по п.17, в котором по меньшей мере один фермент, катализирующий биосинтез диутана, включает DpsG полимеразу и глюкозо-1-фосфаттимидилилтрансферазу; dTDP-6-дезокси-D-глюкозо-3-5-эпимеразу; dTDP-D-глюкозо-4,6-дегидратазу и dTDP-6-дезокси-L-маннозодегидрогеназу.
20. Способ по п.17, в котором по меньшей мере один фермент, катализирующий биосинтез диутана, включает DpsG полимеразу и рамнозилтрансферазу IV; глюкозилизопренилфосфаттрансферазу I; бета-1,4-глюкуронозилтрансферазу II и глюкозилтрансферазу III.
21. Способ по п.17, в котором по меньшей мере один фермент, катализирующий биосинтез диутана, включает DpsG полимеразу и транспортирующие полисахариды белки DpsD, DpsC и DpsE.
22. Способ по п.17, в котором по меньшей мере один фермент, катализирующий биосинтез диутана, включает рамнозилтрансферазу IV; бета-1,4-глюкуронозилтрансферазу II; глюкозилтрансферазу III; глюкозо-1-фосфаттимидилилтрансферазу; глюкозилизопренилфосфаттрансферазу I; dTDP-6-дезокси-D-глюкозо-3-5-эпимеразу; dTDP-D-глюкозо-4,6-дегидратазу и dTDP-6-дезокси-L-маннозодегидрогеназу.
23. Способ по п.17, в котором по меньшей мере один фермент, катализирующий биосинтез диутана, выбран из группы, состоящей из полимеразы; лиазы; рамнозилтрансферазы IV; бета-1,4-глюкуронозил-трансферазы II; глюкозилтрансферазы III; транспортирующего полисахарид белка; секретирующего белка; глюкозилизопренилфосфаттрансферазы I; глюкозо-1-фосфаттимидилилтрансферазы; dTDP-6-дезокси-D-глюкозо-3-5-эпимеразы; dTDP-D-глюкозо-4,6-дегидратазы; dTDP-6-дезокси-L-маннозодегидрогеназы и их комбинаций.
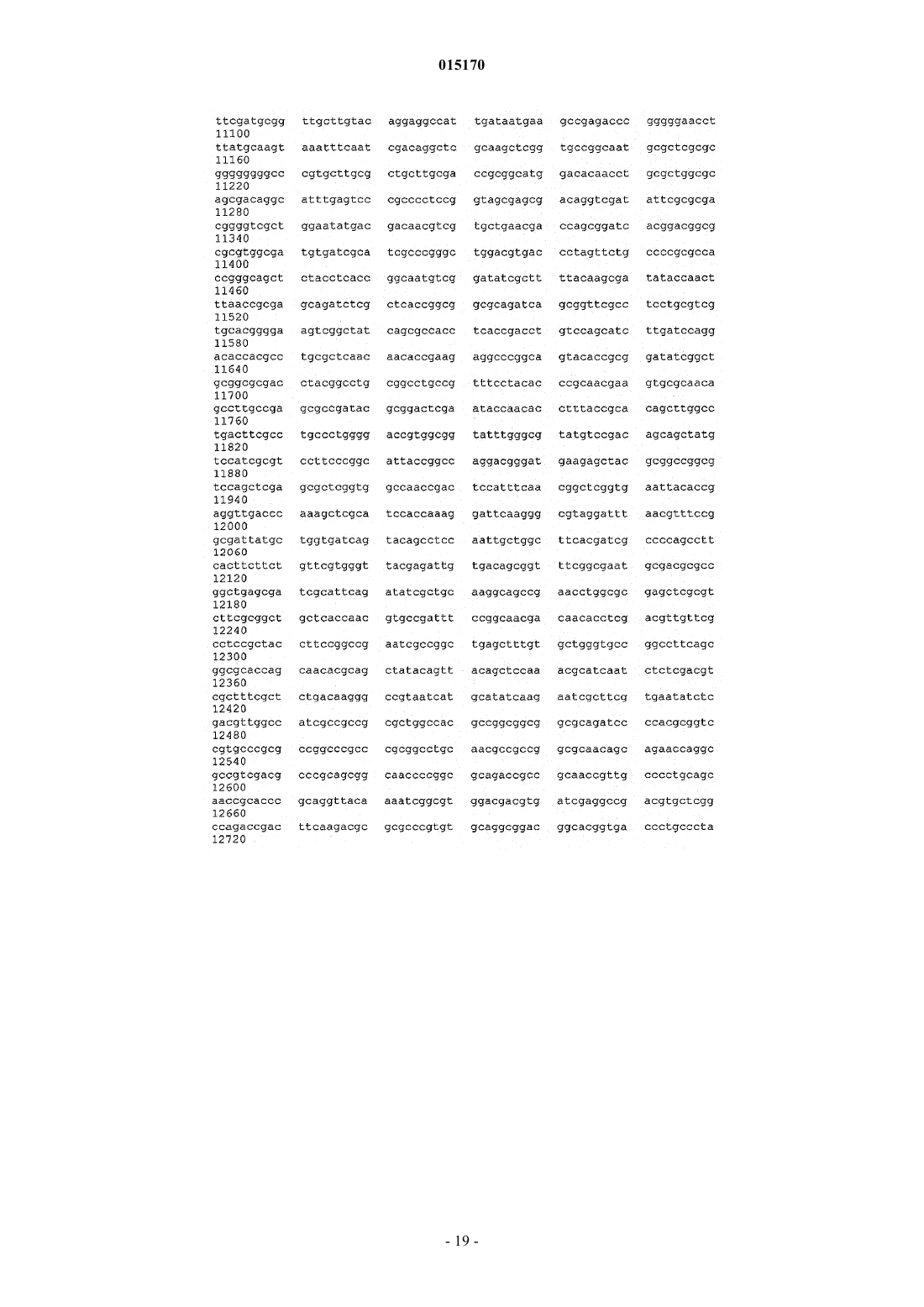
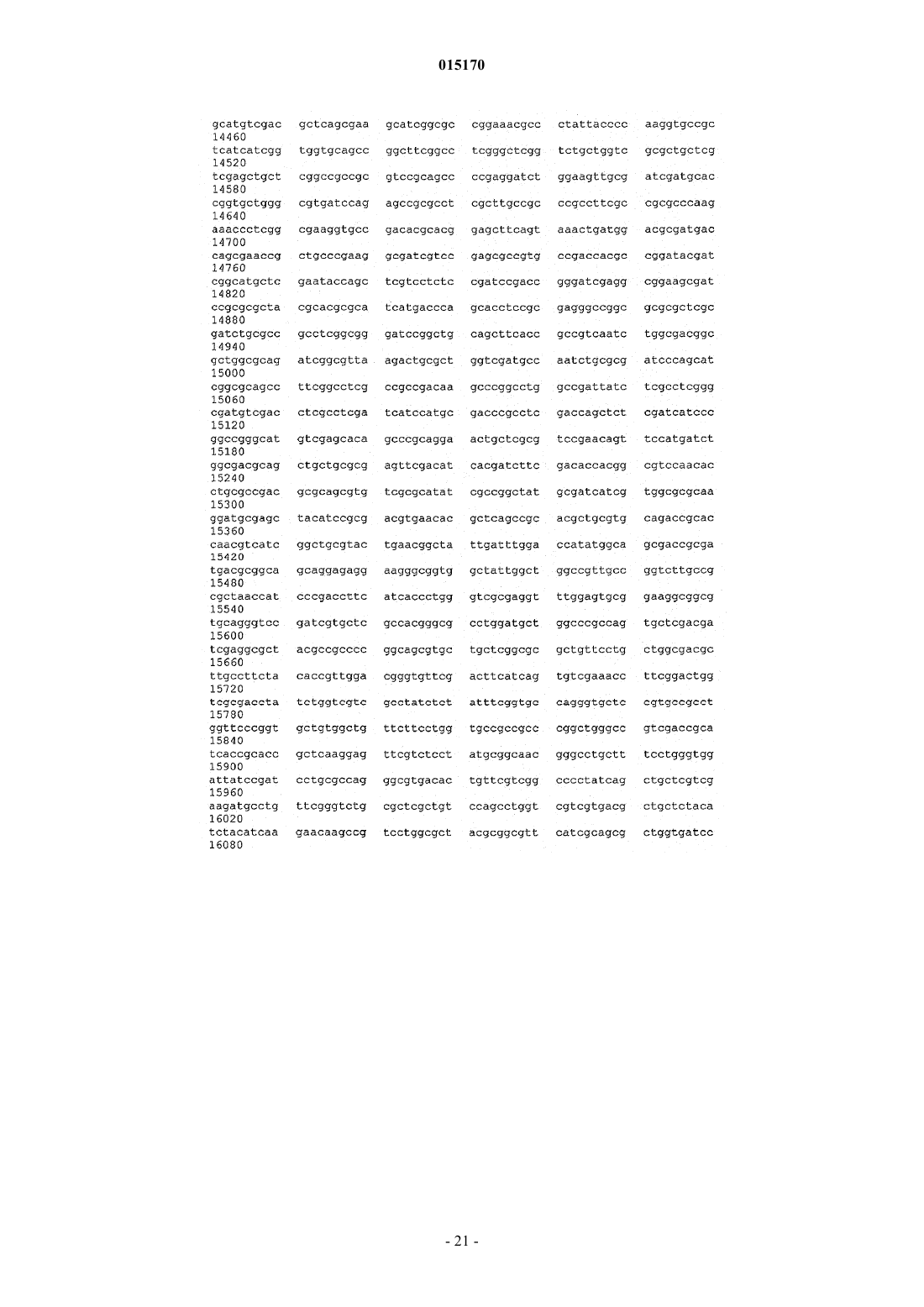
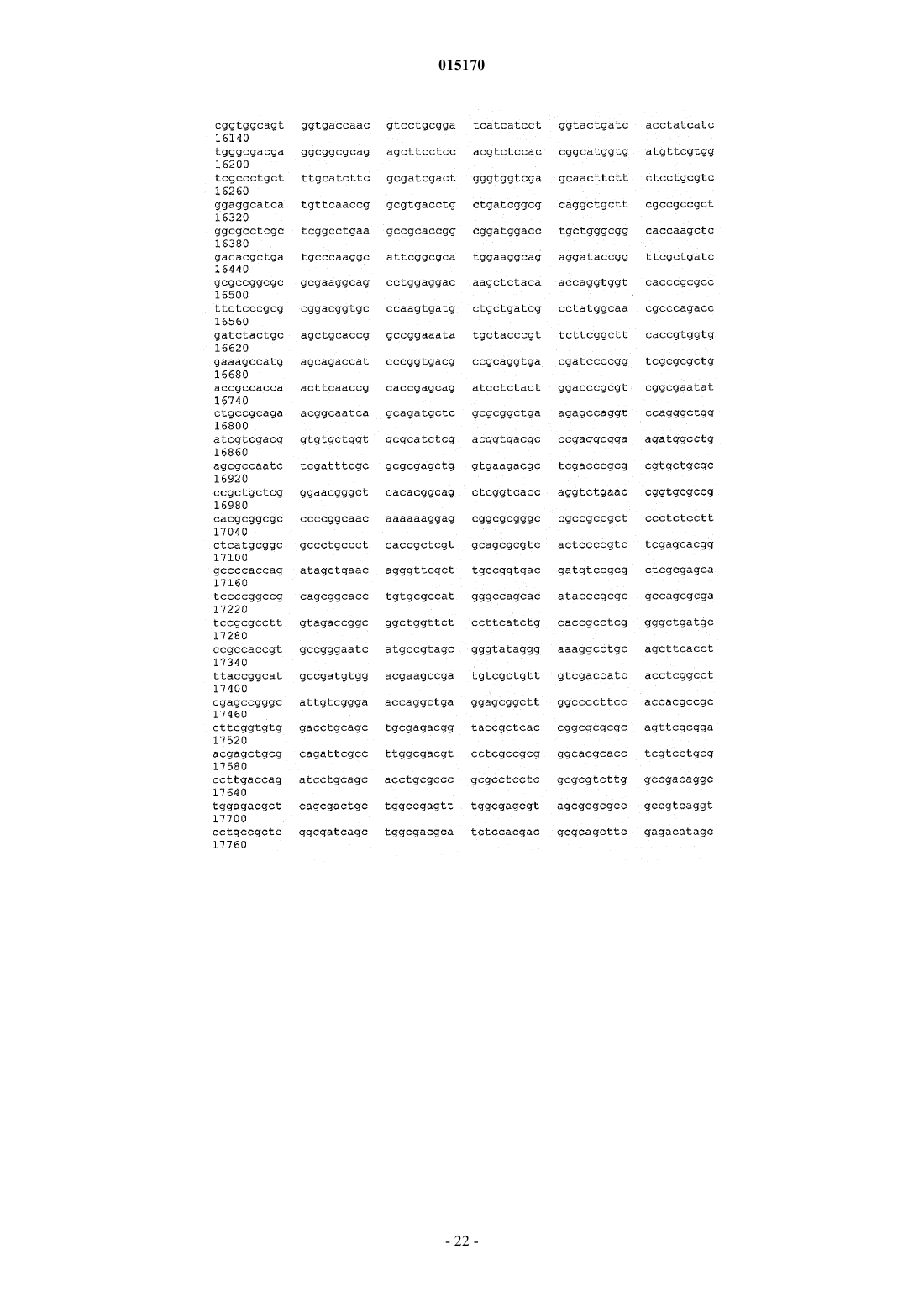
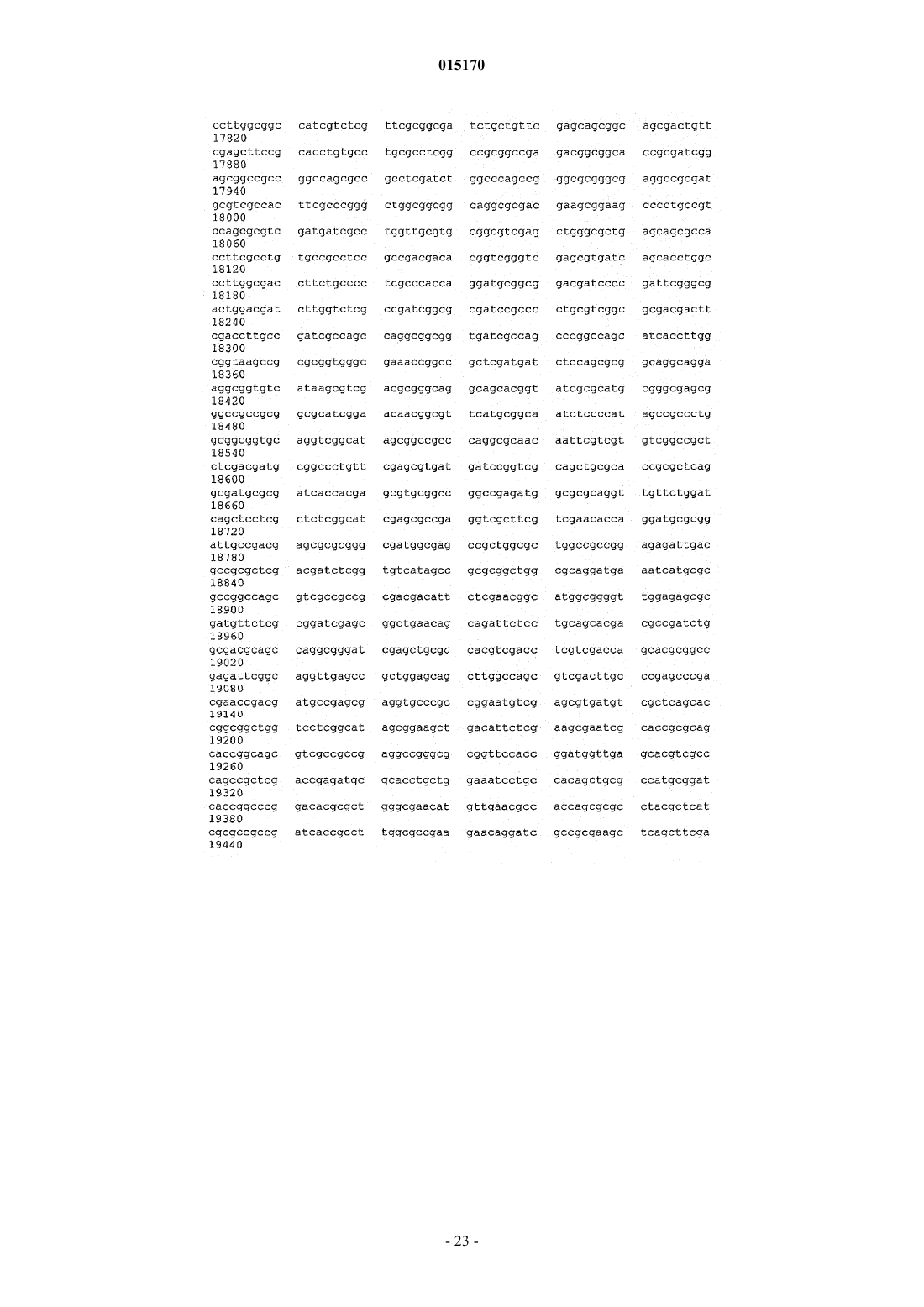
24. Способ по п.17, в котором нуклеотидная последовательность, введенная в продуцирующий диутан организм-хозяин Sphinogomonas, представляет собой последовательность SEQ ID NO: 1.
25. Выделенная молекула нуклеиновой кислоты, которая включает нуклеотидную последовательность SEQ ID NO: 1.
Текст
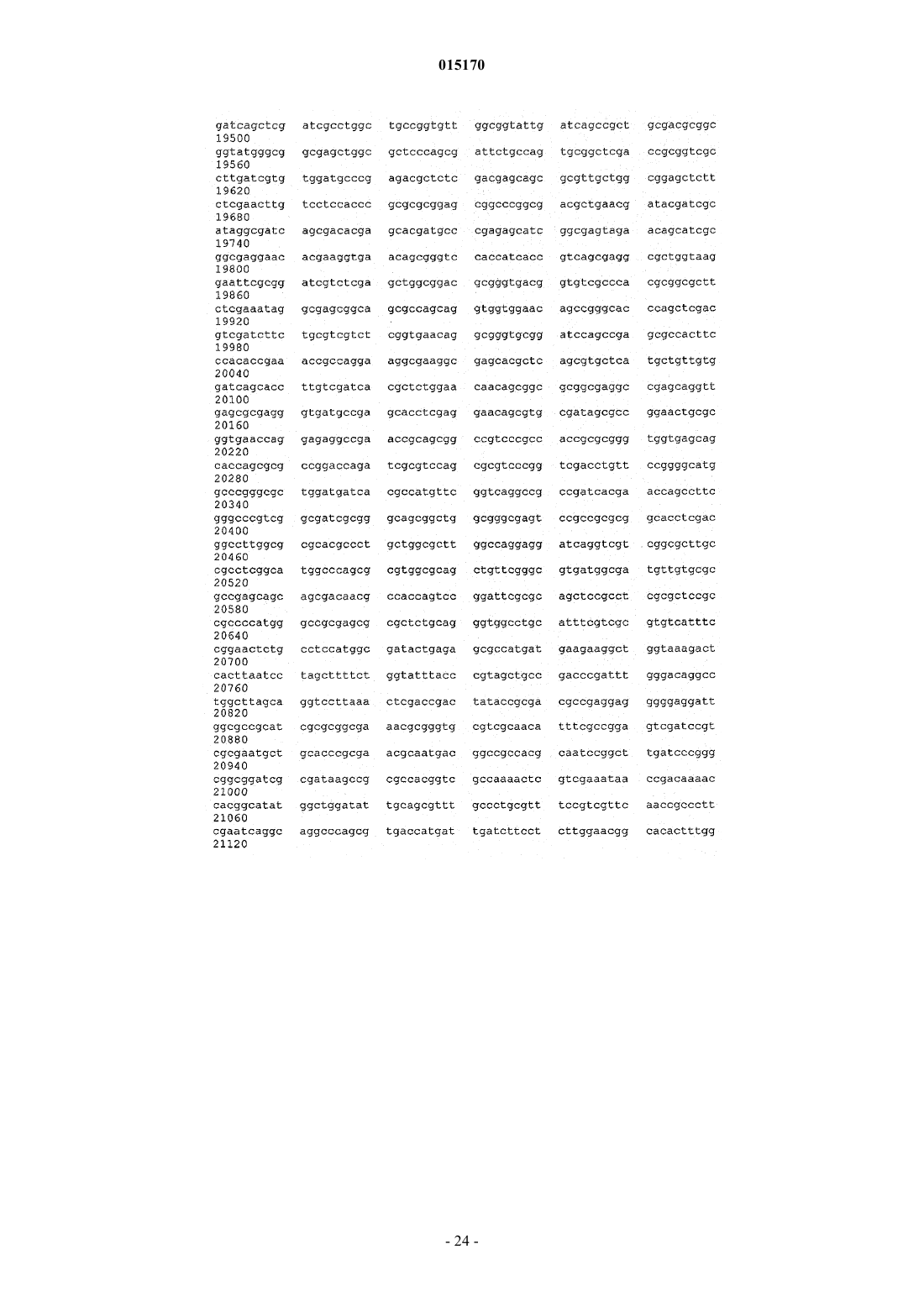
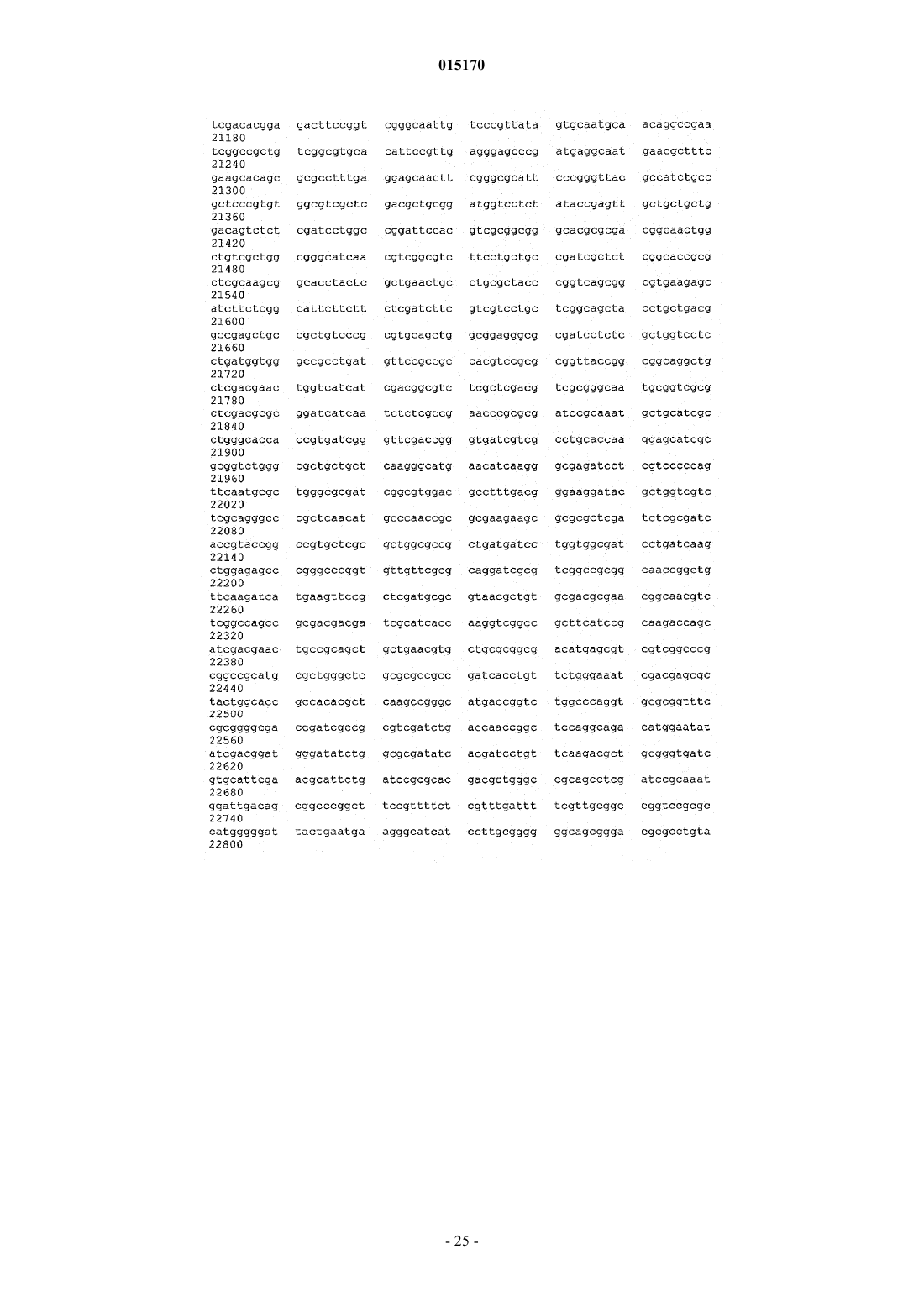
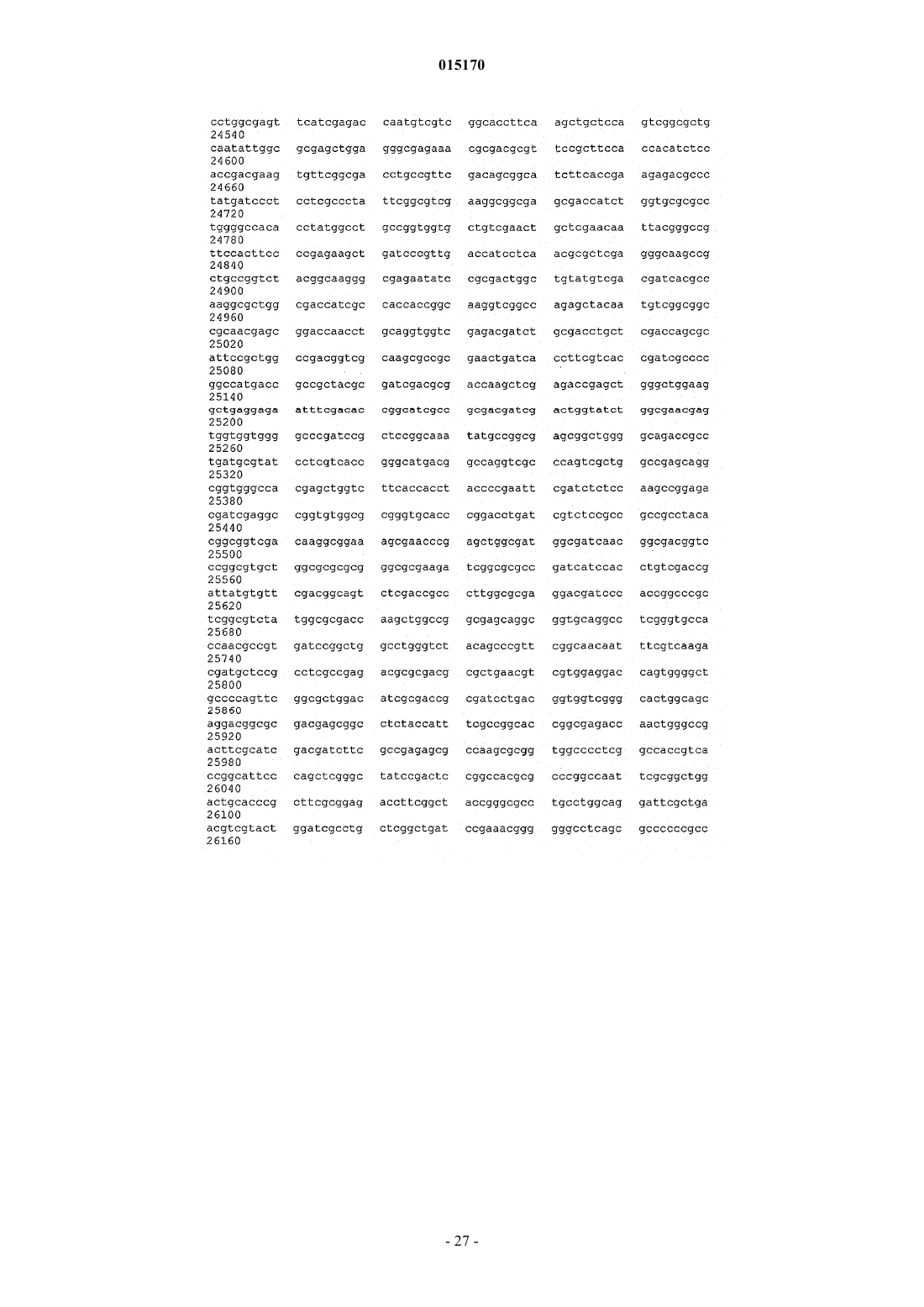
ВЫСОКОВЯЗКИЕ ДИУТАНОВЫЕ КАМЕДИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ Производство полисахарида диутана, показывающего увеличенную вязкость по сравнению с полисахаридом предшествующего уровня техники, состоящим из повторяющихся единиц такого же типа. Этот улучшенный полисахарид диутан получают с помощью вновь генерированного штамма, производного от штамма Sphingomonas sp. АТСС 53159, "приютившего" мультикопийную плазмиду с широким спектром хозяев, в которую клонированы гены, отвечающие за биосинтез полисахарида диутана. В штамме-хозяине Sphingomonas плазмида обеспечивает способность многократного копирования генов, отвечающих за синтез указанного полисахарида. Таким образом, обеспечивается способ получения не только увеличенного количества целевого полисахарида диутана, но и полисахарида диутана с улучшенными физическими свойствами (с вышеупомянутой повышенной вязкостью). Доказано, что такой полисахарид диутан особенно пригоден как возможный модификатор вязкости в нефтедобывающей промышленности и в производстве цементных материалов. Способ получения такого улучшенного полисахарида диутана согласно изобретению, равно как и новые клонированные гены, необходимые для продуцирования улучшенного диутана этим способом, также составляют предмет настоящего изобретения. В дополнение к этому изобретение охватывает также новый генно-инженерный (рекомбинантный) штамм Sphingomonas, включающий требуемую последовательность ДНК. 015170 Область техники, к которой относится изобретение Настоящее изобретение описывает получение полисахарида диутана, обладающего повышенной вязкостью по сравнению с полисахаридом с таким же типом повторяющихся единиц, описанным в предшествующем уровне техники. Полисахарид диутан с улучшенными свойствами получают с помощью вновь генерированного штамма, производного от Sphingomonas sp. ATTC 53159, содержащего мультикопийную плазмиду с широким спектром хозяев, в которую клонированы гены, отвечающие за биосинтез полисахарида диутана. Плазмида проявляет внутри штамма-хозяина Sphingomonas способность к многократному копированию генов, отвечающих за синтез указанного полисахарида. За счет этого обеспечивается способ не только увеличения продукции целевого полисахарида диутана, но и получения полисахарида диутана с улучшенными физическими свойствами (с вышеупомянутой повышенной вязкостью). Доказано, что такой полисахарид диутан особенно пригоден для применения в качестве возможного модификатора вязкости в нефтедобывающей промышленности и в производстве цементных материалов. Настоящее изобретение охватывает также способы производства вышеуказанного улучшенного полисахарида диутана, равно как и новые клонированные гены, необходимые для получения улучшенного диутана этими способами. В дополнение к этому изобретение охватывает также новый генно-инженерный(рекомбинантный) штамм Sphingomonas, включающий требуемую последовательность ДНК. Предшествующий уровень техники Полисахариды, или камеди, используются, главным образом, для повышения вязкости (загущения) или образования геля в водных растворах и часто классифицируются по двум группам - загустители и гелеобразователи. Типичные загустители включают крахмалы, ксантановую камедь, диутановую камедь,велановую камедь, гуаровую камедь, карбоксиметилцеллюлозу, альгинат, метилцеллюлозу, камедь карайи и камедь трагаканта. Известные гелеобразователи включают желатин, геллановую камедь, крахмал,альгинат, пектин, каррагинан, агар и метилцеллюлозу. Некоторые полисахариды, или, как их больше принято называть, биокамеди, такие как ксантан,геллан, велан и диутан, в течение многих лет получали из микроорганизмов путем ферментации. Указанные биокамеди проявляют варьирующие характеристики, такие как способность изменять вязкость, что позволяет использовать их во многих различных областях, в том числе в качестве желирующих агентов(загустителей) в пищевых продуктах, таких как желейные конфеты, джемы и желе, желеобразные десерты, сахарная глазурь и молочные продукты, а также в качестве компонентов микробиологических сред. Кроме того, загустители применяются в многочисленных случаях для модификации вязкости целевых жидкостей на конечной стадии. Особый интерес привлекает способность указанных камедей изменять вязкость подземных и/или подводных нефтеносных жидкостей, что облегчает их сбор, хотя существуют и многие другие возможные сферы их конечного применения (включая производство цемента как один из примеров). Различные биокамеди получали из разных бактериальных источников: так, ксантановую камедь получали из Xanthomonas campestris, геллановую камедь - из Sphingomonas elodea, велановую камедь - из Sphingomonas sp. ATCC 31555 и диутановую камедь (S-657) - из Sphingomonas sp. ATCC 53159. В прошлом были предприняты генетические модификации таких штаммов с тем, чтобы более эффективным путем достигалось значительное модифицирование материалов камедей, получаемых вышеупомянутыми методами ферментации. Указанное модифицирование позволяло достигнуть таких изменений, как удаление ацильных групп с целью получения различных материалов камедей с разными физическими свойствами. В большинстве случаев эти генетические модификации преследовали цель либо изменить, в конечном итоге, состав получаемой камеди путем изменения экспрессии генов в организмехозяине, либо увеличить выход целевой биокамеди путем встраивания плазмиды, способной только к амплификации генов (см. патенты США 5854034, 5985623 и 6284516 (Pollock et al.) и патент США 6709845 (только Pollock). Диутановую камедь (известную также как гетерополисахарид S-657) получают путем ферментации штамма Sphingomonas sp. ATCC 53159; в водных растворах она обладает загущающей, суспендирующей и стабилизирующей способностью. В большинстве случаев диутан показывает гексамерную структуру из повторяющихся единиц, состоящих из четырех сахаров в каркасе (глюкоза-глюкуроновая кислотаглюкоза-рамноза) и боковой цепочки из двух остатков рамнозы, присоединенных к одному из остатков глюкозы. Подробности структуры диутановой камеди см. в статье Chowdhury Т.А., Lindberg В.,Lingquist U. и Baird J., Carbohydrate Research, 164 (1987), 117-122. Diltz et al. (Carbohydrate Research, 331(2001), 265-270) показали, что диутан имеет два ацетильных заместителя на одну повторяющуюся единицу. Обе эти ссылки включены в полном объеме в перечень ссылок к настоящей заявке. Подробности получения диутановой камеди можно найти в патенте США 5175278, который включен в полном объеме в перечень ссылок к настоящей заявке. Диутан можно получать из штамма Sphingomonas с помощью стандартной техники ферментации с использованием, например, источников углеводов (примерами которых, не ограничивающими весь перечень, являются глюкоза, мальтоза и др.), источника азота и дополнительных солей. Физические характеристики, придаваемые такой диутановой биокамедью в е дикой форме, востребованы в определенных областях промышленности, в частности, в рамках е способности модифицировать вязкость и/или водоудерживающих характеристик. К сожалению, доказано, что добиться эффектив-1 015170 ного в плане стоимостных затрат производства диутана крайне трудно. Кроме того, проблемы, связанные с указанными затратами, препятствуют широкому применению диутана в настоящее время, поскольку степень вязкости, проявляемая этой биокамедью, недостаточна для того, чтобы потеснить на рынке другие, менее дорогостоящие, но эффективные, биокамеди (такие как ксантановая камедь как один из примеров). По существу, имеется настоятельная необходимость в обеспечении эффективного способа производства диутана с минимальными, насколько это возможно, затратами и/или в обеспечении способа производства биокамеди диутанового типа, показывающей значительное улучшение своих физических свойств. На сегодняшний день единственное упоминание о производстве любых видов родственных сфинганов (без конкретной ссылки на диутан) касается повышения их выхода (см. вышеупомянутые патенты Pollock et al.). Публикаций, касающихся обсуждения или какого-либо четко сформулированного предложения о возможном пути обеспечения способа получения улучшенной диутановой камеди с более высокой молекулярной массой, которая показала бы в измерениях улучшение вязкости за счет такого способа получения, на сегодняшний день нет. Краткое описание изобретения Авторам изобретения удалось наглядно показать, что амплификация определенных вновь изолированных последовательностей ДНК для биосинтеза диутана в организме-хозяине Sphingomonas не только обеспечивает увеличение продукции диутана из него, но и позволяет получить диутановую камедь, которая обладает повышенной вязкостью. Эта новая последовательность ДНК (которая вводится в организмхозяин хорошо известным методом, например (но их перечень не ограничивается только названным здесь) с помощью плазмиды) обеспечивает требуемые результаты, которые постоянно ожидались от методов биосинтеза диутана. Одним из преимуществ амплификации этих генов в плазмиде является относительно простая природа введения выделенной последовательности ДНК в процессы синтеза диутана. Другим преимуществом является способность придания повышенной вязкости получаемой диутановой камеди при одновременном потенциально возможном повышении, в случае необходимости, эффективности ферментации. Таким образом, настоящее изобретение включает диутановую камедь с улучшенной вязкостью, измеренную различными способами. Среди них: (i) внутренняя (или собственная, т.е. органически присущая) вязкость, составляющая более 150, предпочтительно более 155, более предпочтительно выше 160 дл/г; (ii) вязкость в морской воде при 3 об./мин, составляющая более 35, предпочтительно более 37,более предпочтительно более 40 и наиболее предпочтительно более 42 показаний шкалы прибора;(iii) вязкость в морской воде при 0,3 об./мин, составляющая выше 35000, предпочтительно выше 39000,более предпочтительно выше 40000 и наиболее предпочтительно выше 41000 сантипуаз (сП); (iv) вязкость в PEG (полиэтиленгликоль) при низкой скорости сдвига, составляющая выше 3500, предпочтительно выше 3700, более предпочтительно выше 3900 и наиболее предпочтительно выше 4000 сП. Изобретение включает также способ получения диутановой камеди, определяемой любым из вышеприведенных терминов, за счет введения специфического кластера генов в организм-хозяин Sphingomonas и проведения ферментации указанного организма для получения требуемой диутановой камеди. Кроме того, настоящее изобретение включает также специфические последовательности ДНК и любой вектор(например, плазмиду), обеспечивающий многократные копии генов или повышенную экспрессию генов,при использовании более сильного промотора и т.п. В дополнение к этому изобретение включает также генетически модифицированный штамм Sphingomonas, содержащий многократные копии генов, контролирующих биосинтез диутана и определяемых указанными уникальными выделенными последовательностями ДНК. Такая уникальная выделенная последовательность ДНК, как было установлено, требует по меньшей мере одного фермента, катализирующего биосинтез диутана, и таким ферментом является DpsG полимераза. В другом возможном варианте воплощения изобретения фермент, катализирующий биосинтез диутана, включает DpsG полимеразу и глюкозо-1-фосфат-тимидилилтрансферазу; dTDP-6-дезокси-D-глюкозо-3-5-эпимеразу; dTDP-D-глюкозо-4,6-дегидратазу и dTDP-6-дезокси-L-маннозодегидрогеназу. В ещ одном возможном варианте фермент, катализирующий биосинтез диутана, включает DpsG полимеразу и рамнозилтрансферазу IV; бета-1,4-глюкуронозилтрансферазу II; глюкозил-изопренилфосфаттрансферазуI и глюкозилтрансферазу III. В следующем возможном варианте фермент, катализирующий биосинтез диутана, включает dpsG полимеразу и транспортирующие полисахарид белки dpsD, dpsC и dpsE. В еще одном возможном варианте фермент, катализирующий биосинтез диутана, включает рамнозилтрансферазу IV; бета-1,4-глюкуронозилтрансферазу II; глюкозил-изопренилфосфаттрансферазу I; глюкозилтрансферазу III; глюкозо-1-фосфаттимидилилтрансферазу; dTDP-6-дезокси-D-глюкозо-3-5-эпимеразу;dTDP-D-глюкозо-4,6-дегидратазу и dTDP-6-дезокси-L-маннозодегидрогеназу. В большинстве случаев фермент, катализирующий биосинтез диутана, согласно способу настоящего изобретения и в рамках продукта изобретения может выбираться из группы, состоящей из полимеразы; лиазы; рамнозилтрансферазы IV; бета-1,4-глюкуронозилтрансферазы II; глюкозилтрансферазы III; транспортирующего полисахарид белка; секретирующего белка; глюкозил-изопренилфосфаттрансферазы I; глюкозо-1 фосфаттимидилилтрансферазы; dTDP-6-дезокси-D-глюкозо-3-5-эпимеразы; dTDP-D-глюкозо-4,6-дегидратазы; dTDP-6-дезокси-L-маннозодегидрогеназы и комбинаций перечисленного. Кроме того, настоящее-2 015170 изобретение включает выделенную молекулу нуклеиновой кислоты (в дополнение к ДНК, которая может присутствовать в хромосоме-мишени), которая кодирует по меньшей мере один фермент, катализирующий биосинтез диутана, как показано в SEQ ID NO: 5, 7, 9, 11, 13, 15, 17, 19, 19, 21, 23, 25, 27, 29, 31, 33,35, 37, 39, 41 и 43, или фермент, который по меньшей мере на 95% идентичен SEQ ID NO: 5, 7, 9, 11, 13,15, 17, 19, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41 и 43. Способ изобретения (а также получаемые им продукты) касается сфингановых камедей, в частности диутановых видов, включающих (но их перечень не ограничивается только названными здесь) S88,S60 и S657. Как отмечалось выше, настоящее изобретение является кульминационным пунктом разработки и реализации способа, в котором специфические последовательности ДНК, будучи введенными в многократных копиях в определенные штаммы Sphingomonas, могут обеспечить биосинтез в увеличенном объеме высоковязкого полисахарида диутана. Генно-инженерные (рекомбинантные) бактерии, содержащие гены, отвечающие за увеличенное производство диутана, продуцируют намного более высокие количества полисахарида диутана по сравнению с не генно-инженерными бактериями и обеспечивают его вышеупомянутую высокую конечную вязкость. ДНК-последовательности, которые вводятся в организм-хозяин (в любой хорошо известной форме,такой как плазмида, но перечень не ограничивается только названной формой) для увеличенной продукции и повышенной вязкости (за счет, как предполагается без ссылки на какую-либо конкретную научную теорию, увеличения молекулярной массы) в соответствии с настоящим изобретением, могут быть выделены, извлечены и клонированы известными из уровня техники методами. После этого ДНК вводится в бактерии рода Sphingomonas в многократных копиях (с помощью плазмиды или другим известным методом) или за счет увеличения экспрессии генов с помощью подходящего, например, более сильного промотора. После вставки в бактерию-мишень продуцирование диутана может определяться по ферментации генно-инженерных бактерий и сравнению выхода в рамках продуцируемого количества и продуцируемого качества. И увеличение продуцирования, и повышение вязкости может определяться сравнительной оценкой производства диутана способом изобретения и производства диутана с помощью дикого штамма (АТСС 53159), способного продуцировать диутан. Краткое описание чертежей На фиг. 1 схематично представлены изолированные гены, контролирующие биосинтез диутановой камеди; показаны предполагаемые или известные гены; показаны также фрагменты, встроенные в различные плазмиды; на фиг. 2 графически представлены результаты измерений внутренней (собственной) вязкости, показывающие е повышение при использовании материалов диутановой биокамеди согласно изобретению. Подробное описание изобретения В описании настоящего изобретения употребляются следующие термины, значение которых раскрывается ниже. Термин "Sphingomonas", используемый в описании, относится к штаммам грамотрицательных бактерий рода Sphingomonas. Термин "продуцент" или "увеличенное продуцирование", употребляемый в описании, описывает генно-инженерные бактерии, содержащие многократные копии последовательностей ДНК, выделенных из штамма таких бактерий, который продуцирует значительно более высокое (по меньшей мере примерно на 5 мас.% в пересчете на массу) количество полисахарида диутана по сравнению с бактериями дикого типа такого же штамма. Термин "выделенный, изолированный" употребляется для описания ДНК, которая была выделена из микроорганизма и подвергнута, по меньшей мере, в некоторой степени очистке, например одной или более стадиям очистки, и которую можно расщеплять ферментами рестриктазами, клонировать в многократных копиях или встраивать в плазмидные векторы либо каким-то иным образом вводить в бактерии. Термин "последовательность" употребляется для описания специфического фрагмента ДНК, который идентифицируется последовательностью нуклеотидов. Термин "встроенный" употребляется для описания процесса и эффективности переноса фрагментов ДНК, выделенных из хромосомальной ДНК способного продуцировать диутан штамма Sphingomonas, в штамм Sphingomonas (с помощью плазмиды,но перечень не ограничивается только этим примером). Эту выделенную ДНК можно ввести сначала (и в этом случае перечень не ограничивается только указанной возможностью) в требуемую плазмиду (в данном случае pLAFR3) хорошо известным из уровня техники методом, а затем перенести, например, конъюгацией или мобилизацией в бактерию-реципиент Sphingomonas. После введения в бактерию-реципиентSphingomonas плазмида, содержащая релевантную последовательность ДНК, будет многократно реплицироваться в клетке-реципиенте, обеспечивая несколько (по меньшей мере две, обычно от четырех до десяти) копий фрагмента ДНК, необходимого для увеличенного продуцирования полисахарида диутана с высокой вязкостью (обусловленной опять же, как предполагается, увеличением молекулярной массы). Применение конъюгации или мобилизации для переноса плазмидных векторов в бактерию-реципиент является достаточно эффективным в большинстве случаев. Можно применить также электропорацию-3 015170 или химическую трансформацию компетентных клеток очищенной ДНК. Для переноса ДНК в клеткухозяина можно использовать и другие векторы и бактериофаги. Нет необходимости в поддержании фрагментов ДНК на плазмидах (или других хорошо известных векторах-переносчиках) в продуцирующем диутан Sphingomonas-реципиенте. Общепринятой практикой является введение дополнительных копий фрагмента ДНК в бактериальную хромосому таким образом, чтобы механизм репликации фрагментов каждой генерацией был идентичен механизму репликации бактериальной ДНК. Альтернативно,усиленная экспрессия генов может достигаться за счет использования более сильных промоторов. Термин "амплификация генов" относится либо к увеличению копий генов, например клонированием генов-мишеней в мультикопийную плазмиду (например, от 4 до 10 копий) или встраиванием множественных копий (например, от 4 до 10) генов в бактериальный геном, либо, альтернативно, к усиленной экспрессии генов модификацией промотора для усиления экспрессии генов. Оба этих метода, как и другие, могут приводить к увеличению продукции кодированных белков. Термин "биосинтез" употребляется для описания биологического продуцирования или синтеза диутана бактериями Sphingomonas. Полисахарид диутан синтезируется из отдельных углеводных единиц последовательно в несколько стадий, контролируемых большим количеством бактериальных ферментов. Релевантная последовательность ДНК, которая вводится в бактерию-реципиент в любой выбранной форме (предпочтительно опять же, но не обязательно, в форме плазмиды), кодирует генетическую информацию, которая, как известно, является полезной или существенно важной для биосинтеза повышенного количества полисахарида диутана с увеличенной молекулярной массой. Тем не менее, дополнительно высказывается предположение (без ссылки на конкретную научную теорию), что последовательность ДНК согласно изобретению (такая как в плазмиде pS8) индуцирует не только увеличение производства диутана, но и увеличение числа повторяющихся единиц, полимеризующихся в отдельные полимеры самого диутана. В результате этого, как предполагается, указанное увеличение количества повторяющихся единиц приводит к увеличению конечной вязкости, удивительным образом обеспечиваемую диутановой камедью. Выдвинута гипотеза, что увеличение молекулярной массы обусловлено измеряемым увеличением истинной вязкости, которая связана с молекулярной массой, имеющей силу закона зависимостью. Для линейного полимера (каким является диутановая камедь) истинная вязкость, как известно, пропорциональна, по существу, молекулярной массе. Выделение релевантных последовательностей ДНК, которые составляют основу способа настоящего изобретения и которые генерируют увеличенную вязкость полисахарида диутана, осуществляется стандартными методами. Поэтому такие последовательности могут генерироваться из продуцирующего диутан штамма Sphingomonas, культивированного в стандартных условиях. Затем можно проводить экстракцию ДНК, например, путем начального центрифугирования и ресуспендирования бактериальных клеток и последующего элюирования ДНК через очищающие колонки. По окончании очистки выделенную ДНК можно расщепить рестрикционными эндонуклеазами и клонировать в требуемый плазмидный или другой вектор с последующим введением в штамм-реципиент. Можно использовать и другие методы, известные из уровня техники и не ограничивающие весь перечень методов. Клонирование ДНК в настоящем изобретении основано на общепринятых методиках и методах, которые стали стандартными в уровне техники. Следует заметить, что для клонирования фрагментов ДНК в соответствии с настоящим изобретением можно использовать любое число методов и что настоящее изобретение не ограничивается, например, только применением плазмидных клонирующих векторов. К примеру, фрагменты ДНК можно клонировать вставкой в вектор на основе бактериофага. Клонированные последовательности ДНК могут вводиться затем в штамм Sphingomonas с помощью плазмидного или другого вектора. Для продуцирования диутана ферментацией можно использовать затем генетически модифицированный штамм Sphingomonas. В основном подходящей питательной средой для ферментации является водная среда, которая обычно содержит источник углерода, такой как, например, углеводы, включающие глюкозу, лактозу, мальтозу или мальтодекстрины; источник азота, такой как, например, неорганический аммоний, неорганический нитрат, органические аминокислоты или белковые материалы, такие как гидролизованные дрожжи, соевая мука или казеин, экстракт барды или жидкий кукурузный экстракт, и неорганические соли. Производство диутанов в соответствии с настоящим изобретением может поддерживаться широким спектром разнообразных ферментационных питательных сред. Углеводы могут включаться в ферментационный бульон в варьирующих количествах, но обычно в количестве примерно от 1 до 10 мас.% (предпочтительно от 2 до 8%) ферментационной среды. Углеводы могут добавляться перед ферментацией или, альтернативно, в процессе ферментации. Количество азота может колебаться примерно от 0,01 до 0,4 мас.% водной питательной среды. Может использоваться только один источник углерода или источник азота, а также смеси этих источников. Из неорганических солей, которые могут найти применение в процессе ферментации бактерий Sphingomonas, можно назвать соли, которые содержат ионы натрия, калия, аммония, нитрата, кальция, фосфата, сульфата, хлорида,карбоната и аналогичные ионы. Преимущественно могут включаться также следовые количества таких металлов, как магний, марганец, кобальт, железо, цинк, медь, молибден, йодид и борат. Ферментация может проводиться при температурах примерно от 25 до 40 С, более предпочтитель-4 015170 ным является диапазон температур примерно от 27 до 35 С. Инокулят может приготовляться стандартными методами в объемной пропорции, включая культуры во встряхиваемых склянках и мелкомасштабную глубинную ферментацию в условиях перемешивания. Питательной средой для приготовления инокулята может служить производственная среда или любая из целого ряда стандартных питательных сред,хорошо известных из уровня техники, например бульон Luria или YM-среда. Для получения требуемого объема инокулята можно проводить более одной посевной стадии. Типичные объемы инокулята колеблются примерно от 0,5 до 10% общего конечного ферментационного объема. Ферментр может быть оборудован мешалкой для перемешивания содержимого. Ферментр может быть оборудован также автоматическими приборами контроля рН и пенообразования. Производственная среда может добавляться в ферментр и стерилизоваться в нем соответствующей тепловой обработкой. Альтернативно, источник углевода или источник углерода могут стерилизоваться по отдельности перед добавлением. Предварительно проращнный посевной материал может добавляться в охлажденную среду (в большинстве случаев предпочтительно при температуре ферментации примерно от 27 до 35 С), и перемешиваемая культура может ферментироваться в продолжение примерно от 48 до 110 ч до образования высоковязкого бульона. Полисахарид диутан может извлекаться из бульона стандартным методом осаждения спиртом, в большинстве случаев изопропанолом. Сведения, подтверждающие возможность осуществления изобретения Нижеследующие примеры приведены с целью иллюстрации настоящего изобретения. Описание примеров ни в коем случае не следует рассматривать как ограничивающее масштаб настоящего изобретения. Последовательность ДНК/создание плазмиды До проведения начального выделения и определения подходящей последовательности для описанных выше результатов изобретения была создана библиотека генов АТСС 53159 организма: из Sphingomonas sp. ATCC 53159 была выделена хромосомная ДНК и частично обработана Sau3AI рестрикционной эндонуклеазой. Фрагменты ДНК длиной от 15 до 50 kb (тысяч пар нуклеотидов) очищались из агарозного геля и лигировались в расщепленный BamHI, клонирующий вектор-космиду pLAFR3 (согласноsyrinae pv. Glycinea", J. Bacteriology, 1987, 169: 5789-94), выделенный из штамма Escherichia coli JZ279(согласно Harding et al., "Genetic and physical analysis of a cluster of genes essential for xanthan gum biosynthesis in Xanthomonas campestris", J. Bacteriology, 1987, 169: 2854-61). Реакции лигирования проводились в условиях упаковки вфаговые частицы (с использованием в качестве упаковки экстракта Gigapack IIIGold от фирмы Stratagene, La Jolla, CA) и трансформировались в Library Efficiency E. coli DH5MCR клетки (Life Technologies, Rockville, MD). Для формирования библиотеки генов был отобран пул из примерно 10000 устойчивых к тетрациклину колоний. Из этой библиотеки были выделены впоследствии отдельные последовательности. Работа, проведенная в настоящем примере, включала выделение специфических генов для биосинтеза полисахаридов из организма Sphingomonas ATCC 53159. Указанные гены для биосинтеза полисахаридов в типичных случаях идентифицируются комплементацией мутантов с нарушенной способностью к синтезу полисахаридов, в частности мутантов, блокированных на первом этапе, потерявших специфичность к гликозилтрансферазе I. Поскольку изначально не было в наличии дефектных, т.е. с нарушенной специфичностью к трансферазе I, мутантов АТСС 53159, комплементация дефектных, т.е. с нарушенной специфичностью к трансферазе I, мутантов Sphingomonas elodea и Xanthomonas campestris использовалась для идентификации генов, отвечающих за биосинтез полисахарида диутана. Плазмиду pLAFR3 можно переносить из организма-хозяина Е. coli в другие грамотрицательные бактерии путем конъюгации трех родительских групп с использованием вспомогательной (хелперной) плазмиды, которая придает IncP функции переноса (согласно Ditta et al., "Broadhost range DNA cloning system for gram-negative bacteria: construction of gene bank of Rhizobium meliloti",Proc. Natl. Acad. Sci. (1980), 77: 7347-51). Плазмиды типа RK2 имеют оцениваемое количество копий в Е. coli от пяти до семи на одну хромосому (Figurski et al., "Suppression of Co1E1 replication properties bythe IncP-1 plasmid RK2 in hybrid plasmids constructed in vitro", J. Mol. Biol. (1979), 133: 295-318). Библиотека генов АТСС 53159 хромосомной ДНК в Е. coli переносилась в немукоидный мутант(GPS2) S. elodea АТСС 31461 (конъюгацией трех родительских групп), выбранный за его устойчивость к тетрациклину и стрептомицину. В качестве хелперной использовалась плазмида pRK2013 (в штамме Е. coli JZ279), которая содержит ori-репликации для узкого спектра хозяев, но подходит для мобилизацииpLAFR3. Плазмида pRK2013 не реплицировалась в штаммах Sphingomonas. S. elodea АТСС 31461 продуцирует полисахарид геллан. И полисахарид геллан, и полисахарид диутан содержат одну и ту же повторяющуюся тетрасахаридную единицу, состоящую из [4)L-рамнозы-(13)D-глюкозы-(14)-глюкуроновой кислоты-(14)D-глюкозы-(1]. Однако диутан имеет также боковую цепочку, содержащую две молекулы рамнозы, присоединенные к одному из глюкозных остатков, и модифицируется ацетилом, в то время как геллан не имеет боковой цепочки сахаров и модифицируется ацетилом и глицерилом. Мутант GPS2 является дефектным на первом этапе биосинтеза полисахаридов, т.е. на этапе переноса глюкозо-1-фосфата из UDP-D-глюкозы в бактопренил-фосфат-липидный носитель ферментом глю-5 015170 козилтрансфераза I. Из чашек с тетрациклином были выделены продуцирующие полисахариды (мукоидные) колонии из общего фона немукоидных колоний. Клоны, восстанавливающие продуцирование полисахаридов, предположительно содержали ген АТСС 53159, кодирующий глюкозилтрансферазу I плюс примерно от 20 до 25 kb сопредельной ДНК. Плазмидная ДНК была выделена из восьми мукоидныхGPS2 трансконъюгатов и перенесена в штамм Е. coli DH5 (Life Technologies) электропорацией. Плазмиды были выделены из Е. coli с тем, чтобы получить количество ДНК, достаточное для двойного расщепления рестрикционными эндонуклеазами HindIII/EcoRI (которые расположены в полимере с двух сторон BamHI сайта) с целью изъятия ДНК-вставки из вектора. Размеры ДНК-ставки в клонах определяли гель-электрофорезом. Концевые последовательности нескольких плазмид определяли секвенированием от праймеров, специфичных к плазмидным последовательностям, фланкирующим BamHI участок вектора. Анализ последовательностей проводили путем сравнения их с последовательностями в компьютерных базах данных с использованием программного пакета BLASTX. Две из этих плазмид - pS8 и pS6 представлены на фиг. 1. Равным образом, библиотеку генов АТСС 53159 переносили в устойчивый к рифампицину, немукоидный, дефектный мутант X. campestris, утративший свою специфичность к трансферазе I (CXC109) (который описан Harding et al., см. ссылку выше), путем конъюгации трех родительских групп, отобранных по их устойчивости к тетрациклину и рифампицину. X campestris продуцирует полисахарид ксантан, синтез которого также инициируется переносом глюкозо-1-фосфата из UDP-Dглюкозы в бактопренил-фосфат-липидный носитель ферментом трансферазой I (Ielpi et al., "Sequentialassembly and polymerization of the polyprenol-linked pentasaccharide repeating unit of the xanthan polysaccharide in Xanthomonas campestris", J. Bacteriology (1993), 175: 2490-500). Плазмиды очищались из мукоидных трансконъюгатов, после чего определяли концевые последовательности, как описано выше. Две из этих плазмид - рХ 6 и рХ 4 - представлены на фиг. 1.S657 ДНК, клонированную в плазмиды pS8 и рХ 6, полностью секвенировали двунитевым секвенированием методом "Shotgun" на фирме Lark Technologies Inc., (Houston, TX). Далее проводили анализ этих последовательностей с целью идентификации генов, отвечающих за биосинтез диутана (показаны на фиг. 1). Функции генов определяли на основе их гомологии с другими генами в базах данных, в частности с опубликованными генами, отвечающими за биосинтез сфингана S-88 (такого, какой описан в вышеупомянутом патенте '516, выданном Pollock et al.), номер доступа в GenBank U51197, и геллана(GenBank AY217008 и AY220099). Были идентифицированы гены (фиг. 1), кодирующие трансферазы для четырех сахаров каркаса, и четыре гена, отвечающие за синтез dTDP-рамнозы. Гены, секретирующие полисахарид, были идентифицированы на основе гомологии их с генами, отвечающими за биосинтез других полисахаридов. Два гена кодируют белки, гомологичные белкам, участвующим в секреции белков. Два гена предположительно кодируют полимеразу и лиазу. Вставка в плазмиду рХ 6 содержала 17 генов, включая ген dpsB, кодирующий трансферазу I (которая инициирует первый этап в синтезе диутана), гены, отвечающие за секрецию, и четыре гена, отвечающие за синтез dTDP-рамнозы, но в ней отсутствовали гены, отвечающие за трансферазы II, III и IV, и гены, предположительно отвечающие за полимеразу и лиазу. Плазмида pS8 содержит 20 генов кластера генов dps, включая гены, отвечающие за все трансферазы четырех сахаров каркаса, четыре гена, отвечающие за синтез dTDP-рамнозы, и гены, отвечающие за секрецию полисахарида, включая гены, предположительно отвечающие за полимеразу и лиазу, но в ней отсутствовали гены с неизвестной функцией - orf6 и orf7. Плазмида pS6 содержит гены, отвечающие за секрецию и трансферазы четырех сахаров, но не имеет всех генов, отвечающих за синтезdTDP-рамнозы, или ген, отвечающий за полимеразу. Плазмида рХ 4 содержит только малую часть участка dps, но включает ген, кодирующий трансферазу I, и четыре гена, отвечающие за синтез dTDP-рамнозы, которых, по сообщению Pollock et al., вполне достаточно для достижения увеличенного продуцирования полисахарида в штаммах Sphingomonas. Получение штаммов Четыре плазмиды, описанные выше, вводились затем в штамм Sphingomonas ATCC No. 53159 конъюгацией трех родительских групп, как описано выше, с целью создания новых рекомбинантных(генно-инженерных) штаммов S657 (S657/pS8, S657/pS6, S567/pX6 и S657/pX4). Далее проводилась их ферментация, как описано выше, с тем, чтобы инициировать продуцирование биокамеди, как отмечается ниже. Все четыре плазмиды оказали полезный эффект на продуктивность получения диутана; однако плазмида pS8 удивительным образом обеспечила также и чрезвычайно сильное повышение вязкости диутана и увеличение его молекулярной массы. Обеспечена также последовательность ДНК плазмидыpS8 (26278 bps) (DNA Sequence No. 1); кодируемые гены перечислены в табл. 1 (см. ниже) и в виде диаграммы на фиг. 1. ДНК-вставка в плазмиду pS8 включает гены dpsG через rmlD и часть генов dpsS и orf7. В нижеследующей таблице генов приводится в основном перечень генов, представленных последовательностью ДНК-вставки в плазмиду pS8, как показано на фиг. 1.-6 015170 Таблица 1 Гены на плазмидной вставке pS8 Получение диутана Продуцирование диутана генно-инженерными содержащими плазмиду штаммами SphingomonasS657 в сравнении с диким штаммом S657 без плазмиды определяли в трех сериях опытов по ферментации в одной и той же жидкой питательной среде в ферментрах Applikon емкостью 20 л с перемешиванием и аэрацией. В случае штаммов, содержащих плазмиду, в процессе ферментации добавляли антибиотик тетрациклин в количестве 5 мг/л для сохранения плазмиды. KOH добавляли по мере необходимости для контроля рН. Проводились две стадии посева с переносами от 1 до 6% инокулята. Питательная среда, использовавшаяся для проведения ферментации, содержала кукурузную патоку в качестве источника углевода, источник усвояемого азота и соли. Нутриенты, которые можно использовать для ферментации, хорошо известны из уровня техники и включают углевод, например глюкозу, сахарозу, мальтозу или мальтодекстрины; источник азота, например источник неорганического азота, такой как аммоний или нитрат; источник органического азота, такой как аминокислоты, гидролизованный дрожжевой экстракт, соевый белок или жидкий кукурузный экстракт; и дополнительные соли, включающие, например,хлорид, фосфат, сульфат, кальций, медь, железо, магний, калий, натрий или цинк. Мерой конечного продуцирования диутана служили вязкость бульона и количество осажденных волокон. Вязкость ферментационных бульонов измерялась вискозиметром Брукфилда (Brookfield) при 60 об/мин с использованием шпинделя 4; результаты измерений представлены в табл. 2. По окончании ферментации в бульоны вводился хорошо известный фермент глюкоамилаза для гидролиза остаточных олигосахаридов из кукурузного экстракта. Затем из аликвоты бульона двумя объемами изопропилового спирта осаждалась наработанная диутановая камедь. Волокна собирались на фильтре и высушивались. В табл. 2 аббревиатура DWY означает общий выход осажденной биокамеди в пересчете на сухую массу после гидролиза избыточных олигосахаридов из кукурузного экстракта. Из данных табл. 2 четко видно, что повышенный выход целевого материала обусловлен присутст-7 015170 вием плазмид рХ 4, рХ 6, pS6 или pS8, несущих дополнительные копии генов, отвечающих за биосинтез диутана. Однако в случае плазмиды pS8 вкупе с увеличением выхода в пересчете на сухую массу было отмечено и неожиданное резкое повышение вязкости бульона, что указывает на наличие некоего фактора влияния на вязкость в дополнение к увеличению количества продуцируемого диутана. Таблица 2 Ферментация содержащих плазмиду штаммов Совершенно очевидно, что повышенный выход конечного материала обеспечивался любой из четырех присутствующих плазмид, в то время как плазмиды pS8 и pS6 обеспечили и неожиданно резкое увеличение вязкости бульона, что указывает также на высокое качество продукта. Поэтому далее определялось качество, т.е. вязкость, полученных продуктов диутановой камеди. Реология диутана в тестах на его применение Образцы полученной диутановой камеди анализировали на предмет их потенциального целевого применения в двух различных областях: в нефтедобывающей промышленности в качестве добавок для извлечения нефти и в производстве цемента в качестве добавок для удерживания влаги и быстрой садки. Нефтедобывающая промышленность в целом зависит от того, что обозначается термином тест на"вязкость в морской воде" (SWV) в качестве оценки приемлемой продуктивности камедей в извлечении нефти. Такой тест служит в основном показателем эффективности камеди для повышения вязкости в воде повышенной солености (для осуществления добычи с морского дна, например). Прогнозирование возможности использования полученной камеди как приемлемого модификатора вязкости в области нефтедобычи в большинстве случаев основывается на результатах теста на модификацию вязкости в композиции, аналогичной морской воде. Такую композицию "искусственная морская вода" получают путем размешивания 419,53 г морской соли (ASTM D-1141-52) в 9800 г деионизированной воды. Для проведения теста на вязкость в морской воде 0,86 г образца камеди добавляют к 307,0 г искусственной морской воды и перемешивают примерно при 11500 об/мин в универсальном смесителеFarm Multimixer (модель 9 В 5, номер изделия N5020) в течение 35 мин. По истечении 35 мин раствор охлаждают примерно до 26 С перед проведением измерений вязкости. Для получения показаний шкалы прибора при 3 об/мин образец помещают на платформу для образца Fann (модель 35 А; торсионная пружина МОС 34/35 F0.2b; отвес (маятник) В 1; ротор R1) и устанавливают скорость вращения 3 об/мин,переключив электродвигатель в положение низкой скорости и установив переключатель передач в среднее положение. Затем дают возможность показанию шкалы стабилизироваться, считывают значение напряжения сдвига со шкалы прибора и записывают его как показание шкалы (DR) SWV-3 об/мин. Для определения вязкости при 0,3 об/мин используют вискозиметр Брукфилда (вискозиметр Брукфилда LVDV-II или DV-II со шпинделем LV-2C). Скорость вращения шпинделя устанавливают на 0,3 об/мин и дают возможность шпинделю вращаться в течение по меньшей мере 6 мин, прежде чем снять показаниеSWV-0,3 об/мин и выразить его в сантипуазах (сП). Для определения пригодности для цементной промышленности проводится PEG LSRV тест (тест на определение вязкости при низкой скорости сдвига с использованием полиэтиленгликоля (PEG) в качестве дисперсанта, как указывается ниже), который обеспечивает информацию об эффективности применения модификатора вязкости в указанной промышленности. Указанный тест измеряет вязкость 0,25%-ного раствора биокамеди в стандартной водопроводной воде (STW). STW приготовляют путем добавления 10,0 г NaCl и 1,47 г CaCl2 Н 2 О к 10 л деионизированной воды. Для измерения вязкости 0,75 г биокамеди добавляют к 4,5 г полиэтиленгликоля 200 (CAS 25322-68-3) в лабораторном стакане на 400 мл и тщательно диспергируют. Затем 299 г STW добавляют в лабораторный стакан и перемешивают в течение примерно 4 ч с помощью пропеллерной мешалки с малым уклоном при 80020 об/мин. По окончании 4-часового перемешивания лабораторный стакан помещают на водяную баню 25 С и дают возможность содержимому стакана осесть без перемешивания в течение примерно 30 мин. После этого измеряют вязкость вискозиметром Брукфилда LV, оборудован-8 015170 ным 2.5+ торсионной пружиной (или аналогичным приспособлением, например, модели DVE 2.5+), при 3 об/мин с использованием шпинделя LV1, которому позволяют вращаться в течение 3 мин; измеренную вязкость выражают в сантипуазах (сП). Образцы полученного диутана тестировались именно таким образом; результаты тестирования были следующими. Таблица 3 Реология диутана из содержащих плазмиду штаммовLSRV = вязкость при низкой скорости сдвига Совершенно неожиданно было обнаружено определенное увеличение вязкости диутановых камедей изобретения, продуцируемых некоторыми генно-инженерными, содержащими плазмиды, штаммами. Однако самым удивительным было то, что рост вязкости SWV-3 об/мин в случае штамма с плазмидойpS8 составил 80%, в то время как в случае штамма с плазмидой рХ 6 он составил только 9,6% по сравнению с диким штаммом. Плазмиды pS6 и рХ 4 не привели к значительному увеличению вязкости. Равным образом тест на измерение SWV при более низкой скорости вращения (об/мин) выявил, по сравнению с диким штаммом, увеличение вязкости порядка 51,5% в случае плазмиды pS8 против немногим более 2% в случае плазмиды рХ 6. И, наконец, LSRV тест с полиэтиленгликолем показал, что плазмида pS8 привела к чрезмерному росту (77%) вязкости диутановой камеди по сравнению с камедью, продуцируемой диким штаммом (без плазмиды); плазмида рХ 6 обеспечила повышение вязкости менее чем на 16%,плазмида рХ 4 - на 7,2%, а плазмида pS6 не привела к значительному повышению вязкости. И опять эти неожиданные результаты тестов свидетельствуют о кардинальном улучшении получения диутановой камеди с использованием необходимой последовательности генов, встроенной в плазмиду pS8, как одного из способов введения такой последовательности в способную продуцировать диутан бактериюмишень. Таким образом, способ получения диутана согласно изобретению с введением pS8 показал удивительно высокие результаты измерения вязкости во всех трех тестах, в частности, по сравнению с дикими штаммами и штаммами с плазмидой рХ 6. Как и ожидалось, этот новый диутан функционировал чрезвычайно хорошо в типичных условиях нефтедобычи и цементной промышленности. Фундаментальное объяснение улучшения реологии диутана Вышеописанные примеры показали, что диутан, полученный из штамма S657/pS8, имел значительное улучшение реологических параметров. Это значительное увеличение вязкости при измерениях е в морской воде и при низкой скорости сдвига с PEG невозможно объяснить только повышением продуктивности, поскольку рХ 6 штамм также показал аналогичные результаты (если не более высокие) по выходу диутана. Фактически в описанном выше примере и относящейся к нему табл. 2 выход в пересчете на сухую массу (вещество, осажденное спиртом) увеличился на 8,0% при одновременном значительном большем росте реологических параметров в случае штамма S657/pS8 (от 52 до 80%). Было предпринято фундаментальное исследование с тем, чтобы выявить причины столь значительного улучшения реологии в случае штамма S657/pS8 по сравнению с диким штаммом. Внутренняя (собственная) вязкость - это хорошо известное понятие в науке о полимерах для выведения молекулярной массы макромолекул (Tanford С., 1961, Physical Chemistry of Macromolecules, JohnWileySons, New York). Внутреннюю вязкость получают путем построения кривых зависимости пониженной вязкости (вязкости, приведенной к концентрации) от концентрации раствора и экстраполирования данных линейной регрессией к нулевой концентрации (на у-оси графика). Полученные камеди удивительным образом обладали увеличенной внутренней вязкостью, что очевидно из нижеприведенной таблицы. Пять образцов диутана (два - от дикого штамма (контроль 1, контроль 2) и три - от S657/pS8 штамма (образец 1, образец 2, образец 3 оценивали по результатам анализов на внутреннюю вязкость, содержание нейтральных сахаров и органических кислот. Указанные образцы очищали осаждением спиртом, регидратировали, обрабатывали гипохлоритом, обрабатывали глюкоамилазой, обрабатывали лизо-9 015170 цимом и в заключение обрабатывали протеазой (в указанной последовательности). Затем их извлекали в соотношении СВМ:бульон = 4:1. СВМ - это азеотропная смесь изопропиловый спирт/вода, включающая 82 мас.% изопропилового спирта. Образцы тестировали на содержание влаги следующим образом: в основном две аликвоты (по 0,7 г) образца тестировали с применением галогенового влагомера Mettler HB. Затем результаты двух испытаний усредняли и вновь полученные результаты использовали для корректирования влажности. После получения данных влагосодержания готовился 0,2% раствор камеди в 0,01 М растворе NaCl с учетом скорректированной влажности. Для этих испытаний готовилось всего 200 г 0,2% раствора. Камедь взвешивали на аналитических весах с точностью до одной десятитысячной и добавляли в воду,взвешенную с точностью до одной тысячной. Образцы перемешивали в течение двух часов с помощью пропеллерной мешалки диаметром 2,5 дюйма (5,08 см), вращающейся со скоростью 1000 об/мин, в высоком лабораторном стакане на 400 мл. После начальной гидратации каждый образец разбавлялся до 0,02% с использованием 0,01 М раствора NaCl. Это осуществлялось взвешиванием 20 г 0,2% раствора в лабораторном стакане на 400 мл с последующим добавлением 180 мл разбавителя. Разбавленные образцы перемешивали в течение дополнительных 30 мин. Из этих образцов готовили окончательные разбавления, используемые непосредственно для определения внутренней вязкости. Каждый образец диутана оценивали при следующих концентрациях: 0,004, 0,008, 0,010 и 0,012%. Измерения вязкости проводили с применением системы Vilastic VE System. Перед измерениями проводили калибровка системы Vilastic водой с погрешностью менее 2,0%. Измерения вязкости образцов проводили с использованием таймер-программы (Timer program) при 2 Гц, напряжении 1 и скорости сдвига примерно 12 л/с; все измерения проводили при постоянной температуре 23 С. Для каждого образца проводили пять измерений, по результатам которых выводили усредненный показатель. Полученные усредненные показатели вязкости использовали для расчета внутренней вязкости. На фиг. 2 и в табл. 4 представлены окончательные результаты указанных испытаний. Таблица 4 Сравнительная оценка диутана на основе расчетов внутренней (собственной) вязкости Эти результаты показывают, что штамм S657/pS8 непрерывно продуцировал диутан со значительно более высокой внутренней вязкостью; фактически средняя пониженная вязкость в случае штаммов изобретения составила 165,2, в то время как в контроле - 140,7, при одинаковых во всех случаях уровнях содержания сухих веществ. Это открытие указывает на то, что диутан, продуцируемый штаммомS657/pS8, имеет и более высокую молекулярную массу, чем диутан, продуцируемый диким штаммом(контроль). На фиг. 2 графически представлены эти выявленные между контролем и штаммами изобретения тенденции, показывающие последовательное увеличение внутренней вязкости, измерения которой проводились во всех случаях при одинаковом содержании сухих веществ. Для установления идентичности составов диутановой камеди с повышенной вязкостью от штаммаS657/pS8 и диутановой камеди от дикого штамма проводили анализ на содержание в них нейтральных сахаров и органических кислот. Очищенные образцы, использовавшиеся для измерений внутренней вязкости, использовали и для анализа на нейтральные сахара. Аликвотное количество каждого очищенного образца подвергали гидролизу трифторуксусной кислотой (100 С/18 ч) до компонентов сахаров. Количественную оценку нейтральных сахаров в гидролизатах проводили методом анионообменной хроматографии высокого разрешения с импульсным амперометрическим детектором. Количественная оценка органических кислот в гидролизатах - методом ионоисключающей хроматографии высокого разрешения с детектором с химическим подавлением проводимости. В табл. 5 суммированы результаты анализа на нейтральные сахара. Как видно из табл. 5, профиль нейтральных сахаров в случае штамма S657/pS8 был почти идентичен профилю нейтральных сахаров в случае дикого штамма S657. Хотя результаты в обоих случаях отличались от теоретических значений, эти результаты указывают на то, что структура повторяющейся единицы диутановой камеди, продуцируемой с использованием плазмиды pS8, та же, что и в случае дикого штамма (т.е. без плазмиды), и что увеличение вязкости, сообщаемое материалом pS8, обусловлено более длинными цепочками, означающими увеличение молекулярной массы.- 10015170 Таблица 5 Анализ на нейтральные сахара и органические кислоты диутана, продуцируемого Значительно улучшенные показатели вязкости в морской воде и вязкости при низкой скорости сдвига с PEG для диутана, продуцируемого генно-инженерным штаммом S657/pS8, могут быть обусловлены увеличением молекулярной массы или длины диутановой молекулы, т.е. увеличением числа повторяющихся единиц в молекуле, а не изменением состава диутана и не изменением структуры самой повторяющейся единицы. Невозможно улучшить реологию только за счет увеличения количества продуцируемого диутана. Хотя оценке были подвергнуты все четыре плазмиды - pS6, pS8, рХ 4 и рХ 6 - с различными долями кластера генов, контролирующих биосинтез диутана, и все они показали некоторое увеличение продуктивности, но только плазмида pS8 показала неожиданное и очень сильное увеличение реологических параметров извлеченного диутанового продукта. Сравнительная оценка генов, отвечающих за биосинтез диутана, клонированных в тестируемые плазмиды, позволила сделать предположение, что геном, ответственным за увеличение молекулярной массы, по всей вероятности является ген dpsG, поскольку этот ген присутствует в pS8, а не в других плазмидах. Ген dpsG кодирует гидрофобный мембранный белок с сильно выраженной гомологией с другими мембранными белками, участвующими в синтезе полисахаридов. Часть белка является гомологичной белкам, специфичным к полимеразе, ферменту, который катализирует связывание повторяющихся единиц с образованием высокомолекулярного полисахарида. Было постулировано, что гомологичный генgelG в S60 функционирует как полимераза в синтезе геллана (Harding N.E. et al., 2004, "Organization ofBiotech., 31: 70-82; Sa-Correia I. et al., 2002, "Gellan gum biosynthesis in Sphingomonas paucimobilis ATCC 31461: Genes, enzymes and exopolysaccharide production engineering", J. Ind. Microbiol. Biotech., 29: 170176). Гомологи dpsG были также выделены из штаммов Sphingomonas ATCC 31554 и АТСС 21423, продуцирующих полисахариды S88 и S7 (Pollock et al., U.S. Patent Nos. 5854034, 5985623 и 6284516 и PollockT.J., U.S. Patent No. 6709845). Поэтому весьма вероятно, что дополнительные копии гена, отвечающего за полимеразу, могут оказывать влияние на увеличение длины молекулы диутана. Нельзя исключать того,что и другие гены кластера генов, контролирующих биосинтез диутана, могут потребоваться в комбинации с dpsG для достижения наблюдавшегося в тестах увеличения вязкости. Наиболее вероятными кандидатами являются гены dpsB, dpsL, dpsK и dpsQ, кодирующие трансферазы сахаров I, II, III и IV, в частности ген dpsB, который кодирует трансферазу I, добавляющую первый сахар повторяющейся единицы на липидный носитель. Другими наиболее важными генами могут быть dpsD, dpsC и dpsE, которые являются гомологами генов gumB и gumC, которые, как было показано, увеличивают молекулярную массу ксантана при амплификации на мультикопийной плазмиде. Возможно, что все гены, клонированные в плазмиду pS8, могут потребоваться для достижения резкого повышения вязкости. Хотя в настоящем описании изобретение раскрывается в некоторых предпочтительных вариантах его воплощения и практических условиях, сделано это не с целью ограничения изобретения указанными конкретными вариантами, а скорее с намерением подчеркнуть, что оно охватывает структурные эквиваленты и все альтернативные варианты и модификации, которые могут быть предприняты в масштабе прилагаемой формулы изобретения и эквивалентны ей. Депонирование штамма Следующий бактериальный штамм был депонирован 21 октября 2005 г. в патентном депозитарии при Американской коллекции типовых культур (Patent Depository at the American Type Culture Collection) по адресу: 10801 University Boulevard, Manassas, Va. 20110, в соответствии с Будапештским договором о международном признании депозита микроорганизмов (Budapest Treaty for the International Recognition of
МПК / Метки
МПК: C12P 19/04
Метки: камеди, способы, высоковязкие, получения, диутановые
Код ссылки
<a href="https://eas.patents.su/30-15170-vysokovyazkie-diutanovye-kamedi-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Высоковязкие диутановые камеди и способы их получения</a>
Предыдущий патент: Применение ингибиторов дипептидилпептидазы
Следующий патент: Лечение субъектов с хроническим заболеванием почек с применением соединений лантана
Случайный патент: Способ пломбирования зубов