Гибридные полипептиды с селектируемыми свойствами
Номер патента: 14647
Опубликовано: 30.12.2010
Авторы: Льюис Диана, Джодка Кэролин М., Соарес Кристофер Дж., Паркес Дэвид Г., Леви Одиль Эстер, Мэк Кристин М., Форуд Бехроуз Брюс, Д'соуза Лоуренс, Ханли Майкл Р., Гхош Соумитра С.
Формула / Реферат
1. Гибридный полипептид, проявляющий по крайней мере одну гормональную активность, где указанный гибридный полипептид содержит первый биоактивный модуль пептидного гормона, ковалентно связанный по крайней мере с одним дополнительным биоактивным модулем пептидного гормона; где
биоактивные модули пептидного гормона независимо выбраны из группы, состоящей из сложных пептидных гормонов, фрагментов сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, аналогов и производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, фрагментов аналогов и производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, и пептидных энхансеров;
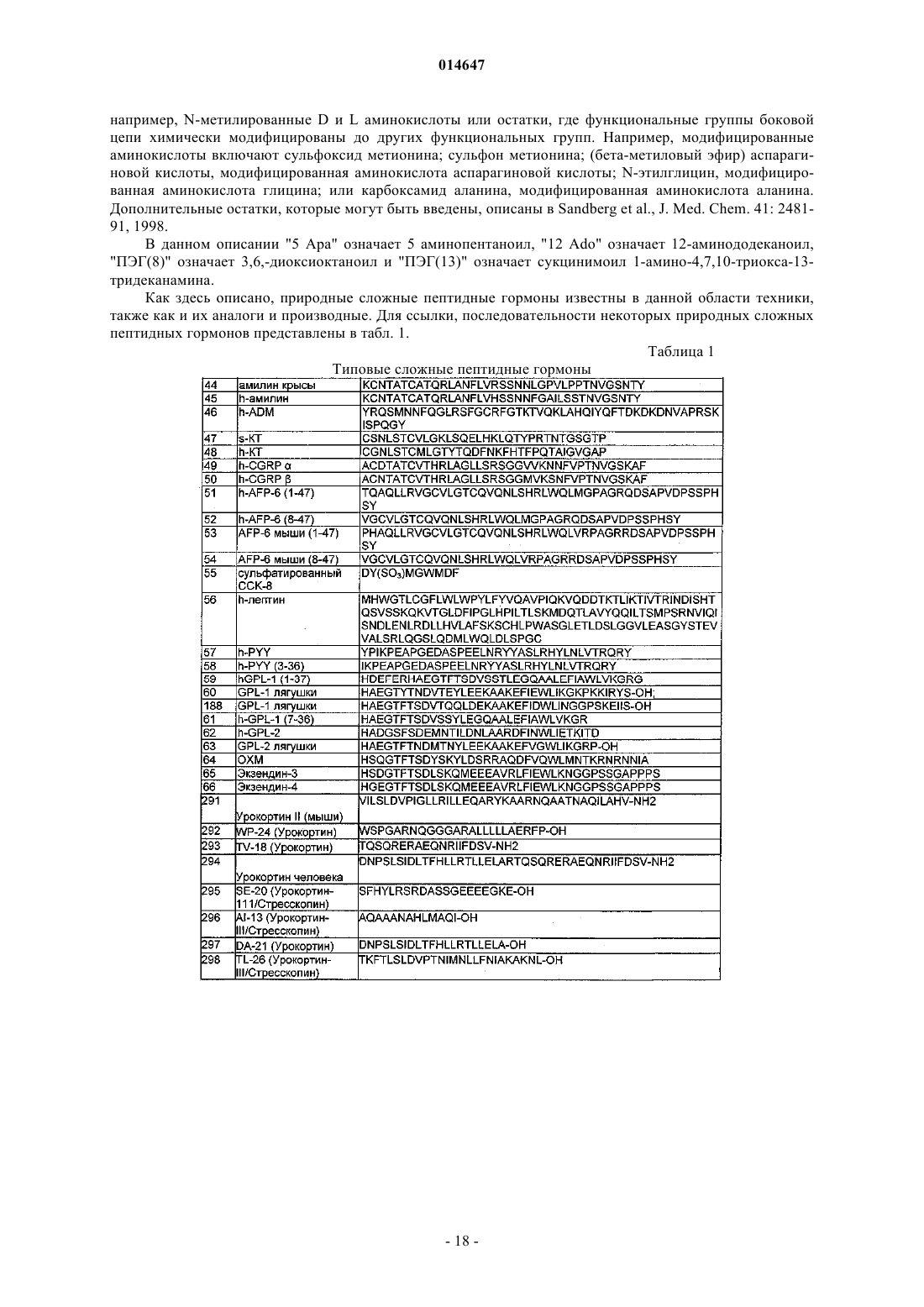
сложные пептидные гормоны независимо выбраны по крайней мере из двух из группы, состоящей из амилина, адреномедуллина (ADM), кальцитонина (СТ), пептида, кодируемого геном кальцитонина (CGRP), интермедина, холецистокинина (CCK), лептина, пептида YY (PYY), глюкагоноподобного пептида-1 (GPL-1), глюкагоноподобного пептида 2 (GPL-2), оксинтомодулина (ОХМ), натрийуретического пептида, пептида семейства урокортинов, например Ucn-2 и Ucn-3, пептида семейства нейромединов, например нейромедина U25 или сплайсированного варианта, и ANP, BNP, CNP или уродилатина и экзендина-4;
пептидные энхансеры независимо выбраны из группы, состоящей из структурных мотивов сложных пептидных гормонов, которые придают гибридному полипептиду желаемую химическую стабильность, конформационную стабильность, метаболическую стабильность, биодоступность, направленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание с белком плазмы или другую фармакокинетическую характеристику, и структурных мотивов аналогов и производных сложных пептидных гормонов, которые придают гибридному полипептиду желаемую химическую стабильность, конформационную стабильность, метаболическую стабильность, биодоступность, направленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание с белком плазмы или другую фармакокинетическую характеристику; и
по крайней мере один из биоактивных модулей пептидного гормона проявляет по крайней мере одну гормональную активность сложного пептидного гормона.
2. Гибридный полипептид по п.1, где пептидные энхансеры независимо выбраны из группы, состоящей из амилина (32-37) (SEQ ID NO: 242), амилина (33-37) (SEQ ID NO: 243), амилина (34-37) (SEQ ID NO: 244), амилина (35-37), амилина (36-37), амилина (37), ADM (47-52) (SEQ ID NO: 245), ADM (48-52) (SEQ ID NO: 246), ADM (49-52) (SEQ ID NO: 247), ADM (50-52), ADM (51-52), ADM (52), CT (27-32) (SEQ ID NO: 248), CT (27-32) (SEQ ID NO: 248), CT (28-32) (SEQ ID NO: 249), CT (29-32) (SEQ ID NO: 250), CT (30-32), CT (31-32), CT (32), CGRP (32-37) (SEQ ID NO: 251), CGRP (33-37) (SEQ ID NO: 252), CGRP (34-37) (SEQ ID NO: 253), CGRP (35-37), CGRP (36-37), CGRP (37), интермедина (42-47) (SEQ ID NO: 254), интермедина (43-47) (SEQ ID NO: 255), интермедина (44-47) (SEQ ID NO: 256), интермедина (45-47), интермедина (46-47), интермедина (47), PYY (25-36) (SEQ ID NO: 257), PYY (26-36) (SEQ ID NO: 258), PYY (27-36) (SEQ ID NO: 259), PYY (28-36) (SEQ ID NO: 260), PYY (29-36) (SEQ ID NO: 261), PYY (30-36) (SEQ ID NO: 262), PYY (31-36) (SEQ ID NO: 263), PYY (32-36) (SEQ ID NO: 264), PYY (25-35) (SEQ ID NO: 265), PYY (26-35) (SEQ ID NO: 266), PYY (27-35) (SEQ ID NO: 267), PYY (28-35) (SEQ ID NO: 268), PYY (29-35) (SEQ ID NO: 269), PYY (30-35) (SEQ ID NO: 270), PYY (31-35) (SEQ ID NO: 271), PYY (32-35) (SEQ ID NO: 272), GPL-1 (29-37) лягушки (SEQ ID NO: 273), GPL-1 (30-37) лягушки (SEQ ID NO: 274), GPL-2 (24-31) лягушки (SEQ ID NO: 275), экзендина-4 (31-39) (SEQ ID NO: 277), экзендина-4 (32-39) (SEQ ID NO: 278), экзендина-4 (33-39) (SEQ ID NO: 279), экзендина-4 (34-39) (SEQ ID NO: 280), экзендина-4 (35-39) (SEQ ID NO: 281), экзендина-4 (36-39) (SEQ ID NO: 282), экзендина-4 (37-39), экзендина-4 (38-39), экзендина-4 (39) и их аналогов.
3. Гибридный полипетид по п.1, где по крайней мере один из первых биоактивных модулей пептидного гормона или по крайней мере один из дополнительных биоактивных модулей пептидного гормона является сложным пептидным гормоном или фрагментом сложного пептидного гормона, который проявляет по крайней мере одну гормональную активность сложного пептидного гормона.
4. Гибридный полипептид по п.1, где по крайней мере один из первых биоактивных модулей пептидного гормона или по крайней мере один из дополнительных биоактивных модулей пептидного гормона является аналогом или производным сложного пептидного гормона, который проявляет по крайней мере одну гормональную активность, или фрагментом аналога или производного сложного пептидного гормона, который проявляет по крайней мере одну гормональную активность сложного пептидного гормона.
5. Гибридный полипептид по п.1, где по крайней мере один из первых биоактивных модулей пептидного гормона или по крайней мере один дополнительный биоактивный модуль пептидного гормона является пептидным энхансером.
6. Гибридный полипептид по п.1, где сложные пептидные гормоны независимо выбраны из группы, состоящей из амилина, кальцитонина, CCK, PYY, пептида семейства урокортинов, пептида семейства нейромединов и ANP, BNP, CNP или уродилатина и экзендина-4.
7. Гибридный полипептид по п.1, где по крайней мере один биоактивный модуль пептидного гормона, который проявляет по крайней мере одну гормональную активность, расположен в N-концевой части гибридного полипептида.
8. Гибридный полипептид по п.7, где по крайней мере один биоактивный модуль пептидного гормона, который проявляет по крайней мере одну гормональную активность, расположенный в N-концевой части гибридного полипептида, ориентирован в направлении от С-концевой области к N-концевой области.
9. Гибридный полипептид по п.8, где N-концевая часть гибридного полипептида амидирована.
10. Гибридный полипептид по п.1, где по крайней мере один биоактивный модуль пептидного гормона, который проявляет по крайней мере одну гормональную активность, расположен в С-концевой части гибридного полипептида.
11. Гибридный полипептид по п.10, где С-концевая область гибридного полипептида амидирована.
12. Гибридный полипептид по п.1, где С-концевая область одного биоактивного модуля пептидного гормона присоединена непосредственно к N-концевой области другого биоактивного модуля пептидного гормона с образованием ковалентной связи.
13. Гибридный полипептид по п.1, где биоактивные модули пептидного гормона ковалентно соединены с применением одной или нескольких линкерных групп, независимо выбранных из группы, состоящей из алкилов; ПЭГ дикарбоновых кислот; аминокислот; полиаминокислот; бифункциональных линкеров; аминокапроила (Аса), Gly, b-аланила, 8-амино-3,6-диоксаоктаноила и Gly-Lys-Arg (GKR).
14. Гибридный полипептид по п.1, где первый биоактивный модуль пептидного гормона выбран из группы, состоящей из экзендина-4, фрагмента экзендина-4, который проявляет по крайней мере одну гормональную активность, аналога или производного экзендина-4, который проявляет по крайней мере одну гормональную активность, и фрагмента аналога экзендина-4, который проявляет по крайней мере одну гормональную активность; и по крайней мере один дополнительный биоактивный модуль пептидного гормона независимо выбраны из группы, состоящей из амилина, фрагмента амилина, который проявляет по крайней мере одну гормональную активность, аналога или производного амилина, который проявляет по крайней мере одну гормональную активность, или фрагмента аналога амилина, который проявляет по крайней мере одну гормональную активность, CCK, фрагмента CCK, который проявляет по крайней мере одну гормональную активность, аналога или производного CCK, который проявляет по крайней мере одну гормональную активность, фрагмента аналога CCK, который проявляет по крайней мере одну гормональную активность, СТ, фрагмента СТ, который проявляет по крайней мере одну гормональную активность, аналога или производного СТ, который проявляет по крайней мере одну гормональную активность, фрагмента аналога СТ, который проявляет по крайней мере одну гормональную активность, и пептидного энхансера.
15. Гибридный полипептид по п.14, где первый биоактивный модуль пептидного гормона выбран из группы, состоящей из экзендина-4, зкзендина-4 (1-27) (SEQ ID NO: 236), экзендина-4 (1-28) (SEQ ID NO: 237), 14Leu,25Phe-экзендина-4 (1-28) (SEQ ID NO: 284); 5Ala,14Leu,25Phe-экзендина-4 (1-28) (SEQ ID NO: 240) и 14Leu-экзендина-4 (1-28) (SEQ ID NO: 190); и по крайней мере один дополнительный биоактивный модуль пептидного гормона независимо выбран из группы, состоящей из 25,28,29Pro-h-амилина (SEQ ID NO: 67), амилина (1-7) (SEQ ID NO: 217), 2,7Ala-амилина (1-7) (SEQ ID NO: 285), sCT (8-10), sCT (8-27) (SEQ ID NO: 288), 11,18Arg-sCT (8-27) (SEQ ID NO: 289), 14Glu, 11,18Arg-sCT (8-27) (SEQ ID NO: 286), CCK-8, Phe2CCK-8 (SEQ ID NO: 287), амилина (33-37) (SEQ ID NO: 243), PYY (25-36) (SEQ ID NO: 257), PYY (30-36) (SEQ ID NO: 262) и PYY (31-36) (SEQ ID NO: 263).
16. Гибридный полипептид по п.14, где гибридный полипептид содержит по крайней мере три биоактивных модуля пептидного гормона.
17. Гибридный полипептид по п.14, где гибридный полипептид содержит по крайней мере четыре биоактивных модуля пептидного гормона.
18. Гибридный полипептид по п.14, где первый биоактивный модуль пептидного гормона расположен в С-концевой области гибридного полипептида и по крайней мере один дополнительный биоактивный модуль пептидного гормона расположен в N-концевой области гибридного полипептида.
19. Гибридный полипептид по п.14, где первый биоактивный модуль пептидного гормона расположен в N-концевой области гибридного полипептида и по крайней мере один дополнительный биоактивный модуль пептидного гормона расположен в С-концевой области гибридного полипептида.
20. Гибридный полипептид по п.1, где первый биоактивный модуль пептидного гормона выбран из группы, состоящей из амилина, фрагмента амилина, который проявляет по крайней мере одну гормональную активность, аналога или производного амилина, который проявляет по крайней мере одну гормональную активность, и фрагмента аналога амилина, который проявляет по крайней мере одну гормональную активность; и по крайней мере один дополнительный биоактивный модуль пептидного гормона представляет собой пептидный энхансер, независимо выбранный из группы, состоящей из PYY (25-36) (SEQ ID NO: 257), PYY (26-36) (SEQ ID NO: 258), PYY (27-36) (SEQ ID NO: 259), PYY (28-36) (SEQ ID NO: 260), PYY (29-36) (SEQ ID NO: 261), PYY (30-36) (SEQ ID NO: 262), PYY (31-36) (SEQ ID NO: 263), PYY (32-36) (SEQ ID NO: 264), PYY (25-35) (SEQ ID NO: 265), PYY (26-35) (SEQ ID NO: 266), PYY (27-35) (SEQ ID NO: 267), PYY (28-35) (SEQ ID NO: 268), PYY (29-35) (SEQ ID NO: 269), PYY (30-35) (SEQ ID NO: 270), PYY (31-35) (SEQ ID NO: 271), PYY (32-35) (SEQ ID NO: 272) и их аналогов.
21. Гибридный полипептид, проявляющий по крайней мере одну гормональную активность, где указанный гибридный полипептид содержит первый биоактивный модуль пептидного гормона, ковалентно связанный со вторым биоактивным модулем пептидного гормона; где
биоактивные модули пептидного гормона независимо выбраны из группы, состоящей из сложных пептидных гормонов, фрагментов сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, аналогов и производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, фрагментов аналогов и производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, и пептидных энхансеров;
сложные пептидные гормоны независимо выбраны по крайней мере из двух из группы, состоящей из амилина, PYY и экзендина-4;
пептидные энхансеры независимо выбраны из группы, состоящей из структурных мотивов сложных пептидных гормонов, которые придают гибридному полипептиду желаемую химическую стабильность, конформационную стабильность, метаболическую стабильность, биодоступность, направленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание с белком плазмы или другую фармакокинетическую характеристику, и структурных мотивов аналогов или производных сложных пептидных гормонов, которые придают гибридному полипептиду желаемую химическую стабильность, конформационную стабильность, метаболическую стабильность, биодоступность, направленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание с белком плазмы или другую фармакокинетическую характеристику; и
по крайней мере один из биоактивных модулей пептидного гормона проявляет по крайней мере одну гормональную активность сложного пептидного гормона.
22. Гибридный полипептид по п.21, где гибридный полипептид содержит сочетания биоактивных модулей пептидного гормона, выбранные из группы, состоящей из экзендина-4/PYY, PYY/экзендина-4, экзендина/амилина, амилина/экзендина, амилина/PYY и PYY/амилина биоактивных модулей пептидного гормона.
23. Гибридный полипептид, проявляющий по крайней мере одну гормональную активность, где указанный гибридный полипептид содержит первый биоактивный модуль пептидного гормона, ковалентно связанный по крайней мере с вторым биоактивным модулем пептидного гормона; где
биоактивные модули пептидного гормона независимо выбраны из группы, состоящей из сложных пептидных гормонов, фрагментов сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, аналогов и производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, фрагментов аналогов и производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, и пептидных энхансеров;
первый сложный пептидный гормон содержит лептин;
по крайней мере один второй биоактивный модуль пептидного гормона содержит полипептид, независимо выбранный из экзендина или GPL1; и
по крайней мере один из биоактивных модулей пептидного гормона проявляет по крайней мере одну гормональную активность его сложного пептидного гормона.
24. Гибридный полипептид по п.23, где модуль пептидного гормона лептина содержит полипептид, выбранный из группы, состоящей из лептина, фрагментов лептина, которые проявляют по крайней мере одну гормональную активность, аналогов и производных лептина, которые проявляют по крайней мере одну гормональную активность, и фрагментов аналогов и производных лептина, которые проявляют по крайней мере одну гормональную активность.
25. Гибридный полипептид по п.23, где модуль пептидного гормона лептина содержит полипептид, выбранный из группы, состоящей из лептина, фрагментов лептина, которые проявляют по крайней мере одну гормональную активность, аналогов и производных лептина, которые проявляют по крайней мере одну гормональную активность, фрагментов аналогов и производных лептина, которые проявляют по крайней мере одну гормональную активность, и где по крайней мере один модуль пептидного гормона экзендина содержит полипептид, выбранный из группы, состоящей из экзендина-4, фрагмента экзендина-4, который проявляет по крайней мере одну гормональную активность, аналога или производного экзендина-4, который проявляет по крайней мере одну гормональную активность, и фрагмента аналога экзендина-4, который проявляет по крайней мере одну гормональную активность.
26. Гибридный полипептид по п.23, где экзендин выбран из группы, состоящей из экзендина-4, 14Leu,25Phe-экзендина-4, 5Ala, 14Leu,25Phe-экзендина-4, 14Leu,22Ala,25Phe-экзендина-4 и их активных фрагментов.
27. Способ лечения пациента, страдающего заболеванием или нарушением обмена веществ, включающий введение пациенту терапевтически эффективного количества гибридного полипептида по п.23.
28. Способ по п.27, где заболеванием или нарушением обмена веществ являются диабет, диабет 1 типа, диабет 2 типа, ожирение, гипертония, атеросклероз, дислипидемия, застойная сердечная недостаточность, инсульт, гиперхолестеринемия, сердечно-сосудистое заболевание, ишемия миокарда, реперфузия миокарда, нарушения питания, диабет при беременности, диабетическая невропатия, легочная гипертензия или заболевания, связанные с недостаточной массой бета-клеток поджелудочной железы.
29. Гибрид по любому из пп.1-26, где гибрид не является гибридом, описанным в WO 2005/077072.
30. Способ по пп.27, 28, где гибрид не является гибридом, описанным в WO 2005/077072.
Текст
Данное изобретение главным образом относится к новым, селектируемым гибридным полипептидам, пригодным в качестве агентов для лечения и профилактики заболеваний и нарушений обмена веществ, которые могут быть облегчены контролем уровней глюкозы плазмы, секреции инсулина и/или секреции инсулина, таких как диабет и связанные с диабетом состояния. Такие состояния и нарушения включают, но не ограничены ими, гипертонию, дислипидемию, сердечно-сосудистое заболевание, нарушения питания, резистентность к инсулину, ожирение и сахарный диабет любого типа, включая тип 1, тип 2 и диабет при беременности. Леви Одиль Эстер, Ханли Майкл Р.,Джодка Кэролин М., Льюис Диана, Соарес Кристофер Дж., Гхош Соумитра С.,Д'Соуза Лоуренс, Паркес Дэвид Г., Мэк Кристин М., Форуд Бехроуз Брюс (US) 014647 Родственные заявки По заявке на данный патент испрашивается приоритет по принадлежащей нескольким владельцам предварительной заявке на патент США 11/201664, поданной 11 августа 2005 г., и по USSN 11/206903,поданной 17 августа 2005 г., обе из которых озаглавлены "Гибридные полипептиды с селектируемыми свойствами", и USSN 11/301744, поданной 12 декабря 2005 г., которые все полностью включены в настоящее описание в качестве ссылок. Бумажная копия списка последовательностей и машиночитаемая форма списка последовательностей на двух компакт-дисках, озаглавленных "Список последовательностей, копия 1" и "Список последовательностей, копия 2", каждый из которых содержит файл размером 216 KB, обозначенный "0701WO2Seqlst 10-26-06.txt", созданный 26 октября 2006 г., также включены в настоящее описание в качестве ссылки. Область техники Данное изобретение относится к пептидной химии, более конкретно к гибридным полипептидам с селектируемыми свойствами. Уровень техники Основным во многих заболеваниях обмена веществ и нарушениях является регулирование уровней инсулина и уровней глюкозы в крови. Секреция инсулина частично модулируется гормонами, усиливающими секрецию, названными инкретинами, которые вырабатываются энтероэндокринными клетками. Гормон инкретин, глюкагоноподобный пептид-1 ("GPL-1") представляет собой пептидный гормон,секретируемый клетками кишечника, который, как показали многочисленные исследования, оказывает усиливающее действие на секрецию инсулина. GPL-1 вырабатывается из проглюкагона в кишечнике и усиливает вызванное питательными веществами выделение инсулина (Krcymann В., et al., Lancet, 2: 1300-1303 (1987. Известно, что различные усеченные формы GPL-1 стимулируют секрецию инсулина(инсулинотропное действие) и образование цАМФ [см., например, Mojsov, S., Int. J. Pep. Pro. Res., 40: 333-343 (1992)]. Установлена взаимосвязь между различными лабораторными экспериментами in vitro и инсулинотропными реакциями у млекопитающих, особенно человека, на экзогенное введение GPL-1,GPL-1 (7-36) амида (SEQ ID NO: 61) и GPL-1 (7-37) кислоты (SEQ ID NO: 204) (см., например, Nauck, M.GPL-1 (7-36) амид (SEQ ID NO: 61) оказывает выраженное антидиабетогенное действие у больных инсулинозависимым диабетом посредством стимулирования чувствительности к инсулину и посредством усиления вызываемого глюкозой выделения инсулина в физиологических концентрациях (GutniakM., et al., New Eng. J. Med., 326: 1316-1322 (1992. При введении больным неинсулинозависимым диабетом GPL-1 (7-36) амид (SEQ ID NO: 61) стимулирует выделение инсулина, снижает секрецию глюкагона,ингибирует опорожнение желудка и улучшает утилизацию глюкозы (Nauck, 1993; Gutniak, 1992; Nauck,1993). Однако применение молекул типа GPL-1 для длительного лечения диабета осложнено из-за того,что период полувыведения в сыворотке для таких пептидов слишком короткий. Более конкретно, GPL-1 представляет собой пептид из 30 аминокислот, полученный из проглюкагона, прогормона из 160 аминокислот. Действия различных конвертаз прогормона в поджелудочной железе и кишечнике приводит к образованию глюкагона и других недостаточно определенных пептидов, в то время как расщепление проглюкагона вызывает образование GPL-1 и GPL-2, а также двух других пептидов. Последовательность аминокислот GPL-1 является на 100% гомологичной для всех изученных на данный момент млекопитающих, что означает критическую физиологическую роль. GPL-1 (7-37) кислоту подвергают С-концевому усечению и амидируют с получением GPL-1 (7-36) NH2 (SEQ ID NO: 61). Биологические эффекты и метаболическое обновление свободной кислоты GPL-1 (7-37) ОН (SEQ ID NO: 204) и амида, GPL-1 (7-36) NH2 (SEQ ID NO: 61), являются неразличимыми. При превращении нумерация аминокислот основана на полученном из проглюкагона GPL-1 (1-37) ОН (SEQ ID NO: 59). Биологически активный GPL-1 является результатом дальнейшей обработки: GPL-1 (7-36) NH2 (SEQ ID NO: 61). Таким образом, первой аминокислотой GPL-1 (7-37) ОН (SEQ ID NO: 204) или GPL-1 (7-36) NH2 (SEQ IDNO: 61) является 7His. В желудочно-кишечном тракте GPL-1 продуцируется L-клетками слизистой кишечника, толстой кишки и прямой кишки в ответ на стимулирование внутрипросветной глюкозой. Период полувыведения активного GPL-1 в плазме составляет 5 мин, скорость его метаболического клиренса составляет около 12-13 мин (Hoist, Gastroenterology 107(6): 1848-55 (1994. Основной протеазой, вовлеченной в метаболизм GPL-1, является дипептидилпептидаза (DPP) IV (CD26), которая расщепляет N-концевой дипептидID NO: 206), которые описываются различным образом как неактивные, слабые агонисты или антагонисты рецептора GPL-1. Рецептор GPL-1 (GPL-1R) представляет собой сопряженный с G белком рецептор из 463 аминокислот и локализуется в бета-клетках поджелудочной железы, в легких, и, в меньшей степени, в мозге, жировой ткани и почках. Стимуляция GPL-1R с помощью GPL-1 (7-37) ОН (SEQ ID NO: 204) или GPL-1 (7-36) NH2 (SEQ ID NO: 61) приводит к активации аденилатциклазы, синтезу цАМФ, деполяризации мембраны, увеличению внутриклеточного кальция и увеличению вызванной глюкозой секрецииGPL-1 является эффективным стимулятором секреции инсулина, который секретируется слизистой кишечника в ответ на потребление пищи. Сложное инкретиновое действие GPL-1 недооценивается из-за того, что мыши, нокаутные по GPL-1R, не переносят глюкозу. Инкретиновая реакция на внутривенное вливание GPL-1 сохраняется у пациентов с диабетом, хотя инкретиновая реакция на пероральную глюкозу у таких пациентов является нарушенной. Введение GPL-1 вливанием или подкожными инъекциями регулирует уровни глюкозы в плазме натощак у пациентов с диабетом и поддерживает пороговый уровень глюкозы для секреции инсулина (Gutniak et al., N. Engl. J. Med. 326: 1316-22 (1992); Nauck et al., Diabet. Med. 13:(9 Suppl 5):S39-S43 (1996); Nauck et al., J. Clin. Endocrinol. Metab. 76:912-917 (1993. GPL-1 обладает огромным потенциалом в качестве терапевтического агента, способного увеличивать секрецию инсулина физиологическим образом, избегая при этом гипогликемии, характерной для лекарственных средств на основе сульфонилмочевины. Другими важными воздействиями GPL-1 на гомеостаз глюкозы является подавление секреции глюкагона и ингибирование двигательной функции желудка. Ингибирующие действия GPL-1 на секрецию глюкагона альфа-клетками поджелудочной железы ведет к снижению вырабатывания глюкозы в печени через снижение глюконеогенеза и гликогенолиза. Такое антиглюкагоновое действие GPL-1 сохраняется у пациентов с диабетом. Так называемый эффект торможения подвздошной кишки, оказываемый GPL-1, при котором ингибируется двигательная функция желудка и желудочная секреция, достигается через вагусные эфферентные рецепторы или через непосредственное воздействие на гладкие мышцы кишечника. Снижение желудочной секреции с помощью GPL-1 способствует возникновению латентной фазы в усвоении питательных веществ, что позволяет избежать необходимости в быстрой инсулиновой реакции. В общем, действие GPL-1 на желудочно-кишечный тракт значительно способствует замедлению абсорбции глюкозы и жирной кислоты и модулирует секрецию инсулина и гомеостаз глюкозы. Также было показано, что GPL-1 воздействует на гены, специфичные к бета-клеткам, такие как транспортер GLUT-1, инсулин (через взаимодействие PDX-1 с промотором гена инсулина) и гексокиназа-1. Таким образом, GPL-1 предположительно может отменять непереносимость глюкозы, обычно связанную со старением, что показали эксперименты на грызунах. Кроме того, GPL-1 может способствовать неогенезу бета-клеток и увеличивать массу бета-клеток, в дополнение к восстановлению функции бетаклеток во время состояний недостаточности бета-клеток. Центральное действие GPL-1 включает усиление чувства сытости при одновременном снижении потребления пищи, достигаемое через действие GPL-1R в гипоталамусе. Непрерывное 48-часовое подкожное вливание GPL-1 больным диабетом типа II снижает чувство голода и количество потребляемой пищи и усиливает чувство сытости. Также анорексические действия отсутствует у нокаутных по GPL-1R мышей. Экзендины представляют собой другое семейство пептидов, вовлеченных в секрецию инсулина. Экзендины найдены в слюне ящериц-ядозубов, ящериц, которые водятся в Аризоне, и мексиканских ядозубов. Экзендин-3 присутствует в слюне ящериц эскорпионов, и экзендин-4 присутствует в слюне ящериц Жилатье (Eng, J., et al., J. Biol. Chem., 265:20259-62, 1990; Eng., J., et al., J. Biol. Chem., 267:7402-05(1992. Экзендины имеют некоторое сходство последовательности с некоторыми членами семейства глюкагоноподобных пептидов, при этом самая высокая идентичность, 53%, обнаружена для GPL-1(Goke, et al., J. Biol. Chem., 268:19650-55 (1993. Экзендин-4 связывает рецепторы GPL-1 на секретирующих инсулин клетках TCl, на диспергированных ацинарных клетках поджелудочной железы морских свинок, и на париетальных клетках желудка; пептид также стимулирует высвобождение соматостатина и ингибирует высвобождение гастрина в изолированных желудках (Goke, et al., J. Biol. Chem., 268:19650-55 (1993); Schepp, et al., Eur. J. Pharmacol.,69:183-91 (1994); Eissele, et al., Life Sci., 55:629-34 (1994. Было обнаружено, что экзендин-3 и экзендин 4 связывают рецепторы GPL-1 на, стимулируют образование цАМФ в, и высвобождение амилазы из ацинарных клеток поджелудочной железы (Malhotra, R., et al., Relulatory Peptides, 41:149-56 (1992);Raufman, et al., J. Biol. Chem., 267:21432-37 (1992); Singh, et al., Regul. Pept., 53:47-59 (1994. Было предложено применение инсулинотропных активностей экзендина-3 и экзендина-4 для лечения сахарного диабета и профилактики гипергликемии (Eng, патент США 5424286). Было описано, что усеченные пептиды экзендина, такие как экзендин[9-39], карбоксиамидированная молекула и фрагменты 3-39 - 9-39 являются эффективными и селективными антагонистами GPL-1(1996. Экзендин[9-39] (SEQ ID NO: 207) блокирует эндогенный GPL-1 in vivo, что приводит к пониженной секреции инсулина (Wang, et al., J. Clin. Invest., 95:417-21 (1995); D'Alessio, et al., J. Clin. Invest.,97:133-38 (1996. Рецептор, предположительно ответственный за инсулинотропное действие GPL-1, был клонирован из островковых клеток поджелудочной железы крыс (Thorens, В., Proc. Natl. head. Sci. USA 89:8641-8645 (1992. Экзендины и экзендин[9-39] связывается с клонированным рецептором GPL-1 (рецептор GPL-1 клеток поджелудочной железы крысы: Fehmann Н.С., et al., Peptides, 15 (3): 453-6 (1994);-2 014647 человеческий рецептор GPL-1: Thorens В., et al., Diabetes, 42 (11): 1678-82 (1993. В клетках, трансфицированных клонированным рецептором GPL-1, экзендин-4 является агонистом, т.е. он увеличивает цАМФ, в то время как экзендин[9-39] (SEQ ID NO: 207) является антагонистом, т.е. он блокирует стимулирующее действие экзендина-4 и GPL-1. Id. Более конкретно, экзендин-4 является С-концевым амидированным пептидом из 39 аминокислот,обнаруженным в слюне ящериц-ядозубов (Heloderma suspectum), с 53% идентичностью последовательности аминокислот с последовательностью пептида GPL-1, см., например, Eng, J., et al. "Isolation andCharacterization of Exendin-4, and Exendin-3 Analogue from Heloderma suspectum Venom", J. Bio. Chem.,267:11, p. 7402-7405 (1992), Young, A. A., et al., "Glucose-Lowering and Insulin-Sensitizing Actions of Exendin-4", Diabetes, Vol. 48, p. 1026-1034, May, 1999. С точки зрения его активности, экзендин-4 является высоко специфическим агонистом рецептора GPL-1 и, подобно GPL-1, способен стимулировать секрецию инсулина. Поэтому, также как и GPL-1, экзендин-4 считается инсулинотропным пептидом. Однако в отличие от GPL-1 экзендин-4 имеет относительно долгий период полувыведения у человека благодаря его устойчивости к дипептидилпептидазе IV, которая быстро разрушает последовательность GPL-1 in vivo. Более того, было показано, что по сравнению с GPL-1 экзендин-4 обладает более сильной способностью стимулировать секрецию инсулина и что для получения такого стимулирующего действия могут применяться более низкие концентрации экзендина-4, см., например, патент США 5424286, включенный в настоящее описание в качестве ссылки. Поэтому пептиды экзендина-4 или их производные (примеры таких производных можно увидеть, например, в патенте США 6528486, включенном в настоящее описание в качестве ссылки, и соответствующей международной заявкеWO 01/04156) имеют большее потенциальное применение для лечения состояний, включающих дисрегулирование уровней инсулина (например, таких состояний как диабет), чем инсулин или GPL-1. Другим семейством пептидных гормонов, вовлеченных в заболевания и нарушения обмена веществ, является амилиновое семейство пептидных гормонов, включающее амилин, кальцитонин, пептид,кодируемый геном кальцитонина, адреномедуллин и интермедии (также известный как "AFP-6"). Амилин представляет собой пептидный гормон из 37-аминокислот. Он был выделен, очищен и химически охарактеризован как основной компонент амилоидных отложений в островках поджелудочной железы людей, страдающих диабетом 2 типа (Cooper et al., Proc. Natl. Acad. Sci., USA, 84:8628-8632 (1987. Молекула амилина имеет две посттрансляционные модификации: С-концевая область амидирована, и цистеины в положениях 2 и 7 поперечно сшиты с образованием N-концевой петли. Последовательность открытой рамки считывания гена амилина человека демонстрирует присутствие сигнала протеолитического расщепления Lys-Arg диосновной аминокислоты перед N-концевым кодоном для Lys, и Gly перед протеолитическим сигналом Lys-Arg в CLAIMS-концевом положении, типовую последовательность для амидирования с помощью амидирующего белок фермента, РАМ (Cooper et al., Biochem. Biophys. Acta,1014:247-258 (1989. Полагают, что амилин регулирует опорожнение желудка и подавляет секрецию глюкагона и потребление пищи, тем самым регулируя скорость появления глюкозы в кровотоке. Это, по-видимому, дополняет действия инсулина, который регулирует скорость исчезновения глюкозы из кровотока и ее поглощение периферическими тканями. Эти действия подтверждаются экспериментальными открытиями у грызунов и людей, которые показывают, что амилин дополняет действия инсулина при контроле глюкозы после приема пищи с помощью по крайней мере трех независимых механизмов, все из которых влияют на скорость появления глюкозы. Во-первых, амилин подавляет секрецию глюкагона после приема пищи. По сравнению со здоровыми взрослыми людьми, пациенты, страдающие диабетом 1 типа, не имеют циркулирующего амилина, и пациенты, страдающие диабетом 2 типа, имеют пониженные концентрации амилина после приема пищи. Более того, вливание специфичных к амилину моноклональных антител, которые связывают циркулирующий амилин, снова вызывает значительное увеличение концентраций глюкагона по сравнению с контролем. Оба этих вывода указывают на физиологическую роль эндогенного амилина в регуляции секреции глюкагона после приема пищи. Во-вторых, амилин замедляет желудочно-кишечную двигательную активность и опорожнение желудка. Наконец, было показано, что инъекции крысиного амилина в гипоталамус снижают количество поедаемого крысами корма и изменяют метаболизм нейротрансмиттера в гипоталамусе. В некоторых исследованиях потребление пищи значительно снижалось в течение вплоть до 8 ч после инъекции в гипоталамус крысиного амилина и крысиного CGRP. В исследованиях на людях было показано, что аналог амилина, прамлинтид, снижает вес или прирост веса. Амилин может быть полезным при лечении таких состояний обмена веществ, как диабет и ожирение. Амилин также может применяться для лечения боли, костных нарушений, гастритов, для модулирования липидов, в частности триглицеридов, или для влияния на телосложение, такого как избирательная потеря жира и сохранение мышечной ткани. Гормон кальцитонин (СТ) назван так из-за его секреции в ответ на вызванную гиперкальциемию, и его быстрое гипокальцемическое действие. Он вырабатывается и секретируется из нейроэндокринных клеток щитовидной железы, которые называют С-клетками. Наиболее изученным действием СТ(1-32)(SEQ ID NO: 48) является его действие на остеокласт. In vitro действия СТ включают быструю потерю гофрированных краев и пониженное высвобождение лизосомальных ферментов. В конечном счете, ин-3 014647 гибирование функций остеокласта с помощью СТ дает снижение резорбции кости. Однако ни хроническое снижение СТ в сыворотке в случае тироидектомии, ни повышенный СТ в сыворотке, обнаруженный при медуллярном раке щитовидной железы, не связаны с изменением кальция в сыворотке или костной массы. Таким образом, наиболее вероятно, что основной функцией СТ(1-32) (SEQ ID NO: 48) является борьба с острой гиперкальциемией в критических ситуациях и/или защита скелета во время "кальциевого стресса", такого как рост, беременность и кормление грудью (Обзор у Becker, JCEM, 89(4): 1512-1525(2004) и Sexton, Current Medicinal Chemistry 6: 1067-1093 (1999. С этим согласуются недавние данные,полученные у нокаутных по гену кальцитонина мышей, у которых удалены и кальцитонин и пептидыCGRP-I, которые показывают, что мыши имеют нормальные уровни основных показателей кальция, но повышенную кальцемическую реакцию (Kurihara H, et al., Hypertens Res. 2003 Feb; 26 Suppl:S105-8). СТ оказывает действие на уровни кальция в плазме и ингибирует функцию остеокласта и широко применяется для лечения остеопороза. Терапевтически, вероятно, что СТ лосося (sCT) повышает плотность костей и снижает скорость образования трещин при минимальных побочных эффектах. Также СТ успешно применялся в течение последних 25 лет в качестве терапии костной болезни Пэджета, которая представляет собой хроническое костное нарушение, которое может привести к увеличению или деформации костей в одной или нескольких частях скелета. Также СТ широко применяется из-за обезболивающего действия при боли в костях, возникающих при остеопорозе, хотя механизм этого действия не изучен подробно. Пептид, кодируемый геном кальцитонина (CGRP), представляет собой нейропептид, рецепторы которого широко распространены в организме, включая нервную систему и сердечно-сосудистую систему. По-видимому этот пептид модулирует сенсорную нейротрансмиссию и является одним из наиболее эффективных эндогенных сосудорасширяющих пептидов, обнаруженных до настоящего времени. Описанные биологические действия CGRP включают модуляцию вещества Р при воспалении, активность никотинового рецептора в нервно-мышечном соединении, стимуляцию секреции фермента поджелудочной железы, снижение секреции кислоты желудочного сока, расширение периферических сосудов, учащение сердечной деятельности, нейромодуляцию, регулирование метаболизма кальция, остеогенную стимуляцию, секрецию инсулина и повышение температуры тела и снижение потребления пищи (Wimalawansa,Amylin, calcitonin gene-related peptide, calcitonin and ADM: a peptide superfamily. Crit Rev Neurobiol. 1997; 11 (2-3): 167-239). Важной ролью CGRP является контроль притока крови к различных органам благодаря его эффективному сосудорасширяющему действию, что подтверждается снижением среднего артериального давления после внутривенного ведения -CGRP. Сосудорасширяющее действие также подтверждается недавним анализом гомозиготных нокаутных по CGRP мышей, который демонстрирует повышенную устойчивость периферических сосудов и высокое кровяное давление, вызванное повышенной периферической симпатической активностью (Kurihara H., et al., Targeted disruption of ADM and CGRPgenes reveals their distinct biological roles. Hypertens Res. 2003 Feb; 26 Suppl:S105-8). Таким образом, вероятно CGRP вызывает сосудорасширяющие эффекты, гипотензивные эффекты и увеличение сердечной деятельности среди прочих эффектов. Длительное вливание CGRP пациентам с застойной сердечной недостаточностью показало продолжительное благоприятное действие на гемодинамические функции без побочных эффектов, что позволяет предложить его применение при сердечной недостаточности. Другие показания для применения CGRP включают почечную недостаточность, острую и хроническую ишемию коронарной артерии, лечение сердечной аритмии, другие заболевания периферических сосудов, такие как феномен Рейно, субарахноидальное кровоизлияние, гипертонию и легочную гипертензию. Предположительно также можно лечить преэкламптический токсикоз беременных и преждевременные роды (Wimalawansa, 1997). Недавние терапевтические использования включают применение антагонистов CGRP для лечения мигрени. Адреномедуллин (ADM) почти повсеместно экспрессируется в большинстве тканей, содержащих пептид, чем нет. В опубликованном обзоре ADM (Hinson, J.P. et al., Endocrine Reviews (2000) 21(2): 138167) детализируются его действия на сердечно-сосудистую систему, рост клеток, центральную нервную систему и эндокринную систему, где спектр биологических действий включает расширение сосудов,рост клеток, регуляцию секреции гормона и натрийурез. Исследования на крысах, кашках, овцах и человеке подтверждают, что внутривенное вливание ADM дает эффективную и длительную гипотонию, и это действие сравнимо с действием CGRP. Однако гипотензивное действие ADM на артериальное среднее давление у анестезированных крыс не ингибируется антагонистом CGRP CGRP8-37, что позволяет предположить, что этот эффект не опосредован рецепторами CGRP. Острое или хроническое введение человеческого ADM крысам, анестезированным, находящимся в сознании или имеющим повышенное артериальное давление, дает значительное снижение общего периферического сопротивления, сопровождающееся падением кровяного давления, при одновременном увеличении частоты сердечных сокращений, минутного сердечного выброса и систолического объема сердца.ADM также был предложен как важный фактор при эмбриональном развитии и дифференциации, и как фактор выживания при апоптозе эндотелиальных клеток крыс. Эти предложения подтверждаются недавними исследованиями нокаутных по ADM мышей, в которых мыши, гомозиготные к потере генаADM, демонстрируют нарушенное образование сосудов во время эмбрионального развития и, таким образом, гибнут на средних сроках беременности. Было описано, что ADM +/- гетерозиготные мыши имеют высокое кровяное давление одновременно с предрасположенностью к повреждению тканей (Kurihara Н., et al., Hypertens Res. 2003 Feb; 26 Suppl:S105-8).ADM влияет на такие эндокринные органы, как гипофиз, надпочечники, репродуктивные органы и поджелудочная железа. По-видимому пептид играет роль в ингибировании высвобождения АСТН из гипофиза. В надпочечниках он, вероятно, влияет на секреторную активность коры надпочечников у крыс и у людей, и он увеличивает кровоток в надпочечниках, действуя как сосудорасширяющее средство в сосудистом ложе надпочечников у здоровых крыс. Было показано, что ADM присутствует в репродуктивной системе самок, и при нормальной беременности его уровни в плазме повышены. Исследования крысиной модели преэклампсии показывают, что ADM может обращать гипертонию и снижать смертность детенышей при введении крысам на поздних сроках беременности. Так как он не оказывает подобного действия у животных на ранних сроках беременности и на не беременных крыс в модели преэклампсии, было выдвинуто предположение, что ADM может играть важную регуляторную роль в маточноплацентарной сердечно-сосудистой системе. В поджелудочной железе ADM, наиболее вероятно, играет ингибирующую роль, так как он ослабляет и задерживает инсулиновую реакцию на пероральную сахарную нагрузку, что дает исходно повышенные уровни глюкозы. ADM также может воздействовать на почечную функцию. Периферически вводимый болюс может значительно снижать среднее артериальное давление и увеличивать кровоток в почках, скорость клубочковой фильтрации и поток мочи. В некоторых случаях также отмечается увеличение выведения Na+.ADM также оказывает другие периферические действия на кости и на легкие. Для костей исследования подтвердили роль, выходящую за пределы сердечно-сосудистой системы и гомеостаза жидкостей,и продемонстрировали, что ADM действует на остеобласты зародышей и взрослых особей грызунов,увеличивая рост клеток, сравнимый с действием известных факторов роста остеобластов, таких как трансформирующий фактор роста-. Это важно клинически, так как одной из основных задач при изучении остеопороза является разработка лечения, которое увеличивало бы массу костей через остеобластные стимуляции. В легких ADM не только вызывает расширение сосудов легких, но также ингибирует бронхостеноз, вызванный гистамином или ацетилхолином. Недавние исследования с применением аэрозольного ADM для лечения легочной гипертензии на крысиной модели показали, что лечение ингаляциями данного состояния является эффективным, что подтверждается тем фактом, что артериальное среднее давление в легких и общая резистентность легких значительно ниже у крыс, получавших ADM,по сравнению с крысами, которым давали физиологический раствор. Этот результат достигается без изменений системного артериального давления или частоты сердечных сокращений (Nagaya N. et al., Am. J.Physiol Heart Circ Physiol. 2003; 285:H2125-31). Было показано, что у здоровых добровольцев внутривенное вливание ADM снижает артериальное давление и стимулирует сердечные сокращения, минутный сердечный выброс и уровни цАМФ в плазме,пролактина, норэпинефрина и реннина. У таких пациентов имеется незначительное или отсутствует увеличение объема мочи или наблюдается выведение натрия. У пациентов с сердечной недостаточностью или хронической почечной недостаточностью внутривенное введение ADM имеет такие же действия, как и у здоровых людей, а также вызывает диурез и натрийурез, в зависимости от вводимой дозы (Nicholls,MG et al. Peptides. 2001; 22:1745-1752). Также было показано, что экспериментальное лечение ADM является благоприятным при артериальной и легочной гипертензии, септическом шоке и ишемическом/реперфузионном повреждении (Beltowski J., Pol. J. Pharmacol. 2004; 56:5-27). Другие показания для лечения ADM включают заболевание периферических сосудов, субарахноидальное кровоизлияние, гипертонию, преэкламптический токсикоз беременных и преждевременные роды, и остеопороз. Экспрессия AFP-6 (например, интермедина) в основном происходит в гипофизе и желудочнокишечном тракте. Специфический рецептор для AFP-6 не описан; однако исследования связывания показали, что AFP-6 связывается со всеми известными рецепторами семейства амилинов. Было показано, чтоAFP-6 увеличивает выработку цАМФ в клетках SK-N-MC и L6, экспрессирующих эндогенные рецепторы CGRP, и конкурирует с меченным CGRP за связывание с его рецепторами в этих клетках. В опубликованных in vivo исследованиях, введение AFP-6 вызывает снижение кровяного давления и у нормальных крыс, и у крыс со спонтанной гипертонией, наиболее вероятно, через взаимодействие с рецепторамиCRLR/RAMP. In vivo введение мышам приводит к подавлению опорожнения желудка и потребления пищи (Ron et al. J. Biol. Chem. 2004 Feb 20; 279(8):7264-74.) Было описано, что биологические действия пептидных гормонов семейства амилинов в основном опосредуются через связывание с двумя близко родственными сопряженным с G-белком рецепторами II типа (GPCR), рецептором кальцитонина (CTR) рецептором, подобным рецептору кальцитонина (CRLR). Клонирование и функциональные исследования показали, что CGRP, ADM и амилин взаимодействуют с различными сочетаниями CTR или CRLR и белком, модифицирующим активность рецептора (RAMP). Множество клеток экспрессирует множество RAMP. Полагают, что совместная экспрессия RAMP и либоCTR, либо CRLR требуется для создания функциональных рецепторов для кальцитонина, CGRP, ADM и амилина. Семейство RAMP включает три члена (RAMP1, -2 и -3), которые имеют менее чем 30% иден-5 014647 тичность последовательности, но имеют общую топологическую организацию. Совместная экспрессияCRLR и RAMP1 приводит к образованию рецептора для CGRP. Совместная экспрессия CRLR и RAMP2 приводит к образованию рецептора для ADM. Совместная экспрессия CRLR и RAMP3 приводит к образованию рецептора для ADM и CGRP. Совместная экспрессия hCTR2 и RAMP1 приводит к образованию рецептора для амилина и CGRP. Совместная экспрессия hCTR2 и RAMP3 приводит к образованию рецептора для амилина. Еще одним семейством пептидных гормонов, вовлеченным в заболевания и нарушения обмена веществ, является семейство лептинов. Зрелой формой циркулирующего лептина является белок из 146 аминокислот, который обычно исключается из ЦНС гематоэнцефалическим барьером (ВВВ) и гематоCSF барьером, см., например, Weigle et al., 1995. J. Clin Invest 96: 2065-2070. Лептин является афферентным сигналом в отрицательном обратном цикле, регулирующем потребление пищи и массу тела. Рецептор лептина является членом семейства цитокинов. Анорексигенное действие лептина зависит от связывания с гомодимером изоформы Ob-Rb этого рецептора, которая кодирует длинный внутрицитоплазматический домен, который включает несколько мотивов для взаимодействия белок-белок. Ob-Rb в значительной степени экспрессируется в гипоталамусе, что позволяет предположить, что эта область мозга является важным местом действия лептина. Было продемонстрировано, что мутация ob гена мыши вызывает синдром, который демонстрирует патофизиологию, которая включает: ожирение, повышенное отложение жира в организме, гипергликемию, гиперинсулинемию, гипотермию и ухудшение функций щитовидной железы и репродуктивной системы у самцов и самок гомозиготных ob/ob мышей с ожирением (см., например, Ingalis, et al., 1950. J. Hered 41: 317-318). Терапевтическое применение лептина или рецептора лептина включает (i) диабет (см., например, заявки РСТ на патент WO 98/55139, WO 98/12224 и WO 97/02004); (ii) гемопоэз (см., например, заявки РСТ на патент WO 97/27286 и WO 98/18486); (iii) бесплодие (см., например, заявки РСТ на патент WO 97/15322 и WO 98/36763) и (iv) подавление опухоли(см., например, заявки РСТ на патент WO 98/48831), каждая из которых полностью включена в настоящее описание в качестве ссылки. Ген рецептора лептина (OB-R) был клонирован (GenBank Accession No. AF098792) и картирован в локусе db (см., например, Tartaglia, et al., 1995. Cell 83:1263-1271). Также были идентифицированы несколько транскриптов OB-R, полученных альтернативным сплайсингом. Нарушения в образовании OB-R вызывают синдром у мутированных ob/ob мышей с диабетом, которые фенотипически идентичны ob/ob мышам (см., например, Ghilardi, et al., 1996. Proc. Natl. Acad. Sci. USA 93: 6231-6235). В отличие от ob/ob мышей, однако, введение рекомбинантного лептина C57BLKS/J-m ob/ob мышам не вызывает снижения потребления пищи и массы тела (см., например, Roberts and Greengerg, 1996. Nutrition Rev. 54: 41-49). В большинстве относящихся к лептину исследованиях описано действие на снижение веса при введении рекомбинантного лептина, фрагментов лептина и/или вариантов рецептора лептина при введении указанных конструкций непосредственно в желудочки головного мозга, см., например, Weigle, et al.,1995. J. Clin Invest 96: 2065-2070; Barash, et al., 1996. Endocrinology 137: 3144-3147. Другие исследования показали значительное действие на снижение веса при введении пептидов лептина при внутрибрюшинном (в.б.) введении тестируемым пациентам, см. Grasso et al., 1997. Endocrinology 138: 1413-1418. Далее, было описано, что фрагменты лептина, более конкретно, фрагмент из 18 аминокислот, содержащий остатки, полученные из полноразмерного лептина человека, воздействует на потерю веса, но только при непосредственном введении через имплантированный катетер в боковой желудочек мозга крысы, см., например, заявку РСТ на патент WO 97/46585, которая полностью включена в настоящее описание в качестве ссылки. Другим пептидным гормоном, вовлеченным в заболевания и нарушения обмена веществ, является холецистокинин (CCK). По имеющимся данным, CCK был идентифицирован в 1928 г. из препаратов кишечных экстрактов благодаря его способности стимулировать сокращение желчного пузыря. С тех пор были описаны другие биологические действия CCK, включая стимуляцию секреции поджелудочной железы, замедление опорожнения желудка, стимуляцию подвижности кишечника и стимуляцию секреции инсулина, см. Lieverse et al., Ann. N.Y. Acad. Sci. 713: 268-272 (1994). По имеющимся данным, действияCCK также включают действия на сердечно-сосудистую функцию, дыхательную функцию, нейротоксичность и конвульсии, пролиферацию раковых клеток, аналгезию, сон, сексуальное и репродуктивное поведение, память, тревогу и опосредованное дофамином поведение. Crawley and Corwin, Peptides 15: 731-755 (1994). Другие описанные действия CCK включают стимуляцию роста поджелудочной железы,стимуляцию сокращения желчного пузыря, ингибирование секреции желудочной кислоты, высвобождение полипептида поджелудочной железы и сокращающий компонент перистальтики. Дополнительные описанные действия CCK включают расширение сосудов. Walsh, "Gastrointestinal Hormones", In Physiology of the Gastrointestinal Tract (3d ed. 1994; Raven Press, New York). Было описано, что инъекции сочетаний глюкагона, CCK и бомбезина усиливают ингибирование потребления тестовых блюд из концентрированного молока у крыс, имеющих свободный доступ к пище, по сравнению с ингибированием, полученным с использованием отдельных соединений. Hinton et al., BrainRes. Bull. 17:615-619 (1986). Также было описано, что глюкагон и CCK синергетически ингибируют ложное питание у крыс. LeSauter and Geary, Am. J. Physiol. 253:R217-225 (1987); Smith and Gibbs, Annals N.Y.Acad. Sci. 713:236-241 (1994). Также было предположено, что эстрадиол и CCK могут оказывать синергетическое действие на чувство сытости. Dulawa et al., Peptides 15:913-918 (1994); Smith and Gibbs, выше. Также было предположено, что сигналы, поступающие из тонкого кишечника в ответ на поступление в него питательных веществ, могут синергетически взаимодействовать с CCK для снижения потребления пищи. Cox, Behav. Brain Res. 38:35-44 (1990). Кроме того, было описано, что CCK вызывает чувство насыщения у некоторых видов. Например, было описано, что снижение объема питания вызывается введением CCK внутрибрюшинно у крыс, внутриартериально у свиней, внутривенно у кошек и свиней, в желудочки мозга у обезьян, крыс, собак и овец, внутривенно у людей с и без ожирения, см. Lieverse et al.,выше. По имеющимся данным, исследования, проведенные в нескольких лабораториях, подтвердили поведенческую специфичность низких доз CCK при ингибировании питания, путем сравнения реакции на пищевые и реакции на непищевые стимуляторы у обезьян и крыс, и тем, что они показали, что CCK показывает последовательность поведения, обычно наблюдаемую после потребления пищи (например,последовательность насыщения, возникающую после приема пищи). Кроме того, сравнение поведения после CCK с поведением после приема пищи, в чистом виде или в сочетании с CCK, по имеющимся сведениям выявляет поведенческое сходство между CCK приемом пищи. Crawley and Corwin, выше. Также было описано, что CCK в физиологических концентрациях в плазме ингибирует потребление пищи и усиливает чувство насыщения у худых и толстых людей, см. Lieverse et al., выше.CCK был охарактеризован в 1966 как пептид из 33-аминокислот. Crawley and Corwin, выше. Были идентифицированы видоспецифические молекулярные варианты аминокислотной последовательностиCCK. По имеющимся данным, последовательность из 33-аминокислот и усеченный пептид, его Сконцевая последовательность (CCK-8) из 8-аминокислот были идентифицированы у свиньи, крысы, курицы, шиншиллы, собаки и человека. Последовательность из 39-аминокислот была, по имеющимся данным, найдена у свиньи, собаки и морской свинки. Последовательность из 58-аминокислот была найдена у кошки, собаки и человека. Лягушка и черепаха, по имеющимся данным, имеют последовательность из 47-аминокислот, гомологичные к CCK, и гастрину. Совсем недавно было описано, что кишечник человека содержит небольшие количества даже больших молекул, названных CCK-83. По имеющимся данным,преобладающая промежуточная форма была идентифицирована у крысы и названа CCK-22. Walsh, "Gastrointestinal Hormones", In Physiology of the Gastrointestinal Tract (3d ed. 1994; Raven Press, New York). He сульфатированный CCK-8 и тетрапептид названный CCK-4 (CCK(30-33 был найден в мозге крысы. С-концевой пентапептид названный CCK-4 (CCK(29-33 сохраняет структурную гомологию CCK, а также гомологию с нейропептидом, гастрином. С-концевая сульфатированная последовательность октапептида, CCK-8, по имеющимся данным, относительно консервативна между видами. Клонирование и анализ последовательности кДНК, кодирующей препрохолецистокинин из клеток рака щитовидной железы крысы, мозга свиньи и кишечника свиньи, по имеющимся данным, показывают 345 нуклеотидов,кодирующих предшественник CCK, который имеет 115 аминокислот и содержит все последовательностиCCK, ранее описанные как выделенные. Crawley and Corwin, выше.CCK был охарактеризован в 1966 как пептид из 33-аминокислот. Crawley and Corwin, выше. Были идентифицированы видоспецифические молекулярные варианты последовательности аминокислот CCK. По имеющимся данным, последовательность из 33 аминокислот и, усеченный пептид, его С-концевая последовательность из 8-аминокислот (CCK-8) были идентифицированы у свиньи, крысы, курицы, шиншиллы, собаки и человека. Последовательность из 39-аминокислот была, по имеющимся данным, найдена у свиньи, собаки и морской свинки. Последовательность из 58-аминокислот была найдена у кошки,собаки и человека. Лягушка и черепаха, по имеющимся данным, имеют последовательность из 47 аминокислот, гомологичную и CCK, и гастрину. Совсем недавно было описано, что кишечник человека содержит небольшие количества даже больших молекул, названных CCK-83. По имеющимся данным,преобладающая промежуточная форма была идентифицирована у крысы и названа CCK-22. Walsh, "Gastrointestinal Hormones", In Physiology of the Gastrointestinal Tract (3d ed, 1994; Raven Press, New York). He сульфатированный CCK-8 и тетрапептид (названный CCK-4 (CCK(30-33; SEQ ID NO: 208) был найден в мозге крысы. С-концевой пентапептид (названный CCK-4 (CCK(29-33; SEQ ID NO: 209) сохраняет структурную гомологию CCK, а также гомологию с нейропептидом, гастрином. С-концевая сульфатированная последовательность октапептида, CCK-8, по имеющимся данным, относительно консервативна между видами. Клонирование и анализ последовательности кДНК, кодирующей препрохолецистокинин из клеток рака щитовидной железы крысы, мозга свиньи и кишечника свиньи, по имеющимся данным,обнаружило 345 нуклеотидов, кодирующих предшественник CCK, который имеет 115 аминокислот и содержит все последовательности CCK, ранее описанные как выделенные. Crawley and Corwin, выше. Описано, что CCK распределен в центральной нервной системе и в эндокринных клетках и кишечных нервах верхнего тонкого кишечника. Агонисты CCK включают сам CCK (также называемый CCK33), CCK-8 (CCK(26-33); SEQ ID NO: 55), не сульфатированный CCK-8, пентагастрин (CCK-5 илиCCK(29-33); SEQ ID NO: 209) и тетрапептид, CCK-4 (CCK(30-33); SEQ ID NO: 208). В рецепторе CCK поджелудочной железы CCK-8, по имеющимся данным, замещает связывание с 1000-5000 раз большей эффективностью, чем не сульфатированный CCK-8 или CCK-4, и было описано, что CCK-8 приблизительно в 1000 раз более эффективен, чем не сульфатированный CCK-8 или CCK-4 при стимулировании-7 014647 секреции амилазы поджелудочной железы. Crawley and Corwin, выше. Было описано, что в гомогенатах из коры головного мозга связывание рецептора CCK, замещенное не сульфатированным CCK-8 и CCK-4 в эквимолярных концентрациях, в 10-100 раз больше, чем сульфатированным CCK-8. Id. Еще одним семейством пептидных гормонов, вовлеченным в заболевания и нарушения обмена веществ, является семейство панкреатических полипептидов ("PPF"). Панкреатический полипептид ("РР") был обнаружен как минорный компонент экстрактов инсулина и был назван по органу, в котором его обнаружили, а не по функциональной важности (Kimmel et al., Endocrinology 83: 1323-30 (1968. РР представляет собой пептид из 36-аминокислот, содержащий характерные структурные мотивы. Далее родственный пептид был обнаружен в экстрактах кишечника и назван пептид YY ("PYY") из-за N- и Сконцевых тирозинов (Tatemoto, Proc. Natl. Acad. Sci. USA 79: 2514-8 (1982. Третий родственный пептид был позже обнаружен в экстрактах мозга и назван нейропептид Y ("NPY") (Tatemoto, Proc. Natl. Acad.Sci. USA 79: 5485-9 (1982); Tatemoto et al., Nature 296: 659-60 (1982. Было описано, что эти три родственных пептида оказывают различные биологические действия. Действия РР включают ингибирование секреции поджелудочной железы и расслабление желчного пузыря. Центральное введение РР вызывает умеренное увеличение потребления пищи, которое может быть опосредовано рецепторами, локализованными в гипоталамусе и стволе мозга (обзор в Gehlert, Proc. Soc.Exp. Biol. Med. 218: 7-22 (1998. Высвобождение PYY имеет место после потребления пищи. Альтернативной молекулярной формойPept. 51: 151-9 (1994. Этот фрагмент составляет приблизительно 40% от общей PYY-подобной иммунологической реактивности кишечных экстрактов человека и собаки, и от около 36% от общей PYY иммунологической реактивности в плазме натощак до немногим более 50% после еды. Это очевидно является продуктом расщепления дипептидилпептидазы-IV (DPP4) PYY. PYY (3-36) (SEQ ID NO: 58), по имеющимся данным, является селективным лигандом на Y2 и Y5 рецепторах, которые являются фармакологически уникальными при предпочтении усеченных в N-концевой области (т.е. С-концевыми фрагментами) NPY аналогов. Периферическое введение PYY, по имеющимся данным, снижает секрецию кислоты желудочного сока, двигательную функцию желудка, секрецию экзокрина поджелудочной железыet al., Gastroenterology 91: 1386-9 (1986, сокращение желчного пузыря и подвижности кишечника (Savage et al., Gut 28: 166-70 (1987. Действие центрального введения PYY на опорожнение желудка, двигательную функцию желудка и секрецию кислоты желудочного сока, полученное после прямого введения в или около ромбовидного мозга/ствола мозга (Chen and Rogers, Am. J. Physiol. 269: R787-92 (1995); Chenet al., Regul. Pept. 61: 95-98 (1996); Yang and Tache, Am. J. Physiol. 268: G943-8 (1995); Chen et al., Neurogastroenterol. Motil. 9: 109-16 (1997, может отличаться от действия, наблюдаемого после периферического введения. Например, центрально вводимый PYY обладает некоторыми действиями, противоположным тем, которые описаны здесь для периферически вводимого PYY (3-36) (SEQ ID NO: 58), которое заключается в стимуляции секреции кислоты желудочного сока, а не в ингибировании. Двигательная функция желудка подавляет только в сочетании со стимуляцией TRH, а не при введении в чистом виде, и в действительности является стимулирующим при более высокой дозировке из-за предполагаемого взаимодействия с рецепторами PP. Было показано, что PYY стимулирует потребление пищи и воды после центрального введения (Morley et al., Brain Res. 341: 200-3 (1985); Corp et al., Am. J. Physiol. 259:R317-23 (1990. Заболевания и нарушения обмена веществ могут принимать множество форм, включая ожирение,диабет, дислипидемию, резистентность к инсулину, апоптоз клеток и т.д. Ожирение и связанные с ним нарушения являются распространенными и очень серьезными проблемами общественного здравоохранения в Соединенных Штатах и во всем мире. Ожирение верхней части тела является сильнейшим фактором риска, известным для сахарного диабета 2 типа, и является сильнейшим фактором риска сердечнососудистых заболеваний. Ожирение является признанным фактором риска для гипертонии, атеросклероза, застойной сердечной недостаточности, инсульта, болезни желчного пузыря, остеоартрита, апноэ во сне, нарушений репродуктивной функции, таких как синдром поликистозных яичников, рака груди, простаты и толстой кишки, и для увеличения случаев осложнений при общей анестезии (см., например, Kopelman, Nature 404: 635-43 (2000. Оно снижает продолжительность жизни и несет серьезный риск возникновения перечисленных выше сопутствующих заболеваний, а также таких нарушений как инфекции,варикозное расширение вен, акантокератодермия, экзема, непереносимость физической нагрузки, резистентность к инсулину, гиперхолестеринемия при гипертонии, желчнокаменная болезнь, ортопедические повреждения и тромбоэмболическая болезнь (Rissanen et al., Br. Med. J. 301: 835-7 (1990. Ожирение также является фактором риска для группы состояний, названных синдром резистентности к инсулину,или "синдром X". Недавняя оценка медицинских затрат на лечение ожирения и связанных с ним заболеваний насчитывает 150 миллиардов долларов по всему миру. Полагают, что патогенез ожирения является многофункциональным, но основной проблемой является то, что у пациентов с ожирением усваиваемость питательных веществ и потребление энергии не сбалансированы до тех пор, пока имеется избыток жировой ткани. В настоящее время ожирение плохо поддается лечению, является хроническим, фактиче-8 014647 ски трудноизлечимым нарушением обмена веществ. Терапевтические лекарственные средства, применяемые для снижения веса пациентов с ожирением, могут оказывать основательное благоприятное воздействие на их здоровье. Диабет представляет собой нарушение углеводного обмена веществ, характеризуемое гипергликемией и глюкозурией, возникающими из-за недостаточной выработки или утилизации инсулина. Диабет сильно влияет на качество жизни большей части населения в развитых странах. Недостаточная выработка инсулина характеризуется как диабет 1 типа, и недостаточная утилизация инсулина характеризуется как диабет 2 типа. Однако в настоящее время общепризнано, что существует множество отдельных заболеваний, связанных с диабетом, которые возникают задолго до того, как у пациента диагностируют диабет. Также эффект недостаточного контроля метаболизма глюкозы при диабете вызывает усиление широкого спектра родственных липидных и сердечно-сосудистых нарушений. Дислипидемия, или аномальные уровни липопротеинов в плазме крови, часто возникает у диабетиков. Дислипидемия обычно характеризуется повышенным уровнем триглицеридов в плазме, низким уровнем HDL (липопротеинов высокой плотности) холестерина, нормальным или повышенным уровнемLDL (липопротеинов низкой плотности) холестерина и повышенными уровнями густо расположенных частиц LDL (липопротеинов низкой плотности) в крови. Дислипидемия является одним из основных факторов, содействующих увеличению случаев коронарных приступов и смертности у пациентов с диабетом. Эпидемиологические исследования подтверждают этот вывод, демонстрируя многократное увеличение смертности от коронарных приступов среди пациентов с диабетом по сравнению с пациентами,не страдающими диабетом. У пациентов с диабетом было описано несколько липопротеиновых аномалий. Устойчивость к инсулину представляет собой ослабленную способность инсулина оказывать биологическое действие в широком интервале концентраций. При резистентности к инсулину организм секретирует аномально высокие количества инсулина для компенсации этого дефекта, и развивается состояние ухудшенной переносимости глюкозы. При невозможности компенсировать недостаточное действие инсулина, концентрация глюкозы в плазме неизбежно возрастает, что вызывает клиническое состояние диабета. Признано, что резистентность к инсулину и родственная гиперинсулинемия играют способствующую роль при ожирении, гипертонии, атеросклерозе и диабете 2 типа. Связь резистентности к инсулину с ожирением, гипертонией и стенокардией описана как синдром, синдром X, имеющий резистентность к инсулину в качестве общей патогенной связи. Апоптоз представляет собой активный процесс самоуничтожения клеток, который регулируется наружными и внутренними сигналами, возникающими при нормальном развитии. Подробно описано,что апоптоз играет ключевую роль в регуляции эндокринных бета-клеток поджелудочной железы. Существует все больше доказательств того, что у взрослых млекопитающих масса бета-клеток является предметом динамического изменения для адаптации выработки инсулина для поддержания нормогликемии при конкретных состояниях, таких как беременность и ожирение. Контроль массы бета-клеток зависит от тонкого баланса между пролиферацией клеток, ростом и запрограммированной гибелью клеток (апоптозом). Нарушение этого баланса может привести к ухудшению гомеостаза глюкозы. Например, примечательно, что непереносимость глюкозы развивается с возрастом, когда снижается скорость репликации бета-клеток, и секционное патологоанатомическое исследование человека неоднократно показывало 4060% снижение массы бета-клеток у пациентов, страдающих не инсулинозависимым диабетом, по сравнению с пациентами, не страдающими диабетом. Обычно признают, что устойчивость к инсулину неизменно сопровождает ожирение, но что нормогликемия поддерживается компенсационной гиперинсулинемией до тех пор, пока бета-клетки становятся не способными соответствовать увеличивающейся потребности в инсулине, когда начинается диабет 2 типа. Попытки лечить множество аномалий, связанных с диабетом, заключались во введении нескольких антидиабетических лекарственных средств для того, чтобы воздействовать на такие аномалии у различных пациентов. Примеры антидиабетических лекарственных средств включают белки, такие как инсулин и аналоги инсулина, и небольшие молекулы, такие как средства, повышающие чувствительность к инсулину, средства, усиливающие секрецию инсулина и соединения, регулирующие аппетит. До сих пор остается необходимость в разработке полипептидов, применяемых при указанных выше заболеваниях, состояниях и нарушениях обмена веществ. Следовательно, объектом данного изобретения являются гибридные полипептиды и способы их получения и применения. Соединения в соответствии с данным изобретением находят применение при заболеваниях, состояниях и нарушениях обмена веществ,описанных выше и ниже. Все документы, на которые ссылается данное описание, представлены в данной заявке в качестве ссылок в их полном объеме. Сущность изобретения Данное изобретение в общем относится к новым, селектируемым гибридным полипептидам, применяемым в качестве агентов для лечения и профилактики заболеваний и нарушений обмена веществ,которые могут быть облегчены регуляцией уровней глюкозы в плазме, уровней инсулина и/или секреции инсулина, таких как диабет и связанные с диабетом состояния. Такие состояния и нарушения включают,-9 014647 но не ограничены ими, гипертонию, дислипидемию, сердечно-сосудистое заболевание, нарушения питания, резистентность к инсулину, ожирение и сахарный диабет любого типа, включая тип 1 и тип 2, и диабет при беременности. В одном варианте данного изобретения представлены гибридные полипептиды, проявляющие по крайней мере одну гормональную активность. Гибридные полипептиды в соответствии с данным изобретением включают по крайней мере два биоактивных модуля пептидных гормонов, ковалентно связанные вместе, где по крайней мере один из биоактивных модулей пептидного гормона проявляет по крайней мере одну гормональную активность сложного пептидного гормона. Биоактивные модули пептидного гормона независимо выбирают из сложных пептидных гормонов, фрагментов сложных пептидных гормонов, которые проявляет по крайней мере одну гормональную активность сложных пептидных гормонов, аналогов и производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, фрагментов аналогов или производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов, и пептидных энхансеров. В одном варианте гибридного полипептида, проявляющего по крайней мере одну гормональную активность, гибридный полипептид содержит, по крайней мере, первый биоактивный модуль пептидного гормона, ковалентно связанный по крайней мере с одним дополнительным биоактивным модулем пептидного гормона; где биоактивные модули пептидного гормона независимо выбраны из группы, состоящей из сложных пептидных гормонов, фрагментов сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов; аналогов и производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов; фрагментов аналогов и производных сложных пептидных гормонов, которые проявляют по крайней мере одну гормональную активность сложных пептидных гормонов; и пептидные энхансеры. Сложные пептидные гормоны обычно независимо выбирают по крайней мере из двух из группы, состоящей из амилина, адреномедуллина (ADM), кальцитонина (СТ), пептида, кодируемого геном кальцитонина (CGRP), интермедина, холецистокинина ("CCK"), лептина, пептида YY (PYY), глюкагоноподобного пептида-1 (GPL-1), глюкагоноподобного пептида 2 (GPL-2), оксинтомодулино (ОХМ),натрийуретического пептида и экзендина-4. Обычно пептидные энхансеры независимо выбраны из группы, состоящей из структурных мотивов сложных пептидных гормонов, которые придают гибридному полипептиду желаемую химическую стабильность, конформационную стабильность, метаболическую стабильность, биодоступность, направленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание белка плазмы, или другую фармакокинетическую характеристику, и структурных мотивов аналогов или производных сложных пептидных гормонов, которые придают гибридному полипептиду желаемую химическую стабильность, конформационную стабильность, метаболическую стабильность, биодоступность, направленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание белка плазмы, или другую фармакокинетическую характеристику. В еще одном варианте осуществления по крайней мере один из биоактивных модулей пептидного гормона проявляют по крайней мере одну гормональную активность сложного пептидного гормона. В дополнительных альтернативных вариантах осуществления, если по крайней мере одним биоактивным модулем пептидного гормона, который проявляет по крайней мере одну гормональную активность сложного пептидного гормона, является амилин, фрагмент амилина, который проявляет по крайней мере одну гормональную активность, аналог или производное амилина, который проявляет по крайней мере одну гормональную активность, или фрагмент аналога или производного амилина, который проявляет по крайней мере одну гормональную активность, и по крайней мере одним другим биоактивным модулем пептидного гормона является CCK, фрагмент CCK, который проявляет по крайней мере одну гормональную активность, аналог или производное CCK, который проявляет по крайней мере одну гормональную активность, фрагмент аналога или производного CCK, который проявляет по крайней мере одну гормональную активность, СТ, фрагмент СТ который проявляет по крайней мере одну гормональную активность,аналог или производное СТ, который проявляет по крайней мере одну гормональную активность, или фрагмент аналога или производного СТ, который проявляет по крайней мере одну гормональную активность, тогда гибридный полипептид может дополнительно содержать по крайней мере три биоактивных модуля пептидного гормона, выбранные по крайней мере из трех различных сложных пептидных гормонов. В еще одном дополнительном альтернативном варианте осуществления, если по крайней мере одним биоактивным модулем пептидного гормона, который проявляет по крайней мере одну гормональную активность сложного пептидного гормона, является GPL-1, фрагмент GPL-1, который проявляет по крайней мере одну гормональную активность, аналог или производное GPL-1, который проявляет по крайней мере одну гормональную активность, или фрагмент аналога или производного GPL-1, который проявляет по крайней мере одну гормональную активность, и по крайней мере одним другим биоактивным модулем пептидного гормона является пептидный энхансер, содержащий фрагмент экзендина, тогда гибридный полипептид также может содержать по крайней мере три биоактивных модуля пептидного гормона. Сложные пептидные гормоны в соответствии с данным изобретением включают амилин, адреноме- 10014647 дуллин (ADM), кальцитонин (СТ), пептид, кодируемый геном кальцитонина (CGRP), интермедии, холецистокинин ("CCK"), лептин, пептид YY (PYY), глюкагоноподобный пептид-1 (GPL-1), глюкагоноподобный пептид 2 (GPL-2), оксинтомодулин (ОХМ), натрийуретические пептиды и экзендин-4. Пептидные энхансеры в соответствии с данным изобретением включают структурные мотивы сложных пептидных гормонов, которые придают гибридному полипептиду желаемую химическую стабильность, конформационную стабильность, метаболическую стабильность, биодоступность, направленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание белка плазмы,или другую фармакокинетическую характеристику, и структурные мотивы аналогов или производных сложных пептидных гормонов, которые придают гибридному полипептиду желаемую химическую стабильность, конформационную стабильность, метаболическую стабильность, биодоступность, направленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание белка плазмы,или другую фармакокинетическую характеристику. В другом аспекте данного изобретения представлены способы лечения или профилактики ожирения, где способы включают введение терапевтически или профилактически эффективного количества гибридного полипептида в соответствии с данным изобретением пациенту. В предпочтительном варианте пациент имеет ожирение или лишний вес. Хотя "ожирение" обычно определяется как индекс массы тела, превышающий 30, в целях данного описания любые пациенты, включая тех, которые имеют индекс массы тела менее 30, но нуждаются в снижении массы тела или хотят снизить массу тела, включены в определение "ожирение". Пациенты, которые имеют резистентность к инсулину, непереносимость глюкозы или любую форму сахарного диабета (например, диабет 1, 2 типа или при беременности), могут пользоваться данным способом. В еще одном аспекте данного изобретения представлены способы снижения потребления пищи,снижения усваиваемости питательных веществ, вызывающее потерю веса, лечения сахарного диабета и связанных с диабетом состояний, и улучшения липидного профиля (включая снижение LDL холестерина и уровней триглицеридов и/или изменение уровней HDL холестерина), где способы включают введение пациенту эффективного количества гибридного полипептида в соответствии с данным изобретением. В предпочтительном варианте способы в соответствии с данным изобретением используют для лечения или профилактики состояний или нарушений, которые могут быть облегчены снижением усваиваемости питательных веществ у пациента, включающего введение указанному пациенту терапевтически или профилактически эффективного количества гибридного полипептида в соответствии с данным изобретением. В другом варианте осуществления способы в соответствии с данным изобретением используют для лечения или профилактики состояний или нарушений, которые могут быть облегчены контролем уровней глюкозы в плазме, уровней инсулина и/или секреции инсулина. В еще одном варианте осуществления способы в соответствии с данным изобретением используют для лечения диабета и/или связанных с диабетом состояний. Такие состояния и нарушения включают, но не ограничены ими, гипертонию, дислипидемию, сердечно-сосудистое заболевание, нарушения питания, резистентность к инсулину, ожирение и сахарный диабет любого типа, включая тип I, тип II и диабет при беременности, диабетические осложнения, невропатию (основанная, например, на нейротрофическом действии экзендина-4), невропатическую боль (основанную на, например, действии амилина), ретинопатию, нефропатию, состояния недостаточности массы бета-клеток в поджелудочной железе (основанное на, например, воздействием на неогенез островков экзендина-4 и GPL-1). Данное изобретение также относится к фармацевтическим композициям, включающим терапевтически или профилактически эффективное количество по крайней мере одного гибридного полипептида в соответствии с данным изобретением или его фармацевтически приемлемой соли, вместе с фармацевтически приемлемыми разбавителями, консервантами, солюбилизаторами, эмульгаторами, адъювантами и/или носителями, применяемыми для доставки гибридных полипептидов. Эти и другие аспекты данного изобретения будут более понятны со ссылкой на представленные ниже предпочтительные варианты осуществления и подробное описание изобретения. Краткое описание чертежей На фиг. 1 показано действие типовых соединений в соответствии с данным изобретением в анализе мышей DIO. На фиг. 2 показано действие типовых соединений в соответствии с данным изобретением в анализе мышей DIO. На фиг. 3 А-3 С показано действие типовых соединений в соответствии с данным изобретением в анализе мышей DIO. На фиг. 4 А, 4 В показано действие типовых соединений в соответствии с данным изобретением в анализе потребления пищи по сравнению с исходными пептидными соединениями. На фиг. 5 А, 5 В показано действие типовых соединений в соответствии с данным изобретением в анализе снижения глюкозы в крови и анализе потребления пищи, соответственно. На фиг. 6 изображены структуры различных используемых типовых линкеров. На фиг. 7 изображены структуры различных типовых линкеров, а также последовательность и vitro активность типовых гибридов семейства PYY и амилинов.- 11014647 На фиг. 8 изображены структуры различных типовых линкеров, а также последовательность и in vitro активность других типовых гибридов семейства PYY/PYY. На фиг. 9 изображено снижение массы тела с помощью типовых гибридов семейства PYY и амилинов. На фиг. 10 изображен график мобилизации кальция гибридами семейства CCK8 в колониях клеток,имеющих рецептор CCK. На фиг. 11 А, В и С изображено ингибирование пищи гибридами семейства амилинов, например амилина-sCT-амилина и PYY (например, PYY-NPY химеры). На фиг. 12 А изображено снижение общего потребления пищи и на фиг. 12 В изображено снижение массы тела с помощью гибридов семейства амилин-sCT-амилин/PYY. означает, что Р 0,05 по сравнению с носителем. На фиг. 13 изображено ингибирование потребления пищи гибридами семейства PYY/PYY. Дозы составляют 25 нмоль/кг. Расхождение 15-20% является статистически значимым. На фиг. 14 А и 14 В изображено ингибирующее действие на потребление пищи гибридов семействаCCK с компонентом семейства либо амилинов, либо PYY. Дозы составляют 25 нмоль/кг. Расхождение 15-20% является статистически значимым. На фиг. 15 А и 15 В изображено ингибирующее действие на потребление пищи гибридов семействаMSH с компонентом семейства либо амилинов, либо PYY. Дозы составляют 25 нмоль/кг. Расхождение 15-20% является статистически значимым. На фиг. 16 А изображено снижение общего потребления пищи, и на фигуре 16 В изображено снижение массы тела с помощью гибридов с компонентом семейства MSH и компонентом семейства амилинов, например, амилина-sCT-амилина. означает, что Р 0,05 по сравнению с носителем. На фиг. 17A-17D изображено ингибирование потребления пищи с помощью гибридов, содержащих компонент семейства FN-38 и указанный компонент второго семейства. Фиг. 17 А - FN38 с компонентом семейства амилинов, амилин-sCT-амилин химерой, соединение 10. Фиг. 7 В - FN38 с компонентом семейства PYY, PYY-3-36. Фиг. 17 С - FN38 с компонентом семейства PYY, химерой PYY-NPY. Фиг. 17D FN38 с компонентом семейства CCK8, CCK8. Дозы составляют 25 нмоль/кг. Расхождение 15-20% является статистически значимым. На фиг. 18 А и 18 В изображено ингибирование потребления пищи гибридами, содержащими компоненты семейства экзендинов и семейства амилинов. Если не указано иначе, дозы составляют 25 нмоль/кг. Расхождение 15-20% является статистически значимым. На фиг. 19 А и 19 В изображено ингибирование потребления пищи во время питания в темное время суток и долгосрочное ингибирование общего потребления пищи с помощью гибридов семейства экзендинов/амилинов. На фиг. 20 А и 20 В изображено хроническое ингибирование потребления пищи и действие на потерю веса и потерю жира натощак типового гибрида семейства экзендинов/амилин-sCT-амилинов по сравнению с исходными молекулами. означает, что Р 0,05 по сравнению с носителем. На фиг. 21 А-21 С показано гибридное действие на параметры обмена веществ через 14 дней лечения у крыс. На фиг. 22-29 изображена способность PPF полипептидных химер, например PYY-NPY химерных соединений 4883 и 5705, снижать совокупное потребление пищи в анализах потребления пищи, описанных здесь. Подробное описание изобретения Данное изобретение в общем относится к новым селектируемым гибридным полипептидам, используемым в качестве агентов для лечения и профилактики заболеваний и нарушений обмена веществ,которые могут быть облегчены контролем уровней глюкозы в плазме, уровней инсулина и/или секреции инсулина, таких как диабет и связанные с диабетом состояния. Такие состояния и нарушения включают,но не ограничены ими, гипертонию, дислипидемию, сердечно-сосудистое заболевание, нарушения питания, резистентность к инсулину, ожирение и сахарный диабет любого типа, включая тип 1, тип 2 и диабет при беременности. В одном аспекте изобретение включает модульную конструкцию физиологически, метаболически и/или фармакокинетически активных пептидных молекул, которые могут быть отобраны на основе "биоактивности", например терапевтической эффективности, спектра действия, продолжительности действия,физико-химических свойств и/или других фармакокинетических свойств. Не ограничиваясь теорией, данное изобретение относится, по крайней мере частично, к "инструментальному" подходу, при котором биоактивные модули пептидных гормонов связаны в двухкомпонентных,трехкомпонентных или высшего порядка сочетаниях с получением новых эффективных терапевтических агентов с селектируемыми свойствами. "Биоактивные модули пептидных гормонов" могут включать пептидные гормоны, пептидные фрагменты с гормональной активностью или структурные мотивы пептидных гормонов, которые улучшают химическую, метаболическую и/или другую фармакокинетическую стабильность. Пептидные гормоны могут включать природные пептидные гормоны, а также аналоги и производные пептидных гормонов, известные в данной области техники и описанные здесь.- 12014647 В одном аспекте данного изобретения было обнаружено, что сочетание определенных физикохимических характеристик двух или более пептидных гормонов в единое средство может способствовать вмешательству в несколько точек дисфункциональной системы обмена веществ. В одном аспекте изобретения как таковые представлены рационально сконструированные гибридные полипептиды, которые интегрируют выбранные биологические действия в единый полипептидный агент. В одном варианте селектируемые гибридные полипептиды в соответствии с данным изобретением могут включать применение химически стабильных линкеров для ковалентного присоединения биоактивных молекул. В другом варианте селектируемые гибридные полипептиды в соответствии с данным изобретением могут включать применение расщепляемых линкеров, которые сами по себе могут быть или могут формировать часть биоактивной молекулы. Снова, не ограничиваясь теорией, создание гибридных полипептидов в соответствии с данным изобретением обычно может включать: (1) идентификацию, селекцию и сопряжение биоактивных модулей пептидных гормонов для получения желаемой эффективности и терапевтического применения, и (2) ковалентное связывание биоактивных модулей (например, природных пептидных гормонов, аналогов и производных пептидных гормонов с гормональной активностью, фрагментов пептидных гормонов с гормональной активностью, стабилизирующих мотивов и т.д.) либо непосредственно, либо через линкер,без потери биоактивности составляющих модулей. В определенных вариантах критерии отбора модулей могут включать, но не ограничены ими: (а) желаемое in vivo действие для желаемого терапевтического или профилактического показания, такое как аддитивный или синергетический эффект; (b) необязательный синергизм или двойственное действие связанных модулей для множества терапевтических и/или профилактических показаний/ и/или (с) желаемая химическая стабильность, конформационная стабильность, метаболическая стабильность, биодоступность, нацеленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание с белком плазмы и/или другие фармакокинетические характеристики. Заголовки разделов применяются здесь исключительно в целях упорядочения и не должны рассматриваться как ограничивающие каким-либо образом описанный предмет рассмотрения. Гибридные полипептиды в соответствии с данным изобретением Как указано выше, данное изобретение частично относится к гибридным полипептидам, содержащим по крайней мере два биоактивных модуля пептидного гормона, выбираемые из описанных здесь сложных пептидных гормонов. Гибридные полипептиды в соответствии с данным изобретением обычно применяются для лечения и профилактики состояний и нарушений обмена веществ. Гибридные полипептиды в соответствии с данным изобретением проявляют по крайней мере одну гормональную активность сложного пептидного гормона и предпочтительно могут проявлять по крайней мере одну дополнительную биологическую активность второго сложного пептидного гормона. В одном варианте гибридные полипептиды в соответствии с данным изобретением могут содержать по крайней мере два биоактивных модуля пептидного гормона, где каждый из указанных по крайней мере двух биоактивных модулей пептидного гормона проявляет по крайней мере одну гормональную активность сложного пептидного гормона. В другом варианте гибридные полипептиды в соответствии с данным изобретением могут содержать по крайней мере два биоактивных модуля пептидного гормона,где по крайней мере один из указанных биоактивных модулей пептидного гормона обладает по крайней мере одним гормональным действием сложного пептидного гормона, и по крайней мере один из указанных биоактивных модулей пептидного гормона придает желаемую химическую стабильность, конфирмационную стабильность, метаболическую стабильность, биодоступность, нацеленность на орган/ткань,взаимодействие с рецептором, ингибирование протеазы, связывание с белком плазмы и/или другие фармакокинетические характеристики гибридному полипептиду. В предпочтительном варианте гибридные полипептиды в соответствии с данным изобретением могут обладать сравнимой или большей эффективностью при лечении и/или профилактике состояний и нарушений обмена веществ по сравнению со сложными пептидными гормонами. В другом варианте гибридные полипептиды в соответствии с данным изобретением могут обладать сравнимой или большей эффективностью при лечении и/или профилактике диабета и/или связанных с диабетом нарушений, по сравнению со сложными пептидными гормонами. Альтернативно, предпочтительные гибридные полипептиды в соответствии с данным изобретением могут обладать улучшенной технологичностью, стабильностью и/или простотой составления рецептуры, по сравнению со сложными пептидными гормонами. Более конкретно, гибридные полипептиды в соответствии с данным изобретением обычно включают первый биоактивный модуль пептидного гормона, ковалентно связанный по крайней мере с одним дополнительным биоактивным модулем пептидного гормона. Биоактивные модули пептидного гормона могут быть ковалентно связаны друг с другом любым известным в данной области техники методом,включая, но не ограничиваясь ими, прямые амидные связи или химические линкерные группы, которые более подробно описаны ниже. В одном варианте химические линкерные группы могут включать пептидные миметики, которые вызывают или стабилизируют полипептидную конформацию. Первый биоактивный модуль пептидного гормона может быть выбран из первого сложного пеп- 13014647 тидного гормона и может быть пептидным гормоном (включая природные пептидные гормоны, а также их аналоги и производные), пептидным фрагментом с гормональной активностью (включая фрагменты природных пептидных гормонов, а также их аналогов и производных), или структурным мотивом пептидного гормона (включая природные пептидные гормоны, а также их аналоги и производные), которые придают желаемую химическую стабильность, конформационную стабильность, метаболическую стабильность, биодоступность, нацеленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание с белком плазмы и/или другие фармакокинетические характеристики гибридному полипептиду. Таким образом, дополнительный биоактивный пептидный модуль(и) может быть выбран из сложных пептидных гормонов, и может быть пептидным гормоном (включая природные пептидные гормоны, а также их аналоги и производные), пептидным фрагментом с гормональной активностью(включая фрагменты природных пептидных гормонов, а также их аналогов и производных) или структурный мотив пептидного гормона (включая природные пептидные гормоны, а также их аналоги и производные), которые придают желаемую химическую стабильность, конформационную стабильность,метаболическую стабильность, биодоступность, нацеленность на орган/ткань, взаимодействие с рецептором, ингибирование протеазы, связывание с белком плазмы и/или другие фармакокинетические характеристики гибридному полипептиду. Первый пептидный гормон и дополнительный пептидный гормон могут быть одинаковыми пептидными гормонами, могут быть из одного семейства пептидных гормонов или могут быть различными пептидными гормонами в зависимости от желаемых характеристик биоактивных модулей пептидного гормона. В данном описании термин "биоактивный" относится к (1) биологической активности по крайней мере в одном in vivo гормональном пути, или (2) модулированию терапевтической эффективности, спектра действия, продолжительности действия, физико-химических свойств и/или других фармакокинетических свойств такого биологического действия. Биологическое действие может быть оценено с применением анализов связывания с рецептором целевого гормона, или с применением исследований обмена веществ, которые контролируют физиологические показания, как известно в данной области техники и описано здесь. Модулирование терапевтической эффективности, спектра действия, продолжительности действия, физико-химических свойств и/или других фармакокинетических свойств такого биологического действия может быть проведено путем изменения в, например, химической стабильности, конформационной стабильности, метаболической стабильности, биодоступности, нацеленности на орган/ткань,взаимодействия с рецептором, ингибирования протеазы, связывания с белком плазмы и/или других фармакокинетических характеристик. В одном варианте гибридные полипептиды в соответствии с данным изобретением сохраняют по крайней мере около 25%, предпочтительно около 30, 40, 50, 60, 70, 80, 90, 95, 98 или 99% биологической активности сложного пептидного гормона. Предпочтительными гибридными полипептидами являются такие, которые демонстрируют эффективность в одном из анализов обмена веществ, известных в данной области техники или описанных здесь (например, анализе связывания с рецептором, потребления пищи,опорожнения желудка, секреции поджелудочной железы, секреции инсулина, снижения глюкозы в крови, снижения веса и т.д.), которая равна или превосходит эффективность сложного пептидного гормона в том же анализе. Альтернативно, предпочтительные гибридные полипептиды в соответствии с данным изобретением могут обладать улучшенной технологичностью, стабильностью и/или простотой составления композиций, по сравнению со сложными пептидными гормонами. В другом варианте гибридные полипептиды в соответствии с данным изобретением сохраняют по крайней мере около 25, предпочтительно около 30, 40, 50, 60, 70, 80, 90, 95, 98 или 99% биологической активности природного сложного пептидного гормона, относящейся к снижению усваиваемости питательных веществ, снижению потребления пищи, влиянию на привес массы тела и/или лечению и профилактике состояний и нарушений обмена веществ. В еще одном варианте гибридные полипептиды в соответствии с данным изобретением обладают по крайней мере около 110, 125, 130, 140, 150, 200% или более биологического действия природного пептидного гормона, относящегося к снижению усваиваемости питательных веществ, снижению потребления пищи, влиянию на привес массы тела и/или лечению и профилактике состояний и нарушений обмена веществ. В другом варианте гибридные полипептиды в соответствии с данным изобретением обладают улучшенным агонистическим действием по отношению к рецептору сложного пептидного гормона. Сложные пептидные гормоны, аналоги и производные Сложные пептидные гормоны обычно включают пептидные гормоны, применяемые для лечения или профилактики заболеваний и нарушений обмена веществ, включающие: (а) семейство амилинов,включая амилин, адреномедуллин ("ADM"), кальцитонин ("КТ"), пептид, кодируемый геном кальцитонина ("CGRP"), интермедии (также известный как "AFP-6") и родственные пептиды; (b) холецистокинин("CCK"); (с) семейство лептинов, включая лептин и лептиноподобные пептиды; (d) семейство панкреатических полипептидов, включая панкреатический полипептид ("ПП") и пептид YY ("PYY"); (е) инкретины и миметики инкретинов, включая: пептидные гормоны, полученные из гена проглюкагона, такие как: глюкагон, глюкагоноподобный пептид-1 ("GPL-1"), глюкагоноподобный пептид 2 ("GPL-2") и оксинтомодулин ("ОХМ"); и экзендины, такие как экзендин-3 и экзендин-4; и (f) натрийуретические пепти- 14014647 ды, включая ANP, BNP, CNP и уродилатин, их предшественники и пептиды, полученные из (g) семейства урокортинов и (h) семейства нейромединов, и их аналоги, производные и фрагменты. Как здесь описано, пептидные гормоны в соответствии с данным изобретением также включают аналоги и производные, которые сохраняют гормональную активность таких природных пептидных гормонов. В одном варианте такие аналоги и производные являются агонистами рецептора целевого гормона. Под "амилином" подразумевается человеческий пептидный гормон, обозначенный как амилин и выделяемый из бета-клеток поджелудочной железы, и его видовые вариации, описанные в патенте США 5234906, выданном 10 августа 1993 г., под названием "Гипергликемические композиции", содержание которого включено в настоящее описание в качестве ссылки. Более конкретно, амилин является 37 аминокислотным полипептидным гормоном, обычно выделяемым совместно с инсулином бета-клетками поджелудочной железы в ответ на поступление питательных веществ (см., например, Koda et al., Lancet 339:1179-1180, 1992). В этом смысле термины "амилин", "дикий амилин" и "природный амилин", т.е. немодифицированный амилин, применяются взаимозаменяемо. Под "адреномедуллином" или "ADM" понимается человеческий пептидный гормон и его видовые вариации. Более конкретно, ADM получают из препрогормона, состоящего из 185 аминокислот, через последовательное ферментативное расщепление и амидирование. Этот процесс завершается высвобождением биоактивного пептида из 52 аминокислот. Под "кальцитонином" или "СТ" подразумевается человеческий пептидный гормон и его видовые варианты, включая кальцитонин лосося ("sCT"). Более конкретно, СТ представляет собой пептид из 32 аминокислот, отщепляемый от большего прогормона. Он содержит одинарную дисульфидную связь,которая обуславливает кольцевую форму аминоконцевой области. Альтернативный сплайсинг пре-мРНК кальцитонина может дать мРНК кодирующий пептид, кодируемый геном кальцитонина; предположительно, этот пептид действует в нервной и сосудистой системах. Рецептор кальцитонина клонирован и продемонстрирован как член семейства семи-трансмембраннах сопряженных с G белком рецепторов. Под "родственным гену кальцитонина пептидом" или "CGRP" подразумевается человеческий пептидный гормон и его видовые вариации в любой физиологической форме. Под "интермедином" или "AFP-6" подразумевается человеческий пептидный гормон и его видовые вариации в любой физиологической форме. Под "холецистокинином" или "CCK" подразумевается человеческий пептидный гормон и его видовые вариации. Более конкретно, CCK представляет собой последовательность из 33 аминокислот, сначала идентифицированную у человека, и включает in vivo С-концевой фрагмент из 8 аминокислот ("CCK8"), который, по имеющимся данным, обнаружен у свиньи, крысы, курицы, шиншиллы, собаки и человека. Таким образом, термин "CCK-33" в общем относится к человеческому CCK(1-33), а CCK-8 (CCK(2633); SEQ ID NO: 55) в общем относится к С-концевому октапептиду, сульфатированному или не сульфатированному, если не указано иначе. Далее, пентагастрин или CCK-5 относится к С-концевому пептидуCCK(29-33) (SEQ ID NO: 209), и CCK-4 относится к С-концевому тетрапептиду CCK(30-33) (SEQ ID NO: 208). Однако в данном описании термин CCK относится ко всем существующим в природе вариациям гормона, включая CCK-33, CCK-8, CCK-5 и CCK-4, в сульфатированной и не сульфатированной формах,если не указано иначе. Под "лептином" подразумевается существующий в природе лептин любых видов, а также биологически активные D-изоформы, или фрагменты существующих в природе лептина и его вариаций, и сочетания перечисленного выше. Лептин является полипептидным продуктом ob гена, как описано в публикации международного патентаWO 96/05309, который полностью включен в настоящее описание в качестве ссылки. Предполагаемые аналоги и фрагменты лептина описаны в патенте США 5521283, патенте США 5532336, PCT/US96/22308 и PCT/US96/01471, каждый из которых полностью включен в настоящее описание в качестве ссылки. Под "PP" подразумевается человеческий панкреатический пептид полипептид или его видовые вариации в любой физиологической форме. Таким образом, термин "PP" включает человеческий полный пептид из 36 аминокислот, описанный в (SEQ ID NO: 290), и видовые вариации РР, включая, например,РР мыши, хомяка, курицы, быка, крысы и собаки. В этом смысле термины "РР", "дикий РР" и "природный РР", т.е. не модифицированный РР, применяются взаимозаменяемо. Под "PYY" подразумевается человеческий пептид YY полипептид или его видовые вариации в любой физиологической форме. Таким образом, термин "PYY" включает человеческий полный пептид из 36 аминокислот и видовые вариации PYY, включая, например, PYY мыши, хомяка, курицы, быка, крысы и собаки. В этом смысле термины "PYY" и "дикий PYY" и "природный PYY", т.е. не модифицированныйPYY, применяются взаимозаменяемо. В контексте данного изобретения все модификации, описываемые со ссылкой на PYY аналогичные полипептиды в соответствии с данным изобретением, основаны на 36 аминокислотной последовательности природного человеческого PYY. Под "GPL-1" подразумевается человеческий глюкагоноподобный пептид-1 или его видовые вариации в любой физиологической форме. Термин "GPL-1" включает человеческий GPL-1 (1-37) (SEQ IDNO: 59), GPL-1 (7-37) (SEQ ID NO: 204) и GPL-1 (7-36) амид (SEQ ID NO: 61), со ссылкой на полный человеческий GPL-1 (1-37) (SEQ ID NO: 59), и видовые вариации GPL-1, включая, например, РР мыши,- 15014647 хомяка, курицы, быка, крысы и собаки. В этом смысле термины "GPL-1", "дикий GPL-1" и "природныйGPL-1", т.е. не модифицированный GPL-1, применяются взаимозаменяемо. Под "GPL-2" подразумевается человеческий глюкагоноподобный пептид-2 или его видовые вариации в любой физиологической форме. Более конкретно, GPL-2 представляет собой пептид из 33 аминокислот, выделяемый совместно с GPL-1 из эндокринных клеток кишечника в тонком и толстом кишечнике. Под "ОХМ" подразумевается человеческий оксинтомодулин или его видовые вариации в любой физиологической форме. Более конкретно, ОХМ представляет собой пептид из 37 аминокислот, который содержит последовательность глюкагона из 29 аминокислот с добавлением карбоксиконцевого удлиняющего сегмента из 8 аминокислот. Под "экзендином" подразумевают пептидный гормон, найденный в слюне ящериц-ядозубов, ящериц, которые водятся в Аризоне, и мексиканских ядозубов, а также его видовые вариации. Более конкретно, экзендин-3 присутствует в слюне ящериц эскорпионов, и экзендин-4 присутствует в слюне ящериц Жилатье (Eng, J., et al., J. Biol. Chem., 265:20259-62, 1990; Eng., J., et al., J. Biol. Chem., 267:7402-05(1992. Экзендины имеют некоторое сходство последовательности с некоторыми членами семейства глюкагоноподобных пептидов, с наивысшей идентичностью, 53%, к GPL-1 (Goke, et al., J. Biol. Chem.,268:19650-55 (1993. В этом смысле термины "экзендин", "дикий экзендин" и "природный экзендин", т.е. не модифицированный экзендин, применяются взаимозаменяемо. Под "урокортином" подразумевают человеческий урокортиновый пептидный гормон или его видовые варианты в любой физиологической форме. Более конкретно, существует три человеческих урокортина: Ucn-1, Ucn-2 и Ucn-3. Например, человеческий урокортин 1 имеет формулу: Asp-Asn-Pro-Ser-LeuSer-Ile-Asp-Leu-Thr-Phe-His-Leu-Leu-Arg-Thr-Leu-Leu-Glu-Leu-Ala-Arg-Thr-Gln-Ser-Gln-Arg-Glu-Arg-AlaGlu-Gln-Asn-Arg-Ile-Ile-Phe-Asp-Ser-Val-NH2 (SEQ ID NO: 294). Полученный у крысы урокортин является идентичным, но имеет 2 замещения: Asp2 вместо Asn2 и Pro4 вместо Ser4. Человеческий Ucn-2 имеет последовательность Ile Val Leu Ser Leu Asp Val Pro He Gly Leu Leu Gln Ile Leu Leu Glu Gln Ala Arg AlaPhe Asn Ile Ala Lys Ala Lys Asn Leu Arg Ala Gin Ala Ala Ala Asn Ala His Leu Met Ala Gln Ile (SEQ ID NO: 299). Ucn-3 предпочтительно имеет форму амида. Другие урокортины и аналоги описаны в литературе,например, в патенте США 6214797. Урокортины Ucn-2 и Ucn-3, которые сохраняют свойства подавления потребления пищи и антигипертензивные/кардиопротекторные/инотропные свойства, находят широкое применение в гибридах в соответствии с данным изобретением. Стресскопин (Ucn-3) и родственный стресскопину пептид (Ucn 2), названный так из-за его способности подавлять хроническую активацию НРА в ответ на стрем, такой как диета/голодание, является специфическим к рецептору CRF типа 2 и не активирует CRF-R1, который медиирует выделение АСТН. Гибриды, содержащие урокортин, например, Ucn-2 или Ucn-3, особенно полезны благодаря сосудорасширяющему действию и, таким образом, применяются при описанных здесь сердечно-сосудистых заболеваниях, например CHF. Содержащие урокортин гибриды в соответствии с данным изобретением находят особое применение в лечении или профилактике состояний, связанных со стимуляцией выделения АСТН, гипертонии из-за сосудорасширяющего действия, воспаления, опосредованного отличным от АСТН увеличением, гипертермии, нарушения аппетита, застойной сердечной недостаточности, стресса, тревоги и псориаза. Такие соединения также применяются для получения антипролиферативного действия, такого как лечение или профилактика рака или роста опухоли. Особенный интерес представляет модуль пептидного гормона урокортина,объединенный с натрийуретическим пептидным модулем, семейством амилинов, семейством экзендинов или модулем семейства GPL1, для получения улучшенного благоприятного действия на сердечнососудистую систему, например, для лечения CHF через благоприятное сосудорасширяющее действие. Под "нейромедином" подразумевается семейство пептидов нейромедина, включающее пептиды нейромедин U и S, более конкретно их активные последовательности гормона. Например, природным активным человеческим пептидным гормоном нейромедином U является нейромедин-U25: Phe Arg ValFKVDEEFQGPIVSQNRRYFLFRPRN (SEQ ID NO: 314), особенно ее амидную форму. Другие члены семейства нейромединов U включают перечисленные под обозначением SWISS-PROT и входными номерами: NEUUCANFA (Р 34962), NEUUCAVPO (Р 34966), NEUUCHICK (Р 34963), NEUUHUMAN(P34965), NEUURANTE (P20056) и NEUURAT (P12760). Особенный интерес представляют их обработанные активные пептидные гормоны и их аналоги, производные и фрагменты. В семейство нейромединовU включены различные усеченные или сплайсированные варианты,напримерFLFHYSKTQKLGKSNVVEELQSPFASQSRGYFLFRPRN (SEQ ID NO: 300). Типовым представителем семейства нейромединов S является человеческий нейромедин S, имеющий последовательностьILQRGSGTAAVDFTKKDHTATWGRPFFLFRPRN (SEQ ID NO: 315), особенно его амидная форма. Гибриды в соответствии с данным изобретением, содержащие модуль нейромедина, обладают анорексиген- 16014647 ным действием и, таким образом, являются ценными для лечения ожирения, диабета, снижения потребления пищи и других подобных состояний и нарушений, описанных здесь. Особенный интерес представляют модули нейромедина, объединенные с модулем пептида семейства амилинов, пептида семейства экзендинов или пептида семейства GPL1. В данном описании термин "аналог" относится к пептиду, последовательность которого получена из последовательности основного ссылочного пептида (например, РР, PYY, амилин, GPL-1, экзендин и т.д.), включая вставки, замещения, удлинения и/или делецию ссылочной последовательности аминокислот, предпочтительно имеющему 50 или 55% идентичность последовательности аминокислот с основным пептидом, более предпочтительно, имеющему по крайней мере 70, 80, 90 или 95% идентичность последовательности аминокислот с основным пептидом. В одном варианте такие аналоги могут содержать консервативные или не консервативные замещения аминокислот (включая не природные аминокислоты и L и D формы)."Производное" определено как молекула, имеющая последовательность аминокислот природного ссылочного пептида или аналога, но дополнительно имеющая химические модификации одной или более из боковых групп аминокислот, атомов -углерода, концевой аминогруппы или концевой группы карбоновой кислоты. Химическая модификация включает, но не ограничена ими, добавление химических групп, создание новых связей и удаление химических групп. Модификации боковых групп аминокислот включают, без ограничения, ацилирование -аминогрупп лизина, N-алкилирование аргинина, гистидина или лизина, алкилирование глутаминовых или аспарагиновых групп карбоновой кислоты и деамидирование глутамина или аспаргина. Модификации концевого амино включают, без ограничения, дезамино,N-низший алкил, N-ди-низший алкил, ограниченные алкилы (например, разветвленный, циклический,конденсированный, адамантил) и модификации N-ацила. Модификации концевой карбоксигруппы включают, без ограничения, амид, амид низшего алкила, ограниченные алкилы (например, разветвленный, циклический, конденсированный, адамантил), алкил, диалкиламид и модификации сложного эфира низшего алкила. Низшим алкилом является С 1-С 4-алкил. Далее, одна или более из боковых групп или концевых групп могут быть защищены защитными группами, известными специалисту в области пептидной химии. -углерод аминокислоты может быть моно- или диметилирован. Под "агонистом" понимается соединение, которое обладает биологическим действием природного человеческого ссылочного пептида, предпочтительно имеет эффективность, большую, чем у ссылочного пептида, или имеет пятикратную (плюс/минус) эффективность по сравнению со ссылочным пептидом,более предпочтительно 4-, 3-, 2- или 1-кратную, оцениваемую с применением известных в данной области техники методов измерения, таких как связывание с рецептором/сравнительные исследования. В одном варианте термин относится к соединению, которое обладает биологическим действием, таким же как у природного человеческого ссылочного пептида, например соединению (1) оказывающему действие в анализах потребления пищи, опорожнения желудка, секреции поджелудочной железы или потери веса,сходное с природным человеческим ссылочным пептидом, или (2) которое специфически связывается в анализе ссылочного рецептора или в сравнительном анализе связывания, с меченным ссылочным пептидом. Предпочтительно агонисты связываются в таких анализах со сродством более 1 мкМ, более предпочтительно со сродством более 1-5 нМ. В другом варианте термин относится к соединению, которое оказывает биологическое действие при лечении диабета или связанных с диабетом состояний или нарушений. Такие агонисты могут содержать активный фрагмент ссылочного пептида или небольшую химическую молекулу. Под "аминокислотой" и "остатком аминокислоты" подразумевают природные аминокислоты, не природные аминокислоты и модифицированные аминокислоты. Если не указано иначе, любая ссылка на аминокислоту, обычно или специально на наименование, включает ссылки на оба D и L стереоизомера,если ее структура допускает такие стереоизомерные формы. Природные аминокислоты включают аланин(Tyr) и валин (Val). Неприродные аминокислоты включают, но не ограничены ими, гомолизин, гомоаргинин, азетидинкарбоновую кислоту, 2-аминоадипиновую кислоту, 3-аминоадипиновую кислоту, бетааланин, аминопропионовую кислоту, 2-аминомасляную кислоту, 4-аминомасляную кислоту, 6 аминокапроновую кислоту, 2-аминогептановую кислоту, 2-аминоизомасляную кислоту, 3 аминоизомасляную кислоту, 2-аминопимелиновую кислоту, третичный бутилглицин, 2,4 диаминоизомасляную кислоту, десмозин, 2,2'-диаминопимелиновую кислоту, 2,3-диаминопропионовую кислоту, N-этилглицин, N-этиласпарагин, гомопролин, гидроксилизин, аллогидроксилизин, 3 гидроксипролин, 4-гидроксипролин, изодесмозин, аллоизолейцин, N-метилаланин, N-метилглицин, Nметилизолейцин, N-метилпентилглицин, N-метилвалин, нафталанин, норвалин, норлейцин, орнитин,пентилглицин, пипеколиновая кислота и тиопролин. Дополнительные неприродные аминокислоты включают модифицированные остатки аминокислот, которые химически блокированы, обратимо или необратимо, или химически модифицированы на N-концевой аминогруппе или группах боковых цепей,- 17014647 например, N-метилированные D и L аминокислоты или остатки, где функциональные группы боковой цепи химически модифицированы до других функциональных групп. Например, модифицированные аминокислоты включают сульфоксид метионина; сульфон метионина; (бета-метиловый эфир) аспарагиновой кислоты, модифицированная аминокислота аспарагиновой кислоты; N-этилглицин, модифицированная аминокислота глицина; или карбоксамид аланина, модифицированная аминокислота аланина. Дополнительные остатки, которые могут быть введены, описаны в Sandberg et al., J. Med. Chem. 41: 248191, 1998. В данном описании "5 Ара" означает 5 аминопентаноил, "12 Ado" означает 12-аминододеканоил,"ПЭГ(8)" означает 3,6,-диоксиоктаноил и "ПЭГ(13)" означает сукцинимоил 1-амино-4,7,10-триокса-13 тридеканамина. Как здесь описано, природные сложные пептидные гормоны известны в данной области техники,также как и их аналоги и производные. Для ссылки, последовательности некоторых природных сложных пептидных гормонов представлены в табл. 1. Таблица 1 Типовые сложные пептидные гормоны Эти пептиды обычно являются амидированными на С-концевой области при физиологическом экспрессировании, но это не обязательно для целей данного изобретения. Другими словами, С-концевая область таких пептидов, а также гибридных полипептидов в соответствии с данным изобретением, могут иметь свободную -ОН или -NH2 группу. Эти пептиды также могут иметь другие посттрансляционные модификации. Специалист в данной области техники поймет, что гибридные полипептиды в соответствии с данным изобретением также могут быть сконструированы с метиониновым остатком на Nконцевой области. Типовые пептидные модули для применения в соответствии с данным изобретением также включают продлеваемые на N-концевой области пептидные модули (и их аналоги и фрагменты), включая апелин, который существует в 2 формах, апелин 36 и 13, оба которые активны к рецептору AJPTPDINPAWYASRGIRPVGRF-NH2 (SEQ ID NO: 319; гастрин, который существует в виде большого гастрина и мини-гастрина, область активность которых находится в остатках пентагастринаNO: 327; GRP, у которого основная активность приходится на 10 аминокислот С-концевой областиNO: 329; нейромедин В, у которого основная активность приходится на 10 аминокислот С-концевой области (LSWDLPEPRSRASKIRVHSRGNLWATGHFM-NH2 (SEQ ID NO: 330); GNLWATGHFM-NH2(SEQ ID NO: 331; нейромедин S, у которого основная активность приходится на 9 аминокислот Сконцевой области (ILQRGSGTAAVDFTKKDHTATWGRPFFLFRPRN-NH2 (SEQ ID NO: 315);PFFLFRPRN-NH2 (SEQ ID NO: 332; нейромедин U, у которого основная активность приходится на 9 аминокислот С-концевой области (FRVDEEFQSPFASQSRGYFLFRPRN-NH2 (SEQ ID NO: 308);(KIPYILKRQLYENKPRRPYIL-OH (SEQ ID NO: 333); QLYENKPRRPYIL-OH) (SEQ ID NO: 334); Kiss-1,активность которого в основном приходится на С-концевую областьEKDLPNYNWNSFGLRF-NH2 (SEQ ID NO: 336; RF-амид-3, фрагменты С-концевой области которого обладают активностью (SAGATANLPLRSGRNMEVSLVRRVPNLPQRF-NH2 (SEQ ID NO: 337);VPNLPQRF-NH2 (SEQ ID NO: 338; динорфин, который существует в виде большого динорфина (А) динорфина В (риморфин) (YGGFLRRIRPKLKWDNQKRYGGFLRRQFKVVT-OH (SEQ ID NO: 339) иYGGFLRRQFKVVT-OH (SEQ ID NO: 340; PYY, фрагменты С-концевой области которого активны по- 19014647 отношению к рецептору Y2 (YPIKPEAPGEDASPEELNRYYASLRHYLNLVTRQRY-NH2 (SEQ ID NO: 57); SLRHYLNLVTRQRY-NH2 (SEQ ID NO: 341; AFP-6, 7-47 области которого сохраняют активностьVGCVLGTCQVQNLSHRLWQLMGPAGRQDSAPVDPSSPHSY-NH2 (SEQ ID NO: 52; семейство амилинов, включая адреномодуллин, кальцитонин и CGRP; окситоцин, С-концевой амид которого обычно нуждается в активности и может допускать удлинение N-концевой области. Типовые пептидные модули для применения в соответствии с данным изобретением также включают удлиняемые в С-концевой области пептидные модули, включая эндотелии I, II и III: ETICTCFTYKDKECVYYCHLDIIW-OH (SEQ ID NO: 347; грелин, у которого основная активность приходится на первые 10 остатков (GSSFLSPEHQRVQQRKESKKPPAKLQP-OH (SEQ ID NO: 348);GSSFLSPEHQ-OH (SEQ ID NO: 349; глюкагоны, включая оксинтомодулин, который является удлиненным в С-концевой области глюкагоном с глюкагоноподобной активностью (HSQGTFTSDYSKYLDSRRAQDFVQWLMNTKRNRNNIA-OHHSQGTFTSDYSKYLDSRRAQDFVQWLMNT-OH (SEQ ID NO: 351; GPL-1/GPL-2, активность которых сохраняется с или без С-концевого амида; GIP, который циркулирует в 2 формах, GIP1-42 и GIP1-30, обе которые полностью активны к рецептору GIP (YAEGTFISDYSIAMDKIHQQDFVNWLLAQKGKKNDWKHNITQ-OHW, который существует как NPW23 и NPW30, равно активные к GPR7 и 8HADGVFTSDFSKLLGQLSAKKYLESLM-NH2 (SEQ ID NO: 359; GRF, который существует в 2 формах,GRF29 и GRF40 (YADAIFTNSYRKVLGQLSARKLLQDIMSRQQGESNQERGARARL-NH2 (SEQ ID NO: 360); YADAIFTNSYRKVLGQLSARKLLQDIMS-OH (SEQ ID NO: 361; PTH 1-34 и 1-37 формы, которые обладают активностью полного РТН 1-84 (SVSEIQLMHNLGKHLNSMERVEWLRKKLQDVHNFVALGAPLAPRDAGSQRPRKKEDNVLVES HEKSLGEADKADVNVLTKAKSQ (SEQ ID NO: 362);SVSEIQLMHNLGKHLNSMERVEWLRKKLQDVHNF-OH (SEQ ID NO: 364 PTH-RP, у которого 1-36 обладает активностью полного 1-86 (AVSEHQLLHDKGKSIQDLRRRFFLHHLIAEIHTAEIRATSEVSPNSKPSPNTKNHPVRFGSDDEGRYLTQETNKVETYKEQPLKTPGKKKKGKP-NH2 (SEQ ID NO: 365);AVSEHQLLHDKGKSIQDLRRRFFLHHLIAEIHTAEI-OH (SEQ ID NO: 366 гамма-MSH, у которого более короткий гамма-MSH1 и более длинный гамма-MSH3 имеют одинаковую активностьMSH,у которого альфа-MSH является активной частью АСТН(SYSMEHFRWGKPVGKKRRPVKVYPNGAEDESAEAFPLEF-OH (SEQ ID NO: 369); SYSMEHFRWGKPVNH2 (SEQ ID NO: 370; и эндорфины, у которых А, дельта иэндорфин являются активными пептидными фрагментами большегоэндорфина (YGGFMTSEKSQTPLVTLFKNAIIKNAYKKGE-OH (SEQ ID(SEQ ID NO: 373); YGGFMTSEKSQTPLVT-OH (SEQ ID NO: 374. Например, меланокортины представляют собой пептиды из гена про-опиомеланокортина, включающие альфа-меланоцит-стимулирующий гормон (альфа-MSH) и адренокортикотрофический гормон(АСТН), и известны пять рецепторов меланокортина, MC1-5R. MC4R по всей видимости играет роль в энергетическом обмене и ожирении, см., например, Anderson et al., Expert Opin. Ther. Patents 11:15831592 (2001), Speake et al., Expert Opin. Ther. Patents 12:1631-1638 (2002), Bednarek et al., Expert Opin. Ther.Patents 14:327-336 (2004). Аналоги указанных выше сложных пептидных гормонов известны в данной области техники, но обычно включают модификации, такие как замещения, делеции и включения в последовательность аминокислот таких сложных пептидных гормонов, и любое их сочетание. Замещения, включения и делеции могут быть в N-концевой или С-концевой областях, или могут быть во внутренней части сложного пептидного гормона. В предпочтительном аспекте аналоги сложных пептидных гормонов в соответствии с данным изобретением включают одну или более модификацию "не жизненно важного" аминокислотного остатка. В этом контексте данного изобретения "не жизненно важным" аминокислотным остатком является остаток,который может быть изменен, т.е. убран или замещен, в природной человеческой последовательности аминокислот, например фрагменте сложного пептидного гормона, не отменяя или значительно снижая агонистическое действие на рецептор сложного пептидного гормона у полученного аналога.- 20014647 Предпочтительные замещения включают сохраненные замещения аминокислоты. "Сохраненное замещение аминокислоты" является таким замещением, при котором аминокислотный остаток замещают аминокислотным остатком, имеющим подобную боковую цепь или физико-химические характеристики(например, электростатические, связывающие водород, изостерные, гидрофобные характеристики). Семейства аминокислотных остатков, имеющих похожие боковые цепи, известны в данной области техники. Такие семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин,гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), не заряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, метионин, цистеин), не полярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан), -разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Данное изобретение также относится к производным сложных пептидных гормонов. Такие производные включают сложные пептидные гормоны и их аналоги, сопряженные с одной или более водорастворимыми полимерными молекулами, такими как полиэтиленгликоль ("ПЭГ") или цепи жирной кислоты различной длины (например, стеарил, пальмитоил, октаноил и т.д.), или к которым добавлены полиаминокислоты, такие как поли-his, поли-arg, поли-lys и поли-ala. Модификации сложных пептидных гормонов или их аналогов также включают низкомолекулярные заместители, такие как короткие алкилы и ограниченные алкилы (например, разветвленный, циклический, конденсированный, адамантил) и ароматические группы. Молекулы водорастворимого полимера предпочтительно имеют молекулярную массу от около 500 до около 20000 Дальтонов. Такие модификации сопряжением с полимером и низкомолекулярными заместителями могут быть проведены сингулярно на N- или С-концевой области или на боковых цепях аминокислотных остатков в последовательности гибридных полипептидов. Альтернативно, в гибридном полипептиде может быть множество мест образования производных. Замещение одной или более аминокислот лизином, аспарагиновой кислотой, глутаминовой кислотой или цистеином может обеспечить дополнительные места для образования производных, см., например, патенты США 5824784 и 5824778. Предпочтительно, гибридные полипептиды могут быть сопряжены с одной, двумя или тремя молекулами полимера. Молекулы водорастворимого полимера предпочтительно связаны с амино, карбоксильной или тиольной группой и могут быть связаны через N- или С-концевую область или с боковыми цепями лизина,аспарагиновой кислоты, глутаминовой кислоты или цистеина. Альтернативно, молекулы водорастворимого полимера могут быть связаны с диамином и дикарбоновыми группами. В предпочтительном варианте гибридные полипептиды в соответствии с данным изобретением сопряжены с одной, двумя или тремя молекулами ПЭГ через эпсилон-аминогруппу аминокислоты лизина. Производные в соответствии с данным изобретением также включают сложные пептидные гормоны или аналоги с химическими изменениями в одном или более аминокислотных остатках. Такие химические изменения включают амидирование, гликозилирование, ацилирование, сульфатирование, фосфорилирование, ацетилирование и циклизацию. Химические изменения могут быть проведены сингулярно в N- или С-концевых областях или в боковых цепях аминокислотных остатков в последовательности PPF гибридных полипептидов. В одном варианте С-концевая область таких пептидов может иметь свободные-ОН или -NH2 группы. В другом варианте N-концевая область может быть закрыта изобутилоксикарбонильной группой, изопропилоксикарбонильной группой, н-бутилоксикарбонильной группой, этоксикарбонильной группой, изокапроильной группой (изокап), октанильной группой, октилглициновой группой (G(Oct или группой 8-аминооктановой кислоты. В предпочтительном варианте циклизация может быть осуществлена через образование дисульфидных мостиков. Альтернативно, в гибридном полипептиде может существовать множество мест химического изменения. Семейство амилинов Как описано, сложные пептидные гормоны, применяемые в соответствии с данным изобретением,включают пептидные гормоны семейства амилинов, включающие амилин, адреномодуллин ("ADM"),кальцитонин ("СТ"), пептид, кодируемый геном кальцитонина ("CGRP"), интермедии (также известный как "AFP-6") и родственные пептиды. Природные пептидные гормоны семейства амилинов известны в данной области техники, так же как и их функциональные пептидные аналоги и производные. Определенные предпочтительные природные пептиды, пептидные аналоги и производные описаны здесь, однако должно быть понятно, что любые известные пептиды семейства амилинов, которые обладают гормональным действием, известным в данной области техники, могут применяться в соответствии с данным изобретением. Любой аналог или производное амилина, известные в данной области техники, могут применяться в соответствии с данным изобретением. В одном варианте аналоги и производные амилина проявляют по крайней мере одну гормональную активность природного амилина. В определенных вариантах аналоги амилина являются агонистами рецептора, с которым природный амилин способен специфически связываться. Предпочтительные аналоги и производные амилина включают те, которые описаны в- 21014647 Примеры аналогов амилина включают Как известно в данной области техники, такие аналоги амилина предпочтительно амидированы, но в контексте данного изобретения могут необязательно иметь форму кислоты, если не указано иначе. Любой аналог или производное ADM, известные в данной области техники, могут применяться в соответствии с данным изобретением. В другом варианте аналоги и производные ADM проявляют по крайней мере одну гормональную активность природного ADM. В определенных вариантах аналогамиADM являются агонисты рецептора, с которым природный ADM способен связываться специфически. Любой аналог или производное СТ, известные в данной области техники, могут применяться в соответствии с данным изобретением. В одном варианте аналоги и производные СТ проявляют по крайней мере одну гормональную активность природного СТ. В определенных вариантах аналогами СТ являются агонисты рецептора, с которым природный СТ способен связываться специфически. Предпочтительные аналоги и производные СТ включают те, которые описаны в патентах США 4652627; 4606856; 4604238; 4597900; 4537716; 4497731; 4495097; 4444981; 4414149; 4401593 и 4397780, которые включены в настоящее описание в качестве ссылок. Типовые аналоги СТ включают Как известно в данной области техники, такие аналоги СТ предпочтительно амидированы, но в контексте данного изобретения могут быть необязательно в форме кислоты, если не указано иначе. Любой аналог или производное CGRP, известные в данной области техники, могут применяться в соответствии с данным изобретением. В одном варианте аналоги и производные CGRP проявляют по крайней мере одну гормональную активность природного CGRP. В определенных вариантах аналогами Любой аналог или производное AFP-6, известные в данной области техники, могут применяться в соответствии с данным изобретением. В одном варианте аналоги и производные AFP-6 проявляют по крайней мере одну гормональную активность природного AFP-6. В определенных вариантах аналогами Как известно в данной области техники, такие аналоги AFP-6 предпочтительно амидированы, но в контексте данного изобретения могут быть необязательно в форме кислоты, если не указано иначе. Семейство CCKCCK, включая hCCK и видовые вариации, и различные аналоги известны в данной области техники. В общем, CCK имеют последовательность из 33 аминокислот, впервые идентифицированную у человека, и включают in vivo С-концевой фрагмент из 8 аминокислот ("CCK-8"), который, по имеющимся данным, был найден у свиньи, крысы, курицы, шиншиллы, собаки и человека. Другие видовые вариации включают последовательность из 39 аминокислот, найденную у свиньи, собаки и морской свинки, и последовательность из 58 аминокислот, найденную у кошки, собаки и человека, и последовательности из 47 аминокислот, гомологичные CCK и гастрину. С-концевая тирозин-сульфатированная октапептидная последовательность (CCK-8) относительно сохранена в видах и может быть минимальной последовательностью, обеспечивающей биологическое действие в периферической системе грызунов. Таким образом, термин CCK-33 обычно относится к человеческому CCK(1-33), а CCK-8 (CCK(26-33); SEQ ID NO: 55) относится к С-концевому октапептиду, в общем, в сульфатированной и не сульфатированной формах,если не указано иначе. Далее, пентагастрин или CCK-5 относится к С-концевому пептиду CCK(29-33)(SEQ ID NO: 209), и CCK-4 относится к С-концевому тетрапептиду CCK(30-33) (SEQ ID NO: 208). Было описано, что подтип рецептора типа А (CCKA) является селективным к сульфатированному октапептиду. Подтип рецептора типа В (CCKB) был идентифицирован в мозге и в желудке, и, по имеющимся данным, не требует сульфатирования всех восьми аминокислот. Различные in vivo и in vitro скриннинговые методы для аналогов CCK известны в данной области техники. Примеры включают in vivo анализы, включающие сокращение желчного пузыря собаки или морской свинки после быстрого внутривенного введения соединения, которое тестируется на CCKподобную активность, и in vitro анализы с применением соскобов желчного пузыря кролика, см. Walsh,"Gastrointestinal Hormones", In Physiology of the Gastrointestinal Tract (3d ed. 1994; Raven Press, New York). Определенные типовые CCK и аналоги CCK, обладающие действием CCK включают Как известно в данной области техники, такие аналоги пептидов CCK предпочтительно амидированы, но в контексте данного изобретения могут быть необязательно в форме кислоты, если не указано иначе. Семейство лептинов Сложные пептидные гормоны, применяемые в соответствии с данным изобретением, также включают пептидные гормоны семейства лептинов. Природные пептидные гормоны семейства лептинов известны в данной области техники, так же как и их функциональные пептидные аналоги и производные. Определенные предпочтительные природные пептиды, аналоги и производные пептидов описаны здесь,но должно быть понятно, что любой известный пептид семейства амилинов, который обладает гормональным действием, известным в данной области техники, может применяться в соответствии с данным изобретением. Любой аналог или производное лептина, известные в данной области техники, могут применяться в соответствии с данным изобретением. В одном варианте аналоги и производные лептина проявляют по крайней мере одну гормональную активность природного лептина. В определенных вариантах аналогами лептина являются агонисты рецептора, с которым природный лептин способен связываться специфически. Предпочтительные аналоги и производные лептина включают те, которые описаны, например, вWO 2004/039832, WO 98/55139, WO 98/12224 и WO 97/02004, которые все включены в настоящее описание в качестве ссылок. В одном варианте пептиды лептина включают В одном варианте лептиновый пептид может иметь аминокислотную последовательность Xaan-SerCys-Xaa1-Leu-Pro-Xaa2-Xaa3-Xaan (SEQ ID NO: 410), где Xaan может быть нулевыми остатками в длине,или может быть соседним фрагментом пептидных остатков, полученных из полных человеческих или мышиных последовательностей лептина, фрагментом между 1 и 7 либо в С-концевой, либо в N-концевой областях, или где лептиновый пептид включает всего 15 аминокислот или менее. В другом вариантеXaa1, Xaa2 или Хаа 3 могут быть любым заместителем аминокислоты. В еще одном варианте Xaa1, Xaa2 или Хаа 3 может быть любым консервативным заместителем аминокислоты соответствующих остатков в полном мышином или человеческом лептине. В другом варианте Xaa1 может быть выбран из группы,включающей His или Ser, и Хаа 2 или Хаа 3 является любым заместителем аминокислоты. В другом варианте Хаа 2 может быть выбран из группы, включающей Trp или Gln, и Xaa1 или Хаа 3 является любым заместителем аминокислоты. В еще одном варианте Хаа 3 может быть выбран из группы, включающейAla или Thr, и Xaa1 или Хаа 2 является любым заместителем аминокислоты. В другом варианте Xaa1 может быть выбран из группы, включающей His или Ser, Xaa2 может быть выбран из группы, включающейTrp или Gln, и Хаа 3 может быть выбран из группы, включающей Ala или Thr, см. WO 04039832. В одном варианте лептиновый пептид содержит С-концевые аминокислотные остатки 116-122 природного полного человеческого или мышиного лептина (соответствующие положениям 95-101 их зрелой формы) и его D-изоформ, фрагментов, производных, аналогов и гомологов, которые обладают способностью модулировать гомеостаз массы тела у тестируемых животных при в.б. (внутрибрюшинном) введении. Определенные мышиные D-замещенные пептиды с последовательностью SCSLPQT (SEQ ID NO: 411) включают [D-Ser-1]-, [D-Cys-2]-, [D-Ser-3]-, [D-Leu-4]-, [D-Pro-5]-, [D-Gln-6]-, [D-Thr-7]-SCSLPQT(SEQ ID NO: 411) и все [D] SCSLPQT (SEQ ID NO: 411). Определенные человеческие D-замещенные пептиды SCHLPWA (SEQ ID NO: 412) включают [D-Ser-1]-, [D-Cys-2]-, [D-His-3]-, [D-Leu-4]-, [D-Pro-5]-,[D-Trp-6]-, [D-Ala-7]-SCHLPWA (SEQ ID NO: 412) и все [D]-SCHLPWA (SEQ ID NO: 412). Кроме того,SCHLPWA (SEQ ID NO: 412) и SCSLPQT (SEQ ID NO: 411) пептиды могут содержать D-замещенные аминокислоты в любых двух, трех, четырех, пяти или шести положениях. Также описаны родственные лептину пептиды, содержащие N-концевые аминокислоты 21-35, 31-45, 41-55 и 51-65 природного лепти- 24014647 на и его фрагментов, производных, аналогов и гомологов. Дополнительные лептиновые пептиды в соответствии с данным изобретением включают аминокислотные последовательности 61-75, 71-85, 81-95, 91105, 106-120, 116-130, 126-140, 136-150, 146-160 и 156-167 мышиного и/или человеческого полного лептина, см. WO 04039832. В одном варианте лептин имеет последовательность где Хаа в положении 6 является Trp или Gln; Хаа в положении 36 является Gln или Glu; Хаа в положении 40 является Gln или Glu; Хаа в положении 42 является Ile, Leu, Met или сульфоксидом метионина; Хаа в положении 44 является Trp или Gln; и Хаа в положении 45 является Gln или Glu. В другом варианте представлен лептин, такой как описан выше, где Хаа в положении 6 является Trp; Хаа в положении 36 является Gln; Хаа в положении 40 является Gln; Хаа в положении 42 является Met; Хаа в положении 44 является Trp; и Хаа в положении 45 является Gln, см. патент США 5521283. В одном варианте лептины представляют собой природные последовательности, включая мышиный лептин: В другом варианте лептиновые пептиды имеют последовательность где Хаа в положении 22 является Asn, Asp или Glu; Хаа в положении 27 является Thr или Ala; Хаа в положении 28 является Gln, Glu или отсутствует; Хаа в положении 54 является Met или Ala; Хаа в положении 68 является Met или Leu; Хаа в положен 72 является Asn, Asp или Glu; Хаа в положении 77 является Ser или Ala; Хаа в положении 118 является Gly или Leu; указанный белок имеет по крайней мере один заместитель, выбранный из группы, включающей: His в положении 97 замещен Ser или Pro; Trp в- 26014647 положении 100 замещен Gln, Ala или Leu; Ala в положении 101 замещен Thr или Val; Ser в положении 102 замещен Arg; Gly в положении 103 замещен Ala; Glu в положении 105 замещен Gln; Thr в положении 106 замещен Lys или Ser; Leu в положении 107 замещен Pro; Asp в положении 108 замещен Glu; или Gly в положении 111 замещен Asp. В другом варианте лептин имеет последовательность Хаа в положении 27 является Thr или Ala; Хаа в положении 77 является Ser или Ala; Хаа в положении 118 является Gly или Leu; указанный белок имеет по крайней мере один заместитель, предпочтительно, имеет от одного до пяти заместителей и, наиболее предпочтительно, от одного до двух заместителей, выбранных из группы, включающей: His в положении 97 замещен Ser; Trp в положении 100 замещен Gln; Ala в положении 101 замещен Thr; Glu в положении 105 замещен Gln; Thr в положении 106 замещен Lys; Leu в положении 107 замещен Pro; Asp в положении 108 замещен Glu; или Gly в положении 111 замещен Asp. В других вариантах указанной выше последовательности, Хаа в положении 27 является Thr; Xaa в положении 77 является Ser; Xaa в положении 118 является Gly; и аминокислотные остатки в положениях 97, 100, 101, 105, 106, 107, 108 и 111 такие, как в представленной далее таблице.
МПК / Метки
МПК: A61K 38/22, A61P 35/00, C07K 14/575, C07K 14/435, C07K 19/00
Метки: полипептиды, свойствами, гибридные, селектируемыми
Код ссылки
<a href="https://eas.patents.su/30-14647-gibridnye-polipeptidy-s-selektiruemymi-svojjstvami.html" rel="bookmark" title="База патентов Евразийского Союза">Гибридные полипептиды с селектируемыми свойствами</a>
Предыдущий патент: Макроциклические ингибиторы вируса гепатита с
Следующий патент: Способ обнаружения патогенов
Случайный патент: Гранулярные препараты габоксадола