Конъюгаты гидроксиалкилкрахмала и действующего вещества, полученные химическим лигированием через тиазолидин
Формула / Реферат
1. Способ получения конъюгата действующего вещества и гидроксиалкилкрахмала, в котором действующее вещество и гидроксиалкилкрахмал ковалентно связаны с помощью химического остатка, имеющего структуру формулы (I)
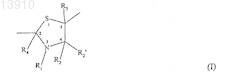
или формулы (I')

или формулы (I")
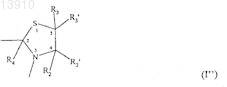
где R1, R2, R2', R3, R3' и R4независимо выбирают из группы, состоящей из водорода, необязательно подходящим образом замещенной, линейной, циклической и/или разветвленной алкильной, арильной, гетероарильной, аралкильной и гетероаралкильной группы, предпочтительно водорода,
указанный способ включает:
(А) взаимодействие альдегидной группы, кетогруппы или полуацетальной группы производного гидроксиалкилкрахмала, содержащего указанную альдегидную группу, кетогруппу или полуацетальную группу, с альфа-SH-бета-аминогруппой
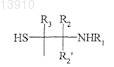
действующего вещества или его производного, содержащего указанную альфа-SH-бета-аминогруппу, таким образом получая конъюгат указанного действующего вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I), или с альфа-SH-бета-аминогруппой
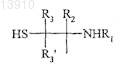
действующего вещества или его производного, содержащего указанную альфа-SH-бета-аминогруппу, таким образом получая конъюгат указанного активного вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I'), или с альфа-SH-бета-аминогруппой
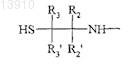
действующего вещества или его производного, содержащего указанную альфа-SH-бета-аминогруппу, таким образом получая конъюгат указанного активного вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I''), где R1, R2, R2', R3, R3' и R4 такие же, как определенные выше,
причем производное гидроксиалкилкрахмала, содержащее указанную альдегидную группу, кетогруппу или полуацетальную группу, получают способом, включающим взаимодействие гидроксиалкилкрахмала по меньшей мере с одним, по меньшей мере, бифункциональным соединением, указанное соединение содержит две функциональные группы M1 и Q, одна функциональная группа M1 взаимодействует с гидроксиалкилкрахмалом и одна функциональная группа Q является:
(i) альдегидной группой, кетогруппой, полуацетальной группой или
(ii) функциональной группой, химически модифицируемой для получения альдегидной группы, кетогруппы или полуацетальной группы; или
(В) взаимодействие альдегидной группы, кетогруппы или полуацетальной группы действующего вещества или его производного, содержащего указанную альдегидную группу, кетогруппу или полуацетатную группу, с альфа-SH-бета-аминогруппой
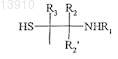
производного гидроксиалкилкрахмала, содержащего указанную альфа-SH-бета-аминогруппу, таким образом получая конъюгат указанного действующего вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I), или с альфа-SH-бета-аминогруппой
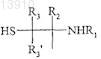
производного гидроксиалкилкрахмала, содержащего указанную альфа-SH-бета-аминогруппу, таким образом получая конъюгат указанного активного вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I'), или с альфа-SH-бета-аминогруппой
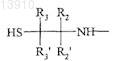
производного гидроксиалкилкрахмала, содержащего указанную альфа-SH-бета-аминогруппу, таким образом получая конъюгат указанного активного вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I''), где R1, R2, R2', R3, R3' и R4 такие же, как определенные выше.
2. Способ по п.1, в котором гидроксиалкилкрахмал имеет следующую структуру (II):
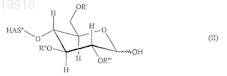
где R', R'' и R''' независимо являются водородом, линейной или разветвленной гидроксиалкильной группой или группой
![]()
где R1, R2, R3и R4 независимо выбирают из группы, состоящей из водорода и алкильной группы, предпочтительно водорода и метильной группы,
m имеет значения от 2 до 4, где остатки R1и R2 могут быть одинаковыми или различаться в m группах CR1R2;
n имеет значения от 0 до 20, предпочтительно от 0 до 4;
o имеет значения от 0 до 20, предпочтительно от 2 до 4, где в случае, если n=0, o не равняется 0, и где остатки R3 и R4 могут быть одинаковыми или различаться в o группах CR3R4;
R', R'' и R''' предпочтительно независимо являются водородом или 2-гидроксиэтильной группой.
3. Способ по п.1 или 2, в котором гидроксиалкилкрахмал является гидроксиэтилкрахмалом, указанный гидроксиэтилкрахмал предпочтительно имеет молекулярную массу от 1 до 300, более предпочтительно от 2 до 200, более предпочтительно от 10 до 150 или от 4 до 130, более предпочтительно от 10 до 100 кДа, указанный гидроксиэтилкрахмал далее предпочтительно имеет молярное замещение от 0,1 до 3, более предпочтительно от 0,1 до 2, еще более предпочтительно от 0,1 до 0,9 или от 0,4 до 2, предпочтительно от 0,4 до 1,3, и указанный гидроксиэтилкрахмал далее предпочтительно имеет предпочтительное соотношение между С2:С6замещением в диапазоне от 2 до 20 по отношению к гидроксиэтильным группам.
4. Способ по любому из пп.1-3, в котором действующее вещество выбирают из группы, состоящей из белков, пептидов, низкомолекулярных лекарственных средств, действующих средств, гликопротеинов и олигонуклеотидов, таких как ДНК, РНК, PNA или их производных, действующее вещество предпочтительно выбирают из группы, состоящей из белков, пептидов и PNA, содержащих альфа-SH-бета-аминогруппу, предпочтительно содержащих цистеиновую группу, в частности N-концевой цистеин, указанный белок предпочтительно выбирают из группы, состоящей из ЕРО, G-CSF, IFN альфа, IFN бета, AT III, IL-2, IL-3, миоглобина, SOD, BSA, rhEPO, rhG-CSF, rhIFN альфа, rhIFN бета, rhAT III, rhIL-2, rhIL-3, A1AT, фактора VII, фактора VIII, фактора IX, tPA и АРС.
5. Способ по п.4, в котором действующее вещество выбирают из группы, состоящей из белков, гликопротеинов или пептидов, содержащих альдегидную, кетогруппу или полуацетальную группу, предпочтительно гликопротеинов, содержащих альдегид в гликановой боковой цепи, или синтетических пептидов.
6. Способ по любому из предыдущих пунктов, в котором производное гидроксиалкилкрахмала содержит от 1 до 100, предпочтительно от 1 до 15, в частности 1 альдегидную группу(ы), кетогруппу(ы) и/или полуацетальную группу(ы) или в котором гидроксиалкилкрахмал или его производное содержит от 1 до 100, предпочтительно от 1 до 15, в частности 1 альфа-SH-бета-аминогруппу(ы).
7. Способ по любому из предыдущих пунктов, в котором действующее вещество содержит от 1 до 15, предпочтительно от 1 до 8, в частности 1 альдегидную группу(ы), кетогруппу(ы) и/или полуацетальную группу(ы) или в котором действующее вещество содержит от 1 до 15, предпочтительно от 1 до 8, в частности 1 альфа-SH-бета-аминогруппу(ы).
8. Способ по любому из пп.1-7, в котором производное гидроксиалкилкрахмала, содержащее указанную альфа-SH-бета-аминогруппу, получают способом, включающим взаимодействие гидроксиалкилкрахмала по меньшей мере с одним, по меньшей мере, бифункциональным соединением, указанное соединение содержит две функциональные группы, M1и Q, одна функциональная группа M1 взаимодействует с гидроксиалкилкрахмалом и одна функциональная группа Q является:
(i) альфа-SH-бета-аминогруппой; или
(ii) функциональной группой, химически модифицируемой для получения альфа-SH-бета-аминогруппы.
9. Способ по п.1 или 8, в котором функциональная группа M1взаимодействует с ОН-группой на гидроксиалкилкрахмале или с окисленным или неокисленным восстанавливающим концом гидроксиалкилкрахмала.
10. Способ по п.1, в котором функциональная группа M1является карбоксильной группой или реакционноспособной карбоксильной группой, а функциональная группа Q является альдегидной группой, кетогруппой или полуацетальной группой, причем указанное бифункциональное соединение, содержащее M1 и Q, предпочтительно выбирают из группы, состоящей из формилбензойной кислоты, пентафторфенилового эфира 4-формилбензойной кислоты, N-гидроксисукцинимидного эфира 4-формилбензойной кислоты и 4-(4-формил-3,5-диметоксифенокси)масляной кислоты или биосовместимого соединения, выбранного из группы, состоящей из альфа-кето-карбоновых кислот, нейраминовых кислот или их производных и пиридоксальфосфата.
11. Способ по п.1 или 8, в котором (ii), по меньшей мере, бифункциональное соединение содержит аминогруппу M1 и аминогруппу Q, по меньшей мере, бифункциональное соединение предпочтительно представляет собой необязательно замещенный диаминоалкан, имеющий от 1 до 20 атомов углерода, предпочтительно соединение, выбранное из группы, состоящей из 1,2-диаминоэтана, 1,3-диаминопропана и 1,4-диаминобутана, 1,5-диаминопентана, 1,6-диаминогексана, 1,7-диаминогептана, 1,8-диаминооктана, 1,9-диаминононана, 1,10-диаминодекана, 1,11-диаминоундекана, 1,12-диаминододекана, 1,13-диаминотридекана, 1,14-диаминотетрадекана, 1,15-диаминопентадекана, 1,16-диаминогексадекана, 1,17-диаминогептадекана, 1,18-диаминооктадекана, 1,19-диаминононадекана и 1,20-диаминоэйкозана, или соединение, имеющее формулу
![]()
где R1', R2', R3' и R4' независимо выбирают из группы, состоящей из водорода и алкильной группы, предпочтительно водорода и метильной группы;
р имеет значения от 2 до 4, где остатки R1' и R2' могут быть одинаковыми или различными в p группах CR1'R2';
q имеет значения от 0 до 20, предпочтительно от 0 до 10;
r имеет значения от 0 до 20, предпочтительно от 2 до 4, где в случае, если q=0, то r не равняется 0, и где остатки R3' и R4' могут быть одинаковыми или различаться в r группах CR3'R4';
и где гидроксиалкилкрахмал предпочтительно взаимодействует по своему необязательно окисленному восстанавливающему концу с функциональной группой M1, в котором статистически более 50, предпочтительно по меньшей мере 55, более предпочтительно по меньшей мере 60, более предпочтительно по меньшей мере 65, более предпочтительно по меньшей мере 70, более предпочтительно по меньшей мере 75, более предпочтительно по меньшей мере 80, более предпочтительно по меньшей мере 85, более предпочтительно по меньшей мере 90 и еще более предпочтительно по меньшей мере 95%, например 95, 96, 97, 98 или 99% молекул гидроксиалкилкрахмала, участвовавших в данной реакции, взаимодействуют по меньшей мере одним необязательно окисленным восстанавливающим концом на молекулу гидроксиалкилкрахмала.
12. Способ по п.11, дополнительно включающий взаимодействие производного гидроксиалкилкрахмала, полученного по реакции гидроксиалкилкрахмала, по меньшей мере, с бифункциональным соединением, содержащим две аминогруппы M1 и Q, по аминогруппе Q с дополнительным бифункциональным соединением, содержащим альдегидную группу, кетогруппу или полуацетальную группу, для получения производного гидроксиалкилкрахмала, имеющего альдегидную группу, кетогруппу или полуацетальную группу, причем дополнительное бифункциональное соединение предпочтительно выбирают из группы, состоящей из формилбензойной кислоты, пентафторфенилового эфира 4-формилбензойной кислоты, N-гидроксисукцинимидного эфира 4-формилбензойной кислоты, 4-(4-формил-3,5-диметоксифенокси) масляной кислоты и ангидрида 4-формилбензойной кислоты.
13. Способ по п.1, в котором в (i) функциональную группу M1 выбирают из группы, состоящей из карбоксильной группы, реакционноспособной карбоксильной группы, ангидрида карбоновой кислоты, галогенида карбоновой кислоты, изоцианата, изотиоцианата, эфира хлороформной кислоты и эпоксидных групп, а функциональная группа Q представляет собой альдегидную группу, кетогруппу или полуацетальную группу, в котором функциональная группа M1 предпочтительно взаимодействует с ОН-группами на гидроксиалкилкрахмале.
14. Способ по п.1, в котором в (i) функциональную группу M1 выбирают из группы, состоящей из аминогруппы и альфа-SH-бета-аминогруппы, и функциональная группа Q представляет собой альфа-SH-бета-аминогруппу, в котором функциональная группа M1 предпочтительно взаимодействует с необязательно окисленным восстанавливающим концом гидроксиалкилкрахмала, в котором статистически предпочтительно более 50, более предпочтительно по меньшей мере 55, более предпочтительно по меньшей мере 60, более предпочтительно по меньшей мере 65, более предпочтительно по меньшей мере 70, более предпочтительно по меньшей мере 75, более предпочтительно по меньшей мере 80, более предпочтительно по меньшей мере 85, более предпочтительно по меньшей мере 90 и еще более предпочтительно по меньшей мере 95%, например 95, 96, 97, 98 или 99% молекул гидроксиалкилкрахмала, участвовавших в данной реакции, взаимодействуют по меньшей мере одним необязательно окисленным восстанавливающим концом на молекулу гидроксиалкилкрахмала.
15. Способ по п.8, в котором в (i) гидроксиалкилкрахмал, содержащий указанную альфа-SH-бета-аминогруппу, получают способом, заключающимся во взаимодействии гидроксиалкилкрахмала на необязательно окисленном восстанавливающем конце с соединением, содержащим функциональную группу M1 и функциональную группу Q, представляющую собой альфа-SH-бета-аминогруппу, в котором соединением, содержащим функциональную группу M1 и альфа-SH-бета-аминогруппу, является 1,3-диамино-2-тиопропан или 2,3-диамино-1-тиопропан.
16. Способ по п.8, в котором в (ii), по меньшей мере, бифункциональное соединение содержит M1, являющуюся карбоксильной группой или реакционноспособной карбоксильной группой, и Q, являющуюся защищенной альфа-SH-бета-аминогруппой.
17. Способ по п.8, в котором в (ii), по меньшей мере, бифункциональное соединение выбирают из группы, состоящей из D-, L-PG1-Cys(PG2)-ОН или их рацемизированной смеси и их активного эфира, где PG1 может быть любой подходящей защитной группой для аминогруппы, предпочтительно выбираемой из группы, состоящей из трет-бутилоксикарбонила (Boc) или 9-флуоренилметоксикарбонила (Fmoc), a PG2 может быть любой подходящей защитной группой для тиоловой группы, предпочтительно выбираемой из группы, состоящей из тритила (Trt), р-метокситритила (Mmt), S-трет-бутилтио (S-t-Bu) и ацетамидометила (Acm).
18. Способ по п.8, в котором в (ii) гидроксиалкилкрахмал, содержащий указанную альфа-SH-бета-аминогруппу, получают способом, заключающимся в том, что гидроксиалкилкрахмал, необязательно окисляемый на своем восстанавливающем конце, взаимодействует окисленным или неокисленным восстанавливающим концом с функциональной группой M1соединения, содержащего помимо M1дополнительную функциональную группу Q, для получения первого производного гидроксиалкилкрахмала, а функциональная группа Q первого производного гидроксиалкилкрахмала взаимодействует с функциональной группой V соединения, содержащего помимо V необязательно защищенную альфа-SH-бета-аминогруппу, для получения функционального производного гидроксиалкилкрахмала с необязательно защищенной альфа-SH-бета-аминогруппой, в котором соединение, содержащее M1 и Q, представляет собой предпочтительно диаминосоединение или карбодиимидазол или N,N'-дисукцинимидилкарбонат, и в котором, по меньшей мере, бифункциональное соединение представляет собой предпочтительно необязательно замещенный диаминоалкан, имеющий от 1 до 20 атомов углерода, предпочтительно соединение, выбранное из группы, состоящей из 1,2-диаминоэтана, 1,3-диаминопропана и 1,4-диаминобутана, 1,5-диаминопентана, 1,6-диаминогексана, 1,7-диаминогептана, 1,8-диаминооктана, 1,9-диаминононана, 1,10-диаминодекана, 1,11-диаминоундекана, 1,12-диаминододекана, 1,13-диаминотридекана, 1,14-диаминотетрадекана, 1,15-диаминопентадекана, 1,16-диаминогексадекана, 1,17-диаминогептадекана, 1,18-диаминооктадекана, 1,19-диаминононадекана и 1,20-диаминоэйкозана, или соединение, имеющее формулу
![]()
где R1', R2', R3' и R4' независимо выбирают из группы, состоящей из водорода и алкильной группы, предпочтительно водорода и метильной группы;
р имеет значения от 2 до 4, где остатки R1' и R2' могут быть одинаковыми или различными в p группах CR1'R2';
q имеет значения от 0 до 20, предпочтительно от 0 до 10;
r имеет значения от 0 до 20, предпочтительно от 2 до 4, где в случае, если q=0, то r не равняется 0, и где остатки R3' и R4' могут быть одинаковыми или различаться в r группах CR3'R4';
в котором предпочтительно соединением, содержащим V и необязательно защищенную альфа-SH-бета-аминогруппу, является цистеин или его производное, V является карбоксильной группой или реакционноспособной карбоксильной группой, предпочтительно реакционноспособным эфиром или ангидридом карбоновой кислоты, или соединение, содержащее V, является 1,3-диамино-2-тиопропаном или 2,3-диамино-1-тиопропаном.
19. Способ по любому из предшествующих пунктов, в котором действующее вещество, предпочтительно необязательно модифицированный белок, пептид, синтетический пептид или олигонуклеотид, содержащие указанную альдегидную группу, кетогруппу, полуацетальную группу или указанную альфа-SH-бета-аминогруппу, получают способом, включающим:
(b)(1) введение по меньшей мере одной альдегидной группы, кетогруппы, полуацетальной группы или по меньшей мере одной альфа-SH-бета-аминогруппы в действующее вещество во время его получения или путем химической модификации или
(b)(2) взаимодействие действующего вещества, по меньшей мере, с бифункциональным соединением, указанное соединение содержит две функциональные группы М2 и Q, одну функциональную группу М2, взаимоидействующую с действующим веществом, и одну функциональную группу Q, представляющую собой:
(i) альдегидную группу, кетогруппу, полуацетальную группу или альфа-SH-бета-аминогруппу или
(ii) функциональную группу, химически модифицируемую для получения альдегидной группы, кетогруппы, полуацетальной группы или альфа-SH-бета-аминогруппы.
20. Способ по п.19, в котором в (b)(1) действующее вещество является белком или пептидом, которое получили органическим синтезом, предпочтительно используя синтетическую смолу, с учетом того, что белок или пептид должен содержать функциональную альдегидную группу, функциональную кетогруппу, функциональную полуацетальную группу или функциональную альфа-SH-бета-аминогруппу, или в котором в (b)(1) действующее вещество представляет собой белок или пептид, который получили, используя экспрессирующий вектор, в результате получая белок или пептид, содержащий функциональную альдегидную группу, функциональную кетогруппу, функциональную полуацетальную группу или функциональную альфа-SH-бета-аминогруппу, или в котором в (b)(1) действующее вещество представляет собой белок или пептид, а остов белка или пептида замещают альдегидной группой, кетогруппой, полуацетальной группой или альфа-SH-бета-аминогруппой, или в котором в (b)(1) действующее вещество представляет собой белок или пептид, в котором указанная альдегидная группа, кетогруппа, полуацетальная группа или указанная альфа-SH-бета-аминогруппа связывается непосредственно с остовом белка или пептида или является частью боковой цепи остова, или в котором действующее вещество представляет собой белок или пептид, а альдегидная группа, кетогруппа или полуацетальная группа содержится в углеводном фрагменте полипептида, в котором предпочтительно указанный углеводный фрагмент
выбирают из группы, состоящей из гидроксиальдегидов, гидроксикетонов и их химических модификаций, или
является производным природного углеводного фрагмента и выбирается из группы, состоящей из глюкозы, галактозы, маннозы и сиаловой кислоты, которые являются необязательно химически или ферментативно окисленными, предпочтительно остатка окисленной галактозы или окисленной сиаловой кислоты углеводной боковой цепи, более предпочтительно концевого остатка галактозы или сиаловой кислоты углеводной боковой цепи, окисление концевого углеводного фрагмента предпочтительно выполняется либо ферментативно, либо химически, химическое окисление предпочтительно выполняется с использованием перйодата, или
является производным природного углеводного фрагмента и является концевой галактозой, химически или ферментативно окисленной, где остаток концевой галактозы необязательно получают после расщепления концевой сиаловой кислоты.
21. Способ по п.19, в котором в (b)(2)(i) альфа-SH-бета-аминогруппа содержится в цистеиновом остатке действующего вещества, предпочтительно белка или пептида, цистеиновый остаток предпочтительно является N-концевым цистеиновым остатком действующего вещества.
22. Способ по любому из предшествующих пунктов, в котором действующее вещество представляет собой модифицированный белок или пептид с N-концевым цистеиновым остатком, не являющимся частью дисульфидного мостика, в котором модифицированный белок или пептид, обладающий N-концевым цистеиновым остатком, является мутантом природного белка или пептида, полученным путем (1) добавления цистеинового остатка к N-концевой аминокислоте, (2) замещения N-концевой аминокислоты цистеином или (3) удаления N-концевой аминокислоты(т) до тех пор, пока не получится концевой цистеин.
23. Способ по любому из предшествующих пунктов, в котором реакцию (А) или (В) выполняют при температуре от 0 до 40°С, предпочтительно от 0 до 25°С, в частности от 20 до 25°С, в присутствии растворителя и при значениях рН от 3,5 до 10, предпочтительно от 4 до 8, в частности от 4,8 до 8,0, с временем проведения реакции предпочтительно от 0,1 до 24 ч, в частности около 21 ч, растворитель выбирают из группы, состоящей из воды, водного буфера, DMF, DMSO, DMA и их смесей, где молекулярное соотношение гидроксиалкилкрахмала к действующему веществу составляет примерно от 1:1 до 200:1, предпочтительно от 10:1 до 100:1, в частности от 40:1 до 70:1.
24. Конъюгат действующего вещества и гидроксиалкилкрахмала, полученный способом по любому из пп.1-23.
25. Конъюгат действующего вещества и гидроксиалкилкрахмала, в котором действующее вещество и гидроксиалкилкрахмал ковалентно связаны с помощью химического остатка, имеющего структуру формулы (I)

или формулы (I')
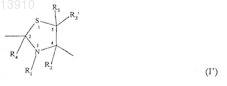
или формулы (I")
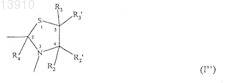
где R1, R2, R2', R3, R3' и R4независимо выбирают из группы, состоящей из водорода, необязательно подходящим образом замещенной, линейной, циклической и/или разветвленной алкильной, арильной, гетероарильной, аралкильной и гетероаралкильной группы, предпочтительно водорода, указанный конъюгат имеет структуру формулы (IV), (IV') или (IV")

где HAS' представляет собой остаток производного гидроксиалкилкрахмала, который связан с альдегидной группой, кетогруппой или полуацетальной группой, посредством взаимодействия гидроксиалкилкрахмала по меньшей мере с одним, по меньшей мере, бифункциональным соединением, указанное соединение содержит две функциональные группы M1и Q, одна функциональная группа M1взаимодействует с гидроксиалкилкрахмалом и одна функциональная группа Q является:
(i) альдегидной группой, кетогруппой или полуацетальной группой или
(ii) функциональной группой, химически модифицируемой для получения альдегидной группы, кетогруппы или полуацетальной группы,
и где AS' представляет собой остаток действующего вещества или его производного, который связан с альфа-SH-бета-аминогруппой,
или структуру формулы (V), (V') или (V'')
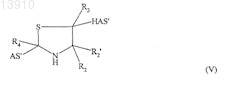
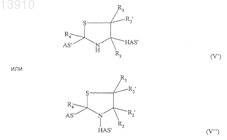
где HAS' является остатком гидроксиалкилкрахмала или его производного, связанным с альфа-SH-бета-аминогруппой, и где AS' является остатком действующего вещества или его производного, связанным с альдегидной группой, кетогруппой или полуацетальной группой.
26. Конъюгат по п.25, в котором конъюгат выбирают из группы, состоящей из
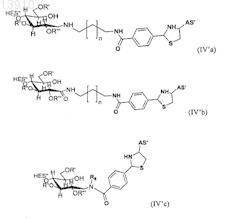
где R5определяют, как для R1-R4, рассмотренных выше,
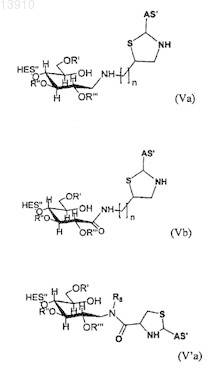
где R5определяют как для R1-R4, рассмотренных выше,
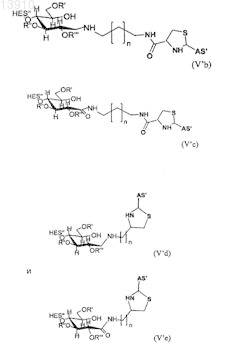
где в формуле (IV'а), (IV'b), (V'b) или (V'c) n принимает целочисленные значения, предпочтительно n имеет значения от 0 до 20, и где в формуле (Va), (Vd), (V'd) или (V'е) n принимает целочисленные значения, предпочтительно n имеет значения от 1 до 20.
27. Конъюгат по п.25, в котором конъюгат представляет собой
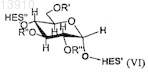
где R', R'' и/или R''' определяют по формуле (II) и где по меньшей мере в одном мономере глюкозы HES по меньшей мере один из R', R'' и/или R''' независимо выбирают из группы, состоящей из
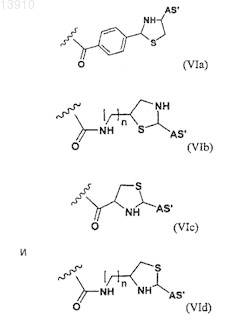
и где n принимает целочисленные значения, предпочтительно от 1 до 20 и/или где по меньшей мере один из R', R'' и/или R''' представляет собой -(CH2CH2O)m-R#, где m является целым числом, предпочтительно от 1 до 3, a R# выбирают из группы, состоящей из формулы (VIa), (VIb), (VIc) и (VId).
28. Альфа-SH-бета-аминофункциональное производное гидроксиалкилкрахмала, выбранное из группы, состоящей из
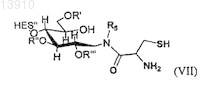
где R5определяют как для R1-R4, рассмотренных выше, и
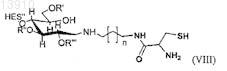
где n является целым числом, предпочтительно от 0 до 20,
или из группы, состоящей из
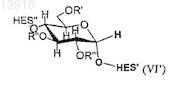
где R', R'' и/или R''' определяются по формуле (II) и где по меньшей мере в одном мономере глюкозы HES по меньшей мере один из R', R'' и/или R''' независимо выбирают из группы, состоящей из
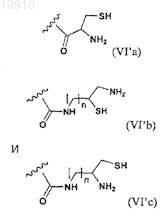
и где n принимает целочисленные значения, предпочтительно от 1 до 20 и/или где по меньшей мере один из R', R'' и/или R''' представляет собой -(СН2СН2О)m-R##, где m является целым числом, предпочтительно от 1 до 3, a R## выбирают из группы, состоящей из формулы (VI'а), (VI'b) и (VI'с).
29. Применение конъюгата по любому из пп.24-27 в способе лечения организма человека или животного.
30. Терапевтическое средство, включающее конъюгат по любому из пп.24-27.
31. Фармацевтическая композиция, содержащая конъюгат по любому из пп.24-27, предпочтительно дополнительно содержащая по меньшей мере один фармацевтически приемлемый разбавитель, наполнитель или носитель.
32. Композиция, содержащая конъюгат действующего вещества и гидроксиалкилкрахмала по любому из пп.24-27.
Текст
КОНЪЮГАТЫ ГИДРОКСИАЛКИЛКРАХМАЛА И ДЕЙСТВУЮЩЕГО ВЕЩЕСТВА,ПОЛУЧЕННЫЕ ХИМИЧЕСКИМ ЛИГИРОВАНИЕМ ЧЕРЕЗ ТИАЗОЛИДИН Настоящее изобретение относится к способу получения конъюгатов действующего вещества и гидроксиалкилкрахмала и к конъюгатам действующего вещества и гидроксиалкилкрахмала,предпочтительно гидроксиэтилкрахмала, где конъюгаты получают путем ковалентного связывания гидроксиалкилкрахмала и действующего вещества с помощью химического остатка, имеющего структуру формулы (I), (I'), (I), в которой R1, R2, R2', R3, R3' и R4 независимо выбирают из группы, состоящей из водорода, необязательно подходящим образом замещенной, линейной,циклической и/или разветвленной алкильной, арильной, гетероарильной, аралкильной и гетероаралкильной группы, предпочтительно водорода.(71)(73) Заявитель и патентовладелец: ФРЕЗЕНИУС КАБИ ДОЙЧЛАНД ГМБХ 013910 Настоящее изобретение относится к способу получения конъюгатов действующего вещества и гидроксиалкилкрахмала и к конъюгатам действующего вещества и гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала, где конъюгаты получают путем ковалентного связывания гидроксиалкилкрахмала и действующего вещества с помощью химического остатка, имеющего структуру формулы (I) где R1, R2, R2', R3, R3' и R4 независимо выбирают из группы, состоящей из водорода, необязательно подходящим образом замещенной, линейной, циклической и/или разветвленной алкильной, арильной, гетероарильной, аралкильной и гетероаралкильной группы, предпочтительно водорода. В WO 03/031581 А 2 описан способ конъюгирования производного полимера с полипептидом,имеющим на N-конце цистеиновый или гистидиновый остаток, где указанный способ содержит получение полипептида, имеющего на N-конце цистеиновый или гистидиновый остаток, получение полимера,оканчивающегося тиоэфирной группой, полимера, включающего водорастворимый и непептидный каркас полимера, предпочтительно полиэтиленгликолевого полимера, и взаимодействие производного полимера и полипептида. В качестве полимеров используются поли(алкиленгликоль), сополимеры этиленгликоля и пропиленгликоля, поли(оксиэтилированный полиол), поли(олефиновый спирт), поли(винилпирролидон), поли(альфа-гидроксильная кислота), поли(виниловый спирт), полифосфазен, полиоксазолин, поли(N-акрилоилморфолин), полиакрилат, полиакриламиды, полисахариды и сополимеры,тройные сополимеры и их смеси. Все подробно описанные полимеры являются полиэтиленгликолевыми полимерами. Несмотря на прогресс способов связывания и использование монофункциональных PEG-молекул,основной недостаток пегилированных лекарственных препаратов заключается в том, что путь метаболизма PEG, как искусственного полимера, точно не известен. Далее, из J. Am. Chem. Soc., 1995, 117, 3893-3899 известен общий подход для образования пептидных дендримеров с оксимным, гидразоновым и тиазолидиновым звеньями. В указанном документе описаны в качестве строительных блоков незащищенные пептиды и селективное лигирование между альдегидом и слабым основанием. В WO 99/07719 А 1 раскрывают пролекарства и конъюгаты тиол- и селеонолсодержащих соединений и способы их использования. В числе некоторых других соединений описывают пролекарство, которое получают путем взаимодействия этилового эфира L-цистеина и моносахарида D-рибозы, указанное пролекарство содержит тиазолидиновое кольцо. В качестве общей формулы моносахарида раскрыт(СНОН)nCH2OH с n=1-5. Совместно с образованием тиазолидиновых колец раскрыты не только дисахариды, не говоря уже о высокомолекулярных полимерных соединениях, таких как крахмал, в частности гидроксиалкилкрахмале. Поэтому целью настоящего изобретения является получение новых конъюгатов действующего вещества и полимера, образованных ковалентной связью, в которых в качестве полимера использовался бы не полиалкиленгликоль, конкретно не полиэтиленгликоль. Соответственно, другой целью настоящего изобретения было создание способа получения этих конъюгатов. Решением этого вопроса является способ получения конъюгата действующего вещества и гидро-1 013910 ксиалкилкрахмала, в котором действующее вещество и гидроксиалкилкрахмал ковалентно связывают с помощью химического остатка, имеющего структуру формулы (I) где R1, R2, R2', R3, R3' и R4 независимо выбирают из группы, состоящей из водорода, необязательно подходящим образом замещенной, линейной, циклической и/или разветвленной алкильной, арильной, гетероарильной, аралкильной и гетероаралкильной группы, предпочтительно водорода,указанный способ включает:(А) взаимодействие альдегидной группы, кетогруппы или полуацетальной группы гидроксиалкилкрахмала или его производного, содержащего указанную альдегидную группу, кетогруппу или полуацетальную группу, с альфа-SH-бета-аминогруппой действующего вещества или его производного, содержащего указанную альфа-SH-бета-аминогруппу,таким образом получая конъюгат указанного действующего вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I); или с альфа-SH-бета-аминогруппой действующего вещества или его производного, содержащего указанную альфа-SH-бета-аминогруппу,таким образом получая конъюгат указанного действующего вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I'); или с альфа-SH-бета-аминогруппой действующего вещества или его производного, содержащего указанную альфа-SH-бета-аминогруппу,таким образом получая конъюгат указанного действующего вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I), где R1,R2, R2', R3, R3' и R4 такие же, как определены выше; или(В) взаимодействие альдегидной группы, кетогруппы или полуацетальной группы действующего вещества или его производного, содержащего указанную альдегидную группу, кетогруппу или полуацетальную группу, с альфа-SH-бета-аминогруппой производного гидроксиалкилкрахмала, содержащего указанную альфа-SH-бета-аминогруппу, таким образом получая конъюгат указанного действующего вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I); или с альфа-SHбета-аминогруппой производного гидроксиалкилкрахмала, содержащего указанную альфа-SH-бета-аминогруппу, таким образом получая конъюгат указанного действующего вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I'); или с альфаSH-бета-аминогруппой производного гидроксиалкилкрахмала, содержащего указанную альфа-SH-бета-аминогруппу, таким образом получая конъюгат указанного действующего вещества и указанного гидроксиалкилкрахмала, ковалентно связанных с помощью химического остатка, имеющего структуру формулы (I), где R1, R2, R2',R3, R3' и R4 такие же, как определены выше. Поэтому используемый в контексте настоящего изобретения термин "альфа-SH-бета-аминогруппа" относится к этиленовой группе, в которой с одним атомом углерода связана необязательно защищеннаяSH-группа, а с соседним атомом углерода связана необязательно защищенная первичная или вторичная аминогруппа. Связями в вышерассмотренных формулах, у которых на одном из концов отсутствует остаток, являются такие связи, к которым присоединяются либо гидроксиалкилкрахмал, либо действующее вещество. Используемый в контексте изобретения термин "алкил" предпочтительно относится к алкильной группе, имеющей от 1 до 20, более предпочтительно от 1 до 10, в частности от 1 до 4 атомов углерода, за исключением случаев, особо указанных в настоящем описании ниже. Используемый в контексте изобретения термин "арил" предпочтительно относится к арильную группе, имеющей от 6 до 20, более предпочтительно от 6 до 14, в частности 6 атомов углерода, за исключением случаев, особо указанных в настоящем описании ниже. Используемый в контексте изобретения термин "гетероарил" предпочтительно относится к гетероарильной группе, имеющей от 6 до 20, более предпочтительно от 6 до 14, в частности 6 атомов углерода, в которой по меньшей мере один, предпочтительно от 1 до 3, в частности 1 из атомов углерода замещается гетероатомом, таким как S, N и/или О, за исключением случаев, особо указанных в настоящем описании ниже. Используемый в контексте изобретения термин "аралкил" предпочтительно относится к арильной группе, связанной через алкильную группу с указанным соединением, за исключением случаев, особо указанных в настоящем описании ниже. Используемый в контексте изобретения термин "алкарил" предпочтительно относится к алкильной группе, связанной через арильную группу с указанным соединением, за исключением случаев, особо указанных в настоящем описании ниже. Используемый в контексте изобретения термин "гетероаралкил" предпочтительно относится к гетероарильной группе, связанной через арильную группу с указанным соединением, за исключением случаев, особо указанных в настоящем описании ниже. Используемый в контексте изобретения термин "необязательно подходящим образом замещенный" предпочтительно означает, что существует от 1 до 10, более предпочтительно от 1 до 4, в частности 1 заместитель, за исключением случаев, особо указанных в настоящем описании ниже. Используемый в контексте изобретения термин "действующее вещество" относится к веществу, которое может воздействовать на какое-либо физическое или биохимическое свойство биологического организма, включая, но ими не ограничиваясь, вирусы, бактерии, грибы, растения, животных и людей. В частности, используемый в контексте изобретения термин "действующее вещество" относится к веществу, предназначенному для диагностики, лечения, смягчения симптомов или профилактики заболевания у людей и животных или же для улучшения физического или психического здоровья людей или животных. Примерами действующих веществ являются, но ими не ограничиваются, пептиды, белки, ферменты,низкомолекулярные лекарственные препараты, красители, липиды, нуклеозиды, нуклеотиды, олигонуклеотиды, полинуклеотиды, нуклеиновые кислоты, клетки, вирусы, липосомы, микрочастицы и мицеллы.-3 013910 Примерами белков являются, но ими не ограничиваются, эритропоэтин (ЕРО), такой как рекомбинантный ЕРО человека (rhEPO), колониестимулирующие факторы (CSF), такие как G-CSF, подобный рекомбинантному G-CSF человека (rhG-CSF), альфа-интерферон (IFN alpha), бета-интерферон (IFN beta) или гамма-интерферон (IFN gamma), такие как рекомбинантный IFN alpha человека или IFN beta (rhIFNalpha или rhIFN beta), интерлейкины, например от IL-1 до IL-18, такие как IL-2 или IL-3, подобные рекомбинантным IL-2 или IL-3 человека (rhIL-2 или rhIL-3), белки сыворотки, такие как факторы свертывания II-XIII, подобные фактору VIII, альфа 1-антитрипсин (А 1 АТ), активированный белок С (АРС), активаторы плазминогена, такие как тканеспецифический активатор плазминогена (tPA), такой как тканевый активатор плазминогена человека (hTPA), AT III, такой как рекомбинантный AT III человека (rhATIII), миоглобин, альбумин, такой как бычий сывороточный альбумин (BSA), факторы роста, такие как эпидермальный фактор роста (EGF), фактор роста тромбоцитов (PDGF), фактор роста фибробластов(FGF), мозговой фактор роста (BDGF), фактор роста нервов (NGF), фактор роста В-клеток (BCGF), мозговой нейротропный фактор роста (BDNF), цилиарный нейротропный фактор (CNTF), трансформирующие факторы роста, такие как TGF альфа или TGF бета, BMP (костные морфогенные белки), гормоны роста, такие как гормон роста человека, факторы некроза опухолей, такие как TNF альфа или TNF бета,соматостатин (пептид), соматотропин, соматомедины, гемоглобин, гормоны или их предшественники,такие как инсулин, гонадотропин, меланоцитстимулирующий гормон (альфа-MSH), трипторелин, гормоны гипоталамуса, такие как антидиуретические гормоны (ADH) и окситоцин, а также высвобождающие гормоны и ингибирующие высвобождение гормоны, паратиреоидный гормон, тиреоидные гормоны, такие как тироксин, тиротропин, тиролиберин, пролактин, кальцитонин, глюкагон, глюкагон-подобные пептиды (GLP-1, GLP-2 и т.д.), экзендины, такие как экзендин-4, лептин, вазопрессин, гастрин, секретин,интегрины, гликопротеиновые гормоны (например, LH, FSH и т.д.), меланозидстимулирующие гормоны,липопротеины и аполипопротеины, такие как апо-В, апо-Е, апо-La, иммуноглобулины, такие как IgG, IgE,IgM, IgA, IgD и их фрагменты, гирудин, ингибитор пути тканевого фактора, растительные белки, такие как лектин или ризин, пчелиный яд, змеиный яд, иммунотоксины, антиген Е, ингибитор альфапротеиназы, пыльцевой аллерген, меланин, олиголизиновые белки, RGD белки или при необходимости соответствующие рецепторы для каждого из этих белков; или функциональное производное или фрагмент любого из этих белков или рецепторов. В наиболее предпочтительном варианте осуществления действующим веществом является ЕРО, конкретно окисленный ЕРО, как описано ниже. Примерами ферментов являются, но ими не ограничиваются, углевод-специфические ферменты,протеолитические ферменты, оксидазы, оксидоредуктазы, трансферразы, гидролазы, лиазы, изомеразы,киназы и лигазы. Специфическими не ограничивающими примерами являются аспарагиназа, аргиназа,аргининдезаминаза, аденозиндезаминаза, глютаминаза, глютаминаза-аспарагиназа, фенилаланин, триптофаназа, тирозиназа, супероксиддисмутаза (SOD), эндотоксиназа, каталаза, пероксидаза, калликреин,трипсин, химотрипсин, эластаза, термолизин, липаза, уриказа, аденозиндифосфатаза, фосфорилаза пуриновых нуклеозидов, оксидаза билирубина, оксидаза глюкозы, глюкодаза, оксидаза глюконата, галактозидаза, глюкоцереброзидаза, глюкуронидаза, гиалуронидаза, тканевый фактор, стрептокиназа, урокиназа,МАР-киназы, ДНКазы, РНКазы, лактоферрин и функциональные производные или их фрагменты. По одному из вариантов настоящего изобретения действующим веществом является низкомолекулярное лекарство, пептид и/или белок. В числе других особо упоминаются следующие белки: эритропоэтин (ЕРО), такой как рекомбинантный ЕРО человека (rhEPO), колониестимулирующие факторы (CSF), такие как G-CSF, подобный рекомбинантному G-CSF человека (rhG-CSF), альфа-интерферон (IFN alpha), бета-интерферон (IFN beta) или гамма-интерферон (IFN gamma), такие как рекомбинантный IFN alpha человека или IFN beta (rhIFNalpha или rhIFN beta), белки сыворотки, такие как факторы свертывания II-XIII, подобные фактору VII,фактору VIII или фактору IX, альфа 1-антитрипсин (А 1 АТ), активированный белок С (АРС), активаторы плазминогена, такие как тканеспецифический активатор плазминогена (tPA), такой как тканевый активатор плазминогена человека (hTPA), AT III, такой как рекомбинантный AT III человека (rhAT III). Примерами пептидов являются АСТН, адреномедуллин, амилоидный бета-протеин, ангиотензин I,ангиотензин II, атриальный натрийуретический пептид (ANP), фрагменты антител, брадикинин, мозговой натрийуретический пептид В-типа (BNP), кальцитонин, фактор высвобождения кортикотропина(CRF), эндорфины, эндотелины, энкефалины, гастрин, родственный гастрину пептид, желудочный ингибирующий полипептид (GIP), гастрин-высвобождающий пептид (GRP), глюкагон, глюкагон-подобные пептиды, фактор высвобождения гормона роста (GRF), фактор роста гепатоцитов, инсулины, гонадотропин-высвобождающий гормон (LH-RH, GnRH), нейрокинины, окситоцин, паратиреоидный гормон, соматостатин, вещество Р, тиреотропин-высвобождающий гормон (TRH), вазоактивный интестинальный пептид (VIP) и вазопрессин. Действующее вещество предпочтительно выбирают из группы, состоящей из антибиотиков, антидепрессантов, противодиабетических, антидиуретических, антихолинэргических, противоаритмических,противорвотных, противокашлевых, противоэпилептических, антигистаминовых, противогрибковых,антисимпатотонических, антитромботических средств, андрогенов, антиандрогенов, эстрогенов, антиэстрогенов, противоостеопорозных, противоопухолевых средств, сосудорасширяющих, других антигипер-4 013910 тонических средств, жаропонижающих средств, болеутоляющих, противовоспалительных средств, блокаторов, цитостатиков, иммуносупрессирующих средств и витаминов. Некоторыми дополняющими, не ограничивающими примерами действующих веществ являются альбутерол, алендронат, амикацин, ампициллин, амоксициллин, амфотерицин В, атенолол, азатиоприн,цефаклор, цефадроксил, цефотаксим, цефтазидим, цефтриаксон, циластатин, циметидин, ципрофлоксацин, клонидин, колистин, козинтропин, циклосерин, даунорубицин, доксорубицин, десмопрессин, дигидроэрготамин, добутамин, допамин, эфедрин, эпинефрин, -аминокапроновая кислота, эргометрин,эсмолол, фамотидин, флекаинид, фолиевая кислота, флюцитозин, фуросемид, ганцикловир, гентамицин,глюкагон, гидразалин, имипенем, изопротеренол, кетамин, лиотиронин, LHRH, мерпатрицин, метараминол, метилдопа, метоклопрамид, метопролол, мексилетин, митомицин, неомицин, нетилмицин, нимодипин, нистатин, октреотид, окситоцин, памидронат, пентамидин, фентоламин, фенилэфрин, прокаинамид,прокаин, пропранолол, ритодрин, соталол, тейкопланин, тербуталин, тиамин, тилудронат, толазолин,триметоприм, трометамин, тилозин, ванкомицин, вазопрессин и винбластин. По одному из вариантов в качестве действующего вещества также можно использовать рифамицин,тетрациклин, спектомицин, стрептомицин или эритромицин. Примерами олигонуклеотида являются аптамеры, ДНК, РНК, PNA или их производные. В контексте настоящего изобретения термин "гидроксиалкилкрахмал" (HAS) относится к производному крахмала, которое имеет по меньшей мере одну замещенную гидроксиалкильную группу. Предпочтительный гидроксиалкилкрахмал по настоящему изобретению имеет структуру формулы (II) где R', R и R независимо являются водородом, линейной или разветвленной гидроксиалкильной группой или группой где R1, R2, R3 и R4 независимо выбирают из группы, состоящей из водорода и алкильной группы, предпочтительно водорода и метильной группы,m имеет значения от 2 до 4, где остатки R1 и R2 могут быть одинаковыми или различаться в m группах CR1R2;n имеет значения от 0 до 20, предпочтительно от 0 до 4; о имеет значения от 0 до 20, предпочтительно от 2 до 4, где в случае, если n=0, о не равняется 0, и где остатки R3 и R4 могут быть одинаковыми или различаться в о группах CR3R4; где остаток HAS вместе с концевым фрагментом глюкозы составляет молекулу HAS, т.е. формула(II) показывает молекулу HAS, концевой углеводный фрагмент которой представлен особо, остальная часть молекулы крахмала представляет собой HAS. В формуле (II) восстанавливающий конец молекулы крахмала показан в не окисленной форме, а концевой сахаридный мономер HAS представлен в полуацетальной форме, которая в зависимости, например, от растворителя может находиться в равновесии с альдегидной формой. Используемая в контексте настоящего изобретения аббревиатура HAS относится к молекуле HAS без концевого сахаридного мономера на восстанавливающем конце молекулы HAS. Используемый в контексте изобретения термин "гидроксиалкилкрахмал" не ограничивается соединениями, в которых концевой углеводный фрагмент содержит гидроксиалкильные группы R', R и/илиR, как показано для краткости в формуле (II), но также относится к соединениям, в которых по меньшей мере одна гидроксиалкильная группа, представленная где угодно, либо в концевом углеводном фрагменте и/или в остальной части молекулы крахмала, HAS, заменяется гидроксиалкильной группой R', R" илиR. Также возможен гидроксиалкилкрахмал, содержащий две или более различные гидроксиалкильные группы. По меньшей мере одна гидроксиалкильная группа, содержащаяся в HAS, может содержать одну или несколько, в частности две или более гидроксильных группы. По предпочтительному варианту осуществления по меньшей мере одна гидроксиалкильная группа, содержащаяся в HAS, содержит одну гидроксильную группу. Выражение "гидроксиалкилкрахмал" также включает производные, в которых алкильная группа является моно- или полизамещенной. В этом контексте предпочтительно, чтобы алкильная группа замещалась галогеном, в частности фтором, или арильной группой. Более того, гидроксильная группа гидроксиалкильной группы может быть превращена в сложный или простой эфир. Более того, вместо алкильных также можно использовать линейные или разветвленные замещенные-5 013910 или незамещенные алкеновые группы. Гидроксиалкилкрахмал является простым эфиром крахмала. В контексте настоящего изобретения помимо указанных производных простого эфира можно также использовать другие производные крахмала. Например, можно использовать производные, которые содержат эстерифицированные гидроксильные группы. Этими производными могут быть, например, производные незамещенных моно- или дикарбоновых кислот с 2-12 атомами углерода или их замещенные производные. В частности, можно использовать производные незамещенных монокарбоновых кислот с 2-6 атомами углерода, конкретно производные уксусной кислоты. В этом контексте предпочитаются ацетильный крахмал, бутирильный крахмал и пропионильный крахмал. Более того, предпочитаются производные незамещенных дикарбоновых кислот с 2-6 атомами углерода. В случае производных дикарбоновых кислот можно использовать то обстоятельство, что вторая карбоксильная группа дикарбоновой кислоты также эстерифицируется. Более того, в контексте настоящего изобретения также подходят производные моноалкильных эфиров дикарбоновых кислот. Для замещенных моно- или дикарбоновых кислот могут быть предпочтительными те же замещающие группы, что и упомянутые выше для замещенных алкильных остатков. Технологии эстерификации крахмала известны в данной области (см., например, Klemm D. et al., Comprehensive Cellulose(ISBN 3-527-29489-9. По предпочтительному варианту осуществления настоящего изобретения используется гидроксиалкилкрахмал вышеупомянутой формулы (II). Другие структуры сахаридного кольца, содержащиеся вHAS, могут быть такими же или отличными от особо описанного сахаридного кольца с тем различием,что у них отсутствует восстанавливающий конец. В отношении остатков R', R и R формулы (II) не существует специфических ограничений. По предпочтительному варианту осуществления R', R и R независимо являются водородом или гидроксиалкильной группой, гидроксиаралкильной группой или гидроксиалкарильной группой, имеющей в соответствующем алкильном остатке от 2 до 10 атомов углерода. Предпочитаются водород и гидроксиалкильные группы, имеющие от 2 до 10 атомов углерода. Более предпочтительно, чтобы гидроксиалкильная группа имела от 2 до 6 атомов углерода, более предпочтительно от 2 до 4 атомов углерода и еще более предпочтительно от 2 до 3 атомов углерода. В предпочтительном варианте осуществления гидроксиалкилкрахмал представляет собой гидроксиэтилкрахмал, в котором R', R и R независимо являются водородом или группой (СН 2 СН 2 О)n-Н, в которой n имеет целочисленные значения, предпочтительно 0, 1,2, 3, 4, 5 или 6. Поэтому "гидроксиалкилкрахмал" предпочтительно содержит гидроксиэтилкрахмал, гидроксипропиловый крахмал и гидроксибутиловый крахмал, где особенно предпочитаются гидроксиэтилкрахмал и гидроксипропиловый крахмал, а наиболее предпочтителен гидроксиэтилкрахмал. Алкильная, аралкильная и/или алкарильная группа может быть линейной или разветвленной и подходящим образом замещенной. Поэтому настоящее изобретение также относится к способу и конъюгату, описанному выше, в котором R', R и R независимо являются водородом или линейной или разветвленной гидроксиалкильной группой с 2-6 атомами углерода. Таким образом, R', R и R предпочтительно могут представлять собой Н, гидроксигексил, гидроксипентил, гидроксибутил, гидроксипропил, такой как 2-гидроксипропил, 3-гидроксипропил, 2 гидроксиизопропил, гидроксиэтил, такой как 2-гидроксиэтил, особенно предпочтительными являются водород и 2-гидроксиэтиловая группа. Поэтому настоящее изобретение также относится к способу и конъюгату, описанному выше, в котором R', R и R независимо являются водородом или 2-гидроксиэтиловой группой, особенно предпочтителен вариант осуществления, в котором по меньшей мере один остаток R', R и R является 2 гидроксиэтилом. Для всех вариантов осуществления настоящего изобретения наиболее предпочтительным является гидроксиэтилкрахмал (HES). Поэтому настоящее изобретение относится к способу и конъюгату, описанному выше, в котором полимер является гидроксиэтилкрахмалом, а производное полимера является производным гидроксиэтилкрахмала. Гидроксиэтилкрахмал (HES) представляет собой производное природного амилопектина и в организме разлагается с помощью альфа-амилазы. HES является замещенным производным углеводного полимера амилопектина, который в кукурузном крахмале присутствует в концентрации до 95% по весу.HES имеет улучшенные биологические свойства и используется во врачебной практике в качестве кровезаменителя и при гемодилюции (Sommermeyer et al., 1987, Krankenhauspharmazie, 8(8), 271-278; andWeidler et al., 1991, Arzneim.-Forschung/Drug Res., 41, 494-498). Амилопектин состоит из фрагментов глюкозы, при этом в главной цепи имеются альфа-1,4 гликозидные связи, а на участках разветвления находятся альфа-1,6-гликозидные связи. Физикохимические свойства этой молекулы определяются, главным образом, типом гликозидных связей. Благодаря разорванной альфа-1,4-гликозидной связи получаются спиральные структуры примерно с шестью мономерами глюкозы на виток. Физико-химические, а также биохимические свойства полимера можно-6 013910 модифицировать путем замещения. Гидроксиэтиловую группу можно ввести путем щелочного гидроксиэтилирования. В отношении гидроксиэтилирования, адаптировав условия проведения реакции, можно использовать различную реакционную способность соответствующей гидроксильной группы в незамещенном мономере глюкозы. Благодаря этому специалист может в ограниченном масштабе влиять на профиль замещения.HES характеризуется, главным образом, распределением молекулярной массы и степенью замещения. Существует две возможности описания степени замещения. 1. Степень замещения можно описать в виде количества замещенных мономеров глюкозы по отношению ко всем фрагментам глюкозы. 2. Степень замещения можно описать в виде молярного замещения, в котором описывается количество гидроксиэтиловых групп на фрагмент глюкозы. В контексте настоящего изобретения степень замещения, обозначаемая как DS, относится к молярному замещению, описанному выше (см. также статью Sommermeyer et al., 1987, Krankenhauspharmazie,8(8), 271-278, приводимую выше, в частности с. 273). Растворы HES представлены в виде полидисперсных композиций, в которых каждая молекула отличается от другой по степени полимеризации, количеству и паттерну участков разветвления и профилю замещения. Поэтому HES является смесью соединений с различной молекулярной массой. Следовательно, конкретный раствор HES определяется средней молекулярной массой с помощью статистической обработки данных. В этом контексте Mn рассчитывают как среднее арифметическое, зависящее от числа молекул. Альтернативно, Mw (или MW), средняя молекулярная масса, представляет собой единицу измерения, которая зависит от массы HES. Предпочтительно, чтобы гидроксиалкилкрахмал, используемый по изобретению, имел среднюю молекулярную массу (среднюю массу) от 1 до 300 кДа. Гидроксиэтилкрахмал может необязательно показывать предпочтительное молярное замещение от 0,1 до 3, предпочтительно от 0,1 до 2, более предпочтительно от 0,1 до 0,9 или от 0,4 до 2, предпочтительно от 0,4 до 1,3 и предпочтительное соотношение замещений в позициях С 2 и С 6 в интервале от 2 до 20 в отношении гидроксиэтиловых групп. Используемый в контексте настоящего изобретения термин "средняя молекулярная масса" относится к массе, определенной по способу LALLS-(малоугловое лазерное светорассеяние)-GPC, описанному в статьях Sommermeyer et al., 1987, Krankenhauspharmazie, 8(8), 271-278; and Weidler et al., 1991, Arzneim.Forschung/Drug Res., 41, 494-498. Для средних молекулярных масс 10 кДа и меньше необязательно выполняли калибровку со стандартом, который предварительно откалибровали с помощью LALLS-GPC. По предпочтительному варианту осуществления настоящего изобретения средняя молекулярная масса используемого гидроксиэтилкрахмала составляет от 1 до 300 кДа, более предпочтительно от 2 до 200 кДа, более предпочтительно от 10 до 150 или от 4 до 130 кДа, более предпочтительно от 10 до 100 кДа. Примером HES, имеющим среднюю молекулярную массу примерно от 1 до 300 кДа, предпочтительно от 10 до 100 кДа, является HES с молярным замещением от 0,1 до 3, предпочтительно от 0,4 до 1,3, например 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0; 1,1; 1,2 или 1,3, предпочтительно от 0,7 до 1,3, например 0,7; 0,8; 0,9; 1,0; 1,1; 1,2 или 1,3. Примером HES со средней молекулярной массой примерно 130 кДа является Voluven, производимый Fresenius. Voluven является искусственным коллоидом, применяемым, например, для замещения объема, что используется по показаниям для лечения и профилактики гиповолемии. Характеристиками Voluven являются средняя молекулярная масса 130,00020,000 Да, молярное замещение 0,4 и соотношение С 2:С 6 примерно 9:1. Настоящее изобретение также относится к способу и к конъюгатам, описанным выше, в которых гидроксиалкилкрахмал представляет собой гидроксиэтилкрахмал, имеющий среднюю молекулярную массу от 10 до 150 кДа, предпочтительно от 10 до 100 кДа. Предпочтительными диапазонами средней молекулярной массы являются, например, от 10 до 150,или от 10 до 130, или от 30 до 130, или от 50 до 130, или от 70 до 130, или от 100 до 130, или от 10 до 100,или от 4 до 100, или от 10 до 100, или от 12 до 100, или от 18 до 100, или от 50 до 100, или от 4 до 70, или от 10 до 70, или от 12 до 70, или от 18 до 70, или от 50 до 70, или от 4 до 50, или от 10 до 50, или от 12 до 50, или от 18 до 50, или от 4 до 18, или от 10 до 18, или от 12 до 18, или от 4 до 12, или от 10 до 12, или от 4 до 10 кДа. По наиболее предпочтительному варианту осуществления настоящего изобретения средняя молекулярная масса используемого гидроксиэтилкрахмала находится в диапазоне от более чем 4 и до менее 150 кДа, например около 10, или в диапазоне от 9 до 10, или от 10 до 11, или от 9 до 11 кДа, или примерно 12 кДа, или в диапазоне от 11 до 12, или от 12 до 13, или от 11 до 13, или около 15 кДа, или в диапазоне от 14 до 15, или от 15 до 16, или около 18 кДа, или в диапазоне от 17 до 18, или от 18 до 19, или от 17 до 19, или около 50 кДа, или в диапазоне от 49 до 50, или от 50 до 51, или от 49 до 51, или около 56 кДа, или в диапазоне от 55 до 56 либо от 56 до 57 кДа. По другому наиболее предпочтительному варианту осуществления настоящего изобретения сред-7 013910 няя молекулярная масса используемого гидроксиэтилкрахмала находится в диапазоне от более чем 60 ивплоть до 130 кДа, например около 70 кДа, или в диапазоне от 65 до 75 или около 80 кДа, или в диапазоне от 75 до 85 или около 90 кДа, или в диапазоне от 85 до 95 или около 100 кДа, или в диапазоне от 95 до 105 или около 110 кДа, или в диапазоне от 105 до 115 или около 120 кДа, или в диапазоне от 115 до 125 или около 130 кДа, или в диапазоне от 125 до 135 кДа. В отношении верхней границы молярного замещения (DS) также возможны значения вплоть до 3,0,например 0,9; 1,0; 1,1; 1,2; 1,3; 1,4; 1,5; 1,6; 1,7; 1,8; 1,9 или 2,0, предпочтительны значения ниже 2,0, более предпочтительны значения менее 1,5, еще более предпочтительны значения менее 1,3, например 0,7; 0,8; 0,9; 1,0; 1,1; 1,2 или 1,3. Поэтому предпочтительные диапазоны молярного замещения находятся в интервале от 0,1 до 2, или от 0,1 до 1,5, или от 0,1 до 1,3, или от 0,1 до 1,0, или от 0,1 до 0,9, или от 0,1 до 0,8. Более предпочтительные диапазоны молярного замещения находятся в интервале от 0,2 до 2, или от 0,2 до 1,5, или от 0,2 до 1,0, или от 0,2 до 0,9, или от 0,2 до 0,8. Еще более предпочтительные диапазоны молярного замещения находятся в интервале от 0,3 до 2, или от 0,3 до 1,5, или от 0,3 до 1,0, или от 0,3 до 0,9, или от 0,3 до 0,8. Даже более предпочтительные диапазоны молярного замещения находятся в интервале от 0,4 до 2, или от 0,4 до 1,5, или от 0,4 до 1,3, или от 0,4 до 1,0, или от 0,4 до 0,9, или от 0,4 до 0,8. Что касается молярного замещения (DS), DS предпочтительно имеет значение по меньшей мере 0,1,более предпочтительно по меньшей мере 0,2, более предпочтительно по меньшей мере 0,4 и более предпочтительно по меньшей мере 0,7. Предпочтительные диапазоны значений DS находятся в интервале от 0,1 до 3, предпочтительно от 0,1 до 2, более предпочтительно от 0,1 до 1,3, более предпочтительно от 0,1 до 0,9, более предпочтительно от 0,1 до 0,8, более предпочтительно от 0,2 до 0,8, более предпочтительно от 0,3 до 0,8 и даже более предпочтительно от 0,4 до 0,8, еще более предпочтительно от 0,1 до 0,7, более предпочтительно от 0,2 до 0,7, более предпочтительно от 0,3 до 0,7 и более предпочтительно от 0,4 до 0,7. Особо предпочтительными значениями DS являются, например, 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0; 1,2 или 1,3 с более предпочтительными 0,2; 0,3; 0,4; 0,5; 0,6; 0,7 или 0,8, даже более предпочтительными 0,3; 0,4; 0,5; 0,6; 0,7 или 0,8, еще более предпочтительными 0,4; 0,5; 0,6; 0,7 или 0,8 и особенно предпочтительными, например, 0,4 или 0,5 и 0,7 или 0,8. В контексте настоящего изобретения заданное значение молярного замещения, такое как 1,3, может быть точным значением или может пониматься как находящееся в диапазоне от 1,25 до 1,34, или точным значением может быть 1,0 или оно может пониматься как находящееся в диапазоне от 0,95 до 1,04, или точным значением может быть 0,9 или оно может пониматься как находящееся в диапазоне от 0,85 до 0,94, или точным значением может быть 0,8 или оно может пониматься как находящееся в диапазоне от 0,75 до 0,84. Поэтому, например, заданное значение 0,1 может быть точным значением 0,1 или может находиться в диапазоне от 0,05 до 0,14, заданное значение 0,4 может быть точным значением 0,4 или может находиться в диапазоне от 0,35 до 0,44 или заданное значение 0,7 может быть точным значением 0,7 или может находиться в диапазоне от 0,65 до 0,74. Особенно предпочтительными сочетаниями молекулярной массы гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала, и его молярного замещения DS являются, например, 10 кДа и 0,4,или 10 кДа и 0,7, или 12 кДа и 0,4, или 12 кДа и 0,7, или 15 кДа и 0,4, или 15 кДа и 0,7, или 18 кДа и 0,4,или 18 кДа и 0,7, или 50 кДа и 0,4, или 50 кДа и 0,7, или 56 кДа и 0,4, или 56 кДа и 0,7, или 70 кДа и 0,4,или 70 кДа и 0,7, или 100 кДа и 0,4, или 100 кДа и 0,7, или 130 кДа и 0,4, или 130 кДа и 0,7. Что касается соотношения С 2:С 6 замещения, указанное замещение является предпочтительным в диапазоне от 2 до 20, более предпочтительно в диапазоне от 2 до 15 и даже более предпочтительно в диапазоне от 3 до 12. По дополнительному варианту осуществления настоящего изобретения также могут использоваться смеси гидроксиэтилкрахмалов, имеющие различные средние молекулярные массы и/или разное молярное замещение и/или разные соотношения С 2:С 6 замещения. Поэтому можно использовать смеси гидроксиэтилкрахмалов, имеющие различные средние молекулярные массы и разное молярное замещение и разные соотношения С 2:С 6 замещения, или имеющие различные средние молекулярные массы и разное молярное замещение и одинаковое или примерно одинаковое соотношение С 2:С 6 замещения, или имеющие различные средние молекулярные массы и одинаковое или примерно одинаковое молярное замещение и разные соотношения С 2:С 6 замещения, или имеющие одинаковую или примерно одинаковую среднюю молекулярную массу и разное молярное замещение и разные соотношения С 2:С 6 замещения, или имеющие различные средние молекулярные массы и одинаковое или примерно одинаковое молярное замещение и одинаковое или примерно одинаковое соотношение С 2:С 6 замещения, или имеющие одинаковые или примерно одинаковые средние молекулярные массы и разное молярное замещение и одинаковое или примерно одинаковое соотношение С 2:С 6 замещения, или имеющие одинаковую или примерно одинаковую среднюю молекулярную массу и одинаковое или примерно одинаковое молярное замещение и разные соотношения С 2:С 6 замещения, или имеющие примерно одинаковую среднюю молекулярную массу и примерно одинаковое молярное замещение и примерно одинаковое соотношение С 2:С 6 замещения. В различных конъюгатах и/или различных способах по настоящему изобретению могут использо-8 013910 ваться разные гидроксиалкилкрахмалы, предпочтительно разные гидроксиэтилкрахмалы и/или различные смеси гидроксиалкилкрахмалов, предпочтительно различные смеси гидроксиэтилрахмалов. В предпочтительном варианте осуществления гидроксиалкилкрахмал или его производное содержит от 1 до 100, предпочтительно от 1 до 15, в частности 1 альдегидную группу(ы), кетогруппу(ы) и/или полуацетальную группу(ы), или гидроксиалкилкрахмал или его производное содержит от 1 до 100, предпочтительно от 1 до 15, в частности 1 альфа-SH-бета-аминогруппу(ы). В другом предпочтительном варианте осуществления действующее вещество содержит от 1 до 15,предпочтительно от 1 до 8, в частности 1 альдегидную группу(ы), кетогруппу(ы) и/или полуацетальную группу(ы), или действующее вещество содержит от 1 до 15, предпочтительно от 1 до 8, в частности 1 альфа-SH-бета-аминогруппу(ы). Гидроксиалкилкрахмал, предпочтительно гидроксиэтилкрахмал, содержащий по меньшей мере одну альдегидную группу, кетогруппу, полуацетальную группу или альфа-SH-бета-аминогруппу, можно получить с помощью любого подходящего способа. В предпочтительном варианте осуществления производное гидроксиалкилкрахмала, содержащее указанную альдегидную группу, кетогруппу, полуацетальную группу или указанную альфа-SH-бета-аминогруппу, получают с помощью способа, заключающегося во(а)(1) введении в гидроксиалкилкрахмал по меньшей мере одной альдегидной группы посредством реакции окисления с раскрытием кольца или(а)(2) взаимодействии гидроксиалкилкрахмала по меньшей мере с одним по меньшей мере бифункциональным компонентом, указанный компонент содержит две функциональные группы, M1 и Q, одна функциональная группа M1 взаимодействует с гидроксиалкилкрахмалом и одна функциональная группа(ii) функциональной группой, химически модифицируемой для получения альдегидной группы, кетогруппы, полуацетальной группы. По (а)(1) предпочитается, чтобы, используя перйодат, гидроксиалкилкрахмал подвергли реакции окисления с раскрытием кольца для получения производного гидроксиалкилкрахмала, имеющего по меньшей мере одну альдегидную группу. Реакцию окисления с раскрытием кольца по (а)(1) можно выполнить в водной среде. Реакцию окисления с раскрытием кольца выполняют при температуре от 0 до 37 С, предпочтительно от 0 до 5 С. В одном из предпочтительных вариантов осуществления (а)(2) функциональную группу M1 выбирают из группы, состоящей из карбоксильной группы, реакционноспособной карбоксильной группы,ангидрида карбоновой кислоты, галогенида карбоновой кислоты, изоцианата, изотиоцианата, хлорформиатов и эпоксидных групп, а функциональная группа Q является альдегидной группой, кетогруппой,полуацетальной группой, альфа-SH-бета-аминогруппой или функциональной группой, химически модифицируемой для получения альдегидной группы, кетогруппы, полуацетальной группы или альфа-SHбета-аминогруппы. По одному из вариантов осуществления настоящего изобретения способ по (а)(2) может заключаться в том, что гидроксиалкилкрахмал участвует в реакции посредством своего необязательно окисленного восстанавливающего конца по меньшей мере с одним бифункциональным компонентом, содержащим по меньшей мере две функциональные группы M1 и Q. Используемый в контексте настоящего изобретения термин, указывающий на то, что гидроксиалкилкрахмал, предпочтительно гидроксиэтилкрахмал, участвует в реакции "посредством необязательно окисленного восстанавливающего конца", может относиться к процессу, по которому гидроксиалкилкрахмал взаимодействует преимущественно посредством своего необязательно окисленного восстанавливающего конца. Термин "преимущественно посредством своего необязательно окисленного восстанавливающего конца" относится к процессу, по которому статистически более 50%, предпочтительно по меньшей мере 55%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 65%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, и еще более предпочтительно по меньшей мере 95%, например 95, 96, 97, 98 или 99% задействованных в данной реакции молекул гидроксиалкилкрахмала участвует в реакции посредством по меньшей мере одного необязательно окисленного восстанавливающего конца на молекулу гидроксиалкилкрахмала, где данная молекула гидроксиалкилкрахмала, которая участвует в реакции посредством по меньшей мере одного восстанавливающего конца, может участвовать в той же данной реакции посредством по меньшей мере одной дополнительной подходящей функциональной группы, которая содержится в указанной молекуле гидроксиалкилкрахмала и которая не является восстанавливающим концом. Если одна или несколько молекул гидроксиалкилкрахмала участвуют в реакции посредством по меньшей мере одной восстанавливающей и одновременно посредством по меньшей мере одной дополнительной подходящей функциональной группы, которая содержится в этой (этих) молекуле(ах) гидроксиалкилкрахмала и не является восстанавливающим концом, статистически предпочтительно более-9 013910 50%, предпочтительно как минимум 55%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 65%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и еще более предпочтительно по меньшей мере 95%, например 95, 96, 97, 98 или 99% от всех реакционноспособных функциональных групп этих молекул гидроксиалкилкрахмала, то указанные функциональные группы, включая восстанавливающие концы, являются восстанавливающими группами. Используемый в контексте настоящего изобретения, термин "восстанавливающий конец" относится к концевой альдегидной группе молекулы гидроксиалкилкрахмала, которая может присутствовать в виде альдегидной группы и/или в виде соответствующей полуацетальной форме. В случае, когда восстанавливающий конец является окисленным, альдегидная или полуацетальная группа существует в форме карбоксильной группы и/или соответствующего лактона. Поэтому по одному из вариантов настоящего изобретения способ по (а)(2) может содержать окисление гидроксиалкилкрахмала на его восстанавливающем конце для получения гидроксиалкилкрахмала формулы (IIIa) где R', R и R определяют по формуле (II),и взаимодействие гидроксиалкилкрахмала, окисленного на своем восстанавливающем конце, по меньшей мере с одним подходящим соединением для получения альдегидного, кето, полуацетального или альфа-SH-бета-амино-функционального гидроксиалкилкрахмала. Окисление гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала, может быть выполнено любым способом или сочетанием способов, которые приводят к соединениям, имеющим вышеупомянутые структуры (IIIa) и/или (IIIb). Несмотря на то что окисление может быть выполнено любым подходящим способом или способами, приводящими к получению окисленного восстанавливающего конца гидроксиалкилкрахмала, предпочитается осуществлять его с использованием щелочного раствора йода,как описано, например, в DE 19628705 А 1, соответствующее содержание которого (пример А, колонка 9,линии с 6 по 24) включено в настоящее описание в качестве ссылки. В другом предпочтительном варианте осуществления полуацетальная группа гидроксиалкилкрахмала является полуацетальной группой восстанавливающего конца гидроксиалкилкрахмала в своей неокисленной форме. По (а)(2) предпочитается, чтобы гидроксиалкилкрахмал, необязательно окисленный на своем восстанавливающем конце, взаимодействовал, по меньшей мере, с бифункциональным соединением, содержащим функциональную группу M1, которая взаимодействует с гидроксиалкильным крахмалом, предпочтительно на необязательно окисленном восстанавливающем конце, и функциональную группу Q, которая является альдегидной группой, кетогруппой, полуацетальной группой или альфа-SH-бетааминогруппой либо функциональной группой, которая может быть модифицирована для получения любой из этих групп. В качестве функциональной группы M1, по меньшей мере, бифункционального соединения, которая взаимодействует с гидроксиалкильным крахмалом, наиболее часто упоминается группа, имеющая структуру R-NH-, где R является водород или алкильный, циклоалкильный, арильный, аралкильный, арилциклоалкильный, алкарильный или циклоалкиларильный остаток, где циклоалкильный, арильный, аралкильный, арилциклоалкильный, алкарильный или циклоалкиларильный остаток может быть непосредственно связан с NH-группой или, по другому варианту осуществления, может быть связан с NH-группой с помощью кислородного мостика. Алкильный, циклоалкильный, арильный, аралкильный, арилциклоалкильный, алкарильный или циклоалкиларильный остатки могут быть подходящим образом замещенными. В качестве предпочтительных заместителей можно упомянуть галогены, такие как F, Cl или Br. Наиболее предпочтительными остатками R являются водород, алкильная или алкоксильная группы и даже- 10013910 более предпочтительными являются водород и незамещенные алкильная и алкоксильная группы. Среди алкильной или алкоксильной групп предпочитаются группы с 1, 2, 3, 4, 5 или 6 атомами С. Более предпочтительными являются метильная, этильная, пропильная, изопропильная, метоксильная,этоксильная, пропоксильная и изопропоксильная группы. Наиболее предпочитаются метильная, этильная, метоксильная, этоксильная, а особое предпочтение отдается метильной или метоксильной группам. По другому варианту настоящего изобретения функциональная группа М 1 имеет структуру R-NHR-, где R предпочтительно содержит структурную единицу -NH- и/или структурную единицу-(C=G)-, где G - это О или S и/или структурная единица -SO2-. Конкретными примерами функциональной группы R являются где если G присутствует дважды, то он независимо является О или S. Поэтому настоящее изобретение также относится к способу и конъюгату, указанным выше, в которых функциональную группу M1 выбирают из группы, состоящей из где G является О или S и, если присутствует дважды, то независимо является О или S, a R' является метильной группой. По особенно предпочтительному варианту осуществления настоящего изобретения функциональная группа M1 является аминогруппой -NH2. Что касается случая, когда группа Q является альдегидной группой, кетогруппой, полуацетальной группой или альфа-SH-бета-аминогруппой или функциональной группой, химически модифицируемой для получения одной из этих групп, среди прочих указываются следующие функциональные группы: С-С-двойные связи или С-С-тройные связи или ароматические С-С-связи; тиогруппа или гидроксильная группа; гидразид алкилсульфоновой кислоты, гидразид арилсульфоновой кислоты; 1,2-диолы; 1,2-амино-тиоспирты; азиды; 1,2-аминоспирты; аминогруппа -NH2 или производные аминогрупп, включающие структурную единицу -NH-, такие как аминоалкильные группы, аминоарильная группа, аминоаралкильные группы или алкариламиногруппы; гидроксиламиногруппа -О-NH2 или производные гидроксиламиногруппы, содержащие структурную единицу -O-NH-, такие как гидроксилалкиламиногруппы, гидроксилариламиногруппы, гидроксиларалкиламиногруппы или гидроксалалкариламиногруппы; алкоксиаминогруппы, арилоксиаминогруппы, аралкилоксиаминогруппы или алкарилоксиаминогруппы, каждая из которых содержит структурную единицу -NH-O-; остатки, имеющие карбонильную группу, -Q-C(=G)-M, где G - это О или S, а N является, например,-ОН или -SH; алкоксильной группой, арилоксильной группой, аралкилоксильной группой или алкарилоксильной группой; алкилтиоловой группой, арилтиоловой группой, аралкилтиоловой группой или алкарилтиоловой группой; алкилкарбонилоксильной группой, арилкарбонилоксильной группой, аралкилкарбонилоксильной группой, алкарилкарбонилоксильной группой; активированными сложными эфирами, такими как эфиры гидроксиламинов, имеющие имидную структуру, такую как N-гидроксисукцинимид, или имеющие структурную единицу O-N, где N является частью гетероарильного соединения или с G=O и отсутствующим Q, такие как арилоксильные соедине- 11013910 ния с замещенным арильным остатком, таким как пентафторфенил, паранитрофенил или трихлорфенил,где Q отсутствует или является NH или гетероатомом, таким как S или О;-NO2; нитрильной группой; карбонильными группами, такими как альдегидная группа или кетогруппа; карбоксильной группой;-N=C=O группой или -N=C=S группой; винилгалогенидными группами, такими как винилйодидная или винилбромидная группа или трифлат;-(C=NH2Cl)-Оалкил группы -(С=O)-СН 2-галоген, где галогеном является Cl, Br или I; В предпочтительном варианте осуществления способа по настоящему изобретению функциональная группа M1 взаимодействует с ОН-группой на гидроксиалкилкрахмале (или с необязательно окисленным или неокисленным восстанавливающим концом гидроксиалкилкрахмала). В этом варианте осуществления функциональная группа M1 предпочтительно является карбоксильной группой или реакционноспособной карбоксильной группой, а функциональная группа Q является альдегидной группой, кетогруппой или полуацетальной группой, конкретно бифункциональное соединение, содержащее М 1 и Q,выбирается из группы, состоящей из формилбензойной кислоты, пентафторфенильного эфира 4 формилбензойной кислоты, N-гидроксисукцинимидного эфира 4-формилбензойной кислоты, 4-(4 формил-3,5-диметоксифенокси)масляной кислоты и ангидрида 4-формилбензойной кислоты или биосовместимого соединения, выбираемого из группы, состоящей из альфа-кетокарбоновых кислот, нейраминовых кислот или их производных и пиридоксальфосфата. В отношении альфа-кетокарбоновых кислот предпочтительными являются такие альфакетокарбоновые кислоты, которые получены из аминокислот и которые в большинстве случаев также могут быть найдены в организме человека. Предпочтительные альфа-кетокарбоновые кислоты, полученные из аминокислот, выбирают из группы, состоящей из кетовалина, кетолейцина, кетоизолейцина и кетоаланина. В предпочтительном варианте осуществления этого изобретения карбоксильная группа альфа-кетокарбоновых кислот взаимодействует с ОН-группой на гидроксиалкилкрахмале (или с необязательно окисленным или неокисленным восстанавливающим концом гидроксиалкилкрахмала) или взаимодействует с группой Q гидроксиалкилкрахмала, являющейся аминогруппой. Оставшаяся свободной кетогруппа альфа-кетокарбоновой кислоты затем может участвовать в реакции с образованием тиазолидина. Соответственно, настоящее изобретение относится к способу по (а)(2)(i) или (а)(2)(ii), в котором гидроксиалкилкрахмал взаимодействует с альфа-кетокарбоновой кислотой. В отношении нейраминовой или сиаловой кислот или их производных предпочтительными являются их биосовместимые разновидности, в частности сахара, присутствующие в организме человека и являющиеся N- и/или О-ацетилированными. В предпочтительном варианте осуществления нейраминовые кислоты или сиаловые кислоты являются N-ацетилнейраминовыми кислотами. Благодаря пиранозной структуре эти соединения имеют требуемую упругость для выполнения спейсерной функции. С другой стороны, в эти соединения можно ввести альдегидную группу путем выборочного окисления. Сиаловые кислоты присутствуют в организме человека, например, в виде концевых моносахаридов в гликановых цепях гликозилированных белков. В предпочтительном варианте осуществления сиаловая кислота может быть избирательно окислена до альдегидной группы. В данной области известны способы избирательного окисления сиаловых кислот или нейраминовых кислот, например, из L.W. Jaques, B.F. Riesco, W. Weltner, Carbohydrate Research, 83 (1980), 21-32 and- 12013910 Предпочтительно, чтобы окисление сиаловой кислоты можно было выполнить до взаимодействия с гидроксиалкильным крахмалом. Затем необязательно окисленная сиаловая кислота может взаимодействовать посредством своей карбоксильной группы с гидроксиалкилкрахмалом. В предпочтительном варианте осуществления способа по настоящему изобретению карбоксильная группа окисленной сиаловой кислоты взаимодействует с ОН-группой на гидроксиалкилкрахмале или с необязательно окисленным или неокисленным восстанавливающим концом гидроксиалкилкрахмала или взаимодействует с Q группой гидроксиалкилкрахмала,являющейся аминогруппой. Оставшаяся карбонильная группа окисленной сиаловой кислоты затем может участвовать в реакции с образованием тиазолидина. Соответственно, настоящее изобретение относится к способу по (а)(2)(i) или (а)(2)(ii), в котором гидроксиалкилкрахмал взаимодействует с окисленной сиаловой кислотой. Что касается пиридоксальфосфата (РуР), он представляет собой бифункциональное соединение с высокой биосовместимостью, также называемое витамином В 6. РуР является коэнзимом, принимающим участие в реакциях переаминирования, декарбоксилирования, рацемизаций и в большом количестве модификаций боковых цепей аминокислот. Все ферменты, которым необходим РуР, действуют посредством образования основания Шиффа между аминокислотой и коэнзимом. В предпочтительном варианте осуществления способа по настоящему изобретению фосфатная группа РуР либо взаимодействует с ОН-группой на гидроксиалкилкрахмале или с необязательно окисленным или неокисленным восстанавливающим концом гидроксиалкилкрахмала, образуя фосфатную группу, либо взаимодействует с Q группой гидроксиалкилкрахмала, являющейся аминогруппой, образуя фосфорамид. Оставшаяся карбонильная группа РуР затем может участвовать в реакции с образованием тиазолидина. В случае РуР, функциональную группу гидроксиалкилкрахмала предпочтительно встраивают в гидроксиалкилкрахмал, используя диаминовое соединение, описанное выше. Соответственно, настоящее изобретение относится к способу по (а)(2)(i) или (а)(2)(ii), в котором гидроксиалкилкрахмал взаимодействует с пиридоксальфосфатом. В предпочтительном варианте осуществления в (а)(2)(i) функциональную группу M1 выбирают из группы, состоящей из карбоксильной группы, реакционноспособной карбоксильной группы, ангидрида карбоновой кислоты, галогенида карбоновой кислоты, изоцианата, изотиоцианата, эфира хлороформной кислоты и эпоксидных групп, а функциональная группа Q представляет собой альдегидную группу, кетогруппу или полуацетальную группу, где функциональная группа M1 взаимодействует с ОН-группой на гидроксиалкилкрахмале. В предпочтительном варианте осуществления в (а)(2)(i) функциональную группу M1 выбирают из группы, состоящей из аминогруппы и альфа-SH-бета-аминогруппы, а функциональная группа Q представляет собой альфа-SH-бета-аминогруппу, в частности, где функциональная группа М 1 взаимодействует с необязательно окисленным восстанавливающим концом гидроксиалкилкрахмала. В предпочтительном варианте осуществления в (а)(2)(i) гидроксиалкилкрахмал, содержащий указанную альфа-SH-бета-аминогруппу, получают способом, заключающимся во взаимодействии гидроксиалкилкрахмала на необязательно окисленном восстанавливающем конце с соединением, содержащим функциональную группу M1 и функциональную группу Q, являющуюся альфа-SH-бета-аминогруппой, в частности где соединение, содержащее M1 и альфа-SH-бета-аминогруппу, представляет собой 1,3 диамино-2-тиопропан или 2,3-диамино-1-тиопропан. В предпочтительном варианте осуществления в (а)(2)(ii), по меньшей мере, бифункциональное соединение содержит M1, являющуюся карбоксильной группой или реакционноспособной карбоксильной группой, и Q, являющуюся защищенной альфа-SH-бета-аминогруппой, в частности, где, по меньшей мере, бифункциональное соединение выбирают из группы, состоящей из D-, L-PG1-Cys(PG2)-ОН или из их рацемизированной смеси и их активного сложного эфира, где PG1 может быть любой подходящей защитной группой для аминогруппы, предпочтительно выбираемой из группы, состоящей из третбутилоксикарбонила (Вос) или 9-флуоренилметоксикарбонила (Fmoc), a PG2 может быть любой подходящей защитной группой для тиоловой группы, предпочтительно выбираемой из группы, состоящей из тритила (Trt), р-метокситритила (Mmt), S-трет-бутилтио (S-t-Bu) и ацетамидометила (Acm). По (а)(2)(ii) функциональная группа Q представляет собой группу, которую дополнительно модифицируют для получения альдегидной группы, кетогруппы, полуацетальной группы или альфа-SH-бетааминогруппы. По этому варианту осуществления производное гидроксиалкилкрахмала, получаемое в реакции гидроксиалкилкрахмала, необязательно окисленного на своем восстанавливающем конце, по меньшей мере, с бифункциональным соединением, взаимодействует с дополнительным, по меньшей мере, бифункциональным соединением, содержащим функциональную группу, которая взаимодействует с функциональной группой Q производного гидроксиалкилкрахмала. В предпочтительном случае (а)(2)(ii) как M1, так и Q представляют собой аминогруппу -NH2, M1 иQ можно разделить с помощью любого подходящего спейсера. Среди прочих, спейсер может быть необязательно замещенным, линейным, разветвленным и/или циклическим углеводным остатком. Как правило, углеводный остаток имеет от 1 до 40, предпочтительно от 1 до 20, более предпочтительно от 2 до- 13013910 10, более предпочтительно от 2 до 6 и наиболее предпочтительно от 2 до 4 атомов углерода. Если присутствуют гетероатомы, разделяющая группа обычно содержит от 1 до 20, предпочтительно от 1 до 8 и наиболее предпочтительно от 1 до 4 гетероатомов. Углеводный остаток может содержать алкильную цепь, при желании разветвленную, или арильную группу или циклоалкильную группу, имеющую, например, от 5 до 7 атомов углерода, или быть аралкильной группой, алкарильной группой, где алкильная часть может быть линейной и/или циклической алкильной группой. Согласно даже более предпочтительному варианту осуществления углеводный остаток является алкильной цепью, состоящей из от 1 до 20, предпочтительно от 2 до 10, более предпочтительно от 2 до 6 и наиболее предпочтительно от 2 до 4 атомов углерода. В одном из вариантов осуществления способа по изобретению по (а)(2)(ii) предпочитают, чтобы, по меньшей мере, бифункциональное соединение, содержащее M1 и Q, представляло собой необязательно замещенный диаминоалкан, имеющий от 1 до 20 атомов углерода, предпочтительно соединение, выбранное из группы, состоящей из 1,2-диаминоэтана, 1,3-диаминопропана и 1,4-диаминобутана, 1,5 диаминопентана, 1,6-диаминогексана, 1,7-диаминогептана, 1,8-диаминооктана, 1,9-диаминононана, 1,10 диаминодекана,1,11-диаминоундекана,1,12-диаминододекана,1,13-диаминотридекана,1,14 диаминотетрадекана, 1,15-диаминопентадекана, 1,16-диаминогексадекана, 1,17-диаминогептадекана,1,18-диаминооктадекана, 1,19-диаминононадекана и 1,20-диаминоэйкозана, или соединение, имеющее формулу где R1', R2', R3' и R4' независимо выбирают из группы, состоящей из водорода и алкильной группы, предпочтительно водорода и метильной группы, p имеет значения от 2 до 4, где остатки R1' и R2' могут быть одинаковыми или различными в p группах CR1'R2', q имеет значения от 0 до 20, предпочтительно от 0 до 10; r имеет значения от 0 до 20, предпочтительно от 2 до 4, где в случае, если q=0, то r не равняется 0, и где остатки R3' и R4' могут быть одинаковыми или различаться в r группах c R3'R4'. Предпочтительный вариант осуществления по настоящему изобретению также относится к способу, описанному ранее, в котором для получения амино-функционального производного гидроксиалкилкрахмала гидроксиалкилкрахмал взаимодействует с бифункциональным соединением, которое можно выбрать из группы, состоящей из 1,2-диаминоэтана, 1,3-диаминопропана и 1,4-диаминобутана, 1,5 диаминопентана, 1,6-диаминогексана, 1,7-диаминогептана, 1,8-диаминооктана, 1,9-диаминононана, 1,10 диаминодекана,1,11-диаминоундекана,1,12-диаминододекана,1,13-диаминотридекана,1,14 диаминотетрадекана, 1,15-диаминопентадекана, 1,16-диаминогексадекана, 1,17-диаминогептадекана,1,18-диаминооктадекана, 1,19-диаминононадекана и 1,20-диаминоэйкозана, или с соединением, имеющим формулу где R1', R2', R3' и R4' независимо выбирают из группы, состоящей из водорода и алкильной группы, предпочтительно, водорода и метильной группы, p имеет значения от 2 до 4, где остатки R1' и R2' могут быть одинаковыми или различными в p группах CR1'R2', q имеет значения от 0 до 20, предпочтительно от 0 до 4, а r имеет значения от 0 до 20, предпочтительно от 2 до 4, где в случае, если q=0, то r не равняется 0, и где остатки R3' и R4' могут быть одинаковыми или различаться в r группах CR3'R4', в частности, с 1,4 диаминобутаном, и это амино-функциональное производное гидроксиалкилкрахмала в дальнейшем взаимодействует, по меньшей мере, с бифункциональным соединением, содержащим одну функциональную группу, взаимодействующую с аминогруппой амино-функционального гидроксиалкилкрахмала,и одну функциональную группу, представляющую собой по меньшей мере одну альдегидную группу,кетогруппу, полуацетальную группу или альфа-SH-бета-аминогруппу. Это необязательное бифункциональное соединение выбирают предпочтительно из группы, состоящей из формилбензойной кислоты,пентафторфенильного эфира 4-формилбензойной кислоты, N-гидроксисукцинимидного эфира 4 формилбензойной кислоты, 4-(4-формил-3,5-диметоксифенокси)масляной кислоты и ангидрида 4 формилбензойной кислоты или биосовместимого соединения, выбираемого из группы, состоящей из альфа-кето-карбоновых кислот, нейраминовых кислот или их производных и пиридоксальфосфата. В другом варианте осуществления способа в (а)(2)(ii) гидроксиалкилкрахмал, содержащий указанную альфа-SH-бета-аминогруппу, получают способом, заключающимся в том, что для получения первого производного гидроксиалкилкрахмала гидроксиалкилкрахмал, необязательно окисляемый на своем восстанавливающем конце, взаимодействует окисленным или неокисленным восстанавливающим концом с функциональной группой M1 соединения, содержащего помимо M1 дополнительную функциональную группу Q, и для получения функционального производного гидроксиалкилкрахмала, имеющего необязательно защищенную альфа-SH-бета-аминогруппу, функциональная группа Q первого производного гидроксиалкилкрахмала взаимодействует с функциональной группой V соединения, содержащего помимо V необязательно защищенную альфа-SH-бета-аминогруппу. Предпочитают функциональные группы M1 и Q, описанные выше. В предпочтительном варианте осуществления соединением, содержащим V и необязательно защищенную альфа-SH-бета-аминогруппу, является цистеин или его производное, V представляет собой кар- 14013910 боксильную группу или реакционноспособную карбоксильную группу, предпочтительно реакционноспособный сложный эфир или ангидрид карбоновой кислоты. Предпочтительно, чтобы в (а)(2)(ii) гидроксиалкилкрахмал в своей неокисленной форме взаимодействовал с бифункциональным соединением, имеющим аминогруппу M1 и аминогруппу Q, путем восстановительного аминирования. Конкретно, бифункциональное соединение можно выбрать из группы, состоящей из первичных аминов, аммония, 1,2-диаминоэтана, 1,3-диаминопропана и 1,4-диаминобутана,1,5-диаминопентана, 1,6-диаминогексана, 1,7-диаминогептана, 1,8-диаминооктана, 1,9-диаминононана,1,10-диаминодекана, 1,11-диаминоундекана, 1,12-диаминододекана, 1,13-диаминотридекана, 1,14 диаминотетрадекана, 1,15-диаминопентадекана, 1,16-диаминогексадекана, 1,17-диаминогептадекана,1,18-диаминооктадекана, 1,19-диаминононадекана и 1,20-диаминоэйкозана, или соединения, имеющего формулу где R1', R2', R3' и R4' независимо выбирают из группы, состоящей из водорода и алкильной группы, предпочтительно водорода и метильной группы, p имеет значения от 2 до 4, где остатки R1' и R2' могут быть одинаковыми или различными в p группах CR1'R2', q имеет значения от 0 до 20, предпочтительно от 0 до 4, и r имеет значения от 0 до 20, предпочтительно от 2 до 4, где в случае, если q=0, то r не равняется 0, и где остатки R3' и R4' могут быть одинаковыми или различаться в r группах CR3'R4', в частности 1,4 диаминобутана. Предпочтительно, чтобы в (а)(2)(ii) гидроксиалкилкрахмал, окисленный на своем восстанавливающем конце, взаимодействовал с бифункциональным соединением, имеющим аминогруппу M1 и аминогруппу Q, путем реакции с раскрытием лактонного кольца. В частности, бифункциональное соединение можно выбрать из группы, состоящей из 1,2-диаминоэтана, 1,3-диаминопропана и 1,4-диаминобутана,1,5-диаминопентана, 1,6-диаминогексана, 1,7-диаминогептана, 1,8-диаминооктана, 1,9-диаминононана,1,10-диаминодекана, 1,11-диаминоундекана, 1,12-диаминододекана, 1,13-диаминотридекана, 1,14 диаминотетрадекана, 1,15-диаминопентадекана, 1,16-диаминогексадекана, 1,17-диаминогептадекана,1,18-диаминооктадекана, 1,19-диаминононадекана и 1,20-диаминоэйкозана, или соединения, имеющего формулу где R1', R2', R3' и R4' независимо выбирают из группы, состоящей из водорода и алкильной группы, предпочтительно водорода и метильной группы, p имеет значения от 2 до 4, где остатки R1' и R2' могут быть одинаковыми или различными в p группах CR1'R2', q имеет значения от 0 до 20, предпочтительно от 0 до 4, и r имеет значения от 0 до 20, предпочтительно от 2 до 4, где в случае, если q=0, то r не равняется 0, и где остатки R3' и R4' могут быть одинаковыми или различаться в r группах CR3'R4', в частности 1,4 диаминобутана. Предпочтительно, чтобы в (а)(2)(ii) гидроксиалкилкрахмал сначала взаимодействовал с бифункциональным соединением, имеющим аминогруппу Q, предпочтительно полученную, как описано выше,а полученный амино-функциональный гидроксиалкилкрахмал далее взаимодействовал с бифункциональным соединением, имеющим активированную карбоксильную группу и альдегидную группу, кетогруппу или полуацетальную группу. В наиболее предпочтительном варианте осуществления способ по изобретению в (а)(2)(ii) включает взаимодействие предпочтительно окисленного гидроксиалкилкрахмала с соединением, имеющим аминогруппу M1 и аминогруппу Q, в частности, с диаминоалкильным соединением, конкретно 1,4 диаминобутаном, и затем во взаимодействии амино-функционального гидроксиалкилкрахмала с соединением, выбранным из группы, состоящей из необязательно защищенного цистеина и 4 формилбензойной кислоты. Действующее вещество, содержащее по меньшей мере одну альдегидную группу, кетогруппу, полуацетальную группу или альфа-SH-бета-аминогруппу, можно получить любым подходящим способом. В предпочтительном варианте осуществления действующее вещество, предпочтительно дополнительно модифицированный белок, пептид, синтетический пептид или олигонуклеотид, содержащие указанную альдегидную группу, кетогруппу, полуацетальную группу или альфа-SH-бета-аминогруппу, получают способом, заключающимся во:(b)(1) встраивании по меньшей мере одной альдегидной группы, кетогруппы, полуацетальной группы или по меньшей мере одной альфа-SH-бета-аминогруппы в действующее вещество во время его получения или путем химической модификации, или(b)(2) взаимодействии действующего вещества, по меньшей мере, с бифункциональным соединением, указанное соединение содержит две функциональные группы М 2 и Q, одну функциональную группу М 2, взаимодействующую с действующим веществом, и одну функциональную группу Q, являющуюся:(ii) функциональной группой, химически модифицируемой для получения альдегидной группы, кетогруппы, полуацетальной группы. Предпочтительно, чтобы в (b)(1) действующее вещество представляло собой белок или пептид, ко- 15013910 торый получили путем органического синтеза, предпочтительно с использованием синтетической смолы,с учетом того, что белок или пептид должен содержать функциональную альдегидную группу, функциональную кетогруппу, функциональную полуацетальную группу, или чтобы в (b)(1) действующее вещество представляло собой белок или пептид, который получили с использованием экспрессирующего вектора, в результате получая белок или пептид, содержащий функциональную альдегидную группу, функциональную кетогруппу, функциональную полуацетальную группу или функциональную альфа-SH-бета аминогруппу, или чтобы в (b)(1) действующее вещество представляло собой белок или пептид, а остов белка или пептида замещался альдегидной группой, кетогруппой, полуацетальной группой или альфаSH-бета аминогруппой, или чтобы в (b)(1) действующее вещество представляло собой белок или пептид,где указанная альдегидная группа, кетогруппа, полуацетальная группа или указанная альфа-SH-бетааминогруппа связывалась непосредственно с остовом белка или пептида или являлась частью боковой цепи остова. В предпочтительном варианте осуществления (b)(1) для введения альдегидной группы действующее вещество получают модификацией действующего вещества, в частности белка или пептида, путем окисления. В предпочтительном варианте осуществления действующее вещество представляет собой белок или пептид, а альдегидная группа, кетогруппа или полуацетальная группа содержится в углеводном фрагменте полипептида, в частности, где углеводный фрагмент выбирают из группы, состоящей из гидроксиальдегидов, гидроксикетонов и их химических модификаций. Углеводный фрагмент может быть производным природного углеводного фрагмента и выбирается из группы, состоящей из глюкозы, галактозы,маннозы и сиаловой кислоты, которые являются необязательно химически или ферментативно окисленными, предпочтительно остатком окисленной галактозы или окисленной сиаловой кислоты углеводной боковой цепи, более предпочтительно концевым остатком галактозы или сиаловой кислоты углеводной боковой цепи, окисление концевого углеводного фрагмента предпочтительно выполняется либо ферментативно либо химически, химическое окисление предпочтительно выполняют, используя перйодат. В предпочтительном варианте осуществления углеводный фрагмент является производным природного углеводного фрагмента и представляет собой концевую галактозу, ферментативно или химически окисленную, когда концевой остаток галактозы дополнительно получают после расщепления концевой сиаловой кислоты. В предпочтительном варианте осуществления альфа-SH-бета-аминогруппа содержится в цистеиновом остатке действующего вещества, предпочтительно белка или пептида, цистеиновый остаток предпочтительно является N-концевым цистеиновым остатком действующего вещества. В предпочтительном варианте осуществления действующее вещество является модифицированным белком или пептидом с N-концевым цистеиновым остатком, который не является частью дисульфидного мостика, в частности, где модифицированный белок или пептид, обладающий N-концевым цистеиновым остатком, является мутантом природного белка или пептида, полученным путем (1) добавления цистеинового остатка к N-концевой аминокислоте, (2) замещения N-концевой аминокислоты цистеином или путем (3) удаления N-концевой аминокислоты(т) до тех пор, пока не получится концевой цистеин. Указанный цистеин можно встроить в пептиды во время синтеза. Пептидный синтез известен в данной области (W. Chang, P.D. White; Fmoc solid phase peptide synthesis, a practical approach; Oxford University Press, Oxford, 2000, ISBN 0199637245). Рекомбинантные полипептиды получают стандартными молекулярно-биологическими технологиями, как, например, описанными в Molecular Cloning: A Laboratory Manual, 3rd edition, Eds. Sambrook et al.,CSHL Press 2001. Кратко, полипептиды можно экспрессировать из рекомбинантных экспрессирующих векторов, содержащих нуклеиновую кислоту, кодирующую желаемый полипептид, где нуклеиновая кислота функционально связана по меньшей мере с одной регуляторной последовательностью, позволяющей экспрессировать желаемый полипептид. Например, последовательность нуклеиновой кислоты, кодирующую желаемый полипептид, можно выделить и клонировать в экспрессирующем векторе, а вектор затем может быть трансформирован в подходящую клетку-хозяина для экспрессии желаемого полипептида. Такой вектор может быть плазмидой, фагмидой или космидой. Например, молекула нуклеиновой кислоты может быть клонирована в подходящей форме в прокариотические или эукариотические экспрессирующие векторы (Molecular Cloning, см. выше). Такие экспрессирующие векторы содержат по меньшей мере один промотор, а также могут содержать сигнал начала трансляции и - в случае прокариотических экспрессирующих векторов - сигнал терминации трансляции, тогда как в случае эукариотических экспрессирующих векторов предпочтительно содержат сигналы терминации транскрипции и полиаденилирования. Примерами прокариотических экспрессирующих векторов для экспрессии в Escherichiacoli являются, например, экспрессирующие векторы, основанные на промоторах, распознаваемых Т 7 РНК-полимеразой, как описано в патенте США 4952496, примерами эукариотических экспрессирующих векторов для экспрессии в Saccharomyces cerevisiae являются, например, векторы G426/Met25 или(1997) Volume 13, U. Reischt, ed. (Totowa, NJ: Humana Press Inc. и для экспрессии в клетках млекопитающих, например, векторы Rc/CMW, Rc/ASW и SW40-векторы, которые являются хорошо известными и коммерчески доступными, или EBNA-система, описанная в примере 4, pCytTS на основе репликона Синдбис (Boorsma et al. (2002) Biotechnol. Bioeng. 79(6): 602-609), экспрессирующая вирус Синдбис система (Schlesinger (1993) Trends Biotechnol. 11(1):18-22) или аденовирусная экспрессирующая система (Неet al. (1998) Proc. Natl. Acad. Sci. USA 95:2509-2514). Специалистам хорошо известны молекулярнобиологические способы получения этих экспрессирующих векторов, а также способы трансфекции клеток-хозяев и культивирования таких трансфицированных клеток-хозяев, а также условия выработки и получения полипептидов по изобретению из указанных трансфицированных клеток-хозяев. Полипептиды с желаемым N-концевым цистеиновым остатком можно получить из полипептидов,экспрессированных и очищенных, как описано выше, путем клонирования интересуемого полипептида,следующего за N-концевой лидерной последовательностью, которую удаляют для получения полипептидов с желаемым N-концевым цистеиновым остатком. Этого можно достичь, например, протеолитическим расщеплением полипептида, экспрессированного и очищенного, как описано ранее. В таком случае клонировали, экспрессировали и очищали слитый полипептид, в котором цистеиновый остаток следует непосредственно за высоко избирательным сайтом расщепления протеазой, например, Cys остаток, непосредственно следующий за участком расщепления фактором Ха: Ile (Glu/Asp) Gly Arg(Cys/His), или His или Cys остаток, непосредственно следующий за участком расщепления энтерокиназой: Asp Asp Asp Asp Lys(Cys/His), гдеобозначает сайт расщепления протеазой. Кроме того, этого можно достичь, например, расщеплением полипептида во время экспрессии, например, расщеплением на этапе ER транслокации с помощью сигнальной пептидазы. В таком случае клонировали и экспрессировали слитый полипептид, в котором Cys остаток следует непосредственно за сигнальным пептидом, направляя рекомбинантный полипептид на секреторный путь (более подробно см.Rapoport et al., Annu Rev Biochem. 1996; 65:271-303). Молекулярно-биологические способы вмешательства в кодирующую последовательность рекомбинантного полипептида хорошо известны в данной области, при этом создают кодирующую последовательность для полипептида с желаемым Cys остатком в желаемом положении (Sambrook, выше). Предпочтительными вариантами осуществления (b)(2) являются такие же, как описанные выше для(а)(2), в частности функциональные группы М 2 и Q предпочтительно такие же, как описанные выше функциональные группы M1 и Q, при условии, что действующее вещество содержит функциональную группу, которая взаимодействует с группой M1, как описано выше. В особенно предпочтительном варианте осуществления действующее вещество выбирают из белка и пептида и получают по (b)(1) предпочтительно, как описано выше. В особенно предпочтительном варианте осуществления по (А) гидроксиалкилкрахмал, содержащий альдегидную группу, получают по (а)(2)(ii), предпочтительно взаимодействием предпочтительно окисленного гидроксиалкилкрахмала с соединением, имеющим аминогруппу M1 и аминогруппу Q, в частности с диаминоалкильным соединением, конкретно 1,4-диаминобутаном, и затем взаимодействием аминофункционального гидроксиалкилкрахмала с бифункциональным соединением, содержащим альдегидную группу, в частности 4-формилбензойную кислоту, а затем взаимодействием альдегидной группы гидроксиалкилкрахмала с необязательно защищенной альфа-SH-бета-аминогруппой действующего вещества,полученного путем (b)(2)(i), предпочтительно встраиванием в действующее вещество, в частности белок или пептид, необязательно защищенного цистеина. В особенно предпочтительном варианте осуществления по (В) действующее вещество, содержащее альдегидную группу, получают путем (b)(1), в частности введением альдегидной группы путем химической модификации, предпочтительно с помощью окисления белка или пептида, и затем взаимодействием альдегидной группы действующего вещества с гидроксиалкилкрахмалом, содержащим альфа-SH-бетааминогруппу, полученным путем (а)(2)(ii), предпочтительно взаимодействием предпочтительно окисленного гидроксиалкилкрахмала с соединением, имеющим аминогруппу M1 и аминогруппу Q, в частности с диаминоалкильным соединением, конкретно 1,4-диаминобутаном, а затем взаимодействием аминофункционального гидроксиалкилкрахмала с бифункциональным соединением, содержащим альфа-SHбета-аминогруппу, в частности цистеин. Реакцию по изобретению по (А) и (В) действующего вещества с гидроксиалкилкрахмалом можно выполнить в любом подходящем растворителе или смеси по меньшей мере двух растворителей, при подходящем значении рН и при подходящей температуре реакции. В предпочтительном варианте осуществления реакцию (А) или (В) выполняют при температуре от 0 до 40 С, предпочтительно от 0 до 25 С, в частности от 20 до 25 С, в присутствии растворителя и при значении рН от 3,5 до 10, предпочтительно от 4 до 8, в частности от 4,8 до 8,0, с временем проведения реакции предпочтительно от 0,1 до 24 ч, в частности около 21 ч. Растворитель предпочтительно выбирают из группы, состоящей из воды, водного буфера, DMF(диметилформамида), DMSO (диметилсульфоксида), DMA (диметилацетамида) и их смеси. Молекулярное соотношение гидроксиалкилкрахмала к действующему веществу составляет при- 17013910 мерно от 1:1 до 2 00:1, предпочтительно от 10:1 до 100:1, в частности от 40:1 до 70:1. Более того, изобретение относится к конъюгату действующего вещества и гидроксиалкилкрахмала,получаемому способом, описанным выше. В другом варианте осуществления изобретение относится к конъюгату действующего вещества и гидроксиалкилкрахмала, в котором действующее вещество и гидроксиалкилкрахмал являются ковалентно связанными посредством химического остатка, имеющего структуру формулы (I) где R1, R2, R2', R3, R3' и R4 независимо выбирают из группы, состоящей из водорода, необязательно подходящим образом замещенной, линейной, циклической и/или разветвленной алкильной, арильной, гетероарильной, аралкильной и гетероаралкильной группы, предпочтительно водорода, указанный конъюгат имеет структуру формулы (IV), (IV') или (IV") где HAS' является остатком гидроксиалкилкрахмала или его производного, связанным с альдегидной группой, кетогруппой или полуацетальной группой, и где AS' является остатком действующего вещества или его производного, связанным с альфа-SH-бета-аминогруппой, или структуру формулы (V), (V') или где HAS' является остатком гидроксиалкилкрахмала или его производного, связанным с альфа-SH-бетааминогруппой, и где AS' является остатком действующего вещества или его производного, связанным с альдегидной группой, кетогруппой или полуацетальной группой. В предпочтительном варианте осуществления конъюгат выбирают из группы, состоящей из где R5 определяют так же, как для R1-R4, рассмотренных выше, где в формуле (IV'а), (IV'b), (V'b) или (V'c) n является целым числом, предпочтительно n имеет значения от 0 до 20, и где в формуле (Va), (Vb), (V'b) или (V'e) n является целым числом, предпочтительно n имеет значения от 1 до 20. В предпочтительном варианте осуществления формулы (IV'b) и (V'c) n имеет значения от 2 до 4, в частности 2. В предпочтительном варианте осуществления конъюгат является где R', R и/или R определяются по формуле (II) и где по меньшей мере в одном глюкозном мономереHES по меньшей мере один из R', R и/или R независимо выбирается из группы, состоящей из и где n является целым числом, предпочтительно от 1 до 20 и/или где по меньшей мере один из R', R и/или R представляет собой -(CH2CH2O)m-R, где m принимает целочисленные значения, предпочтительно от 1 до 3, a R выбирается из группы, состоящей из формулы (VIa), (VIb), (VIc) и (VId). В дополнительном варианте осуществления изобретение относится к альфа-3 Н-бета-аминофункциональному производному гидроксиалкилкрахмала, выбираемому из группы, состоящей из где R', R и/или R определяются по формуле (II) и где по меньшей мере в одном глюкозном мономереHES по меньшей мере один из R', R и/или R независимо выбирают из группы, состоящей из и где n принимает целочисленные значения, предпочтительно от 1 до 20 и/или где по меньшей мере один из R', R и/или R представляет собой -(CH2CH2O)m-R, где m принимает целочисленные значения, предпочтительно от 1 до 3, a R выбирается из группы, состоящей из формулы (VI'a), (VI'b) и (VI'с). Аббревиатуры HES и HES', специфически использованные в контексте формул (VI) и (VI'), относятся к остаткам молекулы HES, которые совместно с углеводным фрагментом, связывающим HES иHES', как показано в (VI) и (VI'), составляют молекулу HES, которая в свою очередь является частью конъюгатов, как определено в (VI) и (VI'). В дополнительном варианте осуществления изобретение относится к описанному выше конъюгату,используемому в способе лечения человека или животного или в качестве лекарственного средства. Конъюгаты по изобретению могут быть очищенными по меньшей мере на 50%, даже более предпочтительно по меньшей мере на 70%, еще более предпочтительно по меньшей мере на 90%, в частности по меньшей мере на 95% или по меньшей мере на 99%. В наиболее предпочтительном варианте осуществления конъюгаты могут быть очищены на 100%, т.е. они не содержат других побочных продуктов. Поэтому по другому аспекту настоящее изобретение также относится к композиции, которая может содержать конъюгат(ы) по изобретению, в которой количество конъюгата(ов) может составлять по меньшей мере 50% по массе, даже более предпочтительно по меньшей мере 70% по массе, еще более предпочтительно по меньшей мере 90% по массе, в частности по меньшей мере 95% по массе или по меньшей мере 99% по массе. В наиболее предпочтительном варианте осуществления композиция может состоять из конъюгата(ов), т.е. количество конъюгата(ов) составляет 100% по массе. Соответственно, настоящее изобретение также относится к фармацевтической композиции, содержащей описанный выше конъюгат или конъюгат, получаемый описанным выше способом. Более того, настоящее изобретение также относится к фармацевтической композиции, содержащей описанный выше конъюгат или конъюгат, получаемый описанным выше способом, указанная фармацевтическая композиция необязательно содержит по меньшей мере один фармацевтически приемлемый разбавитель, адьювант или носитель. Краткое описание фигур На фиг. 1 показан анализ SDS-гель-электрофорезом неочищенных конъюгатов белок-HES, полученных путем образования тиазолидина из H-Cys(H)-HES10/0,4 и окисленного ЕРО. Линия X: маркер молекулярной массы Roti-Mark STANDARD (Carl Roth GmbH + Co. KG,Karlsruhe, D) сверху вниз: 200, 119, 66, 43, 29, 20, 14,3 кДа. Линия А: конъюгирование H-Cys(H)-HES10/0,4 с окисленным ЕРО. На фиг. 2 показан анализ SDS-гель-электрофорезом неочищенных конъюгатов белок-HES, полученных образованием тиазолидина из Н-Cys-пептид-NH2 и альдегидо-HES. Линия X: маркер молекулярной массы Roti-Mark STANDARD (Carl Roth GmbH + Co. KG,Karlsruhe, D) сверху вниз: 200, 119, 66, 43, 29, 20, 14,3 кДа. Линия А: конъюгирование альдегидо-HES10/0,7 при рН 4,6. Линия В: конъюгирование альдегидо-HES50/0,7 при рН 4,6. Линия С: контроль реакции: пептид при рН 4,6. Линия D: конъюгирование альдегидо-HES10/0,7 при рН 8,0. Линия Е: конъюгирование альдегидо-HES50/0,7 при рН 8,0. Линия F: контроль реакции: пептид при рН 8,0. На фиг. 3 показан электрофорез в агарозном геле неочищенных конъюгатов ДНК-HES, полученных образованием тиазолидина из H-Cys(Н)-HES50/0,7 и альдегид-модифицированной ДНК, как описано в экспериментальных разделах 8.4-8.5 настоящего документа. Линия X: маркер pUC19/Msp I (Carl Roth GmbH + Co. KG, Karlsruhe, D) маркер молекулярной массы сверху вниз: 501/489, 404, 331, 242, 190, 147, 111/110, 67 нп. Линия А, верхний ряд: конъюгирование H-Cys(H)-HES50/0,7 с FBA-модифицированной ДНК при- 22013910 рН 4,6, как описано в экспериментальном разделе 8.5. Линия В, верхний ряд: контроль реакции; конъюгирование Oxo-HES50/0,7 с FBAмодифицированной ДНК при рН 4,6, как описано в экспериментальном разделе 8.5. Линия. С, верхний ряд: конъюгирование H-Cys(H)-HES50/0,7 с FBA-модифицированной ДНК при рН 8,0, как описано в экспериментальном разделе 8.5. Линия D, верхний ряд: контроль реакции; конъюгирование Oxo-HES50/0,7 с FBAмодифицированной ДНК при рН 8,0, как описано в экспериментальном разделе 8.5. Линия Е, верхний ряд: контроль реакции; FBA-модифицированная ДНК в воде без HESпроизводного. Линия А, нижний ряд: конъюгирование H-Cys(H)-HES50/0,7 с формилиндол-модифицированной ДНК при рН 4,6, как описано в экспериментальном разделе 8.5. Линия В, нижний ряд: контроль реакции; конъюгирование Охо-HES50/0,7 с формилиндолмодифицированной ДНК при рН 4,6, как описано в экспериментальном разделе 8.5. Линия С, нижний ряд: конъюгирование H-Cys(H)-HES50/0,7 с формилиндол-модифицированной ДНК при рН 8,0, как описано в экспериментальном разделе 8.5. Линия D, нижний ряд: контроль реакции; конъюгирование Охо-HES50/0,7 с формилиндолмодифицированной ДНК при рН 8,0, как описано в экспериментальном разделе 8.5. Линия Е, нижний ряд: контроль реакции; формилиндол-модифицированная ДНК в воде без HESпроизводного. На фиг. 4-6 показан анализ неочищенного конъюгата даунорубицин-HES, полученного образованием тиазолидина из Н-Cys(H)-HES50/0,7 и даунорубицина, посредством HPLC обратнофазовой хроматографии, UV-детекция при 290 нм, как описано в экспериментальном разделе 9 настоящего документа. Фиг. 4: HPLC анализ неочищенного конъюгата. Фиг. 5: HPLC анализ даунорубицина. Фиг. 6: HPLC анализ H-Cys(H)-HES50/0,7. На фиг. 7-9 показан анализ неочищенного конъюгата тилозин-HES, полученного образованием тиазолидина из H-Cys(H)-HES50/0,7 и тилозина, посредством HPLC обратнофазовой хроматографии, UVдетекция при 220 нм, как описано в экспериментальном разделе 9 настоящего документа. Фиг. 7: HPLC анализ неочищенного конъюгата. Фиг. 8: HPLC анализ тилозина. Фиг. 9: HPLC анализ H-Cys(H)-HES50/0,7. На фиг. 10 показан анализ SDS-гель-электрофорезом неочищенных конъюгатов пептид-HES, как описано в экспериментальном разделе 10 настоящего документа. Линия X: маркер молекулярной массы Roti-Mark STANDARD (Carl Roth GmbH + Co. KG,Karlsruhe, D) сверху вниз: 200, 119, 66, 43, 29, 20, 14,3 кДа. Линия А: конъюгирование HES10/0,7 с пептидом при 21 С в DMF. Линия В: конъюгирование HES10/0,7 с пептидом при 37 С в DMF. Линия С: контроль реакции: пептид при 50 С в DMF. Линия D: конъюгирование HES10/0,7 с пептидом при 50 С, рН 4,6. Линия Е: конъюгирование HES10/0,7 с пептидом при 50 С в DMF. Линия F: конъюгирование HES10/0,7 с пептидом при 50 С, рН 4,6, 1% Тритон. Линия G: конъюгирование HES10/0,7 с пептидом при 50 С в DMF, 1% Тритон. Более подробное объяснение изобретения будет дано с помощью следующих примеров. Примеры 1. Синтез H-Cys(StBu)-HES10/0,4. 1.1. Синтез амино-HES10/0,4 из окисленного HES.Oxo-HES10/0,4 (4 г, MW=10,9 кДа, DS=0,4, Supramol Parenteral Colloids GmbH, Rosbach-Rodheim,D) нагревали в течение ночи при 80 С в вакууме, растворяли в атмосфере аргона в безводном диметилсульфоксиде (25 мл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D) и добавляли 1,4-диаминобутан(4,0 мл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После перемешивания при 45 С в течение 24 ч реакционную смесь добавляли к 2-пропанолу (125 мл Carl Roth GmbH + Co. KG, Karlsruhe, D) и инкубировали в течение 1 ч при -20 С. Преципитировавший продукт собирали центрифугированием при 4 С, отмывали 2-пропанолом (100 мл) и собирали центрифугированием. Неочищенный продукт растворяли в воде (20 мл, Milli-Q), диализовали против воды Milli-Q в течение 43 ч (змеевидная диализная трубка, 3,5 кДа MWCO, Perbio Sciences Deutschland GmbH, Bonn, D) и лиофилизировали. Выход выделенного продукта составил 65%. 1.2. Синтез Fmoc-Cys(StBu)-HES10/0,4 из амино-HES.Fmoc-Cys(StBu)-ОН (150 мг, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D) и 1-гидрокси-1 Нбензотриазол (61,4 мг, Aldrich, Sigma-Aldrich Chemie GmbH, Taufkirchen, D) растворяли в N,Nдиметилформамиде (3,5 мл Peptide synthesis grade, Biosolve, Valkenswaard, NL) и добавляли N,N'диизопропилкарбодиимид (54,3 мкл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После инкубации при 21 С в течение 30 мин добавляли амино-HES10/0.4 (0,35 г), полученный в 1.1. После перемеши- 23013910 вания при комнатной температуре в течение ночи реакционную смесь добавляли к охлажденной на льду смеси 1:1 (35 мл, об./об.) ацетона (Carl Roth GmbH + Co. KG, Karlsruhe, D) и этанола (DAB, Sonnenberg,Braunschweig, D) и инкубировали в течение 1 ч при -20 С. Преципитировавший продукт собирали центрифугированием при 4 С, растворяли в воде (20 мл, Milli-Q) и добавляли дихлорметан (Carl Roth GmbH+ Co. KG, Karlsruhe, D) (20 мл). Смесь тщательно перемешивали и центрифугировали. Водный верхний слой диализовали против воды Milli-Q в течение 41 ч (змеевидная диализная трубка, 3,5 кДа MWCO,Perbio Sciences Deutschland GmbH, Bonn, D) и лиофилизировали. Выход выделенного продукта составил 78%. 1.3. Синтез H-Cys(StBu)-HES10/0,4 из Fmoc-Cys(StBu)-HES10/0,4.Fmoc-Cys(StBu)-HES10/0,4 (0,35 г), полученный в 1.2, растворяли в растворе пиперидина (4 мл, 20% в DMF, об./об., Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После перемешивания при комнатной температуре в течение 15 мин реакционную смесь добавляли к охлажденной на льду смеси 1:1 ацетона и этанола (35 мл, об./об.) и инкубировали в течение 1 ч при -20 С. Преципитировавший продукт собирали центрифугированием при 4 С и отмывали трет-бутилметиловым эфиром (25 мл, AcrosOrganics, Geel, В) и инкубировали в течение 1 ч при -20 С. Преципитировавший продукт собирали центрифугированием при 4 С и высушивали в потоке азота. Выход выделенного продукта составил 68%. 2. Синтез альдегидо-HES10/0,7. 2.1. Синтез амино-HES10/0,7 из окисленного HES.Oxo-HES10/0,7 (6,02 г, MW=14,7 кДа, DS=0,76, Supramol Parenteral Colloids GmbH, RosbachRodheim, D) нагревали в течение 16,5 ч при 80 С в вакууме, растворяли в атмосфере аргона в безводном диметилсульфоксиде (25 мл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D) и добавляли 1,4 диаминобутан (5,1 мл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После перемешивания при 40 С в течение 17 ч реакционную смесь добавляли к охлажденной на льду смеси 1:1 ацетона и этанола(150 мл, об./об.). Преципитировавший продукт собирали центрифугированием при 4 С, отмывали охлажденной на льду смесью 1:1 ацетона и этанола (40 мл, об./об.) и собирали центрифугированием. Неочищенный продукт растворяли в воде (80 мл), диализовали против воды Milli-Q в течение 42 ч (змеевидная диализная трубка, 3,5 кДа MWCO, Perbio Sciences Deutschland GmbH, Bonn, D) и лиофилизировали. Выход выделенного продукта составил 67%. 2.2. Синтез альдегидо-HES10/0,7 из амино-HES. 4-Формилбензойную кислоту (75 мг, Lancaster Synthesis, Frankfurt/Main, D) и 1-гидрокси-1 Нбензотриазол (115 мг, Aldrich, Sigma-Aldrich Chemie GmbH, Taufkirchen, D) растворяли в N,Nдиметилформамиде (DMF, 5 мл, Peptide synthesis grade, Biosolve, Valkenswaard, NL) и добавляли N,N'диизопропилкарбодиимид (102 мкл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После инкубации при комнатной температуре в течение 30 мин добавляли амино-HES10/0,7 (0,5 г, MW=14,7 кДа,DS=0,76). После перемешивания при комнатной температуре в течение ночи реакционную смесь добавляли к 2-пропанолу (30 мл, Carl Roth GmbH + Co. KG, Karlsruhe, D) и инкубировали в течение 1 ч при-20 С. Преципитировавший продукт собирали центрифугированием при 4 С, отмывали 2-пропанолом(30 мл) и собирали центрифугированием. Неочищенный продукт растворяли в воде (10 мл, Milli-Q), диализовали против воды Milli-Q в течение 44 ч (змеевидная диализная трубка, 3,5 кДа MWCO, Perbio Sciences Deutschland GmbH, Bonn, D) и лиофилизировали. Выход выделенного продукта составил 86%. 3. Синтез альдегидо-HES50/0,7. 3.1. Синтез амино-HES50/0,7 из окисленного HES.Oxo-HES50/0,7 (6,09 г, MW=56,7 кДа, DS=0,76, Supramol Parenteral Colloids GmbH, RosbachRodheim, D) нагревали в течение 16,5 ч при 80 С в вакууме, растворяли в атмосфере аргона в безводном диметилсульфоксиде (32 мл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D) и добавляли 1,4 диаминобутан (1,2 мл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После перемешивания при 40C в течение 17 ч реакционную смесь добавляли к охлажденной на льду смеси 1:1 ацетона и этанола(150 мл, об./об.). Преципитировавший продукт собирали центрифугированием при 4 С, отмывали охлажденной на льду смесью 1:1 ацетона и этанола (40 мл, об./об.) и собирали центрифугированием. Неочищенный продукт растворяли в воде (80 мл), диализовали против воды Milli-Q в течение 42 ч (змеевидная диализная трубка, 3,5 кДа MWCO, Perbio Sciences Deutschland GmbH, Bonn, D) и лиофилизировали. Выход выделенного продукта составил 82%. 3.2. Синтез альдегидо-HES50/0,7 из амино-HES. 4-Формилбензойную кислоту (124 мг, Lancaster Synthesis, Frankfurt/Main, D) и 1-гидрокси-1 Нбензотриазол (174 мг, Aldrich, Sigma-Aldrich Chemie GmbH, Taufkirchen, D) растворяли в N,Nдиметилформамиде (DMF, 38 мл, Peptide synthesis grade, Biosolve, Valkenswaard, NL) и добавляли N,N'диизопропилкарбодиимид (155 мкл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После инкубации при комнатной температуре в течение 30 мин добавляли амино-HES50/0,7 (3,80 г, MW=56,7 кДа,DS=0,76). После перемешивания при комнатной температуре в течение ночи реакционную смесь добавляли к 2-пропанолу (160 мл, Carl Roth GmbH + Co. KG, Karlsruhe, D) и инкубировали в течение 1 ч при-20 С. Преципитировавший продукт собирали центрифугированием при 4 С, растворяли в DMF (20 мл),преципитировали 2-пропанолом, как описано ранее, и собирали центрифугированием. Неочищенный- 24013910 продукт растворяли в воде, диализовали против воды Milli-Q в течение 24 ч (змеевидная диализная трубка, 3,5 кДа MWCO, Perbio Sciences Deutschland GmbH, Bonn, D) и лиофилизировали. Продукт растворяли в воде (20 мл), преципитировали охлажденной на льду смесью 1:1 ацетона и этанола (150 мл, об./об.),инкубировали в течение 1 ч при -20 С и собирали центрифугированием. Неочищенный продукт растворяли в воде (29 мл), диализовали против воды Milli-Q в течение 24 ч (змеевидная диализная трубка, 10 кДа MWCO, Perbio Sciences Deutschland GmbH, Bonn, D) и лиофилизировали. Выход выделенного продукта составил 77%. 4. Образование тиазолидина из H-Cys(H)-HES10/0,4 и окисленного ЕРО. 4.1. Снятие защитной группы с H-Cys(StBu)-HES10/0,4.H-Cys(StBu)-HES10/0,4 (10 мг), полученный в примере 1, растворяли в натрий-ацетатном буфере (1 мл, 0,1 М, рН 4,6, 10 мМ ЭДТА) и добавляли трис-(2-карбоксиэтил)фосфингидрохлорид (2,8 мг, ТСЕР,Acros Organics, Geel, В). Реакционную смесь инкубировали в течение 30 мин при комнатной температуре и удаляли избыток ТСЕР диафильтрацией. Реакционную смесь разбавляли буфером (натрий-фосфатным буфером, 0,1 М, рН 8,0, 1 мМ ЭДТА) до 0,5 мл и центрифугировали при 20 С в течение 10 мин при 13000g в концентраторе Vivaspin 500(Viva Science, 5 кДа MWCO, Hannover, Germany). Процедуру отмывки повторяли три раза разбавлением остаточного раствора буфером до 0,5 мл и центрифугированием в течение 35 мин, как описано. РастворыH-Cys(H)-HES10/0,4 разбавляли тем же реакционным буфером до 150 мкл, получая конечную рассчитанную концентрацию 66,6 мкг/мл. 4.2. Конъюгирование с окисленным ЕРО. Для получения окисленного ЕРО к 20 мл 2,0 мг/мл раствора ЕРО (полученный по рекомбинантным технологиям ЕРО, имеющий аминокислотную последовательность ЕРО человека и похожие или по существу аналогичные коммерчески доступному эритропоэтину альфа характеристики: Erypo, ORTHOBIOTECH, Jansen-Cilag или эритропоэтину бета: NeoRecormon, Roche; cf. ЕР 0148605, ЕР 0205564, ЕР 0411678), хранящегося при 0 С, добавляли 2,2 мл охлажденного на льду 10 мМ раствора натрия метаперйодата до конечной концентрации 1 мМ натрия метаперйодата. Смесь инкубировали при 0 С в течение 1 ч в ледяной бане в темноте, останавливали реакцию добавлением 40 мкл глицерина и инкубировали в течение дополнительных 5 мин. Заменяли буфер смеси на натрий-ацетатный буфер, рН 5,5. К полученному окисленному ЕРО (14,9 мкл, 1,34 мг/мл, натрий-ацетатный буфер, рН 5,5) добавляли раствор H-Cys(H)-HES10/0,4 (5 мкл), полученный в 4.1. После инкубации в течение 21 ч при комнатной температуре анализировали реакционную смесь с помощью SDS гель-электрофореза. Для проведения SDS гель-электрофореза использовали камеру XCell Sure Lock Mini Cell (Invitrogen GmbH, Karlsruhe,D) и источник питания Consort E143 (GONSORTnv, Turnhout, В). Согласно инструкции производителя использовали 10% бис/трис гель с буфером для проведения электрофореза MOPS в восстанавливающих условиях (оба произведены Invitrogen GmbH, Karlsruhe, D). 5. Образование тиазолидина из H-Cys(H)-пептид-NH2 и альдегидо-HES. Раствор пептида, имеющего на своем N-конце свободный остаток цистеина (2 мкл, 15 мкг,3147 г/моль, 7,5 мг/мл в DMF, H-CLPSLEGNMQQPSEFHCMMNWSSHIAAC-NH2, полученный стандартным твердофазным синтезом Fmoc и очищенный с помощью HPLC) добавляли к 20 мкл раствора альдегидо-HES (см. табл. 1) в реакционном буфере (см. табл. 1, дегазированном в течение 15 мин в ультразвуковой бане), и инкубировали смесь в течение ночи при комнатной температуре. Для анализа посредством SDS гель-электрофореза использовали камеру XCell Sure Lock Mini Cell (Invitrogen GmbH,Karlsruhe, D) и источник питания Consort E143 (CONSORTnv, Turnhout, В). Согласно инструкции производителя использовали 12% бис/трис гель с буфером для проведения электрофореза MES в восстанавливающих условиях (оба произведены Invitrogen GmbH, Karlsruhe, D). Таблица 1 Условия проведения реакции 6. Результаты. Результаты экспериментов можно увидеть на фигурах.- 25013910 Как можно увидеть из вышеприведенных примеров, были осуществлены две различных стратегии. В одном случае (см. 4) карбонильную группу вводили в гликан ЕРО путем перйодатного окисления и конъюгировали с альфа-SH-бета аминогруппой, содержащей HES. Это HES10/0,4 производное синтезировали в два этапа из HES, окисленного на восстанавливающем конце. Окисленный HES с помощью известной процедуры превращали в амино-HES (см. 1.1) с последующим ацилированием защищенным цистеином (Fmoc-Cys(StBu)-ОН) (см. 1.2) и снятием защитной группы (см. 1.3). По другому пути (см. 5) использовали альдегидо-HES10/0,7, альдегидо-HES50/0,7 (см. 2.2 и 3.2), синтезированные ацилированием известного амино-HES (см. 2.1 и 3.1) формилбензойной кислотой, и пептид, содержащий незащищенный цистеин на своем N-конце. Фактически полное превращение получено обеими стратегиями (см. фиг. 1 и 2). Конъюгирование альдегидо-HES с Cys-пептидом одинаково хорошо проходило при значениях рН 4,6 и 8,0 (см. фиг. 2, линию А и D или линию В и Е). В этих условиях проведения реакции пептид сHES10/0,7 или HES50/0,7 не взаимодействовал. При изменении условий проведения реакции можно было бы ожидать успеха. Способ по этому изобретению имеет преимущество для белков, измененные N-концевыми цистеиновыми остатками варианты которых получают путем экспрессии, тогда как другие модификации белков, которые также должны были бы давать возможность хемоселективного конъюгирования, не возможны по этому пути. К тому же предполагается, что допускается избирательное взаимодействие с гидроксиалкильным крахмалом, в частности с гидроксиэтилкрахмалом, через N-концевой остаток белка. Дополнительным преимуществом способа по изобретению является хемоселективность взаимодействия альдегидной, кето или полуацетальной группы с альфа-SH-бета-аминогруппой. Поэтому не должно быть взаимодействия с функциональными группами боковых цепей, например, белка или пептида. 7. Синтез H-Cys(H)-HES50/0,7. 7.1. Синтез амино-HES50/0,7 из окисленного HES.Oxo-HES50/0,7 (10,1 г, MW=44,2 кДа, DS=0,7, Lot 502, Supramol Parenteral Colloids GmbH, RosbachRodheim, D) нагревали в течение 72 ч при 80 С в вакууме, растворяли в атмосфере аргона в безводном диметилсульфоксиде (52 мл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D) и добавляли 1,4 диаминобутан (2,3 мл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После перемешивания при 45 С в течение 19,5 ч реакционную смесь по каплям добавляли к смеси 1:1 (400 мл, об./об.) ацетона (CarlRoth GmbH + Co. KG, Karlsruhe, D) и этанола (DAB, Sonnenberg, Braunschweig, D). Преципитировавший продукт собирали центрифугированием. Неочищенный продукт растворяли в воде (100 мл, Milli-Q), диализовали в течение 24 ч против 20 мМ уксусной кислоты и в течение 3,5 ч против воды (змеевидная диализная трубка, 10 кДа MWCO, Perbio Sciences Deutschland GmbH, Bonn, D). Выход выделенного продукта после лиофилизации составил 84%. 7.2. Синтез Fmoc-Cys(StBu)-HES50/0,7 из амино-HES50/0,7.Peptide synthesis grade, Biosolve, Valkenswaard, NL) и добавляли N,N'-диизопропилкарбодиимид (138 мкл,Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После инкубации при 21 С в течение 30 мин добавляли амино-HES50/0,7 (3,00 г), полученный как описано в 7.1. После перемешивания при комнатной температуре в течение ночи реакционную смесь добавляли к смеси 1:1 (230 мл, об./об.) ацетона (CarlRoth GmbH + Co. KG, Karlsruhe, D) и этанола (DAB, Sonnenberg, Braunschweig, D). Преципитировавший продукт собирали центрифугированием, растворяли в DMF (30 мл) и снова преципитировали, как описано выше. После центрифугирования неочищенный продукт растворяли в воде (30 мл, Milli-Q), диализовали против воды Milli-Q в течение 28 ч (змеевидная диализная трубка, 10 кДа MWCO, Perbio SciencesDeutschland GmbH, Bonn, D) и лиофилизировали. Выход выделенного продукта составил 98%. 7.3. Синтез H-Cys(StBu)-HES50/0,7 из Fmoc-Cys(StBu)-HES50/0,7.Fmoc-Cys(StBu)-HES50/0,7 (2,62 г), полученный как описано в 7.2, растворяли в DMF (20 мл) и добавляли пиперидин (5 мл, Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D). После перемешивания при комнатной температуре в течение 15 мин реакционную смесь добавляли к смеси 1:1 ацетона и этанола(190 мл, об./об.). Преципитировавший продукт собирали центрифугированием, растворяли в DMF(25 мл) и снова преципитировали, как описано выше. После центрифугирования неочищенный продукт растворяли в воде (25 мл, Milli-Q), диализовали против воды Milli-Q в течение 45 ч (змеевидная диализная трубка, 10 кДа MWCO, Perbio Sciences Deutschland GmbH, Bonn, D) и лиофилизировали. Выход выделенного продукта составил 83%. 7.4. Синтез H-Cys(H)-HES50/0,7 из H-Cys(StBu)-HES50/0,7.H-Cys(StBu)-HES50/0,7 (0,50 г), полученный как описано в 7.3, растворяли в 50 мМ растворе трис(2-карбоксиэтил)фосфингидрохлорида (5 мл, ТСЕР, Acros Organics, Geel, В в 0,1 М натрий-ацетатном буфере рН 5,0). После перемешивания при комнатной температуре в течение 1 ч реакционную смесь диализовали (змеевидная диализная трубка, 10 кДа MWCO, Perbio Sciences Deutschland GmbH, Bonn, D) в течение 22 ч против 5 мМ водного ЭДТА (Fluka, Sigma-Aldrich Chemie GmbH, Taufkirchen, D в водеMilli-Q) и 1 ч против воды (Milli-Q) и лиофилизировали. Выход выделенного продукта составил 97%. 8. Конъюгирование с ДНК.GAGGCAGCATTGAATTCGCAGGGTGAGTA) гибридизовали в молярном соотношении 1:1, основываясь на концентрациях, данных производителем. Растворы смешивали и инкубировали при 95 С в течение 5 мин, получая конечную концентрацию двойной цепи ДНК 0,356 мг/мл. 157 мкл (55,9 мкг) лиофилизировали в течение ночи и растворяли в воде (27,9, Milli-Q), получая рассчитанную конечную концентрацию 2 мг/мл. Концентрации являются рассчитанными и экспериментально не проверялись. 8.2. Гибридизация 5'-амино-С 6-модифицированной ДНК. 5'-Амино-С 6-модифицированную ДНК (59,1 нмоль, biomers.net GmbH, Ulm, D, lot 000334261 ДНК,М = 9218 г/моль, 59,1 нмоль, последовательность: TACTCACCCTGCGAATTCAACTGCTGCCTC) растворяли в воде (100 мкл; Milli-Q). Гибридизовали ее (38,78 мкл, 595 мкМ) с немодифицированной комплементарной цепью (600 мкл, atdbio, Southampton, UK, lot A0794, М=9376 г/моль, с=38,2 мкМ в воде,последовательность: GAGGCAGCATTGAATTCGCAGGGTGAGTA) в молярном соотношении 1:1 на основании данных производителем концентраций. Растворы смешивали и инкубировали при 95 С в течение 5 мин, получая конечную рассчитанную концентрацию двойной цепи ДНК 0,667 мг/мл. Концентрации рассчитывались и экспериментально не проверялись. 8.3. Образование FBA-модифицированной ДНК из 5'-амино-С 6-модифицированной ДНК. К двухцепочечной 5'-амино-С 6-модифицированной ДНК (500 мкл, 0,667 мг/мл в воде), полученной как описано в 8.2, добавляли сукцинимидил-4-формилбензоат (50 мкл, 4 мг/мл в DMF, Novabiochem,Merck KGaA, Darmstadt, D) и инкубировали прозрачный раствор в течение 5 ч при 21 С. Реакционную смесь центрифугировали при 21 С в течение 15 мин при 13000g в концентраторе Vivaspin 500 (VivaScience, 5 кДа MWCO, Hannover, Germany). Повторяли процедуру отмывки три раза путем разведения остаточного раствора водой (Milli-Q) до 0,5 мл и центрифугирования в течение 12 мин, как описано. Раствор ДНК разбавляли водой до 167 мкл, получая конечную рассчитанную концентрацию 2 мг/мл. Концентрации рассчитывались и экспериментально не проверялись. 8.4. Образование тиазолидина из H-Cys(H)-HES50/0,7 и формилиндол-модифицированной ДНК. К водному раствору формилиндол-модифицированной ДНК (1,4 мкл, 2 мг/мл), полученной как описано в 8.1, добавляли раствор производного HES50/0,7 (4 мкл, 147,5 мг/мл, см. табл. 1) в реакционном буфере (см. табл. 2 далее в настоящем документе). После инкубирования в течение 14 ч при 21 С реакционную смесь анализировали с помощью электрофореза в агарозном геле. Были использованы AgagelStandard system и источник питания Minicell Power Pack P20 (оба произведены Biometra GmbH, Gttingen,D). Для проведения электрофореза использовали 2% агарозу NEEO Ultra-Qualitt (Carl Roth GmbH + Co.KG, Karlsruhe, D) и буфер 0,5 ТВЕ. Для регистрации результатов использовали систему гельдокументации Gel Doc 2000 вместе с программным обеспечением Quality One V4.0.3 (BIO-RAD Laboratories, Mnchen, D). Результаты экспериментов можно увидеть на фиг. 2. Таблица 2 Условия проведения реакции 8.5. Образование тиазолидина из H-Cys(H)-HES50/0,7 и FBA-модифицированной ДНК. К водному раствору FBA-модифицированной ДНК (1,5 мкл, 2 мг/мл), полученной, как описано в 8.3, добавляли раствор производного HES50/0,7 (4 мкл, 147,5 мг/мл, см. табл. 3 в настоящем документе ниже) в реакционном буфере (см. табл. 3 в настоящем документе ниже). После инкубирования в течение 144 при 21 С реакционную смесь анализировали электрофорезом в агарозном геле, как описано в 8.4. Результаты экспериментов можно увидеть на фиг. 3. 9. Конъюгирование с небольшими органическими молекулами (в настоящем документе подразумеваются антибиотики (даунорубицин) и цитостатики (тилозин. Конъюгирование с небольшими органическими молекулами посредством образования тиазолидина.H-Cys(H)-HES50/0,7 (11,0 мг), полученный как описано в 7.4, растворяли в растворе небольших органических молекул (44 мкл, имеющем концентрацию [А] мг/мл, 13,4 экв., см. табл. 4 в настоящем документе ниже) в DMF (см. табл. 4 ниже), инкубировали при 21 С в течение ночи и анализировали 40 мкл реакционной смеси посредством HPLC. Результаты экспериментов можно увидеть на фиг. 4-9. В качестве небольших органических молекул использовали даунорубицин (Fluka, Sigma-Aldrich,Taufkirchen, D) и тартрат тилозина (оба препарата производства BioChemika grade, Fluka, Sigma-Aldrich,Taufkirchen, D). Для HPLC анализа использовали колонку ReproSil-PUR Basic C18 1504,6 мм i.d. (OrderR15.B9.S1546, Dr. Maisch GmbH, Ammerbuch, D) и систему для хроматографии Akta Basic (насос P900 Серия 01118816, UV-детектор UV900 Серия 01120613, определитель рН/электропроводности рН/С 900 Серия 01120665, коллектор фракций Frac900 Серия 01120011 и программное обеспечение Unicorn 5.0 Серия 01119821, все Amersham Biosciences, Freiburg, D). Для всех анализов применялся следующий способ. Буфер А: вода с 0,1 TFA (Rotisolv LC-MS Garde, Carl Roth GmbH + Co. KG, Karlsruhe, D). Буфер В: смесь 15% воды с 0,1 TFA и 85% ацетонитрила с 0,1% TFA (оба Rotisolv LC-MS grade,Carl Roth GmbH + Co. KG, Karlsruhe, D). Градиент: 0% буфер В в 2 объемах колонки (CV); линейный градиент 0-50% буфер В в 15 CV, линейный градиент 50-100% буфер В в 7 CV, 100% буфер В для 7 CV, 0% буфер В для 5 CV. 10. Образование тиазолидина из H-Cys-пептида и нашивного HES. Раствор пептида, имеющий на своем N-конце свободный цистеиновый остаток (1 мкл, 20 мкг,2528 г/моль, 20 мг/мл в DMF, последовательность H-Cys-Asn-Thr-Arg-Lys-Arg-Ile-Arg-Ile-Gln-Arg-GlyPro-Gly-Arg-Ala-Phe-Val-Thr-Ile-Gly-Lys-OH, SC623, NeoMPS S.A., Strasbourg, F), добавляли к 9 мкл раствора HES10/0,7 (408 мг/мл в [Реакционном буфере] (см. табл. 5 ниже), MW=9,2 кДа, DS=0,7, Lot 437,Supramol Parenteral Colloids GmbH, Rosbach-Rodheim, D), к избранным реакциям (см. табл. 5 ниже) добавляли раствор тритона-Х 100 (1 мкл, 10% в воде) и инкубировали смеси в течение ночи при [В]С (см. табл. 5 ниже). Для анализа путем SDS гель-электрофореза использовали камеру XCell Sure Lock Mini Cell(Invitrogen GmbH, Karlsruhe, D) и источник питания Consort E143 (CONSORTnv, Turnhout, В). Согласно инструкции производителя использовали 12% бис/трис-гель с буфером для проведения электрофорезаMOPS в восстанавливающих условиях (оба произведены Invitrogen GmbH, Karlsruhe, D). Результаты эксперимента можно увидеть на фиг. 10. без HES. 11. Результаты экспериментов по вышерассмотренным пп.8-10. 11.1. Конъюгирование с ДНК путем образования тиазолидина (вышерассмотренный п.8). Конъюгирование с ДНК путем образования тиазолидина получали с двумя различными альдегидмодифицированными ДНК (см. п.8 в настоящем документе выше). Необходимые ДНК-альдегиды были либо коммерчески доступными в случае формилиндол-модифицированной ДНК (см. п.8.1 выше), либо их получали из коммерчески доступных 5'-амино-ДНК и сукцинимидил-4-формилбензоата (см. п.8.3 выше). Альфа-SH-бета-аминогруппу, содержащую HES (H-Cys(H)-HES50/0,7), получали из H-Cys(StBu)HES50/0,7 путем восстановления ТСЕР и очищали преципитацией и диализом (см. п.7.4 выше). НCys(StBu)-HES50/0,7 получали по аналогии с H-Cys(StBu)-HES10/0,4 (см. п.4.1 в настоящем документе выше). Результаты конъюгирования с обеими альдегид-модифицированными ДНК показаны на фиг. 3. О том, что конъюгирование произошло, говорило появление новой полосы с большей молекулярной массой. Увеличенная ширина полосы была обусловлена распределением молекулярной массы HES-части конъюгата. Конъюгирование было получено при значениях рН 4,6 (линия А) или 8,0 (линия С). Отсутствие конъюгирования было обнаружено с OxoHES50/0,7, исходным материалом для получения H-Cys(H)HES50/0,7 (Линия В и D). 11.2. Конъюгирование с небольшими органическими молекулами (рассмотренный выше п.9). Конъюгирование с небольшими органическими соединениями путем образования тиазолидина было получено для цитостатического лекарственного препарата даунорубицин (см. фиг. 4 в настоящем документе ниже) и для антибиотика (тилозин, см. фиг. 7 ниже). Альфа-SH-бета-аминогруппа, содержащаяHES исходный материал (в той же концентрации, что и в реакции конъюгации) появлялась в виде широкой полосы примерно через 10 мин (см. фиг. 6, 9 ниже). Увеличенная ширина пика была обусловлена распределением молекулярной массы HES. На фиг. 5 и 8 показаны HPLC анализы небольших органических соединений (в той же концентрации, что и в реакции конъюгации). О том, что конъюгирование произошло, говорит появление нового широкого пика через интервал времени между появлением HES исходного материала и небольшого органического соединения (фиг. 4 и 7). С другой стороны, образование широкого пика отображало распределение молекулярной массы HES-части конъюгата. 11.3. Конъюгирование с использованием нативного HES (вышерассмотренный п.10). Конъюгирование с нативным HES путем образования тиазолидина было получено для пептида,имеющего на своем N-конце свободный цистеиновый остаток (см. п.10 в настоящем документе выше), вDMF в качестве растворителя в температурном диапазоне между 21 и 50 С (фиг. 10 линии А, В и Е) или в водном буфере при значении рН 4,6 при 50 С (фиг. 10 линия D). Конъюгирование также было обнаружено в присутствии детергента тритона Х-100 при 50 С (фиг. 10, линии F и G). О том, что конъюгирование произошло, говорило появление новой полосы с большей молекулярной массой. Увеличенная ширина полосы была обусловлена распределением молекулярной массы HES-части конъюгата. Таким образом, надо было показать, что конъюгирование нативного HES с Cys-пептидом обычно происходит даже в различных других условиях, что отмечено в вышерассмотренном п.6 настоящего документа.
МПК / Метки
МПК: A61K 47/48, C08B 31/00
Метки: лигированием, действующего, конъюгаты, гидроксиалкилкрахмала, полученные, тиазолидин-2, химическим, вещества
Код ссылки
<a href="https://eas.patents.su/30-13910-konyugaty-gidroksialkilkrahmala-i-dejjstvuyushhego-veshhestva-poluchennye-himicheskim-ligirovaniem-cherez-tiazolidin.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты гидроксиалкилкрахмала и действующего вещества, полученные химическим лигированием через тиазолидин</a>
Предыдущий патент: Пиридиновые производные и их применение для лечения психотических расстройств
Следующий патент: Конструкции-”шпильки” р15 и применение
Случайный патент: Новый неводный раствор диклофенака для местного применения и способ его получения












