Конъюгаты гидроксиалкилкрахмала и белка, полученные восстановительным аминированием
Номер патента: 10501
Опубликовано: 30.10.2008
Авторы: Цандер Норберт, Лангер Клаус, Конрадт Харальд, Орландо Микеле, Хаккет Франк, Франк Рональд, Айхнер Вольфрам
Формула / Реферат
1. Способ получения конъюгата, включающего белок и полимер, где полимер представляет собой гидроксиалкил крахмал, указанный способ включает
(а) (2) взаимодействие полимера по его необязательно окисленному восстановительному концу, по меньшей мере, с бифункциональным соединением, где указанное соединение включает две функциональные группы М и Q, одна функциональная группа М взаимодействует с полимером и одна функциональная группа Q представляет собой (i) альдегидную группу, или кетогруппу, или группу полуацеталя; или (ii) представляет собой функциональную группу, химически модифицированную для получения производного полимера, функционализированного альдегидными или кето- или полуацетальными функциями; и
(b) ковалентное связывание по меньшей мере одной альдегидной группы или кетогруппы, или группы полуацеталя полимера или его производного по меньшей мере с одной аминогруппой белка путем восстановительного аминирования.
2. Способ по п.1, где гидроксиалкилкрахмал представляет собой гидроксиэтилкрахмал.
3. Способ по п.2, где гидроксиэтилкрахмал имеет молекулярную массу от 2 до 200 кДа, предпочтительно от 4 до 130 кДа, более предпочтительно от 4 до 70 кДа.
4. Способ по любому из пп.1-3, где восстановительное аминирование проводят в водной среде.
5. Способ по любому из пп.1-4, где восстановительное аминирование проводят в присутствии NaCNBH3.
6. Способ по любому из пп.1-5, где восстановительное аминирование проводят при рН 7,5, предпочтительно 7 или менее.
7. Способ по п. 6, где рН равен 6 или менее.
8. Способ по любому из пп.1-7, где восстановительное аминирование проводят при температуре от 0 до 25шС.
9. Способ по любому из пп.1-8, где в (а)(2) (i) функциональная группа М представляет собой карбоксильную группу или реакционноспособную карбоксильную группу, функциональная группа Q представляет собой альдегидную группу или кетогруппу, или группу полуацеталя.
10. Способ по п.9, где бифункциональное соединение, включающее М и Q, выбирают из группы, состоящей из формилбензойной кислоты, пентафторфенилового сложного эфира 4-формилбензойной кислоты, N-гидроксисукцинимидного сложного эфира 4-формилбензойной кислоты и 4-(4-формил-3,5-диметоксифенокси)бутановой кислоты.
11. Способ по любому из пп.1-8, где в (а)(2) (ii) функциональная группа М представляет собой аминогруппу и функциональная группа Q представляет собой аминогруппу.
12. Способ по п.11, где соединение, включающее две аминогруппы М и Q, представляет собой необязательно замещенный диаминоалкан, имеющий от 2 до 20 атомов углерода.
13. Способ по п.12, где диаминоалкан выбирают из группы, состоящей из 1,2-диаминоэтана, 1,3-диаминопропана и 1,4-диаминобутана.
14. Способ по любому из пп.11-13, дополнительно включающий взаимодействие производного полимера, полученного реакцией полимера по меньшей мере с одним бифункциональным соединением, включающим две аминогруппы М и Q, по аминогруппе Q с дополнительным бифункциональным соединением, включающим карбоксильную группу или реакционноспособную карбоксильную группу и альдегидную группу или кетогруппу или группу полуацеталя с образованием производного полимера, содержащего альдегидную группу или кетогруппу или группу полуацеталя.
15. Способ по п.14, где дополнительное бифункциональное соединение выбирают из группы, состоящей из формилбензойной кислоты, пентафторфенилового сложного эфира 4-формилбензойной кислоты, N-гидроксисукцинимидного сложного эфира 4-формилбензойной кислоты и 4-(4-формил-3,5-диметоксифенокси)бутановой кислоты.
16. Способ по п.11, где аминогруппа Q соединения, включающего две аминогруппы М и Q, представляет собой бета-гидроксиаминогруппу.
17. Способ по п.16, где бета-гидроксиаминогруппу окисляют с получением альдегидной группы.
18. Способ по п.16 или 17, где соединение, включающее две аминогруппы М и Q, где Q представляет собой бета-гидроксиаминогруппу, представляет собой 1,3-диамино-2-гидроксипропан.
19. Способ по п.17 или 18, где реакцию окисления проводят с использованием периодата.
20. Способ по любому из пп.1-19, где белок выбирают из группы, состоящей из ЕРО, G-CSF, IFN альфа, IFN бета, AT III, IL-2, IL-3, миоглобина, SOD и BSA, предпочтительно из группы, состоящей из rhEPO, rhG-CSF, rhIFN альфа, rhIFN бета, rhAT III, rhIL-2, rhIL-3, миоглобина, SOD и BSA, или из группы, состоящей из А1АТ, фактора VII, фактора VIII, фактора IX, tPA и АРС.
21. Конъюгат, включающий белок и полимер, полученный способом, как определено в любом из пп.1-20.
22. Конъюгат по п.21, где полимер или его производное главным образом связан с N-концевой аминогруппой белка посредством азометиновой или аминовой связи, при этом белок, использованный для взаимодействия, включает N-концевую аминогруппу и по меньшей мере одну дополнительную аминогруппу, предпочтительно дополнительную группу лизина.
23. Конъюгат по п.21 или 22, где белок является ковалентно связанным с производным полимера посредством азометиновой и/или аминовой связи, указанное производное получено реакцией полимера с соединением, включающим две аминогруппы М и Q, по функциональной группе М, полученное соединение было дополнительно подвергнуто взаимодействию по Q с дополнительным бифункциональным соединением, включающим карбоксильную группу или реакционноспособную карбоксильную группу и альдегидную группу или кетогруппу, или группу полуацеталя, указанная карбоксильная группа или реакционоспособная карбоксильная группа образует амидную связь с аминогруппой Q, и указанная альдегидная группа или кетогруппа, или группа полуацеталя взаимодействует с аминогруппой белка при восстановительном аминировании.
24. Конъюгат по п.23, где дополнительное бифункциональное соединение, содержащее карбоксильную группу или реакционноспособную карбоксильную группу и альдегидную группу или кетогруппу, или группу полуацеталя выбирают из группы, состоящей из формилбензойной кислоты, пентафторфенилового сложного эфира 4-формилбензойной кислоты, N-гидроксисукцинимидного сложного эфира 4-формилбензойной кислоты и 4-(4-формил-3,5-диметоксифенокси)бутановой кислоты.
25. Конъюгат по п.24, имеющий структуру
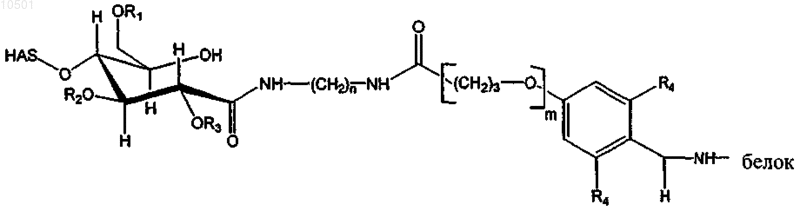
в случае, когда полимер подвергали взаимодействию по его окисленному восстановительному концу, R1, R2 и R3 независимо представляют собой водород или гидроксиалкильную группу, и n = 2, 3 или 4, R4 независимо представляет собой водород или метоксигруппу, и m = 0 в случае, когда R4 представляет собой водород, и m = 1 в случае, когда R4 представляет собой метокси.
26. Конъюгат по п.21 или 22, где белок является ковалентно связанным с производным полимера посредством азометиновой и/или аминовой связи, указанное производное получено реакцией полимера с соединением, включающим две аминогруппы М и Q, где Q представляет собой бета-гидроксиаминогруппу и окислением бета-гидроксиаминогруппы Q с образованием альдегидной группы.
27. Конъюгат по п.26, где соединение, включающее две аминогруппы М и Q, где Q представляет собой бета-гидроксиаминогруппу, представляет собой 1,3-диамино-2-гидроксипропан.
28. Конъюгат по п.27, имеющий структуру
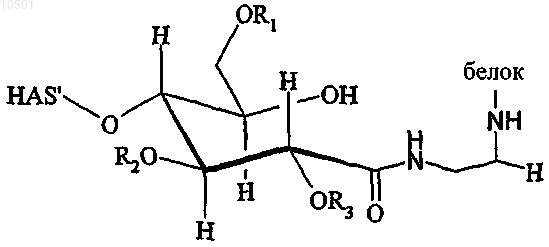
в случае, когда полимер подвергали взаимодействию по его окисленному восстановительному концу, R1, R2 и R3 независимо представляют собой водород или гидроксиалкильную группу.
29. Конъюгат по любому из пп.21-28, где белок выбирают из группы, состоящей из ЕРО, G-CSF, IFN альфа, IFN бета, AT III, IL-2, IL-3, миоглобина, SOD и BSA.
30. Конъюгат по любому из пп.21-28, где белок выбирают из группы, состоящей из rhEPO, rhG-CSF, rhIFN альфа, rhIFN бета, rhAT III, rhIL-2, rhIL-3, миоглобина, SOD и BSA.
31. Конъюгат по любому из пп.21-28, где белок выбирают из группы, состоящей из А1АТ, фактора VII, фактора VIII; фактора IX, tPA и АРС.
32. Применение конъюгата по любому из пп.21-31 или конъюгата, получаемюую способом по любому из пп.1-20, для лечения человека или животного.
33. Фармацевтическая композиция, включающая терапевтически эффективное количество конъюгата по любому из пп.21-31, или конъюгата, получаемого способом по любому из пп.1-20.
34. Фармацевтическая композиция по п.33, дополнительно включающая по меньшей мере один фармацевтически приемлемый разбавитель, адъювант или носитель.
35. Применение конъюгата по любому из пп.21-31 или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой ЕРО, и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения анемических нарушений, или гематопоэтической дисфункции, или связанных с этим заболеваний.
36. Применение конъюгата по любому из пп.21-31 или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой G-CSF и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения нарушения, характеризуемого пониженной гематопоэтической или иммунной функцией, указанное нарушение предпочтительно возникает в результате химиотерапии, лучевой терапии, инфекционного заболевания, тяжелой хронической нейтропении или лейкоза.
37. Применение конъюгата по любому из пп.21-31 или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой AT III и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения наследственного дефекта, венозного тромбоза, ожогов и устройчивости к гепарину при аорто-коронарном шунтировании (CABG), для профилактики образования микросгустков, связанных с вентиляционной терапией, лечения перфорации кишечника в результате травмы и желудочно-кишечной хирургии, рассеянного внутрисосудистого свертывания крови (DIC) и/или сепсиса.
38. Применение конъюгата по любому из пп.21-31 или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой Фактор VIII, и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения гемофилии А.
39. Применение конъюгата по любому из пп.21-31 или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой А1АТ, и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения эмфиземы, цистозного фиброза, атопического дерматита, хронического обструктивного заболевания легких (ХОЗЛ) и/или бронхита.
40. Применение конъюгата по любому из пп.21-31, или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой tPA и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения инфарктов миокарда (сердечных приступов), тромбоза, тромбоэмболии или окклюзионных заболеваний, особенно окклюзионных артериальных заболеваний.
41. Применение конъюгата по любому из пп.21-31 или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой АРС и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения тяжелого сепсиса, тромбоза, тромбоэмболии или окклюзионных заболеваний, особенно окклюзионных артериальных заболеваний.
42. Применение конъюгата по любому из пп.21-31 или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой IFN альфа и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения лейкоза, например лейкоза волосковых клеток, хронического миелогенного лейкоза, множественной миеломы, фоликулярной лимфомы, рака, например карциноидной опухоли, злокачественной меланомы и гепатита, например хронического гепатита В и хронического гепатита С.
43. Применение конъюгата по любому из пп.21-31 или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой IFN бета, и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения рассеянного склероза, предпочтительно рецидивирующих форм рассеянного склероза.
44. Конъюгат, включающий гидроксиалкилкрахмал и белок, где гидроксиалкилкрахмал связан с использованием его окисленного восстановительного конца с первым связывающим соединением посредством амидной связи, указанное связывающее соединение дополнительно связано амидной связью со вторым связывающим соединением, указанное второе связывающее соединение связано азометиновой и/или аминной связью с белком, где первое связывающее соединение предпочтительно используется в качестве диамино-функционализированного соединения, а второе связывающее соединение предпочтительно используется в качестве карбокси- и альдегидо- или кето-, или полуацеталь-, более предпочтительно в качестве карбокси- и альдегидофункционализированного соединения
45. Конъюгат, включающий белок и полимер или его производное, где полимер представляет собой гидроксиалкилкрахмал (HAS), имеющий структуру, соответствующую формуле:
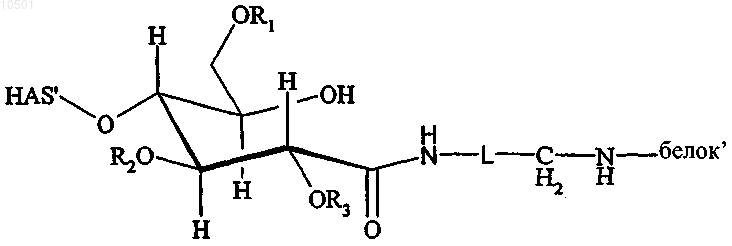
где R1, R2 и R3 независимо представляют собой водород или гидроксиалкильную группу, гидроксиарильную группу, гидроксиаралкильную группу или гидроксиалкарильную группу, имеющую от 1, предпочтительно от 2 до 10 атомов углерода, предпочтительно водород или гидроксиалкильную группу, более предпочтительно водород или гидроксиэтильную группу, и
где L независимо представляет собой необязательно замещенный, линейный, разветвленный и/или циклический углеводородный остаток, необязательно включающий по меньшей мере один гетероатом, имеющий от 1 до 60, предпочтительно от 1 до 40, более предпочтительно от 1 до 20, более предпочтительно от 1 до 10, более предпочтительно от 1 до 6, более предпочтительно от 1 до 2 атомов углерода и особенно предпочтительно 1 атом углерода, в частности L представляет собой CH2.
46. Конъюгат, включающий белок и полимер или его производное, где полимер представляет собой гидроксиалкилкрахмал (HAS), имеющий структуру, соответствующую формуле
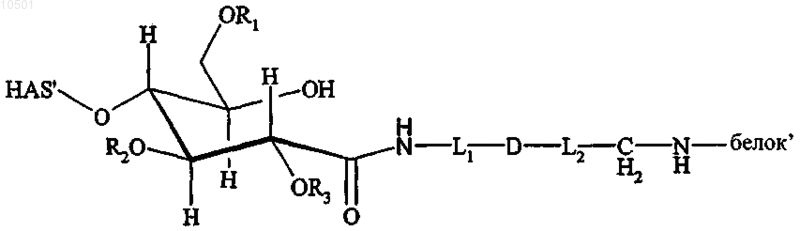
где R1, R2 и R3 независимо представляют собой водород или гидроксиалкильную группу, гидроксиарильную группу, гидроксиаралкильную группу, или гидроксиалкарильную группу, имеющую от 1, предпочтительно от 2 до 10 атомов углерода, предпочтительно водород или гидроксиалкильную группу, более предпочтительно водород или гидроксиэтильную группу, и где L1 и L2 независимо представляют собой необязательно замещенный, линейный, разветвленный и/или циклический углеводородный остаток, необязательно включающий по меньшей мере один гетероатом, включающий алкильный, арильный, аралкильный, гетероалкильный и/или гетероаралкильный фрагмент, при этом указанный остаток содержит от 1 до 60, предпочтительно от 1 до 40, более предпочтительно от 1 до 20, более предпочтительно от 1 до 10 атомов углерода, и где D представляет собой связь, предпочтительно ковалентную связь, которая образована подходящей функциональной группой F2, связанной с L1 и подходящей функциональной группой F3, связанной с L2.
47. Конъюгат по п.46, где L1 представляет собой -(CH2)n-, где n = 2, 3, 4, 5, 6, 7, 8, 9, 10, предпочтительно 2, 3, 4, 5, 6, более предпочтительно 2, 3, 4 и особенно предпочтительно 4.
48. Конъюгат по п.46 или 47, где L2 включает необзательно замещенный подходящим образом арильный фрагмент, предпочтительно арильный фрагмент, содержащий 6 атомов углерода, особенно предпочтительно L2 представляет собой C6H4.
49. Конъюгат по любому из пп.46-48, где F2 выбирают из группы, включающей
двойные С-С-связи или тройные С-С-связи, или ароматические С-С-связи;
тиогруппу или гидроксильные группы;
гидразид алкилсульфоновой кислоты; гидразид арилсульфоновой кислоты;
1,2-диолы;
1,2-аминотиоспирты;
азиды;
1,2-аминоспирты;
аминогруяяу -NH2 или производные аминогрупп, включающие структурное звено -NH-, такие как аминоалкильные группы, аминоарильная группа, аминоаралкильные группы или алкариламиногруппы;
гидроксиламиногруппу -O-NH2 или производные гидроксиаминогруппы, включающие структурное звено -O-NH-, такие как гидроксилалкиламиногруппы, гидроксилариламиногруппы, гидроксиларалкиламиногруппы или гидроксилалкариламиногруппы;
алкоксиаминогруппы, арилоксиаминогруппы,
аралкилоксиаминогруппы или алкарилоксиаминогруппы, каждая из которых включает структурное звено -NH-O-;
остатки, имеющие карбонильную группу, -Q-C(=G)-M, где G представляет собой О или S, и М представляет собой, например,
-ОН или -SH;
алкоксильную группу, арилоксигруппу, аралкилоксигруппу или алкарилоксигруппу;
алкилтиогруппу, арилтиогруппу, аралкилтиогруппу или алкарилтиогруппу;
алкилкарбонилоксигруппу, арилкарбонилоксигруппу, аралкилкарбонилоксигруппу, алкарилкарбонилоксигруппу;
активированные сложные эфиры, такие как сложные эфиры гидроксиламинов, имеющие имидную структуру, такую как N-гидроксисукцинимид, или имеющие структурное звено O-N, где N представляет собой часть гетероарильного соединения, или когда G = О и Q отсутствует, такие арилоксисоединения с замещенным арильным остатком как пентафторфенил, паранитрофенил или трихлорфенил;
где Q отсутствует или представляет собой NH или гетероатом, такой как S или О;
-NH-NH2 или -NH-NH-;
-NO2;
нитрильную группу;
карбонильные группы, такие как альдегидная группа или кетогруппа;
карбоксильную группу;
группу -N=C=O или группу -N=C=S;
винилгалогенидные группы, такие как винилиодидная или винилбромидная группа или трифлат;
-С=С-Н;
-(C-NH2Cl)-О-алкил;
группы -(С=O)-CH2-Hal, где Hal представляет собой Cl, Br или I;
-CH=CH-SO2-;
дисульфидную группу, включающую структуру -S-S-;
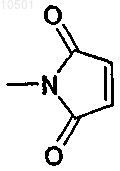 группу
группу
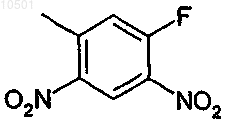 группу
группу
и где F3 представляет собой функциональную группу, способную образовывать химическую связь с F2 и предпочтительно выбран из вышеуказанной группы, F2 предпочтительно включает фрагмент -NH-, более предпочтительно включает аминогруппу, F3 предпочтительно включает фрагмент -(C=G)-, более предпочтительно -(С=O)-, более предпочтительно фрагмент -(C=G)-G-, еще более предпочтительно
-(C=O)-G- и особенно предпочтительно -(С=O)-O, D предпочтительно представляет собой амидную связь.
50. Конъюгат по п.49, имеющий структуру, соответствующую формуле
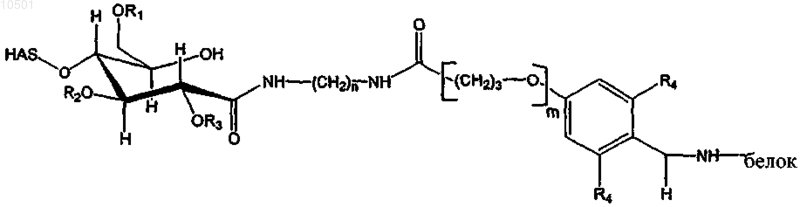
n = 2, 3 или 4, R4 независимо представляет собой водород или метоксильную группу, и m = 0, когда R4 представляет собой водород, и m = 1 в случае, когда R4 представляет собой метокси.
51. Конъюгат по п.50, где гидроксиалкилкрахмал представляет собой гидроксиэтилкрахмал.
52. Конъюгат по п.51, где гидроксиэтилкрахмал имеет молекулярную массу от 2 до 200 кДа, предпочтительно от 4 до 130 кДа, более предпочтительно от 4 до 70 кДа.
53. Конъюгат по любому из пп.44-52, где белок выбирают из группы, состоящей из ЕРО, G-CSF, IFN альфа, IFN бета, AT III, IL-2, IL-3, миоглобина, SOD и BSA, предпочтительно из группы, состоящей из rhEPO, rhG-CSF, rhIFN альфа, rhIFN бета, rhAT III, rhIL-2, rhIL-3, миоглобина, SOD и BSA, и/или из группы, состоящей из А1АТ, фактора VII, фактора VIII, фактора IX, tPA и АРС.
54. Применение конъюгата по любому из пп.21-31 или 44-52, или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой Фактор VII и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения случаев гемофилии А или В у пациентов, обладающих ингибиторами Фактора VIII или Фактора IX.
55. Применение конъюгата по любому из пп.21-31 или 44-52 или конъюгата, получаемого способом по любому из пп.1-20, где белок представляет собой Фактор IX и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для борьбы и профилактики геморрагических случаев у пациентов с гемофилией В, предпочтительно с врожденным дефицитом фактора IX или болезнью Кристмаса, включая контроль и профилактику кровотечения при хирургических вмешательствах.
56. Применение конъюгата по любому из пп.44-52 для лечения человека или животного.
57. Фармацевтическая композиция, включающая терапевтически эффективное количество конъюгата по любому из пп.44-52.
58. Фармацевтическая композиция по п.57, дополнительно включающая по меньшей мере один фармацевтически приемлемый разбавитель, адъювант или носитель.
59. Применение конъюгата по любому из пп.44-52, где белок представляет собой ЕРО и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения анемических нарушений или гематопоэтической дисфункции или связанных с этим заболеваний.
60. Применение конъюгата по любому из пп.44-52, где белок представляет собой G-CSF и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения нарушения, характеризуемого пониженной гематопоэтической или иммунной функцией, указанное нарушение предпочтительно возникает в результате химиотерапии, лучевой терапии, инфекционного заболевания, тяжелой хронической нейтропении или лейкоза.
61. Применение конъюгата по любому из пп.44-52, где белок представляет собой AT III и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения наследственного дефекта, венозного тромбоза, ожогов и устройчивости к гепарину при аорто-коронарном шунтировании (CABG), для профилактики образования микросгустков, связанных с вентиляционной терапией, лечения перфорации кишечника в результате травмы и желудочно-кишечной хирургии, рассеянного внутрисосудистого свертываниюя крови (DIC) и/или сепсиса.
62. Применение конъюгата по любому из пп.44-52, где белок представляет собой Фактор VIII и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения гемофилии А.
63. Применение конъюгата по любому из пп.44-52, где белок представляет собой А1АТ и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения эмфиземы, цистозного фиброза, атопического дерматита, хронического обструктивного заболевания легких (ХОЗЛ) и/или бронхита.
64. Применение конъюгата по любому из пп.44-52, где белок представляет собой tPA и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения инфарктов миокарда (сердечных приступов), тромбоза, тромбоэмболии или окклюзионных заболеваний, особенно окклюзионных артериальных заболеваний.
65. Применение конъюгата по любому из пп.44-52, где белок представляет собой АРС и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения тяжелого сепсиса, тромбоза, тромбоэмболии или окклюзионных заболеваний, особенно окклюзионных артериальных заболеваний.
66. Применение конъюгата по любому из пп.44-52, где белок представляет собой IFN альфа и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения лейкоза, например лейкоза волосковых клеток, хронического миелогенного лейкоза, множественной миеломы, фоликулярной лимфомы, рака, например карциноидной опухоли, злокачественной меланомы и гепатита, например хронического гепатита В и хронического гепатита С.
67. Применение конъюгата по любому из пп.44-52, где белок представляет собой IFN бета и полимер представляет собой HAS, предпочтительно HES, для получения лекарственного средства для лечения рассеянного склероза, предпочтительно рецидивирующих форм рассеянного склероза.
Текст
010501 Настоящее изобретение относится к конъюгатам гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала, и белка, где данные конъюгаты образованы реакцией восстановительного аминирования между по меньшей мере одной альдегидной группой гидроксиалкилкрахмала или производного гидроксиалкилкрахмала и по меньшей мере одной аминогруппой белка, таким образом, что гидроксиалкилкрахмал или его производное являются ковалентно связанными с белком посредством азометиновой связи или аминометиленовой связи. Настоящее изобретение также относится к способу получения данных конъюгатов и к определенным применениям конъюгатов. Общепринято, что стабильность белков может быть улучшена, а иммунный ответ на данные белки снижен, когда данные белки связаны с полимерными молекулами. В WO 94/28024 описано, что физиологически активные белки, модифицированные полиэтиленгликолем (ПЭГ) проявляют пониженную иммуногенность и антигенность, а также циркулируют в системе кровообращения существенно дольше, чем неконъюгированные белки, т.е. имеют более длинный период полураспада в плазме крови.WO 03/074087 относится к способу связывания белков с модифицированными полисахаридами, являющимися производными крахмала. Связывание между белком и полисахаридом, гидроксиалкилкрахмалом, осуществляется посредством ковалентной связи, которая образуется между концевой альдегидной группой или функциональной группой, образующейся в результате химической модификации указанной концевой альдегидной группы молекулы гидроксиалкилкрахмала, и функциональной группой белка. В качестве реакционноспособной группы белка рассматриваются аминогруппы, тиогруппы и карбоксильные группы. Более того, хотя в виде многочисленных списков приведено широкое множество возможностей различных связей, включающих различные функциональные группы, теоретически подходящие разнообразные линкерные молекулы и различные химические способы, в действующих примерах описаны только две альтернативы: во-первых, используется окисленный гидроксиэтилкрахмал, который связывают непосредственно с белками с использованием активации с помощью этилдиметиламинопропилкарбодиимида (EDC), или используется не окисленный гидроксиэтилкрахмал, который связывается непосредственно, т.е. в отсутствие связывающего соединения, с белком с образованием основания Шиффа, которое впоследствии восстанавливают до соответствующего амина. Таким образом, в иллюстративных примерах WO 03/074087 не описан единственный конъюгат, включающий гидроксиэтилкрахмал, белок и одну или несколько линкерных молекул. Кроме того, поскольку рассматриваются конъюгаты, образованные при восстановительном аминировании, в WO 03/074087 не содержится какой-либо информации, касающейся предпочтительной аминогруппы белка, для которой проводится восстановительное аминирование. Следовательно, задача настоящего изобретения заключалась в разработке нового конъюгата гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала, и белка, где конъюгат обладал бы выигрышным терапевтическим действием при введении нуждающемуся в этом субъекту. Следующая задача настоящего изобретения заключается в разработке нового конъюгата гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала, и белка, который образуется посредством восстановительного аминирования при взаимодействии аминогруппы олигопептида или полипептида, содержащего альдегидную группу, или кетогруппу, или группу полуацеталя гидроксиалкилкрахмала,предпочтительно гидроксиэтилкрахмала, или его производного, функционализированного альдегидными группами. Еще одна задача настоящего изобретения заключается в разработке способа получения указанного нового конъюгата, где указанный способ применяется с использованием специфических и селективных условий реакции. Таким образом, настоящее изобретение относится к способу получения конъюгата, включающего белок и полимер или производное полимера, где полимер представляет собой гидроксиалкилкрахмал, где указанный способ включает ковалентное связывание по меньшей мере одной альдегидной группы или кетогруппы, или группы полуацеталя полимера или производного полимера с по меньшей мере одной аминогруппой белка путем восстановительного аминирования; указанный способ дополнительно включает введение по меньшей мере двух альдегидных групп в полимер путем реакции окисления с раскрытием цикла, и взаимодействие по меньшей мере одной из указанных альдегидных групп полимера с аминогруппой белка или взаимодействие полимера с по меньшей мере бифункциональным соединением, где указанное соединение включает две функциональные группы М и Q, при этом одна функциональная группа М взаимодействует с полимером, и одну функциональную группу Q модифицируют химически с получением производного полимера, функционализированного альдегидной группой или кетогруппой,или группой полуацеталя, которая взаимодействует с аминогруппой белка при восстановительном аминировании. Соответственно, настоящее изобретение также относится к конъюгату, включающему белок и полимер или производное полимера, где полимер представляет собой гидроксиалкилкрахмал, который может быть получен с использованием способа получения конъюгата, где указанный способ включает ковалентное связывание по меньшей мере одной альдегидной группы или кетогруппы, или группы полуацеталя полимера или производного полимера по меньшей мере с одной аминогруппой белка путем восстановительного аминирования; указанный способ дополнительно включает введение по меньшей мере-1 010501 двух альдегидных групп в полимер путем реакции окисления с раскрытием цикла, и взаимодействие по меньшей мере одной из указанных альдегидных групп полимера с аминогруппой белка или взаимодействие полимера по меньшей мере с бифункциональным соединением, где указанное соединение включает две функциональные группы М и Q, при этом одна функциональная группа М взаимодействует с полимером, и одну функциональную группу Q модифицируют химически с получением производного полимера, функционализированного альдегидной группой или кетогруппой, или группой полуацеталя, которая взаимодействует с аминогруппой белка при восстановительном аминировании. Термин белок, как он используется в контексте настоящего изобретения, относится к любой последовательности аминокислот, содержащей по меньшей мере 2, предпочтительно по меньшей мере 5,более предпочтительно по меньшей мере 10, более предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, более предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 30, более предпочтительно по меньшей мере 35, более предпочтительно по меньшей мере 40, более предпочтительно по меньшей мере 45, более предпочтительно по меньшей мере 50 и еще более предпочтительно по меньшей мере 100 аминокислот. Белок может быть получен химическими синтетическими способами или получен из любого источника, относящегося к человеку или другому млекопитающему, или он может быть получен очисткой белка, полученного из природных источников. В соответствии с настоящим изобретением белок может представлять собой фактор роста, цитокин,активатор, ингибитор, фермент, антитело, антиген, транспортный белок, биоадгезивный белок, гормон,рецептор, суппрессор, или его функциональное производное или фрагмент. Термин функциональное производное или фрагмент, как он использован в контексте настоящего изобретения, относится к производному или фрагменту, который полностью или частично сохраняет желаемое биологическое свойство или активность первоначальной молекулы, например, по меньшей мере на 10%, более предпочтительно по меньшей мере на 20%, более предпочтительно по меньшей мере на 30%, более предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 50%, более предпочтительно по меньшей мере на 60%, более предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 80% и особенно предпочтительно по меньшей мере на 90% относительно желаемого биологического свойства или активности первоначальной молекулы. Особенно предпочтительными примерами таких фрагментов являются, например, фрагменты антител. Примерами белков являются эритропоэтин (ЕРО), такой как рекомбинантный ЕРО человека(rhIFN альфа или rhIFN бета), интерлейкины, например, от IL-1 до IL-18, такие как IL-2 или IL-3, как,например, рекомбинантные IL-2 или IL-3 человека (rhIL-2 или rhIL-3), белки сыворотки крови, такие как факторы коагуляции II-XIII, такие как факторы VII, VIII, IX, альфа 1-антитрипсин (А 1 АТ), активированный белок С (АРС), плазминогенные активаторы, такие как плазминогенный активатор тканевого типа(tPA), такой как плазминогенный активатор тканей человека (hTPA), AT III, такой как рекомбинантныйAT III человека (rhAT III), миоглобин, альбумин, такой как альбумин бычьей сыворотки (BSA), факторы роста, такие как эпидермальный фактор роста (EGF), фактор роста тромбоцитов (PDGF), фактор роста фибробластов (FGF), фактор роста мозгового происхождения (BDGF), фактор роста нервов (NGF), фактор роста В-клеток (BCGF), нейротропический фактор роста мозгового происхождения (BDNF), мерцательный-нейротрофический фактор (CNTF), трансформирующие факторы роста, такие как TGF альфа или TGF бета, BMP (костные морфогенные белки), гормоны роста, такие как гормон роста человека,факторы некроза опухолей, такие как TNF альфа или TNF бета, соматостатин, соматотропин, соматомедины, гемоглобин, гормоны или прогормоны, такие как инсулин, гонадотропин, меланоцитстимулирующий гормон (альфа-MSH), трипторелин, гипоталамические гормоны, такие как антидиуретические гормоны (ADH и окситоцин, а также высвобождающие гормоны и ингибирующие высвобождение гормоны), паратироидный гормон, тироидные гормоны, такие как тироксин, тиротропин, тиролиберин, пролактин, кальцитонин, глюкагон, глюкагоно-подобные пептиды (GLP-1, GLP-2 и т.д.), эксендины, такие как эксендин-4, лептин, вазопрессин, гастрин, секретин, интегрины, глюкопротеиновые гормоны (например, LH, FSH и т.д.), меланозид-стимулирующие гормоны, липобелки и апо-липобелки, такие как апо-В, апо-Е, ano-La, иммуноглобулины, такие как IgG, IgE, IgM, IgA, IgD и их фрагменты, гирудин,ингибитор тканевого пути, растительные белки, такие как лектин и рицин, пчелиный яд, змеиный яд,иммунотоксины, антиген Е, ингибитор альфа-протеиназы, аллерген амброзии, меланин, олиголизиновые белки, белки RGD или необязательно соответствующие рецепторы для одного из данных белков; или функциональные производные или фрагмент любого из данных белков или рецепторов. Предпочтительными ферментами являются, например, углевод-специфические ферменты, протеолитические ферменты, оксидазы, оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, киназы и лигазы. Конкретными неорганичивающими примерами являются аспарагиназа, аргиназа, аргининдеаминаза, аденозиндеаминаза, глутаминаза, глутаминаза-аспарагиназа, фенилаланин, триптофаназа, тирозиназа, супероксиддисмутаза (SOD), эндотоксиназа, каталаза, пероксидаза, калликреин, трипсин, химотрип-2 010501 син, эластаза, термолизин, липаза, уриказа, аденозиндифосфотаза, пуриннуклеозидфосфорилаза, билирубиноксидаза, глюкозооксидаза, глюкоза, глюконатоксидаза, галактозидаза, глюкоцереброзидаза, глюкуронидаза, гиалуронидаза, тканевый фактор, стрептокиназа, урокиназа, МАР-киназы, ДНКазы, РНКазы,лактоферрин и их функциональные производные или фрагменты. В соответствии с предпочтительными вариантами осуществления настоящего изобретения белок выбирают из группы, состоящей из ЕРО, G-CSF, IFN альфа, IFN бета, ATIII, IL-2, IL-3, миоглобина,SOD, A1AT и BSA. В соответствии с особенно предпочтительными вариантами осуществления настоящего изобретения белок выбирают из группы, состоящей из rhEPO, rhG-CSF, rhIFN альфа, rhIFN бета, rhAT III, rhIL-2,rhIL-3, миоглобина, SOD, A1AT и BSA. Эритропоэтин (ЕРО) представляет собой гликопротеиновый белок, необходимый для созревания эритроидных предшественников клеток в эритроциты. У взрослых людей он продуцируется в почках. ЕРО необходим для регулирования уровня красных кровяных клеток в системе кровообращения. Состояния, для которых характерны низкие уровни кислорода в тканях, вызывают повышенный биосинтез ЕРО, который в свою очередь стимулирует эритроцитопоэз. Утрата функции почек, как это, например,видно при хронической почечной недостаточности, обычно приводит к сниженному биосинтезу ЕРО и сопутствующему снижению числа красных кровяных клеток. Эритропоэтин представляет собой кислый гликопротеиновый гормон массой приблизительно 34000 Да. Эритропоэтин человека представляет собой полипептид из 166 аминокислот, который в природе существует в виде мономера (Lin et al., 1985,PNAS82, 7580-7584, ЕР 148 605 В 2, ЕР 411 678 В 2). Идентификация, клонирование и экспрессия генов,кодирующих эритропоэтин, описаны, например, в патенте США 4703008. Очистка рекомбинантного эритропоэтина от клеточной культуральной среды, которая поддерживает рост клеток млекопитающих, содержащих рекомбинантные плазмиды эритропоэтина, описана, например, в патенте США 4667016. В данной области техники обычно полагают, что биологическая активность ЕРО in vivo главным образом зависит от степени связывания сиалиловых кислот с ЕРО (см., например, ЕР 428267 В 1). Теоретически,14 молекул сиалиловой кислоты может связываться с одной молекулой ЕРО по терминальным концам углеводных боковых цепей, связанных с N- и О-сайтами гликозирования. Для получения высоко сиалилированных препаратов ЕРО необходимы высоко усовершенствованные стадии очистки. Подробную дополнительную информацию, касающуюся эритропоэтина, смотри в публикациях Krantz, Erythropoietin,1991, Blood, 77 (3): 419-34 (обзор) и Cerami, Beyond erythropoiesis: novel applications for recombinant human erythropoietin, 2001, Semin Hematol., (3 Suppl 7): 33-9 (обзор).G-CSF представляет собой гликопротеин в 21 кДа, стабилизированный двумя внутрицепочечными дисульфидными связями и содержащий единственный O-связанный углеводный фрагмент. Зрелый GCSF содержит 174 аминокислоты. В организме животного G-CSF синтезируется стромальными клетками костного мозга, макрофагами и фибробластами. Его основная функция заключается в том, что он является фактором роста и дифференциации для нейтрофилов и их клеток предшественников. Однако в данной области также известно, что G-CSF активирует зрелые нейтрофилы. Кроме того, он стимулирует рост/дифференциацию других различных гемопоэтических клеток-предшественников (совместно с дополнительными гемопоэтическими факторами роста) и промотирует пролиферацию и миграцию эндотелиальных клеток. Клинически G-CSF вводят для лечения дефектов на уровне нейтрофилов (вызываемых,например, апластической анемией, миелодисплазией, СПИДом или химиотерапией).G-CSF можно получать химическими методами синтеза или происходить из любого человеческого источника (см., например, Burgess, A. W. et al. 1977, Stimulation by human placental conditioned medium oflymphocytes, Blood 50 (1977), 811) или иметь происхождение от других млекопитающих и может быть получен очисткой из таких природных источников как плацента человека, человеческая кровь или человеческая моча. Кроме того, множество эпителиальных карцином, клетки острой миелоидной лейкемии и различные опухолевые линии клеток (карциномы мочевого пузыря, меддулобластомы) способны экспрессировать данный фактор. Кроме того, экспрессия G-CSF включает также вариант G-CSF, в котором одна или более аминокислот (например, от 1 до 25, предпочтительно от 1 до 10, более предпочтительно от 1 до 5, наиболее предпочтительно 1 или 2) были заменены на другие аминокислоты, и который проявляет активность GCSF (см., например, Riedhaar-Olson, J. F. et al., 1996, Identification of residues critical to the activity of human granulocyte colony-stimulating фактор, Biochemistry 35: 9034-9041 1996; патенты США 5581476; 5214132; 5362853; 4904584). В данной области описано измерение активности G-CSF (измерение активности G-CSF in vitro смотри, например, Shirafuji, N. et al., 1989, A new bioassay for human granulocyte colony-stimulating factor (hG-CSF) using murine myeloblastic NFS-60 cells as targets and estimation of its levelsand nonneutropenic CD rats, Cancer Chemother Pharmacol (1997) 39; 259-266. Предпочтительно G-CSF продуцируют рекомбинантным образом. Это включает экспрессию прокариотическими и эукариотическими клетками-хозяевами экзогенных последовательностей ДНК, полученных геномным или кДНК клонированием или путем синтеза ДНК. Подходящие прокариотические хозяева включают различные бактерии, такие как Е. coli. Подходящие эукариотические хозяева включают дрожжи, такие как S. cerevisiae и клетки млекопитающих, такие как клетки яичников китайского хомячка и клетки обезьян. Рекомбинантное продуцирование белка известно в технике. Обычно, он включает трансфекцию клеток-хозяев подходящим вектором экспрессии, культивирование клеток-хозяев в условиях, которые дают возможность продуцирования белка и очистку белка от клеток-хозяев. Подробная информация приведена в Souza, L. М. et al. 1986, Recombinant human granulocyte colony-stimulating factor: effects onexpression in Escherichia coli, Jpn J Cancer Res.1987, 78 (11): 1179-1181. В предпочтительном варианте осуществления, G-CSF имеет последовательность аминокислот зрелого G-CSF человека (см., например, Nagata, S. et. al., 1986, Molecular cloning and expression of cDNA forhuman granulocyte colony-stimulating factor, Nature 319: 415-418, 1986), и может дополнительно содержать метионин в качестве аминного конца, что приводит к белку из 175 аминокислот. Кроме того, G-CSF может содержать остаток серина или треонина вместо метионина.G-CSF, используемый в способах настоящего изобретения и конъюгаты согласно настоящему изобретению могут включать одну углеводную боковую цепь, присоединенную к G-CSF посредством Огликозилирования в положение Thr 133, т.е. G-CSF является гликозилированным (V. Gervais et al., Eur. J.Biochem., 1997, 247, 386-395). Структура углеводной боковой цепи может быть NeuNAc(альфа 2-3)Gal(бета 1-3) [NeuNAc(альфа 2-6)]GalNAc и (альфа 2-3)Gal(бета 1-3)GalNAc (NeuNAc = N-ацетилнейраминовая кислота, GalNAc = N-ацетилгалактозамин). Предлагались модификации G-CSF и других полипептидов для того, чтобы ввести по меньшей мере одну дополнительную углеводную цепь по сравнению с природным полипетидом (патент США 5218092). В зависимости от используемого хозяина, продукт экспрессии G-CSF может быть гликозилированным углеводами млекопитающих или других эукариотов. Обычно, когда G-CSF продуцируется в эукариотических клетках, белок гликозилируют посттрансляционно. В результате, углеводная боковая цепь может быть присоединена к G-CSF во время биосинтеза в клетках млекопитающих, особенно человека, насекомых или дрожжей. Рекомбинантный G-CSF человека (rhG-CSF) обычно используется для лечения различных форм лейкопении. Таким образом, коммерческие препараты rhG-CSF доступны под названиями филграстим(Gran и Neupogen), ленограстим (Neutrogin и Granocyte) и нартограстим (Neu-up). Gran и Neupogen являются негликозилированными и продуцируются в рекомбинантных клетках СНО, и Neu-up является негликозилированным и содержит пять замещающих аминокислот в N-концевой области целогоrhG-CSF, продуцируемого рекомбинантными клетками Е. coli. Интерфероны представляют собой цитокины, которые опосредуют противовирусную, антипролиферативную и имммуномодулирующую активность в ответ на вирусную инфекцию и другие биологические индукторы. В противоположность IFN альфа, IFN бета является высоко специфическим в отношении различных разновидностей. Существует два подтипа IFN бета, IFN бета 1 а и IFN бета 1b. При промышленном получении основная разница между IFN бета 1 а и IFN бета 1b заключается в соответствующих клеточных системах, используемых для их получения.IFN бета 1 а получают с использованием клеток млекопитающих и получают обозначенный 1 а поскольку его последовательность аминокислот идентична последовательности природно существующего интерферона бета. IFN бета 1b получают с использованием бактерий. Интерфероны, как большинство других белков млекопитающих модифицируют посттрансляционно путем гликозилирования. Бактрии,однако, не обладают способностью гликозилировать белки, и поэтому IFN бета 1b не включает углеводные боковые цепи, выявленные в природном материале. IFN бета 1 а содержит 166 аминокислот и имеет молекулярную массу примерно 22500 Да, IFN бета 1b содержит 165 аминокислот и имеет молекулярную массу примерно 18500 Да, поскольку в нем отсутствуют N-концевой метионин и гликозилирование вследствие способа получения на основе бактерий. Последовательность аминокислот интерферона бета человека приведена, например, в ЕР 0218 825 А 1. О кристаллической структуре интерферона бета сообщалось в публикациях: Proc. Natl. Acad. Sci. USA 94 (1997) pp. 11813-11818, Biochemistry, Karpusas M.,Nolte M., Benton C.B., Meier W., Lipscomb W.N., Goelz S. Коммерческими препаратами интерферона бета являются Betaseron (IFN бета 1b), Avonex и Rebif (IFN бета 1a). Интерферон бета 1b производят путем бактериального ферментирования штамма Е. coli, который содержит генетически сконструиро-4 010501 ванную плазмиду, содержащую ген интерферона бета ser17 человека. Природный ген был получен из фибробластов человека и изменен таким образом, чтобы он содержал остаток серина вместо остатка цистеина, найденного в положении 17. Интерферон бета 1 а получают методами рекомбинантной ДНК технологии с использованием генетически сконструированных клеток яичника китайского хомячка (СНО), в которые был введен ген интерферона бета человека. Последовательность аминокислот IFN бета 1 а идентична последовательности природного интерферона бета, полученного из фибробластов человека. Природный интерферон бета и интерферон бета 1 а являются гликозилированными, где каждый из них содержит N-связанный сложный углеводный фрагмент у Asn80. Лекарственные средства интерферона бета предназначены для лечения возвратного ослабленного рассеянного склероза. Однако существует множество побочных действий, связанных с введением лекарственных продуктов интерферона бета. Кроме того, их вводят путем инъекции (внутримышечной или подкожно), что приводит к дополнительному риску. Сниженные побочные действия и более легкое (например, менее частое) введение являются причиной, почему проводится множество работ для усовершенствования свойств белков. Применяемый главным образом способ заключается в модификации интерферона полиэтиленгликолем, известный как ПЭГилирование. Формы IFN альфа в природе продуцируются моноцитами/макрофагами, лимфобластоидными клетками, фибробластами и рядом различных типов клеток после индукции вирусами, нуклеиновыми кислотами, глюкокортикоидными гормонами и другими индукторами. Известно по меньшей мере 23 различных варианта IFN альфа. Индивидуальные белки имеют молекулярные массы между 19-26 кДа и состоят из белков длиной в 156-166 и 172 аминокислоты. Все подтипы IFN альфа обладают общей консервативной областью последовательности между положениями аминокислот 115-151, тогда как концевые аминосодержащие фрагменты являются переменными. Множество подтипов IFN альфа отличается в своих последовательностях только по одному или двум положениям. Дисульфидные мостики образуются между цистеинами в положениях 1/98 и 29/138. Дисульфидная связь 29/138 является незаменимой для биологической активности, тогда как связь 1/98 может быть восстановлена, не оказывая влияния на биологическую активность. Все формы IFN альфа содержат потенциальный сайт гликозилирования, но большинство подтипов не являются гликозилированными. В противоположность IFN гамма, белки IFN альфа стабильны при рН 2. Промышленное получение IFN альфа проводят с использованием генетически модифицированной Е. coli. Поскольку бактерии не обладают способностью гликозилировать белок, два варианта IFN альфа(IFN альфа 2 а, и IFN альфа 2b), которые используются в разрешенных лекарственных продуктах, оба являются негликозированными. Основным недостатком коммерческого IFN альфа являются побочные действия. По усовершенствованию лекарственных средств интерферона альфа, которые предназначены для лечения гепатита С, проводилась большая работа. Полимерная модификация белка представляет собой способ, который используется для улучшения свойств белка. Применяемый главным образом способ заключается в модификации интерферона полиэтиленгликолем, известный как ПЭГилирование. Два коммерчески доступных ПЭГилированых варианта IFN альфа известны как PEGIntron (SP) и Pegasys(Roche). Антитромбин III (AT III) представляет собой ингибитор серинтротеазы, который ингибирует тромбин и фактор Ха (Travis, Annu. Rev. Biochem. 52: 655, 1983). В меньшей степени он также ингибирует факторы IXa, XIa, XIIa, tPA, урокиназу, трипсин, плазмин и калликреин (Menache, Semin. Hematol. 28: 1,1991; Menache, Transfusion 32: 580, 1992; Lahiri, Arch. Biochem. Biophys. 175: 737, 1976). AT III человека синтезируется в печени в виде одноцепочечного гликопротеина из 432 аминокислот с молекулярной массой приблизительно 58000 Да. Его концентрация в плазме крови находится в диапазоне 14-20 мг/дл(Rosenberg, Rev. Hematol. 2: 351, 1986; Murano, Thromb. Res. 18: 259, 1 980). Белок содержит три дисульфидных мостика (Cys 8-128, Cys 21-95, Cys 247-430) и четыре N-связанных углеводных цепи (Asn 96,135,-155,-192), что составляет 15% от общей массы (Franzen, J. Biol. Chem. 255: 5090, 1980; Peterson, ThePhysiological Inhibitions of Blood Coagulation and Fibrinolysis, Elsevier/North-Holland Biomedical Press 1979,p. 43). Антитромбин представляет собой ингибитор серинпротеазы серпинового типа, что является особенно важным для контроля за свертываемостью крови. AT III представляет собой эндогенный антикоагулянт, циркулирующий в плазме крови человека в наибольшей концентрации. Данный ингибитор серинпротеазы участвует в регуляции свертывания при физиологическом и патологическом состояниях(Opal, Crit. Care Med. 2002, 30: 325). Он циркулирует в двух формах с низкой способностью ингибирования тромбина (Pike, J. Biol. Chem. 272: 19562, 1997; Ersdal-Badju, Fed. Proc. 44: 404, 1985) (85-95% альфа изоформы с 4 биантеннальными, моно- и дисиалилированными олигосахаридными цепями, 5-15% представляет собой бета-изоформу с высокой аффинностью к гепарину, не имеющую гликозилирования вAsn 135, 2-6 концевой связи сиалиловой кислоты). Небольшая фракция циркулирующего AT III обычным образом связывается с протеогликанами на поверхности эндотелиальных клеток сосудов. Данные протеогликаны главным образом представляют собой гепаран сульфат, молекулу, структурно подобную гепарину, которая способна катализировать ингибирование тромбина таким же образом, что и гепарин. Связывание AT III с хорошо определенными пентасахаридными звеньями гепарина вызывает конформационное изменение этого белка (Choay, Ann. NY Acad. Sci. 370: 644, 1981; Choay, Biochem. Biophys. Res.Commun. 116: 492, 1983; Olson, J. Biol. Chem. 266: 6353, 1991; Bauer, Semin. Hematol. 28: 10, 1991; Carell,Thromb. Haemost. 78: 516, 1997). Такое связывание катализирует 1000-кратное увеличение ингибирующей активности AT III по отношению к тромбину и фактору Ха (Rosenberg, Fed Proc. 44: 404, 1985;Olson, J. Biol. Chem. 267: 12528, 1992). Такая локализация фракции AT III на эндотелиальной поверхности, где обычно генерируются ферменты внутреннего каскада коагуляции, дает возможность AT III быстро нейтрализовать данные гемостатические ферменты и защитить естественные поверхности от образования тромбов. Таким образом, ключевыми свойствами AT III для предотвращения тромботических случаев являются его способности связывать катализатор гепарин, подвергаться конформационному изменению, которое изменяет его ингибирующие свойства, и необратимо связывать тромбин или фактор Ха, ингибируя таким образом их активность. AT III также обладает превосходными противовоспалительными свойствами, некоторые из которых являются результатом его действия в коагуляционном каскаде (Roemisch, Blood Coagul Fibrinolysis. 2002, 13: 657). Активированные коагуляционные протеазы,такие как активированный фактор X и тромбин, вносят свой вклад в воспаление; например, путем высвобождения провоспалительных медиаторов. Ингибирование AT III данных протеаз предотвращает такие специфические взаимодействия с клетками и последующие реакции (Roemisch, Blood Coagul Fibrinolysis. 2002, 13: 657). Противовоспалительные свойства AT III независимо от коагуляции включают непосредственные взаимодействия с клетками, приводящие к высвобождению, например, простациклина. Связывание AT III с недавно идентифицированным клеточным рецептором, синдеканом-4, приводит к вмешательству во внутриклеточный сигнал, индуцированный медиаторами, такими как липополисахариды и,как следствие, к понижению модуляции воспалительной ответной реакции (Roemisch, Blood Coagul Fibrinolysis. 2002, 13: 657). Помимо анализа свободной структуры AT III, были проведены многочисленные исследования, оценивающие сайты комплексообразования для олигосахаридных звеньев гепарина вследствие важности комплекса гепарин- AT III для физиологической функции AT III (Choay, Ann. NY Acad.Sci. 370: 644, 1981; Choay, Biochem. Biophys. Res. Commun. 116: 492, 1983; Olson, J. Biol. Chem. 266: 6353,1991; Bauer, Semin. Hematol. 28: 10, 1991; Carell, Thromb. Haemost. 78: 516, 1997). AT III можно получать в соответствии с классическими методами фракционирования плазмы крови человека. Аффинная хроматография (гепарин-сефароза) с использованием высокой аффинности гепарина в качестве лиганда для ATIII с последующей термической обработкой для дезактивации вируса используется для отделения от плазмы крови. Помимо фракционирования из плазмы для получения AT III доступны более современные альтернативы в соответствии с рекомбинантными методами получения, которые обеспечивают более безопасный доступ к такому важному терапевтическому белку (Levi, Semin Thromb Hemost 27: 405,2001). ATryn представляет собой рекомбинантный AT III человека (rhAT III), продуцируемый GTCBiotherapeutics с использованием трансгенных коз. Были проведены подробные исследования по сравнению структурных и функциональных свойств AT III, полученного из плазмы крови (ph AT III) и rh AT III(Edmunds, Blood, 91: 4561, 1998). На основании данных экспериментов, rh AT III структурно идентиченrh AT III за исключением гликозилирования. Олигоманнозные структуры связаны с Asn 155 в трансгенно продуцируемом веществе, тогда как сложные структуры идентифицируются в случае белка, полученного из плазмы. Некоторые из галактозных звеньев AT III в rh AT III заменены на звенья GalNac. Высокая степень фукозилирования в rh AT III является другим отличием. Наконец, характер сиалилирования обоих белков отличается по двум направлениям: rh AT III является менее сиалилированным и содержит Nацетил-, а также N-гликолилнейраминовые кислоты, такое структурное различие между двумя углеводными частями обоих молекул также приводит к различным биохимическим свойствам. На европейском больничном рынке доступны следующие лекарственные средства AT III (источник: IMS-АТС группа 2001): Kybernin (Aventis Behring), AT III (Baxter, Grifols), Atenativ (Pharmacia), Aclotine (LFB),Anbin (Grifols). Фактор VIII принимает участие во внутреннем каскаде свертывания крови протеиназами и служит в качестве кофактора в реакции фактора IXa, превращающей фактор X в его активную форму Ха, что, в конечном счете, приводит к образованию фибринового тромба. Отсутствие или нестабильность фактораVIII ведет к гемофилии А, обычному рецессивному х-связанному нарушению свертываемости крови. Частота гемофилии А в каждой этнической группе составляет 1-2 случая на 10000 рождений особей мужского пола. У пациентов либо действительно фактор VIII экспрессируется на уровне ниже нормального, либо они принадлежат к так называемой группе crm-положительных пациентов (кросс-положительный материал) (примерно 5% пациентов), которые имеют достаточное количество фактора VIII в плазме крови (по меньшей мере 30% от нормального уровня), но у которых белок является нефункциональным. Примерно 50% всех пациентов страдает тяжелой гемофилией с активностью фактора VIII менее 1% от нормальной; у них часто происходят спонтанные кровотечения в суставы, мышцы и внутренние органы. Умеренная гемофилия А, которая наблюдается у 30-40% пациентов, связана с активностью в 5-30% от нормального уровня. Кровотечения происходят только после значительной травмы или хирургического вмешательства. Гемофилия средней тяжести наблюдается примерно у 10% пациентов. В дан-6 010501 ном случае активность фактора VIII составляет 2-5% от нормального уровня, и кровотечение происходит уже после незначительной травмы. Период полураспада фактора VIII in-vivo у человека составляет обычно 10-15 ч, но следует отметить, что на кинетику высвобождения, стабильности и разложения также оказывает влияние другой фактор, фактор ван Виллебранда (van Willebrand). Фактор VIII получают или обычной экстракцией из плазмы донорской крови человека, или, в более недавнее время, с использованием рекомбинантных систем. Например, клетки почки детенышей хомяка (BHK) используют для продуцирования Kogenate (Bayer), тогда как клетки яичника китайского хомяка используют для получения другого продукта, Rekombinate (Baxter) в виде полного одноцепочечного белка из 2351 аминокислоты с номинальной молекулярной массой 267 кДа (Toole et al., 1984, Nature 312: 342) или в виде различных вариантов, где полный В-домен или его часть удалены для того, чтобы получать продукт, обладающий большей стабильностью, и с более высокими выходами при продуцировании (Bhattacharyya et al. 2003,CRIPS 4/3: 2-8). Продукт-предшественник перерабатывается в две полипептидные цепи по 200 и 80 кДа в аппарате Гольджи, и две цепи, которые удерживаются вместе ионом(ами) металла(ов), экспрессируются в крови (Kaufman et al., 1988, J. Biol. Chem., 263: 6352). Прокоагулирующая активность требует дальнейшего расщепления тромбина с получением фрагментов тяжелой цепи в 54 кДа и 44 кДа плюс фрагмент легкой цепи в 72 кДа (Aly et al., 1992, Proc. Natl. Acad. Sci. USA: 4933). Таким образом, в концентратах фактора VIII, полученных из плазмы крови человека, было описано присутствие нескольких фрагментированных полностью активных форм фактора VIII (Anderson et al., 1986, Proc. Natl. Acad, Sci. 83: 2979). Наиболее общее побочное действие при введении плазматического или рекомбинантного фактора VIII заключается в иммунологических реакциях у большого числа пациентов (до 30%), что лишает его терапевтической ценности. В прошлом, были предприняты разнообразные попытки облегчить переносимость для пациентов с помощью пероральной индукции переносимости, но результаты оказались не слишком обнадеживающими. Были предположены новые генетические способы индуцирования переносимости,которые пока еще не нашли широкого распространения. Авторами настоящего изобретения предполагается, что хезилированный (модифицированный гидроксиксиэтилкрахмалом) белок будет обладать пониженной степенью иммуногенности и таким образом сможет снизить данное осложнение. Фактор VIII очень богат лизиновыми остатками (более 220 в общем количестве 2350 аминокислот), что можно использовать для подхода на основе восстановительного аминирования. Альфа 1-Антитрипсин (А 1 АТ, также упоминаемый как ингибитор альфа 1-протеиназы) представляет собой ингибитор протеиназы, который, как было показано, виртуально ингибирует все серинпротеиназы млекопитающих (Travis Ann. Rev. Biochem. 52 (1983) p. 655), включая нейтрофилэластазу, тромбин, факторы Ха и XIa. A1AT представляет собой синтезируемый в печени одноцепочечный гликопротеин из 394 аминокислот и имеющий молекулярную массу 53 кДа. Концентрация его в плазме крови находится в диапазоне 1-1,3 г/л. Присутствие только одного цистеина в целом белке не дает возможность образования внутримолекулярных дисульфидных мостиков. Молекула содержит три углеводных боковых цепиFEBS Letters 135 (1981) p. 301; Hodges Biochemistry 21(1982) p. 2805), что составляет 12% его молекулярной массы. Были обнаружены два типа углеводных цепей, имеющие би- и триантеннальную структуру,соответственно (Hodges J: Biol. Chem. 254 (1979) p. 8208). A1AT человека существует по меньшей мере в двадцати различных формах в общей популяции. Микрогетерогенность является результатом различных количеств двух типов углеводных цепей. Ключевой функцией является контроль активности нейтрофилэластазы (Travis Ann. Rev. Biochem. 52 (1983) p. 655). Неконтролируемая активность эластазы приводит к атаке по эпителиальным тканям, что приводит к непоправимому повреждению. Во время процесса дезактивации А 1 АТ выступает в качестве субстрата для эластазы, связываясь с активным центром протеазы, которая впоследствии дезактивируется за счет образования данного комплекса. Дефицит А 1 АТ вызывает, например, эмфизему легких, которая связана с повреждением легочного эпителия. Распределение двух типов углеводных боковых цепей А 1 АТ по трем сайтам N-гликозилирования А 1 АТ отличается для каждого изотипа А 1 АТ. Классическое получение А 1 АТ проводят в соответствии с методами фракционирования плазмы крови с использованием различных стадий аффинной хроматографии плазмы крови человека. Однако более современным способом продуцирования А 1 АТ являются рекомбинантные технологии. Компания PPL Therapeutics разработала способ, который позволяет выделять рекомбинантный А 1 АТ человека (rHA1AT) из молока трансгенных овец (Olman Biochem. Soc. Symp. 63 (1998) p. 141; Tebbutt Curr. Opin. Mol. Cher. 2 (2000) p. 199; Carver Cytotechnology 9 (1992) p. 77; Wright Biotechnology (NY) 9(1991) p.830). Что касается белковой части молекулы rhA1AT, она имеет структуру, идентичную структуре pdLA1AT. Но, как и в случае других рекомбинантно продуцируемых белков человека, различие проявляется в углеводных боковых цепях, особенно в числе остатков сиалиловых кислот. Активатор плазминогена тканевого типа (tPA) представляет собой трипсиноподобную серинпротеазу, существенную для лизиса тромбов. В присутствии фибринового тромба, tPA превращает плазминоген в плазмин, который разрушает фибрин. tPA проявляет повышенную активность в присутствии фибрина и в результате вызывает фибрин-специфическую активацию плазминогена (М. W. Spellman, L. J. Basa, С. К. Leonard, J. A. Chakel, J. V. O'Connor, The Journal of Biological Chemistry 264 (1989) p. 14100). Плазмин-7 010501 растворяет фибрин, приводя к продуктам разложения фибрина. За счет положительного механизма обратной связи фибрин усиливает свое собственное разрушение путем стимуляции tPA-опосредованной активации плазминогена (R. J. Stewart et. al. The Journal of Biological Chemistry 275 (2000) pp.1011210120). htPA является физиологическим активатором фибринолиза, который присутствуют в различных типах тканей. Он представляет собой гликопротеин с молекулярной массой приблизительно 68 кДа. В природном виде tPA существует в одноцепочечной форме (одноцепочечный активатор плазминогена тканевого типа, sctPA), которая может быть преобразована путем расщепления плазмина по пептидной связи Arg 275-Ile 276 в двухцепочечную структуру (двухцепочечный активатор плазминогена тканевого типа, tctPA). Для лечения фибринолиза его продуцируют рекомбинантными методами в виде rtPA (рекомбинантный активатор плазминогена тканевого типа). Существуют различные типы tPA, проявляющие структурные отличия в углеводной структуре. tPA типа I имеет N-связанные олигосахариды у аминокислот Asn117, Asn184 и Asn448. tPA типа II является гликозилированным по Asn117 и Asn448. Оба типа содержат О-связанный остаток фукозы у Thr61 (K. Mori et al. The Journal of Biological Chemistry 270(1995) pp. 3261-3267). При исследовании углеводной структуры tPA, экспрессированного в СНО-клетках,показано большое разнообразие ди-, три- и тетра-антеннальных структур в цепях Сахаров (М. W. Spellman, L. J. Basa, С.K. Leonard, J. A. Chakel, J. V. O'Connor, The Journal of Biological Chemistry 264 (1989) p. 14100). Первичная структура tPA содержит несколько цистеинов, которые, как предполагается, являются сшитыми, в дополнение к свободному цистеиновому остатку в положении 83, который может взаимодействовать с другим tPA, образуя димер. Несколько результатов показывают, что на выведение tPA invivo оказывает влияние углеводная структура, особенно за счет высокоманнозного олигосахарида, присоединенного в положении Asn117. Другой предполагаемый механизм выведения включает распознавание О-связанного остатка фукозы в положении Thr61 высокоаффинными рецепторами на гепатоцитах. Данный остаток расположен поблизости от Cys83. Биосконструированный tPA (TNK-tPA) был разработан для увеличения продолжительности периода полураспада. Сайт гликозилирования в положении 117 был смещен в положение 103. аспарагин в положении 117 был заменен на Глутамин, а Треонин в положении 103 был заменен на аспарагин. TNK-tPA является устойчивым к дезактивации под действием ингибитора 1 активатора плазминогена вследствие тетра-аланинового замещения в домене протеазы (R. J.Stewart et. al. The Journal of Biological Chemistry 275 (2000) pp. 10112-10120). TNK-tpA представлен на рынке в виде Tenecteplase (Boehringer Ingelheim). TNK-tPA можно вводить пациенту в виде одного внутривенного болюса, тогда как tPA нужно вводит в виде болюса с последующей инфузией. Активированный белок С (АРС) представляет собой модулятор свертываемости крови и воспаления, связанного с тяжелым сепсисом. Активированный белок С возникает из его неактивного предшественника (белка С) под действием тромбина, связанного с тромбомодулином. Данный комплекс отщепляет короткий N-концевой активированный пептид от тяжелой цепи белка С, приводя к активированному белку С. Дротрекогин (Drotrecogin) альфа (активированный) представляет собой рекомбинантный активированный белок С (rhAPC). Его последовательность аминокислот идентична последовательности полученного из плазмы крови белка С, и он обладает аналогичными свойствами. Активированный белок С поставляется на рынок Eli Lilly как Xigris. Он продуцируется клеточной линией человека (HEK293), в которую введены векторы экспрессии белка С. Данную клеточную линию использовали благодаря ее способности осуществлять корректную серию комплекса пост-трансляционных модификаций, которые требуются для функциональной активности. Рекомбинантный активированный белок С человека представляет собой 2-цепочеченый гликопротеин, содержащий 4 сайта N-гликозилирования и 12 дисульфидных связей. Тяжелая цепь содержит 250 аминокислот. В данной цепи семь остатков представляют собой цистеин и имеется три сайта N-гликозилирования (Asn-248, Asn-313 и Asn-329). Семь цистеиновых остатков образуют три дисульфидных связи внутри тяжелой цепи и одну дисульфидную связь между цепями. Легкая цепь содержит N-связанный сайт гликозилирования (Asn-97) и 17 цистеиновых остатков,которые образуют восемь дисульфидных связей внутри легкой цепи и одну дисульфидную связь между цепями. Первые девять глутаминовых кислот легкой цепи являются гамма-карбоксилированными (Gla), а аспарагиновая кислота 71 является бета-гидроксилированной. RhAPC имеет идентичную последовательность аминокислот, что и полученный из плазмы крови активированный белок С, но отличается от последнего характером гликозилирования. Активированный белок С представляет собой протеазу, принадлежащую к семейству серинпротеаз. Он играет важную роль в регулировании свертываемости крови. Благодаря своему антитромботическому действию активированный белок С обладает способностью ингибировать функцию тромбина. Кроме того, активированный белок С представляет собой важный модулятор воспаления, связанного с тяжелым сепсисом. Эндогенные ингибиторы серинпротеазы представляют собой природные ингибиторы активированного белка С, приводя к очень короткому (менее 30 мин) периоду полураспада активированного белка С в системе кровообращения in vivo. Выведение активированного белка С из системы кровообращения опосредовано сочетанием по меньшей мере трех процессов,включая ингибирование ферментативной активности активированного белка С с помощью эндогенных ингибиторов протеаз, выведение активированного белка С и/или комплексов активированный белок Сингибитор серинпротеазы такими органами, как печень и почки, и разложение активированного белка С-8 010501 и/или комплексов активированный белок С-ингибитор серинпротеазы с помощью протеаз кровообращения или тканевых протеаз. Фаза I клинических исследований при 24-часовой инфузии в дозе 24 мкг/кг/ч приводила к устойчивому состоянию концентрации в плазме крови на уровне 70 нг/мл. Период полураспада rhAPC, измеренный в конце инфузии, составлял 0,5-1,9 ч. Концентрации rhAPC в плазме крови падали ниже уровня обнаружения, составляющего 10 нг/мл, через 2 ч после окончания инфузии. Вследствие его короткого физиологического и фармакокинетического периода полураспада при клиническом использовании для лечения сепсиса активированный белок С непрерывно вводят путем инфузии с определенной скоростью для поддержания желаемой концентрации в плазме крови. Были предприняты попытки для улучшения фармакокинетического профиля активированного белка С. Например, D. Т. Berget. al. Proc. Natl. Acad. Sci. USA 100 (2003) pp. 442 3-4428, описали сконструированный вариант активированного белка С с пролонгированным периодом полураспада в плазме крови. Фактор VII участвует во внутреннем каскаде коагуляции протеиназ и промотирует гемостаз путем активации внешнего пути каскада коагуляции. F VII превращается в фактор VIIa с помощью фактора Ха,фактора XIIa, фактора IXa или тромбина за счет незначительного протеолиза. В присутствии тканевого фактора и ионов кальция фактор VIIa затем превращает фактор X в фактор Ха за счет ограниченного протеолиза. Фактор VIIa будет также превращать фактор IX в фактор IXa в присутствии тканевого фактора и ионов кальция. Фактор VII представляет собой витамин K-зависимый гликопротеин, состоящий из 406 остатков аминокислот (MW 50 кДа). Фактор VII получают или обычной экстракцией из плазмы донорской крови человека, или, в более недавнее время, с использование рекомбинантных систем. NovoNordisk использует клетки почки детенышей хомяка (BHK) для продуцирования NovoSeven, экспрессируемый в виде одноцепочечного белка из 406 аминокислот с номинальной молекулярной массой 55 кДа (Thim, L. et al., Biochemistry 27:7785-7793 (1988). Молекула содержит четыре углеводных боковых цепи. Две О-связанные углеводные боковые цепи расположены у Ser52, 60 и две N-связанные углеводные боковые цепи расположены при Asn 145, 322 (Thim, L. et al., Biochemistry 27: 7785-7793 (1988). Фактор VII предназначен для лечения случаев кровотечения у пациентов с гемофилией А или В,имеющих ингибиторы фактора VIII или фактора IX. Следовательно, настоящее изобретение также относится к применению конъюгата HAS-Фактор VII для получения лекарственного средства для лечения случаев гемофилии А или В у пациентов, обладающих ингибиторами фактора VIII или фактора IX. Фактор IX витамин K-зависимый белок плазмы крови, который участвует во внутреннем пути свертывания крови с помощью фактора X, превращающего его в активную форму в присутствии ионов Са(2+), фосфолипидов и фактора VIIIa. Фактор IX представляет собой гликопротеин с примерной молекулярной массой 55000 Да, состоящий из 415 аминокислот в виде единственной цепи Yoshitake S. et al.,Biochemistry 24: 3736-3750 (1985. Фактор IX получают или обычной экстракцией из плазмы донорской крови человека, или, в более недавнее время, с использованием рекомбинантных систем. Wyeth использует клетки яичников китайского хомяка (СНО) для продуцирования BeneFIX. Он имеет первичную последовательность аминокислот идентичную Ala148 аллельной форме полученного из плазмы крови фактора IX, и обладает структурными и функциональными характеристиками, аналогичными таковым для эндогенного фактора IX. Белок содержит восемь углеводных боковых цепей. Шесть О-связанных углеводных боковых цепей расположены при Ser 53, 61 и у треонина 159, 169, 172, 179 и две Nсвязанных углеводных боковых цепи расположены при Asn 157, 167 (Yoshitake S. et al., Biochemistry 24: 3736-3750 (1985); Balland A. et al., Eur J Biochem. 1988; 172 (3): 565-72). Фактор IX предназначен для борьбы и профилактики геморрагических случаев у пациентов с гемофилией В (например, при врожденном дефиците фактора IX или болезни Кристмаса), включая контроль и профилактику кровотечения при хирургических вмешательствах. Следовательно, настоящее изобретение также относится к применению конъюгата HAS-Фактор IX для получения лекарственного средства для борьбы и профилактики геморрагических случаев у пациентов с гемофилией В (например, при врожденном дефиците фактора IX или болезни Кристмаса), включая контроль и профилактику кровотечения при хирургических вмешательствах. В контексте настоящего изобретения, термин гидроксиалкилкрахмал (HAS) относится к производному крахмала, который является замещенным по меньшей мере одной гидроксиалкильной группой. Предпочтительный гидроксиалкилкрахмал по настоящему изобретению имеет строение, соответствующее формуле (I) где восстановительный конец молекулы крахмала показан в его неокисленной форме и концевое сахаридное звено показано в виде его полуацеталя, который, в зависимости, например, от растворителя,может существовать в равновесии с его альдегидной формой. Термин гидроксиалкилкрахмал, как он использован в настоящем изобретении, не ограничен со-9 010501 единениями, в которых концевые углеводные фрагменты включают гидроксиалкильные группы R1, R2 и/или R3, как показано для краткости в формуле (I), но также относится к соединениям, в которых гделибо присутствует по меньшей мере одна гидроксиалкильная группа; либо концевой углеводный фрагмент и/или оставшаяся часть молекулы крахмала HAS', замещена гидроксиалкильными группами R1, R2 или R3. Также допустим гидроксиалкилкрахмал, включающий две или более различные гидроксиалкильные группы. По меньшей мере одна гидроксиалкильная группа, имеющаяся в HAS, может содержать две или более гидроксильных групп. В соответствии с предпочтительным вариантом осуществления, по меньшей мере одна гидроксиалкильная группа, имеющаяся в HAS, содержит одну гидроксильную группу. Выражение гидроксиалкилкрахмал также включает производные, в которых алкильная группа является моно- или полизамещенной. В данном контексте является предпочтительным, чтобы алкильная группа была замещена галогеном, особенно фтором или арильной группой. Кроме того, гидроксильная группа в гидроксиалкильной группе может быть этерифицирована с образованием сложного или простого эфира. Помимо этого, вместо алкила можно использовать линейные или разветвленные замещенные или незамещенные алкеновые группы. Гидроксиалкилкрахмал является производным, представляющим собой простой эфир крахмала. Помимо указанных простых эфиров в контексте настоящего изобретения также можно использовать другие производные крахмала. Например, можно использовать производные, которые включают этерифицированные с образованием сложного эфира гидроксильные группы. Данные производные могут, например, представлять собой производные незамещенных моно или дикарбоновых кислот, имеющих 2-12 атомов углерода или их замещенные производные. В частности, можно использовать производные незамещенных монокарбоновых кислот с 2-6 атомами углерода, в частности производные уксусной кислоты. В данном контексте предпочтительными являются ацетилкрахмал, бутирилкрахмал и пропионилкрахмал. Кроме того, предпочтительными являются производные незамещенных дикарбоновых кислот,имеющих 2-6 атомов углерода. В случае производных дикарбоновых кислот, полезно, чтобы вторая карбоксильная группа дикарбоновой кислоты также была этерифицирована. Кроме того, в контексте настоящего изобретения также можно использовать моноалкиловые эфиры дикарбоновых кислот. Для замещенных моно- или дикарбоновых кислот замещающие группы предпочтительно могут быть такими же, как отмечалось для замещенных алкильных остатков. Методы этерификации крахмала с образованием сложноэфирных производных известны в данной области (см., например, Klerom D. et al., Comprehensive Cellulose Chemistry Vol. 2, 1998, Whiley-VCH,Weinheim, New York, особенно часть 4.4, Esterification of Cellulose (ISBN3-527-29489-9). В соответствии с предпочтительным вариантом осуществления настоящего изобретения, используется гидроксиалкилкрахмал, соответствующий вышеуказанной формуле (I). В формуле (I) подробно показанное сахаридное кольцо и остатки, обозначенные как HAS', представляют вместе предпочтительную молекулу гидроксиалкилкрахмала. Другие сахаридные кольцевые структуры, включенные в HAS', могут быть такими же или могут отличаться от подробно показанного сахаридного кольца. Что касается остатков R1, R2 и R3 в соответствии с формулой (I), то здесь нет особых ограничений. В соответствии с предпочтительным вариантом осуществления R1, R2 и R3 независимо представляют собой водород или гидроксиалкильную группу, гидроксиарильную группу, гидроксиаралкильную группу или гидроксиалкарильную группу, имеющую от 2 до 10 атомов углерода в соответствующем алкильном остатке, или группу формулы (CH2CH2O)n-H, где n представляет собой целое число, предпочтительно 1,2, 3, 4, 5 или 6. Водород и гидроксиалкильные группы, имеющие от 2 до 10 атомов углерода являются предпочтительными. Более предпочтительно гидроксиалкильная группа имеет от 2 до 6 атомов углерода,более предпочтительно от 2 до 4 атомов углерода и еще более предпочтительно от 2 до 3 атомов углерода. Таким образом гидроксиалкилкрахмал предпочтительно включает гидроксиэтилкрахмал, гидроксипропилкрахмал и гидроксибутилкрахмал, где гидроксиэтилкрахмал и гидроксипропилкрахмал являются особенно предпочтительными и гидроксиэтилкрахмал является наиболее предпочтительным. Алкильная, арильная, аралкильная и/или алкарильная группа может быть линейной или разветвленной и замещенной подходящим образом. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где R1, R3 и R3 независимо представляют собой водород или линейную или разветвленную гидроксиалкильную группу, имеющую 2-6 атомов углерода. Таким образом, R1, R2 и R3 предпочтительно могут представлять собой гидроксигексил, гидроксипентил, гидроксибутил, гидроксипропил, такой как 2-гидроксипропил, 3-гидроксипропил, 2-гидроксиизопропил, гидроксиэтил, такой как 2-гидроксиэтил, водород, и 2-гидроксиэтильная группа является особенно предпочтительной. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,- 10010501 где R1, R2 и R3 независимо представляют собой водород или 2-гидроксиэтильную группу, особенно предпочтительным является вариант осуществления, где по меньшей мере один остаток R1, R2 и R3 представляет собой 2-гидроксиэтильную группу. Гидроксиэтилкрахмал (HES) является наиболее предпочтительным для всех вариантов осуществления настоящего изобретения. Следовательно, настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер представляет собой гидроксиэтилкрахмал и производное полимера представляет собой производное гидроксиэтилкрахмала. Гидроксиэтилкрахмал (HES) представляет собой производное существующего амилопектина в природе, и в организме он разлагается альфа-амилазой. HES представляет собой замещенное производное углеводного полимера амилопектина, которое присутствует в кукурузном крахмале в концентрации до 95% по массе. HES проявляет благоприятные биологические свойства и используется в качестве агента для объемной замены крови и при гемодилюционной терапии в клиниках (Sommermeyer et al., 1987,Krankenhauspharmazie, 8 (8), 271-278; и Weidler et al., 1991, Arzneim.- Forschung/Drug Res., 41, 494-498). Амилопектин состоит из фрагментов глюкозы, где в основной цепи присутствуют альфа-1,4 гликозидные связи, а в местах разветвления выявлены альфа-1,6-гликозидные связи. Физико-химические свойства данной молекулы главным образом определяются типом гликозидных связей. Благодаря гибридной альфа-1,4-гликозидной связи образуются спиральные структуры, содержащие примерно шесть мономеров глюкозы на один виток спирали. Физико-химические, а также биохимические свойства полимера могут быть модифицированы путем замещения. Введение гидроксиэтильной группы можно осуществить посредством щелочного гидроксиэтилирования. Приспосабливая соответствующим образом реакционные условия, можно использовать различную реакционную способность соответствующей гидроксильной группы в незамещенном мономере глюкозы применительно к гидроксиэтилированию. Благодаря этому, специалист в определенной степени способен влиять на характер замещения.HES характеризуется главным образом молекулярно-массовым распределением и степенью замещения. Существует две возможности описания степени замещения: 1. Степень замещения может быть описана как часть замещенных мономеров глюкозы по отношению ко всем фрагментам глюкозы. 2. Степень замещения может быть описана как молярное замещение, где указывается число гидроксиэтильных групп на фрагмент глюкозы. В контексте настоящего изобретения степень замещения, обозначенная как DS, относится к молярному замещению, как описано выше, см., также Sommermeyer et al., 1987, Krankenhauspharmazie, 8 (8),271-278, как процитировано выше, в частности на стр. 273). Растворы HES присутствуют в полидисперсных композициях, где каждая молекула отличается от другой в отношении степени полимеризации, числа и характера сайтов разветвления и характера замещения. Следовательно, HES представляет собой смесь соединений с различной молекулярной массой. Поэтому, конкретный раствор HES определяется с использованием средней молекулярной массы с помощью статистических способов. В данном контексте, Mn рассчитывается как среднее арифметическое в зависимости от числа молекул. Альтернативно, Mw (или MW), средняя масса, представляет собой единицу, которая зависит от массы HES. В контексте настоящего изобретения гидроксиэтилкрахмал предпочтительно имеет среднюю молекулярную массу (среднюю массу) от 1 до 300 кДа. Гидроксиэтилкрахмал может далее обладать предпочтительной молярной степенью замещения от 0,1 до 3, предпочтительно 0,1 до 2, более предпочтительно от 0,1 до 0,9, предпочтительно 0,1 до 0,8, и предпочтительным соотношением между С 2:С 6 замещением в диапазоне от 2 до 20 в отношении гидроксиэтильных групп. Термин средняя молекулярная масса, как он использован в контексте настоящего изобретения,относится к массе, определенной в соответствии со способом LALLS-(рассеяние света лазера под малым углом)-GPC, как описано в Sommermeyer et al., 1987, Krankenhauspharmazie, 8 (8), 271-278; и Weidler et al,1991, Arzneim.- Forschung/Drug Res., 41, 494-498. Для средней молекулярной массы 10 кДа и меньше,дополнительно проводят калибрование по стандарту, масса которого предварительно была определена с использованием LALLS-GPC. В соответствии с предпочтительным вариантом осуществления настоящего изобретения, средняя молекулярная масса используемого гидроксиэтилкрахмала составляет от 1 до 300 кДа, более предпочтительно от 2 до 200 кДа, более предпочтительно от 4 до 130 кДа, более предпочтительно от 4 до 70 кДа. Примером HES, имеющим среднюю молекулярную массу примерно 130 кДа, является HES со степенью замещения от 0,1 до 0,9, предпочтительно от 0,2 до 0,8, как например, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8, предпочтительно от 0,4 до 0,7, как например, 0,4, 0,5, 0,6 или 0,7. Примером HES, имеющим среднюю молекулярную массу примерно 130 кДа, является Voluven отFresenius. Voluven представляет собой искусственный коллоид, используемый, например, для объемного замещения, применяемого по терапевтическим показаниям для лечения и профилактики гиповолемии.Voluven характеризуется средней молекулярной массой 130 кДа +/-20000 Да, молярным замещением,- 11010501 составляющим 0,4, и соотношением С 2:C6, равным приблизительно 9:1. Следовательно, настоящее изобретение относится к способу и конъюгату, как описано выше, где гидроксиалкилкрахмал представляет собой гидроксиэтилкрахмал, имеющий среднюю молекулярную массу от 4 до 100 кДа, предпочтительно от 4 до 70 кДа. Предпочтительными диапазонами средней молекулярной массы являются, например, 4-70 кДа, или 10-70 кДа, или 12-70 кДа, или 18-70 кДа, или 50-70 кДа, или 4-50 кДа, или 10-50 кДа, или 12-50 кДа, или 18-50 кДа, или 4-18 кДа, или 10-18 кДа, или 12-18 кДа, или 4-12 кДа, или 10-121 кДа, или 4-10 кДа. В соответствии с особенно предпочтительными вариантами осуществления настоящего изобретения средняя молекулярная масса используемого гидроксиэтилкрахмала находится в диапазоне более 4 кДа и менее 70 кДа, как например примерно 10 кДа, или в диапазоне от 9 до 10 кДа, или от 10 до 11 кДа,или от 9 до 11 кДа, или примерно 12 кДа, или в диапазоне от 11 до 12 кДа, или от 12 до 13 кДа, или от 11 до 13 кДа, или примерно 18 кДа, или в диапазоне от 17 до 18 кДа, или от 18 до 19 кДа, или от 17 до 19 кДа, или примерно 50 кДа, или в диапазоне от 49 до 50 кДа, или от 50 до 51 кДа, или от 49 до 51 кДа. Что касается более высокого предела молярной степени замещения (DS), то также возможны значения вплоть до 3,0, такие как 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2,0, значения ниже 2,0 являются предпочтительными, значения ниже 1,5 являются более предпочительными, значения ниже 1,0,такие как 0,7, 0,8 или 0,9 являются еще более предпочтительными. Следовательно, предпочтительные диапазоны молярной степени замещения составляют от 0,1 до 2,или от 0,1 до 1,5, или 0,1 до 1,0, или от 0,1 до 0,9, или от 0,1 до 0,8. Более предпочтительные диапазоны молярной степени замещения составляют от 0,2 до 2, или от 0,2 до 1,5, или от 0,2 до 1,0, или от 0,2 до 0,9,или 0,2 до 0,8. Еще более предпочтительные диапазоны молярной степени замещения составляют от 0,3 до 2 или от 0,3 до 1,5, или от 0,3 до 1,0, или от 0,3 до 0,9, или от 0,3 до 0,8. Еще более предпочтительные диапазоны молярной степени замещения составляют от 0,4 до 2 или от 0,4 до 1,5, или от 0,4 до 1,0, или от 0,4 до 0,9, или от 0,4 до 0,8. Поскольку рассматривается степень замещения (DS), DS предпочтительно составляет по меньшей мере 0,1, более предпочтительно по меньшей мере 0,2, более предпочтительно по меньшей мере 0,4 и более предпочтительно по меньшей мере 0,4. Предпочтительные диапазоны DS составляют от 0,1 до 3,предпочтительно от 0,1 до 2, более предпочтительно от 0,1 до 0,9, более предпочтительно от 0,1 до 0,8,более предпочтительно от 0,2 до 0,8, более предпочтительно от 0,3 до 0,8 и даже более предпочтительно от 0,4 до 0,8, еще более предпочтительно от 0,1 до 0,7, более предпочтительно от 0,2 до 0,7, более предпочтительно от 0,3 до 0,7 и более предпочтительно от 0,4 до 0,7. Особенно предпочтительными значениями DS являются, например, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8 или 0,9, где значения 0,2, 0,3, 0,4, 0,5, 0,6,0,7 или 0,8 являются более предпочтительными, значения 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8 являются даже более предпочтительными, значения 0,4, 0,5, 0,6, 0,7 или 0,8 являются еще более предпочтительными, и,например, 0,4 и 0,7 являются особенно предпочтительными. В контексте настоящего изобретения данное значение молярной степени замещения, такое как 0,9,может представлять собой точное значение, или можно понимать, что значение находится в диапазоне от 0,85 до 0,94 или 0,8 может представлять собой точное значение, или можно понимать, что значение находится в диапазоне от 0,75 до 0,84. Следовательно, например, данное значение 0,1 может представлять собой точное значение, равное 0,1, или находиться в диапазоне от 0,05 до 0,14, данное значение 0,4 может представлять собой точное значение, равное 0,4, или находиться в диапазоне от 0,35 до 0,44, или данное значение 0,7 может представлять собой точное значение, равное 0,7, или находиться в диапазоне от 0,65 до 0,74. Особенно предпочтительными сочетаниями молекулярной массы гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала, и его степени замещения DS являются, например, 10 кДа и 0,4, или 10 кДа и 0,7, или 12 кДа и 0,4, или 12 кДа и 0,7, или 13 кДа и 0,4, или 18 кДа и 0,7, или 50 кДа и 0,4, или 50 кДа и 0,7, или 100 кДа и 0,7. Что касается рассматриваемого соотношения С 2:C6 замещения, указанное замещение находится в диапапзоне от 2 до 20, более предпочтительно в диапапзоне от 2 до 15 и еще более предпочтительно в диапазоне от 3 до 12. В соответствии со следующим вариантом осуществления настоящего изобретения, также можно использовать смеси гидроксиэтилкархмалов, имеющих различные средние молекулярные массы и/или различные степени замещения и/или различные соотношения С 2:C6 замещения. Следовательно, можно использовать смеси гидроксиэтилкархмалов, имеющих различные средние молекулярные массы и различные степени замещения и различные соотношения С 2:C6 замещения, или имеющих различные средние молекулярные массы и различные степени замещения и одинаковые или примерно одинаковые соотношения С 2:C6 замещения, или имеющих различные средние молекулярные массы и одинаковые или примерно одинаковые степени замещения и различные соотношения С 2:С 6 замещения, или имеющих одинаковые или примерно одинаковые средние молекулярные массы и различные степени замещения и различные соотношения С 2:C6 замещения, или имеющих различные средние молекулярные массы и одинаковые или примерно одинаковые степени замещения и одинаковые или примерно одинаковые соотношения С 2:C6 замещения, или имеющих одинаковые или примерно одинаковые средние молекуляр- 12010501 ные массы и одинаковые или примерно одинаковые степени замещения и одинаковые или примерно одинаковые соотношения С 2:C6 замещения, или одинаковые или примерно одинаковые средние молекулярные массы и одинаковые или примерно одинаковые степени замещения и различные соотношения С 2:C6 замещения, или имеющих примерно одинаковые средние молекулярные массы и примерно одинаковые степени замещения и примерно одинаковые соотношения С 2:C6 замещения. В различных конъюгатах и/или различных способах согласно настоящему изобретению можно использовать различные гидроксиалкилкрахмалы, предпочтительно различные гидроксиэтилкрахмалы и/или смеси различных гидроксиалкилкрахмалов, предпочтительно смеси различных гидроксиэтилкрахмалов. Реакцию восстановительного аминирования согласно изобретению, где полимер или производное полимера ковалентно связывают через по меньшей мере одну альдегидную группу по меньшей мере с одной аминогруппой белка посредством восстановительного аминирования предпочтительно проводят при температуре от 0 до 40 С, более предпочтительно от 0 до 37 С, более предпочтительно от 0 до 25 С,в частности от 4 до 21 С, но особенно предпочтительно от 0 до 21 С. Время реакции предпочтительно колеблется от 0,5 до 72 ч, более предпочтительно от 2 до 48 ч и особенно предпочтительно от 4 до 7 ч. В качестве растворителя для реакции предпочтительной является водная среда. Таким образом, настоящее изобретение также относится к способу и конъюгату, как описано выше,где восстановительное аминирование проводят при температуре от 4 до 21 С, но особенно предпочтительно от 0 до 21 С. Таким образом, настоящее изобретение также относится к способу и конъюгату, как описано выше,где восстановительное аминирование проводят в водной среде. Таким образом, настоящее изобретение также относится к способу и конъюгату, как описано выше,где восстановительное аминирование проводят при температуре от 4 до 21 С, но особенно предпочтительно от 0 до 21 С, в водной среде. Термин водная среда, как он использован в контексте настоящего изобретения, относится к растворителю или смеси растворителей, включающих воду в диапазоне по меньшей мере от 10% по весу,более предпочтительно по меньшей мере от 20% по весу, более предпочтительно по меньшей мере от 30% по весу, более предпочтительно по меньшей мере от 40% по весу, более предпочтительно по меньшей мере от 50% по весу, более предпочтительно по меньшей мере от 60% по весу, более предпочтительно по меньшей мере от 70% по весу, более предпочтительно по меньшей мере от 80% по весу, еще более предпочтительно по меньшей мере от 90% по весу до 100% по весу из расчета на вес использованных растворителей. Предпочтительной реакционной средой является вода. Значение рН реакционной среды обычно находится в диапазоне от 4 до 9, или от 4 до 8, или от 4 до 7,5, или от 4 до 7,3. В соответствии с предпочтительным вариантом осуществления настоящего изобретения, рН, при котором проводят реакцию восстановительного аминирования, составляет ниже 10, предпочтительно ниже 7,5, предпочтительно 7,3, более предпочтительно меньше или равное 7, и наиболее предпочтительно ниже 7, т.е. в кислотном диапазоне. Предпочтительные диапазоны следовательно составляют от 3 до ниже 7, более предпочтительно от 3,5 до 6,5, еще более предпочтительно от 4 до 6, еще более предпочтительно от 4,5 до 5,5 и особенно предпочтительно примерно 5,0, т.е. 4,6, или 4,7, или 4,8, или 4,9, или 5,0,или 5,1, или 5,2, или 5,3, или 5,4. Предпочтительными диапазонами, наряду с прочими являются 3-6,9, или 3-6,5, или 3-6, или 3-5,5,или 3-5, или 3-4,5, или 3-4, или 3-3,5, или 3,5-6,9, или 3,5-6,5, или 3,5-6, или 3,5-5,5, или 3,5-5, или 3,5-4,5,или 3,5-4, или 4-6,9, или 4-6,5, или 4-6, или 4-5,5, или 4-5, или 4-4,5, или 4,5-6,9 или 4,5-6,5, или 4,5-6, или 4,5-5,5, или 4,5-5, или 5-6,9, или 5-6,5, или 5-6, или 5-5,5, или 5,5-6,9, или 5,5-6,5, или 5,5-6, или 6-6,9, или 6-6,5, или 6,5-6,9. Таким образом, настоящее изобретение также относится к способу и конъюгату, как описано выше,где восстановительное аминирование проводят при рН 7 или менее, более предпочтительно при рН 6 или менее. Таким образом, настоящее изобретение также относится к способу и конъюгату, как описано выше,где восстановительное аминирование проводят при температуре от 0 до 21 С, предпочтительно от 4 до 21 С, при рН 7,5 или менее, предпочтительно 7 или менее, предпочтительно 6 или менее. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где восстановительное аминирование проводят в водной среде при рН 7 или менее, более предпочтительно при рН 6 или менее. Соответственно, настоящее изобретение также относится к способу и конъюгату, как описано выше, где восстановительное аминирование проводят при температуре от 4 до 21 С, в водной среде при рН 7 или менее, более предпочтительно при рН 6 или менее. Молярное соотношение производное полимера:белок, используемое в реакции, предпочтительно находится в диапазоне от 200:1 до 5:1, более предпочтительно от 100:1 до 10:1 и особенно предпочти- 13010501 тельно от 75:1 до 20:1. Неожиданно было установлено, что возможно, особенно в приведенных выше предпочтительных диапазонах рН, в частности при рН ниже 7 и больше или равном 4, проводить взаимодействие производного полимера главным образом по аминогруппе, расположенной на N-конце белка. Термин главным образом, как он использован в контексте настоящего изобретения, относится к варианту осуществления,где по меньшей мере 80%, предпочтительно по меньшей мере 85% доступных N-концевых аминогрупп взаимодействует в реакции восстановительного аминирования. Также возможно осуществить взаимодействие по меньшей мере 90% или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99% доступных N-концевых аминогрупп. Хотя связывание аминогрупп, отличающихся от N-концевых аминогрупп нельзя полностью регулировать,предполагается, что связывание посредством восстановительного аминирования согласно настоящему изобретению при рН ниже 7, предпочтительно ниже 6, происходит селективно по N-концевым аминогруппам. В частности, данные условия реакции являются предпочтительными для белков, которые являются стабильными при данных условиях. Если белок, например, является лабильным к действию кислот,такой как альфа 1-антитрипсин, то является предпочтительным выбирать подходящие условия реакции, в частности от рН ниже чем 7,5 до значения, превышающего 5. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где белок включает N-концевую аминогруппу и по меньшей мере одну дополнительную аминогруппу; указанный конъюгат включает полимер, который главным образом связан с N-концевой аминогруппой. В соответствии с особенно предпочтительным вариантом осуществления настоящее изобретение относится к способу связывания гидроксиалкилкрахмала, функционализированного альдегидной, кето или полуацетальной группой, или производного гидроксиалкилкрахмала, функционализированного альдегидной, кето или полуацетальной группой, с N-концевой аминогруппой белка, при этом указанный способ включает введение указанного гидроксиалкилкрахмала или его производного в реакцию восстановительного аминирования при рН 7 или менее, предпочтительно при рН 6 или менее, указанную реакцию восстановительного аминирования предпочтительно проводят в водной среде. В соответствии с настоящим изобретением гидроксиалкилкрахмал, функционализированный альдегидными группами, или производное гидроксиалкилкрахмала, функционализированное альдегидными группами, являются предпочтительными. В соответствии с еще одним предпочтительным вариантом осуществления настоящее изобретение относится к способу связывания гидроксиэтилкрахмала, функционализированного альдегидной, кето или полуацетальной группой, или производного гидроксиэтилкрахмала, функционализированного альдегидной, кето или полуацетальной группой, селективно с N-концевой аминогруппой белка, при этом указанный способ включает введение указанного гидроксиалкилкрахмала или его производного в реакцию восстановительного аминирования при рН 7 или менее, предпочтительно при рН 6 или менее, указанную реакцию восстановительного аминирования предпочтительно проводят в водной среде; используемый гидроксиэтилкрахмал предпочтительно представляет собой гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 10 кДа и DS примерно 0,4, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 10 кДа и DS примерно 0,7, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 12 кДа и DS примерно 0,4, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 12 кДа и DS примерно 0,7, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 18 кДа и DS примерно 0,4, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 18 кДа и DS примерно 0,7, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 50 кДа и DS примерно 0,4, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 50 кДа и DS примерно 0,7, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 100 кДа и DS примерно 0,7. Взаимодействие производного полимера и белка, которое протекает между альдегидной группой или кетогруппой, или группой полуацеталя и аминогруппой, представляет собой восстановительное аминирование, при котором образуется основание Шиффа. Впоследствии после взаимодействия данное основание может быть восстановлено с использованием по меньшей мере одного восстановительного агента, с образованием стабильной связи между производным полимера и белком. Также возможно проводить реакцию в присутствии по меньшей мере одного восстановительного агента. В соответствии с предпочтительным вариантом осуществления реакцию восстановительного аминирования проводят в присутствии по меньшей мере одного восстановительного агента. Предпочтительные восстановительные агенты представляют собой боргидрид натрия, цианоборгидрид натрия, органические комплексные соединения бора, такие как 4-(диметиламино)пиридинборановый комплекс, N-метилморфолин-борановый комплекс, N-фенилморфолин-борановый комплекс,лутидин-борановый комплекс, триэтиламин-борановый комплекс или триметиламин-борановый комплекс. Особенно предпочтительным является цианоборгидрид натрия. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где восстановительное аминирование проводят в присутствии NaCNBH3. Таким образом, настоящее изобретение также относится к способу и конъюгату, как описано выше,- 14010501 где восстановительное аминирование проводят в водной среде при рН 7 или менее, предпочтительно 6 или менее, в присутствии восстановительного агента, предпочтительно NaCNBH3. Соответственно, настоящее изобретение также относится к способу и конъюгату, как описано выше, где восстановительное аминирование проводят при температуре от 4 до 21 С в водной среде при рН 7 или менее, предпочтительно 6 или менее, в присутствии восстановительного агента, предпочтительноNaCNBH3. Молярное соотношение производное полимера:белок, используемое в реакции, составляет предпочтительно в диапазоне от 200:1 до 10:1, более предпочтительно от 100:1 до 10:1 и особенно предпочтительно от 75:1 до 20:1. Следовательно, настоящее изобретение также относится к способу получения конъюгата, где указанный способ включает взаимодействие полимера или производного полимера, включающего альдегидную группу в водной среде с аминогруппой белка в присутствии восстановительного агента, при этом восстановительный агент предпочтительно представляет собой NaCNBH3. В соответствии с первым предпочтительным вариантом осуществления настоящего изобретения,согласно которому полимер содержит по меньшей мере две альдегидные группы, которые вводят в полимер путем реакции окисления с раскрытием цикла, полимер предпочтительно включает по меньшей мере одну структуру, соответствующую формуле: В соответствии с данным вариантом осуществления настоящего изобретения, можно использовать отдельный окислитель или комбинацию окислителей, которые способны окислять по меньшей мере одно сахаридное кольцо полимера с образованием открытого сахаридного кольца, содержащего по меньшей мере одну, предпочтительно по меньшей мере две альдегидные группы. Данная реакция проиллюстрирована следующей реакционной схемой, на которой показано сахаридное кольцо полимера, которое окисляют с получением раскрытого кольца, имеющего две альдегидные группы: Подходящими окислителями, наряду с другими, являются периодаты, такие как периодаты щелочного металла или смеси двух или более из них, где периодат натрия и периодат калия являются предпочтительными. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где полимер подвергают реакции окисления с раскрытием цикла с использованием периодата, с образованием производного полимера, имеющего по меньшей мере одну, предпочтительно по меньшей мере две альдегидные группы. Для такой реакции окисления можно использовать полимер, содержащий восстановительный конец или в окисленном или в неокисленном виде, где неокисленная форма является предпочтительной. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где используют полимер, восстановительный конец которого находится в неокисленном виде. Температура реакции предпочтительно находится в диапазоне от 0 до 40 С, более предпочтительно от 0 до 25 С и особенно предпочтительно от 0 до 5 С. Время реакции предпочтительно колеблется от 1 мин до 5 ч и особенно предпочтительно от 10 мин до 4 ч. В зависимости от желаемой степени окисления молярное соотношение периодат:полимер может быть выбрано подходящим образом. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где реакцию окисления с раскрытием цикла проводят при температуре от 0 до 5 С. Реакцию окисления полимера периодатом предпочтительно проводят в водной среде, наиболее предпочтительно в воде. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где реакцию окисления с раскрытием цикла проводят в водной среде. Подходящее значение рН реакционной смеси можно регулировать путем доабвления по меньшей мере одного подходящего буфера. Среди предпочтительных буферов можно отметить натрийацетатный буфер, фосфатный или боратный буферы. Гидроксиэтилкрахмал, подвергаемый указанной реакции окисления с раскрытием цикла, предпочтительно представляет собой гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно- 15010501 10 кДа и DS примерно 0,4, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 10 кДа и DS примерно 0,7, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 12 кДа и DS примерно 0,4, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 12 кДа и DS примерно 0,7, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 18 кДа и DS примерно 0,4, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 18 кДа и DS примерно 0,7, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 50 кДа и DS примерно 0,4, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 50 кДа и DS примерно 0,7, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 100 кДа и DS примерно 0,7. Полученное производное полимера может быть очищено от реакционной смеси с использованием по меньшей мере одного подходящего способа. При необходимости, производное полимера может быть осаждено перед выделением с использованием по меньшей мере одного подходящего способа. Если производное полимера первоначально осаждают, это возможно, например, при контакте реакционной смеси по меньшей мере с одним растворителем, или смесью растворителей, отличающихся от растворителя или смеси растворителей, присутствующих в реакционной смеси, при подходящей температуре. В соответствии с особенно предпочтительным вариантом осуществления настоящего изобретения, где в качестве растворителя используют водную среду, предпочтительно воду, реакционную смесь приводят в контакт с 2-пропанолом или со смесью ацетона и этанола, предпочтительно смесью в соотношении 1:1 (об./об.), указывающем на равные объемы указанных соединений, при температуре предпочтительно в диапазоне от -20 до +50 С и особенно предпочтительно в диапазоне от -20 до 25 С. Выделение производного полимера можно проводить с использованием подходящего способа, который может включать одну или более стадий. В соответствии с предпочтительным вариантом осуществления настоящего изобретения, производное полимера первоначально отделяют от реакционной смеси или от смеси реакционной смеси с, например, водным 2-пропанолом, с использованием подходящего способа, такого как центрифугирование или фильтрование. На второй стадии, отделенное производное полимера может быть подвергнуто дополнительной обработке, такой как последующая обработка, как например, диализ, центрифужное фильтрование или фильтрование под давлением, ионообменная хроматография, хроматография с обращенной фазой, ВЭЖХ, МЭЖХ, гель-фильтрование и/или лиофилизация. В соответствии с еще более предпочтительным вариантом осуществления, отделенное производное полимера первоначально подвергают диализу, предпочтительно против воды, а затем лиофилизуют до тех пор, пока содержание растворителя в реакционном продукте не станет достаточно низким в соответствии с желательными характеристиками продукта. Лиофилизацию можно проводить при температуре от 20 до 35 С, предпочтительно от 20 до 30 С. В соответствии с предпочтительным вариантом окисления окисленный полимер, образующийся в результате реакции окисления, очищают с использованием по меньшей мере одного подходящего способа, такого как ультрафильтрование и/или диализ для того, чтобы, например, удалить нежелательные соли и полимерные компоненты с низкой молекулярной массой, что также дает возможность контролирования диапазона молекулярной массы окисленного полимера. Окисленный полимер можно использовать непосредственно для взаимодействия с белком или его выделяют подходящим способом на первой стадии, например, путем лиофилизации, и повторно растворяют в воде для конъюгации с белком на второй стадии. Что касается конденсации по меньшей мере одной аминогруппы белка по меньшей мере с одной альдегидной группой полимера путем восстановительного аминирования, здесь можно сделать ссылку на приведенное выше подробное описание, касающееся конкретных реакционных параметров реакции восстановительного аминирования, таких как рН и температура. В соответствии с особенно предпочтительными вариантами осуществления настоящего изобретения, в соответствии с которыми в качестве белков используют rhIL 2, rhIL 3, rhIFN альфа, rhIFN бета,rhEPO, rhAT III, rhG-CSF, BSA, миоглобин и SOD, восстановительное аминирование предпочтительно проводят при температуре от 0 до 5 С, например, примерно при 4 С и рН примерно от 4,5 до 5,5, например, примерно 5,0, при этом, время реакции составляет примерно от 20 до 30 ч, например, примерно 24 ч. В соответствии со вторым предпочтительным вариантом осуществления полимер подвергают взаимодействию, по меньшей мере, с бифункциональным соединением, включающим по меньшей мере одну функциональную группу М, способную взаимодействовать с полимером, и по меньшей мере одну функциональную группу Q, которая представляет собой альдегидную группу или кетогруппу, или группу полуацеталя, которая взаимодействует с белком при восстановительном аминировании. Предпочтительным является использование соединения, содержащего не считая альдегидной группы или кетогруппы, или группы полуацеталя, по меньшей мере одну карбоксильную группу или по меньшей мере одну реакционноспособную карбоксильную группу, предпочтительно одну карбоксильную группу или одну реакционноспособную карбоксильную группу. Альдегидная группа или кетогруппа, или группа полуацеталя и карбоксильная группа или реакционноспособная карбоксильная группа могут быть разделены любым подходящим спейсером. Среди других, спейсер может представлять собой необязательно замещенный, линейный, разветвленный и/или циклический углеводородный остаток. Обычно углеводородный остаток содержит от 1 до 60, предпочтительно от 1 до 40, более предпочти- 16010501 тельно от 1 до 20, более предпочтительно от 2 до 10, более предпочтительно от 2 до 6 и особенно предпочтительно от 2 до 4 атомов углерода. Если присутствуют гетероатомы, разделяющая группа включает обычно от 1 до 20, предпочтительно от 1 до 8 и особенно предпочтительно от 1 до 4 гетероатомов. Углеводородный остаток может включать необязательно разветвленную алкильную цепь, или арильную группу, или циклоалкильную группу, содержащую от 5 до 7 атомов углерода, или представлять собой аралкильную группу, алкарильную группу, где алкильная часть может представлять собой линейную и/или циклическую алкильную группу. В соответствии с еще более предпочтительным вариантом осуществления, углеводородный остаток представляет собой арильный остаток, имеющий от 5 до 7 и предпочтительно 6 атомов углерода. Наиболее предпочтительно углеводородный остаток представляет собой остаток бензола. В соответствии с данным предпочтительным вариантом осуществления карбоксильная группа и альдегидная группа могут быть расположены в бензольном кольце в 1,4-положении, 1,3 положении или 1,2-положении, где положение 1,4 является предпочтительным. В качестве реакционноспособной карбоксильной группы можно отметить реакционноспособный сложный эфир, изотиоцианаты и изоцианат. Предпочтительные реакционноспособные сложные эфиры являются производными N-гидроксисукцинимидов, таких как N-гидроксисукцинимид или сульфо-Nгидроксисукцинимид, подходящим образом замещенных фенолов, таких как п-нитрофенол, о,п-динитрофенол, о,о'-динитрофенол, трихлорфенол, такой как 2,4,6-трихлорфенол или 2,4,5-трихлорфенол, трифторфенол, такой как 2,4,6-трифторфенол или 2,4,5-трифторфенол, пентахлорфенол, пентафторфенол, или гидроксиазолов, таких как гидроксибензотриазол. Особенно предпочтительными являются N-гидроксисукцинимиды, где N-гидроксисукцинимид или сульфо-N-гидроксисукцинимид являются особенно предпочтительными. Все спирты можно использовать по отдельности или в виде подходящей комбинации двух или более из них. В качестве реакционноспособных сложных эфиров пентафторфениловый сложный эфир и сложный эфир N-гидроксисукцинимида являются особенно предпочтительными. Таким образом, в соответствии с предпочтительным вариантом осуществления настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер подвергают взаимодействию с формилбензойной кислотой. Согласно другому предпочтительному варианту осуществления, настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер подвергают взаимодействию с пентафторфениловым эфиром формилбензойной кислоты. В соответствии с еще одним предпочтительным вариантом осуществления настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер подвергают взаимодействию с Nгидроксисукцинимидным сложным эфиром формилбензойной кислоты. В соответствии с другим вариантом осуществления настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер подвергают взаимодействию с 4-(4-формил-3,5-диметоксифенокси)бутановой кислотой. В соответствии с другим предпочтительным вариантом осуществления настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер подвергают взаимодействию с бифункциональным соединением, которое представляетсобой биосовместимое соединение, выбранное из группы, состоящей из альфа-кетокарбоновых кислот, сиалиловых кислот или их производных и пиридоксальфосфата. Что касается альфа-кетокарбоновых кислот, то предпочтительно они представляют собой альфакетокарбоновые кислоты, полученные из аминокислот, и в большинстве случаев они также могут быть выявлены в организме человека. Предпочтительные альфа-кетокарбоновые кислоты, полученные из аминокислот, выбирают из группы, состоящей из кето-валина, кето-лейцина, кето-изолейцина и кетоаланина. Карбоксильная группа альфа-кетокарбоновых кислот ваимодействует с группой Q полимера,представляющей собой аминогруппу. При этом образуется амидная группа. Оставшаяся свободная кетогруппа альфа-кетокарбоновой кислоты затем может быть подвергнута взаимодействию с функциональной группой белка, в частности с аминогруппой. Таким образом, образуется иминогруппа, которая может быть прогидрирована. Соответственно, настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер взаимодействует с альфа-кетокарбоновой кислотой. Что касается сиалиловых кислот или их производных, они предпочтительно являются биосовместимыми, в частности, они представляют собой сахара, найденные в организме человека, которые являются N- и/или О-ацетилированными. В предпочтительном варианте осуществления, сиалиловые кислоты представляют собой N-ацетилированные нейраминовые кислоты. Данные соединения обладают желательной жесткостью для выполнения функции в качестве спейсера благодаря структуре пиранозы. С другой стороны, в данные соединения посредством селективного окисления можно ввести альдегидную группу. Сиалиловые кислоты выявлены в организме человека, например, в качестве концевых моносахаридов в гликановых цепях гликозилированных белков. В предпочтительном варианте осуществления, сиалиловая кислота может быть селективно окислена с образованием альдегидной группы. Способы селективного окисления сиалиловых кислот известны в данной области, смотри, напри- 17010501 мер, L. W. Jaques, В. F. Riesco, W. Weltner, Carbohydrate Research, 83 (1980), 21-32 и Т. Masuda, S. Shibuya, M. Arai, S. Yoshida, T. Tomozawa, A. Oleo,M. Yamashita, T. Honda, BioorganicS Medicinal ChemistryLetters, 13 (2003), 669-673. Предпочтительно окисление сиалиловой кислоты может быть проведено перед взаимодействием с аминогруппой полимера. Необязательно окисленная сиалиловая кислота затем может быть подвергнута взаимодействию по группе карбоновой кислоты с аминогруппой полимера. Полученные соединения будут содержать альдегидную группу, которая далее может быть подвергнута восстановительному аминированию с аминогруппой белка. Соответственно, настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер взаимодействует с необязательно окисленной сиалиловой кислотой. Что касается пиридоксальфосфата (РуР), он представляет собой высоко биосовместимое бифункциональное соединение и также называется витамин В 6. РуР представляет собой кофермент, который участвует в реакциях трансаминирования, декарбоксилирования, рацемизации и многочисленных модификациях боковых цепей аминокислот. Все требующие присутствия РуР ферменты действуют через образование оснований Шиффа между аминокислотой и коферментом. Фосфатная группа РуР может быть подвергнута взаимодействию с аминогруппой полимера, предпочтительно гидроксиалкилкрахмала, в частности гидроксиэтилкрахмала, с образованием фосфорамида. Альдегидная группа РуР затем может быть подвергнута взаимодействию с аминогруппой белка с образованием основания Шиффа, которое затем может быть восстановлено. В предпочтительном варианте осуществления, структура конъюгата представляет собой HES-NH-P(О)2-O-(пиридоксаль)-CH-NH-белок. В случае РуР, функциональную группу полимера предпочтительно вводят в полимер с использованием диаминосоединения, как описано выше. Соответственно, настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер взаимодействует с пиридоксальфосфатом. Гидроксиэтилкрахмал, подвергаемый взаимодействию с соединением, включающим М, где М предпочтительно представляет собой карбоксильную группу или реакционнноспособную карбоксильную группу, a Q представляет собой альдегидную группу или кетогруппу или группу полуацеталя; наиболее предпочтительно представляет собой гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 10 кДа и DS примерно 0,7. Также возможно использование гидроксиэтилкрахмалов, имеющих среднюю молекулярную массу примерно 10 кДа и DS примерно 0,4 или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 12 кДа и DS примерно 0,4, или гидроксиэтилкрахмала,имеющего среднюю молекулярную массу примерно 12 кДа и DS примерно 0,7, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 18 кДа и DS примерно 0,4, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 18 кДа и DS примерно 0,7, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 50 кДа и DS примерно 0,4, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 50 кДа и DS примерно 0,7, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 100 кДа и DS примерно 0,7. Особенно предпочтительно применение гидроксиалкилкрахмала и еще более предпочтительно гидроксиэтилкрахмала, имеющего восстановительный конец в виде его окисленной формы. Полученное производное полимера, содержащее альдегидную группу или кетогруппу, или группу полуацеталя, впоследствии подвергают взаимодействию с аминогруппой белка посредством восстановительного аминирования. Что касается конденсации по меньшей мере одной аминогруппы белка с по меньшей мере одной альдегидной группой или кетогруппой, или группой полуацеталя полимера при восстановительном аминировании, то здесь следует сослаться на приведенное выше подробное описание, касающееся конкретных реакционных параметров реакции восстановительного аминирования, таких как рН и температура. В соответствии с особенно предпочтительным вариантом осуществления настоящего изобретения, в соответствии с которым в качестве белка используется G-CSF, взаимодействие с аминогруппой белка предпочтительно проводят при температуре от от 0 до 40 С, более предпочтительно от 0 до 25 С и особенно предпочтительно от 4 до 21 С. Время реакции предпочтительно колеблется в диапазоне от 30 мин до 72 ч, более предпочтительно от 2 до 48 ч и особенно предпочтительно от 4 ч до 17 ч. В качестве растворителя для реакции предпочтительной является водная среда. Значение рН реакционной среды предпочтительно находится в диапазоне от 4 до 9, более предпочтительно от 4 до 8 и особенно предпочтительно от 4,5 до 5,5. В соответствии с третьим предпочтительным вариантом осуществления, полимер подвергают взаимодействию по его необязательно окисленному восстановительному концу по меньшей мере с бифункциональным соединением, включающим аминогруппу М и функциональную группу Q, где указанная аминогруппа М взаимодействует с необязательно окисленным восстановительным концом полимера, и где функциональную группу Q модифицируют химически для получения производного полимера, функционализированного альдегидными группами, которое подвергают взаимодействию с аминогруппой белка путем восстановительного аминирования. Термин полимер подвергают взаимодействию по его восстановительному концу или полимер подвергают взаимодействию по его окисленному восстановительному концу, как он использован в кон- 18010501 тексте настоящего изобретения, может относиться к способу, в соответствии с которым гидроксиалкилкрахмал реагирует главным образом за счет его (селективно окисленного) восстановительного конца. Полимер представляет собой гидроксиалкилкрахмал, в частности гидроксиэтилкрахмал. Термин главным образом за счет его (селективно окисленного) восстановительного конца относится к способам, в соответствии с которыми статистически более чем 50%, предпочтительно по меньшей мере 55%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 65%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, и еще более предпочтительно по меньшей мере 95%, как например 95%,96%, 97%, 98%, или 99% молекул полимера, используемого для данной реакции взаимодействует за счет по меньшей мере одного (селективно окисленного) восстановительного конца на молекулу полимера,при этом данная молекула полимера, которая взаимодействует посредством по меньшей мере одного восстановительного конца, может в той же самой реакции реагировать по меньшей мере по одной дополнительной функциональной группе, которая содержится в указанной молекуле полимера, и которая не является восстановительным концом. Если одна или несколько молекул полимера реагируют по меньшей мере по одному восстановительному концу и одновременно по меньшей мере по одной дополнительной подходящей функциональной группе, которая содержится в данной(ых) молекуле(ах) полимера и которая не является его восстановительным концом, статистически предпочтительно, чтобы более чем 50%,предпочтительно по меньшей мере 55%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 65%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, и еще более предпочтительно по меньшей мере 95%, например, 95, 96, 97, 98 или 99% всех взаимодействующих функциональных групп, где указанные функциональные группы включают восстановительные концы, представляли бы собой восстановительные концы. Термин восстановительный конец, как он использован в контексте настоящего изобретения, относится к концевой альдегидной группе молекулы полимера, которая может присутствовать в виде альдегидной группы и/или в виде соответствующего ацеталя. В случае, когда восстановительный конец является окисленным, альдегидная и ацетальная группа находятся в виде карбоксильной группы и/или в виде соответствующего лактона. Что касается функциональной группы Q, наряду с прочими можно отметить следующие функциональные группы: двойные С-С-связи или тройные С-С-связи, или ароматические С-С-связи; тиогруппу или гидроксильные группы; гидразидалкилсульфоновой кислоты; гидразидаарилсульфоновой кислоты; 1,2-диолы; 1,2-аминотиоспирты; азиды; 1,2-аминоспирты; аминогруппу -NH; или производные аминогрупп, включающие структурное звено -NH-, таких как аминоалкильные группы, аминоарильная группа, аминоаралкильные группы или алкариламино группы; гидроксиламиногруппу -O-NH2 или производные гидроксиаминогруппы, включающие структурное звено -O-NH-, такие как гидроксилалкиламиногруппы, гидроксилариламиногруппы, гидроксиларалкиламиногруппы или гидроксилалкариламиногруппы; алкоксиаминогруппы, арилоксиаминогруппы, аралкилоксиаминогруппы или алкарилоксиамино группы, каждая из которых включает структурное звено -NH-O-; остатки, имеющие карбонильную группу, -Q-C(=G)-M, где G представляет собой О или S, и М представляет собой, например,-ОН или -SH; алкоксильную группу, арилоксигруппу, аралкилоксигруппу или алкарилоксигруппу; алкилтиогруппу, арилтиогруппу, аралкилтиогруппу или алкарилтиогруппу; алкилкарбонилоксигруппу, арилкарбонилоксигруппу, аралкилкарбонилоксигруппу, алкарилкарбонилоксигруппу; активированные сложные эфиры, такие как сложные эфиры гидроксиламинов, имеющие имидную структуру, такую как N-гидроксисукцинимид, или имеющие структурное звено O-N, где N представляет собой часть гетероарильного соединения, или когда G = О и Q отсутствует, такие арилокси соединения с замещенным арильным остатком как пентафторфенил, паранитрофенил или трихлорфенил; где Q отсутствует или представляет собой NH или гетероатом, такой как S или О;- 19010501 карбонильные группы, такие как альдегидная группа или кетогруппа; карбоксильную группу; группы -N=C=O или группы -N=C=S; винилгалогенидные группы, такие как винилиодидная или винилбромидная группа или трифлат;- группу В соответствии с предпочтительным вариантом осуществления настоящего изобретения термин функциональная группа Q относится к функциональной группе Q, которая включает химическую структуру -NH-, например -NH2, или производное аминогруппы, включающее структурное звено -NH-,такое как аминоалкильная группа, аминоаралкильные группы или алкариламиногруппы. В соответствии с одним предпочтительным вариантом осуществления настоящего изобретения функциональная группа М представляет собой группу, имеющую структуру R'-NH-, где R' представляет собой водород или алкильный, циклоалкильный, арильный, аралкильный, арилциклоалкильный, алкарильный или циклоалкиларильный остаток, где циклоалкильный, арильный, аралкильный, арилциклоалкильный, алкарильный или циклоалкиларильный остаток могут быть непосредственно связаны с группойNH или, в соответствии с другим вариантом осуществления, могут быть связаны посредством кислородного мостика с группой NH. Алкильный, циклоалкильный, арильный, аралкильный, арилциклоалкильный, алкарильный или циклоалкиларильный остатки могут быть подходящим образом замещенными. Что касается предпочтительных заместителей, то здесь можно отметить галогены, такие как F, Cl или Br. Особенно предпочтительные остатки R' представляют собой водород, алкильную и алкоксильную группы, и еще более предпочтительно представляют собой водород и незамещенную алкильную и алкоксильную группы. Среди алкильных и алкоксильных групп, группы, содержащие 1, 2, 3, 4, 5, или 6 атомов С, являются предпочтительными. Более предпочтительными являются метильная, этильная, пропильная, изопропильная, метоксильная, этоксильная, пропоксильная и изопропоксильная группы. Особенно предпочтительными являются метил, этил, метокси, этокси, и особое предпочтение отдается метилу или метокси. В соответствии с другим вариантом осуществления настоящего изобретения, функциональная группа М имеет структуру R'-NH-R"-, где R" предпочтительно включает структурное звено -NH- и/или структурное звено -(C=G)-, где G представляет собой О или S, и/или структурное звено SO2;-. Конкретными примерами функциональной группы R" являются и где если G присутствует дважды, то он независимо представляет собой О или S. Таким образом, настоящее изобретение также относится к способу и конъюгатам, как отмечено выше, где функциональную группу М выбирают из группы, состоящей из где G представляет собой О или S, и, если присутствует дважды, независимо представляет собой О или S, и R' представляет собой метил. В соответствии с особенно предпочтительным вариантом осуществления настоящего изобретения функциональная группа М представляет собой аминогруппу -NH2. В соответствии с первой альтернативой, функциональная группа М, представляющая собой аминогруппу -NH2, взаимодействует с окисленным восстановительным концом полимера, приводя к связыва- 20010501 нию полимера и соединения, включающего группы М и Q посредством амидной связи. В соответствии со второй альтернативой, функциональная группа М, представляющая собой аминогруппу -NH2, взаимодействует с окисленным восстановительным концом полимера посредством восстановительного аминирования, приводя к образованию иминогруппы, которую впоследствии предпочтительно гидрируют с получением аминогруппы, иминогруппа и аминогруппа, соответственно, связывают полимер и соединение, включающее группы М и Q. В данном случае возможно, чтобы функциональная группа Q представляла собой аминогруппу. В том случае, если полученное производное полимера будет подвергнуто последующей реакции по меньшей мере с бифункцональным соединением с участием карбоксильной группы или реакционноспособной карбоксильной группы, как описано далее,или другой группы по меньшей мере бифункционального соединения, которую нужно подвергнуть взаимодействию с аминогруппой, является предпочтительным, чтобы соединение, включающее М и Q,представляло собой первичный амин, который содержит в качестве функциональной группы только одну аминогруппу. В данном конкретном случае, хотя соединение содержит только одну функциональную группу, оно рассматривается как бифункциональное соединение, включающее М и Q, где М представляет собой аминогруппу, содержащуюся в соединении, которое подвергли восстановительному аминированию по восстановительному концу полимера, и где Q представляет собой вторичную аминогруппу,возникающую в результате восстановительного аминирования и последующего гидрирования. В соответствии с третьей альтернативой, неокисленный восстановительный конец полимера подвергают взаимодействию с аммиаком посредством восстановительного аминирования, приводящего к образованию концевой аминигруппы полимера, которую впоследствии предпочтительно гидрируют с получением терминальной аминогруппы полимера и, таким образом, получают терминальную первичную аминогруппу. В данном конкретном случае аммиак рассматривают как бифункциональное соединение, включающее М и Q, где М представляет собой NH2, содержащуюся в используемом аммиаке, и гдеQ представляет собой первичную аминогруппу, возникающую в результате восстановительного аминирования и последующего гидрирования. Термин аминогруппа Q относится к функциональной группе Q, которая включает химическую структуру NH-, например -NH2, или к производному аминогруппу, включающему структурное звено-NH-, такому как аминоалкильные группы, аминоарильная группа, аминоаралкильная группа или алкариламино группы. В соответствии с предпочтительным вариантом осуществления настоящего изобретения, функциональная группа Q представляет собой группу, имеющую структуру R'-NH-, где R' представляет собой водород или алкильный, циклоалкильный, арильный, аралкильный, арилциклоалкильный, алкарильный или циклоалкиларильный остаток, где циклоалкильный, арильный, аралкильный, арилциклоалкильный,алкарильный или циклоалкиларильный остаток может быть связан непосредственно с группой NH или, в соответствии с другим вариантом осуществления, могут быть связаны посредством кислородного мостика с группой NH. Алкильный, циклоалкильный, арильный, аралкильный, арилциклоалкильный, алкарильный или циклоалкиларильный остатки могут быть подходящим образом замещенными. Что касается предпочтительных заместителей, то здесь можно отметить галогены, такие как F, Cl или Br. Особенно предпочтительные остатки R' представляют собой водород, алкильную и алкоксильную группы, и еще более предпочтительно представляют собой водород и незамещенную алкильную и алкоксильную группы. Среди алкильных и алкоксильных групп, группы, содержащие 1, 2, 3, 4, 5, или 6 атомов С, являются предпочтительными. Более предпочтительными являются метильная, этильная, пропильная, изопропильная, метоксильная, этоксильная, пропоксильная и изопропоксильная группы. Особенно предпочтительными являются метил, этил, метокси, этокси, и особое предпочтение отдается метилу или метокси. В соответствии с другим вариантом осуществления настоящего изобретения, функциональная группа Q имеет структуру R'-NH-R"-, где R" предпочтительно включает структурное звено -NH- и/или структурное звено -(C=G)-, где G представляет собой О или S, и/или структурное звено -SO2-. В соответствии с более предпочтительными вариантами осуществления, функциональную группу R" выбирают из группы, состоящей из где если G присутствует дважды, то он независимо представляет собой О или S. Следовательно, настоящее изобретение также относится к способу и конъюгату, как отмечено выше, где функциональную группу Q выбирают из группы, состоящей из где G представляет собой О или S, и, если присутствует дважды, независимо представляет собой О или S, и R' представляет собой метил.- 21010501 В соответствии с особенно предпочтительным вариантом осуществления настоящего изобретения,функциональная группа Q представляет собой аминогруппу -NH2. В соответствии со следующим предпочтительным вариантом осуществления настоящего изобретения, оба М и Q включают аминогруппу -NH-. В соответствии с особенно предпочтительным вариантом осуществления, оба М и Q представляют собой аминогруппу -NH2. В соответствии с предпочтительным вариантом осуществления настоящего изобретения, соединение, включающее М и Q, представляет собой гомобифункциональное соединение, более предпочтительно гомобифункциональное соединение, включающее в качестве функциональных групп М и Q наиболее предпочтительно аминогруппу -NH2, или в соответствии с другими вариантами осуществления, гидроксиламиногруппу -О-NH2 или группу где G предпочтительно представляет собой О. Конкретными примерами данных соединений, включающих М и Q являются или Гидроксиэтилкрахмал, который подвергают взаимодействию с соединением, включающим М, где М предпочтительно представляет собой аминогруппу -NH-, и более предпочтительно представляет собой аминогруппу -NH2, еще более предпочтительно оба М и Q включают аминогруппу -NH-, и особенно предпочтительно оба М и Q включают аминогруппу -NH2, предпочтительно представляет собой гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 10 кДа и DS примерно 0,4, или гидроксиэтилкрахмал, имеющий среднюю молекулярную массу примерно 10 кДа и DS примерно 0,7. Также возможно использованием гидроксиэтилкрахмалов, имеющих среднюю молекулярную массу примерно 12 кДа и DS примерно 0,4, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 12 кДа и DS примерно 0,7, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 18 кДа и DS примерно 0,4, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 18 кДа и DS примерно 0,7, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 50 кДа и DS примерно 0,4 или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 50 кДа и DS примерно 0,7, или гидроксиэтилкрахмала, имеющего среднюю молекулярную массу примерно 100 кДа и DS примерно 0,7. В том случае, когда оба М и Q представляют собой аминогруппу -NH2, M и Q могут быть разделены любым подходящим спейсером. Среди других, спейсер может представлять собой необязательно замещенный, линейный, разветвленный и/или циклический углеводородный остаток. Обычно углеводородный остаток содержит от 1 до 60, предпочтительно от 1 до 40, более предпочтительно от 1 до 20, более предпочтительно от 2 до 10, более предпочтительно от 2 до 6 и особенно предпочтительно от 2 до 4 атомов углерода. Если присутствуют гетероатомы, разделяющая группа включает обычно от 1 до 20, предпочтительно от 1 до 8 и особенно предпочтительно от 1 до 4 гетероатомов. Углеводородный остаток может включать необязательно разветвленную алкильную цепь, или арильную группу, или циклоалкильную группу, например, содержащую от 5 до 7 атомов углерода, или представлять собой аралкильную группу, алкарильную группу, где алкильная часть может представлять собой линейную и/или циклическую алкильную группу. В соответствии с еще более предпочтительным вариантом осуществления, уг- 22010501 леводородный остаток представляет собой алкильную цепь, содержащую от 1 до 20, предпочтительно от 2 до 10, более предпочтительно от 2 до 6 и особенно предпочтительно от 2 до 4 атомов углерода. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где полимер взаимодействует с 1,4-диаминобутаном, 1,3-диаминопропаном или 1,2-диаминоэтаном, образуя производное полимера. Взаимодействие по меньшей мере бифункционального соединения, включающего М и Q, с полимером предпочтительно проводят при температуре от 0 до 100 С, более предпочтительно от 4 до 80 С и особенно предпочтительно от 20 до 80 С; время реакции предпочтительно колеблется от 4 ч до 7 дней,более предпочтительно от 10 ч до 5 дней и особенно предпочтительно от 17 до 4 ч. Молярное соотношение, по меньшей мере, бифункциональное соединение:полимер предпочтительно находится в диапазоне от 10 до 200, в частности от 50 до 100. Растворитель для реакции, по меньшей мере, бифункционального соединения с полимером предпочтительно представляет собой по меньшей мере один апротонный растворитель, предпочтительно безводный апротонный растворитель, имеющий содержание воды не более чем 0,5 процента по весу, предпочтительным является содержание воды не более чем 0,1 процента по весу. Подходящими растворителямиявляются, наряду с прочими, диметилсульфоксид (ДМСО), N-метилпирролидон, диметилацетамид(ДМА), диметилформамид (ДМФ) и смеси двух или более из них. В качестве растворителя для реакции, по меньшей мере, бифункционального соединения с полимером также можно использовать водную среду. В соответствии с предпочтительным вариантом осуществления производное полимера, включающее полимер и, по меньшей мере, бифункциональное соединение, химически модифицируют по свободной функциональной группе Q с получением производного полимера, включающим альдегидную группу или кетогруппу, или группу полуацеталя. В соответствии с этим вариантом осуществления является предпочтительным подвергнуть производное полимера взаимодействию с по меньшей мере одним бифункциональным соединением, которое содержит функциональную группу, способную взаимодействовать с функциональной группой Q, и альдегидную группу или кетогруппу, или группу полуацеталя. В качестве, по меньшей мере, бифункционального соединения подходящим является каждое соединение, которое содержит альдегидную группу или кетогруппу, или группу полуацеталя, и по меньшей мере одну функциональную группу, которая способна образовывать связь с функциональной группой Q производного полимера. По меньшей мере одну функциональную группу выбирают из того же набора функциональных групп, что и Q, и выбирают так, чтобы она была способна взаимодействовать с Q. В предпочтительном случае Q представляет собой аминогруппу -NH2, или производное аминогруппы,включающее структурное звено -NH-, такое как аминоалкильные группы, аминоарильная группа, аминоаралкильные группы, или алкариламино группы. Предпочтительным является использование соединения, содержащего, не считая альдегидной группы или кетогруппы, или группы полуацеталя, по меньшей мере одну карбоксильную группу или по меньшей мере одну реакционноспособную карбоксильную группу, предпочтительно одну карбоксильную группу или одну реакционноспособную карбоксильную группу. Альдегидная группа или кетогруппа, или группа полуацеталя и карбоксильная группа или реакционноспособная карбоксильная группа могут быть разделены любым подходящим спейсером. Среди других, спейсер может представлять собой необязательно замещенный, линейный, разветвленный и/или циклический углеводородный остаток. Обычно углеводородный остаток содержит от 1 до 60, предпочтительно от 1 до 40, более предпочтительно от 1 до 20, более предпочтительно от 2 до 10, более предпочтительно от 2 до 6 и особенно предпочтительно от 2 до 4 атомов углерода. Если присутствуют гетероатомы, разделяющая группа включает обычно от 1 до 20, предпочтительно от 1 до 8 и особенно предпочтительно от 1 до 4 гетероатомов. Углеводородный остаток может включать необязательно разветвленную алкильную цепь, или арильную группу, или циклоалкильную группу, содержащую от 5 до 7 атомов углерода, или представлять собой аралкильную группу, алкарильную группу, где алкильная часть может представлять собой линейную и/или циклическую алкильную группу. В соответствии с предпочтительным вариантом осуществления, углеводородный остаток представляет собой алкильную группу, содержащую от 2 до 6 и предпочтительно от 2 до 4 атомов углерода. Также возможно, чтобы между альдегидной или кетогруппой и карбоксильной группой атома углерода не присутствовал. Альтернативно, углеводородный остаток может представлять собой замещенную или незамещенную циклическую углеводородную группу, содержащую от 3 до 11 атомов углерода, предпочтительно от 3 до 6 или от 3 до 5 атомов углерода. Когда циклическая углеводородняа группа является замещенной, заместитель может быть выбран из группы, состоящей из замещенных или незамещенных амино или алкоксильных групп. Число заместителей, если они присутствуют, предпочтительно составляет от 1 до 3. Кроме того, алкильная и/или циклическая углеводородная группа может содержать один или несколько гетероатомов, таких как О или S, в частности О. В таком случае предпочтительно присутствует от 1 до 3, в частности 1 или 2 гетероатома. Предпочтительными соединениями в данном контексте являются те, которые выбраны из следующей группы соединений.R= H, алкил, арил, ацил, SiR'3 R' = алкил, арил. В соответствии с еще более предпочтительным вариантом осуществления, углеводородный остаток представляет собой арильный остаток, имеющий от 5 до 7 и предпочтительно 6 атомов углерода. Наиболее предпочтительно углеводородный остаток представляет собой остаток бензола. В соответствии с данным предпочтительным вариантом осуществления карбоксильная группа и альдегидная группа могут быть расположены в бензольном кольце в 1,4-положении, 1,3-положении или 1,2-положении, где положение 1,4 является предпочтительным. В качестве реакционноспособной карбоксильной группы можно отметить реакционноспособный сложный эфир, изотиоцианаты и изоцианаты. Предпочтительные реакционноспособные сложные эфиры являются производными N-гидроксисукцинимидов, таких как N-гидроксисукцинимид или сульфо-Nгидроксисукцинимид, подходящим образом замещенных фенолов, таких как п-нитрофенол, о,пдинитрофенол, о,о'-динитрофенол, трихлорфенол, такой как 2,4,6-трихлорфенол или 2,4,5-трихлорфенол,трифторфенол, такой как 2,4,6-трифторфенол или 2,4,5-трифторфенол, пентахлорфенол, пентафторфенол, или гидроксиазолов, таких как гидроксибензотриазол. Особенно предпочтительными являются Nгидроксисукцинимиды, где N-гидроксисукцинимид или сульфо-N-гидроксисукцинимид являются особенно предпочтительными. Все спирты можно использовать по отдельности или в виде подходящей комбинации двух или более из них. В качестве реакционноспособных сложных эфиров пентафторфениловый сложный эфир и сложный эфир N-гидроксисукцинимида являются особенно предпочтительными. В соответствии с конкретным вариантом осуществления функциональная группа, которая способна образовывать химическую связь с функциональной группой Q, где Q предпочтительно представляет собой NH2 или производное аминогруппы, включающее структурное звено -NH-, такое как аминоалкильные группы, аминоарильная группа, аминоаралкильные группы или алкариламиногруппы, в частности представляет собой NH2, представляет собой реакционноспособную карбоксильную группу. В данном случае функциональную группу, которая способна образовывать химическую связь с функциональной группой Q, и которая представляет собой карбоксильную группу, подходящим образом подвергают взаимодействию с получением реакционноспособной карбоксильной группы. Следовательно, предпочтительным является подвергание взаимодействию по меньшей мере одного по меньшей мере бифункционального соединения, которое включает карбоксильную группу и альдегидную группу, или кетогруппу или группу полуацеталя, в котором карбоксильная группа преобразуется в реакционноспособную карбоксильную группу и полученное по меньшей мере бифункциональное соединение очищают и подвергают взаимодействию с функциональной группой Q производного полимера. Конкретными примерами по меньшей мере бифункционального соединения, включающего карбоксильную группу, которое может быть подвергнуто взаимодействию для получения реакционноспособной карбоксильной группы, являются соединения 1-11 из вышеуказанного списка. В данном контексте, термин карбоксильная группа также относится к лактону и внутреннему ангидриду дикарбоновой кислоты. Таким образом, согласно предпочтительному варианту осуществления настоящее изобретение относится к способу и конъюгату, как описано выше, где производное полимера, включающее Q, где Q представляет собой NH- или производное аминогруппы, включающее структурное звено -NH-, такое как аминоалкильные группы, аминоарильная группа, аминоаралкильные группы или алкариламино группы дополнительно подвергают взаимодействию с формилбензойной кислотой. В соответствии с другим вариантом осуществления, настоящее изобретение относится к способу и- 24010501 конъюгату, как описано выше, где производное полимера, включающее Q, где Q представляет собой аминогруппу, дополнительно подвергают взаимодействию с пентафторфениловым эфиром формилбензойной кислоты. В соответствии с другим вариантом осуществления, настоящее изобретение относится к способу и конъюгату, как описано выше, где производное полимера, включающее Q, где Q представляет собой аминогруппу, дополнительно подвергают взаимодействию с N-гидроксисукцинимидным эфиром формилбензойной кислоты. В соответствии с еще одним вариантом осуществления, настоящее изобретение относится к способу и конъюгату, как описано выше, где производное полимера, включающее Q, где Q представляет собой аминогруппу, дополнительно подвергают взаимодействию с 4-(4-формил-3,5-диметоксифенокси) бутановой кислотой. Согласно другому предпочтительному варианту осуществления, настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер подвергают взаимодействию с бифункциональным соединением, которое представляет собой биосовместимое соединение, выбранное из группы, состоящей из альфа-кетокарбоновых кислот, сиалиловых кислот или их производных и пиридоксальфосфата. Что касается альфа-кетокарбоновых кислот, то предпочтительно они представляют собой альфакетокарбоновые кислоты, полученные из аминокислот, и в большинстве случаев они также могут быть выявлены в организме человека. Предпочтительные альфа-кетокарбоновые кислоты, полученные из аминокислот, выбирают из группы, состоящей из кето-валина, кето-лейцина, кето-изолейцина и кето-аланина. Карбоксильная группа альфа-кетокарбоновых кислот ваимодействует с группой Q полимера, представляющей собой аминогруппу. При этом образуется амидная группа. Оставшаяся свободная кетогруппа альфа-кетокарбоновой кислоты затем может быть подвергнута взаимодействию с функциональной группой белка, в частности с аминогруппой. Таким образом, образуется иминогруппа, которая может быть подвергнута гидрированию. Соответственно, настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер взаимодействует с альфа-кетокарбоновой кислотой. Что касается сиалиловых кислот или их производных, они предпочтительно являются биосовместимыми, в частности, они представляют собой сахара, найденные в организме человека, которые являются N- и/или О-ацетилированными. В предпочтительном варианте осуществления, сиалиловые кислоты представляют собой N-ацетилированные нейраминовые кислоты. Данные соединения обладают желательной жесткостью для выполнения функции в качестве спейсера благодаря структуре пиранозы. С другой стороны, в данные соединения посредством селективного окисления можно ввести альдегидную группу. Сиалиловые кислоты выявлены в организме человека, например, в качестве концевых моносахаридов в гликановых цепях гликозилированных белков. В предпочтительном варианте осуществления, сиаловая кислота может быть селективно окислена с образованием альдегидной группы. Способы селективного окисления сиалиловых кислот известны в данной области, например, из публикаций L. W. Jaques, B. F. Riesco, W. Weltner, Carbohydrate Research, 83 (1980), 21-32 и Т. Masuda, S.Chemistry Letters, 13 (2003), 669-673. Предпочтительно окисление сиалиловой кислоты может быть проведено перед взаимодействием с аминогруппой полимера. Необязательно окисленная сиалиловая кислота затем может быть подвергнута взаимодействию по группе карбоновой кислоты с аминогруппой полимера. Полученные соединения содержат альдегидную группу, которая далее может взаимодействовать с аминогруппой белка при восстановительном аминировании. Соответственно, настоящее изобретение относится к способу и конъюгату, как описано выше, где полимер взаимодействует с необязательно окисленной сиалиловой кислотой. Что касается пиридоксальфосфата (РуР), он представляет собой высоко биосовместимое бифункциональное соединение и также называется витамин В 6. РуР представляет собой кофермент, который участвует в реакциях трансаминирования, декарбоксилирования, рацемизации и многочисленных модификациях боковых цепей аминокислот. Все требующие присутствия РуР ферменты действуют через образование оснований Шиффа между аминокислотой и коферментом. Фосфатная группа РуР может быть подвергнута взаимодействию с аминогруппой полимера, предпочтительно гидроксиалкилкрахмала, в частности гидроксиэтилкрахмала, с образованием фосфорамида. Альдегидная группа РуР затем может быть подвергнута взаимодействию с аминогруппой белка с образованием основания Шиффа, которое затем может быть восстановлено. В предпочтительном варианте осуществления, структура конъюгата представляет собой HES-NH-P(О)2-O-(пиридоксаль)-CH-NH-белок. В случае РуР, функциональную группу полимера предпочтительно вводят в полимер с использованием диаминосоединения, как описано выше. Соответственно, настоящее изобретение относится к способу и конъюгату, как описано выше, где- 25010501 полимер взаимодействует с пиридоксальфосфатом. В качестве растворителя для реакции производного полимера, включащего аминогруппу, например,с формилбензойной кислотой, предпочтительным является по меньшей мере один апротонный растворитель или по меньшей мере один полярный растворитель. Подходящими растворителями являются, наряду с прочими, диметилсульфоксид (ДМСО), N-метилпирролидон, диметилацетамид (ДМА), диметилформамид (ДМФ) и смеси двух или более из них. В качестве растворителя для реакции производного полимера, включащего аминогруппу, по меньшей мере, с бифункциональным соединением, включающим карбоксильную группу, также можно использовать водную среду. Термин водная среда, как он использован в контексте настоящего изобретения, относится к растворителю или к смеси растворителей, включающих воду в диапазоне от по меньшей мере 10% по весу, или по меньшей мере 20% по весу, или по меньшей мере 30% по массе, или по меньшей мере 40% по массе, или по меньшей мере 50% по массе, или по меньшей мере 60% по массе, или по меньшей мере 70% по массе, или по меньшей мере 80% по массе, или по меньшей мере 90% по массе,или до 100% по массе из расчета на массу включенных растворителей. Реакцию предпочтительно проводят при температуре от 0 до 40 С, более предпочтительно от 0 до 25 С и особенно предпочтительно от 15 до 25 С в течение времени реакции предпочтительно от 0,5 до 24 ч и особенно предпочтительно от 1 до 17 ч. В соответствии с предпочтительным вариантом осуществления реакцию проводят в присутствии активирующего агента. Подходящими активирующими агентами, наряду с прочими, являются карбодиимиды, такие как диизопропилкарбодиимид (DIC), дициклогексилкарбодиимид (DCC), 1-этил-3-(3 диметиламинопропил)карбодиимид (EDC), где диизопропилкарбодиимид (DIC) является особенно предпочтительным. Полученное производное полимера может быть очищено от реакционной смеси с использованием по меньшей мере одного подходящего способа. При необходимости, производное полимера может быть осаждено перед выделением с использованием по меньшей мере одного подходящего способа. Если производное полимера первоначально осаждают, это возможно, например, при контакте реакционной смеси по меньшей мере с одним растворителем, или смесью растворителей, отличающихся от растворителя или смеси растворителей, присутствующих в реакционной смеси, при подходящей температуре. В соответствии с особенно предпочтительным вариантом осуществления настоящего изобретения, где в качестве растворителя используют водную среду, предпочтительно воду, реакционную смесь приводят в контакт с 2-пропанолом или со смесью ацетона и этанола, предпочтительно смесью в соотношении 1:1 (об./об.), указывающем на равные объемы указанных соединений, при температуре предпочтительно в диапазоне от -20 до +50 С и особенно предпочтительно в диапазоне от -20 до 25 С. Выделение производного полимера можно проводить с использованием подходящего способа, который может включать одну или более стадий. В соответствии с предпочтительным вариантом осуществления настоящего изобретения, производное полимера первоначально отделяют от реакционной смеси или от смеси реакционной смеси с, например, водным 2-пропанолом, с использованием подходящего способа, такого как центрифугирование или фильтрование. На второй стадии, отделенное производное полимера может быть подвергнуто дополнительной обработке, такой как последующая обработка, как,например, диализ, центрифужное фильтрование или фильтрование под давлением, ионообменная хроматография, хроматография с обращенной фазой, ВЭЖХ, МЭЖХ, гель-фильтрование и/или лиофилизация. В соответствии с еше более предпочтительным вариантом осуществления, отделенное производное полимера первоначально подвергают диализу, предпочтительно против воды, а затем лиофилизуют до тех пор, пока содержание растворителя в реакционном продукте не станет достаточно низким в соответствии с желательными характеристиками продукта. Лиофилизацию можно проводить при температуре от 20 до 35 С, предпочтительно от 20 до 30 С. Полученное производное полимера с альдегидной группой или кетогруппой, или группой полуацеталя впоследствии подвергают взаимодействию с аминогруппой белка посредством восстановительного аминирования. Что касается связывания по меньшей мере одной аминогруппы белка с по меньшей мере одной альдегидной группой или кетогруппой, или группой полуацеталя полимера посредством восстановительного аминирования, здесь следует сослаться на приведенное выше подробное описание, касающееся специфических реакционных параметров реакции восстановительного аминирования, таких как рН и температура. В соответствии с особенно предпочтительным вариантом осуществления настоящего изобретения, в соответствии с которым в качестве белка используют G-CSF, восстановительное аминирование проводят при температуре от 0 до 10 С, например от 1 до 8 С или от 2 до 6 С, например примерно при 4 С и при рН примерно от 4,5 до 5,5, например примерно при 5,0. Время реакции составляет примерно от 10 до 20 ч, например от 12 до 19 ч или от 14 до 18 ч, например примерно 17 ч, или примерно от 20 до 30 ч, например примерно 24 ч. В соответствии с особенно предпочтительным вариантом осуществления настоящего изобретения, в соответствии с которым в качестве белка используют rhIL 2, rhIL 3,rhIFN альфа, rhIFN бета, rhEPO, rhAT III, BSA, миоглобин и SOD, восстановительное аминирование предпочтительно проводят при температуре от 0 до 5 С, например примерно при 4 С и при рН примерно от 4,5 до 5,5, например примерно при 5,0, при времени реакции примерно от 20 до 30 ч, например при- 26010501 мерно 24 ч. Таким образом, в соответствии с вышеуказанными предпочтительными вариантами осуществления настоящее изобретение также относится в том случае, когда полимер подвергают взаимодействию по его окисленному восстановительному концу, к конъюгату, соответствующему формуле В соответствии с особенно предпочтительным вариантом осуществления полимер представляет собой гидроксиэтилкрахмал, т.е. HAS' представляет собой HES', и n = 2, 3 или 4, наиболее предпочтительно 4, как описано выше. Следовательно, в том случае, когда полимер подвергали взаимодействию по его окисленному восстановительному концу, настоящее изобретение также относится к конъюгату, соответствующему формуле Согласно другому предпочтительному варианту осуществления, настоящее изобретение также относится, в том случае, когда полимер подвергали взаимодействию по его окисленному восстановительному концу, к конъюгату, соответствующему формуле где n = 2, 3 или 4, R4 независимо представляет собой водород или метоксильную группу, и m = 0 в том случае, когда R4 представляет собой водород, и m = 1 в случае, когда R4 представляет собой метокси,HAS предпочтительно представляет собой HES'. В каждой из вышеуказанных формул азот, связанный с белком, появляется из аминогруппы белка, с которым производное полимера связано через альдегидную группу. Что касается вышеуказанных вариантов осуществления, в соответствии с которыми функциональные группы М и Q включают аминогруппу -NH2, также возможно, что М представляет собой аминогруппу -NH2, a Q включает бета-гидрокси аминогруппу -СН(ОН)-CH2-NH2 и предпочтительно представляет собой бета-гидроксиаминогруппу. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где аминогруппа Q соединения, включающего две аминогруппы М и Q, представляет собой бетагидрокси аминогруппу -СН(ОН)-CH2-NH2. В таком случае М и Q могут быть разделены любым подходящим спейсером. Среди других, спейсер может представлять собой необязательно замещенный, линейный, разветвленный и/или циклический углеводородный остаток. Обычно углеводородный остаток содержит от 1 до 60, предпочтительно от 1 до 40, более предпочтительно от 1 до 20, более предпочтительно от 2 до 10, более предпочтительно от 1 до 6 и особенно предпочтительно от 1 до 2 атомов углерода. Если присутствуют гетероатомы, разделяющая группа включает обычно от 1 до 20, предпочтительно от 1 до 8 и особенно предпочтительно от 1 до 4 гетероатомов. Углеводородный остаток может включать необязательно разветвленную алкильную цепь,или арильную группу, или циклоалкильную группу, содержащую от 5 до 7 атомов углерода, или представлять собой аралкильную группу, алкарильную группу, где алкильная часть может представлять собой линейную и/или циклическую алкильную группу. В соответствии с еще более предпочтительным вариантом осуществления, углеводородный остаток представляет собой алкильную цепь, содержащую от 1 до 20, предпочтительно от 1 до 10, более предпочтительно от 1 до 6, более предпочтительно от 1 до 4 атомов углерода и особенно предпочтительно от 1 до 2 атомов углерода. Еще более предпочтительно, М и Q разделены метиленовой группой. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где полимер взаимодействует с 1,3-диамино-2-гидроксипропаном. В случае, когда полимер реагирует по его окисленному восстановительному концу, производное полимера соответствует формуле которая особенно предпочтительна при HAS' = HES'. Взаимодействие по меньшей мере бифункционального соединения, включающего М и Q, предпочтительно 1,3-диамино-2-гидроксипропана с полимером предпочтительно проводят при температуре от 40 до 120 С, более предпочтительно от 40 до 90 С и особенно предпочтительно от 60 до 80 С. Время реакции предпочтительно колеблется от 17 до 168 ч, более предпочтительно от 17 до 96 ч и особенно предпочтительно от 48 до 96 ч. Молярное соотношение по меньшей мере бифункциональное соединение : полимер предпочтительно находится в диапазоне от 200:1 до 10:1, в частности от 50:1 до 100:1. Растворитель для реакции по меньшей мере бифункционального соединения с полимером предпочтительно представляет собой по меньшей мере один апротонный растворитель, предпочтительно безводный апротонный растворитель, имеющий содержание воды не более чем 0,5 процента по весу, предпочтительным является содержание воды не более чем 0,1 процента по весу. Подходящими растворителями являются, наряду с прочими, диметилсульфоксид (ДМСО), N-метилпирролидон, диметилацетамид(ДМА), диметилформамид (ДМФ) и смеси двух или более из них. Бета-гидроксиаминогруппа Q производного полимера может взаимодействовать, по меньшей мере,с бифункциональным соединением, включающим по меньшей мере одну функциональную группу, способную взаимодействовать с Q, и дополнительно включающим по меньшей мере одну функциональную группу, представляющую собой альдегидную группу или кетогруппу, или группу полуацеталя, или функциональную группу, которую можно модифицировать с образованием альдегидной группы или кетогруппы, или группы полуацеталя. В соответствии с другим вариантом осуществления настоящего изобретения бета-гидрокси аминогруппу непосредственно модифицируют химически с получением альдегидной группы посредством химического окисления. Данное окисление может быть осуществлено с использованием всех подходящих окислителей, которые способны преобразовывать бета-гидрокси аминогруппу в альдегидную группу. Предпочтительные окислители представляют собой периодаты, такие как периодаты щелочных металлов. Особенно предпочтительным является периодат натрия, который предпочтительно используется в водном растворе. Данный раствор предпочтительно имеет концентрацию периодата от 1 до 50 мМ, более предпочтительно от 1 до 25 мМ и особенно предпочтительно от 1 до 10 мМ. Окисление проводят при температуре от 0 до 40 С, предпочтительно от 0 до 25 С и особенно предпочтительно от 4 до 20 С. Полученное производное полимера может быть очищено от реакционной смеси с использованием по меньшей мере одного подходящего способа. При необходимости, производное полимера может быть осаждено перед выделением с использованием по меньшей мере одного подходящего способа. Если производное полимера первоначально осаждают, это возможно, например, при контакте реакционной смеси по меньшей мере с одним растворителем или смесью растворителей, отличающихся от растворителя или смеси растворителей, присутствующих в реакционной смеси, при подходящей температуре. В соответствии с особенно предпочтительным вариантом осуществления настоящего изобретения, где в качестве растворителя используют водную среду, предпочтительно воду, реакционную смесь приводят в контакт с 2-пропанолом или со смесью ацетона и этанола, предпочтительно смесью в соотношении 1:1 (об./об.), указывающем на равные объемы указанных соединений, при температуре предпочтительно в диапазоне от -20 до +50 С и особенно предпочтительно в диапазоне от -20 до 25 С. Выделение производного полимера можно проводить с использованием подходящего способа, который может включать одну или более стадий. В соответствии с предпочтительным вариантом осуществления настоящего изобретения, производное полимера первоначально отделяют от реакционной смеси или от смеси реакционной смеси с, например, водным 2-пропанолом, с использованием подходящего способа, такого как центрифугирование или фильтрование. На второй стадии, отделенное производное полимера может быть подвергнуто дополнительной обработке, такой как последующая обработка, как например диализ, центрифужное фильтрование или фильтрование под давлением, ионообменная хроматография, хроматография с обращенной фазой, ВЭЖХ, МЭЖХ, гель-фильтрование и/или лиофилизация. В соответствии с еше более предпочтительным вариантом осуществления, отделенное производное полимера первоначально подвергают диализу, предпочтительно против воды, а затем лиофилизуют до тех пор, пока содержание растворителя в реакционном продукте не станет достаточно низким в соответствии с желательными характеристиками продукта. Лиофилизацию можно проводить при температуре от 20 до 35 С, предпочтительно от 20 до 30 С. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше,где окисление бета-гидроксиаминогруппы Q проводят с использованием периодата.- 28010501 Таким образом, настоящее изобретение также относится к способу и конъюгату, как описано выше,где при использовании полимера с окисленным восстановительным концом производное полимера,имеющее бета-гидроксиаминогруппу, особенно предпочтительно и в частности с HAS'=HES'. В соответствии с настоящим изобретение также возможно проводить взаимодействие соединения,включающего указанную выше 1-амино-2-гидрокси структуру, по меньшей мере, с бифункциональным соединением, включающим карбоксильную группу или реакционноспособную карбоксильную группу и альдегидную, кето, или ацетальную группу, описанные выше, с получением производного полимера,который может быть подвергнут восстановительному аминированию с аминогруппой белка. Полученное производное полимера с альдегидной группой А затем подвергают взаимодействию с белком. Следовательно, настоящее изобретение также относится к способу получения конъюгата, как описано выше, где указанный способ включает взаимодействие производного полимера, имеющего бетагидрокси аминогруппу, в случае, когда использовали полимер с окисленным восстановительным концом,особенно предпочтительно полимер, соответствующий формуле и особенно с HAS'=HES', с аминогруппой белка. Полученное производное полимера с альдегидной группой впоследствии подвергают взаимодействию с аминогруппой белка посредством восстановительного аминирования. Что касается связывания по меньшей мере одной аминогруппы белка с по меньшей мере одной альдегидной группой полимера посредством восстановительного аминирования, здесь следует сослаться на приведенное выше подробное описание. Таким образом, в соответствии с вышеуказанным предпочтительным вариантом осуществления,настоящее изобретение также относится к конъюгату, соотвествующему формуле и особенно с HAS'=HES', в том случае, когда используется полимер с окисленным восстановительным концом. В вышеуказанной формуле, азот, присоединенный к белку, имеет происхождение из аминогруппы белка, с которой полимер связан через альдегидную группу. В соответствии со следующим вариантом осуществления, настоящего изобретения, полимер первоначально подвергают взаимодействию с подходящим соединением с получением первого производного полимера, включающего по меньшей мере одну реакционноспособную карбоксильную группу. Данное первое производное полимера затем подвергают взаимодействию с дополнительным, по меньшей мере,бифункциональным соединением, где по меньшей мере одна функциональная группа дополнительного соединения взаимодействует по меньшей мере с одной реакционной карбоксильной группой производного полимера и по меньшей мере одна другая функциональная группа дополнительного соединения представляет собой альдегидную группу или кетогруппу, или группу полуацеталя, или представляет со- 29010501 бой функциональную группу, которую химически модифицируют с получением альдегидной группы или кетогруппы, или группы полуацеталя, и где полученное производное полимера, включающее указанную альдегидную группу или кетогруппу, или группу полуацеталя, взаимодействует посредством восстановительного аминирования, как описано выше, с по меньшей мере одной аминогруппой белка. Также можно изменить последовательность взаимодействия соответствующих соединений друг с другом. В соответствии с первой альтернативой указанного следующего варианта осуществления, полимер,включающий по меньшей мере одну реакционноспособную карбоксильную группу, получают селективным окислением полимера по его восстановительному концу и последующим взаимодействием окисленного полимера, представляющего собой лактон или подходящую соль карболовой кислоты, такую как соль щелочного металла, предпочтительно соль натрия и/или калия, и где HAS' предпочтительно представляет собой HES', с подходящим соединением с получением полимера, включающего по меньшей мере одну реакционноспособную карбоксильную группу. Окисление полимера, предпочтительно гидроксиэтилкрахмала, может быть осуществлено с использованием способа, или комбинации способов, которые приводят к соединениям, имеющим вышеуказанные структуры (IIa) и/или (IIb). Хотя окисление может быть осуществлено в соответствии с любым подходящим способом или способами, приводящими к окислению восстановительного конца гидроксиалкилкрахмала, его предпочтительно проводят с использованием щелочного раствора иода, как описано, например, в патенте ГерманииDE 1962 705 А 1, соответствующее содержание которого (пример А, колонка 9, строки 6-24) включено в данное описание путем ссылки. Введение реакционноспособной карбоксильной группы в полимер, который селективно окислен по его восстановительному концу, можно проводить с использованием любых возможных способов и всех возможных соединений. В соответствии с конкретным способом по настоящему изобретению, полимер, который является селективно окисленным по его восстановительному концу, подвергают взаимодействию по его окисленному восстановительному концу с по меньшей мере одним спиртом, предпочтительно по меньшей мере с одним кислым спиртом, таким как кислые спирты, имеющие величину рКА в диапазоне от 6 до 12 или от 7 до 11 при 25 С. Молекулярная масса кислого спирта может колебаться в диапазоне от 80 до 500 г/моль,например от 90 до 300 г/моль или от 100 до 200 г/моль. Подходящие кислые спирты представляют собой все спирты формулы H-O-RA, имеющие кислый протон и способные взаимодействовать с окисленным полимером с получением соответствующего реакционноспособного сложного эфира полимера, предпочтительно, соответствующего формуле
МПК / Метки
МПК: A61K 47/48, C08B 31/18, C08B 31/00, C07K 14/00
Метки: гидроксиалкилкрахмала, восстановительным, белка, аминированием, полученные, конъюгаты
Код ссылки
<a href="https://eas.patents.su/30-10501-konyugaty-gidroksialkilkrahmala-i-belka-poluchennye-vosstanovitelnym-aminirovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты гидроксиалкилкрахмала и белка, полученные восстановительным аминированием</a>
Предыдущий патент: Детектирование вируса папилломы человека
Следующий патент: Игровой автомат, способ управления игрой и игровая система
Случайный патент: Механизм передачи крутящего момента












