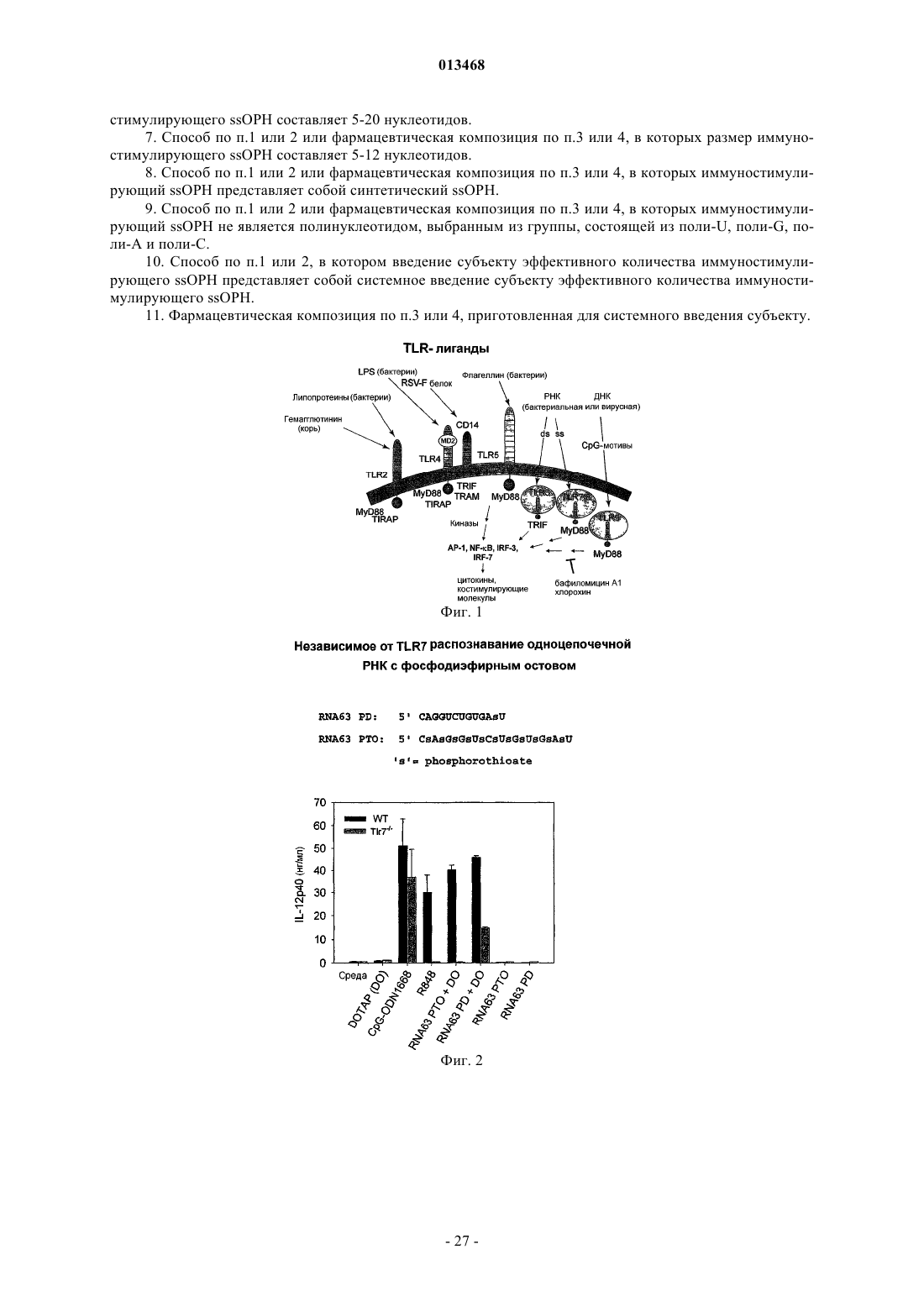
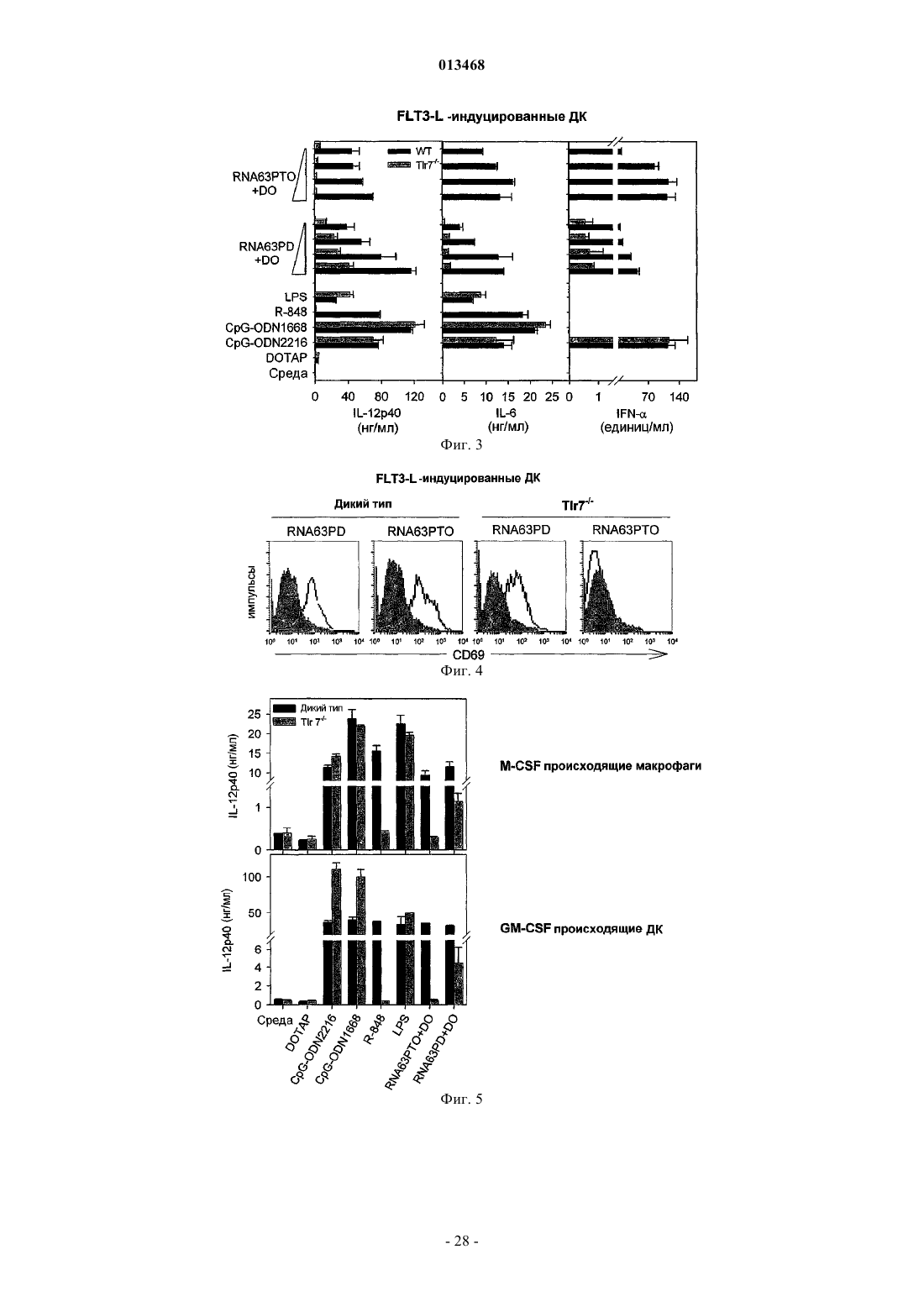
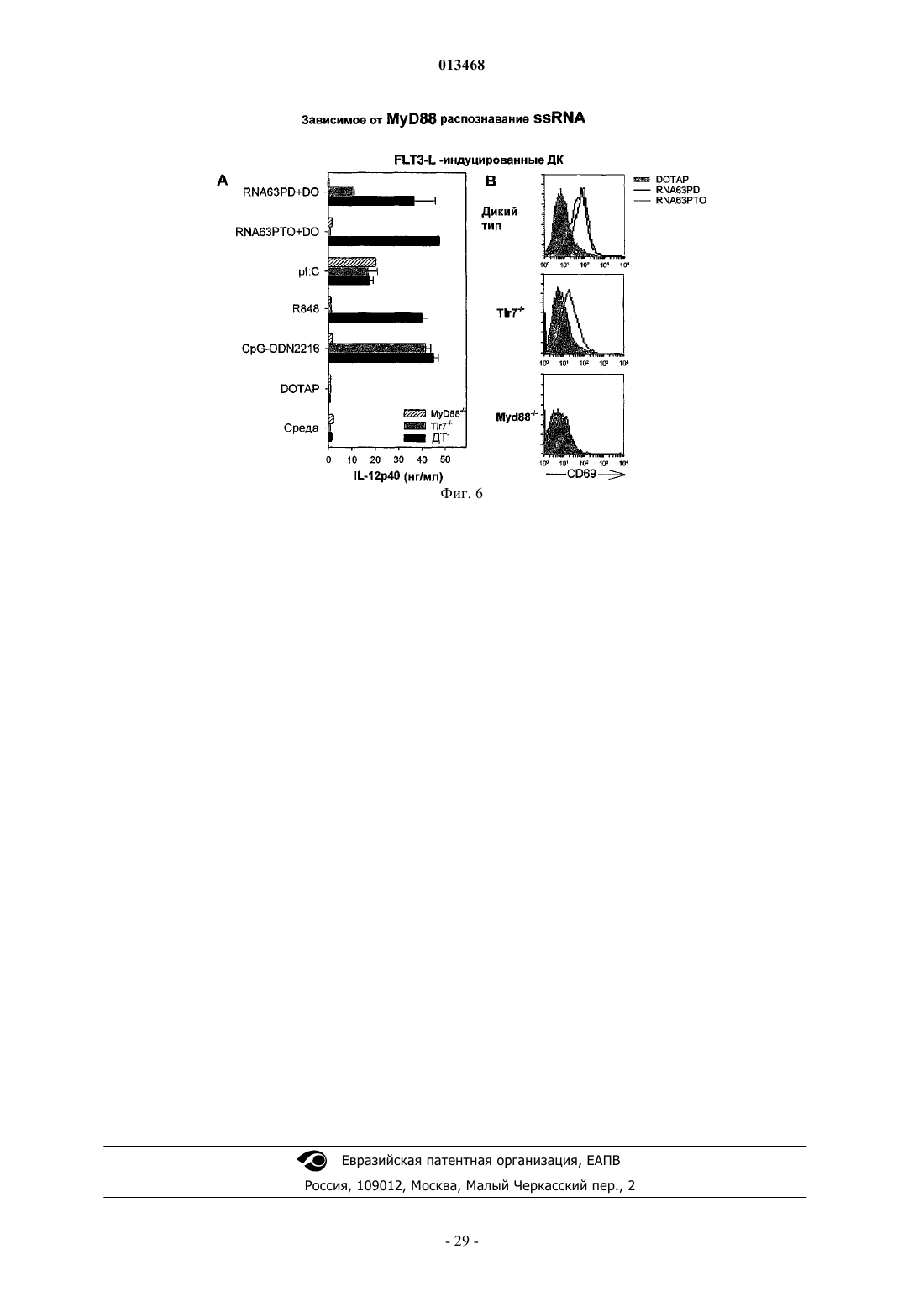
Иммуностимулирующая одноцепочечная рибонуклеиновая кислота с фосфодиэфирным остовом
Формула / Реферат
1. Способ индуцирования у субъекта иммунного ответа Th1-подобного типа, включающий введение субъекту эффективного количества иммуностимулирующего одноцепочечного олигорибонуклеотида (ssOPH) размером 5-100 нуклеотидов, который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая
(1) не включает гуанозин (G) или
(2) включает по меньшей мере один G при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность
(a) не включает уридин (U) и
(b) не включает CpG-мотив X1X2CGX3X4, где Xl, X2, Х3 и Х4 представляют собой нуклеотиды и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным,
при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК).
2. Способ индуцирования у субъекта иммунного ответа Th1-подобного типа по п.1, подходящий для индуцирования у субъекта специфического в отношении антигена иммунного ответа, дополнительно включающий введение субъекту антигена.
3. Фармацевтическая композиция для индуцирования у субъекта иммунного ответа Th1-подобного типа или лечения субъекта, имеющего рак, инфекционное заболевание, аллергическое состояние или астму, содержащая эффективное количество иммуностимулирующего одноцепочечного олигорибонуклеотида (ssOPH) размером 5-100 нуклеотидов, который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая
(1) не включает гуанозин (G) или
(2) включает по меньшей мере один G при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность
(а) не включает уридин (U) и
(b) не включает CpG-мотив X1X2CGX3X4, где X1, X2, Х3 и Х4 представляют собой нуклеотиды и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным,
при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК).
4. Фармацевтическая композиция для индуцирования у субъекта иммунного ответа Th1-подобного типа по п.3, подходящая для индуцирования у субъекта специфического в отношении антигена иммунного ответа, дополнительно содержащая антиген.
5. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых размер иммуностимулирующего ssOPH составляет 5-40 нуклеотидов.
6. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых размер иммуностимулирующего ssOPH составляет 5-20 нуклеотидов.
7. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых размер иммуностимулирующего ssOPH составляет 5-12 нуклеотидов.
8. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых иммуностимулирующий ssOPH представляет собой синтетический ssOPH.
9. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых иммуностимулирующий ssOPH не является полинуклеотидом, выбранным из группы, состоящей из поли-U, поли-G, поли-А и поли-С.
10. Способ по п.1 или 2, в котором введение субъекту эффективного количества иммуностимулирующего ssOPH представляет собой системное введение субъекту эффективного количества иммуностимулирующего ssOPH.
11. Фармацевтическая композиция по п.3 или 4, приготовленная для системного введения субъекту.

Текст
013468 Предпосылки создания изобретения В последнее время на рибонуклеиновой кислоте (РНК) сконцентрировано повышенное внимание благодаря только что обнаруженной возможности ее использования в качестве терапевтического средства. Например, недавно сообщалось, что некоторые специфические в отношении последовательности двухцепочечные РНК размером, как правило, приблизительно 21-23 нуклеотидов можно использовать для подавления избирательным образом экспрессии гена способом, называемым интерференция РНК(PHKi) или посттраскрипционное подавление (молчание) гена. Двухцепочечные РНК, используемые для этого типа интерференции РНК, включают, в частности, так называемые короткие интерферирующие РНК (siPHK). Hannon G.J., 2002, Nature 418:244-51. Напротив, как также недавно сообщалось, что неспецифическая в отношении последовательности двухцепочечная РНК может индуцировать иммуностимулирующие эффекты, действуя через Toll-подобный рецептор 3 (TLR3). Alexopoulou L. et al., 2001, Nature 413:732-8. Кроме того, недавно также сообщалось, что некоторые одноцепочечные РНК, обычно включающие гуанозин (G) и уридин (U) и, в частности, включающие определенные мотивы последовательностей, также являются иммуностимулирующими. Lipford et al., США 2003/0232074 A1. Сообщалось, что иммуностимулирующая одноцепочечная РНК действует через Toll-подобный рецептор 7 (TLR7) и Tollподобный рецептор 8 (TLR8). Помимо стимуляции иммунной системы, возникающей благодаря взаимодействию РНК с TLR3,TLR7 и TLR8, некоторые молекулы нуклеиновых кислоты, содержащие динуклеотид цитозин-гуанин(CpG), в частности CpG-содержащая дезоксирибонуклеиновая кислота (ДНК), как недавно сообщалось,вызывают иммуностимулирующий эффект благодаря взаимодействию с Toll-подобным рецептором 9(TLR9). Hermmi H. et al., 2000, Nature 408:740-5. Любой из TLR7, TLR8 и TLR9 передает сигнал зависимым от MyD8 8 способом. Молекулы дезоксирибонуклеиновых кислот и, даже более того, молекулы рибонуклеиновых кислот с природными фосфодиэфирными межнуклеотидными связями в их сахаро-фосфатном остове чувствительны к опосредуемой нуклеазами деградации. Поскольку для клинического применения иммуностимулирующие нуклеиновые кислоты часто получают в виде синтетических олигонуклеотидов, такие иммуностимулирующие синтетические олигонуклеотиды часто включают одну или несколько стабилизированных межнуклеотидных связей в их сахаро-фосфатном остове. Обычно используемой стабилизированной межнуклеотидной связью является фосфоротиоат. Сущность изобретения В соответствии с настоящим изобретением в настоящее время неожиданно обнаружено, что одноцепочечная РНК с фосфодиэфирным остовом, но не с фосфоротиоатным остовом, стимулирует активацию иммунной системы, по меньшей мере, отчасти через зависимый от MyD88 Toll-подобный рецептор,отличный от TLR7 или TLR8. Предполагают, что зависимым от MyD88 Toll-подобным рецептором, ответственным за данный иммунный ответ, является TLR9.CpG-опосредуемая активация иммунной системы, действуя через TLR9, включает активацию врожденного иммунитета и приводит к сдвигу иммунного ответа к иммунному ответу типа Th1 или Th1 подобного типа. Сообщалось, что CpG-олигонуклеотиды, таким образом, полезны в качестве адъювантов и активных агентов, используемых для лечения заболеваний, для которых желательна стимуляция иммунного ответа типа Th1, т.е. рака, инфекций, аллергии и астмы. Соответственно, в соответствии с настоящим изобретением в настоящее время неожиданно обнаружено, что одноцепочечную РНК с фосфодиэфирным остовом, или без CpG, или без специфических в отношении последовательности признаков ранее описанной иммуностимулирующий одноцепочечной РНК, можно использовать для любого применения, при котором требуется опосредуемая TLR9 активация иммунной системы. Такие применения включают, но не ограничиваясь ими, лечение субъекта,имеющего рак, инфекцию, аллергию или астму. В одном из аспектов изобретение представляет собой способ индуцирования у субъекта иммунного ответа Th1-подобного типа. Способ в соответствии с данным аспектом настоящего изобретения включает стадию введения субъекту эффективного количества иммуностимулирующего одноцепочечного олигорибонуклеотида (ssOPH) размером 5-100 нуклеотидов, который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая(1) не включает гуанозин (G) или(2) включает по меньшей мере один G, при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность(a) не включает уридин (U) и(b) не включает CpG-мотив X1X2CGX3X4, где X1, X2, Х 3 и Х 4 представляют собой нуклеотиды, и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным, при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК). В одном из аспектов изобретение представляет собой способ индуцирования у субъекта специфического в отношении антигена иммунного ответа. Способ в соответствии с данным аспектом настоящего изобретения включает стадии введения субъекту антигена и введения субъекту эффективного количества-1 013468 иммуностимулирующего одноцепочечного олигорибонуклеотида (ssOPH) размером 5-100 нуклеотидов,который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая(1) не включает гуанозин (G) или(2) включает по меньшей мере один G, при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность(a) не включает уридин (U) и(b) не включает CpG-мотив X1X2CGX3X4, где X1, X2, Х 3 и Х 4 представляют собой нуклеотиды и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным, при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК). В одном из аспектов изобретение представляет собой способ лечения субъекта, имеющего рак. Способ в соответствии с данным аспектом настоящего изобретения включает стадию введения субъекту эффективного количества иммуностимулирующего одноцепочечного олигорибонуклеотида (ssOPH) размером 5-100 нуклеотидов, который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая(1) не включает гуанозин (G) или(2) включает по меньшей мере один G, при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность(a) не включает уридин (U) и(b) не включает CpG-мотив X1X2CGX3X4, где X1, X2, Х 3 и Х 4 представляют собой нуклеотиды, и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным,при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК). В одном из аспектов изобретение представляет собой способ лечения субъекта, имеющего инфекционное заболевание. Способ в соответствии с данным аспектом настоящего изобретения включает стадию введения субъекту эффективного количества иммуностимулирующего одноцепочечного олигорибонуклеотида (ssOPH) размером 5-100 нуклеотидов, который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая(1) не включает гуанозин (G) или(2) включает по меньшей мере один G при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность(a) не включает уридин (U) и(b) не включает CpG-мотив X1X2CGX3X4, где Х 1, Х 2, Х 3 и Х 4 представляют собой нуклеотиды, и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным, при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК). В одном из аспектов изобретение представляет собой способ лечения субъекта, имеющего аллергическое состояние. Способ в соответствии с данным аспектом настоящего изобретения включает стадию введения субъекту эффективного количества иммуностимулирующего одноцепочечного олигорибонуклеотида (ssOPH) размером 5-100 нуклеотидов, который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая(1) не включает гуанозин (G) или(2) включает по меньшей мере один G, при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность(a) не включает уридин (U) и(b) не включает CpG-мотив X1X2CGX3X4, где X1, X2, Х 3 и Х 4 представляют собой нуклеотиды, и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным, при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК). В одном из аспектов изобретение представляет собой способ лечения субъекта, имеющего астму. Способ в соответствии с данным аспектом настоящего изобретения включает стадию введения субъекту эффективного количества иммуностимулирующего одноцепочечного олигорибонуклеотида (ssOPH) размером 5-100 нуклеотидов, который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая(1) не включает гуанозин (G) или(2) включает по меньшей мере один G при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность(a) не включает уридин (U) и(b) не включает CpG-мотив X1X2CGX3X4, где X1, Х 2, Х 3 и Х 4 представляют собой нуклеотиды, и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным, при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочеч-2 013468 ной молекулы рибонуклеиновой кислоты (РНК). В одном из вариантов осуществления настоящего изобретения размер иммуностимулирующегоssOPH составляет 5-40 нуклеотидов. В одном из вариантов осуществления настоящего изобретения размер иммуностимулирующегоssOPH составляет 5-20 нуклеотидов. В одном из вариантов осуществления настоящего изобретения размер иммуностимулирующегоssOPH составляет 5-12 нуклеотидов. В одном из вариантов осуществления настоящего изобретения иммуностимулирующий ssOPH представляет собой синтетический ssOPH. В одном из вариантов осуществления настоящего изобретения иммуностимулирующий ssOPH не является полинуклеотидом, выбранным из группы, состоящей из поли-U, поли-G, поли-А или поли-С. В одном из вариантов осуществления настоящего изобретения введение субъекту эффективного количества иммуностимулирующего ssOPH представляет собой системное введение субъекту эффективного количества иммуностимулирующего ssOPH. Краткое описание чертежей На фиг. 1 представлен схематический рисунок, изображающий некоторые Toll-подобные рецепторы, их лиганды и особенности их путей внутриклеточной передачи сигнала, как ранее понималось.MyD88 изображен как адаптерный белок для реагирующих на нуклеиновые кислоты Toll-подобных рецепторов TLR7, TLR8 и TLR9, а также для не реагирующих на нуклеиновые кислоты Toll-подобных рецепторов TLR2, TLR4 и TLR5. На фиг. 2 представлена диаграмма, изображающая не зависимое от TLR7 распознавание одноцепочечной РНК с фосфодиэфирным остовом. PD, фосфодиэфирный остов; РТО, фосфоротиоатный остов;WT, дикий тип. RNA63 представляет собой олигорибонуклеотид, имеющий нуклеотидную последовательность, предоставленную как 5'-CAGGUCUGUGAU-3' (SEQ ID NO:1). CpG-ODN 1668 представляет собой олигодезоксинуклеотид, имеющий нуклеотидную последовательность, предоставленную как 5'TCCATGACGTTCCTGATGCT-3' (SEQ ID NO:2). На фиг. 3 представлена группа из трех диаграмм, изображающих секрецию различных указанных цитокинов FLR3-L-индуцированными дендритными клетками в ответ на различные стимулы. LPS, липополисахарид. CpG-ODN 2216 представляет собой олигодезоксинуклеотид, имеющий нуклеотидную последовательность, предоставленную как 5'-GGGGGACGATCGTCGGGGG-3' (SEQ ID NO:3). На фиг. 4 представлен ряд из четырех диаграмм, изображающих FASC-анализы на экспрессиюCD69 на FLR3-L-индуцированных дендритных клетках в ответ на указанные ssOPH. На фиг. 5 представлены две диаграммы, изображающие секрецию IL-12p40 M-CSF-происходящими макрофагами и GM-CSF-происходящими дендритными клетками в ответ на указанные стимулы. На фиг. 6 А представлена диаграмма, изображающая секрецию IL-12p40 FLR3-L-индуцированными дендритными клетками от мышей дикого типа (WT), TLR7-дефицитных мышей (TLR7-/-) и MyD88 дефицитных мышей (MyD88-/-) в ответ на указанные стимулы. pI:С, полиинозин:цитидин. На фиг. 6 В представлен ряд диаграмм, изображающих FASC-анализы на экспрессию CD69 FLR3-Lиндуцированными дендритными клетками от мышей дикого типа (WT), TLR7-дефицитных мышей(TLR7-/-) и MyD88-дефицитных мышей (MyD88-/-) в ответ на указанные стимулы. Подробное описание изобретения Иммунный ответ концептуально делят на врожденный иммунитет и приобретенный иммунитет. Полагают, что врожденный иммунитет включает распознавание ассоциируемых с патогеном молекулярных структур (РАМР), являющихся общими у некоторых классов молекул, экспрессируемых инфекционными микроорганизмами, или чужеродных макромолекул. Полагают, что ассоциируемые с патогеном молекулярные структуры распознаются распознающими структуры рецепторами (PRR) на определенных клетках иммунной системы.Toll-подобные рецепторы (TLR) являются семейством высококонсервативных полипептидов, играющих решающую роль во врожденном иммунитете у млекопитающих. В настоящее время идентифицировано десять членов семейства, обозначенных TLR1-TLR10. Цитоплазматические домены различныхTLR характеризуются наличием домена рецептора для Toll-интерлейкина 1 (IL-1) (TIR). Medzhitov R. etal., 1998, Mol. Cell 2:253-8. Распознавание TLR микробной инвазии запускает активацию системы передачи сигнала, которая является эволюционно консервативной у Drosophila и у млекопитающих. Содержащий домен TIR адаптерный белок MyD88, как сообщалось, связывается со многими TLR и привлекает к пополнению рецепторов TLR связанную с рецептором IL-1 киназу (IRAK) и связанный с рецептором фактора некроза опухолей (TNF) фактор 6 (TRAF6). Зависимый от MyD88 путь передачи сигнала, как полагают, приводит к активации факторов транскрипции NF-кВ и активируемых митогеном c-Jun NH2 концевой киназы (Jnk) протеинкиназ (МАРК), решающим стадиям в активации иммунной системы и продукции воспалительных цитокинов. Для обзора, см. Aderem A. et al., 2000, Nature 406:782-87. Хотя имеются сообщения о ряде специфических лигандов для TLR, лиганды для некоторых TLR остаются неидентифицированными. Лиганды для TLR2 включают пептидогликан и липопептиды. Yoshimura A. et al., 1999, J. Immunol. 163:1-5; Aliprantic A.O. et al., 1999, Science 285:736-9. Сообщалось, что-3 013468 двухцепочечная РНК (dsPHK) вирусного происхождения и поли-(I:С), синтетический аналог dsPHK, являются лигандами TLR3. Alexopoulou L. et al., 2001, Nature 413:732-8. Липополисахарид (LPS) является лигандом для TLR4. Poltorak A. et al., 1998, Science 282:2085-8; Hoshino К. et al., 1999, J. Immunol. 162:3749-52. Бактериальный флагеллин является лигандом для TLR5. Hayashi F. et al., 2001, Nature 410:1099-1103. Сообщалось, что пептидогликан является лигандом не только для TLR2, но также дляTLR6. Ozinsky A. et al., 2000, Proc. Natl. Acad. Sci. USA 97:13766-72; Takeuchi O. et al., 2001, Int. Immunol. 13:933-40. Сообщалось, что одноцепочечная РНК, содержащая гуанозин и уридин, является лигандом для TLR7 и TLR8. Заявка на патент США 2003/0232074 А 1. Сообщалось, что некоторые низкомолекулярные синтетические соединения, имидазохинолоны имихимод (R-837) и резихимод (R-848), являются лигандами TLR7 и TLR8. Jurk M. et al., 2002, Nat. Immunol. 3:499; Hemmi H. Et al., 2002, Nat. Immunol. 3:196-200. Сообщалось, что бактериальная ДНК (CpG-ДНК) является лигандом для TLR9. Hemmi H. etal., 2000, Nature 408:740-5; Bauer S. et al., 2001, Proc. Natl. Acad. Sci. USA 98, 9237-42. Природные лиганды для TLR1 и TLR10 не известны. Любой из TLR7, TLR8 и TLR9 передает сигнал в ответ на лиганд в виде соответствующей нуклеиновой кислоты с участием адаптерного белка MyD88. Полагают, что TLR8 крысы, в отличие от TLR8 человека, является нефункциональным. Таким образом, у мышей функциональными являются TLR7 иTLR9, и они передают сигнал в ответ на лиганд в виде соответствующей нуклеиновой кислоты с участием MyD88. Мыши, у которых отсутствует TLR7, имеют, таким образом, только TLR9 в качестве функционального TLR, который, как известно, способен передавать сигнал в ответ на лиганд в виде соответствующей нуклеиновой кислоты через зависимый от MyD88 путь (см. фиг. 1). В настоящее время неожиданно обнаружено, что определенные одноцепочечные олигорибонуклеотиды с фосфодиэфирным остовом, но не с фосфоротиоатным остовом, способны стимулировать клетки иммунной системы зависимым от MyD88 способом у мышей, у которых отсутствует функциональныйTLR7 или TLR8. Иммуностимулирующий одноцепочечный олигорибонуклеотид (ssOPH), применимый в соответствии с настоящим изобретением, имеет размер, составляющий 5-100 нуклеотидов, имеет фосфодиэфирный остов и нуклеотидную последовательность, которая(1) не включает гуанозин (G) или(2) включает по меньшей мере один G, при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность(a) не включает уридин (U) или(b) не включает CpG-мотив X1X2CGX3X4, где Х 1, Х 2, Х 3 и Х 4 представляют собой нуклеотиды, и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным, при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК). Иммуностимулирующий одноцепочечный олигорибонуклеотид (ssOPH), применимый в соответствии с настоящим изобретением, в одном из вариантов осуществления настоящего изобретения можно получить и выделить из природных источников РНК. Альтернативно и более конкретно, иммуностимулирующий одноцепочечный олигорибонуклеотид (ssOPH), применимый в соответствии с настоящим изобретением, в одном из вариантов осуществления настоящего изобретения можно получить синтетическими методами, хорошо известными в данной области. Иммуностимулирующий ssOPH настоящего изобретения может быть природного или неприродного происхождения. Природная РНК является типом нуклеиновой кислоты, который, как правило, относится к линейному полимеру из определенных рибонуклеозидных единиц, каждая рибонуклеозидная единица состоит из основания в виде пурина или пиримидина и сахара в виде рибозы, связанных с помощью межнуклеозидных фосфодиэфирных связей. В этом отношении термин "линейный", как подразумевается, описывает первичную структуру РНК. РНК, как правило, может быть одноцепочечной или двухцепочечной, включая частично двухцепочечной. Используемый в данном описании термин "нуклеозид" относится к одной составляющей в виде сахара (например, рибозе или дезоксирибозе), связанной с взаимозаменяемым органическим основанием,которое является или замещенным пиримидином (например, цитозином, тимином или урацилом), или замещенным пурином (например, аденином или гуанином). Соответствующими нуклеотидами являются цитидин, тимидин, уридин, аденозин и гуанозин, которые обычно обозначают как С, Т, U, А и G, соответственно. Как описано в данном описании, нуклеозид может быть природным нуклеозидом, модифицированным нуклеозидом или синтетическим (искусственным) нуклеозидом. Используемые взаимозаменяемо термины "нуклеиновая кислота" и "олигонуклеотид" означают множество нуклеотидов, т.е. молекул, включающих сахар (например, рибозу или дезоксирибозу), связанный с фосфатной группой и взаимозаменяемым органическим основанием, описанным выше. Используемые в данном описании термины относятся к олигорибонуклеотидам (ОРН), а также к олигодезоксирибонуклеотидам (ОДН). Эти термины также включают полинуклеозиды (т.е. полинуклеотид минус фосфат) и любой другой, содержащий органические основания полимер. Молекулы нуклеиновых кислот можно получить из существующих источников нуклеиновых кислот (например, геномная НК или-4 013468 кДНК), но предпочтительными являются синтетические молекулы нуклеиновых кислот (например, полученные синтезом нуклеиновых кислот). Термины "нуклеиновая кислота" и "олигонуклеотид" также включают нуклеиновые кислоты или олигонуклеотиды с заменами или модификациями, такими как в основаниях и/или сахарах. Например,они включают нуклеиновые кислоты, имеющие сахара в остове, которые ковалентно связаны с низкомолекулярными органическими группами, отличными от гидроксильной группы в положении 3' и от фосфатной группы в положении 5'. Таким образом, модифицированные нуклеиновые кислоты могут включать 2'-O-алкилированную рибозную группу. Кроме того, модифицированные нуклеиновые кислоты могут включать сахара, такие как арабиноза, вместо рибозы. Нуклеиновые кислоты могут, следовательно,быть гетерогенными в отношении состава остова, они могут, таким образом, содержать любую возможную комбинацию полимерных единиц, связанных вместе, такие как пептидонуклеиновые кислоты (которые имеют аминокислотный остов с основаниями нуклеиновых кислот). В некоторых вариантах осуществления настоящего изобретения нуклеиновые кислоты являются гомогенными в отношении состава остова. Нуклеиновые кислоты также включают замещенные пурины и пиримидины, такие как С-5 пропин-модифицированные основания. Wagner R.W. et al., 1996, Nat. Biotechnol. 14:840-4. Пурины и пиримидины включают, но, не ограничиваясь ими, аденин, цитозин, гуанин, тимидин, 5-метилцитозин, 2 аминопурин, 2-амино-6-хлорпурин, 2,6-диаминопурин, гипоксантин и другие природные и неприродные нуклеооснования, замещенные и незамещенные ароматические составляющие. Специалистам в данной области известны другие такие модификации. Основания природных нуклеозидов можно заменить модифицированным нуклеозидным основанием, которое выбирают, например, из гипоксантина; дигидроурацила; псевдоурацила; 2-тиоурацила; 4 тиоурацила; 5-аминоурацила; 5-(C1-С 6)алкилурацила; 5-(С 2-С 6)алкенилурацила; 5-(С 2-С 6)алкинилурацила; 5-(гидроксиметил)урацила; 5-хлорурацила; 5-фторурацила; 5-бромурацила; 5-гидроксицитозина; 5- (С 1-С 6)алкилцитозина; 5-(С 2-С 6)алкенилцитозина; 5-(С 2-С 6)алкинилцитозина; 5-хлорцитозина; 5-фторцитозина; 5-бромцитозина; N2-диметилгуанина; 2,4-диаминопурина; 8-азапурина (включающего, в частности, 8-азагуанин); замещенного 7-деазапурина (включающего, в частности, 7 деазагуанин), включая 7-деаза-7-замещенный и/или 7-деаза-8-замещенный пурин, или других модификаций оснований природных нуклеозидов. Данный перечень представлен в качестве примера, и его не следует интерпретировать как ограничивающий. В частности, когда в иммуностимулирующем ssOPH присутствует по меньшей мере один гуанозин,по меньшей мере одно основание гуанина иммуностимулирующего ssOPH может быть замещенным или модифицированным гуанином, таким как 7-деазагуанин; 8-азагуанин; 7-деаза-7-замещенный гуанин (такой как 7-деаза-7-(С 2-С 6)алкинилгуанин; 7-деаза-8-замещенный гуанин; гипоксантин; 2,6-диаминопурин; 2-аминопурин; пурин; 8-замещенный гуанин, такой как 8-гидроксигуанин; и 6-тиогуанин. Данный печень представлен в качестве примера, и его не следует интерпретировать как ограничивающий. Также, в частности, когда в иммуностимулирующем ssOPH присутствует по меньшей мере один уридин, по меньшей мере одно основание урацила иммуностимулирующего ssOPH может быть замещенным или модифицированным урацилом, таким как псевдоурацил и 5-метилурацил. Для использования в настоящем изобретении нуклеиновые кислоты настоящего изобретения можно синтезировать de novo, используя любую из числа методик, хорошо известных в данной области, например, -цианоэтилфосфорамидатный метод (Beaucage S.L. et al., (1981) Tetrahedron Lett 22:1859), нуклеозид-Н-фосфонатный метод (Garegg et al., (1986) Tetrahedron Lett 27:4051-4; Froehler et al., 1986, Nucl. AcidRes. 14:5399-407; Garegg et al., 1986, Tetrahedron Lett 27:4055-8; Gaffney et al., 1988, Tetrahedron Lett 29:2619-22). Такие химические технологии можно выполнить с помощью множества автоматизированных синтезаторов нуклеиновых кислот, имеющихся в продаже. На указанные нуклеиновые кислоты приводится ссылка как на синтетические нуклеиновые кислоты. Нуклеиновые кислоты можно получить из существующих последовательностей нуклеиновых кислот (например, рибосомальной, информационной или транспортной РНК), используя известные методики, в которых используются рестрикционные ферменты, экзонуклеазы или эндонуклеазы. На нуклеиновые кислоты, полученные таким образом, приводится ссылка как на выделенные нуклеиновые кислоты. Выделенная нуклеиновая кислота обычно относится к нуклеиновой кислоте, которая выделена из компонентов, с которыми она обычно связана в природе. Например, выделенная нуклеиновая кислота может быть нуклеиновой кислотой, которая выделена из клетки, из ядра, из митохондрии или из хроматина. Термин "нуклеиновая кислота" включает как синтетическую, так и выделенную нуклеиновую кислоту. Применимый в соответствии с настоящим изобретением ssOPH является иммуностимулирующим. Используемый в данном описании термин "иммуностимулирующий ssOPH" относится к ssOPH, который способен индуцировать иммунный ответ, например, стимулировать клетку иммунной системы с активацией ее пролиферации, дифференциации, миграции, с увеличением ее цитолитической активности, увеличением экспрессии секретируемых продуктов, ассоциируемых с ее активацией, увеличением экспрессии маркеров клеточной поверхности или состимулирующих молекул, ассоциируемых с активацией клетки иммунной системы, или с любой их комбинацией. Секретируемые продукты, ассоциируемые с активацией иммунной клетки, хорошо известны в данной области и могут включать, но не ограничиваясь-5 013468 ими, цитокины, хемокины и антитела. Иммуностимулирующий ssOPH настоящего изобретения можно использовать для индукции иммунного ответа Th1-подобного типа как in vitro, так и in vivo. Используемый в данном описании термин"иммунный ответ Th1-подобного типа" относится к активации клеток иммунной системы с экспрессиейTh1-подобных секретируемых продуктов, включая определенные цитокины, хемокины и подклассы иммуноглобулинов, и к активации определенных клеток иммунной системы. Th1-подобные секретируемые продукты включают, но не ограничиваясь ими, цитокины IFN-, IL-2, IL-12, IL-18, TNF- и хемокин IP10 (CXCL10). У мыши активация иммунного ответа типа Th1 стимулирует секрецию IgG2a. У человека активация иммунного ответа типа Th1 стимулирует секрецию IgG1. Соответственно, иммунный ответTh1-подобного типа у мыши может включать увеличение секреции IgG2a, и иммунный ответ Th1 подобного типа у человека может включать увеличение секреции IgG1. Активация иммунного ответаTh1-типа и Th1-подобного типа может включать активацию NK-клеток (природных киллеров) и дендритных клеток, т.е. клеток, вовлеченных в клеточный иммунитет. Полагают, что активация иммунного ответа Th1-типа и Th1-подобного типа приводит к встречной регуляции активации иммунного ответаTh2-типа. Иммуностимулирующий ssOPH настоящего изобретения можно использовать для индукции специфического в отношении антигена иммунного ответа как in vitro, так и in vivo. Как использовано в данном описании, специфический в отношении антигена иммунный ответ представляет собой адаптивный иммунный ответ, возникающий в результате контакта между клетками иммунной системы и антигеном. Термин "антиген" относится к молекуле, способной провоцировать иммунный ответ. Термин "антиген" в широком значении включает любой тип молекулы, распознаваемой системой хозяина в качестве чужеродного. Антигены включают, но, не ограничиваясь ими, микробные антигены, раковые антигены и аллергены. Антигены включают, но, не ограничиваясь ими, клетки, клеточные экстракты, белки, полипептиды, пептиды, полисахариды, конъюгаты полисахаридов, пептидные и непептидные имитаторы полисахаридов и других молекул, малые молекулы, липиды, гликолипиды и углеводороды. Многие антигены являются по природе белком или полипептидом, поскольку белки или полипептиды являются, как правило, более антигенными, чем углеводороды или жиры. Антиген может быть антигеном, кодируемым являющимся нуклеиновой кислотой вектором, или он может быть антигеном сам по себе. В первом случае являющийся нуклеиновой кислотой вектор вводят субъекту, и антиген экспрессируется in vivo. Во втором случае антиген можно вводить субъекту непосредственно. Используемый в данном описании термин "антиген, не кодируемый являющимся нуклеиновой кислотой вектором," относится к любому типу антигена, который не является нуклеиновой кислотой. Например, в некоторых аспектах настоящего изобретения антиген, не кодируемый являющимся нуклеиновой кислотой вектором, представляет собой пептид или полипептид. Минорные модификации первичных аминокислотных последовательностей антигенов в виде пептидов или полипептидов могут также привести к полипептиду, который имеет, по существу, эквивалентную антигенную активность по сравнению с немодифицированной копией полипептида. Такие модификации могут быть намеренными,например, с помощью сайт-направленного мутагенеза, или спонтанными. Любой полипептид, полученный с помощью таких модификаций, включен в данное описание, при условии, что антигенность все еще существует. Пептиды или полипептиды могут быть, например, вирусного происхождения. Антигены,применимые в настоящем изобретении, могут иметь любую длину, находящуюся в диапазоне от небольших пептидных фрагментов полноразмерного белка или полипептида до полноразмерных форм. Например, длина антигена может быть меньше 5, меньше 8, меньше 10, меньше 15, меньше 20, меньше 30, меньше 50, меньше 70, меньше 100 или более аминокислотных остатков, при условии, что антиген стимулирует специфический иммунный ответ. В некоторых вариантах осуществления настоящего изобретения антигеном является раковый антиген. Как использовано в данном описании, "раковый антиген" представляет собой соединение, такое как пептид или белок, которое связано с поверхностью опухолевой или раковой клетки и способно провоцировать иммунный ответ при экспрессии на поверхности антигенпрезентирующей клетки в контексте молекулы МНС (главного комплекса гистосовместимости). Раковые антигены можно получить из раковых клеток или с помощью приготовления грубых экстрактов раковых клеток, например, как описано уCohen P.A. et al., 1994, Cancer Res. 54:1055-8, с помощью частичной очистки антигенов, с помощью рекомбинантной технологии или с помощью de novo синтеза известных антигенов. Раковые антигены включают, но не ограничиваясь ими, антигены, которые рекомбинантно экспрессированы, их иммуногенную часть или опухоль, или злокачественную опухоль в целом. Такие антигены можно выделить или получить рекомбинантно или с помощью любого другого способа, известного в данной области. Термины "раковый антиген" и "опухолевый антиген" используются взаимозаменяемо и относятся к антигенам, которые дифференциально экспрессируются раковыми клетками и могут, таким образом,эксплуатироваться для того, чтобы использовать раковые клетки в качестве мишеней. Раковыми антигенами являются антигены, которые могут потенциально стимулировать явно специфические в отношении опухоли иммунные ответы. Некоторые из таких антигенов кодируются, хотя необязательно экспрессируются, нормальными клетками. Такие антигены можно охарактеризовать как антигены, которые явля-6 013468 ются обычно подавленными (молчащими) (т.е. не экспрессируются) в нормальных клетках, как антигены, которые экспрессируются только на определенных стадиях дифференциации, и как антигены, которые временно экспрессируются, такие как эмбриональные и фетальные антигены. Другие раковые антигены кодируются мутантными клеточными генами, такими как онкогены (например, активированный онкоген ras), супрессорные гены (например, мутант р 53), слитые белки, являющиеся результатом внутренних делеций или хромосомных транслокаций. Другие раковые антигены могут еще кодироваться вирусными генами, такими как гены, переносимые онкогенными вирусами, содержащими РНК и ДНК. Примеры опухолевых антигенов включают MAGE, MART-1/Melan-A, gp100, дипептидилпептидазу IV(DPPIV), аденозиндезаминаза-связывающий белок (ADAbp), циклофилин b, ассоциируемый с толстой и прямой кишками антиген (CRC)-C017-1A/GA733, канцероэмбриональный антиген (СЕА) и его иммуногенные эпитопы САР-1 и САР-2, etv6, amll, специфический в отношении предстательной железы антиген(PSA) и его иммуногенные эпитопы PSA-1, PSA-2 и PSA-3, специфический в отношении предстательной железы мембранный антиген (PSMA), Т-клеточный рецептор/CD3-зета цепь, MAGE-семейство опухолевых антигенов (например, MAGE-A1, MAGE-A1, MAGE-А 3, MAGE-A4, MAGE-А 5, MAGE-A6, MAGEA7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-All, MAGE-A12, MAGE-Xp2 (MAGE-B2), MAGE-Хр 3(MAGE-B3), MAGE-Xp4 (MAGE-B4), MAGE-C1, MAGE-C2, MAGE-C3, MAGE-C4, MAGE-C5), GAGEсемейство опухолевых антигенов (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6,GAGE-7, GAGE-8, GAGE-9), BAGE, RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназу, р 53,MUC-семейство, HER2/neu, p21ras, RCAS1, -фетопротеин, Е-кадгерин, а-катенин, -катенин и катенин, p120ctn, gp100Pmel117, PRAME, NY-ESO-1, cdc27, коли-белок аденоматозного полипоза (АРС),фодрин, коннексин 37, Ig-идиотип, р 15, др 75, ганглиозиды GM2 и GD2, вирусные продукты, такие как белки вируса папилломы человека, Smad-семейство опухолевых антигенов, lmp-1, P1A, EBVкодируемый ядерный антиген (EBNA)-l, гликогенфосфорилаза головного мозга, SSX-1, SSX-2 (HOMMEL-40), SSX-1, SSX-4, SSX-5, SCP-1 и СТ-7, и с-erB-2. Злокачественные опухоли или опухоли и ассоциированные с такими опухолями опухолевые антигены включают (но не исключительно) острый лимфобластный лейкоз (etv6; amll; циклофилин b), Вклеточную лимфому (Ig-идиотип), глиому (Е-кадгерин; -катенин; -катенин; -катенин; p120ctn), рак мочевого пузыря (p21ras), билиарный рак (p21ras), рак молочной железы (MUC-семейство; HER2/neu: cerB-2), рак шеи (р 53; p21ras), рак толстой кишки (p21ras; HER2/neu; c-erb-2; MUC-семейство), рак толстой и прямой кишок (ассоциируемый с толстой и прямой кишками антиген (CRC)-C017-1A/GA733; АРС), хориокарциному (СЕА), эпителиальноклеточный рак (циклофилин b), рак желудка (HER2/neu; cerbB-2; гликопротеин ga733), печеночноклеточный рак (-фетопротеин), лимфому Ходжкина (lmp-1;EBNA-1), рак легкого (СЕА; MAGE-3; NY-ESO-1), происходящий из лимфоидных клеток лейкоз (циклофилин b), меланому (белок р 15; др 75, онкофетальный антиген, ганглиозиды GM2 и GD2), миелому(MUC-семейство; p21ras), немелкоклеточный рак легкого (HER2/neu; c-erbB-2), рак носоглотки (lmp-1;EBNA-1), рак яичников (MUC-семейство; HER2/neu; c-erbB-2), рак предстательной железы (специфический в отношении предстательной железы антиген (PSA) и его иммуногенные эпитопы PSA-1, PSA-2 иPSA-3; PSMA; HER2/neu; c-erbB-2), рак поджелудочной железы (p21ras; MUC-семейство; HER2/neu; cerbB-2; гликопротеин ga733), рак почки (HER2/neu; c-erbB-2), чешуйчатоклеточные раки шеи и пищевода(вирусные продукты, такие как белки вируса папилломы человека), рак яичка (NY-ESO-1), Т-клеточный лейкоз (эпитопы HTLV-1) и меланому (Melan-A/MART-1; cdc27; MAGE-2; p21ras; gp100Pmel117). Размер иммуностимулирующего ssOPH настоящего изобретения составляет обычно по меньшей мере 5 и не более 100 нуклеотидов. В различных определенных вариантах осуществления настоящего изобретения размер иммуностимулирующего ssOPH настоящего изобретения составляет не более 40 нуклеотидов, включая 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29,30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов. В определенных вариантах осуществления настоящего изобретения иммуностимулирующий ssOPH настоящего изобретения может включать последовательность поли-G, включая по меньшей мере 4 последовательных нуклеотида G, при условии, что ssOPH не состоит полностью из поли-G. В одном из вариантов осуществления настоящего изобретения последовательность поли-G, когда присутствует, находится на 3'-конце ssOPH. В одном из вариантов осуществления настоящего изобретения иммуностимулирующий ssOPH настоящего изобретения не состоит полностью из поли-U. В одном из вариантов осуществления настоящего изобретения иммуностимулирующий ssOPH настоящего изобретения не состоит полностью из полиА. В одном из вариантов осуществления настоящего изобретения иммуностимулирующий ssOPH настоящего изобретения не состоит полностью из поли-С.ssOPH настоящего изобретения, в частности, может быть применим для лечения субъектов, имеющих рак, субъектов, имеющих инфекционное заболевание, субъектов, имеющих аутоиммунное заболевание, субъектов, имеющих аллергию, и субъектов, имеющих астму. Используемый в данном описании термин "рак" относится к неконтролируемому росту клеток, которые мешают нормальному функционированию органов и систем организма. Злокачественные опухоли,-7 013468 которые мигрируют из своего первоначального местонахождения и обсеменяют необходимые для жизни органы, могут, в конечном счете, привести к смерти субъекта благодаря функциональному истощению пораженных органов. Типы рака кроветворной системы, такие как лейкоз, способны вытеснить у субъекта нормальные компартменты кроветворной системы, что приводит, таким образом, к нарушению кроветворной системы (в форме анемии, тромбоцитопении и нейтропении), приводящему, в конечном счете, к смерти. Используемый в данном описании термин "субъект, имеющий рак," относится к субъекту, который имеет определяемые раковые клетки. Метастаз является областью раковых клеток, отличной от местонахождения первичной опухоли,являющейся результатом диссеминирования раковых клеток из первичной опухоли в другие части организма. Во время диагностики массы первичной опухоли субъекта можно проверить на наличие метастазов. Метастазы наиболее часто определяют благодаря исключительному или комбинированному использованию изображений, получаемых с помощью магнитного резонанса (MRI), изображений, получаемых при компьютерной томографии (СТ), числа форменных элементов крови и тромбоцитов, исследований функции печени, рентгеновского исследования грудной клетки и сканограмм костей помимо контролирования специфических симптомов. Злокачественные опухоли включают, но, не ограничиваясь ими, базальноклеточную карциному, рак желчных путей, рак мочевого пузыря, рак кости, рак головного мозга и центральной нервной системы,рак молочной железы, рак шеи, хориокарциному, рак толстой и прямой кишок, рак соединительной ткани, рак пищеварительной системы, эндометрический рак, рак пищевода, рак глаза, рак головы и шеи, рак желудка, интраэпителиальную опухоль, рак почки, рак гортани, лейкоз, рак печени, рак легкого (например, мелкоклеточный и немелкоклеточный), лимфому, включая лимфому Ходжкина и неходжкинскую лимфому, меланому, миелому, нейробластому, рак ротовой полости (например, губ, языка, рта и глотки),рак яичников, рак поджелудочной железы, рак предстательной железы, ретинобластому, рабдомиосаркому, рак прямой кишки, рак почки, рак дыхательной системы, саркому, рак кожи, рак желудка, рак яичка, рак щитовидной железы, рак матки, рак мочевой системы, а также другие карциномы и саркомы. Используемый в данном описании термин "инфекционное заболевание" относится к нарушению,возникающему из-за инвазии инфекционного микроорганизма в хозяина, поверхностно, местно или по всему организму. Инфекционные микроорганизмы включают бактерии, вирусы, паразиты и грибы. Используемый в данном описании термин "субъект, имеющий инфекционное заболевание," относится к субъекту, который подвергся воздействию инфекционного организма и имеет определяемый уровень острой или хронической инфекции в организме. Воздействие инфекционного организма, как правило, происходит с наружной поверхности субъекта, например, кожи или слизистых оболочек, и/или относится к проникновению инфекционного организма в наружную поверхность субъекта. Примеры вирусов, которые были обнаружены у людей, включают, но не ограничиваясь ими, Retroviridae (например, вирусы иммунодефицита человека, такие как HIV-1 (на который также приводится ссылка как на HDTV-III, LAVE или HTLV-III/LAV, или HIV-III; и другие изоляты, такие как HIV-LP);Adenoviridae (большинство аденовирусов); Herpesviridae (вирус простого герпеса (HSV) 1 и 2, вирус ветряной оспы, цитомегаловирус (CMV), вирус герпеса); Poxviridae (вирусы натуральной оспы, вирусы осповакцины, вирусы оспы) и Iridoviridae (например, вирус африканской лихорадки свиней), и неклассифицированные вирусы (например, агент дельта-гепатита, который, как полагают, является дефектным спутником вируса гепатита В; агенты гепатита не-А, не-В (класса 1 = внутренне передающийся; класса 2= парентерально передающийся (т.е. гепатит С); вирусы Норвалк и родственные вирусы и астровирусы). У позвоночных животных как грамположительные, так и грамотрицательные бактерии служат в качестве антигенов. Такие грамположительные бактерии включают, но не ограничиваясь ими, виды Pasteurella, виды Staphylococci и виды Streptococcus. Грамотрицательные бактерии включают, но не ограничиваясь ими, Escherichia coli, виды Pseudomonas и виды Salmonella. Конкретные примеры инфекционных бактерий включают, но не ограничиваясь ими, Helicobacter pyloris, Borrelia burgdorferi, Legionella pneumophilia, виды Mycobacteria (например, М. tuberculosis, M. avium, M. intracellulare, M. kansasii, M. gordonae), Staphylococcus aureus, Neisseria gonorrhoeae, Neisseria meningitidis, Listeria monocytogenes, Streptococcus pyogenes (стрептококк группы A), Streptococcus agalactiae (стрептококк группы В), Streptococcusanthracis, Corynebacterium diphtheriae, виды Corynebacterium, Erysipelothrix rhusiopathiae, Clostridium perfringens, Clostridium tetani, Enterobacter aerogenes, Klebsiella pneumoniae, Pasturella multocida, виды Bacteroides, Fusobacterium nucleatum, Streptobacillus moniliformis, Treponema pallidium, Treponema pertenue, Leptospira, Rickettsia и Actinomyces israelli. Примеры грибов включают Cryptococcus neoformans, Histoplasma capsulatum, Coccidioides immitis,Blastomyces dermatitidis, Chlamydia trachomatis, Candida albicans. Другие инфекционные организмы (т.е. одноклеточные организмы) включают виды Plasmodium, такие как Plasmodium falciparum, Plasmodium malariae, Plasmodium ovale и Plasmodium vivax и Toxoplasmagondii. Паразиты крови-кости и/или тканей включают виды Plasmodium, Babesia microti, Babesia divergens, Leishmania tropica, виды Leishmania, Leishmania braziliensis, Leishmania donovani, Trypanosoma gambiense и Trypanosoma rhodesiense (африканский трипаносомоз), Trypanosoma cryzi (болезнь Шагаса) иToxoplasma gondii. Другие релевантные в медицинском отношении микроорганизмы подробно описаны в литературе,например, см. C.G.A. Thomas, Medical Microbiology, Bailliere Tindall, Великобритания 1983, содержание которой полностью включено в данное описание посредством ссылки.ssOPH настоящего изобретения также применим для лечения и профилактики аутоиммунного заболевания. Аутоиммунное заболевание представляет собой класс заболеваний, при которых собственные антитела субъекта реагируют с тканями хозяина или при которых эффекторные Т-клетки иммунной системы являются аутореактивными в отношении эндогенных аутопептидов и вызывают разрушение ткани. Таким образом, возникает иммунный ответ против собственных антигенов субъекта, на которые приводится ссылка как на аутоантигены. Аутоиммунные заболевания включают, но не ограничиваясь ими,ревматоидный артрит, болезнь Крона, множественный склероз, системную красную волчанку (SLE), аутоиммунный энцефаломиелит, тяжелую миастению (MG), зоб Хасимото, синдром Гудпасчера, пузырчатку (например, пузырчатку обыкновенную), болезнь Грейвса, аутоиммунную гемолитическую анемию,аутоиммунную тромбоцитопеническую пурпуру, склеродерму с антителами против коллагена, болезнь смешанных соединительных тканей, полимиозит, пернициозную анемию, идиопатическую болезнь Аддисона, аутоиммунное сопутствующее бесплодие, гломерулонефрит (например, полулунный гломерулонефрит, пролиферативный, гломерилонефрит), буллезный пемфигоид, синдром Шегрена, инсулинорезистентность и аутоиммунный сахарный диабет. Используемый в данном описании термин "аллергия" относится к приобретенной гиперчувствительности к веществу (аллергену). Аллергические состояния включают, но не ограничиваясь ими, экзему, аллергический ринит или острый ринит, сенную лихорадку, аллергический конъюнктивит, бронхиальную астму, крапивницу (сыпь) и пищевые аллергии, другие атопические состояния, включая атопический дерматит; анафилаксию; лекарственную аллергию и болезнь Квинке. Аллергические заболевания включают, но не ограничиваясь ими, ринит (сенную лихорадку), астму, крапивницу и атопический дерматит. Как использовано в данном описании, субъектом, имеющим аллергию, является субъект, который имеет аллергическую реакцию в ответ на аллерген. Аллерген относится к веществу (антигену), который индуцирует аллергическую или астматическую реакцию у чувствительного субъекта. Перечень аллергенов огромен и может включать пыльцу, яды насекомых, пыль-перхоть животного происхождения, споры грибов и лекарственные средства (например,пенициллин). Примеры природных аллергенов животного и растительного происхождения включают,но, не ограничиваясь ими, белки, специфические в отношении следующих родов: Canis (Canis familiaris);(например, Festuca elatior); Poa (например, Роа pratensis или Poa compressa); Avena (например, Avena sativa); Holcus (например, Holcus lanatus); Anthoxanthum (например, Anthoxanthum odoratum); Arrhenatherum (например, Arrhenatherum elatius); Agrostis (например, Agrostis alba); Phleum (например,Phleum pratense); Phalaris (например, Phalaris arundinacea); Paspalum (например, Paspalum notatum); Sorghum (например, Sorghum halepensis) и Bromus (например, Bromus inermis). Используемый в данном описании термин "астма" относится к заболеванию респираторной системы, характеризующемуся воспалением, сужением дыхательных путей и увеличенной реактивностью дыхательных путей на вдыхаемые агенты. Астма часто, хотя не исключительно, ассоциируется с атопиче-9 013468 ским или аллергическим состоянием. Симптомы астмы включают повторяющиеся эпизоды стерторозного дыхания, одышки и сжатия в груди, и кашель, являющийся результатом затрудненного дыхания. Воспаление дыхательных путей, сопровождающее астму, можно определить благодаря наблюдению за рядом физиологических изменений, таких как денудация эпителия дыхательных путей, отложение коллагена ниже базальной мембраны, отек, активация тучных клеток, инфильтрация воспалительных клеток,включая нейтрофилы, инозинофилы и лимфоциты. В результате воспаления дыхательных путей у больных астмой часто наблюдается гиперреактивность дыхательных путей, затрудненное дыхание, респираторные симптомы и хронический характер болезни. Затрудненное дыхание включает острый бронхостеноз, отек дыхательных путей, образование слизистых пробок и коррекция дыхательных путей, признаки,которые часто приводят к бронхиальной непроходимости. В некоторых случаях астмы может иметь место фиброз суббазальной мембраны, что приводит к персистированному нарушению функции легких. Как использовано в данном описании, субъектом, имеющим астму, является субъект, который имеет заболевание респираторной системы, характеризующееся воспалением, сужением дыхательных путей и увеличенной реактивностью дыхательных путей на вдыхаемые агенты. Астма часто, хотя не исключительно, сопровождается атопическими или аллергическими симптомами. Астма часто, хотя не исключительно, ассоциируется с контактом с инициатором. "Инициатор", как использовано в данном описании,относится к композиционному состоянию или условию окружающей среды, которые инициируют астму. Инициаторы включают, но, не ограничиваясь ими, аллергены, низкие температуры, физические нагрузки, вирусные инфекции, SO2.ssOPH настоящего изобретения можно использовать или отдельно, или в комбинации с другими терапевтическими агентами. Другой терапевтический агент в одном из вариантов осуществления настоящего изобретения представляет собой ssOPH настоящего изобретения. ssOPH и другой терапевтический агент можно вводить одновременно или последовательно. Когда другие терапевтические агенты вводят одновременно, их можно вводить в одной и той же композиции или в отдельных композициях, но их вводят в одно и то же время. Другие терапевтические агенты вводят последовательно с одним другим терапевтическим агентом и с ssOPH, когда введение других терапевтических агентов и ssOPH разделено во времени. Разделение во времени между введением таких соединений может быть делом минут или дольше. Другие терапевтические агенты включают, но, не ограничиваясь ими, противомикробные агенты, противораковые агенты, противоаллергические агенты и т.д.ssOPH настоящего изобретения можно вводить субъекту с противомикробным агентом. Противомикробный агент, используемый в данном описании, относится к природному или синтетическому соединению, которое способно уничтожать или ингибировать инфекционные микроорганизмы. Тип противомикробного агента, применимый в соответствии с настоящим изобретением, будет зависеть от типа микроорганизма, которым инфицирован или риск инфицирования которым имеется у субъекта. Противомикробные агенты включают, но не ограничиваясь ими, антибактериальные агенты, противовирусные агенты, противогрибковые агенты и антипаразитарные агенты. Такие выражения, как "противоинфекционный агент", "антибактериальный агент", "противовирусный агент", "противогрибковый агент", "антипаразитарный агент" и "паразитицид", имеют хорошо установившиеся значения для специалистов в данной области и определены в стандартных руководствах по медицине. Кратко, антибактериальные агенты уничтожают или ингибируют бактерии и включают антибиотики, а также другие синтетические или природные соединения, имеющие схожие функции. Антибиотики представляют собой низкомолекулярные молекулы, которые продуцируются в виде вторичных метаболитов клетками, такими как микроорганизмы. Как правило, антибиотики блокируют одну или несколько функций или структур бактерий, которые являются специфическими для микроорганизма и которые не присутствуют в клетках-хозяина. Противовирусные агенты можно выделить из природных источников или синтезировать, и они используются для уничтожения или ингибирования вирусов. Противогрибковые агенты используют для лечения поверхностных грибковых инфекций, а также инфекций, вызванных условно-патогенными грибами, и первичных системных грибковых инфекций. Антипаразитарные агенты уничтожают или ингибируют паразитов. Примеры антипаразитарных агентов, на которые также приводится ссылка как на паразитициды,используемые для введения человеку включают, но не ограничиваясь ими, альбендазол, амфотерицин В,бензнидазол, битионол, хлорохин HCl, хлорохина фосфат, клиндамицин, дегидроэметин, диэтилкарбамазин, дилоксанида фуроат, эфлорнитин, фуразолидон, глюкокортикоиды, галофантрин, иодхинол, иверместин, мебендазол, мефлохин, меглюмина антимониат, меларсопрол, метрифонат, метронидазол, никлозамид, нифуртимокс, оксамнихин, парамомицин, пентамицина изотионат, пиперазин, празиквантел, примахина фосфат, прогуанил, пирантела памоат, пириметаминсульфонамиды, пириметаминсульфадоксин,хинакрин HCl, хинина сульфат, хинидина глюконат, спирамицин, стибоглюконат натрия (натрия сурьмы глюконат), сурамин, тетрациклин, доксициклин, тиабендазол, тинидазол, триметропримсульфаметоксазол и трипарсамид, некоторые из которых используются отдельно или в комбинации с другими. Антибактериальные агенты уничтожают или ингибируют рост или функцию бактерий. Большим классом антибактериальных агентов являются антибиотики. На антибиотики, эффективные для уничтожения или ингибирования широкого ряда бактерий, приводится ссылка как на антибиотики широкого спектра. Другие типы антибиотиков преимущественно эффективны против грамположительных или гра- 10013468 мотрицательных бактерий. На такие типы антибиотиков приводится ссылка как на антибиотики узкого спектра. На другие антибиотики, которые эффективны против одного организма или болезни и не эффективны против других типов бактерий, приводится ссылка как на антибиотики ограниченного спектра. Классификацию антибактериальных агентов иногда проводят на основе первичного образа действия. Как правило, антибактериальные агенты являются ингибиторами синтеза клеточной стенки, ингибиторами клеточной мембраны, ингибиторами синтеза белков, синтеза нуклеиновых кислот или функциональными ингибиторами и конкурентными ингибиторами. Противовирусными агентами являются соединения, которые предотвращают инфицирование клеток вирусами или репликацию вирусов внутри клетки. Существует намного меньше противовирусных лекарственных средств, чем антибактериальных лекарственных средств, поскольку процесс репликации вирусов столь близко связан с репликацией ДНК внутри клетки-хозяина, что неспецифические противовирусные агенты часто являются токсичными для хозяина. Существует несколько стадий внутри процесса вирусной инфекции, которые можно блокировать или ингибировать с помощью противовирусных агентов. Эти стадии включают прикрепление вируса к клетке-хозяина (иммуноглобулин или связывающие пептиды), декапсидацию вируса (например, амантадин), синтез или трансляцию вирусной мРНК(например, интерферон), репликацию вирусной РНК или ДНК (например, аналоги нуклеотидов), созревание новых вирусных белков (например, ингибиторы протеаз) и почкование и высвобождение вируса. Аналогами нуклеотидов являются синтетические соединения, сходные с нуклеотидами, но которые имеют неполную или аномальную дезоксирибозную или рибозную группу. При попадании аналогов нуклеотидов в клетку они фосфорилируются с образованием трифосфатных форм, которые конкурируют с нормальными нуклеотидами за включение в вирусную ДНК или РНК. После включения трифосфатной формы аналога нуклеотида в растущую нуклеотидную цепь он вызывает необратимое связывание с вирусной полимеразой и, следовательно, обрыв цепи. Аналоги нуклеотидов включают, но не ограничиваясь ими, ацикловир (используемый для лечения вируса простого герпеса и вируса ветряной оспы), ганцикловир (используемый для лечения цитомегаловируса), идоксуридин, рибавирин (используемый для лечения респираторно-синцитиального вируса), дидезоксиинозин, дидезоксицитидин, цидовудин (азидотимидин), имиквимод и резимиквимод. Интерфероны представляют собой цитокины, которые секретируются инфицированными вирусами клетками, а также клетками иммунной системы. Интерфероны функционируют, связываясь со специфическими рецепторами на клетках, примыкающих к инфицированным клеткам, что вызывает в клетке изменение, которое защищает ее от инфицирования вирусом. Интерфероныитакже индуцируют экспрессию молекул МНС класса I и II на поверхности инфицированных клеток, что приводит к увеличению презентации антигенов для распознавания клетками иммунной системы. Интерфероныидоступны в рекомбинантных формах и использовались для лечения хронического гепатита В и С. В дозах,которые являются эффективными для противовирусной терапии, интерфероны имеют тяжелые побочные эффекты, такие как лихорадка, недомогание и потеря веса. Противовирусные агенты, используемые в настоящем изобретении, включают, но не ограничиваясь ими, иммуноглобулины, амантадин, интерфероны, аналоги нуклеотидов и ингибиторы протеаз. Конкретные примеры противовирусных агентов включают, но, не ограничиваясь ими, ацеманнан, ацикловир,ацикловир натрий, адефовир, аловудин, алвирцепт судотокс, амантадин гидрохлорид, аранотин, арилдон,атевирдина мезилат, авридин, цидофовир, ципамфиллин, цитарабин гидрохлорид, делавирдина мезилат,десцикловир, диданозин, дисоксарил, эдоксудин, энвираден, энвироксим, фамцикловир, фамотин гидрохлорид, фиацитабин, фиалуридин, фосарилат, фоскарнет натрий, фосфонет натрий, ганцикловир, ганцикловир натрий, идоксуридин, кетоксаль, ламивудин, лобукавир, мемотин гидрохлорид, метисазон, невирапин, пенцикловир, пиродавир, рибавирин, римантадин гидрохлорид, саквинавира мезилат, сомантадин гидрохлорид, соривудин, статолон, ставудин, тилорон гидрохлорид, трифлуридин, валацикловир гидрохлорид, видарабин, видарабина фосфат, видарабина натрия фосфат, вироксим, залыдитабин, цидовудин и цинвироксим. Противогрибковые агенты применимы для лечения и профилактики инфекционных грибов. Классификацию противогрибковых агентов иногда проводят по их механизму действия. Некоторые противогрибковые агенты функционируют в качестве ингибиторов клеточной стенки путем ингибирования глюкозосинтазы. Такие агенты включают, но не ограничиваясь ими, базиунгин/ЕСВ. Другие противогрибковые агенты функционируют путем дестабилизации целостности мембраны. Такие агенты включают, но,не ограничиваясь ими, иммидазолы, такие как клотримазол, сертаконзол, флуконазол, интраконазол, кетоконазол, миконазол и вориконазол, а также FK 463, амфотерицин В, BAY 38-9502, МК 991, прадимицин, UK 292, бутенафин и тербинафин. Другие противогрибковые агенты функционируют путем разрушения хитина (например, хитиназа) или иммуносупрессии (крем 501).ssOPH настоящего изобретения можно также вводить в соединении с противораковой терапией. Противораковая терапия включает лекарственные средства против рака, облучение и хирургические способы. Используемый в данном описании термин "лекарственное средство против рака" относится к агентам, которые вводят субъекту с целью лечения рака. Как использовано в данном описании, "лечение ра- 11013468 ка" включает предотвращение развития рака, уменьшение симптомов рака и/или ингибирование роста укоренившегося рака. В других аспектах лекарственное средство против рака вводят субъекту с риском развития рака с целью уменьшения риска развития рака. Различные типы лекарственных средств для лечения рака описаны в данном описании. Для целей данного описания лекарственные средства против рака классифицируют в виде химиотерапевтических агентов, иммунотерапевтических агентов, противораковых вакцин, гормонотерапии и модификаторов биологического ответа. Химиотерапевтические агенты могут быть выбраны из группы, состоящей, но не ограничиваясь ими, из метотрексана, винкристина, адриамиуина, цисплатина, не содержащих сахара хлорэтилнитрозомочевин, 5-фторурацила, митомицина С, блеомицина, доксорубицина, дакарбазина, таксола, фрагилина,мегламина GLA, валрубицина, кармустаина и полиферпосана, MMI270, BAY 12-9566, ингибитора фамезилтрансферазы RAS, ингибитора фамезилтрансферазы, ММР, MTA/LY231514, LY264618/лометексола,гламолека, CI-994, TNP-470, гикамтина/топотекана, РКС 412, валсподара/PSC833, новантрона/митроксантрона, метарета/сурамина, батимастата, Е 7070, ВСН-4556, CS-682, 9-AC, AG3340, AG3433,инсела/VX-710, VX-853, ZD0101, ISI641, ODN 698, ТА 2516/мармистата, ВВ 2516/мармистата, CDP 845,D2163, PD183805, DX8951f, лемонала DP 2202, FK 317, пицибанила/ОК-4 32, AD 32/валрубицина, метастрона/производного стронция, темодала/темозоломида, эвацета/липосомального доксорубицина, ютаксана/паклитаксела, таксола/паклитаксела, кселоада/капецитабина, фуртулона/доксифлуридина, циклопакса/перорального паклитаксела, перорального таксоида, SPU-077/цисплатина, HMR 127 5/флавопиридола,СР-358(774)/EGFR, СР-609 (754)/ингибитора онкогена RAS, BMS-182751/пероральной платины,UFT(тегафура/урацила), эргамизола/левамизола, энилурацила/776 С 85/усилителя 5FU, кампто/ левамизола, камптосара/иринотекана, тумодекса/ралитрекседа, леустатина/кладрибина, паксекса/паклитаксела,доксила/липосомального доксорубицина, каеликса/липосомального доксорубицина, флудара/ флударабина, фармарубицина/эпирубицина, DepoCyt, ZD1839, LU 79553/бис-нафталимида, LU 103793/ доластаина, каетикса/липосомального доксорубицина, гемзара/гемцитабина, ZD 0473/анормеда, YM 116, затравочных кристаллов лодина, ингибиторов CDK4 и CDK2, ингибиторов PARP, В 4 809/дексифосамида,ифеса/меснекса/ифосфамида, вумона/тенипозида, параплатина/карбоплатина, плантинола/цисплатина,вепезида/этопозида, ZD 9331, таксотера/доцетаксела, пролекарства гуанина арабинозида, аналога таксана, нитрозомочевин, алкилирующих агентов, таких как мелфелан и циклофосфамид, аминоглутетимида,аспарагиназы, бусулфана, карбоплатина, хлоромбуцила, цитарабина HCl, дактиномицина, даунорубицина HCl, эстрамустина фосфата натрия, этопозида (VP16-213), флоксуридина, фторурацила (5-FU), флутамида, гидроксимочевины (гидроксикарбамида), ифосфамида, интерферона альфа-2 а, альфа-2b, леупролида ацетата (аналога LHRH-высвобождающего фактора), ломустина (CCNU), мехлоретамина HCl (нитрогена мустарда), меркаптопурина, месны, митотана (o.p'-DDD), митоксантрона HCl, октреотида, пликамицина, прокарбазина HCl, стрептозоцина, тамоксифена цитрата, тиогуанина, тиотепа, винбластина сульфата, амсакрина (m-AMSA), азацитидина, эртропоэтина, гексаметилмеламина (НММ), интерлейкина 2, митогуазона (метил-GAG; метилглиоксаля бис-гуанилгидразона; MGBG), пентостатина (2'дезоксикоформицина), семустина (метил-CCNU), тенипозида (VM-26)и виндесина сульфата. Иммунотерапевтические агенты могут быть выбраны из группы, состоящей, но, не ограничиваясь ими, из рибутаксина, герцептина, квадрамета, панорекса, IDEC-Y2B8, ВЕС 2, С 225, онколима, SMARTM195, ATRAGEN, оварекса, бексксара, LDP-03, ior t6, MDX-210, MDX-11, MDX-22, OV103, 3622W94,анти-VEGF, зенапакса, MDX-220, MDX-447, MELIMMUNE-2, MELIMMUNE-1, CEACIDE, Pretarget, NovoMab-G2, TNT, глиомаб-Н, GNI-250, EMD-72000, LymphoCide, CMA 676, монофарм-С, 4 В 5, ior egf.r3,ior c5, BABS, анти-FLK-2, MDX-2 60, ANA Ab, SMART 1D10 Ab, SMART ABL364 Ab и ImmunoRAITCEA. Противораковые вакцины могут быть выбраны из группы, состоящей, но не ограничиваясь ими, изEGF, антиидиотипических противораковых вакцин, антигена Gp75, вакцины против меланомы GMK,вакцины на основе конъюгата с ганглиозидом MGV, Her2/neu, оварекса, M-Vax, O-Vax, L-Vax, STn-KHL тератопа, BLP25 (MUC-1), липосомальной идиотипической вакцины, мелацина, вакцины на основе пептидных антигенов, вакцин на основе токсина/антигена, вакцин на основе MVA, PACIS, вакцины БЦЖ,TA-HPV, TA-CIN, DISC-вируса и ImmunoCyst/TheraCys.ssOPH настоящего изобретения можно также вводить субъекту с лекарственным средством против астмы/аллергии. "Лекарственное средство против астмы/аллергии", используемое в данном описании,представляет собой обсуждаемую композицию, уменьшающую симптомы, предотвращающую развитие или ингибирующую астматическую или аллергическую реакцию. Различные типы лекарственных средств для лечения астмы и аллергии описаны в публикации Guidelines For The Diagnosis and Management of Asthma, Expert Panel Report 2, NIH Publication No. 97/4051, July 19, 1997, содержание которой полностью включено в данное описание посредством ссылки. Краткое описание лекарственных средств,представленных в публикации NIH, приведено ниже. В большинстве вариантов осуществления настоящего изобретения лекарственное средство против астмы/аллергии используется до некоторой степени для лечения как астмы, так и аллергии. Лекарственные средства для лечения астмы, как правило, разделяют на две категории, быстро ослабевающие лекарственные средства и лекарственные средства продолжительного действия. Больные аст- 12013468 мой принимают лекарственные средства продолжительного действия ежедневно для достижения и сохранения контроля над персистированной астмой. Лекарственные средства продолжительного действия включают противовоспалительные агенты, такие как кортикостероиды, кромолин натрия и недокромил; продолжительно действующие бронхолитические средства, такие как продолжительно действующие 2 агонисты и метилксантины, и модификаторы лейкотриена. Быстро успокаивающие лекарственные средства включают короткого действия 2-агонисты, антихолинергичекие средства и системные кортикостероиды. Существует много побочных эффектов, связанных с каждым из указанных лекарственных средств, и ни одно из них отдельно или в комбинации не способно предотвратить или полностью вылечить астму. Лекарственные средства против астмы включают, но не ограничиваясь ими, ингибиторы PDE-4,бронхолитические средства/2-агонисты, средства, открывающие K+-каналы, антагонисты VLA-4, антагонисты нейрокина, ингибиторы синтеза тромбоксана А 2 (ТХА 2), ксантины, антагонисты арахидоновой кислоты, ингибиторы 5-липоксигеназы, антагонисты рецептора для ТХА 2, антагонисты ТХА 2, ингибитор активирующих 5-липоксигеназу белков и ингибиторы протеаз. Бронхолитическое средство/2-агонисты являются классом соединений, вызывающих расширение бронхов или релаксацию гладкой мускулатуры. Бронхолитическое средство/2-агонисты включают, но,не ограничиваясь ими, сальметерол, сальбутанол, альбутерол, тербуталин, D2522/формотерол, фенотерол, битолтерол, пирбутерол, метилксантины и орципреналин. 2-агонисты и бронхолитические средства продолжительного действия представляют собой соединения, которые используют в дополнение к противовоспалительной терапии для продолжительного предотвращения симптомов. 2-агонисты продолжительного действия включают, но, не ограничиваясь ими, сальметерол и альбутерол. Такие соединения обычно используются в комбинации с кортикостероидами и, как правило, не используются без какойлибо противовоспалительной терапии. Они сопровождаются побочными эффектами, такими как тахикардия, тремор скелетной мускулатуры, гипокалемия и удлинение интервала QTc при передозировке. Метилксантины, включающие, например, теофиллин, использовались для продолжительного контроля и предотвращения симптомов. Данные соединения вызывают расширение бронхов, являющееся результатом ингибирования фосфодиэстеразы и, по-видимому, антагонизма в отношении аденозина. С этим типом соединений особой проблемой является связанная с дозой острая токсичность. В результате следует контролировать определенную концентрацию в сыворотке для того, чтобы объяснить токсичность и сузить терапевтический диапазон, возникающий из-за индивидуальных различий в метаболическом очищении. Побочные эффекты включают тахикардию, тахиаритмию, тошноту и рвоту, стимуляцию центральной нервной системы, головную боль, припадки, гематемезис, гипергликемию и гипокалемию. 2-агонисты короткого действия включают, но, не ограничиваясь ими, альбутерол, битолтерол, пирбутерол и тербуталин. Некоторые побочные эффекты, связанные с введением 2-агонистов короткого действия, включают тахикардию, тремор скелетной мускулатуры, гипокалемию, увеличение молочной кислоты, головную боль и гипергликемию. Традиционные способы лечения или профилактики аллергии включали использование антигистаминных средств или десенсибилизационной терапии. Антигистаминные средства и другие лекарственные средства, которые блокируют действие химических медиаторов аллергической реакции, помогают контролировать тяжесть аллергических симптомов, но не предотвращают аллергическую реакцию и не оказывают влияния на последующие аллергические реакции. Десенсибилизационную терапию проводят путем назначения небольших доз аллергена, обычно с помощью инъекции под кожу, для того чтобы индуцировать ответ IgG-типа против аллергена. Присутствие антител в виде IgG помогает нейтрализовать продукцию медиаторов, являющуюся, как полагают, результатом индукции антител в виде IgE. Первоначально субъекта подвергают лечению очень низкой дозой аллергена для того, чтобы избежать индукции тяжелой реакции, и дозу медленно увеличивают. Данный тип терапии является опасным, поскольку субъекту на самом деле вводят соединения, которые вызывают аллергическую реакцию, и результатом могут быть тяжелые аллергические реакции. Лекарственные средства против аллергии включают, но не ограничиваясь ими, антигистаминные средства, стероиды и индукторы простагландинов. Антигистаминные средства представляют собой соединения, которые нейтрализуют гистамин, высвобождаемый тучными клетками или базофилами. Данные соединения хорошо известны в данной области и обычно используются для лечения аллергии. Антигистаминные средства включают, но не ограничиваясь ими, астемизол, азеластин, бетатастин, буклизин,цетиризин, аналоги цетиризина, CS 560, деслоратадин, эбастин, эпинастин, фексофенадин, HSR 609, левокабастин, лоратидин, мизоластин, норастемизол, терфенадин и траниласт. Индукторы простагландинов представляют собой соединения, которые индуцируют активность простагландинов. Простагландины функционируют путем регуляции релаксации гладкой мускулатуры. Индукторы простагландинов включают, но без ограничения, S-5751. Лекарственные средства против астмы/аллергии также включают стероиды и иммуномодуляторы. Стероиды включают, но не ограничиваясь ими, беклометазон, флутиказон, триамцинолон, кортикостероиды и булезонил.- 13013468 Кортикостероиды включают, но не ограничиваясь ими, беклометазона дипропионат, будезонид,флунисолид, флутиказона пропионат и триамцинолона ацетонид. Хотя дексаметазон является кортикостероидом, обладающим противовоспалительным действием, его не используют на регулярной основе для лечения астмы/аллергии в ингаляционной форме, поскольку он сильно абсорбируется и имеет продолжительные супрессивные побочные эффекты при эффективной дозе. Однако дексаметазон можно использовать в соответствии с настоящим изобретением для лечения астмы/аллергии, поскольку при введении в комбинации с нуклеиновыми кислотами настоящего изобретения его можно вводить в низкой дозе для уменьшения побочных эффектов. Некоторые побочные эффекты, связанные с кортикостероидами, включают кашель, дисфонию, стоматит (кандидоз), и при более высоких дозах системные эффекты,такие как подавление надпочечников, остеопороз, подавление роста, утончение кожи и легкость возникновения кровоподтеков. BarnerPeterson, 1993, Am. Res. Respir. Dis. 148:S1-S26; Kamada A.K. et al.,1996, Am. J. Respir. Crit. Care Med. 153:1739-48. Системные кортикостероиды включают, но не ограничиваясь ими, метилпреднизолон, преднизолон и преднизон. Введение кортикостероидов сопровождается обратимыми изменениями метаболизма глюкозы, увеличением аппетита, задержкой жидкости, увеличением веса, изменением настроения, гипертензией, пептической язвой и асептическим некрозом кости. Данные соединения используют для предотвращения в течение короткого времени (3-10 дней) воспалительной реакции при недостаточно контролируемой персистированной астме. Они также функционируют при предотвращении в течение длительного времени симптомов при тяжелой персистированной астме для подавления и контроля, и даже реверсии воспаления. Некоторые побочные эффекты, связанные с продолжительным использованием, включают подавление системы надпочечников, подавление роста, утончение кожи, гипертензию, диабеты, синдром Кушинга, катаракты, мышечную слабость и в редких случаях снижение функции иммунной системы. Рекомендуется использование таких типов соединений в их самых низких эффективных дозах. Guidelinesfor diagnosis and management of astma; expert panel report to; NIH Publication No. 97-4051; July 1997. Иммуномодуляторы включают, но, не ограничиваясь ими, группу, состоящую из противовоспалительных агентов, антагонистов лейкотриенов, мутеинов IL-4, растворимых рецепторов для IL-4, иммунодепрессантов (таких как вызывающая толерантность пептидная вакцина), антител против IL-4, антагонистов IL-4, антител против IL-5, слитых белков растворимый IL-13-рецептор/Fc, антител против IL-9, антагонистов CCR3, антагонистов CCR5, ингибиторов VLA-4 и супрессоров IgE. Модификаторы лейкотриенов часто используют для продолжительного контроля и предотвращения симптомов персистированной астмы средней степени тяжести. Модификаторы лейкотриенов функционируют в качестве антагонистов рецепторов лейкотриенов путем избирательной конкуренции за рецепторы для LTD-4 и LTE-4. Данные соединения включают, но не ограничиваясь ими, зафирлукаст и зилеутон в таблетках. Зилеутон в таблетках функционирует в качестве ингибитора 5-липоксигеназы. Прием таких лекарственных средств сопровождается повышением ферментов печени и в некоторых случаях обратимым гепатитом и гипербилирубинемией. Лейкотриены являются биохимическими медиаторами,высвобождаемыми из тучных клеток, инозинофилов и базофилов, которые вызывают сокращение гладкой мускулатуры дыхательных путей и увеличивают проницаемость сосудов, секрецию слизи и активируют клетки воспаления в дыхательных путях больных астмой. Другие иммуномодуляторы включают нейропептиды, которые, как было показано, обладают иммуномодулирующими свойствами. Функциональные исследования показали, что вещество Р, например,может оказывать влияние на функцию лимфоцитов с помощью опосредуемых специфическими рецепторами механизмов. Вещество Р также, как было показано, модулирует отдельные реакции гиперчувствительности немедленного типа путем стимуляции образования получаемых из арахидоновой кислоты медиаторов в тучных клетках слизистой оболочки. McGillies J. et al., 1987, Fed Proc. 45:196-9. Вещество Р представляет собой нейропептид, впервые идентифицированный в 1931 году. Von Euler and Gaddum, J.Physiol (London) 72:74-87 (1931). Его аминокислотная последовательность сообщена Chang et al. (1971)Chang M.M. et al., 1971, Nature New Biol 232:86-87. Иммунорегуляторная активность фрагментов вещества Р исследовалась Siemion I.Z. et al. (1990) Molec. Immunol. 27:887-890. Другой класс соединений представляет собой супрессоры IgE. Данные соединения включают пептиды или другие молекулы, обладающие способностью связываться с рецептором для IgE и, таким образом, предотвращать связывание специфического в отношении антигена IgE. Другим типом супрессораIgE является моноклональное антитело, направленное против связывающегося с рецептором для IgE района молекулы IgE человека. Следовательно, одним типом супрессора IgE является антитело противIgE или фрагмент такого антитела. Антитело против IgE разработано Genentech. Специалист в данной области сможет получить функционально активные фрагменты антитела в виде связывающихся пептидов, которые имеют такие же функции. Другим типом супрессора IgE являются полипептиды, способные блокировать связывание антител против IgE с рецепторами Fc на клеточной поверхности и вытеснять IgE из сайтов связывания, с которыми IgE уже связан. Одна проблема, связанная с супрессорами IgE, состоит в том, что многие молекулы не обладают способностью связываться с рецептором, соответствующей очень сильному взаимодействию между природной молекулой IgE и ее рецептором. Молекулы, обладающие такой способностью, имеют тенденцию- 14013468 связываться необратимо с рецептором. Однако такие вещества относительно токсичны, поскольку они могут связываться ковалентно и блокировать другие структурно схожие молекулы в организме. В этой связи интерес представляет тот факт, что -цепь рецептора для IgE принадлежит большому семейству генов, в котором содержаться, например, несколько различных рецепторов для Fc IgG. Указанные рецепторы абсолютно необходимы для защиты организма от, например, бактериальных инфекций. Молекулы,активированные для ковалентного связывания, являются, кроме того, часто относительно нестабильными и, следовательно, они, вероятно, должны вводиться несколько раз в день и в таком случае в относительно высоких концентрациях, для того чтобы сделать возможным полное блокирование непрерывно возобновляемого пула рецепторов для IgG на тучных клетках и базофильных лейкоцитах. Кромолин натрия и недокромил используются в качестве лекарственных средств продолжительного действия для предотвращения первичных симптомов астмы, возникающих от физических нагрузок, или аллергических симптомов, возникающих от аллергенов. Полагают, что данные соединения блокируют ранние и поздние реакции на аллергены, мешая функции хлоридных каналов. Они также стабилизируют мембраны тучных клеток и ингибируют активацию и высвобождение медиаторов из инозинофилов и эпителиальных клеток. Для достижения максимальной пользы обычно требуется введение на протяжении четырех-шести недель. Антихолинергичекие средства обычно используют для ослабления острого бронхоспазма. Полагают, что данные соединения функционируют путем конкурентного ингибирования мускариновых холинергичеких рецепторов. Антихолинергичекие средства включают, но без ограничения, ипратропия бромид. Данные соединения реверсируют только холинергичеки опосредуемый бронхоспазм и не модифицируют какую-либо реакцию на антиген. Побочные эффекты включают сухость во рту и респираторную секрецию, возрастание стерторозного дыхания у некоторых индивидуумов и затуманенное зрение при попадании в глаза. Для использования in vitro и in vivo ssOPH настоящего изобретения обычно используют в эффективном количестве. Используемый в данном описании термин "эффективное количество" относится, как правило, к любому количеству, достаточному для достижения желаемого биологического эффекта. В одном из вариантов осуществления настоящего изобретения эффективное количество представляет собой клинически эффективное количество, причем клинически эффективным количеством является любое количество, которое достаточно для лечения субъекта, имеющего заболевание. Используемые в данном описании термины "лечить" и "лечение" относятся к уменьшению, устранению или предотвращению по меньшей мере одного признака или симптома заболевания у субъекта, имеющего заболевание или имеющего риск развития заболевания. Используемый в данном описании термин "субъект" относится к человеку или другому млекопитающему. В комбинации с представленными в данном описании методиками, путем выбора среди различных активных соединений и учитывая такие факторы, как активность, относительная биодоступность, масса тела пациента, тяжесть неблагоприятных побочных эффектов и предпочтительный способ введения,можно планировать эффективную профилактическую или терапевтическую схему лечения, которая не вызывает существенной токсичности и все еще является эффективной для лечения конкретного субъекта. Эффективное количество для любого конкретного применения может варьировать в зависимости от таких факторов, как заболевание или состояние, подвергаемое лечению, конкретный вводимый ssOPH,размер субъекта или тяжесть заболевания или состояния. Специалист в данной области сможет эмпирически определить эффективное количество конкретного ssOPH и/или другого терапевтического агента без необходимости чрезмерного экспериментирования. Обычно предпочтительно использовать максимальную дозу, т.е. наивысшую безопасную дозу согласно некоторым медицинским оценкам. Можно рассматривать множество доз в день для достижения системных уровней соединений. Соответствующие системные уровни можно определить с помощью, например, измерения у больного максимального или устойчивого уровня лекарственного средства в плазме. Термины "доза" и "дозировка" используются в данном описании взаимозаменяемо. Как правило, ежедневные пероральные дозы активных соединений составляют приблизительно от 0,01 до 1000 мг/кг в день. Ожидают, что пероральные дозы, находящиеся в диапазоне 0,5-50 мг/кг, для одного или нескольких введений в день дадут желаемые результаты. Дозы можно регулировать соответствующим образом для достижения желаемых уровней лекарственных средств, местных или системных,в зависимости от способа введения. Например, ожидают, что ежедневная доза при внутривенном введении будет на порядок до нескольких порядков ниже. В том случае, если при таких дозах реакция субъекта является недостаточной, можно использовать даже более высокие дозы (или более высокие эффективные дозы, доставляемые с помощью отличного, более локализованного пути доставки) в такой степени,которую может переносить пациент. Можно рассматривать множество доз в день для достижения соответствующих системных уровней соединений. Для любого описанного в данном описании соединения терапевтически эффективное количество можно определить на моделях животных. Терапевтически эффективную дозу можно также определить по данным от человека для ssOPH, которая была протестирована на людях, и по соединениям, для которых известно, что они проявляют схожую фармакологическую активность, таким как другие родствен- 15013468 ные активные агенты. Более высокие дозы могут потребоваться для парентерального введения. Применяемую дозу можно регулировать на основе относительной биодоступности и активности вводимого соединения. Регулирование дозы для достижения максимальной эффективности на основе способов,описанных выше, и других способов, хорошо известных в данной области, находится в компетенции специалиста в данной области. Для того чтобы повысить доставку ssOPH в клетки, ssOPH необязательно можно представить, получить или иным образом объединить с катионным липидом. В одном из вариантов осуществления настоящего изобретения таким катионным липидом является DOTAR. Для применения в терапии эффективное количество ssOPH можно вводить субъекту любым способом, с помощью которого ssOPH доставляется на желаемую поверхность. Введение фармацевтической композиции настоящего изобретения можно осуществить с помощью любого способа, известного специалистам в данной области. Предпочтительные способы введения включают, но не ограничиваясь ими,оральный, парентеральный, внутримышечный, интраназальный, подъязычный, внутритрахеальный, ингаляционный, глазной, вагинальный и ректальный.ssOPH настоящего изобретения можно доставить к конкретной ткани, типу клетки или иммунной системе, или к тому и другому, с помощью вектора. В самом широком смысле "вектор" представляет собой любой носитель, способный облегчать перенос композиции к клеткам-мишеням. Вектор обычно транспортирует ssOPH, антитело, антиген и/или специфическое в отношении заболевания лекарственное средство к клеткам-мишеням с уменьшенной деградацией относительно степени деградации, которая происходит в отсутствие вектора. Как правило, используемые в настоящем изобретении векторы делят на два класса: биологические векторы и химические/физические векторы. Биологические векторы и химические/физические векторы используют для доставки и/или поглощения терапевтических агентов настоящего изобретения. Используемый в данном описании термин "химический/физический вектор" относится к природной или синтетической молекуле, отличной от молекул, получаемых из бактериологических или вирусных источников, способной доставлять ssOPH и/или другое лекарственное средство. Предпочтительный химический/физический вектор настоящего изобретения представляет собой коллоидную дисперсную систему. Коллоидные дисперсные системы включают системы на основе липидов, включая эмульсии типа масло в воде, мицеллы, смешанные мицеллы и липосомы. Предпочтительной коллоидной системой настоящего изобретения является липосома. Липосомы представляют собой искусственные мембранные емкости, которые используются в качестве векторов доставки in vivo или invitro. Показано, что в большие однослойные везикулы (LUV), размер которых находится в диапазоне 0,24 мкм, можно инкапсулировать большие макромолекулы. РНК, ДНК и интактные вирионы можно инкапсулировать в водное содержимое и доставлять к клеткам в биологически активной форме. Fraley et al.,1981, Trends Biochem. Sci. 6:77. Липосомы можно нацелить на конкретную ткань путем сочетания липосомы со специфическим лигандом, таким как моноклональное антитело, сахар, гликолипид или белок. Лиганды, которые можно использовать для нацеливания липосомы на клетку иммунной системы, включают, но не ограничиваясь ими, интактные молекулы или их фрагменты, которые взаимодействуют со специфическими в отношении иммунных клеток рецепторами и молекулами, такие как антитела, которые взаимодействуют с маркерами клеточной поверхности клеток иммунной системы. Такие лиганды можно легко идентифицировать с помощью анализов связывания, хорошо известных специалистам в данной области. В еще одном из вариантов осуществления настоящего изобретения липосому можно нацелить на рак путем ее сочетания с одним из иммунотерапевтических антител, обсуждаемых выше. Кроме того, вектор можно подвергнуть сочетанию с нацеленным на ядро пептидом, который будет направлять вектор в ядро клеткихозяина. Липидные композиции для трансфекции коммерчески доступны от QIAGEN, например, как EFFECTENE (нелипосомальный липид со специальным ДНК-конденсирующим усилителем) иSUPERFECT (новая действующая дендримерная техника). Липосомы коммерчески доступны от Gibco BRL, например, как LIPOFECTIN и LIPOFECTACE,которые образованы из катионных липидов, таких как N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмонийхлорид (DOTMA) и диметилдиоктадециламмонийбромид (DDAB). Способы получения липосом хорошо известны в данной области и описаны во многих публикациях. Обзор липосом также представлен Gregoriadis G. (1985) Trends Biotechnol. 3:235-241. В одном из вариантов осуществления настоящего изобретения носитель представляет собой биосовместимую микрочастицу или имплантат, который подходит для имплантации или введения являющемуся млекопитающим реципиенту. Примеры биоразрушаемых имплантатов, которые применимы в соответствии с данным способом, описаны в опубликованной международной заявке WO 95/24929, озаглавленной "Polymeric Gene Delivery System". B WO 95/24929 описана биосовместимая, предпочтительно биоразрушаемая полимерная матрица для вмещения экзогенного гена под контролем соответствующего промотора. Полимерную матрицу можно использовать для достижения непрерывного высвобождения- 16013468 терапевтического агента у субъекта. Полимерная матрица предпочтительно находится в форме микрочастиц, таких как микросферы (в которых нуклеиновая кислота и/или другой терапевтический агент диспергированы по всей твердой полимерной матрице) или микрокапсулы (в которых нуклеиновая кислота и/или другой терапевтический агент хранятся в ядре, покрытом полимерной оболочкой). Другие формы полимерной матрицы для вмещения терапевтического агента включают пленки, покрытия, гели, имплантаты и стенты. Размер и состав устройства в виде полимерной матрицы выбирают таким образом, чтобы получить в результате благоприятную кинетику высвобождения в ткани, в которую вводят матрицу. Размер полимерной матрицы,кроме того, выбирают в соответствии со способом доставки, который должен применяться, обычно инъекцией в ткань или введением суспензии с помощью аэрозоля в области носа и/или легких. Когда используется аэрозольный путь, полимерную матрицу и нуклеиновую кислоту и/или другой терапевтический агент предпочтительно включать в носитель в виде поверхностно-активного вещества. Композицию полимерной матрицы можно выбрать таким образом, чтобы она имела благоприятную скорость разрушения, а также чтобы образовывался материал, который является биоадгезивным, для дополнительного увеличения эффективности переноса при назначении матрицы на поверхность носа и/или легкого, которая подверглась повреждению. Композицию матрицы также можно выбрать таким образом, чтобы она не разрушалась, а быстро высвобождалась посредством диффузии на протяжении продолжительного периода времени. В некоторых предпочтительных вариантах осуществления настоящего изобретения нуклеиновую кислоту вводят субъекту через имплантат, в то время как другой терапевтический агент вводят в экстренном порядке. Биосовместимые микросферы, которые подходят для доставки, такой как доставка в ротовую полость или слизистые оболочки, раскрыты Chickering et al. (1996) Biotech. Bioeng. 52:96-101 и Mathiowitz et al. (1997) Nature 386:410-414 и в заявке РСТ WO 97/03702. Как био-неразрушаемые, так и биоразрушаемые полимерные матрицы можно использовать для доставки субъекту нуклеиновой кислоты и/или другого терапевтического агента. Предпочтительными являются биоразрушаемые матрицы. Такие полимеры могут быть природными или синтетическими полимерами. Полимеры выбирают на основе периода времени, на протяжении которого желательно высвобождение, обычно порядка от нескольких часов до года или дольше. Как правило, наиболее желательным, в частности, для агентов, являющихся нуклеиновыми кислотами, является высвобождение на протяжении периода времени в пределах от нескольких часов до трех-двенадцати месяцев. Полимер необязательно находится в форме гидрогеля, который может абсорбировать до приблизительно 90% его массы в воде и, кроме того, необязательно поперечно сшит с поливалентными ионами или другими полимерами. Представляющие особый интерес биоадгезивные полимеры включают биоразрушаемые гидрогели,описанные H.S. Sawhney, C.P. Pathal и J.A. Hubell в Macromolecules, 1993, 26:581-587, рекомендации которых включены в данное описание. Они включают полигиалуроновые кислоты, казеин, желатин, глутин, полиангидриды, полиакриловую кислоту, альгинат, хитозан, поли(метилметакрилаты), поли(этилметакрилаты), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат). Также может быть желательным использование уплотняющих агентов. Уплотняющие агенты также можно использовать отдельно или в комбинации с биологическим или химическим/физическим вектором. Используемый в данном описании термин "уплотняющий агент" относится к агенту, такому как гистон, который нейтрализует отрицательные заряды на нуклеиновой кислоте и, таким образом, делает возможным уплотнение нуклеиновой кислоты в тонкоизмельченную гранулу. Уплотнение нуклеиновой кислоты облегчает поглощение нуклеиновой кислоты клеткой-мишенью. Уплотняющие агенты можно использовать отдельно, т.е. для доставки нуклеиновой кислоты в форме, которая наиболее эффективно поглощается клеткой, или, более предпочтительно, в комбинации с одним или несколькими из описанных выше векторов. Другие примеры композиций, которые можно использовать для облегчения поглощения нуклеиновой кислоты, включают фосфат кальция и другие химические медиаторы внутриклеточного транспорта,микроинжекторные композиции, композициидля электропорации и гомологичной рекомбинации (например, для интеграции нуклеиновой кислоты в предварительно выбранное местонахождение в пределах хромосомы клетки-мишени). Соединения можно вводить отдельно (например, в солевом растворе или буфере) или с использованием любого вектора доставки, известного в данной области. Например, описаны следующие средства доставки: кохлеаты (Gould-Fogerite et al., 1994, 1996); эмульсомы (Vancott et al., 1998, Lowell et al., 1997);al., 1999, Michalek et al., 1989, 1992, de Haan 1995a, 1995b); живые бактериальные векторы (например,Salmonella, Escherichia coli, бациллы Кальметта-Гирена, Shigella, Lactobacillus) (Hone et al., 1996, Pouwelset al., 1998, Chatfield et al., 1993, Stover et al., 1991, Nugent et al., 1998), живые вирусные векторы (например, вирус осповакцины, аденовирус, вирус простого герпеса) (Gallichan et al., 1993, 1995, Moss et al.,1996, Nugent et al., 1998, Flexner et al., 1988, Morrow et al., 1999); микросферы (Gupta et al., 1998, Jones etal., 1996, Maloy et al., 1994, Moore et al., 1995, O'Hagan et al., 1994, Eldridge et al., 1989); вакцины на основе нуклеиновых кислот (Fynan et al., 1993, Kuklin et al., 1997, Sasaki et al., 1998, Okada et al., 1997, Ishii etal., 1998); полимерные кольца (Wyatt et al., 1998); протеосомы (Vancott et al., 1998, Lowell et al., 1988,1996, 1997); натрия фторид (Hashi et al., 1998); трансгенные растения (Tacket et al., 1998, Mason et al.,1998, Haq et al., 1995); виросомы (Gluck et al., 1992, Mengiardi et al., 1995, Cryz et al., 1998) и вирусоподобные частицы (Jiang et al., 1999, Leibl et al., 1998). Композиции настоящего изобретения вводят в фармацевтически приемлемых растворах, которые могут в заведенном порядке содержать фармацевтически приемлемые концентрации солей, буферных агентов, консервантов, совместимых носителей, адъювантов и необязательно других терапевтических ингредиентов. Термин "фармацевтически приемлемый носитель" означает один или несколько совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, которые подходят для введения человеку или другому позвоночному животному. Термин "носитель" означает органический или неорганический ингредиент, природный или синтетический, с которым объединяют активный ингредиент для облегчения применения. Компоненты фармацевтических композиций также можно смешивать с компонентами настоящего изобретения и друг с другом таким образом, чтобы не было взаимодействия,которое может существенно ослабить желаемую фармакологическую эффективность. Для орального введения соединения (т.е. ssOPH и необязательно другие терапевтические агенты) можно легко приготовить в виде лекарственного средства комбинированием активного(ых) компонента(ов) с фармацевтически приемлемыми носителями, хорошо известными в данной области. Такие носители дают возможность приготовить соединения настоящего изобретения в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.п. для орального приема субъектом, подвергаемым лечению. Фармацевтические препараты для орального применения можно получить в виде твердых эксципиентов, необязательно измельчая полученную в результате смесь и перерабатывая смесь гранул, после добавления подходящих вспомогательных веществ, если желательно, с получением ядер таблеток или драже. Подходящими эксципиентами являются, в частности, такие наполнители, как сахара, включая лактозу, сахарозу, маннит или сорбит; такие целлюлозные препараты, как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрийкарбоксиметилцеллюлоза и/или поливинилпирролидон (PVP). Если желательно, можно добавить дезинтегрирующие агенты, такие как поперечно сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия. Необязательно пероральные композиции можно также приготовить в солевом растворе или буферах, например, EDTA, для нейтрализации внутренних кислотных условий, или их можно вводить без каких-либо носителей. Также специально предусмотрены пероральные дозированные формы вышеуказанного соединения или соединений. Соединение или соединения могут быть химически модифицированы таким образом,чтобы оральная доставка производного была эффективной. Как правило, предусмотренная химическая модификация представляет собой присоединение к самой молекуле соединения по меньшей мере одной составляющей, которая делает возможным (а) ингибирование протеолиза и (b) поступление в кровоток из желудка или кишечника. Также желательным является увеличение общей стабильности соединения или соединений и увеличение времени циркуляции в организме. Примеры таких составляющих включают полиэтиленгликоль, сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон и полипролин. Abuchowski and Davis, 1981, "SolublePolymer-Enzyme Adducts" In: Enzymes as Drugs, Hocenberg and Roberts, eds., Wiley-Interscience, New York,NY, pp. 367-383; Newmark et al., 1982, J. Appl. Biochem. 4:185-189. Другими полимерами, которые можно использовать, являются поли-1,3-диоксолан и поли-1,3,6-триоксолан. Предпочтительными для фармацевтического применения, как указано выше, являются составляющие полиэтиленгликоля. Для компонента (или производного) местом высвобождения может быть желудок, тонкая кишка(двенадцатиперстная, тощая или подвздошная) или толстая кишка. Специалисты в данной области располагают подходящими рецептурами композиций, которые не растворяются в желудке, но высвобождают материал в двенадцатиперстной кишке или еще в каком-либо другом месте в кишечнике. Предпочтительно, чтобы высвобождение было лишено вредных воздействий желудочной среды или с помощью защиты ssOPH (или производного), или с помощью высвобождения биологически активного материала после желудочной среды, например в кишечнике. Для гарантии полной устойчивости к желудочной среде существенным является покрытие, непроницаемое по меньшей мере при рН 5,0. Примерами наиболее общих инертных ингредиентов, которые используются в качестве энтеросолюбильных покрытий, являются тримеллитат ацетата целлюлозы(CAT), фталат гидроксипропилметилцеллюлозы (НРМСР), НРМСР 50, НРМСР 55, фталат поливинилацетата (PVAP), Eudragit L30D, Aquateric, фталат ацетата целлюлозы (САР), Eudragit L, Eudragit S и Shellac. Такие покрытия можно использовать в виде смешанных пленок. Для таблеток можно также использовать покрытие или смесь покрытий, которые не предназначены- 18013468 для защиты против желудочной среды. Такие покрытия включают сахарные покрытия или покрытия,которые облегчают глотание таблетки. Капсулы могут состоять из твердой оболочки (такой как желатин) для доставки сухого терапевтического агента, т.е. порошка; для жидких форм можно использовать мягкую желатиновую оболочку. Материалом крахмальных капсул может быть плотный крахмал или другая съедобная бумага. Для пилюль, лепешек, формованных таблеток и таблеток в виде порошков можно использовать методику влажного уплотнения. Терапевтический агент может быть включен в композицию в виде множества тонкоизмельченных частиц в форме гранул с размером частиц, составляющим приблизительно 1 мм. Композиция материала для введения в капсулы также может быть в виде порошка, слегка прессованных включений или даже в виде таблеток. Терапевтический агент можно приготовить с помощью прессования. Можно включить красители или корригенты. Например, ssOPH (или производное) можно приготовить в виде лекарственного средства (например, с помощью инкапсуляции в липосомы или микросферы) и затем включить в съедобный продукт, такой как охлажденный напиток, содержащий красители или корригенты. Терапевтический агент можно развести или увеличить его объем с помощью инертного материала. Такие разбавители могут включать углеводороды, в частности, маннит, -лактозу, безводную лактозу,целлюлозу, сахарозу, модифицированные декстраны и крахмал. Можно также использовать в качестве наполнителей некоторые неорганические соли, включая трифосфат кальция, карбонат магния и хлорид натрия. Некоторыми коммерчески доступными разбавителями являются Fast-Flo, Emdex, STA-Rx 1500,Emcompress и Avicell. В композицию терапевтического агента в твердой дозированной форме можно включить дезинтегрирующие вещества. Материалы, используемые в качестве дезинтегрирующих веществ, включают, но не ограничиваясь ими, крахмал, включая коммерческие дезинтегрирующие вещества на основе крахмала,Explotab. Можно использовать гликолят натрийкрахмала, Amberlite, натрийкарбоксиметилцеллюлозу,ультраамилопектин, альгинат натрия, желатин, апельсиновую корку, кислую карбоксиметилцеллюлозу,природный пористый материал и бентонит. Другой формой дезинтегрирующих веществ являются нерастворимые катионообменные смолы. Камеди в виде порошка можно использовать в качестве дезинтегрирующих веществ и в качестве связующих веществ, и они могут включать камеди в виде порошка, такие как агар, камедь карайи или трагакант. В качестве дезинтегрирующих веществ используют также альгиновую кислоту и ее натриевую соль. Для удерживания вместе терапевтического агента с образованием твердой таблетки можно использовать связующие агенты, и они включают природные продукты, такие как аравийская камедь, трагакант, крахмал и желатин. Другие связующие агенты включают метилцеллюлозу (МС), этилцеллюлозу(ЕС) и карбоксиметилцеллюлозу (CMC). Как поливинилпирролидон, так и гидроксипропилметилцеллюлозу (НРМС) можно использовать в спиртовых растворах для грануляции терапевтического агента. В композицию терапевтического агента можно включить антифрикционный агент для предотвращения прилипания во время процесса приготовления. Лубриканты можно использовать в виде слоя между терапевтическим агентом и стенкой формы, и они включают, но не ограничиваясь ими, стеариновую кислоту, включая ее соли магния и кальция, политетрафторэтилен (PTFE), жидкий парафин, растительные масла и воски. Можно также использовать растворимые лубриканты, такие как лаурилсульфат натрия, лаурилсульфат магния, полиэтиленгликоль различной молекулярной массы, Carbowax 4000 и 6000. Можно добавлять способствующие скольжению вещества (глиданты), которые могут улучшать характеристики текучести лекарственного средства во время приготовления и помочь перегруппировке во время прессования. Способствующие скольжению вещества могут включать крахмал, тальк, пирогенный кремнезем и гидрированный силикоалюминат. Для помощи растворению терапевтического агента в водной среде можно добавить поверхностноактивное вещество в качестве смачивающего вещества. Поверхностно-активные вещества могут включать анионные детергенты, такие как лаурилсульфат натрия, сульфосукцинат диоктилнатрия и сульфонат диоктилнатрия. Можно использовать катионные детергенты, и они могут включать бензальконийхлорид или бензетонийхлорид. Список возможных неионных детергентов, которые могут быть включены в композицию в качестве поверхностно-активных веществ, включает лауромакрогол 400, полиоксил 40 стеарат, полиоксиэтилен гидрированное касторовое масло 10, 50 и 60, моностеарат глицерина, полисорбат 40, 60, 65 и 80, сложный эфир жирных кислот и сахарозы, метилцеллюлозу и карбоксиметилцеллюлозу. Такие поверхностно-активные вещества могут быть представлены в композиции ssOPH или его производного или отдельно, или в смеси в различных соотношениях. Фармацевтические препараты, которые можно использовать перорально, включают выдерживающие давление капсулы, изготовленные из желатина, в также мягкие герметизированные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Выдерживающие давление капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующими веществами, таким как крахмалы, и/или лубрикантами, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленг- 19013468 ликоли. Кроме того, могут быть добавлены стабилизаторы. Можно также использовать микросферы, полученные для орального введения. Такие микросферы подробно описаны в данной области. Все композиции для орального введения должны быть в дозах, подходящих для такого введения. Для трансбуккального введения композиции могут принимать форму таблеток или лепешек, приготовленных традиционным способом. Для введения с помощью ингаляции соединения, используемые в соответствии с настоящим изобретением, можно обычным образом доставить в форме аэрозольного спрея из упаковок, в которых создано повышенное давление, или распылителя с использованием подходящего диспергатора, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под повышенным давлением единицу дозы можно определить с помощью вентиля для доставки отмеренного количества. Капсулы и картриджи, например из желатина, для использования в ингаляторе или инсульффляторе можно получить таким образом, чтобы они содержали смесь в виде порошка соединения и подходящего основания для порошка, такого как лактоза или крахмал. Также в данном изобретении предусмотрена доставка ssOPH (или его производных) в легкие.ssOPH (или производное) доставляется в легкие млекопитающего при вдыхании и перемещается через эпителиальную выстилку легких в кровоток. Другие сообщения о вдыхаемых молекулах включают Adjei(рекомбинантный гормон роста человека); Debs et al., 1988, J. Immunol. 140:3482-3488 (интерферонгамма и фактор альфа некроза опухоли) и Platz et al., патент США 5284656 (гранулоцитарный колониестимулирующий фактор). Способ и композиция для доставки в легкие лекарственных средств для системного эффекта описаны в патенте США 5451569, выданном 19 сентября 1995 на имя Wong et al. Для использования на практике настоящего изобретения предусмотрен широкий диапазон механических устройств, предназначенных для доставки в легкие терапевтических продуктов, включающих, но не ограничиваясь ими, распылители, ингаляторы отмеренной дозы и порошковые ингаляторы, все из которых известны специалистам в данной области. Некоторыми конкретными примерами коммерчески доступных устройств, подходящих для осуществления на практике настоящего изобретения, являются распылитель Ultravent, изготовляемый Mallinckrodt, Inc., St. Louis, Missori; распылитель Acorn II, изготовляемый Marquest Medical Products, Englewood,Colorado; ингалятор отмеренной дозы Ventolin, изготовляемый Glaxo Inc., Research Triangle Park, NorthCarolina; и порошковый ингалятор Spinhaler, изготовляемый Fisons Corp., Bedford, Massachusetts. Для всех таких устройств требуется использовать композиции, подходящие для диспергированияssOPH (или производного). Как правило, такие композиции являются специфическими в отношении типа используемого устройства и могут включать использование соответствующего материала в виде диспергатора в дополнение к обычным разбавителям, адъювантам и/или носителям, применяемым в терапии. Также предусмотрено использование липосом, микрокапсул или микросфер, комплексов включения или других типов носителей. Химически модифицированные ssOPH также могут быть приготовлены в различных композициях в зависимости от типа химической модификации или типа используемого устройства. Композиции, пригодные для использования с распылителем, или струйным, или ультразвуковым,обычно включают ssOPH (или производное), растворенный в воде в концентрации, составляющей приблизительно от 0,1 до 25 мг биологически активного ssOPH на мл раствора. Композиция может также включать буфер или простой сахар (например, для стабилизации ssOPH и регуляции осмотического давления). Композиция для распылителя может также содержать поверхностно-активное вещество для уменьшения или предотвращения индуцированной на поверхности агрегации ssOPH, вызванной атомизацией раствора при образовании аэрозоля. Композиции, используемые в устройствах в виде ингалятора отмеренной дозы, включает очень хорошо разделяемый порошок, содержащий ssOPH (или производное), суспендированный в диспергаторе с помощью поверхностно-активного вещества. Диспергатором может быть любой общепринятый материал, используемый для данной цели, такой как хлорфторуглерод, гидрохлорфторуглерод, гидрофторуглерод или углеводород, включая трихлорфторметан, дихлордифторметан, дихлортетрафторэтанол и 1,1,1,2 тетрафторэтан, или их комбинация. Подходящие поверхностно-активные вещества включают триолеат сорбитана и соевый лецитин. В качестве поверхностно-активного вещества может использоваться олеиновая кислота. Композиции для рассеивания из устройства в виде порошкового ингалятора содержат очень хорошо разделяемый сухой порошок, содержащий ssOPH (или производное), и может также включать наполнитель, такой как лактоза, сорбит, сахароза или маннит, в количествах, которые облегчают рассеивание порошка из устройства, например, 50-90 мас.% композиции. ssOPH (или производное) наиболее выгодно- 20013468 получать в форме частиц со средним размером, составляющим менее 10 мкм (микрон), наиболее предпочтительно 0,5-5 мкм, для самой эффективной доставки в дистальные участки легкий. Также предусматривается назальная доставка фармацевтической композиции. Назальная доставка делает возможным поступление фармацевтической композиции настоящего изобретения в кровоток непосредственно после введения терапевтического продукта в нос, без необходимости депонирования продукта в легком. Композиции для назальной доставки включают композиции с декстраном или циклодекстраном. Для назального введения используемым устройством является небольшой твердый флакон, к которому присоединен разбрызгиватель отмеренной дозы. В одном из вариантов осуществления настоящего изобретения отмеренная доза доставляется с помощью втягивания фармацевтической композиции раствора настоящего изобретения в камеру точно определенного объема, которая имеет отверстие, которому приданы нужные размеры для распыления аэрозольной композиции путем образования брызг, когда жидкость в камере сжата. Камеру сжимают для введения фармацевтической композиции настоящего изобретения. В конкретном варианте осуществления настоящего изобретения камера представляет собой поршневое устройство. Такие устройства коммерчески доступны. Альтернативно, используют пластиковый сжимаемый флакон с отверстием, которому приданы нужные размеры для распыления аэрозольной композиции путем образования брызг при сжатии. Отверстие обычно находится наверху флакона, и верх обычно является тонким и удлиненным для того, чтобы частично входить в носовые проходы для эффективного введения аэрозольной композиции. Предпочтительно назальный ингалятор обеспечивает отмеренное количество аэрозольной композиции для введения отмеренной дозы лекарственного средства. Соединения, когда желательно доставить их системно, можно приготовить для парентерального введения с помощью инъекции, например, болюсной инъекции или непрерывной инфузии. Композиции для инъекции могут быть представлены в единичной дозированной форме, например, в ампулах или в контейнерах с множеством доз, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать формообразующие агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические композиции для парентерального введения включают водные растворы активных компонентов в водорастворимой форме. Кроме того, суспензии активных компонентов можно приготовить в виде соответствующих масляных суспензий для инъекции. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные суспензии для инъекции могут содержать вещества, увеличивающие вязкость суспензии, такие как натрийкарбоксиметилцеллюлоза, сорбит или декстран. Необязательно суспензия может также содержать подходящие стабилизаторы или агенты, увеличивающие растворимость соединений, которые дают возможность приготовить растворы с высокой концентрацией. Альтернативно, активные компоненты могут быть в форме порошка для составления с подходящим носителем, например, стерильной свободной от пирогенов водой, перед применением. Из соединений можно также приготовить ректальные или вагинальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие обычные основания для суппозиториев,такие как масло какао или другие глицериды. Помимо описанных выше композиций из соединений можно приготовить препараты-депо. Такие композиции продолжительного действия можно приготовить с использованием подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в приемлемом масле) или ионообменных смол или в виде умеренно растворимых производных, например, в виде плохо растворимой соли. Фармацевтические композиции также могут содержать подходящие носители или эксципиенты,твердые или гелевой фазы. Примеры таких носителей или эксципиентов включают, но не ограничиваясь ими, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли. Подходящими жидкими или твердыми формами фармацевтических препаратов являются, например, водные или солевые растворы для ингаляции, микроинкапсулированные, помещенные внутрь кохлеат, нанесенные на микроскопические частицы из золота, содержащиеся в липосомах, распыляемые аэрозоли, гранулы для имплантации в кожу или высушенные на остром предмете, делающем царапины в коже. Фармацевтические композиции также включают гранулы, порошки, таблетки, покрытые таблетки,(микро)капсулы, суппозитории, сиропы, эмульсии, суспензии, кремы, капли или препараты с длительным высвобождением активных компонентов, в которых обычно используют, как описано выше, эксципиенты и добавки и/или вспомогательные вещества, такие как дезинтегрирующие вещества, связующие вещества, агенты для покрытия, агенты, вызывающие набухание, лубриканты, корригенты, подсластители или солюбилизаторы. Фармацевтические композиции подходят для применения в различных системах доставки лекарственного средства. С целью краткого обзора способов доставки лекарственных средств см. публикацию Langer, Science 249:1527-1533, 1990, которая включена в данное описание посредством ссылки.ssOPH и необязательно другие терапевтические агенты можно вводить сами по себе (чистыми) или в форме терапевтически приемлемых солей. При использовании в медицине соли должны быть фармацевтически приемлемыми, но фармацевтически неприемлемые соли могут быть подходящим образом использованы для получения их приемлемых солей. Такие соли включают, но не ограничиваясь ими,соли, полученные из следующих кислот: хлористо-водородной, бромисто-водородной, серной, азотной,фосфорной, малеиновой, уксусной, салициловой, паратолуолсульфокислоты, винной, лимонной, метансульфокислоты, муравьиной, малоновой, янтарной, нафталин-2-сульфокислоты и бензолсульфокислоты. Также такие соли могут быть получены в виде солей щелочных или щелочно-земельных металлов, таких как соли натрия, калия или кальция, и карбоксильной группы. Подходящие буферные агенты включают уксусную кислоту и соль (1-2% мас./об.); лимонную кислоту и соль (1-3% мас./об.); борную кислоту и соль (0,5-2,5% мас./об.); и фосфорную кислоту и соль(0,8-2% мас./об.). Подходящие консерванты включают бензальконийхлорид (0,003-0,03% мас./об.); хлорбутанол (0,3-0,9% мас./об.); парабены (0,01-0,25% мас./об.) и тимеросал (0,004-0,02% мас./об.). Фармацевтические композиции настоящего изобретения содержат эффективное количество ssOPH,и необязательно один или несколько дополнительных терапевтических агентов можно включить в фармацевтически приемлемом носителе. Терапевтический(ие) агент(ы), включающие, в частности, но, не ограничиваясь ими, ssOPH, могут быть предоставлены в форме частиц. Используемый в данном описании термин "частицы" означает нано- или микрочастицы (или в некоторых случаях более крупные), которые состоят полностью или частично из ssOPH или другого терапевтического агента(ов), описанного в данном описании. Частицы могут содержать терапевтический агент(ы) в ядре, окруженном оболочкой, включая энтеросолюбильную оболочку. Терапевтический агент(ы) может быть также диспергирован во всей частице. Терапевтический агент(ы) может быть адсорбирован на частицах. Частицы могут обладать кинетикой высвобождения любого порядка, включая высвобождение нулевого порядка, высвобождение первого порядка, высвобождение второго порядка, замедленное высвобождение, непрерывное высвобождение, немедленное высвобождение или любую их комбинацию, и т.д. Помимо терапевтического агента(ов) частицы могут включать любой из материалов, которые обычно используются в области фармации и медицине, включая разрушаемый, неразрушаемый, биоразрушаемый или био-неразрушаемый материал или их комбинации. Частицы могут быть в форме микрокапсул, которые содержат ssOPH в растворе или в полурастворенном состоянии. Частицы могут быть фактически любой формы. При получении частиц для доставки терапевтического агента(ов) можно использовать как бионеразрушаемый, так и биоразрушаемый полимерный материал. Такие полимеры могут быть природными или синтетическими полимерами. Полимер выбирают на основе периода времени, на протяжении которого желательно высвобождение. Представляющие особый интерес биоадгезивные полимеры включают биоразрушаемые гидрогели, описанные H.S. Sawhney, C.P. Pathak and J.A. Hubell in Macromolecules,1993, 26:581-587, рекомендации которых включены в данное описание. Они включают полигиалуроновые кислоты, казеин, желатин, глутин, полиангидриды, полиакриловую кислоту, альгинат, хитозан, поли(метилметакрилаты), поли(этилметакрилаты), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат),поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат). Терапевтический агент(ы) может содержаться в системах контролируемого высвобождения. Термин "контролируемое высвобождение", как подразумевается, относится к любой содержащей лекарственное средство композиции, в которой контролируется способ и профиль высвобождения лекарственного средства. Это относится к композициям как немедленного, так и не немедленного высвобождения,при этом композиции не немедленного высвобождения включают, но не ограничиваясь ими, композиции непрерывного высвобождения и замедленного высвобождения. Используемый в его обычном значении термин "непрерывное высвобождение" (на который также приводится ссылка как на "длительное высвобождение") относится к композиции лекарственного средства, которая обеспечивает постепенное высвобождение лекарственного средства на протяжении длительного периода времени и которая предпочтительно, хотя и необязательно, приводит, по существу, к постоянным уровням лекарственного средства в крови на протяжении длительного периода времени. Используемый в его обычном значении термин "замедленное высвобождение" относится к композиции лекарственного средства, для которой существует задержка во времени между введением композиции и высвобождением из нее лекарственного средства. Замедленное высвобождение может включать или не включать постепенное высвобождение лекарственного средства на протяжении длительного периода времени и, следовательно, может быть или не быть"непрерывным высвобождением". Для лечения хронических состояний может, в частности, подходить использование имплантата с длительным непрерывным высвобождением. Используемый в данном описании термин "длительное" высвобождение означает, что имплантат создан и аранжирован для доставки терапевтических уровней активного ингредиента на протяжении по меньшей мере 7 дней и предпочтительно 30-60 дней. Имплантаты с длительным непрерывным высвобождением хорошо известны специалистам в данной области и включают некоторые из систем высвобождения, описанных выше.- 22013468 Настоящее изобретение далее иллюстрируется следующими примерами, которые никоим образом не следует рассматривать как ограничивающие. Содержание любой приведенной в данном описании ссылки (включая литературных ссылки, выданные патенты, опубликованные заявки на патент и находящиеся в процессе одновременного рассмотрения заявки) специально включено, таким образом, посредством ссылки во всей их полноте. Примеры Пример 1. Независимое от TLR7 распознавание одноцепочечной РНК с фосфодиэфирным остовом. Мононуклеарные клетки периферической крови выделяли из мышей дикого типа и TLR7-/-, переносили в подходящую для роста среду и затем разносили аликвоты отдельно в индивидуальные лунки многолуночных культуральных планшетов. В индивидуальные лунки с клетками добавляли следующие агенты: RNA63 PD, одноцепочечный ОРН, имеющий нуклеотидную последовательность, предоставленную как 5'-CAGGUCUGUGAU-3' (SEQ ID NO:1), в которой все межнуклеотидные связи являются фосфодиэфирными, за исключением фосфоротиоатной связи между А и U на 3'-конце ОРН; RNA63 РТО,одноцепочечный ОРН, имеющий такую же нуклеотидную последовательность, как SEQ ID NO:1, в которой все межнуклеотидные связи являются фосфодиэфирными; CpG-ODN 1668, олигодезоксинуклеотид,имеющий нуклеотидную последовательность, предоставленную как 5'-TCCATGACGTTCCTGATGCT-3'(SEQ ID NO:2); только DOTAR; R-848; RNA63 РТО плюс DOTAR; RNA63 PD плюс DOTAR; и только среду. Клетки выдерживали в культуре в течение 24 часов, затем супернатанты из индивидуальных лунок собирали и анализировали, используя твердофазный иммуноферментный анализ (ELISA), специфический в отношении IL-12p40. Результаты продемонстрированы на фиг. 2. Данные представлены как среднее арифметическоеSEM. Как показано на фиг. 2, как RNA63 PD, так RNA63 РТО, при добавлении с DOTAR, индуцировалиIL-12p40 в клетках дикого типа. В противоположность, однако, RNA63 PD, но не RNA63 РТО, при добавлении с DOTAR, индуцировал IL-12p4 0 в клетках TLR7-/-. Полученный последний из указанных результатов поддерживает предположение о том, что одноцепочечный ОРН с фосфодиэфирным, но не с фосфоротиоатным, остовом индуцирует активацию иммунной системы независимым от TLR7 образом. Пример 2. RNA63 PD индуцирует IL-12p40 зависимым от дозы образом, а также индуцирует IL-6 иIFN- в FRL3-L-индуцированных дендритных клетках от мышей TLR7-/-.FLR3-L-индуцированные дендритные клетки получали от мышей дикого типа и TLR7-/- и культивировали в присутствии различных количеств RNA63 PD или RNA63 РТО, каждый с DOTAR. После инкубации в течение 24 ч супернатанты собирали и анализировали с помощью ELISA, специфического в отношении IL-12 р 40, IL-6 и IFN-. В качестве контролей использовали LPS, R-848, CpG-ODN 1668,CpG-ODN 2216 (5'-GGGGGACGATCGTCGGGGG-3', SEQ ID NO:3), только DOTAR и только среду. Результаты продемонстрированы на фиг. 3. Данные представлены как среднее арифметическоеSEM. Как показано на фигуре, как RNA63 PD, так RNA63 РТО, каждый в присутствии DOTAR, индуцировал значительные количества IL-12p40 (фиг. 3 А), IL-6 (фиг. 3 В) и IFN-oc (фиг. 3 С) в дендритных клетках дикого типа. В противоположность, однако, RNA63 PD, но не RNA63 РТО, при добавлении с DOTAR, индуцировал IL-12p40 и, хотя менее сильно, как IL-6, так и IFN- в дендритных клетках TLR7-/-. Количество IL-12p40, индуцированное в дендритных клетках TLR7-/- с помощью RNA63 PD, менялось пропорционально концентрации RNA63 PD. Пример 3. RNA63 PD, но не RNA63 РТО, индуцирует CD69 на FLR3-L-индуцированных дендритных клетках от мышей TLR7-/-.FRL3-L-индуцированные дендритные клетки получали от мышей дикого типа и TLR7-/- и культивировали в течение 24 часов в присутствии RNA63 PD или RNA63 РТО, каждый с DOTAR, как в примере 2. После инкубации в течение 24 ч клетки собирали и анализировали с помощью FACS на наличиеCD69. Результаты продемонстрированы на фиг. 4. Как показано на фиг. 4, как RNA63 PD, так RNA63 РТО, каждый в присутствии DOTAR, индуцировал значительные количества CD69 на дендритных клетках дикого типа (две левые панели). В противоположность, однако, RNA63 PD, но не RNA63 РТО, при добавлении с DOTAR, индуцировал CD69 на дендритных клетках TLR7-/- (две правые панели). Пример 4. RNA63 PD, но не RNA63 РТО, индуцирует IL-12p40 в M-CSF-происходящих макрофагах и GM-CSF-происходящих дендритных клетках от мышей TLR7-/-.M-CSF-происходящие макрофаги и GM-CSF-происходящие дендритные клетки получали от мышей дикого типа и TLR7-/- и культивировали в течение 24 часов в присутствии RNA63 PD плюс DOTAR;RNA63 РТО плюс DOTAR; LPS; R-848; CpG-ODN 1668; CpG-ODN 2216; только DOTAR и только среды. Супернатанты культур затем собирали и анализировали с помощью ELISA, специфического в отношении IL-12p40. Результаты продемонстрированы на фиг. 5. Данные представлены как среднее арифметическоеSEM. Как показано на фиг. 5, как RNA63 PD, так RNA63 РТО, каждый в присутствии DOTAR, индуцировал значительные количества IL-12 р 40 как в M-CSF-происходящих макрофагах, так и в GM-CSFпроисходящих дендритных клетках от мышей дикого типа. В противоположность, однако, RNA63 PD, но- 23013468 не RNA63 РТО, при добавлении с DOTAR, индуцировал значительные количества IL-12 р 40 в TLR7-/- MCSF-происходящих макрофагах и TLR7-/- GM-CSF-происходящих дендритных клетках. Пример 5. Независимое от TLR7 распознавание одноцепочечной РНК с фосфодиэфирным остовом является MyD88-зависимым.FLR3-L-индуцированные дендритные клетки получали отдельно от мышей дикого типа, TLR7-/- иMyD88-/- и культивировали в течение 24 ч в присутствии RNA63 PD или RNA63 РТО, каждый с DOTAR,как в примере 2. После инкубации в течение 24 часов клетки собирали и анализировали с помощьюELISA, специфического в отношении IL-12p40, и FACS на наличие CD69. Результаты продемонстрированы на фиг. 6. Как показано на фиг. 6, индукция IL-12p40 и CD69 отсутствовала в дендритных клетках MyD88-/- и в случае RNA63 PD, и случае RNA63 РТО одинаково. Пример 6. TLR7-независимая стимуляция иммунной системы с помощью ssPHK зависит от TLR9 иTLR8. Поскольку TLR7-независимая стимуляция иммунной системы с помощью ssPHK зависит от MyD88 и эндосомального созревания, была построена гипотеза, что вовлечены другие внутриклеточные TLR.TLR3 кажется слабым кандидатом на распознавание ssPHK, поскольку он по большей части полагается на адаптерную молекулу TRIF, а не на MyD88 (Hoebe, Du et al. 2003). Тем не менее, чтобы исключитьTLR3 в качестве рецептора для ssPHK, скрещивали TLR3- и TLR7-дефицитных мышей с получением вдвойне TLR3/TLR7 дефицитных мышей, и клетки иммунной системы от таких мышей тестировали на стимуляцию с помощью ssPHK. Результаты таких экспериментов показали, что RNA63-стимулированная продукция IL-12 р 40 и индукция CD69 в вдвойне TLR3/TLR7 дефицитных FLT3-L-индуцированных дендритных клетках все еще были функциональными, что говорит о том, что TLR3 не вовлечен в распознавание ssPHK TLR7-независимым образом. Также получали вдвойне TLR7/TLR9 дефицитных мышей для исследования вовлечения TLR9 в распознавание RNA63. Вызывает интерес, что вдвойне TLR7/TLR9 дефицитные GM-CSF-происходящие дендритные клетки и отсортированные зрелые дендритные клетки не продуцировали IL-12 р 40, и в них не происходила индукция CD69, что говорит о том, что TLR9 вовлечен в распознавание ssPHK TLR7-независимым образом. В общем, полученные данные говорят о том,что TLR9 перекрестно реагирует с ssPHK и опосредует стимуляцию иммунной системы с помощьюssPHK. Пример 7. Роль TLR9 в распознавании одноцепочечной РНК с фосфодиэфирным остовом. Для дальнейшего исследования роли TLR9 в распознавании ssPHK с фосфодиэфирным остовом синтезировали различные РНК-последовательности, такие как RNA41 (5'-GCCCGACAGAAGAGAGACAC-3', SEQ ID NO:4) и RNA42 (5'-ACCCAUCUAUUAUAUAACUC-3', SEQ ID NO;5), которые были ранее описаны в качестве неактивных в клетках крысы при синтезе с фосфоротиоатным остовом (Heil,Hemmi et al. 2004). При сравнении стимулирующей способности ОРН с фосфоротиоатным (РТО) или фосфодиэфирным (PD) остовом наблюдали, что RNA41 PD и RNA42 PD стимулируют IL-12p40, IL-6 иIFN- TLR7-независимым образом в клетках крысы и TNF- (но не IFN-) в РВМС человека, в то время как соответствующие РТО-модифицированные ОРН были неактивными. Вызывает интерес, что когда зрелые дендритные клетки дикого типа, дефицитные в отношении TLR7 или дефицитные в отношенииTLR9, стимулировали RNA41 PD и RNA42 PD, TLR9-дефицитные клетки не продуцировали IL-12p40,что говорит о том, что TLR9, но не TLR7, вовлечен в распознавание He-G/U-богатых молекул ssPHK. Напротив, GU-богатая RNA40 (5'-GCCCGUCUGUDGUGUGACUC-3'; SEQ ID NO:6) индуцировала некоторое количество IL-12p40 в клетках, дефицитных только в отношении TLR7, и в клетках, дефицитных только в отношении TLR9, что говорит о том, что TLR7 или TLR9 может функционировать в качестве рецептора для ssPHK. Незрелые дендритные клетки распознавали GU-богатую РНК TLR7-зависимым образом, но удивительно He-GU-богатые RNA41 и RNA42 также распознавались клетками дикого типа,хотя клетки, дефицитные только в отношении TLR7, и клетки, дефицитные только в отношении TLR9, не отвечали, что говорит о том, комплексы TLR7/TLR9 вовлечены в распознавание He-GU-богатых РНК. Пример 8. Роль TLR8 в распознавании одноцепочечной РНК с фосфодиэфирным остовом. Используя короткие интерферирующие РНК, специфические в отношении mTLR8, было продемонстрировано, что TLR8 вовлечен в распознавание ssPHK. FLR3-L-индуцированные дендритные клетки дикого типа обрабатывали TLR8-специфической короткой интерферирующей РНК или контрольной короткой интерферирующей РНК против eGFP и стимулировали CpG-ODN, RNA40 PD, RNA41 PD иRNA42 PD. Клетки, обработанные mTLR8-специфической короткой интерферирующей РНК, демонстрировали снижение секреции IL-12 на 75% или 50% при стимуляции RNA41 и RNA42, соответственно. На стимуляцию RNA40 не влияла TLR-8-специфическая короткая интерференционная РНК, поскольку стимуляция иммунной системы с помощью RNA40 критическим образом зависит от mTLR7. КонтрольнаяeGFP-специфическая короткая интерференционная РНК не оказывала ингибирующего эффекта на продукцию IL-12, и величины IL-12 соответствовали величинам при стимуляции клеток, не трансфицированных короткой интерферирующей РНК. Для дальнейшей оценки вовлечения TLR8 в TLR7 независимую стимуляцию иммунной системы с помощью ssPHK TLR7-дефицитные FLR-L-индуцированные дендритные клетки транфицировали с использованием mTLR8- или eGFP-специфической корот- 24013468 кой интерферирующей РНК, и определяли продукцию IL-12p40, индуцированную RNA63. Дендритные клетки, обработанные mTLR8-специфической короткой интерферирующей РНК, демонстрировали сильное снижение продукции IL-12p40 и уменьшение маркеров активации, таких как CD40, в то время какeGFP-специфическая короткая интерференционная РНК не имела эффекта. Снижение активации с помощью RNA63 иммунной системы коррелировало с супрессией РНК для mTLR8 под действием короткой интерферирующей РНК. Вместе взятые полученные данные демонстрируют, что TLR8 вовлечен в распознавание ssPHK. Пример 9. Гетеродимеры TLR8/TLR9 опосредуют распознавание одноцепочечной РНК. Поскольку TLR8 и TLR9 вовлечены в распознавание ssPHK, исследовали, кооперируют ли оба рецептора и могут ли образовывать комплексы, опосредующие распознавание ssPHK. С помощью трансфекции меченых TLR в клетки НЕК 293 с последующей иммунопреципитацией и вестерн-блоттингом показали, что TLR8-flag связывается с mTLR9-HA и наоборот, в то время как внутриклеточные TLR3 иTLR9 не взаимодействуют. Эквиваленты Считается, что предшествующее описание является достаточным для того, чтобы специалист в данной области смог осуществить на практике настоящее изобретение. Объем настоящего изобретения не ограничивается приведенными примерами, поскольку примеры предназначены только для иллюстрации одного из аспектов изобретения, и другие функционально эквивалентные варианты осуществления настоящего изобретения входят в пределы объема настоящего изобретения. Различные модификации настоящего изобретения помимо тех, которые продемонстрированы и описаны в данном описании, будут очевидны специалистам в данной области из предшествующего описания и входят в пределы объема прилагаемой формулы изобретения. Преимущества и объекты настоящего изобретения необязательно охватываются каждым вариантом осуществления настоящего изобретения. Список последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ индуцирования у субъекта иммунного ответа Th1-подобного типа, включающий введение субъекту эффективного количества иммуностимулирующего одноцепочечного олигорибонуклеотида(ssOPH) размером 5-100 нуклеотидов, который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая(1) не включает гуанозин (G) или(2) включает по меньшей мере один G при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность(a) не включает уридин (U) и(b) не включает CpG-мотив X1X2CGX3X4, где Xl, X2, Х 3 и Х 4 представляют собой нуклеотиды и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным,при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК). 2. Способ индуцирования у субъекта иммунного ответа Th1-подобного типа по п.1, подходящий для индуцирования у субъекта специфического в отношении антигена иммунного ответа, дополнительно включающий введение субъекту антигена. 3. Фармацевтическая композиция для индуцирования у субъекта иммунного ответа Th1-подобного типа или лечения субъекта, имеющего рак, инфекционное заболевание, аллергическое состояние или астму, содержащая эффективное количество иммуностимулирующего одноцепочечного олигорибонуклеотида (ssOPH) размером 5-100 нуклеотидов, который имеет фосфодиэфирный остов и включает нуклеотидную последовательность, которая(1) не включает гуанозин (G) или(2) включает по меньшей мере один G при условии, что, когда нуклеотидная последовательность включает по меньшей мере один G, нуклеотидная последовательность(а) не включает уридин (U) и(b) не включает CpG-мотив X1X2CGX3X4, где X1, X2, Х 3 и Х 4 представляют собой нуклеотиды и CG представляет собой динуклеотид цитозин (С)-гуанин (G), где С в CG динуклеотиде является неметилированным,при условии, что иммуностимулирующий ssOPH не присутствует в виде части двухцепочечной молекулы рибонуклеиновой кислоты (РНК). 4. Фармацевтическая композиция для индуцирования у субъекта иммунного ответа Th1-подобного типа по п.3, подходящая для индуцирования у субъекта специфического в отношении антигена иммунного ответа, дополнительно содержащая антиген. 5. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых размер иммуностимулирующего ssOPH составляет 5-40 нуклеотидов. 6. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых размер иммуно- 26013468 стимулирующего ssOPH составляет 5-20 нуклеотидов. 7. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых размер иммуностимулирующего ssOPH составляет 5-12 нуклеотидов. 8. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых иммуностимулирующий ssOPH представляет собой синтетический ssOPH. 9. Способ по п.1 или 2 или фармацевтическая композиция по п.3 или 4, в которых иммуностимулирующий ssOPH не является полинуклеотидом, выбранным из группы, состоящей из поли-U, поли-G, поли-А и поли-С. 10. Способ по п.1 или 2, в котором введение субъекту эффективного количества иммуностимулирующего ssOPH представляет собой системное введение субъекту эффективного количества иммуностимулирующего ssOPH. 11. Фармацевтическая композиция по п.3 или 4, приготовленная для системного введения субъекту.
МПК / Метки
МПК: C12N 15/00
Метки: одноцепочечная, иммуностимулирующая, остовом, фосфодиэфирным, рибонуклеиновая, кислота
Код ссылки
<a href="https://eas.patents.su/30-13468-immunostimuliruyushhaya-odnocepochechnaya-ribonukleinovaya-kislota-s-fosfodiefirnym-ostovom.html" rel="bookmark" title="База патентов Евразийского Союза">Иммуностимулирующая одноцепочечная рибонуклеиновая кислота с фосфодиэфирным остовом</a>
Предыдущий патент: Способ культивирования микроорганизмов
Следующий патент: Слитый белок, содержащий домен bh3 белка
Случайный патент: Скважинный фильтр, имеющий внутренний дополнительный канал для потока