Соединения пирролидинил- и пирролинилэтиламина в качестве агонистов k-рецептора
Формула / Реферат
1. Соединение формулы
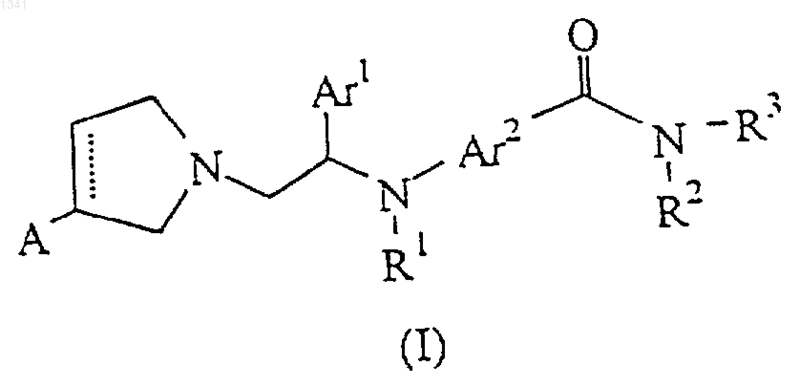
и его соли, где
А обозначает водород, галоген, гидрокси, C1-C6-алкил, галоген-C1-C6-алкил, C1-C6-алкокси, галоген-C1-C6-алкокси, оксо, OY, где Y обозначает гидроксизащитную группу или отсутствует;
пунктирная линия обозначает необязательную двойную связь при условии, что если пунктирная линия является двойной связью, то А отсутствует;
Аr1 обозначает фенил, необязательно замещенный одним или несколькими заместителями, выбранными из галогена, гидрокси, C1-С4-алкила, С1-С4-алкокси, С1-С4-алкокси-С1-С4-алкокси, СF3, карбокси-С1-С4-алкокси и С1-С4-алкоксикарбонил-С1-С43-алкокси;
Аr2 обозначает арил или гетероарил, выбранный из фенила, нафтила, пиридила, тиенила, фурила, пирролила и пиримидила, причем арил или гетероарил необязательно замещены одним или несколькими заместителями, выбранными из галогена, гидрокси, амино, нитро, карбокси, С1-С4-алкила, С1-С4-алкокси, С1-С4-алкиламино, ди-С1-С4-алкиламино, галоген-С1-С4-алкила, С1-С4-алкилтио и сульфонилметила;
R1 обозначает водород, гидрокси, С1-С4-алкил, С1-С4-алкокси или OY, где Y обозначает гидроксизащитную группу; и
R2 и R3 независимо выбраны из водорода, гидрокси, С1-С7-алкила, необязательно замещенного одним или несколькими гидрокси или галогеном, С3-С6-циклоалкила, С2-С6-алкенила, С2-С6-алкинила, С1-С7-алкокси, фенила, необязательно замещенного галогеном, фенила-С1-С7-алкила, галогензамещенного фенил-С1-С7-алкила и (CH2)nX-R4, где n равно 1 или 2, Х обозначает О, NH или S и R4 обозначает C1-С3-алкил, или, когда Аr2 представляет собой фенил, то Ar2-C(=O)-N(R2)- представляет собой фталимидную группу и R3 представляет собой C1-С7-алкил, или
R2 и R3 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо, необязательно замещенное С1-С3-алкилом или галогеном.
2. Соединение по п.1, где
А обозначает водород, галоген, гидрокси, оксо или OY; или если пунктирная линия обозначает двойную связь, то А отсутствует;
Аr1 обозначает фенил, необязательно замещенный одним-тремя заместителями, выбранными из галогена, гидрокси, С1-С4-алкокси, карбокси-С1-С4-алкокси и С1-С4-алкоксикарбонил-С1-С4-алкокси;
Аr2 обозначает фенил, пиридил или тиенил, необязательно замещенный одним-двумя галогенами или С1-С4-алкокси;
R1 обозначает водород, гидрокси или С1-С4-алкил; и
R2 и R3 независимо выбраны из водорода, С1-С7-алкила, необязательно замещенного одним или несколькими гидрокси или галогенами, С3-С6-циклоалкила, С2-С6-алкенила, С2-С6-алкинила, С1-С4-алкоксифенила и галогензамещенного С1-С7-алкила, когда Аr2 обозначает фенил, -Аr2-С(=O)-N(R2)- обозначает фталимидную группу и R3 обозначает С1-С7-алкил, или
R2 и R3 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое или морфолиновое кольцо.
3. Соединение по п.2, где
А обозначает водород, фтор, хлор, гидрокси или OY, где Y обозначает метоксиметил или тетрагидропиранил; или если пунктирная линия является двойной связью, то А отсутствует; или
Аr1 обозначает фенил, необязательно замещенный хлором, гидрокси, метокси или карбоксиметокси;
Аr2 обозначает фенил, пиридил или тиенил, необязательно замещенный хлором, фтором или метокси;
R1 обозначает С1-С4-алкил;
R2 обозначает С1-С7-алкил, необязательно замещенный гидрокси или фтором, С2-С6-алкенил, галогензамещенный фенилметил или фенил; и
R3 обозначает водород или метил; или
R2 и R3 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое или морфолиновое кольцо.
4. Соединение по п.3, где
А обозначает гидрокси, фтор или хлор; или если пунктирная линия представляет собой двойную связь, то А отсутствует;
Аr1 обозначает фенил, необязательно замещенный карбоксиметокси;
Аr2 обозначает фенил, необязательно замещенный метокси или пиридилом;
R1 обозначает С1-С4-алкил; R2 обозначает С1-С7-алкил, необязательно замещенный гидрокси; и
R3 обозначает водород.
5. Соединение по п.4, выбранное из группы, включающей
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-2-метокси-N'-пропилбензамид;
6-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилникотинамид;
4-{N-[1-(S)-(3-карбоксиметоксифенил)-2-(3-(S)-гидроксипирролидин-1-ил)этил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-фторпирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(2-(S)-гидроксипропил)бензамид;
5-{N-[2-(3-(S)-фторпирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилпиколинамид;
4-{N-метиламино-N-[2-(3-пирролин-1-ил)-1-(S)-фенилэтил]}-N'-пропилбензамид; и
4-{N-[2-(3-(S)-хлорпирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(2-(S)-гидроксипропил)бензамид.
6. Соединение по п.3, выбранное из группы, включающей
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-изопропилбензамид;
3-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилбензамид;
2-хлор-4-{N-[2-(3-(S)-гидроксипирролидин-1-ил}-1-(S)-фенилэтил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-3-метокси-N'-пропилбензамид;
3-хлор-4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилбензамид;
4-{N-[1-(S)-(3-гидроксифенил)-2-(3-(S)-гидроксипирролидин-1-ил)этил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-(3-метоксифенил)этил]-N-метиламино}-N'-пропилбензамид;
4-{N-[1-(S)-фенил-2-(пирролидин-1-ил)этил]-N-метиламино}-N'-пропилбензамид;
4-{N-[1-(S)-(3-хлорфенил)-2-(3-(S)-гидроксипирролидин-1-ил)этил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(R)-фенилэтил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}пирролидинбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}морфолинбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(2-(R)-гидроксипропил)бензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-изобутилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-аллилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(3,3,3-трифторпропил)бензамид;
3-фтор-4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино} -N'-пропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(2,2,3,3,3-пентафторпропил)бензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-трет-амилбензамид;
5-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилпиколинамид;
4-{N-[2-(3-(S)-фторпирролидин-1-ил)-1-(3)-фенилэтил]-N-метиламино}-N'-(2-(S)-гидроксипропил)бензамид;
2-хлор-4-{N-[2-(3-(S)-фторпирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилбензамид; и
4-{N-[2-(3-(S)-хлорпирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилбензамид.
7. Соединение по п.2, выбранное из группы, включающей
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-метилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-этилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-бутилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пентилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-фенилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(2-хлорбензил)бензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N',N'-диметилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-метил-N'-пропилбензамид;
5-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропил-2-тиофенкарбоксамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-амино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилфталимид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-этоксибензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(3-гидроксипропил)бензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-циклопропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(S)-втор-бутилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(R)-втор-бутилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропаргилбензамид;
4-{N-[1-(R)-(3-карбоксиметоксифенил)-2-(3-(S)-гидроксипирролидин-1-ил)этил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-трет-бутилбензамид;
4-{N-гидрокси-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]амино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-фторпирролидин-1-ил)-1-(S)-фенилэтил]-N-гидроксиамино}-N'-пропилбензамид;
4-{N-[2-(3-(R)-фторпирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-фторпирролидин-1-ил)-1-(R)-фенилэтил]-N-метиламино}-N'-пропилбензамид;
4-{N-[2-(3-(S)-хлорпирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-(2-(R)-гидроксипропил)бензамид; и
4-{N-[2-(3-оксопирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино}-N'-пропилбензамид.
8. Фармацевтическая композиция для предупреждения или лечения медицинского состояния, для которого необходимо проявление агонистической активности в отношении опиоидного каппа-рецептора у млекопитающего, включающая терапевтически эффективное количество соединения по п.1 и фармацевтически инертный носитель.
9. Фармацевтическая композиция по п.8, полезная в качестве аналгезирующего, анестезирующего, противовоспалительного или нейропротективного агента или для лечения артрита, припадка ("удара") или функционального заболевания пищеварительного тракта.
10. Способ лечения медицинского состояния у млекопитающего, при котором необходимо проявление агонистической активности в отношении опиоидного каппа-рецептора, включающий введение млекопитающему терапевтически эффективного количества соединения по п.1.
11. Соединение следующей формулы
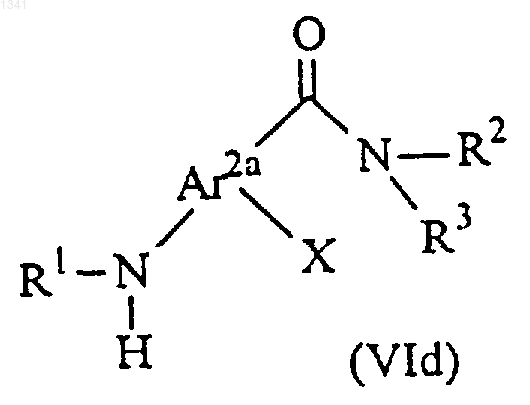
Аr2a обозначает фенил, пиридил или тиенил;
Х обозначает водород, галоген или С1-С7-алкокси;
R1 обозначает водород, необязательно защищенную гидроксигруппу или С1-С4-алкил; и
R2 и R3 независимо обозначают водород или С1-С7-алкил, необязательно замещенный гидрокси или галогеном.
12. Соединение по п.11, выбранное из группы, включающей
4-метиламино-N'-пропилбензамид;
5-N-метиламино-N'-пропилпиколинамид;
2-хлор-4-метиламино-N'-пропилбензамид;
4-метиламино-N'-(2-(S)-гидроксипропил)бензамид;
4-метиламино-N'-(2-(R)-гидроксипропил)бензамид;
4-метиламино-N'-(2,2,3,3,3-пентафторпропил)бензамид; и
4-метиламино-N'-трет-амилбензамид.
13. Соединение, выбранное из группы, включающей
2-(3-(S)-фторпирролидин-1-ил)-1-(S)-фенилэтанол;
2-(3-(S)-фторпирролидин-1-ил)-2-(R)-фенилэтанол;
2-(R)-фенил-2-(3-пирролин-1-ил)этанол;
2-(3-(R)-фторпирролидин-1-ил)-1-(S)-фенилэтанол;
2-(3-(R)-фторпирролидин-1-ил)-2-(R)-фенилэтанол;
2-(3-(S)-фторпирролидин-1-ил)-1-(R)-фенилэтанол;
2-(3-(S)-фторпирролидин-1-ил)-2-(S)-фенилэтанол;
2-(3-(S)-хлорпирролидин-1-ил)-1-(S)-фенилэтанол; и
2-(3-(S)-хлорпирролидин-1-ил)-2-(R)-фенилэтанол.
14. Способ получения соединения формулы (I), включающий взаимодействие амидного производного формулы (VId)
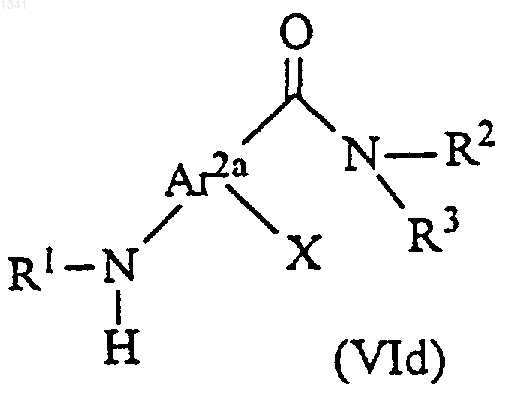
с этанольным производным, выбранным из соединений (Va), (Vb) и (Vc) и смеси соединений (Va) и (Vb)
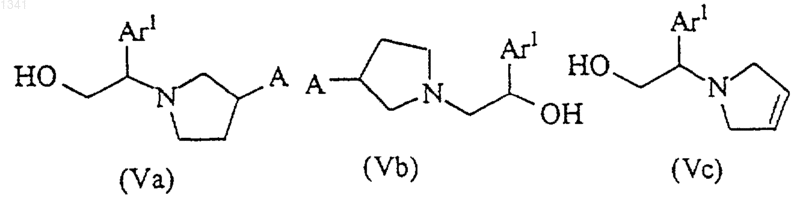
в отсутствие или в присутствии основания в инертном растворителе.
Текст
1 Данное изобретение относится к новым соединениям пирролидинил- и пирролинилэтиламина и их фармацевтически приемлемым солям и к содержащим их фармацевтическим композициям. Фармацевтически активные соединения данного изобретения могут быть использованы в качестве избирательного агониста каппарецептора. Предпосылки изобретения Опиоидные аналгезирующие вещества, такие как морфин, применимы в терапии, но их применимость строго ограничена вследствие их побочных эффектов, таких как лекарственная зависимость и злоупотребление лекарствами. Таким образом, желательны аналгезирующие вещества с высокой полезностью и со сниженной тенденцией индуцирования лекарственной зависимости. Значительные фармакологические и биохимические исследования были проведены для обнаружения опиоидных пептидов и опиоидных рецепторов, и обнаружение подтипа опиоидного рецептора, такого как мю , дельта , каппа (k), в различных видах, в том числе в человеке, положило начало созданию новых аналгезирующих средств. Поскольку считается, что опиоидные аналгезирующие средства, такие как морфин, действуют как агонист рецептора, исследовали отделение действия на основе агониста k-рецептора от действия на основе агониста -рецептора. Недавно каппа-селективные агонистыA.Barber et al., Br.J.Pharmacol., Vol.113,pp.1317-1327, 1994. Некоторые из них в настоящее время были испытаны в клинических испытаниях (Med. Res. Rev., Vol. 12,р.525, 1992). Европейский патент 0254545 В 1 описывает множество соединений этилендиамина. ЕР 0483580 А 2 описывает множество соединений пирролидина в качестве аналгетиков. Международная публикацияWO 96/30339 описывает большое разнообразие соединений пирролидинилгидроксамовой кислоты в качестве селективных агонистов каппа-рецептора. Краткое описание изобретения Данное изобретение обеспечивает соединение следующей формулыC1-C4) алкокси, оксо, OY, где Y обозначает гидроксизащитную группу или отсутствует; пунктирная линия обозначает необязательную двойную связь при условии, что,если пунктирная линия является двойной связью, то А отсутствует; Аr1 обозначает фенил, необязательно замещенный одним или несколькими (предпочтительно одним-двумя) заместителями,выбранными из галогена, гидрокси, C1-C4 алкила, C1-C4-алкокси, C1-C4-aлкокси-C1-C4 алкокси, СF3, карбокси-C1-C4-алкокси и C1C4-алкокси-карбонил-C1-C4-алкокси; Аr2 обозначает арил или гетероарил,выбранный из фенила, нафтила, пиридила,тиенила, фурила, пирролила и пиримидила,причем арил или гетероарил необязательно замещены одним или несколькими (предпочтительно одним-двумя) заместителями,выбранными из галогена, гидрокси, амино,нитро, карбокси, C1-C4-алкила, C1-С 4 алкокси,C1-C4-алкиламино,ди-C1-C4 алкиламино, галоген-C1-C4-алкила, C1-C4 алкилтио и сульфонилметила;R2 и R3 независимо выбраны из водорода, гидрокси, C1-C7-алкила, необязательно замещенного одним или несколькими(предпочтительно одним-пятью) гидрокси или галогеном, C3-C6-циклоалкила, C2-C6 алкенила, C2-C6-алкинила, C1-C7 (предпочтительно C1-С 5)алкокси, фенила, необязательно замещенного галогеном (предпочтительно замещенного одним или двумя атомами галогена), фенилa-C1-C7 (предпочтительно C1-C5) алкила, галогензамещенного фенил-C1-C7-алкила и (CH2)nX-R4, где n равно 1 или 2, Х обозначает О, NH или S иR4 обозначает C1-C3-алкил, или, когда Аr2 представляет собой фенил, то -Аr2-С(=O)N(R2)- представляет собой фталимидную группу и R3 представляет собой C1-C7 алкил, илиR2 и R3 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо, необязательно замещенное C1C3-алкилом или галогеном; когда Аr2 представляет собой фенил,2 3R R N-C(=O)- находится предпочтительно в мета- или пара-положении на фенильном кольце относительно 2-(А-пирролидинил)1-Ar1-этил-N (R1)-, когда оксо выбран в качестве "А"-группы, очевидно, что атом кислорода должен быть присоединен к пирролидинильной группе через двойную связь. 3 Соединения пирролидинил- и пирролидинэтиламина данного изобретения формулы (I) проявляют хорошую активность агониста каппа-рецептора и следовательно применимы в качестве аналгезирующего,анестезирующего, противовоспалительного или нейропротективного агента и также применимы в лечении артрита, внезапного мозгового удара (кровоизлияния, тромбоза,эмболии) или функционального заболевания пищеварительного тракта, такого как боль в животе, для лечения субъектамлекопитающего, в частности субъектачеловека. Конкретно эти соединения применимы в качестве аналгезирующих средств для острой и хронической боли. В частности, эти соединения применимы в качестве аналгезирующих средств в центральной нервной системе млекопитающего. Также эти соединения применимы в качестве аналгезирующих средств для периферически медиируемой воспалительной боли, обусловленной, например, ожогами (индуцированными контактом с нагреванием, кислотой или другими агентами), ожогами (индуцированными контактом с горячей жидкостью или паром), ревматизмом или т.п., в указанном субъекте. Таким образом, данное изобретение обеспечивает фармацевтическую композицию, которая применима в качестве аналгезирующего, анестезирующего, противовоспалительного или нейропротективного агента и также применима в лечении вышеупомянутых заболеваний, которая содержит терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель. Данное изобретение обеспечивает также способ лечения медицинского состояния, для которого необходима агонистическая активность в отношении опиоидного каппа-рецептора,в субъектемлекопитающем, предусматривающий введение этому субъекту терапевтически эффективного количества соединения формулы (I). Подробное описание изобретения В этом описании термин "гидроксизащитная группа" обозначает функциональную группу для защиты гидроксигруппы против нежелательных реакций во время синтетических процедур, в том числе, но не только, бензил, бензоил, метоксиметил, тетрагидропиранил и триалкилсилил. Термин"C1-C6-алкил" обозначает здесь прямой или разветвленный алкил, в том числе, но не только, метил, этил, нпропил, изопропил, н-бутил, втор-бутил,трет-бутил и т.п. Термин "C1-C6-алкокси" обозначает здесь прямой или разветвленный -OR- (R 4 обозначает C1-C6-алкил), в том числе, но не только, метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси и т.п. Термин "галоген" обозначает F, Cl, Вr или I, предпочтительно F или Cl. Термин "галоген-C1-C6-алкил" обозначает прямой или разветвленный, галогензамещенный алкил из 1-6 атомов углерода, в том числе, но не только, метил, этил, нпропил, изопропил, н-бутил, втор-бутил и трет-бутил, замещенный 1-13 (предпочтительно 1-5) атомами галогена. Термин "галоген-C1-C6-алкокси" обозначает C1-C6-алкокси, замещенный 1-13C1-С 7-алкил,имеющий фенильную группу, присоединенную к его концевому атому углерода, причем эта фенильная группа замещена однимпятью (предпочтительно одним-двумя) атомами галогена. Предпочтительная группа соединений данного изобретения включает в себя соединения формулы (I), в которой А обозначает водород, галоген, гидрокси, оксо или OY; или, если пунктирная линия обозначает двойную связь, то А отсутствует; Аr1 обозначает фенил, необязательно замещенный одним-тремя заместителями,выбранными из галогена, гидрокси, C1-C4 алкокси, карбокси-C1-C4-алкокси и C1-C4 алкоксикарбонил-C1-C4-алкокси; Аr2 обозначает фенил, пиридил или тиенил, необязательно замещенный однимдвумя галогенами или C1-C4-алкокси;R2 и R3 независимо выбраны из водорода, C1-C7-алкила, необязательно замещенного одним или несколькими гидрокси или галогенами, C3-C6 (предпочтительно C3-C4) циклоалкила, C2-C6-алкенила, C2-C6 (предпочтительно C2-C3) алкинила, C1-C4 алкоксифенила и гало-гензамещенного C1C7-алкила, когда Аr2 обозначает фенил, -Аr2 С(=O)-N(R2)- обозначает фталимидную группу и R3 обозначает C1-C7-алкил, илиR2 и R3 вместе с атомом азота, к которому они присоединены, образуют пиридиновое или морфолиновое кольцо. Более предпочтительная группа данного изобретения включает в себя соединения формулы (I), в которой А обозначает водород, фтор, хлор,гидрокси или OY, где Y обозначает метоксиметил или тетрагидропиранил; или, если пунктирная линия является двойной связью,то А отсутствует; илиC1-C5)алкил, необязательно замещенный гидрокси или фтором, C2-C6 (предпочтительно С 2-С 3)алкенил, галогензамещенный фенилметил или фенил; иR3 обозначает водород или метил; илиR2 и R3 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое или морфолиновое кольцо. Более предпочтительной группой данного изобретения являются соединения формулы (I), где А обозначает гидрокси,фтор или хлор; или, если пунктирная линия представляет собой двойную связь, то А отсутствует; Аr1 обозначает фенил, необязательно замещенный карбоксиметокси; Аr2 обозначает фенил, необязательно замещенный метокси или пиридилом; R1 обозначаетC1-C4-алкил; R2 обозначает C1-C7-алкил,необязательно замещенный гидрокси; и R3 обозначает водород. Предпочтительными индивидуальными соединениями являются: 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'пропилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-2 метокси-N'-пропилбензамид; 6-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'пропилникотинамид; 4-N-[1-(S)-(3-карбоксиметоксифенил)-2-(3-(S)-гидроксипирролидин-1 ил)этил]-N-метиламино-N'-пропилбензамид; 4-N-[2-(3-(S)-фторпирролидин-1-ил)1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'-(2(S)-гидроксипропил)бензамид; 5-N-[2-(3-(S)-фторпирролидин-1-ил)1-(S)-фенилэтил]-N-метиламино-N'пропилпиколинамид; 4-N-метиламино-N-[2-(3-пирролин-1 ил)-1-(S)-фенилэтил]-N'-пропилбензамид; и 4-N-[2-(3-(S)-хлорпирролидин-1-ил)1-(S)-фенилэтил]-N-метиламино-N'-(2-(S)гидроксипропил)бензамид. Другими предпочтительными индивидуальными соединениями являются: 7 4-N-[2-(3-(S)-фторпирролидин-1-ил)1-(S)-фенилэтил]-N-метиламино-N'-(2-(S)гидроксипропил)бензамид; 2-хлор-4-N-[2-(3-(S)-фторпирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамид; и 4-N-[2-(3-(S)-хлорпирролидин-1-ил)1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамид. Другими предпочтительными соединениями являются: 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'метилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'этилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'бутилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'пентилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'фенилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'-(2 хлорбензил)бензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N',N'диметилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'метил-N'-пропилбензамид; 5-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'пропил-2-тиофенкарбоксамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]амино-N'пропилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'пропилфталимид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'этоксибензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'-(3 гидроксипропил)бензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'циклопропилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'(S)-втор-бутилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'(R)-втор-бутилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'пропаргилбензамид; 8 4-N-[1-(R)-(3-карбоксиметоксифенил)-2-(3-(S)-гидроксипирролидин-1 ил)этил]-N-метиламино-N'-пропилбензамид; 4-N-[2-(3-(S)-гидроксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'трет-бутилбензамид; 4-N-гидрокси-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил] аминоN'-пропилбензамид; 4-N-[2-(3-(S)-фторпирролидин-1-ил)1-(S)-фенилэтил]-N-гидроксиамино-N'пропилбензамид; 4-N-[2-(3-(R)-фторпирролидин-1-ил)1-(S)-фенилэтил]-N-метиламино-N'пропилбензамид; 4-N-[2-(3-(S)-фторпирролидин-1-ил)1-(R)-фенилэтил]-N-метиламино-N'-пропилбензамид; 4-N-[2-(3-(S)-хлорпирролидин-1-ил)1-(S)-фенилэтил]-N-метиламино-N'-(2-(R)гидроксипропил)бензамид; и 4-N-[2-(3-оксопирролидин-1-ил)-1(S)-фенилэтил]-N-метиламино-N'-пропилбензамид. Далее данное изобретение обеспечивает соединение следующей формулы VIdR1 обозначает водород, необязательно защищенную гидроксигруппу или С 1-С 4 алкил; иR2 и R3 независимо обозначают водород или С 1-С 7-алкил, необязательно замещенный гидрокси или галогеном. Предпочтительными соединениями формулы (VId) являются: 4-метиламино-N'-пропилбензамид; 5-N-метиламино-N'-пропилпиколинамид; 2-хлор-4-метиламино-N'-пропилбензамид; 4-метиламино-N'-(2-(S)-гидроксипропил)бензамид; 4-метиламино-N'-(2-(R)-гидроксипропил)бензамид; 4-метиламино-N'-(2,2,3,3,3-пентафторпропил)бензамид; и 4-метиламино-N'-трет-амилбензамид. Далее данное изобретение обеспечивает соединения, выбранные из следующих соединений 2-(3-(S)-фторпирролидин-1-ил)-1-(S)фенилэтанол; 9 2-(3-(S)-фторпирролидин-1-ил)-2-(R)фенилэтанол; 2-(R)-фенил-2-(3-пирролин-1 ил)этанол; 2-(3-(R)-фторпирролидин-1-ил)-1-(S)фенилэтанол; 2-(3-(R)-фторпирролидин-1-ил)-2-(R)фенилэтанол; 2-(3-(S)-фторпирролидин-1-ил)-1-(R)фенилэтанол; 2-(3-(S)-фторпирролидин-1-ил)-2-(S)фенилэтанол; 2-(3-(S)-хлорпирролидин-1-ил)-1-(S)фенилэтанол; и 2-(3-(S)-хлорпирролидин-1-ил)-2-(R)фенилэтанол. Далее данное изобретение обеспечивает способ получения соединения формулы(I), предусматривающий реакцию амидного соединения формулы VId с соединением этанола, выбранным из соединений (Va), (Vb) и (Vc) и смеси соединений (Va) и (Vb) в отсутствие или в присутствии основания в реакционноинертном растворителе. Общий синтез Каппа-агонисты (агонисты каппарецептора) формулы (I) данного изобретения могут быть получены, как описано в следующих схемах. Если нет иных указаний, в схемах реакций, которые следуют далее, A, Ar1, Ar2, R1, R2 и R3 имеют указанные выше значения. Схема 1 а В приведенной выше схеме 1 а необязательно замещенный оксид стирола (II) или 10 необязательно замещенный 2-тозилат фенил-1,2-этандиола (III) может взаимодействовать с соединением пирролидина (IV) в отсутствие или в присутствии основания,такого как К 2 СО 3, с образованием смеси замещенных пирролидинилэтанолов (Va) и(Vb). Эту реакцию можно проводить в отсутствие или в присутствии реакционноинертного растворителя (например, метанола(CH2Cl2), воды, бензола, толуола, н-гексана или циклогексана). Эту реакцию можно проводить при температуре от -78 С до температуры дефлегмации растворителя,предпочтительно от комнатной температуры до температуры дефлегмации растворителя, в течение 5 мин - 48 ч, предпочтительно от 0,5 до 12 ч. Соединение (Va) или смесь соединений (Va) и (Vb) могут быть обработаны метансульфонилхлоридом в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорэтан, с последующим связыванием с метиловым эфиром соединения формулы (VIa) с получением промежуточного соединения (VII). Эту реакцию сочетания можно проводить в отсутствие или в присутствии основания, такого как гидрид натрия (NaH), в подходящем полярном растворителе, таком как вода, EtOH или ДМФ,при температуре от комнатной температуры до температуры дефлегмации растворителя,в течение 15 мин - 6 ч. Затем промежуточное соединение(VII) может быть обработано основанием,таким как NaOH, в реакционноинертном растворителе, таком как метанол, при температуре от 0 до 100 С в течение 5 мин - 12 ч с получением соединения карбоновой кислоты (VIII). Карбоновая кислота (VIII) может взаимодействовать с алкиламином в присутствии карбодиимидного соединения с образованием соединения пирролидинилэтиламина (I). Удобным карбодиимидным соединением является 1-этил-3-(3-диметиламинопропил)карбодиимид (WSC). Эту реакцию можно проводить контактированием по существу эквивалентных количеств карбоновой кислоты и алкиламина с небольшим избытком количества карбодиимида в подходящем растворителе. Подходящими растворителями являются инертные ароматические углеводороды, простые эфиры, галогенированные углеводороды, особенно дихлорметан. Реакция может иметь место при температуре в диапазоне от -30 до 100 С, обычно от 0 до 30 С в течение 30 мин- 24 ч, обычно 12-16 ч при комнатной 11 температуре. Полученный продукт может быть выделен и очищен стандартными способами. Если требуется, гидроксизащитная группа в А полученного соединения (I) (т.е.Y-OY) может быть удалена подходящим способом для конкретной выбранной защитной группы. Например, типичная защитная группа метоксиметил может быть удалена катализируемым кислотой гидролизом в присутствии кислотного катализатора,такого как НСl. Другой удобной защитной группой в А является тетрагидропиранильная группа (ТНР). Она может быть также удалена катализируемым кислотой гидролизом. Подходящими кислотными катализаторами являются органические кислоты, неорганические кислоты или кислоты Льюиса,такие как уксусная кислота (АсОН), птолуолсульфокислота (р-ТsОН), соляная кислота (НСl) и диметилалюминийхлорид(Ме 2 АlСl). Предпочтительным кислотным катализатором является НСl. Оптически неактивное соединение (I),в котором Аr1 является необязательно замещенным фенилом, может быть получено подверганием соответствующего оптически неактивного 2-тозилата 1-фенил-1,2-этандиола формулы (III) или 1-фенил-2 пирролидинилэтанола (Vb) реакциям, описанным в схеме 1 а. Оптически неактивные соединения (III), в которых Аr1 является необязательно замещенным фенилом, могут быть получены согласно процедурам, описанным, например, в Tetrahedron, Vol.47,pp.9861-9866, Chem. Rev., Vol.80, pp.187213, 1980 или J.Org.Chem., Vol.47, pp.12291232, 1982, с последующим тозилированием,таким как реакция с птолуолсульфонилхлоридом в пиридине при 0 С. Оптически неактивный (Vb) может быть получен согласно процедурам, описанным, например, в Tetrahedron Lett.,Vol.35, pp.1511-1514, 1994, с последующим общепринятым восстановлением. Соединение формулы (I), в котором А представляет собой гидрокси, R2 представляет собой алкокси и R3 представляет собой водород, может быть получено из метилбензоата формулы (VII), где А является гидрокси. Сначала гидроксигруппа метилбензоатного соединения может быть защищена подходящей защитной группой, такой как трет-бутилдиметилсилильная группа. Затем гидроксизащищенное соединение метилового эфира может быть подвергнуто гидролизу с получением соответствующей карбоновой кислоты. Затем карбоновая кислота может быть подвергнута амидированию с получением соединения (I). Защита гидрокси может быть проведена реакцией соединения формулы (VII) в ДМФ с трет 001341 12 бутилдиметилсилилхлоридом и раствором имидазола при 0 С в течение 1-6 ч. Гидролиз может проводиться в присутствии основания, такого как гидроксид натрия, в полярном растворителе, таком как метанол притемпературе дефлегмации растворителя в течение от 1 до 10 ч. Амидирование можно проводить с желательным Oалкилгидроксиламином в присутствии карбодиимида, такого как WSC, при комнатной температуре в течение от 1 до 24 ч. Если требуется удаление защитной группы, могут быть применены общепринятые процедуры. Например, когда гидроксигруппа защищена трет-бутилдиметилсилильной группой,амидное соединение может быть обработано тетрабутиламмонийфторидом в подходящем растворителе, таком как ТГФ, при комнатной температуре. Соединение формулы (I), в котором А отсутствует и пунктирная линия является двойной связью, может быть также получено реакциями сочетания 2-фенил-2-(3 пирролин-1-ил)этанольного соединения Производное этанола (Vc) может быть получено реакцией соответствующего фенилглицинола и 1,4-дихлорбутена в присутствии основания, такого как Et3N, в реакционноинертном растворителе, таком как этанол, при температуре дефлегмации растворителя в течение 1-24 ч. Соединение формулы (I), в котором А является оксо (=O), может быть получено окислением соответствующего производного пир-родинола. Подходящим окислением является окисление Сверна. Далее соединения формулы (I), в которых -Аr2-С(=O)-N(R2)- является фталимидной группой, может быть получено с использованием соединения формулы VIb вместо соединения (VIa) в вышеупомянутой схеме 1 а. Соединения формулы (I), в которых Аr2 представляет собой тиенил, могут быть получены с использованием метиламинотиофен-карбоксамида формулы VIc вместо соединения (VIa) в вышеупомянутой схеме 1 а. Соединения (VIc) могут быть получены сначала реакцией нитротиофенкарбоксальдегида с реагентом Jones с образованием нитротиофенкарбоновой кислоты. Затем полученную карбоновую кислоту подвергают конденсации с соединением формулы NHR2R3 и затем восстановлению нитрогруппы порошком железа и хлоридом алюминия с последующим метилированием аминогруппы. Соединения формул (II), (III) и (IV) являются либо известными соединениями,которые могут быть получены известными способами, либо они являются аналогами известных соединений, которые могут быть получены способами, аналогичными известным способам. В соответствии с хорошо известными процедурами или следующими процедурами, может быть селективно определена R,S-конфигурация соединений (Va) и (Vb) путем взаимодействия с 3-пирролидинолом с соответствующей R, S-конфигурацией. Соединения формулы (Va) и (Vb), где А представляет собой фтор и Аr1 представляет собой фенил, могут быть получены из коммерчески доступного 1-бензил-3 пирролидинола. Сначала гидроксигруппа пирролидинола может быть превращена в подходящую уходящую группу, такую как п-толуолсульфонат. Это превращение может быть достигнуто реакцией пирролидинола с п-толуолсульфонилхлоридом в пиридине. Затем уходящая группа может быть вытеснена фтором реакцией с подходящим фторирующим агентом, таким как тетрабутиламмонийфторид, в реакционноинертном растворителе, таком как ТГФ. Затем 3 фторпирролидин может быть подвергнут гидрированию с последующим сочетанием со стиролоксидом формулы (II). Гидрирование можно проводить в присутствии подходящего катализатора, такого как гидроксид палладия на угле в атмосфере водорода в реакционноинертных растворителях, таких как EtOH, при температуре от 0 С до комнатной температуры в течение 5 мин - 48 ч,предпочтительно 12 - 36 ч. Реакция сочетания может иметь место в отсутствие или в присутствии реакционноинертного растворителя, такого как EtOH. Соединения формулы (Va) и (Vb), где А является хлором и Аr1 является фенилом,могут быть также получены из 1-бензил-3 пирролидинола. Например, 1-бензил-3 пирролидинол может быть подвергнут хло 001341 14 рированию с получением 1-бензил-3 хлорпирролидина. Бензильная группа 1 бензил-3-хлорпирролидина может быть удалена обработкой 1-бензил-3-хлорпирролидина 1-хлорэтилхлорформиатом с последующим сочетанием со стиролоксидом формулы (II). Хлорирование 1-бензил-3 пирролидинола может быть проведено при общепринятых условиях, например, в присутствии подходящего реагента, такого как трифенилфосфин, в подходящем растворителе, таком как ССl4, при комнатной температуре. Дебензилирование обычно проводят в реакционноинертном растворителе, таком как дихлорэтан, при температуре дефлегмации растворителя в течение 5 мин - 3 ч. Затем растворитель может быть выпарен и остаток может быть подвергнут реакции сочетания со стиролоксидом в подходящем растворителе, таком как EtOH, при температуре дефлегмации растворителя в течение 5 мин - 4 ч. Соединения формулы (Va) и (Vb), где А является галогеном и Аr1 является необязательно замещенным фенилом, могут быть получены из желательного N-защищенного соединения 3-пирролидинола через соответствующийN-защищенный 3-галогенпирролидин. Во-первых, 1-бензил-3-пирролидинол может быть обработан подходящим галогенирующим реагентом в реакционноинертном растворителе, например,трифенилфосфином в ССl4 при температуре дефлегмации растворителя в течение от 3 до 36 ч. Во-вторых, 1-бензил-3-хлорпирролидин может быть очищен и депротектирование может быть проведено при условиях,известных специалисту в данной области(например, с 1-хлорэтилхлорформиатом в дихлорэтане при 0 С в течение 30 мин - 6 ч). В-третьих, 3-хлорпирролидин может быть обработан соединением стиролоксида с получением этанолов (Va) и (Vb) в соответствии с процедурами, иллюстрированными в схеме 1 а. Производные метилового эфира формулы (VIa), где Аr2 представляет собой необязательно замещенный фенил, являются известными соединениями или могут быть получены обработкой замещенного соединения 4-аминобензойной кислоты алкилгалогенидом в присутствии основания, такого как NaH или Na2CO3, в реакционноинертном растворителе, таком как ДМФ. Более конкретно, соединения формулы(VIa) могут быть получены следующими способами. А: Метил-3-метиламинобензоат формулы (VIa) может быть получен сначала метилированием 3-ацетамидбензойной кислоты в присутствии основания, такого какNaH, в реакционноинертном растворителе, 15 таком как ДМФ, с последующим деацетилированием в присутствии кислотного катализатора, такого как концентрированная серная кислота (H2SO4). В: Соединение формулы (VIa), где Аr2 замещен фтором и R1 представляет собой водород, может быть получено из нитробензойной кислоты этерификацией нитробензойной кислоты с последующим восстановлением. Этерификация может быть достигнута в присутствии кислотного катализатора, такого как серная кислота, в МеОН при температуре дефлегмации растворителя в течение 1-12 ч. Восстановление можно проводить в присутствии восстанавливающего агента, такого как порошок железа, в подходящем растворителе, таком как уксусная кислота, при температуре от комнатной температуры до 60 С в течение 0,5-6 ч. Если желательно, аминогруппа может быть алкилирована хорошо известным способом. Например, сначала метиловый эфир может быть обработан трифторуксусным ангидридом в присутствии основания, такого какNa2CO3, в подходящем растворителе, таком как CH2Cl2, затем может быть алкилирован подходящим алкилирующим агентом, таким как иодметан. Соединение формулы (VIa),где Аr2 замещен хлором и R1 является алкилом, может быть получено из хлорбензойной кислоты алкилированием. Алкилирование может иметь место в присутствии основания, такого как NaH, с подходящим алкилгалогенидом в реакционноинертном растворителе, таком как ДМФ, при температуре приблизительно 0 С в течение 1-24 ч. С: Соединение формулы (VIa), где Аr2 является пиридилом, группа метилового эфира находится в положении 3 и R1HNнаходится в положении 6 кольца пиридина соответственно, может быть получено этерификацией 6-аминоникотиновой кислоты. Неочищенный остаток метилового эфира,полученный таким образом, может быть подвергнут метилированию аминогруппы. Подходящим этерифицирующим агентом является, например, триметилсилилдиазометан. Метилирование аминогруппы может проводиться согласно тем же самым процедурам, которые упомянуты выше для получения соединений (VIa). Альтернативно,амидное соединение общей формулы VId где Аr2a, X, R1, R2 и R3 имеют указанные выше значения, могут быть подвергнуты реакции сочетания с соединениями (Va) и(Vb) с прямым получением соединения (I). 16 Эта реакция сочетания может быть проведена в отсутствие или в присутствии основания, такого как NaH, в реакционноинертном растворителе. Предпочтительные растворители включают в себя EtOH и ДМФ. Реакция может проводиться при температуре в диапазоне от -78 С до температуры дефлегмации растворителя, предпочтительно от комнатной температуры до температуры дефлегмации, в течение 5 мин - 48 ч,предпочтительно 0,5-24 ч. Амидные соединения формулы (VId) могут быть получены согласно процедурам,описанным ниже. А: Соединение формулы (VId), где Аr2a является фенилом, R1 является гидрокси и Х является водородом, может быть получено восстановлением известного нитро-Nалкилбензамидного соединения. Подходящие восстанавливающие агенты включают в себя, например, порошок цинка. Это восстановление может проводиться добавлением восстанавливающего агента к смеси нитро-N-алкилбензамидного соединения и хлорида аммония при комнатной температуре(например, 20-25 С) в течение 1-3 ч. В: Соединение формулы (VId), где Аr2a является фенилом, R1 водородом или С 1-С 4 алкилом, R2 является С 1-С 7-алкилом, необязательно замещенным гидрокси; R3 является водородом и Х является водородом или галогеном, может быть получено из известного аминобензойного соединения, где фенильное кольцо необязательно замещено галогеном. Бензойная кислота может быть подвергнута амидированию при условиях,сходных с условиями, иллюстрированными в схеме 1 а. Если желательно, аминогруппа бензамидного соединения может быть алкилирована. Например, предпочтительным алкилирующим агентом является алкилгалогенид, и это алкилирование может проводиться в присутствии основания, такого как карбонат калия, при приблизительно комнатной температуре в течение 12-24 ч. С: Амидное соединение (VId), где Аr2a является пиридилом и группа-NHR1 находится в положении 5 и амидная группа находится в положении 2 кольца пиридина,соответственно может быть получено обработкой аминозащищенной пиколиновой кислоты оксалилхлоридом с последующим амидированием желательным алкиламином. Обработка 5-защищенной аминопиколиновой кислоты оксалилхлоридом может быть выполнена в реакционноинертном растворителе, таком как СН 2 Сl2 или смесь ДМФ/СН 2 Сl2, в присутствии основания,такого как триэтиламин, при комнатной температуре. Амидирование может проводиться в присутствии основания в реакционноинертном растворителе. Основание 17 предпочтительно представляет собой триэтиламин и реакцию можно проводить в подходящем растворителе, например дихлорэтане, при 15 С. Если требуется, аминозащитная группа может быть удалена процедурами, известными специалистам в данной области. Альтернативный способ получения соединений формулы (I) иллюстрирован в следующей схеме lb. Схема lb Смесь соединений (Va) и (Vb) может быть обработана метансульфонилхлоридом так же, как показано в схеме 1 а, с последующим сочетанием с цианосоединением(VIIb). Эта реакция сочетания может проводиться в реакционноинертном растворителе,таком как ДМФ или этанол, в присутствии или в отсутствии основания, такого какNaH, NaNH2 или 2,6-лутидин. Эта реакция может иметь место при температуре от комнатной до температуры дефлегмации растворителя в течение 30 мин - 12 ч. Затем соединение (VIIb) может быть подвергнуто реакции с подходящим алкоксидом, таким как t-BuOK, в присутствии воды, в полярном растворителе, таком как tBuOH. Эта реакция может иметь место при температуре дефлегмации растворителя в течение 5 мин - 6 ч. Затем к полученной реакционной смеси может быть добавлен подходящий алкилгалогенид. Полученную таким образом смесь нагревают с обратным холодильником в течение 5 мин - 5 ч. Целевое соединение (I) может быть выделено и очищено из полученной реакционной смеси стандартными способами. Цианосоединения формулы (VIe) , гдеAr2a является замещенным фенилом, могут быть получены обработкой известных замещенных 4-аминобензонитрильных соединений NaH или К 2 СО 3 с последующим алкилированием алкилгалогенидом в реакционноинертном растворителе, таком как ДМФ. Соединения формулы (I) этого изобретения являются основными и, следовательно, они могут образовать кислотноаддитивные соли. Все такие соли находятся в объеме данного изобретения. Однако необходимо использовать кислотноаддитивные соли, которые являются фарма 001341 18 цевтически приемлемыми для введения млекопитающему. Кислотно-аддитивные соли могут быть получены стандартными способами, например, контактированием основных и кислотных соединений по существу в эквивалентных соотношениях в воде или органическом растворителе, таком как метанол или этанол или их смеси. Эти соли могут быть выделены выпариванием растворителя. Типичные соли, которые могут быть образованы, представляют собой соли гидрохлорид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат,сукцинат, малат, фумарат, глюконат, сахарат,бензоат,метансульфонат,птолуолсульфонат, оксалат и памоат (1,1'метилен-бис-(2-гидрокси-3-нафтоат. Соединения формулы (I) данного изобретения, где Аr1 является фенилом, замещенным карбокси-С 1-С 4-алкокси, являются кислыми, и они могут образовывать основно-аддитивные соли. Все эти соли находятся в объеме данного изобретения. Однако необходимо использовать соль основания,которая является фармацевтически приемлемой для введения млекопитающему. Основные соли могут быть получены стандартными способами, например, контактированием кислотных или основных соединений по существу в эквивалентных соотношениях в воде или органическом растворителе, таком как метанол, или этанол, или их смеси. Солями, которые могут быть образованы, являются соли натрия, калия,кальция и магния, а также соли с аммиаком и аминами, такие как соли этиламина, диэтиламина, циклогексиламина, пиперидина или морфолина. В объем этого изобретения включены также биопредшественники (так называемые пролекарства) соединений каппаагонистов формулы (I). Биопредшественник каппа-агониста формулы (I) является его химическим производным, которое легко превращается обратно в исходное соединение формулы (I) в биологических системах. В частности, биопредшественник каппаагониста формулы (I) превращается обратно в исходное соединение формулы (I) после того, как этот биопредшественник был введен субъекту-млекопитающему и абсорбирован субъектом-млекопитающим, например, субъектом-человеком. Например, можно приготовить биопредшественник каппаагониста данного изобретения формулы (I),в котором один или оба А и R1 являются гидроксигруппами, путем получения сложного эфира этих гидроксигрупп. Когда только один из А и R1 является гидроксигруппой, возможны только моноэфиры. Когда оба А и R1 являются гидроксигруппами,могут быть получены моно- и диэфиры (ко 19 торые могут быть одинаковыми или различными). Типичными эфирами являются простые алканоатные эфиры, такие как ацетат, пропионат, бутират и т.д. Кроме того,когда А или R1 является гидроксигруппой,биопредшественники могут быть приготовлены превращением этой гидроксигруппы в ацилоксиметилпроизводное (например, пивалоилоксиметилпроизводное) реакцией с ацилоксиметилгалогенидом (например, пивалоилоксиметилхлоридом). Соединения каппа-агонисты данного изобретения формулы (I) проявляют значительную агонистическую активность в отношении опиоидного каппа-рецептора и являются, следовательно, применимыми в качестве аналгезирующего, анестизирующего, противовоспалительного агента или нейропротективного агента и также применимы в лечении артрита, мозгового удара или функционального заболевания пищеварительного тракта, такого как боль в животе, для лечения субъекта-млекопитающего,в частности субъекта-человека. Активность соединений каппаагонистов формулы (I) данного изобретения демонстрируется связывающей активностью в отношении опиоидного рецептора. Такая активность может быть определена в гомогенате из цельного мозга морской свинки, как описано Regina, A. et al., inJ.Receptor Res., Vol.12, pp.171-180, 1992. Вкратце, гомогенат ткани инкубируют при 25 С в течение 30 мин в присутствии меченого лиганда и тест-соединений. Мю-сайты метят 1 нМ (3 Н)-[D-Ala2, MePhe4, Glуо 15]энкефалином (DAMGO) , дельта-сайты 1 нМ (3 Н)-[D-Pen2,5]энкефалином (DPDPE) и каппа-сайты 0,5 нМ (3 Н)-Сl-977. Неспецифическое связывание измеряют с использованием 1 мкМ CI-977 (каппа), 1 мкМ(DAMGO) (мю), 1 мкМ (DPDPE) (дельта). Данные выражают в виде величин IС 50, полученных программой нелинейного построения с использованием уравненияCheng и Pru-soff. Некоторые соединения,приготовленные в примерах, обнаружили убедительную величину IC50 против каппарецептора в диапазоне 0,01-100 нМ. Аналгезирующая активность соединений каппа-агонистов в центральной нервной системе может быть также продемонстрирована при помощи Формалинового Теста,описанного Wheeler-Aceto, H.et al., in Psychopharmacology, Vol. 104: pp.35-44, 1991. В этом тестировании самцов крыс SD (80-100 г) инъецировали подкожно тестсоединением, растворенным в 0,1% метилцеллюлозе, солевом растворе или носителе. После 30 мин 50 мкл 2% формалина инъецировали в заднюю лапку. Количество облизываний инъецированной лапки за период 20 наблюдения измеряют через 15-30 мин после инъекции формалина и выражают в виде% ингибирования по сравнению с соответствующей группой носителя. Некоторые соединения, полученные в примерах, обнаружили убедительную величину ED50 в диапазоне менее 25 мг/кг р.о. Активность каппа-агонистов против периферической острой боли может быть продемонстрирована тестом Randall-Selitto(M.E.Planas, Pain, Vol.60, pp.67-71, 1995). В этом тестировании использовали самцов крыс SD (100-120 г) и порог восприятия боли в правой лапке измеряли по способуRandall-Selitto (Ugo Basile). После трех дней акклиматизации к условиям теста проводили эксперименты. Гипералгезию индуцировали интраплантарной (внутриподошвенной) инъекцией 0,1 мл/правую лапку 1% раствора каррагенина. Болезненное надавливание производили на правую подошву при помощи клинообразного пистона и уровень ответа измеряли при 3,5 и 4,5 ч после инъекции каррагенина. Некоторые соединения, полученные в рабочих примерах, описанных ниже, тестировали в соответствии с вышеописанными процедурами и они показали хорошую активность против острой боли (т.е. величину ЕD50 менее 10 мг/кг р.о.). Активность каппа-агонистов против хронической боли в периферии может быть продемонстрирована при помощи индуцированной адъювантом гипералгезии, в соответствии с процедурой, описанной Judith S.Waker et al., как сообщалось в Life Sciences,Vol.57, pp.371-378, 1995. В этом тестировании использовали самцов крыс SD весом 180-230 г при времени инокуляции. Для получения адъювантного артрита крыс анестезировали эфиром и инокулировали интрадермально в ступню правой задней лапки 0,05 мл Mycobacterium butyricum, суспендированной в парафиновом масле (2 мг/мл). Порог восприятия боли оценивали тестом надавливания на лапку, при помощи тех же самых процедур, которые описаны выше для теста Randal-Selitto, и отек измеряли как ширину ступни. Тесты проводили в течение всего периода. Седативная функция каппа-агонистов может быть определена Rotarod-тестом,описанным Hayes, A.G. et al., inBr.J.Pharmacol., Vol.79, pp.731-736, 1983. В этом испытании группу из 6-10 самцов крысSD (100-120 г) отбирают на их способность балансировать на вращающемся стержне(диаметр 9 см, скорость вращения 5 об/мин). Затем отобранных крыс инъецируют s.с. тест-соединением, растворенным в 0,1% содержащем метилцеллюлозу солевом растворе. Животных тестируют опять через 21 30 мин после обработки; крысу, упавшую со стержня более двух раз в пределах 150 с,рассматривают как обнаружившую двигательную недостаточность, и двигательную активность животного (т.е. время на вращающемся стержне) регистрируют. Величину ED50, определяемую как доза лекарственного средства, которая имеет время двигательной активности, наблюдают в контрольной группе. Несколько соединений,полученных в рабочих примерах, описанных ниже, тестировали в соответствии с описанными выше процедурами. Функция диуреза каппа-агонистов может быть определена в соответствии с процедурой, описанной A.Barber et al. , (Br.(I) данного изобретения могут вводиться перорально, парентерально или топически млекопитающим. Предпочтительный уровень доз может быть в диапазоне от 0,01 мг до 10 мг на кг веса тела в день, хотя будут обязательно иметь место вариации в зависимости от веса и состояния подвергающегося обработке субъекта, причем лечению подвергают определенное патологическое состояние и выбирают конкретный способ введения. Однако уровень дозы, который находится в диапазоне от 0,01 мг до 1 мг на кг веса тела в день, в виде одной дозы или в виде разделенных доз является наиболее применимым для человека в случае лечения боли у постоперационного пациента и боли,подобной гипералгезии,вызываемой хроническими заболеваниями. Соединения данного изобретения могут вводиться отдельно или в комбинации с фармацевтически приемлемыми носителями или разбавителями любым из указанных выше путей введения, и такое введение может проводиться в единственной дозе или в виде многочисленных доз. Более конкретно,новые терапевтические агенты этого изобретения могут быть введены в большом разнообразии различных дозированных форм, т.е. они могут комбинироваться с различными фармацевтическими приемлемыми носителями в форме таблеток, капсул,лепешек, пастилок, карамели, порошков,спреев, кремов, мазей, суппозиториев, желе,гелей, паст, лосьонов, мазей, водных суспензий, инъекционных растворов, эликсиров, сиропов и т.д. Такие носители включают в себя твердые разбавители или наполнители, стерильные водные среды и различные нетоксические органические растворители и т.д. Кроме того, пероральные фарма 001341 22 цевтические композиции могут быть подходящим образом подслащены и/или ароматизированы. В общем, терапевтически эффективные соединения данного изобретения присутствуют в таких дозированных формах при уровнях концентрацией в диапазоне 5-70% по весу, предпочтительно 10-50% по весу. Для перорального введения, таблетки,содержащие различные наполнители, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикалийфосфат и глицин, могут применяться вместе с различными дезинтеграторами, такими как крахмал, и предпочтительно кукурузный,картофельный крахмал или крахмал тапиоки, альгиновая кислота и некоторые комплексированные силикаты, вместе с гранулирующими связывающими веществами,такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Дополнительно для целей таблетирования очень часто применимы смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа могут быть также использованы в качестве наполнителей для желатиновых капсул; предпочтительные материалы в этой связи также включают в себя лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда водные суспензии и/или эликсиры желательны для перорального введения, активный ингредиент может комбинироваться с различными подслащивающими или улучшающими вкус и запах агентами, красителями, и, если желательно, эмульгаторами и суспендирующими агентами, а также вместе с такими разбавителями, как вода, этанол, пропиленгликоль,глицерин и различные их комбинации. Для парентерального введения могут использоваться растворы данного изобретения либо в кунжутном, либо в арахисовом масле или в водном пропиленгликоле. Водные растворы должны быть подходящим образом забуферены (предпочтительно до рН 8), если необходимо, и жидкий разбавитель сначала делают изотоническим. Эти водные растворы пригодны для целей внутривенных инъекций. Приготовление всех этих растворов в стерильных условиях является легко выполнимым при помощи стандартных фармацевтических способов,хорошо известных специалистам в данной области. Кроме того, можно вводить соединения данного изобретения топически (местно), при обработке воспалительных состояний кожи, и это предпочтительно делать с применением кремов, желе, гелей,паст, мазей и т.п., в соответствии со стандартной фармацевтической практикой. 23 Примеры и препаративные примеры Данное изобретение иллюстрируется следующими примерами и получениями. Однако должно быть понятно, что изобретение не ограничивается до конкретных деталей этими примерами и получениями. Точки плавления определяли в микроприборе для определения точки плавления Buchi и они являются некорректированными. Спектры инфракрасного поглощения (ИК) измеряли в инфракрасном спектрофотометре Shimadzu (IR-470). 1H и 13 С-ЯМР измеряли вJEOL (JNM-GX270, 270 МГц), если нет иных указаний, и положения пиков выражают в миллионных долях (м.д.) в сторону слабого поля от тетраметилсилана. Формы пиков обозначают следующим образом: с,синглет; д, дублет; т, триплет; м, мультиплет; шир., широкий. Препаративный пример 1. 2-(3-(S)-Метоксиметоксипирролидин 1-ил)-2-(R)-фенилэтанол. К перемешиваемому раствору (S)-(-)-1,2, 4-бутантриола (10,61 г, 0,1 моль) в пиридине (50 мл) добавляли п-толуолсульфонилхлорид (38,13 г, 0,2 моль) порциями при 0 С. После 14 ч перемешивания реакционную смесь выливали в водный раствор концентрированной НСl со льдом и подкисляли до рН 2. Смесь экстрагировали эфиром(100 мл х 3). Объединенный экстракт промывали насыщенным солевым раствором,сушили (Na2SO4) и концентрировали с получением 18,58 г бесцветного масла. К перемешиваемому раствору этого неочищенного дитозилата (18,58 г, 45,7 ммоль) и диметоксиметана (50 мл) в CH2Cl2 (50 мл) добавляли порциями P2O5 при комнатной температуре и перемешивали в течение 26 ч. Слой CH2Cl2 отделяли и твердое веществоP2O5 (50 г) промывали СН 2 Сl2 (50 мл х 4). Объединенный слой СН 2 Сl2 промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. После высушивания (Na2SO4) растворитель выпаривали с получением 18,01 г коричневого вязкого масла. Смесь этого масла(4,80 г, 35 ммоль) и Et3N (11,3 мл, 80 ммоль) в этаноле (20 мл) нагревали с обратным холодильником с перемешиванием в течение 8 ч. Растворитель выпаривали и остаток растворяли в CH2Cl2 (200 мл). Этот раствор промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 16,69 г коричневого вязкого масла, которое очищали колоночной хроматографией (силикагель 200 г,CH2Cl2/MeOH: 20/1) с получением 5,13 г(20,4%, общий выход) прозрачного коричневого вязкого масла. 1(40 мл) нагревали с обратным холодильником при перемешивании в течение 2 ч. После выпаривания растворителя остаток очищали колоночной хроматографией (силикагель: 120 г, СН 2 Сl2:МеОН=40:1-20:1) с получением 4,91 г (58,7%) бледно-желтого масла в виде смеси 0,65:0,35 указанных в заголовке соединений. 1 Н-ЯМР (270 МГц, CDCl3)7,40-7,27(1,3 Н, м), 2,80-2,40 (4 Н, м), 2,20-2,00 (1H,м), 1,95-1,75 (2 Н, м). Препаративный пример 3. 2-(3-(S)-Метоксиметоксипирролидин 1-ил)-1-(S)-фенилэтанол и 2-(3-(S)-метоксиметоксипирролидин-1-ил)-2-(R)-фенилэтанол. Смесь 3-(S)-метоксиметоксипирролидина (6,10 г, 46,5 ммоль) и (S)-(+)-1-фенил 1,2-этандиол-2-тозилата (13,6 г, 46,5 ммоль) и К 2 СО 3 (7,06 г, 51,1 ммоль) в EtOH (80 мл) нагревали с обратным холодильником при перемешивании в течение 4,5 ч. После выпаривания растворителя добавляли к остатку СН 2 Сl2 и промывали насыщенным водным раствором бикарбоната натрия, насыщенным солевым раствором, сушили(Na2SO4) и концентрировали с получением 14,94 г неочищенных продуктов, которые очищали колоночной хроматографией (силикагель: 150 г, СН 2 Сl2/MeOH=50:1=20:1) с получением 7,75 г (66,4%) коричневого масла в виде смеси 0,65:0,35 указанных в заголовке соединений. 1 Н-ЯМР (270 МГц, CDCl3)7,40-7,27(1,3 Н, м), 2,80-2,40 (4 Н, м), 2,20-2,00 (1 Н,м), 1,95-1,75 (2 Н, м). Препаративный пример 4. 2-(R)-Фенил-2-(3-(S)-тетрагидропиран 2-илоксипирролидин-1-ил)этанол и 1-(S)фенил-2-(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил)этанол. Смесь получали из 3-(S)-тетрагидропиранилоксипирролидина (3,00 г, 17,5 ммоль) и (S)-(-)-стиролоксида (2,10 г, 17,5 ммоль) с выходом 50% в виде смеси 0,35:0,65 указанных в заголовке соединений согласно процедуре, сходной с процедурой,описанной в препаративном примере 2. 1(5,3 Н, м), 2,25-1,45 (9 Н, м). Препаративный пример 5. 2-(R)-Фенил-2-пирролидин-1-илэтанол и 1-(S)-фенил-2-пирролидин-1-илэтанол. Эти соединения получали из пирролидина (592 мг, 8,32 ммоль) и (S)-(-)стиролоксида (1,00 г, 8,32 ммоль) с 96% выходом в виде смеси 0,3:0,7 указанных в заголовке соединений согласно процедуре,сходной с процедурой, описанной в препаративном примере 2. 1(5 Н, м). Препаративный пример 6. Метил-3-метокси-4-метиламинобензоат. К суспензии NaH (2,43 г, 60,7 ммоль) в ДМФ (20 мл) добавляли раствор 4-амино-3 гидроксибензойной кислоты (3,00 г, 19,6 ммоль) в ДМФ (20 мл) при 0 С. После перемешивания при комнатной температуре в течение 1 ч к этой смеси добавляли иодметан (3,78 мл, 60,7 ммоль) при 0 С и перемешивали при комнатной температуре в течение 16 ч. Смесь выливали в ледяную воду и экстрагировали смесью H-гек : AcOEt :Et2 О=1:1:1 (300 мл). Экстракт промывали водой, насыщенным солевым раствором,сушили (Na2SО 4) и концентрировали с получением коричневого масла, которое очищали колоночной хроматографией (силикагель:190 г, H-гек/AcOEt=10/1 и силикагель: 35 г, СН 2 Сl2 только) с получением 481 мг 26 Препаративный пример 7. Метил-2-метокси-4-метиламинобензоат. Это соединение получали из 4-амино 2-гидроксибензойной кислоты (3,00 г, 19,6 ммоль) с выходом 22% согласно процедуре,сходной с процедурой, описанной в препаративном примере 6. 1 Н-ЯМР (270 МГц, CDCl3)7,77 (1H,д, J=8,8 Гц), 6,16 (1H, дд, J=2,2, 8,8 Гц), 6,08(1H, д, J=1,8 Гц), 4,19 (1H, шир.с), 3,88 (3 Н,с), 3,82 (3 Н, с), 2,89 (ЗН, д, J=5,1 Гц). Препаративный пример 8. Метил-2-хлор-4-метиламинобензоат. Соединение получали из 4-амино-2 хлорбензойной кислоты (2,00 г, 11,7 ммоль) с выходом 13% согласно процедуре, сходной с процедурой, описанной в препаративном примере 6. 1 Н-ЯМР (270 МГц, CDCI3)7,80 (1H,д, J=8,8 Гц), 6,59 (1H, д, J=2,6 Гц), 6,44 (1H,дд, J=2,6, 8,8 Гц), 4,21 (1H, шир.с), 3,86 (3 Н,с), 2,87 (3 Н, д, J=5,1 Гц). Препаративный пример 9. 3-Хлор-4-метиламинобензонитрил. Это соединение получали из 4-амино 3-хлорбензонитрила (2,00 г, 13,1 ммоль) с выходом 42% согласно процедуре, сходной с процедурой, описанной в препаративном примере 6. 1 Н-ЯМР (270 МГц, CDCl3)7,50 (1H,д, J=1,8 Гц), 7,43 (1H, дд, J=1,8, 8,4 Гц), 6,61MeCN (10 мл) добавляли 10% раствор триметилсилилдиазометана в СН 2 Сl2 (25 мл) при комнатной температуре. После перемешивания при комнатной температуре в течение 0,5 ч, растворитель выпаривали с получением неочищенного метил-6-аминоникотината в виде желтого твердого вещества. Указанное в заголовке соединение получали из неочищенного метил-6 аминоникотината с выходом 17% согласно процедуре, сходной с процедурой, описанной в препаративном примере 6. 1 Н-ЯМР (270 МГц, CDCl3)8,75 (1H,д, J=2,2 Гц), 8,01 (1H, дд, J=2,2, 8,8 Гц), 6,36(1H, д, J=9,2 Гц), 5,11 (1H, шир.с), 3,87 (3 Н,с), 2,99 (3 Н, д, J=5,5 Гц). Препаративный пример 11. Метил-3-метиламинобензоат. К суспензии NaH (1,54 г, 38,5 ммоль) в ДМФ (20 мл) добавляли раствор 3 ацетамидбензойной кислоты (3,00 г, 16,7 ммоль) в ДМФ (20 мл) при 0 С. После перемешивания при комнатной температуре в течение 0,5 ч к этой смеси добавляли иод 27 метан (2,40 мл, 38,5 ммоль) при 0 С и перемешивали при комнатной температуре в течение 1,5 ч. Смесь выливали в ледяной водный раствор 6 н НСl и экстрагировали смесью AcOEt:толуол=2:1 (200 мл х 3). Экстракт промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 3,08 г коричневого масла. Смесь этого коричневого масла и концентрированной H2SO4 (5 мл) в МеОН(30 мл) нагревали с обратным холодильником при перемешивании в течение 7 ч. После охлаждения до комнатной температуры растворитель выпаривали. Остаток подщелачивали насыщенным водным раствором(10 мл) при 0 С. После перемешивания при комнатной температуре в течение 1 ч, к этой смеси добавляли иодпропан (1,20 мл, 12,3 ммоль) при 0 С и перемешивали при комнатной температуре в течение 28 ч. Смесь выливали в воду и экстрагировали смесьюAcOEt:толуол=2:1 (150 мл х 3). Экстракт промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением желтого масла, которое очищали колоночной хроматографией(2 Н, м), 1,80-1,60 (2 Н, м), 0,93 (3 Н, т, J=7,3 Гц). Препаративный пример 13. 4-Метил-амино-N'-пропилфталимид. Это соединение получали из 4-аминоN'-пропилфталимида с выходом 11% согласно процедуре, сходной с процедурой,описанной в препаративном примере 12. 1(50 мл) добавляли реагент Jones (8 н в ацетоне, 8,12 мл, 65 ммоль) при -20 С. После перемешивания в течение 1 ч к смеси добавляли 30 мл изопропанола. К смеси добавляли Н 2 О и экстрагировали СН 2 Сl2. Экстракт промывали водой, насыщенным солевым раствором, сушили (Na2SО 4) и концентрировали с получением 967 мг (90%) желтого аморфного твердого вещества. 1 Н-ЯМР (270 МГц, СDСl3)7,88 (1H,д, J=4,4 Гц), 7,66 (1H, д, J=4,0 Гц), 5,14 (1H,шир.с). Препаративный пример 15. 5-Нитро-N-пропил-2-тиофенкарбоксамид. К раствору 5-нитро-2-тиофенкарбоновой кислоты (967 мг, 5,59 ммоль) в ДМФ (0,745 мл) и СН 2 Сl2 (4 мл) добавляли оксалилхлорид при 0 С. После перемешивания в течение 0,5 ч при комнатной температуре растворитель выпаривали при температуре ниже 30 С с получением желтого масла и твердого вещества. К раствору нпропиламина (0,551 мл, 6,71 ммоль) в Et3N(1,87 мл, 13,4 ммоль) и СН 2 Сl2 (25 мл) добавляли раствор неочищенного хлорангидрида в СН 2 Сl2 (10 мл) ниже 20 С. После перемешивания в течение 4 ч при комнатной температуре смесь промывали водой,насыщенным водным раствором NаНСО 3,водой, насыщенным солевым раствором,сушили (Na2SO4) и концентрировали с получением коричневого твердого вещества,которое очищали колоночной хроматографиейH-ЯМР (270 МГц, CDCl3)7,85 (1H,д, J=4,0 Гц), 7,35 (1H, д, J=4,4 Гц), 6,12 (1H,шир.с), 3,50-3,35 (2 Н, м), 1,75-1,55 (2 Н, м),0,99 (3 Н, т, J=7,3 Гц). Препаративный пример 16. 5-Амино-N'-пропил-2-тиофенкарбоксамид. Смесь 5-нитро-N-пропил-2-тиофенкарбоксамида (815 мг, 3,81 ммоль), порошка железа (1,06 г, 19,0 ммоль) и NH4Cl (102 мг,1,90 ммоль) в EtOH (12 мл) и H2O (6 мл) нагревали с обратным холодильником при перемешивании в течение 2 ч. Реакционную смесь фильтровали и промывали EtOH. Объединенный фильтрат выпаривали. Остаток растворяли в AcOEt и промывали водой,насыщенным солевым раствором, сушили над безводным сульфатом натрия (Na2SO4) и концентрировали с получением коричневого аморфного вещества, которое очищали(0,631 мл, 4,47 ммоль) при комнатной температуре. После перемешивания в течение 5 ч твердое вещество отфильтровывали. Фильтрат промывали водой и насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 396 мг желтого масла. К раствору этого масла в ДМФAcOEt:толуол=2:1. Экстракт промывали водой, насыщенным солевым раствором,сушили (Na2SO4) и концентрировали с получением 298 мг оранжевого твердого вещества. К раствору этого твердого вещества в МеОН (3,5 мл) добавляли 7%-ный водный раствор К 2 СО 3 (1,8 мл) при комнатной температуре. После перемешивания в течение 18 ч растворитель выпаривали. Остаток растворяли в AcOEt и воде. Органический слой промывали водой, насыщенным солевым раствором, сушили (Nа 2SO4) и концентрировали с получением коричневого масла,которое очищали колоночной хроматографией (силикагель, 15 г, СН 2 Сl2/MeOH=60/140/1) с получением 122,5 мг (44%) указанного в заголовке соединения. 1(1,54 г, 9,39 ммоль) и AD-микса- (13,18 г,9,41 ммоль) в воде (48 мл) и t-BuOH (48 мл) перемешивали при 0 С в течение 6,5 ч. К этой реакционной смеси добавляли Nа 2SО 3(14,13 г) и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь экстрагировали этилацетатом. 30 Экстракт промывали насыщенным солевым раствором, сушили (Nа 2SO4) и концентрировали с получением светло-коричневого масла, которое очищали колоночной хроматографией (силикагель: 90 г, этилацетат/гексан:1/2-3/1 с получением 1,69 г (91%) целевого продукта в виде бесцветного масла. 1 Н-ЯМР (270 МГц, СDСl3)7,25 (1 Н,дд, J=7,7, 8,1 Гц), 7,03 (1H, д, J=1,8 Гц),6,98-6,92 (2 Н, м), 5,15 (2 Н, с), 4,74 (1 Н, дд,J=3,3, 8,1 Гц), 3,71 (1H, шир.д., J=9,9 Гц),3,65-3,55 (2 Н, м, в том числе 1H, дд, J=8,1,11,0 Гц при 3,61 м.д., СНСН 2 ОН), 3,44 (3 Н,с), 3,14 (1H, шир.с, ОН). Препаративный пример 19.(S)-1-(3-Метоксиметоксифенил)-1,2 этандиол-2-тозилат. К перемешиваемому раствору (S)-1-(3 метоксиметоксифенил)-1,2-этандиола (1,69 г, 8,54 ммоль) в пиридине (20 мл) добавляли п-толуолсульфонилхлорид (1,63 г, 8,54 ммоль) и 4-диметиламинопиридин (1,04 г,8,54 ммоль) при 0 С и реакционную смесь перемешивали при температуре от 0 С до комнатной температуры в течение 16 ч и при 60 С в течение 1 ч. Реакционную смесь подкисляли 2 н. водный раствором НСl и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением коричневого масла,которое очищали колоночной хроматографией (силикагель: 150 г, этилацетат/гексан: 1/2-2/1) с получением 2,01 г (67%) целевого продукта в виде бесцветного масла. Его оптическая чистота была 98% эн.изб. согласно ВЖХ. 1-(S)-(3-метоксиметоксифенил)-2-(3-(S)метокси-метоксипирролидин-1-ил)этанол. Эти соединения получали из (S)-1-(3 метоксиметилоксифенил)-1,2-этандиол-2 този-лата с выходом 79% в виде смеси 0,25:0,75 указанных в заголовке соединений согласно процедуре, сходной с процедурой,описанной в препаративном примере 3. 1 Н-ЯМР (270 МГц, CDCl3)7,29-7,21(S)-1-(3-Хлорфенил)-1,2-этандиол. Это соединение получали из 3 хлорстирола с выходом 100% согласно процедуре, сходной с процедурой, описанной в препаративном примере 18. 1(S)-1-(3-Хлорфенил)-1,2-этандиол-2 тозилат. Это соединение получали из (S)-1-(3 хлорфенил)-1,2-этандиола с выходом 74% согласно процедуре, сходной с процедурой,описанной в препаративном примере 19. Его оптическая чистота была 98% эн.изб. согласно ВЖХ. 1 Н-ЯМР (270 МГц, CDCl3)7,76 (2 Н,д, J=8,1 Гц), 7,32 (2 Н, д, J=8,4 Гц), 7,31-7,17(4 Н, м), 5,00-4,92 (1H, м), 4,14 (1H, дд,J=3,3, 10,6 Гц), 4,02 (1 Н, дд, J=8,4, 10,6 Гц),2,63 (1H, д, 3,7 Гц), 2,46 (3 Н, с). Препаративный пример 23. 2-(R)-(3-Хлорфенил)-2-(3-(S)-метоксиметоксипирролидин-1-ил)этанол и 1-(S)-(3 хлорфенил)-2-(3-(S)метоксиметоксипирроли-дин-1-ил)этанол. Эти соединения получали из (S)-1-(3 хлорфенил)-1,2-этандиол-2-тозилата с выходом 62% в виде смеси 0,15:0,85 указанных в заголовке соединений согласно процедуре, сходной с процедурой, описанной в препаративном примере 3. 1 Н-ЯМР (270 МГц, CDCl3)7,40-7,20(R)-1-Бензил-3-пирролидинолтозилат. К перемешиваемому раствору (R)-1 бензил-3-пирролидинола (1,77 г, 10 ммоль) в пиридине (30 мл) добавляли птолуолсульфонилхлорид (9,53 г, 50 ммоль) порциями при 0 С. После 90 ч перемешивания при комнатной температуре к реакционной смеси добавляли воду и смесь экстрагировали эфиром (150 мл). Экстракт промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 3,06 г (92%) в виде коричневого масла. 1 Н-ЯМР (270 МГц, CDCl3)7,76 (2 Н,д, J=8,4 Гц), 7,31 (2 Н, д, J=8,4 Гц), 7,35-7,20(30 мл) добавляли 1,0 М раствор тетрабутилам-монийфторида в ТГФ (37,0 мл, 37,0 ммоль) при комнатной температуре. После 1,5 ч перемешивания при нагревании с обратным холодильником к реакционной смеси добавляли воду (150 мл) и смесь экстрагировали этилацетатом (100 мл х 2). Объединенный экстракт промывали водой, насыщенным солевым раствором, сушили(Nа 2SO4) и концентрировали с получением коричневого масла, которое очищали колоночной хроматографией (силикагель: 80 г,СН 2 Сl2/ MeOH:50/1) с получением 1,18(S)-1-бензил-3 фторпирролидина (1,18 г, 6,58 ммоль) и 20% гидроксида палладия на угле (354 мг) вEtOH (20 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 21,5 ч. После удаления катализатора фильтрованием через целит к этому раствору добавляли раствор (S)-(-)-стиролоксида(791 мг, 6,58 ммоль) в EtOH (5 мл). Смесь нагревали с обратным холодильником в течение 3,5 ч. После выпаривания растворителя остаток очищали колоночной хроматографией(5,4 Н, м), 2,30-1,80 (3 Н, м). Препаративный пример 27. 2-(3-(S)-Метоксиметоксипирролидин 1-ил)-1-(R)-фенилэтанол и 2-(3-(S)метоксиметокси-пирролидин-1-ил)-2-(S)фенилэтанол. Эти соединения получали из 3-(S)метоксиметоксипирролидина и(R)-(-)стиролоксида с выходом 53% в виде смеси 0,7:0,3 указанных в заголовке соединений согласно процедуре, сходной с процедурой,описанной в препаративном примере 2.(R)-1-(3-Метоксиметоксифенил)-1,2 этандиол. Это соединение получали из 3 метоксиметоксистирола и AD-микса- с выходом 100% согласно процедурам, сходным с процедурами, описанными в препаративном примере 18. 1(R)-1-(3-Метоксиметоксифенил)-1,2 этан-диол-2-тозилат. Это соединение получали из (R)-1-(3 метоксиметоксифенил)-1,2-этандиола с выходом 77% согласно процедурам, сходным с процедурами, описанными в препаративном примере 19. 1(1H, м), 7,00-6,92 (3 Н, м), 5,15 (2 Н, с), 5,004,90 (1H, м), 4,20-4,00 (2 Н, м), 3,46 (3 Н, с),2,80-2,60 (1H, м), 2,45 (3 Н, с). 97% энантиомерный избыток (согласно ВЖХ). Препаративный пример 30. 2-(R)-Фенил-2-(3-пирролин-1-ил)этанол. Это соединение получали из R-(-)-2 фенилглицинола и цис-1,4-дихлор-2-бутена с выходом 58% согласно процедурам, сходным с процедурами, описанными в препаративном примере 1. 1 Н-ЯМР (270 МГц, CDCl3)7,36-7,29(S)-1-Бензил-3-пирролидинолтозилат. Это соединение получали из (S)-1 бензил-3-пирролидинола и п-толуолсульфонилхлорида с выходом 98% согласно процедурам, сходным с процедурами, описанными в препаративном примере 24. 1 Н-ЯМР (270 МГц, CDCl3)7,76 (2 Н,д, J=8,4 Гц), 7,33-7,26 (7 Н, м), 4,97 (1 Н, т,J=2,9 Гц), 3,69-3,58 (2 Н, м), 2,89-2,83 (1 Н,м), 2,73-2,68 (2 Н, м), 2,58-2,55 (1 Н, м), 2,44(R)-1-Бензил-3-фторпирролидин. Это соединение получали из (S)-1 бензил-3-пирролидинолтозилата с выходом 61% согласно процедурам, сходным с процедурами, описанными в препаративном примере 25. 1 Н-ЯМР (270 МГц, CDCl3)7,33-7,23(2 Н, м). Препаративный пример 33. 2-(3-(R)-Фторпирролидин-1-ил)-1-(S)фенилэтанол и 2-(3-(R)-фторпирролидин-1 ил)-2-(R) -фенилэтанол. Эти соединения получали из (R)-1 бензил-3-фторпирролидина с общим выходом 76% в виде смеси 0,6:0,4 указанных в заголовке соединении согласно процедурам,сходным с процедурами, описанными в препаративном примере 26. 1 Н-ЯМР (270 МГц, СDСl3)7,40-7,24(5,4 Н, м), 2,23-1,94 (2 Н, м). Препаративный пример 34. 2-(3-(S)-Фторпирролидин-1-ил)-1-(R)фенилэтанол и 2-(3-(S)-фторпирролидин-1 ил)-2-(S)-фенилэтанол. Эти соединения получали из 3(S)фторпирролидина и (R)-(+)-стиролоксида с выходом 72% в виде смеси 0,7:0,3 указанных в заголовке соединений согласно процедурам, сходным с процедурами, описанными в препаративном примере 26. 1(S)-1-Бензил-3-хлорпирролидин. К перемешиваемому раствору (R)-1 бензил-3-пирролидинола (886 мг, 5,0 ммоль) в ССl4 (20 мл) добавляли трифенилфосфин (1,574 г, 6,0 ммоль) при комнатной температуре. После перемешивания в течение 20 ч при температуре дефлегмации растворитель выпаривали. Насыщенный водный раствор NaHCO3 и воду добавляли к остатку и смесь экстрагировали AcOEt. Экстракт промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением коричневого масла,которое очищали колоночной хроматографией (силикагель: 100 г, СН 2 Сl2/MeOH: 50/1-45/1) с получением 706 мг (72%) бледно-желтого масла.(5 Н, м), 4,42-4,33 (1 Н, м), 3,73-3,61 (2 Н, м),3,09 (1 Н, дд, J=6,6 Гц), 2,81-2,61 (3 Н, м),2,48-2,35 (1 Н, м), 2,13-2,03 (1H, м). Препаративный пример 36. 2-(3-(S)-Хлорпирролидин-1-ил)-1-(S)фенилэтанол и 2-(3-(S)-хлорпирролидин-1 ил)-2-(R)-фенилэтанол. К перемешиваемому раствору (S)-1 бензил-3-хлорпирролидина (695 мг, 3,55 ммоль) в дихлорэтане (10 мл) добавляли 1 хлорэтилхлорформиат (0,38 мл, 3,55 ммоль) при 0 С. Смесь перемешивали при 0 С в течение 10 мин и нагревали с обратным холодильником в течение 1,5 ч. После охлаждения до комнатной температуры растворитель выпаривали. Остаток растворяли в МеОН (5 мл) и нагревали с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры растворитель выпаривали с получением 787 мг коричневого твердого вещества. Указанные в заголовке соединения получали из вышеуказанного твердого вещества и (S)-(-)-стиролоксида с общим выходом 39% в виде смеси 0,67:0,33 указанных в заголовке соединений согласно процедурам,сходным с процедурами, описанными в препаративном примере 2. 1(1 Н, м), 2,17-2,03 (1 Н, м). Препаративный пример 37. Метил-3-фтор-4-нитробензоат. Смесь 3-фтор-4-нитробензойной кислоты (2,07 г, 11,2 ммоль) и концентрированной H2SO4 (0,5 мл) в МеОН (10 мл) нагревали с обратным холодильником в течение 8 ч. Растворитель выпаривали. Остаток растворяли в AcOEt и промывали насыщенным водным раствором NаНСО 3, водой,насыщенным солевым раствором, сушили(Na2SO4) и концентрировали с получением 2,14 г (96%) твердого вещества цвета слоновой кости. 1 Н-ЯМР (270 МГц, CDCl3) 5 8,158,07 (1H, м), 7,99-7,96 (1 Н, м), 7,95-7,92 (1H,м), 3,99 (3 Н, с). Препаративный пример 38. Метил-4-амино-3-фторбензоат. Смесь метил-3-фтор-4-нитробензоата(2,14 г, 10,8 ммоль) и порошка железа (2,63 г) в уксусной кислоте (22 мл) перемешивали при 50 С в течение 2,5 ч. После охлаждения до комнатной температуры к смеси добавляли СН 2 Сl2 (100 мл) и воду (300 мл) и фильтровали для удаления порошка железа. Органический слой отделяли и водный слой экстрагировали СН 2 Сl2 (70 мл х 2). Раствор(2 Н, м), 6,79-6,70 (1 Н, м), 4,13 (2 Н, шир.с),3,86 (3 Н, с). Препаративный пример 39. Метил-3-фтор-4-метиламинобензоат. К раствору метил-4-амино-3-фторбензоата (1,77 г, 10,5 ммоль) в СН 2 Сl2 (50 мл) добавляли Nа 2 СО 3 (3,33 г, 31,4 ммоль) и трифторуксусный ангидрид (2,96 мл, 20,9 ммоль) при комнатной температуре. После перемешивания в течение 2,5 ч твердое вещество отфильтровывали. Фильтрат промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 2,70 г (97%) белого твердого вещества. К раствору этого твердого вещества (2,70 г, 10,2 ммоль) в ДМФ (48 мл) добавляли Na2CO3 (16,9 г, 160 ммоль) и иодметан (20,8 мл, 334 ммоль) при 0 С. После перемешивания в течение 2 ч при 0 С в течение 1 ч при комнатной температуре смесь выливали в 2 н НСl со льдом и экстрагировали смесью AcOEt:толуол=2:1 (200 мл х 2). Экстракт промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 3,06 г (количеств. выход) коричневого масла. Это масло растворяли в МеОН (25 мл) и добавляли 7% раствор К 2 СО 3 (12,5 мл) при 0 С. После перемешивания в течение 2 ч при 0 С в течение 4 ч при комнатной температуре добавляли 7% раствор К 2 СО 3 (12,5 мл). После перемешивания в течение 1,5 ч при комнатной температуре смесь подкисляли 5 н НСl и МеОН выпаривали. Остаток экстрагировали AcOEt. Экстракт промывали водой, насыщенным солевым растворам, сушили (Na2SO4) и концентрировали с получением 1,83 г (98%) бледно-коричневого твердого вещества. 1(14 мл) добавляли оксалилхлорид (0,989 мл,11,3 ммоль) по каплям при комнатной температуре. После перемешивания в течение 30 мин при комнатной температуре растворитель выпаривали. Остаток растворяли в 37 СН 2 Сl2 (14 мл). Этот раствор добавляли по каплям к перемешиваемому, охлажденному раствору н-пропиламина (0,756 мл, 9,19 ммоль) и триэтиламина (3,20 мл, 23,0 ммоль) в СН 2 Сl2 (28 мл) при поддержании температуры ниже 15 С. После перемешивания в течение 15 ч при комнатной температуре смесь промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением коричневого масла, которое очищали колоночной хроматографией(1,82 г, 6,21 ммоль) в трифторуксусной кислоте (30 мл) перемешивали при 0 С в течение 2 ч. После удаления растворителя остаток растворяли в СН 2 Сl2 и 25% растворе аммиака. Органический слой отделяли и промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 1,20 г (100%) коричневого твердого вещества. 1H-ЯМР (270 МГц, CDCl3)8,01 (1H,д, J=8,4 Гц), 7,88 (1H, д, J=2,9 Гц), 7,78 (1H,шир.с), 6,90 (1H, дд, J=2,9, 8,4 Гц), 4,17 (1H,шир.с), 3,45-3,35 (2 Н, м), 2,91 (3 Н, д, J=5,1 Гц), 1,75-1,55 (2 Н, м), 0,98 (3 Н, т, J=7,3 Гц). Препаративный пример 42. 4-N-Гидроксиамино-N'-пропилбензамид. К раствору 4-нитро-N-пропилбензамида (2,75 г, 13,2 ммоль) и хлорида аммония (812 мг, 15,2 ммоль) в EtOH (20 мл) и воде (10 мл) добавляли порошок цинка (1,70 г, 26,0 ммоль) порциями с охлаждением водой. После перемешивания в течение 30 мин при комнатной температуре порошок цинка (0,50 г, 7,65 ммоль) добавляли к смеси и перемешивали в течение 30 мин. Твердое вещество удаляли фильтрованием через целит и промывали МеОН. Фильтрат и промывки объединяли и концентрировали с получением желтого твердого вещества,которое очищали колоночной хроматографией (силикагель; 130 г, СН 2 Сl2/MeOH:25/110/1) с получением 2,06 г (80%) твердого вещества цвета слоновой кости. 1 Н-ЯМР (270 МГц, СDСl3-ДМSО-d6)8,32 (1H, д, J=2,2 Гц), 7,72 (2 Н, д, J=8,4 Гц),7,25-7,10 (1H, м), 6,95 (2 Н, д, J=8,8 Гц), 001341(2,88 мл, 35,0 ммоль) и WSC (6,71 г, 35,0 ммоль) в СН 2 Сl2 (35 мл) перемешивали при комнатной температуре в течение 16 ч. Смесь промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением коричневого масла, которое очищали колоночной хроматографией (силикагель; 180 г, СН 2 Сl2/MeOH:30/1-10/1) с получением 2,32 г (62%) бледного твердого вещества цвета слоновой кости. 1(0,68 мл, 10,9 ммоль) и К 2 СО 3 (1,51 г, 10,9 ммоль) в ДМФ (50 мл) перемешивали при комнатной температуре в течение 20 ч. К этой смеси добавляли воду и экстрагировали смесью AcOEt:толуол=1:1. Экстракт промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением бледно-коричневого твердого вещества, которое очищали колоночной хроматографией (силикагель; 120 г,СН 2 Сl2/MeOH:40/1) с получением 887 мгH-ЯМР (270 МГц, СDСl3)7,57 (1H,д, J=8,4 Гц), 6,80 (1H, шир.с), 6,53 (1H, д,J=2,2 Гц), 6,50 (1H, дд, J=2,2, 8,4 Гц), 5,004,80 (1H, м), 3,45-3,30 (2 Н, м), 2,82 (3 Н, д,J=5,1 Гц), 1,75-1,55 (2 Н, м), 0,99 (3 Н, т,J=7,3 Гц). Препаративный пример 45. 4-Meтилaминo-N'-(2-(S)-гидроксипропил) бензамид. Соединение получали из 4-(метиламино)бензойной кислоты и (S)-(+)-1 амино-2-пропанола с выходом 22% согласно процедурам, сходным с процедурами,описанными в препаративном примере 43. 1 39 Препаративный пример 46. 4-Meтилaминo-N'-(2-(R)-гидроксипропилбензамид. Соединение получали из 4-(метиламино)бензойной кислоты и (R)-(-)-1 амино-2-пропанола с выходом 41% согласно процедурам, сходным с процедурами,описанными в препаративном примере 43. 1(1H, м), 3,28-3,18 (1H, м), 2,85 (3 Н, д, J=4,8 Гц), 1,20 (3 Н, д, J=6,2 Гц). Препаративный пример 47. 4-Метиламино-N'-пропилбензамид. Соединение получали из 4-(метиламино)бензойной кислоты и н-пропиламина с выходом 82% согласно процедурам, сходным с процедурами, описанными в препаративном примере 43. 1(100 мг, 0,351 ммоль) в СН 2 Сl2 (1 мл) добавляли оксалилхлорид (0,122 мл, 1,40 ммоль) и ДМФ (0,026 мл) при комнатной температуре. После перемешивания в течение 4 ч при комнатной температуре растворитель выпаривали. Остаток растворяли в СН 2 Сl2(10 мл). К этому раствору добавляли 2,2,3,3,3-пентафторпропиламин (523 мг,3,51 ммоль) и триэтиламин (0,372 мл, 2,67 ммоль) при комнатной температуре. После перемешивания в течение 18 ч при комнатной температуре к смеси добавляли насыщенный водный раствор NaHCO3 и экстрагировали СН 2 Сl2. Экстракт промывали насыщенным солевым раствором, сушили(Na2SO4) и концентрировали с получением коричневого масла, которое очищали колоночной хроматографией (силикагель: 30 г,СН 2 Сl2 только-СН 2 Сl2/МеОН: 50/1) с получением 532 мг (72%) указанного в заголовке соединения. 1H-ЯМР (270 МГц, CDCl3)7,75 (2 Н,д, J=8,8 Гц), 7,39-7,31 (7 Н, м), 6,42-6,31 (1 Н,м), 5,19 (2 Н, с), 4,17 (2 Н, ддд, J=6,2, 14,7,14,7 Гц), 3,36 (3 Н, с). Препаративный пример 49. 4-[N-(Бензилоксикарбонил)-N-метиламино]-N'-трет-амилбензамид. Это соединение получали из 4-[N(бензилоксикарбонил)-N-метиламино]бен 001341H-ЯМР (270 МГц, CDCl3)7,69 (2 Н,д, J=8,4 Гц), 7,32-7,29 (7 Н, м), 5,86-5,75 (1 Н,м), 5,17 (2 Н, с), 3,33 (3 Н, с), 1,88-1,80 (2 Н,м), 1,40 (6 Н, с), 0,89 (3 Н, т, J=7,3 Гц). Препаративный пример 50. 4-[N-(Бензилоксикарбонил)-N-метиламино]-N'-трет-бутилбензамид. Это соединение получали из 4-[N(бензилоксикарбонил)-N-метиламино] бензойной кислоты и трет-бутиламина с выходом 93% согласно процедурам, сходным с процедурами, описанными в препаративном примере 48. 1) и 10% палладия на угле (41 мг) в МеОН (5 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 6 ч. Катализатор удаляли фильтрованием через целит и промывали МеОН. Фильтрат и промывки объединяли и концентрировали с получением 345 мг (96%) указанного в заголовке соединения. 1(1 Н, м), 4,23-4,09 (3 Н, м), 2,89 (3 Н, д, J=4,4 Гц). Препаративный пример 52. 4-Метиламино-N'-трет-амилбензамид. Это соединение получали из 4-[N(бензилоксикарбонил)-N-метиламино]-N'трет-амилбензамида с выходом 88% согласно процедурам, сходным с процедурами,описанными в препаративном примере 51. 1(2 Н, к, J=7,7 Гц), 1,39 (6 Н, с), 0,89 (3 Н, т,J=7,7 Гц). Препаративный пример 53. 4-Метиламино-N'-трет-бутилбензамид. Это соединение получали из 4-[N(бензилоксикарбонил)-N-метиламино]-N'трет-бутилбензамида с выходом 100% согласно процедурам, сходным с процедурами, описанными в препаративном примере 51. 1(I) Метил-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметил-аминобензоат. К перемешиваемому раствору смеси 2(3-(S)-метоксиметоксипирроллидин-1-ил)-1(S)-фенилэтанола и 2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(R)-фенилэтанола(2,01 г, 8,00 ммоль) и триэтиламина (1,34 мл, 9,60 ммоль) в СН 2 Сl2 (35 мл) добавляли метансульфонилхлорид (0,744 мл, 9,60 ммоль) по каплям при 0 С (на бане со льдом). После перемешивания в течение 5,5 ч при комнатной температуре реакционную смесь промывали насыщенным водным раствором NaHCO3, насыщенным солевым раствором, сушили (Nа 2SO4) и концентрировали с получением 2,16 г коричневого вязкого масла. К этому маслу добавляли метил-4 метиламинобензоат (1,45 г, 8,80 ммоль) и этанол (16 мл), и смесь перемешивали при нагревании с обратным холодильником в течение 1,5 ч. Растворитель выпаривали. Остаток растворяли в СН 2 Сl2 и промывали насыщенным водным раствором NaHCO3 и насыщенным солевым раствором, сушили(Na2SO4) и концентрировали с получением коричневого масла, которое очищали колоночной хроматографией (силикагель: 150 г,СН 2 Сl2/MeOH: 100/1-35/1) с получением 1,99 г (62,5%) коричневого масла. 1(II) 4-N-[2-(3-(S)-Метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламинобензойная кислота. Смесь метил-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламинобензоата (1,99 г, 5,00 ммоль) и 4 н NaOH (12,5 мл, 50,0 ммоль) в МеОН (35 мл) перемешивали при 75 С в течение 3 ч. Смесь нейтрализовали 5 н НСl при 0 С. Растворитель удаляли в вакууме. К остатку добавляли СН 2 Сl2 и нерастворимое твердое вещество удаляли фильтрованием. Фильтрат концентрировали с получением 2,04 г (колич.) бледно-коричневого аморфного вещества. 1(III) 4-N-[2-(3-(S)-Метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-пропилбензамид. К перемешиваемому раствору 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламинобензойной кислоты (2,04 г, 5,00 ммоль) и нпропиламина (0,822 мл, 10,0 ммоль) в СН 2 Сl2 (35 мл) добавляли гидрохлорид 1 этил-3-(3-диметиламинопропил) карбодиимида (1,92 г, 10 ммоль) при комнатной температуре. После перемешивания в течение 15,5 ч реакционную смесь промывали водой и насыщенным солевым раствором, сушили(Na2SO4) и концентрировали с получением коричневого масла, которое очищали колоночной хроматографией (силикагель: 100 г,СН 2 Сl2/MeOH: 25/1) с получением 1,52 г(2 Н, м), 2,90-2,80 (1H, м), 2,85 (3 Н, с), 2,782,52 (3 Н, м), 2,14-1,96 (1H, м), 1,84-1,70 (1H,м), 1,68-1,56 (2 Н, м), 0,97 (3 Н, т, J=7,3 Гц). Пример 2. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-пропилбензамида. Смесь 4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамида (1,52 г, 3,58 ммоль) и 10% НСl в МеОН (25 мл) перемешивали при комнатной температуре в течение 6 ч. Растворитель выпаривали. Остаток подщелачивали 25% гидроксидом аммония,экстрагировали СН 2 Сl2. Экстракт промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением бледно-коричневого аморфного вещества, которое очищали колоночной хроматографией (силикагель: 65 г, СН 2 Сl2/MeOH(1H, ддд, J=6,1, 9,0, 9,0 Гц), 2,18-2,00 (1H,м), 1,90-1,50 (4 Н, м), 0,98 (3 Н, т, J=7,3 Гц). 600 мг этого аморфного вещества растворяли в 10% НСl в МеОН (10 мл). Растворитель концентрировали с получением 625 мг соли НСl в виде бледно-коричневого аморфного вещества. ИК (КВr) : 3300, 1610 см-1. МС m/z: 382 (M+H)+ Анал. рассчитано для С 23 Н 31N3O2 НСl 1,5 Н 2O:С, 62,08; Н ,7,93; N ,9,44. Найдено: С, 62,29; Н, 8,01; N, 9,42. Пример 3. Получение 4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-метилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламинобензойной кислоты и гидрохлорида метиламина с выходом 26% согласно процедуре, сходной с процедурой, описанной в примере 1 (III). 1(1H, д, J=6,6 Гц), 4,20-4,13 (1H, м), 3,30 (3 Н,с), 3,15-3,00 (2 Н, м), 2,97 (3 Н, д, J=5,1 Гц),2,90-2,80 (1H, м), 2,83 (3 Н, с), 2,75-2,55 (3 Н,м), 2,05 (1H, ддд, J=7,7, 14,3, 13,9 Гц), 1,901,70 (1H, м). Пример 4. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-метилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фeнилэтил]-N-мeтилaминo-N'-мeтилбeнзaмидa с выходом 82% согласно процедуре, сходной с процедурой, описанной в примере 2. 1 44 Соединение получали из 4-N-[2-(3(S)-метоксиметоксипирролидин-1-ил)-1-(S)фенилэтил]-N-метиламинобензойной кислоты и гидрохлорида этиламина с выходом 33% согласно процедуре, сходной с процедурой, описанной в примере 1 (III). 1(2 Н, м), 3,30 (3 Н, с), 3,10-3,01 (2 Н, м), 2,892,80 (1H, м), 2,83 (3 Н, с), 2,75-2,53 (3 Н, м),2,11-2,01 (1H, м), 1,80-1,74 (1H, м), 1,23 (3 Н,т, J=7,1 Гц). Пример 6. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-этилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламино-N'-этилбензамида с выходом 43% согласно процедуре, сходной с процедурой, описанной в примере 2. 1C22H29N3O2HCl4H2O: С, 55,72; Н, 7,70; N,8,97. Найдено: С, 55,51; Н, 8,05; N, 8,83. Пример 7. Получение 4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметил-амино-N'-бутилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламинобензойной кислоты и н-бутиламина с выходом 40% согласно процедуре, сходной с процедурой,описанной в примере 1 (III). 1 45 Пример 8. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-бутилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламино-N'-бутилбензамида с выходом 59% согласно процедуре, сходной с процедурой, описанной в примере 2. 1 Н-ЯМР (270 МГц, свободный амин,CDCl3)7,65 (2 Н, д, J=8,8 Гц), 7,35-7,24(5 Н, м), 6,80 (2 Н, д, J=8,8 Гц), 5,82-5,78 (1H,м), 5,15 (1H, дд, J=5,9, 8,8 Гц), 4,26-4,24 (1H,м), 3,43 (2 Н, дд, J=7,0, 12,8 Гц), 3,13 (1H, дд,J=8,8, 12,8 Гц), 3,03 (1H, дд, J=6,2, 12,8 Гц),2,93-2,85 (1H, м), 2,84 (3 Н, с), 2,73 (1H, д,J=9,5 Гц), 2,56 (1H, дд, J=4,8, 9,5 Гц), 2,372,28 (1H, м), 2,10-2,06 (1H, м), 1,72-1,52 (4 Н,м), 1,47-1,25 (2 Н, м), 0,95 (3 Н, т, J=7,3 Гц). Соль НСl: аморфное твердое вещество. ИК (КВr): 3350, 1610 см-1. МС m/z: 396 (М+Н)+ Анал. рассчитано для C24H33N3O2HCl 1,4 Н 2O: С, 63,05; Н ,8,11; N, 9,19. Найдено: С, 63,06; Н, 8,04; N, 8,98. Пример 9. Получение 4-N-[1-(S)-фенил-2-(3-(S)тетрагидропиран-2-илоксипирролидин-1 ил)этил]-N-метиламино-N'-пентилбензамида. Это соединение получали из 2-(R)фенил-2-(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил)этанола и 1-(S)-фенил-2(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил)этанола с общим выходом 33% согласно процедуре, сходной с процедурой,описанной в примере 1 (I)-(III). 1(1,2 Н, с), 2,80-2,50 (3 Н, м), 2,20-1,95 (1H, м),1,90-1,25 (13 Н, м), 0,91 (3 Н, т, J=7,0 Гц). Пример 10. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-пентилбензамида. Соединение получали из 4-N-[1-(S)фенил-2-(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил)этил]-N-метиламиноN'-пентилбензамида с выходом 98% согласно процедуре, сходной с процедурой, описанной в примере 2. 1(4 Н, м), 0,93 (3 Н, т, J=7,3 Гц). Соль НСl: аморфное твердое вещество. ИК (КВr) : 3350, 1610 см-1. Анал. рассчитано для С 25 Н 35N3O2 НСl 0,25 Н 2O: С,66,65; Н, 8,17; N, 9,33. Найдено: С, 66,57; Н, 8,47; N, 9,31. Пример 11. Получение 4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-изопропилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламинобензойной кислоты и изопропиламина с выходом 15% согласно процедуре, сходной с процедурой,описанной в примере 1 (III). 1 Н-ЯМР (270 МГц, CDCl3)7,63 (2 Н,д, J=9,2 Гц), 7,34-7,21 (5 Н, м), 6,78 (2 Н, д,J=9,6 Гц), 5,75-5,72 (1H, м), 5,12 (1 Н, дд,J=6,2, 8,8 Гц), 4,59 (1H, д, J=6,6 Гц), 4,55(1H, м), 1,23 (6 Н, д, J=6,6 Гц). Пример 12. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-изопропилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламино-N'-изопропилбензамида с выходом 80% согласно процедуре, сходной с процедурой, описанной в примере 2. 1(5 Н, м), 6,80 (2 Н, д, J=8,8 Гц), 5,79-5,77 (1H,м), 5,15 (1H, дд, J=6,2, 8,8 Гц), 4,30-4,19 (2 Н,м), 3,13 (1H, дд, J=9,2, 12,8 Гц), 3,03 (1H, дд,J=6,2, 12,8 Гц), 2,93-2,84 (1H, м), 2,82 (3 Н,с), 2,72 (1H, д, J=9,5 Гц), 2,57 (1H, дд, J=4,8,9,9 Гц), 2,38-2,29 (1H, м), 2,14-2,02 (2 Н, м),1,68-1,58 (1H, м), 1,23 (6 Н, д, J=6,6 Гц). Соль НСl: аморфное твердое вещество. ИК (КВr): 3350, 1610 см-1. МС m/z: 382 (М+Н)+. Анал. рассчитано для С 23 Н 31N3O2 НСl 1,9 Н 2O:С, 61,09; Н,7,98; N, 9,29. Найдено: С, 61,16; Н, 7,61; N, 9,12. Пример 13. Получение 4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-фенилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1 47(1H, м), 2,80-2,55 (3 Н, м), 2,15-2,00 (1H, м),1,90-1,70 (1H, м). Пример 14. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-фенилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламино-N'-фенилбензамида с выходом 16% согласно процедуре, сходной с процедурой, описанной в примере 2. 1(1H, м), 1,80-1,60 (1H, м). Соль НСl: аморфное твердое вещество. ИК (КВr): 3400, 1600 см-1. Анал. рассчитано для С 26 Н 29N3O2 НСlН 2O: С, 66, 44; Н, 6,86; N,8,94,Найдено: С, 66,33; Н, 7,16; N, 8,86. Пример 15. Получение 4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-(2-хлорбензил)бензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламинобензойной кислоты и 2-хлорбензиламина с выходом 88% согласно процедуре, сходной с процедурой, описанной в примере 1 (III). 1 48 Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламино-N'-(2 хлорбензил)бензамида с выходом 98% согласно процедуре, сходной с процедурой,описанной в примере 2. 1(9 Н, м), 6,79 (2 Н, д, J=8,8 Гц), 6,50-6,40 (1H,м), 5,14 (1H, дд, J=6,0, 9,0 Гц), 4,71 (2 Н, д,J=5,9 Гц), 4,25-4,20 (1H, м), 3,12 (1H, дд,J=8,8, 12,8 Гц), 3,03 (1H, дд, J=6,2, 12,8 Гц),2,95-2,80 (1H, м), 2,84 (3 Н, с), 2,72 (1H, д,J=9,9 Гц), 2,56 (1H, дд, J=4,4, 9,9 Гц), 2,402,32 (1H, м), 2,16-2,00 (1H, м), 1,80-1,55 (2 Н,м). Соль НСl: аморфное твердое вещество. ИК (КВr): 3300, 1630, 1605 см-1. Анал. рассчитано для С 27 Н 30N3O2 СlНСl Н 2O: 0,3 С 3 Н 8 О:С, 62, 46; Н, 6,65; N, 7,83. Найдено: С, 62,51; H, 7,02; N, 7,94. Пример 17. Получение 4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N',N'-диметилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламинобензойной кислоты и гидрохлорида диметиламина с выходом 71% согласно процедуре, сходной с процедурой, описанной в примере 1 (III). 1(2 Н, м), 2,81 (3 Н, с), 2,25-2,05 (1H, м), 2,001,80 (1H, м), 1,80-1,55 (1H, м). Пример 18. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N',N'-диметилбензамида. Это соединение получали из 4-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламино-N',N'диметилбензамида с выходом 88% согласно процедуре, сходной с процедурой, описанной в примере 2. 1C22H29N3O2HClH2O: С, 62, 62; Н, 7,64; N,9,96. Найдено: С, 62, 52; Н, 7,86; N, 9,98. Пример 19. Получение 4-N-[1-(S)-фенил-2-(3-(S)тетрагидропиран-2-илоксипирролидин-1 ил)этил]-N-метиламино-N'-метил-N'-пропилбензамида. Это соединение получали из 2-(R)фенил-2-(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил)этанола и 1-(S)-фенил-2(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил)этанола с общим выходом 32% согласно процедуре, сходной с процедурой,описанной в примере 1 (I)-(III). 1(3 Н, с), 2,81 (1,8 Н, с), 2,80 (1,2 Н, с), 2,802,70 (1H, м), 2,68-2,50 (3 Н, м), 2,15-1,95 (1H,м), 1,90-1,45 (9 Н, м), 1,00-0,80 (3 Н, м). Пример 20. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-метил-N'-пропилбензамида. Это соединение получали из 4-N-[1(S)-фенил-2-(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил)этил]-N-метиламиноN'-метил-N'-пропилбензамида с выходом 83% согласно процедуре, сходной с процедурой, описанной в примере 2. 1(I) Метил-3-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламинобензоат. Это соединение получали из 2-(3-(S)метоксиметоксипирролидин-1-ил)-2-(R)-фенилэтанола и метил-3-метиламинобензоата с выходом 78% согласно процедуре, сходной с процедурой, описанной в примере 1(II) 3-N-[2-(3-(S)-Метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламинобензойная кислота. Это соединение получали из метил-3N-[2-(3-(S)-метоксиметоксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламинобензоата с выходом 100% согласно процедуре,сходной с процедурой, описанной в примере 1 (II). 1(III) 3-N-[2-(3-(S)-Метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамид. Это соединение получали из 3-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламинобензойной кислоты и н-пропиламина с выходом 78% согласно процедуре, сходной с процедурой,описанной в примере 1 (III). 1(1H, м), 4,57 (1H, д, J=6,6 Гц), 4,53 (1H, д,J=6,6 Гц), 4,22-4,12 (1H, м), 3,46-3,32 (2 Н,м), 3,28 (3 Н, с), 3,16-2,96 (1H, м), 2,81 (3 Н,с), 2,86-2,52 (4 Н, м), 2,14-1,98 (1H, м), 1,821,56 (4 Н, м), 0,98 (3 Н, т, J=7,3 Гц). Пример 22. Получение 3-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамида. Это соединение получали из 3-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламино-N'-пропилбензамида с выходом 90% согласно процедуре, сходной с процедурой, описанной в примере 2. 1(I) Метил-2-хлор-4-N-[1-(S)-фенил-2(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил) этил]-N-метиламинобензоат. Это соединение получали из 2-(R)фенил-2-(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил)этанола и 1-(S)-фенил-2(3-(S)-тетра-гидропиран-2-илоксипирролидин-1-ил)этанола и метил-2-хлор-4-метиламинобензоата с выходом 40% согласно процедуре, сходной с процедурой, описанной в примере 1 (I). 1(II) 2-Хлор-4-N-[1-(S)-фенил-2-(3-(S)тетрагидропиран-2-ил-оксипирролидин-1 ил)этил]-N-метиламинобензойная кислота. Это соединение получали из метил-2 хлор-4-N-[1-(S)-фенил-2-(3-(S)-тетрагидропиран-2-илоксипирролидин-1-ил)этил]-Nметиламино бензоата с выходом 100% согласно процедуре, сходной с процедурой,описанной в примере 1 (II). 1(III) 2-Хлор-4-N-[1-(S)-фенил-2-(3(S)-тетрагидропиран-2-илоксипирролидин 1-ил)этил]-N-метиламино-N'-пропилбензамид. Это соединение получали из 2-хлор-4N-[1-(S)-фенил-2-(3-(S)-тетрагидропиран 2-илоксипирролидин-1-ил)этил]-N-метиламинобензойной кислоты и н-пропиламина с выходом 68% согласно процедуре, сходной с процедурой, описанной в примере 1(4 Н, м), 2,20-1,95 (1 Н, м), 1,95-1,40 (9 Н, м),0,99 (3 Н, т, J=7,3 Гц). Пример 24. Получение 2-хлор-4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]N-метиламино-N'-пропилбензамида. Это соединение получали из 2-хлор-4N-[1-(S)-фенил-2-(3-(S)-тетрагидропиран 2-илоксипирролидин-1-ил)этил]-N-метиламино-N'-пропилбензамида с выходом 89% согласно процедуре, сходной с процедурой,описанной в примере 2. 1(I) Метил-2-метокси-4-N-[2-(3-(S)метоксиметоксипирролидин-1-ил)-1-(S)фенилэтил]-N-метиламинобензоат. Это соединение получали из 2-(3-(S)метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтанола и 2-(3-(S)-метоксиметоксипирролидин-1-ил)-2-(R)-фенилэтанола и метил 2-метокси-4-метиламинобензоата с выходом 41% согласно процедуре, сходной с процедурой, описанной в примере 1 (I). 1(II) 2-Метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламинобензойная кислота. Это соединение получали из метил-2 метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино бензоата с выходом 100% согласно процедуре, сходной с процедурой, описанной в примере 1 (II). 1(Ill) 2-Метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамид. Это соединение получали из 2 метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламинобензойной кислоты и нпропиламина с выходом 84% согласно процедуре, сходной с процедурой, описанной в примере 1 (III). 1(1H, м), 1,84-1,70 (1H, м), 1,68-1,50 (2 Н, м),0,97 (3 Н, т, 7,3 Гц). Пример 26. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-2-метокси-N'-пропилбензамида. Это соединение получали из 2 метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамида с выходом 85% согласно процедуре, сходной с процедурой,описанной в примере 2. 1 Н-ЯМР (270 МГц, свободный амин,СDСl3)8,07 (1H, д, J=8,8 Гц), 7,78-7,68(I) Метил-3-метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламинобензоат. Это соединение получали из 2-(3-(S)метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтанола и 2-(3-(S)-метоксиметоксипирролидин-1-ил)-2-(R)-фенилэтанола и метил 3-метокси-4-метиламинобензоата с выходом 60% согласно процедуре, сходной с процедурой, описанной в примере 1 (I). 1(II) 3-Метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламинобензойная кислота. Это соединение получали из метил-3 метокси-4-N-[2-(3-(S)-метоксиметоксипирро-лидин-1-ил)-1-(S)-фенилэтил]-Nметиламино бензоата с выходом 100% согласно процедуре, сходной с процедурой,описанной в примере 1 (II). 1(III) 3-Метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамид. Это соединение получали из 3 метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламинобензойной кислоты и н-пропиламина с выходом 64% согласно процедуре, сходной с процедурой, описанной в примере 1(3 Н, м), 0,99 (3 Н, т, J=7,3 Гц). Пример 28. Получение 4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-3-метокси-N'-пропилбензамида. Это соединение получали из 3 метокси-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилбензамида с выходом 77% согласно процедуре, сходной с процедурой, описанной в примере 2. 1 Н-ЯМР (270 МГц, свободный амин,CDCl3)7,48 (1H, д, J=2,2 Гц), 7,37-7,22(I) 3-Xлop-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламинобензонитрил. К перемешиваемому раствору смеси 2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтанола и 2-(3-(S)-метоксиметоксипирролидин-1-ил)-2-(R)-фенилэтанола (251 мг, 1,00 ммоль) и триэтиламина (0,167 мл, 1,20 ммоль) в CH2Cl2 (4 мл) добавляли метансульфонилхлорид (0,093 мл, 1,20 ммоль) по каплям при 0 С (баня со льдом). После перемешивания в течение 15,5 ч при комнатной температуре реакционную смесь промывали насыщенным водным раствором NаНСО 3, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 238 мг коричневого вязкого масла-(I). К суспензии NaH(48 мг, 1,20 ммоль) в N,N-диметилформамиде (2 мл) добавляли раствор 3 хлор-4-метиламинобензонитрила (200 мг,1,20 ммоль) при комнатной температуре. После перемешивания в течение 45 мин к этой смеси добавляли раствор вышеупомянутого коричневого вязкого масла-(I) в N,Nдиметилформамиде (2 мл) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 4,5 ч. К этой смеси добавляли Н 2 О, подщелачивали 25% NH4OH и экстрагировали CH2Cl2. Экстракт промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением коричневого масла, 001341 56 которое очищали колоночной хроматографией (силикагель: 20 г, СН 2 Сl2/МеОН: 100/1-50/1) с получением 244 мг (61%) коричневого масла. 1(II) 3-Хлор-4-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламино-N'-пропилбензамид. К суспензии t-BuOK (381 мг, 3,05 ммоль) и Н 2 О (0,055 мл, 3,05 ммоль) в tBuOH (1,0 мл) добавляли раствор 3-хлор-4N-[2-(3-(S)-метоксиметоксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламинобензонитрила (244 мг, 0,611 ммоль) в t-BuOH (1,0 мл) при комнатной температуре. После нагревания с обратным холодильником в течение 0,5 ч смеси давали остыть до комнатной температуры. К смеси добавляли нпропилиодид (0,298 мл, 3,05 ммоль) и смесь нагревали с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры растворитель выпаривали. Остаток растворяли в CH2Cl2 и промывали водой, насыщенным солевым раствором,сушили (Na2SO4) и концентрировали с получением бледно-коричневого масла, которое очищали колоночной хроматографией(силикагель: 15 г, CH2Cl2/MeOH: 80/1-50/1) с получением 206 мг (73%) аморфного вещества цвета слоновой кости. 1H-ЯМР (270 МГц, СDСl3)7,77 (1 Н,д, J=2,2 Гц), 7,52 (1 Н, дд, J=2,2, 8,4 Гц),7,36-7,20 (5 Н, м), 6,92 (1 Н, д, J=8,4 Гц),6,15-6,00 (1 Н, м), 4,91 (1H, дд, J=7,3, 7,7 Гц),4,57 (1 Н, д, J=7,0 Гц), 4,53 (1H, д, J=7,0 Гц),4,10-3,98 (1H, м), 3,45-3,35 (2 Н, м), 3,29 (3 Н,с), 3,14 (1H, дд, J=7,7, 12,5 Гц), 3,05 (1H, дд,J=7,3, 12,5 Гц), 2,73 (1H, дд, J=6,2, 9,9 Гц),2,64 (3 Н, с), 2,55-2,43 (3 Н, м), 2,05-1,88 (1H,м), 1,75-1,55 (3 Н, м), 0,96 (3 Н, т, J=7,3 Гц). Пример 30. Получение 3-хлор-4-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]N-метиламино-N'-пропилбензамида. Это соединение получали из 3-хлор-4N-[2-(3-(S)-метоксиметоксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламино-N'пропилбензамида с выходом 96% согласно процедуре, сходной с процедурой, описанной в примере 2. 1(I) Метил 6-N-[2-(3-(S)-метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-Nметиламиноникотинат. Это соединение получали из 2-(3-(S)метоксиметоксипирролидин-1-ил)-1-(S)фенилэтанола и 2-(3-(S)-метоксиметоксипирролидин-1-ил)-2-(R)-фенилэтанола метил-6-метиламиноникотината с выходом 60% согласно процедуре, сходной с процедурой, описанной в примере 29 (I). 1(II) 6-N-[2-(3-(S)-Метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино никотиновая кислота. Это соединение получали из метил-6N-[2-(3-(S)-метоксиметоксипирролидин-1 ил)-1-(S)-фенилэтил]-N-метиламиноникотината с выходом 100% согласно процедуре, сходной с процедурой, описанной в примере 1 (II). 1(Ill) 6-N-[2-(3-(S)-Метоксиметоксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилникотинамид. Это соединение получали из 6-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламиноникотиновой кислоты и н-пропиламина с выходом 65% согласно процедуре, сходной с процедурой, описанной в примере 1 (III).(3 Н, м), 0,99 (3 Н, т, J=7,3 Гц). Пример 32. Получение 6-N-[2-(3-(S)-гидроксипирролидин-1-ил)-1-(S)-фенилэтил]-N-метиламино-N'-пропилникотинамида. Это соединение получали из 6-N-[2(3-(S)-метоксиметоксипирролидин-1-ил)-1(S)-фенилэтил]-N-метиламино-N'-пропилникотинамида с выходом 73% согласно процедуре, сходной с процедурой, описанной в примере 2. 1(I) Метил-4-N-[1-(S)-(3-метоксиметоксифенил)-2-(3-(S)метоксиметоксипирролидин-1-ил)этил]-N-метиламинобензоат. Это соединение получали из смеси 2(R)-(3-метоксиметоксифенил)-2-(3-(S)-метоксиметоксипирролидин-1-ил)этанола и 1(S)-(3-метоксиметоксифенил)-2-(3-(S)метоксиметоксипирролидин-1-ил)этанола и метил-4-метиламинобензоата с выходом 60% согласно процедуре, сходной с процедурой,описанной в примере 1 (I). 1(II) 4-N-[1-(S)-(3-Метоксиметоксифенил)-2-(3-(S)-метоксиметоксипирролидин-1-ил)этил]-N-метиламинобензойная кислота. Это соединение получали из метил-4N-[1-(S)-(3)-метоксиметоксифенил)-2-(3(S)-метоксиметоксипирролидин-1-ил)этил]N-метиламино бензоата с выходом 100% согласно процедуре, сходной с процедурой,описанной в примере 1 (II). 1(III) 4-N-[1-(S)-(3-Метоксиметоксифенил)-2-(3-(S)-метоксиметоксипирролидин-1 ил)этил]-N-метиламино-N'-пропилбензамид. Это соединение получали из 4-N-[1(S)-(3-метоксиметоксифенил)-2-(3-(S)метоксиметоксипирролидин-1-ил)этил]-Nметиламинобензойной кислоты и нпропиламина с выходом 80% согласно процедуре, сходной с процедурой, описанной в примере 1 (III). 1(1H, д, 6,6 Гц), 4,55 (1H, д, J=7,0 Гц), 4,224,12 (1H, м), 3,46 (3 Н, с), 3,45-3,35 (2 Н, м),3,30 (3 Н, с), 3,03 (2 Н, д, J=7,7 Гц), 2,86 (3 Н,с), 2,85-2,80 (1H, м), 2,75-2,50 (3 Н, м), 2,121,95 (1H, м), 1,85-1,52 (3 Н, м), 0,97 (3 Н, т,J=7,3 Гц). Пример 34. Получение 4-N-[1-(S)-(3-гидроксифенил)-2-(3-(S)-гидроксипирролидин-1-ил) этил]-N-метиламино-N'-пропилбензамида. Это соединение получали из 4-N-[1(S)-(3-метоксиметоксифенил)-2-(3-(S)метоксиметоксипирролидин-1-ил)этил]-Nметиламино-N'-пропилбензамида с выходом 97% согласно процедуре, сходной с процедурой, описанной в примере 2. 1CH2Cl2 (0,6 мл) при комнатной температуре. После перемешивания в течение 22 ч при комнатной температуре к этой смеси добавляли 25% NH4OH и экстрагировали CH2Cl2. Экстракт промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением коричневого масла,которое очищали колоночной хроматографией (силикагель: 5 г, CH2Cl2/MeOH: 30/110/1) с получением 55,2 мг (53%) белого аморфного вещества. 1(0,0409 мл, 0,277 ммоль) и К 2 СО 3 (38,3 мг,0,277 ммоль) в ДМФ (1,5 мл) перемешивали при комнатной температуре в течение 2 ч. К смеси добавляли H2O и экстрагировали смесью АсОЕt/толуол=2/1. Экстракт промывали водой, насыщенным солевым раствором,сушили (Na2SO4) и концентрировали с получением бледно-коричневого аморфного вещества, которое очищали колоночной хроматографией
МПК / Метки
МПК: C07D 207/12, C07C 237/30, A61K 31/40, A61P 25/04
Метки: пирролинилэтиламина, k-рецептора, соединения, агонистов, пирролидинил, качестве
Код ссылки
<a href="https://eas.patents.su/30-1341-soedineniya-pirrolidinil-i-pirroliniletilamina-v-kachestve-agonistov-k-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения пирролидинил- и пирролинилэтиламина в качестве агонистов k-рецептора</a>
Предыдущий патент: Способ производства стали в электрической печи при заливке в нее расплавленного передельного чугуна
Следующий патент: Система вызова конференц-связи и способ создания канала беспроводной связи
Случайный патент: Блок воздушного насоса для вентилируемой обуви


































