Синтетические молекулярные конструкции
Номер патента: 13183
Опубликовано: 26.02.2010
Авторы: Корчагина Елена, Генри Стивен, Гилливер Лисса, Бовин Николай
Формула / Реферат
1. Водорастворимая синтетическая молекулярная конструкция структуры
F-S1-S2-L,
где F выбран из группы, состоящей из углеводов;
S1-S2 представляет собой спейсер, связывающий F с L;
L представляет собой липид, выбранный из группы, состоящей из диацил- и диалкилглицеролипидов, включая глицерофосфолипиды; и
F, S1, S2, L ковалентно связаны.
2. Синтетическая молекулярная конструкция по п.1, где L представляет собой липид, выбранный из группы, состоящей из диацилглицеролипидов.
3. Синтетическая молекулярная конструкция по п.2, где L выбран из группы, состоящей из фосфатидата, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозита, фосфатидилглицерина, полученных из одной или нескольких кислот транс-3-гексадеценовой кислоты, цис-5-гексадеценовой кислоты, цис-7-гексадеценовой кислоты, цис-9-гексадеценовой кислоты, цис-6-октадеценовой кислоты, цис-9-октадеценовой кислоты, транс-9-октадеценовой кислоты, транс-11-октадеценовой кислоты, цис-11-октадеценовой кислоты, цис-11-эйкозеновой кислоты или цис-13-докозеновой кислоты.
4. Синтетическая молекулярная конструкция по п.3, где липид получен из одной или нескольких цис-дезтауратированных жирных кислот.
5. Синтетическая молекулярная конструкция по п.1, где L выбран из группы, состоящей из 1,2-O-диолеоил-sn-глицеро-3-фосфатидилэтаноламина (DOPE) и 1,2-О-дистеарил-sn-глицеро-3-фосфатидилэтаноламина (DSPE).
6. Синтетическая молекулярная конструкция по любому из пп.1-5, где L представляет собой глицерофосфолипид, и синтетическая молекулярная конструкция включает в себя субструктуру
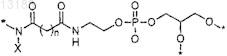
где n равно 3-5, X представляет собой Н или С и * представляет собой остаток, другой, чем Н.
7. Синтетическая молекулярная конструкция по п.6, где n равно 3.
8. Синтетическая молекулярная конструкция по п.1, где синтетическая молекулярная конструкция спонтанно включается в липидный бислой, когда раствор синтетической молекулярной конструкции контактирует с липидным бислоем.
9. Синтетическая молекулярная конструкция по п.8, где синтетическая молекулярная конструкция стабильно включается в липидный бислой.
10. Синтетическая молекулярная конструкция по любому из пп.1-9, где F выбран из группы, состоящей из синтетических гликотопов.
11. Синтетическая молекулярная конструкция по п.10, где F представляет собой синтетический гликотоп, состоящий из трех (трисахарид) или более звеньев сахаров.
12. Синтетическая молекулярная конструкция по п.1, где F представляет собой гликотоп, выбранный из группы, состоящей из ряда олигосахаридов лактонеотетраозила, лактотетраозила, лактоноргексаозила, лактоизооктаозила, глоботетраозила, глобонеотетраозила, глобопентаозила, ганглиотетраозила, ганглиотриаозила, ганглиопентаозила, изоглоботриаозила, изоглоботетраозила, мукотриаозила и мусотетраозила.
13. Синтетическая молекулярная конструкция по п.12, где F выбран из группы гликотопов, включающих в себя концевые сахара
![]()

14. Синтетическая молекулярная конструкция по любому из пп.1-13, где, когда F представляет собой гликотоп, L представляет собой глицерофосфолипид и S2 выбран из группы, включающей в себя -СО(СН2)3СО-,
-СО(СН2)4СО- (адипат), -СО(СН2)5СО- и -CO(CH2)5NHCO(CH2)5CO-.
15. Синтетическая молекулярная конструкция по любому из пп.1-14, где S1 представляет собой С3-5аминоалкил, выбранный из группы, состоящей из 3-аминопропила, 4-аминобутила или 5-аминопентила.
16. Синтетическая молекулярная конструкция по п.15, где S1представляет собой 3-аминопропил.
17. Синтетическая молекулярная конструкция по п.14, имеющая структуру
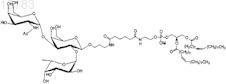
обозначенную Атри-sp-Ad-DOPE (I), и М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.
18. Синтетическая молекулярная конструкция, имеющая структуру
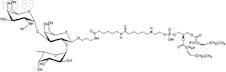
обозначенную Атри-spsp1-Ad-DOPE (II), и М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.
19. Синтетическая молекулярная конструкция, имеющая структуру
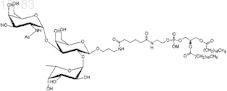
обозначенную Атри-sp-Ad-DSPE (III), и М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.
20. Синтетическая молекулярная конструкция, имеющая структуру
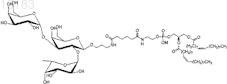
обозначенную Втри-sp-Ad-DOPE (VI), и М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.
21. Синтетическая молекулярная конструкция, имеющая структуру
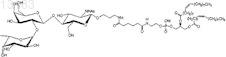
обозначенную Нтри-sp-Ad-DOPE (VII), и М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.
22. Синтетическая молекулярная конструкция, имеющая структуру
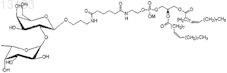
обозначенную Нди-sp-Ad-DOPE (VIII), и М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.
23. Синтетическая молекулярная конструкция, имеющая структуру
![]()
обозначенную Galb1-sp-Ad-DOPE (IX), и М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.
24. Синтетическая молекулярная конструкция, имеющая структуру
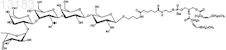
обозначенную Fucal-2Galb1-3GlcNAcb1-3Galb1-4GlcNAc-sp-Ad-DOPE (XII), и М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.
25. Синтетическая молекулярная конструкция, имеющая структуру
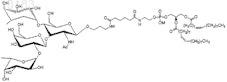
обозначенную Fucal-2Galb1-3(Fuca1-4)GlcNAc-sp-Ad-DOPE (XIII), и М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.
26. Способ получения водорастворимой синтетической молекулярной конструкции структуры F-S1-S2-L, включающий в себя следующие стадии:
реакцию активатора (А) с липидом (L) с образованием активированного липида (A-L);
дериватизацию антигена (F) с получением дериватизированного антигена (F-S1) и
конденсацию A-L с F-S1 с получением конструкции, в которой
А представляет собой активатор, выбранный из группы, включающей в себя бис-(N-гидроксисукцинимидил), бис-(4-нитрофенил), бис-(пентафторфенил), бис-(пентахлорфениловые) эфиры карбодиовых кислот (С3-С7);
L представляет собой липид, выбранный из группы, состоящей из диацил- и диалкилглицеролипидов, включающих в себя глицерофосфолипиды;
F выбран из группы, состоящей из углеводов;
S1-S2 представляет собой спейсер, связывающий F с L, где S1 выбран из группы, включающей в себя первичный аминоалкил, вторичный алифатический аминоалкил или первичный ароматический амин, и S2 отсутствует или выбран из группы, включающей в себя -СО(СН2)3СО-, -СО(СН2)4СО- (адипат) и -СО(СН2)5СО-; и
F, S1, S2 и L ковалентно связаны.
27. Способ по п.26, где L представляет собой липид, выбранный из группы, состоящей из диацилглицеролипидов.
28. Способ по п.27, где L выбран из группы, состоящей из фосфатидата, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозита, фосфатидилглицерина, полученных из одной или нескольких кислот транс-3-гексадеценовой кислоты, цис-5-гексадеценовой кислоты, цис-7-гексадеценовой кислоты, цис-9-гексадеценовой кислоты, цис-6-октадеценовой кислоты, цис-9-октадеценовой кислоты, транс-9-октадеценовой кислоты, транс-11-октадеценовой кислоты, цис-11-октадеценовой кислоты, цис-11-эйкозеновой кислоты или цис-13-докозеновой кислоты.
29. Способ по п.28, где липид получен из одной или нескольких цис-дезтауратированных жирных кислот.
30. Способ по п.26, где L выбран из группы, состоящей из 1,2-O-диолеоил-sn-глицеро-3-фосфатидилэтаноламина (DOPE) и 1,2-О-дистеарил-sn-глицеро-3-фосфатидилэтаноламина (DSPE).
31. Способ по любому из пп.26-30, где L представляет собой глицерофосфолипид и синтетическая молекулярная конструкция включает в себя субструктуру

где n равно 3-5, X представляет собой Н или С и * представляет собой остаток, другой, чем Н.
32. Способ по п.31, где n равно 3.
33. Способ по любому из пп.26-32, где F представляет собой синтетический гликотоп.
34. Способ по п.33, где F представляет собой синтетический гликотоп, состоящий из трех (трисахарид) или более звеньев сахаров.
35. Способ по п.26, где F представляет собой гликотоп, выбранный из группы, состоящей из ряда олигосахаридов лактонеотетраозила, лактотетраозила, лактоноргексаозила, лактоизооктаозила, глоботетраозила, глобонеотетраозила, глобопентаозила, ганглиотетраозила, ганглиотриаозила, ганглиопентаозила, изоглоботриаозила, изоглоботетраозила, мукотриаозила и мусотетраозила.
36. Способ по п.35, где F выбран из группы гликотопов, включающих в себя концевые сахара
![]()

37. Способ по любому из пп.26-36, где, S2 выбран из группы, включающей в себя -СО(СН2)3СО-, -СО(СН2)4СО- (адипат), -СО(СН2)5СО- и CO(CH2)5NHCO(CH2)5CO-.
38. Способ по любому из пп.26-37, где S1 представляет собой С3-5аминоалкил, выбранный из группы, состоящей из 3-аминопропила, 4-аминобутила или 5-аминопентила.
39. Способ по п.38, где S1 представляет собой 3-аминопропил.
40. Водорастворимая синтетическая молекулярная конструкция, полученная способом по любому из пп.26-39.
41. Способ осуществления качественных и/или количественных изменений в поверхностных антигенах, экспрессируемых клеточной или поликлеточной структурой, включающий стадию контактирования суспензии клеточной или поликлеточной структуры с водорастворимой синтетической молекулярной конструкцией по любому из пп.1-25 или 40 в течение времени и при температуре, достаточных для осуществления качественного и/или количественного изменения в поверхностных антигенах, экспрессированных клеточной или поликлеточной структурой.
42. Способ по п.41, где клеточная или поликлеточная структура является структурой человеческого или мышиного происхождения.
43. Способ по п.41 или 42, где концентрация водорастворимой синтетической молекулярной конструкции в суспензии находится в диапазоне 0,1-10 мг/мл.
44. Способ по любому из пп.41-43, где суспензию клеточной или поликлеточной структуры контактируют с водорастворимой синтетической молекулярной конструкцией при температуре в диапазоне 2-37°С.
45. Способ по п.44, где суспензию клеточной или поликлеточной структуры контактируют с раствором водорастворимого синтетического мембранного якоря или водорастворимой синтетической молекулярной конструкции при температуре в диапазоне 2-25°С.
46. Способ по п.45, где суспензию клеточной или поликлеточной структуры контактируют с раствором водорастворимого синтетического мембранного якоря или водорастворимой синтетической молекулярной конструкции при температуре в диапазоне 2-4°С.
47. Способ по любому из пп.41-46, где F выбран из группы гликотопов, включающих в себя концевые сахара
![]()

48. Способ по п.47, где F выбран из группы гликотопов, состоящей из олигосахаридов GalNAca1-3(Fuca1-2)Galbи Gala1-3(Fuca1-2)Galb.
49. Способ по п.41, где синтетическая молекулярная конструкция выбрана из группы, включающей в себя
![]()
![]()
50. Способ по п.41, где клеточной или поликлеточной структурой является эмбрион.
51. Способ по п.50, где F представляет собой молекулу присоединения, где молекула присоединения имеет аффинность для компонента, экспрессированного на эпитеальных клетках или внеклеточной матрице эндометрия.
52. Способ по п.51, где компонент, экспрессированный на эпитеальных клетках или внеклеточной матрице эндометрия, может быть экспрессированным в природе компонентом или экзогенно включенным компонентом.
53. Способ по п.41, где клеточной или поликлеточной структурой является эритроцит.
54. Способ по п.53, где F представляет собой лиганд для связывания молекулы, когда присутствие связывающей молекулы является диагностическим для патологического состояния.
55. Способ по п.54, где F представляет собой лиганд для антитела (иммуноглобулина).
56. Клеточная или поликлеточная структура, включающая водорастворимую синтетическую молекулярную конструкцию по любому из пп.1-25 или 40.
57. Клеточная или поликлеточная структура по п.56, где клеточная или поликлеточная структура имеет человеческое или мышиное происхождение.
58. Клеточная или поликлеточная структура по п.56 или 57, где клеточной или поликлеточной структурой является эритроцит, включающий водорастворимую синтетическую молекулярную конструкцию, выбранную из группы, включающей в себя
![]()
![]()
59. Клеточная или поликлеточная структура по п.56 или 57, где клеточной или поликлеточной структурой является эмбрион, включающий водорастворимую синтетическую молекулярную конструкцию, выбранную из группы, включающей в себя
![]()
60. Набор, включающий в себя высушенный препарат или раствор водорастворимой синтетической молекулярной конструкции по любому из пп.1-25 или 40.
61. Набор по п.60, где водорастворимая синтетическая молекулярная конструкция по любому из пп.1-25 или 40 выбрана из группы, состоящей из
![]()
![]()
62. Набор, включающий в себя суспензию в суспендирующем растворе клеток или поликлеточных структур по любому из пп.56-59.
63. Набор по п.62, где суспендирующий раствор, по существу, не содержит липид.
64. Набор по п.62 или 63, где клеточная или поликлеточная структура имеет человеческое или мышиное происхождение.
65. Набор по любому из пп.62-64, где клетками являются эритроциты, которые в природе не экспрессируют А- или В-антиген и включают в себя водорастворимую синтетическую молекулярную конструкцию, выбранную из группы, состоящей из
![]()
![]()
66. Набор по п.62, где суспендирующий раствор дополнительно содержит одно или несколько антител.
67. Набор по п.62, где клетки являются контролями чувствительности.
68. Фармацевтический препарат, включающий в себя высушенный препарат или раствор водорастворимой синтетической молекулярной конструкции по любому из пп.1-25 или 40.
69. Фармацевтический препарат по п.68, где фармацевтический препарат находится в форме для введения ингаляцией.
70. Фармацевтический препарат по п.68, где фармацевтический препарат находится в форме для введения инъекцией.
71. Фармацевтический препарат, включающий в себя клетки или поликлеточные структуры по любому из пп.56-59.
72. Фармацевтический препарат по п.71, где клетки или поликлеточные структуры имеют человеческое происхождение.
73. Фармацевтический препарат по п.71 или 72, где фармацевтический препарат находится в форме для введения ингаляцией.
74. Фармацевтический препарат по п.71 или 72, где фармацевтический препарат находится в форме для введения инъекцией.
Текст
013183 Область техники, к которой относится изобретение Изобретение относится к синтетическим молекулам, которые самопроизвольно и стабильно включаются в липидные бислои, включающие клеточные мембраны. В частности, хотя и не исключительно,изобретение относится к применению этих молекул в качестве синтетических мембранных якорей или синтетических молекулярных конструкций для осуществления качественных и количественных изменений в экспрессии антигенов клеточной поверхности. Уровень техники Антигены клеточной поверхности опосредуют ряд взаимодействий между клетками и их окружающей средой. Эти взаимодействия включают в себя взаимодействие клетка-клетка, взаимодействия клетка-поверхность и взаимодействия клетка-растворенное вещество. Антигены клеточной поверхности опосредуют также внутриклеточную передачу сигнала. Клетки характеризуются качественными и количественными различиями в экспрессированных антигенах клеточной поверхности. Качественные и количественные различия в экспрессированных антигенах клеточной поверхности изменяют как функцию клетки (способ действия), так и функциональность клетки (оказываемое действие). Способность осуществлять качественные и/или количественные изменения в антигенах клеточной поверхности, экспрессированных клетками, имеет диагностическую и терапевтическую ценность. Трансгенные и нетрансгенные методы осуществления качественных и количественных изменений в поверхностных антигенах, экспрессированных клеткой, являются известными. Окрашивание белка является нетрансгенным методом осуществления качественных и количественных изменений в поверхностных антигенах, экспрессированных клеткой. Этот метод использует способность GPI-связанных белков спонтанно прикрепляться к клеточной мембране через их липидные хвосты. Метод, изложенный в описании, сопровождающем международную патентную заявкуPCT/US 98/15124 (WO 99/05255), включает в себя стадию встраивания GPI-связанного белка, выделенного из биологического источника, в мембрану. Выделенные GPI-прикрепленные белки указываются как обладающие необычной способностью реинтегрироваться с мембраной поверхности клетки. Клетки существуют в водной окружающей среде. Клеточная мембрана является липидным бислоем,который служит в качестве полупроницаемого барьера между цитоплазмой клетки и этой водной окружающей средой. Локализацию антигенов на клеточной поверхности можно также достичь посредством применения гликолипидов в качестве мембранных якорей. Способ, изложенный в описании, сопровождающем международную патентную заявкуPCT/NZ 02/00214 (WO 93/034074), включает в себя стадию встраивания регулируемого количества гликолипида в мембрану. Количество встроенного гликолипида регулируют для обеспечения клеток требуемым уровнем экспрессии антигена. Способ, изложенный в описании, сопровождающем международную патентную заявкуPCT/NZ 03/00059 (WO 93/087346), включает в себя стадию встраивания модифицированного гликолипида в мембрану в качестве мембранного якоря. Модифицированный гликолипид обеспечивает локализацию антигенов на поверхности клетки или поликлеточной структуры. Тем самым клетке или поликлеточной структуре могут быть приданы новые характеристики. Эти методы обычно включают в себя выделение гликолипида или связанного с гликолипидом антигена из биологического источника. Выделение гликолипидов или связанных с гликолипидом антигенов из биологических источников является дорогим, изменяемые и поддающиеся выделению количества их часто ограничены. Терапевтическое применение получаемых из зоологических источников реагентов является особенно проблематичным, особенно, когда реагент или его продукты-производные нужно ввести субъекту, являющемуся человеком. Предпочтительными являются синтетические молекулы, для которых риск загрязнения зоопатогенными агентами может быть исключен. Описаны синтетические аналоги для существующих в природе гликолипидов и синтетических неогликолипидов. Однако синтетический гликолипид, который нужно применять в качестве мембранного якоря, должен быть способен спонтанно и стабильно включаться в липидный бислой из водной окружающей среды. Полезность синтетических гликолипидов в диагностических или терапевтических применениях дополнительно ограничивается теми синтетическими гликолипидами, которые могут образовывать раствор в солевом растворе. Органические растворители и/или поверхностно-активные вещества, применяемые для облегчения растворения гликолипидов в солевом растворе, должны быть биосовместимыми. Растворители и поверхностно-активные вещества часто должны быть исключены или быстро удалены, так как они могут быть вредными для некоторых клеточных мембран. Удаление растворителей или поверхностно-активных веществ из таких препаратов может быть проблематичным. Повреждение клеточных мембран должно быть исключено, особенно, когда подача клеток или поликлеточных структур ограничена, например эмбрионов, или клетки являются особенно восприимчивыми к нарушению, например гепатоциты. Здесь существует потребность в водорастворимых синтетических молекулах, которые являются функционально эквивалентными существующим в природе гликолипидам и связанных с гликолипидами-1 013183 антигенам в отношении их способности спонтанно и стабильно включаться в липидные бислои, включая клеточные мембраны. Обеспечение такими синтетическими молекулами может устранить ограничения гликолипидов и связанных с гликолипидами антигенов, выделенных из биологических источников, и облегчить их способность осуществлять качественные и/или количественные изменения в поверхностных антигенах, экспрессированных клеткой. Задачей данного изобретения является обеспечение таких синтетических молекул и метода для их получения. Следующей задачей данного изобретения является предоставление синтетических молекул для применения в диагностических и терапевтических применениях. Предшествующие задачи должны быть истолкованы отдельно от настоящей задачи, чтобы, по меньшей мере, обеспечить общественность полезным выбором. Сущность изобретения В первом аспекте изобретение заключается в применении молекулы структуры R-S2-L в качестве синтетического мембранного якоря или при получении синтетических молекулярных конструкций, гдеR представляет собой химически реакционноспособную функциональную группу;L - липид, выбранный из группы, состоящей из диацил- и диалкилглицеролипидов, включающих в себя глицерофосфолипиды и полученных из сфингозина диацил- и диалкиллипидов, включающих церамид. Предпочтительно R выбран из группы, включающей в себя бис-(N-гидроксисукцинимидил), бис-(4 нитрофенил), бис-(пентафторфенил), бис-(пентахлорфенил). Предпочтительно S2 выбран из группы, включающей в себя -СО(СН 2)3 СО-, -СО(СН 2)4 СО- (адипат(Ad и -СО(СН 2)5 СО-. Предпочтительно R и S2 являются связанными сложноэфирными связями. Предпочтительно L представляет собой липид, выбранный из группы, включающей в себя диацили диалкилглицеролипиды, включая глицерофосфолипиды. Более предпочтительно L выбран из группы,состоящей из диацилглицеролипидов, фосфатидата, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозита, фосфатидилглицерина и дифосфатидилглицерина, полученного из одной или нескольких транс-2-гексадеценовой кислоты, цис-5-гексадеценовой кислоты, цис-7 гекадеценовой кислоты, цис-9-гексадеценовой кислоты, цис-6-октадеценовой кислоты, цис-9 октадеценовой кислоты, транс-9-октадеценовой кислоты, транс-11-октадеценовой кислоты, цис-11 октадеценовой кислоты, цис-11-эйкозеновой кислоты или цис-13-докозеновой кислоты. Более предпочтительно липид получен из одной или нескольких цис-дезтауратированных жирных кислот. Наиболее предпочтительноL выбран из группы,состоящей из 1,2-О-диолеоил-sn-глицеро-3 фосфатидилэтаноламина (DOPE), 1,2-О-дистеарил-sn-глицеро-3-фосфатидилэтаноламина (DSPE) и рац 1,2-диолеоилглицерина (DOG). Предпочтительно L представляет собой глицерофосфолипид, и молекула его включает в себя структуру где n равно 3-5 ипредставляет собой остаток, другой, чем Н. Предпочтительно n равно 3. В конкретных вариантах осуществления молекула имеет структуруM обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+.Bo втором аспекте изобретение заключается в синтетической молекулярной конструкции структуры F-S1-S2-L, гдеL представляет собой липид, выбранный из группы, состоящей из диацил- и диалкилглицеролипидов, включая глицерофосфолипиды, и полученных из сфингозина диацил- и диалкиллипидов, включая церамид. Предпочтительно молекула является водорастворимой. Предпочтительно молекула спонтанно включается в липидный бислой, когда раствор молекулы контактирует с липидным бислоем. Более предпочтительно молекула стабильно включается в липидный бислой. Предпочтительно F, S1, S2 и L ковалентно связаны. Предпочтительно F выбран из группы, состоящей из существующих в природе или синтетических гликотопов, антител (иммуноглобулинов), лецитинов, авидинов и биотина. Наиболее предпочтительно F выбран из группы, состоящей из существующих в природе и синтетических гликотопов или антител(иммуноглобулинов). Предпочтительно L представляет собой липид, выбранный из группы, состоящей из диацил- и диалкилглицеролипидов, включающих в себя глицерофосфолипиды. Более предпочтительно L выбран из группы, состоящей из диацилглицеролипидов, фосфатидата, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозита, фосфатидилглицерина и дифосфатидилглицерина, полученных из одной или нескольких транс-2-гексадеценовой кислоты, цис-5-гексадеценовой кислоты, цис-7 гекадеценовой кислоты, цис-9-гексадеценовой кислоты, цис-6-октадеценовой кислоты, цис-9 октадеценовой кислоты, транс-9-октадеценовой кислоты, транс-11-октадеценовой кислоты, цис-11 октадеценовой кислоты, цис-11-эйкозеновой кислоты или цис-13-докозеновой кислоты. Более предпочтительно липид получен из одной или нескольких цис-дезтауратированных жирных кислот. Наиболее предпочтительноL выбран из группы,состоящей из 1,2-O-диолеоил-sn-глицеро-3 фосфатидилэтаноламина (DOPE), 1,2-О-дистеарил-sn-глицеро-3-фосфатидилэтаноламина (DSPE) и рац 1,2-диолеоилглицерина (DOG). Предпочтительно L представляет собой глицерофосфолипид и молекула его включает в себя субструктуруS1-S2 выбран так, чтобы образовывалась водорастворимая синтетическая молекулярная конструкция. В первом варианте осуществления F представляет собой существующий в природе или синтетический гликотоп. Предпочтительно F представляет собой существующий в природе или синтетический гликотоп, состоящий из трех (трисахарид) или более единиц сахаров. Более предпочтительно F представляет собой гликотоп, выбранный из группы, состоящей из ряда лактонеотетраозила, лактотетраозила,лактоноргексаозила, лактоизооктаозила, глоботетраозила, глобонеотетраозила, глобопентаозила, ганглиотетраозила, ганглиотриаозила, ганглиопентаозила, изоглоботриаозила, изоглоботетраозила, мукотриаозила и мусотетраозила олигосахаридов. Более предпочтительно F выбран из группы гликотопов,включающих в себя концевые сахара Когда F представляет собой гликотоп, L представляет собой глицерофосфолипид и S2 выбран из группы, включающей в себя -СО(СН 2)3 СО-, -СО(СН 2)4 СО- (адипат), -СО(СН 2)5 СО- иCO(CH2)5NHCO(CH2)5CO-, предпочтительно S1 представляет собой С 3-5 аминоалкил, выбранный из группы, состоящей из 3-аминопропила, 4-аминобутила или 5-аминопентила. Более предпочтительно S1 представляет собой 3-аминопропил. Во втором варианте осуществления F представляет собой молекулу, которая опосредует взаимодействие клетка-клетка или клетка-поверхность. Предпочтительно F представляет собой углевод, белок или липид с аффинностью для компонента, экспрессированного на являющейся целью клетке или поверхности. Более предпочтительно F имеет аффинность для компонента, экспрессированного на эпитеальных клетках или внеклеточных матрицах. Еще более предпочтительно F имеет аффинность для компонента,экспрессированного на эпитеальных клетках или внеклеточной матрице эндометрия. Наиболее предпочтительно компонент, экспрессируемый на эпитеальных клетках или внеклеточной матрице эндометрия,может быть экспрессируемым в природе компонентом или экзогенно включенным компонентом. В третьем варианте осуществления F представляет собой молекулу, которая опосредует взаимодействие клетка-растворенное вещество. Предпочтительно F представляет собой лиганд для связывания молекулы, когда присутствие связывающей молекулы является диагностическим для патологического состояния. Более предпочтительно F представляет собой лиганд для антитела (иммуноглобулина). В конкретных вариантах осуществления водорастворимая синтетическая молекулярная конструкция имеет структуру обозначенную Fuc1-2Gal1-3(Fuc1-4)GlcNAc-sp-Ad-DOPE (XIII). М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+. В третьем аспекте изобретение заключается в методе получения синтетической молекулярной кон-5 013183 струкции F-S1-S2-L, включающем в себя стадии: 1) реакцию активатора (А) с липидом (L) с образованием активированного липида (A-L); 2) дериватизацию антигена (F) для получения производного антигена (F-S1) и 3) конденсацию A-L с F-S1 для получения молекулы; в которой А представляет собой активатор, выбранный из группы, включающей в себя бис-(Nгидроксисукцинимидил), бис-(4-нитрофенил), бис-(пентафторфенил), бис-(пентахлорфениловые) эфиры карбодиовых кислот (С 3-С 7);L представляет собой липид, выбранный из группы, состоящей из диацил- и диалкилглицеролипидов, включающих в себя глицерофосфолипиды; и полученных из сфингозина диацил- и диалкиллипидов,включающих в себя церамид;S1-S2 представляет собой спейсер, связывающий F с L, где S1 выбран из группы, включающей в себя первичный аминоалкил, вторичный алифатический аминоалкил или первичный ароматический амин, иS2 отсутствует или выбран из группы, включающей в себя -СО(СН 2)3 СО-, -СО(СН 2)4 СО- (адипат) и-СО(СН 2)5 СО-. Предпочтительно молекула является водорастворимой. Предпочтительно молекула спонтанно включается в липидный бислой, когда раствор молекулы контактирует с липидным бислоем. Более предпочтительно молекула стабильно включается в липидный бислой. Предпочтительно F, S1, S2 и L являются ковалентно связанными. Предпочтительно F выбран из группы, состоящей из существующих в природе или синтетических гликотопов, антител (иммуноглобулинов), лецитинов, авидинов и биотина. Наиболее предпочтительно F выбран из группы, состоящей из существующих в природе или синтетических гликотопов или антител(иммуноглобулинов). Предпочтительно L представляет собой липид, выбранный из группы, состоящей из диацил- и диалкилглицеролипидов, включая глицерофосфолипиды. Более предпочтительно L выбран из группы, состоящей из диацилглицеролипидов, фосфатидата, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозита, фосфатидилглицерина и дифосфатидилглицерина, полученных из одной или нескольких кислот: транс-3-гексадеценовой кислоты, цис-5-гексадеценовой кислоты, цис-7 гекадеценовой кислоты, цис-9-гексадеценовой кислоты, цис-6-октадеценовой кислоты, цис-9 октадеценовой кислоты, транс-9-октадеценовой кислоты, транс-11-октадеценовой кислоты, цис-11 октадеценовой кислоты, цис-11-эйкозеновой кислоты или цис-13-докозеновой кислоты. Более предпочтительно липид получен из одной или нескольких цис-дезтауратированных жирных кислот. Наиболее предпочтительно L выбран из группы, состоящей из 1,2-O-диолеоил-sn-глицеро-3-фосфатидилэтаноламина (DOPE), 1,2-О-дистеарил-sn-глицеро-3-фосфатидилэтаноламина (DSPE) и рац-1,2 диолеоилглицерина (DOG). Предпочтительно L представляет собой глицерофосфолипид, и молекула его включает в себя структуру где n равно 3-5, X представляет собой Н или С ипредставляет собой остаток, другой, чем Н. Предпочтительно n равно 3. Предпочтительно A(R-S2) и S1 выбраны так, чтобы образовывалась водорастворимая синтетическая молекулярная конструкция. В первом варианте осуществления F представляет собой существующий в природе или синтетический гликотоп. Предпочтительно F представляет собой существующий в природе или синтетический гликотоп, состоящий из трех (трисахарид) или более звеньев сахаров. Более предпочтительно F представляет собой гликотоп, выбранный из группы, состоящей из ряда лактонеотетраозила, лактотетраозила,лактоноргексаозила, лактоизооктаозила, глоботераозила, глобонеотетраозила, глобопентаозила, ганглиотетраозила, ганглиотриаозила, ганглиопентаозила, изоглоботриаозила, изоглоботетраозила, мукотриаозила и мусотетраозила олигосахаридов. Наиболее предпочтительно F выбран из группы гликотопов,включающих в себя концевые сахара Когда F представляет собой гликотоп, L представляет собой глицерофосфолипид и S2 выбран из группы, включающей в себя -СО(СН 2)3 СО-, -СО(СН 2)4 СО- (адипат), -СО(СН 2)5 СО- (например, А представляет собой бис-(N-гидроксисукцинимидил)адипат), предпочтительно S1 представляет собой С 3-5 аминоалкил, выбранный из группы, состоящей из 3-аминопропила, 4-аминобутила или 5-аминопентила). Более предпочтительно S1 представляет собой 3-аминопропил. Во втором варианте осуществления F представляет собой молекулу, которая опосредует взаимодействие клетка-клетка или клетка-поверхность. Предпочтительно F представляет собой углевод, белок или липид с аффинностью для компонента, экспрессированного на являющейся целью клетке или поверхности. Более предпочтительно F имеет аффинность для компонента, экспрессированного на эпитеальных клетках или внеклеточных матрицах. Еще более предпочтительно F имеет аффинность для компонента,экспрессированного на эпитеальных клетках или внеклеточной матрице эндометрия. Наиболее предпочтительно компонент, экспрессируемый на эпитеальных клетках или внеклеточной матрице эндометрия,может быть экспрессируемым в природе компонентом или экзогенно включенным компонентом. В третьем варианте осуществления F представляет собой молекулу, которая опосредует взаимодействие клетка-растворенное вещество. Предпочтительно F представляет собой лиганд для связывания молекулы, когда присутствие связывающей молекулы является диагностическим для патологического состояния. Более предпочтительно F представляет собой лиганд для антитела (иммуноглобулина). В конкретных вариантах осуществления водорастворимая синтетическая молекулярная конструкция имеет структуру обозначенную Fuc1-2Gal1-3(Fuc1-4)GlcNAc-sp-Ad-DOPE (XIII). М обычно представляет собой Н, но может быть заменен другим одновалентным катионом, таким как Na+, K+ или NH4+. В четвертом аспекте изобретение относится к водорастворимой синтетической молекулярной кон-8 013183 струкции, полученной методом согласно третьему аспекту изобретения. В пятом аспекте изобретение относится к методу осуществления качественных и количественных изменений в поверхностных антигенах, экспрессируемых клеточной или поликлеточной структурой,включающему стадию 1) контактирования суспензии клеточной или поликлеточной структуры с синтетической молекулярной конструкцией согласно второму аспекту или четвертому аспекту изобретения в течение времени и при температуре, достаточных для осуществления качественного и/или количественного изменения в поверхностных антигенах, экспрессированных клеточной или поликлеточной структурой. Предпочтительно клеточная или поликлеточная структура является структурой человеческого или мышиного происхождения. Предпочтительно концентрация водорастворимой синтетической молекулярной конструкции в суспензии находится в диапазоне 0,1-10 мг/мл. Предпочтительно температура находится в диапазоне 2-37 С. Более предпочтительно температура находится в диапазоне 2-25 С. Наиболее предпочтительно температура находится в диапазоне 2-4 С. В первом варианте осуществления клеткой является эритроцит. В этом варианте осуществления предпочтительно F выбран из группы гликотопов, включающих в себя концевые сахара Предпочтительно синтетическая молекулярная конструкция выбрана из группы, включающей в себя Во втором варианте осуществления поликлеточной структурой является эмбрион. В этом варианте осуществления предпочтительно F представляет собой молекулу присоединения,где молекула присоединения имеет аффинность в отношении компонента, экспрессированного на эпитеальных клетках или внеклеточной матрице эндометрия. Компонентом, экспрессируемым на эпитеальных клетках или внеклеточной матрице эндотелия,может быть экспрессируемый в природе компонент или экзогенно включаемый компонент. Предпочтительно синтетическая молекулярная конструкция выбрана из группы, включающей в себя Третьим вариантом осуществления клетки является эритроцит. В этом варианте осуществления предпочтительно F представляет собой лиганд для молекулы связывания, где присутствие молекулы связывания является диагностическим для патологического состояния. Более предпочтительно F представляет собой лиганд для антитела (иммуноглобулина). В шестом аспекте изобретение заключается в клеточной или поликлеточной структуре, включающей в себя водорастворимую синтетическую молекулярную конструкцию согласно второму или четвертому аспекту изобретения. Предпочтительно клеточная или поликлеточная структура является структурой человеческого или мышиного происхождения. В первом варианте осуществления клеткой является эритроцит, включающий в себя водорастворимую синтетическую молекулярную конструкцию, выбранную из группы, включающей в себя Во втором варианте осуществления клеткой является эмбрион, включающий в себя водорастворимую синтетическую молекулярную конструкцию, выбранную из группы, состоящей из В седьмом аспекте изобретение заключается в наборе, включающем в себя высушенный препарат или раствор молекулы согласно первому аспекту изобретения, или высушенный препарат или раствор водорастворимой синтетической молекулярной конструкции согласно второму или четвертому аспекту изобретения. Предпочтительно молекула согласно первому аспекту изобретения выбрана из группы, состоящей из Ad-DOPE; sp1-Ad-DOPE и ad-DSPE. Предпочтительно водорастворимая синтетическая молекулярная конструкция согласно второму или четвертому аспекту изобретения выбрана из группы, состоящей из В восьмом аспекте изобретение заключается в наборе, включающем в себя суспензию в суспендирующем растворе клеток или поликлеточных структур согласно шестому аспекту изобретения. Предпочтительно суспендирующий раствор, по существу, не содержит липид. Предпочтительно клеточная или поликлеточная структура является структурой человеческого или мышиного происхождения. Предпочтительно клетки являются эритроцитами, которые в природе не экспрессируют А- или Вантиген и включают в себя водорастворимую синтетическую молекулярную конструкцию, выбранную из группы, состоящей из Более предпочтительно клетки являются контролями чувствительности. В девятом аспекте изобретение заключается в фармацевтическом препарате, включающем в себя высушенный препарат или раствор водорастворимой синтетической молекулярной конструкции согласно второму или пятому аспекту изобретения. Предпочтительно фармацевтический препарат находится в форме для введения ингаляцией. Предпочтительно фармацевтический препарат находится в форме для введения инъекцией. В десятом аспекте изобретение заключается в фармацевтическом препарате, включающем в себя клетки или поликлеточные структуры согласно шестому аспекту изобретения. Предпочтительно клетки или поликлеточные структуры имеют человеческое или мышиное происхождение. Предпочтительно фармацевтический препарат находится в форме для введения ингаляцией. Предпочтительно фармацевтический препарат находится в форме для введения инъекцией. Подробное описание Синтетические молекулярные конструкции изобретения спонтанно и стабильно включаются в липидный бислой, такой как мембрана, когда раствор молекулы контактируют с липидным бислоем. Без намерения быть связанным с теорией считают, что встраивание в мембрану липидных концов липида (L) термодинамически является предпочтительным. Считается, что последующее отделение диссоциацией синтетической молекулярной конструкции от липидной мембраны термодинамически не является предпочтительной. Неожиданным образом обнаружено, что синтетические молекулярные конструкции, идентифицированные здесь, являются водорастворимыми. Синтетические молекулярные конструкции применяют для трансформации клеток, что приводит к- 10013183 качественным и/или количественным изменениям в экспрессированных поверхностных антигенах. Должно быть понятно, что трансформация клеток согласно изобретению отличается от трансформации клеток генной инженерией. Изобретение обеспечивает фенотипическую трансформацию клеток без генетической трансформации. В контексте данного изобретения термин трансформация в отношении к клеткам применяют для указания на встраивание или включение в клеточную мембрану экзогенно полученных синтетических молекулярных конструкций, чтобы тем самым осуществить качественные и/или количественные изменения в клеточных поверхностных антигенах, экспрессированных клеткой. Синтетические молекулярные конструкции изобретения включают в себя антиген (F), связанный с липидной частью (или остатком) (L) через спейсер (S1-S2). Синтетические молекулярные конструкции можно получить конденсацией первичного аминоалкильного, вторичного алифатического аминоалкильного или первичного ароматического аминного производного антигена с активированным липидом. Описан обзор методов получения неогликоконъюгатов (Bovin, N. Biochem. Soc. Symp., 69, 143-160). Требуемую фенотипическую трансформацию можно достичь с применением синтетических молекулярных конструкций. Требуемую фенотипическую трансформацию можно достичь с применением синтетических молекулярных конструкций изобретения одностадийным методом или двухстадийным методом. В одностадийном методе водорастворимая синтетическая молекулярная конструкция (F-S1-S2-L) включает в себя поверхностный антиген в качестве F. В двухстадийном методе синтетическая молекулярная конструкция (F-S1-S2-L) включает в себя антиген (F), который служит в качестве функциональной группы, с которой поверхностный антиген может быть связан после встраивания синтетической молекулярной конструкции в мембрану. Функциональной группой может быть такая группа, как лецитин, авидин или биотин. При применении в двухстадийном методе синтетическая молекулярная конструкция действует в качестве синтетического мембранного якоря. Согласно изобретению первичный аминоалкил, вторичный алифатический аминоалкил или первичный ароматический амин и активатор липида выбирают для обеспечения образования синтетической молекулярной конструкции, которая является водорастворимой и будет спонтанно и стабильно включаться в липидный бислой, когда раствор синтетической молекулярной конструкции контактирует с липидным бислоем. В контексте данного изобретения термин водорастворимый означает, что образуется стабильная,однофазная система, когда синтетическую молекулярную конструкцию контактируют с водой или солевым раствором (таким как PBS) в отсутствие органических растворителей или поверхностно-активных веществ, и термин раствор имеет соответствующее значение. В контексте данного изобретения фраза стабильно включается означает, что синтетические молекулярные конструкции включаются в липидный бислой или мембрану с минимальным последующим обменом между липидным бислоем или мембраной и водной внешней окружающей средой липидного бислоя или мембраны. Выбор первичного аминоалкила, вторичного алифатического аминоалкила или первичного ароматического амина и активатора зависит от физико-химических свойств антигена (F), который нужно связать с липидом (L). Специалисту в данной области должно быть понятно, что для неспецифического взаимодействия,такого как взаимодействие между диацил- или диалкилглицеролипидом и мембраной, структурные изомеры и стереоизомеры существующих в природе липидов могут быть функционально эквивалентными. Например, авторами изобретения предполагается, что фосфатидат (3-фосфат диацилглицерина) может быть заменен 2-фосфатом диацилглицерина. Кроме того, авторами изобретения предполагается, что абсолютная конфигурация фосфатидата может быть либо R-, либо S-конфигурацией. Авторы изобретения определили, что для получения синтетических молекулярных конструкций изобретения, в которых антиген (F) представляет собой олигосахарид, выбранный из группы гликотопов для А-, В- и Н-антигенов групп крови АВО, первичный аминоалкил, вторичный алифатический аминоалкил или первичный ароматический амин и активатор должны быть выбраны так, чтобы обеспечить образование альтернативных структур S1-S2 для водорастворимой синтетической молекулярной конструкции (F-S1-S2-L), где F представляет собой углевод (или другой антиген) с одинаковыми физикохимическими свойствами с углеводной частью А-, В- или Н-антигенов групп крови АВО, и L представляет собой глицерофосфолипид, S1 выбран из -O(CH2)nNH- и S2 выбран из -O(CH2)nCO- или-CO(CH2)mNHCO(CH2)nCO- (n, m независимо равны 2-5). Специалисту в данной области должно быть понятно, что после того, как структура спейсера (S1-S2) определена для данного класса антигенов, такая же структура спейсера может быть принята для получения синтетических молекулярных конструкций других классов антигена с подобными физикохимическими свойствами. Например, структура спейсера для синтетических молекулярных конструкций (F-S1-S2-L), где F представляет собой гликотоп А-, В- или Н-антигенов групп крови АВО, может быть структурой спейсе- 11013183 ра, выбранного для получения синтетических молекулярных конструкций других антигенов с физикохимическими свойствами, подобными гликотопам А-, В- или Н-антигенов групп крови АВО. В принципе гликотопом широкого диапазона связанных с группой крови гликолипидов или гликопротеинов может быть антиген (F) синтетической молекулярной конструкции F-S1-S2-L, где S1-S2-L является идентичной или эквивалентной соответствующей части синтетических молекулярных конструкций,обозначенных Структуры известных связанных с группой крови гликолипидов и гликопротеинов (см. ссылки) представлены в нижеследующем перечне. Гликолипиды(В общем, почти для всех примеров А-антигенов концевой сахар А GalNAc может быть заменен сахаром В Gal. Кроме того, отсутствие либо А-, либо В-детерминанты создает эквивалентную детерминанту Н). Трисиалоилфоетальный антиген эритроцита (дисиалоильная группа на разветвлении) Монофукозилмоносиалилфоетальный антиген эритроцита (фукозилированная главная цепь)- 21013183 Монофукозилмоносиалилфоетальный антиген эритроцита (дисиалильная группа на разветвлении) Монофукозилдисиалилфоетальный антиген эритроцита (дисиалильная группа на разветвлении) Монофукозилмоносиалоильный антиген зрелого эритроцита Монофукозилмоносиалоильный антиген зрелого эритроцита- 22013183 Дифукозильный антиген зрелого эритроцита Специалисту должно быть понятно, что синтетические молекулярные конструкции (F-S1-S2-L) изобретения, где F представляет собой олигосахарид, можно применять в качестве синтетических гликолипидов и замещений для гликолипидов, полученных из биологических (ботанических и зоологических) источников. В контексте данного изобретения термин гликолипид означает липид, содержащий углевод амфипатического характера, включающий в себя гликозилированные глицеролипиды, такие как гликозилированные фосфоглицериды и гликозилглицериды; гликозилированные сфинголипиды (нейтральные гликолипиды), такие как гликозилцерамиды или цереброзиды; и ганглиозиды (кислотные гликолипиды). В контексте данного изобретения фраза связанный с гликолипидом антиген означает липид, содержащий углевод, в котором антиген (например, белок) связан с гликолипидом через углеводную часть молекулы. Примеры связанных с гликолипидом антигенов включают в себя GPl-связанные белки. Специалисту в данной области должно быть понятно, что гликолипид сам является антигеном. Термин и фраза гликолипид и связанный с гликолипидом антиген применяют для проведения различия между существующими в природе молекулами, у которых антигеном является гликолипид, и существующими в природе молекулами, у которых антиген связан с гликолипидом через углеводную часть гликолипида. По аналогии синтетические молекулярные конструкции изобретения могут быть описаны в качестве как синтетических гликолипидов, так и синтетических мембранных якорей до степени, при которой антигеном может быть синтетический гликолипид per se или антиген присоединен к синтетическому гликолипиду. Специалисту в данной области должно быть понятно, что углеводная часть гликолипида может быть модифицирована и связана с другими антигенами методами, изложенными в описании, сопровождающим международную патентную заявкуPCT/NZ 2003/00059 (опубликована как WO 03087346). В контексте данного описания изобретения термин гликотоп применяют для обозначения антигенной детерминанты, расположенной на углеводной части гликолипида. Классификация гликолипидных антигенов в серологии групп крови основана на структуре углеводной части гликолипида. В серологии групп крови известно, что концевыми сахарами гликотопов А-антигенов являютсяGalNAc1-3(Fuc1-2)Galp и концевыми сахарами гликотопов В-антигенов являются Gal1-3(Fuc12)Gal. Включение в мембрану RBC водорастворимых синтетических молекулярных конструкций изобретения, в которых F представляет собой GalNAc1-3(Fuc1-2)Gal или Gal1-3(Fuc1-2)Gal, даетRBC, которые являются серологически эквивалентными А-антигену или В-антигену, экспрессируемомуRBC, соответственно. Концевые три сахара углеводной части присутствующего в природе А- или В-антигена являются детерминантой определения групп крови А и В. Концевые четыре или пять сахаров углеводной части присутствующего в природе А- или В-антигена являются детерминантой подгрупп крови А типа 1 А и типа 2 А и т.д. Соответственно этому, RBC, включающие синтетические молекулярные конструкции изобретения, можно применять для характеризации и проведения различий между реагентами типирования крови (антителами) различной специфичности. Водорастворимые синтетические молекулярные конструкции изобретения, которые исключают углеводную часть, рассматриваются изобретением. Антигены, другие, чем углеводы или олигосахариды,но со сходными физико-химическими свойствами, могут заменять F в описанных синтетических гликолипидах. Синтетические молекулярные конструкции изобретения, которые включают в себя антиген F с физико-химическими свойствами, отличными от физико-химических свойств углеводов или олигосахаридов, также рассматриваются авторами изобретения. Водорастворимые синтетические молекулярные конструкции, включающие в себя эти антигены, можно получить выбором разных спейсеров. Преимущества, обеспечиваемые синтетическими молекулярными конструкциями данного изобретения, будут повышаться при применении на практике изобретений, изложенных в описаниях международных патентных заявокPCT/NZ 02/00212 (опубликована как WO 03/034074) и PCT/NZ 03/00059(опубликована как WO 03087346). Описания, сопровождающие эти заявки, включены здесь в качестве ссылки. Синтетические молекулярные конструкции преодолевают многие из ограничений применяемых- 23013183 природных гликолипидов на практике этих изобретений. Конкретным преимуществом синтетических молекулярных конструкций является их превосходящая активность и способности быть пригодными для применения при трансформации клеток при пониженных температурах, например 4 С. Как описано здесь, не все структуры спейсера (S1-S2) могут обеспечивать получение синтетической молекулярной конструкции (F-S1-S2-L), которая является водорастворимой и спонтанно и стабильно включается в липидный бислой, такой как клеточная мембрана. Обнаружено, что синтетические молекулярные конструкции, обозначенные Атри-sp-липид (IV) и Атри-PAA-DOPE (V), не являются водорастворимыми и/или не способны спонтанно и стабильно включаться в липидный бислой, такой как клеточная мембрана. обозначенная Атри-PAA-DOPE (V), где х, у = 0,05-0,2. Изобретение теперь будет иллюстрировано ссылкой на нижеследующие неограничивающие примеры и фигуры прилагаемых графических материалов. На фиг. 1 показаны результаты анализа Diamed сохраняемых в Cellstab клеток, трансформированных раствором природного гликолипида А для трансформации (L к R) при 10 мг/мл, 5 мг/мл, 2 мг/мл, 2 мг/мл и 1 мг/мл. Применяемыми антисыворотками являются албаклон (верх) и биоклон (низ). ( - раствор для трансформации (содержащий гликолипиды) не промывали после инкубации, его оставляли на ночь и промывали на следующий день (день 2. На фиг. 2 показаны результаты анализа Diamed сохраняемых в Cellstab клеток, трансформированных раствором природного гликолипида В для трансформации (L к R) при 10 мг/мл, 5 мг/мл, 2 мг/мл, 2 мг/мл и 1 мг/мл. Применяемыми антисыворотками являются албаклон (верх) и биоклон (низ). ( - раствор для трансформации (содержащий гликолипиды) не промывали после инкубации, его оставляли на ночь и промывали на следующий день (день 2. На фиг. 3 показан анализ FACS после трансформации in vitro Le(a-b)-эритроцитов человека природным Leb-6-гликолипидом на протяжении времени при трех температурах трансформации, 37 С(верх), 22 С (середина) и 4 С (низ). На фиг. 4 показаны результаты анализа Diamed клеток, трансформированных при 4 С раствором для трансформации Атри-sp-Ad-DOPE (I) (L к R (слева направо: промытые, 0,08 мг/мл; не промытые,0,08 мг/мл; промытые, 0,05 мг/мл; не промытые, 0,05 мг/мл; промытые, 0,03 мг/мл и не промытые, 0,03 мг/мл. Применяемой антисывороткой был биоклон анти-А. На фиг. 5 показаны клетки, которые уже не промывали перед испытанием. Результаты Diamed анализа клеток, трансформированных при 4 С раствором трансформации Атри-sp-Ad-DOPE (I) (L к R): 0,08,0,05 и 0,03 мг/мл. Применяемой антисывороткой был биоклон анти-А. На фиг. 6 в левом столбце показаны результаты Diamed анализа клеток, трансформированных при 4 С раствором трансформации Втри-sp-Ad-DOPE (VI) (L к R): промытые, 0,6 мг/мл; не промытые, 0,6- 24013183 мг/мл; промытые, 0,3 мг/мл; не промытые, 0,3 мг/мл; промытые, 0,15 мг/мл и не промытые, 0,15 мг/мл; в правом столбце показаны результаты Diamed анализа клеток, трансформированных при 4 С раствором трансформации Втри-sp-Ad-DOPE (VI) (L к R): промытые, 0,08 мг/мл; не промытые, 0,08 мг/мл; промытые, 0,05 мг/мл; не промытые 0,05 мг/мл; промытые, 0,03 мг/мл и не промытые, 0,03 мг/мл. Применяемой антисывороткой был биоклон анти-В. На фиг. 7 показаны клетки, которые уже не промывали перед испытанием. Результаты Diamed анализа клеток, трансформированных при 4 С раствором трансформации Втри-sp-Ad-DOPE (VI) (L к R): 0,6,0,3 и 0,15 мг/мл. На фиг. 8 показаны результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втри-sp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки, промытые А 0,07 + В 0,3 мг/мл против анти-А и анти-В. Лунки 3 и 4 (L к R) содержат клетки, не промытые А 0,07 + В 0,3 мг/мл против анти-А и анти-В. На фиг. 9 показаны клетки, которые уже не промывали перед испытанием. Результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втри-spAd-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки, не промытые А 0,07 + В 0,3 мг/мл против анти-А и анти-В. На фиг. 10 показаны результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втри-sp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки,промытые А 0,07 А + В 0,2 мг/мл против анти-А и анти-В. Лунки 3 и 4 (L к R) содержат клетки, не промытые А 0,07 + В 0,2 мг/мл против анти-А и анти-В. На фиг. 11 показаны клетки, которые уже не промывали перед испытанием. Результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втриsp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки, не промытые А 0,07 + В 0,2 мг/мл против анти-А и анти-В. На фиг. 12 показаны результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втри-sp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки,промытые А 0,06 А + В 0,3 мг/мл против анти-А и анти-В. Лунки 3 и 4 (L к R) содержат клетки, не промытые А 0,06 + В 0,3 мг/мл против анти-А и анти-В. На фиг. 13 показаны клетки, которые уже не промывали перед испытанием. Результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втриsp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки, не промытые А 0,06 + В 0,3 мг/мл против анти-А и анти-В. На фиг. 14 показаны результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втри-sp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки,промытые А 0,06 А + В 0,2 мг/мл против анти-А и анти-В. Лунки 3 и 4 (L к R) содержат клетки, не промытые А 0,06 + В 0,2 мг/мл против анти-А и анти-В. На фиг. 15 показаны клетки, которые уже не промывали перед испытанием. Результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втриsp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки, не промытые А 0,06 + В 0,2 мг/мл против анти-А и анти-В. На фиг. 16 показаны результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втри-sp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки,промытые А 0,05 А + В 0,3 мг/мл против анти-А и анти-В. Лунки 3 и 4 (L к R) содержат клетки, не промытые А 0,05 + В 0,3 мг/мл против анти-А и анти-В. На фиг. 17 показаны клетки, которые уже не промывали перед испытанием. Результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втриsp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки, не промытые А 0,05 + В 0,3 мг/мл против анти-А и анти-В. На фиг. 18 показаны результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втри-sp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки,промытые А 0,05 А + В 0,2 мг/мл против анти-А и анти-В. Лунки 3 и 4 (L to R) содержат клетки, не промытые А 0,05 + В 0,2 мг/мл против анти-А и анти-В. На фиг. 19 показаны клетки, которые уже не промывали перед испытанием. Результаты Diamed анализа клеток, трансформированных при 4 С параллельной трансформацией Атри-sp-Ad-DOPE (I) и Втриsp-Ad-DOPE (VI). Лунки 1 и 2 (L к R) содержат клетки, не промытые А 0,05 + В 0,2 мг/мл против анти-А и анти-В. Сравнительные примеры. Сравнительные примеры не образуют часть заявленного изобретения. Сравнительные примеры описывают трансформацию эритроцитов природными гликолипидами.- 25013183 Сравнительный пример 1. Получение природных гликолипидов. Очистка ВЭЖХ. В первой стадии колонки заполняли сухим диоксидом кремния (15-25 мкм) перед каждым опытом. Можно применять относительно нечистые образцы при анализе ВЭЖХ, поскольку диоксид кремния можно разгрузить вместе с теоретически высоким уровнем необратимо связанных загрязняющих примесей. Гликолипиды разделяли на силикагеле с подвижной фазой повышенной пористости. Программой был линейный градиент, начинающийся 100% смесью 80:20:1 (об./об.) хлороформ-метанол-вода и кончающийся 100% смесью 40:40:12 (об./об.) хлороформ-метанол-вода. Применяемым оборудованием ВЭЖХ была система Shimadzu, способная перекачивать и смешивать четыре отдельных растворителя при программированных отношениях. Поскольку хлороформ, метанол и вода испаряются с разными скоростями, была разработана программа, при помощи которой компоненты растворителя не смешивали перед подачей для ВЭЖХ. Четыре разные жидкости для ВЭЖХ Shimadsu смешивали быстрым отбором выстрелом их по очереди из каждой из четырех бутылей. Выстрелы хлороформа и воды непосредственно друг за другом в линиях могут вызвать проблемы смешиваемости. Метанол был прослойкой между этими двумя несмешиваемыми компонентами. Кроме того, воду предварительно смешивали с метанолом в отношении 1:1 для дополнительного предотвращения появления проблем со смешиваемостью. Сравнительный пример 2. Трансформация эритроцитов природными гликолипидами. Агглютинация. Трансформацию эритроцитов определяли агглютинацией с применением системы микротипирования Diamed-ID помимо применения общепринятой пробирочной серологии. Карты типирования DiamedABO не применяли. Применяемыми картами были содержащие NaCl, ферментную пробу и не содержащие радиоактивное вещество карты агглютинина, которые предварительно не загружали какой-либо антисывороткой или другими реагентами. Это позволяет применять специфические антисыворотки в обеих методологиях. Таблица 1 Гель-карты Сравнительное испытание проводили между пробирочной серологией и системой Diamed для установления эффективности двух систем. Клетки трансформировали при 25 С в течение 4 ч. Для измерения эквивалентности примеряли анти-А-сыворотки сераклон и альбаклон. Результаты показаны в приведенной ниже табл. 3. Таблица 2 Антисыворотки, применяемые при сравнении пробирочной серологии с системой Diamed Таблица 3 Результаты агглютинации, сравнивающие пробирочную серотологию с системой Diamed В этом эксперименте доказали, что система Diamed является более чувствительной к более слабым реакциям, чем пробирочная серотология с сераклоном анти-А, но не с албаклоном. Эти реагенты изготовляют различно и, таким образом, не предполагается, что они выполняют анализ идентично. Однако тот факт, что комбинация пробирочной серотологии с сераклоном анти-А не давала положительный результат, вероятно, является результатом интерпретации оператора. Более слабые реакции заведомо трудно оценить в баллах и разница между 1+ и 0 может быть трудно различимой в пробирках.- 26013183 Оптимизация. Изучали влияние изменения концентрации гликолипидов, температуры инкубации, продолжительности инкубации, разбавителя и раствора для хранения на жизнеспособность клеток. Эффективность и стабильность трансформации определяли агглютинацией соответствующим антителом. Таблица 4 Определяемая пробирочной серологией агглютинация клеток, трансформированных природным гликолипидом А на протяжении различного времени и при разных температурах Концентрация гликолипида. Эксперименты с начальной трансформацией проводили с очень очищенным (ВЭЖХ) образцом Lebгликолипида и менее чистым образцом гликолипида группы крови А. Трансформацию проводили при 37 С в течение 2,5 ч. Образец гликолипида А содержал другие липидные примеси и, таким образом, сравнительно меньше молекул группы крови А по массе, чем образец Leb-гликолипида эквивалентной концентрации(мас./об.). По-видимому это подтверждается фактом, что более высокие концентрации гликолипида А,чем Leb-гликолипида, требовались для получения эквивалентной оценки агглютинации в баллах (см. табл. 6). Уровень примеси в образце гликолипида А может также способствовать более низкой стабильности на протяжении периода 62 дней - А-трансформированные клетки умирали при самой высокой концентрации (получившие самую высокую дозу примеси). Таблица 5 Анти-А и анти-Leb, применяемые при начальном тестировании трансформации природным гликолипидом Таблица 6 Стабильность RBC, трансформированных природным гликолипидом А и Leb,оцениваемая агглютинацией пробирочной серологией на протяжении периода 62 дней Указанные выше клетки оценивали также для гемолиза и эти результаты приводятся ниже в табл. 7.- 27013183 Таблица 7 Гемолиз, подсчитываемый визуально День 1 - в супернатанте первого промывания после трансформации; дни 25 и 62 - в растворе консервации клеток перед тем, как клетки ресуспендируют после хранения. Шкала подсчета в баллах аналогична шкале агглютинации от 4+ до 0; hhhh - сильно гемолизованные, hhh - очень гемолизованные, hh умеренно гемолизованные, h - среднегемолизованные, w - слабогемолизованные и 0 - гемолиз не виден. Можно обнаружить, что эти результаты показывают, что гемолиз клеток ассоциирован с трансформацией с высокими концентрациями гликолипида. Не ясно, является ли лежащим в основе этого механизма разрыв мембраны плазмы большими количествами встраиваемого гликолипида, скорость такого встраивания или это, возможно, обусловлено количеством ассоциированных примесей. Однако оказалось, что результаты для Leb на день 62 поддерживают первое объяснение. Образец Leb был очень очищенным перед растворением, он был порошком чистого белого цвета и поэтому маловероятно, что гемолиз был обусловлен вредным влиянием примесей. Из данных ясно видно, что на день 62 степень имеющего место гемолиза уменьшается в соответствии со снижением концентрации гликолипида. Температура инкубации. Эксперименты проводили для исследования возможных механизмов снижения гемолиза RBC во время стадии встраивания. Предыдущие эксперименты показали, что гемолиз снижался при более высоких концентрациях гликолипида, чем при более низких концентрациях, и, считается, что гемолиз может быть также связан со скоростью встраивания гликолипида. Поскольку считается, что температура влияет на скорость встраивания, эксперименты проводили для сравнения трансформации при 37 С с трансформацией при комнатной температуре (к.т.; 25 С). Поскольку предполагается, что скорость снижается, когда снижается температура, период инкубации для эксперимента при к.т. был 4 ч. Гемолиз оценивали визуально и считали в баллах после встраивания. Тесты серологии также проводили на клетках. Результаты показаны в табл. 8. Таблица 8 Влияние температуры инкубации на гемолиз и агглютинацию во время встраивания гликолипидов в мембраны RBC. Гемолиз оценивали в баллах визуально при каждой из трех промывок Продолжительность промывки. Инкубацию при 37 С проводили в течение 1 и 2 ч и ее влияние на гибель и трансформацию клеток оценивали агглютинацией подходящим антителом.- 28013183 Таблица 9 Антисыворотки, применяемые при различных продолжительностях опытов инкубации Таблица 10 Влияние времени инкубации на агглютинацию клеток,трансформированных природными гликолипидами Эти результаты показывают, что повышение продолжительности инкубации во время встраивания природных гликолипидов не повышает агглютинацию. Фактически, баллы счета агглютинации снижаются после 2 ч инкубации. Это может быть обусловлено дестабилизацией мембраны или возвращением гликолипидов обратно в раствор. Разбавитель. Эксперименты проводили также для определения, может ли замена раствора для разведения гликолипида снижать гемолиз. Рабочую эффективность PBS сравнивали с рабочей эффективностью 2PBS и 2% бычьего сывороточного альбумина (BSA) в PBS. Клетки инкубировали при 37 С в течение 1,5 ч. Результаты показаны в табл. 11. Таблица 11 Исследование по влиянию на гемолиз замены растворов для разведения гликолипидов во время встраивания гликолипидов в мембраны RBC Стабильность. После того как гликолипиды групп крови А и В были очищены ВЭЖХ до приемлемого уровня,проводили эксперимент для нахождения подходящих концентраций для проведения опытов по стабильности.- 29013183 Таблица 12 Исследование ранней стабильности клеток, трансформированных природным гликолипидом А Таблица 14 Пробирочная серология О RBC, трансформированных гликолипидом А,для установления подходящих концентраций для проведения испытаний стабильности 1 и 2 Трансформация при 25 С в течение 4 ч. Таблица 15 Пробирочная серотология О RBC, трансформированных гликолипидом В,для установления подходящих концентраций для проведения испытаний на стабильность 1 и 2 Трансформация при 25 С в течение 4 ч. Два набора клеток трансформировали при различных концентрациях природного гликолипида А. Трансформацию проводили при 25 С. Один набор клеток тестировали в течение длительного времени и один набор клеток тестировали еженедельно на агглютинацию. Результаты агглютинации, проводимой пробирочной серологией и Diamed, показаны ниже в табл. 16. Все клетки хранили в Cellstab в бутылях с плоскими основаниями. Клетки обнаружили от минимального гемолиза до отсутствия гемолиза в любой точке времени.
МПК / Метки
МПК: C07H 15/04, C07F 9/117, A61K 31/7032, C07F 9/10, A61P 43/00, A61K 31/685
Метки: молекулярные, конструкции, синтетические
Код ссылки
<a href="https://eas.patents.su/30-13183-sinteticheskie-molekulyarnye-konstrukcii.html" rel="bookmark" title="База патентов Евразийского Союза">Синтетические молекулярные конструкции</a>
Предыдущий патент: Новые конденсированные пирролокарбазолы
Следующий патент: Конденсированные производные пиразола и способы лечения с их помощью заболеваний, вызванных нарушением обмена веществ
Случайный патент: Отделяемый каркас, используемый для намотки оптоволоконных катушек, и способ изготовления оптоволоконных катушек