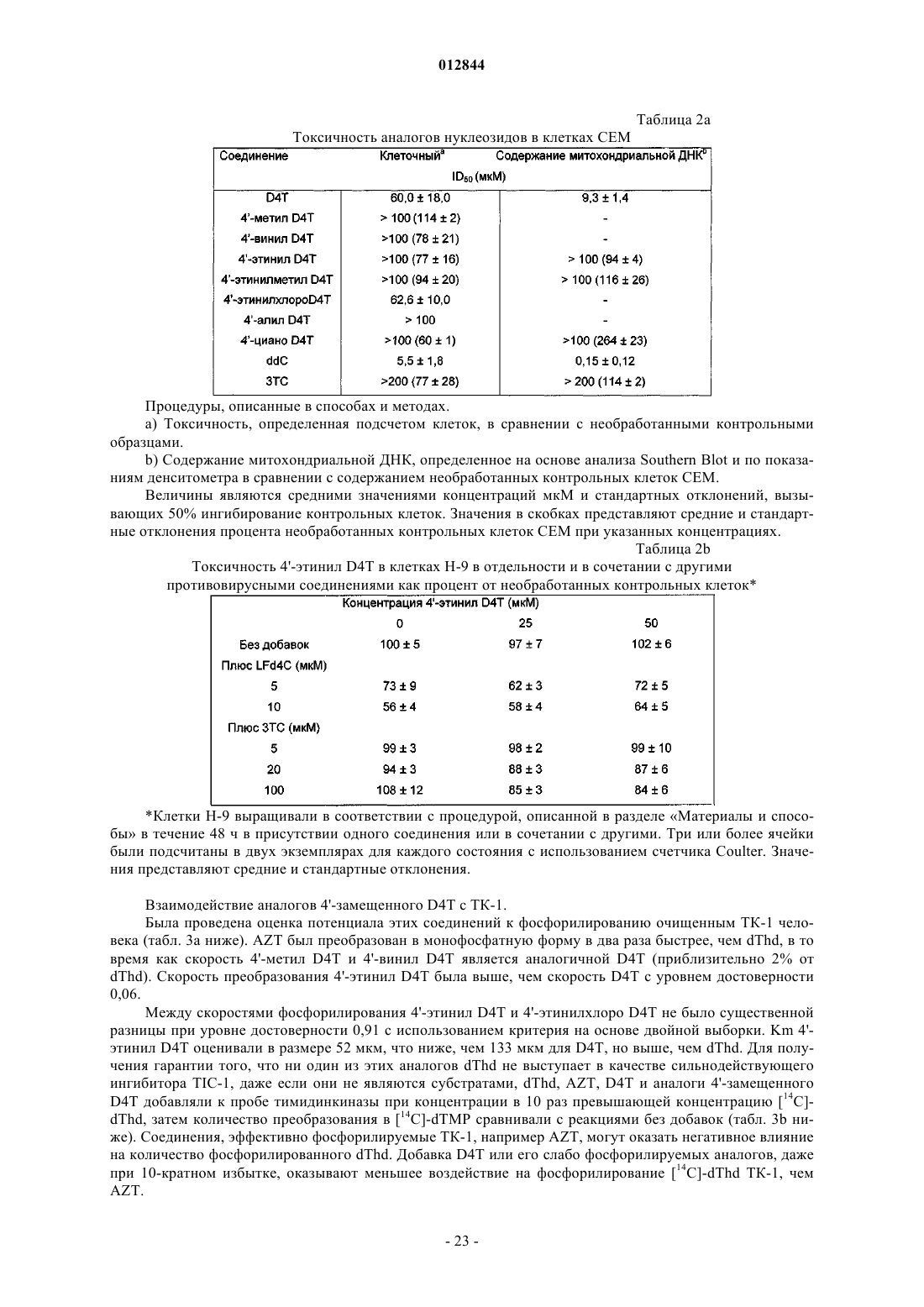
Аналоги противовирусных нуклеозидов и способы лечения вирусных инфекций, в частности вич инфекций
Формула / Реферат
1. Соединение в соответствии с формулой
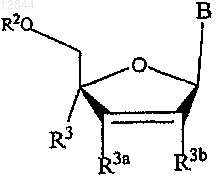
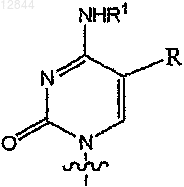
в которой В обозначает
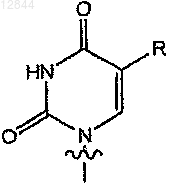
или
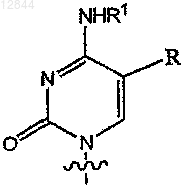
R обозначает Н, F, Cl, Br, I, С1-С4алкил, -CуN, -CуC-Ra,  или
или 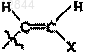
X обозначает Н, С1-С4алкил, F, Cl, Br или I;
R1 обозначает Н, ацильную группу, С1-С20алкильную или эфирную группу;
R2 обозначает Н, ацильную группу, С1-С20алкильную или эфирную группу, фосфатную, дифосфатную, трифосфатную, фосфодиэфирную группу либо группу
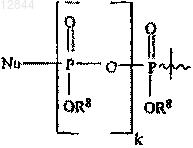
или
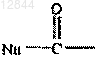
Nu обозначает радикал биологически активного противовирусного соединения, таким образом, чтобы аминогруппа или гидроксильная группа из указанного биологически активного противовирусного соединения образовывала фосфатную, фосфорамидатную, карбонатную или уретановую группу с соседней частью;
R8 обозначает Н или С1-С20алкильную или эфирную группу;
R3 обозначает С3 или С4алкильную группу; -(CH2)n-CуC-Ra, 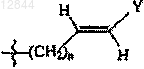 или
или 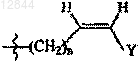
R3a и R3b, каждый независимо, обозначают Н, F, Cl, Br или I;
Ra обозначает Н, F, Cl, Br, I или -С1-С4алкил;
Y обозначает Н, F, Cl, Br, I или -С1-С4алкил;
k составляет 0, 1 или 2 и
n составляет 0, 1, 2, 3, 4 или 5,
либо их аномеры, фармацевтически приемлемые соли, полиморфы или их сольваты.
2. Соединение по п.1, в котором В обозначает 
3. Соединение по п.1 или 2, в котором R3 обозначает -(CH2)n-CуC-Ra, 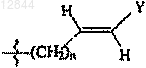 или
или 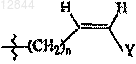
4. Соединение по любому из пп.1-3, в котором R обозначает F, Cl, Br, I, С1-С3алкил, -CуC-Ra, 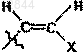 или
или  и X обозначает Н, С1-С4алкил, F, Cl, Br или I.
и X обозначает Н, С1-С4алкил, F, Cl, Br или I.
5. Соединение по п.1, в котором R обозначает СН3, R3 обозначает -(СН2)n-CуC-Ra, n составляет 0 и Ra обозначает Н.
6. Соединение по любому из пп.1-5, в котором R3a и R3b оба обозначают Н.
7. Соединение по любому из пп.1-6, в котором R2 обозначает Н.
8. Соединение по п.1, которое обозначает
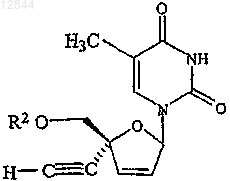
9. Соединение по п.8, в котором R2 обозначает Н, ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу.
10. Соединение по п.8, в котором R2 обозначает Н.
11. Соединение по п.1, в котором В обозначает
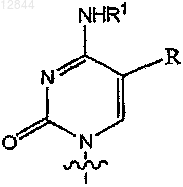
12. Соединение по п.11, в котором R3 обозначает -(CH2)n-CуC-Ra, 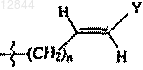 или
или 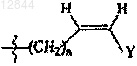 и n составляет 0.
и n составляет 0.
13. Соединение по любому из пп.11 или 12, в котором R обозначает Н, F, Cl, Br, I, СН3, -CуC-Ra, 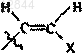 или
или 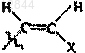 и X обозначает Н, С1-С4алкил, F, Cl, Br или I.
и X обозначает Н, С1-С4алкил, F, Cl, Br или I.
14. Соединение по п.11 или 12, в котором R обозначает СН3, R3 обозначает -(CH2)n-CуC-Ra, n составляет 0 и Ra обозначает Н.
15. Соединение по любому из пп.11-14, в котором R3a и R3b оба обозначают Н.
16. Соединение по любому из пп.11-15, в котором R2 обозначает Н.
17. Фармацевтический состав, включающий эффективное количество соединения по п.1 в сочетании с фармацевтически приемлемым носителем, добавкой или наполнителем.
18. Состав по п.17, в котором В обозначает
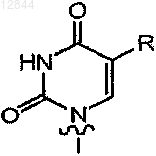
19. Состав по п.17 или 18, в котором R3 обозначает -(CH2)n-CуC-Ra, 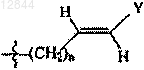 или
или 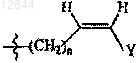
20. Состав по любому из пп.17-19, в котором R обозначает F, Cl, Br, I, С1-С3алкил, -CуC-Ra, 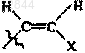 или
или  и X обозначает Н, С1-С4алкил, F, Cl, Br или I.
и X обозначает Н, С1-С4алкил, F, Cl, Br или I.
21. Состав по п.17, в котором R обозначает СН3, R3 обозначает -(CH2)n-CуC-Ra, n составляет 0 и Ra обозначает Н.
22. Состав по любому из пп.17-21, в котором R3a и R3b оба обозначают Н.
23. Состав по любому из пп.17-22, в котором R2 обозначает Н.
24. Состав по п.17, в котором указанное соединение обозначает
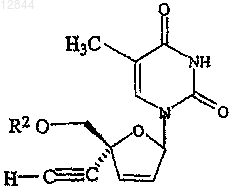
25. Состав по п.24, в котором R2 обозначает Н, ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу.
26. Состав по любому из пп.24 или 25, в котором R2 обозначает Н.
27. Состав по п.17, в котором В обозначает
28. Состав по п.27, в котором R3 обозначает -(CH2)n-CуC-Ra, 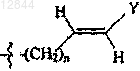 или
или 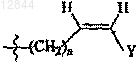 и n составляет 0.
и n составляет 0.
29. Состав по п.27 или 28, в котором R обозначает Н, F, Cl, Br, I, CH3, -CуC-Ra, 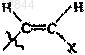 или
или 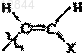 ; X обозначает Н, С1-С4алкил, F, Cl, Br или I.
; X обозначает Н, С1-С4алкил, F, Cl, Br или I.
30. Состав по любому из пп.27-29, в котором R обозначает СН3, R3 обозначает -(CH2)n-CуC-Ra, n составляет 0 и Ra обозначает Н.
31. Состав по любому из пп.27-30, в котором R3a и R3b оба обозначают Н.
32. Состав по любому из пп.27-31, в котором R2 обозначает Н.
33. Состав по п.27, в котором указанное соединение обозначает
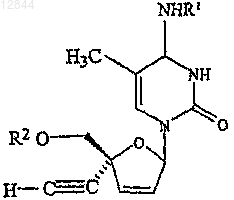
где R1 обозначает Н или ацильную группу, R2 обозначает Н, ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу.
34. Состав по п.33, в котором R1 обозначает Н и R2 обозначает Н.
35. Состав по любому из пп.17-34, дополнительно включающий по меньшей мере офэю дополнительное средство против ВИЧ.
36. Состав по п.35, в котором указанное дополнительное средство против ВИЧ выбирают из группы, состоящей из ddC, абакавира, ddI, ddA, 3TC, AZT, D4T, FTC, FddC, Fd4C, Атазанавира, Адефовир дипивоксила, Тенофовир дизопроксила, Этекавира, Индинавира, KHI-227, 2-[3-[3-(S)-[(тетрагидрофуранилокси)карбонил]амино]-4-фенил-2(R)-гидроксибутил]-N-(1,1-диметилэтил)декагидро-3-изохинолинкарбоксамида,VB-11,328, KNI-174, Val-Val-Sta, CPG53820, бис-Val HOEt-N2 азапептид изостера, производного C2-Sym Фосфиникамида, 2,5-Диамино-N,N'-бис-(N-бензилоксикарбонилуэлил)-1,6-дифенил-3(S),4(S)-гексанедиол BzOCValPhe[diCHOH(SS)]PheValBzOC, 2,5-Диамино-N,N'-бис-(N-бензилоксикарбонилуэлил)-1,6-дифенил-3(R),4(R)-гексанедиол BzOCValPhe[diCHOH(RR)]PheValBzOC, бис-(SATE)ddAMP, BILA2186BS, Агенеразы, А-98881, А-83962, А-80987, (2-Нафталкарбонил)Asn[декарбонилфегидроксиэтил]ПроОтертБутила, производного 2-Аминобензилстатина валила Cbz, производного 10H-2(Cbz-ValNH)3PhPr[14] парациклофана, производного 10H-2(Cbz-ValNH)3PhPr[13] парациклофана, производного 10H-2(Cbz-ValNH)3PhPr[13] метациклофана, производного 10H-2(Cbz-Tle)3PhPr[14] парациклофана, 1-(20HPr)-4-замещенного пиперазина (сциклопропила), производного тиенилкарбамата, 1-(20HPr)-4-замещенного пиперазина (циклобутила), производного тиенилкарбамата, 1-(20HPr)-4-замещенного пиперазина (3-пентила), производного тиенилкарбамата, производного 10H-2(Cbz-ValNH)3PhPr[17] парациклофана, А-81525, ХМ323, Типранавира, производных Тиенопирида-CON тиенилуретана, SDZ PRI 053, SD146, Телинавира, (R)2QuinCOAsnPhe[CHOHCH2]PipCONHtBu, Сахинавира, производного Сахинавира/Мелфинавира, аналога Изохин-CON Thf-Thf уретана, аналога Изохин-CON тиенилуретана, R-87366, ДМФ 460, L685,434, производного L685,434-6-гидроксила, L685,434-OEtNMe2, производного L685,434-Opr-Морф, L689,502, Лазинавира, Алувирана, аналога Нельфинавир-октагидро-тиенопиридина, Р9941, Палинавира и Пенициллина, аналога 2-Изохин-OHPrNH2 и их смесей.
37. Состав по п.35, в котором указанное дополнительное средство против ВИЧ выбирают из группы, состоящей из ddC, абакавира, ddI, ddA, 3TC, AZT, D4T, FTC, FddC и Fd4C.
38. Применение состава по любому из пп.17-37 при производстве лекарственного препарата для лечения вирусной инфекции, вызванной вирусом, выбранным из группы, состоящей из вирусов 1 и 2 иммунодефицита человека (ВИЧ-1 и ВИЧ-2), вирусов 1 и 2 Т-клеточного лейкоза человека (HTLV-1 и HTLV-2), респираторного синтициального вируса (RSV), вируса папилломы человека (HPV), аденовируса, вируса гепатита В (HBV), вируса гепатита С (HCV), вируса Эпштейна-Барра (EBV), вируса ветряной оспы-опоясывающего герпеса (VZV), цитомегаловируса (CMV), вирусов 1 и 2 простого герпеса (HSV-1 и HSV-2), вируса 8 герпеса человека (HHV-8, также известного как вирус, сопутствующий саркоме Капоши) и флавивирусов, включающих вирус желтой лихорадки, вирус лихорадки денге, вирусы японского энцефалита и вирусы лихорадки Западного Нила.
39. Применение по п.38, в котором указанный вирус является ВИЧ-1 или 2.
40. Применение состава по любому из пп.17-37 при производстве лекарственного препарата для снижения вероятности либо для замедления наступления состояния, являющегося вторичным от вирусной инфекции у пациента при риске развития указанного состояния.
41. Применение по п.40, в котором указанное состояние является СПИДом, а указанная вирусная инфекция является ВИЧ-1 или 2.
Текст
012844 Перекрестная ссылка на родственные заявки По заявке на данный патент испрашивается приоритет на основании предварительной заявки на патент номер 60/448554, поданной 19 февраля 2003 г., которая полностью включена в данное описание. Область техники, к которой относится изобретение Настоящее изобретение относится к новым аналогам 2',3'-дидезокси и дидегидронуклеозида и связанными с ними пролекарствами и их использованием при лечении ряда вирусных инфекций и заболеваний, включая ВИЧ и связанный с ними СПИД, наряду с другими заболеваниями, в частности вызываемыми ретровирусами. Проведение данной работы финансировалось из средств гранта AI-38204 на развитие здравоохранения, предоставленного Национальным институтом здравоохранения. Правительство сохраняет за собой определенные права на данное изобретение. Предпосылки к созданию изобретения Вирус иммунодефицита человека (ВИЧ/СПИД) стал основной инфекционной причиной смерти людей во всех странах мира, превзойдя малярию и туберкулез по уровню смертности. По данным изданного в декабре 2002 г. отчета ВОЗ об эпидемии ВИЧ в настоящее время зарегистрировано 3,1 млн смертельных случаев и 42 млн людей, больных СПИДом. Существует очевидная необходимость в новых более эффективных терапевтических средствах. Дидезоксинуклеозиды являются важной группой противовирусных химических соединений (16, 26, 27). Относящийся к этой группе 3'-азидо-3'-дезокситимидин(AZT, Ретровир, Зидовудин) стал первым лекарственным средством, одобренным для лечения ВИЧ. Побочным эффектом, ограничивающим его дозировку, является миелосупрессия (14, 36, 39), которая может усиливаться при одновременном приеме других лекарств, что вызывает подавление функции костного мозга или функций, за метаболизм которых отвечает печень. 2',3'-дидегидро-3'-дезокситимид (D4T, Ставудин, Церит) был в дальнейшем одобрен ввиду простоты его биологического получения и сниженного токсического воздействия (1). Применение D4T ограничивается долгосрочной отсроченной токсичностью, периферийной сенсорной невропатией (4), которая связана с митохондриальным повреждением (3,5, 6, 13, 18, 22, 30, 33, 34). 2',3'-Дидезоксииннозин (ddI, Диданозин, Видекс) и 2',3'-дидезоксицитедин(ddC, Цальситабин) являются дидезоксиниуклиазидными против ВИЧ соединениями, которые также характеризуются периферийной невропатией, являющейся их основным побочным эффектом. В процессе поиска аналогов против ВИЧ-нуклиазидов, характеризующихся меньшей невропатией, было синтезировано много классов химических соединений и была проведена их оценка на антивирусную активность и цитотоксичность, включая их воздействие на митохондриальные ДНК. Дидезоксинуклиозиды в необычной форме L, представленные -L-2',3'-дидезокси-3'-тиацитидином (3 ТС, Ламивудин), его 5-фтор аналогом (FTC, Эмтрицитабин) и -L-2',3'-дидезокси-2',3'-дидегидро-5-фторцитидином (LFd4C, Элвуцитабин),как было продемонстрировано изобретателями (2, 11, 12, 23-25) и другими авторами (8, 9, 15, 37), обладают хорошей противовирусной активностью и низкой митохондриальной токсичностью. Тем не менее,даже при наличии химических соединений, являющихся относительно нетоксичными по отношению к митохондрии, отсутствует пролонгированный ответ. Это состояние может быть вызвано либо быстрым появлением резистентных вирусов, либо изменениями в организме-хозяине, вызывающими различия в метаболизме лекарств (10, 19, 35). Один подход к решению этой проблемы заключается в разработке менее токсичных соединений, не имеющих перекрестной резистентности к другим антивирусным лекарствам. При использовании в сочетании эти соединения позволят снизить дозировку существующих лекарств, необходимых для достижения аналогичного антивирусного эффекта при меньшей токсичности. Кроме того, эти соединения могли бы даже отсрочить наступление резистентности, которая могла бы быть основана на более низкой вирусной нагрузке во время курса лечения. В процессе поиска новых противовирусных соединений другие авторы обратили внимание на аналоги 4'-замещенного dThd (29, 32), в то время как нами была синтезирована серия аналогов 4'-замещенных D4T. Испытания показали, что 4'-этил D4T является наиболее активным из протестированных соединений (17). В изложенном в данном документе исследовании нами описывается отношение действий структур в этом классе соединений и дается более детальная характеристика 4'-этил D4T относительно его принципа действия против ВИЧ и взаимодействия с основными клеточными ферментами, способствующими его активности. Цели изобретения Целью настоящего изобретения является создание соединений для лечения вирусных инфекций. Другой целью изобретения является создание фармацевтических составов, которые могут быть использованы для лечения вирусных инфекций. Еще одной целью настоящего изобретения является создание пролекарственных форм соединений в соответствии с настоящим изобретением, изготавливаемых по химической формуле в сочетании с известными противовирусными препаратами. Другой целью изобретения является создание терапевтических способов для лечения различных вирусных заболеваний, как описано в настоящем патенте, или рака. Эти и/или иные цели изобретения изложены в нижеприведенном описании изобретения.-1 012844 Краткое описание чертежей Фиг. 1 изображает ряд предпочтительных химических соединений в соответствии с настоящим изобретением. Фиг. 2 изображает против ВИЧ химические соединения L(-)Fd4C, L(-)SddC, ddC и D4T. Фиг. 3 изображает предпочтительные соединения динуклеозида в соответствии с настоящим изобретением. Фиг. 4 показывает химический синтез TDK-4-152 по схеме А. Фиг. 5 показывает химический синтез TDK-4-114 по схеме В. Фиг. 5 А показывает альтернативный химический синтез TDK4-114. Фиг. 5 В показывает альтернативную подготовку промежуточных соединений ацилоксинуклеозида в соответствии с изобретением, которые могут использоваться для производства TKD-4-114 по фиг. 5 А. Фиг. 6 показывает химический синтез KMA-23-153. Фиг. 7 А показывает синтез 4'-этинил-2'-дезоксинуклеозидов из 2'-дезоксинулкозидов в соответствии с методологией Nomura, et al. J. Med. Chem., 42, 2901-2908 (1999). Следует отметить, что SiR3 представляет собой трет-бутилдиметилсилильную группу, a SiR'3 трет-бутилдифенилсилильную группу. X представляет собой атом галогена, например хлора, а В является нуклеозидным основанием, например урацилом, аденином, гуанином или цитозином и т.д. Фиг. 7 В показывает синтез 4'-этинил-2'-дезоксинуклеозидов из блокированного предшественника сахара в соответствии с методологией Ohrui, et al., J. Med. Chem. 43, 4516-4525 (2000). Следует отметить,что В представляет собой нуклеозидное основание. Фиг. 7 С показывает общий химический синтез 2',3'-дидегидронуклеозидных соединений из соответствующих аналогов 2'-дезоксинулеозидов в соответствии с настоящим изобретением. Фиг. 8 показывает против ВИЧ активность аналогов 4'-замещенных D4T: противовирусная активность 4'-этинил D4T, D4T, 4'-этинилметил D4T и 4'-циано D4T была определена в системе MT-2/HIVIIIB, описанной в разделе Материалы и способы в примерах. Ингибирование определяли путем сравнения показаний при оптической плотности 595 нм с показаниями неинфицированных необработанных(НН) контрольных клеток МТ-2. Фиг. 9 показывает обращение против ВИЧ эффекта 4'-этинил D4T. dThd (10 мкМ), dThd (1 мкМ) иdCyd (10 мкМ) в присутствии THU (5 мкМ) добавляли к стандартной пробе. Ингибирование определяли путем сравнения показаний при оптической плотности 595 нм с показаниями неинфицированных необработанных (НН) контрольных клеток МТ-2. Фиг. 10 показывает противовирусные изоболограммы D4T и 4'-этилэтинил D4T в сочетании с: данными А) 3 ТС и В) LFd4C, полученными в системе MT-2/HIV IIIB. Номера вдоль каждой оси являются пропорциями ЕС 50 (взятыми за 1) для лекарственного препарата, указанного в качестве единичного реагента. [ЕС 50 для единичных реагентов являются 1,4 мкМ D4T, 0,5 мкМ 4'-этинил D4T, 1,0 мкМ 3 ТС и 0,18 мкМ LFd4C]. Каждая опорная точка представляет сочетание, создающее эффект, эквивалентный эффекту ЕС 50 для любого отдельного лекарственного препарата. Индекс синергизма (ИС) рассчитан как дробная часть 45-градусной линии к линии, указывающей, что взаимодействие лекарственных препаратов является аддитивным, при этом общее расстояние составляет 1,0. Фиг. 11 показывает лечение аналогов D4T с использованием тимидинфосфорилазы: dThd, D4T и 4'этинил D4T были инкубированы из экстракта человеческой печени с помощью частично очищенного препарата ТР. Отношение основания к нуклеозиду определяли с помощью обратной фазы жидкостной хроматографии высокого разрешения на колонке ОДС Бэкмана в соответствии с описанием в разделе Материалы и способы. Краткое изложение существа изобретения Настоящее изобретение относится к соединению в соответствии с формулойR1 обозначает Н, ацильную группу, С 1-С 20 алкильную или эфирную группу;R2 обозначает Н, ацильную группу, С 1-С 20 алкильную или эфирную группу, фосфатную, дифосфатную, трифосфатную, фосфодиэфирную группу либо группуNu обозначает радикал биологически активного противовирусного соединения, таким образом,чтобы аминогруппа или гидроксильная группа из указанного биологически активного противовирусного соединения образовывала фосфатную, фосфорамидатную, карбонатную или уретановую группу с соседней частью;R8 обозначает Н или С 1-С 20 алкильную или эфирную группу; илиn составляет 0, 1, 2, 3, 4 или 5,либо их аномеры, фармацевтически приемлемые соли, полиморфы или их сольваты. Предпочтительно В является тиминовым основанием (т.е. урацильным основанием с 5-метиловым замещением) или незамещенным адениновым основанием. R1 и R2 предпочтительно обозначают Н. R3 предпочтительно обозначает -(СН 2)n-CH=C-Ra, где n составляет 0 и Ra обозначает Н. Другие предпочтительные особенности настоящего изобретения заключаются в том, что средство против ВИЧ выбирают из группы, состоящей из ddC, ddI, ddA, AZT, абакавира, 3 ТС, D4T и FTC, Fddc иFd4C, в которых биологически активное средство присоединено к фосфатной, фосфорамидатной, карбонатной или уретановой части через гидроксильную группу в положении 5' нуклеозида синтона сахара. В другом примере осуществления изобретения в соответствии с настоящим изобретением фармацевтические составы включают эффективное количество одного или нескольких соединений, как описывалось выше, произвольно в сочетании с фармацевтически приемлемым носителем, наполнителем или добавкой. Применение состава в соответствии с настоящим изобретением при производстве лекарственного препарата для лечения вирусных инфекций является еще одной особенностью настоящего изобретения. Соединения могут быть использованы для лечения инфекций или заболеваний, связанных с вирусами,включающими, например, вирусы 1 и 2 иммунодефицита человека (ВИЧ-1 и ВИЧ-2), включая лекарственно устойчивые штаммы, вирусы 1 и 2 Т-клеточного лейкоза человека (HTLV-1 и HTLV-2), респираторный синтициальный вирус (RSV), вирус папилломы человека (HPV), аденовирус, вирус гепатита В(HBV), вирус гепатита С (HCV), вирус Эпштейна-Барра (EBV), вирус ветряной оспы-опоясывающего герпеса (VZV), цитомегаловирус (CMV), вирусы 1 и 2 простого герпеса (HSV-1 и HSV-2), вирус герпеса человека 8 (HHV-8, также известного как вирус, сопутствующий саркоме Капоши) и флавивирусы,включающие вирус желтой лихорадки, вирус лихорадки денге, вирусы японского энцефалита и вирусы лихорадки Западного Нила. Предпочтительно соединения в соответствии с настоящим изобретением-3 012844 могут использоваться для лечения ВИЧ-инфекций. Кроме того, настоящие соединения могут использоваться для предотвращения и/или снижения вероятности таких вирусных инфекций, как ВИЧ-инфекция или состояния, которое может быть побочно вызвано вирусной инфекцией, при риске развития состояния, которое является СПИДом, а указанная вирусная инфекция является ВИЧ-1 или ВИЧ-2. Подробное описание изобретения Термин соединение, в том смысле, в каком он используется в данном описании, если не указано иначе, относится к любому конкретному химическому соединению, описываемому в настоящем патенте. В пределах использования термина в данном контексте он обычно относится к единичному соединению,предпочтительно -аномерам, но в некоторых случаях он может также относится к стереоизомерам и/или оптическим изомерам (включая рацемические смеси), также предпочтительно специфические энантиомеры, в частности -D или -L, предпочтительно аналогам -D нуклеозида или энантиомерическим обогащенным смесям описанных соединений. В настоящем изобретении в некоторых случаях, в частности при описании особенности настоящего изобретения, относящегося к двойным антагонистам/динуклеозидным пролекарствам, соединение в соответствии с настоящим изобретением химически связано через фосфатную (включая полифосфатную), фосфофамидатную, карбонатную или уретановую часть с биологически активным противовирусным средством через аминогруппу или гидроксильную группу биологически активного противовирусного средства. Термин двойной антагонист (в контексте динуклеозид) относится к соединению пролекарства,включающему два активных средства, при этом одно является активным нуклеозидным соединением в соответствии с настоящим изобретением, а второе является известным активным средством, предпочтительно известным противовирусным средством, более предпочтительно средством против ВИЧ, имеющим свободную аминогруппу или гидроксильную группу, которая может использоваться для создания связи средства с соединением в соответствии с настоящим изобретением через фосфатную или карбонатную группу. В этой особенности изобретения, относящейся к двойному антагонисту, биологически активное средство, имеющее свободную гидроксильную или аминогруппу, может использоваться для создания связи с соединением в соответствии с настоящим изобретением через фосфатную или карбонатную часть для создания соединений пролекарства, проявляющих биологическую активность, предпочтительно противовирусную активность. С этой точки зрения аналог нуклеозида в соответствии с настоящим изобретением связан с биоактивным средством предпочтительно через первичный спирт в положении 5'ОН синтона сахара для получения фосфатной, фосфорамидатной, карбонатной или уретановой части. В предпочтительных примерах осуществления изобретения биологически активное противовирусное средство предпочтительно является другим противовирусным нуклеозидным средством, таким как ddC, абакавир, ddI, ddA, 3TC, AZT, D4T, FTC, FddC и Fd4C. Предпочтительные нуклеозидные соединения приведены на фиг. 3. Приведенные в качестве примера биоактивные средства, в частности средства против ВИЧ, которые могут использоваться в соответствии с этой особенностью настоящего изобретения, относящейся к двойному антагонисту, включают, например (название соединения и активная часть, через которую возникает связь с нуклеозидным соединением в соответствии с настоящим изобретением), следующие: Атазанавир (BMS-232632) с использованием свободной вторичной гидроксильной группы; бис-(РОМ)-РМЕА (Адефовир дипивоксил) с использованием свободной аминогруппы; бис-(РОС)-РМРА (Тенофовир дизопроксил) с использованием свободной аминогруппы; Этекавир с использованием первичной гидроксильной группы на карбоциклическом синтоне сахара; Индинавир (Криксиван, MK-639 L-735,524, Merck) с использованием свободной вторичной гидроксильной группы;KHI-227 (Киностатин, Nikko Kyodo Co.) с использованием свободной вторичной гидроксильной группы: 2-[3-[3-(S)-[(тетрагидрофуранилокси)карбонил]амино]-4-фенил-2(R)-гидроксибутил]-N-(1,1 диметилэтил)дека-гидро-3-изохинолинкарбоксамид (аналог Изохин-CON фуранилуретана, Merck) с использованием свободной вторичной гидроксильной группы; карбаминовая кислота, [3-[(4-метоксифенил)сульфонил](циклофенилметил)амино-2-гидрокси-1(фенилметил)пропил]-, тетрагидрофураниловый эфир (VB-11,328, Vertex) с использованием свободной вторичной гидроксильной группы;KNI-174 (Nikko Kyodo Co.) с использованием свободной вторичной гидроксильной (или свободной амино) группы;Val-Val-Sta (Sandoz (Австрия с использованием свободной вторичной гидроксильной группы;CPG53820 (Ciba-Geigy) с использованием свободной вторичной гидроксильной группы; бис-Val HOEt-N2 аза-пептид изостер с использованием свободной вторичной гидроксильной группы; производное C2-Sym Фосфиник (Hoechst AG) с использованием свободной аминогруппы; 2,5-диамино-N,N'-бис-(N-бензилоксикарбонилуэлил)-1,6-дифенил-3(S),4(S)-гексанедиол BzOCVal-4 012844Phe[diCHOH(SS)]PheValBzOC (Abbott) с использованием свободной вторичной гидроксильной группы; 2,5-диамино-N,N'-бис-(N-бензилоксикарбонилуэлил)-1,6-дифенил-3(R),4(R)-гексанедиол BzOCValPhe[diCHOH(RR)]PheValBzOC (Abbott) с использованием свободной вторичной гидроксильной группы; бис-(S-ацетил-2-тиоэтил)фосфотриеэфир ddA или [бис-(SATE)ddAMP] c использованием свободного амина;BlLA2186BS (Bio-Mega/Boellringer Ingellieim) с использованием свободной вторичной гидроксильной группы; Агенеразе (Ампренавир; VX-478; 141W94) (Vertex/Kissei/Glaxo Wellcome) при свободной вторичной гидроксильной или аминогруппе; А-98881 (производное азациклической мочевины) (Abbott) с использованием свободной вторичной гидроксильной группы или фенольной гидроксильной группы; А-83962 (производное Рифонавира) (Abbott) с использованием свободной вторичной гидроксильной группы; А-80987 (производное Рифонавира) (Abbott) с использованием свободной вторичной гидроксильной группы;(2-Нафталкарбонил)Asn[декарбонилфе-гидроксиэтил]ПроОтертБутил или 2NaphCOAsnPhe[CHOHCH2]Про-ОтБу (Roche) с использованием свободной вторичной гидроксильной группы; производное 2-Аминобензилстатина валила Cbz (Sandoz) с использованием свободной вторичной гидроксильной группы или амина; производное 2-Аминобензилстатина валила Cbz (Sandoz) с использованием свободной гидроксильной группы; производное 10H-2(Cbz-ValNH)3PhPr[14] парациклофана (Sandoz) с использованием свободной вторичной гидроксильной группы; производное 10H-2(Cbz-ValNH)3PhPr[13] парациклофана (Sandoz) с использованием свободной вторичной гидроксильной группы; производное 10H-2(Cbz-ValNH)3PhPr[13] метациклофана (Sandoz) с использованием свободной вторичной гидроксильной группы; производное 10H-2(Cbz-Tle)3PhPr[14] парациклофана (Sandoz) с использованием свободной вторичной гидроксильной группы; 1-(20HPr)-4-замещенный пиперазин (циклопропил), производное тиенилкарбамата (Merck) с использованием свободной вторичной гидроксильной группы; 1-(20HPr)-4-замещенный пиперазин (циклобутил), производное тиенилкарбамата (Merck) с использованием свободной вторичной гидроксильной группы; 1-(20HPr)-4-замещенный пиперазин (3-пентил), производное тиенилкарбамата (Merck) с использованием свободной вторичной гидроксильной группы; производное 10H-2(Cbz-ValNH)3PhPr[17] парациклофана (Sandoz) с использованием свободной вторичной гидроксильной группы; А-81525 (Abbott) с использованием свободной вторичной гидроксильной группы; ХМ 323 (DMP (диметилфенол (ДМФ) - 323, DuPont Merck) с использованием свободной первичной или вторичной гидроксильных групп; Типранавир (U-140690 или PHU-140690, PharmaciaUpjohn) с использованием фенольной гидроксильной группы; производные Тиенопирид-CON тиенилуретана (НОСН 2 СН 2 изостер, Lilly) (замещенное производное бензила или замещенные производные метил меркаптофенила) с использованием свободных вторичных гидроксильных групп;SDZ PRI 053 (Sandoz) с использованием свободной вторичной гидроксильной группы;SD146 (DuPont Merck) с использованием любой из свободных вторичных гидроксильных групп; Телинавир (SC-52151, Searle/Monsanto) с использованием свободной вторичной гидроксильной группы или амина;(R)2QuinCOAsnPhe[CHOHCH2]PipCONHtBu (Roche) с использованием свободной вторичной гидроксильной группы или амина; Сахинавир (Инвиразе или RO 31-8959, Roche) с использованием свободной вторичной гидроксильной группы или амина; производное Сахинавира/Мелфинавира (Lilly) с использованием свободной вторичной гидроксильной группы; аналог Изохин-CON Thf-Thf уретана (Merck) с использованием свободной вторичной гидроксильной группы; аналог Изохин-CON тиенилуретана (Merck) с использованием свободной вторичной гидроксильной группы;R-87366 (АНРВА аналог, Sankyo) с использованием свободной аминогруппы; ДМФ 460 (Dupont MercldAvid) с использованием свободный вторичных гидроксильных групп или-5 012844 любой из анилиновых аминогрупп;L685,434 (Merck) с использованием свободной вторичной гидроксильной группы; производное L685,434-6-гидроксила (Merck) с использованием свободной вторичной гидроксильной группы;L685,434-OEtNMe2 (Merck) с использованием свободной вторичной гидроксильной группы; производное L685,434-OPr-Морф (Merck) с использованием свободной вторичной гидроксильной группы;L689,502 (Merck) с использованием свободной вторичной гидроксильной группы; Лазинавир (CGP 61755, CIBA/Novartis) с использованием свободной вторичной гидроксильной группы; Алувиран (Лопинавир, АВТ-378, RS-346 A157378, Abbott) с использованием свободной вторичной гидроксильной группы; аналог Нельфинавир-октагидро-тиенопиридина (Lilly) с использованием свободной вторичной гидроксильной группы; Р 9941 (DuPot Merclc) с использованием любой из свободных вторичных гидроксильных групп; Палинавир (BILA 2011 BS, BIO-MEGA/Boelminger Ingelheim) с использованием свободной вторичной гидроксильной группы; Пенициллин, аналог 2-Изохин-OHPrMH2 (Glaxo Wellcome) с использованием свободной вторичной гидроксильной группы, наряду с другими. Информацию о вышеперечисленных активных соединениях и иных соответствующих биоактивных средствах, предназначенных для использования в двойных антагонистах в соответствии с настоящим изобретением, можно найти на веб-сайте NIH по адресу http://www.niaid.nih.gov/daids/dtpdb/, соответствующие части которых включены в данное описание по ссылке. Предпочтительно, хотя не обязательно или несущественно, чтобы в двойном антагонисте в соответствии с настоящим изобретением два активных средства, образующих двойной антагонист, обладали различными механизмами действия, такими как обратное ингибирование транскриптазы, ингибирование протеазы, ингибирование цинкосодержащей пальцеобразной области, ингибирование ТАТ, ингибирование интегразы либо иным ингибирующим действием. Следует отметить тот факт, что каждое из вышеуказанных средств, без ограничения, может приниматься в сочетании с любым одним или несколькими соединениями в соответствии с настоящим изобретением без образования химических связей. Термин эффективный используется в настоящем описании, если не указано иначе, для описания количества соединения, которое в контексте используется для получения или достижения намеченного результата независимо от того, относится ли этот результат к лечению состояния вирусного заболевания,расстройства или состояния, связанного с вирусным заболеванием, или, в альтернативном случае, используется для получения другого соединения, средства или состава. Данный термин включает все другие термины эффективного количества или эффективной концентрации, которые, так или иначе, описываются в настоящей заявке. Термин пациент используется в тексте описания изобретения для описания животного, в основном млекопитающего и предпочтительно человека, которому предоставляется лечение, включая профилактическое лечение с использованием составов в соответствии с настоящим изобретением. Для лечения указанных инфекций, состояний или болезненных состояний, являющихся специфическими для конкретного животного, например пациента-человека, термин пациент относится к этому специфическому животному. Термин вирус используется для описания всех типов вирусов, рост или репликация которых могут быть ингибированы либо болезненные состояния которых могут быть излечены с использованием одного или нескольких способов в соответствии с настоящим изобретением. Вирусы, которые могут быть излечены в соответствии с настоящим изобретением, включают, например, наряду с другими, вирусы 1 и 2 иммунодефицита человека (ВИЧ-1 и ВИЧ-2), вирусы 1 и 2 Т-клеточного лейкоза человека(HTLV-1 и HTLV-2), респираторный синтициальный вирус (RSV), вирус папилломы человека (HPV),аденовирус, вирус гепатита В (HBV), вирус гепатита С (HCV), вирус Эпштейна-Барра (EBV), вирус ветряной оспы-опоясывающего герпеса (VZV), цитомегаловирус (CMV), вирусы 1 и 2 простого герпеса(HSV-1 и HSV-2), вирус герпеса человека 8 (HHV-8, также известного как вирус, сопутствующий саркоме Капоши) и флавивирусы, включающие вирус желтой лихорадки, вирус лихорадки денге, вирусы японского энцефалита и вирусы лихорадки Западного Нила. Термин вирус иммунодефицита человека используется для описания вируса иммунодефицита человека (ВИЧ) и его инфекций, при этом термин включает как вирус 1 иммунодефицита человека (ВИЧ 1), так и вирус 2 иммунодефицита человека (ВИЧ-2). Термин вирус Т-клеточного лейкоза человека используется для описания вируса Т-клеточного лейкоза человека и его инфекций, при этом термин охватывает как вирус 1 Т-клеточного лейкоза человека (HTLV-1), так и вирус 2 Т-клеточного лейкоза человека (HTLV-2). Термин вирус гепатита В (HBV) используется для описания вируса (вируса сывороточного гепатита), вызывающего вирусный гепатит типа В у человека. Это вирусное заболевание с длительным инку-6 012844 бационным периодом (от 50 до 160 дней) в противоположность вирусу гепатита А (вирус инфекционного гепатита), характеризующегося коротким инкубационным периодом. Вирус обычно передается при инъекции зараженной крови или производных крови или путем использования зараженных шприцевых игл,ланцетов или иных инструментов. Клинически и патологически заболевание аналогично вирусному гепатиту А, тем не менее отсутствует перекрестный иммунитет. После инфекции в сыворотке находится вирусный антиген (HBAg). Термин вирус простого герпеса (HSV) используется в описании изобретения для описания HSV1 и HSV2, которые являются вирусными возбудителями инфекций герпеса, включая инфекции генитального герпеса. Термин вирус гепатита С (HCV) используется по всему тексту описания изобретения для описания вируса гепатита, который является вирусным возбудителем неинфекционного и несывороточного гепатита А, В. Заболевание в острой стадии в целом протекает в более легкой форме, чем гепатит В, но значительная часть таких инфекций переходит в хроническое заболевание. Термин вирус Эпштейна-Барра (EBV) используется в описании изобретения для описания герпетовируса, найденного в клеточных культурах лимфомы Беркитта. EBV является возбудителем инфекционного мононуклеоза, а также ряда других сопутствующих состояний/болезненных состояний, включающих лимфомы, связанные с EBV. Термин вирус ветряной оспы-опоясывающего герпеса (VZV) используется для описания Herpesvirus Varicellae, также известного как ветряная оспа или опоясывающий герпес. Ветряная оспа возникает от первичной инфекции вирусом; опоясывающий герпес возникает в результате вторичной инвазии, вызванной аналогичной или реактивационной инфекцией, которая во многих случаях являлась латентной в течение ряда лет. Как первичная, так и вторичная инфекции VZV могут быть излечены с использованием составов в соответствии с настоящим изобретением. Термин респираторный синтициальный вирус (RSV) используется по всему тексту описания изобретения для описания РНК-содержащего вируса семейства Pneunnovirus, вызывающего легкую респираторную инфекцию с ринитом и кашлем у взрослых, но способного вызвать бронхит и бронхопневмонию у детей младшего возраста. Вирус получил это название в связи с тенденцией формирования синцития в тканевой культуре. Термин аденовирус используется по всему тексту описания изобретения для описания вируса семейства adenoviridae, являющегося вирусом, который содержит двунитевую ДНК и который инфицирует млекопитающих и птиц. Вирион составляет 70-90 нм в диаметре и является безоболочным. Вирус развивается в ядрах инфицированных клеток. Для его выделения требуются культуры тканей, так как лабораторные животные не восприимчивы к явной инфекции. Семейство включает два класса: Mastadenovirus иAcviadenovirus. Термин вирус герпеса человека 8 (HHV-8) используется по всему тексту описания изобретения для описания герпетовируса, который, как считается, является возбудителем саркомы Капоши у больных СПИДом. Термин вирус папилломы человека (HPV) используется по всему тексту описания изобретения для описания вируса, вызывающего остроконечные кондиломы. Также известный как инфекционный вирус остроконечных кондилом HPV является универсальной общей рецидивирующей вирусной инфекцией с большим количеством серотипов. Инфекция HPV может привести к образованию остроконечных кондилом, которые, в свою очередь, могут вызвать генитальный и/или пришеечный рак. Остроконечные кондиломы, вызванные HPV типа 1, 2, 6, 11, 16 и 18 обычно передаются половым путем и нередко связаны с пришеечным и/или генитальным раком. HPV может развиться и вызвать аденопапиллярную опухоль или остроконечную кондилому, представляющую собой скрытую доброкачественную эпителиальную опухоль, выступающую над окружающей поверхностью. Обычно она представляет собой скрытую эпителиальную неоплазму, состоящую из ворсинчатых или древовидных выростов сосудистоволокнистой стромы, покрытой неопластическими клетками. Термин флавивирус используется по всему тексту описания изобретения для описания вирусов рода Flavivirus семейства Togaviridae. В соответствии с систематикой вирусов около 50 вирусов, включая вирус гепатита С (HCV), вирус желтой лихорадки, вирус лихорадки денге, вирус японского энцефалита,вирус лихорадки Западного Нила и сопутствующие флавивирусы относятся к этому роду. Вирусы, относящиеся к роду Flavivirus, просто называются флавивирусами. Эти вирусы в прошлом классифицировались как группа В арбовирусов. Флавивирусы являются возбудителями инфекционного заболевания и превалируют в Восточной, Юго-Восточной Азии и Африке, хотя они также могут быть обнаружены в других частях мира. Термин вирус желтой лихорадки используется для описания флавивируса, являющегося возбудителем желтой лихорадки. Желтая лихорадка является переносимым москитами вирусным гепатитом, вызываемым вирусом желтой лихорадки (YFV), с городской формой, передаваемой Aedes aegypti, и сельской, джунглевой и лесной формой, разносимой различными москитами видового комплекса Haemagogus от обитающих не деревьях млекопитающих. Клинически желтая лихорадка характеризуется высокой температурой, замедленным пульсом, протеинурией, желтухой, отечностью лица, геморрагией, в-7 012844 частности гематимезисом (кровавой рвотой). Желтая лихорадка приводит к летальному исходу приблизительно в 5-10% случаев. Термин вирус лихорадки денге используется по всему тексту описания изобретения для описания флавивируса, являющегося возбудителем лихорадки денге/геморрагической лихорадки денге. Лихорадка денге является заболеванием тропических и субтропических регионов, возникающим эпидемически и вызываемым вирусом денге, одним из группы арбовирусов, вызывающих синдром геморрагической лихорадки. Заболевание имеет четыре степени тяжести: степень I - повышенная температура и конституциональные симптомы, степень II - степень I плюс самопроизвольное кровотечение (кожи, десен и желудочно-кишечного тракта), степень III - степень II плюс тревожное возбуждение и нарушение кровообращения и степень IV - глубокий шок. Заболевание передается москитом рода Aedes (обычно A. aegyptil, но часто A. albopictzis). Болезнь также имеет названия Аден, букет, костолом, денди, дейт, денге (геморрагический) или полька, солнечная лихорадка, кривошейная лихорадка, ревматическая скарлатина или арторозная экзантема. Геморрагическая лихорадка денге является более патогенной эпидемической формой лихорадки денге, вспышки которой произошли в тихоокеанском регионе за последние годы. Термин фармацевтически приемлемая соль используется по всему тексту описания изобретения для описания формы соли одного или нескольких составов (и в исключительно предпочтительных примерах в соответствии с настоящим изобретением - фосфатные соли), которые предназначены для повышения растворимости соединения в соляном растворе для парентерального приема или в желудочном соке желудочно-кишечного тракта пациента с целью содействия растворению и бионакоплению соединений. Фармацевтически приемлемые соли включают соли, полученные из фармацевтически приемлемых неорганических или органических оснований и кислот. Приемлемые соли включают соли, полученные из таких щелочных металлов, как калий и натрий, таких земельно-щелочных металлов как кальций,магний и соли аммония, наряду с другими многочисленными кислотами, хорошо известными в фармацевтической области. Соли натрия и калия являются исключительно предпочтительными в качестве нейтрализующих солей карбоновых кислот и свободных кислых фосфатов, содержащих составы в соответствии с настоящим изобретением. Термин соль означает любую соль, совместимую с использованием соединений в соответствии с настоящим изобретением. В том случае, если соединение используется в фармацевтических показаниях, включая лечение неоплазий, в том числе рака, термин соль означает фармацевтически приемлемую соль совместимую с использованием соединений в качестве фармацевтических средств. Термин фармацевтически приемлемое производное используется по всему тексту описания изобретения для описания любой фармацевтически приемлемой формы пролекарства (например, сложного эфир или простого эфира или другой группы пролекарств), которая при введении пациенту прямо или косвенно обеспечивает получение настоящего соединения или активного метаболита настоящего соединения. Термин алкил в рамках своего контекста обозначает С 1-С 20, предпочтительно С 1-С 10 линейный, с разветвленной цепью или циклический полностью насыщенный углеводородный радикал. Термин простой эфир означает эфирную группу С 1-С 20, образованную из кислорода и алкильной группы в положении на сахарной части соединения в соответствии с настоящим изобретением, либо, в альтернативном случае, также может содержать по меньшей мере одну кислородную группу в алкильной цепи. Термин ацил используется по всему тексту описания изобретения для описания группы в положении 5' нуклеозидного аналога (т.е. в положении свободного гидроксила в синтоне сахара), содержащего С 1-С 20 линейную, разветвленную или циклически алкильную цепь. Ацильная группа в положении 5' в сочетании с 5'-гидроксильной группой образует сложный эфир, который после введения может быть расщеплен с образованием свободной нуклеозидной формы в соответствии с настоящим изобретением. Ацильные группы в соответствии с настоящим изобретением представлены структурой где R4 обозначает С 1-С 20 линейную, разветвленную или циклическую алкильную группу, алкиксиалкил,арилоксиалкил, например феноксиметил, арил, алкокси и т.д. Предпочтительными ацильными группами являются группы, в которых R4 является С 1-С 10 алкильной группой. Ацильные группы, в соответствии с настоящим изобретением, также включают, например, ацильные группы, полученные из бензойной кислоты и родственных кислот, 3-хлорбензойную кислоту, янтарную, каприновую и капроновую, лауриновую, миристиновую, пальмитиновую, стеариновую и олеиновую группы, наряду с многочисленными другими, включая мезилатные группы. Специалисты в данной области смогут определить, что ацильные группы, которые используются в настоящем изобретении, можно применять либо для синтеза целевых фармацевтических соединений, либо в качестве форм пролекарственных форм нуклеозидов в соответствии с настоящим изобретением. Термин эфир фосфорной кислоты, или фосфодиэфир, используется по всему тексту описания изобретения для описания монофосфатных групп в положении 5' диоксанильной части или синтона са-8 012844 хара, которые диестерифицируют таким образом, чтобы фосфатная группа стала нейтральной, т.е. имела нейтральный заряд. Эфиры фосфорной кислоты, используемые в настоящем изобретении, включают эфиры, представленные структурами нуклеозид где R5, R6 и R" выбирают из С 1-С 20 линейной, разветвленной или циклической алкильной группы, алкоксиалкила, арилоксиалкила, например феноксиметила, арила и алкокси наряду с другими, a R7 обозначает С 1-С 20 линейную, разветвленную или циклическую алкильную или ацильную группу, алкоксиалкил, арилоксиалкил, например феноксиметил, арил и алкокси наряду с другими. Предпочтительными эфирами монофосфорной кислоты для использования в пролекарственных формах в соответствии с настоящим изобретением являются эфиры, в которых R5 является С 1-С 20 линейной или с разветвленной цепью алкильной группой, более предпочтительно, С 1-С 3 алкильной группой. Термин защитная группа или блокирующая группа означает в данном контексте химическую группу или часть, используемую для предотвращения реакции в данной схеме реакции активной части,например аминовой, гидроксильной или меркаптогруппы, и которая легко удаляется при мягких условиях, которые не оказывают нежелательного неблагоприятного воздействия на молекулу или соединение, к которой присоединена защитная группа. В настоящем изобретении многочисленные защитные группы могут использоваться для получения соединений в соответствии с настоящим изобретением, причем предпочтительные группы включают бензоатную группу для защиты или блокировки первичной или вторичной гидроксильной группы и силильных групп (в частности, третичную бутидиметилсилильную группу, третичную бутилдифинилсилильную группу или триметилсилильную группу или родственную силильную защитную группу) для блокировки первичных (или вторичных) гидроксильных групп. Специалисты в данной области техники определят различные защитные группы, которые могут быть использованы в контексте при получении соединений и промежуточных соединений в соответствии с настоящим изобретением. Термин ингибирующая эффективная концентрация или ингибирующее эффективное количество используется по всему тексту описания изобретения для описания концентраций и количеств соединений в соответствии с настоящим изобретением, которые существенно или значительно тормозят рост или репликацию (размножение) восприимчивых вирусов, в частности, включающих наряду с другими вирусы 1 и 2 иммунодефицита человека (ВИЧ-1 и ВИЧ-2), вирусы 1 и 2 Т-клеточного лейкоза человека(HTLV-1 и HTLV-2), респираторный синтициальный вирус (RSV), вирус папилломы человека (HPV),аденовирус, вирус гепатита В (HBV), вирус гепатита С (HCV), вирус Эпштейна-Барра (EBV), вирус ветряной оспы-опоясывающего герпеса (VZV), цитомегаловирус (CMV), вирусы 1 и 2 простого герпеса(HSV-1 и HSV-2), вирус герпеса человека 8 (HHV-8, также известного как вирус, сопутствующий саркоме Капоши) и флавивирусы, включающие вирус желтой лихорадки, вирус лихорадки денге, вирусы японского энцефалита и вирусы лихорадки Западного Нила. Термин профилактическое эффективное количество используется по всему тексту описания изобретения для описания концентраций и количеств соединений в соответствии с настоящим изобретением, являющихся профилактически эффективными в предотвращении, снижении вероятности инфекции или замедления наступления инфекций у пациентов, вызванных наряду с другими вирусами 1 и 2 иммунодефицита человека (ВИЧ-1 и ВИЧ-2), вирусами 1 и 2 Т-клеточного лейкоза человека (HTLV-1 иHTLV-2), респираторным синтициальным вирусом (RSV), вирусом папилломы человека (HPV), аденовирусом, вирусом гепатита В (HBV), вирусом гепатита С (HCV), вирусом Эпштейна-Барра (EBV), вирусом ветряной оспы-опоясывающего герпеса (VZV), цитомегаловирусом (CMV), вирусами 1 и 2 простого герпеса (HSV-1 и HSV-2), вирусом 8 герпеса человека (HHV-8, также известного как вирус, сопутствующий саркоме Капоши) и флавивирусами, включающими вирус желтой лихорадки, вирус лихорадки денге,вирусы японского энцефалита и вирусы лихорадки Западного Нила. Соединения в соответствии с настоящим изобретением могут использоваться в фармацевтических составах, обладающих биологической/фармакологической активностью для лечения, например, вирусных инфекций, а также ряда иных заболеваниях и/или болезненных состояний, которые могут быть побочно вызваны вирусной инфекцией, в частности, СПИДом. Указанные составы включают эффективное-9 012844 количество одного или нескольких соединений, описание которых приведено выше в настоящем патенте,произвольно в сочетании с фармацевтически приемлемой добавкой, носителем или инертным наполнителем. Составы в соответствии с настоящим изобретением могут изготавливаться обычным способом с использованием одного или нескольких фармацевтически приемлемых носителей. Фармацевтически приемлемые носители, которые могут быть использованы в указанных фармацевтических составах,включают иониты, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси частичного глицерида насыщенных растительных жирных кислот, воды, соли или электролитов, таких как сульфат проламина, фосфороводород динатрия, фосфороводород калия, хлорид натрия, соли цинка, коллоидальный диоксид кремния, трисиликат магния, поливинилпирролидол, вещества на основе целлюлозы, полиэтиленовый спирт, карбоксиметил целлюлоза натрия, полиакрилаты, воски,полиэтилен - полиоксипропилен - блок-сополимеры, полиэтиленгликоль и ланолин, но не ограничиваются ими. Составы в соответствии с настоящим изобретением можно вводить орально, парентерально, путем ингаляционных спреев, локально, ректально, назально, буккально, вагинально или с помощью имплантированной емкости. Термин парентеральный в соответствии со значением, используемым в настоящем описании, включает подкожные, внутривенные, внутримышечные, внутрисуставные, внутрисиновиальные, внутристернальные, внутритекальные, внутригепатические, внутрилезиональные и внутрикраниальные способы инъекции или инфузии. Предпочтительно составы принимаются орально и внутриперетониально или внутривенно. Стерильные инъекционные формы составов в соответствии с настоящим изобретением могут быть водными или маслянистыми суспензиями. Эти суспензии могут быть изготовлены в соответствии со способами, известными в данной области техники, с применением приемлемых диспергирующих или смачивающих веществ и суспендирующих агентов. Стерильные инъекционные препараты могут также быть стерильным инъекционным раствором или суспензией в нетоксичном парентерально приемлемым разбавителем или растворителем, например, раствором в 1,3-бутанэдиоле. Среди приемлемых разбавителей и растворителей может быть использована вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные жидкие жиры обычно используются в качестве растворителя или суспендирующей среды. Для этой цели может быть использован любой мягкий жидкий жир, включая синтетические моно или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные являются приемлемыми для подготовки инъекционных препаратов, также как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, в частности их полиоксиэтилированные варианты. Растворы или суспензии этих масел могут также содержать длинноцепной спиртовый разбавитель или диспергатор, например Ph. Helv или аналогичный спирт. Фармацевтические составы в соответствии с настоящим изобретением можно вводить орально в любой орально приемлемой дозированной форме, включая капсулы, таблетки, водные суспензии или растворы, но не ограничиваясь ими. В случае таблеток для орального приема широко используемые носители включают лактозу или кукурузный крахмал. Обычно также добавляются смазывающие вещества,например стеарат магния. Для орального приема в виде капсул эффективные разбавители включают лактозу и высушенный кукурузный крахмал. При оральном приеме в виде водных суспензий активные ингредиенты смешиваются с эмульгаторами и суспендирующими агентами. При необходимости также могут быть добавлены определенные подсластители, ароматизаторы или красители. Кроме того, фармацевтические составы в соответствии с настоящим изобретением можно вводить в форме свеч для ректального приема. Эти свечи могут быть изготовлены путем смешивания реагента с приемлемым нераздражающим наполнителем, затвердевающим при комнатной температуре, но превращающийся в жидкость при ректальной температуре и, таким образом, расплавляются в прямой кишке для высвобождения лекарственного препарата. Такие материалы включают какао-масло, пчелиный воск и полиэтиленгликоли. Фармацевтические составы по настоящему изобретению можно также вводить местно, в частности,если объект лечения включает зоны или органы, доступные для местного применения, включая заболевания глаз, кожи или нижнего пищеварительного тракта. Приемлемые составы для местного применения можно легко приготовить для каждой из этих зон или органов. Местное применение для нижней части пищеварительного тракта может быть осуществлено в виде ректальных свечей (см. выше) или в виде приемлемой клизмы. Также могут быть использованы местно наносимые трансдермальные пластыри. Для местного применения фармацевтические составы могут быть изготовлены в виде приемлемой мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Носители для местного введения соединений в соответствии с настоящим изобретением включают минеральное масло, жидкий вазелин, медицинский вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульгирующий воск и вода, но не ограничены ими. В альтернативном случае фармацевтические составы могут быть изготовлены в виде приемлемого бальзама или- 10012844 крема, содержащего активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически приемлемых носителях. Приемлемые носители включают минеральное масло, сорбитанмоностеарат, полисорбат 60, воск цетилового эфира, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду, но не ограничиваются ими. Для офтальмического применения фармацевтические составы могут быть изготовлены в виде тонкоизмельченных суспензий в изотоническом, рН отрегулированном стерильном соляном растворе или предпочтительно в виде растворов в изотоническом, рН отрегулированном стерильном соляном растворе, либо с консервантом, таким как, например, хлорид бензилалкония. Кроме того, для офтальмического применения могут быть изготовлены фармацевтические составы на основе мази, например вазелина. Фармацевтические составы в соответствии с настоящим изобретением также могут вводиться в виде назальной аэрозоли или путем ингаляции. Такие составы изготавливаются в соответствии со способами, хорошо известными в области изготовления фармацевтических составов и могут быть изготовлены в виде растворов в соляном растворе с использованием бензилового спирта или иных приемлемых консервантов, активаторов всасывания с целью повышения бионакопления, фтороуглеродов и/или иных обычных растворителей и диспергаторов. Количество нового нуклеозида в соответствии с настоящим изобретением, которое может сочетаться с материалами носителя для получения единичной дозовой формы, изменяется в зависимости от организма-хозяина, проходящего лечения, и конкретного режима приема. Предпочтительно составы должны изготавливаться таким образом, чтобы доза в диапазоне примерно 0,01-150, предпочтительно примерно 0,5-25 мг/кг веса пациента в день нового нуклеозида была введена пациенту, получающему эти составы. Специалистам в данной области также должно быть понятно, что конкретная доза и режим лечения,назначенные любому конкретному пациенту, зависят от множества факторов, включая активность конкретного примененного соединения, возраст, вес, общее состояние здоровья, пол, питание, время приема,скорость выделения, сочетание лекарств, заключение лечащего врача и тяжесть конкретного заболевания или состояния, в отношении которого применяется лечение. Введение активного соединения может включать как непрерывный прием (внутривенное капельное введение), так и несколько оральных приемов в день (например, четыре раза в день) и могут включать оральные, местные, парентеральные, внутримышечные, внутривенные, подкожные, трансдермальные(которые могут включать промотор всасывания), буккальные, суппозитарные и иные способы введения. Таблетки с энтеросолюбильным покрытием для орального применения также могут использоваться для повышения бионакопления соединений при оральном способе приема. Наиболее эффективная форма дозировки зависит от фармакокинетики конкретного выбранного реагента, а также от тяжести заболевания пациента. Оральная форма дозировки является исключительно предпочтительной ввиду легкости введения и перспективного благоприятного соблюдения больным режима и схемы лечения. Для подготовки фармацевтических составов в соответствии с настоящим изобретением терапевтически эффективное количество одного или нескольких соединений в соответствии с настоящим изобретением предпочтительно однородно примешивается к фармацевтически приемлемому носителю в соответствии с известными способами фармацевтического приготовления лекарственного средства для получения дозы. Носитель может иметь большое разнообразие форм в зависимости от формы препарата, требуемого для введения, например, орального или парентерального. При подготовке фармацевтических составов в форме оральной дозы может быть использована любая из обычных фармацевтических сред. Таким образом, для жидких оральных препаратов, таких как суспензии, эликсиры и растворы, могут быть использованы приемлемые носители и добавки, включающие воду, гликоли, масла, спирты, ароматизаторы, консерванты, красители и т.п. Для твердых оральных препаратов, таких как порошки, таблетки, капсулы и для твердых препаратов, таких как свечи, могут быть использованы приемлемые носители и добавки, включающие крахмалы, сахарные носители, такие как декстроза, маннитол, лактоза и родственные носители, разбавители, грануляторы, смазочные вещества, связывающие вещества, дезинтеграторы и т.п. При необходимости таблетки или капсулы могут иметь энтеросолюбильное покрытие для постоянного выделения лекарственных препаратов с использованием стандартных способов. Использование указанных форм дозировки может существенно повысить бионакопление соединений в организме пациента. Для парентеральных составов носитель обычно включает стерильную воду или водный раствор хлорида натрия, хотя также могут быть включены другие ингредиенты, способствующие дисперсии. Без сомнения, в тех случаях, когда предусматривается использование стерильной воды и сохранение ее стерильности, составы и носители также должны подвергнуться стерилизации. Также могут быть изготовлены инъекционные суспензии, и в этом случае могут быть использованы соответствующие жидкие носители, суспендирующие агенты и т.п. Липосомные суспензии (включая липосомы, нацеленные на вирусные антигены) также могут быть изготовлены с использованием известных способов с целью получения фармацевтически приемлемых носителей. Это может быть приемлемым для доставки свободных нуклеозидов, ацил/алкилнуклеозидов или пролекарственных форм эфира фосфорной кислоты нуклеозидных соединений в соответствии с настоящим изобретением.- 11012844 В исключительно предпочтительных примерах осуществления в соответствии с настоящим изобретением соединения и составы используются для лечения вирусных инфекций млекопитающих, в частности ВИЧ-инфекции, инфекции вируса гепатита В, инфекции вируса 1 и/или 2 простого герпеса, инфекции вируса Эпштейна-Барра, инфекции вируса 8 герпеса человека и флавивирусные инфекции. В предпочтительных примерах осуществления соединения используются для лечения ВИЧ-инфекций, инфекций вируса 1 и/или 12 простого герпеса, инфекций вируса гепатита В, инфекций вируса Эпштейна-Барра или инфекций вируса 8 гепатита человека, в частности ВИЧ-инфекций у людей. Предпочтительно для лечения, профилактики или замедления наступления вирусной инфекции предусматривается введение составов в форме оральной дозы в количествах от приблизительно 250 мкг до приблизительно 500 мг или более, как минимум один раз в день, предпочтительно до 4 раз в день в пределах дозировок, используемых для терапевтического лечения. Указанные соединения предпочтительно вводятся орально, но могут быть введены парентерально, местно, в виде свечей или иной форме. Соединения в соответствии с настоящим изобретением ввиду их низкой токсичности для клетокхозяина могут быть с успехом профилактически применены для предотвращения вирусной инфекции или предотвращения возникновения клинических симптомов, связанных с вирусной инфекцией, например, СПИДа, являющийся вторичным от ВИЧ. Таким образом, настоящее изобретение охватывает способы профилактического лечения (предотвращения, снижения вероятности или замедления наступления) вирусных инфекций и, в частности, ВИЧ и, в частности, состояний, возникающих вторично от указанного вируса. В этой особенности в соответствии с настоящим изобретением указанные составы используются для предотвращения, снижения вероятности или замедления наступления вирусной инфекции, в частности ВИЧ, или связанной с таким состоянием, как СПИД. Этот профилактический метод включает введение пациенту, нуждающемуся в таком лечении, или пациенту, находящемуся под угрозой приобретения ВИЧ, количества соединения в соответствии с настоящим изобретением, являющегося эффективным для устранения, предотвращения или замедления наступления вирусной инфекции. При профилактическом лечении в соответствии с настоящим изобретением предпочтительно, чтобы используемое противовирусное соединение обладало максимально низкой токсичностью и, предпочтительно, являлось нетоксичным для пациента. Исключительно предпочтительным в данной особенности настоящего изобретения является то, что используемое соединение должно быть максимально эффективным против вируса и должно характеризоваться минимальной токсичностью для пациента. Соединения в соответствии с настоящим изобретением для профилактического лечения вирусных инфекций могут вводиться в одном и том же диапазоне доз для терапевтического лечения (как описывалось выше) в качестве профилактического агента для предотвращения распространения вирусной инфекции или, в альтернативном случае, для замедления наступления вирусной инфекции или снижения вероятности заражения вирусной инфекцией, проявляющейся в клинических симптомах. Кроме того, соединения в соответствии с настоящим изобретением можно вводить отдельно или в сочетании с другими средствами, включая другие соединения в соответствии с настоящим изобретением. Определенные соединения в соответствии с настоящим изобретением могут являться эффективными для повышения биологической активности некоторых средств в соответствии с настоящим изобретением путем снижения метаболизма, катаболизма или инактивирования других соединений и, как таковые, вводятся совместно для достижения этого планируемого эффекта. Как указывалось, соединения в соответствии с настоящим изобретением можно вводить по отдельности или в сочетании с другими противовирусными реагентами для лечения вирусных инфекций, как описывается в настоящем изобретении, в частности, включающими другие соединения в соответствии с настоящим изобретением или соединения, которые применяют для лечения ВИЧ или флавивирусных инфекций, включая соединения, используемые в настоящее время для лечения ВИЧ, такие как ингибиторы нуклеозидной обратной транскриптазы (NRTI), ингибиторы ненуклеозидной обратной транскриптазы, ингибиторы протеазы, ингибиторы синтеза и т.д., характерные соединения которых могут, например,включать 3 ТС (Ламивудин), AZT (Зидовудин), (-)-FTC, ddI (Диданозин), ddC (зальцитабин), абакавир(ABC), тенофовир (РМРА), D-D4FC (Реверсет), D4T (Ставудин), Рацивир, L-FddC, L-D4FC, NVP (Невирапин), DLV (Делавирдин), EFV (Ефаверенц), SQVM (Сахинавир мезилат), RTV (Ритонавир), IDV (Индинавир), SQV (Сахинавир), NFV (Нельфинавир), APV (Ампренавир), LPV (Лопинавир), такие ингибиторы синтеза, как Т 20, наряду с фузеоном и его смесями, включая соединения против ВИЧ, проходящие в настоящее время клинические испытания или находящиеся на стадии разработки, а также соединения,описанные inter alia в патентах США 6240690; 6316505; 6316492; 6232120; 6180604; 6114327; 5891874; 5821242; 5532215; 5491135; 5179084 и 4880784, соответствующие части которых включены в данный патент со ссылкой на них. Настоящее изобретение далее описывается в целях иллюстрации на следующих примерах. Специалистам в данной области техники понятно, что указанные примеры ни в коей мере не являются ограничивающими и что могут быть внесены различные изменения, не выходящие за пределы существа и объема настоящего изобретения. Химия. Новые соединения в соответствии с настоящим изобретением в основном получены в соответствии- 12012844 с общим описанием синтеза, приведенном на фиг. 4-7 С. Остальные соединения могут быть легко синтезированы по аналогии. Как правило, первоначально получают аналог нуклеозида (т.е. соединение, содержащее основание и синтон сахара), а далее вводится соответствующая 4'-группа в соответствии с общим описанием по схемам А и В и с описанием экспериментов. Специалисты в данной области техники смогут легко синтезировать соединения в соответствии с настоящим изобретением по аналогии, исходя из синтеза, описанного в экспериментах, не занимаясь чрезмерным экспериментированием. Как указано на фиг. 4, 5'-йодо, 3'-О-блокированный 2'-дезоксинуклеозид преобразуется в 4',5'-винил блокированный нуклеозид 2, который далее преобразуется, проходя серию этапов, через 4',5'-оксиран блокированный нуклеозид 4 в 4'-винил соединение TDK-4-152. Как показано на фиг. 5, TKD-4-114 синтезируется из 5'-йодо-3'-О-блокированного нуклеозидного соединения 7 путем формирования 4',5'-винил соединения 8, введения этинильной группы в положение 4'-блокированного нуклеозида для получения нуклеозида 10 а и далее, в конечном счете, путем формирования 2',3'-ненасыщенной двойной связи за счет ликвидации мезилированной гидроксильной группы в положении 3' соединения 13. Другие соединения в соответствии с настоящим изобретением синтезируют по аналогии с использованием вышеописанных химических схем. На фиг. 5 А приведен альтернативны синтез TDK-4-114 из промежуточного химического соединения 9 на фиг. 5. В этом примере изобретения промежуточное химическое соединение 9 вступает в реакцию с бензоатом свинца Pb(OCOPh)4 или тетраацетатом свинца Pb(OAc)4 в основании для удаления примесей, таком как триетиламин, диизопропилэтиламин или пиридин в соответствующем растворителе для получения 4',5'-диацил (бензоил или ацетил) блокированного нуклеозида 2 (фиг. 5 А), в зависимости от используемого свинцового (Pb) ацилирующего реагента. Введение 4'-этинил группы происходит через промежуточный блокированный нуклеозид 2 за счет действия реагента ацетилена алюминия EtAl(Cl)CSiMe3 (см. фиг. 5 А) в растворителе для получения 4'-ацетиленнуклеозидного соединения 3 (фиг. 5 А). Синтез TKD-4-114 протекает непосредственно путем удаления мезилированной гидроксильной группы для образования 4'-этинил-2',3' ненасыщенного нуклеозидного соединения 7. Следует отметить, что промежуточное химическое соединение 3 на фиг. 5 А (и 5 В) может в альтернативном случае быть синтезировано из 4',5'-винил блокированного нуклеозидного соединения 1 на фиг. 5 А и 5 В (идентичного соединению 9 на фиг. 5) в двухэтапной реакции, в результате которой получают ди-О-бензоил соединение 3 (или ди-О-ацетил) на фиг. 5 В с использованием первого этапа йода и бензоата серебра (ацетат серебра) в растворителе для получения промежуточного химического соединения 2 (фиг. 5 В), которое далее может вступить в реакцию с бензоатом серебра (ацетатом серебра) в растворителе при повышенной температуре для получения промежуточного химического соединения 3 (или ди-О-ацетил соединения по аналогии). Схема химического синтеза на фиг. 6 является примером синтеза ненасыщенного углеродноциклического аналога KMA-23-153 (фиг. 6) из сложного эфира циклопентанона 1 (фиг. 6), который проходит через ряд промежуточных химических соединений и образует промежуточное химическое соединение 8 (фиг. 6), которое может быть концентрировано нуклеозидным основанием для получения промежуточного химического соединения 9, в котором 4'-сложный эфир может быть преобразован в 4'этинил соединение 10 с последующим удалением 5'-блокирующей группы для получения KMA-23-153. На фиг. 7 А приведен химический синтез 4'-этинил-2'-дезоксинуклеозидных соединений, исходя из общего способа Nomura, et al., J. Med. Chem., 42,2901-2908 (1999) путем введения галогенированной виниловой группы в положении 4' нуклеозида, который подвергается дегидрогалогенированию и образует 4'-этинилнуклеозидного соединение 8 (фиг. 7 А). На фиг. 7 В приведен синтез 4'-этинил-2'дезоксинуклеозида из доступного предшественника сахара 9 (фиг. 7 В), который протекает путем введения 4'-галогенированной виниловой группы в 4'-формиловую группу синтона сахара 10 для получения 11(фиг. 7 В) с последующим дегидрогалогенированием, введением нуклеозидного основания и, в конечном счете, преобразованием 2'-гидроксильной группы через ряд этапов и получением соединения 18. На схеме 3 на фиг. 7 С показано введение 2',3'-двойной связи в аналог 4'-этинила путем мезилирования 3'ОН группы с последующей реакцией мезилированного промежуточного химического соединения с сильным основанием для получения двойной связи в положении 2', 3' сахара. Специалисты в данной области техники могут легко получить соединения в соответствии с настоящим изобретением, следуя одному или нескольким из вышеописанных способов синтеза и используя установившиеся в данной области техники способы синтеза. Конкретные примеры Химический синтез в соответствии со схемами А и В на фиг. 5 и 6. Синтез TKD-4-152 (фиг. 4).TKD-4-152 (4'-аллилтимидин) был синтезирован путем проведения серии реакций, приведенных на фиг. 5, схема А, начиная от соединения 1, которое было изготовлено в соответствии с опубликованной процедурой: J.P.H. Verheyden и J.G. Moffatt, J. Org. Chem., 39, 3573-3579 (1974). 1-[3-О-(t-Бутилдиметилсилил)-2,5-дидезоксиD-глицеро-pent-4-энофуранозил]тимин (3). К раствору соединения 1 (11,9 г, 30,19 ммоль) в CH3CN (150 мл) добавляли ДБН (ди-N-бутил- 13012844 нитрозамин (ДБН) (11,2 мл, 90,57 ммоль) при температуре 0 С в атмосфере аргона и смесь перемешивали при комнатной температуре в течение ночи. После нейтрализации путем добавления АсОН реакционную смесь выпаривали до получения сухого остатка и остаток разделяли между CHCl3/насыщенным водным раствором NaHCO3 (200 мл 2/50 мл). Путем силикагелевой колоночной хроматографии(гексан/AcOEt=5/1-1/2) органического слоя получали 2 (6,98 г, 87%) в виде пены. Соединение 2 (6,90 г,25,92 ммоль) обрабатывали насыщенным NH3 в МеОН (350 мл) в течение ночи при температуре 0 С. Реакционную смесь выпаривали до получения сухого остатка, который высушивали в течение ночи под вакуумом. К раствору DMF (N,N-диметил-формамид (ДМФ (60 мл) остатка добавляли имидазол (5,29 г,77,75 ммоль) и трет-бутилдиметилсилилхлорид (7,81 г, 51,83 ммоль) при 0 С в атмосфере аргона и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разделяли междуAcOEt/H2O (300 мл/100 мл 5). После силикагелевой колончатой хроматографии (гексан/AcOEt=10/1-3/1) органического слоя получали соединение 3 (7,87 г, 90%) в виде пены:FAB-MS m/z 339 (MH). Аналогично рассчитано для C16H26N2O4Si: С, 56,78; H, 7,74; N, 8,28. Обнаружено: С, 57,04; Н, 7,99;N, 8,14. 3'-О-(t-Бутилдиметилсилил)тимидин 4',5'-эпоксид (4). К раствору соединения 3 (20 мг, 0,059 ммоль) в CH2Cl2 (3 мл) добавляли диметилдиоксиран (0,072 М в ацетоне, 1,2 мл, 0,089 ммоль) при -30 С в атмосфере аргона и перемешивали реакционную смесь в течение 30 мин при -30 С. Выпаривание растворителей позволило получить соединение 4 в виде твердого вещества: 1 Н ЯМР (CDCl3)0,09, 0,10 (6 Н, каждый как s, SiMe), 0,90 (9 Н, s, SiBu-t), 1,95 (3 Н, d, J6,Me=1,3 Hz,Me), 2,25 (1H, ddd, Jgem=14,0 Hz, J2'a,3'=4,9 Hz и J1,2'a=7,1 Hz, H-2'a), 2,52 (1H, ddd, Jgem=14,0 Hz, J2'b,3'=1,6 Hz и J1'2'b=6,2 Hz, H-2'b), 3,07 (1H, d, Jgem=3,3 Hz, H-5'a), 3,36 (1H, d, Jgem=3,3 Hz, H-5'b), 4,26 (1H, dd, J2'a,3'=4,9 и J2',b,3'=1,6 Hz), 6,12 (1H, dd, J1',2'a=7,1 Hz и J1'2'b=6,2 Hz, Н-1'), 7,27 (1H, d, J6,Me=1,3 Hz, H-6), 9,06 (1H, br,NH);-30 С. Растворители выпаривали, а остаток высушивали вакуумированием в течение 1 ч с получением соединения 4. К раствору соединения 4 в CH2Cl2 (5 мл) добавляли аллилтриметилсилан (0,11 мл, 0,71 ммоль) и SnCl4 (1M в CH2Cl2, 0,71 мл, 0,71 ммоль) при -30 С в атмосфере аргона, и смесь перемешивалась в течение 4 ч при -30 С. После гашения насыщенным водным раствором NaHCO3 реакционную смесь фильтровали через селитный наполнитель. Фильтрат разделяли между CHCl3/насыщенным водным раствором NaHCO3 (60 мл 3/20 мл). Органический слой выпаривали до сухого остатка, а остаток обрабатывали насыщенной NH3 в МеОН (30 мл) при комнатной температуре в течение 12 ч. После выпаривания проводили препаративную очистку тонкослойной хроматографией (гексан/EtOAc=2/3) органического слоя и получали соединение 5 (75 мг, 80%) в виде пены:FAB-MS m/z 397 (МН). Аналогично рассчитано для C19H32N2O5Si1/3H2O: С, 56,69; Н, 8,18; N, 6,96. Обнаружено: С, 56,46; Н, 8,18; N, 6,87.TKD-4-152 (4'-аллилтимидин) на фиг. 4. Смесь из соединения 5 (59 мг, 0,149 ммоль) и фторид тетрабутиламмония (58 мг, 0,223 ммоль) в ТГФ (тетрагидрофуран (ТГФ) (3 мл) перемешивали при комнатной температуре в течение 12 ч. После силикагелевой колончатой хроматографии (CHCl/MeOH=20/1) выпаренной реакционной смеси получалиFAB-MS m/z 283 (MH), 321 (MK). Аналогично рссчитано для C13H18N2O51/2H2O: С, 54,16; Н, 6,57; N, 9,62. Обнаружено: С, 53,87; Н,6,49; N, 9,28.TKD-4-114 (2',3'-дидегидро-3'-дезокси-4'-этинилтимидин, 4'-этинил-d4 Т) синтезировали путем проведения серии реакций, приведенных на схеме В, начиная с соединения 6, которое было получено в соответствии с опубликованной процедурой: В.V. Joshi и С.В. Reese, Tetrahedron Lett., 32, 2371-2374 (1992). 1-(3-О-ацетил-2,5-дидезокси-5-йодоD-трео-пентофуранозил)тимин (7). Смесь из соединения 6 (5,3 г, 15,05 ммоль) и Ас 2 О (4,3 мл, 45,15 ммоль) в пиридине (30 мл) перемешивали при комнатной температуре в течение 13 ч. Реакционную смесь разделяли междуCHCl3/насыщенным водным раствором NaHCO3 (250 мл 3/50 мл). После силикагелевой колончатой хроматографии (гексан/EtOAc=1/1-1/2) органического слоя получали соединение 7 (5,53 г, 93%) в виде пены: 1 Н ЯМР (CDCl3)1,96 (3 Н, s, Me), 2,11 (3 Н, s, Ас), 2,11-2,16 (1 Н, m, H-2'a), 2,82 (1 Н, ddd, Jgem=15,8FAB-MS m/z 395 (MH). 1-(3-О-ацетил-2,5-дидезоксиL-глицеро-пент-4-энофуранозил)тимин (8). К раствору соединения 7 (5,5 г, 13,95 ммоль) в CH3CN (40 мл) добавляли ДБН (6,9 мл, 55,81 ммоль) при 0 С и реакционную смесь перемешивали при комнатной температуре в течение 17 ч. После нейтрализации путем добавления АсОН реакционную смесь выпаривали до сухого остатка. Остаток разделяли между CHCl3/насыщенным водным раствором NaHCO3 (200 мл 3/50 мл). После силикагелевой колончатой хроматографии (гексан/EtOAc=2/1-1/1) органического слоя получали соединение 8 (3,34 г, 90%) в виде пены: 1 Н ЯМР (CDCl3)1,96 (3 Н, d, J6,Me=1,3 Hz, Me), 2,06 (3 Н, s, Ac), 2,21 (1H, dt, Jgem=15,2Hz,J1',2'a=J2'a,3'=2, 7Hz, H-2'a), 2,83 (1H, dt, Jgem=15, 2 Hz, J1',2'b=J2'b,3'=7,1Hz, H-2'b), 4,51 (1H, dd, Jgem=2,4 Hz,J3',5'a=0,8 Hz, H-5'a), 4,73 (1H, dd, Jgem=2,4 Hz и J3',5'b=0,7 Hz, H-5'b), 5,70-5,73 (1H, m, H-3'), 6,44 (1H, dd,J1',2'a=2,7 Hz и J1',2'b=7,1 Hz, Н-1), 7,25 (1H, d, J6,Me=1,3 Hz, H-6), 8,54 (1H, br, NH);FAB-MS m/z 267 (MH). 1-[3-O-(t-Бутилдиметилсилил)-2,5-дидезоксиL-глицеро-пент-4-энофуранозил]тимин (9). Соединение 8 (5,2 г, 19,53 ммоль) в насыщенном NH3 в растворе МеОН (150 мл) выдерживали при комнатной температуре в течение 9 ч. После выпаривания остаток растворяли в ДМФ (60 мл). К этому раствору добавляли имидазол (5,32 г, 78,12 ммоль) и хлорид трет-бутилдиметилсилила (8,83 г, 58,59 ммоль) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 11 ч и затем разделяли между EtOAc/Н 2 О (250 мл/50 мл 4). После силикагелевой колончатой хроматографии (гексан/EtOAc=10/1) органического слоя получали соединение 9 (6,43 г, 97%) в виде пены:FAB-MS m/z 339 (MH). Аналогично рассчитано для C16H26N2O4Si: С, 56,78; H, 7,74; N, 8,28. Обнаружено: С, 56,61; Н, 7,87;N, 8,17. 1-[2-Дезокси-3-О-(t-бутилдиметилсилил)-4-этинилD-трео-пенто-фуранозил]тимин (10 а) и 1-[2 дезокси-3-О-(t-бутилдиметилсилил)-4-этинилL-эритро-пентофуранозил]тимин (10b). К раствору соединения 9 (60 мг, 0,177 ммоль) в CH2Cl2 (5 мл) добавляли диметилдиоксиран (0,09 М в ацетоне, 3,0 мл, 0,266 ммоль) при -30 С. После перемешивания в течение 0,5 ч смесь выпаривали и высушивали в вакууме в течение 1 ч. Остаток растворяли в CH2Cl2 (5 мл). К этому раствору добавляли триэтинилалюминий (0,3 М в CH2Cl2, 1,8 мл, 0,532 ммоль) при -30 С в атмосфере аргона и реакционную смесь перемешивали при комнатной температуре в течение 17 ч. После гашения насыщенным водным раствором NH4Cl реакционную смесь фильтровали через целитный наполнитель. Фильтрат разделяли между CHCl3/насыщенным водным раствором NH4Cl (60 мл 3/20 мл). Разделением с помощью жидкостной хроматографией высокого разрешения (гексан/EtOAc=2/3) органического слоя получали соединение 10 а (tR=10,8 мин, 39,3 мг, 58%, пена) и соединение 10b (tR=16,2 мин, 18,8 мг, 28%, твердое вещество). 1- 15012844 Физические данные по соединению 10 а:FAB-MS m/z 381 (MH). Аналогично рассчитано для C18H28N2O5SiH2O: С, 54,24; H, 7,59; N, 7,03. Обнаружено: С, 54,46; Н,7,20; N, 6,72. Физические данные по соединению 10b: точка плавления 96-98 С;FAB-MS m/z 381 (MH). Аналогично рассчитано для C18H28N2O5Si: С, 56,82; H, 7,42; N, 7,36. Обнаружено: С, 56,57; Н, 7,58;(11). К раствору пиридина (4 мл) 10 а (161 мг, 0,423 ммоль) добавляли Ас 2 О (120 мл, 1,269 ммоль) при 0 С и перемешивали смесь при комнатной температуре в течение 11 ч. Реакционную смесь разделяли между CHCl3/насыщенным водным раствором NaHCO3 (60 мл 3/20 мл). После силикагелевой колончатой хроматографии (гексан/EtOAc=3/1) органического слоя получали соединение 11 (169,7 мг, 95%) в виде пены:FAB-MS m/z 461 (MK). Аналогично рассчитано для C20H30N2O6Si: С, 56,85; H, 7,16; N, 6,63. Обнаружено: С, 56,84; Н, 7,35;N, 6,26. 1-(5-О-Ацетил-2-дезокси-4-этинилD-трео-пентофуранозил)тимин (12). К раствору ТГФ (4 мл) 11 (169,7 мг, 0,402 ммоль) добавляли фторид тетрабутиламмония (1 М в ТГФ, 602 мкл, 0,602 ммоль) в атмосфере аргона. После перемешивания в течение 1 ч при комнатной температуре растворитель выпаривали. После силикагелевой колончатой хроматографии(CHCl3/МеОН=100/1) остатка получали соединение 12 (114,7 мг, 93%) а в виде пены:FAB-HR-MS m/z. Рассчитано для C14H17N2O6 309,1087 (MH), обнаружено 309,1074. 1-(5-О-Ацетил-2-дезокси-3-О-метансульфонил-4-этинилD-трео-пентофуранозил)тимин (13). К раствору пиридина (4 мл) 12 (76 мг, 0,247 ммоль) добавляли хлорид метансульфонила (57 мкл,0,74 ммоль) при 0 С и перемешивали смесь при комнатной температуре в течение 16 ч. Реакционную смесь разделяли между CHCl3/насыщенным водным раствором NaHCO3 (60 мл 3/20 мл). После силикагелевой колончатой хроматографии (CHCl3/МеОН=100/0-100/1) органического слоя получали соединение 13 (95,0 мг, 100%) в виде пены: 1 Н ЯМР (CDCl3)1,96 (3 Н, d, J6,Me=1,2 Hz, Me), 2,16 (3 Н, s, Ac), 2,38 (1H, ddd, Jgem=6,0 Hz, J1',2'a=3,5TKD-4-114 (2',3'-дидегидро-3'-дезокси-4'-этинилтимидин). Смесь соединения 13 (105 мг, 0,272 ммоль) и ДБН (101 мкл, 0,815 ммоль) в CH3CN (10 мл) дефлег- 16012844 мировали в течение 11 ч. После гашения АсОН реакционную смесь разделяли междуCHCl3/насыщенным водным раствором NaHCO3 (60 мл 3/20 мл). Продукт, полученный после очистки силикагелевой колончатой хроматографией (гексан/EtOAc=1/1) органического слоя, растворяли в насыщенном NH3 в МеОН (30 мл) и выдерживали при комнатной температуре в течение 12 ч. После выпаривания раствора с последующей очисткой препаративной тонкослойной хроматографией (гексан/EtOAc=1/1) получали TKD-4-114 (49,6 мг, 74%) в виде твердого вещества: точка плавления 207209 С;FAB-MS m/z 249 (MH). Аналогично рассчитано для C12H12N2O41/6H2O: С, 57,37; H, 4,95; N, 11,15. Обнаружено: С, 57,36; Н,4,69; N, 10,98. Альтернативный химический синтез TDK-4-114 (фиг. 5 А).TKD-4-114 (2',3'-дидегидро-3'-дезокси-4'-этинилтимидин, 4'-этинил-d4 Т) был синтезирован путем проведения серии реакций, приведенных на схеме (см. фиг. 5 А), начиная с соединения 1, изготовление которого было описано ранее. Приготовление соединения 2 дибензоила (смесь двух диастереомеров). К соединению 1 (3,98 мг, 11,76 ммоль) в растворе толуола (70 мл) добавляли i-Pr2NEt (5,1 мл, 29,4 ммоль) и Pb(OCOPh) 4 (20,33 г, 29,4 ммоль) при 0 С в атмосфере аргона и перемешивали смесь в течение 4 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 и фильтровали через целит. Фильтрат разделяли между CHCl3/насыщенным водным раствором NaHCO3. Очистку органического слоя проводили силикагелевой колончатой хроматографией (гексан/AcOEt=2/1) с получением соединения 2 (4,84 г, 71%) в виде пены: 1 Н ЯМР (CDCl3)0,02, 0,07, 0,15 и 0,20 (6 Н, каждый как s, SiMe), 0,75 и 0,93 (9 Н, каждый как s,SiBu-t), 1,69 и 1,91 (3 Н, каждый как d, J6,Me=1,2 Hz, Me-5), 1,91- 2,00, 2,33-2,40, 2,76-2,83 и 2,94-3,01 (2 Н,каждый как m, Н-2'), 4,73 и 4,95 (1 Н, t и d, J2',3'=6,8 и 4,4 Hz, H-3'), 4,91, 5,08, 5,11 и 5,19 (2 Н, каждый какFAB-MS (m/z) 581 (MH). Аналогично рассчитано для C30H36N2O8Si: С, 62,05; Н, 6,25; N, 4,82. Обнаружено: С, 61,85; Н, 6,37;(9,2 мл, 22,44 ммоль) при 0 С в атмосфере аргона и смесь перемешивали в течение 30 мин. К этому раствору добавляли EtAlCl2 (0,94 М в гексане) (23,4 мл, 22,44 ммоль) при 0 С. После перемешивания смеси в течение 30 мин добавляли соединение 2 (3,26 г, 5,61 ммоль) в CH2Cl2 (50 мл) при 0 С и перемешивали смесь в течение ночи. Реакционную смесь разделяли между CHCl3/насыщенным водным раствором NaHCO3. Органический слой очищали с применением силикагелевой колончатой хроматографии (гексан/EtOAc=3/1) с получением соединения 3 (1,14 г, 37%) в виде пены: 1 Н ЯМР (CDCl3)0,09 и 0,13 (6 Н, каждый как s, SiMe), 0,12 (9 Н, s, CCSiMe3), 0,89 (9 Н, s, SiBu-t),1,90 (3 Н, d, JMe,6=0,8 Hz, Me-5), 1,95 (1H, ddd, J1',2'a=2,8, J2'a,3'=1,2 и J2'a,2'b=14,6 Hz, H-2'a), 3,02 (1H, ddd,J1',2'b=8,2, J2'b,3'=5,2 и J2'a,2'b=14,6 Hz, H-2'b), 4,50 (1H, dd, J2'a,3'=1,2 и J2'b,3'=5,2 Hz, H-3'), 4,64 (1H, d,J5'a,5'b=10,8 Hz, H-5'a), 4,68 (1H, d, J5'a,5'b=10,8 Hz, H-5'b), 6,40 (1H, d, J1',2'a=2,8 и J1',2'b=8,2 Hz, Н-1'), 7,447,48, 7,57-7,61 и d 8,07-8,10 (6H, каждый как m, H-6 и Ph), 8,24 (1H, br);FAB-MS (m/z) 557 (MH). 1-[5-О-Бензоил-2-дезокси-4-этинилD-трео-пентофуранозил]тимин (4). К раствору соединения 3 (208,2 мг, 0,37 ммоль) в ТГФ (5 мл) добавляли Bu4NF 3 Н 2 О (290,2 мг, 1,11 ммоль) при 0 С и перемешивали смесь в течение 1 ч. Реакционную смесь выпаривали до сухого остатка. Силикагелевая колончатая хроматография (2% МеОН в CH2Cl2) остатка давала соединение 3 (115,3 мг,84%) в виде пены: 1 Н ЯМР (CDCl3+D2O)1,94 (3 Н, d, JMe,6=1,2 Hz, Me-5), 2,15 (1H, dd, J1',2'a=3,2 и J2'a,2'b=15,0 Hz, H-2'a),2,60 (1H, s, CCH), 3,01 (1H, ddd, J1',2'b=9,0, J2'b,3'=5,2 и J2'a,2'b=15,0 Hz, H-2'b), 4,34 (1H, d, J2'b,3'=5,2 Hz, H-3'),4,40 (1H, d, J5'a,5'b=11,2 Hz), 4,96 (1H, d, J5a,5'b=11,2 Hz), 6,34(1H, d, J1',2'a=3,2 и J1',2'b=9,0 Hz, Н-1'), 7,46-7,51,7, 61-7,65 и 8,09-8,11 (5H, каждый как m, Ph), 7,70 (1H, d, JMe,6=1,2 Hz), 8,47 (1H, br);FAB- MS (m/z) 371 (MH). 1-[5-О-Бензоил-2-дезокси-4-этинил-3-О-метасульфонилD-трео-пентофуранозил]тимин (5). К раствору соединения 4 (110,9 мг, 0, 30 ммоль) в пиридине (3,5 мл) добавляли MsCl (0,12 мл,- 17012844 1,5 ммоль) при 0 С в атмосфере аргона и перемешивали смесь в течение 6 ч. Реакционную смесь разделяли между CHCl3/насыщенным водным раствором NaHCO3. Силикагелевая колончатая хроматография(1,5% МеОН в CH2Cl2) органического слоя дала соединение 5 (105,2 мг, 78%) в виде пены: 1 Н ЯМР (CDCl3)1,92 (3 Н, d, JMe,6=1,2 Hz, Ме-5), 2,43 (1 Н, dd, J1',2'a=3,6 и J2'a,2'b=16,0 Hz, H-2'a), 2,72FAB-MS (m/z) 449 (MH). 5'-О-Бензоил-2',3'-дидегидро-3'-дезокси-4'-этинилтимидин (6). К раствору соединения 5 (101,9 мг, 0,23 ммоль) в CH3CN (4 мл) добавляли ДБН (67 мкл, 0,54 ммоль) при 0 С в атмосфере аргона и смесь перемешивали при 80 С в течение 9 ч. Реакционную смесь нейтрализовывали путем добавления АсОН и разделяли между CHCl3/насыщенным водным растворомNaHCO3. Силикагелевая колончатая хроматография (1,5% МеОН в CH2Cl2) органического слоя давала соединение 6 (60 мг, 74%) в виде твердого вещества; 1 Н ЯМР (CDCl3)1,42 (3 Н, d, JMe,6=1,2 Hz, Ме-5), 2,70 (1 Н, s, CsCH), 4,59 (1 Н, d, J5'a,5'b=12,0 Hz, H5'a), 4,76 (1H, d, J5'a,5'b=12,0 Hz, H-5'b), 5,99 (1H, dd, J1',2'=1,2, J2',3'=5,9, H-2'), 6,38 (1H, dd, J1',3'=2,0 и J2',3'=5,9FAB-MS (m/z) 353 (MH). 2',3'-Дидегидро-3'-дезокси-4'-этинилтимидин (7) (TKD-4-114,4'-Этинил-d4 Т). К суспензии соединения в (56 мг, 0,16 ммоль) в МеОН (3 мл) добавляли 1 М NaOMe (0,32 мл, 0,32 ммоль) при 0 С в атмосфере аргона и смесь перемешивали при комнатной температуре в течение 0 ч. Реакционную смесь нейтрализовывали путем добавления АсОН и хроматографировали на силикагелевой колонке (2% МеОН в CH2Cl2) с получением соединения 7 (35,8 мг, 90%) в виде твердого вещества. Физические данные соединения 7 (TKD-4-114) соответствуют данным, приведенным выше. Химический синтез KMA-23-153: углеродно-циклический аналог TKD-4-114 (см. фиг. 6).KMA-23-153 получали в виде рацемической модификации (смеси равных количеств D- и Lэнантиомеров) путем проведения серии реакций, приведенных на схеме, проиллюстрированной на фиг. 6. Способ приготовления начального материала 2 был уже опубликован: см. Kato, et al., Chem. Pharm.Bull., 47, 1256-1264 (1999). 1-Гидроксиметил-2-оксоциклопентанкарбоновокислый метиловый эфир (3 на фиг. 6). К суспензии соединения 2 (10 г, 55,48 ммоль) и НМРА (29 мл, 166,44 ммоль) в ТГФ (450 мл) добавляли Bu3SnCl (16,5 мл, 61,0 ммоль) при 0 С при избыточном давлении сухого аргона. После перемешивания при 0 С в течение 30 мин к смеси добавляли (СН 2 О)n (8,32 г, 277,4 ммоль) и перемешивали всю реакционную смесь в течение 48 ч при комнатной температуре. Реакционную смесь разделяли междуAcOEt и соляным раствором. Органический слой высушивали (Na2SO4), выпаривали и хроматографировали на силикагелевой колонке (гексан/EtOAc=1/1). Получали соединение 3 (7,13 г, 77%) в виде масла. 1 Н ЯМР (CDCl3)1,97-2,18 (2 Н, m, СН 2), 2,21-2,25 (1 Н, m, СН 2), 2,29-2,53 (3 Н, m, ОН и СН 2), 2,622,66 (1 Н, m, СН 2), 3,74 (3 Н, s, Me), 3,81 (1 Н, dd, J=11,2 и 8,0 Hz, СН 2 ОН), 3,89 (1 Н, dd, J=11,2 и 4,4 Hz,CH2OH). 1-(трет-Бутилдифенилсилилоксиметил)-2-оксо-циклопентанкарбоновокислый метиловый эфир (4 на фиг. 6). Смесь соединения 3 (10,35 г, 60,1 ммоль), имидазола (8,18 г, 120,2 ммоль) и TBDPSCl (15,6 мл, 60,1 ммоль) в ДМФ (40 мл) перемешивали в течение 16 ч при комнатной температуре при избыточном давлении сухого аргона. Смесь разделяли между EtOAc и насыщенным водным раствором NaHCO3. Органический слой высушивали (Na2SO4) и выпаривали. Полученный густой остаток обрабатывали МеОН (са. 40 мл) и получали соединение 4 в виде осадка. Эту процедуру повторяли дополнительно 3 раза для получения соединения 4 (18,97 г, 77%) в виде белого твердого вещества. 1 Н ЯМР (CDCl3)1,02 (9 Н, s, SiBu-t), 2,03-2,11 (2 Н, m, СН 2), 2,26-2,35 (1 Н, m, СН 2), 2,41-2,53 (3 Н,m, СН 2), 3,65 (3 Н, s, Me), 3,87 (1 Н, d, J=9,6 Hz, CH2OSi), 4,09 (1H, d, J=9,6 Hz, CH2OSi), 7,37-7,46 (6H, m,Ph), 7,61-7,65 (4H, m, Ph). 1-(трет-Бутилдифенилсилилоксиметил)-2-оксоциклопент-3-энекарбоновокислый метиловый эфир(5 на фиг. 6). К перемешиваемой смеси соединения 4 (3,58 г, 8,72 ммоль) и Et3N (6,1 мл, 43,6 ммоль) добавлялиMe3SiOSO2CF3 (2,56 мл, 13,0 ммоль) при 0 С при избыточном давлении сухого аргона. Смесь перемешивали в течение 30 мин при этой же температуре и затем разделяли между CH2Cl2 и насыщенным водным раствором NaHCO3. Органический слой высушивали (Na2SO4) и выпаривали. Остаток растворяли вDMSO (12 мл). К этому раствору добавляли Pd(OAc)2 (98 мг, 0,44 ммоль) и перемешивали смесь в течение 36 ч при избыточном давлении О 2. Смесь разделяли между EtOAc и соляным раствором. Органический слой высушивали (Na2SO4), выпаривали и хроматографировали на силикагелевой колонке (гексан/EtOAc=5/1) с получением соединения 5 (3,13 г, 88%) в виде белого твердого вещества. Н ЯМР (CDCl3)0,97 (9 Н, s, SiBu-t), 2,99-3,05 (1 Н, m, СН 2), 3,21-3,26 (1 Н, m, СН 2), 3,66 (3 Н, s,Me), 3,98 (1 Н, d, J=10,0 Hz, CH2OSi), 4,18 1 Н, d, J=10,0 Hz, CH2OSi), 6,24-6,26 (1H, m, CH=CH), 7,377,45 (6H, m, Ph), 7,58-7,62 (4H, m, Ph), 7,86-7,88 (1H, m, CH=CH). 1-(трет-Бутилдифенилсилилоксиметил)-(транс-2-ацетокси)циклопент-3-энекарбоновокислый метиловый эфир (6 на фиг. 6). Смесь NaBH4 (628 мг, 16,6 ммоль) и МеОН (50 мл) охлаждали и перемешивали при -70 С. К этой смеси капельно добавляли смесь соединения 5 (3,39 г, 8,3 ммоль) и CeCl37H2O (3,1 г, 8,3 ммоль) в ТГФ/МеОН=1/1 (50 мл) в течение 15 мин. Полученную суспензию перемешивали в течение 1 ч при-70 С. Реакцию гасили путем добавления АсОН (са. 1 мл). Реакционную смесь выпаривали. Остаток суспендировали в MeCN (15 мл). К этой суспензии добавляли DMAP (1,02 г, 8,3 ммоль), i-Pr2NEt (1,45 мл,8,3 ммоль) и Ас 2 О (1,57 мл, 16,6 ммоль). Смесь перемешивали в течение 30 мин при 0 С при избыточном давлении сухого аргона и разделяли между CH2Cl2 и насыщенным водным раствором NaHCO3. Органический слой высушивали (Na2SO4), выпаривали и хроматографировали на силикагелевой колонке (гексан/EtOAc=4/1). Получали соединение 6 (3,74 г, 100%) в виде масла. 1 Н ЯМР (CDCl3)1,02 (9 Н, s, SiBu-t), 1,87 (3 Н, s, Ac), 2,50-2,55 (1 Н, m, CH2), 2,91-2,97 (1 Н, m, СН 2),3,71 (3 Н, s, Me), 3,87 (1 Н, d, J=9,6 Hz, CH2OSi), 4,08 (1H, d, J=9,6 Hz, CH2OSi), 5,76-5,78 (1H, m, CH=CH),5,99-6,00 (1H, m, CH=CH), 6,07-6,08 (1H, m, AcOCH), 7,29-7,45 (4H, m, Ph), 7,61-7,65 (4H, m, Ph). 1-(трет-Бутилдифенилсилилоксиметил)-(транс-4-гидрокси)циклопент-2-энекарбоновокислый метиловый эфир (7 на фиг. 6) Смесь соединения 6 (1,87 г, 4,13 ммоль), PdCl2 (MeCN)2 (106 мг, 0,41 ммоль) и р-хинона (224 мг,2,07 ммоль) в ТГФ (17 мл) дефлегмировали в течение 3 ч при избыточном давлении сухого аргона. Смесь разделяли между CH2Cl2 и насыщенным водным раствором Na2S2O3. Органический слой высушивали(Na2SO4) и выпаривали. Остаток растворяли в МеОН (5 мл) и обрабатывали KzGO3 (685 мг, 4,96 ммоль) в течение 1 ч при перемешивании. Смесь разделяли между CHCl3 и соляным раствором. Органический слой высушивали (Na2SO4), выпаривали и хроматографировали на силикагелевой колонке (гексан/EtOAc=6/1). Получали соединение 7 (1,14 г, 67%) в виде масла. 1 Н ЯМР (CDCl3)1,02 (9 Н, s, SiBu-t), 1,87 (1 Н, dd, J=14,4 и 2,4 Hz, СН 2), 2,73 (1 Н, dd, J=14,4 и 7,2Hz, CH2), 3,65 (3H, s, Me), 3,79 (1H, d, J=9,6 Hz, CH2OSi), 3,85 (1H, d, J=9,6 Hz, CH2OSi), 4,82-4,87 (1H, m,CHOH), 5,84-5,87 (1H, m, CH=CH), 6,02-6,04 (1H, m, CH=CH), 7,38-7,44 (6H, m, Ph), 7,63-7,65 (4H, m, Ph). 1-(трет-Бутилдифенилсилилоксиметил)-(цис-4-гидрокси)циклопент-2-энекарбоновокислый метиловый эфир (8 на фиг. 6). Смесь соединения 7 (1,08 г, 2,63 ммоль), Ph3P (897 мг, 3,42 ммоль) и АсОН (301 мкл, 5,26 ммоль) в ТГФ (10 мл) охлаждали до 0 С при избыточном давлении сухого аргона. К ней капельно добавляли диэтилазодикарбоксилат (2,3 М раствор в толуоле, 1,49 мл, 3,42 моль). После перемешивания в течение 30 мин смесь разделяли между CH2Cl2 и насыщенным водным раствором NaHCO3. Органический слой высушивали (Na2SO4) и выпаривали. Остаток обрабатывали K2CO3 (727 мг, 5,26 ммоль) в МеОН (5 мл) в течение 1 ч. Смесь разделяли между CHCl3 и соляным раствором. Органический слой высушивали(Na2SO4), выпаривали и хроматографировали на силикагелевой колонке (гексан/EtOAc=4/1). Получали соединение 8 (892 мг, 83%) в виде масла. 1 Н ЯМР (CDCl3)1,02 (9 Н, s, SiBu-t), 2,20-2,31 (3 Н, m, СН 2 и ОН), 3,70 (1 Н, d, J=9,6 Hz, CH2OSi),3,71 (3 Н, s, Me), 3,87 (1H, d, J=9,6 Hz, CH2OSi), 4,76-4,81 (1H, m, CHOH), 5,88 (1H, d, J=5,6 Hz, CH=CH),6,03 (1H, dd, J=5,6 и 2,4 Hz, CH=CH), 7,36-7,46 (6H, m, Ph), 7,61-7,65 (4H, m, Ph). 1-[цис-4-(трет-Бутилдифенилсилилоксиметил)транс-4-метоксикарбонилциклопент-2-эн-1-ил]тимин(2,3 М раствор в толуоле, 3,63 мл, 8,35 моль) при 0 С при избыточном давлении сухого аргона. После перемешивания в течение 30 мин к суспензии ТГФ (76 мл), содержащей соединение 8 (1,37 г, 3,34 ммоль), капельно добавляли N3-бензоилтимин (1,15 г, 5,01 ммоль). Смесь перемешивали в течение 70 ч при комнатной температуре, выпаривали и затем обрабатывали 2 М NaOMe в МеОН (6,7 мл) в течение 2 ч. За нейтрализацией реакционной смеси путем добавления АсОН (1,15 мл) следовало разделение междуCH2Cl2 и насыщенным водным раствором NaHCO3. Органический слой высушивали (Na2SO4), выпаривали и хроматографировали на силикагелевой колонке (гексан/EtOAc=1/1). Получали соединение 9 (1,21 г,70%) в виде белой пены. 1 Н ЯМР (CDCl3)1,05 (9 Н, s, SiBu-t), 1,74 (3 Н, d, J=1,2 Hz, тимин-5-Ме), 1,75 (1H, dd, J=14,0 и 6,8- 19012844 М в толуоле, 1,16 мл, 1,17 ммоль) при -70 С при избыточном давлении сухого аргона. После перемешивания в течение 20 мин добавляли дополнительное количество i-Bu2AlH (2,32 мл, 2,34 ммоль) и перемешивание продолжали в течение 20 мин. После гашения путем добавления АсОН (200 мл) производили выпаривание. После силикагелевой хроматографии на короткой колонке (гексан/EtOAc=1/5) получали производное транс-4-гидроксимитила (294 мг). Производное транс-4-гидроксиметила растворяли вCH2Cl2 (10 мл) и оксидировали с помощью периодинана Десс-Мартина (Dess-Martin periodinane) (477 мг,1,12 ммоль). После перемешивания в течение 1,5 ч смесь разделяли между CH2Cl2 и насыщенным водным раствором NaHCO3. Органический слой высушивали (Na2SO4) и выпаривали для получения неочищенного транс-4-альдегида (274 мг). Альдегид растворяли в МеОН, содержащей K2CO3 (310 мг, 2,24 ммоль) и перемешивали в течение 10 мин при 0 С при избыточном давлении сухого аргона. К этой смеси добавляли диметил(1-диазо-2-оксопропил)фосфонат (для приготовления этого реагента см. P. Callant, L.D'Haenes и М. Vandewalle, Synth. Commun., 14, 155-161 (1984). Использование этого реагента для преобразования RCHO в RCCH: I. Gillaizeau, I.M. Lagoja, S.P. Nolan, V. Aucagne, J. Rozenski, P. Herdewijn иL.A. Agrofoglio, Eur. J. Org.Chem., 666-671 (2003 (270 мг, 1,4 ммоль). Смесь перемешивали в течение 1 ч, а затем разделяли между EtOAc и насыщенным водным раствором NaHCO3. Органический слой высушивали (Na2SO4), выпаривали и хроматографировали на силикагелевой колонке (гексан/EtOAc=1/1). Получали соединение 10 (138 мг, 27%) в виде белой пены. 1 Н ЯМР (CDCl3)1,07 (9 Н, s, SiBu-t), 1,71 (3 Н, d, J=1,2 Hz, тимин-5-Ме), 2,02 (1H, dd, J=13,2 и 7,6(3 мл) перемешивали в течение 2 ч при комнатной температуре. К этой смеси добавляли 4 диметилламинопиридин (51 мг, 0,42 ммоль), i-Pr2NEt (73 мкл, 0,42 ммоль) и Ас 2 О (80 мкл, 0,84 ммоль). Реакционную смесь перемешивали в течение 30 мин, а затем разделяли между CH2Cl2 и насыщенным водным раствором NaHCO3. Органический слой высушивали (Na2SO4), выпаривали и хроматографировали на силикагелевой колонке (AcOEt). Получали ацетат (52 мг) в виде белого твердого вещества. Полученный ацетат обрабатывали NH3/MeOH (35 мл) ниже 0 С в течение 12 ч. В процессе выпаривания растворителя происходило осаждение вещества. Осадок промывали горячим бензолом(50 мл) для получения аналитически чистого соединения 11 (31 мг, 60%). 1 Н ЯМР (CDCl3)1,96-1,94 (5 Н, m, СН 2, ОН и тимин-5-Ме), 2,30 (1 Н, s, CCH), 2,81 (1 Н, dd, J=13,6 и 8,8 Hz, CH2), 3,65 (1 Н, dd, J=10,0 и 7,6 Hz, CH2OH), 3,78 (1 Н, dd, J=10,0 и 4,8 Hz, CH2OH), 5,78-5,80 (1 Н,m, CH=CH), 5,85-5,89 (1 Н, m, CHN), 6,04-6,06 (1 Н, m, СН=СН), 7,10 (1 Н, q, J=1,2 Hz, тимин-Н-6), 8,09(1 Н, br, тимин-NH). Аналогично рассчитано для C13H14N2O31/5 Н 2 О: С, 62,49; Н, 5,81; N, 11,21. Обнаружено: С, 62,57; Н, 5,65; N,11,22,Биологическая активность. Способы и материалы. Химические препараты: 4'-D4T аналоги (фиг. 1) были синтезированы в лаборатории д-ра Хиромати Танака, Школа фармацевтических наук, университет Сева, Япония. dThd, D4T и AZT были закуплены уSigma-Aldrich Corp, Св. Луис, шт. Миссури, ddI был закуплен у ICN Biochemicals Inc, Аврора, шт. Огайо. 3 ТС был получен от Triangle Pharmaceuticals, Дурхамб шт. Сев. Каролина. LFd4C был получен от Vion Inc, Нью Хэйвен, шт. Коннектикут. Все другие использованные химические препараты обладали чистотой реактивов или более высокой чистотой. Линии клеток и вирус: как линия клеток Н 9, используемая для исследований токсичности и разведения вирусов, так и линия клеток МТ-2, используемая для исследования противовирусной активности,были получены в рамках программы исследования СПИДа и эталонных реагентов Национального института здравоохранения и были переданы Др. Робертом Галло и Др. Дугласом Ричманом соответственно. Штамм IIIB ВИЧ-1 был получен от д-ра Джона Меллорса. Определение вирусной активности: соединения были испытаны в клетках МТ-2, инфицированных штаммом IIIB ВИЧ-1 в целом, как описывалось ранее (31). Вкратце, серийные растворы лекарственных препаратов помещали в тройные ячейки чашки для культуры тканей с 96 ячейками, затем клетки МТ-2,выращенные в среде RPMI 1640, дополненной 10% диализированной плодной бычьей сывороткой и 100 мкг/мл канамицина, добавляли при 104 клеток/100 мкл 0,1 множественного заражения ВИЧ-1 IIIB. Пять дней спустя в ячейки добавляли краситель МТТ, и цвет тетразолиевого красителя, измеренный при 595 нм, использовался для количественного определения клеточной жизнеспособности (20). Описываются расчеты процентной защиты и комбинированных исследований изоболограммы (12). Клеточная токсичность аналогов нуклеозидов.HepG2. Основные процедуры являются аналогичными. Клетки высевают при низкой концентрации, затем добавляют серийные растворы испытываемых соединений. Используемые линии клеток СЕМ, МТ-2 и Н 9 выращивали в среде RPMI 1640, дополненной диализированной плодной бычьей сывороткой и 100 мкг/мл канамицина. После 48-96 ч инкубации при 37 С в 5% СО 2 увлажнительном инкубаторе анализ завершали. Образцы, подвергшиеся воздействию лекарства, сравнивали с необработанными контрольными образцами. Анализ завершали в суспензионных линиях клеток путем подсчета количества клеток либо с помощью гемоцитометра или счетчика Coulter. Клетки HepG2, клетки линии гепатомы человека выращивали в среде DMEM, дополненной диализированной плодной бычьей сывороткой и 10 мкг/мл канамицина. Влияние на HepG2, монослойную линию клеток, было количественно определено путем окрашивания красителем 1,0% синего метилена, растворенного в 50% этаноле, после декантирования среды для выращивания. Далее слой клеток растворяли в 5% растворе саркозила и полученный цвет измеряли при 595 нм на считывающем спектрофотометре Molecular Devices модели Vmax plate (MenloPark, шт. Калифорния). Цвет необработанных контрольных образцов сравнивали с образцами, подвергшимися воздействию лекарственного препарата. Митохондриальная ДНК. Оценка влияния аналогов нуклеозидов на содержание мтДНК проводилась в соответствии с ранее описанной процедурой (2). Вкратце, клетки СЕМ, содержащиеся в среде RPMI 1640, дополненной диализированной плодной бычьей сывороткой, были засеяны при 2105/мл на чашке для культуры ткани с 24 ячейками. Клетки, обработанные лекарственным препаратом при различных концентрациях либо по отдельности, либо в сочетании с другими препаратами, выращивали в течение 4 дней, далее был произведен сбор клеток и их обработка протеиназой К и ДНКазой свободной РНКазой. Экстракты были нанесены на нейлоновые мембраны и гибридизированы с использованием мтДНК пробы. После очистки мембраны загрузка была нормализирована путем повторной гибридизации мембраны с использованием пробы Alu. Пятна количественно определяли с помощью персонального денситометра Molecular Dynamics SI и аналитического программного обеспечения ImageQuaNT. Монофосфорилирование аналогов тимидинкиназой. Все аналоги испытывали на возможность их фосфорилирования с использованием тимидинкиназы(ТК-1) от клеток СЕМ. Этот фермент очищали с помощью аффинного колончатого способа (хроматография по сродству), разработанного в лаборатории (7). Аналоги тимидинов (250 мкМ) инкубировались в смеси, содержащей 150 мМ Tris HCl рН 7,5, 2,4 мМ АТР, 2,4 мМ MgCl2, 0,6 мг креатинфосфата, 5,8 единиц креатинфосфокиназы, 0,19 мг альбумина и 0,07 единиц ТК-1 в общем объеме 200 мкл. В конце инкубационного периода реакцию останавливали путем добавления 3 частей холодного метанола класса жидкостной хроматографии высокого разрешения (HPLC). После инкубации на льду как минимум в течение 10 мин проводили осаждение метанолового нерастворимого материала путем центрифугирования,а метаноловые растворимые надосадочные жидкости помещали в чистые пробирки микроцентрифуги. Эти образцы высушивали в центрифуге Speedvac. Образцы растворяли в воде и разделяли на жидкостном хроматографе высокого разрешения Shimatzu модели SCL 10Avp с использованием градиента воды до 300 мМ фосфата калия и SAX колонки 10/25 частиц Whatman. Исследования Km и соответствующие исследования Vmax проводили аналогичным образом с использованием той же самой смеси и различных количеств субстрата и фермента. Исследование стабильности кислоты. Нуклеозидные образцы смешивали с 1N HCl и инкубировали при 37 С в течение 2,5 ч. Затем образцы исследовали с помощью жидкостной хроматографии высокого разрешения с использованием колонкиBeckman ODS, применяющей градиент воды до 80% метанола. Анализы тимидин фосфорилазы. Аналоги нуклеозидов (100 мкМ) инкубировали в 75 мМ буфере фосфата калия рН 7,3 при 37 С с использованием частично очищенного препарата экстракта печени человека (28) в качестве источника тимидин фосфорилазы (ТР). После инкубации реакцию останавливали путем добавления трихлоруксусной кислоты до окончательной концентрации 15%. Далее образцы инкубировали на льду. Затем кислотные нерастворимые компоненты удаляли путем центрифугирования, надосадочную жидкость нейтрализовали двумя экстракциями с половиной объема триоктиламина/фреона (45:55). Водные надосадочные жидкости исследовали с помощью жидкостной хроматографии высокого разрешения с использованиемODS колончатого способа Beckman, как описывалось в исследованиях стабильности кислоты. Анализы тимидинкиназы. Анализы тимидинкиназы проводились аналогичным способом в соответствии с описанием в (21). Вкратце, при анализе используется [14 С]-dThd (100 мкМ, 6,7 мКи/ммоль) в смеси, содержащей 2,4 мМATP-Mg, 156 мМ Tris-HCl рН 7,5, 0,23 мг креатинфосфата, 7 мкг креатинфосфокиназы, 67 мкг BSA и 1,9 мМ DTT в 75 мкл объеме. Реакции инкубировали в течение различных периодов времени, затем их останавливали путем нанесения проб 50 мкл целых частей на DE-81 анионнообменные диски (Whatman Inc.,Клифтон, шт. Нью-Джерси), которые немедленно погружали в 95% этанол. После двух дополнительных- 21012844 промывок в этаноле диски высушивали и помещали в стинцилляционные пробирки, содержащие 5 мл стинцилляционный коктейль (SafeScint Scintillation Cocktail (American Bioanalytical, Натик, шт. Массачусетс). Количество радиоактивности, представляющее количество образованного dTMP, было количественно определено в стинцилляционном счетчике (Beckman LS5000TD Scintillation Counter (Beckman Instruments Inc., Пало Альто, шт. Калифорния). Результаты биологической активности. Противовирусное действие аналогов 4'-замещенных D4T. В системе MT-2/IIIB анти-ВИЧ-1 были проведены эксперименты путем добавления соединений,замещенных в 4' положении D4T метиловой, виниловой, этиниловой этинилметиловой, этинилхлоро,алиловой и цианогруппой (фиг. 1). Результаты указывали на то, что 4'-этиниловый аналог оказался более эффективным против ВИЧ и менее токсичным, чем исходное соединение D4T. В то время как 4'-цианоD4T и 4'-этинилметил D4T были менее активными, чем D4T против ВИЧ (фиг. 8), 4'-метил, 4'-винил, 4'этинилхлоро и аналоги 4'-аллил замещенного D4T не достигли ЕС 50 при концентрации 100 мкМ. В табл.1 ниже приведена сводная информация о ЕС 50 против ВИЧ этих соединений совместно с D4T. Таблица 1 Влияние аналогов 4'-замещенного D4T на ВИЧ Эффективная концентрация необходимая для достижения 50% защиты от ВИЧ в клетках МТ-2. Концентрация необходимая для ингибирования роста клеток МТ-2 на 50%.d ЕС 50 описанный ранее (17). Для определения того, действует ли 4'-этинил D4T как аналог dThd против ВИЧ, было изучено воздействие добавки dThd или dCyd на противовирусную активность 4'-этинил D4T. С целью предотвращения возможности того, чтобы dCyd не мог быть дезаминирован до dUrd в клетках, также добавляли ингибитор цитидиндиаминазы, тетранидроуридин, на нетоксичном уровне. Было обнаружено, что dThd снижал противовирусное воздействие 4'-этинил D4T в зависимости от концентрации. Тем не менее, dCyd не оказал существенного воздействия на активность 4'-этинил D4T против ВИЧ (фиг. 9). С целью оценки взаимодействия 4'-этинил D4T с другими противовирусными нуклеозидными группами были созданы его изоболограммы в сочетании с 3 ТС, LFd4C, ddI и AZT. Было продемонстрировано, что 4'-этинил D4T синергетически взаимодействует с 3 ТС и LFd4C против ВИЧ (фиг. 10) и индекс синергизма был определен путем измерения относительно расстояния от линии, указывающей на аддитивное воздействие лекарственного препарата. Тем не менее, противовирусное воздействие 4'этинил D4T с ddI и AZT носило только аддитивный характер (данные не приведены). Клеточная токсичность. Воздействие 4'-замещенных D4T аналогов на рост клеток и содержание мтДНК определяли в клетках СЕМ (см. нижеприведенную табл. 2 а). Ни один из этих аналогов за исключением 4'-этиленхлоро D4T не мог замедлить четырехдневный рост клеток с ID50 менее чем 100 мкМ. Результаты 72-часового исследования токсичности в клетках HepG2 также показали, что ID50 для D4T, 4'-винил D4T и 4'-этинил D4T был выше чем 100 мкМ. 4'-Этинил D4T смог снизить внутриклеточную митохондриальную ДНК с ID50 100 мкМ, что в 10 раз превышает концентрацию D4T. Ввиду синергетического взаимодействия 4'-этинилD4T с 3 ТС и LFd4C против ВИЧ, также была проведена оценка эффекта взаимодействия указанных соединений на рост клеток. В ходе 48-часового анализа не наблюдалось значительного повышения токсических взаимодействий в клетках Н 9 (табл. 2 а)- 22012844 Таблица 2 а Токсичность аналогов нуклеозидов в клетках СЕМb) Содержание митохондриальной ДНК, определенное на основе анализа Southern Blot и по показаниям денситометра в сравнении с содержанием необработанных контрольных клеток СЕМ. Величины являются средними значениями концентраций мкМ и стандартных отклонений, вызывающих 50% ингибирование контрольных клеток. Значения в скобках представляют средние и стандартные отклонения процента необработанных контрольных клеток СЕМ при указанных концентрациях. Таблица 2b Токсичность 4'-этинил D4T в клетках Н-9 в отдельности и в сочетании с другими противовирусными соединениями как процент от необработанных контрольных клеток Клетки Н-9 выращивали в соответствии с процедурой, описанной в разделе Материалы и способы в течение 48 ч в присутствии одного соединения или в сочетании с другими. Три или более ячейки были подсчитаны в двух экземплярах для каждого состояния с использованием счетчика Coulter. Значения представляют средние и стандартные отклонения. Взаимодействие аналогов 4'-замещенного D4T с ТК-1. Была проведена оценка потенциала этих соединений к фосфорилированию очищенным ТК-1 человека (табл. 3 а ниже). AZT был преобразован в монофосфатную форму в два раза быстрее, чем dThd, в то время как скорость 4'-метил D4T и 4'-винил D4T является аналогичной D4T (приблизительно 2% отdThd). Скорость преобразования 4'-этинил D4T была выше, чем скорость D4T с уровнем достоверности 0,06. Между скоростями фосфорилирования 4'-этинил D4T и 4'-этинилхлоро D4T не было существенной разницы при уровне достоверности 0,91 с использованием критерия на основе двойной выборки. Km 4'этинил D4T оценивали в размере 52 мкм, что ниже, чем 133 мкм для D4T, но выше, чем dThd. Для получения гарантии того, что ни один из этих аналогов dThd не выступает в качестве сильнодействующего ингибитора TIC-1, даже если они не являются субстратами, dThd, AZT, D4T и аналоги 4'-замещенногоD4T добавляли к пробе тимидинкиназы при концентрации в 10 раз превышающей концентрацию [14C]dThd, затем количество преобразования в [14 С]-dTMP сравнивали с реакциями без добавок (табл. 3b ниже). Соединения, эффективно фосфорилируемые ТК-1, например AZT, могут оказать негативное влияние на количество фосфорилированного dThd. Добавка D4T или его слабо фосфорилируемых аналогов, даже при 10-кратном избытке, оказывают меньшее воздействие на фосфорилирование [14C]-dThd ТК-1, чем- 23012844 Таблица 3 а Фосфорилирование цитоплазматической тимидинкиназой человека 250 мкМ dThd или аналог и 2,4 мМ ATP инкубировали с 0,07 единиц ТК-1 при 37 С в течение 285 мин. Значения были опубликованы ранее (21). Таблица 3b Воздействие добавки аналогов тимидина на пробу тимидинкиназы Анализы были проведены в целом в соответствии с описанием в разделе Материалы и способы,за тем исключением, что концентрация [14 С]-dThd в пробе была снижена до 25 мкМ, и концентрация добавленного нуклеозида составляла 250 мкМ. Взаимодействие с тимидинфосфорилазой и кислотостойкость 4'-этинил D4T. Для проведения этих исследований использовали частично очищенный препарат тимидинфосфорилазы (ТР) из печени человека. dThd распался исключительно быстро, в то время как распад D4T происходил в 10 раз медленнее. Распад 4'-этинил D4T был ниже уровня обнаружения в течение всего исследуемого инкубационного периода (фиг. 11). Стабильность D4T и 4'-этинил D4T при рН 1 и при 37 С изучалась в течение 2,5 ч. Не было обнаружено заметного распада любого из двух соединений. Подробное обсуждение вопроса.D4T является эффективным D-дидезокситимидиновым аналогом против ВИЧ. Его ограниченная клиническая токсичность при длительном сроке лечения представляет собой периферийную невропатиею, связанную с его действием по сокращению содержания митохондриальной ДНК периферийных нейронов (4, 5, 33, 34). Биохимические детерминанты действия D4T отличаются от биохимических детерминант 3 ТС, ddI или ddC. Аналог D4T, характеризующийся более сильным действием против ВИЧ и меньшим воздействием на ядерный или митохондриальный ДНК синтез, мог бы иметь более высокий терапевтический эффект, чем D4T и мог бы заменить D4T в комбинированной терапии против ВИЧ. Таким образом, синтез аналогов D4T с более высокими фармакологическими свойствами является направлением, по которому идут при разработке лекарственных препаратов против ВИЧ. Среди всех аналогов 4'замещенных D4T, синтезированных нами и другими изобретателями, 4'-этинил D4T является наиболее активным аналогом против ВИЧ в культуре клеток. Maag et al. описал 4'-азидо D4T, не проявляющий действие против ВИЧ на нетоксичных уровнях (29) и O-Yang et al. описал три аналога 4'-замещенныхD4T, являвшихся нетоксичными и пассивными по отношению к ВИЧ (32).D4T достаточно быстро катаболизируется, в бета-аминоизомасляную кислоту и тимин гепатоцитом печени (38). Фермент, ответственный за этот распад, является ТР, который в присутствии фосфата расщепляет dThd на тимин и 2-дезокси-D-рибоза-1-фосфат. Путем инкубирования 4'-этинил D4T и D4T час- 24012844 тично очищенным препаратом ТР печени человека было продемонстрировано, что 4'-этинил D4T проявлял более высокую сопротивляемость к ТР, чем D4T. Это указывает на то, что 4'-этинил обладает дополнительными преимуществами над D4T с фармакокинетической точки зрения. Более того, 4'-этинил D4T характеризуется аналогичной стабильностью, как и D4T в кислотных условиях, имитирующих условия желудка (данные не приведены). Это указывает на то, что 4'-этинил D4T мог бы быть орально активным агентом, как и D4T. В перспективе предусматривается проведение детального фармакокинетического исследования. Так как 4'-этинил D4T является более сильнодействующим, чем D4T, следует полагать,что 4'-этинил D4T мог бы характеризоваться меньшей устойчивостью вирусов к этому препарату. При приеме пациентом 4'-этинил D4T при той же дозировке, как и D4T, вирусная нагрузка будет намного ниже, благодаря чему снижается вероятность появления резистентных штаммов. Также существует возможность давать 4'-этинил D4T при более высоких дозировках, чем D4T, так как 4'-этинил D4T в меньшей степени угнетает рост клеток и вызывает меньшее снижение митохондральной ДНК по сравнению сD4T. Тем не менее, требуется проведение дальнейших исследований с целью определения количества 4'этинил D4T, которое явилось бы безопасным для использования. Монотерапия в большей степени способствует развитию и появлению резистентных штаммов вирусов, чем комбинированная терапия. Таким образом, необходимо, чтобы противовирусные соединения действовали совместно с другими одобренными противовирусными лекарственными препаратами,имеющими различные биохимические детерминанты лекарственной устойчивости. Если соединения являются синергическими или, по крайней мере, аддитивными по отношению к их противовирусной активности, но не по отношению к их цитотоксическому воздействию на клетку-хозяина, можно было бы достичь более эффективного лечения. Несомненно, комбинированная терапия ВИЧ достигла огромного прогресса в борьбе против СПИДа, и D4T часто используется в качестве одного из лекарственных препаратов в комбинированных протоколах. Для оценки потенциального использования 4'-этинил D4T в комбинированной терапии нами было исследовано взаимодействие этого соединения с четырьмя противовирусными нуклеозидными аналогами. 4'-этинил D4T является синергическим с 3 ТС и LFd4C (фиг. 9) и аддитивным с AZT и ddI (данные не приведены) по отношению к активности против ВИЧ, но не к цитотоксичности (табл. 2b). Это указывает на то, что 4'-этинил D4T мог бы явиться полезным соединением для комбинированной терапии и мог бы явиться эффективным против вируса, резистентного в настоящее время к нуклеозидам, благодаря повышению их эффективности через синергическую реакцию. В настоящее время исследуется активность 4'-этинил D4T против вируса, резистентного к другим аналогам нуклеозидов. Исследуемый механизм, лежащий в основе более высокой активности 4'-этинил D4T по сравнению с другими аналогами 4'-замещенных D4T против ВИЧ, является неясным. Дезоксинуклеозидные аналоги обычно преобразуются в 5'-трифосфатметаболиты, являющиеся субстратами для вирусных ДНК полимераз. Трифосфатные метаболиты известных против ВИЧ дидезоксинуклеозидов взаимодействуют избирательно с вирусной обратной транскриптазой и действуют в качестве терминаторов при их включении в нить ДНК. Формирование монофосфатного метаболита является первым шагом в процессе преобразования в трифосфатный метаболит. Соединения 4'-замещенного D4T, например D4T, являются аналогами dThd, в результате был использован очищенный ТК-1 для определения того, мог ли он фосфорилировать эти аналоги до их соответствующих монофосфатных форм. Результаты показали, что 4'этинил D4T фосфорилировался в два раза быстрее, чем D4T, хотя более медленными темпами, чем dThd или AZT. Следует отметить, что 4'-метил D4T и 4'-винил D4T аналоги фосфорилировались с той же скоростью, что и D4T, но ни один из них не проявлял значительную активность против ВИЧ. Таким образом, можно сделать вывод, что отсутствие активности некоторых из этих аналогов 4'-замещенного D4T против ВИЧ не обусловлено неспособностью фосфорилировать ТК-1. Фосфорилирование 4'-этинил D4T ТК-1 является важным шагом, но недостаточным для обладания противовирусной активностью. Так как его противовирусное воздействие могло бы быть нейтрализовано dThd, но не dCyd, 4'-этинил D4T, например D4T, действует как аналог dThd, но противовирусный механизм действия 4'-этинил D4T мог бы быть до сих пор крайне отличным от механизма действия D4T. Наши неопубликованные материалы указывают, что D4T мог бы быть более эффективно фосфорилирован в трифосфатный метаболит, чем 4'этинил D4T с использованием СЕМ клеточного экстракта, дополненного частично очищенным ТК-1 и рекомбинантной dTMP киназой человека. Это вызывает вопрос относительно того, является ли 4'-этинилD4TMP активным метаболитом вместо 4'-этинил D4TTP и требуется ли дальнейшее исследование. В заключение следует отметить, что 4'-этинил D4T является более сильно действующим средством против ВИЧ и менее токсичным, чем D4T в культуре клеток. Предполагается, что он будет иметь фармакокинетические преимущества перед D4T, так как он не является субстратом тимидинфосфорилазы. Таким образом, 4'-этинил D4T проявляет высокий потенциал как новый лекарственный препарат против ВИЧ. Специалистам в данной области должно быть понятно, что вышеприведенное описание и примеры являются иллюстративными для практического использования настоящего изобретения, ни в коей мере не ограничивающими его. Могут быть предложены и другие варианты данного изобретение, не выходящие за пределы его существа и объема, определенного прилагаемой формулой изобретения.R1 обозначает Н, ацильную группу, С 1-С 20 алкильную или эфирную группу;R2 обозначает Н, ацильную группу, С 1-С 20 алкильную или эфирную группу, фосфатную, дифосфатную, трифосфатную, фосфодиэфирную группу либо группуNu обозначает радикал биологически активного противовирусного соединения, таким образом,чтобы аминогруппа или гидроксильная группа из указанного биологически активного противовирусного соединения образовывала фосфатную, фосфорамидатную, карбонатную или уретановую группу с соседней частью;R8 обозначает Н или С 1-С 20 алкильную или эфирную группу; илиn составляет 0, 1, 2, 3, 4 или 5,либо их аномеры, фармацевтически приемлемые соли, полиморфы или их сольваты. 2. Соединение по п.1, в котором В обозначает 4. Соединение по любому из пп.1-3, в котором R обозначает F, Cl, Br, I, С 1-С 3 алкил, -CC-Ra,или и X обозначает Н, С 1-С 4 алкил, F, Cl, Br или I. 5. Соединение по п.1, в котором R обозначает СН 3, R3 обозначает -(СН 2)n-CC-Ra, n составляет 0 иRa обозначает Н. 6. Соединение по любому из пп.1-5, в котором R3a и R3b оба обозначают Н. 7. Соединение по любому из пп.1-6, в котором R2 обозначает Н. 8. Соединение по п.1, которое обозначает 9. Соединение по п.8, в котором R2 обозначает Н, ацильную группу, фосфатную, дифосфатную,- 28012844 трифосфатную или фосфодиэфирную группу. 10. Соединение по п.8, в котором R2 обозначает Н. 11. Соединение по п.1, в котором В обозначаетn составляет 0. 13. Соединение по любому из пп.11 или 12, в котором R обозначает Н, F, Cl, Br, I, СН 3, -CC-Ra,или и X обозначает Н, С 1-С 4 алкил, F, Cl, Br или I. 14. Соединение по п.11 или 12, в котором R обозначает СН 3, R3 обозначает -(CH2)n-CC-Ra, n составляет 0 и Ra обозначает Н. 15. Соединение по любому из пп.11-14, в котором R3a и R3b оба обозначают Н. 16. Соединение по любому из пп.11-15, в котором R2 обозначает Н. 17. Фармацевтический состав, включающий эффективное количество соединения по п.1 в сочетании с фармацевтически приемлемым носителем, добавкой или наполнителем. 18. Состав по п.17, в котором В обозначает 19. Состав по п.17 или 18, в котором R3 обозначает -(CH2)n-CC-Ra,или 20. Состав по любому из пп.17-19, в котором R обозначает F, Cl, Br, I, С 1-С 3 алкил, -CC-Ra,или и X обозначает Н, С 1-С 4 алкил, F, Cl, Br или I. 21. Состав по п.17, в котором R обозначает СН 3, R3 обозначает -(CH2)n-CC-Ra, n составляет 0 и Ra обозначает Н. 22. Состав по любому из пп.17-21, в котором R3a и R3b оба обозначают Н. 23. Состав по любому из пп.17-22, в котором R2 обозначает Н. 24. Состав по п.17, в котором указанное соединение обозначает 25. Состав по п.24, в котором R2 обозначает Н, ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу. 26. Состав по любому из пп.24 или 25, в котором R2 обозначает Н. 27. Состав по п.17, в котором В обозначает; X обозначает Н, С 1-С 4 алкил, F, Cl, Br или I. 30. Состав по любому из пп.27-29, в котором R обозначает СН 3, R3 обозначает -(CH2)n-CC-Ra, n составляет 0 и Ra обозначает Н. 31. Состав по любому из пп.27-30, в котором R3a и R3b оба обозначают Н. 32. Состав по любому из пп.27-31, в котором R2 обозначает Н. 33. Состав по п.27, в котором указанное соединение обозначает где R1 обозначает Н или ацильную группу, R2 обозначает Н, ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу. 34. Состав по п.33, в котором R1 обозначает Н и R2 обозначает Н. 35. Состав по любому из пп.17-34, дополнительно включающий по меньшей мере одно дополнительное средство против ВИЧ. 36. Состав по п.35, в котором указанное дополнительное средство против ВИЧ выбирают из группы, состоящей из ddC, абакавира, ddI, ddA, 3TC, AZT, D4T, FTC, FddC, Fd4C, Атазанавира, Адефовир дипивоксила,Тенофовир дизопроксила,Этекавира,Индинавира,KHI-227,2-[3-[3-(S)[(тетрагидрофуранилокси)карбонил]амино]-4-фенил-2(R)-гидроксибутил]-N-(1,1-диметилэтил)декагидро-3-изохинолинкарбоксамида,VB-11,328, KNI-174, Val-Val-Sta, CPG53820, бис-Val HOEt-N2 азапептид изостера, производного C2-Sym Фосфиникамида, 2,5-Диамино-N,N'-бис-(N-бензилоксикарбонилуэлил)1,6-дифенил-3(S),4(S)-гексанедиол BzOCValPhe[diCHOH(SS)]PheValBzOC, 2,5-Диамино-N,N'-бис-(Nбензилоксикарбонилуэлил)-1,6-дифенил-3(R),4(R)-гексанедиол BzOCValPhe[diCHOH(RR)]PheValBzOC,бис-(SATE)ddAMP, BILA2186BS, Агенеразы, А-98881, А-83962, А-80987, (2-Нафталкарбонил)Asn[декарбонилфегидроксиэтил]ПроОтертБутила, производного 2-Аминобензилстатина валила Cbz, производного 10H-2(Cbz-ValNH)3PhPr[14] парациклофана, производного 10H-2(Cbz-ValNH)3PhPr[13] парациклофана,производного 10H-2(Cbz-ValNH)3PhPr[13] метациклофана, производного 10H-2(Cbz-Tle)3PhPr[14] парациклофана, 1-(20HPr)-4-замещенного пиперазина (сциклопропила), производного тиенилкарбамата, 1(20HPr)-4-замещенного пиперазина (циклобутила), производного тиенилкарбамата, 1-(20HPr)-4 замещенного пиперазина (3-пентила), производного тиенилкарбамата, производного 10H-2(CbzValNH)3PhPr[17] парациклофана, А-81525, ХМ 323, Типранавира, производных Тиенопирида-CON тиенилуретана, SDZ PRI 053, SD146, Телинавира, (R)2QuinCOAsnPhe[CHOHCH2]PipCONHtBu, Сахинавира,производного Сахинавира/Мелфинавира, аналога Изохин-CON Thf-Thf уретана, аналога Изохин-CON тиенилуретана, R-87366, ДМФ 460, L685,434, производного L685,434-6-гидроксила, L685,434-OEtNMe2,производного L685,434-Opr-Морф, L689,502, Лазинавира, Алувирана, аналога Нельфинавир-октагидротиенопиридина, Р 9941, Палинавира и Пенициллина, аналога 2-Изохин-OHPrNH2 и их смесей. 37. Состав по п.35, в котором указанное дополнительное средство против ВИЧ выбирают из группы, состоящей из ddC, абакавира, ddI, ddA, 3TC, AZT, D4T, FTC, FddC и Fd4C. 38. Применение состава по любому из пп.17-37 при производстве лекарственного препарата для лечения вирусной инфекции, вызванной вирусом, выбранным из группы, состоящей из вирусов 1 и 2 иммунодефицита человека (ВИЧ-1 и ВИЧ-2), вирусов 1 и 2 Т-клеточного лейкоза человека (HTLV-1 иHTLV-2), респираторного синтициального вируса (RSV), вируса папилломы человека (HPV), аденовируса, вируса гепатита В (HBV), вируса гепатита С (HCV), вируса Эпштейна-Барра (EBV), вируса ветряной оспы-опоясывающего герпеса (VZV), цитомегаловируса (CMV), вирусов 1 и 2 простого герпеса (HSV-1 иHSV-2), вируса 8 герпеса человека (HHV-8, также известного как вирус, сопутствующий саркоме Капоши) и флавивирусов, включающих вирус желтой лихорадки, вирус лихорадки денге, вирусы японского энцефалита и вирусы лихорадки Западного Нила. 39. Применение по п.38, в котором указанный вирус является ВИЧ-1 или 2. 40. Применение состава по любому из пп.17-37 при производстве лекарственного препарата для снижения вероятности либо для замедления наступления состояния, являющегося вторичным от вирусной инфекции у пациента при риске развития указанного состояния. 41. Применение по п.40, в котором указанное состояние является СПИДом, а указанная вирусная инфекция является ВИЧ-1 или 2.
МПК / Метки
МПК: A61K 31/70
Метки: способы, вирусных, частности, противовирусных, лечения, нуклеозидов, аналоги, инфекций, вич
Код ссылки
<a href="https://eas.patents.su/30-12844-analogi-protivovirusnyh-nukleozidov-i-sposoby-lecheniya-virusnyh-infekcijj-v-chastnosti-vich-infekcijj.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги противовирусных нуклеозидов и способы лечения вирусных инфекций, в частности вич инфекций</a>
Предыдущий патент: Композиции для предотвращения и устранения обледенения и для борьбы с обледенением и способ их применения
Следующий патент: Фармацевтическая композиция, содержащая зофеноприл и hctz, для лечения гипертензии
Случайный патент: Альфа-излучающие частицы гидроксиапатита