Безводные кристаллические формы n-[1-(2-этоксиэтил)-5-(n-этил-n-метиламино)-7-(4-метилпиридин-2-иламино)-1н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида
Номер патента: 12577
Опубликовано: 30.10.2009
Авторы: Энтуистл Дэвид Эндрю, Тэйлор Стефан Колин Джон, Маршалл Питер Воллэнс
Формула / Реферат
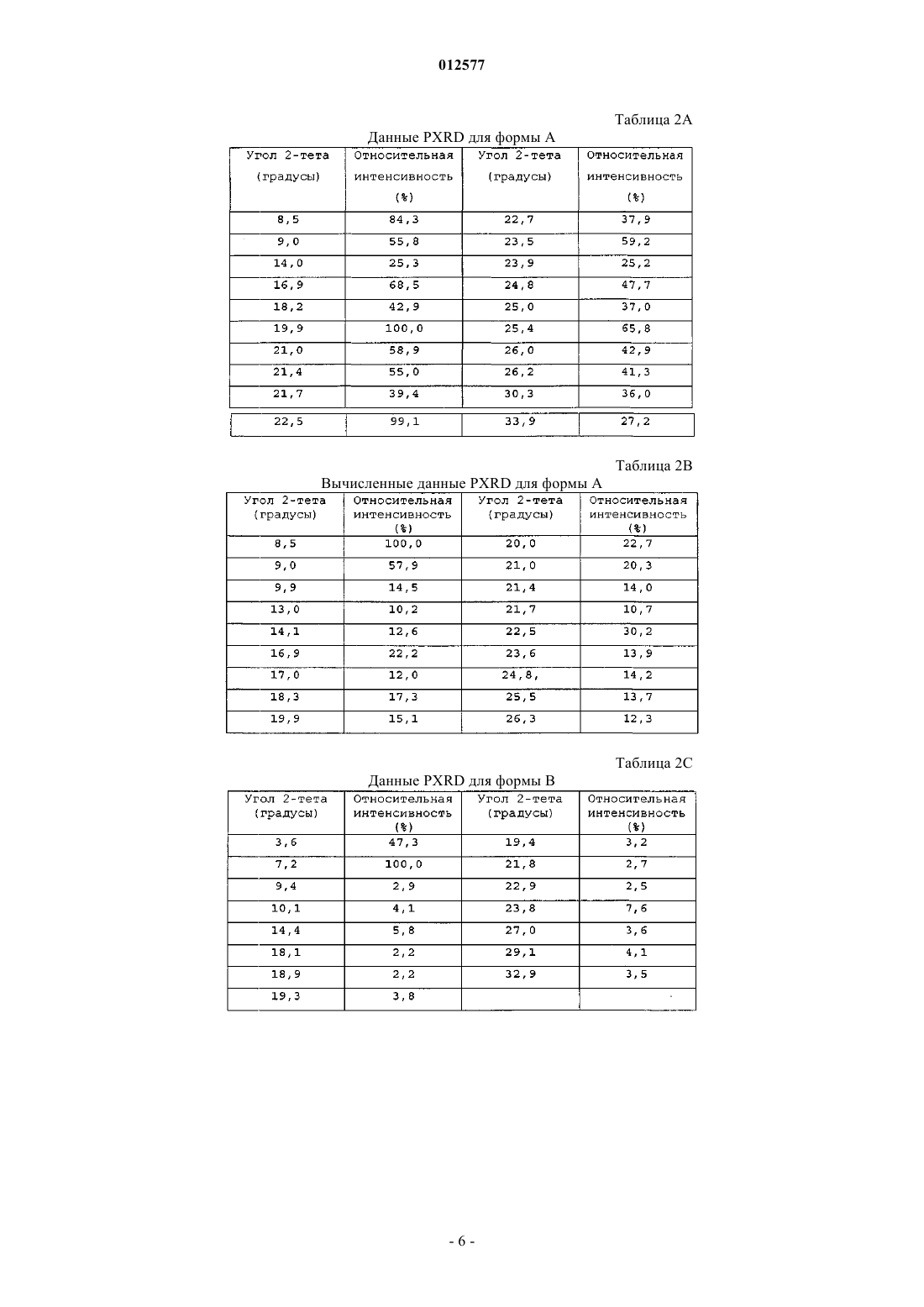
1. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, имеющий порошковую рентгенограмму, содержащую пик дифракции при 8,5+0,1ш 2-тета.
2. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.1, где порошковая рентгенограмма дополнительно содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 9,0+0,1; 16,9+0,1; 20,0+0,1 и 22,5+0,1ш 2-тета.
3. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.2, где порошковая рентгенограмма не содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 3,6+0,1 и 7,2+9,1ш 2-тета.
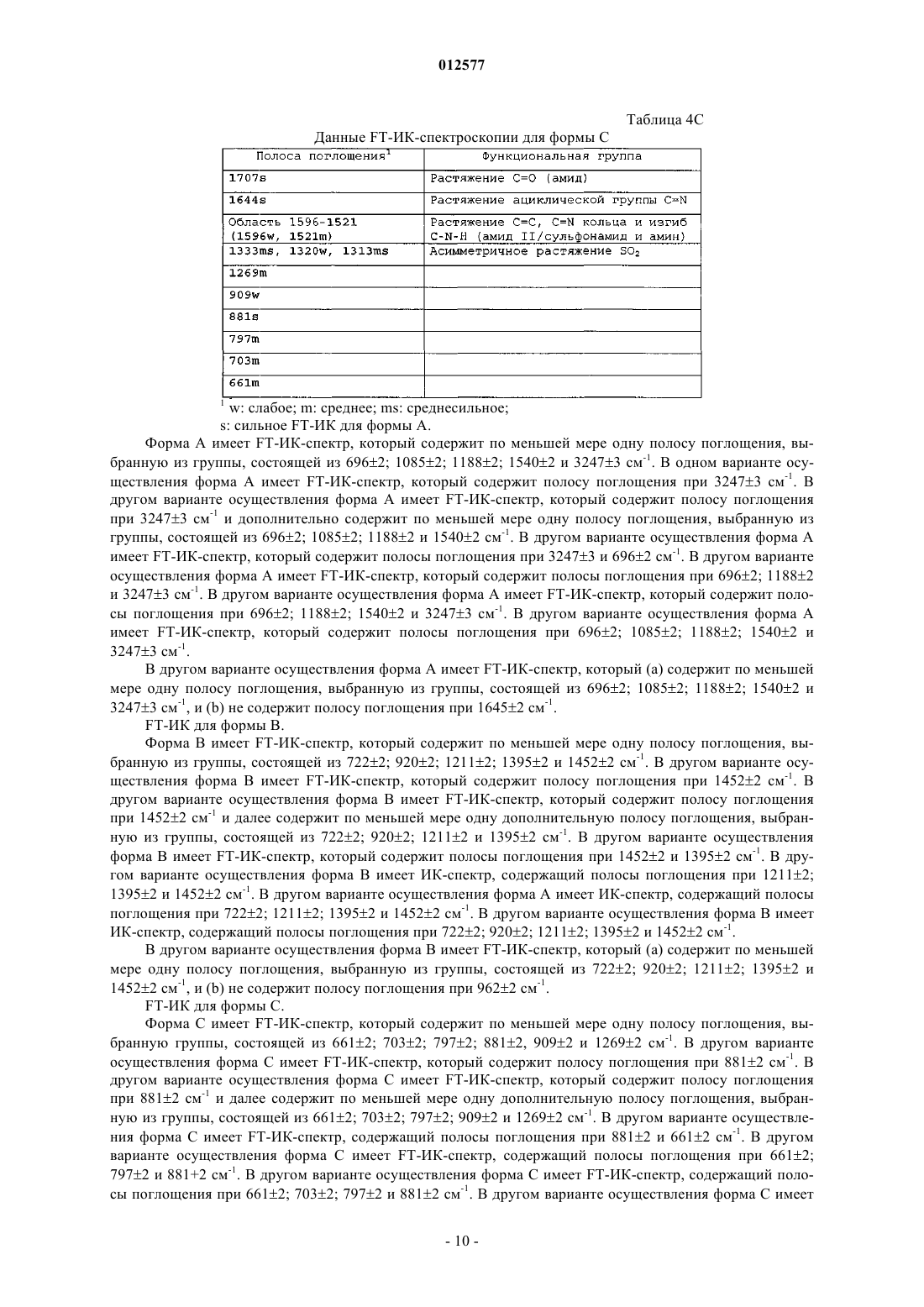
4. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.1, имеющий инфракрасный спектр с Фурье-преобразованием, содержащий полосу поглощения при 3247+3 см-1.
5. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.1, где инфракрасный спектр с Фурье-преобразованием дополнительно содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 696+2; 1085+2; 1188+2 и 1540+2 см-1.
6. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.1, где инфракрасный спектр с Фурье-преобразованием не содержит полосу поглощения при 1645+2 см-1.
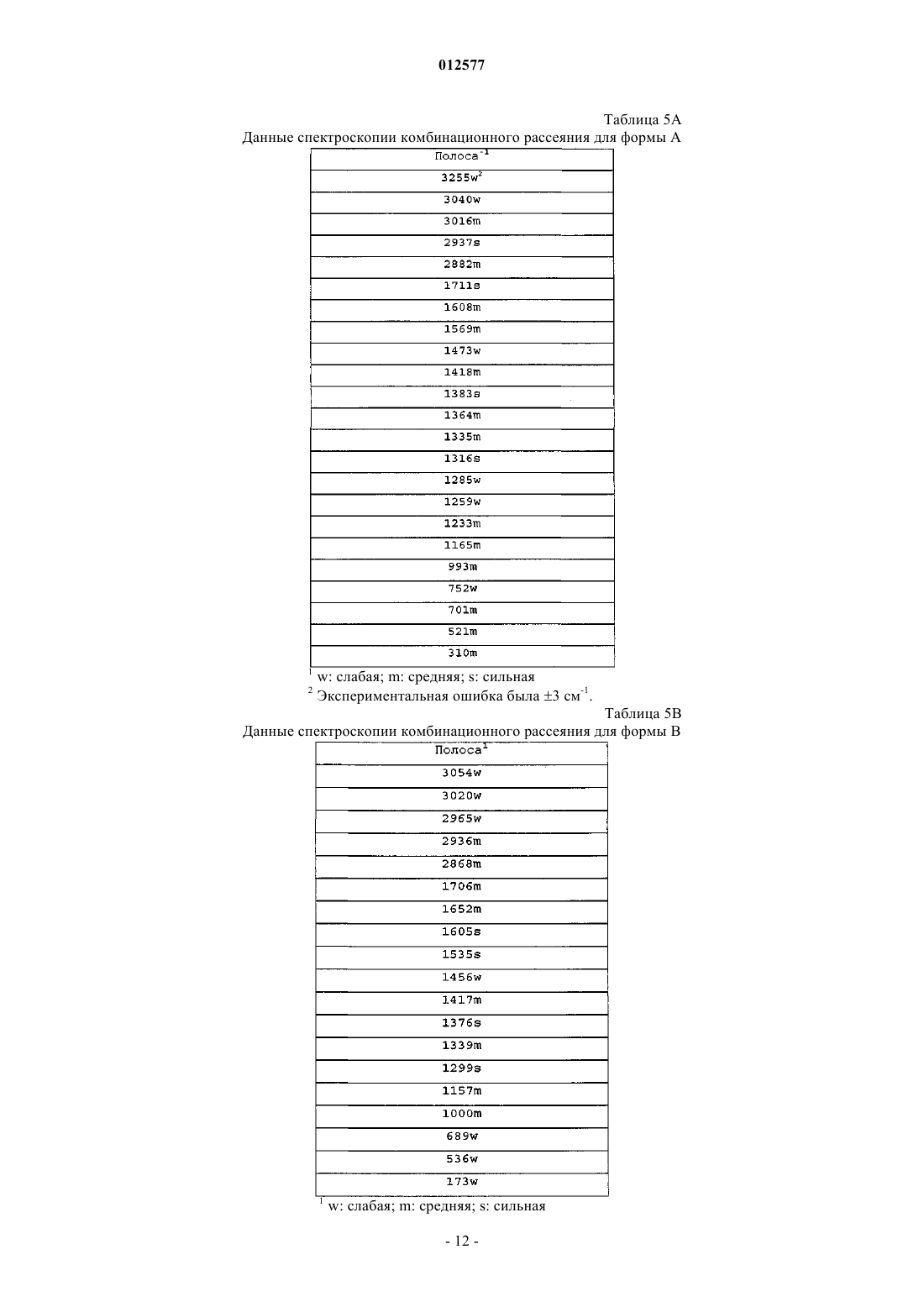
7. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.1, имеющий спектр комбинационного рассеяния, содержащий полосу при 3255+3 см-1.
8. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.1, где спектр комбинационного рассеяния дополнительно содержит по меньшей мере одну полосу, выбранную из группы, состоящей из 993+2; 1383+2; 1473+2 и 1569+2 см-1.
9. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.1, где спектр комбинационного рассеяния не содержит полосу при 1652 см-1.
10. Фармацевтическая композиция, содержащая терапевтически эффективное количество кристаллического N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида по п.1 и фармацевтически приемлемый носитель.
11. Фармацевтическая композиция, содержащая терапевтически эффективное количество N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида и фармацевтически приемлемый носитель, где по меньшей мере приблизительно 50 мас.% N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида присутствует в виде кристаллического N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида по п.1.
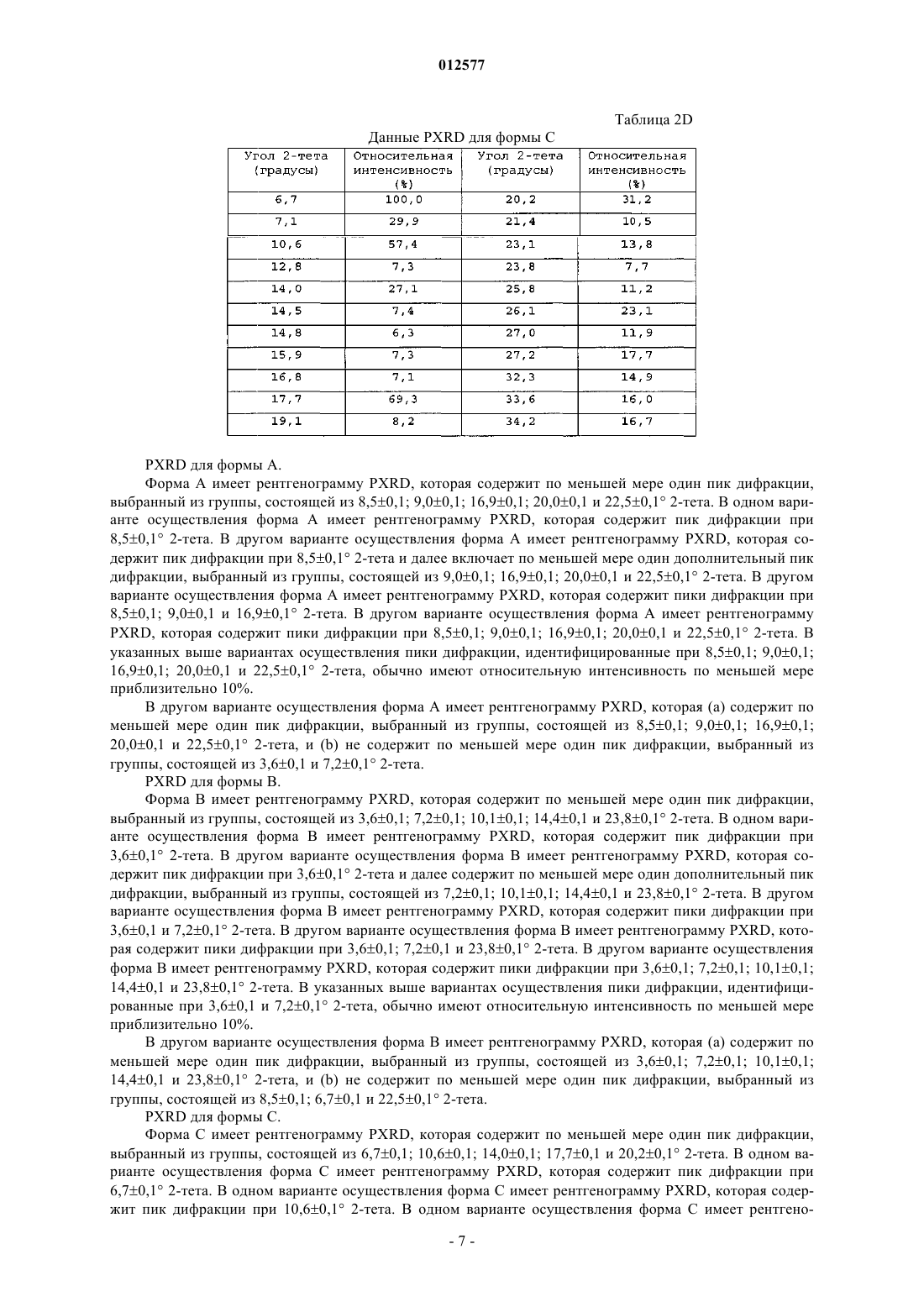
12. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, имеющий порошковую рентгенограмму, содержащую пик дифракции при 3,6+0,1ш 2-тета.
13. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.12, где порошковая рентгенограмма дополнительно содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 7,2+0,1; 10,1+0,1; 14,4+0,1 и 23,8+0,1ш 2-тета.
14. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.13, где порошковая рентгенограмма не содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 8,5+0,1; 20,2+0,1 и 22,5+0,1ш 2-тета.
15. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.12, имеющий инфракрасный спектр с Фурье-преобразованием, содержащий полосу поглощения 1452+2 см-1.
16. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.12, где инфракрасный спектр с Фурье-преобразованием дополнительно содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 722+2; 920+2; 1211+2 и 1395+2 см-1.
17. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.12, где инфракрасный спектр с Фурье-преобразованием не содержит полосу поглощения при 962+2 см-1.
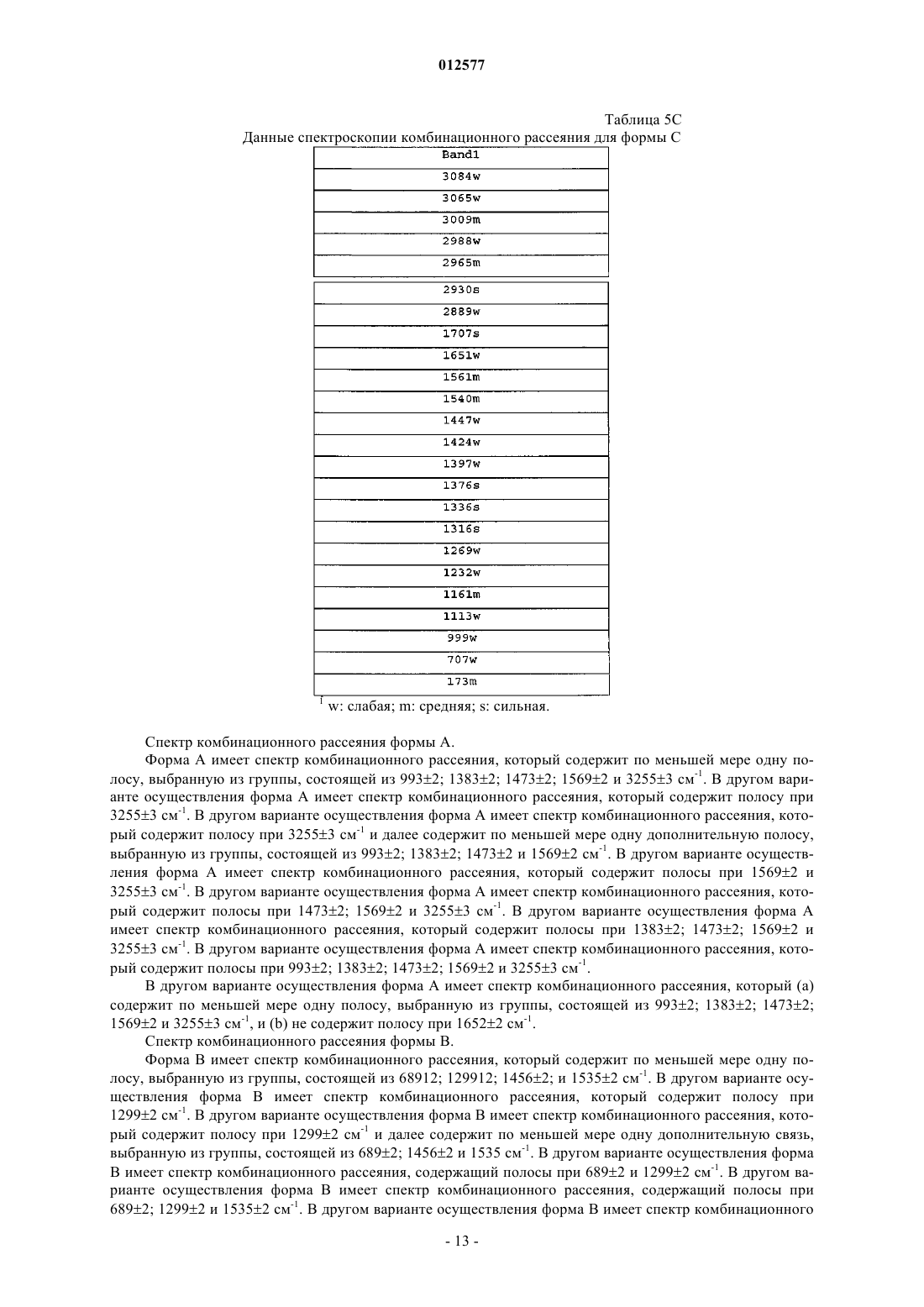
18. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.12, имеющий спектр комбинационного рассеяния, содержащий полосу при 1299+2 см-1.
19. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.12, где спектр комбинационного рассеяния дополнительно содержит по меньшей мере одну полосу, выбранную из группы, состоящей из 689+2; 1456+2 и 1535+2 см-1.
20. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.12, где спектр комбинационного рассеяния не содержит полосу при 1316+2 см-1.
21. Фармацевтическая композиция, содержащая терапевтически эффективное количество кристаллического N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида по п.12 и фармацевтически приемлемый носитель.
22. Фармацевтическая композиция, содержащая терапевтически эффективное количество N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида и фармацевтически приемлемый носитель, где по меньшей мере приблизительно 50 маё.% N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида присутствует в виде кристаллического N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида по п.12.
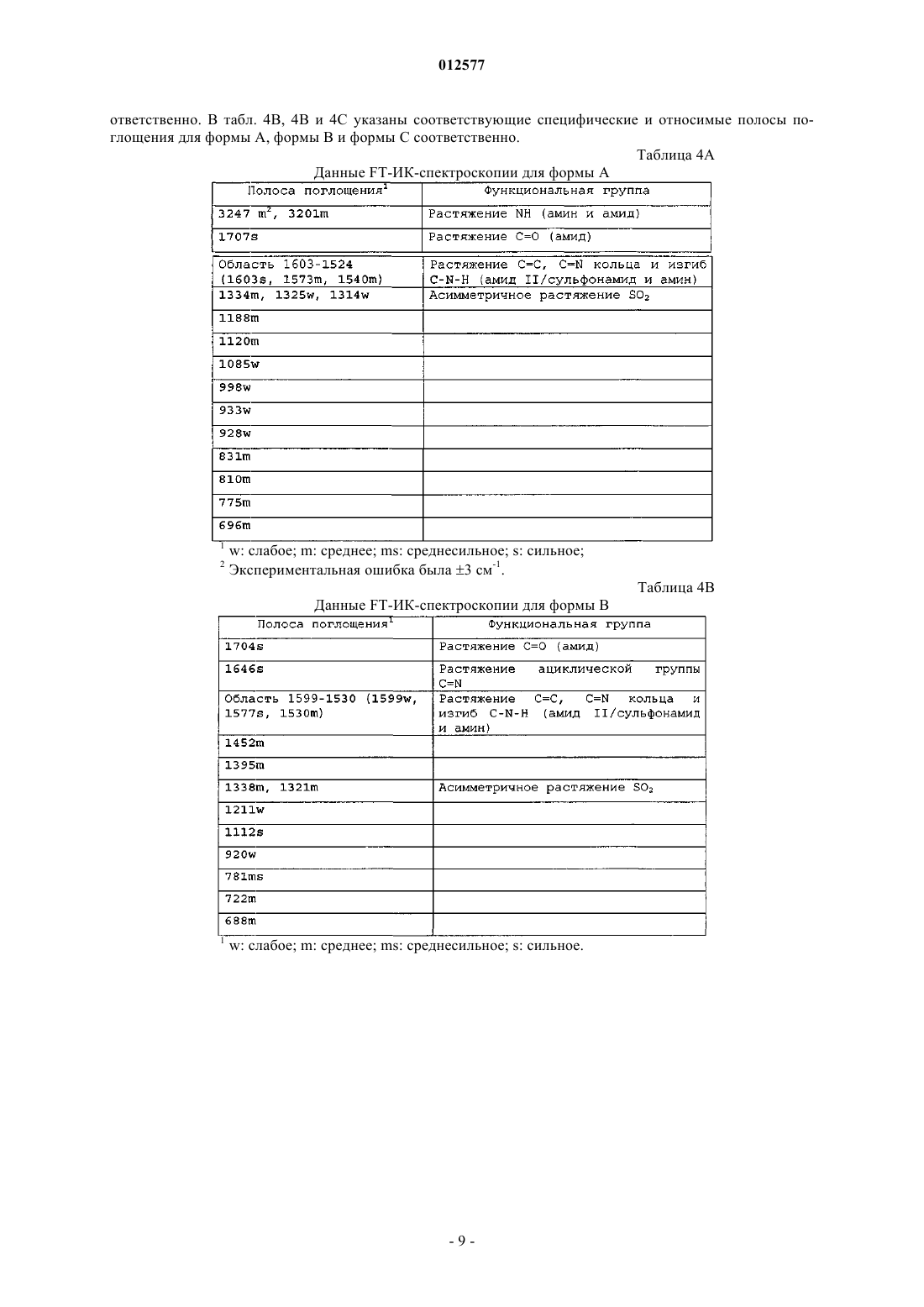
23. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, имеющий порошковую рентгенограмму, содержащую пик дифракции при 6,7+0,1ш 2-тета.
24. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.23, где порошковая рентгенограмма дополнительно содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 10,6+0,1; 14,0+0,1; 17,7+0,1 и 22,2+0,1ш 2-тета.
25. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.24, где порошковая рентгенограмма не содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 3,6+0,1 и 9,0+0,1ш 2-тета.
26. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.23, имеющий инфракрасный спектр с Фурье-преобразованием, содержащий полосу поглощения 881+2 см-1.
27. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.23, где инфракрасный спектр с Фурье-преобразованием дополнительно содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 661+2; 703+2; 797+2; 909+2 и 1269+2 см-1.
28. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.23, где инфракрасный спектр с Фурье-преобразованием не содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 688+2 и 696+2 см-1.
29. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.23, имеющий спектр комбинационного рассеяния, содержащий полосу при 2988+2 см-1.
30. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.23, где спектр комбинационного рассеяния дополнительно содержит по меньшей мере одну полосу, выбранную из группы, состоящей из 707+2 и 1447+2 см-1.
31. Кристаллический N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид по п.23, где спектр комбинационного рассеяния не содержит полосу при 1417+2 см-1.
32. Фармацевтическая композиция, содержащая терапевтически эффективное количество кристаллического N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида по п.23 и фармацевтически приемлемый носитель.
33. Фармацевтическая композиция, содержащая терапевтически эффективное количество N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида и фармацевтически приемлемый носитель, где по меньшей мере приблизительно 50 мас.% N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида присутствует в виде кристаллического N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида по п.23.
34. Способ лечения легочной артериальной гипертензии у субъекта, включающий введение субъекту терапевтически эффективного количества N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида по п.1.
35. Способ лечения легочной артериальной гипертензии у субъекта, включающий введение субъекту терапевтически эффективного количества N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида по п.12.
36. Способ лечения легочной артериальной гипертензии у субъекта, содержащий введение субъекту терапевтически эффективного количества N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида по п.23.
Текст
012577 Перекрестная ссылка на родственные заявки В заявке на данный патент испрашивается приоритет согласно предварительной заявке на патент США с регистрационным номером 60/680445, поданной 12 мая 2005 г., и предварительной заявке на патент США с регистрационным номером 60/681711, поданной 17 мая 2005 г., описание каждой из которых включено здесь посредством ссылки во всей ее полноте. Область техники, к которой относится изобретение Данное изобретение в общем относится к кристаллическим формам N-[1-(2-этоксиэтил)-5-(N-этилN-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида. Более конкретно, данное изобретение относится к (1) безводным кристаллическим формамN-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамида, (2) фармацевтическим композициям, содержащим по меньшей мере одну такую форму, (3) способам лечения опосредуемого фосфодиэстеразой-5 состояния с применением по меньшей мере одной такой формы и (4) способам получения таких форм. Уровень техники Соединение,N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Нпиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, имеет следующую структуру 1:N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Hпиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида описан в примере 115 опубликованной заявки РСТ WO 2005/049616 (заявка соединения). В заявке соединения далее описано, что N-[1-(2 этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3 карбонил]метансульфонамид является ингибитором фосфодиэстеразы-5 ("PDE-5"), который можно применять для лечения опосредуемого PDE-5 состояния, такого как гипертензия. Различные формы твердого состояния фармацевтического соединения могут иметь существенно разные физические свойства. Такие различия в физических свойствах могут оказывать влияние, например, на то, как фармацевтическое соединение получают, обрабатывают, изготовляют из него препарат или как вводят. Согласно этому, желательной является идентификация новых форм твердого состоянияN-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамида, которые имеют преимущество относительно других форм твердого состояния при получении, обработке, изготовлении препарата или введении соединения. Как обсуждается ниже, идентифицированы три новые безводные кристаллические формы N-[1-(2 этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1H-пиразоло[4,3-d]пиримидин-3 карбонил]метансульфонамида. Сущность изобретения В одном варианте осуществления настоящее изобретение относится к безводным кристаллическим формам N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1H-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамида. В другом варианте осуществления изобретение относится к форме А безводной кристаллической формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамида (форма А). В другом варианте осуществления изобретение относится к форме В безводной кристаллической формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамида (форма В). В другом варианте осуществления изобретение относится к форме С безводной кристаллической формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамида (форма С). В другом варианте осуществления изобретение относится к композиции, содержащей по меньшей мере две формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Нпиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида, выбранные из группы, состоящей из форм А, В и C. В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей по меньшей мере одну форму N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин 2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида, выбранную из группы, состоящей из форм А, В и С, и фармацевтически приемлемый носитель. В другом варианте осуществления изобретение относится к способам лечения PDE-5 опосредуемого состояния, включающим введение субъекту терапевтически эффективного количества по-1 012577 меньшей мере одной формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2 иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида, выбранной из группы, состоящей из форм А, В и С. В другом варианте осуществления изобретение относится к способам получения форм А, В и С. Дополнительные варианты осуществления изобретения обсуждаются на всем протяжении описания данного патента. Краткое описание графических материалов На фиг. 1 показана иллюстративная порошковая рентгенограмма для формы А. На фиг. 2 - рассчитанная порошковая рентгенограмма для формы А. На фиг. 3 - иллюстративная порошковая рентгенограмма для формы В. На фиг. 4 - иллюстративная порошковая рентгенограмма для формы С. На фиг. 5 - иллюстративная термограмма ДСК для формы А. На фиг. 6 - иллюстративная термограмма ДСК для формы В. На фиг. 7 - иллюстративная термограмма ДСК для формы С. На фиг. 8 - иллюстративный FT-ИК-спектр для формы А. На фиг. 9 - иллюстративный FT-ИК-спектр для формы В. На фиг. 10 - иллюстративный FT-ИК-спектр для формы С. На фиг. 11 - иллюстративный спектр комбинационного рассеяния для формы А. На фиг. 12 - иллюстративный спектр комбинационного рассеяния для формы В. На фиг. 13 - иллюстративный спектр комбинационного рассеяния для формы С. На фиг. 14 - иллюстративная порошковая рентгенограмма для вещества, полученного в примере 1. На фиг. 15 - иллюстративная альтернативная синтетическая схема для получения N-[1-(2 этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3 карбонил]метансульфонамида. Подробное описание предпочтительных вариантов осуществления Форма соединения в твердом состоянии может оказывать существенное влияние на физические свойства соединения, включающие:(1) свойства упаковки, такие как молярный объем, плотность и гигроскопичность,(2) термодинамические свойства, такие как температура плавления, давление паров и растворимость,(3) кинетические свойства, такие как скорость растворения и устойчивость (в том числе устойчивость в условиях окружающей среды, особенно к действию влаги и условий хранения),(4) поверхностные свойства, такие как площадь поверхности, смачиваемость, межфазное натяжение и форма,(5) механические свойства, такие как твердость, прочность на разрыв, уплотняемость, манипулирование, текучесть и смешиваемость, и(6) свойства фильтрования. Выбор и регулирование формы в твердом состоянии являются особенно важными для соединений,которые являются фармакологическими агентами. Тщательный выбор и регулирование формы в твердом состоянии могут уменьшать проблемы синтеза, обработки, приготовления препарата или введения, связанные с соединением. Идентифицированы три новые безводные кристаллические формы (форма А, форма В и форма С) соединения, N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида. Как объясняется более подробно ниже, каждая из форм А, В и С имеет отличительные физические свойства относительно каждой другой из них. Имеется в виду, что применяемая в данном изобретении номенклатура N-[1-(2-этоксиэтил)-5-(Nэтил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид (а также соответствующая структура 1) включает все таутомерные изомеры N-[1-(2 этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3 карбонил]метансульфонамида. Например, два таутомерных изомера N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида показаны ниже как таутомер (1) и таутомер (2) (иллюстрированные ниже резонансными структурами): Без связи с конкретной теорией предполагается, что форма А кристаллизуется, как указанный выше таутомер (1), и что каждая из формы В и формы С кристаллизуется, как указанный выше таутомер (2). А. Аббревиатуры и определения Применяемый в отношении к 1 Н ЯМР символотносится к химическому сдвигу 1 Н ЯМР. Применяемая в отношении к 1 Н ЯМР аббревиатура ушир. относится к уширенному сигналу 1H ЯМР. Применяемая в отношении к 1 Н ЯМР аббревиатура д относится к дублетному пику 1 Н ЯМР. Аббревиатура m/z относится к пику масс-спектра. Применяемая в отношении к 1 Н ЯМР аббревиатура м относится к мультиплетному пику 1 Н ЯМР. Применяемая в отношении к 1 Н ЯМР аббревиатура кв. относится к квартетному пику 1 Н ЯМР. Применяемая в отношении к 1 Н ЯМР аббревиатура с относится к синглетному пику 1 Н ЯМР. Применяемая в отношении к 1 Н ЯМР аббревиатура т относится к триплетному пику 1 Н ЯМР. Термин ДСК относится к дифференциальной сканирующей калориметрии. Термин ВЭЖХ относится к высокоэффективной жидкостной хроматографии. Термин PXRD относится к порошковой дифракции рентгеновских лучей. Термины PDE-5-опосредуемое состояние и фосфодиэстераза-5-опосредуемое состояние относится к любому состоянию, опосредуемому PDE-5, независимо от того, путем ли непосредственной регуляции PDE-5 или путем опосредуемой регуляции PDE-5 в качестве компонента пути передачи сигнала. Термин композиция относится к изделию производства, которое является результатом смешивания или сочетания более чем одного элемента или ингредиента. Термин кристаллическая форма, применяемый для N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида, относится к форме твердого состояния, в которой молекулы N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида располагаются с образованием отличимой кристаллической решетки, (i) включающей отличимые элементарные ячейки и (ii) образующей пики дифракции, когда ее подвергают рентгеновскому излучению. Термин кристаллизация, применяемый на всем протяжении данного изобретения, может относиться к кристаллизации и/или перекристаллизации, в зависимости от применимых условий, относящихся к получению исходного соединения N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида. Термин чистота относится к химической чистоте N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида согласно данным общепринятого анализа ВЭЖХ. Термин фазовая чистота относится к чистоте твердого состояния N-[1-(2-этоксиэтил)-5-(N-этилN-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида относительно конкретной формы твердого состояния N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида, определяемой описанными здесь аналитическими методами. Термин фармацевтически приемлемый носитель относится к носителю, который является совместимым с другими ингредиентами композиции и не является вредным для субъекта. Такими носителями могут быть фармацевтически приемлемый материал, композиция или наполнитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или капсулирующее вещество,принимающее участие в переносе или перемещении химического агента. Предпочтительная композиция зависит от метода введения. Термины предотвращает, предотвращение или предотвращающий относится либо к предотвращению начала преклинически вполне очевидного состояния в целом, либо к предотвращению начала преклинически очевидной стадии состояния у субъекта. Предотвращение включает, но не ограничивается указанным, профилактическое лечение субъекта при риске развития состояния. Термин относительная интенсивность относится к отношению интенсивности отдельного пика-3 012577 дифракции (или спектральной линии, в зависимости от того, какой может быть случай) к интенсивности самого сильного пика дифракции в той же дифрактограмме. Другими словами, интенсивность самого сильного пика принимают за 100 и все другие интенсивности соизмеряют, соответственно. Термин терапевтически эффективное количество относится к такому количеству лекарственного средства или фармацевтического агента, которое может вызывать биологическую или медицинскую реакцию ткани, системы или животного, которую определяет исследователь или клиницист. Термин лечение (и соответствующие термины лечит и лечащий) относится к паллиативному,восстанавливающему (здоровье) и превентивному лечению субъекта. Термин паллиативное лечение относится к лечению, которое облегчает или снижает действие или интенсивность патологического состояния у субъекта без лечения состояния. Термин превентивное лечение (и соответствующий термин профилактическое лечение) относится к лечению, которое предотвращает появление такого состояния у субъекта. Термин восстанавливающее (здоровье) лечение относится к лечению, которое останавливает развитие патологических проявлений или уменьшает патологические проявления или полностью устраняет состояние у субъекта. В. Характеризация кристаллических форм Кристаллическое состояние соединения можно описать несколькими кристаллографическими параметрами, включающими структуру монокристалла, порошковую рентгенограмму, температуру плавления, спектр инфракрасного поглощения и спектр комбинационного рассеяния. 1. Рентгеноструктурный анализ монокристалла Кристаллическую структуру формы А определяли рентгеноструктурным анализом монокристаллов. Данные рентгеноструктурного анализа монокристаллов, применяемые в анализе, собирали при комнатной температуре с применением рентгеновского дифрактометра для монокристаллов Bruker SMART(контроль) и SAINT v.6.02 (интегрирование), Bruker AXS Inc., Madison, WI 1994) из нескольких серий экспонирований, где каждое экспонирование охватывало 0,3 в , со временем экспонирования 30 с и общий набор данных был более чем полусферой. Данные корректировали для поглощения с применением метода мультисканирований (SADABS, программа для масштабирования и коррекции данных детектора площади, G.M. Sheldrick, University of Gottingen, 1997 (основана на методе R.H. Blessing, Acta Cryst. 1995, A51, 33-38. Кристаллическую структуру затем разрешали прямыми методами с применениемSHELXS-97 (Программа для уточнения кристаллической структуры G.M. Sheldrick, University of Gottingen, Germany, 1997, release 97-2), в пространственной группе P21/c и уточняли методом наименьших квадратов, применяющим SHELXL-97. Выбранные данные кристаллической структуры суммированы в табл. 1 А. Кристаллическую структуру формы С также определяли рентгеноструктурным анализом монокристаллов тем же самым методом, как описано выше для формы А, за исключением того, что применяли время экспонирования 120 с. Кристаллическую структуру разрешали прямыми методами, применяющими SHELXS-97, в пространственной группе Р-1, и уточняли методом наименьших квадратов, применяющим SHELXL-97. Выбранные данные кристаллической структуры для формы С суммированы в табл. 1 В. Таблица 1 А Данные кристаллической структуры формы А-4 012577 Таблица 1 В Данные кристаллической структуры формы С Как ранее указано, предполагается, что форма А кристаллизуется в виде таутомера (1) и форма С кристаллизуется в виде таутомера (2). Рентгеноструктурный анализ монокристалла подтверждает эту предположение. 2. Порошковая дифракция рентгеновских лучей Кристаллические структуры форм А, В и С анализировали с применением порошковой дифракции рентгеновских лучей (PXRD). Данные дифракции рентгеновских лучей собирали при комнатной температуре с применением порошкового дифрактометра рентгеновских лучей Bruker AXS D4 (излучениеCu K), снабженного автоматическим устройством для замены образца, гониометром тета-тета, автоматического контроля расходимости потока лучей щелями, дополнительным монохроматором и счетчиком сцинтилляции. Образцы готовили для анализа заполнением порошка в полость с диаметром 12 мм и глубиной 0,25 мм, которую врезали в кремниевую форму для образца из кремниевых пластин. Образец вращали при облучении рентгеновскими лучами K-альфа 1 меди (длина волны=1,5406 Ангстрем) рентгеновской трубки, действующей при 40 кВ/40 мА. Анализы проводили гониометром, действующим непрерывным образом и установленным для 5-секундного подсчета на шаг 0,02 на протяжении диапазона 2-тета от 2 до 55 С. Пики, полученные для формы А, выравнивали по отношению к пикам из рассчитанной картины структуры монокристалла. Для формы В и формы С полученные пики выравнивали по отношению к кремниевому эталонному стандарту. Для формы А углы 2-тета, расстояния d и относительные интенсивности вычисляли из структуры монокристалла с применением модуля "Reflex Powder Diffraction" Accelrys Materials Studio [версия 2.2]. Подходящие параметры моделирования были в каждом случае: длина волны=1,540562(Cu Kальфа 1), фактор поляризации=0,5; профиль Pseudo-Voigt (U=0,01, V=-0,001, W=0,002). Как должно быть понятно специалисту в области кристаллографии, относительные интенсивности различных пиков, указанные в приведенных ниже таблицах и фигурах, могут варьировать вследствие ряда таких факторов, как эффекты ориентации кристаллов в рентгеновском пучке или чистота анализируемого вещества либо степень кристаллизации образца. Положения пиков могут также сдвигаться для вариантов в высоте образца, но положения пиков будут сохраняться, по существу, как указано в табл. 2 А, 2 С и 2D для формы А, формы В и формы С соответственно. Специалист в области кристаллографии должен также знать, что измерения, проведенные с применением различных длин волн, приведут к различным сдвигам согласно уравнению Бреггаn=2dsin. Считается, что такие дополнительные рентгенограммы PXRD, полученные с применением альтернативных длин волн, являются альтернативными представлениями рентгенограмм PXRD кристаллических веществ настоящего изобретения и как таковые входят в объем настоящего изобретения. Иллюстративные рентгенограммы PXRD для формы А, формы В и формы С показаны на фиг. 1, 3 и 4 соответственно. В табл. 2 А, 2 С и 2D перечислены соответствующие основные пики дифракции в терминах величин 2 и интенсивностей для формы А, формы В и формы С соответственно. В табл. 2 А перечислены пики формы А, имеющие относительную интенсивность больше чем 25%. В табл. 2 С перечислены пики формы В, имеющие относительную интенсивность больше чем 2%. В табл. 2D перечислены пики формы А, имеющие относительную интенсивность больше чем 10%.PXRD для формы А. Форма А имеет рентгенограмму PXRD, которая содержит по меньшей мере один пик дифракции,выбранный из группы, состоящей из 8,50,1; 9,00,1; 16,90,1; 20,00,1 и 22,50,1 2-тета. В одном варианте осуществления форма А имеет рентгенограмму PXRD, которая содержит пик дифракции при 8,50,1 2-тета. В другом варианте осуществления форма А имеет рентгенограмму PXRD, которая содержит пик дифракции при 8,50,1 2-тета и далее включает по меньшей мере один дополнительный пик дифракции, выбранный из группы, состоящей из 9,00,1; 16,90,1; 20,00,1 и 22,50,1 2-тета. В другом варианте осуществления форма А имеет рентгенограмму PXRD, которая содержит пики дифракции при 8,50,1; 9,00,1 и 16,90,1 2-тета. В другом варианте осуществления форма А имеет рентгенограммуPXRD, которая содержит пики дифракции при 8,50,1; 9,00,1; 16,90,1; 20,00,1 и 22,50,1 2-тета. В указанных выше вариантах осуществления пики дифракции, идентифицированные при 8,50,1; 9,00,1; 16,90,1; 20,00,1 и 22,50,1 2-тета, обычно имеют относительную интенсивность по меньшей мере приблизительно 10%. В другом варианте осуществления форма А имеет рентгенограмму PXRD, которая (а) содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 8,50,1; 9,00,1; 16,90,1; 20,00,1 и 22,50,1 2-тета, и (b) не содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 3,60,1 и 7,20,1 2-тета.PXRD для формы В. Форма В имеет рентгенограмму PXRD, которая содержит по меньшей мере один пик дифракции,выбранный из группы, состоящей из 3,60,1; 7,20,1; 10,10,1; 14,40,1 и 23,80,1 2-тета. В одном варианте осуществления форма В имеет рентгенограмму PXRD, которая содержит пик дифракции при 3,60,1 2-тета. В другом варианте осуществления форма В имеет рентгенограмму PXRD, которая содержит пик дифракции при 3,60,1 2-тета и далее содержит по меньшей мере один дополнительный пик дифракции, выбранный из группы, состоящей из 7,20,1; 10,10,1; 14,40,1 и 23,80,1 2-тета. В другом варианте осуществления форма В имеет рентгенограмму PXRD, которая содержит пики дифракции при 3,60,1 и 7,20,1 2-тета. В другом варианте осуществления форма В имеет рентгенограмму PXRD, которая содержит пики дифракции при 3,60,1; 7,20,1 и 23,80,1 2-тета. В другом варианте осуществления форма В имеет рентгенограмму PXRD, которая содержит пики дифракции при 3,60,1; 7,20,1; 10,10,1; 14,40,1 и 23,80,1 2-тета. В указанных выше вариантах осуществления пики дифракции, идентифицированные при 3,60,1 и 7,20,1 2-тета, обычно имеют относительную интенсивность по меньшей мере приблизительно 10%. В другом варианте осуществления форма В имеет рентгенограмму PXRD, которая (а) содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 3,60,1; 7,20,1; 10,10,1; 14,40,1 и 23,80,1 2-тета, и (b) не содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 8,50,1; 6,70,1 и 22,50,1 2-тета.PXRD для формы С. Форма С имеет рентгенограмму PXRD, которая содержит по меньшей мере один пик дифракции,выбранный из группы, состоящей из 6,70,1; 10,60,1; 14,00,1; 17,70,1 и 20,20,1 2-тета. В одном варианте осуществления форма С имеет рентгенограмму PXRD, которая содержит пик дифракции при 6,70,1 2-тета. В одном варианте осуществления форма С имеет рентгенограмму PXRD, которая содержит пик дифракции при 10,60,1 2-тета. В одном варианте осуществления форма С имеет рентгено-7 012577 грамму PXRD, которая содержит пик дифракции при 10,60,1 2-тета. В одном варианте осуществления форма С имеет рентгенограмму PXRD, которая содержит пик дифракции при 17,70,1 2-тета. В одном варианте осуществления форма С имеет рентгенограмму PXRD, которая содержит пик дифракции при 20,20,1 2-тета. В другом варианте осуществления форма С имеет рентгенограмму PXRD, которая содержит пик дифракции при 6,70,1 2-тета и далее содержит по меньшей мере один дополнительный пик дифракции, выбранный из группы, состоящей из 10,60,1; 14,00,1, 17,70,1 и 20,210,1 2-тета. В другом варианте осуществления форма С имеет рентгенограмму PXRD, которая содержит пики дифракции при 6,70,1 и 20,2+0,1 2-тета. В другом варианте осуществления форма С имеет рентгенограмму PXRD,которая содержит пики дифракции при 6,70,1; 17,70,1 и 20,20,1 2-тета. В другом варианте осуществления форма С имеет рентгенограмму PXRD, которая содержит пики дифракции при 6,7+0,1; 17,70,1; 10,60,1 и 20,2+0,1 2-тета. В другом варианте осуществления форма С имеет рентгенограмму PXRD,которая содержит пики дифракции при 6,7+0,1; 10,6+0,1; 14,00,1; 17,7+0,1 и 20,20,1 2-тета. В указанных выше вариантах осуществления пики дифракции, идентифицированные при 6,7+0,1; 10,60,1; 14,00,1; 17,70,1 и 20,20,1 2-тета, предпочтительно имеют относительную интенсивность по меньшей мере приблизительно 10%. В другом варианте осуществления форма С имеет рентгенограмму PXRD, которая (а) содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 6,70,1; 10,60,1; 14,00,1; 17,70,1 и 20,20,1 2-тета, и (b) не содержит по меньшей мере один пик дифракции, выбранный из группы, состоящей из 3,60,1 и 9,00,1 2-тета. 3. Дифференциальная сканирующая калориметрия Каждую из формы А, формы В и формы С анализировали с применением дифференциальной сканирующей калориметрии (ДСК). Для проведения каждого анализа применяли дифференциальный сканирующий калориметр ТА instruments Q1000. Каждый образец нагревали от 25 до 300 С при скорости нагрева 20 С/мин в алюминиевой кювете с крышкой на верху кюветы при продувании газообразным азотом. Температуру эндотермического пика плавления указывали как точку плавления. Данные анализа ДСК зависят от нескольких факторов, включающих скорость нагрева, чистоту образца, размер кристаллов и размер образца. Поэтому нижеследующие точки плавления являются репрезентативными для образцов, получаемых ниже. ДСК для формы А. 3,171 мг образца формы А анализировали ДСК, как описано выше. Термограмма ДСК, полученная для образца А, показана на фиг. 5. Форма А показала первый эндотермический пик при 1743 С, последующий процесс экзотермической перекристаллизации при 1793 С и второй эндотермический пик при 2193 С. Пик при 1743 С соответствует плавлению формы А. Процесс экзотермической перекристаллизации при 1793 С соответствует перекристаллизации расплавленного соединения в виде формы В. Пик при 2193 С соответствует плавлению формы В. ДСК для формы В. 4,405 мг образца формы В анализировали ДСК, как описано выше. Термограмма ДСК, полученная для образца В, показана на фиг. 6. Форма В показала эндотермический пик при 218 С 3 С, который соответствует плавлению формы В. ДСК для формы С. 4,405 мг образца формы С анализировали ДСК, как описано выше. Термограмма ДСК для полученного образца С показана на фиг. 7. Форма С показывает первый эндотермический пик при 1883 С, последующий процесс экзотермической перекристаллизации при 1993 С и второй эндотермический пик при 2193 С. Пик при 1883 С соответствует плавлению формы С. Процесс экзотермической перекристаллизации при 1993 С соответствует перекристаллизации расплавленного соединения в виде формы В. Пик при 2193 С соответствует плавлению формы В. 4. Инфракрасная спектроскопия с преобразованием Фурье Кристаллические структуры формы А, формы В и формы С анализировали с применением инфракрасной спектроскопии с преобразованием Фурье (FT-ИК). FT-ИК-спектры образцов формы А, формы В и формы С получали с применением спектрометра ThermoNicolet Avatar 360 с вспомогательным устройством ATR с однократным отражением Smart Golden Gate (пластина, покрытая сверху алмазом, и линзы с селенидом цинка). Данные измерений собирали с применением разрешающей способности 2 см-1, 128 сканирований и аподизации Нарр Genzel. Поскольку FT-ИК-спектры регистрировали с применением ATR с однократным отражением, не требовалось приготовления образца. Применение ATR FTИК, однако, может вызвать регистрацию относительных интенсивностей инфракрасных полос, отличающихся от относительных интенсивностей, обычно наблюдаемых в FT-ИК-спектре с применением дисков KBr. Вследствие природы ATR FT-ИК интенсивности полос обычно повышаются при переходе от области с более высокой длиной волны к области с более низкой длиной волны. Экспериментальная ошибка, если не оговорено особо, была 2 см-1. Иллюстративные FT-ИК-спектры для формы А, формы В и формы С показаны на фиг. 8, 9 и 10 со-8 012577 ответственно. В табл. 4 В, 4 В и 4 С указаны соответствующие специфические и относимые полосы поглощения для формы А, формы В и формы С соответственно. Таблица 4 А Данные FT-ИК-спектроскопии для формы Аw: слабое; m: среднее; ms: среднесильное; s: сильное; Экспериментальная ошибка была 3 см-1. Таблица 4 В Данные FT-ИК-спектроскопии для формы Вs: сильное FT-ИК для формы А. Форма А имеет FT-ИК-спектр, который содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 6962; 10852; 11882; 15402 и 32473 см-1. В одном варианте осуществления форма А имеет FT-ИК-спектр, который содержит полосу поглощения при 32473 см-1. В другом варианте осуществления форма А имеет FT-ИК-спектр, который содержит полосу поглощения при 32473 см-1 и дополнительно содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 6962; 10852; 11882 и 15402 см-1. В другом варианте осуществления форма А имеет FT-ИК-спектр, который содержит полосы поглощения при 32473 и 6962 см-1. В другом варианте осуществления форма А имеет FT-ИК-спектр, который содержит полосы поглощения при 6962; 11882 и 32473 см-1. В другом варианте осуществления форма А имеет FT-ИК-спектр, который содержит полосы поглощения при 6962; 11882; 15402 и 32473 см-1. В другом варианте осуществления форма А имеет FT-ИК-спектр, который содержит полосы поглощения при 6962; 10852; 11882; 15402 и 32473 см-1. В другом варианте осуществления форма А имеет FT-ИК-спектр, который (а) содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 6962; 10852; 11882; 15402 и 32473 см-1, и (b) не содержит полосу поглощения при 16452 см-1.FT-ИК для формы В. Форма В имеет FT-ИК-спектр, который содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 7222; 9202; 12112; 13952 и 14522 см-1. В другом варианте осуществления форма В имеет FT-ИК-спектр, который содержит полосу поглощения при 14522 см-1. В другом варианте осуществления форма В имеет FT-ИК-спектр, который содержит полосу поглощения при 14522 см-1 и далее содержит по меньшей мере одну дополнительную полосу поглощения, выбранную из группы, состоящей из 7222; 9202; 12112 и 13952 см-1. В другом варианте осуществления форма В имеет FT-ИК-спектр, который содержит полосы поглощения при 14522 и 13952 см-1. В другом варианте осуществления форма В имеет ИК-спектр, содержащий полосы поглощения при 12112; 13952 и 14522 см-1. В другом варианте осуществления форма А имеет ИК-спектр, содержащий полосы поглощения при 7222; 12112; 13952 и 14522 см-1. В другом варианте осуществления форма В имеет ИК-спектр, содержащий полосы поглощения при 7222; 9202; 12112; 13952 и 14522 см-1. В другом варианте осуществления форма В имеет FT-ИК-спектр, который (а) содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 7222; 9202; 12112; 13952 и 14522 см-1, и (b) не содержит полосу поглощения при 9622 см-1.FT-ИК для формы С. Форма С имеет FT-ИК-спектр, который содержит по меньшей мере одну полосу поглощения, выбранную группы, состоящей из 6612; 7032; 7972; 8812, 9092 и 12692 см-1. В другом варианте осуществления форма С имеет FT-ИК-спектр, который содержит полосу поглощения при 8812 см-1. В другом варианте осуществления форма С имеет FT-ИК-спектр, который содержит полосу поглощения при 8812 см-1 и далее содержит по меньшей мере одну дополнительную полосу поглощения, выбранную из группы, состоящей из 6612; 7032; 7972; 9092 и 12692 см-1. В другом варианте осуществления форма С имеет FT-ИК-спектр, содержащий полосы поглощения при 8812 и 6612 см-1. В другом варианте осуществления форма С имеет FT-ИК-спектр, содержащий полосы поглощения при 6612; 7972 и 881+2 см-1. В другом варианте осуществления форма С имеет FT-ИК-спектр, содержащий полосы поглощения при 6612; 7032; 7972 и 8812 см-1. В другом варианте осуществления форма С имеетFT-ИК-спектр, содержащий полосы поглощения при 6612; 7032; 7972; 8812 и 909+2 см-1. В другом варианте осуществления форма С имеет FT-ИК-спектр, содержащий полосы поглощения при 6612; 7032; 7972; 8812 и 9092 и 12692 см-1. В другом варианте осуществления форма С имеет FT-ИК-спектр, который (а) содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 6612; 7032; 8812; 9092 и 12692 см-1, и (b) не содержит полосу поглощения при 6882 см-1. В другом варианте осуществления форма С имеет FT-ИК-спектр, который (а) содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 6612; 7032; 7972; 8812; 9092 и 12692 см-1, и (b) не содержит полосу поглощения при 6882 см-1. В другом варианте осуществления форма С имеет FT-ИК-спектр, который(а) содержит по меньшей мере одну полосу поглощения, выбранную из группы, состоящей из 6612; 7032; 7972; 8812; 9092 и 12692 см-1, и (b) не содержит по меньшей мере одну полосу поглощения,выбранную из группы, состоящей из 6882 или 6962 см-1. Как указано ранее, предполагается, что форма А кристаллизуется в виде таутомера (1) и каждая из формы В и формы С кристаллизуется в виде таутомера (2). FT-ИК-анализ подтверждает эту гипотезу. В частности, FT-ИК-спектр формы С имеет среднесильную полосу поглощения при 16442 см-1 и FT-ИКспектр формы В имеет сильную полосу поглощения при 16462 см-1. Считается, что эти полосы соответствуют частоте растяжения ациклической группы C=N, которая согласуется с таутомером (2). В противоположность этому, FT-ИК-спектр формы А не имеет полосы поглощения при соответствующей частоте. Считается, что у формы А отсутствует частота растяжения ациклической группы C=N вследствие того, что она кристаллизуется в виде таутомера (1). 5. Спектроскопия комбинационного рассеяния с Фурье-преобразованием Каждую из формы А, формы В и формы С анализировали с применением спектроскопия комбинационного рассеяния (рамановской спектроскопии) с Фурье-преобразованием. Спектры комбинационного рассеяния для формы А, формы В и формы С получали с применением спектрометра комбинационного рассеяния ThermoNicolet 960 Raman. Каждый образец (приблизительно 5 мг) помещали в стеклянную ампулу и для возбуждения подвергали действию мощности лазерного излучения Nd-YAG 1064,5 нм. Данные собирали при разрешающей способности 2 см-1, измеряли как интентивность спектра комбинационного рассеяния в виде функции сдвига спектра комбинационного рассеяния. Данные обрабатывали как Фурье-преобразование с применением аподизации Happ-Genzel. Экспериментальная ошибка, если не оговорено особо, была 2 см-1. Иллюстративные спектры комбинационного рассеяния формы А (условия измерения: 2000 сканирований, мощность лазерного излучения: 750 мВт, мощность лазерного излучения у образца: 400 мВт), формы В (условия измерения: 4000 сканирований, мощность лазерного излучения: 600 мВт, мощность лазерного излучения у образца: 340 мВт) и формы С (условия измерения: 960 сканирований, мощность лазерного излучения: 600 мВт, мощность лазерного излучения у образца: 340 мВт) показаны на фиг. 11, 12 и 13 соответственно. Х-ось является сдвигом комбинационного рассеяния (см-1) и Y-ось является интенсивностью. Интенсивности являются отнесениями интенсивности относительно основной линии поглощения на спектре и не основаны на абсолютных величинах, измеренных от базовой линии. В табл. 5 А, 5 В и 5 С указаны соответствующие характеристические полосы спектра комбинационного рассеяния для формы А, формы В и формы С соответственно.- 11012577 Таблица 5 А Данные спектроскопии комбинационного рассеяния для формы Аw: слабая; m: средняя; s: сильная Экспериментальная ошибка была 3 см-1. Таблица 5 В Данные спектроскопии комбинационного рассеяния для формы В- 12012577 Таблица 5 С Данные спектроскопии комбинационного рассеяния для формы С Спектр комбинационного рассеяния формы А. Форма А имеет спектр комбинационного рассеяния, который содержит по меньшей мере одну полосу, выбранную из группы, состоящей из 9932; 13832; 14732; 15692 и 32553 см-1. В другом варианте осуществления форма А имеет спектр комбинационного рассеяния, который содержит полосу при 32553 см-1. В другом варианте осуществления форма А имеет спектр комбинационного рассеяния, который содержит полосу при 32553 см-1 и далее содержит по меньшей мере одну дополнительную полосу,выбранную из группы, состоящей из 9932; 13832; 14732 и 15692 см-1. В другом варианте осуществления форма А имеет спектр комбинационного рассеяния, который содержит полосы при 15692 и 32553 см-1. В другом варианте осуществления форма А имеет спектр комбинационного рассеяния, который содержит полосы при 14732; 15692 и 32553 см-1. В другом варианте осуществления форма А имеет спектр комбинационного рассеяния, который содержит полосы при 13832; 14732; 15692 и 32553 см-1. В другом варианте осуществления форма А имеет спектр комбинационного рассеяния, который содержит полосы при 9932; 13832; 14732; 15692 и 32553 см-1. В другом варианте осуществления форма А имеет спектр комбинационного рассеяния, который (а) содержит по меньшей мере одну полосу, выбранную из группы, состоящей из 9932; 13832; 14732; 15692 и 32553 см-1, и (b) не содержит полосу при 16522 см-1. Спектр комбинационного рассеяния формы В. Форма В имеет спектр комбинационного рассеяния, который содержит по меньшей мере одну полосу, выбранную из группы, состоящей из 68912; 129912; 14562; и 15352 см-1. В другом варианте осуществления форма В имеет спектр комбинационного рассеяния, который содержит полосу при 12992 см-1. В другом варианте осуществления форма В имеет спектр комбинационного рассеяния, который содержит полосу при 12992 см-1 и далее содержит по меньшей мере одну дополнительную связь,выбранную из группы, состоящей из 6892; 14562 и 1535 см-1. В другом варианте осуществления форма В имеет спектр комбинационного рассеяния, содержащий полосы при 6892 и 12992 см-1. В другом варианте осуществления форма В имеет спектр комбинационного рассеяния, содержащий полосы при 6892; 12992 и 15352 см-1. В другом варианте осуществления форма В имеет спектр комбинационного- 13012577 рассеяния, содержащий полосы при 6892; 12992; 14562 и 15352 см-1. В другом варианте осуществления форма В имеет спектр комбинационного рассеяния, который (а) содержит по меньшей мере одну полосу, выбранную из группы, состоящей из 6892; 12992; 14562 и 15352 см-1, и (b) не содержит полосу при 13162 см-1. Спектр комбинационного рассеяния формы С. Форма С имеет спектр комбинационного рассеяния, который содержит по меньшей мере одну полосу, выбранную из группы, состоящей из 7072; 14472 и 29882 см-1. В другом варианте осуществления форма С имеет спектр комбинационного рассеяния, который содержит полосу при 29882 см-1. В другом варианте осуществления форма С имеет спектр комбинационного рассеяния с существенной полосой при 29882 см-1 и далее содержит по меньшей мере одну дополнительную связь, выбранную из группы, состоящей из 7072 и 14472 см-1. В другом варианте осуществления форма С имеет спектр комбинационного рассеяния, содержащий полосы при 7072 и 29882 см-1. В другом варианте осуществления форма С имеет спектр комбинационного рассеяния, содержащий полосы при 7072; 14472 и 29882 см-1. В другом варианте осуществления форма С имеет спектр комбинационного рассеяния, который (а) содержит по меньшей мере одну полосу, выбранную из группы, состоящей из 7072; 14472 и 29882 см-1, и (b) не содержит полосу при 14172 см-1. Как указано ранее, предполагается, что форма А кристаллизуется в виде таутомера (1) и каждая из формы В и формы С кристаллизуется в виде таутомера (2). Анализ спектроскопией комбинационного рассеяния с FT подтверждает это предположение. В частности, спектр комбинационного рассеяния с FT для формы С показывает слабую полосу комбинационного рассеяния при 16522 см-1. Считается, что эти полосы соответствуют частоте растяжения ациклической группы C=N, которая согласуется с таутомером(2). В противоположность этому спектр комбинационного рассеяния с FT для формы А не имеет полосу спектра комбинационного рассеяния при соответствующей частоте. Считается, что у формы А отсутствует частота растяжения ациклической группы C=N вследствие того, что она кристаллизуется в виде таутомера (1). С. Свойства формы А, формы В и формы С 1. Термодинамическая устойчивость. Форма А, форма В и форма С имеют разные термодинамические устойчивости. Форма В является более термодинамически устойчивой, чем форма А при температуре окружающей среды и при повышенных температурах (см. ниже пример 13). Однако форма В и форма С являются энантиотропически близкими. Перекрывание в термодинамической устойчивости формы В и формы С имеет место при температуре между приблизительно 40 и приблизительно 60 С (см. ниже пример 14). В другом варианте осуществления перекрывание в термодинамической устойчивости формы В и формы С имеет место при температуре между приблизительно 40 и приблизительно 50 С. При температурах выше точки перекрывания форма В является более термодинамически устойчивой, чем форма С. При температурах ниже этой точки перекрывания (в том числе температурах окружающей среды) форма С является более теромодинамически устойчивой, чем форма В. Эти различия в термодинамической устойчивости имеют практическое значение. Термодинамическая устойчивость кристаллической формы влияет на потенциальный срок годности изготовленного фармацевтического продукта, содержащего кристаллическую форму. Более высокая термодинамическая устойчивость обычно коррелирует с более длительным сроком годности изготовленного фармацевтического продукта. Кроме того, различия в термодинамической устойчивости могут создать проблемы, когда обработка приводит к повышенным температурам (например, вследствие размалывания соединения) или когда обработка имеет место в пределах диапазона температур. Такие изменения температуры во время обработки потенциально могут привести к превращению одной кристаллической формы в другую кристаллическую форму. Если образовавшаяся кристаллическая форма не является желательной формой,может быть необходимо более внимательно регулировать температуру(ы) обработки. 2. Морфология Форма А и форма В имеют также разные морфологии кристаллов. Хотя такие факторы, как температура, растворитель, примеси и гидродинамика (колебания), могут влиять на морфологию кристаллов,форма А и форма В явно имеют разные морфологии кристаллов. Форма А обычно проявляет морфологию, подобную пластинкам. Форма В обычно проявляет морфологию, подобную иглам. Форма С содержит смесь мелких планок, пластин и фрагментов, диапазон размера которых составляет от приблизительно 5 до приблизительно 350 мкм; обычно 50-60 мкм. Эти различия в морфологии потенциально могут влиять на легкость обработки соединения для получения изготовленного фармацевтического продукта. Например, морфология, подобная иглам, может сделать фильтрование и обработку более трудной. В альтернативном случае, морфология, подобная пластинкам, часто является более равноразмерной, что приводит к улучшенной текучести соединения и более легкому манипулированию с соединением, что тем самым приводит к повышению легкости стадий фильтрования, обработки и таблетирования относительно морфологии, подобной иглам.- 14012577 3. Цвет Форма А, форма В и форма С имеют также разный визуальный внешний вид. Форма А обычно имеет окрашивание от слабо-желтоватого до цвета слоновой кости. Форма В обычно имеет желтое окрашивание. Форма С обычно имеет светло-желтое окрашивание. Спецификация продукта для изготовленного фармацевтического продукта часто описывает не только химическую чистоту активного ингредиента, но также фазовую чистоту активного ингредиента. Изменчивость в кристаллической форме активного ингредиента от партии к партии обычно является нежелательной. В случае N-[1-(2-этоксиэтил)-5-(N-этилN-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида цвет партии можно использовать для целей контроля качества для обеспечения качественного способа оценки того, удовлетворяет ли чистота фазы этой партии требуемому стандарту чистоты фазы. Кроме того, важной является эстетика продукта и желательной является однородность цвета во внешнем виде конечного фармацевтического продукта. Когда цветные свойства кристаллической формы влияют на внешний вид изготовленного продукта, будет необходимо осуществлять подходящий контроль кристаллической формы, присутствующей в продукте, чтобы сохранять равномерность цвета продукта.D. Дополнительные варианты осуществления Ниже представлены дополнительные варианты осуществления формы А, формы В и формы С. Дополнительные варианты осуществления формы А. В одном варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пик дифракции при 8,80,1 2-тета и FT-ИК-спектр, содержащий полосу поглощения при 32473 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пик дифракции при 8,50,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 32473 и 6962 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1 и 9,00,1 2-тета, и FT-ИК-спектр, содержащий полосу поглощения при 32473 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1 и 9,00,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 6962 см-1 и 32473 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1; 9,00,1 и 16,90,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 6962, 11882 и 32473 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пик дифракции при 8,50,1 2-тета, и спектр комбинационного рассеяния, содержащий полосу при 32553 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пик дифракции при 8,50,1 2-тета, и спектр комбинационного рассеяния, содержащий полосы при 15692 и 32553 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1 и 9,00,1 2-тета, и спектр комбинационного рассеяния, содержащий полосу при 32553 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1 и 9,00,1 2-тета, и спектр комбинационного рассеяния, содержащий полосы при 15692 и 32553 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1; 9,00,1 и 16,90,1 2-тета, и спектр комбинационного рассеяния, содержащий полосы при 15692 и 32553 см-1. В другом варианте осуществления форма А имеет рентгенограммуPXRD, содержащую пики дифракции при 8,50,1; 9,00,1 и 16,90,1 2-тета, и спектр комбинационного рассеяния, содержащий полосы при 14732; 15692 и 32553 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пик дифракции при 8,50,1 2-тета, и точку плавления 1743 С. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1 и 9,00,1 2-тета, и точку плавления 1743 С. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1; 9,00,1 и 16,90,1 2-тета, и точку плавления 1743 С. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пик дифракции при 8,50,1 2-тета, FT-ИК-спектр, содержащий полосу поглощения при 32473 см-1, и точку плавления 1743 С. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1 и 9,00,1 2-тета, FT-ИК-спектр, содержащий полосу поглощения при 32473 см-1, и точку плавления 1743 С. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1; 9,00,1 и 16,90,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 32473 и 6962 см-1, и точку плавления 1743 С. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1; 9,00,1 и 16,90,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 6962; 11882 и 32473 см-1, и точку плавления 1743 С. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пик дифракции при 8,50,1 2-тета, FT-ИК-спектр, содержащий полосу поглощения при 32473 см-1, и спектр- 15012577 комбинационного рассеяния, содержащий полосу при 32553 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1 и 9,00,1 2-тета, FTИК-спектр, содержащий полосу поглощения при 6962 и 32473 см-1, и спектр комбинационного рассеяния, содержащий полосы при 15692 и 32553 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1; 16,90,1 и 22,50,1 2-тета, FT-ИКспектр, содержащий полосы поглощения при 6962; 11882 и 32473 см-1, и спектр комбинационного рассеяния, содержащий полосы при 15692 и 32553 см-1. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1 и 9,00,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 6962 и 32473 см-1, спектр комбинационного рассеяния, содержащий полосы при 15692 и 32553 см-1, и точку плавления 1743 С. В другом варианте осуществления форма А имеет рентгенограмму PXRD, содержащую пики дифракции при 8,50,1; 16,90,1 и 22,50,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 6962; 11882 и 32473 см-1, спектр комбинационного рассеяния, содержащий полосы при 15692 и 32553 см-1, и точку плавления 1743 С. Дополнительные варианты осуществления формы В. В одном варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, и FT-ИК-спектр, содержащий полосу поглощения при 14522 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 13952 и 14522 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 12111; 13952 и 14522 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 7222; 9202; 12112; 13952 и 14522 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пики дифракции при 3,60,1 и 7,20,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 12112,13952 и 14522 см-1. В одном варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, и точку плавления 2183 С. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пики дифракции при 3,60,1 и 1,20,1 2-тета, и точку плавления 2183 С. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пики дифракции при 3,60,1; 7,20,1 и 2 3,80,1 2-тета, и точку плавления 2183 С. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пики дифракции при 3,60,1; 7,20,1; 10,10,1; 14,40,1 и 23,80,1 2-тета, и точку плавления 2183 С. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, FT-ИК-спектр, содержащий полосу поглощения при 14522 см-1, и точку плавления 2183 С. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 13952 и 14522 см-1, и точку плавления 2183 С. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пики дифракции при 3,60,1; 7,20,1; 10,10,1; 14,40,1 и 23,80,11 2-тета,FT-ИК-спектр, содержащий полосы поглощения при 7222; 9202; 12112; 13952 и 14522 см-1, и точку плавления 2183 С. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, и спектр комбинационного рассеяния, содержащий полосу поглощения при 12992 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, и спектр комбинационного рассеяния, содержащий полосы поглощения при 6892 и 12992 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, и спектр комбинационного рассеяния, содержащий полосы поглощения при 6892; 12992 и 15352 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, и спектр комбинационного рассеяния, содержащий полосы поглощения при 6892; 12992; 14562 и 15352 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, FT-ИК-спектр, содержащий полосу поглощения при 14522 см-1, и спектр комбинационного рассеяния, содержащий полосу поглощения при 12992 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, FTИК-спектр, содержащий полосы поглощения при 13952 и 14522 см-1, и спектр комбинационного рассеяния, содержащий полосы поглощения при 12992 и 6892 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, FT-ИК-спектр,содержащий полосы поглощения при 13952 см-1; 14522 и 15352 см-1, и спектр комбинационного рас- 16012577 сеяния, содержащий полосы поглощения при 12992 и 6892 см-1. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 13952 см-1 и 14522 см-1, спектр комбинационного рассеяния, содержащий полосу поглощения при 12992 см-1, и точку плавления 2183 С. В другом варианте осуществления форма В имеет рентгенограмму PXRD, содержащую пик дифракции при 3,60,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 13952 см-1; 14522 и 15352 см-1, спектр комбинационного рассеяния, содержащий полосы поглощения при 12992 и 6892 см-1, и точку плавления 2183 С. Дополнительные варианты осуществления формы С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, и FT-ИК-спектр, содержащий полосу поглощения при 8812 см-1. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 8812 и 6612 см-1. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 8812; 7972; 7032 и 6612 см-1. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пики дифракции при 6,70,1 и 26,10,1 2-тета, и FT-ИК-спектр, содержащий полосы поглощения при 8812 и 6612 см-1. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, и точку плавления 1883 С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пики дифракции при 6,70,1 и 26,10,1 2-тета, и точку плавления 1883 С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пики дифракции при 6,70,1; 20,20,1 и 17,70,1 2-тета, и точку плавления 1883 С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пики дифракции при 6,70,1; 10,60,1; 14,00,1; 17,70,1 и 20,20,1 2-тета, и точку плавления 1883 С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, и спектр комбинационного рассеяния, содержащий полосу поглощения при 29882 см-1. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, и спектр комбинационного рассеяния, содержащий полосу поглощения при 7072 и 29882 см-1. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, и спектр комбинационного рассеяния, содержащий полосы поглощения при 7072; 14472 и 29882 см-1. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пики дифракции при 6,70,1 и 26,10,1 2-тета, и спектр комбинационного рассеяния, содержащий полосы поглощения при 7072; 14472 и 29882 см-1. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 6612 и 8812 см-1, и точку плавления 1883 С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пики дифракции при 6,70,1 и 20,20,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 6612, 8812 и 7972 см-1, и точку плавления 1883 С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, FT-ИК-спектр, содержащий полосу поглощения при 8812 см-1, спектр комбинационного рассеяния, содержащий полосу поглощения при 29882 см-1, и точку плавления 1883 С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пик дифракции при 6,70,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 6612 и 8812 см-1,спектр комбинационного рассеяния, содержащий полосу поглощения при 29882 см-1, и точку плавления 1883 С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пики дифракции при 6,70,1 и 20,20,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 6612 и 8812 см-1, спектр комбинационного рассеяния, содержащий полосы поглощения при 7072 и 29882 см-1, и точку плавления 1883 С. В другом варианте осуществления форма С имеет рентгенограмму PXRD, содержащую пики дифракции при 6,70,1 и 20,20,1 2-тета, FT-ИК-спектр, содержащий полосы поглощения при 8812; 7972; 7032 и 6612 см-1, спектр комбинационного рассеяния, содержащий полосы поглощения при 7072; 14472 и 29882 см-1, и точку плавления 1883 С. Е. Формы чистых фаз и комбинации формы А, формы В и формы С Каждую из форм А, В и С можно получить как форму, по существу, чистой фазы. В альтернативном случае, каждую из формы А, формы В и формы С можно представить в комбинации с одной или несколькими другими формами. В одном варианте осуществления изобретение включает N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, где по меньшей мере приблизительно 50 мас.% соединения является формой А. В допол- 17012577 нительных вариантах осуществления изобретение включает N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, где по меньшей мере приблизительно 20%, по меньшей мере 30% или по меньшей мере приблизительно 40 мас.% соединения является формой А. В дополнительных вариантах осуществления изобретение включает N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Нпиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, где по меньшей мере приблизительно 60, по меньшей мере приблизительно 70, по меньшей мере приблизительно 80, по меньшей мере приблизительно 85, по меньшей мере приблизительно 90, по меньшей мере приблизительно 95, по меньшей мере приблизительно 96, по меньшей мере приблизительно 97, по меньшей мере приблизительно 98 или по меньшей мере приблизительно 99 мас.% соединения является формой А. В другом варианте осуществления изобретение включаетN-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2 иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, который является, по существу,чистой фазой формы А. В одном варианте осуществления изобретение включает N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, где по меньшей мере приблизительно 50 мас.% соединения является формой В. В дополнительных вариантах осуществления изобретение включает N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, где по меньшей мере приблизительно 20, по меньшей мере приблизительно 30 или по меньшей мере приблизительно 40 мас.% соединения является формой В. В дополнительных вариантах осуществления изобретение включает N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2 иламино)-1 Н-пиразоло[4,3-d]пиримидин-карбонил]метансульфонамид, где по меньшей мере приблизительно 60, по меньшей мере приблизительно 70, по меньшей мере приблизительно 80, по меньшей мере приблизительно 85, по меньшей мере приблизительно 90, по меньшей мере приблизительно 95, по меньшей мере приблизительно 96, по меньшей мере приблизительно 97, по меньшей мере приблизительно 98 или по меньшей мере приблизительно 99 мас.% соединения является формой В. В другом варианте осуществления изобретение включает N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин 2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, который является, по существу, чистой фазой формы В. В одном варианте осуществления изобретение включает N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, где по меньшей мере приблизительно 50 мас.% соединения является формой С. В дополнительных вариантах осуществления изобретение включает N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4 метилпиридин-2-иламино)-1H-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, где по меньшей мере приблизительно 20%, по меньшей мере 30% или по меньшей мере приблизительно 40 мас.% соединения является формой С. В дополнительных вариантах осуществления изобретение включает N[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамид, где по меньшей мере приблизительно 60, по меньшей мере приблизительно 70, по меньшей мере приблизительно 80, по меньшей мере приблизительно 85, по меньшей мере приблизительно 90, по меньшей мере приблизительно 95, по меньшей мере приблизительно 96, по меньшей мере приблизительно 97, по меньшей мере приблизительно 98 или по меньшей мере приблизительно 99 мас.% соединения является формой С. В другом варианте осуществления изобретение включаетN-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Нпиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, который является, по существу, чистой фазой формы С.F. Способы получения формы А, формы В и формы С Настоящее изобретение включает также способы получения формы А, формы В и формы С. Репрезентативные способы описаны в примерах, содержащихся в данном изобретении. Изобретение далее включает каждую из формы А, формы В и формы С, полученные согласно способам, описанным в данном патенте. В одном варианте осуществления изобретение включает форму А,полученную согласно таким способам. В другом варианте осуществления изобретение включает форму В, полученную согласно таким способам. В другом варианте осуществления изобретение включает форму С, полученную согласно таким способам.G. Фармацевтические композиции Формы А, В и С и комбинации таких форм можно вводить любым подходящим путем, предпочтительно в форме фармацевтической композиции, адаптированной для такого пути, и в дозе, эффективной для предполагаемого лечения. В соответствии с этим, изобретение, в частности, включает по меньшей мере одну безводную кристаллическую форму N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4 метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида в сочетании с одним или несколькими фармацевтически приемлемыми носителями. Количество формы А, формы В и формы С, которую вводят, и схема приема лекарственного средства для лечения состояния или нарушения формой А, формой В и/или формой С, зависит от различных факторов, включающих возраст, массу,- 18012577 пол и состояние субъекта, тяжесть заболевания, путь и частота введения и конкретное применяемое соединение, и поэтому может варьировать в широких пределах. Фармацевтические композиции могут содержать форму А, форму В и форму С в диапазоне приблизительно 0,1-2000 мг, предпочтительно в диапазоне приблизительно 0,5-500 мг и наиболее предпочтительно приблизительно 1-200 мг. Подходящей суточной дозой может быть приблизительно 0,01-100 мг/кг массы тела, предпочтительно от приблизительно 0,5 до приблизительно 20 мг/кг массы тела и наиболее предпочтительно приблизительно 0,1-10 мг/кг массы тела. Суточную дозу можно вводить в виде одной-четырех доз в день. В одном варианте осуществления фармацевтическая композиция содержит форму А и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтическая композиция содержитN-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамид, который, по существу, является чистой фазой формы А, и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтическая композиция содержит форму В и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтическая композиция содержитN-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4 метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид, который, по существу, является чистой фазой формы В, и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтическая композиция содержит форму С и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтическая композиция содержит N-[1-(2 этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3 карбонил]метансульфонамид, который, по существу, является чистой фазой формы С, и фармацевтически приемлемый носитель. Еще в одном варианте осуществления фармацевтическая композиция содержит комбинацию по меньшей мере двух форм N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида, выбранных из группы, состоящей из формы А, формы В и формы С, и фармацевтически приемлемый носитель. В одном варианте осуществления массовым отношением количества первой формы ко второй форме является по меньшей мере приблизительно 1:1. В другом варианте осуществления этим отношением является по меньшей мере приблизительно 3:2, по меньшей мере приблизительно 7:3, по меньшей мере приблизительно 4:1; по меньшей мере приблизительно 9:1; по меньшей мере приблизительно 95:5, по меньшей мере приблизительно 96:4; по меньшей мере приблизительно 97:1; по меньшей мере приблизительно 98:2 или по меньшей мере приблизительно 99:1. В другом варианте осуществления фармацевтическая композиция содержит три формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамида, выбранные из группы, состоящей из формы А, формы В и формы С, и фармацевтически приемлемый носитель. Н. Способы лечения Настоящее изобретение далее включает способы лечения состояния у субъекта, имеющего такое состояние или восприимчивого к появлению такого состояния, введением субъекту терапевтически эффективного количества одного или нескольких соединений формы А, формы В, формы С или комбинаций таких форм, как описано выше. В одном варианте осуществления лечением является превентивное лечение. В другом варианте осуществления лечением является паллиативное лечение. В другом варианте осуществления лечением является восстанавливающее здоровье лечение. Состояния, которые можно лечить согласно настоящему изобретению, являются PDE-5 опосредуемые состояния. Такие состояния включают сердечно-сосудистые заболевания, метаболические заболевания, заболевания центральной нервной системы, легочные заболевания, половую дисфункцию и почечную дисфункцию. В одном варианте осуществления состоянием является сердечно-сосудистое заболевание, особенно сердечно-сосудистое заболевание, выбранное из группы, состоящей из гипертензии (такой как эссенциальная гипертензия, легочная гипертензия, вторичная гипертензия, изолированная систолическая гипертензия, гипертензия, связанная с диабетом, гипертензия, связанная с атеросклерозом, и реноваскулярная гипертензия); осложнения, связанные с гипертензией (такие как васкулярное поражение органа, застойная сердечная недостаточность, стенокардия, удар, глаукома и ослабленная почечная функция); вальвулярная недостаточность; стабильная, нестабильная и вариантная (стенокардии Принцметалла) стенокардия; периферическое васкулярное заболевание; инфаркт миокарда; удар; тромбоэмболическое заболевание; рестеноз; артериосклероз; атеросклероз; легочная артериальная гипертензия; ангиостеноз после шунтирования; ангиопластика (такая как чрескожная транслюминальная ангиопластика или чрескожная транслюминальная коронарная ангиопластика); гиперлипидемия; гипоксическая вазоконстрикция; васкулит, такой как синдром Кавасаки; сердечная недостаточность (такая как застойная, декомпенсированная, систолическая, диастолическая и левожелудочковая сердечная недостаточность; правожелудочковая сердечная недостаточность и левожелудочковая гипертрофия); болезнь Рейно; преэклапсия; вызванное беременностью высокое кровяное давление; кардиомиопатия и артериальные окклюзивные нарушения. В другом варианте осуществления состоянием является гипертензия. В другом варианте осуществления состоянием является легочная артериальная гипертензия. В другом варианте осуществления со- 19012577 стоянием является сердечная недостаточность. В другом варианте осуществления состоянием является диастолическая сердечная недостаточность. В другом варианте осуществления состоянием является систолическая сердечная недостаточность. В другом варианте осуществления состоянием является стенокардия. В другом варианте осуществления состоянием является тромбоз. В другом варианте осуществления состоянием является удар. В другом варианте осуществления состоянием является метаболическое заболевание, особенно метаболическое заболевание, выбранное из группы, состоящей из синдрома X; инсулинорезистентности или ослабленной толерантности к глюкозе; диабет (такой как диабет типа I и типа II); синдромы инсулинорезистентности (такие как нарушения рецепторов инсулина, синдром Rabson-Mendenhall, лепречаунизм, синдром Kobberling-Dunnigan, синдром Seip, синдром Lawrence, синдром Кушинга, акромегалия,феохромоцитома, глюкагонома, первичный альдостеронизм, соматостатинома, липоатрофический диабет, диабет, вызванный токсином -клеток, болезнь Грейвса, зоб Хасимото и идиопатическая болезнь Аддисона); диабетические осложнения (такие как диабетическая гангрена, диабетическая артропатия,диабетическая нефропатия, диабетический гломерулосклероз, диабетическая дераматопатия, диабетическая невропатия, периферическая диабетическая невропатия, диабетическая катаракта и диабетическая ретинопатия); гипергликемия и ожирение. В другом варианте осуществления состоянием является инсулинорезистентность. В другом варианте осуществления состоянием является нефропатия. В другом варианте осуществления состоянием является заболевание центральной нервной системы,особенно заболевание центральной нервной системы, выбранное из группы, состоящей из васкулярной деменции; черепно-мозговой травмы; церебральных инфарктов; деменции; нарушений сосредоточения(внимания); болезни Альцгеймера; болезни Паркинсона; бокового амиотрофического склероза (ALS); болезни Хантингтона; рассеянного склероза, болезни Крейтцфельда-Якоба; тревоги; депрессии; нарушений сна и мигрени. В одном варианте осуществления состоянием является болезнь Альцгеймера. В другом варианте осуществления состоянием является болезнь Паркинсона. В одном варианте осуществления состоянием является ALS. В другом варианте осуществления состоянием является нарушение сосредоточения. В одном варианте осуществления состоянием является легочное заболевание, особенно легочное заболевание, выбранное из группы, состоящей из астмы; острого респираторного дистресс-синдрома; муковисцидоза; хронического обструктивного заболевания легких (CORD); бронхита и хронической обратимой закупорки легких. В одном варианте осуществления состоянием является половая дисфункция, особенно половая дисфункция, выбранная из группы, состоящей из импотенции (органической или психической), мужской эректильной дисфункции; дисфункции клитора; половой дисфункции после повреждения спинного мозга; нарушения женского полового возбуждения; женской половой оргазменной дисфункции, женского полового болевого нарушения и нарушения женского гипоактивного полового желания. В другом варианте осуществления состоянием является эректильная дисфункция. В другом варианте осуществления состоянием является почечная дисфункция, особенно почечная дисфункция, выбранная из группы, состоящей из острой или хронической почечной недостаточности; нефропатии (такой как диабетическая нефропатия); гломерулопатии и нефрита. В другом варианте осуществления состоянием является боль. В другом варианте осуществления состоянием является острая боль. Примеры острой боли включают острую боль, связанную с повреждением или хирургией. В другом варианте осуществления состоянием является хроническая боль. Примеры хронической боли включают невропатическую боль (в том числе послегерпетическую невралгию и боль,связанную с периферической, раковой или диабетической невропатией), синдром канала запястья, боль спины (включая боль, связанную с грыжей или нарушением межпозвоночных дисков или нарушениями поясничных небольших гладких поверхностей суставов, крестцово-подвздошных суставов, параспинальных мышц или задней продольной связки), головную боль, раковую боль (включая связанную с опухолью боль, такую как костная боль, головная боль, лицевая боль или висцелярная боль) или боль, связанную с раковой терапией (включая послехимиотерапевтический синдром, синдром хронической послехирургической боли, пострадиационный синдром, боль, связанную с иммунотерапией, или боль, связанную с гормональной терапией), артритную боль (включая боль при остеоартрите и ревматоидном артрите),хроническую постхирургическую боль, послегерпетическую невралгию, невралгию тройничного нерва,ВИЧ-невропатию, фантомную боль конечностей, боль после удара и боль, связанную с хроническим алкоголизмом, гипотироидизмом, уремией, рассеянным склерозом, повреждением спинного мозга, болезнью Паркинсона, эпилепсией и дефицитом витаминов. В другом варианте осуществления состоянием является ноцицептивная боль (включая боль из-за травмы центральной нервной системы, напряжениярасслабления, ожогов, инфаркта миокарда и острого панкреатита, послеоперационную боль (боль после любого типа хирургической операции), послетравматическую боль, почечную колику, раковую боль и боль спины). В другом варианте осуществления состоянием является боль, связанная с воспалением(включая артритную боль, такую как боль при остеоартрите и ревматоидном артрите), анкилозирующим спондилоартритом, висцеральная боль (включая боль воспалительного заболевания кишечника, функ- 20012577 ционального нарушения работы кишечника, гастроэзофагеального рефлюкса, диспепсии, синдрома раздраженного кишечника, синдрома функциональной абдоминальной боли, болезни Крона, илеита, неспецифического язвенного колита, дисменореи, цистита, панкреатита и тазовую боль). В другом варианте осуществления состоянием является боль, являющаяся результатом мышечно-скелетных нарушений(включая миалгию, фибромиалгию, спондилит, серонегативные (неревматоидные) артропатии, несуставной ревматизм, дистрофинопатию, гликогенолиз, полимиозит и пиомиозит). В другом варианте осуществления состояние выбрано из группы, состоящей из головной и васкулярной боли (включая боль, вызванную стенокардией, инфарктом миокарда, митральным стенозом, перикардитом, феноменом Рейно,склередомой и скелетно-мышечной ишемией). В другом варианте осуществления состояние выбрано из группы, состоящей из головной боли (включая мигрень, такую как мигрень с аурой и мигрень без ауры),мигрень, головную боль типа напряжения, смешанную головную боль и головную боль, связанную с васкулярными нарушениями; оролицевую боль, включающую зубную боль, ушную боль, синдром обожженного рта и височно-нижнечелюстную миофасциальную боль). В другом варианте осуществления состоянием является урологическое состояние, выбранное из группы, состоящей из синдрома инфравезикальной обструкции, недержания и доброкачественной простатической гиперплазии. В другом варианте осуществления состоянием является офтальмическое состояние, выбранное из ретинального заболевания; дегенерации желтого пятна и глаукомы. В другом варианте осуществления состояние выбрано из группы, состоящей из тубулоинтерстициальных нарушений; трещины заднего прохода; алопеции; опухолевой кахексии; церебральной апоплексии; нарушений сократительной способности кишечника; нарушений энтероподвижности, дисменореи(первичной и вторичной); глаукомы; дегенерации желтого пятна; заболевания, требующего антитромбоцитарной терапии; геморроев; недержания; синдрома раздраженного кишечника (IBS); метастазы опухоли; рассеянного склероза; неоплазии; нитратной непереносимости; эзофагита любителей орехов; остеопороза, бесплодия; преждевременных родов; псориаза; ретинального заболевания; кожного некроза и крапивницы. В другом варианте осуществления состоянием является остеопороз. В другом варианте осуществления состояние связано с эндотелиальной дисфункцией, особенно состояния, выбранные из группы, состоящей из атеросклеротических повреждений, миокардиальной ишемии, периферической ишемии, вальвулярной недостаточности, легочной артериальной гипертензии, стенокардии, васкулярных осложнений после васкулярного шунтирования, васкулярной дилатации, васкулярной репроницаемости и трансплантации сердца. Способы и композиции настоящего изобретения являются подходящими для применения, например, для субъектов-млекопитающих, таких как люди, другие приматы (например, обезьяны, шимпанзе), животные-компаньоны (например, собаки, кошки, лошади), сельскохозяйственные животные (например, козы, овцы, свиньи, крупный рогатый скот), лабораторные животные (например, мыши, крысы) и дикие животные и животные зоопарков (например, волки,медведи, олени). В другом варианте осуществления субъектом является человек.I. Применение при изготовлении лекарственного средства Настоящее изобретение далее включает способы получения фармацевтической композиции (или лекарственного средства), содержащего форму А, форму В, форму С или комбинации таких форм в сочетании с одним или несколькими фармацевтически приемлемыми носителями и/или другими активными ингредиентами для применения при лечении описанных выше состояний.J. Рабочие примеры Пример 1. Получение Диметил-4-нитро-1 Н-пиразол-3,5-дикарбоксилат (2,0 г, 8,83 ммоль, WO 00/24745, с. 48, получение 2) добавляют к раствору 2-этоксиэтилбромида (1,18 мл, 10,45 ммоль) и карбоната калия (1,32 г,9,56 ммоль) в N,N-диметилформамиде (35 мл) и реакционную смесь перемешивают в течение 48 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме и остаток распределяют между этилацетатом (200 мл) и водой (100 мл). Органический слой отделяют, сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают колоночной хроматографией на силикагеле с элюированием смесью пентан:этилацетат, 100:0-70:30, получая при этом указанный в заголовке продукт,1,63 г. 1 Сложный эфир стадии 1 (1,63 г, 5,4 ммоль) добавляют к раствору гидроксида калия (330 мг,5,9 ммоль) в метаноле (20 мл) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь концентрируют в вакууме и сырой продукт растворяют в воде и промывают простым эфиром. Водную фазу подкисляют 2 М хлористо-водородной кислотой и экстрагируют дихлорметаном (3100 мл). Органические фазы объединяют, сушат над сульфатом магния и концентрируют в вакууме, получая при этом указанный в заголовке продукт. 1 Оксалилхлорид (1,2 мл, 13,76 ммоль) и N,N-диметилформамид (39 мкл) добавляют к раствору карбоновой кислоты стадии 2 (1,33 г, 4,63 ммоль) в дихлорметане (20 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь концентрируют в вакууме и подвергают азеотропной перегонке с дихлорметаном (350 мл). Продукт растворяют в тетрагидрофуране(50 мл), охлаждают на ледяной бане, обрабатывают 0,88 раствором аммиака (10 мл) и перемешивают в течение 18 ч при комнатной температуре. Смесь концентрируют в вакууме и остаток распределяют между дихлорметаном (200 мл) и водой (50 мл). Органическую фазу сушат над сульфатом магния и концентрируют в вакууме, получая при этом указанный в заголовке продукт. 1 Н ЯМР (ДМСО-d6, 400 МГц) : 1,06 (т, 3 Н), 3,40 (м, 2 Н), 3,77 (м, 2 Н), 3,84 (с, 3 Н), 4,38 (м, 2 Н), 8,35 Гидроксид палладия(II) (100 мг) добавляют к раствору нитросоединения стадии 3 (970 мг,3,39 ммоль) в метаноле (20 мл) и смесь нагревают для кипячения с обратным холодильником. Добавляют формиат аммония (1,07 г, 16,97 ммоль) и реакционную смесь перемешивают при кипячении с обратным холодильником в течение 2 ч. Катализатор удаляют фильтрованием через арбоцел и реакционную смесь концентрируют в вакууме, получая при этом указанный в заголовке продукт. 1 Н ЯМР (ДМСО-d6, 400 МГц) : 1,02 (т, 3 Н), 3,33 (м, 2 Н), 3,66 (м, 2 Н), 3,80 (с, 3 Н), 4,57 (м, 2 Н), 5,11 Раствор амида стадии 4 (570 мг, 3,38 ммоль) в N,N-диметилформамиде (30 мл) обрабатывают N,N'карбонилдиимидазолом (658 мг, 4,06 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем при 90 С в течение 18 ч. Реакционную смесь концентрируют в вакууме и сырой продукт суспендируют в ацетоне и обрабатывают ультразвуком в течение 30 мин. Твердый продукт отделяют фильтрованием и сушат в вакууме, получая при этом указанный в заголовке продукт. 1 Оксихлорид фосфора (934 мкл, 10,0 ммоль) и хлорид тетраэтиламмония (195 мг, 1,50 ммоль) добавляют к раствору диона стадии 5 (140 мг, 0,50 ммоль) в пропионитриле (5 мл) и реакционную смесь кипятят с обратным холодильником в течение 18 ч. Реакционную смесь концентрируют в вакууме и сырой продукт распределяют между этилацетатом (50 мл) и водой (50 мл). Органический слой сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают колоночной хроматографией на силикагеле с элюированием смесью пентан:этилацетат, 100:0-75:25, получая при этом указанный в заголовке продукт. 1 Дихлорсоединение стадии 6 (1,98 г, 6,20 ммоль) растворяют в диметилсульфоксиде (10 мл) и раствор обрабатывают 2-амино-4-метилпиридином (1,34 г, 12,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь распределяют между дихлорметаном(300 мл) и водой (500 мл) и слой дихлорметана отделяют. Органическую фазу промывают водой(3100 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол, 100:0-98:2. Сырой продукт растирают с простым эфиром (50 мл), фильтруют и концентрируют в вакууме, получая при этом указанный в заголовке продукт, 1,2 г. 1 Сложный эфир стадии 7 (4,3 г, 11 ммоль) растворяют в диоксане (50 мл) и раствор обрабатывают 1 М водным раствором гидроксида натрия (22,0 мл, 22,0 ммоль). Реакционную смесь затем перемешивают в течение 18 ч при комнатной температуре. Реакционную смесь упаривают досуха, остаток растворяют в воде (100 мл) и раствор промывают дихлорметаном (50 мл). Водную фазу затем подкисляют 1 М раствором лимонной кислоты до pH 4-5 с образованием желтого осадка. Смесь перемешивают в течение 15 мин перед фильтрованием и твердый продукт сушат в вакууме над пентоксидом фосфора, получая при этом указанный в заголовке продукт, 3,75 г. 1 Карбоновую кислоту стадии 8 (1,0 г, 2,70 ммоль), метансульфонамид (330 мг, 3,5 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (660 мг, 3,5 ммоль) и 4-диметиламинопиридин(390 мг, 3,5 ммоль) растворяют в N,N-диметилформамиде (10 мл) и реакционную смесь перемешивают при комнатной температуре в течение 60 ч. Добавляют дополнительный метансульфонамид (165 мг, 1,7 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (330 мг, 1,7 ммоль) и 4 диметиламинопиридин (195 мг, 1,7 ммоль) и реакционную смесь перемешивают в течение дополнительных 20 ч. Добавляют еще метансульфонамид (165 мг, 1,7 ммоль), гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида (330 мг, 1,7 ммоль) и 4-диметиламинопиридин (195 мг,1,7 ммоль) и реакционную смесь перемешивают в течение заключительных 18 ч. Реакционную смесь концентрируют в вакууме и остаток распределяют между дихлорметаном (25 мл) и водой (25 мл). Органическую фазу отделяют, промывают водой (225 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол:уксусная кислота, 100:0:0-96:3,5:0,5. Сырой продукт растирают с нагретым этилацетатом(10 мл), получая при этом указанный в заголовке продукт, 290 мг. 1 Хлорсоединение стадии 9 (110 мг, 0,24 ммоль), N-метилэтиламин (79 мг, 1,2 ммоль), Nэтилдиизопропиламин (210 мкл, 1,20 ммоль) и фторид цезия (37 мг, 0,24 ммоль) растворяют в диметилсульфоксиде (1 мл) и реакционную смесь нагревают до 110 С в течение 5 ч в ReactiVial. Реакционную смесь распределяют между этилацетатом (10 мл) и водой (10 мл) и органическую фазу отделяют и промывают водой (210 мл). Органическую фазу затем сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол, 99:1-97:3. Очищенное вещество упаривают и сушат, получая при этом светло-желтое твердое вещество (66 мг). Рентгенограмма PXRD для твердого вещества показана на фиг. 14. 1N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2 иламино)-1H-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида. Альтернативная синтетическая схема для получения N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида описана на синтетической схеме, показанной на фиг. 15. Пример 3. Получение формы А (перекристаллизация из этилацетата). Форму А кристаллического N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2 иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида получают, как указано ниже. Стадия 1. Диметил-1-(2-этоксиэтил)-4-нитро-1 Н-пиразол-3,5-дикарбоксилат. Диметил-4-нитро-1 Н-пиразол-3,5-дикарбоксилат (WO 00/24745, с. 48, получение 2) (2,0 г,8,83 ммоль) добавляют к раствору 2-этоксиэтилбромида (1,18 мл, 10,45 ммоль) и карбоната калия (1,32 г,9,56 ммоль) в N,N-диметилформамиде (35 мл) и реакционную смесь перемешивают в течение 48 ч при- 24012577 комнатной температуре. Реакционную смесь концентрируют в вакууме и остаток распределяют между этилацетатом (200 мл) и водой (100 мл). Органический слой отделяют, сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают колоночной хроматографией на силикагеле с элюированием смесью пентан:этилацетат, 100:0-70:30, получая при этом указанный в заголовке продукт,1,63 г. 1MC APCI+ m/z 302 [MH]+. Стадия 2. 3-Метиловый эфир 4-нитро-1-(2-этоксиэтил)-1 Н-пиразол-3,5-дикарбоновой кислоты. Сложный эфир стадии 1 (1,63 г, 5,4 ммоль) добавляют к раствору гидроксида калия (330 мг,5,9 ммоль) в метаноле (20 мл) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь концентрируют в вакууме и сырой продукт растворяют в воде и промывают простым эфиром. Водную фазу подкисляют 2 М хлористо-водородной кислотой и экстрагируют дихлорметаном (3100 мл). Органические фазы объединяют, сушат над сульфатом магния и концентрируют в вакууме, получая при этом указанный в заголовке продукт. 1 Оксалилхлорид (1,2 мл, 13,76 ммоль) и N,N-диметилформамид (39 мкл) добавляют к раствору карбоновой кислоты стадии 2 (1,33 г, 4,63 ммоль) в дихлорметане (20 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь концентрируют в вакууме и подвергают азеотропной перегонке с дихлорметаном (350 мл). Продукт растворяют в тетрагидрофуране(50 мл), охлаждают на ледяной бане, обрабатывают 0,88 раствором аммиака (10 мл) и перемешивают в течение 18 ч при комнатной температуре. Смесь концентрируют в вакууме и остаток распределяют между дихлорметаном (200 мл) и водой (50 мл). Органическую фазу сушат над сульфатом магния и концентрируют в вакууме, получая при этом указанный в заголовке продукт. 1 Гидроксид палладия(II) (100 мг) добавляют к раствору нитросоединения стадии 3 (970 мг,3,39 ммоль) в метаноле (20 мл) и смесь нагревают для кипячения с обратным холодильником. Добавляют формиат аммония (1,07 г, 16,97 ммоль) и реакционную смесь перемешивают при кипячении с обратным холодильником в течение 2 ч. Катализатор удаляют фильтрованием через арбоцел и реакционную смесь концентрируют в вакууме, получая при этом амидный продукт. 1 Н ЯМР (ДМСО-d6, 400 МГц) : 1,02 (т, 3 Н), 3,33 (м, 2 Н), 3,66 (м, 2 Н), 3,80 (с, 3 Н), 4,57 (м, 2 Н), 5,11 Раствор амида стадии 4 (570 мг, 3,38 ммоль) в N,N-диметилформамиде (30 мл) обрабатывают N,N'карбонилдиимидазолом (658 мг, 4,06 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем при 90 С в течение 18 ч. Реакционную смесь концентрируют в вакууме и сырой продукт суспендируют в ацетоне и обрабатывают ультразвуком в течение 30 мин. Твердый продукт отделяют фильтрованием и сушат в вакууме, получая при этом дионовый продукт. Оксихлорид фосфора (934 мкл, 10,0 ммоль) и хлорид тетраэтиламмония (195 мг, 1,50 ммоль) добавляют к раствору диона стадии 5 (140 мг, 0,50 ммоль) в пропионитриле (5 мл) и реакционную смесь кипятят с обратным холодильником в течение 18 ч. Реакционную смесь концентрируют в вакууме и сырой продукт распределяют между этилацетатом (50 мл) и водой (50 мл). Органический слой сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают колоночной хроматографией на силикагеле с элюированием смесью пентан:этилацетат, 100:0-75:25, получая при этом дихлорпродукт. 1 Дихлорсоединение стадии 6 (1,98 г, 6,20 ммоль) растворяют в диметилсульфоксиде (10 мл) и раствор обрабатывают 2-амино-4-метилпиридином (1,34 г, 12,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь распределяют между дихлорметаном(300 мл) и водой (500 мл) и слой дихлорметана отделяют. Органическую фазу промывают водой(3100 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол, 100:0-98:2. Сырой продукт растирают с простым эфиром (50 мл), фильтруют и концентрируют в вакууме, получая при этом указанный в заголовке продукт, 1,2 г. 1 Раствор N-этилметиламина (4,6 мл, 53,8 ммоль) в N-метилпирролидин-2-оне (7 мл) добавляют к раствору монохлорсоединения стадии 7 (7,0 г, 17,93 ммоль) в N-метилпирролидин-2-оне (28 мл) при 110 С. Реакционную смесь нагревают на протяжении ночи и после завершения нагревания раствор охлаждают до комнатной температуры и добавляют воду (25 мл). После перемешивания при комнатной температуре в течение 2 ч суспензию фильтруют и осадок промывают 215 мл воды. Твердое вещество сушат на протяжении ночи в вакууме при 55 С, получая при этом оранжевое твердое вещество (5,988 г,15,0 ммоль, 84%). 1 Сложный эфир стадии 8 (13,57 г, 32,83 ммоль) и 1 M водный раствор гидроксида натрия (90 мл) растворяют в метаноле (10 мл) и реакционную смесь перемешивают при 85 С в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и подкисляют 10% водной лимонной кислотой (90 мл). Водный слой экстрагируют два раза дихлорметаном (36 мл и 24 мл). Водный слой дополнительно окисляют 10% водной лимонной кислотой (20 мл) и экстрагируют дихлорметаном (24 мл). Объединенные экстракты в дихлорметане объединяют и добавляют этанол (13 мл). Из раствора отгоняют дихлорметан при давлении окружающей среды и отогнанный дихлорметан заменяют этанолом (52 мл). Добавляют воду (12 мл) и смесь охлаждают до 5 С и перемешивают в течение 1 ч. Суспензию фильтруют и промывают водой (24 мл) и сушат в вакууме при 55 С, получая при этом желтое твердое вещество (8,858 г,22,2 ммоль, 68%). 1 Н ЯМР (CD3OD, 400 МГц) : 1,10 (т, 3 Н), 1,30 (т, 3 Н), 2,43 (с, 3 Н), 3,24 (с, 3 Н), 3,57 (м, 2 Н), 3,70 (м,2 Н), 3,93 (т, 2 Н), 4,84 (м, 2 Н), 7,02 (м, 1 Н), 8,13 (м, 1 Н), 8,16 (м, 1 Н). Карбоновую кислоту стадии 9 (29,0 г, 72,6 ммоль), метансульфонамид (8,28 г, 87 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (18,0 г, 94 ммоль) и 4-диметиламинопиридин(10,59 г, 94 ммоль) растворяют в дихлорметане (385 мл) и реакционную смесь перемешивают при комнатной температуре на протяжении ночи. Реакционную смесь разбавляют дихлорметаном (до 1500 мл) и два раза промывают водной лимонной кислотой (50 г в 200 мл), затем промывают один раз кислым раствором смеси лимонной кислоты и гидроксида натрия. Фазу дихлорметана сушат над сульфатом магния и концентрируют в вакууме. Твердый остаток кипятят с обратным холодильником в изопропаноле (1 л) в течение 20 мин, дают ему возможность охладиться и образовавшееся твердое вещество отделяют фильтрованием. Выделенное твердое вещество затем кипятят с обратным холодильником в этилацетате(2000 мл) до образования раствора, после чего объем этилацетата уменьшают до 1000 мл. Образовавшийся раствор фильтруют и дают ему возможность охладиться до комнатной температуры на протяжении ночи и затем помещают на ледяную баню и перемешивают в течение 1,5 ч. Образовавшееся твердое вещество отделяют фильтрованием и промывают простым эфиром (250 мл), сушат на фильтровальной подушке в течение 3 ч и затем в вакууме над пентоксидом фосфора, получая при этом белый порошок(16,7 г). Анализ PXRD порошка показал, что он представляет собой форму А кристаллической формы N[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамида. 1 Н ЯМР (CDCl3, 400 МГц) : 1,20 (т, 3 Н), 1,29 (т, 3 Н), 2,41 (с, 3 Н), 3,24 (с, 3 Н), 3,45 (с, 3 Н), 3,64 (кв.,2 Н), 3,75 (м, 2 Н), 3,99 (т, 2 Н), 4,82 (м, 2 Н), 6,87 (д, 1 Н), 8,20 (д, 1 Н), 8,29 (с, 1 Н), 9,87(ушир., 1 Н). Неочищенный N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1Hпиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамид (16,7 г) (см. пример 1) суспендируют в дихлорметане (20 мл) и изопропиловом спирте (70 мл). Суспензию нагревают для кипячения с обратным холодильником (приблизительно 60 С), но, оказывается, что твердое вещество остается, по существу, нерастворенным. К суспензии добавляют дополнительное количество дихлорметана (40 мл) с 5 мл инкрементов. Образовавшийся раствор кипятят с обратным холодильником в течение приблизительно 1 мин и нагревание прекращают. В конце этого времени оказывается, что твердое вещество растворилось с образованием желтого раствора. Раствор затем охлаждают до 35 С без признака кристаллизации. В раствор вносят в качестве затравки небольшое количество (меньше чем приблизительно 0,5 г) неочищенного N-[1-(2-этоксиэтил)-5(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3 карбонил]метансульфонамида, но без признака кристаллизации. Раствор дополнительно охлаждают до комнатной температуры, но без признака кристаллизации. При охлаждении до 5 С раствор становится суспензией. Суспензию перемешивают при такой же температуре, затем фильтруют и вещество, собранное на фильтре, сушат при 50 С, получая при этом твердое вещество (7,7 г). Анализ PXRD твердого вещества показал, что он представлял собой форму А кристаллической формы N-[1-(2-этоксиэтил)-5-(Nэтил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1H-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида. Пример 5. Получение формы В (кипячение с обратным холодильником в метаноле). Форму В кристаллической формыN-[1-(2-Этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3d]пиримидин-3-карбонил]метансульфонамид (13,9 г), содержащий кристаллическую форму А (см. пример 3), растворяют в кипящей с обратным холодильником смеси дихлорметана (160 мл) и метанола(200 мл). Дихлорметан отгоняют (собирают приблизительно 110 мл дистиллята). Смесь охлаждают до комнатной температуры, дают возможность образоваться гранулам в течение 30 мин и фильтруют. Твердое вещество промывают метанолом (30 мл) и сушат в вакууме, получая при этом ярко-желтое твердое вещество (10,8 г). Анализ PXRD твердого вещества показал, что он представлял собой форму В кристаллической формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Нпиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида. Пример 6. Получение формы В (кипячение с обратным холодильником в метаноле). Форму В кристаллической формы(344 г, 3,6 моль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (810,0 г, 4,21 моль) и 4 диметиламинопиридин (488,8 г, 4,01 моль) растворяют в дихлорметане (12 л) в атмосфере азота и реакционную смесь перемешивают при комнатной температуре. Через 3 ч к раствору добавляют дополнительную порцию 4-диметиламинопиридина (62,0 г, всего 551,7 г, 4,52 моль) и реакционную смесь перемешивают при комнатной температуре в течение еще 20 ч. Реакционную смесь разбавляют 10% водной лимонной кислотой (12 л) и органическую фазу отделяют, промывают 10% водной лимонной кислотой(12 л) и затем промывают водой. Образовавшийся раствор (10 л) фильтруют и перегоняют при атмосферном давлении до достижения приблизительно половины начального объема и горячий раствор разбавляют порциями метанола(всего 14 л), в то время как дихлорметан удаляют порциями дистилляцией (всего собирают 11 л дистиллятных фракций, что приводит к конечному объему раствора 13 л, который кипятят с обратным холодильником при 55 С). Желтую суспензию охлаждают до комнатной температуры, перемешивают на протяжении ночи и затем охлаждают до 5 С. Суспензию затем фильтруют и осадок промывают порциями охлажденного метанола (всего 5,8 л). Вещество, собранное с фильтра, сушат в вакууме при 55 С в течение 3 дней, получая при этом продукт в виде ярко-желтого твердого вещества (1,038 кг, выход 73%), которое является формой В кристаллической формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4 метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида.N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4 метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида получают, как указано ниже. Дихлорметан (260 мл) кипятят с обратным холодильником с пропусканием потока азота через головное пространство колбы, уменьшая объем до 240 мл, и затем охлаждают до комнатной температуры в атмосфере азота. В дихлорметане (240 мл) в атмосфере азота растворяют 1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(6-этилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбоновую кислоту (24 г,60 ммоль) (см. пример 3, стадия 9), метансульфонамид (6,88 г, 72 ммоль) и 4-диметиламинопиридин(10,98 г, 90 ммоль). Раствор перемешивают в течение 30 мин, затем добавляют гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида (16,13 г, 84 ммоль) и реакционную смесь перемешивают при комнатной температуре на протяжении ночи в атмосфере азота. Реакционную смесь разбавляют 10% водной лимонной кислотой (240 мл) и органическую фазу отделяют, промывают 10% водной лимонной кислотой (240 мл) и затем промывают водой (240 мл). Образовавшийся раствор перегоняют при атмосферном давлении до достижения приблизительно половины его первоначального объема (приблизительно 120 мл). Горячий раствор медленно разбавляют метанолом (240 мл) и затем смесь перегоняют при атмосферном давлении до достижения приблизительно 240 мл. Горячую смесь снова разбавляют метанолом (120 мл) и снова перегоняют при атмосферном давлении до достижения приблизительно 240 мл. Горячую смесь еще снова разбавляют метанолом(120 мл) и еще снова перегоняют при атмосферном давлении до достижения приблизительно 240 мл. Смеси дают возможность охладиться до комнатной температуры с перемешиванием на протяжении 1 ч и затем охлаждают и перемешивают при 0-5C в течение 1 ч. Образовавшуюся желтую суспензию затем фильтруют и твердое вещество промывают охлажденным метанолом (96 мл). Твердое вещество сушат в вакууме на протяжении ночи при 55 С, получая при этом ярко-желтое твердое вещество (25,78 г, выход 90%), которое является формой В кристаллической формы N-[1-(2-этоксиэтил)-5-(N-этил-Nметиламино)-7-(4-метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида. Пример 8. Получение формы В (применение ионообменной смолы и кипячение с обратным холодильником в метаноле). Форму В кристаллической формы(6,88 г, 72,4 ммоль) и 4-диметиламинопиридин (10,98 г, 90 ммоль) растворяют в дихлорметане (240 мл) в атмосфере азота. Раствор перемешивают в течение 30 мин, затем добавляют гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида (16,14 г, 84,1 ммоль) и реакционную смесь перемешивают при комнатной температуре до тех пор, пока не решат, что реакция, по существу, завершается спустя 5 ч. Реакционную смесь разбавляют 10% водной лимонной кислотой (240 мл) и органическую фазу отделяют, промывают 10% водной лимонной кислотой (240 мл) и затем промывают водой (240 мл). К перемешиваемой отделенной органической фазе добавляют амберлит IRN-78 (24 г) (основная ионообменная смола) и смесь перемешивают в течение 3 ч. Гранулы смолы отделяют фильтрованием,фильтровальный осадок промывают дихлорметаном (48 мл) и объединенные фильтраты промывают 10% водной лимонной кислотой (120 мл) и затем дважды промывают водой (240 мл). Образовавшийся раствор перегоняют при атмосферном давлении до приблизительно половины его первоначального объема (приблизительно 120 мл). Горячий раствор медленно разбавляют метанолом(240 мл), осаждая тем самым желтое твердое вещество, и затем смесь перегоняют при атмосферном давлении до достижения приблизительно 240 мл. Горячую смесь снова разбавляют метанолом (240 мл) и снова перегоняют при атмосферном давлении до достижения приблизительно 240 мл. Желтой суспензии дают возможность охладиться до комнатной температуры с перемешиванием на протяжении ночи и затем охлаждают на ледяной бане в течение 1 ч (приблизительно до 0-5 С). Образовавшуюся суспензию затем фильтруют и твердое вещество промывают метанолом (96 мл). Твердое вещество сушат в вакууме на протяжении ночи при 50 С, получая при этом ярко-желтое твердое вещество (21,51 г, выход 75,1%),которое является формой В кристаллической формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4 метилпиридин-2-иламино)-1H-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида. Пример 9. Получение формы В (превращение суспензии). Приблизительно 25 мг формы А (см. пример 3) суспендируют при комнатной температуре в 1 мл метанола. Имеет место быстрое повышение интенсивности желтого цвета суспензии за 10 мин. Из суспензии отбирают небольшой образец. Анализ образца PXRD указывает, что он является формой В кристаллической формы N-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4-метилпиридин-2-иламино)-1 Нпиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида.- 29012577 Пример 10. Получение формы В (температурное превращение). Образец формы А (см. пример 3) нагревают до 180 С с применением ДСК. Образец плавят и перекристаллизовывают в виде формы В. Образцу дают возможность охладиться до комнатной температуры. Для подтверждения того, что не остается формы А и что превращение в форму В является полным, образец снова нагревают в приборе ДСК до 175 С. Никакие значительные термические явления не детектируются. Образцу дают возможность охладиться до комнатной температуры. Образец снова нагревают до 250 С. Плавление формы В наблюдают при 220 С. Пример 11. Получение формы С (превращение суспензии). Форму С кристаллической формыN-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4 метилпиридин-2-иламино)-1 Н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида получают, как указано ниже. Образец формы В (см. примеры 5-9) суспендируют в смеси ТГФ/Н 2 О (50:50, объем/объем) при 4 С. Спустя 16 дней небольшой образец фильтруют и сушат при комнатной температуре, получая при этом светло-желтое твердое вещество. Анализ ДСК образца согласуется с формой С. Из суспензии отбирают другой небольшой образец во влажном состоянии. Анализ образца PXRD согласуется с формой С. После 31 дня суспендирования из суспензии отбирают другой небольшой образец во влажном состоянии. Анализ образца PXRD согласуется с формой С. Пример 12. Получение формы С (внесение затравки). Форму С кристаллической формыN-[1-(2-этоксиэтил)-5-(N-этил-N-метиламино)-7-(4 метилпиридин-2-иламино)-1H-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида получают, как указано ниже. Образец формы В (см. примеры 5-9) (129,6 г) перемешивают в ацетоне (1300 мл) при 23 С в атмосфере азота. Добавляют затравочные кристаллы формы С (20 мг) и перемешивание продолжают в течение 13 дней при температуре окружающей среды. Твердое вещество собирают фильтрованием и сушат в вакууме при температуре окружающей среды, но выше, чем 20 С, получая при этом с выходом 92,4% продукт в виде формы С (119,8 г), имеющий порошковую рентгенограмму, показанную на фиг. 4. Пример 13. Устойчивость формы А и формы В. Термодинамические устойчивости формы А и формы В сравнивали, как описано ниже. Сначала приблизительно 25 мг формы А суспендируют приблизительно в 1 мл метанола. Имеет место быстрое повышение интенсивности желтого цвета суспензии. Из суспензии отбирают небольшой образец. АнализPXRD подтверждает, что образец является формой В. Затем форму А и форму В анализируют ДСК, иллюстративные данные для образцов формы А и формы В показаны на фиг. 5 и 6, соответственно. Данные ДСК показывают, что точка плавления формы В выше, чем точка плавления формы А. В соответствии с этим, результаты как анализа превращения суспензии, так и анализа ДСК подтверждают, что форма В является более термодинамически устойчивой, чем форма А. Пример 14. Устойчивость формы В и формы С. Перекрывающиеся исследования проводили для определения относительной термодинамической устойчивости формы В и формы С в следующих системах растворителей: (1) ТГФ/Н 2 О (50:50, объем/объем), (2) метилэтилкетон (МЕК), (3) метанол и (4) метанол/дихлорметан (DCM) (50:50, объем/объем). Исследование с МЕК проводили при комнатной температуре, тогда как исследования с другими тремя системами растворителей проводили как при 40 С, так и при 60 С. В каждом исследовании получали суспензию формы В в подходящей системе растворителей. Затем к каждой суспензии добавляли приблизительно 10 мг формы С. Суспензиям затем дают возможность суспендироваться при подходящей температуре в течение определенного периода времени. Система растворителей, температура системы растворителей и период времени, на протяжении которого суспензии дают возможность суспендироваться, приводятся ниже для каждого исследования:(1) исследование А: суспендируют в течение 3 дней в МЕК при комнатной температуре;(7) исследование G: суспендируют в течение 21 дня в смеси метанол/DCM при 60 С. В конце определенного периода времени из каждой суспензии отбирают образец и анализируютPXRD. Анализы PXRD показывают, что все образцы, полученные при комнатной температуре и при 40 С, были формой С, и все образцы, полученные при 60 С, были формой В. Как указывалось ранее,имеется переходная область в термодинамической устойчивости формы В и формы С при температуре между 40 и 60 С (т.е. две формы являются энантиотропами). При температурах ниже точки перехода форма С является наиболее термодинамически устойчивой формой. При температурах выше этой точки перехода форма В является наиболее термодинамически устойчивой формой. Пример 15. Анализы ex vivo Метод А. Анализ аортальных колец.
МПК / Метки
МПК: A61K 31/519, C07D 487/04, A61P 9/12
Метки: n-[1-(2-этоксиэтил)-5-(n-этил-n-метиламино)-7-(4-метилпиридин-2-иламино)-1н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида, формы, безводные, кристаллические
Код ссылки
<a href="https://eas.patents.su/30-12577-bezvodnye-kristallicheskie-formy-n-1-2-etoksietil-5-n-etil-n-metilamino-7-4-metilpiridin-2-ilamino-1n-pirazolo43-dpirimidin-3-karbonilmetansulfonamida.html" rel="bookmark" title="База патентов Евразийского Союза">Безводные кристаллические формы n-[1-(2-этоксиэтил)-5-(n-этил-n-метиламино)-7-(4-метилпиридин-2-иламино)-1н-пиразоло[4,3-d]пиримидин-3-карбонил]метансульфонамида</a>
Предыдущий патент: Новый способ предупреждения или лечения инфекции, вызываемой m.tuberculosis
Следующий патент: Носитель для доставки в нервные клетки
Случайный патент: Способ геофизического исследования перспективного нефтеносного района