Высокоаффинные мелан-а т-клеточные рецепторы
Формула / Реферат
1. Т-Клеточный рецептор (TCR), обладающий свойством связываться с AAGIGILTV-HLA-A*0201 и включающий по меньшей мере один вариабельный регион TCR a-цепи, имеющий последовательность SEQ ID NO:1, у которой одна или несколько аминокислот 28D, 29R, 30G, 31S, 49М, 51I, 53S, 54N, 72Y, 94V, 95A, 96G, 97K, 98S и 99Т мутирована/мутированы, и по меньшей мере один вариабельный регион TCR b-цепи, имеющий последовательность SEQ ID NO:2, у которой одна или несколько аминокислот 45L, 51S, 52V, 53G, 54I, 76I, 100G, 101Т, 102G, 103Е, 104L и 105F мутирована/мутированы, и характеризующийся тем, что имеет KD в отношении указанного комплекса AAGIGILTV-HLA-A*0201 менее или равный 3 mМ и/или скорость диссоциации (koff), равную 1_10-3 S-1 или ниже.
2. Т-Клеточный рецептор по п.1, включающий одну или несколько мутаций вариабельного региона a-цепей, соответствующих

3. Т-Клеточный рецептор по п.1 или 2, включающий одну или несколько мутаций вариабельного региона b-цепей, соответствующих

4. Т-Клеточный рецептор по п.1 или 2, включающий одну из аминокислотных последовательностей вариабельного региона a-цепей в SEQ ID NO:11-24 или 47-53.
5. Т-Клеточный рецептор по п.1 или 4, включающий одну из аминокислотных последовательностей вариабельного региона b-цепей в SEQ ID NO:54-67.
6. Т-Клеточный рецептор по п.3, включающий соединенные парами вариабельные регионы a- и b-цепей, показанные в следующей таблице:
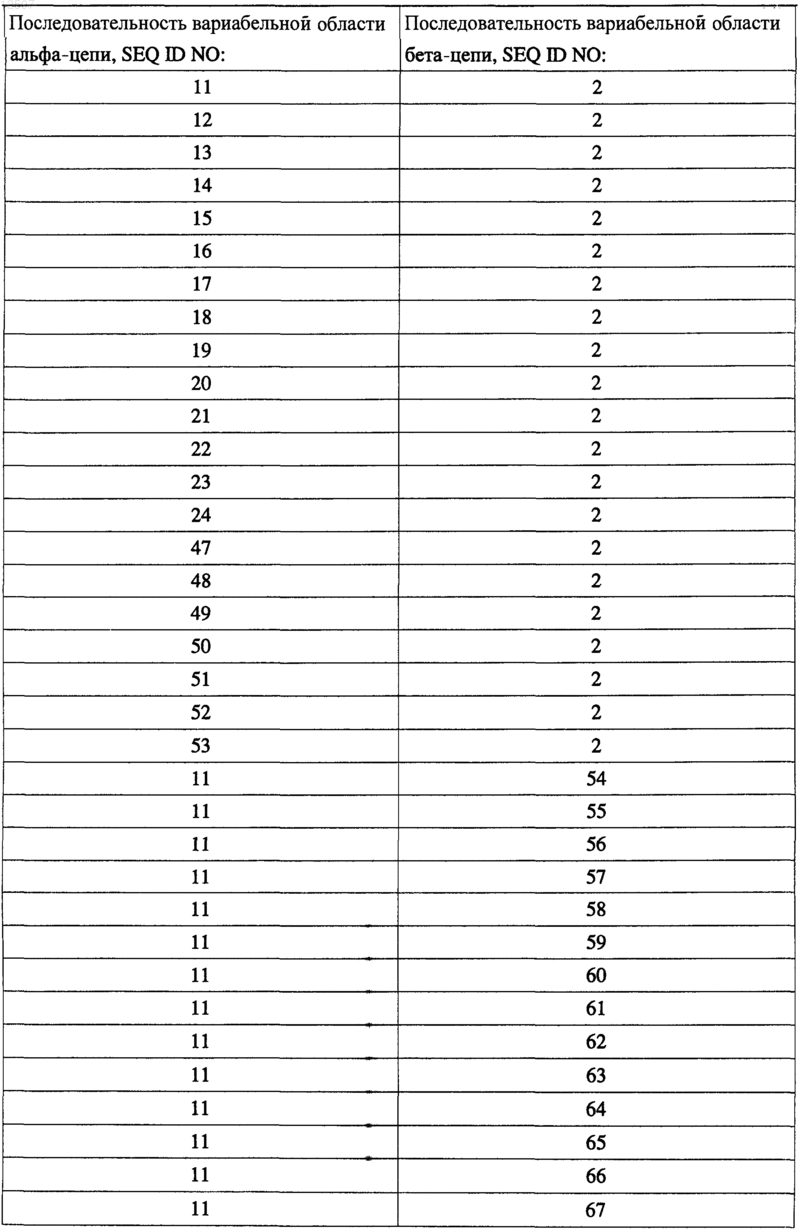
7. Т-Клеточный рецептор по любому из предшествующих пунктов, дополнительно включающий аминокислотную последовательность константной области a-цепи, показанную на SEQ ID NO:25, и/или одну из аминокислотных последовательностей константных областей b-цепей в SEQ ID NO:26 и 27.
8. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:29 и аминокислотную последовательность b-цепи SEQ ID NO:10.
9. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:68 и аминокислотную последовательность b-цепи SEQ ID NO:10.
10. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:69 и аминокислотную последовательность b-цепи SEQ ID NO:10.
11. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:70 и аминокислотную последовательность b-цепи SEQ ID NO:10.
12. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:29 и аминокислотную последовательность b-цепи SEQ ID NO:71.
13. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:29 и аминокислотную последовательность b-цепи SEQ ID NO:72.
14. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:29 и аминокислотную последовательность b-цепи SEQ ID NO:73.
15. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:29 и аминокислотную последовательность b-цепи SEQ ID NO:74.
16. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:29 и аминокислотную последовательность b-цепи SEQ ID NO:75.
17. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:29 и аминокислотную последовательность b-цепи SEQ ID NO:76.
18. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:29 и аминокислотную последовательность b-цепи SEQ ID NO:77.
19. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность a-цепи SEQ ID NO:29 и аминокислотную последовательность b-цепи SEQ ID NO:78.
Текст
012507 Область техники Настоящее изобретение относится к Т-клеточным рецепторам (TCR), обладающим свойством связываться с AAGIGILTV-HLA-A0201 и включающим по меньшей мере один вариабельный домен TCRAAGIGILTV-HLA-A0201 менее или равный 3 М и/или скорость диссоциации (koff), равную 110-3 S-1 или ниже. Уровень техникиAAGIGILTV пептид получен из Melan-A (Mart-1) белка, который экспрессируется большинством свежеотобранных проб меланомы и примерно 60% клеточных линий меланомы, а также нормальными меланоцитами Coulie et al., (1994) J. Exp. Med. 180: (1)1-4) и Kawakami et al., (1994) PNAS USA 91:3515). Класс I HLA веществ этих раковых клеток включает пептиды из этого белка, в том числеAAGIGILTV (SEQ ID NO:43) (Melan-A27-35). AAGIGILTV-HLA-A0201 комплекс является, по-видимому,иммунодоминантной мишенью для меланома-специфичных Т-клеток (Kawakami et al., (1994) PNAS USA 91:3515) и (Rivoltini et al., (1995) J. Immunol. 154:2257). Следовательно, этот пептид-HLA комплекс является маркером рака и может служить мишенью для TCR, например, с целью доставки цитотоксических или иммуностимулирующих средств к раковым клеткам. Однако с этой целью было бы предпочтительным, если бы TCR имел более высокую аффинность и/или более низкую скорость диссоциации в отношении пептид-HLA комплекса, чем нативные TCR, специфичные для этого комплекса. Сущность изобретения Благодаря данному изобретению впервые становятся доступными TCR-ы, имеющие высокую аффинность связывания (KD) менее или равную 3 М и/или скорость диссоциации (koff), равную 110-3 S-1 или ниже в отношении AAGIGILTV-HLA-A0201 комплекса. Такие TCR-ы могут применяться как сами по себе, так и в сочетании с терапевтическим агентом для нацеливания на клетки рака, содержащие этот комплекс. Подробное описание изобретения Настоящее изобретение относится к Т-клеточному рецептору (TCR), обладающему свойством связываться с AAGIGILTV-HLA-A0201, включающему по меньшей мере один вариабельный домен TCR-цепи и/или по меньшей мере один вариабельный домен TCR -цепи и характеризующемуся тем, что указанный TCR имеет KD в отношении указанного комплекса AAGIGILTV-HLA-A0201 менее или равный 3 М и/или скорость диссоциации (koff), равную 110-3 S-1 или ниже. В другом варианте настоящего изобретения указанные TCR-ы имеют KD в отношении комплексаAAGIGILTV-HLA-A0201 менее или равный 1 М. Определение KD может быть осуществлено любым из известных методов. Предпочтительным является метод Surface Plasmon Resonance (Biacore) по примеру 4. Для сравнения взаимодействие дисульфидно-связанного растворимого варианта нативного MELTCR (см. SEQ ID NO:9 для TCR -цепи и SEQ ID NO:10 для TCR -цепи) и комплекса AAGIGILTVHLA-A0201 имеет KD примерно 4 М при определении Biacore-методом по примеру 4. Для нативного MEL TCR, специфичного к комплексу AAGIGILTV-HLA-A0201, нужно использовать следующие гены V -цепи и V -цепи (используя терминологию для Т-клеточного рецептора по-цепь - TRAV 12-2,-цепь - TRBV 30. Нативный MEL TCR может использоваться как матрица, на которой могут осуществляться различные мутации, которые и придают высокую аффинность и/или низкую скорость диссоциации при взаимодействии между заявленными TCR-ами и комплексом AAGIGILTV-HLA-A0201. Таким образом, изобретение относится к TCR-ам, мутированным относительно вариабельного региона -цепи нативногоMEL TCR (см. фиг. 1a и SEQ ID NO:1) и/или вариабельного региона -цепи (см. фиг. 1b и SEQ ID NO:2) по меньшей мере в одной области, определяющей комплементарность (CDR), и/или каркасной области вариабельных регионов. Это также дает возможность предполагать, что другие гипервариабельные области в вариабельных регионах заявленных TCR-ов, как, например, гипервариабельные 4 (HV4) области,могут быть мутированными так, что получается мутант с высокой аффинностью. Нативные TCR-ы существуют в гетеродимерныхилиформах. Однако уже было показано, что рекомбинантные TCR-ы, состоящие из единственной TCR - или TCR -цепи, связывают пептидные МНС молекулы. В одном варианте TCR настоящего изобретения включает и вариабельный домен -цепи, и вариабельный домен TCR -цепи. Специалисту в данной области должно быть очевидно, что мутация(и) в последовательности TCR-цепи и/или последовательности TCR -цепи могут быть вызваны замещением(ями), делецией(ми) или инсерцией(ями). Эти мутации могут быть получены с помощью соответствующего метода, включающего(но не только) полимеразную цепную реакцию (PCR), клонирование на основе энзимов рестрикции или-1 012507 процедуры лигационного независимого клонирования (LIC). Эти методы подробно описаны во многих пособиях по молекулярной биологии. Для более детального ознакомления в отношении мутагенеза полимеразной цепной реакции (PCR) и клонирования с использованием энзимов рестрикции (см. SambrookRussell, (2001) Molecular Cloning - A Laboratory Manual (3rd Ed.) CSHL Press). Дополнительная информация по LIC процедурам может быть найдена в Rashtchian, (1995) Curr. Opin. Biotechnol. 6 (1):30-6. Фаговый дисплей является единственным средством, с помощью которого могут быть получены библиотеки TCR вариантов. Методы, пригодные для фагового дисплея и последующего скринирования библиотекTCR вариантов, каждый из которых содержит ненативную дисульфидную междуцепочечную связь, детально описаны в Li et al., (2005) Nature Biotech. 23(3): 349-354 и WO 2004/04404. Следует отметить, что любойTCR включает применение сходных V - и V -генов и, следовательно, аминокислотную последовательность с тем, чтобы MEL TCR мог образовать удобный матричный TCR. Это сделает возможным внесение в ДНК, кодирующую один или оба вариабельных региона матричногоTCR, изменений, необходимых для получения заявляемых мутированных TCR-ов с высокой аффинностью. Как должно быть очевидно специалисту в данной области, необходимые мутации могут быть внесены с помощью целого ряда методов, например метода сайт-направленного мутагенеза. Если только не утверждается обратное, аминокислотные последовательности TCR в настоящем описании получаются с использованием N-терминального остатка метионина (Met или М). Как должно быть известно специалистам в данной области, этот остаток может быть удален в процессе получения рекомбинантных белков. Как должно быть также очевидно специалистам в данной области, возможно усечение последовательностей на С-конце и/или N-конце на 1, 2, 3, 4, 5 остатков или более без оказания существенного воздействия на рМНС связывающие свойства TCR, все такие обычные варианты включаются в объем данного изобретения. Следует иметь в виду, что в используемом здесь смысле термин вариабельный регион охватывает все аминокислоты данного TCR, которые не включены в константный домен, кодируемый TRAC геном для TCR -цепей и/или TRBC1, или TRBC2 для TCR -цепей (Т cell receptor Factsbook, (2001) LeFrancand LeFranc Academic Press, ISBN 0-12-441352-8). Также должно быть понятно, что в используемом здесь смысле термин вариабельный домен охватывает все аминокислоты данного TCR, которые входят в состав аминокислотной последовательности,кодируемой TRAV геном для TCR -цепей и TRBV геном для TCR -цепей (Т cell receptor Factsbook,(2001) LeFranc and LeFranc Academic Press, ISBN 0-12-441352-8). Варианты изобретения включают мутированные TCR-ы, которые имеют мутацию одной или более аминокислот вариабельного региона -цепей, соответственно: 28D, 29R, 30G, 31S, 49 М, 51I, 53S, 54N,72Y, 94V, 95A, 96G, 97K, 98S и 99 Т, например, мутации, соответствующие: Нумерация, используемая выше, та же, что и приведенная на фиг. 1 и SEQ ID NO:1. Варианты изобретения включают мутированные TCR-ы, которые имеют мутацию одной или более аминокислот вариабельного региона -цепей, соответственно: 45L, 51S, 52V, 53G, 54I, 76I, 100G, 101T,102G, 103 Е, 104L и 105F, используя нумерацию, показанную в SEQ ID NO:2, которая имеет мутацию(и),например, мутации, соответствующие: Нумерация, используемая выше, та же, что и приведенная на фиг. 1b и SEQ ID NO:2. Другие предпочтительные варианты изобретения относятся к TCR-ам, включающим одну из мутированных аминокислотных последовательностей вариабельного региона -цепей, показанных на фиг. 6(SEQ ID NO:11-24) или фиг. 20 (SEQ ID NO:47-53). Фенотипически молчащие варианты таких TCR-ов также являются частью изобретения. Другие предпочтительные варианты изобретения относятся к TCR-ам, включающим одну из мутированных аминокислотных последовательностей вариабельного региона -цепей, показанных на фиг. 21(SEQ ID NO:54-67). Фенотипически молчащие варианты таких TCR-ов также являются частью изобретения. Нативные TCR-ы существуют в гетеродимерныхилиформах. Однако было показано, что и рекомбинантные TCR-ы, состоящие изилигомодимеров, связывают пептидные МНС молекулы. Следовательно, один из вариантов изобретения относится TCRили TCRгомодимерам. Другие предпочтительные варианты относятся к TCR-ам данного изобретения, включающим комбинации аминокислотной последовательности вариабельного региона -цепи и аминокислотной последовательности вариабельного региона -цепи, перечисленные ниже, фенотипически молчащие варианты таких TCR-ов также являются частью этого изобретения. Предпочтительные варианты относятся к заявляемым TCR-ам, включающим вариабельный регион -цепи, показанный в виде SEQ ID NO:11, и вариабельный регион -цепи,показанный в виде SEQ ID NO:2; вариабельный регион -цепи, показанный в виде SEQ ID NO:47, и вариабельный регион -цепи,показанный в виде SEQ ID NO:2; вариабельный регион -цепи, показанный в виде SEQ ID NO:48, и вариабельный регион -цепи,показанный в виде SEQ ID NO:2; вариабельный регион -цепи, показанный в виде SEQ ID NO:53, и вариабельный регион -цепи,показанный в виде SEQ ID NO:2; вариабельный регион -цепи, показанный в виде SEQ ID NO:11, и вариабельный регион -цепи,показанный в виде SEQ ID NO:54; вариабельный регион -цепи, показанный в виде SEQ ID NO:11, и вариабельный регион -цепи,показанный в виде SEQ ID NO:55; вариабельный регион -цепи, показанный в виде SEQ ID NO:11, и вариабельный регион -цепи,показанный в виде SEQ ID NO:56; вариабельный регион -цепи, показанный в виде SEQ ID NO:11, и вариабельный регион -цепи,показанный в виде SEQ ID NO:57; вариабельный регион -цепи, показанный в виде SEQ ID NO:11, и вариабельный регион -цепи,показанный в виде SEQ ID NO:58; вариабельный регион -цепи, показанный в виде SEQ ID NO:11, и вариабельный регион -цепи,показанный в виде SEQ ID NO:62; вариабельный регион -цепи, показанный в виде SEQ ID NO:11, и вариабельный регион -цепи,показанный в виде SEQ ID NO:65; вариабельный регион -цепи, показанный в виде SEQ ID NO:11, и вариабельный регион -цепи,показанный в виде SEQ ID NO:66,или фенотипически молчащие варианты любого из вышеприведенных TCR-ов,В другом предпочтительном варианте TCR-ы изобретения, включающие сочетания (комбинации) вариабельных регионов, раскрытые выше, включают также аминокислотную последовательность константной области -цепи, показанную на фиг. 7 а (SEQ ID NO:25), и одну из аминокислотных последовательностей константных областей -цепей, показанных на фиг. 7b и 7 с (SEQ ID NO:26 и 27), или их фенотипически молчащие варианты. В используемом здесь смысле под термином фенотипически молчащие варианты подразумеваются те TCR-ы, которые имеют KD для указанного комплекса AAGIGILTV-HLA-A0201 менее или равный 3 М. Например, специалистам в данной области известно, что можно создать TCR-ы, у которых имеются минорные изменения в константных и/или вариабельных областях по сравнению с теми, что детально описаны выше, но без изменения аффинности и/или скорости диссоциации при взаимодействии с AAGIGILTV-HLA-A0201. Такие варианты тоже включены в объем настоящего изобретения. ТакиеTCR-ы, в которых осуществлены один или несколько консервативных замен, также составляют часть данного изобретения. В широком аспекте TCR-ы данного изобретения находятся либо в форме одноцепочечных TCR-ов(scTCR), либо в форме димерных TCR-ов (dTCRs), как описано в WO 04/033685 и WO 03/020763. Подходящая scTCR форма включает первый сегмент, состоящий из аминокислотной последовательности, соответствующей вариабельному региону -цепи TCR, второй сегмент, состоящий из аминокислотной последовательности, соответствующей вариабельному региону -цепи TCR, слитой с Nконцом аминокислотной последовательности, соответствующей экстрацеллюлярной последовательности-4 012507 константного домена -цепи TCR, и линкерную последовательность, соединяющую С-конец первого сегмента с N-концом второго сегмента. Или же первый сегмент может состоять из аминокислотной последовательности, соответствующей вариабельному региону -цепи TCR; второй сегмент может состоять из аминокислотной последовательности, соответствующей последовательности вариабельного региона -цепи TCR, слитой с N-концом аминокислотной последовательности, соответствующей экстрацеллюлярной последовательности константного домена -цепи TCR. Вышеупомянутые scTCR-ы могут также включать дисульфидную связь между первой и второй цепями, причем эта дисульфидная связь является связью, которая не имеет эквивалента в нативных Тклеточных рецепторах, и где длина линкерной последовательности и положение дисульфидной связи таковы, что последовательности вариабельных доменов первого и второго сегментов взаимно ориентированы практически так же, как в нативных Т-клеточных рецепторах. Более конкретно первый сегмент может состоять из аминокислотной последовательности, соответствующей последовательности вариабельного региона -цепи TCR, слитой с N-концом аминокислотной последовательности, соответствующей экстрацеллюлярной последовательности константного домена цепи TCR, второй сегмент может состоять из аминокислотной последовательности, соответствующей вариабельному региону -цепи TCR, слитой с N-концом аминокислотной последовательности, соответствующей экстрацеллюлярной последовательности константного домена -цепи TCR, а между первой и второй цепями может быть предусмотрена дисульфидная связь, причем не имеющая эквивалента в нативных Т-клеточных рецепторах. В вышеуказанных scTCR формах линкерная последовательность может связывать С-конец первого сегмента с N-концом второго сегмента и может характеризоваться формулой - PGGG-(SGGGG)n-Р, где n равно 5 или 6, а Р является пролином, G является глицином, a S является серином. Подходящая dTCR форма TCR-ов настоящего изобретения включает первый полипептид, в котором последовательность, соответствующая последовательности вариабельного региона -цепи TCR, слита сN-концом последовательности, соответствующей экстрацеллюлярной последовательности константного домена -цепи TCR, и второй полипептид, в котором последовательность, соответствующая последовательности вариабельного региона -цепи TCR, слита с N-концом последовательности, соответствующей экстрацеллюлярной последовательности константного домена -цепи TCR, причем первый и второй полипептид соединены дисульфидной связью, которая не имеет эквивалента в нативныхТ-клеточных рецепторах. Первый полипептид может включать последовательность вариабельного региона -цепи TCR, слитую с N-концом последовательности, соответствующей экстрацеллюлярной последовательности константного домена -цепи TCR, и второй полипептид, в котором последовательность, соответствующая последовательности вариабельного региона -цепи TCR, слита с N-концом последовательности, соответствующей экстрацеллюлярной последовательности константного домена -цепи TCR, причем первый и второй полипептиды связаны дисульфидной связью между цистеиновыми остатками, которыми замещены Thr 48 экзона 1 TRAC01 и серии 57 экзона 1 TRBC101 или TRBC201 или их эквивалента нечеловеческого происхождения. (TRAC и др. номенклатурные обозначения приведены соответственно принятым для Т-клеточных рецепторов по Factsbook, (2001) LeFranc and LeFranc, Academic Press, ISBN 0-12441352-8).dTCR или scTCR форма заявляемых TCR-ов могут иметь аминокислотные последовательности, соответствующие последовательностям экстрацеллюлярных константных и вариабельных регионов TCR человека, а дисульфидная связь может соединять аминокислотные остатки указанных константнодоменовых последовательностей, причем дисульфидная связь не имеет эквивалента в нативных TCR-ах. Дисульфидная связь имеет место между цистеиновыми остатками, соответствующими аминокислотным остаткам, -углеродные атомы которых в нативных TCR-ах находятся на расстоянии менее чем 0,6 нм,например, между цистеиновыми остатками, которыми замещены Thr 48 экзона 1 TRAC01 и Ser 57 экзона 1 TRBC101 или TRBC201 или их эквивалента нечеловеческого происхождения. Другие сайты, куда могут быть введены цистеины для создания дисульфидной связи, следующие остатки в экзоне 1 Конкретные варианты изобретения относятся к заявляемым TCR и, в частности, dTCR, включающим первый полипептид, в котором последовательность, соответствующая последовательности вариабельного региона -цепи TCR, слита с N-концом последовательности, соответствующей экстрацеллюлярной последовательности константного домена -цепи TCR, и второй полипептид, в котором последовательность, соответствующая последовательности вариабельного региона -цепи TCR, слита с N-концом последовательности, соответствующей экстрацеллюлярной последовательности константного домена -цепи TCR,первый и второй полипептиды соединены дисульфидной связью, которая не имеет эквивалента в нативныхТ клетках, между цистеиновыми остатками, которыми замещены Thr 48 экзона 1 TRAC01 и Ser 57 экзона 1 TRBC101 или TRBC201 или их эквивалента нечеловеческого происхождения. Помимо ненативной дисульфидной связи, упомянутой выше, dTCR или scTCR форма заявленныхTCR-ов может включать дисульфидную связь между остатками, соответствующими остаткам, связанным дисульфидной связью в нативных TCR-ax.dTCR или scTCR форма TCR-ов изобретения предпочтительно не включает последовательности,соответствующей трансмембранным или цитоплазматическим последовательностям нативных TCR-ов. В настоящее время предпочтительные варианты изобретения обеспечиваются растворимыми TCRами, включающими аминокислотную последовательность -цепи SEQ ID NO:29 и аминокислотную последовательность-цепи SEQ ID NO:78. Изобретение предлагает также нуклеиновую кислоту или нуклеиновые кислоты, кодирующиеTCR-ы изобретения. Такие нуклеиновая кислота или нуклеиновые кислоты могут предусматриваться в форме, которая адаптирована для экспрессии в прокариотической или эукариатической клетке-хозяине. Подходящие клетки-хозяева включают, но без ограничения, клетки бактерий, дрожжей, млекопитающих или насекомых. Например, хозяйская клетка может быть Т-клеткой человека или гемопоэтической стволовой клеткой человека. Такие адаптированные нуклеиновая кислота или нуклеиновые кислоты мутирована/мутированы для того, чтобы отражать предпочтение (выбор) в отношении кодонов клетки-хозяина, в которую она/они включена/ы. Введенные мутации являются молчащими мутациями, которые не оказывают влияние на аминокислотную последовательность кодируемых полипептида или полипептидов. GeneArt (Regensburg,-6 012507Germany) предлагает подходящий сервис по оптимизации нуклеиновых кислот (GeneOptimizer). ЗаявкаWO 2004/059556, принадлежащая GeneArt, предлагает дополнительные детали по оптимизационной технике процесса. Другие предпочтительные в настоящее время варианты изобретения относятся к нуклеиновым кислотам, состоящим из одной из полноразмерных ДНК-последовательностей -цепи TCR SEQ ID NO:33,35 или 37 (фиг. 12 а, 13 а или 14 а соответственно) и ДНК-последовательности -цепи TCR SEQ ID NO:39(показано на фиг. 15 а). Нуклеиновая кислота, комплементарная любой из вышеперечисленных, или соответствующая РНКпоследовательность также составляет часть данного изобретения. Кроме того, специалисту в данной области должно быть очевидно, что нуклеиновая кислота или нуклеиновые кислоты, кодирующиеTCR-ы данного изобретения, могут также включать некодирующие последовательности (интроны). Полноразмерные дикого типа и высокоаффинные ДНК цепей MEL TCR, имеющие SEQ ID NO:31,33, 35, 37 и 39, кодируют аминокислотные последовательности SEQ ID NO:32, 34, 36, 38 и 40 соответственно (фиг. 11b, 12b, 13b, 14b и 15b соответственно). Аминокислотные последовательности SEQ ID NO:33, 35 и 37 включают высокоаффинные вариабельные регионы -цепи MEL TCR SEQ ID NO:11, 15 и 23 соответственно. Как должно быть очевидно специалистам в данной области, такие полноразмерные ДНКпоследовательности цепей TCR кодируют следующие последовательности: лидерную последовательность и экстрацеллюлярную, трансмембранную и цитоплазматическую последовательности TCR. Указанные здесь полноразмерные последовательности ДНК включают также последовательности,узнающие рестрикционные энзимы для облегчения лигирования в выбранном векторе. ПЭГилированные TCR мономеры В частном варианте TCR связывают по меньшей мере с одной цепочкой (цепочками) полиалкиленгликоля. Такая ассоциация может быть осуществлена с помощью различных методов, известных специалистам в данной области. Предпочтительно полиалкиленовая цепочка (звенья, цепочки) ковалентно присоединяется/присоединяются к TCR. В другом варианте полиэтиленгликолевые цепи данного аспекта изобретения включают по меньшей мере два повторяющихся полиэтиленовых звена. Мультивалентные TCR комплексы Один способ данного изобретения касается мультивалентного TCR комплекса, включающего по меньшей мере два TCR изобретения. В одном варианте по меньшей мере две молекулы TCR связаны через линкерные остатки и образуют мультивалентные комплексы. Предпочтительно эти комплексы водорастворимые, так что линкерную часть следует соответственно подбирать. Кроме того, желательно, чтобы линкерный фрагмент был бы способен присоединяться в определенных положениях молекул TCR,так чтобы структурное различие между образованными комплексами было минимальным. Один из таких вариантов изобретения обеспечивается TCR комплексом изобретения, где полимерная цепь или последовательность пептидного линкера простирается между аминокислотными остатками каждого TCR, которые не находятся в вариабельном регионе последовательности TCR. Так как комплексы данного изобретения могут предназначаться для использования в медицине,линкерные остатки должны подбираться с учетом их фармацевтической пригодности, например, их иммуногенности. Примеры линкерных фрагментов, которые отвечают вышеупомянутым желательным критериям,хорошо известны в данной области, например, в практике связывания фрагментов антител. Существуют два класса линкеров, которые предпочтительны для использования при получении мультивалентных TCR молекул настоящего изобретения. TCR комплекс по изобретению, в которомTCR-ы связаны полиалкиленгликолевой цепью, обеспечивает один из вариантов данного аспекта. Прежде всего в качестве гидрофильных полимеров следует рассмотреть полиалкиленгликоли. Наиболее часто используемым из этого класса является полиэтиленгликоль, или PEG, структура которого показана нижеHOCH2CH2O(CH2CH2O)n-CH2CH2OH,где n больше чем 2. Однако в основе других линкеров могут быть иные подходящие необязательно замещенные полиалкиленгликоли, включающие полипропиленгликоль и сополимеры этиленгликоля и пропиленгликоля. Такие полимеры могут использоваться для обработки терапевтических средств или конъюгации с ними, особенно с лекарственными средствами, представляющими собой полипептиды или белки, для достижения благоприятных изменений в отношении РК профиля терапевтического средства, например сниженного ренального клиренса, улучшенного значения показателя полужизни плазмы, сниженной иммуногенности и улучшенной растворимости. Считается, что такие улучшения РК профиля PEGтерапевтических конъюгатов являются следствием того, что PEG молекула (или молекулы) образуют оболочку вокруг терапевтического средства, которые создают стерические затруднения для взаимодействия с иммунной системой и уменьшают протеолитическое разрушение (Casey et al., (2000) TumorTargetting 4, 235-244). Размер используемого гидрофильного полимера может быть, в частности, подоб-7 012507 ран на основе предназначенного терапевтического использования TCR комплекса. Таким образом, если предполагается, что продукт покидает кровоток и просачивается в ткань, например, при использовании для лечения опухолей, удобно использовать полимеры с низким молекулярным весом порядка 5 кДа. Существует множество обзоров и литературных источников, которые детально раскрывают применение(1997) Chemistry and Biological Applications of Polyethylene Glycol ACS Books, Washington, D.C. Используемый полимер может быть линейным или разветвленным. Разветвленные PEG-молекулы,а также их производные, могут быть созданы использованием разветвляющихся остатков, в том числе глицерин и олигомеры глицерина, пентаэритритол, сорбитол и лизин. Как правило, этот полимер должен иметь в своей структуре химически реакционноспособную группу или группы, например, на одном или обоих концах и/или на разветвлениях боковых цепей, обеспечивающие возможность полимера связываться с предназначенными сайтами в TCR. Эта химически реакционноспособная группа или группы могут быть непосредственно присоединены к гидрофильному полимеру или же должен быть специальный спейсер в виде химической группы или фрагмента между гидрофильным полимером и активным химическим соединением, как показано ниже: активное соединение - гидрофильный полимер - активное соединение; активное соединение - спейсер - гидрофильный полимер - спейсер - активное соединение. Спейсер, используемый для образования конструкций типа показанной выше, может быть любым органическим остатком, который не реакционноспособен, химически стабилен, представляет собой цепочку. Такие спейсеры включают, например, следующие:TCR комплекс изобретения, в котором двухвалентный алкиленовый спейсерный радикал располагается между полиалкиленгликолевой цепью и точкой его присоединения к TCR комплексу, представляет собой еще один вариант этого аспекта изобретения. Другой вариант этого аспекта представляет собой TCR комплекс изобретения, в котором цепь полиалкиленгликоля включает по меньшей мере две повторяющиеся единицы полиэтиленгликоля. На рынок поставляется множество гидрофильных полимеров, связывающихся непосредственно или через спейсер, для активации химических веществ, которые могут использоваться в настоящем изобретении. К поставщикам таких веществ относятся Nektar Therapeutics (CA, USA), NOF Corporation (Japan),Sunbio (South Korea) и Enzon Pharmaceuticals (NY, USA). Коммерчески доступные гидрофильные полимеры для активации химических средств, связанные непосредственно или через спейсер, которые могут использоваться в настоящем изобретении, включают Огромное множество связывающих химических веществ могут использоваться, чтобы связывать молекулы полимеров с лекарственными средствами, которые представляют собой белки или пептиды. Выбор самого подходящего химического связывающего реагента в большой степени зависит от желаемого сайта связывания. Например, следующие связывающие реагенты использовали для присоединения к одному или более концам PEG молекул (Информация: Nektar Molecular Engineering Catalogue 2003):N - малеимид,винилсульфон,карбонат бензотриазола,пропионат сукцинимидила,бутаноат сукцинимидила,тиоэфир,ацетальдегиды,акрилаты,биотин,первичные амины. Как упоминалось выше, полимеры, в основе которых не PEG, также могут быть подходящими для мультимеризации TCR-ов настоящего изобретения. Например, могут быть использованы остатки, содержащие малеимидные концы, связанные алифатическими цепями, такие как ВМН и ВМОЕ (Pierce, продукты 22330 и 22323). Пептидные линкеры представляют собой другой класс TCR линкеров. Эти линкеры включают аминокислотную цепочку и обладают свойством образовывать простые линкеры или домены мультимеризации, на которые могут присоединяться TCR молекулы. Система биотин/стрептавидин ранее уже использовалась для получения TCR тетрамеров (см. WO/99/60119) в in vitro исследованиях связывания. Однако-9 012507 стрептавидин - это полипептид микробного происхождения и поэтому не идеально подходит для использования в терапии.TCR комплекс изобретения, в котором TCR-ы связаны пептидным линкером, полученным из мультимеризационного домена человека, является одним из вариантов настоящего изобретения. Есть целый ряд белков человека, которые содержат мультимеризационный домен, который можно было использовать при получении мультивалентных TCR комплексов. Например, тетрамеризационный домен р 53, который уже использовался для получения тетрамеров scFv фрагментов антитела, которые показали повышенную сывороточную персистентность и значительно пониженную скорость диссоциации по сравнению с мономерным scFv фрагментом Willude et al. (2001) J. Biol. Chem. 276 (17): 1438514392. Гемоглобин также представляет собой тетрамеризационный домен, который потенциально мог бы быть использован для такого рода применения. Мультивалентный TCR комплекс данного изобретения, включающий по меньшей мере два TCR-,обеспечивает заключительный вариант, в котором по меньшей мере один из указанных TCR-ов ассоциирован с терапевтическим средством. В одном из вариантов TCR данного изобретения (или его мультивалентный комплекс) мог альтернативно или дополнительно включать реакционноспособный цистеин на С-конце или N-конце его - или-цепей. Диагностическое или терапевтическое применение В одном аспекте TCR изобретения может быть связан с терапевтическим средством или детектируемым остатком. Например, этот терапевтический агент или детектируемый остаток может быть ковалентно связан с TCR. В одном варианте изобретения указанный терапевтический агент или детектируемый остаток ковалентно связан с С-концом одной или обеих TCR-цепей. В одном аспекте scTCR или одна, или обе цепи dTCR-цепи TCR-ов настоящего изобретения могут быть мечены детектируемым остатком, например, меткой, которая пригодна для целей диагностики. Такие меченые TCR-ы могут применяться в способе детектирования AAGIGILTV-HLA-A0201 комплекса, причем способ включает контактирование TCR лиганда с TCR (или мультимерным высокоаффинным TCR комплексом), который специфичен по отношению к TCR лиганду, и детектирование связывания с TCR лигандом. В тетрамерных TCR комплексах, образованных, например, с использованием биотинилированных гетеродимеров, в качестве детектируемой метки может быть использован флуоресцентный стрептавидин. Такой флуоресцентномеченный TCR тетрамер пригоден для использования в FACS анализе, например,для того, чтобы определить антигенпрезентирующие клетки, несущие AAGIGLTV-HLA-A0201 комплекс, к которому эти высокоаффинные TCR-ы специфичны. Другой способ, с помощью которого могут быть определены растворимые TCR-ы настоящего изобретения, основан на применении TCR-специфичных антител, в частности моноклональных антител. Существует множество коммерчески доступных анти-TCR антител, таких как FI и FI, которые распознают константные домены - и -цепей соответственно. Согласно другому аспекту изобретения TCR (или его мультивалентный комплекс) может быть альтернативно или дополнительно ассоциирован с терапевтическим средством (например, ковалентно или какой-либо другой связью), которое может представлять собой токсичный остаток для применения с целью уничтожения (Killing) клеток или оказывающее иммуноактивное действие вещество, такое как интерлейкин или цитокин. Мультивалентный комплекс TCR данного изобретения может обладать повышенной способностью к связыванию с TCR лигандом, по сравнению с немультимерным данного типа или гетеродимером Т-клеточного рецептора данного изобретения. Так что мультивалентные TCR комплексы согласно изобретению особенно пригодны для слежения или нацеливания на клетки, презентирующие конкретные антигены in vitro или in vivo, и которые также пригодны как промежуточные для производства уже других TCR комплексов, имеющих такое же применение. Эти TCR-ы или мультивалентные TCR комплексы могут, следовательно, быть представлены в составе фармацевтически приемлемого средства для применения in vivo. Изобретением также предлагается способ доставки терапевтического средства в клетку-мишень,причем этот способ включает контактирование потенциальных клеток/мишеней с TCR или мультивалентным TCR комплексом в соответствии с изобретением в условиях, позволяющих присоединение TCR или мультивалентного TCR комплекса к клетке-мишени, причем указанный TCR или мультивалентныйTCR комплекс специфичен в отношении AAGIGILTV-HLA-A0201 комплекса и несет присоединенное к нему терапевтическое средство. В частности, растворимый TCR или мультивалентный TCR комплекс настоящего изобретения может быть использован для доставки терапевтических средств в место локализации клеток, презентирующих конкретный антиген. Это может быть полезно во многих ситуациях и, в частности, против опухолей. Терапевтическое средство, которое доставляется, должно быть таким, которое проявляет свое действие локально, но не только в отношении к клетке, с которой связывается. Таким образом, одна кон- 10012507 кретная стратегия намечает противоопухолевые вещества, связанные с TCR-ами или с мультивалентными TCR комплексами в соответствии с изобретением, специфичными к опухолевым антигенам. Многие терапевтические агенты могут применяться для этой цели, к примеру, радиоактивные соединения, энзимы (перфорин, например) или химиотерапевтические агенты (цисплатин, например). Чтобы обеспечить проявление токсических эффектов в нужном месте, токсин может быть заключен внутрь липосомы, связанной со стрептавидином, так чтобы соединение выделялось медленно. Это должно предотвращать повреждающие эффекты в процессе продвижения в организме и обеспечивать максимальный эффект токсина после связывания TCR с соответствующими антигенпрезентирующими клетками. Другие подходящие терапевтические средства включают низкомолекулярные цитотоксические агенты, т.е. соединения, обладающие способностью убивать клетки млекопитающего, имеющие молекулярную массу менее чем 700 дальтон (Да). Такие соединения могут также содержать токсичные металлы, способные оказывать цитотоксическое действие. Кроме того, понятно, что эти низкомолекулярные цитотоксические агенты также включают пролекарства, т.е. соединения, которые разрушаются или подвергаются конверсии при физиологических условиях с высвобождением цитотоксических агентов. Примеры таких агентов включают цисплатин, производные мейтензина, рахельмицин, калихеамицин, доцетаксель, этопозид, гемцитабин, ифосфамид, иринотекан, мелфалан, митоксантрон, сорфимер натрийфотофрин II, темозолмид, топотекан, триметриат глюкуронат,ауристатин Е винкристин и доксорубицин; пептидные цитокины, т.е. белки и их фрагменты, способные убивать клетки млекопитающих. В том числе, но не только, рицин, дифтерийный токсин, псевдомонадный бактериальный экзотоксин А, ДНКаза и РНК-аза; радионуклиды, т.е. нестабильные изотопы элементов, которые разрушаются при одновременной эмиссии одного или нескольких факторов: - или -частиц или -лучей, включая, но не только йод 131,рений 186, индий 111, иттрий 90, висмут 210 и 213, актиний 225 и астатин 213, хелатирующие агенты могут быть использованы для того, чтобы облегчить ассоциацию этих радионуклидов с высокоаффинными TCR-ами или их мультимерами; пролекарства, включающие (но не только) антителонаправленные энзимные пролекарства; иммуностимуляторы, т.е. вещества, которые стимулируют иммунный ответ. Включают (но не только) цитокины, такие как IL-2 и IFN, суперантигены и их мутанты, pHLA комплексы и хемокины, такие как IL-8, тромбоцитный фактор 4, протеин, стимулирующий рост меланомы и т.д., антитела или их фрагменты, активаторы комплемента, ксеногенные белковые домены, домены аллогенных белков, домены вирусных бактериальных белков, виральные или бактериальные пептиды, антитела к Т-клеточным детерминантам (например, анти-CD3 или анти-CD28). Функциональные фрагменты антител и варианты Фрагменты антител и варианты/аналоги, которые пригодны для использования в композициях и способах, описанных здесь, включают (но без ограничения) следующие. Фрагменты антител. Как известно специалистам в данной области, можно получать фрагменты данного антитела, которые сохраняют практически те же характеристики связывания, как и исходное родительское антитело. Далее охарактеризованы детали таких фрагментов. Минитела - эти конструкции состоят из антител с усеченной Fc частью. Как таковые, они сохраняют цельные связывающие домены антитела, из которого они получены.Fab фрагменты - они включают одиночную легкую цепь иммуноглобулина, ковалентно связанную с частью тяжелой цепи иммуноглобулина. Как таковые, Fab фрагменты содержат один антигенсвязывающий сайт. Отличительной особенностью Fab фрагментов является часть IgG, которая высвобождается при обработке папаином. Такие фрагменты обычно получают методами рекомбинантных ДНК (Reeves etF(ab')2 фрагменты - они включают оба антитенсвязывающих сайта и шарнирный регион единого(отдельно взятого) антитела. Отличительной особенностью F(ab')2 фрагментов является часть IgG, которая высвобождается при обработке пепсином. Такие фрагменты обычно получают методами рекомбинантных ДНК (Reeves et al., (2000) Lecture Notes on Immunology (4 th Edition) Published by Blackwell Science).Fv фрагменты - они включают иммуноглобулиновый вариабельный тяжелый домен, связанный с иммуноглобулиновым вариабельным легким доменом. Ряд Fv конструкций уже создан. Они включаютdsFv, в которых ассоциация между двумя доменами усилена введенной дисульфидной связью. Альтернативно scFv могут быть получены с помощью пептидного линкера для связывания два домена вместе в единый полипептид. Fv конструкции, содержащие вариабельный домен тяжелой или легкой цепи иммуноглобулина, ассоциированный с вариабельным и константным доменом соответствующей тяжелой или легкой цепи иммуноглобулина, также уже получены. Fv были также мультимеризованы с получением диател и триател (Maynard et al., (2000) Annu. Rev. Biomed. Eng. 2, 339-376). Нанотела - эти конструкции, поставляемые на рынок Ablynx (Belgium), включают синтетический- 11012507 вариабельный тяжелый домен отдельного полипептида, полученный из антитела отряда верблюжьих(например, верблюда или ламы). Доменные антитела - эти конструкции, поставляемые на рынок Domantis (Belgium), включают вариабельный тяжелый домен аффинно-зрелого отдельного полипептида или вариабельный легкий иммуноглобулиновый домен. Варианты и аналоги антител. Определяющая функциональная характеристика антител в контексте настоящего изобретения - это их способность специфически связываться с намеченным лигандом. Как это известно специалистам в данной области, можно создать целый ряд белков с такими же связывающими характеристиками. Примеры вариантов и аналогов антител, пригодные для использования в композициях и способах настоящего изобретения, включают следующие (но без ограничения указанными ниже). Созданные на основе каркаса белка связывающие полипептиды. Семейство этих связывающих конструкций включает мутированные аналоги белков, которые содержат нативные связывающие петли. Примеры включают Affibodies, поставляемые Affibody (Sweden), в основе которых лежит мотив из трех завитков, получаемый из одного из IgG связывающих доменов белка A Staphylococcus aureus. Другой пример - продукт, поставляемый под маркой Evibodies, производимый EvoGenix (Australia), в основе которого лежат экстрацеллюлярные домены CTLA, в которые пересажены домены, подобные петлям антитела, где происходит связывание. Еще один пример, Cytokine Traps, поставляемый Regeneron Pharmaceuticals (US), получаемый пересадкой рецепторных доменов цитокина на каркас антитела (Nygren etal., (2000) Current Opinion in Structural biology 7: 463-469), дает обзор использования каркасов для создания новейших конструкций связывающих сайтов в белках. В этом обзоре указаны следующие белки как источники каркасов: СР 1 цинковый палец, Tendamistat, Z домен (аналог белка А), РСТ 1, Coiled coils(свернутые в спираль кольца), LACI-D1 и цитохром b562. В других исследованиях каркасов белков сообщалось об использовании Fibronectin, зеленого флуоресцентного белка (GFP) и анкириновых повторов. Как известно специалистам в данной области, можно получить антитела или их фрагменты, варианты, аналоги, которые связываются с различными частями данного белкового лиганда. Например, могут быть созданы анти-CD3 антитела к любой из полипептидных цепей, из которых этот комплекс сформирован (т.е. , , ,иCD3-цепей). Антитела, которые связываются с -цепью CD3, являются предпочтительными анти-CD3 антителами для использования в композициях и способах настоящего изобретения. Растворимые TCR-ы или мультивалентные TCR комплексы изобретения могут быть связаны с энзимом, способным превращать пролекарство в лекарство. Это обуславливает превращение пролекарства в лекарство только в том сайте, который требуется (т.е. намеченном sTCR). Полагают, что высокоаффинные AAGIGILTV (SEQ ID NO:43)-HLA-A0201 специфичные TCR-ы,охарактеризованные здесь, могут использоваться в способах диагностики и лечения рака. Что касается лечения рака, близлежащее расположение опухолей и метастаз должно усиливать действие токсинов или иммуностимуляторов. Что касается доставки вакцин, вакцинный антиген может локализоваться вблизи антигенпрезентирующих клеток, усиливая таким образом действенность антигена. Этот метод может быть также применен с целью получения изображений. Один вариант изобретения обеспечивается выделенной клеткой, презентирующей TCR изобретения. Например, указанная клетка может быть человеческой Т-клеткой или гемопоэтической стволовой клеткой человека. Другие варианты изобретения обеспечиваются фармацевтической композицией, включающей TCR или мультивалентный TCR комплекс изобретения (необязательно связанный с терапевтическим агентом) или совокупность клеток, презентирующих, по меньшей мере, TCR изобретения, или нуклеиновую кислоту или нуклеиновые кислоты, кодирующие TCR изобретения, вместе с фармацевтически приемлемым носителем. Изобретением также предусматривается способ лечения рака, включающий введение субъекту,страдающему от ракового заболевания, эффективного количества TCR или мультивалентного TCR комплекса изобретения (необязательно связанного с терапевтическим агентом), или совокупности клеток,презентирующих по меньшей мере один TCR изобретения, или нуклеиновой кислоты или нуклеиновых кислот, кодирующих TCR изобретения. Изобретение также предусматривает (как еще один вариант) применение TCR или мультивалентного TCR комплекса изобретения (необязательно связанного с терапевтическим агентом) или совокупности клеток, презентирующих по меньшей мере один TCR изобретения, или нуклеиновой кислоты или нуклеиновых кислот, кодирующих TCR изобретения, для получения композиции для лечения рака. Специалисту в данной области будет очевидно, что рак, который будет поддаваться лечению композициями, включающими TCR-ы данного изобретения, это Melan-А+ виды рака.TCR-ы данного изобретения терапевтического характера, а также TCR-ы, позволяющие получать изображения, следует обычно применять как часть стерильной фармацевтической композиции, которая обычно включает фармацевтически приемлемый носитель. Эта фармацевтическая композиция может быть в любой подходящей форме (в зависимости от требуемого пациенту способа введения). Она может быть в виде единичных доз, должна обычно быть упакованной в запечатанный контейнер и может пред- 12012507 ставлять собой часть набора. Такой набор может, как правило, (хотя не обязательно) включать инструкции по использованию. Он может включать несколько указанных однократных дозировочных форм. Фармацевтическая композиция может быть приспособлена для введения любым соответствующим способом, например, парентерально, трансдермально или путем ингаляции, предпочтительно парентеральным (включая подкожным, внутримышечным или наиболее предпочтительно внутривенным) путем. Такие композиции могут быть получены любым известным в фармацевтике методом, например смешиванием активного ингредиента с носителем (носителями) или разбавителем (разбавителями) в условиях стерильности. Дозировки веществ настоящего изобретения могут варьировать в широком диапазоне, в зависимости от заболевания или состояния, требующих лечения, возраста и состояния индивидуума, которого лечат, и т.д., и врачом будут назначаться дозы, соответствующие конкретному случаю. Дополнительные аспекты.scTCR или dTCR настоящего изобретения (которые предпочтительно составлены константными и вариабельными последовательностями, соответствующими человеческим последовательностям) могут быть представлены в практически чистом виде или как очищенный или выделенный препарат. Например, он может быть представлен в форме, которая практически не содержит других белков. Изобретением также обеспечивается способ идентификации высокоаффинного TCR, обладающего свойством связываться с AAGIGILTV-HLA-A0201, характеризующийся тем, что TCR (i) включает по меньшей мере один вариабельный домен -цепи TCR и/или по меньшей мере один вариабельный домен-цепи TCR и (ii) имеет KD в отношении указанного комплекса AAGIGILTV-HLA-A0201 менее 3 М, и способ включает:(a) получение (составление) обширной библиотеки TCR-ов, включающих вариабельные домены и -цепей MEL TCR, причем один или оба вариабельных домена - и -цепей включают мутацию(и);(b) контактирование вышеупомянутой обширной библиотеки TCR-ов с AAGIGILTV-HLA-A0201 в условиях, способных обеспечить связывание TCR-ов с AAGIGILTV-HLA-A0201, и(c) измерение KD взаимодействия. Существуют предпочтительные особенности каждого аспекта изобретения, так что для каждого из этих аспектов можно предусмотреть соответствующие изменения. Указанные здесь источники из уровня техники включены для полноты изложения, не противоречащей закону. Примеры Далее изобретение охарактеризовано следующими примерами, которые никак не ограничивают объем изобретения. В нижеследующих примерах даны отсылки на приложенные графические материалы. На фиг. 1 а и 1b приведены аминокислотные последовательности вариабельного региона -цепи и вариабельного региона -цепи нативного MEL TCR соответственно. На фиг. 2 а и 2b приведены соответственно ДНК-последовательности - и -цепей растворимых версий нативного MEL TCR. На фиг. 3a и 3b приведены экстрацеллюлярные аминокислотные последовательности соответственно - и -цепей MEL TCR, полученные на основе ДНК-последовательностей, приведенных на фиг. 2 а и 2b. На фиг. 4 а и 4b приведены ДНК-последовательности - и -цепей растворимых версий MEL TCR,мутированные включением дополнительных остатков цистеина с образованием ненативной дисульфидной связи. Мутированный кодон в каждой цепи показан штриховкой, а введенные сайты распознавания энзимами рестрикции подчеркнуты. На фиг. 5 а и 5b показаны экстрацеллюлярные аминокислотные последовательности соответственно- и -цепей MEL TCR, соответствующие ДНК-последовательностям фиг. 4 а и 4b. Введенный цистеин в каждой цепи показан штриховкой. На фиг. 6 показаны аминокислотные последовательности вариабельного региона -цепей высокоаффинных вариантов MEL TCR. Мутированные остатки подчеркнуты. На фиг. 7 а показана аминокислотная последовательность усеченной формы TRAC. На фиг. 7b показана аминокислотная последовательность усеченной формы TRBC1. На фиг. 7 с показана аминокислотная последовательность усеченной формы TRBC2. На фиг. 8 а приведена плазмидная карта плазмиды рЕХ 202. На фиг. 8b приведена ДНК-последовательность плазмиды рЕХ 202. На фиг. 9 а детально показаны аминокислотные последовательности -цепей предпочтительного растворимого высокоаффинного варианта MEL TCR. На фиг. 9b детально охарактеризованы аминокислотные последовательности -цепей растворимогоMEL TCR дикого типа вместе с кодируемым TRBC2 константным регионом, слитым с помощью пептидного линкера с человеческим IL-2 дикого типа. Последовательности линкера и IL-2 даны курсивом. На фиг. 10 приведена кривая Biacore отклика, полученного в результате взаимодействия растворимого дисульфидсвязанного MEL TCR дикого типа и AAGIGILTV-HLA-A0201.- 13012507 На фиг. 11 а и 11b приведены ДНК-последовательность -цепи полноразмерного MEL TCR дикого типа, мутированная для повышения экспрессии в человеческих клетках, и соответственно кодируемая ею аминокислотная последовательность. На фиг. 12 а и 12b приведены ДНК-последовательность -цепи полноразмерного высокоаффинногоc1 MEL TCR, мутированная для повышения экспрессии в человеческих клетках, и соответственно кодируемая ею аминокислотная последовательность. На фиг. 13 а и 13b приведены ДНК-последовательность -цепи полноразмерного высокоаффинногоcld MEL TCR, мутированная для повышения экспрессии в человеческих клетках, и соответственно кодируемая его аминокислотная последовательность. На фиг. 14 а и 14b приведены ДНК-последовательность -цепи полноразмерного высокоаффинного с 9 MEL TCR, мутированная для повышения экспрессии в человеческих клетках, и соответственно кодируемая его аминокислотная последовательность. На фиг. 15 а и 15b приведены ДНК-последовательность -цепи полноразмерного с 9 MEL TCR, мутированная для повышения экспрессии в человеческих клетках, и соответственно кодируемая его аминокислотная последовательность. На фиг. 16 показаны данные ELISPOT анализа, показывающие способность растворимого дисульфидсвязанного варианта высокоаффинного c1 WT Mel TCR ингибировать активацию Mel-специфичногоTCR, включая ДНК-кодоны дикого типа за исключением тех, которые кодируют мутированные аминокислоты. На фиг. 19 а приведены FACS данные по уровню экспрессии TCR, достигаемому при трансфекцииJurkat клеток не оптимизированной по кодонам ДНК, кодирующей a c1 /WTMEL TCR. На фиг. 19b приведены FACS данные по уровню экспрессии TCR, достигаемому при трансфекцииJurkat клеток оптимизированной по кодонам ДНК, кодирующей a c1 /WTMEL TCR. На фиг. 20 показаны аминокислотные последовательности вариабельных регионов дополненных цепей высокоаффинного MEL TCR. Мутированные остатки подчеркнуты. На фиг. 21 показаны аминокислотные последовательности вариабельных регионов дополненных цепей высокоаффинного MEL TCR. Мутированные остатки подчеркнуты. На фиг. 22 показаны аминокислотные последовательности -цепей растворимого высокоаффинногоMEL TCR, включающие ненативный цистеиновый остаток. Этот ненативный цистеиновый остаток высвечен, а мутированные остатки подчеркнуты. На фиг. 23 показаны аминокислотные последовательности -цепей растворимого высокоаффинногоMEL TCR, включающие ненативный цистеиновый остаток. Этот ненативный цистеиновый остаток высвечен, а мутированные остатки подчеркнуты. Пример 1. Получение растворимого дисульфидно-связанного TCR, включающего вариабельные домены нативного MEL. На фиг. 4 а и 4b показаны ДНК-последовательности растворимых дисульфидсвязанных - и -цепейMEL TCR дикого типа, который специфичен в отношении AAGIGILTV-HLA-A0201 комплекса. Эти ДНК-последовательности могут синтезироваться de-novo множеством контрактных исследовательских компаний, например GeneArt (Regensburg, Germany). Распознаваемые рестриктазами сайты также добавлялись к этим ДНК-последовательностям для того, чтобы облегчить лигирование этих ДНКпоследовательностей в экспрессионные плазмиды на основе pGMT7, которые содержат промотор Т 7 для высокоуровневой экспрессии в штамме E.coli BL21-DE3 (pLysS), (Pan et al., Biotechiques (2000), 29(6): 1234-8). ДНК последовательности, кодирующие каждую TCR цепь, усеченные Nde I и Hind III, лигируются в различных рЕХ 202 pGMT7 - основанных векторах, которые также были вырезаны с помощью Nde I иHind III (см. на фиг. 8 а плазмидную карту рЕХ 202 и на фиг. 8b - ДНК-последовательность этого вектора(SEQ ID NO:28. Сайты, распознаваемые энзимами рестрикции, используемые для включения в ДНК, кодирующие цепи водорастворимого MEL TCR дикого типа:Hind III - AAGCTT. Лигирование. Лигируемые плазмиды переносят в компетентные клетки штамма E.coli XL1-голубой и помещают в плашки с LB-агаром, содержащим ампициллин в количестве 100 мг/мл. После этого их инкубируют в течение ночи при 37 С, отдельные колонии отбирают и выращивают в 10 мл LB, содержащего 100 мг/мл ампициллина, в течение ночи при 37 С при встряхивании. Клонированные плазмиды очищают с помощью Miniprep набора (Qiagen) и инсертные вставки анализируют секвенированием на автоматическом- 14012507 ДНК-секвенаторе (Lark Technologies). На фиг. 5 а и 5b приведены экстрацеллюлярные аминокислотные последовательности - и -цепей соответственно растворимого дисульфидно-связанного MEL TCR дикого типа, полученные исходя из ДНК-последовательностей, приведенных на фиг. 4 а и 4b. Сайты, распознаваемые рестриктазами, в этих ДНК-последовательностях подчеркнуты. Пример 2. Получение высокоаффинных вариантов растворимого с дисульфидными связями MELTCR. Растворимый дисульфидно-связанный нативный MEL TCR, полученный согласно примеру 1, может использоваться как матрица, с помощью которой можно получать TCR-ы данного изобретения, которые обладают повышенной аффинностью в отношении AAGIGILTV (SEQ ID NO:43) HLA-A0201 комплекса. Фаговый дисплей является одним из средств, с помощью которого могут быть созданы библиотекиHIV Gag TCR вариантов для того, чтобы определять высокоаффинные мутанты. Например, фаговый дисплей TCR и способы скринирования, описанные в Li et al., (2005) Nature Biotech. 23(3): 349-354, могут быть приспособлены и использованы применительно к HIV Gag TCR-ов. Аминокислотные последовательности мутированных вариабельных регионов -цепей мутированного TCR, которые при сочетании с вариабельным регионом -цепи MEL дикого типа, проявляют высокую аффинность в отношении AAGIGILTV-HLA-А 0201 комплекса, приведены на фиг. 6 (SEQ IDNO:11-24). Как известно специалистам в данной области, необходимые изменения кодонов, которые требуются для получения этих мутированных цепей, могут быть включены в ДНК, кодирующие эти-цепи,сайт-направленным мутагенезом (Quick Chauge Site-Directed Mutagenesis Kit от Stratagene). В основном, это достигается использованием праймеров, которые включают желаемое изменение(изменения) кодонов, и рЕХ 202 плазмид, содержащих релевантную ДНК цепи MEL TCR в качестве матрицы для мутагенеза. Мутагенез осуществляют в следующих условиях: 50 нг плазмидной матрицы, 1 л 10 мМ dNTP,5 л 10 X Pfu ДНК-полимеразного буфера, полученного от производителя, 25 пмоль fwd праймера,25 пмоль rev праймера, 1 л pfu ДНК-полимеразы в общем объеме 50 л. После первоначальной денатурационной стадии в течение 2 мин при 95 С реакцию проводили в 25 циклов денатурации (95 С, 10 с),отжига (55 С, 10 с) и удлинения (72 С, 8 мин). Полученный продукт подвергали действию рестрикционного энзима DpnI, чтобы удалить матрицу-плазмиду и трансформировать его в E.coli штамм XL1 - голубой. Мутагенез был проконтролирован секвенированием. Пример 3. Экспрессия, рефолдинг и очистка растворимого TCR. Экспрессионные рЕХ 202 плазмиды, содержащие MEL TCR -цепи и MEL TCR -цепи, полученные как описано в примерах 1 или 2, вводят раздельно в E.coli штамм BL21 pLys S, и одинарные колонии с устойчивостью к ампициллину выращивают при 37 С в ТУР (ампициллин 100 г/мл) среде до OD600,равной 0,4, до индуцирования экспрессии белка, с 0,5 мМ IPTG. Клетки собирают спустя 3 ч после начала индукции, центрифугируя в течение 30 мин при 4000 об/мин на Beckman J-6B. Клеточную массу ресуспендировали в буфере, содержащем 50 мМ Трис-HCl, 25% (вес./об.) сахарозы, 1 мМ Na-ЭДТА, 0,1%(вес./об.) NaAzide, 10 мМ DTT, pH 8,0. После процедуры замораживания-оттаивания, выполняемой в течение ночи, клетки озвучивали в целом около 10 мин в Milsonics XL2020 устройстве для озвучивания,используя стандартную 12-миллиметровую по диаметру пробу. Осадок телец включения отделяли центрифугированием в течение 30 мин при 13000 об/мин на Beckman J2-21 центрифуге. Три раза промыли детергентом, чтобы удалить клеточный дебрис и мембранные компоненты. Каждый раз осадок телец включения гомогенизировали в Triton буфере (50 мМ Трис-HCl, 0,5% Triton-X100, 200 мМ NaCl, 10 мМNa-ЭДТА, 0,1% (вес./об.) NaAzide, 2 мМ DTT, pH 8,0) перед осаждением центрифугированием в течение 15 мин при 15000 об/мин на Beckman J2-21. Детергент и соли потом удаляли простым промыванием следующим буфером: 50 мМ Трис-HCl, 1 мМ Na-ЭДТА, 0,1% (вес./об.) NaAzide, 2 мМ DTT, pH 8,0. Наконец, тельца включения разделили на аликвоты на 30 мг и заморозили при -70 С. Выход белка телец включения определяется количественно растворением 6 М гуанидин - HCl и определением по связыванию с красителем Bradford (PerBio). Примерно 30 мг TCR -цепных и 60 мг TCR -цепных солюбилизированных телец включения дают оттаять из замороженных блоков, затем полученные образцы были смешаны и смесь разбавили, вылив ее в 15 мл раствора гуанидина (6 М гуанидин-хлорид, 10 мМ ацетата натрия, 10 мМ ЭДТА) для обеспечения полной денатурации цепей. Раствор гуанидина, содержащий полностью разрушенные и денатурированные цепи TCR, затем инжектируют в 1 л буфера для рефолдинга, который имеет следующий состав: 100 мМ Трис pH 8,5, 400 мМ L-аргинина, 2 мМ ЭДТА, 5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона, 5 М мочевины, 0,2 мМ PMSF. Реагенты восстановительного сочетания 2 меркаптоэтиламин и цистамин (до конечных концентраций 6,6 мМ и 3,7 мМ соответственно) добавляют приблизительно за 5 мин до добавления денатурированных TCR-цепей. Раствор оставляют на 5 ч 15 мин. Рефолдированный TCR диализуют с помощью Spectrapor 1 мембраны (Spectrum; Product No. 132670) против 10 л 10 мМ Трис pH 8,1 при 53 С в течение 18-20 ч. После этого диализный буфер заме- 15012507 няют на свежий 10 мМ Трис pH 8,1 (10 л) и диализ продолжают при 53 С еще 20-22 ч.sTCR продукт отделяют от разрушенных продуктов и примесей, нанеся диализованный рефолд на анионообменную колонку POROC 50HQ и элюируя связанный белок градиентом 0-500 мМ NaCl в пределах 50 колоночных объемов, используя Akta purifer (Phormacia). Фракции, соответствующие пикам,хранили при 4 С и анализировали с использованием кумасси-окрашенного SDS-PAGE перед тем, как их собрать и концентрировать. Наконец, sTCR очищают и характеризуют, используя гель-фильтрационную колонну Superdex 200 HR, предварительно уравновешенную HBS-EP буфером (10 мМ HEPES pH 7,4,150 мМ NaCl, 3,5 мМ ЭДТА, 0,05% nonidet p40). Собирают фракцию, элюируемую при соответствии молекулярной массе приблизительно 50 kDa, концентрируют ее прежде, чем подвергнуть анализу с помощью Biacore метода поверхностного плазмонного резонанса. Пример 4. Характеристика sTCR, связывающегося со специфическим рМНС, полученная BIA-core методом поверхностного плазменного резонанса. Биосенсор поверхностного плазменного резонанса (Biacore 3000) использовали для анализа связывания растворимых MEL TCR-ов с родственным пептид-МНС лигандом. Это обеспечивалось тем, что получали отдельные рМНС комплексы (описанные ниже), которые затем иммобилизовали на стрептавидинсодержащий связывающей поверхности полуориентированным образом, позволяющим проводить эффективную проверку связывания растворимого Т-клеточного рецептора с четырьмя различными МНС(иммобилизованными на отдельно движущихся в потоке клетках) одновременно. Впрыскивание HLA комплекса, производимое вручную, обеспечивает точный уровень содержания иммобилизованных молекул класса I с тем, чтобы ими было легко манипулировать. Биотинилированные молекулы класса I HLA-A0201 были подвергнуты рефолдингу in vitro, исходя из экспрессируемых бактериями телец включения, содержащих составляющие субъединичные белки и синтетический пептид, с последующей очисткой и in vitro энзиматическим биотинилированием (О' Callaghan et al. (1999) Anal. Biochem. 266: 9-15). HLA-A0201 - тяжелая цепь экспрессировалась с Сконцевой биотинилированной метки, что заменяет трансмембранные и цитоплазмические домены белка на соответствующий конструкт. Были получены уровни экспрессии телец включения 75 мг/л бактериальной культуры. МНС легкая цепь или 2-микроглобулин также экспрессировался в тельцах включения в E.coli с соответствующего конструкта, в количестве 500 мг/л бактериальной культуры. Клетки E.coli лизировали и выделяли тельца включения с чистотой примерно 80%. Белок из телец включения денатурировали в 6 М гуанидин-HCl, 50 мМ Трис pH 8,1, 100 мМ NaCl, 10 мМ DTT, 10 мМ ЭДТА, и подвергали рефолдингу при концентрации 30 мг/л тяжелой цепи, 30 мг/л 2m в 0,4 М Lаргинин-HCl, 100 мМ Трис pH 8,1, 3,7 мМ цистамина, 6,6 мМ -цистеамина, 4 мг/мл AAGIGILTV пептида, необходимых для присоединения молекулы HLA-A0201 путем одномоментного добавления денатурированного белка в рефолд-буфер при температуре ниже 5 С. Рефолдинг достигал полного завершения в течение по крайней мере 1 ч при 4 С. Затем меняли буфер диализом в 10 объемах 10 мМ Трис pH 8,1. Две замены буфера необходимы для существенного уменьшения ионной силы раствора. Затем раствор белка фильтровали через 1,5 м ацетатцеллюлозный фильтр и наносили на анионообменную колонку POROS 50 HQ (объем слоя 8 мл). Белок элюировали линейным градиентом 0-500 мМ NaCl. HLA-A0201 - пептидный комплекс элюировали при примерно 250 мМ NaCl, фракции пиков собирали, добавляли смесь ингибиторов протеаз (Calbiochem) и эти фракции охлаждали на льду. Для меченных биотинилированием рМНС молекул заменяли буфер на 10 мМ Трис pH 8,1, 5 мМNaCl, используя Pharmacia колонку быстрого обессоливания, уравновешенную тем же буфером. Сразу же после элюции белоксодержащие фракции охлаждали на льду и добавляли смесь ингибиторов протеаз(Calbiochem). Были добавлены следующие реагенты биотинилирования 1 мМ биотин, 5 мМ АТР (забуференного до pH 8), 7,5 мМ MgCl2 и 5 г/мл BirA энзим (очищенный согласно О' Callaghan et al. (1999)Anal. Biochem. 266: 9-15). Затем смесь оставляли инкубироваться на ночь при комнатной температуре. Биотинилированные pHLA-A0201 молекулы очищали гель-фильтрационной хроматографией. Колонка Pharmacia Superdex 75 HR 10/30 была предварительно уравновешена отфильтрованным PBS и затем 1 мл реакционной смеси биотинилирования наслаивали на колонку и затем пропускали РВС со скоростью 0,5 мл/мин. Биотинилированные pHLA-A0201 молекулы элюировались одиночным пиком объемом примерно 15 мл. Фракции, содержащие белок, собирали, охлаждали на льду и добавили смесь ингибиторов протеаз. Концентрацию белка определяли, используя Coomassie-связывающий метод анализа(PerBio), аликвоты биотинилированных pHLA-A0201 молекул были заморожены при -20 С. Был иммобилизирован стрептавидин стандартными аминосвязывающими методами. Такие иммобилизованные комплексы способны связывать как рецепторы Т-клеток, так и корецептор CD8, причем и те, и другие могут вводиться в растворимой фазе. Специфическое связывание TCR происходит даже при низких концентрациях (по меньшей мере 40 г/мл), при этом подразумевается, что TCR относительно стабилен. Установлено, что связывающие рМНС свойства sTCR качественно и количественно аналогичны, независимо от того, используется sTCR в растворимом или иммобилизованном виде. Это является важным средством контроля частной активности растворимых образцов и также наводит на мысль, что биотини- 16012507 лированные рМНС комплексы так же биологически активны, как и небиотинилированные комплексы. Взаимодействия между растворимыми MEL TCR-ами, содержащими новую, неизвестную межцепочечную связь, и родственным рМНС или нерелевантной комбинацией рМНС, получение которой описано выше, анализировали с помощью Biacore 3000 биосенсора поверхностного плазмонного резонанса(SPR). SPR измеряет изменения рефрактивного индекса, выражаемого в единицах отклика (RU) вблизи поверхности сенсора внутри небольшой проточной ячейки, принцип которого может использоваться для определения взаимодействий между рецептором и лигандом и позволяет анализировать их аффинность и кинетические параметры. Проточные ячейки, содержащие пробы, готовили иммобилизацией конкретных отдельных HLA-пептидных комплексов в отдельных проточных ячейках, осуществляя связывания между биотином поперечно-сшитым на 2m и стрептавидином, который был поперечно сшит с активированной поверхностью проточных ячеек. Это исследование выполнялось при пропускании sTCR над поверхностями различных, не схожих проточных ячеек при постоянной скорости протока и измерении откликаSPR в текущий момент выполнения. Измерение константы равновесного связывания. Готовили серийные разбавления MEL sTCR, мутированных или дикого типа, и впрыскивали их при постоянной скорости протока, равной 5 л/мин, над двумя различными проточными ячейками; одна покрыта примерно 1000 RU специфичного AAGIGILTV-HLA-A0201 комплекса, вторая покрыта примерно 1000 RU неспецифичного HLA-А 2-пептидного комплекса. Отклик был нормализован для каждой концентрации с помощью измерения фона в контрольной ячейке. Нормализованный уровень отклика наносили против величины концентрации образца TCR и подгоняли гиперболу для того, чтобы вычислить константу равновесия связывания, KD (PriceDwek, Principles and Problems in Physical Chemistry for Biochemists (2nd Edition) 1979, Clarendon Press, Oxford). Измерение кинетических параметров. Для высокоаффинных TCR-ов KD определяли экспериментально, измеряя константу скорости диссоциации kd, и константу скорости ассоциации ka. Константу равновесия вычисляли как kd/ka.TCR впрыскивали в две разные ячейки, одна - с покрытием 300 RU специфичного HLA-A2-AAGIGILTV комплекса, другая - с покрытием 300 RU неспецифичного HLA-A2 - пептидного комплекса. Скорость протока составляла 50 л/мин. Обычно впрыскивали 250 л TCR при 3 M концентрации. Затем пропускали буфер, пока уровень отклика не возвращался к исходному. Кинетические параметры вычисляли, используя Biaevaluation программное обеспечение. Фазу диссоциации также подгоняли к простому уравнению экспоненциального снижения, позволяющему вычислить срединный уровень полужизни. Результаты. Взаимодействие между растворимым дисульфидно-связанным MEL TCR дикого типа (состоящим изиTCR цепей, охарактеризованных на SEQ ID NO: 9 и 10 соответственно) и AAGIGILTV-HLAA0201 комплексом анализировали с помощью вышеуказанного способа, и оно показало KD, равное 4 М (см. фиг. 12 для Biacore кривой отклика).TCR-ы, характеризующиеся применением вариабельных регионов, указанных в нижеследующей таблице, имеют KD менее или равный 3 М. Учитывая опыт с высокоаффинными TCR-ами, отличными от имеющихся MEL TCR-ов (см., например, Li et al., Nature Biotech. 2005, 23 (3):349-354), ожидали, что некоторые или все из TCR-ов, перечисленных в нижеследующей таблице, будут иметь Koff, равный 110-3 S-1 или ниже, и на самом деле было показано, что это имело место с образцами растворимых TCR,включающих эти вариабельные домены (см. таблицу).Biacore данные взаимодействия высокоаффинных растворимых дисульфидно-связанныхMEL TCR-ов, включающих определенные вариабельные регионы и родственного Пример 5. Получение слитого белка на основе растворимого высокоаффинного MEL TCR и WT человеческого IL-2. Способы, конкретно описанные в примерах 1-3, могут использоваться для получения слитого белка на основе растворимого высокоаффинного MEL TCR и WT человеческого IL-2. Кратко говоря, ДНК,кодирующую желаемый линкер, и WT человеческий IL-2, добавляют к 3'-концу ДНКпоследовательности растворимого дисульфидно-связанного -цепи MEL TCR дикого типа непосредственно до ТАА (Stop) кодона. На фиг. 9b показана аминокислотная последовательность слитого белка,включающего -цепь дисульфидно-связанного MEL TCR дикого типа, слитую с WT человеческого IL-2 через линкерную последовательность (SEQ ID NO:30). Линкер и IL-2 часть, входящая в состав данного слитого белка, показаны курсивом. ДНК, кодирующая этот конструкт, затем была лигирована в рЕХ 202. Слитый белок в виде растворимого высокоаффинного MEL TCR-IL-2 может затем экспрессироваться при сочетании этого слитого белка на основе -цепи с -цепью растворимого высокоаффинного дисульфидно-связанного MEL TCR, содержащей один из вариабельных регионов, показанных на фиг. 6 (SEQ(SEQ ID NO:29) показана аминокислотная последовательность -цепи растворимого высокоаффинного- 18012507 дисульфидно-связанного MEL TCR, содержащая вариабельный регион, показанный на SEQ ID NO:11. Пример 6. ELISPOT анализ для оценки in vitro ингибирования активации цитотоксических Т-клеток(CTL) с помощью растворимых высокоаффинных Mel C1 с WT Mel TCR-ов. Нижеследующий способ обеспечивает средства для оценки способности Mel c1 с WT - высокоаффинных Mel TCR-ов ингибировать активацию AAGIGILTV-HLA-A0201 - реактивных Т-клеточных клонов. Растворимый Mel c1 с WT - высокоаффинный Mel TCR, используемый в данном опыте, содержал вариабельный домен -цепи Mel TCR и вариабельные регионы (SEQ ID NO:11) и (SEQ ID NO:2) -цепиWT Mel TCR соответственно. Полные аминокислотные последовательности TCR - и -цепей этого растворимого дисульфидно-связанного TCR показаны на фиг. 9 а (SEQ ID NO:29) и на фиг. 5b (SEQ ID(Gibco, cat42401-018), 1% глутамин (Gibco, cat25030-024) и 1% пенициллин стрептомицин (Gibco,cat15070-063). Промывочный буфер: 0,01 M PBS/0,05% Твин 20 (1 саше фосфатно-солевого буфера с Твином 20,pH 7,4 от Sigma, CafР-3563, растворенные в 1 л дистиллированной воды, дает конечную композицию 0,01 М PBS, 0,138 М NaCl, 0,0027 М KCl, 0,05% Твин 20).Diaclone EliSpot набор (IDS) EliSpot набор содержит все остальные требующиеся реагенты, то есть антитела для иммобилизации и для определения, сухое обезжиренное молоко, BSA, стрептавидин - щелочная фосфатаза, BCIP/NBT раствор (человеческий IFN- PVDE Eli - spot 2096 ячеечных планшетов(IDS catDC-856, 051.020, DC-856.000.000. Нижеследующее описание способа основано на инструкциях производителей, которыми снабжается каждый набор, но с некоторыми изменениями. Способ. 100 л иммобилизованного антитела растворили в 10 мл стерильного PBS в расчете на 1 ячейку. 100 л растворенного иммобилизованного антитела аликвотно наносили в каждую ячейку и оставляли на ночь при 4 С или 2 ч при комнатной температуре. Затем ячейки промыли три раза 450 л промывочного буфера, Ultrawash промывателем 96-луночных планшетов (Thermo Life Sciences), чтобы удалить избыток иммобилизованных антител. 100 л 2% обезжиренного молока было затем добавлено в каждую ячейку(один пузырек с сухим обезжиренным молоком из тех, которые поставляются с ELISPOT набором, растворили в 50 мл стерильного PBS). Планшеты затем инкубировали при комнатной температуре в течение 2 ч, затем промывали трижды 450 л промывочным буфером, Ultrawash промывателем для 96-луночных планшетов (Thermo Life Sciences). Клетки-мишени рака Mel 624 и Mel 526 выделяли из соответствующих прокультивированных тканевых культур, используя трипсин, промывали один раз, центрифугируя (280g в течение 10 мин) в среде для анализа, и ресуспендировали при 1106/мл той же самой среды. 50 мл этой суспензии затем добавили на планшет для анализа с получением общего количества клеток-мишеней 50000 клеток/на ячейку. Импульсированные ELAGIGILTV клетки Т 2 мишени также были использованы как контроль. Этот аналогичный пептид был использован, так как он имеет большую аффинность в отношении MLAA0201, чем WT пептид. Эти импульсированные пептидами клетки были промыты при центрифугировании (280 g в течение 10 мин) в среде для анализа и ресуспендированы при 1106 клеток/мл той же среды. 50 мкл этой суспензии затем добавили на планшет для анализа с получением общего количества клеток мишеней 50000 клеток/на ячейку. Клон Т-клеток (КА/С 5), подвергнутых аутологичной стимуляции ELAGIGILTV пептидом, собирали центрифугированием (280g в течение 10 мин) и ресуспендировали при 1105 клеток/мл в среде для анализа с получением концентрации 500 клеток/на ячейку при добавлении на планшет для анализа. Растворимые высокоаффинные MEL TCR-ы MEL c1 с WT высокоаффинного Mel TCR разбавили средой для анализа в 3 Х концентрации с получением 1X конечной при добавлении 50 мкл на планшет до конечного объема 150 мкл. Диапазон концентраций исследуемых высокоаффинных Mel TCR-ов был 1 М-1 нМ. Затем готовили ячейки, в которых содержалось (конечный реакционный объем в каждой ячейке был 100 л): Анализируемые образцы (добавлялось в указанном порядке) 50 мкл Mel 624 или Mel 526 клеток+мишеней 50 мкл растворимого высокоаффинного Mel c1 с WT TCR-ов желаемой концентрации 50 мкл эффекторных клеток клеточного клона КА/С 5 Негативные контроли 50 мкл клеток мишеней 50 мкл растворимого высокоаффинного Mel c1 с WT TCR-ов самой высокой концентрации 50 мкл среды для анализа и- 19012507 50 л эффекторных клеток 50 л растворимого высокоаффинного Mel c1 с WT TCR-ов самой высокой концентрации 50 л среды для анализа и 50 л эффекторных клеток 50 л клеток-мишеней 50 л растворимого нерелевантного (HLA-A0201 - Tax - специфичного) высокоаффинного mTCR с самой высокой концентрацией Позитивный контроль 50 л Mel 624, Mel 526 или пептидно-пульсированных Т 2 мишенных клеток 50 л эффекторных клеток 50 л среды для анализа Планшеты затем инкубировали в течение ночи при 37 С/5% CO2. Затем планшеты промывали 6 раз промывочным буфером и стряхнули его избыток. Затем добавляли 550 л дистиллированной воды в каждый сосуд для определения антител, снабженный ELISPOT набором для приготовления разбавленного раствора. 100 л разбавленного раствора определения антител далее разбавили в 10 мл PBS/1% BSA на планшет и 100 л разбавленного раствора определения антител аликвотно разливали в каждую ячейку. Затем планшеты инкубировали при комнатной температуре в течение 90 мин. После этого планшеты промывали три раза промывочным буфером (три раза по 450 л промывочного буфера, Ultrawash промыватель 96-луночных планшетов (Thermo Life Sciences) и стряхнули досуха. 10 л стрептавидина - щелочной фосфатазы затем разбавили 10 мл PBS/1% BSA на планшет и 100 л разбавленного стрептавидина добавили в каждую ячейку и инкубировали при комнатной температуре в течение 1 ч. Затем планшеты промывали 3 раза по 450 л промывочного буфера и стряхнули досуха. В каждую ячейку добавили 100 л BCIP/NBT, планшеты накрывали фольгой и оставляли на 5-15 мин. В течение этого времени планшеты регулярно просматривают на предмет образования пятна(пятен) для того, чтобы решить, закончилась ли реакция. Планшеты затем тщательно промыли водой и досуха стряхнули и оставили сушиться. Ставшие сухими планшеты подвергли считыванию с помощью ELISPOT считывателя (AntoimmunDiagnostika, Germany). Количество появившихся в каждой ячейке пятен прямо пропорционально числу активированных Тклеток. Следовательно, любое снижение числа пятен в ячейках, содержащих высокоаффинный Mel TCR,показывает ингибирование активации клона КА/С 5 CTL. Результаты. Как показано на фиг. 16, растворимые с 1 с WT высокоаффинные Mel TCR-ы были эффективны в плане ингибирования активирования КА/С 5 CTL клона. Эти данные показывают, что 100% ингибирование CTL активирования достигалось при 1 М водорастворимых c1 с WT высокоаффинных Mel TCR-ов. Пример 7. Сравнение уровней экспрессии TCR в Jurkat клетках, трансфицированных кодоноптимизированой и кодон-неоптимизированной ДНК, кодирующей высокоаффинный (c1 a WT) MELTCR 4106 Jurkat клеток, выращенных в RMPI, содержащей 10% инактивированных теплом фетальных клеток теленка, выращенных на среде с сывороткой, были промыты бессывороточной средой и трансфицированы следующим: а) 5 г безэндотоксинной плазмидой pCIneo, содержащей кодон-оптимизированную последовательность, кодирующую MEL с 1 мутантную полноразмерную TCR цепь, плюс 5 г безэндотоксинной плазмиды pCI, содержащей некодон-оптимизированную последовательность, кодирующую MEL wt полноразмерную TCR цепь (ORF-ы этих последовательностей показаны на фиг. 18 (SEQ ID NO:46) и фиг. 17b (SEQ ID NO:45) соответственно), илиb) 5 г безэндотоксинной плазмидой pCIneo, содержащей ORF кодон-оптимизированную MEL с 1 мутантную полноразмерную TCR цепь, плюс 5 г безэндотоксинной плазмиды pCI, содержащей ORF кодон-оптимизированной MEL wt полноразмерную TCR цепь (ORF-ы этих последовательностей показаны на фиг. 12 а (SEQ ID NO:33) и фиг. 17b (SEQ ID NO:39) соответственно). Трансфекцию осуществляли электропорацией, используя 0,4 см кюветы при 0,27 кв и 975 F в BioRad Genepulser аппарате. Клетки помещали в 6 мл RPMI, содержащую 20% инактивированной теплом фетальной сыворотки теленка, при 37 С в течение 72 ч. Клетки окрашивали в объеме 100 л PBS, используя 1 л (0,54 г) РЕ - меченного p/HLA-A2 тетрамера на основе стрептавидина (пептид был либо гетероциклический MEL пептид ELAGIGILTV или негативный контроль NY-ESO пептид SLL MWITQC). Спустя 20 мин при комнатной температуре клетки промывали один раз 5 мл RPMI и ресуспендировали в 800 л RPMI и анализировали с помощью FC 500FACS данные по окрашиванию, показанные на фиг. 19 а и 19b, отражают степень окрашивания род- 20012507 ственного рМНС тетрамера, полученную с помощью Jurkat клеток, трансфицированных кодоннеоптимизированной и кодон-оптимизированной ДНК, кодирующей с 1 /WTMEL TCR. Эти данные показывают, что высокий уровень экспрессии поверхности TCR был достигнут с помощью использования кодон-оптимизированной ДНК, по сравнению с уровнем, достигнутым при использовании соответствующей кодон-неоптимизированной ДНК. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Т-Клеточный рецептор (TCR), обладающий свойством связываться с AAGIGILTV-HLA-A0201 и включающий по меньшей мере один вариабельный регион TCR -цепи, имеющий последовательностьSEQ ID NO:1, у которой одна или несколько аминокислот 28D, 29R, 30G, 31S, 49 М, 51I, 53S, 54N, 72Y,94V, 95A, 96G, 97K, 98S и 99 Т мутирована/мутированы, и по меньшей мере один вариабельный регионTCR -цепи, имеющий последовательность SEQ ID NO:2, у которой одна или несколько аминокислот 45L, 51S, 52V, 53G, 54I, 76I, 100G, 101 Т, 102G, 103 Е, 104L и 105F мутирована/мутированы, и характеризующийся тем, что имеет KD в отношении указанного комплекса AAGIGILTV-HLA-A0201 менее или равный 3 М и/или скорость диссоциации (koff), равную 110-3 S-1 или ниже. 2. Т-Клеточный рецептор по п.1, включающий одну или несколько мутаций вариабельного региона 3. Т-Клеточный рецептор по п.1 или 2, включающий одну или несколько мутаций вариабельного региона -цепей, соответствующих 4. Т-Клеточный рецептор по п.1 или 2, включающий одну из аминокислотных последовательностей вариабельного региона -цепей в SEQ ID NO:11-24 или 47-53. 5. Т-Клеточный рецептор по п.1 или 4, включающий одну из аминокислотных последовательностей вариабельного региона -цепей в SEQ ID NO:54-67. 6. Т-Клеточный рецептор по п.3, включающий соединенные парами вариабельные регионы - и цепей, показанные в следующей таблице: 7. Т-Клеточный рецептор по любому из предшествующих пунктов, дополнительно включающий аминокислотную последовательность константной области -цепи, показанную на SEQ ID NO:25, и/или одну из аминокислотных последовательностей константных областей -цепей в SEQ ID NO:26 и 27. 8. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:29 и аминокислотную последовательность -цепи SEQ ID NO:10. 9. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:68 и аминокислотную последовательность -цепи SEQ ID NO:10. 10. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:69 и аминокислотную последовательность -цепи SEQ ID NO:10. 11. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:70 и аминокислотную последовательность -цепи SEQ ID NO:10. 12. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:29 и аминокислотную последовательность -цепи SEQ ID NO:71. 13. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:29 и аминокислотную последовательность -цепи SEQ ID NO:72. 14. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:29 и аминокислотную последовательность -цепи SEQ ID NO:73. 15. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:29 и аминокислотную последовательность -цепи SEQ ID NO:74. 16. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:29 и аминокислотную последовательность -цепи SEQ ID NO:75. 17. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:29 и аминокислотную последовательность -цепи SEQ ID NO:76. 18. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепиSEQ ID NO:29 и аминокислотную последовательность -цепи SEQ ID NO:77. 19. Растворимый Т-клеточный рецептор, включающий аминокислотную последовательность -цепи
МПК / Метки
МПК: C07K 14/705
Метки: высокоаффинные, рецепторы, т-клеточные, мелан-а
Код ссылки
<a href="https://eas.patents.su/30-12507-vysokoaffinnye-melan-a-t-kletochnye-receptory.html" rel="bookmark" title="База патентов Евразийского Союза">Высокоаффинные мелан-а т-клеточные рецепторы</a>
Предыдущий патент: Иммуногенная композиция
Следующий патент: Печь для производства олефинов с трубой, выполненной в виде спирали с малой амплитудой
Случайный патент: Способ управления воздушным движением












