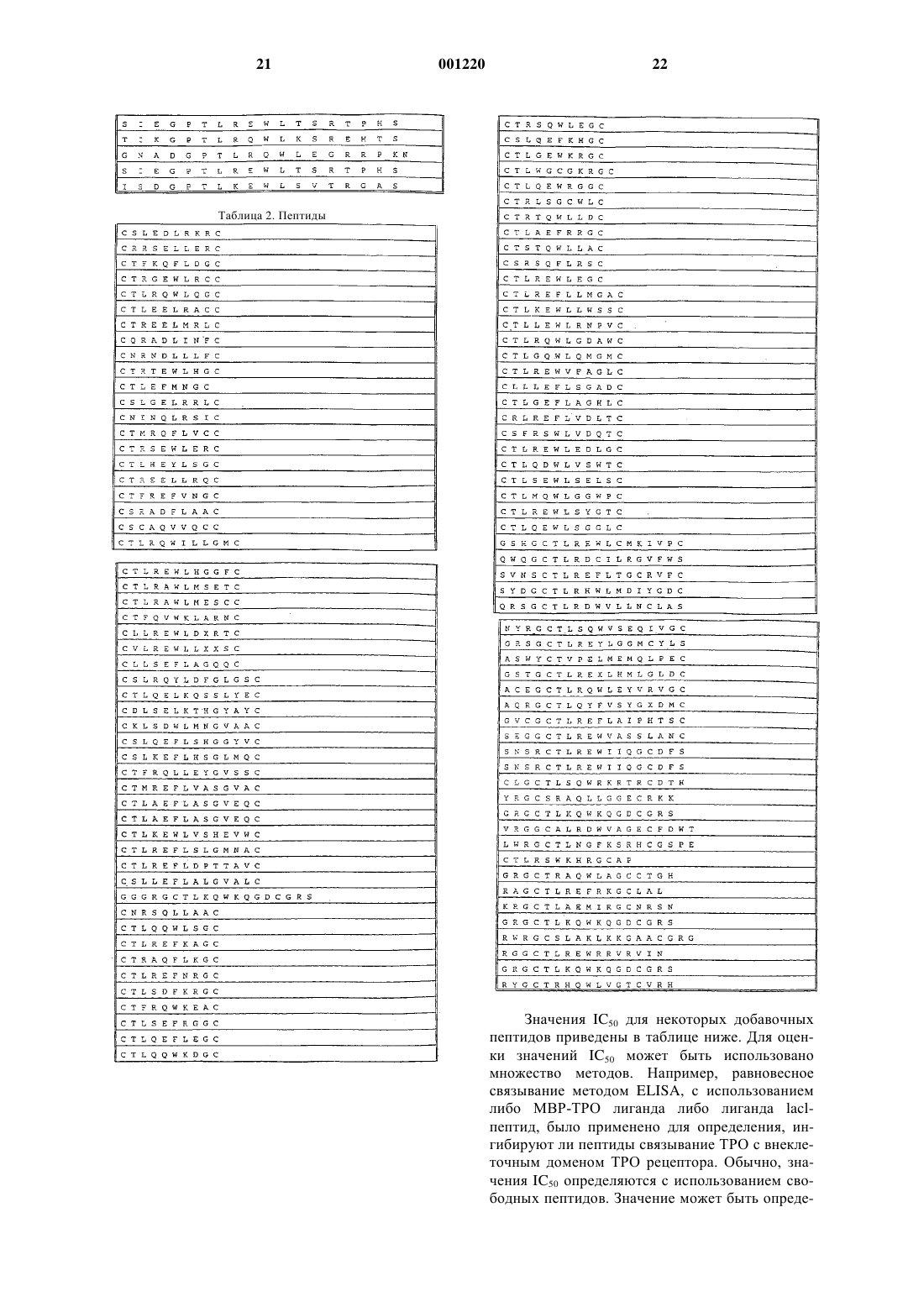
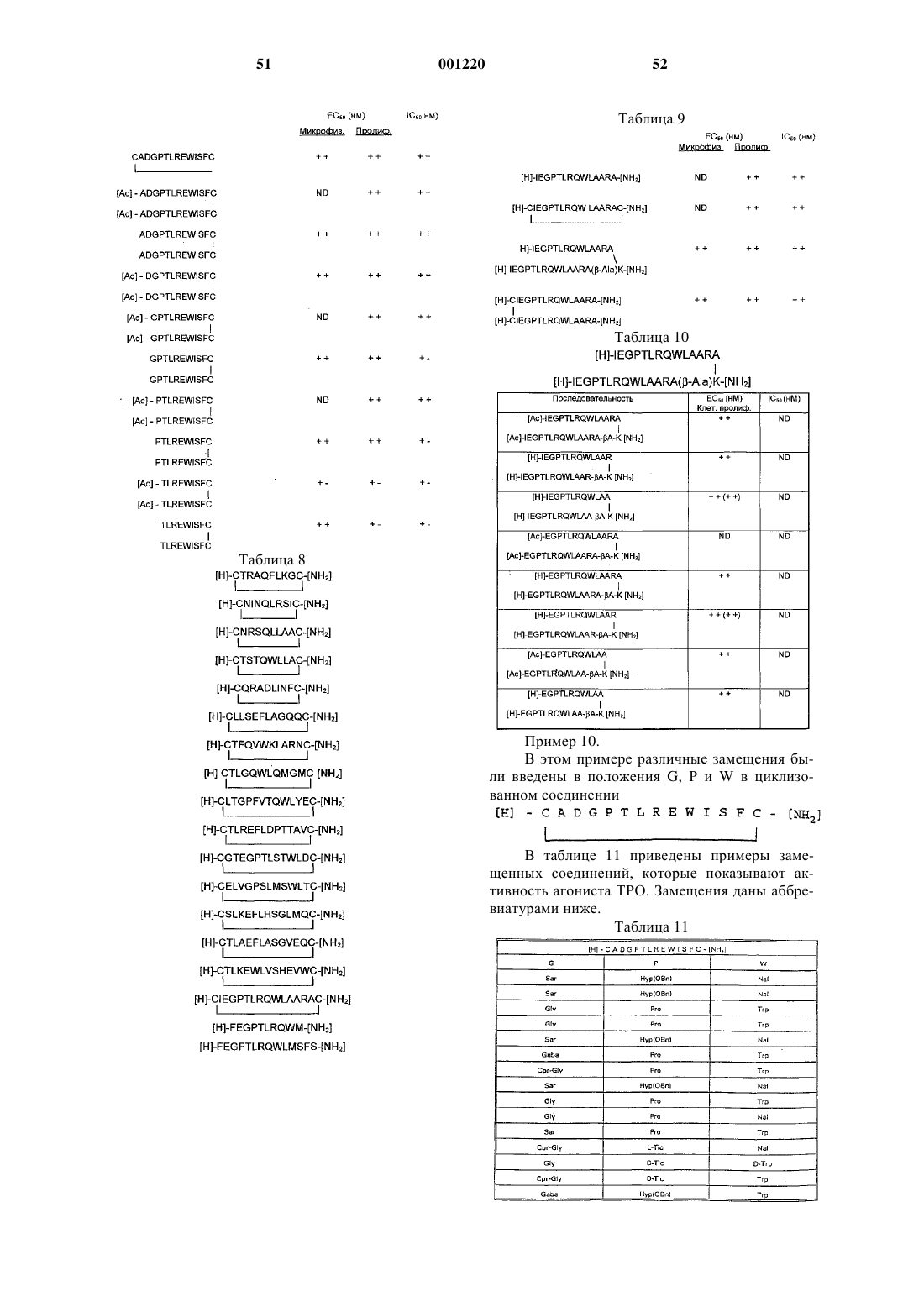
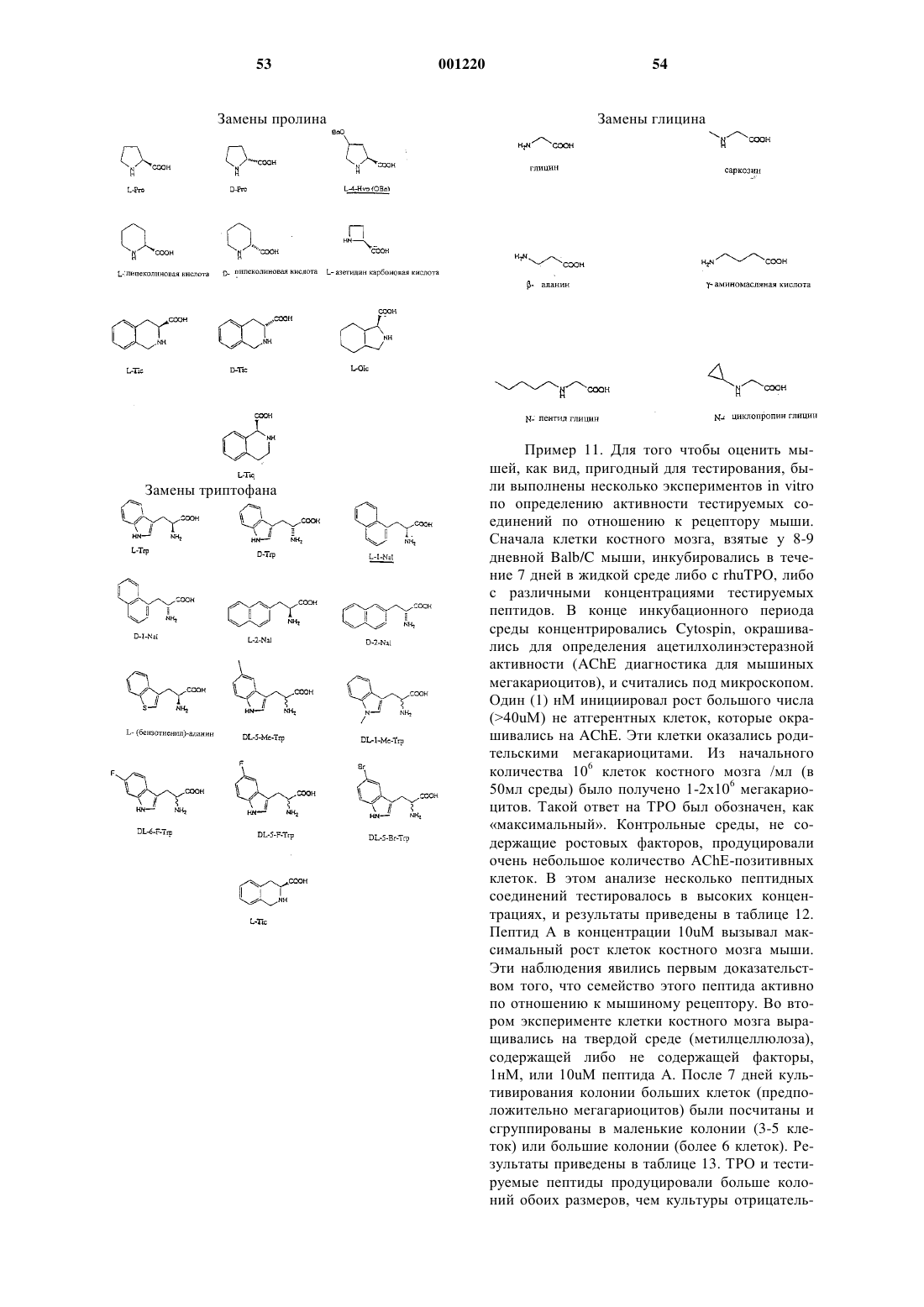
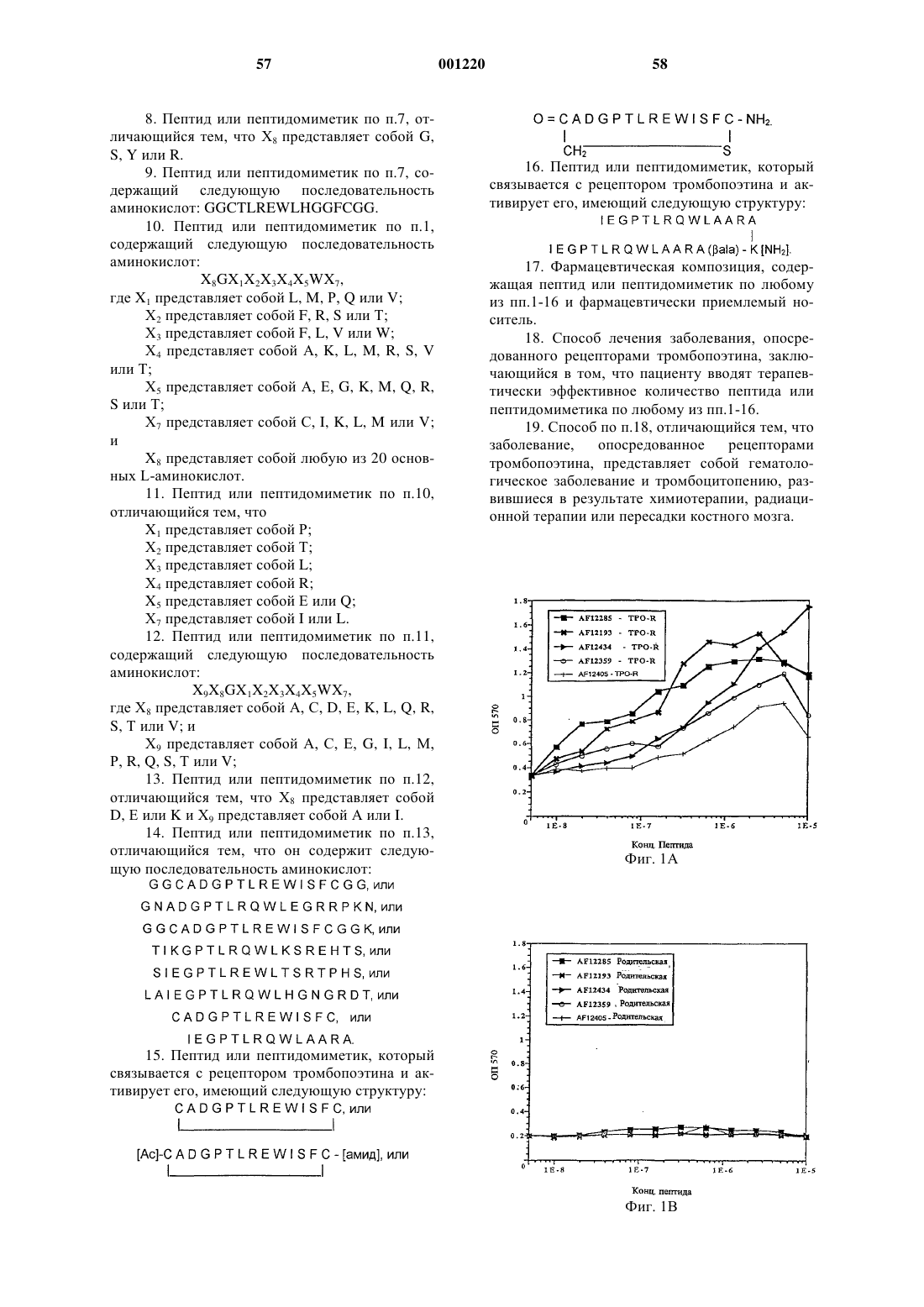
Пептид или пептидомиметик, который связывается с рецептором тромбоэтина, фармацевтическая композиция и способ лечения.
Номер патента: 1220
Опубликовано: 25.12.2000
Авторы: Гейтс Крисчиан М., Шац Питер Дж., Райтон Николас К., Дауэр Уильям Дж., Кверла Стивен И., Даффин Дейвид Дж., Уогстром Кристофер Р., Хейзелден Шеррил С., Мэттикис Лэрри К, Бэррет Роналд У.
Формула / Реферат
1. Пептид или пептидомиметик, который связывается с рецептором тромбопоэтина и активирует его, имеющий молекулярую массу менее примерно 8000 Дальтон, афинность связывания с рецептором тромбопоэтина, которая соответствует значению IC50, равному не более чем примерно 100 мкМ, и содержащий следующую последовательность аминокислот:
Х1Х2Х3Х4Х5Х6Х7,
где X1 представляет собой С, L, M, P, Q или V;
Х2 представляет собой F, K, L, N, Q, R, S, Т или V;
Х3 представляет собой С, F, I, L, M, R, S, V или W;
Х4 представляет собой любую из 20 основных L-аминокислот;
X5 представляет собой A, D, Е, G, K, M, Q, R, S, Т, V или Y;
Х6 представляет собой С, F, G, L, M, S, V, W или Y; и
Х7 представляет собой С, G, I, K, L, M, N, R или V.
2. Пептид или пептидомиметик по п.1, имеющий циклическую структуру.
3. Пептид или пептидомиметик по п.1, имеющий форму димера.
4. Пептид или пептидомиметик по п.1, содержащий следующую последовательность аминокислот:
СХ2Х3Х4X5Х6Х7,
где Х2 представляет собой K, L, N, Q, R, S, Т или V;
Х3 представляет собой С, F, I, L, M, R, S или V;
Х4 представляет собой любую из 20 основных L-аминокислот;
Х5 представляет собой А, D, Е, G, S, V или Y;
Х6 представляет собой С, F, G, L, M, S, V, W или Y; и
Х7 представляет собой С, G, I, K, L, M, N, R или V.
5. Пептид или пептидомиметик по п.3, где Х4 представляет собой А, Е, G, Н, K, L, M, P, Q, R, S, Т или W.
6. Пептид или пептидомиметик по п.5, отличающийся тем, что
X2 представляет собой S или Т;
Х3 представляет собой L или R;
Х4 представляет собой R;
Х5 представляет собой D, Е или G;
Х6 представляет собой F, L или W; и
Х7 представляет собой I, K, L, R или V.
7. Пептид или пептидомиметик по п.4, содержащий следующую последовательность аминокислот:
X8СХ2Х3Х4Х5Х6Х7,
где Х2 представляет собой F, K, L, N, Q, R, S, Т или V;
Х3 представляет собой С, F, I, L, M, R, S, V или W;
Х4 представляет собой любую из 20 основных L-аминокислот,
X5 представляет собой А, D, Е, G, K, M, Q, R, S, Т, V или Y;
Х6 представляет собой С, F, G, L, M, S, V, W или Y;
Х7 представляет собой С, G, I, K, L, M, N, R или V; и
X8 представляет собой любую из 20 основных L-аминокислот.
8. Пептид или пептидомиметик по п.7, отличающийся тем, что Х8 представляет собой G, S, Y или R.
9. Пептид или пептидомиметик по п.7, содержащий следующую последовательность аминокислот: GGCTLREWLHGGFCGG.
10. Пептид или пептидомиметик по п.1, содержащий следующую последовательность аминокислот:
X8GX1X2X3X4X5WX7,
где X1 представляет собой L, M, Р, Q или V;
Х2 представляет собой F, R, S или Т;
Х3 представляет собой F, L, V или W;
Х4 представляет собой А, K, L, M, R, S, V или Т;
Х5 представляет собой А, Е, G, K, M, Q, R, S или Т;
Х7 представляет собой С, I, K, L, M или V; и
X8 представляет собой любую из 20 основных L-аминокислот.
11. Пептид или пептидомиметик по п.10, отличающийся тем, что
X1 представляет собой Р;
Х2 представляет собой Т;
Х3 представляет собой L;
Х4 представляет собой R;
X5 представляет собой Е или Q;
Х7 представляет собой I или L.
12. Пептид или пептидомиметик по п.11, содержащий следующую последовательность аминокислот:
X9X8GX1X2X3X4X5WX7,
где Х8 представляет собой А, С, D, Е, K, L, Q, R, S, Т или V; и
Х9 представляет собой А, С, Е, G, I, L, М, Р, R, Q, S, Т или V;
13. Пептид или пептидомиметик по п.12, отличающийся тем, что Х8 представляет собой D, Е или K и Х9 представляет собой А или I.
14. Пептид или пептидомиметик по п.13, отличающийся тем, что он содержит следующую последовательность аминокислот:

15. Пептид или пептидомиметик, который связывается с рецептором тромбопоэтина и активирует его, имеющий следующую структуру:


16. Пептид или пептидомиметик, который связывается с рецептором тромбопоэтина и активирует его, имеющий следующую структуру:

17. Фармацевтическая композиция, содержащая пептид или пептидомиметик по любому из пп.1-16 и фармацевтически приемлемый носитель.
18. Способ лечения заболевания, опосредованного рецепторами тромбопоэтина, заключающийся в том, что пациенту вводят терапевтически эффективное количество пептида или пептидомиметика по любому из пп.1-16.
19. Способ по п.18, отличающийся тем, что заболевание, опосредованное рецепторами тромбопоэтина, представляет собой гематологическое заболевание и тромбоцитопению, развившиеся в результате химиотерапии, радиационной терапии или пересадки костного мозга.
Текст
1 Ссылки на сходные работы Данная заявка является частичным продолжением заявки на патент США 08/485,301, поданной 7 июня 1995 года, и заявки на патент США 08/478, 128, поданной 7 июня,1995 года, каждая из которых включена здесь по ссылке. Предпосылки изобретения В данном изобретении предлагаются пептиды и соединения, которые связываются с тромбопоэтиновым рецептором (с-mpl или TPOR) и активируют его или, другими словами, действуют как ТРО агонисты. Изобретение имеет применение в области биохимии, медицинской химии и, в частности, предлагает ТРО агонисты для использования в лечении заболеваний человека. Мегакариоциты - это клетки костного мозга, ответственные за продукцию тромбоцитов в циркулирующей крови. Хотя у большинства видов они составляют 0,25% клеток костного мозга, их объем в 10 раз превышает объем обычных клеток костного мозга (Kuter et.al.,Proc. Natl. Acad. Sci. USA 91:11104-11108,(1994. Мегакариоциты претерпевают процесс,известный как эндомитоз, в ходе которого они воспроизводят свои ядра, но сами клетки не делятся, давая таким образом начало полиплоидным клеткам. В ответ на снижение числа тромбоцитов возрастает скорость эндомитоза, образуются высокоплоидные мегакариоциты, и их количество может возрастать в три раза (HarkerJ. Clin. Invest. 47:458-465, (1968. Напротив, в ответ на повышение числа тромбоцитов скорость эндомитоза снижается, образуются низкоплоидные мегакариоциты, и их количество может снижаться на 50%. Точный физиологический механизм обратной связи, посредством которого масса циркулирующих тромбоцитов регулирует скорость эндомитоза и количество мегакариоцитов костного мозга, не известен. Сейчас считается, что циркулирующим тромбопоэтическим фактором,вовлеченным в опосредование этого витка обратной связи, является тромбопоэтин (ТРО). Конкретнее, было показано, что ТРО является главным гуморальным регулятором в случаях, включающих в себя тромбоцитопению(Metcalf, Nature 359:519-520, (1994. В нескольких исследованиях было показано, что ТРО увеличивает количество тромбоцитов, увеличивает их размер и усиливает включение изотопов в тромбоциты реципиентных животных. Конкретнее, считается, что ТРО оказывает воздействие на мегакариоцитопоэз несколькими путями: (1) он вызывает увеличение размеров мегакариоцитов и их количества; (2) он вызывает увеличение содержания ДНК, в форме полиплоидии, в мегакариоцитах; (3) он усиливает эндомитоз мегакариоцитов;(4) он вызывает усиленное созревание мегакариоцитов; и (5) он вызывает увеличение 2 процентного содержания клеток-предшественников, в форме маленьких ацетилхолинэстеразаположительных клеток, в костном мозге. Так как кровяные пластинки (тромбоциты) необходимы для свертывания крови, и, когда их число очень мало, у пациента существует серьезный риск смерти от катастрофического кровоизлияния, ТРО может применяться как в диагностических целях, так и для лечения различных гематологических заболеваний, например заболеваний, изначально связанных с дефектами тромбоцитов. Текущие клинические испытания с ТРО показали, что применение ТРО безвредно для пациентов. Кроме того, недавние исследования создали основу для эффективного использования ТРО терапии при лечении тромбоцитопении, в частности, тромбоцитопении, возникшей в результате химиотерапии, лучевой терапии или пересадки костного мозга, применяемых для лечения рака или лимфомы (McDonaldSci. USA 91:11104-11108 (1994); Barley et al.,Cell 77:1117-1124 (1994); Kaushansky et. al., Nature 369:568-571 (1994); Wendling et al., Nature 369:571-574 (1994); Sauvage et.al., Nature 369:533-538 (1994. Тромбопоэтин является гликопротеидом и имеет, по меньшей мере, две формы с приблизительными молекулярными массами, равными 25 кД и 31 кД, с общей Nтерминальной аминокислотной последовательностью (Bartley et al., Cell 77:1117-1124 (1994. Оказалось, что тромбопоэтин имеет два отдельных района, разделенных потенциальным ArgArg сайтом расщепления. Аминотерминальный район у человека и мыши высококонсервативен и имеет некоторую гомологию с эритропоэтином и интерфероном-а и интерфероном-b. Карбокситерминальный район показывает широкую видовую дивергенцию. Известны последовательности ДНК и кодируемые пептидные последовательности для человеческого TPO-R (известен также как сmpl) (Vigon et.al., Proc. Natl. Acad. Sci. USA 89:5640-5644 (1992. TPO-R является членом семейства рецепторов гематопоэтиновых ростовых факторов, это семейство характеризуется общей структурной особенностью внеклеточного домена, включая четыре консервативных С остатка в N-терминальной части и WSXWS мотив, близкий к трансмембранному району (Bazan Proc. Natl. Acad. Sci. USA 87:6934-6938(1990. Доказательством того, что этот рецептор играет функциональную роль в гематопоэзе,служит наблюдение того, что его экспрессия ограничена селезенкой, костным мозгом и печенью эмбрионов у мышей (Souyri et.al., Cell 63:1137-1147 (1990, и мегакариоцитами, тромбоцитами и CD34+ клетками у человека (Methiaet. al., Blood 82:1395-1401 (1993. Более того, 3 обработка CD34+ клеток синтетическими олигонуклеотидами, антисмысловыми по отношению к mpl РНК, значительно ингибирует появление колоний мегакариоцитов, не влияя на образование эритроидных или миелоидных колоний. Некоторые работы постулируют, что рецептор функционирует как гомодимер, подобно рецепторам для G-CSF и эритропоэтина. Наличие клонированных TPO-R генов облегчает поиск агонистов этого важного рецептора. Наличие рекомбинантного рецепторного белка позволяет изучить взаимодействие рецептор-лиганд на множестве произвольных и полупроизвольных систем генерации пептидного разнообразия. Такие системы включают в себя известную систему пептиды на плазмидах(патенты США 5,270,170 и 5,338,665), известную систему пептиды на фагах (заявка на патент США 07/718,577, поданная 20 июня 1991 г, и заявка на патент США 07/541,108,поданная 20 июня 1990 года; Cwirla et.al., Proc.Natl. Acad. Sci. USA 87:6378-6382 (1990; полисомную систему (заявка на патент США 08/300,262, поданная 2 сентября 1994 года, которая является частично продолжающей заявкой, основанной на заявке на патент США N 08/144, 775, поданной 29 октября 1993 года, и РСТ WO 95/11992); систему кодируемая синтетическая библиотека (заявка на патент США 08/146886, поданная 12 ноября 1993 года,07/946239, поданная 16 сентября 1992 года, и 07/762522, поданная 18 сентября 1991 года); систему очень крупномасштабный синтез иммобилизованных полимеров (патент США 5143854; публикации патента РСТ 90/15070,опубликованная 13 декабря 1990 года; заявка на патент США 07/624120, поданная 6 декабря 1990 года; Fodor et al., Science 251:767-773(2/1991); DowerFodor Ann. Rep. Med. Chem. 26:271-180 (1991); заявка на патент США 07/805727, поданная 6 декабря 1991 года); каждая из следующих заявок на патенты или публикаций включена здесь ссылкой. Медленное восстановление уровней тромбоцитов у пациентов, страдающих тромбоцитопенией, является серьезной проблемой и требует срочного поиска агониста кровяного фактора роста, способного ускорить регенерацию тромбоцитов. Согласно данному изобретению предложен такой агонист. Сущность изобретения Данное изобретение относится, в частности, к новому неожиданному открытию того,что определенные пептиды и пептидомиметики с низкой молекулярной массой обладают сильными свойствами связывания с TPO-R и могут активировать его. Соответственно, такие пептиды и пептидомиметики пригодны для использования в терапевтических целях для лечения состояний, опосредованных ТРО (например,тромбоцитопении, вызванной химиотерапией,лучевой терапией или пересадкой костного моз 001220 4 га), а также для диагностических целей в изучении механизма гематопоэза и для размножения мегакариоцитов и коммитированных клетокпотомков in vitro. Таким "образом, согласно одному воплощению настоящего изобретения предложен пептид или пептидомиметик, который связывается с рецептором тромбопоэтина и активирует его,имеющий молекулярную массу менее примерно 8000 Дальтон, аффинность связывания с рецептором тромбопоэтина, которая соответствует значению IC50, равному не более примерно 100 мкМ, и содержащий следующую последовательность аминокислот:X1X2X3X4X5X6X7 где X1 представляет собой С, L, M, P, Q или V; Х 2 представляет собой F, К, L, N, Q, R, S, Т или V; Х 3 представляет собой С, F, I, L, M, R, S, V или W; Х 4 представляет собой любую из 20 основных L-аминокислот;X5 представляет собой A, D, Е, G, К, M, Q,R, S, Т, V или Y; Х 6 представляет собой С, F, G, L, M, S, V,W или Y; и Х 7 представляет собой С, G, I, К, L,M, N, R или V. Предпочтительно, указанный пептид или пептидомиметик имеет циклическую структуру. Предпочтительно, указанный пептид или пептидомиметик имеет форму димера. Предпочтительно, Х 4 представляет собой А, Е, G, Н, К, L, M, P, Q, R, S, Т или W. Более предпочтительно, Х 2 представляет собой S или Т; Х 3 представляет собой L или R;D, Е или G; Х 6 представляет собой F, L или W; и Х 7 представляет собой I, К, L, R или V. Предпочтительно, согласно данному воплощению настоящего изобретения предложен пептид или пептидомиметик, содержащий следующую последовательность аминокислот: СХ 2 Х 3X4X5 Х 6 Х 7 где Х 2 представляет собой К, L, N, Q, R, S, Т илиX4 представляет собой любую из 20 основных L-аминокислот;Y; Х 6 представляет собой С, F, G, L, M, S, V,W или Y; и Х 7 представляет собой С, G, I, К, L, M, N,R или V. Более предпочтительный пептид или пептидомиметик содержит следующую последовательность аминокислот: 5 Х 3 представляет собой С, F, I, L, М, R, S, V или W; Х 4 представляет собой любую из 20 основных L-аминокислот,X5 представляет собой A, D, Е, G, К, М, Q,R, S, Т, V или Y; Х 6 представляет собой С, F, G, L, М, S, V,W или Y; Х 7 представляет собой С, G, I, К, L, М, N,R или V; и Х 8 представляет собой любую из 20 основных L-аминокислот. В частности, Х 8 предпочтительно представляет собой G, S, Y или R. Наиболее предпочтительным в данном воплощении является пептид или пептидомиметик, содержащий следующую последовательность аминокислот:GGCTLREWLHGGFCGG. В другом воплощении настоящего изобретения предложен пептид или пептидомиметик,содержащий следующую последовательность аминокислот:X5 представляет собой А, Е, G, К, М, Q, R,S или Т; Х 7 представляет собой С, I, К, L, М или V; и Х 8 представляет собой любую из 20 основных L-аминокислот. В частности, предпочтительным является пептид или пептидомиметик, отличающийся тем, что X1 представляет собой Р; Х 2 представляет собой Т; Х 3 представляет собой L; Х 4 представляет собой R; Х 5 представляет собой Е или Q; Х 7 представляет собой I или L. Более предпочтительным является пептид или пептидомиметик, содержащий следующую последовательность аминокислот:X9X8GX1X2X3X4X5WX7 где Х 8 представляет собой А, С, D; Е, К, L, Q,R, S, Т или V; и Х 9 представляет собой А, С, Е, G, I, L, М,Р, R, Q, S, Т или V; Еще более предпочтительно, X8 представляет собой D, Е или К; и Х 9 представляет собой А или I. Наиболее предпочтительным в данном воплощении изобретения является пептид или пептидомиметик, содержащий следующую последовательность аминокислот: Согласно еще одному воплощению настоящего изобретения предложен пептид или пептидомиметик, который связывается с рецептором тромбопоэтина и активирует его, имеющий следующую структуру: Согласно еще одному воплощению настоящего изобретения, предложен пептид или пептидомиметик, который связывается с рецептором тромбопоэтина и активирует его, имеющий следующую структуру: Описанные здесь соединения пригодны для предотвращения и лечения заболеваний,регулируемых ТРО. Таким образом, согласно настоящему изобретению предложена фармацевтическая композиция, содержащая пептид или пептидомиметик, такой как описано выше, и фармацевтически приемлемый носитель. Фармацевтические композиции по изобретению могут иметь множество различных форм,включая формы для перорального применения,порошки и растворы для ингаляций, и растворы для инъекций и вливаний. Согласно настоящему изобретению предложен также способ лечения заболевания, опосредованного рецепторами тромбопоэтина, заключающийся в том, что пациенту вводят терапевтически эффективное количество пептида или пептидомиметика, такого как описано выше. В частности, заболевание, опосредованное рецепторами тромбопоэтина, представляет собой гематологическое заболевание и тромбоцитопению, развившиеся в результате химиотерапии, радиационной терапии или пересадки костного мозга. Краткое описание графических материалов Фиг.1 А-В иллюстрирует результаты функционального анализа в присутствии различных пептидов; этот анализ описан в примере 2. 7 Фиг.1 А является графическим отображением результатов анализа пролиферации TPO-R трансфецированных Ba/F3 клеток для выбранных пептидов по изобретению:LAIEGPTLRQWLHGNGRDT; О - обозначает результаты для GTIKGPTLRQWLKSREHTS. Фиг. 1 В является графическим отображением результатов анализа с теми же пептидами и родительской клеточной линией. Фиг. 2 А-С представляет результаты олигомеризации пептидов с использованием анализа пролиферации TPO-R трансфецированныхBa/F3 клеток. Фиг. 2 А представляет результаты анализа сложных биотинилированных пептидов (AF 12285 со стрептавидином (SA как на трансфецированных, так и на родительских клеточных линиях. Фиг.2 В представляет результаты анализа свободного биотинилированного пептида (AF 12285) как на трансфецированных, так и на родительских клеточных линиях. Фиг. 2 С представляет результаты анализа отдельно для стрептавидина как на трансфецированных, так и на родительских клеточных линиях. Фиг. 3A-G представляет результаты серии контрольных экспериментов, демонстрирующих активность ТРО, пептидов данного изобретения,ЕРО, EPO-R связывающих пептидов в анализе пролифелирации клеток с использованием либоTPO-R трансфецированной Ba/F3 клеточной линии и ее соответствующей родительской линии, либо ЕРО зависимой клеточной линии. Фиг. 3 А отображает результаты для активности ТРО в анализе пролиферации клеток с использованием TPO-R трансфецированнойBa/F3 клеточной линии и соответствующей родительской линии. Фиг. 3 В отображает результаты активности ЕРО в анализе пролиферации клеток с использованием TPO-R трансфецированной Ba/F3 клеточной линии и соответствующей родительской линии. Фиг. 3 С отображает результаты для биотинилированного пептида в виде комплекса (AF 12285 со стрептавидином (SA и комплексной формы биотинилированного EPO-R связывающего пептида (AF 11505 с SA) на TPO-R трансфецированнойBa/F3 клеточной линии. Результаты для соответствующих родительских линий показаны на Фиг. 3D. Фиг. 3 Е отображает результаты для ТРО в анализе пролиферации клеток с использованием ЕРО-зависимой клеточной линии. Фиг. 3F отображает результаты для ЕРО в анализе пролиферации клеток с использованием 8 ЕРО-зависимой клеточной линии. Фиг. 3G отображает результаты для биотинилированного пептида в форме комплекса (AF 12285 со стрептавидином (SA и комплексной формы биотинилированного EPO-R связывающего пептида(AF 11505 с SA) на ЕРО- зависимой клеточной линии. Фиг. 4 А-С иллюстрирует конструкцию библиотеки пептидов на плазмидах, составленную с использованием вектора pJS142. Фиг. 4 А показывает рестрикционную карту и позицию генов. Плазмида, использованная для создания библиотеки, включает терминатор транскрипции rrnВ, ген bla для селекции по ампицилину, внутригенный район фага М 13 (М 13IG) для получения однонитевой ДНК, район инициации репликации плазмиды (ori), две последовательности lасОs, ген аrаС для осуществления позитивной и негативной регуляции аrаВ промотора, регулирующего экспрессию слитого с lас гена. Фиг. 4 В представляет последовательность области клонирования на 3'-конце lacl гена, включая Sfil и Еаgl сайты, использованные при конструкции библиотеки. Фиг. 4 С показывает лигирование отожженных олигонуклеотидов библиотеки, ON-829 и ON-830, в Sfil сайтыpJS142 для создания библиотеки. Единичные пробелы в последовательности обозначают сайты лигирования. Фиг. 5 А-В иллюстрирует клонирование в рЕLM3 и pELM15 MBP векторах. Фиг. 5 А представляет последовательность 3' конца слитого malE гена, включая MBP последовательность, полиаспарагиновый линкер,фактор Ха сайта протеазной активности, и доступные сайты клонирования. Оставшаяся часть векторов взята из pMALc2 (pELM3) и pMALp2(pELM15), доступные в New England Biolabs. Фиг. 5 В представляет последовательность векторов после переноса BspEll - Scal фрагмента библиотеки в Agel-Scal-расщепленную pELM3/pELM15. Перенесенная последовательность включает последовательность, кодирующуюGGG пептидный линкер из pJS142 библиотеки. Фиг. 6 А отображает рестрикционную карту и позицию генов для конструирования в векторе pCMG14 библиотек димеров головных частей. Плазмида, использованная для создания библиотеки, включает терминатор транскрипции rrnВ, ген blа для селекции по ампицилину,внутригенную область фага М 13 (М 13 IG) для получения однонитевой ДНК, район инициации репликации плазмиды (ori), одну последовательность lacOs, и ген аrаС для осуществления позитивной и негативной регуляции аrаВ промотора, регулирующего экспрессию слитого гeна димера головной части. Фиг. 6 В отображает последовательность области клонирования на 3' конце гена димера головной части, включаяSfil и Eagl сайты, использованные при конструировании библиотеки. Фиг. 6 С представляет лигирование отожженных ON-1679, ON-829 иON-830 в Sfil сайты pCMG14 для создания библиотеки. Единичные пробелы в последовательности обозначают сайты лигирования. Фиг. 7-9 представляют результаты дальнейших анализов оценки активности пептидов и пептидомиметиков изобретения. В этом анализе у мышей карбоплатиной вызывается тромбоцитопения. Фиг. 7 отображает типичные результаты после обработки Balb/C мышей карбоплатиной (125 мг/кг внутрибрюшинно) в 0 день. Пунктирная линия обозначает необработанных в трех экспериментах. Непрерывная линия обозначает группы, обработанные карбоплатиной, в трех экспериментах. Жирная линия представляет предшествующие данные. Фиг. 8 отображает эффект титрования карбоплатины на количество тромбоцитов у мышей, обработанных указанным количеством карбоплатины (в мг/кг внутрибрюшинно (ip) в 0 день). Рисунок 9 отображает метиорацию тромбоцитопении, индуцированной введением карбоплатины, на 10 день при использовании пептида AF12513 (513). Карбоплатина (СВР 50-125 мг/кг, внутрибрюшинно) вводилась в 0 день. AF12513 (1 мг/кг, ip) вводился в 1-9 день. Описание конкретных воплощений 1. Определение и главные параметры. Следующие определения приведены для иллюстрации и пояснения значения различных терминов, используемых здесь для описания изобретения. Агонист относится к биологически активным лигандам, которые связывают комплементарные им биологически активные рецепторы и активируют их, чтобы вызвать биологический ответ рецептора или усилить его уже существующую активность. Фармацевтически приемлемые соли относятся к нетоксичным щелочным металлам,щелочно-земельным металлам, и солям аммония, обычно используемым в фармацевтической индустрии, включая натрий, калий, литий, кальций, магний, барий, аммоний, и протаминовые цинковые соли, получаемые хорошо известными в данной области методами. Этот термин также включает нетоксичные соли, получаемые взаимодействием соединений данного изобретения с подходящими органическими или неорганическими кислотами. Представители таких солей включают гидрохлориды, гидробромиды,сульфаты, бисульфаты, ацетаты, оксалаты, валераты, олеаты, лаураты, бораты, бензоаты, лактаты, фосфаты, тосилаты, цитраты, малеаты,фумараты, сукцинаты, тартраты, напсилаты, и подобные им. Фармацевтически приемлемые соли, полученные присоединением кислот относятся к тем солям, которые имеют биологическую эффективность и свойства свободных оснований, и которые не являются нежелательными с точки зрения, в частности, биологии, образованные с неорганическими кислотами, такими как хлори 001220 10 стоводородная, бромистоводородная, серная,азотная, фосфорная и подобные им, и органических кислот, таких как уксусная, пропионовая,гликолевая, пировиноградная, щавелевая, яблочная, малоновая, янтарная, малеиновая, фумаровая, винная, лимонная, бензойная, коричная, миндальная, метаносульфоновая, этаносульфоновая, р-толуолсульфоновая, салициловая и подобные им. Для описания фармацевтически приемлемых солей, полученных присоединениeм кислот, в качестве пролекарств смотри Bundgaard, H (выше). Фармацевтически приемлемые эфиры относятся к тем эфирам, которые после гидролиза эфирной связи сохраняют биологическую эффективность и свойства карбоновой кислоты или спирта, и которые не являются нежелательными с точки зрения, в частности, биологии. Для описания фармацевтически приемлемых эфиров в качестве пролекарств смотри Bundgaard, H., ed., Design of Prodrugs, Elsevier SciencePublishers, Amsterdam (1985). Эти эфиры обычно образуются из соответствующих карбоновых кислот и спиртов. В основном образование эфиров может происходить согласно традиционным методикам синтеза (смотри, например, MarchYork (1980). Спиртовой компонент эфира будет главным образом содержать (1) С 2-С 12 алифатический спирт, который может содержать (или нет) одну или более двойную связь и разветвленные углеводороды или (2) С 7-С 12 ароматические или гетероароматические спирты. Данное изобретение рассматривает использование таких композиций, которые являются эфирами,как здесь описано, и в то же время являются их фармацевтически приемлемыми, полученными присоединением кислот. Фармацевтически приемлемые амиды относяся к тем амидам, которые после гидролиза амидной связи сохраняют биологическую эффективность и свойства карбоновой кислоты или амина, и которые не являются нежелательными с точки зрения, в частности, биологии. Для описания фармацевтически приемлемых амидов в качестве пролекарств смотри Bundgaard, H., ed., Design of Prodrugs, Elsevier SciencePublishers, Amsterdam (1985). Эти амиды обычно образуются из соответствующей карбоновой кислоты и амина. В основном получение амидов можно осуществить с помощью традиционных методик (смотри, например, March AdvancedSons, New York (1980). Данное изобретение рассматривает также применение композиций, которые являются амидами, как здесь описано, и в 11 то же время их фармацевтически приемлемыми солями, полученными присоединением кислот. Фармацевтически или терапевтически приемлемый носитель относится к среденосителю, которая не влияет на эффективность и биологическую активность активных ингредиентов и не является токсичной по отношению к организму или пациенту. Стереоизомер относится к химическому соединению, имеющему такой же молекулярный вес, химический состав и структуру, как и другое соединение, но сгруппированными по другому атомами. Это обозначает, что определенные идентичные химические структуры находятся в различной пространственной ориентации и в чистом виде могут вращать плоскость поляризации света. Однако некоторые чистые стереоизомеры имеют настолько малую оптическую ротацию, что е невозможно определить современным оборудованием. Соединения данного изобретения могут иметь один или более асимметричный углеводородный атом и, тем самым, представлять разные стереоизомеры. Все стереоизомеры включены в рамки изобретения. Терапевтически или фармацевтически эффективное количество в применении к соединениям данного изобретения относится к количеству соединения, достаточного для получения желаемого биологического результата. Этим результатом может быть мелиорация(уменьшение) признаков, симптомов, или причин заболевания, или любое другое желаемое изменение биологической системы. В данном изобретении результат подразумевает снижение в иммунологическом и/или воспалительном ответах на инфекцию или тканевое повреждение. Аминокислотные остатки в пептидах имеют следующие сокращения: Фенилаланин - Phe или F; Лейцин Leu или L; Изолейцин IIе или I; Метионин Met или М; Валин Val или V; СеринW; Аргенин Аrg или R; Глицин Gly или G. Вдобавок Bu -бутокси, Bzl - бензил, СНА - циклогексиламин, Ac - ацетил, Me - метил, Pen - пенициламин, Aib - аминоизомасляная кислота,Nva - норвалин, Abu -аминомасляная кислота,Thi - тинилаланин, Obn - O-бензил, hyp гидроксипролин. В добавление, кроме пептидов, состоящих только из встречающихся в природе аминокислот, приводятся также пептидомиметики или аналоги пептидов. Аналоги пептидов широко используются в фармацевтической индустрии,как непептидные лекарства, имеющие свойства,аналогичные тем, которые имеет матричный пептид. Типы непептидных соединений опреде 001220 12 ляются как пептидные миметики или пептидомимметики (Faucher, J., Adv. Drug Res. 15:29Evans et.al., J. Med. Chem. 30:1229 (1987), которые подкреплены ссылками). Пептидные миметики, похожие структурно на терапевтически применимые пептиды, могут быть использованы для достижения эквивалентного или усиленного терапевтического или профилактического эффекта. В основном, пептидомиметики структурно подобны полипептидам, имеющим биологическую или фармакологическую активность,таким как встречающиеся в природе рецепторсвязывающие полипептиды, но имеют одну или более пептидную связь, замененную на группы:(-СН 2-S-); (включены сюда только в виде ссылки). В частности, предпочтительна непептидная связь -СН 2NН-. Такие пептидомиметики могут иметь значительное преимущество над полипептидными конструкциями, включая, например, более экономичное производство, большую химическую стабильность, улучшенные фармакологические свойства (время полужизни, абсорбцию, потенциал, эффективность и т.д.), измененную специфичность (например, расширенный спектр биологической активности),сниженную антигенность и т.д. Мечение пептидомиметиков обычно проводится путем ковалентного введения одной или более метки напрямую или через спейсер (например, амидную группу) в нейтральную позицию, которая предсказывается данными количественного структура-активность анализа и/или молекулярного моделирования. Такие нейтральные позиции, в основном это позиции, не имеющие прямого контакта с макромолекулами (например с молекулами семейства иммуноглобулинов), с которыми связываются пептидомиметики, оказывая терапевтический эффект. Образование производных от пептидомиметиков (например введение метки) не должно изменять ожидаемую биологическую или фармакологическую актив 13 ность пептидомиметика. Обычно пептидомиметики связывающихся с рецептором пептидов связываются с рецептором с высокой афинностью и обладают активностью, которую можно определить (то есть являются агонистами или антогонистами и вызывают одно или более чем одно фенотипическое изменение). Системная замена одной или более аминокислоты в консенсусной последовательности наD-аминокислоту такого же типа (например Dлизин заменяет L-лизин) может быть использовано для получения более стабильных пептидов. В добавление, напряженные пептиды, содержащие вариацию консенсусной последовательности или по существу идентичной ей консенсусной последовательности могут быть получены известными методами (RizoGierasch Ann.Rev. Biochem. 61:387 (1992, только ссылка),например путем добавления внутреннего остатка цистеина, способного образовывать внутримолекулярные дисульфидные мостики, преобразующие пептид в циклический. Синтетические или не встречающиеся в природе аминокислоты относятся к аминокислотам, которые не встречаются в природе invivo, но которые, тем не менее, могут быть встроены в описанные здесь пептидные структуры. Предпочтительные синтетические аминокислоты - D-a-аминокислоты природных L-aаминокислот, также как не встречающиеся в природе D- и L- аминокислоты, представленные формулой H2NCHR5COOH, где R5 1) низший алкил, 2) циклоалкил с 3-7 атомами углерода, 3) гетероцикл с 3-7 атомами улерода и 1-2 гетероатомами, выбранными из группы, состоящей из кислорода, серы и азота, 4) ароматический остаток от 6 до 10 атомов углерода, возможно имеющий от 1 до 3 заместителей на ароматическом ядре, выбранных из группы содержащей гидроксил, низший алкоксил, аминогруппу или карбоксил, 5) -алкилен-Y, где алкилен - это алкиленовая группа, содержащая от 1 до 7 атомов углерода, и Y выбран из группы, содержащей(а) гидроксигруппу, (б) аминогруппу, (в) циклоалкил и циклоалкинил с 3 - 7 атомами углерода,(г) арил с 6-10 атомами углерода, возможно имеющий от 1 до 3 заместителей на ароматическом ядре, выбранных из группы, состоящей из гидроксила, низшего алкоксила, амино или карбоксила, (д) гетероциклическую группу с 3-7 атомами углерода и 1-2 гетероатомами, выбранными из группы, включающей в себя кислород,серу, азот, (е) -C(O)R2, где R2 выбран из группы,содержащей водород, гидроксил, низший алкил,низший алкоксил, и NR3R4, где R3 и R4 выбраны независимо из группы, содержащей водород и низший алкил, (ж) -S(O)nR6 , где n = 1,2 и R6 низший алкил, имея в виду, что R5 не обозначает боковую цепь из природных аминокислот. Остальные предпочтительные синтетические аминокислоты включают такие, где аминогруппа отделена от карбоксильной более, чем 14 одним атомом углерода, такие как b-аланин, gаминомасляная кислота и подобные. В частности предпочтительные синтетические аминокислоты включают, в качестве примера, D- аминокислоты природных L- аминокислот, L-1-нафтил-аланин, L-2-нафтилаланин,L-циклогексилаланин, L-2-амино изомасляная кислота, сульфоксидные и cульфоновые производные метионина(например,HOOC(H2NCH)CH2CH2-S(O)nR6), где n и R6 определены выше, также как низшие алкоксильные производные метионина (например, НООС(H2NCH)CH2CH2-OR6), где R6 oпределен выше. Метка, которую можно обнаружить относится к материалам, ковалентно связывающимся с пептидами и пептидомиметиками данного изобретения и позволяющими обнаружить пептид или пептидомиметик in vivo у пациента,который принимал данный пептид или пептидомиметик. Подходящие детектируемые метки хорошо известны и включают, например, радиоизотопы, флюоресцентные метки (например флюоресцин), и подобные им. Выбор конкретной метки не является существенным и производится с учетом, как количества необходимой метки, так и ее токсичности в таком количестве. Подбор метки относится к хорошо известным в данной области вещам. Ковалентное присоединение детектируемой метки к пептиду или пептидомиметику производится хорошо известными традиционными способами. Например, когда в качестве метки присоединяется радиоизотоп 125I, ковалентное связывание 125I с пептидом или пептидомиметиком можно осуществить путем встраивания тирозина в пептид или пептидомиметик и дальнейшего иодирования. Если тирозин не присутствует в данном пептиде или пептидомиметике, то встраивание тирозина по N или С концу можно осуществить хорошо известными в химии способами. Подобно этому, в пептид или пептидомиметик может быть встроен 32P в качестве фосфатной группы пептида или пептидомиметика вместо гидроксильной,используя способы обычной химии. 2. Общий обзор. Данное изобретение представляет соединения, связывающиеся и активирующие TPO-R или, другими словами, ведущие себя как ТРО агонисты. Такие соединения включают ведущие пептидные соединения и производные соединения, сконструированные таким образом,что они имеют такую же или подобную структуру и форму, как и ведущие соединения, но отличающиеся от них либо чувствительностью к гидролизу или протеолизу и/или другими биологическими свойствами, такими как повышенная афинность к рецептору. Данное изобретение представляет также композиции, включающие эффективное количество ТРО агониста, а конкретнее, соединение, пригодное для лечения гематологических расстройств, в частности 15 тромбоцитопении, ассоциированной с химиотерапией, радиационной терапией, или пересадкой костного мозга. 3. Идентификация ТРО агонистов. Пептиды, имеющие афинность связывания к TPO-R, могут быть легко обнаружены с помощью системы случайной генерации пептидного разнообразия, сопровождающейся процессом усиления афинности. Конкретнее, системы случайного производства пептидов включают пептиды на плазмидах, описанные в патенте 5,270,170 и 5,338, 665, США; пептиды на фаге, описанные в заявке на патент 07/718,577 от 20 июня,1991, которая является частичным продолжением заявки на патент 07/541,108 от 20 июня,1990, и Cwirla et.al., Proc. Natl. Acad. Sci. USA 87:6378-6382 (1980); полисомные системы,описанные в заявке на патент 08/300, 262 США от 2 сентября, 1994, которая является частичным продолжением заявки на патент 08/144,775 от 29 октября, 1993 и РСТ WO 95/11992; кодирующие синтетические библиотеки (ESL), описанные в заявке на патент 08/146,886 от 12 ноября 1993, которая является частичным продолжением заявки на патент 07/946,239 от 16 сентября, 1992, которая является продолжением заявки на патент 07/762,522 от 18 сентября 1991; и систему синтез иммобилизованных полимеров большого размера,описанную в патенте 5,143,854, США; РСТ публикации патента 90/15070, опубликованной 13 декабря, 1990; заявке на патент 07/624,120, США от 6 декабря, 1990; Fodor et.Ann.Rep.Med.Chem. 26:271-180 (1991); и заявке на патент N 805,727 от 6 декабря, 1991. Используя описанные выше методы, случайные пептиды создают таким образом, что они имеют определенное количество аминокислотных остатков (пример 12). Для получения набора олигонуклеотидов, кодирующих случайные пептиды, был использован мотив кодона(в эквимолярных количествах; в зависимости от методики могут быть использованы другие нуклеотиды), К - это G или Т (в эквимолярных количествах) и х - это целое число, отвечающее количеству аминокислот в пептиде (пример 12) для того, чтобы получить один из 32 возможных кодонов, образующихся из NNK мотива: 1 кодон для каждой из 12 аминокислот, 2 кодона для каждой из 5 аминокислот, 3 для каждой из 3 аминокислот, и один из трех стоп кодонов. Таким образом NNK мотив кодирует все аминокислоты, только один стоп кодон и снижает разброс кодонов. В используемых системах случайный пептид представлен либо на поверхности фага, в качестве части слитого белка, включающего pIII или pVIII белки оболочки fd производного фага(пептиды на фаге) или как часть слитого Lacl 16 белка, связанного с плазмидой (белки на плазмидах). Фаги или плазмиды, несущие ДНК, кодирующую пептиды, индентифицируются и выделяются с помощью процесса определения афинности, используя иммобилизованный TPO-R. Определение афинности, иногда называемоеpanning, включает несколько циклов инкубации фагов, плазмид или полисом с иммобилизованным рецептором, собирающим фаги, плазмиды или полисомы, связывающиеся с рецептором (вместе с ДНК и мРНК), и продуцирующие еще большее количество прикрепленного фага или плазмиды (вместе со слитым Lacl белком). Во время процедуры обычно используется внеклеточный домен (ECD) TPO-R. После нескольких циклов процесса, фаги или плазмиды и связанные пептиды анализируются методом ELISA для определения специфичности связывания с TPO-R. Этот анализ выполняется подобно способам, используемым в процессе определения афинности, за исключением того, что после удаления несвязанных фагов, лунки обычно обрабатывается противофаговыми антителами кролика, затем щелочной фосфотазой (АР), смешанной с антителами козла, действующими против кроличьих антител. Количество щелочной фосфотазы на лунку определяется стандартными методами. Подобная методу ELISA процедура для пептидов на плазмидах подробно описывается ниже. Путем сравнения тестируемых лунок с контрольными (нет рецептора) можно определить специфичность связывания слитого белка с рецептором. Фракция фагов, показавших связывание с TPO-R, скринируется на колониях, несущих пробы, с использованием радиоактивно меченного моновалентного рецептора. Такая проба может быть получена с использованием протеин киназы А путем фосфорилирования последовательности, слитой с С-концом растворимого рецептора. Сконструированная форма ТРО рецептора экспрессируется в рацепиентных клетках, обычно в СНО клетках. После результатов PI-PLC, рецептор тестируется на связывание с ТРО или TPO-R специфичными фаговыми клонами. Далее в рецептор вводиться метка 33P для использования его в качестве моновалентной пробы для идентификации лигандов с высокой афинностью, с использованием колоний,несущих пробы. Пептиды, показывающие специфическое связывание с рецептором, синтезируются затем в чистом виде (например без фага) и тестируются в анализах по блокированию. Анализы по блокированию выполняются похоже на ELISA,за исключением того, что ТРО или упомянутый пептид добавляется к лункам до слитого пептида (контрольные лунки двух типов: (1) без рецептора и (2) без ТРО или упомянутого пептида). Слитые белки, для которых связывание с рецептором, блокируется ТРО или упомянутым 17 пептидом, содержат порцию случайных пептидов, наиболее предпочтительную в качестве соединений изобретения.TPO-R, также как его внеклеточный домен продуцируется в рекомбинантных реципиентных клетках. Одна подходящая форма TPO-R конструируется путем экспресcии белка, как растворимого, в трансформированных бацилловирусом рацепиентных клетках, используя стандартные методики; другая подходящая форма конструируется с сигнальным пептидом для секреции белка и его присоединения к гликофосфолипидной мембране, с помощью якоря. Такая форма якорного присоединения называется PIG-tailing. Смотри CarasWendell Science 243:1196-1198 (1989) и Lin et. at., Science 249:677-679 (1990). Используя PIG-tailing систему можно отрезать рецептор от поверхности клеток, где он экспрессируется (например, трансформированные СНО клетки, отобранные по высокому уровню экспрессии) с помощью фосфолипазы С. Отрезанный рецептор все еще имеет терминальную последовательность аминокислот, так называемый НРАР хвост от сигнального пептида, использованный для прикрепления к мембране, и может быть иммобилизован без дальнейшей очистки. Рекомбинантный белок рецептора может быть иммобилизован путем покрытия лунок плашки антителами к НРАР хвосту(Аb 179 или МАb 179), блокируя неспецифическое связывание с бычьим сывороточным альбумином (BSA) в PBS и, затем присоединяя отрезанный рекомбинантный рецептор к антителу. Используя эту процедуру, следует выполнять реакцию иммобилизации, используя различные концентрации рецептора, для определения оптимального количества для данного образца, так как различные образцы рекомбинантного белка часто содержат различное количество желаемого пептида. В добавление следует удостовериться, что иммобилизованные антитела полностью блокированы (при помощи ТРО или другого блокирующего соединения) в процессе определения афинности. В противном случае не блокированные антитела могут связывать нежелательные фаги в процессе определения афинности. Можно использовать пептиды, связывающиеся с иммобилизованными антителами, для блокирования сайтов, остающихся после иммобилизации рецептора, для того, чтобы избежать эту проблему, или можно иммобилизовать рецептор прямо в лунках плашек, без помощи иммобилизованных антител. Смотри заявку на патент 07/947,339 от 18 сентября 1992, подкрепленную ссылками. Используя систему производства случайных пептидов, пригодную для мультивалентного связывания лигандрецептор, нужно понимать, что плотность иммобилизованного рецептора - это важный фактор для определения афинности лигандов, связывающихся с иммоби 001220 18 лизованным рецептором. При высокой плотности рецептора (например, каждое антитело рецептора обрабатывается 0,25 - 0,5 мг рецептора), более вероятно мультивалентное связывание, чем при низкой плотности (например, каждое антитело к рецептору обрабатывается 0,51 нг рецептора). Если происходит мультивалентное связывание, предпочтительнее изолировать лиганды с низкой афинностью, и использовать высокую плотность иммобилизованного рецептора для поиска ведущего соединения и низкую плотность рецептора для выделения производных соединений с высокой афинностью. Для поиска различий между пептидами с высокой афинностью часто используют моновалентную пробу рецептора. Такая проба может быть получена с помощью протеин киназы А путем фосфорилирования последовательности,слитой с С-концом растворимого рецептора. Сконструированная форма ТРО рецептора экспрессируется в рацепиентных клетках, обычно в СНО клетках. После результатов PI-PLC,рецептор тестируется на связывание с ТРО илиTPO-R специфичными фаговыми клонами. Далее в рецептор вводится метка 33P для использования его в качестве моновалентной пробы для идентификации лигандов с высокой афинностью, с использованием колоний, несущих пробы. Предпочтительные методы скрининга для поиска пептидов, связывающихся с TPO-R включают сначала индентификацию ведущих пептидов, которые связываются с внеклеточным доменом рецептора, и затем анализ других пептидов, имеющих сходство с ведущими. Конкретнее, случайная библиотека может быть скринирована на поиск фагов, несущих пептид,связывающийся с TPO-R, используя пептиды на фаге на основе pIII и pVIII. Фаговая ДНК сиквенируется для определения последовательности пептидов, расположенных на поверхности фагов. Клоны, способные специфично связываться с TPO-R, были идентифицированы из pVIII библиотеки случайных линейных 10-меров и изpVIII библиотеки случайных циклических 10-и 12-меров. Последовательности данных пептидов служат основой для конструкции других пептидных библиотек, содержащих с высокой плотностью производные от начально определенных пептидов. Данные библиотеки могут быть сконструированы таким образом, чтобы содержать пептиды, отличающиеся от связывающегося пептида, только несколькими остатками. Такой подход включает синтез олигонуклеотидов с последовательностью связывающегося пептида, за исключением использования в синтезе каждого из четырех нуклеотид трифосфатов (например, 55% правильного нуклеотида и 15% каждого из трех других - одна предпочтительная для данной цели смесь; и 70% правильного нуклеотида и 10% каждого из 19 трех других - другая предпочтительная смесь) так, чтобы получить производные от кодирующей последовательности связывающегося пептида. Было использовано множество подходов для получения производных ведущего пептида,включающих создание мутагенез по теме библиотек. Такие библиотеки на pVlll фагах основаны на последовательности с частотой мутагенеза 70:10:10:10 и заканчивающейся на терминирующем кодоне со случайными остатками так, что получаются клоны, которые кодируют последовательность ХХХХ (С, S, Р, или R)TLREWL XXXXXX (С или S). Подобные библиотеки были получены с использованием систем пептиды-на-плазмидах для получения клонов, кодирующих последовательность ХХХХХ(С, S, Р, или R) TLREWL ХХХХХХХ (С или S). В добавление, такие библиотеки, ХХХХ (С, S, Р,или R) TLREWL XXXXXX (С или S), были получены с использованием полисомных систем. Все три типа библиотек были скринированы на эллюцию пептида и опробированы на радиоактивно меченном моновалентном рецепторе. Для скрининга пептидов и изучения мутагенеза были также использована техника пептиды на плазмидах, подробно описанная в Патенте N 5,338,655, который подкреплен ссылками для всех назначений. Согласно этому подходу, случайный пептид сливается с С-концомLacl и экспрессируется на плазмидном векторе,несущем слитый ген. Связь Lacl-пептида с кодирующей ДНК осуществляется через lacO последовательности на плазмиде с образованием стабильного комплекса пептид-Lасl-плазмида,который может быть скринирован путем определения афинности (panning) на иммобилизованном рецепторе. Выделенные таким образом плазмиды могут быть в дальнейшем введены вE.coli методом электропарации с целью амплификации выбранной популяции для дополнительного скрининга или для изучения индивидуальных клонов. В добавление скрининг случайных пептидов и изучение мутагенеза выполняются с использованием системы модифицированного Сконца, в которой выделенная валентность уменьшена (система headpiece dimer). Библиотеки скринируются, и отобранные вставки ДНК клонируются в векторе, несущем мальтозу связывающий белок (МВР), и экспрессируются как С-конец слитого пептида. Грубые клеточные лизаты МВР из случайно выбранных клонов затем исследуются на связывание с TPO-R методом ELISA, как описано выше. Изучение мутагенеза пептидов проводится также с использованием полисомных систем,как описано в заявке на патент 08/300,262 США от 2 сентября 1994, которая является частичным продолжением заявки на патент 08/144,775 США от 29 октября 1993 и РСТ WO 95/11992, каждая из которых подкреплена ссыл 001220 20 ками. Библиотеки мутантных пептидов были получены, основываясь на последовательности ХХХХ (С, Р, R, или S) t l r e f l XXXXXX (С илиS), где Х обозначает случайный кодон NNK и прописные буквы обозначают кодоны аминокислот, имеющие в позиции 1 и 2 мутагенез 70:10:10:10 и К (G или Т) в позиции 3. Библиотеки затем скринируются в течение 5 раундов путем определения афинности к ТРО рецептору,иммобилизованному на магнитных бусах. После 5 раунда PCR амплифицированные ДНК клонируются в pAFF6 и ELISA позитивные клоны сиквенируются. Далее последовательности субклонируются в MBR вектор и их афинность связывания определяется методом MBR ELISA. При иммобилизации TPO-R для скрининга полисом, ab 179 сначала химически связывается с тосил активированными магнитными бусами(от Dynal Corporation), как описано производителями. Магнитные бусы затем инкубируются с антителами в 0,5 М боратном буфере (рН 9,5) в течение ночи при комнатной температуре. Далее бусы промываются и смешиваются с TPO-R,имеющим НРАР хвост. Антитела, покрывающие бусы и рецептор, инкубируются в течение часа при 4 С, и далее бусы промываются снова перед смешиванием с библиотекой на полисомах. Описанный выше скрининг различных библиотек позволил выделить пептиды, связывающиеся с ТРО рецептором, которые указаны ниже в таблице 1 и 2, а также и другие не приведенные здесь пептиды. Таблица 1 Пептиды Значения IC50 для некоторых добавочных пептидов приведены в таблице ниже. Для оценки значений IC50 может быть использовано множество методов. Например, равновесное связывание методом ELISA, с использованием либо МВР-ТРО лиганда либо лиганда laclпептид, было применено для определения, ингибируют ли пептиды связывание ТРО с внеклеточным доменом ТРО рецептора. Обычно, значения IC50 определяются с использованием свободных пептидов. Значение может быть опреде 23 лено с использованием свободных пептидов,которые могут быть аминированы с С-конца или получены в виде эстеров или других карбокси амидов. Для воспроизведения точной последовательности, представленной на фаге, N-концевым и С-концевым аминокислотам синтетических пептидов часто предшествуют один или два остатка глицина. Полагается, что эти глициновые остатки не являются необходимыми для связывания или активности пептида. Подобным образом, воспроизведения точной последовательности пептидов, представленных на полисомах, Сконцевым аминокислотам синтетических пептидов часто предшествует последовательностьM,A,S. Аналогично, полагается, что эта последовательность не является необходимой для связывания или активности пептида. Значения IC50 обозначаются символически,как -, +, и . Например, пептиды, показывающие значения IC50 до 200 М, обозначаются -. Пептиды, показывающие значенияIC50 близкие или равные 200M, обозначаются+, а те, которые имеют значения IC50 500 М и менее, обозначаются . Пептиды, показывающие значения IC50 около определенной отрезной точки, обозначаются смешанными символами, например, +/-. Пептиды, у которых значения IC50 не были определены, приводятся в списке как N.D. Значение IC50 для пептидов,имеющих структуру: GGCTLREWLHGGFCGG,было 500 М или ниже. (Заметим, что Nконцевым и С-концевым аминокислотам предшествовало два глицина для воссоздания точной последовательности, представленной на фаге. Полагается, что эти глицины не являются необходимыми для связывания или активности пептида). Таблица 3 Таблицы выше, особенно таблица 3, иллюстрируют основные пептиды с предпочтительной последовательностью аминокислот:X4 - любая из генетически кодируемых аминокислот; Х 5 -A, D, E, G, K, M, Q, R, S, T, V или Y; 24 Более предпочтительная основа пептида состоит из следующей аминокислотной последовательности: Х 8GХ 1 Х 2 Х 3 Х 4 Х 5WХ 7 где X1 - L, M, P, Q или V; Х 2 - F, R, S или Т; Х 3 - F, L, V или W;X5 - A, E, G, K, M, Q, R, S или Т; Х 7 - C, I, K, L, M, или V,X8 -выбран независимо из 20 любых Lаминокислот, кодируемых генетически, их стереоизомеров D-аминокислот и не встречающиеся в природе аминокислот. Предпочтительно, X8 выбран независимо из 20 любых L-аминокислот, кодируемых генетически или их стереоизомеров D-аминокислот. В предпочтительной конструкции X1 - Р, Х 2 - Т, Х 3 - L, X4 - R, X5 - Е или Q, Х 7 - I или L. Более предпочтительная основа пептида состоит из следующей аминокислотной последовательности: Х 9 Х 8GX1X2X3X4X5WX7 где Х 9 - A, C, E, G, I, L, M, P, R, Q, S, T или V; В дальнейших конструкциях изобретения пептиды, предпочтительные для использования,включают пептиды с основной аминокислотной последовательностью: С Х 2 Х 3 Х 4 Х 5X6 Х 7 где X2 - K, L, N, Q, R, S, T или V; Х 3 - C, F, I, L, M, R, S или V; X4 - любая из 20 аминокислот, кодируемых генетически;X7 - I, K, L, R или V. В частности, предпочтительные пептиды включают: G, G, C, T, L, R, E,W, L, H, G, G, F, C, G, G. В дальнейших конструкциях, предпочтительные пептиды для использования в данном изобретении включают пептиды, имеющие следующую аминокислотную последовательность: Х 8 СХ 2 Х 3 Х 4X5X6 Х 7 где X2 - F, K, L, N, Q, R, S, T или V;L-аминокислот. В некоторых конструкциях X8 предпочтительно G,S,Y или R. Пептиды и пептидомиметики, имеющие значение IC50 больше, чем 100 М, теряют эффективность связывания, достаточную для их использования в диагностических или терапевтических аспектах изобретения. Для диагностических целей предпочтительны пептиды и пептидомиметики, имеющие значение IC50 около 2 М или менее и для фармацевтических пептиды и пептидомиметики, имеющие значение IC50 100 M или менее. Представляется также необходимым определить минимальную длину TPO-R связывающего соединения изобретения. Используя кодирующую синтетическую библиотеку (ESL) или синтез иммобилизованных полимеров большого размера, можно не только определить минимальный размер пептида, но также образовать группы пептидов, имеющих мотив,отличный от предпочтительного (или минимальную длину данного мотива) на один, два или три аминокислотных остатка. Такая коллекция пептидов далее может быть скринирована на способность связывания с ТРО-рецептором. Такие системы синтеза иммобилизованных полимеров или другие методы для синтетических пептидов могут быть применены для получения сокращенных аналогов, аналогов с делециями,замещениями и комбинаций всех пептидных соединений изобретения. Пептиды и пептидомиметики данного изобретения были также оценены с помощью анализа пролиферации тромбопоэтин-зависимых клеток, как подробно описано ниже в примере 2. Клеточная пролиферация измерялась хорошо известными методами, такими как МТТ анализ,который сопровождается 3H-встраиванием в качестве индикатора клеточной пролиферации(1983. Пептиды были протестированы на стимулированную пролиферацию TPO-R трансфецированных Ba/F3 клеток в дозо-зависимой форме, как показано на фиг. 1 А. Эти пептиды не оказывали действия на родительскую клеточную линию, как показано на фиг. 1 В. Фиг. 7-9 представляют результаты дальнейших анализов по оценке активности пептидов и пептидомиметиков изобретения. В этих анализах с использованием карбоплатины у мышей вызывалась тромбоцитопения. Фиг. 7 отображает типичные результаты внутрибрюшинного введения Balb/C мышам карбоплатины(125 мг/кг) в 0 день. Пунктирная линия обозначает животных без введения карбоплатины в трех экспериментах. Непрерывная линия обозначает группы с введением карбоплатины в трех экспериментах. Жирная линия представляет предшествующие данные. Фиг. 8 отображает 26 эффект влияния титрования карбоплатины на количество тромбоцитов у мышей, которым вводится указанное количество карбоплатины (в мг/кг в 0 день внутрибрюшинно (ip. Фиг. 9 отображает мелиорацию тромбоцитопении, индуцированной введением карбоплатины, на 10 день при использовании пептида AF12513 (513). Карбоплатина (СВР 50-125 мг/кг, внутрибрюшинно) вводилась в 0 день. AF12513 (1 мг/кг, ip) вводился с 1-9 день. Данные результаты указывают на то, что пептиды данного изобретения могут способствовать мелиорации тромбоцитопении на мышиных моделях. Некоторые пептиды данного изобретения могут быть димеризованы или олигомеризованы, чем повышается афинность и/или активность соединений. Для изучения того, какой эффект оказывает димеризация/олигомеризация на свойства пептидов при использовании их в качестве ТРО миметиков в анализах на пролифелирацию клеток, был синтезирован биотинилированный аналог пептида GGCADGPTLREWISFCGG (GGCADGPTLREWISFCGG К (Биотин. Пептид инкубировался со стрептавидином в HEHPES - буфере без серы с RPMI в молярном отношении 4:1. Комплекс тестировался на стимуляцию пролиферации TPO-R трансфецированных Ba/F3 клеток тремя биотинилированными пептидами и не биотинилированным родительским пептидом, как указано выше. Фиг. 2 А показывает результаты анализа для сложного биотинилированного пептида (AF 12885 со стрептавидином (SA как для трансфецированных, так и для родительских клеточных линий. Фиг. 2 В показывает результаты анализа для не биотинилированного пептида (AF 12285) на трансфецированных и родительских клеточных линиях. Фиг. 2 С показывает результаты анализа отдельно для стрептавидина на трансфецированных и родительских клеточных линиях. Эти рисунки иллюстрируют, что сформированный комплекс действует приблизительно в 10 раз сильнее свободного пептида. Специфичность связывания и активность пептидов изобретения была изучена путем исследования параллельной активности пептидов к рецептору эритропоэтина (EPO-R). EPO-R также как и TPO-R является членом семейства рецепторов гематопоэтиновых факторов роста. Пептиды изобретения, также как и ТРО, ЕРО и известный ЕРО-связывающий пептид были изучены на пролифелирующих клетках, используя ЕРО-зависимую клеточную линию. Этот анализ использовал FDCP-1 линию мышиных мульти потенциальных кроветворных клеток предшественников, зависимых от фактора роста (Смотри,Dexter et. al., J. Exp. Med. 152:1036-1047 (1981. Эта клеточная линия может пролиферировать,но не может дифференцироваться при использовании WEHI -3 среды (среды, содержащей IL3, АТСС номер Т 1 В 68). Родительские клеточные линии трансфецируются TPO-R человека 27 или мыши для того, чтобы получить FDCP-1EPO-R клеточную линию. Такие клеточные линии могут пролифелировать, но не могут дифференцироваться в присутствии ЕРО человека или мыши. Клетки выращиваются до половинной плотности в присутствии необходимых факторов роста. Далее клетки промываются PBS и выдерживаются лишенными питания в цельной среде без факторов роста в течение 16-24 ч. После определения жизнеспособности клеток, основной раствор (среда без факторов роста) дает около 105 клеток на 50 л. Далее серия разведений соединений (обычно свободное разведение пептида в противоположность связанному с фагом или иммобилизованному) тестируется на 96-луночном планшете в конечном объеме 50 л на лунку. Клетки (50 л) добавляются к каждой лунке и инкубируются в течение 24-28 ч, до того времени, когда негативный контроль должен погибнуть или находиться в неподвижности. Далее, клеточная пролиферация измеряется известными методами, например МТТ анализом. Фиг. 3 А-С представляет результаты серии контрольных экспериментов, демонстрирующих активность ТРО, пептидов данного изобретения,ЕРО, EPO-R связывающихся пептидов в анализе пролиферации клеток, используя либо TPO-R трансфецированную Ba/F3 клеточную линию и соответствующие родительские линии или ЕРОзависимые клеточные линии и соответствующие родительские линии. Фиг. 3 А отображает результаты для ТРО в анализе на пролиферирующей TPO-R трансфецированной Ba/F3 клеточной линии и соответствующей родительской линии. Фиг. 3 В отображает результаты для ЕРО в анализе на пролиферирующей TPO-R трансфецированной Ba/F3 клеточной линии и соответствующей родительской линии. Фиг. 3 С отображает результаты для сложного биотинилированного пептида (AF 12285 со стрептавидиномEPO-R связывающего пептида (AF 11505 со SA) на TPO-R трансфецированной Ba/F3 клеточной линии. Результаты для соответствующих родительских клеточных линий представлены на фиг. 3D. Фиг. 3 Е отображает результаты для ТРО в анализе на пролиферирующих клетках,используя ЕРО зависимую клеточную линию. Фиг. 3F отображает результаты для сложного биотинилированного пептида (AF 12285 со стрептовидином) и для сложной формы биотинилированного EPO-R связывающего пептида(AF 11505 со SA) на ЕРО зависимой клеточной линии. Эти результаты подтверждают, что пептиды изобретения связываются и активируютTPO-R с высокой специфичностью. 4. Получение пептидов и пептидомиметиков. А. Твердофазный синтез. Пептиды изобретения могут быть получены известными классическими методами, на 001220 28 пример путем использования стандартной твердофазной методики. Стандартные методы включают твердофазный синтез, частично твердофазный синтез, конденсацию фрагментов,классический синтез в растворе и технологию рекомбинантной ДНК. Смотри, например, Merrifield J. Am. Chem. Soc. 85:2149 (1963). На твердой фазе синтез обычно начинается с Сконца пептида, с использованием смолы с защищенной альфа аминогруппой. Подходящий исходный материал может быть получен, например, путем присоединения требуемой альфа аминокислоты к хлорметилированной смоле,гидроксиметилированной смоле, или бензогидриламинированной смоле. Одна из таких хлорметилированных смол выпускается под названием BIO-BEADS SX-1 Bio Rad Laboratories,Richmond, CA, и получение гидроксиметилированной смолы описано Bodonsky et.al., Chem.Ind. (London) 38:1597 (1966). Бензогидриламинированная смола (ВНА) описана PiettaMarshall Chem. Commn. 650 (1970) и может быть приобретена у Beckman Instruments, Ind., PaloAlto, CA в гидрохлоридной форме. Таким образом соединения изобретения могут быть получены путем соединения защищенной альфа аминокислоты с хлорметилированной смолой с помощью, например, цезия бикарбоната в качестве катализатора, согласно методу описанному Gisin Helv. Chim. Aсta 56:1467 (1973). После начального присоединения защищенная альфа аминогруппа устраняется выбранным реагентом, включая растворы трифторуксусной кислоты (TFA) или хлористоводородной кислоты (HCI) в органическом растворителе при комнатной температуре. Известно, что группы, защищающие альфа аминогруппу, необходимы при пошаговом синтезе пептидов. Они включают защитные группы типа ацильной (например, формил, трифторацетил, ацетил), группы типа ароматического уретана (например, бензилоксикарбоил (Cbz) и замещенный Cbz), группы алифатических уретанов (например, t-бутилоксикарбонил (Воc), изопропилоксикарбонил, циклогексилоксикарбонил) и группы типа алкильных (например, бензил, трифенилметил). Воc и Fmoc являются предпочтительными защитными группами. Боковая цепь защитной группы остается интактной в процессе присоединения и не отщепляется при снятии защитных групп с аминогруппы или в процессе присоединения. Боковая цепь защитной группы должна быть устраняема после завершения синтеза конечного пептида и при условиях, не изменяющих требуемый пептид. Боковая цепь защитных групп для Туr включает тетрагидропиранил, терт-бутил, тритил, бензил, Cbz, Z-Br-Cbz, и 2,5-дихлорбензил. Боковая цепь защитных групп для Asp включает бензил, 2,6-дихлорбензил, метил, этил, и циклогексил. Боковая цепь для защитных групп Thr иSer включает ацетил, бензоил, тритил, тетрагид 29 ропиранил, бензил, 2,6-дихлорбензил, и Cbz. Боковая цепь защитной группы для Thr и Ser бензил. Боковая цепь защитных групп для Аrg включает нитро, тосил (Tos), Cbz, адамантилоксикарбонил, мезитоилсульфонил (Mts), или Воc. Боковая цепь защитных групп для Lys включаетCbz, 2-хлорбензилоксикарбонил (2-Cl-Cbz), 2 бромбензилоксикарбонил (2-BrCbz), Tos, или Воc. После снятия защитных групп для альфа аминогруппы оставшиеся защищенные аминокислоты соединяются поэтапно в желаемом порядке. Каждая защищенная аминокислота обычно используется в избытке с соответствующим активатором карбоксильной группы,таким как дициклогексилкарбодиимид (DCC) в растворе, например, в смеси метил хлорида(CH2Cl2), и диметил формамида (DMF). После получения желаемой аминокислотной последовательности желаемый пептид отсоединяется от смоляной основы путем взаимодействия с такими реагентами, как трифторуксусная кислота или фторводород (HF), которые не только отщепляют пептид от смолы, но также отщепляют все оставшиеся боковые цепи защитных групп. Когда используется хлорметилированная смола, обработка фторводородом приводит к отсоединению пептидного амида в свободном виде. При использовании бензилгидриламинированной смолы обработка также фторводородом приводит к отсоединению пептидного амида в свободном виде. Альтернативно, при использовании хлорметилированной смолы пептид с боковыми цепями защитных групп может быть отсоединен при взаимодействии с аммонием до получения желаемого амида или при взаимодействии с алкиламином до получения алкиламида или диалкиламида с боковыми цепями защитных групп. Боковые цепи защитных групп далее удаляются обычным способом при взаимодействии с фторводородом до получения свободных амидов, алкиламидов или диалкиламидов. Эти процедуры твердофазного синтеза хорошо известны в данной области и описаны вCo., San Francisco, 1969). Используя кодирующую синтетическую библиотеку или синтез иммобилизованных полимеров большого масштаба описанный в заявке на патент 07/492,462 от 7 марта 1990;07/624,120 от 6 декабря 1990; и 07/805,727 от 6 декабря 1991 можно не только определить минимальный размер пептида с требуемой активностью, но также получить все пептиды, образующие группу, отличную от предпочтительного мотива (или минимального размера этого мотива) в один, два или более остатков. Такая коллекция пептидов может потом быть скринирована на способность связываться с TPO-R. Такая система синтеза иммобилизованных полимеров или другие методы пептидного синтеза 30 могут также быть использованы для синтеза сокращенных аналогов, аналогов с делециями и комбинации сокращенных аналогов и аналогов делециями всех пептидных соединений изобретения. В. Синтетические аминокислоты. Эти способы могут также быть использованы для получения пептидов, в которых аминокислоты, отличные от 20 встречающихся в природе, генетически кодируемых аминокислот,замещают аминокислоты в одном, двух или более положениях любого из соединений изобретения. Например, нафтилаланином может быть замещен триптофан. Другие синтетические аминокислоты, которые могут быть использованы для замещения в пептидах данного изобретения включают L-гидроксипропил, L-3,4 дигидроксифенилаланин, d-аминокислоты такие как L-d-гидроксилизил и D-d-метилаланин, L-aметилаланил, b аминокислоты, и изохиноил. D аминокислоты и не встречающиеся в природе синтетические аминокислоты могут также быть встроены в пептиды данного изобретения. Можно также заменить боковую цепь, состоящую из 20 встречающихся в природе аминокислот (или D аминокислот) другими боковыми цепями, например, с такими группами, как алкил, низший алкил, циклический 4-, 5-, 6-, до 7-членного алкил, амидный низший алкил,амидный ди(низкомолекулярный алкил), низший алкокси, гидрокси, карбоксигруппами и их низшими эфирами и с 4-, 5-, 6-, до 7 членными гетероциклами. В частности, может быть использован аналог пролина, в котором размер кольца пролинового остатка заменен с 5 членного на 4, 6, или 7-членное. Циклические группы могут быть как насыщенными, так и ненасыщенными, и в случае ненасыщенных могут быть ароматическими или не ароматическими. Циклические группы могут быть как насыщенными, так и ненасыщенными, и в случае ненасыщенных могут быть ароматическми или неароматическими. Гетероциклические группы предпочтительно содержат один или два азота,кислород, и/или гетероатомы серы. Примеры таких групп включают фуразанил, фурил, имидазолидинил, имидазолил, имидазолинил, изотиазолил, изоксазолил, морфолинил (например,морфолино), оксазолил, пиперазонил (например, 1-пиперазинил), пиперидил (например, 1 пиперидил, пиперидино), пиранил, пиразинил,пиразолидинил, пирролидинил (например, 1 пирролидинил), пирролинил, пирролил, тиадиазолил, тиазолил, тиэнил, тиоморфолинил (например, тиоморфолино), и триазолил. Эти гетероциклические группы могут быть замещенными или незамещенными. В случае замещенной группы заместителем может являться алкил,алкоксигруппа, галлоген, кислород, или замещенный или незамещенный фенил. 31 Можно также модифицировать пептиды изобретения методом фосфорилирования, или другими методами по получению производных от соединений данного изобретения, описанными Hruby et. al. Таким образом, пептидные соединения изобретения, включая пептидомиметики, могут быть ковалентно модифицированы замещением на один или более из множества не пептидных полимеров, например, полиэтиленгликоль, полипропиленгликоль, или полиоксиалкен способами, предложенными в патенте 4,640,835; США патент 4,496,689 США; патент 4,301,144 США; патент 4,670,417 США; патент 4,791,192 США; или патент 4,179,337 США, подкрепленных ссылками. С. Модификации концов пептида. Специалистам известно, что существует множество методов для получения пептидомиметиков с такими же или подобными, как у основного пептида, свойствами, но с более выгодной растворимостью, стабильностью, способностью к гидролизу и протеолизу. Смотри MorganGainor Ann. Rep. Med. Chem. 24:243-252(1989). Далее описываются методы получения пептидомиметиков, модифицированных с Nконцевой аминогруппы, с С- концевой карбоксильной группы, и/или с заменой одной или более амидной связи в пептиде на не амидную. Надо понимать, что две или более модификации могут быть совмещены в одной структуре пептидомиметика (например, модификация С- концевой карбоксильной группы и включение -СН 2 карбаматной связи между двумя аминокислотами пептида). 1. Модификации N-конца. Обычно пептиды синтезируются в виде свободных кислот, но,как сказано выше, могут быть получены в виде амидов или эфиров. Можно модифицировать амино и/или карбоксильный конец пептида изобретения с целью получения других соединений изобретения. Модификации аминоконца включают метилирование (например, -NНСН 3-NН(СН 3)2), ацетилирование, присоединение карбобензольной группы, или блокирование аминоконца блокирующей группой, содержащей карбоксилат, определенный как RCOO-, гдеR выбран из группы, состоящей из нафтила,акридинила, стероидила, и подобных групп. Модификации карбоксильного конца включают замещение свободной кислоты карбоксиамидной группой или образование циклического лактама на карбоксильном конце с целью введения структурных перестроек. Модификации аминоконца включают, как сказано выше, алкилирование, ацетилирование,добавление карбобензоильной группы, образование сукцинимидной группы, и т.д. Детальнее,N -концевые аминогруппы могут быть изменены следующим образом:(а) с образованием амидной группы с формулой RC(O)NH-, где R определен выше в реакции с кислыми галидами (например, RC(O)Cl) 32 или кислыми ангидридами. Обычно, реакция может проводиться с взятыми в эквимолярных количествах или в избытке (например, около 5 эквивалентов) кислыми галидами и пептидом в инертном растворителе (например, дихлорметане), предпочтительно в избытке (например около 10 эквивалентов) содержащем третичный амин, такой как диизопропилэтиламин, для связывания кислоты, образующейся в процессе реакции. Условия реакции обычные (например при комнатной температуре в течение 30 мин). Алкилирование аминоконца с присоединением низкомолекулярного алкила с последующей реакцией с кислым галидом, как описано выше,придаст N-алкил амидной группе следующую формулу RC(O)NR-;(в) с образованием сукцинимидной группы путем реакции с сукцинидным ангидридом. Как и выше, используются примерно эквимолярные количества или избыточные количества сукцинидного ангидрида (например около 5 эквивалентов), и аминогруппа превращается в сукцинимид хорошо известными методами, включая использование избыточного количества (например 10 эквивалентов) третичного амина, такого как диизопропилэтиламин в подходящем инертном растворителе (например, дихлорметане). Смотри, например, Wollenberg, et. al., патент 4,612,132, подкрепленный ссылками. Надо понимать, что сукцинидная группа может быть замещена, например, C2-C6 алкилом или -SR заместителем, полученным обычным способом для замещения сукцинимида на N-конце пептида. Такие алкильные заместители получаются при реакции низкомолекулярных олефинов (С 2 С 6) с ангидридом малеиновой кислоты способом, описанным Wollenberg, et.al., supra, и -SR заместители получаются при реакции RSH с ангидридом малеиновой кислоты, где R определен выше;(с) с образованием бензилоксикарбонилNН- или замещенной бензилоксикарбонил-NНгруппы путем реакции эквимолярных или избыточных количеств CBZ-Cl (например, бензилоксикарбонил хлорид) или замещенный CBZ-Cl в подходящем инертном растворителе (например дихлорметане), предпочтительно содержащем третичный амин для связывания кислот, образующихся в процессе реакции;(а) с образованием сульфонамидной группы при реакции эквивалентных или избыточных(например 5 эквивалентов) количеств R-S(O)2 Сl в подходящем инертном растворителе (дихлорметане) для замещения концевой аминокислоты в сульфоноамид, где R определено выше. Предпочтительно инертный растворитель содержит избыточное количество третичного амина (например, 10 эквивалентов), такого как диизопропилэтиленамин, для связывания кислот, образующихся в процессе реакции. Условия реакции обычные (например при комнатной температуре в течение 30 мин);(е) с образованием карбаматной группы при реакции с эквивалентным или избыточным(например 5 эквивалентов) количеством RОС(О)Сl или R-OC(O)OC6H4-p-NO2 в подходящем инертном растворителе (дихлорметане) для замещения концевой аминокислоты на карбамат, где R определено выше. Предпочтительно инертный растворитель содержит избыточное количество третичного амина (например 10 эквивалентов), такого как диизопропилэтиленамин, для связывания кислот, образующихся в процессе реакции. Условия реакции обычные(например при комнатной температуре в течение 30 мин); и(f) с образованием мочевинной группы при реакции с эквивалентным или избыточным (например, 5 эквивалентов) количеством R-N=C=O в подходящем инертном растворителе (дихлорметане) для замещения концевой аминокислоты на мочевину, где R определено выше. Предпочтительно инертный растворитель содержит избыточное количество третичного амина (например 10 эквивалентов), такого как диизопропилэтиленамин, для связывания кислот, образующихся в процессе реакции. Условия реакции обычные (например при комнатной температуре в течение 30 мин). 2. Модификации С- конца. При получении пептидомиметиков с Сконцом, замещенным эфиром (например C(O)OR, R где определено выше) используются смолы, участвовавшие в синтезе пептида, и защищенный боковыми цепями пептид отрезается основанием или соответственным спиртом, например, метанолом. Боковые цепи защитных групп затем устраняются обычным способом при обработке фторводородом с целью получения желаемого эстера. При получении пептидомиметиков, где Сконец карбоксильной группы заменен на амид C(O)NR3R4, бензиогидриламинированная смола используется в качестве твердой фазы при синтезе пептида. Перед концом синтеза обработка хлорводородом освобождает пептид от твердой фазы, и получаем пептидный амид в свободном состоянии (например, С-конец -С(О)NН 2). Альтернативно, использование хлорметилированной смолы в процессе синтеза пептида совместно с обработкой аммонием для отрезания от твердой фазы защищенного боковыми цепями пептида приводит к получению свободного пептида, и реакция с алкиламином или диалкиламином приводит к образованию алкиламида или диалкиламида с боковыми цепями (например,С-конец - C(O)NRR1, где R, R1 определены выше). Боковые цепи затем устраняются обычным способом при обработке фторводородом до получения свободных амидов, алкиламидов, или диалкиламидов. В другой альтернативной конструкции, Сконец карбоксильной группы или С-конец эфира может способствовать образованию цикличе 001220 34 ского пептида при внутреннем совмещении -ОН или эфира (-OR) карбоксильной группы или эфира С-концом аминогруппы. Например, после синтеза и отрезания до получения пептидной кислоты, свободная кислота превращается в активированный эфир соответственным активатором карбоксильной группы, таким как дициклогексилкарбодиимид (DCC), в растворе, например, в смеси метилен хлорида (CH2Cl2), диметил формамида (DMF). Далее циклический пептид образуется внутренним совмещением активированного эфира и амино конца. Образование циклических пептидов, в противоположность полимеризации, может быть усилено использованием очень разведенных растворов. Такие методы хорошо известны в данной области. Можно также получить пептиды изобретения в циклической форме или встроить неаминную группу или некарбоксильную группу на концах пептида так, что концевые аминогруппа и карбоксильная группа будут отсутствовать,тем самым снижая чувствительность к протеолизу или изменяя конформацию пептида. Сконцевые функциональные группы соединений данного изобретения включают амиды, амиды низкомолекулярных алкилов, амиды ди(низкомолекулярных алкилов), низкомолекулярные алкокси, гидрокси, и карбоксигруппы и их производные низкомолекулярные эстеры, и их применимые в фармацевтике соли.D. Модификации основы. Другие методы получения пептидных производных от соединений данного изобретения описаны у Hruby et.al., Biochem J. 268(2):249262 (1990). Таким образом, пептидные соединения изобретения также служат структурными моделями для непептидных соединений с похожей биологической активностью. Специалистам данной области известно множество методов получения соединений с такой же или подобной желаемой биологической активностью основного пептидного соединения, но с более выгодными свойствами растворимости, стабильности,чувствительности к гидролизу и протеолизу. Смотри MorganGainor Ann. Rep. Med. Chem. 24:243-252 (1989). Эти методы включают замену пептидной основы на основу, состоящую из фосфонатов, амидов, карбаматов, сульфоноамидов, вторичных аминов, и N-метиламинокислот. Пептидомиметики, где одна или более пептидная связь (-С(О)NH-) заменена на такую связь, как -СН 2-карбаматная, фосфонатная,-CH2-сульфоноамидная, мочевинная, вторичная аминная (-CH2NH-) и алкилированная пептидная (-C(O)NR6-, где R6 низший алкил) получаются при обычном синтезе пептидов с замещением в нужной точке синтеза участвующих в реакции аминокислот на подходящие защищенные аминокислотные аналоги. Подходящие реагенты включают, например, аминокислотные аналоги, где карбоксиль 35 ная группа аминокислоты заменена на группу,удобную для образования одной из связей, указанных выше. Например, если желательно заменить -C(O)NR-связь в пептиде на -СН 2 карбаматную связь (-СН 2 ОС(О)NR-), карбоксильная группа (-СООН) защищенной аминокислоты превращается в -СН 2 ОН группу, которая затем обычным способом превращается в-OC(O)O-C6H4-p-NO2. Реакция либо таких функциональных групп свободных аминов или частично синтезированного прикрепленного алкилированного с N-конца пептида приводит к образованию -CH2 ОC(О)NR- связи. Для более детального описания таких -СН 2 карбаматных связей смотри Cho et.al., Science 261:13031305(1993). Подобным образом замещение амидосвязи в пептиде на фосфонатную связь может быть достигнуто способом, описанным в заявках на патент 07/943,805, 08/081,577 и 08/119,700,США, подкрепленных ссылками. Замещение амидной связи в пептиде на сульфоноамидную связь может быть получено при превращении карбоксильной группы (СООН) защищенной аминокислоты в -CH2OH, и гидроксильная группа затем превращается в подходящую, такую как тосил, обычным способом. Реакция тосил производного, например, с тиоуксусной кислотой с последующим гидролизом и хлорированием приводит к образованию СН 2-S(O)2 Сl группы, которая затем замещает карбоксильную группу защищенной аминокислоты. Использование подходящих защищенных аналогов аминокислот в синтезе пептида приводит к включению -CH2S(O)2NR- связи, которая заменяет амидную связь в пептиде, способствуя тем самым получению пептидомиметика. Для более полного описания превращения карбоксильной группы аминокислоты в -CН 2S(O)2Cl группу смотри, например, Weinstein, BorisChemistryBiochemistry of Amino Acids, PeptidesProteins Vol.7, pp267-357, Marcel Dekker,Inc., New York (1983). Замещение амидной связи в пептиде на мочевинную может быть достигнуто способом,предложенным в заявке на патент 08/147,805. Вторичная аминная связь, где -CH2NHсвязь заменяет амидосвязь в пептиде может быть получена, например, использованием подходящего защищенного дипептидного аналога,в котором карбонильная группа амидосвязи заменена на CH2 группу обычными способами. Например, защищенные подходящим способом дипептидные аналоги, где карбонильная группа амидной связи заменена на СН 2 группу обычными методами. Например, в случае диглицина,превращение амида в амин происходит после снятия защитной группы H2NCH2CH2NHCH2COOH, которая далее используется в защите Nконца в следующей реакции присоединения. Способы получения таких аналогов путем за 001220 36 мещения карбоксильной группы амидной связи в дипептиде хорошо известны в данной области. Защищенный аминокислотный аналог используется в обычном синтезе пептидов также как использовалась бы соответствующая аминокислота. Например, обычно в реакции используется три эквивалента защищенного аминокислотного аналога. Используется инертный растворитель такой как метилен хлорид или DMF,и, когда в качестве побочного продукта реакции образуется кислота, растворитель обычно содержит избыточное количество третичного амина для связывания кислоты, образующейся в процессе реакции. Одним из предпочтительных третичных аминов является диизопропилэтиламин, который обычно добавляется в 10-кратном количестве. В результате реакции образуется пептидомиметик, состоящий из аминокислотных аналогов и имеющий непептидную связь. Такие замещения могут быть повторены желаемое количество раз, таким образом от нуля до всех связей в пептиде будут заменены на неамидные связи. Можно также получить пептиды изобретения в циклическом виде или встроить в концы пептида неаминный или некарбоксильный остаток таким образом, что концевые амино или карбоксильная группы будут отсутствовать, с целью снижения чувствительности к протеазам или изменения конформации пептида. Сконцевые группы соединений данного изобретения включают амиды, амиды низших алкилов,амиды ди(низших алкилов), низшие алкокси,гидрокси, и карбоксигруппы и их низшие эфиры, а также их применимые в фармацевтике соли. Примеры циклических соединений приведены в таблицах 4, 5, 6, 8 и 9. Е. Образование дисульфидной связи. Соединения данного изобретения могут существовать в циклической форме с внутримолекулярными дисульфидными связями между тиольными группами цистеинов. Альтернативно, межмолекулярная связь между тиольными группами цистеинов может быть образована для получения димерного (или высоко олигомерного) соединения. Один или более цистеиновый остаток может быть также замещен на гомоцистеин. Эти производные с внутримолекулярными или межмолекулярными связями могут быть схематично представлены, как показано ниже: где m и n независимо 1 или 2. Другие конструкции данного изобретения представляют аналоги этих дисульфидных производных, в которых один из атомов серы заменен на СН 2 группу или другой изостереомер. Эти аналоги могут быть получены посредством внутримолекулярного или межмолекулярного 37 замещения, используя хорошо известные методы, смотри ниже: где р это 1 или 2. Специалисты данной области смогут провести данное замещение, используя другие гомологи производных -амино-gбутиловой кислоты, показанные выше, и гомоцистеин. Альтернативно, аминоконцы пептида могут быть копированы, используя альфазамещенную аминокислоту, в которой альфа группа является замещаемой, такой как галлогенуксусной кислотой, например, хлоруксусной кислотой, -бромуксусной кислотой или -йодуксусной кислотой. Соединения данного изобретения могут быть получены в циклическом виде или в виде димеров посредством замещения группы на серу цистеинового или гомоцистеинового остатка. Смотри, например, Barker et.al., J.Med.Chem. 35:2040-2048(1991). Примеры димеризованных соединений приведены в таблицах 7, 9, и 10.V. Применимость. Соединения изобретения применимы invitro в качестве уникальных инструментов для изучения биологической роли ТРО, включая оценку многих факторов, которые, как предполагается, влияют на синтез ТРО или находятся под влиянием ТРО, и процесса связывания с рецептором. Данные соединения применимы также при конструировании других соединений,связывающихся и активирующих TPO-R, поскольку данные соединения дают важную информацию о связи структуры и активности. Соединения также применимы в анализах по конкурентному связыванию при скрининге новых агонистов ТРО рецептора. В таких анализах соединения изобретения могут быть использованы без модификаций или могут быть модифицированы различными способами, например,введением метки, путем ковалентного или нековалентного присоединения группы, прямо или косвенно производящей сигнал, который можно обнаружить. В любом из этих анализов, метка может быть введена прямо или косвенно. Возможности прямого мечения включают такие метки, как радиоактивные метки, как 125l, белковые метки (патент 3,645,090 США), как пероксидаза и щелочная фосфотаза, и флуоресцентные метки (патент 3,940,475 США), мониторинг которых можно провести по изменению интен 001220 38 сивности флюоресценции, сдвигу длины волны,или поляризации флюоресценции. Возможности для непрямого мечения включают биотинилирование составного звена с последующим связыванием с авидином, связанным с одной из меченных групп, описанных выше. Соединения могут также быть спейсорами или лигандами в случае прикрепления к твердой подложке. Более того, основываясь на способности связывания с ТРО рецептором, пептиды данного изобретения могут применяться в качестве реагентов для детекции ТРО рецепторов в живых клетках, фиксированных клетках, в биологических средах, в тканевых гомогенатах в очищенных биологических природных материалах и т.д. Например, введя метку в такие пептиды,можно идентифицировать клетки, имеющиеTPO-R на их поверхности. В добавление, основываясь на способности связываться с рецептором, пептиды данного изобретения могут быть использованы при окраске in situ, FACS (отбор флюоресцентно-меченых клеток), Вестерн блоттинге, ELISA и т.д. В добавление, основываясь на способности связываться с рецептором, пептиды данного изобретения могут быть использованы при очистке рецептора, или очистке клеток, экспрессирующих ТРО рецепторы на поверхности (или внутри пермеабилизованны(проницаемых) клеток). Соединения данного изобретения могут также быть использованы в качестве коммерческих реагентов для различных медицинских исследований или диагностических применений. Такие применения включают, но не ограничиваются: (1) использование в качестве калибровочного стандарта при количественном измерении активности кандидатов в ТРО агонисты в ряде анализов; (2) использование для поддержания пролиферации и роста ТРОзависимых клеточных линий; (3) использование в структурных анализах ТРО-рецептора посредством параллельной кристаллизации; (4) использование для исследования механизма передачи ТРО сигнала при активировании рецептора; и (5) другие исследования и диагностические применения, в которых ТРО-рецептор предпочтительно активирован или такая активация удобна для калибровки относительно известного количества ТРО агониста; и во всех подобных случаях. Соединения данного изобретения могут также быть применены при культивировании invitro мегакариоцитов и их предшественников, в соединении с цитокинами или отдельно (DiGiusto et al. публикация РСТ 95/05843). Химиотерапия и радиационная терапия вызывают тромбоцитопению, убивая быстро делящуюся популяцию зрелых мегакариоцитов. Тем не менее, это терапевтическое лечение может также снижать количество и разновидность незрелых,менее митотически активных клеток предшественников мегакариоцитов. Таким образом, 39 улучшение тромбоцитопении при использовании ТРО или соединений данного изобретения может быть усилено введением пациентам после химиотерапии или радиационной терапии популяции их собственных клеток, обогащенной мегакариоцитами или незрелыми предшественниками, выращенными в среде in vitro. Соединения изобретения могут также назначаться теплокровным животным, включая человека, для активации ТРО-R in vivo. Таким образом, данное изобретение включает методы для терапевтического лечения заболеваний, связанных с ТРО, заключающиеся в назначении соединения изобретения в количествах, достаточных для имитирования эффекта ТРО на TPOR in vivo. Например, пептиды и соединения изобретения могут применяться для лечения ряда гематологических заболеваний, включая, но не ограничиваясь, заболеваниями, связанными с тромбоцитами, тромбоцитопенией, ассоциированной с пересадкой костного мозга, радиационной и химиотерапией. В некоторых конструкциях изобретения,ТРО агонисты назначаются пациентам до прохождения химиотерапии или радиационной терапии, вместе с назначением ТРО агонистов изобретения после этих процедур. Активность соединений данного изобретения может быть измерена либо in vitro либо in(1992), подкрепленной ссылками. Согласно одной из конструкций, препараты данного изобретения применимы для лечения тромбоцитопении, ассоциированной с пересадкой костного мозга, радиационной терапией и химиотерапией. Соединения обычно назначаются профилактически до химиотерапии, радиационной терапии и пересадки костного мозга или после этих процедур. Далее, данное изобретение представляет фармацевтические композиции, содержащие в качестве активного ингредиента хотя бы один из пептидов или пептидомиметиков изобретения вместе с фармацевтическим носителем или средой. Соединения данного изобретения могут назначаться орально, легочным путем, парентерально (внутримышечно, внутрибрюшинно,внутривенно (IV) или в виде инъекции), в виде ингаляций (порошки), трансдермально, нозально, вагинально, ректально, или подъязычно и могут быть дозированы для каждого способа употребления. Смотри, Berstein et. al., РСТ публикация WO 93/25221; Pitt et. al., PCT публикация патента WO 93/17784; Pitt et.al., Европейская заявка на патент 613,683. Твердые лекарственные формы для орального применения включают капсулы, таблетки,пилюли, порошки, и гранулы. В таких твердых формах активное соединение смешано, по крайней мере, с одним инертными применимым в фармацевтике носителем, таким как сахароза, 001220 40 лактоза или крахмал. Такие лекарственные формы могут также на практике включать добавочные вещества, отличные от инертных растворителей, например формирующие агенты,такие как стеарат магния. В случае капсул, таблеток и пилюль лекарственные формы могут также включать буферные агенты. Таблетки и пилюли могут вдобавок приготавливаться с брюшной оболочкой. Жидкие лекарственные формы для орального применения включают применимые в фармацевтике эмульсии, растворы, суспензии, сиропы, с элексиром, содержащие инертные растворители, широко применяемые в данной области, например, воду. Кроме того, такие инертные растворители, могут содержать добавки,такие как агенты, поддерживающие влажность,образующие эмульсию или суспензию агенты, и придающие сладость вкусовые добавки. Препараты данного изобретения для парентерального использования включают стерильные водные или неводные растворы, суспензии или эмульсии. Примерами неводных растворителей или носителей являются пропиленгликоль, полиэтиленгликоль, растительное масло, такое как оливковое и кукурузное, желатин, и подходящие для инъекции органические эстеры такие как этилолеаты. Такие лекарственные формы могут также содержать добавки,такие как консервирующие, поддерживающие влажность, образующие эмульсию или суспензию агенты. Они могут стерилизоваться, например, фильтрацией через фильтр, задерживающий бактерии, включением в состав стерилизующих агентов, облучением, или нагреванием. Они могут также приготавливаться с использованием стерильной воды, или других стерильных сред, подходящих для инъекций, непосредственно перед применением. Лекарственные формы для ректального или вагинального применения - это предпочтительно свечи, которые могут содержать в дополнение к активному ингредиенту, добавочную среду, такую как кокосовое масло или воск для свечей. Лекарственные формы для нозального или подъязычного использования приготавливаются в смеси со стандартными носителями, хорошо известными в данной области. Лекарственные формы, содержащие соединения, могут назначаться для профилактического или терапевтического лечения. При терапевтическом применении соединения назначаются пациенту уже страдающему от заболевания, как описано выше, в количествах, достаточных для излечения или, по крайней мере,частичной задержки симптомов заболевания и его последствий. Адекватная для этого доза называется терапевтически эффективной дозой. Количества, эффективные для такого применения, будут зависеть от тяжести заболевания и веса и состояния больного. 41 Лекарственные формы соединения могут также быть приготовлены в виде микрокапсул,например, методом TiceBibi (in Treatise onControlled Drug Delivery, ed. A. Kydonieus, Marcel Dekker, N.Y. (1992), pp.315-339). При профилактическом использовании лекарственные формы, содержащие соединения изобретения, назначаются пациенту при повышенной чувствительности или при риске заболевания. Такие количества называются профилактически эффективной дозой. При данном использовании назначаемое количество опять же зависит от состояния здоровья пациента и его веса. Количество ТРО агониста, необходимое для эффективной терапии, будет зависеть от многих различных факторов, включая цель назначения, место действия, физиологическое состояние пациента, и другие назначенные лекарства. Таким образом, лекарственную дозу следует титровать для оптимизации безопасности и эффективности. Обычно, дозы, применяемые могут представлять полезное руководство по использованию реагентов. Тестирование эффективной дозы для лечения различных заболеваний на животных служит дополнительным индикатором для расчета дозы для человека. Описаны различные мнения, например, Gilman et.al.,(eds);(1990); Reington's Pharmaceutical Science, 7th ed.,Mack Publishing Co., Easton, Penn. (1985), каждая из которых подкреплена ссылками. Пептиды и пептидомиметики данного изобретения эффективны при лечении состояний опосредованных ТРО, при назначении дозы в пределах от 0,001 мг до 10 мг/кг массы тела ежедневно. Специфика назначаемой дозы регулируется состоянием заболевания, схемой лечения, а также по усмотрению врача в зависимости от таких факторов, как тяжесть состояния, возраст и общее состояние пациента, и подобных факторов. Хотя выше описаны только предпочтительные конструкции изобретения, ценно то,что модификации и вариации изобретения могут быть получены, не отклоняясь от намерений и целей данного изобретения. Пример 1. Твердофазный синтез пептидов. Различные пептиды изобретения синтезированы с использованием метода твердофазного синтеза Merrifield (StewardYoung, Solid PhaseSoc. 85:2149 (1963 на автоматическом синтезаторе Milligen/Biosearch 9600 или Applied Biosystems Inc. Model 431 А пептидном синтезаторе. Пептиды были синтезированы с использованием стандартных протоколов Applied Biosystems Inc. System Software version 1.01. Каждое присоединение проводилось в течение одного 001220 42 двух часов с ВОР (бензотриазол Nокситросдиметиламинофосфониум гексафторфосфана) и HOBt (1-гидроксибензотриазола). Использовалась смола НМР или PAL (Milligen/Biosearch), поперечно сшитая полистиреновая смола с 5-(4'-Fmос-аминометил-3,5'диметиоксифенокси) валерьяновой кислотой в качестве линкера. Использование PAL смолы приводит к получению карбоксильного конца в виде амида после отрезания пептида от смолы. При использовании НМР смолы после отрезания на С-конце конечного продукта имеем группу карбоксильной кислоты. Большинство реагентов, смол, и защищенных аминокислот было приобретено от Millipore, or Applied Biosystems Inc.Fmoc группа была использована для защиты аминогрупп при реакции присоединения. Первичная защита аминокислотных аминогрупп осуществлялaсь с помощью Fmoc и для защиты боковых групп использовались t-бутил для серина, тирозина, аспарагина, глюламиновой кислоты и треонина; тритил для глютамина; РmcN-тритил для гистидина и глютамина; и Sтритил для цистеина. Снятие пептидов со смолы и одновременное отщепление боковых цепей проводилось с использованием реагента К или небольшими модификациями последнего. Альтернативно, в синтезе пептидов, имеющий карбоксильный конец в виде амида, синтезированный пептид отрезался с использованием смеси 90% трифторуксусной кислоты, 5% этанэдитиола, и 5% воды, изначально при 4 С при повышении до комнатной температуры. После снятия защитных групп пептид осаждается диэтилэфиром. Во всех случаях очистка пептидов производится обратной жидкостной хроматографией высокого разрешения на колонках с C18 связанным гелем из двуокиси кремния в градиенте ацетонитрила/воды в 0,1% трифторуксусной кислоте. Гомогенизированные пептиды характеризуются масс спектрометрией(Fast Atom Bombardment) или поточной масс спектрометрией и анализом аминокислотной последовательности в соответствующих случаях. Пример 2. Биоанализы. Биоактивность пептидов может быть измерена с использованием анализа пролиферации тромбопоэтин зависимых клеток. Мышиные IL3 зависимые Ba/F3 клетки трансфецировались полноразмерным TPO-R человека. В отсутствииIL-3 (WEHl-3 среда) пролиферация этих клеток зависит от ТРО. Родительские нетрасфецированные клеточные линии не реагируют на воздействие человеческим ТРО, но остаются IL-3 зависимыми. Биоанализы выполнялись на обеих вышеописанных клеточных линиях с использованием 43 синтетических пептидов, найденных после скрининга библиотеки. Клетки выращивались на полной RPMI-10 среде, содержащей 10%WEHI-3 среды, далее дважды промывались, ресуспендировались в среде без WEHI-3 среды и наносились в лунки, содержащие разведение пептида или ТРО в концентрации 2 х 104 клеток на лунку. Клетки инкубировались а течение 48 ч при 37 С в увлажненной 5% СО 2 атмосфере и метаболическая активность анализировалась путем смешивания МТТ с формазаном и измерялась при 570 нм на ELISA счетчике. Тестируемые пептиды вызывали пролиферацию TPOR трансфецированных Ba/F3 клеток в зависимости от используемой дозы, как показано на фиг. 1. Эти пептиды не оказывали воздействие на материнскую клеточную линию. Пример 3. Афинность связывания. Афинность связывания с TPO-R химически синтезированных пептидов измерялась конкурентным анализом. Лунки планшета покрывались 1 мг стрептавидина, блокированногоPBS/1% BSA, и затем наносилось 50 нг биотинилированных иммобилизованных антител к рецептору (Аb179). Затем лунки обрабатываются растворимым TPO-R в разведении 1:10. Различные разведения пептида или пептидомиметика смешиваются с постоянным количеством сокращенной формы ТРО, состоящей из остатков 1-156 слитых с С-концом белка, связывающего мальтозу (МВР-ТРО 156). Смесь МВРТРО 156 добавляется в лунки, покрытые TPO-R,инкубируется в течение 2 ч при 4 С и затем промывается PBS. Связавшееся количество измеряется при добавлении антисера антител кролика, направленных против МВР, с последующей обработкой щелочной фосфотазой вместе с противокроличьими IgG козла. Количество щелочной фосфотазы на лунку определяется стандартными методами. Анализ проводится с различными концентрациями пептидов, и результаты представлены графически, где на оси у откладывается количество связавшегося MBP-TPO156 и по оси х откладывается концентрация пептида или пептидомиметика. Можно определить концентрацию,при которой пептид или пептидомиметик снизит количество связавшегося МВР-ТРО 156 с иммобилизованным TPO-R на 50% (IC50). Константа диссоциации (Kd) для пептида будет подобна измеренному IC50, используя условия анализа, описанные выше. Пример 4. Пептиды на плазмидах. Вектор pJS142, использованный для конструирования библиотеки, показан на фиг. 4. Для конструирования библиотеки необходимы три олигонуклеотидные последовательности:ON-829 (5' АСС АСС ТСС GG); ON-830 (5' ТТА СТТ AGT ТА) и специфический олигонуклеотид для библиотеки (5' GA GGT GGT (NNK)n ТАА СТА AGT AAA GC), где обозначает случайно выбранный участок желаемой длины и 44 последовательности. Олигонуклеотиды могут быть химически фосфорилированы с 5-конца в процессе синтеза или после очистки с использованием полинуклеотид киназы. Далее они лигируются с вектором в молярном отношении 1:1:1. Штамм Е.соli, предпочтительный для использования в анализе по определению афинности связывания (panning) имеет следующий генотип: (srl-recA) endA1 nupG lon-11 sulA1lac ZU118, который может быть получен из штамма E.coli от E.coli Genetic Stock Center atYale University (E.coli b/r центр производства растворов CGSC:6573) с генотипом lon-11sulA1. Описанный выше штамм E.coli приготавливается для электропарации, как описано уDower et.al., Nuclear Acids Res. 16:6127 (1988),за исключением того, что для промывания на всех этапах используется 10% глицерол. Клетки тестируются с использованием 1 пг Bluescript плазмиды (Stratagene). Эти клетки используются для наращивания библиотеки и амплификации популяции после каждого раунда анализа по определению афинности связывания. Для выполнения анализа по определению афинности связывания пептиды на плазмидах высвобождаются из клеток, используя мягкое энзиматическое вскрытие клеточной стенки лизосомами. После осаждения клеточных оболочек грубый лизат может быть использован прямо для большинства рецепторов. Если плазмидный комплекс нуждается в дополнительной очистке, могут быть использованы гель фильтрационные колонки для устранения из грубого лизата низкомолекулярных соединений. Данный анализ выполняется в буфере(HEKL) с концентрацией соли ниже, чем в большинстве физиологических буферов. Анализ может проводиться на лунках с рецептором,иммобилизованном на незаблокированных моноклональных антителах (МАb), а также на подложках или колонках. Конкретнее, в первом раунде анализа могут быть использованы 24 лунки, покрытые рецептором. Во втором раунде обычно используются 6 лунок, покрытых рецептором (PAN образец), и 6 лунок без рецептора(NC образец). Сравнение числа плазмид в этих образцах позволяют определить, нарастились ли клоны специфичные к рецептору. Наращивание определяется как отношение PAN трансформантов к связавшимся с NC образцом. 10 кратное наращивание обозначает присутствие клонов, специфичных к рецептору. В следующем раунде анализа полезно понизить количество лизата, наносимое в каждую лунку, для того, чтобы снизить неспецифическое фоновое связывание плазмидных комплексов. Во втором раунде обычно используется 100 л лизата на лунку. В третьем раунде 100 л лизата на лунку разводится 1/10 HEKL/BSA. Для следующих раундов анализа плазмид ис 45 пользуются, по крайней мере, в трансформирующих единицах в 1000 раз больше их прежде определенного числа. Способность связывания пептидов, кодируемых индивидуальными клонами, обычно определяется после 3,4 или 5 раундов анализа, в зависимости от наблюдаемого числа наращивания. Обычно используется ELISA, определяющая специфичность связывания с рецептором,используя слитый с Lacl-белком пептид. Lacl обычно является терамером, и некоторые ДНК связывающие виды являются димером. Таким образом, пептиды располагаются мультивалентно на слитом белке. Предполагая, что в лунках может быть иммобилизована достаточная плотность рецептора, пептиды, слитые с Lacl, будут связываться с поверхностью в кооперативным,мультивалентным способом. Такое кооперативное связывание позволяет определить событие связывания при низкой истинной афинности. Чувствительность этого анализа является преимуществом в том смысле, что легко может быть определена низкая афинность, и недостаток анализа в том, что сигнал ELISA не коррелирует с истинной афинностью пептидов. Пептиды, слитые со связывающимся с мальтозой белком (МВР), позволяют, как описано ниже,проводить тестирование методом ELISA, в котором усиленный сигнал лучше коррелирует с афинностью. Смотри фиг. 5 А-В. ДНК интересующих клонов может быть получена в двунитевом виде, используя стандартные процедуры. Кодирующая последовательность интересующего единичного клона или популяции клонов может быть трансфецирована в вектора, сливающие последовательности с геном, кодирующим МВР, белок, который обычно существует в растворе в виде мономера. Клонирование библиотеки в pJS142 создаетBspEl рестрикционный сайт около начала случайно выбранного кодирующего участка библиотеки. Рестрикция BspEl и Scal позволяет очистить 900 пн фрагмент ДНК, который может быть субклонирован в один из двух векторовpELM3 (цитоплазматический) или pELM15 (периплазматический), которые являются простыми модификациями векторов pMALc2 иpJS142 библиотеки. BspEl и Agel концы подходят для лигирования. В добавление, правильное лигирование сайтов существенно для воссоздания функционального bla (Amp резистентности) гена, снижая тем самым уровень фоновых клонов из-за нежелательных событий лигирования. Экспрессия пептида слитого с МВР белком подtac промотором может быть индуцированаIPTG. Лизаты Lacl или МВР ELISAs приготавливаются из индивидуальных клонов путем лизи 001220 46 са, используя лизосомы и устранения нерастворимых клеточных оболочек центрифугированием. Затем лизаты наносятся в лунки, содержащие иммобилизованный рецептор, и в контрольные лунки без рецептора. Связывание пептида, слитого с Lacl или МВР, обнаруживается после инкубации с поликлональными анти-сера антителами кролика, направленными противLacl либо МВР с последующей инкубацией со щелочной фосфотазой, меченой противокроличьими антителами козла. Связывание щелочной фосфотазы обнаруживается с помощью рнитропенил фосфат субстрата. Пример 5. Система димер головной части. Множество методов, использующих ДНК связывающие пептиды называются димер головной части. ДНК, связывающаяся с рецептором, кодирует примерно 60 аминокислотный домен "головной части". Димер доменов головной части, связывающийся с lac опероном, в норме образуется при соединении с большим,примерно, 300 аминокислотный С-концевой домен. Система димер головной части включает молекулы димеров головной части, содержащие две основы, соединенные через короткий пептидный линкер. Эти пептиды связывают ДНК с достаточной стабильностью, позволяющей связывать пептидный эпитоп, расположенный на С-конце димера головной части с плазмидой, кодирующей пептид. Случайные пептиды, слитые с С-концом димера головной части, который связывается с плазмидой, образуют пептиддимер головной частиплазмидный комплекс, который может быть скринирован в анализе по определению афинности связывания. Система димер головной части - пептиды на плазмиде позволяет с большей селективностью оценить афинность лиганда, чем Lacl система. Таким образом, система димера головной части полезна при конструировании библиотек при помощи мутагенеза,основываясь на изначально низкой афинности и отбирая варианты с высокой активностью из этих начальных последовательностей. Библиотеки конструируются как пептиды на плазмидах, используя димер головной части вектора pCMG14 (смотри фиг. 6 А-С). Присутствие последовательности lac не является необходимым для связывания с димером головной части. Библиотеки вносятся в штамм E.coli (Ion-11lacZU118 (srI-recA) 306: :Tn10 и и амплифизируется при условиях (А) индукции промотора. Анализ на афинность связывания библиотеки основного димера производится подобно анализу при исследовании Lacl библиотек, за исключением того, что HЕК буфер используется вместо буфера HEKL, и эллюция плазмид из лунок производится водным раствором фенола вместоIPTG. Анализируемые последовательности обычно харaктеризуются после переноса в МВР 47 вектор, так как в этом случае они могут быть тестированы чувствительным МВР ELISA анализом, а также популяции клонов могут быть скринированы на колониях с меченным рецептором. Пример 6. В этом примере циклические соединения анализируются тремя способами. Первое, значения IC50 определяются, как описано выше. Затем, проводится анализ на пролиферирующих МТТ клетках, как описано выше, для вычисления значений ЕС 50. И наконец проводится анализ по микрофизиометрии (Molecular DevicesCorp.). В этом анализе определяется скорость подкисления внеклеточной среды в ответ на стимуляцию ТРО рецептора соединениями изобретения. Диапазон для EC50 определяется также, как описано выше для IС 50. Результаты приведены в таблице 4. Таблица 4 Пример 7. В этом примере аминокислотные замены в позициях D, Е, I, S, F в циклическом соединении анализируются на значения ЕС 50 и IC50 способом, описанным выше. Результаты микрофизиометрии даны в скобках. Результаты ссуммированы в таблице 5 ниже. Таблица 5 Пример 9. В этом примере значения ЕС 50 и IC50 вычислены, как описано выше для димерных соединений, указанных в таблице 7 ниже. Циклизованный мономер включен в качестве сравнения. Соединения в таблице 8 были не активны при максимальной концентрации 10 м. В таблице 9 сравниваются, как описано выше, значения EC50 и IC50 для циклизованных и димеризованых вариантов IEGPTLRQWLA Значения ЕС 50 и IC50 вычислены, как описано выше. Результаты микрофизиометрии даны в скобках. Таблица 7 Пример 8. В этом примере аминокислотные замены в соединении произведены в позициях D, S, F, как показано в таблице 6 ниже. Значения ЕС 50 и IC50 вычислены, как описано выше. Результаты микрофизиометрии приведены в скобках. Таблица 6 Пример 10. В этом примере различные замещения были введены в положения G, Р и W в циклизованном соединении В таблице 11 приведены примеры замещенных соединений, которые показывают активность агониста ТРО. Замещения даны аббревиатурами ниже. Таблица 11 Пример 11. Для того чтобы оценить мышей, как вид, пригодный для тестирования, были выполнены несколько экспериментов in vitro по определению активности тестируемых соединений по отношению к рецептору мыши. Сначала клетки костного мозга, взятые у 8-9 дневной Balb/C мыши, инкубировались в течение 7 дней в жидкой среде либо с rhuTPO, либо с различными концентрациями тестируемых пептидов. В конце инкубационного периода среды концентрировались Cytospin, окрашивались для определения ацетилхолинэстеразной активности (AChE диагностика для мышиных мегакариоцитов), и считались под микроскопом. Один (1) нМ инициировал рост большого числа(40uМ) не атгерентных клеток, которые окрашивались на AChE. Эти клетки оказались родительскими мегакариоцитами. Из начального количества 106 клеток костного мозга /мл (в 50 мл среды) было получено 1-2 х 106 мегакариоцитов. Такой ответ на ТРО был обозначен, как максимальный. Контрольные среды, не содержащие ростовых факторов, продуцировали очень небольшое количество AChE-позитивных клеток. В этом анализе несколько пептидных соединений тестировалось в высоких концентрациях, и результаты приведены в таблице 12. Пептид А в концентрации 10uМ вызывал максимальный рост клеток костного мозга мыши. Эти наблюдения явились первым доказательством того, что семейство этого пептида активно по отношению к мышиному рецептору. Во втором эксперименте клетки костного мозга выращивались на твердой среде (метилцеллюлoза),содержащей либо не содержащей факторы,1 нМ, или 10uМ пептида А. После 7 дней культивирования колонии больших клеток (предположитeльно мегагариоцитов) были посчитаны и сгруппированы в маленькие колонии (3-5 клеток) или большие колонии (более 6 клеток). Результаты приведены в таблице 13. ТРО и тестируемые пептиды продуцировали больше колоний обоих размеров, чем культуры отрицатель 55 ного контроля. Это говорит о том, что пептиды имитируют ТРО в его способности стимулировать рост популяции клеток предшественников мегакариоцитов. Для того, чтобы получить более точное количественное сравнение активности тестируемых соединений относительно рецепторов мыши и человека muTPO рецептор был клонирован и трансфецирован в Ba/F3 клетки. Была выделена ТРО зависимая популяция клеток. Таблица 12 Пептиды Тестируемая конОтвет центрация (нМ)"maximal"сложный пептид со стрептавидином концентрация 1:4;в сравнении с рекомбинантным ТРО человека;25-30% АСЕ окрашенных на цитопсине клеток. Культура без факторов роста - са. 5%AChE окрашенных клеток (низкая насыщенность клетками). Таблица 13 3-5 больших 6-12 больСоединение клеток ших клетокNo factors 2 1 1 1 nM ТРО 1-1 15 6 1 nM ТРО 1-2 12 1 1 nМ ТРО 2-1 16 8 1 nM ТРО 2-2 13 3 10 uM Peptide 1-1 25 10 10 uM Peptide 1-2 22 8 10 uM Peptide 2-1 22 7 10 uM Peptide 2-2 21 10 Все упомянутые в этой заявке с любой целью статьи и ссылки, включая патентные документы, даны только в виде ссылок на их содержание. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пептид или пептидомиметик, который связывается с рецептором тромбопоэтина и активирует его, имеющий молекулярую массу менее примерно 8000 Дальтон, афинность связывания с рецептором тромбопоэтина, которая соответствует значению IC50, равному не более чем примерно 100 мкМ, и содержащий следующую последовательность аминокислот: Х 1 Х 2 Х 3 Х 4 Х 5 Х 6 Х 7,где X1 представляет собой С, L, M, P, Q или V; 56 Х 2 представляет собой F, K, L, N, Q, R, S, Т или V; Х 3 представляет собой С, F, I, L, M, R, S, V или W; Х 4 представляет собой любую из 20 основных L-аминокислот;X5 представляет собой A, D, Е, G, K, M, Q,R, S, Т, V или Y; Х 6 представляет собой С, F, G, L, M, S, V,W или Y; и Х 7 представляет собой С, G, I, K, L, M, N,R или V. 2. Пептид или пептидомиметик по п.1,имеющий циклическую структуру. 3. Пептид или пептидомиметик по п.1,имеющий форму димера. 4. Пептид или пептидомиметик по п.1, содержащий следующую последовательность аминокислот: СХ 2 Х 3 Х 4X5 Х 6 Х 7,где Х 2 представляет собой K, L, N, Q, R, S, Т или V; Х 3 представляет собой С, F, I, L, M, R, S или V; Х 4 представляет собой любую из 20 основных L-аминокислот; Х 5 представляет собой А, D, Е, G, S, V илиY; Х 6 представляет собой С, F, G, L, M, S, V,W или Y; и Х 7 представляет собой С, G, I, K, L, M, N,R или V. 5. Пептид или пептидомиметик по п.3, где Х 4 представляет собой А, Е, G, Н, K, L, M, P, Q,R, S, Т или W. 6. Пептид или пептидомиметик по п.5, отличающийся тем, чтоX2 представляет собой S или Т; Х 3 представляет собой L или R; Х 4 представляет собой R; Х 5 представляет собой D, Е или G; Х 6 представляет собой F, L или W; и Х 7 представляет собой I, K, L, R или V. 7. Пептид или пептидомиметик по п.4, содержащий следующую последовательность аминокислот:X8 СХ 2 Х 3 Х 4 Х 5 Х 6 Х 7,где Х 2 представляет собой F, K, L, N, Q, R, S, Т или V; Х 3 представляет собой С, F, I, L, M, R, S, V или W; Х 4 представляет собой любую из 20 основных L-аминокислот,X5 представляет собой А, D, Е, G, K, M, Q,R, S, Т, V или Y; Х 6 представляет собой С, F, G, L, M, S, V,W или Y; Х 7 представляет собой С, G, I, K, L, M, N,R или V; иX8 представляет собой любую из 20 основных L-аминокислот. 57 8. Пептид или пептидомиметик по п.7, отличающийся тем, что Х 8 представляет собой G,S, Y или R. 9. Пептид или пептидомиметик по п.7, содержащий следующую последовательность аминокислот: GGCTLREWLHGGFCGG. 10. Пептид или пептидомиметик по п.1,содержащий следующую последовательность аминокислот:X8 представляет собой любую из 20 основных L-аминокислот. 11. Пептид или пептидомиметик по п.10,отличающийся тем, чтоX5 представляет собой Е или Q; Х 7 представляет собой I или L. 12. Пептид или пептидомиметик по п.11,содержащий следующую последовательность аминокислот:X9X8GX1X2X3X4X5WX7,где Х 8 представляет собой А, С, D, Е, K, L, Q, R,S, Т или V; и Х 9 представляет собой А, С, Е, G, I, L, М,Р, R, Q, S, Т или V; 13. Пептид или пептидомиметик по п.12,отличающийся тем, что Х 8 представляет собойD, Е или K и Х 9 представляет собой А или I. 14. Пептид или пептидомиметик по п.13,отличающийся тем, что он содержит следующую последовательность аминокислот: 17. Фармацевтическая композиция, содержащая пептид или пептидомиметик по любому из пп.1-16 и фармацевтически приемлемый носитель. 18. Способ лечения заболевания, опосредованного рецепторами тромбопоэтина, заключающийся в том, что пациенту вводят терапевтически эффективное количество пептида или пептидомиметика по любому из пп.1-16. 19. Способ по п.18, отличающийся тем, что заболевание,опосредованное рецепторами тромбопоэтина, представляет собой гематологическое заболевание и тромбоцитопению, развившиеся в результате химиотерапии, радиационной терапии или пересадки костного мозга.
МПК / Метки
Метки: пептидомиметик, тромбоэтина, композиция, лечения, фармацевтическая, связывается, рецептором, пептид, способ
Код ссылки
<a href="https://eas.patents.su/30-1220-peptid-ili-peptidomimetik-kotoryjj-svyazyvaetsya-s-receptorom-tromboetina-farmacevticheskaya-kompoziciya-i-sposob-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пептид или пептидомиметик, который связывается с рецептором тромбоэтина, фармацевтическая композиция и способ лечения.</a>
Предыдущий патент: Антигрибковые композиции с улучшенной биологической доступностью.
Следующий патент: Тгф-содержащие сульфонамидные ингибиторы аспартил-протеазы
Случайный патент: Раздаточная головка для покапельной раздачи жидкости